Введение
В последние годы коррекция дисбиоза рассматривается как одно из приоритетных направлений профилактики и лечения многих заболеваний. По определению ВОЗ, «пробиотики — это живые микроорганизмы, которые при применении в адекватных количествах вызывают улучшение здоровья организма-хозяина». Наиболее часто в качестве пробиотиков используются штаммы Lactobacillus и Bifidobacterium, кроме того, используются дрожжи Saccharomyces cerevisiae и Saccharomyces boulardii и некоторые виды Escherichia coli и Bacillus. Недавно в Европейском союзе зарегистрирован новый пищевой продукт — Clostridium butyricum [1].
Актуально исследование применения пробиотических культур в педиатрии. Показано, что олигосахариды, содержащиеся в материнском молоке, способствуют развитию бифидогенного микробиома у младенцев. Изменение состава данного микробиома может приводить к значительным функциональным расстройствам желудочно-кишечного тракта (ЖКТ) и ассоциированным с ними заболеваниям.
Функциональные нарушения ЖКТ — одна из самых распространенных проблем в детской гастроэнтерологии. По данным различных авторов, функциональные нарушения ЖКТ встречаются у 55–75% детей первых месяцев жизни. У детей раннего возраста отсутствует диагноз «функциональная абдоминальная боль». Состояние с похожими симптомами называют младенческими коликами. В первые три месяца жизни более чем у 70% детей отмечаются функциональные кишечные колики. В соответствии с Римскими критериями IV колики у младенцев представляют собой эпизоды повышенной раздражительности, беспокойства или безутешного плача, возникающие и завершающиеся без очевидных причин. Длительность младенческих кишечных колик составляет более трех часов в день и не менее трех дней в течение одной недели.
Младенческие кишечные колики характеризуются многофакторной этиологией, при этом патофизиологические механизмы, лежащие в основе кишечных колик, не установлены. Общепринято связывать их с непосредственными нарушениями функционирования ЖКТ [2]. Многофакторная этиология младенческих кишечных колик связана с различными подходами к лечению данного заболевания, включая изменение ухода за ребенком, поддержку грудного вскармливания, рациональное питание матери и медикаментозную терапию [3].
В педиатрической практике широкое применение в терапии колик нашли пеногасители, в основном препараты симетикона. Несмотря на некоторые позитивные отзывы со стороны родителей, нет достоверных доказательств в пользу пеногасителей как обезболивающего средства при кишечных коликах у младенцев [4]. Плацебо-контролируемые исследования симетикона подтверждают эти выводы [5, 6]. Сравнительные исследования пробиотиков и симетикона также показали, что симетикон неэффективен в терапии младенческих колик [7].
В терапии желудочно-кишечных нарушений у детей (в частности, при острой инфекционной диарее) довольно широко используются адсорбенты, например диосмектит. С одной стороны, метаанализ показывает, что диосмектит сокращает продолжительность диареи на один день и увеличивает шансы на полное выздоровление на третий день лечения [8]. С другой стороны, клинические рекомендации Европейского общества педиатрической гастроэнтерологии, гепатологии и нутрициологии (the European Society for Paediatric Gastroenterology Hepatology and Nutrition, ESPGHAN) подчеркивают, что комбинация диосмектита и пробиотика, содержащего Lactobacillus GG (LGG), и LGG отдельно одинаково эффективны при терапии острой инфекционной диареи у детей раннего возраста [9]. Соответственно, вопрос о сравнительной эффективности диосмектита и пробиотика остается открытым.
В последнее время состав микробиоты кишечника рассматривается как независимый фактор риска развития младенческих колик. Сравнительные исследования микрофлоры кишечника у детей с коликами и детей без колик показали значительное увеличение заселенности анаэробными грамотрицательными и грамположительными бактериями (Clostridium difficile) и снижение колонизации кишечника бактериями Lactobacillus spp. [10, 11]. Отмечено, что при тяжелых формах колик изменяется профиль жирных кислот — это также связано с лактобациллами.
Считается, что образование кишечных газов является одной из причин брюшного дискомфорта у младенцев, страдающих коликами. К главным газообразующим бактериям кишечной микрофлоры относятся Escherichia coli, Klebsiella pneumoniae, Klebsiella oxytoca, Enterobacter aerogenes, Enterobacter cloacae и Enterococcus faecalis. Положительный эффект бактерий рода Lactobacillus объясняется ингибированием подобных газообразующих микроорганизмов кишечника [12].
Пробиотики при кишечной колике могут оказывать разнонаправленное действие: нормализовать микрофлору, улучшать моторику кишечника, подавлять рост патогенных микроорганизмов и усиливать барьерные функции кишечника. Пробиотики, оптимизируя микробиоценоз, одновременно корректируют другие звенья кишечного гомеостаза, связанные с микрофлорой. В клинической практике для лечения детских колик применяются бактерии рода Lactobacillus и рода Bifidobacterium. Раннее применение пребиотиков и пробиотиков у недоношенных детей может облегчать симптомы, связанные с младенческими коликами [13].
Известно, что микрофлора детей, находящихся на грудном вскармливании, значительно отличается от таковой у младенцев, получающих молочные смеси [14]. В случае раннего перевода ребенка на вскармливание искусственной смесью процесс становления микробиоценоза кишечника нарушается. Микрофлора кишечника искусственно вскармливаемых детей характеризуется повышенным содержанием бактероидов, энтеробактерий, а также более частым выделением представителей условно-патогенной флоры на фоне снижения количества бифидобактерий.
С целью воссоздания бифидогенных свойств грудного молока производители обогащают молочные смеси комплексом пре- и пробиотиков. Согласно заключению Комитета нутрициологии ESPGHAN включение в состав молочных смесей пробиотиков (по отдельности или в комбинации) безопасно и может быть ассоциировано с рядом положительных клинических эффектов, таких как снижение риска неспецифических инфекций ЖКТ, снижение частоты применения антибиотиков и меньшая частота колик и раздражения кишки [15]. У младенцев, которые получали LGG-обогащенную формулу в течение 6 мес., наблюдались более значительное увеличение роста и веса и более высокая частота дефекации, чем в группе контроля [16].
Несмотря на то, что клинические данные преимущественно свидетельствуют об эффективности пробиотических препаратов у детей с функциональными нарушениями ЖКТ, подобные исследования имеют ряд ограничений (например, размер выборки, выборочные критерии включения детей), что не дает возможности однозначной рекомендации пробиотиков при данных видах патологий. Данные обстоятельства требуют проведения дальнейших исследований.
Цель настоящего ретроспективного фармакоэпидемиологического исследования — получение дополнительных клинических данных по особенностям применения пробиотических средств у детей раннего возраста с функциональными нарушениями ЖКТ.
Материал и методы
Проведен ретроспективный анализ случайно выбранных историй болезни пациентов в возрасте до 3 лет, обратившихся за медицинской помощью и проходивших амбулаторное лечение в 7 лечебных учреждениях г. Москвы с тремя группами диагнозов: I — младенческие кишечные колики и другие функциональные нарушения ЖКТ; II — острые кишечные инфекции, ОРВИ с кишечными проявлениями, другие инфекционные заболевания; III — атопический дерматит и другие аллергические реакции.
Была сформирована база данных, включающая 502 истории болезни только тех детей, у которых были диагностированы нарушения микробиоценоза кишечника различной этиологии и присутствовали как минимум такие симптомы, как продолжительный плач и беспокойство в дневное и ночное время.
Сбор необходимых для исследования данных осуществлялся путем копирования соответствующей информации из истории болезни пациента в специально разработанную индивидуальную регистрационную карту (ИРК), в которую вносились клинико-эпидемиологические характеристики детей. Во избежание дублирования данных каждой ИРК присваивался уникальный идентификационный номер.
Критерии эффективности терапии. Эффективность терапии оценивалась по длительности симптомов заболевания (температура, диарея, рвота, боли в животе — колики, метеоризм, кожная сыпь и др.). Общая продолжительность болезни рассчитывалась как число полных дней с момента обращения к врачу до разрешения симптомов.
Дети были разделены на 3 группы в зависимости от назначенных им препаратов для ЖКТ или пробиотических продуктов:
1-я группа получала одно- и двухкомпонентные пробиотические препараты, содержащие до двух штаммов бактерий;
2-я группа получала пробиотические препараты, содержащие более двух штаммов бактерий каждый;
3-я группа не получала препараты с живыми пробиотическими бактериями, а получала другие симптоматические средства для лечения нарушений ЖКТ, например пеногасители и сорбенты.
Статистические методы. Размер выборки предварительно не рассчитывался. Данные из индивидуальных карт стационарных больных вносились в единую базу в MS Excel. Значения количественных признаков представляли в форме среднего со стандартным отклонением (M±SD) в случае нормального распределения значений или медианы и квартилей (2,5% и 97,5%). Нормальность распределения определяли по критерию Колмогорова — Смирнова. Достоверность различий средних значений определяли с использованием t-критерия для независимых выборок в случае нормального распределения значений и с применением непараметрического критерия Тьюки в иных случаях. Качественные признаки представляли в форме доли пациентов со значением данного признака от общего числа пациентов с известным значением данного признака. Доверительный интервал для доли пациентов определяли по методу Wald. Значения частоты качественных признаков в группах сравнивались с помощью критерия хи-квадрат (χ2). Достоверными считали различия при уровне значимости p≤0,05. При множественных сравнениях учитывалась поправка Бонферрони. Анализ данных проводили в пакете программ R-Studio version 1.2.1335. Результаты представлены в соответствии со стандартом STROBE. В данной работе не было условий, способных существенным образом повлиять на выводы. В связи с ретроспективным характером исследования диагнозы или патологические состояния определялись по имеющимся в медицинской документации сведениям.
Результаты исследования
Для анализа данных по детям с функциональными нарушениями ЖКТ в исследование было включено 259 историй болезни детей раннего возраста, мальчиков и девочек поровну. Абсолютное большинство детей — 92% — получали грудное вскармливание, на смешанном питании и на сухих смесях находились 6% и 2% детей соответственно. Продолжительность симптоматики до обращения к врачу в среднем составляла 2,08±2,39 сут, среднее время, в течение которого дети находились на амбулаторном наблюдении, — 8,89±4,48 сут. Общая клинико-эпидемиологическая характеристика пациентов, включенных в исследование, приведена в таблице 1.
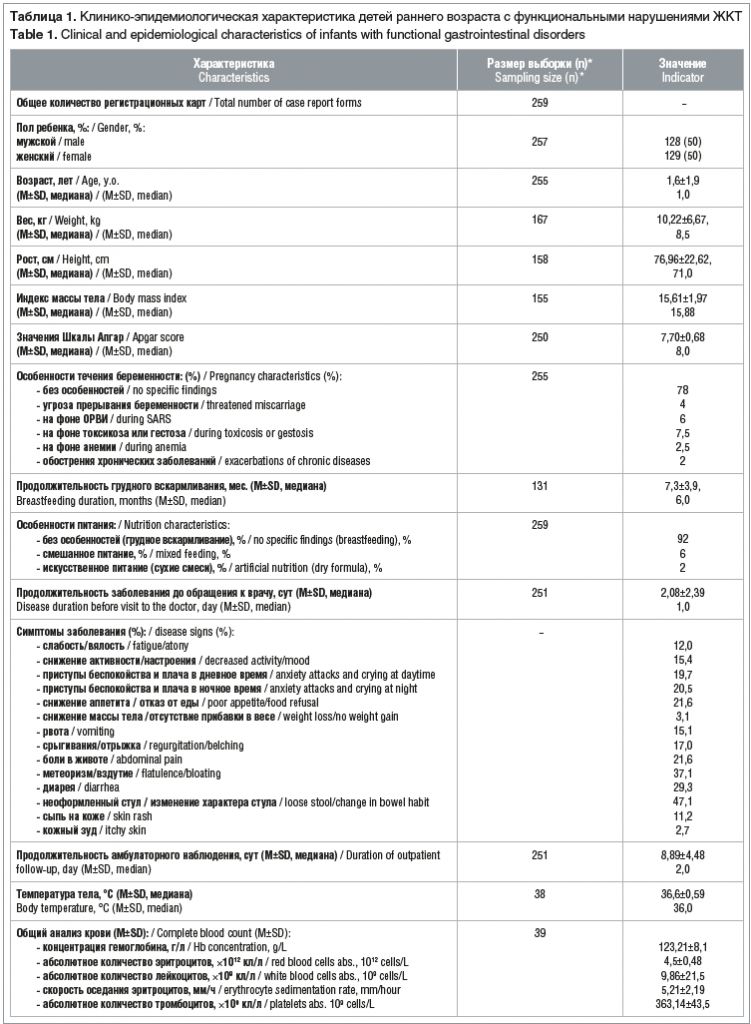

Для оценки эффективности пробиотиков в комплексной терапии функциональных нарушений ЖКТ исследуемая когорта детей была систематизирована по составу принимаемых препаратов. Из общего числа пациентов, включенных в исследование, 37 младенцев получали пробиотики из группы лактобактерий, 28 — бифидобактерии, 110 — лакто- и бифидобактерии в комбинациях, 37 — препараты энтерококков, 6 — препараты сахаромицетов и 41 младенец получал различные препараты для симптоматического лечения нарушений ЖКТ (табл. 2).
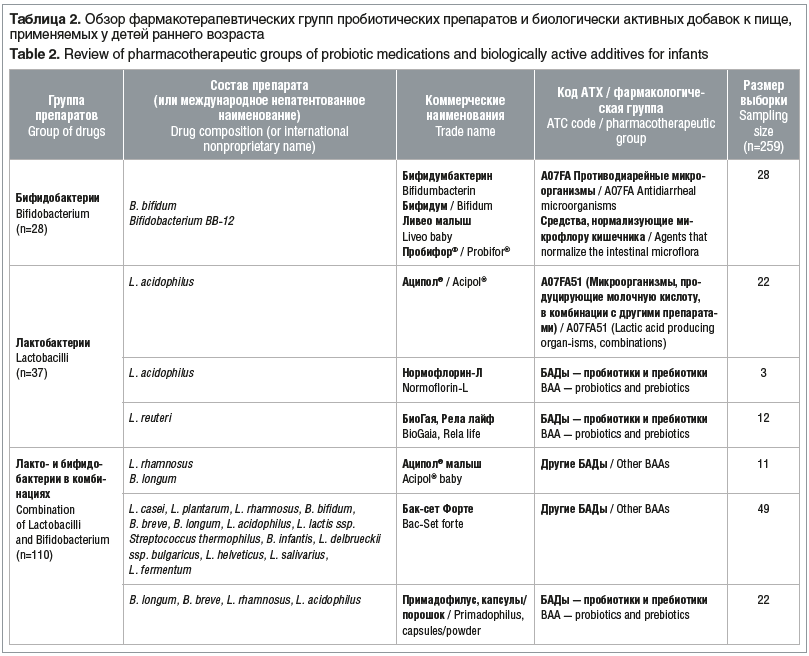
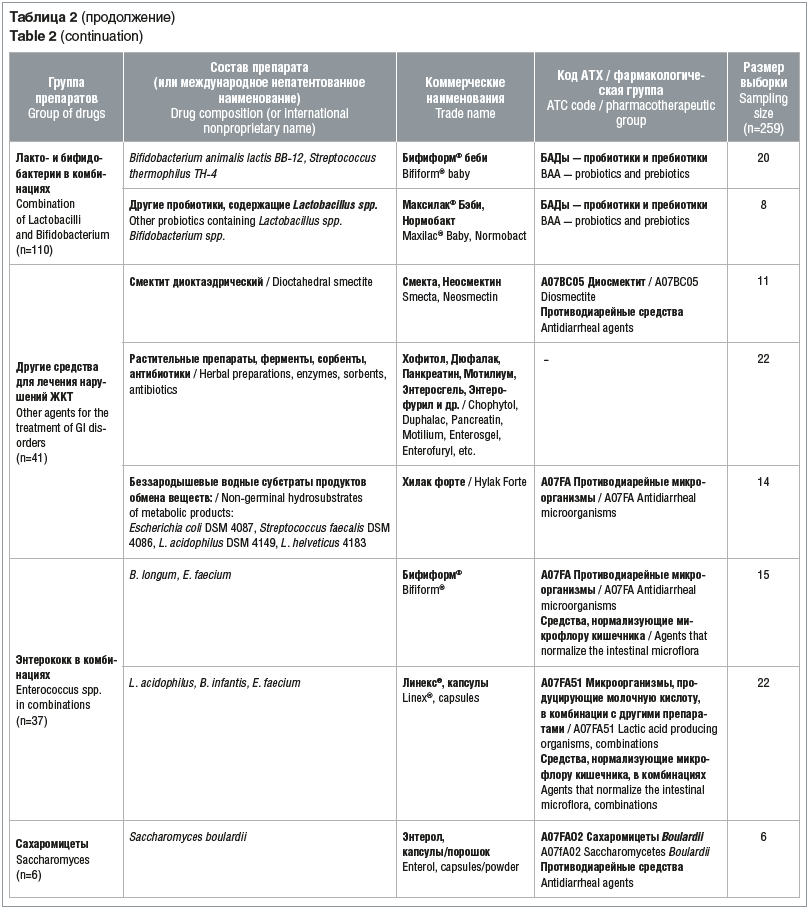
Наиболее частыми проявлениями нарушений со стороны ЖКТ были боли в животе, метеоризм, диарея и изменение консистенции стула (жидкий стул). У некоторых детей наблюдались атопические и аллергические реакции. Изменение продолжительности перечисленных симптомов рассматривалось в качестве основного показателя эффективности. Оценка эффективности различных пробиотиков представлена в таблице 3.
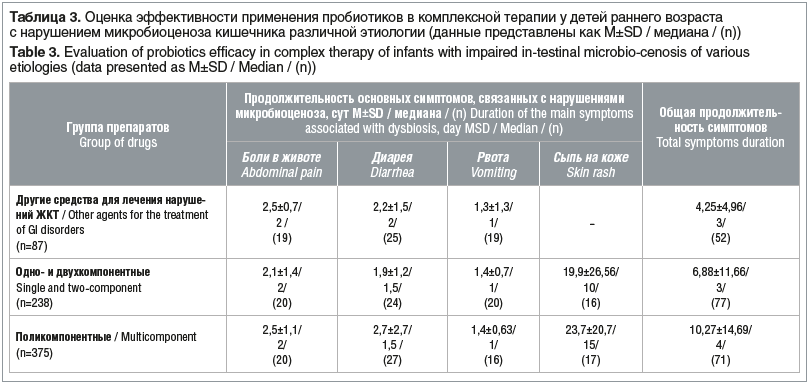
Оценка влияния характера питания на продолжительность симптомов, связанных с нарушением микробиоценоза кишечника, представлена на рисунке 1. Показано, что у младенцев на искусственном питании продолжительность симптомов была достоверно больше (p=0,0002).
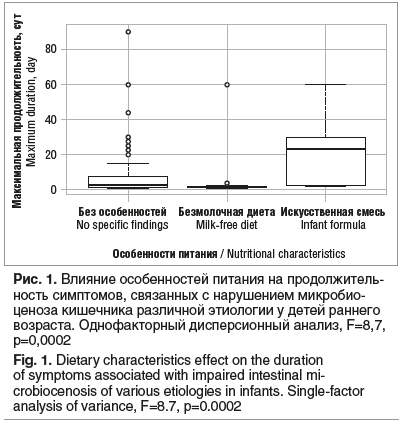
Оценка эффективности пробиотиков в комплексной терапии различных состояний, связанных с дисбактериозом, не показала значимых различий по продолжительности основных симптомов между младенцами, принимавшими различные группы пробиотиков и другие средства для терапии нарушений ЖКТ. Однако по общей максимальной продолжительности симптомов наименьшее значение показали средства для лечения нарушений ЖКТ, не содержащие в своем составе пробиотических продуктов, продолжительность симптомов в этой группе отличалась от таковой в группе поликомпонентных пробиотических препаратов (p=0,0031), но не отличалась от таковой в группе одно- и двухкомпонентных пробиотических препаратов (p=0,15). При этом наблюдалась тенденция к различию между одно- и двухкомпонентными препаратами и поликомпонентными препаратами (p=0,08).
Обсуждение
Результаты ретроспективного исследования показали разнообразие субъективных и объективных симптомов заболеваний, связанных с нарушением микробиоты кишечника и требующих применения пробиотиков у детей. При этом первостепенную роль играет тип питания ребенка. Так, в данном исследовании показано, что питание детей, включающее сухие смеси, значительно увеличивает продолжительность симптомов функциональных нарушений ЖКТ.
Известно, что тип кормления играет определяющую роль при формировании микробиоты кишечника младенцев. Так, в исследовании Baђ ckhed et al. показано, что при грудном вскармливании в микробиоте кишечника младенца преобладают бактерии рода Bifidobacterium. Также отмечается, что к возрасту 4 мес. в кишечной микробиоте младенцев на естественном вскармливании преобладают Lactobacillus johnsonii, L. gasseri, L. paracasei, L. casei и B. longum, тогда как у детей на искусственном вскармливании повышено содержание условно-патогенных бактерий: Clostridium difficile, Granulicatella adiacens, Citrobacter spp., Enterobacter cloacae, Bilophila wadsworthia [17].
Последние исследования показывают терапевтическую эффективность пробиотиков при заболеваниях, ассоциированных с изменением микрофлоры и pH кишечника, при коликах у детей, находящихся преимущественно на грудном вскармливании [7]. Исследования свидетельствуют, что повышенная заселенность кишечника бактериями рода Lactobacillus и рода Bifidobacterium является фактором защиты от развития кишечных колик и связанного с ними плача у младенцев [18]. Подобный защитный эффект может быть обусловлен тем, что бактерии Lactobacillus способны индуцировать экспрессию противовоспалительных генов [19], улучшая тем самым моторику кишечника, что в итоге ведет к снижению боли [20, 21]. Помимо этого, бактерии рода Lactobacillus и рода Bifidobacterium могут предотвращать развитие колик посредством модуляции иммунного ответа [22]. Применение пробиотиков сокращает продолжительность плача у младенцев с коликами [23].
В функциональных нарушениях ЖКТ определенную роль играют ассоциированные со специфической микробиотой процессы альтерации кишечной моторики и состояния слизистой оболочки кишечника [24]. Это обусловливает необходимость проведения более специфической (таргетной) терапии детских колик определенными видами пробиотиков, что подтверждается руководящими рекомендациями Всемирной организации гастроэнтерологов [1].
В настоящее время на фармацевтическом рынке наблюдается тенденция к формированию пула пробиотиков, содержащих широкий спектр штаммов микроорганизмов. Считается, что использование полиштаммовых пробиотиков ассоциировано с рядом преимуществ по сравнению с моноштаммовыми продуктами: 1) больший шанс на успех положительного воздействия пробиотика; 2) более широкий спектр эффективности пробиотика; 3) создание условий для синергетического эффекта (повышение адгезивных свойств различных штаммов, создание благоприятной среды, снижение антагонизма эндогенной микробиоты). С другой стороны, негативным эффектом применения комплексных пробиотиков может стать явный антагонизм между комбинированными штаммами. Штаммы в таких пробиотических комплексах могут присутствовать в разном количестве, что с точки зрения контроля качества создает проблему адекватного учета количества жизнеспособных микроорганизмов на протяжении всего срока годности продукта [25].
Иногда применение пробиотиков не позволяет добиться эффективного результата проводимой терапии [26]. Это может быть связано с тем, что гетерогенность пробиотических бактерий для организма нового хозяина может служить препятствием к их включению в состав резидентной микрофлоры. Кроме того, отмечается рост числа побочных эффектов, особенно в сенсибилизированном организме, поскольку гетерогенная микробная масса препарата, а иногда и дополнительно включенные в его состав компоненты могут давать значительную антигенную нагрузку на организм [26].
В настоящее время изучается вопрос о возможности лабораторного прогнозирования результатов лечения пробиотиками. Известно, что пробиотические штаммы могут по-разному взаимодействовать с собственной микрофлорой кишечника. Известны механизмы, посредством которых пробиотические бактерии могут воздействовать на микробиоту человека. Эти механизмы включают: конкуренцию за питательные вещества в качестве субстратов для роста; биоконверсию; производство субстратов (например, витаминов) для роста других бактерий; прямой антагонизм (с помощью бактериоцинов); конкуренцию за связывание с кишечной стенкой; улучшение барьерной функции; уменьшение воспаления; стимуляцию врожденного иммунного ответа (механизмы до конца не известны) [27]. Индивидуальный подбор монокомпонентных пробиотиков путем тестирования упрощает прогнозирование результатов лечения. В случае же с поликомпонентным пробиотиком результат лечения трудно прогнозировать, так как суммировать взаимодействие штаммов препарата с аутохтонной флорой практически невозможно. Кроме того, в одном препарате положительное действие одних штаммов может сочетаться с угнетающим действием других штаммов на собственную микрофлору пациента.
Помимо этого, пробиотики могут вырабатывать биогенные амины (гистамин, тирамин, 2-фенилэтиламин, путресцин, кадаверин), высокие количества которых вызывают головную боль, учащенное сердцебиение, рвоту, диарею, гипертензивные кризы и другие негативные эффекты [28]. При этом чем больше в пробиотическом препарате штаммов, продуцирующих биогенные амины, тем больше вероятность возникновения побочных эффектов, которые при этом не всегда можно связать с приемом пробиотиков, но которые вызывают дискомфорт.
В недавнем систематическом обзоре и метаанализе сравнительной эффективности полиштаммовых и моноштаммовых пробиотиков было показано, что в большинстве случаев отдельные штаммы эквивалентны комбинациям [29]. Выбор подходящего пробиотика должен основываться не на количестве штаммов в продукте, а на результатах доказательных исследований препаратов.
Результаты нашего исследования согласуются с выводами, что одно- и двухкомпонентные пробиотики не уступают по эффективности и могут быть более предпочтительными по сравнению с комбинированными препаратами за счет тех недостатков у последних, которые перечислены выше.
Заключение
Комплексная терапия пробиотиками обоснована при широком спектре нозологий. Постоянно расширяется применение данных препаратов, открываются новые их возможности в терапии различных заболеваний. Однако, как было показано в данном исследовании, необходим рациональный подход к назначению таргетной терапии пробиотиками. Поликомпонентные пробиотические препараты не всегда обладают преимуществами по сравнению с монокомпонентными. Более того, они имеют ряд недостатков, таких как избыточная антигенная нагрузка на слизистую ЖКТ, конкурентное взаимодействие штаммов. В связи с этим при назначении пробиотической терапии функциональных нарушений ЖКТ у детей раннего возраста предпочтение следует отдавать монокомпонентным препаратам. В настоящее время наиболее эффективными при терапии функциональных нарушений ЖКТ у младенцев и других нарушений, связанных с дисбактериозом, считаются пробиотики, содержащие бактерии L. rhamnosus, L. reuteri, L. casei, L. bulgaricus, L. acidophilus, а также B. longum и B. animalis [30].
Благодарность
Авторы и редакция благодарят компанию АО «ОТИСИФАРМ» за предоставление полных текстов иностранных статей, требовавшихся для подготовки обзорной части данной публикации.
Acknowledgement
The authors and Editorial Board are grateful to «OTCPharm» JSC for providing full-text foreign articles required to write the review.
Сведения об авторах:
Блохин Борис Моисеевич — д.м.н., профессор, заведующий кафедрой поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-4762-5975.
Прохорова Анастасия Дмитриевна — ассистент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-9028-7791.
Лобушкова Ирина Павловна — к.м.н., доцент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-2690-676X.
Суюндукова Алия Сагитовна — к.м.н., доцент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-4369-4300.
Гордиенко Галина Иосифовна — к.м.н., доцент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-2966-6696.
Стешин Вадим Юрьевич — к.м.н., доцент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0002-2279-2577.
Кагирова Зарема Руслановна — ассистент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-9002-7909.
Мирзоев Тахир Ханафиевич — к.м.н., доцент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0003-3126-2380.
Мельникова Марина Анатольевна — к.м.н., ассистент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD ORCID iD 0000-0002-5342-622X.
Антипова Надежда Владимировна — ассистент кафедры поликлинической и неотложной педиатрии педиатрического факультета ФГАОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России; 117997, Россия, г. Москва, ул. Островитянова, д. 1; ORCID iD 0000-0001-6950-2584.
Контактная информация: Блохин Борис Моисеевич, e-mail: blokhinb@gmail.com. Конфликт интересов отсутствует. Прозрачность финансовой деятельности: авторы не имеют финансовой заинтересованности в представленных материалах или методах. Статья поступила 14.09.2020, поступила после рецензирования 05.10.2020, принята в печать 19.10.2020.
About the authors:
Boris M. Blokhin — Dr. of Sci. (Med.), Professor, Head of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-4762-5975.
Anastasia D. Prokhorova — Assistant Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-9028-7791.
Irina P. Lobushkova — Cand. of Sci. (Med.), Associate Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-2690-676X.
Aliya S. Suyundukova — Cand. of Sci. (Med.), Associate Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-4369-4300.
Galina I. Gordiyenko — Cand. of Sci. (Med.), Associate Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-2966-6696.
Vadim Yu. Steshin — Cand. of Sci. (Med.), Associate Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-2279-2577.
Zarema R. Kagirova — Assistant Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-9002-7909.
Takhir Kh. Mirzoev — Cand. of Sci. (Med.), Associate Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0003-3126-2380.
Marina A. Melnikova — Cand. of Sci. (Med.), Assistant Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0002-5342-622X.
Nadezhda V. Antipova — Assistant Professor of the Department of Outpatient and Emergency Pediatrics, Faculty of Pediatrics, Pirogov Russian National Research Medical University: 1, Ostrovityanova str., Moscow, 117997, Russian Federation; ORCID iD 0000-0001-6950-2584.
Contact information: Boris M. Blokhin, e-mail: blokhinb@gmail.com. There is no conflict of interest. Financial Disclosure: no authors have a financial or property interest in any material or method mentioned. Received 14.09.2020, revised 05.10.2020, accepted 19.10.2020.
Синдром раздраженного кишечника (СРК) является хроническим рецидивирующим и функциональным расстройством желудочно-кишечного тракта (ЖКТ). В прошлом синдром раздраженного кишечника рассматривался как диагноз исключения. В последние 10–20 лет синдром раздраженной кишки стал привлекать к себе значительный научный интерес. Принятие биопсихосоциальной модели [1], применение симптомов на основе диагностических критериев (например, III Римских диагностических критериев), рост биологических и поведенческих технологий исследования [2, 3] позволили создать эффективную территорию для новых исследований СРК с перспективой для более эффективного лечения.
В настоящее время очевидно, что СРК это не одно заболевание, а четко выявляемый симптомокомплекс, который сочетает симптомы различных базовых физиологических детерминант «от кишечника к мозгу и обратно». Таким образом, одна «волшебная таблетка» в качестве лечения этого расстройства вряд ли применима: лечение должно основываться на моно- или полинаправленном фармакологическом воздействии, для целевой коррекции физиологической детерминанты, индивидуальной для каждого человека [4].
СРК — страдание, имеющее полиэтиологическую природу, характеризуется рецидивирующими болями в животе или дискомфортом наряду с нарушениями частоты или формы стула [5].
СРК имеет определенную симптоматику — «АВСD» синдрома раздраженной кишки (The ABCDs of irritable bowel syndrome):
А — боль в животе или дискомфорт, обычно в нижней части живота, но может быть без четкой локализации по всему животу (Abdominal pain or discomfort).
В — вздутие живота или ощущение распирания (Bloating or visible distention).
С — запор: затрудненная эвакуация при дефекации или редкая дефекация (Constipation: hard, difficult-to-evacuate, or infrequent stools).
D — диарея: кашицеобразный, водянистый или частый стул (Diarrhea: loose, watery, or frequent stools).
Экстракишечные симптомы, такие как усталость, головная боль, боли в спине, боль в мышцах, нарушения сна (Extra-bowel symptoms such as fatigue, headache, backache, muscle pain, and sleep disturbance).
1. Основанные на симптоматике:
- СРК с преобладанием кишечной дисфункции;
- СРК с преобладанием болевого синдрома;
- СРК с преобладанием метеоризма.
2. Основанные на наличии отягощающих факторов:
- постинфекционный СРК (ПИ-СРК);
- СРК, связанный с определенными пищевыми продуктами;
- СРК, связанный со стрессом.
В нашей статье мы хотим более подробно разобрать тип СРК, который встречается почти у каждого третьего больного, перенесшего бактериальную, вирусную или паразитарную острую желудочно-кишечную инфекцию (ОКИ) — ПИ-СРК. Впервые ПИ-СРК описали Chaudhary N. A. и Truelove S. C. [6] более 50 лет назад, после изучения 130 случаев «синдрома раздраженной толстой кишки», они выявили 26% пациентов, у которых СРК стало следствием перенесенной дизентерии.
У большинства людей, которые заболевают острой бактериальной диареей, самопроизвольное исчезновение симптомов наступает в течение < 5 дней, однако у части больных развивается неспецифическая кишечная симптоматика, которая может проявляться в течение многих лет [7]. Постинфекционный СРК развивается у 4–32% пациентов после перенесенного бактериального гастроэнтерита [8] как ответ на неспецифические инфекции, вызванные различными кишечными возбудителями, такими как, например, Campylobacter, Salmonella, диарейные штаммы Escherichia coli, Shigella, Entamoeba histolytica, Yersinia, Cryptosporidium, Legionella [9–12]. Douglas K. Rex в своем исследовании выявил, что ПИ-СРК развивается после перенесенного лямблиоза в 46% случаев, в контрольной группе в 14% [13].
ПИ-СРК диагностируется при наличии симптомов, соответствующих III Римским диагностическим критериям СРК — наличие рецидивирующей боли в животе или дискомфорта по крайней мере 3 дня в месяц за последние 3 месяца с началом симптомов не менее 6 месяцев, которые должны сочетаться с двумя или более из нижеследующих признаков: улучшение после дефекации; начало связано с изменением частоты стула; начало связано с изменением формы стула [14].
После эпизода острого инфекционного гастроэнтерита необходимо наличие двух из следующих симптомов: повышение температуры, рвота, диарея и обнаружение маркеров ОКИ в биологических средах больного [15]. Как правило, острые инфекционные симптомы — рвота и лихорадка купируются через несколько дней с разрешением инфекции, однако дискомфорт в животе, вздутие живота и диарея сохраняются [8, 9]. Ряд факторов, таких как продолжительность и тяжесть ОКИ, может увеличить риск развития ПИ-СРК [16, 17].
Ключевым фактором для развития СРК являются отклонения в работе системы мозг/кишечник. За функциональную связь компонентов системы отвечает ряд нейромедиаторов, таких как холецистокинин, вазоактивный интестинальный пептид, серотонин и др. На сегодняшний день более 60 генов исследовано на предмет их влияния на развитие СРК.
Постинфекционный СРК возникает в результате резкой ответной реакции иммунной системы на какую-либо инфекцию при последующем медленном ослаблении эффекта иммунного ответа. При этом у пациентов наблюдается слабо выраженное воспаление толстой кишки и повышенная кишечная проницаемость. Важными регуляторами иммунного ответа являются цитокины. В ряде независимых работ была выявлена связь полиморфизмов в генах IL-4, IL-6, IL-10 и фактора некроза опухоли-альфа (TNF-α), кодирующих провоспалительные интерлейкины, с развитием постинфекционного СРК. Gwee и др. [18] сообщили об увеличении экспрессии IL-1б в ректальной биопсии у пациентов с ПИ-СРК, по сравнению с теми, кто страдал инфекционным энтеритом без последующего ПИ-СРК. Wang и др. [19] также наблюдали увеличение IL-1б у пациентов с ПИ-СРК после шигеллезной инфекции по сравнению с пациентами без СРК [20]. Недавнее исследование, проведенное Villani A. и др. [21], определило три гена — TLR9, CDH1 и IL6, которые были связаны с развитием ПИ-СРК. Ген TLR9 кодирует трансмембранный рецептор, являющийся важным компонентом иммунного ответа организма. Также была обнаружена связь однонуклеотидной замены в промоторе гена CDH1, кодирующего трансмембранный гликопротеин, регулирующий межклеточную адгезию, с развитием СРК постинфекционного типа [22, 23].
У пациентов с ПИ-СРК в ряде исследований выявлено повышение уровня серотонина в энтерохромаффинных клетках (ЭК) кишечника по сравнению со здоровыми людьми. Результаты биопсии у всех пациентов были в пределах нормы с использованием обычных критериев, однако количественное исследование показало увеличение ЭК клеток (р = 0,017) по сравнению с контрольной группой (р = 0,02). Также было увеличено количество Т-лимфоцитов собственной пластинки слизистой оболочки (р = 0,026) и количество тучных клеток (р = 0,054) по сравнению с контрольной группой [24]. Увеличение на 25% в ректальной зоне числа ЭК клеток может привести к увеличению уровня серотонина и к последующей диарее [8]. У пациентов с ПИ-СРК были выявлено повышение уровня постпрандиального серотонина в плазме по сравнению с пациентами с СРК-З (запоры) и здоровыми добровольцами [25].
Воспаление слизистой оболочки кишки при ОКИ изменяет висцеральную сенсорику и часто предшествует началу симптомов в группе пациентов с ПИ-СРК. Даже легкий бессимптомный острый колит может вызывать длительную висцеральную гипералгезию при наличии дополнительных стимулов [26]. Такое «вздутие» значительно быстрее вызывало болезненную реакцию у пациентов с СРК, чем в контрольной группе [27, 28].
Риск развития ПИ-СРК коррелирует с тяжестью острой кишечной инфекции и повышается, по крайней мере, в два раза, если диарея продолжается более 1 недели, и в три раза, если диарея продолжается более 3 недель [29, 30]. Спазмы в животе и боль, потеря веса, кровавый стул увеличивают риск возникновения ПИ-СРК в четыре раза [29, 31]. Возбудители, такие как Campylobacter и Shigella, могут вызвать более серьезные повреждения слизистой и более длительные заболевания, чем Salmonella [32]. В исследовании с участием 231 пациента, которые наблюдались в течение 3 месяцев, чаще (4,2% от 119 пациентов) развивался ПИ-СРК после инфекции Campylobacter, чем после заражения сальмонеллой (2,6% из 38 пациентов), но эта разница не была значимой [17].
Sykes M. A. и соавт. [33] определили, что люди с психиатрическими преморбидными диагнозами, в частности, тревожными расстройствами, также подвергаются повышенному риску развития ПИ-СРК после ОКИ. Кроме того, депрессия, невротизации, соматизированные расстройства, стресс и негативное восприятие болезни также связаны с ПИ-СРК [34–36]. В недавнем исследовании у пациентов, у которых развился ПИ-СРК, был значительно более высокий уровень восприятия напряжения, тревоги, соматизированных расстройств и негативного отношения к заболеванию во время ОКИ, чем у тех пациентов, у которых не развивался ПИ-СРК [35]. Кроме того, Gwee и соавт. [37] установили, что пациенты с ПИ-СРК имели более высокие показатели ипохондрии. Эти наблюдения показывают психосоматические взаимодействия, которые могут вызвать симптомы ПИ-СРК и длительно поддерживать психические расстройства у этих пациентов [35]. Эта парадигма обеспечивает поддержку когнитивно-поведенческой терапии для лечения ПИ-СРК. Для объективной оценки психологической картины может помочь Шкала госпитальной тревожности и депрессии (Hospital Anxiety end Depression Seale, HADS) [38]. Мы в своей практике регулярно используем этот простой опросник из 14 пунктов, предназначенный для оценки уровня тревожности и депрессии.
Несмотря на то, что не существует гендерных различий в развитии ОКИ и иммунном ответе, риск развития ПИ-СРК выше среди женщин, чем среди мужчин [35, 39]. Женская предрасположенность к ПИ-СРК может быть обусловлена более выраженной реакцией на психологический стресс. В исследовании Gwee и др. [37] женский пол не был существенным фактором риска, когда психологические переменные контролируются в многофакторном анализе. В двух исследованиях риск развития ПИ-СРК уменьшается с увеличением возраста старше 60 лет [40]. Dunlop и соавт. [41] показали, что пожилые люди имеют меньше лимфоцитов и тучных клеток в слизистой прямой кишки, что может ослаблять воспалительные реакции и давать снижение риска ПИ-СРК.
Вероятность развития ПИ-СРК увеличивается в шесть раз после острых желудочно-кишечных инфекций при наличии следующих факторов риска развития ПИ-СРК: молодой возраст, женский пол, диарея > 7 дней, наличие крови в кале, боль в животе, потеря веса, по крайней мере, десять фунтов (примерно 4,5 кг), тревожное или депрессивное расстройство, ипохондрия, предшествующие неблагоприятные жизненные события [42].
Диагноз ПИ-СРК является диагнозом, который может быть поставлен после тщательного обследования больного, позволяющего исключить у пациента органические заболевания ЖКТ. Решающее значение в обследовании больных с ПИ-СРК имеют данные ирригоскопии, компьютерной колоноскопии, дуоденоскопии, сигмоскопии или эндоскопической колоноскопии для исключения воспалительных заболеваний кишечника, целиакии, паразитозов и других заболеваний кишечника (табл.). Показано обследование кала для определения количества лейкоцитов, скрытой крови, паразитов. Выявление дивертикулеза кишечника не противоречит диагнозу ПИ-СРК. У некоторых больных с целиакией и спру также выявляются симптомы ПИ-СРК. У больных с ПИ-СРК с HLA-DQ2 и интестинальными антителами к глиадину и другим пищевым протеинам после ограничения глютена частота дефекаций и уровень кишечных Ig уменьшаются.
Лечение ПИ-СРК, как правило, симптоматически направленное и включает в себя диетические рекомендации, психотерапию и средства, предназначенные для лечения СРК с диареей (СРК-Д). Эмпатия и поддержка доктора имеют решающее значение для пациента. Врач должен подчеркнуть, что ПИ-СРК не является опасным для жизни расстройством, и должен успокоить пациента, объяснить, что его симптомы не являются мнимыми и связаны с различными факторами. Диетические рекомендации направлены на исключение продуктов, провоцирующих диарею и метеоризм, пища должна быть химически и термически щадящая с хорошей кулинарной обработкой. Психотерапевтические мероприятия направлены на устранение напряжения, тревоги, депрессии, ипохондрии и включают в себя различные методики и/или психотропную коррекцию. Разумно назначать психотропные препараты, которые имеют побочным эффектом запоры и в данной ситуации работают как анксиолитики или антидепрессанты, при этом уменьшая или устраняя диарею. К таким препаратам относятся сульпирид, амитриптилин, антидепрессанты с точкой приложения 5-НТ1— или 5-НТ3-рецепторов, антигистаминные и ГАМКергические анксиолитики.
Антидиарейные средства, такие как лоперамид, могут быть эффективными в снижении частоты диареи. Лоперамид тормозит перистальтику и секрецию жидкости, что приводит к увеличению транзитного времени желудочно-кишечного тракта, повышает поглощение жидкости и электролитов в желудочно-кишечном тракте. Тем не менее, лоперамид не уменьшает боли в животе, которые связаны с ПИ-СРК [44]. Общие побочные реакции на лоперамид включают судороги и тошноту. Также необходимо исключить синдром избыточного бактериального роста (СИБР) в тонкой кишке, при котором прием лоперамида может усилить интоксикацию.
Достаточно часто ПИ-СРК бывает ассоциирован с СИБР, особенно после курсов специфической терапии ОКИ. У таких пациентов еще более выражены синдромы мальабсорбции, мальдигестии, нарушена деконъюгация желчных кислот, беспокоят метеоризм, диарея и боль в животе. Исключить или подтвердить диагноз СИБР помогает дыхательный водородный тест с лактулозой. При сочетании ПИ-СРК и СИБР показано применение антибиотиков [45], пребиотиков и пробиотиков [38]. Препаратом выбора для деконтаминации тонкой кишки во многих исследованиях и рекомендациях стал рифаксимин, который показал хорошие результаты при лечении СРК. В рандомизированном плацебо-контролируемом исследовании 124 пациентов проведен 10-дневный курс рифаксимина 400 мг 3 раза в день или плацебо, рифаксимин статистически значимо уменьшал вздутие живота и флатуленцию [46]. Эти результаты были подтверждены в двойном слепом, плацебо-контролируемом исследовании с участием 87 пациентов с СРК в 2006 году. По окончании лечения большинство пациентов в группе рифаксимина отмечали значительное уменьшение симптомов СРК (37,7% против 23,4%) (p < 0,05) и стойкий клинический ответ (37,2% против 15,9%) (р < 0,05) [47].
Ведущий симптом ПИ-СРК — боль, вызванная спазмом, в основе которого лежит непроизвольное сокращение гладких мышц кишечника, не сопровождающееся их немедленным расслаблением. Главные механизмы развития абдоминальной боли обусловлены нарушением моторики кишечника и висцеральной гиперчувствительностью. В национальных практических руководствах по СРК (Guideline IBS) разных стран рекомендуются основные спазмолитики различных групп: отилония бромид, тримебутин, циметропия бромид, гиосцина бутилбромид, пинаверия бромид, алверина цитрат, мебеверин, в том числе и масло перечной мяты. Почти все они показали значительное преимущество по сравнению с плацебо [48]. В зависимости от основного механизма воздействия на этапы сокращения мышечного волокна выделяют несколько групп мышечных релаксантов.
Антихолинергические средства (атропин, платифилин, гиосцина бутилбромид) снижают концентрацию интрацеллюлярных ионов кальция, что приводит к мышечной релаксации. Важно отметить, что степень релаксации находится в прямой зависимости от предшествующего тонуса парасимпатической нервной системы.
Блокаторы фосфодиэстеразы — миотропные спазмолитики (папаверин, дротаверин) способствуют накоплению в клетке цАМФ и уменьшению концентрации ионов кальция, что тормозит соединение актина с миозином. Данные препараты используются кратковременно (от однократного приема до недели) для купирования спазма, но не для курсового лечения, направленного на купирование и профилактику рецидива заболевания.
Определенное значение в регуляции моторной функции органов ЖКТ отводится эндогенным опиатам. В настоящее время в лечении больных СРК используется агонист опиатных рецепторов — тримебутин — регулятор моторики ЖКТ. В рандомизированных плацебо-контролируемых исследованиях по СРК Quartero A. O. и соавт. (2005) и Ford A. C. и соавт. (2008) тримебутин не показал значительного преимущества и статистически значимо не отличался от плацебо [49, 50].
Пинаверия бромид (Дицетел®), основным действующим веществом которого является пинаверия бромид, представляет собой спазмолитик миотропного действия — антагонист кальция для лечения нарушений перистальтики кишечника [51]. Он избирательно блокирует потенциалзависимые кальциевые каналы гладкой мускулатуры кишечника и препятствует избыточному поступлению кальция внутрь клетки. В отличие от других антагонистов кальция, Дицетел® проявляет одинаковое сродство к каналам в доступном и инактивированном состоянии, что обусловливает его высокую эффективность и отсутствие привыкания [52]. Сбалансированная работа гладкомышечного аппарата желудочно-кишечного тракта зависит от концентрации кальция в цитоплазме миоцита и его перемещений через клеточную мембрану. Ионы кальция играют роль не только в связке «возбуждение-сокращение», но и в связке «возбуждение-расслабление». Кальциевые каналы L-типа гладкомышечных клеток ЖКТ активируются двумя путями:
- Первый, наиболее полно изученный, характеризуется деполяризацией клеточной мембраны посредством воздействия нервного импульса, с последующим сокращением гладкомышечной клетки.
- Второй способ включает активацию кальциевого канала пищеварительными гормонами и медиаторами, такими как холецистокинин, гастрин или субстанция P. Связываясь со специфическими рецепторами, они активируют рецептор-управляемые Са2+-каналы, что вызывает деполяризацию клеточной мембраны и приводит к открытию потенциал-зависимых кальциевых каналов. В случае если кальциевые каналы заблокированы молекулами пинаверия бромида, действие вышеуказанных пищеварительных гормонов и медиаторов не может быть реализовано.
Таким образом, пинаверия бромид ингибирует не только гипермоторику кишечника, но и путь, вовлеченный в висцеральную гиперчувствительность, — второй признак синдрома раздраженного толстого кишечника. Кроме того, в мембранах гладкомышечных клеток кишечника человека недавно были открыты кальциевые каналы, чувствительные к механическим воздействиям. Существование такого типа кальциевых каналов может изменить представление о желудочно-кишечной гладкой мускулатуре как о «сугубо двигательном органе», обладающем как двигательной, так и сенсорной функцией. Об эффективности применения Дицетела® у больных СРК всех типов свидетельствует большое количество исследований как в нашей стране, так и за рубежом [53–56]. Большинство исследователей показывают хорошие и очень хорошие результаты по полному купированию и уменьшению интенсивности боли при СРК на фоне приема Дицетела® в качестве монотерапии в стандартной дозировке (на уровне более 60%).
Обзор 22 рандомизированных контролируемых исследований (n = 1778), в которых проводилось сравнение 12 различных спазмолитиков (в том числе пинаверия бромид, тримебутин и дицикломин), показал статистически значимый эффект терапии. Уменьшение болевого синдрома имело место у 39% пациентов, получающих лечение, и у 56% пациентов, получающих плацебо. При этом пинаверия бромид показал статистически значимый эффект терапии, в отличие от тримебутина. Болевой синдром сохранился у 28% пациентов, получающих лечение, и у 61% пациентов, получающих плацебо [49, 50].
Дицетел® в начальном периоде заболевания при выраженном болевом синдроме (3–6 дней) назначается по 100 мг 2–3 раза в сутки во время еды. Суточная доза Дицетела® (таблетки, покрытые пленочной оболочкой, 100 мг) — по 1 таблетке 2 раза в сутки, утром и вечером во время еды. Если необходимо, суточная доза может быть увеличена до 3 таблеток в сутки. После стихания обострения поддерживающей дозировкой пинаверия бромида является стандартная доза — 50 мг 3–4 раза в сутки, назначаемая на курс от 2 до 6 недель и более. Действуя селективно на кишечник, Дицетел® не имеет побочных антихолинергических эффектов, поэтому его можно без опасений назначать пациентам с глаукомой и гипертрофией предстательной железы.
В своей клинической практике мы достаточно часто встречаемся с СРК, в том числе и с ПИ-СРК. Особенности течения ПИ-СРК заключаются в более выраженной и длительной диарее и стойком болевом синдроме.
Интересные клинические случаи из нашей практики
Пациент М., 35 лет. В декабре 2009 года перенес тяжелый стресс (смерть матери от онкологического заболевания), через несколько дней началась диарея до 5–7 раз в сутки, которая прогрессировала, самостоятельные попытки купировать симптоматику были тщетны. В январе 2010 года обратился к инфекционисту, при обследовании были выявлены антитела к иерсиниозу, проведен курс лечения антибиотиками. Диарея сохранялась. В феврале 2010 года при повторном обследовании титр антител к иерсинизу сохранялся на прежнем уровне, курс антибиотикотерапии был повторен. После второго курса лечения дирейный синдром не купировался. За время лечения потеря веса более 10 килограмм, резко снизилась трудоспособность, наблюдались выраженная слабость, ангедония, канцерофобия, бессонница. С марта по апрель 2010 года был на приеме у нескольких гастроэнтерологов, обследование — клинические и биохимические анализы крови, ирригоскопия, колоноскопия, копроовоскопия — без патологии, обычное лечение диареи (лоперамид, смекта) было малоэффективным. В мае 2010 года назначен курс лечения с учетом основных симптомов ПИ-СРК: Дицетел® по 100 мг 3 раза в сутки в течение месяца, Просульпин 50 мг 3 раза в сутки в течение месяца. Назначен дыхательный водородный тест с лактулозой, в результате которого выявлена высокая бактериальная контаминация тонкой кишки. К лечению добавлен Альфа Нормикс 400 мг 3 раза в сутки — курс 6 дней, затем Линекс по 2 капсулы 3 раза в сутки — курс 14 дней и Дюфалак® по 5 мл до 3 месяцев. Через месяц лечения отмечает значительное улучшение, стул не чаще 1–2 раз утром после завтрака, остается умеренная тревожно-депрессивная симптоматика, страх возврата диареи. Дицетел® рекомендован для приема по потребности при болях в животе, вместо Просульпина назначен Тразодон по 150 мг в сутки до 6 месяцев. В декабре 2010 года — следующий визит к гастроэнтерологу — жалоб не предъявляет, вес восстановился, занимается спортом, вернулся к обычной профессиональной деятельности.
Пациентка П., 86 лет. Направлена инфекционистом в апреле 2012 года с выраженным абдоминальным болевым синдромом, диареей, страхом приема пищи, которая усиливает боль в животе. В анамнезе месяц назад перенесла ОКИ в сочетании с лямблиозом, лечилась антибиотиками, нитрофуранами, похудела на 7–8 кг. Обследования — клинические и биохимические анализы крови, УЗИ органов брюшной полости, ФГДС, колоноскопия — в пределах возрастной нормы. При водородном дыхательном тесте с лактулозой выявлен СИБР. Назначено лечение: Дицетел® по 100 мг 3 раза в сутки в течение месяца, Альфа Нормикс 400 мг 2 раза в сутки в течение 6 дней, затем РиоФлора Баланс по 2 капсулы 2 раза в сутки в течение 14 недель. Через месяц на приеме гастроэнтеролога — значительное улучшение самочувствия, боль в животе возникает значительно реже, стул не чаще 2 раз в сутки, остается страх приема пищи, нарушенный сон. Рекомендован прием Дицетела® по 50–100 мг при болях в животе по потребности, флувоксамин по 50 мг на ночь в течение полугода. В июне 2012 года отмечает значительное улучшение самочувствия, прибавку в весе, стул нормализовался, расширила рацион употребляемых продуктов, продолжает прием флувоксамина.
Заключение. Лечение ПИ-СРК должно иметь четкие и реалистичные цели, к которым необходимо стремиться как врачу, так и пациенту. Согласованная тактика лечения должна включать в себя мероприятия на уменьшение симптомов (или исключение) и улучшение качества жизни пациентов. Большинство пациентов нуждаются в коррекции СИБР путем деконтаминации тонкой кишки с помощью современных энтеросептиков. Части пациентов с течением ПИ-СРК средней степени тяжести и тяжелым часто необходима рациональная психотерапия, назначение препаратов разных фармакологических групп — спазмолитиков, пробиотиков, пребиотиков, антибиотиков, антидирейных препаратов, антидепрессантов и некоторых других, при необходимости — психотерапия. Разумно использовать различные схемы этих препаратов как для лечения симптомов обострения, так и с профилактической целью для удлинения ремиссии и улучшения качества жизни пациентов с постинфекционным синдромом раздраженной кишки.
Литература
- Drossman D. A. Presidential address: gastrointestinal illness and the biopsychosocial model // Psychosom Med. 1998. 60. Р. 258–67.
- Drossman D. A. The functional gastrointestinal disorders and the Rome III process. In: Drossman D. A., Corazziari E., Delvaux M., Spiller R., Talley N. J., Thompson W. G. et al. Rome III: The Functional Gastrointestinal Disorders. 3 rd ed. McLean, VA: Degnon Associates. 2006. Р. 1–30.
- Drossman D. A. The functional gastrointestinal disorders and the Rome III process // Gastroenterology. 2006. 130. Р. 1377–1390.
- Drossman D. A. Treatment for Bacterial Overgrowth in the Irritable Bowel Syndrome // Comment on: Ann Intern Med. 2006. Oct 17. 145 (8). Р. 557–563.
- Longstreth G. F., Thompson W. G., Chey W. D. et al. Functional bowel disorders // Gastroenterology. 2006. 130. Р. 1480–1491.
- Chaudhary N. A., Truelove S. C. The irritable colon syndrome: a study of the clinical features, predisposing causes, and prognosis in 130 cases // Q J Med. 1962. 31. Р. 307–322.
- Neal K. R., Barker L., Spiller R. C. Prognosis in post-infective irritable bowel syndrome: a six year follow up study // Gut. 2002. 51. Р. 410–413.
- Spiller R. C., Campbell E. Post-infectious irritable bowel syndrome // Curr Opin Gastroenterol. 2006. 22. Р. 13–17.
- Spiller R. C., Jenkins D., Thornley J. P. et al. Increased rectal mucosal enteroendocrine cells, T lymphocytes and increased gut permeability following acute Campylobacter enteritis and in post-dysenteric irritable bowel syndrome // Gut. 2000. 47. Р. 804–811.
- Gwee K. A., Collins S. M., Read N. W. Increased rectal mucosal expression of interleukin 1β in recently acquired postinfectious irritable bowel syndrome // Gut. 2003. 52. Р. 523–526.
- Wang L. H., Fang X. C., Pan G. Z. Bacillary dysentery as a causative factor of irritable bowel syndrome and its pathogenesis // Gut. 2004. 53. Р. 1096–1101.
- Triantafillidis J. K., Peros G. Post-infectious Irritable bowel syndrome // Annals of Gastroenterology. 2007. 20 (4). Р. 243–245.
- Douglas K. Rex. Add Parasites to the Causes of Postinfectious Irritable Bowel Syndrome // Gut. 2012. Feb. 61. Р. 214.
- Longstreth G. F., Thompson W. G., Chey W. D. et al. Functional bowel disorders // Gastroenterology. 2006. 130. Р. 1480–1491.
- Dunlop S. P., Jenkins D., Spiller R. C. Distinctive histological patterns of chronic inflammatory cells in rectal biopsies of patients with different clinical subtypes of IBS // Gastroenterology. 2002. 122 (Suppl 1). Р. 60.
- Neal K. R., Hebden J., Spiller R. Prevalence of gastrointestinal symptoms six months after bacterial gastroenteritis and risk factors for development of the irritable bowel syndrome: postal survey of patients // BMJ. 1997. 314. Р. 779–782.
- Borgaonkar M. R., Ford D. C., Marshall J. K. et al. The incidence of irritable bowel syndrome among community subjects with previous acute enteric infection // Dig Dis Sci. 2006. 51. Р. 1026–1032.
- Gwee K. A., Collins S. M., Read N. W. et al. Increased rectal mucosal expression of interleukin 1 beta in recently acquired post-infectious irritable bowel syndrome // Gut. 2003. 52. Р. 523–526.
- Marshall J. K., Thabane M., Garg A. X. et al. Intestinal permeability in patients with irritable bowel syndrome after a waterborne outbreak of acute gastroenteritis in Walkerton, Ontario // Aliment Pharmacol Ther. 2004. 20. Р. 1317–1322.
- Wang L. H., Fang X. C., Pan G. Z. Bacillary dysentery as a causative factor of irritable bowel syndrome and its pathogenesis // Gut. 2004. 53. Р. 1096–1101.
- Villani A., Lemire M., Thabane M. Genetic risk factors for post-infectious IBS in the E. coli 0157: H7 outbreak in Walkerton (Canada) in 2000 // Gastroenterology. 2008. 134. A122.
- Zanini B. Norovirus gastroenteritis may lead to post-infectious IBS // Am J Gastroenterol. 2012. doi:10. Р. 1038.
- Van der Veek P. P., Van den Berg M., de Kroon Y. E. Role of tumor necrosis factor-alpha and interleukin-10 gene polymorphisms in irritable bowel syndrome // Am J Gastroenterol. 2005. 100. Р. 2510–2516.
- Dunlop S. P., Jenkins D., Spiller R. C. Distinctive clinical, psychological, and histological features of postinfective irritable bowel syndrome // Am J Gastroenterol. 2003. 98. Р. 1578–1583.
- Dunlop S. P., Coleman N. S., Blackshaw E. et al. Abnormalities of 5-hydroxytryptamine metabolism in irritable bowel syndrome // Clin Gastroenterol Hepatol. 2005. 3. Р. 349–357.
- Adam B Liebregts T., Gschossmann J. M. et al. Severity of mucosal inflammation as a predictor for alterations of visceral sensory function in a rat model // Pain. 2006. 123. Р. 179–186.
- Rogers J., Henry M. M., Misiewicz J. J. Increased segmental activity and intraluminal pressures in the sigmoid colon of patients with the irritable bowel syndrome // Gut. 1989. 30. Р. 634–641.
- Ritchie J. Pain from distension of the pelvic colon by inflating a balloon in the irritable colon syndrome // Gut. 1973. 14. Р. 125–132.
- Marshall J. K., Thabane M., Garg A. X. et al. Incidence and epidemiology of irritable bowel syndrome after a large waterborne outbreak of bacterial dysentery // Gastroenterology. 2006. 131. Р. 445–450.
- Neal K. R., Hebden J., Spiller R. Prevalence of gastrointestinal symptoms six months after bacterial gastroenteritis and risk factors for development of the irritable bowel syndrome: postal survey of patients // BMJ. 1997. 314. Р. 779–782.
- Wang L. H., Fang X. C., Pan G. Z. Bacillary dysentery as a causative factor of irritable bowel syndrome and its pathogenesis // Gut. 2004. 53. Р. 1096–1101.
- Connor B. A. Sequelae of traveler’s diarrhea: focus on postinfectious irritable bowel syndrome // Clin Infect Dis. 2005. 41 (suppl 8). S. 577-S586.
- Sykes M. A., Blanchard E. B., Lackner J. et al. Psychopathology in irritable bowel syndrome: support for a psychophysiological model // J Behav Med. 2003. 26. Р. 361–372.
- Parry S. D., Stansfield R., Jelley D. et al. Does bacterial gastroenteritis predispose people to functional gastrointestinal disorders? A prospective, community-based, case-control study // Am J Gastroenterol. 2003. 98. Р. 1970–1975.
- Spence M. J., Moss-Morris R. The cognitive behavioural model of irritable bowel syndrome: a prospective investigation of patients with gastroenteritis // Gut. 2007. 56. Р. 1066–1071.
- Dunlop S. P., Jenkins D., Neal K. R., Spiller R. C. Relative importance of enterochromaffin cell hyperplasia, anxiety, and depression in postinfectious IBS // Gastroenterology. 2003. 125. Р. 1651–1659.
- Gwee K. A., Leong Y. L., Graham C. et al. The role of psychological and biological factors in postinfective gut dysfunction // Gut. 1999. 44. Р. 400–406.
- Quigley E., Fried M., Gwee K. A. at al. Практические рекомендации Всемирной гастроэнтнрологической организации. Синдром раздраженного кишечника: глобальные перспективы. 20 апреля 2009. http://www.worldgastroenterology.
- Tuteja A. K., Talley N. J., Gelman S. S. et al. Development of functional diarrhea, constipation, irritable bowel syndrome, and dyspepsia during and after traveling outside the USA // Dig Dis Sci. 2008. 53. Р. 271–276.
- Neal K. R., Hebden J., Spiller R. Prevalence of gastrointestinal symptoms six months after bacterial gastroenteritis and risk factors for development of the irritable bowel syndrome: postal survey of patients // BMJ. 1997; 314: 779–782.
- Dunlop S. P., Jenkins D., Spiller R. C. Age-related decline in rectal mucosal lymphocytes and mast cells // Eur J Gastroenterol Hepatol. 2004. 16. Р. 1011–1015.
- Thabane M., Kottachchi D. T., Marshall J. K. Systematic review and meta-analysis: The incidence and prognosis of post-infectious irritable bowel syndrome // Aliment Pharmacol Ther. 2007. Aug. 15. 26 (4). Р. 535–544.
- Herbert L. DuPont. Postinfectious Irritable Bowel Syndrome: Clinical Aspects, Pathophysiology, and Treatment // Practical Gastroenterology. 2007. Volume XXXI. Issue 9. Р. 18–24.
- Baker D. E. Loperamide: a pharmacological review // Rev Gastroenterol Disord. 2007. 7 (suppl 3). S. 11-S18.
- Viera J. A., Hoag S., Shaugnessy J. Management of Irritable Bowel Syndrome // Am Fam Physician. 2002. Nov. 15. 66 (10). Р. 1867–1875.
- Sharara A. I., Aoun E., Abdul-Baki H. et al. A randomized double-blind placebo-controlled trial of rifaximin in patients with abdominal bloating and flatulence // Am J Gastroenterol. 2006. 101. Р. 326–333.
- Pimentel M., Park S., Mirocha J. et al. The effect of a nonabsorbed oral antibiotic (rifaximin) on the symptoms of the irritable bowel syndrome: a randomized trial // Ann Intern Med. 2006 145. Р. 557–563.
- National Collaborating Centre for Nursing and Supportive Care. Irritable bowel syndrome in adults. Diagnosis and management of irritable bowel syndrome in primary care. London (UK): National Institute for Health and Clinical Excellence (Clinical guideline; no. 61). 2008, Feb. 881 p.
- Ford A. C., Talley N. J., Spiegel M. R. et al. Effect of fibre, antispasmodics, and peppermint oil in the treatment of irritable bowel syndrome: systematic review and meta-analysis // BMJ. 2008. 337. 2313.
- Quartero A. O., Meineche-Schmidt V., Muris J. et al. Bulking agents, antispasmodic and antidepressant medication for the treatment of irritable bowel syndrome // Cochrane Database of Systematic Reviews. 2005 (2). CD003460.
- Wesdorp I. The central role of Ca++ as mediator of gastrointestinal motility. In: Calcium antagonism & Gastrointestinal motility // Experta Medica. 1989. P. 20–27.
- McCallum R. W. The role of calcium and calcium antagonism in motility disorders of the gastrointestinal tract. In: Calcium antagonism & Gastrointestinal motility // Experta Medica. 1989. P. 28–31.
- Guslandi М. The clinical pharmacological profile of pinaverium bromide // Minerva Med. 1994. Apr. 85 (4). Р. 179–85.
- Wittmann T., Feher A., Rosztoczy A., Janosi J. Effectiveness of pinaverium bromide therapy on colonic motility disorders in irritable bowel syndrome // Orv Hetil. 1999. Feb 28. 140 (9). Р. 469–73.
- Awad R. A., Cordova V. H., Dibildox M. et al. Reduction of post-prandial motility by pinaverium bromide a calcium channel blocker acting selectively on the gastrointestinal tract in patients with irritable bowel syndrome // Acta Gastroenterol Latinoam. 1997. 27 (4). Р. 247–51.
- Christen M. O. Action of pinaverium bromide, a calcium-antagonist, on gastrointestinal motility disorders // General Pharmacology: The Vascular System. 1990 V. 21. Issue 6. P. 821–825.
А. А. Самсонов*, доктор медицинских наук, профессор
Е. Ю. Плотникова**, доктор медицинских наук, профессор
М. В. Борщ***
*ГБОУ ВПО МГМСУ Минздравсоцразвития России, Москва
**ГБОУ ВПО КемГМА Минздравсоцразвития России, Кемерово
***МБЛПУ ГКБ № 1, Новокузнецк
Контактная информация об авторах для переписки: eka-pl@rambler.ru
Современные возможности эффективного лечения ротавирусной инфекции у детей раннего возраста (результаты двойного слепого плацебоконтролируемого исследования лечебной эффективности анаферона детского)
Статьи
Опубликовано в журнале:
«Педиатрия » № 1, Том 91 2012
Н.Х. Тхакушинова, Н.Г. Соболева
Специализированная клиническая детская инфекционная больница, г. Краснодар, РФ
В ходе двойного слепого плацебоконтролируемого исследования у детей в возрасте от 2 до 3 лет со среднетяжелой формой ротавирусной инфекции (РВИ) доказана клиническая и противовирусная эффективность препарата Анаферон детский. Установлено, что 5-дневный курс лечения Анафероном детским, назначенный в течение первых 48 ч от начала заболевания в комплексе с базисными патогенетическими средствами, приводил к значимому сокращению длительности симптомов РВИ — рвоты, диареи, явлений метеоризма, болевого синдрома, лихорадки и других проявлений токсикоза, а также катаральных явлений со стороны респираторного тракта, по сравнению с плацебо-терапией, проводимой на фоне базисного лечения. Положительная динамика клинической картины сочеталась с ускорением элиминации ротавируса (РВ) из желудочно-кишечного тракта, что подтверждалось отрицательным результатом иммуноферментного анализа на антиген РВ у 90% детей на 5-е сутки лечения.
Ключевые слова: дети раннего возраста, ротавирусная диарея, вирусный гастроэнтерит, Анаферон детский.
Double-blind placebo-controlled trial performed in children aged 2-3 years with moderate rotaviral infection (RVI) proved clinical and anti-viral effect of Anaferon for children. The study showed that 5-days course of Anaferon for children started within 48 hours after RVI manifestation in combination with basic pathogenetic treatment, leaded to significant reduce of such RVI signs as vomit, diarrhea, flatulence, abdominal pain, fever and other signs of infectious toxicosis and catarrhal changes of respiratory tract in comparison with control group, receiving basic treatment and placebo. Positive dynamic of clinical presentations was associated with accelerated Rotaviruc (RV) clearance from gastrointestinal tract, which was confirmed by negative result of immunoassay on RV antigen in 90% of patients after 5 days of treatment.
Key words: infants, rotaviral diarrhea, viral gastroenteritis, Anaferon for children.
Острые кишечные инфекции (ОКИ) занимают ведущее место среди инфекционной патологии, уступая по частоте лишь гриппу и острым респираторным заболеваниям [1-3]. По данным международной статистики, до 70% гастроэнтеритов вызываются вирусами, причем основное значение среди вирусных диарей у детей принадлежит ротавирусной инфекции (РВИ) [4-8]. По оценкам экспертов ВОЗ, практически каждый ребенок в течение первых 5 лет жизни переносит ротавирусный гастроэнтерит. Дети младше 3 лет составляют до 70-80% заболевших РВИ [4, 5, 7, 8]. Спорадические заболевания РВИ регистрируются в течение всего года, однако большинство заболеваний, в отличие от других ОКИ, регистрируется в зимне-весенний период [6, 7]. Отчасти это объясняется высокой устойчивостью ротавирусов (РВ) во внешней среде, особенно при замораживании.
В течение последних 10 лет в Краснодарском крае возрос удельный вес РВИ в структуре ОКИ у детей от 0 до 14 лет. Соотношение РВИ к ОКИ бактериальной этиологии увеличилось от 1:10 в 2001 г. до 1:2,5 в 2010 г., что связано прежде всего с широким внедрением методов вирусологической диагностики. Повсеместное распространение в регионе имеют 4 серотипа РВ группы А (P8G1, P8G3, P8G4, P4G2), чаще всего вызывающие развитие ротавирусной диареи.
РВ, поражающие «зрелый» эпителий микроворсинок тонкого кишечника, приводят к развитию дисахаридазной недостаточности. Не всосавшиеся вещества с высокой осмотической активностью нарушают реабсорбцию воды и электролитов, следствием чего является водянистая диарея — основной симптомом РВИ [4, 5]. Важно, что диарея возникает уже при низких уровнях вирусной нагрузки, поскольку воспалительные изменения в слизистой оболочке кишечника не играют роли в ее развитии [9, 10].
Ведущую роль в противовирусной защите, начиная с самого раннего этапа проникновения РВ в слизистую оболочку желудочно-кишечного тракта (ЖКТ), принадлежит системе интерферонов (ИФН). Благодаря ингибированию процессов транскрипции и трансляции вирусных матриц они способны подавлять репликацию многих РНК- и ДНК-содержащих вирусов [9, 11].
В настоящее время в педиатрической практике широко применяется индуктор эндогенных ИФН — Анаферон детский, разработанный специально для лечения вирусных инфекций у детей [12-14].
Принимая во внимание имеющийся опыт применения Анаферона детского при лечении кишечных инфекций вирусной этиологии [15], в настоящем исследовании мы оценивали эффективность данного препарата при лечении РВИ у детей раннего возраста. Клиническая эффективность Анаферона детского в лечении РВИ изучали в ходе рандомизированного двойного слепого плацебоконтролируемого клинического исследования (КИ) в параллельных группах. С целью оценки противовирусной активности препарата проводили исследование вирусовыделения в динамике наблюдения.
Материалы и методы исследования
Под нашим наблюдением находились 137 детей в возрасте от 1 месяца до 6 лет, поступивших в Специализированную клиническую детскую инфекционную больницу г. Краснодара по поводу РВИ средней степени тяжести. В КИ включали детей в возрасте от 2 до 3 лет, поступивших в стационар не позднее 2 суток от начала заболевания, у которых выявлялся синдром поражения ЖКТ по типу гастроэнтерита в сочетании с повышением температуры тела >38°C, интоксикационным синдромом и катаральными явлениями со стороны верхних дыхательных путей.
После подписания информированного согласия родителями/законными представителями пациента на этапе скрининга пациентам проводили начальное обследование, включавшее сбор данных анамнеза, оценку витальных функций, физикальное и лабораторное обследования. Этиологию заболевания подтверждали обнаружением антигенов РВ в фекалиях с помощью иммуноферментного анализа (ИФА) до начала терапии. Кроме РВ (54%), методом ИФА в фекалиях больных выявляли аденовирусы (11,7%), норовирусы (14,6%), сальмонеллы (8,8%), микст-инфекцию (РВ+другие возбудители — 10,9%). В ходе исследования пациент ежедневно осматривался врачом, фиксировали температуру тела, кратность рвоты и стула, степень выраженности других симптомов заболевания.
Пациентов не включали в КИ при подозрении/ наличии бактериальной инфекции или тяжелого заболевания, требующего назначения антибактериальных препаратов, обострении или декомпенсации хронических заболеваний, поливалентной аллергии в анамнезе.
Всем больным назначали базисную патогенетическую терапию: диетотерапию, оральную регидратацию, энтеросорбенты, дезинтоксикационные средства; кроме того, использовали пробиотики и биопрепараты, прокинетики, ферментативные препараты, отхаркивающие средства.
После включения в КИ пациентов рандомизировали в группу приема Анаферона детского либо группу плацебо. Анаферон детский/плацебо назначали по схеме: в первые сутки лечения -8 таблеток (в первые 2 ч по 1 таблетке каждые 30 мин, затем в оставшееся время суток еще 3 раза через равные промежутки времени), со 2-х по 5-е сутки препарат принимали 3 раза в день.
В окончательный анализ вошли результаты наблюдения 53 пациентов, которые соответствовали всем критериям включения, и у них отсутствовали все критерии исключения. Группу Анаферона детского составили 33 пациента, группу плацебо — 20 детей. Обе группы исходно были сопоставимы по всем демографическим и клинико-лабораторным данным, включая возраст (2-3 года), тяжесть заболевания (среднетяжелые формы), топике поражения кишечника (гастроэнтерит), этиологии (РВИ) и типу диареи («секреторная»).
Эффективность лечения в обеих группах оценивали на основании выраженности и длительности каждого из симптомов РВИ.
Статистическую обработку данных проводили с помощью статистического пакета Statistica 6.0 (StatSoft Inc.). Использовали методы параметрической (для непрерывных и интервальных переменных) и непараметрической (частотный анализ по категориальным переменным) статистики.
Результаты и их обсуждение
Основными гастроинтестинальными симптомами у пациентов обеих групп были рвота (92%) и диарея (100%). Рвота появлялась одновременно с диареей или опережала ее, у 66% больных она была повторной и многократной (до 5-7 раз в сутки). Диарея выявлялась у всех детей; стул был обильным, водянистым, желтого цвета, без видимых патологических примесей; кратность дефекации колебалась от 3 до 8 раз в сутки. Более чем у половины пациентов клиническая картина заболевания проявлялась болевым абдоминальным синдромом (55%), вздутием живота (60%), урчанием по ходу кишечника (89%), метеоризмом (60%). Лихорадка выше 39 0С отмечалась у 9% больных, у остальных детей повышение температуры тела было в пределах 38,1-39 0С. У всех пациентов при поступлении в клинику выявлялись признаки эксикоза умеренной степени выраженности, синдром интоксикации в виде вялости, адинамии, снижения аппетита и умеренные катаральные проявления со стороны верхнего отдела респираторного тракта (затрудненное носовое дыхание, ринорея, кашель).
Анализ полученных результатов показал, что применение Анаферона детского в комплексе базисной терапии приводило к более быстрой положительной клинической динамике (рис. 1, 2). Так, уже на 2-й день лечения у 80% пациентов прекратилась рвота (против 60% в группе плацебо; р<0,05), на 3-и сутки она отмечалась лишь у 5% детей (против 25% детей группы плацебо; р<0,05).
Рис. 1. Частота выявления рвоты в 1-5-й дни лечения наблюдаемых пациентов.
Здесь и на рис. 4 и 5: 1-й столбик — Анаферон детский, 2-й столбик — плацебо.
В группе больных, получавших Анаферон детский, уже к концу первых суток терапии в 55%, а на 2-й день — в 88% случаев водянистый характер стула сменился на кашицеобразный (против 15 и 39% в группе плацебо соответственно; р<0,05). Одновременно с более быстрой нормализацией характера стула происходило сокращение и его частоты (рис. 2). На 2-е сутки применения Анаферона детского 45% пациентов имели однократный стул, на 3-й день эта цифра достигла 65%, на 4-й — 75% (против 20; 40 и 50% в группе плацебо соответственно; р<0,05).
На рис. 3 представлена динамика среднесуточных значений температуры тела у пациентов обеих групп, которая отражает позитивное влияние Анаферона детского в комплексной терапии РВИ. Результатом включения препарата в схему лечения явилась более быстрая нормализация температуры тела, которая прогрессивно снижалась в течение первых 2 суток от начала терапии.
Частота регистрации других симптомов заболевания в двух сравниваемых группах также была в пользу Анаферона детского. В группе Анаферона значимо быстрее нивелировались такие симптомы, как сниженный аппетит, боли в животе, метеоризм, катаральные явления со стороны верхних дыхательных путей (ринит и сухой кашель). Частота выявления этих признаков РВИ на 3-и сутки наблюдения в зависимости от вида терапии представлена на рис. 4.
Итогом применения Анаферона детского в комплексе терапии РВИ явилась более быстрая обратная динамика всех симптомов инфекционно-воспалительного процесса. Уже на 3-й день лечения у 65% пациентов наступило клиническое выздоровление, а к 5-м суткам все дети данной группы клинически были здоровы.
Рис. 2. Число пациентов с нормальной частотой стула в 1-5-й дни лечения.
Здесь и на рис. 3: а — Анаферон детский, б — плацебо.
Рис. 3. Динамика температурной кривой в 1-5-й дни лечения наблюдаемых пациентов.
Отмеченная положительная динамика клинической картины РВИ на фоне терапии Анафероном детским сочеталась и во многом объяснялась быстрой элиминацией РВ из ЖКТ. Повторное исследование методом ИФА на 5-е сутки лечения свидетельствовало о том, что у 90% детей вирусовыделение прекращалось. Комплекс базисной терапии без включения Анаферона детского не позволял достичь подобного результата и антиген РВ в копрофильтрате повторно определялся у 40% пациентов группы плацебо (рис. 5).
Следует подчеркнуть, что в группе Анаферона детского нежелательных явлений зарегистрировано не было, все дети хорошо перенесли курс лечения, что еще раз подтвердило известную безопасность этого лекарственного средства.
Рис. 4. Частота выявления некоторых симптомов РВИ на 3-й день лечения наблюдаемых пациентов.
Рис. 5. Частота вирусовыделения в копрофильтратах в зависимости от вида терапии в динамике наблюдения.
Заключение
Таким образом, проведенное КИ показало, что включение на ранних сроках в комплексную терапию РВИ Анаферона детского обладает выраженной терапевтической эффективностью. Доказано положительное влияние препарата на длительность и степень выраженности основных клинических симптомов РВИ — рвоты, диареи, явлений метеоризма, болевого синдрома, лихорадки и других проявлений токсикоза, а также катаральных изменений со стороны респираторного тракта. Клиническая эффективность Анаферона детского обусловлена его активирующим влиянием на противовирусную резистентность и иммунный ответ [8, 12, 13, 15], что обеспечивает ускоренную санацию организма от РВ, несмотря на известную склонность последнего к длительной персистенции [5, 6, 8]. Применение Анаферона детского в течение 5-дневного курса терапии приводило к элиминации вируса у 90% больных. Полученная противовирусная эффективность объясняется хорошо изученными и описанными эффектами препарата на продукцию ИФН α/γ и рецепцию ИФНγ, а также функциональную активность фагоцитов и NK-клеток [8, 12, 13, 15]. Интерфероногенная активность Анаферона детского, как доказано в многочисленных исследованиях, в том числе при РВИ у детей [8], оказывает позитивное влияние на различные звенья гуморального и клеточного противовирусного иммунного ответа: повышает продукцию антител (включая секреторный IgA), активизирует функции Т-эффекторов, Т-хелперов, повышает выработку цитокинов T-хелперами первого (ИФНγ, ИЛ2) и второго (ИЛ4, 10) типа, нормализует (модулирует) их баланс. Итогом антивирусной и иммуномодулирующей активности Анаферона детского при РВИ является снижение концентрации вируса в пораженных тканях ЖКТ и повышение скорости элиминации вируса.
Быстрая санация организма на фоне лечения Анафероном детским имеет важное значение и для конкретного пациента, и для детской популяции в целом, поскольку предотвращает пролонгированное вирусовыделение реконвалесцентами и способствует снижению уровня спорадической и вспышечной заболеваемости РВИ.
Противовирусная и клиническая эффективность Анаферона детского, а также его безопасность, подтвержденная результатами проведенного исследования, позволяют использовать препарат для лечения вирусных диарей у детей, в том числе, у детей раннего возраста.
Литература
- Atkins KE, Shim E, Pitzer VE, Galvani AP. Impact of rotavirus vaccination on epidemiological dynamics in England and Wales. Vaccine. 2012; 30 (3): 552-564.
- Kamiya H, Nakano T, Kamiya H, et al. The Rotavirus Epidemiology Study Group. Rotavirus-Associated Acute Gastroenteritis Hospitalizations among Japanese Children Aged<5 Years: Active Rotavirus Surveillance in Mie Prefecture, Japan. Jpn. J. Infect. Dis. 2011; 64 (6): 482-487.
- Tai IC, Huang YC, Lien RI, et al. Clinical manifestations of a cluster of rotavirus infection in young infants hospitalized in neonatal care units. J. Microbiol. Immunol. Infect. 2011. Dec. 9. [http://www.sciencedirect.com/science/article/ pii/S1684118211001782].
- Wilhelmi I, Roman Е, Sanchez-Fauquier А. Viruses causing gastroenteritis. Clin. Microbiol. Infect. 2003; 9: 247-262.
- Guarino A, Dupont C, Gorelov AV, et al. The management of acute diarrhea in children in developed and developing areas: from evidence base to clinical practice. Expert. Opin. Pharma-cother. 2012; 13 (1): 17-26.
- Васильев Б.Я., Васильева Р.И., Лобзин Ю.В. Острые кишечные заболевания. Ротавирусы и ротавирусная инфекция. СПб.: Лань, 2000: 267 с.
- Учайкин В.Ф. Решенные и нерешенные проблемы инфекционной патологии у детей. Детские инфекции. 2003; 4: 3-7.
- Тихомирова О.В., Сергеева Н.В., Агсенов ОА. Рота-вирусная инфекция у детей. Рос. вестн. перинатологии и педиатрии. 2004; 49 (5): 51-56.
- Yu TH, Tsai CN, Lai MW, еt al. Antigenemia and cytokine expression in rotavirus gastroenteritis in children. J. Microbiol. Immunol. Infect. 2011. Dec. 12. [http://www.sciencedirect.com/ science/article/pii/S1684118211002325].
- Lunch М, Shieh WJ, Tatti K, et al. The pathology of rotavirus-associated deaths, using new molecular diagnostics. Clin. Infect. Dis. 2003; 37: 1327-1333.
- Ершов Ф.И., Киселев О.И. Интерфероны и их индукторы. М.: Гэотар-Медиа, 2005: 356 с.
- Эпштейн О.И. Сверхмалые дозы (история одного исследования). М.: Изд-во РАМН, 2008: 336 с.
- Dugina Y, Tarasov S, Elfimova U, et al. Clinical efficacy of anaferon, a novel oral antibody therapeutic, in pediatric acute viral gastroenteritis. 25th International Congress of Pediatrics. Athens — Greece, 2007: 526.
- Martyushev-Poklad AV, Sergeeva SA, Dugina JL, Epstein OI. Anaferon an oral anti-interferon gamma antiviral clinical efficacy in common pediatric viral infections. Acta Pharmacologica Sinica. 2006; 27 (Suppl. 1): 52.
- Тихомирова О.В., Ныркова О.И., Раздьяконова И.В. и др. Место противовирусной терапии в лечении острых кишечных инфекций у детей. Детские инфекции. 2008; 4: 51-55.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Правильное, сбалансированное содержание белков, жиров и углеводов является ключом к здоровью на долгие годы. Продукты не способны в полной мере обеспечить организм человека всем необходимым. Есть целый перечень лекарств, которые помогают держать себя в хорошей форме и не болеть от легкого дуновения ветра.
Предлагаем список лучших пробиотиков. Перед началом терапии рекомендуется проконсультироваться с врачом, чтобы исключить наличие противопоказаний и правильно рассчитать дозировку.
Полезные свойства
Пробиотики – живые микроорганизмы, которые могут принести пользу человеку. В большинстве случаев это бактерии, но могут быть и другие представители микробов (например, дрожжи). Пробиотики несут пользу для кишечника, нормализуя микрофлору и устраняя дисбактериоз.
Даже лучшие пробиотики для восстановления микрофлоры нужно принимать правильно, чтобы достичь заявленного производителем результата:
- пить за час до еды;
- курс терапии – до полного исчезновения симптомов;
- запивать небольшим количеством воды.
Лечение дисбактериоза должно проводиться в несколько этапов. Пробиотики первого поколения принимать от 2 до 4 недель, второго – от 5 до 7 дней, третьего и четвертого – не более 7 дней.
Нормы и различные вариации
Пробиотики колонизируют кишечник полезными бактериями, противодействуют патогенной (вредной) флоре, вызывающей запор или диарею, повышают иммунитет.
Основную массу бактерий – пробиотиков можно разделить на 2 вида: лакто- и бифидобактерии. В каждом из них существует значительное количество подвидов. Они оказывают то или иное благотворное влияние на организм человека.
Существуют различные типы пробиотиков:
- Монокомпонентные. Первое поколение, содержащее бактерии одного вида (коли- бифидо- или лактосодержащие).
- Антагонисты. Второе поколение, которое включает препараты конкурентного действия. Они не являются представителями естественной микрофлоры желудочно-кишечного тракта.
- Поликомпонентные симбиотики. Третье поколение, которое состоит из более одного штамма полезных микроорганизмов. Они, как правило, усиливают действие друг друга.
- Сорбированные бифидосодержащие. Четвертое поколение отличается наличием активных компонентов, которые обладают выраженным иммуномодулирующим действием.
- Синбиотики. Пятое поколение, содержащее облигатную флору и вещества пребиотического действия.
В зависимости от поколения препарата в рецептуру могут быть включены энтерококки. Названия звучат жутко, но ингредиенты препарата не вредят человеку. Продукты изготавливаются в сухом и жидком виде.
Отклонения от нормы
Многие из необходимых микроорганизмов находятся в ежедневной пище (молочные продукты, овощи, фрукты), но в некоторых случаях необходим дополнительный прием пробиотиков:
- частые простуды для укрепления иммунной системы;
- синдром раздраженного кишечника для улучшения подвижности и восстановления слизистой оболочки кишечника;
- пищевая аллергия (бактерии образуют защитный слой, который предотвращает проникновение аллергена в кровь);
- непереносимость лактозы;
- дефицит витаминов B, H или K;
- во время грудного вскармливания (пробиотики положительно влияют на здоровье матери и ребенка);
- после приема антибиотиков для восстановления микрофлоры.
Непатогенные живые микроорганизмы поддерживают синтез интерферона, снимая симптомы аллергии. Действующие компоненты нейтрализуют бактерии Helicobacter Pylori, которые вызывают язвенную болезнь желудка.
Чем отличаются пробиотики от пребиотиков?
Обе группы биоактивных препаратов разработаны для восстановления полезной микрофлоры кишечника. Но их действие несколько различно, т. к. они имеют различную биологическую структуру:
- Пробиотики. Состоят из дрожжей, бифидо- и лактобактерий. В норме в небольшом количестве они населяют организм человека, помогая усваивать питательные вещества и переваривать пищу.
- Пребиотики. Включают фруктозоолигосахариды, низкомолекулярные углеводы, лактулозу и инсулин. В достаточном количестве можно получить из таких продуктов питания, как чеснок, бананы, крупы и горох.
Могут ли навредить пробиотики?
Пробиотики практически не имеют противопоказания. Не рекомендуется принимать при онкологических заболеваниях, поражении лимфатический и кровеносной системы, ВИЧ. С осторожностью рекомендуется принимать в период беременности и лактации. Маленьким детям допустимо давать только те препараты, которые не имеют возрастных ограничений.
Как выбрать пробиотики для кишечника?
Лучшие пробиотики для восстановления кишечника может посоветовать только врач. Должны быть учтены основные критерии: возраст пациента, состояние организма, характер дисфункций, противопоказания и пр. Самолечение может не дать должного результата и привести к развитию проблем со здоровьем.
В список препаратов включены лучшие пробиотики для восстановления микрофлоры кишечника. Рейтинг основан на эффективности, безопасности и соотношении цена-качество.
№1 – «Нормофлорин-Д» (Бифилюкс, Россия)
Биологически активная добавка разработана на основе лактобактерий и их метаболитов. Используется в комплексном лечении язвы двенадцатиперстной кишки и желудка, при ожирении и метаболическом синдроме. Назначается после антибактериальной терапии для восстановления нарушенного микробиоценоза.
№2 – «Бифиформ» (Ferrosan, Дания)
Противодиарейный препарат регулирует равновесие микрофлоры кишечника. Содержит Bifidobacterium longum и Enterococcus faecium. МИБП-эубиотик назначается при непереносимости лактозы, для восстановления микрофлоры кишечника и для лечения хеликобактерной инфекции в составе комплексной терапии.
№3 – «Линекс» (Lek d. d., Словения)
Находится в первых рядах списка пробиотиков для кишечника. Основные активные компоненты этого препарата стимулируют изменение рН путем брожения лактозы. Это тормозит развитие патогенных и условно-патогенных микроорганизмов и создает благоприятные условия для пищеварительных ферментов.
Активные вещества, входящие в «Линекс» устойчивы к антибиотикам. Они оказывают влияние не только на нижние отделы кишечника, но и на верхние (этими свойствами обладают далеко не все пробиотики). Многокомпонентное средство, пригодно практически для всех пациентов, включая детей (даже тех, кто находится на искусственном питании).
№4 – «Хилак Форте» (Merckle, Германия)
Комбинированный препарат для нормализации кислотности желудка в соответствии с физиологической нормой. Биологически восстанавливает микрофлору кишечника. Таким образом, создает неблагоприятную среду для жизнедеятельности патогенных и условно-патогенных бактерий.
№5 – «Линекс Форте» (Sandoz, Словения)
Пробиотик регулирует равновесие микрофлоры кишечника. Разработан на основе молочнокислых живых бактерий, которые представляют собой составляющие естественной микрофлору. Широко используется при дисбактериоза, запорах и хеликобактериозе у детей и взрослых.
№6 – «Бифидумбактерин» (Ланафарм, Россия)
Лучший пробиотик для восстановления микрофлоры, который устойчив ко многим лекарственным средствам и антибиотикам. «Бифидумбактерин» является антагонистом достаточно широкого спектра болезнетворных и условно болезнетворных микроорганизмов. Выпускается в форме ректальных суппозиториев и капсул.
Эффективность препарата обусловлена сильной концентрацией бифидобактерий. Быстро нормализует микрофлору кишечника, которая, будучи естественной, накапливает токсические вещества (как поступающие в организм извне, так и находящиеся в нем) и разлагает их на нетоксичные компоненты. Нельзя давать детям, страдающим непереносимостью молочных продуктов.
№7 – «Бак-Сет Форте» (Probiotics International, Великобритания)
Мульти-пробиотик нового поколения, который включает в состав 14 видов пробиотических живых бактерий. Они дополняют действие друг друга, устраняя проблемы с пищеварением у детей от 3-х летнего возраста и у взрослых. Усовершенствованная микрокапсулированная технология способствует сохранению полезных свойств бактерий на протяжении всего срока хранения препарата.
№8 – «Бифиформ Баланс» (Pfizer, Россия)
Один из лучших пробиотиков для восстановления микрофлоры кишечника. разработан на основе лакто- и бифидобактерий. Биологически активная добавка к пище назначается для лечения дисбактериоза различной этиологии и поддерживает микрофлору кишечника. Способствует коррекции функциональных нарушений желудочно-кишечного тракта.
№9 – «Флорин Форте» (Партнер, Россия)
Лакто- и бифидобактерии, входящие в состав, принимают участие в процессах синтеза аскорбиновой кислоты, калия, витаминов группы В. В результате повышается устойчивость к агрессивным воздействиям окружающей среды. Также действующие компоненты участвуют в обменных процессах желчных кислот и пигментов. В их присутствии происходит синтез веществ, оказывающих антибактериальное действие. Также препарат повышает иммунную-реактивность человеческого организма.
№10 – «Бактериофаг» (Микроген НПО, Россия)
Стафилококковый раствор входит в список лучших пробиотиков для кишечника для взрослых и детей. Используется преимущественно в составе комплексной терапии с антибактериальными препаратами и другими лекарственными средствами.
№11 – «Секстафаг» (Микроген НПО, Россия)
Завершает список препаратов пробиотиков для кишечника. Иммунобиологический препарат специфически лизирует бактерии стрептококков и стафилококков, протеи, кишечной и синегнойной палочки. Назначается при энтеральных и гнойно-воспалительных заболеваниях. При необходимости может быть использован в составе комплексной терапии.
Выводы
Пробиотические средства нормализуют процессы пищеварения, активируя перистальтику кишечника и восстанавливая микрофлору. Препараты способствуют синтезу полиаминов, укрепляют клеточный цитоскелет и регенерируют кишечный эпителий, повышая защитные функции организма. Они не только уменьшают газообразование, н и тормозят рост вредоносных микроорганизмов.
Какие пробиотики принимать в том или ином случае может посоветовать врач. Специалист отталкивается от показаний и общего состояния организма пациента, исключая развитие передозировки или побочных реакций.
Литература:
https://www.vidal.ru/drugs/clinic-pointer/11.12.01.01
https://medi.ru/info/15562/
https://www.rlsnet.ru/fg_index_id_626.htm
https://medi.ru/spisok/probiotiki/
Викс День и Ночь (Vicks Day and Night)
💊 Состав препарата Викс День и Ночь
✅ Применение препарата Викс День и Ночь
Описание активных компонентов препарата
Викс День и Ночь
(Vicks Day and Night)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2020.03.19
Владелец регистрационного удостоверения:
Код ATX:
N02BE51
(Парацетамол в комбинации с другими препаратами, кроме психолептиков)
Активные вещества
-
дифенгидрамин
(diphenhydramine)
Rec.INN
зарегистрированное ВОЗ -
парацетамол
(paracetamol)
Rec.INN
зарегистрированное ВОЗ -
фенилэфрин
(phenylephrine)
Rec.INN
зарегистрированное ВОЗ
Лекарственная форма
| Викс День и Ночь |
Таб. 650 мг+10 мг, 25 мг+500 мг: 16 шт. рег. №: ЛП-006018 |
Форма выпуска, упаковка и состав
препарата Викс День и Ночь
Таблетки, покрытые пленочной оболочкой , «День» желтого цвета, овальные, двояковыпуклые, с перламутровым отблеском; на поперечном разрезе ядро от белого до почти белого цвета.
Вспомогательные вещества: кроскармеллоза натрия — 18 мг, целлюлоза микрокристаллическая тип 101 — 116.5 мг, целлюлоза микрокристаллическая тип 102 — 56.27 мг, коповидон — 46 мг, кремния диоксид коллоидный — 9.43 мг, магния стеарат — 13.8 мг.
Пленочная оболочка: ШеффКоат Бриллиант Йеллоу (SheffCoat Brilliant Yellow) — 22 мг (гипромеллоза — 13.64 мг, тальк — 2.2 мг, триацетин — 1.76 мг, краситель перламутровый (титана диоксид/слюда) — 3.85 мг, краситель железа оксид желтый — 0.55 мг).
Таблетки, покрытые пленочной оболочкой, «Ночь» голубого цвета, с перламутровым отблеском, круглые, двояковыпуклые, с фаской; на поперечном разрезе ядро от белого до почти белого цвета.
Вспомогательные вещества: кроскармеллоза натрия — 14.2 мг, целлюлоза микрокристаллическая тип 101 — 100 мг, целлюлоза микрокристаллическая тип 102 — 46.3 мг, коповидон — 25 мг, кремния диоксид коллоидный — 7.25 мг, магния стеарат — 7.25 мг.
Пленочная оболочка: ШеффКоат Бриллиант Блу (SheffCoat Brilliant Blue) — 22 мг (гипромеллоза — 13.64 мг, тальк — 3.3 мг, триацетин — 1.76 мг, краситель перламутровый (титана диоксид/слюда) — 3.17 мг, индигокармин — 0.13 мг).
16 шт. (12 таблеток «День» и 4 таблетки «Ночь») — блистеры (1) — пачки картонные.
Фармакологическое действие
Комбинированное лекарственное средство.
Парацетамол — анальгетик-антипиретик. Обладает анальгезирующим, жаропонижающим и слабым противовоспалительным действием. Механизм действия связан с ингибированием синтеза простагландинов, преимущественным влиянием на центр терморегуляции в гипоталамусе.
Фенилэфрин — альфа1-адреномиметик, вызывает сужение сосудов, устраняет отечность и гиперемию слизистой оболочки полости носа.
Дифенгидрамин — блокатор H1-гистаминовых рецепторов I поколения, обладает выраженной антигистаминной активностью, уменьшает и предупреждает вызываемые гистамином спазмы гладкой мускулатуры, повышение проницаемости капилляров, отек тканей, зуд и гиперемию.
Фармакокинетика
Парацетамол быстро и практически полностью всасывается из ЖКТ. Cmax в плазме достигается через 10-60 мин после приема внутрь. Распределяется в большинстве тканей организма. Проникает через плацентарный барьер, выделяется с грудным молоком. В терапевтических концентрациях связывание с белками плазмы незначительное, но возрастает при увеличении концентрации. Подвергается первичному метаболизму в печени. Выводится в основном с мочой в виде глюкуронидов и сульфатов. T1/2 составляет от 1 до 3 ч.
Фенилэфрин всасывается из ЖКТ. Метаболизируется при «первом прохождении» через стенку кишечника и в печени, поэтому при приеме внутрь фенилэфрина гидрохлорид характеризуется ограниченной биодоступностью. Cmax в плазме достигается в интервале от 45 мин до 2 ч. Выводится почками почти полностью в виде сульфатных соединений. T1/2 составляет 2-3 ч.
Дифенгидрамин всасывается из ЖКТ, Tmax — 2-2.5 часа. Продолжительность действия составляет 4-8 часов. Подвергается выраженному пресистемному метаболизму. Значения плазменного клиренса лежат в диапазоне от 100 до 1300 мл/мин, T1/2 составляет 3.4-9.3 часов, небольшое количество неизмененного вещества экскретируется с мочой.
Показания активных веществ препарата
Викс День и Ночь
Симптоматическое лечение простудных заболеваний, ОРВИ, гриппа: лихорадочный синдром; болевой синдром; ринорея (острый ринит, аллергический ринит); синусит.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Внутрь. Режим дозирования индивидуальный, в зависимости от показаний, возраста пациента и клинической ситуации.
Побочное действие
Парацетамол
Со стороны крови и лимфатической системы: тромбоцитопения, агранулоцитоз, гемолитическая анемия, нейтропения, лейкопения, панцитопения.
Со стороны иммунной системы: анафилаксия, кожные реакции гиперчувствительности, включая кожную сыпь, ангионевротический отек, синдром Стивенса-Джонсона.
Со стороны дыхательной системы, органов грудной клетки и и средостения: бронхоспазм у пациентов, чувствительных к аспирину и другим НПВС.
Со стороны печени и желчевыводящих путей: нарушение функции печени.
Фенилэфрин
Со стороны сердечно-сосудистой системы: повышение АД, тахикардия, брадикардия, ощущение сердцебиения.
Со стороны ЦНС: бессонница, состояние беспокойства, тремор, тревога, галлюцинации, задержка мочи, головокружение.
Со стороны кожи: очень редко — кожные реакции.
Со стороны пищеварительной системы: очень редко — тошнота, рвота.
Дифенгидрамин
Общие реакции: повышенная утомляемость, потливость, звон в ушах.
Со стороны иммунной системы: реакции гиперчувствительности, включая сыпь, крапивницу, одышку и ангионевротический отек, анафилаксия.
Психические нарушения: спутанность сознания, парадоксальное возбуждение (повышенная энергия, раздражительность, беспокойство).
Со стороны ЦНС: часто — седация, сонливость, расстройство внимания, неустойчивость, головокружение; судороги, головная боль, парестезии, дискинезия.
Со стороны органов чувств: нечеткое зрение.
Со стороны сердечно-сосудистой системы: тахикардия, ощущение сердцебиения.
Со стороны дыхательной системы, органов грудной клетки и и средостения: сгущение бронхиального секрета, затрудненность дыхания, свистящее дыхание, заложенность носа.
Со стороны пищеварительной системы: сухость во рту/ в горле/ в носу, тошнота, рвота.
Со стороны костно-мышечной системы: судороги.
Со стороны мочевыделительной системы: затруднение мочеиспускания, задержка мочи.
Противопоказания к применению
Повышенная чувствительность, выраженная почечная/печеночная недостаточность, гипертиреоз (в т.ч. тиреотоксикоз), заболевания сердца (выраженный стеноз устья аорты, острый инфаркт миокарда, тахиаритмии), артериальная гипертензия, феохромоцитома, стенозирующая язва желудка, беременность, период лактации (грудного вскармливания), одновременный прием трициклических антидепрессантов, бета-адреноблокаторов, одновременный прием ингибиторов МАО (в т.ч. в период 14 дней после их отмены), одновременный прием других парацетамолсодержащих средств и средств для облегчения симптомов «простуды», гриппа и заложенности носа, гиперплазия предстательной железы, затрудненное мочеиспускание, закрытоугольная глаукома, детский возраст до 18 лет.
С осторожностью: у пациентов, страдающих эпилепсией или судорожными припадками, миастенией, задержкой мочи, пилородуоденальной обструкцией, контрактурой шейки мочевого пузыря, бронхиальной астмой, ХОБЛ, алкогольной болезнью печени, не достигающей степени цирроза, нарушением функции печени, хроническим алкоголизмом, почечной недостаточностью (СКФ ≤ 50 мл/мин), синдром Жильбера, гемолитической анемией, дефицитом глутатиона, хронической недостаточности питания, массе тела менее 50 кг, в пожилом возрасте; пациентам страдающим сахарным диабетом.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации (грудного вскармливания).
Применение при нарушениях функции печени
C осторожностью: печеночная недостаточность.
Применение при нарушениях функции почек
C осторожностью: почечная недостаточность.
Применение у детей
Противопоказано детям до 18 лет.
Применение у пожилых пациентов
С осторожностью применять у пациентов пожилого возраста во избежание обострения хронических заболеваний.
Особые указания
С осторожностью применять у пациентов пожилого возраста во избежание обострения хронических заболеваний.
Лекарственное взаимодействие
Использование с другими препаратами, индуцирующими микросомальные ферменты печени, такими как антиконвульсанты, изониазид, рифампицин, ритонавир, зидовудин, хлорамфеникол или оральные контрацептивы, может приводить к ускорению метаболической трансформации парацетамола со снижением его концентрации в плазме крови и более высокой скоростью элиминации.
Скорость всасывания парацетамола увеличивается в присутствии метоклопрамида или домперидона.
Скорость всасывания парацетамола снижается в присутствии холестирамина.
При длительном регулярном приеме парацетамола отмечается увеличение антикоагулянтного эффекта варфарина и прочих производных кумарина, что увеличивает риск развития кровотечения; эпизодическое применение не приводит к каким-либо значимым эффектам.
Пробенецид за счет ингибирования конъюгации парацетамола с глюкуроновой кислотой вызывает снижение клиренса парацетамола почти в 2 раза. При одновременном приеме следует рассмотреть снижение дозы парацетамола.
Хроническая алкогольная интоксикация может увеличивать гепатотоксические эффекты передозировки парацетамола и может стать причиной острого пакреатита. Разовый прием алкоголя может снижать метаболизм больших доз парацетамола, что сопровождается увеличением T1/2 парацетамола из плазмы.
Фенилэфрин может неблагоприятно взаимодействовать с другими симпатомиметическими, сосудорасширяющими средствами, а так же препаратами из группы бета-блокаторов.
Взаимодействие фенилэфрина с ингибиторами МАО может вызвать гипертонический криз, а при взаимодействии с трициклическими антидепрессантами возможно появление артериальной гипертензии или аритмии.
Дифенгидрамин может потенцировать эффекты алкоголя и других веществ, угнетающих нервную систему.
Следует избегать одновременного приема с лекарственными средствами, провоцирующими удлинение интервала QT.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код

![Дифференциальный диагноз с ПИ-СРК [42]](https://www.lvrach.ru/img/default.webp)