Содержание
-
Русское название
-
Английское название
-
Латинское название
-
Химическое название
-
Брутто формула
-
Фармакологическая группа вещества Абемациклиб
-
Нозологическая классификация
-
Фармакологическое действие
-
Фармакология
-
Применение вещества Абемациклиб
-
Противопоказания
-
Ограничения к применению
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Абемациклиб
-
Взаимодействие
-
Передозировка
-
Способ применения и дозы
-
Меры предосторожности
-
Источники информации
-
Торговые названия с действующим веществом Абемациклиб
Русское название
Абемациклиб
Английское название
Abemaciclib
Латинское название
Abemaciclibum (род. Abemaciclibi)
Химическое название
N-(5-((4-этилпиперазин-1-ил-2,3,5,6-13C4-1,4-15N2)метил)пиридин-2-ил)-5-фтор-4-(4-фтор-1-изопропил-2-метил-1H-бензо[d]имидазол-6-ил)пиримидин-2-амин
Брутто формула
C27H32F2N8
Фармакологическая группа вещества Абемациклиб
Нозологическая классификация
Фармакологическое действие
—
противоопухолевое, ингибирующее протеинкиназу.
Фармакология
Механизм действия
Абемациклиб является ингибитором циклинзависимых киназ 4 и 6 (CDK4 и CDK6). Эти киназы активируются при связывании с D-циклинами. При раке молочной железы с положительным статусом эстрогеновых рецепторов (ER+) комплекс циклин D1 и CDK4/6 способствует фосфорилированию белка ретинобластомы (Rb), прогрессированию клеточного цикла и пролиферации клеток. Длительное воздействие абемациклиба в условиях in vitro ингибирует фосфорилирование Rb и блокирует прогрессирование клеточного цикла из фазы G1 в фазу S, что приводит к старению и апоптозу. В моделях ксенотрансплантата рака молочной железы абемациклиб ежедневно непрерывно вводили в клинически значимых концентрациях в качестве монотерапии или в сочетании с антиэстрогенами, что приводило к уменьшению размера опухоли.
Фармакодинамика
У пациентов с раком абемациклиб в дозах от 50 до 200 мг 2 раза в день подавляет активность CDK4 и CDK6, ингибируя фосфорилирование Rb и топоизомеразу II альфа, что приводит к остановке клеточного цикла перед рестрикционной точкой G1. При проведении анализа зависимости экспозиция — эффективность в исследованиях MONARCH 2 и MONARCH 3 была определена доза 150 мг 2 раза в день для начальной терапии (в сочетании с эндокринной терапией) и подтверждена необходимость снижения дозы до 50 мг 2 раза в день в случае плохой переносимости. При проведении анализа зависимости экспозиция — эффективность в исследовании MONARCH 1 была определена доза 200 мг 2 раза в день для начальной монотерапии абемациклибом.
Влияние абемациклиба на длительность интервала QT с корректировкой Фридериция (QTcF) оценивали у 144 пациентов с распространенным раком. Никаких значимых изменений (>20 мс) длительности интервала QTcF не было обнаружено при среднем значении наблюдаемой равновесной Cmax абемациклиба после его применения в терапевтических дозах.
Анализ зависимости экспозиция — эффективность у здоровых добровольцев при приеме абемациклиба в наиболее высоких клинически значимых дозах показал, что применение абемациклиба не приводило к клинически значимому увеличению интервала QTcF.
Фармакокинетика
Всасывание
Абемациклиб характеризуется медленным всасыванием с медианой Тmах, равной 8 ч. Абсолютная биодоступность абемациклиба составляет 45% (90% ДИ: 40–51%). В диапазоне терапевтических доз от 50 до 200 мг увеличение экспозиции (Сmах и AUC) является пропорциональным дозе. Равновесное состояние достигается в течение 5 дней при приеме абемациклиба 2 раза в день. Абемациклиб накапливается со средним геометрическим отношением, составляющим 3,7 (58% CV, CV — коэффициент вариации) и 5,8 (65% CV) при расчете на основании Сmах и AUC соответственно.
Распределение
Абемациклиб обладает высокой степенью связывания с белками плазмы человека (среднее значение связанной фракции составляет 96–98%), при этом связывание не зависит от концентрации абемациклиба в диапазоне от 152 до 5066 нг/мл. Абемациклиб связывается как с сывороточным альбумином человека, так и с альфа-1-кислым гликопротеином. Среднее геометрическое значение системного Vd составляет приблизительно 747 л (68,6% CV).
У пациентов с распространенным раком концентрация абемациклиба и его активных метаболитов М2 и М20 в спинномозговой жидкости сравнимы с концентрациями несвязанных метаболитов в плазме.
Метаболизм
Абемациклиб подвергается метаболизму в основном в печени, главным образом, при участии изоферментов CYР3А с образованием основного метаболита N-дезэтилабемациклиба (М2) и дополнительных метаболитов — гидроксиабемациклиба (М20), гидрокси-N- дезэтилабемациклиба (M18) и окисленного метаболита (M1). Активность метаболитов М2 и М20 сходна с активностью абемациклиба.
Выведение
Среднее геометрическое значение печеночного клиренса абемациклиба составляет 21,8 л/ч (39,8% CV), средний T1/2 из плазмы крови — 24,8 ч (52,1% CV).
После приема внутрь однократной дозы меченного изотопом [14С] абемациклиба приблизительно 81% от принятой дозы выводится через кишечник и 3,4% — почками. Бóльшую часть дозы, выведенной через кишечник, составляли метаболиты.
Особые группы пациентов
Возраст, пол и масса тела. Возраст, пол и масса тела не оказывали влияния на экспозицию абемациклиба в анализе популяционной фармакокинетики у пациентов с раком (135 мужчин и 859 женщин в возрасте от 24 лет до 91 года и массой тела от 36 до 175 кг).
Нарушение функции печени. Абемациклиб подвергается метаболизму в печени. У пациентов с нарушением функции печени тяжелой степени экспозиция несвязанного абемациклиба увеличивалась в 2,69 раза, а T1/2 — с 24 до 55 ч. У пациентов с нарушением функции печени тяжелой степени необходимо уменьшить частоту дозирования до 1 раза в день.
Нарушение функции почек. Абемациклиб и его метаболиты не выводятся через почки в значительной степени. Коррекция дозы у пациентов с нарушением функции почек легкой или умеренной степени не требуется. Нет данных о применении абемациклиба у пациентов с почечной недостаточностью тяжелой степени, терминальной стадией почечной недостаточности, а также у пациентов, находящихся на диализе.
Применение вещества Абемациклиб
Лечения положительного по гормональным рецепторам (HR+) и отрицательного по рецептору ЭФР человека 2-го типа (HER2-) распространенного или метастатического рака молочной железы:
— в комбинации с первой линией эндокринной терапии ингибитором ароматазы;
— в комбинации с фулвестрантом, назначаемым в качестве первой или второй линии эндокринной терапии;
— в качестве монотерапии у пациентов с прогрессированием заболевания после эндокринной терапии и одной или двух линий предшествующей химиотерапии по поводу метастатической стадии заболевания.
У женщин в пре- или перименопаузе терапию необходимо комбинировать с назначением агониста ЛГРГ.
Противопоказания
Повышенная чувствительность к абемациклибу; почечная недостаточность тяжелой степени; терминальная стадия почечной недостаточности; пациенты, находящиеся на гемодиализе (эффективность и безопасность не установлены); беременность и период грудного вскармливания; детский возраст.
Ограничения к применению
Нарушение функции печени тяжелой степени тяжести; одновременное применение с сильными ингибиторами изофермента CYP3A4; одновременное применение с индукторами изофермента CYP3A4 (следует избегать ввиду риска снижения эффективности абемациклиба).
Применение при беременности и кормлении грудью
Данные доклинических исследований на животных показали, что абемациклиб при применении во время беременности может оказывать вредное воздействие на плод. В исследованиях репродуктивной функции у животных применение абемациклиба в период органогенеза оказывало тератогенное действие и приводило к снижению массы плода во время беременности, что было сходно с данными о воздействии на человека, основанными на AUC при применении максимально рекомендованной человеку дозы. Данные о риске, связанном с применением абемациклиба у человека, отсутствуют. Беременная женщина должна быть предупреждена о возможном риске для плода.
Данные о возможности проникновения абемациклиба в грудное молоко, влиянии абемациклиба на ребенка, находящегося на грудном вскармливании, или о влиянии на выработку молока отсутствуют. Поскольку у ребенка, находящегося на грудном вскармливании, возможно развитие серьезных нежелательных реакций, связанных с проникновением абемациклиба в грудное молоко, следует рекомендовать кормящим женщинам прекратить грудное вскармливание на время применения абемациклиба и как минимум в течение 3 нед после завершения терапии.
Женщины и мужчины с репродуктивным потенциалом
Тестирование на беременность. Данные доклинических исследований на животных показали, что применение абемациклиба во время беременности может причинить вред плоду. Проведение теста на беременность рекомендуется женщинам детородного возраста до начала терапии.
Контрацепция у женщин. Применение абемациклиба во время беременности может причинить вред плоду. Женщинам детородного возраста следует рекомендовать использование эффективных методов контрацепции во время терапии и в течение как минимум 3 нед после приема последней дозы.
Бесплодие у мужчин. На основании данных исследований на животных, абемациклиб может влиять на фертильность мужчин репродуктивного возраста.
Побочные действия вещества Абемациклиб
Комбинированная терапия с фулвестрантом или ингибитором ароматазы
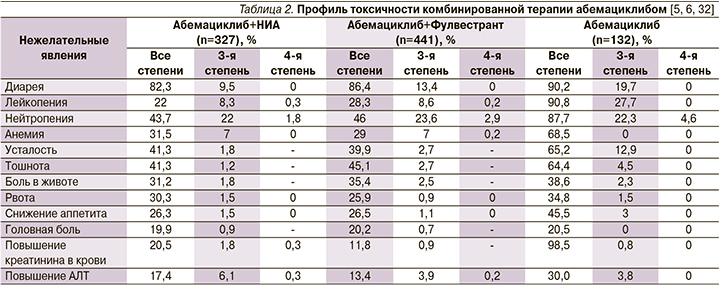
Наиболее распространенными нежелательными реакциями являются диарея, инфекции, нейтропения, анемия, утомляемость, тошнота, рвота и снижение аппетита. Нежелательные реакции, приведенные ниже, классифицированы в соответствии с классами систем и органов и частотой, представленными в MedDRA. Частота развития нежелательных реакций определена как очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000) и частота неизвестна (частота не может быть определена на основании имеющихся данных). В каждой группе нежелательные реакции расположены в порядке убывания степени тяжести.
Инфекционные и паразитарные заболевания: очень часто — инфекции (включают все предпочтительные термины, которые являются частью класса системы органов «Инфекционные и паразитарные заболевания» по MedDRA).
Со стороны крови и лимфатической системы: очень часто — нейтропения, лейкопения, анемия, тромбоцитопения; часто — снижение числа лимфоцитов; нечасто — фебрильная нейтропения.
Со стороны обмена веществ и питания: очень часто — снижение аппетита.
Со стороны нервной системы: очень часто — дисгевзия, головокружение.
Со стороны органа зрения: часто — повышенное слезотечение.
Со стороны сосудов: часто — венозная тромбоэмболия (явления венозной тромбоэмболии включали тромбоз глубоких вен, тромбоэмболию легочной артерии, тромбоз синусов твердой мозговой оболочки, тромбоз подключичной вены, тромбоз подмышечной вены, тромбоз глубоких вен системы нижней полой вены и почечной вены).
Со стороны ЖКТ: очень часто — диарея, рвота, тошнота.
Со стороны кожи и подкожных тканей: очень часто — алопеция, зуд, сыпь; часто — сухость кожи.
Со стороны костно-мышечной системы и соединительной ткани: часто — мышечная слабость.
Общие расстройства и нарушения в месте введения: очень часто — утомляемость, пирексия.
Данные лабораторных и инструментальных исследований: очень часто — повышение уровня АЛТ, ACT.
Описание отдельных нежелательных реакций
Нейтропения
Часто сообщалось о случаях развития нейтропении (41,5%) у пациентов, получавших абемациклиб в сочетании с ингибитором ароматазы или фулвестрантом, при этом у 28,2% пациентов наблюдалось развитие нейтропении 3-й и 4-й степени (на основании лабораторных исследований). Медиана времени до развития первого эпизода нейтропении 3-й или 4-й степени составляла от 29 до 33 дней, при этом медиана продолжительности нейтропении — от 11 до 15 дней. Сообщалось о развитии фебрильной нейтропении у 0,9% пациентов. При нейтропении 3-й или 4-й степени тяжести рекомендуется коррекция дозы.
Диарея
Диарея была наиболее часто отмечаемой нежелательной реакцией. Частота развития диареи была выше в течение первого месяца применения абемациклиба, после чего снижалась. В ходе исследований медиана времени до развития первого эпизода диареи составляла от 6 до 8 дней, а медиана продолжительности диареи — от 9 до 12 дней (для диареи 2-й степени тяжести) и от 6 до 8 дней (для диареи 3-й степени тяжести). Купирование диареи достигалось с помощью сопутствующей терапии такими ЛС, как лоперамид, и/или посредством коррекции дозы.
Повышение уровня аминотрансфераз
Часто сообщалось о случаях повышения уровня АЛТ и ACT (15,1 и 14,2% соответственно) у пациентов, получавших абемациклиб в сочетании с ингибитором ароматазы или фулвестрантом, при этом повышение уровня АЛТ и ACT 3-й и 4-й степени тяжести (на основании лабораторных исследований) наблюдалось у 6,1 и 4,2% пациентов соответственно. У пациентов с повышением уровня АЛТ 3-й или 4-й степени медиана времени до развития данного явления составляла от 57 до 61 дня, медиана времени до его разрешения — 14 дней. У пациентов с повышением уровня ACT 3-й или 4-й степени медиана времени до развития данного явления составляла от 71 до 185 дней, медиана времени до его разрешения — от 13 до 15 дней. При повышении уровня АЛТ или ACT 3-й или 4-й степени тяжести рекомендуется коррекция дозы.
Повышение уровня креатинина
Показано, что у 98,3% пациентов при применении абемациклиба повышается уровень креатинина в сыворотке крови (на основании лабораторных исследований), при этом повышение уровня креатинина 3-й или 4-й степени тяжести отмечалось у 1,9% пациентов. Сообщалось о случаях повышения уровня креатинина (все степени тяжести) у 78,4% пациентов, получавших монотерапию ингибитором ароматазы или фулвестрантом. Было показано, что абемациклиб повышает уровень креатинина в сыворотке крови ввиду ингибирования переносчиков тубулярной секреции почек без влияния на СКФ, определяемой по клиренсу йогексола.
В клинических исследованиях повышение уровня креатинина в сыворотке отмечалось в течение первого месяца применения абемациклиба, и уровень креатинина оставался повышенным, но стабильным, в течение всего периода лечения, причем это повышение было обратимым после прекращения лечения и не сопровождалось изменениями в маркерах функции почек, таких как азот мочевины крови, цистатин С или СКФ, рассчитанная на основании уровня цистатина С.
Монотерапия
Наиболее распространенными нежелательными реакциями, о которых сообщалось с частотой ≥20% были диарея, утомляемость, тошнота, снижение аппетита, боль в животе, нейтропения, рвота, инфекции, анемия, головная боль и тромбоцитопения.
Наиболее частые нежелательные реакции, о которых сообщалось с частотой ≥10%, приведены ниже.
Со стороны ЖКТ: диарея, тошнота, боль в животе, рвота, запор, сухость во рту, стоматит.
Инфекционные и паразитарные заболевания: инфекции.
Общие расстройства и нарушения в месте введения: утомляемость (включает астению, утомляемость), пирексия.
Со стороны крови и лимфатической системы: нейтропения (включает нейтропению, снижение числа нейтрофилов), анемия (включает анемию, снижение гематокрита, снижение уровня Hb, снижение числа эритроцитов, тромбоцитопения (включает снижение числа тромбоцитов, тромбоцитопению), лейкопения (включает лейкопению, снижение числа лейкоцитов).
Со стороны обмена веществ и питания: снижение аппетита, обезвоживание.
Со стороны дыхательной системы, органов грудной клетки и средостения: кашель.
Со стороны костно-мышечной системы и соединительной ткани: артралгия.
Со стороны нервной системы: головная боль, дисгевзия, головокружение.
Со стороны кожи и подкожных тканей: алопеция.
Данные лабораторных и инструментальных исследований: повышение уровня креатинина в сыворотке крови, снижение массы тела, снижение числа лейкоцитов, снижение числа нейтрофилов, анемия, снижение числа лимфоцитов, снижение числа тромбоцитов, повышение уровня АЛТ, ACT.
Описание отдельных нежелательных реакций
Повышение уровня креатинина
Было показано, что при применении абемациклиба повышается уровень креатинина в сыворотке крови, что связано с ингибированием переносчиков тубулярной секреции почек без нарушения гломерулярной функции. В клинических исследованиях повышение уровня креатинина в сыворотке (среднее увеличение на 0,2–0,3 мг/дл) отмечалось в течение первого 28-дневного цикла применения абемациклиба, и уровень креатинина оставался повышенным, но стабильным в течение всего периода лечения, причем это повышение было обратимым после прекращения лечения. Для определения нарушения функции почек могут использоваться альтернативные маркеры, такие как азот мочевины крови, цистатин С или рассчитанная СКФ, которые не основаны на креатинине.
Пострегистрационный опыт применения
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: интерстициальная легочная болезнь/пневмонит (с частотой ≥1, <10%).
Взаимодействие
Влияние других ЛС на фармакокинетику абемациклиба
Абемациклиб подвергается метаболизму преимущественно с помощью изофермента CYP3A4.
Ингибиторы изофермента CYP3A4
При одновременном применении ингибиторов изофермента CYP3A4 и абемациклиба отмечалось увеличение концентрации абемациклиба в плазме крови. У пациентов с распространенным и/или метастатическим раком одновременное применение ингибитора изофермента CYP3A4 кларитромицина увеличивало экспозицию абемациклиба в плазме крови в 3,4 раза и сочетанную свободную экспозицию абемациклиба и его активных метаболитов с поправкой на активность в плазме крови — в 2,5 раза.
Следует избегать одновременного применения сильных ингибиторов изофермента CYP3A4 и абемациклиба. Если сопутствующая терапия ингибиторами изофермента CYP3A4 необходима, следует уменьшить дозу абемациклиба и далее тщательно проводить мониторинг токсичности. Примеры сильных ингибиторов изофермента CYP3A4 включают (но не ограничиваются) кларитромицин, итраконазол, кетоконазол, лопинавир/ритонавир, позаконазол и вориконазол. Следует избегать употребления грейпфрутов или грейпфрутового сока.
Коррекция дозы не требуется у пациентов, получающих терапию умеренными или слабыми ингибиторами изофермента CYP3A4. Однако следует проводить мониторинг признаков токсичности.
Индукторы изофермента CYP3A4
Одновременное применение сильного индуктора изофермента CYP3A4 рифампицина и абемациклиба приводило к снижению концентрации абемациклиба в плазме крови на 95% и свободной концентрации абемациклиба и его активных метаболитов с поправкой на активность в плазме крови — на 77% на основании показателя AUC0–∞. Следует избегать одновременного применения абемациклиба с сильными индукторами изофермента CYP3A4, включая (но не ограничиваясь) карбамазепин, фенитоин, рифампицин и зверобой, ввиду риска снижения эффективности абемациклиба.
Влияние абемациклиба на фармакокинетику других ЛС
ЛС, являющиеся субстратами переносчиков
Абемациклиб и его основные активные метаболиты ингибируют почечные переносчики ОСТ2, МАТЕ1 и МАТЕ2-К. In vivo возможно взаимодействие абемациклиба и клинически значимых субстратов этих переносчиков, таких как дофетилид или креатинин. В клиническом исследовании лекарственного взаимодействия с метформином (субстрат ОСТ2, МАТЕ1 и МАТЕ2) его одновременный прием в дозе 400 мг с абемациклибом приводил к небольшому клинически незначимому увеличению (37%) экспозиции метформина в плазме крови. Было показано, что это было вызвано уменьшением почечной секреции при неизменной клубочковой фильтрации.
У здоровых добровольцев одновременное применение абемациклиба и субстрата Р-gp лоперамида приводило к увеличению экспозиции лоперамида в плазме крови на 9% на основании показателя АUС0–∞ и на 35% на основании показателя Сmах. Данное увеличение не считалось клинически значимым. Однако, основываясь на ингибировании in vitro P-gp и BCRP в присутствии абемациклиба, возможно взаимодействие in vivo абемациклиба с субстратами данных переносчиков с узким терапевтическим индексом, такими как дигоксин или дабигатрана этексилат.
В ходе клинических исследований с участием пациентов с раком молочной железы не было выявлено клинически значимого влияния абемациклиба на фармакокинетику анастрозола, фулвестранта, эксеместана, летрозола или тамоксифена.
На данный момент неизвестно, способен ли абемациклиб снижать эффективность гормональных контрацептивов системного действия.
Передозировка
Антидоты абемациклиба неизвестны. В случае передозировки следует проводить общую симптоматическую терапию.
Способ применения и дозы
Внутрь, 2 раза в день, примерно в одно и то же время, независимо от приема пищи.
Меры предосторожности
Нейтропения
Сообщалось о случаях развития нейтропении у пациентов, получавших абемациклиб. При развитии нейтропении 3-й или 4-й степени тяжести рекомендуется коррекция дозы. Сообщалось о случаях летального исхода у <1% пациентов. Пациенты должны быть проифнормированы о необходимости незамедлительно сообщать обо всех случаях лихорадки лечащему врачу.
Инфекции/паразитарные заболевания
Частота сообщений о развитии инфекций у пациентов, получавших абемациклиб в комбинации с эндокринной терапией, была выше по сравнению с пациентами, получавшими плацебо в комбинации с эндокринной терапией. Сообщалось о случаях развития инфекции легких у пациентов без сопутствующей нейтропении. Сообщалось о случаях летального исхода у <1% пациентов. Необходимо следить за признаками и симптомами развития инфекции и при необходимости провести соответствующую терапию, следуя существующим стандартам лечения.
Венозная тромбоэмболия
Венозная тромбоэмболия наблюдалась у 5,3% пациентов, получавших абемациклиб в сочетании с фулвестрантом или ингибитором ароматазы, и у 0,8% пациентов, получавших плацебо в комбинации с фулвестрантом или ингибитором ароматазы. Необходимо следить за признаками и симптомами развития тромбоза глубоких вен и тромбоэмболии легочной артерии и в случае необходимости провести соответствующую терапию, следуя существующим стандартам лечения.
Повышение уровня аминотрансфераз
Сообщалось о случаях повышения уровня АЛТ и ACT у пациентов, получавших абемациклиб. В зависимости от степени повышения уровня АЛТ или ACT может потребоваться коррекция дозы.
Диарея
Диарея является самой распространенной нежелательной реакцией. В ходе исследований медиана времени до развития первого эпизода диареи составляла от 6 до 8 дней, а медиана продолжительности диареи — от 9 до 12 дней (для диареи 2-й степени тяжести) и от 6 до 8 дней (для диареи 3-й степени тяжести). Эпизоды диареи могут быть связаны с дегидратацией. При первых признаках жидкого стула следует начать прием противодиарейных ЛС, таких как лоперамид, увеличить потребление жидкости и сообщить о проблеме лечащему врачу. При развитии диареи ≥2-й степени тяжести рекомендуется коррекция дозы.
Одновременное применение индукторов изофермента CYP3A4
Следует избегать одновременного приема индукторов изофермента CYP3A4 по причине риска снижения эффективности абемациклиба (см. «Взаимодействие»).
Висцеральный криз
Данные об эффективности и безопасности абемациклиба у пациентов, имеющих висцеральный криз, отсутствуют.
Влияние на способность управлять транспортными средствами и работать с механизмами. Исследования по влиянию абемациклиба на способность управлять транспортными средствами и работать с механизмами не проводились. Однако пациентам, у которых при приеме абемациклиба возникают нежелательные явления со стороны нервной системы, следует проявлять осторожность при управлении автотранспортными средствами и работе с механизмами.
Источники информации
Обобщенные материалы www.grls.rosminzdrav.ru, 2020.
Торговые названия с действующим веществом Абемациклиб
| Торговое название | Цена за упаковку, руб. |
|---|---|
| Зенлистик™ |
от 19565.00 до 19565.00 |
Rec.INN
зарегистрированное ВОЗ
Входит в состав препаратов:
список
Фармакологическое действие
Противоопухолевое средство, ингибитор циклин-зависимых киназ 4 и 6 (CDK4 и CDK6). Эти киназы активируются при связывании с D-циклинами. При раке молочной железы с положительным статусом эстрогеновых рецепторов (ER+) комплекс циклин D1 и CDK4/6 способствует фосфорилированию белка ретинобластомы (Rb), прогрессированию клеточного цикла и пролиферации клеток. Длительное воздействие абемациклиба в условиях in vitro ингибирует фосфорилирование Rb и блокирует прогрессирование клеточного цикла из фазы G1 в фазу S, что приводит к старению и апоптозу. В моделях ксенотрансплантата рака молочной железы абемациклиб ежедневно непрерывно вводился в клинически значимых концентрациях, в качестве монотерапии или в сочетании с антиэстрогенами, что приводило к уменьшению размера опухоли.
У пациентов с раком абемациклиб в дозах от 50 мг до 200 мг 2 раза/сут подавляет активность CDK4 и CDK6, ингибируя фосфорилирование Rb и топоизомеразу II альфа, что приводит к остановке клеточного цикла перед рестрикционной точкой G1.
Фармакокинетика
Абемациклиб характеризуется медленным всасыванием с медианой Тmax, равной 8 ч. Абсолютная биодоступность абемациклиба составляет 45% (90% доверительный интервал: 40-51%). В диапазоне терапевтических доз от 50 мг до 200 мг увеличение экспозиции (Cmax и AUC) является пропорциональным дозе. Равновесное состояние достигается в течение 5 дней при приеме абемациклиба 2 раза/сут. Абемациклиб накапливается со средним геометрическим отношением, составляющим 3.7 (58% CV, CV-коэффициент вариации) и 5.8 (65% CV) на основании Cmax и AUC соответственно.
Связывание с с белками плазмы человека высокое — среднее значение связанной фракции составляет 96-98%), при этом связывание не зависит от концентрации абемациклиба в диапазоне от 152 нг/мл до 5066 нг/мл. Абемациклиб связывается как с сывороточным альбумином человека, так и с альфа1-кислым гликопротеином. Среднее геометрическое значение системного Vd составляет приблизительно 747 л (68.6% CV).
У пациентов с распространенным раком концентрация абемациклиба и его активных метаболитов М2 и М20 в спинномозговой жидкости сравнимы с концентрациями несвязанных метаболитов в плазме.
Абемациклиб подвергается метаболизму в основном в печени, главным образом, при участии цитохромов CYP3A с образованием основного метаболита N-дезэтилабемациклиба (М2) и дополнительных метаболитов: гидроксиабемациклиба (М20), гидрокси-N-дезэтилабемациклиба (Ml8) и окисленного метаболита (Ml). Активность метаболитов N- дезэтилабемациклиба (М2) и гидроксиабемациклиба (М20) сходна с активностью абемациклиба.
Среднее геометрическое значение печеночного клиренса абемациклиба составляет 21.8 л/ч (39.8% CV), средний T1/2 из плазмы — 24.8 ч (52.1% CV)
После приема внутрь однократной дозы меченного изотопом [14С] абемациклиба приблизительно 81% от принятой дозы выводится через кишечник и приблизительно 3,4% — почками. Большую часть дозы, выведенной через кишечник, составляли метаболиты.
Показания активного вещества
АБЕМАЦИКЛИБ
Лечение положительного по гормональным рецепторам (HR+) и отрицательного по рецептору человеческого эпидермального фактора роста 2 типа (HER2-) распространенного или метастатического рака молочной железы: в комбинации с первой линией эндокринной терапии ингибитором ароматазы; в комбинации с фулвестрантом, назначаемым в качестве первой или второй линии эндокринной терапии; в качестве монотерапии у пациентов с прогрессированием заболевания после эндокринной терапии и одной или двух линий предшествующей химиотерапии по поводу метастатической стадии заболевания.
У женщин в пре- или перименопаузе терапию необходимо комбинировать с назначением агониста ЛГРГ.
Режим дозирования
Внутрь в составе комбинированной терапии с фулвестрантом или ингибитором ароматазы рекомендуемая доза составляет 150 мг 2 раза/сут.
При проведении монотерапии рекомендуемая доза составляет 200 мг внутрь 2 раза/сут.
Терапию следует продолжать до прогрессирования заболевания или развития непереносимой токсичности.
Побочное действие
Инфекционные и паразитарные заболевания: очень часто: инфекции.
Со стороны системы кроветворения: очень часто — нейтропения, лейкопения, анемия, тромбоцитопения; часто — снижение числа лимфоцитов; нечасто — фебрильная нейтропения.
Со стороны обмена веществ: очень часто — снижение аппетита.
Со стороны нервной системы: очень часто — дисгевзия, головокружение.
Со стороны органа зрения: часто — повышенное слезотечение.
Со стороны сосудов: часто — венозная тромбоэмболия
Со стороны пищеварительной системы: очень часто — диарея, рвота, тошнота, повышение активности АЛТ и ACT.
Со стороны кожи и подкожных тканей: очень часто — алопеция, зуд, сыпь; часто — сухость кожи.
Со стороны костно-мышечной системы и соединительной ткани: часто — мышечная слабость
Общие реакции: очень часто — утомляемость, пирексия.
При монотерапии наиболее часто: ≥20%) — диарея, утомляемость, тошнота, снижение аппетита, боль в животе, нейтропения, рвота, инфекции, анемия, головная боль и тромбоцитопения; ≥10% — диарея, тошнота, боль в животе, рвота, запор, сухость во рту, стоматит, инфекции, утомляемость, пирексия, повышение уровня креатинина в сыворотке крови, снижение массы тела, снижение числа лейкоцитов, снижение числа нейтрофилов, анемия, снижение числа лимфоцитов, снижение числа тромбоцитов, повышение активности АЛТ и ACT.
Противопоказания к применению
Повышенная чувствительность к абемациклибу, беременность, период грудного вскармливания, детский возраст, почечная недостаточность тяжелой степени, терминальная стадия почечной недостаточности, пациенты, находящиеся на гемодиализе.
С осторожностью
Пациенты с нарушением функции печени тяжелой степени тяжести, одновременное применение с сильными ингибиторами изофермента CYP3A4. Следует избегать одновременного применения индукторов изофермента CYP3A4 ввиду риска снижения эффективности абемациклиба.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период грудного вскармливания.
Абемациклиб может влиять на фертильность мужчин репродуктивного возраста.
Применение при нарушениях функции почек
Противопоказания: почечная недостаточность тяжелой степени, терминальная стадия почечной недостаточности, пациенты, находящиеся на гемодиализе.
Применение у детей
Препарат противопоказан для применения у детей и подростков в возрасте до 18 лет
Особые указания
При нейтропении 3 или 4 степени тяжести рекомендуется коррекция дозы.
Сообщалось о случаях летального исхода у <1% пациентов. Пациентам следует незамедлительно сообщать обо всех случаях лихорадки лечащему врачу.
Сообщалось о случаях развития инфекции легких у пациентов без сопутствующей нейтропении. Сообщалось о случаях летального исхода у <1% пациентов. Необходимо следить за признаками и симптомами развития инфекции и, в случае необходимости, провести соответствующую терапию, следуя существующим стандартам лечения.
Необходимо контролировать симптомы развития тромбоза глубоких вен и тромбоэмболии легочной артерии и, в случае необходимости, провести соответствующую терапию, следуя существующим стандартам лечения.
В зависимости от степени повышения активности АЛТ или ACT может потребоваться коррекция дозы.
Эпизоды диареи могут приводить к дегидратации. При первых признаках жидкого стула следует начать прием противодиарейных препаратов, таких как лоперамид, увеличить потребление жидкости и сообщить о проблеме лечащему врачу.
Влияние на способность к управлению транспортными средствами и механизмами
Пациентам, у которых при приеме абемациклиба возникают нежелательные явления со стороны нервной системы, следует проявлять осторожность при управлении транспортными средствами и работе с механизмами.
Лекарственное взаимодействие
При одновременном применении ингибиторов изофермента CYP3A4 и абемациклиба отмечалось увеличение концентрации абемациклиба в плазме крови. У пациентов с распространенным и/или метастатическим раком одновременное применение ингибитора изофермента CYP3A4 кларитромицина увеличивало экспозицию абемациклиба в плазме крови в 3.4 раза и сочетанную свободную экспозицию абемациклиба и его активных метаболитов с поправкой на активность в плазме крови в 2.5 раза.
Следует избегать одновременного приема сильных ингибиторов изофермента CYP3A4 и абемациклиба. Если сопутствующая терапия ингибиторами изофермента CYP3A4 необходима, следует уменьшить дозу абемациклиба и далее тщательно проводить мониторинг токсичности. Примеры сильных ингибиторов изофермента CYP3A4 включают, но не ограничиваются следующими: кларитромицин, итраконазол, кетоконазол, лопинавир/ритонавир, позаконазол и вориконазол.
В период лечения следует избегать употребления грейпфрутов или грейпфрутового сока.
Коррекция дозы не требуется у пациентов, получающих терапию умеренными или слабыми ингибиторами изоферментами CYP3A4. Однако следует проводить мониторинг признаков токсичности.
Одновременное применение сильного индуктора изофермента CYP3A4 рифампицина и абемациклиба приводило к снижению концентрации абемациклиба в плазме крови на 95% и свободной концентрации абемациклиба и его активных метаболитов с поправкой на активность в плазме крови на 77%. Данная комбинация противопоказана.
Абемациклиб и его основные активные метаболиты ингибируют почечные переносчики ОСТ2 (переносчик органических катионов 2), МАТЕ1 и МАТЕ2-К (белков множественной резистентности и выведения токсинов 1 и 2-К). In vivo может происходить взаимодействие абемациклиба и клинически значимых субстратов этих переносчиков, таких как дофетилид или креатинин. В клиническом исследовании лекарственного взаимодействия с метформином (субстратом ОСТ2, МАТЕ1 и 2) его одновременный прием с абемациклибом в дозе 400 мг приводил к небольшому клинически незначимому увеличению (37%) экспозиции метформина в плазме крови. Было показано, что это было вызвано уменьшением почечной секреции при неизменной клубочковой фильтрации.
У здоровых добровольцев одновременное применение абемациклиба и субстрата Р- гликопротеина (P-gp) лоперамида приводило к увеличению экспозиции лоперамида в плазме крови на 9% на основании показателя AUC на 35% на основании показателя Cmax. Данное увеличение не считалось клинически значимым. Однако, основываясь на ингибировании in vitro P-gp и белка резистентности рака молочной железы (BCRP) в присутствии абемациклиба, возможно взаимодействие in vivo абемациклиба с субстратами данных переносчиков с узким терапевтическим индексом, такими как дигоксин или дабигатрана этексилат.
Женщинам, получающим абемациклиб, рекомендуется дополнительно использовать барьерный метод контрацепции.
- Главная
- Аналитика
- Абемациклиб: первый ингибитор циклинзависимых киназ в адъювантной терапии рака молочной железы
Абемациклиб: первый ингибитор циклинзависимых киназ в адъювантной терапии рака молочной железы
Автор: Фонд «Вместе против рака»
Первый препарат из группы ингибиторов циклинзависимых киназ одобрен в комбинации с гормональной терапией для предотвращения рецидивов HR-положительного HER2-отрицательного рака молочной железы (РМЖ) у пациентов группы высокого риска. Эффективность такой адъювантной терапии доказана в ходе исследования monarchE: препарат снизил относительный риск развития инвазивного заболевания на 30,4%, а риск появления отдаленных метастазов – на 31,3%.
Абемациклиб («Зенлистик», Zenlistic) одобрен Минздравом 10 июня 2021 года для применения в комбинации с гормонотерапией в адъювантной терапии HR-положительного HER2-отрицательного РМЖ на ранних стадиях у пациентов с поражением регионарных лимфатических узлов и высоким риском развития рецидивов.
Подчеркнем, что Минздрав принял такое решение раньше FDA, которое также дало одобрение на применение абемациклиба (под торговым названием «Верзенио») по этому показанию 12 октября 2021 года.
Однако есть и различия в решениях Минздрава и FDA: агентство уточнило, что условием назначения препарата должен быть уровень Ki-67 ≥ 20%, который должен быть установлен только с помощью одобренного FDA теста. FDA также одобрило тест Ki-67 IHC MIB-1 pharmDx assay для такой сопроводительной диагностики.
EMA зарегистрировало данное показание 4 апреля 2022 года.
Первый из группы CDK-ингибиторов
Для адъювантной терапии РМЖ применяется мало препаратов: в начале нулевых с этой целью начали применять ингибиторы ароматазы, и с тех пор никаких подвижек не было в этой области. «За последние 20 лет не произошло никаких новых событий в адъювантной терапии люминального HER2-отрицательного РМЖ. До прошлого года, когда впервые были представлены результаты исследования monarchE», – подчеркивает к.м.н. Инна Ганьшина, ведущий научный сотрудник, врач-онколог химиотерапевтического отделения №1 НМИЦ онкологии им. Н.Н. Блохина. Сейчас в перечень препаратов для адъювантной терапии РМЖ вошел представитель СDK-ингибиторов абемациклиб – могут ли другие препараты этого класса составить ему конкуренцию?
Абемациклиб – это не первый препарат из группы CDK 4/6-ингибиторов, который изучался в адъювантном режиме, однако единственный, чьи испытания увенчались успехом. «Всего на сегодняшний день существует три CDK-ингибитора – рибоциклиб, палбоциклиб и абемациклиб. В медицинском сообществе отношение к ним одинаковое – как к одному классу препаратов. Немного отличается механизм действия и, соответственно, побочные эффекты, но считается, что они равноэффективны. Например, в рекомендациях ABC не выделяется отдельно каждый препарат, а говорится просто о классе CDK-ингибиторов, – рассказывает д.м.н. Мона Фролова, ведущий научный сотрудник онкологического отделения лекарственных методов лечения №1 НИИ клинической онкологии НМИЦ онкологии им. Н.Н. Блохина. – Сейчас идут исследования по адъювантному применению рибоциклиба (NATALEE), но результаты еще неизвестны. Было два исследования палбоциклиба (PALLAS и Penelope-B), но в них не было продемонстрировано увеличение выживаемости при добавлении палбоциклиба к адъювантной гормонотерапии. Исследование абемациклиба monarchE – единственное, которое на данный момент достигло своей конечной точки».
Почему именно абемациклиб смог продемонстрировать свою эффективность? «Наиболее активно обсуждаются две точки зрения. Первая – абемациклиб принимается без перерыва, каждый день, а палбоциклиб требует 7-дневного перерыва каждые три недели, – объясняет к.м.н. Марк Глузман, доцент кафедры онкологии Санкт-Петербургского государственного университета, заведующий отделением противоопухолевой лекарственной терапии Городского клинического онкологического диспансера (г. Санкт-Петербург). – Возможно, перерывы влияют на эффективность палбоциклиба, мы видим это при лечении, например, метастатических форм РМЖ: палбоциклиб в комбинации с фулвестрантом во второй и последующих линиях не продемонстрировал статистически значимый выигрыш в общей выживаемости в исследовании PALOMA-3, в отличие от комбинации абемациклиба с фулвестрантом в исследовании MONARCH 2. Вторая причина – это то, что в исследование с абемациклибом включали пациентов с более агрессивным течением заболевания: большему числу проводилась периоперационная химиотерапия, больше было тех, у кого поражены четыре и более лимфоузла, патоморфологически определялась III степень злокачественности. И это правильно, на мой взгляд, именно у этих больных надо было тестировать этот препарат. А в исследование с палбоциклибом включили всех пациентов со II и III стадией, и столь значимого преимущества в сравнении со стандартной терапией не получили, потому что стандартная терапия и так высокоэффективна у этих пациентов».
Таким образом, абемациклиб стал первым препаратом из группы ингибиторов циклинзависимых киназ, эффективность которого в адъювантной терапии РМЖ получила предварительные доказательства. Производитель препарата подчеркивает, что увеличение выживаемости без признаков инвазивного заболевания, которое препарат обеспечивает, очень важно для пациентов с HR-положительным HER2-отрицательным РМЖ.
Результаты исследования
Абемациклиб был одобрен на основании результатов исследования monarchE (NCT03155997). Обновленные данные были представлены на заседании ESMO 14 октября 2021 года.
В этом рандомизированном открытом многоцентровом исследовании III фазы участвовало 5637 взрослых женщин и мужчин с HR-положительным HER2-отрицательным ранним РМЖ, которые перенесли операцию, а также лучевую терапию и/или адъювантную/неоадъювантную химиотерапию. Для исследования эффективности абемациклиба были отобраны пациенты, у которых имелись признаки, свидетельствующие о высоком риске рецидива. Такими признаками были:
- 4 и более пораженных подмышечных лимфатических узла;
- или 1–3 пораженных лимфатических узла в сочетании как минимум с одним из следующих признаков: размер опухоли ≥5 см, III степень злокачественности (8 баллов и более по системе Bloom – Richardson), Ki-67 ≥ 20% в не подвергавшейся лечению ткани железы.
Пациенты контрольной группы проходили стандартную адъювантную гормонотерапию, а пациенты основной группы получали абемациклиб в дополнение к ней (150 мг 2 раза в день в течение 2 лет).
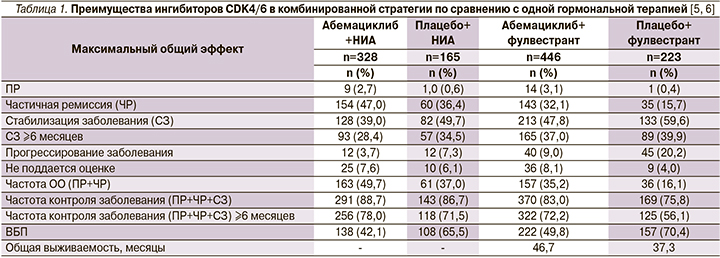
В группе абемациклиба в комбинации с гормонотерапией выживаемость без признаков инвазивного заболевания была статистически значимо выше (р = 0,0001), чем в группе стандартной терапии: двухлетний показатель в ITT-популяции составил 92,7 и 90% соответственно, а трехлетний – 88,8 и 83,4%. Отношение рисков – 0,696 (95% ДИ 0,588–0,823).
Добавление абемациклиба к гормональной терапии также повысило выживаемость без признаков отдаленных метастазов (р = 0,0001): двухлетний показатель составил 94,1% (абемациклиб) и 91,6% (контроль), а трехлетний – 90,3 и 86,1%. Отношение рисков – 0,686 (95% ДИ 0,571–0,826).
Частота нежелательных явлений в исследовании monarchE не отличалась от уже известных данных о препарате, и новых токсических реакций зарегистрировано не было. Артралгия и «приливы» – частые нежелательные явления при гормональной терапии – наблюдались значительно реже у пациентов, получавших абемациклиб в дополнение к ней (артралгия – 27 и 38%; «приливы» – 15 и 23%. Наиболее частым (84%) побочным эффектом была диарея. Она возникала рано, была кратковременной и хорошо поддавалась контролю. Всего лишь 4,8% пациентов прекратили принимать абемациклиб из-за диареи.
Понимание биологии опухолей у пациентов, которым адъювантная терапия абемациклибом помогает в наибольшей степени, очень важна, что подчеркнули исследователи при публикации результатов. В настоящее время проводятся параллельные исследования для изучения образцов тканей и плазмы у участников исследования monarchE.
История препарата
Впервые абемациклиб был одобрен FDA в сентябре 2017 года. Он был выпущен на рынок как препарат для лечения метастатического РМЖ. При этом если рак прогрессирует на фоне гормонотерапии, абемациклиб должен применяться в комбинации с ингибиторами ароматазы или фулвестрантом, а если прогрессирование зарегистрировано после нескольких линий гормональной терапии и химиотерапии по поводу метастатического процесса, то препарат может быть назначен и в монорежиме.
Уже в феврале 2018 года FDA разрешило применение абемациклиба в комбинации с 1-й линией эндокринотерапии ингибитором ароматазы.
Появлением этих показаний мы обязаны результатам исследований MONARCH 2 (NCT02107703), MONARCH 1 (NCT02102490) и MONARCH 3 (NCT02246621).
Российская инструкция к абемациклибу также включает эти три показания. С 1 января 2021 года абемациклиб включен в перечень ЖНВЛП.
EMA в сентябре 2018 года одобрило применение препарата в сочетании с ингибитором ароматазы или фулвестрантом (в качестве 1-й линии эндокринной терапии) и у женщин, которые ранее получали эндокринную терапию.
В сентябре 2019 года появилось предупреждение FDA о том, что абемациклиб – в редких случаях – может вызывать тяжелое поражение легких (как и весь класс ингибиторов циклинзависимых киназ 4/6). Это интерстициальная легочная болезнь или пневмонит (с частотой 1–3%; летальный исход зарегистрирован менее чем в 1% случаев). Однако агентство подчеркнуло, что польза от применения этого класса препаратов все еще превышает риски.
Ценность в долгосрочной перспективе
Российские клинические рекомендации по диагностике и лечению рака молочной железы (2021) содержат схемы терапии абемациклибом в соответствии с официальной инструкцией: при метастатическом HER2-отрицательном раке препарат (наряду с другими ингибиторами циклинзависимых киназ 4/6) рекомендован в сочетании с ингибиторами ароматазы 3-го поколения или фулвестрантом как предпочтительный вариант 1-й и 2-й линий лечения. Применение в монорежиме показано при прогрессировании на фоне гормональной терапии и нескольких линий химиотерапии.
Однако адъювантное лечение абемациклибом в клинические рекомендации по лечению РМЖ войти не успело. Мона Фролова считает, что продемонстрированный эффект недостаточен, чтобы безоговорочно рекомендовать этот препарат. «На мой взгляд, применение CDK-ингибиторов в адъювантном режиме – потенциально интересная опция. Но учитываются результаты только одного положительного исследования. Наблюдение за пациентами было непродолжительным, а люминальный рак имеет свойство прогрессировать практически в течение всей жизни пациента, – комментирует ситуацию эксперт. – Очень важно дождаться более отдаленных результатов. Только тогда мы узнаем истинную ценность назначения CDK-ингибитора для адъювантной терапии, когда поймем, как она сказывается на общей выживаемости. Что мы сейчас видим – снижение частоты ранних рецидивов, т. е. по сути дела, как мне кажется, мы лечим субклиническую метастатическую болезнь до того, как она манифестировала. И на мой взгляд, это не совсем целесообразно: лечить болезнь надо тогда, когда она есть».
«Это пациенты высокого риска – у них более четырех пораженных лимфоузлов, высокий индекс Ki-67, высокая пролиферативная активность опухоли, они получили предоперационную химиотерапию по поводу местно-распространенного рака и имеют остаточную опухоль. У них крайне вероятно прогрессирование в ближайшее время после окончания лечения. Если мы имеем хотя бы небольшой шанс на то, что отложим наступление прогрессирования, то это будет для нас, врачей, успехом – и для пациентов тоже», – считает Инна Ганьшина.
«Мы должны взвесить все за и против. С одной стороны, каждая жизнь имеет значение, и эти 5% – это все-таки 5 пациентов из 100, причем это статистически значимое улучшение, доказанное на большой популяции пациенток. С другой стороны, очевидно изначальное предположение ученых о том, что выигрыш если и будет, то весьма незначительный, поэтому в это исследование специально включено более 5,5 тыс. больных, чтобы уловить даже небольшие статистические отклонения. Кроме того, абемациклиб – это препарат, у которого есть побочные явления – представьте, если у пациента будет диарея хотя бы даже I степени (т. е. до 3 раз в сутки), на протяжении всех двух лет терапии – это довольно сильное ухудшение качества жизни. Мой прогноз – препарат, скорее всего, в ближайшее время войдет в клинические рекомендации с данным показанием, – выражает осторожный оптимизм Марк Глузман. – Мы видим в своей практике, что есть больные с очень высоким риском рецидива заболевания, и мы безусловно не должны лишать их возможности получать современное лечение. Я сейчас в первую очередь говорю о пациентках с наличием резидуальной опухоли после неоадъювантного лечения с поражением четырех и более регионарных лимфоузлов. В любом случае в рекомендациях должна быть мягкая формулировка, чтобы ни в коем случае доктора в нашей стране не стали бы в один миг обязаны назначать препарат всем пациентам, соответствующим критериям включения в исследовании MonarchE. Мы прекрасно понимаем, что клинические рекомендации становятся с этого года обязательными к исполнению, и нужно быть очень внимательным, когда описываешь показания к препаратам, особенно дорогостоящим и обладающим определенной токсичностью».
Станут ли вышеперечисленные факторы препятствием для включения данной опции в российские клинические рекомендации, пока неясно. Очевидно, что имеются аргументы и за, и против, а значит, если рекомендация и будет, то очень осторожная.
«Эта терапия долгосрочная, дорогостоящая, и могут быть серьезные проблемы у назначивших ее онкологов. Я предвижу ряд жалоб со стороны пациентов, которым ее не назначат, – поясняет Мона Фролова. – Хотя и до официального включения этого показания в клинические рекомендации отдельные доктора уже назначают эту терапию, такая возможность есть – по решению врачебной комиссии… Хочу добавить, что у ряда экспертов есть мнение, что нужно внести показание в клинические рекомендации, чтобы появилась соответствующая КСГ. Но эта опция в группировщике КСГ и так уже есть, потому что мы применяем комбинацию гормонотерапии с абемациклибом при метастатическом раке. В общем, будем обсуждать, спорить, голосовать. Но даже в случае включения опции в клинические рекомендации формулировка, надеюсь, не будет безапелляционной».
«Я думаю, что абемациклиб будет назначаться в качестве адъювантной терапии уже сейчас, до включения в клинические рекомендации, – предполагает Марк Глузман. – Есть пациентки с очень высоким риском рецидива, и после стандартной адъювантной гормонотерапии их прогноз глобально не изменится. У меня уже есть как минимум одна такая пациентка на примете, которой я назначу абемациклиб в качестве адъювантной терапии. Безусловно, по решению врачебной комиссии, но назначу – в интересах пациентки».
«Мы все понимаем, что пока имеются лишь ранние результаты этого исследования, хотя хотелось бы скорее получить отдаленные результаты. Но, к сожалению, для этого необходимо время. Тем не менее уже даже по ранним результатам мы видим, что часть пациентов получает значительную пользу от применения препарата. Это те пациенты, которые получали неоадъювантную химиотерапию, имели остаточную резидуальную опухоль и относились к группе высокого риска уже на момент после операции. Абсолютная разница в выживаемости без прогрессирования достигает почти 7%, и это, конечно же, прекрасные результаты именно для адъювантной терапии, – подвела итог Инна Ганьшина. – Я уверена, что препарат сможет войти и в российские рекомендации, и наши пациенты смогут получать дополнительное лечение, когда оно им необходимо».
- Первый из группы CDK-ингибиторов
- Результаты исследования
- История препарата
- Ценность в долгосрочной перспективе
Абемациклиб блокирует активность циклинзависимых киназ 4 и 6, которые играют ключевую роль в регулировании роста и деления клеток. При некоторых видах рака, включая HR-положительный РМЖ, активность этих киназ усиливается, что помогает раковым клеткам бесконтрольно размножаться. Блокируя данные киназы, абемациклиб замедляет рост HR-положительных клеток РМЖ.
В западных странах абемациклиб выпускается под торговым названием «Верзенио» (Verzenio). На российский рынок препарат вышел тоже с этим названием, но в октябре 2020 года был переименован.
Сопроводительная (сопутствующая) диагностика (companion diagnostics), согласно определению, данному FDA, – это исследование (чаще всего in vitro), которое дает информацию, необходимую для безопасного и эффективного использования соответствующего препарата, иначе говоря, проведение такого теста является обязательным условием назначения определенного препарата.
Важная особенность такой диагностики: инструкция по применению препарата обязательно включает информацию о соответствующем тесте, и наоборот, инструкция к тесту содержит указание на препарат.
Сопроводительные диагностические тесты чаще всего разрабатываются и утверждаются FDA параллельно с препаратом.
Точнее, их эффективность не сравнивалась в одном клиническом исследовании.
ESO-ESMO International Consensus Guidelines for Advanced Breast Cancer – ABC.
Выживаемость без признаков инвазивного заболевания определялась в данном случае как срок с даты рандомизации пациентов до даты первого возникновения ипсилатеральной рецидивной инвазивной карциномы молочной железы, регионарного или отдаленного метастаза, контралатеральной инвазивной карциномы, второй первичной инвазивной опухоли, не являющейся РМЖ, смерти по любой причине. (Invasive disease free survival, as defined by the STEEP System, was measured from the date of randomization to the date of first occurrence of one of the following events: ipsilateral invasive breast tumor recurrence, regional invasive breast cancer recurrence, distant recurrence, contralateral invasive breast cancer, second primary non-breast invasive cancer, death attributable to any cause.)
Все пациенты с назначенным лечением, получавшие хотя бы одну дозу препарата.
Пациенты получали абемациклиб или плацебо в дополнение к летрозолу или анастрозолу в качестве 1-й линии лечения метастатического рака. Медиана выживаемости без прогрессирования составила 28,2 мес. (95% ДИ 23,5 мес. – не достигнута) в группе абемациклиба и 14,8 мес. (95% ДИ 11,2–19,2 мес.) в группе плацебо (ОР 0,540; 95% ДИ 0,418–0,698; р = 0,000002). Частота объективного ответа составила 61,0% в группе абемациклиба и 45,5% в группе плацебо (р = 0,003).
Женщины с HR-положительным HER2-отрицательным метастатическим РМЖ с прогрессированием заболевания на фоне гормональной терапии или после ее окончания, которые не проходили химиотерапию по поводу метастатической болезни, получали абемациклиб (n = 446) или плацебо (n = 223) в дополнение к фулвестранту до прогрессирования заболевания или развития неприемлемых токсических реакций. Медиана выживаемости без прогрессирования составила 16,4 мес. в группе абемациклиба и 9,3 мес. в группе плацебо (ОР 0,553; 95% ДИ 0,449–0,681; p < 0,0001).
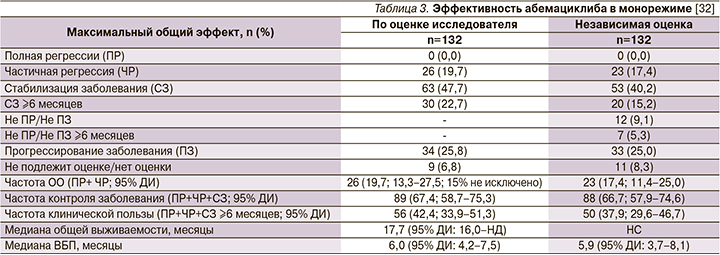
В исследование были включены женщины с HR-положительным HER2-отрицательным метастатическим РМЖ, который прогрессировал на фоне эндокринотерапии или после ее завершения, а также после 1-й или 2-й линий химиотерапии по поводу метастазов. В общей сложности 132 пациента получали абемациклиб до прогрессирования заболевания или развития неприемлемых токсических реакций. Общая частота объективного ответа составила 19,7% (95% ДИ 13,3–27,5%), медиана выживаемости без прогрессирования – 6,0 мес., а медиана общей выживаемости – 17,7 мес.
Отметим, что в схемах терапии действительно есть КСГ sh0984 «абемациклиб + анастрозол». Можно пользоваться этой схемой, поскольку она относится к диапазону диагнозов C00–C80. Более того, новая КСГ не понадобится, если не ожидается появления нового режима дозирования.
Колонка редакции

Камолов Баходур Шарифович
Главный редактор
И снова о документе, который уже больше года никому не дает покоя – приказе №116н – порядке оказания онкологической помощи взрослым, который начал действовать с 2022 года. В адрес этого документа высказано так много замечаний и организаторами здравоохранения, и руководителями лечебных учреждений, и рядовыми врачами, что, казалось бы, говорить больше не о чем. К сожалению, это не так: тема оказалась неисчерпаемой. Эксперты фонда «Вместе против рака» тоже и уже не раз давали оценки новому порядку. Сегодня хочу остановиться на одном аспекте, имеющем колоссальную важность: речь пойдет о двух категориях онкологических больных, которым не нашлось места в новом порядке. Фактически о них просто забыли. Однако не забыл о них следственный комитет. Как раз на днях «Медицинская газета» осветила уголовное дело в отношении врача-хирурга, выполнившего спасительную резекцию ректосигмоидного отдела толстой кишки.
Если человека нельзя вылечить, то это не значит, что ему нельзя помочь
Таков основной посыл паллиативной помощи. Однако ее возможности ограничены: в частности, для онкологических пациентов не предусмотрена хирургическая помощь. Равно как не предусмотрена она и соответствующим порядком онкологической помощи. Речь о пациентах с распространенным раком, которые не могут быть прооперированы радикально, но нуждаются в паллиативном хирургическом вмешательстве. Такая помощь обеспечивает более высокое качество дожития, например, онкобольных с кишечной непроходимостью, кровотечениями при распространенном процессе, с нарушением оттока мочи, скоплением жидкости в плевральной или брюшной полости и т. д. Химиотерапевты не могут без стабилизации состояния провести таким пациентам лекарственное лечение. В специализированных онкологических учреждениях симптоматическая хирургия не предусмотрена. Да и вообще система паллиативной помощи не подразумевает хирургию. В неспециализированных учреждениях таких пациентов теперь тоже не ждут, если стационар не включен в региональную систему маршрутизации онкобольных.
С вступлением в силу приказа №116н такой больной может быть госпитализирован в многопрофильный стационар только как неонкологический пациент. Чтобы не нарушать никакие порядки и получить оплату за данный клинический случай, врачи вынуждены хитрить и фантазировать, выдумывая обоснования для госпитализации.
Часть людей обращается за такой помощью в частные клиники. Еще часть – в хосписы и паллиативные отделения, но вот только там нет хирургии. Таким образом, сформировалась когорта онкобольных, на которых действие нового порядка не распространяется. Подсчитать число таких пациентов сложно, так как теперь они находятся вне зоны внимания онкослужбы.
Между небом и землей
Ситуация вокруг этих больных нередко обрастает и дополнительными сложностями, которые недавно освещала наша редакция по результатам большого аналитического исследования, посвященного вопросам паллиативной помощи в России.
Во-первых, не все онкологи сообщают пациенту, что возможности лечения заболевания исчерпаны. Из-за этого не выдают направление в специализированные паллиативные отделения или хосписы. А некоторые просто не знают, что требуется дополнительное заключение. И складывается ситуация, когда пациент не получает онкологическое лечение, поскольку показаний уже нет, но и нет возможности получить паллиативную помощь, поскольку отсутствует направление от врача-онколога. Но наиболее важно то, что в контексте хирургической паллиативной помощи такие пациенты попросту вне курации обеих служб, т. е. без гарантий и помощи.
Во-вторых, имеются интересные особенности в преемственности онкологической и паллиативной помощи, а именно: странное «блуждание» пациентов между паллиативом и онкологией. Это обусловлено тем, что сопроводительная терапия в онкологическом секторе, в том числе уход за пациентом, обезболивание, устранение тошноты и рвоты, толком не регулируется и не оплачивается по программе госгарантий. Поэтому тяжелые, фактически умирающие от осложнений, пациенты попадают в паллиатив. А там при грамотном подходе буквально оживают и возвращаются в онкологические учреждения, чтобы продолжить основное лечение. С клинической точки зрения это нонсенс.
Сопровожден до осложнений
Означенные проблемы онкослужбы дали почву для появления другой когорты онкологических пациентов, оказание помощи которым не предусмотрено ни новым минздравовским порядком, ни иными нормативными актами, регулирующими данную сферу здравоохранения.
Я говорю о тех, кто нуждается в сопроводительной терапии осложнений, наступающих во время лечения онкологических заболеваний. По большому счету к их числу относятся все 100% онкобольных, поскольку те или иные неблагоприятные последствия «химии» возникают у каждого. Таких состояний много: тошнота, рвота, нейтропения, тромбоцитопения, анемия, инфекции, мукозиты, болевой синдром и т. д.
Да, онкологи назначают пациентам препараты, снижающие негативные проявления последствий химиотерапии, в частности противорвотные средства. Но, во-первых, такие препараты покупаются обычно за средства пациентов, во-вторых, состояния могут быть куда более серьезными, они не снимаются приемом таблетированных лекарств и требуют проведения инфузионной либо иной терапии в стационарных условиях. Однако попасть туда не так просто. В онкологической службе вся помощь исключительно плановая, поэтому онкобольной с осложнениями может поступить только в общелечебную сеть, где не всегда знают, как помочь пациенту с диагнозом «онкология» в случае резкого снижения гемоглобина, высокого лейкоцитоза и пр.
Иными словами, из поля зрения авторов порядка оказания онкологической помощи и разработчиков клинических рекомендаций выпала не просто группа больных, а целый раздел лечения. Хотя справедливости ради надо сказать, что «проведение восстановительной и корригирующей терапии, связанной с возникновением побочных реакций на фоне высокотоксичного лекарственного лечения» предусмотрено как одна из функций онкологических учреждений, однако соответствующих условий для реализации нет.
До сих пор нет ни отдельного тома клинических рекомендаций по сопроводительной терапии осложнений онкологических заболеваний, ни соответствующих разделов в профильных клинических рекомендациях по злокачественным новообразованиям, за редким исключением, которое еще больше подтверждает правило. А коль скоро нет клинических рекомендаций по оказанию данного вида медицинской помощи, нет и тарифов на него. А если нет тарифов, медицинские организации не могут заниматься сопроводительной терапией осложнений онкологических заболеваний. Круг замкнулся.
Безусловно, некая положительная тенденция к решению этой проблемы есть. Для начала в последние годы она довольно активно обсуждается. Кроме того, с 2023 года введен подход по использованию коэффициента сложности лечения пациента (КСЛП), который «удорожает» базовый тариф, доплата предназначена для возмещения расходов на сопроводительную терапию. Однако механизм крайне выборочно покрывает препараты, используемые для лечения осложнений, да и сумма в 16–18 тыс. руб. зачастую меньше реальных расходов.
Если бы данный вид медицинской помощи нашел полноценное отражение в клинических рекомендациях и новом порядке, это позволило бы создать в онкодиспансерах отделения сопроводительной терапии, которые принимали бы пациентов с осложнениями в режиме 24/7, в том числе по экстренным показаниям.
Что же происходит в реальности? То же, что и в случае с первой категорией онкобольных: человек сам приобретает нужные препараты и (или) ищет врача или медсестру, которые готовы ему помочь. Какими в случае неблагоприятных событий могут быть юридические последствия такой помощи «по договоренности», несложно представить.
- Если человека нельзя вылечить, то это не значит, что ему нельзя помочь
- Между небом и землей
- Сопровожден до осложнений
21/03/2023, 12:05
Комментарий к публикации:
Потерянные и забытые

Габай Полина Георгиевна
Шеф-редактор
Внедрение IT-технологий в работу системы здравоохранения абсолютно необходимо, в этом нет сомнений. Сомнения вызывает лишь подход к реализации этого намерения, конкретно – тот кавалерийский наскок, с которым государство взялось за информатизацию и цифровизацию медицинской отрасли, не рассчитав ни свои силы и возможности, ни силы и возможности субъектов РФ и конкретных медицинских организаций. В итоге заявленные сроки реализации ряда важных разделов информатизации и цифровизации здравоохранения отодвигаются. Конструкции красиво описанной «единой цифровой экосистемы здравоохранения» по мере приближения к ней оказываются миражом. А часть из тех компонентов «цифровой экосистемы», которые уже готовы и внедрены, тоже нельзя назвать полностью проработанными.
Звучит красиво – «цифровая экосистема»
Фундамент будущего цифрового здравоохранения был заложен еще в 2011 году с утверждения концепции единой государственной информационной системы в сфере здравоохранения (ЕГИСЗ). А через несколько лет Минздрав России презентовал федеральный проект «Создание единого цифрового контура (ЕЦК) в здравоохранении на основе ЕГИСЗ». Срок реализации проекта – 2019–2024 годы, консолидированное финансирование проекта оценивается в 177 млрд руб.
Так называемая цифровая экосистема здравоохранения предполагает не только объединение всех потоков медицинской информации в ЕГИСЗ, но и появление большого количества сервисов для медицинского сообщества и пациентов: электронный документооборот, телемедицинские технологии, электронная запись к врачу, оформление электронных рецептов и автоматизированное управление льготным лекарственным обеспечением, программы поддержки принятия врачебных решений и т. д.
Благодаря всем этим техническим инновациям, как указывает регулятор, будет обеспечено «повышение эффективности функционирования системы здравоохранения».
Правильные цели, верные задачи. А что мы имеем на пятом году работы над решением этих задач?
Старт без финиша
Начнем с единого цифрового контура медицинской отрасли. Создание федеральной информационной сети ЕГИСЗ, у которой есть разные подсистемы – федеральный регистр медицинских работников, федеральный реестр медорганизаций, федеральная регистратура и т. д., – движется медленно, а внедрение дается тяжело. Медицинские организации элементарно не готовы ни морально, ни технически к новой тяжеловесной системе. В 2021 году, чтобы хоть как-то загнать участников в систему, подключение к ЕГИСЗ сделали даже лицензионным требованием.
В 2019 году Минздрав России инициировал разработку вертикально-интегрированных медицинских информационных систем (ВИМИС) по основным профилям: онкология, акушерство и гинекология, профилактическая медицина, сердечно-сосудистые заболевания и инфекционные заболевания. По замыслу регулятора, это должен быть эффективный механизм управления профильными службами, а также мониторинга оказания медицинской помощи и ее качества. Платформы ВИМИС предполагалось инкорпорировать в ЕГИСЗ.
Так вот, окончание работ по созданию всех ВИМИС было запланировано на 2020 год. 19 июня 2020 года министр здравоохранения России Михаил Мурашко сообщил, что ВИМИС «Онкология» разработана и готовится к апробации. На самом деле, если остальные четыре ВИМИС в той или иной мере уже функционируют, то по онкологии окончание работы над проектом отодвигалось сначала до 2021 года, затем до 2022 года и до сих пор не произошло.
Притом изначально в ВИМИС «Онкология» должны были входить траектории деятельности врача, системы поддержки принятия врачебных решений (СППВР) и некоторые другие. Однако в 2020 году многие сложные составляющие ВИМИС, в том числе СППВР, были исключены из технического задания. В таком упрощенном виде ВИМИС стала большой МИС, работающей просто-напросто на сбор данных.
Исполнить нельзя, но обязаны
Почему от сложных блоков в ВИМИС избавляются? Возможно, потому что разработка таких алгоритмов крайне сложна, а результаты нелицеприятны.
В 2022 году фонд «Вместе против рака» запустил свою программу поддержки принятия врачебных решений по диагностике и лечению рака предстательной железы. Наши специалисты трудились над ней около полугода большой командой. И это только одна локализация рака. Между тем в рубрикаторе Минздрава России уже более 80 клинических рекомендаций по онкозаболеваниям, и, чтобы под каждую нозологию сформировать СППВР, нужны большие затраты времени и сил.
Кроме того, дело не ограничивается клиническими рекомендациями: кроме них, есть стандарты медпомощи, тарифы, клинико-статистические группы – и все эти профессиональные, правовые и финансовые нормы должны быть увязаны между собой. По факту же они не гармонизированы, многие положения клинических рекомендаций по тем или иным причинам не попали в стандарты и далее в тарифную программу. Не исключено, что именно поэтому СППВР убрали из задач ВИМИС: любая система поддержки принятия врачебных решений высвечивает разобщенность профессиональных норм и финансовой регуляторики.
Последнее является серьезной проблемой. При выборе тактики оказания медицинской помощи пациенту врачи должны руководствоваться клиническими рекомендациями, в то же время они знают, что если назначат лечение, которое не вошло в стандарты и тарифы, то больнице оно не будет оплачено фондом ОМС. Таким образом, с принятием закона о клинических рекомендациях врачи оказались в ловушке: исполнить их невозможно, а не исполнить нельзя.
После долгой пробуксовки в НМИЦ онкологии им. Н.Н. Блохина проект ВИМИС «Онкология» не так давно попал в ЦЭККМП Минздрава России. Это вселяет надежду на упорядочивание системы, ведь центр в настоящее время призван играть лидирующую роль в подготовке и экспертизе всей цепочки норм: клинреки – номенклатура медуслуг – стандарты медпомощи – КСГ. В разработку ВИМИС, помимо больших денег (более 2,3 млрд руб.), вложены и многолетние ожидания, в том числе о создании адекватного канцер-регистра. Отрасль, без сомнения, требует корректной систематизации и информатизации, но итогового результата пока нет.
Что еще смущает? Даже правовой статус и конкретный функционал ВИМИС до сих пор не определены. Положения о ВИМИС должны были войти в новый нормативный акт о ЕГИСЗ, однако в утвержденном документе норм о ВИМИС нет.
Телерисковая зона
Еще один цифровой продукт, предусмотренный к внедрению в рамках информатизации отрасли, – телемедицинские технологии, которые используются для консультирования в режиме «врач-врач» либо «врач-пациент», а также для дистанционного мониторинга за состоянием здоровья пациента. Какие здесь плюсы и минусы? Телемедицинские технологии привязаны к системе ЕГИСЗ: таким образом, каждый участник процесса распознан через единую систему идентификации и аутентификации (ЕСИА) и имеет цифровые подписи. Врач должен быть зарегистрирован в федеральном реестре медработников, а клиника – в федеральном реестре медорганизаций. Это, с одной стороны, правильно, но с другой – сложно исполнимо, особенно если речь идет о частном секторе здравоохранения. Да и пациенты в большинстве своем хотят куда более простых решений.
Кроме того, это не вопрос одного дня! Между тем регуляторика по телемедицине вступила в силу в январе 2018 года без какого-либо переходного периода. Тогда ни одна медицинская организация не была готова к этому технически, ведь требуется обеспечить защиту персональных данных пациента, передачу информации в федеральные регистры и реестры и т. д. Таким образом, приказ Минздрава о телемедицине в одночасье сделал противозаконной всю ту телемедицину, что была и довольно успешно практиковалась до 2018 года. Да и сейчас спустя 5 лет совершенно нельзя сказать, что клиники, врачи и пациенты готовы к новому формату.
Кроме технических сложностей, нормативные акты предусматривают жесткие ограничения по функционалу сервиса. Например, без очного приема врач не может поставить диагноз и назначить лечение, хотя на сегодняшний день возможности медицины и запрос пациентов шире. Уже не первый год пытаются ввести «человеческую» телемедицину на экспериментальных территориях. Это так называемые цифровые песочницы, но пока все эти задумки тоже на мели. Возможно, и потому, что многие против того, чтобы одним было можно то, что всем другим нельзя.
В итоге с 2018 года развитие телемедицины буксует, на текущий момент – это зона повышенного правового риска при одновременно больших вложениях ресурсов и высокой вероятности негатива со стороны пациентов. Телемедицина востребована и в среде врачей, однако для обращения к коллеге за помощью врачу не требуется ни ЕСИА, ни ЭЦП. Он просто возьмет телефон и позвонит. Или напишет. Теневая телемедицина еще долгие годы будет превалировать, пока условия не станут реально приемлемыми для ее участников.
Сделаем выводы из сказанного. Много и красиво говорится об информатизации отрасли, телемедицине, использовании искусственного интеллекта, но все это внедряется где-то на Олимпе, а внизу, у его подножия, ни врачи, ни клиники, ни пациенты пока не могут пользоваться всеми этими инновациями в полной мере.
К печальным выводам пришла и Счетная палата РФ в начале 2021 года. Аудиторы констатировали, что федеральная программа по созданию ЕЦК не поможет сократить временные затраты медработников, не обеспечивает высокое качество, полноту и достоверность информации о состоянии здоровья пациента, а также оптимальную маршрутизацию.
- Звучит красиво – «цифровая экосистема»
- Старт без финиша
- Исполнить нельзя, но обязаны
- Телерисковая зона
14/03/2023, 14:02
Комментарий к публикации:
Мираж цифровизации

Габай Полина Георгиевна
Шеф-редактор
Oфф-лейбл уже можно, но все еще нельзя
29 июня 2022 года вступил в силу долгожданный федеральный закон, допускающий применение препаратов офф-лейбл (вне инструкции) у детей. Это вконец оголило правовую неурегулированность взрослого офф-лейбла, однако детский вопрос, казалось бы, теперь успешно решен…
Рано обрадовались
В реальности под громкие фанфары закон вступил в силу – но работать так и не начал. Не помогло и распоряжение Правительства от 16.05.2022 №1180-р, определившее перечень заболеваний, при которых допускается применение препаратов офф-лейбл (вступило в силу одновременно с законом).
Фактическую невозможность применять препараты офф-лейбл у детей Минздрав России признал буквально на днях. Почему так случилось?
Во-первых, до сих пор не утверждены стандарты медпомощи, в которые теперь допустимо включать препараты офф-лейбл. Стандарты старательно маринуются в недрах Минздрава – в том числе по причине номер два: не утверждены требования, которым должны удовлетворять препараты для их включения в стандарты медпомощи и клинические рекомендации. Требования же должно утвердить правительство, точнее должно было утвердить уже к моменту вступления закона в силу.
Закон не работает, но это закон?
По всей видимости, нормотворцам непросто вернуть джинна в бутылку. Текущие клинические рекомендации для детей содержат назначения офф-лейбл (#), притом онкогематологические содержат их в избытке. Как известно, для детской онкогематологии использование препаратов офф-лейбл критично, это 80–90% всех назначений.
И пока на высоких трибунах решаются все эти дилеммы, потенциал закона достиг плинтуса и одновременно потолка абсурда.
В отношении взрослых ведомство, как заезженная пластинка, повторило пассаж о правомерности таких назначений через врачебную комиссию. Опустим «правомерность» такого подхода, не так давно мы приводили подробные контраргументы.
Важно другое – что делать врачам, а главное детям? На этом месте патефон затих, оставив ряд резонных вопросов:
- Зачем принимали закон, если было можно через ВК?
- Почему сейчас нельзя, несмотря на вступление закона в силу и наличие препаратов офф-лейбл в клинических рекомендациях?
- Зачем принимали закон, если он только ухудшил положение врачей и пациентов?
- Как врачам и детям дождаться требований и стандартов медицинской помощи?
Хотели как лучше, а получилось как всегда
Очевидно, проблема не в самом законе, а в некорректной юридической технике реализации правовых норм. Огрехи в этом должны компенсироваться своевременными и адекватными действиями регулятора.
Неготовность стандартов ко «времени Ч» была предопределена. Даже если бы правительство своевременно утвердило требования к препаратам офф-лейбл, подготовить и принять стандарты за один день – невозможно. Соответственно, заранее была ясна и необходимость переходного периода, в котором, например, было бы допустимо назначать препараты вне инструкции в соответствии с клиническими рекомендациями до момента принятия требований и стандартов медпомощи. Но такой период никто не предусмотрел.
И даже эти упущения регулятор мог бы худо-бедно компенсировать своими разъяснениями при условии, что они устраняют пробел и решают возникшую проблему. Минздрав же, фактически признавая регуляторную ошибку, поставил в тупик субъекты здравоохранения и безвременно переложил на них ответственность за любые действия в ситуации неопределенности.
Налицо казус законодателя. Блестящая инициатива центра им. Димы Рогачева и вице-спикера Госдумы Ирины Яровой, принятый в декабре 2021 года прогрессивный закон – а в итоге ухудшение (!) условий в отрасли. Вместо шага вперед – шаг назад, вместо новых возможностей – потеря старых. И все сходится, и никто не виноват. И Минздрав вполне справедливо пишет, что при отсутствии стандартов возможность назначения препаратов офф-лейбл детям отсутствует.
- Рано обрадовались
- Закон не работает, но это закон?
- Хотели как лучше, а получилось как всегда
29/08/2022, 19:47
Комментарий к публикации:
ТАСС
Страница редакции
Подписаться на рассылку
Наши подписчики получают рассылки с новыми и самыми интересными материалами нашего портала
Верзенио — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-005715
Торговое наименование препарата:
Верзенио™
Международное непатентованное наименование:
Абемациклиб
Лекарственная форма:
таблетки, покрытые пленочной оболочкой
Состав:
1 таблетка, покрытая пленочной оболочкой, 50 мг содержит:
действующее вещество: абемациклиб – 50,00 мг;
вспомогательные вещества: микрокристаллическая целлюлоза 102 – 49,00 мг; микрокристаллическая целлюлоза 101 – 14,00 мг; лактозы моногидрат – 14,00 мг; кроскармеллоза натрия – 7,000 мг; кремния диоксид – 2,000 мг; натрия стеарилфумарат – 4,000 мг;
оболочка таблетки: смесь красителей бежевая 85F97280 – 4,200 мг.
Смесь красителей бежевая 85F97280: поливиниловый спирт частично гидролизованный, титана диоксид, макрогол 4000/пол и этилен гликоль ММ 3350, тальк, железа оксид желтый, железа оксид красный.
1 таблетка, покрытая пленочной оболочкой, 100 мг содержит:
действующее вещество: абемациклиб – 100,0 мг;
вспомогательные вещества: микрокристаллическая целлюлоза 102 – 98,00 мг; микрокристаллическая целлюлоза 101 – 28,00 мг; лактозы моногидрат – 28,00 мг; кроскармеллоза натрия – 14,00 мг; кремния диоксид – 4,000 мг; натрия стеарилфумарат – 8,000 мг;
оболочка таблетки: смесь красителей белая 85F18422 – 11,20 мг.
Смесь красителей белая 85F18422: поливиниловый спирт частично гидролизованный, титана диоксид, макрогол 4000/ полиэтиленгликоль ММ 3350, тальк.
1 таблетка, покрытая пленочной оболочкой, 150 мг содержит:
действующее вещество: абемациклиб – 150,0 мг;
вспомогательные вещества: микрокристаллическая целлюлоза 102 – 147,0 мг; микрокристаллическая целлюлоза 101 – 42,00 мг; лактозы моногидрат – 42,00 мг; кроскармеллоза натрия – 21,00 мг; кремния диоксид – 6,000 мг; натрия стеарилфумарат – 12,00 мг;
оболочка таблетки: смесь красителей желтая 85F92473 – 12,60 мг.
Смесь красителей желтая 85F92473: поливиниловый спирт частично гидролизованный, титана диоксид, макрогол 4000/ полиэтиленгликоль ММ 3350, тальк, железа оксид желтый.
1 таблетка, покрытая пленочной оболочкой, 200 мг содержит:
действующее вещество: абемациклиб – 200,0 мг;
вспомогательные вещества: микрокристаллическая целлюлоза 102 – 196,0 мг; микрокристаллическая целлюлоза 101 – 56,00 мг; лактозы моногидрат – 56,00 мг; кроскармеллоза натрия – 28,00 мг; кремния диоксид – 8,000 мг; натрия стеарилфумарат – 16,00 мг;
оболочка таблетки: смесь красителей бежевая 85F97280 – 16,80 мг.
Смесь красителей бежевая 85F97280: поливиниловый спирт частично гидролизованный, титана диоксид, макрогол 4000/полиэтиленгликоль ММ 3350, тальк, железа оксид желтый, железа оксид красный.
Описание:
Таблетки 50 мг:
овальные таблетки светло-оранжевого цвета с гравировкой «Lilly» на одной стороне и «50» на другой.
Таблетки 100 мг:
овальные таблетки от белового до почти белого цвета с гравировкой «Lilly» на одной стороне и «100» на другой.
Таблетки 150 мг:
овальные таблетки желтого цвета с гравировкой «Lilly» на одной стороне и «150» на другой.
Таблетки 200 мг:
овальные таблетки светло-оранжевого цвета с гравировкой «Lilly» на одной стороне и «200» на другой.
Фармакотерапевтическая группа:
противоопухолевые средства, ингибиторы протеинкиназ.
Код ATX:
L01XE50.
Фармакологические свойства
Механизм действия
Абемациклиб является ингибитором циклин-зависимых киназ 4 и 6 (CDK4 и CDK6). Эти киназы активируются при связывании с D-циклинами. При раке молочной железы с положительным статусом эстрогеновых рецепторов (ER+) комплекс циклин D1 и CDK4/6 способствует фосфорилированию белка ретинобластомы (Rb), прогрессированию клеточного цикла и пролиферации клеток. Длительное воздействие абемациклиба в условиях in vitro ингибирует фосфорилирование Rb и блокирует прогрессирование клеточного цикла из фазы G1 в фазу S, что приводит к старению и апоптозу. В моделях ксенотрансплантата рака молочной железы абемациклиб ежедневно непрерывно вводился в клинически значимых концентрациях, в качестве монотерапии или в сочетании с антиэстрогенами, что приводило к уменьшению размера опухоли.
Фармакодинамика
У пациентов с раком абемациклиб в дозах от 50 мг до 200 мг 2 раза в день подавляет активность CDK4 и CDK6, ингибируя фосфорилирование Rb и топоизомеразу II альфа, что приводит к остановке клеточного цикла перед рестрикционной точкой G1. При проведении анализа зависимости экспозиция – эффективность в исследованиях MONARCH 2 и MONARCH 3 была определена доза 150 мг 2 раза в день для начальной терапии в сочетании с эндокринной, и подтверждена необходимость снижения дозы до 50 мг 2 раза в день в случае плохой переносимости. При проведении анализа зависимости экспозиция – эффективность в исследовании MONARCH 1 была определена доза 200 мг 2 раза в день для начальной монотерапии абемациклибом.
Влияние абемациклиба на длительность интервала QT с корректировкой Фридериция (QTcF) оценивали у 144 пациентов с распространенным раком. Никаких значимых изменений (>20 мсек) длительности интервала QTcF не было обнаружено при среднем значении наблюдаемой максимальной равновесной концентрации абемациклиба после его применения в терапевтических дозах.
При проведении анализа зависимости экспозиция – эффективность у здоровых добровольцев при приеме препарата в наиболее высоких клинически значимых дозах было показано, что применение абемациклиба не приводило к клинически значимому увеличению интервала QTcF.
Фармакокинетика
Всасывание
Абемациклиб характеризуется медленным всасыванием с медианой времени достижения максимальной концентрации Тmax, равной 8,0 ч. Абсолютная биодоступность абемациклиба составляет 45% (90% доверительный интервал: 40-51%). В диапазоне терапевтических доз от 50 мг до 200 мг увеличение экспозиции (Сmax и площади под кривой «концентрация-время» AUC) является пропорциональным дозе препарата. Равновесное состояние достигается в течение 5 дней при приеме абемациклиба 2 раза в день. Абемациклиб накапливается со средним геометрическим отношением, составляющим 3,7 (58% CV, CV – коэффициент вариации) и 5,8 (65% CV) на основании Сmax и AUC, соответственно.
Распределение
Абемациклиб обладает высокой степенью связывания с белками плазмы человека (среднее значение связанной фракции составляет 96-98%), при этом связывание не зависит от концентрации абемациклиба в диапазоне от 152 нг/мл до 5066 нг/мл. Абемациклиб связывается как с сывороточным альбумином человека, так и с альфа-1-кислым гликопротеином. Среднее геометрическое значение системного объема распределения составляет приблизительно 747 л (68,6% CV).
У пациентов с распространенным раком концентрация абемациклиба и его активных метаболитов М2 и М20 в спинномозговой жидкости сравнимы с концентрациями несвязанных метаболитов в плазме.
Метаболизм
Абемациклиб подвергается метаболизму в основном в печени, главным образом, при участии цитохрома Р450 (CYP) ЗА с образованием основного метаболита N-дезэтилабемациклиба (М2) и дополнительных метаболитов: гидроксиабемациклиба (М20), гидрокси-N-дезэтилабемациклиба (M18) и окисленного метаболита (M1). Активность метаболитов N-дезэтилабемациклиба (М2) и гидроксиабемациклиба (М20) сходна с активностью абемациклиба.
Выведение
Среднее геометрическое значение печеночного клиренса (CL) абемациклиба составляет 21,8 л/ч (39,8% CV), средний период полувыведения из плазмы крови – 24,8 ч (52,1% CV).
После приема внутрь однократной дозы меченного изотопом [14С] абемациклиба приблизительно 81% от принятой дозы выводится через кишечник и приблизительно 3,4% – почками. Большую часть дозы, выведенной через кишечник, составляли метаболиты.
Особые группы пациентов
Возраст, пол и масса тела
Возраст, пол и масса тела не оказывали влияния на экспозицию абемациклиба в анализе популяционной фармакокинетики у пациентов с раком (135 мужчин и 859 женщин в возрасте от 24 лет до 91 года и массой тела от 36 до 175 кг).
Пациенты с нарушением функции печени
Абемациклиб подвергается метаболизму в печени. У пациентов с нарушением функции печени тяжелой степени экспозиция несвязанного абемациклиба увеличивалась в 2,69 раза, а период полувыведения – с 24 до 55 часов. У пациентов с нарушением функции печени тяжелой степени необходимо уменьшить частоту дозирования до одного раза в день.
Пациенты с нарушением функции почек
Абемациклиб и его метаболиты не выводятся через почки в значительной степени. Коррекция дозы у пациентов с нарушением функции почек легкой или умеренной степени не требуется. Нет данных о применении препарата у пациентов с почечной недостаточностью тяжелой степени, терминальной стадией почечной недостаточности, а также у пациентов, находящихся на диализе.
Показания к применению
Верзенио™ показан для лечения положительного по гормональным рецепторам (HR+) и отрицательного по рецептору эпидермального фактора роста человека 2-го типа (HER2-) распространенного или метастатического рака молочной железы:
— в комбинации с первой линией эндокринной терапии ингибитором ароматазы;
— в комбинации с фулвестрантом, назначаемым в качестве первой или второй линии эндокринной терапии;
— в качестве монотерапии у пациентов с прогрессированием заболевания после эндокринной терапии и одной или двух линий предшествующей химиотерапии по поводу метастатической стадии заболевания.
У женщин в пре- или перименопаузе терапию необходимо комбинировать с назначением агониста лютеинизирующего гормона рилизинг-гормона (ЛГРГ).
Противопоказания
Повышенная чувствительность к абемациклибу или любому компоненту, входящему в состав препарата; беременность и период грудного вскармливания.
Детский возраст, почечная недостаточность тяжелой степени, терминальная стадия почечной недостаточности, пациенты, находящиеся на гемодиализе (эффективность и безопасность не установлены).
С осторожностью
Пациенты с дефицитом лактазы, непереносимостью лактозы или глюкозно-галактозной мальабсорбцией, пациенты с нарушением функции печени тяжелой степени тяжести, одновременное применение с сильными ингибиторами изофермента CYP3A4. Следует избегать одновременного применения индукторов изофермента CYP3A4 ввиду риска снижения эффективности абемациклиба.
Применение при беременности и в период грудного вскармливания
Беременность
Данные доклинических исследований на животных показали, что препарат Верзенио™ при применении во время беременности может оказывать вред для плода. В исследованиях репродуктивной функции у животных применение абемациклиба в период органогенеза оказывало тератогенное действие и приводило к снижению массы плода во время беременности, что было сходно с данными о воздействии на человека, основанными на AUC при применении максимально рекомендованной человеку дозы. Данные о риске, связанном с применением препарата у человека, отсутствуют. Следует сообщить беременной женщине о возможном риске для плода.
Период грудного вскармливания
Данные о возможности проникновения абемациклиба в грудное молоко, влиянии абемациклиба на ребенка, находящегося на грудном вскармливании, или о влиянии на выработку молока, отсутствуют. Поскольку у ребенка, находящегося на грудном вскармливании, возможно развитие серьезных нежелательных реакций, связанных с проникновением абемациклиба в грудное молоко, следует рекомендовать кормящим женщинам прекратить грудное вскармливание на время приема препарата Верзенио™ и как минимум в течение 3 недель после завершения терапии.
Женщины и мужчины с репродуктивным потенциалом
Тестирование на беременность
Данные доклинических исследований на животных показали, что применение препарата Верзенио™ во время беременности может причинить вред плоду. Проведение теста на беременность рекомендуется женщинам детородного возраста до начала терапии препаратом Верзенио™.
Контрацепция у женщин
Применение препарата Верзенио™ во время беременности может причинить вред плоду. Женщинам детородного возраста следует рекомендовать использование эффективных методов контрацепции во время терапии препаратом Верзенио™ и в течение как минимум 3 недель после приема его последней дозы.
Бесплодие у мужчин
На основании данных исследований на животных, препарат Верзенио™ может влиять на фертильность мужчин репродуктивного возраста.
Способ применения и дозы
Рекомендуемые дозы и режим дозирования
В составе комбинированной терапии с фулвестрантом или ингибитором ароматазы рекомендуемая доза препарата Верзенио™ составляет 150 мг внутрь 2 раза в день.
- Следует обратиться к инструкции по медицинскому применению ингибитора ароматазы для получения информации о рекомендуемой дозе препарата.
- Рекомендуемая доза фулвестранта составляет 500 мг в 1-й, 15-й и 29-й дни цикла и далее 1 раз в месяц. Следует ознакомиться с инструкцией по медицинскому применению фулвестранта. При комбинированной терапии препаратом Верзенио™ и фулвестрантом в соответствии с существующими стандартами клинической практики женщинам в пери- и пременопаузе следует пройти курс лечения агонистом гонадотропин-рилизинг гормона (ГнРГ).
При проведении монотерапии рекомендуемая доза препарата Верзенио™ составляет 200 мг внутрь 2 раза в день.
Терапию следует продолжать до прогрессирования заболевания или развития непереносимой токсичности. Препарат Верзенио™ можно принимать независимо от приема пищи. Необходимо принимать назначенные дозы препарата Верзенио™ примерно в одно и то же время каждый день.
При возникновении рвоты у пациента или при пропуске приема препарата Верзенио™ необходимо принять следующую дозу в обычное время. Таблетку необходимо проглатывать целиком, не следует разжевывать, дробить или делить таблетку. Не следует принимать поврежденные таблетки, разломанные, с трещинами или другими признаками повреждения.
Коррекция режима дозирования
Коррекция режима дозирования при развитии нежелательных реакции
Рекомендации по коррекции дозы при развитии нежелательных реакций представлены в таблицах 1-5. Следует отменить прием препарата Верзенио™ при непереносимости дозы 50 мг 2 раза в день.
Таблица 1. Коррекция дозы препарата Верзенио™ при развитии нежелательных реакций.
| Уровень снижения дозы |
Доза Верзенио™ при комбинированной терапии с фулвестрантом или ингибитором ароматазы |
Доза Верзенио™ при монотерапии |
| Рекомендуемая начальная доза | 150 мг 2 раза в день | 200 мг 2 раза в день |
| Первое снижение дозы | 100 мг 2 раза в день | 150 мг 2 раза в день |
| Второе снижение дозы | 50 мг 2 раза в день | 100 мг 2 раза в день |
| Третье снижение дозы | Не применимо | 50 мг 2 раза в день |
Таблица 2. Коррекция дозы препарата Верзенио™ при гематологической токсичности1.
| Необходимо контролировать показатели общего анализа крови перед началом терапии Верзенио™, каждые 2 недели в течение первых 2 месяцев, ежемесячно в течение следующих 2 месяцев и затем в соответствии с клиническими показаниями. | |
| Степень тяжести в соответствии с СТСАЕ | Коррекция дозы Верзенио™ |
| 1 или 2 степень | Коррекция дозы не требуется |
| 3 степень | Временная отмена до восстановления показателя до ≤2 степени. Уменьшение дозы не требуется |
| Повторное развитие 3 степени или 4 степень | Временная отмена до восстановления показателя до ≤2 степени. Возобновить прием в дозе, сниженной до следующего уровня |
CTCAE (Common Terminology Criteria for Adverse Events) – Общая терминология критериев нежелательных реакций.
1 – В случае необходимости применения гемопоэтических ростовых факторов следует отменить терапию препаратом Верзенио™ как минимум на 48 часов после последнего введения гемопоэтических ростовых факторов до восстановления показателя до ≤2 степени. Возобновить прием в дозе, уменьшенной до следующего уровня, если доза еще не была снижена ввиду токсичности, потребовавшей применение гемопоэтических ростовых факторов. Применение гемопоэтических ростовых факторов следует проводить согласно существующим стандартам лечения.
Таблица 3. Коррекция дозы препарата Верзенио™ при диарее.
| При первых признаках жидкого стула следует начать прием противодиарейных препаратов. | |
| Степень тяжести в соответствии с СТСАЕ | Коррекция дозы Верзенио™ |
| 1 степень | Коррекция дозы не требуется |
| 2 степень | Если токсичность не разрешается в течение 24 часов до ≤1 степени, временно отменить прием до выздоровления. Коррекция дозы не требуется |
| Сохранение или повторное развитие 2 степени после возобновления прежней дозы, несмотря на полный комплекс симптоматической терапии | Временная отмена до восстановления показателя до ≤1 степени. Возобновить прием в дозе, уменьшенной до следующего уровня |
| 3 или 4 степень или диарея, требующая госпитализации | Временная отмена до восстановления показателя до ≤1 степени. Возобновить прием в дозе, уменьшенной до следующего уровня |
Таблица 4. Коррекция дозы препарата Верзенио™ при гепатотоксичности.
| Необходимо контролировать уровень АЛТ, ACT и общего билирубина перед началом терапии Верзенио™, каждые 2 недели в течение первых 2 месяцев, ежемесячно в течение следующих 2 месяцев и затем в соответствии с клиническими показаниями. | |
| Степень тяжести в соответствии с СТСАЕ для показателей АЛТ и ACT | Коррекция дозы Верзенио™ |
| 1 степень (>ВГН – 3,0 х ВГН) 2 степень (>3,0-5,0 х ВГН) БЕЗ увеличения концентрации общего билирубина выше 2 х ВГН |
Коррекция дозы не требуется |
| Сохранение или повторное развитие 2 степени или 3 степень (>5,0-20,0 х ВГН) БЕЗ увеличения концентрации общего билирубина выше 2 х ВГН | Временная отмена до восстановления исходной степени или 1 степени. Возобновить прием в дозе, уменьшенной до следующего уровня |
| Повышение уровня ACT и/или АЛТ >3 х ВГН с увеличением концентрации общего билирубина >2 х ВГН при отсутствии холестаза | Полная отмена препарата |
| 4 степень (>20,0 х ВГН) | Полная отмена препарата |
ACT – аспартатаминотрансфераза, АЛТ – аланинаминотрансфераза, ВГН – верхняя граница нормы.
Таблица 5. Коррекция дозы препарата Верзенио™ при других проявлениях токсичности1.
| Степень тяжести в соответствии с СТСАЕ | Коррекция дозы Верзенио™ |
| 1 или 2 степень | Коррекция дозы не требуется |
| Сохранение или повторное развитие токсичности 2 степени, которая не снижается до исходного уровня или 1 степени в течение 7 дней, несмотря на полный комплекс симптоматической терапии | Временная отмена до восстановления исходной степени или до ≤1 степени. Возобновить прием в дозе, уменьшенной до следующего уровня |
| 3 или 4 степень | Временная отмена до восстановления исходной степени или до ≤1 степени. Возобновить прием в дозе, уменьшенной до следующего уровня |
1 – Кроме случаев диареи, гематологической токсичности и гепатотоксичности.
Следует обратиться к инструкции по медицинскому применению ингибитора ароматазы или фулвестранта для получения информации о коррекции дозы и другой информации по безопасности.
Коррекция дозы препарата Верзенио™ при применении с сильными ингибиторами изофермента CYP3A
Следует избегать одновременного применения препарата Верзенио™ и кетоконазола, являющегося сильным ингибитором изофермента CYP3A. При одновременном применении иного сильного ингибитора изофермента CYP3A у пациентов, которым показана начальная доза 200 мг 2 раза в день или 150 мг 2 раза в день, необходимо снизить дозу препарата Верзенио™ до 100 мг 2 раза в день. Если доза была снижена до 100 мг ввиду нежелательных реакций, необходимо дополнительно снизить дозу до 50 мг 2 раза в день. При отмене сильного ингибитора изофермента CYP3A дозу препарата Верзенио™ следует увеличить (спустя по меньшей мере 3-5-кратный период полувыведения сильного ингибитора) до дозы, которую принимал пациент до начала применения сильного ингибитора изофермента CYP3A (см. разделы «Взаимодействие с другими лекарственными препаратами»).
Особые группы пациентов
Пациенты с печеночной недостаточностью
Не требуется коррекции дозы при применении препарата у пациентов с нарушением функции печени легкой или средней степени тяжести (класс А или В по классификации Чайлд-Пью).
У пациентов с нарушением функции печени тяжелой степени (класс С по классификации Чайлд-Пью) необходимо снижать частоту приема препарата Верзенио™ до 1 раза в сутки.
Следует обратиться к инструкции по медицинскому применению ингибитора ароматазы или фулвестранта для получения информации о коррекции дозы этих препаратов у пациентов с нарушением функции печени тяжелой степени.
Пациенты с почечной недостаточностью
Не требуется коррекции дозы при применении препарата у пациентов с нарушением функции почек легкой или средней степени тяжести (клиренс креатинина ≥30-89 мл/мин). Фармакокинетика абемациклиба у пациентов с почечной недостаточностью тяжелой степени тяжести (клиренс креатинина <30 мл/мин), терминальной стадией почечной недостаточности, а также у пациентов, которым требуется проведение гемодиализа, не изучалась.
Дети и подростки до 18 лет
Безопасность и эффективность Верзенио™ при применении у детей и подростков в возрасте до 18 лет не установлены.
Пациенты пожилого возраста
Из 900 пациентов, получавших препарат Верзенио™ в исследованиях MONARCH 1, MONARCH 2 и MONARCH 3, 38% пациентов были в возрасте 65 лет и старше и 10% были в возрасте 75 лет и старше. Наиболее частыми нежелательными реакциями (≥5%) 3 или 4 степени тяжести у пациентов в возрасте 65 лет и старше в исследованиях MONARCH 1, MONARCH 2 и MONARCH 3 были нейтропения, диарея, утомляемость, тошнота, дегидратация, лейкопения, анемия, инфекции и повышение активности АЛТ. В целом, не было отмечено различий в безопасности или эффективности препарата Верзенио™ у пациентов в возрасте 65 лет и старше по сравнению с более молодыми пациентами.
Побочное действие
В составе комбинированной терапии с фулвестрантом или ингибитором ароматазы
Наиболее распространенными нежелательными реакциями являются диарея, инфекции, нейтропения, анемия, утомляемость, тошнота, рвота и снижение аппетита.
Нежелательные реакции приведены в соответствии с классами систем органов и частотой, представленными в Медицинском словаре для нормативно-правовой деятельности (MedDRA). Нежелательные реакции распределены и представлены по частоте развития: очень частые (≥1/10), частые (от ≥1/100 до <1/10), нечастые (от ≥1/1000 до <1/100), редкие (от ≥1/10000 до <1/1000), очень редкие (< 1/10000), с неизвестной частотой (частота не может быть определена на основании имеющихся данных). В каждой группе нежелательные реакции расположены в порядке убывания степени тяжести.
Инфекционные и паразитарные заболевания: очень часто: инфекции1.
1 – Включают все предпочтительные термины, которые являются частью класса системы органов «Инфекционные и паразитарные заболевания».
Нарушения со стороны крови и лимфатической системы: очень часто – нейтропения, лейкопения, анемия, тромбоцитопения; часто – снижение числа лимфоцитов; нечасто – фебрильная нейтропения.
Нарушения со стороны обмена веществ и питания: очень часто – снижение аппетита.
Нарушения со стороны нервной системы: очень часто – дисгевзия, головокружение.
Нарушения со стороны органа зрения: часто – повышенное слезотечение.
Нарушения со стороны сосудов: часто – венозная тромбоэмболия2.
2 – Явления венозной тромбоэмболии включали: тромбоз глубоких вен, тромбоэмболию легочной артерии, тромбоз синусов твердой мозговой оболочки, тромбоз подключичной вены, тромбоз подмышечной вены, тромбоз глубоких вен системы нижней полой вены и почечной вены.
Нарушения со стороны желудочно-кишечного тракта: очень часто – диарея, рвота, тошнота.
Нарушения со стороны кожи и подкожных тканей: очень часто – алопеция, зуд, сыпь; часто – сухость кожи.
Нарушения со стороны костно-мышечной системы и соединительной ткани: часто – мышечная слабость.
Общие расстройства и нарушения в месте введения: очень часто – утомляемость, пирексия.
Лабораторные и инструментальные данные: очень часто – повышение уровня АЛТ, повышение уровня ACT.
Описание отдельных нежелательных реакций
Нейтропения
Часто сообщалось о случаях развития нейтропении (41,5%) у пациентов, получавших препарат Верзенио™ в комбинации с ингибитором ароматазы или фулвестрантом, при этом у 28,2% пациентов наблюдалось развитие нейтропении 3 и 4 степени (на основании лабораторных исследований). Медиана времени до развития первого эпизода нейтропении 3 или 4 степени составляла от 29 до 33 дней, при этом медиана продолжительности нейтропении – от 11 до 15 дней. Сообщалось о развитии фебрильной нейтропении у 0,9% пациентов. При нейтропении 3 или 4 степени тяжести рекомендуется коррекция дозы (см. раздел «Способ применения и дозы»).
Диарея
Диарея была наиболее часто сообщаемой нежелательной реакцией. Частота развития диареи была выше в течение первого месяца терапии препаратом Верзенио™, после чего снижалась. В ходе исследований медиана времени до развития первого эпизода диареи составляла от 6 до 8 дней, а медиана продолжительности диареи – от 9 до 12 дней (для диареи 2 степени тяжести) и от 6 до 8 дней (для диареи 3 степени тяжести). Купирование диареи достигалось с помощью сопутствующей терапии такими лекарственными препаратами, как лоперамид, и/или посредством коррекции дозы (см. раздел «Способ применения и дозы»).
Повышение уровня аминотрансфераз
Часто сообщалось о случаях повышения уровня АЛТ и ACT (15,1% и 14,2%, соответственно) у пациентов, получавших препарат Верзенио™ в комбинации с ингибитором ароматазы или фулвестрантом, при этом повышение уровня АЛТ и ACT 3 и 4 степени тяжести (на основании лабораторных исследований) наблюдалось у 6,1% и 4,2% пациентов, соответственно. У пациентов с повышением уровня АЛТ 3 или 4 степени медиана времени до развития данного явления составляла от 57 дней до 61 дня, медиана времени до его разрешения – 14 дней. У пациентов с повышением уровня ACT 3 или 4 степени медиана времени до развития данного явления составляла от 71 дня до 185 дней, медиана времени до его разрешения – от 13 до 15 дней. При повышении уровня АЛТ или ACT 3 или 4 степени тяжести рекомендуется коррекция дозы (см. раздел «Способ применения и дозы»).
Повышение уровня креатинина
Было показано, что у 98,3% пациентов при применении препарата Верзенио™ повышается уровень креатинина в сыворотке крови (на основании лабораторных исследований), при этом повышение уровня креатинина 3 или 4 степени тяжести отмечалось у 1,9% пациентов (на основании лабораторных исследований). Сообщалось о случаях повышения уровня креатинина (все степени тяжести) у 78,4% пациентов, получавших монотерапию ингибитором ароматазы или фулвестрантом. Было показано, что абемациклиб повышает уровень креатинина в сыворотке крови ввиду ингибирования переносчиков тубулярной секреции почек без влияния на скорость клубочковой фильтрации (СКФ), определяемой по клиренсу йогексола.
В клинических исследованиях повышение уровня креатинина в сыворотке отмечалось в течение первого месяца применения препарата Верзенио™, и уровень креатинина оставался повышенным, но стабильным в течение всего периода лечения, причем это повышение было обратимым после прекращения лечения и не сопровождалось изменениями в маркерах функции почек, таких как азот мочевины крови, цистатин С или СКФ, рассчитанная на основании уровня нистатина С.
В качестве монотерапии
Наиболее распространенными нежелательными реакциями, о которых сообщалось с частотой ≥20% были: диарея, утомляемость, тошнота, снижение аппетита, боль в животе, нейтропения, рвота, инфекции, анемия, головная боль и тромбоцитопения.
Наиболее частыми нежелательными реакциями, о которых сообщалось с частотой ≥10% были:
нарушения со стороны желудочно-кишечного тракта: диарея, тошнота, боль в животе, рвота, запор, сухость во рту, стоматит;
инфекционные и паразитарные заболевания: инфекции;
общие расстройства и нарушения в месте введения: утомляемость1, пирексия;
1 – Включает астению, утомляемость;
нарушения со стороны крови и лимфатической системы:, нейтропения2, анемия3, тромбоцитопения4, лейкопения5;
2 – Включает нейтропению, снижение числа нейтрофилов;
3 – Включает анемию, снижение гематокрита, снижение уровня гемоглобина, снижение числа эритроцитов;
4 – Включает снижение числа тромбоцитов, тромбоцитопению;
5 – Включает лейкопению, снижение числа лейкоцитов.
нарушения со стороны обмена веществ и питания: снижение аппетита, обезвоживание;
нарушения со стороны дыхательной системы, органов грудной клетки и средостения: кашель;
нарушения со стороны костно-мышечной системы и соединительной ткани: артралгия;
нарушения со стороны нервной системы: головная боль, дисгевзия, головокружение;
нарушения со стороны кожи и подкожных тканей: алопеция;
лабораторные и инструментальные данные: повышение уровня креатинина в сыворотке крови, снижение массы тела, снижение числа лейкоцитов, снижение числа нейтрофилов, анемия, снижение числа лимфоцитов, снижение числа тромбоцитов, повышение уровня АЛТ, повышение уровня ACT.
Описание отдельных нежелательных реакций
Повышение уровня креатинина
Было показано, что при применении абемациклиба повышается уровень креатинина в сыворотке крови, что связано с ингибированием переносчиков тубулярной секреции почек без нарушения гломерулярной функции. В клинических исследованиях повышение уровня креатинина в сыворотке (среднее увеличение на 0,2-0,3 мг/дл) отмечалось в течение первого 28-дневного цикла применения препарата Верзенио™, и уровень креатинина оставался повышенным, но стабильным в течение всего периода лечения, причем это повышение было обратимым после прекращения лечения. Для определения нарушения функции почек могут использоваться альтернативные маркеры, такие как азот мочевины крови, нистатин С или рассчитанная СКФ, которые не основаны на креатинине.
Передозировка
Антидоты препарата Верзенио™ не известны. В случае передозировки следует проводить общую симптоматическую терапию.
Взаимодействие с другими лекарственными препаратами
Влияние других лекарственных препаратов на фармакокинетику Верзенио™
Верзенио™ подвергается метаболизму преимущественно с помощью изофермента CYP3A4.
Ингибиторы изофермента CYP3A4
При одновременном применении ингибиторов изофермента CYP3A4 и препарата Верзенио™ отмечалось увеличение концентрации абемациклиба в плазме крови. У пациентов с распространенным и/или метастатическим раком одновременное применение ингибитора изофермента CYP3A4 кларитромицина увеличивало экспозицию абемациклиба в плазме крови в 3,4 раза и сочетанную свободную экспозицию абемациклиба и его активных метаболитов с поправкой на активность в плазме крови в 2,5 раза.
Следует избегать одновременного приема сильных ингибиторов изофермента CYP3A4 и Верзенио™. Если сопутствующая терапия ингибиторами изофермента CYP3A4 необходима, следует уменьшить дозу препарата Верзенио™ (см. раздел «Способ применения и дозы») и далее тщательно проводить мониторинг токсичности. Примеры сильных ингибиторов изофермента CYP3A4 включают, но не ограничиваются следующими: кларитромицин, итраконазол, кетоконазол, лопинавир/ритонавир, позаконазол и вориконазол. Следует избегать употребления грейпфрутов или грейпфрутового сока.
Коррекция дозы не требуется у пациентов, получающих терапию умеренными или слабыми ингибиторами изоферментами CYP3A4. Однако следует проводить мониторинг признаков токсичности.
Индукторы изофермента CYP3A4
Одновременное применение сильного индуктора изофермента CYP3A4 рифампицина и препарата Верзенио™ приводило к снижению концентрации абемациклиба в плазме крови на 95% и свободной концентрации абемациклиба и его активных метаболитов с поправкой на активность в плазме крови на 77% на основании показателя AUC0-∞. Следует избегать одновременного применения препарата Верзенио™ с сильными индукторами изофермента CYP3A4 (включая, но не ограничиваясь, следующими: карбамазепин, фенитоин, рифампицин и зверобой) ввиду риска снижения эффективности абемациклиба.
Влияние Верзенио™ на фармакокинетику других лекарственных препаратов
Лекарственные препараты, являющиеся субстратами переносчиков
Абемациклиб и его основные активные метаболиты ингибируют почечные переносчики ОСТ2 (переносчик органических катионов 2), МАТЕ1 и МАТЕ2-К (белков множественной резистентности и выведения токсинов 1 и 2-К). In vivo может происходить взаимодействие абемациклиба и клинически значимых субстратов этих переносчиков, таких как дофетилид или креатинин. В клиническом исследовании лекарственного взаимодействия с метформином (субстратом ОСТ2, МАТЕ1 и 2) его одновременный прием с абемациклибом в дозе 400 мг приводил к небольшому клинически незначимому увеличению (37%) экспозиции метформина в плазме крови. Было показано, что это было вызвано уменьшением почечной секреции при неизменной клубочковой фильтрации.
У здоровых добровольцев одновременное применение абемациклиба и субстрата Р-гликопротеина (P-gp) лоперамида приводило к увеличению экспозиции лоперамида в плазме крови на 9% на основании показателя AUC0-∞ и на 35% на основании показателя Сmax. Данное увеличение не считалось клинически значимым. Однако, основываясь на ингибировании in vitro P-gp и белка резистентности рака молочной железы (BCRP) в присутствии абемациклиба, возможны взаимодействия in vivo абемациклиба с субстратами данных переносчиков с узким терапевтическим индексом, такими как дигоксин или дабигатрана этексилат.
В ходе клинических исследований с участием пациентов с раком молочной железы не было выявлено клинически значимого влияния препарата Верзенио™ на фармакокинетику анастрозола, фулвестранта, эксеместана, летрозола или тамоксифена.
На данный момент неизвестно, способен ли препарат Верзенио™ снижать эффективность гормональных контрацептивов системного действия, поэтому женщинам, применяющим препарат данной группы, рекомендуется дополнительно использовать барьерный метод контрацепции.
Особые указания
Нейтропения
Сообщалось о случаях развития нейтропении у пациентов, получавших препарат Верзенио™. При нейтропении 3 или 4 степени тяжести рекомендуется коррекция дозы (см. раздел «Способ применения и дозы»). Сообщалось о случаях летального исхода у <1% пациентов. Пациентам следует незамедлительно сообщать обо всех случаях лихорадки лечащему врачу.
Инфекции/паразитарные заболевания
Частота сообщений о развитии инфекций у пациентов, получавших препарат Верзенио™ в комбинации с эндокринной терапией, была выше по сравнению с группой, получавшей плацебо в комбинации с эндокринной терапией. Сообщалось о случаях развития инфекции легких у пациентов без сопутствующей нейтропении. Сообщалось о случаях летального исхода у <1% пациентов. Необходимо следить за признаками и симптомами развития инфекции и, в случае необходимости, провести соответствующую терапию, следуя существующим стандартам лечения.
Венозная тромбоэмболия
Венозная тромбоэмболия наблюдалась у 5,3% пациентов, получавших препарат Верзенио™ в комбинации с фулвестрантом или ингибитором ароматазы, и у 0,8% пациентов, получавших плацебо в комбинации с фулвестрантом или ингибитором ароматазы. Необходимо следить за признаками и симптомами развития тромбоза глубоких вен и тромбоэмболии легочной артерии и, в случае необходимости, провести соответствующую терапию, следуя существующим стандартам лечения.
Повышение уровня аминотрансфераз
Сообщалось о случаях повышения уровня АЛТ и ACT у пациентов, получавших препарат Верзенио™. В зависимости от степени повышения уровня АЛТ или ACT может потребоваться коррекция дозы (см. раздел «Способы применения и дозы»).
Диарея
Диарея является самой распространенной нежелательной реакцией. В ходе исследований медиана времени до развития первого эпизода диареи составляла от 6 до 8 дней, а медиана продолжительности диареи – от 9 до 12 дней (для диареи 2 степени тяжести) и от 6 до 8 дней (для диареи 3 степени тяжести). Эпизоды диареи могут быть связаны с дегидратацией. При первых признаках жидкого стула следует начать прием противодиарейных препаратов, таких как лоперамид, увеличить потребление жидкости и сообщить о проблеме лечащему врачу. При развитии диареи ≥2 степени тяжести рекомендуется коррекция дозы (см. раздел «Способы применения и дозы»).
Одновременный прием индукторов изофермента CYP3A4
Следует избегать одновременного приема индукторов изофермента CYP3A4 по причине риска снижения эффективности абемациклиба (см. раздел «Взаимодействие с другими лекарственными препаратами»).
Висцеральный криз
Данные об эффективности и безопасности препарата Верзенио™ у пациентов, имеющих висцеральный криз, отсутствуют.
Лактоза
Не следует принимать данный препарат пациентам, имеющим редкие наследственные состояния непереносимости галактозы, абсолютного дефицита лактазы или глюкозно-галактозной мальабсорции.
Натрий
Каждая таблетка препарата Верзенио™ содержит менее 1 ммоль натрия (23 мг).
Влияние на способность управлять транспортными средствами и работать с механизмами
Исследования по влиянию препарата на способность управлять транспортными средствами и работать с механизмами не проводились. Однако пациентам, у которых при приеме препарата возникают нежелательные явления со стороны нервной системы, следует проявлять осторожность при управлении автотранспортными средствами и работе с механизмами.
Форма выпуска
Таблетки, покрытые пленочной оболочкой.
14 таблеток в блистер из ПВХ/ПЭ/ПХТФЭ и алюминиевой фольги, покрытой термолаком. По одному блистеру в обложку картонную. По одной обложке картонной вместе с инструкцией по медицинскому применению в упаковку картонную.
Хранение
Хранить при температуре не выше 30°С.
Хранить в местах, недоступных для детей.
Срок годности
24 месяца.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Название и адрес производителя
Производство готовой лекарственной формы:
Лилли дель Карибе, Инк
12,6 км 65 Инфантри Роуд, Каролина, Пуэрто-Рико
Упаковка и выпускающий контроль качества:
Эли Лилли энд Компани, США
Корпоративный Центр Лилли, Индианаполис, Индиана, 46285, США
Представительство в России/Организация, принимающая претензии потребителей:
Представительство АО «Эли Лилли Восток С.А.»
123112, Москва, Пресненская наб., д. 10
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
В обзоре особое внимание уделено абемациклибу – избирательному ингибитору CDK4/6 непрерывного перорального применения с активностью в отношении CDK4 в 14 раз выше, чем в отношении CDK6. Выделена группа больных ЭР+ HER2- метастатическим раком молочной железы (мРМЖ), для которых назначение абемациклиба оптимально. Абемациклиб зарегистрирован в комбинации с эндокринотерапией в качестве первой линии лечения ЭР+ HER2- мРМЖ и после прогрессирования на фоне гормонотерапии. Применение абемациклиба в режиме монотерапии пациенток с ЭР+ HER2- мРМЖ с неблагоприятным прогнозом, получавших интенсивное предшествовавшее лечение, показало обнадеживающую эффективность и удовлетворительную переносимость.
Введение
Получение новых данных о гетерогенности люминального метастатического рака молочной железы (ЭР+ HER2- мРМЖ) способствовало поиску терапевтических агентов, биологически направленных на различные жизненно важные сигнальные пути, приводящих в конечном итоге к необратимым изменениям клеточного цикла опухолевой клетки. Все большее внимание уделяется необходимости одновременного воздействия на несколько мишеней, что позволяет преодолевать резистентность, возникающую в результате перекрестного патогенетического взаимодействия между сигнальными путями, в т.ч. активации рецепторов тирозинкиназы и т. д. [1–4]. Изучается несколько важных вопросов, касающихся последовательности лечения, комбинаторных стратегий, что способствует дальнейшему расширению и совершенствованию клинического применения ингибиторов циклинзависимых киназ-4 и -6 (CDK4/6) в лечении больных гормонопозитивным РМЖ.
За последние 4 года FDA одобрено 3 низкомолекулярных ингибитора CDK4/6: рибоциклиб, палбоциклиб и абемациклиб, для комбинированной стратегии эндокринной терапии в качестве предпочтительного метода для лечения больных ЭР+ HER2-мРМЖ в отсутствие висцерального криза. Применение различных пероральных ингибиторов CDK4/6 уже сегодня позволяет значительно улучшить показатели выживаемости больных ЭР+ HER2- мРМЖ. Профиль токсичности препаратов данного класса хорошо известен и предсказуем [5–14].
Роль CDK4/6 в жизнедеятельности опухолевой клетки
Представления о причастности циклинзависимых киназ к процессам злокачественной трансформации подтверждаются экспериментами на лабораторных животных. При помощи генноинженерных процессов у ряда мышей был «повержен» ген CDK4, что привело к снижению их чувствительности к канцерогенам. Абемациклиб по своей структуре отличается от других ингибиторов CDK4/6 (таких, как рибоциклиб и палбоциклиб). По данным ферментных анализов абемациклиб проявляет активность в отношении комплекса циклин D1/CDK4, в 14 раз более высокую, чем в отношении комплекса циклин D3/CDK6 [15–17]. Как показали данные доклинических исследований, для пролиферации, индуцированной эстрогеновыми рецепторами (ЭР), требуется циклин D [18, 19], который экспрессирован в высокой степени клетками РМЖ более чем у 50% пациенток [20].
Регулирование клеточного цикла осуществляется десятками молекул, нарушение деятельности которых запускает процесс злокачественной трансформации [21]. Комплекс циклин D1-CDK4/6-RB1 является основным медиатором клеточной пролиферации, опосредованной передачей сигналов эстрогена [22–24]. Эстроген индуцирует экспрессию циклина D1 [25–27] и тем самым способствует активности CDK4/6 в клетках ЭР+ HER2- мРМЖ, приводя к гиперфосфорилированию RB1 и продвижению клеточного цикла [28]. CDK4/6 в комплексе с циклинами D-типа фосфорилируют белок ретинобластомы (Rb), что приводит к высвобождению фактора E2F, связанного с белком Rb. Фактор E2F в свою очередь способствует прохождению клеточного цикла из G1-фазы в S-фазу [29, 30]. Прямое подавление CDK 4/6 приводит к разрыву этого пути и подавлению роста клеток РМЖ. Данные доклинических исследований показали, что краткосрочное ингибирование CDK4/6 вызывает временную остановку клеточного цикла в фазе G1, который возобновляется после отмены подавления [16]. Однако непрерывное длительное ингибирование CDK4/6 приводит к устойчивой остановке роста, инициации апоптоза и старению клеток [31].
Преклинические и клинические исследования CDK4/6 на дорегистрационном этапе
Абемациклиб является избирательным низкомолекулярным ингибитором CDK 4/6 для непрерывного приема внутрь 2 раза в сутки [15, 16, 32]. Доклинические данные показали новую потенциальную роль абемациклиба как стимулятора противоопухолевого иммунитета за счет повышения презентации антигенов и избирательного ингибирования пролиферации регуляторных Т-клеток. Это указывает на возможность участия в лечебном эффекте различных механизмов действия абемациклиба, приводящих к уменьшению размера опухоли [33]. Исследование IВ-фазы, включившее 47 пациенток с частотой клинического ответа 61,1%, дало начало разработке клинического исследования MONARCH-1 по оценке эффективности монотерапии абемациклибом больных, интенсивно предлеченных по поводу ЭР+ HER2- мРМЖ [34].
Воздействие абемациклиба на клетки РМЖ, экспрессирующие ЭР, приводило к снижению фосфорилирования Rb, остановке клеточного цикла в фазе G1 и уменьшению пролиферации клеток. Также отмечалась реакция старения, о чем свидетельствуют накопление β-галактозидазы, образование связанных со старением очагов гетерохроматина и уменьшение количества FOXM1-позитивных клеток.
В ксенотрансплантатной модели ЭР+ РМЖ монотерапия абемациклибом вызывала регресс опухолевого роста. Противоопухолевую активность абемациклиба in vivo оценивали у мышей, которым имплантировали ксенотрансплантат ZR-75-1 (модель люминального ЭР+ рака молочной железы человека). Дозозависимая противоопухолевая активность наблюдалась после применения абемациклиба в качестве единственного агента в дозе 75 мг/кг [17].
Исследования с применением ксенотрансплантатов на грызунах, проведенные другой группой исследователей, показали, что абемациклиб может преодолевать гематоэнцефалический барьер [35].
В исследовании I фазы с эскалацией дозы абемациклиба у больных мРМЖ (включая одну когорту пациенток с ГР+ мРМЖ, получавших абемациклиб в комбинации с фулвестрантом) был продемонстрирован фармакокинетический профиль препарата, свидетельствующий об отсутствии необходимости корректировки дозы в зависимости от массы тела пациенток, возраста или пола [36]. В исследование I фазы включали интенсивно предлеченных больных с висцеральными метастазами, получавших в среднем 7 линий предшествовавшей терапии. Активность абемациклиба была продемонстрирована в режиме монотерапии с частотой ответа 23% и медианой выживаемости без прогрессирования (ВБП) 5,8 месяца [15]. В данное исследование не закладывалась оценка противоопухолевого ответа в зависимости от гормонального статуса. Однако был отмечен более высокий уровень контроля заболевания у 81% пациенток с ГР+ РМЖ против 70% в общей когорте и против 33% в подгруппе с ГР- РМЖ. Аналогичные результаты в представленных группах также были отмечены в отношении медианы продолжительности ответа и медианы ВБП. Это исследование включило отдельную когорту пациенток с эскалацией дозы 1 раз в день и 2 раза в день с использованием схемы «3+3». Дозолимитирующая токсичность не наблюдалась у пациенток, получавших абемациклиб 1 раз в день в предписанной максимальной дозе 225 мг/день, поэтому максимальная переносимая доза не была достигнута. В группе пациенток, получавших абемациклиб 200 мг каждые 12 часов, у одной из 7 больных отмечена дозолимитирующая токсичность в виде усталости 3-й степени. У когорты пациенток, получавших абемациклиб в дозе 275 мг каждые 12 часов, об усталости 3-й степени сообщили двое из трех больных. Таким образом, рекомендованная исследовательская доза II фазы была установлена на уровне 200 мг каждые 12 часов [15].
Регистрационные клинические исследования Абемациклиба
MONARCH-2 – рандомизированное двойное слепое плацебо-контролируемое исследование III фазы по оценке фулвестранта в комбинации с абемациклибом и без такового у женщин с ГР+ HER2- мРМЖ и прогрессированием заболевания на фоне предшествовавшей эндокринной терапии
Впервые результаты исследования MONARCH-2 были опубликованы в 2017 г. В 2019 г. были представлены результаты в отношении общей выживаемости (ОВ). В исследование включали женщин в возрасте ≥18 лет с любым менопаузальным статусом (женщины в пре- и перименопаузе также получали агонист гонадотропин-рилизинг гормона) и оценкой общего состояния по критериям ECOG 0–1.
Основной первичной оценочной точкой был принят критерий ВБП, оцениваемый от даты рандомизации до объективного прогрессирования заболевания или смерти больного по любой причине. Второстепенные критерии включали частоту объективного ответа (ОО), длительность ремиссии и переносимость.
Медиана ВБП в группе абемациклиба в комбинации с фулвестрантом достигла 16,4 месяца против 9,3 в контрольной группе (относительный риск [ОР]=0,553; 95% доверительный интервал [ДИ]: 0,449–0,681; р<0,001. Слепой централизованный анализ показал сходные результаты (ОР=0,460; 95% ДИ: 0,363–0,584; p<0,001). Частота ОО составила 35,2% (95% ДИ: 30,8–39,6) в группе абемациклиба и 16,1% (95% ДИ: 11,3–21,0) в контрольной группе (p<0,001). В этот показатель были включены 14 случаев полного регресса (ПР; 3,1%) в группе абемациклиба и 1 случай ПР (0,4%) в контрольной группе (табл. 1). Ремиссия в обеих группах была продолжительной. Ремиссия длительностью 12 месяцев зарегистрирована у 67,8% пациентов в группе абемациклиба и 66,9% – в группе плацебо [5, 7].
Профиль токсичности препарата представлен в табл. 2. Диарея 1-й и 2-й степеней наблюдалась у 73,0% (322) пациенток в группе абемациклиба против 24,2% (54) – в группе плацебо. Диарея 3-й степени регистрировалась реже: 13,4% (n=59) в группе абемациклиба против 0,4% (n=1) в группе плацебо. В группе абемациклиба диарея обычно начиналась на первом цикле лечения (медиана срока наступления диареи составила 6 дней). В большинстве случаев диарею удавалось эффективно купировать применением противодиарейных лекарственных средств и модификацией дозы абемациклиба.
В группе абемациклиба у 14,5% пациенток с диареей 2-й степени и у 1,1% пациенток с диареей 3-й степени на начальном этапе отмечалось повторное появление диареи той же или более тяжелой степени тяжести. В большинстве случаев (70,1%) пациентам с диареей не требовалось изменения режима назначения абемациклиба (перерыв в дозировании, редукция дозы или отмена лечения) в связи с нежелательными явлениями. В группе абемациклиба частота возрастания уровня креатинина в сыворотке была на 25% выше, чем в группе плацебо. Показано, что применение абемациклиба приводило к повышению уровня креатинина в сыворотке в результате подавления его секреции почечными канальцами без ухудшения функции клубочков. Другие негематологические нежелательные явления (НЯ), часто отмечавшиеся в группе абемациклиба, включали тошноту, усталость и боль в животе (табл. 2).
На фоне лечения или в первые 30 дней после окончания терапии в группе абемациклиба в комбинации с фулвестрантом умерли 3,2% (14) пациенток (9 по причине НЯ) против 4,5% (10) в контрольной группе (2 по причине НЯ). НЯ, классифицируемые как связанные с исследуемым препаратом, отмечены в 0,7% случаев (3 летальных исхода): 2 – в результате сепсиса у больных с несоблюдением рекомендаций относительно применения гранулоцитарного колониестимулирующего фактора и редукции дозы и 1 – в результате вирусной пневмонии у пациентки, получавшей глюкокортикостероиды по поводу компрессии спинного мозга [5, 7].
На основании результатов регистрационного исследовании MONARCH-2 в сентябре 2017 г. абемациклиб был зарегистрирован FDA в комбинации с фулвестрантом для лечения женщин с ЭР+ HER2- местнораспространенным/метастатическим РМЖ и прогрессированием заболевания после эндокринной терапии [5, 38].
MONARCH-3: рандомизированное плацебо-контролируемое исследование III фазы по изучению комбинации абемациклиба с нестероидными ингибиторами ароматазы (НИА) летрозолом или анастрозолом и монотерапии НИА (+плацебо) в 1-й линии лечения ЭР+ HER2- мРМЖ
В исследовании III фазы MONARCH-3 были рандомизированы 493 пациента для получения абемациклиба в комбинации с НИА (n=328) или плацебо в комбинации с нестероидными ИА (n=165; табл. 1). Предшествовавшую неоадъювантную или адъювантную эндокринную терапию получали 46,7% (230) пациенток, предшествовавшую неоадъювантную или адъювантную химиотерапию – 38,7% (191). На момент окончания регистрации данных для окончательного анализа ВБП было зарегистрировано 246 событий: 138 (42,1%) в группе абемациклиба и 108 (65,5%) в группе плацебо. Медиана периода последующего наблюдения составила 26,73 месяца. Медиана ВБП, по оценке исследователя, составила 28,18 месяца в группе абемациклиба и 14,76 в группе плацебо (ОР=0,540; 95% ДИ: 0,418–0,698; р=0,000002). Эти оценки ВБП согласовывались с независимой централизованной оценкой этого показателя (ОР=0,465; 95% ДИ: 0,339–0,636; p<0,000001). Анализ ВБП в подгруппах пациентов показал, что добавление абемациклиба к НИА было эффективным во всех подгруппах.
У пациенток, получавших абемациклиб, эффект обычно отмечался в первые восемь циклов лечения. Медиана длительности ремиссии была значительно больше в группе абемациклиба (27,39 месяца), чем в группе плацебо (17,46 месяца) [39].
Анализ периода отсутствия лечения (ПОЛ), проведенный в рамках исследования MONARCH-3, с распределением больных в две группы в зависимости от величины ПОЛ (<36 или ≥36 месяцев) показал, что у пациенток с более длительным ПОЛ отмечалась более продолжительная ВБП. Анализ в подгруппах, основанный на данных ПОЛ, показал, что у пациенток с ПОЛ <36 месяцев добавление абемациклиба к нестероидному НИА улучшало результаты лечения, а также увеличивало частоту ОО на 32,11% [37].
Профиль токсичности изучаемого режима подробно представлен в табл. 2.
В группе абемациклиба более продолжительное последующее наблюдение подтвердило, что диарея 1-й и 2-й степеней наблюдалась в 72,8% случаев, начиналась на первом цикле у 69,1% пациенток и успешно купировалась в большинстве случаев. Нейтропения отмечалась у 43,7% пациенток, причем у 23,9% – 3–4-й степеней. Если по данным промежуточного анализа у одного пациента отмечалась фебрильная нейтропения, то ко времени окончательного анализа новых случаев этого НЯ не отмечено (табл. 3).
В феврале 2018 г. абемациклиб был зарегистрирован FDA для применения в комбинации с НИА на основании данных исследования MONARCH-3 (NCT02246621). По данным промежуточного анализа исследования MONARCH-3 по применению абемациклиба в комбинации с НИА было получено статистически значимое увеличение ВБП и повышение частоты ОО у больных в первой линии терапии ЭР+ HER2- мРМЖ [6].
С целью определения статистически значимых прогностических факторов был проведен комбинированный анализ исследований MONARCH-2 и MONARCH-3. Анализ клинических факторов подтвердил прогностическую ценность следующих из них: метастатическое поражение только костей, метастазы в печени, степень злокачественности опухоли, статус рецепторов прогестерона, соматический статус, ПОЛ с момента окончания адъювантной эндокринотерапии и время от момента постановки диагноза до рецидива. Среди пациенток с неблагоприятными прогностическими факторами эффект добавления к терапии абемациклиба был максимальным. К таким факторам неблагоприятного прогноза относили метастазы в печени, отрицательный статус рецепторов прогестерона, агрессивное течение (ПОЛ <36 месяцев с момента окончания адъювантной эндокринотерапии и короткий период с момента постановки диагноза) [37].
MONARCH-1: исследование II фазы по оценке ингибитора CDK4/6 абемациклиба в режиме монотерапии пациентов с рефрактерным ЭР+ HER2- мРМЖ
В исследование были включены 132 пациентки с ЭР+ HER2-мРМЖ. У всех пациенток на момент включения в исследование определялись измеряемые опухоли в соответствии с требованием протокола (RECIST v. 1.1).
У большинства больных (90,2%) зарегистрированы метастазы во внутренние органы и у 50,8% ≥3 органов метастазирования; чаще всего органами метастазирования являлись печень и кости. Абемациклиб в режиме монотерапии показал противоопухолевую активность интенсивно предлеченных пациентов с ЭР+ HER2- мРМЖ. Частота ОО составила 19,7% (95% ДИ: 13,3–27,5); частота клинически значимого ответа – 42,4%. Подтвержденная ЧР отмечена у 26 из 132 пациентов, что соответствовало 19,7% (95% ДИ: 13,3–27,5); случаев ПР зарегистрировано не было (табл. 3).
Из 26 больных ЭР+ HER2- мРМЖ с ЧР 12 (46,2%) получали не менее двух режимов предшествовавшей химиотерапии по поводу метастатического заболевания, у 24 (92,3%) определялись метастазы во внутренние органы и у 12 (46,2%) было ≥3 органов метастазирования [32].
Медиана ВБП достигла 6,0 месяцев. Медиана длительности ремиссии составила 8,6 месяца, медиана времени до наступления эффекта – 3,7 месяца.
По данным исследования MONARCH-1, диарея отмечена у 90,2% (119) пациенток: 1-й степени – у 41,7% (55); 2-й – у 28,8% (38); реже наблюдалась диарея 3-й степени – 19,7% (26) пациенток. Медиана времени до начала диареи составила 7,0 дней. Важно отметить, что продолжительность диареи не была значительной: медиана продолжительности диареи 2-й степени составила 7,5 дней, 3-й степени – 4,5; диарея 4-й степени не зарегистрирована. Отмена лечения в связи с диареей потребовалась всего 1 (0,8%) пациентке. Повышение уровня креатинина в сыворотке чаще всего наблюдалось в течение первого цикла; далее он оставался повышенным, но стабильным в течение всего периода терапии и снижался через небольшое время в период последующего наблюдения (в первые 30 дней после окончания лечения по протоколу исследования). Снижение уровня нейтрофилов наблюдалось у 114 (87,7%) пациенток: нейтропения 1-й или 2-й степени – у большинства больных, нейтропения 3-й степени – у 22,3% и нейтропения 4-й степени – у 4,6% пациенток. Нейтропения обычно достигала минимума между 2-й и 4-й неделями от начала лечения и оставалась стабильной в течение всего периода терапии абемациклибом (табл. 2).
Таким образом, непрерывное применение абемациклиба в режиме монотерапии больных ЭР+ HER2- мРМЖ с неблагоприятным прогнозом, получавших интенсивное предшествовавшее лечение, показало не только обнадеживающую эффективность, но и удовлетворительную переносимость.
Абемациклиб – единственный ингибитор CDK4/6 был одобрен FDA в сентябре 2017 г. для применения в режиме монотерапии больных ЭР+ HER2- мРМЖ, получавших интенсивное предшествовавшее лечение, на основании регистрационного исследования MONARCH-1 [32, 38].
Алгоритм профилактики и лечения осложнений терапии абемациклибом
Необходимо проводить полный анализ крови до начала терапии абемациклибом и каждые 2 недели в течение первых 2 месяцев лечения, а затем ежемесячно в течение следующих 2 месяцев терапии. Приостановка приема абемациклиба или снижение дозы рекомендуется пациентам, у которых развивается нейтропения 3-й или 4-й степени тяжести.
При первых признаках диареи рекомендуется начать использовать лоперамид и увеличить потребление жидкости. В тяжелых случаях применение абемациклиба необходимо приостановить, затем возобновить в более низкой дозе. В клиническом исследовании MONARCH-1 многие пациентки (60,6%) получали препараты против диареи, в 94% случаев это был лоперамид [32].
Редукция дозы абемациклиба
По данным исследования MONARCH-1, редукция дозы в связи с НЯ потребовалась 65 (49,2%) пациенткам (46 больным – 1 редукция, 18 пациенткам – 2 и 1 пациентке – 3).
В большинстве случаев редукция дозы была обусловлена развитием диареи (n=27; 20,5%) или нейтропении (n=14; 10,6%). Пропуск дозы требовался 76 (57,6%) пациенткам, чаще всего по причине диареи (n=32; 24,2%) и нейтропении (n=21; 15,9). Отмена лечения в связи с НЯ потребовалась в небольшом числе случаев (n=10; 7,6%). Обычно период пропуска дозирования был непродолжительным. Медиана числа пропущенных доз составила 6,5% от назначенного режима, что соответствовало медиане относительной дозовой интенсивности 89,2%. Большинство пациенток, участвовавших в исследовании MONARCH-1, смогли продолжить лечение с использованием химиотерапии [32].
Исследование MONARCH-2 показало, что в группе пациенток, получавших абемациклиб в комбинации с фулвестрантом, отмена абемациклиба по причине НЯ потребовалась в 15,9% (70) наблюдения, отмена плацебо в связи с НЯ – 3,1% (7), причем у 2,9% пациенток исследуемое лечение было отменено из-за диареи. Редукция дозы в связи с НЯ проведена 42,9% (189) пациенткам в группе абемациклиба и 1,3% (3) больным, получавшим плацебо. Перерыв в применении абемациклиба требовался в 51,9% (229) случаев, в применении плацебо – в 11,7% (26) [7].
По данным анализа результатов исследования MONARCH-3, при увеличении времени последующего наблюдения и непрерывном применении абемациклиба частота модификации дозы в группе абемациклиба была выше, чем по данным промежуточного анализа. Не менее одной редукции дозы абемациклиба/плацебо в связи с НЯ потребовалось 46,5% (152) пациенток группы абемациклиба и 6,2% (10) – группы плацебо. Лечение каким-либо из исследуемых препаратов было отменено в связи с НЯ у 25,1% (82) пациенток группы абемациклиба и 4,3% (7) – группы плацебо. Полная отмена лечения по протоколу в связи с НЯ потребовалась 16,5% (54) пациенток группы абемациклиба и 3,1% (5) – в группе плацебо. Отмена лечения абемациклибом/плацебо с продолжением получения НИА в связи с НЯ потребовалась 9,5% (31) пациенток группы абемациклиба и никому в группе плацебо. В группе абемациклиба диарея купировалась модификацией дозы: ее редукция была проведена 16,7% пациенток; пропуск дозы в связи с диареей – 19% больных. Как правило, диарея не влияла на длительность лечения в группе абемациклиба: отмена терапии в связи с диареей потребовалась 1,8% (6) пациенток. У четверых из них до отмены терапии дозу не редуцировали. Следует отметить, что в группе абемациклиба у половины пациенток с отменой лечения в связи с НЯ редукцию дозы до этого не проводили. И наоборот, 74% (112 из 152) пациенток с редукцией дозы в связи с НЯ не потребовалась отмена лечения из-за токсичности [6, 39].
Выводы
- Абемациклиб – избирательный ингибитор CDK4/6 непрерывного перорального применения с активностью в отношении CDK4, в 14 раз выше, чем в отношении CDK6.
- Абемациклиб зарегистрирован в комбинации с эндокринотерапией в качестве первой линии лечения и после прогрессирования на фоне гормонотерапии. Абемациклиб – единственный ингибитор CDK4/6, зарегистрированный в качестве применения в режиме монотерапии после прогрессирования на фоне эндокринотерапии и предшествовавшей химиотерапии по поводу ЭР+ HER2- мРМЖ.
- Особенно важно, что значимая эффективность и удовлетворительная переносимость абемациклиба отмечены у пациенток с ЭР+ HER2- мРМЖ с неблагоприятными про-гностическими факторами: метастазами в печени, отрицательным статусом рецепторов прогестерона, агрессивным течением (ПОЛ<36 месяцев с момента окончания адъювантной эндокринотерапии; короткий период с момента постановки диагноза).
1. Gradishar W.J., Anderson B.O., Balassanian R., et al. National Comprehensive Cancer Network. Invasive Breast Cancer Version 1.2016 NCCN Clinical Practice Guidelines in Oncology. J Natl Compr Canc Netw. 2016;14:324–54. Doi: 10.6004/jnccn.2016.0037.
2. Rugo H.S., Rumble R.B., Barton D.L., et al. Endocrine therapy for hormone receptor-positive metastatic breast cancer: American society of clinical oncology guideline. J Clin Oncol. 2016;34:3069–103. Doi: 10.1200/JCO.2016.67.1487.
3. Milani A., Geuna E., Mittica G., et al. Overcoming endocrine resistance in metastatic breast cancer: current evidence and future directions. World J Clin. Oncol. 2014;5:990–1001. Doi: 10.5306/wjco.v5.i5.990.
4. Семиглазов В.В., Криворотько П.В., Семиглазов В.Ф.и др. Международные рекомендации по лечению рака молочной железы: руководство для врачей. Под ред. В.Ф. Семиглазова. М.: МК, 2020. 232 с.
5. Sledge G.W. Jr, Toi M., Neven P., et al. MONARCH 2: abemaciclib in combination with fulvestrant in women with HR+/HER2- advanced Breast cancer who had progressed while receiving endocrine therapy J Clin Oncol. 2017;35: 2875–84. Doi: 10.1200/JCO.2017.73.7585.
6. Goetz M.P., Toi M., Campone M., Sohn J., et al. MONARCH 3: Abemaciclib as Initial Therapy for Advanced Breast Cancer. J Clin Oncol. 2017;35:3638–46. Doi: 10.1200/JCO.2017.75.6155.
7. Sledge G.W., Toi M., et al. The effect of abemaciclib plus fulvestrant on overall survival in hormone receptor-positive, ERBB2-negative breast cancer that progressed on endocrine therapy-MONARCH 2: a randomized clinical trial JAMA Oncol. 2019;6:116–24. Doi: 10.1001/jamaoncol.2019.4782.
8. Finn R.S., Martin M., Rugo H.S., et al. Palbociclib and letrozole in advanced breast cancer N Engl J Med. 2016;375:1925–36. Doi: 10.1056/NEJMoa1607303.
9. Hortobagyi G.N., Stemmer S.M., Burris H.A., et al. Ribociclib as first-line therapy for HR-positive, advanced breast cancer. N Engl J Med. 2016;375:1738–48. Doi: 10.1056/NEJMoa1609709.
10. Turner N.C., Ro J., et al. Palbociclib in hormone-receptor-positive advanced breast cancer N Engl J Med. 2015;373:209–19. Doi: 10.1056/NEJMoa1505270.
11. Turner N.C., Slamon D.J., et al. Overall survival with palbociclib and fulvestrant in advanced breast cancer. N Engl J Med. 2018;379:1926–36. Doi: 10.1056/NEJMoa1810527.
12. Slamon D.J., Neven P., Chia S., et al. Phase III randomized study of ribociclib and fulvestrant in hormone receptor-positive, human epidermal growth factor receptor 2-negative advanced breast cancer: MONALEESA-3 J Clin Oncol. 2018;36:2465–72. Doi: 10.1200/JCO.2018.78.9909.
13. Slamon D.J., Neven P., Chia S., et al.Overall survival with ribociclib plus fulvestrant in advanced breast cancer. N Engl J Med. 2019. Published online Dec 11. Doi: 10.1056/NEJMoa1911149.
14. Tripathy D., Im S.A., Colleoni M., et al. Ribociclib plus endocrine therapy for premenopausal women with hormone-receptor-positive, advanced breast cancer (MONALEESA-7): a randomised phase 3 trial Lancet Oncol. 2018;19:904–15. Doi: 10.1016/S1470-2045(18)30292-4.
15. Patnaik A., Rosen L.S., Tolaney S.M., et al: Efficacy and safety of abemaciclib, an inhibitor of CDK4 and CDK6, for patients with breast cancer, non-small cell lung cancer, and other solid tumors. Cancer Discov. 2016;6:740–53. Doi: 10.1158/2159-8290.CD-16-0095.
16. Gelbert L.M., Cai S., Lin X., et al. Preclinical characterization of the CDK4/6 inhibitor LY2835219: In-vivo cell cycle-dependent/independent anti-tumor activities alone/in combination with gemcitabine. Invest New Drugs. 2014;32:825–37. Doi: 10.1007/s10637-014-0120-7.
17. Torres-Guzman R., Calsina B., Hermoso A., et al. Preclinical characterization of abemaciclib in hormone receptor positive breast cancer. Oncotarget. 2017;8(41):69493–69507. Published online 2017 May 10. Doi: 10.18632/oncotarget.17778.
18. Lukas J., Bartkova J., Bartek J. Convergence of mitogenic signalling cascades from diverse classes of receptors at the cyclin D-cyclin-dependent kinasepRb-controlled G1 checkpoint. Mol Cell Biol. 1996;16:6917–25. Doi: 10.1128/mcb.16.12.6917.
19. Altucci L., Addeo R., Cicatiello L., et al. 17betaEstradiol induces cyclin D1 gene transcription, p36D1-p34cdk4 complex activation and p105Rb phosphorylation during mitogenic stimulation of G(1)- arrested human breast cancer cells. Oncogene. 1996;12:2315–24.
20. Bartkova J., Lukas J., Muller H., et al. Cyclin D1 protein expression and function in human breast cancer. Int J Cancer. 1994;57:353–61. Doi: 10.1002/ijc.2910570311.
21. Стенина М.Б. и др. Практические рекомендации по лекарственному лечению инвазивного рака молочной железы. Злокачественные опухоли: Практические рекомендации RUSSCO#3s2. 2019;9:128–63.
22. Butt A.J., Musgrove E.A., Sutherland R.L., et al. Downstream targets of growth factor and oestrogen signalling and endocrine resistance: the potential roles of c-Myc, cyclin D1 and cyclin E. Endocr Relat Cancer. 2005;12(suppl 1):S47–S59. DOI: org/10.1677/erc.1.00993.
23. Musgrove E.A., Lee C.S., Buckley M.F., et al. Cyclin D1 induction in breast cancer cells shortens G1 and is sufficient for cells arrested in G1 to complete the cell cycle Proc Natl Acad Sci USA. 1994;91:8022–26. DOI: 10.1073/pnas.91.17.8022.
24. Nair B.C., Vadlamudi R.K. Regulation of hormonal therapy resistance by cell cycle machinery Gene Ther Mol Biol. 2008;12:395.
25. Thangavel С., Dean J.L., Ertel A., et al. Therapeutically activating RB: reestablishing cell cycle control in endocrine therapy-resistant breast cancer Endocr Relat Cancer. 2011;18:333–45. Doi: 10.1530/ERC-10-0262.
26. Altucci L., Addeo R., Cicatiello L., et al. Estrogen induces early and timed activation of cyclin-dependent kinases 4, 5, and 6 and increases cyclin messenger ribonucleic acid expression in rat uterus. Endocrinology. 1997;138:978–84.
27. Geum D., Sun W., Paik S.K., et al. Estrogen-induced cyclin D1 and D3 gene expressions during mouse uterine cell proliferation in vivo: differential induction mechanism of cyclin D1 and D3 Mol Reprod Dev. 1997;46:450–58. Doi: 10.1210/endo.138.3.5002.
28. Roberts P.J., Bisi J.E., Strum J.C., et al. Multiple roles of cyclin-dependent kinase 4/6 inhibitors in cancer therapy. J Natl Cancer Inst. 2012;104:476–87. Doi: 10.1093/jnci/djs002.
29. Malumbres M., Barbacid M. Cell cycle, CDKs and cancer: a changing paradigm. Nat Rev Cancer. 2009;9:153–66. Doi: 10.1038/nrc2602.
30. Musgrove E.A., Caldon C.E., Barraclough J., et al. Cyclin D as a therapeutic target in cancer. Nat Rev Cancer. 2011;11:558–72. Doi: 10.1038/nrc3090.
31. Lallena M.J., Boehnke K., Torres R., et al. In-vitro characterization of abemaciclib pharmacology in ER+ breast cancer cell lines. Cancer Res. 2015;75(15 suppl; abstract nr 3101). Doi: 10.1158/1538-7445.AM2015-3101.
32. Dickler M.N., Tolaney S.M., Rugo H.S., et al. MONARCH 1, A Phase II Study of Abemaciclib, a CDK4 and CDK6 Inhibitor, as a Single Agent, in Patients with Refractory HR+/HER2- Metastatic Breast Cancer. Published September 2017 CCR-17-0754. Doi: 10.1158/1078-0432.CCR-17-0754.
33. Goel S., DeCristo M.J. et al. CDK4/6 inhibition triggers anti-tumour immunity. Nature. 2017;548:471–75. Doi: 10.1038/nature23465.
34. Patnaik A., Rosen L.S., Tolaney S.M., et al. LY2835219, a novel cell cycle inhibitor selective for CDK 4/6, in combination with fulvestrant for patients with hormone receptor positive (HR+) metastatic breast cancer. J Clin Oncol. 2014;32(suppl):abstr 534.
35. Raub T.J., Wishart G.N., Kulanthaivel P., et al. Brain exposure of two selective dual CDK4 and CDK6 inhibitors and the antitumor activity of CDK4 and CDK6 inhibition in combination with temozolomide in an intracranial glioblastoma xenograft. Drug Metab Dispos. 2015;43:1360–71. Doi: 10.1124/dmd.114.062745.
36. Tate S.C., Sykes A.K., Kulanthaivel P., et al. A population pharmacokinentic and pharmacodynamic analysis of abemaciclib in a phase I clinical trial in cancer patients. Clin Pharmacokinet. 2018;57:335–44.
37. Di Leo A., O’Shaughnessy J., Sledge G.W. Prognostic characteristics in hormone receptor-positive advanced breast cancer and characterization of abemaciclib efficacy. Reprinted from an article originally published online in NPJ Breast Cancer on December 18, 2018. URL: www.nature.com/npjbcancer.
38. van Dam P.A., et al. Neoadjuvant endocrine treatment in early breast cancer: an overlooked alternative? Eur J Surg Oncol. 2016;42:333–42. Doi: 4010.1016/j.ejso.2015.10.015.
39. Johnston S., Martin M., Di Leo A., et al. MONARCH 3 final PFS: a randomized study of abemaciclib as initial therapy for advanced breast cancer. NPJ Breast Cancer. 2019;5:5. https://doi.org/10.1038/s41523-018-0097-z.
Автор для связи: Т.Ю. Семиглазова, д.м.н., доцент, зав. отделом – ведущий науч. сотр. научного отдела инновационных методов терапевтической онкологии и реабилитации, НМИЦ онкологии им. Н.Н. Петрова; профессор кафедры онкологии, СЗГМУ им. И.И. Мечникова Санкт-Петербург, Россия; e-mail: tsemiglazova@mail.ru, https://orcid.org/0000-0002-4305-6691
Адрес: 197758, Россия, Санкт-Петербург, пос. Песочный, ул. Ленинградская, 68