Содержание
-
Структурная формула
-
Русское название
-
Английское название
-
Латинское название
-
Химическое название
-
Брутто формула
-
Фармакологическая группа вещества Ацитретин
-
Нозологическая классификация
-
Код CAS
-
Фармакологическое действие
-
Характеристика
-
Фармакология
-
Применение вещества Ацитретин
-
Противопоказания
-
Ограничения к применению
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Ацитретин
-
Взаимодействие
-
Передозировка
-
Способ применения и дозы
-
Меры предосторожности
Структурная формула
Русское название
Ацитретин
Английское название
Acitretin
Латинское название
Acitretinum (род. Acitretini)
Химическое название
(E)-9-(4-Метокси-2,3,6-триметилфенил)-3,7-диметилнонатетраеновая кислота
Брутто формула
C21H26O3
Фармакологическая группа вещества Ацитретин
Нозологическая классификация
Список кодов МКБ-10
-
L30.8 Другой уточненный дерматит
-
L40 Псориаз
-
L40.1 Генерализованный пустулезный псориаз
-
L40.3 Пустулез ладонный и подошвенный
-
L43 Лишай красный плоский
-
L44.9 Папулосквамозные изменения неуточненные
-
Q80 Врожденный ихтиоз
Код CAS
55079-83-9
Фармакологическое действие
—
противопсориатическое.
Характеристика
Желтый или зеленовато-желтый порошок. Молекулярная масса 326,44.
Фармакология
Нормализует процессы обновления, дифференцировки и ороговения клеток кожи, в т.ч. при псориазе.
Быстро и достаточно полно абсорбируется из ЖКТ, Cmax достигается через 1–4 ч. Биодоступность — около 60% (повышается при назначении во время или после еды). Связывается с белками плазмы на 99%. Легко проникает в ткани (обладает высокой липофильностью), диффундирует через плацентарный барьер и в грудное молоко. Биотрансформация осуществляется, главным образом, путем изомеризации (с образованием 13-цис-изомера) и глюкуронидирования. Т1/2 ацитретина — 50 ч, а его основного метаболита — 60 ч. В течение 36 дней после прекращения приема 99% выводится в виде метаболитов с мочой и желчью в равных количествах. В некоторых случаях в организме образуется этретинат, Т1/2 которого около 4 мес. Ацитретин и все продукты его биотрансформации полностью выводятся в течение 2 лет после окончания лечения.
Терапия продолжается до исчезновения псориатических поражений. При нарушении ороговения длительно назначаются поддерживающие минимально эффективные дозы (до 50 мг/сут).
Применение вещества Ацитретин
Псориатическая эритродермия, пустулезный псориаз (локализованный или генерализованный), врожденный ихтиоз, красный плоский лишай, болезнь Дарье.
Противопоказания
Гиперчувствительность (в т.ч. к витамину А и другим ретиноидам), выраженные нарушения функции почек и печени, терапия тетрациклинами, витамином A и другими ретиноидами, метотрексатом, беременность, грудное вскармливание.
Ограничения к применению
Сахарный диабет, панкреатит в анамнезе.
Применение при беременности и кормлении грудью
Категория действия на плод по FDA — X.
Побочные действия вещества Ацитретин
Симптомы гипервитаминоза A: сухость слизистых оболочек, хейлит, трещины в углах рта, конъюнктивит; истончение и шелушение кожи, алопеция, хрупкость ногтей, паронихия, фотосенсибилизация, головная боль, нарушение сумеречного зрения, обратимое повышение активности трансаминаз и ЩФ в плазме крови, гиперкальциемия, повышение концентрации триглицеридов и холестерина плазмы крови, боли в костях и мышцах, гиперостоз и кальциноз тканей в т.ч. позвонковых связок с последующей компрессией спинного мозга.
Взаимодействие
Несовместим с тетрациклинами, метотрексатом, витамином A и другими ретиноидами. Вытесняет фенитоин из связи с белками. Этанолсодержащие препараты и напитки способствуют образованию этретината.
Передозировка
Симптомы: головная боль, головокружение.
Лечение: симптоматическое при обязательной отмене препарата.
Способ применения и дозы
Внутрь, 1 раз в сутки, во время еды или с молоком. Взрослым — 25–30 мг в сутки в течение 2–4 нед, затем — по 25–50 мг в течение 6–8 нед, возможно увеличение максимальной суточной дозы до 75 мг.
Детям — 500 мкг/кг/сут, возможно кратковременное увеличение до 1 мг/кг/сут (но не более 35 мг/сут); поддерживающая доза — по возможности более низкая.
Меры предосторожности
Необходимо контролировать функцию печени (до начала и каждые 1–2 нед терапии в течение 2 мес, а затем — каждые 3 мес и после ее прекращения; при патологических изменениях анализы выполняют каждую неделю, и, если функция печени не приходит в норму или ухудшается, препарат отменяют), определять концентрацию холестерина и триглицеридов в сыворотке крови натощак, особенно при нарушениях липидного обмена, сахарном диабете, ожирении, хроническом алкоголизме, во время длительного лечения. У пациентов с сахарным диабетом надо тщательно следить за уровнем глюкозы в крови, у детей — за показателями роста и развития костей. Терапию женщин детородного возраста начинают на 2 или 3 день менструального цикла; они должны использовать контрацептивные средства в течение 4 нед до начала лечения, во время курса и, по крайней мере, в течение 2 лет после него. Обязательны дополнительные исследования на беременность.
Фармакологическое действие
Ретиноид, синтетический ароматический аналог ретиноевой кислоты. Клинические исследования подтвердили, что при псориазе и нарушениях ороговения ацитретин нормализует процессы пролиферации, дифференцировки и кератинизации клеток эпидермиса. Механизм действия остается, в основном, неизвестным.
В доклинических исследованиях по переносимости ацитретина мутагенного или канцерогенного действия обнаружено не было; отсутствовали также указания на его прямую гепатотоксичность. Ацитретин оказывал на животных выраженное тератогенное действие.
Фармакокинетика
После приема внутрь ацитретин абсорбируется из ЖКТ, Cmax в плазме крови достигается через 1-6 ч. При приеме вместе с пищей возможно повышение биодоступности. Ацитретин в высокой степени связывается с белками плазмы.
Метаболизируется с образованием 13-cis-ацитретина, у некоторых пациентов в плазме также определяется этретинат.
T1/2 ацитретина составляет около 2 сут, но всегда следует иметь в виду, что T1/2 этретината более длительный и составляет около 120 сут. Ацитретин выводится с желчью и мочой.
Показания активного вещества
АЦИТРЕТИН
Тяжелые формы псориаза, в т.ч. псориатическая эритродермия, локализованный или генерализованный пустулезный псориаз.
Тяжелые дискератозы, такие, как врожденный ихтиоз; красный волосяной лишай; болезнь Дарье (фолликулярный дискератоз); другие тяжелые нарушения ороговения, резистентные к традиционным видам терапии.
Режим дозирования
При приеме внутрь: для взрослых суточная доза составляет 25-50 мг, для детей — около 0.5 мг/кг.
Максимальные дозы для взрослых — 75 мг/сут, для детей — 35 мг/сут.
Побочное действие
Дерматологические реакции: сухость слизистых оболочек, хейлит, трещины в углах рта, истончение и шелушение кожи по всему телу, алопеция, хрупкость ногтей, паронихия, фотосенсибилизация.
Со стороны ЦНС: головные боли, нарушение сумеречного зрения, конъюнктивит.
Со стороны костно-мышечной системы: боли в костях и мышцах, гиперостоз и кальциноз тканей. Описан случай позвонкового гиперостоза и кальциноза позвонковых связок с последующей компрессией спинного мозга.
Со стороны лабораторных показателей: транзиторное повышение активности трансаминаз и ЩФ, гиперкальциемия, увеличение концентрации ТГ и холестерина в плазме крови.
Противопоказания к применению
Выраженные нарушения функции почек и/или печени, гиперлипидемия; одновременное применение с тетрациклинами, ретинолом (витамином А), другими ретиноидами, метотрексатом; беременность, период лактации (грудного вскармливания), повышенная чувствительность к ацитретину или другим ретиноидам.
Применение при беременности и кормлении грудью
Противопоказан к применению при беременности и в период лактации.
Ацитретин выделяется с грудным молоком.
Женщинам детородного возраста следует применять надежные методы контрацепции без перерыва в течение 4 недель до начала терапии, во время курса лечения и, по крайней мере, в течение 2 лет после его окончания.
Применение при нарушениях функции печени
Противопоказание: выраженные нарушения функции печени.
До начала и в период применения, а также в течение 3 мес после отмены ацитретина следует контролировать функцию печени.
Применение при нарушениях функции почек
Противопоказание: выраженные нарушения функции почек.
Применение у детей
Применение ацитретина у детей оправдано в случаях неэффективности альтернативных способов лечения. До настоящего времени все последствия терапии ацитретином не установлены.
Учитывая возможность тяжелых побочных явлений, при длительном лечении следует тщательно сопоставить возможный риск с ожидаемым терапевтическим эффектом. Ацитретин нужно назначать только при неэффективности всех других методов лечения.
Суточная доза зависит от массы тела и составляет около 0.5 мг/кг. В некоторых случаях на ограниченное время могут потребоваться более высокие дозы, до I мг/кг/сут (не более 35 мг/сут). Поддерживающая доза должна быть как можно меньшей, учитывая возможные побочные реакции при длительном лечении.
Особые указания
До начала и в период применения, а также в течение 3 мес после отмены ацитретина следует контролировать функцию печени. В период лечения необходим контроль следующих параметров: холестерин, ТГ в сыворотке натощак (особенно при нарушениях липидного обмена, сахарном диабете, ожирении, хроническом алкоголизме, а также при проведении длительной терапии); уровень гликемии у пациентов с сахарным диабетом; у детей — показатели роста и развития костей.
Применение ацитретина у детей оправдано в случаях неэффективности альтернативных способов лечения. До настоящего времени все последствия терапии ацитретином не установлены.
У пациентов, получающих ацитретин, в плазме крови иногда определяется этретинат.
Лекарственное взаимодействие
При одновременном применении ацитретина с этанолом повышается вероятность образования этретината.
При одновременном применении этретината с метотрексатом повышается риск гепатотоксического действия (следует избегать комбинации ацитретина с метотрексатом).
Ацитретин несколько уменьшает связывание фенитоина с белками плазмы (клиническое значение неизвестно).
Ацитретин может уменьшить контрацептивное действие препаратов, содержащих прогестерон в малых дозах.
Эта статья завершает наш спецпроект по псориазу. Теперь, когда мы уже знакомы с особенностями развития этой патологии, пришло время разобраться с ее лечением. Поиски лекарства для полной и безоговорочной победы над этой болезнью пока не увенчались успехом, но привели к появлению множества терапевтических подходов, позволяющих держать ее в узде. Познакомимся с преимуществами и недостатками основных способов лечения псориаза и попытаемся разобраться, как они работают.
Псориаз
Спецпроект посвящен генетическому кожному заболеванию, от которого страдает около 1% россиян. В статьях спецпроекта мы стараемся подробно, достоверно и интересно осветить это заболевание со всех возможных сторон. В этом нам помогают наши рецензенты: специалист по псориазу, кандидат биологических наук Алёна Золотаренко и врач-дерматовенеролог, кандидат медицинских наук Михаил Бетехтин.
Предыдущие статьи нашего цикла о псориазе («Псориаз: на войне с собственной кожей» [1], «Псориаз: Т-хелперы, цитокины и молекулярные шрамы» [2], «Генетика псориаза: иммунитет, барьерная функция кожи и GWAS» [3], «Эпигенетика псориаза: молекулярные отметины судьбы» [4]) очень подробно объяснили, насколько сложна этиология этого заболевания: она связана и с особенностями генома, и с эпигенетическими модификациями, и с провоцирующими факторами внешней среды. Вычленить из этого коктейля конкретные причины заболевания еще не удалось, поэтому и его лечение до сих пор не этиотропное (позволяющее повлиять на причину болезни), а патогенетическое — направленное на то или иное звено патогенеза псориаза. К сожалению, о полном излечении пока речи нет, но современные терапевтические подходы позволяют приостановить развитие заболевания и достичь ремиссии.
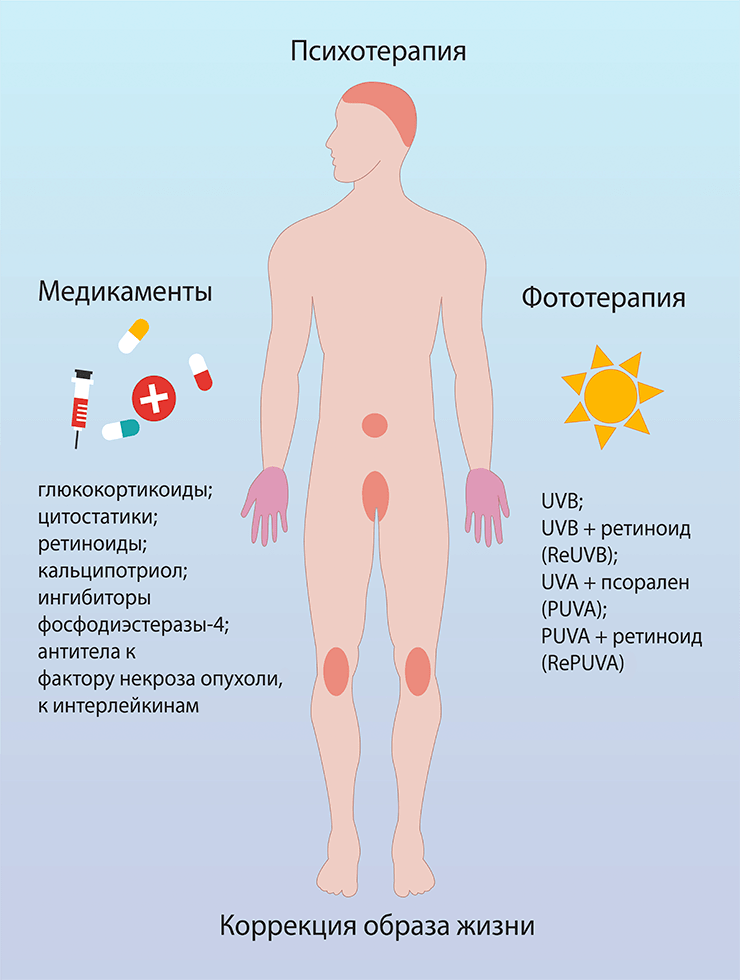
Чаще всего псориаз контролируют с помощью следующих подходов (рис. 1):
- лекарственной терапии (глюкокортикоиды, аналоги витаминов D и А, цитостатики, антитела к цитокинам, ингибиторы провоспалительных ферментов);
- фототерапии (УФ-лучи самостоятельно или в сочетании с молекулами, повышающими их эффективность).
Рисунок 1. Лечение псориаза
Глюкокортикоиды
Гормоны из группы глюкокортикостероидов входят в число антипсориатических препаратов первой линии, то есть тех, с которых лечение начинают. Эти гормоны сокращенно называют глюкокортикоидами, кортикостероидами или даже просто стероидами, хотя последнее не совсем корректно. Название этой группы гормонов отражает их принадлежность к стероидам — веществам, главной и системообразующей молекулой которых является циклопентанопергидрофенантрен. Знаменитые «стероиды» бодибилдеров тоже содержат эту молекулу. К глюкокортикоидам относят лишь те стероиды, что способны повышать уровень глюкозы в крови. Термин же «кортикостероиды» очерчивает круг стероидов, происходящих исключительно из коркового слоя, или кортекса, надпочечников.
Природные гормоны из надпочечников животных — кортизон и гидрокортизон (кортизол) — были выделены еще в первой половине XX века. Благодаря широкому спектру действия на разные процессы в организме (общий обмен веществ, водно-электролитный обмен и др.) их применяли для лечения различных заболеваний. Затем появилась возможность усовершенствовать их путем химического синтеза — чтобы они действовали сильнее и прицельнее. Так появились:
- преднизолон, в четыре раза превосходящий кортизол по глюкокортикоидной (влияющей на обмен глюкозы) активности;
- флудрокортизон, превосходящий кортизол не только по глюкокортикоидной, но и по минералокортикоидной активности;
- бетаметазон, в 25 раз превосходящий кортизол по глюкокортикоидной активности и не влияющий на водно-солевой обмен; структура вещества позволяет применять его местно на коже и слизистых.
Хотя эти гормоны давно известны, ученые лишь приоткрыли завесу тайны над молекулярными основами их действия. Известно, что они проникают внутрь клетки и соединяются со специальными внутриклеточными глюкокортикоидными рецепторами. Комплекс гормон—рецептор транспортируется в ядро, где взаимодействует с участками ДНК GRE (glucocorticoid response elements) в промоторах ряда генов, регулируя таким образом их активность. Стероиды, в частности, контролируют экспрессию генов таких факторов транскрипции, как активаторный белок 1 (AP-1) и ядерный фактор каппа-би (NF-kB). А они, в свою очередь, регулируют работу генов цитокинов, молекул адгезии, протеиназ и других веществ, участвующих в иммунном ответе и воспалении [5].
Глюкокортикоиды — мощные иммуносупрессоры и регуляторы воспаления. На иммунную систему они действуют неизбирательно, вмешиваясь в работу чуть ли не всех ее звеньев. В частности, они влияют на дифференцировку и/или функции макрофагов, нейтрофилов, моноцитов, Т- и В-лимфоцитов. При псориазе глюкокортикоиды оказывают противовоспалительное действие за счет угнетения синтеза простагландинов, лейкотриенов и цитокинов, уменьшения проницаемости кровеносных сосудов для клеток и жидкости, снижения хемотаксиса иммунокомпетентных клеток и их активности, а также подавления активности фибробластов.
Для лечения псориаза кортикостероиды назначают как наружно (мази, кремы, лосьоны, крело — что-то среднее между кремом и лосьоном), так и внутрь (таблетки, растворы и суспензии для инъекций); выбор препарата и его лекарственной формы зависит от стадии и степени тяжести заболевания. Из-за побочных действий этих препаратов их назначение внутрь стараются отложить настолько, насколько это возможно.
Парацельс, известный врач эпохи Ренессанса, утверждал, что лекарство и яд различает лишь доза. Справедливо это и для глюкокортикоидов: при длительном и/или неадекватном их применении повышается риск побочных эффектов. В связи с тем, что эти гормоны влияют на все виды обмена — углеводный, белковый, жировой и минеральный, — злоупотребление ими серьезно нарушает множество процессов в организме. Например, они стимулируют глюконеогенез (образование глюкозы из неуглеводных веществ) в печени, увеличивают концентрацию глюкозы в крови, что может вести к «стероидному» сахарному диабету. По симптомам он схож с сахарным диабетом II типа: постепенное развитие мышечной слабости и зуда кожи, нарушение зрения, изменения нервов и сосудов. Влияние на белковый обмен характеризуется угнетением синтеза и ускорением распада белков, что особенно выражено в коже, мышцах и костях и ведет к атрофии кожи и мышц, замедлению заживления ран. Влияние на обмен жиров заключается в расщеплении жира в тканях конечностей и его накоплении в туловище и лице: формируется так называемое лунообразное лицо.
Однако перечисленные нежелательные эффекты проявляются при применении глюкокортикоидов внутрь. Их нанесение на небольшие участки кожи позволяет избежать системных реакций, хотя и не делает местное применение абсолютно безопасным. Чаще всего при длительном наружном использовании сильных глюкокортикоидов могут наблюдаться телеангиэктазии (расширенные мелкие сосуды), атрофия (истончение) кожи, стероидное акне (прыщи на лице и теле), стрии (растяжки кожи) и кожные инфекции. Если переусердствовать с нанесением сильных гормональных мазей на большие участки кожи, то можно получить и системные побочные эффекты [6].
При всех несомненных преимуществах глюкокортикоидов перед другими лекарствами по части эффективности и доступности, их можно сравнить с дубиной, которой мы лупим по иммунной системе и обмену веществ. Ниже мы обсудим лекарства, более тонко регулирующие иммунные механизмы.
Производные витаминов
Витамины А и D, включая их синтетические варианты, способны подавлять проявления псориаза. Эти вещества связываются с ядерными рецепторами (и по совместительству транскрипционными факторами) RARγ/RXR и VDR/RXR, активируя экспрессию ряда генов, ответственных за дифференцировку и пролиферацию клеток. Один из таких генов кодирует особый цитокин — тимический стромальный лимфопоэтин (TSLP, thymic stromal lymphopoietin), который заставляет антигенпредставляющие дендритные клетки воспитывать Th2- и регуляторные (Treg) клетки в ущерб Th1-клеткам. Мы помним из статьи [2], что для псориаза характерна повышенная активность Th1 и Th17 при сниженной активности Th2 и Treg. Соответственно, предполагалось, что А/D-витаминные средства, активируя синтез TSLP в кератиноцитах и других клетках, могут корректировать этот дисбаланс и уменьшать Th1/Th17-опосредованное аутоиммунное воспаление. Но всё оказалось сложнее: TSLP модулирует иммунные реакции по-разному в зависимости от условий. Гомеостатическую и, вероятно, терапевтическую роли играет короткая изоформа TSLP, в то время как длинная образуется в патологических условиях, включая псориатические бляшки. Активный синтез TSLP с последующим «иммунным перекосом» в сторону Th2-звена провоцирует аллергическое воспаление, характерное для атопического дерматита и астмы. А в воспалительной среде, характерной для псориаза, TSLP (по косвенным данным, длинная форма) с помощью CD40L запускает патологическую IL-23/IL-17-сигнализацию [7], [8]. Поэтому в лечении можно было бы использовать ингибиторы длинной формы TSLP и стимуляторы синтеза короткой (либо ее саму).
Роль TSLP в патогенезе и терапии псориаза еще предстоит уточнить, но в то же время очевидно, что антипсориатические эффекты витаминов A и D обусловлены изменением транскрипции многих других генов — регуляторов дифференцировки и пролиферации клеток [1]. (Здесь я должен принести извинения читателю за весьма скудное понимание исследователями как причин, так и механизмов действия лекарств от некоторых кожных болезней.)
Ретиноиды
К ретиноидам в широком смысле слова причисляют витамин А (ретинол) и его биологически активные производные. Но в медицине так принято называть группу синтетических производных витамина А, служащих для лечения определенных болезней, а не восполнения витаминодефицита. Кожные заболевания с их помощью успешно лечат уже более 40 лет.
Чаще других для лечения псориаза используют ацитретин — ретиноид второго поколения. Как и любой другой препарат этой группы, он подавляет избыточный клеточный рост и кератинизацию — главные характеристики псориатической кожи.
Точный механизм действия ацитретина неизвестен. Судя по всему, ацитретин связывается с рецепторами ретиноевой кислоты — активного метаболита витамина А, образующегося в кератиноцитах, — и запускает характерную для нее сигнализацию [9]. Как это происходит, и почему влияет на течение псориаза, показано на рисунке 2.
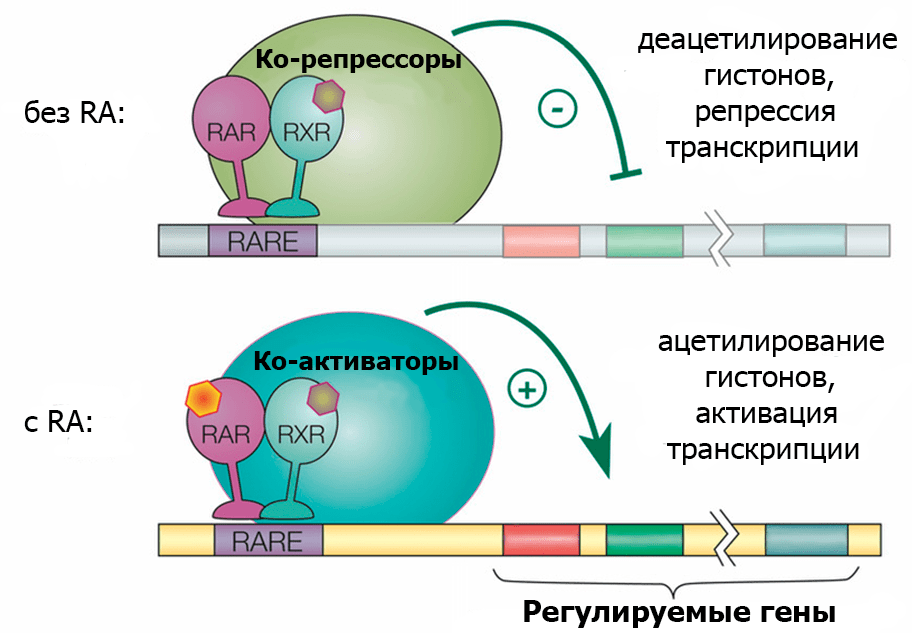
Рисунок 2. Принцип работы ретиноидных рецепторов (на примере связывания ретиноевой кислоты). За восприятие ретиноидных сигналов в клетке отвечают ядерные рецепторы семейства RAR (retinoic acid receptors, RARα–γ). RAR образует пару с другой рецепторной молекулой, RXR (retinoid X receptors, RXRα–γ), и этот комплекс взаимодействует с особыми нуклеотидными последовательностями — RARE (RA response elements) — в регуляторных областях ряда генов. Это взаимодействие модулирует активность многих генов, контролирующих рост, деление и дифференцировку клеток. Несвязанная с ретиноевой кислотой (RA) или другим лигандом пара RAR—RXR, взаимодействуя с RARE, чаще всего подавляет экспрессию близлежащих генов, потому что привлекает ко-репрессоры: они конденсируют хроматин так, что считывание наследственной информации в этом участке становится невозможным. Если же с RAR связана RA, то к такому RARE устремляются активаторы экспрессии генов, «расслабляющие» хроматин для посадки компонентов транскрипционной машины. Ретиноидная сигнализация нормализует структуру эпидермиса путем стимуляции клеточной дифференцировки и эксфолиации.
Хотя ацитретин демонстрирует высокую эффективность при псориазе, заранее сложно сказать, как долго пациенту нужно будет принимать препарат и насколько стойкую ремиссию он даст. Прием ацитретина может сопровождаться нежелательными реакциями, порой непереносимыми: фоточувствительностью, истончением и шелушением кожи по всему телу, хрупкостью ногтей, болями в костях и мышцах, тошнотой и др. Препарат противопоказан при нарушениях работы почек и печени, а из-за тератогенного эффекта — и при беременности. Более того, планировать беременность или становиться донором крови можно не менее чем через три года после завершения терапии. Из-за всех этих ограничений вопрос о назначении системных ретиноидов и их преимуществах перед другими лечебными подходами решается строго индивидуально [10].
Кальципотриол (кальципотриен)
Под таким мудреным названием скрывается синтетический аналог витамина D, а именно — его активной формы, кальцитриола. Эффективность кальципотриола была случайно обнаружена при лечении больных остеопорозом, которые также страдали и от псориаза [11]. Точный механизм действия препарата при псориазе не установлен. Известно, что благодаря своему химическому строению кальципотриол взаимодействует с рецепторами витамина D (VDR), но, в отличие от последнего, на обмен кальция влияет незначительно. Рецептор витамина D представлен в различных клетках, включая лимфоциты и кератиноциты; он относится к семейству стероидных рецепторов и работает чаще в виде гетеродимера с уже знакомым нам RXR. Одна часть VDR взаимодействует с лигандом, другая — с участками VDRE (vitamin D response elements) в промоторах регулируемых генов [12]. Далее события развиваются по аналогичному с ретиноидной регуляцией сценарию. Некоторые мутации VDR связаны с предрасположенностью к псориазу, да и дефицит VDR-сигнализации любой природы может иметь патогенетическое значение при этом заболевании.
При местном использовании кальципотриола у мышей и людей выявили дозозависимое повышение секреции кератиноцитами иммуномодулятора TSLP, причем у людей — его короткой формы (у мышей она не синтезируется) [8], [13].
Вообще, эффекты витамина D множественны, связаны не только с TSLP-сигнализацией и не до конца объяснены. При псориазе же важнее всего то, что в терапевтических дозах он:
- смещает баланс Th1+Th17/Th2-влияний в пользу последних, подавляя синтез Th1/Th17- и ряда других провоспалительных цитокинов, в числе которых IL-2, IFN-γ, TNF, IL-17, IL1β. В то же время активнее размножаются и вырабатывают цитокины клетки Th2, повышается уровень противовоспалительного IL-10, который подавляет активность Th1 и дендритных клеток;
- способствует дифференцировке и иммуносупрессивной активности регуляторных Т-клеток. Витамин D здесь может действовать через посредников — дендритные клетки;
- ограничивает избыточную пролиферацию Т-клеток и кератиноцитов, провоцируя их дифференцировку и апоптоз, а также снижает избыточную продукцию псориазина, которая нарушает дифференцировку кератиноцитов [14], [15];
- предохраняет от вторичных инфекций, стимулируя макрофагальный фагоцитоз [16].
При использовании мази, крема или раствора кальципотриола лечебный эффект появляется в течение двух недель. Существуют препараты, содержащие и кальципотриол, и глюкокортикоид: такая комбинация действует сильнее. Несмотря на все положительные стороны кальципотриола, его не стόит наносить на обширные участки пораженной кожи (более 30%), так как через нее в кровь может проникнуть избыточное количество лекарства, а это грозит повышением содержания кальция в крови и отложением его солей в почках [17].
Цитостатические препараты
Или просто цитостатики. Это противоопухолевые препараты, нарушающие процессы роста и размножения клеток, особенно быстро делящихся. Очевидно, что чаще всего их применяют для уничтожения злокачественных опухолей. Но поскольку при псориазе кератиноциты, подстегиваемые большим количеством иммунных клеток и цитокинов, делятся как угорелые, для его лечения тоже предложили использовать цитостатики, а точнее — метотрексат, циклоспорин и такролимус. Последние два препарата к этой группе относят не всегда, так как они всё же больше влияют на функции, чем на деление чувствительных клеток. Зато все три препарата можно назвать иммуносупрессорами.
Метотрексат относится к группе антиметаболитов — молекул, которые похожи по химической структуре на вещества, родные для нашего организма, и потому могут занять их место в биохимических процессах и привести к нарушению клеточных функций. Это всё равно что заменить одно из автомобильных колес колесом того же диаметра, но от велосипеда: вроде, всё то же, но далеко не уедешь.
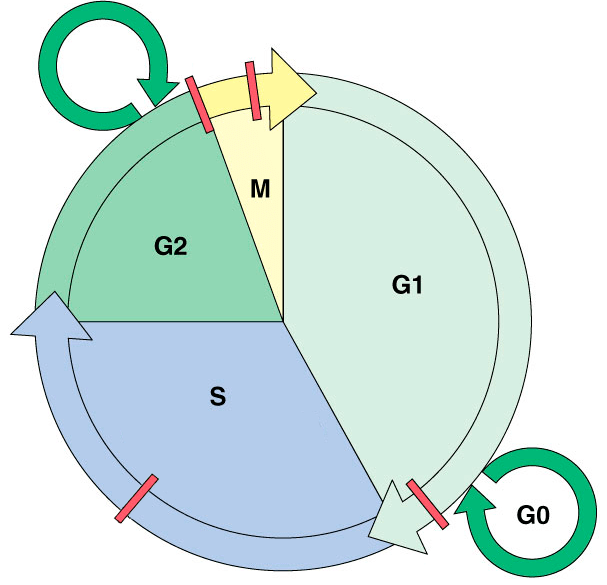
Метотрексат активен в отношении быстро пролиферирующих клеток (в том числе клеток кожи), находящихся в S-фазе клеточного цикла (рис. 3). Но с этим связано и его губительное действие на костный мозг, слизистые оболочки желудочно-кишечного тракта и мочевыводящих путей [6], [18]. Универсальный механизм его работы таков. Для синтеза ДНК организму необходима тетрагидрофолиевая кислота, которая образуется с помощью фермента дигидрофолатредуктазы. Метотрексат блокирует работу этого фермента, притворяясь его субстратом, дигидрофолатом. Кроме того, он ингибирует и другие ферменты, необходимые для синтеза нуклеотидов. В результате подавляются синтез и репарация ДНК, нарушается митоз. Описаны и более специфические механизмы влияния метотрексата на активность лимфоцитов [19].
Деликатнее работает иммуносупрессор циклоспорин. Более 40 лет назад его выделили из почвенных грибков и чуть позже дали на вооружение врачам, которые начали его применять для лечения псориаза. Циклоспорин избирательно блокирует фосфатазную активность кальциневрина в фазах G0 или G1 клеточного цикла T-лимфоцитов. Этот фермент активирует (дефосфорилирует) транскрипционные факторы NFAT, необходимые для синтеза IL-2, IFN-γ и других цитокинов — факторов роста и созревания Т-лимфоцитов [20]. Циклоспорин также мешает экспрессии генов IL-3, IL-4, IL-5, гранулоцитарно-макрофагального колониестимулирующего фактора и TNF. Говоря проще, этот препарат борется с воспалением, обусловленным активацией Т-клеток. Но важно отметить, что он не блокирует синтез цитокинов лимфоцитами раз и навсегда. При снижении его концентрации всё возвращается на круги своя. Более того, в отличие от метотрексата, циклоспорин не подавляет гемопоэз, а в отличие от глюкокортикоидов, не парализует сразу большинство иммунных процессов. Тем не менее его иммуносупрессивного действия хватает для повышения у пациентов риска развития инфекций, паразитарных инвазий и опухолей (особенно лимфом и злокачественных новообразований кожи).
Рисунок 3. Клеточный цикл. M — митоз (деление клетки); S — синтетическая фаза (репликация ДНК); G1 и G2 (Gap 1/2) — пре- и постсинтетическая фазы; G0 — выход из клеточного цикла (временный/постоянный). Красные прямоугольники — контрольные точки (checkpoints) клеточного цикла.
Другой ингибитор кальциневрина — такролимус — можно применять местно. Этот макролид, производимый стрептомицетами, подавляет активность Т-лимфоцитов так же, как и циклоспорин. Помимо этого такролимус тормозит высвобождение медиаторов воспаления из эозинофилов, базофилов и тучных клеток (тканевых базофилов). Клетки Лангерганса под его влиянием меньше экспрессируют FcεRI (высокоаффинный поверхностный рецептор иммуноглобулина Е), что подавляет их активность и презентацию антигенов Т-лимфоцитам. Такролимус — хорошая альтернатива местным глюкокортикоидам, поскольку он не нарушает синтез коллагена и не вызывает атрофии кожи. К побочным эффектам препарата можно отнести повышение вероятности возникновения кожных инфекций, зуд, отеки и фоточувствительность. Однозначных данных о повышении риска злокачественных новообразований кожи на фоне применения такролимуса пока нет [21], [22].
Ингибиторы фактора некроза опухоли
Фактор некроза опухоли альфа (TNF-α, или просто TNF) считают главным инициатором воспаления. В пораженной псориазом коже TNF секретируют Т-клетки и дендритные клетки. Он стимулирует синтез провоспалительных цитокинов IL-1, IL-2, IL-6, IL-8 и IFN-γ, вызывает экспрессию молекул адгезии на стенках кровеносных сосудов, способствуя привлечению иммуноцитов из кровяного русла в кожу, стимулирует производство кератиноцитами других медиаторов воспаления, активирует макрофаги, дендритные и Т-клетки.
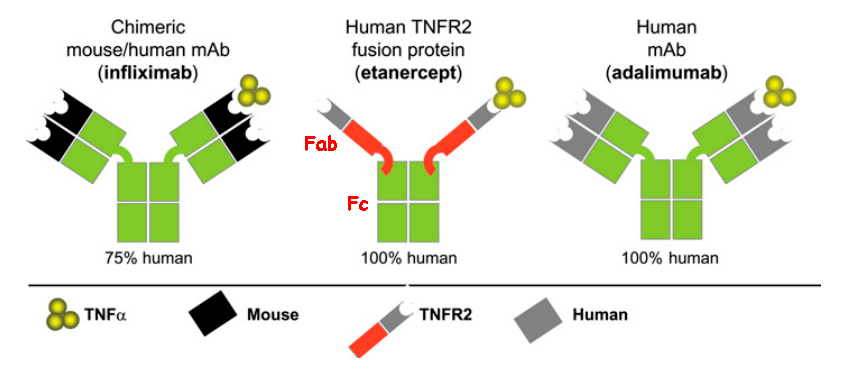
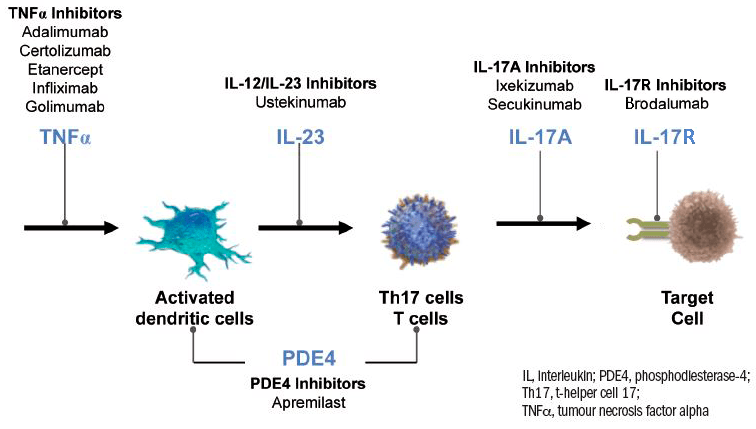
Для ингибирования TNF применяют моноклональные антитела (инфликсимаб, адалимумаб) и гибридные белки (этанерцепт) [5], [23].
Моноклональные антитела — антитела, произведенные одним клоном клеток, берущим свое начало от одной плазматической клетки. Соединяясь с белком или другим антигеном, к которому они имеют сродство, антитела мешают ему выполнять свои функции. Лекарства из этой группы носят очень странные названия, оканчивающиеся на «-маб» (monoclonal antibody). А буквы перед «-маб» позволяют понять происхождение этих молекул: «-омабы» — полностью мышиные, «-ксимабы» — химерные, «-зумабы» — гуманизированные, «-умабы» — полностью человеческие антитела . Моноклональные антитела к TNF (рис. 4) влияют на иммунные реакции, которые изменяют уровень молекул адгезии, ответственных за миграцию лейкоцитов к очагам воспаления. Инфликсимаб вводится внутривенно, адалимумаб — подкожно.
Для препаратов, зарегистрированных после июня 2017 года, этот принцип упразднили, потому что с развитием биотехнологии появилось много комбинированных вариантов антител и возникла проблема выбора более подходящего названия [45]. — Ред.
Среди новых (применительно к обыкновенному псориазу) молекул можно выделить цертолизумаб пэгол. Это гуманизированный ПЭГилированный Fab-фрагмент антитела к TNF. Связывание с ПЭГ снижает иммуногенность, улучшает распределение в пораженных тканях и продляет жизнь молекулы в кровяном русле, а отсутствие Fc-фрагмента человеческого IgG1 меняет ее профиль цитотоксичности и затрудняет проникновение через плаценту, что может дать цертолизумабу преимущество перед одногруппниками в лечении беременных [24]. В фазе III клинических исследований препарат в дозировке 200 мг не уступил по эффективности этанерцепту, а в дозировке 400 мг — превзошел его, причем без ухудшения переносимости [25].
Гибридный белок этанерцепт действует немного иначе — как ловушка для TNF. Дело в том, что существуют два типа рецепторов TNF: рецепторы на лейкоцитах, соединение TNF с которыми запускает иммунный ответ, и растворимые рецепторы, циркулирующие в кровяном русле, которые оттягивают на себя TNF и тем самым уменьшают иммунный ответ. Как раз под последние и «подделывается» этанерцепт (рис. 4), но, благодаря Fc-фрагменту человеческого IgG1, он может дольше находиться в кровяном русле и дольше оставаться эффективным.
Рисунок 4. Примеры блокаторов TNF. Инфликсимаб — химерное (мышино-человеческое) моноклональное антитело к TNF. Адалимумаб — полностью человеческое моноклональное антитело. Этанерцепт — гибрид, состоящий из двух растворимых рецепторов TNF (p75) и Fc-фрагмента человеческого IgG1. Fab — антигенсвязывающий фрагмент антитела.
Одним из молекулярных механизмов терапевтического действия TNF-ингибиторов может быть перестройка эпигенетических процессов. Например, в ходе лечения этанерцептом или адалимумабом в крови частично корректируются метильные профили ДНК, меняется продукция десятков типов микроРНК [4].
Поскольку TNF участвует во множестве биологических процессов, подавление его сигнализации не может быть безобидным. Ингибиторы TNF иммуногенны (их эффективность со временем падает из-за выработки антител к ним), противопоказаны в случае тяжелых инфекций (например, туберкулеза) и могут провоцировать частые инфекции кожи и слизистых, хотя по этому пункту ученые ведут споры, ежегодно публикуя обширные статистические работы как в поддержку [26], так и в опровержение этого [27].
Ингибиторы интерлейкинов
Ингибиторы интерлейкинов фактически действуют так же, как и ингибиторы TNF, и тоже представляют собой моноклональные антитела, но связываются они уже с интерлейкинами. Поскольку популяция клеток Тh17 играет ключевую роль в возникновении псориаза, а цитокин IL-17 специфичен для иммуноопосредованных воспалительных заболеваний (псориаза, болезни Крона, ревматоидного артрита и др.), моноклональные антитела к IL-17 бьют по цели точнее, чем ингибиторы TNF. С IL-17А взаимодействуют секукинумаб и иксекизумаб, а с рецептором IL-17 — бродалумаб.
Моноклональные антитела к субъединицам IL-12 и/или IL-23 тоже эффективно подавляют деятельность Тh17 и Тh1. В эту группу препаратов входят широко известный устекинумаб и относительно недавно одобренная к применению в США и Евросоюзе молекула гуселькумаб [28].
Поскольку ингибиторов интерлейкинов появляется всё больше, приходится регулярно сравнивать их эффективность. Так, одно из исследований 2018 года выстроило препараты по мере снижения эффективности в таком порядке: иксекизумаб и бродалумаб → секукинумаб → устекинумаб [29]. Однако препараты могут проявлять разную эффективность при разных исходных данных, таких как возраст, форма и тяжесть псориаза, сопутствующие болезни и др. А эти исследования им только предстоит пройти.
Моноклональные антитела к интерлейкинам произвели революцию в лечении псориаза, но, к сожалению, эти лекарства отличает очень высокая цена. Поэтому, несмотря на высокую эффективность в клинических исследованиях, они пока остаются малодоступными для широкого круга больных. Нежелательные реакции при применении этой группы препаратов и ингибиторов TNF схожи [27], [30].
Исследователи не ограничились существующим набором молекул и продолжают поиск более эффективных и при этом не менее безопасных. Или не менее эффективных, но более безопасных и/или экономически выгодных. Недавно завершилась фаза 2b клинических исследований новой гуманизированной молекулы — бимекизумаба [31]. Она блокирует сразу две разновидности интерлейкина-17 — IL-17A и IL-17F. Если сравнивать с традиционной блокировкой IL-17A, такая двойная нейтрализация сильнее подавляет экспрессию провоспалительных генов и миграцию иммунных клеток. К 2020 году должна завершиться III фаза клинических исследований бимекизумаба, с бóльшим числом участников, продленным сроком лечения и секукинумабом в качестве контрольного препарата.
Ингибиторы фосфодиэстеразы-4
Фосфодиэстераза-4 (PDE4) — это основная фосфодиэстераза, регулирующая обмен циклического аденозинмонофосфата (цАМФ) в иммунных клетках. Высокая концентрация цАМФ в клетках приводит к депонированию кальция, направлению активности ферментов и цитокиновой сигнализации в сторону подавления воспаления: выработка TNF, IL-23, IL-17 снижается, а IL-10 — повышается. PDE4 разрушает цАМФ, чем стимулирует воспаление, а потому служит одной из терапевтических мишеней при псориазе.
Показано, что апремиласт ингибирует PDE4, что в конечном счете ведет к ослаблению воспалительной реакции. Преимуществом апремиласта считают то, что он подавляет воспаление на более раннем этапе, чем моноклональные антитела к TNF (инфликсимаб, адалимумаб), IL-12/23 (устекинумаб) или IL-17A (секукинумаб, иксекизумаб) [32].
Из нежелательных реакций при приеме апремиласта чаще всего фиксируют расстройства пищеварения и инфекции дыхательных путей [33]. Эффективность апремиласта оценивают лишь к концу первого полугодия лечения, что в сочетании с его высокой стоимостью и доступностью более дешевых противопсориатических препаратов говорит не в пользу его назначения.
Сводная схема таргетированных терапевтических воздействий на основные звенья патогенеза псориаза приведена на рисунке 5. Если говорить о сравнительной эффективности ингибиторов TNF, интерлейкинов и PDE4, то крупное исследование 2018 года показало, что с помощью ингибиторов интерлейкинов или инфликсимаба можно избавиться от псориатических бляшек быстрее, чем с помощью этанерцепта, адалимумаба или апремиласта. Инфликсимаб проигрывает ингибиторам интерлейкинов по двум параметрам: его нужно вводить внутривенно, и на фоне его применения чаще развиваются инфекционные заболевания [29].
Рисунок 5. Патогенетическая терапия псориаза. Объяснения даны в тексте.
Фототерапия
В борьбе с псориазом часто задействуют и физические факторы, а именно — ультрафиолетовое (УФ) излучение. Облучение пораженных участков кожи УФ определенной длины волны (UVА, UVB) называют фототерапией. UVB-терапия может быть широкополосной (280–320 нм) и узкополосной средневолновой (NB-UVB, 311 нм). Второму варианту практически идентична UVB-терапия, проводимая эксимерным лазером (308 нм). Эта группа методов не требует применения каких-либо специальных медикаментов и не противопоказана даже детям.
UVА-терапию чаще используют в виде модификации PUVA — облучения длинноволновым УФ (320–400 нм) с применением фотосенсибилизаторов из группы псораленов. Фотосенсибилизаторы — это вещества, повышающие чувствительность клеток к воздействию УФ. Они могут применяться перорально или наружно, в том числе в виде псораленовых ванн. Из-за повышенной (относительно UVB-терапии) канцерогенности к PUVA прибегают при тяжелых формах псориаза, его прогрессии и в случае неэффективности других средств.
Фототерапия может действовать на течение псориаза несколькими способами, которые обычно делят на четыре категории: индукция апоптоза, изменение цитокиновой сигнализации, иммуносупрессия, прочие механизмы (см. врезку) [34]. Однако эти эффекты во многом взаимосвязаны и взаимообусловлены.
Выбор лечебного подхода
Любой лечебный подход преследует три главных цели: уменьшение баллов PASI (индекса охвата и тяжести псориаза), повышение качества жизни и максимальная продолжительность ремиссии. Достичь этих целей можно только под руководством грамотного врача, который обязан учитывать многообразие эффектов лечебного агента, особенности его метаболизма [3] и возможное взаимодействие с другими лекарственными средствами.
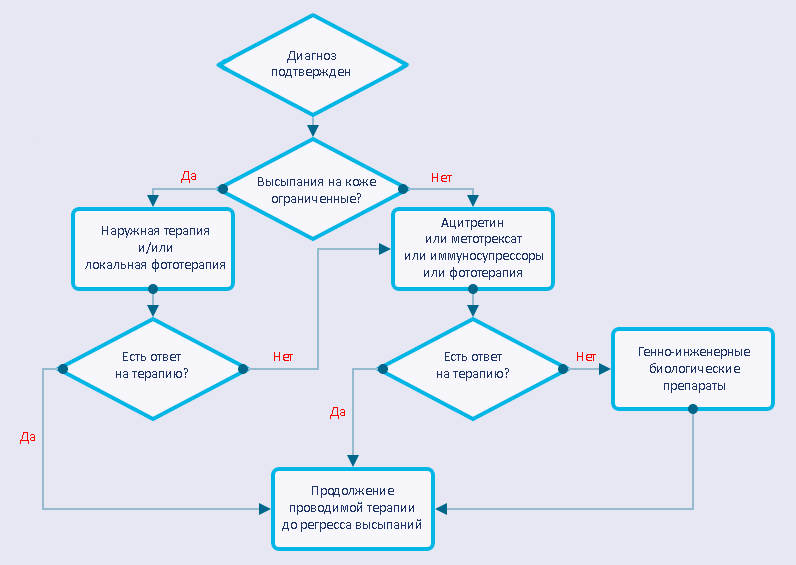
В лечении псориаза, как и большинства заболеваний, всё очень и очень индивидуально. То, что работает у одного, другому может абсолютно не подойти. Тем не менее врачи разработали общую стратегию ведения пациентов с псориазом (рис. 7).
Рисунок 7. Стандартный алгоритм ведения пациента с подтвержденным диагнозом «псориаз»
Выбор того или иного лечебного подхода определяется степенью тяжести псориаза. А объективным критерием тяжести псориаза, принятым в большинстве стран мира, служит PASI. При значении индекса до 10 псориаз считается легким, от 10 до 20 — средней тяжести, более 20 — тяжелым. У большинства пациентов PASI не превышает 10, и в таких случаях ограничиваются наружным лечением. Превышение 10 баллов служит показанием для назначения метотрексата, циклоспорина и ацитретина [40]. В некоторых случаях целесообразно комбинировать метотрексат или ацитретин с фототерапией (UVВ, PUVA), что позволяет одновременно снизить дозировку препаратов, частоту побочных эффектов и канцерогенный потенциал фототерапии [41], [42]. В случае неэффективности, непереносимости побочных эффектов или при противопоказаниях к применению перечисленных подходов прибегают к биологическим препаратам (моноклональным антителам).
Вносить свою лепту в тяжесть болезни и длительность ремиссии могут и вспомогательные, немедикаментозные подходы. Обычно врачи рекомендуют снижение уровня стресса, соблюдение диеты, климатотерапию (курорты с сероводородными, кремнистыми и радоновыми водами) и применение увлажняющих средств.
Заключение
Даже если просто просмотреть заголовки в этой статье, станет ясно: разнообразие видов терапии псориаза настолько велико, что позволяет более-менее индивидуализировать лечение. Но ни один из существующих подходов не лишен недостатков, порой весьма серьезных.
Псориаз — одна из самых распространенных кожных болезней, которая до сих пор окружена множеством загадок и сильно влияет на жизнь больных. Поэтому пациенты с этим диагнозом больше, чем многие другие страдающие хроническими воспалительными заболеваниями, могут рассчитывать на изобретение той самой «волшебной таблетки» (а скорее, нескольких), которая наконец заставит забыть о недуге навсегда. В последние годы новая информация о патогенезе, генетике и эпигенетике псориаза появляется особенно быстро. Это позволяет постепенно переходить от неизбирательной «тяжелой артиллерии» к специфичным средствам, бьющим по конкретным звеньям патогенеза. Каждый год в мире синтезируются новые молекулы, но лишь единицы из них, пройдя длинный путь проверок безопасности и эффективности, достигают организма больного. При этом каждый новый одобренный препарат хоть в чём-то превосходит старые, приближая нас к моменту, когда псориаз станет очередной побежденной болезнью в истории медицины.
- Псориаз: на войне с собственной кожей;
- Псориаз: Т-хелперы, цитокины и молекулярные шрамы;
- Генетика псориаза: иммунитет, барьерная функция кожи и GWAS;
- Эпигенетика псориаза: молекулярные отметины судьбы;
- Karow T. Allgemeine und Spezielle Pharmakologie und Toxikologie. Verlag: Dr. med. Thomas Karow, 2012. — 1275 p.;
- Кубанова А.А., Кисина В.И., Блатун Л.А., Вавилов А.М. и др. Рациональная фармакотерапия заболеваний кожи и инфекций, передаваемых половым путем: Рук. для практикующих врачей / под общ. ред. Кубановой А.А., Кисиной В.И. М.: «ЛитТерра», 2005. — 890 с.;
- Elisabetta Volpe, Lucia Pattarini, Carolina Martinez-Cingolani, Stephan Meller, Marie-Helene Donnadieu, et. al.. (2014). Thymic stromal lymphopoietin links keratinocytes and dendritic cell–derived IL-23 in patients with psoriasis. Journal of Allergy and Clinical Immunology. 134, 373-381.e4;
- Katerina Tsilingiri, Giulia Fornasa, Maria Rescigno. (2017). Thymic Stromal Lymphopoietin: To Cut a Long Story Short. Cellular and Molecular Gastroenterology and Hepatology. 3, 174-182;
- Ferdinand Marlétaz, Linda Z. Holland, Vincent Laudet, Michael Schubert. (2006). Retinoic acid signaling and the evolution of chordates. Int. J. Biol. Sci.. 38-47;
- United States pharmacopeia dispensing information. Drug information for the health care professional. 24th ed. V. 1.plus updates. Thomson/Micromedex. Greenwood Village, CO, 2004. — p. 21;
- Morimoto S. and Kumahara Y. (1985). A patient with psoriasis cured by 1-α-hydroxyvitamin D3. Med. J. Osaka Univ. 35 (3–4), 51–54;
- Igor Orlov, Natacha Rochel, Dino Moras, Bruno P Klaholz. (2012). Structure of the full human RXR/VDR nuclear receptor heterodimer complex with its DR3 target DNA. The EMBO Journal. 31, 291-300;
- M. Li, P. Hener, Z. Zhang, S. Kato, D. Metzger, P. Chambon. (2006). Topical vitamin D3 and low-calcemic analogs induce thymic stromal lymphopoietin in mouse keratinocytes and trigger an atopic dermatitis. Proceedings of the National Academy of Sciences. 103, 11736-11741;
- Ananya Datta-Mitra, Suravi Raychaudhuri, Anupam Mitra. (2014). Immunomodulatory mechanisms of action of calcitriol in psoriasis. Indian J Dermatol. 59, 116;
- A Ekman, J Vegfors, C Eding, C Enerbäck. (2017). Overexpression of Psoriasin (S100A7) Contributes to Dysregulated Differentiation in Psoriasis. Acta Derm Venerol. 97, 441-448;
- Luigi Barrea, Maria Cristina Savanelli, Carolina Di Somma, Maddalena Napolitano, Matteo Megna, et. al.. (2017). Vitamin D and its role in psoriasis: An overview of the dermatologist and nutritionist. Rev Endocr Metab Disord. 18, 195-205;
- Дерматовенерология. Клинические рекомендации / под ред. Кубановой А.А. М.: «ДЭКС-Пресс», 2010. — 428 с.;
- Биохимия: Учеб. для вузов / под ред. Северина Е.С. М.: «ГЭОТАР-Медиа», 2003. — 779 с.;
- J. A. M. Wessels, T. W. J. Huizinga, H.-J. Guchelaar. (2007). Recent insights in the pharmacological actions of methotrexate in the treatment of rheumatoid arthritis. Rheumatology. 47, 249-255;
- Satoshi Matsuda, Shigeo Koyasu. (2000). Mechanisms of action of cyclosporine. Immunopharmacology. 47, 119-125;
- T.C. Lucka, D. Pathirana, A. Sammain, F. Bachmann, S. Rosumeck, et. al.. (2012). Efficacy of systemic therapies for moderate-to-severe psoriasis: a systematic review and meta-analysis of long-term treatment. Journal of the European Academy of Dermatology and Venereology. 26, 1331-1344;
- Alan Menter, Neil J. Korman, Craig A. Elmets, Steven R. Feldman, Joel M. Gelfand, et. al.. (2009). Guidelines of care for the management of psoriasis and psoriatic arthritis. Journal of the American Academy of Dermatology. 61, 451-485;
- Róbert Kui, Brigitta Gál, Magdolna Gaál, Mária Kiss, Lajos Kemény, Rolland Gyulai. (2016). Presence of antidrug antibodies correlates inversely with the plasma tumor necrosis factor (TNF)-α level and the efficacy of TNF-inhibitor therapy in psoriasis. J Dermatol. 43, 1018-1023;
- Enrique Soriano, Maria Laura Acosta Felquer, Javier Rosa. (2016). An evidence-based review of certolizumab pegol in the treatment of active psoriatic arthritis: place in therapy. OARRR. 37;
- Mark Lebwohl, Andrew Blauvelt, Carle Paul, Howard Sofen, Jolanta Węgłowska, et. al.. (2018). Certolizumab pegol for the treatment of chronic plaque psoriasis: Results through 48 weeks of a phase 3, multicenter, randomized, double-blind, etanercept- and placebo-controlled study (CIMPACT). Journal of the American Academy of Dermatology. 79, 266-276.e5;
- Allison S. Dobry, Charles P. Quesenberry, G. Thomas Ray, Jamie L. Geier, Maryam M. Asgari. (2017). Serious infections among a large cohort of subjects with systemically treated psoriasis. Journal of the American Academy of Dermatology. 77, 838-844;
- André Vicente Esteves de Carvalho, Rodrigo Pereira Duquia, Bernardo Lessa Horta, Renan Rangel Bonamigo. (2017). Efficacy of Immunobiologic and Small Molecule Inhibitor Drugs for Psoriasis: A Systematic Review and Meta-Analysis of Randomized Clinical Trials. Drugs R D. 17, 29-51;
- Kristian Reich, April W. Armstrong, Peter Foley, Michael Song, Yasmine Wasfi, et. al.. (2017). Efficacy and safety of guselkumab, an anti-interleukin-23 monoclonal antibody, compared with adalimumab for the treatment of patients with moderate to severe psoriasis with randomized withdrawal and retreatment: Results from the phase III, double-blind, placebo- and active comparator–controlled VOYAGE 2 trial. Journal of the American Academy of Dermatology. 76, 418-431;
- Anne M. Loos, Shanshan Liu, Celia Segel, Daniel A. Ollendorf, Steven D. Pearson, Jeffrey A. Linder. (2018). Comparative effectiveness of targeted immunomodulators for the treatment of moderate-to-severe plaque psoriasis: A systematic review and network meta-analysis. Journal of the American Academy of Dermatology. 79, 135-144.e7;
- Agnieszka Wasilewska, Marta Winiarska, Małgorzata Olszewska, Lidia Rudnicka. (2016). Interleukin-17 inhibitors. A new era in treatment of psoriasis and other skin diseases. pdia. 4, 247-252;
- Kim A. Papp, Joseph F. Merola, Alice B. Gottlieb, Christopher E.M. Griffiths, Nancy Cross, et. al.. (2018). Dual neutralization of both interleukin 17A and interleukin 17F with bimekizumab in patients with psoriasis: Results from BE ABLE 1, a 12-week randomized, double-blinded, placebo-controlled phase 2b trial. Journal of the American Academy of Dermatology. 79, 277-286.e10;
- Stacy L. Haber, Sarah Hamilton, Mark Bank, Shi Yun Leong, Evelyn Pierce. (2016). Apremilast. Ann Pharmacother. 50, 282-290;
- Kim Papp, Jennifer C Cather, Les Rosoph, Howard Sofen, Richard G Langley, et. al.. (2012). Efficacy of apremilast in the treatment of moderate to severe psoriasis: a randomised controlled trial. The Lancet. 380, 738-746;
- Tami Wong, Leon Hsu, Wilson Liao. (2013). Phototherapy in Psoriasis: A Review of Mechanisms of Action. J Cutan Med Surg. 17, 6-12;
- S. Haupt. (2003). Apoptosis — the p53 network. Journal of Cell Science. 116, 4077-4085;
- Terrence C. Keaney, Robert S. Kirsner. (2010). New Insights into the Mechanism of Narrow-Band UVB Therapy for Psoriasis. Journal of Investigative Dermatology. 130, 2534;
- Chih-Hung Lee, Shi-Bei Wu, Chien-Hui Hong, Hsin-Su Yu, Yau-Huei Wei. (2013). Molecular Mechanisms of UV-Induced Apoptosis and Its Effects on Skin Residential Cells: The Implication in UV-Based Phototherapy. IJMS. 14, 6414-6435;
- Olga María Palomino. (2015). Current knowledge in Polypodium leucotomos effect on skin protection. Arch Dermatol Res. 307, 199-209;
- Chih-Hung Lee, Shi-Bei Wu, Chien-Hui Hong, Hsin-Su Yu, Yau-Huei Wei. (2013). Molecular Mechanisms of UV-Induced Apoptosis and Its Effects on Skin Residential Cells: The Implication in UV-Based Phototherapy. IJMS. 14, 6414-6435;
- U. Mrowietz, E.M.G.J. de Jong, K. Kragballe, R. Langley, A. Nast, et. al.. (2014). A consensus report on appropriate treatment optimization and transitioning in the management of moderate-to-severe plaque psoriasis. J Eur Acad Dermatol Venereol. 28, 438-453;
- John Koo, Mio Nakamura. (2017). Combing Phototherapy with Acitretin: Re-PUVA and Re-UVB. Clinical Cases in Phototherapy. 113-118;
- Heba M. Mashaly, Marwa F. Hussein, Shaimaa Hamdy, Olfat Shaker. (2017). Evaluation of carcinogenic risk of PUVA versus Re-PUVA in psoriatic patients. Journal of the Egyptian Womenʼs Dermatologic Society. 14, 106-110;
- Jacquelyn J. Bower, Leah D. Vance, Matthew Psioda, Stephanie L. Smith-Roe, Dennis A. Simpson, et. al.. (2017). Patterns of cell cycle checkpoint deregulation associated with intrinsic molecular subtypes of human breast cancer cells. npj Breast Cancer. 3;
- Cristina Russo, Riccardo Polosa. (2005). TNF-α as a promising therapeutic target in chronic asthma: a lesson from rheumatoid arthritis. Clin. Sci.. 109, 135-142;
- Paul W. H. I. Parren, Paul J. Carter, Andreas Plückthun. (2017). Changes to International Nonproprietary Names for antibody therapeutics 2017 and beyond: of mice, men and more. mAbs. 9, 898-906.
Псориаз (чешуйчатый лишай) — хроническое, весьма
распространенное заболевание кожи, известное с давних времен.
Распространенность его в различных странах колеблется от 0,1 до 3%.
Однако эти цифры отражают лишь удельный вес псориаза у больных с
другими дерматозами или частоту его встречаемости у пациентов с
внутренними болезнями. Поскольку болезнь часто носит локализованный и
неактивный характер, больные обычно не обращаются за помощью в
медицинские учреждения, а следовательно, нигде не регистрируются.
Причина болезни остается неясной. Несмотря на огромное количество
предлагаемых гипотез, ни одна не является общепризнанной. Четко
установлена лишь роль генетических факторов — семейный показатель
больных в несколько раз превышает популяционный. Есть указания на связь
псориаза с антигенами HLA-cистемы — В13, В15, В16, В17, В27, В39, Dw11,
DRW6, DR7, A1. Имеются данные о возможной патогенетической значимости
генетических маркеров Lewis, MN, Ss, Duffy, Hp.
Основным патогенетическим звеном, вызывающим появление кожных
высыпаний, являются повышенная митотическая активность и ускоренная
пролиферация клеток эпидермиса, приводящая к тому, что клетки нижних
слоев «выталкивают» вышележащие клетки, не дав им ороговеть. Этот
процесс носит название паракератоза и сопровождается обильным
шелушением. Большое значение в развитии псориатических поражений в коже
играют местные иммунопатологические процессы, связанные с
взаимодействием различных цитокинов — фактора некроза опухоли,
интерферонов, интерлейкинов, а также лимфоцитов различных субпопуляций.
Пусковым моментом возникновения болезни часто является сильный
стресс — этот фактор присутствует в анамнезе большинства больных. К
другим триггерным факторам можно отнести травмы кожи, применение
медикаментов, злоупотребление алкоголем, инфекции.
Многочисленные нарушения в эпидермисе, дерме и во всех системах
организма тесно связаны и не могут по отдельности объяснить механизм
развития болезни.
Общепринятой классификации псориаза нет. Традиционно наряду с
обычным (вульгарным) псориазом выделяют эритродермическую,
артропатическую, пустулезную, экссудативную, каплевидную,
ладонно-подошвенную формы.
Обычный псориаз клинически проявляется образованием плоских папул,
четко отграниченных от здоровой кожи. Папулы розовато-красного цвета,
покрыты рыхлыми серебристо-белыми чешуйками. С диагностической точки
зрения интересна группа признаков, возникающих при поскабливании папул
и называемых псориатической триадой. Сначала появляется феномен
«стеаринового пятна», характеризующийся усилением шелушения при
поскабливании, что придает поверхности папул сходство с каплей
стеарина. После удаления чешуек наблюдается феномен «терминальной
пленки», проявляющийся в виде влажной блестящей поверхности элементов.
Вслед за этим при дальнейшем поскабливании отмечается феномен «кровяной
росы» — в виде точечных, несливающихся капелек крови.
Высыпания могут располагаться на любом участке кожного покрова, но
преимущественно локализуются на коже коленных и локтевых суставов и
волосистой части головы, с поражения которой очень часто заболевание
начинается. Для псориатических папул характерна склонность к
периферическому росту и слиянию в бляшки различных размеров и
очертаний. Бляшки могут быть изолированными, небольшими или крупными,
занимающими обширные участки кожных покровов.
При экссудативном псориазе меняется характер шелушения — чешуйки
становятся желтовато-сероватыми, склеиваются с образованием корочек,
плотно прилегающих к коже. Сами высыпания более яркие и отечные, чем
при обычном псориазе.
Псориаз ладоней и подошв может наблюдаться в виде изолированного
поражения или сочетаться с поражениями других локализаций. Проявляется
он в виде типичных папуло-бляшечных элементов, а также
гиперкератотических, мозолеподобных очагов с болезненными трещинами или
пустулезных высыпаний.
Практически всегда при псориазе поражаются ногтевые пластинки.
Наиболее патогномоничным считается появление на ногтевых пластинках
точечных вдавлений, придающих ногтевой пластинке сходство с наперстком.
Также могут отмечаться разрыхление ногтей, ломкость краев, изменение
окраски, поперечные и продольные борозды, деформации, утолщение,
подногтевой гиперкератоз.
Псориатическая эритродермия является одной из наиболее тяжелых форм
псориаза. Она может развиваться за счет постепенного прогрессирования
псориатического процесса и слияния бляшек, но чаще возникает под
влиянием нерационального лечения. При эритродермии вся кожа приобретает
ярко-красный цвет, становится отечной, инфильтрированной, отмечается
обильное шелушение. Больных беспокоит сильный зуд, ухудшается общее
состояние.
Рентгенологически различные изменения костно-суставного аппарата
наблюдаются у большинства больных без клинических признаков поражения
суставов. К таким изменениям относят околосуставной остеопороз, сужение
суставных щелей, остеофиты, кистозные просветления костной ткани.
Диапазон клинических проявлений может варьировать от незначительных
артралгий до развития инвалидизирующего анкилозирующего артроза.
Клинически обнаруживаются припухлость суставов, покраснение кожи в зоне
пораженных суставов, болезненность, ограничение подвижности, деформации
суставов, анкилозы, мутиляции.
Пустулезный псориаз проявляется в виде генерализованных или
ограниченных высыпаний, локализованных преимущественно на коже ладоней
и подошв. Хотя ведущим симптомом этой формы псориаза считается
возникновение на коже пустул, считающихся в дерматологии проявлением
гнойничковой инфекции, содержимое этих пузырьков обычно стерильно.
Каплевидный псориаз чаще развивается у детей и сопровождается
внезапным высыпанием рассеянных по всему кожному покрову мелких
папулезных элементов.
Псориаз наблюдается примерно с одинаковой частотой у мужчин и
женщин. У большинства пациентов заболевание начинает развиваться до 30
лет. У многих больных отмечается связь обострений с временем года: чаще
заболевание обостряется в холодный период (зимняя форма), гораздо реже
— летом (летняя форма). В дальнейшем эта зависимость может меняться.
В течении псориаза различают 3 стадии: прогрессирующую, стационарную
и регрессирующую. Для прогрессирующей стадии характерны рост по
периферии и появление новых высыпаний, особенно на местах прежних
высыпаний (изоморфная реакция Кебнера). В регрессирующей стадии
наблюдается уменьшение либо исчезновение инфильтрации по окружности или
в центре бляшек.
Вульгарный псориаз дифференцируют от парапсориаза, вторичного
сифилиса, красного плоского лишая, дискоидной красной волчанки,
себорейной экземы. Сложности возникают при дифференциальной диагностике
ладонно-подошвенного и артропатического псориаза.
При вульгарном псориазе прогноз для жизни благоприятный. При
эритродермии, артропатическом и генерализованном пустулезном псориазе
возможны инвалидизация и даже летальный исход из-за истощения и
развития тяжелых инфекций.
Неопределенным прогноз остается в отношении продолжительности
заболевания, длительности ремиссии и обострений. Высыпания могут
существовать длительно, многие годы, но чаще обострения чередуются с
периодами улучшения и клинического выздоровления. У значительной части
больных, в особенности не подвергавшихся интенсивному системному
лечению, возможны многолетние, самопроизвольные периоды клинического
выздоровления.
Нерациональное лечение, самолечение, обращение к «целителям»
ухудшают течение болезни, приводят к обострению и распространению
кожных высыпаний. Именно поэтому основная цель данной статьи — дать
краткую характеристику современным методам лечения этой болезни.
Сегодня существует огромное количество методов лечения псориаза, в
терапии этого заболевания используются тысячи различных препаратов.
Ноэто лишь означает, что ни один из методов не дает гарантированного
эффекта и не позволяет вылечить болезнь окончательно. Более того,
вопрос об излечении и не ставится — современная терапия в состоянии
лишь свести к минимуму кожные проявления, не затрагивая многих
неизвестных на сегодня патогенетических факторов.
Лечение псориаза проводится с учетом формы, стадии, степени
распространенности высыпаний, общего состояния организма. Как правило,
лечение комплексное, предусматривающее сочетание наружных и системных
препаратов.
Большое значение при лечении имеют мотивация пациента, семейные
обстоятельства, социальное положение, образ жизни, злоупотребление
алкоголем.
Способы лечения можно разделить на следующие направления: наружная
терапия, системная терапия, физиотерапия, климатотерапия,
нетрадиционные и народные методы.
Наружная терапия
Терапия препаратами наружного действия имеет при псориазе важнейшее
значение. В легких случаях лечение начинают с местных мероприятий и ими
ограничиваются. Как правило, препараты для местного применения реже
оказывают какие-либо побочные действия, но по эффективности уступают
системной терапии.
В прогрессирующей стадии наружное лечение проводят с большой
осторожностью, чтобы не вызвать ухудшения состояния кожи. Чем
интенсивнее воспаление, тем меньшей должна быть концентрация мазей.
Обычно на этой стадии при лечении псориаза ограничиваются кремом
«Унна», 0,5–2% салициловой мазью, травяными ваннами.
На стационарной и регрессирующей стадии показаны более активные
препараты — 5–10% нафталановая мазь, 2–10% мазь АСД, 2–5% салициловая
мазь, 2–5% серно-дегтярная мазь, а также многие другие способы терапии.
В современных условиях при выборе способа терапии или конкретного
препарата врач должен руководствоваться официальными протоколами и
формулярами, разработанными руководящими органами здравоохранения. В
Федеральном руководстве по использованию лекарственных средств (выпуск
IV) для местного лечения больных псориазом предлагаются стероидные
лекарственные средства, салициловая мазь, препараты дегтя и
кальципотриол.
Исходя из «Методических материалов по диагностике и лечению наиболее
распространенных инфекций, передаваемых половым путем, и заболеваний
кожи», разработанных ЦНИКВИ в 2001 г., в качестве наружной терапии
используют 1–2% салициловую мазь, мази с содержанием дегтя 5–10%,
нафталана 5–10%, витамина Д3, а также кортикостероидные мази
(бетаметазон с салициловой кислотой, мометазон) и аэрозоль цинка
пиритионата. В «Протоколах ведения больных», разработанных учеными
ЦНИКВИ в 2003 г., рекомендуются те же препараты.
Остановимся в основном на указанных в руководствах препаратах.
Гидратитрующие средства. Смягчают шелушащуюся поверхность
псориатических элементов, уменьшают стягивание кожи, улучшают
эластичность. Используют кремы на основе ланолина с витаминами, крем
«Унна». По данным литературы, даже после такого легкого воздействия
клинические эффекты (снижение зуда, эритемы и шелушения) достигаются у
трети больных.
Препараты салициловой кислоты. Обычно используют мази с
концентрацией от 0,5 до 5% салициловой кислоты. Она обладает
антисептическим, противовоспалительным, кератопластическим и
кератолитическим действием, может применяться в комбинации с дегтем и
кортикостероидами. Салициловая мазь размягчает шелушащиеся слои
псориатических элементов, а также усиливает действие местных стероидов
путем усиления их всасывания, поэтому часто используется в комбинации с
ними. Сама салициловая кислота легко проникает в кожу и затем в кровь.
Поэтому ее не применяют на обширных поверхностях и в концентрации
больше 2%, а у детей даже 2-процентную мазь накладывают только на
ограниченных участках кожи. Непереносимость встречается редко, однако
салициловая кислота может вызывать в качестве побочного эффекта
усиление воспаления кожи.
Дегтярные препараты. Применяются издавна в виде 5–15% мазей и
паст, часто в сочетании с другими местными препаратами. В России
используются мази с древесным дегтем (обычно березовым), в некоторых
зарубежных странах — с каменноугольным. Последний более активен, но,
как считают наши ученые, обладает канцерогенными свойствами, хотя
многочисленные публикации и зарубежный опыт не подтверждают этого.
Деготь превосходит салициловую кислоту по активности, обладает
противовоспалительными, кератопластическими и антиэксфолиативными
свойствами. Его применение при псориазе обусловлено, кроме того,
влиянием на клеточную пролиферацию. Применение дегтярных препаратов
ограничено из-за неприятного запаха, их нельзя накладывать на лицо.
Комбинации дегтя с цинком или салициловой кислотой не обладают
значительными преимуществами перед монокомпонентными препаратами дегтя.
Способность дегтя повышать фоточувствительность используется для
комбинированной терапии в сочетании с ультрафиолетовым облучением. Не
следует применять препараты дегтя длительно и в повышенной
концентрации, так как это может привести к всасыванию и системному
действию (поражение почек, общая интоксикация, паралич). При назначении
препаратов дегтя следует учитывать его фотосенсибилизирующее действие и
риск ухудшения функции почек у лиц с нефрологическими болезнями.
Для мытья головы используют шампуни с дегтем (фридерм-тар, Т/гель).
Нефть нафталанская. Смесь углеводородов и смол, содержит серу,
фенол, магний и много других веществ. Препараты нафталанской нефти
обладают противовоспалительными, рассасывающими, противозудными,
антисептическими, отшелушивающими и репарационными свойствами. Для
лечения псориаза применяются 10–30% нафталановые мази и пасты. Часто
нафталанская нефть используется в комбинации с серой, ихтиолом, борной
кислотой, цинковой пастой.
Местная терапия ретиноидами. Первый эффективный местно
применяемый ретиноид, разрешенный к употреблению как средство для
лечения псориаза, — тазаротен. В России этот препарат пока не
зарегистрирован. Он представляет собой желе на водной основе и
выпускается в концентрации 0,05 и 0,1%. По эффективности он сравним с
сильнодействующими ГКС. Из побочных эффектов отмечаются зуд и
раздражение кожи. Одним из преимуществ этого препарата является более
продолжительная по сравнению с ГКС ремиссия. Так, по данным J. Koo,
через 3 мес после лечения рецидив наблюдали только у 185 больных (после
флуоцинонида — у 55%). В работе A. Marchetti показаны
фармакоэкономические преимущества тазаротена в виде 0,1% геля в
сравнении с мазью флуоцинонида (местный ГКС) и кальципотриена
(разновидность витамина Д3 для местного использования).
Гидрантроны. В первой половине XX в. применялись мази со смесью
естественных дериватов антрацена — хризаробином, который получали из
стволов бразильского дерева Vonacopua araroba семейства бобовых.
В настоящее время в Европе и США используются синтетические гидроксиантроны — дитранол, антралин, цигнолин, антраробин.
Дитранол — аналог естественного хризаробина, оказывает
цитотоксическое и цитостатическое действие, приводит к снижению
активности окислительных и гликолитических процессов в эпидермисе. В
результате уменьшаются количество митозов в эпидермисе, а также
гиперкератоз и паракератоз. К сожалению, дитранол обладает выраженным
местно-раздражающим действием, и при попадании на здоровую кожу могут
возникать ожоги. С другой стороны, дитранол очень эффективен и не
вызывает системных побочных эффектов. Несколько лет назад в Европе
появились препараты, которые высвобождают дитранол только при
температуре кожи человека (миканол). В результате ослабляется
окрашивание кожи. Сегодня дитранол применяют в достаточно высоких
концентрациях (>1%), нанося его на 5–30 минут. Этот способ не
уступает по эффективности применению препарата в низких концентрациях
на ночь. По данным литературы, средняя ремиссия при лечении дитранолом
составляет 4 – 6 мес.
Российские специалисты редко используют препараты этой группы, в
России они не производятся и за рубежом не закупаются. Ранее
предлагались несколько препаратов этой группы — цигнодерм, дитрастик,
псоракс. Они выпускаются в виде стержня, наподобие губной помады.
Добавление парафина позволяет наносить препараты точно на область
поражения, что особенно удобно при лечении ограниченных, застарелых
очагов.
К препаратам этой группы можно отнести антралин, который применяется
в европейских и американских лечебных центрах. Препарат тормозит синтез
ДНК ядра и митохондрий, угнетает метаболизм в тканях, что приводит к
снижению пролиферации. При использовании сильно окрашивает
контактируемые поверхности, может вызывать раздражения и ожоги.
Производные иприта.
К ним относятся псориазин и антипсориатикум. В их состав входят
вещества кожно-нарывного действия — иприт и трихлорэтиламин. Лечение
этими препаратами проводят с большой осторожностью, применяя сначала
мази с небольшой концентрацией на небольшие очаги поражения 1 раз в
день. Затем при хорошей переносимости концентрацию, площадь и кратность
при использовании увеличивают. Лечение осуществляют под тщательным
врачебным контролем, проводя еженедельные тесты крови и мочи. Сейчас
данные препараты практически не применяются, однако они весьма
эффективны в стационарной стадии болезни.
Цинка пиритионат. Активное вещество, выпускаемое в виде
аэрозолей, кремов и шампуней под торговым названием «Скин-кап».
Обладает противомикробным, противогрибковым, а также
антипролиферативным действием — подавляет патологический рост клеток
эпидермиса, находящихся в состоянии гиперпролиферации. Последнее
свойство определяет эффективность препарата при псориазе. Препарат
снимает воспаление, уменьшает инфильтрацию и шелушение псориатических
элементов. Лечение проводят в среднем в течение месяца. Для терапии
больных с поражениями волосистой части головы используют аэрозоль и
шампунь, при поражениях кожи — аэрозоль и крем. Препарат наносят 2 раза
в сутки, шампунь применяют 3 раза в неделю. В России начиная с 1995 г.
проводилось изучение клинической эффективности и переносимости всех
лекарственных форм цинка пиритионата. По заключению ведущих
дерматологических центров — ЦНИКВИ, РГМУ, ММА, ВМА — эффективность
препарата при лечении больных псориазом достигает 85–90%. Исходя из
данных, опубликованных в периодической печати ведущими специалистами
этих и других центров, клинического излечения удается добиться к концу
3–4 нед лечения. Эффект развивается постепенно, но очень важно, что
результаты лечения очевидны уже к концу первой недели с момента начала
применения препарата — резко снижается зуд, устраняется шелушение,
бледнеет эритема. Такое быстрое достижение клинического эффекта
приводит, соответственно, к быстрому улучшению качества жизни
пациентов. Препарат хорошо переносится. Разрешен для применения с 3-
летнего возраста.
Мази с витамином Д3. С 1987 г. при местном лечении используется синтетический препарат витамина Д3
— кальципотриол. Многочисленными экспериментальными исследованиями
показано, что кальципотриол вызывает торможение пролиферации
кератиноцитов, ускоряет их морфологическую дифференциацию, воздействует
на факторы иммунной системы кожи, регулирующие пролиферацию клеток,
обладает противовоспалительными свойствами. На российском рынке
представлены 3 препарата данной группы от различных производителей.
Препараты наносят на пораженные участки кожи 1-2 раза в сутки.
Эффективность мазей с Д3 примерно соответствует эффекту
кортикостероидных мазей I, II классов, а по данным J. Koo — даже III
класса. При применении этих мазей выраженный клинический эффект
наступает у большинства больных (до 95%). Однако для достижения
хорошего эффекта может понадобиться достаточно много времени (от 1 мес
до 1 г.), а площадь поражения не должна превышать 40%. И. В. Хамаганова
сообщает о положительном опыте применения кальципотриола у детей.
Препарат наносили 2 раза в день, выраженный эффект наблюдался к концу
четвертой недели лечения. Побочных эффектов не выявлено. О таких же
результатах лечения при использовании кальципотриола у взрослых
сообщает В. А. Самсонов.
Иногда при использовании кальципотриола могут наблюдаться
раздражение кожи, дерматит, фотосенсибилизация, обострение
псориатического процесса, гиперкальциемия. Однако кальципотриол не
вызывает побочных эффектов, характерных для стероидов, и иногда дает
более стойкий эффект, чем мази с ГКС. Хотя, по данным того же J. Koo,
рецидивы возникают у более 50% больных, при этом средняя
продолжительность ремиссии не превышает 1,5 мес.
Более выраженных эффектов достигают при сочетанном применении
кальципотриола с любыми формами фототерапии, а также с системной
терапией.
Кортикостероидные препараты. Применяются в медицинской практике
в качестве наружных средств с 1952 г., когда Sulzberger впервые показал
эффективность наружного применения стероидов. На сегодняшний день на
российском фармацевтическом рынке зарегистрированы около 50
глюкокортикостероидных средств для наружного применения. Это,
несомненно, затрудняет выбор врача, который должен иметь информацию обо
всех препаратах. Специальное анкетирование, проведенное Н. Г.
Кочергиным среди дерматологов, показало, что при выборе средств для
наружной терапии врачи исходят из следующих данных: активности кожного
процесса, локализации высыпаний, возраста больного, эффективности
рекламы и стоимости препарата в аптеке. К наиболее часто назначаемым
при псориазе ГКС, по данным того же опроса, относятся комбинированные
препараты (флуметазона пивалат с салициловой кислотой), мометазона
фуроат или бетаметазона дипропионат.
Терапевтический эффект наружных ГКС обусловлен целым рядом потенциально благоприятных эффектов:
- противовоспалительным действием (сужением сосудов, разрешением воспалительного инфильтрата);
- эпидермостатическим (антигиперпластическим влиянием на клетки эпидермиса);
- антиаллергическим;
- местным аналгезирующим действием (устранением зуда, жжением, болезненностью, чувством стягивания).
Изменение структуры ГКС отражалось на их свойствах, активности. Так
появилась достаточно обширная группа препаратов, различающихся по
своему химическому строению и активности. Гидрокортизона ацетат сегодня
при псориазе практически не применяется, его используют в клинических
исследованиях для сравнения со вновь получаемыми препаратами. Например,
считается, что если активность гидрокортизона принять за единицу, то
активность триамцинолона ацетонида составит 21 единицу, а бетаметазона
— 24 единицы. Из препаратов второго класса при псориазе чаще
используется флуметазона пивалат в комбинации с салициловой кислотой, а
наиболее современными являются нефторированные ГКС. В связи с
минимальным риском возникновения побочных явлений мази и кремы с
аклометазоном разрешены для применения на чувствительных участках
(лицо, кожные складки), лечения детей и пожилых людей, при нанесении на
обширные участки кожи.
Среди препаратов третьего класса можно выделить группу фторированных
ГКС — флуоцинолона ацетонид, триамцинолона ацетонид, бетаметазона
валерат и дипропионат. Фармакоэкономический анализ применения этих
препаратов (правда, не при псориазе), заключающийся в изучении
соотношения «цена/безопасность/эффективность», по данным В. А.
Аковбяна, выявил благоприятные показатели у бетаметазона валерата —
быстрое развитие терапевтического эффекта, более низкая стоимость курса
лечения.
При лечении псориаза начинать следует с более легких препаратов —
гидрокортизона, преднизолона, аклометазона, а при повторных обострениях
и неэффективности используемых препаратов давать более сильные. Однако
среди американских дерматологов популярна следующая тактика: вначале
применяется сильный ГКС для достижения быстрого эффекта, а потом
пациента переводят на умеренный или слабый препарат для проведения
поддерживающей терапии. В любом случае сильные препараты используют
короткими курсами и лишь на ограниченные участки, так как при их
назначении чаще развиваются побочные эффекты.
Помимо указанной классификации, препараты подразделяют на
фторированные, дифторированные и нефторированные средства разных
поколений. Нефторированные ГКС первого поколения (гидрокортизона
ацетат) по сравнению с фторированными, как правило, менее эффективны,
но более безопасны в отношении побочных реакций. Сейчас проблема низкой
эффективности нефторированных ГКС уже решена — созданы нефторированные
препараты четвертого поколения, сравнимые по силе с фторированными, а
по безопасности — с гидрокортизона ацетатом. Это, в частности,
гидрокортизона бутират, мометазона фуроат, метилпреднизолона ацепонат.
Проблема усиления действия препарата решается не путем галогенизации, а
благодаря этерификации. Кроме усиления действия это позволяет
использовать этерифицированные препараты 1 раз в сутки. К примеру,
гидрокортизона бутират имеет следующие фармакодинамические свойства:
торможение миграции лейкоцитов и лимфоцитов в область воспаления,
угнетение протеолитической активности тканевых кининов, задержка роста
фибробластов, предупреждение развития соединительной ткани в очаге
воспаления. Именно нефторированные ГКС четвертого поколения являются
сегодня предпочтительными для местного применения при псориазе.
Стандартные побочные эффекты при применении местных стероидов — это
развитие атрофии кожи, гипертрихоза, телеангиэктазий, гнойничковых
инфекций, системное действие с влиянием на
гипоталамо-гипофизарно-надпочечниковую систему. В современных
нефторированных препаратах, упомянутых выше, эти побочные эффекты
сведены к минимуму.
Фармацевтические компании стараются разнообразить спектр
лекарственных форм и выпускают ГКС в виде мазей, кремов, лосьонов.
Жирная мазь, создавая пленку на поверхности очага поражения, вызывает
более эффективное рассасывание инфильтрации, чем другие лекарственные
формы. Крем лучше купирует островоспалительные явления, увлажняет,
охлаждает кожу. Безжировая основа лосьона обеспечивает его легкое
распределение по поверхности волосистой части головы без склеивания
волос.
По литературным данным, при использовании, например, мометазона в
течение 3 нед положительного терапевтического эффекта (уменьшения
количества высыпаний на 60–80%) удается добиться почти у 80% больных.
По данным В. Ю. Уджуху, наиболее выгодного соотношения
«эффективность/безопасность» можно достичь при использовании
гидрокортизона бутирата. Выраженный клинический эффект при применении
этого препарата сочетается с хорошей переносимостью — ни у одного из
прошедших курс лечения больных авторы не наблюдали побочных реакций,
даже при нанесении на лицо. При длительном использовании других ГКС
приходилось останавливать лечение из-за развития побочных эффектов. По
данным B. Bianchi и Н. Г. Кочергина, сравнение результатов клинического
применения мометазона фуората и метилпреднизолона ацепоната показало
одинаковую эффективность этих лекарственных средств при наружном
применении. Ряд авторов (Е. Р. Аравийская, Е. В. Соколовский)
предлагают этапную кортикостероидную терапию псориаза. Рекомендуется
начинать наружную терапию с комбинированных препаратов, содержащих ГКС
(например, бетаметазон и салициловую кислоту). Средняя
продолжительность такого лечения — около 3 нед. В дальнейшем происходит
переход на чистый ГКС, желательно третьего класса (например,
гидрокортизона бутират или мометазона фуроат).
Больных привлекают простота использования стероидных препаратов,
возможность достаточно быстро снять клиническую симптоматику
заболевания, доступность, отсутствие запаха. Кроме того, эти
лекарственные средства не оставляют жирных пятен на одежде. Однако их
применение должно быть кратковременным, во избежание ухудшения течения
болезни. При длительном применении стероидных мазей развивается
привыкание. Резкая отмена кортикостероидов может вызвать обострение
кожного процесса. В литературе указывается разная длительность ремиссии
после местного лечения кортикостероидами. Большинство работ
свидетельствует о непродолжительной ремиссии — от 1 до 6 мес.
Исследования R. Seville установили, что ГКС в комбинации с другими
методами (в частности, с дитранолом) повышают эффективность лечения, но
уменьшают длительность ремиссии. Пациентам нужно рекомендовать как
можно дольше обходиться без применения кортикостероидных мазей. Во
многих зарубежных источниках мази, содержащие глюкокортикостероидные
гормоны, рекомендуют предпочтительно использовать на ограниченных
открытых участках поверхности кожи — лицо, руки. Однако следует помнить
об опасности развития на лице стероидного периорального дерматита или
розацеа, особенно при применении фторированных ГКС.
При псориазе наиболее эффективны комбинации стероидных гормонов
(чаще всего бетаметазона) с салициловой кислотой. Салициловая кислота
благодаря своему кератолитическому и противомикробному действию
дополняет дерматотропную активность стероидов.
На волосистую часть головы удобно наносить комбинированные лосьоны с
кортикостероидами и салициловой кислотой. По данным отечественных
авторов (Г. И. Суколин, В. А. Молочков, Н. С. Потекаев), эффективность
комбинированных препаратов достигает 80 — 100%, при этом очищение кожи
происходит очень быстро —в течение 3 нед.
Подводя итоги, следует сказать, что на практике врачу всегда
необходимо решать, использовать ли только наружные методы лечения или
назначать их в сочетании с какой-либо системной терапией в целях
повышения эффективности лечения и удлинения ремиссии.
Ю. Н. Перламутров, доктор медицинских наук, профессор
А. М. Соловьев, кандидат медицинских наук
МГМСУ, Москва
В настоящее время препарат не числится в Государственном реестре лекарственных средств или указанный регистрационный номер исключен из реестра.
Регистрационный номер:
П N016163/01
Торговое название препарата: НЕОТИГАЗОН® (NEOTIGASON®)
Международное непатентованное название:
ацитретин (Acitretin)
Лекарственная форма:
капсулы
Состав
1 капсула 10 мг содержит:
активное вещество: ацитретин 10 мг (в виде, сухого спрея, содержащего 25 % активного вещества);
вспомогательное вещество: микрокристаллическая целлюлоза 50 мг.
1 капсула 25 мг содержит:
активное вещество: ацитретин 25 мг (в виде сухого спрея, содержащего 25 % активного вещества);
вспомогательное вещество: микрокристаллическая целлюлоза 125 мг.
Состав сухого спрея (на 1 г):
ацитретин 250 мг, желатин 270 мг, мальтодекстрин 410 мг, натрия аскорбат 70 мг.
Описание
Капсулы 10 мг: желатиновые капсулы № 4, корпус — белого или слегка желтоватого цвета, непрозрачный; крышечка — коричневого цвета, непрозрачная; с надписью черного цвета «10» на корпусе, с надписью черного цвета « 
Капсулы 25 мг: желатиновые капсулы № 1, корпус — желтого цвета, непрозрачный; крышечка — коричневого цвета, непрозрачная; с надписью черного цвета «25» на корпусе, с надписью черного цвета « 
Содержимое капсул — порошок с уплотненными кусками от бледно-желтого до желтого цвета.
Фармакотерапевтичсская группа: Репарации тканей стимулятор
КОД ATX [D05BB02]
Фармакологические свойства
Фармакодинамика
Системный ретиноид.
Ацитретин, действующее вещество препарата Неотигазон®, — синтетический ароматический аналог ретиноевой кислоты. В доклинических исследованиях по переносимости ацитретина мутагенного или канцерогенного действия обнаружено не было; отсутствовали также указания на его прямую гепатотоксичность. Ацитретин оказывал на животных выраженное тератогенное действие.
Клинические исследования подтвердили, что при псориазе и нарушениях ороговения ацитретин нормализует процессы пролиферации, дифференцировки и кератинизации клеток эпидермиса, причем его побочные действия, в целом, вполне переносимы. Действие препарата является чисто симптоматическим; его механизм остается, в основном, неизвестным.
Фармакокинетика
Всасывание
Максимальные концентрации ацитретина в плазме наблюдаются через 1-4 часа после приема. Наилучшая биодоступность ацитретина достигается при приеме препарата во время еды. Биодоступность разовой дозы составляет около 60%, однако она подвержена значительным индивидуальным колебаниям (36-95%).
Распределение
Ацитретин обладает выраженной липофильностью и легко проникает в ткани. Его связывание с белками превышает 99%. В исследованиях на животных ацитретин проходил через плацентарный барьер в количествах, способных вызвать пороки развития у плода. Липофильные свойства ацитретина заставляют предполагать, что он в значительных количествах попадает в грудное молоко.
Метаболизм
Ацитретин метаболизируется путем изомеризации в 13-цис-изомер (цис-ацитретин), а также путем образования глюкуронидов и отщепления боковой цепи.
Выведение
Исследования с многократным приемом препарата больными в возрасте от 21 до 70 лет показали, что период полувыведения (Т1/2) ацитретина составляет около 50 часов, а его основного метаболита в плазме, цис-ацитретина, который является тератогенным, — 60 часов. Учитывая наибольшую продолжительность периода полувыведения ацитретина (96 часов) и цис-ацитретина (123 часа) у этих больных, а также исходя из их линейной кинетики, можно прогнозировать, что более 99% препарата выведется из организма в течение 36 дней после прекращения длительного лечения. Более того, в пределах 36 дней после прекращения лечения концентрации ацитретина и цис-ацитретина в плазме уменьшались ниже предела чувствительности метода (Показания к применению
Тяжелые формы псориаза, в том числе, псориатическая эритродермия, локализованный или генерализованный пустулезный псориаз.
Тяжелые дискератозы, такие, как врожденный ихтиоз; красный волосяной лишай; болезнь Дарье; другие тяжелые нарушения ороговения, резистентные к традиционным видам терапии.
Противопоказания
Неотигазон обладает сильным тератогенным действием и не должен назначаться беременным. Это же относится и ко всем женщинам, способным к деторождению, если только они не применяют надежные противозачаточные средства за четыре недели до начала лечения, в ходе лечения и в течение двух лет после его завершения (см. далее). Беременность и лактация
Беременность
Неотигазон высокотератогенен. Он противопоказан не только беременным и женщинам, которые могут забеременеть во время лечения или в течение 2 лет после прекращения его приема, но и всем женщинам, потенциально способным к деторождению. Риск рождения ребенка с пороками рождения особенно высок, если Неотигазон принимают до или во время беременности, вне зависимости от дозы и продолжительности терапии. Действие Неотигазона на плод всегда сопряжено с риском врожденных пороков развития. Неотигазон противопоказан любой женщине, способной к деторождению, если не удовлетворяется хотя бы одно из следующих условий: 1. Больная страдает тяжелым нарушением ороговения, резистентным к стандартным видам лечения. 2. Можно быть уверенным в том, что больная принимает и выполняет указания врача. 3. Больная в состоянии аккуратно и беспрерывно применять предусмотренные противозачаточные средства. 4. Абсолютно необходимо, что бы каждая женщина, способная к деторождению, применяла эффективные противозачаточные средства (предпочтительно 2 метода контрацепции одновременно) без перерывов в течение 4 недель до начала лечения, в процессе лечения и в течение двух лет после завершения лечения Неотигазоном. Основной метод контрацепции — это прием комбинированного перорального контрацептива или внутриматочные противозачаточные средства, также рекомендуется использование презерватива или диафрагмы (колпачка). Не рекомендуется применение низкодозированных монопрепаратов прогестерона (минипилли) в виду возможного ослабления их контрацептивного эффекта. 5. Лечение не должно начинаться ранее 2-го или 3-го следующего нормального менструального цикла. 6. По крайней мере, за неделю до начала лечения должен быть получен отрицательный результат обследования на беременность. Во время лечения рекомендуется проводить дополнительные обследования на беременность не реже 1 раза в месяц и через интервалы 1-3 месяца после отмены препарата. 7. До начала лечения Неотигазоном врач должен подробно, устно и письменно, проинформировать женщин, способных к деторождению, о необходимых мерах предосторожности, опасности очень тяжелых пороков развития плода и возможных последствиях наступления беременности во время лечения Неотигазоном или в течение 2 лет после его окончания. 8. Те же самые эффективные и непрерывные противозачаточные меры должны применяться каждый раз при повторении курса лечения, независимо от его продолжительности, и соблюдаться в течение двух лет после окончания курса. 9. Если, несмотря на все меры предосторожности, во время лечения Неотигазоном или в течение двух лет после его окончания наступит беременность, существует большой риск тяжелых пороков развития плода (например, грыжи головного мозга). 10. Женщина должна избегать употребления алкоголя во время лечения и в течение двух месяцев после окончания приема препарата.
Кормление грудью
Неотигазон нельзя назначать кормящим матерям. Способ применения и дозы
Из-за индивидуальных различий во всасывании и скорости метаболизма ацитретина дозу нужно подбирать индивидуально. Капсулы лучше принимать один раз в сутки во время еды или с молоком. Далее приводятся ориентировочные рекомендации. Взрослые
Начальная суточная доза 25 мг (т.е. 1 капсула по 25 мг) или 30 мг в сутки (т.е. 3 капсулы по 10 мг) в течение 2-4 недель может оказывать достаточный терапевтический эффект.
Поддерживающая доза зависит от клинической эффективности и переносимости препарата. Как правило, оптимальный терапевтический эффект достигается при суточной дозе 25-50 мг, принимаемой еще в течение 6-8 недель. В некоторых случаях бывает необходимо увеличить дозу до максимальной, равной 75 мг/сутки (т.е. 3 капсулы по 25 мг).
После достаточного регресса псориатических поражений лечение больных псориазом можно прекратить. Рецидивы лечат как указано выше.
При дискератозах обычно требуется поддерживающая терапия, которую проводят как можно меньшими дозами. Они могут быть ниже 20 мг в сутки и не должны превышать 50 мг в сутки. Дети
Учитывая возможность тяжелых побочных явлений, при длительном лечении следует тщательно сопоставлять возможный риск с ожидаемым терапевтическим эффектом. Ацитретин нужно назначать только при неэффективности всех других методов лечения. Суточная доза зависит от массы тела и составляет около 0,5 мг/кг. В некоторых случаях на ограниченное время могут потребоваться более высокие дозы, до 1 мг/кг в сутки (не более 35 мг/сутки). Поддерживающая доза должна быть как можно меньшей, учитывая возможные побочные реакции при длительном лечении. Комбинированная терапия
Если Неотигазон применяется в комбинации с другими видами лечения, то можно уменьшить его дозу в зависимости от индивидуальной реакции больного.
При лечении Неотигазоном можно продолжать применять обычное наружное лечение; оно не влияет на действие Неотигазона. Побочное действие
Побочные реакции отмечаются у большинства больных, принимающих Неотигазон. Однако они обычно исчезают после уменьшения дозы или отмены препарата. Иногда в начале лечения наблюдается обострение симптомов заболевания.
Самыми частыми побочными действиями являются симптомы гипервитаминоза А, например, сухость губ, которую можно устранить применением жирного крема; хейлит и трещины в уголках рта, сухость и воспаление слизистых оболочек и переходного эпителия; иногда — носовое кровотечение, ринит и офтальмологические нарушения (ксерофтальмия, конъюнктивит), а также непереносимость контактных линз; редко — язвы роговицы. Наблюдались также случаи жажды и сухости во рту, иногда — стоматит, гингивит и нарушение вкусовых ощущений, увеличение частоты вульвовагинитов, вызванных Candida albicans.
Может возникать истончение и шелушение кожи по всему телу, особенно на ладонях и подошвах. Описаны частые случаи «клейкости» кожи, дерматита, экземы и зуда, выпадения волос, ломкости ногтей и паронихии. Есть отдельные сообщения о возникновении буллезных высыпаний и изменении структуры волос; редко развиваются реакции фотосенсибилизации. После отмены Неотигазона эти побочные действия, как правило, обратимы.
Имеются отдельные сообщения о головных болях, хотя повышение внутричерепного давления отмечаются редко. При появлении сильных головных болей, тошноты рвоты и нарушения зрения Неотигазон нужно немедленно отменить, а больного направить к невропатологу. Иногда отмечалось нарушение темновой адаптации.
Могут возникнуть боли в мышцах, костях и суставах. Поддерживающая терапия может приводить к увеличению уже имевшихся гиперостозов позвоночника, появлению новых гиперостозов и кальциноза мягких тканей, как это наблюдается при длительном системном применении и других ретиноидов.
Описаны случаи появления периферических отеков и приливов, редко развиваются желудочно-кишечные расстройства, гепатит, желтуха, временное и, как правило, обратимое повышение активности аминотрансфераз и щелочной фосфатазы.
При лечении большими дозами Неотигазона возникло обратимое повышение триглицеридов и холестерина сыворотки, особенно у больных группы высокого риска (с нарушениями липидного обмена, сахарным диабетом, ожирением, алкоголизмом). Если данные нарушения персистируют, нельзя исключить повышенный риск атерогенеза.
При лечении ацитретином в редких случаях может возникнуть периферическая нейропатия. Передозировка
В случае острой передозировки Неотигазон следует немедленно отменить. Других специальных мер принимать не требуется, поскольку острая токсичность препарата мала. Симптомы передозировки идентичны таковым при остром гипервитаминозе А (головная боль, головокружение). Взаимодействие с другими лекарственными препаратами
Из-за риска гипервитаминоза А следует избегать одновременного применения витамина А и других ретиноидов.
Поскольку как Неотигазон, так и тетрациклины могут вызывать повышение внутричерепного давления, их одновременное применение противопоказано.
Имеются сообщения о повышенном риске развития гепатита при комбинированном применении метотрексата и Тигасона (этретината), поэтому назначение метотрексата одновременно с Неотигазоном также противопоказано.
Неотигазон не влияет на связывание антикоагулянтов кумаринового ряда (варфарина) с белками.
Если Неотигазон назначают одновременно с фенитоином, следует учесть, что Неотигазон частично понижает степень связывания фенитоина с белками.
Низкодозированные монопрепараты прогестерона (минипилли) могут быть не надежным средством контрацепции во время терапии ацитретином.
Иных взаимодействий между Неотигазоном и другими лекарственными средствами (например, дигоксином, циметидином, комбинированными эстроген/прогестогенными пероральными противозачаточными средствами) до настоящего времени не обнаружено.
В исследовании у здоровых добровольцев однократный прием ацитретина вместе с этиловым спиртом приводил к образованию этретината (ранее это было обнаружено in vitro). В недавно проведенных исследованиях у некоторых больных, принимавших Неотигазон, также обнаруживалось образование этретината. До тех пор, пока это явление не получит полного объяснения, необходимо учитывать фармакокинетические особенности этретината: поскольку период его полувыведения составляет примерно 120 дней, в течение двух лет после завершения лечения необходимо пользоваться противозачаточными средствами. Особые указания
Неотигазон может назначаться только врачами, имеющими опыт применения системных ретиноидов и понимающих риск тератогенного действия ацитретина.
Женщины детородного возраста в ходе лечения Неотигазоном не должны употреблять алкоголь а также алкогольсодержащие напитки, продукты и лекарственные препараты, поскольку имеются клинические данные о том, что при одновременном приеме ацитретина и алкоголя в организме может образоваться этретинат. Механизм — этого метаболического превращения не установлен, поэтому неясно, могут ли в нем участвовать и другие вещества. Этретинат высоко тератогенен и имеет более длительный Т1/2 по сравнению с ацитретином. Приема этанола следует избегать на протяжении 2 месяцев после прекращения терапии ацитретином.
Женщинам детородного возраста нельзя переливать кровь от больных, получающих Неотигазон. Следовательно, во время лечения Неотигазоном и в течение года после его завершения донорство крови запрещено.
Следует контролировать функцию печени до начала лечения Неотигазоном, каждые 1-2 недели в течение первого месяца после начала лечения, а затем — через каждые 3 месяца. Если результаты анализов указывают на патологию, контроль следует проводить еженедельно. Если функция печени не нормализуется или будет ухудшаться дальше, Неотигазон нужно отменить. В этом случае рекомендуется продолжать контролировать функцию печени на протяжении, по крайней мере, еще 3 месяцев.
Необходимо контролировать уровень холестерина и триглицеридов сыворотки натощак, особенно у больных группы риска (нарушения липидного обмена, сахарный диабет, ожирение, алкоголизм) и при длительном лечении.
У больных сахарным диабетом ретиноиды могут улучшить или ухудшить толерантность к глюкозе, поэтому на ранних этапах лечения концентрацию глюкозы в крови следует проверять чаще обычного.
Взрослым, получающим длительную терапию Неотигазоном, следует регулярно проводить соответствующие обследования, учитывая возможность аномалий окостенения (см. «Побочные действия»). При возникновении таких нарушений следует обсудить с больным вопрос о продолжении лечения, тщательно соотнеся возможный риск и пользу от применения препарата.
У детей нужно внимательно следить за параметрами роста и развитием костей.
Из-за возможности нарушения ночного зрения больных следует предупреждать об необходимости проявления осторожности при вождении автомобиля или работе с машинами и механизмами в ночное время. Необходимо проводить тщательный мониторинг за нарушением зрения.
В настоящее время известны не все последствия применения Неотигазона, которые могут возникнуть на протяжении жизни.
На основании доступных данных о степени влияния на частоту врожденных дефектов при оплодотворении женщин спермой и семенной жидкостью пациентов мужского пола, принимающих ацитретин, можно сделать вывод о минимальном риске развития тератогенных эффектов. Форма выпуска
Капсулы 10 мг или 25 мг.
По 5 или 10 капсул в блистер ПВХ/Ал/ПВДХ. По 6, 10 или 20 блистеров по 5 капсул или по 3, 5 или 10 блистеров по 10 капсул с инструкцией по применению в картонную пачку. Условия хранения
При температуре не выше 25 oС, в защищенном от света и влаги месте. Хранить в недоступном для детей месте! Срок годности
3 года. Препарат не следует использовать по истечении срока годности, указанного на упаковке. Условия отпуска из аптек
Отпускается по рецепту. Производитель
«Актавис Групп ПТС ехф», Исландия произведено «Патеон Инк.», 2100 Синтекс Корт, Миссисауга, Онтарио, Канада, Л5H 7К9. *Упаковщик
1. «Патеон Инк.», Канада
2. «Сенекси», Франция
3. «Ф.Хоффманн-Ля Рош Лтд.», Швейцария
4. «Рош Фарма АГ», Германия Претензии потребителей направлять по адресу:
ООО «Актавис»
127018, г. Москва, ул. Сущевский Вал, д. 18. *В данном разделе указывают название и страну компании упаковщика, принимающую участие в производственном процессе.