Состав
В 1 мл концентрата, рассчитанного для приготовления инфузионных растворов, содержится 20 мг действующего вещества тоцилизумаба и вспомогательные соединения: сахароза, полисорбат 80, додекагидрат и дигидрат натрия гидрофосфата, вода инъекционная.
Форма выпуска
Препарат Актемра реализуется во флаконах объемом 4/10/20 мл. В одной картонной пачке обычно находится 4 или 1 флакон. Сам концентрат представляет собой опалесцирующую бесцветную жидкость.
Фармакологическое действие
Актемра обладает иммунодепрессивным влиянием.
Фармакодинамика и фармакокинетика
Тоцилизумаб является рекомбинантным гуманизированным моноклональным антителом к рецепторам интерлейкина 6 (сокр. ИЛ-6) в человеческом организме и относится к подклассу иммуноглобулинов изотипу IgG1. В основе механизма действия лежит селективное связывание и подавление как растворимых, так и мембранных рецепторов на ИЛ-6.
Интерлейкин 6 – это показатель иммунного ответа, его — многофункциональный цитокин вырабатывают различные типы клеток, принимающие участие в паракринной регуляции, в патологических процессах и системных физиологических реакциях, например, активация Т-лимфоцитов, стимуляция выработки Ig, гемопоэза, белков острой фазы воспаления (стресс-белков) в печени. Так как Интерлейкин 6 вовлечен в патогенез заболеваний, воспалительных процессов, новообразований, то не следует исключать отрицательное воздействие тоцилизумаба, к примеру, на противоинфекционную или противоопухолевую защиту организма.
При ревматоидном артрите (РА) терапевтический эффект наблюдается спустя 0,5 года при использовании дозы 8 мг/кг и возникает в отношении всех критериев АКР (Американская коллегия ревматологов), включая количество отекших суставов, оценка болевого синдрома, общее улучшение, данные опросника HAQ, анализ С-реактивного белка. Ответ на лечение возникает быстро – со ІІ недели и усиливается в течение всей терапии, сохраняясь более 1,5 года.
Исследования показали, что доза тоцилизумаба 8 мг/кг при проведении монотерапии и в комбинации с БПВП + Метотрексат, дает статистически значимое (р<0,0001) увеличение показателя гемоглобина на 24 неделе (наиболее выражено у пациентов, страдающих хронической анемией, сопровождающей РА).
После введения препарата происходит быстрое снижение острофазовых показателей, включая C-реактивный белок, СОЭ, сывороточный амилоид А, в пределах нормы снижается число тромбоцитов.
Фармакокинетические показатели
- Максимальная концентрация тоцилизумаба и величина дозы имеют прямо пропорциональную зависимость. Стандартная дозировка в 8 мг/кг в 4 недели дает Cmax 183 мкг/мл при низком коэффициенте кумуляции до 1,22. При низких концентрациях клиренс является нелинейным.
- Распределение: поступая в организм в/в тоцилизумаб подвергается двухфазному выведению из системного кровяного русла, при ревматоидном артрите объем распределения до 3,5 л, на периферии — до 2,91 л, при достижении равновесного состояния — 6,41 л.
- Элиминация: общий клиренс разделен на линейный — 12,5 мл/ч и нелинейный клиренс, который зависит от дозы и наиболее значим при низких концентрациях. Кажущийся период полувыведения, который зависит от концентрации тоцилизумаба для дозы 4 мг/кг в 4 недели составляет 11 суток, а для дозы 8 мг/кг в 4 недели — 13 суток.
Показания к применению
Лекарство Актемра назначают при ревматоидном артрите средней или высокой степени активности как монотерапию, либо в сочетании с Метотрексатом, а также с прочими ключевыми противовоспалительными препаратами.
Противопоказания
- инфекционные заболевания в активной фазе, включая туберкулез (необходимо провести исследования для выявления латентного туберкулеза);
- гиперчувствительность к любому компоненту Актемры;
- иммунизация живыми или живыми, но ослабленными вакцинами;
- беременные/кормящие грудью пациентки.
Возможное применение с осторожностью:
- при рецидивирующей инфекции, имеющейся в анамнезе;
- наличие сопутствующих заболеваний, которые могут привести к развитию инфекции, например: сахарный диабет, дивертикулит и пр.;
- заболевания печени, недостаточность печеночной функции;
- нейтропения.
Побочные действия
- Очень часто (у 1 пациента из 10) наблюдалось развитие инфекций верхних дыхательных путей, а также флегмоны, инфекций, вызванных Herpes simplex, Herpes zoster, дивертикулита.
- Встречались случаи возникновения язвы в ротовой полости, гастрита, стоматита.
- Системные нежелательные реакции со стороны эпидермиса проявлялись в виде сыпи, зуда, нечасто — крапивницы.
- Возможны головные боли, головокружение, повышение АД.
- Реакции гиперчувствительности.
Актемра, инструкция по применению (Способ и дозировка)
Стандартная дозировка
Водить следует в/в капельно дозу 8 мг/кг в течение 60 мин, не чаще чем раз в четыре недели.
Препарат Актемра рекомендовано разводить до 100 мл при помощи стерильного 0,9% раствора натрия хлорида с учетом соблюдения асептических условий.
Алгоритм приготовления раствора
- Отмерьте количество препарата, исходя из расчета 0,4 мл на 1 кг веса пациента.
- Отберите, используя одноразовый стерильный шприц, из инфузионного пакета (100 мл) 0,9% раствор натрия хлорида (стерильный и апирогенный) в соответствии с рассчитанным для введения количеством Актемры .
- Возьмите другой одноразовый стерильный шприц и, соблюдая асептические условия, отберите из флакона препарат Актемра, затем — введите его в инфузионный пакет с натрия хлоридом, получив в результате приготовленный раствор объемом равным 100 мл.
- Переворачивайте пакет, чтобы аккуратно перемешать раствор, избегайте пенообразования, проверьте содержимое на предмет отсутствия посторонних частиц либо изменений окраски. Внимание! Введению подлежат лишь бесцветные опалесцирующие либо светло-желтые, только что приготовленные растворы.
Перечень правил хранения приготовленного раствора
Не смотря на то, что приготовленный раствор является физически и химически стабильным первые 24 часа (температура не должна превышать + 2–8 °C), но с микробиологической точки зрения его необходимо вводить немедленно. В противном случае – последствия становятся ответственностью пользователя.
Передозировка
Был зафиксирован случай непреднамеренной передозировки препаратом. Пациент с множественной миеломой использовал дозу 40 мг/кг и нежелательных реакций не возникло. Здоровые добровольцы, согласившиеся однократно получить 28 мг/кг Актемры, столкнулись с развитием нейтропении, влияющей на снижение дозы.
Взаимодействие
- Актемра имеет клинически значимое влияние на изоферменты CYP (исключение: СYP2C19, CYP2D6), что необходимо учитывать при коррекции доз препаратов, являющихся субстратами для CYP450 и имеющих узкий терапевтический индекс.
- Концентрация Симвастатина (является субстратом СYP3A4) спустя 1 неделю после однократной дозы тоцилизумаба снижается на 57%.
- Терапия Актемрой требует тщательного наблюдения за пациентами, принимавшими ЛС, метаболизирующимися посредством таких изоферментов как CYP450 3A4, 1A2 и 2C9. К ним относятся: Аторвастатин, Теофиллин, БКК, Циклоспорин, Варфарин, фенитоин и бензодиазепины. Чтобы обеспечить терапевтический эффект вышеперечисленных препаратов, может понадобиться увеличение их дозировки. Кроме того, следует учитывать длительный период полувыведения Актемры, ведь влияние на активность изоферментов группы CYP450 может продолжаться несколько недель после отмены препарата.
Условия продажи
Актемра должна отпускаться по рецепту.
Условия хранения
Темнота, 2-8 °С (замораживать запрещено).
Дети не должны иметь доступ к флаконам с концентратом Актемра.
Срок годности
В оригинальной упаковке возможно хранение 2,5 года.
Детям
Не было получено данных о безопасности и эффективности использования тоцилизумаба у детей.
При беременности и лактации
Принято считать, что интерлейкин 6 не играет решающей роли во внутриутробном развитии или иммунной регуляции системы матери и плода, однако, взаимосвязь с использованием тоцилизумаба исключать нельзя.
Аналоги
Совпадения по коду АТХ 4-го уровня:
- Зенапакс (конц. для инф. р-ра, активное в-во даклизумаб);
- Иларис (порошок для инф. р-ра, активное в-во канакинумаб).
Отзывы об Актемре
Найти отзывы достаточно сложно. Многих интересует данный препарат и они пытаются его достать. Об Актемре было упомянуто на центральном телевидении как о новейшем прогрессивном средстве при ревматоидном артрите. Это достаточно дорогое ЛС нового поколения, на которое многие возлагают серьезные надежды.
Цена Актемры, где купить
Купить Актемру 4 мл возможно по цене — около 45000 рублей.
- Интернет-аптеки РоссииРоссия
ЛюксФарма* специальное предложение
-
Актемра (Тоцилизумаб) 200мг раствор для ин. 20мг/мл 10мл №1
-
Актемра (Тоцилизумаб) 80мг раствор для ин. 20мг/мл 4мл №1
-
Актемра раствор для инъекций 162мг/0,9мл №4
-
Актемра (Тоцилизумаб) 20мг/мл 20мл (400мг) №1
показать еще

05.09.2022
Описание препарата Актемра® (концентрат для приготовления раствора для инфузий, 20 мг/мл) основано на официальной инструкции, утверждено компанией-производителем в 2022 году
Дата согласования: 05.09.2022
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Концентрат для приготовления раствора для инфузий | 1 мл |
| действующее вещество: | |
| тоцилизумаб | 20 мг |
| вспомогательные вещества: полисорбат 80 — 0,5 мг; сахароза — 50,0 мг; натрия гидрофосфата додекагидрат — q.s.; натрия дигидрофосфата дигидрат — q.s.; вода для инъекций — q.s. |
Описание лекарственной формы
Прозрачная или опалесцирующая бесцветная или светло-желтого цвета жидкость.
Фармакологическое действие
Фармакологическое действие
—
иммунодепрессивное.
Фармакодинамика
Механизм действия
Тоцилизумаб — рекомбинантное гуманизированное моноклональное антитело к человеческому рецептору ИЛ-6 из подкласса иммуноглобулинов IgG1. Тоцилизумаб связывается и подавляет как растворимые, так и мембранные рецепторы ИЛ-6 (sIL-6R и mIL-6R). ИЛ-6 является многофункциональным цитокином, вырабатываемым различными типами клеток, и участвует в паракринной регуляции, системных физиологических и патологических процессах, таких как стимуляция секреции Ig, активация Т-клеток, стимуляция выработки белков острой фазы в печени и стимуляция гемопоэза. ИЛ-6 вовлечен в патогенез различных заболеваний, в том числе воспалительных заболеваний, остеопороза и новообразований.
Нельзя исключить вероятность отрицательного воздействия тоцилизумаба на противоопухолевую и противоинфекционную защиту организма. Роль ингибирования рецептора ИЛ-6 в развитии опухолей неизвестна.
У пациентов с коронавирусной инфекцией (COVID-19, COronaVIrus Disease 2019), получавших тоцилизумаб в дозе 8 мг/кг однократно, снижение показателя С-реактивного белка (СРБ) до нормальных значений наблюдалось уже на 7-й день.
Клиническая эффективность при ревматоидном артрите (РА)
Эффективность препарата у пациентов, получавших тоцилизумаб как в монотерапии, так и в комбинации с метотрексатом (МТ) или базисными противовоспалительными препаратами (БПВП), не зависела от наличия или отсутствия ревматоидного фактора, возраста, пола, расовой принадлежности, числа предшествующих курсов лечения или стадии заболевания. Ответ на терапию возникал быстро (уже на 2-й неделе), в дальнейшем усиливался и сохранялся более 3 лет.
У пациентов, получавших тоцилизумаб в дозе 8 мг/кг, существенно снижается индекс активности заболевания по шкале (Desease Activity Score, 28 суставов (DAS28) по сравнению с пациентами, получавшими плацебо + БПВП. Число пациентов, достигших клинической ремиссии (DAS28 <2,6) на 24-й неделе, было значительно больше в группе терапии тоцилизумабом (27,5–33,6%) по сравнению с контрольной группой (0,8–12,1%). К 52-й неделе терапии число пациентов, достигших DAS28 <2,6, увеличивается до 47% по сравнению с 33% на 24-й неделе терапии.
Хороший или удовлетворительный ответ по критериям EULAR отмечался чаще у пациентов, получавших тоцилизумаб, чем получавших плацебо + БПВП.
Через 2 года терапии тоцилизумабом/МТ у 14% пациентов наблюдался значительный клинический ответ (АКР 70 (критерии Американской Коллегии Ревматологов, АКР) сохранялся на протяжении 24 недель и более).
Рентгенологическая оценка. У 83% пациентов, получавших терапию тоцилизумабом/МТ в течение года, не зарегистрировано прогрессирования деструкции суставов (изменение суммарного индекса Шарпа равно нулю или менее) по сравнению с 67% пациентов, получавших плацебо/МТ. Данный результат сохранялся на протяжении 2 лет терапии. У 93% пациентов отсутствовало прогрессирование деструкции суставов.
Показатели качества жизни. У пациентов, получавших тоцилизумаб в дозе 8 мг/кг (монотерапия или в сочетании с БПВП), по сравнению с теми, кто получал MT/БПВП, наблюдалось клинически значимое улучшение функциональной активности (по индексу HAQ-DI), снижение утомляемости (по шкале функциональной оценки терапии хронических заболеваний по показателю утомляемости FACIT-Fatigue), а также улучшение как показателей физического, так и показателей психического здоровья по опроснику SF-36.
Лабораторные показатели. После введения тоцилизумаба происходит быстрое снижение средних значений острофазовых показателей, CРБ, СОЭ, сывороточного амилоида А и фибриногена, снижение числа тромбоцитов в пределах нормальных значений, а также увеличение гемоглобина, которое в наибольшей степени наблюдалось у пациентов с хронической анемией, связанной с РА.
Клиническая эффективность у пациентов с ранним ревматоидным артритом (рРА), ранее не получавших терапию МТ
При применении тоцилизумаба в монотерапии в дозе 8 мг/кг и тоцилизумаба в дозе 4 или 8 мг/кг каждые 4 недели в комбинации с МТ индекс активности заболевания по шкале DAS28 существенно снижается в группах, получавших тоцилизумаб в дозе 8 мг/кг, по сравнению с пациентами, получавшими монотерапию МТ. Число пациентов, достигших клинической ремиссии (DAS28 <2.6) на 24-й неделе, значительно больше в группах, получавших тоцилизумаб (38,7–44,8%), по сравнению с группой монотерапии МТ (15%). К 52-й неделе число пациентов, достигших DAS28 <2,6 в группах терапии тоцилизумабом, увеличивается до 39,4–49% по сравнению с 19,5% в группе монотерапии МТ. Число пациентов, достигших ответа АКР 20, 50, 70, также существенно выше в группах терапии тоцилизумабом (70,2–74,5; 47,6–56,9; 30,1–38,6% на 24-й неделе и 63–67,2; 49,3–55,9; 36–43,1% на 52-й неделе соответственно) по сравнению с группой монотерапии МТ (65,2; 43,2; 25,4% на 24-й неделе и 57,1; 40,8; 28,9% на 52-й неделе соответственно).
Рентгенологическая оценка. Отсутствие прогрессирования деструкции суставов (изменение суммарного индекса Шарпа равно нулю или менее) наблюдается у 82–83% пациентов, получавших тоцилизумаб в дозе 8 мг/кг в качестве монотерапии или в комбинации с МТ, по сравнению с 73% пациентов в группе монотерапии МТ.
Показатели качества жизни. Клинически значимое улучшение функциональной активности по индексу HAQ-DI наблюдается у пациентов, получавших тоцилизумаб в дозе 8 мг/кг в качестве монотерапии или в комбинации с МТ, по сравнению с теми, кто получал монотерапию МТ.
При монотерапии тоцилизумабом (в дозе 8 мг/кг в/в каждые 4 недели у пациентов с РА, c непереносимостью МТ или при нецелесообразности продолжения терапии МТ (в т.ч. при неадекватном ответе на терапию МТ) наблюдалось более выраженное статистически значимое снижение активности заболевания по шкале DAS28 по сравнению с монотерапией адалимумабом (в дозе 40 мг п/к каждые 2 недели). Количество пациентов, ответивших на терапию с показателями DAS28 <2,6 и DAS28 ≤3,2, было больше при терапии тоцилизумабом, чем при терапии адалимумабом (39,9 против 10,5% и 51,5 против 19,8% соответственно). Ответы АКР 20, 50, 70 наблюдались у 65, 47,2, 32,5% пациентов, получавших тоцилизумаб, по сравнению с 49,4, 27,8, 17,9% пациентов, получавших адалимумаб.
Клиническая эффективность при полиартикулярном ювенильном идиопатическом артрите (пЮИА)
Ответы АКР 30, 50, 70, 90 были получены у 89,4, 83,0, 62,2 и 26,1% пациентов соответственно. Доля пациентов с ответом АКР 30, 50, 70 на 40-й неделе терапии относительно показателей на начало терапии составила 74,4, 73,2 и 64,6% соответственно.
Клиническая эффективность при системном ювенильном идиопатическом артрите (сЮИА)
Эффективность тоцилизумаба для лечения активного сЮИА изучалась в 12-недельном рандомизированном двойном слепом плацебо- контролируемом периоде исследования с 2 параллельными группами. На 12-й неделе доля пациентов, достигших ответа АКР 30, 50, 70, 90 при ЮИА, также была больше в группе терапии тоцилизумабом, чем в группе плацебо: 90,7 против 24,3%, 85,3 против 10,8%, 70,7 против 8,1%, 37,3 против 5,4%, соответственно (р<0,0001). Ответ на терапию сохранялся и в открытом расширенном периоде исследования.
Системные эффекты. У 85% пациентов, имевших исходно лихорадку, через 12 недель терапии тоцилизумабом лихорадка отсутствовала по сравнению с 21% пациентов, получавших плацебо (р<0,0001). Кроме того, у 64% пациентов, имевших сыпь исходно, через 12 недель терапии тоцилизумабом сыпь отсутствовала по сравнению с 11% пациентов, получавших плацебо (р=0,0008).
Наблюдалось значимое снижение интенсивности болевого синдрома в группе терапии тоцилизумабом по сравнению с плацебо на 12-й неделе. Скорректированное среднее изменение оценки боли по визуальной аналоговой шкале (ВАШ) после 12 недель терапии тоцилизумабом соответствовало 41 пункту (от 0 до 100 пунктов) по сравнению с 1 пунктом у пациентов, получавших плацебо (р<0,0001). Системные эффекты сохранялись и в продолжающемся открытом расширенном периоде исследования.
Снижение дозы ГКС. У 8 из 31 пациента в группе плацебо и у 48 из 70 пациентов в группе тоцилизумаба, получавших ГКС исходно, наблюдался ответ АКР 70 при ЮИА на 6-й или 8-й неделе, что позволило снизить дозу ГКС. При этом 24% пациентов в группе тоцилизумаба и 3% пациентов в группе плацебо смогли снизить дозу ГКС как минимум на 20% без последующего снижения частоты ответа по критериям АКР 30 при ЮИА или без возникновения системных проявлений к 12-й неделе (р=0,028). Снижение дозы ГКС продолжилось, при этом 44 пациента не получали ГКС на 44-й неделе и ответы АКР не изменялись.
Показатели качества жизни. На 12-й неделе доля пациентов в группе тоцилизумаба, демонстрирующих минимальное клинически значимое улучшение показателя по опроснику CHAQ-DI (определенного как снижение индивидуального общего балла на ≥0,13), была значительно выше, чем доля пациентов в группе плацебо — 77% против 19% соответственно (р<0,0001). Ответы сохранялись и в продолжающемся открытом расширенном периоде исследования.
Лабораторные показатели. Исходно у 67% пациентов из группы тоцилизумаба содержание Hb было ниже нормального диапазона. У 80% из этих пациентов на 12-й неделе наблюдалось увеличение Hb в пределах нормального диапазона по сравнению с 7% пациентов в группе плацебо (р<0,0001). У 88% пациентов из группы тоцилизумаба, имевших исходно сниженное содержание Hb, его уровень увеличился на ≥10 г/л к 6-й неделе, в группе плацебо частота повышения составила 3% (р<0,0001).
Доля пациентов, имевших исходно тромбоцитоз и у которых на 12-й неделе наблюдалось нормальное число тромбоцитов, была выше в группе тоцилизумаба по сравнению с группой плацебо — 90 против 4% (р<0,0001).
После введения тоцилизумаба происходило быстрое снижение средних значений острофазовых показателей: CРБ, СОЭ и сывороточного амилоида А.
Клиническая эффективность при COVID-19
Исследование совместной исследовательской группы RECOVERY (рандомизированная оценка терапии по поводу COVID-19) у госпитализированных взрослых пациентов с диагнозом COVID-19. Исследование RECOVERY представляло собой крупномасштабное рандомизированное контролируемое открытое многоцентровое платформенное исследование, проведенное в Великобритании для оценки эффективности и безопасности потенциальных вариантов терапии у госпитализированных взрослых пациентов с тяжелой формой COVID-19. Все пациенты, подходящие для включения в исследование, получали стандартную терапию и прошли начальную (основную) рандомизацию. Пациенты, подходящие для включения в исследование, имели подозреваемую на основании клинических признаков или лабораторно подтвержденную инфекцию SARS-CoV-2 и не имели медицинских противопоказаний к применению любого из рассматриваемых в исследовании видов терапии. Пациенты с клиническими подтверждениями прогрессирующей инфекции COVID-19 (определяемыми как уровень сатурации крови кислородом (SpO2) <92% при дыхании атмосферным воздухом или получение терапии кислородом, а также уровень CРБ ≥75 мг/л) могли пройти вторую рандомизацию в группы, получавшие либо тоцилизумаб в/в, либо только стандартную терапию.
Анализы эффективности были проведены в популяции в соответствии с назначенным лечением (intent-to-treat, ITT), которая включала в себя 4116 рандомизированных пациентов: 2022 пациента были рандомизированы в группу, получавшую тоцилизумаб + стандартную терапию, 2094 пациента — в группу, получавшую только стандартную терапию. Исходные демографические характеристики и характеристики заболевания популяции ITT были надлежащим образом сбалансированы между группами терапии. Средний возраст участников составлял 63,6 года (стандартное отклонение (СО): 13,6 года). Большинство пациентов были мужского пола (67%) и относились к европеоидной расе (76%). Медиана (диапазон) значений уровня СРБ составляла 143 мг/л (75–982). На исходном уровне 0,2% (n=9) пациентов не получали дополнительный кислород, 45% пациентов требовалась низкопоточная кислородная терапия, 41% пациентов — высокопоточная кислородная терапия и 14% пациентов — инвазивная искусственная вентиляция легких (ИВЛ); 82% пациентов получали системные ГКС. Наиболее частыми сопутствующими заболеваниями были сахарный диабет (28,4%), заболевание сердца (22,6%) и хроническая болезнь легких (23,3%).
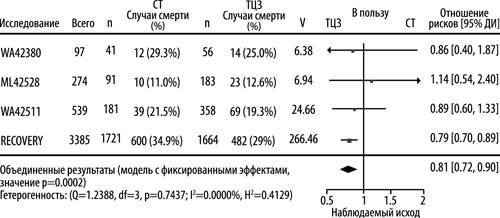
Первичным показателем исхода было время до момента смерти в период до дня 28-го. Отношение рисков, демонстрирующее сравнение группы, получавшей тоцилизумаб + стандартную терапию, с группой, получавшей только стандартную терапию, составило 0,85 (95% ДИ: от 0,76 до 0,94), статистически значимый результат (p=0,0028). Расчетные показатели вероятности смерти ко дню 28-му составили 30,7 и 34,9% в группах, получавших тоцилизумаб и только стандартную терапию, соответственно. Расчетная разность рисков составила -4,1% (95% ДИ: от -7,0 до -1,3%), что согласуется с результатами первичного анализа. Отношение рисков в заранее определенной подгруппе пациентов, получавших системные ГКС на исходном уровне, составляло 0,79 (95% ДИ: от 0,70 до 0,89), а в заранее определенной подгруппе пациентов, не получавших системные ГКС на исходном уровне, отношение рисков составило 1,16 (95% ДИ: от 0,91 до 1,48).
Медиана времени до выписки из стационара составляла 19 дней в группе, получавшей тоцилизумаб + стандартную терапию, и >28 дней в группе, получавшей стандартную терапию (отношение рисков (95% ДИ) = 1,22 (от 1,12 до 1,33).
Среди пациентов, которым не требовалась инвазивная ИВЛ на исходном уровне, доля пациентов, у которых появилась потребность в ИВЛ или наступила смерть ко дню 28-му, составляла 35% (619/1754) в группе, получавшей тоцилизумаб + стандартную терапию, и 42% (754/1800) в группе, получавшей только стандартную терапию (отношение рисков (95% ДИ) = 0,84 (от 0,77 до 0,92) p<0,0001).
Исследование ML42528 (EMPACTA). Исследование ML42528 представляло собой глобальное рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование III фазы по оценке эффективности и безопасности применения тоцилизумаба для в/в введения в комбинации со стандартной терапией у госпитализированных взрослых пациентов с пневмонией, ассоциированной с COVID-19, не находящихся на ИВЛ. Для включения в исследование подходили пациенты в возрасте по меньшей мере 18 лет, имевшие инфекцию SARS-CoV-2, подтвержденную положительным результатом теста методом полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР), имевшие пневмонию, подтвержденную результатами рентгенологического исследования, и уровень SpO2 <94% при дыхании атмосферным воздухом. Стандартная терапия могла включать в себя противовирусную терапию, применение системных ГКС в низких дозах и поддерживающую терапию. Пациенты были рандомизированы в соотношении 2:1 в группы, получавшие одну инфузию тоцилизумаба в дозе 8 мг/кг, при максимальной дозе 800 мг либо плацебо. Если клинические признаки или симптомы ухудшались или не улучшались, могла быть введена одна дополнительная инфузия тоцилизумаба или плацебо по слепой схеме через 8–24 часа после проведения первой инфузии.
Из 389 пациентов, которые были рандомизированы, анализы эффективности были проведены в модифицированной популяции в соответствии с назначенным лечением (modified intent-to-treat, mITT), которая включала в себя пациентов, получивших любое количество исследуемого лекарственного препарата (249 пациентов в группе тоцилизумаба; 128 пациентов в группе плацебо). Исходные демографические характеристики и характеристики заболевания были в целом сбалансированы между группами терапии. В популяции mITT (n=377) на момент рандомизации медиана возраста составляла 57 лет (диапазон: от 20 до 95); 59,2% пациентов были мужского пола, 56% пациентов имели испанское или латиноамериканское этническое происхождение, 52,8% пациентов принадлежали к европеоидной расе, 20,4% пациентов были американскими индейцами/представителями коренного населения Аляски, 15,1% пациентов были представителями негроидной расы/афроамериканцами и 1,6% пациентов были представителями монголоидной расы. На исходном уровне 35 (9,3%) пациентов не получали дополнительный кислород, 242 (64,2%) пациентам требовалась низкопоточная кислородная терапия и 100 (26,5%) пациентам — высокопоточная кислородная терапия. Медиана времени с момента возникновения симптомов составляла 8 дней. На исходном уровне в обеих группах терапии в совокупности 72,7% пациентов получали системные ГКС и 47,7% пациентов — ремдесивир. Значения медианы (диапазон) уровня СРБ и ферритина составляли соответственно 136,10 мг/л (2,5–3776,0) и 1,4 пмоль/мл (0,03–122,3). Наиболее частыми сопутствующими заболеваниями были артериальная гипертензия (48,3%), сахарный диабет (40,6%), гиперлипидемия (27,6%) и ожирение (24,4%).
Первичной конечной точкой оценки эффективности была совокупная доля пациентов, у которых появилась потребность в ИВЛ или наступила смерть ко дню 28-му. У пациентов, которые получали тоцилизумаб, наблюдалось статистически значимое улучшение в отношении времени до прогрессирования до ИВЛ или смерти в сравнении с пациентами, которые получали плацебо (значение p для логрангового критерия = 0,0360; ОР = 0,56 (95% ДИ: от 0,33 до 0,97). Совокупная доля пациентов, у которых появилась потребность в ИВЛ или наступила смерть ко дню 28-му (оценка с использованием метода Каплана-Мейера), составила 12,0% (95% ДИ: от 8,52 до 16,86%) в группе, получавшей тоцилизумаб, и 19,3% (95% ДИ: от 13,34 до 27,36%) в группе, получавшей плацебо.
Медиана времени до выписки из стационара либо «готовности к выписке» за период до дня 28-го составляла 6,0 дня в группе, получавшей тоцилизумаб, и 7,5 дня в группе, получавшей плацебо (ОР = 1,16 (95% ДИ: от 0,91 до 1,48).
Показатель смертности на день 28-й составлял 10,4% в группе, получавшей тоцилизумаб, в сравнении с 8,6% в группе, получавшей плацебо (взвешенная разница (группа тоцилизумаба — группа плацебо): 2,0% (95% ДИ: от -5,2 до 7,8%). Показатель смертности на день 60-й (ретроспективный анализ) составлял 11,2% в группе, получавшей тоцилизумаб, в сравнении с 10,9% в группе, получавшей плацебо (взвешенная разница (группа тоцилизумаба — группа плацебо): 0,5% (95% ДИ: от -6,9 до 6,8%).
Исследование WA42380 (COVACTA). Исследование WA42380 представляло собой глобальное рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование III фазы по оценке эффективности и безопасности применения тоцилизумаба для в/в введения в комбинации со стандартной терапией у взрослых пациентов, госпитализированных с тяжелой пневмонией, ассоциированной с COVID-19. Для включения в исследование подходили пациенты в возрасте, по меньшей мере, 18 лет, имевшие инфекцию SARS-CoV-2, подтвержденную положительным результатом теста методом ОТ-ПЦР, имевшие пневмонию, подтвержденную результатами рентгенологического исследования, и показатель SpO2 ≤93% при дыхании атмосферным воздухом либо отношение парциального давления кислорода в артериальной крови к фракции кислорода во вдыхаемом воздухе 300 мм рт.ст. или менее. Стандартная терапия могла включать в себя противовирусную терапию, применение ГКС в низких дозах, применение реконвалесцентной плазмы и другую поддерживающую терапию. Пациенты были рандомизированы в соотношении 2:1 в группы, получавшие одну инфузию тоцилизумаба в дозе 8 мг/кг при максимальной дозе 800 мг либо плацебо. Если клинические признаки или симптомы ухудшались или не улучшались, могла быть введена одна дополнительная инфузия тоцилизумаба или плацебо по слепой схеме, через 8–24 часа после проведения первой инфузии.
Из 452 пациентов, которые были рандомизированы, анализы эффективности были проведены в популяции mITT, которая включала в себя пациентов, получивших любое количество исследуемого лекарственного препарата (294 пациента в группе тоцилизумаба; 144 пациента в группе плацебо). Исходные демографические характеристики и характеристики заболевания были в целом сбалансированы между группами терапии. Для популяции mITT в целом (n=438) на момент рандомизации медиана возраста составляла 62 года (диапазон: 22–96, при этом 44,3% пациентов были в возрасте от 65 лет или старше); 69,9% пациентов были мужского пола, 32,2% пациентов были испанского или латиноамериканского этнического происхождения, 57,5% пациентов принадлежали к европеоидной расе, 15,1% пациентов были представителями негроидной расы/афроамериканцами и 8,7% пациентов были представителями монголоидной расы. На исходном уровне 3,4% пациентов не получали дополнительный кислород, 27,9% пациентов получали низкопоточную кислородную терапию, 30,4% пациентов находились на неинвазивной ИВЛ или получали высокопоточную кислородную терапию и 38,4% пациентов находились на инвазивной ИВЛ. Медиана времени с момента возникновения симптомов составляла 11,0 дней. На исходном уровне в обеих группах терапии в совокупности 22,4% пациентов получали системные ГКС и 5,7% пациентов — ремдесивир. Значения медианы (диапазон) уровня ИЛ-6, СРБ и ферритина составляли соответственно 85,8 нг/л (3,1–4020), 155,15 мг/л (1,1–99,6) и 2,20 пмоль/мл (0,0–75,3). Наиболее частыми сопутствующими заболеваниями были артериальная гипертензия (62,1%), сахарный диабет (38,1%), нарушения со стороны сердечно-сосудистой системы (28,1%) и ожирение (20,5%).
Первичной конечной точкой для оценки эффективности был клинический статус в день 28-й, оцениваемый с использованием порядковой шкалы со следующими 7 категориями:
1. Выписан из стационара (либо «готов к выписке», что определяется как достижение нормальной температуры тела и частоты дыхания, а также стабильного SpO2 при дыхании атмосферным воздухом или при использовании ≤2 л дополнительного кислорода).
2. В общей палате (или «готов к переводу в общую палату»), без потребности в дополнительном кислороде.
3. В общей палате (или «готов к переводу в общую палату»), требуется дополнительный кислород.
4. В отделении интенсивной терапии или в общей палате, требуется неинвазивная вентиляция легких или высокопоточная кислородная терапия.
5. В отделении интенсивной терапии, требуется интубация или ИВЛ.
6. В отделении интенсивной терапии, требуется экстракорпоральная мембранная оксигенация (ЭКМО) или ИВЛ и дополнительная поддержка органов (например, применение вазопрессорных препаратов, заместительная почечная терапия).
7. Смерть.
При сравнении группы, получавшей тоцилизумаб, с группой, получавшей плацебо, не было выявлено статистически значимого различия в распределении оценок клинического статуса по порядковой шкале с 7 категориями в день 28-й. Медианой категории клинического статуса в день 28-й была категория 1,0 в группе, получавшей тоцилизумаб, и 2,0 в группе, получавшей плацебо (отношение шансов (ОШ) 1,19 (95% ДИ: 0,81, 1,76).
Медиана времени до выписки из стационара либо «готовности к выписке» за период до дня 28-го составляла 20 дней в группе, получавшей тоцилизумаб, и 28 дней в группе, получавшей плацебо (ОР = 1,35 (95% ДИ: от 1,02 до 1,79).
Показатель смертности на день 28-й составлял 19,7% в группе, получавшей тоцилизумаб, в сравнении с 19,4% в группе, получавшей плацебо (взвешенная разница (группа тоцилизумаба — группа плацебо): 0,3% (95% ДИ: от -7,6 до 8,2). Показатель смертности на день 60-й составлял 24,5% в группе, получавшей тоцилизумаб, в сравнении с 25,0% в группе, получавшей плацебо (взвешенная разница (группа тоцилизумаба — группа плацебо): -0,5% (95% ДИ: от -9,1 до 8,0).
Исследование WA42511 (REMDACTA). Исследование WA42511 представляло собой глобальное рандомизированное двойное слепое плацебо-контролируемое многоцентровое исследование III фазы, проведенное с целью оценки эффективности и безопасности применения тоцилизумаба для в/в введения в комбинации с ремдесивиром в сравнении с соответствующим плацебо в комбинации с ремдесивиром у госпитализированных взрослых пациентов с тяжелой пневмонией, ассоциированной с COVID-19. Для включения в исследование подходили пациенты в возрасте по меньшей мере 12 лет с подтвержденной инфекцией SARS-CoV-2, включая положительный результат теста методом полимеразной цепной реакции (ПЦР), и пневмонией, подтвержденной результатами рентгенологического исследования, которым требовался дополнительный кислород в количестве >6 л/мин для поддержания уровня SpO2 >93%. Пациенты были рандомизированы в соотношении 2:1 в группы, получавшие по слепой схеме либо тоцилизумаб + ремдесивир, либо соответствующее плацебо + ремдесивир. Исследуемую терапию применяли в комбинации со стандартной терапией в соответствии с локальными руководствами (например, ГКС, поддерживающая терапия). Пациенты, распределенные в группу лечения комбинацией тоцилизумаб + ремдесивир, получили одну инфузию тоцилизумаба в дозе 8 мг/кг, при максимальной дозе 800 мг, а пациенты, распределенные в группу лечения комбинацией плацебо + ремдесивир, получили одну инфузию плацебо. В обеих группах в случаях, если клинические признаки или симптомы ухудшались или не улучшались, могла быть введена одна дополнительная инфузия тоцилизумаба или плацебо по слепой схеме, через 8–24 часа после проведения первой инфузии.
Из 649 пациентов, которые были рандомизированы, анализы эффективности были проведены в популяции mITT, которая включала в себя пациентов, получивших любое количество тоцилизумаба/плацебо (430 пациентов в группе лечения комбинацией тоцилизумаб + ремдесивир; 210 пациентов в группе лечения комбинацией плацебо + ремдесивир). Исходные демографические характеристики и характеристики заболевания были в целом сбалансированными между группами терапии. Для популяции mITT в целом (n=640) на момент рандомизации медиана возраста составляла 60 лет (диапазон: от 20 до 93 лет, при этом 38,3% пациентов были в возрасте от 65 лет или старше); 63,3% пациентов были мужского пола, 51,6% пациентов были испанского или латиноамериканского этнического происхождения, 67% пациентов принадлежали к европеоидной расе, 10,9% пациентов были представителями негроидной расы/афроамериканцами и 3,4% пациентов были представителями монголоидной расы. На исходном уровне 6,6% пациентов получали низкопоточную кислородную терапию, 79,8% пациентов находились на неинвазивной ИВЛ или получали высокопоточную кислородную терапию и 13,6% пациентов находились на инвазивной ИВЛ. Медиана времени с момента возникновения симптомов составляла 8 дней. На исходном уровне большинство пациентов получали ГКС (84,2% во всех группах терапии в совокупности). Значения медианы (диапазон) уровня СРБ и ферритина составляли 98,20 мг/л (1,3–418,3) и 2,13 пмоль/мл (0,1–30,8) соответственно. Наиболее частыми сопутствующими заболеваниями были артериальная гипертензия (61,7%), сахарный диабет (39,5%) и ожирение (27%).
Первичной конечной точкой для оценки эффективности было время с момента рандомизации до выписки из стационара либо «готовности к выписке» за период до дня 28-го. Не было выявлено статистически значимой разницы между группами терапии в отношении времени до выписки из стационара либо «готовности к выписке» за период до дня 28-го (ОР: 0,965 (95% ДИ: от 0,78 до 1,19) или времени до начала использования ИВЛ или смерти за период до дня 28-го (ОР: 0,980 (95% ДИ: от 0,72 до 1,34).
Показатель смертности на день 28-й составлял 18,1% в группе, получавшей тоцилизумаб, в сравнении с 19,5% в группе, получавшей плацебо (взвешенная разница (группа тоцилизумаба — группа плацебо): -1,3% (95% ДИ: от -7,8 до 5,2%). Показатель смертности на день 60-й составлял 22,6% в группе, получавшей тоцилизумаб, в сравнении с 25,7% в группе, получавшей плацебо (взвешенная разница (группа тоцилизумаба — группа плацебо): -3,0% (95% ДИ: от -10,1 до 4%).
Метаанализ по результатам исследований RECOVERY, EMPACTA (исследование ML42528), COVACTA (исследование WA42380) и REMDACTA (исследование WA42511) для пациентов, получавших терапию системными ГКС на исходном уровне. Метаанализ на уровне исследований был проведен по результатам 3 исследований компании Рош и исследования RECOVERY. Для каждого исследования была введена оценка ОР для времени до момента смерти за период до дня 28-го в подгруппе пациентов, получавших системные кортикостероиды на исходном уровне (тоцилизумаб — 597 пациентов и плацебо — 313 пациентов из исследований компании Рош; тоцилизумаб — 1664 пациента и стандартная терапия — 1721 пациент из исследования RECOVERY).
Комбинированный показатель ОР указывал на то, что терапия тоцилизумабом (n=2261) приводила к относительному уменьшению на 19% риска смерти за период до дня 28-го (ОР = 0,81; 95% ДИ: 0,72, 0,90; p=0,0002) в сравнении со стандартной терапией (n=2034).
Отношение рисков Кокса для исследований компании Рош. Логранговый показатель O-E для исследования RECOVERY, в котором значение ОР было вычислено путем принятия In(ОР) равным (O-E)/V при нормальной дисперсии 1/V.
Модель с фиксированными эффектами, в которую In(ОР) был включен в качестве ответа и V – в качестве весов для оценки объединенного эффекта.
CT = стандартная терапия, ТЦЗ = тоцилизумаб
Источник данных компании Рош: root/clinical_studies/R04877533/share/pool_COVID19/prod/outdata_vad.
Рисунок 1. Метаанализ времени до момента смерти за период до дня 28-го в субпопуляции пациентов, получавших кортикостероиды на исходном уровне.
Доклинические данные безопасности
Канцерогенность. Исследования по изучению канцерогенности тоцилизумаба не проводились. Имеющиеся доклинические данные демонстрируют вклад плейотропного ИЛ-6 в прогрессирование злокачественных новообразований и устойчивость к апоптозу при различных формах рака. Эти данные не предполагают, что лечение тоцилизумабом приводит к существенному риску развития и прогрессирования рака.
Мутагенность. Стандартные генотоксические тесты как в прокариотических, так и в эукариотических клетках были отрицательными.
Влияние на фертильность. Имеющиеся доклинические данные не предполагают влияния аналогов тоцилизумаба на фертильность. В исследованиях по изучению хронической токсичности у яванских макак и у самок или самцов мышей с недостаточностью ИЛ-6 отрицательного влияния тоцилизумаба на эндокринные или репродуктивные органы не обнаружено.
Тератогенность. Не обнаружено прямого или опосредованного неблагоприятного влияния на беременность или внутриутробное развитие при в/в введении тоцилизумаба яванским макакам на ранних сроках гестационного периода.
Прочее. Отмечалось незначительное увеличение случаев спонтанного выкидыша/ внутриутробной гибели плода при высоком уровне системного кумулятивного воздействия (более чем в 100 раз превышающего таковое у человека) при введении дозы 50 мг/кг/сутки в сравнении с плацебо или меньшим уровнем вводимых доз. Частота выкидыша была в пределах исторического контроля для яванских макак, содержащихся в неволе; отдельные случаи выкидыша/внутриутробной гибели не демонстрировали какой-либо взаимосвязи между данными явлениями и дозой или продолжительностью введения тоцилизумаба.
Несмотря на то что ИЛ-6, по-видимому, не играет решающей роли в развитии плода или иммунологической регуляции системы «мать—плод», взаимосвязь этих явлений с введением тоцилизумаба не может быть исключена.
Наблюдалась экскреция мышиного аналога тоцилизумаба в молоко лактирующих мышей.
Применение мышиного аналога тоцилизумаба не оказывало токсичного действия на ювенильных мышей. В частности, не наблюдалось нарушения роста скелета, иммунной функции и полового развития.
Фармакокинетика
Фармакокинетика (ФК) тоцилизумаба характеризуется нелинейным выведением, представляющим комбинацию линейного клиренса и выведения по Михаэлис-Ментен. Нелинейная часть выведения тоцилизумаба приводит к более чем дозозависимому увеличению экспозиции. Фармакокинетические параметры тоцилизумаба не меняются с течением времени. Так как общий клиренс зависит от концентрации тоцилизумаба в сыворотке, T1/2 тоцилизумаба также является зависимым от его концентрации и может быть рассчитан только при наличии значения сывороточной концентрации. Популяционный ФК-анализ, проведенный во всех популяциях пациентов, не выявил связи между кажущимся клиренсом и наличием антител к тоцилизумабу.
Ревматоидный артрит (РА)
ФК тоцилизумаба сопоставима у здоровых добровольцев и пациентов с РА.
Таблица 1
Прогнозируемые средние ФК-параметры (± стандартное отклонение, СО) тоцилизумаба при равновесном состоянии у пациентов с РА
| Параметр тоцилизумаба | 4 мг/кг 1 раз в четыре недели | 8 мг/кг 1 раз в четыре недели |
| Максимальная концентрация (Cmax), мкг/мл | 83,8 ± 23,1 | 182 ± 50,4 |
| Минимальная концентрация (Ctrough), мкг/мл | 0,5 ± 1,5 | 15,9 ± 13,1 |
| Средняя концентрация (Cmean), мкг/мл | 17,8 ± 6,1 | 56,6 ± 19,3 |
| Кумулятивная Cmax | 1,01 | 1,09 |
| Кумулятивная Ctrough | 2,62 | 2,47 |
| Кумулятивная Cmeanили площадь под кривой «концентрация-время» (AUCτ)* | 1,09 | 1,32 |
*На протяжении 4 недель.
При высоких значениях концентрации тоцилизумаба в сыворотке линейный клиренс преобладает над общим клиренсом тоцилизумаба и конечный T1/2 составляет приблизительно 21,5 дней (на основе приблизительных параметров популяции пациентов). В то время как после в/в введения Cmax дозозависимо увеличивается между дозами 4 и 8 мг/кг каждые 4 недели, более чем дозозависимое увеличение наблюдалось для Cmean и Ctrough. В равновесном состоянии значения Cmean и Ctrough были в 3,2 и 32 раза выше при применении тоцилизумаба в дозе 8 мг/кг по сравнению с дозой 4 мг/кг соответственно.
Коэффициенты накопления AUC и Cmax после многократного применения тоцилизумаба в дозах 4 и 8 мг/кг каждые 4 недели были ниже, чем коэффициенты накопления Ctrough (2,62 и 2,47), благодаря участию нелинейного клиренса при более низких концентрациях тоцилизумаба.
Более 90% равновесного состояния при Cmax достигается после первой в/в инфузии; 90% равновесное состояние при AUCτ и Cmean достигается после первой и третьей в/в инфузии тоцилизумаба в дозе 4 и 8 мг/кг, соответственно; приблизительно 90% равновесное состояние при Ctrough достигается после четвертой в/в инфузии тоцилизумаба.
Масса тела является значимым фактором, влияющим на ФК тоцилизумаба. При в/в инфузии, рассчитанной в мг/кг, у пациента с массой тела ≥100 кг ожидается более высокая средняя экспозиция в равновесном состоянии по сравнению со средним значением в популяции пациентов. Таким образом, не рекомендуется увеличение дозы препарата выше 800 мг на одну инфузию у пациентов с массой тела ≥100 кг (см. «Способ применения и дозы»).
Полиартикулярный ювенильный идиопатический артрит (пЮИА)
После в/в применения приблизительно 90% равновесное состояние достигается к 12-й неделе при введении в дозе 10 мг/кг (масса тела <30 кг) и к 16-й неделе при введении в дозе 8 мг/кг (масса тела ≥30 кг).
Таблица 2
Прогнозируемые средние ФК-параметры (± стандартное отклонение, СО) тоцилизумаба при равновесном состоянии у пациентов с пЮИА
| Параметр тоцилизумаба | 8 мг/кг 1 раз в четыре недели (масса тела ≥30 кг) | 10 мг/кг 1 раз в четыре недели (масса тела <30 кг) |
| Максимальная концентрация (Cmax), мкг/мл | 183 ± 42,3 | 168 ± 24,8 |
| Минимальная концентрация (Ctrough), мкг/мл | 6,55 ± 7,93 | 1,47 ± 2,44 |
| Средняя концентрация (Cmean), мкг/мл | 42,2 ± 13,4 | 31,6 ± 7,84 |
| Кумулятивная Cmax | 1,04 | 1,01 |
| Кумулятивная Ctrough | 2,22 | 1,43 |
| Кумулятивная Cmeanили площадь под кривой «концентрация-время» (AUCτ)* | 1,16 | 1,05 |
*На протяжении 4 недель.
Системный ювенильный идиопатический артрит (сЮИА)
После в/в применения приблизительно 90% равновесное состояние достигается к 8-й неделе при введении в дозе 12 и 8 мг/кг 1 раз в 2 недели.
Таблица 3
Прогнозируемые средние ФК-параметры (± СО) тоцилизумаба при равновесном состоянии у пациентов с сЮИА
| Параметр тоцилизумаба | 8 мг/кг 1 раз в 2 недели (масса тела ≥30 кг) | 10 мг/кг 1 раз в 2 недели (масса тела <30 кг) |
| Cmax, мкг/мл | 256 ± 60,8 | 274 ± 63,8 |
| Ctrough, мкг/мл | 69,7 ± 29,1 | 68,4 ± 30,0 |
| Cmean, мкг/мл | 119 ± 36,0 | 123 ± 36,0 |
| Кумулятивная Cmax | 1,42 | 1,37 |
| Кумулятивная Ctrough | 3,20 | 3,41 |
| Кумулятивная Cmean или площадь под кривой «концентрация-время» (AUCτ)* | 2,01 | 1,95 |
*На протяжении 2 недель
ФК-параметры тоцилизумаба у пациентов в возрасте до 2 лет были сопоставимы с ФК-параметрами у пациентов старше 2 лет с массой тела <30 кг при в/в применении тоцилизумаба (в дозе 12 мг/кг каждые 2 недели).
COVID-19
Фармакокинетику тоцилизумаба у взрослых пациентов с COVID-19 оценивали в исследованиях WA42380 (COVACTA) и CA42481 (MARIPOSA) посредством популяционного ФК-анализа, в который было включено 380 взрослых пациентов. Пациенты получали 1 или 2 в/в инфузии тоцилизумаба в дозе 8 мг/кг, которые вводили с интервалом как минимум 8 часов.
Таблица 4
Расчетные средние (±СО) ФК-параметры после в/в введения тоцилизумаба в дозе 8 мг/кг
| Параметр фармакокинетики тоцилизумаба | 8 мг/кг | |
| Одна доза | Две дозы | |
| Cmax, мкг/мл | 154 (34,9) | 296 (64,7) |
| Cдень 28-й, мкг/мл | 0,934 (1,93) | 8,94 (8,5) |
В ходе популяционного ФК-анализа масса тела и тяжесть заболевания были определены как значимые ковариаты, которые оказывают влияние на ФК тоцилизумаба. При режиме дозирования тоцилизумаба 8 мг/кг и максимальной дозой 800 мг в рамках отдельной категории порядковой шкалы (ПШ) у пациентов с массой тела менее 60 кг экспозиция была на 20% ниже, по сравнению с пациентами со средней массой тела 80 кг. Экспозиция у пациентов с массой тела более 100 кг находилась в том же диапазоне экспозиций, что и у пациентов со средней массой тела 80 кг. Для пациента с массой тела 80 кг экспозиция снижалась с увеличением тяжести заболевания, для каждой последующей категории ПШ экспозиция соответственно снижалась на 13%.
Распределение
После в/в введения тоцилизумаб претерпевает двухфазное выведение из системного кровотока. У пациентов с РА объем распределения в центральной камере составляет 3,5 л, в периферической камере — 2,9 л, а объем распределения в равновесном состоянии составляет 6,4 л.
У детей с пЮИА объем распределения в центральной камере составляет 1,98 л, в периферической камере — 2,1 л, а объем распределения в равновесном состоянии — 4,08 л.
У детей с сЮИА объем распределения в центральной камере составляет 1,87 л, в периферической камере — 2,14 л, а объем распределения в равновесном состоянии — 4,01 л.
У взрослых пациентов с COVID-19 объем распределения в центральной камере составляет 4,52 л, в периферической камере — 4,23, таким образом, объем распределения — 8,75 л.
Выведение
Общий клиренс тоцилизумаба зависит от концентрации и представляет собой сумму линейного и нелинейного клиренса. Линейный клиренс составляет 12,5 мл/ч у пациентов с РА, 5,8 мл/ч у детей с пЮИА и 5,7 мл/ч у детей с сЮИА. Нелинейный клиренс, зависящий от концентрации, имеет наибольшее значение при низких концентрациях тоцилизумаба. При более высоких концентрациях тоцилизумаба преобладает линейный клиренс в связи с насыщением пути нелинейного клиренса. Так как общий клиренс зависит от сывороточной концентрации тоцилизумаба, T1/2 тоцилизумаба также является зависимым от его концентрации и может быть рассчитан только при наличии значения сывороточной концентрации.
При РА зависимый от концентрации кажущийся T1/2 для тоцилизумаба в равновесном состоянии в дозе 4 мг/кг один раз в 4 недели составляет до 11 дней, а для тоцилизумаба в дозе 8 мг/кг один раз в 4 недели — до 13 дней. При высоких значениях концентрации тоцилизумаба в сыворотке линейный клиренс преобладает над общим клиренсом тоцилизумаба и конечный T1/2 составляет приблизительно 21,5 дней (на основе приблизительных параметров популяции пациентов).
У детей с пЮИА эффективный T1/2 тоцилизумаба в равновесном состоянии (между введениями в дозе 8 мг/кг для детей с массой тела ≥30 кг или в дозе 10 мг/кг для детей с массой тела <30 кг) составляет до 17 дней.
У детей с сЮИА эффективный T1/2 тоцилизумаба в равновесном состоянии (между введениями в дозе 8 и 12 мг/кг) составляет до 16 дней.
У взрослых пациентов с COVID-19 сывороточные концентрации были ниже предела количественного определения по прошествии 35 дней (в среднем) после введения одной инфузии тоцилизумаба в дозе 8 мг/кг. Средний линейный клиренс в популяционном ФК-анализе составил 17,6 мл/ч у пациентов с категорией 3 ПШ (пациенты, которым требуется поддерживающая терапия кислородом) на исходном уровне, 22,5 мл/ч у пациентов с категорией 4 ПШ (пациенты, которым требуется высокопоточная кислородная терапия или неинвазивная вентиляция легких) на исходном уровне, 29 мл/ч у пациентов с категорией 5 ПШ (пациенты, которым требуется ИВЛ) на исходном уровне, 35 мл/ч у пациентов с категорией 6 ПШ (пациенты, которым требуется ЭКМО или ИВЛ и дополнительная поддержка органов) на исходном уровне.
ФК у особых групп пациентов
Пациенты с печеночной недостаточностью. ФК тоцилизумаба у пациентов с печеночной недостаточностью не изучалась.
Пациенты с почечной недостаточностью. Специальных исследований у пациентов с почечной недостаточностью не проводилось. У большинства пациентов с РА, учтенных в популяционном ФК-анализе, была нормальная функция почек или нарушение функции почек легкой степени тяжести (расчетный клиренс креатинина по формуле Кокрофта-Голта), которое не влияло на фармакокинетику тоцилизумаба. Коррекции дозы тоцилизумаба пациентам с нарушением функции почек легкой степени тяжести не требуется.
Пол, раса, пожилой возраст. Популяционный ФК-анализ у взрослых пациентов с РА показал, что возраст, пол и раса не влияют на ФК тоцилизумаба. Коррекции дозы тоцилизумаба не требуется.
Показания
ревматоидный артрит со средней или высокой степенью активности у взрослых как в виде монотерапии, так и в комбинации с MT и/или с другими базисными противовоспалительными препаратами (БПВП), в т.ч. для торможения рентгенологически доказанной деструкции суставов;
активный полиартикулярный ювенильный идиопатический артрит у пациентов в возрасте 2 лет и старше как в виде монотерапии, так и в комбинации с МТ;
активный системный ювенильный идиопатический артрит у пациентов в возрасте 2 лет и старше как в виде монотерапии, так и в комбинации с МТ;
лечение новой коронавирусной инфекции (COVID-19) у госпитализированных взрослых пациентов, получающих системные ГКС, которым требуется поддерживающая терапия кислородом или ИВЛ.
Противопоказания
гиперчувствительность к тоцилизумабу, любому компоненту препарата в анамнезе;
активные инфекционные заболевания (в т.ч. туберкулез), за исключением COVID-19;
комбинация с ингибиторами ФНО-альфа или применение в течение 1 месяца после лечения анти-ФНО-антителами;
повышение активности печеночных ферментов в ≥10 раз от ВГН; абсолютное число нейтрофилов (АЧН) <1·109/л; число тромбоцитов <50·103/мкл (COVID-19).
детский возраст до 2 лет для пациентов с полиартикулярным ювенильным идиопатическим артритом и системным ювенильным идиопатическим артритом.
детский возраст до 18 лет для пациентов с ревматоидным артритом;
детский возраст до 18 лет для пациентов с новой коронавирусной инфекцией (COVID-19) (данные отсутствуют).
С осторожностью: рецидивирующие или хронические инфекции в анамнезе, а также сопутствующие заболевания (например, дивертикулит, сахарный диабет и интерстициальное заболевание легких), предрасполагающие к развитию инфекций; язвенное поражение органов ЖКТ или дивертикулит в анамнезе; активное заболевание печени или печеночная недостаточность; показатели АЛТ или АСТ, превышающие ВГН более чем в 1,5 раза; уровень тромбоцитов ниже 100·103/мкл.
Применение при беременности и кормлении грудью
Беременность. Безопасность и эффективность применения препарата Актемра® при беременности изучены недостаточно. Исследования у обезьян не обнаружили дисморфогенетического потенциала препарата Актемра®. Однако при введении препарата в высоких дозах обнаружен повышенный риск спонтанного выкидыша/внутриутробной гибели. Значение данной информации для людей не известно (см. «Фармакодинамика»). Не следует применять тоцилизумаб во время беременности, за исключением тех случаев, когда имеется очевидная клиническая необходимость.
Период грудного вскармливания. Неизвестно, выводится ли препарат Актемра® с грудным молоком у человека. Несмотря на выделение эндогенных IgG в грудное молоко, системная абсорбция препарата при грудном вскармливании маловероятна в связи с быстрой протеолитической деградацией таких белков в системе пищеварения. При принятии решения о продолжении/прерывании кормления грудью или продолжении/отмене терапии тоцилизумабом следует принимать во внимание пользу от грудного вскармливания для ребенка и пользу от продолжения терапии для матери.
Способ применения и дозы
Лечение должны назначать медицинские специалисты, имеющие опыт в постановке диагноза и терапии РА, COVID-19, сЮИА и пЮИА.
Препарат предназначен для введения как в амбулаторно-поликлинических, так и в стационарных условиях.
Стандартный режим дозирования
Ревматоидный артрит
Рекомендуемая доза составляет 8 мг/кг 1 раз в четыре недели.
Не рекомендуется увеличение дозы свыше 800 мг на одну инфузию пациентам с массой тела выше 100 кг (см. «Фармакокинетика»).
Рекомендации по коррекции дозы при изменении лабораторных показателей (см. «Особые указания»)
— Повышение активности печеночных ферментов
| Значение показателя | Коррекция лечения |
| Превышение ВГН в >1–3 раза | При необходимости провести коррекцию дозы одновременно назначаемого МТ/БПВП. При устойчивом повышении активности трансаминаз в этом диапазоне снизить дозу препарата Актемра® до 4 мг/кг или прервать лечение препаратом до нормализации показателей АЛТ или АСТ. Возобновить лечение препаратом в дозе 4 или 8 мг/кг в соответствии с клинической необходимостью |
| Превышение ВГН в >3–5 раз (подтвержденное при повторном исследовании, см. «Особые указания») | Прервать лечение препаратом Актемра® до снижения показателя до уровня, менее чем в 3 раза превышающего ВГН; далее следовать рекомендациям для превышения ВГН в >1–3 раза. Прекратить лечение препаратом Актемра® при устойчивом повышении показателя, превышающем ВГН более чем в 3 раза |
| Превышение ВГН более чем в 5 раз | Прекратить лечение препаратом Актемра® |
— Низкое АЧН
Пациентам, ранее не получавшим лечение препаратом Актемра®, не рекомендуется начинать применение препарата при показателе АЧН ниже 2·109/л.
| Значение показателя (число клеток ·109/л) | Коррекция лечения |
| АЧН >1 | Дозу не изменять |
| АЧН 0,5–1 | Прервать лечение препаратом Актемра®. При увеличении показателя до >1·109/л возобновить лечение препаратом в дозе 4 мг/кг и увеличить дозу до 8 мг/кг в соответствии с клинической необходимостью |
| АЧН <0,5 | Прекратить лечение препаратом Актемра® |
— Низкое число тромбоцитов
| Значение показателя (число клеток ·103/мкл) | Коррекция лечения |
| 50–100 | Прервать лечение препаратом Актемра®. При увеличении показателя >100·103/мкл возобновить лечение препаратом в дозе 4 мг/кг и увеличить дозу до 8 мг/кг в соответствии с клинической необходимостью |
| <50 | Прекратить лечение препаратом Актемра® |
COVID-19
Рекомендуемая доза для лечения COVID-19 составляет 8 мг/кг в виде однократной в/в инфузии в течение 60 минут у пациентов, получающих системные ГКС и которым требуется поддерживающая терапия кислородом или ИВЛ (см. «Фармакодинамика»).
Если клинические признаки или симптомы ухудшаются или не улучшаются после введения одной инфузии, можно ввести дополнительную инфузию препарата Актемра® в дозе 8 мг/кг через, как минимум, 8 часов после первой инфузии.
Не рекомендуется увеличение дозы свыше 800 мг на одну инфузию пациентам с массой тела более 100 кг (см. «Фармакокинетика»).
Применение препарата Актемра® не рекомендуется пациентам с COVID-19, у которых наблюдается любое из следующих отклонений в лабораторных показателях.
| Тип лабораторного исследования | Значение лабораторного показателя | Действие |
| Печеночные ферменты | ≥10·ВГН | Применение препарата Актемра®не рекомендуется |
| АЧН | <1·109/л | |
| Число тромбоцитов | <50·103/мкл |
Особые группы пациентов
Дети
сЮИА. Рекомендуемая доза у пациентов старше 2 лет составляет 8 мг/кг один раз в 2 недели у пациентов с массой тела ≥30 кг или 12 мг/кг один раз в 2 недели у пациентов с массой тела <30 кг. Дозу следует рассчитывать исходя из массы тела пациента при каждом введении препарата. Изменение дозы должно быть основано только на соответствующем изменении массы тела пациента с течением времени.
Безопасность и эффективность внутривенного введения препарата Актемра® у детей в возрасте до 2 лет не установлены.
У пациентов с сЮИА рекомендуется прерывание терапии тоцилизумабом при изменениях в лабораторных показателях, приведенных в таблицах ниже. При необходимости следует изменить дозу одновременно назначаемого МТ и/или других сопутствующих препаратов или прекратить их прием, а также прервать введение тоцилизумаба до оценки клинической ситуации. Решение о прекращении терапии тоцилизумабом при возникновении изменений в лабораторных показателях должно основываться на медицинской оценке состояния конкретного пациента, поскольку существует множество сопутствующих заболеваний, которые могут оказывать влияние на лабораторные показатели при сЮИА.
— Повышение активности печеночных ферментов
| Значение показателя | Коррекция лечения |
| Превышение ВГН в >1–3 раза | При необходимости провести коррекцию дозы одновременно назначаемого МТ. При устойчивом повышении активности трансаминаз в этом диапазоне прервать лечение препаратом до нормализации показателей АЛТ/АСТ |
| Превышение ВГН в >3–5 раз | При необходимости провести коррекцию дозы одновременно назначаемого МТ. Прервать лечение препаратом Актемра® до снижения показателя до уровня, менее чем в 3 раза превышающего ВГН; далее следовать рекомендациям для превышения ВГН в >1–3 раза |
| Превышение ВГН более чем в 5 раз | Прекратить лечение препаратом Актемра®. Решение о прекращении терапии препаратом Актемра® при сЮИА при возникновении изменений в лабораторных показателях должно основываться на медицинской оценке состояния конкретного пациента |
— Низкое АЧН
| Значение показателя (число клеток·109/л) | Коррекция лечения |
| АЧН >1 | Дозу не изменять |
| АЧН 0,5–1 | Прервать лечение препаратом Актемра®. При увеличении показателя до >1·109/л возобновить лечение препаратом Актемра® |
| АЧН <0,5 | Прекратить лечение препаратом Актемра®. Решение о прекращении терапии препаратом Актемра® при сЮИА в случае возникновения изменений в лабораторных показателях должно основываться на медицинской оценке состояния конкретного пациента |
— Низкое число тромбоцитов
| Значение показателя (число клеток ·103/мкл) | Коррекция лечения |
| 50–100 | При необходимости провести коррекцию дозы одновременно назначаемого МТ. Прервать лечение препаратом Актемра®. При увеличении показателя >100·103/мкл возобновить лечение препаратом Актемра® |
| <50 | Прекратить лечение препаратом Актемра®. Решение о прекращении терапии препаратом Актемра® при сЮИА в случае возникновения изменений в лабораторных показателях должно основываться на медицинской оценке состояния конкретного пациента |
Клинических данных недостаточно, чтобы оценить влияние снижения дозы тоцилизумаба у пациентов с сЮИА, у которых наблюдались изменения в лабораторных показателях.
Имеющиеся данные свидетельствуют о том, что клиническое улучшение наблюдается в течение 6 недель после начала лечения препаратом Актемра®. В случае, если у пациента не наблюдается улучшения в течение данного периода времени, целесообразность продолжения терапии должна быть тщательно пересмотрена.
пЮИА. Рекомендуемая доза у пациентов старше 2 лет составляет 8 мг/кг один раз в 4 недели у пациентов с массой тела ≥30 кг или 10 мг/кг один раз в 4 недели у пациентов с массой тела <30 кг. Дозу следует рассчитывать исходя из массы тела пациента при каждом введении препарата. Изменение дозы должно быть основано только на соответствующем изменении массы тела пациента с течением времени.
Безопасность и эффективность внутривенного введения препарата Актемра® у детей в возрасте до 2 лет не установлены.
У пациентов с пЮИА рекомендуется прерывание терапии тоцилизумабом при изменениях в лабораторных показателях, приведенных в таблицах ниже. При необходимости следует изменить дозу одновременно назначаемого МТ и/или других сопутствующих препаратов или прекратить их прием, а также прервать введение тоцилизумаба до оценки клинической ситуации. Поскольку существует множество сопутствующих заболеваний, которые могут оказывать влияние на лабораторные показатели при пЮИА, решение о прекращении терапии тоцилизумабом в случае возникновения изменений в лабораторных показателях должно основываться на медицинской оценке состояния конкретного пациента.
— Повышение активности печеночных ферментов
| Значение показателя | Коррекция лечения |
| Превышение ВГН в >1–3 раза | При необходимости провести коррекцию дозы одновременно назначаемого МТ. При устойчивом повышении активности трансаминаз в этом диапазоне прервать лечение препаратом до нормализации показателей АЛТ/АСТ |
| Превышение ВГН в >3–5 раз | При необходимости провести коррекцию дозы одновременно назначаемого МТ. Прервать лечение препаратом Актемра® до снижения показателя до уровня, менее чем в 3 раза превышающего ВГН; далее следовать рекомендациям для превышения ВГН в >1–3 раза |
| Превышение ВГН более чем в 5 раз | Прекратить лечение препаратом Актемра®. Решение о прекращении терапии препаратом Актемра® при пЮИА в случае возникновения изменений в лабораторных показателях должно основываться на медицинской оценке состояния конкретного пациента |
— Низкое АЧН
| Значение показателя (число клеток·109/л) | Коррекция лечения |
| АЧН >1 | Дозу не изменять |
| АЧН 0,5–1 | Прервать лечение препаратом Актемра®. При увеличении показателя до >1·109/л возобновить лечение препаратом Актемра® |
| АЧН <0,5 | Прекратить лечение препаратом Актемра®. Решение о прекращении терапии препаратом Актемра® при пЮИА в случае возникновения изменений в лабораторных показателях должно основываться на медицинской оценке состояния конкретного пациента |
— Низкое число тромбоцитов
| Значение показателя (число клеток·103/мкл) | Коррекция лечения |
| 50–100 | При необходимости провести коррекцию дозы одновременно назначаемого МТ. Прервать лечение препаратом Актемра®. При увеличении показателя >100·103/мкл возобновить лечение препаратом Актемра® |
| <50 | Прекратить лечение препаратом Актемра®. Решение о прекращении терапии препаратом Актемра® при пЮИА в случае возникновения изменений в лабораторных показателях должно основываться на медицинской оценке состояния конкретного пациента |
Возможность снижения дозы тоцилизумаба в связи с возникновением изменений в лабораторных показателях у пациентов с пЮИА не изучалась.
Имеющиеся данные свидетельствуют о том, что клиническое улучшение наблюдается в течение 12 недель после начала лечения препаратом Актемра®. Целесообразность продолжения терапии должна быть тщательно пересмотрена, если у пациента не наблюдается улучшения в течение данного периода времени.
Пациенты пожилого возраста. Коррекции дозы у пациентов пожилого возраста (≥65 лет) не требуется.
Пациенты с нарушением функции почек. Коррекции дозы у пациентов с нарушением функции почек легкой степени тяжести не требуется (см. ФК у особых групп пациентов). Применение тоцилизумаба у пациентов с умеренным и тяжелым нарушением функции почек не изучалось (см. ФК у особых групп пациентов).
Пациенты с нарушением функции печени. Безопасность и эффективность тоцилизумаба у пациентов с нарушением функции печени не изучались.
Способ применения
После разведения препарат Актемра® пациентам с РА, сЮИА, пЮИА и COVID-19 следует вводить в виде в/в инфузии в течение 1 часа.
Пациенты с РА, сЮИА, пЮИА и COVID-19 с массой тела ≥30 кг
Препарат Актемра®следует развести до объема 100 мл стерильным апирогенным раствором натрия хлорида 9 мг/мл (0,9%) с соблюдением правил асептики.
Инструкции по разведению лекарственного препарата перед введением представлены ниже.
Пациенты с сЮИА и пЮИА с массой тела <30 кг
Препарат Актемра®следует развести до объема 50 мл стерильным апирогенным раствором натрия хлорида 9 мг/мл (0,9%) с соблюдением правил асептики.
Инструкции по разведению лекарственного препарата перед введением представлены ниже.
При появлении у пациента признаков и симптомов инфузионной реакции следует уменьшить скорость инфузии или прекратить введение препарата и немедленно назначить соответствующие препараты/поддерживающую терапию (см. «Особые указания»).
Приготовление раствора лекарственного препарата
Препарат Актемра® должен вводиться медицинским персоналом. Препарат предназначен для введения как в амбулаторно-поликлинических, так и в стационарных условиях.
Препарат Актемра® в лекарственной форме для внутривенного введения не предназначен для подкожного введения!
Подготовка препарата к введению должна проводиться в асептических условиях.
Перед введением необходимо осмотреть приготовленный раствор на предмет отсутствия посторонних частиц или изменения окраски.
Следует вводить только прозрачный или опалесцирующий бесцветный или светло-желтый раствор без видимых посторонних частиц.
Следует использовать стерильную иглу и шприц для приготовления раствора для инфузий препарата Актемра®.
Пациенты с РА и COVID-19
1. Рассчитать количество препарата, необходимое для введения пациенту (из расчета 0,4 мл/кг).
2. В асептических условиях из инфузионного флакона (пакета), содержащего 100 мл 0,9% раствора натрия хлорида (раствор должен быть стерильным и апирогенным), отобрать одноразовым стерильным шприцем количество 0,9% раствора натрия хлорида, равное рассчитанному для введения количеству препарата Актемра®.
3. Другим одноразовым стерильным шприцем в асептических условиях из флакона с препаратом Актемра® отобрать рассчитанное количество препарата и ввести его в инфузионный флакон (пакет) с 0,9% раствором натрия хлорида; в результате объем приготовленного раствора должен быть равным 100 мл.
4. Для перемешивания аккуратно перевернуть флакон (пакет) во избежание пенообразования.
Пациенты с пЮИА и сЮИА с массой тела ≥30 кг
1. Рассчитать количество препарата, необходимое для введения пациенту (из расчета 0,4 мл/кг).
2. В асептических условиях из инфузионного флакона (пакета), содержащего 100 мл 0,9% раствора натрия хлорида (раствор должен быть стерильным и апирогенным), отобрать одноразовым стерильным шприцем количество 0,9% раствора натрия хлорида, равное рассчитанному для введения количеству препарата Актемра®.
3. Другим одноразовым стерильным шприцем в асептических условиях из флакона с препаратом Актемра® отобрать рассчитанное количество препарата и ввести его в инфузионный флакон (пакет) с 0,9% раствором натрия хлорида; в результате объем приготовленного раствора должен быть равным 100 мл.
4. Для перемешивания аккуратно перевернуть флакон (пакет) во избежание пенообразования.
Пациенты с пЮИА с массой тела <30 кг
1. Рассчитать количество препарата, необходимое для введения пациенту (из расчета 0,5 мл/кг).
2. В асептических условиях из инфузионного флакона (пакета), содержащего 50 мл 0,9% раствора натрия хлорида (раствор должен быть стерильным и апирогенным), отобрать одноразовым стерильным шприцем количество 0,9% раствора натрия хлорида, равное количеству, рассчитанному для введения препарата Актемра®.
3. Другим одноразовым стерильным шприцем в асептических условиях из флакона с препаратом Актемра® отобрать рассчитанное количество препарата и ввести его в инфузионный флакон (пакет) с 0,9% раствором натрия хлорида; в результате объем приготовленного раствора должен быть равным 50 мл.
4. Для перемешивания аккуратно перевернуть флакон (пакет) во избежание пенообразования.
Пациенты с сЮИА с массой тела <30 кг
1. Рассчитать количество препарата, необходимое для введения пациенту (из расчета 0,6 мл/кг).
2. В асептических условиях из инфузионного флакона (пакета), содержащего 50 мл 0,9% раствора натрия хлорида (раствор должен быть стерильным и апирогенным), отобрать одноразовым стерильным шприцем количество 0,9% раствора натрия хлорида, равное рассчитанному для введения количеству препарата Актемра®.
3. Другим одноразовым стерильным шприцем в асептических условиях из флакона с препаратом Актемра® отобрать рассчитанное количество препарата и ввести его в инфузионный флакон (пакет) с 0,9% раствором натрия хлорида; в результате объем приготовленного раствора должен быть равным 50 мл.
4. Для перемешивания аккуратно перевернуть флакон (пакет) во избежание пенообразования.
Препарат Актемра® предназначен только для однократного применения.
Правила хранения приготовленного раствора
Приготовленный инфузионный раствор препарата Актемра® физически и химически стабилен в 0,9% растворе натрия хлорида в течение 24 ч при температуре 30 °С.
С микробиологической точки зрения приготовленный раствор должен быть использован немедленно.
Если препарат не используется сразу, то время и условия хранения приготовленного раствора являются ответственностью пользователя и не должны превышать 24 ч при температуре от 2 до 8 °С (хранить в холодильнике) и только в том случае, если приготовление раствора проводилось в контролируемых и валидируемых асептических условиях.
Инструкция по уничтожению неиспользованного препарата, а также по истечении срока годности
Попадание лекарственных препаратов в окружающую среду должно быть сведено к минимуму. Не следует утилизировать препарат с помощью сточных вод или вместе с бытовыми отходами. По возможности необходимо использовать специальные системы для утилизации лекарственных препаратов.
Побочные действия
Резюме профиля безопасности
Наиболее часто отмечавшимися нежелательными реакциями (наблюдались у ≥5% пациентов, получавших тоцилизумаб в виде монотерапии или в комбинации с БПВП для лечения РА, сЮИА и пЮИА) были инфекции верхних дыхательных путей, назофарингит, головная боль, артериальная гипертензия и повышение активности АЛТ.
Наиболее серьезными нежелательными реакциями были серьезные инфекции, осложнения дивертикулита и реакции гиперчувствительности.
Наиболее часто отмечавшимися нежелательными реакциями (наблюдались у ≥5% пациентов, получавших тоцилизумаб для лечения COVID-19) были повышение активности печеночных трансаминаз, запор и инфекция мочевыводящих путей.
Нежелательные реакции, выявленные в ходе клинических исследований и/или при пострегистрационном применении препарата Актемра® на основании спонтанных сообщений, случаев, описанных в литературных источниках, и случаев, наблюдаемых в рамках программ неинтервенционных исследований, представлены в таблицах 5 и 6 в соответствии с системно-органной классификацией медицинского словаря для нормативно-правовой деятельности MedDRA. Для описания частоты развития нежелательных реакций используются следующие категории: очень часто (≥1/10); часто (≥1/100, но <1/10), нечасто (≥1/1000, но <1/100); редко (≥1/10000, но <1/1000); очень редко (<1/10000). В каждой группе (по частоте возникновения) нежелательные реакции представлены в порядке убывания степени их серьезности.
РА
Профиль безопасности тоцилизумаба был изучен в 4 плацебо-контролируемых исследованиях (исследования II, III, IV и V), 1 контролируемом исследовании с применением МТ (исследование I) и в ходе расширенных периодов к данным исследованиям (см. «Фармакодинамика»).
Двойной слепой контролируемый период исследования составил 6 месяцев в четырех исследованиях (исследования I, III, IV и V) и до 2 лет в одном исследовании (исследование II). В двойных слепых контролируемых исследованиях 774 пациента получали тоцилизумаб в дозе 4 мг/кг в комбинации с МТ, 1870 пациентов получали тоцилизумаб в дозе 8 мг/кг в комбинации с МТ или другими БПВП и 288 пациентов получали тоцилизумаб в дозе 8 мг/кг в качестве монотерапии.
Популяция пациентов с длительной экспозицией препарата включает всех пациентов, которые получили по меньшей мере одну дозу тоцилизумаба во время двойного слепого контролируемого периода или во время открытого расширенного периода. Из 4009 пациентов в данной популяции 3577 пациентов получали терапию в течение по меньшей мере 6 месяцев, 3296 пациентов — в течение по меньшей мере одного года, 2806 пациентов — в течение по меньшей мере 2 лет и 1222 пациента — в течение 3 лет.
Таблица 5
Перечень нежелательных реакций, наблюдавшихся у пациентов с РА, получавших тоцилизумаб в качестве монотерапии или в комбинации с МТ или другими БПВП в период проведения двойного слепого контролируемого исследования или при пострегистрационном применении
| Системно-органная классификация | Категории частоты развития нежелательных реакций, представленных с использованием терминов предпочтительного употребления | |||
| Очень часто | Часто | Нечасто | Редко/Очень редко | |
| Инфекции и инвазии | Инфекции верхних дыхательных путей | Воспаление подкожной клетчатки, пневмония, простой герпес полости рта, опоясывающий лишай (Herpes zoster) | Дивертикулит | |
| Нарушения со стороны крови и лимфатической системы | Лейкопения, нейтропения, гипофибриногенемия | |||
| Нарушения со стороны иммунной системы | Анафилаксия (с летальным исходом)2,3,4 | |||
| Эндокринные нарушения | Гипотиреоз | |||
| Нарушения метаболизма и питания | Гиперхолестеринемия1 | Гипертриглицеридемия | ||
| Нарушения со стороны нервной системы | Головная боль, головокружение | |||
| Нарушения со стороны органа зрения | Конъюнктивит | |||
| Нарушения со стороны сосудов | Повышение артериального давления | |||
| Нарушения со стороны дыхательной системы, органов грудной клетки и средостения | Кашель, одышка | |||
| Желудочно-кишечные нарушения | Боль в животе, язвенный стоматит, гастрит | Стоматит, язва желудка | ||
| Нарушения со стороны печени и желчевыводящих путей | Лекарственное поражение печени, гепатит, желтуха; очень редко — печеночная недостаточность | |||
| Нарушения со стороны кожи и подкожных тканей | Сыпь, зуд, крапивница | Синдром Стивенса-Джонсона4 | ||
| Нарушения со стороны почек и мочевыводящих путей | Нефролитиаз | |||
| Общие нарушения и реакции в месте введения | Периферический отек, реакции гиперчувствительности | |||
| Лабораторные и инструментальные данные | Повышение активности печеночных трансаминаз, увеличение массы тела, повышение общего билирубина1 |
1Включены повышения уровней, собранные в рамках рутинного мониторинга лабораторных показателей (см. текст ниже).
2См. «Противопоказания».
3См. «Особые указания».
4Данная нежелательная реакция была выявлена при пострегистрационном применении, но не наблюдалась в контролируемых клинических исследованиях. Категория частоты была рассчитана исходя из верхней границы 95% доверительного интервала, вычисленного на основании общего количества пациентов, получавших тоцилизумаб в клинических исследованиях.
Описания отдельных нежелательных реакций
Инфекции
В 6-месячных контролируемых исследованиях частота возникновения всех инфекций среди пациентов, получавших тоцилизумаб в дозе 8 мг/кг + БПВП, составила 127 явлений на 100 пациенто-лет по сравнению с 112 явлениями на 100 пациенто-лет в группе пациентов, получавших плацебо + БПВП. В популяции пациентов с длительной экспозицией препарата общая частота возникновения инфекций на фоне терапии препаратом Актемра® составила 108 явлений на 100 пациенто-лет экспозиции.
В 6-месячных контролируемых клинических исследованиях частота возникновения серьезных инфекций среди пациентов, получавших тоцилизумаб в дозе 8 мг/кг + БПВП, составила 5,3 явления на 100 пациенто-лет экспозиции по сравнению с 3,9 явления на 100 пациенто-лет экспозиции в группе пациентов, получавших плацебо + БПВП. В исследовании монотерапии частота возникновения серьезных инфекций составила 3,6 явления на 100 пациенто-лет экспозиции в группе пациентов, получавших тоцилизумаб, и 1,5 явления на 100 пациенто-лет экспозиции в группе пациентов, получавших МТ.
В популяции пациентов с длительной экспозицией препарата общая частота возникновения серьезных инфекций (бактериальных, вирусных и грибковых) составила 4,7 явления на 100 пациенто-лет экспозиции. Серьезные инфекции, некоторые из которых были с летальным исходом, включали активный туберкулез в легочной или внелегочной форме, инвазивные легочные инфекции, включая кандидоз, аспергиллез, кокцидиоидомикоз и пневмоцистную пневмонию, пневмонию, воспаление подкожной клетчатки, опоясывающий лишай (Herpes zoster), гастроэнтерит, дивертикулит, сепсис и бактериальный артрит. Сообщалось о случаях возникновения оппортунистических инфекций.
Интерстициальное заболевание легких
Нарушение функции легких может повысить риск развития инфекций. При пострегистрационном применении препарата были получены сообщения о развитии интерстициального заболевания легких (включая пневмонит и фиброз легких); некоторые из этих случаев привели к летальному исходу.
Перфорация ЖКТ
На протяжении 6-месячных контролируемых клинических исследований общая частота возникновения явлений, связанных с перфорацией ЖКТ, составила 0,26 явления на 100 пациенто-лет у пациентов, получавших терапию тоцилизумабом. В популяции пациентов с длительной экспозицией препарата общая частота возникновения явлений, связанных с перфорацией ЖКТ, составила 0,28 явления на 100 пациенто-лет. Случаи перфорации ЖКТ у пациентов, получавших тоцилизумаб, в основном, как отмечалось, были представлены в виде осложнений дивертикулита, включая генерализованный гнойный перитонит, перфорацию нижних отделов ЖКТ, свищ и абсцесс.
Инфузионные реакции
В 6-месячных контролируемых исследованиях нежелательные явления, связанные с инфузиями (отдельные явления, возникшие во время инфузии или в течение 24 часов после инфузии), отмечались у 6,9% пациентов в группе, получавшей тоцилизумаб в дозе 8 мг/кг + БПВП, и у 5,1% пациентов в группе, получавшей плацебо + БПВП. Явления, возникшие во время инфузии, преимущественно представляли собой эпизоды повышения артериального давления; явления, возникшие в течение 24 часов после завершения инфузии, представляли собой головную боль и реакции со стороны кожи (сыпь, крапивница). Эти реакции не приводили к ограничению терапии.
Частота возникновения анафилактических реакций (которые наблюдались в общей сложности у 8 из 4009 пациентов, 0,2%) была в несколько раз выше в группе, получавшей препарат в дозе 4 мг/кг, в сравнении с группой, получавшей препарат в дозе 8 мг/кг.
Клинически значимые реакции гиперчувствительности, связанные с введением тоцилизумаба и потребовавшие прекращения терапии, отмечались в общей сложности у 56 из 4009 пациентов (1,4%), получавших тоцилизумаб в ходе контролируемых и открытых клинических исследований. Данные реакции наблюдались, как правило, в период между второй и пятой инфузией тоцилизумаба (см. «Особые указания»). При пострегистрационном применении тоцилизумаба отмечались случаи анафилаксии с летальным исходом (см. «Особые указания»).
Иммуногенность
В общей сложности у 2876 пациентов были проведены анализы на антитела к тоцилизумабу в рамках 6-месячных контролируемых клинических исследований. Из 46 пациентов (1,6%) с антителами к тоцилизумабу в 6 случаях отмечалась значимая лекарственная реакция гиперчувствительности, приведшая в 5 случаях к прекращению лечения. У 30 пациентов (1,1%) выработались нейтрализующие антитела.
Отклонения показателей общего анализа крови
Нейтрофилы. В 6-месячных контролируемых исследованиях явления снижения числа нейтрофилов до уровня ниже 1·109/л отмечались у 3,4% пациентов, получавших тоцилизумаб в дозе 8 мг/кг + БПВП, в сравнении с <0,1% пациентов, получавших плацебо + БПВП. Примерно у половины пациентов снижение АЧН ниже 1·109/л возникло в пределах 8 недель после начала терапии. О снижении числа нейтрофилов ниже 0,5·109/л сообщалось у 0,3% пациентов, получавших тоцилизумаб в дозе 8 мг/кг + БПВП. Сообщалось о случаях инфекций, сопровождавшихся нейтропенией.
Во время двойного слепого контролируемого периода и при длительной экспозиции характер и частота возникновения явлений, связанных с уменьшением показателя нейтрофилов, оставались такими же, как и в 6-месячных контролируемых клинических исследованиях.
Тромбоциты. В 6-месячных контролируемых исследованиях явления снижения числа тромбоцитов до уровня ниже 100·103/мкл отмечались у 1,7% пациентов, получавших тоцилизумаб в дозе 8 мг/кг + БПВП, в сравнении с <1% пациентов, получавших плацебо + БПВП. Эти явления снижения уровня тромбоцитов не сопровождались развитием эпизодов кровотечений.
Во время двойного слепого контролируемого периода и при длительной экспозиции характер и частота возникновения явлений, связанных с уменьшением числа тромбоцитов, оставались такими же, как и в 6-месячных контролируемых клинических исследованиях.
При пострегистрационном применении в очень редких случаях сообщалось об эпизодах панцитопении.
Повышение активности печеночных трансаминаз. В ходе 6-месячных контролируемых исследований наблюдалось транзиторное повышение показателей АЛТ/АСТ выше 3× ВГН у 2,1% пациентов, получавших тоцилизумаб в дозе 8 мг/кг, в сравнении с 4,9% пациентов, получавших МТ, и у 6,5% пациентов, получавших тоцилизумаб в дозе 8 мг/кг + БПВП, в сравнении с 1,5% пациентов, получавших плацебо + БПВП. Присоединение к монотерапии тоцилизумабом препаратов, обладающих потенциальным гепатотоксическим действием (например, МТ), приводило к увеличению частоты случаев повышения активности трансаминаз. Повышение показателей АЛТ/АСТ более чем в 5 раз относительно ВГН наблюдалось у 0,7% пациентов, получавших монотерапию тоцилизумабом, и у 1,4% пациентов, получавших тоцилизумаб + БПВП; в большинстве из этих случаев терапия тоцилизумабом была отменена.
В течение двойного слепого контролируемого периода исследования частота случаев повышения уровня непрямого билирубина выше ВГН, оцениваемых в рамках рутинного мониторинга лабораторных показателей, составила 6,2% у пациентов, получавших тоцилизумаб в дозе 8 мг/кг + БПВП. У 5,8% пациентов наблюдалось повышение уровня непрямого билирубина в диапазоне от >1 до 2×ВГН, а у 0,4% — >2×ВГН.
Во время двойного слепого контролируемого периода и при длительной экспозиции характер и частота возникновения явлений, связанных с повышением активности АЛТ/АСТ, оставались такими же, как и в 6-месячных контролируемых клинических исследованиях.
Показатели липидного обмена. В ходе 6-месячных контролируемых исследований часто сообщалось о повышении показателей липидного обмена, таких как общий холестерин, триглицериды, ЛПНП и/или ЛПВП. При рутинном мониторинге лабораторных показателей примерно у 24% пациентов, получавших препарат Актемра® в рамках проведения клинических исследований, наблюдалось стойкое повышение уровня общего холестерина ≥6,2 ммоль/л, а у 15% — стойкое повышение уровня ЛПНП до ≥4,1 ммоль/л. Повышение, наблюдавшееся в показателях липидного обмена, реагировало на лечение гиполипидемическими препаратами.
Во время двойного слепого контролируемого периода и при длительной экспозиции характер и частота возникновения явлений, связанных с повышением показателей, характеризующих липидный обмен, оставались такими же, как и в 6-месячных контролируемых клинических исследованиях.
Злокачественные новообразования
Клинических данных недостаточно для оценки потенциальной частоты возникновения злокачественных новообразований после применения тоцилизумаба. Оценка долгосрочной безопасности терапии продолжается.
Кожные реакции
При пострегистрационном применении в редких случаях сообщалось об эпизодах синдрома Стивенса-Джонсона.
COVID-19
Оценка безопасности применения препарата Актемра® у пациентов с COVID-19 была основана на результатах, полученных в 3 рандомизированных двойных слепых плацебо-контролируемых исследованиях (исследования ML42528, WA42380 и WA42511).
В общей сложности 974 пациента получили терапию препаратом Актемра® в рамках проведения данных исследований. Сбор данных по безопасности в рамках проведения исследования RECOVERY был ограничен и здесь не представлен.
Следующие нежелательные реакции, перечисленные в соответствии с системно-органной классификацией медицинского словаря для нормативно-правовой деятельности MedDRA в таблице 6, были отнесены к событиям, которые наблюдались не менее чем у 3% пациентов, получавших терапию препаратом Актемра®, и чаще, чем у пациентов, получавших плацебо, в объединенной популяции пациентов для оценки безопасности применения препарата в рамках проведения клинических исследований ML42528, WA42380 и WA42511.
Таблица 6
Перечень нежелательных реакций1, выявленных в объединенной популяции для оценки безопасности в рамках проведения клинических исследований препарата Актемра® у пациентов COVID-192
| Системно-органный класс | Часто |
| Инфекции и инвазии | Инфекция мочевыводящих путей |
| Нарушения метаболизма и питания | Гипокалиемия |
| Психические нарушения | Тревожность, бессонница |
| Нарушения со стороны сосудов | Повышение артериального давления |
| Желудочно-кишечные нарушения | Запор, диарея, тошнота |
| Нарушения со стороны печени и желчевыводящих путей | Повышение активности печеночных трансаминаз |
1Пациенты учитываются один раз в каждой категории независимо от количества реакций.
2Включены реакции, о которых сообщалось в исследованиях WA42511, WA42380 и ML42528.
Описание отдельных нежелательных реакций
Инфекции
В объединенной популяции пациентов для оценки безопасности в ходе проведения исследований ML42528, WA42380 и WA42511 частота событий, связанных с инфекциями/серьезными инфекциями, была сбалансирована между пациентами с COVID-19, получавшими тоцилизумаб (30,3/18,6%, n=974) и плацебо (32,1/22,8%, n=483).
Профиль безопасности, наблюдаемый на исходном уровне в группе, получавшей лечение системными ГКС, соответствовал профилю безопасности применения тоцилизумаба в общей популяции, представленному в таблице 6. В данной подгруппе инфекции и серьезные инфекции наблюдались у 27,8 и 18,1% пациентов, получавших тоцилизумаб в/в, и у 30,5 и 22,9% пациентов, получавших плацебо, соответственно.
Изменения лабораторных показателей
Частота изменений, наблюдаемых в лабораторных показателях, была в целом сходной между пациентами с COVID-19, получившими в/в одну или две дозы препарата Актемра®, по сравнению с теми, кто получал плацебо в рандомизированных двойных слепых плацебо-контролируемых исследованиях, за редким исключением. Снижение числа тромбоцитов и нейтрофилов, а также повышение активности АЛТ и АСТ чаще наблюдалось у пациентов, получавших препарат Актемра®, по сравнению с плацебо (см. «Способ применения и дозы» и «Особые указания»).
сЮИА и пЮИА
Профиль безопасности применения тоцилизумаба в популяции детей обобщен ниже в разделах, касающихся пЮИА и сЮИА. В целом, нежелательные реакции у пациентов с пЮИА и сЮИА были схожи по типу с теми, которые наблюдались у пациентов с РА; см. «Побочные действия» выше.
Нежелательные реакции у пациентов с пЮИА и сЮИА, получавших тоцилизумаб, перечислены в таблице 7 и представлены в соответствии с системно-органной классификацией медицинского словаря для нормативно-правовой деятельности MedDRA. Для описания частоты развития нежелательных реакций используются следующие категории: очень часто (≥1/10); часто (≥1/100, но <1/10) и нечасто (≥1/1000, но <1/100).
Таблица 7
Перечень нежелательных реакций, наблюдавшихся у пациентов с сЮИА или пЮИА, получавших тоцилизумаб в качестве монотерапии или в комбинации с МТ
| Системно-органный класс | Термин предпочтительного употребления | Частота возникновения | ||
| Очень часто | Часто | Нечасто | ||
| Инфекции и инвазии | ||||
| Инфекции верхних дыхательных путей | пЮИА, сЮИА | |||
| Назофарингит | пЮИА, сЮИА | |||
| Нарушения со стороны нервной системы | ||||
| Головная боль | пЮИА | сЮИА | ||
| Желудочно-кишечные нарушения | ||||
| Тошнота | пЮИА | |||
| Диарея | пЮИА, сЮИА | |||
| Общие нарушения и реакции в месте введения | ||||
| Инфузионные реакции | пЮИА1, сЮИА2 | |||
| Лабораторные и инструментальные данные | ||||
| Повышение активности печеночных трансаминаз | пЮИА | |||
| Снижение числа нейтрофилов | сЮИА | пЮИА | ||
| Снижение числа тромбоцитов | сЮИА | пЮИА | ||
| Повышение уровня холестерина | сЮИА | пЮИА |
1Инфузионные реакции у пациентов с пЮИА включали головную боль, тошноту и повышение артериального давления, но не ограничивались ими.
2Инфузионные реакции у пациентов с сЮИА включали сыпь, крапивницу, диарею, дискомфорт в эпигастрии, артралгию и головную боль, но не ограничивались ими.
пЮИА
Профиль безопасности препарата Актемра® в/в при пЮИА был изучен у 188 пациентов от 2 до 17 лет. Общая продолжительность воздействия препарата на пациентов составила 184,4 пациенто-лет. Частота развития нежелательных реакций у пациентов с пЮИА представлена в таблице 7. Типы нежелательных реакций, наблюдавшихся у пациентов с пЮИА, были аналогичны тем, которые наблюдались у пациентов с РА и сЮИА (см. «Побочные действия» выше). По сравнению с популяцией взрослых пациентов с РА в популяции пациентов с пЮИА чаще регистрировались такие явления, как назофарингит, головная боль, тошнота и снижение числа нейтрофилов. Случаи повышения уровня холестерина в популяции пациентов с пЮИА отмечались реже, чем в популяции взрослых пациентов с РА.
Инфекции
Частота возникновения инфекций в популяции всех пациентов, получавших тоцилизумаб, составила 163,7 явления на 100 пациенто-лет. Наиболее часто регистрируемыми явлениями были назофарингит и инфекции верхних дыхательных путей. Частота возникновения серьезных инфекций была численно выше у пациентов с массой тела <30 кг, получавших тоцилизумаб в дозе 10 мг/кг (12,2 явления на 100 пациенто-лет), в сравнении с пациентами с массой тела ≥30 кг, получавшими тоцилизумаб в дозе 8 мг/кг (4,0 явления на 100 пациенто-лет). Частота возникновения инфекций, которые привели к прерыванию терапии, также была численно выше среди пациентов с массой тела <30 кг, получавших тоцилизумаб в дозе 10 мг/кг (21,%), в сравнении с пациентами с массой тела ≥30 кг, получавшими тоцилизумаб в дозе 8 мг/кг (7,6%).
Инфузионные реакции
У пациентов с пЮИА инфузионные реакции определяют как все явления, развившиеся во время инфузии или в течение 24 часов после инфузии. В популяции всех пациентов, получавших тоцилизумаб, у 11 пациентов (5,9%) развились инфузионные реакции во время инфузии, а у 38 пациентов (20,2%) данное явление развилось в течение 24 часов после инфузии. Наиболее частыми явлениями, развившимися во время инфузии, были головная боль, тошнота и гипотензия, а наиболее частыми явлениями, развившимися в течение 24 часов после инфузии, были головокружение и гипотензия. В целом нежелательные реакции, наблюдавшиеся во время инфузии или в течение 24 часов после нее, были сходными по характеру с нежелательными реакциями, наблюдавшимися у пациентов с РА и сЮИА (см. «Побочные действия» выше).
О клинически значимых реакциях гиперчувствительности, связанных с тоцилизумабом и требующих прекращения лечения, не сообщалось.
Иммуногенность
У одного пациента из группы, получавшей тоцилизумаб в дозе 10 мг/кг, с массой тела <30 кг, был получен положительный результат анализа на антитела к тоцилизумабу, без развития реакции гиперчувствительности; впоследствии этот пациент был исключен из исследования.
Нейтрофилы
В ходе рутинного мониторинга лабораторных показателей в популяции всех пациентов, получавших тоцилизумаб, снижение числа нейтрофилов до уровня ниже 1·109/л наблюдалось у 3,7% пациентов.
Тромбоциты
В ходе рутинного мониторинга лабораторных показателей в популяции всех пациентов, получавших тоцилизумаб, у 1% пациентов наблюдалось снижение числа тромбоцитов до уровня ≤50·103/мкл, которое не сопровождалось развитием эпизодов кровотечений.
Повышение активности печеночных трансаминаз
В ходе рутинного мониторинга лабораторных показателей в популяции всех пациентов, получавших тоцилизумаб, явления, связанные с повышением активности АЛТ или АСТ до уровня ≥3×ВГН, наблюдались у 3,7 и <1% пациентов соответственно.
Показатели липидного обмена
В ходе рутинного мониторинга лабораторных показателей, выполняемого в рамках проведения исследования препарата Актемра® в/в (исследование WA19977), у 3,4 и 10,4% пациентов наблюдалось повышение ЛПНП до уровня ≥130 мг/дл и общего холестерина до уровня ≥200 мг/дл в любой временной точке в ходе терапии, выполняемой в рамках исследования, соответственно, по сравнению с исходным уровнем.
сЮИА
Профиль безопасности препарата Актемра® в/в при сЮИА был изучен у 112 пациентов от 2 до 17 лет. В 12-недельной двойной слепой контролируемой части исследования 75 пациентов получали терапию тоцилизумабом (8 или 12 мг/кг в зависимости от массы тела). По прошествии 12 недель или в момент перехода на терапию препаратом Актемра® из-за ухудшения течения заболевания пациенты получили лечение в рамках открытого расширенного периода исследования.
В целом нежелательные реакции у пациентов с сЮИА были схожи по типу с теми, которые наблюдались у пациентов с РА (см. «Побочные действия» выше). Частота развития нежелательных реакций у пациентов с сЮИА представлена в таблице 7. По сравнению с популяцией взрослых пациентов с РА, у пациентов с сЮИА чаще наблюдались назофарингит, снижение числа нейтрофилов, повышение активности печеночных трансаминаз и диарея. Случаи повышения уровня холестерина в популяции пациентов с сЮИА отмечались реже, чем в популяции взрослых пациентов с РА.
Инфекции
В 12-недельной контролируемой фазе исследования частота возникновения всех инфекций в группе пациентов, получавших препарат Актемра® в/в, составила 344,7 случая на 100 пациенто-лет и 287,0 случая на 100 пациенто-лет в группе пациентов, получавших плацебо. В ходе открытого расширенного периода исследования (часть II) общая частота возникновения инфекций осталась сходной и составила 306,6 случая на 100 пациенто-лет.
В 12-недельной контролируемой фазе исследования частота возникновения серьезных инфекций в группе пациентов, получавших в/в препарат Актемра®, составила 11,5 случая на 100 пациенто-лет. Через один год в ходе открытого расширенного периода исследования общая частота возникновения серьезных инфекций осталась стабильной и составила 11,3 случая на 100 пациенто-лет. Серьезные инфекции были сходными с серьезными инфекциями, наблюдавшимися у пациентов с РА, дополнительно отмечались случаи ветряной оспы и отита среднего уха.
Инфузионные реакции
Инфузионные реакции определяют как все явления, развившиеся во время инфузии или в течение 24 часов после нее. В 12-недельной контролируемой фазе исследования у 4% пациентов из группы, получавшей тоцилизумаб, отмечались явления, произошедшие во время инфузии. Одно явление (ангионевротический отек) было оценено как серьезное и жизнеугрожающее, и пациент был исключен из исследования.
В 12-недельной контролируемой фазе исследования у 16% пациентов из группы, получавшей тоцилизумаб, и у 5,4% пациентов из группы, получавшей плацебо, инфузионная реакция развилась в течение 24 часов после инфузии. В группе, получавшей тоцилизумаб, явления включали сыпь, крапивницу, диарею, дискомфорт в эпигастрии, артралгию и головную боль (но не ограничиваясь ими). Одно из этих явлений (крапивница) было оценено как серьезное.
Клинически значимые реакции гиперчувствительности, связанные с введением тоцилизумаба и потребовавшие прекращения терапии, отмечались у 1 из 112 пациентов (<1%), получавших тоцилизумаб в ходе контролируемого исследования, включая открытое клиническое исследование.
Иммуногенность
У всех 112 пациентов на исходном уровне был проведен анализ на антитела к тоцилизумабу. У двух пациентов были обнаружены антитела к тоцилизумабу, при этом у одного из этих пациентов развилась реакция гиперчувствительности, которая привела к прекращению терапии. Частота образования антител к тоцилизумабу может быть недооценена из-за влияния тоцилизумаба на результаты анализа и более высокой концентрации препарата, наблюдаемой у детей по сравнению со взрослыми.
Нейтрофилы
В ходе рутинного мониторинга лабораторных показателей, выполняемого в рамках 12-недельной контролируемой фазы исследования, снижение числа нейтрофилов до уровня ниже 1·109/л наблюдалось у 7% пациентов из группы, получавшей тоцилизумаб; в группе, получавшей плацебо, такого снижения не наблюдалось.
В ходе открытого расширенного периода исследования уменьшение числа нейтрофилов до уровня ниже 1·109/л наблюдалось у 15% пациентов из группы, получавшей тоцилизумаб.
Тромбоциты
В ходе рутинного мониторинга лабораторных показателей, выполняемого в рамках 12-недельной контролируемой фазы исследования, у 3% пациентов из группы, получавшей плацебо, и у 1% пациентов из группы, получавшей тоцилизумаб, наблюдалось снижение числа тромбоцитов до уровня ≤100·103/мкл.
В ходе открытого расширенного периода исследования у 3% пациентов из группы, получавшей тоцилизумаб, наблюдалось снижение числа тромбоцитов до уровня ниже 100·103/мкл, которое не сопровождалось развитием эпизодов кровотечений.
Повышение активности печеночных трансаминаз
В ходе рутинного мониторинга лабораторных показателей, выполняемого в рамках 12-недельной контролируемой фазы исследования, явления, связанные с повышением активности АЛТ или АСТ до уровня ≥3×ВГН, наблюдались у 5 и 3% пациентов соответственно в группе, получавшей тоцилизумаб, и у 0% пациентов в группе, получавшей плацебо.
В ходе открытого расширенного периода исследования явления, связанные с повышением активности АЛТ или АСТ до уровня ≥3×ВГН, наблюдались у 12 и 4% пациентов соответственно в группе, получавшей тоцилизумаб.
Иммуноглобулин G
Уровень IgG снижается во время терапии. Снижение до нижней границы нормы было отмечено у 15 пациентов в определенный момент исследования.
Показатели липидного обмена
В ходе рутинного мониторинга лабораторных показателей, выполняемого в рамках 12-недельной контролируемой фазы исследования (исследование WA18221), у 13,4 и 33,3% пациентов наблюдалось повышение ЛПНП до уровня ≥130 мг/дл и общего холестерина до уровня ≥200 мг/дл в любой временной точке в ходе терапии, выполняемой в рамках исследования, соответственно, по сравнению с исходным уровнем.
В ходе открытого расширенного периода исследования (исследование WA18221) у 13,2 и 27,7% пациентов наблюдалось повышение ЛПНП до уровня ≥130 мг/дл и общего холестерина до уровня ≥200 мг/дл в любой временной точке в ходе терапии, выполняемой в рамках исследования, соответственно.
Взаимодействие
Исследования взаимодействий были проведены только у взрослых пациентов.
Одновременное однократное введение тоцилизумаба в дозе 10 мг/кг и МТ в дозе 10–25 мг один раз в неделю не оказывало клинически значимого влияния на экспозицию МТ.
Популяционные ФК-анализы не выявили какого-либо воздействия МТ, НПВП или ГКС на клиренс тоцилизумаба.
Экспрессия печеночных изоферментов системы CYP450 подавляется под действием цитокинов, таких как ИЛ-6, которые стимулируют хроническое воспаление. Таким образом, при проведении терапии средствами, ингибирующими действие цитокинов (например, тоцилизумаб), экспрессия изоферментов CYP450 может быть нарушена.
В исследованиях in vitro, проведенных на культуре гепатоцитов человека, было показано, что ИЛ-6 вызывает снижение экспрессии ферментов CYP1A2, CYP2C9, CYP2C19 и CYP3A4. Применение тоцилизумаба нормализует экспрессию этих изоферментов.
В исследовании у пациентов с РА концентрация симвастатина (CYP3A4) через 1 неделю после однократного введения тоцилизумаба снижалась на 57%, т.е. была немного повышенной или аналогичной таковой у здоровых добровольцев.
В начале или при завершении курса терапии тоцилизумабом следует наблюдать за пациентами, получающими лекарственные средства в индивидуально подобранных дозах и которые метаболизируются посредством изоферментов CYP450 3A4, 1A2 или 2C9 (например, метилпреднизолон, дексаметазон (с возможностью развития синдрома отмены ГКС, предназначенных для приема внутрь), аторвастатин, блокаторы кальциевых каналов, теофиллин, варфарин, фенпрокумон, фенитоин, циклоспорин или бензодиазепины), поскольку для поддержания терапевтического эффекта может потребоваться коррекция их дозы.
Учитывая длительный T1/2 тоцилизумаба, его действие на активность изоферментов CYP450 может сохраняться в течение нескольких недель после прекращения терапии.
Передозировка
Доступные данные о передозировке препарата Актемра® ограничены. В одном случае непреднамеренной передозировки препарата в дозе 40 мг/кг у пациента с множественной миеломой нежелательных реакций не отмечено. Не отмечалось также серьезных нежелательных реакций у здоровых добровольцев, которые получали однократно препарат Актемра® в дозе до 28 мг/кг, хотя наблюдалась нейтропения, требующая снижения дозы.
Особые указания
В медицинской документации пациента следует указывать торговое наименование препарата (Актемра®) и номер серии.
РА, пЮИА и сЮИА
Инфекции. У пациентов, получающих иммуносупрессанты (в т.ч. препарат Актемра®), отмечались серьезные случаи возникновения инфекций, некоторые из них сопровождались летальным исходом (см. «Побочные действия»). Не следует начинать лечение препаратом Актемра® пациентам с активными инфекциями (см. «Противопоказания»). Введение препарата Актемра® должно быть приостановлено в случае развития у пациента серьезной инфекции, до момента взятия инфекции под контроль (см. «Побочные действия»). Медицинским работникам следует соблюдать осторожность при рассмотрении вопроса о применении препарата Актемра® у пациентов с рецидивирующими или хроническими инфекциями в анамнезе, а также с сопутствующими заболеваниями (например, дивертикулитом, сахарным диабетом и интерстициальным заболеванием легких), предрасполагающими к развитию инфекций.
Следует проявлять особую осторожность с целью своевременного выявления серьезных инфекций у пациентов, получающих терапию биологическими препаратами, поскольку признаки и симптомы острого воспаления могут быть стерты в связи с подавлением реакции острой фазы. Следует учитывать влияние тоцилизумаба на уровень СРБ, число нейтрофилов и на признаки и симптомы развития инфекций при обследовании пациента на предмет возможного развития инфекции.
Необходимо проинструктировать пациентов (включая детей раннего возраста с сЮИА или пЮИА, которые не всегда способны описать симптомы) и родителей/опекунов пациентов с сЮИА или пЮИА о немедленном обращении к врачу при любых симптомах, свидетельствующих о появлении инфекции, с целью обеспечения быстрой диагностики и назначения необходимого лечения.
Туберкулез. Как и при назначении других биологических препаратов, перед началом терапии препаратом Актемра® пациенты с РА, сЮИА и пЮИА должны пройти обследование на латентный туберкулез. Пациенты, у которых был выявлен латентный туберкулез, должны пройти стандартный курс антимикобактериальной терапии перед началом лечения препаратом Актемра®. Лечащему врачу следует помнить о риске получения ложноотрицательных результатов туберкулиновой кожной пробы и квантиферонового теста, особенно у пациентов с тяжелыми заболеваниями или ослабленным иммунитетом.
Пациенты должны быть проинструктированы о необходимости обратиться к врачу, если признаки/симптомы (например, стойкий кашель, истощение/снижение массы тела, субфебрильная температура), указывающие на туберкулезную инфекцию, возникают во время или после терапии препаратом Актемра®.
Реактивация вирусных инфекций. Были описаны случаи реактивации вирусной инфекции (например, вирусного гепатита B) при применении биологических препаратов для лечения РА. Пациенты, имевшие положительный результат при скрининговом обследовании на гепатит, не включались в клинические исследования тоцилизумаба.
Осложнения дивертикулита. О случаях перфорации дивертикула, как осложнения дивертикулита при применении препарата Актемра® у пациентов с РА, сообщалось нечасто (см. «Побочные действия»). Следует соблюдать осторожность при применении препарата Актемра® у пациентов с язвенным поражением органов ЖКТ или дивертикулитом в анамнезе. Пациенты с симптомами, возможно указывающими на осложнения дивертикулита, такими как боль в животе, кровотечение и/или необъяснимые изменения в частоте и характере стула, сопровождающиеся повышением температуры тела, должны быть немедленно обследованы с целью раннего выявления дивертикулита, который может быть связан с перфорацией ЖКТ.
Реакции гиперчувствительности. При инфузии препарата Актемра® наблюдались серьезные реакции гиперчувствительности (см. «Побочные действия»). Такие реакции могут быть более тяжелыми и потенциально летальными у пациентов, у которых наблюдались реакции гиперчувствительности во время предшествующих инфузий, даже если они получали премедикацию стероидами и антигистаминными препаратами. Должно быть предусмотрено наличие необходимого оборудования и персонала для оказания экстренной помощи в случае развития анафилактической реакции во время терапии препаратом Актемра®. При возникновении анафилактической реакции или другой серьезной реакции гиперчувствительности/серьезной инфузионной реакции введение препарата Актемра® следует немедленно прекратить, при этом терапия препаратом Актемра® должна быть отменена.
Активные заболевания печени и печеночная недостаточность. Терапия препаратом Актемра®, особенно одновременно с МТ, может быть ассоциирована с повышением активности печеночных трансаминаз, поэтому следует проявлять осторожность при назначении терапии пациентам с активным заболеванием печени или печеночной недостаточностью (см. «Способ применения и дозы» и «Побочные действия»).
Гепатотоксичность. При лечении препаратом Актемра® часто наблюдалось преходящее или периодическое легкое и умеренное повышение активности печеночных трансаминаз (см. «Побочные действия»). Частота возникновения такого повышения возрастала при применении препарата Актемра® совместно с препаратами, обладающими потенциально гепатотоксическим действием (например, МТ). При наличии клинических показаний следует рассмотреть возможность выполнения других функциональных печеночных проб, включая оценку уровня билирубина.
При применении препарата Актемра® наблюдалось серьезное лекарственное поражение печени, включая острую печеночную недостаточность, гепатит и желтуху (см. «Побочные действия»). Серьезные поражения печени отмечались в интервале от 2 недель до >5 лет после начала терапии препаратом Актемра®. Сообщалось о случаях развития печеночной недостаточности, которые привели к трансплантации печени. Пациентам следует рекомендовать немедленно обратиться за медицинской помощью при появлении признаков и симптомов поражения печени.
Следует соблюдать осторожность при решении вопроса о начале терапии препаратом Актемра® у пациентов с показателями АЛТ или АСТ, превышающими ВГН более чем в 1,5 раза. Терапия препаратом Актемра® не рекомендуется при показателях АЛТ или
АСТ, превышающих ВГН более чем в 5 раз у пациентов с РА, пЮИА и сЮИА.
У пациентов с РА, пЮИА и сЮИА следует контролировать АЛТ/АСТ каждые 4–8 недель на протяжении первых 6 месяцев после начала терапии, а в дальнейшем — каждые 12 недель. Рекомендации по дозированию, а также отмене препарата Актемра® в зависимости от активности трансаминаз, представлены в разделе «Способ применения и дозы». Следует прекратить лечение препаратом Актемра® при повышении показателей АЛТ или АСТ в 3–5 раз выше ВГН, подтвержденном повторным анализом.
Отклонения показателей общего анализа крови. После лечения тоцилизумабом в дозе 8 мг/кг в комбинации с МТ наблюдалось снижение числа нейтрофилов и тромбоцитов (см. «Побочные действия»). Может быть повышен риск развития нейтропении у пациентов, которые ранее получали лечение антагонистом ФНО.
Пациентам, ранее не получавшим лечение препаратом Актемра®, не рекомендуется начинать лечение с АЧН менее 2·109/л. Следует проявлять осторожность при рассмотрении вопроса о начале лечения препаратом Актемра® у пациентов с низким уровнем тромбоцитов (т.е. с уровнем тромбоцитов ниже 100·103/мкл). У пациентов с РА, сЮИА и пЮИА с АЧН <0,5·109/л или числом тромбоцитов <50·103/мкл продолжать лечение не рекомендуется.
Тяжелая нейтропения может быть связана с повышенным риском развития серьезных инфекций, хотя до настоящего времени в клинических исследованиях препарата Актемра® не было выявлено четкой связи между снижением числа нейтрофилов и возникновением серьезных инфекций.
У пациентов с РА следует контролировать показатели нейтрофилов и тромбоцитов в период с 4-й по 8-ю неделю после начала терапии и в дальнейшем в соответствии со стандартами клинической практики. Рекомендации по коррекции дозы в зависимости от АЧН и уровня тромбоцитов представлены в разделе «Способ применения и дозы».
У пациентов с сЮИА и пЮИА показатели нейтрофилов и тромбоцитов следует контролировать в день проведения 2-й инфузии, а в дальнейшем в соответствии со стандартами клинической практики (см. «Способ применения и дозы»).
Показатели липидного обмена. У пациентов, получавших тоцилизумаб, наблюдалось повышение показателей липидного обмена, включая общий холестерин, ЛПНП, ЛПВП и триглицериды (см. «Побочные действия»). У большинства пациентов индекс атерогенности не повышался, а повышение концентрации общего холестерина эффективно корригировалось гиполипидемическими препаратами.
При РА, пЮИА и сЮИА следует оценивать показатели липидного обмена у пациентов в период с 4 по 8 неделю после начала терапии препаратом Актемра®. При ведении пациентов следует руководствоваться локальными рекомендациями по лечению гиперлипидемии.
Нарушения со стороны нервной системы. Врачи должны проявлять особую осторожность с целью раннего выявления симптомов, возможно указывающих на дебют демиелинизирующих заболеваний ЦНС. В настоящее время влияние препарата Актемра® на развитие демиелинизирующих заболеваний ЦНС не известно.
Злокачественные новообразования. У пациентов с РА повышен риск развития злокачественных новообразований. Иммуномодулирующие лекарственные препараты могут повышать риск развития злокачественных новообразований.
Иммунизация. Не следует проводить иммунизацию живыми и живыми ослабленными вакцинами одновременно с терапией препаратом Актемра®, поскольку клиническая безопасность подобного сочетания не установлена. В рандомизированном открытом исследовании у взрослых пациентов с РА, получавших терапию препаратом Актемра® и МТ, ответ на 23-валентную пневмококковую полисахаридную вакцину и столбнячный анатоксин был сопоставим с таковым у пациентов, получающих монотерапию МТ. Всем пациентам, особенно пациентам с сЮИА и пЮИА, рекомендуется пройти вакцинацию в соответствии с национальным календарем прививок до начала лечения препаратом Актемра®. Следует соблюдать интервал (в соответствии с действующим национальным календарем прививок) у пациентов, получающих терапию иммуносупрессивными препаратами, между иммунизацией живыми вакцинами и началом терапии препаратом Актемра®.
Риск развития сердечно-сосудистых заболеваний. У пациентов с РА имеется повышенный риск развития сердечно-сосудистых заболеваний, поэтому факторы риска (например, повышение артериального давления, гиперлипидемия) должны контролироваться в рамках стандартного лечения.
Комбинация с антагонистами ФНО. Опыт применения препарата Актемра® с антагонистами ФНО или другими биологическими препаратами для лечения пациентов с РА, сЮИА или пЮИА отсутствует. Не рекомендуется применять препарат Актемра® с другими биологическими препаратами.
Содержание натрия. Данный препарат содержит 1,17 ммоль (или 26,55 мг) натрия в пересчете на максимальную дозу 1200 мг. Необходимо учитывать пациентам, находящимся на диете с ограничением поступления натрия. Данный лекарственный препарат в дозах менее 1025 мг содержит менее 1 ммоль натрия (23 мг), т. е. практически не содержит натрий.
COVID-19
При новой коронавирусной инфекции COVID-19 препарат Актемра® следует применять в условиях стационара.
Эффективность применения препарата Актемра® не была установлена при лечении пациентов с COVID-19, у которых не был повышен уровень СРБ (см. «Фармакодинамика»).
Препарат Актемра® не должен назначаться пациентам с COVID-19, не получающим системные ГКС, поскольку в этой подгруппе нельзя исключить увеличение уровня смертности (см. «Фармакодинамика»).
Инфекции. Пациентам с COVID-19 не следует назначать препарат Актемра®, если у них имеется какая-либо другая сопутствующая тяжелая активная инфекция. Медицинским работникам следует соблюдать осторожность при применении препарата Актемра® у пациентов с рецидивирующими или хроническими инфекциями в анамнезе, а также при сопутствующих заболеваниях (например, при дивертикулите, сахарном диабете и интерстициальном заболевании легких), предрасполагающих к развитию инфекций.
Гепатотоксичность. У госпитализированных пациентов с COVID-19 может быть повышена активность АЛТ или АСТ. Полиорганная недостаточность с поражением печени признана осложнением тяжелой формы COVID-19. При принятии решения о применении тоцилизумаба следует сбалансировать потенциальную пользу, получаемую от лечения COVID-19, с потенциальным риском неотложной терапии тоцилизумабом. У пациентов с COVID-19 с повышением активности АЛТ или АСТ, превышающей ВГН более чем в 10 раз, применение препарата Актемра® не рекомендуется. У пациентов с COVID-19 следует мониторировать активность АЛТ/АСТ в соответствии с текущей стандартной клинической практикой.
Отклонения показателей общего анализа крови. У пациентов с COVID-19 с АЧН <1·109/л или числом тромбоцитов <50·103/мкл лечение не рекомендуется. Показатели нейтрофилов и тромбоцитов следует мониторировать в соответствии с текущей стандартной клинической практикой (см. «Способ применения и дозы»).
Дети
Синдром активации макрофагов у пациентов с сЮИА. Синдром активации макрофагов является серьезным жизнеугрожающим состоянием, которое может развиться у пациентов с сЮИА. В клинических исследованиях применение тоцилизумаба у пациентов в период возникновения синдрома активации макрофагов не изучалось.
Влияние на способность управлять транспортными средствами, механизмами. Исследования по изучению влияния препарата на способность управлять транспортными средствами и механизмами не проводились. Однако учитывая тот факт, что при терапии препаратом Актемра® часто наблюдалось головокружение, пациентам, испытывающим данную нежелательную реакцию, следует рекомендовать не управлять транспортными средствами и механизмами до тех пор, пока головокружение не прекратится.
Форма выпуска
Концентрат для приготовления раствора для инфузий, 20 мг/мл. По 4 мл (80 мг/4 мл), 10 мл (200 мг/10 мл) или 20 мл (400 мг/20 мл) препарата во флаконах, изготовленных из бесцветного стекла (гидролитический класс 1 ЕФ), укупоренных крышкой из бутилкаучука, обжатых алюминиевыми колпачками и закрытых пластмассовыми крышками; цвет колпачка и крышки соответствует цвету, которым выделена дозировка препарата на этикетке флакона и на пачке. 1 флакон вместе с инструкцией по применению помещают в картонную пачку с картонными вкладышами (перегородками) внутри.
С целью контроля первого вскрытия на пачку наносится защитная голографическая наклейка.
Упаковка на ОАО «Фармстандарт-УфаВИТА». 1 флакон помещают в пластиковый поддон или в картонный вкладыш, который вместе с инструкцией по медицинскому применению помещают в пачку из картона импортного.
С целью контроля первого вскрытия на пачку наклеивают самоклеящиеся круглые стикеры с надписью «Контроль вскрытия».
Производитель
Производитель. Чугай Фарма Мануфектуринг Ко. Лтд., Япония/Chugai Pharma Manufacturing Co. Ltd, 16-3, Kiyohara Kogyodanchi, Utsunomiya city, Tochigi, Japan.
Владелец регистрационного удостоверения. Ф. Хоффманн-Ля Рош Лтд., Швейцария/F. Hoffmann-La Roche Ltd, Grenzacherstrasse 124, 4070 Basel, Switzerland.
Организация, принимающая претензии потребителя. Претензии потребителей направлять в компанию АО «Рош-Москва» по адресу 107031, Россия, Москва, Трубная площадь, 2, пом. 1, этаж 1-й, комн. 42.
Тел.: (495) 229-29-99; факс: (495) 229-79-99
или через форму обратной связи на сайте:
www.roche.ru
В случае упаковки на ОАО «Фармстандарт-УфаВИТА» претензии потребителей направлять по адресу 450077, Россия, Республика Башкортостан, г. Уфа, ул. Худайбердина, 28.
Тел./факс: (347) 272-92-85.
www.pharmstd.ru
Условия отпуска из аптек
По рецепту.
Условия хранения
В защищенном от света месте, при температуре 2–8 °C (не замораживать).
Хранить в недоступном для детей месте.
Срок годности
2 года 6 мес.
Не применять по истечении срока годности, указанного на упаковке.
Актемра® (Actemra®) инструкция по применению
📜 Инструкция по применению Актемра®
💊 Состав препарата Актемра®
✅ Применение препарата Актемра®
📅 Условия хранения Актемра®
⏳ Срок годности Актемра®
Описание лекарственного препарата
Актемра®
(Actemra®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2023 года.
Дата обновления: 2022.11.16
Код ATX:
L04AC07
(Тоцилизумаб)
Лекарственные формы
| Актемра® |
Концентрат д/пригот. р-ра д/инфузий 80 мг/4 мл: фл. 1 шт. рег. №: ЛСР-003012/09 |
|
|
Концентрат д/пригот. р-ра д/инфузий 200 мг/10 мл: фл. 1 шт. рег. №: ЛСР-003012/09 |
||
|
Концентрат д/пригот. р-ра д/инфузий 400 мг/20 мл: фл. 1 шт. рег. №: ЛСР-003012/09 |
Форма выпуска, упаковка и состав
препарата Актемра®
Концентрат для приготовления раствора для инфузий в виде прозрачной или опалесцирующей, бесцветной или светло-желтого цвета жидкости.
Вспомогательные вещества: полисорбат 80 — 0.5 мг, сахароза — 50 мг, натрия гидрофосфата додекагидрат — q.s., натрия дигидрофосфата дигидрат — q.s., вода д/и — q.s.
4 мл — флаконы бесцветного стекла (1) — пачки картонные с вкладышами картонными (перегородками)×.
4 мл — флаконы бесцветного стекла (1) — поддоны пластиковые* (1) — пачки из картона импортного××.
Концентрат для приготовления раствора для инфузий в виде прозрачной или опалесцирующей, бесцветной или светло-желтого цвета жидкости.
Вспомогательные вещества: полисорбат 80 — 0.5 мг, сахароза — 50 мг, натрия гидрофосфата додекагидрат — q.s., натрия дигидрофосфата дигидрат — q.s., вода д/и — q.s.
10 мл — флаконы бесцветного стекла (1) — пачки картонные с вкладышами картонными (перегородками)×.
10 мл — флаконы бесцветного стекла (1) — поддоны пластиковые* (1) — пачки из картона импортного××.
Концентрат для приготовления раствора для инфузий в виде прозрачной или опалесцирующей, бесцветной или светло-желтого цвета жидкости.
Вспомогательные вещества: полисорбат 80 — 0.5 мг, сахароза — 50 мг, натрия гидрофосфата додекагидрат — q.s., натрия дигидрофосфата дигидрат — q.s., вода д/и — q.s.
20 мл — флаконы бесцветного стекла (1) — пачки картонные с вкладышами картонными (перегородками)×.
20 мл — флаконы бесцветного стекла (1) — поддоны пластиковые* (1) — пачки из картона импортного××.
× с целью контроля первого вскрытия на пачку наносится защитная голографическая наклейка.
×× с целью контроля первого вскрытия на пачку наклеивают самоклеящиеся круглые стикеры с надписью «контроль вскрытия» (в случае упаковки на ОАО «Фармстандарт-УфаВИТА»).
* поддоны пластиковые или вкладыши картонные.
Фармакологическое действие
Механизм действия
Тоцилизумаб — рекомбинантное гуманизированное моноклональное антитело к человеческому рецептору интерлейкина-6 (ИЛ-6) из подкласса иммуноглобулинов IgG1. Тоцилизумаб связывается и подавляет как растворимые, так и мембранные рецепторы ИЛ-6 (sIL-6R и mIL-6R). ИЛ-6 является многофункциональным цитокином, вырабатываемым различными типами клеток, и участвует в паракринной регуляции, системных физиологических и патологических процессах, таких как стимуляция секреции Ig, активация Т-клеток, стимуляция выработки белков острой фазы в печени и стимуляция гемопоэза. ИЛ-6 вовлечен в патогенез различных заболеваний, в т.ч. воспалительных заболеваний, остеопороза и новообразований.
Нельзя исключить вероятность отрицательного воздействия тоцилизумаба на противоопухолевую и противоинфекционную защиту организма. Роль ингибирования рецептора ИЛ-6 в развитии опухолей неизвестна.
У пациентов с коронавирусной инфекцией (COVID-19, COronaVIrus Disease 2019), получавших тоцилизумаб в дозе 8 мг/кг однократно, снижение показателя C-реактивного белка (CРБ) до нормальных значений наблюдалось уже на 7 день.
Клиническая эффективность при ревматоидном артрите (РА)
Эффективность препарата у пациентов, получавших тоцилизумаб как в монотерапии, так и в комбинации с метотрексатом (МТ) или базисными противовоспалительными препаратами (БПВП), не зависела от наличия и отсутствия ревматоидного фактора, возраста, пола, расовой принадлежности, числа предшествующих курсов лечения или стадии заболевания. Ответ на терапию возникал быстро (уже на второй неделе), в дальнейшем усиливался и сохранялся более 3 лет в продолжающихся открытых расширенных исследованиях.
У пациентов, получавших тоцилизумаб в дозе 8 мг/кг, существенно снижался индекс активности заболевания по шкале DAS28 по сравнению с пациентами, получавшими плацебо + БПВП. Число пациентов, достигших клинической ремиссии (DAS28 <2.6) на 24 неделе, было значительно больше в группе терапии тоцилизумабом (27.5-33.6%) по сравнению с контрольной группой (0.8-12.1%). К 52 неделе терапии число пациентов, достигших DAS28 <2.6, увеличивается до 47% по сравнению с 33% на 24 неделе терапии. Хороший или удовлетворительный ответ по критериям EULAR отмечался чаще у пациентов, получавших тоцилизумаб, чем получавших плацебо + БПВП.
Через 2 года терапии тоцилизумабом/МТ у 14% пациентов наблюдался значительный клинический ответ (АКР 70 (критерии Американской Коллегии Ревматологов, АКР) сохранялся на протяжении 24 недель и более).
Рентгенологическая оценка
У 83% пациентов, получавших терапию тоцилизумабом/МТ в течение года, не зарегистрировано прогрессирования деструкции суставов (изменение суммарного индекса Шарпа равно нулю или менее) по сравнению с 67% пациентов, получавших плацебо/МТ. Данный результат сохранялся на протяжении 2 лет терапии. У 93% пациентов отсутствовало прогрессирование деструкции суставов между 52 и 104 неделями терапии.
Показатели качества жизни
У пациентов, получавших тоцилизумаб в дозе 8 мг/кг (монотерапия или в сочетании с БПВП), по сравнению с теми, кто получал МТ/БПВП, наблюдалось клинически значимое улучшение функциональной активности (по индексу HAQ-DI), снижение утомляемости (по шкале функциональной оценки терапии хронических заболеваний по показателю утомляемости FACIT-Fatigue), а также улучшение как показателей физического, так и показателей психического здоровья по опроснику SF-36.
Лабораторные показатели
После введения тоцилизумаба происходит быстрое снижение средних значений острофазовых показателей, С-реактивного белка, СОЭ, сывороточного амилоида А и фибриногена, снижение числа тромбоцитов в пределах нормальных значений, а также увеличение гемоглобина, которое в наибольшей степени наблюдалось у пациентов с хронической анемией, связанной с РА.
Клиническая эффективность у пациентов с ранним ревматоидным артритом (рРА), ранее не получавших терапию МТ
При применении тоцилизумаба в монотерапии в дозе 8 мг/кг и тоцилизумаба в дозе 4 или 8 мг/кг каждые 4 недели в комбинации с МТ индекс активности заболевания по шкале DAS28 существенно снижается в группах, получавших тоцилизумаб в дозе 8 мг/кг, по сравнению с пациентами, получавшими монотерапию МТ. Число пациентов, достигших клинической ремиссии (DAS28 <2.6) на 24 неделе, значительно больше в группах, получавших тоцилизумаб (38.7-44.8%), по сравнению с группой монотерапии МТ (15%). К 52 неделе число пациентов, достигших DAS28 <2.6 в группах терапии тоцилизумабом, увеличивается до 39.4-49% по сравнению с 19.5% в группе монотерапии МТ. Число пациентов, достигших ответа АКР 20, 50, 70, также существенно выше в группах терапии тоцилизумабом (70.2-74.5%; 47.6-56.9%; 30.1-38.6% на 24 неделе и 63-67.2%; 49.3-55.9%; 36-43.1% на 52 неделе, соответственно) по сравнению с группой монотерапии МТ (65.2%; 43.2%; 25.4% на 24 неделе и 57.1%; 40.8%; 28.9% на 52 неделе, соответственно).
Рентгенологическая оценка
Отсутствие прогрессирования деструкции суставов (изменение суммарного индекса Шарпа равно нулю или менее) наблюдается у 82-83% пациентов, получавших тоцилизумаб в дозе 8 мг/кг в качестве монотерапии или в комбинации с МТ, по сравнению с 73% пациентов в группе монотерапии МТ.
Показатели качества жизни
Клинически значимое улучшение функциональной активности по индексу HAQ-DI наблюдается у пациентов, получавших тоцилизумаб в дозе 8 мг/кг в качестве монотерапии или комбинации с МТ, по сравнению с теми, кто получал монотерапию МТ.
При монотерапии тоцилизумабом (в дозе 8 мг/кг в/в каждые 4 недели у пациентов с РА, с непереносимостью МТ или при нецелесообразности продолжения терапии МТ (в т.ч. при неадекватном ответе на терапию МТ)) наблюдалось более выраженное статистически значимое снижение активности заболевания по шкале DAS28 по сравнению с монотерапией адалимумабом (в дозе 40 мг п/к каждые 2 недели). Количество пациентов, ответивших на терапию с показателями DAS28 <2.6 и DAS28 ≤3.2, было больше при терапии тоцилизумабом, чем при терапии адалимумабом (39.9% против 10.5% и 51.5% против 19.8%, соответственно). Ответы АКР 20, 50, 70 наблюдались у 65%, 47.2%, 32.5% пациентов, получавших тоцилизумаб, по сравнению с 49.4%, 27.8%, 17.9% пациентов, получавших адалимумаб.
Клиническая эффективность при полиартикулярном ювенильном идиопатическом артрите (пЮИА)
Ответы АКР 30, 50, 70, 90 были получены у 89.4%, 83.0%, 62.2% и 26.1% пациентов, соответственно. Доля пациентов с ответом АКР 30, 50, 70 на 40 неделе терапии относительно показателей на начало терапии составила 74.4%, 73.2% и 64.6% соответственно.
Клиническая эффективность при системном ювенильном идиопатическом артрите (сЮИА)
Эффективность тоцилизумаба для лечения активного сЮИА изучалась в 12-недельном рандомизированном двойном слепом плацебо контролируемом периоде исследования с 2 параллельными группами. На 12 неделе доля пациентов, достигших ответа АКР 30, 50, 70, 90 при ЮИА, также была больше в группе терапии тоцилизумабом, чем в группе плацебо: 90.7% против 24.3%, 85.3% против 10.8%, 70.7% против 8.1%, 37.3% против 5.4%, соответственно (р<0.0001). Ответ на терапию сохранялся и в открытом расширенном периоде исследования.
Системные эффекты
У 85% пациентов, имевших исходно лихорадку, через 12 недель терапии тоцилизумабом лихорадка отсутствовала по сравнению с 21% пациентов, получавших плацебо (р<0.0001). Кроме того, у 64% пациентов, имевших сыпь исходно, через 12 недель терапии тоцилизумабом сыпь отсутствовала по сравнению с 11% пациентов, получавших плацебо (р=0.0008).
Наблюдалось значимое снижение интенсивности болевого синдрома в группе терапии тоцилизумабом по сравнению с плацебо на 12 неделе. Скорректированное среднее изменение оценки боли по визуальной аналоговой шкале (ВАШ) после 12 недель терапии тоцилизумабом соответствовало 41 пункту (от 0 до 100 пунктов) по сравнению с 1 пунктом у пациентов, получавших плацебо (р<0.0001). Системные эффекты сохранялись и в продолжающемся открытом расширенном периоде исследования.
Снижение дозы ГКС
У 8 из 31 пациента в группе плацебо и у 48 из 70 пациентов в группе тоцилизумаба, получавших ГКС исходно, наблюдался ответ АКР 70 при ЮИА на 6 или 8 неделе, что позволило снизить дозу ГКС. При этом 24% пациентов в группе тоцилизумаба и 3% пациентов в группе плацебо смогли снизить дозу ГКС как минимум на 20% без последующего снижения частоты ответа по критериям АКР 30 при ЮИА или возникновения системных проявлений к 12 неделе (р=0.028). Снижение дозы ГКС продолжилось, при этом 44 пациента не получали ГКС на 44 неделе, и ответы АКР не изменялись.
Показатели качества жизни
На 12 неделе доля пациентов в группе тоцилизумаба, демонстрирующих минимальное клинически значимое улучшение показателя по опроснику CHAQ-DI (определенного как снижение индивидуального общего балла на ≥0.13), была значительно выше, чем доля пациентов в группе плацебо — 77% против 19%, соответственно (р<0.0001). Ответы сохранялись и в продолжающемся открытом расширенном периоде исследования.
Лабораторные показатели
Исходно у 67% пациентов из группы тоцилизумаба содержание гемоглобина было ниже нормального диапазона. У 80% из этих пациентов на 12 неделе наблюдалось увеличение Hb в пределах нормального диапазона по сравнению с 7% пациентов в группе плацебо (р<0.0001). У 88% пациентов из группы тоцилизумаба, имевших исходно сниженное содержание гемоглобина, его уровень увеличился на ≥10 г/л к 6 неделе, в группе плацебо частота повышения составила 3% (р<0.0001).
Доля пациентов, имевших исходно тромбоцитоз и у которых на 12 неделе наблюдалось нормальное число тромбоцитов, была выше в группе тоцилизумаба по сравнению с группой плацебо — 90% против 4% (р<0.0001).
После введения тоцилизумаба происходило быстрое снижение средних значений острофазовых показателей: С-реактивного белка, СОЭ и сывороточного амилоида А.
Клиническая эффективность при COVID-19
Исследование совместной исследовательской группы RECOVERY (рандомизированная оценка терапии по поводу COVID-19) у госпитализированных взрослых пациентов с диагнозом COVID-19
Исследование RECOVERY представляло собой крупномасштабное, рандомизированное, контролируемое, открытое, многоцентровое платформенное исследование, проведенное в Великобритании для оценки эффективности и безопасности потенциальных вариантов терапии у госпитализированных взрослых пациентов с тяжелой формой COVID-19. Все пациенты, подходящие для включения в исследование, получали стандартную терапию и прошли начальную (основную) рандомизацию. Пациенты, подходящие для включения в исследование, имели подозреваемую на основании клинических признаков или лабораторно подтвержденную инфекцию SARS-CoV-2 и не имели медицинских противопоказаний к применению любого из рассматриваемых в исследовании видов терапии. Пациенты с клиническими подтверждениями прогрессирующей инфекции COVID-19 (определяемыми как уровень сатурации крови кислородом (SpO2) <92% при дыхании атмосферным воздухом или получение терапии кислородом, а также уровень CРБ≥75мг/л) могли пройти вторую рандомизацию в группы, получавшие либо тоцилизумаб в/в, либо только стандартную терапию.
Анализы эффективности были проведены в популяции в соответствии с назначенным лечением (intent-to-treat, ITT), которая включала в себя 4116 рандомизированных пациентов: 2022 пациента были рандомизированы в группу, получавшую тоцилизумаб + стандартную терапию, 2094 пациента — в группу, получавшую только стандартную терапию. Исходные демографические характеристики и характеристики заболевания популяции ITT были надлежащим образом сбалансированы между группами терапии. Средний возраст участников составлял 63.6 года (стандартное отклонение [СО]: 13.6 года). Большинство пациентов были мужского пола (67%) и относились к европеоидной расе (76%). Медиана (диапазон) значений уровня CРБ составляла 143 мг/л (75-982). На исходном уровне 0.2% (N=9) пациентов не получали дополнительный кислород, 45% пациентов требовалась низкопоточная кислородная терапия, 41% пациентов требовалась высокопоточная кислородная терапия и 14% пациентов требовалась инвазивная искусственная вентиляция легких (ИВЛ); 82% пациентов получали системные ГКС. Наиболее частыми сопутствующими заболеваниями были сахарный диабет (28.4%), заболевание сердца (22.6%) и хроническая болезнь легких (23.3%).
Первичным показателем исхода было время до момента смерти в период до дня 28. Отношение рисков, демонстрирующее сравнение группы, получавшей тоцилизумаб + стандартную терапию, с группой, получавшей только стандартную терапию, составило 0.85 (95% ДИ: от 0.76 до 0.94), статистически значимый результат (р=0.0028). Расчетные показатели вероятности смерти ко дню 28 составили 30.7% и 34.9% в группах, получавших тоцилизумаб и только стандартную терапию соответственно. Расчетная разность рисков составила -4.1% (95% ДИ: от -7.0 до -1.3%), что согласуется с результатами первичного анализа. Отношение рисков в заранее определенной подгруппе пациентов, получавших системные ГКС на исходном уровне, составляло 0.79 (95% ДИ: от 0.70 до 0.89), а в заранее определенной подгруппе пациентов, не получавших системные ГКС на исходном уровне, отношение рисков составило 1.16 (95% ДИ: от 0. 91 до 1.48).
Медиана времени до выписки из стационара составляла 19 дней в группе, получавшей тоцилизумаб + стандартную терапию, и >28 дней в группе, получавшей стандартную терапию (отношение рисков [95% ДИ] = 1.22 [от 1.12 до 1.33]).
Среди пациентов, которым не требовалась инвазивная ИВЛ на исходном уровне, доля пациентов, у которых появилась потребность в ИВЛ или наступила смерть ко дню 28, составляла 35% (619/1754) в группе, получавшей тоцилизумаб + стандартную терапию, и 42% (754/1800) в группе, получавшей только стандартную терапию (отношение рисков [95% ДИ] = 0.84 [от 0.77 до 0.92] р<0.0001).
Исследование ML42528 (EMPACTA)
Исследование ML42528 представляло собой глобальное рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое исследование III фазы по оценке эффективности и безопасности применения тоцилизумаба для в/в введения в комбинации со стандартной терапией у госпитализированных взрослых пациентов с пневмонией, ассоциированной с COVID-19, не находящихся на ИВЛ. Для включения в исследование подходили пациенты в возрасте, по меньшей мере, 18 лет, имевшие инфекцию SARS-CoV-2, подтвержденную положительным результатом теста методом полимеразной цепной реакции с обратной транскриптазой (ОТ-ПЦР), имевшие пневмонию, подтвержденную результатами рентгенологического исследования, и уровень SpO2 <94% при дыхании атмосферным воздухом. Стандартная терапия могла включать в себя противовирусную терапию, применение системных ГКС в низких дозах и поддерживающую терапию. Пациенты были рандомизированы в соотношении 2:1 в группы, получавшие одну инфузию тоцилизумаба в дозе 8 мг/кг, при максимальной дозе 800 мг, либо плацебо. Если клинические признаки или симптомы ухудшались или не улучшались, могла быть введена одна дополнительная инфузия тоцилизумаба или плацебо по слепой схеме через 8-24 ч после проведения первой инфузии.
Из 389 пациентов, которые были рандомизированы, анализы эффективности были проведены в модифицированной популяции в соответствии с назначенным лечением (modified intent-to-treat, mITT), которая включала в себя пациентов, получивших любое количество исследуемого лекарственного препарата (249 пациентов в группе тоцилизумаба; 128 пациентов в группе плацебо). Исходные демографические характеристики и характеристики заболевания были в целом сбалансированы между группами терапии. В популяции mITT (n=377) на момент рандомизации медиана возраста составляла 57 лет (диапазон: от 20 до 95); 59.2% пациентов были мужского пола, 56% пациентов имели испанское или латиноамериканское этническое происхождение, 52.8% пациентов принадлежали к европеоидной расе, 20.4% пациентов были американскими индейцами/представителями коренного населения Аляски, 15.1% пациентов были представителями негроидной расы/афроамериканцами и 1.6% пациентов были представителями монголоидной расы. На исходном уровне 35 (9.3%) пациентов не получали дополнительный кислород, 242 (64.2%) пациентам требовалась низкопоточная кислородная терапия и 100 (26.5%) пациентам требовалась высокопоточная кислородная терапия. Медиана времени с момента возникновения симптомов составляла 8.0 дня. На исходном уровне в обеих группах терапии в совокупности 72.7% пациентов получали системные глюкокортикостероиды и 47.7% пациентов получали ремдесивир. Значения медианы (диапазон) уровня СРВ и ферритина составляли, соответственно, 136.10 мг/л (2.5- 3776.0) и 1.4 пмоль/мл (0.03-122.3). Наиболее частыми сопутствующими заболеваниями были артериальная гипертензия (48.3%), сахарный диабет (40.6%), гиперлипидемия (27.6%) и ожирение (24.4%).
Первичной конечной точкой оценки эффективности была совокупная доля пациентов, у которых появилась потребность в ИВЛ или наступила смерть ко дню 28. Для пациентов, которые получали тоцилизумаб, наблюдалось статистически значимое улучшение в отношении времени до прогрессирования до ИВЛ или смерти в сравнении с пациентами, которые получали плацебо (значение р для логрангового критерия = 0.0360; ОР [95% ДИ] = 0.56 [от 0.33 до 0.97]). Совокупная доля пациентов, у которых появилась потребность в ИВЛ или наступила смерть ко дню 28 (оценка с использованием метода Каплана-Мейера), составила 12.0% (95% ДИ: от 8.52 до 16.86%) в группе, получавшей тоцилизумаб, и 19.3% (95% ДИ: от 13.34 до 27.36%) в группе, получавшей плацебо
Медиана времени до выписки из стационара либо «готовности к выписке» за период до дня 28 составляла 6.0 дня в группе, получавшей тоцилизумаб, и 7.5 дня в группе, получавшей плацебо (отношение рисков =1.16 [95% ДИ: от 0.91 до 1.48]).
Показатель смертности на день 28 составлял 10.4% в группе, получавшей тоцилизумаб, в сравнении с 8.6% в группе, получавшей плацебо (взвешенная разница (группа тоцилизумаба — группа плацебо): 2.0% [95% ДИ: от -5.2 до 7.8%]). Показатель смертности на день 60 (ретроспективный анализ) составлял 11.2% в группе, получавшей тоцилизумаб, в сравнении с 10.9% в группе, получавшей плацебо (взвешенная разница (группа тоцилизумаба — группа плацебо): 0.5% [95% ДИ: от -6.9 до 6.8%]).
Исследование WA42380 (COVACTA)
Исследование WA42380 представляло собой глобальное рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое исследование III фазы по оценке эффективности и безопасности применения тоцилизумаба для внутривенного введения в комбинации со стандартной терапией у взрослых пациентов, госпитализированных с тяжелой пневмонией, ассоциированной с COVID-19. Для включения в исследование подходили пациенты в возрасте, по меньшей мере, 18 лет, имевшие инфекцию SARS-CoV-2, подтвержденную положительным результатом теста методом ОТ-ПЦР, имевшие пневмонию, подтвержденную результатами рентгенологического исследования, и показатель SpO2≤93% при дыхании атмосферным воздухом, либо отношение парциального давления кислорода в артериальной крови к фракции кислорода во вдыхаемом воздухе 300 мм рт. ст. или менее. Стандартная терапия могла включать в себя противовирусную терапию, применение ГКС в низких дозах, применение реконвалесцентной плазмы и другую поддерживающую терапию. Пациенты были рандомизированы в соотношении 2:1 в группы, получавшие одну инфузию тоцилизумаба в дозе 8 мг/кг, при максимальной дозе 800 мг, либо плацебо. Если клинические признаки или симптомы ухудшались или не улучшались, могла быть введена одна дополнительная инфузия тоцилизумаба или плацебо по слепой схеме, через 8-24 часа после проведения первой инфузии.
Из 452 пациентов, которые были рандомизированы, анализы эффективности были проведены в популяции mITT, которая включала в себя пациентов, получивших любое количество исследуемого лекарственного препарата (294 пациента в группе тоцилизумаба; 144 пациента в группе плацебо). Исходные демографические характеристики и характеристики заболевания были в целом сбалансированы между группами терапии. Для популяции mITT в целом (п=438) на момент рандомизации медиана возраста составляла 62 года (диапазон: 22-96, при этом 44.3% пациентов были в возрасте 65 лет или старше); 69.9% пациентов были мужского пола, 32.2% пациентов были испанского или латиноамериканского этнического происхождения, 57.5% пациентов принадлежали к европеоидной расе, 15.1% пациентов были представителями негроидной расы/афроамериканцами и 8.7% пациентов были представителями монголоидной расы. На исходном уровне 3.4% пациентов не получали дополнительный кислород, 27.9% пациентов получали низкопоточную кислородную терапию, 30.4% пациентов находились на неинвазивной ИВЛ или получали высокопоточную кислородную терапию и 38.4% пациентов находились на инвазивной ИВЛ. Медиана времени с момента возникновения симптомов составляла 11.0 дней. На исходном уровне в обеих группах терапии в совокупности 22.4% пациентов получали системные глюкокортикостероиды и 5.7% пациентов получали ремдесивир. Значения медианы (диапазон) уровня ИЛ-6, CРБ и ферритина составляли, соответственно, 85.8 нг/л (3.1-4020), 155.15 мг/л (1.1-499.6) и 2.20 пмоль/мл (0.0-75.3). Наиболее частыми сопутствующими заболеваниями были артериальная гипертензия (62.1%), сахарный диабет (38.1%), нарушения со стороны сердечно-сосудистой системы (28.1%) и ожирение (20.5%).
Первичной конечной точкой для оценки эффективности был клинический статус в день 28, оцениваемый с использованием порядковой шкалы со следующими 7 категориями:
- выписан из стационара (либо «готов к выписке», что определяется как достижение нормальной температуры тела и частоты дыхания, а также стабильного уровня сатурации крови кислородом при дыхании атмосферным воздухом или при использовании ≤2 л дополнительного кислорода);
- в общей палате (или «готов к переводу в общую палату»), без потребности в дополнительном кислороде;
- в общей палате (или «готов к переводу в общую палату»), требуется дополнительный кислород;
- в ОИТ или в общей палате, требуется неинвазивная вентиляция легких или высокопоточная кислородная терапия;
- в отделении интенсивной терапии, требуется интубация или ИВЛ;
- в ОИТ, требуется экстракорпоральная мембранная оксигенация или ИВЛ и дополнительная поддержка органов (например, применение вазопрессорных препаратов, заместительная почечная терапия);
- смерть.
При сравнении группы, получавшей тоцилизумаб, с группой, получавшей плацебо, не было выявлено статистически значимого различия в распределении оценок клинического статуса по порядковой шкале с 7 категориями в день 28. Медиана категории клинического статуса в день 28 была категория 1.0 в группе, получавшей тоцилизумаб, и 2.0 в группе, получавшей плацебо (отношение шансов (ОШ) 1.19 [95% ДИ: 0.81, 1.76]).
Медиана времени до выписки из стационара либо «готовности к выписке» за период до дня 28 составляла 20 дней в группе, получавшей тоцилизумаб, и 28 дней в группе, получавшей плацебо (отношение рисков = 1.35 [95% ДИ: от 1.02 до 1.79]).
Показатель смертности на день 28 составлял 19.7% в группе, получавшей тоцилизумаб, в сравнении с 19.4% в группе, получавшей плацебо (взвешенная разница (группа тоцилизумаба — группа плацебо): 0.3% [95% ДИ: от -7.6 до 8.2]. Показатель смертности на день 60 составлял 24.5% в группе, получавшей тоцилизумаб, в сравнении с 25.0% в группе, получавшей плацебо (взвешенная разница (группа тоцилизумаба — группа плацебо): -0.5% [95% ДИ: от -9.1 до 8.0]).
Исследование WA42511 (REMDACTA)
Исследование WA42511 представляло собой глобальное рандомизированное, двойное слепое, плацебо-контролируемое, многоцентровое исследование III фазы, проведенное с целью оценки эффективности и безопасности применения тоцилизумаба для внутривенного введения в комбинации с ремдесивиром в сравнении с соответствующим плацебо в комбинации с ремдесивиром, у госпитализированных взрослых пациентов с тяжелой пневмонией, ассоциированной с COVID-19. Для включения в исследование подходили пациенты в возрасте, по меньшей мере, 12 лет с подтвержденной инфекцией SARS-CoV-2, включая положительный результат теста методом полимеразной цепной реакции (ПЦР), и пневмонией, подтвержденной результатами рентгенологического исследования, которым требовался дополнительный кислород в количестве >6 л/мин для поддержания уровня SpO2>93%. Пациенты были рандомизированы в соотношении 2:1 в группы, получавшие по слепой схеме либо тоцилизумаб + ремдесивир, либо соответствующее плацебо + ремдесивир. Исследуемую терапию применяли в комбинации со стандартной терапией в соответствии с локальными руководствами (например, ГКС, поддерживающая терапия). Пациенты, распределенные в группу лечения комбинацией тоцилизумаб + ремдесивир, получили одну инфузию тоцилизумаба в дозе 8 мг/кг, при максимальной дозе 800 мг, а пациенты, распределенные в группу лечения комбинацией плацебо + ремдесивир, получили одну инфузию плацебо. В обеих группах в случаях, если клинические признаки или симптомы ухудшались или не улучшались, могла быть введена одна дополнительная инфузия тоцилизумаба или плацебо по слепой схеме, через 8-24 часа после проведения первой инфузии.
Из 649 пациентов, которые были рандомизированы, анализы эффективности были проведены в популяции mITT, которая включала в себя пациентов, получивших любое количество тоцилизумаба/плацебо (430 пациентов в группе лечения комбинацией тоцилизумаб + ремдесивир; 210 пациентов в группе лечения комбинацией плацебо + ремдесивир). Исходные демографические характеристики и характеристики заболевания были в целом сбалансированными между группами терапии. Для популяции mITT в целом (п=640) на момент рандомизации медиана возраста составляла 60 лет (диапазон: от 20 до 93 лет, при этом 38.3% пациентов были в возрасте 65 лет или старше); 63.3% пациентов были мужского пола, 51.6% пациентов были испанского или латиноамериканского этнического происхождения, 67% пациентов принадлежали к европеоидной расе, 10.9% пациентов были представителями негроидной расы/афроамериканцами и 3.4% пациентов были представителями монголоидной расы. На исходном уровне 6.6% пациентов получали низкопоточную кислородную терапию, 79.8% пациентов находились на неинвазивной ИВЛ или получали высокопоточную кислородную терапию и 13.6% пациентов находились на инвазивной ИВЛ. Медиана времени с момента возникновения симптомов составляла 8 дней. На исходном уровне большинство пациентов получали ГКС (84.2% во всех группах терапии в совокупности). Значения медианы (диапазон) уровня CРБ и ферритина составляли 98.20 мг/л (1.3-418.3) и 2.13 пмоль/мл (0.1-30.8) соответственно. Наиболее частыми сопутствующими заболеваниями были артериальная гипертензия (61.7%), сахарный диабет (39.5%) и ожирение (27%).
Первичной конечной точкой для оценки эффективности было время с момента рандомизации до выписки из стационара либо «готовности к выписке» за период до дня 28. Не было выявлено статистически значимой разницы между группами терапии в отношении времени до выписки из стационара либо «готовности к выписке» за период до дня 28 (отношение рисков: 0.965 [95% ДИ: от 0.78 до 1.19]) или времени до начала использования ИВЛ или смерти за период до дня 28 (отношение рисков: 0.980 [95% ДИ: от 0.72 до 1.34]). Показатель смертности на день 28 составлял 18.1% в группе, получавшей тоцилизумаб, в сравнении с 19.5% в группе, получавшей плацебо (взвешенная разница (группа тоцилизумаба — группа плацебо): -1.3% [95% ДИ: от -7.8 до 5.2%]). Показатель смертности на день 60 составлял 22.6% в группе, получавшей тоцилизумаб, в сравнении с 25.7% в группе, получавшей плацебо (взвешенная разница (группа тоцилизумаба — группа плацебо): -3.0% [95% ДИ: от -10.1 до 4%]).
Метаанализ по результатам исследований RECOVERY, EMPACTA (исследование ML42528), COVACTA (исследование WA42380) и REMDACTA (исследование WA42511) для пациентов, получавших терапию системными ГКС на исходном уровне
Метаанализ на уровне исследований был проведен по результатам 3 исследований компании Рош и исследования RECOVERY. Для каждого исследования была введена оценка отношения рисков для времени до момента смерти за период до дня 28 в подгруппе пациентов, получавших системные кортикостероиды на исходном уровне (тоцилизумаб 597 пациентов, и плацебо: 313 пациентов из исследований компании Рош; тоцилизумаб: 1664 пациента, и стандартная терапия: 1721 пациент из исследования RECOVERY).
Комбинированный показатель отношения рисков указывал на то, что терапия тоцилизумабом (п=2261) приводила к относительному уменьшению на 19% риска смерти за период до дня 28 (отношение рисков = 0.81; 95% ДИ: 0.72, 0.90; р=0.0002) в сравнении со стандартной терапией (п=2034).
Рисунок 1. Метаанализ времени до момента смерти за период до дня 28 в субпопуляции пациентов, получавших кортикостероиды на исходном уровне.
Отношение рисков Кокса для исследований компании Рош. Логранговый показатель O-E для исследования RECOVERY, в котором значение ОР было вычислено путем принятия In(ОР) равным (O-E)/V при нормальной дисперсии I/V.
Модель с фиксированными эффектами, в которую In(ОР) был включен в качестве ответа и V — в качестве весов для оценки объединенного эффекта.
СТ — стандартная терапия, ТЦЗ — тоцилизумаб
Источник данных компании Рош:
root/clinical_studies/R04877533/share/pool_COVID19/prod/outdata_vad
Доклинические данные безопасности
Канцерогенность: исследования по изучению канцерогенности тоцилизумаба не проводились. Имеющиеся доклинические данные демонстрируют вклад плейотропного ИЛ-6 в прогрессирование злокачественных новообразований и устойчивость к апоптозу при различных формах рака. Эти данные не предполагают, что лечение тоцилизумабом приводит к существенному риску развития и прогрессирования рака.
Мутагенность: стандартные генотоксические тесты как в прокариотических, так и в эукариотических клетках были отрицательными.
Влияние на фертильность: имеющиеся доклинические данные не предполагают влияния аналогов тоцилизумаба на фертильность. В исследованиях по изучению хронической токсичности у яванских макак и у самок или самцов мышей с недостаточностью ИЛ-6 отрицательного влияния тоцилизумаба на эндокринные или репродуктивные органы не обнаружено.
Тератогенность: не обнаружено прямого или опосредованного неблагоприятного влияния на беременность или внутриутробное развитие при в/в введении тоцилизумаба яванским макакам на ранних сроках гестационного периода.
Прочее: отмечалось незначительное увеличение случаев спонтанного выкидыша/внутриутробной гибели плода при высоком уровне системного кумулятивного воздействия (более чем в 100 раз превышающего таковое у человека) при введении дозы 50 мг/кг/сут в сравнении с плацебо или меньшим уровнем вводимых доз. Частота выкидыша была в пределах исторического контроля для яванских макак, содержащихся в неволе; отдельные случаи выкидыша/внутриутробной гибели не демонстрировали какой-либо взаимосвязи между данными явлениями и дозой или продолжительностью введения тоцилизумаба. Несмотря на то, что ИЛ-6, по-видимому, не играет решающей роли в развитии плода или иммунологической регуляции системы мать-плод, взаимосвязь этих явлений с введением тоцилизумаба не может быть исключена.
Наблюдалась экскреция мышиного аналога тоцилизумаба в молоко лактирующих мышей. Применение мышиного аналога тоцилизумаба не оказывало токсичного действия на ювенильных мышей. В частности, не наблюдалось нарушения роста скелета, иммунной функции и полового развития.
Фармакокинетика
Фармакокинетика тоцилизумаба характеризуется нелинейным выведением, представляющим комбинацию линейного клиренса и выведения по Михаэлис-Ментен. Нелинейная часть выведения тоцилизумаба приводит к более чем дозозависимому увеличению экспозиции. Фармакокинетические параметры тоцилизумаба не меняются с течением времени. Т.к. общий клиренс зависит от концентрации тоцилизумаба в сыворотке, Т1/2 тоцилизумаба также является зависимым от его концентрации и может быть рассчитан только при наличии значения сывороточной концентрации. Популяционный фармакокинетический анализ, проведенный во всех популяциях пациентов, не выявил связи между кажущимся клиренсом и наличием антител к тоцилизумабу.
Ревматоидный артрит
Фармакокинетика тоцилизумаба сопоставима у здоровых добровольцев и пациентов с РА.
Таблица 1. Прогнозируемые средние фармакокинетические параметры (± стандартное отклонение, СО) тоцилизумаба при равновесном состоянии у пациентов с РА
* t на протяжении 4 недель.
При высоких значениях концентрации тоцилизумаба в сыворотке линейный клиренс преобладает над общим клиренсом тоцилизумаба, и конечный Т1/2 составляет приблизительно 21.5 дней (на основе приблизительных параметров популяции пациентов). В то время как после в/в введения Cmax дозозависимо увеличивается между дозами 4 мг/кг и 8 мг/кг каждые 4 недели, более чем дозозависимое увеличение наблюдалось для Cmean и Ctrough. В равновесном состоянии значения Cmean и Ctrough были в 3.2 и 32 раза выше при применении тоцилизумаба в дозе 8 мг/кг по сравнению с дозой 4 мг/кг, соответственно.
Коэффициенты накопления AUC и Cmax после многократного применения тоцилизумаба в дозах 4 мг/кг и 8 мг/кг каждые 4 недели были ниже, чем коэффициенты накопления Ctrough (2.62 и 2.47), благодаря участию нелинейного клиренса при более низких концентрациях тоцилизумаба.
Более 90% равновесного состояния при Cmax достигается после первой в/в инфузии; 90% равновесное состояние при AUCt и Cmean достигается после первой и третьей в/в инфузии тоцилизумаба в дозе 4 мг/кг и 8 мг/кг, соответственно; приблизительно 90% равновесное состояние при Ctrough достигается после четвертой в/в инфузии тоцилизумаба.
Масса тела является значимым фактором, влияющим на фармакокинетику тоцилизумаба. При в/в инфузии, рассчитанной в мг на кг массы тела, у пациента с массой тела ≥100 кг ожидается более высокая средняя экспозиция в равновесном состоянии по сравнению со средним значением в популяции пациентов. Таким образом, не рекомендуется увеличение дозы препарата выше 800 мг на одну инфузию у пациентов с массой тела ≥100 кг (см. раздел «Режим дозирования»).
Полиартикулярный ювенильный идиопатический артрит (пЮИА)
После в/в применения приблизительно 90% равновесное состояние достигается к 12 неделе при введении в дозе 10 мг/кг (масса тела <30 кг) и к 16 неделе при введении в дозе 8 мг/кг (масса тела ≥30 кг).
Таблица 2. Прогнозируемые средние фармакокинетические параметры (± стандартное отклонение, СО) тоцилизумаба при равновесном состоянии у пациентов с пЮИА
* t на протяжении 4 недель.
Системный ювенильный идиопатический артрит
После в/в применения приблизительно 90% равновесное состояние достигается к восьмой неделе при введении в дозе 12 мг/кг и 8 мг/кг 1 раз в 2 недели.
Таблица 3. Прогнозируемые средние фармакокинетические параметры (± стандартное отклонение, СО) тоцилизумаба при равновесном состоянии у пациентов с сЮИА
* t на протяжении 2 недель.
Фармакокинетические параметры тоцилизумаба у пациентов в возрасте до 2 лет были сопоставимы с фармакокинетическими параметрами у пациентов старше 2 лет с массой тела <30 кг при в/в применении тоцилизумаба (в дозе 12 мг/кг каждые 2 недели).
COVID-19
Фармакокинетику тоцилизумаба у взрослых пациентов с COVID-19 оценивали в исследованиях WA42380 (COVATA) и CA42481 (MARIPOSA) посредством популяционного фармакокинетического анализа, в который было включено 380 взрослых пациентов. Пациенты получали одну или две в/в инфузии тоцилизумаба в дозе 8 мг/кг, которые вводили с интервалом, как минимум, 8 ч.
Таблица 4. Расчетные средние (±СО) фармакокинетические параметры после в/в введения тоцилизумаба в дозе 8 мг/кг
В ходе популяционного фармакокинетического анализа масса тела и тяжесть заболевания были определены как значимые ковариаты, которые оказывают влияние на фармакокинетику тоцилизумаба. При режиме дозирования тоцилизумаба 8 мг/кг и максимальной дозой 800 мг в рамках отдельной категории порядковой шкалы (ПШ) по сравнению с пациентами со средней массой тела 80 кг у пациентов с массой тела менее 60 кг экспозиция была на 20% ниже. Экспозиция у пациентов с массой тела более 100 кг находилась в том же диапазоне экспозиций, что и у пациентов со средней массой тела 80 кг. Для пациента с массой тела 80 кг экспозиция снижалась с увеличением тяжести заболевания, для каждой последующей категории ПШ, экспозиция соответственно снижалась на 13%.
Распределение
После в/в введения тоцилизумаб претерпевает двухфазное выведение из системного кровотока. У пациентов с РА Vd в центральной камере составляет 3.5 л, в периферической камере – 2.9 л, а Vd в равновесном состоянии составляет 6.4 л.
У детей с пЮИА Vd в центральной камере составляет 1.98 л, в периферической камере – 2.1 л, а Vd в равновесном состоянии составляет 4.08 л.
У детей с сЮИА Vd в центральной камере составляет 1.87 л, в периферической камере – 2.14 л, а Vd в равновесном состоянии составляет 4.01 л.
У взрослых пациентов с COVID-19 Vd в центральной камере составляет 4.52 л, в периферической камере — 4.23, таким образом, Vd составляет 8.75 л
Выведение
Общий клиренс тоцилизумаба зависит от концентрации и представляет собой сумму линейного и нелинейного клиренса. Линейный клиренс составляет 12.5 мл/ч у пациентов с РА, 5.8 мл/ч у детей с пЮИА и 5.7 мл/ч у детей с сЮИА. Нелинейный клиренс, зависящий от концентрации, имеет наибольшее значение при низких концентрациях тоцилизумаба. При более высоких концентрациях тоцилизумаба преобладает линейный клиренс в связи с насыщением пути нелинейного клиренса. Т.к. общий клиренс зависит от сывороточной концентрации тоцилизумаба, Т1/2 тоцилизумаба также является зависимым от его концентрации и может быть рассчитан только при наличии значения сывороточной концентрации.
При РА зависимый от концентрации кажущийся Т1/2 для тоцилизумаба в равновесном состоянии в дозе 4 мг/кг 1 раз в 4 недели составляет до 11 дней, а для тоцилизумаба в дозе 8 мг/кг 1 раз в 4 недели – до 13 дней. При высоких значениях концентрации тоцилизумаба в сыворотке линейный клиренс преобладает над общим клиренсом тоцилизумаба, и конечный Т1/2 составляет приблизительно 21.5 дней (на основе приблизительных параметров популяции пациентов).
У детей с пЮИА эффективный Т1/2 тоцилизумаба в равновесном состоянии (между введениями в дозе 8 мг/кг для детей с массой тела ≥30 кг или в дозе 10 мг/кг для детей с массой тела <30 кг в равновесном состоянии) составляет до 17 дней.
У детей с сЮИА эффективный Т1/2 тоцилизумаба в равновесном состоянии (между введениями в дозе 8 мг/кг и 12 мг/кг) составляет до 16 дней.
У взрослых пациентов с COVID-19 сывороточные концентрации были ниже предела количественного определения по прошествии 35 дней (в среднем) после введения одной инфузии тоцилизумаба в дозе 8 мг/кг. Средний линейный клиренс в популяционном фармакокинетическом анализе составил 17.6 мл/ч у пациентов с категорией 3 ПШ (ПШ 3 — пациенты, которым требуется поддерживающая терапия кислородом) на исходном уровне, 22.5 мл/ч у пациентов с категорией 4 ПШ (пациенты, которым требуется высокопоточная кислородная терапия или неинвазивная вентиляция легких) на исходном уровне, 29 мл/ч у пациентов с категорией 5 ПШ (пациенты, которым требуется ИВЛ) на исходном уровне, 35 мл/ч у пациентов с категорией 6ПШ (пациенты, которым требуется экстракорпоральная мембранная оксигенация (ЭКМО) или ИВЛ и дополнительная поддержка органов) на исходном уровне.
Фармакокинетика у особых групп пациентов
Пациенты с печеночной недостаточностью. Фармакокинетика тоцилизумаба у пациентов с печеночной недостаточностью не изучалась.
Пациенты с почечной недостаточностью. Специальных исследований у пациентов с почечной недостаточностью не проводилось. У большинства пациентов с РА, учтенных в популяционном фармакокинетическом анализе, была нормальная функция почек или нарушение функции почек легкой степени тяжести (расчетный КК по формуле Кокрофта-Голта), которое не влияло на фармакокинетику тоцилизумаба. Коррекции дозы тоцилизумаба пациентам с нарушением функции почек легкой степени тяжести не требуется.
Пол, раса, пожилой возраст. Популяционный фармакокинетический анализ у взрослых пациентов с РА показал, что возраст, пол и раса не влияют на фармакокинетику тоцилизумаба. Коррекции дозы тоцилизумаба не требуется.
Показания препарата
Актемра®
- ревматоидный артрит со средней или высокой степенью активности у взрослых как в виде монотерапии, так и в комбинации с метотрексатом и/или с другими базисными противовоспалительными препаратами, в т.ч. для торможения рентгенологически доказанной деструкции суставов;
- активный полиартикулярный ювенильный идиопатический артрит у пациентов в возрасте 2 лет и старше как в виде монотерапии, так и в комбинации с метотрексатом;
- активный системный ювенильный идиопатический артрит у пациентов в возрасте 2 лет и старше как в виде монотерапии, так и в комбинации с метотрексатом;
- лечение новой коронавирусной инфекции (COVID-19) у госпитализированных взрослых пациентов, получающих системные глюкокортикоиды, которым требуется поддерживающая терапия кислородом или ИВЛ.
Режим дозирования
Лечение должны назначать медицинские специалисты, имеющие опыт в постановке диагноза и терапии РА, COVID-19, сЮИА и пЮИА.
Препарат предназначен для введения как в амбулаторно-поликлинических, так и в стационарных условиях.
Стандартный режим дозирования
Ревматоидный артрит
Рекомендуемая доза составляет 8 мг/кг массы тела 1 раз в 4 недели.
Не рекомендуется увеличение дозы свыше 800 мг на одну инфузию пациентам с массой тела выше 100 кг (см. раздел «Фармакокинетика»).
Рекомендации по коррекции дозы при изменении лабораторных показателей (см. раздел «Особые указания»)
Повышение активности печеночных ферментов
Низкое АЧН
У пациентов, ранее не получавших лечение препаратом Актемра®, не рекомендуется начинать применение препарата при показателе АЧН ниже 2×109/л.
Низкое число тромбоцитов
COVID-19
Рекомендуемая доза для лечения COVID-19 составляет 8 мг/кг в виде однократной в/в инфузии в течение 60 мин у пациентов, получающих системные ГКС и которым требуется поддерживающая терапия кислородом или ИВЛ (см. раздел «Фармакологическое действие»).
Если клинические признаки или симптомы ухудшаются или не улучшаются после введения одной инфузии, можно ввести дополнительную инфузию препарата Актемра® в дозе 8 мг/кг через, как минимум, 8 ч после первой инфузии.
Не рекомендуется увеличение дозы свыше 800 мг на одну инфузию пациентам с массой тела более 100 кг (см. раздел «Фармакокинетика»).
Применение препарата Актемра® не рекомендуется пациентам с COVID-19, у которых наблюдается любое из следующих отклонений в лабораторных показателях.
Особые группы пациентов
Дети
сЮИА
Рекомендуемая доза у пациентов старше 2 лет составляет 8 мг/кг 1 раз в 2 недели у пациентов с массой тела ≥30 кг или 12 мг/кг 1 раз в 2 недели у пациентов с массой тела <30 кг. Дозу следует рассчитывать исходя из массы тела пациента при каждом введении препарата. Изменение дозы должно быть основано только на соответствующем изменении массы тела пациента с течением времени.
Безопасность и эффективность в/в введения препарата Актемра® у детей в возрасте до 2 лет не установлены.
У пациентов с сЮИА рекомендуется прерывание терапии тоцилизумабом при изменениях в лабораторных показателях, приведенных в таблицах ниже. При необходимости следует изменить дозу одновременно назначаемого МТ и/или других сопутствующих препаратов или прекратить их прием, а также прервать введение тоцилизумаба до оценки клинической ситуации. Решение о прекращении терапии тоцилизумабом при возникновении изменений лабораторных показателей должно основываться на медицинской оценке состояния конкретного пациента, поскольку существует множество сопутствующих заболеваний, которые могут оказывать влияние на лабораторные показатели при сЮИА.
Повышение активности печеночных ферментов
Низкое АЧН
Низкое число тромбоцитов
Клинических данных недостаточно, чтобы оценить влияние снижения дозы тоцилизумаба у пациентов с сЮИА, у которых наблюдались изменения в лабораторных показателях. Имеющиеся данные свидетельствуют о том, что клиническое улучшение наблюдается в течение 6 недель после начала лечения препаратом Актемра®. В случае, если у пациента не наблюдается улучшения в течение данного периода времени, целесообразность продолжения терапии должна быть тщательно пересмотрена.
пЮИА
Рекомендуемая доза у пациентов старше 2 лет составляет 8 мг/кг 1 раз в 4 недели у пациентов с массой тела ≥30 кг или 10 мг/кг 1 раз в 4 недели у пациентов с массой тела <30 кг. Дозу следует рассчитывать исходя из массы тела пациента при каждом введении препарата. Изменение дозы должно быть основано только на соответствующем изменении массы тела пациента с течением времени.
Безопасность и эффективность в/в введения препарата Актемра® у детей в возрасте до 2 лет не установлены.
У пациентов с пЮИА рекомендуется прерывание терапии тоцилизумабом при изменениях лабораторных показателей, приведенных в таблицах ниже. При необходимости следует изменить дозу одновременно назначаемого МТ и/или других сопутствующих препаратов или прекратить их прием, а также прервать введение тоцилизумаба до оценки клинической ситуации. Поскольку существует множество сопутствующих заболеваний, которые могут оказывать влияние на лабораторные показатели при пЮИА, решение о прекращении терапии тоцилизумабом в случае возникновения изменений лабораторных показателей должно основываться на медицинской оценке состояния конкретного пациента.
Повышение активности печеночных ферментов
Низкое АЧН
Низкое число тромбоцитов
Возможность снижения дозы тоцилизумаба в связи с возникновением изменений в лабораторных показателях у пациентов с пЮИА не изучалась.
Имеющиеся данные свидетельствуют о том, что клиническое улучшение наблюдается в течение 12 недель после начала лечения препаратом Актемра®. Целесообразность продолжения терапии должна быть тщательно пересмотрена, если у пациента не наблюдается улучшения в течение данного периода времени.
Пациенты пожилого возраста
Коррекции дозы у пациентов пожилого возраста (≥ 65 лет) не требуется.
Пациенты с нарушением функции почек
Коррекции дозы у пациентов с нарушением функции почек легкой степени тяжести не требуется (см. раздел «Фармакокинетика»). Применение тоцилизумаба у пациентов с умеренным и тяжелым нарушением функции почек не изучалось (см. раздел «Фармакокинетика»).
Пациенты с нарушением функции печени
Безопасность и эффективность тоцилизумаба у пациентов с нарушением функции печени не изучались.
Способ применения
После разведения препарат Актемра® пациентам с РА, сЮИА, пЮИА и COVID-19 следует вводить в виде в/в инфузии в течение 1 ч.
Пациенты с РА, сЮИА, пЮИА и COVID-19 с массой тела ≥30 кг
Препарат Актемра® следует развести до объема 100 мл стерильным апирогенным раствором натрия хлорида 9 мг/мл (0.9%) с соблюдением правил асептики.
Инструкции по разведению лекарственного препарата перед введением представлены ниже.
Пациенты с сЮИА и пЮИА с массой тела <30 кг
Препарат Актемра® следует развести до объема 50 мл стерильным апирогенным раствором натрия хлорида 9 мг/мл (0.9%) с соблюдением правил асептики.
Инструкции по разведению лекарственного препарата перед введением представлены ниже.
При появлении у пациента признаков и симптомов инфузионной реакции следует уменьшить скорость инфузии или прекратить введение препарата и немедленно назначить соответствующие препараты/поддерживающую терапию (см. раздел «Особые указания»).
Приготовление раствора лекарственного препарата
Препарат Актемра® должен вводиться медицинским персоналом. Препарат предназначен для введения как в амбулаторно-поликлинических, так и в стационарных условиях.
Препарат Актемра® в лекарственной форме для внутривенного введения не предназначен для подкожного введения!
Подготовка препарата к введению должна проводиться в асептических условиях.
Перед введением необходимо осмотреть приготовленный раствор на предмет отсутствия посторонних частиц или изменения окраски.
Следует вводить только прозрачный или опалесцирующий бесцветный или светло-желтый раствор без видимых посторонних частиц
Следует использовать стерильную иглу и шприц для приготовления раствора для инфузий препарата Актемра®.
Пациенты с РА и COVID-19
- Рассчитать количество препарата, необходимое для введения пациенту (из расчета 0.4 мл на 1 кг массы тела (0.4 мл/кг)).
- В асептических условиях из инфузионного флакона (пакета), содержащего 100 мл 0.9% раствора натрия хлорида (раствор должен быть стерильным и апирогенным), отобрать одноразовым стерильным шприцем количество 0.9% раствора натрия хлорида, равное рассчитанному для введения количеству препарата Актемра®.
- Другим одноразовым стерильным шприцем в асептических условиях из флакона с препаратом Актемра® отобрать рассчитанное количество препарата и ввести его в инфузионный флакон (пакет) с 0.9% раствором натрия хлорида; в результате объем приготовленного раствора должен быть равным 100 мл.
- Для перемешивания аккуратно перевернуть флакон (пакет) во избежание пенообразования.
Пациенты с пЮИА и сЮИА с массой тела ≥30 кг
- Рассчитать количество препарата, необходимое для введения пациенту (из расчета 0.4 мл на 1 кг массы тела (0.4 мл/кг)).
- В асептических условиях из инфузионного флакона (пакета), содержащего 100 мл 0.9% раствора натрия хлорида (раствор должен быть стерильным и апирогенным), отобрать одноразовым стерильным шприцем количество 0.9% раствора натрия хлорида, равное рассчитанному для введения количеству препарата Актемра®.
- Другим одноразовым стерильным шприцем в асептических условиях из флакона с препаратом Актемра® отобрать рассчитанное количество препарата и ввести его в инфузионный флакон (пакет) с 0.9% раствором натрия хлорида; в результате объем приготовленного раствора должен быть равным 100 мл.
- Для перемешивания аккуратно перевернуть флакон (пакет) во избежание пенообразования.
Пациенты с пЮИА с массой тела <30 кг
- Рассчитать количество препарата, необходимое для введения пациенту (из расчета 0.5 мл на 1 кг массы тела (0.5 мл/кг)).
- В асептических условиях из инфузионного флакона (пакета), содержащего 50 мл 0.9% раствора натрия хлорида (раствор должен быть стерильным и апирогенным), отобрать одноразовым стерильным шприцем количество 0.9% раствора натрия хлорида, равное количеству, рассчитанному для введения препарата Актемра®.
- Другим одноразовым стерильным шприцем в асептических условиях из флакона с препаратом Актемра® отобрать рассчитанное количество препарата и ввести его в инфузионный флакон (пакет) с 0.9% раствором натрия хлорида; в результате объем приготовленного раствора должен быть равным 50 мл.
- Для перемешивания аккуратно перевернуть флакон (пакет) во избежание пенообразования.
Пациенты с сЮИА с массой тела <30 кг
- Рассчитать количество препарата, необходимое для введения пациенту (из расчета 0.6 мл на 1 кг массы тела (0.6 мл/кг)).
- В асептических условиях из инфузионного флакона (пакета), содержащего 50 мл 0.9% раствора натрия хлорида (раствор должен быть стерильным и апирогенным), отобрать одноразовым стерильным шприцем количество 0.9% раствора натрия хлорида, равное количеству, рассчитанному для введения препарата Актемра®.
- Другим одноразовым стерильным шприцем в асептических условиях из флакона с препаратом Актемра® отобрать рассчитанное количество препарата и ввести его в инфузионный флакон (пакет) с 0.9% раствором натрия хлорида; в результате объем приготовленного раствора должен быть равным 50 мл.
- Для перемешивания аккуратно перевернуть флакон (пакет) во избежание пенообразования.
Препарат Актемра® предназначен только для однократного применения.
Правила хранения приготовленного раствора
Приготовленный инфузионный раствор препарата Актемра® физически и химически стабилен в 0.9% растворе натрия хлорида в течение 24 ч при температуре 30°С.
С микробиологической точки зрения приготовленный раствор должен быть использован немедленно.
Если препарат не используется сразу, то время и условия хранения приготовленного раствора являются ответственностью пользователя и не должны превышать 24 ч при температуре от 2°С до 8°С (хранить в холодильнике) и только в том случае, если приготовление раствора проводилось в контролируемых и валидируемых асептических условиях.
Инструкция по уничтожению неиспользованного препарата, а также по истечении срока годности
Попадание лекарственных препаратов в окружающую среду должно быть сведено к минимуму. Не следует утилизировать препарат с помощью сточных вод или вместе с бытовыми отходами. По возможности необходимо использовать специальные системы для утилизации лекарственных препаратов.
Побочное действие
Наиболее часто отмечавшимися нежелательными реакциями (наблюдались у ≥5% пациентов, получавших тоцилизумаб в виде монотерапии или в комбинации с БПВП для лечения РА, сЮИА и пЮИА) были инфекции верхних дыхательных путей, назофарингит, головная боль, артериальная гипертензия и повышение активности АЛТ.
Наиболее серьезными нежелательными реакциями были серьезные инфекции, осложнения дивертикулита и реакции гиперчувствительности.
Наиболее часто отмечавшимися нежелательными реакциями (наблюдались у ≥5% пациентов, получавших тоцилизумаб для лечения COVID-19) были повышение активности печеночных трансаминаз, запор и инфекция мочевыводящих путей.
Нежелательные реакции, выявленные в ходе клинических исследований и/или при пострегистрационном применении препарата Актемра® на основании спонтанных сообщений, случаев, описанных в литературных источниках, и случаев, наблюдаемых в рамках программ неинтервенционных исследований, представлены в таблицах 5 и 6 в соответствии с системно-органной классификацией медицинского словаря для нормативно-правовой деятельности MedDRA. Для описания частоты развития нежелательных реакций используются следующие категории: очень часто (≥1/10); часто (≥1/100, но <1/10), нечасто (≥1/1000, но <1/100), редко (≥1/10000, но <1/1 000), очень редко (<1/10000). В каждой группе (по частоте возникновения) нежелательные реакции представлены в порядке убывания степени их серьезности.
РА
Профиль безопасности тоцилизумаба был изучен в 4 плацебо-контролируемых исследованиях (исследования II, III, IV и V), 1 контролируемом исследовании с применением МТ (исследование I) и в ходе расширенных периодов к данным исследованиям (см. раздел «Фармакологическое действие»).
Двойной слепой контролируемый период исследования составил 6 месяцев в четырех исследованиях (исследования I, III, IV и V) и до 2 лет в одном исследовании (исследование II). В двойных слепых контролируемых исследованиях 774 пациента получали тоцилизумаб в дозе 4 мг/кг в комбинации с МТ, 1870 пациентов получали тоцилизумаб в дозе 8 мг/кг в комбинации с МТ или другими БПВП и 288 пациентов получали тоцилизумаб в дозе 8 мг/кг в качестве монотерапии.
Популяция пациентов с длительной экспозицией препарата включает всех пациентов, которые получили по меньшей мере одну дозу тоцилизумаба во время двойного слепого контролируемого периода или во время открытого расширенного периода. Из 4009 пациентов в данной популяции 3577 пациентов получали терапию в течение по меньшей мере 6 месяцев, 3296 пациентов — в течение по меньшей мере одного года, 2806 пациентов получали терапию в течение по меньшей мере 2 лет и 1222 пациента — в течение 3 лет.
Таблица 5. Перечень нежелательных реакций, наблюдавшихся у пациентов с РА, получавших тоцилизумаб в качестве монотерапии или в комбинации с МТ или другими БПВП в период проведения двойного слепого контролируемого исследования или при пострегистрационном применении
*Включены повышения уровней, собранные в рамках рутинного мониторинга лабораторных показателей (см. текст ниже).
1 См. раздел «Противопоказания».
2 См. раздел «Особые указания».
3 Данная нежелательная реакция была выявлена при пострегистрационном применении, но не наблюдалась в контролируемых клинических исследованиях. Категория частоты была рассчитана исходя из верхней границы 95% доверительного интервала, вычисленного на основании общего количества пациентов, получавших тоцилизумаб в клинических исследованиях.
Инфекции
В 6-месячных контролируемых исследованиях частота возникновения всех инфекций среди пациентов, получавших тоцилизумаб в дозе 8 мг/кг + БПВП, составила 127 явлений на 100 пациенто-лет по сравнению с 112 явлениями на 100 пациенто-лет в группе пациентов, получавших плацебо + БПВП. В популяции пациентов с длительной экспозицией препарата общая частота возникновения инфекций на фоне терапии препаратом Актемра® составила 108 явлений на 100 пациенто-лет экспозиции.
В 6-месячных контролируемых клинических исследованиях частота возникновения серьезных инфекций среди пациентов, получавших тоцилизумаб в дозе 8 мг/кг + БПВП, составила 5.3 явления на 100 пациенто-лет экспозиции по сравнению с 3.9 явления на 100 пациенто-лет экспозиции в группе пациентов, получавших плацебо + БПВП. В исследовании монотерапии частота возникновения серьезных инфекций составила 3.6 явления на 100 пациенто-лет экспозиции в группе пациентов, получавших тоцилизумаб, и 1.5 явления на 100 пациенто-лет экспозиции в группе пациентов, получавших МТ.
В популяции пациентов с длительной экспозицией препарата общая частота возникновения серьезных инфекций (бактериальных, вирусных и грибковых) составила 4.7 явления на 100 пациенто-лет экспозиции. Серьезные инфекции, некоторые из которых были с летальным исходом, включали активный туберкулез в легочной или внелегочной форме, инвазивные легочные инфекции, включая кандидоз, аспергиллез, кокцидиоидомикоз и пневмоцистную пневмонию, пневмонию, воспаление подкожной клетчатки, опоясывающий лишай (Herpes zoster), гастроэнтерит, дивертикулит, сепсис и бактериальный артрит. Сообщалось о случаях возникновения оппортунистических инфекций.
Интерстициальное заболевание легких
Нарушение функции легких может повысить риск развития инфекций. При пострегистрационном применении препарата были получены сообщения о развитии интерстициального заболевания легких (включая пневмонит и фиброз легких); некоторые из этих случаев привели к летальному исходу.
Перфорация ЖКТ
На протяжении 6-месячных контролируемых клинических исследований общая частота возникновения явлений, связанных с перфорацией ЖКТ, составила 0.26 явления на 100 пациенто-лет у пациентов, получавших терапию тоцилизумабом. В популяции пациентов с длительной экспозицией препарата общая частота возникновения явлений, связанных с перфорацией ЖКТ, составила 0.28 явления на 100 пациенто-лет. Случаи перфорации ЖКТ у пациентов, получавших тоцилизумаб, в основном, как отмечалось, были представлены в виде осложнений дивертикулита, включая генерализованный гнойный перитонит, перфорацию нижних отделов ЖКТ, свищ и абсцесс.
Инфузионные реакции
В 6-месячных контролируемых исследованиях нежелательные явления, связанные с инфузиями (отдельные явления, возникшие во время инфузии или в течение 24 ч после инфузии), отмечались у 6.9% пациентов в группе, получавшей тоцилизумаб в дозе 8 мг/кг + БПВП, и у 5.1% пациентов в группе, получавшей плацебо + БПВП. Явления, возникшие во время инфузии, преимущественно представляли собой эпизоды повышения АД; явления, возникшие в течение 24 ч после завершения инфузии, представляли собой головную боль и реакции со стороны кожи (сыпь, крапивница). Эти реакции не приводили к ограничению терапии.
Частота возникновения анафилактических реакций (которые наблюдались в общей сложности у 8 из 4009 пациентов, 0.2%) была в несколько раз выше в группе, получавшей препарат в дозе 4 мг/кг, в сравнении с группой, получавшей препарат в дозе 8 мг/кг. Клинически значимые реакции гиперчувствительности, связанные с введением тоцилизумаба и потребовавшие прекращения терапии, отмечались в общей сложности у 56 из 4009 пациентов (1.4%), получавших тоцилизумаб в ходе контролируемых и открытых клинических исследований. Данные реакции наблюдались, как правило, в период между второй и пятой инфузией тоцилизумаба (см. раздел «Особые указания»). При пострегистрационном применении тоцилизумаба отмечались случаи анафилаксии с летальным исходом (см. раздел «Особые указания»).
Иммуногенность
В общей сложности у 2876 пациентов были проведены анализы на антитела к тоцилизумабу в рамках 6-месячных контролируемых клинических исследований. Из 46 пациентов (1.6%) с антителами к тоцилизумабу в 6 случаях отмечалась значимая лекарственная реакция гиперчувствительности, приведшая в 5 случаях к прекращению лечения. У 30 пациентов (1.1%) выработались нейтрализующие антитела.
Отклонения показателей общего анализа крови
Нейтрофилы. В 6-месячных контролируемых исследованиях явления снижения числа нейтрофилов до уровня ниже 1×109/л отмечались у 3.4% пациентов, получавших тоцилизумаб в дозе 8 мг/кг + БПВП, в сравнении с <0.1% пациентов, получавших плацебо + БПВП. Примерно у половины пациентов снижение АЧН ниже 1×109/л возникло в пределах 8 недель после начала терапии. О снижении числа нейтрофилов ниже 0.5×109/л сообщалось у 0.3% пациентов, получавших тоцилизумаб в дозе 8 мг/кг + БПВП. Сообщалось о случаях инфекций, сопровождавшихся нейтропенией.
Во время двойного слепого контролируемого периода и при длительной экспозиции характер и частота возникновения явлений, связанных с уменьшением показателя нейтрофилов, оставались такими же, как и в 6-месячных контролируемых клинических исследованиях.
Тромбоциты. В 6-месячных контролируемых исследованиях явления снижения числа тромбоцитов до уровня ниже 100 ×103/мкл отмечались у 1.7% пациентов, получавших тоцилизумаб в дозе 8 мг/кг + БПВП, в сравнении с <1% пациентов, получавших плацебо + БПВП. Эти явления снижения уровня тромбоцитов не сопровождались развитием эпизодов кровотечений.
Во время двойного слепого контролируемого периода и при длительной экспозиции характер и частота возникновения явлений, связанных с уменьшением числа тромбоцитов, оставались такими же, как и в 6-месячных контролируемых клинических исследованиях. При пострегистрационном применении в очень редких случаях сообщалось об эпизодах панцитопении.
Повышение активности печеночных трансаминаз
В ходе 6-месячных контролируемых исследований наблюдалось транзиторное повышение показателей АЛТ/АСТ выше 3×ВГН у 2.1% пациентов, получавших тоцилизумаб в дозе 8 мг/кг, в сравнении с 4.9% пациентов, получавших МТ, и у 6.5% пациентов, получавших тоцилизумаб в дозе 8 мг/кг + БПВП, в сравнении с 1.5% пациентов, получавших плацебо + БПВП. Присоединение к монотерапии тоцилизумабом препаратов, обладающих потенциальным гепатотоксическим действием (например, МТ), приводило к увеличению частоты случаев повышения активности трансаминаз. Повышение показателей АЛТ/АСТ более чем в 5 раз относительно ВГН наблюдалось у 0.7% пациентов, получавших монотерапию тоцилизумабом, и у 1.4% пациентов, получавших тоцилизумаб + БПВП; в большинстве из этих случаев терапия тоцилизумабом была отменена.
В течение двойного слепого контролируемого периода исследования частота случаев повышения уровня непрямого билирубина выше ВГН, оцениваемых в рамках рутинного мониторинга лабораторных показателей, составила 6.2% у пациентов, получавших тоцилизумаб в дозе 8 мг/кг + БПВП. У 5.8% пациентов наблюдалось повышение уровня непрямого билирубина в диапазоне от >1 до 2 ×ВГН, а у 0.4% — >2×ВГН.
Во время двойного слепого контролируемого периода и при длительной экспозиции характер и частота возникновения явлений, связанных с повышением активности АЛТ/АСТ, оставались такими же, как и в 6-месячных контролируемых клинических исследованиях.
Показатели липидного обмена
В ходе 6-месячных контролируемых исследований часто сообщалось о повышении показателей липидного обмена, таких как общий холестерин, триглицериды, ЛПНП и/или ЛПВП. При рутинном мониторинге лабораторных показателей примерно у 24% пациентов, получавших препарат Актемра® в рамках проведения клинических исследований, наблюдалось стойкое повышение уровня общего холестерина ≥6.2 ммоль/л, а у 15% — стойкое повышение уровня ЛПНП до ≥4.1 ммоль/л. Повышение, наблюдавшееся в показателях липидного обмена, реагировало на лечение гиполипидемическими препаратами.
Во время двойного слепого контролируемого периода и при длительной экспозиции характер и частота возникновения явлений, связанных с повышением показателей, характеризующих липидный обмен, оставались такими же, как и в 6-месячных контролируемых клинических исследованиях.
Злокачественные новообразования
Клинических данных недостаточно для оценки потенциальной частоты возникновения злокачественных новообразований после применения тоцилизумаба. Оценка долгосрочной безопасности терапии продолжается.
Кожные реакции
При пострегистрационном применении в редких случаях сообщалось об эпизодах синдрома Стивенса-Джонсона.
COVID-19
Оценка безопасности применения препарата Актемра® у пациентов с COVID-19 была основана на результатах, полученных в 3 рандомизированных двойных слепых плацебо-контролируемых исследованиях (исследования ML42528, WA42380 и WA42511).
В общей сложности 974 пациента получили терапию препаратом Актемра® в рамках проведения данных исследований. Сбор данных по безопасности в рамках проведения исследования RECOVERY был ограничен и здесь не представлен.
Следующие нежелательные реакции, перечисленные в соответствии с системно-органной классификацией медицинского словаря для нормативно-правовой деятельности MedDRA в таблице 6, были отнесены к событиям, которые наблюдались не менее чем у 3% пациентов, получавших терапию препаратом Актемра®, и чаще, чем у пациентов, получавших плацебо, в объединенной популяции пациентов для оценки безопасности применения препарата в рамках проведения клинических исследований ML42528, WA42380 и WA42511.
Таблица 6. Перечень нежелательных реакций1, выявленных в объединенной популяции для оценки безопасности в рамках проведения клинических исследований препарата Актемра® у пациентов COVID-192
1 Пациенты учитываются один раз в каждой категории независимо от количества реакций.
2 Включены реакции, о которых сообщалось в исследованиях WA42511, WA42380 и ML42528.
Описание отдельных нежелательных реакций
Инфекции
В объединенной популяции пациентов для оценки безопасности в ходе проведения исследований ML42528, WA42380 и WA42511 частота событий, связанных с инфекциями/серьезными инфекциями, была сбалансирована между пациентами с COVID-19, получавшими тоцилизумаб (30.3%/18.6%, n = 974) и плацебо (32.1%/22.8%, n = 483). Профиль безопасности, наблюдаемый на исходном уровне в группе, получавшей лечение системными ГКС, соответствовал профилю безопасности применения тоцилизумаба в общей популяции, представленному в таблице 6. В данной подгруппе инфекции и серьезные инфекции наблюдались у 27.8% и 18.1% пациентов, получавших тоцилизумаб в/в, и у 30.5% и 22.9% пациентов, получавших плацебо, соответственно.
Изменения лабораторных показателей
Частота изменений, наблюдаемых в лабораторных показателях, была в целом сходной между пациентами с COVID-19, получившими в/в одну или две дозы препарата Актемра®, по сравнению с теми, кто получал плацебо в рандомизированных двойных слепых плацебо-контролируемых исследованиях, за редким исключением. Снижение числа тромбоцитов и нейтрофилов, а также повышение активности АЛТ и АСТ чаще наблюдалось у пациентов, получавших препарат Актемра®, по сравнению с плацебо (см. разделы «Режим дозирования» и «Особые указания»).
сЮИА и пЮИА
Профиль безопасности применения тоцилизумаба в популяции детей обобщен ниже в разделах, касающихся пЮИА и сЮИА. В целом, нежелательные реакции у пациентов с пЮИА и сЮИА были схожи по типу с теми, которые наблюдались у пациентов с РА (см. раздел «Побочное действие» выше).
Нежелательные реакции у пациентов с пЮИА и сЮИА, получавших тоцилизумаб, перечислены в таблице 7 и представлены в соответствии с системно-органной классификацией медицинского словаря для нормативно-правовой деятельности MedDRA. Для описания частоты развития нежелательных реакций используются следующие категории: очень часто (≥1/10); часто (≥1/100, но <1/10) и нечасто (≥1/1000, но <1/100).
Таблица 7. Перечень нежелательных реакций, наблюдавшихся у пациентов с сЮИА или пЮИА, получавших тоцилизумаб в качестве монотерапии или в комбинации с МТ
1 Инфузионные реакции у пациентов с пЮИА включали головную боль, тошноту и повышение АД, но не ограничивались ими.
2 Инфузионные реакции у пациентов с сЮИА включали сыпь, крапивницу, диарею, дискомфорт в эпигастрии, артралгию и головную боль, но не ограничивались ими.
пЮИА
Профиль безопасности препарата Актемра® в/в при пЮИА был изучен у 188 пациентов в возрасте от 2 до 17 лет. Общая продолжительность воздействия препарата на пациентов составила 184.4 пациенто-лет. Частота развития нежелательных реакций у пациентов с пЮИА представлена в таблице 7. Типы нежелательных реакций, наблюдавшихся у пациентов с пЮИА, были аналогичны тем, которые наблюдались у пациентов с РА и сЮИА (см. раздел «Побочное действие» выше). По сравнению с популяцией взрослых пациентов с РА в популяции пациентов с пЮИА чаще регистрировались такие явления, как назофарингит, головная боль, тошнота и снижение числа нейтрофилов. Случаи повышения уровня холестерина в популяции пациентов с пЮИА отмечались реже, чем в популяции взрослых пациентов с РА.
Инфекции
Частота возникновения инфекций в популяции всех пациентов, получавших тоцилизумаб, составила 163.7 явления на 100 пациенто-лет. Наиболее часто регистрируемыми явлениями были назофарингит и инфекции верхних дыхательных путей. Частота возникновения серьезных инфекций была численно выше у пациентов с массой тела <30 кг, получавших тоцилизумаб в дозе 10 мг/кг (12.2 явления на 100 пациенто-лет), в сравнении с пациентами с массой тела ≥30 кг, получавшими тоцилизумаб в дозе 8 мг/кг (4.0 явления на 100 пациенто-лет). Частота возникновения инфекций, которые привели к прерыванию терапии, также была численно выше среди пациентов с массой тела <30 кг, получавших тоцилизумаб в дозе 10 мг/кг (21.4%), в сравнении с пациентами с массой тела >30 кг, получавшими тоцилизумаб в дозе 8 мг/кг (7.6%).
Инфузионные реакции
У пациентов с пЮИА инфузионные реакции определяют, как все явления, развившиеся во время инфузии или в течение 24 часов после инфузии. В популяции всех пациентов, получавших тоцилизумаб, у 11 пациентов (5.9%) развились инфузионные реакции во время инфузии, а у 38 пациентов (20.2%) данное явление развилось в течение 24 ч после инфузии. Наиболее частыми явлениями, развившимися во время инфузии, были головная боль, тошнота и артериальная гипотензия, а наиболее частыми явлениями, развившимися в течение 24 ч после инфузии, были головокружение и артериальная гипотензия. В целом, нежелательные реакции, наблюдавшиеся во время инфузии или в течение 24 ч после нее, были сходными по характеру с нежелательными реакциями, наблюдавшимися у пациентов с РА и сЮИА (см. раздел «Побочное действие» выше).
О клинически значимых реакциях гиперчувствительности, связанных с тоцилизумабом и требующих прекращения лечения, не сообщалось.
Иммуногенность
У одного пациента из группы, получавшей тоцилизумаб в дозе 10 мг/кг, с массой тела <30 кг, был получен положительный результат анализа на антитела к тоцилизумабу, без развития реакции гиперчувствительности; впоследствии этот пациент был исключен из исследования.
Нейтрофилы
В ходе рутинного мониторинга лабораторных показателей в популяции всех пациентов, получавших тоцилизумаб, снижение числа нейтрофилов до уровня ниже 1×109/л наблюдалось у 3.7% пациентов.
Тромбоциты
В ходе рутинного мониторинга лабораторных показателей в популяции всех пациентов, получавших тоцилизумаб, у 1% пациентов наблюдалось снижение числа тромбоцитов до уровня ≤ 50×103/мкл, которое не сопровождалось развитием эпизодов кровотечений.
Повышение активности печеночных трансаминаз
В ходе рутинного мониторинга лабораторных показателей в популяции всех пациентов, получавших тоцилизумаб, явления, связанные с повышением активности АЛТ или АСТ до уровня ≥3×ВГН, наблюдались у 3.7% и <1% пациентов соответственно.
Показатели липидного обмена
В ходе рутинного мониторинга лабораторных показателей, выполняемого в рамках проведения исследования препарата Актемра® в/в (исследование WA19977), у 3.4% и 10.4% пациентов наблюдалось повышение ЛПНП до уровня ≥130 мг/дл и общего холестерина до уровня ≥200 мг/дл в любой временной точке в ходе терапии, выполняемой в рамках исследования, соответственно, по сравнению с исходным уровнем.
сЮИА
Профиль безопасности препарата Актемра® в/в при сЮИА был изучен у 112 пациентов в возрасте от 2 до 17 лет. В 12-недельной двойной слепой контролируемой части исследования 75 пациентов получали терапию тоцилизумабом (8 мг/кг или 12 мг/кг в зависимости от массы тела). По прошествии 12 недель или в момент перехода на терапию препаратом Актемра® из-за ухудшения течения заболевания пациенты получили лечение в рамках открытого расширенного периода исследования.
В целом, нежелательные реакции у пациентов с сЮИА были схожи по типу с теми, которые наблюдались у пациентов с РА (см. раздел «Побочное действие» выше). Частота развития нежелательных реакций у пациентов с сЮИА представлена в таблице 7. По сравнению с популяцией взрослых пациентов с РА, у пациентов с сЮИА чаще наблюдались назофарингит, снижение числа нейтрофилов, повышение активности печеночных трансаминаз и диарея. Случаи повышения уровня холестерина в популяции пациентов с сЮИА отмечались реже, чем в популяции взрослых пациентов с РА.
Инфекции
В 12-недельной контролируемой фазе исследования частота возникновения всех инфекций в группе пациентов, получавших препарат Актемра® в/в, составила 344.7 случая на 100 пациенто-лет и 287.0 случая на 100 пациенто-лет в группе пациентов, получавших плацебо. В ходе открытого расширенного периода исследования (часть II) общая частота возникновения инфекций осталась сходной и составила 306.6 случая на 100 пациенто-лет.
В 12-недельной контролируемой фазе исследования частота возникновения серьезных инфекций в группе пациентов, получавших в/в препарат Актемра®, составила 11.5 случая на 100 пациенто-лет. Через один год в ходе открытого расширенного периода исследования общая частота возникновения серьезных инфекций осталась стабильной и составила 11.3 случая на 100 пациенто-лет. Серьезные инфекции были сходными с серьезными инфекциями, наблюдавшимися у пациентов с РА, дополнительно отмечались случаи ветряной оспы и отита среднего уха.
Инфузионные реакции
Инфузионные реакции определяют, как все явления, развившиеся во время инфузии или в течение 24 ч после нее. В 12-недельной контролируемой фазе исследования у 4% пациентов из группы, получавшей тоцилизумаб, отмечались явления, произошедшие во время инфузии. Одно явление (ангионевротический отек) было оценено как серьезное и жизнеугрожающее, и пациент был исключен из исследования.
В 12-недельной контролируемой фазе исследования у 16% пациентов из группы, получавшей тоцилизумаб, и у 5.4% пациентов из группы, получавшей плацебо, инфузионная реакция развилась в течение 24 ч после инфузии. В группе, получавшей тоцилизумаб, явления включали сыпь, крапивницу, диарею, дискомфорт в эпигастрии, артралгию и головную боль (но не ограничиваясь ими). Одно из этих явлений (крапивница) было оценено как серьезное.
Клинически значимые реакции гиперчувствительности, связанные с введением тоцилизумаба и потребовавшие прекращения терапии, отмечались у 1 из 112 пациентов (<1%), получавших тоцилизумаб в ходе контролируемого исследования, включая открытое клиническое исследование.
Иммуногенность
У всех 112 пациентов на исходном уровне был проведен анализ на антитела к тоцилизумабу. У двух пациентов были обнаружены антитела к тоцилизумабу, при этом у одного из этих пациентов развилась реакция гиперчувствительности, которая привела к прекращению терапии. Частота образования антител к тоцилизумабу может быть недооценена из-за влияния тоцилизумаба на результаты анализа и более высокой концентрации препарата, наблюдаемой у детей по сравнению со взрослыми.
Нейтрофилы
В ходе рутинного мониторинга лабораторных показателей, выполняемого в рамках 12-недельной контролируемой фазы исследования, снижение числа нейтрофилов до уровня ниже 1×109/л наблюдалось у 7% пациентов из группы, получавшей тоцилизумаб; в группе, получавшей плацебо, такого снижения не наблюдалось.
В ходе открытого расширенного периода исследования уменьшение числа нейтрофилов до уровня ниже 1×109/л наблюдалось у 15% пациентов из группы, получавшей тоцилизумаб.
Тромбоциты
В ходе рутинного мониторинга лабораторных показателей, выполняемого в рамках 12-недельной контролируемой фазы исследования, у 3% пациентов из группы, получавшей плацебо, и у 1% пациентов из группы, получавшей тоцилизумаб, наблюдалось снижение числа тромбоцитов до уровня ≤100×103/мкл.
В ходе открытого расширенного периода исследования у 3% пациентов из группы, получавшей тоцилизумаб, наблюдалось снижение числа тромбоцитов до уровня ниже 100×103/мкл, которое не сопровождалось развитием эпизодов кровотечений.
Повышение активности печеночных трансаминаз
В ходе рутинного мониторинга лабораторных показателей, выполняемого в рамках 12-недельной контролируемой фазы исследования, явления, связанные с повышением активности АЛТ или АСТ до уровня ≥3×ВГН, наблюдались у 5% и 3% пациентов соответственно в группе, получавшей тоцилизумаб, и у 0% пациентов в группе, получавшей плацебо.
В ходе открытого расширенного периода исследования явления, связанные с повышением активности АЛТ или АСТ до уровня ≥3×ВГН, наблюдались у 12% и 4% пациентов соответственно в группе, получавшей тоцилизумаб.
Иммуноглобулин G
Уровень IgG снижается во время терапии. Снижение до нижней границы нормы было отмечено у 15 пациентов в определенный момент исследования.
Показатели липидного обмена
В ходе рутинного мониторинга лабораторных показателей, выполняемого в рамках 12-недельной контролируемой фазы исследования (исследование WA18221), у 13.4% и 33.3% пациентов наблюдалось повышение ЛПНП до уровня ≥130 мг/дл и общего холестерина до уровня ≥200 мг/дл в любой временной точке в ходе терапии, выполняемой в рамках исследования, соответственно, по сравнению с исходным уровнем.
В ходе открытого расширенного периода исследования (исследование WA18221) у 13.2% и 27.7% пациентов наблюдалось повышение ЛПНП до уровня ≥130 мг/дл и общего холестерина до уровня ≥200 мг/дл в любой временной точке в ходе терапии, выполняемой в рамках исследования, соответственно.
Противопоказания к применению
- повышенная чувствительность к тоцилизумабу, любому компоненту препарата в анамнезе;
- активные инфекционные заболевания (в т.ч. туберкулез), за исключением COVID-19;
- детский возраст до 2 лет для пациентов с полиартикулярным ювенильным идиопатическим артритом и системным ювенильным идиопатическим артритом;
- возраст до 18 лет для пациентов с ревматоидным артритом;
- комбинация с ингибиторами ФНОα или применение в течение 1 месяца после лечения анти-ФНО антителами;
- детский возраст до 18 лет для пациентов с новой коронавирусной инфекцией (COVID-19) (данные отсутствуют);
- повышение активности печеночных ферментов в ≥10 раз от ВГН; абсолютное число нейтрофилов (АЧН) <1×109/л; число тромбоцитов <50×103/мкл (COVID-19).
С осторожностью
Рецидивирующие или хронические инфекции в анамнезе, а также сопутствующие заболевания (например, дивертикулит, сахарный диабет и интерстициальное заболевание легких), предрасполагающие к развитию инфекций.
Язвенное поражение органов ЖКТ или дивертикулит в анамнезе.
Активное заболевание печени или печеночная недостаточность.
Показатели АЛТ или АСТ, превышающие ВГН более чем в 1.5 раза.
Уровень тромбоцитов ниже 100×103/мкл.
Применение при беременности и кормлении грудью
Беременность
Безопасность и эффективность применения препарата Актемра® при беременности изучены недостаточно. Исследования у обезьян не обнаружили дисморфогенетического потенциала препарата Актемра®. Однако при введении препарата в высоких дозах обнаружен повышенный риск спонтанного выкидыша/внутриутробной гибели. Значение данной информации для людей неизвестно (см. раздел «Фармакологическое действие»).
Не следует применять тоцилизумаб во время беременности, за исключением тех случаев, когда имеется очевидная клиническая необходимость.
Период грудного вскармливания
Неизвестно, выводится ли препарат Актемра® с грудным молоком у человека. Несмотря на выделение эндогенных IgG в грудное молоко, системная абсорбция препарата при грудном вскармливании маловероятна в связи с быстрой протеолитической деградацией таких белков в системе пищеварения.
При принятии решения о продолжении/прерывании кормления грудью или продолжении/отмене терапии тоцилизумабом следует принимать во внимание пользу от грудного вскармливания для ребенка и пользу от продолжения терапии для матери.
Применение при нарушениях функции печени
Противопоказание: повышение активности печеночных ферментов в ≥10 раз от ВГН; абсолютное число нейтрофилов (АЧН) <1×109/л; число тромбоцитов <50×103/мкл (COVID-19).
С осторожностью: активное заболевание печени или печеночная недостаточность
Применение при нарушениях функции почек
Применение тоцилизумаба у пациентов с почечной недостаточностью умеренной и тяжелой степени не изучалось.
Специальных исследований у пациентов с почечной недостаточностью не проводилось. У большинства пациентов с РА, учтенных в популяционном фармакокинетическом анализе, была нормальная функция почек или нарушение функции почек легкой степени тяжести (расчетный КК по формуле Кокрофта-Голта), которое не влияло на фармакокинетику тоцилизумаба. Коррекции дозы тоцилизумаба пациентам с нарушением функции почек легкой степени тяжести не требуется.
Применение у детей
Противопоказания: детский возраст до 2 лет для пациентов с полиартикулярным ювенильным идиопатическим артритом и системным ювенильным идиопатическим артритом; возраст до 18 лет для пациентов с ревматоидным артритом; детский возраст до 18 лет для пациентов с COVID-19.
Применение у пожилых пациентов
Коррекции дозы у пациентов пожилого возраста (65 лет и старше) не требуется.
Особые указания
В медицинской документации пациента следует указывать торговое наименование препарата (Актемра®) и номер серии.
РА, пЮИА и сЮИА
Инфекции
У пациентов, получающих иммуносупрессанты (в т.ч. препарат Актемра®) отмечались серьезные случаи возникновения инфекций, некоторые из них с летальным исходом (см. раздел «Побочное действие»). Не следует начинать лечение препаратом Актемра® пациентам с активными инфекциями (см. раздел «Противопоказания»). Введение препарата Актемра® должно быть приостановлено в случае развития у пациента серьезной инфекции, до момента взятия инфекции под контроль (см. раздел «Побочное действие»). Медицинским работникам следует соблюдать осторожность при рассмотрении вопроса о применении препарата Актемра® у пациентов с рецидивирующими или хроническими инфекциями в анамнезе, а также с сопутствующими заболеваниями (например, дивертикулитом, сахарным диабетом и интерстициальным заболеванием легких), предрасполагающих к развитию инфекций.
Следует проявлять особую осторожность с целью своевременного выявления серьезных инфекций у пациентов, получающих терапию биологическими препаратами, поскольку признаки или симптомы острого воспаления могут быть стерты в связи с подавлением реакции острой фазы. Следует учитывать влияние тоцилизумаба на уровень CРБ, число нейтрофилов и на признаки и симптомы развития инфекций при обследовании пациента на предмет возможного развития инфекции.
Необходимо проинструктировать пациентов (включая детей раннего возраста с сЮИА или пЮИА, которые не всегда способны описать симптомы) и родителей/опекунов пациентов с пЮИА или сЮИА о немедленном обращении к врачу при любых симптомах, свидетельствующих о появлении инфекции, с целью обеспечения быстрой диагностики и назначения необходимого лечения.
Туберкулез
Как и при назначении других биологических препаратов, перед началом терапии препаратом Актемра® пациенты с РА, сЮИА и пЮИА должны пройти на латентный туберкулез. Пациенты, у которых был выявлен латентный туберкулез, должны пройти стандартный курс антимикобактериальной терапии перед началом лечения препаратом Актемра®. Лечащему врачу следует помнить о риске получения ложноотрицательных результатов туберкулиновой кожной пробы и квантиферонового теста, особенно у пациентов с тяжелыми заболеваниями или ослабленным иммунитетом. Пациенты должны быть проинструктированы о необходимости обратиться к врачу, если признаки/симптомы (например, стойкий кашель, истощение/снижение массы тела, субфебрильная температура), указывающие на туберкулезную инфекцию, возникают во время или после терапии препаратом Актемра®.
Реактивация вирусных инфекций
Были описаны случаи реактивации вирусной инфекции (например, вирусного гепатита В) при применении биологических препаратов для лечения РА. Пациенты, имевшие положительный результат при скрининговом обследовании на гепатит, не включались в клинические исследования тоцилизумаба.
Осложнения дивертикулита
О случаях перфорации дивертикула, как осложнения дивертикулита при применении препарата Актемра® у пациентов с РА, сообщалось нечасто (см. раздел «Побочное действие»). Следует соблюдать осторожность при применении препарата Актемра® у пациентов с язвенным поражением органов ЖКТ или дивертикулитом в анамнезе. Пациенты с симптомами, возможно указывающими на осложнения дивертикулита, такими как боль в животе, кровотечение и/или необъяснимые изменения в частоте и характере стула, сопровождающиеся повышением температуры тела, должны быть немедленно обследованы с целью раннего выявления дивертикулита, который может быть связан с перфорацией ЖКТ.
Реакции гиперчувствительности
При инфузии препарата Актемра® наблюдались серьезные реакции гиперчувствительности (см. раздел «Побочное действие»). Такие реакции могут быть более тяжелыми и потенциально летальными у пациентов, у которых наблюдались реакции гиперчувствительности во время предшествующих инфузий, даже если они получали премедикацию стероидами и антигистаминными препаратами. Должно быть предусмотрено наличие необходимого оборудования и персонала для оказания экстренной помощи в случае развития анафилактической реакции во время терапии препаратом Актемра®. При возникновении анафилактической реакции или другой серьезной реакции гиперчувствительности/серьезной инфузионной реакции, введение препарата Актемра® следует немедленно прекратить, при этом терапия препаратом Актемра® должна быть отменена.
Активные заболевания печени и печеночная недостаточность
Терапия препаратом Актемра®, особенно одновременно с МТ, может быть ассоциирована с повышением активности печеночных трансаминаз, поэтому следует проявлять осторожность у пациентов с активным заболеванием печени или печеночной недостаточностью (см. разделы «Режим дозирования», «Побочное действие»).
Гепатотоксичность
При лечении препаратом Актемра® часто наблюдалось преходящее или периодическое легкое и умеренное повышение активности печеночных трансаминаз (см. раздел «Побочное действие»). Частота возникновения такого повышения возрастала при применении препарата Актемра® совместно с препаратами, обладающими потенциально гепатотоксическим действием (например, МТ). При наличии клинических показаний следует рассмотреть возможность выполнения других функциональных печеночных проб, включая оценку уровня билирубина.
При применении препарата Актемра® наблюдалось серьезное лекарственное поражение печени, включая острую печеночную недостаточность, гепатит и желтуху (см. раздел «Побочное действие»). Серьезные поражения печени отмечались в интервале от 2 недель до >5 лет после начала терапии препаратом Актемра®. Сообщалось о случаях развития печеночной недостаточности, которые привели к трансплантации печени. Пациентам следует рекомендовать немедленно обратиться за медицинской помощью при появлении признаков и симптомов поражения печени.
Следует соблюдать осторожность при решении вопроса о начале терапии препаратом Актемра® у пациентов с показателями АЛТ или АСТ, превышающими ВГН более чем в 1.5 раза. Терапия препаратом Актемра® не рекомендуется при показателях АЛТ или АСТ, превышающих ВГН более чем в 5 раз у пациентов с РА, пЮИА и сЮИА.
У пациентов с РА, пЮИА и сЮИА следует контролировать АЛТ/АСТ каждые 4-8 недель на протяжении первых 6 месяцев после начала терапии, а в дальнейшем — каждые 12 недель. Рекомендации по дозированию, включая отмену препарата Актемра® в зависимости от активности трансаминаз, представлены в разделе «Режим дозирования». Следует прекратить лечение препаратом Актемра® при повышении показателей АЛТ или АСТ в 3-5 раз выше ВГН, подтвержденном повторным анализом.
Отклонения показателей общего анализа крови
После лечения тоцилизумабом в дозе 8 мг/кг в комбинации с МТ наблюдалось снижение числа нейтрофилов и тромбоцитов (см. раздел «Побочное действие»). Может быть повышен риск развития нейтропении у пациентов, которые ранее получали лечение антагонистом ФНО.
Пациентам, ранее не получавшим лечение препаратом Актемра®, не рекомендуется начинать лечение с АЧН менее 2×109/л. Следует проявлять осторожность при рассмотрении вопроса о начале лечения препаратом Актемра® у пациентов с низким уровнем тромбоцитов (т. е. с уровнем тромбоцитов ниже 100×103/мкл). У пациентов с РА, сЮИА и пЮИА, с АЧН <0.5×109/л или числом тромбоцитов <50×103/мкл продолжать лечение не рекомендуется.
Тяжелая нейтропения может быть связана с повышенным риском развития серьезных инфекций, хотя до настоящего времени в клинических исследованиях препарата Актемра® не было выявлено четкой связи между снижением числа нейтрофилов и возникновением серьезных инфекций.
У пациентов с РА следует контролировать показатели нейтрофилов и тромбоцитов в период с 4 по 8 неделю после начала терапии и в дальнейшем в соответствии со стандартами клинической практики. Рекомендации по коррекции дозы в зависимости от АЧН и уровня тромбоцитов представлены в разделе «Режим дозирования».
У пациентов с сЮИА и пЮИА показатели нейтрофилов и тромбоцитов следует контролировать в день проведения 2 инфузии, а в дальнейшем в соответствии со стандартами клинической практики (см. раздел «Режим дозирования»).
Показатели липидного обмена
У пациентов, получавших тоцилизумаб, наблюдалось повышение показателей липидного обмена, включая общий холестерин, ЛПНП, ЛПВП и триглицериды (см. раздел «Побочное действие»). У большинства пациентов индекс атерогенности не повышался, а повышение концентрации общего холестерина эффективно корригировалось гиполипидемическими препаратами.
При РА, пЮИА и сЮИА следует оценивать показатели липидного обмена у пациентов в период с 4 по 8 неделю после начала терапии препаратом Актемра®. При ведении пациентов следует руководствоваться локальными рекомендациями по лечению гиперлипидемии.
Нарушения со стороны нервной системы
Врачи должны проявлять особую осторожность с целью раннего выявления симптомов, возможно указывающих на дебют демиелинизирующих заболеваний ЦНС. В настоящее время влияние препарата Актемра® на развитие демиелинизирующих заболеваний ЦНС не известно.
Злокачественные новообразования
У пациентов с РА повышен риск развития злокачественных новообразований. Иммуномодулирующие лекарственные препараты могут повышать риск развития злокачественных новообразований.
Иммунизация
Не следует проводить иммунизацию живыми и живыми ослабленными вакцинами одновременно с терапией препаратом Актемра®, поскольку клиническая безопасность подобного сочетания не установлена. В рандомизированном открытом исследовании у взрослых пациентов с РА, получавших терапию препаратом Актемра® и МТ, ответ на 23-валентную пневмококковую полисахаридную вакцину и столбнячный анатоксин был сопоставим с таковым у пациентов, получающих монотерапию МТ. Всем пациентам, особенно пациентам с сЮИА и пЮИА, рекомендуется пройти вакцинацию в соответствии с национальным календарем прививок до начала лечения препаратом Актемра®. Следует соблюдать интервал (в соответствии с действующими национальным календарем прививок) у пациентов, получающих терапию иммуносупрессивными препаратами, между иммунизацией живыми вакцинами и началом терапии препаратом Актемра®.
Риск развития сердечно-сосудистых заболеваний
У пациентов с РА имеется повышенный риск развития сердечно-сосудистых заболеваний, поэтому факторы риска (например, повышение АД, гиперлипидемия) должны контролироваться в рамках стандартного лечения.
Комбинация с антагонистами ФНО
Опыт применения препарата Актемра® с антагонистами ФНО или другими биологическими препаратами для лечения пациентов с РА, сЮИА или пЮИА отсутствует. Не рекомендуется применять препарат Актемра® с другими биологическими препаратами.
Содержание натрия
Данный препарат содержит 1.17 ммоль (или 26.55 мг) натрия в пересчете на максимальную дозу 1200 мг. Необходимо учитывать пациентам, находящимся на диете с ограничением поступления натрия. Данный лекарственный препарат в дозах менее 1025 мг содержит менее 1 ммоль натрия (23 мг), т. е. практически «не содержит натрий».
COVID-19
При новой коронавирусной инфекции COVID-19 препарат Актемра® следует применять в условиях стационара.
Эффективность применения препарата Актемра® не была установлена при лечении пациентов с COVID-19, у которых не был повышен уровень CРБ (см. раздел «Фармакологическое действие»).
Препарат Актемра® не должен назначаться пациентам с COVID-19, не получающим системные ГКС, поскольку в этой подгруппе нельзя исключить увеличение уровня смертности (см. раздел «Фармакологическое действие»).
Инфекции
Пациентам с COVID-19 не следует назначать препарат Актемра®, если у них имеется какая- либо другая сопутствующая тяжелая активная инфекция. Медицинским работникам следует соблюдать осторожность при применении препарата Актемра® у пациентов с рецидивирующими или хроническими инфекциями в анамнезе, а также при сопутствующих заболеваниях (например, при дивертикулите, сахарном диабете и интерстициальном заболевании легких), предрасполагающих к развитию инфекций.
Гепатотоксичность
У госпитализированных пациентов с COVID-19 может быть повышена активность АЛТ или АСТ. Полиорганная недостаточность с поражением печени признана осложнением тяжелой формы COVID-19. При принятии решения о применении тоцилизумаба следует сбалансировать потенциальную пользу, получаемую от лечения COVID-19, с потенциальным риском неотложной терапии тоцилизумабом. У пациентов с COVID-19 с повышением активности АЛТ или АСТ, превышающей ВГН более чем в 10 раз, применение препарата Актемра® не рекомендуется. У пациентов с COVID-19 следует мониторировать активность АЛТ/АСТ в соответствии с текущей стандартной клинической практикой.
Отклонения показателей общего анализа крови
У пациентов с COVID-19 с АЧН <1×109/л или числом тромбоцитов <50 ×103/мкл лечение не рекомендуется. Показатели нейтрофилов и тромбоцитов следует мониторировать в соответствии с текущей стандартной клинической практикой (см. раздел «Режим дозирования»).
Дети
Синдром активации макрофагов у пациентов с сЮИА
Синдром активации макрофагов является серьезным жизнеугрожающим состоянием, которое может развиться у пациентов с сЮИА. В клинических исследованиях применение тоцилизумаба у пациентов в период возникновения синдрома активации макрофагов не изучалось.
Влияние на способность к управлению транспортными средствами и механизмами
Исследования по изучению влияния препарата на способность управлять транспортными средствами и механизмами не проводились. Однако, учитывая тот факт, что при терапии препаратом Актемра® часто наблюдалось головокружение, пациентам, испытывающим данную нежелательную реакцию, следует рекомендовать не управлять транспортными средствами и механизмами до тех пор, пока головокружение не прекратится.
Передозировка
Доступные данные о передозировке препарата Актемра® ограничены. В одном случае непреднамеренной передозировки препарата в дозе 40 мг/кг у пациента с множественной миеломой нежелательных реакций не отмечено. Не отмечалось также серьезных нежелательных реакций у здоровых добровольцев, которые получали однократно препарат Актемра® в дозе до 28 мг/кг, хотя наблюдалась нейтропения, требующая снижения дозы.
Лекарственное взаимодействие
Исследования взаимодействия были проведены только у взрослых пациентов.
Одновременное однократное введение тоцилизумаба в дозе 10 мг/кг и метотрексата в дозе 10-25 мг 1 раз в неделю не оказывало клинически значимого влияния на экспозицию метотрексата.
Популяционные фармакокинетические анализы клинических не выявил какого-либо воздействия метотрексата, НПВП или ГКС на клиренс тоцилизумаба.
Экспрессия печеночных изоферментов системы CYP450 подавляется под действием цитокинов, таких как ИЛ-6, которые стимулируют хроническое воспаление. Таким образом, при проведении терапии средствами, ингибирующими действие цитокинов (например, тоцилизумаб), экспрессия изоферментов CYP450 может быть нарушена.
В исследованиях in vitro, проведенных на культуре гепатоцитов человека, было показано, что ИЛ-6 вызывает снижение экспрессии изоферментов CYP1A2, CYP2C9, CYP2C19 и CYP3A4. Применение тоцилизумаба нормализует экспрессию этих изоферментов.
В исследовании у пациентов с РА концентрация симвастатина (субстрат CYP3A4) через 1 неделю после однократного введения тоцилизумаба снижалась на 57%, т.е. была немного повышенной или аналогичной таковой у здоровых добровольцев.
В начале или при завершении курса терапии тоцилизумабом следует наблюдать за пациентами, получающими лекарственные средства в индивидуально подобранных дозах, и которые метаболизируются посредством изоферментов CYP450 3A4, 1A2 или 2C9, например, метилпреднизолон, дексаметазон (с возможностью развития синдрома отмены ГКС, предназначенных для приема внутрь), аторвастатин, блокаторы кальциевых каналов, теофиллин, варфарин, фенпрокумон, фенитоин, циклоспорин или бензодиазепины, поскольку для поддержания терапевтического эффекта может потребоваться увеличение их дозы.
Учитывая длительный T1/2 тоцилизумаба, его действие на активность изоферментов CYP450 может сохраняться в течение нескольких недель после прекращения терапии.
Условия хранения препарата Актемра®
Препарат следует хранить в недоступном для детей, защищенном от света месте при температуре от 2° до 8°С; не замораживать.
Срок годности препарата Актемра®
Срок годности — 2 года 6 месяцев. Не применять по истечении срока годности.
Условия реализации
Препарат отпускают по рецепту.
Контакты для обращений
Ф.ХОФФМАНН-ЛЯ РОШ ЛТД.
(Швейцария)

|
|
Претензии потребителей следует направлять |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Актемра — инструкция по применению
Синонимы, аналоги
Статьи
Читать в формате pdf
Регистрационный номер
ЛСР-003012/09
Торговое наименование
Актемра®
Международное непатентованное или группировочное наименование
Тоцилизумаб
Лекарственная форма
Концентрат для приготовления раствора для инфузий
Состав
1 мл препарата содержит:
действующее вещество: тоцилизумаб – 20 мг;
вспомогательные вещества: полисорбат 80 – 0.5 мг, сахароза – 50.0 мг, натрия гидрофосфата додекагидрат – q.s., натрия дигидрофосфата дигидрат – q.s., вода для инъекций – q.s.
Описание
Прозрачная или опалесцирующая бесцветная или светло-желтого цвета жидкость.
Фармакотерапевтическая группа
Антитела моноклональные
Код АТХ
L04AC07
Фармакологические свойства
Фармакодинамика
Механизм действия
Тоцилизумаб – рекомбинантное гуманизированное моноклональное антитело к человеческому рецептору интерлейкина-6 (ИЛ-6) из подкласса иммуноглобулинов IgG1. Тоцилизумаб связывается и подавляет как растворимые, так и мембранные рецепторы ИЛ-6 (sIL-6R и mIL-6R). ИЛ-6 является многофункциональным цитокином, вырабатываемым различными типами клеток, и участвует в паракринной регуляции, системных физиологических и патологических процессах, таких как стимуляция секреции Ig, активация Т-клеток, стимуляция выработки белков острой фазы в печени и стимуляция гемопоэза. ИЛ-6 вовлечен в патогенез различных заболеваний, в том числе воспалительных заболеваний, остеопороза и новообразований.
Нельзя исключить вероятность отрицательного воздействия тоцилизумаба на противоопухолевую и противоинфекционную защиту организма. Роль ингибирования рецептора ИЛ-6 в развитии опухолей неизвестна.
Клиническая эффективность при ревматоидном артрите (РА)
Эффективность препарата у пациентов, получавших тоцилизумаб как в монотерапии, так и в комбинации с метотрексатом или базисными противовоспалительными препаратами (БПВП), не зависела от наличия или отсутствия ревматоидного фактора, возраста, пола, расовой принадлежности, числа предшествующих курсов лечения или стадии заболевания. Ответ на терапию возникал быстро (уже на второй неделе), в дальнейшем усиливался и сохранялся более 3 лет.
У пациентов, получавших тоцилизумаб в дозе 8 мг/кг, существенно снижается индекс активности заболевания по шкале DAS28 по сравнению с пациентами, получавшими плацебо + БПВП. Число пациентов, достигших клинической ремиссии (DAS28 <2.6) на 24 неделе, было значительно больше в группе терапии тоцилизумабом (27.5-33.6%) по сравнению с контрольной группой (0.8-12.1%). К 52 неделе терапии число пациентов, достигших DAS28 <2.6, увеличивается до 47% по сравнению с 33% на 24 неделе терапии. Хороший или удовлетворительный ответ по критериям EULAR отмечался чаще у пациентов, получавших тоцилизумаб, чем получавших плацебо + БПВП.
Через 2 года терапии тоцилизумабом/МТ у 14% пациентов наблюдался значительный клинический ответ (АКР 70 (критерии Американской Коллегии Ревматологов, АКР) сохранялся на протяжении 24 недель и более).
Рентгенологическая оценка
У 83% пациентов, получавших терапию тоцилизумабом/МТ в течение года, не зарегистрировано прогрессирования деструкции суставов (изменение суммарного индекса Шарпа равно нулю или менее) по сравнению с 67% пациентов, получавших плацебо/МТ. Данный результат сохранялся на протяжении 2 лет терапии. У 93% пациентов отсутствовало прогрессирование деструкции суставов между 52 и 104 неделями терапии.
Показатели качества жизни
У пациентов, получавших тоцилизумаб в дозе 8 мг/кг (монотерапия или в сочетании с БПВП), по сравнению с теми, кто получал МТ/БПВП, наблюдалось клинически значимое улучшение функциональной активности (по индексу HAQ-DI), снижение утомляемости (по шкале функциональной оценки терапии хронических заболеваний по показателю утомляемости FACIT-Fatigue), а также улучшение как показателей физического, так и показателей психического здоровья по опроснику SF-36.
Лабораторные показатели
После введения тоцилизумаба происходит быстрое снижение средних значений острофазовых показателей, С-реактивного белка, СОЭ, сывороточного амилоида А и фибриногена, снижение числа тромбоцитов в пределах нормальных значений, а также увеличение гемоглобина (Нb), которое в наибольшей степени наблюдалось у пациентов с хронической анемией, связанной с РА.
Клиническая эффективность у пациентов с ранним ревматоидным артритом (рPA), ранее не получавших терапию МТ
При применении тоцилизумаба в монотерапии в дозе 8 мг/кг и тоцилизумаба в дозе 4 или 8 мг/кг каждые 4 недели в комбинации с МТ индекс активности заболевания по шкале DAS28 существенно снижается в группах, получавших тоцилизумаб в дозе 8 мг/кг, по сравнению с пациентами, получавшими монотерапию МТ. Число пациентов, достигших клинической ремиссии (DAS28 <2.6) на 24 неделе, значительно больше в группах, получавших тоцилизумаб (38.7-44.8%), по сравнению с группой монотерапии МТ (15%). К 52 неделе число пациентов, достигших DAS28 <2.6 в группах терапии тоцилизумабом, увеличивается до 39.4-49% по сравнению с 19.5% в группе монотерапии МТ. Число пациентов, достигших ответа АКР 20, 50, 70, также существенно выше в группах терапии тоцилизумабом (70.2-74.5%; 47.6-56.9%; 30.1-38.6% на 24 неделе и 63-67.2%; 49.3-55.9%; 36-43.1% на 52 неделе, соответственно) по сравнению с группой монотерапии МТ (65.2%; 43.2%; 25.4% на 24 неделе и 57.1%; 40.8%; 28.9% на 52 неделе, соответственно).
Рентгенологическая оценка
Отсутствие прогрессирования деструкции суставов (изменение суммарного индекса Шарпа равно нулю или менее) наблюдается у 82-83% пациентов, получавших тоцилизумаб в дозе 8 мг/кг в качестве монотерапии или в комбинации с МТ, по сравнению с 73% пациентов в группе монотерапии МТ.
Показатели качества жизни
Клинически значимое улучшение функциональной активности по индексу HAQ-DI наблюдается у пациентов, получавших тоцилизумаб в дозе 8 мг/кг в качестве монотерапии или комбинации с МТ, по сравнению с теми, кто получал монотерапию МТ.
При монотерапии тоцилизумабом (в дозе 8 мг/кг внутривенно каждые 4 недели у пациентов с РА, с непереносимостью МТ или при нецелесообразности продолжения терапии МТ (в том числе при неадекватном ответе на терапию МТ)) наблюдалось более выраженное статистически значимое снижение активности заболевания по шкале DAS28 по сравнению с монотерапией адалимумабом (в дозе 40 мг подкожно каждые 2 недели). Количество пациентов, ответивших на терапию с показателями DAS28 <2.6 и DAS28 ≤3.2, было больше при терапии тоцилизумабом, чем при терапии адалимумабом (39.9% против 10.5% и 51.5% против 19.8%, соответственно). Ответы АКР 20, 50, 70 наблюдались у 65%, 47.2%, 32.5% пациентов, получавших тоцилизумаб, по сравнению с 49.4%, 27.8%, 17.9% пациентов, получавших адалимумаб.
Клиническая эффективность при полиартикулярном ювенильном идиопатическом артрите (пЮИА)
Ответы АКР 30, 50, 70, 90 были получены у 89.4%, 83.0%, 62.2% и 26.1% пациентов, соответственно. Доля пациентов с ответом АКР 30, 50, 70 на 40 неделе терапии относительно показателей на начало терапии составила 74.4%, 73.2% и 64.6%, соответственно.
Клиническая эффективность при системном ювенильном идиопатическом артрите (сЮИА)
Эффективность тоцилизумаба для лечения активного сЮИА изучалась в 12-недельном рандомизированном, двойном слепом плацебо контролируемом периоде исследования с 2 параллельными группами. На 12 неделе доля пациентов, достигших ответа АКР 30, 50, 70, 90 при ЮИА, также была больше в группе терапии тоцилизумабом, чем в группе плацебо: 90.7% против 24.3%, 85.3% против 10.8%, 70.7% против 8.1%, 37.3% против 5.4%, соответственно (р<0.0001). Ответ на терапию сохранялся и в открытом расширенном периоде исследования.
Системные эффекты
У 85% пациентов, имевших исходно лихорадку, через 12 недель терапии тоцилизумабом лихорадка отсутствовала по сравнению с 21% пациентов, получавших плацебо (р<0.0001). Кроме того, у 64% пациентов, имевших сыпь исходно, через 12 недель терапии тоцилизумабом сыпь отсутствовала по сравнению с 11% пациентов, получавших плацебо (р=0.0008).
Наблюдалось значимое снижение интенсивности болевого синдрома в группе терапии тоцилизумабом по сравнению с плацебо на 12 неделе. Скорректированное среднее изменение оценки боли по визуальной аналоговой шкале (ВАШ) после 12 недель терапии тоцилизумабом соответствовало 41 пункту (от 0 до 100 пунктов) по сравнению с 1 пунктом у пациентов, получавших плацебо (р<0.0001). Системные эффекты сохранялись и в продолжающемся открытом расширенном периоде исследования.
Снижение дозы глюкокортикостероидов
У 8 из 31 пациента в группе плацебо и у 48 из 70 пациентов в группе тоцилизумаба, получавших глюкокортикостероиды исходно, наблюдался ответ АКР 70 при ЮИА на 6 или 8 неделе, что позволило снизить дозу глюкокортикостероидов. При этом 24% пациентов в группе тоцилизумаба и 3% пациентов в группе плацебо смогли снизить дозу глюкокортикостероидов как минимум на 20% без последующего снижения частоты ответа по критериям АКР 30 при ЮИА (по критериям Американской Коллегии Ревматологов, АКР) или возникновения системных проявлений к 12 неделе (р=0.028). Снижение дозы глюкокортикостероидов продолжилось, при этом 44 пациента не получали глюкокортикостероиды на 44 неделе, и ответы АКР не изменялись.
Показатели качества жизни
На 12 неделе доля пациентов в группе тоцилизумаба, демонстрирующих минимальное клинически значимое улучшение показателя по опроснику CHAQ-DI (определенного как снижение индивидуального общего балла на >0.13), была значительно выше, чем доля пациентов в группе плацебо – 77% против 19%, соответственно (р<0.0001). Ответы сохранялись и в продолжающемся открытом расширенном периоде исследования.
Лабораторные показатели
Исходно у 67% пациентов из группы тоцилизумаба содержание Нb было ниже нормального диапазона. У 80% из этих пациентов на 12 неделе наблюдалось увеличение Нb в пределах нормального диапазона по сравнению с 7% пациентов в группе плацебо (р<0.0001). У 88% пациентов из группы тоцилизумаба, имевших исходно сниженное содержание Нb, его уровень увеличился на >10 г/л к 6 неделе, в группе плацебо частота повышения составила 3% (р<0.0001).
Доля пациентов, имевших исходно тромбоцитоз и у которых на 12 неделе наблюдалось нормальное число тромбоцитов, была выше в группе тоцилизумаба по сравнению с группой плацебо – 90% против 4% (р<0.0001).
После введения тоцилизумаба происходило быстрое снижение средних значений острофазовых показателей: С-реактивного белка, СОЭ и сывороточного амилоида А.
Доклинические данные безопасности
Канцерогенность: исследования по изучению канцерогенности тоцилизумаба не проводились. Имеющиеся доклинические данные демонстрируют вклад плейотропного ИЛ-6 в прогрессирование злокачественных новообразований и устойчивость к апоптозу при различных формах рака. Эти данные не предполагают, что лечение тоцилизумабом приводит к существенному риску развития и прогрессирования рака.
Мутагенность: стандартные генотоксические тесты как в прокариотических, так и в эукариотических клетках были отрицательными.
Влияние на фертильность: имеющиеся доклинические данные не предполагают влияния аналогов тоцилизумаба на фертильность. В исследованиях по изучению хронической токсичности у яванских макак и у самок или самцов мышей с недостаточностью ИЛ-6 отрицательного влияния тоцилизумаба на эндокринные или репродуктивные органы не обнаружено.
Тератогенность: не обнаружено прямого или опосредованного неблагоприятного влияния на беременность или внутриутробное развитие при внутривенном введении тоцилизумаба яванским макакам на ранних сроках гестационного периода.
Прочее: отмечалось незначительное увеличение случаев спонтанного выкидыша/ внутриутробной гибели плода при высоком уровне системного кумулятивного воздействия (более чем в 100 раз превышающего таковое у человека) при введении дозы 50 мг/кг/сутки в сравнении с плацебо или меньшим уровнем вводимых доз. Частота выкидыша была в пределах исторического контроля для яванских макак, содержащихся в неволе; отдельные случаи выкидыша/внутриутробной гибели не демонстрировали какой-либо взаимосвязи между данными явлениями и дозой или продолжительностью введения тоцилизумаба. Несмотря на то, что ИЛ-6, по-видимому, не играет решающей роли в развитии плода или иммунологической регуляции системы мать-плод, взаимосвязь этих явлений с введением тоцилизумаба не может быть исключена.
Наблюдалась экскреция мышиного аналога тоцилизумаба в молоко лактирующих мышей. Применение мышиного аналога тоцилизумаба не оказывало токсичного действия на ювенильных мышей. В частности, не наблюдалось нарушения роста скелета, иммунной функции и полового развития.
Фармакокинетика
Фармакокинетика (ФК) тоцилизумаба характеризуется нелинейным выведением, представляющим комбинацию линейного клиренса и выведения по Михаэлис-Ментен. Нелинейная часть выведения тоцилизумаба приводит к более чем дозозависимому увеличению экспозиции. Фармакокинетические параметры тоцилизумаба не меняются с течением времени. Так как общий клиренс зависит от концентрации тоцилизумаба в сыворотке, период полувыведения (t1/2) тоцилизумаба также является зависимым от его концентрации и может быть рассчитан только при наличии значения сывороточной концентрации. Популяционный ФК анализ, проведенный во всех популяциях пациентов, не выявил связи между кажущимся клиренсом и наличием антител к тоцилизумабу.
Ревматоидный артрит
ФК тоцилизумаба сопоставима у здоровых добровольцев и пациентов с РА.
Таблица 1. Прогнозируемые средние ФК параметры (±стандартное отклонение, СО) тоцилизумаба при равновесном состоянии у пациентов с РА.
| Параметр тоцилизумаба | 4 мг/кг 1 раз в четыре недели |
8 мг/кг 1 раз в четыре недели |
| Максимальная концентрация (Сmax), мкг/мл | 83.8 ±23.1 | 182 ±50.4 |
| Минимальная концентрация (Ctrough), мкг/мл | 0.5±1.5 | 15.9±13.1 |
| Средняя концентрация (Cmean), мкг/мл | 17.8±6.1 | 56.6±19.3 |
| Кумулятивная Сmax | 1.01 | 1.09 |
| Кумулятивная Ctrough | 2.62 | 2.47 |
| Кумулятивная Cmean или площадь под кривой «концентрация-время» (AUCτ)* | 1.09 | 1.32 |
* τ – на протяжении 4 недель
При высоких значениях концентрации тоцилизумаба в сыворотке линейный клиренс преобладает над общим клиренсом тоцилизумаба, и конечный период полувыведения составляет приблизительно 21.5 дней (на основе приблизительных параметров популяции пациентов). В то время как после внутривенного введения (в/в) Сmax дозозависимо увеличивается между дозами 4 мг/кг и 8 мг/кг каждые 4 недели, более чем дозозависимое увеличение наблюдалось для Cmean и Ctrough. В равновесном состоянии значения Cmean и Ctrough были в 3.2 и 32 раза выше при применении тоцилизумаба в дозе 8 мг/кг по сравнению с дозой 4 мг/кг, соответственно.
Коэффициенты накопления AUC и Сmax после многократного применения тоцилизумаба в дозах 4 мг/кг и 8 мг/кг каждые 4 недели были ниже, чем коэффициенты накопления Ctrough (2.62 и 2.47), благодаря участию нелинейного клиренса при более низких концентрациях тоцилизумаба.
Более 90% равновесного состояния при Сmax достигается после первой в/в инфузии; 90% равновесное состояние при AUCτ и Cmean достигается после первой и третьей в/в инфузии тоцилизумаба в дозе 4 мг/кг и 8 мг/кг, соответственно; приблизительно 90% равновесное состояние при Ctrough достигается после четвертой в/в инфузии тоцилизумаба.
Масса тела является значимым фактором, влияющим на ФК тоцилизумаба. При в/в инфузии, рассчитанной в мг на кг массы тела, у пациента с массой тела >100 кг ожидается более высокая средняя экспозиция в равновесном состоянии по сравнению со средним значением в популяции пациентов. Таким образом, не рекомендуется увеличение дозы препарата выше 800 мг на одну инфузию у пациентов с массой тела >100 кг (см. раздел «Способ применения и дозы»).
Полиартикулярный ювенильный идиопатический артрит
После внутривенного применения приблизительно 90% равновесное состояние достигается к двенадцатой неделе при введении в дозе 10 мг/кг (масса тела <30 кг) и к шестнадцатой неделе при введении в дозе 8 мг/кг (масса тела >30 кг).
Таблица 2. Прогнозируемые средние ФК параметры (±стандартное отклонение, СО) тоцилизумаба при равновесном состоянии у пациентов с пЮИА.
| Параметр тоцилизумаба | 8 мг/кг 1 раз в четыре недели (масса тела >30 кг) |
10 мг/кг 1 раз в четыре недели (масса тела <30 кг) |
| Максимальная концентрация (Сmax), мкг/мл | 183±42.3 | 168±24.8 |
| Минимальная концентрация (Ctrough), мкг/мл | 6.55±7.93 | 1.47±2.44 |
| Средняя концентрация (Cmean), мкг/мл | 42.2±13.4 | 31.6±7.84 |
| Кумулятивная Сmax | 1.04 | 1.01 |
| Кумулятивная Ctrough | 2.22 | 1.43 |
| Кумулятивная Cmean или площадь под кривой «концентрация-время» (AUCτ)* | 1.16 | 1.05 |
* τ – на протяжении 4 недель
Системный ювенильный идиопатический артрит
После внутривенного применения приблизительно 90% равновесное состояние достигается к восьмой неделе при введении в дозе 12 мг/кг и 8 мг/кг 1 раз в 2 недели.
Таблица 3. Прогнозируемые средние ФК параметры (±стандартное отклонение, СО) тоцилизумаба при равновесном состоянии у пациентов с сЮИА.
| Параметр тоцилизумаба | 8 мг/кг 1 раз в две недели (масса тела >30 кг) |
10 мг/кг 1 раз в две недели (масса тела <30 кг) |
| Максимальная концентрация (Сmax), мкг/мл | 256±60.8 | 274±63.8 |
| Минимальная концентрация (Ctrough), мкг/мл | 69.7±29.1 | 68.4±30.0 |
| Средняя концентрация (Cmean), мкг/мл | 119±36.0 | 123±36.0 |
| Кумулятивная Сmax | 1.42 | 1.37 |
| Кумулятивная Ctrough | 3.20 | 3.41 |
| Кумулятивная Cmean или площадь под кривой «концентрация-время» (AUCτ)* | 2.01 | 1.95 |
* τ – на протяжении 2 недель
ФК параметры тоцилизумаба у пациентов в возрасте до 2-х лет были сопоставимы с ФК параметрами у пациентов старше 2-х лет с массой тела <30 кг при внутривенном применении тоцилизумаба (в дозе 12 мг/кг каждые 2 недели).
Распределение
После внутривенного введения тоцилизумаб претерпевает двухфазное выведение из системного кровотока. У пациентов с РА объем распределения в центральной камере составляет 3.5 л, в периферической камере – 2.9 л, а объем распределения в равновесном состоянии составляет 6.4 л.
У детей с пЮИА объем распределения в центральной камере составляет 1.98 л, в периферической камере – 2.1 л, а объем распределения в равновесном состоянии составляет 4.08 л.
У детей с сЮИА объем распределения в центральной камере составляет 1.87 л, в периферической камере – 2.14 л, а объем распределения в равновесном состоянии составляет 4.01 л.
Выведение
Общий клиренс тоцилизумаба зависит от концентрации и представляет собой сумму линейного и нелинейного клиренса. Линейный клиренс составляет 12.5 мл/ч у пациентов с РА, 5.8 мл/ч у детей с пЮИА и 5.7 мл/ч у детей с сЮИА. Нелинейный клиренс, зависящий от концентрации, имеет наибольшее значение при низких концентрациях тоцилизумаба. При более высоких концентрациях тоцилизумаба преобладает линейный клиренс в связи с насыщением пути нелинейного клиренса. Так как общий клиренс зависит от сывороточной концентрации тоцилизумаба, период полувыведения (t1/2) тоцилизумаба также является зависимым от его концентрации и может быть рассчитан только при наличии значения сывороточной концентрации.
При РА зависимый от концентрации кажущийся t1/2 для тоцилизумаба в равновесном состоянии в дозе 4 мг/кг один раз в 4 недели составляет до 11 дней, а для тоцилизумаба в дозе 8 мг/кг один раз в 4 недели – до 13 дней. При высоких значениях концентрации тоцилизумаба в сыворотке линейный клиренс преобладает над общим клиренсом тоцилизумаба, и конечный t1/2 составляет приблизительно 21.5 дней (на основе приблизительных параметров популяции пациентов).
У детей с пЮИА эффективный t1/2 тоцилизумаба в равновесном состоянии (между введениями в дозе 8 мг/кг для детей с массой тела >30 кг или в дозе 10 мг/кг для детей с массой тела <30 кг в равновесном состоянии) составляет до 17 дней.
У детей с сЮИА эффективный t1/2 тоцилизумаба в равновесном состоянии (между введениями в дозе 8 мг/кг и 12 мг/кг) составляет до 16 дней.
Фармакокинетика у особых групп пациентов
Пациенты с печеночной недостаточностью
Фармакокинетика тоцилизумаба у пациентов с печеночной недостаточностью не изучалась.
Пациенты с почечной недостаточностью
Специальных исследований у пациентов с почечной недостаточностью не проводилось. У большинства пациентов с РА, учтенных в популяционном фармакокинетическом анализе, была нормальная функция почек или нарушение функции почек легкой степени тяжести (расчетный клиренс креатинина по формуле Кокрофта-Голта), которое не влияло на фармакокинетику тоцилизумаба. Коррекции дозы тоцилизумаба пациентам с нарушением функции почек легкой степени тяжести не требуется.
Пол, раса, пожилой возраст
Популяционный фармакокинетический анализ у взрослых пациентов с РА показал, что возраст, пол и раса не влияют на фармакокинетику тоцилизумаба. Коррекции дозы тоцилизумаба не требуется.
Показания
Ревматоидный артрит
Ревматоидный артрит со средней или высокой степенью активности у взрослых как в виде монотерапии, так и в комбинации с метотрексатом (МТ) и/или с другими базисными противовоспалительными препаратами (БПВП), в том числе для торможения рентгенологически доказанной деструкции суставов.
Полиартикулярный ювенильный идиопатический артрит
Активный полиартикулярный ювенильный идиопатический артрит у пациентов в возрасте 2 лет и старше как в виде монотерапии, так и в комбинации с МТ.
Системный ювенильный идиопатический артрит
Активный системный ювенильный идиопатический артрит у пациентов в возрасте 2 лет и старше как в виде монотерапии, так и в комбинации с МТ.
Противопоказания
Гиперчувствительность к тоцилизумабу, любому компоненту препарата в анамнезе; активные инфекционные заболевания (в т.ч. туберкулез).
Детский возраст до 2 лет для пациентов с полиартикулярным ювенильным идиопатическим артритом и системным ювенильным идиопатическим артритом.
Детский возраст до 18 лет для пациентов с ревматоидным артритом.
Комбинация с ингибиторами ФНО-альфа или применение в течение 1 месяца после лечения анти-ФНО антителами.
С осторожностью
В медицинской документации пациента следует указывать торговое наименование препарата (Актемра®) и номер серии.
Для всех показаний
Инфекции: у пациентов, получающих иммуносупрессанты (в том числе и препарат Актемра®) наблюдались серьезные случаи возникновения инфекционных заболеваний (иногда с летальным исходом) (см. раздел «Побочное действие»). Не следует начинать лечение препаратом Актемра® пациентам с активными инфекционными заболеваниями.
При развитии серьезных инфекций терапия препаратом Актемра® должна быть прервана до разрешения инфекции. Следует соблюдать осторожность при использовании препарата Актемра® у пациентов с рецидивирующими инфекционными заболеваниями в анамнезе, а также при сопутствующих заболеваниях, предрасполагающих к развитию инфекций (например, при дивертикулита, сахарном диабете).
Следует проявлять особую осторожность с целью раннего выявления серьезных инфекционных заболеваний у пациентов, получающих терапию иммуносупрессорами (например, тоцилизумабом), поскольку признаки или симптомы острого воспаления могут быть стерты в связи с подавлением реакции острой фазы. Пациентов (включая детей раннего возраста, которые не всегда способны описать симптомы заболевания) и родителей/опекунов детей с пЮИА или сЮИА необходимо проинструктировать о немедленном обращении к врачу при любых симптомах, свидетельствующих о появлении инфекции, с целью своевременной диагностики и назначения необходимого лечения.
Осложнения дивертикулита: у пациентов, получающих терапию тоцилизумабом, сообщались случаи перфорации дивертикула как осложнения дивертикулита. Следует соблюдать осторожность при применении препарата Актемра® у пациентов с язвенным поражением органов желудочно-кишечного тракта (ЖКТ) или дивертикулитом в анамнезе. Пациенты с признаками, возможно указывающими на осложненный дивертикулит (боль в животе), должны быть немедленно обследованы с целью раннего выявления перфорации ЖКТ.
Туберкулез: до назначения препарата Актемра®, как и при назначении других биологических препаратов для лечения РА, пЮИА или сЮИА, следует провести предварительное обследование пациентов на наличие латентного туберкулеза. При выявлении латентного туберкулеза следует провести стандартный курс антимикобактериальной терапии перед началом лечения препаратом Актемра®.
Иммунизация: не следует проводить иммунизацию живыми и живыми ослабленными вакцинами одновременно с терапией препаратом Актемра®, поскольку безопасность подобного сочетания не установлена. Отсутствуют данные о вторичной передаче инфекции от пациентов, получающих живые вакцины, к пациентам, получающим тоцилизумаб. У пациентов с РА, получавших терапию тоцилизумабом/МТ, ответ на 23-валентную пневмококковую полисахаридную вакцину и столбнячный анатоксин был сопоставим с таковым у пациентов, получающих монотерапию МТ.
Рекомендуется, чтобы до начала лечения препаратом Актемра® все пациенты (особенно дети и пациенты пожилого возраста) прошли вакцинацию в соответствии с национальным календарем прививок. Следует соблюдать интервал (в соответствии с действующими рекомендациями по иммунизации) у пациентов, получающих терапию иммуносупрессивными препаратами, между иммунизацией живыми вакцинами и началом терапии препаратом Актемра®.
Реакции гиперчувствительности: при инфузии препарата Актемра® наблюдались серьезные реакции гиперчувствительности, включая анафилаксию (см. раздел «Побочное действие»). При постмаркетинговом применении серьезные явления гиперчувствительности и анафилаксии возникали у пациентов, получавших различные дозы препарата Актемра® независимо от наличия сопутствующей терапии, премедикации и/или реакций гиперчувствительности в анамнезе. При постмаркетинговом применении препарата Актемра® для внутривенного введения были зарегистрированы случаи со смертельным исходом. Данные явления возникали уже во время первой инфузии препарата (см. разделы «Противопоказания» и «Побочное действие»).
При внутривенном введении препарата Актемра® должен быть предусмотрен комплекс необходимых мероприятий для лечения возможной анафилактической реакции.
При возникновении анафилактической реакции или другой серьезной реакции гиперчувствительности введение препарата Актемра® следует немедленно остановить и не возобновлять терапию препаратом в дальнейшем.
Активные заболевания печени и печеночная недостаточность: терапия препаратом Актемра®, особенно одновременно с МТ, может быть ассоциирована с повышением активности «печеночных» трансаминаз, поэтому следует проявлять осторожность у пациентов с активным заболеванием печени или печеночной недостаточностью (см. разделы «Особые указания», «Побочное действие»).
Реактивация вирусных инфекций: у пациентов с РА, получавших терапию биологическими препаратами, наблюдались случаи реактивации вирусной инфекции (например, вирусного гепатита В). Пациенты, имевшие положительный результат при скрининговом обследовании на гепатит, не включались в клинические исследования препарата Актемра®.
Демиелинизирующие заболевания: несмотря на то, что в настоящее время способность тоцилизумаба вызывать демиелинизирующие заболевания ЦНС не известна, следует проявлять особую осторожность с целью раннего выявления симптомов, возможно указывающих на развитие демиелинизирующих заболеваний центральной нервной системы (ЦНС).
Применение во время беременности и в период грудного вскармливания
Беременность
Безопасность и эффективность применения препарата Актемра® при беременности изучены недостаточно. Исследования у обезьян не обнаружили дисморфогенетического потенциала препарата Актемра®. Однако при введении препарата в высоких дозах обнаружен повышенный риск спонтанного выкидыша/внутриутробной гибели. Значение данной информации для людей не известно (см. раздел «Фармакологические свойства», подраздел «Фармакодинамика»).
Не следует применять тоцилизумаб во время беременности, за исключением тех случаев, когда имеется очевидная клиническая необходимость.
Период грудного вскармливания
Неизвестно, выводится ли препарат Актемра® с грудным молоком у человека. Несмотря на выделение эндогенных IgG в грудное молоко, системная абсорбция препарата при грудном вскармливании маловероятна в связи с быстрой протеолитической деградацией таких белков в системе пищеварения.
При принятии решения о продолжении/прерывании кормления грудью или продолжении/отмене терапии тоцилизумабом следует принимать во внимание пользу от грудного вскармливания для ребенка и пользу от продолжения терапии для матери.
Способ применения и дозы
Стандартный режим дозирования
Препарат Актемра® должен вводиться медицинским персоналом. Препарат предназначен для введения как в амбулаторно-поликлинических, так и в стационарных условиях. Рекомендуется вводить внутривенно капельно в течение 1 часа.
Препарат Актемра® в лекарственной форме для внутривенного введения не предназначен для подкожного введения!
Подготовка препарата к введению должна проводиться в асептических условиях.
Перед введением необходимо осмотреть приготовленный раствор на предмет отсутствия посторонних частиц или изменения окраски.
Следует вводить только прозрачный или опалесцирующий бесцветный или светло-желтый раствор без видимых посторонних частиц.
Ревматоидный артрит
Внутривенно капельно в дозе 8 мг/кг 1 раз в четыре недели.
Препарат Актемра® может применяться как в монотерапии, так и в комбинации с МТ и/или БПВП.
Не рекомендуется увеличение дозы свыше 800 мг на одну инфузию пациентам с массой тела выше 100 кг (см. раздел «Фармакологические свойства», подраздел «Фармакокинетика»).
Приготовление раствора
- Рассчитать количество препарата, необходимое для введения пациенту (из расчета 0.4 мл на 1 кг массы тела (0.4 мл/кг)).
- В асептических условиях из инфузионного флакона (пакета), содержащего 100 мл 0.9% раствора натрия хлорида (раствор должен быть стерильным и апирогенным), отобрать одноразовым стерильным шприцем количество 0.9% раствора натрия хлорида, равное рассчитанному для введения количеству препарата Актемра®.
- Другим одноразовым стерильным шприцем в асептических условиях из флакона с препаратом Актемра® отобрать рассчитанное количество препарата и ввести его в инфузионный флакон (пакет) с 0.9% раствором натрия хлорида; в результате объем приготовленного раствора должен быть равным 100 мл.
- Для перемешивания аккуратно перевернуть флакон (пакет) во избежание пенообразования.
Рекомендации по коррекции дозы при изменении лабораторных показателей (см. раздел «Особые указания»).
Повышение активности «печеночных» ферментов:
| Значение показателя | Коррекция лечения |
| Превышение ВГН* в >1-3 раза | При необходимости провести коррекцию дозы одновременно назначаемого БПВП. При устойчивом повышении активности трансаминаз в этом диапазоне снизить дозу препарата Актемра® до 4 мг/кг или прервать лечение препаратом до нормализации показателей аланинаминотрансферазы (АЛТ) или аспартатаминотрансферазы (ACT). Возобновить лечение препаратом в дозе 4 мг/кг или 8 мг/кг в соответствии с клинической необходимостью. |
| Превышение ВГН в >3-5 раз | Прервать лечение препаратом Актемра® до снижения показателя до уровня менее чем в 3 раза превышающего ВГН; далее следовать рекомендациям для превышения ВГН в >1-3 раза (см. выше). Прекратить лечение препаратом Актемра® при устойчивом повышении показателя, превышающем ВГН более чем в 3 раза (подтвержденном при повторном исследовании, см. раздел «Особые указания»). |
| Превышение ВГН более чем в 5 раз | Прекратить лечение препаратом Актемра®. |
ВГН* – верхняя граница нормы
Низкое абсолютное число нейтрофилов (АЧН):
| Значение показателя (число клеток × 109/л) | Коррекция лечения |
| АЧН >1 | Дозу не изменять. |
| АЧН 0.5-1 | Прервать лечение препаратом Актемра®. При увеличении показателя до >1×109/л возобновить лечение препаратом в дозе 4 мг/кг и увеличить дозу до 8 мг/кг в соответствии с клинической необходимостью. |
| АЧН <0.5 | Прекратить лечение препаратом Актемра®. |
Низкое число тромбоцитов:
| Значение показателя (число клеток × 103/мкл) | Коррекция лечения |
| 50-100 | Прервать лечение препаратом Актемра®. При увеличении показателя >100×103/мкл возобновить лечение препаратом в дозе 4 мг/кг и увеличить дозу до 8 мг/кг в соответствии с клинической необходимостью. |
| <50 | Прекратить лечение препаратом Актемра®. |
Полиартикулярный ювенильный идиопатический артрит
Изменение дозы возможно исключительно в случае стойкого изменения массы тела пациента. Препарат Актемра® может применяться как в монотерапии, так и в комбинации с МТ.
Внутривенно капельно 1 раз в четыре недели в дозе:
- пациентам с массой тела <30 кг – 10 мг/кг;
- пациентам с массой тела >30 кг – 8 мг/кг.
Приготовление раствора
Пациенты с массой тела >30 кг
- Рассчитать количество препарата, необходимое для введения пациенту (из расчета 0.4 мл на 1 кг массы тела (0.4 мл/кг)).
- В асептических условиях из инфузионного флакона (пакета), содержащего 100 мл 0.9% раствора натрия хлорида (раствор должен быть стерильным и апирогенным), отобрать одноразовым стерильным шприцем количество 0.9% раствора натрия хлорида, равное рассчитанному для введения количеству препарата Актемра®.
- Другим одноразовым стерильным шприцем в асептических условиях из флакона с препаратом Актемра® отобрать рассчитанное количество препарата и ввести его в инфузионный флакон (пакет) с 0.9% раствором натрия хлорида; в результате объем приготовленного раствора должен быть равным 100 мл.
- Для перемешивания аккуратно перевернуть флакон (пакет) во избежание пенообразования.
Пациенты с массой тела <30 кг
- Рассчитать количество препарата, необходимое для введения пациенту (из расчета 0.5 мл на 1 кг массы тела (0.5 мл/кг)).
- В асептических условиях из инфузионного флакона (пакета), содержащего 50 мл 0.9% раствора натрия хлорида (раствор должен быть стерильным и апирогенным), отобрать одноразовым стерильным шприцем количество 0.9% раствора натрия хлорида, равное количеству, рассчитанному для введения препарата Актемра®.
- Другим одноразовым стерильным шприцем в асептических условиях из флакона с препаратом Актемра® отобрать рассчитанное количество препарата и ввести его в инфузионный флакон (пакет) с 0.9% раствором натрия хлорида; в результате объем приготовленного раствора должен быть равным 50 мл.
- Для перемешивания аккуратно перевернуть флакон (пакет) во избежание пенообразования.
Системный ювенильный идиопатический артрит
Изменение дозы возможно только в случае стойкого изменения массы тела пациента. Препарат Актемра® может применяться как в монотерапии, так и в комбинации с МТ. Внутривенно капельно 1 раз в две недели в дозе:
- пациентам с массой тела <30 кг – 12 мг/кг;
- пациентам с массой тела >30 кг – 8 мг/кг.
Приготовление раствора
Пациенты с массой тела >30 кг
- Рассчитать количество препарата, необходимое для введения пациенту (из расчета 0.4 мл на 1 кг массы тела (0.4 мл/кг)).
- В асептических условиях из инфузионного флакона (пакета), содержащего 100 мл 0.9% раствора натрия хлорида (раствор должен быть стерильным и апирогенным), отобрать одноразовым стерильным шприцем количество 0.9% раствора натрия хлорида, равное рассчитанному для введения количеству препарата Актемра®.
- Другим одноразовым стерильным шприцем в асептических условиях из флакона с препаратом Актемра® отобрать рассчитанное количество препарата и ввести его в инфузионный флакон (пакет) с 0.9% раствором натрия хлорида; в результате объем приготовленного раствора должен быть равным 100 мл.
- Для перемешивания аккуратно перевернуть флакон (пакет) во избежание пенообразования.
Пациенты с массой тела <30 кг
- Рассчитать количество препарата, необходимое для введения пациенту (из расчета 0.6 мл на 1 кг массы тела (0.6 мл/кг)).
- В асептических условиях из инфузионного флакона (пакета), содержащего 50 мл 0.9% раствора натрия хлорида (раствор должен быть стерильным и апирогенным), отобрать одноразовым стерильным шприцем количество 0.9% раствора натрия хлорида, равное рассчитанному для введения количеству препарата Актемра®.
- Другим одноразовым стерильным шприцем в асептических условиях из флакона с препаратом Актемра® отобрать рассчитанное количество препарата и ввести его в инфузионный флакон (пакет) с 0.9% раствором натрия хлорида; в результате объем приготовленного раствора должен быть равным 50 мл.
- Для перемешивания аккуратно перевернуть флакон (пакет) во избежание пенообразования.
Рекомендации по коррекции дозы при изменении лабораторных показателей у пациентов с пЮИА и сЮИА
Снижение дозы препарата Актемра® не изучалось у пациентов с пЮИА и сЮИА. Перерывы во введении препарата у пациентов с пЮИА или сЮИА в случае возникновения изменений лабораторных показателей рекомендуются в тех же ситуациях, которые перечислены для пациентов с РА выше (см. также разделы «Особые указания», «С осторожностью»). При необходимости следует изменить дозу одновременно принимаемого МТ и/или других сопутствующих препаратов или прекратить их прием, а также сделать перерыв во введении препарата Актемра® до разъяснения клинической ситуации. У пациентов с пЮИА или сЮИА решение о прекращении терапии препаратом Актемра® при возникновении изменений в лабораторных показателях должно быть принято в зависимости от индивидуальной клинической ситуации.
Правила хранения приготовленного раствора
Приготовленный инфузионный раствор препарата Актемра® физически и химически стабилен в 0.9% растворе натрия хлорида в течение 24 ч при температуре 30°С.
С микробиологической точки зрения приготовленный раствор должен быть использован немедленно.
Если препарат не используется сразу, то время и условия хранения приготовленного раствора являются ответственностью пользователя и не должны превышать 24 ч при температуре от 2°С до 8°С (хранить в холодильнике) и только в том случае, если приготовление раствора проводилось в контролируемых и валидируемых асептических условиях.
Инструкция по уничтожению неиспользованного препарата, а также по истечении срока годности
Попадание лекарственных препаратов в окружающую среду должно быть сведено к минимуму. Не следует утилизировать препарат с помощью сточных вод или вместе с бытовыми отходами. По возможности необходимо использовать специальные системы для утилизации лекарственных препаратов.
Дозирование в особых случаях
Пожилые пациенты
Коррекции дозы у пожилых пациентов (>65 лет) не требуется.
Пациенты с почечной недостаточностью
Коррекции дозы у пациентов с почечной недостаточностью легкой степени тяжести не требуется (см. раздел «Фармакологические свойства», подраздел «Фармококинетика у особых групп пациентов»). Применение тоцилизумаба у пациентов с умеренной и тяжелой почечной недостаточностью не изучалось.
Пациенты с печеночной недостаточностью
Безопасность и эффективность тоцилизумаба у пациентов с печеночной недостаточностью не изучалась (см. раздел «Особые указания»).
Дети
Безопасность и эффективность применения тоцилизумаба у детей не установлены, за исключением системного ювенильного идиопатического артрита и полиартикулярного ювенильного идиопатического артрита (дети до 2 лет не исследовались).
Побочное действие
Ревматоидный артрит
Для описания частоты нежелательных реакций используются следующие категории: очень часто (>1/10), часто (>1/100 и <1/10), нечасто (>1/1000 и <1/100).
Приведенные ниже нежелательные реакции представлены согласно классам систем органов медицинского словаря для нормативно-правовой деятельности MedDRA и перечислены в порядке клинической значимости для пациента.
Таблица 4. Обобщенные данные о нежелательных реакциях, зарегистрированных у пациентов, получавших препарат Актемра®.
| Система Орган Класс | Очень часто | Часто | Нечасто |
| Инфекции | инфекции верхних дыхательных путей | флегмона, пневмония, инфекции, вызванные Herpes simplex 1 типа и Herpes zoster | дивертикулит |
| Со стороны системы пищеварения | боли в животе, язвы ротовой полости, гастрит | стоматит, язва желудка, перфорация ЖКТ | |
| Со стороны кожи и ее придатков | сыпь, зуд, крапивница | ||
| Со стороны нервной системы | головная боль, головокружение | ||
| Изменения лабораторных показателей | повышение активности «печеночных» трансаминаз, увеличение массы тела, повышение общего билирубина | ||
| Со стороны сердечно¬сосудистой системы | повышение артериального давления (АД) | ||
| Со стороны крови и лимфатической системы | лейкопения, нейтропения | ||
| Со стороны обмена веществ | гиперхолестеринемИЯ | гипертриглицеридемия | |
| Со стороны организма в целом и реакции в месте введения | периферические отеки, реакции гиперчувствительности | ||
| Со стороны дыхательной системы | кашель, одышка | ||
| Со стороны органа зрения | конъюнктивит | ||
| Со стороны мочевыделительной системы | нефролитиаз | ||
| Со стороны эндокринной системы | гипотиреоз |
Профили безопасности тоцилизумаба у пациентов с РА, пЮИА и сЮИА были сопоставимы и не подлежат дифференцировке.
Ниже представлена дополнительная информация по отдельным нежелательным реакциям, наблюдавшимся в ходе клинических исследований.
Ревматоидный артрит
Профиль безопасности тоцилизумаба, исследованный у пациентов с рРА средней и высокой степени активности, которые не получали ранее терапию МТ и терапию биологическими препаратами, сопоставим с известным профилем безопасности тоцилизумаба.
Инфекции: регистрировались следующие серьезные инфекционные заболевания: пневмония, флегмона, инфекции, вызванные Herpes zoster, гастроэнтерит, дивертикулит, сепсис, бактериальный артрит, некоторые из них сопровождались летальным исходом. Сообщались случаи возникновения оппортунистических инфекций.
Перфорации ЖКТ: главным образом случаи перфорации ЖКТ сообщались как осложнения дивертикулита и включали разлитой гнойный перитонит, перфорацию нижних отделов ЖКТ, свищ и абсцесс.
Инфузионные реакции: нежелательными реакциями, которые наиболее часто отмечались во время введения препарата, были эпизоды повышения АД. Нежелательными реакциями, которые отмечались в течение 24 ч после окончания введения препарата, являлись головная боль и реакции со стороны кожных покровов (сыпь, крапивница). Эти реакции не приводили к ограничению терапии.
Частота анафилаксии была в несколько раз выше у пациентов, получавших препарат в дозе 4 мг/кг, чем у пациентов, получавших препарат в дозе 8 мг/кг. Клинически значимые реакции гиперчувствительности, обусловленные введением препарата Актемра® и потребовавшие прекращения лечения, отмечались у 0.3% пациентов. Данные реакции наблюдались, как правило, в период между второй и пятой инфузией препарата Актемра® (см. раздел «С осторожностью»).
Иммуногенность: антитела к тоцилизумабу были выявлены у 1.6% обследованных пациентов. У 5 из них были отмечены клинически значимые реакции гиперчувствительности, что привело к полной отмене лечения. У 1.1% пациентов выявлены нейтрализующие антитела.
Полиартикулярный ювенильный идиопатический артрит
Нежелательные явления у пациентов с пЮИА были аналогичны наблюдавшимся у пациентов с РА и сЮИА.
Инфекции: наиболее часто встречающееся нежелательное явление у пациентов с пЮИА. Наиболее часто встречающимися инфекциями были назофарингит и инфекции верхних дыхательных путей. Частота тяжелых инфекций, а также инфекций, приводящих к временному прекращению использования тоцилизумаба, значительно выше у пациентов с массой тела <30 кг, получавших тоцилизумаб в дозе 10 мг/кг, по сравнению с пациентами, масса тела которых была >30 кг, получавших тоцилизумаб в дозе 8 мг/кг.
Инфузионные реакции: реакции, связанные с инфузией, у пациентов с пЮИА определялись как любое явление, возникающее во время или в течение 24 ч после инфузии. У 5.9% пациентов, получавших тоцилизумаб, отмечались инфузионные реакции непосредственно во время инфузии, у 20.2% пациентов инфузионные реакции отмечались в течение 24 часов после инфузии. Наиболее частыми явлениями, отмечавшимися во время инфузии, были головная боль, тошнота и гипотензия; наиболее частыми явлениями, отмечавшимися в течение 24 часов после инфузии, были головокружение и гипотензия. Нежелательные реакции у пациентов с пЮИА, отмечавшиеся во время инфузии или в течение 24 часов после инфузии, по своему характеру не отличались от таковых, наблюдавшихся у пациентов с РА и сЮИА (см. раздел «Побочное действие»).
Иммуногенность: нейтрализующие антитела к тоцилизумабу без развития серьезной или клинически значимой реакции гиперчувствительности были выявлены у 0.5% пациентов, получавших тоцилизумаб, вследствие чего 1 пациент был исключен из исследования. Связь между наличием антител и клиническим ответом на терапию или развитием нежелательных явлений не обнаружена.
Системный ювенильный идиопатический артрит
В основном нежелательные реакции у пациентов с сЮИА по своему характеру не отличаются от таковых, наблюдавшихся у пациентов с РА (см. раздел «Побочное действие» выше).
Инфекции: зарегистрированные серьезные инфекции не отличались от таковых у пациентов с РА, за исключением ветряной оспы и среднего отита.
Инфузионные реакции: реакции, связанные с инфузией, у пациентов с сЮИА определялись как любое явление, возникающее во время или в течение 24 ч после инфузии. У пациентов, получавших тоцилизумаб, нежелательными явлениями были: сыпь, крапивница (серьезное явление), диарея, дискомфорт в эпигастрии, артралгия, головная боль и др.
У <1% пациентов, получавших тоцилизумаб, зарегистрирована клинически значимая реакция гиперчувствительности, связанная с терапией и потребовавшая ее отмены.
Иммуногенность: антитела к тоцилизумабу были выявлены у 2 из 112 обследованных пациентов. У одного из них развилась реакция гиперчувствительности, что привело к отмене лечения.
Изменения со стороны лабораторных показателей
Гематологические нарушения
Нейтрофилы
Четкой связи между снижением числа нейтрофилов ниже 1×109/л и развитием серьезных инфекционных заболеваний у пациентов с РА, пЮИА и сЮИА не отмечалось.
Ревматоидный артрит
Снижение числа нейтрофилов ниже 1×109/л было отмечено у 3.4% пациентов, которым препарат Актемра® вводили в дозе 8 мг/кг в комбинации с БПВП, по сравнению менее чем с 0.1% пациентов, получавших плацебо в комбинации с БПВП. Приблизительно в половине случаев снижение АЧН ниже 1×109/л возникало в пределах 8 недель после начала лечения. Снижение числа нейтрофилов ниже 0.5×109/л сообщалось у 0.3% пациентов, получавших препарат Актемра® в дозе 8 мг/кг в комбинации с БПВП (см. разделы «Способ применения и дозы», «С осторожностью», «Особые указания»).
Полиартикулярный ювенильный идиопатический артрит
При рутинном мониторинге лабораторных показателей снижение числа нейтрофилов ниже 1×109/л отмечалось у 3.7% пациентов, получавших препарат Актемра®.
Системный ювенильный идиопатический артрит
При рутинном мониторинге лабораторных показателей в течение 12 недель терапии снижение числа нейтрофилов ниже 1×109/л возникло у 7% пациентов, получавших препарат Актемра®, и отсутствовало у пациентов, получавших плацебо.
В последующем периоде наблюдения снижение числа нейтрофилов ниже 1×109/л зарегистрировано у 15% пациентов, получающих препарат Актемра®.
Тромбоциты
Ревматоидный артрит
Снижение числа тромбоцитов ниже 100×103/мкл было отмечено у 1.7% пациентов, получавших препарат Актемра® в дозе 8 мг/кг в комбинации с БПВП, и не сопровождалось развитием эпизодов кровотечения (см. разделы «Способ применения и дозы», «С осторожностью», «Особые указания»).
Полиартикулярный ювенильный идиопатический артрит
При рутинном мониторинге лабораторных показателей снижение числа тромбоцитов ≤50×103/мкл возникло у 1% пациентов, получавших препарат Актемра®. Данные изменения не сопровождались развитием эпизодов кровотечения.
Системный ювенильный идиопатический артрит
При рутинном мониторинге лабораторных показателей в течение 12 недель терапии снижение числа тромбоцитов ≤100×103/мкл возникло у 1% пациентов, в последующем периоде наблюдения снижение числа тромбоцитов ниже 100×103/мкл зарегистрировано у 3% пациентов, получающих препарат Актемра®. Данные изменения не сопровождались развитием эпизодов кровотечения.
Повышение активности «печеночных» трансаминаз
Ревматоидный артрит
Присоединение к монотерапии тоцилизумабом препаратов, обладающих потенциальным гепатотоксическим действием (например, МТ), приводило к увеличению частоты случаев повышения активности трансаминаз. Повышение активности «печеночных» трансаминаз не сопровождалось клинически значимым увеличением концентрации прямого билирубина, а также клиническими проявлениями гепатита или печеночной недостаточности. У пациентов, получавших тоцилизумаб в дозе 8 мг/кг в комбинации с БПВП, частота превышения верхней границы нормы непрямого билирубина составила 6.2%. Транзиторное повышение активности АЛТ (более чем в 3 раза превышающее ВГН), наблюдавшееся у взрослых пациентов с рРА средней или высокой степени активности (средняя продолжительность заболевания >6 месяцев), которые ранее не получали терапию МТ, имело более выраженную тенденцию возврата к нормальным значениям по сравнению с популяцией пациентов с РА.
Полиартикулярный ювенильный идиопатический артрит
При рутинном мониторинге лабораторных показателей повышение активности АЛТ или ACT в >3 раза превышающее ВГН зарегистрировано у 3.7% и <1% пациентов, соответственно.
Системный ювенильный идиопатический артрит
При рутинном мониторинге лабораторных показателей в 12-недельном периоде лечения повышение активности АЛТ или ACT в >3 раза превышающее ВГН зарегистрировано у 5% и 3% пациентов, получавших тоцилизумаб, соответственно. В последующем периоде наблюдения повышение активности АЛТ или ACT в >3 раза превышающее ВГН зарегистрировано у 12% и 4% пациентов, получавших тоцилизумаб, соответственно.
Изменение показателей липидного обмена
Ревматоидный артрит
При терапии препаратом Актемра® наблюдалось повышение показателей липидного обмена (общего холестерина, триглицеридов, ЛПВП, ЛПНП). Стойкое повышение показателя общего холестерина >6.2 ммоль/л (240 мг/дл) наблюдалось примерно у 24% пациентов, а стойкое повышение показателя ЛПНП >4.1 ммоль/л (160 мг/дл) – у 15% пациентов. У большинства пациентов индекс атерогенности не повышался, а повышение концентрации общего холестерина эффективно корригировалось гиполипидемическими препаратами.
Полиартикулярный ювенильный идиопатический артрит
При рутинном мониторинге лабораторных показателей повышение показателя общего холестерина >200 мг/дл отмечалось у 10.4% пациентов, получавших препарат Актемра®. Повышение показателя ЛПНП >130 мг/дл отмечалось у 3.4% пациентов, получавших препарат Актемра®.
Системный ювенильный идиопатический артрит
При рутинном мониторинге лабораторных показателей повышение показателя ЛПНП >130 мг/дл и общего холестерина >200 мг/дл отмечалось у 13.4% пациентов и 33.3% пациентов, получавших препарат Актемра®, соответственно. В последующем периоде наблюдения повышение показателя ЛПНП >130 мг/дл и общего холестерина >200 мг/дл отмечалось у 13.2% пациентов и 27.7% пациентов, получавших препарат Актемра®, соответственно.
Постмаркетинговое наблюдение
Приведенные ниже нежелательные реакции были выявлены в ходе постмаркетингового наблюдения на основании спонтанных сообщений, литературных источников и неинтервенционных исследовательских программ. Нежелательные реакции представлены согласно классам систем органов медицинского словаря для нормативно-правовой деятельности MedDRA. Для описания частоты нежелательных реакций используются следующие категории: часто (>1/100 и <1/10), редко (>1/10000 и <1/1000).
Таблица 5. Нежелательные реакции, выявленные в ходе постмаркетингового применения.
| Система Орган Класс | Часто | Редко |
| Со стороны кожи и ее придатков | синдром Стивенса-Джонсона1 | |
| Со стороны крови и лимфатической системы | гипофебриногенемия | |
| Со стороны иммунной системы | анафилаксия (фатальная)2,3 |
1 – реакция наблюдалась в ходе постмаркетингового наблюдения, но не отмечалась в ходе контролируемых клинических исследований. Категория частоты была определена как верхняя граница 95%-го доверительного интервала, рассчитанного исходя из общего количества пациентов, получавших тоцилизумаб в клинических исследованиях.
2 – см. раздел «Особые указания».
3 – см. раздел «Противопоказания».
Передозировка
Доступные данные о передозировке препарата Актемра® ограничены. В одном случае непреднамеренной передозировки препарата в дозе 40 мг/кг у пациента с множественной миеломой нежелательных реакций не отмечено. Не отмечалось также серьезных нежелательных реакций у здоровых добровольцев, которые получали однократно препарат Актемра® в дозе до 28 мг/кг, хотя наблюдалась нейтропения, требующая снижения дозы.
Взаимодействие с другими лекарственными средствами
Популяционный фармакокинетический анализ клинических исследований не выявил какого-либо воздействия МТ, нестероидных противовоспалительных препаратов или глюкокортикостероидов на клиренс тоцилизумаба у пациентов с РА.
Фармакокинетические параметры тоцилизумаба остаются неизменными при одновременном применении других препаратов для лечения ревматоидного артрита (таких как противомалярийные препараты (хлорохин и его производные), иммуносупрессанты (азатиоприн, лефлуномид), фолиевая кислота и ее производные, ингибиторы циклооксигеназы-2 (целекоксиб) и анальгетики (парацетамол, трамадол, кодеин и их производные)).
Одновременное однократное введение тоцилизумаба в дозе 10 мг/кг и МТ в дозе 10-25 мг один раз в неделю не оказывало клинически значимого влияния на экспозицию МТ.
Исследования по изучению комбинированного применения тоцилизумаба с другими биологическими БПВП не проводились.
Поскольку экспрессия печеночных изоферментов CYP450 подавляется под действием цитокинов (например, ИЛ-6, который стимулирует хроническое воспаление), при проведении терапии средствами, ингибирующими действие цитокинов (например, тоцилизумаб), экспрессия изоферментов CYP450 может быть нарушена.
В исследованиях in vitro, проведенных на культуре гепатоцитов человека, было показано, что ИЛ-6 вызывает снижение экспрессии изоферментов CYP1A2, CYP2C9, CYP2C19 и CYP3A4. Применение тоцилизумаба нормализует экспрессию этих изоферментов.
Влияние препарата Актемра® на изоферменты CYP (кроме CYP2C19 и CYP2D6) имеет клиническое значение для препаратов, являющихся субстратами CYP450, с узким терапевтическим индексом и/или для которых дозы подбираются индивидуально.
У пациентов с РА концентрация симвастатина (субстрат CYP3A4) через 1 неделю после однократного введения тоцилизумаба снижалась на 57%, т.е. была немного повышенной или аналогичной таковой у здоровых добровольцев.
В начале или при завершении курса терапии препаратом Актемра® следует тщательно наблюдать за пациентами, получающими лекарственные средства в индивидуально подобранных дозах, и которые метаболизируются посредством изоферментов CYP450 ЗА4, 1А2 или 2С9 (например, аторвастатин, блокаторы «медленных» кальциевых каналов, теофиллин, варфарин, фенитоин, циклоспорин или бензодиазепины). Для обеспечения терапевтического действия этих препаратов возможно потребуется увеличение их дозы. Учитывая длительный t1/2 препарата Актемра®, его действие на активность CYP450 ферментов может сохраняться в течение нескольких недель после прекращения терапии.
Особые указания
Синдром активации макрофагов у пациентов с сЮИА
Синдром активации макрофагов является серьезным жизнеугрожающим состоянием, которое может развиться у пациентов с сЮИА. Эффективность и безопасность препарата Актемра® в период возникновения синдрома активации макрофагов не изучались.
Изменения лабораторных показателей
Для всех показаний
Нейтропения: терапия препаратом Актемра® ассоциировалась с более высокой частотой развития нейтропении и не ассоциировалась с развитием серьезных инфекций. Следует проявлять осторожность при назначении препарата Актемра® пациентам с нейтропенией, т.е. при АЧН <2.0×109/л. При АЧН <0.5×109/л лечение препаратом Актемра® не рекомендуется.
При РА следует мониторировать число нейтрофилов в день проведения 2-ой или 3-ей инфузии, а в дальнейшем в соответствии с клинической практикой. Рекомендации по дозированию препарата в зависимости от АЧН представлены в разделе «Способ применения и дозы».
При пЮИА и сЮИА число нейтрофилов следует контролировать в день проведения 2-ой инфузии, а в дальнейшем в соответствии с клинической практикой (см. раздел «Способ применения и дозы»).
Тромбоцитопения: терапия препаратом Актемра® ассоциировалась со снижением числа тромбоцитов и не ассоциировалась с серьезными случаями кровотечений. Следует соблюдать осторожность при решении вопроса о начале терапии препаратом Актемра® при числе тромбоцитов ниже 100×103/мкл. Лечение не рекомендуется при числе тромбоцитов <50×103/мкл.
При РА следует мониторировать число тромбоцитов в день проведения 2-ой или 3-ей инфузии, а в дальнейшем в соответствии с клинической практикой. Рекомендации по дозированию препарата в зависимости от числа тромбоцитов представлены в разделе «Способ применения и дозы».
При пЮИА и сЮИА число тромбоцитов следует контролировать в день проведения 2-ой инфузии, а в дальнейшем в соответствии с клинической практикой (см. раздел «Способ применения и дозы»).
Повышение активности «печеночных» трансаминаз: наблюдалось легкое или умеренное повышение активности «печеночных» трансаминаз без признаков печеночной недостаточности (см. раздел «Побочное действие»). Частота возникновения подобных изменений возрастала при использовании препарата Актемра® совместно с препаратами, обладающими гепатотоксическим действием (например, МТ). Следует соблюдать осторожность при решении вопроса о начале терапии препаратом Актемра® у пациентов с показателем АЛТ или ACT, превышающем ВГН более чем в 1.5 раза. Терапия препаратом Актемра® не рекомендуется при показателе АЛТ или ACT. превышающем ВГН более чем в 5 раз.
При РА следует мониторировать АЛТ и ACT в день проведения 2-ой или 3-ей инфузии, а в дальнейшем в соответствии с клинической практикой. Рекомендации по дозированию препарата в зависимости от активности «печеночных» трансаминаз представлены в разделе «Способ применения и дозы».
При пЮИА и сЮИА АЛТ и ACT следует контролировать в день проведения 2-ой инфузии, а в дальнейшем в соответствии с клинической практикой (см. раздел «Способ применения и дозы»).
Изменение показателей липидного обмена: наблюдалось повышение показателей липидного обмена (общего холестерина, ЛПНП, триглицеридов) (см. раздел «Побочное действие»).
При РА, пЮИА и сЮИА следует оценивать показатели липидного обмена в день проведения 2-ой или 3-ей инфузии препаратом Актемра®. При ведении пациентов следует руководствоваться национальными рекомендациями по лечению гиперлипидемии.
Особенности действия лекарственного препарата при первом приеме или при его отмене
Исследования по изучению возможности препарата Актемра® вызывать зависимость не проводились. Исходя из имеющихся данных, препарат Актемра® не обладает таким действием.
Влияние на способность управлять транспортными средствами, механизмами
Исследования по изучению влияния препарата на способность управлять транспортными средствами и механизмами не проводились. Однако, учитывая тот факт, что при терапии препаратом Актемра® часто наблюдалось головокружение, пациентам, испытывающим данную нежелательную реакцию, следует рекомендовать не управлять транспортными средствами и механизмами до тех пор, пока головокружение не прекратится.
Форма выпуска
Концентрат для приготовления раствора для инфузий 20 мг/мл
По 4 мл (80 мг/4 мл), 10 мл (200 мг/10 мл) или 20 мл (400 мг/20 мл) препарата во флаконы, изготовленные из бесцветного стекла (гидролитический класс 1 ЕФ), укупоренные крышкой из бутилкаучука, обжатые алюминиевыми колпачками и закрытые пластмассовыми крышками; цвет колпачка и крышки соответствует цвету, которым выделена дозировка препарата на этикетке флакона и на пачке. 1 флакон вместе с инструкцией по применению помещают в картонную пачку с картонными вкладышами (перегородками) внутри. На пачке имеется контроль вскрытия.
Упаковка на ОАО «Фармстандарт-УфаВИТА»: 1 флакон помещают в пластиковый поддон или в картонный вкладыш, который вместе с инструкцией по медицинскому применению помещают в пачку из картона импортного.
С целью контроля первого вскрытия на пачку наклеивают самоклеящиеся круглые стикеры с надписью «контроль вскрытия».
Условия хранения
Хранить при температуре 2-8°С в защищенном от света месте.
Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
2 года 6 месяцев. Не применять по истечении срока годности.
Условия отпуска
Отпускают по рецепту.
Владелец регистрационного удостоверения
Ф. Хоффманн-Ля Рош Лтд., Швейцария
F. Hoffmann-La Roche Ltd. Grenzacherstrasse 124, 4070 Basel, Switzerland
Производитель
Чугай Фарма Мануфектуринг Ко. Лтд., Япония
Chugai Pharma Manufacturing Со. Ltd, 16-3, Kiyohara Kogyodanchi, Utsunomiya city, Tochigi, Japan
Организация, принимающая претензии потребителя
Претензии потребителей направлять в компанию ЗАО «Рош-Москва» по адресу:
107031, Россия, г. Москва, Трубная площадь, д. 2
В случае упаковки на ОАО «Фармстандарт-УфаВИТА» претензии потребителей направлять по адресу:
450077, Россия, Республика Башкортостан, г. Уфа, ул. Худайбердина, д. 28
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
В одном миллилитре концентрата содержится 20 мг тоцилизумаба*.
В каждом флаконе в 4 мл содержится 80 мг тоцилизумаба* (20 мг/мл).
В каждом флаконе в 10 мл содержится 200 мг тоцилизумаба* (20 мг/мл).
В каждом флаконе в 20 мл содержится 400 мг тоцилизумаба* (20 мг/мл).
* гуманизированное моноклональное антитело IgG1 к рецептору интерлейкина-6 (ИЛ-6) человека, получаемое с использованием клеток яичника китайского хомячка (CHO) по технологии рекомбинантной ДНК.
Вспомогательные вещества, обладающие известным действием
В каждом 80 мг флаконе содержится 0,10 ммоль (2,21) натрия.
В каждом 200 мг флаконе содержится 0,20 ммоль (4,43) натрия.
В каждом 400 мг флаконе содержится 0,39 ммоль (8,85) натрия.
Полный перечень вспомогательных веществ смотрите в разделе «Перечень вспомогательных веществ».
Прозрачная или опалесцирующая бесцветная или светло-желтого цвета жидкость.
Препарат Актемра® в комбинации с метотрексатом (МТ) показан для:
— лечения тяжелого активного прогрессирующего ревматоидного артрита (РА) у взрослых, не получавших ранее терапию МТ,
— лечения РА средней или высокой степени активности у взрослых пациентов с неадекватным ответом на предшествующую терапию одним или более базисными противовоспалительными препаратами (БПВП) или антагонистами фактора некроза опухолей (ФНО), либо с непереносимостью таковых.
В случае непереносимости МТ или нецелесообразности продолжения лечения МТ, таким пациентам можно назначать Актемра® в виде монотерапии. Было показано, что в комбинации с метотрексатом Актемра® тормозит прогрессирование рентгенологически доказанной деструкции суставов и улучшает их функцию.
Препарат Актемра® показан для лечения активного системного ювенильного идиопатического артрита (сЮИА) у пациентов в возрасте 2 лет и старше с неадекватным ответом на предшествующую терапию нестероидными противовоспалительными препаратами (НПВП) и системными кортикостероидами. Препарат Актемра® можно принимать как в виде монотерапии (в случае непереносимости МТ или нецелесообразности лечения МТ), так и в комбинации с МТ.
Препарат Актемра® в комбинации с метотрексатом (МТ) показан для лечения ювенильного идиопатического полиартрита (пЮИА; с положительным или отрицательным ревматоидным фактором и распространенным олигоартритом) у пациентов в возрасте 2 лет и старше с неадекватным ответом на предшествующую терапию метотрексатом. В случае непереносимости МТ или нецелесообразности продолжения лечения МТ, препарат Актемра® можно использовать в виде монотерапии.
Лечение должен начинать медицинский работник с опытом в выявлении и лечении РА, сЮИА или пЮИА.
Все пациенты, получающие лечение препаратом Актемра®, должны быть снабжены памяткой для пациента.
Режим дозирования
Пациенты с РА
Рекомендуемый режим дозирования – 8 мг/кг массы тела один раз каждые четыре недели.
Не рекомендуется увеличение дозы более 800 мг на одну инфузию пациентам с массой тела более 100 кг.
В клинических исследованиях дозы более 1,2 г не оценивались (смотрите раздел «Фармакодинамические свойства»).
Коррекции дозы при отклонении лабораторных показателей от нормы (смотрите раздел «Особые предупреждения и меры предосторожности»).
— Повышение активности печеночных ферментов
| Значение показателя | Действие |
| Превышение верхней границы нормы (ВГН) в 1-3 раза | При необходимости провести коррекцию дозы одновременно назначаемого МТ. При устойчивом повышении в этом диапазоне – снизить дозу препарата Актемра® до 4 мг/кг или прервать лечение до нормализации показателей аланинаминотрансферазы (АЛТ) или аспартатаминотрансферазы (ACT). Исходя из клинической ситуации – возобновить введение препарата в дозе 4 мг/кг или 8 мг/кг. |
| Превышение ВГН в 3-5 раз (подтвержденное при повторном исследовании, см. раздел «Особые предупреждения и меры предосторожности») | Прервать лечение препаратом Актемра® до снижения показателя до уровня менее чем в 3 раза превышающего ВГН; далее следовать рекомендациям для превышения ВГН в 1-3 раза, как указано выше. Прекратить лечение препаратом Актемра® при устойчивом повышении показателя, превышающем ВГН в > 3 раза. |
| Превышение ВГН более чем в 5 раз | Прекратить лечение препаратом Актемра®. |
— Низкое абсолютное число нейтрофилов (АЧН)
Не рекомендуется начинать лечение у пациентов, ранее не получавших лечение препаратом Актемра®, с абсолютным числом нейтрофилов (АЧН) ниже 2 × 109/л.
| Значение показателя (число клеток × 109/л) | Действие |
| АЧН более 1 | Дозу не изменять. |
| АЧН 0,5-1 | Прервать лечение препаратом Актемра®. При увеличении показателя АЧН выше 1 × 109/л – возобновить лечение препаратом в дозе 4 мг/кг и увеличить дозу до 8 мг/кг в соответствии с клинической необходимостью. |
| АЧН менее 0,5 | Прекратить введение препарата Актемра®. |
— Низкое число тромбоцитов
| Значение показателя (число клеток × 103/мкл) | Действие |
| 50-100 | Прервать лечение препаратом Актемра®. При увеличении числа тромбоцитов выше 100 × 103/мкл – возобновить лечение препаратом в дозе 4 мг/кг и увеличить дозу до 8 мг/кг в соответствии с клинической необходимостью. |
| менее 50 | Прекратить введение препарата Актемра®. |
Особые группы пациентов
Дети:
Пациенты с сЮИА
Рекомендуемый режим дозирования у пациентов в возрасте старше 2 лет: 8 мг/кг один раз каждые 2 недели при массе тела 30 кг и более, или 12 мг/кг один раз каждые 2 недели при массе тела менее 30 кг. Дозу следует рассчитывать при каждом введении с учетом массы тела пациента. Изменение дозы должно быть обосновано только длительным стойким изменением массы тела пациента.
Безопасность и эффективность применения препарата Актемра® в лекарственной форме для внутривенного применения у детей в возрасте до 2 лет не установлены.
У пациентов с сЮИА рекомендуется временное прекращение терапии тоцилизумабом при отклонениях лабораторных показателей от нормы, указанных в нижеследующей таблице. В случае необходимости следует откорректировать дозы совместно принимаемого МТ и/или других препаратов или отменить их, а терапию тоцилизумабом – прекратить до оценки клинической картины. Поскольку имеется много сопутствующих патологических состояний, которые при сЮИА могут влиять на лабораторные показатели, решение о прерывании приема тоцилизумаба из-за отклонений лабораторных показателей от нормы должно основываться на медицинском заключении для каждого отдельного пациента.
— Повышение активности печеночных ферментов
| Значение показателя | Действие |
| Превышение ВГН в 1-3 раза | При необходимости провести коррекцию дозы одновременно назначаемого МТ. При устойчивом повышении в этом диапазоне – прервать прием препарата Актемра® до нормализации показателей АЛТ/АСТ. |
| Превышение ВГН в 3-5 раз | При необходимости провести коррекцию дозы одновременно назначаемого МТ. Прервать лечение препаратом Актемра® до снижения показателя менее чем в 3 раза превышающего ВГН; далее следовать рекомендациям для превышения ВГН в 1-3 раза, как указано выше. |
| Превышение ВГН более чем в 5 раз | Прекратить лечение препаратом Актемра®. При сЮИА решение о прерывании приема препарата Актемра® из-за отклонений лабораторных показателей о нормы должно основываться на медицинском заключении для каждого отдельного пациента. |
— Низкое абсолютное число нейтрофилов (АЧН)
| Значение показателя (число клеток × 109/л) | Действие |
| АЧН более 1 | Дозу не изменять. |
| АЧН 0,5–1 | Прервать лечение препаратом Актемра®. При увеличении показателя АЧН выше 1 × 109/л – возобновить лечение препаратом Актемра®. |
| АЧН менее 0,5 | Прекратить лечение препаратом Актемра®. При сЮИА решение о прерывании приема препарата Актемра® из-за отклонений лабораторных показателей от нормы должно основываться на медицинском заключении для каждого отдельного пациента. |
— Низкое число тромбоцитов
| Значение показателя (число клеток × 103/мкл) | Действие |
| 50–100 | При необходимости провести коррекцию дозы одновременно назначаемого МТ. Прервать лечение препаратом Актемра®. При увеличении числа тромбоцитов выше 100 × 103/мкл – возобновить лечение препаратом Актемра®. |
| менее 50 | Прекратить лечение препаратом Актемра®. При сЮИА решение о прерывании приема препарата Актемра® из-за отклонений лабораторных показателей от нормы должно основываться на медицинском заключении для каждого отдельного пациента. |
У пациентов с сЮИА снижение дозы тоцилизумаба при отклонениях лабораторных показателей от нормы не изучалось.
Имеющиеся данные свидетельствуют о том, что клиническое улучшение наблюдается в течение 6 недель после начала лечения препаратом Актемра®. В случае отсутствия улучшения за данный период – следует тщательно пересмотреть вопрос о целесообразности продолжения терапии.
Пациенты с пЮИА
Рекомендуемый режим дозирования у пациентов в возрасте старше 2 лет: 8 мг/кг один раз каждые 4 недели при массе тела 30 кг и более, или 10 мг/кг один раз каждые 4 недели при массе тела менее 30 кг. Дозу следует рассчитывать при каждом введении с учетом массы тела пациента. Изменение дозы должно быть обосновано только длительным стойким изменением массы тела пациента.
Безопасность и эффективность применения препарата Актемра® в лекарственной форме для внутривенного введения у детей в возрасте до 2 лет не установлены.
У пациентов с пЮИА рекомендуется временное прекращение терапии тоцилизумабом при отклонениях лабораторных показателей от норм, указанных в нижеследующей таблице. В случае необходимости следует откорректировать дозы совместно принимаемого МТ и/или других препаратов или отменить их, а терапию тоцилизумабом – прекратить, пока не будет оценена клиническая картина. Поскольку имеется много сопутствующих патологических состояний, которые при пЮИА могут сказываться на лабораторных показателях, решение о прерывании приема тоцилизумаба из-за отклонений лабораторных показателей от нормы должно основываться на медицинском заключении для каждого отдельного пациента.
— Повышение активности печеночных ферментов
| Значение показателя | Действие |
| Превышение ВГН в 1-3 раза | При необходимости провести коррекцию дозы одновременно назначаемого МТ. При устойчивом повышении в этом диапазоне – прервать прием препарата Актемра® до нормализации показателей АЛТ/АСТ. |
| Превышение ВГН в 3-5 раз | При необходимости провести коррекцию дозы одновременно назначаемого МТ. Прервать лечение препаратом Актемра® до снижения показателя менее чем в 3 раза превышающего ВГН; далее следовать рекомендациям для превышения ВГН в 1-3 раза, как указано выше. |
| Превышение ВГН более чем в 5 раз | Прекратить лечение препаратом Актемра®. При пЮИА решение о прерывании приема препарата Актемра® из-за отклонений лабораторных показателей от нормы должно основываться на медицинском заключении для каждого отдельного пациента. |
— Низкое абсолютное число нейтрофилов (АЧН)
| Значение показателя (число клеток × 109/л) | Действие |
| АЧН выше 1 | Дозу не изменять. |
| АЧН 0,5-1 | Прервать лечение препаратом Актемра®. При увеличении показателя АЧН выше 1 × 109/л – возобновить лечение препаратом Актемра®. |
| АЧН менее 0,5 | Прекратить лечение препаратом Актемра®. При пЮИА решение о прерывании приема препарата Актемра® из-за отклонений лабораторных показателей от нормы должно основываться на медицинском заключении для каждого отдельного пациента. |
— Низкое число тромбоцитов
| Значение показателя (число клеток × 103/мкл) | Действие |
| 50-100 | При необходимости провести коррекцию дозы одновременно назначаемого МТ. Прервать лечение препаратом Актемра®. При увеличении числа тромбоцитов выше 100 × 103/мкл – возобновить лечение препаратом Актемра®. |
| менее 50 | Прекратить лечение препаратом Актемра®. При пЮИА решение о прерывании приема препарата Актемра® из-за отклонений лабораторных показателей от нормы должно основываться на медицинском заключении для каждого отдельного пациента. |
У пациентов с пЮИА снижение дозы тоцилизумаба при отклонениях лабораторных показателей от нормы не изучалось.
Согласно имеющимся данным предполагается, что клиническое улучшение наблюдается в течение 12 недель после начала лечения препаратом Актемра®. В случае отсутствия улучшения за данный период – следует тщательно пересмотреть вопрос о целесообразности продолжения терапии.
Пациенты пожилого возраста
Коррекции дозы у пациентов в возрасте 65 лет и старше не требуется.
Почечная недостаточность
Коррекции дозы у пациентов с почечной недостаточностью легкой степени тяжести не требуется. Применение препарата Актемра® у пациентов с почечной недостаточностью умеренной и тяжелой степени не изучалось (смотрите раздел «Фармакокинетические свойства»). У таких пациентов следует тщательно наблюдать за функцией почек.
Печеночная недостаточность
Применение препарата Актемра® у пациентов с печеночной недостаточностью не изучалось. Поэтому невозможно дать рекомендации по дозированию препарата.
Способ введения
После разведения препарат Актемра® следует вводить пациентам с РА, сЮИА, пЮИА внутривенно капельно в течение 1 часа.
Пациенты с РА, сЮИА и пЮИА с массой тела ≥ 30 кг
В асептических условиях препарат Актемра® следует развести до конечного объема, равного 100 мл, стерильным, апирогенным 9 мг/мл (0,9 %) раствором натрия хлорида для инъекций.
Пациенты с сЮИА и пЮИА с массой тела < 30 кг
В асептических условиях препарат Актемра® следует развести до конечного объема, равного 50 мл, стерильным, апирогенным 9 мг/мл (0,9 %) раствором натрия хлорида для инъекций.
Инструкции по разведению лекарственного средства перед его введением смотрите в разделе «Особые меры предосторожности при применении и другом обращении с препаратом».
Повышенная чувствительность к действующему веществу или любому вспомогательному веществу, указанному в разделе «Перечень вспомогательных веществ».
Активные тяжелые инфекционные заболевания (смотрите раздел «Особые предупреждения и меры предосторожности»).
Прослеживаемость
В целях улучшения прослеживаемости биологических лекарственных препаратов следует четко регистрировать наименование и серию введенного препарата.
Инфекции
У пациентов, получавших иммуносупрессанты, в том числе Актемра®, сообщалось о развитии серьезных инфекционных заболеваниях! в том числе с летальным исходом (смотрите раздел «Нежелательные реакции»). Не следует начинать лечение препаратом Актемра® пациентам в случае активных инфекционных заболеваний (смотрите раздел «Противопоказания»). При развитии у пациентов серьезных инфекций – введение препарата Актемра® должно быть прервано до устранения инфекции (смотрите раздел «Нежелательные реакции»). Работникам здравоохранения следует соблюдать осторожность при использовании препарата Актемра® у пациентов с рецидивирующими или хроническими инфекционными заболеваниями в анамнезе, а также с сопутствующими заболеваниями (например, при дивертикулите, сахарном диабете и интерстициальном заболевании легких), предрасполагающих к развитию инфекций.
Рекомендуется проявлять осторожность с целью раннего выявления серьезных инфекционных заболеваний у пациентов, получающих лечение биологическими препаратами, с РА, сЮИА или пЮИА средней и тяжелой степени, поскольку признаки или симптомы острого воспаления могут быть менее выраженными в связи с подавлением реакции острой фазы. При оценке риска развития инфекционного заболевания следует учитывать действие тоцилизумаба на С-реактивный белок (СРБ), нейтрофилы, а также признаки и симптомы инфекционного заболевания. Пациентов (в том числе новорожденных с сЮИА или пЮИА, которые в меньшей степени способны сообщить о симптомах) и родителей/опекунов пациентов с сЮИА следует проинформировать о необходимости сразу обратиться к работнику здравоохранения при любых симптомах, свидетельствующих о появлении инфекции, с целью своевременной диагностики и назначения необходимого лечения.
Туберкулез
До начала терапии препаратом Актемра®, как рекомендуется и при назначении других биологических препаратов, следует провести обследование пациентов с РА, сЮИА и пЮИА на наличие латентного туберкулеза (ТБ). Пациентам с латентным ТБ следует назначить стандартный курс антимикобактериальной терапии перед началом лечения препаратом Актемра®. Лечащие врачи должны помнить о существовании риска ложноотрицательных результатов туберкулиновых кожных проб и определении гамма-интерферона в крови для диагностики ТБ, особенно у тяжелобольных пациентов или пациентов с иммунодефицитом. Пациентов следует инструктировать о необходимости обратиться за медицинской помощью в случае, если во время или после завершения терапии препаратом Актемра® развиваются характерные для туберкулеза признаки/симптомы (например, непрекращающийся кашель, истощение / потеря веса, субфебрильная температура тела).
Реактивация вирусных инфекций
У пациентов с РА, получавших терапию биологическими препаратами, сообщалось о случаях реактивации вирусной инфекции (например, вирусного гепатита В). Пациентов, имевших положительный результат при скрининговом обследовании на гепатит, исключали из клинических исследований тоцилизумаба.
Осложнения дивертикулита
У пациентов с РА, получавших Актемра®, о случаях перфорации дивертикула как осложнения дивертикулита сообщались нечасто (смотрите раздел «Нежелательные реакции»). Следует соблюдать осторожность при применении препарата Актемра® у пациентов с язвенным поражением органов ЖКТ или дивертикулитом в анамнезе. Пациенты с подозрением на осложненный дивертикулит (например, с болями в области живота, кровотечениями и/или необъяснимым изменением ритма опорожнения кишечника) должны быть немедленно обследованы с целью раннего выявления дивертикулита с перфорацией ЖКТ
Реакции гиперчувствительности
В связи с применением препарата Актемра® сообщалось о серьезных реакциях гиперчувствительности (смотрите раздел «Нежелательные реакции»). Такие реакции могут быть более тяжелыми и потенциально с фатальным исходом у пациентов, у которых развивались реакции гиперчувствительности во время предшествующих инфузий, даже в случае премедикации кортикостероидами и антигистаминными лекарственными средствами. Во время лечения препаратом Актемра® должен быть предусмотрен комплекс необходимых мероприятий для лечения возможной анафилактической реакции. При возникновении анафилактической реакции или другой серьезной реакции гиперчувствительности / серьезной инфузионной реакции следует немедленно остановить и не возобновлять терапию препаратом Актемра® в дальнейшем.
Активное заболевание печени и печеночная недостаточность
Лечение препаратом Актемра®, особенно одновременно с МТ, может быть ассоциировано с повышением активности печеночных трансаминаз, поэтому при назначении лечения следует проявлять осторожность у пациентов с активным заболеванием печени или печеночной недостаточностью (смотрите разделы «Режим дозирования и способ применения» и «Нежелательные реакции»).
Гепатотоксичность
При терапии препаратом Актемра® часто сообщалось о транзиторном или интермиттирующем легком и умеренном повышении активности печеночных трансаминаз без прогрессирования до повреждения печени (смотрите раздел «Нежелательные реакции»). При использовании препарата Актемра® совместно с препаратами, обладающими потенциальным гепатотоксическим действием (например, МТ) наблюдалась повышенная частота возникновения подобных изменений. При наличии клинических показаний следует определить другие биохимические показатели, в том числе билирубин.
При применении препарата Актемра® наблюдалось серьезное лекарственное поражение печени, включая острую печеночную недостаточность, гепатит и желтуху (см. раздел «Нежелательные реакции»). Серьезные поражения печени отмечались в интервале от 2 недель до ≥5 лет после начала терапии препаратом Актемра®. Сообщалось о случаях развития печеночной недостаточности, которые привели к трансплантации печени. Пациентам следует рекомендовать немедленно обратиться к врачу, если они испытывают признаки и симптомы повреждения печени.
Следует соблюдать осторожность при решении вопроса о начале лечения препаратом Актемра® у пациентов с показателем АЛТ или ACT, превышающем ВГН более чем в 1,5 раза. Не рекомендуется проводить лечение препаратом Актемра® при показателе АЛТ или ACT, превышающем ВГН более чем в 5 раз.
У пациентов с РА, сЮИА и пЮИА следует мониторировать показатели АЛТ/ACT каждые 4-8 недель на протяжении первых 6 месяцев лечения, а в дальнейшем – каждые 12 недель. Рекомендации по коррекции доз, включая отмену препарата Актемра®, в зависимости от активности трансаминаз смотрите в разделе «Режим дозирования и способ применения». При показателе повышения активности АЛТ или ACT, превышающем ВГН в 3-5 раз, подтвержденном повторным исследованием, следует прервать лечение препаратом Актемра®.
Отклонения гематологических показателей от нормы
После лечения тоцилизумабом в дозе 8 мг/кг в комбинации с МТ было отмечено снижение уровня нейтрофилов и тромбоцитов (смотрите раздел «Нежелательные реакции»). У пациентов, ранее получавших лечение антагонистами ФНО, возможен повышенный риск развития нейтропении.
У пациентов, ранее не получавших лечение препаратом Актемра®, не рекомендуется начинать лечение препаратом при абсолютном числе нейтрофилов (АЧН) ниже 2 × 109/л. Следует соблюдать осторожность при назначении лечения препаратом Актемра® у пациентов с низким уровнем тромбоцитов (т. е. ниже 100 × 103/мкл). Не рекомендуется продолжать лечение у пациентов с АЧН менее 0,5 × 109/л или числом тромбоцитов менее 50 × 103/мкл.
Тяжелая нейтропения может быть связана с повышенным риском развития серьезных инфекций, хотя на сегодняшний день в клинических исследованиях препарата Актемра® явной связи между снижением числа нейтрофилов и развитием серьезных инфекций показано не было.
У пациентов с РА следует контролировать число нейтрофилов и тромбоцитов через 4-8 недель после начала терапии, а в дальнейшем в соответствии со стандартной клинической практикой. Информацию по коррекции доз в зависимости от АЧН и числа тромбоцитов смотрите в разделе «Режим дозирования и способ применения».
У пациентов с сЮИА и пЮИА число нейтрофилов и тромбоцитов следует контролировать во время второй инфузии, а в дальнейшем в соответствии с надлежащей клинической практикой, смотрите раздел «Режим дозирования и способ применения».
Показатели липидного обмена
Наблюдалось повышение показателей липидного обмена, в том числе общего холестерина, липопротеина низкой плотности (ЛПНП), липопротеина высокой плотности (ЛПВП), триглицеридов, у пациентов, получавших лечение тоцилизумабом (смотрите раздел «Нежелательные реакции»). У большинства пациентов, отвечавших на лечение гиполипидемическими средствами, повышения индекса атерогенности и показателей общего холестерина не было.
У пациентов с сЮИА, пЮИА и РА показатели липидного обмена следует оценивать через 4-8 недель после начала терапии препаратом Актемра®. При ведении пациентов следует руководствоваться национальными клиническими рекомендациями по лечению гиперлипидемии.
Неврологические расстройства
Врачам следует быть осведомленными о возможных симптомах впервые развивающихся демиелинизирующих заболеваний ЦНС. В настоящее время способность препарата Актемра® вызывать демиелинизирующие заболевания ЦНС неизвестна.
Злокачественные новообразования
Пациенты с РА находятся в группе риска развития злокачественных новообразований. Иммуномодулирующие препараты могут увеличивать риск развития злокачественных образований.
Иммунизация
Не следует проводить иммунизацию живыми и ослабленными вакцинами одновременно с терапией препаратом Актемра®, поскольку клиническая безопасность подобного сочетания не установлена. В рандомизированном открытом исследовании взрослые пациенты с РА, получавшие лечение препаратом Актемра® совместно с МТ, достигали эффективного ответа как на 23-валентный пневмококковый полисахарид, так и на противостолбнячные вакцины, который был аналогичен таковому при монотерапии МТ. Рекомендуется, чтобы до начала лечения препаратом Актемра® все пациенты, особенно с сЮИА и пЮИА, прошли вакцинацию в соответствии с действующими рекомендациями по иммунизации. Следует соблюдать интервал между иммунизацией живыми вакцинами и началом терапии препаратом Актемра® в соответствии с действующими рекомендациями по иммунизации при терапии иммуносупрессивными препаратами.
Риск развития сердечно-сосудистых заболеваний
Пациенты с РА находятся в группе риска развития сердечно-сосудистых заболеваний, и факторы риска (например, гипертензия, гиперлипидемия) следует контролировать согласно установленным стандартам.
Комбинация с антагонистами ФНО
У пациентов с РА, сЮИА или пЮИА препарат Актемра® не применялся одновременно с антагонистами ФНО или другими биологическими препаратами. Не рекомендуется применять препарат Актемра® одновременно с другими биологическими препаратами.
Натрий
Данное лекарственное средство содержит 1,17 ммоль (или 26,55 мг) натрия в максимальной дозе 1200 мг. Пациентам следует контролировать содержание натрия в пище.
Дозы данного лекарственного средства менее 1025 мг содержат менее чем 1 ммоль натрия (23 мг), т. е. практически не содержат натрия.
Дети
Пациенты с сЮИА
Синдром активации макрофагов (САМ) является серьезным жизнеугрожающим состоянием, которое может развиться у пациентов с сЮИА. В клинических исследованиях тоцилизумаб не изучался у пациентов в период возникновения САМ.
Исследования по лекарственному взаимодействию проводились только у взрослых пациентов. Одновременное однократное введение тоцилизумаба в дозе 10 мг/кг и МТ в дозе 10-25 мг 1 раз в неделю не оказывало клинически значимого влияния на концентрацию МТ.
Популяционные фармакокинетические анализы не выявили какого-либо воздействия МТ,
нестероидных противовоспалительных препаратов (НПВП) или кортикостероидов на клиренс тоцилизумаба.
Экспрессия печеночных изоферментов CYP450 подавляется под действием цитокинов, например, ИЛ-6, которые стимулируют хроническое воспаление. Поэтому при проведении терапии средствами, ингибирующими действие цитокинов, например, тоцилизумабом, экспрессия изоферментов CYP450 может быть изменена.
В исследованиях in vitro, проведенных на культуре гепатоцитов человека, было показано, что ИЛ-6 вызывает снижение экспрессии изоферментов CYP1A2, CYP2C9, CYP2C19 и CYP3A4. Тоцилизумаб нормализует экспрессию этих изоферментов.
В одном из исследований через одну неделю после однократного введения тоцилизумаба у пациентов с РА концентрация симвастатина (субстрат CYP3A4) снижалась на 57 %, т. е. до концентрации, которая была такой же или незначительно выше, как у здоровых добровольцев.
В начале или при завершении курса терапии тоцилизумабом следует тщательно наблюдать за пациентами, получающими лекарственные средства в индивидуально подобранных дозах, и которые метаболизируются посредством изоферментов CYP450 3А4, 1А2 или 2С9 (например, метилпреднизолон, дексаметазон (с возможным развитием синдрома отмены на перорально применяемые глюкокортикоиды), аторвастатин, блокаторы медленных кальциевых каналов , теофиллин, варфарин, фенпрокумон, фенитоин, циклоспорин или бензодиазепины), поскольку для обеспечения терапевтического действия этих препаратов может потребоваться увеличение их дозы. Учитывая длительный период полувыведения (Т1/2) тоцилизумаба, его действие на активность изоферментов CYP450 может сохраняться в течение нескольких недель после прекращения терапии.
Женщины с детородным потенциалом
Женщинам детородного возраста следует использовать надежные средства контрацепции во время терапии и в течение 3 месяцев после завершения лечения.
Беременность
Достаточных данных по применению тоцилизумаба у беременных женщин нет. В исследовании на животных было показано, что при приеме препарата в высоких дозах повышается риск спонтанного выкидыша / смерти эмбриона или плода (смотрите раздел «Доклинические данные по безопасности»). Потенциальный риск для человека неизвестен.
Не следует принимать препарат Актемра® во время беременности при отсутствии очевидной необходимости.
Лактация
Неизвестно, выводится ли тоцилизумаб с грудным молоком у человека. Выведение тоцилизумаба с грудным молоком у животных не изучалось. При принятии решения о продолжении/прерывании грудного вскармливания и продолжении/прерывании терапии препаратом Актемра® следует принимать во внимание пользу грудного вскармливания для ребенка и пользу терапии для матери.
Фертильность
Имеющиеся доклинические данные свидетельствуют о том, что во время лечения тоцилизумабом влияния на фертильность не происходит.
Актемра® незначительно влияет на способность к вождению транспортных средств и управление механизмами (смотрите раздел «Нежелательные реакции», головокружение).
Резюме профиля безопасности
Наиболее часто сообщаемыми нежелательными реакциями (НР) (которые встречались у ≥ 5 % пациентов, получавших лечение тоцилизумабом в виде монотерапии или в комбинации с БПВП) были инфекции верхних дыхательных путей, назофарингит, головная боль, гипертензия и повышенная активность АЛТ.
Самыми серьезными НР были серьезные инфекции, осложнения дивертикулита и реакции гиперчувствительности.
Пациенты с РА
Профиль безопасности тоцилизумаба изучали в 4 плацебо-контролируемых исследованиях (в исследованиях II, III, IV и V фазы) и в 1 МТ-контролируемом исследовании (исследовании I), и в их открытых расширенных периодах (смотрите раздел «Фармакодинамические свойства»).
Двойной слепой контролируемый период длился 6 месяцев в четырех исследованиях (в исследованиях I, III, IV и V) и 2 года – в одном исследовании (в исследовании II). В двойных слепых контролируемых исследованиях 774 пациента получало тоцилизумаб в дозе 4 мг/кг в комбинации с МТ, 1870 пациентов – тоцилизумаб в дозе 8 мг/кг в комбинации с МТ или другими БПВП и 288 пациентов – тоцилизумаб в дозе 8 мг/кг в монотерапии.
Популяция, подвергавшаяся длительной экспозиции, включает всех пациентов, получавших как минимум одну дозу тоцилизумаба или в двойной слепой контролируемый период исследований, или в открытый расширенный период этих исследований. Из 4009 пациентов данной популяции 3577 пациентов получало терапию не менее 6 месяцев, 3296 пациентов – не менее 1 года, 2806 пациентов – не менее 2 лет и 1222 пациентов – в течение 3 лет.
Нежелательные лекарственные реакции, информация о которых была получена из клинических исследований и / или данных пострегистрационного опыта применения препарата Актемра по результатам спонтанных сообщений, данных медицинской литературы и неинтервенционных исследований, перечисленных в Таблице 1 в соответствии с системно-органной классификацией MedDRA. Категория частоты, присваеваемая каждой нежелательной реакции, представлена в соответствии со следующим правилом: очень часто (≥ 1/10), часто (от ≥ 1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10 000 до <1/1000), очень редко (<1/10000). В пределах каждой категории нежелательные реакции представлены в порядке начиная с серьезных.
Таблица 1. Перечень нежелательных реакций, которые встречались у пациентов с РА, получавших тоцилизумаб в монотерапии или в комбинации с МТ или другими БПВП в двойной слепой контролируемый период
или в течение пострегистрационного периода
|
MedDRA Системно-органный класс |
Категории частот с терминами предпочтительного употребления |
||||
Очень часто |
Часто |
Нечасто |
Редко |
Очень редко |
|
| Инфекции и инвазии | Инфекции верхних дыхательных путей | Флегмона, пневмония, оральный простой герпес, опоясывающий герпес | Дивертикулит | ||
| Желудочно-кишечные нарушения | Боли в животе, изъязвления ротовой полости, гастрит | Стоматит, язва желудка | |||
| Нарушения со стороны кожи и подкожных тканей | Сыпь, зуд, крапивница | ||||
| Нарушения со стороны нервной системы | Головная боль, головокружение | ||||
| Лабораторные и инструментальные данные |
Повышение активности печеночных трансаминаз, увеличение массы тела, повышение общего билирубина* |
||||
| Нарушения со стороны сосудов | Гипертония | ||||
| Нарушения со стороны крови и лимфатической системы | Лейкопения, нейтропения, гипофибриногенемия | ||||
| Нарушения метаболизма и питания | Гиперхолестеринемия* | Гипертриглицеридемия | |||
| Общие нарушения и реакции в месте введения | Периферические отеки, реакции гиперчувствительности | ||||
| Нарушения со стороны органа зрения | Конъюнктивит | ||||
|
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения |
Кашель, одышка | ||||
| Нарушения со стороны почек и мочевыводящих путей | Почечнокаменная болезнь | ||||
| Эндокринные нарушения | Гипотиреоз | ||||
| Нарушения со стороны печени и желчевыводящих путей | Лекарственное поражение печени, гепатит, желтуха | Печеночная недостаточность |
* Включает показатели повышения, полученные при рутинном мониторинге лабораторных показателей (смотрите текст ниже).
Инфекции
По данным 6-месячных контролируемых исследований частота всех инфекций, о которых сообщалось при введении тоцилизумаба в дозе 8 мг/кг в комбинации с БПВП, составила 127 случаев на 100 пациенто-лет в сравнении с 112 случаями на 100 пациенто-лет в группе, получавшей плацебо в комбинации с БПВП. В популяции долгосрочного применения общая частота инфекций на фоне применения препарата Актемра® составила 108 случаев на 100 пациенто-лет.
По данным 6-месячных контролируемых клинических исследований частота серьезных инфекций в группе, принимавшей тоцилизумаб в дозе 8 мг/кг в комбинации с БПВП, составила 5,3 случая на 100 пациенто-лет в сравнении с 3,9 случаями на 100 пациенто-лет в группе, получавшей плацебо в комбинации с БПВП. В исследовании монотерапии препаратом в группе, принимавшей тоцилизумаб, частота серьезных инфекций составила 3,6 случая на 100 пациенто-лет по сравнению с 1,5 случаями на 100 пациенто-лет в группе, получавшей МТ.
В популяции долгосрочного применения общая частота серьезных инфекций (бактериальных, вирусных и грибковых) составила 4,7 случаев на 100 пациенто-лет. Сообщаемые серьезные инфекционные заболевания, в том числе с летальным исходом, включали: активный туберкулез, который мог быть внутрилегочным или внелегочным, инвазивные инфекции легких, включая кандидоз, аспергиллез, кокцидиоидомикоз, пневмоцистную пневмонию Йировеца, флегмону, простой герпес, гастроэнтерит, дивертикулит, сепсис и бактериальный артрит. Сообщалось о случаях возникновения оппортунистических инфекций.
Интерстициальное заболевание легких
Нарушение функции легких может повышать риск развития инфекций. В период постмаркетинговых наблюдений поступали сообщения о развитии интерстициального заболевания легких (включая пневмонит и фиброз легких), в том числе с летальным исходом.
Перфорации ЖКТ
Во время проведения 6-месячных контролируемых клинических исследований в группе пациентов, получавших терапию тоцилизумабом, общая частота перфораций ЖКТ составила 0,26 случаев на 100 пациенто-лет. В популяции длительного применения общая частота перфораций ЖКТ составила 0,28 случаев на 100 пациенто-лет. Главным образом о случаях перфорации ЖКТ сообщалось в виде осложнения дивертикулита и включали разлитой гнойный перитонит, перфорацию нижних отделов ЖКТ, свищ и абсцесс.
Инфузионные реакции
В 6-месячных контролируемых исследованиях сообщалось о нежелательных реакциях, связанных с введением препарата (определенные реакции, возникающие во время введения препарата или в течение 24 часов после инфузии) у 6,9 % пациентов, получавших тоцилизумаб в дозе 8 мг/кг в комбинации с БПВП, и у 5,1 % пациентов, получавших плацебо в комбинации с БПВП. Нежелательными реакциями, которые отмечались во время введения препарата, главным образом, были эпизоды повышения артериального давления; нежелательными реакциями, о которых сообщалось в течение 24 часов после окончания введения препарата, являлись головная боль и реакции со стороны кожных покровов (сыпь, крапивница). Эти реакции не приводили к ограничению терапии.
Частота анафилаксии (в целом встречалась у 8 из 4009 пациентов – 0,2 %) была в несколько раз выше при использовании препарата в дозе 4 мг/кг, чем в дозе 8 мг/кг. В контролируемых и открытых клинических исследованиях клинически значимые реакции гиперчувствительности, обусловленные введением тоцилизумаба и потребовавшие прекращения лечения, отмечены в целом у 56 из 4009 пациентов (1,4 %). В основном данные реакции наблюдались в период между второй и пятой инфузией тоцилизумаба (смотрите раздел «Особые предупреждения и меры предосторожности»). Об анафилаксии с летальным исходом во время внутривенного применения тоцилизумаба сообщалось после выхода препарата на рынок (смотрите раздел «Особые предупреждения и меры предосторожности»).
Иммуногенность
В 6-месячных контролируемых клинических исследованиях в целом 2876 пациентов было обследовано на антитела к тоцилизумабу. У 46 пациентов (1,6 %) образовались антитела к тоцилизумабу; у 6 пациентов были клинически значимые реакции гиперчувствительности, из них у 5 пациентов это привело к полной отмене лечения. У тридцати пациентов (1,1 %) образовались нейтрализующие антитела.
Отклонения гематологических показателей от нормы
Нейтрофилы
В 6-месячных контролируемых исследованиях снижение числа нейтрофилов ниже 1 × 109/л происходило у 3,4 % пациентов, которым тоцилизумаб вводили в дозе 8 мг/кг в комбинации с БПВП, по сравнению с менее 0,1 % пациентов, получавших плацебо в комбинации с БПВП.
Приблизительно у половины пациентов с АЧН менее 1 × 109/л такое снижение возникало в течение 8 недель после начала терапии. Снижение числа нейтрофилов ниже 0,5 × 109/л сообщалось у 0,3 % пациентов, получавших тоцилизумаб в дозе 8 мг/кг в комбинации с БПВП.
Сообщалось о случаях инфекций с нейтропенией.
В двойной слепой контролируемый период при долгосрочном применении характер и частота снижения числа нейтрофилов были аналогичны таковым, наблюдавшимся в 6-месячных контролируемых клинических исследованиях.
Тромбоциты
В 6-месячных контролируемых исследованиях снижение числа тромбоцитов ниже 100 × 103/мкл происходило у 1,7 % пациентов, получавших тоцилизумаб в дозе 8 мг/кг в комбинации с БПВП, по сравнению с менее 1 % пациентов, получавших плацебо в комбинации с БПВП. Данные изменения не сопровождались развитием эпизодов кровотечения.
Во время двойного слепого контролируемого периода и долгосрочного применения характер и частота снижения числа тромбоцитов соответствовали таковым, наблюдавшимся в 6-месячных контролируемых клинических исследованиях.
В период постмаркетинговых наблюдений очень редко поступали сообщения о панцитопении.
Повышение активности печеночных трансаминаз
В ходе проведения 6-месячных клинических исследований транзиторное повышение активности АЛТ/АСТ, более чем в 3 раза превышающее ВГН, наблюдалось у 2,1 % пациентов, получавших тоцилизумаб в дозе 8 мг/кг, по сравнению с 4,9 % пациентов, получавшими МТ, и у 6,5 % пациентов, получавших тоцилизумаб в дозе 8 мг/кг в комбинации с БПВП, по сравнению с 1,5 % пациентов, получавших плацебо в комбинации с БПВП.
Присоединение к монотерапии тоцилизумабом препаратов, обладающих потенциальным гепатотоксическим действием (например, МТ), приводило к увеличению частоты случаев повышения активности трансаминаз. Повышение активности АЛТ/АСТ, более чем в 5 раз превышающее ВГН, наблюдалось у 0,7 % пациентов, получавших монотерапию тоцилизумабом, и у 1,4 % пациентов, получавших тоцилизумаб в комбинации с БПВП. При этом большинство пациентов навсегда прекратили терапию тоцилизумабом. Во время двойного слепого, контролируемого периода у пациентов, получавших лечение тоцилизумабом в дозе 8 мг/кг в комбинации с БПВП, частота превышения ВГН непрямого билирубина составила 6,2 %. В целом у 5,8 % пациентов происходило увеличение уровня непрямого билирубина, в 1-2 раза превышающее ВГН, и у 0,4 % – более чем в 2 раза превышающее ВГН.
Во время двойного слепого контролируемого периода при долгосрочном применении характер и частота повышения активности АЛТ/АСТ соответствовали таковым, наблюдавшимся в 6-месячных контролируемых клинических исследованиях.
Показатели липидного обмена
Во время контролируемых исследований продолжительностью 6 месяцев часто сообщалось о повышении таких показателей липидного обмена, как общего холестерина, триглицеридов, холестерина ЛПНП и/или холестерина ЛПВП. Вместе с тем в ходе рутинного мониторинга лабораторных показателей было показано, что приблизительно у 24 % пациентов, получавших препарат Актемра® во время клинических исследований, происходило устойчивое повышение общего холестерина в целом до уровня 6,2 ммоль/л и выше, при этом у 15 % пациентов происходило устойчивое повышение показателя ЛПНП до 4,1 ммоль/л и выше. Показатели липидного обмена нормализовались при лечении гиполипидемическими препаратами.
Во время двойного слепого контролируемого периода при долгосрочном применении характер и частота повышения показателей липидного обмена соответствовали таковым, наблюдавшимся в 6-месячных контролируемых исследованиях.
Злокачественные новообразования
Клинических данных недостаточно, чтобы оценить возможную частоту развития злокачественных новообразований после использования тоцилизумаба. На настоящее время долгосрочная оценка безопасности продолжается.
Реакции со стороны кожи
В постмаркетинговом периоде сообщалось об очень редких случаях синдрома Стивенса-Джонсона.
Дети
Профиль безопасности тоцилизумаба в группе пациентов детского возраста указан ниже в разделах о пЮИА и сЮИА. В целом НР у пациентов с пЮИА и сЮИА аналогичны таковым, наблюдавшимся у пациентов с РА, смотрите раздел «Нежелательные реакции».
НР у пациентов с пЮИА и сЮИА, получавших лечение тоцилизумабом, описаны ниже и представлены в Таблице 2 в соответствии с системно-органной классификацией MedDRA и категориями частоты, представленными в соответствии со следующим правилом: очень часто (≥ 1/10), часто (от ≥ 1/100 до < 1/10) или нечасто (от ≥ 1/1000 до < 1/100).
Таблица 2. Перечень нежелательных реакций, полученных из клинических исследований у пациентов с сЮИА или пЮИА, получавших тоцилизумаб в виде монотерапии или в комбинации с МТ
| MedDRA Системно-органный класс | Термин предпочтительного употребления | Частота | ||
| Инфекции и инвазии | Очень часто | Часто | Нечасто | |
| Инфекции верхних дыхательных путей | пЮИА, сЮИА | |||
| Назофарингит | пЮИА, сЮИА | |||
| Нарушения со стороны желудочно-кишечного тракта | ||||
| Тошнота | пЮИА | |||
| Диарея | пЮИА, сЮИА | |||
| Общие нарушения и реакции в месте введения | ||||
| Инфузионные реакции | пЮИА1, сЮИА2 | |||
| Нарушения со стороны нервной системы | ||||
| Головная боль | пЮИА | сЮИА | ||
| Изменения лабораторных показателей | ||||
| Повышение активности печеночных трансаминаз | пЮИА | |||
| Снижение числа нейтрофилов | сЮИА | пЮИА | ||
| Снижение числа тромбоцитов | сЮИА | пЮИА | ||
| Повышение уровня холестерина | сЮИА | пЮИА |
1 Инфузионные реакции у пациентов с пЮИА, включавшие, но не ограниченные ими, головную боль, тошноту, гипотензию.
2 Инфузионные реакции у пациентов с сЮИА реакции, включавшие, но не ограниченные ими, сыпь, крапивницу, диарею, дискомфорт в эпигастральной области, боли в суставах, головную боль.
Пациенты с пЮИА
Профиль безопасность препарата Актемра® в лекарственной форме для внутривенного применения изучалась у 188 детей в возрасте от 2 до 17 лет с пЮИА. Общая экспозиция у пациентов составила 184,4 пациенто-лет. Частоту НР у пациентов с пЮИА можно найти в таблице 2. Типы НР у пациентов с пЮИА были аналогичны таковым, наблюдавшимся у пациентов с РА и сЮИА, смотрите раздел «Нежелательные реакции». По сравнению с группой взрослых пациентов с РА о случаях назофарингита, головной боли, тошноты и повышения числа нейтрофилов чаще сообщалось в группе пациентов с пЮИА. О случаях повышения показателя холестерина реже сообщалось в группе пациентов с пЮИА по сравнению с группой взрослых пациентов с РА.
Инфекции
Частота инфекций во всей группе тоцилизумаба составила 163,7 случаев на 100 пациенто-лет. Наиболее часто встречающимися инфекциями были назофарингит и инфекции верхних дыхательных путей. Частота серьезных инфекций была значительно выше у пациентов с массой тела менее 30 кг, получавших лечение тоцилизумабом в дозе 10 мг/кг (12,2 случая на 100 пациенто-лет), по сравнению с пациентами, масса тела которых была 30 кг и выше, получавших лечение тоцилизумабом в дозе 8 мг/кг (4,0 случая на 100 пациенто-лет). Частота инфекций, приводивших к временному прекращению применения тоцилизумаба, также была значительно выше у пациентов с массой тела менее 30 кг, получавших лечение тоцилизумабом в дозе 10 мг/кг (21,4 %), по сравнению с пациентами, масса тела которых была 30 кг и выше, получавших лечение тоцилизумабом в дозе 8 мг/кг (7,6 %).
Инфузионные реакции
Инфузионные реакции у пациентов с пЮИА определялись как любое явление, возникающее во время или в течение 24 часов после инфузии. Из всей группы пациентов, получавших тоцилизумаб, у 11 пациентов (5,9 %) отмечены инфузионные реакции во время инфузии, у 38 пациентов (20,2 %) инфузионные реакции возникали в течение 24 часов после инфузии. Самыми частыми реакциями, происходившими во время инфузии, были головная боль, тошнота и гипотензия, а в течение 24 часов после инфузии – головокружение и гипотензия. В целом нежелательные реакции на препарат, наблюдавшиеся во время инфузии или в течение 24 часов после инфузии, по своему характеру не отличались от таковых, наблюдавшихся у пациентов с РА и сЮИА, смотрите раздел «Нежелательные реакции».
О клинически значимых реакциях гиперчувствительности, связанных с применением тоцилизумаба и требующих отмены лечения, не сообщалось.
Иммуногенность
Антитела к тоцилизумабу без реакции гиперчувствительности образовались у одного пациента с массой тела менее 30 кг, получавшего тоцилизумаб в дозе 10 мг/кг, который впоследствии выбыл из исследования.
Нейтрофилы
Рутинный мониторинг лабораторных показателей всех пациентов, принимавших тоцилизумаб, выявил снижение числа нейтрофилов ниже 1 × 109/л у 3,7 % пациентов.
Тромбоциты
Рутинный мониторинг лабораторных показателей всех пациентов, принимавших тоцилизумаб, выявил снижение числа тромбоцитов до 50 × 103/мкл и ниже у 1 % пациентов, что не сопровождалось развитием эпизодов кровотечения.
Повышение активности печеночных трансаминаз
Рутинный мониторинг лабораторных показателей всех пациентов, принимавших тоцилизумаб, определил повышение активности АЛТ или ACT, в 3 раза и выше превышающее ВГН, у 3,7 % пациентов и у менее чем 1 % пациента, соответственно.
Показатели липидного обмена
Во время рутинного мониторинга лабораторных показателей в клиническом исследовании WA19977 препарата Актемра® для внутривенного применения у 3.4 % и 10.4 % пациентов отмечалось повышение уровня ЛПНП-холестерина до ≥130 мг/дл и общего холестерина до ≥200 мг/дл по сравнению с базовым уровнем на всем протяжении лечения, соответственно.
Пациенты с сЮИА
Профиль безопасность препарата Актемра® в лекарственной форме для внутривенного применения изучался у 112 детей с сЮИА в возрасте от 2 до 17 лет. В течение 12-недельного двойного слепого контролируемого периода 75 пациентов получало лечение тоцилизумабом (в дозе 8 мг/кг или 12 мг/кг в зависимости от массы тела). После 12 недель или при переходе на препарат Актемра® в связи с ухудшением течения заболевания пациенты продолжали лечение в открытом расширенном периоде исследования.
В основном типы НР у пациентов с сЮИА были аналогичны таковым, наблюдавшимся у пациентов с РА, смотрите раздел «Нежелательные реакции». Частоту НР у пациентов с сЮИА можно найти в таблице 2. По сравнению с группой взрослых пациентов с РА у пациентов с сЮИА чаще происходили случаи назофарингита, снижения числа нейтрофилов, повышения активности печеночных трансаминаз и диарея. О случаях повышения показателя холестерина сообщалось реже в группе пациентов с сЮИА, по сравнению с группой взрослых пациентов с РА.
Инфекции
За 12-недельный контролируемый период частота всех инфекций в группе препарата Актемра® в лекарственной форме для внутривенного применения составила 344,7 случаев на 100 пациенто-лет и 287 случаев на 100 пациенто-лет в группе плацебо. В открытом расширенном периоде исследования (часть II) общая частота инфекций оставалась на уровне 306,6 случаев на 100 пациенто-лет.
За 12-недельный контролируемый период частота серьезных инфекций в группе препарата Актемра® в лекарственной форме для внутривенного применения составила 11,5 случаев на 100 пациенто-лет. В первый год открытого расширенного периода исследования общая частота серьезных инфекций в группе тоцилизумаба оставалась стабильной на уровне 11,3 случаев на 100 пациенто-лет. Сообщаемые серьезные инфекции не отличались от таковых у пациентов с РА, за исключением ветряной оспы и среднего отита.
Инфузионные реакции
Инфузионные реакции (ИР) определялись как любые явления, возникающие во время или в течение 24 часов после инфузии. В 12-недельном контролируемом периоде исследования нежелательные явления, возникавшие во время инфузии, зафиксированы у 4 % пациентов группы тоцилизумаба. В рамках исследования у одного пациента терапия была отменена в связи с развитием серьезного и жизнеугрожающего нежелательного явления (ангионевротического отека).
В 12-недельный контролируемый период у 16 % пациентов группы тоцилизумаба и у 5,4 % пациентов группы плацебо возникло нежелательное явление в течение 24 часов после проведения инфузии. У пациентов группы тоцилизумаба нежелательными явлениями, которые считались серьезными, были: сыпь, крапивница, диарея, дискомфорт в эпигастральной области, боли в суставах, головная боль, но не ограничивались ими.
У 1 из 112 пациентов (менее 1 %), получавших лечение тоцилизумабом в контролируемый и открытый периоды клинического исследования, сообщалась клинически значимая реакция гиперчувствительности, связанная с применением тоцилизумаба и потребовавшая отмены лечения.
Иммуногенность
До лечения все 112 пациентов были обследованы на антитела к тоцилизумабу. У двоих пациентов образовались антитела к тоцилизумабу, при этом у одного из них развилась реакция гиперчувствительности, что привело к отмене лечения. Частота образования антител к тоцилизумабу может быть недооценена в связи с интерференцией тоцилизумаба в анализе и более высокой концентрацией у детей по сравнению с взрослыми пациентами.
Нейтрофилы
Рутинный мониторинг лабораторных показателей в 12-недельном контролируемом периоде выявил снижение числа нейтрофилов ниже 1 × 109/л у 7 % пациентов группы тоцилизумаба, а у пациентов группы плацебо такового не происходило.
В продолжающемся открытом расширенном периоде снижение числа нейтрофилов ниже 1 × 109/л отмечено у 15 % пациентов группы тоцилизумаба.
Тромбоциты
Рутинный мониторинг лабораторных показателей в 12-недельном контролируемом периоде выявил снижение числа тромбоцитов до уровня менее 100 × 103/мкл у 3 % пациентов группы плацебо и у 1 % пациентов группы тоцилизумаба.
В открытом расширенном периоде исследования снижение числа тромбоцитов ниже 100 × 103/мкл произошло у 3 % пациентов группы тоцилизумаба, при этом оно не сопровождалось развитием эпизодов кровотечения.
Повышение активности печеночных трансаминаз
По данным рутинного мониторинга лабораторных показателей в 12-недельном контролируемом периоде повышение активности АЛТ или ACT, в 3 и более раза превышающее ВГН, возникло у 5 % и 3 % пациентов группы тоцилизумаба, соответственно, в группе плацебо – у 0 % пациентов.
В продолжающемся открытом расширенном периоде исследования повышение активности АЛТ или ACT, в 3 и более раза превышающее ВГН, возникло у 12 % и 4 % пациентов группы тоцилизумаба, соответственно.
Иммуноглобулин G
Во время терапии уровень иммуноглобулина класса G (IgG) снижается. В какой-то момент в ходе исследования снижение ниже нижней границы нормы произошло у 15 пациентов.
Показатели липидного обмена
Согласно данным рутинного мониторинга лабораторных показателей в 12-недельном контролируемом периоде (исследование WA18221) у 13.4% и 33.3% пациентов отмечалось повышение уровня ЛПНП-холестерина до ≥130 мг/дл и общего холестерина до ≥200 мг/дл по сравнению с базовым уровнем на всем протяжении лечения, соответственно.
В расширенной фазе (исследование WA18221) у 13.2% и 27.7% пациентов отмечалось повышение уровня ЛПНП-холестерина до ≥130 мг/дл и общего уровня холестерина до ≥200 мг/дл по сравнению с базовым уровнем на всем протяжении лечения, соответственно.
Информирование о возможных нежелательных реакциях
Важно информировать о возможных нежелательных реакциях после регистрации лекарственного средства. Это позволяет продолжать мониторинг соотношения пользы и риска при применении препарата. Работникам здравоохранения предлагается сообщать о любых возможных нежелательных реакциях через национальную систему репортирования.
Имеются ограниченные данные о передозировке препаратом Актемра®. Сообщалось об одном случае непреднамеренной передозировки препаратом, при этом пациент с множественной миеломой получил препарат однократно в дозе 40 мг/кг. Нежелательных реакций не наблюдалось.
У здоровых добровольцев, получавших препарат однократно в дозе до 28 мг/кг, серьезных нежелательных реакций также не наблюдалось, хотя имела место нейтропения, которая потребовала ограничения дозы.
Дети
О случаях передозировки у детей не сообщалось.
Иммунодепрессанты, ингибиторы интерлейкина.
Код ATX: L04AC07.
Фармакодинамические свойства
Механизм действия
Тоцилизумаб специфически связывается как с растворимыми, так и с мембранными рецепторами ИЛ-6 (sIL-6R и mIL-6R). Было показано, что тоцилизумаб обладает способностью подавлять сигналы медиаторов sIL-6R и mIL-6R. ИЛ-6 является плейотропным провоспалительным цитокином, вырабатываемым различными типами клеток, в том числе Т- и В-клетками, моноцитами и фибробластами. ИЛ-6 участвует в различных физиологических процессах, таких как Т-клеточная активация, индукция секреции иммуноглобулина, начало печеночного синтеза белка острой фазы и стимуляция гемопоэза. ИЛ-6 вовлечен в патогенез таких заболеваний как воспалительные заболевания, остеопороз и новообразования.
Пациенты с РА
Фармакодинамическое действие
В клинических исследованиях тоцилизумаба наблюдалось быстрое снижение уровня С-реактивного белка (СРБ), скорости оседания эритроцитов (СОЭ) и содержания сывороточного амилоида А (САА) и фибриногена. Применение тоцилизумаба было сопряжено со снижением числа тромбоцитов в пределах нормы, что указывает на действие на белок острой фазы воспаления. Наблюдалось повышение уровня гемоглобина за счет ослабления тоцилизумабом отрицательных эффектов ИЛ-6 на образование гепсидина, способствующего повышению уровня железа. Применение тоцилизумаба приводило к снижению уровня СРБ до нормальных значений уже на 2 неделе терапии, при этом это снижение сохранялось во время всего лечения. У здоровых добровольцев введение тоцилизумаба в дозах от 2 до 28 мг/кг приводило к снижению абсолютного числа нейтрофилов до самого низкого уровня через 3–5 дней после применения. В дальнейшем уровень нейтрофилов возвращался до исходного значения в зависимости от дозы. У пациентов с ревматоидным артритом был продемонстрирован аналогичный характер снижения абсолютного числа нейтрофилов после введения тоцилизумаба (смотрите раздел «Нежелательные реакции»).
Клиническая эффективность и безопасность
Эффективность тоцилизумаба по уменьшению признаков и симптомов РА оценивалась в 5 рандомизированных, двойных слепых, многоцентровых исследованиях. Исследования I-V включали пациентов в возрасте 18 лет и старше с установленным активным РА по критериям Американской коллегии ревматологов (АКР), у которых до лечения было не менее восьми болезненных и шести опухших суставов.
В исследовании I тоцилизумаб вводили внутривенно каждые четыре недели в качестве монотерапии. В исследованиях II, III и V тоцилизумаб вводили внутривенно каждые четыре недели в комбинации с МТ в сравнении с комбинацией плацебо и МТ. В исследовании IV тоцилизумаб вводили внутривенно каждые 4 недели в комбинации с другими БПВП в сравнении с комбинацией плацебо и других БПВП. Первичной конечной точкой для каждого из 5 исследований являлась доля пациентов с ответом АКР20 на 24 неделе исследования.
В исследовании I оценивали состояние 673 пациентов, которые не получали МТ в течение шести месяцев до рандомизации и которые не прекращали предшествующее лечение МТ в связи с клинически значимыми токсическими эффектами или отсутствием ответа. Большинство пациентов (67 %) ранее не получало МТ. Тоцилизумаб давали в виде монотерапии в дозе 8 мг/кг каждые четыре недели. Группа сравнения получала МТ еженедельно (на протяжении 8-недельного периода дозу еженедельно титровали с 7,5 мг до максимальной в 20 мг).
В исследовании II, двухгодичное с плановыми анализами на 24, 52 и 104 неделе, оценивали состояние 1196 пациентов с неадекватным клиническим ответом на лечение МТ. Тоцилизумаб в дозе 4 или 8 мг/кг или плацебо давали каждые четыре недели в качестве «слепой терапии» на протяжении 52 недель в комбинации с неизменными дозами МТ (10-25 мг еженедельно). После 52 недели все пациенты могли получать открытое лечение тоцилизумабом в дозе 8 мг/кг. Из числа тех пациентов, которые завершили исследование и изначально были рандомизированы в группу плацебо и МТ, 86 % получало открытое лечение тоцилизумабом в дозе 8 мг/кг через 2 года. Первичной конечной точкой являлась доля пациентов с ответом АКР20 на 24 неделе исследования. На 52 и 104 неделе исследования составными первичными точками были предотвращение деструкции суставов и улучшение их функции.
В исследовании III оценивали состояние 623 пациентов с неадекватным клиническим ответом на МТ. Тоцилизумаб в дозе 4 или 8 мг/кг или плацебо вводились каждые четыре недели в комбинации с неизменными дозами МТ (10-25 мг еженедельно).
В исследовании IV оценивали состояние 1220 пациентов с неадекватным ответом на текущую терапию ревматологического заболевания, в том числе на лечение одним или более БПВП. Тоцилизумаб в дозе 8 мг/кг или плацебо вводили каждые четыре недели в комбинации с неизменными дозами БПВП.
В исследовании V оценивали состояние 499 пациентов с неадекватным клиническим ответом на терапию одним или более антагонистами ФНО либо с непереносимостью таковых. Перед рандомизацией терапию антагонистом ФНО отменяли. Тоцилизумаб в дозе 4 или 8 мг/кг или плацебо применяли каждые четыре недели в комбинации с неизменными дозами МТ (10-25 мг еженедельно).
Клинический ответ
Во всех исследованиях на 6 месяце лечения у пациентов, получавших лечение тоцилизумабом в дозе 8 мг/кг, была статистически значимая более высокая частота ответов АКР20, 50 и 70, чем в контрольной группе (таблица 3). В исследовании I было показано преимущество тоцилизумаба в дозе 8 мг/кг над активным компаратором МТ.
Эффективность лечения была схожей и не зависела от наличия или отсутствия ревматоидного фактора, возраста, пола, расовой принадлежности, числа предшествующих курсов лечения или стадии заболевания. Ответ на терапию возникал быстро (уже на 2 неделе) и выраженность ответа продолжала расти с продлением лечения. Стойкий ответ наблюдался в дальнейшем на протяжении более 3 лет в открытых расширенных исследованиях I-V.
При лечении тоцилизумабом в дозе 8 мг/кг существенные улучшения отмечались по всем компонентам ответа АКР, в том числе: число болезненных и опухших суставов; общая оценка пациентом и врачом; индекс нетрудоспособности; оценка боли и уровень СРБ в сравнение с таковыми у пациентов, получавших плацебо и МТ или другие БПВП во всех исследованиях.
У пациентов, принимавших участие в исследованиях I-V, в начале лечения индекс активности заболевания (DAS28) составлял 6,5-6,8. У пациентов, получавших лечение тоцилизумабом, в сравнении с исходным показателем наблюдалось значительное снижение DAS28 (среднее улучшение) на 3,1-3,4 по сравнению с пациентами из контрольной группы (1,3-2,1). На 24 неделе терапии доля пациентов, достигших клинической ремиссии по DAS28 (DAS28 < 2,6), была значительно больше в группе тоцилизумаба (28-34 %), чем в контрольной группе (1-12 %). В исследовании II 65 % пациентов достигло DAS28 < 2,6 на 104 неделе терапии, по сравнению с 48 % пациентов, достигших этого показателя на 52 неделе, и 33 % пациентов – на 24 неделе.
В сводном анализе результатов исследований II, III и IV доля пациентов, достигших ответа АКР20, 50 и 70 была значительно больше (59 % по сравнению с 50 %, 37 % по сравнению с 27 %, 18 % по сравнению с 11 %, соответственно) в группе, получавшей тоцилизумаб в дозе 8 мг/кг и БПВП, по сравнению с группой, получавшей тоцилизумаб в дозе 4 мг/кг и БПВП (p < 0,03).
Аналогично этому доля пациентов, достигших ремиссии DAS28 (DAS28 < 2,6) была значительно больше (31 % по сравнению с 16 %, соответственно) среди пациентов, получавших тоцилизумаб в дозе 8 мг/кг и БПВП, чем среди пациентов, получавших тоцилизумаб в дозе 4 мг/кг и БПВП (p < 0,0001).
Таблица 3. Ответы АКР в плацебо-, МТ- или БПВП-контролируемых исследованиях (% пациентов)
| Исследование I «AMBITION» | Исследование II «LITHE» | Исследование III «OPTION» | Исследование IV «TOWARD» | Исследование V «RADIATE» | ||||||
| Неделя | TCZ 8 мг/кг | MTX | TCZ 8 мг/кг + MTX | РВО + MTX | TCZ 8 мг/кг + MTX | РВО + MTX | TCZ 8 мг/кг + DMA RD | РВО + DMARD | TCZ8 мг/кг + MTX | РВО + MTX |
| N = 286 | N = 284 | N = 398 | N = 393 | N = 205 | N = 204 | N = 803 | N = 413 | N=170 | N = 158 | |
| АКР20 | ||||||||||
| 24 | 70 % *** | 52 % | 56 %*** | 27 % | 59 %*** | 26 % | 61 %*** | 24 % | 50 %*** | 10 % |
| 52 | 56 %*** | 25 % | ||||||||
| АКР50 | ||||||||||
| 24 | 44 % ** | 33 % | 32 %*** | 10 % | 44 %*** | 11 % | 38 %*** | 9 % | 29 %*** | 4 % |
| 52 | 36 %*** | 10 % | ||||||||
| AKP70 | ||||||||||
| 24 | 28 % ** | 15 % | 13 %*** | 2 % | 22 %*** | 2 % | 21 %*** | 3 % | 12 % ** | 1 % |
| 52 | 20 %*** | 4 % |
TCZ – тоцилизумаб
MTX – метотрексат
PBO – плацебо
DMARD – базисный противовоспалительный препарат
** – p < 0,001, TCZ по сравнению с PBO + MTX/DMARD
*** – p < 0,0001, TCZ по сравнению с PBO + MTX/DMARD
Хороший клинический ответ
Через 2 года лечения тоцилизумабом в комбинации с МТ 14 % пациентов достигало хорошего клинического ответа (ответ АКР70 сохранялся на протяжении 24 недель или более).
Рентгенологический ответ
В исследовании II у пациентов с неадекватным ответом на лечение МТ проводилась рентгенологическая оценка торможения деструкции суставов, которая была выражена как изменение модифицированного индекса Шарпа и его компонентов, индекса эрозирования и индекса сужения суставной щели. По сравнению с контрольной группой, у пациентов, получавших тоцилизумаб, было показано торможение деструкции суставов со значительно меньшим рентгенологическим прогрессированием (таблица 4).
В открытый расширенный период исследования II у пациентов, получавших лечение тоцилизумабом в комбинации с МТ, торможение прогрессирования деструкции суставов сохранялось на втором году лечения. На 104 неделе терапии среднее значение суммарного индекса Шарпа-Генанта по сравнению с исходным было значительно ниже у пациентов, рандомизированных в группу тоцилизумаба в дозе 8 мг/кг в комбинации с МТ (р < 0,0001), по сравнению с пациентами, рандомизированными в группу плацебо в комбинации с МТ.
Таблица 4. Средние показатели рентгенологических изменений за 52 недели исследования II
| РВО + MTX (+ TCZ с 24 недели) N = 393 |
TCZ 8 мг/кг + MTX N = 398 |
|
| Суммарный индекс Шарпа-Генанта | 1,13 | 0,29* |
| Индекс эрозирования | 0,71 | 0,17* |
| Индекс сужения суставной щели | 0,42 | 0,12** |
РВО – плацебо
MTX – метотрексат
TCZ – тоцилизумаб
JSN – сужение суставной щели
* – p < 0,0001, TCZ по сравнению с РВО + MTX
** – p < 0,005, TCZ по сравнению с РВО + MTX
После одного года лечения тоцилизумабом в комбинации с МТ у 85 % пациентов (n = 348) не было прогрессирования структурного повреждения суставов согласно изменению суммарного индекса Шарпа, равного 0 или менее, по сравнению с 67 % пациентов, получавших лечение плацебо и МТ (n = 290) (р ≤ 0,001). Данный результат сохранялся на протяжении 2 лет лечения (83 %; n = 353). У девяноста трех процентов пациентов (93 %; n = 271) отсутствовало прогрессирование деструкции суставов между 52 и 104 неделями терапии.
Показатели качества жизни, связанного со здоровьем
Согласно анкетированию пациентов применение тоцилизумаба привело к улучшению всех показателей по опроснику оценки состояния здоровья – HAQ-DI, по краткой форме-36 и опросникам функциональной оценки терапии хронических заболеваний. Статистически значимые улучшения по индексу HAQ-DI наблюдались у пациентов, получавших лечение препаратом Актемра®, по сравнению с пациентами, получавшими лечение БПВП. Во время открытого периода исследования II улучшение физического состояния сохранялось в течение 2 лет. На 52 неделе среднее изменение по индексу HAQ-DI было -0,58 в группе тоцилизумаба в дозе 8 мг/кг и МТ, по сравнению с -0,39 в группе плацебо и МТ. На 104 неделе среднее изменение по индексу HAQ-DI сохранялось в группе тоцилизумаба 8 мг/кг и МТ (-0,61).
Уровень гемоглобина
Наблюдались статистически значимые улучшения уровня гемоглобина на 24 неделе терапии при применении тоцилизумаба, по сравнению с БПВП (p < 0,0001). Средний уровень гемоглобина повышался ко 2 неделе и оставался в пределах нормы в течение всех 24 недель.
Монотерапия тоцилизумабом по сравнению с монотерапией адалимумабом
В исследовании WA19924, 24-недельное двойное слепое исследование, в котором сравнивали монотерапию тоцилизумабом с монотерапией адалимумабом, оценивали состояние 326 пациентов с РА с непереносимостью МТ или когда продолжение лечения МТ считалось нецелесообразным (включая пациентов с неадекватным ответом на лечение МТ). Пациентам из группы тоцилизумаба внутривенно (IV) вводили тоцилизумаб (8 мг/кг) каждые 4 недели и делали инъекции плацебо подкожно (SC) каждые 2 недели. Пациентам группы адалимумаба делали инъекции адалимумаба SC (40 мг) каждые 2 недели и вводили плацебо IV каждые 4 недели. Наблюдалось статистически значимое превосходство в эффективности тоцилизумаба над адалимумабом по контролю активности заболевания к 24 неделе терапии по сравнению с исходными показателями, выраженное в изменении показателя первичной точки DAS28 и всех вторичных точек (таблица 5).
Таблица 5. Результаты эффективности в исследовании VI (WA19924)
| ADA+ плацебо (IV) N = 162 |
TCZ + плацебо (SC) N = 163 |
р-значение(а) | |
| Первичная конечная точка – среднее изменение показателя к 24 неделе в сравнении с исходным | |||
| DAS28 (скорректированная средняя величина) | -1,8 | -3,3 | |
| Разница в скорректированной средней величине (95 % доверительный интервал (ДИ)) | -1,5 (-1,8, -1,1) | <0,0001 | |
| Вторичные конечные точки – доля пациентов, ответивших на лечение к 24 неделе(b) | |||
| DAS28 < 2,6, n (%) DAS28 ≤ 3,2, n (%) Ответ АКР20, n (%) Ответ АКР50, n (%) Ответ АКР70, n (%) |
17 (10,5) 32 (19,8) 80 (49,4) 45 (27,8) 29(17,9) |
65 (39,9) 84 (51,5) 106 (65,0) 77 (47,2) 53 (32,5) |
< 0,0001 < 0,0001 0,0038 0,0002 0,0023 |
а р-значение скорректировано по локализации и длительности РА для всех конечных точек и по дополнительной исходной оценке для всех постоянных конечных точек.
b Для отсутствующих данных использовался условный учет пациентов, не ответивших на лечение. Критерий множественных сравнений с поправкой Бонферрони-Хольма.
В целом, у тоцилизумаба и адалимумаба были схожие профили нежелательных явлений. Доли пациентов с серьезными нежелательными явлениями в группах лечения были сопоставимы (тоцилизумаб 11,7 % по сравнению с адалимумабом 9,9 %). Типы нежелательных реакций на препарат в группе тоцилизумаба были аналогичны имеющимся профиле безопасности тоцилизумаба; о нежелательных реакциях на препарат сообщалось со схожей частотой, указанной в таблице 1. О повышенной частоте возникновения инфекций и инвазий сообщалось в группе тоцилизумаба (48 % в сравнении с 42 %), при этом разницы в частоте возникновения серьезных инфекций (3,1 %) не было. Оба исследуемые препарата приводили к одинаковой картине изменений лабораторных показателей (снижение числа нейтрофилов и тромбоцитов, повышение активности АЛТ, ACT и уровня липидов); однако значимость изменений и частота отмеченных отклонений была выше в группе тоцилизумаба. У четверых пациентов (2,5 %) группы тоцилизумаба и двоих (1,2 %) группы адалимумаба имело место снижение числа нейтрофилов 3 или 4 степени по шкале критериев общей токсичности (СТС). У одиннадцати пациентов (6,8 %) группы тоцилизумаба и пяти (3,1 %) группы адалимумаба отмечено повышение активности АЛТ 2й степени или выше по шкале СТС. Повышение показателя ЛПНП по сравнению с исходным, в среднем, составило 0,64 ммоль/л (25 мг/дл) у пациентов группы тоцилизумаба и 0,19 ммоль/л (7 мг/дл) у пациентов группы адалимумаба. Данные по безопасности в группе тоцилизумаба соответствовали таковым, указанным в имеющемся профиле безопасности тоцилизумаба, и новых или неожиданных нежелательных реакций на препарат не наблюдалось (смотрите таблицу 1).
Ранний РА без предшествовавшего лечения МТ
В двухгодичном исследовании VII (WA19926) с запланированным первичным анализом на 52-й неделе приняло участие 1162 взрослых пациента без предшествовавшей терапии МТ с умеренным/тяжелым активным ранним РА (средняя продолжительность болезни ≤ 6 месяцев). Около 20 % пациентов ранее получало БПВП, за исключением МТ. Данное исследование оценивало эффективность внутривенного введения тоцилизумаба в дозе 4 или 8 мг/кг каждые 4 недели в комбинации с МТ, монотерапию парентеральным тоцилизумабом 8 мг/кг и монотерапию МТ в уменьшении признаков и симптомов и степени прогрессирования суставного поражения на протяжении 104 недель. Первичной конечной точкой была доля пациентов, достигших ремиссии по DAS28 (DAS28 < 2,6) к 24-й неделе. В группе комбинации тоцилизумаба 8 мг/кг и МТ, а также в группе монотерапии тоцилизумабом достоверно большая часть пациентов достигла первичной конечной точки по сравнению с группой монотерапии МТ. Группа тоцилизумаба 8 мг/кг + МТ также продемонстрировала статистически значимые результаты по ключевым вторичным конечным точкам. В количественном отношении ответы в группе монотерапии тоцилизумабом 8мг/кг превзошли ответы в группе монотерапии МТ по всем вторичным конечным точкам, включая рентгенографические показатели. В данном исследовании также на основании анализа булевского значения и индекса ремиссии по ACR/EULAR, как заданных поисковых конечных точек, выявлено преимущество групп тоцилизумаба по уровню ответов. Результаты исследования VII отражены в таблице 6.
Таблица 6. Результаты исследования VII (WA19926) у пациентов с ранним РА без предшествовавшего лечения МТ
| ТЦЗ 8 мг/кг + МТ N = 290 |
ТЦЗ 8 мг/кг + плацебо N = 292 |
ТЦЗ 4 мг/кг + МТ N = 288 |
Плацебо + МТ N = 287 |
|
| Первичная конечная точка | ||||
| Ремиссия по DAS28 24-я неделя n (%) |
130 (44,8)*** | 113 (38,7)*** | 92 (31,9) | 43 (15,0) |
| Ключевые вторичные конечные точки | ||||
| Ремиссия по DAS 28 52-я неделя n (%) |
142 (49,0)*** | 115 (39,4) | 98 (34,0) | 56 (19,5) |
| ACR 24-я неделя ACR20, n (%) ACR50, n (%) ACR70, n (%) 52-я неделя ACR20, n (%) ACR50, n (%) ACR70, n (%) |
216(74.5)* 165 (56,9)** 112 (38,6)** 195 (67,2)* 162 (55,9)** 125 (43,1)** |
205 (70,2) 139 (47,6) 88 (30,1) 184 (63,0) 144 (49,3) 105 (36,0) |
212 (73,6) 138 (47,9) 100 (34,7) 181 (62,8) 151 (52,4) 107 (37,2) |
187 (65,2) 124 (43,2) 73 (25,4) 164 (57,1) 117 (40,8) 83 (28,9) |
| HAQ-DI (скорректированное среднее изменение от исходного) 52-я неделя |
-0,81* | -0,67 | -0,75 | -0,64 |
| Рентгенографические конечные точки (средние изменения от исходных данных) | ||||
| 52-я неделя мОСШ Индекс эрозирования ССЩ Рентгенологически без прогрессирования n (%) (изменения от исходного в мОСШ ≤ 0) |
0,08*** 0,05** 0,03 226 (83)‡ |
0,26 0,15 0,11 226 (82)‡ |
0,42 0,25 0,17 211 (79) |
1,14 0,63 0,51 194 (73) |
| Поисковые конечные точки | ||||
| 24-я неделя: булевская ремиссия по ACR/EULAR, n (%) индекс ремиссии по ACR/EULAR, n (%) 52-я неделя: булевская ремиссия по ACR/EULAR, n (%) индекс ремиссии по ACR/EULAR, n (%) |
47(18,4)‡ 73 (28,5)‡ 59 (25,7)‡ 83 (36,1)‡ |
38 (14,2) 60 (22,6) 43 (18,7) 69 (30,0) |
43(16,7)‡ 58 (22,6) 48 (21,1) 66 (29,3) |
25 (10,0) 41 (16,4) 34 (15,5) 49 (22,4) |
мОСШ – модифицированный общий счет Шарпа
ССЩ – сужение суставной щели
Все сравнения эффективности по отношению к плацебо + МТ. *** p ≤ 0,0001; ** p < 0,001; * p < 0,05;
‡ p-величина < 0,05 в сравнении с плацебо + МТ, но конечная точка являлась поисковой (не включалась в иерархию статистического тестирования и поэтому не контролировалась множественностью)
Дети
сЮИА
Клиническая эффективность
Эффективность тоцилизумаба для лечения активного сЮИА оценивалась в 12-недельном рандомизированном, двойном слепом плацебо-контролируемом исследовании с 2 параллельными группами. У пациентов, включенных в исследование, общая продолжительность активного заболевания составляла не менее 6 месяцев без острого внезапного обострения болезни, требовавшего применения кортикостероидов в дозе, эквивалентной выше 0,5 мг/кг преднизона. Эффективность лечения тоцилизумабом синдрома активации макрофагов не изучали.
Пациенты (получавшие лечение в комбинации с МТ или без него) были рандомизированы (тоцилизумаб: плацебо = 2:1) на две группы: 75 пациентов получало инфузии тоцилизумаба каждые две недели, 8 мг/кг с массой тела 30 кг и выше или 12 мг/кг с массой тела менее 30 кг, 37 пациентам были назначены инфузии плацебо каждые две недели. Пациентам с ЮИА,
достигшим ответа АКР70, разрешалось постепенное снижение дозы кортикостероидов с шестой недели лечения. После 12 недели или с момента «ускользания» ответа на лечение из-за ухудшения течения заболевания пациенты получали лечение в открытом периоде исследования в дозе из расчета на массу тела.
Клинический ответ
Первичной конечной точкой была доля пациентов, достигших по крайней мере 30 % улучшения по АКР при ЮИА (ответ АКР30 при ЮИА) при отсутствии лихорадки (за предшествующие 7 дней не зарегистрировано температуры 37,5 °C и выше) к 12 неделе. Восемьдесят пять процентов пациентов (64/75), получавших тоцилизумаб, и 24,3 % пациентов (9/37), получавших плацебо, достигли этой конечной точки. Удельный вес этих пациентов различался значительно (p < 0,0001).
Доля пациентов с ЮИА, достигших ответа на лечение АКР30, 50, 70 и 90 представлены в таблице 7.
Таблица 7. Частота ответов АКР при ЮИА на 12 неделе терапии (% пациентов)
| Частота ответов | Тоцилизумаб N = 75 |
Плацебо N = 37 |
| АКР30 при ЮИА | 90,7 %1 | 24,3 % |
| АКР50 при ЮИА | 85,3 %1 | 10,8 % |
| AKP70 при ЮИА | 70,7 %1 | 8,1 % |
| АКР90 при ЮИА | 37,3 %1 | 5,4 % |
1 p < 0,0001, тоцилизумаб при сравнении с плацебо
Системные эффекты
Из пациентов, получавших лечение тоцилизумабом, на 12 неделе терапии у 85 % пациентов, имевших исходно лихорадку из-за сЮИА, лихорадка отсутствовала (за предшествующие 14 дней не зарегистрировано температуры 37,5 °C и выше) по сравнению с 21 % пациентов, получавших плацебо (p < 0,0001).
Скорректированное среднее изменение оценки боли по визуальной аналоговой шкале (ВАШ) после 12 недель терапии тоцилизумабом показало снижение на 41 пункт по шкале от 0 до 100 пунктов по сравнению со снижением на 1 пункт у пациентов, получавших плацебо (p < 0,0001).
Снижение дозы кортикостероидов
Пациентам с ЮИА, достигшим ответа АКР70, разрешалось постепенное снижение дозы кортикостероидов. К 12 неделе семнадцати пациентам (24 %), получавшим лечение тоцилизумабом, по сравнению с 1 пациентом (3 %), получавшим плацебо, можно было снизить дозу кортикостероидов как минимум на 20 % без последующего ухудшения АКР30 при ЮИА или возникновения системных симптомов (p = 0,028). Снижение дозы кортикостероидов продолжалось, при этом 44 пациента не принимало кортикостероиды перорально на 44 неделе, и ответы АКР при ЮИА не изменялись.
Показатели качества жизни, связанного со здоровьем
На 12 неделе доля пациентов, получавших лечение тоцилизумабом, демонстрирующих минимальное клинически значимое улучшение по опроснику оценки здоровья детей – индексу нетрудоспособности (определенному как снижение индивидуального общего балла на 0,13 и больше), была значительно больше, чем доля пациентов, получавших плацебо, 77 % по сравнению с 19 % (p < 0,0001).
Лабораторные показатели
У пятидесяти из семидесяти пяти пациентов (67 %), получавших тоцилизумаб, исходный уровень гемоглобина был ниже НГН. Из них у сорока пациентов (80 %) отмечалось повышение уровня гемоглобина до нормального уровня к 12 неделе терапии по сравнению с 2 из 29 пациентов (7 %), получавших плацебо, относительно исходного значения гемоглобина (p < 0,0001).
Пациенты с пЮИА
Клиническая эффективность
Эффективность тоцилизумаба оценивалась у детей с активным пЮИА в состоящем из трех частей исследовании WA19977, включая открытый расширенный период. Часть I состояла из 16-недельного вводного периода активного лечения (n=188), за которой следовала часть II – 24-недельный рандомизированный, двойной слепой, плацебо-контролируемый период ожидания (n=163), после него была часть III – 64-недельный открытый период. В ходе части I пациенты, включенные в исследовании, с массой тела 30 кг и выше получили 4 дозы тоцилизумаба IV по 8 мг/кг каждые 4 недели. Пациенты с массой тела менее 30 кг были рандомизированы в соотношении 1:1 и получили 4 дозы тоцилизумаба или по 8 мг/кг, или по 10 IV, по одной каждые 4 недели. Пациенты, завершившие часть I исследования и достигшие ответа по меньшей мере АКР30 при ЮИА на 16 неделе по сравнению с исходными показателями, были включены в слепой период ожидания исследования (часть II). В части II пациенты были рандомизированы в группы тоцилизумаба (получали ту же дозу, что и в части I) или плацебо в соотношении 1:1, которые распределялись по одновременному применению МТ и одновременному применению кортикостероидов. Каждый пациент продолжал участие в части II исследования до 40 недели или до достижения критериев ухудшения АКР30 при ЮИА (по сравнению с 16 неделей) и был исключен из курса терапии тоцилизумабом (получали ту же дозу, что и в части I).
Клинический ответ
Первичной конечной точкой была доля пациентов с ЮИА с ухудшением АКР30 на 40 неделе терапии относительно показателя, достигнутого на 16 неделе. Ухудшение было отмечено у сорока восьми процентов пациентов (48,1 %, 39/81), получавших плацебо, по сравнению с 25,6 % пациентов (21/82), получавших тоцилизумаб. Расхождение между этими показателями было статистически значимым (p = 0,0024).
По завершении части I исследования ответы АКР30/50/70/90 были достигнуты у 89,4 %, 83,0 %, 62,2 % и 26,1 % пациентов, соответственно.
Во время периода ожидания доля пациентов с ответом АКР30, 50, 70 на 40 неделе исследования относительно исходных показателей представлена в таблице 8. При проведении статистического анализа пациенты, у которых имело место ухудшение течения заболевания («ускользание» от TCZ) во время части II или которые исключались из исследования, были классифицированы как пациенты, не ответившие на лечение. Дополнительные анализы ответов АКР при ЮИА, полученных на 40 неделе исследования, показали, что независимо от наличия ухудшения течения заболевания к 40 неделе, 95,1 % пациентов, непрерывно получавших тоцилизумаб, достигали ответа АКР 30 и более выраженного улучшения.
Таблица 8. Частота ответов АКР при ЮИА на 40 неделе относительно исходных показателей (% пациентов)
| Частота ответов | Тоцилизумаб N = 82 |
Плацебо N = 81 |
| АКР30 | 74,4 %* | 54,3 %* |
| АКР50 | 73,2 %* | 51,9 %* |
| АКР70 | 64,6 %* | 42,0 %* |
* p < 0,01, тоцилизумаб по сравнению с плацебо
Число пораженных суставов было значительно меньше относительно такового до начала лечения у пациентов, получавших тоцилизумаб, по сравнению с пациентами, получавшими плацебо (скорректированное среднее изменение -14,3 против -11,4, p = 0,0435). Общая врачебная оценка активности заболевания, измеряемая по шкале от 0 до 100 мм, показала большее снижение активности заболевания при применении тоцилизумаба, чем при использовании плацебо (скорректированное среднее изменение -45,2 мм против -35,2 мм, p = 0,0031).
Скорректированное среднее изменение оценки боли по ВАШ после 40 недель лечения тоцилизумабом составило 32,4 мм по шкале от 0 до 100 мм по сравнению со снижением на 22,3 мм у пациентов, получавших плацебо (статистически высоко значимое; p = 0,0076).
Частота ответов АКР была численно ниже у пациентов, ранее получавших лечение биологическими препаратами, смотрите ниже таблицу 9.
Таблица 9. Число и доля пациентов с ЮИА с ухудшением по АКР30 и доля пациентов с ЮИА с ответом АКР30/50/70/90 на 40 неделе при предшествующем применении биологических препаратов (часть II исследования)
| Плацебо | Тоцилизумаб | |||
| Применение биологических препаратов | Да (N = 23) |
Нет (N = 58) |
Да (N = 27) |
Нет (N = 55) |
| Ухудшение АКР30 при ЮИА | 18 (78,3) | 21 (36,2) | 12 (44,4) | 9 (16,4) |
| Ответ АКР30 при ЮИА | 6 (26,1) | 38 (65,5) | 15 (55,6) | 46 (83,6) |
| Ответ АКР50 при ЮИА | 5 (21,7) | 37 (63,8) | 14 (51,9) | 46 (83,6) |
| Ответ АКР70 при ЮИА | 2 (8,7) | 32 (55,2) | 13 (48,1) | 40 (72,7) |
| Ответ АКР90 при ЮИА | 2 (8,7) | 17 (29,3) | 5 (18,5) | 32 (58,2) |
Вне зависимости от предшествующего применения биологических препаратов у пациентов, рандомизированных в группу тоцилизумаба, ухудшение АКР30 отмечалось реже, а общая частота ответов АКР была выше, чем у пациентов, получавших плацебо.
Европейское агентство лекарственных средств отозвало обязательство представлять результаты исследований применения препарата Актемра® во всех подгруппах детей с ревматоидным артритом и отложило исполнение обязательства представлять результаты исследований применения препарата Актемра® в одной или более подгруппах детей с ювенильным идиопатическим артритом. Информацию по применению препарата у детей смотрите в разделе «Режим дозирования и способ применения».
Фармакокинетические свойства
Пациенты с РА
Внутривенное введение
Фармакокинетику тоцилизумаба оценивали с использованием популяционного фармакокинетического анализа базы данных 3552 пациентов с РА, получавших тоцилизумаб в виде одночасовой инфузии в дозе 4 или 8 мг/кг каждые 4 недели на протяжении 24 недель, или 162 мг тоцилизумаба п/к 1 раз в неделю или 162 мг 1 раз в 2 недели на протяжении 24 недель.
Нижеследующие параметры (расчетная средняя ± стандартное отклонение (SD) оценивались при введении тоцилизумаба в дозе 8 мг/кг каждые 4 недели: площадь под кривой «концентрация-время» (AUC) в равновесном состоянии = 38 000 ± 13 000 ч мкг/мл, минимальная остаточная концентрация (Cmin) = 15,9 ± 13,1 мкг/мл и максимальная концентрация (Cmax) = 182 ± 50,4 мкг/мл; коэффициент кумуляции для AUC и Cmax был малым – 1,32 и 1.09, соответственно. Коэффициент кумуляции для Cmin был больше (2,49), как и ожидалось из-за нелинейного клиренса при более низких концентрациях. Равновесное состояние было достигнуто после первого введения для Cmax и через 8 и 20 недель – для AUC и Cmin соответственно. Показатели AUC, Cmin и Cmax для тоцилизумаба возрастали при увеличении массы тела. При массе тела ≥ 100 кг расчетная средняя (± SD) AUC в равновесном состоянии, Cmin и Cmax тоцилизумаба составила 50 000 ± 16 800 мкг•ч/мл, 24,4 ± 17,5 мкг/мл и 226 ± 50,3 мкг/мл, соответственно, что превышало средние значения концентрации в популяции пациентов, т.е. для всех категорий массы тела, указанных выше. Дозозависимая кривая тоцилизумаба уплощается при более высоких концентрациях, что приводит к меньшему приросту эффективности тоцилизумаба при каждом постепенном увеличении его концентрации, в результате чего у пациентов, получавших лечение тоцилизумабом в дозе > 800 мг, клинически значимого увеличения эффективности продемонстрировано не было. Поэтому не рекомендуется увеличивать дозу препарата выше 800 мг в одну инфузию (смотрите раздел «Режим дозирования и способ применения»).
Распределение
У пациентов с РА центральный объем распределения составлял 3,72 л, а периферический объем распределения – 3,35 л, что приводило к объему распределения в равновесном состоянии 7,07 л.
Выведение
После внутривенного введения тоцилизумаб претерпевает двухфазное выведение из системного кровотока. Общий клиренс тоцилизумаба зависел от концентрации и представляет собой сумму линейного и нелинейного клиренса. В популяционном фармакокинетическом анализе линейный клиренс оценивался как параметр и составлял 9,5 мл/ч. Дозозависимый нелинейный клиренс, зависящий от концентрации, имеет наибольшее значение при низких концентрациях тоцилизумаба. При более высоких концентрациях тоцилизумаба преобладает линейный клиренс в связи с насыщением пути нелинейного клиренса.
T1/2 тоцилизумаба концентрационзависимый. После введения препарата в дозе 8 мг/кг каждые 4 недели эффективный Т1/2 уменьшался по мере снижения концентраций в промежутке между введениями препарата в состоянии равновесия от 18 до 6 дней.
Линейность
С течением времени фармакокинетические параметры тоцилизумаба не изменялись. Более чем пропорциональное дозе увеличение AUC и Cmin наблюдалось при дозах 4 и 8 мг/кг каждые 4 недели. Cmax повышалась прямо пропорционально увеличению дозы. В равновесном состоянии расчетные AUC и Cmin были в 3,2 и 30 раз больше при дозе 8 мг/кг, по сравнению с дозой 4 мг/кг, соответственно.
Особые группы пациентов
Почечная недостаточность. Формального исследования влияния почечной недостаточности на фармакокинетику тоцилизумаба не проводилось. В популяционном фармакокинетическом анализе у большинства пациентов имела место нормальная функция почек или почечная недостаточность легкой степени тяжести. Почечная недостаточность легкой степени тяжести (клиренс креатинина по формуле Кокрофта-Голта < 80 мл/мин и ≥ 50 мл/мин) не влияла на фармакокинетику тоцилизумаба.
Печеночная недостаточность. Формального исследования влияния печеночной недостаточности на фармакокинетику тоцилизумаба не проводилось.
Возраст, пол и расовая принадлежность. Популяционные фармакокинетические анализы у пациентов с РА показали, что возраст, пол и расовая принадлежность не влияют на фармакокинетику тоцилизумаба.
Пациенты с сЮИА
Фармакокинетику тоцилизумаба оценивали с использованием популяционного фармакокинетического анализа базы данных 140 пациентов с сЮИА, получавших тоцилизумаб внутривенно в дозе 8 мг/кг каждые 2 недели (с массой тела ≥30 кг), или 12 мг/кг внутривенно каждые 2 недели (пациенты с массой тела <30 кг), или 162 мг подкожно каждую неделю (пациенты с массой тела >30 кг), или 162 мг подкожно каждые 10 дней или каждые 2 недели (пациенты с массой тела <30 кг).
Таблица 10. Прогнозируемые средние ФК параметры (± стандартное отклонение, СО) тоцилизумаба при равновесном состоянии у пациентов с сЮИА после внутривенного введения.
|
ФК параметры препарата Актемра® |
8 мг/кг каждые 2 недели масса тела ≥30 кг |
12 мг/кг каждые 2 недели масса тела <30 кг |
| Максимальная концентрация (Сmax), мкг/мл | 256 ± 60,8 | 274 ± 63,8 |
| Минимальная концентрация (Ctrough), мкг/мл | 697 ± 29,1 | 68,4 ± 30,0 |
| Средняя концентрация (Cmean), мкг/мл | 119 ± 36,0 | 123 ± 36,0 |
| Кумулятивная Сmax | 1,42 | 1,37 |
| Кумулятивная Ctrough | 3,20 | 3,41 |
|
Кумулятивная Cmean или площадь под кривой «концентрация-время» (AUCτ)* |
2,01 | 1,95 |
*τ – на протяжении 2 недель для внутривенного введения.
После для внутривенного введения ~ 90 % равновесное состояние достигается к
8-ой неделе в обеих дозах: 8 мг/кг каждые 2 недели (масса тела ≥30 кг) или 12 мг/кг
каждые 2 недели (масса тела <30 кг).
У пациентов с сЮИА центральный объем распределения составлял 1.87 л, а
периферический объем распределения – 2,14 л, что приводило к объему
распределения в равновесном состоянии 4,01 л. В популяционном
фармакокинетическом анализе линейный клиренс оценивался как параметр и
составлял 5,7 мл/ч.
У обеих весовых категорий пациентов с сЮИА период полувыведения
тоцилизумаба составлял до 16 дней (8 мг/кг при массе тела ≥30 кг или 12 мг/кг при
массе тела <30 кг) на 12 неделе.
Пациенты с пЮИА
Фармакокинетику тоцилизумаба оценивали с использованием популяционного
фармакокинетического анализа базы данных 237 пациентов с пЮИА, получавших
тоцилизумаб внутривенно в дозе 8 мг/кг каждые 4 недели (с массой тела ≥30 кг), или 10 мг/кг
внутривенно каждые 4 недели (пациенты с массой тела <30 кг), или 162 мг
подкожно каждые 2 недели (пациенты с массой тела >30 кг), или 162 мг
подкожно каждые 3 недели (пациенты с массой тела <30 кг).
Таблица 11. Прогнозируемые средние ФК параметры (± стандартное отклонение,
СО) тоцилизумаба при равновесном состоянии у пациентов с пЮИА после
внутривенного введения.
|
ФК параметры препарата Актемра® |
8 мг/кг каждые 2 недели масса тела ≥30 кг |
10 мг/кг каждые 2 недели масса тела <30 кг |
| Максимальная концентрация (Сmax), мкг/мл | 183 ± 42,3 | 168 ± 24,8 |
| Минимальная концентрация (Ctrough), мкг/мл | 6,55 ± 7,93 | 1.47 ±2,44 |
| Средняя концентрация (Cmean), мкг/мл | 42,2 ± 13,4 | 31,6 ± 7,84 |
| Кумулятивная Сmax | 1,04 | 1,01 |
| Кумулятивная Ctrough | 2,22 | 1,43 |
|
Кумулятивная Cmean или площадь под кривой «концентрация-время» (AUСτ)* |
1,16 | 1,05 |
*τ – на протяжении 4 недель для внутривенного введения.
После для внутривенного введения ~ 90 % равновесное состояние достигается к
12-ой неделе для дозы 10 мг/кг (масса тела <30 кг) и к 16-ой неделе для дозы
8 мг/кг (масса тела ≥30 кг).
У обеих весовых категорий пациентов с пЮИА период полувыведения
тоцилизумаба составлял до 16 дней (8 мг/кг с массой тела ≥30 кг или 10 мг/кг с
массой тела <30 кг) в промежутке между введениями препарата в состоянии
равновесия.
Данные доклинической безопасности
Доклинические данные, полученные из стандартных исследований по изучению фармакологической безопасности, токсичности многократных доз и генотоксичности, не показали особой опасности для человека.
Исследований по изучению канцерогенности тоцилизумаба не проводилось, поскольку признано, что моноклональные антитела IgG1 не обладают истинной способностью вызывать рак.
Имеющиеся доклинические данные продемонстрировали влияние ИЛ-6 на прогрессирование злокачественных новообразований и устойчивость к апоптозу при различных формах рака. Эти данные свидетельствуют о том, что лечение тоцилизумабом не приводит к существенному риску развития и прогрессирования рака. Кроме того, при проведении 6-месячных исследований по изучению хронической токсичности на яванских макаках и мышах с недостаточностью ИЛ-6 пролиферативных поражений не наблюдалось.
Имеющиеся доклинические данные не предполагают влияния тоцилизумаба на фертильность. В исследованиях по изучению хронической токсичности у яванских макак и у самок или самцов мышей с недостаточностью ИЛ-6 влияния тоцилизумаба на эндокринную или репродуктивную систему не наблюдалось. При введении тоцилизумаба яванским макакам во время ранней стадии беременности прямого или непрямого неблагоприятного влияния на беременность или развитие эмбриона либо плода не наблюдалось. Однако наблюдалось незначительное увеличение случаев спонтанного выкидыша / внутриутробной гибели плода при высоком уровне системной концентрации (> 100 раз превышающего таковую у человека) в группе, получавшей препарат в высоких дозах, равных 50 мг/кг/сут, в сравнении с группой плацебо или группой, получавшей препарат в низких дозах. Несмотря на то, что ИЛ-6, по-видимому, не является цитокином, играющим решающую роль в развитии плода или иммунологической регуляции системы мать-плод, взаимосвязь этих явлений с введением тоцилизумаба не может быть исключена.
Лечение мышиным аналогом тоцилизумаба не оказывало токсичного действия на ювенильных мышей. В частности, не было нарушений развития скелета, иммунной системы и полового созревания.
Перечень вспомогательных веществ
Сахароза
Полисорбат 80
Натрия гидрофосфата додекагидрат
Натрия дигидрофосфата дигидрат
Вода для инъекций
Несовместимость
Этот лекарственный препарат нельзя смешивать с другими лекарственными средствами, кроме тех, которые указаны в разделе «Особые меры предосторожности при применении и другом обращении с препаратом».
Невскрытый флакон: 30 месяцев.
Не использовать по истечении срока годности, указанного на упаковке.
Разведенный препарат: после разведения приготовленный раствор для инфузии физически и химически стабилен в 9 мг/мл (0,9 %) раствора натрия хлорида для инъекций при 30 °C на протяжении 24 часов.
С микробиологической точки зрения приготовленный раствор для инъекций следует использовать сразу. Если раствор не используется сразу, пользователь несет ответственность за соблюдение сроков и условий хранения приготовленного препарата, обычно не более 24 часов при 2-8 °C, за исключением тех случаев, когда препарат разводится в контролируемых и валидированных асептических условиях.
Хранить при температуре 2-8 °C в защищенном от света месте. Не замораживать.
Хранить в недоступном для детей месте.
Информацию по условиям хранения разведенного лекарственного средства смотрите в разделе «Срок годности».
По 4 мл (80 мг/4 мл), 10 мл (200 мг/10 мл) или 20 мл (400 мг/20 мл) препарата во флаконы, изготовленные из бесцветного стекла (гидролитический класс 1, ЕФ), укупоренные крышкой из бутилкаучука, обжатые алюминиевыми колпачками и закрытые пластмассовыми крышками; цвет колпачка и крышки соответствует цвету, которым выделена дозировка препарата на этикетке флакона и на пачке. 1 флакон вместе с инструкцией по применению помещают в картонную пачку с картонными вкладышами (перегородками) внутри. На пачке имеется контроль вскрытия.
Инструкции по разведению препарата перед его инфузией
Перед применением парентеральные лекарственные средства необходимо визуально проверять на наличие твердых частиц или изменение цвета. Разводить следует только прозрачный или опалесцирующий бесцветный или светло-желтый раствор без видимых посторонних частиц.
Пациенты с РА (≥30 кг)
В асептических условиях из 100 мл инфузионного пакета отобрать 9 мг/мл (0,9 %) стерильного, апирогенного раствора натрия хлорида для инъекций, эквивалентно объему концентрата Актемра®, необходимому для введения пациенту. Необходимое количество концентрата Актемра® (0,4 мл/кг) следует отобрать из флакона и ввести его в 100 мл инфузионный пакет. Объем приготовленного раствора должен быть равным 100 мл. Для перемешивания аккуратно перевернуть инфузионный пакет во избежание пенообразования.
Применение у детей
Пациенты с сЮИА и пЮИА с массой тела 30 кг и более
В асептических условиях из 100 мл инфузионного пакета отобрать 9 мг/мл (0,9 %) стерильного, апирогенного раствора натрия хлорида для инъекций, эквивалентно объему концентрата Актемра®, необходимому для введения пациенту. Необходимое количество концентрата Актемра® (0,4 мл/кг) следует отобрать из флакона и ввести его в 100 мл инфузионный пакет. Объем приготовленного раствора должен быть равным 100 мл. Для перемешивания аккуратно перевернуть инфузионный пакет во избежание пенообразования.
Пациенты с сЮИА с массой тела менее 30 кг
В асептических условиях из 50 мл инфузионного пакета отобрать 9 мг/мл (0,9 %) стерильного, апирогенного раствора натрия хлорида для инъекций, эквивалентно объему концентрата Актемра®, необходимому для введения пациенту. Необходимое количество концентрата Актемра® (0,6 мл/кг) следует отобрать из флакона и ввести его в 50 мл инфузионный пакет. Объем приготовленного раствора должен быть равным 50 мл. Для перемешивания аккуратно перевернуть инфузионный пакет во избежание пенообразования.
Пациенты с пЮИА с массой тела менее 30 кг
В асептических условиях из 50 мл инфузионного пакета отобрать 9 мг/мл (0,9 %) стерильного, апирогенного раствора натрия хлорида для инъекций, эквивалентно объему концентрата Актемра®, необходимому для введения пациенту. Необходимое количество концентрата Актемра® (0,5 мл/кг) следует отобрать из флакона и ввести его в 50 мл инфузионный пакет. Объем приготовленного раствора должен быть равным 50 мл. Для перемешивания аккуратно перевернуть инфузионный пакет во избежание пенообразования.
Препарат Актемра® предназначен только для одноразового применения.
Неиспользованный лекарственный препарат или его отходы должны быть уничтожены в соответствии с национальными требованиями.
По рецепту.
Владелец регистрационного удостоверения
Ф. Хоффманн-Ля Рош Лтд., Швейцария
F. Hoffmann-La Roche Ltd, Grenzacherstrasse 124,4070 Basel, Switzerland
Производитель
Чугай Фарма Мануфектуринг Ко. Лтд., Япония
Chugai Pharma Manufacturing Co. Ltd, 16-3 Kiyohara Kogyodanchi, Utsunomiya-city, Tochigi, 321-3231, Japan
В случае поставок и реализации на территории Республики Беларусь претензии потребителей направлять на адрес ИООО «Рош Продакте Лимитед»:
220073, г. Минск, 1-й Загородный пер., 20, 8-й этаж, кабинет 20.
Тел. (017) 256 23 08; факс (017) 256 23 06.
Email: belarus.safety@roche.com