Лечение патологии суставов по технологии Аллоплант
(технология защищена Патентами Российской Федерации)
В отличии от традиционных способов лечения (массаж, медикаментозное (в том числе внутрисуставное введение препаратов), физиотерапия, применение внутрисуставных любрикантов и т.д.), после применения биоматериала «Аллоплант» достигается восстановление пораженных структур суставов (артроз, артрит, менискоз и.т.д.). Это происходит засчет многократной активизации кровотока, восстановления капсулы сустава с нормализацией выработки внутрисуставной жидкости (смазывающей и питающей хрящевой покров), восстановления хрящевого покрова сустава, вследствие созидательной деятельности собственных мульти- и плюрипотентных клеток костного мозга, привлекаемых в зону поражения вводимым биоматериалом.
При применении метода (более 14 лет) осложнений не наблюдалось, наиболее яркими клиническими примерами, демонстрирующими эффективность метода являются случаи восстановления функции при артрозах 3 стадии (по классификации Коссинской Н.С) и 4 стадии (по рентгенологической классификации J. Kellgren & J. Lawrence, 1957).
В основном курс лечения включает одно-, двух- или трехкратное введение биоматериала в пораженный сустав с интервалом 10 дней в зависимости от степени артропатии. В тяжелых случаях формируется индивидуальный график лечения.
Для записи на лечение Вам необходимо заблаговременно позвонить (с 10.00 до 17.00 в рабочие дни) по номеру +7(347) 293-42-07; +7(347) 293-42-12
Введение. За последние десятилетия наблюдается рост заболеваемости остеоартритом, это связано с увеличением продолжительности жизни и выраженным «омоложением» данной патологии [2]. К факторам риска развития и прогрессирования остеоартрита относятся возраст, пол, наследственная предрасположенность, высокий индекс массы тела, чрезмерная механическая нагрузка [4].
Современные методы лечения остеоартрита коленного сустава (ОКС) направлены на борьбу с болевым синдромом и сохранение его функционального состояния [1]. В настоящее время предложена клиническая концепция в развитии остеоартрита, где важнейшее значение придается хроническому низкоинтенсивному воспалению [7], в том числе в корреляции с изменениями иммунно-клеточного состава периферической крови [8]. На данном этапе развития медицины разработка новых терапевтических подходов с учётом роли иммунной системы является важной задачей.
К перспективным методам лечения и профилактики ОКС, позволяющим повысить эффективность при остеоартрите, относится диспергированный биоматериал «Аллоплант» (ДБМА), который изготавливается из обработанных биологических тканей и включён в общую классификацию биологической продукции, разрешён к широкому клиническому применению (спецификация № 42-2-537-93 МЗ РФ, рег.№ 056/003230 от 17.05.1993). Морфологические исследования в области подкожной инъекции диспергированного трансплантата показали, что в тканевом ложе длительно (до 30 суток) поддерживаются репаративные процессы в виде полиморфной клеточной инфильтрации, в последующем сменяемые макрофагальной инвазией и резорбцией биоматериала. Фармакопунктура биоматериалом Аллоплант длительно поддерживает комплекс локальных сосудистых и клеточных изменений [6].
Основной лечебный эффект ДБМА заключается в стимуляции регенерации тканей и дифференциации клеточных элементов с ингибированием развития рубцовой ткани, что широко используется в медицине [3]. При локальном введении ДБМА в биологически активные точки (БАТ) стимулируется рост и пролиферация мезенхимальных стволовых клеток, а также оказывается эффект местной иммунокоррекции [5]. Вопросы лечения остеоартрита остаются актуальной проблемой медицины и нуждаются в дальнейшем изучении.
Материалы и методы. Работа проведена на базе научно-исследовательского лечебно-оздоровительного центра «Здоровье и Долголетие» г. Уфа, исследовано 98 больных первичным остеоартритом коленного сустава I-II стадии по J.H. Kellgren — J.S. Lawrens, диагноз верифицировали согласно клиническим рекомендациям Ассоциации ревматологов России «Остеоартрит» 2013 [9]. Возраст обследованных составил от 40 до 65 лет (средний возраст 53,2 ± 1,4 года), из них мужчин 27 (27,5%) и женщин 71 (72,5%).
Для оценки эффективности лечения применением ДБМА в БАТ, больные ОКС, методом простой рандомизации, были разделены на четыре группы, сопоставимые по клинико-функциональным характеристикам: I группа (n=24), получали стандартную базисную медикаментозную терапию НПВС – нимесулид в дозе 100 мг 2 раза в день, в течение 3 недель; II группа (n=24), дополнительно к медикаментозной терапии применяли магнитотерапию импульсным магнитным полем на аппарате Алимп-1 на область коленного сустава, с частотой импульсов 100 Гц, степень магнитной индукции 30% — 1,5 мТл, в течение 15 минут; III группа (n=25), дополнительно к медикаментозной терапии применяли ДБМА по оригинальной методике [6], 50 мг биоматериала разводили ex temporae в 10 мл физиологического раствора и по 1,0 мл вводили в биологически активные точки (БАТ): парные E36; Gi11; РС145 и непарные РС156; РС160; VB33; Т4; курс лечения составил 10 процедур через день; IV группа (n=25), на фоне базисной медикаментозной терапии применяли сочетание ДБМА в БАТ и магнитотерапию (МТ). Контрольную группу составили 20 здоровых доноров, сопоставимых по полу и возрасту. У больных ОКС при введении ДБМА не отмечалось аллергических реакций и осложнений. Всем исследуемым с ОКС был рекомендован здоровый образ жизни, сбалансированная диета и занятия скандинавской ходьбой. Исследования проводили исходно, после лечения и через 6 месяцев.
Эффективность предложенной терапии у больных ОКС оценивали по динамике функционального индекса WOMAC (Western Ontario and McMaster Universities Arthritis Index): по уровню боли, ограничению подвижности или скованности в суставе, функциональной несостоятельности и суммарному индексу WOMAC. Объём движений в коленном суставе определяли по углу активного сгибания с помощью ортопедического гониометра. Ультразвуковое исследование коленных суставов проводили на приборе MindrayDC-8 с использованием линейного датчика с частотой 7,5 МГц.
Состояние иммунологического статуса изучали по уровню Т- и В- лимфоцитов и по субпопуляционному составу лимфоцитов периферической крови (CD3+, CD4+, CD8+, CD19+) методом непрямой иммунофлюоресценции с применением моноклональных антител производства ТОО «МедБиоСпектр» (Россия, Москва), функциональное состояние иммунной системы оценивали по иммунорегуляторному индексу CD4+/СD8+ (ИРИ). Забор крови проводили утром натощак до начала, после лечения и через 6 месяцев.
Статистическую обработку осуществляли с использованием программы StatSoft STATISTICA 10.0.1011 Russian. При исследовании взаимосвязей между величинами показателей вычисляли непараметрический коэффициент корреляции Спирмена (r). Различия считались значимыми при p≤0,05.
Результаты и обсуждение. Анализ данных анкетёров показал, что нерегулярный приём НПВС отметили 65 (66,3%) больных с ОКС, не лечились или впервые обратились по поводу болевого синдрома 33(33,7%). По данным ультразвукового исследования коленного сустава больных ОКС минимально выраженный синовит был у 35 (35,7%), умеренно выраженный у 17 (17,3%) и у 46 (47,0%) не выявили явлений синовита.
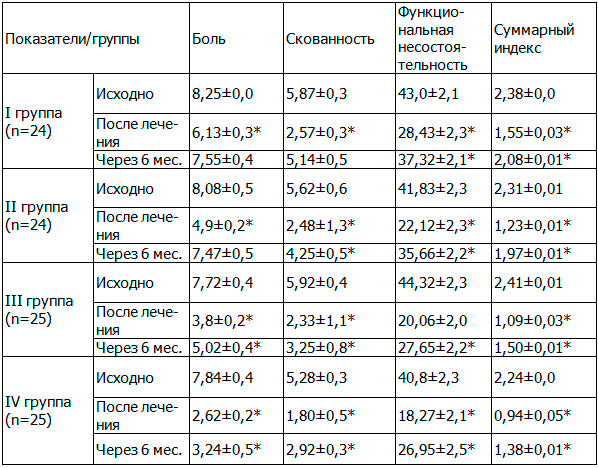
Исходный уровень функционального индекса WOMAC у больных ОКС показал, что суммарный индекс в I группе составил 2,38±0,0 балла, во II группе 2,31±0,01 балла, в III группе 2,41±0,01 балла, и в IV группе 2,24±0,01 балла. На фоне проведённого лечения у больных ОКС наблюдалась позитивная динамика и суммарный индекс WOMAC снизился в I группе на 34,9 %, во II группе на 46,7 %, в III группе на 54,8 % и в IV группе на 58,0 %.
Через 6 месяцев у больных ОКС отмечалось сохранение эффекта лечения, суммарный индекс WOMAC в I группе был снижен на 12,6 %, во II группе на 14,7 %, в III группе на 37,7 %, и в IV группе на 38,4 %, в сравнении с исходным уровнем, данные представлены в табл. 1.
Таблица 1. Динамика показателей функционального индекса WOMAC в баллах(M±m).
Примечание: *при p≤0,05, в сравнении с исходным уровнем.
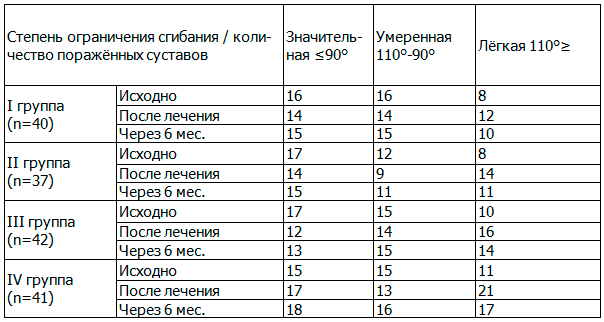
У больных ОКС исходно наблюдалось ограничение объёма движения: число суставов со значительной степенью ограничения подвижности коленного сустава (угол активного сгибания ≤90°) в I группе было 16, во II группе — 17, в III группе — 17, и в IV группе — 15; с умеренной степенью ограничения (угол активного сгибания в диапазоне 90°-110°) — 16, 12, 15 и 15 суставов, с лёгкой степенью (угол активного сгибания 110°≥) — 8, 8, 10 и 11 суставов, соответственно, данные представлены в табл. 2.
На фоне проведённого лечения у больных ОКС наблюдалась позитивная динамика: число суставов со значительной степенью ограничения сгибания уменьшилось в I группе на 12,5 %, во II группе на 17,6 %, в III группе на 29,4 % и в IV группе на 53,3 %; с умеренной степенью ограничения сгибания уменьшилось на 12,5 %, на 16,7 %, на 6,7 %, и на 13,3 % соответственно; а с лёгкой степенью ограничения сгибания в коленном суставе увеличилось на 50,0 %, на 75,0 %, на 60,0 %, и на 90,9 %, соответственно.
Через 6 месяцев после лечения у больных ОКС позитивная динамика сохранялась, но более выраженная была в III и IV группах: число поражённых коленных суставов со значительной степенью ограничения сгибания в I группе уменьшилось на 6,2 %, во II группе на 11,8 %, в III группе на 23,5 %, и в IV группе на 46,7 %; с умеренной степенью ограничения сгибания на 6,2 %, на 8,3 %, в III группе оставалось без изменений, а в IV группе увеличилось на 6,7 %; с лёгкой степенью ограничения сгибания количество суставов увеличилось на 25,0 %, на 37,5 %, на 40,0 %, и на 54,5 % соответственно, в сравнении с исходным уровнем.
Таблица 2. Динамика активного сгибания коленного сустава больных с остеоартритом
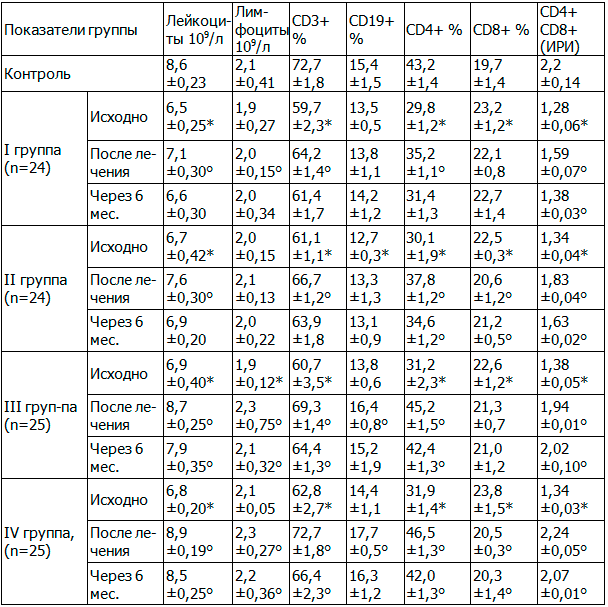
Учитывая современные представления о роли иммунной системы в клиническом течении ОКС, нами был изучен иммунологический статус исследуемых и выявили наличие дисфункции иммунной системы. Анализ результатов иммунограмм у больных ОКС выявил: снижение общего числа лейкоцитов на 21,9 %, лимфоцитов на 5,7 %, лейкоцитарно-лимфоцитарного индекса на 17,1 % в сравнении с контрольной группой. Качественный состав субпопуляций лимфоцитов у больных ОКС показал снижение CD3+ (основного маркера Т-лимфоцитов) на 15,99 %, CD19+ (основного маркера В-лимфоцитов) на 11,75 %, CD4+ (Т-хелперов) на 28,81 % что может свидетельствовать о недостаточности Т – звена иммунитета, а повышение уровня CD8+ (Т-цитотоксических лимфоцитов) на 16,9 % — об активации цитотоксического ответа, снижение иммунно-регуляторного индекса (CD4+/CD8+) на 39,09 %, в сравнении с контролем. Результаты исследования указывают на дисфункцию иммунной системы с преимущественным ослаблением клеточного звена.
Динамика иммунологического ответа у больных ОКС после проведённого лечения показала увеличение Т-лимфоцитов: субпопуляций CD3+ в I группе на 4,5 %, во II группе на 9,7 %, в III группе на 14,37 %, в IV группе на 15,8 % и через 6 месяцев на 2,8 %, на 4,6 %, на 6,1 % и на 5,4 % соответственно; субпопуляций CD4+ на 18,1 %, на 25,6 %, на 44,9 %, и на 45,8 %, через 6 месяцев на 5,4 %, на 14,9 %, на 35,9 % и на 31,7 % соответственно; снижение уровня субпопуляций CD8+ на 4,7 %, на 8,4 %, на 5,8 %, и на 13,9 %, через 6 месяцев на 2,6 %, на 5,8 %, на 7,1 %, и на 12,2 % соответственно; количество В-лимфоцитов увеличилось, субпопуляция CD19+ повысились на 2,5 %, на 4,7 %, на 18,8 % и на 22,9 %, а через 6 месяцев на 5,2 %, 3,1 %, 8,9 % и 13,2 % соответственно, в сравнении с исходным уровнем.
После проведённого лечения у больных ОКС наблюдалось восстановление иммунно-регуляторного индекса CD4+/CD8+, который определяет интенсивность иммунного ответа: в I группе увеличился на 24,21 %, во II группе на 36,56 %, в III группе на 40,58 %, в IV группе на 67,16 %, и через 6 месяцев на 7,81 %, на 21,64 %, на 46,37 %, и на 54,47 % соответственно, в сравнении с исходным уровнем. Достигнутый баланс Т-хелперов и Т-цитотоксических лимфоцитов указывает на восстановление иммунного ответа, которое более выражено в III и IV группах, на фоне применения ДБМА в БАТ раздельно и в сочетании с МТ, данные представлены в табл. 3.
Таким образом, результаты исследования указывают, что на фоне проведённого лечения у больных ОКС отмечалась положительная динамика: уменьшение интенсивности боли при ходьбе и в покое, чувства скованности, увеличение объёма движений в коленных суставах и восстановление иммунологического статуса в результате активации нейрогуморальных механизмов. Более выраженная позитивная динамика наблюдалась у исследуемых ОКС в IV группе, при сочетанном воздействии магнитотерапии и акупунктурного введения биоматериала «Аллоплант» в биологически активные точки.
Таблица 3. Динамика иммунологических показателей больных ОКС (M±m)
Примечание: *при p≤0,01 в сравнении с контролем, °при p≤0,01 в сравнении с исходными значениями.
Преимуществом предложенного метода лечения больных ОКС с дополнительным воздействием ДБМА через биологически активные точкиявляется восстановление иммунного статуса в результате резорбции в тканях тканевыми макрофагами, что обеспечивает пролонгированный эффект.
Выводы:
- У больных ОКС на фоне проведённого лечения наблюдалась положительная динамика, снижение индекса боли и скованности по WOMAC было более выражено в III и IV группах, при дополнительном применении ДБМА раздельно и в сочетании с магнитотерапией, через 6 месяцев сохранялся достигнутый эффект.
- Состояние иммунологического статуса у больных ОКС показало значимое улучшение, при дополнительном применении ДБМА отдельно и в сочетании с магнитотерапией наблюдалось полное восстановление баланса Т-хелперов и Т-цитотоксических лимфоцитов.
- По отдалённым результатам лечения больных ОКС более выраженная положительная динамика по объёму движений в поражённом суставе наблюдалась в IV группе исследуемых.
СОДЕРЖАНИЕ СТАТЬИ:
- Аллоплант для пластики конъюнктивы
- Аллоплант для кератопластики
- Аллоплант для реваскуляризации хориоидеи
- Аллоплант для реваскуляризации зрительного нерва
- Аллоплант для супрацилиарной канализации
- Аллоплант для вдавления хориоидеи
- Аллоплант для вдавления склеры
- Аллоплант для циркляжа склеры
- Аллоплант для укрепления имеющихся бельм при кератопротезировании
- Аллоплант, предназначенный для пластики век
- Аллоплант для пластики свободного края век
- Аллоплант для воспроизведения опорно-двигательной культи при энуклеации глазного яблока
- Аллоплант, применяемый для спонч–дренирования при лечении глаукомы
- Аллоплант, предназначенный для лечебного ретросклеропломбирования
«Аллоплант» — торговая марка применяемых при аллотрансплантации материалов, производимых из трупного донорского материала. Производством биоматериала занимаются во Всероссийском Центре глазной и пластической хирургии «Аллоплант», возглавляемом Эрнстом Мулдашевым (г. Уфа).
По утверждению производителей, особенность производимых ими материалов — это селективная экстракция гликозаминогликанов, применяемая при обработке донорских тканей, что обеспечивает минимизацию реакций тканевой несовместимости при операциях трансплантации. Вместе с тем, пересадка подобранных специально материалов стимулирует замещение их тканью пациента сходной структуры в процессе локальной регенерации ткани. Простая же пересадка донорского материала грозит отторжением и зарастанием области пересадки без восстановления функциональности рубцовой тканью.
По заявлению врачей Центра, «Аллоплант» способствует регенерации любых тканей, например, печени, повреждённой циррозом даже в запущенной стадии. После его трансплантации печень полностью восстанавливает свой функционал.
Аллоплант для склеропластики — это биологический материал, применяемый для укрепления склеры, что необходимо при прогрессирующей близорукости высокой степени. Его преимуществами является хорошая приживляемость, незначительная реакция на выполненную операцию и гарантированный склероукрепляющий эффект.
Сегодня для нужд склеропластики выпускается четыре вида Аллопланта:
- Для окончатой склеропластики быстро прогрессирующей миопии.
- Для окончатой склеропластики медленно прогрессирующей миопии.
- Для меридиональной склеропластики (методика Пивоварова).
- Для склеропластики (по методике Снайдера-Томпсона).
Склероукрепляющие пломбы — диспергированный биоматериал Аллоплант с максимально сохраненной первичной структурой и биологическими свойствами, присущими цельным аллоплантам. При подсадке, он способен замещаться плотно-оформленным соединительнотканным регенератом, который спаян с эписклерой реципиента, что позволяет стабилизировать миопический процесс. Склероукрепляющие пломбы вводятся инъекционно и обеспечивают отсутствие локальной или системной реакций, что гарантирует высокую эффективность, безопасность и малотравматичность операции, давая возможность проведения ее в амбулаторных условиях.
Биоматериал предназначен для стабилизации медленно прогрессирующей миопии, когда годовой градиент прогрессирования составляет до –1,0 Д с медленно прогрессирующими изменениями глазного дна пациента.
Аллоплант для пластики конъюнктивы
Биоматериал, изготавливаемый в форме мембраны. Его назначение — замещения дефектов конъюнктивы яблока глаза, а также век, кроме конъюнктивальных сводов (в пределах хряща). Преимущество данного Аллопланта — возможность замещения любого размера дефектов конъюнктивы, а также благоприятный косметический и стойкий клинический эффект. В области замещения спустя 1-2 месяца образовавшаяся конъюнктива уже не отличается от соседних тканей.
Его применяют в хирургии симблефаронов, опухолей, птеригиума, а также прочих патологий конъюнктивы.
Для пластики конъюнктивы выпускается два вида Аллоплантов:
- Для тотальной пластики.
- Для частичной пластики.
Аллоплант для кератопластики
Материал, предназначенный для замещения послойных поражений роговицы в хирургии кератитов, бельм, язв, а также прочих патологий роговой оболочки глаза. Его легко моделировать по форме иссекаемого очага патологии, что позволяет максимально сохранять здоровые участки роговицы. Такой Аллоплант – это принципиально новый пластический материал, в клиническом отношении превосходящий традиционно используемую при послойной кератопластике консервированную или нативную роговицу. Новый Аллоплант имеет белый цвет, который за 2 — 4 месяца замещается прозрачной роговичной тканью. Он производится с толщиной в 100 или 200 микрон.
Аллоплант для кератопластики производится двух видов:
- Для типичной послойной кератопластики (имеющий округлую форму, с диаметром 5 — 10 мм).
- Для атипичной послойной кератопластики (имеющий форму кольца – для барьерной кератопластики, а также произвольную форму — для замещения различных поражений роговицы).
Аллоплант для реваскуляризации хориоидеи
При заболеваниях сетчатки и хориоидеи достаточно часты сосудистые нарушения. Один из способов восстановления кровообращения сетчатке и хориоидеи — операция реваскуляризации хориоидеи.
Данный биоматериал для реваскуляризации хориоидеи способен после пересадки индуцировать ангиогенез. Он предназначается для стимуляции реваскуляризирующего действия при хирургии пигментной дистрофии сетчатки, а также вторичной хориоретинальной дистрофии или иных сосудистых и дистрофических заболеваний сетчатой оболочки. Аллоплант применяется с лечебным ретросклеропломбированием либо самостоятельно.
Аллоплант для реваскуляризации зрительного нерва
Материал реваскуляризирующий зрительный нерв, который вводят в супрахориоидальное пространство вплоть до области перипапиллярной хориоидеи.
Его преимущество перед традиционными шовными материалами в особой надежность шовной фиксации. Швы могут применяться во всех практически областях хирургии, поэтому изготовляются разной толщины и длины.
Аллоплант грибовидный, предназначенный для спонч-дренирования в супрахориоидальном пространстве. – специальный биоматериал, изготовленный
из губчатых тканей. Благодаря запатентованной «грибовидной» форме, способствует перераспределению жидкости супрахориоидального пространства в область субтенонового. Он стимулирует процессы ультрациркуляции, а также дренажа в стекловидном теле, нормализует тонус заднего отрезка глаза. При этом активируется венозный отток, что устраняет отек сетчатки.
Применяется в хирургии первичной закрытоугольной глаукомы, злокачественной глаукомы, некоторых форм вторичной глаукомы с имеющимся витреальным блоком.
Аллоплант для супрацилиарной канализации
Материал, смоделированный в форме распорок. Его упруго-эластичные свойства позволяют использовать две имеющиеся распорки для организации прямого тока жидкости передней камеры в супрахориоидальное пространство, со свободной ее циркуляцией.
Применяется при лечении глаукомы (хронической первичной открытоугольной, первичной закрытоугольной, вторичной ожоговой, рефрактерной, посттравматической).
Аллоплант для вдавления хориоидеи
Наименее травматического метода получение стойкого контакта между хориоидеей и сетчатой оболочкой при лечении отслойки последней с применением в качестве пломбы биоматериала Аллоплант.
Данный материал индуцирует ангиогенез, что способствует активации кровообращения в отслоенной ранее сетчатке.
Предназначается для вдавления хориоидеи и подходит для лечения различных видов отслойки сетчатки, в том числе макулярной зоны, возможно применение в сочетании с витрэктомией, а также задней аутолимфосорбцией. Лентовидная форма трансплантата позволяет вводить его в супрахориоидальное пространство через разрез склеры, укладывать в виде складок, что по мере увеличения его плотности постепенно вдавливает хориоидею. Материал обладает низкими антигенными свойствами, что обуславливает его способность постепенно замещаться богато васкуляризированными тканями.
Аллоплант для вдавления склеры
Биологический имплантат, применяемый для эписклерального вдавления в хирургии отслойки сетчатки. Его преимуществами являются: эластичность, оптимальная плотность и хорошая приживляемость. В отличие от полимерных синтетических материалов не вызывает реактивного хронического воспалительного процесса тканей.
Аллоплант для циркляжа склеры
Биоматериал, позволяющий улучшить результаты лечения отслойки сетчатки, в особенности ее тяжелых форм. Трансплантат представляет собой ленту с высокой прочностью и упругостью. Его отличительные особенности: оптимальная толщина, а также хорошее приживление.
Аллоплант для укрепления имеющихся бельм при кератопротезировании
Ткань бельма роговицы не позволяет вытолкнуть кератопротез из глаза при кератопротезирования. Поэтому исход операции зависит от степени укрепления самого бельма.
Биоматериал для укрепления бельм, применяемый при кератопротезировании производится плотным и прочным, с хорошей приживляемостью, что позволяет добиваться утолщения бельма. Аллоплант высокоэффективен клинически и способен заменить аутотрансплантаты слизистой губы, роговицы, хряща ушной раковины.
Набор биоматериала, замещающего дефекты склеры. Данный Аллоплант представляет собой специфический трансплантационный материал, который легко моделировать по форме имеющегося дефекта. Он предотвращает развитие стафилом склеры, способствует восстановлению анатомии фиброзной оболочки и достижению хорошего косметического эффекта посредством пластического укрепления истонченной ткани склеры.
Набор Аллоплантов для замещения имеющихся дефектов склеры содержит:
- Аллосухожильные нити.
- Биоматериал для пластики склер при стафиломах.
- Биоматериал для пластики склер при травмах или опухолях.
Возможно производство Аллопланта для пластики склер при стафиломах, ограниченных и обширных.
Набор биоматериала для лечения субатрофии. Аллопланты для бандажа склеры дают возможность создать каркас склеры, который предотвратит ее сморщивание и деформацию, восстановит форму и объем глазного яблока. Они обладают выраженными свойствами каркасов, такими, как упругость, жесткость, высокая прочность, а также имеют достаточную толщину, хорошую приживляемость и постепенное (не менее года) замещение собственной соединительной тканью, которая образует плотный регенерат.
Аллоплант, предназначенный для переднего бандажа, производится в форме разорванного кольца. Его укладывают вокруг роговицы, фиксируя к эписклере вдоль наружного и внутреннего диаметров. Аллоплант, предназначенный для заднего бандажа, тоже имеет кольцевидную форму. Его укладывают под прямыми мышцами и фиксируют трансплантат к эписклере. Бандаж глазного яблока проводят одновременно с реваскуляризацией хориодеи, а также аутолимфосорбцией или лечебным ретросклеропломбированием.
Выполнение операции необходимо при субатрофии глазного яблока, вне зависимости от этиологии заболевания и его стадии.
Аллоплант, предназначенный для пластики век
Биоматериал создающий каркас век и удерживающий его в нормальном положении. Аллоплант, сочетает в себе необходимую плотность и оптимальные упруго-деформативные свойства, позволяя придать веку естественную форму и положение при выполнении различных пластических операций. Кроме того, с его помощью можно восстанавливать тарзо-конъюнктивальную зону век, благодаря интенсивной эпителизации поверхности биоматериала.
Для пластики век Аллоплант производится двух видов:
- Для тотальной пластики.
- Для частичной пластики.
Незаменим при различных операциях блефаропластики (устранение заворота, выворота, при резекции и пр.).
Аллоплант для пластики свободного края век
Материал, применяемый при замещении дефектов в интермаргинальном пространстве века. Преимущество данного трансплантата — его способность устранить дефект ткани в едином контакте с принимающим ложем, отличная приживляемость, стойкий клинический эффект, благоприятный косметический результат.
Используется в хирургии последствий трахомы, травм (трихиаз, заворот), ожогов, опухолей, врожденных аномалий свободного края век глаза.
Аллоплант для воспроизведения опорно-двигательной культи при энуклеации глазного яблока
Данный биоматериал имплантируют в орбиту для создания протезной культи, которая необходима после энуклеации (удаления) глазного яблока. Трансплантат отлично моделируется и приживляется, он не выталкивается, что позволяет создать мобильную, выпуклую культю, которая идеально подходит для изготовления индивидуального протеза.
Стимулятор васкулогенеза — это диспергированный биоматериал с технологической обработкой, которая обеспечивает максимум концентрации биологических факторов, которые индуцируют процессы васкулогенеза.
Материал применяют для ретробульбарного введения при осложненной миопии, высоких степеней, абиотрофиях и пр. Кроме того, он используется для местного введения в иные участки тела.
Аллоплант, применяемый для спонч–дренирования при лечении глаукомы
Биоматериал, изготовленный из «спонча» (губчатого биоматериала). Благодаря своей микропористой структуре Аллоплант отлично впитывает влагу в передней камере, способствуя ее оттоку в зону супрахориоидального пространства, заднего отдела глаза.Он применяется в хирургии первичной хронической открытоугольной, рефрактерной, врожденной глаукомы, а также некоторых вторичных глауком.
Аллоплант, предназначенный для интрасклерального спонч-дренирования при лечении глаукомы — это губчатый материал, имеющий микропористую структуру. Его отличительная особенность — способность интенсивно впитывать влагу в передней камере из фильтрационной зоны, перенаправляя ее в область супрахориоидального пространства между слоями склеры.
Незаменим в хирургии глаукомы (первичной и хронической открытоугольной, некоторых вторичных глаукомах).
Аллоплант, предназначенный для лечебного ретросклеропломбирования
Продукт измельчения тщательно подобранных по составу биологических тканей. Его предназначение — введение в пространство между теноновой капсулой и склерой, в заднем отделе глазного яблока. Вследствие увеличения площади касания с тканевым ложем биоматериал для ретросклеропломбирования помогает интенсификации физико-химического взаимодействия, что создает особенно благоприятные условия для выхода биоактивных соединений из матрикса Аллопланта.
Этот Аллоплант стимулирует кровообращение в склере, сетчатке и хориоидее, нормализует проницаемость сосудов, активирует процессы рассасывания патологических очагов, обладает склероукрепляющим действием.
Применяется самостоятельно при миопии слабой или средней степени, абиотрофиях сетчатки, атрофии зрительного нерва, поражениях макулярной области. А также в комбинации с иными оперативными вмешательствами: реваскуляризацией хориоидеи или зрительного нерва, аутолимфосорбцией.
В медицинском центре «Московская Глазная Клиника» все желающие могут пройти обследование на самой современной диагностической аппаратуре, а по результатам – получить консультацию высококлассного специалиста. Клиника открыта семь дней в неделю и работает ежедневно с 9 ч до 21 ч. Наши специалисты помогут выявить причину снижения зрения, и проведут грамотное лечение выявленных патологий.
Уточнить стоимость той или иной процедуры, записаться на прием в «Московскую Глазную Клинику» Вы можете по телефонам в Москве 8 (800) 777-38-81 и 8 (499) 322-36-36 (ежедневно с 9:00 до 21:00) или воспользовавшись ФОРМОЙ ОНЛАЙН ЗАПИСИ.
УДК 611.721.1
Э.Р. МУЛДАШЕВ, У.К. МУСИН
Всероссийский центр глазной и пластической хирургии МЗ РФ, г. Уфа
Контактная информация:
Мулдашев Эрнст Рифгатович – доктор медицинских наук, профессор, президент Всероссийского центра глазной и пластической хирургии
Адрес: 450075, г. Уфа, ул. Р. Зорге, д. 67/1, тел.: +7 (347) 224-68-01, e—mail: centre@alloplant.ru
До настоящего времени отсутствовали методы лечения, способные запустить регенеративные процессы в дегенеративно измененных межпозвонковых дисках при протрузиях, грыжах и экструзиях, однако использование биоматериала «Аллоплант» для решения данной задачи дало положительные результаты. Методика, использованная в ФГБУ «Всероссийский центр глазной и пластической хирургии» Минздрава РФ при лечении пациентов с дегенеративными поражениями межпозвонковых дисков, заключалась в паравертебральном введении биоматериала «Аллоплант» непосредственно к пораженному диску. Был получен положительный результат – восстановление конфигурации пораженных дисков за счет регенерации с полным восстановлением трудоспособности.
Ключевые слова: грыжи межпозвонковых дисков, протрузии межпозвонковых дисков, артроз.
E.R. MULDASHEV, U.K. MUSIN
Russian Eye and Plastic Surgery Center of the Russian Federation Health Ministry, Ufa, the Republic of Bashkortostan, Russian Federation
Transplant alolplant technology in treatment of patients with degenerative changes of intervertebral disсs
Contact details:
Muldashev E.R. – D. Sc. (medicine), Professor, President of the Russian Eye and Plastic Surgery Center
Address: 67/1 R. Sorge St., Ufa, the Republic of Bashkortostan, Russian Federation, 450075, tel.: +7 (347) 224-68-01, e-mail: centre@alloplant.ru
Till now, there have been no treatment methods capable of starting regenerative processes in the degeneratively altered intervertebral disks in case of protrusions, hernias, and extrusions. The use of Alloplant biomaterials gave positive results in solving this problem. The method used in Federal State Budgetary Institution «Russian Eye and Plastic Surgery Center» for treating patients with degenerative lesions of intervertebral disks consists in the paravertebral insertion of Alloplant biomaterial directly to the affected disk. A positive result was obtained – restoration of the affected disks configuration by regeneration with complete vocational rehabilitation.
Key words: hernia of intervertebral disks, protrusions of intervertebral disks, arthrosis.
Дегенерация межпозвонковых дисков происходит с возрастом или по причине различных травм (в том числе при поднятии тяжестей) и у большинства сопровождается клиническими проявлениями, порой лишающими трудоспособности. При лечении данной категории пациентов применяются консервативные способы лечения вертебропатологии, заключающиеся в применении мануальной терапии [1], физиотерапии, анальгетиков, новокаиновых блокад, лечебной гимнастики, противовоспалительных препаратов, а также введения папаина в межпозвоночный диск [7] и медикаментов, улучшающих тканевой метаболизм. В силу того, что основной причиной дегенеративных изменений межпозвонковых дисков является трофический фактор, определяемый низким уровнем регионального и местного лимфо- и кровотока, очевидным является факт, что вводимые извне вещества не могут достичь должной лечебной концентрации в зоне поражения, более того, не существует средств, способных увеличить количество кровеносных сосудов в зоне поражения и, как следствие, нормализовать тканевой обмен посредством усиления местного кровотока. Однако только иногда, когда первоначальной причиной патологии позвоночника является воспалительный синдром, преимущественно локализующийся в дугоотросчатых (фасеточных) суставах, прием противовоспалительных препаратов дает временный эффект, ограниченный периодом приема и непродолжительным последействием, в то время как длительный прием противовоспалительных препаратов сопряжен с риском развития грозных осложнений со стороны внутренних органов [2]. В случае же дегенеративного поражения дугоотросчатых суставов (спондилоартроз), с отсутствием или слабовыраженным воспалительным синдромом, применение вышеперечисленных методов лечения редко приводит к стабилизации или регрессу патологического процесса.
Немаловажное значение в лечении вертебропатологии придается различным видам вытяжения, в том числе подводному [7], в ходе выполнения которых в тканях, наряду с устранением рефлекторно-спастических явлений, возникает разрежение, что способствует активному перемещению тканевой жидкости, обеспечивающей обмен веществ в структурах позвоночника. Однако очевидно, что лечебное воздействие данного метода ограничено временем вытяжения с кратковременным последействием. При грыжах, протрузиях и экструзиях межпозвонковых дисков широко и обоснованно применяется иммобилизация различными способами, цель которых заключается в обездвиживании позвоночника для уменьшения болевого синдрома. Однако очень часто иммобилизация служит пусковым механизмом дальнейшей дегенерации межпозвонковых дисков на фоне атрофии мышечного футляра позвоночника, так как движение в норме является мощным фактором, усиливающим местный лимфо- и кровоток и, как следствие, обмена тканевой жидкости в структурах позвоночника, представленных дисками и связками, наряду с качественной перестройкой структуры позвонков.
При дегенеративном поражении дисков с явлениями протрузии, образованием грыж и экструзии, как правило, возникает дискорадикулярный конфликт с выраженным болевым синдромом, а в последующем из-за компрессии спинномозговых корешков и, как следствие, необратимого их дегенеративного перерождения нарушается функция конечностей, что может привести к инвалидности. Применение консервативного лечения в ряде случаев оказывается абсолютно неэффективным, что является показанием для проведения различного рода хирургических вмешательств по освобождению компримированного спинномозгового корешка [3]. Из-за нередко наблюдаемых послеоперационных парезов и параличей применяемые хирургические вмешательства большинством специалистов характеризуются как «операция отчаяния». Кроме того, пересечение околопозвоночных мягких тканей с проходящими в них сосудами неминуемо приводит к дефициту лимфо- и кровотока, что служит пусковым механизмом появления или прогрессирования уже имеющихся дегенеративных изменений в структурах позвоночника. Следует отметить, что при наличии воспаления в дугоотросчатых (фасеточных) суставах любая хирургическая инвазия может также спровоцировать выраженное обострение воспаления с появлением или прогрессированием уже имеющегося спондилоартроза.
В доступных источниках описывается способ регенерации хряща при заболеваниях опорно-двигательной системы (остеохондроз, грыжи и протрузии дисков, спондилез и т.д.), в ходе выполнения которого осуществляют инъекционное введение биоматериала «Аллоплант» подкожно или в межостистую связку на уровне поражения. При этом авторы утверждают, что применяемый ими способ обеспечивает стимуляцию регенеративных процессов в хрящевой ткани за счет межтканевых индуктивных взаимодействий [5]. Очевидно, что при подкожном введении и введении в толщу межостистой связки «Аллопланта» исключается проникновение частиц биоматериала непосредственно к корешкам спинного мозга, не говоря о позвонках и дисках между ними, так как между последними и местом введения «Аллопланта» имеется барьер, представленный мышцами, задними опорными структурами позвонков и мощным связочным аппаратом. Положительный лечебный эффект при указанном способе введения биоматериала связан с тем, что на месте введения «Аллопланта» наблюдается расширение кровеносных сосудов, вследствие чего устраняются ангиоспастические рефлексы, возникающие в пораженной зоне, усиливается кровоток, что благотворно отражается на состоянии задней порции околопозвоночных мышц, участвующих в стабилизации позвоночно-двигательного сегмента. Также в этот период купируются миотонические рефлекторные синдромы, так как раздражение механорецепторов околопозвоночных мышц является эффективным «отвлекающим» фактором. Все вышеперечисленное устраняет патологический рефлекторный спазм околопозвоночного мышечного «футляра» и приводит к значительному уменьшению компрессии дисков, что сопровождается увеличением высоты сохранивших свою эластичность дисков за счет расправления бокового патологического выпячивания по периметру, чем и объясняется уменьшение протрузии или выступания грыжи на 2–3мм, а возникающее при этом относительное разрежение в структурах диска сопровождается гидратацией, на магнитно-резонансной томограмме (МРТ) проявляющее себя как «усиление гидратации».
Материал и методы
В период с декабря 2013 по февраль 2017 г. проведен анализ эффективности паравертебрального введения биоматериала «Аллоплант» у 2 558 пациентов с протрузией, у 1 738 с грыжей и у 300 – с экструзией межпозвонкового диска.
До начала лечения всем пациентам проводилась МРТ. Наряду с МРТ исследовались функциональные показатели позвоночника с фиксацией ограничения движений пораженных отделов с учетом возрастных нормативов [6], при этом была констатирована скованность пациентов из-за выраженного болевого синдрома, в ряде случаев обуславливающая невозможность совершать какие-либо движения, или же пациент находился в вынужденном положении.
В шейном отделе в норме при сгибании подбородок касается грудины, а у исследуемых пациентов расстояние от подбородка до грудины варьировало от 2 см и до незначительного сгибания шеи. При разгибании в шейном отделе затылок в норме соприкасается со спиной, а у исследуемых пациентов расстояние от затылка до поверхности спины варьировало от 3 см и до незначительного разгибания шеи. Боковые наклоны оценивались расстоянием от мочек ушей до надплечий, данное расстояние варьировало от 2,5 см до незначительного наклона головы. Ротационные движения исследовались с большой осторожностью, и также было зарегистрировано их ограничение различной степени выраженности вплоть до незначительной ротации.
В грудном отделе сгибание и разгибание оценивалось по изменению расстояния между остистыми отростками CVII и TXII, в норме при сгибании данное расстояние увеличивается на 8–10 см, а при разгибании уменьшается с индивидуальными градациями, зависящими от гибкости, то есть даже незначительное уменьшение указанного расстояния можно принять за норму. У исследованных пациентов при сгибании указанное выше расстояние варьировало от 5 см до полной обездвиженности, а при разгибании соответствующее расстояние изменялось незначительно или оставалось неизменным.
В поясничном отделе подвижность исследовалась измерением расстояния между LI и LV при сгибании (в номе увеличивается на 4–6 см) и разгибании. Другие способы оценки подвижности поясничного отдела не применялись в виду их неточности. У исследованных пациентов при сгибании указанное выше расстояние варьировало от 3,5 см до незначительного сгибания, а при разгибании соответствующее расстояние изменялось незначительно.
В ходе манипуляции в проекции пораженного межпозвонкового диска игла вводилась до границы между околопозвоночными мышцами и поперечным отростком позвонка или межпоперечной связкой и вводился диспергированный, то есть разведенный в соотношении 50 мг биоматериала «Аллоплант» (интенсивного действия (при экструзии и грыже) или стимулятор регенерации (при протрузии)) на 20 мл физиологического раствора, а следом вводился физиологический раствор в количестве 20–100 мл до получения иррадиирущих неприятных или болезненных ощущений, создавая дополнительное давление, обеспечивающее продвижение биоматериала по гидравлически расширенным межтканевым, периневральным и параваскулярным пространствам к зоне поражения, после чего пациентов позиционировали на животе в течение 12–24 ч для гравитационного распространения раствора к передним отделам позвоночника, причем лечение проводили курсом, включающим 3–5 инъекций.
У пожилых или больных после хирургического вмешательства на позвоночнике, когда ткани ригидные или рубцово перерождены, вследствие чего продвижение раствора «Аллопланта» по вышеописанному механизму невозможно, биоматериал вводился непосредственно к телу позвонка или к межпозвонковому диску, при этом игла проводилась на расстоянии 3 см от остистого отростка, обходя поперечный отросток по верхнему краю (аналогично блокаде по Шнеку).
Динамикой патологического процесса и переносимостью определялась соответственно кратность введения раствора биоматериала и интервал между процедурами. В случае наличия выраженного воспаления дугоотросчатых суставов и других структур позвоночника наряду с биоматериалом допускалось применение противовоспалительных препаратов. Также допускалась комбинация известных способов медикаментозного лечебного воздействия с предложенным методом, и при этом каких-либо побочных эффектов и несовместимости нами не выявлено.
Полученный клинически значимый положительный результат, по нашему мнению, достигается благодаря тому, что введение биоматериала «Аллопланта» непосредственно в зону поражения (однократно или многократно, в зависимости от динамики патологического процесса) обеспечивает ферментативно-макрофагальный лизис поврежденных (нежизнеспособных) структур дисков (грыжи, представляющей «секвестр», элементов фиброзного кольца при протрузии), а также нервной ткани вследствие имбибиции последних биоматериалом «Аллоплант». Это сопровождается заполнением образовавшихся дефектов новообразованной полноценной состоятельной тканью, идентичной пораженной, благодаря постаттракционной деятельности стволовых клеток [4]. Лизис и замещение нежизнеспособных волокон по периметру диска (спондилез и т.д.) имеют очень важное значение еще и потому, что эти волокна создают барьер, препятствующий полноценной диффузии тканевой жидкости в глублежащие структуры диска и пульпозное ядро, чем и объясняется обезвоживание и снижение высоты дисков при данной патологии наряду с инволюционным снижением гидрофильности ядер последних. Поскольку используемый в предложенном способе биоматериал «Аллоплант» обладает предельно низкими антигенными свойствами, то практически исключается иммунный характер реакции после его введения. Возникающее в околопозвоночных мягких тканях после введения «Аллопланта» асептическое воспаление сопровождается расширением сосудов, более того, согласно экспериментальным исследованиям, проведенным авторами во ВЦГ и ПХ, на месте введения «Аллопланта» в последующем образуется богатая сеть новообразованных кровеносных сосудов, что благотворно отражается на составе и количестве тканевой жидкости, обеспечивающей трофику структур позвоночно-двигательного сегмента.
Результаты
В первые трое суток все пациенты отмечали обострение болевого синдрома различной степени выраженности из-за отека параартикулярных тканей. Спустя неделю наступало облегчение и в дальнейшем через месяц исходный болевой синдром, преимущественно обусловленный диско-радикулярным конфликтом, полностью был купирован, за исключением редких случаев при экструзиях.
По данным контрольной МРТ через 6 месяцев наблюдалось восстановление конфигурации пораженных дисков различной степени выраженности с уменьшением (от 3 до 6 мм) проминирования (обуславливающего диско-радикулярный конфликт) благодаря постаттракционной деятельности стволовых клеток [4].
При лечении протрузий анатомическое восстановление межпозвонковых дисков было полным у 779 пациентов (31,4%), выраженным у 807 пациентов (31,5%), невыраженным у 870 пациентов (34%), отсутствовало у 102 пациентов (3,9%), при этом функция пораженного отдела позвоночника была восстановлена у всех пациентов (100%).
При лечении грыж анатомическое восстановление межпозвонковых дисков было выраженным у 973 пациентов (56%), невыраженным у 625 пациентов (36%), отсутствовало у 140 пациентов (8%), при этом функция была восстановлена у 1 633 пациентов (94%), а неполное восстановление функции пораженного отдела позвоночника наблюдалось у 105 пациентов (6%) с полным восстановлением трудоспособности.
При лечении экструзий анатомическое восстановление межпозвонковых дисков было выраженным у 144 пациентов (48%), невыраженным у 123 пациентов (41%), отсутствовало у 33 пациентов (11%), при этом функция была восстановлена у 267 пациентов (89%), а неполное восстановление функции наблюдалось у 3 пациентов (11%), что послужило показанием для проведения хирургического вмешательства из-за некупируемого болевого синдрома.
Выводы
Восстановление конфигурации пораженных дисков по данным контрольной МРТ после паравертебрального введения биоматериала «Аллоплант» при протрузиях, грыжах и экструзиях, наряду с полным функциональным восстановлением позвоночника и трудоспособности пациентов, может достаточно убедительно свидетельствовать о произошедшей регенерации вовлеченных в патологический процесс дисков, а отсутствие побочных эффектов и осложнений, а также доступность определяют рациональность широкого применения предлагаемого метода в клинической практике.
Мулдашев Э.Р. – http:/orcid.org/0000-0003-3834-8427
Мусин У.К. – http:/orcid.org/0000-0003-4034-5372
ЛИТЕРАТУРА
- Бобырь А.И., Никитин В.В. Дефанотерапия нарушений осанки и сколиоза. – 1999. – С. 50–60.
- Bjarnason I., Zanelli G., Smith T. et al. Nonsteroidal antiinflammatory drug-induced intestinal inflammation in humans // Gastroenterol. – 1987. – № 93. – С. 480–489.
- Мовшович И.А. Оперативная ортопедия. – 1994. – С. 356–357.
- Муслимов С.А. Морфологические аспекты регенеративной хирургии. – 2000. – С. 18.
- Патент РФ № 2347559 МПК А61К31/00, опубл. 27.02.2009 г.
- Шапошникова Ю.Г. Травматология и ортопедия. – 1997. – Т. 1. – С. 66–68.
- Шапошникова Ю.Г. Травматология и ортопедия. – 1997. – Т. 3. – С. 175.
REFERENCES:
- Bobir A.I., Nikitin V.V. Defanoterapiya narusheniy osanki i skolioza [Dephanotherapy of the posture and scoliosis disorders], 1999, pp 50-60.
- Bjarnason I., Zanelli G., Smith T et al. Nonsteroidal anti-inflammatory drug-induced intestinal inflammation in humans. Gastroeneterol., 1987, vol. 93, pp 480-489.
- Movshovich I.A. Operativnaya ortopediya [Operative orthopedics], 1994, pp 356-357.
- Muslimov S.A. Morfologicheskie aspekty regenerativnoj hirurgii [Morphological aspects of regenerative surgery], 2000, P. 18.
- Patent R.F. No.2347559 MPK A 61K31/00, published 27.02.2009.
- Shaposhnikova Yu.G. Travmatologiya i ortopediya [Traumatology and orthepedics], vol. 1, 1997, pp 66-68.
- Shaposhnikova Yu.G. Travmatologiya i ortopediya [Traumatology and orthepedics], vol. 3, 1997, P. 175.
Обсуждение закрыто.
Плазмотерапия для суставов — это лечение тромбоцитарно-обогащенной плазмой (platelet rich plasma). Такая плазма является аутологичным материалом, т.е. полученным у самого донора — кровь для ее изготовления сдает непосредственно сам пациент.
Аутоплазмотерапия суставов имеет следующие преимущества:
- отсутствие негативного влияния на желудочно-кишечный тракт;
- быстрое достижение терапевтического эффекта;
- полная биологическая совместимость;
- низкий риск аллергических реакций;
- продолжительный срок действия (до 1,5 лет).
Методика является малоинвазивной, так как жидкость вводится в сустав с помощью инъекции. Это связано с незначительным риском осложнений (образования гематом, местного воспаления в зоне укола, повреждения сосудов, периферических нервов. Благодаря строгому соблюдению санитарных норм и высокому профессионализму врачей центра вероятность данных последствий минимальна.