📜 Инструкция по применению БУТОФАН® OR
💊 Состав препарата БУТОФАН® OR
✅ Применение препарата БУТОФАН® OR
📅 Условия хранения БУТОФАН® OR
⏳ Срок годности БУТОФАН® OR
Описание лекарственного препарата ветеринарного назначения БУТОФАН® OR
Основано на официально утвержденной инструкции по применению
препарата БУТОФАН® OR для специалистов
и утверждено компанией-производителем для электронного издания справочника Видаль Ветеринар
2021 года
Дата обновления: 2020.12.01
Лекарственная форма
|
|
БУТОФАН® OR |
Раствор рег. №ПВИ-2-17.13/02935 |
Форма выпуска, состав и упаковка
Раствор прозрачный, от розового до розово-красного цвета.
* включая необходимую норму превышения для стабильности 0.0225 мг.
Вспомогательные вещества: метил-4-гидроксибензоат — 1 мг, вода очищенная — до 1 мл.
Не содержит генно-инженерно-модифицированных продуктов.
Содержание вредных примесей не превышает предельно допустимых норм, принятых в РФ.
Расфасован по 1 л в полимерные бутылки или по 5 л в полимерные канистры. Бутылки и канистры укупорены навинчиваемыми крышками с контролем первого вскрытия.
Каждая упаковка маркирована этикеткой на русском языке с указанием: наименования организации-производителя, ее адреса и товарного знака, названия, назначения и способа применения кормовой добавки, состава и гарантированных показателей, срока и условий хранения, номера партии (включает дату изготовления — день, месяц, год), объема в единице фасовки, информации о соответствии, регистрационного номера, обозначения СТО, надписи «Для животных», «Не содержит генно-инженерно-модифицированных продуктов» и снабжена инструкцией по применению.
Фармакологические (биологические) свойства и эффекты
Кормовая добавка Бутофан® нормализует метаболические и регенеративные процессы, оказывает стимулирующее действие на белковый, углеводный и жировой обмен веществ, повышает резистентность организма к неблагоприятным факторам внешней среды, способствует росту и развитию молодняка.
Входящий в состав кормовой добавки бутафосфан способствует улучшению функции печени, стимулирует метаболические процессы, повышает двигательную активность гладкой мускулатуры, стимулирует образование костной ткани.
Витамин В12 активизирует процессы кроветворения, синтез нуклеиновых кислот, восстанавливает до нормы уровень лимфоцитов-супрессоров, участвует в синтезе метионина, способствует образованию гликогена, мобилизует запасы энергии, необходимые для образования дезоксирибозы и синтеза ДНК.
Показания к применению препарата БУТОФАН® OR
Сельскохозяйственной птице для нормализации обмена веществ, повышения продуктивности и неспецифической резистентности, в т.ч.:
- для повышения сохранности поголовья, в т.ч. при расклеве;
- для повышения сопротивляемости организма заболеваниям различной этиологии и неблагоприятным факторам внешней среды, в т.ч. к тепловому стрессу;
- для нормализации функций печени, белкового, углеводного и жирового обмена веществ, регенеративных процессов;
- для повышения продуктивности, стимуляции роста и развития молодняка, улучшения качества яйца.
Порядок применения
Кормовую добавку применяют птице перорально с водой для поения в течение 4-5 дней подряд, в разовых дозах:
- курам-несушкам, бройлерам 2-3 мл на 1 л воды для поения;
- цыплятам, ремонтному молодняку 1-1.5 мл на 1 л воды для поения;
- цыплятам-бройлерам для снятия теплового стресса — 20 мл на 1 л питьевой воды для поения.
Побочные эффекты
Побочных явлений и осложнений при применении кормовой добавки в соответствии с инструкцией не выявлено.
Противопоказания к применению препарата БУТОФАН® OR
Противопоказания не установлены.
Особые указания и меры личной профилактики
Кормовая добавка совместима с другими кормовыми добавками и лекарственными препаратами.
Продукцию от сельскохозяйственных животных и птиц после применения кормовой добавки Бутофан® OR можно использовать в пищевых целях без ограничений.
Меры личной профилактики
При работе с кормовой добавкой Бутофан® OR следует соблюдать общие правила личной гигиены и техники безопасности, предусмотренные при работе с кормовыми добавками. По окончании работы руки следует вымыть теплой водой с мылом.
При попадании кормовой добавки в глаза их следует немедленно промыть большим количеством воды.
Условия хранения БУТОФАН® OR
Кормовую добавку следует хранить в закрытой упаковке производителя в защищенном от прямых солнечных лучей, недоступном для детей месте при температуре от 5°С до 25°С.
Срок годности БУТОФАН® OR
Срок годности — 2 года с даты производства, после вскрытия флакона — не более 28 суток. Не применять по истечении срока годности.
Контакты для обращений
|
|
410010 Саратов, |
БУТОФАН® OR отзывы
Помогите другим с выбором, оставьте отзыв об БУТОФАН® OR
Оставить отзыв
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Подагра является наиболее частой причиной артрита [1], что обусловлено отложением кристаллов моноурата натрия (МУН) в суставах и мягких тканях. Для формирования кристаллов МУН необходима персистирующая гиперурикемия. При повышении сывороточного уровня мочевой кислоты (МК) происходит насыщение тканей МУН, что создает условия для его кристаллизации и, соответственно, манифестации подагры [2]. Порог насыщения МК составляет около 7 мг/дл (420 мкмоль/л), хотя для пациентов с подагрой рекомендуется достигать сывороточный уровень МК менее 6 мг/дл (360 мкмоль/л), поскольку такой уровень МК приводит к более быстрому уменьшению кристаллических отложений МУН [3–6].
Достигнутые в настоящее время успехи в понимании основных механизмов развития хронической гиперурикемии и подагры позволили пересмотреть многие положения, лежащие в основе диагностики и лечения заболевания. Между тем, несмотря на успехи в понимании патофизиологии подагры и доступность эффективных методов лечения, подагра остается плохо контролируемым заболеванием во всех странах [7, 8]. Пожалуй, самой распространенной проблемой является низкая приверженность пациентов к снижению сывороточного уровня МК, что главным образом связано с недостаточным пониманием цели терапии подагры и врачами, и пациентами. Целесообразно объяснить пациентам цель лечения [9–11], которая заключается в растворении имеющихся отложений кристаллов МУН путем снижения сывороточного уровня МК ниже точки насыщения сыворотки уратами и купировании приступов артрита, если таковые возникают. Следует также поддерживать сывороточный уровень МК ниже порога насыщения, чтобы избежать образования новых кристаллов.
Целью настоящей статьи было предоставить практический обзор существующих подходов к управлению заболеванием в четырех аспектах: немедикаментозные методы профилактики и лечения гиперурикемии; купирование острого приступа артрита; уратснижающая терапия, направленная на профилактику приступов артрита и образование тофусов; профилактика приступов артрита при инициации уратснижающей терапии.
Лечение подагры в соответствии с современными рекомендациями направлено на улучшение исходов заболевания. Эффективность лечебно-профилактических вмешательств при подагре зависит от четкого следования предложенной в них концепции лечения [4, 12, 13].
Немедикаментозные методы профилактики
Немедикаментозные методы профилактики, нацеленные на модификацию факторов образа жизни, связанных с риском развития гиперурикемии, предусматривают индивидуальное или групповое профилактическое консультирование по актуальным вопросам диетотерапии, контролю массы тела при ожирении, достижению целевых уровней артериального давления, коррекции нарушений углеводного и липидного обмена.
Ожирение является ведущим фактором риска подагры, особенно у мужчин, соответственно, контроль массы тела оказывает существенное влияние на частоту приступов подагры [14]. Снижение веса за счет ограничения общей калорийности пищи и потребления углеводов благотворно влияет на уровни сывороточного урата у пациентов с подагрой [15, 16].
Следует отметить, что в настоящее время пересмотрены некоторые принципиальные позиции по диетотерапии при подагре. Так, рекомендация по жесткому ограничению в пищевом рационе пуринсодержащих продуктов распространяется только на животные производные (мясо, морепродукты), поскольку именно такая мера способствует снижению сывороточного уровня мочевой кислоты. При этом богатая пуринами растительная пища не оказывает существенного влияния на урикемию [4, 17]. Показано, что потребление обезжиренных молочных продуктов [18, 19], растительных масел и овощей ассоциируется с уменьшением риска гиперурикемии и приступов подагры [4, 12]. Витамин С увеличивает почечную экскрецию мочевой кислоты, поэтому его можно использовать в качестве дополнительной меры при терапии подагры [20, 21]. Безопасным в отношении сывороточного уровня МК и риска развития подагры считается потребление небольшого количества сухого вина [20, 22]. При этом потребление пива, в т. ч. безалкогольного, крепких спиртных напитков, а также подслащенных безалкогольных напитков с высоким содержанием фруктозы должно быть ограничено максимально [20, 23–25].
Несмотря на то, что основная масса клинических исследований затрагивают оценку эффективности диетотерапии в аспекте профилактики риска развития подагры, а не управления частотой приступов артрита у лиц с верифицированным диагнозом, рекомендации по модификации образа жизни должны даваться всем пациентам с подагрой, в т. ч. получающим медикаментозную терапию.
Купирование острого приступа подагрического артрита
В современных рекомендациях в качестве препаратов первой линии противовоспалительной терапии рассматриваются нестероидные противовоспалительные средства (НПВС), колхицин и глюкокортикостероиды (ГК) [4, 12, 13]. Сравнительно недавний систематический обзор показал, что НПВС (в том числе селективные ингибиторы ЦОГ-2), ГК (перорально и внутримышечно), колхицин и ингибитор ИЛ-1β (канакинумаб) являются эффективными методами лечения острых приступов [26]. Целесообразность персонифицированного выбора режима терапии обусловлена и индивидуальными особенностями больного, и гетерогенностью собственно подагрического процесса, протекающего с вовлечением многих органов и систем организма, что существенно модифицирует фармакодинамику препаратов, приводя к кумуляции нежелательных эффектов.
Терапия НПВС занимает лидирующие позиции в лечении как острого приступа, так и хронического подагрического артрита. Считается, чем раньше назначен препарат, тем быстрее может быть достигнут анальгетический эффект. НПВС следует использовать в максимальных суточных дозах, которые могут быть уменьшены по мере ослабления симптоматики. Выбор конкретного НПВС во многом зависит от личных предпочтений. И селективные ингибиторы ЦОГ-2, и традиционные НПВС эффективны при лечении острых приступов подагрического артрита. Недавний систематический обзор, объединяющий результаты шести рандомизированных клинических исследований (851 пациент), продемонстрировал одинаковый эффект эторикоксиба (120 мг в сутки), индометацина и диклофенака при остром артрите, с лучшей у эторикоксиба переносимостью со стороны желудочно-кишечного тракта [27]. Другой селективный ингибитор ЦОГ-2 — целекоксиб также обнаружил сопоставимый с индометацином эффект в отношении умеренной и выраженной боли у пациентов с острым подагрическим артритом [28]. Еще в одном систематическом обзоре был сделан вывод о том, что НПВС и селективные ингибиторы ЦОГ-2 обнаруживают эквивалентные преимущества в плане уменьшения боли, отечности и улучшения общего самочувствия, однако традиционные НПВС отличаются большей частотой отмены из-за нежелательных явлений [29].
Колхицин — алкалоид, получаемый из растения безвременника осеннего (Colchicum autumnae), используется для лечения острой подагры на протяжении многих десятилетий. Клинические исследования и ежедневная рутинная практика демонстрируют высокую частоту побочных эффектов при применении колхицина, которые, вероятно, можно объяснить назначением в прошлые годы более высоких доз препарата, чем рекомендованы в настоящее время. По крайней мере, большое многоцентровое исследование пациентов с подагрой и сохраненной функцией почек убедительно показало сопоставимую эффективность двух режимов терапии острого подагрического артрита: низкодозового (1,8 мг колхицина в сутки: 1,2 мг сразу и 0,6 мг через час) и высокодозового (4,8 мг колхицина в сутки: 1,2 мг сразу и по 0,6 мг каждый час; 6 раз), с существенно меньшей частотой побочных эффектов со стороны желудочно-кишечного тракта в группе с низкой дозой. Причем эффективность низких доз колхицина была эквивалентна высоким в том случае, если колхицин в низких дозах назначался в течение первых 12 часов после начала острого приступа артрита [30]. Клиническая практика показывает, что колхицин оказывается гораздо менее эффективным, если его назначают после 12–24 часов от начала приступа. Соответственно, более позднее назначение может потребовать больших доз препарата, что практически всегда заканчивается развитием нежелательных лекарственных реакций.
Согласно современным национальным рекомендациям для купирования острой атаки артрита целесообразным считается назначение у большинства пациентов низких доз колхицина (1,5 мг в первые сутки (1 мг сразу и через 1 час еще 0,5 мг) и по 1 мг со следующего дня) [13].
Назначение ГК для купирования острого приступа подагры возможно в виде внутрисуставных (после удаления синовиальной жидкости), внутримышечных инъекций или внутрь.
Пероральный прием преднизолона в суточной дозе 30–35 мг/сут демонстрирует высокую эффективность [31, 32] и рекомендуется группами Американского колледжа ревматологов (American College of Rheumatology, ACR) и Европейской антиревматической лиги (European League Against Rheumatism, EULAR) в качестве терапии первой линии при лечении острого приступа подагры [12, 33]. При этом стартовая доза преднизолона 30–35 мг/сут назначается на несколько (3–6) дней с последующей быстрой (в течение 1 недели) полной отменой.
Внутримышечное введение ГК может быть применено в случаях полиартикулярного поражения суставов [34]. Внутрисуставные инъекции стероидов оказываются очень эффективными и рекомендуются как ACR, так и EULAR при моно- или полиартикулярном поражении суставов, несмотря на отсутствие рандомизированных клинических исследований [12, 33].
Однако важно отметить, что, вопреки бытующему мнению, прием преднизолона не эффективнее НПВС. Так, сравнение двух режимов терапии (преднизолон 35 мг/сут и напроксен 1000 мг/сут) у пациентов с острым подагрическим артритом показало отсутствие различий в динамике интенсивности боли при сопоставимой частоте нежелательных эффектов [35]. Кроме того, ГК не безопаснее НПВС, поскольку способны усугубить течение артериальной гипертонии и сахарного диабета [36]. В исследовании [37] частота побочных эффектов даже на однократное внутрисуставное введение ГК (бетаметазон 7 мг) оказалась чрезвычайно высокой: у 73% пациентов обнаружилось клинически значимое повышение уровня систолического артериального давления, у 23% — гликемия натощак, у 13% — ЭКГ-признаки ишемии миокарда.
При наличии абсолютных противопоказаний и/или неэффективности НПВС, колхицина и ГК, а также отсутствии текущей инфекции, с целью купирования острого артрита возможно применение моноклональных антител к ИЛ-1 (канакинумаб) [12].
Уратснижающая терапия
Уратснижающая терапия, основной целью которой является предупреждение образования и растворение имеющихся кристаллов МУН, возможна посредством достижения уровня МК ниже точки супернасыщения сыворотки уратами (< 360 мкмоль/л), при котором процесс кристаллизации МК приостанавливается, а депозиты кристаллов в тканях постепенно растворяются. Для пациентов с тяжелой тофусной подагрой, хроническим артритом и частыми атаками предпочтительно поддержание целевого сывороточного уровня МК ниже 300 мкмоль/л, поскольку это способствует более быстрому рассасыванию тофусов [12, 33].
Нужно заметить, что целесообразность регулярного контроля гиперурикемии на фоне уратснижающей терапии признается далеко не всеми исследователями. По крайней мере, данный подход был опротестован группой ACR, которая рекомендовала врачам назначать терапию подагры с целью управления симптомами, а не уровнем урикемии [38]. Между тем многочисленные клинические и патофизиологические исследования свидетельствуют о том, что снижение уровня МК ниже точки насыщения сыворотки уратами является лучшим и самым надежным способом контроля симптомов подагры в долгосрочной перспективе и что назначение уратснижающей терапии без отслеживания темпов снижения уровня урикемии является частым поводом отказа от лечения подагры для многих пациентов [4, 12, 33].
Поскольку у значительной доли больных хроническое воспаление, обусловленное депозитами моноурата натрия, предшествует клинической манифестации заболевания, то зачастую лечащему врачу довольно сложно принять решение, когда начинать лекарственную уратснижающую терапию: сразу после первого приступа или после повторения двух и более атак острого артрита.
Разумеется, уратснижающая терапия показана всем пациентам со стойкой гиперурикемией и острыми атаками артрита (в том числе в анамнезе), хроническим артритом, наличием тофусов (независимо от их локализации и методов выявления: при осмотре, методами лучевой визуализации). Пациентам с дебютом подагры в возрасте моложе 40 лет, при наличии коморбидной патологии (заболевание почек, артериальная гипертензия, ишемическая болезнь сердца, хроническая сердечная недостаточность) уратснижающая терапия должна быть инициирована сразу после первого приступа подагры, вне зависимости от уровня гиперурикемии. Проведение уратснижающей терапии в других случаях (при неосложненной подагре) показано при неэффективности нефармакологических методов лечения.
Уратснижающими препаратами являются аллопуринол и фебуксостат. Мишенью действия этих препаратов является ключевой фермент пуринового обмена — ксантиноксидаза, которая обеспечивает окисление гипоксантина до ксантина и далее ксантина — до МК. В этой сложной реакции превращения МК из гипоксантина высвобождаются супероксидные анионы и молекулярный кислород, способные вызывать оксидативный стресс и повреждение тканей [39].
Аллопуринол является ингибитором ксантиноксидазы, впервые введенным в клинику в шестидесятые годы. Сегодня он признан препаратом базисной терапии подагры. По своей химической природе аллопуринол — аналог гипоксантина. Механизм действия аллопуринола весьма интересен: в начале реакции он действует в качестве субстрата фермента ксантиноксидазы, а затем — в качестве ее ингибитора. Так, вначале ксантиноксидаза гидроксилирует аллопуринол, превращая его в аналог гипоксантина — аллоксантин (оксипуринол). А далее аллоксантин, прочно связываясь с активным центром ксантиноксидазы, содержащим ион молибдена, меняет ее свойства, в результате чего последующего этапа превращения МК не происходит. Кроме ингибирования трансформации гипоксантина в МК, аллопуринол устраняет выработку продуктов оксидативного стресса [39].
В клинической практике широко используемая доза аллопуринола составляет 300 мг/сут (90–95% пациентов с подагрой) [40], но для контроля гиперурикемии этого довольно часто бывает недостаточно. Так, по данным исследования [41] только 53% пациентов с подагрой достигли сывороточного уровня МК менее 6 мг/дл (360 мкмоль/л) на аллопуриноле 300 мг в день, но когда доза препарата была увеличена до 450–600 мг в сутки, то к целевому уровню МК приблизились все 100% испытуемых. В другом исследовании только 26,0% пациентов, получавших 300 мг аллопуринола в сутки, достигли целевого уровня МК ниже 6 мг/дл (360 мкмоль/л), тогда как 78% пациентов смогли достичь целевых значений только при повышении суточной дозы аллопуринола свыше 600 мг в сутки [42]. Таким образом, стандартная доза аллопуринола 300 мг в сутки зачастую недостаточна для достижения цели и должна титроваться в большую сторону, с учетом целевого уровня МК. Еще один важный момент, который должен учитываться при выборе оптимальной дозы препарата, — это состояние функции почек, поскольку ключевой метаболит аллопуринола — оксипуринол выводится главным образом почками [43]. В свое время, чтобы иметь возможность контролировать токсичность препарата, были предложены правила титрования дозы аллопуринола в зависимости от клиренса креатинина [44], но эта мера довольно часто не позволяла достичь целевых уровней МК [45].
В настоящее время рекомендуется назначать аллопуринол в исходно низкой дозе (50–100 мг в сутки) с последующим увеличением дозы (при необходимости) по 100 мг каждые 2–4 недели, что особенно важно у пациентов с почечной недостаточностью [5, 13]. Такое медленное титрование дозы снижает вероятность острого приступа после старта терапии [3]. Хотя в двух недавних исследованиях было показано, что опасения по поводу вероятности развития острой атаки артрита нередко бывают преувеличенными [46, 47]. По крайней мере, приостанавливать ранее начатую уратоснижающую терапию в случае вспышки острого артрита у большинства больных нет оснований.
Во всяком случае, аллопуринол следует назначать не ранее чем через 2 недели после купирования приступа острого артрита, постепенно титруя дозу до эффективной и отслеживая возможные нежелательные явления, частота которых существенно возрастает параллельно увеличению дозы.
К сожалению, аллопуринол относится к препаратам, на высокие дозы которого возможно развитие серьезных нежелательных явлений в виде прогрессирующей почечной недостаточности, гепатотоксичности, тяжелых аллергических реакций, в т. ч. синдрома Стивена–Джонсона, эпидермального некролиза, DRESS-синдрома [48, 49]. К возможным причинам развития таких тяжелых реакций на аллопуринол относят носительство гена HLA-В 5801, которое с высокой частотой встречается в разных этнических популяциях и максимально распространено в Азии (17%). В России носительство аллеля HLA-В 5801 сопоставимо с таковым в азиатских странах и выше, чем в странах Европы [50].
Впервые за 50 лет в качестве альтернативы аллопуринолу был разработан и внедрен в клиническую практику фебуксостат — сильный селективный непуриновый ингибитор ксантиноксидазы. Мощный уратснижающий эффект препарата связан с селективным подавлением двух изоформ ксантиноксидазы. Известно, что фебуксостат образует прочные высокоаффинные связи с активным молибденовым центром как окисленной, так и восстановленной изоформ ксантиноксидазы. Аллопуринол образует комплексы только с восстановленной изоформой фермента. Поскольку обе изоформы ксантиноксидазы, легко обмениваясь ионами молибдена, могут быстро переходить из одной в другую, это позволяет энзиму ускользать от эффекта аллопуринола. На фоне приема аллопуринола восстановленная форма фермента, под действием спонтанной реоксидации молибденового центра, способна очень быстро реактивироваться. Для фебуксостата характерно длительное и плотное заполнение узких каналов, ведущих к молибденовому центру, обеспечивающее прочность связей и устойчивость энзима к действию каскада окислительных кофакторов. Наконец, фебуксостат, в отличие от аллопуринола, не вступает в иные пуриновые и пиримидиновые реакции, что обеспечивает его селективность и адресное воздействие на синтез МК [51].
Важным преимуществом фебуксостата является смешанный (печеночный и почечный) метаболизм. В отличие от аллопуринола, препарат не требует корректировки дозы у пациентов с легкой или умеренной почечной недостаточностью и общей коморбидностью, которая с высокой частотой отмечается у пациентов с подагрой [52]. Недавние исследования показали, что эффективность и безопасность фебуксостата сохраняется у пациентов с клиренсом креатинина ниже 30 мл/мин [53]. Между тем Европейское агентство лекарственных средств (European Medicines Agency, ЕМА) рекомендует взвешенный подход к титрованию дозы фебуксостата пациентам со сниженной (< 30 мл/мин) скоростью клубочковой фильтрации [54].
В ходе масштабных клинических исследований (APEX, FACT, CONFIRMS, CACTUS, FORTE) фебуксостат доказал более мощный, чем у аллопуринола или плацебо, эффект [55].
В рандомизированном двойном слепом многоцентровом исследовании (с общей численностью больных 760 человек, у 35% из которых имелось легкое или умеренное снижение почечной функции) 52?недельная терапия фебуксостатом в дозах, одобренных для использования в ЕС (80 и 120 мг/день), была значительно более эффективной в отношении снижения сывороточного уровня МК у пациентов с гиперурикемией и подагрой, чем аллопуринол, в дозах, обычно назначаемых в клинической практике (100–300 мг/день). Так, целевого уровня МК (< 360 мкмоль/л) достигли 53% пациентов, принимавших 80 мг фебуксостата, 62% больных, принимавших 120 мг фебуксостата, и 21% принимавших 300 мг аллопуринола (р < 0,001) [56].
Фебуксостат продемонстрировал большую эффективность в снижении урикемии, чем аллопуринол, у пациентов с почечной недостаточностью. Так, в ходе 28?недельного многоцентрового двойного слепого исследования III фазы CONFIRMS с участием 2269 пациентов с подагрой, которые были рандомизированы на 4 группы терапии в зависимости от функции почек: фебуксостат в дозах 40 мг/сут и 80 мг/сут и аллопуринол в дозах 200 мг/сут и 300 мг/сут, было обнаружено, что применение аллопуринола в 300 мг/сут и фебуксостата в дозе 40 мг/сут способствует достижению целевого уровня МК (< 360 мкмоль/л) более чем в 45% случаев. У пациентов, получавших фебуксостат в дозе 80 мг/сут, результат статистически значимо превосходил результаты в двух других группах — 67% (р < 0,001). Подобные результаты были получены при сравнении групп с различной степенью почечной недостаточности: 72% больных, получавших 80 мг/сут фебуксостата, достигли целевых уровней МК, тогда как в группах, принимавших 40 мг/сут фебуксостата или аллопуринол, таких больных было 50% и 42% соответственно [57].
В 28?недельном двойном слепом клиническом исследовании, которое включало 1067 пациентов с подагрой и гиперурикемией более 480 мкмоль/л, пациенты были рандомизированы на группы фебуксостат (80, 120 или 240 мг/сут), аллопуринол (100 или 300 мг/сут) или плацебо. В группах больных, получавших фебуксостат, подбор дозы осуществлялся без учета функции почек. В группах, получавших аллопуринол, учитывался уровень креатинина. Так, больные с уровнем креатинина менее 1,5 мг/дл принимали 300 мг аллопуринола, а больные с уровнем креатинина от 1,6 до 2,0 мг/дл соответственно 100 мг аллопуринола в сутки. Фебуксостат вне зависимости от дозы показал большую эффективность в поддержании уровней сывороточного уровня МК ниже 360 мкмоль/л по сравнению с аллопуринолом или плацебо. Так, доля пациентов, достигших целевых значений МК на дозе фебуксостата 80 мг, 120 мг и 240 мг, составила соответственно 76%, 87% и 94%, тогда как количество больных, достигших целевого уровня МК на аллопуриноле в суточной дозе 300/100 мг и плацебо, составило соответственно 41% и 1% (р < 0,05 для всех групп фебуксостата по сравнению с аллопуринолом и плацебо) [58].
В исследованиях с длительным периодом наблюдения, 3–5?летнее лечение фебуксостатом поддерживало целевой уровень МК (< 360 мкмоль/л) у большинства пациентов. Одно из самых продолжительных исследований FOCUS продемонстрировало не только высокую эффективность фебуксостата в отношении достижения целевых уровней урикемии, но и обнаружило весьма устойчивую связь между снижением уровня МК и ликвидацией приступов артрита. Причем по мере продолжения терапии фебуксостатом преимущества терапии становились более очевидными [59].
В более позднем ретроспективном исследовании, в котором сравнивалась эффективность фебуксостата и аллопуринола, также была отмечена большая эффективность фебуксостата (40 мг/сут или 80 мг/сут) по сравнению с аллопуринолом (300 мг/сут) в снижении сывороточного уровня МК. Причем исследование показало, что на терапии фебуксостатом клинический эффект достигается быстрее [60].
Переносимость фебуксостата во всех клинических исследованиях была хорошей, а частота нежелательных явлений низкой [58, 61, 62]. Сообщаемые побочные эффекты включали нарушения функции печени, диарею и доброкачественные кожные высыпания, о которых сообщалось примерно у 3% пациентов во время испытаний фазы III. Сообщения о развитии серьезных кожных реакций были крайне редкими [63]. Причем кожные реакции на фебуксостат проявлялись чаще у пациентов с ранее предшествующей кожной непереносимостью аллопуринола. При этом было показано, что повышенный риск кожных реакций у таких пациентов возникает не из-за перекрестной реактивности, а из-за повышенной вероятности того, что любой пациент с аллергической реакцией на известный препарат развивает реакцию кожи на другое лекарственное средство [64]. Было отмечено, что фебуксостат — препарат выбора для пациентов с предшествующей сыпью или реакцией гиперчувствительности на аллопуринол [65], хотя не исключено, что в редких случаях реакция гиперчувствительности на фебуксостат также возможна [66].
Причины отмены также были реже у фебуксостата, за исключением приступов подагры, которые чаще встречались на терапию фебуксостатом (вероятно, из-за более глубокого и более быстрого снижения сывороточного уровня МК при назначении относительно более высоких доз (120–240 мг/сут) препарата).
Препарат применяется в Европе и США с 2008 г. В настоящее время он разрешен к применению в РФ. Рекомендованная доза фебуксостата — 80 мг 1 раз в день. При необходимости доза может быть увеличена до 120 мг в сутки. Общая тактика применения фебуксостата не отличается от таковой при назначении аллопуринола. Лечение фебуксостатом не рекомендуется начинать во время острого артрита.
Профилактика приступов острого артрита при инициации уратснижающей терапии
Увеличение частоты приступов артрита в течение первых недель и даже месяцев после старта уратснижающей терапии происходит независимо от препарата (аллопуринол, фебуксостат) в результате быстрых изменений сывороточного уровня мочевой кислоты [4, 12, 13]. Для профилактики приступов артрита рекомендовано в течение первых 6 месяцев от инициации терапии использовать колхицин в дозе 0,5–1,0 мг/сут или НПВС в низких дозах (с обязательной гастропротекцией при наличии показаний).
В случаях почечной недостаточности или при лечении статинами врач и пациент должны иметь настороженность в отношении потенциальной нейро- и миотоксичности на применение колхицина в качестве средства профилактики острых приступов артрита. Следует также избегать сочетанного назначения ингибиторов Р-гликопротеина (циклоспорин A) или ингибиторов CYP3А4 (кларитромицин, эритромицин, кетоконазол, дилтиазем, верапамил и др.) [67].
Таким образом, современные подходы к лечению подагры позволяют управлять заболеванием при достижении целевых уровней МК в сыворотке крови, опираясь на технологии профилактического консультирования и обучения пациентов, а также применения ингибиторов ксантиноксидазы. Фебуксостат является хорошо исследованным уратснижающим средством, которое обеспечивает эффективную альтернативу аллопуринолу в лечении подагры у широкого круга пациентов.
Литература
- Roddy E., Choi H. Epidemiology of gout // Rheum Dis Clin North Am. 2014; 40: 155–175.
- Mandal A. K., Mount D. B. The molecular physiology of uric acid homeostasis // Annu Rev Physiol. 2015; 77: 323–334.
- Zhang W., Doherty M., Bardin T., Pascual E., Barskova V., Conaghan P. et al. EULAR evidence based recommendations for gout. Part II: management. Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT) // Ann Rheum Dis. 2006; 65: 1312–1324.
- Khanna D., Fitzgerald J., Khanna P., Bae S., Singh M., Neogi T. et al. American College of Rheumatology guidelines for management of gout. Part 1: systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia // Arthritis Care Res. 2012; 64: 1431–1446.
- Sivera F., Andrés M., Carmona L., Kydd A., Moi J., Seth R. et al. Multinational evidence-based recommendations for the diagnosis and management of gout: integrating systematic literature review and expert opinion of a broad panel of rheumatologists in the 3 e initiative // Ann Rheum Dis. 2014; 73: 328–333.
- Pascual E., Andrés M., Vela P. Gout treatment: should we aim for rapid crystal dissolution? // Ann Rheum Dis. 2013; 72: 635–637.
- Roddy E., Zhang W., Doherty M. Concordance of the management of chronic gout in a UK primary-care population with the EULAR gout recommendations // Ann Rheum Dis. 2007; 66: 1311–1315.
- Pascual E., Sivera F. Why is gout so poorly managed? // Ann Rheum Dis. 2007; 66: 1269–1270.
- Riedel A., Nelson M., Joseph-Ridge N., Wallace K., MacDonald P., Becker M. Compliance with allopurinol therapy among managed care enrollees with gout: a retrospective analysis of administrative claims // J Rheumatol. 2004; 31: 1575–1581.
- Harrold L., Andrade S., Briesacher B., Raebel M., Fouayzi H., Yood R. et al. Adherence with urate-lowering therapies for the treatment of gout // Arthritis Res Ther. 2009; 11: R46.
- Rees F., Jenkins W., Doherty M. Patients with gout adhere to curative treatment if informed appropriately: proof-of-concept observational study // Ann Rheum Dis. 2013; 72: 826–830.
- Richette P., Doherty M., Pascual E., Barskova V., Becce F., Castaneda-Sanabria J. EULAR evidence-based recommendations for the management of gout // Ann Rheum Dis. 2017; 76 (1): 29–42.
- Елисеев М. С. Подагра. В кн.: Российские клинические рекомендации. Ревматология / Под ред. Е. Л. Насонова. М.: ГЭОТАР-Медиа, 2017. С. 372–385.
- Choi H. K., Atkinson K., Karlson E. W., Curhan G. Obesity, weight change, hypertension, diuretic use, and risk of gout in men: the health professionals follow-up study // Arch Intern Med. 2005; 165 (7): 742–748.
- Dessein P. H., Shipton E. A., Stanwix A. E., Joffe B. I., Ramokgadi J. Beneficial effects of weight loss associated with moderate calorie/carbohydrate restriction, and increased proportional intake of protein and unsaturated fat on serum urate and lipoprotein levels in gout: a pilot study // Ann Rheum Dis. 2000; 59 (7): 539–543.
- Timmers S., Konings E., Houtkooper R. H. et al. Calorie restriction-like effects of 30 days of resveratrol supplementation on energy metabolism and metabolic profile in obese humans // Cell. Metab. 2011. Vol. 14 (5). Р. 612–622.
- Сhoi H. K., Atkinson K., Karlson E. W., Willett W., Curhan G. Purine-rich foods, dairy and protein intake, and the risk of gout in men // N Engl J Med. 2004; 350 (11): 1093–1103.
- Dalbeth N., Wong S., Gamble G. D., Horne A., Mason B., Pool B. Acute effect of milk on serum urate concentrations: a randomised controlled crossover trial // Ann Rheum Dis. 2010; 69 (9): 1677–1682.
- Dalbeth N., Ames R., Gamble G. D. et al. Effects of skim milk powder enriched with glycomacropeptide and G600 milk fat extract on frequency of gout flares: a proof-of-concept randomized controlled trial // Ann Rheum Dis. 2012; 71 (6): 929–934.
- Kanbara A., Seyama I. Effect of urine pH on uric acid excretion by manipulating food materials // Nucleosides, Nucleotides Nucleic Acids. 2011; 30 (12): 1066–1071.
- Towiwat P., Li Z. G. The association of vitamin C, alcohol, coffee, tea, milk and yogurt with uric acid and gout // Int J Rheum Dis. 2015; 18 (5): 495–501.
- Choi H. K. Atkinson K, Karlson E. W., Willett W., Curhan G. Alcohol intake and risk of incident gout in men: a prospective study // Lancet. 2004; 363 (9417): 1277–1281.
- Choi H. K., Curhan G. Soft drinks, fructose consumption, and the risk of gout in men: prospective cohort study // BMJ. 2008; 336 (7639): 309–312.
- Choi H. K., Willett W., Curhan G. Fructose-rich beverages and risk of gout in women // JAMA. 2010; 304 (20): 2270–2278.
- Kedar E., Simkin P. A. A perspective on diet and gout // Adv Chronic Kidney Dis. 2012; 19 (6): 392–397.
- Khanna P., Gladue H., Singh M., FitzGerald J., Bae S., Prakash S. et al. Treatment of acute gout: a systematic review. Semin Arthritis Rheum. 2014; 44: 31–38.
- Zhang S., Zhang Y., Liu P., Zhang W., Ma J., Wang J. Efficacy and safety of etoricoxib compared with NSAIDs in acute gout: a systematic review and a meta-analysis // Clin Rheumatol June. 2015; Epub ahead of print.
- Schumacher H., Berger M., Li-Yu J., Pérez-Ruiz F., Burgos-Vargas R., Li C. Efficacy and tolerability of celecoxib in the treatment of acute gouty arthritis: a randomized controlled trial // J Rheumatol. 2012; 39: 1859–1866.
- Van Durme C., Wechalekar M., Buchbinder R., Schlesinger N., van der Heijde D., Landewé R. Non-steroidal anti-inflammatory drugs for acute gout // Cochrane Database Syst Rev. 2014; 9: CD010–120.
- Terkeltaub R. A., Furst D. E., Bennett K., Kook K. A., Crockett R. S., Davis M. W. High versus low dosing of oral colchicine for early acute gout flare: Twenty-four-hour outcome of the first multicenter, randomized, double-blind, placebo-controlled, parallel-group, dose-comparison colchicine study // Arthritis Rheum. 2010; 62 (4): 1060–1068.
- Man C. Y., Cheung I. T., Cameron P. A., Rainer T. H. Comparison of oral prednisolone/paracetamol and oral indomethacin/paracetamol combination therapy in the treatment of acute goutlike arthritis: a double-blind, randomized, controlled trial // Ann Emerg Med. 2007; 49 (5): 670–677.
- Rainer T. H., Cheng C. H., Janssens H. J., Man C. Y., Tam L. S., Choi Y. F. Oral prednisolone in the treatment of acute gout: a pragmatic, multicenter, double-blind, randomized trial // Ann Intern Med. 2016; 164 (7): 464–471.
- Khanna D., Khanna P. P., Fitzgerald J. D., Singh M. K., Bae S., Neogi T. American College of Rheumatology guidelines for management of gout. Part 2: therapy and antiinflammatory prophylaxis of acute gouty arthritis // Arthritis Care Res (Hoboken). 2012; 64 (10): 1447–1461.
- Bernal J. A., Quilis N., Andrés M., Sivera F., Pascual E. Gout: optimizing treatment to achieve a disease cure // Ther Adv Chronic Dis. 2016; 7 (2): 135–144.
- Janssens H. J., Janssen M., van de Lisdonk E. H., van Riel P. L., van Weel C. Use of oral prednisolone or naproxen for the treatment of gout arthritis: a double-blind, randomised equivalence trial // Lancet. 2008; 371 (9627): 1854–1860.
- Richette P., Bardin T. Should prednisolone be first-line therapy for acute gout? // Lancet. 2008; 372 (9646): 1301.
- Федорова А. А., Барскова В. Г., Якунина И. А., Насонова В. А. Кратковременное применение глюкокортикоидов у больных затяжным и хроническим подагрическим артритом. Ч. III. Частота развития нежелательных реакций // Научно-практическая ревматология. 2009; № 2. С. 38–42.
- Qaseem A., Harris R. P., Forciea M. A. Management of acute and recurrent gout: a clinical practice guideline from the american college of physicians // Ann Intern Med. 2017; 166 (1): 58–68.
- McLean L., Becker M. A. The pathogenesis of gout. Rheumatology Fourth Edition. Edited by Hochberg M. C., Silman A. J., Smolen J. S. Phyladelphia, 2008. P. 1813–27.
- Annemans L., Spaepen E., Gaskin M., Bonnemaire M., Malier V., Gilbert T. Gout in the UK and Germany: prevalence, comorbidities and management in general practice 2000–2005 // Ann Rheum Dis. 2008; 67 (7): 1021–1030.
- Pérez-Ruiz F., Alonso-Ruiz A., Calabozo M., Herrero-Beites A., García-Erauskin G., Ruiz-Lucea E. Efficacy of allopurinol and benzbromarone for the control of hyperuricaemia. A pathogenic approach to the treatment of primary chronic gout // Ann Rheum Dis. 1998; 57: 545–549.
- Reinders M., van Roon E., Jansen T., Delsing J., Griep E., Hoekstra M. et al. Efficacy and tolerability of urate-lowering drugs in gout: a randomised controlled trial of benzbromarone versus probenecid after failure of allopurinol // Ann Rheum Dis. 2009; 68: 51–56.
- Jennings C., Mackenzie I., Flynn R., Ford I., Nuki G., De Caterina R. et al. Up-titration of allopurinol in patients with gout // Semin Arthritis Rheum. 2014; 44: 25–30.
- Hande K., Noone R., Stone W. Severe allopurinol toxicity. Description and guidelines for prevention in patients with renal insufficiency // Am J Med. 1984; 76: 47–56.
- Dalbeth N., Kumar S., Stamp L., Gow P. Dose adjustment of allopurinol according to creatinine clearance does not provide adequate control of hyperuricemia in patients with gout // J Rheumatol. 2006; 33: 1646–1650.
- Taylor T., Mecchella J., Larson R., Kerin K., Mackenzie T. Initiation of allopurinol at first medical contact for acute attacks of gout: a randomized clinical trial // Am J Med. 2012; 125: 1126–1134.
- Hill E., Sky K., Sit M., Collamer A., Higgs J. Does starting allopurinol prolong acute treated gout? A randomized clinical trial // J Clin Rheumatol. 2015; 21: 120–125.
- Lin M. S., Day Y. S., Pwu R. F. et al. Risk estimates for drugs suspected of being associated with Stevens-Johnson syndrpme and toxic epidermal necrolysis: a case-control study // Inern Med J. 2005; 35 (3): 188–190.
- Yaylact S., Demir M. V., Temis T. et al. Allopourinol-induced DRESS syndrome // Indian J Pharmacol. 2012; 44 (3): 412–414.
- Елисеев М. С. Современные возможности терапии подагры: «вверх по спирали» или «бег на месте» // Ревматология, травматология, ортопедия. 2017; 2: 20–22.
- Zhao L., Takano Y., Horiuchi Y. Effect of febuxostat, a novel non-purine, selective inhibitor of xantin oxidase (NP-SIXO), on enzymes in purine and perimidine methabolism pathway // Arthr Rheum. 2003; 48 (suppl. 9): 531.
- Richette P., Clerson P., Périssin L., Flipo R., Bardin T. Revisiting comorbidities in gout: a cluster analysis // Ann Rheum Dis. 2015; 74: 142–147.
- Juge P. A., Truchetet M. E., Pillebout E., Ottaviani S., Vigneau C., Loustau C. Efficacy and safety of febuxostat in 73 gouty patients with stage 4/5 chronic kidney disease: A retrospective study of 10 centers // Joint Bone Spine. 2016; 364 p.
- EMA® product information. 2015; Available at: http://www.ema.europa.eu.
- Frampton J. E. Febuxostat: a review of its use in the treatment of hyperuricaemia in patients with gout // Drugs. 2015, Mar; 75 (4): 427–438. DOI: 10. 1007/s40265–015–0360–7.
- Becker M. A., Schumacher H. R., Jr, Wortmann R. L., MacDonald P. A., Eustace D., Palo W. A. Febuxostat compared with allopurinol in patients with hyperuricemia and gout // N Engl J Med. 2005; 353 (23): 2450–2461.
- Becker M. A., Schumacher H. R., Espinosa L. et al. The urate-lowering efficacy and safety of febuxostat in treatment of hyperuricemia of gout: the CONFIRMS treal // Arthritis Res. Ther. 2010; 12 (2): ID R63.
- Schumacher H., Becker M., Wortmann R., Macdonald P., Hunt B., Streit J. et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phase III, randomized, double-blind, parallel-group trial // Arthritis Rheum. 2008; 59: 1540–1548.
- Schumacher H., Becker M., Lloyd E. et al. Febuxostat is the treatment of gout: 5-yr findingsof the FOCUS efficacy and safety study // Rheumatology (Oxford). 2009; 48 (2): 188–194.
- Singh J., Akhras K., Shiozawa A. Comparative effectiveness of urate lowering with febuxostat versus allopurinol in gout: analyses from large U. S. managed care cohort // Arthritis Res Ther. 2015; 17: 120–139.
- Huang X., Du H., Gu J., Zhao D., Jiang L., Li X. et al. An allopurinol-controlled, multicenter, randomized, double-blind, parallel between-group, comparative study of febuxostat in Chinese patients with gout and hyperuricemia // Int J Rheum Dis. 2015; 17: 679–686.
- Tausche A., Reuss-Borst M., Koch U. Urate lowering therapy with febuxostat in daily practice-a multicentre, open-label, prospective observational study // Int J Rheumatol. 2014; 27: 1–6.
- Chou H. Y., Chen C. B., Cheng C. Y., Chen Y. A., Ng C. Y., Kuo K. L. Febuxostat-associated drug reaction with eosinophilia and systemic symptoms (DRESS) // J Clin Pharm Ther. 2015; 40 (6): 689–692.
- Bardin T., Chales G., Pascart T., Flipo R. M., Korng Ea H., Roujeau J. C. Risk of cutaneous adverse events with febuxostat treatment in patients with skin reaction to allopurinol. A retrospective, hospital-based study of 101 patients with consecutive allopurinol and febuxostat treatment // Joint Bone Spine. 2016; 83 (3): 314–317.
- Chohan S. Safety and efficacy of febuxostat treatment in subjects with gout and severe allopurinol adverse reactions // J Rheumatol. 2011; 38: 1957–1959.
- Abeles A. Febuxostat hypersensitivity // J Rheumatol. 2012; 39: 659–671.
- Terkeltaub R. A. Novel evidence-based colchicine dose-reduction algorithm to predict and prevent colchicine toxicity in the presence of cytochrome P450 3 A4/Pglycoprotein inhibitors // Arthritis Rheum. 2011; 63: 2226–2237.
М. И. Шупина1, кандидат медицинских наук
Г. И. Нечаева, доктор медицинских наук, профессор
Е. Н. Логинова, кандидат медицинских наук
ФГБОУ ВО ОмГМУ МЗ РФ, Омск
1 Контактная информация: mshupina@mail.ru
Список продуктов, которые нельзя при подагре кушать и пить
Дата публикации: 29.09.2021
Боль в суставахБоль в суставах и мышцахВоспаление суставовДля суставов и связокМинеральная водаПодагра
Содержание статьи
- Что такое подагра
- Сколько длится приступ подагры
- При подагре какие продукты категорически нельзя кушать?
- Что нельзя есть при подагре?
- Другие меры профилактики обострений
- Задайте вопрос эксперту по теме статьи
- Источники
Подагра – болезнь, известная еще в древности. Она возникает из-за нарушения обменных процессов: ураты (соли мочевой кислоты) накапливаются в некоторых тканях организма. Большую роль в развитии подагры играет наследственность. Но провоцируют и усугубляют болезнь неправильное питание, переохлаждение, травмы суставов, стрессы. Они становятся причиной острых подагрических атак. Их можно избежать, придерживаясь диеты и следя за своим здоровьем. Что разрешено при болезни, а чего при подагре категорически нельзя?
Что такое подагра
Подагра относится к заболеваниям суставов, так как ураты откладываются прежде всего там. Также страдают почки, связки, кости, печень.
Причина патологии – устойчивое повышение мочевой кислоты в крови. Она образуется при расщеплении пуринов (азотсодержащих соединений, поступающих с пищей и/или синтезируемых организмом). В норме, с током крови она поступает в почки, где после фильтрации выводится с мочой. Но при нарушениях метаболизма выведение вещества нарушается. В результате чего концентрация мочевой кислоты растет. Ее соли откладываются в виде кристаллов и провоцируют подагру.
В большинстве случаев болезнь имеет несколько стадий:
- острый артрит;
- межприступная стадия;
- хроническая тофусная стадия.
Острая подагрическая атака – первый признак развития патологии.
Нет времени читать длинные статьи? Подписывайтесь на нас в соцсетях: слушайте фоном видео и читайте короткие заметки о красоте и здоровье.
Мегаптека в соцсетях: ВКонтакте, Telegram, OK, Viber
Сколько длится приступ подагры
Характерное отличие болезни – несимметричное поражение суставов. Чаще в первую очередь страдает большой палец одной из нижних конечностей. Также могут затрагиваться фаланги пальцев и лучезапястные суставы. В дальнейшем нередко заболевание распространяется и на другие сочленения.
Приступ возникает внезапно, чаще всего ночью. Он проявляется:
- острой болью в суставе;
- синюшностью кожи и припухлостью над пораженным участком;
- ознобом, повышением температуры до 38о и выше;
- полной потерей суставом подвижности.
Болезненные ощущения усиливаются при малейшем прикосновении к суставу и не всегда снимаются анальгетиками. Днем их интенсивность несколько уменьшается, а к ночи возрастает снова. Сильная боль сохраняется до 3-х дней, затем постепенно стихает. В среднем приступ длится от 3-х дней до недели.
Частота приступов может быть разной – от 1-го раза в полгода до нескольких лет. Их число увеличивается по мере прогрессирования болезни. Со временем приступы становятся менее острыми, но более длительными, а процесс распространяется на все большее число суставов. При длительном течении у 50-60% пациентов образуются тофусы – белые или желтые узелки, внутри которых скопились ураты. Они возникают на пальцах верхних и нижних конечностей, ушных раковинах, стопах, коленных и локтевых суставах. Тофусы безболезненны, но иногда самопроизвольно вскрываются, причиняя довольно сильную боль.
Подагру нельзя излечить полностью. Но соблюдение диеты и отказ от вредных привычек значительно снижают частоту приступов.
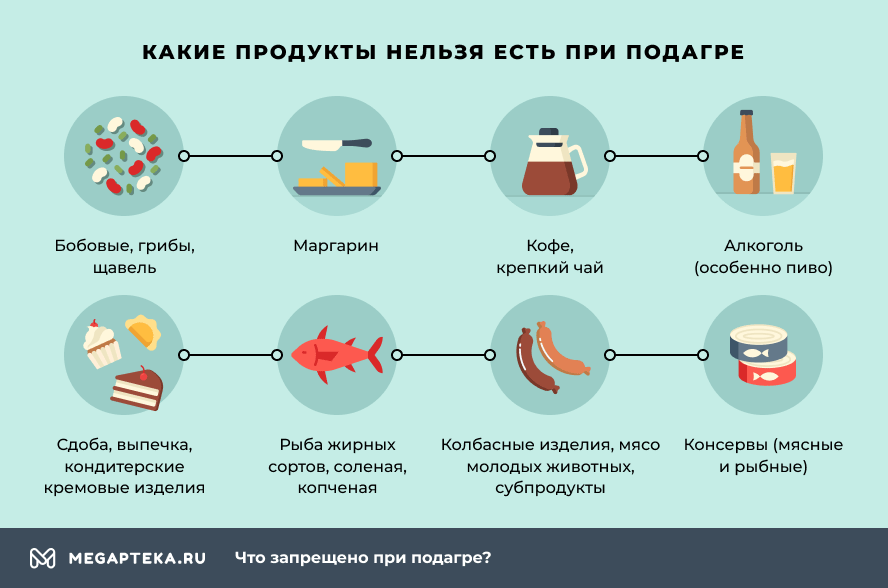
При подагре какие продукты категорически нельзя кушать?
Диета соблюдается пациентами всю жизнь, а не только в острый период. Рацион должен содержать овощи, молочные продукты. Мясо рекомендуется употреблять в отварном виде в минимальных количествах. Важно пить достаточное количество воды, особенно щелочной минеральной. Она улучшает выведение мочевой кислоты.
Диета будет способствовать снижению концентрации мочевой кислоты. Кроме того, она поможет нормализовать вес и уменьшить нагрузку на суставы. Из меню нужно исключить продукты, содержащие пурины.
К ним относятся:
- сдоба, свежая выпечка, кондитерские кремовые изделия;
- консервы (мясные и рыбные);
- колбасные изделия, мясо молодых животных, субпродукты;
- рыба жирных сортов, соленая, копченая;
- бобовые;
- грибы;
- щавель, шпинат, ревень, цветная капуста;
- кофе, крепкий чай, какао.
Существенно замедляет выведение мочевой кислоты алкоголь. Поэтому его употребление крайне нежелательно.
Одной из причин подагры врачи называют такие заболевания как диабет, ишемическая болезнь сердца (ИБС), гипертония. Их наличие в анамнезе также требует определенной коррекции рациона.
Подагра на фоне диабета нуждается в контроле общей калорийности потребляемых продуктов, количества жира и пищи с высоким уровнем холестерина. При ее сочетании с ИБС или гипертонией полезна низкокалорийная диета с ограничением соли и насыщенных жиров.
Что нельзя есть при подагре?
Другие меры профилактики обострений
Подагра нередко возникает на участках нанесения суставу травмы. Поэтому к таким местам нужно относиться с особой осторожностью. Следует уделить внимание выбору обуви. Спровоцировать приступ может обувь, сдавливающая большой палец ноги, который чаще всего «атакует» подагра.
Для восстановления подвижности суставов будет полезна специальная гимнастика и прогулки на свежем воздухе. Курильщикам рекомендуется отказаться от вредной привычки.
Диагноз «подагра» означает, что пациенту придется существенно изменить свой образ жизни и рацион питания. Это единственная возможность взять болезнь под контроль, уменьшить число рецидивов и застраховать себя от тяжелых осложнений.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же Вы можете поделиться своим опытом с другими читателями Мегасоветов.
Источники
- «Gout», Национальная служба здравоохранения Великобритании
- «Gout», Центры по контролю и профилактике заболеваний США
- «Prevention and management of gout», Отделение медицины Медицинской школы Университета Мэриленда, Балтимор, США
Выпускающий редактор
Эксперт-провизор
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда
Гид по аналогам за подписку
подпишитесь на соцсети и напишите в сообщения «аналоги»
Программа лечения Врачи Цены Отзывы
Содержание
- Общие сведения о заболевании
- Причина и механизм развития
- Классификация
- Симптомы
- Первичные признаки
- Явные симптомы
- Когда нужно срочно обращаться к врачу
- Чем опасно заболевание
- Стадии подагрического артрита
- Если подагрический артрит не лечить
- Что делать при обострениях
- Локализации
- Подагрический артрит нижних конечностей
- Подагрический артрит верхних конечностей
- Тофусное поражение позвоночника
- Диагностика
- Лечение подагрического артрита
- Медикаментозное лечение
- Лечение острого приступа артрита
- Мочевая кислота в крови
- Немедикаментозное лечение
- Диета при подагрическом артрите
- Контроль коморбидных заболеваний
- Физиотерапевтические процедуры
- Народные средства
- Хирургическое лечение
- Медикаментозное лечение
- Подход к лечению в клинике «Парамита»
- Общие клинические рекомендации
- Профилактика подагры
- Частые вопросы
В последние годы специалисты отмечают рост заболеваемости подагрой. Лечение далеко не всегда способно предупредить очередной подагрический приступ. Часто это связано с непониманием пациентами необходимости лечения подагрического артрита в состоянии ремиссии, что приводит к хронизации патологического процесса и постепенной утрете функции суставов.
Общие сведения о заболевании
Подагрический артрит – это системное заболевание обмена веществ, связанное с отложением солей мочевой кислоты в суставных и околосуставных тканях. Болеют чаще мужчины после 40 лет. У женщин подагра встречается реже и начинается позже – в постменопаузальном периоде после 50-60 лет. Всего подагрой страдают около 2,5% данных контингентов населения. С возрастом этот процент значительно увеличивается и к 80 годам составляет 9% у мужчин м 6% у женщин. Код по МКБ-10 — М10.
Подагрический артрит коморбиден (часто сочетается) с заболеваниями почек и хронической почечной недостаточностью, сердечно-сосудистыми заболеваниями (стенокардией, высоким АД), сахарным диабетом 2-го типа, ожирением.
Несмотря на то, что лечение этого заболевания разработано, держать под контролем атаки подагры удается далеко не всегда. В основном это происходит из-за непонимания пациентами механизма развития (патогенеза) подагры и отказа или нерегулярного проведения поддерживающей терапии.
Подробнее об артрите, его симптомах и лечении в этой статье.
Причина и механизм развития (этиология и патогенез) заболевания
Причиной подагрического артрита является нарушение пуринового обмена. Пурины – это химические соединения, составляющие основу нуклеиновых кислот, необходимых для образования молекул ДНК и РНК. При распаде клеток пурины разлагаются до мочевой кислоты (МК). Последняя попадает в межклеточное пространство и в плазму крови, соединяется там с натрием, образуя соль – моноурат натрия (МУН).
Повышенное содержание уратов в крови (гиперурикемия — ГУ) может быть следствием генетической предрасположенности (почки не выводят МУН полностью), повышенного артериального давления (АД), употребления большого количества животной пищи, алкоголя.
При избытке уратов, когда они уже не могут растворяться в окружающей жидкости (концентрация МУН более 0,4 ммоль/л), соли кристаллизуются, откладываются в суставных и околосуставных тканях и окружаются белковыми кольцами. Такое образование называется тофусом. Высвобождение МУН из тофуса вызывает иммунологическую реакцию: в синовиальной оболочке и суставной жидкости появляется большое количество нейтрофилов (один из видов лейкоцитов, отвечающих за клеточный иммунитет).
Нейтрофилы заглатывают кристаллы МУН, что вызывает выброс провоспалительных (вызывающих и поддерживающих воспаление) цитокинов и развитие острой воспалительной реакции в синовиальной оболочке. Острые атаки в виде синовитов протекают очень болезненно, но не оставляют после себя каких-либо последствий. Длительное хроническое течение заболевания с частыми повторными атаками приводит к разрушению суставного хряща, разрастанию костной ткани, деформации и нарушению функции сустава. Отложение МУН в почках вызывает снижение их функции.
Факторы, способствующие повышению уратов в крови:
- наличие в рационе большого количества мясных блюд, субпродуктов, яиц, спиртных напитков,
- избыточный вес;
- прием некоторых лекарств – мочегонных, аспирина, никотиновой кислоты, лекарств для снижения АД (Конкор) и др.;
- отравление свинцом;
- усиление распада пуринов при заболеваниях крови, псориазе и др.;
- повышение образования пуринов;
- нарушение функции почек и выведения мочевой кислоты.
Классификация
По причинам возникновения подагрический артрит делится на формы:
- первичную – связанную с наследственными особенностями пуринового обмена м выведением МУН почками;
- вторичную – причиной развития являются какие-то другие заболевания, нарушения питания, вредные привычки и др.
По механизму накопления МУН подагра делится на типы:
- метаболический – повышенная внутренняя выработка пуринов при их нормальном выведении почками;
- почечный – нарушение выведения мочевой кислоты почками;
- смешанный.
По степени тяжести:
- легкое течение – атаки подагрического артрита не чаще 2-х раз в год с поражением не более двух суставов; тофусы единичные не более 1 см в диаметре; осложнений со стороны почек и нарушения суставной функции нет;
- средней тяжести — не более 5 приступов в год с поражением не более 4-х суставов с небольшими изменениями в хрящевой и костной ткани; большое количество мелких тофусов; камни в почках;
- тяжелое – атаки подагрического артрита более 5 раз в год, множественные крупные тофусы и артриты; снижение функции почек.
Симптомы подагрического артрита
Появлению первых симптомов подагрического артрита предшествует порой длительное увеличение концентрации уратов в крови. Поэтому мужчинам после 40 лет, а женщинам после наступления менопаузы нужно периодически проверять содержание солей мочевой кислоты (МК) в крови. Особенно важно это для тех, у кого близкие родственники страдают подагрой. Подагрический артрит развивается при концентрации в крови уратов свыше 0, 4 ммоль/л. Но при наличии такого показателя артрит проявляется только у пятой части больных, остальные могут не подозревать о наличии у себя риска развития подагры.
Первичные признаки
Первый приступ острого подагрического артрита начинается внезапно. Появляются резкие боли в пораженном суставе, ткани над ним отекают, кожа краснеет. Боли очень сильные. Может повышаться температура тела, нарушаться общее состояние больного.
В половине случаев подагрический артрит начинается с поражения одного сустава. Обычно это первый плюснефаланговый сустав стопы. Могут также поражаться коленный, локтевой, мелкие суставы кисти и др.
Симптомы подагрического артрита особенно выражены в ночное время.
Явные симптомы
Атака подагрического артрита продолжается от 2 дней до 2 – 3 недель. Затем наступает полная ремиссия без каких-либо последствий. Следующий приступ обычно развивается в течение года, но иногда ремиссия продолжается несколько лет.
Острый подагрический артрит может рецидивировать в течение ряда лет, но постепенно его течение становится хроническим. Асимметрично поражается несколько суставов, в том числе, обязательно I плюснефаланговый на нижних конечностях.
Под кожей на разгибательной поверхности суставов, а также в области ушных раковин появляются тофусы – мелкие поверхностные узелки или более крупные подкожные узлы, имеющие хрящевую консистенцию. Они безболезненные, но могут воспаляться во время обострения подагрического артрита. В таком случае они становятся болезненными и иногда прорываются на поверхность кожи в виде беловатой массы.
Могут появиться приступы мочекаменной болезни – ураты отлагаются на стенках мочевыводящих путей, а также в почках, что приводит к нарушению их функции.
Когда нужно срочно обращаться к врачу
За медицинской помощью нужно обращаться, если:
- появились суставные боли, сопровождающиеся резким покраснением и отеком тканей; повысилась температура тела, появились озноб и недомогание;
- появились сильные приступообразные боли в нижней части спины – приступ мочекаменной болезни;
- суставные боли беспокоят и в межприступный период – признак хронического течения подагрического артрита.
Чем опасно заболевание
Подагрический артрит опасен тем, что может осложниться:
- стойким нарушением суставной функции и инвалидностью;
- нарушением функции почек;
- мочекаменной болезнью;
- тяжелым течением сердечно-сосудистых заболеваний, сахарного диабета.
Стадии подагрического артрита
Подагрический артрит протекает в 4 стадии:
- Бессимптомная — Повышенное содержание МУН в крови без наличия кристаллов и приступов подагры.
- Бессимптомная — повышенное содержание МУН в крови с наличием кристаллов в синовиальной оболочке и суставной жидкости, но без признаков подагрического артрита и наличия тофусов.
- Интермиттирующая — отложение кристаллов МУН в тканях в сочетании с приступами острого подагрического артрита.
- Хроническая тофусная — наличие тофусов в суставных и околосуставных тканях в сочетании с хроническим артритом, разрушением хрящевой ткани, нарушением суставной функции и поражением почек.
Если подагрический артрит не лечить
При подозрении на подагрический артрит следует немедленно обращаться к ревматологу. Заболевание требует лечения, как во время приступа, так и в межприступный период. Основная причина, по которой развитие подагрических атак не удается взять под контроль, — отказ пациентов от проведения лечения в межприступный период, что неизбежно приводит к:
- гиперурикемии – повышению содержания уратов в крови;
- возобновлению приступов подагрического артрита;
- переходу острого подагрического артрита в хронический;
- разрушению суставов и инвалидности;
- тяжелым осложнениям со стороны почек и сердечно-сосудистой системы.
Что делать при обострениях
При появлении сильных суставных болей в сочетании с резким отеком и покраснением тканей, повышением температуры тела, недомоганием, следует:
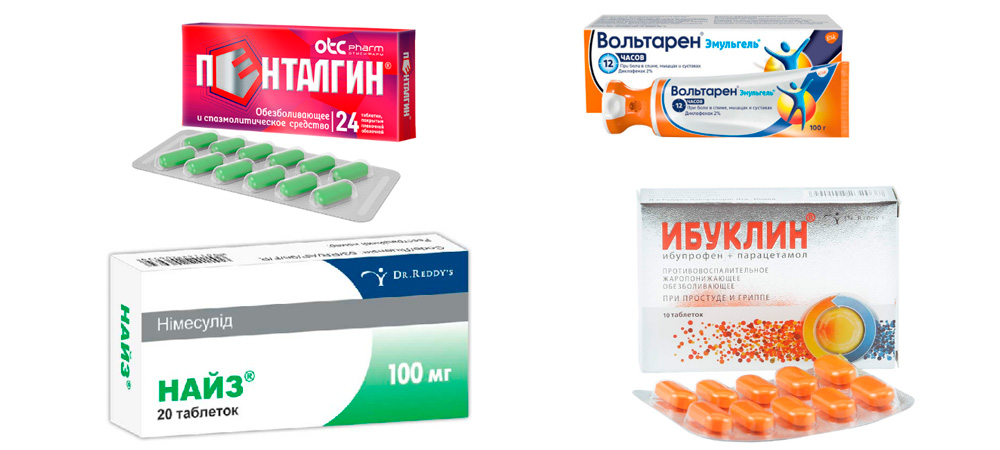
- принять любое успокоительное + лекарство из группы нестероидных противовоспалительных средств (НПВС) – Диклофенак (таблетку внутрь или ректальную свечу), Ибуклин, Найз и др. На кожу над больным суставом нанести мазь или гель из этой же группы (Вольтарен, Пенталгин и др.);
- вызвать врача на дом;
- лечь и принять положение, максимально снижающее боль в суставах.
Локализации
При подагре чаще всего развивается подагрический артрит суставов нижних конечностей. Могут быть и другие локализации, в том числе, поражение суставов верхних конечностей. Для подагры также характерно асимметричные суставные поражения.
Подагрический артрит нижних конечностей
При первичной подагрической атаке в патологический процесс в половине случаев вовлекается 1-ый плюснефаланговый сустав стопы. И даже если этот сустав не поражается самым первым, в дальнейшем в нем все равно развивается подагрический артрит. Околосуставные ткани отекают, кожа краснеет. В дальнейшем на тыльной поверхности стопы появляются мелкие и крупные тофусы.
Подагрический артрит голеностопного сустава встречается реже, в большинстве случаев это происходит при повторных атаках. Голеностоп воспаляется, отекает и краснеет, воспаление переходит на пятку. Возникает сильная боль и невозможность наступить на стопу.
Колено поражается часто, поражения асимметричные, часто сочетаются с поражение м 1-го плюснефалангового и локтевого суставов. Сильные боли, отек и покраснение сочетаются вначале с нарушением функции конечности из-за болей, но при длительном течении подагры происходит суставная деформация и анкилоз (неподвижность).
Тазобедренный подагрический артрит встречается редко, покраснение и отек не так заметны под мощным слоем мышц и связок. Но боли могут быть сильные.
Хондропротекторы что это как выбрать, насколько они эффективны
Боль в суставах в состоянии покоя
Подагрический артрит верхних конечностей
Мелкие суставные сочленения кисти и пальцев воспаляются часто, при этом пальцы делаются похожими на сосиски. Боли, воспаление и отек очень сильные. На тыле кисти появляются крупные тофузы.
Не менее часто поражается локоть. Поражения асимметричные и часто сочетаются с вовлечением мелких суставчиков кисти и стопы. На разгибательной поверхности плеча и предплечья появляются мелкие и крупные тофусы.
Плечевой подагрический артрит развивается гораздо реже, но протекает болезненно. Отек и покраснение не выражены, на сгибательной поверхности плеча появляются тофусы.
Тофусное поражение позвоночника
В середине 50-х годов прошлого века было впервые выявлено поражение позвоночника при подагре. При этом происходит разрастание тофусов в мягких тканях и суставах позвоночника с разрушением их структур.
Чаще всего поражается поясничный отдел, затем – шейный. В спине появляются боли, которые часто принимаются за симптомы остеохондроза. При разрушении позвонков и сдавливании спинномозговых нервов и спинного мозга появляются неврологические симптомы. При поражении шейного отдела – это парезы и параличи верхних конечностей, корешковые боли.
При поражении пояснично-крестцового отдела может осложняться сдавливанием конечного отдела спинного мозга – конского хвоста. При этом нарушается функция органов малого таза – происходит непроизвольное мочеиспускание, дефекация, нарушения потенции.
Диагностика
Несмотря на то, что подагрический артрит имеет ярко выраженную симптоматику, правильный диагноз при первой атаке удается поставить только 10% больных. В остальных случаях выставляется диагноз других видов артритов. Диагностическими критериями подагры являются:
- острый артрит 1-го пальца стопы;
- наличие крупных и мелких тофусов;
- повышенное содержание мочевой кислоты в крови;
- выявление кристаллов МУН в суставной жидкости и тканях.
При выявлении не менее двух критериев диагноз подагрического артрита считается достоверным.
Лабораторные исследования:
- общий анализ крови – признаки воспаления;
- биохимический анализ крови – содержание мочевой кислоты более 0,32 ммоль/л; повышение уровня С-реактивного белка (признак воспалительной реакции);
- общий анализ мочи;
- исследование синовиальной жидкости методом поляризационной микроскопии – выявление кристаллов МУН и большого количества лейкоцитов.
Инструментальные исследования:
- УЗИ суставов – выявление кристаллов МУН на поверхности хряща и тофусов;
- рентгенография суставов – на ранних стадиях изменений нет; на поздних выявляются костные изменения;
- компьютерная томография (КТ) – выявляет наличие изменений в области позвоночника.
Лечение подагрического артрита
Целью лечения подагрического артрита является улучшение исходов заболевания. Для этого применяются в основном медикаментозные методы лечения. Немедикаментозные методы имеют вспомогательное значение.
Медикаментозное лечение
Основными задачами медикаментозного лечения подагрического артрита являются:
- снятие воспалительных явлений и болей при остром артрите;
- предупреждение приступов артрита путем снижения содержания мочевой кислоты в крови.
Лечение острого приступа артрита
В купировании приступа подагрического артрита используют препараты:
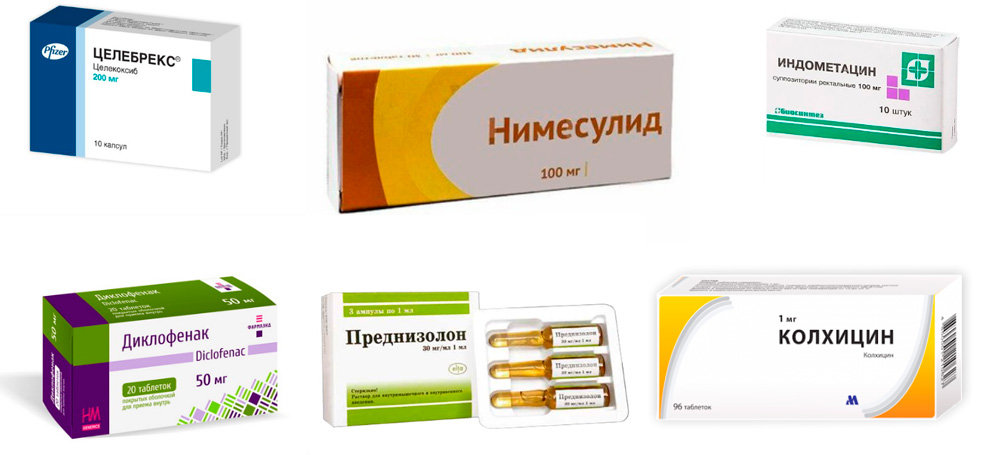
- Колхицин — сухой экстракт семян безвременника осеннего. Выпускается в таблетках. Эффективен в первые 12 часов от начала подагрического приступа. Результатом его применения является устранение отека и боли. Назначают препарат в небольших дозировках. Суточная доза делится на несколько приемов. Сначала назначают большую часть суточной дозы, зачтем через час – меньшую. При необходимости прием можно повторить несколько раз в день. Через сутки после начала приступа минимальными дозировками не обойтись, их увеличивают, что способствует проявлению побочных эффектов, главным образом, со стороны ЖКТ. Все дозировки подбираются врачом.
- Нестероидные противовоспалительные средства (НПВС) – снимают воспаление, боль и отек. Эти лекарства делятся на 2 группы: неселективные и селективные. Неселективные или НПВС 1-го поколения подавляют действие биологически активных веществ – простагландинов, поддерживающие воспалительные процессы. Но действуют они не избирательно, подавляя также действие простагландинов, защищающих слизистую оболочку желудка. Поэтому такие препараты, как Диклофенак, Индометацин, Ибупрофен имеют побочные эффекты со стороны желудочно-кишечного тракта (ЖКТ). Тем не менее, некоторым пациентам они подходят и их достаточно часто назначают, как внутрь, так и внутримышечно. Селективные НПВС (Нимесулид, Эторикоксиб, Целекоксиб) относятся ко второму поколению. Они действуют избирательно на провоспалительные простагландины и почти не оказывают воздействия на ЖКТ. Подбор препарата осуществляется индивидуально, в соответствии с особенностями организма пациента.
- Глюкокортикоидные гормоны (ГК) – быстро снимают воспаление, боль и отек, но подходят не всем, так как могут повышать артериальное давление, сахар крови и вызывать обострение язвенной болезни. Назначают короткими курсами внутрь (Преднизолон), внутримышечно (Бетаметазон), в виде внутрисуставных инъекций. В настоящее время стараются применять преимущественно препараты группы НПВС и только при наличии противопоказаний для их применения используют ГК.
- Канакинумаб (торговое название Иларис) — моноклональные антитела к интерлейкину-1бета (ИЛ-1b). ИЛ-1b – это информационные белковые молекулы (цитокины), отвечающие за реакцию воспаления. Антитела связываются с ИЛ-1b и нейтрализуют его действие, что приводит к устранению воспаления и боли. Канакинумаб применяют в индивидуально подобранной дозировке пациентам, имеющим противопоказания к применению Колхицина, НПВС и ГК.
Снижение содержания мочевой кислоты в крови в межприступный период
Вне приступов пациентам, страдающим подагрическим артритом, назначают длительные курсы уратснижающей терапии (УСТ), понижающие содержание мочевой кислоты (МК) в сыворотке крови, предупреждающие образование кристаллов МК в тканях. При низком содержании МК в крови уже имеющиеся в тканях кристаллы постепенно рассасываются. При наличии хронического подагрического артрита, тофусов содержание МК снижают до минимального (ниже 0,3 ммоль/л), что способствует ускоренному устранению тофусов. При отсутствии тофусов допустимо содержание МК равное 0,36 ммоль/л.
Для уратснижающей терапии при подагрическом артрите применяют следующие группы лекарственных препаратов:
- Группа средств, нарушающих образование мочевой кислоты. Они подавляют действие фермента, участвующего в образовании МК. При их назначении необходим постоянный контроль содержания МК в сыворотке крови. К таким лекарствам относятся:
- Аллопуринол – препарат, применяющийся для лечения подагры более 50 лет. Назначается длительными курсами через 2 недели после окончания подагрического приступа с небольших доз, которые постепенно доводят до необходимых. Иногда дает побочные эффекты со стороны почек, печени, тяжелые аллергические кожные реакции. На начальном этапе лечения часто вызывает обострение подагрического артрита, поэтому его комбинируют с назначением НПВС.
- Фебуксостат (торговые названия – Аденурик, Азурикс) – более современный препарат этой группы, действует избирательно только на один фермент, участвующий в синтезе МК. Другие ферменты не подавляет, поэтому имеет меньше побочных эффектов. Действует мягко и эффективно. Дозы подбираются индивидуально и вначале лечения сочетают с применением НПВС.
- Препараты, усиливающие выведение МК через почки. Назначаются при непереносимости лекарств первой группы или неэффективности их применения:
- Пробенецид – назначается длительными курсами, противопоказан при наличии камней в почках.
- Ферменты, отсутствующие у человека, способные снижать содержание МК в крови. Фермент уриказа присутствует в крови некоторых млекопитающих и снижает содержание в крови МК, но в крови человека его нет. Генно- инженерным способом из бактерий был изготовлен препарат расбуриказа (рекомбинантная бактериальная уриказа), которая применяется при подагрическом артрите, если другими способами снизить МК в крови не удается. Недостатком препарата является повышенная аллергенность, поэтому применяется он строго по показаниям.
Пегуриказа – это уриказа с полиэтиленгликолем, который подавляет повышенную аллергенность. Более современный препарат, но он также применяется строго по показаниям.
Хруст в суставах — когда стоит беспокоиться
Внутрисуставные инъекции гиалуроновой кислоты
Немедикаментозное лечение
Данный вид лечения включает в себя:
- диету;
- контроль за течением коморбидных (часто сочетающихся с подагрой и отягощающих ее течение) заболеваний;
- физиотерапевтические процедуры;
- народные средства.
Диета при подагрическом артрите
Пациенты, страдающие подагрическим артритом, не должны употреблять продукты, богатые пуриновыми основаниями. Но последние исследования установили, что отрицательное воздействие оказывают только продукты животного происхождения. Это жирное красное мясо, субпродукты (печень, почки, сердце, мозги), крепкие мясные бульоны, консервы из рыбы в масле, мясные консервы и паштеты.
Напротив, растительные продукты, содержащие пуриновые основания не должны полностью исключаться из рациона. Это орехи, горох, фасоль, чечевица, бобовые, какао и кофе. Очень полезны молочно-растительные диеты с нежирными молочными продуктами, разнообразными овощами и фруктами. Особенно полезны продукты, богатые витамина С, который способствует выведению мочевой кислоты.
Из рациона следует исключить алкоголь: крепкие спиртные напитки и пиво, в том числе, безалкогольное. Разрешается только небольшое количество сухого вина. Не следует употреблять сладости, сдобу и особенно сладкие газированные напитки. Необходимо также отказаться от курения.
Контроль за течением коморбидных заболеваний
С подагрическим артритом часто сочетаются и отягощаю его течение ожирение, сахарный диабет, сердечно-сосудистые и почечные заболевания.
Ожирение требует постоянного контроля массы тела. Это соблюдение диеты с пониженной калорийностью суточного рациона, подвижный образ жизни, курсы лечебной гимнастики.
Сахарный диабет также требует постоянного наблюдения, лабораторного контроля и поддерживающего лечения.
Частыми сопутствующими заболеваниями при подагрическом артрите бывают также артериальная гипертензия (стабильно высокое АД) и ишемическая болезнь сердца с приступами стенокардии. В настоящее время имеются лекарственные препараты, позволяющие стабилизировать состояние таких больных, но для этого необходимо постоянно наблюдение кардиолога.
Осложняет течение подагрического артрита и любая почечная патология. Ее также нужно наблюдать и лечить.
Физиотерапевтические процедуры
Физиолечение является дополнительным методом лечения подагрического артрита. В период подагрической атаки назначают электрофорез с глюкокортикоидными гормонами и ультрафиолетовое облучение пораженной области.
В период ремиссии назначают курсы магнито- и лазеротерапии, улучшающие микроциркуляцию крови и восстанавливающие измененные суставные ткани.
При отсутствии подагрических атак в течение полугода можно проводить санаторно-курортное лечение. Подойдут санатории Кавказский Минеральных Вод и Крыма.
О других методах лечения артрита читайте в этой статье.
Народные средства
Чтобы снять воспаление, отек и боль при подагрической атаке, народная медицина рекомендует компрессы с активированным углем. Раньше для этой цели использовали древесный уголь, сегодня достаточно взять 50 таблеток активированного угля, растолочь, развести водой до консистенции домашней сметаны, ввести столовую ложку растительного масла, перемешать и нанести на воспаленный участок, сверху приложить салфетку, компрессную бумагу, вату, прибинтовать и оставить на всю ночь. Отлично снимает воспаление, отек, уменьшает болевые ощущения.
Хирургическое лечение
При крупных тофусах, которые часто нагнаиваются и сдавливают окружающие ткани, нарушая их функцию, проводят их удаление.
Хирургические операции, направленные на восстановление функции сустава, проводятся строго по показаниям, при разрушении хрящевой такни, разрастании костной ткани с суставной деформацией и утратой функции конечности. При полном разрушении сустава проводится его замена на искусственный (эндопротезирование).
Подход к лечению подагрического артрита в клинике «Парамита»
В нашей клинике разработана уникальная методика лечения подагрического артрита. Применяются два противоположных подхода к выявлению и лечению этого заболевания. Прежде всего, проводится тщательное клиническое, лабораторное и инструментальное обследование пациента. После установления окончательного диагноза и сопутствующих заболеваний, назначается индивидуально подобранное комплексное лечение, включающее:
- современные западные методики, в том числе с применением новейших лекарственных препаратов; это позволяет устранить воспаление и боли при подагрической атаке и поддерживать нужный уровень мочевой кислоты в сыворотке крови в межприступный период;
- традиционные восточные методики, оказывающие регулирующее воздействие на организм в целом и на очаг воспаления; методики позволяют устранить боль уже после первого сеанса; после курса лечения пациент ощущает прилив сил и полное обновление.
Проведенный курс лечения и правильно подобранная уратснижающая терапия позволяет пациенту надолго (в большинстве случаев до конца жизни) забыть о приступах подагры. Более подробную информацию о лечении в клинике вы сможете получить на нашем сайте.
Общие клинические рекомендации пациентам с подагрическим артритом
Всем больным, страдающим подагрой, рекомендуется:
- соблюдать диету, вести подвижный образ жизни;
- выполнять все назначения врача, в том числе принимать назначенные уратснижающие лекарства;
- следить за своим весом;
- лечить сопутствующие заболевания: сахарный диабет, ожирение, стенокардию, высокое АД, хронические заболевания почек.
Профилактика подагры
Подагра чаще всего связана с наследственными особенностями обмена. Не есть также факторы, предрасполагающие к развитию этого заболевания. Если устранить их влияние, то, даже имея отягощенную наследственность, можно значительно снизить риск развития заболевания. Для этого нужно выполнять следующие рекомендации:
- не переедать, снизить калорийность суточного рациона, не употреблять субпродуктов, красного мяса, алкоголя, бросить курить;
- избавиться от избыточного веса;
- прием любых лекарств согласовывать с врачом – некоторые из них повышают концентрацию мочевой кислоты (диуретики, никотинка, ацетилсалициловая кислота и др.);
- регулярно лечить хронические заболевания: сахарный диабет, ожирения, почечные и сердечно-сосудистые заболевания;
- мужчинам после 40 лет, а женщинам после 50 лет периодически проверять содержание мочевой кислоты в крови.
Частые вопросы по заболеванию
Можно ли получить инвалидность?
Какой врач лечит?
Какие прогнозы обычно дают врачи?
При правильном систематическом лечении под контролем врача прогноз благоприятный.
Подагрический артрит требует постоянного наблюдения ревматолога, проведения уратснижающей терапии, соблюдения диеты и всех рекомендаций врача. Если правильно лечиться, то можно навсегда забыть о подагрических атаках. Врачи клиники «Парамита» имеют большой опыт в лечении подагры. Обращайтесь!
Литература:
- Федорова А. А., Барскова В. Г., Якунина И. А., Насонова В. А. Кратковременное применение глюкокортикоидов у больных затяжным и хроническим подагрическим артритом. Ч. III. Частота развития нежелательных реакций // Научно-практическая ревматология. 2009; № 2. С. 38–42.
- Елисеев М. С. Подагра. В кн.: Российские клинические рекомендации. Ревматология / Под ред. Е. Л. Насонова. М.: ГЭОТАР-Медиа, 2017. С. 372–385.
- Rainer T. H., Cheng C. H., Janssens H. J., Man C. Y., Tam L. S., Choi Y. F. Oral prednisolone in the treatment of acute gout: a pragmatic, multicenter, double-blind, randomized trial // Ann Intern Med. 2016; 164 (7): 464–471.
- Reinders M., van Roon E., Jansen T., Delsing J., Griep E., Hoekstra M. et al. Efficacy and tolerability of urate-lowering drugs in gout: a randomised controlled trial of benzbromarone versus probenecid after failure of allopurinol // Ann Rheum Dis. 2009; 68: 51–56.
Оценка читателей
Энрофлон инъекционный раствор по внешнему виду представляет собой прозрачный стерильный раствор слегка желтоватого цвета с содержанием 25, 50 или 100 мг энрофлоксацина в 1 мл. Энрофлон инъекционный раствор выпускают во флаконах по 2, 5, 10, 25, 50 и 100 мл.
Энрофлоксацин, входящий в состав энрофлона, относится к группе фторхинолонов и обладает широким спектром антибактериального действия, активен в отношении грамположительных и грамотрицательных микроорганизмов, в том числе e.соli, haemоphilus, klebsiella, pasteurella, pseudоmоnas, bоrdetella, сampylоbaсter, erysipelоthris, соrynebaсterium, staphylососсus, streptососсus, aсtinоbaсillus, сlоstridium, baсterоides, fusоbaсterium, а также микоплазм.
Энрофлон хорошо и быстро всасывается из места инъекции и проникает во все органы и ткани организма. Максимальная концентрация препарата в крови достигается через 0,5-1 час после введения энрофлона и сохраняется на протяжении 4-6 часов, а терапевтическая концентрация — на протяжении 24 часов
Энрофлоксацин практически не подвергается биотрансформации в организме и выделяется преимущественно в неизмененном виде с мочой и желчью.
Применение препарата Энрофлон инъекционный раствор применяют для лечения бронхопневмоний, колибактериоза, сальмонеллеза и других заболеваний телят, ягнят и поросят, вызванных микроорганизмами чувствительными к фторхинолонам, а также для лечения атрофического ринита, энзоотической пневмонии и синдрома маститметритагалактия у свиней.
Энрофлон инъекционный раствор вводят один раз в сутки телятам и ягнятам подкожно, а поросятам внутримышечно в дозе 2,5-5 мг/кг массы тела в течение 3-5 дней, а при мастит-метрит-агалактии 2,5 мг/кг массы животного в течение 1-2 дней.
В одно место телятам вводят не более 10 мл, ягнятам — не более 5 мл, а поросятам — не более 2,5 мл.
Не допускается применение энрофлона одновременно с левомицетином, тетрациклинами, теофилином, стероидами, а также животным в период беременности.
Особые указания
Убой животных на мясо разрешается не ранее, чем через 14 суток после последнего применения препарата. Мясо животных, вынужденно убитых до истечения указанного срока, может быть использовано для кормления пушных зверей или для производства мясо-костной муки.
флакон 100 мл
Пока нет отзывов…