Состав
В составе одной капсулы лекарства: дутастерида 0,5 мг + дополнительные ингредиенты (бутилгидрокситолуол, желатин, диоксид титана, триглицериды, монодиглицериды каприловой кислоты, глицерин, оксид железа черный, красные чернила для печати, лецитин).
Форма выпуска
Препарат выпускают в виде желтых матовых непрозрачных капсул. На каждой капсуле напечатано красными чернилами GX CE2. В картонных коробках по 30 или 90 штук (по 10 в блистере, 3 или 9 блистеров в упаковке).
Фармакологическое действие
Антиандрогенное.
Фармакодинамика и фармакокинетика
Активный компонент средства – двойной ингибитор фермента 5-альфа-редуктазы. Вещество ингибирует процесс превращения тестостерона в ДГТ, путем подавления активности 5-альфа-редуктазы 1 и 2 типа. Ведь именно дигидротестостерон отвечает за развитие гиперплазии. Таким образом, уменьшается размер предстательной железы, нормализуется мочеиспускание, повышается вероятность излечения без хирургического вмешательства.
Чем выше доза принятого препарата, тем больше он влияет на выработку ДГТ. Своего максимального влияния средство достигает через одну — две недели, после начала лечения.
Максимальная концентрация лекарства в сыворотке крови достигается примерно через 1,5 часа после приема. Биодоступность – 60% (по сравнению с внутривенным введением). Прием пищи не оказывает влияния на показатели.
У препарата очень большая степень связывания с белками плазмы крови, порядка 99%. Около 11,5 % действующего вещества при систематическом длительном приеме попадает в сперму.
В живом организме Avodart интенсивно метаболизируется. Экскреция 1-15 % вещества происходит через кишечник в неизмененном виде, 74 % составляют 4 крупных метаболита, 5% — прочие малые метаболиты. Полностью из организма препарат выводится примерно через месяц после окончания приема. Однако даже через 6 месяцев его незначительное количество можно обнаружить в сыворотке.
У пожилых пациентов не наблюдалось значительного изменения каких-либо фармакокинетических показателей. Из этого следует вывод, что коррекция дозы не нужна.
Показания к применению
Препарат назначают:
- в составе комплексного лечения гиперплазии предстательной железы или для профилактики, в сочетании с альфа-адреноблокаторами;
- для монотерапии гиперплазии предстательной железы.
Противопоказания
Лекарство противопоказано при аллергии на его компоненты, женщинам и детям.
При наличии печеночной недостаточности следует соблюдать осторожность.
Побочные эффекты
Частота встречаемости побочных реакций и их характер зависит от длительности приема и наличия вспомогательных препаратовпри лечении гиперплазии.
Наблюдались:
- крапивница, зудящие высыпания на коже, отеки, прочие аллергические реакции вплоть до ангионевротического отека;
- депрессия, апатия;
- тестикулярный отек и боль;
- гипертрихоз и потеря волос на поверхности тела;
- эректильная дисфункция, снижение полового влечения и либидо, проблемы с эякуляцией, болезненные ощущения и набухание грудных желез.
Вероятность возникновения нежелательной побочной реакции снижается с увеличением длительности приема (со второго года приема препарата).
При сочетании Аводарта с прочими препаратами частота возникновения побочных эффектов может отличаться.
Инструкция на Аводарт (способ и дозировка)
Препарат назначают отдельно или в сочетании с тамсулозином.
Инструкция по применению Аводарта для взрослых
Рекомендуется прием 1 капсулы (0,5 мг) в сутки. Перорально. Капсулу нельзя раскусывать или разжевывать, ее содержимое может повредить слизистую оболочку рта или глотки.
Лекарство пьют вне зависимости от еды. Минимальное время приема средства – полгода.
При заболеваниях почек и печени нужно принимать средство с осторожностью. При тяжелой степени печеночной недостаточности препарат противопоказан.
Передозировка
По данным клинических исследований, у пациентов, принимавших 40 мг лекарства в сутки в течение недели, не выявлено отклонений от нормы.
При приеме 5 мг препарата в сутки в течение полугода, отклонений также выявлено не было.
Лекарство не имеет специфического антидота, если же передозировка все-таки произошла, рекомендуется произвести симптоматическую терапию.
Взаимодействие
Препараты – ингибиторы изофермента цитохрома P450 CYP3A4 могут повысить концентрацию дутастерида в крови. Доказано, что верпамил и дилтиазем снижают клиренс препарата, но амлодипин и прочие БКК, не повышают концентрации лекарства в крови. В связи с этим, коррекции суточной дозировки не требуется.
Препарат можно сочетать с варфарином, колестирамином, аценокумаролом, Тамсулозином, фенпрокумоном, Теразозином, Дигоксином, фенитоином и Диазепамом.
Не наблюдалось нежелательных реакций при сочетании лекарства с ингибиторами АПФ, БКК, диуретиками, ингибиторами ФДЭ-5, гиполипидемическими средствами, бета-адреноблокаторами, кортикостероидами, нестероидными противовоспалительными средствами, хинолоновыми антибиотиками.
Изоферменты CYP1A2, CYP2E1, CYP2C9, CYP2D6, CYP2C19, CYP2A6, CYP2C8, CYP2B6 не участвуют в метаболизме лекарственного средства.
Условия продажи
Нужен рецепт.
Условия хранения
Не допускать попадания к детям. Хранить в прохладном месте в оригинальной упаковке.
Срок годности
4 года.
Особые указания
Капсулы нельзя раскрывать, допускать контакта их содержимого с кожей или слизистой оболочкой. Если жидкость попала на кожу, следует немедленно смыть ее проточной водой. Особенно избегать контакта с препаратом следует женщинам и детям.
Несмотря на то, что не установлено прямой и непосредственной зависимости от приема лекарства и развития заболеваний сердца, при проведении исследований было доказано, что сочетание дутастерида с альфа-адреноблокаторами несколько повышает риск возникновения данного заболевания.
Пациентам с серьезными нарушениями в работе печени следует избегать приема данного средства.
Перед назначением лекарства и в процессе лечения препаратом нужно производить исследование предстательной железы (пальцевое ректальное, анализы на ПСА). Через полгода после начала приема препарата следует определить новый начальный уровень ПСА и в дальнейшем тщательно его контролировать. Следует помнить, что любое (даже в рамках нормы) повышение уровня постатспецифического антигена может служить сигналом о развитии рака предстательной железы.
В течение полугода после отмены препарата уровень ПСА возвращается к нормальному.
Не доказано и не обнаружено прямой зависимости между приемом препарата и развитием рака молочной железы у мужчин.
В ходе продолжительным 4-летних исследований дутастерида, было доказано, что его прием не повышает вероятность развития высокодифференцированного рака предстательной железы. Однако, мужчинам, которые принимают препарат, следует контролировать уровень ПСА.
Клинически значимой зависимости качества и количества сперматозоидов в сперме от продолжительности приема средства выявлено не было.
Аналоги Аводарта
Совпадения по коду АТХ 4-го уровня:
Распространенные аналоги: Аденостерид, Проскар, Урофин, Финпрос, Пенестер, Простан, Финистер.
Цена аналогов, как правило, несколько выше, чем у оригинала.
Пенестер или Аводарт — что лучше?
Пенестер имеет другое действующее вещество – финастерид. В отличие от оригинала, его можно сочетать с прочими лекарственными средствами. Также препара-аналог имеет меньшее количество побочных эффектов. Оба средства достаточно эффективны в борьбе с гиперплазией предстательной железы. Многое зависит от индивидуальных особенностей организма.
Отзывы об Аводарте
Отзывы об Аводарте на форумах различные. Одни пишут, что после годового использования препарата предстательная железа уменьшилась, но при прекращении приема снова немного увеличилась. Другие недовольны высокой стоимостью препарата. Есть отзывы, в которых мужчины возмущаются по поводу снижения полового влечения и эректильной дисфункции в первые месяцы приема средства. В таком случае следует учитывать, что нормальная половая функция, как правило, налаживается по истечению 3-4 месяцев после начала приема препарата. Частота возникновения побочных реакций невелика, однако есть случаи острой непереносимости лекарства и появления утраченных волос на голове.
Цена Аводарта
В среднем, цена лекарства составляет приблизительно 1 599 рублей за 30 капсул.
Сколько стоит купить в Москве? Цена Аводарта в столице РФ составляет примерно 3600 рублей за 90 таблеток.
- Интернет-аптеки РоссииРоссия
ЛюксФарма* специальное предложение
-
Аводарт капсулы 0,5мг №30
ЗдравСити
-
Аводарт капсулы 0,5мг 90штГлаксоСмитКляйн Фармасьютикалз С.А.
-
Аводарт капсулы 0,5мг 30штГлаксоСмитКляйн Фармасьютикалз С.А.
Аптека Диалог
-
Аводарт капсулы 0,5мг №90GlaxoSmithKline/Polfa
-
Аводарт капсулы 0,5мг №30GlaxoSmithKline
показать еще
Аводарт® (Avodart®) инструкция по применению
📜 Инструкция по применению Аводарт®
💊 Состав препарата Аводарт®
✅ Применение препарата Аводарт®
📅 Условия хранения Аводарт®
⏳ Срок годности Аводарт®
Описание лекарственного препарата
Аводарт®
(Avodart®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2018
года, дата обновления: 2018.07.31
Код ATX:
G04CB02
(Дутастерид)
Лекарственная форма
| Аводарт® |
Капс. 500 мкг: 30 или 90 шт. рег. №: ЛС-000052 |
Форма выпуска, упаковка и состав
препарата Аводарт®
Капсулы мягкие желатиновые, желтого цвета, продолговатые, непрозрачные, промаркированные кодом «GX CE2».
Вспомогательные вещества: моно-ди-глицериды каприловой/каприновой кислоты (МДК) — 349.5 мг, бутилгидрокситолуол — 0.035 мг.
Состав оболочки капсулы: желатин — 144.8 мг, глицерол (глицерин) — 70.8 мг, титана диоксид — 1.78 мг, железа оксид желтый — 0.127 мг; технологические добавки: триглицериды среднецепочечные (ТСЦ) — q.s., лецитин — q.s.
10 шт. — блистеры (3) — пачки картонные.
10 шт. — блистеры (9) — пачки картонные.
Фармакологическое действие
Механизм действия
Дутастерид — двойной ингибитор 5α-редуктазы. Подавляет активность изоферментов 5α-редуктазы 1 и 2 типов, которые ответственны за превращение тестостерона в дигидротестостерон (ДГТ). Дигидротестостерон является основным андрогеном, ответственным за гиперплазию железистой ткани предстательной железы.
Фармакодинамические свойства
Максимальное влияние суточных доз дутастерида на снижение концентрации ДГТ является дозозависимым и наблюдается в течение 1-2 недель. Через 1 и 2 недели приема дутастерида в дозе 500 мкг/сут средние значения концентраций ДГТ в сыворотке крови снижались на 85% и 90% соответственно.
У пациентов с доброкачественной гиперплазией предстательной железы (ДГПЖ), получавших дутастерид в дозе 500 мкг/сут, среднее снижение концентрации ДГТ составило 94% через 1 год и 93% через 2 года, среднее увеличение концентрации тестостерона в сыворотке крови составило 19% как через 1 год, так и через 2 года. Это является ожидаемым последствием ингибирования 5α-редуктазы и не приводит ни к одному из известных нежелательных явлений.
Фармакокинетика
Всасывание
После приема одной дозы дутастерида (500 мкг) Cmax в сыворотке крови достигается в течение 1-3 ч. Абсолютная биодоступность дутастерида у мужчин составляет около 60% по отношению к 2-часовой в/в инфузии. Биодоступность дутастерида не зависит от приема пищи.
Распределение
Фармакокинетические данные, полученные после однократного и многократного приема дутастерида внутрь, свидетельствуют о большом Vd (от 300 до 500 л). Дутастерид обладает высокой степенью связывания с белками плазмы крови (более 99.5%).
При ежедневном приеме концентрация дутастерида в сыворотке крови достигает 65% от равновесной концентрации через 1 месяц и примерно 90% от равновесной концентрации через 3 месяца. Css дутастерида в сыворотке крови, составляющие примерно 40 нг/мл, достигаются через 6 месяцев однократного ежедневного приема 500 мкг дутастерида. В сперме, как и в сыворотке крови, Css дутастерида также достигаются через 6 месяцев. Через 52 недели лечения концентрации дутастерида в сперме составляют в среднем 3.4 нг/мл (от 0.4 до 14 нг/мл). Из сыворотки крови в сперму попадает в среднем 11.5% дутастерида.
Метаболизм
In vitro дутастерид метаболизируется изоферментом CYP3A4 системы цитохрома Р450 человека до двух минорных моногидроксилированных метаболитов; изоферменты CYP1A2, CYP2A6, CYP2E1, CYP2C8, CYP2C9, CYP2C19, CYP2B6 или CYP2D6 в метаболизме дутастерида не участвуют.
После достижения Css дутастерида в сыворотке крови с помощью масс-спектрометрического метода были выявлены неизмененный дутастерид, 3 основных метаболита (4′-гидроксидутастерид, 1,2-дигидродутастерид и 6-гидроксидутастерид) и 2 минорных метаболита (6,4′-дигидроксидутастерид и 15-гидроксидутастерид). 5 метаболитов дутастерида, обнаруженных в сыворотке крови человека, были выявлены в сыворотке крови крыс, при этом стереохимия гидроксильных групп в положениях 6 и 15 метаболитов у человека и крыс неизвестна.
Выведение
Дутастерид подвергается интенсивному метаболизму. После приема внутрь дутастерида в суточной дозе 500 мкг до достижения равновесной концентрации у человека от 1% до 15.4 % (в среднем 5.4%) принятой дозы экскретируется через кишечник в неизмененном виде. Остальная часть экскретируется через кишечник в виде 4 основных метаболитов, составляющих 39%, 21%, 7% и 7% соответственно, и 6 второстепенных метаболитов (на долю каждого из которых приходится менее 5%).
В моче человека обнаруживаются только следовые количества неизмененного дутастерида (менее 0.1% дозы). При низкой концентрации в сыворотке крови (менее 3 нг/мл) дутастерид выводится быстро обоими способами, как зависимыми от концентрации, так и не зависимыми от концентрации. При приеме однократной дозы дутастерида 500 мкг или менее наблюдался быстрый клиренс с коротким Т1/2 от 3 до 9 дней.
При концентрации в сыворотке крови более 3 нг/мл дутастерид выводится медленно (от 0.35 до 0.58 л/ч), в основном линейно, независимо от концентрации, с конечным Т1/2 от 3 до 5 недель. При приеме терапевтических доз дутастерида конечный Т1/2 составляет 3-5 недель, после многократного приема в дозе 500 мкг/сут доминирует более медленный клиренс, и общий клиренс носит линейный и независимый от концентрации характер. Дутастерид обнаруживается в сыворотке крови (в концентрациях выше 0.1 нг/мл) в течение 4-6 месяцев после прекращения лечения.
Фармакокинетика у особых групп пациентов
Пациенты пожилого возраста. Фармакокинетику и фармакодинамику дутастерида изучали у 36 здоровых добровольцев-мужчин в возрасте от 24 лет до 87 лет после приема одной дозы (500 мкг) дутастерида. Между разными возрастными группами не было выявлено статистически значимых различий в отношении экспозиции дутастерида, представленной такими фармакокинетическими параметрами, как AUC и Cmax. Также не установлены статистически значимые различия для значений Т1/2 дутастерида между возрастными группами мужчин 50-69 лет и старше 70 лет, к которым относится большинство мужчин с ДГПЖ. Между различными возрастными группами не выявлены отличия в действии препарата, определяемом по степени снижения концентрации ДГТ. Представленные результаты указывают на отсутствие необходимости коррекции дозы дутастерида в зависимости от возраста пациентов.
Пациенты с нарушением функции почек. Влияние нарушения функции почек на фармакокинетику дутастерида не исследовалось. Однако менее 0.1% равновесной концентрации дутастерида (при приеме дозы дутастерида 500 мкг) выделяется у человека почками, таким образом, нет необходимости в коррекции дозы при нарушении функции почек.
Пациенты с нарушением функции печени. Влияние нарушения функции печени на фармакокинетику дутастерида не исследовалось.
Показания препарата
Аводарт®
- в качестве монотерапии для лечения и профилактики прогрессирования доброкачественной гиперплазии предстательной железы посредством уменьшения ее размеров, облегчения симптомов, улучшения мочеиспускания, снижения риска возникновения острой задержки мочи и необходимости оперативного вмешательства;
- в качестве комбинированной терапии с альфа1-адреноблокаторами для лечения и профилактики прогрессирования доброкачественной гиперплазии предстательной железы посредством уменьшения ее размеров, облегчения симптомов, улучшения мочеиспускания, снижения риска возникновения острой задержки мочи и необходимости оперативного вмешательства. В основном изучалась комбинация дутастерида и альфа1-адреноблокатора тамсулозина.
Режим дозирования
Препарат можно принимать независимо от приема пищи. Капсулы следует проглатывать целиком, не разжевывать и не открывать, поскольку содержимое капсулы может вызывать раздражение слизистой оболочки ротоглотки.
Доброкачественная гиперплазия предстательной железы (ДГПЖ)
У взрослых мужчин (включая пожилых) рекомендуемая доза препарата Аводарт® составляет 1 капс. (500 мкг) 1 раз/сут.
Хотя улучшение на фоне применения препарата наступает довольно быстро, лечение следует продолжать не менее 6 месяцев для того, чтобы объективно оценить терапевтический эффект.
Для лечения ДГПЖ препарат Аводарт® может быть назначен в качестве монотерапии или в комбинации с альфа1-адреноблокаторами.
Особые группы пациентов
При приеме 500 мкг/сут через почки выделяется менее 0.1% дозы, поэтому нет необходимости снижать дозу у пациентов с нарушениями функции почек.
В настоящее время нет данных по применению препарата Аводарт® у пациентов с нарушениями функции печени. Т.к. дутастерид подвергается интенсивному метаболизму, а его Т1/2 составляет 3-5 недель, необходимо соблюдать осторожность при лечении препаратом Аводарт® пациентов с нарушениями функции печени.
Побочное действие
Нежелательные явления, представленные ниже, перечислены по системам и в соответствии с частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (≥1/10), часто (≥1/100 и <1/10), нечасто (≥1/1000 и <1/100), редко (≥1/10 000 и <1/1000), очень редко (<1/10 000, включая отдельные случаи). Категории частоты были сформированы на основании клинических исследований препарата и пострегистрационного наблюдения.
Частота встречаемости нежелательных явлений, сформированная на основании пострегистрационного наблюдения
Со стороны иммунной системы: очень редко — аллергические реакции (включая сыпь, зуд, крапивницу, локализованный отек) и ангионевротический отек.
Со стороны кожи и подкожно-жировой клетчатки: редко — алопеция (преимущественно потеря волос на теле) или гипертрихоз.
Нарушение психики: очень редко — депрессивное состояние.
Со стороны репродуктивной системы и грудных желез: очень редко — тестикулярная боль, тестикулярный отек.
Частота встречаемости нежелательных явлений, сформированная на основании данных клинических исследований (нежелательные явления, связанные применением дутастерида в качестве монотерапии)
В третьей фазе плацебо-контролируемых исследований с применением дутастерида по сравнению с плацебо исследователи оценивали нежелательные явления, связанные с приемом дутастерида:
1 Включая болезненность и увеличение грудных желез.
2 Нежелательные явления со стороны репродуктивной системы и грудных желез, связанные с применением дутастерида (как при монотерапии, так и в комбинации с тамсулозином). Данные нежелательные явления могут сохраняться после прекращения лечения и влияние дутастерида на сохранение данных нежелательных явлений неизвестно.
Нежелательные явления, связанные с применением дутастерида в комбинации с тамсулозином
Представленные ниже нежелательные явления были зарегистрированы в исследовании CombAT (сравнение приема дутастерида 500 мкг и тамсулозина 400 мкг 1 раз/сут в качестве монотерапии или в виде комбинации в течение 4 лет) и оценены исследователями с кумулятивным эффектом ≥1%).
1 Комбинация = дутастерид 500 мкг 1 раз/сут + тамсулозин 400 мкг 1 раз/сут.
2 Включая болезненность и увеличение молочных желез.
3 Нежелательные явления со стороны репродуктивной системы и грудных желез, связанные с применением дутастерида (как при монотерапии, так и в комбинации с тамсулозином). Данные нежелательные явления могут сохраняться после прекращения лечения. Влияние дутастерида на сохранение данных нежелательных явлений неизвестно.
Противопоказания к применению
- повышенная чувствительность к дутастериду и другим компонентам препарата;
- повышенная чувствительность к другим ингибиторам 5α-редуктазы.
Аводарт® противопоказан женщинам и детям.
С осторожностью следует назначать препарат при печеночной недостаточности.
Применение при беременности и кормлении грудью
Фертильность
Влияние дутастерида в суточной дозе 0.5 мг на характеристики спермы изучалось у здоровых добровольцев в возрасте 18-52 лет. К 52-й неделе лечения в группе пациентов, получавших дутастерид, средние значения процентного снижения общего количества сперматозоидов, объема спермы и двигательной активности сперматозоидов составляли 23%, 26% и 18%, соответственно, по сравнению с исходным уровнем в группе пациентов, получавших плацебо. Концентрация сперматозоидов и их морфология не изменялись.
Через 24 недели наблюдения среднее значение процентного изменения общего количества сперматозоидов в группе дутастерида оставалось на 23% ниже по сравнению с исходным уровнем. Среднее значение для всех параметров спермы во всех временных точках оставалось в пределах нормы и не соответствовало заданным критериям для клинически значимого изменения (30%), на 52-й неделе лечения у двух добровольцев в группе дутастерида общее количество сперматозоидов снижалось более чем на 90% по сравнению с исходным уровнем, с частичным восстановлением на 24-й неделе наблюдения.
Таким образом, клиническое значение влияния дутастерида на показатели спермы и на индивидуальную фертильность пациента неизвестно.
Беременность
Дутастерид противопоказан женщинам. Дутастерид не изучался у женщин, т.к. доклинические данные свидетельствуют о том, что подавление уровня ДГТ может вызывать торможение развития наружных половых органов у плода мужского пола.
Период лактации
Нет данных о проникновении дутастерида в грудное молоко.
Применение при нарушениях функции печени
С осторожностью следует назначать препарат при печеночной недостаточности.
Применение при нарушениях функции почек
При нарушениях функции почек снижение дозы препарата не требуется.
Применение у детей
Аводарт® противопоказан детям.
Особые указания
Рак предстательной железы (РПЖ)
В 4-летнем исследовании участвовали более 8000 мужчин в возрасте от 50 до 75 лет, характеризующихся отрицательным результатом биопсии на наличие РПЖ и концентрацией ПСА между 2.5 нг/мл и 10 нг/мл (исследование REDUCE) при первичном обследовании, при этом у 1517 из них был диагностирован РПЖ. Зарегистрировано больше случаев РПЖ с оценкой 8-10 баллов по шкале Глисона в группе дутастерида (n=29; 0.9%) по сравнению с группой плацебо (n=19; 0.6%). Не отмечалось увеличения количества случаев РПЖ с оценкой 5-6 и 7-10 баллов по шкале Глисона. Причинно-следственная связь между приемом дутастерида и развитием РПЖ высокой степени градации не установлена. Клиническое значение количественного дисбаланса неизвестно. Мужчины, принимающие дутастерид, должны регулярно проходить обследования в отношении оценки риска развития РПЖ, включая определение концентрации ПСА.
В дополнительном 2-летнем исследовании, направленном на последующее наблюдение пациентов из исследования REDUCE по химиопрофилактике, новые случаи РПЖ диагностировались редко (дутастерид (n=14, 1.2%) и плацебо (n=7, 0.7 %)), новые случаи РПЖ с оценкой 8-10 баллов по шкале Глисона отсутствовали.
Долгосрочные наблюдения (до 18 лет) в исследовании по химиопрофилактике с помощью другого ингибитора 5α-редуктазы (финастерид) не выявили статистически значимое различие в применении финастерида и плацебо по показателям общей выживаемости (ОР 1.02, 95% ДИ 0.97-1.08) или выживаемости после подтверждения диагноза РПЖ (ОР 1.01, 95% ДИ 0.85-1.20).
Простат-специфический антиген (ПСА)
Определение концентрации ПСА является важным компонентом скрининга, направленного на выявление РПЖ. После 6-месячной терапии дутастеридом средняя концентрация ПСА в сыворотке крови снижается примерно на 50%.
Для пациентов, принимающих дутастерид, должна быть установлена новая базовая концентрация ПСА после 6 месяцев терапии. После этого рекомендуется регулярное мониторирование концентрации ПСА. Любое подтвержденное повышение концентрации ПСА относительно наименьшего его значения при лечении дутастеридом может свидетельствовать о развитии РПЖ или о несоблюдении режима терапии препаратом и должно подвергаться тщательной оценке, даже если эти концентрации ПСА остаются в пределах нормальных значений для мужчин, не принимающих ингибиторы 5α-редуктазы. При интерпретации значений концентрации ПСА у пациентов, принимающих дутастерид, необходимо использовать для сравнения предыдущие результаты оценки концентрации ПСА.
Применение дутастерида не влияет на диагностическую ценность определения концентрации ПСА как маркера РПЖ после того, как установлена новая базовая концентрация ПСА.
Концентрация общего ПСА в сыворотке крови возвращается к исходному значению в течение 6 месяцев после отмены дутастерида.
Отношение концентрации свободного ПСА к общему остается постоянным даже на фоне терапии дутастеридом. Если для выявления РПЖ у мужчин, получающих дутастерид, дополнительно используется определение процентного содержания свободной фракции ПСА, не требуется проводить коррекцию этого показателя.
У пациентов необходимо проводить пальцевое ректальное исследование и использовать другие методы диагностики РПЖ до начала лечения дутастеридом, а также регулярно повторять обследование пациента в процессе лечения.
Побочные явления со стороны сердечно-сосудистой системы
В двух 4-летних клинических исследованиях частота развития сердечной недостаточности (обобщенный термин для наблюдавшихся событий, представленных в основном сердечной недостаточностью и застойной сердечной недостаточностью) была выше у пациентов, получавших комбинацию дутастерида и α1-адреноблокатора, главным образом тамсулозина, чем у пациентов, не получавших комбинированного лечения. В этих двух клинических исследованиях частота развития сердечной недостаточности оставалась низкой (<1%) и варьировала между исследованиями. В целом различия между показателями частоты побочных явлений со стороны сердечно-сосудистой системы в обоих исследованиях не отмечались. Причинно-следственная связь между приемом дутастерида (в виде монотерапии или в комбинации с α1-адреноблокатором) и сердечной недостаточностью не установлена.
При мета-анализе 12 рандомизированных, контролируемых с помощью плацебо или препаратов сравнения клинических исследований (n=18 802), целью которого являлась оценка риска развития сердечно-сосудистых побочных явлений при применении дутастерида (по сравнению с контрольной группой), не выявлено соответствующего статистически значимого увеличения риска развития сердечной недостаточности (ОР 1.05, 95% ДИ 0.71, 1.57), острого инфаркта миокарда (ОР 1.00, 95% ДИ 0.77, 1.30) или инсульта (ОР 1.20, 95% ДИ 0.88, 1.64).
Рак грудной железы
При проведении клинических исследований и в пострегистрационном периоде зарегистрированы редкие сообщения о развитии рака грудной железы у мужчин, принимающих дутастерид. Тем не менее, данные эпидемиологических исследований не свидетельствуют о повышении риска развития рака грудной железы у мужчин при применении ингибиторов 5α-редуктазы. Специалисты должны проинструктировать пациентов о необходимости немедленно сообщать о любых изменениях со стороны грудных желез, таких как уплотнения в железе или выделения из соска.
Утечка содержимого капсул
Дутастерид всасывается через кожу, поэтому женщины и дети должны избегать контакта с капсулами, у которых наблюдается утечка содержимого. В случае контакта с такими капсулами затронутую область следует немедленно промыть водой с мылом.
Нарушения функции печени
Влияние нарушений функции печени на фармакокинетику дутастерида не исследовалось. Поскольку дутастерид интенсивно метаболизируется и его Т1/2 составляет от 3 до 5 недель, следует с осторожностью назначать дутастерид пациентам с нарушением функции печени.
Влияние на способность к управлению транспортными средствами и механизмами
Прием дутастерида не влияет на вождение автомобиля или работу с механизмами.
Передозировка
При назначении дутастерида до 40 мг/сут однократно (в 80 раз выше терапевтической дозы) в течение 7 дней значимых побочных эффектов не отмечалось. При проведении клинических исследований пациенты в течение 6 месяцев получали дутастерид в дозе 5 мг ежедневно, при этом каких-либо дополнительных побочных эффектов к тем, что наблюдались на фоне приема дутастерида в дозе 500 мкг, обнаружено не было.
Лечение: специфического антидота дутастерида нет, поэтому при подозрении на передозировку достаточно проводить симптоматическое и поддерживающее лечение.
Лекарственное взаимодействие
In vitro дутастерид метаболизируется изоферментом CYP3A4 ферментной системы цитохрома Р450 человека. Следовательно, в присутствии ингибиторов CYP3A4 концентрации дутастерида в крови могут возрастать.
При одновременном применении дутастерида с ингибиторами CYP3A4 верапамилом и дилтиаземом отмечается снижение клиренса дутастерида. Вместе с тем, амлодипин, другие блокаторы кальциевых каналов при одновременном применении с дутастеридом не уменьшают клиренс дутастерида. Уменьшение клиренса дутастерида и последующее повышение его концентрации в крови в присутствии ингибиторов CYP3A4 не является клинически значимым вследствие широкого диапазона границ безопасности дутастерида, поэтому нет необходимости корректировать его дозу.
In vitro дутастерид не метаболизируется следующими изоферментами системы цитохрома Р450 человека: CYP1A2, CYP2A6, CYP2E1, CYP2C8, CYP2C9, CYP2C19, CYP2B6 или CYP2D6.
Дутастерид не ингибирует in vitro ферменты системы цитохрома Р450 человека, участвующие в метаболизме лекарственных препаратов.
In vitro дутастерид не вытесняет варфарин, аценокумарол, фенпрокумон, диазепам и фенитоин из участков их связывания с белками плазмы, а эти препараты, в свою очередь, не вытесняют дутастерид.
При проведении исследований взаимодействия дутастерида с тамсулозином, теразозином, варфарином, дигоксином и колестирамином у человека каких-либо клинически значимых фармакокинетических или фармакодинамических взаимодействий не отмечалось.
При применении дутастерида одновременно с гиполипидемическими препаратами, ингибиторами АПФ, бета-адреноблокаторами, блокаторами кальциевых каналов, кортикостероидами, диуретиками, НПВП, ингибиторами фосфодиэстеразы 5-го типа и хинолоновыми антибиотиками какого-либо значимого нежелательного лекарственного взаимодействия не наблюдалось.
Условия хранения препарата Аводарт®
Препарат следует хранить в недоступном для детей месте при температуре не выше 30°С.
Срок годности препарата Аводарт®
Срок годности — 4 года. Не применять после истечения срока годности.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
ГЛАКСОСМИТКЛЯЙН ТРЕЙДИНГ АО
(Россия)

|
|
125167 Москва |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код


Аналоги Аводарт

Товары из категории — Лекарства от заболеваний мочеполовой системы
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 2 229
Немного интересных фактов
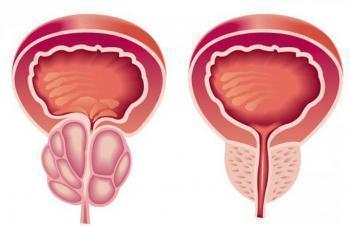
Аденома простаты, или доброкачественная гиперплазия предстательной железы (ДГПЖ) – это одна из самых распространенных урологических проблем среди мужского населения старшей возрастной категории. По своему характеру это опухолеподобное аденоматозное разрастание парауретральных желез. Точную причину развития данной патологии не установлено, но выделено ряд этиологических факторов, которые способствуют развитию болезни:
• гормональный дисбаланс;
• частые психоэмоциональные нагрузки;
• злоупотребление алкоголем и никотином;
• неблагоприятные экологические факторы.
Фармацевтическая промышленность постоянно работает над изобретением качественных и эффективных препаратов для лечения данной патологии. Одним из современных терапевтических средств для лечения гиперплазии предстательной железы является препарат Аводарт, который не только устраняет беспокоящие пациента симптомы, но и эффективно воздействует на первопричину развития недуга.
Фармакологические свойства
Дигидротестостерон – это один из главных мужских половых гормонов, который отвечает за гиперплазию тканей простаты. Для нормализации уровня данного гормона в крови пациента применяют препарат Аводарт, который является селективным ингибитором 5- α редуктазы, ответственной за трансформацию тестостерона в 5 α–дигидротестостерон. Активнодействующее вещество Аводарта способно подавлять синтез и активность ферментов, участвующих в обменных процессах тестостерона.
Развитие стойкого терапевтического эффекта возможно после 7-14 дней регулярного приема лекарства. При правильно подобранной дозе Аводарта и регулярном ее употреблении предстательная железа сокращается в объеме, нормализуется процесс мочеиспускания, предупреждается возникновение острой задержки мочи и исключается потребность в проведении оперативного вмешательства.
Состав и форма выпуска
Аводарт представлен в форме продолговатых капсул, изготовленных из мягкого желатина. На каждой капсульной оболочке нанесено обозначение GX CE2, а внутри содержится 0,5 мг активнодействующего вещества дутастерида. В качестве вспомогательных ингредиентов используют бутилгидрокситолуол и монодиглицерид каприловой кислоты. Желатиновые капсулы упакованы в контурно-ячеечный блистер по 10 штук. В оригинальной картонной упаковке содержится 30 или 90 капсул, а также инструкция от производителя.
Показания к назначению
Прямым показанием к применению данного медикаментозного средства является гиперплазия предстательной железы у мужчин доброкачественного характера. Данное лекарственное средство используют как для лечения, так и для профилактики недуга.
Стоит отметить, что перед началом лечения пациенту необходимо сдать ряд анализов и пройти инструментальные исследования для уточнения природы опухоли. В случае если она не является доброкачественной, то лечение будет проводиться другими методами под контролем онкологов.
Противопоказания к лечению препаратом
Противопоказанием к назначению Аводарта является индивидуальная гиперчувствительность к активнодействующим или вспомогательным компонентам, а также женский пол и детский возраст пациента.
Также стоит учитывать тот факт, что активный метаболизм дутастерида происходит в печени. Поэтому, пациенты, имеющие в анамнезе заболевание гепатобилиарной системы, принимают данное лекарство с особой осторожностью.
Особенности назначения при беременности
Назначение средства во время беременности или кормления грудью исключено по той лишь причине, что данный препарат не предназначен для лечения болезней женского организма.
Особенности и способ приема
Точную дозу лекарственного средства, необходимую для нормализации гормонального фона мужского организма, определяет лечащий врач, опираясь на результаты полученных лабораторных анализов и заключения инструментальных исследований.
Данное лекарственное средство может использоваться как препарат для монотерапии, так и в виде составляющей комплексного лечения ДГПЖ. Для получения более выраженного терапевтического эффекта Аводарт часто сочетают с препаратами, содержащими тамсулозин.
Стандартная схема назначения, которую также рекомендует производитель в инструкции по применению, предусматривает каждодневный однократный прием 1 капсулы. У некоторых пациентов было отмечено раздражение слизистой оболочки рта после раскусывания капсулы. По этой причине, для исключения раздражения слизистой оболочки ЖКТ, капсулу рекомендуется глотать целиком, запивая достаточным количеством воды.
Пациенты преклонного возраста, а также те, кто имеет в анамнезе нефропатическую недостаточность, не требуют корректировки дозы и могут также принимать по 1 капсуле лекарства Аводарт в сутки.
Ощутимый результат от приема медикамента можно заметить спустя 7 дней после начала терапии, но для достижения выраженного и стойкого терапевтического результата курс лечения не должен быть меньше 6 месяцев. В зависимости от степени тяжести болезни и особенностей организма пациента, лечащий врач может провести коррекцию курса.
Побочное действие лекарства
Согласно клиническим исследованиям, а также опыту применения данного лекарства среди мужчин разной возрастной категории установлено, что Аводарт хорошо переносится пациентами как в качестве монопрепарата для лечения ДГПЖ, так и составе комплексной терапии. Стоит отметить, что сообщения о наличии побочных эффектов также есть. В редких случаях пациенты отмечали, что на фоне терапии появлялись такие неблагоприятные симптомы, как:
• импотенция;
• снижение влечения к женскому полу;
• нарушение процесса эякуляции.
Пациента необходимо предупредить о возможных побочных эффектах, дабы не нанести ему психологическую травму во время самой терапии. Учитывая то, что данный препарат влияет на гормональный фон мужского организма, в единичных случаях сообщалось о том, что на фоне терапии ДГПЖ развивалась у мужчин гинекомастия, то есть увеличивались и болели грудные железы.
При приеме необходимо следовать всем рекомендациям инструкции. При появлении неблагоприятных симптомов необходимо сообщить об этом лечащему врачу, дабы скорректировать курс лечения.
При одновременном применении препарата Аводарт и тамсулозина, возрастает риск развития гипотонии, головокружения и головной боли.
Также возможно развитие побочных эффектов со стороны иммунной системы, в виде кожной сыпи, зуда, отека тканей, анафилактического шока. При появлении подобных симптомов необходимо провести курс десенсибилизирующей терапии.
Женщинам и детям необходимо остерегаться контакта с содержимым капсулы, так как даже при наружном нанесении на кожные покровы, дутастерид может всасываться в кровяное русло. При попадании активнодействующего вещества на кожные покровы, необходимо промыть их большим количеством воды с мылом.
Совместимость с алкоголем
Учитывая то, что Аводарт предназначен для лечения мужских заболеваний, то у пациентов часто возникает вопрос о совместимости лекарственного средства с алкоголем. Врачи не рекомендуют одновременно употреблять капсулы Аводарт и напитки, содержащие алкоголь, так как взаимодействие этих веществ может иметь неблагоприятный результат для общего состояния здоровья. При этом больше всего риску поддается печень и половая система мужского организма.
Взаимодействие с другими лекарствами
Что делать при передозировке?
Условия продажи
В аптечной сети данное лекарственное средство представлено от двух производителей:
• Каталент Франс Байнхайм, Франция;
• ГласкаСмитКляйн Фармасьютиклс С.А., Польша.
Отпускает из аптеки по рецепту врача.
Как хранить
Срок хранения лекарственного вещества составляет 4 года с даты производства. По истечению 48 месяцев, остатки лекарства утилизируют, так как они уже непригодны к применению. Сохранять препарат рекомендуется в темном прохладном месте, где температура окружающей среды не превышала бы 24-25 С. Оригинальная упаковка и инструкция по применению также хранится вместе с препаратом. Необходимо четко следить за тем, чтобы лекарство сохранялось вне досягаемости детей, так как это может быть опасным для их здоровья.
Аналоги
При отсутствии препарата Аводарт в аптечной сети, заменяют аналогом этой же фармацевтической группы:
• Урофин;
• Финпрос;
• Зерлон;
• Пенестер.
Замена лекарственного средства на его аналог должна быть одобрена лечащим врачом. Самолечение недопустимо, так как последствия могут быть плачевными как для здоровья, так и для последующей жизни в целом.
Цены на Аводарт в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 2 229 руб.
Сертификаты и лицензии
Аводарт — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛС-000052
Торговое наименование препарата:
Аводарт® (Avodart®)
Международное непатентованное наименование:
Дутастерид (Dutasteride)
Лекарственная форма:
капсулы
Состав:
1 капсула содержит:
| Наименование компонентов | Количество в 1 капсуле, мг |
| Действующее вещество | |
| Дутастерид | 0,5 |
| Вспомогательные вещества | |
| Моно-ди-глицериды каприловой/ каприновой кислоты (МДК) | 349,5 |
| Бутилгидрокситолуол | 0,035 |
| Масса содержимого капсулы | 350 |
| Оболочка капсулы | |
| Желатин | 144,8 |
| Глицерин (глицерол) | 70,8 |
| Титана диоксид | 1,78 |
| Железа оксид жёлтый | 0,127 |
| Приблизительная масса капсулы | 218 |
| Технологические добавки | |
| Триглицериды среднецепочечные (ТСЦ) | qs |
| Лецитин | qs |
Описание:
Мягкая, продолговатая, непрозрачная, желтая желатиновая капсула, промаркированная кодом «GX CE2».
Фармакотерапевтическая группа:
Двойной ингибитор 5α-редуктазы.
Код АТХ:
G04СВ02
Фармакологические свойства
Фармакодинамика
Механизм действия
Дутастерид — двойной ингибитор 5α-редуктазы. Он подавляет активность изоферментов 5α-редуктазы 1 -го и 2-го типов, под действием которых происходит превращение тестостерона в дигидротестостерон (ДГТ) — основной андроген, обуславливающий гиперплазию железистой ткани предстательной железы.
Фармакодинамические свойства
Максимальное влияние суточных доз дутастерида на снижение концентрации ДГТ является дозозависимым и наблюдается в течение 1-2 недель. Через 1 и 2 недели приема дутастерида в дозе 0,5 мг в сутки средние значения концентраций ДГТ в сыворотке крови снижались на 85 % и 90 % соответственно. У пациентов с доброкачественной гиперплазией предстательной железы (ДГПЖ), получавших 0,5 мг дутастерида в сутки, среднее снижение концентрации ДГТ составило 94 % через 1 год и 93 % через 2 года, среднее увеличение концентрации тестостерона в сыворотке крови составило 19 % как через 1 год, так и через 2 года. Это является ожидаемым последствием ингибирования 5α-редуктазы и не приводит ни к одному из известных нежелательных явлений.
Фармакокинетика
Всасывание
После приема одной дозы дутастерида (0,5 мг) максимальная концентрация в сыворотке крови достигается в течение 1-3 часов.
Абсолютная биодоступность дутастерида у мужчин составляет около 60 % по отношению к 2-х часовой внутривенной инфузии. Биодоступность дутастерида не зависит от приема пищи.
Распределение
Фармакокинетические данные, полученные после однократного и многократного приема дутастерида внутрь, свидетельствуют о большом объеме его распределения (от 300 до 500 л). Дутастерид обладает высокой степенью связывания с белками плазмы крови (более 99,5 %).
При ежедневном приеме концентрация дутастерида в сыворотке крови достигает 65 % от равновесной концентрации через 1 месяц и примерно 90 % от равновесной концентрации через 3 месяца. Равновесные концентрации дутастерида в сыворотке крови (Css), составляющие примерно 40 нг/мл, достигаются через 6 месяцев однократного ежедневного приема 0,5 мг дутастерида. В сперме, как и в сыворотке крови, равновесные концентрации дутастерида также достигаются через 6 месяцев. Через 52 недели лечения концентрации дутастерида в сперме составляют в среднем 3,4 нг/мл (от 0,4 до 14 нг/мл). Из сыворотки крови в сперму попадает в среднем 11,5 % дутастерида.
Метаболизм
In vitro дутастерид метаболизируется изоферментом CYP3A4 системы цитохрома Р450 человека до двух минорных моногидроксилированных метаболитов; изоферменты CYP1A2, CYP2A6, CYP2E1, CYP2C8, CYP2C9, CYP2C19, CYP2B6 или CYP2D6 в метаболизме дутастерида не участвуют. После достижения равновесной концентрации дутастерида в сыворотке крови с помощью масс-спектрометрического метода были выявлены неизмененный дутастерид, 3 основных метаболита (4′-гидроксидутастерид, 1,2-дигидродутастерид и 6-гидроксидутастерид) и 2 минорных метаболита (6,4′-дигидроксидутастерид и 15-гидроксидутастерид). 5 метаболитов дутастерида, обнаруженных в сыворотке крови человека, были выявлены в сыворотке крови крыс, при этом стереохимия гидроксильных групп в положениях 6 и 15 метаболитов у человека и крыс неизвестна.
Выведение
Дутастерид подвергается интенсивному метаболизму. После приема внутрь дутастерида в суточной дозе 0,5 мг до достижения равновесной концентрации у человека от 1,0 % до 15,4 % (в среднем 5,4 %) принятой дозы экскретируется через кишечник в неизмененном виде. Остальная часть экскретируется через кишечник в виде 4 основных метаболитов, составляющих 39 %, 21 %, 7 % и 7 % соответственно, и 6 минорных метаболитов (на долю каждого из которых приходится менее 5 %).
В моче человека обнаруживаются только следовые количества неизмененного дутастерида (менее 0,1 % дозы). При низкой концентрации в сыворотке крови (менее 3 нг/мл) дутастерид выводится быстро обоими способами, как зависимыми от концентрации, так и не зависимыми от концентрации. При приеме однократной дозы дутастерида 5 мг или менее наблюдался быстрый клиренс с коротким периодом полувыведения от 3 до 9 дней.
При концентрации в сыворотке крови более 3 нг/мл дутастерид выводится медленно (от 0,35 до 0,58 л/ч), в основном линейно, независимо от концентрации, с конечным периодом полувыведения от 3 до 5 недель. При приеме терапевтических доз дутастерида его конечный период полувыведения составляет 3-5 недель, после многократного приема в дозе 0,5 мг/сутки доминирует более медленный клиренс, и общий клиренс носит линейный и независимый от концентрации характер. Дутастерид обнаруживается в сыворотке крови (в концентрациях выше 0,1 нг/мл) в течение 4-6 месяцев после прекращения лечения.
Особые группы пациентов
Пациенты пожилого возраста
Фармакокинетику и фармакодинамику дутастерида изучали у 36 здоровых добровольцев-мужчин в возрасте от 24 лет до 87 лет после приема одной дозы (5 мг) дутастерида. Между разными возрастными группами не было выявлено статистически значимых различий в отношении экспозиции дутастерида, представленной такими фармакокинетическими параметрами, как площадь под фармакокинетической кривой (AUC) и максимальная концентрация в плазме крови (Cmax). Также не установлены статистически значимые различия для значений периода полувыведения (Т½) дутастерида между возрастными группами мужчин 50-69 лет и старше 70 лет, к которым относится большинство мужчин с ДГПЖ. Между различными возрастными группами не выявлены отличия в действии препарата, определяемом по степени снижения концентрации ДГТ. Представленные результаты указывают на отсутствие необходимости коррекции дозы дутастерида в зависимости от возраста пациентов.
Пациенты с нарушением функции почек
Влияние нарушения функции почек на фармакокинетику дутастерида не исследовалось. Однако менее 0,1 % равновесной концентрации дутастерида (при приеме дозы дутастерида 0,5 мг) выделяется у человека почками, таким образом, нет необходимости в коррекции дозы при нарушении функции почек.
Пациенты с нарушением функции печени
Влияние нарушения функции печени на фармакокинетику дутастерида не исследовалось.
Показания к применению
Препарат Аводарт® назначают пациентам:
- в качестве монотерапии для лечения и профилактики прогрессирования доброкачественной гиперплазии предстательной железы посредством уменьшения ее размеров, облегчения симптомов, улучшения мочеиспускания, снижения риска возникновения острой задержки мочи и необходимости оперативного вмешательства;
- в качестве комбинированной терапии с α1-адреноблокаторами для лечения и профилактики прогрессирования доброкачественной гиперплазии предстательной железы посредством уменьшения ее размеров, облегчения симптомов, улучшения мочеиспускания, снижения риска возникновения острой задержки мочи и необходимости оперативного вмешательства. В основном изучалась комбинация дутастерида и α1-адреноблокатора тамсулозина.
Противопоказания
Препарат Аводарт® противопоказан пациентам с гиперчувствительностью к дутастериду или любому компоненту препарата и другим ингибиторам 5α-редуктазы. Применение дутастерида противопоказано женщинам и детям.
С осторожностью
Печеночная недостаточность.
Применение при беременности и в период грудного вскармливания
Фертильность
Влияние дутастерида в суточной дозе 0,5 мг на характеристики спермы изучалось у здоровых добровольцев в возрасте 18-52 лет. К 52-й неделе лечения в группе пациентов, получавших дутастерид, средние значения процентного снижения общего количества сперматозоидов, объема спермы и двигательной активности сперматозоидов составляли 23 %, 26 % и 18 %, соответственно, по сравнению с исходным уровнем в группе пациентов, получавших плацебо. Концентрация сперматозоидов и их морфология не изменялись. Через 24 недели наблюдения среднее значение процентного изменения общего количества сперматозоидов в группе дутастерида оставалось на 23 % ниже по сравнению с исходным уровнем. Среднее значение для всех параметров спермы во всех временных точках оставалось в пределах нормы и не соответствовало заданным критериям для клинически значимого изменения (30 %), на 52-й неделе лечения у двух добровольцев в группе дутастерида общее количество сперматозоидов снижалось более чем на 90 % по сравнению с исходным уровнем, с частичным восстановлением на 24-й неделе наблюдения. Таким образом, клиническое значение влияния дутастерида на показатели спермы и на индивидуальную фертильность пациента неизвестно.
Беременность
Дутастерид противопоказан женщинам. Дутастерид не изучался у женщин, так как доклинические данные свидетельствуют о том, что подавление уровня ДГТ может вызывать торможение развития наружных половых органов у плода мужского пола.
Лактация
Нет данных о проникновении дутастерида в грудное молоко.
Способ применения и дозы
Препарат Аводарт® можно применять независимо от приема пищи.
Капсулы следует глотать целиком, не разжевывать, не открывать, поскольку содержимое капсулы может вызывать раздражение слизистой ротоглотки.
ДГПЖ
Взрослые мужчины (включая пожилых)
Рекомендуемая доза препарата Аводарт® — одна капсула (0,5 мг) один раз в сутки перорально. Капсулы следует принимать целиком.
Хотя улучшение на фоне применения препарата наступает довольно быстро, лечение следует продолжать не менее 6 месяцев для того, чтобы объективно оценить терапевтический эффект.
Для лечения ДГПЖ препарат Аводарт® может быть назначен в качестве монотерапии или в комбинации с α1 -адреноблокаторами.
Особые группы пациентов
Пациенты с нарушениями функции почек
При приеме 0,5 мг препарата Аводарт® в сутки через почки выделяется менее 0,1 % дозы, поэтому нет необходимости снижать дозу у пациентов с нарушениями функции почек.
Пациенты с нарушениями функции печени
В настоящее время нет данных по применению препарата Аводарт® у пациентов с нарушениями функции печени. Так как дутастерид подвергается интенсивному метаболизму, а его период полувыведения составляет 3-5 недель, необходимо соблюдать осторожность при лечении препаратом Аводарт® пациентов с нарушениями функции печени.
Побочное действие
Нежелательные явления, представленные ниже, перечислены по системам организма и в соответствии с частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (>1/10), часто (>1/100 и <1/10), нечасто (>1/1 000 и <1/100), редко (>1/10 000 и <1/1 000), очень редко (<1/10 000, включая отдельные случаи). Категории частоты были сформированы на основании пострегистрационного наблюдения.
Частота встречаемости нежелательных явлений, сформированная на основании пострегистрационного наблюдения
Со стороны иммунной системы
Очень редко: аллергические реакции (включая сыпь, зуд, крапивницу, локализованный отек) и ангионевротический отек.
Со стороны кожи и подкожно-жировой клетчатки
Редко: алопеция (преимущественно потеря волос на теле) или гипертрихоз.
Нарушение психики
Очень редко: депрессивное состояние.
Со стороны репродуктивной системы и грудных желез
Очень редко: тестикулярная боль, тестикулярный отек.
Частота встречаемости нежелательных явлений, сформированная на основании данных клинических исследований (нежелательные явления, связанные применением дутастерида в качестве монотерапии)
В третьей фазе плацебо-контролируемых исследований с применением дутастерида по сравнению с плацебо исследователи оценивали нежелательные явления, связанные с приемом дутастерида:
| Нежелательное явление | Возникновение нежелательного явления в 1-й год применения |
Возникновение нежелательного явления во 2-й год применения |
||
| Плацебо (n = 2158) |
Дутастерид (n = 2167) |
Плацебо (n = 1736) |
Дутастерид (n = 1744) |
|
| Эректильная дисфункция2 | 3% | 6% | 1% | 2% |
| Снижение либидо2 | 2% | 4% | <1% | <1% |
| Нарушение эякуляции2 | <1% | 2% | <1% | <1% |
| Нарушения со стороны грудных желез1 | <1% | 1% | <1% | 1% |
1 — включая болезненность и увеличение грудных желез.
2 — нежелательные явления со стороны репродуктивной системы и грудных желез, связанные с применением дутастерида (как при монотерапии, так и в комбинации с тамсулозином). Данные нежелательные явления могут сохраняться после прекращения лечения и влияние дутастерида на сохранение данных нежелательных явлений неизвестно.
Нежелательные явления, связанные с применением дутастерида в комбинации с тамсулозином
Представленные ниже нежелательные явления были зарегистрированы в исследовании CombAT (сравнение .приема дутастерида 0,5 мг и тамсулозина 0,4 мг один раз в сутки в качестве монотерапии или в виде комбинации в течение четырех лет) и оценены исследователями с кумулятивным эффектом >1%).
| Нежелательное явление | Возникновение нежелательного явления во время периода применения тамсулозина в комбинации с дутастеридом | |||
| 1-й год | 2-й год | 3-й год | 4-й год | |
| Комбинация1(n)
|
(n = 1610) (n = 1623) (n = 1611) |
(n = 1428) (n = 1464) (n = 1468) |
(n = 1283) (n = 1325) (n = 1281) |
(n = 1200) (n = 1200) (n = 1112) |
| Эректильная дисфункция3
|
6% 5% 3% |
2% 2% 1% |
<1% <1% <1% |
<1% <1% 1% |
| Снижение либидо3
|
5% 4% 2% |
<1% 1% <1% |
<1% <1% <1% |
0% 0% <1% |
| Нарушение эякуляции3
|
9% 1% 3% |
1% <1% <1% |
<1% <1% <1% |
<1% <1% <1% |
| Нарушения со стороны грудных желез2
|
2% 2% <1% |
<1% 1% <1% |
<1% <1% <1% |
<1% <1% 0% |
| Головокружение
|
1% <1% 1% |
<1% <1% <1% |
<1% <1% <1% |
<1% <1% 0% |
1 — комбинация = дутастерид 0,5 мг один раз в сутки + тамсулозин 0,4 мг один раз в сутки;
2 — включая болезненность и увеличение молочных желез;
3 — нежелательные явления со стороны репродуктивной системы и грудных желез, связанные с применением дутастерида (как при монотерапии, так и в комбинации с тамсулозином). Данные нежелательные явления могут сохраняться после прекращения лечения. Влияние дутастерида на сохранение данных нежелательных явлений неизвестно.
Передозировка
При назначении дутастерида до 40 мг/день однократно (в 80 раз выше терапевтической дозы) в течение 7 дней значимых побочных эффектов не отмечалось. При проведении клинических исследований пациенты в течение 6 месяцев получали дутастерид в дозе 5 мг ежедневно, при этом каких-либо дополнительных побочных эффектов к тем, что наблюдались на фоне приема 0,5 мг дутастерида, обнаружено не было. Специфического антидота дутастерида нет, поэтому при подозрении на передозировку достаточно проводить симптоматическое и поддерживающее лечение.
Взаимодействие с другими лекарственными средствами
In vitro дутастерид метаболизируется изоферментом CYP3A4 системы цитохрома Р450 человека. Следовательно, в присутствии ингибиторов CYP3A4 концентрации дутастерида в крови могут возрастать. При одновременном применении дутастерида с ингибиторами CYP3A4 верапамилом и дилтиаземом отмечается снижение клиренса дутастерида. Вместе с тем, амлодипин, другие блокаторы кальциевых каналов при одновременном применении с дутастеридом не уменьшает клиренс дутастерида. Уменьшение клиренса дутастерида и последующее повышение его концентрации в крови в присутствии ингибиторов CYP3A4 не является клинически значимым вследствие широкого диапазона границ безопасности дутастерида, поэтому нет необходимости корректировать его дозу.
In vitro дутастерид не метаболизируется следующими изоферментами системы цитохрома Р450 человека: CYP1A2, CYP2A6, CYP2E1, CYP2C8, CYP2C9, CYP2C19, CYP2B6 или CYP2D6.
Дутастерид не ингибирует in vitro ферменты системы цитохрома Р450 человека, участвующие в метаболизме лекарственных препаратов.
In vitro дутастерид не вытесняет варфарин, аценокумарол, фенпрокумон, диазепам и фенитоин из участков их связывания с белками плазмы, а эти препараты, в свою очередь, не вытесняют дутастерид. При проведении исследований взаимодействия дутастерида с тамсулозином, теразозином, варфарином, дигоксином и колестирамином у человека каких-либо клинически значимых фармакокинетических или фармакодинамических взаимодействий не отмечалось.
При применении дутастерида одновременно с гиполипидемическими препаратами, ингибиторами АПФ, бета-адреноблокаторами, блокаторами кальциевых каналов, кортикостероидами, диуретиками, нестероидными противовоспалительными препаратами, ингибиторами фосфодиэстеразы V-го типа и хинолоновыми антибиотиками каких-либо значимых нежелательных лекарственных взаимодействий не наблюдалось.
Особые указания
Рак предстательной железы (РПЖ)
В 4-летнем исследовании участвовали более 8000 мужчин в возрасте от 50 до 75 лет, характеризующихся отрицательным результатом биопсии на наличие РПЖ и концентрацией ПСА между 2,5 нг/мл и 10,0 нг/мл (исследование REDUCE) при первичном обследовании, при этом у 1517 из них был диагностирован РПЖ. Зарегистрировано больше случаев РПЖ с оценкой 8-10 баллов по шкале Глисона в группе дутастерида (n = 29; 0,9 %) по сравнению с группой плацебо (n = 19; 0,6 %). Не отмечалось увеличения количества случаев РПЖ с оценкой 5-6 и 7-10 баллов по шкале Глисона. Причинно-следственная связь между приемом дутастерида и развитием РПЖ высокой степени градации не установлена. Клиническое значение количественного дисбаланса неизвестно. Мужчины, принимающие дутастерид, должны регулярно проходить обследования в отношении оценки риска развития РПЖ, включая определение концентрации ПСА. В дополнительном 2-летнем исследовании, направленном на последующее наблюдение пациентов из исследования REDUCE по химиопрофилактике, новые случаи РПЖ диагностировались редко (дутастерид (n = 14, 1,2 %) и плацебо (n = 7, 0,7 %)), новые случаи РПЖ с оценкой 8-10 баллов по шкале Глисона отсутствовали.
Долгосрочные наблюдения (до 18 лет) в исследовании по химиопрофилактике с помощью другого ингибитора 5α-редуктазы (финастерид) не выявили статистически значимое различие в применении финастерида и плацебо по показателям общей выживаемости (ОР 1,02, 95 % ДИ 0,97-1,08) или выживаемости после подтверждения диагноза РПЖ (ОР 1,01, 95 % ДИ 0,85-1,20).
Простат-специфический антиген (ПСА)
Определение концентрации ПСА является важным компонентом скрининга, направленного на выявление РПЖ. После 6-месячной терапии дутастеридом средняя концентрация ПСА в сыворотке крови снижается примерно на 50 %.
Для пациентов, принимающих дутастерид, должна быть установлена новая базовая концентрация ПСА после 6 месяцев терапии. После этого рекомендуется регулярное мониторирование концентрации ПСА. Любое подтвержденное повышение концентрации ПСА относительно наименьшего его значения при лечении дутастеридом может свидетельствовать о развитии РПЖ или о несоблюдении режима терапии препаратом и должно подвергаться тщательной оценке, даже если эти концентрации ПСА остаются в пределах нормальных значений для мужчин, не принимающих ингибиторы 5α-редуктазы. При интерпретации значений концентрации ПСА у пациентов, принимающих дутастерид, необходимо использовать для сравнения предыдущие результаты оценки концентрации ПСА.
Применение дутастерида не влияет на диагностическую ценность определения концентрации ПСА как маркера РПЖ после того, как установлена новая базовая концентрация ПСА.
Концентрация общего ПСА в сыворотке крови возвращается к исходному значению в течение 6 месяцев после отмены дутастерида.
Отношение концентрации свободного ПСА к общему остается постоянным даже на фоне терапии дутастеридом. Если для выявления РПЖ у мужчин, получающих дутастерид, дополнительно используется определение процентного содержания свободной фракции ПСА, не требуется проводить коррекцию этого показателя.
У пациентов необходимо проводить пальцевое ректальное исследование и использовать другие методы диагностики РПЖ до начала лечения дутастеридом, а также регулярно повторять обследование пациента в процессе лечения.
Побочные явления со стороны сердечно-сосудистой системы
В двух 4-летних клинических исследованиях частота развития сердечной недостаточности (обобщенный термин для наблюдавшихся событий, представленных в основном сердечной недостаточностью и застойной сердечной недостаточностью) была выше у пациентов, получавших комбинацию дутастерида и α1-адреноблокатора, главным образом тамсулозина, чем у пациентов, не получавших комбинированного лечения. В этих двух клинических исследованиях частота развития сердечной недостаточности оставалась низкой (<1 %) и варьировала между исследованиями. В целом различия между показателями частоты побочных явлений со стороны сердечно-сосудистой системы в обоих исследованиях не отмечались. Причинно-следственная связь между приемом дутастерида (в виде монотерапии или в комбинации с α1-адреноблокатора) и сердечной недостаточностью не установлена.
При мета-анализе 12 рандомизированных, контролируемых с помощью плацебо или препаратов сравнения клинических исследований (n = 18802), целью которого являлась оценка риска развития сердечно-сосудистых побочных явлений при применении дутастерида (по сравнению с контрольной группой), не выявлено соответствующего статистически значимого увеличения риска развития сердечной недостаточности (ОР 1,05, 95 % ДИ 0,71, 1,57), острого инфаркта миокарда (ОР 1,00, 95 % ДИ 0,77, 1,30) или инсульта (ОР 1,20, 95 % ДИ 0,88, 1,64).
Рак грудной железы
При проведении клинических исследований и в пострегистрационном периоде зарегистрированы редкие сообщения о развитии рака грудной железы у мужчин, принимающих дутастерид. Тем не менее, данные эпидемиологических исследований не свидетельствуют о повышении риска развития рака грудной железы у мужчин при применении ингибиторов 5α-редуктазы. Специалисты должны проинструктировать пациентов о необходимости немедленно сообщать о любых изменениях со стороны грудных желез, таких как уплотнения в железе или выделения из соска.
Утечка содержимого капсул
Дутастерид всасывается через кожу, поэтому женщины и дети должны избегать контакта с капсулами, у которых наблюдается утечка содержимого. В случае контакта с такими капсулами затронутую область следует немедленно промыть водой с мылом.
Нарушения функции печени
Влияние нарушений функции печени на фармакокинетику дутастерида не исследовалось. Поскольку дутастерид интенсивно метаболизируется и его период полувыведения составляет от 3 до 5 недель, следует с осторожностью назначать дутастерид пациентам с нарушением функции печени.
Влияние на способность управлять транспортными средствами и механизмами
Прием дутастерида не влияет на вождение автомобиля или работу с механизмами.
Форма выпуска
Капсулы, 0,5 мг.
По 10 капсул в ПВХ/ПВДХ/Al блистере. По 3 или 9 блистеров вместе с инструкцией по применению в пачку картонную.
Условия хранения
При температуре не выше 30°С.
Хранить в недоступном для детей месте.
Срок годности
4 года.
Не использовать после истечения срока годности.
Условия отпуска
По рецепту.
Производитель
Производитель (выпускающий контроль качества)
«ГлаксоСмитКляйн Фармасьютикалз С.А.» / GlaxoSmithKline Pharmaceuticals S.A.
улица Грюнвальдска, 189, 60-322, Познань, Польша / ul. Grunwaldzka, 189, 60-322, Poznan, Poland
Наименование и адрес держателя или владельца регистрационного удостоверения лекарственного препарата
АО «ГлаксоСмитКляйн Трейдинг», Россия
125167, г. Москва, Ленинградский проспект, д. 37А, корпус 4, этаж 3, помещение XV, комната 1
Организация, принимающая претензии по качеству лекарственного препарата и сообщения о нежелательных реакциях:
АО «ГлаксоСмитКляйн Трейдинг», Россия
125167, г. Москва, Ленинградский проспект, д. 37А, корпус 4, этаж 3, помещение XV, комната 1
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Фармакодинамика
Дутастерид снижает циркулирующие уровни дигидротестостерона (ДГТ) путем подавления активности изоферментов 5-α-редуктазы 1 и 2 типа, которые ответственны за превращение тестостерона в ДГТ.
В режиме монотерапии
Влияние на концентрацию дигидротестостерона (ДГТ) /тестостерона
Влияние ежедневного приема препарата Аводарт™ на снижение уровня ДГТ является дозозависимым и отмечается через 1-2 недели (снижение на 85 и 90% соответственно).
У пациентов с доброкачественной гиперплазией предстательной железы (ДГПЖ), получавших дутастерид в дозе 0,5 мг/сутки, медиана снижения концентрации ДГТ в сыворотке составила 94% через 1 год терапии и 93% через 2 года терапии, а медиана увеличения концентрации тестостерона в сыворотке составила 19% через 1 и 2 года терапии.
Влияние на объем предстательной железы
Значительное уменьшение объема предстательной железы обнаруживается уже через один месяц после начала лечения и продолжается по 24-ый месяц (р < 0,001). На 12-ый месяц лечения применение препарата Аводарт™ привело к среднему сокращению объема предстательной железы на 23,6% (с 54,9 мл на исходном уровне до 42,1 мл), в то время как в группе плацебо среднее сокращение объема составило 0,5% (с 54,0 мл до 53,7 мл). Существенное (р < 0,001) уменьшение также имело место в переходной зоне предстательной железы уже после одного месяца терапии, оно продолжалось по 24-ый месяц; через 12 месяцев среднее сокращение объема переходной зоны предстательной железы в группе терапии препаратом Аводарт™ составило 17,8% (с 26,8 мл на исходном уровне до 21,4 мл), при этом в группе плацебо имело место увеличение объема в среднем на 7,9% (с 26,8 мл до 27,5 мл). Сокращение объема предстательной железы, наблюдавшееся в течение первых двух лет двойной слепой терапии, сохранилось на протяжении дополнительных двух лет терапии в ходе расширенных открытых исследований. Уменьшение размеров предстательной железы ведет к облегчению симптомов и к снижению риска острой задержки мочи (ОЗМ) и хирургического вмешательства в связи с ДГПЖ.
Клиническая эффективность и безопасность
Применение препарата Аводарт™ в дозе 0,5 мг/сутки изучалось в сравнении с плацебо на примере 4325 испытуемых мужского пола с ДГПЖ с симптомами в степени от умеренной до тяжелой, с объемом предстательной железы ≥30 мл и с концентрацией ПСА в пределах 1,5-10 нг/мл в ходе трех двухгодичных многоцентровых международных плацебо-контролируемых двойных слепых первичных исследований эффективности. Данные клинические исследования были продлены до четырёх лет за счет дополнительного периода открытой терапии, при этом все пациенты, оставшиеся в исследовании, продолжали получать ту же самую дозу 0,5 мг. По прошествии 4 лет из первоначально рандомизированных пациентов в группе плацебо и в группе дутастерида осталось 37 и 40% испытуемых соответственно. Большинство (71%) из 2340 испытуемых в дополнительных периодах с открытой терапией получали лечение в течение двух дополнительных лет.
Наиболее важными параметрами клинической эффективности были: индекс симптомов американской урологической ассоциации (AUA-SI), максимальная скорость мочеиспускания (Qmax), частота случаев острой задержки мочи и хирургического вмешательства в связи с ДГПЖ.
Максимальное значение индекса AUA-SI, определяемого с помощью опросника для оценки симптомов, связанных с ДГПЖ, из семи пунктов, составляет 35 баллов. Исходное среднее значение индекса составляло примерно 17 баллов. По прошествии шести месяцев, одного года и двух лет терапии улучшение индекса в группе плацебо составляло 2,5, 2,5 и 2,3 балла соответственно, а в группе лекарственного средства Аводарт™
3,2, 3,8 и 4,5 балла соответственно. Различия между группами терапии были статистически значимыми. Улучшение индекса AUA-SI, наблюдавшееся в течение первых двух лет двойной слепой терапии, сохранилось на протяжении еще двух лет в ходе расширенных открытых исследований.
Qmax (максимальная скорость мочеиспускания)
Среднее значение Qmax в клинических исследованиях на исходном уровне было около 10 мл/сек (нормальное значение Qmax ≥15 мл/сек). По прошествии одного года и двух лет терапии скорость мочеиспускания увеличилась в группе плацебо на 0,8 и 0,9 мл/сек соответственно, а в группе лекарственного средства Аводарт™ на 1,7 и 2,0 мл/сек соответственно. Различия между двумя группами терапии на отрезке времени с 1-го по 24-ый месяц было статистически значимым. Увеличение максимальной скорости мочеиспускания, наблюдавшееся в течение первых двух лет двойной слепой терапии, сохранилось на протяжении еще двух лет в ходе расширенных открытых исследований.
Острая задержка мочи и хирургическое вмешательство
По прошествии двух лет терапии частота случаев ОЗМ в группе плацебо составляла 4,2%, а в группе лекарственного средства Аводарт™ 1,8% (снижение риска на 57%). Данное различие является статистически значимым, оно означает, что лечение 42 (95% ДИ 30-73) пациентов препаратом Аводарт™ на протяжении двух лет предотвращает один случай ОЗМ.
После двух лет терапии частота случаев хирургического вмешательства в связи с ДГПЖ в группе плацебо составляла 4,1%, а в группе лекарственного средства Аводарт™ 2,2% (снижение риска на 48%). Данное различие является статистически значимым, оно означает, что лечение 51 пациента (95% ДИ 33-109) препаратом Аводарт™ на протяжении двух лет позволяет избежать одного хирургического вмешательства.
Распределение волосяного покрова
В рамках реализации программы клинических исследований Фазы III влияние дутастерида на распределение волосяного покрова официально не изучалось; вместе с тем, применение ингибиторов 5-α-редуктазы может снизить потерю волос и способствовать их росту у пациентов с облысением мужского типа (мужская андрогенная алопеция).
Функция щитовидной железы
Влияние на функцию щитовидной железы изучалось в ходе годичного клинического исследования с участием здоровых мужчин. После одного года терапии дутастеридом показатели уровня несвязанного тироксина не изменились, в то же время в сравнении с плацебо уровень тиреостимулирующего гормона (ТСГ) незначительно увеличился (на 0,4 мкМЕ/мл). Вместе с тем, поскольку показатели уровня ТСГ варьировались, причем диапазон медианных значений уровня ТСГ (1,4-1,9 мкМЕ/мл) находился в пределах нормы (0,5 — 5/6 мкМЕ/мл), а показатели концентрации тироксина были устойчивыми в пределах нормы и схожими при применении плацебо и дутастерида, указанные изменения уровня ТСГ были расценены как клинически незначимые. Результаты всех клинических исследований свидетельствуют об отсутствии отрицательного влияния дутастерида на функцию щитовидной железы.
Новообразования молочной железы
В двухлетних клинических исследованиях с продолжительностью применения дутастерида 3374 пациенто-лет по состоянию на момент перехода участников в 2-летнее расширенное (дополнительное) открытое исследование случаи рака молочной железы у мужчин были отмечены у 2 пациентов в группе дутастерида и у 1 пациента в группе плацебо. В клинических исследованиях CombAT и REDUCE, проводившихся на протяжении 4 лет, случаи рака молочной железы не были отмечены ни в одной группе терапии, при этом воздействие дутастерида составило 17489 пациенто-лет, а воздействие комбинации тамсулозина и дутастерида — 5027 пациенто-лет.
В двух эпидемиологических исследованиях типа случай-контроль, одно из которых было проведено в США (n = 339 случаев рака грудной железы и n = 6780 контрольных случаев), а другое в базе данных здравоохранения Великобритании (n = 398 случаев рака грудной железы и n = 3930 контрольных случаев) не было продемонстрировано увеличения риска развития рака грудной железы у мужчин при применении ингибиторов 5-α-редуктазы (см. раздел «Меры предосторожности»). Результаты первого исследования не выявили положительной связи между раком грудной железы у мужчин (относительный риск для ≥ 1 года применения до постановки диагноза рака грудной железы по сравнению с < 1 годом применения: 0,70: 95 % ДИ 0,34; 1,45). Во втором исследовании оцененное отношение шансов для рака грудной железы, связанного с применением ингибиторов 5-α-редуктазы, по сравнению с отсутствием применения составляло 1,08: 95 % ДИ 0,62; 1,87.
Взаимосвязь между длительным применением дутастерида и раком грудной железы у мужчин не установлена.
Влияние на мужскую фертильность
Влияние дутастерида в дозе 0,5 мг/сутки на свойства спермы изучалось в исследовании с участием здоровых добровольцев в возрасте от 18 до 52 лет (n = 27 в группе дустастерида; n = 23 в группе плацебо) на протяжении 52 недель терапии и 24 недель последующего наблюдения. Через 52 недели лечения средние показатели процентного уменьшения общего количества сперматозоидов, объема спермы и подвижности сперматозоидов с корректировкой по изменению от исходного уровня в группе плацебо составляли 23, 26 и 18% соответственно. Изменение концентрации и морфологии сперматозоидов не отмечалось. Через 24 недели последующего наблюдения среднее процентное изменение общего количества сперматозоидов в группе дутастерида оставалось на 23% ниже исходного показателя. При том, что средние значения всех параметров во всех отметках времени оставались в пределах нормы и не соответствовали заранее определенным критериям клинически существенного изменения (30%), у двух пациентов в группе дутастерида через 52 недели терапии количество сперматозоидов уменьшилось более чем на 90% от исходного уровня, при этом через 24 недели последующего наблюдения было отмечено частичное восстановление. Возможность снижения мужской фертильности нельзя исключать.
В комбинации с альфа-адреноблокатором тамсулозином
В ходе многоцентрового международного рандомизированного двойного слепого клинического исследования в параллельных группах (исследование CombAT), в котором участвовали пациенты с симптомами ДГПЖ в степени от умеренной до тяжелой с объемом предстательной железы ≥30 мл и концентрацией ПСА в пределах 1,5-10 нг/мл, изучалось применение следующих препаратов: Аводарт™ 0,5 мг/сутки (n = 1623), тамсулозин 0,4 мг/сутки (n = 1611) и комбинация Аводарт™ 0,5 мг плюс тамсулозин 0,4 мг (n = 1610). Примерно 53% пациентов ранее получали терапию с применением ингибиторов 5-α-редуктазы или блокаторов α-адренорецепторов. Первичной конечной точкой в течение первых 2 лет терапии было изменение суммы баллов по международной шкале оценки простатических симптомов (IPSS) (шкала из 8 пунктов, основанная на AUA-SI с дополнительным вопросом по качеству жизни). Вторичные конечные точки, оценивавшиеся после 2 лет лечения, включали такие показатели, как максимальная скорость мочеиспускания (Qmax) и объем предстательной железы. В сравнении с группой лекарственного средства Аводарт™ и группой тамсулозина результаты в отношении IPSS, полученные в группе комбинированной терапии, были значимыми, начиная с отметок времени Месяц 3 и Месяц 9 соответственно. Результаты в отношении Qmax в группе комбинированной терапии были значимыми, начиная с отметки времени Месяц 6, в сравнении с группами лекарственного средства Аводарт™ и тамсулозина.
Первичной конечной точкой после 4 лет терапии было время до развития первого случая ОЗМ или хирургического вмешательства в связи с ДГПЖ. После 4 лет терапии снижение риска ОЗМ или хирургического вмешательства в связи с ДГПЖ в группе комбинированной терапии было статистически значимым (снижение риска на 65,8% при значении р < 0,001 [95% ДИ 54,7% — 74,1%]) в сравнении с результатом в группе монотерапии тамсулозином. Показатели частоты случаев ОЗМ и хирургического вмешательства в связи с ДГПЖ за 4 года в группе комбинированной терапии и в группе тамсулозина составили 4,2 и 11,9% соответственно (р < 0,001). По сравнению с группой монотерапии препаратом Аводарт™ в группе комбинированной терапии риск случаев ОЗМ и хирургического вмешательства в связи с ДГПЖ снизился на 19,6% (р = 0,18 [95% ДИ 10,9% — 41,7%]). Показатели частоты случаев ОЗМ и хирургического вмешательства в связи с ДГПЖ за 4 года в группе комбинированной терапии и в группе лекарственного средства Аводарт™ 4,2 и 5,2% соответственно.
Вторичные конечные точки, оценивавшиеся после 4 лет терапии, включали время до клинического прогрессирования (комбинированный показатель, включавший следующие составляющие: ухудшение, подтвержденное изменением суммы баллов по шкале IPSS на >4 балла, случаи ОЗМ, связанные с ДГПЖ, недержание мочи, инфекция мочевыводящих путей (ИМП) и почечная недостаточность); изменение суммы баллов по международной шкале оценки простатических симптомов (IPSS), изменение максимальной скорости мочеиспускания и объема предстательной железы. Результаты исследования после 4 лет терапии представлены далее.
|
Параметр |
Отметка времени |
Комбинация |
Аводарт™ |
Тамсулозин |
|
ОЗМ и хирургическое вмешательство в связи с ДГПЖ (%) |
Через 48 месяцев |
4,2 |
5,2 |
11,9а |
|
Клиническое прогрессирование* (%) |
48 месяцев |
12,6 |
17,8b |
21,5а |
|
IPSS (баллы) |
[Исходный уровень] 48 месяцев (изменение от исходного уровня) |
[16,6] -6,3 |
[16,4] -5,Зb |
[16,4] -3,8а |
|
Qmax (мл/с) |
[Исходный уровень] 48 месяцев (изменение от исходного уровня) |
[10,9] 2,4 |
[10,6] 2,0 |
[10,7] 0,7а |
|
Объем предстательной железы (мл) |
[Исходный уровень] 48 месяцев (изменение 07 исходного уровня) |
[54,7] -27,3 |
[54,6] -28,0 |
[55,8] +4,6а |
|
Объем переходной зоны предстательной железы (мл)# |
[Исходный уровень] 48 месяцев (изменение от исходного уровня) |
[27,7] -17,9 |
[30,3] -26,5 |
[30,5] 18,2а |
|
Индекс влияния ДГПЖ (BII) (баллы) |
[Исходный уровень] 48 месяцев (изменение от исходного уровня) |
[5,3] -2,2 |
[5,3] -1,8b |
[5,3] -1,2а |
|
IPSS, вопрос 8 (оценка состояния здоровья в контексте ДГПЖ) (баллы) |
[Исходный уровень] 48 месяцев (изменение от исходного уровня) |
[3,6] -1,5 |
[3,6] -1,Зb |
[3,6] -1,1а |
Значения показателей на исходном уровне — средние, значения изменений от исходного уровня — откорректированные средние значения.
* Клиническое прогрессирование является комбинированным показателем, включавшим следующие составляющие: ухудшение, подтвержденное изменением суммы баллов по шкале IPSS на >4 балла, случаи ОЗМ, связанные с ДГПЖ, недержание мочи, ИМП и почечная недостаточность,
# оценка проводилась в отдельных исследовательских центрах (13% рандомизированных пациентов).
a. Результаты были значимыми в группе комбинированной терапии (р < 0,001) в сравнении с группой тамсулозина по прошествии 48 месяцев.
b. Результаты были значимыми в группе комбинированной терапии (р < 0,001) в сравнении с группой препарата Аводарт™ по прошествии 48 месяцев.
Нежелательные явления со стороны сердечно-сосудистой системы
В 4-летнем исследовании ДГПЖ с применением лекарственного средства Аводарт™ в комбинации с тамсулозином у 4844 пациентов (исследование CombAT) частота случаев, описываемых комбинированным термином «сердечная недостаточность», в группе комбинированной терапии (14/1610, 0,9%) была выше, чем в обеих группах монотерапии: Аводарт™ -4/1623, 0,2%, тамсулозин — 10/1611, 0,6%.
В отдельном четырехлетием клиническом исследовании (исследование REDUCE) с участием 8231 пациента в возрасте от 50 до 75 лет с полученным ранее отрицательным результатом биопсии на рак предстательной железы и с концентрацией ПСА на исходном уровне в пределах 2,5 -10,0 нг/мл (у мужчин в возрасте от 50 до 60 лет) и 3 — 10 нг/мл (у мужчин в возрасте старше 60 лет) частота случаев, описываемых комбинированным термином «сердечная недостаточность», в группе препарата Аводарт™ 0,5 мг один раз в сутки (30/4105, 0,7%) была выше, чем в группе плацебо (16/4126, 0,4%). Ретроспективный анализ результатов данного исследования свидетельствовал о том, что частота случаев, описываемых комбинированным термином «сердечная недостаточность», у пациентов, получавших одновременно Аводарт™ и блокатор α- адренорецепторов (12/1152, 1,0%), была выше, чем у пациентов, получавших Аводарт™ в режиме монотерапии (18/2953, 0,6%), плацебо и блокатор α-адренорецепторов (1/1399, <0,1%) или только плацебо (15/2727, 0,6%) (см. раздел «Меры предосторожности»).
В мета-анализе 12 рандомизированных клинических исследований с контролем плацебо или препаратом сравнения клинических исследований (п = 18802), в которых оценивали риски развития сердечно-сосудистых нежелательных явлений при применении препарата Аводарт (по сравнению с контролем), не было обнаружено стабильного статистически значимого увеличения риска развития сердечной недостаточности (ОР (относительный риск) 1,05; 95 % ДИ 0,71; 1,57), острого инфаркта миокарда (ОР 1,00; 95 % ДИ 0,77; 1,30) или инсульта (ОР 1,20; 95 % ДИ 0,88; 1,64).
Рак предстательной железы и рак предстательной железы высокой степени злокачественности
В четырехлетнем клиническом исследовании лекарственного средства Аводарт™ в сравнении с плацебо (исследование REDUCE) с участием 8231 пациента в возрасте от 50 до 75 лет с полученным ранее отрицательным результатом биопсии на рак предстательной железы и с концентрацией ПСА на исходном уровне в пределах 2,5 — 10,0 нг/мл (у мужчин в возрасте от 50 до 60 лет) и 3 — 10 нг/мл (у мужчин в возрасте старше 60 лет) результаты пункционной биопсии (первоначально обязательной по протоколу) для определения суммы баллов по шкале Глисона имелись в отношении 6706 пациентов. Рак предстательной железы в этом исследовании был диагностирован у 1517 пациентов. Большинство случаев выявляемого путем биопсии рака предстательной железы в обеих группах терапии были случаями низкозлокачественных опухолей (сумма баллов по шкале Глисона 5-6, 70%).
Частота случаев рака предстательной железы с суммой баллов по шкале Глисона 8-10 в группе лекарственного средства Аводарт™(n = 29, 0,9%) была выше, чем в группе плацебо (n = 19, 0,6%) (р = 0,15). На протяжении первых двух лет терапии показатели частоты случаев рака с суммой баллов по шкале Глисона 8-10 в группе лекарственного средства Аводарт™ (n = 17, 0,5%) и в группе плацебо (n = 17, 0,5%) были схожие. В течение следующих двух лет (год 3 — год 4) частота случаев диагностированного рака предстательной железы с суммой баллов по шкале Глисона 8-10 в группе лекарственного средства Аводарт™ (п = 12, 0,5%) была выше, чем в группе плацебо (n = 1, <0,1%) (р = 0,0035). Данные о результатах применения препарата Аводарт™ на протяжении более 4 лет у пациентов с риском развития рака предстательной железы отсутствуют. Процент пациентов с диагностированным раком предстательной железы с суммой баллов по шкале Глисона 8-10 был устойчивым на протяжении всех периодов исследования (годы 1- 2, годы 3-4) в группе лекарственного средства Аводарт™ (0,5% в каждом периоде); вместе с тем, в группе плацебо процент пациентов с диагностированным раком предстательной железы с суммой баллов по шкале Глисона 8-10 на отрезке времени Год 3 — Год 4 был ниже, чем на отрезке времени Год 1 — Год 2 (<0,1% и 0,5%, соответственно) (см. раздел «Меры предосторожности»). Различия по показателю частоты случаев рака с суммой баллов по шкале Глисона 7-10 (р = 0,81) отсутствовали.
В дополнительном исследовании последующего наблюдения продолжительностью 2 года после окончания исследования REDUCE не было выявлено новых случаев выявления рака предстательной железы с суммой баллов по шкале Глисона 8-10.
В 4-летнем исследовании с участием пациентов с ДГПЖ (исследование CombAT), в котором проведение биопсии не было определено протоколом, а все диагнозы рака предстательной железы основывались на биопсии по показаниям, частота рака с оценкой 8-10 баллов по шкале Глисона была следующей: группа лекарственного средства Аводарт™ — n = 8, 0,5%; группа тамсулозина — n = 11, 0,7% и группа комбинированной терапии — n = 5, 0,3%.
Результаты 4 различных эпидемиологических популяционных исследований (2 из которых включали общую популяцию 174 895 человек, одно — 13 892 человека и одно — 38 058 человек) показали, что применение ингибиторов 5-α-редуктазы не сопровождалось ни повышением числа случаев рака предстательной железы высокой степени злокачественности, ни случаев рака предстательной железы, ни общей смертности.
Связь между применением препарата Аводарт™ и высокозлокачественным раком предстательной железы не представляется очевидной.
Влияние на половую функцию
Влияние фиксированной комбинации дутастерид-тамсулозин на половую функцию было оценено в двойном слепом плацебо-контролируемом исследовании с участием мужчин с ДГПЖ, ведущих половую жизнь (n = 243 комбинация дутастерид-тамсулозин, n = 246 плацебо). Через 12 месяцев было отмечено статистически значимое (р< 0,001) более выраженное снижение (ухудшение) баллов по Опроснику оценки состояния сексуального здоровья мужчин (MSHQ) в группе комбинированной терапии. Снижение баллов преимущественно было связано с ухудшением по показателям эякуляции и общего уровня удовлетворенности, а не показателя эрекции. Эти изменения не повлияли на отношение участников исследования к комбинированному препарату, удовлетворенность которым на протяжении всего исследования оценивалась как статистически значимо более высокая по сравнению с плацебо (р < 0,05). В этом исследовании нежелательные явления со стороны половой функции возникали в течение 12 месяцев терапии и примерно в половине случаев разрешились в течение 6 месяцев после терапии.
Известно, что комбинация дутастерид-тамсулозин и монотерапия дутастеридом вызывают нежелательные эффекты со стороны половой функции (см. раздел «Побочное действие»).
Как было отмечено в других клинических исследованиях, включая CombAT и REDUCE, частота развития нежелательных явлений со стороны половой функции уменьшается со временем при продолжении терапии.
Фармакокинетика
Абсорбция
После приема одной дозы 0,5 мг внутрь максимальная концентрация дутастерида в сыворотке достигается в течение 1-3 ч.
Абсолютная биодоступность составляет около 60%. Биодоступность дутастерида не зависит от приема пищи.
Распределение
Дутастерид характеризуется большим объемом распределения (от 300 до 500 л) и высокой степенью связывания с белками плазмы (>99,5 %).
При ежедневном приеме концентрация дутастерида в сыворотке достигает 65% от равновесных концентраций через 1 мес. и примерно 90% от этого уровня через 3 мес. Равновесная концентрация дутастерида в сыворотке (Css), равная примерно 40 нг/мл, достигается через 6 мес. ежедневного приема 0,5 мг один раз в сутки. Из сыворотки в сперму попадает примерно 11,5 % дутастерида.
Биотрансформация
Дутастерид значительно метаболизируется in vivo. In vitro дутастерид метаболизируется изоферментами CYP3A4 и CYP3A5 системы Р450 с образованием трех моногидроксилированных метаболитов и одного дигидроксилированного метаболита.
После приема внутрь дутастерида в дозе 0,5 мг в сутки и достижения равновесного состояния в сыворотке от 1,0 до 15,4 % (в среднем 5,4 %) принятой дозы экскретируется с калом в неизмененном виде. Остальная часть дозы экскретируется в виде 4 крупных метаболитов, составляющих 39 , 21 , 7 и 7 % соответственно, и 6 малых метаболитов (на долю каждого из которых приходится менее 5 %). В моче у человека обнаруживаются только следовые количества неизмененного дутастерида (менее 0,1 % дозы).
Элиминация
Выведение дутастерида является дозозависимым. Процесс выведения может быть описан как два параллельных процесса элиминации, один насыщаемый при клинически значимых концентрациях и один ненасыщаемый. При низких концентрациях в сыворотке (менее 3 нг/мл) дутастерид быстро выводится с помощью обоих процессов элиминации: зависимого и независимого от концентрации. После однократного приема в дозах 5 мг и менее дутастерид быстро элиминируется из организма и имеет короткий период полувыведения, равный 3-9 дням.
При терапевтических концентрациях на фоне ежедневного применения препарата в дозе 0,5 мг/сутки преобладает более медленное, линейное выведение, период полувыведения составляет около 3-5 недель.
Пожилые мужчины
Фармакокинетика дутастерида изучалась в исследовании с участием 36 здоровых добровольцев мужского пола в возрасте от 24 до 87 лет после применения однократной дозы 5 мг. Существенное влияние возраста на показатели экспозиции дутастерида отсутствовало, однако период полувыведения у мужчин в возрасте до 50 лет был меньше. Между показателями периода полувыведения у пациентов в возрасте от 50 до 69 лет и у пациентов в возрасте старше 70 лет статистически значимые различия отсутствовали.
Почечная недостаточность
Влияние почечной недостаточности на фармакокинетику дутастерида не изучалось.
Вместе с тем, поскольку менее 0,1% от дозы 0,5 мг дутастерида в равновесном состоянии выделяется с мочой, клинически значимое увеличение концентрации дутастерида в плазме крови у пациентов с почечной недостаточностью «Способ применения и дозировка»).
Печёночная недостаточность
Влияние печеночной недостаточности на фармакокинетику дутастерида не изучалось (см. раздел «Противопоказания»), Поскольку дутастерид преимущественно выводится путем метаболизма, у пациентов с печеночной недостаточностью концентрация дутастерида в плазме может повышаться, и период полувыведения может увеличиваться (см. разделы «Способ применения и дозировка» и «Меры предосторожности»).