Карсил®
МНН: Расторопши пятнистой плодов экстракт
Производитель: СОФАРМА АО
Анатомо-терапевтическо-химическая классификация: Silymarin
Номер регистрации в РК:
№ РК-ЛС-5№019885
Информация о регистрации в РК:
18.05.2018 — 18.05.2023
- Скачать инструкцию медикамента
Торговое название
КАРСИЛ®
Международное непатентованное название
Нет
Лекарственная форма
Таблетки, покрытые оболочкой
Состав
Одна таблетка содержит:
активнoе вещество — расторопши пятнистой плодов экстракта сухого (эквивалентного силимарину в форме силибинина 22.5 мг) 40.9-56.3 мг,
вспомогательные вещества: лактозы моногидрат, крахмал пшеничный, повидон К 25, целлюлоза микрокристаллическая (Тип 101), магния стеарат, тальк, маннитол, кросповидон, полисорбат 80, натрия гидрокарбонат,
состав оболочки: целлюлозы ацетат фталат, диэтилфталат, сахароза, акации камедь, желатин, тальк, титана диоксид (Е 171), макрогол 6000, Опалюкс AS 26586 коричневый (в сухой форме): сахароза, железа оксид красный (Е 172), железа оксид черный (Е 172), метилпарагидрокси-бензоат, пропилпарагидроксибензоат, глицерол.
Описание
Таблетки, покрытые оболочкой коричневого цвета, правильной круглой формы.
Фармакотерапевтическая группа
Препараты для лечения заболеваний печени и желчевыводящих путей. Препараты для лечения заболеваний печени.
Код ATХ: A05BA03
Фармакологические свойства
Фармакокинетика
Всасывание
После перорального применения силимарин неполностью резорбируется из желудочно-кишечного тракта (до 23-47%). Пик плазменной концентрации достигается через 4-6 часов после перорального применения однократной дозы. Небольшая часть количества абсорбированного препарата проходит через кишечно-печеночную циркуляцию.
Распределение
При исследованиях с 14С меченным силибинином самые высокие концентрации устанавливаются в печени, легких, желудке и поджелудочной железе и в незначительных количествах в почках, сердце и других органах. Обратимо связывается с белками плазмы крови.
Метаболизм
Метаболизируется в печени путем конъюгации с сульфатами и глюкуроновой кислотой. В качестве метаболитов в желчи обнаружены глюкурониды и сульфаты.
Выведение
Период полувыведения составляет 1-3 часа для неизмененного силимарина и 6-8 часов для его метаболитов. Выводится в основном с желчью (около 80%) в форме глюкуронидов и сульфатов и в незначительной степени (около 5%) с мочой в неизмененном виде. Не кумулирует.
Фармакодинамика
Силимарин — растительная активная составная часть препарата Карсил®, полученная из экстрактов плодов растения расторопши пятнистой (Silybum marianum). Препарат обладает гепатопротективным и антитоксическим действием. Карсил® тормозит проникновение токсинов в клетки печени (показано на ядах бледной поганки), а также вызывает физико-химическую стабилизацию клеточной мембраны гепатоцитов, тем самым предотвращая выход из клетки ферментов (в частности, трансаминаз) и других веществ. Антиоксидантный эффект Карсила® обусловлен взаимодействием силибинина со свободными радикалами в печени и преобразованием их в менее токсичные соединения. Тем самым прерывается процесс перекисного окисления липидов и не происходит дальнейшего разрушения клеточных структур; токсины обезвреживаются физиологическим путем. Карсил® стимулирует биосинтез структурных и функциональных белков и фосфолипидов (за счет специфической стимуляции РНК-полимеразы А) и ускоряет регенерацию клеток печени.
Клиническое действие Карсила® проявляется в улучшении общего состояния больных с заболеваниями печени, уменьшении субъективных жалоб (таких как слабость, ощущение тяжести в правом подреберье, потеря аппетита, кожный зуд, рвота). Улучшаются лабораторные показатели: понижение активности трансаминаз, гамма-глутамилтрансферазы, щелочной фосфатазы и уровня билирубина в плазме крови. Длительное применение Карсила® достоверно увеличивает процент выживаемости больных, страдающих циррозом печени.
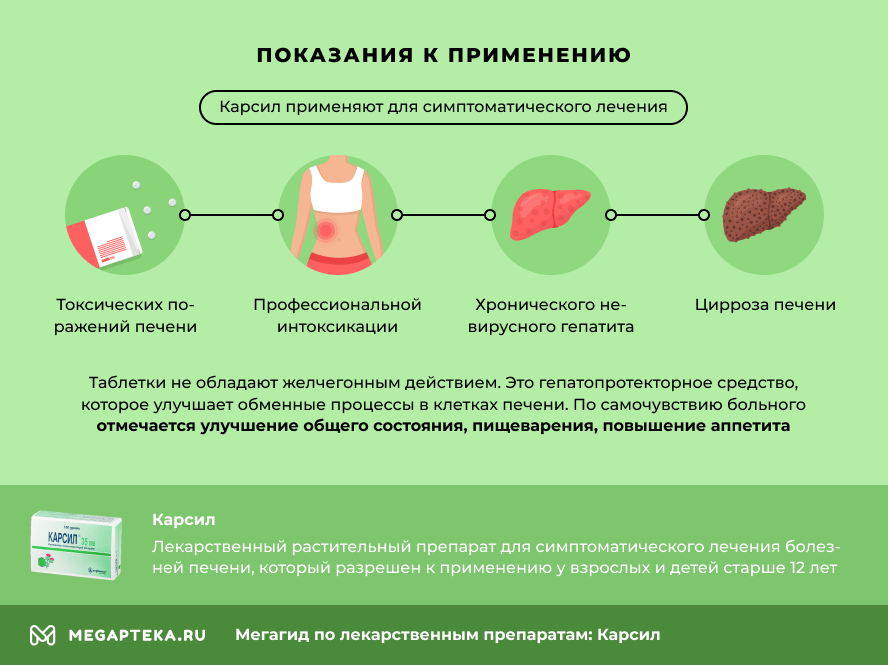
Показания к применению
— токсические поражения печени, вызванные алкоголем, длительным применением лекарств, хроническими интоксикациями
— в составе комплексной терапии хронических гепатитов и цирроза печени.
Способ применения и дозы
Таблетки принимают целиком, запивая достаточным количеством жидкости. Курс лечения продолжается 3 месяца.
Взрослые и дети старше 18 лет:
Для лечения тяжелых поражений печени — по 4 таблетки (90 мг) 3 раза в сутки.
В менее тяжелых случаях и для поддерживающей терапии — по 2 таблетки (45 мг) 3 раза в сутки, в дальнейшем — по 2 таблетки (45 мг) 2 раза в сутки.
Дети младше 18 лет
Не рекомендуется детям младше 18-летнего возраста.
Побочные действия
Побочные действия классифицированы по частоте и по системно-органному классу. Частота по MedDRA определяется следующим образом: очень частые (>1/10), частые (>1/100 до <1/10), нечастые (>1/1 000 до <1/100), редкие (>1/10 000 до < 1/1 000), очень редкие (<1/10 000), с неизвестной частотой (на основании существующих данных нельзя сделать оценку).
Лекарственный препарат обладает хорошей переносимостью. Побочные действия наблюдались очень редко и были легкими и преходящими.
Очень редко: кожные аллергические реакции: зуд, сыпь
С неизвестной частотой: анафилактический шок
Редко: усиление существующих вестибулярных нарушений
Редко: диарея в результате усиленной функции печени и желчного пузыря
С неизвестной частотой: тошнота, рвота, диспепсия, уменьшение аппетита, метеоризм
Противопоказания
— гиперчувствительность к активному или любому из вспомогательных веществ;
— механическая желтуха;
— первичный биллиарный цирроз печени;
— детский возраст до 18 лет;
— беременность и период лактации.
Лекарственные взаимодействия
Фармакодинамические лекарственные взаимодействия
Силимарин не оказывает существенного влияния на фармакодинамику других лекарственных препаратов.
При совместном применении силимарина и пероральных контрацептивных средств, используемых при заместительном лечении эстрогенами и тамоксифеном, возможно уменьшение эффектов последних.
Фармакокинетические лекарственные взаимодействия
Силимарин может усилить эффекты таких лекарственных препаратов, как диазепам, альпразолам, кетоконазол, ловастатин, аторвастатин, винбластин из-за его подавляющего действия на систему цитохрома Р 450.
Растительные продукты, содержащие силимарин, широко используются в качестве гепатопротекторов в онкологической практике одновременно с цитостатиками. Клинические исследования показывают незначительный риск возможных фармакокинетических взаимодействий силимарина, как ингибитора изофермента CYP3A4 и UGT1A1, и цитостатиков, которые являются субстратами этих ферментов.
Особые указания
Лечение этим препаратом не может заменить соблюдения диеты или воздержания от употребления алкоголя.
Из-за возможного эстрогеноподобного эффекта силимарина, его следует применять с осторожностью у пациентов с гормональными нарушениями (эндометриоз, миома матки, карцинома молочной железы, яичников и матки, карцинома предстательной железы).
Лекарственный препарат содержит в качестве вспомогательного вещества пшеничный крахмал. Пшеничный крахмал может содержать только следы глютена и считается безопасным для лиц с целиакией.
Лекарственный препарат содержит вспомогательное вещество лактозы моногидрат. Пациентам с редкими наследственными проблемами непереносимости галактазы, дефицитом Lapp лактазы или мальабсорбцией глюкозы/галактозы не следует принимать этот лекарственный препарат.
Лекарственный препарат содержит вспомогательное вещество сахароза. Пациентам с редкими наследственными проблемами непереносимости фруктозы, мальабсорбцией глюкозы/галактозы или недостаточностью сукразы-изомальтазы не следует применять этот лекарственный препарат.
В состав препарата входят метилпарагидроксибензоат (E 218) и пропилпарагидроксибензоат (E 216), которые могут вызвать аллергические реакции (возможно – замедленного типа).
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Карсил® не оказывает неблагоприятного влияния на способность управлять транспортными средствами и работать с машинами.
Передозировка
Симптомы
Нет сообщений о случаях передозировки силимарина.
Лечение
При случайном приеме высокой дозы необходимо вызвать рвоту, промыть желудок, принять активированный уголь и при необходимости провести симптоматическое лечение.
Форма выпуска и упаковка
По 10 таблеток, покрытых оболочкой, помещают в контурную ячейковую упаковку из пленки поливинилхлоридной, бесцветной, прозрачной и фольги алюминиевой.
По 8 контурных упаковок вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в пачку из картона, покрытого пигментом с одной стороны.
Условия хранения
В оригинальной упаковке, в сухом месте при температуре не выше 25 °С.
Хранить в недоступном для детей месте!
Срок хранения
2 года
Не принимать по истечении срока годности.
Условия отпуска из аптек
Без рецепта
Производитель
АО «Софарма»
ул. Илиенское шоссе 16
1220 София, Болгария
Владелец регистрационного удостоверения
АО «Софарма»
ул. Илиенское шоссе 16
1220 София, Болгария
Адрес организации, принимающей на территории Республики Казахстан претензии от потребителей по качеству продукции (товара):
АО «Софарма» Торговое представительство в г. Алматы, Казахстан, 050036, мкр. «Мамыр 4», д. 190.
Номер телефона: 7 (727 3) 80 01 03
Номер факса: 7 (727 3) 81 63 86
Адрес электронной почты: info@sopharma.kz
| 933660421477976917_ru.doc | 68 кб |
| 744343281477978078_kz.doc | 71 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Карсил таблетки : инструкция по применению
- Состав•
- Описание•
- Что такое данный препарат и для чего его применяют•
- Не принимайте препарат•
- Особые указания и меры предосторожности•
- Другие препараты и данный препарат•
- Беременность и грудное вскармливание•
- Управление транспортными средствами и работа с механизмами•
- Данный препарат содержит пшеничный крахмал и моногидрат лактозы•
- Как следует принимать данный препарат•
- Возможные нежелательные реакции•
- Как следует хранить препарат•
- Срок годности•
- Форма выпуска•
- Условия отпуска•
- Цены•
- Аналоги•
Действующее вещество:
40,9-56,3 мг расторопши пятнистой плодов экстракта сухого очищенного и стандартизированного (35-50:1), что эквивалентно 22,5 мг силимарина в форме силибинина (ВЭЖХ); (экстрагент — метанол или ацетон).
Вспомогательные вещества:
Ядро таблетки: лактозы моногидрат, пшеничный крахмал, повидон, целлюлоза микрокристаллическая, магния стеарат, тальк, маннитол, кросповидон, полисорбат 80, натрия гидрокарбонат.
Состав оболочки: Опадрай АМВ II 88А265025 коричневый (поливиниловый спирт, тальк, железа оксид красный (Е172), железа оксид желтый (Е172), глицерол монокаприлокапрат, титана диоксид (Е171), железа оксид черный (Е172), натрия лаурилсульфат).
Таблетки, покрытые оболочкой, правильной круглой формы, коричневого цвета.
Карсил — лекарственный препарат, который содержит активное вещество силимарин, выделенное из плодов растения расторопши пятнистой. Силимарин активирует синтез белков и фосфолипидов в поврежденных клетках печени, стабилизирует их клеточные мембраны, связывает свободные радикалы (антиоксидантное действие). Его основное действие заключается в защите клеток печени от вредных воздействий различных факторов, таких как алкоголь, лекарства, вирусные инфекции, промышленные загрязнители. При поражениях клеток печени он способствует их более быстрому восстановлению.
Используется для симптоматического лечения хронических токсических поражений печени, для поддерживающего лечения пациентов с хроническими воспалительными заболеваниями печени и с циррозом печени.
— при наличии аллергии (гиперчувствительности) к активному веществу или любому из вспомогательных веществ препарата, перечисленных в разделе 6;
— у детей младше 12 лет из-за отсутствия достаточного клинического опыта.
Перед применением препарата Карсил проконсультируйтесь с лечащим врачом или работником аптеки.
Обратитесь к лечащему врачу, если у вас есть заболевания, сопровождающиеся гормональными нарушениями (эндометриоз, миома матки, рак молочной железы, яичников и матки, рак простаты), из-за возможного эстрогеноподобного эффекта силимарина.
Лечение препаратом Карсил не может заменить диету или воздержание от употребления алкоголя при поражениях печени.
Сообщите лечащему врачу или работнику аптеки о том, что вы принимаете, недавно принимали или можете начать принимать какие-либо другие препараты.
Препарат Карсил может уменьшить эффективность пероральных противозачаточных средств и лекарственных препаратов, которые используются при заместительном гормональном лечении.
Препарат Карсил может усилить действие таких лекарственных препаратов, как диазепам, алпразолам, кетоконазол, ловастатин, винбластин.
Если вы беременны или кормите грудью, полагаете что можете быть беременны или планируете беременность, обратитесь к вашему лечащему врачу или работнику аптеки перед тем, как начать прием данного препарата.
Применение препарата Карсил при беременности и в период кормления грудью возможно только по медицинским показаниям, и в том случае если польза использования препарата для матери превышает риск для плода или младенца.
Препарат Карсил не оказывает неблагоприятного влияния на способность управлять транспортными средствами и работать с механизмами.
Препарат Карсил содержит пшеничный крахмал
Пшеничный крахмал содержит очень небольшое количество глютена и вряд ли вызовет проблемы при глютеновой болезни (непереносимость глютена). Одна таблетка содержит не более 3,95 микрограмма глютена.
Если у вас аллергия на пшеницу (состояние, отличное от целиакии), вам не следует принимать это лекарство.
Препарат Карсил содержит моногидрат лактозы
Если ваш врач сказал вам, что у вас непереносимость некоторых сахаров, обратитесь к врачу, прежде чем принимать этот лекарственный препарат.
Всегда принимайте это лекарство в точности так, как описано в этом листке или так, как сказал ваш врач или работник аптеки. При появлении сомнений посоветуйтесь с лечащим врачом или работником аптеки.
Взрослые и дети старше 12 лет
Рекомендуемая доза для более тяжелых состояний составляет 4 таблетки, покрытые оболочкой, 3 раза в день.
В более легких случаях и в качестве поддерживающей терапии доза составляет 2 таблетки, покрытые оболочкой, 3 раза в день.
Продолжительность курса лечения определяется вашим врачом.
Продолжительность применения лекарственного средства — не менее 3 месяцев.
Карсил принимается внутрь с достаточным количеством жидкости. Использовать у детей младше 12 лет
Недостаточно клинических данных по применению у детей до; 12 лет.
Курс лечения длится не менее трех месяцев. Если ваши жалобы сохраняются, обратитесь за советом к вашему врачу.
Если вы приняли большую дозу препарат, чем необходимо
Если вы приняли дозу, превышающую назначенную, обратитесь за советом к своему лечащему врачу.
Если вы пропустили прием препарата Карсил
Не принимайте двойную дозу для компенсации забытой.
Если у вас есть любые дополнительные вопросы, связанные с применением этого лекарственного препарата, обратитесь к вашему врачу или работнику аптеки.
Как и все лекарственные средства, Карсил может вызвать нежелательные реакции, несмотря на то, что они проявляются не у каждого.
Лекарственный препарат обладает хорошей переносимостью. Нежелательные реакции носят временный характер и исчезают после прекращения приема лекарственного средства.
Очень редко (менее чем у 1 из 10 000 пациентов) возможны кожные аллергические реакции, такие как зуд, сыпь, крапивница.
Редко (с вероятностью появления от 1 до 10 пациентов на 10 000) можно наблюдать усиление существующих вестибулярных нарушений. Возможно появление диареи.
Неизвестно (на основании имеющихся данных частоту возникновения определить невозможно): анафилактический шок, тошнота, рвота, диспепсия (боль, жжение или дискомфорт в подложечной области, тяжесть и чувство переполнения в эпигастрии, возникающие после еды, раннее насыщение, вздутие живота), снижение аппетита, метеоризм (избыточное скопление газов в кишечнике).
Сообщение о нежелательных реакциях.
Если у Вас возникли какие-либо нежелательные реакции, сообщите об этом своему врачу. Это касается любых возможных нежелательных реакций, в том числе тех, которые не перечислены в этом листке-вкладыше.
Вы также можете сообщить о нежелательных реакциях напрямую в РУП «Центр экспертиз и испытаний в здравоохранении», 220037, г. Минск, Товарищеский пер. 2а, тел./факс: +375 17 242 00 29, адрес электронной почты: rcpl@rceth.by, www.rceth.by. Сообщая о нежелательных реакциях, вы помогаете получить больше сведений о безопасности препарата.
Хранить в оригинальной упаковке для защиты от влаги при температуре не выше 25°C. Хранить в недоступном для детей месте.
3 (три) года.
Не принимайте Карсил после истечения срока годности, отмеченного на картонной упаковке. Срок годности соответствует последнему дню указанного месяца.
Лекарства не следует выбрасывать в канализацию или в контейнер для бытовых отходов. Спросите у Вашего фармацевта, как утилизировать ненужные Вам лекарства. Эти меры будут способствовать охране окружающей среды.
10 таблеток, покрытых оболочкой, упаковывают в блистер из твердой, бесцветной, прозрачной ПВХ/ПЭ/ПВДХ пленки и алюминиевой фольги.
8 блистеров (80 таблеток, покрытых оболочкой). вместе с листком-вкладышем для потребителя помещают в картонную пачку.
Без рецепта.
Владелец регистрационного удостоверения и производитель
АО СОФАРМА
ул. Илиенское шоссе 16, 1220 София, Болгария.
Претензии потребителей следует направлять по адресу:
Представительство АО Софарма (Республика Болгария) в Республике Беларусь, ул. Надеждинская, д.2, офис 4, г. Минск, 220006, тел./факс: +375 17 242-82-92. Адрес электронной почты: info@sopharma.by.
Одна таблетка содержит:
активнoе вещество – расторопши пятнистой плодов экстракта сухого (эквивалентного силимарину в форме силибинина 22.5 мг) 40.9-56.3 мг,
вспомогательные вещества: лактозы моногидрат, крахмал пшеничный, повидон К 25, целлюлоза микрокристаллическая (Тип 101), магния стеарат, тальк, маннитол, кросповидон, полисорбат 80, натрия гидрокарбонат,
состав оболочки: целлюлозы ацетат фталат, диэтилфталат, сахароза, акации камедь, желатин, тальк, титана диоксид (Е 171), макрогол 6000, Опалюкс AS 26586 коричневый (в сухой форме): сахароза, железа оксид красный (Е 172), железа оксид черный (Е 172), метилпарагидрокси-бензоат, пропилпарагидроксибензоат, глицерол.
Таблетки, покрытые оболочкой коричневого цвета, правильной круглой формы.
Препараты для лечения заболеваний печени и желчевыводящих путей. Препараты для лечения заболеваний печени. Силимарин.
Код ATХ: A05BA03
Фармакокинетика
Всасывание
После перорального применения силимарин неполностью резорбируется из желудочно-кишечного тракта (до 23-47%). Пик плазменной концентрации достигается через 4-6 часов после перорального применения однократной дозы. Небольшая часть количества абсорбированного препарата проходит через кишечно-печеночную циркуляцию.
Распределение
При исследованиях с 14С меченным силибинином самые высокие концентрации устанавливаются в печени, легких, желудке и поджелудочной железе и в незначительных количествах в почках, сердце и других органах. Обратимо связывается с белками плазмы крови.
Метаболизм
Метаболизируется в печени путем конъюгации с сульфатами и глюкуроновой кислотой. В качестве метаболитов в желчи обнаружены глюкурониды и сульфаты.
Выведение
Период полувыведения составляет 1-3 часа для неизмененного силимарина и 6-8 часов для его метаболитов. Выводится в основном с желчью (около 80%) в форме глюкуронидов и сульфатов и в незначительной степени (около 5%) с мочой в неизмененном виде. Не кумулирует.
Фармакодинамика
Силимарин – растительная активная составная часть препарата Карсил®, полученная из экстрактов плодов растения расторопши пятнистой (Silybum marianum). Препарат обладает гепатопротективным и антитоксическим действием. Карсил® тормозит проникновение токсинов в клетки печени (показано на ядах бледной поганки), а также вызывает физико-химическую стабилизацию клеточной мембраны гепатоцитов, тем самым предотвращая выход из клетки ферментов (в частности, трансаминаз) и других веществ. Антиоксидантный эффект Карсила® обусловлен взаимодействием силибинина со свободными радикалами в печени и преобразованием их в менее токсичные соединения. Тем самым прерывается процесс перекисного окисления липидов и не происходит дальнейшего разрушения клеточных структур; токсины обезвреживаются физиологическим путем. Карсил® стимулирует биосинтез структурных и функциональных белков и фосфолипидов (за счет специфической стимуляции РНК-полимеразы А) и ускоряет регенерацию клеток печени.
Клиническое действие Карсила® проявляется в улучшении общего состояния больных с заболеваниями печени, уменьшении субъективных жалоб (таких как слабость, ощущение тяжести в правом подреберье, потеря аппетита, кожный зуд, рвота). Улучшаются лабораторные показатели: понижение активности трансаминаз, гамма-глутамилтрансферазы, щелочной фосфатазы и уровня билирубина в плазме крови. Длительное применение Карсила® достоверно увеличивает процент выживаемости больных, страдающих циррозом печени.
— токсические поражения печени, вызванные алкоголем, длительным применением лекарств, хроническими интоксикациями
— в составе комплексной терапии хронических гепатитов и цирроза печени.
Таблетки принимают целиком, запивая достаточным количеством жидкости. Курс лечения продолжается 3 месяца.
Взрослые и дети старше 18 лет:
Для лечения тяжелых поражений печени – по 4 таблеток (90 мг) 3 раза в сутки.
В менее тяжелых случаях и для поддерживающей терапии – по 2 таблетки (45 мг) 3 раза в сутки, в дальнейшем – по 2 таблетки (45 мг) 2 раза в сутки.
Дети младше 18 лет
Не рекомендуется детям младше 18-летнего возраста.
Побочные действия классифицированы по частоте и по системно-органному классу. Частота по MedDRA определяется следующим образом: очень частые (>1/10), частые (>1/100 до <1/10), нечастые (>1/1 000 до <1/100), редкие (>1/10 000 до < 1/1 000), очень редкие (<1/10 000), с неизвестной частотой (на основании существующих данных нельзя сделать оценку).
Лекарственный препарат обладает хорошей переносимостью. Побочные действия наблюдались очень редко и были легкими и преходящими.
Очень редко: кожные аллергические реакции: зуд, сыпь
С неизвестной частотой: анафилактический шок
Редко: усиление существующих вестибулярных нарушений
Редко: диарея в результате усиленной функции печени и желчного пузыря
С неизвестной частотой: тошнота, рвота, диспепсия, уменьшение аппетита, метеоризм
— гиперчувствительность к активному или любому из вспомогательных веществ;
— механическая желтуха;
— первичный биллиарный цирроз печени;
— детский возраст до 18 лет;
— беременность и период лактации.
Фармакодинамические лекарственные взаимодействия
Силимарин не оказывает существенного влияния на фармакодинамику других лекарственных препаратов.
При совместном применении силимарина и пероральных контрацептивных средств, используемых при заместительном лечении эстрогенами и тамоксифеном, возможно уменьшение эффектов последних.
Фармакокинетические лекарственные взаимодействия
Силимарин может усилить эффекты таких лекарственных препаратов, как диазепам, альпразолам, кетоконазол, ловастатин, аторвастатин, винбластин из-за его подавляющего действия на систему цитохрома Р 450.
Растительные продукты, содержащие силимарин, широко используются в качестве гепатопротекторов в онкологической практике одновременно с цитостатиками. Клинические исследования показывают незначительный риск возможных фармакокинетических взаимодействий силимарина, как ингибитора изофермента CYP3A4 и UGT1A1, и цитостатиков, которые являются субстратами этих ферментов.
Лечение этим препаратом не может заменить соблюдения диеты или воздержания от употребления алкоголя.
Из-за возможного эстрогеноподобного эффекта силимарина, его следует применять с осторожностью у пациентов с гормональными нарушениями (эндометриоз, миома матки, карцинома молочной железы, яичников и матки, карцинома предстательной железы).
Лекарственный препарат содержит в качестве вспомогательного вещества пшеничный крахмал. Пшеничный крахмал может содержать только следы глютена и считается безопасным для лиц с целиакией.
Лекарственный препарат содержит вспомогательное вещество лактозы моногидрат. Пациентам с редкими наследственными проблемами непереносимости галактазы, дефицитом Lapp лактазы или мальабсорбцией глюкозы/галактозы не следует принимать этот лекарственный препарат.
Лекарственный препарат содержит вспомогательное вещество сахароза. Пациентам с редкими наследственными проблемами непереносимости фруктозы, мальабсорбцией глюкозы/галактозы или недостаточностью сукразы-изомальтазы не следует применять этот лекарственный препарат.
В состав препарата входят метилпарагидроксибензоат (E 218) и пропилпарагидроксибензоат (E 216), которые могут вызвать аллергические реакции (возможно – замедленного типа).
Карсил® не оказывает неблагоприятного влияния на способность управлять транспортными средствами и работать с машинами.
Симптомы
Нет сообщений о случаях передозировки силимарина.
Лечение
При случайном приеме высокой дозы необходимо вызвать рвоту, промыть желудок, принять активированный уголь и при необходимости провести симптоматическое лечение.
По 10 таблеток, покрытых оболочкой, помещают в контурную ячейковую упаковку из пленки поливинилхлоридной, бесцветной, прозрачной и фольги алюминиевой.
По 8 контурных упаковок вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в пачку из картона, покрытого пигментом с одной стороны.
В оригинальной упаковке, в сухом месте при температуре не выше 25 °С.
Хранить в недоступном для детей месте!
3 (три) года
Не принимать по истечении срока годности.
Без рецепта
Производитель
АО «Софарма»
ул. Илиенское шоссе 16
1220 София, Болгария
Владелец регистрационного удостоверения
АО «Софарма», Болгария
Наименование, адрес и контактные данные (телефон, факс, электронная почта) организации на территории Республики Казахстан, ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства:
«Софарма Казахстан» Товарищество с ограниченной ответственностью в
г. Алматы, Казахстан, 050036, мкр. «Мамыр 4», д. 190.
Номер телефона: 7 (727 3) 80 01 03
Номер факса: 7 (727 3) 81 63 86
Адрес электронной почты: info@sopharma.kz
ИМЕЮТСЯ ПРОТИВОПОКАЗАНИЯ. ВОЗМОЖНЫ ПОБОЧНЫЕ ЭФФЕКТЫ. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СПЕЦИАЛИСТА.ГепатитЖировая болезнь печениТаблеткиЦирроз
Автор статьи
Подойницына Алёна Андреевна
,
Диплом о фармацевтическом образовании: 105924 3510722 рег. номер 31917
Все авторы
Содержание статьи
- Карсил: от чего помогает
- Карсил — желчегонное средство или нет
- Карсил, как принимать — до или после еды
- Карсил: аналоги
- Краткое содержание
- Задайте вопрос эксперту по теме статьи
Печень выполняет множество функций. Одна из них — дезинтоксикационная — обезвреживание токсических веществ, попадающих в организм. При большом попадании и накоплении химических или других вредных веществ в клетках печени, развивается токсический гепатит. Симптомами которого являются:
- увеличение размеров печени
- боль в правом подреберье
- желтуха
Одним из препаратов, способствующих очищению печени от накопленных токсинов фармацевты советуют Карсил. Мы попросили провизора Алёну Подойницыну рассказать об этом препарате: от чего он помогает, является ли желчегонным средством и как правильно принимать его. Приведем несколько препаратов-аналогов лекарственного средства Карсил.
Карсил: от чего помогает
Чтобы узнать, от чего применяют таблетки Карсил, расскажем о его показаниях к применению. Его применяют для симптоматического лечения:
- токсических поражений печени, вызванных алкоголем, приемом лекарств
- хронической профессиональной интоксикации
- хронических невирусный гепатит
- цирроза печени
Вам может быть интересно: Как восстановить печень?
Карсил — желчегонное средство или нет
Карсил таблетки не обладают желчегонным действием. Это гепатопротекторное средство, которое улучшает обменные процессы в клетках печени. Карсил уменьшает симптомы нарушения работы печени.Это нормализует показатели состояния печени в крови (АСТ, АЛТ, гамма-глобулин, билирубин). По самочувствию больного отмечается улучшение общего состояния, пищеварения, повышению аппетита и набору массы тела.
Карсил, как принимать — до или после еды
Ответим на вопрос: как принимать Карсил: до еды или после. Препарат пьют внутрь до еды, запивая достаточным количеством воды. Таблетки можно принимать с 12 лет.
- Курс лечения составляет минимум 3 месяца.
- При тяжелых поражениях печени пьют по 4 таблетки 3 раза в день.
- При легком течении и в качестве поддерживающего лечения — по 1-2 таблетки 3 раза в день
- В качестве профилактики — по 2-3 таблетки в день.
Карсил: аналоги
Приведем несколько препаратов-аналогов Карсила, совпадающих по его свойствам и действующему веществу:
- Легалон
- Силибинин
- Силимар
- Силимарин
- Форливер Хелп
Все эти средства максимально схожи по составу, показаниям, противопоказаниям и другим характеристикам с лекарством Карсил. Все препараты можно заменить на друг друга, предварительно проконсультировавшись с сотрудником аптеки.
Краткое содержание
- Карсил — растительный препарат для симптоматического лечения болезней печени
- Карсил таблетки не обладают желчегонным действием. Препарат защищает клетки печени — имеет гепатопротекторный эффект.
- Препарат пьют внутрь до еды, запивая достаточным количеством воды. Таблетки можно принимать с 12 лет.
- Аналоги Карсила можно заменить на друг друга, предварительно проконсультировавшись с сотрудником аптеки.
Задайте вопрос эксперту по теме статьи
Остались вопросы? Задайте их в комментариях ниже – наши эксперты ответят вам. Там же Вы можете поделиться своим опытом с другими читателями Мегасоветов.
Поделиться мегасоветом
Понравилась статья? Расскажите маме, папе, бабушке и тете Гале из третьего подъезда
Описание препарата Карсил® Форте (капсулы, 90 мг) основано на официальной инструкции, утверждено компанией-производителем в 2017 году
Дата согласования: 11.08.2017
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Фотографии упаковок

11.08.2017
Действующее вещество
ATX
Фармакологическая группа
Нозологическая классификация (МКБ-10)
Список кодов МКБ-10
- B94.2 Отдаленные последствия вирусного гепатита
- K70 Алкогольная болезнь печени
- K70.0 Алкогольная жировая дистрофия печени [жирная печень]
- K71 Токсическое поражение печени
- K73.9 Хронический гепатит неуточненный
- K74 Фиброз и цирроз печени
- K76.0 Жировая дегенерация печени, не классифицированная в других рубриках
- K76.9 Болезнь печени неуточненная
- T50.9 Другими и неуточненными лекарственными средствами, медикаментами и биологическими веществами
- T51 Токсическое действие алкоголя
- T65.9 Неуточненного вещества
- Y57 Другие и неуточненные лекарственные средства и медикаменты
- Z57 Профессиональная подверженность факторам риска
Состав
| Капсулы | 1 капс. |
| активное вещество: | |
| расторопши пятнистой плодов экстракт сухой | 163,6–225 мг |
| (эквивалентно содержанию силимарина 90 мг) | |
| вспомогательные вещества: лактозы моногидрат — 38,2–7,5 мг; МКЦ (тип 101) — 38,2–7,5 мг; крахмал пшеничный — 15,5 мг; повидон К25 — 3,7 мг; полисорбат 80 — 3,7 мг; кремния диоксид коллоидный безводный — 3,4 мг; маннитол — 80 мг; кросповидон — 14 мг; натрия гидрокарбонат — 6 мг; магния стеарат — 3,7 мг | |
| капсула: железа оксид черный — 0,02%; железа оксид красный — 0,03%; титана диоксид — 0,6666%; железа оксид желтый — 0,35%; желатин — до 100% |
Описание лекарственной формы
Твердые желатиновые капсулы №0 светло-коричневого цвета.
Содержимое капсулы — порошкообразная масса от светло-желтого до желто-коричневого цвета с агломератами.
Фармакологическое действие
Фармакологическое действие
—
гепатопротекторное.
Фармакодинамика
Карсил® Форте содержит экстракт плодов расторопши пятнистой, основными действующими веществами которого является смесь 6 изомеров флавонолигнанов (силимарин): силибинина A и B, изо-силибинина A и B, силидианина и силикристина. Из них самым активным является силибинин. Механизм гепатопротекторного действия до конца не изучен, существующие данные доказывают наличие нескольких основных механизмов действия
Антиоксидантное действие. Силимарин взаимодействует со свободными радикалами в печени и переводит их в менее токсичные соединения, прерывая процесс перекисного окисления липидов, препятствует разрушению клеточных структур, связываясь со свободными радикалами и регулируя внутриклеточное содержание глутатиона. В зависимости от концентрации подавляет микросомальную пероксидацию, вызванную НАДФH-Fe2+ -АДФ. Влияет на ферментные системы, связанные с глутатионом и супероксид дисмутазой. Компоненты силимарина подавляют пероксидацию линоленовой кислоты, катализированную липоксигеназой и предохраняют печеночные митохондрии и микросомы от образования липидных пероксидов, вызванных различными агентами.
Мембраностабилизирующее действие. Силимарин стабилизирует клеточные мембраны и регулирует их проницаемость, в результате чего предотвращается поступление гепатотоксических агентов в гепатоциты. Установлено, что мембраностабилизирующее действие силимарина обусловлено его конкурирующим взаимодействием с рецепторами к соответствующим токсинам на мембране гепатоцитов. Влияние силимарина на проницаемость мембраны связано с качественными и количественными изменениями в мембранных липидах — холестерол и фосфолипиды.
Силимарин стимулирует регенерационные процессы в печени (восстановление поврежденных гепатоцитов) в результате активирования синтеза структурных и функциональных белков (рибосомный синтез РНК, протеина и ДНК) и фосфолипидов. Экспериментально установлено, что силимарин также подавляет трансформацию звездообразных клеток печени в миофибробласты, процесс, ответственный за расположение коллагеновых волокон.
Противовоспалительное действие. По результатам экспериментальных исследований показано, что силибин в определенной концентрации способен ингибировать синтез ЛТ B4 (leukotriene B4/LTB4) в изолированных клетках Купфера животных. Силимарин, силибин, силидианин и силикристин угнетают активность липоксигеназы и простагландинсинтазы in vitro. В исследованиях in vitro на человеческих полиморфноядерных лейкоцитах показано, что одним из механизмов реализации противовоспалительного действия силибина является подавление образования перекиси водорода.
Клинически фармакодинамические свойства силимарина выражаются в улучшении субъективной и объективной симптоматики и нормализации показателей функционального состояния печени (трансаминазы, гамма-глобулин, билирубин).
Фармакокинетика
Всасывание. После применения внутрь силимарин не полностью всасывается из ЖКТ (до 23–47%). Плазменная Cmax достигается через 4–6 ч после применения внутрь однократной дозы.
Распределение. При исследованиях с 14С-меченным силибинином самые высокие концентрации устанавливаются в печени, легких, желудке и поджелудочной железе и в незначительных количествах в почках, сердце и других органах.
Метаболизм. Подвергается кишечно-печеночной рециркуляции. Метаболизируется в печени путем конъюгации с сульфатами и глюкуроновой кислотой. В качестве метаболитов в желчи обнаружены глюкурониды и сульфаты.
Выведение. T1/2 составляет 1–3 ч для неизмененного силимарина и 6–8 ч для его метаболитов. Выводится в основном с желчью (около 80%) в форме глюкуронидов и сульфатов, в незначительной степени (около 5%) почками в неизмененном виде. Не кумулирует.
Показания
В составе комплексной терапии следующих состояний и заболеваний:
токсическое поражение печени;
состояния после перенесенного острого гепатита;
хронический гепатит невирусной этиологии;
стеатоз печени (неалкогольный и алкогольный);
цирроз печени;
профилактика печеночных поражений при продолжительном приеме лекарств, алкоголя, хронической интоксикации (в т.ч. профессиональной).
Противопоказания
гиперчувствительность к активному или любому из вспомогательных веществ;
лактазная недостаточность, галактоземия или синдром мальабсорбции глюкозы/галактозы (из-за наличия в составе препарата лактозы);
целиакия (глютеновая энтеропатия) — из-за наличия в составе препарата пшеничного крахмала;
дети младше 12 лет (нет достаточных клинических данных).
С осторожностью: пациенты с гормональными нарушениями (эндометриоз, миома матки, карцинома молочной железы, яичников и матки, карцинома предстательной железы) — возможно проявление эстрогеноподобного эффекта силимарина.
Применение при беременности и кормлении грудью
Не рекомендуется применять препарат во время беременности и в период грудного вскармливания.
Способ применения и дозы
Внутрь, запивая достаточным количеством воды.
Взрослым и детям старше 12 лет: лечение тяжелых поражений печени начинают с дозы 1 капс. 3 раза в день.
При более легких и среднетяжелых случаях дозировка составляет по 1 капс. 1–2 раза в день.
Для профилактики химических интоксикаций — 1–2 капс. в день.
Курс лечения — не менее 3 мес.
Побочные действия
Лекарственный препарат хорошо переносится.
Побочные реакции наблюдаются очень редко, и они, как правило, легкие и преходящие.
Нежелательные побочные реакции классифицированы по частоте и по системно-органному классу. Частота по MedDRA определяется следующим образом: очень часто (>1/10); часто (>1/100 — <1/10); нечасто (>1/1000 — <1/100); редко (>1/10000 — <1/1000); очень редко (<1/10000); с неизвестной частотой (на основании существующих данных нельзя сделать оценку).
Со стороны иммунной системы: очень редко — кожные аллергические реакции (зуд, сыпь); с неизвестной частотой — анафилактический шок.
Со стороны органа слуха и лабиринтные нарушения: редко — усиление существующих вестибулярных нарушений.
Со стороны ЖКТ: редко — диарея в результате усиленной функции печени и желчного пузыря; с неизвестной частотой — тошнота, рвота, диспепсия, уменьшение аппетита, метеоризм.
Взаимодействие
Фармакодинамические лекарственные взаимодействия
Силимарин не оказывает существенное влияние на фармакодинамику других лекарственных препаратов. При совместном применении силимарина с пероральными контрацептивами и препаратами, которые используются при гормональной заместительной терапии, возможно уменьшение эффектов последних.
Фармакокинетические лекарственные взаимодействия
Так как силимарин обладает ингибирующим действием на систему цитохрома Р450, то возможно повышение концентрации в плазме крови таких ЛС, как диазепам, алпразолам, кетоконазол, ловастин, винбластин.
Передозировка
Нет данных о передозировке препарата.
Лечение при случайном приеме высокой дозы: индукция рвоты, промывание желудка, назначение активированного угля, проведение при необходимости симптоматической терапии.
Особые указания
Влияние на способность управлять автотранспортом и работу с механизмами. Применение препарата в монотерапии не влияет на способность управлять автотранспортом и работу с механизмами.
Форма выпуска
Капсулы, 90 мг. В блистерах из ПВХ-пленки и фольги алюминиевой по 6 шт.; в пачке картонной 5 бл.
Производитель
«Софарма» АО. Болгария, 1220, София, ул. Илиенское шоссе, 16.
Тел.: (+359 2) 813-42-00; факс: (+359 2) 936-02-86.
Претензии потребителей и информацию о нежелательных явлениях следует направлять по адресу: 109429, Москва, МКАД 14-й км, 10.
Тел./факс: (495) 786-22-26.
Условия отпуска из аптек
Без рецепта.
Условия хранения
При температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Состав
Одна таблетка препарата Кардосал 40 включает 40 мг медоксомила олмесартана.
Одна таблетка препарата Кардосал 20 включает 20 мг медоксомила олмесартана.
Одна таблетка препарата Кардосал 10 включает 10 мг медоксомила олмесартана.
Дополнительные вещества: гипролоза, микрокристаллическая целлюлоза, моногидрат лактозы, стеарат магния.
Состав оболочки: гипромеллоза, тальк, диоксид титана.
Форма выпуска
14 таблеток в ячейковой упаковке — одна, две, четыре или семь упаковок в картонной пачке.
Фармакологическое действие
Гипотензивное действие.
Фармакодинамика и фармакокинетика
Фармакодинамика
Блокатор рецепторов ангиотензина второго типа, который является гормоном и играет большую роль в развитии артериальной гипертонии.
Олмесартан предположительно тормозит эффекты ангиотензина второго типа путем блокирования соответствующих рецепторов.
При артериальной гипертонии вызывает дозозависимое длительное понижение давления. Нет данных о появлении артериальной гипотензии, тахикардии (во время продолжительного лечения) или синдрома отмены после приема препарата.
Прием олмесартана один раз в день обеспечивает мягкое и эффективное понижение давления в течение суток. Гипотензивное действие развивается через две недели, а наибольший эффект – приблизительно через два месяца после начала лечения.
Фармакокинетика
Активное вещество является пролекарством. В слизистой оболочке пищеварительного тракта под действием ферментов оно быстро превращается в активный метаболит. Медоксомил олмесартана в первоначальном виде в крови не фиксируется. Биодоступность составляет примерно 25,6%. Наибольшая концентрация в крови достигается в среднем через два часа после перорального приема. Прием пищи не влияет на биодоступность.
Связывается с протеинами плазмы на 99,7%. Связь с клетками крови слабая. 40% препарата выделяется почками, еще 60% — с желчью. Время полувыведения составляет 11-14 часов.
Показания к применению
Артериальная гипертония эссенциального характера.
Противопоказания
- Почечная недостаточность, состояние после пересадки почки.
- Обструкция билиарных путей.
- Недостаток лактазы, синдром мальабсорбции или галактоземия.
- Возраст менее 18 лет.
- Беременность и лактация.
- Гиперчувствительность к компонентам препарата.
Рекомендуется с осторожностью применять препарат при нижеперечисленных заболеваниях и состояниях:
- обструктивная гипертрофическая кардиомиопатия;
- стеноз клапанов сердца;
- первичный альдостеронизм;
- почечная недостаточность легкой степени;
- гиперкалиемия или гипонатриемия;
- хроническая недостаточность сердечной деятельности;
- ишемическая болезнь сердца;
- двусторонний стеноз артерий почек;
- цереброваскулярные нарушения;
- понижение объема циркулирующей жидкости вследствие диеты, рвоты или поноса;
- нарушение работы печени;
- пожилой возраст;
- совместное применение с диуретиками.
Побочные действия
- Реакции со стороны кроветворения: тромбоцитопения.
- Реакции со стороны нервной деятельности: головокружение, головная боль.
- Реакции со стороны дыхания: кашель, ринит, фарингит, бронхит.
- Реакции со стороны пищеварения: тошнота, понос, диспепсия, боль в животе, гастроэнтерит, рвота.
- Реакции со стороны кожи: зуд, сыпь на коже, аллергический дерматит, отек Квинке, крапивница.
- Реакции со стороны опорно-двигательной системы: боль в костях и суставах, артрит, боль в спине, судороги мышц.
- Реакции со стороны мочеполовой сферы: инфекции мочеполовых путей, гематурия, острая почечная недостаточность.
- Реакции со стороны лабораторных анализов: увеличение содержания мочевины и креатинина в крови, увеличение содержания ферментов печени.
- Реакции со стороны кровообращения: тахикардия, стенокардия, понижение давления.
- Реакции со стороны метаболизма: увеличение содержания креатинфосфокиназы, гиперурикемия, гипертриглицеридемия, гиперкалиемия.
- Общие реакции: гриппоподобные симптомы, боль в груди, астения, периферические отеки, недомогание, утомляемость, сонливость.
Инструкция по применению Кардосала (Способ и дозировка)
Инструкция по применению Кардосала предписывает принимать препарат перорально ежедневно в одинаковое время, один раз в сутки.
Рекомендуемая первичная доза составляет 10 мг раз в сутки. Если снижение давления недостаточное при приеме 10 мг в сутки, возможно ее увеличение до 20 мг в сутки. В случае, если требуется дополнительное понижение давления, дозировку увеличивают до максимальной, составляющей 40 мг в сутки либо дополнительно назначают диуретик (например, гидрохлоротиазид).
Наибольшая суточная доза составляет 40 мг.
Передозировка
Признаки передозировки: сильное понижение давления.
Терапия: рекомендуется уложить больного на спину, придав ногам возвышенное положение. Рекомендовано произвести промывание желудка, назначить активированный уголь, при необходимости регулировать изменения водно-солевого обмена, своевременно восполнять объем циркулирующей жидкости.
Взаимодействие
Не советуется совместное использование с препаратами калия, калийсберегающими диуретиками или другими средствами, способными увеличивать содержание калия в крови.
Антигипертензивный эффект от лечения олмесартаном усиливается при комбинированном использовании с иными гипотензивными препаратами.
Нестероидные противовоспалительные препараты, ингибиторы циклооксигеназы второго типа и блокаторы рецепторов ангиотензина второго типа могут взаимодействовать синергично, подавляя гломерулярную фильтрацию. При этом возникает вероятность появления острой почечной недостаточности. Во избежание подобных явлений рекомендуется осуществлять контроль работы почек в начале терапии, а также своевременный прием достаточного объема жидкости.
При совместном применении с антацидами возможно умеренное понижение биодоступности олмесартана.
Применение олмесартана вместе с препаратами лития опасно повышением концентрации последнего в крови.
Условия продажи
Возможно приобретение только по рецепту.
Условия хранения
Хранить при температуре до 30 градусов. Беречь от детей.
Срок годности
3 года.
Особые указания
При использовании препарата у лиц с нарушением работы почек рекомендуется регулярно проводить контроль содержания калия и креатинина в крови.
Следует помнить, что чрезмерное понижение давления у больных с ишемической болезнью или с цереброваскулярными изменениями может вызвать инфаркт или инсульт.
При вождении автотранспорта в период лечения данным средством следует быть осторожным.
Аналоги Кардосала
Совпадения по коду АТХ 4-го уровня:
Полные аналоги Кардосала: Олиместра, Олмесар.
Детям
Препарат не предназначен для лечения детей.
При беременности и лактации
Назначение препарата в данные периоды противопоказано.
Отзывы о Кардосале
Отзывы о Кардосале на форумах и отзывы врачей о препарате повторяют друг друга и сообщают об отличном гипотензивном эффекте и частых побочных явлениях в виде постоянной слабости и болях в груди. При появлении подобных симптомов нужно обратиться за консультацией к лечащему врачу.
Цена Кардосала, где купить
В России цена Кардосала 10 №28 составляет 460-570 рублей, цена Кардосала 20 №28 – 505-660 рублей, а Кардосала 40 тем же числом – 670-715 рублей.
На Украине цены на препарат в тех же формах выпуска приближаются к 248, 328 и 374 гривнам соответственно.
- Интернет-аптеки РоссииРоссия
ЗдравСити
-
Кардосал Плюс таблетки п/о плен. 12,5мг+20мг 28штДаичи Санкио Юроуп Гмбх
-
Кардосал таблетки п/о плен. 20мг 28штДаичи Санкио Юроуп Гмбх
Аптека Диалог
-
Кардосал (таб. п/о 20мг №28)Berlin-Chemie AG/Menarini
-
Кардосал (таб.п/об.40мг №28)Berlin-Chemie AG/Menarini
-
Кардосал (таб.п/о 40мг №28)Berlin-Chemie AG/Menarini
-
Кардосал (таб.п/об.10мг №28)Berlin-Chemie AG/Menarini
-
Кардосал плюс (таб. п.пл/об.12,5мг+20мг №28)Daiichi Sankyo
показать еще
Карсил® Форте (Carsil® Forte) инструкция по применению
📜 Инструкция по применению Карсил® Форте
💊 Состав препарата Карсил® Форте
✅ Применение препарата Карсил® Форте
📅 Условия хранения Карсил® Форте
⏳ Срок годности Карсил® Форте
Описание лекарственного препарата
Карсил® Форте
(Carsil® Forte)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2016
года, дата обновления: 2021.07.05
Владелец регистрационного удостоверения:
Контакты для обращений:
СОФАРМА АО
(Болгария)
Лекарственная форма
| Карсил® Форте |
Капс. 90 мг: 30 шт. рег. №: ЛП-000128 |
Форма выпуска, упаковка и состав
препарата Карсил® Форте
Капсулы твердые желатиновые, размер №0, светло-коричневого цвета, содержимое капсул — порошкообразная масса от светло-желтого до желто-коричневого цвета с агломератами.
Вспомогательные вещества: лактозы моногидрат — 38.2-7.5 мг, целлюлоза микрокристаллическая (тип 101) — 38.2-7.5 мг, крахмал пшеничный — 15.5 мг, повидон К25 — 3.7 мг, полисорбат 80 — 3.7 мг, кремния диоксид коллоидный безводный — 3.4 мг, маннитол — 80 мг, кросповидон — 14 мг, натрия гидрокарбонат — 6 мг, магния стеарат — 3.7 мг.
Состав оболочки капсулы: железа оксид черный — 0.02%, железа оксид красный — 0.03%, титана диоксид — 0.6666%, железа оксид желтый — 0.35%, желатин — до 100%.
6 шт. — блистеры (5) — пачки картонные.
Фармакологическое действие
Гепатопротекторный препарат. Карсил® Форте содержит экстракт плодов расторопши пятнистой, основными действующими веществами которого является смесь 6 изомеров флавонолигнанов (силимарин): силибинина А и B, изо-силибинина А и В, силидианина и силикристина. Из них самым активным является силибинин. Механизм гепатопротекторного действия до конца не изучен, существующие данные доказывают наличие нескольких основных механизмов действия.
Антиоксидантное действие. Силимарин взаимодействует со свободными радикалами в печени и переводит их в менее токсичные соединения, прерывая процесс перекисного окисления липидов, препятствует разрушению клеточных структур, связываясь со свободными радикалами и регулируя внутриклеточное содержание глутатиона. В зависимости от концентрации подавляет микросомальную пероксидацию, вызванную НАДФН-Fe2+-АДФ. Влияет на ферментные системы, связанные с глутатионом и супероксиддисмутазой. Компоненты силимарина подавляют пероксидацию линолеиновой кислоты, катализированную липооксигеназой и предохраняют печеночные митохондрии и микросомы от образования липидных пероксидов, вызванных различными агентами.
Мембраностабилизирующее действие. Силимарин стабилизирует клеточные мембраны и регулирует их проницаемость, в результате чего предотвращается поступление гепатотоксических агентов в гепатоциты. Установлено, что мембраностабилизирующее действие силимарина обусловлено его конкурирующим взаимодействием с рецепторами к соответствующим токсинам на мембране гепатоцитов. Влияние силимарина на проницаемость мембраны связано с качественными и количественными изменениями в мембранных липидах — холестерол и фосфолипиды.
Силимарин стимулирует регенерационные процессы в печени (восстановление поврежденных гепатоцитов) в результате активирования синтеза структурных и функциональных белков (рибосомный синтез РНК, протеина и ДНК) и фосфолипидов. Экспериментально установлено, что силимарин также подавляет трансформацию звездообразных клеток печени в миофибробласты, процесс, ответственный за расположение коллагеновых волокон.
Противовоспалительное действие. По результатам экспериментальных исследований показано, что силибинин в определенной концентрации способен ингибировать синтез лейкотриена В4 (leukotriene B4/LTB4) в изолированных клетках Купфера животных. Силимарин, силибинин, силидианин и силикристин угнетают активность липооксигеназы и простагландинсинтазы in vitro. В исследованиях in vitro на человеческих полиморфноядерных лейкоцитах показано, что одним из механизмов реализации противовоспалительного действия силибинина является подавление образования перекиси водорода.
Клинически фармакодинамические свойства силимарина выражаются в улучшении субъективной и объективной симптоматики и нормализации показателей функционального состояния печени (трансаминазы, гамма-глобулин, билирубин).
Фармакокинетика
Всасывание
После применения внутрь силимарин не полностью всасывается из ЖКТ (до 23-47%). Cmax в плазме достигается через 4-6 ч после применения внутрь однократной дозы.
Распределение
При исследованиях с 14С меченным силибинином самые высокие концентрации устанавливаются в печени, легких, желудке и поджелудочной железе и в незначительных количествах в почках, сердце и других органах.
Метаболизм
Подвергается кишечно-печеночной рециркуляции. Метаболизируется в печени путем конъюгации с сульфатами и глюкуроновой кислотой. В качестве метаболитов в желчи обнаружены глюкурониды и сульфаты.
Выведение
T1/2 составляет 1-3 ч для неизмененного силимарина и 6-8 ч для его метаболитов. Выводится в основном с желчью (около 80%) в форме глюкуронидов и сульфатов, в незначительной степени (около 5%) почками в неизмененном виде. Не кумулирует.
Показания препарата
Карсил® Форте
В составе комплексной терапии:
- токсического поражения печени;
- состояний после перенесенного острого гепатита;
- хронического гепатита невирусной этиологии;
- стеатоза печени (не алкогольного и алкогольного);
- цирроза печени;
- профилактики печеночных поражений при продолжительном приеме лекарств, алкоголя, при хронической интоксикации (в т.ч. профессиональной).
Режим дозирования
Капсулы принимают внутрь, запивая достаточным количеством воды.
Взрослые и дети старше 12 лет
Лечение тяжелых поражений печени начинается с дозы 1 капсула 3 раза/сутки. При более легких и среднетяжелых случаях доза составляет по 1 капсуле 1-2 раза в сутки.
Для профилактики химических интоксикаций — 1-2 капсулы в сутки. Курс лечения продолжается не менее 3 месяцев.
Дети младше 12-летнего возраста
Нет достаточных клинических данных о применении у детей.
Побочное действие
Лекарственный препарат хорошо переносится. Побочные реакции наблюдаются очень редко и они, как правило, легкие и преходящие.
Нежелательные побочные реакции классифицированы по частоте и по системно-органным классам. Частота по MedDRA определяется следующим образом: очень часто (>1/10), часто (>1/100 до <1/10), нечасто (>1/1000 до <1/100), редко (>1/10 000 до <1/1000), очень редко (<1/10 000), с неизвестной частотой (на основании существующих данных нельзя сделать оценку).
Со стороны иммунной системы: очень редко — кожные аллергические реакции — зуд, сыпь; с неизвестной частотой — анафилактический шок.
Со стороны органа слуха и лабиринтные нарушения: редко — усиление существующих вестибулярных нарушений.
Со стороны ЖКТ: редко — диарея в результате усиленной функции печени и желчного пузыря; с неизвестной частотой — тошнота, рвота, диспепсия, уменьшение аппетита, метеоризм.
Противопоказания к применению
- гиперчувствительность к активному или любому из вспомогательных веществ;
- дети младше 12 лет;
- лактазная недостаточность, галактоземия или синдром мальабсорбции глюкозы/галактозы (из-за наличия в составе лактозы).
- целиакия (глютеновая энтеропатия) (из-за наличия в составе пшеничного крахмала).
С осторожностью: назначают пациентам с гормональными нарушениями (эндометриоз, миома матки, карцинома молочной железы, яичников и матки, карцинома предстательной железы) из-за возможного проявления эстрогеноподобного эффекта силимарина.
Применение при беременности и кормлении грудью
Не рекомендуется применять препарат во время беременности и в период грудного вскармливания.
Применение у детей
Противопоказан детям младше 12 лет.
Особые указания
Влияние на способность управлять транспортными средствами и механизмами
Применение препарата в качестве монотерапии не влияет на способность управлять автотранспортом и работать с механизмами.
Передозировка
Нет данных о передозировке препарата.
Лечение при случайном приеме высокой дозы: индукция рвоты, промывание желудка, применение активированного угля, проведение при необходимости симптоматической терапии.
Лекарственное взаимодействие
Фармакодинамическое лекарственное взаимодействие
Силимарин не оказывает существенного влияния на фармакодинамику других лекарственных препаратов.
При совместном применении силимарина с пероральными контрацептивами и препаратами, которые используются при гормональной заместительной терапии, возможно уменьшение эффектов последних.
Фармакокинетическое лекарственное взаимодействие
Т.к. силимарин обладает ингибирующим действием на систему цитохрома Р450, возможно повышение концентрации в плазме крови таких лекарственных средств, как диазепам, алпразолам, кетоконазол, ловастатин, винбластин.
Условия хранения препарата Карсил® Форте
Хранить в сухом защищенном от света месте, при температуре не выше 25°С.
Срок годности препарата Карсил® Форте
Срок годности — 3 года.
Хранить в недоступном для детей месте!
Не использовать по истечении срока годности, указанного на упаковке.
Условия реализации
Без рецепта.
Контакты для обращений
СОФАРМА АО
(Болгария)

|
|
СОФАРМА АО Представительство в России |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Ксолар — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер
ЛП-004376
Торговое наименование препарата
Ксолар®
Международное непатентованное наименование
Омализумаб
Лекарственная форма
раствор для подкожного введения
Состав
На 1 предварительно заполненный шприц объемом 0,.5 мл/1,0 мл:
Действующее вещество: омализумаб — 75,00 мг/150,00 мг;
вспомогательные вещества: аргинина гидрохлорид — 21,05 мг/42,10 мг, гистидина гидрохлорид — 1.17 мг/2,34 мг, гистидин — 0,68 мг/1,37 мг, полисорбат-20 — 0,20 мг/0,40 мг, вода для инъекций — до 0,50 мл/1,00 мл.
Описание
Прозрачный или слабо опалесцирующий раствор от бесцветного до светло-коричневато-желтого цвета.
Фармакотерапевтическая группа
Другие средства для системного применения при обструктивных заболеваниях дыхательных путей
Код АТХ
R03DX05
Фармакодинамика:
Омализумаб является гуманизированным моноклональным антителом, полученным на основе рекомбинантной ДНК, селективно связывающимся с иммуноглобулином (IgE). Омализумаб представляет собой IgG1 каппа антитело, содержащее человеческую стру ктурную основу с определяющими комплементарность участками мышиного антитела, связывающими IgE.
Пациенты с атопической бронхиальной астмой
Омализумаб связывается с IgE и предотвращает его взаимодействие с высокоаффинным FcɛRI-рецептором. Таким образом, происходит снижение количества свободного IgE, который является пусковым фактором для каскада аллергических реакций.
При применении препарата у пациентов с атопической бронхиальной астмой (БА) отмечается заметное уменьшение количества FcɛRI-рецепторов на поверхности базофилов. В клинических исследованиях у пациентов с БА концентрация свободного IgE в сыворотке крови дозозависимо уменьшалась в течение 1 часа после введения первой дозы препарата Ксолар® и сохранялась на достигнутом уровне в период между введением последующих доз.
При применении в рекомендуемых дозах среднее уменьшение концентрации свободного IgE в сыворотке крови составляло более 96%.
Общая концентрация IgE (связанного и несвязанного) в сыворотке крови увеличивалась после применения первой дозы вследствие образования комплекса омализумаб-IgE, характеризующегося более медленной скоростью выведения по сравнению со свободным IgE.
На 16 неделе после введения первой дозы препарата средняя концентрация общего IgE в сыворотке крови была в 5 раз выше по сравнению с таковым до лечения.
После отмены лечения препаратом обусловленное его действием увеличение концентрации общего IgE и уменьшение концентрации свободного IgE были обратимыми.
После полного выведения омализумаба из организма не наблюдалось увеличения концентрации IgE в сыворотке крови. Концентрация общего IgE оставалась повышенной в течение 1 года после отмены препарата Ксолар®.
При применении препарата Ксолар® у пациентов со среднетяжелой и тяжелой атопической БА отмечалось достоверное уменьшение частоты обострений БА (определяемых как ухудшение течения БА. требующее применения системных глюкокортикостероидов (ГКС) или удвоения исходной дозы ингаляционных ГКС) и снижение потребности в ингаляционных ГКС по сравнению с плацебо.
При применении препарата Ксолар® в течение 16 недель на фоне постепенного уменьшения дозы ингаляционных или пероральных ГКС также наблюдалось достоверное уменьшение частоты обострений БА и снижение потребности в ингаляционных ГКС по сравнению с плацебо.
У пациентов с БА и круглогодичным аллергическим ринитом, получавших терапию ГКС, при применении омализумаба в течение 28 недель отмечалось снижение выраженности симптомов БА и круглогодичного аллергического ринита, а также улучшение параметров легочной функции. Уменьшение частоты обострений БА и улучшение качества жизни пациентов (по сертифицированному опроснику качества жизни) на фоне терапии препаратом Ксолар® сохранялось в течение длительного времени по сравнению с плацебо.
При применении препарата Ксолар® у детей от 6 до 12 лет в течение 52 недель было отмечено снижение частоты обострений БА по сравнению с группой пациентов, получавших плацебо. В другом исследовании на фоне применения препарата Ксолар® в течение 28 недель у детей в возрасте 6-12 лет было отмечено уменьшение частоты и выраженности обострений БА, а также снижение дозы применяемых ингаляционных ГКС к концу 28 недели терапии по сравнению с группой применения плацебо.
Пациенты с хронической идиопатической крапивницей
У некоторых пациентов с хронической идиопатической крапивницей (ХИК) из сыворотки крови были выделены аутоиммунные антитела к IgE и FcɛRI-рецептору. Данные антитела способны к активации базофилов или тучных клеток, что приводит к высвобождению гистамина.
Одна из гипотез механизма действия омализумаба у пациентов с ХИК заключается в снижении концентрации свободного IgE в крови, а затем и в коже. В результате уменьшается передача сигнала посредством FcɛRI-рецепторов и, следовательно, подавляется активация клеток, участвующих в воспалительной реакции. Таким образом, частота возникновения и выраженность симптомов ХИК снижается.
Кроме того, считается, что снижение концентрации циркулирующего IgE приводит к быстрой неспецифической десенсибилизации тучных клеток в коже, а FcɛRI-рецепторы посредством обратной отрицательной связи поддерживают данную реакцию.
В клинических исследованиях у пациентов с ХИК, так же как и у пациентов с атопической БА, применение омализумаба приводило к дозозависимому снижению концентрации свободного IgE и повышению концентрации общего IgE. Максимальное снижение концентрации свободного IgE наблюдалось через 3 дня после подкожного (п/к) введения первой дозы препарата Ксолар®.
После повторного введения препарата 1 раз каждые 4 недели, концентрация свободного IgE в сыворотке крови перед введением очередной дозы сохранялась на достигнутом уровне в период между 12 и 24 неделями лечения. Концентрация общего IgE в сыворотке крови повышалась после введения первой дозы вследствие образования комплекса омализумаб- IgE, характеризующегося более медленной скоростью выведения по сравнению со свободным IgE.
После повторного введения препарата 1 раз каждые 4 недели в дозе от 75 мг до 300 мг, концентрация общего IgE в сыворотке крови на 12 неделе от начала лечения была в 2-3 раза выше по сравнению с таковым до лечения и сохранялась на достигнутом уровне в период между 12 и 24 неделями лечения.
После отмены препарата Ксолар® в течение 16 недель последующего наблюдения концентрация общего IgE уменьшалась, а концентрация свободного IgE увеличивалась, приближаясь к исходным значениям.
При применении препарата Ксолар® в дозах 150 и 300 мг каждые 4 недели у пациентов с ХИК наблюдались воспроизводимые и статистически значимые терапевтические эффекты в отношении уменьшения тяжести зуда. Эффект достигал максимума к 12 неделе лечения и сохранялся на протяжении всего периода наблюдения.
Кроме того, препарат Ксолар® в дозе 300 мг, оказывал воспроизводимый и статистически значимый эффект в отношении индекса активности крапивницы (UAS), доли дней без ангионевротического отека, недельного индекса нарушений сна и качества жизни пациентов, оцениваемого по опроснику Cu-Q2oL (опросник для изучения качества жизни у пациентов с ХИК), а также индексом DLQI (Дерматологический индекс качества жизни).
Фармакокинетика:
Всасывание
После п/к введения у пациентов с БА абсолютная биодоступность омализумаба составляет в среднем 62%. При применении в дозах более 0,5 мг/кг фармакокинетика омализумаба имеет линейный характер.
Пациенты с атопической БА
После однократного п/к введения у взрослых и подростков с БА всасывание омализумаба происходит медленно, пик концентрации в сыворотке крови достигается в среднем через 7-8 дней.
После многократного введения омализумаба площадь под кривой «концентрация-время» (AUC) в течение периода от 0 до 14 сут в равновесном состоянии была в 6 раз выше, чем после введения однократной дозы.
Пациенты с ХИК
После однократного п/к введения у взрослых и подростков с ХИК всасывание омализумаба происходит медленно, пик концентрации в сыворотке крови достигается в среднем через 6- 8 дней. При применении омализумаба у пациентов с ХИК в диапазоне доз от 75 мг до 600 мг в виде однократной п/к инъекции фармакокинетика имеет линейный характер. Минимальная концентрация омализумаба в сыворотке крови увеличивается пропорционально повышению дозы при введении 75 мг, 150 мг или 300 мг каждые 4 недели.
Распределение
In vitro омализумаб с IgE образует комплекс определенного размера. In vitro или in vivo не наблюдалось образования преципитирующих комплексов и комплексов, молекулярный вес которых превышал 1 млн дальтон.
В клинических исследованиях не выявлено специфического накопления омализумаба в каких-либо органах и тканях.
Пациенты с атопической БА
У пациентов с атопической БА после п/к введения кажущийся объем распределения омализумаба составлял 78±32 мл/кг.
Пациенты с ХИК
На основании популяционной фармакокинетической модели было показано, что распределение омализумаба у пациентов с ХИК было сходно с таковым у пациентов с атопической БА.
Выведение
Клиренс омализумаба включает как собственно клиренс IgG, так и клиренс путем специфического связывания и образования комплексов с лигандом-мишенью — свободным IgE сыворотки крови.
Печеночная элиминация IgG включает деградацию в ретикулоэндотелиальной системе печени и эндотелиальных клетках печени. Интактный IgG также выводится с желчью.
Пациенты с атопической БА
У пациентов с БА период полувыведения омализумаба из сыворотки составлял в среднем 26 дней, кажущийся клиренс в среднем составлял 2,4 ± 1,1 мл/кг/сут. Кроме того, при увеличении массы тела вдвое отмечалось приблизительно двукратное увеличение кажущегося клиренса.
Пациенты с ХИК
На основании популяционной фармакокинетической модели у пациентов с ХИК период полувыведения омализумаба из сыворотки крови при равновесной концентрации составлял в среднем 24 дня, кажущийся клиренс при равновесной концентрации в среднем составлял 240 мл/сут (что соответствует 3,0 мл/кг/сут для пациента с массой тела 80 кг).
Фармакокинетика в особых клинических случаях
Возраст, расовая/этническая принадлежность, пол, масса тела, индекс массы тела, исходная концентрация IgE, аутоиммунные антитела к FcɛRI-рецептору, одновременное применение лекарственных средств
Пациенты с атопической БА
У пациентов с БА не требуется коррекции дозы омализумаба в зависимости от возраста (6-76 лет), расовой или этнической принадлежности, пола и индекса массы тела.
Пациенты с ХИК
У пациентов с ХИК не требуется коррекции дозы омализумаба в зависимости от возраста (12-75 лет), расовой или этнической принадлежности, пола пациента, массы тела, индекса массы тела, исходной концентрации IgE, аутоиммунных антител к FcɛRI-рецептору или одновременного применения блокаторов Н2-гистаминовых рецепторов и антагонистов лейкотриеновых рецепторов.
Нарушения функции почек и печени
Фармакокинетические и фармакодинамические параметры омализумаба у пациентов с атопической БА или ХИК и нарушениями функции почек или печени не изучались.
Так как метаболизм препарата осуществляется преимущественно ретикулоэндотелиальной системой, нарушение функции печени и почек не оказывают на него влияния. Несмотря на то, что коррекция дозы омализумаба не требуется, препарат следует применять с осторожностью у пациентов данной категории.
Показания:
— Лечение персистирующей атопической бронхиальной астмы среднетяжелого и тяжелого течения, симптомы которой недостаточно контролируются применением ингаляционных глюкокортикостероидов у пациентов 6 лет и старше.
— Лечение хронической идиопатической крапивницы, резистентной к терапии блокаторами Н1-гистаминовых рецепторов, у пациентов 12 лет и старше.
Противопоказания:
Повышенная чувствительность к омализумабу или к другому компоненту препарата.
Противопоказано применение препарата Ксолар® у пациентов с атопической БА в возрасте до 6 лет и у пациентов с ХИК в возрасте до 12 лет в связи с отсутствием данных по эффективности и безопасности.
С осторожностью:
Следует с осторожностью применять препарату пациентов с нарушениями функции печени и/или почек, с аутоиммунными заболеваниями или заболеваниями, связанными с накоплением иммунных комплексов, а также у пациентов с повышенным риском развития гельминтных инвазий (особенно в эндемичных районах).
При применении препарата Ксолар®, как и при любых других протеинсодержащих препаратов, могут возникать местные или системные аллергические реакции, включая анафилактические реакции. Перед введением препарата Ксолар® необходимо заранее приготовить соответствующее реанимационное оборудование и лекарственные средства, необходимые для купирования реакций гиперчувствительности.
Беременность и лактация:
Специальных исследований по применению омализумаба у беременных женщин не проводилось, В экспериментальных исследованиях не было выявлено прямого или непрямого отрицательного влияния препарата на течение беременности, развитие эмбриона и плода, течение родов и развитие новорожденных. Известно, что молекулы IgG проникают через гемато-плацентарный барьер.
Человеческий IgG выделяется с грудным молоком. Неизвестно, выделяется ли омализумаб с грудным молоком у человека. Учитывая возможность выделения препарата с грудным молоком и возможное отрицательное воздействие омализумаба на ребенка, следует соблюдать осторожность при применении препарата у пациенток в период грудного вскармливания.
Влияние на фертильность
Отсутствуют данные о влиянии омализумаба на фертильность у человека. Исследования продемонстрировали отсутствие нарушения мужской и женской фертильности у животных при применении многократных доз, превышающих 75 мг/кг.
Способ применения и дозы:
Только для подкожного введения! Препарат нельзя вводить внутривенно или внутримышечно.
Атопическая БА
Дозу препарата Ксолар® и периодичность введения определяют на основании исходной концентрации IgE (МЕ/мл), измеренной до начала лечения, а также массы тела (кг).
В зависимости от исходной концентрации IgE (МЕ/мл) и массы тела (кг), рекомендуемая доза препарата составляет от 75 до 600 мг 1 раз в 2 или 4 недели (см. табл. 3 и 4).
Препарат Ксолар® не следует применять у пациентов с исходной концентрацией IgE и массой тела, не соответствующих приведенным в таблице по подбору режима дозирования. Определение количества шприцев, инъекций и общий объем раствора препарата Ксолар® в зависимости от дозы см. в таблице 1.
Таблица 1. Количество предзаполненных шприцев, количество инъекции и общий объем раствора препарата в зависимости от дозы
|
Доза (мг) |
Количество шприцев |
Количество инъекций |
Общий объем раствора (мл) |
|
|
75 мг/0,5 мл |
150 мг/1,0 мл |
|||
|
75 |
1 |
0 |
1 |
0,5 |
|
150 |
0 |
1 |
1 |
1,0 |
|
225 |
1 |
1 |
2 |
1,5 |
|
300 |
0 |
2 |
2 |
2,0 |
|
375 |
1 |
2 |
3 |
2,5 |
|
450 |
0 |
3 |
3 |
3,0 |
|
525 |
1 |
3 |
4 |
3,5 |
|
600 |
0 |
4 |
4 |
4,0 |
Продолжительность лечения, мониторинг и коррекция дозы
Дозу препарата Ксолар® следует корректировать при значительных изменениях массы тела. Схемы определения дозы см. в таблицах 2 и 3.
Таблица 2. Расчет дозы препарата Ксолар® (мг) для п/к введения каждые 4 недели
|
Масса тела (кг) |
||||||||||
|
Исходная концентрация IgE (МЕ/мл) |
>20-25 |
>25-30 |
>30-40 |
>40-50 |
>50-60 |
>60-70 |
>70-80 |
>80-90 |
>90-125 |
>125-150 |
|
>30-100 |
75 |
75 |
75 |
150 |
150 |
150 |
150 |
150 |
300 |
300 |
|
>100-200 |
150 |
150 |
150 |
300 |
300 |
300 |
300 |
300 |
450 |
600 |
|
>200-300 |
150 |
150 |
225 |
300 |
300 |
450 |
450 |
450 |
600 |
|
|
>300-400 |
225 |
225 |
300 |
450 |
450 |
450 |
600 |
600 |
||
|
>400-500 |
225 |
300 |
450 |
450 |
600 |
600 |
Применяется 1 раз в 2 недели |
|||
|
>500-600 |
300 |
300 |
450 |
600 |
600 |
См. таблицу 4 |
||||
|
>600-700 |
300 |
450 |
600 |
Таблица 3. Расчет дозы препарата Ксолар® (мг) для п/к введения каждые 2 недели
|
Масса тела (кг) |
|||||||||||
|
Исходная концентрация IgE (МЕ/мл) |
>20- 25 |
>25-30 |
>30-40 |
>40-50 |
>50-60 |
>60-70 |
>70-80 |
>80-90 |
>90-125 |
>125-150 |
>150-200 |
|
>30-100 |
Применяется 1 раз в 4 недели |
225 |
|||||||||
|
>100-200 |
См. таблицу 3 |
375 |
|||||||||
|
>200-300 |
375 |
525 |
|||||||||
|
>300-400 |
450 |
525 |
|||||||||
|
>400-500 |
375 |
375 |
525 |
600 |
|||||||
|
>500-600 |
375 |
450 |
450 |
600 |
|||||||
|
>600-700 |
225 |
375 |
450 |
450 |
525 |
||||||
|
>700-800 |
225 |
225 |
300 |
375 |
450 |
450 |
525 |
600 |
|||
|
>800-900 |
225 |
225 |
300 |
375 |
450 |
525 |
600 |
||||
|
>900-1000 |
225 |
300 |
375 |
450 |
525 |
600 |
|||||
|
>1000-1100 |
225 |
300 |
375 |
450 |
600 |
||||||
|
>1100-1200 |
300 |
300 |
450 |
525 |
600 |
Не применяется |
|||||
|
>1200-1300 |
300 |
375 |
450 |
525 |
|||||||
|
>1300-1500 |
300 |
375 |
525 |
600 |
При применении препарата Ксолар® в течение первых 16 недель в ходе клинических исследований наблюдалось уменьшение частоты развития обострений БА, снижение числа случаев применения неотложной терапии, а также улучшение симптомов заболевания.
Оценку эффективности терапии препаратом Ксолар® следует проводить по прошествии минимум 12 недель лечения препаратом.
Препарат Ксолар® предназначен для длительной терапии. Отмена препарата, как правило, приводит к восстановлению повышенной концентрации свободного IgE и развитию соответствующих симптомов.
Концентрация общего IgE возрастает в ходе лечения и остается повышенной в течение одного года после прекращения терапии. Таким образом, концентрация IgE при повторном определении на фоне терапии препаратом Ксолар® не может служить ориентиром для подбора дозы препарата. Для подбора дозы препарата после приостановления лечения на период менее 1 года следует ориентироваться на концентрацию IgE в сыворотке крови, установленную до введения начальной дозы препарата.
Если лечение препаратом Ксолар® было приостановлено на 1 год или более для подбора дозы препарата Ксолар® следует повторно определить концентрацию IgE в сыворотке крови.
Хроническая идиопатическая крапивница
Рекомендуемая доза препарата Ксолар® составляет 300 мг каждые 4 недели в виде п/к инъекции. Лечащему врачу следует периодически повторно оценивать необходимость продолжения терапии препаратом.
Опыт длительного применения омализумаба в клинических исследованиях у пациентов с ХИК ограничен.
Применение у детей и подростков
Препарат Ксолар® противопоказан к применению у пациентов с атопической БА в возрасте до 6 лет и у пациентов с ХИК в возрасте до 12 лет в связи с отсутствием данных по эффективности и безопасности (см. раздел «Противопоказания»).
Применение у пациентов пожилого возраста
Имеется ограниченный опыт применения препарата Ксолар® у пациентов старше 65 лет. Однако данных, свидетельствующих о необходимости коррекции дозы препарата у пациентов этого возраста, нет.
Инструкция по использованию предварительно заполненного шпица препарата Ксолар®
Перед тем как использовать шприц, пожалуйста, внимательно прочтите следующую информацию.
Каждая упаковка с препаратом Ксолар® содержит предварительно заполненный шприц в индивидуальной герметичной пластиковой упаковке.
Важная информация по безопасности
Внимание! Храните шприц в месте, не доступном для детей.
1. Колпачок иглы может содержать производные натурального латекса, в связи с чем, пациентам с гиперчувствительностью к латексу следует избегать прямого контакта с его поверхностью.
2. Не вскрывайте запечатанную внешнюю коробку, пока не будете готовы к проведению инъекции.
3. Не используйте шприц при обнаружении повреждений целостности внешней коробки или этикетки блистера, поскольку это может быть небезопасным.
4. Никогда не оставляйте шприц в пределах доступности для других лиц.
5. Будьте внимательны и никогда не дотрагивайтесь до активирующих защелок (см. первый рисунок). При дотрагивании до защелок происходит самоактивация защитного устройства иглы.
6. Колпачок с иглы следует снимать только непосредственно перед введением раствора препарата.
7. Предварительно заполненный шприц является одноразовым. Утилизируйте использованный шприц сразу же после использования.
Хранение шприца
1. Храните шприц в запечатанной внешней упаковке в холодильнике при температуре от 2 °С до 8 °С. НЕ ЗАМОРАЖИВАТЬ!
2. Заранее достаньте шприц из холодильника, чтобы температура раствора сравнялась с комнатной (на это потребуется около 20 минут), а затем подготовьте шприц к инъекции.
3. Не используйте шприц после истечения срока годности, указанного на картонной пачке или на маркировке шприца.
Место инъекции
Место инъекции — это то место на теле, куда Вы будете вводить лекарственный препарат при помощи шприца. Препарат Ксолар® следует вводить в верхне-наружную поверхность бедра или в верхне-наружную поверхность плеча. Если вам требуется провести более одной инъекции за один раз, сделайте вторую инъекцию в другое бедро или руку, избегая пораженных участков кожи.
Подготовка шприца к использованию
Предупреждение: До завершения инъекции не дотрагивайтесь до активирующих защелок устройства (см. первый рисунок), чтобы предохранитель иглы не закрыл ее раньше времени.
1. Достаньте коробку со шприцем из холодильника приблизительно за 20 минут до проведения инъекции, чтобы температура раствора сравнялась с комнатной (не извлекая шприц из коробки, во избежание попадания на него света).
2. Если шприц необходимо использовать позже, его можно снова убрать в холодильник, однако больше одного раза это делать не следует. Общее время, в течение которого шприц находится при комнатной температуре (25 °С), не должно превышать 4 часов.
3. Когда вы будете готовы использовать шприц, тщательно вымойте руки водой с мылом.
4. Найдите чистое, удобное место для проведения инъекции.
5. Достаньте из пачки пластиковый поддон, и извлеките шприц.
6. Осмотрите шприц. НЕ ИСПОЛЬЗУЙТЕ его, если он разбит или если жидкость выглядит мутной или содержит нерастворимые частицы.
7. Удерживая шприц в горизонтальном положении, как показано на рисунке, посмотрите в смотровое окошко, чтобы удостовериться в дозе препарата (75 мг или 150 мг) и сроке годности, указанных на этикетке.
Примечание: чтобы увидеть в смотровом окошке маркировку, проверните внутреннюю часть шприца, как показано на рисунке.
8. Удерживая шприц вертикально с максимально отведенным назад поршнем как показано на рисунке, постучите по стенке шприца пальцем, чтобы воздух поднялся.
9. Убедитесь, что уровень жидкости совпадает с линией отметки минимального наполнения или находится выше нее.
НЕ ИСПОЛЬЗУЙТЕ шприц, если срок годности истек или доза не соответствует дозе, назначенной Вам врачом.
Как использовать шприц
Этап 1
Удерживая шприц иглой вверх, аккуратно снимите со шприца колпачок иглы и выбросьте его. Не дотрагивайтесь до открытой иглы. Слегка постучите по шприцу, чтобы крупные пузырьки воздуха поднялись наверх, затем медленно надавите на поршень, чтобы удалить воздух из шприца, не допуская вытекания раствора.
Этап 2
Аккуратно возьмите кожу в месте инъекции в небольшую складку. Введите иглу в кожную складку.
Этап 3
Уперев указательный и средний пальцы в специальные выступы, медленно протолкните поршень вниз до конца, пока не будет введен весь раствор.
Этап 4
После введения полной дозы извлеките иглу из кожи, продолжая надавливать на поршень.
Этап 5
Медленно отпустите поршень — при этом игла автоматически закроется предохранителем.
ВАЖНО! Если предохранитель иглы не сработает, резко нажмите на поршень, после чего отпустите, при этом игла закроется предохранителем.
Этап 6
Сразу же выбросьте использованный шприц в контейнер для острых предметов.
Неиспользованный объем препарата, а также все использованные материалы следует утилизировать в соответствии с местными требованиями.
Побочные эффекты:
Атопическая БА
Наиболее частыми нежелательными явлениями (НЯ) при применении препарата Ксолар® являются головная боль, реакции в месте инъекции, включая боль, отек, эритему и зуд в месте введения препарата. Большинство НЯ были легкой или умеренной степени тяжести.
Для определения частоты развития нежелательных реакций, выявленных в ходе клинических исследований, были использованы следующие критерии: очень часто (≥ 1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (< 1/1000).
Инфекционные и паразитарные заболевания: нечасто — фарингит; редко — паразитарные инвазии.
Нарушения со стороны иммунной системы: редко — анафилактические реакции и другие аллергические состояния, включая ангионевротический отек, возникновение антител к омализумабу.
Нарушения со стороны нервной системы: часто — головная боль; нечасто — головокружение, сонливость, парестезии, синкопальные состояния.
Нарушения со стороны сосудов: нечасто — постуральная гипотензия, «приливы».
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: нечасто — кашель, аллергический бронхоспазм; редко — отек гортани.
Нарушения со стороны желудочно-кишечного тракта: нечасто — тошнота, диарея, диспепсические явления.
Нарушения со стороны кожи и подкожных тканей: нечасто — крапивница, сыпь, зуд, фотосенсибилизация.
Общие расстройства и нарушения в месте введения: часто — реакции в месте инъекции, такие как боль, эритема, зуд, отечность; нечасто — увеличение массы тела, чувство усталости, отечность рук, гриппоподобное состояние.
На фоне терапии препаратом Ксолар® в клинической практике отмечались следующие НЯ (отдельные сообщения)
Нарушения со стороны иммунной системы: анафилаксия и анафилактоидные реакции (отмечались как при первом, так и при повторном применениях препарата в большинстве случаев в течение 2-х часов после п/к инъекции, у некоторых пациентов спустя более 2 часов после введения препарата Ксолар®), сывороточная болезнь.
Нарушения со стороны кожи и подкожных тканей: алопеция.
Нарушения со стороны крови и лимфатической системы: тяжелая идиопатическая тромбоцитопения.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: аллергический гранулематозный ангиит (синдром Чарга-Стросса).
Нарушения со стороны скелетно-мышечной и соединительной ткани: артралгия, миалгия, припухлость суставов.
В клинических исследованиях у детей 6-12 лет были отмечены следующие НИ:
Нарушения со стороны нервной системы: очень часто — головная боль.
Нарушения со стороны желудочно-кишечного тракта:часто — боль в верхнем отделе живота.
Общие расстройства и нарушения в месте введения: очень часто — повышение температуры тела.
ХИК
Наиболее частыми НЯ при применении препарата Ксолар® у пациентов 12 лет и старше являются головная боль и назофарингит.
Представленные ниже НЯ отмечались у >1% пациентов во всех группах лечения и не менее чем на 2% чаще у пациентов, получавших препарат Ксолар® в рекомендованных дозах (150 мг и 300 мг), по сравнению с группой применения плацебо.
НЯ сгруппированы в соответствии с классификацией органов и систем органов MedDRA, в пределах каждой группы перечислены в порядке уменьшения частоты встречаемости.
Для определения частоты для определения частоты встречаемости использованы следующие критерии: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥ 1/1000, <1/100), редко (< 1 /1000), очень редко (< 1 /10000).
Инфекционные и паразитарные заболевания: часто — назофарингит, синусит, инфекции верхних дыхательных путей, включая вирусной этиологии, инфекции мочевыводящих путей.
Нарушения со стороны нервной системы: очень часто — головная боль; часто — головная боль в области придаточных пазух носа.
Нарушения со стороны скелетно-мышечной и соединительной ткани: часто — артралгия, миалгия. боль в конечностях, костно-мышечная боль.
Общие расстройства и нарушения вместе введения: часто — повышение температуры тела, реакции в месте инъекции, такие как отечность, эритема, боль, гематома, зуд, кровотечение, крапивница.
Анафилаксия
В пострегистрационном периоде частота встречаемости анафилактических реакций при применении препарата Ксолар® составила приблизительно 0,2% (из всех случаев анафилактических реакций на 500000 пациенто-лет).
Анафилактические реакции в анамнезе, не связанные с применением омализумаба, могут являться фактором риска развития анафилактической реакции на введение препарата Ксолар®.
Малигнизация
Общая частота развития новообразований при применении препарата Ксолар® в клинических исследованиях была сходной с таковой в общей популяции.
Частота развития злокачественных новообразований в группе пациентов, получавших препарат Ксолар®, и в контрольной группе оценивалась <1/100.
В наблюдательном исследовании при сравнении пациентов, получавших лечение препаратом Ксолар®, и пациентов, получавших иное лечение продолжительностью до 5 лет, не было выявлено увеличения риска развития злокачественных новообразований.
У детей 6-12 лет случаев развития злокачественных новообразований в группе пациентов, получавших Ксолар®, зарегистрировано не было.
Тромбоэмболические осложнения
В контролируемых клинических исследованиях у пациентов, получавших лечение препаратом Ксолар®, отмечалось развитие тромбоэмболических осложнений, включая инсульт, транзиторные ишемические атаки, инфаркт миокарда, нестабильную стенокардию, смерть от сердечно-сосудистых причин (в том числе, летальный исход по неустановленным причинам).
При анализе основных факторов сердечно-сосудистого риска, соотношение рисков составило 1,32.
Гельминтные инвазии
Возможно участие IgE в иммунном ответе при развитии гельминтных инвазий. В плацебо-контролируемых исследованиях у пациентов с аллергическими заболеваниями и риском развития гельминтных инвазий при применении препарата Ксолар® отмечалась небольшое повышение частоты возникновения гельминтозов (однако течение, тяжесть заболевания и ответ на терапию не изменялись). Общая частота развития гельминтных инвазий во всех клинических исследованиях была менее 1 из 1000 (дизайн исследований не включал специальное изучение частоты развития гельминтных заболеваний).
Изменение количества тромбоцитов крови
При применении препарата Ксолар® в ходе клинических исследований у нескольких пациентов наблюдалось снижение количества тромбоцитов ниже нормы, что не сопровождалось кровотечением или уменьшением концентрации гемоглобина.
В ходе клинических исследований не было выявлено постоянного уменьшения количества тромбоцитов.
Данные других лабораторных исследовании
Значимых изменений лабораторных показателей в ходе клинических исследований не выявлено.
Если отмечено ухудшение клинического течения любого из указанных в инструкции побочных эффектов, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка:
О случаях передозировки омализумабом до настоящего времени не сообщалось. Максимальная переносимая доза препарата Ксолар® до настоящего времени не определена. При однократном внутривенном введении в дозе до 4000 мг не отмечено признаков дозолимитирующей токсичности. При введении наивысшей кумулятивной дозы препарата — 44 000 мг в течение 20 недель не отмечалось развития каких-либо тяжелых острых НЯ.
Взаимодействие:
Поскольку ферменты цитохрома Р450, механизмы системы энергетического выброса (эффлюксные насосы) и связывания с белками не играют роли в клиренсе омализумаба, вероятность возникновения лекарственного взаимодействия с другими препаратами мала.
Специальных исследований по взаимодействию препарата Ксолар® с лекарственными препаратами, включая вакцины, не проводилось.
Взаимодействие омализумаба с лекарственными препаратами, используемыми для лечения БА или ХИК, маловероятно.
Атопическая БА
В клинических исследованиях препарат Ксолар® широко применяли в комбинации с ингаляционными и пероральными ГКС, ингаляционными бета-агонистами короткого и длительного действия, антагонистами лейкотриенов, теофиллином и пероральными антигистаминными средствами. Вышеуказанные препараты не влияют на безопасность препарата Ксолар®.
В настоящее время данные по применению препарата Ксолар® в комбинации со специфической иммунотерапией (гипосенсибилизирующей терапией) ограничены.
ХИК
В клинических исследованиях препарат Ксолар® применяли в комбинации с антигистаминными средствами (блокаторами Н1— и Н2-гистаминовых рецепторов), антагонистами лейкотриеновых рецепторов. Не выявлено влияния вышеуказанных препаратов на профиль безопасности препарата Ксолар®. В результате популяционного фармакокинетического анализа также не выявлено влияния блокаторов Н2-гистаминовых рецепторов и антагонистов лейкотриеновых рецепторов на фармакокинетику омализумаба.
Применение препарата Ксолар® в комбинации с иммунодепрессивными средствами не изучалось.
Препарат Ксолар® не следует смешивать с какими-либо другими лекарственными препаратами или растворами.
Особые указания:
Аллергические реакции
При применении препарата Ксолар®, как и при любых других протеинсодержащих препаратов, могут возникать местные или системные аллергические реакции, включая анафилактические реакции.
Перед введением препарата Ксолар® необходимо заранее приготовить соответствующее реанимационное оборудование и лекарственные средства, необходимые для купирования реакций гиперчувствительности.
Следует проинформировать пациентов о возможности развития анафилактических реакций и обеспечить соответствующее медицинское наблюдение.
В клинических исследованиях развитие анафилаксии и анафилактоидных реакций отмечалось при применении как первой, так и повторных доз препарата Ксолар®. В большинстве случаев возникновение таких реакций отмечалось в течение 2 часов после введения препарата.
Так же как при применении иных гуманизированных моноклональных антител — производных рекомбинантной ДНК. в редких случаях возможно образование антител к омализумабу.
У пациентов, получавших терапию гуманизированными моноклональными антителами, в том числе омализумабом, в редких случаях наблюдалось развитие сывороточной болезни и подобных ей состояний, являющихся проявлением отсроченным аллергических реакций 3 типа. Начало развития таких состояний обычно отмечалось на 1-5 день после первой или последующих инъекций, а также при длительной терапии.
Симптомы, позволяющие заподозрить развитие сывороточной болезни, включают в себя: артрит/артралгию, сыпь (крапивница или другие формы), лихорадку и лимфаденопатию.
В качестве профилактики и лечения данной патологии возможно применение антигистаминных препаратов и глюкокортикостероидов.
Следует проинформировать пациента о возможности развития данного состояния и предупредить о необходимости обращения к врачу при появлении возможных симптомов.
Гиперчувствительность к натуральному латексу
Колпачок иглы предзаполненного шприца может содержать производное натурального латекса. Безопасность использования предзаполненного шприца у пациентов с гиперчувствительностью к латексу не исследована. Несмотря на отсутствие натурального латекса в составе колпачка иглы, таким пациентам следует избегать прямого контакта с его поверхностью.
Общие указания
Препарат не следует применять для лечения острых приступов БА, острого бронхоспазма или астматического статуса.
Не изучалось применение препарата Ксолар® у пациентов с синдромом повышенной концентрации IgE, с аллергическим бронхолегочным аспергиллезом, для профилактики анафилактических реакций, при атопическом дерматите, аллергическом рините или при пищевой аллергии.
Не изучалось применение препарата Ксолар® у пациентов с нарушениями функции печени и/или почек, аутоиммунными заболеваниями или заболеваниями, связанными с накоплением иммунных комплексов. Следует соблюдать осторожность при применении препарата у таких пациентов.
Не следует резко отменять терапию системными или ингаляционными глюкокортикостероидами после начала лечения препаратом Ксолар®. Дозу указанных препаратов, применяемых одновременно с препаратом Ксолар®, снижают постепенно под наблюдением врача.
Влияние на способность управлять транспортными средствами и механизмами:
Пациентам, у которых на фоне применения препарата Ксолар® возникает головокружение, повышенная утомляемость, синкопальные состояния или сонливость следует воздержаться от управления транспортными средствами и механизмами.
Форма выпуска/дозировка:
Раствор для подкожного введения, 75 мг/0,5 мл и 150 мг/мл.
Упаковка:
По 0,5 мл (75 мг) и 1 мл (150 мг) в стеклянный шприц с закрепленной иглой с защитным колпачком.
По 1 предварительно заполненному шприцу с устройством для пассивной защиты иглы в поддон, закрытый этикеткой, вместе с инструкцией по медицинскому применению в пачку картонную.
Условия хранения:
В защищенном от света месте, при температуре от 2 до 8 °С.
Не замораживать.
Препарат следует хранить в недоступном для детей месте.
Срок годности:
18 месяцев.
Препарат не следует применять по истечении срока годности.
Условия отпуска
По рецепту
Производитель
Новартис Фарма Штейн АГ, Schaffhauserstrasse, 4332 Stein, Switzerland, Швейцария
Владелец регистрационного удостоверения/организация, принимающая претензии потребителей:
Новартис Фарма АГ
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)