Правда и вымысел вокруг иммунотерапии. Интервью с онкологом Михаилом Ласковым
09.11.2018
В октябре Нобелевку вручили исследователям иммуотерапии. Если и раньше вокруг этого метода ходило много слухов, то после решения Нобелевского комитета ажиотаж возрос еще больше. Мы поговорили с онкологом Михаилом Ласковым о том, что такое иммунотерапия и что выдают за иммунотерапию, при лечении каких видов рака она наиболее эффективна, и почему во многих случаях ее нельзя использовать.
- Обновление. В сентябре 2022 года мы опубликовали новый материал об иммунотерапии онкологических заболеваний. В нем подробно рассказываем, как работают иммуноонкологические препараты и в каких ситуациях они могут назначаться, как проводится иммунотерапия и какие побочные эффекты возникают чаще всего. Прочитать статью можно по этой ссылке.
Что такое иммунотерапия?
Иммунотерапия – это относительно новый метод лечения онкологических заболеваний. Иммунотерапия не действует напрямую на опухоль, но заставляет иммунитет убивать раковые клетки. Это и есть принципиальное ее отличие от химиотерапии и таргетной терапии.
По большому счету, иммунотерапия заставляет иммунитет делать то, что он и так должен, но не делает по каким-либо причинам. Например, иногда раковые клетки маскируются под здоровые, тогда иммунная система перестает воспринимать их как инородные и не уничтожает. Иммунотерапия может “снимать маску” с опухолевых клеток и помогать иммунитету распознавать их.
Справедливости ради нужно сказать, что сейчас поднялся очень большой хайп по поводу иммунотерапии, потому что вышли действительно эффективные препараты: авелумаб, атезолизумаб, дурвалумаб, пембролизумаб, ниволумаб и ипилимумаб. Но иммунотерапия началась, конечно же, не сейчас и даже не три года назад. Она очень давно применялась с переменным успехом. Как правило, с не очень большим.
Что же произошло сейчас? Появился новый класс препаратов, которые действуют на рецепторы PD1 и PD-L1. Именно эти рецепторы позволяют опухолевой клетке повлиять на иммунитет так, чтобы он перестал распознавать ее, и, следовательно, убивать раковые клетки.
Для лечения каких видов рака используется иммунотерапия?
Сначала эти препараты начали применяться при меланоме и имели большой успех. Почему именно при меланоме? Как мы понимаем, есть опухоли, которые лечатся относительно легко, а есть те, что лечатся очень плохо, рак поджелудочной, например.
Новые препараты стараются разрабатывать именно для труднолечимых раков. Меланома – это как раз один из таких труднолечимых раков, в лечении которого двадцать лет не происходило ничего хорошего, никаких новых высокоэффективных препаратов не появлялось.
Иммунотерапия показала себя очень эффективно при меланоме, все воодушевились и начали применять этот метод лечения на все раки, которые только могли. Тут, конечно же, очень быстро выяснилось, что где-то он работает, где-то не работает совсем, а где-то работает только в конкретных ситуациях.
Иммунотерапия сейчас успешно применяется при лечении рака легких. Как мы знаем, есть разные мутации и разные виды этого рака. И при некоторых из них иммунотерапия быстро заменила химию, оказалась и лучше, и безопаснее. Это очень большой успех. Но стоит помнить, что далеко не весь рак легких успешно лечится иммунотерапией.
В России иммунотерапию также используют при лечении рака почек, а на Западе – в случаях рака головы и шеи, лимфомы Ходжкина, рака мочевого пузыря и некоторых случаях рака печени.
Как объяснить, что иммунотерапия подходит только по показаниям и небольшому проценту больных?
Как и все, что есть в онкологии, иммунотерапия – это не панацея от всего рака. Это просто еще один способ воздействовать на опухоль, далеко не всегда эффективный и ни разу не безопасный
Использовать иммунотерапию можно лишь в ограниченном количестве случаев. На данный момент ее эффективность доказана только для следующих видов рака:
— меланома;
— немелкоклеточный рак легких;
— мелкоклеточный рак легких;
— рак почки;
— рак головы и шеи;
— лимфома Ходжкина;
— рак мочевого пузыря.
*** Иммунотерапия может быть эффективной в строго определенных ситуациях даже при вышеуказанных видах рака.
К тому же есть ряд побочных эффектов. И довольно серьезных. В некоторых случаях иммунная система начинает атаковать здоровые ткани и органы, что может вызвать такие осложнения, как:
— пневмония,
— гормональные нарушения,
— проблемы с желудочно-кишечным трактом,
— нефрит и нарушение функции почек,
— мышечные боли, боли в костях и суставах,
— ощущение усталости, слабость,
— тошнота, диарея, нарушения аппетита и др.
Впрочем, серьезные осложнения появляются в среднем только в одном случае из шести.
В октябре вы назвали Нобелевскую премию за иммунотерапию премией для маркетологов. Почему вы отреагировали именно так?
Вспомним историю прекрасного препарата бевацизумаб. Когда он вышел, маркетологи подняли хайп по поводу этого средства, которое останавливает рост сосудов в опухоли. Начали из каждого утюга говорить о том, какое это чудо-чудо-чудо. В итоге, конечно, никакого чуда не было, и этот препарат нашел свое довольно ограниченное применение. И по соотношению цена-польза он, вежливо говоря, далеко не идеален.
И вот уже на этой неделе ко мне толпами приходят люди, которые пытаются спастись при помощи иммунотерапии. И только максимум у 10 % из них этот метод можно пробовать с неизвестным результатом.
Вот про такую ситуацию как раз и было предостережение в этом посте. Потому что на этом сейчас можно быстро срубить много денег в России, именно срубить, а не заработать. Ведь у людей есть все подтверждения: 1) не могли просто так дать Нобелевку; 2) все журналисты написали, что это чудо и панацея; 3) препарат стоит от 200 тысяч в месяц. Все сходится – Нобелевка, цена. Отлично, квартиру продаем.
И тут еще какой-нибудь радостный доктор из частной клиники предлагает его назначить и прямо сейчас, ведь завтра может быть уже поздно.
И главное – очень хочется верить, что это спасет. Это ведь не гомеопатия, а высокая наука.
Как пациенту понять, назначают ему фейковые препараты или нормальные?
Это сделать можно, но необходимо, конечно, включать голову. Нужно много читать и стараться уметь разбираться в источниках.
Например, почитать гайдланы для пациентов NCCN или ESMO. Это англоязычные источники, NCCN – американский , ESMO – европейский. Кстати, мы сейчас переводим их на русский язык при помощи благотворительного фонда «Живой».
Еще можно посмотреть русскоязычные рекомендации, но только профессиональные.
Тут проблема, конечно, в том, что на русском языке практически ничего нету. Существуют клинические рекомендации, но они для врачей. Для пациентов – почти ничего. Вот у нас (на ютуб-канале Клиники амбулаторной онкологии и гематологии — примечание Profilaktika.Media) есть видео про иммунотерапию. Еще пара моих комментариев и несколько материалов моих коллег на эту тему. Но в общем море «ура-ура, нашли лекарство от рака», «британские ученые доказали…» это может быть очень сложно найти.
А какие препараты иммунотерапии используются сейчас в России?
Их всего четыре, и они довольно дорогие. Это атезолизумаб «Тецентрик», пембролизумаб «Кейтруда», ипилимумаб «Ервой» и ниволумаб «Опдиво». И все, больше пока ничего нет, но много всего на предрегистрационной стадии.
Какие “методики” на рынке выдают за фальшивую иммунотерапию? Например, назначают профилактические капельницы с иммуномодуляторами против рака.
Инарон, рефнот, вакцины всякие, фракция АСД, всего и не упомнишь.
Как пациенту понять, что ему нужна и может помочь иммунотерапия и как ее можно попробовать получить в рамках ОМС?
Поговорить с врачом, почитать надежные источники (об этом выше). По ОМС пойти к химиотерапевту по месту жительства. Все, больше никак.
За счет чего иммунотерапия такая дорогая? Из чего складывается стоимость лекарства?
Разработка нового лекарства, действительно нового, как эти ингибиторы, стоит миллиард долларов. И семь лет после разработки формула защищена патентом. После этого срока буквально на следующий же день заранее скопированный препарат начинают продавать дешевле.
Появляется большая конкуренция. Соответственно, за эти семь лет люди, работающие над созданием лекарства, должны вернуть себе “ярд” и заработать. Один “ярд” что в себя включает? Что из 10 лекарств, которые на ранней стадии компания начинает разрабатывать, до клиник доходит только одно, и это занимает лет двадцать.
Соответственно, вот и вся экономика, за 7 лет нужно всю стоимость отбить и немного заработать для акционеров. Очень сложно разрабатывать и очень просто копировать.
Как пациенту понять, что он наткнулся на мошенников?
Сигнальный значок – это, прежде всего, давление. Когда начинается – давайте скорее, уже вчера надо было начать применять препарат, думать вам некогда, по другим местам ходить нечего. То есть такие довольно простые элементы давления.
В онкологии, на самом деле, крайне редко бывает так, что необходимо вот прямо сейчас, сию минуту начать лечение.
Понятно, что если требуют много денег и есть давление по времени, чтобы человек не успел одуматься, то, скорее всего, что-то не так.
В Беларуси дан старт реализации программы лечения пациентов с немелкоклеточным раком легкого и уротелиальным раком с помощью нового метода иммунотерапии. Об этом в интервью «Медвестнику» сообщил заведующий онкологическим (торакальным) отделением РНПЦ онкологии и медрадиологии им. Н. Н. Александрова, кандидат мед. наук Павел Короткевич.
Онкология

Механизм действия иммунотерапии кардинально отличается от тех методов, которые применялись в онкологии на протяжении последних десятилетий. В отличие от стандартной химиотерапии, направленной непосредственно на опухолевые клетки, иммунотерапия действует другим способом. Она активирует собственную иммунную систему организма на уничтожение опухолевых клеток. В норме у каждого человека ежедневно образуются такие клетки, но иммунная система мгновенно распознает их и убивает, поэтому они не успевают размножаться. Процесс распознавания собственных нормальных клеток организма происходит благодаря особым белкам на поверхности Т-лимфоцитов, их называют контрольными точками. Чтобы обойти иммунную защиту, опухолевые клетки пытаются подстроиться под нормальные, воздействуя на белок PD-L1. В итоге идет сложный процесс блокировки иммунитета, Т-лимфоциты перестают распознавать чужеродные для организма клетки, начинается опухолевый рост и развитие метастазов.
Препараты для иммунотерапии рака направлены на разблокирование иммунной системы, чтобы заставить ее опять работать против раковых клеток. За открытие этого прорывного метода в 2018 году была присуждена Нобелевская премия в медицине. На сегодняшний день в мире зарегистрировано несколько таких препаратов — ингибиторов контрольных точек. И с этого года один из препаратов (МНН: атезолизумаб) стал доступным для граждан нашей страны. Такая возможность появилась благодаря приказу Минздрава № 610 от 04.06.2020, которым утверждена программа лечения пациентов с немелкоклеточным раком легкого и уротелиальным раком (с текстом приказа можно ознакомиться на сайте «Медвестника». — Прим. авт.).
Почему именно эти два вида новообразований были выбраны для внедрения метода иммунотерапии рака в нашей стране? И какие результаты лечения можно ожидать?
Разрабатывая программу лечения онкопациентов методом иммунотерапии, мы взяли за основу мировой опыт. Рак легкого — одна из патологий, при которой иммунотерапия показала довольно высокую эффективность. Первоначально в международные клинические исследования включались пациенты с отдаленными метастазами либо нерезектабельной опухолью, у которых развилось прогрессирование заболевания на фоне химиотерапии. В таких случаях назначается 2-я линия химиотерапии, однако, как правило, это не дает желаемого эффекта, позволяя лишь на несколько месяцев продлить жизнь пациенту. В исследованиях сравнивали продолжительность жизни при стандартной химиотерапии и иммунотерапии. Было показано, что иммунотерапия дает результат: пациенты живут дольше с лучшим качеством жизни. Есть пациенты, которые живут два и более года, что в принципе невозможно при стандартной химиотерапии. Да, такой эффект не у всех, а лишь примерно у 30 %, но для рака легкого это огромное достижение. Поэтому все больше стран включают метод иммунотерапии в национальные протоколы лечения метастатического рака легкого.
Как часто выявляется рак легкого в нашей стране?
Ежегодно в Беларуси выявляется порядка 4,5 тысячи новых случаев рака легкого. В структуре смертности от злокачественных новообразований у мужчин он находится на первом месте. 85 % вновь выявленных случаев приходится на немелкоклеточный рак. К сожалению, этот вид опухоли сложно диагностировать на ранних стадиях. Причем это проблема абсолютно всех стран. Только 30 % пациентов поддаются радикальному хирургическому лечению. Все остальные имеют либо местно-распространенный процесс, требующий комплексного лечения (комбинация хирургического, лучевого и химиотерапевтического методов), либо 4-ю стадию с метастазами в других органах. Таких пациентов порядка 1,5–2 тысячи в год. Они получают химиотерапию, направленную на продолжение жизни.
Теперь у этих пациентов появился новый шанс в виде иммунотерапии?
Да, но не у всех, а только у тех из них, кто соответствует определенным критериям и у кого мы ожидаем максимальной эффективности иммунотерапии. Все это четко прописано в программе, утвержденной приказом Минздрава № 610.
Критерии включения пациентов в программу иммунотерапии
Пациенты с местно-распространенным или метастатическим немелкоклеточным раком легкого при соблюдении следующих критериев:
- гистологически подтвержденный плоскоклеточный рак и аденокарцинома легкого;
- местно-распространенный или метастатический немелкоклеточный рак легкого у пациентов с прогрессированием заболевания в течение 12 месяцев с момента прохождения химиотерапии и невозможности выполнения радикальной операции;
- экспрессия PD-L1 ≥10 % на иммунных клетках при иммуногистохимическом исследовании опухолевой ткани;
- общее состояние по шкале ECOG 0–1;
- наличие измеряемой первичной опухоли или метастазов по системе RECIST 1.1 при рентгенологическом исследовании.
Пациенты с местно-распространенным неоперабельным или метастатическим раком мочевого пузыря, лоханки, мочеточников при соблюдении следующих критериев:
- гистологически подтвержденный уротелиальный рак;
- неполучение пациентами системной химиотерапии на основе препаратов платины или получение адъювантной/неоадъювантной химиотерапии 12 месяцев назад и более с момента прогрессирования заболевания, при наличии противопоказаний к применению цисплатина или пациенты с прогрессированием заболевания в течение 12 месяцев с момента прохождения химиотерапии на основе препаратов платины;
- экспрессия PD-L1 ≥5 % на иммунных клетках при иммуногистохимическом исследовании опухолевой ткани;
- общее состояние по шкале ECOG 0–1;
- наличие измеряемой первичной опухоли или метастазов по системе RECIST 1.1 при рентгенологическом исследовании.
Как пациент может попасть в программу? Его должен направить онколог, у которого он наблюдается по месту жительства? Знают ли онкологи в областных и районных онкодиспансерах о программе иммунотерапии рака?
Приказ Минздрава № 610 доведен до региональных онкодиспансеров, более того, мы сделали и разослали информационное письмо, где в максимально доступной и понятной форме изложили критерии первичного отбора пациентов и их включения в программу, организацию лечения и всю связанную с этим логистику.
В задачу онкологов на местах входит первичный отбор пациентов с раком легкого и уротелиальным раком. Критерии первичного отбора ведь предельно просты. И если врач видит, что пациент соответствует требованиям, то выписывает направление на иммуногистохимическое исследование для оценки экспрессии PD-L1. Этот показатель говорит о чувствительности опухоли к иммунотерапии. Исследование выполняется в молекулярно-генетической лаборатории канцерогенеза на базе нашего центра. Экспрессия PD-L1 на иммунных клетках от 10 % и выше при раке легкого, от 5 % и выше при уротелиальном раке позволяет рассчитывать на более высокую эффективность иммунотерапии.
Решение о включении пациента в программу принимается только республиканским врачебным консилиумом, который организуется в нашем центре. Важный момент — оценка состояния пациента и распространенности опухолевого процесса на текущий момент. Предпочтительным методом обследования является спиральная компьютерная томография грудной клетки, брюшной полости и таза с контрастным усилением либо полноконтрастная позитронно-эмиссионная томография, совмещенная с компьютерной томографией.
Как проходит процесс лечения методом иммунотерапии?
Лечение проводится на базе РНПЦ ОМР им. Н. Н. Александрова, госпитализация в большинстве случаев не требуется. Препарат вводится в виде внутривенной капельной инфузии. Первый этап рассчитан на 4 введения препарата с интервалом в 3 недели. Далее выполняется контрольная КТ и врачебным мультидисциплинарным консилиумом оценивается эффективность лечения опять же по определенным строгим критериям. Если ответ на иммунотерапию есть, лечение может быть продолжено.
На какой эффект можно рассчитывать, исходя из международного опыта применения метода иммунотерапии? Были ли клинические случаи, которые вас удивили?
Критерием частичного ответа является уменьшение суммы размеров опухолевых очагов более чем на 30 % по сравнению с исходными без появления новых очагов. Если это достигается на первом этапе, лечение продолжается. Критерий полного ответа — исчезновение всех экстранодальных опухолевых образований. Международные исследования показывают, что такой эффект достигается у 15–30 % пациентов. В мировой практике были очень необычные случаи, когда на фоне иммунотерапии исходно неоперабельная местно-распространенная опухоль уменьшалась в размерах, хирурги шли на операцию и удаляли опухолевое образование. После чего исследовали его гистологически — и оказывалось, что там были лишь единичные опухолевые клетки, окруженные огромным скоплением иммунных клеток. То есть иммунная система практически полностью уничтожила опухоль. Это говорит о том, что у части пациентов можно ожидать действительно очень хорошего эффекта.
После старта программы пришлось ли столкнуться с какими-либо сложностями?
К сожалению, да, это связано с первичным отбором пациентов в программу в регионах. Несмотря на то что во все региональные онкодиспансеры были направлены приказ Минздрава и разъяснительные письма, возникает ощущение, что онкологи на местах невнимательно читали эти документы. Некоторые не направили ни одного пациента, другие направляют пациентов, не соответствующих критериям включения. Хочу подчеркнуть, что иммунотерапия не панацея, она не даст эффекта у всех пациентов. Но у тех, кто соответствует критериям включения в программу, действительно появился шанс в борьбе с болезнью. Поэтому мне как онкологу очень хотелось бы, чтобы врачи на местах более внимательно изучили приказ Минздрава и дали пациентам этот шанс.
Фото эксперта Татьяны Столяровой, «МВ».
В настоящее время наблюдается значительный рост цереброваскулярной патологии. Цереброваскулярные болезни (ЦВБ) — одна из основных причин летальности и стойкой утраты трудоспособности больных. В клинической практике широко используются препараты, объединенные в группу «нейропротекторы». Целевым воздействием на ключевые звенья процессов гибели нервных клеток сосудистой, травматической, токсической и другой этиологии из группы нейропротекторов обладает препарат Цераксон (цитиколин) — естественный эндогенный нуклеозид, состоящий из цитидина и холина, связанных дифосфатным мостиком, и участвующий в синтезе мембранных фосфолипидов в качестве промежуточного звена. Цитиколин не только восстанавливает поврежденные нейрональные мембраны, а также служит донором холина для синтеза ацетилхолина [1]. Цитиколин также угнетает синтез фосфолипазы А2, уменьшая накопление свободных жирных кислот, восстанавливает функционирование Na+/K+-АТФазы, усиливает активность антиоксидантных систем, препятствует процессам окислительного стресса и апоптоза, позитивно влияет на холинергическую передачу, модулирует дофамин- и глутаматергическую нейротрансмиссию. Помимо этого Цераксон обладает выраженным нейрорепаративным эффектом, стимулируя процессы нейро- и ангиогенеза [2].
Образование цитиколина в мембранах нейронов и фосфолипидов макросом являются этапом, лимитирующим скорость в синтезе фосфатидилхолина (лецитина); в данном случае цитиколин служит донором холина для синтеза ацетилхолина и может ограничивать объем последнего; при окислении образуется бетаин — донор метильных групп [3]. Поскольку цитиколин является естественным метаболитом биохимических процессов в организме и сочетает в своем спектре действия нейромедиаторные и нейрометаболические эффекты. Важнейшим из них является активация биосинтеза мембранных фосфолипидов нейронов мозга, в первую очередь фосфатидилхолина.
Когнитивные нарушения являются ключевым проявлением дисциркуляторной энцефалопатии (ДЭП), которое во многом определяет тяжесть состояния больных. На ранней стадии ДЭП преобладают умеренные нейродинамические нарушения в виде замедленности, аспонтанности, снижения работоспособности, истощаемости, ослабления концентрации внимания. Дальнейшее прогрессирование когнитивного дефекта при ДЭП сопряжено с развитием деменции, при которой когнитивный дефицит приводит к ограничению повседневной активности и хотя бы частичной утрате бытовой независимости. Лечение пациентов с ДЭП, по сути, ограничено терапевтическим воздействием на проявления ДЭП I и II ст. Основными направлениями ведения данных больных являются купирование развившейся декомпенсации патологического процесса, профилактика прогрессирования заболевания, в том числе инсульта, снижение выраженности когнитивных расстройств, неврологического дефицита [4, 5].
В некоторых исследованиях, посвященных диагностике и принципам терапии когнитивных расстройств при сосудистых заболеваниях головного мозга, дано обоснование назначения цитиколина при умеренных когнитивных расстройствах (УКР) и деменции [6]. Авторами делается вывод, что положительные эффекты цитиколина воздействуют на все этапы «ишемического каскада», а сочетание нейропротективного и нейрометаболического действия препарата обуславливает его способность снижать отложение бета-амилоида в головном мозге. Цитиколин рассматривается как перспективный препарат в лечении сосудистых форм УКР, которые также формируются у больных, длительно принимающих этанол.
Клинические исследования последних лет показали нейропротективное действие цитиколина при остром нарушении мозгового кровообращения (ОНМК), в раннем восстановительном периоде, терапии КН. В обзорных статьях по препарату цитиколин приведены данные зарубежных исследований начиная с 1980-х гг. [3]. Анализ полученных данных, основанный на принципах доказательной медицины, показал эффективность цитиколина при остром мозговом инсульте. Цитиколин способен потенцировать действие других лекарственных средств при лечении острой цереброваскулярной патологии, в т. ч. тромболитиков, антиагрегантов и нейротрофиков. В связи с этим назначение цитиколина обосновано в комплексной терапии с другими препаратами, улучшающими нейрометаболизм, такими как Актовегин.
Проведено исследование по оценке эффективности комплексной терапии препаратами Цераксон и Актовегин с участием 104 пациентов в возрасте 55–80 лет в остром периоде ишемического инсульта [7]. Пациенты были разделены на 4 группы: пациенты 1-й группы (n = 25) получали стандартную базисную терапию; 2-й (n = 25) — в течение 10 дней дополнительно получали цитиколин (1000 мг/сут, внутривенно, капельно на 200 мл физраствора); 3-й (n = 26) — в течение 10 дней дополнительно получали Актовегин (250 мл 20-процентного раствора внутривенно, капельно на физрастворе); 4-й (n = 28) — комбинированную терапию цитиколином и Актовегином в течение 10 дней. Динамика состояния проведена на 2-е, 7-е, 10-е и 30-е сутки инсульта, оценены параметры компьютерной томографии головного мозга (на 5-е сутки), неврологический статус, показатели шкалы инсульта Национального института здоровья США (National Institute of Health, NIH), шкалы Рэнкина, индекса Бартел. Наиболее выраженный эффект от проводимой терапии был получен в 4-й группе больных, получавших комбинированную терапию цитиколином и Актовегином, по сравнению с контрольной группой: на 5-е сутки обнаружена тенденция к более значимому уменьшению объема ишемического повреждения головного мозга в динамике, на 10-е сутки отмечено достоверное ускорение регресса неврологической симптоматики по шкале NIH, к 30-м суткам — достоверно более значимое функциональное восстановление по шкале Рэнкина и индексу Бартел. Выяснено, что в 3-й группе больных, получавших цитиколин, динамика показателей была схожей с таковой в 4-й группе (восстановление по шкале Рэнкина и индексу Бартел). Таким образом, сочетанное применение цитиколина и Актовегина наиболее оптимально, т. к. приводит к более полному регрессу неврологического дефицита и большей функциональной независимости больного к концу острого периода инсульта.
В обзорных статьях [8, 9] акцент сделан на улучшение когнитивных функций под влиянием цитиколина (оптимальная доза — 1 г/сут) в терапии сосудистой деменции и деменции при нейродегенеративных заболеваниях (болезнь Альцгеймера, болезнь Паркинсона), при которых назначение цитиколина замедляет развитие когнитивного дефицита [3]. Отдельно выделяется, что при назначении цитиколина 600 мг/сут в течение 20 дней в качестве монотерапии у больных с болезнью Паркинсона наблюдается также и улучшение двигательной функции (уменьшение брадикинезии, ригидности, тремора). Применение цитиколина в комплексной терапии болезни Паркинсона позволяет вдвое снизить необходимую дозу L-DOPA и, соответственно, минимизировать побочные эффекты заместительной L-DOPA-терапии, а на ранних стадиях заболевания — существенно отсрочить назначение L-DOPA [8]. Подчеркивается также, что по результатам многочисленных исследований применение цитиколина 750–3000 мг/сут в первые сутки после черепно-мозговой травмы (ЧМТ) с последующим курсовым лечением в течение 14–20 дней существенно сокращает длительность коматозного периода.
При сосудистых заболеваниях головного мозга нередко встречается астенический синдром не изолированно, а в комплексе с другими синдромами. В ряде проведенных исследований показана высокая эффективность инъекционной формы цитиколина, как в виде монотерапии, так и в комплексной терапии острой и хронической ишемии мозга и связанных с ними астенических состояний [5]. В 2011 г. проведено исследование по оценке эффективности и безопасности цитиколина у 60 больных в возрасте 50–70 лет, имевших диагноз ОНМК с УКР [10]. В ходе исследования пациенты были разделены на 2 группы: основная (n = 30), получавшие цитиколин наряду с базовой терапией, и контрольная (n = 30), получавшие только базовую терапию. Цитиколин назначали ежедневно в дозе 3 мл 2 раза в сут на протяжении 6 месяцев. Проводили анализ динамики показателей: неврологического статуса и батарею тестов для оценки лобной дисфункции, тест рисования часов, вербальных ассоциаций, запоминание и воспроизведение 12 слов, исследование зрительной памяти), эмоционального статуса, оценки качества жизни, субъективной оценки эффективности лечения. К 3-му месяцу наблюдения у пациентов, принимавших цитиколин, отмечено нарастание силы в конечностях, через 6 месяцев получено достоверное улучшение показателей по шкалам, оценивающим неврологический дефицит (регресс КН, эмоционально-аффективных и поведенческих расстройств) [10].
Проведено исследование по оценке эффективности цитиколина в восстановительном периоде ишемического инсульта у больных с КН [11]. Обследованы 33 больных в возрасте 46–82 лет, перенесших ишемический инсульт. По данным нейропсихологического обследования у всех больных обнаружены легкие или умеренные КН в виде расстройства памяти, внимания и мышления. По степени тяжести КН больные были разделены на две группы: 1-я (n = 22) с умеренными КН, цитиколин назначали по 1000 мг/сут внутривенно капельно в течение 10 дней; 2-я (n = 11) с более легкими КН, цитиколин вводили по 500 мг/сут внутривенно капельно в течение 10 дней. Под влиянием лечения цитиколином в дозе 500 или 1000 мг/сут в течение 10 дней отмечены положительные изменения нейродинамических характеристик когнитивных функций (улучшение памяти, мышления). Улучшение когнитивных функций было более значительным в группе цитиколина в дозе 1000 мг/сут. Нежелательные лекарственные реакции при назначении цитиколина не зафиксированы. Таким образом, исследование показало эффективность и безопасность применения цитиколина в восстановительном периоде у больных с постинсультными КН [11].
В обзорных статьях приведены данные оптимального режима дозирования по результатам клинических исследований препарата [12]: цитиколин, вводимый в дозе 1000 мг/сут на протяжении 8 недель, ускоряет регресс гемиплегии; внутривенное введение препарата в дозе 750 мг/сут в течение 10 дней, начиная с первых 48 часов после появления симптомов инсульта, способствовало восстановлению двигательных и когнитивных функций; при внутривенном введении 1 г в течение 14 дней отмечено более быстрое восстановление сознания, значительное улучшение общего состояния и функционального статуса. Отмечается, что относительно высокий функциональный статус достигается у 61,3%, принимавших цитиколин в дозе 500 мг/сут, 39,4%, принимавших цитиколин в дозе 1000 мг/сут, и 52,3%, принимавших цитиколин в дозе 2000 мг/сут. Степень улучшения в группах, принимавших цитиколин в дозе 500 и 2000 мг/сут, была примерно одинакова.
В ряде проведенных исследований показано, что цитиколин может корригировать КН уже на начальных этапах их проявлений у пациентов с ДЭП. Высокая эффективность цитиколина в профилактике и терапии умеренных когнитивных расстройств сосудистого генеза показана [4]. Его применение способствует регрессу КН, уменьшает сопутствующие эмоционально-аффективные и поведенческие расстройства. Кроме того, цитиколин способен потенцировать действие других лекарственных средств при лечении острой цереброваскулярной патологии, в том числе тромболитиков, антиагрегантов и нейротрофиков [8]. Уже отработаны и активно используются схемы назначения цитиколина: по 1000 мг 10 дней внутримышечно или внутривенно один раз в день, затем внутрь раствор цитиколина 2 мл 3 раза в день в течение 3 месяцев [13], или ежедневно в дозе 3 мл 2 раза в сутки на протяжении 6 месяцев. Длительность нейропротекции может длиться до 12 месяцев [3].
В настоящее время доказана универсальность механизмов повреждения клеток при различных видах патологических процессов, в том числе и воздействии этанола. Конечным звеном при воспалении, ишемии является нарушение окислительно-восстановительных процессов, нарушение метаболизма и энергетического обеспечения клеток. Сегодня нейротрофичность, нейропротекция, нейропластичность и нейрогенез рассматриваются как фундаментальные нейробиологические процессы, участвующие в реализации эндогенной защитной активности, а также в попытках противодействовать патофизиологическим повреждающим механизмам и стимулировании эндогенного восстановления. Нейропротекцию определяют как непрерывную адаптацию нейрона к новым функциональным условиям, как ключ к уменьшению повреждений мозговой ткани, вызванных ишемией, она действует на уровне молекулярного каскада, обусловливающего дисфункцию и смерть нейронов [14].
Клинический опыт применения цитиколина при алкоголизме и наркомании не столь обширен, хотя есть некоторые свидетельства его эффективности при этих состояниях [2, 15]. Так, в рандомизированном, двойном слепом исследовании А. Chinchilla и соавт. (1995) [16] изучали эффекты цитиколина у 20 пациентов с абстинентным алкогольным синдромом. В группе пациентов, получавших цитиколин, в конце исследования (через 2 месяца) отмечалось значимое улучшение внимания и концентрации, а также ориентации во времени и пространстве. Как отметили авторы, данное наблюдение свидетельствует о том, что препарат может быть полезен в лечении хронического алкоголизма.
В ряде работ показана эффективность применения цитиколина у наркозависимых лиц, в том числе употреблявших этанол. Так, P. F. Renshaw и соавт. (1999) [17] провели двойное слепое, плацебо-контролируемое исследование по оценке влияния цитиколина на улучшение функционального состояния центральной нервной системы. Опыт наблюдения составили 14 пациентов с кокаиновой зависимостью: группа «цитиколин» (n = 6; 38,0 ± 6,1 года) и группа «плацебо» (n = 8; 35,8 ± 6,5 года). Цитиколин назначали в капсулах 500 мг 2 раза в день коротким курсом (2 недели). Пациенты данной группы также имели длительный анамнез употребления этанола. Оценивался эффект влияния цитиколина на непосредственную тягу к наркотику и субъективное настроение. В ходе исследования по данным результатов опросника «Зависимость от кокаина» было отмечено достоверное (р = 0,002) уменьшение тяги к наркотику при сравнении показателей «до и после лечения», а также снижение уровня тревоги (р = 0,013), улучшение настроения (желание испытывать приятные чувства) по визуально-аналоговой шкале (р = 0,07). Субъективные показатели после лечения в тесте «Необходимость (убежденность) в кокаине» в группе «плацебо» были достоверно выше (р = 0,057), чем в группе «цитиколин». Также отмечены достоверные (р = 0,046) изменения после лечения в группе «цитиколин» в тестах «Желание использовать кокаин прямо сейчас» и «Отсутствие контроля над применением кокаина». За весь период наблюдения нежелательные лекарственные реакции (НЛР) не отмечены. Результаты пилотного исследования позволяют предполагать, что цитиколин может быть дополнением к основному методу лечения.
В другом исследовании E. S. Brown и соавт. (2007) [14] провели 12-недельное, рандомизированное, двойное слепое, плацебо-контролируемое наблюдение по назначению цитиколина как дополнительного средства терапии у больных манией (гипоманией) и зависимостью к кокаину. Цель исследования заключалась в оценке изменения в декларативной памяти, настроении и тяги (зависимости) к кокаину. В исследование были включены 44 пациента, которым назначали цитиколин (n = 23; 42,1 ± 6,6 года) или плацебо (n = 21; 40,7 ± 8,0 года) по схеме: начиная с 1 табл. (500 мг/сут) с последующим увеличением до 2 табл. (1000 мг/сут) в течение двух недель, далее по 3 табл. (1500 мг/сут) в течение четырех недель и по 4 табл. (2000 мг/сут) в течение шести недель. Настроение, тягу к кокаину, НЛР оценивали каждые две недели, познавательные процессы — каждые четыре недели, в течение 12 недель. О НЛР пациентами не сообщалось. По результатам оценки теста Рея на запоминание «Rey Auditory Verbal Learning Test» авторы пришли к заключению, что цитиколин можно рассматривать как новый подход в лечении наркозависимости.
S. J. Yoon и соавт. (2010) [18] провели исследование методом лонгитудинальной протонной магнитно-резонансной спектроскопии с целью оценки изменения уровня нейрометаболитов после 4-недельной терапии цитиколином у пациентов с метамфитаминовой (МА) зависимостью. В исследовании принял участие 31 больной с МА-зависимостью, получавший цитиколин (n = 16; 38,6 ± 3,9 года) или плацебо (n = 15; 38,3 ± 3,5 года) в течение четырех недель. На основании уровней N-ацетиласпартата и холина в префронтальной зоне получено, что изменения данных маркеров выше в группе цитиколина, нежели плацебо. НЛР отмечены не были. На основании полученных данных авторы сделали вывод, что результаты могут свидетельствовать о том, что терапия цитиколином может иметь непосредственное нейроактивное влияние на снижение дозировки употребляемого наркотика при МА-зависимости.
В последнее время проведено двойное слепое, плацебо-контролируемое исследование по оценке эффектов влияния цитиколина на волонтерах с кокаиновой зависимостью [19]. Всего в исследовании приняли участие 43 человека (контрольная группа) и 29 участников с наркозависимостью (марихуана, алкоголь), из них методом рандомизации выделили группу цитиколина (n = 15; 38,4 ± 4,5 года) и плацебо (n = 14; 39,0 ± 5,3 года). Цитиколин назначали по 500 мг/сут 2 раза в день. Курс лечения составил 8 недель с последующим 4-недельным продолжением лечения в группе кокаинозависимых лиц. За период исследования отмечены НЛР (головная боль, ощущение холода/потение, мышечные спазмы, тошнота/расстройство желудка/диарея, дрожь/встряска), которые наблюдали в обеих группах и в т. ч. в контрольной. По результатам самоотчетов пациентов за весь период наблюдения отмечено улучшение концентрации внимания, аппетита, качества сна, преимущественно в группе цитиколина, а также снижение уровня раздражительности и физического дискомфорта после терапии. Однако не было никаких существенных изменений в эмоциональной сфере (настроение, беспокойство, напряженность) как во время периода лечения, так при последующем лечении, и также не получено существенных различий между группами цитиколина и плацебо. В каждой из групп (цитиколин, плацебо) наряду с употреблением марихуаны у пациентов был алкогольный анамнез и табакокурение. Данные исследования позволили авторам предположить, что цитиколин может быть использован как вспомогательное средство (уменьшение дозы употребления) в терапии алкогольной и марихуанозависимости. Результаты данного исследования должны интерпретироваться с осторожностью, потому что оно не было разработано, чтобы оценивать количество потребления алкоголя или марихуаны среди зависимых от кокаина лиц.
Благодаря стабилизирующему влиянию на мембрану, цитиколин оказывает противоотечный эффект и предупреждает развитие отека мозга, а путем подавления фосфолипаз А1, А2, С-D уменьшает образование свободных радикалов и усиливает антиоксидантные защитные системы. Вышеуказанные свойства препарата позволяют рекомендовать цитиколин для включения в схему стандартной терапии пациентов с головокружением центрального генеза сосудистой этиологии [20]. Хорошо известно, что отоневрологическая симптоматика является составной частью клинической картины ЦВБ и наблюдается как в симптомокомплексе асимптомного ишемического поражения головного мозга, так и при инсульте различной степени тяжести.
Актуальность и медико-социальная значимость оптимизации лечения головокружения сосудистого генеза определяются не только его широкой распространенностью, но и частой хронизацией этого состояния, что требует значительных усилий [21]. Головокружение — одна из наиболее частых жалоб; это вторая после головной боли причина обращения к врачу. Подсчитано, что головокружением может проявляться около 80 заболеваний: неврологических, психических, сердечно-сосудистых, офтальмологических, оториноларингологических и т. д. [22]. Распространенной причиной головокружения у лиц трудоспособного возраста являются остеохондроз шейного отдела позвоночника и вертебробазилярная дисциркуляция. Предпосылкой развития вертебробазилярной дисциркуляции могут быть деформации (патологическая извитость, перегибы) и аномалии (гипоплазия, аномалии отхождения, расположения и вхождения артерий и др.) позвоночных артерий, которые встречаются в 20–35% случаев у больных с сосудистыми заболеваниями головного мозга [21].
Головокружение при цереброваскулярных заболеваниях обусловлено преходящим или стойким нарушением кровоснабжения центральных или периферических отделов вестибулярной системы [22]. Головокружение (vertigo или dizziness) — иллюзорное ощущение движения окружающих предметов относительно пациента или же движения пациента относительно предметов. В понятие головокружения также входят нарушения равновесия, «звон/шум в ушах»: все эти симптомы существенно снижают качество жизни и трудоспособность пациента. На первом этапе лечения острых и хронических заболеваний вестибулярного анализатора обычно назначается комбинация вазоактивных, ноотропных препаратов, дегидратирующих препаратов, средств от головокружения и нестероидных противовоспалительных препаратов [20, 22]. Часто такая комбинированная терапия оказывается недостаточно эффективной, что требует увеличения доз применяемых средств и, таким образом, увеличивает риск для пациентов.
Особый интерес представляет исследование по применению высоких доз цитиколина при головокружениях, проведенное в период с января по декабрь 2010 г. в двух крупнейших неврологических клиниках Софии, Болгария. В проведенном открытом исследовании дана сравнительная оценка кратковременной терапевтической эффективности цитиколина у пациентов с центральным головокружением сосудистой этиологии. Цитиколин назначался в дозировке 2000 мг/сут внутривенно и 1000 мг/сут внутривенно на фоне недостаточно эффективной стандартной терапии [20]. В исследование были включены 40 пациентов (средний возраст 55,5 ± 4,2 года), которые были разделены на две группы: группа 1 (n = 20) получала цитиколин в дозе 2000 мг/сут, группа 2 (n = 20) — цитиколин в дозе 1000 мг/сут. Схемы лечения: для группы 1 — доза цитиколина 2000 мг/сут в течение 5 дней, далее перорально по 500 мг/сут (2 мл + 2 мл + 1 мл) длительностью до 30 дней, для группы 2 — доза цитиколина 1000 мг/сут в течение 5 дней, далее перорально по 500 мг/сут (2 мл + 2 мл + 1 мл) длительностью до 30 дней. Курс лечения до 5 дней: цитиколин добавляли в 100 мл физраствора, вводили в/в капельно в течение 30–60 минут. Далее цитиколин в обеих группах назначали перорально, длительностью до 30 дней, в дозе 500 мг/сут (2 мл + 2 мл + 1 мл, в каждом миллилитре — 20 капель раствора, содержащего 100 мг цитиколина). Динамику состояния оценивали в определенных «точках» исследования: 1 — до начала лечения цитиколином, 2 — через 5 дней после курса парентерального лечения в виде внутривенной инфузии в ежедневной дозе 1000 мг/сут или 2000 мг/сут цитиколина и 3 — на 30-е сутки после перорального приема в дозе 500 мг/сут (2 мл + 2 мл + 1 мл). В течение исследования пациенты принимали только соответствующий препарат от головокружения (бетагистина гидрохлорид) и цитиколин в определенной дозе. Для оценки динамики состояния использовались: 1) анкета, содержащая подробный отоневрологический анамнез; 2) неврологический и отологический статус; 3) тональный порог аудиометрии; 4) исследование вестибулярного анализатора (спонтанные и вызванные ответы); 5) электроэнцефалография. Лечение цитиколином следует начинать с дозы 2000 мг/сут внутривенно, так как терапевтический эффект достигается быстрее, при этом не получено существенных отличий по переносимости, НЛР в сравнении с дозой в 1000 мг/сут. В ходе исследования получено: на 5-й день парентерального применения цитиколина 2000 мг/сут (группа 1) наиболее выраженный положительный эффект получен для вертиго, головокружения и субъективного ощущения «шума в ушах» (примерно в 1/2 случаев), тогда как в группе 2 (цитиколин 1000 мг/сут) — только в 1/3 случаев (вертиго: группа 1 — 20% vs группа 2 — 35%; головокружение 25% vs 40%; «шум в ушах» — 25% vs 35%). Значительный эффект проявился в отношении коррекции неустойчивости в обеих группах — около половины всех пациентов. На 30-е сутки лечения вертиго, головокружение, нарушение равновесия, «шум в ушах» сохранялись только у 1/3 больных, степень выраженности симптомов уменьшилась. Наибольшее влияние на спонтанный и, в частности, латентный нистагм отмечено на 5-е сутки приема цитиколина в дозе 2000 мг/сут. После пятых суток лечения цитиколином в дозе 2000 мг/сут улучшение в отношении асимметрии (по данным электронистагмографии) отмечено более чем у 20% пациентов в сравнении с группой пациентов, получавших цитиколин в дозе 1000 мг/сут. Улучшение субъективных результатов сопровождалось объективными изменениями параметров обследования вестибулярного анализатора, симметричности реакции, результатов координационных и статокинетических проб. Данный факт позволяет рекомендовать начало терапии цитиколином с дозы 2000 мг/сут, т. к. высокая доза приводит к значимому ускорению восстановления вестибулярной функции. Полученные результаты позволяют постулировать следующее: начало парентеральной терапии цитиколином в дозе 2000 мг/сут, длительностью как минимум 5 дней, затем переход на цитиколин 500 мг/сут перорально (2 мл + 2 мл + 1 мл) в сроки от 1 до 3 месяцев в рамках стандартного лечения для пациентов с головокружением центрального генеза сосудистой этиологии [20]. Таким образом, данное исследование расширяет показания к применению цитиколина в составе комплексной терапии у пациентов с головокружением.
Заключение
В ряде проведенных исследований показана эффективность применения препарата Цераксон в лечении хронической ишемии мозга, сопровождающейся КН, в терапии сосудистой деменции и деменции при нейродегенеративных заболеваниях (болезнь Альцгеймера, болезнь Паркинсона). Кроме того, применение Цераксона в комплексной терапии болезни Паркинсона позволяет вдвое снизить необходимую дозу L-DOPA. Показано нейропротективное действие цитиколина при ОНМК, в раннем восстановительном периоде, а также в комплексной терапии с Актовегином. Имеется опыт применения Цераксона у наркозависимых больных и лиц, страдающих алкогольной зависимостью. В последних исследованиях показана терапевтическая эффективность Цераксона у пациентов с центральным головокружением сосудистой этиологии парентеральной терапии Цераксоном в дозе 2000 мг/сут, длительностью как минимум 5 дней.
Литература
- Plataras C., Taskiris S., Angelogianni P. Effect of CDP-choline on brain acetylcholinesterase and Na+/K+-ATPase in adult rats // Clin Biochem. 2000; 33: 351–357.
- Secades J. J. Citicoline: pharmacological and clinical review, 2010 update // Rev Neurol. 2011. Vol. 52 (Suppl.2): S1-S62.
- Шавловская О. А. Нейропротективная терапия неврологического дефицита при цереброваскулярной патологии // Практикующий врач сегодня. 2012. № 3. С. 39–44.
- Шавловская О. А. Нейропротективная терапия при хронической ишемии мозга // Лечащий Врач. 2013. № 9. С. 32–37.
- Шавловская О. А. Терапия астенических состояний у больных, страдающих хронической ишемией мозга // Фарматека. 2013. № 19 (272). С. 56–61.
- Сорокина И. Б., Гудкова А. А., Гехт А. Б. Умеренные когнитивные расстройства при сосудистых заболеваниях головного мозга: диагностика и принципы терапии // Трудный пациент. 2010; 8 (3): 9–13.
- Шамалов Н. А., Стаховская Л. В., Шетова И. М. и др. Исследование безопасности и эффективности комбинированной терапии цитиколином и Актовегином больных в остром периоде ишемического инсульта // Журнал неврологии и психиатрии им. С. С. Корсакова. 2010. № 9. Вып. 2. С. 13–17.
- Бойко А. Н., Кабанов А. А. Цитоколин: новые возможности нейропротекции и фармакотерапии при заболеваниях нервной системы // Фарматека. 2007, № 15, с. 42–48.
- Румянцева С. А., Силина Е. В., Свищева С. П., Шучалин О. Г., Корюкова И. В., Елисеев Е. В. Комплексная нейропротекция у больных с сосудистой патологией мозга // РМЖ. 2008; 16 (17): 1124–1129.
- Путилина М. В. Особенности комбинированной нейропротекторной терапии острых нарушений мозгового кровообращения // РМЖ. 2009, т. 17, № 4, с. 261–267.
- Шахпаронова Н. В., Кадыков А. С., Кашина Е. М. Постинсультные когнитивные нарушения и их терапия цераксоном // Неврология, нейропсихиатрия, психосоматика. 2011, 3: 56–60.
- Шетова И. М., Шамалов Н. А., Боцина А. Ю. Использование цитиколина в остром периоде церебрального инсульта // Журнал неврологии и психиатрии им. С. С. Корсакова. 2009. № 12, вып. 2. С. 51–54.
- Путилина М. В., Нахлас М. С. Место нейропротективной терапии в раннем реабилитационном периоде ишемического инсульта // Лечение заболеваний нервной системы. 2011; 3 (8): 26–31.
- Brown E. S., Gorman A. R., Hynan L. S. A randomized, placebo-controlled trial of citicoline add-on therapy in outpatients with bipolar disorder and cocaine dependence // J Clin Psychopharmacol. 2007. Vol. 27. Р. 498–502.
- Шавловская О. А. Возможности терапии посталкогольных изменений нервной системы // Лечащий Врач. 2014. № 5. С. 24–29.
- Chinchilla A., Lopez-Ibor J. J., Vega M., Camarero M. CDP-colina en la evolucion de las funciones mentales en el sindrome de abstinencia alcoholica // Psiquiatria Biologica. 1995; 2: 171–175.
- Renshaw P. F., Daniels S., Lundahl L. H. et al. Short-term treatment with citicoline (CDP-choline) attenuates some measures of craving in cocaine-dependent subjects: a preliminary report // Psychopharmacology. 1999. Vol. 142. P. 132–138.
- Yoon S. J., Lyoo I. K., Kim H. J. Neurochemical alterations in methamphetamine-dependent patients treated with cytidine-50-diphosphate choline: a longitudinal proton magnetic resonance spectroscopy study // Neuropsychopharmacology. 2010. Vol. 35. P. 1165–1173.
- Licata S. C., Penetar D. M., Ravichandran C. et al. Effects of daily treatment with citicoline: A double-blind, placebo-controlled study in cocaine-dependent volunteers // J Addict Med. 2011 March; 5 (1): 57–64. doi:10.1097/ADM.0 b013 e3181 d80 c93; J Addict Med. Author manuscript; available in PMC 2012 March 1.
- Petrova D., Maslarov D., Angelov I., Zekin D. Analysis of therapeutic efficacy of citicoline in patients with vertigo of central origin and vascular aetiology // Am. J. Neuroprotec. Neuroregen. 2012. Vol. 4. № 1: 1–8.
- Морозова С. В., Зайцева О. В., Налетова Н. А. Головокружение как медико-социальная проблема // РМЖ. 2002. № 16. С. 725–729.
- Замерград М. В. «Сосудистое» головокружение // РМЖ. 2007. № 9. С. 769–772.
О. А. Шавловская, доктор медицинских наук
ГБОУ ВПО Первый МГМУ им. И. М. Сеченова МЗ РФ, Москва
Контактная информация: shavlovskaya@mma.ru

Иммунотерапия препаратом Ниволумаб
Обновлено: 28 апреля 2022
28365
Как действует ниволумаб при раке? О клиническом применении препарата Опдиво, его преимуществах и побочных эффектах рассказывает онколог-химиотерапевт высшей категории Круглова Марина Сергеевна
- arrow_forward
Как действует Ниволумаб? - arrow_forward
Преимущества терапии ниволумабом - arrow_forward
Побочные эффекты ниволумаба
Ниволумаб — противоопухолевый препарат из группы ингибиторов контрольных точек и фактический стимулятор иммунитета. Опдиво — это торговое название, присвоенное компанией-производителем моноклональному человеческому антителу ниволумаб. Антитело представляет собой чистейший и абсолютно однородный по свойствам белок.
Как действует Ниволумаб?
Принцип действия Ниволумаба на опухоль диаметрально отличается от всех прочих иммунологических противоопухолевых препаратов. Доставшиеся нам из прошлого века и до настоящего времени используемые в онкологии цитокины — интерферон-альфа и интерлейкин-2 — синтезированные человеком продукты жизнедеятельности лимфоцитов, доставляемые в организм уже в готовом виде.
Ниволумаб также радикально отличается от механизма действия цитостатиков, суть которых уничтожить опухолевую клетку (цитотоксический эффект) или остановить ее пролиферативную активность (цитостатический эффект).
В конечном итоге Опдиво вынуждает лимфоциты вырабатывать цитокины, но не прямым способом, а помогая лимфоциту выйти из оцепенения, в которое его ввергает злокачественный процесс.
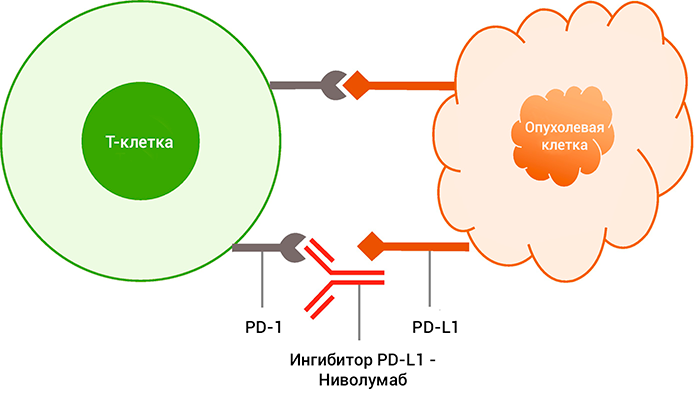
Ниволумаб блокирует взаимодействие между рецептором программируемой смерти (PD-1) и его лигандами (PD-L1 и PD-L2).
PD-1-рецептор является негативным регулятором активности Т-клеток. Связывание PD-1 с лигандами PD-L1 и PD-L2, которые способны экспрессироваться клетками опухолей или иными клетками микроокружения опухолей, приводит к ингибированию пролиферации Т-клеток и секреции цитокинов. Ниволумаб потенцирует иммунный ответ посредством блокады связывания PD-1 с лигандами PD-L1 и PD-L2.
Выражаясь простыми словами, взаимодействие ниволумаба с лимфоцитом осуществляет через специальный рецептор на поверхностной мембране. Занятый им рецептор не может связаться с продуцируемыми опухолевыми клетками и их окружением — лигандами.
Лиганды специально синтезируются для обмана лимфоцита, чтобы он не замечал развитие злокачественного процесса. Связывание лигандов со специальным рецептором PD-1 на поверхности лимфоцита приводит к нарушению его работы и воспроизводства. В результате получается, что опухолевые клетки не замечаются «больным» лимфоцитом и могут спокойно воспроизводить себе подобных.
С помощью ниволумаба лимфоцит «прозревает» и вырабатывает смертельные для раковой клетки цитокины. Если интерферон и интерлейкин вводятся в огромных дозах, то активированный опдиво лимфоцит вырабатывает их без превышения своих функциональных возможностей.
О существовании рецептора можно узнать по присутствию специфического белка PD-1, который имеется у 10–15% больных.
Применение Ниволумаба
Ниволумаб при раке доказал свою эффективность в многочисленных клинических исследованиях по всему миру и сегодня зарегистрирован в России для лечения девяти нозологий:
- 1-я линия терапии почечно-клеточного рака;
- 2-я линия терапии почечно-клеточного рака;
- Метастатическая меланома;
- Адъювантная терапия меланомы;
- Опухоли головы и шеи;
- Мелкоклеточный рак легкого;
- Немелкоклеточный рак легкого;
- Рак желудка или пищеводно-желудочного перехода;
- Рак мочевого пузыря;
- Гепатоцеллюлярный рак;
- Колоректальный рак;
- Лимфома Ходжкина.
Преимущества терапии ниволумабом
Преимущество иммунотерапии состоит в том, что при показаниях, ее можно использовать у ослабленных, возрастных пациентов, с выраженной сопутствующей патологией ввиду меньшей токсичности и более легкой переносимостью.
То есть иммунотерапия дает новые возможности пациентам, которым химиотерапия противопоказана по состоянию здоровья.
Еще одним достоинством иммунотерапии является длительность ответа на лечение. Если по результатам контрольных обследований на иммунотерапии возникает регресс опухоли, то зачастую этот ответ может быть очень длительным.
Как проводится лечение Ниволумабом?
Препарат вводится в виде внутривенной инфузии в течение 30 или 60 минут согласно инструкции. Терапия ниволумабом должна продолжаться до прогрессирования или развития непереносимой токсичности.

Возможность назначать препарат одним из трех одобренных способов введения позволяет врачу подобрать оптимальный режим для каждого конкретного пациента:
- 3 мг/кг каждые 2 недели в течение 60 или 30 минут;
- 240 мг каждые 2 недели в течение 60 или 30 минут;
- 480 мг каждые 4 недели в течение 60 или 30 минут.
Отличие иммунотерапии от химиотерапии заключается в отсутствии специальной пре- и постмедикации. Пациент не нуждается в антиэметогенной терапии, глюкокортикостероидах, антигистаминных, гастропротективных препаратах. Не требуется принимать их для профилактики и между курсами иммунотерапии.
Побочные эффекты ниволумаба
Вторая сторона медали современной иммунотерапии – это побочные эффекты, осложнения, а также иммуноопосредованные нежелательные явления.
Токсичность на фоне иммунотерапии имеет другой профиль, нежели стандартная химиотерапия. Побочные действия ниволумаба связаны с аутоиммунными реакциями на фоне «гиперактивного» иммунитета. Они обусловлены избыточной активацией иммунной системы с аутоиммунным поражением нормальных тканей различных органов и систем.
Осложнения на терапии ниволумабом могут появиться уже в течение 1 недели или только через 54 недели от начала терапии, симптомы могут усиливаться в любой момент времени и приводить к фатальным последствиям.
Наиболее частыми побочными эффектами ниволумаба по результатам клинических исследований являются утомляемость (34%), сыпь (19%), зуд (14%), диарея (13%), тошнота (13%) и снижение аппетита (10%), а также – повышение температуры или озноб с лихорадочным состоянием. В большинстве случаев побочные реакции выражаются от легкой до средней степени тяжести.
Все побочные реакции, включая тяжелые, купируются или при помощи симптоматической терапии, или путем отмены иммунотерапии.
Что делать, если на лечении ниволумабом развились нежелательные явления?
Для того, чтобы устранить побочные эффекты иммунотерапии, необходимо не только знать весь анамнез и сопутствующие заболевания конкретного пациента, но и понимать природу и механизм иммуноопосредованной токсичности.
Крайне важно, чтобы лечение ниволумабом осуществлял онколог, который не только имеет опыт проведения иммунотерапии, но и умеет распознавать ее нежелательные явления на ранней стадии. Своевременное выявление осложнений позволит не только их купировать, но и не прерывать противоопухолевое лечение.
Например, когда мы проводим иммунотерапию в клинике, мы осуществляем тщательный мониторинг показателей систем организма, строго по графикам. Также мы информируем и обучаем пациентов, как оперативно выявить и вовремя среагировать на нежелательные явления, так как своевременная диагностика и надлежащая медикаментозная терапия может улучшить результаты и при этом не окажет негативного влияния на активность иммунного препарата.
Мы накопили большой клинический опыт применения ниволумаба и разработали собственные восстановительные программы и этапы действий для успешного устранения побочных эффектов иммунотерапии. Наш подход – сделать лечение не только эффективным, но и максимально комфортным для вас.
Запишитесь на прием к онкологу по телефону +7 (812) 952-83-73, и мы примем вас в день обращения.
Отзывы
Леонова О.П.
21 августа 2020
Хочу выразить благодарность сотрудникам клиники De Vita и особенно врачу-химиотерапевту Кругловой Марине Сергеевне за квалифицированную помощь, человечное отношение, высокий профессионализм. В тяжелые моменты онкологического лечения необходимы грамотные и своевременные консультации, психологическая помощь и поддержка. Все это было сделано в вашей клинике.
Спасибо вам за ваш опыт, профессионализм, грамотность и человеческое отношение. С уважением,
…
Читать полностью
семья Ивановых
20 августа 2020
Благодаря грамотному лечению, профессионализму и внимательному отношению врача с большой буквы Ирины Александровны, я вернулась к жизни! Спасибо Вам большое, что в самое сложное время для нашей семьи Вы были с нами! Отдельное спасибо хирургу Сергею Александровичу и всему медицинскому персоналу! С уважением, семья Ивановых. Желаем здоровья, долголетия и многомонетия!
…
Читать полностью
Замулина И.В.
7 августа 2020
Благодарю за чуткость, профессионализм, доброе отношение в клинике Де Вита. Очень серьезное лечение прошла легко и без побочных эффектов. Отдельное спасибо за профессионализм Анне Игоревне Буйняковой! С благодарностью,
…
Читать полностью
Вот и закончился мой 12-недельный курс химиотерапии в клинике De Vita.
Все это время сотрудники клиники помогали мне пройти лечение без осложнений и максимально комфортно .
Хочу поблагодарить:
— руководство за безупречную организацию работы и замечательно подобранных сотрудников;
— моего лечащего врача Круглову Марину Сергеевну за профессионализм, внимание и доброе отношение благодаря которому я поверила в лечение и смогла его выдержать;
— замечательных медсестер за золотые руки и сердечность, особенно Анастасию;
— улыбчивых и внимательных менеджеров, которые встречали и провожали меня каждый раз.
Желаю всем работникам крепкого здоровья, хорошего настроения и терпения в нелегком труде.
…
Читать полностью
Елена Викторовна
17 июля 2020
Хочу сказать большое спасибо всем сотрудникам клиники De VIta, это замечательные, внимательные, знающие свое дело люди. Отдельное спасибо моему лечащему врачу Буйняковой А.И. за ее помощь, поддержку и внимание. Доктора знаю уже больше 10 лет и очень ей благодарна за маму, которую она подняла на ноги. Судьба меня свела опять с Анной Игоревной, я очень рада, что эта замечательная женщина, мой лечащий врач. Она не просто профессионал своего дела, а красивая, чуткая женщина. И я от всего сердца хочу поблагодарить ее за все усилия и помощь в лечении. Так же огромное спасибо девочкам мед.сестрам и администраторам за четкую, слаженную работу. Всем сотрудникам клиники желаю успехов, процветания и конечно здоровья.
…
Читать полностью
Григорьева Л.Е.
26 июня 2020
Сегодня 26 июня 2020 года — моя последняя капельница!!! Позади долгий непростой путь длиной в 6 месяцев. И все это время я чувствовала огромную поддержку и внимание своего доктора Буйняковой Анны Игоревны.
Уважаемая, дорогая Анна Игоревна! Огромное Вам спасибо и низкий поклон за Вашу отзывчивость, Ваш профессионализм, чуткость, внимательность, ответственность, за позитивный настрой! Хочется поблагодарить медсестру Людмилу за ее «волшебные руки», внимательность, ответственное отношение к больным. Спасибо девушкам администраторам Яне и Марии, Вале за доброжелательность и внимание, четкую слаженную работу, а также психологу А.А. Ястребовой за моральную поддержку. Желаю всем сотрудникам ДеВита успехов, процветания, здоровья!
…
Читать полностью
семья Чаусовых
21 июня 2020
Наша семья выражает благодарность Уваровой Светлане Николаевне, Кругловой Марине Сергеевне и всему персоналу онкологического центра за отзывчивость, доброжелательность, высокий профессионализм. Поздравляем Вас с Днем Медицинского работника! Пусть всё сделанное Вами добро возвращается к Вам многократно в виде здоровья и долголетия!!
…
Читать полностью
Спасибо всей команде De Vita за работу и отношение. Особенно благодарю Андрея Сергеевича за профессионализм и поддержку! Спокойствие и уверенность врача передаётся пациенту, мне это очень помогло. В такой трудной ситуации сходишь с ума, здесь я получила помощь! А также все ответы на свои вопросы, заботу, хорошее лечение и только позитивный заряд. Спасибо!
…
Читать полностью
Поздравляю клинику с днём рождения и хочу сердечно поблагодарить химиотерапевта Анну Игоревну Буйнякову за высокий профессионализм, за помощь и поддержку в непростой «химический» период. Ни один вопрос не остался без ответа, Анна Игоревна практически провела меня за руку через всю химию. Спасибо Вам огромное за это!
Также благодарю и хочу отметить медсестру Людмилу, ее отличную работу и душевность. Очень хорошее и приятное впечатление от всех, с кем пришлось разговаривать и встречаться в клинике. Хорошие и комфортные условия для лечения такого коварного заболевания. Вы даёте уверенность в победе! Низкий поклон вам!
Татьяна, Великий Новгород.
…
Читать полностью
Юдина Наталия Андреевна
15 мая 2020
Всех сотрудников De Vita хочу поблагодарить за внимательное и чуткое отношение к запросам и потребностям клиентов. Отдельная огромная-преогромная благодарность лечащему врачу Буйняковой Анне Игоревне за профессионализм, отзывчивость, внимательность, за веру в возможности пациента, за готовность прийти на помощь а любое время суток. Здоровья Вам, успехов, всех благ.! Спасибо Вам большое.
С уважением,
…
Читать полностью
Статья на конкурс «Био/Мол/Текст»: Корректировка диеты часто применяется для лечения и профилактики заболеваний. Онкологические заболевания — не исключение: правильное питание может служить не только профилактической мерой, но и повышать эффективность терапии. Здесь мы предлагаем обсудить «вкусовые предпочтения» раковых клеток и разобраться в том, как отдельные питательные вещества могут помочь бороться с опухолью.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.
Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Введение: на вкус и цвет товарищей нет
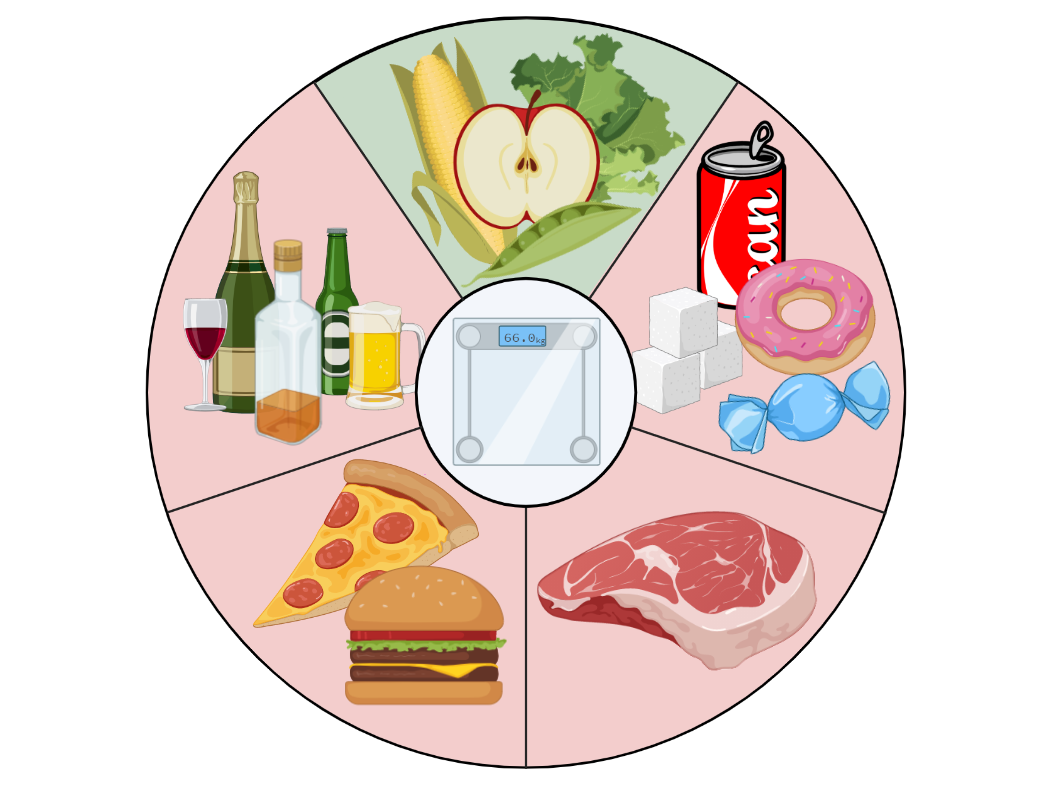
С начала 1980-х годов ведущие организации здравоохранения выпускают рекомендации по питанию и образу жизни, которые позволяют снизить индивидуальный риск развития рака. Данные рекомендации основаны на результатах метаанализов эпидемиологических исследований (иными словами, анализ многолетнего опыта миллионов людей, которые питались тем или иным образом). Эти рекомендации универсальны и просты в исполнении: они не требуют подсчета калорий, строгого контроля состава продуктов, а лишь предлагают общую схему и принцип питания для поддержания здорового веса (рис. 1).
Рисунок 1. Рекомендации по питанию, которые направлены на снижение вероятности возникновения онкологических заболеваний. Ежедневный рацион должен включать фрукты, овощи, бобовые культуры, цельнозерновые крупы. По возможности, необходимо ограничивать употребление красного мяса, сахара, сладких газированных напитков и алкоголя. Следование данным советам позволит поддерживать здоровый вес в течение всей жизни и снизить индивидуальный риск развития рака.
коллаж авторов статьи. Создан с помощью BioRender.com
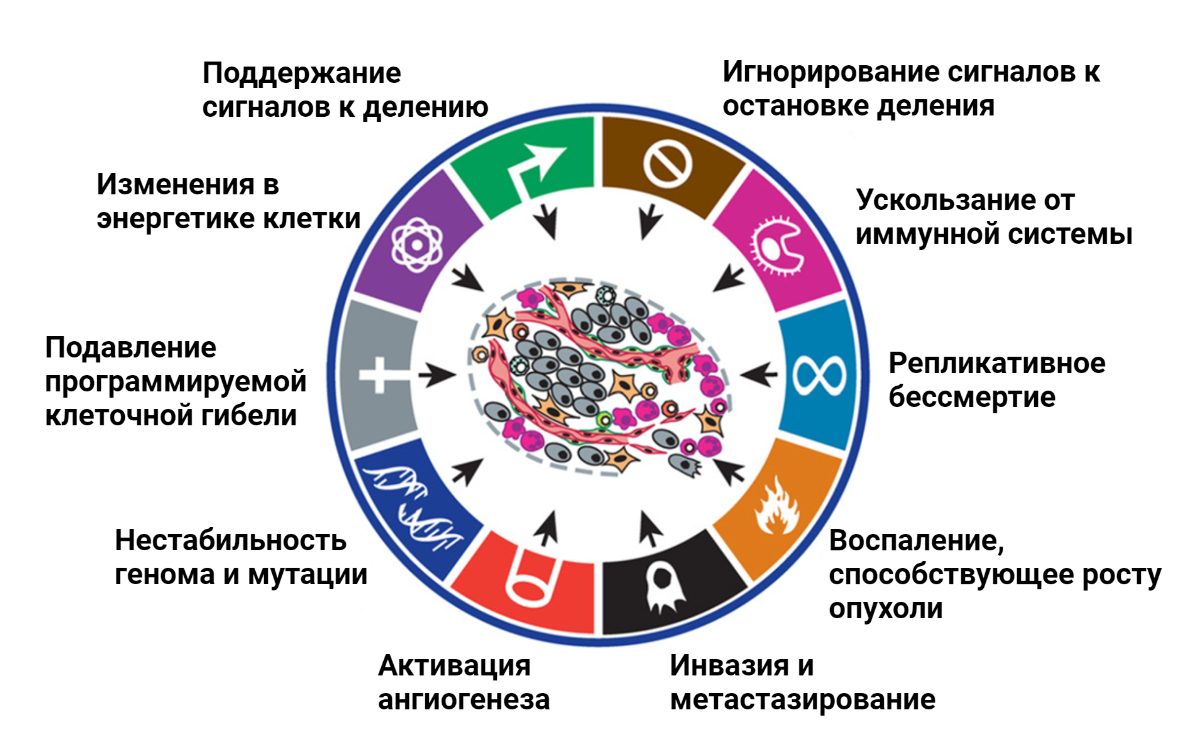
Подобного рода советы относятся к здоровым людям, тогда как для людей, страдающих онкологическими заболеваниями, стандартных рекомендаций по питанию не существует. В то же время, питание пациентов может сильно влиять на успешность терапии злокачественных образований [1]. Почему для людей, больных раком, нельзя составить универсальные рекомендации по составу пищи? Ответ на этот вопрос следует из принципов, согласно которым развиваются все опухоли [2]. Изначально клетка, которая в будущем даст начало опухоли, ничем не отличается от своих соседей. По мере накопления мутаций нормальные клетки могут постепенно эволюционировать и приобретать черты раковых клеток [3], [4]. В 2000 году среди многочисленных особенностей рака, в легендарном обзоре Hallmarks of cancer [3] были обозначены основные признаки, которые определяют биологию опухолевой клетки (рис. 2).
Рисунок 2. Особенности опухолевых клеток (hallmarks of cancer), которые отличают их от нормальных. Были сформулированы в 2000 году [3] и затем дополнены в 2011 [4].
адаптировано из [4]
Важнейшей особенностью всех раковых клеток является нестабильность генома, которая приводит к огромному генетическому разнообразию опухолей. Несмотря на ряд свойств, присущих всем раковым клеткам, каждая опухоль обладает уникальным набором мутаций, которые и определяют ее агрессивность, скорость роста, эффективность терапии. Генетическое разнообразие опухолей является основной преградой для составления универсальных рекомендаций по питанию для пациентов.
В последнее время исследователи активно изучают влияние питательных веществ на прогрессию опухоли и эффективность лечения. В основном проводятся экспериментальные работы на животных моделях, но есть и немногочисленные клинические исследования. Мы предлагаем читателям познакомиться поближе с особенностями метаболизма опухолевой клетки. Попытаемся разобраться, как вещества, потребляемые с пищей, могут влиять на опухоль и ее окружение. И, наконец, попробуем ответить на вопрос: может ли диета помочь в борьбе с раком?
Для того, чтобы разобраться в тонкостях метаболизма раковой клетки, кратко вспомним основные принципы и термины биоэнергетики. Метаболизм — это совокупность химических превращений в клетке, которые направлены на получение энергии и необходимых веществ. Только посмотрите, какое бесчисленное количество реакций включает в себя метаболизм (рис. 3)! Все метаболические пути можно условно разделить на биодеградацию (катаболизм) и биосинтез (анаболизм) [5]. Катаболизм приводит к получению энергии в виде макроэргических соединений (таких как АТФ), а также NADH, NADPH и FADH2 — коферментов, участвующих в окислительно-восстановительных реакциях. Анаболические процессы используют запасенную энергию для синтеза молекул, необходимых для жизни клетки: жиров, нуклеотидов, белков, углеводов.
Рисунок 3. Метаболическая карта — схема, объединяющая основные метаболические пути в клетке.
Метаболизм тесно связан с питанием: ежедневно мы потребляем питательные вещества, которые, с одной стороны, участвуют в катаболических реакциях и поставляют энергию клеткам, а с другой — необходимы для синтеза собственных молекул. Углеводы, белки и жиры, которые мы потребляем, разрушаются в пищеварительном тракте до мономерных единиц: углеводы до моносахаридов (глюкоза, фруктоза и др.), жиры до жирных кислот и глицерина, белки до аминокислот. Эти молекулы поступают в клетки организма и принимают участие в метаболических процессах.
В раковой клетке зачастую увеличена активность некоторых метаболических ферментов или целых метаболических путей, а значит, и потребность в питательных веществах у клеток опухоли может отличаться от нормальных клеток [6]. Эти особенности могут быть учтены при лечении опухоли: исключение из рациона пациента определенных компонентов пищи приведет к понижению их содержания в плазме крови, а следовательно, и в окружении раковых клеток, что негативно скажется на их размножении. Кроме этого, некоторые элементы питания могут непосредственно влиять на противоопухолевый иммунитет, что также должно быть учтено при составлении диеты.
Глюкоза
Глюкоза является основным источником энергии для живых организмов. В нормальном рационе человека она встречается как в свободном виде, так и в составе олиго- и полисахаридов (например, в сахарозе, лактозе и мальтозе). Одним из важнейших биоэнергетических путей в клетке является гликолиз — последовательность химических реакций, в результате которых из 1 молекулы глюкозы получается 2 молекулы пировиноградной кислоты, 2 молекулы АТФ и 2 молекулы NADH. Затем пировиноградная кислота может быть вовлечена в цикл трикарбоновых кислот (цикл Кребса) — биохимический процесс, протекающий в митохондриях, который поставляет NADH и FADH2 что, в конечном счете, делает возможным синтез АТФ посредством окислительного фосфорилирования. При этом из 1 молекулы глюкозы можно получить приблизительно 36 молекул АТФ, что гораздо более выгодно с точки зрения энергетики, нежели просто гликолиз. Вследствие этого большинство клеток активно использует цикл трикарбоновых кислот и окислительное фосфорилирование для получения энергии.
Тем не менее, известно множество случаев, когда по разным причинам клетки смещают баланс в сторону гликолиза, используя этот путь в качестве основного источника энергии, ингибируя ферменты цикла трикарбоновых кислот или активируя ферменты гликолиза.
Давно известно, что опухолевые клетки активно используют гликолиз, несмотря на его относительно низкую эффективность с точки зрения энергетической выгоды. Это явление было открыто Отто Генрихом Варбургом в 1924 году. Сам Варбург считал, что нарушение клеточного дыхания — главная причина развития опухоли. Однако оказалось, что клеточное дыхание в большинстве опухолевых клеток не нарушено, а просто подавляется из-за активного гликолиза. Сейчас понятно, что активный гликолиз дает преимущество опухолевым клеткам. Во-первых, гликолиз протекает без кислорода, и, по-видимому, во многом является адаптацией к гипоксии, которая развивается по мере удаления опухолевых клеток от кровеносных сосудов. Частично эта проблема также решается тем, что раковые клетки могут способствовать ангиогенезу — прорастанию сосудов в опухоль за счет продукции ангиогенных факторов, например фактора роста эндотелия сосудов (VEGF, Vascular endothelial growth factor). Во-вторых, активный гликолиз сопряжен с образованием большого количества молочной кислоты, что приводит к закислению среды, тем самым способствуя инвазии опухоли за счет разрушения нормальных популяции клеток и деградации внеклеточного матрикса.
В то же время, нельзя не отметить тот факт, что эффект Варбурга наблюдается не только в опухолевых клетках, но и вообще во всех активно пролиферирующих клетках. Глюкоза — один из основных источников углерода в клетке, и ее полное окисление в цикле трикарбоновых кислот идет вразрез с потребностями пролиферирующей клетки. Некоторая часть глюкозы, а точнее, ее метаболитов, должна быть направлена на пути биосинтеза аминокислот, нуклеотидов и жирных кислот. Важную роль в производстве предшественников нуклеотидов и аминокислот, а также NADPH, необходимого для синтеза жирных кислот, играет пентозофосфатный путь — альтернативный путь окисления глюкозы, который также имеет ключевое значение в поддержании роста раковых клеток.
Итак, глюкоза особенно необходима раковым клеткам в связи с их активным размножением; при этом она служит не только источником энергии, но и важным предшественником для синтеза аминокислот, нуклеотидов и жирных кислот. Однако помимо непосредственной роли глюкозы в клеточном метаболизме, важным физиологическим аспектом также является эффект инсулина на опухолевые клетки.
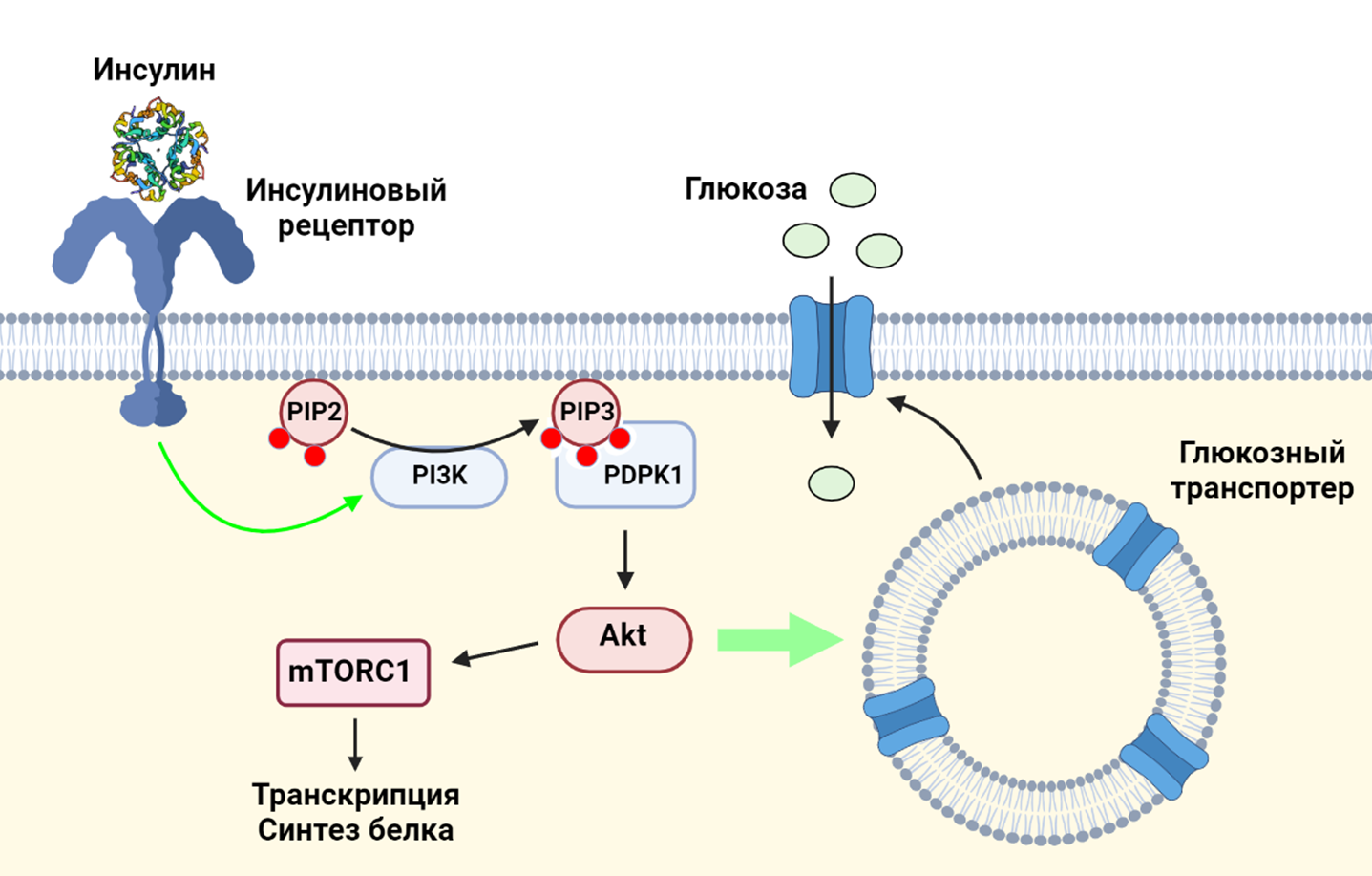
Как известно, повышение уровня глюкозы в крови вызывает секрецию гормона инсулина бета-клетками поджелудочной железы. Инсулин, в свою очередь, взаимодействует с инсулиновыми рецепторами на поверхностях клеток. Взаимодействие инсулина с его рецептором приводит к активации фосфатидилинозитол-3-киназы (PI3K) — ключевого фермента PI3K/AKT/mTOR сигнального пути: работа PI3K делает возможным фосфорилирование протеинкиназы Akt, что приводит, с одной стороны, к транслокации глюкозных транспортеров на клеточную мембрану (и, как следствие, к увеличению поглощения глюкозы клетками), а с другой стороны — к активации протеинкиназы mTORС1, важнейшего регулятора клеточного метаболизма и роста [1].
Рисунок 4. Взаимодействие инсулина и его рецептора приводит к активации фосфатидилинозитол-3-киназы (PI3K), которая фосфорилирует фосфатидилинозитолдифосфат (PIP2). Образовавшийся фосфатидилинозитолтрифосфат (PIP3) нужен для того, чтобы фосфоинозитид-зависимая киназа-1 (PDPK1) активировала протеинкиназу Akt. Akt необходима для стыковки внутриклеточных везикул, несущих глюкозный транспортер, с клеточной мембраной. Также Akt активирует mTORC1.
коллаж авторов статьи. Создан с помощью BioRender.com
Сигнальный путь PI3K/AKT/mTOR играет важную роль в раковых клетках, которые могут активно экспрессировать рецепторы к инсулину и, получая сигналы при их стимуляции, увеличивать темпы роста и размножения.
Снижение уровня глюкозы в крови пациентов рассматривается как одна из потенциальных диетических стратегий при терапии рака. Такой подход ограничит доступность глюкозы для раковых клеток и понизит секрецию инсулина бета-клетками поджелудочной железы. Как можно понизить содержание глюкозы в крови пациентов? Конечно, уменьшение калорийности пищи приведет к снижению уровня глюкозы в крови, но такой способ не может быть оптимальным, так как поставит под угрозу общее состояние пациента. Куда более выгодной стратегией может стать кетогенная диета, которая предполагает ограничение потребления углеводов с одновременным увеличением доли жиров в рационе. Действительно, есть данные доклинических исследований и немногочисленные клинические испытания, которые говорят, что такая диета может способствовать благоприятному исходу болезни — например, при глиобластоме [7]. Однако важно отметить, что некоторые типы опухолей, наоборот, зависят от жирных кислот, а значит, диета, богатая жирами, может опосредовать проканцерогенный эффект [1], о чем мы поговорим чуть далее.
А что насчет других углеводов?
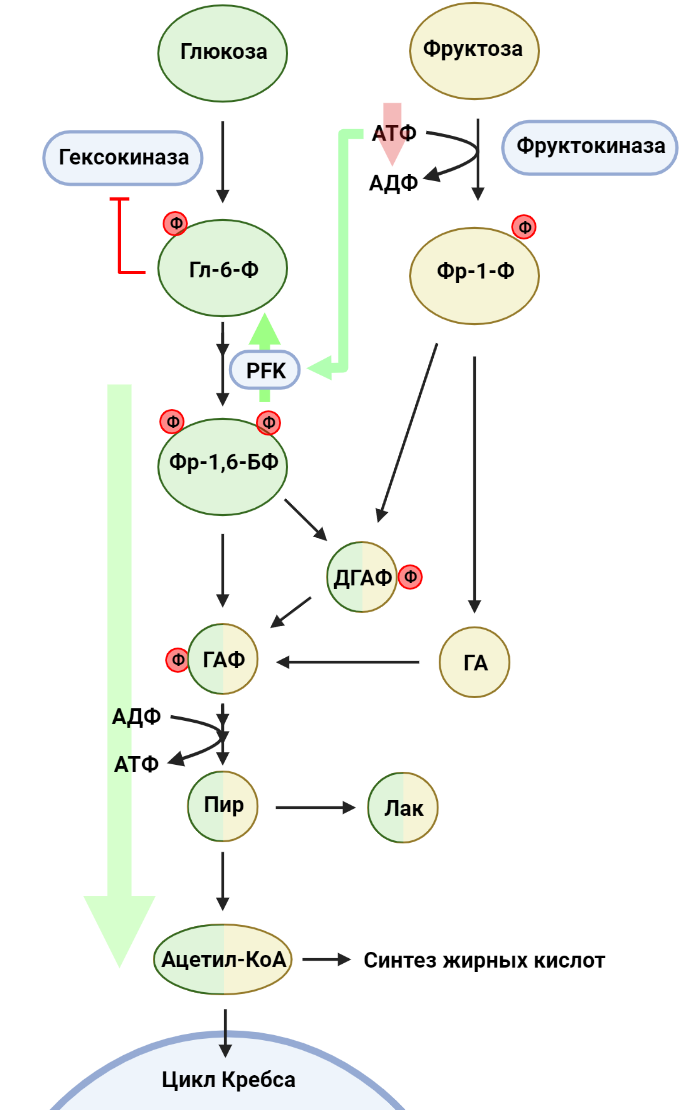
Рисунок 5. Метаболизм фруктозы. В первой стадии гликолиза глюкоза фосфорилируется до глюкозо-6-фосфата (Гл-6-Ф). Параллельно фруктоза фосфорилируется до фруктозо-1-фосфата (Фр-1-Ф). Фруктоза-1,6-бисфосфат (Фр-1,6-БФ), продукт фосфофруктокиназы (PFK), распадается на глицеральдегидфосфат (ГАФ) и дигидроксиацетонфосфат (ДГАФ), а Фр-1,6-БФ расщепляется на ДГАФ и глицеральдегид (ГА). ДГАФ и ГА переходят в ГАФ, который в оставшихся реакциях гликолиза превращается в пируват (ПИР). ПИР может восстановиться до лактата (ЛАК) или подвергаться превращению в ацетил-КоА, соединение, использующееся в многих биохимических процессах.
коллаж авторов статьи. Создан с помощью BioRender.com
Помимо глюкозы, в наш ежедневный рацион входит множество других углеводов. Например, фруктоза, один из наиболее распространенных в природе сахаров, встречается в пище как в свободном виде, так и в составе олигосахаридов, например, сахарозы. Эпидемиологи связывают рост потребления сахаросодержащих напитков с увеличением частоты заболеваемости раком [8]. Более того, оказывается, что даже умеренное потребление фруктозы (эквивалентное одной банке газировки в день) оказывает негативное воздействие и может способствовать росту опухоли, что было отмечено в экспериментах с мышами на примере колоректального рака [9]. Глюкоза эффективно поглощается эпителиальными клетками тонкого кишечника за счет специальных белков, осуществляющих совместный транспорт глюкозы и ионов натрия. При этом транспорт фруктозы опосредуется пассивным транспортером GLUT5 и потому менее эффективен. В результате значительная часть потребляемой фруктозы проходит тонкую кишку и попадает в толстый кишечник. В случае колоректального рака фруктоза становится одним из потенциальных питательных веществ для опухолевых клеток: действительно, раковые клетки в кишечнике активно экспрессируют как GLUT5, так и ферменты, метаболизирующие фруктозу. Глюкоза и фруктоза похожи между собой с точки зрения строения молекул, однако с точки зрения их метаболизма они немного отличаются (рис. 5). Если говорить про глюкозу, то первая стадия гликолиза представляет собой фосфорилирование глюкозы с затратой АТФ и образованием глюкозо-6-фосфата, причем активность гексокиназ (ферментов, осуществляющих эту реакцию) зависит от концентрации глюкозо-6-фосфата в среде: чем больше продукта для фермента, тем менее активно он работает. Это явление — пример отрицательной обратной связи, важного аспекта регуляции активности метаболических путей. Фруктоза же в первую очередь фосфорилируется фруктокиназой до фруктозо-1-фосфата (Фр-1-Ф), также с затратой АТФ, однако в данном случае активность фермента не зависит от концентрации продукта. Это значит, что киназа будет фосфорилировать всю доступную фруктозу, вне зависимости от того, сколько Фр-1-Ф уже было сделано. Следовательно, при повышенной концентрации фруктозы клетка будет тратить много АТФ на ее фосфорилирование. В ответ на понижение уровня АТФ активируется фермент глизолиза фосфофруктокиназа (PFK), а также, помимо этого, продукты расщепления Фр-1-Ф в конечном счете попадают в реакции гликолиза. Таким образом, фруктоза усиливает гликолиз, что на руку раковым клеткам: в случае колоректального рака активация гликолиза способствует индукции синтеза жирных кислот, необходимых для роста опухоли [9].
Надо отметить, что фруктоза, хоть и способствует росту опухолей в случае колоректального рака, для роста и выживания нормальных клеток вовсе не обязательна, так что фармакологическое подавление переносчиков фруктозы и ферментов, участвующих в ее метаболизме (например, фруктокиназы) может препятствовать прогрессии колоректального рака. И конечно же, исключение фруктозы из рациона пациента также может оказывать благотворный эффект на течение болезни. Однако клинических данных, подтверждающих это, пока недостаточно [1].
Еще один любопытный пример связан с маннозой, моносахаридом, который также часто встречается в рационе как в свободном виде, так и в составе полисахаридов. Манноза поглощается теми же транспортерами, что и глюкоза, но затем накапливается в клетках в виде маннозо-6-фосфата и дальше почти не метаболизируется. В то же время, маннозо-6-фосфат ингибирует некоторые ферменты гликолиза (гексокиназу и глюкозоизомеразу), а также глюкозо-6-фосфатдегидрогеназу — первый фермент пентозофосфатного пути, альтернативного способа окисления глюкозы. Таким образом, накопление маннозо-6-фосфат влечет за собой подавление метаболизма глюкозы, что негативно сказывается на жизнеспособности раковых клеток. Однако не все опухоли чувствительны к маннозе. Дело в том, что в клетках есть фермент маннозо-6-фосфат—изомераза (PMI), который катализирует превращение маннозо-6-фосфата в фруктозо-6-фосфат, метаболит гликолиза. Казалось бы, накопление маннозо-6-фосфата перестает быть проблемой для клетки, но дело в том, что разные опухоли имеют разную активность PMI, и если в каких-то опухолевых клетках его активность понижена, то манноза будет подавлять рост опухоли. Оказалось, что колоректальные опухоли обычно имеют очень низкие уровни PMI, и действительно, на мышиной модели колоректального рака было показано, что биодобавки, содержащие маннозу, значительно подавляют рост опухолей и не оказывают отрицательный эффект на здоровье и вес мышей [10]. Возможно, применение маннозы в виде добавок к пище будет повышать эффективность терапии колоректального рака и у людей, но клинических исследований на этот счет еще не проводилось [1].
Жирные кислоты
Жирные кислоты являются важнейшим источником энергии в клетке, особенно для «энергозатратных» тканей вроде скелетной и сердечной мышечных тканей. При окислении жирных кислот (которое в основном происходит в ходе процесса β-окисления) образуются NADH и FADH2, а также ацетил-КоА — вещества, необходимые для синтеза АТФ при окислительном фосфорилировании. Более того, если сравнить между собой жирные кислоты и углеводы, то окажется, что по отношению к своей сухой массе жирные кислоты обеспечивают больше АТФ, чем углеводы, а значит, они лучше подходят на роль запасного питательного вещества (жирные кислоты запасаются в форме триглицеридов в жировой ткани). Разумеется, не могло бы случиться такого, чтобы не нашлось опухолевых клеток, активно использующих жирные кислоты как источник энергии и восстановительных эквивалентов. Действительно, описаны процессы, когда раковая клетка переходит на β-окисление, а также отдельные опухоли, для которых основной источник энергии — это жиры, а не углеводы [1], [11].
Так, было показано, что окисление жирных кислот критично для клеток рака груди при их откреплении от матрикса. Протоки молочных желез выстланы слоем эпителиальных клеток, которые дают начало опухоли. На ранних стадиях развития рака молочной железы опухолевые клетки открепляются от матрикса, покидают свои ниши, начинают пролиферировать в просветах полых железистых структур, заполняя их. Эпителиальные клетки имеют на своей поверхности рецепторы эпидермального фактора роста (epidermal growth factor receptor, EGFR). При стимуляции EGFR, помимо прочего, происходит активация сигнального пути PI3K/AKT/mTOR, что приводит к росту, пролиферации, а также способствует поглощению глюкозы и подавлению апоптоза. Для эпителиальной клетки очень важен контакт с внеклеточным матриксом. Если клетка по какой-либо причине теряет контакт с матриксом, то экспрессия EGFR падает, и, как одно из следствий, клетка начинает испытывать дефицит в глюкозе. В норме эта череда событий непременно приведет к нехватке АТФ, окислительному стрессу, и наконец — к аноикису— гибели клетки, происходящей в ответ на открепление от матрикса. Но опухолевая клетка не так проста и активно пытается спастись от апоптоза. Активность ряда онкогенов в данном случае способствует активации окисления жирных кислот, что обеспечивает клетку энергией и предотвращает гибель [12].
Другой важный пример роли жирных кислот в раковых клетках связан с никотинамидадениндинуклеотидфосфатом (NADPH) — веществом, которое выполняет две основные функции. С одной стороны, он участвует в защите клетки от токсичных активных форм кислорода (АФК), обеспечивая регенерацию антиоксиданта глутатиона (GSH), что особенно важно для выживания раковых клеток в условиях метаболического стресса. С другой стороны, NADPH необходим для синтеза жирных кислот и нуклеотидов, необходимых для поддержания роста и пролиферации клеток, что является неотъемлемой частью биологии опухолевой клетки. Зачастую рост раковой клетки ограничен уровнями NADPH, следовательно, изменения в метаболизме раковой клетки должны учитывать этот важный аспект. Как связаны между собой окисление жирных кислот и производство NADPH? Основным продуктом окисления жиров является ацетил-КоА, который вступает в цикл Кребса и превращается в цитрат. Цитрат может остаться воволеченным в цикл Кребса, а может покинуть митохондрию и выйти в цитоплазму. Там он превратится в изоцитрат, который является субстратом для NADP-зависимой изоцитратдегидрогеназы [13]. Этот фермент окисляет изоцитрат, при этом происходит перенос водорода на NADP+ и образуется NADPH, необходимый раковым клеткам. Например, в клетках глиомы, в которых ингибируется окисление жирных кислот, значительно понижается уровень NADPH, что приводит к накоплению АФК и, как следствие, клеточной гибели [14].
Рисунок 6. Ацетил-КоА, продукт окисления жирных кислот, поступает в цикл Кребса. В то же время цитрат, промежуточное соединение цикла Кребса, покидает митохондрию, где превращается в изоцитрат. При окислении изоцитрата происходит перенос водорода на NADP+, образуется NADPH, необходимый клеткам для множества процессов.
коллаж авторов статьи. Создан с помощью BioRender.com
Из данных примеров мы видим, что в некоторых случаях жирные кислоты способствуют выживанию и метастазированию опухолевых клеток. Это значит, что для отдельных пациентов диета с низким содержанием жиров может оказаться полезной. В то же время, кетогенная диета, которую мы обсуждали в главе про глюкозу, может вызывать непредвиденные проканцерогенные эффекты и способствовать росту опухоли. Таким образом, режим питания пациентов должен подбираться индивидуально с учетом стадии опухоли, ее локализации и особенностей метаболизма.
Аминокислоты
Как известно, белки принимают участие в большинстве клеточных процессов: поддерживают форму клетки, обеспечивают ее подвижность, контролируют работу генов, регулируют метаболические процессы и многое-многое другое. Аминокислоты являются строительными мономерными блоками для белков. Удивительно, что при огромном разнообразии белков, все они построены из довольно ограниченного набора аминокислот (рис. 7).
Рисунок 7. 20 классических аминокислот.
С пищей в организм попадают белки, после чего в желудочно-кишечном тракте они деградируют до отдельных аминокислот. Смесь аминокислот всасывается в тонком кишечнике, поступает в кровь и разносится к каждой клетке организма. В клетках аминокислоты используются уже для синтеза собственных белков, которые необходимы для нормального функционирования организма. Важно отметить, что некоторые из аминокислот клетки нашего организма умеют синтезировать сами (так называемые заменимые аминокислоты), а некоторые непременно должны поступать с пищей (незаменимые аминокислоты). Итак, аминокислоты, которые попали в клетку, могут войти в состав белков, но для нас более интересен тот факт, что отдельные аминокислоты могут выполнять специальные метаболические функции. Далее мы будем рассматривать роль конкретных аминокислот в метаболизме раковых клеток, а также возможные диетические стратегии для пациентов с онкологическими заболеваниями, основанные на ограничении или биодобавках данных аминокислот в рационе.
Метионин
Метионин относится к незаменимым аминокислотам для клеток человека. При этом раковые клетки для своего роста требуют бóльшие количества метионина по сравнению с нормальными клетками. Дело в том, что метионин выполняет ряд регуляторных функций. В клетке есть специальные сенсоры, которые в ответ на высокий уровень метионина (а точнее, его производного — S-аденозилметионина) способны активировать протеинкиназу mTORC1. Эта протеинкиназа крайне важна для раковых клеток: она активирует процесс синтеза белка и, как следствие, ускоряет рост и деление клетки [15]. Кроме этого, S-аденозилметионин является главным донором метильной группы в клетке, то есть обеспечивает метилирование. Метилирование ДНК и гистонов (белков, связанных с ДНК) позволяет «включать» и «выключать» определенные гены. Изменения статуса метилирования гистонов и ДНК регулируют экспрессию генов и вносят свой вклад в рост и развитие опухоли [16]. Начиная с 1990 года проводятся исследования на животных, которые демонстрируют, что ограничение потребления метионина улучшает исход лечения опухолей [1], [17]. Совсем недавно было проведено первое клиническое исследование, которое показало, что снижение количества метионина в рационе пациентов позволяет замедлить прогрессирование опухоли [18]. Таким образом, диетическое ограничение метионина у людей, страдающих онкологическими заболеваниями, является весьма многообещающим подходом [1]. Важно уточнить, что диетическое ограничение тех или иных аминокислот можно осуществить только за счет «искусственных» диет, при которых основным источником белковой пищи являются протеиновые напитки/батончики без содержания определенных аминокислот. Именно такой режим питания соблюдали пациенты, принявшие участие в клиническом испытании диеты с низким содержанием метионина: 75% белковой пищи представляли из себя протеиновые напитки без метионина [18].
Серин
Аминокислота серин принимает участие во множестве метаболических процессов: в синтезе нуклеотидов и липидов; она может превращаться в пируват и поступать в цикл Кребса, и так далее. Серин относится к заменимым аминокислотам и может синтезироваться в нормальных клетках из глюкозы и глицина (самой простой аминокислоты). Для раковых клеток, которые активно используют гликолиз и, соответственно, остро нуждаются в глюкозе, синтез серина из глюкозы непременно обернется потерями в количестве АТФ и скорости размножения. Именно поэтому можно сказать, что для опухолевых клеток серин является незаменимой аминокислотой, то есть обязательно должен поступать извне. Путь синтеза серина из глицина для раковых клеток тоже крайне нежелателен, так как глицин принимает непосредственное участие в синтезе нуклеотидов, а значит, превращение глицина в серин опять же ставит под угрозу скорость деления раковых клеток. Таким образом, ограничение потребление серина действительно может помочь в терапии опухолей. Эффективность такой диеты уже была показана в экспериментах на мышах, но клинических исследований пока не проводилось [1].
Аргинин
В нормальных клетках аргинин способен образовываться de novo, то есть является заменимой аминокислотой. В опухолевых клетках меланомы, гепатоцеллюлярной карциномы и рака простаты синтез аргинина сильно снижен. Это связано с низким уровнем фермента аргининосукцинатсинтетазы, участвующем в образовании аргиинина. Выходит, что некоторые раковые опухоли требуют поступление аргинина извне (для клеток этих опухолей аргинин — незаменимая аминокислота). «Аргининовая зависимость» опухолей может быть использована для терапии, причем как в фармакологических подходах, так и в простом диетическом ограничении аргинина. Про фармакологическое снижение аргинина в раковых клетках уже кое-что известно из научных работ: так, например, препараты, снижающие уровень аргинина в плазме крови пациентов, оказались эффективными при лечении гепатоцеллюлярной карциномы и меланомы [19].
Однако аргинин может негативно сказываться на противоопухолевом иммунитете. Важнейшими клетками, участвующими в борьбе с опухолью, являются T-лимфоциты. Аргинин активно поглощается активированными T-клетками, затем метаболизируется, что приводит к увеличению выживаемости клеток и усилению противоопухолевого Т-клеточного ответа. В мышиной модели рака кожи увеличение количества потребляемого с пищей аргинина привело к уменьшению размера опухолей, способствовало выживанию мышей [20].
Не менее важную роль в противоопухолевом иммунитете играют NK-клетки (Natural killer cells, натуральные киллеры) — иммунные клетки, способные уничтожать опухолевые клетки. Исследования показали, что потребление аргинина с пищей увеличивает количество и активность NK-клеток [21], и, наоборот, дефицит аргинина угнетает работу и жизнеспособность натуральных киллеров [22], что может негативно сказаться на борьбе с опухолью.
Таким образом, аргинин необходим как некоторым опухолям для роста, так и иммунным клеткам, сражающимся с опухолью. По-видимому, только масштабные клинические испытания помогут понять, в каких случаях стоит исключать или, наоборот, увеличивать содержание аргинина в пище для достижения максимального эффекта терапии.
Цистин и цистеин
Одна из важнейших функций аминокислоты цистеина в клетке — защита от активных форм кислорода (например, перекиси водорода), которые повреждают ДНК, липиды и белки, вызывая в клетке окислительный стресс. Раковые клетки, по сравнению с нормальными, испытывают сильный окислительный стресс и требуют большого количества цистеина. Действительно, для некоторых опухолевых клеток снижение уровня цистеина губительно: клетки «сгорают» из-за накопленных активных форм кислорода. Цистеин образуется из неклассической аминокислоты цистина, которая поступает в клетку из плазмы крови [1]. Препараты, снижающие уровень цистина в плазме крови, тормозят рост опухолей с мутантным рецептором эпидермального фактора роста (например, немелкоклеточного рака легких) у мышей [23]. Теоретически, достичь снижения уровня цистина в плазме крови пациентов можно при помощи корректировки диеты, без применения препаратов, но такой подход пока не исследован.
Гистидин
При деградации гистидина в клетке тратится тетрагидрофолат — кофактор, который необходим для синтеза нуклеотидов, а значит, определяет скорость деления раковых клеток. Чем больше в раковую клетку поступает гистидина, тем больше тетрагидрофолата тратится на распад гистидина и тем медленнее клетка делится. Применение гистидина вместе с пищей может помочь в терапии некоторых видов опухолей. В частности, такой диетический подход может стать особенно эффективным при лечении рака химиотерапевтическим агентом — метотрексатом (часто применяется для лечения злокачественных заболеваний крови). Метотрексат нарушает синтез тетрагидрофолата, что приводит к остановке синтеза нуклеотидов и к гибели раковых клеток. Оказалось, что эффективность лечения лейкемии метотрексатом заметно увеличивается при добавлении к пище аминокислоты гистидина — это было показано на мышиной модели [24].
Биодобавки фолиевой кислоты
В заключение мы хотим уделить внимание витаминам. Витамины необходимы для протекания многих биохимических реакций и должны поступать в организм с пищей. Существует распространенное заблуждение о том, что прием витаминных биодобавок может послужить защитой от рака и других заболеваний. На самом деле, витамины должны поступать исключительно с пищей, а дополнительный прием витаминов здоровым людям в основном не рекомендован (за некоторыми редкими исключениями). Регулярный прием биодобавок может оказаться не только неэффективными, но и вредным, особенно людям, страдающим онкологическими заболеваниями. Давайте рассмотрим пример того, как дополнительный прием витаминов способствует росту опухоли.
Фолиевая кислота (фолат, витамин B9) является необходимым веществом для синтеза нуклеотидов. Опухолевые клетки быстро делятся и нуждаются в больших количествах нуклеотидов для синтеза ДНК, поэтому активно потребляют фолат. Еще в 1948 году стало известно, что биодобавки фолиевой кислоты способствуют росту некоторых видов опухолей [25]. На сегодняшний день метаболизм фолиевой кислоты является фармакологической мишенью для терапии рака: упоминавшийся ранее химиотерапевтический препарат метотрексат нарушает метаболизм фолата и ингибирует пути синтеза нуклеотидов. Надо подчеркнуть, что антифолиевая терапия рака пока что является сугубо фармакологической и не предполагает корректировки диеты [1].
Однако потенциальные негативные эффекты фолата в опухолевой прогрессии на этом не заканчиваются. Ряд исследований показал, что присутствие в крови неметаболизированной фолиевой кислоты, связанное с ее избыточным потреблением, влекло за собой снижение количества и активности NK-клеток [26-28]. Упоминавшиеся ранее NK-клетки — это иммунные клетки, одна из основных функций которых состоит в защите организма от раковых клеток. Следовательно, снижение числа и подавление активности NK-клеток может повлечь за собой повышенный риск образования и прогрессии рака, хотя конкретных исследований о влиянии высоких доз фолата на противоопухолевый иммунитет не проводилось.
Таким образом, витамины необходимы для поддержания функций организма, однако чрезмерное потребление некоторых из них может привести к негативным последствиям, в том числе и к прогрессии опухоли, как в случае с витамином B9. Возможно, диета с низким содержанием фолата будет полезной для некоторых пациентов.
Заключение
Мы постарались кратко охарактеризовать некоторые особенности метаболизма опухолевых клеток и роль питательных веществ в прогрессии рака. В заключение мы хотели бы еще раз обратить внимание на то, что не существует какой-либо универсальной диеты для людей, страдающих онкологическими заболеваниями. Это связано с тем, что опухоли сильно различаются по своему метаболизму. Перечисленные диетические подходы пока что не могут использоваться повсеместно, так как перед внедрением любого из них для каждого типа рака, его локализации и стадии заболевания должны быть проведены масштабные клинические испытания, подтверждающие безопасность и эффективность нового метода лечения. Однако, ввиду многообещающих результатов исследований, модификации диеты являются перспективным подходом к лечению рака. Мы уверены, что в скором времени контроль состава диеты пациентов станет важной частью терапии онкологических заболеваний и поможет спасти многие жизни. А пока что давайте просто стараться питаться правильно и вести здоровый образ жизни. Будьте здоровы!
- Naama Kanarek, Boryana Petrova, David M. Sabatini. (2020). Dietary modifications for enhanced cancer therapy. Nature. 579, 507-517;
- Путь клетки «из греков в варяги». Малигнизация: причины и следствия;
- Douglas Hanahan, Robert A Weinberg. (2000). The Hallmarks of Cancer. Cell. 100, 57-70;
- Douglas Hanahan, Robert A. Weinberg. (2011). Hallmarks of Cancer: The Next Generation. Cell. 144, 646-674;
- Метаболизм клетки;
- Вослед Варбургу — последние достижения в изучении биоэнергетики рака;
- Colin E. Champ, Joshua D. Palmer, Jeff S. Volek, Maria Werner-Wasik, David W. Andrews, et. al.. (2014). Targeting metabolism with a ketogenic diet during the treatment of glioblastoma multiforme. J Neurooncol. 117, 125-131;
- Julie K. Bassett, Roger L. Milne, Dallas R. English, Graham G. Giles, Allison M. Hodge. (2020). Consumption of sugar‐sweetened and artificially sweetened soft drinks and risk of cancers not related to obesity. Int. J. Cancer. 146, 3329-3334;
- Marcus D. Goncalves, Changyuan Lu, Jordan Tutnauer, Travis E. Hartman, Seo-Kyoung Hwang, et. al.. (2019). High-fructose corn syrup enhances intestinal tumor growth in mice. Science. 363, 1345-1349;
- Pablo Sierra Gonzalez, James O’Prey, Simone Cardaci, Valentin J. A. Barthet, Jun-ichi Sakamaki, et. al.. (2018). Mannose impairs tumour growth and enhances chemotherapy. Nature. 563, 719-723;
- Arkaitz Carracedo, Lewis C. Cantley, Pier Paolo Pandolfi. (2013). Cancer metabolism: fatty acid oxidation in the limelight. Nat Rev Cancer. 13, 227-232;
- Zachary T. Schafer, Alexandra R. Grassian, Loling Song, Zhenyang Jiang, Zachary Gerhart-Hines, et. al.. (2009). Antioxidant and oncogene rescue of metabolic defects caused by loss of matrix attachment. Nature. 461, 109-113;
- Alessandra Castegna, Pasquale Scarcia, Gennaro Agrimi, Luigi Palmieri, Hanspeter Rottensteiner, et. al.. (2010). Identification and Functional Characterization of a Novel Mitochondrial Carrier for Citrate and Oxoglutarate in Saccharomyces cerevisiae. Journal of Biological Chemistry. 285, 17359-17370;
- Lisa S. Pike, Amy L. Smift, Nicole J. Croteau, David A. Ferrick, Min Wu. (2011). Inhibition of fatty acid oxidation by etomoxir impairs NADPH production and increases reactive oxygen species resulting in ATP depletion and cell death in human glioblastoma cells. Biochimica et Biophysica Acta (BBA) — Bioenergetics. 1807, 726-734;
- Xin Gu, Jose M. Orozco, Robert A. Saxton, Kendall J. Condon, Grace Y. Liu, et. al.. (2017). SAMTOR is an
S
-adenosylmethionine sensor for the mTORC1 pathway. Science. 358, 813-818; - Samantha J. Mentch, Mahya Mehrmohamadi, Lei Huang, Xiaojing Liu, Diwakar Gupta, et. al.. (2015). Histone Methylation Dynamics and Gene Regulation Occur through the Sensing of One-Carbon Metabolism. Cell Metabolism. 22, 861-873;
- Raghu Sinha, Timothy K. Cooper, Connie J. Rogers, Indu Sinha, William J. Turbitt, et. al.. (2014). Dietary methionine restriction inhibits prostatic intraepithelial neoplasia in TRAMP mice. Prostate. 74, 1663-1673;
- Xia Gao, Sydney M. Sanderson, Ziwei Dai, Michael A. Reid, Daniel E. Cooper, et. al.. (2019). Dietary methionine influences therapy in mouse cancer models and alters human metabolism. Nature. 572, 397-401;
- Francesco Izzo, Paolo Marra, Gerardo Beneduce, Giuseppe Castello, Paolo Vallone, et. al.. (2004). Pegylated Arginine Deiminase Treatment of Patients With Unresectable Hepatocellular Carcinoma: Results From Phase I/II Studies. JCO. 22, 1815-1822;
- Roger Geiger, Jan C. Rieckmann, Tobias Wolf, Camilla Basso, Yuehan Feng, et. al.. (2016). L-Arginine Modulates T Cell Metabolism and Enhances Survival and Anti-tumor Activity. Cell. 167, 829-842.e13;
- K.G.M. Park, P.D. Hayes, O. Eremin, H. Sewell, K.G.M. Park, P.J. Garlick. (1991). Stimulation of lymphocyte natural cytotoxicity by L-arginine. The Lancet. 337, 645-646;
- Bruno Lamas, Juliette Vergnaud-Gauduchon, Nicolas Goncalves-Mendes, Olivier Perche, Adrien Rossary, et. al.. (2012). Altered functions of natural killer cells in response to L-Arginine availability. Cellular Immunology. 280, 182-190;
- Ioannis Poursaitidis, Xiaomeng Wang, Thomas Crighton, Christiaan Labuschagne, David Mason, et. al.. (2017). Oncogene-Selective Sensitivity to Synchronous Cell Death following Modulation of the Amino Acid Nutrient Cystine. Cell Reports. 18, 2547-2556;
- Naama Kanarek, Heather R. Keys, Jason R. Cantor, Caroline A. Lewis, Sze Ham Chan, et. al.. (2018). Histidine catabolism is a major determinant of methotrexate sensitivity. Nature. 559, 632-636;
- Sidney Farber, Louis K. Diamond, Robert D. Mercer, Robert F. Sylvester, James A. Wolff. (1948). Temporary Remissions in Acute Leukemia in Children Produced by Folic Acid Antagonist, 4-Aminopteroyl-Glutamic Acid (Aminopterin). N Engl J Med. 238, 787-793;
- Hathairat Sawaengsri, Junpeng Wang, Christina Reginaldo, Josiane Steluti, Dayong Wu, et. al.. (2016). High folic acid intake reduces natural killer cell cytotoxicity in aged mice. The Journal of Nutritional Biochemistry. 30, 102-107;
- Aron M. Troen, Breeana Mitchell, Bess Sorensen, Mark H. Wener, Abbey Johnston, et. al.. (2006). Unmetabolized Folic Acid in Plasma Is Associated with Reduced Natural Killer Cell Cytotoxicity among Postmenopausal Women. The Journal of Nutrition. 136, 189-194;
- Clovis Paniz, Juliano Felix Bertinato, Maylla Rodrigues Lucena, Eduardo De Carli, Patrícia Mendonça da Silva Amorim, et. al.. (2017). A Daily Dose of 5 mg Folic Acid for 90 Days Is Associated with Increased Serum Unmetabolized Folic Acid and Reduced Natural Killer Cell Cytotoxicity in Healthy Brazilian Adults. The Journal of Nutrition. 147, 1677-1685.