Статья посвящена этапам разработки клинических рекомендаций по бактериальному циститу в соответствии с приказом Минздрава России. Даны принципы отбора доказательных данных на основе мета-анализов, систематических обзоров и рандомизированных клинических исследований. Приведены шкала оценки уровней достоверности доказательств (УДД) и шкала оценки уровней убедительности рекомендаций (УУР). В соответствии с этими требованиями отобраны современные методы диагностики бактериального цистита, в том числе шкала оценки симптомов острого цистита (ACSS), дневник мочеиспускания. Даны современные подходы к лечению асимптоматической бактериурии, схемы лечения острого и рецидивирующего бактериального цистита. Приведены доказательные методы профилактики рецидивов цистита. Также представлена информация для пациентов, включающая рекомендации по образу жизни, питьевому режиму, факторам риска рецидивов цистита и разъяснения по заполнению опросников и дневников.
1. Kunin C.M. Urinary Tract Infections: Detection, Prevention and Management. 5th ed. – Baltimore: Williams & Wilkins, 1997.
2. Hooton T.M. Uncomplicated urinary tract infections. New England Journal of Medicine.2012; 366:1028-37;
3. Perepanova T.S. Uncomplicated urinary tract infection. In the book: «Rational pharmacotherapy in urology: A guide for practitioners-2 ed. N.A. Lopatkin, T.S. Perepanova. M: Litterra, 2012. s. 303–318. Russian (Перепанова Т.С. Неосложненная инфекция мочевых путей. В кн: «Рациональная фармакотерапия в урологии: Руководство для практикующих врачей-2 изд. исп., и доп./ под общ. ред. Н.А. Лопаткина, Т.С. Перепановой. М.:Литтерра, 2012.с. 303–318.
4. Palagin I.S., Sukhorukova M.V., Dekhnich A.V., Eidelstein M.V., Perepanova T.S., Kozlov R.S. and the research group «DARMIS-2018» «Antibiotic resistance of pathogens of out-of-hospital urinary tract infections in Russia: results of a multicenter study» DARMIS-2018. Klinicheskaya mikrobiologiya i antimikrobnaya himioterapiya. 2019;21(2):134–146. Russian (Палагин И.С., Сухорукова М.В., Дехнич А.В., Эйдельштейн М.В., Перепанова Т.С., Козлов Р.С. и исследовательская группа «ДАРМИС-2018» «Антибиотикорезистентность возбудителей внебольничных инфекций мочевых путей в России: результаты многоцентрового исследования «ДАРМИС-2018». Клиническая микробиология и антимикробная химиотерапия. 2019;21(2):134–146). Doi: 10.36488/cmac.2019.2.134-146.
5. Sofia Ny, Petra Edquist, Uga Dumpis, Kirsi Gr¨ondahl-Yli- Hannuksela, Julia Hermes, Anna-Maria Kling, Anja Klingeberg, Roman Kozlov, Owe K¨allman, Danuta O.Lis, Monika Pomorska-Wesołowska, Mara Saule, Karin Tegmark Wisell, Jaana Vuopio, Ivan Palagin, Antibiotic resistance of Escherichia coli from outpatient urinary tract infection in women in six European countries including Russia (2018), https://doi.org/10.1016/j.jgar.2018.11.004
6. Shang Y.J., Wang Q.Q., Zhang J.R., Xu Y.L., Zhang W.W., Chen Y., Gu M.L., Hu Z.D., Deng A.M. Systematic review and meta-analysis of flow cytometry in urinary tract infection screening. Clin Chim Acta 2013; 424: 90–95.
7. Ana L. Flores-Mireles, Jennifer N. Walker, Michael Caparon, Scott J. Hultgren. Urinary tract infections: epidemiology, mechanisms of infection and treatment options. Nat Rev Microbiol. 2015;13(5): 269–284. Doi:10.1038/nrmicro3432
8. Takashi Hato, Pierre C. Dagher. How the Innate Immune System Senses Trouble and Causes Trouble. Clin J Am Soc Nephrol. 2015;10(8):1459–1469. Doi: 10.2215/CJN.04680514
9. Gerard Apodaca. The Uroepithelium: Not Just a Passive Barrier. Traffic. 2004;5:117–128. Doi: 10.1046/j.1600-0854.2003.00156.x
10. Wagenlehner F.M. et al. Uncomplicated urinary tract infections. Dtsch Arztebl Int. 2011;108:415. https://www.ncbi.nlm.nih.gov/pubmed/21776311
11. Alidjanov J.F., Abdufattaev U.A., Makhsudov S.A., Pilatz A., Akilov F.A., Naber K.G., Wagenlehner F.M. New self-reporting questionnaire to assess urinary tract infections and differential diagnosis: acute cystitis symptom score. Urol Int. 2014;92:230–236. Urol Int 2016;96:369.
12. Alidjanov J.F., Abdufattaev U.A., Makhsudov S.A., Pilatz A., Akilov F.A., Naber K.G., Wagenlehner F.M: The acute cystitis symptom score for patient-reported outcome assessment. Urol Int. 2016;97:402–409.
13. Naber K.G., Alijanov J.F. Are there alternative methods of antibacterial therapy and prevention of uncomplicated urinary tract infections? Urologiia. 2014;6:5–13. Russian (Naber K.G., Алиджанов Ж.Ф. Существуют ли альтернативные методы антибактериальной терапии и профилактики неосложненных инфекций мочевыводящих путей? Урология. 2014;6:5–13).
14. Chapple C.R.. Is a voiding diary really necessary in 2014? Eur Urol. 2014;66(2):301–302. Doi: 10.1016/j.eururo.2014.05.001.
15. Bright E., Drake M.J., Abrams P. Urinary diaries: evidence for the development and validation of diary content, format, and duration. Neurourol Urodyn. 2011;30(3):348–352. Doi: 10.1002/nau.20994.
16. Bonkat G., Bartoletti R.R., Bruyere F., Cai T., Geerlings S.E., Koves B., Schubert S., Wagenlehner F. EAU Guidelines on Urological Infections European Association of Urology 2019. 52 p.
17. Kaltenis P., Baciulis V., Liubsis A. Reliability of detection of leucocyturia by means of the dip-stick Cytur-Test. Int Urol Nephrol. 1984;16(3):233–235.
18. Foxman B. Urinary tract infection syndromes: occurrence, recurrence, bacteriology, risk factors, and disease burden. Infect Dis Clin North Am. 2014; 28:1–13.
19. Hooton T.M., Roberts P.L., Cox M.E., Stapleton A.E. Voided midstream urine culture and acute cystitis in premenopausal women. N Engl J Med. 2013;369(20):1883–1891. Doi: 10.1056/NEJMoa1302186;
20. Perepanova T.S., Kozlov R.S., Rudnov V.A., Sinyakova L.A. «Antimicrobial therapy and prevention of kidney, urinary tract and male genital infections» Federal’nye klinicheskie rekomendacii. 2017, 70 s. Russian (Перепанова Т.С., Козлов Р.С., Руднов В.А., Синякова Л.А. «Антимикробная терапия и профилактика инфекций почек, мочевыводящих путей и мужских половых органов» Федеральные клинические рекомендации 2017. 70 с.).
21. Colgan R., Williams M. Diagnosis and treatment of acute uncomplicated cystitis. Am Fam Physician. 2011;84(7):771–776.
22. Guglietta A. Recurrent urinary tract infections in women: risk factors, etiology, pathogenesis and prophylaxis. Future Microbiol. 2017;12:239–246.
23. McLellan L.K., Hunstad D.A. Urinary Tract Infection: Pathogenesis and Outlook. Trends Mol Med. 2016;22(11):946–957.
24. Kaltenis P., Baciulis V., Liubsis A. Reliability of detection of leucocyturia by means of the dip-stick Cytur-Test. Int Urol Nephrol. 1984;16(3):233–235.
25. Lindsay E. Nicolle, Kalpana Gupta, Suzanne F. Bradley, Richard Colgan, Gregory P. DeMuri, Dimitri Drekonja, Linda O. Eckert, Suzanne E. Geerlings, Béla Köves, Thomas M. Hooton, Manisha Juthani-Mehta, Shandra L. Knight, Sanjay Saint, Anthony J. Schaeffer, Barbara Trautner, Bjorn Wullt, Reed Siemieniuk. IDSA 2019 Clinical Practice Guideline for the Management of Asymptomatic Bacteriuria Clinical Infectious Diseases 2019: 3/21/2019. https://doi.org/10.1093/cid/ciy1121)
26. Kranz J., Schmidt S., Lebert C., Schneidewind L., Mandraka F., Kunze M., Helbig S., Vahlensieck W., Naber K., Schmiemann G., Wagenlehner F.M. The 2017 update of the German clinical guideline on epidemiology, diagnostics, therapy, prevention, and management of uncomplicated urinary tract infections in adult patients: Part I. Urol Int 2018.
27. European Committee for Antimicrobial Susceptibility Testing (EUCAST) of the European Society of Clinical Microbiology and Infectious Diseases (ESCMID). EUCAST Definitive Document E.Def 1.2, May 2000: Terminology relating to methods for the determination of susceptibility of bacteria to antimicrobial agents. Clin Microbiol Infect. 2000;6(9):503–508.
28. Wagenlehner F.M.E., Naber K.G. Asymptomatic bacteriuria – shift of paradigm. Clin Infect Dis. 2012;55:778–779.
29. Foxman B. Epidemiology of urinary tract infections: incidence, morbidity, and economic costs. Dis Mon. 2003;49:53–70.
30. Chu C.M., Lowder J.L. Diagnosis and treatment of urinary tract infections across age groups. Am J Obstet Gynecol. 2018;219(1):40–51. Doi: 10.1016/j.ajog.2017.12.231.
31. Urologiya: nacional’noe rukovodstvo/ pod red. N. A. Lopatkina. M.: GEOTAR-Media, 2009 s. 484–490 (Seriya «Nacional’nye rukovodstva») ISBN 978-5-9704-0983-1. Russian (Урология: национальное руководство/ под ред. Н.А. Лопаткина. М.: ГЭОТАР-Медиа, 2009 с. 484–490 (Серия «Национальные руководства») ISBN 978-5-9704-0983-1
32. Puech P., Lagard D., Leroy C., Dracon M., Biserte J., Lemaître L. Imaging in urinary tract infections in adults. J Radiol. 2004;85(2 Pt 2):220–240.
33. Christiaens T.C., de Meyere M., Verschraegen G., Peersman W., Heytens S., de Maeseneer J.M. Randomised controlled trial of nitrofurantoin versus placebo in the treatment of uncomplicated urinary tract infection in adult women. Br J Gen Pract 2002;52:729–734.
34. Falagas M.E., Kastoris A.C., A M Kapaskelis A.M., E Karageorgopoulos D.E. Fosfomycin for the trea tment of multidrug-resistant, including extended-spectrum β-lactamase producing, Enterobacteriaceae infections: a systematic review. Lancet Infect Dis 2010;10:43–50. www.thelancet.com/infection Vol 10 January 2010
35. Tommaso Cai, Irene Tamanini, Carlo Tascini, Bela Köves, Gernot Bonkat, Mauro Gacci, Andrea Novelli, Juan Pablo Horcajada, Truls E. Bjerklund Johansen, George Zanel. Fosfomycin Trometamol versus Comparator Antibiotics for the Treatment of Acute Uncomplicated Urinary Tract Infections in Women: A Systematic Review and Meta-Analysis. J Urol. 2020;203(3):570–578. https://doi.org/10.1097/JU.0000000000000620
36. Patel S.S., Balfour J.A., Bryson H.M. Fosfomycin tromethamine. A review of its antibacterial activity, pharmacokinetic properties and therapeutic efficacy as a single-dose oral treatment for acute uncomplicated lower urinary tract infections. Drugs. 1997;53(4):637–656. Doi: 10.2165/00003495-199753040-00007.
37. Keating G.M. Fosfomycin trometamol: a review of its use as a single-dose oral treatment for patients with acute lower urinary tract infections and pregnant women with asymptomatic bacteriuria. Drugs. 2013;73(17):1951–1966. Doi: 10.1007/s40265-013-0143-y.
38. Loran O.B., Petrov S.B., Sinyakova L.A., Perepanova T.S., Vinarov A.Z., Kosov I.V. Effectiveness of Fosfomycin trometamol (Monural 3g) in the treatment of patients with chronic recurrent cystitis. Effektivnaya farmakoterapiya. Urologiya i nefrologiya. 2008;4:14–16. Russian (Лоран О.Б., Петров С.Б., Синякова Л.А., Перепанова Т.С., Винаров А.З., Косова И.В. Эффективность применения фосфомицина трометамола (Монурала 3г) в лечении больных хроническим рецидивирующим циститом. Эффективная фармакотерапия. Урология и нефрология. 2008;4:14–16).
39. Dawson-Hahn E.E., Mickan S., Onakpoya I., Roberts N., Kronman M., Butler C.C., Thompson M.J. Short-course versus long-course oral antibiotic treatment for infections treated in outpatient settings: a review of systematic reviews. Fam Pract. 2017;34(5):511–519.
40. Galkin V.V., Dovgan E.V., Kozlov S.N., Rafalsky V.V. Cefixim in comparison with ciprofloxacin in acute uncomplicated cystitis: clinical and economic research. Klinicheskaya mikrobiologiya i antimikrobnaya himioterapiya. 2012;14(1):59–66. Russian (Галкин В.В., Довгань Е.В., Козлов С.Н., Рафальский В.В. Цефиксим в сравнении с ципрофлоксацином при остром неосложненном цистите: клинико-экономическое исследование. Клиническая микробиология и антимикробная химиотерапия. 2012;14(1):59–66).
41. Bader MS, Loeb M, Brooks AA. An update on the management of urinary tract infections in the era of antimicrobial resistance. Postgrad Med. 2017;129(2):242–258. doi: 10.1080/00325481.2017.1246055.
42. Jennifer Anger, Una Lee, A. Lenore Ackerman, Roger Chou et al. American Urological Association (AUA)/Canadian Urological Association (CUA)/Society of Urodynamics, Female Pelvic Medicine & Urogenital Reconstruction (SUFU) “Recurrent Uncomplicated Urinary Tract Infections in Women: AUA/CUA/SUFU Guideline”/Copyright © 2019 American Urological Association Education and Research, Inc.®, 36 s.
43. Elisabetta Costantini, Alessandro Zucchi, Eleonora Salvini, Annarita Cicalese, Vincenzo Li Marzi, Maria Teresa Filocamo, Vittorio Bini, Massimo Lazzeri. Prulifloxacin vs fosfomycin for prophylaxis in female patients with recurrent UTIs: a non-inferiority trial. Int Urogynecol J. 2014;25(9):1173–1178. Doi: 10.1007 / s00192-013-2318-1.
44. Raz R., Gennesin Y., Wasser J., Stoler Z., Rosenfeld S., Rottensterich E., et al. Recurrent urinary tract infections in postmenopausal women. Clin Infect Dis. 2000;30:152e6.
45. Eriksen B. A randomized, open, parallel-group study on the preventive effect of an estradiol-releasing vaginal ring (Estring) on recurrent urinary tract infections in postmenopausal women. Am J Obstet Gynecol. 1999;5:1072e9.
46. Perrotta C., Aznar M., Mejia R., Albert X., Ng C.W. Oestrogens for preventing recurrent urinary tract infection in postmenopausal women (Review).Cochrane Database Syst Rev 2008;2:CD005131.
47. Ivanov D., Abramov-Sommariva D., Moritz K., Eskötter H., Kostinenko T., Martynyuk L., Kolesnik N., Naber KG. An open label, non-controlled, multicentre, interventional trial to investigate the safety and efficacy of Canephron® N in the management of uncomplicated urinary tract infections (uUTIs). Clinical Phytoscience. 2015;1:7. Doi:10.1186/s40816-015-0008-x. ;
48. Gessner A. The influence of urologic therapeutics on the microbiome in an experimental model” in “How the microbiome is influenced by the therapy of urological diseases: standard vs. alternative approaches”. 31st Annual EAU Congress, Munich 2016.
49. Naber K.G. Efficacy and safety of the phytotherapeutic drug Canephron® N in prevention and treatment of urogenital and gestational disease: review of clinical experience in Eastern Europe and Central Asia. Research and Reports in Urology, Dovepress, 2013:5 39–46.
50. Dimitri Abramov-Sommariva, Martina Höller, Hubert Steindl,Kurt G. Naber. Non-Antibiotic Herbal Therapy (BNO 1045) versus Antibiotic Therapy (Fosfomycin Trometamol) for the Treatment of Acute Lower Uncomplicated Urinary Tract Infections in Women: A Double-Blind, Parallel-Group, randomized, Multicentre, Non-Inferiority Phase III Trial Florian M. Wagenlehner. Internationalis Urologia. Doi: 10.1159/000493368, Published online: September 19, 2018.
51. Beerepoot M.A., Geerlings S.E., van Haarst E.P., van Charante N.M., ter Riet G. Nonantibiotic prophylaxis for recurrent urinary tract infections: a systematic review and meta-analysis of randomized controlled trials. J Urol 2013;190:1981-1989.
52. Kurt G. Naber, Yong-Hyun Cho, Tetsuro Matsumoto, Anthony J Schaeffer Immunoactive prophylaxis of recurrent urinary tract infections: a meta-analysis. International Journal of Antimicrobial Agents 2009;33:111–119. Doi: 10.1016/j.ijantimicag.2008.08.011.
53. Aziminia N., Hadjipavlou M., Philippou Y., Pandian S.S., Malde S., Hammadeh M.Y. Vaccines for the prevention of recurrent urinary tract infections: a systematic review. BJU Int. 2019;123(5):753–768. Doi: 10.1111/bju.14606. Epub 2018 Dec 19. PMID: 30378242.
54. Albert X., et al. Antibiotics for preventing recurrent urinary tract infection in non-pregnant women. Cochrane Database Syst Rev, 2004: CD001209, http:/www.ncbi.nlm.nih.gov/pubmed/15266443
55. Osamwonyi B., Foley C. Management of recurrent urinary tract infections in adults, Surgery 2017. http:// dx.doi.org/10.1016/j.mpsur.2017.03.004
56. Costantini E., Lazzeri M., Pistolesi D., Del Zingaro M., Frumenzio E., Boni A., Pietropaolo A., Fragalà E., Porena M. Morphological changes of bladder mucosa in patients who underwent instillation with combined sodium hyaluronic acid-chondroitin sulphate (Ialuril®).Urol Int. 2013;91(1):81–88. Doi: 10.1159/000345047.
57. Madersbacher H., van Ophoven A., van Kerrebroeck P.E. GAG layer replenishment therapy for chronic forms of cystitis with intravesical glycosaminoglycans—a review. Neurourol Urodyn. 2013;32(1):9–18. Doi: 10.1002/nau.22256. Epub 2012 Jul 10.
58. Rocco Damiano The role of sodium hyaluronate and sodium chondroitin sulphate in the management of bladder disease Ther Adv Urol. 2011;3(5):223–232. Doi: 10.1177/1756287211418723
А в тор д л я с в я з и: Т. С. Перепанова – д.м.н., профессор, руководитель группы инфекционно-воспалительных заболеваний и клинической фармакологии отдела общей и реконструктивной урологии НИИ урологии и интервенционной радиологии им. Н. А. Лопаткина – филиал ФГБУ «НМИЦ радиологии» Минздрава России, Москва, Россия; e-mail: Perepanova2003@mail.ru
Введение
Инфекции мочевыводящих путей (ИМП) являются распространенными заболеваниями, которыми ежегодно страдают около 11% женщин в возрасте старше 18 лет [1]. У женщин наиболее часто встречается острый цистит — инфекционно-воспалительное заболевание слизистой мочевого пузыря, с легким неосложненным течением; у мужчин данное заболевание развивается только при наличии факторов риска. Рецидивное течение неосложненного и осложненного воспалительного процесса мочевого пузыря причиняет существенный ущерб здоровью, снижает качество жизни пациентов и влечет большие расходы системы здравоохранения. Так, например, общие расходы на лечение ИМП у женщин в США в 2000 г. составили приблизительно 2,47 млрд долларов [2]. Длительный или необоснованный прием антибактериальных препаратов, например с целью профилактики ИМП, способствует прогрессивному росту резистентности возбудителей и развитию побочных эффектов, снижению комплаентности.
Неосложненный инфекционно-воспалительный процесс в мочевом пузыре может быть как спорадический, так и рецидивирующий у небеременных женщин и в пременопаузе, без анатомических и функциональных изменений нижних мочевыводящих путей (НМП) и без коморбидных заболеваний и состояний.
Осложненный инфекционно-воспалительный процесс в мочевом пузыре развивается при наличии факторов риска у мужчин, у беременных, у пациентов с анатомическими и функциональными изменениями НМП, с наличием катетеров в мочевыводящих путях, у пациентов с сахарным диабетом, иммунокомпрометирующими заболеваниями, хронической болезнью почек.
Рецидивирующий инфекционно-воспалительный процесс в мочевом пузыре может быть как осложненный, так и неосложненный [3]. Критериями рецидивирующего инфекционно-воспалительного процесса в мочевом пузыре является частота не менее трех рецидивов в год или двух — за последние 6 мес.
Этиология
Возбудителем острого неосложненного цистита в большинстве случаев (около 80–90%) является Escherichia coli и значительно реже — другие возбудители мочевой инфекции: Staphylococcus saprophyticus, Klebsiella spр., Proteus spp. и др. [4].
В настоящее время в мире с целью мониторинга возбудителей ИМП и их антибиотикорезистентности регулярно проводятся многоцентровые клинические исследования. Крупнейшее международное исследование ECO–SENS с участием 4734 пациентов из 252 клиник 16 стран Европы и Канады, закончившееся в 2003 г., позволило выявить следующие закономерности: у 77,7% пациенток ИМП были вызваны E. coli, у 5,2% — Proteus mirabilis, у 2,8% — Klebsiella spp., у 3,9% — другими представителями семейства Enterobacteriaceae, у 4,6% — S. saprophyticus и у 5,8% — прочими микроорганизмами. Нечувствительны к ампициллину оказались 29,8% выделенных штаммов микроорганизмов, к сульфаметоксазолу — 29,1% и к триметоприму — 14,8%. Устойчивость штаммов E. coli к ципрофлоксацину, комбинации амоксициллина и клавулановой кислоты, нитрофурантоину, гентамицину и фосфомицина трометамолу была отмечена менее чем у 3% пациентов [5].
В России под руководством профессора Л.C. Страчунского были проведены аналогичные исследования: UTIAP I (1998–1999 гг.), UTIAP II (2000–2001 гг.) и UTIAP III (2004–2005 гг.). В ходе этих исследований установлено, что на территории России острый цистит в 85,9% наблюдений вызывала E. coli, в 6% — Klebsiella spp., в 1,8% — Proteus spp., в 1,6% — S. saprophyticus, в 1,2% — Pseudomonas aeruginosa и др. Штаммы E. coli, устойчивые к ампициллину, встречались в 22,7–44% случаев, к ко-тримоксазолу — в 16,2–26,9%, к нитроксолину — в 6,8–7,9% наблюдений. Устойчивость штаммов E. coli к норфлоксацину, ципрофлоксацину и нитрофурантоину была отмечена менее чем у 3% больных острым циститом [6, 7].
Многоцентровое исследование «ДАРМИС-2011» показало, что среди возбудителей ИМП доля представителей семейства Enterobacteriaceae составила 83,5%. При этом E. coli выявлялась у 63,5% пациентов. В целом частота выделения возбудителей значимо не различалась у пациентов с осложненными и неосложненными ИМП [8]. В исследовании «ДАРМИС-2018» выявляемость E. coli в группе пациентов с неосложненной инфекцией составила 74,6%, осложненной — 67,2%, Klebsiella pneumoniae — 9,6% и 12,7%; P. mirabilis — 3% и 4,6%; Enterococcus faecalis — 5% и 6,3%; Staphylococcus spр. — 2,3% и 1,2% соответственно; доля P. aeruginosa, которая определялась при осложненных ИМП, составила 1,7%. Зарегистрирована резистентность штаммов E. coli к ампициллину (57,7%), амоксициллину/клавуланату (43%) и триметоприму/сульфаметоксазолу (36,9%), также отмечено снижение чувствительности к ципрофлоксацину (60,6%), которая оказалась существенно ниже, чем 7 лет назад (79,9%). По сравнению с предыдущим исследованием, по данным «ДАРМИС-18», статистически значимо выросло количество патогенных микроорганизмов, продуцирующих β-лактамазы расширенного спектра, — с 8,5% до 27% [8].
Патогенез и клиническая картина
Острый цистит, как правило, является результатом восходящей инфекции (рис. 1).

Как уже было сказано выше, цистит чаще встречается у женщин, что можно объяснить анатомо-физиологическими особенностями их организма. К таковым относятся короткая и широкая уретра, ее близость к естественным резервуарам инфекции (заднепроходное отверстие, влагалище), а также частые сопутствующие гинекологические заболевания (воспалительные процессы во влагалище, в преддверии влагалища, гормональные нарушения, особенно у пожилых женщин в постменопаузе, недержание мочи, пролапс тазовых органов) [9].
Большинство рецидивов возникает в первые 3 мес. после излечения предшествующего эпизода. В течение 6 мес. после первого эпизода ИМП у 27% молодых женщин развивается хотя бы один культурально подтвержденный рецидив, а у 2,7% — не менее двух рецидивов [10].
К факторам риска развития рецидивирующей ИМП у молодых женщин и женщин в период пременопаузы относят [4]:
культуру половой жизни;
использование спермицидов;
смену полового партнера;
наличие в анамнезе ИМП у матери;
анамнез ИМП в детстве;
секреторный статус антигена группы крови.
У женщин в период постменопаузы факторами риска развития рецидивов ИМП являются [4]:
анамнез ИМП до менопаузы;
недержание мочи, цистоцеле;
атрофия слизистых мочеполовых путей, дефицит эстрогенов;
остаточная моча;
катетеризация мочевого пузыря;
функциональные нарушения мочевого пузыря, деменция, заболевания головного мозга.
К клиническим симптомам острого инфекционно-воспалительного процесса в мочевом пузыре относятся: боль внизу живота; рези и жжение при мочеиспускании; частое мочеиспускание малыми порциями; примесь гноя в моче, гематурия, субфебрильная температура тела.
Диагностика
В соответствии с европейскими и российскими рекомендациями для подтверждения диагноза острого спорадического цистита необходимо выполнение общего анализа мочи, хотя для назначения лечения достаточно анамнеза заболевания и клинических симптомов [3, 4]. Культуральное исследование мочи с определением чувствительности возбудителя при впервые возникшем остром неосложненном цистите не показано. Лечение, помимо уролога, могут проводить врач общей практики и терапевт.
Консультация уролога и исследование мочи на предмет выявления патогенного возбудителя являются обязательными при осложненном, рецидивирующем цистите или неэффективности назначенной терапии. Необходимо помнить, что культуральное исследование мочи должно проводиться до начала антибактериальной терапии.
В таблице 1 представлены обновленные критерии лабораторной диагностики ИМП, предложенные Американским обществом инфекционных болезней (Guidelines IDSA), опубликованные в рекомендациях Европейской ассоциации урологов (ЕAU, 2019) [4].

В большинстве случаев острый спорадический цистит легко купируется антимикробными препаратами в сочетании с растительными диуретиками или комплексными противовоспалительными препаратами. При определении тактики лечения осложненных и рецидивирующих инфекционно-воспалительных заболеваний НМП необходимо определить причину их развития и провести комплексное обследование пациента. Так, например, у женщин в постменопаузе причиной развития урогенитальных расстройств часто является дефицит эстрогенов, ведущий к атрофии слизистой мочеполовых органов, снижению концентрации лактобактерий во влагалище, повышению значений рН вагинального секрета. Это обусловливает преобладание факультативно-анаэробных микроорганизмов, развитие предрасположенности к ИМП [11]. Кроме того, необходимо помнить, что острый цистит может быть связан с вульвовагинитом бактериальной природы и инфекциями, передающимися половым путем (ИППП). Обильные гнойные выделения из уретры или влагалища, жжение при мочеиспускании, неприятный запах, зуд, диспареуния, дизурия, гиперемия половых губ, преддверия влагалища, болезненность при пальпации, гнойный цервицит или бартолинит — все это симптомы и предрасполагающие факторы для возникновения острого инфекционно-воспалительного процесса НМП. Частыми причинами вульвовагинита служат также грибковая инфекция (кандидоз) и генитальный герпес. Выявление перечисленных выше состояний требует проведения дополнительного обследования пациентки у гинеколога. Ультразвуковое исследование мочеполовых органов применяется довольно широко как скрининговая методика для исключения объемных образований и камней мочевого пузыря [12].
Перед назначением антибактериальной терапии необходимо:
собрать анамнез;
провести физикальный осмотр, включая осмотр на гинекологическом кресле;
при необходимости провести забор биоматериала из влагалища на ИППП, бактериальную флору;
выполнить ультразвуковое исследование почек и мочевого пузыря до и после мочеиспускания;
исследование мочи — общий анализ мочи с подсчетом форменных элементов, микробиологический посев мочи с определением возбудителя и его чувствительности к антибактериальным препаратам.
Лечение
Рост резистентности возбудителей ИМП в мире привел к кардинальным ограничениям и запрету применения ряда антибактериальных препаратов (АБП). Так, Комитет по оценке риска лекарственных препаратов фармаконадзора Европейского медицинского агентства (PRAC EMA), Американская администрация по контролю за пищевыми продуктами и медикаментами (FDA), Американское общество инфекционных болезней (Guidelines IDSA) опубликовали в 2019 г. новые рекомендации по критериям диагностики и лечению ИМП, в частности воспалительных заболеваний мочевого пузыря [3].
Цель лечения острого и рецидивирующего цистита: купирование клинических проявлений заболевания, эрадикация возбудителя, профилактика рецидивов.
При назначении эмпирической антибактериальной терапии необходимо соблюдать: терапевтическую дозу; кратность приема; пути введения препарата; учитывать особенности фармакокинетики и фармакодинамики препарата, чувствительность возбудителя в регионе, стационаре; переносимость и возможные побочные эффекты; сочетание с другими лекарственными препаратами.
При остром неосложненном цистите лечение назначается эмпирически, в соответствии с рекомендациями EAU. Рекомендованы пероральные препараты, эффективные в отношении основного возбудителя острого цистита — E. coli: фосфомицин (чувствительность — 98,4%), фуразидин (95,7%), нитрофурантоин (94,1%) и пероральные цефалоспорины (цефадроксил) (табл. 2).
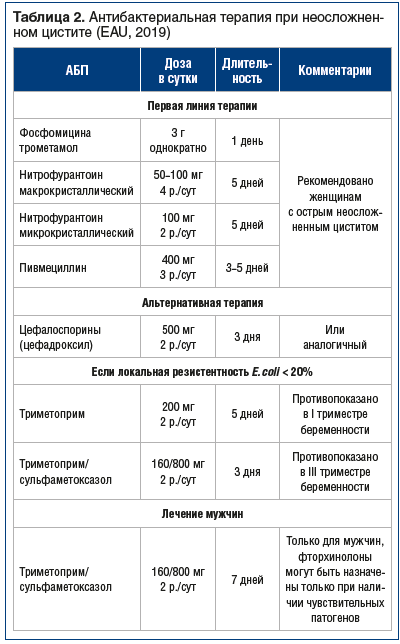
Пациентам, у которых симптомы не купировались или повторились в течение 2 нед. после окончания лечения, показаны полное урологическое обследование и культуральное исследование мочи с определением чувствительности возбудителя к АБП. Лечение рецидивирующей ИМП крайне сложно и связано с наличием факторов риска и образованием биопленок, в которых расположены скопления патогенных микроорганизмов. Длительность терапии должна составлять не менее 7 дней с учетом чувствительности возбудителя к АБП.
Профилактика
Профилактика воспалительного процесса в мочевом пузыре включает следующие меры:
предупреждение переохлаждения;
питьевой режим — 2,5 л жидкости;
соблюдение правил личной гигиены и сексуальной жизни;
лечение хронических заболеваний;
регулярное опорожнение мочевого пузыря в течение дня, а также до и после полового акта;
диетотерапию.
Профилактика рецидивирующих ИМП направлена на изменение образа жизни и питьевого режима, устранение урологических факторов риска и коррекцию сопутствующих заболеваний. EAU и Российским обществом урологов АБП рекомендовано назначать в случае неэффективности поведенческой терапии и мер неантимикробной профилактики, которые рекомендуются после полового контакта [13].
Посткоитальная антибактериальная профилактика должна применяться только после консультирования урологом и проведения курса поведенческой терапии и в тех случаях, когда другие методы лечения неэффективны. Режимы включают нитрофурантоин 50 мг или 100 мг 1 р./сут, фосфомицина трометамол 3 г каждые 10 дней, а во время беременности — цефалексин 125 или 250 мг или цефаклор 250 мг 1 р./сут.
С целью лечения и профилактики ИМП также применяются альтернативные препараты В постменопаузальном периоде показана местная терапия эстрогенами. Европейской и Российской ассоциацией урологов рекомендовано много различных растительных, комплексных препаратов — это лиофилизированный бактериальный лизат 18 штаммов E. coli, гиалуроновая кислота, инстилляции гиалуроновой кислоты и хондроитина сульфата в мочевой пузырь для восстановления гликозамингликанового слоя слизистой мочевого пузыря, препараты, содержащие проантоцианидины, D-маннозу, пробиотики, витамин D3, дефицит, которого характерен для регионов с коротким световым днем, и др. Метаанализ по неантибактериальной профилактике рецидивирующих ИМП показал, что пероральный прием лиофилизированного бактериального лизата 18 штаммов E. coli, проантицианидинов и вагинальных эстрогенов увеличивал безрецидивный период ИМП [14].
Функции витамина D многообразны — это контроль кальций-фосфорного обмена, влияние на физиологические процессы в организме, включающие пролиферацию, дифференцировку, апоптоз, клеточный рост, нервно-мышечную проводимость, иммунитет, экспрессию генов и воспаление как защитную реакцию организма [15].
Впервые на связь между рецидивирующим циститом у женщин в пременопаузе и дефицитом витамина D указали W. Nseir et al. [16]. Исследование, проведенное в Нидерландах van der Starre et al. [17], показало, что у большинства взрослых пациентов с ИМП имелся дефицит витамина D и его уровень был ниже у респондентов, чем в контрольной группе. S. Javadi Nia et al. [18] в перекрестном исследовании сравнили уровень витамина D у 25 детей с ИМП и 40 здоровых. Уровень витамина D был ниже у детей с ИМП, чем в контрольной группе, но разница не была статистически значимой. Авторы пришли к выводу, что дефицит витамина D может играть роль в предрасположенности детей к ИМП, но для более точных результатов необходимо проведение хорошо спланированных исследований на больших когортах.
M. Tekin et al. [19] в обсервационном исследовании сравнивали уровень концентрации витамина D в сыворотке у детей с и без ИМП и показали, что частота появления ИМП у детей с уровнем витамина D ниже 20 нг/мл в 3,5 раза выше, чем у детей с нормальным уровнем витамина D.
Исследования in vitro показали, что эпителий мочевого пузыря у женщин, проходивших лечение с использованием витамина D3, обладает способностью вырабатывать большее количество кателицидина и β-дефензинов, которые являются антимикробными пептидами и оказывают защитное иммунопротективное действие, предотвращая развитие ИМП [20, 21].
Таким образом, в клинических исследованиях подтверждена обоснованность назначения витамина D3 в лечении и профилактике воспалительных заболеваний НМП. Более эффективная профилактика ИМП возможна при использовании сочетания нескольких компонентов, каждый из которых показал в клинических исследованиях свою эффективность.
D-манноза представляет собой сахар, выполняющий важную функцию в метаболизме человека, в особенности в процессе гликозилирования белков протеома человека, а также поддержки функции иммунной, сердечно-сосудистой, мочевой системы организма. В то же время, являясь природным антибактериальным агентом, D-манноза препятствует бактериальной адгезии к клеткам эпителия мочевыводящих путей основных возбудителей инфекционно-воспалительного процесса, таких как E. coli, Klebsiella spp., P. aeruginosa и др. Эксперименты in vitro продемонстрировали, что D-манноза связывается с фимбриями типа I энтеробактерий, препятствуя их адгезии к клеткам эпителия мочевыводящих путей, а снижение уровней бактериурии было подтверждено результатами исследований in vivo на моделях животных [22–26].
В рандомизированном клиническом исследовании показано влияние регулярного приема порошка D-маннозы в дозировке 2000 мг на сокращение в 4 раза частоты рецидивов ИМП в сравнении со стандартной профилактикой нитрофурантоином [27]. После первоначальной антибиотикотерапии острого цистита 308 женщин с рецидивирующими ИМП были случайным образом распределены по трем группам и включены в сравнительное исследование. Первая группа (n=103) в качестве профилактики получала 2000 мг порошка D-маннозы в 200 мл воды ежедневно в течение 6 мес., вторая группа (n=103) — 50 мг нитрофурантоина ежедневно, а третья группа (n=102) не получала профилактического лечения. Частота рецидива ИМП в группе приема D-маннозы составила 14,6%, в группе приема нитрофурантоина — 20,4%, в группе без профилактического лечения — 60,8% (рис. 2). Продолжительность безрецидивного периода в группах нитрофурантоина и без профилактического лечения составила 24 и 28 дней соответственно, а в группе D-маннозы увеличилась до 43 дней. Таким образом, полученные результаты позволяют рекомендовать D-маннозу как средство профилактики ИМП [27].
Хотелось бы отметить, что D-манноза 2000 мг вызывает интерес у европейского урологического сообщества и, как отмечено выше, была упомянута в последних руководствах и рекомендациях как перспективное вещество при лечении и профилактике ИМП.
Способность клюквы (Vaccinium macrocarpon, дикая североамериканская голубика) ингибировать адгезию E. coli к эпителию мочевыводящих путей впервые была продемонстрирована в 1984 г. в рандомизированном клиническом исследовании, проведенном A.E. Sobota [28]. Это действие связано с присутствием танинов (проантоцианидинов и антоцианидинов), которые обладают выраженными антиоксидантными свойствами, ингибируют синтез фимбрий E. coli и снижают выброс медиаторов воспаления, оказывая противовоспалительное действие, тем самым улучшая трофику слизистой оболочки уретры и мочевого пузыря [29–32].
В 2004 г. в журнале Кокрейновской библиотеки был опубликован обзор нескольких клинических исследований, которые подтвердили роль проантоцианидинов в профилактике рецидивирующих ИМП [33].
Опираясь на результаты исследований, проведенных J. Avorn et al. [34] и T. Kontiokari et al. [35] в 2004 г., Французское агентство по безопасности продуктов питания (Afssa-Agence française de sécurité sanitaire des aliments) определило терапевтическую дозировку проантоцианидина — 36 мг.
Для профилактики ИМП целесообразнее всего использовать комбинации веществ, обладающие иммунопротективным действием, улучшающие трофику слизистой мочевого пузыря и оказывающие бактерицидное и бактериостатическое действие. Так, например, биологически активная добавка Уронекст (ООО «НПО Петровакс Фарм», Россия) содержит D-маннозу 2000 мг, проантоцианидины 36 мг (или 500 мг брендированного концентрата экстракта клюквы Cran-Max), витамин D3 1 мкг. Рекомендовано принимать 1 саше 1 р./сут, предварительно растворив в стакане воды (100 мл) комнатной температуры. Длительность приема, согласно инструкции по применению и опыту использования в других странах, составляет 7 дней. Такой короткий курс приема обоснован вышеуказанным составом в правильных и эффективных дозировках и его комплексным действием. Имея в составе необходимую стандартизированную дозировку проантоцианидинов (36 мг), Уронекст отличается повышенной биодоступностью экстракта клюквы за счет запатентованной формулы высвобождения: лигнин-целлюлозные волокна защищают активные молекулы клюквы от деградации в тонком кишечнике, действуя как естественная система доставки.
Применение комбинации активных компонентов, D-маннозы, проантоцианидина и витамина D3, подтвердило свою эффективность и отличный профиль безопасности в рамках международных клинических исследований и показало снижение частоты рецидивов цистита в 4 раза [36]. В проспективном рандомизированном двойном слепом исследовании продолжительностью 45 дней приняло участие 120 пациенток, имевших в анамнезе более 6 эпизодов ИМП за последние 12 мес., развивавшихся после полового контакта. Пациенток случайным образом распределили в три группы. В течение 6 ч после полового акта каждой пациентке 1-й группы требовалось принять 1 капсулу с порошком клюквы, полученным в соответствии с методикой Bioshield (Cran-Max); пациенткам 2-й группы — 1 капсулу сухого экстракта клюквы с содержанием проантоцианидинов А в количестве 36 мг; 3-й группы — 1 капсулу плацебо (магния стеарат и красный оксид железа). В течение периода исследования в 1-й группе рецидив ИМП наблюдали у 10,8% пациенток, во 2-й и 3-й — у 18,9% и 43,2% пациенток соответственно [36].
Заключение
Проблема инфекционно-воспалительного процесса в НМП остается актуальной в связи с большим количеством пациенток и ростом резистентности возбудителей, а также изменением антибактериальной политики в мире. Для повышения эффективности антибактериальной терапии и профилактики рецидивов острого и рецидивирующего цистита рекомендовано применение в комплексной терапии комбинаций активных компонентов, имеющих патогенетическую направленность, таких как Уронекст.
Благодарность
Редакция благодарит ООО «НПО Петровакс Фарм» за помощь в обеспечении взаимодействия между авторами настоящей публикации.
Дата публикации 16 ноября 2020Обновлено 25 июля 2022
Определение болезни. Причины заболевания
Цистит — это инфекционно-воспалительный процесс в стенке мочевого пузыря, локализующийся преимущественно в слизистой оболочке [12][19].
Острым циститом (Acute cystitis) болеют преимущественно женщины. Это связано с анатомо-физиологическим строением женского организма — у женщин короткая уретра, наружное отверстие уретры расположено ближе к прямой кишке, чем у мужчин. Половина женщин в мире в течение жизни имели, по крайней мере однократно, эпизод цистита [12][19]. В России ежегодно регистрируется более 30 млн новых случаев цистита [12][19]. Чаще заболеванием страдают женщины в возрасте от 25 до 30 лет или старше 55 лет [1][6].
Краткое содержание статьи — в видео:
Острый цистит – это состояние, прежде всего возникающее у небеременных женщин пременопаузального возраста, не имеющих анатомических и функциональных нарушений мочевыводящих путей, а также на фоне полного здоровья [12][19]. У женщин пожилого возраста мочеполовые симптомы необязательно обусловлены циститом.
Существуют редкие неинфекционные формы острого цистита, связанные с физическими воздействиями. Например ионизирующее излучение при прохождении лучевой терапии часто становится причиной острого лучевого цистита.
Основные симптомы:
- боли внизу живота;
- частое болезненное мочеиспускание;
- кровь в моче;
- потемнение и помутнение мочи.
При типичном развитии острого цистита общее самочувствие сохраняется на удовлетворительном уровне, многие пациенты продолжают вести обычную повседневную жизнь.
В большинстве случаев к развитию острого цистита приводит жизнедеятельность бактерий:
- кишечной палочки (Еschеrichia coli) – 70-95 %;
- реже стафилококка (Staphylococcus spp.) – 10-20 %;
- клебсиеллы (Klеbsiеlla pnеumoniaе);
- протея (Protеus mirabilis) [11].
Существует небольшая группа циститов, развивающихся после применения медицинских препаратов. Типичный пример возникновения острого цистита — возникающий после внутрипузырного введения вакцины БЦЖ (живые микобактерии вакцинного штамма бацилл Кальмета-Герена) в мочевой пузырь при иммунотерапии неинвазивного рака мочевого пузыря.
Провоцирующими факторами для возникновения острого цистита являются:
- повреждение слизистой оболочки мочевого пузыря;
- варикозное расширение вен таза и, как следствие, застой венозной крови;
- гормональный дисбаланс в организме;
- общее переохлаждение;
- сахарный диабет;
- инфекции, передающиеся половым путём;
- гиподинамия;
- ожирение;
- мочекаменная болезнь;
- аномальное строение мочевыводящих путей;
- длительное стояние мочевого катетера.
Беременность также предрасполагает к развитию острого цистита — влияние гормона прогестерона и сдавление мочеточников маткой затрудняют процесс опорожнения мочевого пузыря, что приводит к его увеличению и застою мочи. При беременности увеличивается количество крови, проходящей ежеминутно через фильтры в почках. Нагрузка глюкозы на почечные канальцы становится чрезмерной, ухудшается её реабсорбция (транспорт глюкозы из мочи обратно в кровь). В результате концентрация глюкозы в моче повышается, изменяется уровень pH мочи, тем самым создаётся благоприятный фон для роста бактерий [5][14].
У мужчин острый цистит развивается редко и обычно является осложнением другого заболевания, например уретрита или простатита, а также следствием аденомы простаты.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы острого цистита
Появление симптомов острого цистита носит внезапный характер, заболевание может развиться за несколько часов. Часто пациенты отмечают наличие провоцирующего фактора, например общего переохлаждения или сексуальной активности. Если в течение шести месяцев происходит два и более острых эпизода, то в таких случаях говорят о рецидивирующем цистите.
Наиболее частые проявления острого цистита:
- частое болезненное мочеиспускание (более 6-8 раз в день);
- мочеиспускание малыми порциями;
- ложные позывы к мочеиспусканию;
- рези при мочеиспускании;
- боли внизу живота, над лоном в проекции мочевого пузыря, изредка отдающая в промежность;
- редко/иногда примесь крови в моче;
- редко/иногда подъем температуры тела 37-37,5 °C;
- помутнение мочи с появлением неприятного запаха [12][19].
Часто у молодых женщин симптомы острого цистита могут быть связаны с половым актом, появлением нового полового партнёра, использованием спермицидов, наличием камней в почках или аномалий мочевыводящих путей, сахарного диабета и др. [12][19]
Патогенез острого цистита
Проникновение патогенных микроорганизмов в мочевой пузырь возможно следующими путями:
- восходящим по мочеиспускательному каналу — самый частый путь, при котором уропатогены проникают в мочеиспускательный канал с поверхности кожи промежности, со слизистой влагалища, из окружающих уретру тканей и из кишки, а далее поднимаются по слизистой мочеиспускательного канала в мочевой пузырь;
- нисходящим из почек — при воспалительных заболеваниях почек (пиелонефрите и его терминальной стадии — пионефрозе);
- с током лимфы из половых органов — при сальпингоофорите, эндометрите, параметрите (воспалении соответственно маточных труб и яичников, слизистой оболочки матки и соединительной ткани, окружающей матку);
- гематогенным (с кровью) — встречается редко, возможен при недавно перенесённых инфекционных заболеваниях;
- прямом — при наличии мочевых свищей, катетеризации мочевого пузыря и проведении цистоскопии (эндоскопический метод диагностики заболеваний мочевого пузыря).
После попадания уропатогенов на слизистую мочевого пузыря происходит их фиксация и «противостояние» возбудителя защитным клеткам слизистой оболочки органа. Фиксация уропатогенов к слизистой оболочке осуществляется за счёт так называемых адгезинов — ворсинок, среди которых наиболее изучены тип 1, Р и S. Тип 1 — это маннозо-чувствительный тип. В дальнейшем зафиксированные уропатогены на слизистой оболочке мочевого пузыря начинают формировать над собой защитную биоплёнку. Благодаря биоплёнкам уропатогены могут оставаться достаточно долго неуязвимыми и периодически вызывать обострения цистита [12][18][19][20].
Длительное пребывание и размножение бактерий приводит к неадекватному опорожнению мочевого пузыря, застою мочи, разложению и накоплению токсичных веществ, в том числе продуктов жизнедеятельности бактерий [11].
В мочевом пузыре появляются признаки воспалительного процесса — боль в связи с раздражением болевых рецепторов в подслизистом слое, отёк и покраснение слизистой, локальное повышение температуры в мочевом пузыре и нарушение его функций. При проникновении бактерий в подслизистый слой возможно разрушение микроциркуляторного русла с развитием геморрагического цистита, при котором кровь из повреждённых мелких сосудов изливается внутрь мочевого пузыря, из-за чего в моче появляются примеси крови.
Классификация и стадии развития острого цистита
По этиологии выделяют:
- инфекционный — бактериальный, вирусный, вызванный грибами;
- неинфекционный — лекарственный, лучевой, токсический, химический, паразитарный, аллергический.
По течению воспалительного процесса делят:
- острый;
- рецидивирующий — возникает не менее двух раз в течение полугода;
- хронический (периоды обострения и ремиссии) в клинической картине часто выявляется лишь один симптом — частое мочеиспускание.
По характеру морфологических изменений:
- катаральный (поверхностный), когда воспаление в мочевом пузыре локализуется в пределах слизистого слоя;
- язвенно-фибринозный, когда происходит более глубокое поражение слизистой оболочки с образованием язвенных дефектов на слизистой мочевого пузыря вплоть до мышечного слоя;
- геморрагический — преимущественно поражаются мелкие сосуды в подслизистом слое;
- гангренозный — редкая форма, при которой развивается некроз стенки мочевого пузыря [12][19].
С учётом развития осложнения острый цисит подразделяют на:
- неосложнённый, когда нет нарушения оттока мочи и в общем не страдает здоровье человека;
- осложненный, когда цистит возникает в следствии других болезней (например при мочекаменной болезни, опухолях или туберкулезе мочевого пузыря и др.) [12][19].
Также выделяют внебольничный и внутрибольничный цистит. Внутрибольничный цистит отличается наличием устойчивых бактерий к тем или иным антибиотикам [12][19].
Существует обособленная форма острого цистита — интерстициальный цистит. Он возникает при распространении воспаления до мышечного слоя мочевого пузыря. Причиной этой формы цистита часто является резкое нарушение защитного слизистого слоя мочевого пузыря. С проникновением калия и других агрессивных веществ из мочи вглубь стенки мочевого пузыря происходит активация чувствительных нервных окончаний и повреждение гладкой мускулатуры. Со временем происходит рубцовое перерождение слизистой мочевого пузыря, приводящее к уменьшению его резервуарной способности. В результате увеличивается частота мочеиспускания вплоть до недержания мочи, мочевой пузырь опорожняется не полностью, что приводит к патологическому замкнутому циклу развития заболевания [1][9].
Осложнения острого цистита
К основным осложнениям острого цистита относятся: острый пиелонефрит, хронический цистит и гематурия.
Острый пиелонефрит — это воспаление почек, обусловленное инфекционным агентом с поражением паренхимы, чашечно-лоханочного комплекса и волокнистой соединительной ткани почки.
Острый пиелонефрит — более грозная болезнь, чем цистит, способная приводить к тяжёлой интоксикации и сепсису. Подавляющее количество случаев острого пиелонефрита связано с восходящей инфекцией — миграцией микроорганизмов по мочеточникам из мочевого пузыря. При остром пиелонефрите поражаться могут как одна, так и обе почки. При развитии острого пиелонефрита рекомендовано стационарное лечение, это обусловлено частым развитием осложнений и более длительной терапией, чем при остром цистите [15].
Хронический цистит — клиническая картина при обострении соответствует острому циститу, но симптомы менее выражены, температура зачастую не поднимается выше 37,5 °С. Нередко при хроническом цистите не удаётся выявить взаимосвязь с инфекционным агентом, поэтому антибактериальная терапия нужна не всегда.
Гематурия (геморрагический цистит). При проникновении бактерий в более глубокий слой (подслизистый) происходит разрушение микроциркуляторного русла, которое проявляется микрокровоизлияниями в слизистой оболочке. Гематурия при остром цистите протекает относительно доброкачественно и редко приводит к тяжёлым последствиям, таким как анемия, коллапс и шок. Более злокачественное течение гематурия приобретает у лиц, принимающих препараты, препятствующие тромбообразованию.
При обширном поражении подслизистого слоя возможно развитие грозного осложнения — тампонады мочевого пузыря массивным сгустком крови. При заболевании просвет мочевого пузыря заполняется сгустками, вследствие чего повышается давление внутри мочевого пузыря, в мочеточниках и почках. Часто проявляется задержкой и отсутствием самостоятельного мочеиспускания с резкими болями над лоном. Осложнение требует незамедлительной госпитализации в хирургический стационар, так как может привести к острой почечной недостаточности.
Диагностика острого цистита
При неосложнённом течении болезни для постановки диагноза достаточно осмотра у врача-уролога, наличия вышеописанных жалоб и общего анализа мочи.
При остром цистите в общем анализе мочи обнаруживаются лейкоциты, бактерии, белок. Анализ мочи может быть выполнен как при помощи лабораторного анализатора, так и при помощи тест-полосок (положительный тест на нитриты и лейкоцитарную эстеразу свидетельствует о цистите).
Если в течение четырёх недель симптомы острого неосложненного цистита не прошли, несмотря на проводимое лечение, или прошли, но вернулись через две недели, то показано выполнение посева мочи с определением чувствительности к антибиотикам[12][19].
На посев сдаётся средняя порция утренней мочи и желательно сразу её отправить на анализ, если это невозможно, то мочу желательно до отправки хранить при температуре от +2 до +8.
В национальных российских клинических рекомендациях также рекомендовано выполнить бактериологическое исследование влагалищного содержимого и анализ на инфекции, передаваемые половым путём.
В последнее время для диагностики рецидивного цистита (при условии отсутствия роста на обычном посеве) применяют анализ на микробиом при помощи техники расширенного количественного посева мочи и генного секвенирования [20]. Раньше общепринято было считать, что моча стерильна, однако это не так. Моча не стерильна. Следует помнить, что часто бактерии в моче можно не обнаружить, ведь порой бактерии могут проникать внутрь клеток слизистого слоя мочевого пузыря с формированием защитных пленок [12][19].
Если возможности оценить микробиом нет, а посев оказался «чистым», но при этом присутствуют клинические симптомы цистита, то мочу можно отправить на посев для исключения Ureaplasma urealyticum или Mycoplasma hominis [12][19].
Осмотр в кресле у пациенток с рецидивной формой цистита является обязательной частью: исключаются влагалищная эктопия и/или гипермобильность наружного отверстия уретры, выделение из наружного отверстия уретры, наличие воспаления около уретральных желез, оценивается состояние слизистой влагалища или его выпадения и т. д. Вероятность инфицирования значительно возрастает при влагалищной эктопии и/или гипермобильности наружного отверстия уретры.
Влагалищная эктопия — расположение наружного отверстия уретры на границе или на передней стенке влагалища.
Гипермобильность — повышенная подвижность наружного отверстия и дистального отдела уретры у женщин в связи с наличием уретрогименальных спаек. При каждом половом акте происходит смещение наружного отверстия уретры во влагалище, ввиду чего осуществляется непрерывный ретроградный заброс микрофлоры влагалища в уретру, которая в свою очередь является постоянным источником инфицирования нижних мочевыводящих путей. Эта разновидность цистита получила название посткоитальный цистит.
Ультразвуковое исследование почек и мочевого пузыря выполняется всем пациенткам с рецидивной формой цистита, учитывая безопасность метода и потенциальную полезность.
Цистоскопию рекомендовано выполнять при отсутствии эффекта от проводимой терапии, с частыми рецидивами, связанным с бактериальной инфекцией и/или при наличии предрасполагающих факторов риска (аномалии мочевых путей, камни, опухоли). Цистоскопия представляет собой эндоскопическое исследование, которое выполняется цистоскопом, введённым в уретру, позволяющее осмотреть слизистую мочевого пузыря.
Лечение острого цистита
Алгоритм лечения острого цистита:
- обильное питье не менее 1,5 литров жидкости в день;
- исключить половые контакты на весь период заболевания;
- антибактериальная терапия.
Если цистит носит рецидивный характер, то антибиотик выбирается по результатам посева мочи.
Антибактериальные препараты:
- Фосфомицин — антибиотик широкого спектра действия, который показывает высокую активность в отношении большинства бактерий: Psеudomonas aеruginosa, Еschеrichia coli, Protеus mirabilis, Klеbsiеlla pnеumoniaе, Staphylococcus spp. (в т.ч. Staphylococcus aurеus, Staphylococcus еpidеrmidis), Strеptococcus spp. (в т. ч. Еntеrococcus faеcalis) [11].
- Альтернативой фосфомицину служат препараты из группы нитрофуранов («Нитрофурантоин», фуразидина калиевая соль). Препараты эффективны против Еschеrichia coli, Klеbsiеlla pnеumoniaе и других бактерий, а также грибов рода Candida. К нитрофуранам редко развивается резистентность.
- Реже прибегают к назначению системных пероральных антибактериальных препаратов, таких как цефиксим — антибиотик цефалоспоринового ряда III поколения. Антибиотики групп фторхинолонов (левофлоксацин, норфлоксацин, ципрофлоксацин и др) и цефалоспорины (цефиксим, цефуроксим и др) связаны с большим количеством побочных реакций и могут приводить к развитию устойчивых бактериальных форм, и потому не должны быть первой линией лечения острого неосложненного цистита [12][19].
Этиологическое лечение (направленное на устранение причины и условий развития болезни)
При рецидивах острого цистита в последнее время всё чаще используют препараты бактериофагов — лекарства на основе вирусов, избирательно, словно снайперским огнём, уничтожающих бактерии. Чаще всего бактериофаги размножаются внутри бактерий и вызывают их распад на фрагменты.
Лечение бактериофагами безопаснее, чем антибиотиками, но следует учесть, что для прицельного уничтожения бактерий требуется бактериологическое исследование мочи для определения возбудителя и его чувствительности к фагам [2].
У пациенток с рецидивирующим циститом, который имеет прямую зависимость с половым актом (посткоитальный цистит) и при наличии глубоко расположенного наружного отверстия уретры используется хирургическое лечение. Операция, направленная на перемещение (транспозицию) уретры имеет высокий процент успеха.
Патогенетическое лечение (направленное на устранение или подавление механизмов развития болезни)
Вакцина Уро-Ваксом, принимаемая перорально (путём проглатывания). Средство обладает иммунобиологическим свойством, защищающим от воздействия кишечной палочки и запускающим иммунный ответ неспецифического характера (активизирует макрофагов и клеточный фагоцитоз). При назначении вакцины стоит учитывать, что эффективность сохраняется при повторном курсе приёма препарата [4].
Д-манноза — моносахарид, попадающий после всасывания из кишечника с мочой в мочевой пузырь, где блокирует прикрепление бактериальных пилей (нитевидных выростов бактерий). В результате бактерии вместе с мочой покидают организм. Д-манноза — это биологически активная добавка, а не лекарство, однако данный препарат обладает доказанной эффективностью и рекомендован Европейской ассоциацией урологов [17].
Заместительная гормональная терапия. В постменопаузальном периоде у женщин резко снижается уровень эстрогенов. Эстрогены являются одним из факторов защиты слизистой мочевого пузыря, при снижении ослабляются защитные механизмы слизистой. Возможно введение через уретру или через влагалище гормональных препаратов, содержащих эстрогены.
В качестве вспомогательных средств для лечения острого цистита применяют фитопрепараты, обладающие противовоспалительным, слабым диуретическим и антисептическим действиями. Из фитопрепаратов эффективен «Канефрон» — комплексный препарат растительного происхождения, в состав которого входит трава золототысячника, корень любистока и листья розмарина. Препарат обладает мочегонным, противовоспалительным, спазмолитическим, антимикробным, сосудорасширяющим и нефропротекторным действиями [1].
При выраженной гематурии возможно назначение кровоостанавливающих препаратов. Наиболее эффективными в данной группе являются антифибринолитические препараты — аминокапроновая и транексамовая кислоты [11].
Если причиной острого цистита является обструктивная уропатия (затруднённое отхождение мочи, связанное с сужением просвета уретры), то после купирования острого периода и ликвидации инфекционного агента проводится хирургическая коррекция — установка цистостомы (специальной дренажной трубки), пластика уретры и т. д.
Симптоматическое лечение (уменьшающее проявления болезни)
НПВС (нестероидные противовоспалительные средства) — большая группа лекарственных средств, обладают обезболивающим, жаропонижающим и противовоспалительным эффектами, уменьшают боль, лихорадку и воспаление. Наиболее известные представители НПВС: аспирин, парацетамол, ибупрофен, диклофенак.
Более современные препараты из группы НПВС, обладающие теми же положительными свойствами и имеющие гораздо меньше побочных эффектов: нимесулид, мелоксикам, целебрекс [10].
Феназопиридин — данный препарат, попадая с мочой в мочевой пузырь, воздействует на слизистую оболочку нижних мочевых путей, оказывая местное действие. Это способствует уменьшению боли над лоном, жжения и снижению частоты мочеиспускания. Эффект появляется быстро, в считанные часы.
При заболевании необходимо соблюдать диету с исключением острых блюд. Желательно употреблять в пищу продукты, богатые витаминами и увеличивающих суточный диурез (например, клюкву), а также достаточное количество жидкости для поддержания суточного мочеотделения в объёме 2000-2500 мл [1].
Прогноз. Профилактика
В подавляющем количестве случаев острый цистит (при отсутствии нарушений в выделении мочи, сопутствующих болезней, стандартном возбудителе и наличии у него чувствительности к антибактериальным лекарственным средствам, рациональной антибактериальной терапии) проходит без последствий. При рецидивирующем цистите лечение требует более углублённой лабораторной и инструментальной диагностики и может быть эффективным только при соблюдении принципов патогенетической терапии и активной профилактики повторов заболевания [12][21].
Профилактика заключается:
- Придерживаться правильной гигиены наружных половых органов у женщин и девочек для предотвращения развития вагинитов, а затем уретритов и циститов. Подмывать девочку нужно спереди назад, достаточно двух раз в день, утром и вечером, под проточной водой.
- При наличии показаний корректировать в детстве аномалии развития нижних мочевыводящих путей.
- Своевременно и адекватно лечить гинекологические заболевания.
- Избегать переохлаждения.
- Соблюдать гигиену половой жизни (принимать душ до и после интимной близости).
- Лечить бессимптомную бактериурию у беременных. Бессимптомная бактериурия устанавливается при выявлении 105 КОЕ/мл одного штамма бактерий или 102 КОЕ/мл кишечной палочки (Escherichia coli) в двух пробах мочи, взятых с интервалом 24 часа, при отсутствии клинических проявлений инфекции мочевых путей.
- Проводить антибактериальную профилактику при инвазивных урологических вмешательствах — вводить однократную дозу антибактериального препарата до или сразу после процедуры.
- Корректировать урологическую патологию, приводящую к нарушению выведения мочи, например аденому простаты и стриктуру уретры.
- Пить достаточное количество жидкости (от 2 литров) и своевременно опорожнять мочевой пузырь.
- Женщинам с рецидивирующими приступами острого цистита необходимо проводить принудительное мочеиспускание сразу после полового акта, а также использовать однократную дозу антибактериального препарата (фосфомицин или нитрофуран) [1].
- Не использовать спермициды и влагалищную диафрагму для контрацепции.
- Проводить иммунологическую профилактику препаратом Уро-Ваксом (от двух месяцев, продолжительность лечения определяет врач) [1].
На сегодняшний день рекомендации по использованию различных препаратов таких как: клюква, влагалищные эстрогены, пробиотики в виде влагалищных свечей, метенамин (Уротропин), D-Манноза, внутрипузырное введение гиалуроновой кислоты и хондроитина сульфата с целью восстановления поверхностного защитного слоя слизистой мочевого пузыря могут иметь положительный эффект, однако их использование имеет слабо доказанный эффект.
В 2006 году были опубликованы «Практические рекомендации Европейской ассоциации урологов по лечению инфекций мочевыводящих путей». В настоящих рекомендациях приводятся данные по классификации, диагностике, этиологии, антибактериальной терапии и профилактике осложненных и неосложненных инфекций мочевыводящих путей различной локализации (острый цистит, пиелонефрит, уретрит, простатит, эпидидимит и орхит). Также обсуждаются вопросы тактики лечения инфекций мочевыводящих путей у детей, пациентов с почечной недостаточностью, иммуносупрессией, постоянным мочевым катетером, при уросепсисе, применения антибиотиков для периоперационной профилактики.
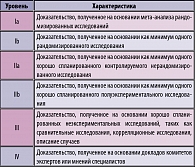
Таблица 1. Уровень доказательности данных в «Практических рекомендациях»

Таблица 2. Категории доказательности рекомендаций
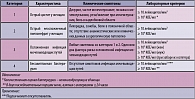
Таблица 3. Клинические и лабораторные критерии диагноза инфекций мочевыводящих путей
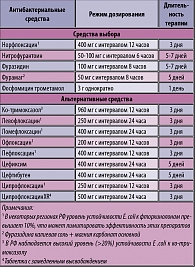
Таблица 4. Рекомендации по режимам антибактериальной терапии острого неосложненного цистита у небеременных женщин с учетом локальных данных антибиотикорезистентности
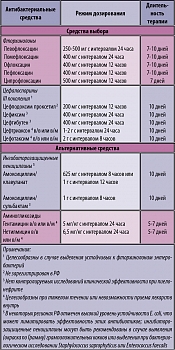
Таблица 5. Рекомендации по антибактериальной терапии пиелонефрита у небеременных женщин (в модификации)
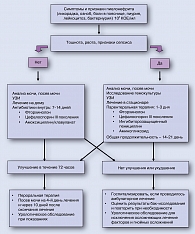
Схема. Алгоритм ведения пациентов с острым пиелонефритом
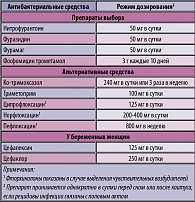
Таблица 6. Рекомендованные режимы профилактики рецидивирующих неосложненных инфекций мочевыводящих путей у женщин ( в модификации с учетом национальных особенностей)
В качестве основы для разработки рекомендаций были использованы материалы первой версии Европейских рекомендаций (2), а также практические рекомендации общества инфекционных заболеваний США (IDSA) по диагностике и лечению острого цистита и пиелонефрита у женщин (3).
В настоящей работе будут обсуждены рекомендации по антибактериальной терапии и профилактике острых и рецидивирующих неосложненных инфекций мочевыводящих путей у женщин, а также острых осложненных мочевых инфекций у мужчин с акцентом на возможность практического применения этих рекомендаций в нашей стране, учитывая локальные особенности этиологической структуры заболеваний и уровень антибиотикорезистентности возбудителей. Учитывая методологию медицины, основанную на доказательствах, все рекомендации и источники определены в соответствии с их уровнем и категорией доказательности (таблицы 1-2).
Эпидемиология
Инфекции мочевыводящих путей относятся к наиболее частым инфекционным заболеваниям человека. В США регистрируется свыше 7 млн обращений к врачу ежегодно по поводу инфекций мочевыводящих путей, из них 2 млн случаев приходится на острый цистит. Эти инфекции являются причиной свыше 100 000 госпитализаций ежегодно, большинство случаев связано с пиелонефритом. Примерно у 25-35% женщин в возрасте от 20 до 40 лет наблюдается острый цистит, из них у 1/3 заболевание приобретает рецидивирующее течение.
Классификация
Инфекции мочевыводящих путей могут быть классифицированы в соответствии с их локализацией – цистит, пиелонефрит, простатит, уретрит, эпидидимит, орхит. Однако следует учитывать, что изолированные инфекции указанных локализаций встречаются редко, чаще возбудители могут обнаруживаться в разных отделах урогенитального тракта. С практических позиций антимикробной химиотерапии целесообразно выделять следующие типы инфекций:
- неосложненные инфекции нижних отделов мочевых путей (цистит):
- острые
- рецидивирующие;
- неосложненный пиелонефрит;
- осложненные инфекции мочевыводящих путей (пиелонефрит и без вовлечения почек);
- уросепсис;
- уретрит;
- особые формы: простатит, эпидидимит, орхит.
С клинических позиций важно дифференцировать неосложненные и осложненные инфекции мочевыводящих путей, так как они различаются по прогнозу и тактике антибактериальной терапии. При неосложненных инфекциях клинический эффект и эрадикация возбудителя достигаются как правило при коротких курсах антибактериальной терапии. Кроме того, при неосложненных инфекциях не требуется рутинно проводить микробиологическую диагностику и лабораторный контроль излечения. Осложненные инфекции мочевыводящих путей ассоциируются с наличием факторов, предрасполагающих к их развитию, длительному сохранению симптомов, возникновению осложнений и неуспеху антибактериальной терапии. К факторам, ассоциированным с осложненными инфекциями мочевыводящих путей, относятся:
- принадлежность к мужскому полу;
- пожилой возраст;
- инфекция, развившаяся в стационаре;
- беременность;
- наличие мочевого катетера;
- недавно перенесенная операция на органах мочеполовой системы;
- функциональные или анатомические нарушения мочевых путей;
- недавнее применение антибиотиков;
- сохранение симптомов более 7 дней;
- сахарный диабет;
- иммуносупрессия.
Также целесообразно выделять бессимптомную бактериурию, которая часто выявляется у определенных категорий пациентов (пожилые, беременные женщины, наличие постоянного мочевого катетера, больные сахарным диабетом) и требует решения вопроса о целесообразности проведения антибактериальной терапии. Бессимптомная бактериурия редко ассоциируется с неблагоприятными последствиями и неназначение антибиотиков не сопровождается повышенным риском развития инфекций у большинства пациентов.
Диагностика
Острый цистит обычно сопровождается такими симптомами, как дизурия, рези и боли при мочеиспускании, учащенное мочеиспускание, позывы на мочеиспускание, боли в надлобковой области. Примерно у 40% женщин с острым циститом наблюдается гематурия, которая не является признаком осложненной инфекции. Остро возникшая дизурия у женщин требует исключения других симптомосходных заболеваний – острый уретрит, вызванный Chlamydia trachomatis, Neisseria gonorrhoeae или вирусом простого герпеса, или вагинит, вызванный Candida spp. или Trichomonas vaginalis. При остром цистите в общем анализе мочи всегда выявляется пиурия и бактериурия (таблица 3). Отсутствие пиурии свидетельствует в пользу другого диагноза.
Традиционный количественный критерий диагноза острой инфекции мочевыводящих путей ≥ 105 колониеобразующих единиц (КОЕ) микроорганизмов в средней порции мочи в последние годы пересмотрен. Было показано, что примерно у 1/3 женщин с документированным диагнозом острого цистита выявлена бактериурия
< 105 КОЕ/мл (II). Для диагностики острого цистита рекомендуется учитывать бактериурию >102 КОЕ/мл. Проведение бактериологического исследования мочи (выделение чистой культуры возбудителя и определение чувствительности к антибиотикам) у небеременных женщин с острым циститом не рекомендуется, так как этиология заболевания и антибиотикочувствительность возбудителей хорошо прогнозируются.
Рецидивирующая неосложненная инфекция мочевыводящих путей определяется как три и более эпизодов острой инфекции в последние 12 месяцев или два и более эпизода в последние 6 месяцев.
В отличие от острого цистита, острый пиелонефрит характеризуется симптомами генерализованной инфекции (гектическая лихорадка, ознобы) и интоксикации (головная боль, тошнота, рвота); также обычно наблюдаются боли в поясничной области. При этом симптомы цистита могут присутствовать или отсутствовать. В анализе мочи всегда наблюдается пиурия. Клинически значимой бактериурией считается >103 КОЕ/мл. Дополнительное обследование при пиелонефрите целесообразно для выявления обструкции мочевыводящих путей, уролитиаза (УЗИ, КТ). При отсутствии эффекта от адекватной антибактериальной терапии в течение 72 часов необходимо дальнейшее обследование для исключения возможных осложняющих факторов (уролитиаз, абсцесс).
Диагностически значимым уровнем бактериурии для постановки диагноза бессимптомная бактериурия следует считать > 104 КОЕ/мл микроорганизмов в двух порциях мочи, собранных с интервалом ≥ 24 часа.
Этиология
Этиологический спектр возбудителей острых неосложненных инфекций верхних (цистит) и нижних отделов (пиелонефрит) мочевыводящих путей сходен. Доминирующим возбудителем является Escherichia coli, на долю которого приходится 70-95% случаев заболеваний. В 5-19% выделяются коагулазонегативные стафилококки (главным образом Staphylococcus saprophyticus). В остальных случаях возбудителями могут быть другие энтеробактерии (Proteus mirabilis, Klebsiella spp.) и энтерококки (Enterococcus faecalis).
Российские данные1. Следует выделить некоторые национальные особенности в спектре возбудителей острых инфекций мочевыводящих путей. При анализе 1000 штаммов микроорганизмов, полученных от амбулаторных пациентов с острыми мочевыми инфекциями в Москве в 2004-2005 гг., было установлено, что наиболее частыми возбудителями были микроорганизмы семейства Enterobacteriaceae (73,8%), среди которых преобладала E. coli – 59,9%
(4, 17). В то же время выявлен высокий удельный вес энтерококков 18,7%, самый частый из которых – Enterococcus faecalis – 15%. Высокая этиологическая значимость энтерококков, вероятно, связана с тем, что около ¼ штаммов микроорганизмов было получено от мужчин, среди которых естественно преобладают осложненные инфекции мочевыводящих путей. В то же время в другом исследовании, проведенном в 3 городах РФ, в этиологической структуре острого неосложненного цистита у женщин также отмечен высокий удельный вес грамположительной микрофлоры: E. coli – 67%, другие грамотрицательные – 11%, S. saprophyticus – 13%, E. faecalis – 9% [5]. Таким образом, отечественные данные свидетельствуют о несколько меньшем удельном весе E. coli в этиологической структуре острых инфекций мочевыводящих путей за счет возрастания роли грамположительных микроорганизмов – E. faecalis и S. saprophyticus.
Антибиотикорезистентность уропатогенов
В настоящих рекомендациях вопросы состояния антибиотикорезистентности в европейских странах практически не обсуждаются. Отмечено только, что повсеместно наблюдается высокий уровень устойчивости E. coli к ампициллину и ко-тримоксазолу, а также наблюдаются тревожные тенденции роста устойчивости к фторхинолонам. В то же время хорошая чувствительность сохраняется к цефалоспоринам III поколения, фосфомицину и нитрофуранам.
В последние годы, по данным зарубежных исследований, наблюдаются отчетливые тенденции к росту устойчивости уропатогенных штаммов E. coli к антибактериальным препаратам, которые традиционно широко назначаются при внебольничных инфекциях мочевыводящих путей, прежде всего к ампициллину (устойчивость >30%) и ко-тримоксазолу (20-30%), нефторированным хинолонам (5-27%) (6-9). Неблагоприятной тенденцией является повышение устойчивости также к амоксициллину/клавуланату и фторированным хинолонам (ципрофлоксацину, норфлоксацину и др.), в некоторых странах Европы до 9 и 15% соответственно (10). Наименьший уровень устойчивости E. coli в Европе наблюдался к цефалоспоринам III поколения (цефадроксилу, мециллинаму), гентамицину, фосфомицину и нитрофурантоину. Стабильно высокая чувствительность уропатогенов к фосфомицину и нитрофурантоину на протяжении многих лет отмечена также в другом исследовании (11).
Российские данные. Исследование антибиотикочувствительности возбудителей острых внебольничных мочевых инфекций в г. Москве также показало высокий уровень устойчивости E. coli к ампициллину (43,5%), ампициллину/сульбактаму (28,5%), ко-тримоксазолу (31%), налидиксовой кислоте (21%) и фторхинолонам – ципрофлоксацину (15,5%) и левофлоксацину (15%) (4). На этом фоне сохраняется низкий уровень устойчивости
E. coli к цефалоспоринам III поколения и нитрофуранам (в пределах 5%). Среди нитрофуранов самым активным препаратом в отношении E. coli и других Enterobacteriaceae был фуразидин К (калиевая соль фуразидина), процент чувствительных штаммов к нему был выше, чем к фуразидину и нитрофурантоину. Среди стафилококков все штаммы сохраняли чувствительность к нитрофуранам, невысокая устойчивость отмечена к ко-тримоксазолу и гентамицину (7%), более высокая – к левофлоксацину (11%) и ципрофлоксацину (14%). Энтерококки характеризовались хорошей чувствительностью к ампициллину и нитрофуранам (нет устойчивых штаммов), левофлоксацину (6%); устойчивость к ципрофлоксацину и гентамицину была выше
(11 и 30%).
В другом многоцентровом исследовании, проведенном в различных регионах РФ, высокий уровень устойчивости E. coli также отмечен к ампициллину (37%), ко-тримоксазолу (21%); к другим антибактериальным препаратам устойчивость была не высокой: норфлоксацину, ципрофлоксацину – 4%, амоксициллину/клавуланату – 3%, цефуроксиму – 2%, нитрофурантоину – 1% (12).
В нашем исследовании (5) низкий уровень устойчивости внебольничных штаммов E. coli отмечен к гентамицину, цефотаксиму, фуразидину К (препарат фурамаг), ципрофлоксацину (соответственно 7,7%, 8,5%, 13% и 14,9%), более высокий уровень – к амоксициллину/клавуланату (19,1%), ко-тримоксазолу (23,4%), налидиксовой кислоте (33,3%), цефазолину (34,6%), ампициллину (46,7%). Чувствительность других энтеробактерий к антибиотикам была закономерно хуже, меньшее количество устойчивых штаммов наблюдалось к цефотаксиму. S. saprophyticus проявлял хорошую чувствительность к фуразидину К, амоксициллин/клавуланату, ципрофлоксацину; устойчивость была высокой к цефотаксиму. Чувствительность E. faecalis была высокой к ампициллину, амоксициллину/клавуланату, фуразидину К и низкой к ципрофлоксацину и ко-тримоксазолу.
Таким образом, на основании отечественных данных по антибиотикорезистентности внебольничных штаммов уропатогенов для лечения острых неосложненных инфекций мочевыводящих путей могут быть рекомендованы нитрофураны, цефалоспорины III поколения, гентамицин, фторхинолоны, последние – с оговоркой про неблагоприятные тенденции к росту устойчивости. Среди указанных препаратов следует отметить, что цефалоспорины лишены активности против энтерококков, на долю которых в РФ приходится около 15% острых мочевых инфекций, а ципрофлоксацин обладает слабой активностью против этого возбудителя. Для лечения острых неосложненных мочевых инфекций в РФ не следует использовать ко-тримоксазол, ингибиторозащищенные аминопенициллины, ампициллин и амоксициллин, нефторированные хинолоны (налидиксовая кислота, пипемидиевая кислота), у которых отмечается высокий уровень резистентности E. coli.
Антибактериальные средства
Для лечения острых внебольничных инфекций мочевыводящих путей традиционно используются бета-лактамы, фторхинолоны, нефторированные хинолоны, нитрофураны, ко-тримоксазол, фосфомицин трометамол.
Фторхинолоны
Фторхинолоны обладают высокой природной активностью против кишечной палочки и других энтеробактерий. Их активность против грамположительных уропатогенов (энтерококков, стафилококков) ниже. В этом отношении новые фторхинолоны (левофлоксацин, моксифлоксацин, гатифлоксацин) превосходят ранние.
Контролируемые клинические исследования эффективности имеются для многих представителей этой группы (ципрофлоксацин, норфлоксацин, офлоксацин, пефлоксацин, левофлоксацин, моксифлоксацин, гатифлоксацин), причем различий между разными препаратами не установлено. Для всех указанных препаратов показана эффективность коротких 3-дневных курсов терапии острого неосложненного цистита (IbA2), эффективность более коротких курсов (1 день) уступает 3-дневным. Во всех исследованиях показана равная эффективность фторхинолонов и ко-тримоксазола. Лечение фторхинолонами острых неосложненных мочевых инфекций сопровождается высоким уровнем эрадикации возбудителей (более 90%).
Для ципрофлоксацина (IbA), гатифлоксацина (IbA), левофлоксацина (IbA), ломефлоксацина (IbB), офлоксацина (IbB) имеются данные контролируемых клинических исследований высокой эффективности при неосложненном пиелонефрите.
Фторхинолоны в течение многих лет традиционно рассматривались как препараты выбора при лечении неосложненных инфекций мочевыводящих путей. Специалистами давно высказывалось опасение, что широкое использование фторхинолонов для лечения неосложненных мочевых инфекций может способствовать селекции резистентных штаммов в популяции. Подтверждений этим данным к настоящему времени не получено, по крайней мере, при использовании коротких курсов терапии (III). В то же время, учитывая эти опасения, для лечения неосложненных мочевых инфекций (цистит) более предпочтительно использование не «системных» фторхинолонов, а норфлоксацина, фармакокинетика которого характеризуется высокими концентрациями в моче и низкими в тканях. Для лечения пиелонефрита норфлоксацин не должен применяться, как раз из-за низких тканевых концентраций, в этом случае предпочтительны другие фторхинолоны.
Учитывая высокий удельный вес грамположительных бактерий в этиологической структуре острых внебольничных инфекций мочевыводящих путей в России, новые фторхинолоны (левофлоксацин, моксифлоксацин, гатифлоксацин) возможно более предпочтительны, чем ранние, однако клинического подтверждения этого нет.
Следует отметить, что уровень устойчивости в России основного возбудителя острых неосложненных мочевых инфекций – E. coli – во многих регионах превышает 10%, что может ограничивать эффективность всех фторхинолонов.
Нефторированные хинолоны
Налидиксовая кислота и пипемидиевая кислота около 50 лет применяются для лечения острых неосложненных инфекций мочевыводящих путей, так как препараты обладают высокой природной активностью против кишечной палочки. В то же время нефторированные хинолоны не активны против грамположительных бактерий. В нашей стране значение этих препаратов для лечения урогенитальных инфекций не высоко, с одной стороны, из-за высокого уровня устойчивости
E. coli (21-33%), с другой стороны, из-за высокой доли энтрококков и стафилококков в этиологической структуре острых внебольничных инфекций мочевыводящих путей (22-26%, по данным исследований (4-5)).
Бета-лактамные антибиотики
В общем, бета-лактамные антибиотики немного уступают по эффективности фторхинолонам при лечении острых неосложненных мочевых инфекций (III). В отличие от фторхинолонов и ко-тримоксазола, бета-лактамы эффективны при более длительных курсах лечения острого цистита (5 дней) и пиелонефрита (10-14 дней); при коротких курсах увеличивается частота ранних рецидивов инфекции (Ib).
Клинических данных о различиях в эффективности между разными бета-лактамами нет. Препараты I и II поколения цефалоспоринов обычно не рекомендуются для лечения острого цистита (IbA) и пиелонефрита из-за более низкой природной активности против Enterobacteriaceae по сравнению с препаратами III поколения. Наиболее хорошая доказательная база при лечении неосложненных мочевых инфекций имеется для двух препаратов – пивмециллинама и цефподоксим проксетила, которые, однако, не зарегистрированы в России. Из других пероральных цефалоспоринов III поколения, которые зарегистрированы в России, можно упомянуть цефиксим и цефтибутен, однако рандомизированных исследований их эффективности при мочевых инфекциях нет. Из парентеральных цефалоспоринов возможно использование цефтриаксона при пиелонефрите в амбулаторной практике, так как препарат вводится 1 раз в день.
Среди бета-лактамных антибиотиков при мочевых инфекциях не следует использовать ампициллин и амоксициллин из-за высокой резистентности уропатогенов, по той же причине цефалоспорины III поколения предпочтительнее ингибиторозащищенных аминопенициллинов.
Аминогликозиды
В настоящее время уровень устойчивости внебольничных мочевых штаммов E. coli к аминогликозидам не высокий. В тоже время эти антибиотики проявляют меньшую активность против грамположительных микроорганизмов. Более высокая токсичность аминогликозидов по сравнению с другими антибиотиками также ограничивает их назначение при неосложненных инфекциях мочевыводящих путей. Назначение гентамицина рационально при пиелонефрите в случае устойчивости возбудителя к цефалоспоринам и фторхинолонам.
Ко-тримоксазол
Этот препарат является наиболее хорошо изученным средством при неосложненных инфекциях мочевыводящих путей (30 исследований). Показана эффективность 3-дневных курсов лечения ко-тримоксазолом острого цистита (эффективность выше, чем при однодневном курсе), сравнимого с эффективностью фторхинолонов (IaA). Имеется тесная корреляция между выявлением устойчивых к ко-тримоксазолу штаммов
E. coli и клиническим неуспехом терапии (Ib). В этой связи подчеркивается, что в странах с уровнем устойчивости E. coli к ко-тримоксазолу выше 20% препарат не может рассматриваться как средство выбора при лечении неосложненных мочевых инфекций. В РФ устойчивости кишечной палочки к ко-тримоксазолу составляет
21-31% (4-5, 12), поэтому надежнее использовать другие антибиотики.
Фосфомицин
В отдельных клинических исследованиях и в мета-анализе показано, что фосфомицин трометамол эффективен при терапии острого неосложненного цистита в однократной дозе 3 г (IaA). Несмотря на 20-летнее применение, устойчивость E. coli к фосфомицину остается на низком уровне – в пределах 3%, причем отсутствует перекрестная устойчивость с другими группами антимикробных средств (IIb). В то же время устойчивость других энтеробактерий к фосфомицину высокая – в среднем 16%, а для Klebsiella spp. – 57% (10).
Фосфомицин используется только для лечения острого неосложненного цистита у женщин, при других уроинфекциях (пиелонефрит, уретрит и т. д.) препарат не применяется. Фосфомицин обычно хорошо переносится, однако имеются данные, что частота нежелательных явлений несколько выше по сравнению с норфлоксацином.
Показана эффективность фосфомицина при длительном применении для профилактики рецидивов цистита (IaB). Фосфомицин может назначаться для лечения острого цистита у беременных женщин (IIaB).
Нитрофураны
Представлены тремя препаратами – нитрофурантоином, фуразидином и фуразидином К (калиевая соль фуразидина). В контролируемых клинических исследованиях установлена высокая клиническая эффективность нитрофурантоина при лечении острого неосложненного цистита (IIaB). Рекомендованный курс терапии острого цистита нитрофурантоином составляет 5-7 дней, при более коротких курсах эффективность препарата ниже (IIaB). Показана эффективность нитрофурантоина при длительном профилактическом применении (IIaB). Для других нитрофуранов рандомизированных исследований нет, имеются отдельные клинические нерандомизированные исследования и наблюдения (III).
В Европейских Практических рекомендациях среди нитрофуранов представлен только один препарат – нитрофурантоин, который, однако, практически не используется в РФ. В нашей стране традиционно используется фуразидин (фурагин) и фуразидин К, в последние годы применяется препарат фурамаг, представляющий собой сочетание калиевой соли фуразидина и магния карбоната основным. Данная лекарственная форма обеспечивает лучшую биодоступность фуразидина, благодаря чему в моче достигаются концентрации фуразидина в 1,5-2 раза более высокие, чем после приема таблеток фурагина. В проведенном сравнительном клиническом исследовании (5) показана высокая клиническая и бактериологическая эффективность 5-дневного курса лечения фурамагом острого цистита у женщин.
Несмотря на длительное использование нитрофуранов в медицине, устойчивость E. coli и грамположительных уропатогенов к нитрофуранам в Европе и Америке не высока (IIb), также низкий уровень устойчивости основных уропатогенов к нитрофуранам наблюдается в России. Более низкая природная активность нитрофуранов проявляется в отношении Klebsiella spp. и P. mirabilis. При сравнении антимикробной активности различных нитрофуранов наиболее высокий уровень активности в отношении E.coli и других энтеробактерий отмечен у фуразидина калиевой соли, наименьший – у нитрофурантоина (4). Таким образом, как по антимикробной активности, так и более пролонгированной фармакокинетике фуразидин имеет определенные преимущества по сравнению с нитрофурантоином.
В литературе описаны серьезные побочные эффекты при применении нитрофурантоина, в частности, острая и хроническая легочная токсичность в виде кашля, одышки и пневмонита. Однако тщательное наблюдение за пациентами, длительно принимающих нитрофураны с целью профилактики (до 1 года), позволило установить, что риск развития острой и хронической легочной токсичности при применении нитрофуранов незначительный и подобных осложнений не развивалось у девочек и женщин молодого и среднего возраста (III) (13-14).
Нитрофураны являются препаратами выбора при остром цистите у женщин, рецидивирующем цистите, а также для лечения бессимтомной бактериурии при наличии показаний. При пиелонефрите нитрофураны назначаться не могут из-за низких тканевых концентраций. Нитрофураны могут назначаться беременным женщинам для лечения и профилактики цистита (IVC), отсутствие у фуразидина и нитрофурантоина тератогенных или эмбриотоксических свойств подтверждено в больших популяционных исследованиях (15-16).
Рекомендации по антибактериальной терапии внебольничных инфекций мочевыводящих путей
Острый неосложненный цистит у небеременных женщин
Хотя острый цистит характеризуется благоприятным прогнозом и высоким уровнем спонтанного выздоровления, в контролируемых исследованиях показано преимущество антибиотиков по сравнению с плацебо, как по клинической, так и бактериологической эффективности и быстроте прекращения симптомов заболевания (Ib).
Эффективность лечения острого цистита показана для многих антибактериальных средств в контролируемых клинических исследованиях: триметоприм, ко-тримоксазол, фторхинолоны (ципрофлоксацин, эноксацин, флероксацин, гатифлоксацин, левофлоксацин, ломефлоксацин, моксифлоксацин, норфлоксацин, офлоксацин, пефлоксацин, руфлоксацин), бета-лактамы (амоксициллин, ампициллин, амоксициллин/клавуланат, цефадроксил, цефуроксим аксетил, цефподоксим проксетил, цефтибутен, пивмециллинам, ритипенем аксетил, цефиксим), фосфомицин трометамол, нитрофураны (нитрофурантоин, фуразидин). Подчеркивается, что сложно предоставить единые рекомендации по выбору режима антибактериальной терапии острого цистита для всех стран из-за региональных особенностей распространения антибиотикорезистентности.
В нашей стране невысокий уровень устойчивости урогенитальных внебольничных штаммов кишечной палочки отмечен к цефалоспоринам III поколения, фосфомицину и нитрофуранам. Устойчивость кишечной палочки к фторхинолонам в настоящее время превышает 10%, что может ограничивать их эффективность. Высокий уровень устойчивости наблюдается к нефторированным хинолонам, аминопенициллинам и защищенным пенициллинам, ко-тримоксазолу.
Рекомендации по режимам антибактериальной терапии острого неосложненного цистита с учетом локальных данных по антибиотикорезистентности уропатогенов представлены в таблице 4.
Короткие курсы терапии имеют преимущества в плане лучшей переносимости и снижения стоимости лечения и могут быть применены у небеременных женщин до менопаузы при назначении фторхинолонов и ко-тримоксазола (3 дня), фосфомицина (1 день). Бета-лактамы и нитрофураны целесообразно применять в течение 5-7 дней.
При назначении антибиотиков пациентам следует объяснить, что даже при эффективном лечении симптомы заболевания могут сохраняться в течение 2-3 дней. При выраженных симптомах возможно назначение анальгетиков, таких как феназопиридин в дозе 200 мг с интервалом 8 часов. Целесообразны также рекомендации по увеличению количества принимаемой жидкости, однако убедительных доказательств в пользу этого утверждения нет.
Острый неосложненный пиелонефрит у небеременных женщин
Несмотря на несколько сотен клинических исследований антибиотиков при пиелонефрите, только 5 из них могут быть отнесены к проспективным, рандомизированным, контролируемым. Резюме по этим исследованиям и еще 4 хорошо спланированным исследованиям представлено ниже.
- Ко-тримоксазол превосходит ампициллин при остром пиелонефрите (IbA).
- 2-недельный курс лечения ко-тримоксазолом острого неосложненного пиелонефрита является адекватным и достаточным у большинства женщин (IbA). В некоторых исследованиях показана эффективность других антибиотиков в более коротких курсах (7-10 дней), а аминогликозидов даже при 5-7-дневной терапии, однако доказательная сила этих данных не очень высокая (IIIB).
- В регионах, где уровень устойчивости E. coli к ко-тримоксазолу превышает 10% (в России >20%), фторхинолоны должны расцениваться как средства выбора. Показано преимущество 7-дневного курса ципрофлоксацином по сравнению с 14-дневным курсом ко-тримоксазолом по уровню эрадикации возбудителей (IbA). Одинаковая эффективность с ципрофлоксацином в дозе 500 мг с интервалом 12 часов показана для других фторхинолонов: ципрофлоксацин с замедленным высвобождением (1 г с интервалом 24 часа), гатифлоксацин (400 мг с интервалом 24 часа), левофлоксацин (250 мг с интервалом 12 часов), ломефлоксацин (400 мг с интервалом 24 часа) (IbA).
- Возможность применения ингибиторозащищенных пенициллинов (амоксициллин/клавуланат) и пероральных цефалоспоринов II-III поколения при остром пиелонефрите не подтверждена в рандомизированных сравнительных исследованиях с фторхинолонами или ко-тримоксазолом. В единственном контролируемом исследовании бета-лактамов показана одинаковая эффективность 10-дневной терапии цефподоксим проксетилом (200 мг с интервалом 12 часов) и ципрофлоксацина в дозе 500 мг с интервалом 12 часов (IbA).
- В регионах с уровнем устойчивости E. coli к фторхинолонам >10% (в России по данным трех исследований устойчивость составляла 15, 4 и 15%) или в тех ситуациях, когда фторхинолоны противопоказаны (беременные, период лактации, дети и подростки), препаратами выбора могут считаться ингибиторозащищенные аминопенициллины или цефалоспорины III поколения (IIIB). В нашей стране предпочтительнее пероральные (цефиксим, цефтибутен) или парентеральные (цефтриаксон, цефотаксим) цефалоспорины III поколения, учитывая более высокий уровень устойчивости уропатогенных штаммов
E. coli к амоксициллину/клавуланату и ампициллину/сульбактаму.
Резюме по результатам контролируемых, рандомизированных, проспективных исследований антибактериальных средств при пиелонефрите, обладающих высоким уровнем доказательности, представлены ниже.
- Ципрофлоксацин внутрь 500 мг с интервалом 12 часов в течение 7 дней более эффективен и лучше переносится, чем ступенчатая терапия цефтриаксоном и ко-тримоксазолом (IbA).
- Ципрофлоксацин в лекарственной форме с замедленным высвобождением (XR) в дозе 1000 мг с интервалом 24 часа в течение 7-10 дней эквивалентен по эффективности и переносимости ципрофлоксацину в обычной лекарственной форме (IbA).
- Цефподоксим проксетил в дозе 200 мг с интервалом 12 часов в течение 10 дней эквивалентен ципрофлоксацину в дозе 500 мг с интервалом 12 часов (IbB).
- Гатифлоксацин в дозе 400 мг с интервалом 24 часа в течение 10 дней эквивалентен ципрофлоксацину в стандартной дозе (IbA).
- Левофлоксацин в дозе 250 мг с интервалом 12 часов в течение 10 дней эквивалентен ципрофлоксацину в стандартной дозе (IbA).
- Ломефлоксацин в дозе 400 мг с интервалом 24 часа в течение 10 дней эквивалентен ципрофлоксацину, однако количество пациентов было недостаточно для выводов о статистической значимости результатов (IbB).
- Ко-тримоксазол в дозе 960 мг с интервалом 12 часов в течение 14 дней эквивалентен ципрофлоксацину в стандартной дозе в течение 7 дней только в случае, если возбудитель был чувствителен к триметоприму (IbB).
Таким образом, в случаях нетяжелого течения пиелонефрита целесообразен 7-дневный курс лечения пероральным фторхинолоном (кроме норфлоксацина). В случаях невозможности применения фторхинолонов (см. выше) оправдано назначение перорального цефалоспорина III поколения – цефиксима или цефтибутена (В). Назначение амоксициллина/клавуланата целесообразно при выявлении при окраски по Грамму грамположительных бактерий (В). По усмотрению врача пациенты могут получать также парентеральную антибиотикотерапию на дому, в этом случае предпочтительнее назначение цефтриаксона (1-2 г с интервалом 24 часа) (С).
Рекомендованные режимы антибактериальной терапии острого неосложненного пиелонефрита с учетом локальных данных по антибиотикорезистентности представлены в таблице 5.
При тяжелом течении пиелонефрита пациента следует госпитализировать и лечение проводить парентеральным антибиотиком – фторхинолоном или цефалоспорином III поколения или аминогликозидом. При улучшении состояния долечивание пациента (до полного курса, 1-2 недели) может осуществляться пероральным антибиотиком (ступенчатая терапия) (В).
Около 12% госпитализированных пациентов с пиелонефритом имеют бактериемию, однако нет данных по прогностическому значению этого феномена. У всех госпитализированных пациентов, наряду с бактериологическим исследованием мочи, взятой до начала антибиотикотерапии, целесообразно исследование гемокультуры.
После окончания терапии и отсутствия симптомов заболевания нет необходимости проводить повторное исследование мочи. В случае если симптомы заболевания сохраняются свыше 3 дней на фоне адекватной антибиотикотерапии, или если наблюдается рецидив инфекции в течение 2 недель после окончания терапии, необходимо проведение бактериологического исследования мочи и определение чувствительности возбудителя к антибиотикам, а также надлежащее инструментальное обследование (УЗИ. КТ). При отсутствии урологической патологии в этих ситуациях необходим повторный 2-недельный курс терапии другим антибиотиком с учетом данных чувствительности. В случае если рецидив был вызван тем же штаммом возбудителя, что и первичная инфекция, то необходим более длительный, 6-недельный, курс антибиотикотерапии.
Рецидивирующая (неосложненная) инфекция мочевыводящих путей у женщин
Рецидивирующая неосложненная инфекция мочевыводящих путей определяется как три и более эпизодов острой инфекции в последние 12 месяцев или два и более эпизода в последние 6 месяцев.
При рецидивирующих неосложненных инфекциях мочевыводящих путей предложены различные методы профилактики, включающие антибиотикопрофилактику, опорожнение мочевого пузыря после полового акта, прием клюквенного сока.
В отношении антибиотикопрофилактики не установлены оптимальная продолжительность применения антибиотиков и наиболее эффективные схемы профилактики. В настоящее время большинство специалистов считает наиболее адекватным способом профилактики регулярный прием антибиотика перед сном (Ib) или после полового акта (Ib). В Кокрэновском обзоре (Ia) проанализированы 108 исследований антибиотикопрофилактики. В плацебоконтролируемых исследованиях было показано, что частота рецидивов на фоне антибиотиков составила от 0 до 0,9 пациентов/год и была достоверно ниже, чем на фоне плацебо (от 0,8 до 3,6). Относительный риск рецидива инфекции составил 0,21 (95%, доверительный интервал – 0,13-0,34) в пользу антибиотиков, но риск нежелательных явлений при применении антибиотиков достоверно выше – 1,78 (95%, ДИ – 1,06-3,00), наиболее частыми были кандидоз полости рта или влагалища, желудочно-кишечные симптомы. Таким образом, частота рецидивов на фоне антибиотикопрофилактики снижается в 8 раз по сравнению с периодом до профилактики и в 5 раз по сравнению с плацебо. Период профилактического применения антибиотиков составлял от 6 до 12 месяцев. Однако после окончания профилактического приема антибиотиков примерно у 60% женщин в течение 3-4 месяцев наблюдался рецидив инфекции.
Клиническая эффективность профилактического применения антибиотиков показана в контролируемых исследованиях для фторхинолонов (норфлоксацин, ципрофлоксацин, пефлоксацин, циноксацин), нитрофурантоина, ко-тримоксазола, цефалексина, цефаклора, триметоприма.
Рекомендованные режимы профилактики рецидивирующего цистита с учетом национальных особенностей антибиотикорезистентности и антибиотикотерапии представлены в таблице 6.
Оптимальная продолжительность профилактики не установлена, но обычно не менее 6-12 месяцев.
Другие меры профилактики включают применение иммуноактивных фракций кишечной палочки ОМ-89 (уроваксом), клюквенный сок, вагинальную аппликацию лактобацилл, однако единого мнения по их эффективности в настоящее время нет.
Инфекции мочевыводящих путей у беременных
У беременных женщин не проводятся короткие 3-дневные курсы антибиотикотерапии острого цистита из-за высокого риска рецидивов инфекции. Обычно рекомендуются 7-дневные курсы терапии пероральным цефалоспорином III поколения (цефиксим, цефтибутен) или нитрофураном (фуразидин или фурамаг); фосфомицин трометамол может назначаться в однократной дозе 3 г. До начала терапии и после окончания целесообразно проводить бактериологическое исследование мочи.
Для лечения острого пиелонефрита следует использовать цефалоспорины III поколения или ингибиторозащищенные пенициллины или аминогликозиды. Оптимальная продолжительность терапии не установлена.
У беременных женщин противопоказаны фторхинолоны, тетрациклины и ко-тримоксазол.
Инфекции мочевыводящих путей у женщин в постменопаузе
Подходы к антибактериальной терапии сходные, как у женщин до менопаузы. При остром цистите короткие курсы антибиотикотерапии поддерживаются не всеми специалистами. В то же время есть исследования, подтверждающие возможность использования фторхинолонов (ципрофлоксацин, офлоксацин) в 3-дневном режиме. При возникновении острого цистита у женщины в постменопаузе рекомендуется проведение гинекологического обследования.
Бессимптомная бактериурия
Бессимптомная бактериурия диагностируется при выделении в двух последовательных анализах мочи бактерий в количестве ≥ 105 КОЕ/мл. Бессимптомная бактериурия часто выявляется у определенных категорий пациентов (пожилые, беременные женщины, наличие постоянного мочевого катетера, больные сахарным диабетом) и требует решения вопроса о целесообразности проведения антибактериальной терапии.
Бессимптомная бактериурия редко ассоциируется с неблагоприятными последствиями, и неназначение антибиотиков не сопровождается повышенным риском развития инфекций у большинства пациентов. Не рекомендуется дальнейшее обследование и антибиотикотерапия при бессимптомной бактериурии у следующих категорий пациентов:
- небеременные женщины до менопаузы (IbA);
- женщины с сахарным диабетом (IbA);
- лица пожилого возраста, живущие дома (IIB);
- лица пожилого возраста в домах престарелых (IIaB);
- пациенты с повреждениями спинного мозга (IIaB);
- пациенты с постоянным мочевым катетером (IbA).
Скрининг на наличие бактериурии и антибактериальная терапия рекомендуются только в трех ситуациях:
- беременные женщины (IbA);
- перед трансуретральной резекцией предстательной железы (IbA);
- перед другими травматическими урологическими вмешательствами (IIIB).
В двух последних случаях антибиотики следует назначить незадолго до операции (IIIb) (обычно за 1-3 дня). Возможно применение фторхинолонов или нитрофуранов.
У беременных женщин в случае выявления бессимптомной бактериурии применяется 5-7-дневный курс терапии (IIIB) одним из следующих антибактериальных препаратов: цефиксим (400 мг в сутки), цефтибутен (400 мг в сутки), фуразидин (300 мг в сутки), фурамаг (150 мг в сутки). Контрольное бактериологическое исследование мочи следует проводить через 1-4 недели после лечения и еще раз перед родами (IIIB).
Комментарии автора:
- Курсивом выделены комментарии автора.
- В скобках уровни и категории доказательности (см. таблицу 1-2).
Текущие руководящие принципы лечения интерстициального цистита включают следующие документы: “Руководство Европейской ассоциации урологов (EAU)”, обновленное в марте 2017 г., “Руководство американской Ассоциации урологов (AUA)” 2014 г., “Королевский колледж акушеров и гинекологов (RCOG) совместно с британским обществом Урогинекологов (BSUG), руководящие принципы” 2016 г.
Руководство Европейской Ассоциации Урологии (EAU)
По мнению американских специалистов, обучение пациентов является главным приоритетом, за которым следует физиотерапия, включая трансвагинальную мануальную терапию для мышц тазового дна, специальные инъекции триггерных точек и миофасциальную физиотерапию, выполняемую квалифицированным физиотерапевтом. В рекомендациях EAU говорится, что фармакотерапия никогда не принесет симптоматической пользы при монотерапии, поэтому следует использовать комбинированную терапию.
едикаментозные методы:
- Результаты применения пентозан сульфата субъективны, и его эффективность возрастает при более длительном применении и при подкожном введении гепарина.
- Для снятия боли назначаются трициклические антидепрессанты. Наиболее часто используется амитриптилин, за ним следует нортриптилин, когда у пациента развиваются побочные эффекты, такие как седативное действие амитриптилина.
- Антагонисты гистаминовых рецепторов применяются, но проявляют различную степень эффективности.
- Используются иммунодепрессанты. Азатиоприн вызывает облегчение боли и симптомов нижних мочевыводящих путей, а вот циклоспорин и метотрексат не уменьшают срочность и частоту позывов.
- Кортикостероиды в рекомендациях EAU не рекомендуются.
Внутрипузырная терапия применяется тогда, когда необходима высокая концентрация препаратов в самом пузыре или пероральная терапия дает слишком много побочных эффектов. Комбинация таких лекарств как гепарин, бикарбоната натрия, лидокаин оказалась эффективной.
Хирургия является последним средством в рекомендациях EAU и должна применяться только тогда, когда пациент невосприимчив к другим вариантам лечения. Исключением являются случаи язвенной формы (поражения Ханнера), когда фульгурация или лазерная терапия приносят больше пользы, чем медикаментозная терапия.
Гидродистензия здесь является скорее диагностическим инструментом, причем она применяется при использовании с ботулиническим токсином (эффекты были выше, чем только гидродистензия). Другие принятые хирургические процедуры – это отведение мочи без цистэктомии, надтригональная цистэктомия с увеличением мочевого пузыря, субтригональная цистэктомия и цистэктомия с формированием подвздошного кондуита.
Руководство Американской Ассоциации Урологов (AUA)
В тексте используются следующие обозначения: при наличии достаточных доказательств, совокупности доказательств для конкретного лечения присваивалась оценка силы A (высокая), B (умеренная) или C (низкая). Дополнительная информация о лечении предоставляется в виде «Клинических принципов» и «Заключения эксперта», если не имеется достаточных доказательств.
- Стратегии лечения должны начинаться в первую очередь с более консервативных методов лечения, затем продолжаются с использованием менее консервативных методов лечения, если не наблюдается облегчение симптомов для приемлемого качества жизни. Из-за необратимости хирургическое лечение (кроме фульгурации поражений Хуннера) целесообразно только после того, как исчерпаны другие альтернативы лечения, или в любое время, в редких случаях, когда подтверждена конечная стадия наличия маленького фиброзного пузыря и когда значительно страдает качество пациента жизни и имеется положительное соотношение риска и пользы для серьезной операции. Клинический принцип.
- Тип и уровень начального лечения должны зависеть от серьезности симптомов, оценки уролога и предпочтений пациента.Клинический принцип
- Можно рассмотреть возможность одновременного проведения нескольких процедур, если это отвечает наилучшим интересам пациента. При этом необходимо определение исходных симптомов и регулярное отслеживание уровня симптомов. Это необходимо для оценки одиночного и комбинированного лечения. Клинический принцип.
- Неэффективное лечение следует прекратить по истечении клинически значимого интервала. Клинический принцип.
- Эффективность обезболивания следует постоянно оценивать, поскольку это важна для качества жизни. Если обезболивание не достигается, следует рассмотреть не просто смену препаратов, а возможность применения мультидисциплинарного подхода. Клинический принцип.
- Диагноз ИЦ/СБМП следует пересмотреть, если после нескольких подходов к лечению не наступает улучшение. Клинический принцип.
Лечение, которое может быть предложено, разделено на группы первой, второй, третьей, четвертой, пятой и шестой линии в зависимости от баланса между потенциальной пользой для пациента и потенциальной серьезностью побочных эффектов.
Терапия первой линии (выполняется всем)
- Всех пациентов необходимо проинформировать о нормальной работе мочевого пузыря, о характеристике СБМП, преимуществах и рисках лечения/отказа от него, неудобствах доступных альтернативных методов лечения, о том факте, что ни одно лечение в настоящее время не признано эффективным/оптимальным для большинства случаев. Для облегчения симптомов может потребоваться использование нескольких терапевтических вариантов (в том числе комбинированную терапию). Клинический принцип.
- Следует обсудить и внедрить методы самопомощи, изменения поведения, которые могут улучшить симптомы. Клинический принцип.
- Следует поощрять всех пациентов бороться со стрессом, чтобы справиться с обострениями симптомов, вызванных постоянным перенапряжением. Клинический принцип
Лечение второй линии
- Следует предложить соответствующие методы физиотерапии (например, маневры, которые воздействуют на триггерные точки мышц таза, живота и/или бедра, устраняют мышечные контрактуры и снимают, уменьшают болезненные рубцы и другие ограничения при разрастании соединительной ткани). Следует избегать упражнений на укрепление тазового дна, например, упражнений Кегеля (обратите внимание, что упражнения для тазового дна не рекомендуются в этом руководстве). Стандарт (степень достоверности доказательств A).
- Следует начать мультимодальные подходы к лечению боли (например, фармакологические, стресс-менеджмент, мануальная терапия, если таковая имеется). Мнение эксперта.
- Амитриптилин, циметидин, гидроксизин или пентозан полисульфат можно вводить в качестве пероральных препаратов второго ряда (перечислены в алфавитном порядке; иерархия не предполагается). Варианты (уровни доказательности B, B, C и B).
- Диметилсульфоксид ДМСО, гепарин или лидокаин можно вводить в качестве внутрипузырных препаратов второго ряда (перечислены в алфавитном порядке; иерархия не подразумевается). Вариант (уровни доказательности C, C и B).
Третья линия лечения
- Цистоскопия под анестезией с кратковременной гидродистензией под низким давлением может быть проведена, если лечение первой и второй линии не обеспечило приемлемого контроля симптомов и качества жизни или если симптомы пациента предполагают более инвазивный подход (степень достоверности доказательств C).
- При наличии поражений Ханнера следует выполнить фульгурацию (с помощью лазера или электрокоагуляции) и/или инъекцию триамцинолона. Рекомендация (степень достоверности доказательств C).
Четвертая линия лечения
- Внутридетрузорный ботулинический токсин A (BTX-A) можно вводить, если другие методы лечения не обеспечивают адекватного контроля симптомов и качества жизни или если клиницист и пациент соглашаются, что симптомы требуют такого подхода. Пациенты должны быть готовы принять возможность того, что может потребоваться периодическая самокатетеризация после лечения. Вариант (степень доказательности C).
- Может быть проведено испытание нейростимуляции и, в случае успеха, может быть проведена имплантация постоянных устройств нейростимуляции, если другие методы лечения не обеспечивают адекватного контроля симптомов и качества жизни или если клиницист и пациент соглашаются, что симптомы требуют такого подхода (степень доказательности C).
Лечение пятой линии
Циклоспорин А можно вводить перорально, если другие методы лечения неэффективны (облегчения симптомов нет) по мнению как уролога, так и пациента (степень доказательности C).
Шестая линия лечения
Серьезное хирургическое вмешательство, например, заместительная цистопластика, отведение мочи с цистэктомией или без нее, может проводиться у тщательно отобранных пациентов, у которых все другие методы лечения не смогли обеспечить адекватный контроль симптомов и качество жизни. (Сила доказательств C).
Лечение, которое по мнению Американской Ассоциации Урологов нельзя предлагать пациентам
Описанные ниже методы лечения неэффективны и/или неприемлемы:
- Не следует предлагать длительный пероральный прием антибиотиков. Стандарт (степень доказательности B).
- Внутрипузырное введение бациллы Кальметта-Герена (БЦЖ) не следует предлагать вне рамок исследовательских работ. Стандарт (степень доказательности B).
- Не следует предлагать длительное гидрорастяжение под высоким давлением. Рекомендация (Сила доказательств – C).
- Не следует предлагать системное (пероральное) длительное введение глюкокортикоидов. Рекомендация (Сила доказательств – C).
Королевский колледж акушеров и гинекологов (RCOG) совместно с рекомендациями Британского общества урогинекологов (BSUG), 2016 г.
Эти руководящие принципы рекомендуют в качестве первого шага принятие консервативных методов.
Обезболивание – это часть начального лечения с применением в качестве пероральных препаратов амитриптилина и циметидина. Чтобы оптимизировать лечение, внутрипузырное введение препаратов начинают, если, пациент не видит пользы от пероральных и консервативных лекарств. В качестве препаратов для введения в мочевой пузырь лучше всего использовать лидокаин, внутрипузырный ботулотоксин А и гепарин.
Если эта терапия не дает результатов, пациентам рекомендуют консультации и обсуждения в многопрофильной группе с участием физиотерапевтов, специалистов по лечению боли, психотерапевтов для психологической поддержки, консультирования и обсуждения.
Предлагаются дополнительные варианты лечения, такие как фульгурация поражений Хуннера, задняя большеберцовая или крестцовая нейромодуляция, циклоспорин А и цистоскопическая гидродистензия. Последнее средство – серьезные операции. Некоторые исследования показали, что увеличивающая илеоцистопластика может уменьшить боль и привести к значительному увеличению емкости мочевого пузыря.
Из-за отсутствия доказательств уровня B и уровня A для лекарств, в RCOG/BSUG гидроксизин и пентозан полисульфат не рекомендуются, в отличие от руководств AUA.
Общие соображения в лечении
Болевой синдром мочевого пузыря (СБМП) – это диагноз исключения. В настоящее время передовой практикой ведения пациентов с интерстициальным циститом / СБМП является обобщение всех международных рекомендаций, однако из-за отсутствия доказательств клиницист не всегда уверен, какое лечение выбрать.
Европейское общество по изучению BPS (ESSIC) имеет список дифференциальных диагнозов, которые следует исключить при СБМП: злокачественные новообразования, инфекции мочевыводящих путей, гиперактивный мочевой пузырь, лучевой или лекарственный цистит, непроходимость выходного отверстия мочевого пузыря, камни мочевыводящих путей, дивертикул уретры, пролапс тазовых органов, эндометриоз, ущемление полового нерва, синдром раздраженного кишечника и дивертикулярная болезнь.
Многие из них могут быть подтверждены или исключены с помощью надлежащего анамнеза, систематического обследования, анализа мочи, ультразвукового исследования почек и цистоскопии.
Пациент при ИЦ часто пропускает мочеиспускание, чтобы избежать боли. Больному рекомендуется завести дневник с подробной информацией о частоте, количестве и боли во время мочеиспускания. Это поможет указать на диагноз и помогает оценить эффективность лечения.
Продолжение статьи
- Часть 1. Интерстициальный цистит: причины, симптомы, лечение.
- Часть 2. Лечение интерстициального цистита – руководящие принципы ведущих урологических ассоциаций.





