Торшин И.Ю., Аполихина И.А., Громов А.Н., Громова О.А.
Сведения об авторах:
- Торшин И.Ю. – к.ф-м.н., к.х.н., с.н.с. Институт Фармакоинформатики, ФИЦ «Информатика и Управление» РАН, Scopus Author ID 7003300274
- Аполихина И.А. – заведующая отделением эстетической гинекологии и реабилитации, профессор кафедры акушерства, гинекологии, неонатологии, анестезиологии и реаниматологии ФГБУ «НЦ АГ и П им. В.И. Кулакова», Минздрава России, AuthorID 261593
- Громов А.Н. – в.н.с. ФИЦ ИУ РАН, AuthorID 15082
DOI: 10.29188/2222-8543-2020-12-2-164-170
ВВЕДЕНИЕ
D -Манноза – эндогенный моносахарид, участвующий в N-гликозилировании более 12 000 белков протеома. N-гликозилирование является пост-трансляционной модификацией белков, которая изменяет стабильность и активность белковых структур в соответствии с потребностями клеток. В частности, N-гликозилирование принципиально необходимо для осуществления функций иммуно-глобулинов (A, D, G, E, M) и других иммунорецепторов [1].
Название молекулы «D-манноза» происходит от древнееврейского слова «манна» ( ). Как известно, манна – та самая спасительная пища, данная израильтянам, ведомым пророком Моисеем, для облегчения их перехода через Синай в Землю Обетованную. В самом деле, D-манноза калорийна, сладковата на вкус, была идентифицирована в ясене манновом (лат. Fraxinus ornus). Выделяясь из листьев Fraxinus ornus, сок растения быстро засыхает, формируя белую мелкую крупку, которую на Ближнем Востоке называют «манной» и до сего времени [2].
D-манноза усваивается микробиотой организма и частично подвергается расщеплению в процессе гликолиза. Многие представители микробиоты человека (лактобациллы, бифидобактерии, непатогенные штаммы E.coli и др.) имеют гены, кодирующие белок XYZ-пермеазы Dманнозы, необходимой для всасывания D-маннозы внутрь бактерий для последующей переработки [3]. D-манноза является метабиотиком (пребиотиком), потенциально поддерживающим рост бифидобактерий лонгум [4].
Фракция D-маннозы, всосавшаяся в кишечнике, фосфорилируется ферментом гексокиназой с образованием D-маннозо-6-фосфата в клетках печени. D-маннозо6-фосфат, при участии фермента D-манноза-6-фосфатизомеразы (ген MPI, белок P34949 по UniProtKB), превращается в D-фруктозо-6-фосфат, расщепляющийся в процессе гликолиза. Синтез D-маннозо-6-фосфата необходим для выполнения основной биологической функции D-маннозы – N-гликозилирования белков протеома [5].
В целом, экзогенная D-манноза, поступающая из пищи, частично метаболизируется микробиотой и организмом, а непереработанная фракция экзогенной D-маннозы выводится с мочой. Последний факт весьма важен для терапии и профилактики бактериального цистита: ведь моча, насыщенная D-маннозой, таргетно снижает адгезию уропатогенных бактерий (штаммы E.coli, Klebsiella, Proteus и др.) к уротелию почечных лоханок, мочеточников, мочевого пузыря и уретры [6]. При этом, терапия D-маннозой эффективно снижает симптоматику цистита и не проявляет никаких побочных эффектов, присущих антибиотикотерапии. Поэтому D-маннозу следует использовать для лечения цистита у пациентов с аллергией на антибиотики, сахарным диабетом, гипертонией, а также у беременных с преэклампсией [7].
МАТЕРИАЛЫ И МЕТОДЫ
В настоящей работе представлены результаты вычислительного анализа 33 064 публикаций по D-маннозе, найденных в базе данных биомедицинских публикаций PUBMED по запросу «D-mannose OR mannose». Анализ данного массива публикаций выполнен с использованием современных методов анализа больших данных, развиваемых в рамках топологического и метрического подходов к задачам распознавания/классификации [8-11]. В статье представлен анализ 49 научных статей, отвечающих тематике настоящего исследования.
Результаты вычислительного анализа публикаций по D-маннозе
В ходе систематического анализа литературы были определены наиболее информативные ключевые слова, отличающие публикации по специфическим эффектам D-маннозы от публикаций в контроле [12,13]. В качестве контрольной выборки публикаций использовались 33 000 случайно выбранных статей из 556 152 найденных по запросу «glucose NOT D-mannose» в базе данных PUBMED. В результате проведенного анализа текстов были отобраны более 40 информативных ключевых слов, описывающих клинико-фармакологическую специфику D-маннозы (рис. 1).
Рис.1. Количество абстрактов по ключевым словам в публикациях по D-маннозе и в контроле
Fig. 1. The number of abstracts by keywords in publications on D-mannose and in the control
РЕЗУЛЬТАТЫ
Общие сведения о D-маннозе D-манноза имеет важное значение для осуществления N-гликозилирования белков протеома (в т.ч. белков иммунной системы: комплемента, иммуноглобулинов A, G, E, M и др.). Нарушения процессов N-гликозилирования белков стимулируют дисморфогенез нервной системы, нервнопсихическую отсталость, нарушения регуляции артериального давления, свертываемости крови и иммунодефицит. D-манноза-связывающий лектин и D-маннозный рецептор принципиально важны для поддержки сердечно-сосудистой, иммунной и других систем организма. В частности, концентрации D-манноза-зависимых белков в крови ассоциированы с показателями артериального давления [14].
Первым шагом N-гликозилирования белков протеома является перенос олигосахаридного блока «Glc3Man9GlcNAc2», содержащего 9 остатков D-маннозы, на специфические остатки аспарагина в аминокислотных последовательностях белков, транспортируемых в эндоплазматический ретикулум (рис. 2). Олигосахаридный блок переносится посредством ферментного комплекса олигосахаридтрансферазы (OST). Затем происходит т.н. «вызревание» гликопротеинов в компартменте Гольджи, заключающееся в удалении избыточных остатков глюкозы и D-маннозы и добавлении необходимых остатков N-ацетилглюкозамина, галактозы и сиаловой кислоты.
Рис. 2.Перенос олигосахаридного блока «Glc3Man9GlcNAc2» – основная реакция N-гликозилирования белков
Fig. 2. Glc3Man9GlcNAc2 oligosaccharide block transfer is the main N-glycosylation reaction of proteins
Как правило, зрелые гликопротеины человека содержат только три остатка D-маннозы, которые «защищены» остатками N-ацетилглюкозамина, галактозы и сиаловой кислоты (рис. 2). Процесс «защиты» остатков D-маннозы чрезвычайно важен для профилактики аутоиммунной патологии и поддержания антибактериального иммунитета. Действительно, «открытые», «незащищенные» остатки D-маннозы часто встречаются на поверхности гликобелков носителей бактериальных и грибковых инфекций. Поэтому, «открытые» остатки D-маннозы распознаются рецептором D-маннозы и распознаются системой врожденного иммунитета как бактериальные липополисахариды [15].
Нами найдено значительное число публикаций (2242 ссылок) по потенциальным противовирусным эффектам D-маннозы (информативные ключевые слова: вирус вакцинии, вирус парагриппа человека, коронавирус, симплекс-вирус, комплемент герпесвирус, папилломавирус, ретровирус, цитомегаловирус). Например, уровни манноза-связывающего лектина ассоциированы с прогрессированием респираторно-синцитиальной инфекции и вируса гепатита В, а уровни рецептора D-маннозы – с развитием хронической печеночной недостаточности вследствие гепатита В [16-18]. Макрофаги человека, дифференцирующиеся при достаточных уровнях витамина D3, ограничивают рост вируса лихорадки денге за счет регуляции рецептора D-маннозы [19]. Лектин водорослей с высоким содержанием D-маннозы эффективно тормозит рост вирус гриппа, а D-маннозный лектин цыплят проявляет противовирусную активность по отношению к вирусу бронхита и др [20,21]. Детальное рассмотрение противовирусных эффектов D-маннозы является темой отдельной статьи. Далее будут рассмотрены участие D-маннозы в поддержании иммунитета и в сдерживании хронического воспаления и перспективы использования D-маннозы для профилактики опухолевых заболеваний.
Участие D-маннозы в поддержании иммунитета и в снижении хронического воспаления
В экспериментах было показано, что D-манноза может ингибировать развитие аутоиммунных заболеваний и снижать уровень хронического воспаления [22]. Систематический анализ показал, что уровни D-маннозы в крови, в моче, в слизи и в других средах организма существенно влияют на прикрепление бактерий к слизистой оболочке тканей. Предотвращая адсорбцию патогенных штаммов кишечной палочки и других бактерий (шигеллы, P. aeruginosa, лейшмании, микобактерии), D-манноза способствует профилактике бактериальных заболеваний и, в т.ч., острого и хронического цистита. В поддержании антибактериального иммунитета особую роль играют упоминаемые ранее белки рецептор D-маннозы (ген CD206) и манноза-связывающий лектин (ген MBL).
Рецептор D-маннозы представляет собой С-лектин, который, в основном, присутствует на поверхности макрофагов, фибробластов и кератиноцитов [23]. Рецептор CD206 распознает «открытые» остатки D-маннозы, N-ацетилглюкозамина и фукозы на гликанах поверхности патогенных микроорганизмов. Тем самым, рецептор D-маннозы опосредует уничтожение Candida albicans и поддерживает врожденный и приобретенный иммунитет [24,25].
D-манноза-связывающий лектин (MBL) играет ключевую роль в активации комплемента – врожденного пути антибактериального иммунитета. Дефицит активности MBL ассоциирован с обострением инфекционных заболеваний. В частности, в проспективном когортном исследовании было показано, что концентрация сывороточного MBL ассоциирована с риском рецидивов заболеваний, вызванных инфекцией Clostridium difficile (n=308). Сравнение с контрольными пациентами с антибиотик-ассоциированной диареей (n=145) показало, что сниженная концентрация MBL (<50 нг/мл) соответствует повышению риска инфицирования C. difficile (ОШ 3.18, 95% ДИ 1,40-7,24, p<0,001) [26].
Избыточная активация комплемента, опосредованная D-манноза-связывающим лектином, способствует развитию и усилению тяжести протекания аутоиммунных заболеваний – рассеянного склероза (РС), синдрома Гийена-Барре (СГБ), тяжелой миастении (ТМ). В исследовании «случай-контроль» плазма была получена от здоровых контрольных лиц (n=100), а также пациентов с РС (n=120), СГБ (n=30) и ТМ (n=30). Средний уровень MBL в сыворотке крови достоверно различался между группами пациентов с РС, СГБ, ТМ и контролей (р<0,001). Установлены положительные корреляции между концентрациями MBL в сыворотке крови и тяжестью течения рассмотренных аутоиммунных патологий в соответствии с расширенной шкалой состояния инвалидности EDSS (r=+0,60 и p=<0,001), шкалой миастении QMGS (r=+ 0,56 и p=0,01) и шкалой нетрудоспособности GDS (r=+ 0,37 и p=0,04) [27].
Избыточная активация MBL различными агентами может быть предотвращена посредством D-маннозы, которая будет ингибировать MBL и, одновременно, снижать избыточную провоспалительную активность макрофагов посредством взаимодействия с рецептором D-маннозы. В частности, усиления экспрессии рецептора D-маннозы (наблюдаемое при использовании D-маннозы) снижает повреждение легочной ткани у крыс с моделью тяжелого острого панкреатита [28].
Взаимодействуя с одноименным рецептором, D-манноза стимулирует трансформацию макрофагов в т.н. «противовоспалительные макрофаги». Напомним, что макрофаги, в зависимости от клеточного фенотипа и секреции цитокинов, могут как стимулировать, так и подавлять воспаление. Трансформация фенотипа макрофагов от провоспалительного фенотипа М1 к противовоспалительному фенотипу М2 – необходимое условие лечения заболеваний, в основе которых лежит хроническое воспаление. Эта трансформация, индуцируемая при участии определенных цитокинов (в частности, ИЛ-4 и ИЛ-13), важна для регенерации тканей, поврежденных избыточным воспалением. Однако терапевтическое применение этих цитокинов in vivo не проводится вследствие высокого риска осложнений. Альтернативным подходом к изменению фенотипа макрофагов с M1 на M2 является индукция кластеризации макрофагов через D- маннозные рецепторы на поверхности клеток с использованием субстратов D-маннозы (например, в виде наночастиц, покрытых D-маннозой). В эксперименте на мышах с моделью воспалительного заболевания кишечника введение таких D-маннозных наночастиц эффективно облегчало симптомы колита без использования экзогенных цитокинов [29].
Перспективы противоопухолевых применений D-маннозы
Повышение уровней гликанов с высоким содержанием D-маннозы является общей чертой злокачественных клеток и, возможно, является одним из перспективных направлений для терапии ряда опухолей. В эксперименте D-манноза повышает естественную цитотоксичность здоровых клеток селезенки по отношению к опухолевым клеткам фибросаркомы (линия Meth-A) и карциномы предстательной железы (линия MM2) [30].
Повышенные уровни рецептора D-маннозы являются потенциальным биомаркером рака желудка. Уровень экспрессии рецептора D-маннозы в раковых клетках желудка составил 45,8%, что значительно выше, чем в окружающих тканях (20%, р=0,012). Выживаемость пациентов в подгруппе с высокой экспрессией рецепторов D-маннозы была достоверно короче, чем в подгруппе с низкой экспрессией рецепторов D-маннозы (р<0,05) [31].
Сама молекула D-маннозы является перспективным прогностическим биомаркером для пациентов с аденокарциномой пищевода. По сравнению с пациентами с низкими уровнями D-маннозы (нижняя треть концентраций D-маннозы в крови) у пациентов с более высокими уровнями D-маннозы риск рецидива заболевания снижался на 49% (ОШ 0,51; 95% ДИ 0,29-0,91; р=0,02), а риск смерти – на 56% (ОШ 0,44; 95% ДИ 0,25-0,77, р<0,01) [32].
D-манноза и ее производные избирательно накапливаются в опухолях. Например, производные D-маннозы, меченные изотопом фтора (фтор-18), могут быть использованы в качестве агентов для визуализации опухолей при проведении позитронно-эмиссионной томографии (ПЭТ). Опухолевые клетки показали значительное дозозависимое всасывание 18F-производных D-маннозы. Анализ профилей метаболитов через 10, 60 и 120 мин после инкубации с клетками гепатомы (линия AH109A) показал, что количество введенных 18F-производных D-маннозы резко уменьшалось, что указывает на его активное всасывание опухолевыми клетками. Анализ биораспределения изотопной метки 18F in vivo у крыс с перевитой внутрибрюшинной гепатомой (линия клеток AH109A) показал, что всасывание производных D-маннозы было максимально именно для опухолей [33,34].
Показано ингибирующее действие полимера D-маннозы, извлеченного из гемагглютинина Pseudomonas Aeruginosa, на инвазию и метастазирование гепатоцеллюлярной карциномы. Данный полимерный экстракт D-маннозы вызывал значительное ингибирование пролиферации клеток и остановку клеточного цикла посредством снижения уровней циклинов D1 и E, циклин-зависимых киназ CDK2 и CDK4, ядерного антигена пролиферирующих клеток (PCNA) и повышения уровней белков p21 и p27. Эти эффекты были ассоциированы с ингибированием сигнального пути пролиферации EGFR/Akt/IkB/NF-kB [35].
Избирательное накопление D-маннозы и/или ее производных в опухолевой ткани напрямую способствует противоопухолевыму действию D-маннозы. Например, 1,3,4,6-тетра-O-ацетил-2-дезокси-2- (бромацетамидо) бета-D-манноза, в концентрациях 6…9 мкМ, ингибирует включение тимидина в ДНК опухолевых клеток на 50% при лейкемии мышей (клеточная линия L1210) [36].
В эксперименте было показано, что D-манноза может увеличивать уровни регуляторных Т-клеток, тормозя рост раковых клеток [37]. D-манноза вызывает задержку роста некоторых типов опухолей in vitro, усиливая апоптоз опухолевых клеток (в т.ч. в ответ на химиотерапию). Эти эффекты были подтверждены in vivo в экспериментах на мышах после перорального приема D-маннозы. В частности, комбинация химиотерапевтических препаратов (цисплатина, доксорубицин) с D-маннозой (25 мМ) усиливает гибель опухолевых клеток посредством усиления апоптоза. Например, в экспериментах на культурах клеток остеосаркомы кости (линии Saos-2 и U2OS-e1a) D-манноза повышала эффективность цисплатины в 3,1 раза, а доксорубицина – в 2,2 раз [38].
D-манноза всасывается внутрь опухолевых клеток белком-транспортером глюкозы (GLUT) и накапливается в клетках в виде D-маннозо-6-фосфата, тем самым частично ингибируя метаболизм глюкозы и синтез гликанов. В сочетании с химиотерапией D-манноза снижает уровни антиапоптотических белков Bcl-2, что приводит к сенсибилизации опухолевых клеток к апоптозу. Восприимчивость опухолевых клеток к D-маннозе зависит от уровня фермента фосфоманноза изомеразы (PMI), т.к. низкие уровни PMI делают клетки более чувствительными к D-маннозе. Уровни фермента PMI сильно различаются у разных пациентов и разных типов опухолей, что указывает на то, что уровни PMI можно использовать в качестве биомаркера для оценки терапевтической эффективности D-маннозы [38]. Альтернативно могут разрабатываться таргетные ингибиторы PMI, которые будут способствовать повышению противоопухолевого потенциала D-маннозы.
Вопросы синергизма с инулином
Приведенные выше результаты биомедицинских исследований показывают, что D-манноза может проявлять антибактериальные, противовоспалительные и противоопухолевые свойства посредством специфических молекулярных механизмов. Эти фармакологические свойства D-маннозы усиливаются при поддержке здоровья микробиоты – совокупности бактерий-комменсалов человека, в т.ч. бифидо- и лактобактерий.
D-манноза и инулин являются синергидными метабиотиками (пребиотиками), т.е. веществами, поддерживающими рост полезной микробиоты. Ранее, был проведен хемомикробиомный анализ действия D-маннозы и D-фруктозы (структурной основы инулина) для 38 бактерий-комменсалов человека и 42 болезнетворных бактерий и грибков. Показано, что D-манноза в меньшей степени способствует росту условно-патогенных бактерий микробиома человека, чем другие метабиотики. D-манноза в большей степени, чем молекулы сравнения, может способствовать росту Bifidobacterium longum subsp. longum, продуцирующих масляную кислоту и другие короткоцепочечные жирные кислоты (КЦЖК). Положительные эффекты воздействия D-маннозы на микробиоту эффективно дополняются инулином и важны для улучшения синтеза КЦЖК, поддержки врожденного иммунитета и роста полезных штаммов E.coli [4].
В эксперименте прием Bifidobacterium longum per os тормозили развитие рака толстой кишки [39]. Bifidobacterium longum, обогащенные селеном, ингибировали рост перевитых опухолей (линии клеток гепатомы BEL7402 и H22). Кроме того, бифидобактерии усиливали эффекты противоопухолевой терапии циклофосфамидом посредством повышения уровней интерлейкина-2, стимулирования активности NK- и Т-лимфоцитов [40].
Инулин также характеризуется противоспалительными и противоопухолевыми свойствами. Было показано, что рост перевитых карцином на основе клеток цервикального рака (линия Hela) и гепатоцеллюлярной карциномы (линии клеток HepG2, 7721) тормозился инулином на 50-90% [41]. Инулин ингибировал метастазирование перевитой карциномы печени (линия клеток C3H) [42]. Фортификация мясных продуктов инулином снижала концентрацию канцерогенных нитрозосоединений, образующихся после потребления красного мяса [43]. Эффекты инулина улучшают качество жизни онкологических пациентов, повышая содержание бутирата и других КЦЖК в стуле, способствуя оздоровлению микробиты [44]. Инулин повышал эффективность терапии доксирубицином и циклофосфамидом у женщин страдающих раком молочной железы на фоне ожирения, гипертонии и хронического воспаления [45].
О клинических применениях D-маннозы для лечения цистита
У женщин в период менопаузы на фоне снижения эстрогенов развиваются урогенитальные расстройства (гиперактивный мочевой пузырь, поллакиурия, подтекание мочи, атрофический цистоуретрит и др.) [46]. Эти нарушения уродинамики создают условия для инфицирования урогенитального тракта и развития хронического бактериального цистита. При коррекции эстроген-дефицитных состояний достигается частичное улучшение урогенитальной симтоматики, но не санация урогенитального тракта [47].
Бактериальная адгезия к слизистой оболочке, опосредованная фимбриями бактерий (в частности, D-манноза-связывающими фимбриями типа 1 – ген FimH и др.), является важным условием для развития инфекций мочеполовых путей (ИМП). Если в моче присутствует повышенное количество D-маннозы, то молекулы D-маннозы, взаимодействуя c FimH и с другими адгезинами фимбрий, будут блокировать адгезию уропатогенных бактерий к мукозе уротелия. Низкие уровни D-маннозы у пациенток с ИМП делают необходимым насыщение мочи экзогенной D-маннозой для эффективной профилактики цистита [48].
В клиническом исследовании группы женщин с рецидивирующим циститом (n=308) все участницы прошли стартовую терапию острой стадии цистита ципрофлоксацином (1000 мг/сут, 1 нед). Затем, группа пациенток была рандомизирована на прием 2 г/сут D-маннозы, 50 мг/сут нитрофурантоина (одного из самых эффективных антибиотиков для терапии цистита) или плацебо в течение 6 месяцев. В течение 6-месячного периода наблюдений рецидивы цистита были зарегистрированы у 98 из 308 пациенток (32%). Частота рецидивов цистита была значительно выше в группе плацебо (60%) по сравнению с группами, получавшими нитрофурантоин (20%) или D-маннозу (15%). В целом, пациентки, принимавшие D-маннозу, характеризовались значительно более низким риском рецидивов цистита (О.Ш. 0,24, 95% ДИ 0,15…0.39, р=0,0001) [49].
Сравнительная оценка безопасности применения D-маннозы и нитрофурантоина в исследовании B. Kranjcec и соавт. показала, что пациенты, получавшие D-маннозу, характеризовались в 3 раза более низким риском побочных эффектов (ОР 0,27, р=0,0001). При этом, единственным побочным эффектом применения D-маннозы являлась легкая диарея (7,8%). В то же время, побочные эффекты при применении нитрофурантоина наблюдались у 27 % пациентов и включали диарею (10%), тошноту (5,8%), ощущение жжения влагалища (8,7%), головную боль (2.9%) и высыпания на коже (0,97%) [49].
При лечении цистита D-маннозой в сочетании с инулином одновременно происходит нормализация кишечной микробиоты, что способствует вытеснению патогенных бактерий. Например, инулин и D-манноза дозозависимо тормозят адгезию и образование биопленок бактерий Clostridium difficile, способствующих развитию диареи [50].
На российском рынке зарегистрирована биологически активная добавка (БАД) Экоцистин на основе синергидной комбинации «D-манноза+инулин». Экоцистин содержит значительные дозы D-маннозы (1500 мг) и инулина (1492,5 мг) в одном саше для приготовления раствора для питья. Этих количеств D-маннозы и инулина вполне достаточно для:
- поддержки полезной микробиоты;
- торможения абсорбции уропатогенных штаммов E.coli;
- оздоровления микробиоты;
- модуляции активности рецептора D-маннозы, D-манноза-связывающего лектина и других D-маннозазависимых белков.
Терапевтический эффект может быть достигнут употреблением одного саше Экоцистина в сутки. При лечении цистита рекомендуется принимать раствор Экоцистина на ночь, сразу после опорожнения мочевого пузыря. Такой режим приема обеспечивает повышенные концентрации D-маннозы и инулина в моче, которые воздействуют на уротелий в течение более длительного времени, чем днем. Назначение Экоцистина на ночь также будет способствовать более эффективному оздоровлению микробиоты кишечника. При лечении тяжелых форм цистита, дозировка Экоцистина может быть увеличена до 2-4 саше в сутки. БАД Экоцистин рекомендуется назначать после проведения беседы с пациентом о питании и о питьевом режиме.
ЗАКЛЮЧЕНИЕ
Приведенные в настоящей работе результаты систематического анализа 33 064 исследований указали на важность D-маннозы для гликозилирования белков, поддержки иммунной, сердечно-сосудистой, мочевыводящей и других систем организма. Нарушения обмена D-маннозы – неотъемлемый компонент патогенеза аутоиммунных заболеваний (сахарного диабета 1-го типа, болезни Крона, ревматоидного артрита и др.). Кроме этого, нарушения уровней и активности D-манноза-зависимых белков ассоциированы с повышенным риском бактериального цистита и опухолевых патологий. Бактериостатические, противовоспалительные и противоопухолевые эффекты D-маннозы усиливаются пребиотиком (метабиотиком) инулином. В сочетании с инулином D-манноза тормозит рост патогенных бактерий и, одновременно, поддерживает рост полезной микробиоты кишечника.
ЛИТЕРАТУРА
- Medus ML, Gomez GE, Zacchi LF, Couto PM, Labriola CA, Labanda MS, et al. N-glycosylation triggers a dual selection pressure in eukaryotic secretory proteins. Sci Rep 2017;7(1):8788. doi: 10.1038/s41598-017-09173-6.
- Rushforth K. Trees of Britain and Europe. (Collins Wild Guide). Harpercollins Pub Ltd; 1999. 1333p
- Postma P.W., Lengeler JW, Jacobson GR. Phosphoenolpyruvate: carbohydrate phosphotransferase systems of bacteria. Microbiol Rev 1993;57(3):543-94.
- Громова О.А., Торшин И.Ю., Галустян А.Н., Сорокин А.И., Иванова М.И. Хемомикробиомный анализ синергизма D-маннозы и D-фруктозы в сравнении с молекулами других метабиотиков. Эффективная фармакотерапия. Урология и нефрология 2020;(2): [Gromova O.A., Torshin I.Yu., Galustyan A.N., Sorokin A.I., Ivanova M.I. Chemomicrobiome analysis of the synergism of D-mannose and D-fructose compared with molecules of other metabiotics. Effektivnaya farmakoterapiya. Urologiya i nefrologiya = Effective pharmacotherapy. Urology and Nephrology 2020;(2): (In Russian)].
- Dalziel M, Crispin M, Scanlan CN, Zitzmann N, Dwek RA. Emerging principles for the therapeutic exploitation of glycosylation. Science 2014;343(6166):1235681. doi: 10.1126/science.1235681.
- Громова О.А., Торшин И.Ю., Тетруашвили Н.К. Систематический анализ исследований по D-маннозе и перспективы ее применения при рецидивирующих инфекциях мочеполовых путей у женщин репродуктивного возраста. Акушерство Гинекология Репродукция 2019;13(2):119–131. doi: 10.17749/2313-7347.2019.13.2.119-131. [Gromova O.A., Torshin I.Yu., Tetruashvili N.K. A systematic analysis of studies on D-mannose and the prospects for its use in recurrent urinary tract infections in women of reproductive age. Akusherstvo Ginekologiya Reproduktsiya. = Obstetrics Gynecology Reproduction. 2019; 13 (2): 119–131. doi: 10.17749 / 2313-7347.2019.13.2.119-131.]
- Porru D, Parmigiani A, Tinelli C, Barletta D, Choussos D, Franco C Di, et al. Oral D-mannose in recurrent urinary tract infections in women: a pilot study. J Clin Urol 2014;7(3): 208-213. doi: 10.1177/2051415813518332
- Torshin IY, Rudakov KV. Combinatorial analysis of the solvability properties of the problems of recognition and completeness of algorithmic models. part 1: factorization approach. Pattern Recognition and Image Analysis 2017;27(1):16-28.
- Torshin I.Yu., Rudakov K.V. On the theoretical basis of metric analysis of poorly formalized problems of recognition and classification. Pattern Recognition and Image Analysis 2015;25(4):577-587.
- Torshin I.Yu., Rudakov K.V. On metric spaces arising during formalization of problems of recognition and classification. part 1: properties of compactness. Pattern Recognition and Image Analysis 2016; 26(2):274-284.
- Красняк С.С. Неантибактериальная терапия и профилактика острого и рецидивирующего цистита: существующие варианты и перспективы. Экспериментальная и клиническая урология 2020;(1):136-143. DOI: 10.29188/2222-8543-2020-12-1-136-143. [Krasnyak S.S. Non-antibacterial therapy and prevention of acute and recurrent cystitis: existing options and future trends. Experimtntal and clinical urology 2020;(1):136-143 (In Russian].
- Торшин И.Ю., Гусев Е.И., Громова О.А., Калачева А.Г., Рудаков К.В. Мировой опыт изучения эффектов омега-3 полиненасыщенных жирных кислот: влияние на когнитивный потенциал и некоторые психические расстройства. Журнал неврологии и психиатрии им. C.C. Корсакова 2011;111(11): 79-86. [Torshin IYu, Gusev EI, Gromova OA, Kalacheva AG, Rudakov KV. International experience in studying effects of omega-3 polyunsaturated fatty acids: the influence on cognitive abilities and some mental disorders. Zhurnal nevrologii i psikhiatrii imeni S.S. Korsakova = S.S. Korsakov Journal of Neurology and Psychiatry 2011;111(11 Pt 1):79-86. (In Russian)].
- Громова О.А., Торшин И.Ю., Калачева А.Г., Грустливая У.Е., Керимкулова Н.В., Гришина Т.Р., Гусев Е.И. Перспективы использования стандартизированных форм омега-3 полиненасыщенных жирных кислот в неврологии. Журнал неврологии и психиатрии им. C.C. Корсакова. 2012;112(1):101-105. [Gromova OA, Torshin IIu, Kalacheva AG, Grustlivaia UE, Kerimkulova NV, Grishina TR, Gusev EI. The perspective lines of using standardized forms of omega-3 polyunsaturated fatty acids in neurology. Zhurnal nevrologii i psikhiatrii imeni S.S. Korsakova = S.S. Korsakov Journal of Neurology and Psychiatry 2012;112(1):101-5. (In Russian)]
- Kondrashova MN, Doliba NM. Polarographic observation of substrate-level phosphorylation and its stimulation by acetylcholine. FEBS Lett. 1989;243(2):153-5. doi: 10.1016/0014-5793(89)80119-x.
- Vlahopoulos S, Gritzapis AD, Perez SA, Cacoullos N, Papamichail M, Baxevanis CN. Mannose addition by yeast Pichia Pastoris on recombinant HER-2 protein inhibits recognition by the monoclonal antibody herceptin. Vaccine 2009;27(34):4704-8. doi: 10.1016/j.vaccine.2009.05.063.
- Ribeiro LZ, Tripp RA, Rossi LM, Palma PV, Yokosawa J, Mantese OC, et al. Serum mannose-binding lectin levels are linked with respiratory syncytial virus (RSV) disease. J Clin Immunol 2008;28(2):166-73. doi: 10.1007/s10875-007-9141-8.
- Chong WP, To YF, Ip WK, Yuen MF, Poon TP, Wong WH, et al. Mannose-binding lectin in chronic hepatitis B virus infection. Hepatology 2005;42(5):1037-45. doi: 10.1002/hep.20891.
- Li TP, Guan SH, Wang Q, Chen LW, Yang K, Zhang H. Soluble mannose receptor as a predictor of prognosis of hepatitis B virus-related acute-on-chronic liver failure. World J Gastroenterol 2019;25(37):5667-5675. doi: 10.3748/wjg.v25.i37.5667.
- Arboleda Alzate JF, Rodenhuis-Zybert IA, Hernández JC, Smit JM, Urcuqui-Inchima S. Human macrophages differentiated in the presence of vitamin D3 restrict dengue virus infection and innate responses by downregulating mannose receptor expression. PLoS Negl Trop Dis 2017;11(10):e0005904. doi: 10.1371/journal.pntd.0005904.
- Mu J, Hirayama M, Sato Y, Morimoto K, Hori K. A Novel high-mannose specific lectin from the green alga hHalimeda renschii exhibits a potent anti-influenza virus activity through high-affinity binding to the viral hemagglutinin. Mar Drugs 2017;15(8). pii: E255. doi: 10.3390/md15080255.
- Zhang W, Bouwman KM, van Beurden SJ, Ordonez SR, van Eijk M, Haagsman HP, et al. Chicken mannose binding lectin has antiviral activity towards infectious bronchitis virus. Virology 2017;509:252-259. doi: 10.1016/j.virol.2017.06.028.
- Ferrannini E, Bokarewa M, Brembeck P, Baboota R, Hedjazifar S, Andersson K, et al. Mannose is an insulin-regulated metabolite reflecting whole-body insulin sensitivity in man. Metabolism 2020;102:153974. doi: 10.1016/j.metabol.2019.153974.
- Lee SJ, Evers S, Roeder D, Parlow AF, Risteli J, Risteli L, et al. Mannose receptor-mediated regulation of serum glycoprotein homeostasis. Science 2002;295(5561):1898-901.
- Szolnoky G, Bata-Csörgö Z, Kenderessy AS, Kiss M, Pivarcsi A, Novák Z, et al. A mannosebindingreceptor is expressed on human keratinocytes and mediates killing of Candidaalbicans. J Invest Dermatol 2001;117(2):205-13.
- Gazi U, Martinez-Pomares L. Influence of the mannose receptor in host immuneresponses. Immunobiology 2009;214(7):554-61. doi: 10.1016/j.imbio.2008.11.004.
- Swale A, Miyajima F, Kolamunnage-Dona R, Roberts P, Little M, Beeching NJ, et al. Serum mannose-binding lectin concentration, but not genotype, is associated with Clostridium difficile infection recurrence: a prospective cohort study. Clin Infect Dis 2014;59(10):1429-36. doi: 10.1093/cid/ciu666.
- Farrokhi M, Dabirzadeh M, Dastravan N, Etemadifar M, Ghadimi K, Saadatpour Z, et al. Mannose-binding lectin mediated complement pathway in autoimmune neurological disorders. Iran J Allergy Asthma Immunol 2016;15(3):251-6.
- Zhang WF, Li ZT, Fang JJ, Wang GB, Yu Y, Liu ZQ, et al. Effect of mannose on the lung function of rats with acute pancreatitis. J Biol Regul Homeost Agents 2018;32(3):627-633.
- Gan J, Dou Y, Li Y, Wang Z, Wang L, Liu S, et al. Producing anti-inflammatory macrophages by nanoparticle-triggered clustering of mannose receptors. Biomaterials 2018;178:95-108. doi: 10.1016/j.biomaterials.2018.06.015.
- Tanino T, Egawa K. Suppression of natural cytotoxicity in tumor-bearing mice and inhibition of the suppression by D-mannose. Jpn J Exp Med 1985;55(4):155-60.
- Liu DR, Guan QL, Gao MT, Jiang L, Kang HX. Mannose receptor as a potential biomarker for gastric cancer: a pilot study. Int J Biol Markers 2017;32(3):e278-e283. doi: 10.5301/jbm.5000244. PMID: 28085174.
- Gu J, Liang D, Pierzynski JA, Zheng L, Ye Y, Zhang J, et al. D-mannose: a novel prognostic biomarker for patients with esophageal adenocarcinoma. Carcinogenesis 2017;38(2):162-167. doi: 10.1093/carcin/bgw207.
- Fukuda H, Matsuzawa T, Abe Y, Endo S, Yamada K, Kubota K, et al. Experimental study for cancer diagnosis with positron-labeled fluorinated glucose analogs: [18F]-2-fluoro-2-deoxy-D-mannose: a new tracer for cancer detection. Eur J Nucl Med 1982;7(7):294-7. doi: 10.1007/BF00253423.
- Furumoto S, Shinbo R, Iwata R, Ishikawa Y, Yanai K, Yoshioka T, et al. In vitro and in vivo characterization of 2-deoxy-2-18F-fluoro-D-mannose as a tumor-imaging agent for PET. J Nucl Med. 2013;54(8):1354-61. doi: 10.2967/jnumed.112.113571.
- Li T, Dong ZR, Guo ZY, Wang CH, Zhi XT, Zhou JW, et al. Mannose-mediated inhibitory effects of PA-MSHA on invasion and metastasis of hepatocellular carcinoma via EGFR/Akt/I?B?/NF-?B pathway. Liver Int 2015;35(4):1416-29. doi: 10.1111/liv.12644.
- Fondy TP, Emlich CA. Haloacetamido analogues of 2-amino-2-deoxy-D-mannose. Syntheses and effects on tumor-bearing mice. J Med Chem 1981;24(7):848-52. doi: 10.1021/jm00139a016.
- Ferrannini E, Bokarewa M, Brembeck P, Baboota R, Hedjazifar S, Andersson K, et al. Mannose is an insulin-regulated metabolite reflecting whole-body insulin sensitivity in man. Metabolism 2020;102:153974. doi: 10.1016/j.metabol.2019.153974.
- Gonzalez PS, O’Prey J, Cardaci S, Barthet VJA, Sakamaki JI, Beaumatin F, et al. Mannose impairs tumour growth and enhances chemotherapy. Nature 2018;563(7733):719-723. doi: 10.1038/s41586-018-0729-3.
- Singh J, Rivenson A, Tomita M, Shimamura S, Ishibashi N, Reddy BS. Bifidobacterium longum, a lactic acid-producing intestinal bacterium inhibits colon cancer and modulates the intermediate biomarkers of colon carcinogenesis. Carcinogenesis 1997;18(4):833-41. doi: 10.1093/carcin/18.4.833.
- Yin Y, Wang RR, Wang Y, Wang JJ, Xu GX. Preparation of selenium-enriched Bifidobacterium longum and its effect on tumor growth and immune function of tumor-bearing mice. Asian Pac J Cancer Prev 2014;15(8):3681-6. doi: 10.7314/apjcp.2014.15.8.3681
- Xu J, Chen D, Liu C, Wu XZ, Dong CX, Zhou J. Effect of inulin-type fructans in patients undergoing cancer treatments: A systematic review. Structural characterization and anti-tumor effects of an inulin-type fructan from Atractylodes chinensis. Int J Biol Macromol 2016;82:765-71. doi: 10.1016/j.ijbiomac.2015.10.082. PMID: 26522246.
- Taper HS, Roberfroid MB. Inhibitory effect of dietary inulin or oligofructose on the development of cancer metastases. Anticancer Res 2000;20(6B):4291-4.
- Thøgersen R, Gray N, Kuhnle G, Van Hecke T, De Smet S, Young JF, et al. Inulin-fortification of a processed meat product attenuates formation of nitroso compounds in the gut of healthy rats. Food Chem 2020;302:125339. doi: 10.1016/j.foodchem.
- Mazraeh R, Azizi-Soleiman F, Jazayeri SMHM, Noori SMA. Effect of inulin-type fructans in patients undergoing cancer treatments: A systematic review. Pak J Med Sci 2019;35(2):575-580. doi: 10.12669/pjms.35.2.701.
- Becerril-Alarcón Y, Campos-Gómez S, Valdez-Andrade JJ, Campos-Gómez KA, Reyes-Barretero DY, Benítez-Arciniega AD, et al. Inulin supplementation reduces systolic blood pressure in women with breast cancer undergoing neoadjuvant chemotherapy. Cardiovasc Ther 2019;2019:5707150. doi: 10.1155/2019/5707150.
- Аполихина И.А., Саидова А.С. Гиперактивный мочевой пузырь. Акушерство и гинекология 2019;(S3/1):15-18. [Apolikhina I.A., Saidova A.S. Overactive bladder. Akusherstvo i ginekologiya = Obstetrics and gynecology 2019;( S3 /1):15-18. (In Russian)]
- Сычева Е.Г., Аполихина И.А. Коррекция эстроген-дефицитных состояний у женщин с урогенитальными расстройствами. Акушерство и гинекология 2015;( 4): 75-79. [Sycheva E.G., Apolikhina I.A. Correction of estrogen-deficient conditions in women with urogenital disorders. Akusherstvo i ginekologiya = Obstetrics and gynecology 2015;( 4):75-79. (In Russian)]
- Громова О.А., Торшин И.Ю., Тетруашвили Н.К. Систематический анализ исследований по D-маннозе и перспективы ее применения при рецидивирующих инфекциях мочеполовых путей у женщин репродуктивного возраста. Акушерство Гинекология Репродукция 2019;13(2):119–131. doi: 10.17749/2313-7347.2019.13.2.119-131. [Gromova O.A., Torshin I.Yu., Tetruashvili N.K. A systematic analysis of studies on D-mannose and the prospects for its use in recurrent urinary tract infections in women of reproductive age. Akusherstvo Ginekologiya Reproduktsiya = Obstetrics Gynecology Reproduction 2019;13(2):119–131. doi: 10.17749 / 2313-7347.2019.13.2.119-131. (In Russian)]
- Kranjcec B, Papes D, Altarac S. D-mannose powder for prophylaxis of recurrent urinary tract infections in women: a randomized clinical trial. World J Urol 2014;32(1):79-84. doi: 10.1007/s00345-013-1091-6.
- Piotrowski M, Wultańska D, Obuch-Woszczatyński P, Pituch H. Fructooligosaccharides and mannose affect Clostridium difficile adhesion and biofilm formation in a concentration-dependent manner. Eur J Clin Microbiol Infect Dis 2019;38(10):1975-1984. doi: 10.1007/s10096-019-03635-7.
Журнал
Пероральное применение D-маннозы при рецидивирующих инфекциях мочевых путей у женщин: пилотное исследование
D Porru, A Parmigiani, C Tinelli, D Barletta, D Choussos, C Di Franco, V Bobbi, S Bassi, O Miller, B Gardella, RE Nappi, A Spinillo and B Rovereto
Оригинальная ссылка на полный текст публикации: www.moh-it.pure.elsevier.com/en/publications/oral-d-mannose-in-recurrent-urinary-tract-infections-in-women-a-p
Вводная информация: При рецидивирующих инфекциях мочевых путей (ИМП) традиционный профилактический прием антибиотиков не влияет на риск рецидива в долгосрочной перспективе. Цель исследования состояла в том, чтобы оценить эффективность D-маннозы в лечении и профилактике рецидивирующих ИМП.
Методы: В этом рандомизированном перекрестном исследовании пациентки включались в исследование, если у них наблюдались симптомы острой ИМП, а также было 3 или более рецидивов ИМП в течение предшествующих 12 месяцев. Пациентки были рандомизированы на 2 группы: одна группа использовала антибиотикотерапию с применением триметоприма / сульфаметоксазола, другая принимала D-маннозу — по 1 г 3 раза в день, каждые 8 часов в течение 2 недель и затем по 1 г 2 раза в день в течение 22 недель. Они получили другую терапию во второй фазе исследования без дальнейшей антибиотикопрофилактики. Оценивалась длительность безрецидивного периода; а также наличие боли в мочевом пузыре (VASp) и ургентности (VASu).
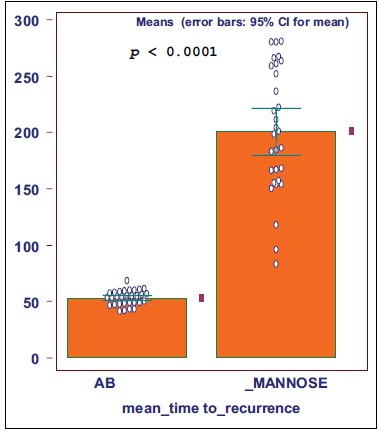
Результаты: Результаты для количественных переменных были выражены в виде среднего значения и СО, все значения были нормально распределены (по тесту Шапиро-Вилка). Всего в исследование было включено 60 пациенток в возрасте от 22 до 54 лет (в среднем 42 года). Среднее время наступления рецидива ИМП составило 52,7 дня при лечении антибиотиками и 200 дней при пероральном приеме D-маннозы (p <0,0001).
Обсуждение: Средние оценки VASp, VASu и среднее число мочеиспусканий в сутки значительно снизилась. D-манноза оказалась безопасным и эффективным средством лечения рецидивирующих ИМП у взрослых женщин. Важно отметить, что значительной части женщин, получающих антибактериальную терапию, положительной динамики достигнуть не удалось.
Введение:
Рецидивирующая ИМП (rUTI) определяется как 3 эпизода инфекции мочевыводящих путей (ИМП) с положительными бактериологическими анализами мочи за 12 месяцев или 2 эпизода — за последние 6 месяцев.1 Традиционная стратегия лечения включают долгосрочное профилактическое противомикробное лечение низкими дозами или посткоитальный прием антибиотика, но, по всей вероятности, эти стратегия не влияет на риск рецидива в долгосрочной перспективе. Пациенты с частыми ИМП, принимающие профилактические противомикробные средства в течение длительного периода времени, во время профилактики практически не болеют, но после прекращения лечения риск рецидива возвращается к исходным показателям 2,3. Долгосрочный прием антибиотиков, по-видимому, не оказывает положительного влияния на восприимчивость пациента к инфекциям.4
Клеточная стенка бактерий Escherichia coli имеет крошечные пальцевидные выступы, которые содержат на поверхности сложные молекулы, называемые лектинами. Лектины действуют как клеточный клей, который связывает бактерии со стенкой мочевого пузыря, по этой причине они не удаляются при мочеиспускании, прикрепившись к маннозосодержащим рецепторам стенки мочевого пузыря.5 D-манноза (рисунок 1) представляет собой простой сахар, структурно связанный с глюкозой; он содержится в некоторых плодах и также синтезируется в организме человека.
Рисунок 1. Химическая структура D-глюкозы и D-маннозы.
Мы предполагаем, что D-манноза в моче может связывать и выводить бактерии, такие как E. coli, конкурируя за адгезию E.coli к эпителиальным клеткам мочевого пузыря.6-8
В терапии рецидивирующих ИМП у женщин распространенной практикой является борьба с резистентностью E. coli путем изменения типа антибиотика или увеличения его дозы и продолжительности терапии. Однако, при этом бактерии приобретают все большую устойчивость к антибиотикам широкого спектра действия. Вполне вероятно, что часть старой колонии бактерий выживает в мочевом тракте; некоторые бактерии, вероятно, остаются скрытыми и активируются при благоприятных условиях, поэтому постоянные рецидивы могут и не быть истинными рецидивирующими инфекциями. 9
Целью этого рандомизированного перекрестного исследования было оценить, можно ли использовать пероральную D-маннозу в качестве безопасного и эффективного лечения ИМП, а также в качестве профилактики рецидивов ИМП у взрослых женщин.
Методы
В исследование включались женщины старше 18 лет, имевшие острую симптоматическую ИМП и 3 или более эпизодов ИМП, с подтвержденным бактериологическим анализом мочи, в течение предыдущих 12 месяцев, и которые не принимали противомикробные препараты в течение 4 недель, не были беременны или не планировали беременность. Критериями исключения были: инфекции верхних мочевых путей и/или температура выше 38°C, боль в боку или пояснице, заболевания почек, анатомические аномалии, предшествующая гинекологическая операция, прием иммунодепрессантов или иммунные заболевания (таблица 1). Все пациенты дали свое письменное согласие на проведение исследования. Работа велась в соответствии с принципами Хельсинкской декларации Всемирной медицинской ассоциации. Каждый участник, вступивший в исследование, получал на одно из следующих видов лечения в случайном порядке: (a) 5-дневная антибактериальная терапия триметопримом / сульфаметоксазолом 160 мг / 800 мг 2 раза в день, затем однократная доза перед сном в течение 1 недели каждый месяц в течение следующих 23 недель; (b) пероральный прием D-маннозы по 1 г 3 раза в день, каждые 8 часов в течение 2 недель, а затем 1 г 2раза в день в течение 22 недель. Активность D-маннозы выше при нейтральном рН мочи; поэтому пациентам было поручено измерять рН мочи с помощью тест-полосок и принимать бикарбонат натрия 250 мг или цитрат калия 1 г в качестве подщелачивающего агента при рН мочи < 7.
В каждой группе пациентов было 30 человек: первая группа сначала получала антибиотикотерапию, а вторая – D-маннозу. Точка перекреста группы А и В была на 24 неделе исследования. Затем пациенты группы А переходили в группу В и наоборот. Данные пациентов обеих групп, которые имели симптомы ИМП и возвращались к врачу, по крайней мере, один раз были включены в анализ результатов лечения и побочных эффектов.
Таблица 1. Критерии включения и исключения
|
Критерии включения |
Критерии исключения |
|
Женщина старше 18 лет |
вИМП и/или температура выше 380С |
|
Симптомы острой ИМП |
Боль в боку или пояснице |
|
Не менее 3 бактериологически подтвержденных эпизодов ИМП за последние 12 месяцев |
Заболевания почек |
|
Отсутствие антимикробныой терапии за последние 4 недели |
Анатомические аномалии |
|
Отсутствие беременности или ее планирования |
Предшествующие гинекологические операции |
|
Иммунные заболевания или прием иммунодепрессантов |
Основные критерии оценки
Бактериурия с симптомами ИМП определялась как значительная, если в моче определялось не менее 104/мл бактерий. Анализ мочи делался каждый раз при возникновении симптомов ИМП или в конце исследования. Частота мочеиспускания в течение 24 часов фиксировалась путем заполнения дневника мочеиспусканий до и в конце лечения в обеих группах. Длительность безрецидивного периода (время повторения рецидива (TTR)) оценивалась и сравнивалась между двумя группами терапии; длительность наблюдения за пациентками составила 12 месяцев.
Первичным результатом исследования была длительность безрецидивного периода ИМП, которая оценивалась и сравнивалась как после антибиотикотерапии, так и после приема D-маннозы. ИМП определяли как острую вспышку симптомов цистита + положительный посев мочи. Затем оценивались результаты по визуальной аналоговой шкале (ВАШ) боли и ургентности, зафиксированные в период эпизодов ИМП.
Статистический анализ
Результаты количественных переменных были выражены в виде среднего значения и СО, поскольку все они были нормально распределены (тест Шапиро-Вилка); t-критерий для парных данных использовался для анализа различий в безрецидивных периодах, ВАШ боли, ВАШ ургентности и количестве мочеиспусканий между терапиями. Анализ данных проводился с использованием статистического пакета STATA (выпуск 11.1, 2010, Stata Corporation, College Station, Texas, USA).
Результаты.
В общей сложности 60 пациенток в возрасте от 22 до 54 лет (в среднем 42 года), которые посетили амбулаторную поликлинику нашего урологического отделения, были включены в исследование. Значительная разница в безрецидивном периоде была обнаружена между пациентками, получавшими антибиотики, и пациентками, получавшими D-маннозу. Результаты анализов мочи пациентов, находящихся на лечении в обеих группах, показаны в таблице 2, а факторы риска для ИМП приведены в таблице 3.
Таблица 2. Результаты через 6, 12 и 24 недели во время лечения. Прием 1 г D-маннозы каждые 8 часов у 60 пациенток. Число пациенток с бактериями в моче через 0, 6, 12 и 24 недели после начала лечения.
|
Бактерии в моче |
До лечения |
Через 6 недель |
Через 12 недель |
Через 24 недели |
|
E. Coli |
40 |
28 |
20 |
10 |
|
Klebsiella pneumonia |
10 |
12 |
6 |
2 |
|
Proteus |
4 |
4 |
6 |
0 |
|
Streptococcus agalactiae |
4 |
2 |
0 |
0 |
|
Enterococcus |
2 |
0 |
0 |
0 |
|
Кол-во пациентов |
60 |
46 |
32 |
12 |
Таблица 3. Факторы риска ИМП у 60 пациентов.
|
Синдром раздраженного кишечника |
5 |
|
Запор |
26 |
|
ИМП через 24-48 часов после полового акта |
24 |
Через 1 неделю после лечения антибиотиками в моче всех пациентов бактерии отсутствовали, а среднее время повторения безрецидивного периода составило 52,7 дня (СО 11,2; 95% доверительный интервал). После терапии D-маннозой безрецидивный период составил 200 дней (СО 50,7) (Рисунок 2); разница была статистически значимой (p < 0.0001).
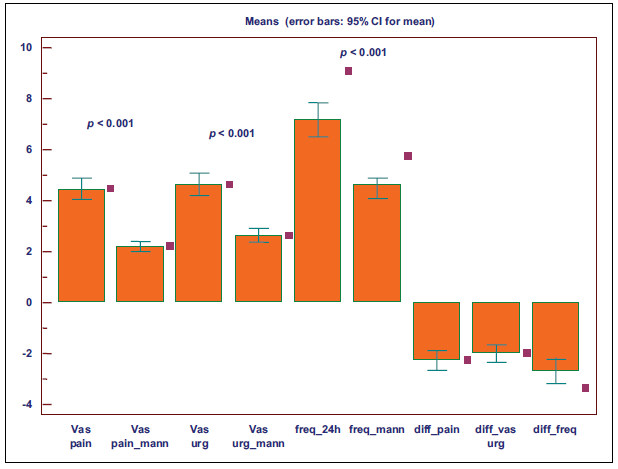
Из 60 пациенток 45 (75%) имели 1 рецидив во время 24-недельного курса лечения антибиотиками, 10 из 60 (16,6%) имели 2 рецидива, а 5 из 60 (8,3%) не имели рецидивов. 12 из 60 пациенток (20%) имели бактерии в моче во время лечения D-маннозой до завершения 24-недельного лечения, а 48 (80%) оставались без ИМП. РН мочи находился в пределах 6,5 – 7,5. Средняя оценка боли по ВАШ составляла 4,4 (СО: 1,1) до лечения D-маннозой и 2,2 (СО: 0,5) после курса терапии. Средняя оценка ургентности по ВАШ снижалась с 4,6 (СО: 1.1) до 2,6 (СО: 0.7) до и после лечения (Рисунок 2).
Рисунок 2. Время рецидива у 60 женщин-пациентов с рецидивирующими ИМП с применением антибиотиков: 52,7 дня (SD: 11,2) и при лечении D-маннозой в течение 24 недель: 200 дней (SD: 50,7).
Среднее количество мочеиспусканий составляло 7,1 (СО: 1,7) до применения D-маннозы и 4,7 (SD: 1,0) в конце лечения D-маннозой (Рисунок 3). Все различия были статистически значимыми (р <0,001).
Рисунок 3. ВАШ боли, ВАШ ургентности и 24-часовая частота мочеиспускания при лечении антибиотиками и в течение 24-недельной терапии пероральной D-маннозой. Средняя ВАШ боли от 4,4 (СО: 1,1) до 2,2 (СО: 0,5). Средний бал ургентности по ВАШ от 4,6 (СО: 1,1) до 2,6 (СО: 0,7). Среднее количество мочеиспусканий от 7,1 (СО: 1,7) до 4,7. Все различия были статистически значимыми (р <0,001).
Обсуждение
Из-за необходимости применения альтернативы антибиотикам в терапии рецидивирующей ИМП предлагаются другие схемы лечения или профилактики, такие как введение интравагинально эстриола, применение клюквенного сока per os или вагинальное введение лактобактерий. 10-12
Штаммы E. coli крепятся к в норме стерильному уротелию с использованием пилий типа 1. Было отмечено, что первоначально инвазия на поверхности клеток мочевого пузыря обеспечивает уропатогенную кишечную палочку защитой, в результате которой бактерии могут реплицироваться.14 Впоследствии бактерии, которым удается избежать быстрого удаления из мочевых путей, могут вторгаться в основной эпителий, 15 где они могут создать более стабильный бактериальный резервуар. В этом резервуаре бактерии могут оставаться в течение нескольких недель в состоянии покоя, будучи не обнаруживаемыми иммунной системой и защищёнными от антибиотиков, 16 поскольку эпителий мочевого пузыря для них (иммунитета и антибиотиков) не проницаем. Внутриклеточная уропатогенная E. coli лучше защищена от ряда антибиотиков, включая цефуроксим, гентамицин и триметоприм-сульфаметоксазол. 17-19
Химическая структура D-маннозы заставляет ее прилипать к бактериям E.coli, вероятно, даже более прочно, чем E. coli прикрепляется к клеткам человека. Мы предполагаем, что если в моче присутствует достаточное количество D-маннозы, она может связываться с бактериями и не допускать их прикрепления к слизистой мочевого пузыря.20
В нашем исследовании сравниваются два разных метода лечения для решения проблемы рецидивирующих неосложнённых ИМП у женщин, в течение 6 месяцев. Мы сравнивали результаты терапии антибиотиками и D-маннозы; наш опыт показывает, что D-манноза представляет собой хорошее решение проблемы лечения острых ИМП, а также профилактики рецидивирующих ИМП. Проведение плацебо-контролируемого перекрестного исследования представляется не возможным, поскольку острая ИМП может приводить к тяжелым клиническим симптомам, включая боль, которые могут быть устранены одним из использованных методов лечения. Нет сравнимых исследований с теми же характеристиками, что и D-манноза; при рассмотрении результатов предыдущих исследований 21-23 мы задаемся вопросом, имеют ли долгосрочная антибиотикопрофилактика реальные преимущества по сравнению с длительным приемом D-маннозы, что, возможно, поспособствует дальнейшим репрезентативным исследованиям.
В качестве контрольной группы мы использовали группу ежедневной непрерывной антибиотикопрофилактики в течение 6 месяцев, наиболее популярный метод, 21, предполагая, что антибиотик будет «стерилизовать» мочу путем устранения микроорганизмов; однако его непрерывное и продолжительное использование, вероятно, также снижает нормальную бактериальную флору влагалища и кишечника, что может провоцировать новые рецидивы ИМП у пациентов высокого риска. 24
На основе предыдущего опыта еженедельное периодическое введение триметоприма / сульфаметоксазола было выбрано для контрольной группы 25, а по некоторым данным еженедельная профилактика эффективнее ежемесячной. 26
Манноза участвует в обширной серии метаболических превращений, включается в гликопротеины и гликолипиды или преобразуется во фруктозу, которая затем включается в гликопротеины. Основным источником маннозы является глюкоза. Манноза в виде свободного сахара содержится в персиках, яблоках и апельсинах, но всасывается из желудочно-кишечного тракта крыс только около 12 % скорости всасывания глюкозы.
Наши данные показывают, что D-манноза обеспечивает как профилактический, так и терапевтический эффект, и мы считаем, что ее свойства могут быть значительно улучшены. Мы знаем, что манноза не обладает бактерицидными свойствами, и вполне возможно, что дозировка и продолжительность терапии должны подбираться индивидуально в зависимости от роста бактерий и скорости репликации в мочевом пузыре и мочевом тракте. Было описано, что большая часть поступившей маннозы связывается с бактериями, сконцентрированными в зараженной моче, и избавляет от инфекции 5. Этот механизм относится к большинству случаев рецидивов ИМП.
Очень часто рецидивы ошибочно рассматриваются как реинфекции: вероятно, что клинические результаты по d маннозе получены при ликвидации прогрессирующей бактериальной нагрузки в моче, «живыми», хотя и инактивированными, неподвижными и лишенными патогенного потенциала из-за связанной с ними маннозы. Это основная причина проведения перекрестного исследования с достаточно длительным периодом лечения D-маннозой; для повышения эффективности и получения адекватного периода без инфекции, D-маннозы требуется больше времени, чем для лечения антибиотиками. Дальнейшие исследования должны прояснить положительный эффект снижения частоты рецидивов для микроорганизмов, отличных от E. coli, таких как Klebsiella и Proteus (таблица 2), которые, как известно, не крепятся с помощью пилей к уротелию. О каких-либо серьезных побочных явлениях во время терапии, которые бы ей препятствовали, не сообщалось. Было показано, что D-манноза дозазависимо уменьшает количество бактерий у крыс. Основные микробиологические данные в экспериментах in vitro отсутствует. Однако было обнаружено, что D-манноза значительно снижает количество бактерий в течение 1 дня 23,27,28, и в модели цистита на крысах потенциал конструкции антагонистов ИМП на основе лигандов определяется структурной мимикой природных эпитопов и распространяется на блокирование бактериальной инвазии, внутриклеточного роста и способности к флюсу и рецидиву инфекции.23
Консультации
В нашем исследовании пероральный прием D-маннозы показал себя безопасным и перспективным способом для лечения острых и рецидивирующих ИМП у взрослых женщин, которые существенно осложняют их сексуальную жизнь. Это был первый опыт в клинической практике, предыдущие данные были получены в исследованиях на животных. Статистически значимая разница наблюдалась в отношении доли женщин без рецидива как во время лечения в течение 24 недель, для лечения острых эпизодов, так и в качестве безопасной профилактической терапии рецидивов ИМП, по сравнению с целенаправленной антибиотикотерапией.
Необходимы в будущем научные и клинические исследования на более широких группах населения для установления и подтверждения применения D-маннозы в качестве удобной, безопасной и эффективной терапии.
Конфликт интересов
Не объявлялся
Финансирование
Это исследование не получило специфического гранта от какого-либо финансирующего агентства в публичных, коммерческих или некоммерческих секторах.
Список литературы:
1. Albert X, Huertas I, Pereiro I, et al. Antibiotics for preventing recurrent urinary tract infection in non-pregnant women. Cochrane Database Syst Rev 2004; 3: CD001209.
2. Stamm WE, Wagner KF, Amsel R, et al. Antimicrobial prophylaxis of recurrent urinary tract infections: A doubleblind, placebo controlled trial. Ann Intern Med 1980; 92: 770–775.
3. Vosti KL. Recurrent urinary tract infections: prevention by prophylactic antibiotics after sexual intercourse. JAMA 1975; 231: 934–940.
4. Mazzulli T. Resistance trends in urinary tract pathogens and impact on management. J Urol 2002; 168: 1720–1722.
5. Ofek I and Beachey EH. Mannose binding and epithelial cell adherence of Escherichia coli. Infect Immun 1978; 22: 247–254.
6. Schaeffer AJ. Infections of the urinary tract. In: Walsh PC, Retik AB, Vaughan ED, et al. (eds). Campbell’s Urology. Downloaded from uro.sagepub.com by guest on October 13, 2015 Porru et al. 213 8th ed. Philadelphia: WB Saunders Company, 2002. pp.539–544.
7. Anderson G. Intracellular bacterial biofilm-like pods in urinary tract infections. Science 2003; 301: 105–107.
8. Alton G, Kjaergaard S, Etchison JR, et al. Oral ingestion of mannose elevates blood mannose levels: A first step toward a potential therapy for carbohydrate-deficient glycoprotein syndrome type I. Biochem Mol Med 1997; 60: 127–133.
9. Bar-Shavit Z, Goldman R, Ofek I, et al. Mannose-binding activity of Escherichia coli: A determinant of attachment and ingestion of the bacteria by macrophages. Infect Immun 1980; 29: 417–424.
10. Mohsin R and Siddiqui KM. Recurrent urinary tract infections in females. J Pak Med Assoc 2010; 60: 55–59.
11. Raz R and Stamm WE. A controlled trial of intravaginal estriol in postmenopausal women with recurrent urinary tract infections. New Engl J Med 1993; 329: 753–755.
12. Avorn J, Monane M, Gurwitz JH, et al. Reduction of bacteriuria and pyuria after ingestion of cranberry juice. JAMA 1994; 271: 751–754.
13. Reid G, Bruce AW and Taylor M. Influence of three-day antimicrobial therapy and lactobacillus vaginal suppositories on recurrence of urinary tract infections. Clin Ther 1992; 14: 11–14.
14. Mulvey MA, Lopez-Boado YS, Wilson CL, et al. Induction and evasion of host defenses by type 1-piliated uropathogenic Escherichia coli. Science 1998; 282: 1494–1497.
15. Mulvey MA, Schilling JD and Hultgren SJ. Establishment of a persistent Escherichia coli reservoir during the acute phase of a bladder infection. Infect Immun 2001; 69: 4572– 4579.
16. Mulvey MA, Schilling JD, Martinez JJ, et al. Bad bugs and beleaguered bladders: Interplay between uropathogenic Escherichia coli and innate host defenses. Proc Natl Acad Sci U S A 2000; 97: 8829–8835.
17. Kerrn MB, Struve C, Blom J, et al. Intracellular persistence of Escherichia coli in urinary bladders from mecillinam-treated mice. J Antimicrob Chemother 2005; 55: 383–386.
18. Foxman B, Gillespie B, Koopman J, et al. Risk factors for second urinary tract infection among college women. Am J Epidemiol 2000; 151: 1194–1205.
19. Bouckaert J. Receptor binding studies disclose a novel class of high-affinity inhibitors of the Escherichia coli FimH adhesin. Mol Microbiol 2005; 55: 441–455.
20. Ofek I, Goldhar J, Eshdat Y, et al. The importance of mannose specific adhesins (lectins) in infections caused by Escherichia coli. Scand J Infect Dis Suppl 1982; 33: 61–67.
21. JC Nickel. Practical management of recurrent urinary tract infections in premenopausal women. Rev Urol 2005; 7: PMC1477561.
22. Hvidberg H, Struve C, Krogfelt KA, et al. Development of a long-term ascending urinary tract infection mouse model for antibiotic treatment studies. Antimicrob Agents Chemother 2000; 44: 156–163.
23. Wellens A, Garofalo C, Nguyen H, et al. Intervening with urinary tract infections using anti-adhesives based on the crystal structure of the FimH-oligomannose-3 complex. PLoS One 2008; 3: e2040.
24. Schaeffer AJ and Stamey TA. Studies of introital colonization in women with recurrent urinary infections. IX. The role of antimicrobial therapy. J Urol 1977; 118: 221.
25. Nicolle LE. Prophylaxis recurrent urinary tract infections in women. Infection 1992; 20(Suppl 3): S203–S204.
26. Albert X, Huertas I, Pereiró II, et al. Antibiotics for preventing recurrent urinary tract infection in non-pregnant women. Cochrane Database Syst Rev 2004; 4: CD001209.
27. Michaels EK, Chmiel JS, Plotkin BJ, et al. Effect of D-mannose and D-glucose on Escherichia coli bacteriuria in rats. Urol Res 1983; 11: 97–102.
28. Sharon N. Carbohydrates as future anti-adhesion drugs for infectious diseases. Biochim Biophys Acta 2006; 1760: 527–537.

Внимание!
Указана стоимость товара, действительная только при оформлении заказа
на сайте. Цена на данный товар в розничных аптечных точках может отличаться.
Есть на складе
В аптеках:
158
аптек
Производитель:
В-МИН+ ООО
Внимание!
Указанные цены действительны только при оформлении заказа на сайте.
Состав
D-манноза 500 мг/табл., экстракт клюквы 50 мг/табл., витамин С, витамин А, антислеживающие агенты (магниевая соль стеариновой кислоты и диоксид кремния).
Пищевая ценность в суточной порции (2 таблетки в день) (средние значения): белки – 0 г жиры – 0 г, углеводы – 1 г. Энергетическая ценность: 17 кДж/4 ккал.
Фармакологические свойства
Способствует очищению и улучшению функционального состояния мочевого пузыря и может быть использована по назначению врача в комплексной терапии инфекционно-воспалительных заболеваний мочевыводящих путей и почек.
Проантоцианидины – это полифенольные соединения с очень высокими антиоксидантными свойствами, обладающие мощным воздействием на все клетки организма. Проантоцианидины из вытяжки клюквы блокируют размножение и распространение бактерий, препятствуют их закреплению на стенках мочевого пузыря, в результате патологические микроорганизмы вымываются вместе с мочой из выделительной системы.
D-манноза – изомер глюкозы, который входит в состав растительных и животных полисахаридов. Вещество является уникальным по составу и свойствам. D-манноза присутствует в мочевом пузыре и мочевыводящих путях, она продуцируется эпителиальными клетками и служит своеобразной «пищей» для бактерий. Прием D-маннозы является и приманкой, и оружием одновременно. Питательные сахара, которые необходимы бактериям для роста и размножения, находятся в свободной среде в моче. Интеграция с такими сахарами для бактерий легче, чем с молекулами на стенках мочевыводящих путей и достаточно скользкой слизистой. Таким образом D-манноза связывает бактериальную флору и выводит ее с мочой, не давая поражать органы изнутри. D-манноза может дополнять терапию антибиотиками для снижения риска разрастания грибков и неспецифический бактерий. Прием D-маннозы может быть полезен в качестве профилактики при хронических и обострившихся заболеваниях почек. D-манноза не влияет на здоровую флору и хорошо переносится, не влияет на уровень сахара, поскольку не превращается в гликоген.
Экстракт клюквы защищает стенки мочевого пузыря от воздействия бактерий, способствует предупреждению повторного развития дискомфорта мочеполовой системы, оказывает антиоксидантное действие , помогая уменьшить негативные последствия воспалительных процессов.
Витамин С улучшает функциональное состояние мочеполовых путей, способствует созданию в мочевом пузыре кислой среды, неблагоприятной для развития микроорганизмов. Обладает антиоксидантным действием.
Витамин А повышает сопротивляемость инфекциям, стимулирует клеточный и гуморальный иммунитет, требуется для функционирования слизистых оболочек мочевыводящих путей.
Показания к применению
Рекомендуется в качестве биологически активной добавки к пище – дополнительного источника витаминов А, С, источника проантоцианидинов.
Противопоказания
Индивидуальная непереносимость компонентов, беременность, кормление грудью. Перед применением рекомендуется проконсультироваться с врачом.
Способ применения и дозы
Взрослым принимать по 1 таблетке 2 раза в день во время еды. Продолжительность приема – 1 месяц. При необходимости прием можно повторить.
Условия хранения
Хранить в недоступном для детей месте, при температуре не выше 25 °С и относительной влажности воздуха не более 70%.



.png)