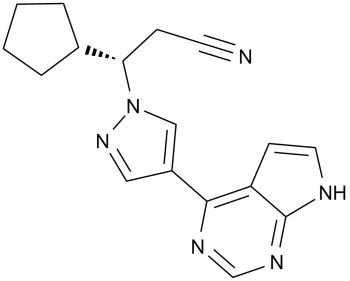
Описание препарата Джакави® (таблетки, 15 мг) основано на официальной инструкции, утверждено компанией-производителем в 2013 году
Дата согласования: 06.09.2013
Внутрь, независимо от приема пищи.
Начальная доза
Рекомендуемая начальная доза препарата Джакави составляет 15 мг 2 раза в день для пациентов с количеством тромбоцитов 100–200·109/л; и 20 мг 2 раза в день для пациентов с количеством тромбоцитов >200·109/л. Максимальная рекомендуемая начальная доза у пациентов с количеством тромбоцитов 50–100·109/л составляет 5 мг 2 раза в день внутрь, с последующей титрацией дозы, которую проводят с осторожностью.
Подбор дозы
Доза препарата Джакави подбирается на основании безопасности и эффективности проводимого лечения. Лечение должно быть приостановлено при выявлении количества тромбоцитов менее 50·109/л или снижении абсолютного числа нейтрофилов менее 0,5·109/л. После восстановления числа тромбоцитов и нейтрофилов выше указанных показателей применение Джакави может быть возобновлено в дозе 5 мг 2 раза в день, далее доза может постепенно повышаться, при этом необходим тщательный мониторинг числа форменных элементов крови.
Рекомендовано снижение дозы при уменьшении числа тромбоцитов менее 100·109/л, во избежание приостановления применения препарата вследствие развившейся тромбоцитопении.
В случае терапевтической необходимости и если количество тромбоцитов и нейтрофилов является достаточным, принимаемая доза Джакави может быть увеличена максимально на 5 мг 2 раза в день. Начальная доза не должна повышаться в течение первых 4 нед лечения и затем не чаще чем 1 раз в 2 нед.
Максимальная доза препарата Джакави составляет 25 мг 2 раза в день внутрь.
В случае пропуска приема очередной дозы препарата пациент не должен принимать дополнительную дозу и следующую дозу должен принять в обычное предписанное время.
Лечение препаратом продолжают до тех пор, пока сохраняется положительный терапевтический эффект.
Рекомендации по мониторингу
Подсчет форменных элементов крови: до начала лечения препаратом Джакави должен быть произведен подсчет форменных элементов крови.
Абсолютное число форменных элементов крови необходимо контролировать каждые 2–4 нед во время подбора дозы руксолитиниба и далее по клиническим показаниям.
Коррекция дозы при одновременном применении мощных ингибиторов CYP3A4
В случае если препарат Джакави применяется одновременно с мощными ингибиторами CYP3A4 (кларитромицин, индинавир, итраконазол, кетоконазол, лопинавир/ритонавир, нелфинавир, ритонавир, саквинавир, телитромицин, вориконазол, грейпфрутовый сок), общая суточная доза препарата Джакави должна быть снижена приблизительно на 50%, либо путем соответственного снижения дозы при приеме 2 раза в день, либо путем снижения частоты введения соответственно до 1 раза в день (в случае, когда такой режим приема возможен). Также рекомендован более частый мониторинг гематологических показателей и клинических признаков и симптомов, связанных с нежелательными реакциями на препарат Джакави.
Особые группы пациентов
Почечная недостаточность. У пациентов с тяжелой почечной недостаточностью (Cl креатинина <30 мл/мин) рекомендуемая начальная доза, основанная на числе тромбоцитов, должна быть снижена приблизительно на 50%.
Пациенты с тяжелой почечной недостаточностью, получающие препарат Джакави, должны тщательно наблюдаться, и при необходимости доза препарата должна быть снижена во избежание развития нежелательных лекарственных реакций.
Имеются ограниченные данные по применению руксолитиниба у пациентов с терминальной стадией почечной недостаточности, находящихся на гемодиализе. У данной категории больных лечение должно быть начато приемом однократной дозы 15 или 20 мг (на основании количества тромбоцитов), с последующей однократной дозой, которая назначается только после процедуры гемодиализа, и при тщательной оценке соотношения польза/риск.
Печеночная недостаточность. У пациентов с печеночной недостаточностью рекомендуемая начальная доза, основанная на числе тромбоцитов, должна быть снижена приблизительно на 50%. Пациенты с диагностированной тяжелой печеночной недостаточностью, получающие препарат Джакави, должны тщательно наблюдаться, и при необходимости доза препарата должна быть снижена во избежание развития нежелательных лекарственных реакций.
Пациенты в возрасте ≤18 лет. Безопасность и эффективность препарата Джакави у пациентов в возрасте ≤18 лет не установлена.
Пациенты в возрасте ≥65 лет. Коррекция дозы препарата не требуется.
Таблетки, 5 мг, 15 мг, 20 мг. По 60 табл. в ПЭ банках с крышкой с защитой от вскрытия детьми и защитным элементом. По 14 табл. в блистере из ПВХ/ПХТФЭ/алюминиевой фольги. 1 банка или 4 блистера в пачке картонной.
По рецепту.
При температуре не выше 25 °C.
Хранить в недоступном для детей месте.
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Джакави (Jakavi)
💊 Состав препарата Джакави
✅ Применение препарата Джакави
Описание активных компонентов препарата
Джакави
(Jakavi)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2020.05.19
Владелец регистрационного удостоверения:
Код ATX:
L01EJ01
(Руксолитиниб)
Лекарственная форма
| Джакави |
Таб. 20 мг: 56 или 60 шт. рег. №: ЛП-002028 |
Форма выпуска, упаковка и состав
препарата Джакави
Таблетки белого или почти белого цвета, продолговатые, двояковыпуклые, без фаски, с гравировкой «L20» на одной стороне и «NVR» — на другой.
Вспомогательные вещества: лактозы моногидрат — 285.8 мг, целлюлоза микрокристаллическая — 273.4 мг, карбоксиметилкрахмал натрия (тип А) — 19.2 мг, гипролоза — 12.8 мг, повидон — 12.8 мг, кремния диоксид коллоидный — 6.4 мг, магния стеарат — 3.2 мг.
14 шт. — блистеры (4) — пачки картонные.
60 шт. — банки (1) — пачки картонные.
Фармакологическое действие
Ингибитор протеинтирозинкиназы. Руксолитиниб является селективным ингибитором JAK-киназ (Janus Associated Kinases — JAKs) — JAK 1 и JAK 2. Данные киназы способствуют передаче сигналов от многочисленных цитокинов и факторов роста, играющих важную роль в гемопоэзе и функции иммунной системы.
Активированные JAK-киназы, воздействуя на цитокиновые рецепторы, активируют STAT-белки (STATs) (переносчики сигнала и активаторы транскрипции), которые в результате активации транспортируются внутрь ядра и модулируют экспрессию генов. Дисрегуляция пути JAK-STAT ассоциирована с некоторыми видами злокачественных новообразований и повышением пролиферации и выживаемости злокачественных клеток. Миелофиброз — миелопролиферативное заболевание, связанное с дисрегуляцией сигнального пути JAIC1 и JAK2. Как полагают, основой дисрегуляции является высокий циркулирующий уровень цитокинов, которые активируют путь JAK-STAT, приводя к патологическим функциональным мутациям, таким, как JAK2 V 617F, и к подавлению отрицательных регуляторных механизмов. У пациентов с миелофиброзом обнаруживается дисрегуляция JAK сигнального пути, независимо от наличия мутации JAK2V617F.
Руксолитиниб ингибирует цитокин-индуцированное фосфорилирование STAT 3 в цельной крови, как у здоровых добровольцев, так и у пациентов с миелофиброзом. Руксолитиниб приводит к максимальному ингибированию фосфорилирования STAT 3 через 2 ч после введения, которое возвращалось к исходному показателю через 8 ч у здоровых добровольцев и у пациентов с миелофиброзом, что указывает на отсутствие кумуляции как исходного вещества, так и его метаболитов.
Исходное повышение воспалительных маркеров, таких как ФНОα, ИЛ-6 и C-реактивный белок, наблюдающееся у пациентов с миелофиброзом, снижается после лечения руксолитинибом. У пациентов с миелофиброзом не отмечалось формирования резистентности к фармакодинамическим эффектам руксолитиниба.
В клиническом исследовании не отмечалось удлинения QT/QTc интервала при применении руксолитиниба однократно в супратерапевтических дозах (200 мг), что указывает на отсутствие влияния на реполяризацию сердца.
Фармакокинетика
Руксолитиниб относится к I классу молекул по биофармацевтической классификационной системе (Biopharmaceutical Classification System), с высокой проницаемостью, высокой растворимостью и быстрым распадом. В клинических исследованиях руксолитиниб быстро всасывался после перорального применения со временем достижения Cmax приблизительно 1 ч. Абсорбция руксолитиниба составляет 95% или более. Средняя Cmax и общая экспозиция (AUC) повышаются пропорционально в диапазоне доз от 5 до 200 мг. При применении руксолитиниба одновременно с пищей с высоким содержанием жира наблюдались клинически незначимые изменения фармакокинетики руксолитиниба: средняя Cmax незначительно снижалась (24%), в то время как AUC практически не изменялась (повышалась на 4%).
Кажущийся Cssmax составлял 53-65 л у пациентов с миелофиброзом. В клинически значимых концентрациях руксолитиниба связь с белками in vitro(в основном, с альбумином) составила приблизительно 97%. В исследовании на животных было показано, что руксолитиниб не проникает через ГЭБ.
Руксолитиниб является субстратом изофермента CYP3A4. После приема внутрь в крови циркулирует 60% руксолитиниба в неизмененном виде. В крови человека определены 2 основных активных метаболита руксолитиниба, представляющие 25% и 11% AUC. Фармакологическая активность руксолитиниба на 18% складывается из активности его метаболитов. В клинически значимых концентрациях руксолитиниб не ингибирует CYP1A2, CYP2B6, CYP2C8, CYP2C9, CYP2C19, CYP2D6 или CYP3A4 и не является мощным индуктором CYP1A2, CYP2B6 или CYP3A4.
После введения однократной дозы меченого радиоактивной меткой руксолитиниба пациентам большая часть (74%) радиоактивности определялась в моче (выводилось почками), и 22% выводилось через кишечник. Неизмененное вещество составило менее чем 1% общего выведенного препарата. Средний T1/2 руксолитиниба составляет приблизительно 3 ч.
Фармакокинетика руксолитиниба изменяется пропорционально вводимым (однократно, многократно) дозам препарата.
AUC метаболитов руксолитиниба повышается с увеличением тяжести почечной недостаточности достигает существенных значений у пациентов с терминальной стадией почечной недостаточности, нуждающихся в гемодиализе. Руксолитиниб не выводится посредством диализа. Для пациентов с тяжелой и терминальной стадиями почечной недостаточности (КК менее 30 мл/мин) рекомендуется коррекция дозы руксолитиниба.
Средняя AUC руксолитиниба увеличивалась у пациентов с легкой, умеренной и тяжелой печеночной недостаточностью на 87%, 28% и 65% соответственно, по сравнению с нормальной функцией печени, при этом отсутствует явная взаимосвязь со степенью печеночной недостаточности, основанной на шкале Чайлд-Пью. Конечный T1/2 увеличен у пациентов с печеночной недостаточностью по сравнению со здоровыми добровольцами (4.1-5.0 ч против 2.8 ч). У пациентов с печеночной недостаточностью рекомендуется снижение дозы руксолитиниба.
Показания активных веществ препарата
Джакави
Лечение пациентов с миелофиброзом, включая первичный миелофиброз и вторичный миелофиброз, развившимся вследствие истинной полицитемии и эссенциальной тромбоцитемии.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Принимают внутрь.
Рекомендуемая начальная доза — 15 мг 2 раза/сут для пациентов с количеством тромбоцитов 100-200×109/л; и 20 мг 2 раза/сут для пациентов с количеством тромбоцитов >200×109/л. Максимальная рекомендуемая начальная доза у пациентов с количеством тромбоцитов 50-100×109/л составляет 5 мг 2 раза/сут с последующим титрованием дозы.
Дозу руксолитиниба подбирают индивидуально с учетом безопасности и эффективности проводимого лечения.
Максимальная доза — 25 мг 2 раза/сут.
Абсолютное число форменных элементов крови необходимо контролировать каждые 2-4 недели во время подбора дозы руксолитиниба и далее по клиническим показаниям.
Пациентам с почечной недостаточностью тяжелой степени (КК менее 30 мл/мин), пациентам, находящимся на гемодиализе, пациентам с тяжелой печеночной недостаточностью, пациентам, одновременно получающим сильные ингибиторы изофермента CYP3A4 (кларитромицин, индинавир, итраконазол, кетоконазол, лопинавир/ритонавир, нелфинавир, ритонавир, саквинавир, телитромицин, вориконазол, грейпфрутовый сок) требуется коррекция режима дозирования.
Побочное действие
Инфекционные и паразитарные заболевания: очень часто — инфекции мочевыводящих путей, часто — инфекция, вызванная Herpes zoster.
Со стороны системы кроветворения: очень часто — анемия (в т.ч. 3 степени тяжести (>80-65 г/л), тромбоцитопения (1, 2 степени тяжести), нейтропения (1, 2 степени тяжести); часто — анемия 4 степени тяжести (<65 г/л), тромбоцитопения 4 (<25×109/л) и 3 (50-25×109/л) степени тяжести), нейтропения 4 (<0.5×109/л) и 3 (<1-0.5×109/л) степени тяжести.
Со стороны обмена веществ: очень часто — гиперхолестеринемия (3,4 степени), часто — повышение массы тела.
Со стороны нервной системы: очень часто — головокружение, головная боль.
Со стороны пищеварительной системы: часто — метеоризм.
Со стороны печени и желчевыводящих путей: очень часто — повышение активности АЛТ (1 степени), повышение активности ACT (1, 2 степени), часто — повышение активности АЛТ (в 5-20 раз выше нормы).
Со стороны кожи и подкожно-жировой клетчатки: очень часто — подкожные кровоизлияния.
Противопоказания к применению
Беременность, период лактации (грудного вскармливания), детский и подростковый возраст до 18 лет, повышенная чувствительность к руксолитинибу.
Применение при беременности и кормлении грудью
Противопоказано применение при беременности и в период лактации (грудного вскармливания).
Женщины детородного возраста в период лечения должны использовать надежные методы контрацепции.
В случае наступления беременности во время терапии необходимо тщательно оценить соотношение польза/риск индивидуально для каждого пациента, с учетом известных данных об эмбриотоксичности руксолитиниба.
Особые указания
С осторожностью следует применять руксолитиниб у пациентов с почечной недостаточностью тяжелой степени, у пациентов на гемодиализе, у пациентов с печеночной недостаточностью, у пациентов с тяжелыми инфекционными заболеваниями в фазе обострения, также у пациентов с тромбоцитопенией, анемией и нейтропенией, одновременно с сильными мощными ингибиторами изофермента CYP3A4.
До начала лечения руксолитинибом следует провести общий анализ крови.
У пациентов со сниженным количеством тромбоцитов (<200×109/л) в начале терапии, приблизительно в 2 раза вырастает вероятность развития тромбоцитопении во время лечения руксолитинибом. Тромбоцитопения, в целом, обратима и обычно корректируется снижением дозы или временным прекращением приема руксолитиниба. Тем не менее, в некоторых случаях, могут потребоваться трансфузии концентратов тромбоцитов.
При развитии анемии у пациентов может потребоваться также переливание эритроцитарной массы. Кроме того, необходимо оценить необходимость коррекции дозы руксолитиниба.
Нейтропения (абсолютное число нейтрофилов <0.5×109/л) в случае ее развития, в целом, обратима и корректируется временной отменой приема руксолитиниба.
Перед началом терапии руксолитинибом следует оценить наличие и риск развития тяжелых бактериальных, микобактериальных, грибковых и вирусных инфекций. Терапию не следует начинать до разрешения тяжелого активного инфекционного процесса. Врач должен вести тщательное наблюдение за пациентами, получающими терапию руксолитинибом на предмет развития симптомов инфекции, и в случае необходимости, незамедлительно начинать соответствующее лечение.
После прекращения терапии руксолитинибом симптомы миелофиброза (такие как, усталость, боль в костях, лихорадка, зуд, ночная потливость, симптоматическая спленомегалия и снижение массы тела) могут возвращаться. В клинических исследованиях общая шкала симптомов миелофиброза постепенно возвращалась к исходным показателям в течение 7 дней после прекращения применения.
Влияние на способность к управлению транспортными средствами и механизмами
Исследования влияния руксолитиниба на способность к вождению и работе с механизмами не проводились. Учитывая возможность развития некоторых побочных эффектов руксолитиниба (головокружение) пациентам следует соблюдать осторожность при управлении транспортными средствами и занятиях другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания.
Лекарственное взаимодействие
У здоровых добровольцев прием кетоконазола, мощного ингибитора изофермента CYP3A4, в дозе 200 мг 2 раза/сут в течение 4 дней, приводил к повышению AUC руксолитиниба на 91% и удлинению T1/2 с 3.7 ч до 6 ч. В случае применения руксолитиниба с мощными ингибиторами изофермента CYP3A4, общая суточная доза руксолитиниба должна быть снижена приблизительно на 50%.
Прием эритромицина, умеренного ингибитора изофермента, в дозе 500 мг 2 раза/сут у здоровых добровольцев в течение нескольких дней, приводил к повышению на 27% AUC руксолитиниба. Коррекция дозы не требуется при одновременном применении руксолитиниба с легкими или умеренными ингибиторами изофермента CYP3A4 (в т.ч. эритромицином).
У здоровых добровольцев, получавших рифампицин, мощный индуктор изофермента CYP3A4, в дозе 600 мг 1 раз/сут в течение 10 дней, AUC руксолитиниба после приема однократной дозы, снижалась на 71%, T1/2 уменьшался с 3.3 ч до 1.7 ч. Относительное количество активных метаболитов повышалось по отношению к исходному веществу.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Джакави — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-002028 -191119
Торговое наименование препарата:
Джакави®
Международное непатентованное наименование:
руксолитиниб
Лекарственная форма:
таблетки
Состав:
1 таблетка содержит:
действующее вещество — руксолитиниба фосфат 6,60/19,80/26,40 мг (соответствует руксолитинибу основанию 5/15/20 мг);
вспомогательные вещества: лактозы моногидрат — 71,45/214,35/285,80 мг, целлюлоза микрокристаллическая (РН 102) — 68,35/205,05/273,40 мг; карбоксиметилкрахмал натрия (тип А) -4,80/14,40/19,20 мг; гипролоза 3,20/9,60/12,80 мг; повидон К-30 3,20/9,60/12,80 мг; кремния диоксид коллоидный — 1,60/4,80/6,40 мг; магния стеарат 0,80/2,40/3,20 мг.
Описание:
Таблетки 5 мг:
Круглые двояковыпуклые таблетки белого или почти белого цвета без фаски. На одной стороне нанесена гравировка «L5», на другой — «NVR»
Таблетки 15 мг:
Овальные двояковыпуклые таблетки белого или почти белого цвета без фаски. На одной стороне нанесена гравировка «L15», на другой — «NVR»
Таблетки 20 мг:
Продолговатые двояковыпуклые таблетки белого или почти белого цвета без фаски. На одной стороне нанесена гравировка «L20», на другой — «NVR»
Фармакотерапевтическая группа:
противоопухолевое средство, ингибитор протеинкиназы.
Код АТХ:
L01XE18
Фармакологические свойства
Механизм действия
Руксолитиниб является селективным ингибитором JAK-киназ (Janus Associated Kinases -JAKs) JAK1 и JAK2. Данные киназы способствуют передаче сигналов от многочисленных цитокинов и факторов роста, играющих важную роль в гемопоэзе и функции иммунной системы. Активированные JAK-киназы, воздействуя на цитокиновые рецепторы, активируют STAT-белки (STATs) (переносчики сигнала и активаторы транскрипции), которые в результате активации транспортируются внутрь ядра и модулируют экспрессию генов. Дисрегуляция пути JAK-STAT ассоциирована с некоторыми видами злокачественных новообразований и увеличением пролиферации и выживаемости злокачественных клеток.
Миелофиброз и истинная полицигемия — миелопролиферативные заболевания, связанные с дисрегуляцией сигнального пути JAK1 и JAK2. Как полагают, основой дисрегуляции является высокий уровень циркулирующих цитокинов, которые активируют путь JAK-STAT, приводя к патологическим функциональным мутациям, таким, как JAK2V617F, и к подавлению отрицательных регуляторных механизмов. У пациентов с миелофиброзом обнаруживается дисрегуляция JAK сигнального пути, независимо от наличия мутации JAK2V617F. Активирующие мутации сигнального пути JAK2 (V617F или экзона 12) обнаруживаются у >95% пациентов с истинной полицитемией.
Руксолитиниб подавляет проведение сигнала JAK-STAT и клеточную пролиферацию в цитокин-зависимых онкогематологических моделях, а также в Ba/F3 цитокин-независимых клетках (за счет экспрессии мутантного JAK2V617F белка) со значением 50%-ой ингибирующей концентрации (IC50) в диапазоне 80-320 нмоль. В исследованиях у JAK2V617F-no3HTHBHbix животных онкогематологических моделей при применении руксолитиниба внутрь в дозах, не вызывавших эффектов миелосупрессии, предотвращалось развитие спленомегалии, избирательно уменьшалось количество JAK2V617Р-мутантных клеток селезенки и концентрация циркулирующих цитокинов (например, фактора некроза опухоли-альфа (ФНО-альфа) и интерлейкина-6 (ИЛ-6), что приводило к значительному увеличению продолжительности выживаемости.
Фармакодинамика
Руксолитиниб ингибирует цитокин-индуцированное фосфорилирование STAT3 в цельной крови как у здоровых добровольцев, так и у пациентов с миелофиброзом или истинной полицитемией. Максимальное ингибирование фосфорилирования STAT3 руксолитинибом достигалось через 2 часа после применения с восстановлением до исходного уровня через 8 часов у здоровых добровольцев и у пациентов с миелофиброзом, что указывает на отсутствие кумуляции как исходного вещества, так и его метаболитов.
Исходное повышение концентрации маркеров воспалительного процесса, таких как ФНО-альфа, ИЛ-6 и С-реактивного белка (СРБ), наблюдающееся у пациентов с миелофиброзом, снижается после лечения руксолитинибом. У пациентов с миелофиброзом не отмечалось формирования резистентности к фармакодинамическим эффектам руксолитиниба. Аналогично у пациентов с истинной полицитемией наблюдалось исходное повышение концентрации маркеров воспалительного процесса, снижавшейся после лечения руксолитинибом.
В клиническом исследовании не отмечалось удлинения QT/QTc интервала при применении руксолитиниба однократно в супратерапевтических дозах (200 мг), что указывает на отсутствие влияния на реполяризацию миокарда.
Фармакокинетика
Абсорбция
Руксолитиниб относится к 1 классу молекул по биофармацевтической классификационной системе (Biopharmaceutical Classification System) с высокой проницаемостью, высокой растворимостью и быстрым растворением. В клинических исследованиях руксолитиниб быстро всасывался после приема внутрь со временем достижения максимальной концентрации (Сmах) приблизительно 1 час. Всасывание руксолитиниба после его приема внутрь составляет 95% или более. Средняя Сmах и площадь под фармакокинетической кривой «концентрация-время» (AUC) повышаются пропорционально в диапазоне доз от 5 до 200 мг. При применении руксолитиниба одновременно с пищей с высоким содержанием жиров наблюдались клинически незначимые изменения фармакокинетики руксолитиниба: средняя Стах незначительно снижалась (24%), в то время как AUC практически не изменялась (повышалась на 4%).
Распределение
Средний объем распределения в равновесном состоянии составил 72 л у пациентов с миелофиброзом с межиндивидуальной вариабельностью 29,4% и 75 л у пациентов с истинной полицитемией, межиндивидуальная вариабельность у данных пациентов составила 22,6%.
В клинически значимых концентрациях связь руксолитиниба с белками in vitro (в основном с альбумином) составила приблизительно 97%. В исследовании у животных было показано, что руксолитиниб не проникает через гематоэнцефалический барьер.
Биотрансформация/метаболизм
Руксолитиниб является субстратом изофермента CYP3A4. После приема препарата внутрь в крови циркулирует 60% руксолитиниба в неизмененном виде. В крови человека определены 2 основных активных метаболита руксолитиниба, составляющих 25% и 11% AUC. Фармакологическая активность руксолитиниба на 18% складывается из активности его метаболитов. В клинически значимых концентрациях руксолитиниб не ингибирует изоферменты CYP1A2, CYP2B6, CYP2C8. CYP2C9, CYP2C19, CYP2D6 или CYP3A4 и не является мощным индуктором изоферментов CYP1А2, CYP2B6 или CYP3A4.
Выведение
После введения однократной дозы меченого радиоактивной меткой руксолитиниба большая часть (74%) радиоактивности определялась в моче (выводилось почками), и 22% выводилось через кишечник. Неизмененное вещество составило менее чем 1% общего выведенного препарата. Период полувыведения руксолитиниба составляет приблизительно 3 часа.
Линейность/нелинейность фармакокинетики
Фармакокинетика руксолитиниба изменяется пропорционально вводимым (однократно, многократно) дозам.
Фармакокинетика у отдельных групп пациентов
Влияние возраста, пола или расы
Не выявлено значительных различий в фармакокинетике руксолитиниба в зависимости от пола и расы. Клиренс руксолитиниба у пациентов с миелофиброзом составляет 17,7 л/ч у женщин и 22,1 л/ч у мужчин (межиндивидуальная вариабельность — 39%).
У пациентов с истинной полицитемией клиренс руксолитиниба составляет 12,7 л/ч (межиндивидуальная вариабельность — 42%); не выявлено влияния пола, возраста или расы на клиренс при приеме препарата внутрь.
Пациенты в возрасте <18 лет
Эффективность и безопасность препарата Джакави® у пациентов младше 18 лет не установлена.
Нарушение функции почек
AUC метаболитов руксолитиниба повышается с увеличением степени тяжести нарушения функции почек и достигает существенных значений у пациентов с терминальной стадией почечной недостаточности, нуждающихся в гемодиализе. Руксолитиниб не выводится посредством диализа. Для пациентов с тяжелой и терминальной стадиями почечной недостаточности (КК (клиренс креатинина) менее 30 мл/мин) рекомендуется коррекция дозы руксолитиниба.
Нарушение функции печени
AUC руксолитиниба повышалась у пациентов с нарушением функции печени легкой, средней и тяжелой степени соответственно на 87%, 28% и 65% по сравнению с пациентами с нормальной функцией печени, при этом отсутствует явная взаимосвязь со степенью тяжести нарушения функции печени, определяемой по шкале Чайлд-Пью. Конечный период полувыведения удлинен у пациентов с нарушением функции печени по сравнению со здоровыми добровольцами (4,1-5,0 часов и 2.8 часов соответственно). У пациентов с нарушением функции печени рекомендуется снижение дозы руксолитиниба.
Показания к применению
Миелофиброз
Лечение пациентов с миелофиброзом, включая первичный миелофиброз и вторичный миелофиброз, развившийся вследствие истинной полицитемии и эссенциальной тромбоцитемии.
Полицитемия истинная
Лечение пациентов с истинной полицитемией, резистентных к терапии препаратами гидроксимочевины или при их непереносимости.
Противопоказания
Повышенная чувствительность к руксолитинибу или любому другому компоненту препарата.
Беременность и период грудного вскармливания.
Возраст младше 18 лет.
С осторожностью
Следует соблюдать осторожность при применении препарата Джакави® у пациентов с нарушением функции почек тяжелой степени, в том числе, находящихся на гемодиализе или получающих процедуру гемодиализа, у пациентов с нарушением функции печени, у пациентов с тяжелыми инфекционными заболеваниями в стадии обострения, также у пациентов с тромбоцитопенией, анемией и нейтропенией, у пациентов с дефицитом лактазы, непереносимостью лактозы, глюкозо-галактозной мальабсорбцией.
Следует соблюдать осторожность при применении препарата Джакави® одновременно с мощными ингибиторами изофермента CYP3A4.
Применение при беременности и в период грудного вскармливания
Противопоказано применение препарата Джакави® в период беременности и грудного вскармливания.
Беременность
Пациенткам с сохраненным репродуктивным потенциалом следует использовать надежные методы контрацепции во время терапии препаратом Джакави®. В доклинических исследованиях влияния руксолитиниба на эмбрио-фетальное развитие тератогенных явлений не выявлено. Отмечены, однако, явления эмбрио- и фетотоксичности у крыс (увеличение постимплантационных потерь и уменьшение массы тела плода).
Грудное вскармливание
В доклинических исследованиях руксолитиниб и/или его метаболиты были обнаружены в молоке лактирующих животных в концентрациях, в 13 раз превышающих концентрацию в плазме крови матери. Неизвестно, выделяется ли руксолитиниб в грудное молоко у человека.
Нет данных о влиянии руксолитиниба на фертильность у человека. В исследованиях у животных не выявлено влияния на фертильность.
Способ применения и дозы
Препарат Джакави® принимают внутрь независимо от времени приема пищи.
Начальная доза
Рекомендуемая начальная доза препарата Джакави® при лечении пациентов с миелофиброзом составляет 15 мг 2 раза в день для пациентов с количеством тромбоцитов 100-200х109/л; и 20 мг 2 раза в день для пациентов с количеством тромбоцитов >200×109/л.
Максимальная рекомендуемая начальная доза у пациентов с количеством тромбоцитов 50-<100х109/л составляет 5 мг 2 раза в день внутрь, с последующей коррекцией дозы, которую проводят с осторожностью (см. Таблица 1).
Таблица 1. Рекомендуемая начальная доза препарата Джакави® при лечении пациентов с миелофиброзом
| Количество тромбоцитов | Начальная доза |
| >200×109/л | 20 мг 2 раза в день |
| 100-200х109/л | 15 мг 2 раза в день |
| 50-менее 100х109/л | 5 мг 2 раза в день |
Рекомендуемая начальная доза препарата Джакави® при лечении пациентов с истинной полицитемией составляет 10 мг 2 раза в день внутрь.
Подбор дозы
Доза препарата Джакави® корректируется на основании безопасности и эффективности проводимого лечения. Лечение пациентов с миелофиброзом должно быть приостановлено при выявлении количества тромбоцитов менее 50х109/л или при снижении абсолютного числа нейтрофилов менее 0,5х109/л.
После восстановления числа тромбоцитов и нейтрофилов выше указанных показателей, применение препарата Джакави® может быть возобновлено в дозе 5 мг 2 раза в день, возможно дальнейшее постепенное повышение дозы с тщательным контролем количества форменных элементов крови (см. Таблица 2).
Таблица 2. Миелофиброз: максимальная доза препарата Джакави® при возобновлении терапии после приостановления его применения вследствие тромбоцитопении (для пациентов с количеством тромбоцитов 100*109/л и более к начачу терапии)
| Количество тромбоцитов | Максимальная доза препарата Джакави® при возобновлении терапии |
| 125х109/л и более | 20 мг 2 раза в день |
| 100-менее 125х109/л | 15 мг 2 раза в день |
| 75-менее 100х109/л | 10 мг 2 раза в день в течение 2 недель минимум; далее при сохранении количества тромбоцитов возможно увеличение до 15 мг 2 раза в день |
| 50-менее 75×109/л | 5 мг 2 раза в день в течение 2 недель минимум; далее при сохранении количества тромбоцитов возможно увеличение до 10 мг 2 раза в день |
| менее 50×109/л | Приостановление применения |
* При возобновлении применения препарата Джакави® следует начинать с дозы как минимум на 5 мг 2 раза в день ниже таковой, применявшейся до приостановления его применения.
Рекомендовано снижение дозы препарата при уменьшении числа тромбоцитов менее 100 х 109/л во избежание приостановления терапии вследствие развившейся тромбоцитопении (см. Таблица 3).
Таблица 3. Миелофиброз: рекомендуемая доза препарата Джакави® (для пациентов с количеством тромбоцитов 100*109/л и более к началу терапии)
| Доза, применяемая до снижения количества тромбоцитов | |||||
| Количество тромбоцитов | 25 мг 2 раза в день | 20 мг 2 раза в день | 15 мг 2 раза в день | 10 мг 2 раза в день | 5 мг 2 раза в день |
| Сниженная доза | Сниженная доза | Сниженная доза | Сниженная доза | Сниженная доза | |
| 100 — менее 125х109/л | 20 мг 2 раза в день | 15 мг 2 раза в день | Без изменений | Без изменений | Без изменений |
| 75 — менее 100х109/л | 10 мг 2 раза в день | 10 мг 2 раза в день | 10 мг 2 раза в день | Без изменений | Без изменений |
| 50 — менее 75х109/л | 5 мг 2 раза в день | 5 мг 2 раза в день | 5 мг 2 раза в день | 5 мг 2 раза в день | Без изменений |
| менее 50×109/л | Приостановление применения | Приостановление применения | Приостановление применения | Приостановление применения | Приостановление применения |
Следует рассмотреть возможность снижения дозы при снижении концентрации гемоглобина в крови <120 г/л у пациентов с истинной полицитемией, при снижении концентрации гемоглобина в крови <100 г/л снижение дозы рекомендовано. Лечение должно быть приостановлено при снижении концентрации гемоглобина в крови <80 г/л у пациентов с истинной полицитемией (см. Таблица 4).
Таблица 4. Снижение дозы у пациентов с истинной полицитемией
| Концентрация гемоглобина и/или количество тромбоцитов | Рекомендуемая доза |
| Концентрация гемоглобина >120 г/л И количество тромбоцитов >100х 109/л | Коррекции дозы не требуется. |
| Концентрация гемоглобина 100 — <120 г/л И количество тромбоцитов 75 — <100х109/л | Следует рассмотреть возможность снижения дозы препарата, во избежание приостановления терапии вследствие развившейся анемии и тромбоцитопении. |
| Концентрация гемоглобина 80 — <100 г/л ИЛИ количество тромбоцитов 50 — <75х109/л | Снижение дозы на 5 мг 2 раза в день У пациентов, принимающих 5 мг 2 раза в день, рекомендовано снижение дозы до 5 мг 1 раз в день. |
| Концентрация гемоглобина <80 г/л ИЛИ количество тромбоцитов <50* 109/л | Приостановление применения. |
В случае терапевтической необходимости и если количество тромбоцитов и нейтрофилов у пациентов с миелофиброзом или концентрация гемоглобина у пациентов с истинной полицитемией являются достаточными, доза препарата Джакави® может быть увеличена максимально на 5 мг 2 раза в день, вплоть до максимальной дозы 25 мг 2 раза в день.
Не следует увеличивать начальную дозу препарата в течение первых 4 недель лечения и затем не чаще чем 1 раз в 2 недели.
Максимальная доза препарата Джакави® составляет 25 мг 2 раза в день внутрь.
В случае пропуска приема очередной дозы препарата, пациенту не следует принимать дополнительную дозу, следующую дозу необходимо принять в обычное предписанное время.
Лечение препаратом продолжают до тех пор, пока сохраняется терапевтический эффект.
Рекомендации по мониторингу
Подсчет форменных элементов крови: до начала лечения препаратом Джакави® должен быть произведен подсчет количества форменных элементов крови.
Абсолютное количество форменных элементов крови необходимо контролировать каждые 2-4 недели во время подбора дозы руксолитиниба и далее по клиническим показаниям.
Коррекция дозы при одновременном применении мощных ингибиторов изофермента CYP3A4 или флуконазола
В случае одновременного применения с мощными ингибиторами изофермента CYP3A4 (кларитромицин, индинавир, итраконазол, кетоконазол, лопинавир/ритонавир, нелфинавир, ритонавир, саквинавир, телитромицин, вориконазол, грейпфрутовый сок), или с двойными умеренными ингибиторами изоферментов CYP2C9 и CYP3A4 (например, флуконазол), суточная доза препарата Джакави® должна быть снижена приблизительно на 50%, путем снижения суточной дозы, разделенной на 2 приема, или путем соответствующего снижения частоты приема до I раза в день (в случае, когда такой режим приема возможен). Следует избегать одновременного применения препарата с флуконазолом в дозе более 200 мг в день.
Рекомендован более частый контроль гематологических показателей и клинических признаков и симптомов, связанных с нежелательными реакциями на препарат Джакави®, в начале одновременного применения мощных ингибиторов изофермента CYP3A4 или двойных умеренных ингибиторов изоферментов CYP2C9 и CYP3A4 (см. Таблица 5).
Таблица 5. Коррекция дозы при одновременном применении мощных ингибиторов изофермента CYP3A4 или двойных умеренных ингибиторов изоферментов CYP2C9 и CYP3A4
| Применение препарата Джакави® одновременно с мощными ингибиторами CYP3A4 | Рекомендуемая коррекция дозы |
| Начальная доза у пациентов с миелофиброзом и количеством тромбоцитов | |
| 100х109/л и более | 10 мг 2 раза в день |
| 50-менее 100х109/л | 5 мг 1 раз в день |
| Начальная доза у пациентов с истинной полицитемией | 5 мг 2 раза в день |
| У пациентов, принимающих препарат в дозе, установленной на основании безопасности и эффективности проводимого лечения | |
| >10 мг 2 раза в день | Снижение дозы на 50% |
| 5 мг 2 раза в день | 5 мг 1 раз в день |
| 5 мг 1 раз в день | Следует прекратить применение мощных ингибиторов CYP3A4 или препарата Джакави® на время применения мощных ингибиторов CYP3A4 |
Особые группы пациентов
Нарушение функции почек
У пациентов с миелофиброзом и нарушением функции почек тяжелой степени (КК менее 30 мл/мин) рекомендуемая начальная доза, основанная на количестве тромбоцитов, должна быть снижена приблизительно на 50%. Рекомендуемая начальная доза при лечении пациентов с истинной полицитемией и нарушением функции почек тяжелой степени составляет 5 мг 2 раза в день внутрь.
Пациентов с нарушением функции почек тяжелой степени, получающих препарат Джакави®, следует тщательно наблюдать, при необходимости доза препарата должна быть снижена во избежание развития нежелательных лекарственных реакций.
Имеются ограниченные данные по применению руксолитиниба у пациентов с терминальной стадией почечной недостаточности на гемодиализе. У данной категории пациентов с миелофиброзом лечение следует начинать с приема однократной дозы 15 мг или 20 мг (на основании количества тромбоцитов), с последующими однократными дозами, применяемыми только после каждой процедуры гемодиализа при тщательной оценке соотношения польза/риск.
У пациентов с истинной полицитемией и терминальной стадией почечной недостаточности на гемодиализе лечение следует начинать с приема однократной дозы 10 мг после процедуры гемодиализа только в день ее проведения при тщательном контроле состояния и оценке соотношения польза/риск (см. Таблица 6).
Таблица 6. Рекомендуемая доза препарата Джакави® у пациентов с нарушением функции почек
| Степень тяжести нарушения функции почек | Количество тромбоцитов | Рекомендуемая начальная доза |
| Пациенты с миелофиброзом Средняя (КК 30-59 мл/мин) или Тяжелая (КК 15-29 мл/мин) |
Более 150х109/л | Коррекции дозы не требуется |
| 100х109/л — 150×109/л | 10 мг 2 раза в день | |
| 50-менее 100х109/л | 5 мг 1 раз в день | |
| Менее 50×109/л | Приостановление применения | |
| Пациенты с истинной полицитемией: Средняя (КК 30-59 мл/мин) или Тяжелая (КК 15-29 мл/мин) |
Любое | 5 мг 2 раза в день |
Нарушение функции печени
У пациентов с нарушением функции печени рекомендуемая начальная доза, основанная на количестве тромбоцитов, должна быть снижена приблизительно на 50%. Пациентов с диагностированным нарушением функции печени тяжелой степени, получающих препарат Джакави®, следует тщательно наблюдать, при необходимости доза препарата должна быть снижена во избежание развития нежелательных лекарственных реакций (см. Таблица 7).
Таблица 7. Рекомендуемая доза препарата Джакави® у пациентов с нарушением функции печени
| Степень тяжести нарушения функции печени | Количество тромбоцитов | Рекомендуемая начальная доза |
| Пациенты с миелофиброзом: легкая, средняя или тяжелая (класс А, В или С по классификации Чайлд-Пью) |
Более 150х109/л | Коррекции дозы не требуется |
| 100х109/л- 150х109/л | 10 мг 2 раза в день | |
| 50-менее 100х109/л | 5 мг 1 раз в день | |
| Менее 50×109/л | Приостановление применения | |
| Пациенты с истинной полицитемией: легкая, средняя или тяжелая (класс А, В или С по классификации Чайлд-Пью) |
Любое | 5 мг 2 раза в день |
Пациенты в возрасте <18 лет
Безопасность n эффективность препарата Джакави® у пациентов в возрасте <18 лет не установлена.
Пациенты в возрасте >65 лет
Коррекции дозы препарата не требуется.
Побочное действие
Безопасность руксолитиниба оценена в клинических исследованиях у 982 пациентов с миелофиброзом или истинной полицитемией.
Миелофиброз
Прекращение терапии руксолитинибом вследствие развития нежелательных лекарственных реакций (HЛP), независимо от причинно-следственной связи с исследуемым препаратом, потребовалось у 11,3% пациентов.
Наиболее часто встречаемыми НЛР были тромбоцитопения и анемия. Гематологические НЛР (любой степени тяжести по СТСАЕ*) включали анемию (82,4%), тромбоцитопению (69,8%) и нейтропению (16,6%), которые носили дозозависимый характер. Гремя наиболее часто встречающимися негематологическими HЛP были: подкожная гематома (21,6%), головокружение (15,3%) и головная боль (14%).
Тремя наиболее часто встречающимися негематологическими нарушениями лабораторных показателей были: увеличение активности аланинаминотрансферазы (AJIT, 27,2%), аспартатаминотрансферазы (ACT, 19,9%) и гиперхолестеринемия (16,9%).
При оценке долгосрочных данных по безопасности препарата у пациентов с миелофиброзом, которые получали терапию руксолитинибом, кумулятивная частота нежелательных явлений (НЯ) увеличилась пропорционально увеличению периода наблюдения. В результате анализа обновленных данных, прекращение лечения в результате развития НЛР потребовалось у 27,4% пациентов.
Истинная полицитемия
Прекращение лечения вследствие развития НЛР, независимо от причинно-следственной связи с исследуемым препаратом, потребовалось у 2,2% пациентов.
Гематологические НЛР (любой степени тяжести по СТСАЕ) включали анемию (40,8%) и тромбоцитопению (16,8%). Анемия или тромбоцитопения 3 или 4 стадии зарегистрированы у 1.1% и 3,3% пациентов соответственно.
Тремя наиболее часто встречающимися негематологическими НЛР были: головокружение (9,2%), запор (8,7%) и повышение артериального давления (6,5%).
Тремя наиболее часто встречающимися негематологическими нарушениями лабораторных показателей (любой степени тяжести) были: увеличение активности ACT (26,1%) и AJ1T (22,3%), гиперхолестеринемия (20,7%). Вышеперечисленные НЛР были 1 или 2 степени тяжести, за исключением одного отмеченного случая увеличения активности АЛТ.
С увеличением продолжительности воздействия препарата кумулятивная частота некоторых НЯ увеличилась, однако новых явлений зарегистрировано не было. При корректировке относительно времени воздействия препарата, частота НЯ была в целом сопоставима с данными, полученными на начальных стадиях клинических исследований.
НЛР, отмечавшиеся при применении препарата в ходе клинических исследовании
НЛР сгруппированы в соответствии с классификацией органов и систем органов MedDRA, в пределах каждой группы перечислены в порядке уменьшения частоты встречаемости.
Для оценки частоты встречаемости использованы следующие критерии (согласно классификации Всемирной организации здравоохранения (ВОЗ)): очень часто (>>1/10); часто (>1/100, <1/10); нечасто (>1/1000, <1/100); редко (>1/10000, <1/1000); очень редко (<1/10000).
В клинических исследованиях тяжесть НЛР оценивалась согласно классификации СТСАЕ.
Миелофиброз
Инфекционные и паразитарные заболевания: очень часто — инфекции мочевыводящих путей, в частности цистит, уросепсис, пиурия, инфекции почек; часто — опоясывающий герпес, пневмония; нечасто — туберкулез.
Нарушения со стороны крови и лимфатической системы: очень часто — анемия всех степеней тяжести (в том числе 3 степени тяжести (>80 — 65 г/л), 4 степени тяжести (<65 г/л)), тромбоцитопения всех степеней тяжести, нейтропения всех степеней тяжести, кровотечения, включая желудочно-кишечное кровотечение, внутричерепное кровоизлияние, подкожное кровоизлияние, синяки, включая ушибы, экхимозы, гематомы, в том числе периорбитальная гематома, повышенная склонность с синякам, петехии, пурпура; часто — тромбоцитопения 4-й степени тяжести (<25х109/л), 3-й степени тяжести (50-25х109/л), нейтропения 4-й степени тяжести (<0,5х109/л), 3-й степени тяжести (<1 -0,5х109/л).
Нарушения со стороны обмена веществ и питания: очень часто — увеличение массы тела, гиперхолестеринемия (1,2 степени тяжести).
Нарушения со стороны нервной системы: очень часто — головокружение, вертиго, головная боль; часто — нарушение равновесия; нечасто — болезнь Меньера.
Нарушения со стороны желудочно-кишечного тракта: часто — метеоризм.
Нарушения со стороны печени и желчевыводящих путей: очень часто — повышение активности AЛT всех степеней тяжести, повышение активности ACT всех степеней тяжести; часто — повышение активности АЛТ 3-й степени (в 5-20 раз выше нормы).
При применении препарата Джакави® было получено сообщение о случае развития прогрессирующей мультифокальной лейкоэнцефалопатии (ПМЛ). При подозрении на развитие ПМЛ следует прекратить применение препарата.
После прекращения терапии препаратом Джакави® некоторые пациенты с миелофиброзом испытывали следующие НЯ: лихорадка, респираторный дистресс-синдром, артериальная гипотензия, синдром диссеминированного внутрисосудистого свертывания (ДВС-синдром) или полиорганная недостаточность.
Истинная полицитемия
Инфекционные и паразитарные заболевания: часто — назофарингит, опоясывающий герпес, инфекции мочевыводящих путей.
Нарушения со стороны крови и лимфатической системы: очень часто — анемия всех степеней тяжести, тромбоцитопения всех степеней тяжести; часто — тромбоцитопения 3-й степени тяжести (50 — 25х109/л); нечасто — анемия 3 степени тяжести (>80 — 65 г/л), 4 степени тяжести (<65 г/л), тромбоцитопения 4-й степени тяжести (<25х109/л). Нарушения со стороны обмена веществ и питания: очень часто — гиперхолестеринемия (1,2 степени тяжести), гипертриглицеридемия (1 степени тяжести); часто — увеличение массы тела.
Нарушения со стороны нервной системы: очень часто — головокружение.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: очень часто — одышка, в том числе одышка при физической нагрузке; часто — кашель, носовое кровотечение.
Нарушения со стороны желудочно-кишечного тракта: очень часто — абдоминальная боль, диарея; часто — запор, тошнота.
Нарушения со стороны печены и желчевыводящих путей: очень часто — повышение активности АЛТ всех степеней тяжести, повышение активности ACT всех степеней тяжести; нечасто — повышение активности АЛТ 3-й степени (в 5-20 раз выше нормы).
Нарушения со стороны скелетно-мышечной и соединительной ткани: очень часто -мышечные спазмы; часто — артралгия.
Нарушения со стороны сосудов: часто — повышение артериального давления.
Общие расстройства и нарушения в месте введения: очень часто — усталость; часто — астения, отек, в том числе периферические отеки.
Описание отдельных НЛР Анемия
В клиническом исследовании у пациентов с миелофиброзом медиана времени до развития первого эпизода анемии 2 степени тяжести или выше по классификации СТСАЕ составляла 1,5 месяца. Одному из пациентов потребовалось прекращение терапии по причине анемии.
У пациентов, получавших препарат Джакави®, концентрация гемоглобина достигала максимально низкого уровня (на 15-20 г/л ниже исходного показателя) на 8-12 неделе терапии, после чего постепенно повышалась и сохранялась на уровне на 10 г/л ниже исходной (до начала лечения). Данная тенденция наблюдалась независимо от того, получал ли пациент гемотрансфузии во время терапии.
В плацебо-контролируемом клиническом исследовании у 59,4% пациентов с миелофиброзом, получавших терапию руксолитинибом, потребовалось проведение гемотрансфузий, в то время как в группе плацебо гемотрансфузии потребовались у 37,1% пациентов. В клиническом исследовании с активным контролем (оптимальная доступная терапия) частота гемотрансфузий в группе руксолитиниба составила 51,4%, в группе контроля данный показатель составил 38.4%.
В клинических исследованиях анемия менее часто отмечалась у пациентов с истинной полицитемией (40,8%) по сравнению с пациентами с миелофиброзом (82,4%). У пациентов с истинной полицитемией частота случаев 3 и 4 степени тяжести по СТСАЕ составляла 1,1% по сравнению с 42,5% у пациентов с миелофиброзом.
Тромбоцитопения
В клинических исследованиях у пациентов с миелофиброзом тромбоцитопения 3 или 4 степени тяжести развивалась приблизительно к 8 неделе терапии. Тромбоцитопения как правило, была обратима при снижении дозы или временном прекращении приема препарата. Среднее время для восстановления количества тромбоцитов выше 50х109/л составляло 14 дней. В клинических исследованиях трансфузии концентрата тромбоцитов потребовалась 4,5% пациентов, получавших руксолитиниб и 5.8% пациентов из группы контроля. Прекращение терапии руксолитинибом в связи с развитием тромбоцитопении отмечено у 0,7% и 0,9% пациентов из группы контроля. У пациентов с исходно низким количеством тромбоцитов (100х109/л — 200×109/л) вероятность развития тромбоцитопении 3 и 4 степени тяжести на фоне терапии руксолитинибом была приблизительно в 2 раза выше по сравнению с пациентами с количеством тромбоцитов >200×109/л (64.2% против 35,4%).
В клинических исследованиях у пациентов с истинной полицитемией тромбоцитопения отмечалась реже (16.8%), чем у пациентов с миелофиброзом (69,8%). Тромбоцитопения 3 и 4 степени тяжести отмечалась реже у пациентов с истинной полицитемией (3,3%), чем у пациентов с миелофиброзом (11,6%).
Нейтропения
В клинических исследованиях у пациентов с миелофиброзом нейтропения 3 и 4 степени развивалась приблизительно к 12 неделе терапии. В ходе сравнительных клинических исследований пропуск дозы или снижение дозы руксолитиниба в связи с развитием нейтропении отмечено у 1% пациентов, у 0,3% пациентов терапия препаратом была прекращена. У пациентов с истинной полицитемией нейтропения была отмечена у 3 пациентов (1,6%), при этом у одного из пациентов отмечено развитие нейтропении 4 степени тяжести.
Кровотечения
Кровотечения (включая внутричерепные кровоизлияния, желудочно-кишечные кровотечения, подкожные кровоизлияния, петехии, пурпуру и другие кровотечения) были зарегистрированы у 32,6% пациентов, получавших препарат Джакави® 65,3% всех кровотечений составляли случаи развития подкожных гематом, которые отмечались у 21,3% пациентов. Частота развития кровотечений 3 и 4 степени тяжести составляла 4,7%. Случаи развития внутричерепных кровоизлияний были отмечены у 1% пациентов, желудочно-кишечных кровотечений — у 5,0% пациентов, кровотечений вследствие других причин (в том числе носовое кровотечение, послеоперационные кровотечения и гематурия)-у 13,3% пациентов, получавших препарат Джакави®.
Инфекции мочевыводящих путей
В клинических исследованиях инфекция мочевыводящих путей 3 и 4 степени тяжести зарегистрированы у 1,0% у пациентов с миелофиброзом. У 1,0% пациентов зарегистрировано развитие уросепсиса, инфекционное поражение почек — у 1 пациента. В клинических исследованиях среди пациентов с истинной полицитемией был зарегистрирован один случай (0,5%) инфекции мочевыводящих путей 3-4 степени тяжести.
Опоясывающий герпес
Частота развития опоясывающего герпеса была сравнима среди пациентов с истинной полицитемией и миелофиброзом (4,3% и 4,0% соответственно). Среди пациентов с истинной полицитемией зарегистрирован один случай развития постгерпетической невралгии 3 и 4 степени тяжести.
* — классификация степеней тяжести нежелательных явлений по классификации СТСАЕ (Common Terminology Criteria for Adverse Events, стандартные терминологические критерии оценки нежелательных явлений)
1 — легкая степень
2 — средняя степень
3 — тяжелая степень
4 — крайне тяжелая (жизнеугрожающая) степень
Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка
Симптомы: Применение руксолитиниба однократно в дозе до 200 мг переносилось удовлетворительно. Превышение рекомендуемых доз ассоциировалось с усилением миелосупрессии, что проявлялось лейкопенией, анемией и тромбоцитопенией.
Лечение: при развитии нежелательных явлений, связанных с передозировкой препарата, необходимо применить соответствующее поддерживающее лечение.
Гемодиализ неэффективен.
Антидот к руксолитинибу неизвестен.
Взаимодействие с другими лекарственными средствами
Средства, которые могут изменить концентрацию руксолитиниба в плазме крови
Мощные ингибиторы изофермента CYP3A4: у здоровых добровольцев прием кетоконазола, мощного ингибитора изофермента CYP3A4, в дозе 200 мг 2 раза в день в течение 4 дней, приводил к повышению AUC руксолитиниба на 91% и удлинению периода полувыведения с 3,7 ч до 6,0 ч.
В случае применения с мощными ингибиторами изофермента CYP3A4, общая суточная доза руксолитиниба должна быть снижена приблизительно на 50%.
Пациента следует тщательно наблюдать на предмет снижения количества форменных элементов крови, при необходимости рекомендуется дальнейшая коррекция дозы на основании данных эффективности и безопасности.
Слабые и умеренные ингибиторы изофермента CYP3A4: прием эритромицина, умеренного ингибитора изофермента CYP3A4, в дозе 500 мг 2 раза в день у здоровых добровольцев в течение 4 дней приводил к повышению на 27% AUC руксолитиниба.
Коррекция дозы не требуется при одновременном применении препарата Джакави® со слабыми или умеренными ингибиторами изофермента CYP3A4 (в т.ч. эритромицином). В начале терапии руксолитинибом одновременно с умеренными ингибиторами изофермента CYP3A4 пациента следует тщательно наблюдать с определением количества форменных элементов крови.
Двойные умеренные ингибиторы изоферментов CYP2C9 и CYP3A4: на основании результатов моделирования лекарственного взаимодействия ожидается увеличение AUC руксолитиниба в 2,9 и 4,3 раза при одновременном применении с флуконазолом в дозах 200 мг и 400 мг соответственно. Дозу препарата следует уменьшить на 50% при одновременном применении с двойными умеренными ингибиторами изоферментов CYP2C9 и CYP3A4. Следует избегать одновременного применения руксолитиниба с флуконазолом в дозе, превышающей 200 мг в день.
Индукторы изофермента CYP3A4: в начале лечения одновременно с индукторами изофермента CYP3A4 коррекция дозы не рекомендована. При уменьшении эффективности одновременного лечения препаратом Джакави® с индукторами изофермента CYP3A4 необходимо рассмотреть постепенное увеличение дозы препарата Джакави®.
У здоровых добровольцев, получавших рифампицин, мощный индуктор изофермента CYP3A4, в дозе 600 мг 1 раз в день в течение 10 дней AUC руксолитиниба после приема однократной дозы уменьшалась на 71% и период полувыведения снижался с 3,3 ч до 1,7 ч.
Относительное количество активных метаболитов повышалось по отношению к исходному веществу.
Р-гликопротеин и другие белки-переносчики: не рекомендуется коррекция дозы при применении препарата Джакави® одновременно с лекарственными средствами, взаимодействующими с Р-гликопротеином и другими белками-переносчиками.
Другие изученные лекарственные взаимодействия
Субстраты CYP3A4: исследование у здоровых добровольцев продемонстрировало отсутствие клинически значимого фармакокинетического взаимодействия руксолитиниба с мидазоламом (субстратом изофермента CYP3A4).
Пероральные контрацептивы: исследование у здоровых добровольцев продемонстрировало отсутствие влияния руксолитиниба на фармакокинетику пероральных контрацептивов, содержащих этинилэстрадиол и левоноргестрел, в связи с чем не ожидается снижения эффективности пероральных контрацептивов с данной комбинацией действующих веществ при одновременном применении с руксолитинибом.
Особые указания
Снижение количества форменных элементов крови
Лечение препаратом Джакави® может приводить к развитию гематологических нежелательных реакций, включающих тромбоцитопению, анемию и нейтропению. До начала лечения препаратом Джакави® необходимо провести общий анализ крови.
Тромбоцитопения
У пациентов с исходно низким количеством тромбоцитов (<200х109/л перед началом терапии) возрастает вероятность развития тромбоцитопении во время лечения руксолитинибом.
Тромбоцитопения в целом обратима и, как правило, корректируется снижением дозы или временным прекращением приема препарата Джакави® (см. раздел «Побочное действие»). Тем не менее, в некоторых случаях может потребоваться трансфузия концентратов тромбоцитов.
Анемия
При развитии анемии может потребоваться трансфузия эритроцитной массы. Кроме того, необходимо оценить возможность коррекции дозы или прерывания лечения препаратом Джакави® (см. раздел «Побочное действие»).
Нейтропения
В целом нейтропения (абсолютно число нейтрофилов (АЧН) <0,5х 109/л), в случае ее развития, была обратима и корректировалась временной отменой приема препарата Джакави®.
Следует контролировать показатели общеклинического анализа крови в соответствии с клинической ситуацией и корректировать дозу препарата (см. раздел «Побочное действие»).
Инфекции
У пациентов, получавших терапию препаратом Джакави®, зарегистрированы серьезные случаи бактериальных, микобактериальных, грибковых, вирусных и других оппортунистических инфекций. Перед применением препарата Джакави® следует оценить риск развития серьезных инфекций. Следует тщательно наблюдать пациента, получающего препарат Джакави®, для выявления симптомов инфекции и в случае необходимости незамедлительно начинать соответствующее лечение. Не следует начинать терапию препаратом до разрешения тяжелого активного инфекционного процесса.
У пациентов, получавших препарат Джакави® по поводу миелофиброза, сообщалось о случаях туберкулеза. Вследствие возможности развития активной формы туберкулеза перед началом терапии препаратом следует обследовать пациента для выявления активной или латентной формы туберкулеза в соответствии с местными клиническими рекомендациями.
У пациентов с хроническим вирусным гепатитом В, получающих препарат Джакави®, отмечалось увеличение титра ДНК вируса гепатита В как с, так и без сопровождающего увеличения активности ACT и АЛТ. Неизвестно влияние препарата Джакави® на репликацию ДНК вируса гепатита В. Лечение и контроль состояния пациентов с хроническим вирусным гепатитом В следует проводить в соответствии с общепринятыми стандартами клинической практики.
Опоясывающий герпес
Перед применением препарата Джакави® врачу следует обучить пациента своевременному выявлению ранних симптомов опоясывающего герпеса, сообщив о необходимости раннего начала лечения.
Прогрессирующая мультифокальная лейкоэнцефалопатия
При применении препарата Джакави® было получено сообщение о случае развития ПМЛ. Лечащему врачу следует сохранять настороженность в отношении нейропсихиатрических симптомов, позволяющих заподозрить развитие ПМЛ. При подозрении на развитие ПМЛ следует прекратить применение препарата Джакави® до исключения данного диагноза.
Злокачественные новообразования кожи за исключением меланомы
При применении препарата Джакави® сообщалось о случаях развития злокачественных новообразований кожи, за исключением меланомы, в том числе базальноклеточной и плоскоклеточной карциномы, а также карциномы из клеток Меркеля. В большинстве случаев у таких пациентов в анамнезе проводилось продолжительное лечение препаратами гидроксимочевины или ранее были выявлены злокачественные новообразования кожи, за исключением меланомы, или предраковые поражения кожи.
Причинно-следственная связь с применением руксолитиниба не была установлена. Рекомендуется проводить периодическое обследование кожных покровов у пациентов с повышенным риском развития злокачественных новообразований кожи.
Изменение липидного профиля
Отмечено увеличение концентрации липидов, включая увеличение концентрации общего холестерина, липопротеидов высокой и низкой плотности и триглицеридов, ассоциированные с лечением препаратом Джакави®. Рекомендован контроль липидного профиля и коррекция дислипидемии в соответствии с местными клиническими рекомендациями.
Синдром «отмены»
После прекращения терапии препаратом Джакави® симптомы миелофиброза (такие как усталость, боль в костях, лихорадка, зуд, ночная потливость, симптоматическая спленомегалия и снижение массы тела) могут возвращаться. В клинических исследованиях общая шкала симптомов миелофиброза постепенно возвращалась к исходным показателям в течение 7 дней после прекращения применения.
Влияние на способность управлять транспортными средствами и механизмами
Исследования влияния препарата на способность к управлению транспортными средствами и/или механизмами не проводились. Учитывая возможность развития некоторых побочных эффектов на фоне приема препарата Джакави® (головокружение), пациентам следует соблюдать осторожность при управлении транспортными средствами и занятиях другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания.
Форма выпуска
Таблетки 5 мг, 15 мг, 20 мг.
По 14 таблеток в блистер ПВХ/ПХТФЭ/Ал.
4 блистера вместе с инструкцией по применению в картонную пачку.
Условия хранения
Хранить при температуре не выше 25°С, в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности.
Условия отпуска
Отпускают по рецепту.
Производитель
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение
Новартис Фарма АГ, Лихтштрассс 35, 4056 Базель, Швейцария / Novartis Pharma AG,
Lichtstrasse 35, 4056 Basel, Switzerland
Производитель
Производство готовой лекарственной формы, первичная упаковка
Новартис Фарма Штейн АГ, Шаффхаузерштрассе, 4332 Штейн, Швейцария / Novartis Pharma Stein AG, Schaffhauserstrasse, 4332 Stein, Switzerland
Вторичная/потребительская упаковка, выпускающий контроль качества
Новартис Фарма Штейн АГ, Шаффхаузерштрассе, 4332 Штейн, Швейцария / Novartis Pharma Stein AG, Schaffhauserstrasse, 4332 Stein, Switzerland
Общество с ограниченной ответственностью «СКОПИНСКИЙ ФАРМАЦЕВТИЧЕСКИЙ ЗАВОД» (ООО «СКОПИНФАРМ»);
Россия, Рязанская обл., Скопинский район, Промышленная зона № 1 тер., зд.1.
Получить дополнительную информацию о препарате, а также направить претензии и информацию о нежелательных явлениях можно по следующему адресу в россии:
ООО «Новартис Фарма»
125315, г. Москва, Ленинградский проспект, дом 72, корпус 3
www.novartis.ru
В случае упаковки в РФ направить претензии и информацию о нежелательных явлениях можно также по следующему адресу:
ООО «СКОПИНФАРМ»
391800, Россия, Рязанская область, Скопинский район, Промышленная зона № 1 тер., зд.1.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Снижение числа форменных элементов крови
Джакави может вызвать гематологические нежелательные реакции, включая тромбоцитопению, анемию и нейтропению. Перед началом терапии необходимо выполнить развернутый общий анализ крови (указания о частоте проведения контрольных исследований представлены в разделе 4 Дозирование и способ применения).
Было отмечено, что у пациентов с низким числом тромбоцитов на момент начала терапии (<200 000/мм3) имеется большая вероятность развития тромбоцитопении в ходе самого лечения.
В большинстве случаев тромбоцитопения была обратимой и обычно купировалась путем снижения дозы или временной отмены Джакави. Тем не менее, по клиническим показаниям может возникнуть необходимость переливания тромбоцитарной массы (см. раздел 4 Дозирование и способ применения, и раздел 7 Нежелательные реакции).
Пациентам, у которых развилась анемия, может потребоваться проведение переливания крови. Также, для пациентов, у которых развилась анемия, можно рассмотреть возможность изменения дозы препарата или перерыва в лечении.
Пациенты с уровнем гемоглобина ниже 100 г/л в начале лечения имеют более высокий риск снижения уровня гемоглобина ниже 80 г/л в ходе лечения по сравнению с пациентами с более высоким исходным уровнем гемоглобина (79,3% по сравнению с 30,1%). Для пациентов с исходным уровнем ниже 100 г/л рекомендуется более частый контроль гематологических параметров и клинических проявлений нежелательных реакций, связанных с применением препарата Джакави.
Нейтропения (абсолютное число нейтрофилов (АЧН) <500/мм3) в целом имела обратимый характер и купировалась при временном прекращении применения Джакави (см. раздел 4 Дозирование и способ применения, и раздел 7 Нежелательные реакции).
При наличии клинических показаний необходимо контролировать результаты развернутого анализа крови и, при необходимости, корректировать дозу препарата (см. раздел 4 Дозирование и способ применения, и раздел 7 Нежелательные реакции).
Инфекции
Серьезные бактериальные, микобактериальные, грибковые, вирусные и другие оппортунистические инфекции имели место у пациентов, принимавших Джакави. У пациентов необходимо оценивать риск развития серьезных инфекций. Врачи должны тщательно наблюдать за пациентами, принимающими Джакави, и выявлять симптоматику инфекций, по поводу которых необходимо незамедлительно начинать соответствующее лечение. Имеются сообщения о туберкулезе у пациентов, принимавших Джакави по поводу миелофиброза. Перед началом лечения, пациенты должны быть обследованы на наличие активного или неактивного («латентного») туберкулеза в соответствии с местными рекомендациями.
У пациентов с хронической инфекцией вирусом гепатита В (ВГВ), принимавших Джакави, сообщалось об увеличении вирусной нагрузки (титра ДНК ВГВ), что в ряде случаев сопровождалось увеличением АЛТ и ACT. Влияние Джакави на репликацию вируса у пациентов с хронической инфекцией ВГВ неизвестно. Таких пациентов следует лечить и наблюдать согласно клиническим рекомендациям.
Опоясывающий герпес
Врачи должны рассказать пациентам о ранних симптомах развития опоясывающего герпеса, при котором необходимо как можно ранее обратиться за лечебной помощью.
Прогрессивная мультифокальная лейкоэнцефалопатия
Имеются сообщения о прогрессивной мультифокальной лейкоэнцефалопатии (ПМЛ) при лечении руксолитинибом. Необходима настороженность врачей в отношении нейропсихиатрических симптомов, которые могут указывать на ПМЛ. Если подозревается ПМЛ, дальнейшее дозирование должно быть прекращено до тех пор, пока ПМЛ не будет исключен.
Немеланомный рак кожи
Имеются сообщения о развитии немеланомного рака кожи (НМРК), включая базальноклеточный рак, плоскоклеточный рак и карциному Меркеля, у пациентов, принимавших Джакави. У большинства этих пациентов в анамнезе было продолжительное лечение гидроксимочевиной и наличие предшествующего НМРК или предраковых поражений кожи. Не было установлено причинно-следственной связи с руксолитинибом. У пациентов в группе повышенного риска развития рака кожи рекомендуется периодическое обследование кожных покровов.
Липидные аномалии/ Элевации
Лечение Джакави было связано с увеличением параметров липидов, включая общий холестерин, липопротеиды высокой плотности (ЛПВП), липопротеиды низкой плотности (LDL) холестерина и триглицеридов. Рекомендуется мониторинг липидов и лечение дислипидемии в соответствии с клиническими рекомендациями.
Особые группы пациентов
Нарушение функции почек
Для лечения пациентов с тяжелым нарушением функции почек начальная доза Джакави должна быть уменьшена. У пациентов с терминальной стадией почечной недостаточности, находящихся на диализе, начальная доза при лечении МФ (миелофиброза) должна рассчитываться в зависимости от числа тромбоцитов, а при лечении ИП (истинной полицитемии) начальная доза составляет 10 мг в один прием. Последующие дозы следует принимать только в дни гемодиализа после каждого сеанса диализа. Дальнейшие корректировки доз должны основываться на данных о безопасности и эффективности препарата (см. раздел 4 Дозирование и способ применения, и раздел 11 Клиническая фармакология, особые группы пациентов).
Нарушение функции печени
Для лечения пациентов с нарушением функции печени начальная доза Джакави должна быть уменьшена. Дальнейшие корректировки доз должны основываться на данных о безопасности и эффективности препарата (см. раздел 4 Дозирование и способ применения, и раздел 11 Клиническая фармакология, особые группы пациентов).
Взаимодействия
Если Джакави необходимо назначить совместно с сильными ингибиторами CYP3A4 или с препаратами, ингибирующими одновременно ферменты CYP2C9 и CYP3A4 (напр., флуконазол), дозу Джакави необходимо снизить примерно на 50% (информация о частоте контрольных исследований представлена в разделе 4 Дозирование и способ применения и разделе 8 Взаимодействия).
Эффекты отмены препарата
После перерыва в приеме Джакави или отмены препарата симптомы миелофиброза могут возобновиться в течение примерно одной недели. Среди пациентов, прервавших прием препарата Джакави, наблюдались случаи развития более тяжелых проявлений, особенно при наличии острых сопутствующих заболеваний. Не установлено, способствует ли резкое прекращение приема препарата Джакави развитию этих явлений. Кроме случаев, когда необходимо резкое прекращение применения препарата, следует рассмотреть возможность постепенного снижения дозы Джакави, хотя польза постепенного снижения дозы не доказана.
Вспомогательные вещества
Джакави содержит лактозу. Пациентам с такими редкими наследственными заболеваниями, как непереносимость галактозы, дефицит лактазы или мальабсорбция глюкозо-галактозы, не следует принимать это лекарственное средство.
Нежелательные реакции
Резюме профиля безопасности
Профиль безопасности Джакави оценивался у 855 пациентов с миелофиброзом или истинной полицитемией в исследованиях 2 и 3 фазы.
Миелофиброз
При первичном анализе рандомизированного периода двух базовых исследований COMFORT-I и COMFORT-II медиана длительности применения Джакави составила 10,8 месяцев (варьировала от 0,3 до 23,5 месяцев). Большинство пациентов (68,4%) получало лечение в течение не менее 9 месяцев. У 111 пациентов из 301 (36,9%) исходное число тромбоцитов находилось в пределах от 100 000/мм3 до 200 000/мм3, и у 190 пациентов (63,1%) исходное число тромбоцитов составляло >200 000/мм3.
В этих клинических исследованиях прекращение приема из-занежелательных реакций, независимо от наличия причинно-следственной связи, наблюдалось у 11,3% пациентов. Наиболее часто сообщаемыми нежелательными лекарственными реакциями были тромбоцитопения и анемия.
Гематологические нежелательные реакции (любой степени по классификации СТСАЕ) включали анемию (82,4%), тромбоцитопению (69,8%) и нейтропению (16,6 %).
Анемия, тромбоцитопения и нейтропении являются эффектами, зависящими от величины дозы.
Тремя наиболее частыми негематологическими нежелательными реакциями были образование кровоподтеков (21,6%), головокружение (15,3%) и головная боль (14,0%).
Тремя наиболее частыми негематологическими нарушениями в лабораторных анализах были повышение уровня АЛТ (27,2%), повышение ACT (18,6%) и гиперхолестеринемия (16,9%).
Безопасность при длительном применении
Долгосрочные данные по безопасности от двух ключевых исследований фазы 3, оценивающих 457 пациентов с миелофиброзом, принимающих руксолитиниб, включая данные пациентов, первоначально рандомизированы в ruxolitinib (n = 301; облучение от 0,3 до 68,1 месяцев, медиана воздействие 33,4 месяцев) и у пациентов, принимавших руксолитиниб, после пересечения сверх от процедур контроля (n = 156; экспозиции: от 0,5 до 59,8 месяцев, медиана воздействия 25,0 месяцев): совокупная частота нежелательных реакций увеличивается пропорционально увеличению последующего времени. С помощью этих обновленных данных, наблюдалась отмена терапии из-за неблагоприятных событий в 27,4% пациентов, принимавших руксолитиниб.
Истинная полицитемия
Безопасность Джакави оценивалась у 110 пациентов с ИП в открытом рандомизированном контролируемом исследовании 3 фазы RESPONSE. Приведенные ниже нежелательные реакции отражают начальный период исследования (до 32 недели) с эквивалентной экспозицией руксолитиниба и наилучшей доступной терапии, соответствующей медианной продолжительности экспозиции Джакави 7,8 мес. Средний возраст пациентов, принимавших Джакави, составил около 60 лет.
Из-за нежелательных явлений вне зависимости от причинно-следственной связи лечение прекратили 3,6% пациентов на Джакави и 1,8% пациентов на наилучшей доступной терапии.
Гематологические нежелательные реакции (любой степени по СТСАЕ) включали анемию (43,6%) и тромбоцитопению (24,5%). Анемия и тромбоцитопения 3 и 4 степени сообщалась у 1,8% и 5,4%. Три наиболее частые негематологические нежелательные реакции включали головокружение (15,5%), запор (8,2%) и опоясывающий герпес (6,4%).
Три наиболее частые негематологические нарушения лабораторных показателей (любой степени по СТСАЕ) включали гиперхолистеринемию (30,0%), увеличение АЛТ (22,7%) и увеличение ACT (20,9%). За исключением одного повышения АЛТ 3 степени, все они были 1-2 степени.
Безопасность при длительном применении
Медиана продолжительности экспозиции у пациентов составила 25,6 месяцев (0,3-43,5 месяцев). При более длительной экспозиции кумулятивная частота нежелательных явлений возрастала, однако новых данных по безопасности выявлено не было. С поправкой на экспозицию частота нежелательных явлений в целом была сопоставима с таковой в начальном периоде исследования.
Сводная таблица нежелательных лекарственных реакций, наблюдаемых в клинических исследованиях
Нежелательные лекарственные реакции (НЛР), наблюдаемые в клинических исследованиях (Таблица 7-1), перечислены в соответствии с системно-органными классами MedDRA. В рамках каждого системно-органного класса НЛР распределены в зависимости от частоты их возникновения, начиная с самых частых. Кроме того, соответствующая категория частоты для каждой НЛР определяется следующим образом (CIOMS III): очень частые (≥ 1/10); частые (≥ 1/100, <1/10); нечастые (≥ 1/1 000, <1/100); редкие (≥ 1/10 000, <1/1 000); очень редкие (<1/10 000).
В программе клинических исследований тяжесть НЛР оценивали на основании Общих критериев терминологии для обозначения нежелательных явлений (Common Terminology Criteria for Adverse Events, СТСАЕ), согласно которым 1 степень – легкая степень тяжести, 2 степень – умеренная степень тяжести, 3 степень – тяжелая реакция, 4 степень – угрожающая жизни или инвалидизирующая реакция.
Таблица 7-1 Частота нежелательных реакций в клинических исследованиях1
| Нежелательные лекарственные реакции и тяжесть по СТСАЕ | Категория частоты у пациентов с МФ | Категория частоты у пациентов с ИП |
| Инфекционные и паразитарные заболевания | ||
| Инфекции мочевыводящих путей1 | Очень частые | Частые |
| Пневмония | Часто | — |
| Опоясывающий герпес1 | Частые | Частые |
| Туберкулез* | Нечастые | — |
| Нарушения со стороны крови и лимфатической системы | ||
| Анемия2 | ||
| СТСАЕ3 4 степени (<6,5 г/дл) | Очень частые | Нечастые |
| СТСАЕ 3 степени(<8,0 — 6,5 г/дл) | Очень частые | Нечастые |
| Любая степень СТСАЕ | Очень частые | Очень частые |
| Тромбоцитопения2 | ||
| СТСАЕ 4 степени(<25 000/мм3) | Частые | Нечастые |
| СТСАЕ 3 степени (50 000 -25 000/мм3) | Частые | Частые |
| Любая степень СТСАЕ | Очень частые | Очень частые |
| Нейтропения2 | ||
| СТСАЕ 4 степени(<500/мм3) | Частые | — |
| СТСАЕ 3 степени (<1000 — 500/мм3) | Частые | — |
| Любая степень СТСАЕ | Очень частые | — |
| Нарушения со стороны обмена веществ и питания | ||
| Увеличение массы тела1 | Очень частые | Частые |
| Гиперхолестеринемия2СТСАЕ 1 и 2 степени | Очень частые | Очень частые |
| Гипертриглицеридемия2СТСАЕ 1 степени | — | Очень частые |
| Нарушения со стороны нервной системы | ||
| Г оловокружение1 | Очень частые | Очень частые |
| Головная боль1 | Очень частые | — |
| Нарушения со стороны желудочно-кишечного тракта | ||
| Метеоризм1 | Частые | — |
| Запор1 | — | Частые |
| Нарушения со стороны печени и желчевыводящих путей | ||
| Повышенный уровень аланинаминотрансферазы (АЛТ)2 | ||
| СТСАЕ 3 степени(> 5х – 20хВГН) | Частые | Нечастые |
| Любая степень СТСАЕ | Очень частые | Очень частые |
| Повышенный уровень аспартатаминотрансферазы (ACT)2 | ||
| Любая степень СТСАЕ | Очень частые | Очень частые |
| Нарушения со стороны кожи и подкожных тканей | ||
| Возникновение кровоподтеков1 | Очень частые | — |
| Сосудистые нарушения | ||
| Гипертензия1| | — | Частые |
| 1Частота устанавливается по имеющимся данным о явлениях.2Частота устанавливается по лабораторным показателям.3Общие критерии терминологии для обозначения нежелательных явлений (СТСАЕ), версия 3.0;1 степень = легкая, 2 степень = умеренная, 3 степень = тяжелая,4 степень = угрожающая жизни или инвалидизирующая.ВГН — верхний предел диапазона нормальных значений (верхняя граница нормы).* Частота среди всех пациентов, принимавших руксолитиниб в клинических испытаниях (N=4755). |
После отмены препарата у пациентов могли возобновляться симптомы миелофиброза, такие как утомляемость, боль в костях, лихорадка, зуд, ночная потливость, симптоматическая спленомегалия и снижение массы тела. В клинических исследованиях суммарный балл выраженности симптомов миелофиброза постепенно восстанавливался до исходных значений в течение 7 суток после отмены препарата.
Описание отдельных нежелательных реакций
Анемия
В клинических исследованиях 3 фазы при МФ медиана времени до развития первых признаков анемии 2 степени тяжести по СТСАЕ и выше составляло 1,5 месяца. Один пациент (0,3%) прекратил терапию по причине возникшей анемии.
Среди пациентов, получающих Джакави, средние показатели снижения гемоглобина достигали минимальных значений, которые были на 15-20 г/л ниже исходного значения по прошествии 8-12 недель терапии, а затем постепенно восстанавливались, достигая новое равновесное значение, которое было примерно на 10 г/л меньшим, чем исходное значение. Такая динамика наблюдалась среди пациентов независимо от того, выполнялась им трансфузия во время терапии или нет.
В рандомизированном плацебо-контролируемом исследовании (COMFORT-I) 59,4% пациентов, получавших Джакави, и 37,1% пациентов, получавшим плацебо, была выполнена трансфузия эритроцитов в периоде рандомизированного лечения. В исследовании COMFORT-II частота переливаний эритроцитарной массы составила 51,4% среди пациентов, получавших Джакави, и 38,4% среди пациентов, получавших наилучшую доступную терапию. На протяжении периода рандомизации в ключевых исследованиях анемия встречалась реже у пациентов с ИП (43,6%) по сравнению с пациентами с МФ (82.4%). Нежелательные реакции 3 и 4 степени по СТСАЕ сообщались у 1,8% пациентов с ИП, а при МФ частота составила 42,5%.
Тромбоцитопения
В клинических исследованиях 3 фазы среди пациентов с МФ, у которых развилась тромбоцитопения 3 или 4 степени тяжести, медиана времени до развития этого явления составила примерно 8 недель. Тромбоцитопения в целом имела обратимый характер, при условии снижения дозы препарата или прерывания его применения. Медиана времени до восстановления числа тромбоцитов более 50 000/мм3 составила 14 суток. В течение рандомизированного периода переливание тромбоцитов проводилось у 4,5% пациентов, получавших Джакави, и у 5,8% пациентов, получавших контрольные режимы терапии. Прекращение лечения по причине тромбоцитопении наблюдалось у 0,7% пациентов, получавших Джакави, и у 0,9% пациентов, получавших контрольные режимы. Среди пациентов с числом тромбоцитов в пределах от 100 000/мм3 до 200 000/мм3 до начала приема Джакави наблюдалась более высокая частота тромбоцитопении 3 или 4 степени тяжести по сравнению с пациентами с числом тромбоцитов >200 000/мм3 (64,2% в сравнении с 35,4%).
На протяжении периода рандомизации в ключевых исследованиях тромбоцитопения встречалась реже у пациентов с ИП (24,5%) по сравнению с пациентами с МФ (69.8%). Тяжелые нежелательные реакции (3 и 4 степени по СТСАЕ) были реже у пациентов с ИП (5,5%) по сравнению с пациентами с МФ (11,6%).
Нейтропения
В клинических исследованиях 3 фазы среди пациентов с МФ, у которых развилась нейтропения 3 или 4 степени тяжести, медиана времени до развития этого явления составила примерно 12 недель. В течение рандомизированного периода исследований временная отмена препарата или снижение его дозы по причине нейтропении наблюдалась у 1,3% пациентов, при этом 0,3% пациентов прекратили терапию по причине нейтропении.
На протяжении периода рандомизации в ключевом исследовании у пациентов с ИП нейтропения наблюдалась у 2 пациентов (1,8%), в т. ч. у одного – 4 степени по СТСАЕ.
Кровотечение
В основных клинических испытаниях 3 фазы при МФ кровотечения (включая внутричерепные кровоизлияния, желудочно-кишечные кровотечения, подкожные кровоизлияния и другие проявления кровоточивости) были зарегистрированы у 32,6% пациентов, получавших препарат Джакави, и у 23,2% пациентов, получавших сравнительное лечение (плацебо либо наилучшую доступную терапию). Частота развития кровотечений 3 и 4 степени тяжести была сходной у пациентов, получавших Джакави и сравнительное лечение (соответственно 4,7% и 3,1%). У большинства пациентов с явлениями кровоточивости отмечены случаи развития подкожных гематом (65,3%). Появление гематом зарегистрировано чаще у пациентов, получавших Джакави, чем у получавших сравнительное лечение (21,3% и 11,6%). Случаи развития внутричерепных кровоизлияний были отмечены у 1% пациентов, получавших Джакави, и у 0,9% получавших сравнительное лечение. Желудочно-кишечные кровотечения встречались у 5,0% пациентов, получавших Джакави, в сравнении с 3,1% у получавших сравнительное лечение. Кровотечения вследствие других причин (в том числе носовое кровотечение, послеоперационное кровотечение и гематурия) зарегистрированы у 13,3% пациентов, получавших препарат Джакави, и у 10,3% пациентов, получавших сравнительную терапию.
В рандомизированный период основных клинических испытаний у пациентов с ИП случаи кровотечений (включая внутричерепные кровоизлияния, желудочно-кишечные кровотечения, подкожные кровоизлияния и другие проявления кровоточивости) были зарегистрированы у 20% пациентов, получавших препарат Джакави, и у 15,3% пациентов, получавших наилучшую доступную терапию. Гематомы встречались в группах Джакави и сравнительной терапии с близкой частотой (10,9% и 8,1%). Не было зарегистрировано случаев внутричерепных кровоизлияний или желудочно-кишечных кровотечений у пациентов, получавших Джакави. Один пациент, получавший Джакави, перенес кровотечение 3 степени тяжести (послеоперационное кровотечение); кровотечений 4 степени не было. Другие случаи кровотечений (в том числе носовое кровотечение, послеоперационное кровотечение, кровоточивость десен) были зарегистрированы у 11,8% пациентов, получавших Джакави и у 6,3% пациентов, получавших наилучшую доступную терапию.
Инфекции мочевыводящих путей
В клинических исследованиях 3 фазы при МФ инфекции мочевыводящих путей 3 или 4 степени тяжести наблюдались у 1,0% пациентов. Уросепсис наблюдался у 1,0% пациентов, а инфекция почек у 1 пациента.
На протяжении периода рандомизации в ключевом исследовании у 1 (0,9%) пациента с ИП наблюдалась инфекция мочевыводящих путей 3-4 степени.
Повышение систолического артериального давления (АД)
В основных клинических испытаниях 3 фазы при МФ увеличение систолического АД на 20 мм рт. ст. и более от исходного уровня наблюдалось у 31,5% пациентов по крайней мере при одном посещении по сравнению с 19,5% у пациентов, получавших контрольное лечение. В исследовании COMFORT-I (пациенты с МФ) среднее увеличение систолического АД от исходного уровня составило 0-2 мм рт.ст. в группе Джакави против уменьшения на 2-5 мм рт.ст. в группе плацебо. В исследовании COMFORT-П средние значения у пациентов с МФ, получавшими руксолитиниб и контрольное лечение, мало различались.
В рандомизированный период основных клинических испытаний у пациентов с ИП среднее систолическое артериальное давление увеличилась на 0,65 мм рт.ст. в группе Джакави против уменьшения на 2 мм рт.ст. в группе пациентов, получавших наилучшую доступную терапию.
Опоясывающий герпес
Частота опоясывающего герпеса была несколько выше у пациентов с ИП (6,4%) по сравнению с пациентами с МФ (4,0%). Имелось 1 сообщение о герпетической невралгии 3-4 степени у пациента с ИП.
Взаимодействие с другими лекарственными препаратами и другие виды взаимодействий
Изучение взаимодействий проводилось только среди взрослых пациентов.
Руксолитиниб выводится посредством цепочки метаболических реакций, катализаторами в которых являются ферменты CYP3A4 и CYP2C9. Поэтому лекарственные средства, способные ингибировать эти ферменты, могут привести к усилению эффекта Руксолитиниба.
Взаимодействия, послужившие причиной уменьшения дозы препарата
Сильные ингибиторы CYP3A4: у здоровых лиц, принимавших кетоконазол (сильный ингибитор CYP3A4) в дозе 200 мг два раза в сутки на протяжении четырех дней, AUC руксолитиниба возрастал примерно на 91%, а период полувыведения возрастал примерно с 3,7 часов до 6,0 часов.
При применении Джакави в сочетании с сильными ингибиторами CYP3A4 суммарную суточную дозу Джакави необходимо снижать примерно на 50%.
Пациенты должны находится под тщательным наблюдением на предмет развития нейтропении, а дозы препарата повышать с учетом эффективности и безопасности (см. раздел 4 Дозирование и способ применения).
Другие взаимодействия, которые необходимо учитывать
Слабые или умеренные ингибиторы активности CYP3A4: у здоровых лиц, получающих эритромицин, который является умеренным ингибитором активности CYP3A4, в дозе 500 мг два раза в сутки на протяжении четырех дней, наблюдалось 27%- ное увеличение AUC руксолитиниба.
При одновременном применении Джакави с легкими и умеренными ингибиторами активности CYP3A4 (например, эритромицина) нет необходимости корректировать дозу Джакави. При начале терапии препаратами, являющимися умеренными ингибиторами активности CYP3A4, за пациентами необходимо осуществлять тщательный контроль на предмет развития цитопений.
Препараты, ингибирующие одновременно ферменты CYP2C9 и CYP3A4 (напр., флуконазол): По данным компьютерного моделирования при одновременном применении с флуконазолом в дозе 200 мг и 400 мг можно ожидать увеличение AUC руксолитиниба в 2,9 и 4,3 раза, соответственно. При применении препаратов, ингибирующих одновременно ферменты CYP2C9 и CYP3A4, следует рассмотреть 50% снижение дозы руксолитиниба. Следует избегать одновременного применения Джакави и флуконазола в дозе более 200 мг в сутки.
Индукторы CYP3A4: В начале применения индуктора CYP3A4 нет необходимости в корректировке доз Джакави. Если на фоне применения индуктора CYP3A4 наблюдается снижение эффективности терапии, можно постепенно повысить дозу Джакави.
У здоровых лиц, принимавших рифампин (сильный индуктор активности CYP3A4) в дозе 600 мг один раз в сутки на протяжении десяти дней, AUC руксолитиниба после его однократного приема снижался примерно на 71%, а период полувыведения уменьшался примерно с 3,3 часов до 1,7 часов. Относительное количество активных метаболитов по сравнению с исходным веществом возрастало.
Р-гликопротеин и другие переносчики: При одновременном применении Джакави с веществами, способными взаимодействовать с Р-гликопротеином и другими переносчиками, нет необходимости корректировать дозу Джакави.
Прочие изученные взаимодействия
Субстраты CYP3A4: Исследование фармакокинетики у здоровых добровольцев показало, что Джакави не проявляет клинически значимого взаимодействия с мидазоламом (субстратом CYP3A4).
Пероральные контрапептивы: Исследование фармакокинетики у здоровых добровольцев показало, что Джакави не влияет на фармакокинетику пероральных контрацептивов, содержащих этинилэстрадиол и левоноргестрел. Поэтому не ожидается, что эффективность контрацепции с помощью этой комбинации может быть снижена при совместном применении с руксолитинибом.
Женщины детородного возраста, беременность, грудное вскармливание и фертильность
Женщины детородного возраста
Женщины детородного возраста должны использовать эффективные способы контацепции во избежание наступления беременности в период терапии препаратом.
При наступлении беременности необходимо в индивидуальном порядке оценить соотношение риск/польза, ознакомившись с современными данными о потенциальном риске в отношении плода.
Беременность
Достоверных и хорошо контролируемых исследований с применением Джакави у беременных женщин не проводилось.
В исследованиях токсичности руксолитиниба в отношении развития эмбриона и плода на крысах и кроликах тератогенности препарата выявлено не было. Руксолитиниб у крыс оказывал эмбриотоксическое и фетотоксическое воздействие (увеличение постимплангационнных потерь и снижение массы плодов).
Потенциальный риск для человека не установлен. Применение Джакави во время беременности противопоказано.
Грудное вскармливание
При лечении препаратом Джакави женщинам нельзя осуществлять грудное вскармливание.
У крыс в период лактации руксолитиниб и/или его метаболиты проникали в грудное молоко в концентрациях, которые в 13 раз превышали соответствующие концентрации в плазме крови материнской особи. Неизвестно, экскретируется ли Джакави в грудное молоко у человека.
Фертильность
Данных о влиянии руксолитиниба на фертильность у человека не получено. В исследованиях на животных, влияний препарата на фертильность или репродуктивную систему самцов и самок крыс не выявлено. В пре- и постнатальном исследовании на крысах руксолитиниб также не оказывал влияния на фертильность особей потомства первого поколения.
Влияние на способность к управлению транспортными средствами и работе с механизмами
Джакави может вызывать незначительный седативный эффект. Тем не менее, пациентам, испытывающим головокружение после приема Джакави, следует воздерживаться от управления транспортными средствами и работы с механизмами.
Товары из категории — Препараты для лечения онкологических заболеваний
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 74 000
Фармакологические свойства
Препарат Джакави считается противоопухолевым средством, выполняющим функцию замедлителя фосфотрансферазы. Основное активное вещество, входящее в формулу химического соединения – руксолитиниб. Это по своей сути избирательный блокатор ферментов, которые модифицируют другие протеины путем фосфорилирования аминокислотных фракций, обладающих гидроксильными или гетероциклическими остатками. Замедляя ферментные киназы, руксолитиниб обеспечивает трансляцию импульсов от подобных гормонам белков, которые синтезируются в организме клетками иммунной структуры, вилочковой железы, крови, селезенки. Цитокины имеют высокостепенное значение в программе кроветворения и функциональности иммунитета.
Благодаря применению киназ тонизируется функциональность протеинов активаторов транскрипции, перемещающихся в середину ядра клетки и модулирующих экспрессивность генома. В ходе экспрессии генов происходит преобразование наследственной информации (последовательности расположения нуклеотидов ДНК) от генов непосредственно в материальные структуры РНК или протеины. Нарушение этих процессов ведет к формированию и пролиферации патологических опухолевых новообразований, а также увеличению резистенции злокачественной ткани.
Миелофиброз представляет собой миелопролиферативный недуг, в основе которого лежит деструкция сигнального трансфера и повышенный уровень цитокинов. Все это приводит к образованию мутированных клеток и к угнетению негативных регулирующих функций. В задачу руксолитиниба входит ингибирование реакций фосфорилирования, пиковое значение действия которых наступает через 2 часа после введения средства. К нормальному показателю влияние препарата возвращалось в течение 8 часов, что свидетельствует об отсутствии аккумулирования руксолитиниба и его продуктов распада.
Начальное и повышенное содержание маркеров воспаления резко снижается после применения таблеток. У больных с миелофиброзом отсутствовали:
• воздействие на реполяризацию сердца;
• реакции привыкания к фармакодинамическому действию руксолинитиба.
Состав и упаковка выпуска
Медикамент выпускается в таблетированном виде, круглой формы, белого цвета. Активный компонент – руксолинитиба фосфат. Упаковывается Джакави в блистерные системы по 14 единиц или в банки по 60 таблеток.
Показания к применению
Используется химпродукт для проведения терапевтических курсов при миелофиброзе, в том числе, на первичной и вторичной стадии заболевания.
Международная классификация болезней (МКБ-10)
D47.1. Затяжное миелопролиферативное заболевание.
Побочные эффекты
Исследования по поводу определения профиля безопасности и результативности действия препарата проводились у более, чем 600 больных. Чаще всего акцидентные признаки сопровождались повышенной кровоточивостью, что свидетельствует о понижении уровня тромбоцитов в крови. Сопутствующим осложнением была патология малокровия, когда падало значение красных кровяных телец в крови. В зависимости от применения той или иной дозы регистрировались анемия, тромбоцитопения, нейтропения.
К негематологическим осложнениям приема Джакави, согласно статистике, относят появление подкожных гематом, спазмов головы, повышение количества холестерина. Побочные эффекты замечены также со стороны:
• паразитарных и инфекционных заболеваний в виде инфицирования органов мочевыделения, туберкулеза, герпеса;
• обмена веществ – повышение веса тела;
• центральной нервной системы – головокружение, нарушение вестибулярного аппарата, негнойное воспаление внутреннего слухового прохода;
• органов ЖКТ — диспепсия;
• гепатобилиарной системы – повышение тонуса аланинаминотрансферазы и аспартатаминотрансферазы 1 и 2 степени.
Противопоказания
Ограничения применения лекарства связаны со следующими состояниями пациента:
• вынашиванием ребенка;
• периодом лактообразования;
• гиперсенсибилизацией к составляющим компонентам продукта.
Не назначается материал лицам, которым не исполнилось 18 лет. Рекомендуется осторожно использовать Джакави пациентам с тяжелой почечной дисфункцией и больным, находящимся на гемодиализе. Повышенное внимание требуется к людям с дисфункцией гепатобилиарной структуры, при поражениях инфекционного характера на стадии обострения, а также при нарушениях состава крови: пониженном количестве гемоглобина, тромбоцитов, нейтрофилов.
Применение при беременности
С учетом появившихся современных сведений о токсичности средства его запрещается назначать при беременности и во время лактационного периода.
Способ и особенности применения
Джакави разрешается употреблять вне зависимости от времени и количества пищи методом перорального введения. Первоначальная дозировка рассчитывается на основании лабораторных данных по количественному содержанию тромбоцитов. Терапия прекращается в случае заметного падения их уровня, а также снижения абсолютного значения нейтрофилов.
Если по истечению некоторого количества времени не произошло восстановление соответствующего числа макрофагов в крови, использование материала может быть продолжено. Дозировка, как гласит инструкция по применению, сохраняется в пределах 5 мг с двукратным введением в течение суток. Медицинский персонал обязан наблюдать за состоянием здоровья пациента. Чтобы не останавливать выполнение процедур, рекомендуется снижение вводимой дозы.
При возникновении терапевтической потребности, когда показатели крови нормализованы, употребляемая норма, согласно инструкции для применения, по разрешению медицинского персонала увеличивается до 5 мг 2 раза в сутки. Первоначальная дозировка не повышается в течение первого месяца терапии. После чего разрешается увеличение объема вещества. Максимально разрешенная возможная доза препарата Джакави достигает 25 мг при двукратном суточном введении.
Если очередной прием медикамента пропущен, то больному не разрешается восполнять пропуск дополнительным внедрением, а следовать схеме в соответствии с графиком. Процедуры продолжаются на протяжении всего времени пока регистрируется врачами устойчивый положительный эффект по терапевтическому действию химпродукта.
Перед использованием таблеток проводится подсчет форменных компонентов кровяной субстанции. Эта процедура проводится на протяжении всего курса лечения через 2-4 недели.
При употреблении Джакави одновременно с сильными замедлителями изоферментов его общая дневная норма снижается на половину при двукратном введении, либо уменьшается частота приема лекарства.
Больным, страдающим почечной недостаточностью в тяжелой степени, первоначальная доза рассчитывается по числу тромбоцитов и снижается примерно на половину. При этом осуществляется постоянный мониторинг. В случае необходимости количество вводимого препарата уменьшается для недопущения появления побочных осложнений.
Существует ограниченные сведения по введению руксолитиниба людям, страдающим почечной дисфункцией на терминальной стадии, которым проводится гемодиализ. Для этой группы лиц начальная однократная доза Джакави соответствует 15-20 мг с последующим введением однократной нормы после гемодиализа. Больным с недостаточной работой печени вводят препарат на 50% меньше нормы. Детям до 18 лет средство не назначается. Больным до 65 лет коррекция дозы не проводится.
Взаимодействие с другими лекарствами
По данным специалистов существуют некоторые группы терапевтических средств, которые способны увеличивать количество вещества руксолитиниба в кровяной субстанции. Эксперименты проводились на здоровых добровольцах, употреблявших соединение кетоконазола в дозе 200 мг несколько раз в день. Это привело к значительному повышению числа Джакави в системе. При использовании подобных продуктов следует тщательно наблюдать за больным, проводить анализы и контролировать состояние организма. При значительном понижении объема некоторых элементов кровяной субстанции следует корректировать норму с целью повышения безопасности и эффективности терапии.
Запрещено вводить медикамент самостоятельно, без назначения специалиста. Это может вызвать серьезные осложнения. Согласно исследованиям, употребление соединения эритромицина приводит к повышению числа средства примерно на 27%. Специалисты указывают на возможность использовать средство Джакави в таких случаях без изменения нормы препарата.
Однако, врач должен обращать особое внимание на самочувствие пациента в начале лечения. Если речь идет о необходимости употребления материала индуктора изофермента CYP3A4, то корректировка дозировки не потребуется. При слабо выраженном эффекте противоопухолевого средства его количество нужно увеличить. В случае использования сильнодействующего вышеуказанного изофермента происходит понижение количества Джакави в кровяной субстанции. При введении некоторых типов транспортёров, материалов, которые реагируют на Р-гликопротеины, изменение нормы антиопухолевого продукта не обязательно. Проводится это только в индивидуальных случаях, когда выявлены определенные особенности организма пациента.
Передозировка
Значительное количество Джакави, не превышающее 200 мг, воспринималось организмом удовлетворительно. Как показывает практика, овердоза приводила к таким изменениям, как возникновение миелосупрессии. Что проявлялось тромбоцитопенией, лейкопенией, анемией. После использования гемодиализа улучшения не наблюдались. Поэтому проводить данную манипуляцию во время передозировки не рекомендуется. Специальный антидот к активному химкомпоненту неизвестен. При случайном употреблении значительного объема вещества необходимо срочно обратиться к медработнику. Он проведет соответствующие реабилитирующие мероприятия по восстановлению функций организма.
Аналоги
К альтернативным продуктам Джакави относят все лекарства, которые имеют такой же основной ингредиент, как антиопухолевый медикамент. Перед использованием аналога необходимо посоветоваться с врачом. Только он может изменить схему терапии и назначить похожие вещества. Перед употреблением средства необходимо изучить информационный вкладыш, состав изделия, наличие дополнительных компонентов, возможные проявления акцидентных эффектов и другие особенности использования таблеток.
Условия продажи
Джакави принадлежит к лекарственным препаратам, которые отпускаются в аптеке только по рецепту специалиста.
Условия хранения
Медикамент до употребления рекомендуется содержать в месте, к которому нет доступа несовершеннолетним лицам, при температурном режиме не выше 30°С. Изделия, упакованные в блистерах, разрешены к использованию на протяжении 1 года. Если продукт сберегается в банках, то срок его годности не может превышать 2 лет.
Цены на Джакави в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 74 000 руб.