Содержание
-
Русское название
-
Английское название
-
Латинское название
-
Химическое название
-
Брутто формула
-
Фармакологическая группа вещества Энзалутамид
-
Нозологическая классификация
-
Код CAS
-
Фармакологическое действие
-
Характеристика
-
Фармакология
-
Применение вещества Энзалутамид
-
Противопоказания
-
Ограничения к применению
-
Применение при беременности и кормлении грудью
-
Побочные действия вещества Энзалутамид
-
Взаимодействие
-
Передозировка
-
Способ применения и дозы
-
Меры предосторожности
-
Источники информации
-
Торговые названия с действующим веществом Энзалутамид
Русское название
Энзалутамид
Английское название
Enzalutamide
Латинское название
Enzalutamidum (род. Enzalutamidi)
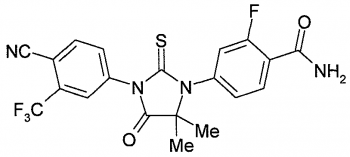
Химическое название
4-[3-[4-циано-3-(трифторметил)фенил]-5,5-диметил-4-оксо-2-сульфанилиденеимидазолидин-1-ил]-2-фтор-N-метилбензамид
Брутто формула
C21H16F4N4O2S
Фармакологическая группа вещества Энзалутамид
Нозологическая классификация
Код CAS
915087-33-1
Фармакологическое действие
—
антиандрогенное.
Характеристика
Антиандрогенное средство.
RxList
Белое кристаллическое негигроскопичное твердое вещество, практически нерастворимое в воде. Молекулярная масса 464,44.
Фармакология
Фармакодинамика
Механизм действия. Рак предстательной железы зависит от наличия андрогенов и реагирует на подавление активности андрогенных рецепторов. Несмотря на низкие или даже неопределяемые уровни андрогенов в плазме крови, активность андрогенных рецепторов на клетках опухоли продолжает способствовать прогрессированию болезни. Стимуляция роста опухолевых клеток с помощью андрогенных рецепторов требует их транслокации в ядро клетки и связывания с ДНК. Энзалутамид является сильным ингибитором андрогенных рецепторов, который блокирует несколько этапов сигнального пути андрогенных рецепторов. Энзалутамид конкурентно ингибирует связывание андрогенов с андрогенными рецепторами, угнетает ядерную транслокацию активированных рецепторов и ингибирует связывание активированных рецепторов андрогенов с ДНК даже в условиях избыточной экспрессии андрогенных рецепторов и в клетках опухоли, резистентных к антиандрогенам. Лечение энзалутамидом подавляет рост клеток опухоли предстательной железы и может индуцировать гибель клеток и регрессию опухоли. В доклинических исследованиях у энзалутамида отсутствовала активность агониста андрогенных рецепторов.
В ходе клинического исследования III фазы у пациентов после неэффективности химиотерапии доцетакселом, у 54% пациентов, получавших энзалутамид, по сравнению с 1,5% пациентов, получавших плацебо, наблюдалось по крайней мере 50% снижение уровня ПСА по сравнению с исходным.
Клиническая эффективность и безопасность
Эффективность энзалутамида была установлена в двух рандомизированных плацебо-контролируемых многоцентровых клинических исследованиях III фазы (CRPC2 (AFFIRM), MDV3100-03 (PREVAIL) у пациентов с прогрессирующим метастатическим раком предстательной железы, у которых прогрессия заболевания наблюдалась на фоне антиандрогенной терапии (при использовании аналогов ГнРГ или после билатеральной орхиэктомии). В исследовании PREVAIL принимали участие пациенты, не получавшие химиотерапию; в исследовании AFFIRM — пациенты, получавшие до этого химиотерапию с использованием доцетаксела. Все пациенты продолжали прием аналогов ГнРГ или перенесли билатеральную орхиэктомию.
Исследование MDV3100-03 (PREVAIL) (пациенты, не получавшие химиотерапию). 1717 пациентов без симптомов или с умеренно выраженными симптомами были рандомизированы 1:1 в группу энзалутамида в дозе 160 мг 1 раз в день (N=872) либо плацебо 1 раз в день (N=845).
Предварительно запланированный промежуточный анализ общей выживаемости показал, что лечение энзалутамидом приводило к статистически достоверному увеличению общей выживаемости по сравнению с плацебо со снижением риска смерти на 29,4% (отношение рисков (ОР)=0,706 (95% ДИ: 0,596; 0,837), р <0,0001). На момент проведения промежуточного анализа умерли 27,6% (241 из 872) пациентов в группе получавших энзалутамид и 35,4% (299 из 845) пациентов, получавших плацебо. Расчетная медиана общей выживаемости составила 32,4 мес (95% ДИ: 30,1; не достигнута) в группе получавших энзалутамид и 30,2 мес (95% ДИ: 28; не достигнута) — в группе получавших плацебо. Кроме того 40% пациентов в группе получавших энзалутамид и 70% — в группе получавших плацебо назначали последующие варианты терапии с доказанным увеличением общей выживаемости.
Анализ беспрогрессивной выживаемости по радиологическим критериям (рБПВ) продемонстрировал статистически достоверное улучшение между группами пациентов со снижением риска радиографической прогрессии или смерти на 81,4% в группе получавших энзалутамид (ОР=0,186 (95% ДИ: 0,149; 0,231), р <0,0001). Прогрессия отмечалась у 118 (14%) пациентов в группе получавших энзалутамид и 321 (40%) пациентов в группе получавших плацебо. Медиана рБПВ не достигнута (95% ДИ: 13,8; не достигнута) в группе получавших энзалутамид и составила 3,9 мес (95% ДИ: 3,7; 5,4) в группе получавших плацебо. Одинаковое повышение рБПВ наблюдалось среди всех заранее определенных подгрупп пациентов (возраст, исходный статус ECOG, исходный уровень ПСА и ЛДГ, балл Глисона на момент диагноза, висцеральное заболевание при скрининге). При проведении запланированного анализа рБПВ во время наблюдения, который основывался на оценке радиографической прогрессии, продемонстрировано статистически достоверное снижение риска радиографической прогрессии или смерти на 69,3% в группе получавших энзалутамид (ОР=0,307 (95% ДИ: 0,267; 0,353), р <0,0001). Медиана рБПВ составила 19,7 мес в группе получавших энзалутамид и 5,4 мес в группе получавших плацебо.
В дополнение к составным первичным показателям эффективности статистически достоверное улучшение было продемонстрировано в отношении следующих проспективно определенных конечных точек. Медиана времени до начала цитотоксической химиотерапии составила 28 мес в группе получавших энзалутамид и 10,8 мес в группе получавших плацебо (ОР=0,350 (95% ДИ: 0,303; 0,403), р <0,0001).
Доля пациентов в группе получавших энзалутамид с исходно определявшимся заболеванием и имевших объективный ответ со стороны мягких тканей составила 58,8% (95% ДИ: 53,8; 63,7) по сравнению с 5% (95% ДИ: 3; 7,7) у пациентов получавших плацебо. Абсолютное различие в объективном ответе со стороны мягких тканей между группами пациентов, получавших энзалутамид и плацебо, составило 53,9% (95% ДИ: 48,5%; 59,1%), р <0,0001). Полный ответ был отмечен у 19,7% пациентов, получавших энзалутамид, по сравнению с 1% пациентов, получавших плацебо; частичный ответ был отмечен у 39,1% пациентов в группе получавших энзалутамид против 3,9% пациентов в группе получавших плацебо.
Энзалутамид достоверно снижал риск первого костного осложнения на 28% (ОР=0,718 (95% ДИ: 0,61; 0,844), р <0,0001). У пациентов, получавших энзалутамид, отмечался достоверно более высокий ПСА-ответ (определялся как снижение >50% от исходного уровня) по сравнению с пациентами, получавшими плацебо, — 78 против 3,5% (различие 74,5%, р <0,0001).
Медиана времени до ПСА-прогрессии по критериям PCWG2 составила 11,2 мес для пациентов, получавших энзалутамид, и 2,8 мес для пациентов в группе плацебо (ОР=0,169, (95% ДИ: 0,147; 0,195), р <0,0001).
Лечение энзалутамидом снижало риск ухудшения по шкале FACT-Р на 37,5% по сравнению с плацебо (р <0,001). Медиана времени до ухудшения по шкале FACT-P составила 11,3 мес в группе получавших энзалутамида и 5,6 мес — в группе плацебо.
Исследование CRPC2 (AFFIRM) (пациенты, получавшие химиотерапию). Эффективность и безопасность энзалутамида у пациентов с метастатическим кастрационно-резистентным раком предстательной железы (КРРПЖ), которые получали доцетаксел и использовали аналог ГнРГ или перенесли орхиэктомию, оценивалась в рандомизированном плацебо-контролируемом многоцентровом клиническом исследовании III фазы. 1199 пациентов были рандомизированы 2:1 в группу энзалутамида в дозе 160 мг 1 раз в день (N=800) либо плацебо 1 раз в день (N=399).
Запланированный по протоколу промежуточный анализ после 520 смертей продемонстрировал статистически значимое превосходство в общей выживаемости у пациентов, получавших энзалутамид, по сравнению с пациентами из группы плацебо: медиана выживаемости 18,4 и 13,6 мес соответственно (ОР=0,631 (95% ДИ: 0,529; 0,752), р <0,0001).
рБПВ (оценка исследователей с использованием критериев оценки ответа солидных опухолей на терапию (RESICT), версия 1,1 для мягких тканей и появление 2 или более поражений костей на остеосцинтиграфии) составила 8,3 мес у пациентов, получавших энзалутамид, и 2,9 мес у пациентов, получавших плацебо (ОР=0,404 (95% ДИ: 0,35; 0,466), р <0,0001). Анализ включал 216 смертей без документированного прогрессирования и 645 документально подтвержденных случаев прогрессии, 303 из которых (47%) были связаны с прогрессированием в мягких тканях, 268 (42%) были обусловлены прогрессированием костных метастазов и 74 (11%) были связаны с поражением мягких и костных тканей. Подтвержденное снижение уровня ПСА на 50 или 90% наблюдалось у 54 и 24,8% пациентов, которые получали энзалутамид, и у 1,5 и 0,9% пациентов, которые получали плацебо (р <0,0001). Медиана времени до ПСА-прогрессии составила 8,3 мес у пациентов, которые получали энзалутамид, и 3 мес у пациентов из группы плацебо (ОР=0,248 (95% ДИ: 0,204; 0,303), р <0,0001).
Медиана времени до появления первого костного осложнения составила 16,7 мес у пациентов, получавших энзалутамид, и 13,3 мес у пациентов, получавших плацебо (ОР=0,688 (95% ДИ: 0,566; 0,835), р <0,0001). Эффективность энзалутамида у пациентов, получавших абиратерон, не была изучена.
Пожилые люди. Среди 1671 пациента, получавшего энзалутамид в исследованиях фазы III, 1261 пациент (75%) был в возрасте 65 лет и старше и 516 пациентов (31%) были в возрасте 75 лет и старше. У данных пожилых и более молодых пациентов не отмечалось каких- либо различий в безопасности и эффективности.
Фармакокинетика
Фармакокинетика энзалутамида была изучена у больных раком предстательной железы и здоровых добровольцев. Средний Т1/2 энзалутамида у пациентов после однократного перорального приема составляет 5,8 сут (диапазон 2,8–10,2), а Css достигается примерно через 1 мес. При ежедневном пероральном применении энзалутамид аккумулируется примерно в 8,3 раза быстрее разовой дозы. Суточные колебания концентрации в плазме крови незначительные (соотношение от пика до минимума — 1,25). Выведение энзалутамида главным образом осуществляется путем печеночного метаболизма с образованием активного метаболита, который аналогичен по активности энзалутамиду и циркулирует в плазме примерно в той же концентрации, что и энзалутамид.
Абсорбция. Сmax энзалутамида у пациентов наблюдалась через 1–2 ч после приема. На основе изучения баланса массы у людей, всасывание при пероральном приеме энзалутамида оценивается по меньшей мере на уровне 84,2%. Энзалутамид не является субстратом эффлюксных транспортеров P-gp или BCRP. Стабильный уровень, среднее значение Сmax энзалутамида и его активного метаболита составляют 16,6 пг/мл (коэффициент вариации (CV) 23%) и 12,7 пг/мл (CV 30%) соответственно.
Прием пищи не оказывает значимое влияние на степень абсорбции энзалутамида. В клинических исследованиях энзалутамид применялся независимо от приема пищи.
Распределение. Средний Vd энзалутамида у пациентов после однократного перорального приема составляет 110 л (CV 29%). Vd энзалутамида больше, чем общий объем жидкости в организме, что указывает на активное распределение в периферических тканях. Исследования на грызунах показали, что энзалутамид и его активный метаболит могут проникать через ГЭБ.
Энзалутамид на 97–98% связывается с белками плазмы, в первую очередь с альбумином. Активный метаболит связывается с белками плазмы на 95%. В исследованиях in vitro не отмечалось замещение связывания с белками плазмы между энзалутамидом и другими ЛС с высокой связывающей способностью (варфарин, ибупрофен и салициловая кислота).
Метаболизм. Энзалутамид активно метаболизируется. В плазме крови человека присутствуют два основных метаболита: N-десметилэнзалутамид (активный) и производное соединение карбоновой кислоты (неактивный). Энзалутамид метаболизируется ферментами CYP2C8 и в меньшей степени CYP3A4/5, которые играют важную роль в формировании активного метаболита. В исследовании in vitro N-десметилэнзалутамид метаболизируется до метаболита карбоновой кислоты за счет карбоксилэстеразы 1, которая также играет небольшую роль в метаболизме энзалутамида до метаболита карбоновой кислоты. N-десметилэнзалутамид не метаболизировался ферментами CYP in vitro.
В условиях клинического применения энзалутамид является сильным индуктором фермента CYP3A4, умеренным индуктором ферментов CYP2C9 и CYP2C19 и не имеет клинически значимое влияние на фермент CYP2C8.
Выведение. Средний кажущийся клиренс энзалутамида у пациентов составляет от 0,52 до 0,564 л/ч. При пероральном приеме меченного 14С-энзалутамида к 77-му дню выводилось приблизительно 84,6% радиоактивной дозы: 71% — почками (в первую очередь в виде неактивного метаболита с незначительным количеством энзалутамида и активного метаболита) и 13,6% — через кишечник (0,39% дозы энзалутамида в неизмененном виде).
Данные лабораторных исследований показывают, что энзалутамид не является субстратом для ОАТР1В1, ОАТР1В3 или ОСТ1 и N-десметилэнзалутамид не является субстратом для P-gp и BCRP.
Данные лабораторных исследований показывают, что энзалутамид и его основные метаболиты при клинически значимых концентрациях не ингибируют транспортеры ОАТР1В1, ОАТР1В3, ОСТ2 или ОАТ1.
Линейность. В диапазоне доз от 40 до 160 мг серьезных отклонений от пропорциональности дозе не наблюдается. Значения стабильного уровня Cmin энзалутамида и его активного метаболита у отдельных пациентов оставались неизменными в течение более одного года терапии, демонстрируя временную линейную фармакокинетику после достижения стабильного уровня концентрации.
Особенности фармакокинетики у отдельных категорий пациентов
Почечная недостаточность. Исследования по применению энзалутамида у пациентов с почечной недостаточностью не проводились. Пациенты с уровнем сывороточного креатинина >177 мкмоль/л (2 мг/дл) были исключены из клинических исследований. Основываясь на популяционном анализе фармакокинетики, у пациентов со значениями Cl креатинина >30 мл/мин (по формуле Кокрофта-Голта) коррекция дозы не требуется. Энзалутамид не изучался у пациентов с тяжелой почечной недостаточностью (Cl креатинина <30 мл/мин) или терминальной стадией почечной недостаточности, поэтому при лечении этих пациентов рекомендуется назначать препарат с осторожностью. Маловероятно, что энзалутамид будет значительно выводиться с помощью интермиттирующего гемодиализа или постоянного амбулаторного перитонеального диализа.
Печеночная недостаточность. Фармакокинетика энзалутамида была изучена у пациентов с исходной легкой (N=6) или умеренной (N=8) печеночной недостаточностью (классы А и В по шкале Чайлд-Пью соответственно) и 14 пациентов из контрольной группы с нормальной функцией печени. После однократного перорального приема энзалутамида в дозе 160 мг значения AUC и Сmax энзалутамида у пациентов с легкой печеночной недостаточностью увеличились на 5 и 24% соответственно, а у пациентов с умеренными нарушениями функции печени увеличились на 29% и снизились на 11% соответственно по сравнению с контрольной группой. В расчете на сумму несвязанного энзалутамида плюс несвязанный активный метаболит значения AUC и Сmax у пациентов с легкими нарушениями функции печени увеличились на 14 и 19% соответственно, a у пациентов с умеренными нарушениями увеличились на 14% и снизились на 17% соответственно по сравнению с контрольной группой. Однако у пациентов в группе с умеренной печеночной недостаточностью наблюдалось незначительное ухудшение параметров, указывающее на снижение метаболической функции (альбумин, ПВ), и, следовательно, нельзя исключить, что этот эффект у пациентов с умеренной печеночной недостаточностью может быть выше.
Пациенты с исходной тяжелой печеночной недостаточностью (класс С по шкале Чайлд- Пью) были исключены из клинических исследований.
Раса. Большинство пациентов, участвовавших в клинических исследованиях (>84%), были европейцами. По данным исследования фармакокинетики у пациентов с раком предстательной железы в Японии, не отмечалось клинически значимых различий в фармакокинетике между европейцами и японцами. Данных для оценки потенциальных различий фармакокинетики энзалутамида между другими расами недостаточно.
Пожилые люди. Не было отмечено клинически значимое влияние возраста на фармакокинетику энзалутамида. Коррекция дозы у пожилых людей не требуется.
RxList.com
Фармакодинамика
Электрофизиология сердца
Влияние энзалутамида в дозе 160 мг/сут в состоянии равновесия на интервал QTc оценивалось у 796 пациентов с метастатическим КРРПЖ. Не выявлено значительных различий (>20 мс) между средними изменениями интервала QT по сравнению с исходным уровнем у пациентов, получавших энталузамид, и пациентов, получавших плацебо, при оценке по формуле Фредерика. Тем не менее нельзя исключить небольшое увеличение среднего интервала QTc (т.е. <10 мс) из-за ограничений в дизайне исследования.
Фармакокинетика
Фармакокинетические параметры энзалутамида и его основного активного метаболита N-десметилэнзалутамида оценивались у пациентов с метастатическим КРРПЖ и здоровых добровольцев (мужчин). Уровни энзалутамида в плазме крови адекватно описывались двухкамерной фармакокинетической моделью с абсорбцией первого порядка.
Абсорбция. После перорального применения энзалутамида в дозе 160 мг/сут у пациентов с метастатическим КРРПЖ среднее Tmax в пламе крови составляет 1 ч (диапазон 0,5–3 ч). В состоянии равновесия cредние значения Cmax энзалутамида и N-десметилэнзалутамида в плазме крови составляют 16,6 (коэффициент вариации 23%) и 12,7 (коэффициент вариации 30%) мкг/мл соответственно; Cmin перед введением следующей дозы — 11,4 (коэффициент вариации 26%) и 13 (коэффициент вариации 30%) мкг/мл соответственно.
В режиме ежесуточного дозирования состояние равновесия достигается к 28-му дню, и кумуляция энзалутамида приблизительно в 8,3 раза выше по сравнению с однократной дозой. Суточные колебания плазменной концентрации энзалутамида низкие (соотношение Сmax и Cmin 1,25). В состоянии равновесия фармакокинетические параметры энзалутамида приблизительно пропорциональны дозе в интервале доз 30–360 мг).
Разовую дозу энзалутамида 160 мг получали здоровые добровольцы вместе с пищей с высоким содержанием жиров или натощак. Прием пищи с высоким содержанием жиров не оказывал влияние на AUC энзалутамида и N-десметилэнзалутамида.
Распределение. Средний кажущийся Vd энзалутамида у пациентов после однократной дозы составляет 110 л (коэффициент вариации 29%).
Энзалутамид на 97–98% связывается с белками плазмы, преимущественно с альбумином, связывание N-десметилэнзалутамида с белками плазмы — 95%. В исследованиях in vitro не выявлено вытеснение из связи с белками между энзалутамидом и другими ЛС с высокой связью с белками плазмы (варфарин, ибупрофен и салициловая кислота) в клинически значимых концентрациях.
Метаболизм. После однократного перорального применения 160 мг 14C-энзалутамида образцы плазмы анализировали на наличие энзалутамида и его метаболитов в течение 77 дней после приема. Энзалутамид, N-десметилэнзалутамид и основной неактивный метаболит в виде карбоновой кислоты составляли 88% радиоактивности в плазме, занимая соответственно 30, 49 и 10% общей 14C-AUC0–inf.
В метаболизме энзалутамида in vitro участвуют CYP2C8 и CYP3A4 человека. По данным in vivo и in vitro исследований, основным ферментом, ответственным за образование активного метаболита (N-десметилэнзалутамид), является CYP2C8.
По данным исследований in vitro N-десметилэнзалутамид не является субстратом CYP1A1, CYP1A2, CYP2A6, CYP2B6, CYP2C8, CYP2C9, CYP2C18, CYP2C19, CYP2D6, CYP2E1 и CYP3A4/5.
Выведение. Основным путем выведения энзалутамида является печеночный метаболизм. После однократного перорального применения 160 мг 14C-энзалутамида 85% радиоактивности выводится к 77-му дню после приема, из них 77% с мочой (включая только следы энзалутамида и N-десметилэнзалутамида) и 14% с фекалиями (0,4% введенной дозы в виде неизмененного энзалутамида и 1% — в виде N-десметилэнзалутамида). Средний кажущийся клиренс энзалутамида у пациентов после однократной пероральной дозы составляет 0,56 л/ч (диапазон 0,33–1,01 л/ч).
Средний конечный T1/2 энзалутамида у пациентов после однократной пероральной дозы составляет 5,8 дня (диапазон 2,8–10,2 дня). После применения однократной пероральной дозы энзалутамида 160 мг у здоровых добровольцев средний конечный T1/2 N-десметилэнзалутамида составляет приблизительно 7,8–8,6 дня).
Особые группы пациентов
Почечная недостаточность. Популяционный фармакокинетический анализ (основанный на сведениях о исходном состоянии функции почек) был выполнен по данным от 59 здоровых добровольцев (мужчин) и 296 пациентов с метастатическим КРРПЖ, включенных в клинические испытания, в т.ч. 512 пациентов с нормальной функцией почек (Cl креатинина ≥90 мл/мин), 332 пациента с легкой степенью почечной недостаточности (Cl креатинина 60–90 мл/мин), 88 пациентов с умеренной почечной недостаточностью (Cl креатинина 30–60 мл/мин) и 1 пациент с тяжелой почечной недостаточностью (Cl креатинина <30 мл/мин). Кажущийся клиренс энзалутамида был аналогичным у пациентов с исходной легкой или умеренной почечной недостаточностью (Cl креатинина 30–90 мл/мин) и нормальной функцией почек. Потенциальное влияние тяжелой или терминальной почечной недостаточности на фармакокинетические параметры энзалутамида оценить было невозможно, т.к. были доступны клинические и фармакокинетические данные только одного пациента.
Печеночная недостаточность. Плазменные фармакокинетические параметры энзалутамида и N-десметилэнзалутамида оценивали у добровольцев с нормальной функцией печени (N=22) и исходной легкой (N=8, класс A по шкале Чайлд-Пью), умеренной (N=8, класс B по шкале Чайлд-Пью) или тяжелой (N=8, класс C по шкале Чайлд-Пью) почечной недостаточностью. Энзалутамид применяли в разовой дозе 160 мг. Суммарный AUC энзалутамида и N-десметилэнзалутамида был аналогичным у добровольцев с легкой, умеренной или тяжелой исходной печеночной недостаточностью и добровольцев с нормальной функцией печени.
Масса тела и возраст. Популяционный фармакокинетический анализ показал, что масса тела (диапазон 46–163 кг) и возраст (диапазон 41–92 года) не оказывали клинически значимое влияние на экспозицию энзалутамида.
Пол. Влияние пола на фармакокинетику энзалутамида не оценивалось.
Раса. Большая часть пациентов, включенных в рандомизированные клинические испытания были европеоидной расы (85%). Фармакокинетические данные японцев с раком предстательной железы показали, что отсутствуют клинически значимые различия в экспозиции между японцами и лицами европеоидной расы. Отсутствуют достаточные данные для оценки возможных различий в фармакокинетических параметрах энзалутамида у других рас.
Применение вещества Энзалутамид
Метастатический кастрационно-резистентный рак предстательной железы.
Противопоказания
Гиперчувствительность; противопоказан женщинам и детям; тяжелое нарушение функции печени.
Ограничения к применению
Риск развития судорог. Энзалутамид следует применять с осторожностью у пациентов, страдающих эпилептическими припадками или имеющих другие предрасполагающие факторы, включая, но не ограничиваясь следующими: травмы головного мозга, инсульт, первичные опухоли головного мозга или метастазы в головной мозг, алкоголизм. Кроме того, риск развития судорог может быть повышен у пациентов, получающих сопутствующую терапию ЛС, снижающими порог судорожной готовности.
Синдром обратимой задней энцефалопатии. В ходе применения энзалутамида были зарегистрированы редкие сообщения о развитии синдрома обратимой задней энцефалопатии. Синдром обратимой задней энцефалопатии — редкое обратимое неврологическое заболевание, которое может характеризоваться быстро развивающимися симптомами, такими как судороги, головная боль, спутанность сознания, слепота и другие зрительные и неврологические расстройства, сопровождаемые или несопровождаемые гипертензией. Диагноз синдрома обратимой задней энцефалопатии должен быть подтвержден результатами томографии головного мозга, лучше всего результатами МРТ. Рекомендуется прекратить прием энзалутамида при подтвержденном диагнозе.
Одновременное применение с другими ЛС. Энзалутамид является сильным индуктором ферментов и может привести к снижению эффективности многих часто используемых ЛС. Поэтому, начиная лечение энзалутамидом, необходимо провести анализ сопутствующих ЛС. Следует избегать одновременного применения энзалутамида с ЛС, которые являются чувствительными субстратами многих метаболизирующих ферментов или транспортеров, если их терапевтическое воздействие имеет большое значение для пациента, а также если на основании контроля эффективности или концентрации в плазме невозможно скорректировать дозу.
Следует избегать одновременного применения с варфарином и кумаринподобными антикоагулянтами. Если энзалутамид используется совместно с антикоагулянтом, который метаболизируется ферментом CYP2C9 (например варфарин или аценокумарол), требуется дополнительный контроль МНО.
Почечная недостаточность. С осторожностью следует назначать пациентам с тяжелой почечной недостаточностью, т.к. действие энзалутамида в этой группе пациентов не изучено.
Печеночная недостаточность. С осторожностью следует назначать пациентам с умеренной печеночной недостаточностью (класс В по шкале Чайлд-Пью), т.к. отсутствуют конечные данные о применении энзалутамида у пациентов с умеренной печеночной недостаточностью. Поскольку нет данных о применении энзалутамида у пациентов с тяжелой печеночной недостаточностью, и энзалутамид выводится главным образом через печень, его не рекомендуется применять у пациентов с тяжелой печеночной недостаточностью (класс С по шкале Чайлд-Пью).
Недавно перенесенные сердечно-сосудистые заболевания. В исследования III фазы не были включены пациенты, которые недавно перенесли инфаркт миокарда (в течение последних 6 мес) или страдают нестабильной стенокардией (в течение последних 3 мес), сердечной недостаточностью класса III или IV по шкале NYHA, за исключением пациентов с ФВЛЖ >45%, брадикардией или неконтролируемой артериальной гипертензией. Это необходимо принимать во внимание при назначении энзалутамида таким пациентам.
Андрогендепривационная терапия может удлинять интервал QT. У пациентов с наличием удлиненного интервала QT или с предрасполагающими факторами и пациентов, получающих сопутствующую терапию ЛС, которые могут удлинять интервал QT, врачи перед назначением энзалутамида должны оценить соотношение пользы и риска, включая возможность возникновения желудочковой тахикардии типа «пируэт».
Сопутствующая химиотерапия. Безопасность и эффективность одновременного применения энзалутамида с цитотоксической химиотерапией не установлена. Одновременное назначение энзалутамида не оказывает клинически значимый эффект на фармакокинетику доцетаксела, вводимого в/в, однако нельзя исключать увеличение частоты нейтропении, вызванной приемом доцетаксела.
Применение при беременности и кормлении грудью
Нет данных о применении энзалутамида у женщин во время беременности, т.к. он не предназначен для использования у женщин детородного возраста.
Энзалутамид противопоказан беременным женщинам и женщинам детородного возраста.
Контрацепция для мужчин и женщин. Нет данных, присутствует ли энзалутамид или его метаболиты в сперме. Если пациент имеет сексуальный контакт с беременной женщиной, во время и в течение 3 мес после лечения энзалутамидом требуется использование презерватива, наряду с другими эффективными методами контрацепции.
Исследования на животных показали репродуктивную токсичность энзалутамида.
Побочные действия вещества Энзалутамид
Наиболее частыми нежелательными реакциями являются астения/повышенная утомляемость, приливы, головная боль и гипертония. Другие важные нежелательные реакции включают падения, непатологические переломы, когнитивные расстройства и нейтропению.
Судороги наблюдались у 0,4% пациентов в группе энзалутамида и 0,1% пациентов в группе плацебо.
Ниже приведены распределенные по частоте встречаемости нежелательные реакции, наблюдавшиеся в ходе клинических исследований. Частота встречаемости классифицирована как очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000); неизвестно (невозможно оценить на основании имеющихся данных). Все нежелательные реакции в каждой группе представлены в порядке убывания серьезности.
Со стороны кроветворной и лимфатической системы: нечасто — лейкопения, нейтропения.
Со стороны иммунной системы: неизвестно (сообщения, полученные в постмаркетинговый период) — отек языка, губ, глотки.
Системные нарушения: очень часто — астения/усталость.
Нарушения психики: часто — чувство страха; нечасто — визуальные галлюцинации.
Со стороны нервной системы: очень часто — головная боль; часто — ухудшение памяти, потеря памяти, нарушение внимания, синдром беспокойных ног; нечасто — когнитивные расстройства, судороги; неизвестно (сообщения, полученные в постмаркетинговый период) — синдром задней обратимой энцефалопатии.
Со стороны репродуктивной системы и грудных желез: часто — гинекомастия.
Со стороны ССС: очень часто — приливы, гипертония; неизвестно (сообщения, полученные в постмаркетинговый период) — удлинение интервала QT.
Со стороны ЖКТ: неизвестно (сообщения, полученные в постмаркетинговый период) — тошнота, рвота.
Со стороны кожи и подкожных тканей: часто — сухость кожи, кожный зуд; неизвестно (сообщения, полученные в постмаркетинговый период) — сыпь.
Со стороны костно-мышечной системы и соединительной ткани: часто — переломы (любые переломы, за исключением патологических); неизвестно (сообщения, полученные в постмаркетинговый период) — миалгия, мышечный спазм, мышечная слабость, боль в спине.
Травмы, отравления и осложнения, вызванные проведением исследовательских процедур: часто — падения.
Судороги. В ходе клинических исследований III фазы судороги отмечались у 7 (0,4%) из 1671 пациента, которые ежедневно принимали энзалутамид в дозе 160 мг, и у 1 пациента (<0,1%), из получавших плацебо. Доза представляется важным предиктором риска развития судорог, о чем свидетельствуют данные доклинических исследований и исследований с увеличением дозы. Из исследований III фазы исключались пациенты с судорогами в анамнезе или факторами риска возникновения судорог.
В исследовании AFFIRM судороги наблюдались у 6 из 800 пациентов (0,8%), которые получали 160 мг/сут энзалутамида после перенесенной химиотерапии, в то время как у пациентов, получавших плацебо, судорог не наблюдалось. Потенциально способствующие факторы, которые могли увеличить риск развития судорог, присутствовали у некоторых из этих пациентов. В исследовании PREVAIL судороги наблюдались у 1 из 871 пациента (0,1%), не получавшего химиотерапию и получавшего 160 мг/сут энзалутамида, и у 1 пациента (0,1%), получавшего плацебо.
Механизм, посредством которого энзалутамид может снижать порог судорожной готовности, неизвестен. Однако он может быть связан с данными исследований in vitro, которые показали, что энзалутамид и его активный метаболит связываются и могут ингибировать активность хлорных каналов ГАМК-рецепторов.
RxList
Следующие побочные реакции обсуждаются более подробно в других разделах описания:
— судороги (см. Меры предосторожности);
— синдром обратимой задней энцефалопатии (см. «Меры предосторожности»).
Так как клинические испытания проведены с различным набором условий, частота встречаемости побочных реакций, наблюдавшихся в этих исследованиях, может не совпадать с полученной в других исследованиях и наблюдаемой в клинической практике.
Были проведены 2 рандомизированные клинические испытания с участием пациентов с метастатическим раком предстательной железы, который прогрессировал на фоне проведения антиандрогенной терапии (терапия ГнРГ или билатеральная орхиэктомия) и получил определение как метастатический КРРПЖ. В обоих исследованиях пациенты получали перорально энзалутамид в дозе 160 мг 1 раз в сутки в основной группе и плацебо — в контрольной. Все пациенты продолжали антиандрогенную терапию. Пациентам разрешалось, но не требовалось, получать ГКС.
Наиболее распространенными побочными реакциями (≥10%), которые возникали чаще в группе пациентов, получавших энзалутамид (≥2% выше чем в группе плацебо), в этих двух рандомизированных клинических испытаниях были астения/повышенная утомляемость, боль в спине, снижение аппетита, запор, артралгия, диарея, приливы, инфекция верхних дыхательных путей, периферический отек, одышка, скелетно-мышечная боль, понижение массы тела, головная боль, гипертензия и головокружение/вертиго.
Исследование 1: метастатический КРРПЖ после получения химиотерапии
В исследование 1 были включены 1199 пациентов с метастатическим КРРПЖ, которые предварительно получали доцетаксел. Средняя продолжительность лечения составила 8,3 мес в основной группе получавших энзалутамид и 3 мес в контрольной группе плацебо. В период испытания 48% пациентов основной группы и 46 пациентов группы плацебо получали ГКС.
Побочные реакции степени тяжести 3 и выше отмечались у 47% пациентов в основной группе и 53% пациентов в группе плацебо. Прекращение лечения из-за побочных реакций отмечено у 16% пациентов в группе получавших энзалутамид и 18% пациентов в группе плацебо. Чаще всего к прекращению лечения приводила такая побочная реакция, как судороги, которые возникали у 0,9% пациентов в основной группе и 0% — в группе плацебо. Ниже перечислены побочные реакции, которые возникали с частотой ≥2% в группе получавших энзалутамид по сравнению с группой плацебо; данные приведены в процентах в следующей последовательности: первая цифра — побочные реакции всех степеней тяжести (по классификации CTCAE, версия 4), отмеченные в основной группе (N=800), вторая — в группе плацебо (N=399); в скобках частота побочных реакций степени тяжести 3–4.
Общие расстройства: астенические состояния1 50,6% (9%) и 44,4% (9,3%); периферический отек 15,4% (1%) и 13,3% (0,8%).
Со стороны скелетно-мышечной системы и соединительной ткани: боль в спине 26,4% (5,3%) и 24,3% (4%); артралгия 20,5% (2,5%) и 17,3% (1,8%); скелетно-мышечная боль 15% (1,3%) и 11,5% (0,3%); мышечная слабость 9,8% (1,5%) и 6,8% (1,8%); скелетно-мышечная ригидность 2,6% (0,3%) и 0,3% (0%).
Со стороны ЖКТ: диарея 21,8% (1,1%) и 17,5% (0,3%).
Со стороны сосудов: приливы 20,3% (0%) и 10,3% (0%); гипертензия 6,4% (2,1%) и 2,8% (1,3%).
Со стороны нервной системы: головная боль 12,1% (0,9%) и 5,5% (0%); головокружение2 9,5% (0,5%) и 7,5% (0,5%); компрессия спинного мозга и синдром конского хвоста 7,4% (6,6%) и 4,5% (3,8%); парестезия 6,6% (0%) и 4,5% (0%); психические расстройства3 4,3% (0,3%) и 1,8% (0%); гипестезия 4% (0,3%) и 1,8% (0%).
Инфекции и инвазии: инфекция верхних дыхательных путей4 10,9% (0%) и 6,5% (0,3%); инфекция нижних дыхательных путей и легких5 8,5% (2,4%) и 4,8% (1,3%).
Нарушения психики: бессонница 8,8% (0%) и 6% (0,5%); чувство страха 6,5% (0,3%) и 4% (0%).
Со стороны почек и мочевых путей: гематурия 6,9% (1,8%) и 4,5% (1%); поллакиурия 4,8% (0%) и 2,5% (0%).
Травмы, интоксикации и осложнения процедур: падения 4,6% (0,3%) и 1,3% (0%); непатологические переломы 4% (1,4%) и 0,8% (0,3%).
Со стороны кожи и подкожных тканей: зуд 3,8% (0%) 1,3% (0%); сухость кожи 3,5% (0%) и 1,3% (0%).
Со стороны органов дыхания: носовое кровотечение 3,3% (0,1%) и 1,3% (0,3%).
1Включая астению и повышенную утомляемость.
2Включая головокружение и вертиго.
3Включая амнезию, нарушение памяти, когнитивные нарушения и нарушение внимания.
4Включая назофарингит, инфекцию верхних дыхательных путей, синусит, ринит, фарингит и ларингит.
5Включая пневмонию, инфекцию нижних дыхательных путей, бронхит и инфекцию легких.
Исследование 2: метастатический КРРПЖ у пациентов, ранее не получавших химиотерапию
В исследование 2 были включены 1717 пациентов с метастатическим КРРПЖ, которые предварительно не получали цитотоксическую химиотерапию, из которых 1715 пациентов получили по крайней мере 1 дозу исследуемого ЛС. Средняя продолжительность лечения составила 17,5 мес в группе получавших энзалутамид и 4,6 мес — в группе плацебо. Побочные реакции степени тяжести 3–4 отмечались у 44% пациентов в основной группе и 37% пациентов в группе плацебо. Прекращение лечения из-за побочных реакций отмечено у 6% пациентов в группе получавших энзалутамид и 6% пациентов в группе плацебо. Чаще всего к прекращению лечения приводила такая побочная реакция, как повышенная утомляемость/астения, которые возникали у 1% пациентов в каждой из исследуемых групп. Ниже перечислены побочные реакции, отмеченные в исследовании 2, которые возникали с частотой ≥2% в группе получавших энзалутамид по сравнению с группой плацебо; данные приведены в процентах в следующей последовательности: первая цифра — побочные реакции всех степеней тяжести (по классификации CTCAE, версия 4), отмеченные в основной группе (N=871), вторая — в группе плацебо (N=844); в скобках частота побочных реакций степени тяжести 3–4.
Общие расстройства: астенические состояния1 46,9% (3,4%) и 33% (2,8%); периферический отек 11,5% (0,2%) и 8,2% (0,4%).
Со стороны скелетно-мышечной системы и соединительной ткани: боль в спине 28,6% (2,5%) и 22,4% (3%); артралгия 21,4% (1,6%) и 16,1% (1,1%).
Со стороны ЖКТ: запор 23,2% (0,7%) и 17,3% (0,4%); диарея 16,8% (0,3%) и 14,3% (0,4%).
Со стороны сосудов: приливы 18% (0,1%) и 7,8% (0%); гипертензия 14,2% (7,2%) и 4,1% (2,3%).
Со стороны нервной системы: головокружение2 11,3% (0,3%) и 7,1% (0%); головная боль 11% (0,2%) и 7% (0,4%); дисгевзия 7,6% (0,1%) и 3,7% (0%); психические расстройства3 5,7% (0%) и 1,3% (0,1%); синдром беспокойных ног 2,1% (0,1%) и 0,4% (0%).
Со стороны органов дыхания: одышка4 11% (0,6%) и 8,5% (0,6%).
Инфекции и инвазии: инфекция верхних дыхательных путей5; инфекция нижних дыхательных путей и легких6 7,9% (1,5%) и 4,7% (1,1%).
Нарушения психики: бессонница 8,2% (0,1%) и 5,7% (0%).
Со стороны почек и мочевых путей: гематурия 8,8% (1,3%) и 5,8% (1,3%).
Травмы, интоксикации и осложнения процедур: падения 12,7% (1,6%) и 5,3% (0,7%); непатологические переломы 8,8% (2,1%) и 3% (1,1%).
Со стороны обмена веществ и нарушения питания: снижение аппетита 18,9% (0,3%) и 16,4% (0,7%).
Нарушения, выявленные в ходе обследования: уменьшение массы тела 12,4% (0,8%) и 8,5% (0,2%).
Со стороны репродуктивной системы и грудной железы: гинекомастия 3,4% (0%) и 1,4% (0%).
1Включая астению и повышенную утомляемость.
2Включая головокружение и вертиго.
3Включая амнезию, нарушение памяти, когнитивные нарушения и нарушение внимания.
4Включая одышку, в т. ч. при физической нагрузке и в покое.
5Включая назофарингит, инфекцию верхних дыхательных путей, синусит, ринит, фарингит и ларингит.
6Включая пневмонию, инфекцию нижних дыхательных путей, бронхит и инфекцию легких.
Отклонения лабораторных показателей. В данных 2 рандомизированнных клинических испытаний нейтропения степени тяжести 1–4 возникала у 15% пациентов, получавших энзалутамид (1% пациентов со степенью тяжести 3–4), и 6% пациентов, получавших плацебо (0,5% пациентов со степенью тяжести 3–4). Частота возникновения тромбоцитопении степени тяжести 1–4 составила 6% у пациентов, получавших энзалутамид (0,3% пациентов со степенью тяжести 3–4), и 5% пациентов в группе плацебо (0,5% пациентов со степенью тяжести 3–4). Повышение уровня АЛТ со степенью тяжести 1–4 возникало у 10% пациентов в основной группе (0,2% пациентов со степенью тяжести 3–4) и 16% пациентов в контрольной группе (0,2% со степенью тяжести 3–4), а увеличение уровня билирубина — у 3% (0,1%) и 2% (0%) соответственно.
Инфекции. Исследование 1: умерли от инфекций или сепсиса 1% пациентов, получавших энзалутамид, 0,3% пациентов, получавших плацебо. Исследование 2: в каждой из групп 1 пациент (0,1%) имел инфекцию, приведшую к смерти.
Падения и травмы, связанные с падением. В данных 2 рандомизированных клинических испытаний падения, включая травмы, связанные с падением, случались у 9% пациентов в группе получавших энзалутамид, по сравнению с 4% пациентов в группе плацебо. Падения не были связаны с потерей сознания или судорогами. Травмы, связанные с падением, были более серьезными у пациентов, получавших энзалутамид, и включали непатологические переломы, травмы суставов и гематомы.
Гипертензия. В данных 2 рандомизированных клинических испытаний гипертензия отмечалась у 11% пациентов, получавших энзалутамид, и 4% пациентов контрольной группы. Гипертензивный криз не зарегистрирован ни у одного из пациентов. Частота гипертонии была сопоставимой в обеих исследуемых группах. Гипертензия привела к отмене лечения у <1% пациентов в каждой группе.
Опыт постмаркетинговых наблюдений. В период после разрешения энзалутамида к медицинскому применению идентифицирована дополнительная неврологическая побочная реакция — синдром обратимой задней энцефалопатии. Так как сообщения об этой реакции поступили в добровольном порядке от популяции неустановленного размера, не представляется возможным реально оценить частоту этой побочной реакции или установить причинно-следственную связь с применением энзалутамида.
Взаимодействие
Ингибиторы и индукторы CYP2C8. Фермент CYP2C8 играет важную роль в выведении энзалутамида и формировании его активного метаболита. После перорального применения сильного ингибитора CYP2C8 гемфиброзила (600 мг 2 раза в день) у здоровых пациентов мужского пола AUC энзалутамида увеличилась на 326%, тогда как Сmax уменьшилась на 18%. В расчете на сумму несвязанного энзалутамида плюс несвязанный активный метаболит AUC увеличилась на 77%, в то время как Сmax снизилась на 19%. Во время лечения энзалутамидом следует избегать приема сильных ингибиторов (например гемфиброзил) или индукторов (например рифампицин) фермента CYP2C8 или применять их с осторожностью. Если пациентам необходимо совместно применять сильный ингибитор CYP2C8, дозу энзалутамида следует снизить до 80 мг 1 раз в день.
Ингибиторы и индукторы CYP3A4. Фермент CYP3A4 играет незначительную роль в метаболизме энзалутамида. После приема сильного ингибитора фермента CYP3A4 итраконазола (200 мг 1 раз в день) здоровыми добровольцами AUC энзалутамида увеличилась на 41%, в то время как Сmax не изменилась. В расчете на сумму несвязанного энзалутамида плюс несвязанный активный метаболит AUC увеличилась на 27%, тогда как Сmax снова осталась без изменений. При совместном применении энзалутамида с ингибиторами или индукторами CYP3A4 коррекция дозы не требуется.
Индукция ферментов. Энзалутамид является сильным индуктором ферментов и повышает синтез многих ферментов и транспортеров, поэтому он взаимодействует со многими обычными ЛС, которые являются субстратами ферментов или транспортерами. Снижение концентрации в плазме может быть существенным и вести к потере или уменьшению клинического эффекта. Существует также риск образования активных метаболитов. К ферментам, образование которых может быть индуцировано, относятся CYP3A в печени и кишечнике, CYP2C9, CYP2C19, CYP1B6 и UGT1A1. Также возможна индукция транспортного белка Р-gp и других транспортеров, а также, например MRP2, BCRP и ОАТР1В1.
Исследования in vivo показали, что энзалутамид является сильным индуктором CYP3A4 и умеренным индуктором CYP2C9 и CYP2C19. Совместное применение энзалутамида (160 мг 1 раз в день) у больных раком предстательной железы привело к 86% снижению AUC мидазолама (субстрат CYP3A4), 56% снижению AUC S-варфарина (субстрат CYP2C9) и 70% снижению AUC омепразола (субстрат CYP2C19). Также возможна индукция UGT1A1. В клиническом исследовании у пациентов с метастатическим КРРПЖ прием энзалутамида (160 мг 1 раз в день) не оказывал клинически значимый эффект на фармакокинетику доцетаксела, вводимого в/в (75 мг/м в/в каждые 3 нед). AUC доцетаксела снизилась на 12% (среднее геометрическое отношение (СГО)=0,882 (90% ДИ: 0,767; 1,02), тогда как Сmax снизилась на 4% (СГО=0,963 (90% ДИ: 0,834; 1,11).
Энзалутамид также взаимодействует с определенными ЛС, которые выводятся в процессе метаболизма или активного транспорта. Если их терапевтический эффект имеет большое значение для пациента и коррекция дозы на основе контроля эффективности или концентрации в плазме невозможна, приема этих ЛС следует избегать или применять их с осторожностью. Предполагается, что риск повреждения печени после приема парацетамола выше у пациентов, которым одновременно вводили индукторы ферментов.
К ЛС, которые могут взаимодействовать с энзалутамидом, относятся: анальгетики (например фентанил, трамадол), антибиотики (например кларитромицин, доксициклин), противоопухолевые ЛС (например кабазитаксел), антикоагулянты (например аценокумарол, варфарин), противоэпилептические ЛС (например карбамазепин, клоназепам, фенитоин, примидон, вальпроевая кислота), нейролептики (например галоперидол), бета-адреноблокаторы (например бисопролол, пропранолол), БКК (например дилтиазем, фелодипин, никардипин, нифедипин, верапамил), сердечные гликозиды (например дигоксин), ГКС (например дексаметазон, преднизолон), противовирусные препараты для лечения ВИЧ-инфекции (например индинавир, ритонавир), снотворные ЛС (например диазепам, мидазолам, золпидем), статины, метаболизируемые с участием фермента CYP3A4 (например аторвастатин, симвастатин), тиреоидные ЛС (например левотироксин).
Все индукционные возможности энзалутамида могут проявиться приблизительно через 1 мес после начала лечения, после достижения стабильной плазменной концентрации энзалутамида, хотя некоторые индукционные эффекты могут стать заметными и раньше. У пациентов, принимающих ЛС, которые являются субстратами ферментов CYP2B6, CYP3A4, CYP2C9, CYP2C19 или UGT1A1, следует оценивать возможное снижение фармакологического воздействия (или увеличение воздействия в случае образования активных метаболитов) в течение первого месяца лечения энзалутамидом и соответствующим образом корректировать дозу. Учитывая длительный T1/2 энзалутамида (5,8 сут), влияние на образование ферментов может сохраняться в течение 1 мес и более после прекращения применения энзалутамида. При прекращении лечения энзалутамидом может потребоваться постепенное снижение дозы сопутствующих ЛС.
Субстраты CYP2C8. Энзалутамид (160 мг 1 раз в день) не вызывает клинически значимых изменений AUC или Сmax пиоглитазона (субстрат CYP2C8). AUC пиоглитазона увеличивается на 20%, в то время как Сmax снижается на 18%. Если субстрат CYP2C8 применяют совместно с энзалутамидом, коррекция дозы не требуется.
Субстраты Р-gp. Данные in vitro показывают, что энзалутамид может быть ингибитором эффлюксного транспортера Р-gp. Действие энзалутамида на субстраты Р-gp in vivo не оценивали, однако в условиях клинического применения энзалутамид может быть индуктором Р-gp через активацию ядерного прегнанрецептора (прегнан-Х-рецептор). ЛС с узким терапевтическим диапазоном, являющиеся субстратами Р-gp (например колхицин, дабигатрана этексилат, дигоксин), следует с осторожностью применять одновременно с энзалутамидом, а для поддержания оптимальной концентрации в плазме может потребоваться коррекция дозы.
Субстраты BCRP, MRP2, транспортеры ОАТ3 и ОСТ1. На основе данных лабораторных исследований нельзя исключить ингибирования BCRP и MRP2 (в кишечнике), а также транспортеров ОАТ3 и ОСТ1 (системного). Теоретически, индукция этих транспортеров также возможна, и суммарный эффект в настоящее время неизвестен.
ЛС, удлиняющие интервал QT. В связи с тем, что андрогендепривационная терапия может удлинять интервал QT, должно быть тщательно оценено одновременное применение энзалутамида с ЛС, удлиняющими интервал QT, а также с ЛС, которые могут вызывать возникновение желудочковой тахикардии типа «пируэт», такими как антиаритмические препараты класса IA (например хинидин, дизопирамид) или III (например амиодарон, соталол, дофетилид, ибутилид), метадон, моксифлоксацин, нейролептики.
Влияние пищи на воздействие энзалутамида. Прием пищи не оказывает клинически значимое влияние на степень воздействия энзалутамида. В клинических исследованиях энзалутамид применяли независимо от приема пищи.
RxList
ЛС-ингибиторы CYP2C8
Совместное применение сильного ингибитора CYP2C8 (гемфиброзил) увеличивает составную AUC энзалутамида и N-десметилэнзалутамида в 2,2 раза. По возможности следует избегать совместного применения энзалутамида с сильными ингибиторами CYP2C8. Если такого применения нельзя избежать, необходимо уменьшить дозу энзалутамида.
ЛС-индукторы CYP3A4
Совместное применение рифампицина (сильный индуктор CYP3A4 и умереннный индуктор CYP2С8) уменьшает составную AUC энзалутамида и N-десметилэнзалутамида на 37%. По возможности следует избегать совместного применения индукторов CYP3A4 (например карбамазепин, фенобарбитал, фенитоин, рифабутин, рифампицин, рифапентин) с энзалутамидом. Зверобой может уменьшить экспозицию энзалутамида, и их совместное применение противопоказано. Если совместного применения сильного индуктора CYP3A4 и энзалутамида нельзя избежать, следует увеличить дозу энзалутамида.
Влияние энзалутамида на ферменты, участвующие в метаболизме ЛС
Энзалутамид является сильным индуктором CYP3A4 и умеренным индуктором CYP2C9 и CYP2C19 у людей. В равновесном состоянии энзалутамид уменьшал плазменную концентрацию мидазолама (субстрат CYP3A4), варфарина (субстрат CYP2C9) и омепразола (субстрат CYP2C19). Следует избегать совместного применения энзалутамида с ЛС, имеющими узкий терапевтический индекс, которые метаболизируются CYP3A4 (например алфентанил, циклоспорин, дигидроэрготамин, эрготамин, фентанил, пимозид, хинидин, сиролимус и такролимус), CYP2C9 (например фенитоин, варфарин) и CYP2C19 (например S-мефенитоин), т.к. энзалутамид может уменьшить их экспозицию. Если совместного применения с варфарином нельзя избежать, необходимо проводить дополнтельный контроль МНО.
Передозировка
Антидотов энзалутамида не существует.
В случае передозировки лечение энзалутамидом следует прекратить и принять общие меры с учетом T1/2 5,8 сут. После передозировки у пациентов может быть повышенный риск развития судорог.
RxList
В случае передозировки следует прекратить лечение энзалутамидом и начать общие поддерживающие мероприятия с учетом T1/2 5,8 сут. В исследовании с увеличением дозы не было отмечено развитие судорог в дозе ≤240 мг/сут, тогда как 3 случая развития судорог были отмечены при дозах 360, 480 и 600 мг/сут, по одному в каждой дозе. При передозировке существует повышеный риск развития судорог.
Способ применения и дозы
Внутрь, независимо от приема пищи, рекомендуемая суточная доза составляет 160 мг 1 раз в день.
Меры предосторожности
Влияние на способность управлять транспортными средствами и механизмами. Энзалутамид может оказывать умеренное влияние на способность управлять автомобилем и работать с механизмами, т.к. были зарегистрированы психические и неврологические нарушения, включая судороги. Пациенты с судорогами или другими предрасполагающими факторами в анамнезе должны быть предупреждены о риске при вождении или эксплуатации механизмов. Исследований с целью определения воздействия применения энзалутамида на способность управлять автомобилем и работать с механизмами не проводилось.
RxList
Судороги
В исследовании 1, в которое были включены пациенты, предварительно получавшие доцетаксел, у 7 из 800 (0,9%) пациентов, получавших энзалутамид, отмечались судороги; в контрольной группе плацебо такие случаи не были зарегистрированы. Судороги возникали в период от 31 до 603 дней после начала применения энзалутамида. В исследовании 2 с участием пациентов, ранее не получавших химиотерапию, судороги отмечались у 1 из 871 (0,1%) пациента в группе получавших энзалутамид и 1 из 844 (0,1%) пациентов в группе плацебо. Пациентам, у которых случились судороги, была перманентно отменена терапия энзалутамидом, и все случаи судорог были разрешены. Клинический опыт повторного применения энзалутамида у пациентов, перенесших судороги, отсутствует.
Данные по безопасности применения энзалутамида у пациентов с предрасполагающими факторами риска развития судорог отсутствуют, т.к. такие пациенты исключались из испытаний. Критерии исключения включали судороги в анамнезе, сопутствующее повреждение головного мозга с потерей сознания, транзиторные ишемические атаки в течение последних 12 мес, цереброваскулярные нарушения, метастазы в головной мозг и артериовенозную мальформацию головного мозга. В исследовании 1 исключалось сопутствующее применение ЛС, способных снижать порог судорожной готовности, в то время как в исследовании 2 применение подобных ЛС разрешалось.
Ввиду возможности развития судорог, связанных с применением энзалутамида, пациентов следует предупреждать о риске вовлечения в любую деятельность, в которой внезапная потеря сознания может нанести серьезный ущерб им самим или окружающим их лицам. Пациентам, у которых во время лечения отмечено развитие судорог, необходимо перманентно отменить лечение энзалутамидом.
Синдром обратимой задней энцефалопатии
У пациентов, получавших энзалутамид, отмечались случаи синдрома обратимой задней энцефалопатии (см. «Побочные действия»). Синдром обратимой задней энцефалопатии представляет собой неврологическое заболевание, которое характеризуется быстро развивающимися симптомами, такими как судороги, головная боль, апатия, смятение, слепота, и другими расстройствами зрения и неврологическими нарушениями, сопровождающимися или не сопровождающимися гипертензией. Диагноз требует подтверждения путем получения изображения мозга, предпочтительно методом МРТ. Необходимо отменить энзалутамид при развитии синдрома обратимой задней энцефалопатии.
Источники информации
Обобщенные материалы www.grls.rosminzdrav.ru, 2016 и www.rxlist.com, 2015.
Торговые названия с действующим веществом Энзалутамид
Кстанди — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер :
ЛП-003605
Действующее вещество :
Энзалутамид
Лекарственная форма :
капсулы
Состав :
На 1 капсулу:
Раствор-наполнитель
Действующее вещество: энзалутамид (MDV3100) 40,0 мг;
Вспомогательные вещества: каприлокапроил макроголглицериды 905,81 мг, бутилгидроксианизол 0,095 мг, бутилгидрокситолуол 0,095 мг; гелевая масса 444,3 мг (желатин 260,6 мг, вода очищенная 191,7 мг, раствор сорбитола и сорбитана 90,3 мг, глицерин 90,3 мг, титана диоксид 3,10 мг); черные чернила — незначительное количество (этанол безводный, этилацетат, пропиленгликоль, краситель железа оксид черный, поливинилацетатфталат, вода очищенная, изопропиловый спирт, макрогол 400, раствор аммиака концентрированный).
Описание :
Непрозрачная, продолговатая мягкая желатиновая капсула от белого до почти белого цвета с маркировкой «ENZ» черными чернилами на одной стороне.
Содержимое капсулы — маслянистая жидкость светло-жёлтого цвета.
Фармакотерапевтическая группа :
Антиандроген
АТХ :
L.02.B.B.04
Фармакодинамика :
Механизм действия
Рак предстательной железы зависит от наличия андрогенов и реагирует на подавление активности андрогенных рецепторов. Несмотря на низкие или даже неопределяемые уровни андрогенов в плазме крови, активность андрогенных рецепторов на клетках опухоли продолжает способствовать прогрессированию болезни. Стимуляция роста опухолевых клеток с помощью андрогенных рецепторов требует их транслокации в ядро клетки и связывания с ДНК.
Энзалутамид является мощным ингибитором андрогенных рецепторов, который блокирует несколько этапов сигнального пути андрогенных рецепторов.
Энзалутамид конкурентно ингибирует связывание андрогенов с андрогенными рецепторами, угнетает ядерную транслокацию активированных рецепторов и ингибирует связывание активированных рецепторов андрогенов с ДНК даже в условиях избыточной экспрессии андрогенных рецепторов и в клетках опухоли, резистентных к антиандрогенам. Лечение энзалутамидом подавляет рост клеток опухоли предстательной железы и может индуцировать гибель клеток и регрессию опухоли.
В доклинических исследованиях у энзалутамида отсутствовала активность агониста андрогенных рецепторов.
Фармакодинамика
В ходе клинического исследования III фазы у пациентов после неэффективности химиотерапии доцетакселом, у 54% пациентов, получавших
энзалутамид, по сравнению с 1,5% пациентов, получавших плацебо, наблюдалось, по крайней мере, 50%-ное снижение уровня ПСА по сравнению с исходным уровнем.
Клиническая эффективность и безопасность
Эффективность энзалутамида была установлена в двух рандомизированных, плацебо-контролируемых, многоцентровых клинических исследованиях III фазы [CRPC2 (AFFIRM), MDV3100-03 (PREVAIL)] у пациентов с прогрессирующим метастатическим раком предстательной железы, у которых прогрессия заболевания наблюдалась на фоне антиандрогенной терапии [при использовании аналога лютеинизирующего гормона рилизинг-гормона (ЛГРГ) или после билатеральной орхиэктомии]. В исследовании PREVAIL принимали участие пациенты, не получавшие лечения с использованием химиотерапии; при этом в исследовании AFFIRM принимали участие пациенты, получавшие до этого химиотерапию с использованием доцетаксела. Все пациенты продолжали прием аналогов ЛГРГ или перенесли билатеральную орхиэктомию.
Исследование MDV3100-03 (PREVAIL) (пациенты, не получавшие химиотерапию)
1717 пациентов без симптомов или с умеренно выраженными симптомами были рандомизированы 1:1 в группы энзалутамида в дозе 160 мг 1 раз в день (N = 872) либо плацебо 1 раз в день (N = 845).
При проведении предварительно запланированного промежуточного анализа для общей выживаемости было показано, что лечение энзалутамидом приводило к статистически достоверному увеличению общей выживаемости по сравнению с плацебо со снижением риска смерти на 29,4%, [отношение рисков (ОР) = 0,706 (95% ДИ: 0,596; 0,837), р <0,0001]. На момент проведения промежуточного анализа 27,6% (241 из 872) пациентов в группе энзалутамида умерли по сравнению с 35,4% (299 из 845) пациентов в группе плацебо. Расчетная медиана общей выживаемости составила 32,4 месяца (95% ДИ: 30,1, не достигнута) в группе энзалутамида и 30,2 месяца (95% ДИ: 28,0, не достигнута) в группе плацебо. Кроме того, 40% пациентов в группе энзалутамида и 70% пациентов в группе плацебо получали последующие варианты терапии с доказанным увеличением общей выживаемости.
При проведении запланированного анализа рБПВ было продемонстрировано статистически достоверное улучшение между группами лечения со снижением риска радиографической прогрессии или смерти на 81,4% в группе энзалутамида [ОР = 0,186 (95% ДИ: 0,149, 0,231), р < 0,0001]. Прогрессия отмечалась у ста восемнадцати (14%) пациентов в группе энзалутамида и у 321 (40%) пациентов в группе плацебо. Медиана рБПВ не была достигнута (95% ДИ: 13.8, не достигнута) в группе энзалутамида и составила 3.9 месяцев (95% ДИ: 3,7, 5,4) в группе плацебо. Одинаковое улучшение рБПВ наблюдалось среди всех заранее определенных подгрупп пациентов (возраст, исходный статус ECOG, исходный уровень ПСА и ЛДГ, балл Глисона на момент диагноза, висцеральное заболевание при скрининге). При проведении запланированного анализа рБПВ во время наблюдения, который основывался на оценке радиографической прогрессии исследователем, было продемонстрировано статистически достоверное улучшение между группами лечения со снижением риска радиографической прогрессии или смерти на 69,3% в группе энзалутамида [ОР = 0,307 (95% ДИ: 0.267, 0,353), р < 0,0001]. Медиана рБПВ составила 19,7 месяца в группе энзалутамида и 5,4 месяца в группе плацебо.
В дополнение к составным первичным показателям эффективности статистически достоверное улучшение было продемонстрировано в отношении следующих проспективно определенных конечных точек.
Медиана времени до начала цитотоксической химиотерапии составила 28,0 месяцев в группе энзалутамида и 10,8 месяцев в группе плацебо (ОР = 0,350, 95% ДИ: [0,303, 0,403], р< 0,0001).
Процент пациентов в группе энзалутамида с исходно определявшимся заболеванием и имевших объективный ответ со стороны мягких тканей составил 58,8% (95% ДИ: 53,8, 63,7) по сравнению с 5,0% (95% ДИ: 3,0, 7,7) пациентов в группе плацебо. Абсолютное различие в объективном ответе со стороны мягких тканей между группами энзалутамида и плацебо составило 53,9% (95% ДИ: 48,5%, 59,1%, р < 0,0001). Полный ответ был отмечен у 19,7% пациентов в группе энзалутамида по сравнению с 1,0% пациентов в группе плацебо, и частичный ответ был отмечен у 39,1% пациентов в группе энзалутамида против 3,9% пациентов в группе плацебо.
Энзалутамид достоверно снижал риск первого костного осложнения на 28% [ОР = 0,718 (95% ДИ: 0,610, 0,844) р < 0,0001]. У пациентов, получавших
энзалутамид, отмечался достоверно более высокий ПСА-ответ (определялся как снижение > 50% от исходного уровня), по сравнению с пациентами, получавшими плацебо, 78,0% против 3,5% (различие = 74,5%, р < 0,0001).
Медиана времени до ПСА-прогрессии по критериям PCWG2 составила 11.2 месяца для пациентов в группе энзалутамида и 2,8 месяца для пациентов в группе плацебо [ОР = 0,169, (95% ДИ: 0,147, 0,195), р < 0,0001].
Лечение энзалутамидом снижало риск ухудшения по шкале FACT-Р на 37,5% по сравнению с плацебо (р < 0,001). Медиана времени до ухудшения по шкале FACT-P составила 11,3 месяцев в группе энзалутамида и 5,6 месяцев в группе плацебо.
Исследование CRPC2 (AFFIRM) (пациенты, получавшие химиотерапию)
Эффективность и безопасность энзалутамида у пациентов с метастатическим кастрационно-резистентным раком предстательной железы (КРРПЖ), которые получали
доцетаксел и использовали аналог ЛГРГ или перенесли орхиэктомию, оценивалась в рандомизированном, плацебо-контролируемом, многоцентровом клиническом исследовании III фазы. 1199 пациентов были рандомизированы 2:1 в группы энзалутамида в дозе 160 мг 1 раз в день (N = 800) либо плацебо 1 раз в день (N = 399).
Запланированный по протоколу промежуточный анализ после 520 смертей продемонстрировал статистически значимое превосходство в общей выживаемости у пациентов, получавших
энзалутамид, по сравнению с пациентами из группы плацебо: медиана выживаемости 18,4 и 13,6 месяцев соответственно (ОР = 0,631 95% ДИ: [0,529, 0,752], р< 0,0001).
Радиографическая выживаемость без прогрессии (оценка исследователей с использованием критериев оценки ответа солидных опухолей на терапию (RESICT) версии 1.1 для мягких тканей и появление 2 или более поражений костей на остеосцинтиграфии) составила 8,3 месяца у пациентов, получавших
энзалутамид, и 2,9 месяца у пациентов, получавших плацебо (ОР = 0,404, 95% ДИ: [0,350, 0,466], р < 0,0001). Анализ включал 216 смертей без документированного прогрессирования и 645 документально подтвержденных случаев прогрессии, 303 из которых (47%) были связаны с прогрессированием в мягких тканях, 268 (42%) были обусловлены прогрессированием костных метастазов и 74 (11%) были связаны с поражением мягких и костных тканей. Подтвержденное снижение уровня ПСА на 50% или 90% наблюдалось у 54,0% и 24,8% пациентов, которые получали
энзалутамид, и у 1,5% и 0,9% пациентов, которые получали плацебо (р<0,0001). Медиана времени до ПСА-прогрессии составила 8,3 месяца у пациентов, которые получали
энзалутамид, и 3,0 месяца у пациентов из группы плацебо (ОР = 0,248, 95% ДИ: [0,204, 0,303], р < 0,0001).
Медиана времени до появления первого костного осложнения составила 16,7 месяцев у пациентов, получавших
энзалутамид, и 13,3 месяца у пациентов, получавших плацебо (ОР = 0,688, 95% ДИ: [0,566, 0,835], р <0,0001). Эффективность энзалутамида у пациентов, получавших
абиратерон, не была изучена.
Пожилые люди
Из 1671 пациента, получавшего
энзалутамид в исследованиях фазы III, 1261 пациент (75%) был в возрасте 65 лет и старше и 516 пациентов (31%) были в возрасте 75 лет и старше. У данных пожилых пациентов и более молодых пациентов не отмечалось каких-либо различий в безопасности и эффективности.
Фармакокинетика:
Энзалутамид плохо растворим в воде. В данном препарате растворимость энзалутамида увеличена благодаря использованию каприлокапроил макроголглицеридов и эмульгатора/сурфактанта. В доклинических исследованиях абсорбция энзалутамида увеличивалась при растворении в каприлокапроил макроглицеридах.
Фармакокинетика энзалутамида была изучена у больных раком предстательной железы и у здоровых добровольцев. Средний период полувыведения (Т1/2) энзалутамида у пациентов после однократного перорального приема составляет 5,8 суток (от 2,8 до 10,2 дней), а равновесная концентрация достигается примерно через месяц. При ежедневном пероральном введении
энзалутамид аккумулируется примерно в 8,3 раз быстрее разовой дозы. Суточные колебания концентрации в плазме крови незначительные (соотношение от пика до минимума 1,25). Выведение энзалутамида, главным образом, осуществляется путем печеночного метаболизма с образованием активного метаболита, который является столь же активным, как и
энзалутамид и циркулирует в плазме примерно в той же концентрации, что и
энзалутамид.
Абсорбция
Максимальная концентрация в плазме (Сmах) энзалутамида у пациентов наблюдалась через 1-2 часа после приема. На основе изучения баланса массы у людей, всасывание при пероральном приеме энзалутамида оценивается, по меньшей мере, на уровне 84,2%.
Энзалутамид не является субстратом эффлюксных транспортеров Р-гликопротеина или BCRP. Стабильный уровень, среднее значение Сmах энзалутамида и его активного метаболита составляет 16,6 пг/мл (коэффициент вариации [CV] 23%) и 12,7 пг/мл (CV 30%) соответственно.
Прием пищи не оказывает значимого влияния на степень абсорбции энзалутамида. В клинических исследованиях Кстанди применялся независимо от приема пищи.
Распределение
Средний объем распределения энзалутамида у пациентов после однократного перорального приема составляет 110 л (CV 29%). Объем распределения энзалутамида больше, чем объем общего количества жидкости в организме, что указывает на активное распределение в периферических тканях. Исследования на грызунах показали, что
энзалутамид и его активный метаболит может проникать через гематоэнцефалический барьер.
Энзалутамид на 97-98% связывается с белками плазмы, в первую очередь с альбумином. Активный метаболит связывается с белками плазмы на 95%. В исследованиях in vitro не отмечалось замещения связывания с белками плазмы между энзалутамидом и другими препаратами с высокой связывающей способностью (
варфарин,
ибупрофен и
салициловая кислота).
Метаболизм
Энзалутамид активно метаболизируется. В плазме крови человека присутствуют два основных метаболита: N-десметил
энзалутамид (активный) и производное соединение карбоновой кислоты (неактивный).
Энзалутамид метаболизируется ферментами CYP2C8 и, в меньшей степени, CYP3A4/5, которые играют важную роль в формировании активного метаболита. В исследовании in vitro N-десметил
энзалутамид метаболизируется до метаболита карбоновой кислоты за счет карбоксилэстеразы 1, которая также играет небольшую роль в метаболизме энзалутамида до метаболита карбоновой кислоты. N-десметил
энзалутамид не метаболизировался ферментами CYP in vitro.
В условиях клинического применения
энзалутамид является сильным индуктором фермента CYP3A4, умеренным индуктором ферментов CYP2C9 и CYP2C19, и не имеет клинически значимого влияния на фермент CYP2C8.
Выведение
Средний кажущийся клиренс энзалутамида у пациентов составляет от 0,520 и 0,564 л/час. При пероральном приеме меченного 14С-энзалутамида к 77 дню выводилось приблизительно 84,6% радиоактивной дозы: 71,0% выводился почками (в первую очередь как неактивный метаболит с незначительным количеством энзалутамида и активного метаболита), и 13,6% выводился через кишечник (0,39% дозы энзалутамида в неизмененном виде).
Данные лабораторных исследований показывают, что
энзалутамид не является субстратом для ОАТР1В1, ОАТР1В3 или ОСТ1; и N-десметил
энзалутамид не является субстратом для Р-гликопротеина и BCRP.
Данные лабораторных исследований показывают, что
энзалутамид и его основные метаболиты не ингибируют следующие транспортеры при клинически значимых концентрациях: ОАТР1В1, ОАТР1В3, ОСТ2 или ОАТ1.
Линейность
В диапазоне доз от 40 до 160 мг серьезных отклонений от пропорциональности дозы не наблюдается. Значения стабильного уровня Cmin энзалутамида и его активного метаболита у отдельных пациентов оставались неизменными в течение более одного года продолжительной терапии, демонстрируя временную линейную фармакокинетику после достижения стабильного уровня концентрации.
Особенности фармакокинетики у отдельных категорий пациентов
Пациенты с почечной недостаточностью
Исследования по применению энзалутамида у пациентов с почечной недостаточностью не проводились. Пациенты с уровнем сывороточного креатинина > 177 мкмоль/л (2 мг/дл) были исключены из клинических исследований. Основываясь на популяционном анализе фармакокинетики, для пациентов со значениями клиренса креатинина > 30 мл/мин (по формуле Кокрофт и Голт) коррекция дозы не требуется.
Энзалутамид не изучался у пациентов с тяжелой почечной недостаточностью (клиренс креатинина < 30 мл/мин) или терминальной стадией почечной недостаточности, поэтому при лечении этих пациентов рекомендуется назначать препарат с осторожностью. Маловероятно, что
энзалутамид будет значительно выводиться с помощью интермиттирующего гемодиализа или постоянного амбулаторного перитонеального диализа.
Пациенты с печеночной недостаточностью
Фармакокинетика энзалутамида была изучена у пациентов с исходной легкой (N = 6) или умеренной (N = 
Пациенты с исходной тяжелой печеночной недостаточностью (класс С по шкале Чайлд-Пью) были исключены из клинических исследований.
Расовая принадлежность
Большинство пациентов, участвовавших в клинических исследованиях (>84%), были европейцами. По данным исследования фармакокинетики у пациентов с раком предстательной железы в Японии не отмечалось клинически значимых различий в фармакокинетике между европейцами и японцами. Данных для оценки потенциальных различий фармакокинетики энзалутамида между другими расами недостаточно.
Пожилые люди
Не было отмечено клинически значимого влияния возраста на фармакокинетику энзалутамида. Коррекция дозы у пожилых людей не требуется.
Показания к применению
Кстанди показан для лечения метастатического кастрационно-резистентного рака предстательной железы.
Противопоказания
Гиперчувствительность к активному компоненту или к любому из вспомогательных веществ препарата.
Противопоказано женщинам и детям.
Тяжелое нарушение функции печени.
С осторожностью :
Риск развития судорог
Кстанди следует применять с осторожностью у пациентов, страдающих эпилептическими припадками или другими предрасполагающими факторами, включая, но не ограничиваясь, травмы головного мозга, инсульт, первичные опухоли головного мозга или метастазы в головной мозг, алкоголизм. Кроме того, риск развития судорог может быть повышен у пациентов, получающих сопутствующую терапию лекарственными средствами, которые снижают судорожный порог.
Синдром задней обратимой энцефалопатии
В ходе применения пациентами препарата Кстанди были зарегистрированы редкие сообщения о развитии синдрома задней обратимой энцефалопатии (PRES). Синдром задней обратимой энцефалопатии — это редкое обратимое неврологическое заболевание, которое может характеризоваться быстро развивающимися симптомами, такими как судороги, головная боль, спутанность сознания, слепота и другие зрительные и неврологические расстройства, сопровождаемые или несопровождаемые гипертензией. Диагноз синдром задней обратимой энцефалопатии должен быть подтвержден результатами томографии головного мозга, лучше всего результатами МРТ. Рекомендуется прекратить прием препарата Кстанди при подтвержденном диагнозе.
Одновременное применение с другими лекарственными средствами
Энзалутамид является мощным индуктором ферментов и может привести к снижению эффективности многих часто используемых лекарственных средств. Поэтому, начиная лечение энзалутамидом, необходимо провести анализ сопутствующих лекарственных средств. Следует избегать одновременного применения энзалутамида с лекарственными средствами, которые являются чувствительными субстратами многих метаболизирующих ферментов или транспортеров, если их терапевтическое воздействие имеет большое значение для пациента, а также если на основании контроля эффективности или концентрации в плазме невозможно скорректировать дозу.
Следует избегать одновременного применения с варфарином и кумарин-подобными антикоагулянтами. Если Кстанди используется совместно с антикоагулянтом, который метаболизируется ферментом CYP2C9 (например,
варфарин или
аценокумарол), требуется дополнительный контроль международного нормализованного отношения (МНО).
Почечная недостаточность
С осторожностью следует назначать пациентам с тяжелой почечной недостаточностью, так как действие энзалутамида в этой группе пациентов не изучено.
Печеночная недостаточность
С осторожностью следует назначать пациентам с умеренной печеночной недостаточностью (класс В по шкале Чайлд-Пью), так как отсутствуют конечные данные о применении препарата у пациентов с умеренной печеночной недостаточностью. Поскольку нет данных о применении препарата у пациентов с тяжелой печеночной недостаточностью, и
энзалутамид выводится, главным образом, через печень, Кстанди не рекомендуется применять у пациентов с тяжелой печеночной недостаточностью (класс С по шкале Чайлд-Пью).
Недавно перенесенные сердечно-сосудистые заболевания
В исследования III фазы не были включены пациенты, которые недавно перенесли инфаркт миокарда (в течение последних 6 месяцев) или страдают нестабильной стенокардией (в течение последних 3 месяцев), сердечной недостаточностью класса III или IV по шкале Нью-Йоркской кардиологической ассоциации (NYHA) за исключением пациентов с фракцией выброса левого желудочка (ФВЛЖ) более 45%, брадикардией или неконтролируемой артериальной гипертензией. Это необходимо принять во внимание при назначении Кстанди таким пациентам.
Андрогендепривационная терапия может удлинять интервал QT
У пациентов с наличием удлиненного интервала QT или с предрасполагающими факторами и у пациентов, получающих сопутствующую терапию препаратами, которые могут удлинять интервал QT, врачи перед назначением Кстанди должны оценить соотношение пользы и риска, включая возможность возникновения желудочковой тахикардии типа «пируэт».
Применение с химиотерапией
Безопасность и эффективность одновременного применения Кстанди с цитотоксической химиотерапией не установлена. Одновременное назначение энзалутамида не имеет клинически значимого эффекта на фармакокинетику доцетаксела, вводимого внутривенно; однако увеличение частоты нейтропении, вызванной приемом доцетаксела, нельзя исключать.
Вспомогательные вещества
Кстанди содержит
сорбитол (Е420). Пациентам с редкой наследственной непереносимостью фруктозы не следует принимать этот лекарственный препарат.
Беременность и лактация :
Женщины детородного возраста
Нет данных о применении Кстанди у женщин во время беременности, и это лекарственное средство не предназначено для использования у женщин детородного возраста.
Контрацепция для мужчин и женщин
Нет данных, присутствует ли
энзалутамид или его метаболиты в сперме. Если пациент имеет сексуальный контакт с беременной женщиной, во время и в течение 3 месяцев после лечения энзалутамидом требуется использование презерватива. Если пациент имеет сексуальный контакт с женщиной детородного возраста, необходимо использовать презерватив наряду с другими эффективными методами контрацепции во время и в течение 3 месяцев после лечения. Исследования на животных показали репродуктивную токсичность препарата.
Беременность и лактация
Энзалутамид не был изучен у женщин.
Энзалутамид противопоказан беременным женщинам и женщинам детородного возраста.
Способность к зачатию
Исследования на животных показали, что
энзалутамид оказывает воздействие на репродуктивную систему у самцов крыс и собак.
Способ применения и дозы
Дозы
Рекомендуемая суточная доза Кстанди составляет 160 мг (четыре капсулы по 40 мг) 1 раз в день. Капсулы следует проглатывать целиком, запивая водой, их можно принимать независимо от приема пищи.
Медикаментозная кастрация с использованием аналога ЛГРГ должна быть продолжена во время лечения у пациентов, не прошедших хирургическую кастрацию.
Если пациент пропустил прием Кстанди в обычное время, предписанную дозу следует принять как можно ближе к обычному времени. Если пациент пропустил прием препарата в течение целого дня, лечение следует возобновить на следующий день с обычной суточной дозы.
Если у пациента развивается токсичность 3 степени и выше или опасные нежелательные реакции, прием препарата необходимо отменить на одну неделю или до снижения симптомов до уровня 2 степени и ниже, а затем, если это оправдано, возобновить прием в такой же или уменьшенной дозировке (120 или 80 мг).
Одновременное применение с сильными ингибиторами фермента CYP2C8
По возможности, следует избегать одновременного применения сильных ингибиторов фермента CYP2C8. Если пациент должен одновременно принимать сильный ингибитор фермента CYP2C8, дозу энзалутамида необходимо снизить до 80 мг один раз в день. Если применение сильного ингибитора фермента CYP2C8 прекращено, дозу энзалутамида следует повысить до первоначального уровня.
Детский возраст
Энзалутамид противопоказан детям до 18 лет.
Побочное действие
Наиболее частыми нежелательными реакциями являются астения/усталость, «приливы», головная боль и гипертония. Другие важные нежелательные реакции включают падения, непатологические переломы, когнитивные расстройства и нейтропению.
Судороги наблюдались у 0,4% пациентов в группе энзалутамида и у 0,1% пациентов в группе плацебо.
Ниже приведены и распределены по частоте нежелательные реакции, наблюдавшиеся в ходе клинических исследований . Категории частоты распределены следующим образом: очень часто (?1/10); часто (от ?1/100 до <1/10); нечасто (от ?1/1000 до <1/100), редко (от ?1/10 000 до <1/1, 000), очень редко (<1/10 000); неизвестно (невозможно оценить на основании имеющихся данных). Все нежелательные реакции в каждой группе представлены в порядке убывания серьезности.
|
Система органов |
Частота |
|
Нарушения со стороны кроветворной и лимфатической системы |
нечасто: лейкопения, нейтропения |
|
Нарушения со стороны иммунной системы |
неизвестно*: отек языка, отек губ, отек глотки |
|
Системные нарушения |
очень часто: астения/у стал ость |
|
Психические расстройства |
часто: чувство страха нечасто: визуальные галлюцинации |
|
Нарушения со стороны нервной системы |
очень часто: головная боль часто: ухудшение памяти, потеря памяти, нарушение внимания, синдром беспокойных ног нечасто: когнитивные расстройства, судороги неизвестно*: синдром задней обратимой энцефалопатии |
|
Нарушения со стороны репродуктивной системы и молочной железы |
часто: гинекомастия |
|
Нарушение деятельности сердечно-сосудистой системы |
очень часто: «приливы», гипертония неизвестно*: удлинение интервала QT |
|
Нарушения со стороны желудочно-кишечного тракта |
неизвестно*: тошнота, рвота |
|
Нарушения со стороны кожи и подкожных тканей |
часто: сухость кожи, кожный зуд неизвестно*: сыпь |
|
Нарушения со стороны костно-мышечной системы и соединительной ткани |
часто: переломы** неизвестно*: миалгия, мышечный спазм, мышечная слабость, боль в спине |
|
Травмы, отравления и осложнения, вызванные проведением исследовательских процедур |
часто: падения |
* Сообщения, полученные в постмаркетинговый период
** Любые переломы, за исключением патологических
Судороги
В ходе клинических исследований III фазы судороги отмечались у 7 пациентов (0,4%) из 1671 пациента, которые ежедневно принимали
энзалутамид в дозе 160 мг, и у 1 пациента (<0,1%), получавшего плацебо. Доза представляется важным предиктором риска развития судорог, о чем свидетельствуют данные доклинических исследований и данные исследований с увеличением дозы. Из обоих исследованиях III фазы исключались пациенты с судорогами в анамнезе или факторами риска возникновения судорог.
В исследовании AFFIRM судороги наблюдались у шести из 800 пациентов (0,8%), которые принимали 160 мг энзалутамида в сутки после перенесенной химиотерапии, в то время как у пациентов, получавших плацебо, судорог не наблюдалось. Потенциально способствующие факторы, которые могли увеличить риск развития судорог, присутствовали у некоторых из этих пациентов. В исследовании PREVAIL судороги наблюдались у одного из 871 пациента (0,1%), не получавших химиотерапию, которые принимали 160 мг энзалутамида в сутки, и у одного пациента (0,1%), получавшего плацебо.
Механизм, посредством которого
энзалутамид может снижать судорожный порог, неизвестен. Однако он может быть связан с данными исследований in vitro, которые показали, что
энзалутамид и его активный метаболит связываются и могут ингибировать активность хлорных каналов ГАМК-рецепторов.
Передозировка :
Антидотов энзалутамида не существует. В случае передозировки лечение энзалутамидом следует прекратить и принять общие меры с учетом периода полувыведения 5,8 суток. После передозировки у пациентов может быть повышенный риск развития судорог.
Взаимодействие
Ингибиторы и индукторы CYP2C8
Фермент CYP2C8 играет важную роль в выведении энзалутамида и в формировании его активного метаболита. После перорального применения сильного ингибитора CYP2C8 гемфиброзила (600 мг дважды в день) у здоровых пациентов мужского пола AUC энзалутамида увеличилась на 326%, тогда как Сmах энзалутамида уменьшилась на 18%. На сумму несвязанного энзалутамида плюс несвязанный активный метаболит, AUC увеличилась на 77%, в то время как Сmax снизилась на 19%. Во время лечения энзалутамидом следует избегать приема сильных ингибиторов (например, гемфиброзил) или индукторов (например,
рифампицин) фермента CYP2C8, или применять их с осторожностью. Если пациентам необходимо совместно применять сильный ингибитор CYP2C8, дозу энзалутамида следует снизить до 80 мг один раз в день.
Ингибиторы и индукторы CYP3A4
Фермент CYP3A4 играет незначительную роль в метаболизме энзалутамида. После приема сильного ингибитора фермента CYP3A4 итраконазола (200 мг один раз в день) здоровыми добровольцами, AUC энзалутамида увеличилась на 41%, в то время как Сmах не изменилась. На сумму несвязанного энзалутамида плюс несвязанный активный метаболит, AUC увеличилась на 27%, тогда как Сmax снова осталась без изменений. При совместном применении Кстанди с ингибиторами или индукторами CYP3A4 коррекция дозы не требуется.
Индукция ферментов
Энзалутамид является мощным индуктором ферментов и повышает синтез многих ферментов и транспортеров, поэтому он взаимодействует со многими обычными лекарственными средствами, которые являются субстратами ферментов или транспортерами. Снижение концентрации в плазме может быть существенным и вести к потере или уменьшению клинического эффекта. Существует также риск образования активных метаболитов. К ферментам, образование которых может быть индуцировано, относятся CYP3A в печени и кишечнике, CYP2C9, CYP2C19, CYP1B6 и уридин-5′-дифосфат глюкуронозилтрансфераза. Также возможна индукция транспортного белка Р-гликопротеина и других транспортеров, а также, например, белка множественной лекарственной резистентности 2 (MRP2), белка резистентности рака молочной железы (BCRP) и органического анион-транспортирующего полипептида 1В1 (ОАТР1В1). Исследования in vivo показали, что
энзалутамид является сильным индуктором CYP3A4 и умеренным индуктором CYP2C9 и CYP2C19. Совместное применение энзалутамида (160 мг один раз в день) у больных раком предстательной железы привело к 86%-ному снижению AUC мидазолама (субстрат CYP3A4), 56%-ному снижению AUC S-варфарина (субстрат CYP2C9) и 70%-ному снижению AUC омепразола (субстрата CYP2C19). Также возможна индукция UGT1A1. В клиническом исследовании у пациентов с метастатическим КРРПЖ прием Кстанди (160 мг один раз в день) не имел клинически значимого эффекта на фармакокинетику доцетаксела, вводимого внутривенно (75 мг/м2 в/в каждые 3 недели). AUC доцетаксела снизилась на 12% [среднее геометрическое отношение (СТО) = 0,882 (90% ДИ: 0,767, 1,02)], тогда как Сmах снизилась на 4% [СТО = 0,963 (90% ДИ: 0,834, 1,11)].
Также препарат взаимодействует с определенными лекарственными средствами, которые выводятся в процессе метаболизма или активного транспорта. Если их терапевтический эффект имеет большое значение для пациента и коррекцию дозы на основе контроля эффективности или концентрации в плазме сделать не так просто, приема этих лекарственных средств следует избегать или применять их с осторожностью. Предполагается, что, риск повреждения печени после приема парацетамола выше у пациентов, которым одновременно вводили индукторы ферментов.
К группе лекарственных средств, которые могут взаимодействовать с препаратом, относятся, не ограничиваясь:
— Анальгетики (например, фентанил, трамадол)
— Антибиотики (например, кларитромицин, доксициклин)
— Противоопухолевые агенты (например, кабазитаксел)
— Антикоагулянты (например, аценокумарол, варфарин)
— Антиэпилептики (например, карбамазепин, клоназепам, фенитоин, примидон, вальпроевая кислота)
— Нейролептики (например, галоперидол)
— Бета-блокаторы (например, бисопролол, пропранолол)
— Блокаторы кальциевых каналов (например, дилтиазем, фелодипин, никардипин, нифедипин, верапамил)
— Сердечные гликозиды (например, дигоксин)
— Кортикостероиды (например, дексаметазон, преднизолон)
— Антивирусные препараты для лечения ВИЧ-инфекции (например, индинавир, ритонавир)
— Снотворные средства (например, диазепам, мидазолам, золпидем)
— Статины, метаболизируемые с участием фермента CYP3A4 (например, аторвастатин, симвастатин)
— Тиреоидные средства (например, левотироксин)
Все индукционные возможности энзалутамида могут проявиться приблизительно через 1 месяц после начала лечения, после достижения стабильной плазменной концентрации энзалутамида, хотя некоторые индукционные эффекты могут стать заметными и раньше. У пациентов, принимающих лекарственные препараты, которые являются субстратами ферментов CYP2B6, CYP3A4, CYP2C9, CYP2C19, or UGT1A1, следует оценивать возможное снижение фармакологического воздействия (или увеличение воздействия в случае образования активных метаболитов) в течение первого месяца лечения энзалутамидом и соответствующим образом корректировать дозу. Учитывая длительный период полувыведения энзалутамида (5,8 суток), влияние на образование ферментов может сохраняться в течение одного месяца и более после прекращения применения энзалутамида. При прекращении лечения энзалутамидом может потребоваться постепенное снижение дозы сопутствующих лекарственных средств.
Субстраты CYP2C8
Энзалутамид (160 мг один раз в день) не вызывает клинически значимых изменений в AUC или С max пиоглитазона (субстрат CYP2C8). AUC пиоглитазона увеличилась на 20%, в то время как Сmах снизилась на 18%. Если субстрат CYP2C8 применяют совместно с Кстанди, коррекция дозы не требуется.
Субстраты Р-гликопротеина
Данные in vitro показывают, что
энзалутамид может быть ингибитором эффлюксного транспортера Р-гликопротеина. Действие энзалутамида на субстраты Р-гликопротеина in vivo не оценивали, однако в условиях клинического применения
энзалутамид может быть индуктором Р-гликопротеина через активацию ядерного прегнан-рецептора (прегнан-Х-рецептор). Лекарственные препараты с узким терапевтическим диапазоном, являющиеся субстратами для Р-гликопротеина (например,
колхицин, дабигатран этексилат,
дигоксин), при одновременном применении с Кстанди следует применять с осторожностью, а для поддержания оптимальной концентрации в плазме может потребоваться коррекция дозы.
Субстраты белков резистентности рака молочной железы (BCRP), белков множественной лекарственной резистентности 2 (MRP2), транспортеры органических анионов человека 3 типа (ОАТ3) и транспортера органических катионов человека 1 (ОСТ1)
На основе данных лабораторных исследований, нельзя исключить ингибирования BCRP и MRP2 (в кишечнике), а также транспортеров органических анионов человека 3 типа (ОАТ3) и транспортеров органических катионов человека 1 (ОСТ1) (системного). Теоретически, индукция этих транспортеров также возможна, и суммарный эффект в настоящее время неизвестен.
Препараты, удлиняющие интервал QT
В связи с тем, что андрогендепривационная терапия может удлинять интервал QT, должно быть тщательно оценено одновременное применение Кстанди вместе с препаратами, удлиняющими интервал QT, а также препаратами, которые могут вызывать возникновение желудочковой тахикардии типа «пируэт», такими как антиаритмические препараты класса IA (например,
хинидин, дизопирамид) или класса III (например,
амиодарон,
соталол, дофетилид, ибутилид), метадон,
моксифлоксацин, нейролептики и др.
Влияние пищи на воздействие энзалутамида
Прием пищи не имеет клинически значимого влияния на степень воздействия энзалутамида. В клинических исследованиях Кстанди применяли независимо от приема пищи.
Особые указания :
Энзалутамид может иметь умеренное влияние на способность управлять автомобилем и работать с механизмами, так как были зарегистрированы психические и неврологические нарушения, включая судороги. Пациенты с судорогами или другими предрасполагающими факторами в анамнезе должны быть предупреждены о риске при вождении или эксплуатации механизмов. Исследований с целью определения воздействия применения энзалутамида на способность управлять автомобилем и работать с механизмами не проводилось.
Форма выпуска :
Капсулы, 40 мг.
Упаковка :
По 28 капсул в блистере из ПВХ/ПХТФЭ/алюминиевой фольги.
По 1 блистеру в картонный футляр.
По 4 картонных футляра (112 капсул) вместе с инструкцией по медицинскому применению в картонной пачке.
Условия хранения :
Хранить при температуре не выше 25°С.
Хранить в недоступном для детей месте.
Срок годности :
3 года.
Препарат не следует применять после срока годности, указанного на упаковке.
Условия отпуска из аптек :
По рецепту
Владелец регистрационного удостоверения :
Владелец Регистрационного удостоверения:Астеллас Фарма Юроп Б.В.
Производитель
ASTELLAS PHARMA EUROPE, B.V. Нидерланды
АСТЕЛЛАС ФАРМА ЮРОП Б.В.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Rec.INN
зарегистрированное ВОЗ
Лекарственное взаимодействие
Входит в состав препаратов:
список
Фармакологическое действие
Противоопухолевое лекарственное средство, антиандроген. Рак предстательной железы зависит от наличия андрогенов и реагирует на подавление активности андрогенных рецепторов. Несмотря на низкие или даже неопределяемые уровни андрогенов в плазме крови, активность андрогенных рецепторов на клетках опухоли продолжает способствовать прогрессированию болезни. Стимуляция роста опухолевых клеток с помощью андрогенных рецепторов требует их транслокации в ядро клетки и связывания с ДНК. Энзалутамид является мощным ингибитором андрогенных рецепторов, который блокирует несколько этапов сигнального пути андрогенных рецепторов. Энзалутамид конкурентно ингибирует связывание андрогенов с андрогенными рецепторами, угнетает ядерную транслокацию активированных рецепторов и ингибирует связывание активированных рецепторов андрогенов с ДНК даже в условиях избыточной экспрессии андрогенных рецепторов и в клетках опухоли, резистентных к антиандрогенам. Лечение энзалутамидом подавляет рост клеток опухоли предстательной железы и может индуцировать гибель клеток и регрессию опухоли. В доклинических исследованиях у энзалутамида отсутствовала активность агониста андрогенных рецепторов.
Фармакокинетика
Фармакокинетика энзалутамида была изучена у больных раком предстательной железы и у здоровых добровольцев. Средний Т1/2 энзалутамида у пациентов после однократного перорального приема составляет 5.8 суток (от 2.8 до 10.2 суток), Css достигается примерно через месяц. При ежедневном пероральном введении энзалутамид кумулирует примерно в 8.3 раз быстрее разовой дозы. Суточные колебания концентрации в плазме крови незначительные (соотношение от пика до минимума 1.25). Выведение энзалутамида, главным образом, осуществляется путем печеночного метаболизма с образованием активного метаболита, который является столь же активным, как и энзалутамид и циркулирует в плазме примерно в той же концентрации, что и энзалутамид.
Cmax энзалутамида в плазме крови у пациентов наблюдалась через 1-2 ч после приема. На основе изучения баланса массы у людей, всасывание при пероральном приеме энзалутамида оценивается, по меньшей мере, на уровне 84.2%. Энзалутамид не является субстратом эффлюксных транспортеров Р-гликопротеина или BCRP. Стабильный уровень, среднее значение Сmax энзалутамида и его активного метаболита составляет 16.6 пг/мл (коэффициент вариации [CV] 23%) и 12.7 пг/мл (CV 30%) соответственно.
Средний Vd энзалутамида у пациентов после однократного перорального приема составляет 110 л (CV 29%). Vd энзалутамида больше, чем объем общего количества жидкости в организме, что указывает на активное распределение в периферических тканях. Исследования на грызунах показали, что энзалутамид и его активный метаболит может проникать через ГЭБ.
Энзалутамид на 97-98% связывается с белками плазмы, в первую очередь с альбумином. Активный метаболит связывается с белками плазмы на 95%.
Энзалутамид активно метаболизируется. В плазме крови человека присутствуют два основных метаболита: N-десметилэнзалутамид (активный) и производное соединение карбоновой кислоты (неактивный). Энзалутамид метаболизируется ферментами CYP2C8 и, в меньшей степени, CYP3A4/5, которые играют важную роль в формировании активного метаболита. В исследовании in vitro N-десметилэнзалутамид метаболизируется до метаболита карбоновой кислоты за счет карбоксилэстеразы 1, которая также играет небольшую роль в метаболизме энзалутамида до метаболита карбоновой кислоты. N-десметилэнзалутамид не метаболизировался ферментами CYP in vitro. В условиях клинического применения энзалутамид является сильным индуктором фермента CYP3A4, умеренным индуктором ферментов CYP2C9 и CYP2C19 и не имеет клинически значимого влияния на фермент CYP2C8.
Средний кажущийся клиренс энзалутамида у пациентов составляет от 0.52 и 0.564 л/ч. При пероральном приеме меченного 14С-энзалутамида к 77 дню выводилось приблизительно 84.6% радиоактивной дозы: 71% — почками (в первую очередь как неактивный метаболит с незначительным количеством энзалутамида и активного метаболита) и 13.6% — через кишечник (0.39% дозы энзалутамида в неизмененном виде).
Показания активного вещества
ЭНЗАЛУТАМИД
Лечение метастатического кастрационно-резистентного рака предстательной железы.
Режим дозирования
Принимают внутрь в дозе 160 мг 1 раз/сут.
Медикаментозная кастрация с использованием аналога ЛГРГ должна быть продолжена во время лечения у пациентов, не прошедших хирургическую кастрацию.
Если у пациента развивается токсичность 3 степени и выше или опасные нежелательные реакции, прием энзалутамида необходимо отменить на 1 неделю или до снижения симптомов до уровня 2 степени и ниже, а затем, если это оправдано, возобновить прием в такой же или уменьшенной дозе (120 или 80 мг).
По возможности, следует избегать одновременного применения сильных ингибиторов CYP2C8. Если пациент должен одновременно принимать сильный ингибитор CYP2C8, дозу энзалутамида необходимо снизить до 80 мг 1 раз/сут. Если применение сильного ингибитора фермента CYP2C8 прекращено, дозу энзалутамида следует повысить до первоначального уровня.
Побочное действие
Со стороны системы кроветворения: нечасто — лейкопения, нейтропения.
Со стороны иммунной системы: неизвестно — отек языка, отек губ, отек глотки.
Психические расстройства: часто — чувство страха; нечасто — визуальные галлюцинации.
Со стороны нервной системы: очень часто — головная боль; часто — ухудшение памяти, потеря памяти, нарушение внимания, синдром беспокойных ног; нечасто — когнитивные расстройства, судороги; неизвестно — синдром задней обратимой энцефалопатии.
Со стороны репродуктивной системы и молочной железы: часто — гинекомастия.
Со стороны сердечно-сосудистой системы: очень часто — приливы, гипертензия; неизвестно — удлинение интервала QT.
Со стороны пищеварительной системы: неизвестно — тошнота, рвота.
Со стороны кожи и подкожных тканей: часто — сухость кожи, кожный зуд; неизвестно — сыпь.
Со стороны костно-мышечной системы: часто — переломы; неизвестно — миалгия, мышечный спазм, мышечная слабость, боль в спине.
Прочие: очень часто — астения/усталость; часто — падения.
Противопоказания к применению
Тяжелое нарушение функции печени; повышенная чувствительность к активному веществу.
Применение препарата противопоказано женщинам и детям.
Применение при беременности и кормлении грудью
Применение у женщин противопоказано.
Нет данных, присутствует ли энзалутамид или его метаболиты в сперме. Если пациент имеет сексуальный контакт с беременной женщиной во время и в течение 3 месяцев после лечения энзалутамидом, требуется использование презерватива. Если пациент имеет сексуальный контакт с женщиной детородного возраста, необходимо использовать презерватив наряду с другими эффективными методами контрацепции во время и в течение 3 месяцев после лечения.
Исследования на животных показали репродуктивную токсичность препарата.
Исследования на животных показали, что энзалутамид оказывает воздействие на репродуктивную систему у самцов крыс и собак.
Применение при нарушениях функции печени
Противопоказано применение препарата при тяжелых нарушениях функции печени.
С осторожностью следует назначать препарат пациентам с умеренной печеночной недостаточностью (класс В по шкале Чайлд-Пью), т.к. отсутствуют конечные данные о применении препарата у пациентов с умеренной печеночной недостаточностью.
Применение при нарушениях функции почек
С осторожностью следует назначать препарат пациентам с тяжелой почечной недостаточностью, т.к. действие энзалутамида в этой группе пациентов не изучено.
Применение у детей
Энзалутамид противопоказан детям и подросткам в возрасте до 18 лет.
Применение у пожилых пациентов
Не было отмечено клинически значимого влияния возраста на фармакокинетику энзалутамида. Коррекция дозы у пожилых пациентов не требуется.
Особые указания
Следует применять с осторожностью у пациентов, страдающих эпилептическими припадками или другими предрасполагающими факторами, в т.ч. травмы головного мозга, инсульт, первичные опухоли головного мозга или метастазы в головной мозг, алкоголизм. Кроме того, риск развития судорог может быть повышен у пациентов, получающих сопутствующую терапию лекарственными средствами, которые снижают судорожный порог.
В ходе применения энзалутамида были зарегистрированы редкие сообщения о развитии синдрома задней обратимой энцефалопатии (PRES). Синдром задней обратимой энцефалопатии — редкое обратимое неврологическое заболевание, которое может характеризоваться быстро развивающимися симптомами, такими как судороги, головная боль, спутанность сознания, слепота и другие зрительные и неврологические расстройства, сопровождаемые или несопровождаемые гипертензией. Диагноз синдром задней обратимой энцефалопатии должен быть подтвержден результатами томографии головного мозга, лучше всего результатами МРТ. Рекомендуется прекратить прием энзалутамида при подтвержденном диагнозе.
Энзалутамид является мощным индуктором ферментов и может привести к снижению эффективности многих часто используемых лекарственных средств. Поэтому, начиная лечение энзалутамидом, необходимо провести анализ сопутствующей терапии. Следует избегать одновременного применения энзалутамида с лекарственными средствами, которые являются чувствительными субстратами многих метаболизирующих ферментов или транспортеров, если их терапевтическое воздействие имеет большое значение для пациента, а также если на основании контроля эффективности или концентрации в плазме невозможно скорректировать дозу.
Следует избегать одновременного применения с варфарином и кумарин-подобными антикоагулянтами. При применении совместно с антикоагулянтом, который метаболизируется ферментом CYP2C9 (например, варфарин или аценокумарол), требуется дополнительный контроль MHO.
С осторожностью следует применять у пациентов с тяжелой почечной недостаточностью, т.к. действие энзалутамида в этой группе пациентов не изучено.
С осторожностью следует применять у пациентов с умеренной печеночной недостаточностью (класс В по шкале Чайлд-Пью), т.к. отсутствуют конечные данные о применении препарата у пациентов с умеренной печеночной недостаточностью. Поскольку нет данных о применении энзалутамида у пациентов с тяжелой печеночной недостаточностью, и энзалутамид выводится, главным образом, через печень, не рекомендуется применять у пациентов с тяжелой печеночной недостаточностью (класс С по шкале Чайлд-Пью).
У пациентов с наличием удлиненного интервала QT или с предрасполагающими факторами и у пациентов, получающих сопутствующую терапию препаратами, которые могут удлинять интервал QT, перед началом применения энзалутамида следует оценить соотношение пользы и риска, включая возможность возникновения желудочковой тахикардии типа «пируэт».
Одновременное назначение энзалутамида не имеет клинически значимого эффекта на фармакокинетику доцетаксела, вводимого в/в; однако увеличение частоты нейтропении, вызванной приемом доцетаксела, нельзя исключать.
Влияние на способность к управлению транспортными средствами и механизмами
Энзалутамид может иметь умеренное влияние на способность управлять автомобилем и работать с механизмами, т.к. были зарегистрированы психические и неврологические нарушения, включая судороги. Пациенты с судорогами или другими предрасполагающими факторами в анамнезе должны быть предупреждены о риске при вождении или эксплуатации механизмов. Исследований с целью определения воздействия применения энзалутамида на способность управлять автомобилем и работать с механизмами не проводилось.
Лекарственное взаимодействие
Изофермент CYP2C8 играет важную роль в выведении энзалутамида и в формировании его активного метаболита. После перорального применения сильного ингибитора CYP2C8 гемфиброзила (600 мг 2 раза/сут) у здоровых пациентов мужского пола AUC энзалутамида увеличилась на 326%, тогда как Сmax энзалутамида уменьшилась на 18%. На сумму несвязанного энзалутамида плюс несвязанный активный метаболит, AUC увеличилась на 77%, в то время как Сmax снизилась на 19%. Во время лечения энзалутамидом следует избегать приема сильных ингибиторов (например, гемфиброзил) или индукторов (например, рифампицин) фермента CYP2C8, или применять их с осторожностью. Если пациентам необходимо совместно применять сильный ингибитор CYP2C8, дозу энзалутамида следует снизить до 80 мг 1 раз/сут.
Энзалутамид является мощным индуктором ферментов и повышает синтез многих ферментов и транспортеров, поэтому он взаимодействует со многими обычными лекарственными средствами, которые являются субстратами ферментов или транспортерами. Снижение концентрации в плазме может быть существенным и вести к потере или уменьшению клинического эффекта. Существует также риск образования активных метаболитов. К ферментам, образование которых может быть индуцировано, относятся CYP3A в печени и кишечнике, CYP2C9, CYP2C19, CYP1B6 и уридин-5′-дифосфатглюкуронозилтрансфераза. Также возможна индукция транспортного белка Р-гликопротеина и других транспортеров, а также, например, белка множественной лекарственной резистентности 2 (MRP2), белка резистентности рака молочной железы (BCRP) и органического анион-транспортирующего полипептида 1В1 (ОАТР1В1).
Исследования in vivo показали, что энзалутамид является сильным индуктором CYP3A4 и умеренным индуктором CYP2C9 и CYP2C19. Совместное применение энзалутамида (160 мг 1 раз/сут) у больных раком предстательной железы привело к 86% снижению AUC мидазолама (субстрат CYP3A4), 56% снижению AUC S-варфарина (субстрат CYP2C9) и 70% снижению AUC омепразола (субстрата CYP2C19). Также возможна индукция UGT1A1. В клиническом исследовании у пациентов с метастатическим КРРПЖ прием Кстанди (160 мг 1 раз/сут) не имел клинически значимого эффекта на фармакокинетику доцетаксела, вводимого в/в (75 мг/м в/в каждые 3 недели). AUC доцетаксела снизилась на 12% [среднее геометрическое отношение (СГО) = 0.882 (90% ДИ: 0.767, 1.02)], тогда как Сmax снизилась на 4% [СГО = 0.963 (90% ДИ: 0.834, 1.11)].
Также препарат взаимодействует с определенными лекарственными средствами, которые выводятся в процессе метаболизма или активного транспорта. Если их терапевтический эффект имеет большое значение для пациента и коррекцию дозы на основе контроля эффективности или концентрации в плазме сделать не так просто, приема этих лекарственных средств следует избегать или применять их с осторожностью. Предполагается, что, риск повреждения печени после приема парацетамола выше у пациентов, которым одновременно вводили индукторы ферментов.
К группе лекарственных средств, которые могут взаимодействовать с препаратом, относятся в т.ч.: анальгетики (например, фентанил, трамадол); антибиотики (например, кларитромицин, доксициклин); противоопухолевые препараты (например, кабазитаксел); антикоагулянты (например, аценокумарол, варфарин); противоэпилептический средства (например, карбамазепин, клоназепам, фенитоин, примидон, вальпроевая кислота); нейролептики (например, галоперидол); бета-адреноблокаторы (например, бисопролол, пропранолол); блокаторы кальциевых каналов (например, дилтиазем, фелодипин, никардипин, нифедипин, верапамил); сердечные гликозиды (например, дигоксин); кортикостероиды (например, дексаметазон, преднизолон); противовирусные препараты для лечения ВИЧ-инфекции (например, индинавир, ритонавир); снотворные средства (например, диазепам, мидазолам, золпидем); статины, метаболизирующиеся при участии изофермента CYP3A4 (например, аторвастатин, симвастатин); тиреоидные средства (например, левотироксин).
Все индукционные возможности энзалутамида могут проявиться приблизительно через 1 месяц после начала лечения, после достижения стабильной плазменной концентрации энзалутамида, хотя некоторые индукционные эффекты могут стать заметными и раньше. У пациентов, принимающих лекарственные препараты, которые являются субстратами изоферментов CYP2B6, CYP3A4, CYP2C9, CYP2C19, а также UGT1A1 , следует оценивать возможное снижение фармакологического воздействия (или увеличение воздействия в случае образования активных метаболитов) в течение первого месяца лечения энзалутамидом и соответствующим образом корректировать дозу. Учитывая длительный Т1/2 энзалутамида (5.8 сут), влияние на образование ферментов может сохраняться в течение 1 месяца и более после прекращения применения энзалутамида. При прекращении лечения энзалутамидом может потребоваться постепенное снижение дозы сопутствующих лекарственных средств.
Данные in vitro показывают, что энзалутамид может быть ингибитором эффлюксного транспортера Р-гликопротеина. Действие энзалутамида на субстраты Р-гликопротеина in vivo не оценивали, однако в условиях клинического применения энзалутамид может быть индуктором Р-гликопротеина через активацию ядерного прегнан-рецептора (прегнан-Х-рецептор). Лекарственные препараты с узким терапевтическим диапазоном, являющиеся субстратами для Р-гликопротеина (например, колхицин, дабигатрана этексилат, дигоксин), при одновременном применении с Кстанди следует применять с осторожностью, а для поддержания оптимальной концентрации в плазме может потребоваться коррекция дозы.
Субстраты белков резистентности рака молочной железы (BCRP), белков множественной лекарственной резистентности 2 (MRP2), транспортеры органических анионов человека 3 типа (ОАТ3) и транспортера органических катионов человека 1 (ОСТ1): на основе данных лабораторных исследований, нельзя исключить ингибирования BCRP и MRP2 (в кишечнике), а также транспортеров органических анионов человека 3 типа (ОАТ3) и транспортеров органических катионов человека 1 (ОСТ1) (системного). Теоретически, индукция этих транспортеров также возможна, и суммарный эффект в настоящее время неизвестен.
В связи с тем, что андроген-депривационная терапия может удлинять интервал QT, следует тщательно оценить одновременное применение энзалутамида с препаратами, удлиняющими интервал QT, а также препаратами, которые могут вызывать возникновение желудочковой тахикардии типа «пируэт», в т.ч. антиаритмические препараты класса IA (например, хинидин, дизопирамид) или класса III (например, амиодарон, соталол, дофетилид, ибутилид), метадон, моксифлоксацин, нейролептики.
Состав
Основной активный компонент – Энзалутамид.
Дополнительные компоненты отсутствуют.
Форма выпуска
Производится лекарственное средство в капсулах. Продается в упаковках по 112 штук в каждой.
Фармакодинамика препарата
Энзалутамид является конкурентным ингибитором рецепторов андрогенов, который влияет на несколько стадий сигнального пути. Он работает путем ингибирования связывания андрогена с его рецептором, ядерной транслокации рецептора андрогена и последующего взаимодействия с ДНК. В результате снижается пролиферация клеток рака предстательной железы, что в конечном итоге приводит к апоптозу и уменьшению объема опухоли.
Инденза предотвращает влияние тестостерона на надпочечники. Препарат работает путем ингибирования рецепторов андрогенов на поверхности клеток рака предстательной железы. Поскольку гормон не может прикрепляться к рецепторам андрогенов, раковые клетки не могут размножаться где-либо в организме.
Фармакокинетика
После проглатывания энзалутамид легко растворяется (биодоступен) в организме в течение 3 часов. Он метаболизируется в печени, а затем распределяется по всей области рака с высокой аффинностью связывания (97%) с раковыми клетками. Как только энзалутамид завершает свое действие, более 50% дозы выводится из организма в период от 3 до 11 дней.
Показания к применению
Indenza представляет собой ингибитор рецептора андрогена (АР), показанный пациентам, страдающим такими типами рака предстательной железы, как:
- метастатический резистентный к кастрации рак предстательной железы, когда другие варианты химиотерапии не работают (рак, который снижает рост тестостерона, мужского гормона);
- метастатический рак предстательной железы, чувствительный к кастрации, когда другая гормональная терапия не помогла (рак, который распространяется на другие части тела).
Противопоказания
Нельзя назначать лекарство больным с предрасположенностью к аллергии на его составляющие вещества.
Побочные действия
Наиболее распространенные негативные реакции:
- усталость;
- боли в спине, мышцах, костях и суставах;
- диарея;
- слабость в мышцах;
- головокружение;
- отек в руках и ногах;
- сильная головная боль;
- симптомы простуды;
- беспокойство или стресс.
Другими отрицательными реакциями являются: изменение цвета мочи на розовый или красный цвет; высыпания на коже; проблемы с засыпанием; проблемы с дыханием; слабость в ногах; боль в пояснице; высокое кровяное давление; жжение или онемение кожи; возбуждение или замешательство.
Медикаментозные взаимодействия
Одновременные комбинации противопоказаны с:
- обезболивающими;
- антибиотиками;
- противораковые препараты
- антикоагулянтами;
- противоэпилептическими препаратами;
- нейролептиками;
- кортикостероидами;
- снотворными;
- гормонами щитовидной железы.
Применение и дозы
Indenza принимают перорально в дозе 160 мг (4×40 мг) один раз в 24 часа независимо от приема пищи. Если у больных возникают какие-либо побочные эффекты, дозировка может быть изменена и снижена до 120 мг (3×40 мг) или 80 мг (2×40 мг).
Передозировка
В результате интоксикации могут возникнуть судороги. Специфического антидота не существует, поэтому лечение заключается в прекращении приема препарата и лечении симптомов передозировки.
Особые указания
Особая осторожность при приеме препарата необходима больным, у которых:
- были в анамнезе или наблюдаются внезапные необоснованные изменения в поведении, вызванные нарушениями в головном мозге (припадки);
- подтверждены такие симптомы, как головная боль, нарушение зрения и низкое кровяное давление (синдром задней обратимой энцефалопатии);
- наблюдаются заболевания почек (тяжелая почечная недостаточность и терминальная стадия почечной недостаточности);
- обнаруживаются признаки тяжелого заболевания печени;
- наблюдаются пациенты с относительным риском сердечных заболеваний;
- аллергия на дозу и проявляются такие симптомы, как отек языка, губ или глотки (отек);
- есть непереносимость лактозы.
Применение при беременности и кормлении грудью
Лекарственное средство нельзя принимать беременным и кормящим грудью женщинам.
Влияние на способность управлять автомобилем или другими механизмами
Во время применения медикамента не рекомендуется выполнять данные действия из-за возможности возникновения судорог, нарушений внимания и памяти.
Условия продажи
По назначению доктора.
Условия хранения
Препарат следует хранить в недоступном для детей месте. Температурные показатели – не более 25°С.
Действующим веществом препарата Кстанди является энзалутамид.
Лекарственный препарат Кстанди применяется для лечения рака предстательной железы у взрослых мужчин, который:
— больше не реагирует на гормональную терапию или хирургическое лечение, направленные на снижение уровня тестостерона
или
— распространился на другие части тела и реагирует на гормональную терапию или хирургическое лечение, направленные на снижение уровня тестостерона.
Механизм действия препарата Кстанди
Кстанди представляет собой лекарственный препарат, блокирующий действие гормонов под названием «андрогены» (такие как тестостерон). Блокируя андрогены, энзалутамид прекращает рост и деление клеток рака предстательной железы.
— Если у Вас аллергия на энзалутамид или на любые другие вспомогательные вещества данного лекарственного препарата (перечисленные в разделе «Состав» листка-вкладыша);
— Если Вы беременны или можете забеременеть (см. «Беременность, грудное вскармливание, фертильность»)
Судороги
О развитии судорог сообщалось у 5 из 1000 человек, принимавших препарат Кстанди, и менее чем у одного из 1000 человек, принимавших плацебо (см. «Взаимодействие препарата Кстанди с другими лекарственными препаратами» ниже и раздел «Возможные нежелательные реакции»).
Если Вы принимаете лекарственный препарат, который может вызвать судороги или может повысить предрасположенность к судорогам: см. «Взаимодействие препарата с другими лекарственными препаратами» ниже.
Если у Вас возникают судороги во время лечения: обратитесь к врачу как можно скорее. Возможно, лечащий врач примет решение о прекращении приема препарата Кстанди.
Синдром обратимой задней энцефалопатии (PRES)
У пациентов, получавших лекарственный препарат Кстанди, были зарегистрированы редкие случаи возникновения синдрома обратимой задней энцефалопатии (PRES), редкого обратимого состоянии, поражающего мозг.
При возникновении судорог, усиливающейся головной боли, спутанности сознания, слепоты или других нарушений зрения, как можно скорее обратитесь к врачу. Также см. раздел «Возможные нежелательные реакции».
Риск возникновения нового рака (вторых основных злокачественных новообразований)
Поступали сообщения о случаях возникновения нового (второго) рака, включая рак мочевого пузыря и прямой кишки, у пациентов, которые лечились препаратом Кстанди.
Если при приеме препарата Кстанди Вы заметите у себя признаки желудочно-кишечного кровотечения, кровь в моче или частые позывы к мочеиспусканию, как можно скорее обратитесь к своему врачу.
Перед началом приема препарата Кстанди проконсультируйтесь с лечащим врачом
— Если Вы принимаете какие-либо лекарственные препараты для предотвращения образования тромбов (например, варфарин, аценокумарол, клопидогрел)
— Если Вы проходите химиотерапию, например, доцетакселом
— Если у Вас имеются нарушения функции печени
— Если у Вас имеются нарушения функции почек
Сообщите своему лечащему врачу, если у Вас наблюдаются следующие состояния:
Заболевания сердца или кровеносных сосудов, в том числе нарушение сердечного ритма (аритмия), или Вы принимаете какие-либо лекарственные препараты для лечения данных состояний. Риск возникновения осложнений, связанных с нарушением сердечного ритма, может повышаться при применении препарата Кстанди.
Если у Вас аллергия на энзалутамид, это может вызвать сыпь или отек лица, языка, губ или гортани. Если у Вас аллергия на энзалутамид или на другие вещества, перечисленные в разделе «Состав» данного листка-вкладыша, не принимайте препарат Кстанди.
Сообщалось о случаях возникновения выраженной кожной сыпи или шелушения кожи, пузырчатой сыпи и/или язв в полости рта, которые сопровождали лечение препаратом Кстанди. Если Вы заметите у себя какой- либо из этих симптомов, немедленно обратитесь за медицинской помощью.
Если что-либо из вышеперечисленного применимо к Вам (или у Вас есть сомнения), проконсультируйтесь с лечащим врачом, прежде чем начать прием данного препарата.
Применение у детей и подростков
Данный лекарственный препарат не предназначен для применения у детей и подростков.
Лекарственный препарат Кстанди содержит сорбитол
Данный лекарственный препарат содержит 57,8 мг сорбитола (тип сахара) в одной мягкой капсуле. При диагностированной непереносимости некоторых сахаров обратитесь к лечащему врачу до начала приема данного лекарственного препарата
Сообщите лечащему врачу, если Вы принимаете, недавно принимали или можете начать принимать какие-либо другие препараты. Вам следует знать названия принимаемых Вами лекарственных препаратов. Имейте при себе их список, чтобы показать врачу в случае назначения Вам нового лекарственного препарата. Вы не должны начинать или прекращать прием каких-либо препаратов, пока не проконсультируетесь с врачом, назначившим препарат Кстанди.
Сообщите своему лечащему врачу, если Вы принимаете какие-либо из нижеперечисленных лекарственных препаратов. При одновременном приеме с препаратом Кстанди эти лекарственные препараты могут повысить риск развития судорог:
— Некоторые лекарственные препараты, используемые для лечения астмы и других респираторных заболеваний (например, аминофиллин, теофиллин).
— Лекарственные препараты, используемые для лечения определенных психических расстройств, таких как депрессия и шизофрения (например, клозапин, оланзапин, рисперидон, зипразидон, бупропион, литий, хлорпромазин, мезоридазин, тиоридазин, амитриптилин, дезипрамин, доксепин, имипрамин, мапротилин, миртазапин).
— Некоторые лекарственные препараты, предназначенные для лечения боли (например, петидин).
Сообщите своему врачу, если Вы принимаете какие-либо из нижеперечисленных лекарственных препаратов. Эти лекарственные препараты могут влиять на действие препарата Кстанди, или препарат Кстанди может влиять на действие этих лекарственных препаратов.
К ним относятся некоторые лекарственные препараты, используемые для:
— снижения уровня холестерина (например, гемфиброзил, аторвастатин, симвастатин)
— лечения боли (например, фентанил, трамадол)
— лечения рака (например, кабазитаксел)
— лечения эпилепсии (например, карбамазепин, клоназепам, фенитоин, примидон, вальпроевая кислота)
— лечения некоторых психических нарушений, таких как тяжелая тревожность или шизофрения (например, диазепам, мидазолам, галоперидол)
— лечения нарушений сна (например, золпидем)
— лечения сердечных заболеваний или снижения артериального давления (например, бисопролол, дигоксин, дилтиазем, фелодипин, никардипин, нифедипин, пропранолол, верапамил)
— лечения серьезных заболеваний, связанных с воспалением (например, дексаметазон, преднизолон)
— лечения ВИЧ-инфекции (например, индинавир, ритонавир)
— лечения бактериальных инфекций (например, кларитромицин, доксициклин)
— лечения заболеваний щитовидной железы (например, левотироксин)
— лечения подагры (например, колхицин)
— лечения заболеваний желудка (например, омепразол)
— предотвращения сердечных заболеваний или инсульта (например, дабигатрана этексилат)
— предотвращения отторжения органов (например, такролимус)
Лекарственный препарат Кстанди может взаимодействовать с некоторыми лекарственными препаратами, используемыми для лечения нарушений сердечного ритма (например, хинидином, прокаинамидом, амиодароном и соталолом), или может повышать риск развития нарушений сердечного ритма при использовании с некоторыми другими препаратами (например, метадоном, используемым для облегчения боли и в рамках детоксикации при наркозависимости), моксифлоксацином (антибиотик), нейролептиками, применяемыми при серьезных психических заболеваниях).
Сообщите своему врачу, если Вы принимаете какие-либо из лекарственных препаратов, перечисленных выше. Возможно, потребуется изменить дозу препарата Кстанди или других принимаемых Вами лекарственных препаратов.
— Лекарственный препарат Кстанди не предназначен для применения у женщин. В случае применения женщинами в период беременности, этот препарат может отрицательно повлиять на внутриутробное развитие плода или привести к потенциальной потере плода. Препарат Кстанди нельзя принимать беременным женщинам, женщинам, которые предположительно могут быть беременны, или женщинам в период лактации.
— Существует вероятность влияния препарата Кстанди на фертильность у мужчин.
— В ходе лечения этим препаратом и в течение 3 месяцев после его завершения используйте презерватив и другой эффективный метод контрацепции во время полового акта с женщиной детородного возраста. Во время полового акта с беременной женщиной следует использовать презерватив с целью защиты внутриутробного ребенка.
— Женщинам, осуществляющим уход за пациентами, для получения сведений по использованию и обращению с препаратом Кстанди следует обратиться к разделу «Применение препарата Кстанди».
Лекарственный препарат Кстанди может оказывать умеренное влияние на способность к управлению транспортными средствами и работе с механизмами. У пациентов, принимающих препарат Кстанди, были зарегистрированы случаи возникновения судорог. Если у Вас имеется повышенный риск развития судорог, проконсультируйтесь с врачом.
Всегда принимайте препарат в строгом соответствии с рекомендациями лечащего врача. При появлении сомнений проконсультируйтесь с лечащим врачом.
Рекомендуемая доза составляет 160 мг (четыре мягких капсулы по 40 мг), которые принимают в одно и то же время один раз в сутки.
Рекомендации по применению препарата Кстанди
— Мягкую капсулу следует прогладывать целиком, запивая водой.
— Не разжевывайте, не растворяйте и не открывайте мягкие капсулы перед проглатыванием.
— Препарат Кстанди можно принимать независимо от приема пищи.
— Выполнять манипуляции с препаратом Кстанди следует только пациенту или лицу, осуществляющему уход за ним. Беременным женщинам или. женщинам детородного возраста не следует контактировать с поврежденными или открытыми капсулами Кстанди без средств защиты, например, перчаток.
Ваш врач может также назначить другие лекарственные препараты одновременно с приемом препарата Кстанди.
Если Вы приняли препарат Кстанди в дозе, которая превышает назначенную
В случае приема большего количества мягких капсул, чем Вам было назначено, прекратите прием препарата Кстанди и свяжитесь с врачом, так как возможно повышение риска развития судорог или других нежелательных реакций.
Если Вы забыли принять препарат Кстанди
— Если Вы забыли принять препарат Кстанди в обычное время, примите назначенную дозу, как только вспомните.
— Если Вы забыли принять препарат Кстанди в течение всего дня, примите назначенную дозу на следующий день.
— Если Вы забыли принять препарат Кстанди в течение нескольких дней, незамедлительно обратитесь к врачу.
— Не принимайте двойную дозу препарата, чтобы компенсировать пропущенную дозу.
Если Вы прекратили прием препарата Кстанди
Не прекращайте принимать лекарственный препарат без предварительного согласования с Вашим лечащим врачом.
При возникновении вопросов по применению данного лекарственного препарата, обратитесь к лечащему врачу.
Подобно всем лекарственным препаратам препарат Кстанди может вызывать нежелательные реакции, однако они возникают не у всех.
Судороги
Появление судорог было зарегистрировано у 5 из 1000 человек, принимавших препарат Кстанди, и менее чем у 1 из 1000 человек, принимавших плацебо.
Вероятность возникновения судорог возрастает, если Вы принимаете больше рекомендованной дозы препарата Кстанди, если Вы принимаете другие лекарственные препараты или если у Вас имеется более высокий, чем обычно, риск возникновения судорог.
В случае возникновения судорог как можно скорее обратитесь к врачу. Возможно, лечащий врач примет решение о прекращении приема препарата Кстанди.
Синдром обратимой задней энцефалопатии (PRES)
У пациентов, получавших препарат Кстанди были зарегистрированы редкие случаи развития синдрома обратимой задней энцефалопатии (PRES) (может возникать не более чем у 1 человека из 1000), редкого обратимого состояния, поражающего мозг. При возникновении судорог, усиливающаяся головной боли, спутанности сознания, слепоты или других нарушений зрения, как можно скорее обратитесь к врачу.
К другим возможным побочным реакциям относятся:
Очень частые (могут возникать более чем у 1 пациента из 10)
Утомляемость, падения, переломы, «приливы», высокое артериальное давление
Частые (могут возникать не более чем у 1 пациента из 10)
Головная боль, тревожность, сухость кожи, зуд, трудности с запоминанием, закупорка артерий в сердце (ишемическая болезнь сердца), увеличение молочной железы у мужчин (гинекомастия), синдром беспокойных ног (неконтролируемое желание пошевелить частью тела, обычно нога), снижение концентрации внимания, забывчивость, изменение вкусовых ощущений.
Нечастые (могут возникать не более чем у 1 пациента из 100)
Галлюцинации, трудности с ясным мышлением, низкое количество лейкоцитов
Частота неизвестна (частота не может быть установлена на основе доступных данных)
Боль в мышцах, мышечные спазмы, мышечная слабость, боль в спине, изменения на ЭКГ (удлинение интервала QT), расстройство желудка, включая тошноту, сыпь, тошнота (рвота), отек лица, губ, языка и/или гортани, снижение уровня тромбоцитов (что увеличивает риск возникновения кровотечения или образования синяков), диарея
Сообщение о нежелательных реакциях
Если у Вас возникают какие-либо нежелательные реакции, обратитесь к лечащему врачу. Данная рекомендация распространяется на любые возможные нежелательные реакции, в том числе на не перечисленные в данном листке-вкладыше. Вы также можете сообщить о нежелательных реакциях (включая сообщения об отсутствии эффективности лекарственного препарата) напрямую в национальную базу сбора данных о нежелательных реакциях (эффектах) на лекарственные препараты в соответствии с рекомендациями УП «Центр экспертизы и испытаний в здравоохранении» Министерства Здравоохранения Республики Беларусь, размещенными на сайте http://www.rceth.by. Сообщая о нежелательных реакциях, Вы можете помочь получить больше сведений о безопасности данного лекарственного препарата.
Храните при температуре не выше 25°С.
Храните данный лекарственный препарат в недоступном и скрытом от глаз детей месте.
Не принимайте данный лекарственный препарат после истечения срока годности, указанного на картонном футляре и картонной пачке после надписи «ГОДЕН ДО». Датой истечения срока годности является последний день месяца, указанного на упаковке.
Не принимайте мягкие капсулы, если Вы заметили, что они протекают, повреждены или имеют признаки постороннего вмешательства.
Не выбрасывайте лекарственный препарат в канализацию и не утилизируйте с бытовыми отходами. Уточните у работника аптеки о порядке утилизации лекарственного препарата, который Вы больше не принимаете. Эти меры позволят защитить окружающую среду.
Препарат Кстанди содержит
— Действующим веществом является энзалутамид. Каждая капсула содержит 40 мг энзалутамида.
— Прочими ингредиентами капсулы являются каприлокапроил макроголглицериды, бутилгидроксианизол (Е320) и бутилгидрокситолуол (Е321).
— В состав гелевой массы входят желатин, раствор сорбитола (см. раздел «Особые указания и меры предосторожности» данного листка-вкладыша), глицерин, титана диоксид (Е171) и вода очищенная.
— Состав чернил: этанол безводный, этилацетат, пропиленгликоль, железа оксид черный (Е172), поливинилацетат фталат, вода очищенная, изопропиловый спирт, макрогол 400, раствор аммиака концентрированный (аммония гидрохлорид 28%).
Капсулы 40 мг.
По 28 капсул в контурной ячейковой упаковке (блистере) из ПВХ/ ПХТФЭ/ алюминиевой фольги. По 1 контурной ячейковой упаковке (блистеру) в картонный футляр. По 4 картонных футляра (112 мягких капсул) вместе с инструкцией по медицинскому применению (листком-вкладышем) в картонной пачке.
По рецепту
Держатель регистрационного удостоверения
Астеллас Фарма Юроп Б.В.. Нидерланды
(Сильвиусвег 62, 2333 BE Лейден, Нидерланды)/
Astellas Pharma Europe В. V., The Netherlands
(Sylviusweg 62, 2333 BE Leiden, The Netherlands)
Выпуск серий
Астеллас Фарма Юроп Б.В., Нидерланды
(Хогемат 2, 7942JG Меппель, Нидерланды)
Astellas Pharma Europe B.V., The Netherlands
(Hogemaat 2, Meppel, 7942JG, The Netherland)
Производитель
Каталент Фарма Солюшнс ЛЛС, США
2725 Шерер Драйв, Сент- Петерсберг, ФЛ 33716
Catalent Pharma Solutions, LLC., USA
(2725 Scherer Drive, St. Petersburg, FL 33716, USA)
Претензии по качеству следует направлять в
Представительство «Астеллас Фарма Юроп Б.В.» (Astellas Pharma Europe B.V.) (Нидерланды) в г. Москве по адресу:
Россия, 109147 г. Москва, ул. Марксистская, 16,
Мосаларко Плаза-1» бизнес-центр, этаж 3
Тел.: +7 (495) 737-07-55; факс: +7 (495) 737-07-67
Фармакокинетика
Энзалутамид плохо растворим в воде. Растворимость энзалутамида увеличена с помощью каприлокапроил макрогол глицерида, используемого в качестве эмульгатора/поверхностно-активного вещества. В доклинических исследованиях абсорбция энзалутамида была увеличена при растворении в каприлокапроил макрогол глицерида.
Фармакокинетика энзалутамида была изучена у больных раком предстательной железы и у здоровых мужчин. Средний период полувыведения (T1/2) энзалутамида у пациентов после однократного перорального приема составляет 5,8 суток (от 2,8 до 10,2 суток), а равновесная концентрация достигается примерно через месяц. При ежедневном пероральном приеме энзалутамид аккумулируется примерно в 8,3 раз быстрее разовой дозы. Суточные колебания концентрации в плазме крови незначительные (соотношение от пика до минимума 1,25). Выведение энзалутамида, главным образом, осуществляется путем печеночного метаболизма с образованием активного метаболита, который является столь же активным, как и энзалутамид и циркулирует в плазме примерно в той же концентрации, что и энзалутамид.
Абсорбция
Максимальная концентрация в плазме (Сmax) энзалутамида у пациентов наблюдалась через 1 — 2 часа после приема. Всасывание при пероральном приеме энзалутамида оценивается, по меньшей мере, на уровне 84,2%. Энзалутамид не является субстратом эффлюксных переносчиков Р-гликопротеина или белка резистентности рака молочной железы (BCRP). В равновесном состоянии среднее значение Сmax энзалутамида и его активного метаболита составляет 16,6 пг/мл (коэффициент вариации [CV] 23%) и 12,7 пг/мл (CV 30%), соответственно.
Прием пищи не оказывает значимого влияния на степень абсорбции энзалутамида. В клинических исследованиях Кстанди применялся независимо от приема пищи.
Распределение
Средний объем распределения энзалутамида у пациентов после однократного перорального приема составляет 110 л. Объем распределения энзалутамида больше, чем объем общего количества жидкости в организме, что указывает на активное распределение в периферических тканях. Исследования на грызунах показали, что энзалутамид и его активный метаболит могут проникать через гематоэнцефалический барьер.
Энзалутамид на 97-98% связывается с белками плазмы, в первую очередь с альбумином. Активный метаболит связывается с белками плазмы на 95%.
В исследованиях in vitro не отмечалось замещения связывания с белками плазмы между энзалутамидом и другими препаратами с высокой связывающей способностью (варфарин, ибупрофен и салициловая кислота).
Метаболизм
Энзалутамид активно метаболизируется. В плазме крови человека присутствуют два основных метаболита: N-десметил энзалутамид (активный) и производное соединение карбоновой кислоты (неактивный). Энзалутамид метаболизируется ферментами CYP2C8 и, в меньшей степени, CYP3A4/5, которые играют важную роль в формировании активного метаболита.
Энзалутамид является сильным индуктором фермента CYP3A4, умеренным индуктором ферментов CYP2C9 и CYP2C19, и не имеет клинически значимого влияния на фермент CYP2C8.
Выведение
Средний наблюдаемый клиренс энзалутамида у пациентов составляет от 0,520 и 0,564 л/час.
При пероральном приеме меченного 14C-энзалутамида, выводилось приблизительно 84,6% радиоактивной дозы через 77 дней после введения дозы: 71,0% выводился почками (в первую очередь, как неактивный метаболит с незначительным количеством энзалутамида и активного метаболита), и 13,6% выводился через кишечник (0,39% дозы энзалутамида в неизмененном виде).
Данные исследований in vitro показывают, что энзалутамид не является субстратом для органических анион-транспортирующих полипептидов 1В1 и 1В3 (ОАТР1В1, ОАТР1В3) или переносчиков органических катионов человека 1 (ОСТ1).
Данные исследований in vitro показывают, что энзалутамид и его основные метаболиты не ингибируют следующие транспортеры при клинически значимых концентрациях: ОАТР1В1, ОАТР1В3, ОСТ2 или переносчиков органических анионов человека 1 типа (ОАТ1).
Линейность
В диапазоне доз от 40 до 160 мг значимых отклонений от пропорциональности дозы не наблюдается. Значения равновесной концентрации Сmin энзалутамида и его активного метаболита у отдельных пациентов оставались неизменными в течение более одного года постоянной терапии, демонстрируя временную линейность фармакокинетики после достижения равновесной концентрации.
Особенности фармакокинетики у отдельных категорий пациентов
Пациенты с почечной недостаточностью
Исследования по применению энзалутамида у пациентов с почечной недостаточностью не проводились. Пациенты с уровнем сывороточного креатинина > 177 мкмоль/л (2 мг/дл) были исключены из клинических исследований. Основываясь на популяционном анализе фармакокинетики, для пациентов со значениями клиренса креатинина > 30 мл/мин (по формуле Кокрофт и Голт) коррекция дозы не требуется. Эффективность энзалутамида не была изучена у пациентов с тяжелой почечной недостаточностью (клиренс креатинина < 30 мл/мин) или терминальной стадией почечной недостаточности, поэтому при лечении этих пациентов рекомендуется назначать препарат с осторожностью. Маловероятно, что энзалутамид будет значительно выводиться с помощью интермиттирующего гемодиализа или постоянного амбулаторного перитонеального диализа.
Пациенты с печеночной недостаточностью
Печеночная недостаточность не имеет значительного влияния на концентрацию энзалутамида или его активного метаболита. Тем не менее, период полувыведения лекарственного средства был в два раза больше у пациентов с тяжелой печеночной недостаточностью по сравнению со здоровыми пациентами (10,4 дня по сравнению с 4,7 днями), что возможно связано с повышенным распределением в тканях.
Фармакокинетика энзалутамида была изучена у пациентов с исходной легкой (N = 6), умеренной (N = 

Расовая принадлежность
Большинство пациентов, участвовавших в клинических исследованиях (> 84%), были европейцами. По данным исследования фармакокинетики у пациентов с раком предстательной железы в Японии не отмечалось клинически значимых различий в фармакокинетике между европейцами и японцами. Данных для оценки потенциальных различий фармакокинетики энзалутамида между другими расами недостаточно.
Пожилые люди
Не было отмечено клинически значимого влияния возраста на фармакокинетику энзалутамида. Коррекция дозы у пожилых людей не требуется.
Фармакодинамика
Механизм действия.
Рак предстательной железы зависит от наличия андрогенов и реагирует на подавление активности андрогенных рецепторов. Несмотря на низкие или даже неопределяемые уровни андрогенов в плазме крови, активность андрогенных рецепторов на клетках опухоли продолжает способствовать прогрессированию болезни. Стимуляция роста опухолевых клеток с помощью андрогенных рецепторов требует их транслокации в ядро клетки и связывания с ДНК. Энзалутамид является мощным ингибитором андрогенных рецепторов, который блокирует несколько этапов сигнального пути андрогенных рецепторов. Энзалутамид конкурентно ингибирует связывание андрогенов с андрогенными рецепторами, угнетает ядерную транслокацию активированных рецепторов и ингибирует связывание активированных андрогенных рецепторов с ДНК даже в условиях избыточной экспрессии андрогенных рецепторов и в клетках рака предстательной железы, резистентных к анти-андрогенам. Лечение энзалутамидом подавляет рост клеток рака предстательной железы и может индуцировать гибель клеток и регрессию опухоли. В доклинических исследованиях у энзалутамида отсутствовала активность агониста андрогенных рецепторов.
Фармакодинамические эффекты.
В ходе клинического исследования III фазы у пациентов после неэффективности химиотерапии доцетакселом, у 54% пациентов, получавших энзалутамид, по сравнению с 1,5% пациентов, получавших плацебо, наблюдалось, по крайней мере, 50%-ное снижение уровня ПСА по сравнению с исходным уровнем.
Клиническая эффективность и безопасность
Эффективность энзалутамида была установлена в двух рандомизированных, плацебо-контролируемых, многоцентровых клинических исследованиях III фазы [CRPC2 (AFFIRM), MDV3100-03 (PREVAIL)] у пациентов с прогрессирующим метастатическим раком предстательной железы, у которых прогрессия заболевания наблюдалась на фоне антиандрогенной терапии [при использовании аналога лютеинизирующего гормона рилизинг-гормона (ЛГРГ) или после билатеральной орхиэктомии]. В исследовании PREVAIL принимали участие пациенты, не получавшие лечения с использованием химиотерапии; при этом в исследовании AFFIRM принимали участие пациенты, получавшие до этого химиотерапию с использованием доцетаксела. Все пациенты продолжали прием аналогов ЛГРГ или перенесли билатеральную орхиэктомию. В группе активного лечения Кстанди использовался перорально в ежедневной дозе 160 мг. В обоих клинических исследованиях в контрольной группе пациенты получали плацебо и они могли, но не были обязаны, принимать преднизон (максимальная ежедневная доза преднизона или эквивалента составляла 10 мг).
Изменения только уровня ПСА не всегда определяют клиническую эффективность. Таким образом, в обоих исследованиях было рекомендовано, чтобы пациенты продолжали принимать назначенное лечение до появления у них признаков, соответствующих критериям выбывания из исследования, как обозначено ниже для каждого исследования.
Исследование MDV3100-03 (PREVAIL) (пациенты, не получавшие химиотерапию)
1717 пациентов без симптомов или с умеренно выраженными симптомами были рандомизированы 1:1 в группы энзалутамида в дозе 160 мг 1 раз в день (N = 872) либо плацебо 1 раз в день (N = 845). Пациенты с висцеральными метастазами, с наличием умеренной и выраженной сердечной недостаточности (класс NYHA 1 или 2) в анамнезе, и пациенты, принимающие препараты, которые могут снижать судорожный порог, включались в исследование. Пациенты с судорогами в анамнезе или состоянием, которое может способствовать возникновению судорог, и пациенты с умеренной или выраженной болью, связанной с раком предстательной железы, исключались из исследования. Лечение в исследовании продолжалось до прогрессии заболевания (наличие радиографической прогрессии, костного осложнения или клинической прогрессии) и начала либо цитотоксической химиотерапии, либо лечения другим исследуемым препаратом, либо до развития непереносимой токсичности.
Данные пациентов и исходные характеристики заболевания были сбалансированы между группами лечения. Средний возраст составил 71 год (разброс 42-93 года) и расовое распределение составило: 77% Европейцы, 10% Азиаты, 2% Афроамериканцы и 11% другие или неизвестные расы. Шестьдесят восемь процентов (68%) пациентов имели балл по шкале оценки жизнедеятельности ECOG 0 и 32% пациентов имели балл ECOG 1. Исходная оценка боли составила 0-1 (отсутствие симптомов) у 67% пациентов и 2-3 (умеренные симптомы) у 32% пациентов при оценке по Краткому опроснику оценки боли (сокращенная форма) (худший вариант боли за прошедшие 24 часа по шкале от 0 до 10). Около 45% пациентов имели определяемое заболевание мягких тканей в начале исследования и 12% пациентов имели висцеральные (легкое и/или печень) метастазы.
Составными первичными точками были общая выживаемость и выживаемость без радиографической прогрессии (рБПВ). В дополнение к первичным точкам эффективность оценивалась по времени до начала цитотоксической химиотерапии, лучшему общему ответу со стороны мягких тканей, времени до первого костного осложнения, ПСА-ответу (снижение ≥ 50% от исходного уровня), времени до ПСА-прогрессии и времени до ухудшения общего балла по шкале FACT-P.
Радиографическая прогрессия оценивалась при последовательных лучевых обследованиях с использованием критериев PCWG2 (для костных поражений) и/или RECIST v1.1 (при поражении мягких тканей). При оценке рБПВ использовалась централизованная оценка радиографической прогрессии.
При проведении предварительно запланированного промежуточного анализа для общей выживаемости было показано, что лечение энзалутамидом приводило к статистически достоверному увеличению общей выживаемости по сравнению с плацебо со снижением риска смерти на 29,4%, [отношение рисков (ОР) = 0.706 (95% ДИ: 0.596; 0.837), p <0.0001]. Обновленный анализ выживаемости был проведен после 784 смертей. Результаты обновленного анализа выживаемости [медиана общей выживаемости составила 35.3 и 31.3 месяца, соответственно), отношение рисков (95% ДИ) 0.77 (0.67, 0.88, p <0.0002)] подтвердили результаты промежуточного анализа [медиана общей выживаемости составила 32.4 и 30.2 месяца, соответственно), отношение рисков (95% ДИ) 0.71 (0.60, 0.84, p <0.00041)]. В обновленном анализе 52% пациентов, которые получали энзалутамид, и 81% пациентов, получавших плацебо, получали последующие варианты терапии метастатического КРРПЖ с доказанным увеличением общей выживаемости.
При проведении запланированного анализа рБПВ было продемонстрировано статистически достоверное улучшение между группами лечения со снижением риска радиографической прогрессии или смерти на 81.4% в группе энзалутамида [ОР = 0.186 (95% ДИ: 0.149, 0.231), p < 0.0001]. Прогрессия отмечалась у ста восемнадцати (14%) пациентов в группе энзалутамида и у 321 (40%) пациентов в группе плацебо. Медиана рБПВ не была достигнута (95% ДИ: 13.8, не достигнута) в группе энзалутамида и составила 3.9 месяцев (95% ДИ: 3.7, 5.4) в группе плацебо. Одинаковое улучшение рБПВ наблюдалось среди всех заранее определенных подгрупп пациентов (возраст, исходный статус ECOG, исходный уровень ПСА и ЛДГ, балл Глисона на момент диагноза, висцеральное заболевание при скрининге). При проведении запланированного анализа рБПВ во время наблюдения, который основывался на оценке радиографической прогрессии исследователем, было продемонстрировано статистически достоверное улучшение между группами лечения со снижением риска радиографической прогрессии или смерти на 69.3% в группе энзалутамида [ОР = 0.307 (95% ДИ: 0.267, 0.353), p < 0.0001]. Медиана рБПВ составила 19.7 месяца в группе энзалутамида и 5.4 месяца в группе плацебо.
В дополнение к составным первичным показателям эффективности статистически достоверное улучшение было продемонстрировано в отношении следующих проспективно определенных конечных точек.
Медиана времени до начала цитотоксической химиотерапии составила 28.0 месяцев в группе энзалутамида и 10.8 месяцев в группе плацебо (ОР = 0.350, 95% ДИ: [0.303, 0.403], p < 0.0001).
Процент пациентов в группе энзалутамида с исходно определявшимся заболеванием и имевших объективный ответ со стороны мягких тканей составил 58.8% (95% ДИ: 53.8, 63.7) по сравнению с 5.0% (95% ДИ: 3.0, 7.7) пациентов в группе плацебо. Абсолютное различие в объективном ответе со стороны мягких тканей между группами энзалутамида и плацебо составило 53.9% (95% ДИ: 48.5%, 59.1%, p < 0.0001). Полный ответ был отмечен у 19.7% пациентов в группе энзалутамида по сравнению с 1.0% пациентов в группе плацебо, и частичный ответ был отмечен у 39.1% пациентов в группе энзалутамида против 3.9% пациентов в группе плацебо.
Энзалутамид достоверно снижал риск первого костного осложнения на 28% [ОР = 0.718 (95% ДИ: 0.610, 0.844) p < 0.0001]. Костное осложнение определялось как лучевая терапия или хирургия на костных тканях в связи с раком предстательной железы, патологический костный перелом, сдавление спинного мозга или изменение противоопухолевой терапии для лечения боли в костях. Анализ включал 587 костных осложнений, из которых 389 случая (66.3%) составила лучевая терапия, 79 случаев (13.5%) – сдавление спинного мозга, 70 случаев (11.9%) – патологический костный перелом, 45 случаев (7.6%) – изменение противоопухолевой терапии для лечения боли в костях, и 22 случая (3.7%) – хирургия на костной ткани.
У пациентов, получавших энзалутамид, отмечался достоверно более высокий ПСА-ответ (определялся как снижение ≥ 50% от исходного уровня), по сравнению с пациентами, получавшими плацебо, 78.0% против 3.5% (различие = 74.5%, p < 0.0001).
Медиана времени до ПСА-прогрессии по критериям PCWG2 составила 11.2 месяца для пациентов в группе энзалутамида и 2.8 месяца для пациентов в группе плацебо [ОР = 0.169, (95% ДИ: 0.147, 0.195), p < 0.0001].
Лечение энзалутамидом снижало риск ухудшения по шкале FACT-P на 37.5% по сравнению с плацебо (p < 0.001). Медиана времени до ухудшения по шкале FACT-P составила 11.3 месяцев в группе энзалутамида и 5.6 месяцев в группе плацебо.
Исследование CRPC2 (AFFIRM) (пациенты, получавшие химиотерапию)
Эффективность и безопасность энзалутамида у пациентов с метастатическим кастрационно-резистентным раком предстательной железы (КРРПЖ), которые получали доцетаксел и использовали аналог ЛГРГ или перенесли орхиэктомию, оценивалась в рандомизированном, плацебо-контролируемом, многоцентровом клиническом исследовании III фазы. 1199 пациентов были рандомизированы 2:1 в группы энзалутамида в дозе 160 мг 1 раз в день (N = 800) либо плацебо 1 раз в день (N = 399). Пациенты могли, но не были обязаны, принимать преднизон (максимальная ежедневная доза преднизона или эквивалента составляла 10 мг). Пациенты, рандомизированные в каждую группу, продолжали лечение до прогрессии заболевания (наличие радиографической прогрессии или появление костного осложнения) и начала новой системной противоопухолевой терапии, либо до развития непереносимой токсичности, либо выбывания.
Следующие данные пациентов и исходные характеристики заболевания были сбалансированы между группами лечения. Средний возраст составил 69 лет (разброс 41-92 года) и расовое распределение составило: 93% Европейцы, 4% Афроамериканцы, 1% Азиаты, и 2% другие расы. 91.5% пациентов имели балл по шкале оценки жизнедеятельности ECOG 0-1 и 8.5% пациентов имели балл ECOG 2. У 28% пациентов балл при оценке по Краткому опроснику оценки боли (сокращенная форма) был ≥ 4 (средний отмеченный пациентами худший вариант боли за прошедшие 24 часа, определяемый в течение семи дней до рандомизации). У большинства (91%) больных были костные метастазы, а у 23% — висцеральные поражения легких и/или печени. При включении в исследование, у 41% пациентов была прогрессия только по уровню ПСА, в то время как у 59% пациентов наблюдалась прогрессия по рентгенографическим данным. Пятьдесят один процент (51%) пациентов получали бисфосфонаты при включении в исследование.
Из исследования AFFIRM исключались пациенты с медицинскими состояниями, которые могли способствовать возникновению судорог, и пациенты, принимавшие препараты, которые могут снижать судорожный порог, а также пациенты с клинически выраженными сердечно-сосудистыми заболеваниями такими, как неконтролируемая гипертензия, инфаркт миокарда или нестабильная стенокардия в недавнем прошлом, сердечная недостаточность (класс NYHA III или IV при отсутствии фракции выброса ≥ 45%), клинически выраженная желудочковая аритмия или АВ-блокада (при отсутствии постоянного водителя ритма).
Исследование продемонстрировало статистически достоверное превосходство в общей выживаемости у пациентов, получавших энзалутамид, по сравнению с пациентами из группы плацебо: медиана выживаемости 18,4 и 13,6 месяца соответственно (ОР = 0.631 95% ДИ: [0.529, 0.752], p < 0.0001).
В дополнение к наблюдаемому улучшению общей выживаемости в пользу энзалутамида говорят и ключевые второстепенные критерии оценки (ПСА-прогрессия, радиографическая выживаемость без прогрессирования заболевания и время до первого осложнения со стороны костных тканей), значения которых статистически значимо отличались от плацебо.
Подтвержденное снижение уровня ПСА на 50% или 90% наблюдалось у 54,0% и 24,8% пациентов, которые получали энзалутамид, и у 1,5% и 0,9% пациентов, которые получали плацебо (р<0,0001). Медиана времени до ПСА-прогрессии составила 8,3 месяца у пациентов, которые получали энзалутамид, и 3,0 месяца у пациентов из группы плацебо.
Радиографическая выживаемость без прогрессии (оценка исследователей с использованием критериев оценки ответа солидных опухолей на терапию (RESICT) версии 1.1 для мягких тканей и появление 2 или более поражений костей на остеосцинтиграфии) составила 8,3 месяца у пациентов, получавших энзалутамид, и 2,9 месяца у пациентов, получавших плацебо (ОР = 0,404, 95% ДИ: [0.350, 0.466], р < 0,0001). Анализ включал 216 смертей без документированного прогрессирования и 645 документально подтвержденных случаев прогрессии, 303 из которых (47%) были связаны с прогрессированием в мягких тканях, 268 (42%) были обусловлены прогрессированием костных метастазов и 74 (11%) были связаны с поражением мягких и костных тканей.
Медиана времени до появления первого костного осложнения составила 16,7 месяцев у пациентов, получавших энзалутамид, и 13,3 месяца у пациентов, получавших плацебо (ОР = 0,688, 95% ДИ: [0.566, 0.835], р < 0,0001). Костное осложнение было определено как лучевая терапия или хирургическое вмешательство на костных тканях, патологический перелом кости, компрессия спинного мозга или изменение противоопухолевой терапии для лечения боли в костях. Анализ включал 448 костных осложнений, на 227 из которых (62%) приходилась лучевая терапия костей, 95 (21%) — компрессия спинного мозга, 47 (10%) — патологические переломы костей, 36 (8%) — изменение противоопухолевой терапии для лечения боли в костях и 7 (2%) — операции на костях.
Эффективность энзалутамида у пациентов, получавших абиратерон, не была изучена.
Пожилые люди
Из 1671 пациента, получавшего энзалутамид в исследованиях фазы III, 1261 пациент (75%) был в возрасте 65 лет и старше и 516 пациентов (31%) были в возрасте 75 лет и старше. У данных пожилых пациентов и более молодых пациентов не отмечалось каких-либо различий в безопасности и эффективности.

Товары из категории — Препараты для лечения онкологических заболеваний
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 175 350
Фармакологические свойства
Кстанди – медицинский препарат, который предназначен для терапии опухолей и новообразований предстательной железы в тяжелой форме, когда оперативное вмешательство или лечение медикаментами не помогает и не способствует понижению андрогенов.
Активный действующий компонент медикамента – энзалутамид. Это искусственно созданный антиандроген, действие которого направлено на блокировку использования организмом любых гормонов, вырабатываемых мужскими и женскими половыми железами, и корой надпочечников.
Рак предстательной железы – заболевание, которое характерно для представителей мужского пола, опухоль формируется ниже мочевика непосредственно перед прямой кишкой. Под воздействием мужского гормона тестостерона и других гормонов репродуктивной системы опухоль растет и развивается.
Если терапевтическое действие направить на понижение числа андрогенов в организме мужчины, то можно добиться уменьшения новообразования и замедления ее развития вплоть до полной остановки. Кстанди способствует понижению активной деятельности половых гормонов, и как следствие, замедляет рост и развитие опухоли.
После проведенных многочисленных исследований препарата было установлено, что он эффективно борется с раковыми опухолями, уменьшая риск их развития. Прием препарата, содержащего энзалутамид, способствует уменьшению смертности из-за онкологических заболеваний предстательной железы. Многим пациентам, которые вовремя начали прием медикамента, не понадобилось лечение инфекционных, опухолевых заболеваний с помощью воздействия на больные участки химическими препаратами.
Состав и форма выпуска
Медикаментозное средство выпускается в виде непрозрачных капсул, имеющих белый цвет. На одной из сторон таблетки имеется гравировка черного цвета в виде буквенных изображений. Внутри каждой капсулы содержится действующее вещество в виде тягучей маслообразной жидкости желтоватого оттенка.
В состав препарата входят:
Препарат продается в картонных упаковках по 28 таблеток в блистере. В комплекте идет инструкция.
Показания к применению
Медикаментозное средство используется для терапии опухолей предстательной железы в тяжелой форме. Производитель гарантирует эффективность лекарственного средства в борьбе с раком простаты, когда хирургическое вмешательство не приносит результатов или не может быть выполнено.
Международная классификация болезней (МКБ-10)
С.61. Злокачественное новообразование предстательной железы;
С79.8. Вторичное злокачественное новообразование других уточненных локализаций.
Побочные эффекты
Прием медикаментозного средства Кстанди может привести к проявлению ряда побочных признаков:
При появлении следующих симптоматических признаков стоит прекратить прием медикамента, содержащего энзалутамид:
Прием медикамента может привести к снижению скорости реакции, потери сознания и рассеянности, поэтому следует воздержаться от управления транспортными средствами и выполнения работы, требующей концентрации внимания.
Перед приёмом медикамента необходимо сообщить лечащему врачу о наличии следующих проблем со здоровьем: заболевания сердечно-сосудистой системы, эпилептические припадки, перенесенные травматические повреждения головы, острое нарушение мозгового кровообращения, опухоли мозга, непроизвольные сокращения мышц.
Противопоказания
Медикаментозное средство не рекомендуется принимать пациентам, у которых обнаружена непереносимость к энзалутамиду или другим компонентам препарата. С осторожностью следует принимать медикамент детям, пожилым людям, пациентам с почечными и печеночными заболеваниями, так как нет клинических данных и показаний о воздействии медикамента на эти группы больных.
Применение при беременности
Медикаментозное средство предназначено для лечения представителей мужского пола, однако прием медикамента мужчиной во время зачатия ребенка может оказать влияние на плод и привести к риску возникновения врожденных дефектов и отставанию в развитии плода. Во время применения медикамента, а также спустя три месяца после, следует использовать надежные средства контрацепции.
Способ и особенности применения
Медикаментозное средство следует принимать только по назначению лечащего врача, после проведения всех необходимых медицинских обследований, сдачи всех анализов, а также точного определения клинической картины заболевания.
Согласно инструкции по применению, рекомендуемая суточная доза составляет четыре таблетки по 40 мг. ежедневно. Принимают медикамент независимо от времени употребления пищи внутрь, запивая достаточным количеством жидкости.
При пропуске таблетки необходимо восполнить пробел в этот же день, если прошло больше суток, то не стоит увеличивать ежедневную дозировку.
Точную дозировку и продолжительность курса лечения назначает пациенту лечащий врач.
Взаимодействие с другими лекарствами
При приеме других медикаментов следует сообщить об этом лечащему врачу, который примет решение о возможности совмещения препаратов или об отмене одного из них в случае несовместимости. Это касается не только сильнодействующих лекарственных препаратов, но и биологически активных добавок, витаминов, гомеопатических средств.
При приеме следующих видов лекарственных средств и Кстанди следует соблюдать осторожность и находиться под наблюдением медицинского персонала:
Передозировка
При передозировке медикаментозным средством или энзалутамидом следует незамедлительно сообщить об этом лечащему врачу. При чрезмерном употреблении медикамента следует незамедлительно прекратить его применение. Полный вывод средства из организма происходит в течение 6 дней. Передозировка медикаментом может привести к риску проявления побочных эффектов в острой форме, а также к судорогам.
Аналоги
Аналогами медикамента Кстанди по составу, а также фармакологическому воздействию являются:
Решение о замене медикамента, а также его отмене принимает исключительно лечащий врач.
Условия продажи
Медикаментозное средство продается в аптечных пунктах по назначению лечащего врача при наличии рецептурного листа.
Условия хранения
Медикамент Кстанди следует хранить в недоступном для доступа детей месте при комнатной температуре, не превышающей 30 ° С. В инструкции содержатся более подробные сведения о нормах и правилах хранения медикамента в открытом и запечатанном виде.
Цены на Кстанди в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 175 350 руб.
Сертификаты и лицензии
Актуальность
Энзалутамид является ингибитором рецепторов к андрогенам, который продемонстрировал общее положительное влияние на выживаемость при метастатическом кастрационно-резистентном раке простаты. Исследование 2 фазы по применению монотерапии энзалутамидом у пациентов с раком предстательной железы без предшествующей гормональной терапии (РПЖБГТ) продемонстрировало высокий показатель ответа по предопределённой первичной конечной точке (т.е. ответ со стороны уровня простат-специфического антигена [PSA] через 25 недель) независимо от наличия метастазов перед началом лечения и хорошую переносимость препарата.
Цель исследования
Определить долгосрочную эффективность и безопасность монотерапии энзалутамидом через 1 и 2 года.
Дизайн, условия и участники исследования
Открытое исследование с одной группой пациентов с РПЖБГТ и некастрационным уровнем тестостерона (> 230 нг/дл).
Проведённые вмешательства
Энзалутамид в дозе 160 мг/сут перорально до прогрессирования заболевания или развития неприемлемых побочных эффектов.
Определение результатов и анализ
Ответ со стороны уровня PSA (снижение на 80% и более по сравнению с начальным уровнем) оценивался через 1 год (49 недель) и 2 года (97 недель).
Результаты и ограничения
Медиана (диапазон) возраста составила 73 года (48-86 лет), а у 26 пациентов (39%) имелись метастазы на момент включения в исследование. Из 67 включённых пациентов 45 (67%) продолжали принимать энзалутамид к 97 неделе. У пациентов, продолживших терапию, показатель PSA-ответа на 97 неделе составил 100% (95%-ный доверительный интервал – 92-100%). Из 26 пациентов с метастазами на момент вхождения в исследование у 13 (50%) наблюдался полный, а у четырёх (15.4%) – частичный наилучший ответ со стороны опухоли на 97 неделю терапии. В целом отмечены поддержание минеральной плотности костной ткани (МПК) всего тела и умеренные изменения сухой и жировой массы тела на 49 и 97 неделе. Самыми частыми нежелательными явлениями были гинекомастия, боль в сосках, усталость и приливы крови к лицу. Ограничениями исследования были отсутствие контрольной группы и данных о содержании гормонов, глюкозы и липидов в крови на 97 неделе.
Заключение
Долгосрочная монотерапия энзалутамидом у мужчин с некастрационным РПЖБГТ ассоциирована со значительным и продолжительным снижением уровня PSA, признаками благоприятного ответа со стороны опухоли и хорошим профилем безопасности / переносимости с относительно небольшим отрицательным влиянием на МПК всего тела.
Регистрация исследования.
NCT01302041
Ключевые слова: рецепторы к андрогенам, энзалутамид, рак простаты без предшествующей гормональной терапии, ответ со стороны простат-специфического антигена.
Long-term Efficacy and Safety of Enzalutamide Monotherapy in Hormone-naive Prostate Cancer: 1- and 2-Year Open-label Follow-up Results
By: Bertrand Tombal a, Michael Borre b , Per Rathenborg c , Patrick Werbrouck d , Hendrik Van Poppel e , Axel Heidenreich f , Peter Iversen g , Johan Braeckman h , Jiri Heracek i , Edwina Baskin-Bey j , Taoufik Ouatas j , Frank Perabo k , De Phung j , Benoit Baron j , Mohammad Hirmand l and Matthew R. Smith m
- a Institut de Recherche Clinique, Université Catholique de Louvain, Brussels, Belgium
- b Aarhus University Hospital, Aarhus, Denmark
- c Herlev Hospital, Herlev, Denmark
- d AZ Groeninge Kortrijk, Kortrijk, Belgium
- e UZ Leuven, Leuven, Belgium
- f Klinik und Poliklinik für Urologie, RWTH University Aachen, Aachen, Germany
- g Rigshospitalet, University of Copenhagen, Copenhagen, Denmark
- h UZ Brussel, Brussels, Belgium
- i Univerzita Karlova v Praze, Prague, Czech Republic
- j Astellas Pharma Global Development, Leiden, The Netherlands
- k Astellas Pharma Global Development, Northbrook, IL, USA
- l Medivation Inc., San Francisco, CA, USA
- m Massachusetts General Hospital Cancer Center, Boston, MA, USA
European Urology, Volume 68 Issue 5, November 2015, Pages 787-794
Keywords: Androgen receptor, Enzalutamide, Hormone-naïve prostate cancer, Prostate-specific antigen response
Автор перевода: Шатылко Тарас Валерьевич