Описание препарата Эральфон® (раствор для внутривенного и подкожного введения, 1000 МЕ) основано на официальной инструкции, утверждено компанией-производителем в 2019 году
Дата согласования: 19.08.2019
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Фотографии упаковок
19.08.2019
19.08.2019
Действующее вещество
ATX
Фармакологическая группа
Состав
| Раствор для внутривенного и подкожного введения | 1 амп. (1 мл) |
| действующее вещество: | |
| эпоэтин альфа (эритропоэтин человека рекомбинантный) | 1000 МЕ |
| 2000 МЕ | |
| 4000 МЕ | |
| 10000 МЕ | |
| вспомогательные вещества: альбумина раствор в пересчете на сухой альбумин — 2,5/2,5/2,5/2,5 мг; натрия цитрата пентасесквигидрат — 5,8/5,8/5,8/5,8 мг или натрия цитрата дигидрат — 4,776/4,776/4,776/4,776 мг; натрия хлорид — 5,84/5,84/5,84/5,84 мг; лимонной кислоты моногидрат — 0,057/0,057/0,057/0,057 мг; вода для инъекций — до 1 мл |
| Раствор для внутривенного и подкожного введения | 1 шприц (0,3 мл) |
| действующее вещество: | |
| эпоэтин альфа (эритропоэтин человека рекомбинантный) | 1000 МЕ |
| 2000 МЕ | |
| вспомогательные вещества: альбумина раствор в пересчете на сухой альбумин — 0,75/0,75 мг; натрия цитрата пентасесквигидрат — 1,74/1,74 мг или натрия цитрата дигидрат — 1,4328/1,4328 мг; натрия хлорид — 1,752/1,752 мг; лимонной кислоты моногидрат — 0,0171/0,0171 мг; вода для инъекций — до 0,3 мл |
| Раствор для внутривенного и подкожного введения | 1 шприц (0,5 мл) |
| действующее вещество: | |
| эпоэтин альфа (рекомбинантный эритропоэтин человека) | 2000 МЕ |
| вспомогательные вещества: альбумина раствор в пересчете на сухой альбумин — 1,25 мг; натрия цитрата пентасесквигидрат — 2,9 мг или натрия цитрата дигидрат — 2,388 мг; натрия хлорид — 2,92 мг; лимонной кислоты моногидрат — 0,0285 мг; вода для инъекций — до 0,5 мл |
| Раствор для внутривенного и подкожного введения | 1 шприц (0,4 мл) |
| действующее вещество: | |
| эпоэтин альфа (эритропоэтин человека рекомбинантный) | 4000 МЕ |
| вспомогательные вещества: альбумина раствор в пересчете на сухой альбумин — 1 мг; натрия цитрата пентасесквигидрат — 2,32 мг или натрия цитрата дигидрат — 1,9104 мг; натрия хлорид — 2,336 мг; лимонной кислоты моногидрат — 0,0228 мг; вода для инъекций — до 0,4 мл |
| Раствор для внутривенного и подкожного введения | 1 шприц (0,6 мл) |
| действующее вещество: | |
| эпоэтин альфа (эритропоэтин человека рекомбинантный) | 10000 МЕ |
| вспомогательные вещества: альбумина раствор в пересчете на сухой альбумин — 1,5 мг; натрия цитрата пентасесквигидрат — 3,48 мг или натрия цитрата дигидрат — 2,8656 мг; натрия хлорид — 3,504 мг; лимонной кислоты моногидрат — 0,0342 мг; вода для инъекций — до 0,6 мл |
| Раствор для внутривенного и подкожного введения | 1 шприц (1 мл) |
| действующее вещество: | |
| эпоэтин альфа (рекомбинантный эритропоэтин человека) | 10000 МЕ |
| вспомогательные вещества: альбумина раствор в пересчете на сухой альбумин — 2,5 мг; натрия цитрата пентасесквигидрат — 5,8 мг или натрия цитрата дигидрат — 4,776 мг; натрия хлорид — 5,84 мг; лимонной кислоты моногидрат — 0,057 мг; вода для инъекций — до 1 мл |
| Раствор для внутривенного и подкожного введения | 1 шприц (0,3 мл) |
| действующее вещество: | |
| эпоэтин альфа (эритропоэтин человека рекомбинантный) | 3000 МЕ |
| 5000 МЕ | |
| вспомогательные вещества: альбумина раствор в пересчете на сухой альбумин — 0,75/0,75 мг; натрия цитрата пентасесквигидрат — 1,74/1,74 мг или натрия цитрата дигидрат — 1,4328/1,4328 мг; натрия хлорид — 1,752/1,752 мг; лимонной кислоты моногидрат — 0,0171/0,0171 мг; вода для инъекций — до 0,3 мл |
| Раствор для внутривенного и подкожного введения | 1 шприц (0,5 или 0,6 мл) |
| действующее вещество: | |
| эпоэтин альфа (эритропоэтин человека рекомбинантный) | 20000 МЕ |
| вспомогательные вещества: альбумина раствор в пересчете на сухой альбумин — 1,25/1,5 мг; натрия цитрата пентасесквигидрат — 2,9/3,48 мг или натрия цитрата дигидрат — 2,388/2,8656 мг; натрия хлорид — 2,92/3,504 мг; лимонной кислоты моногидрат — 0,0285/0,0342 мг; вода для инъекций — до 0,5/0,6 мл |
| Раствор для внутривенного и подкожного введения | |
| действующее вещество: | |
| эпоэтин альфа (эритропоэтин человека рекомбинантный) | 40000 МЕ |
| вспомогательные вещества: альбумина раствор в пересчете на сухой альбумин — 2,5 мг; натрия цитрата пентасесквигидрат — 5,8 мг или натрия цитрата дигидрат — 4,776 мг; натрия хлорид — 5,84 мг; лимонной кислоты моногидрат — 0,057 мг; вода для инъекций — до 1 мл |
Описание лекарственной формы
Прозрачная бесцветная жидкость.
Фармакодинамика
Эпоэтин альфа представляет собой очищенный гликопротеин, стимулирующий эритропоэз; влияет на деление и дифференциацию клеток-предшественников.
Он продуцируется клетками млекопитающих со встроенным геном, кодирующим синтез эритропоэтина человека. По биологическим свойствам эпоэтин альфа не отличается от человеческого эритропоэтина.
Белковая фракция составляет около 58% от молекулярной массы и состоит из 165 аминокислот. Четыре углеводородных цепи присоединены к белку тремя М-гликозидными связями и одной О-гликозидной связью. Молекулярный вес эритропоэтина составляет приблизительно 32000–40000 Да.
После введения препарата количество эритроцитов, ретикулоцитов, уровень Hb и скорость поглощения 59Fe увеличиваются. На культуре клеток костного мозга показано, что эпоэтин альфа избирательно стимулирует эритропоэз, не оказывая влияния на лейкопоэз.
Здоровые добровольцы
После введения единичной дозы эритропоэтина альфа (от 20000 до 160000 МЕ п/к), наблюдался дозозависимый ответ, оцененный по следующим фармакодинамическим маркерам: содержание ретикулоцитов, эритроцитов и Hb. Профиль концентрация-время с пиком и возвратом к базовой линии наблюдался для изменения числа ретикулоцитов. Менее четкий профиль наблюдался для эритроцитов и Hb. Все фармакодинамические маркеры возрастали в линейной зависимости с максимальным значением ответа при наиболее высоких дозах.
При сравнении введения одной дозы 40000 МЕ и 3 доз 150 МЕ/кг/нед, несмотря на различие профилей концентрация-время, фармакодинамический ответ был одинаковым для двух режимов дозирования. Дополнительно проводили сравнение режимов при введении 1 раз в неделю и 1 раз в 2 нед. В итоге, основываясь на результатах фармакодинамических исследований, режим 40000 МЕ однократно в неделю показал себя более эффективным, чем при однократном введении в 2 нед, несмотря на подобие показателей для ретикулоцитов.
Пациенты с ХПН
Эритропоэтин альфа способен стимулировать эритропоэз у пациентов с анемией и ХПН, включая находящихся на гемодиализе. Первый очевидный ответ на введение эритропоэтина альфа с повышением числа ретикулоцитов наблюдался через 10 дней, с последующим повышением показателей гематокрита, эритроцитов и Hb, обычно в период от 2 до 6 нед. Ответ для Hb различается для отдельных пациентов и может зависеть от запасов железа и сопутствующих проблем со здоровьем.
Дети с ХПН
В клинических исследованиях с участием пациентов от 0,5 до 18 лет эритропоэтин альфа вводился в режиме 75 МЕ/кг/нед в/в в 2 или 3 дозы после диализа, титрование дозы производилось на 75 МЕ/кг/нед с интервалом в 4 нед (до максимальных 300 МЕ/кг/нед) для достижения роста концентрации Hb 1 г/дл/мес. 81% пациентов достигли желаемого значения концентрации Hb: от 9,6 до 11,2 г/дл. При среднем времени лечения 11 нед и средней дозе 150 МЕ/кг/нед, из пациентов, достигших целевых результатов терапии, 90% находились на режиме введения 3 раза в неделю.
Пациенты с анемией, вызванной проведением химиотерапии
Эритропоэтин альфа при введении 3 раза в неделю или 1 раз в неделю показал способность повышать Hb и уменьшать потребность в переливании крови через месяц после начала химиотерапии у онкологических пациентов с анемией. Профили АДС фармакодинамических параметров (содержание эритроцитов, ретикулоцитов, Hb) были одинаковы для здоровых добровольцев и для пациентов после химиотерапии.
Взрослые участники программы сбора аутологичной крови перед обширным хирургическим вмешательством
Эритропоэтин альфа доказано стимулирует выработку эритроцитов с целью увеличить объем сбора аутологичной крови и останавливает снижение содержания Hb у взрослых пациентов, направленных на обширные хирургические операции, которые не собираются создавать запас собственной крови.
Взрослые пациенты перед ортопедическими операциями
Для пациентов перед обширным хирургическим вмешательством со значением показателя Hb до лечения от >10 до <13 г/дл эритропоэтин альфа снижает риск получения трансфузии чужой крови и ускоряет восстановление числа эритроцитов (повышает уровень Hb, значение гематокрита и число ретикулоцитов).
Фармакокинетика
T1/2 при в/в введении составляет 5–6 ч, вне зависимости от тяжести заболевания. Vd приблизительно равен объему плазмы. Концентрация препарата в сыворотке крови при п/к введении значительно ниже, чем при в/в введении. Уровень препарата в сыворотке крови повышается медленно и достигает максимума через 12–18 ч после п/к введения. T1/2 при п/к введении составляет примерно 24 ч. Биодоступность препарата при п/к введении составляет около 25%.
В/в введение
Измерение концентрации эритропоэтина альфа после нескольких в/в инъекций при введении от 50 до 100 МЕ/кг выявило T1/2 4 ч у здоровых добровольцев и более долгий T1/2 у пациентов с ХПН — около 5 ч после доз 50, 100 и 150 МЕ/кг. Для детей T1/2 составляет 6 ч. При анализах крови с интервалом как минимум 4 дня ожидаемые значения T1/2 длительностью от 20,1 до 33 ч были отмечены у онкологических пациентов, получавших 667 и 1500 МЕ/кг эритропоэтина альфа в/в.
П/к введение
Сывороточные концентрации при п/к введении эритропоэтина альфа ниже, чем при в/в. Сывороточные концентрации нарастали медленно и достигали пиковых значений в период от 12 до 18 ч после п/к введения. Сывороточная Cmax при п/к введении ниже пикового значения при в/в введении (примерно на 1/20 от значения).
Накопления не происходит: сывороточные концентрации остаются прежними, как для анализов через 24 ч после первого введения, так и через 24 ч после последнего введения. Профили концентрация-время для 1-й и 4-й нед были одинаковыми при нескольких введениях 600 МЕ/кг/раз еженедельно у здоровых добровольцев.
T1/2 при п/к введении около 24 ч. Средние значения T1/2 были (19,4+8,1) и (15+6,1) ч при нескольких введениях дозы 150 МЕ/кг 3 раза в неделю и 40000 МЕ раз в неделю соответственно.
В исследованиях сравнивали режимы дозирования эритропоэтина альфа: 40000 МЕ п/к 1 раз в неделю с 150 МЕ/кг п/к 3 раза в неделю у здоровых пациентов, были оценены следующие параметры: исходя из сравнения АПС, относительная биодоступность эритропоэтина альфа 40000 МЕ 1 раз в неделю сравнительно с 150 МЕ/кг 3 раза в неделю была 176%.
Биодоступность эритропоэтина альфа при п/к введении в дозе 120 МЕ/кг была значительно ниже, чем при в/в: около 20%.
Особые группы пациентов
Пожилой возраст. Данные фармакокинетических исследований не выявили существенных различий в T1/2 для пациентов в возрасте 65 лет и старше.
Исследования у 7 новорожденных с низкой массой тела и 10 здоровых взрослых при в/в введении эритропоэтина альфа показали, что Vd был примерно от 1,5 до 2 раз выше у недоношенных детей, чем у здоровых добровольцев, а клиренс — примерно в 3 раза. Фармакокинетические показатели для здоровых добровольцев по сравнению с онкологическими пациентами с анемией, вызванной циклической химиотерапией, различались на 1-й нед применения (во время получения химиотерапии последними), но были одинаковым на 3-й нед (в отсутствие химиотерапии у пациентов с анемией), режим дозирования 150 МЕ/кг 3 раза в неделю или 40000 МЕ 1 раз в неделю.
Эпоэтин альфа обладает минимальной способностью индуцировать образование антител. Исследований канцерогенности не проводилось.
Эпоэтин альфа не вызывает мутаций бактериальных генов (тест Эймса), хромосомных аберраций в клетках млекопитающих, а также мутаций генов локуса НОРКТ. В ходе одного исследования было выявлено отсутствие различий в частоте возникновения фиброза костного мозга у пациентов, находившихся на диализе и получавших эпоэтин альфа в течение 3 лет, и у аналогичных пациентов, не получавших эпоэтин альфа. Тератогенность препарата у человека не изучена, у крыс и кроликов тератогенное действие эпоэтина альфа не обнаружено.
Показания
анемия, связанная с хронической почечной недостаточностью, у взрослых и детей, в т.ч. у пациентов, находящихся на гемо- или перитонеальном диализе;
анемия у взрослых онкологических пациентов при солидных (немиелоидных) опухолях, злокачественной лимфоме или множественной миеломе (для профилактики и лечения);
анемия у взрослых ВИЧ-инфицированных пациентов, получающих терапию зидовудином, при уровне эндогенного эритропоэтина менее 500 МЕ/мл;
в рамках предепозитной программы перед обширным хирургическим вмешательством у пациентов с уровнем гематокрита, равным 33–39%, для облегчения сбора аутологичной крови и уменьшения риска, связанного с использованием аллогенных гемотрансфузий, если ожидаемая потребность в переливаемой крови превышает количество, которое можно получить методом аутологичного сбора без применения эпоэтина альфа;
перед проведением обширной операции с ожидаемой кровопотерей 900–1800 мл у взрослых пациентов, не имеющих анемии или с легкой и средней степенью анемии (уровень Hb 100–130 г/л) для уменьшения потребности в аллогенных гемотрансфузиях и облегчения восстановления эритропоэза.
Противопоказания
повышенная чувствительность к препарату или его компонентам;
неконтролируемая артериальная гипертензия;
парциальная красноклеточная аплазия после ранее проведенной терапии каким-либо эритропоэтином;
невозможность проведения адекватной антикоагулянтной терапии;
тяжелая патология коронарных, сонных, мозговых и периферических сосудов, включая недавно перенесенный инфаркт миокарда или острое нарушение мозгового кровообращения (в рамках предепозитной программы сбора крови перед обширной хирургической операцией);
беременность;
период грудного вскармливания.
С осторожностью: эпилепсия, эпилептический синдром (в т.ч. в анамнезе) или заболевания, которые могут спровоцировать эпилептическую активность (например, инфекции ЦНС или метастазы в мозг), тромбоцитоз, тромбоз (в анамнезе), облитерирующие заболевания периферических сосудов и другие сосудистые осложнения, подагра, серповидно-клеточная анемия, железо-, В12— или фолиеводефицитные состояния, ишемическая болезнь сердца.
Если количество ретикулоцитов менее 20000 мм3 (или менее 20000/мкл, или менее 0,5%), количество тромбоцитов и лейкоцитов в норме и отсутствуют другие причины потери эффективности, необходимо провести анализ на наличие антител к эритропоэтину и исследование костного мозга для диагностики парциальной красноклеточной аплазии.
При подозрении на парциальную красноклеточную аплазию следует немедленно прекратить лечение эпоэтином альфа. Не следует назначать аналогичные препараты в связи с возможностью перекрестной реакции антител к эритропоэтину с другими эритропоэтинами. По показаниям может быть проведена соответствующая терапия (гемотрансфузии).
Эпоэтин альфа, будучи ростовым фактором, может оказывать стимулирующее действие на некоторые типы опухолей, особенно на злокачественные новообразования костного мозга.
Применение при беременности и кормлении грудью
Данные о применении эритропоэтина альфа у беременных женщин отсутствуют. Исследования на животных показали наличие у эритропоэтина альфа репродуктивной токсичности. Применение препарата при беременности не рекомендовано.
Неизвестно, проникает ли эритропоэтин альфа в грудное молоко. Применение препарата в период грудного вскармливания не рекомендовано.
Способ применения и дозы
В/в, п/к.
Перед применением следует внимательно осмотреть раствор на предмет наличия видимых частиц или изменения цвета. Препарат не следует встряхивать, т.к. это может привести к денатурации гликопротеина и потере активности препарата. Эральфон® не содержит консервантов, поэтому индивидуальная упаковка предназначена для однократного использования.
В/в введение. Продолжительность инъекции составляет не менее 1–5 мин. Более медленное введение предпочтительнее для пациентов, у которых отмечается гриппоподобный синдром на введение препарата. Пациентам, находящимся на гемодиализе, инъекция препарата производится через иглу в фистулу по завершении процедуры диализа. Для промывания соединительных трубок, а также для обеспечения удовлетворительного введения препарата в систему циркуляции после инъекции препарата Эральфон® вводят 10 мл изотонического раствора хлорида натрия.
Запрещается вводить препарат в виде в/в инфузии или смешивать его с другими ЛС.
П/к инъекции. Максимальный объем одной п/к инъекции не должен превышать 1 мл, при необходимости введения бóльших объемов следует использовать несколько точек введения. Препарат вводят под кожу плеча, бедра, передней брюшной стенки.
При изменении способа введения препарат вводят в прежней дозе, затем дозу при необходимости корректируют (для достижения одинакового терапевтического эффекта при п/к введении требуется доза на 20–30% меньше, чем при в/в введении).
Пациенты с ХПН
У пациентов ХПН Эральфон® может применяться в/в и п/к. В/в введение препарата предпочтительно для пациентов, находящихся на гемодиализе. У пациентов с ХПН, не получающих диализ, и пациентов, находящихся на перитонеальном диализе, препарат может вводиться п/к.
Оптимальное содержание Hb для взрослых пациентов составляет 100–120 г/л, для детей — 95–110 г/л.
При наличии у пациентов сопутствующей клинически выраженной ИБС или ХСН поддерживаемый уровень Hb не должен превышать верхний предел оптимального значения.
Доза препарата составляет 50 МЕ/кг. В процессе подбора доза препарата Эральфон® увеличивается, если уровень Hb повышается менее чем на 10 г/л/мес.
Клинически значимое увеличение уровня Hb обычно не наблюдается в срок менее 2 нед, а некоторым пациентам может потребоваться 6–10 нед.
При достижении нормального значения уровнек5я Hb доза препарата должна быть уменьшена до 25 МЕ/кг для того, чтобы не допустить превышения нормы уровня Hb. Доза должна быть уменьшена при достижении уровня Hb 120 г/л. Уменьшение дозы может быть достигнуто путем отмены одного введения в неделю или уменьшением вводимой дозы.
Взрослые пациенты, находящиеся на гемодиализе
У пациентов, находящихся на гемодиализе, Эральфон® предпочтительно применять в/в.
Лечение делится на 2 фазы — фаза коррекции анемии и поддерживающая фаза.
Фаза коррекции анемии. Эральфон® вводится из расчета 50 МЕ/кг 3 раза в неделю. При необходимости дозу можно увеличивать (не чаще, чем 1 раз в 4 нед) на 25 МЕ/кг 3 раза в неделю до достижения оптимального содержания Hb.
Поддерживающая терапия. обычная доза для поддержания оптимального содержания Hb составляет 30–100 МЕ/кг 3 раза в неделю. Имеющиеся данные позволяют предположить, что пациентам с тяжелой анемией (содержание Hb <60 г/л) требуется большая поддерживающая доза.
Взрослые пациенты, находящиеся на перитонеальном диализе
У пациентов, находящихся на перитонеальном диализе возможен как в/в, так и п/к способ введения препарата Эральфон®.
Фаза коррекции анемии. Препарат вводится из расчета 50 МЕ/кг 2 раза в неделю. При необходимости дозу можно поэтапно увеличивать на 25 МЕ/кг (не чаще, чем 1 раз в 4 нед) 2 раза в неделю до достижения оптимального содержания Hb.
Поддерживающая фаза. Обычная доза для поддержания оптимального Hb составляет от 25 до 50 МЕ/кг 2 раза в неделю.
Взрослые пациенты с ХПН, не получающие диализ
У пациентов с ХПН, не получающих диализ, возможен как в/в, так и п/к способ введения препарата Эральфон®.
Фаза коррекции анемии. Эральфон® вводится из расчета 50 МЕ/кг 3 раза в неделю. При необходимости дозу можно увеличивать (не чаще, чем один раз в 4 нед) на 25 МЕ/кг 3 раза в неделю до достижения оптимального содержания Hb.
Поддерживающая фаза. Обычная доза для поддержания оптимального содержания Hb составляет от 17 до 33 МЕ/кг 3 раза в неделю.
Дети, находящиеся на гемодиализе, вне зависимости от возраста
Фаза коррекции анемии. Эральфон® вводится из расчета 50 МЕ/кг 3 раза в неделю в/в. При необходимости дозу можно увеличивать (не чаще, чем один раз в 4 нед) на 25 МЕ/кг 3 раза в неделю до достижения оптимального содержания Hb.
Поддерживающая фаза. Обычно детям с массой тела до 30 кг требуется бóльшая поддерживающая доза, чем взрослым и детям с массой тела более 30 кг. В ходе клинических исследований после шестимесячной терапии эпоэтином альфа были установлены следующие поддерживающие дозы эпоэтина альфа (см. таблицу).
Таблица
| Масса тела, в кг | Доза препарата, МЕ/кг 3 раза в неделю | |
| Обычная поддерживающая | Медиана | |
| <10 | 75–150 | 100 |
| 10–30 | 60–150 | 75 |
| >30 | 30–100 | 33 |
Имеющиеся данные позволяют предположить, что пациентам с тяжелой анемией (Hb <68 г/л) требуется бóльшая поддерживающая доза, чем пациентам с менее тяжелой анемией.
Пациенты, страдающие онкологическими заболеваниями
Для лечения анемии у взрослых онкологических пациентов Эральфон® вводится п/к. Оптимальное содержание Hb должно составлять 100–120 г/л у мужчин и женщин и не должно быть превышено.
Начальная доза для профилактики или лечения анемии должна составлять 150 МЕ/кг 3 раза в неделю п/к. В качестве альтернативы начальная доза может составлять 40000 МЕ 1 раз в неделю п/к.
Если после четырех недель лечения содержание Hb повысилось и составляет не менее 10 г/л или количество ретикулоцитов увеличилось более чем на 40000 клеток/мкл выше исходного количества доза препарата Эральфон® остается прежней.
Если после 4 нед лечения повышение содержания Hb составляет менее 10 г/л и повышение количества ретикулоцитов составляет менее 40000 клеток/мкл по сравнению с исходным количеством в течение следующих 4 нед дозу увеличивают до 300 МЕ/кг 3 раза в неделю или до 60000 МЕ 1 раз в неделю.
Если после дополнительных 4 нед лечения при дозе препарата Эральфон® 300 МЕ/кг 3 раза в неделю или 60000 МЕ 1 раз в неделю содержание Hb повысилось и составляет не менее 10 г/л или количество ретикулоцитов увеличилось более чем на 40000 клеток/мкл, то сохраняют существующую дозу препарата Эральфон®. Если после 4 нед лечения в дозе 300 МЕ/кг или 60000 МЕ 1 раз в неделю содержание Hb повышается менее чем на 10 г/л и повышение количества ретикулоцитов составляет менее 40000 клеток/мкл по сравнению с исходным количеством, лечение следует прекратить.
В случае повышения содержания Hb более чем на 20 г/л в течение месяца или достижения содержания Hb 120 г/л дозу препарата необходимо уменьшить на 25%. Если содержание Hb превышает 120 г/л, необходимо приостановить лечение до снижения Hb ниже 120 г/л и затем продолжить введение препарата Эральфон® в дозе на 25% ниже первоначальной.
Терапия препаратом Эральфон® должна продолжаться в течение 1 мес после окончания курса химиотерапии.
ВИЧ-инфицированные пациенты, получающие терапию зидовудином
Рекомендуется до начала лечения препаратом Эральфон® определить исходный уровень эндогенного эритропоэтина в сыворотке крови. Проведенные исследования показывают, что при уровне эритропоэтина более 500 МЕ/мл эффект от терапии препаратом Эральфон® маловероятен.
Фаза коррекции анемии. Препарат назначается в дозе 100 МЕ/кг 3 раза в неделю п/к или в/в в течение 8 нед. Если по истечении 8 нед терапии не удалось достичь удовлетворительного эффекта (например, снизить потребность в гемотрансфузиях или добиться повышения Hb), доза может поэтапно увеличиваться (не чаще, чем один раз в 4 нед) на 50–100 МЕ/кг 3 раза в неделю. Если не удалось достигнуть удовлетворительного эффекта от терапии препаратом Эральфон® в дозе 300 МЕ/кг 3 раза в неделю, то появление ответа на дальнейшую терапию в более высоких дозах маловероятно.
Поддерживающая фаза. После достижения удовлетворительного эффекта в фазе коррекции анемии, поддерживающая доза должна обеспечить гематокрит в пределах 30–35% в зависимости от изменения дозы зидовудина, наличия сопутствующих инфекционных или воспалительных заболеваний. При гематокрите более 40%, следует прекратить введение препарата Эральфон® до снижения гематокрита до 36%. При возобновлении терапии доза эпоэтина альфа должна быть снижена на 25% с последующей корректировкой для поддержания требуемого гематокрита.
Содержание Hb у ВИЧ-инфицированных пациентов, получающих терапию зидовудином не должно превышать 120 г/л.
Уровень ферритина сыворотки (или уровень сывороточного железа) необходимо определять у всех пациентов до начала и в процессе лечения препаратом Эральфон®. При необходимости назначается дополнительный прием железа.
Взрослые пациенты, участвующие в программе сбора аутологичной крови перед хирургическими вмешательствами
Рекомендуется использовать в/в путь введения препарата. Эпоэтин альфа следует вводить по окончании процедуры сбора крови.
Перед назначением препарата Эральфон® следует учесть все противопоказания к сбору аутологичной крови. При каждом посещении врача у пациента забирают порцию крови (если уровень гематокрита равен 33–39% и/или уровень Hb равен 100–130 г/л) и сохраняют для аутологичной трансфузии. Рекомендуемая доза препарата Эральфон® — 600 МЕ/кг в/в 2 раза в неделю в течение 3 нед до операции. Уровень ферритина сыворотки (или уровень сывороточного железа) необходимо определять у всех пациентов до начала и в процессе лечения препаратом Эральфон®. При необходимости назначается дополнительный прием железа.
При наличии анемии ее причина должна быть установлена до начала терапии препаратом Эральфон®.
Пациенты в пред- и послеоперационном периоде, не участвующие в программе сбора аутологичной крови
Рекомендуется использовать п/к способ введения препарата в дозе 600 МЕ/кг/нед на протяжении 3 нед, предшествующих операции (21-, 14- и 7-й дни перед операцией), и в день операции. При необходимости, когда по медицинским показаниям необходимо сократить предоперационный период, Эральфон® можно назначать ежедневно в дозе 300 МЕ/кг в течение 10 дней до операции, в день операции и в течение 4 дней после операции. При содержании Hb <130 г/л рекомендуется назначать препарат Эральфон® в дозировке 300 МЕ/кг в день. Если содержание Hb достигает 150 г/л и выше, применение эпоэтина следует прекратить.
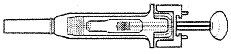
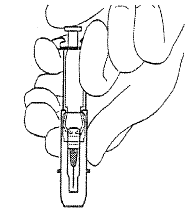
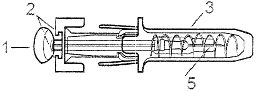
Устройство и порядок работы со шприцем с автоматическим устройством защиты иглы
Перед инъекцией.
После инъекции.
Составные части:
1. Шток.
2. Зажимы.
3. Защитный кожух.
4. Защитный колпачок.
5. Игла.
После завершения инъекции игла и шприц переместятся назад в защитное устройство.
Следует принимать во внимание, что необходимо избегать контакта с зажимами во время подготовки шприца. Устройство активируется путем нажатия на шток до зажимов.
Внимательно осмотреть преднаполненный стеклянный шприц с защитным устройством. Снять защитный колпачок с иглы.
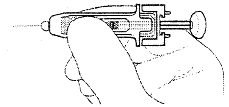
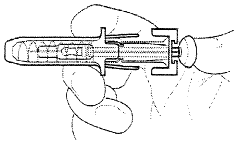
Провести инъекцию согласно стандартной процедуре.
Нажать на шток большим пальцем и удерживать до тех пор, пока вся доза препарата не будет введена.
Извлечь иглу, отпустить шток, позволить защитному кожуху переместиться вперед до тех пор, пока игла полностью не будет защищена и заблокирована на месте.
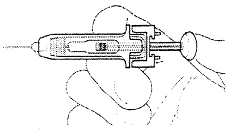
Порядок работы со шприцем с неавтоматическим устройством защиты иглы
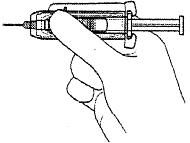
Провести инъекцию согласно стандартной процедуре. Следует принимать во внимание, что при проведении инъекции необходимо держать пальцы на защитном кожухе, чтобы предотвратить преждевременную активацию защитного устройства.
После инъекции переместить защитное устройство вдоль иглы. Звуковой щелчок укажет на правильность действия. Во время всей процедуры пальцы должны находиться позади иглы.
Побочные действия
Во время терапии эпоэтином альфа наиболее часто наблюдается дозозависимое повышение АД или ухудшение течения уже существующей артериальной гипертензии. Необходимо адекватно контролировать АД, особенно в начале терапии эпоэтином альфа. Также очень часто наблюдались диарея, тошнота, повышение температуры, рвота. Гриппоподобный синдром чаще всего наблюдался в начале терапии.
У пациентов, получающих эритропоэтинстимулирующие препараты, наблюдалась повышенная частота тромботических сосудистых явлений.
Отмечались реакции гиперчувствительности, включая сыпь, крапивницу, анафилактические реакции и ангионевротический отек.
Гипертонический криз с энцефалопатией и судорогами, требующий интенсивной терапии, наблюдался во время терапии эритропоэтином у пациентов, ранее имевших нормальное или пониженное АД. Рекомендуется внимательно наблюдать за возникновением внезапных мигренеподобных головных болей.
Ниже указаны нежелательные реакции, наблюдавшиеся у пациентов. Частоту нежелательных реакций классифицировали следующим образом: очень часто (≥10%); часто (≥1 и <10%); нечасто (≥0,1 и <1%); редко (≥0,01 и <0,1%); очень редко (<0,01%); неустановленной частоты.
Со стороны кровеносной и лимфатической систем: очень редко — эритропоэтиновая антителоопосредованная парциальная красноклеточная аплазия, тромбоцитемия.
Со стороны нервной системы: часто — головная боль, судороги, неустановленной частоты — цереброваскулярные случаи (в т.ч. инсульт, включающий церебральный инфаркт и внутримозговое кровоизлияние), транзиторная ишемическая атака, гипертоническая энцефалопатия.
Офтальмологические нарушения: неустановленной частоты — тромбоз сетчатки.
Со стороны ССС: часто — артериальная гипертензия (в т.ч. гипертонический криз), артериальные и венозные (в т.ч. летальные случаи) тромбозы и эмболии: ТГВ, артериальный тромбоз (в т.ч. инфаркт миокарда), тромбоз артериовенозного шунта аневризмы, эмболия легочной артерии.
Со стороны ЖКТ: очень часто — тошнота, диарея, рвота.
Со стороны дыхательной системы: часто — кашель, неустановленной частоты — заложенность дыхательных путей.
Со стороны кожи: часто — кожная сыпь; неустановленной частоты — крапивница, ангионевротический отек.
Со стороны костно-мышечной системы и соединительной ткани: часто — миалгия, артралгия, боль в костях, боль в конечностях.
Нарушения метаболизма и питания: нечасто — гиперкалиемия.
Другие: очень часто — повышение температуры, часто — гриппоподобный синдром, озноб, периферические отеки, реакции в месте введения препарата, тромбоз шунта (в т.ч. компонент диализа), неустановленной частоты — порфирия, неэффективность препарата.
Взаимодействие
Данных о взаимодействии эпоэтина альфа с другими ЛС нет. Препараты, которые снижают эритропоэз, могут ослаблять действие эритропоэтина альфа. Однако возможно влияние на концентрацию циклоспорина при одновременном применении, вследствие этого требуется дополнительный контроль уровня циклоспорина в сыворотке крови с последующей его коррекцией.
Нельзя разводить и переливать препарат из оригинальной в какую-либо другую емкость, нельзя вводить Эральфон® в смеси с другими ЛС.
У пациентов с метастазирующим раком груди, которым назначен одновременный прием эпоэтина альфа п/к в дозировке 40000 МЕ/мл и трастузумаба в дозировке 6 мг/кг, введение эпоэтина альфа не влияет на фармакокинетику трастузумаба.
Передозировка
Симптомы: усиление побочных эффектов.
Лечение: симптоматическое. При высоком уровне Hb — кровопускание.
Особые указания
До и после начала терапии препаратом Эральфон® необходимо адекватно контролировать АД. Препарат Эральфон® следует применять с осторожностью при наличии нелеченой или плохо контролируемой артериальной гипертензии. Во время терапии препаратом Эральфон® может понадобиться назначение антигипертензивной терапии. При невозможности снизить давление антигипертензивными средствами терапию препаратом Эральфон® необходимо прекратить.
Гипертонический криз, сопровождаемый энцефалопатией и судорогами, требующий немедленного медицинского вмешательства, также может произойти во время терапии препаратом Эральфон® у пациентов, ранее имевших нормальное или пониженное АД. Особое внимание должно быть уделено внезапно возникшей стреляющей мигренеподобной головной боли как возможному сигналу наступления криза (см. «Побочные действия»).
Эпоэтин альфа также следует с осторожностью использовать у пациентов с ХПН. Безопасность эпоэтина альфа у пациентов с нарушением функции печени не установлена. Вследствие сниженного метаболизма у пациентов с нарушением функции печени при применении эпоэтина альфа может происходить усиление эритропоэза.
У пациентов, получавших эритропоэтинстимулирующие препараты, наблюдалось повышение частоты тромботических сосудистых явлений, например венозные и артериальные тромбозы и эмболии (включая несколько случаев со смертельным исходом), такие как ТГВ, эмболия легочной артерии, тромбоз сетчатки и инфаркт миокарда. Кроме того, отмечались нарушения мозгового кровообращения (включая инфаркт головного мозга, внутримозговое кровоизлияние и транзиторные ишемические атаки). Следует тщательно сопоставлять отмеченный риск тромботических сосудистых явлений и пользу от лечения эпоэтином альфа, в особенности у пациентов с наличием факторов риска. У всех пациентов следует проводить тщательный мониторинг уровня Hb из-за потенциально повышенного риска развития тромбоэмболических явлений и смертельных исходов, наблюдаемого у пациентов, с повышенным уровнем Hb в случае терапии препаратом Эральфон®.
Безопасность и эффективность терапии эпоэтином альфа у пациентов с фоновыми гематологическими заболеваниями, например такими, как гемолитическая анемия, СКА, талассемия, изучена не была.
При лечении препаратом Эральфон® требуется регулярный контроль уровня тромбоцитов, особенно в течение первых 8 нед, т.к. возможно развитие дозозависимого относительного повышения количества тромбоцитов, которое нормализуется в дальнейшем без отмены терапии; в редких случаях отмечается абсолютное повышение числа тромбоцитов.
Перед началом терапии эпоэтином альфа, а также при принятии решения о повышении его дозы следует провести оценку и лечение других причин анемии (дефицит железа, фолиевой кислоты или витамина В12, интоксикация алюминием, инфекция или воспаление, кровопотеря, гемолиз и фиброз костного мозга любого генеза). В большинстве случаев значения уровня ферритина в сыворотке крови снижаются одновременно с увеличением гематокрита. Для достижения оптимального ответа на эпоэтин альфа следует обеспечить адекватные запасы железа, с введением при необходимости дополнительного приема железосодержащих препаратов:
— пациентам с ХПН рекомендуется дополнительный прием железосодержащих препаратов (элементарного железа 200–300 мг/сут перорально у взрослых и 100–200 мг/сут перорально у детей) в случае уровня ферритина сыворотки ниже 100 нг/мл;
— пациентам с онкологическим заболеванием рекомендуется дополнительный прием железосодержащих препаратов (элементарного железа 200–300 мг/сут перорально) в случае насыщения трансферрина менее 20%;
— пациентам программы сбора аутологичной крови рекомендуется дополнительный прием железосодержащих препаратов (элементарного железа 200 мг/сут перорально) в течение нескольких недель перед началом сбора аутологичной крови, с целью достижения больших запасов железа перед началом терапии эпоэтином альфа, а также в течение всего курса терапии эпоэтином альфа;
— пациентам, которым назначена большая плановая ортопедическая операция, рекомендуется дополнительный прием железосодержащих препаратов (элементарного железа 200 мг/сут перорально) в течение всего курса терапии эпоэтином альфа. При возможности, применение препаратов, содержащих железо, следует начать до начала терапии эпоэтином альфа, чтобы создать достаточные запасы железа.
Очень редко у пациентов, получавших лечение эпоэтином альфа, в начале лечения наблюдались обострения порфирии. У пациентов с порфирией эпоэтин альфа следует использовать с осторожностью.
Средства, стимулирующие эритропоэз, необязательно эквивалентны. Поэтому следует уточнить, что пациентов следует переводить с одного препарата, стимулирующего эритропоэз (такого как Эральфон®), на другой только с одобрения лечащего врача.
У пациентов с ХПН, получавших лечение п/к введением эпоэтина очень редко, спустя месяцы и годы лечения отмечалась антителоопосредованная истинная эритроцитарная аплазия (ИЭА).
Изредка отмечались также случаи этого заболевания у пациентов с гепатитом С, получавших лечение интерфероном и рибавирином, когда одновременно проводилось лечение эритропоэтинстимулирующими препаратами, поэтому они не одобрены для лечения анемии, связанной с гепатитом С.
У пациентов с ХПН, у которых возникает внезапное снижение эффективности, определяемое по снижению Hb (1–2 г/дл/мес) с повышением потребности в трансфузиях, необходимо провести подсчет количества ретикулоцитов и обследовать на наличие типичных причин отсутствия ответа (например, дефицит железа, фолиевой кислоты или витамина В12, интоксикация алюминием, инфекция или воспаление, кровопотеря, гемолиз и фиброз костного мозга любого генеза). Если количество ретикулоцитов, скорректированное с учетом анемии (т.е. ретикулоцитарный индекс), низкое (<20000/мм3 или <20000/мкл, или <0,5%), а количество тромбоцитов и лейкоцитов нормальны и не выявлены другие причины снижения эффекта, следует произвести определение уровня антител к эритропоэтину, а также рассмотреть возможность исследования костного мозга с целью диагностики ИЭА.
Если возникает подозрение на ИЭА, опосредованную антиэритропоэтиновыми антителами, терапию эпоэтином альфа следует немедленно прекратить. Не следует начинать лечение какими-либо иными эритропоэтинстимулирующими препаратами, поскольку существует риск развития перекрестной реакции. При наличии показаний пациентам может быть проведена соответствующая терапия, такая как переливание крови.
Пациентам с ХПН на фоне лечения препаратом Эральфон®, необходимо регулярно измерять уровень Hb до тех пор, пока уровень Hb не достигнет стабильных значений, с периодическим контролем в дальнейшем. Для уменьшения риска возникновения артериальной гипертензии скорость повышения уровня Hb должна составлять приблизительно 10 г/л (максимально 20 г/л) в месяц. Доза должна быть уменьшена, когда уровень Hb достигнет 120 г/л.
У пациентов с ХПН поддерживаемый уровень Hb не должен превышать верхней границы указанного диапазона уровня Hb. Уровень Hb, равный 130 г/л или выше, может привести к повышенному риску развития сердечно-сосудистых явлений, включая смерть.
Пациенты с ХПН и недостаточным ответом Hb на терапию эритропоэтинстимулирующими препаратами могут подвергаться даже еще большему риску сердечно-сосудистых явлений и смертности, чем другие пациенты. Исходя из доступной на данный момент информации, применение эпоэтина альфа у пациентов до начала применения диализа (терминальная стадия почечной недостаточности) не повышает скорость прогрессирования почечной недостаточности.
У пациентов на гемодиализе возникали тромбозы шунтов, в особенности — у пациентов с тенденцией к гипотензии или осложнениями со стороны артериовенозных фистул (например, стенозы, аневризмы). У данных пациентов рекомендуются ранняя проверка шунта и профилактика тромбоза путем введения, например, ацетилсалициловой кислоты.
В отдельных случаях наблюдалась гиперкалиемия, хотя ее причинно-следственная связь с применением препарата не установлена. У пациентов с ХПН следует производить мониторинг электролитов сыворотки. Если уровень калия сыворотки повышен или нарастает, тогда, в дополнение к надлежащему лечению гиперкалиемии, следует рассмотреть возможность прекращения введения эпоэтина альфа вплоть до корректировки уровня калия сыворотки.
Вследствие повышения гематокрита на фоне терапии эпоэтином альфа пациентам на гемодиализе может потребоваться увеличение дозы гепарина, в противном случае возможна окклюзия диализной системы.
У некоторых пациенток с ХПН на фоне лечения эпоэтином альфа отмечалось возобновление менструаций. Возможность наступления беременности и необходимость контрацептивных мер должны быть обсуждены с пациенткой до начала терапии.
Средства, стимулирующие эритропоэз, являются факторами роста, которые стимулируют в первую очередь образование эритроцитов. Рецепторы эритропоэтина могут экспрессироваться на поверхности многих опухолевых клеток. Как и в случае всех факторов роста, существуют сомнения в отношении того, что средства, стимулирующие эритропозз, могут стимулировать рост опухолей.
С точки зрения вышесказанного, решение о введении препарата рекомбинантного эритропоэтина должно приниматься на основании оценки отношения риска и пользы с участием конкретного пациента, и должно учитывать конкретную клиническую ситуацию. Факторы, которые следует рассматривать при такой оценке, включают: тип и стадию опухоли, степень тяжести анемии, ожидаемую продолжительность жизни, условия, в которых пациент получает лечение, предпочтения пациента.
У пациентов с онкологическим заболеванием, получающих химиотерапию, при оценке пригодности терапии эпоэтином альфа (в особенности у пациентов, подверженных риску трансфузии) следует учитывать задержку в 2–3 нед между введением средств, стимулирующих эритропоэз и появлением стимулированных эритропоэтином эритроцитов. Если ВИЧ-инфицированный пациент не отвечает или ответ на терапию эпоэтином альфа недостаточный, следует рассмотреть другие возможные причины анемии, включая дефицит железа.
У пациентов, связанных с программой сбора аутологичной крови и получающих дополнительное лечение эпоэтином альфа, следует учитывать все особые предупреждения и особые меры предосторожности, в особенности — обязательное восполнение объема.
В до- и послеоперационном периоде всегда следует соблюдать надлежащие стандарты контроля показателей крови.
Пациентам, которым назначена большая плановая ортопедическая операция, следует проводить антитромботическую профилактику, поскольку у хирургических пациентов могут возникать тромботические и сосудистые явления, в особенности — у пациентов с фоновым сердечно-сосудистым заболеванием. Кроме того, следует соблюдать особые меры предосторожности у пациентов с предрасположенностью к развитию тромботических осложнений. Более того, у пациентов с исходным уровнем Hb >130 г/л (8,1 ммоль/л) нельзя исключить возможности того, что лечение эпоэтином альфа может быть связано с повышенным риском развития послеоперационных тромботических сосудистых явлений. Следовательно, у пациентов с исходным уровнем Hb >130 г/л (8,1 ммоль/л) применение эпоэтина альфа не рекомендуется.
Влияние на способность управлять транспортными средствами, механизмами. Влияние на способность управлять транспортными средствами или заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, не изучалось.
Форма выпуска
Раствор для внутривенного и подкожного введения, 1000 ME, 2000 ME, 2500 ME, 4000 ME, 6000 ME, 8000 ME и 10000 ME. По 1 мл в ампулах бесцветного нейтрального стекла с цветным кольцом разлома или цветной точкой и насечкой. На ампулах дополнительно нанесено 1, 2 или 3 цветных кольца и/или двухмерный штрихкод, и/или буквенно-цифровая кодировка, или без дополнительных цветных колец, двухмерного штрихкода, буквенно-цифровой кодировки.
По 5 амп. в контурной ячейковой упаковке из пленки ПВХ и пленки многослойной, или без пленки. 1 или 2 контурные ячейковые упаковки в пачке из картона.
Пачка с двух сторон заклеивается наклейками из самоклеящегося материала для контроля вскрытия или без наклеек.
По 0,3 мл 1000 ME, 0,4 мл 4000 ME в шприце стерильном стеклянном градуированном с иглой, защитным колпачком, с дополнительным автоматическим или неавтоматическим устройством для защиты иглы после использования шприца или без него.
По 1, 2 или 3 шприца в контурной ячейковой упаковке из пленки ПВХ или ПЭТ и пленки многослойной или полипропиленовой, или ПЭ, или бумаги упаковочной с полимерным покрытием, или бумаги для упаковывания медицинских изделий. 1 или 2 контурные ячейковые упаковки в пачке из картона.
Пачку с двух сторон заклеивают наклейками из самоклеящегося материала для контроля вскрытия или без наклеек.
По 0,3 мл 2000 ME, 0,5 мл 2000 ME, 0,6 мл 10000 ME, 1 мл по 10000 ME в шприце стерильном стеклянном градуированном с иглой, защитным колпачком, с дополнительным автоматическим или неавтоматическим устройством для защиты иглы после использования шприца или без него.
По 1, 2 или 3 шприца в контурной ячейковой упаковке из пленки ПВХ или ПЭТ и пленки многослойной или полипропиленовой, или ПЭ, или бумаги упаковочной с полимерным покрытием, или бумаги для упаковывания медицинских изделий. 1 или 2 контурные ячейковые упаковки в пачке из картона. 5 контурных ячейковых упаковок по 2 шприца без устройства для защиты иглы в пачке из картона.
Пачку с двух сторон заклеивают наклейками из самоклеящегося материала для контроля вскрытия или без наклеек.
По 0,25 мл (2500 ME); 0,6 мл (6000 ME); 0,8 мл (8000 ME) в шприце стерильном стеклянном градуированном с иглой, защитным колпачком, с дополнительным автоматическим или неавтоматическим устройством для защиты иглы после использования шприца или без него.
По 3 шприца в контурной ячейковой упаковке из пленки ПВХ или ПЭТ и пленки многослойной или полипропиленовой, или ПЭ, или бумаги упаковочной с полимерным покрытием, или бумаги для упаковывания медицинских изделий. 1 или 2 контурные ячейковые упаковки в пачке из картона.
Пачка с двух сторон заклеивается наклейками из самоклеящегося материала для контроля вскрытия или без наклеек.
Раствор для внутривенного и подкожного введения, 3000 ME, 5000 ME, 20000 ME. По 0,3 мл 3000 ME; по 0,3 мл 5000 ME; по 0,5 мл или по 0,6 мл 20000 ME в в шприце стерильном стеклянном градуированном с иглой, защитным колпачком, с дополнительным автоматическим или неавтоматическим устройством для защиты иглы после использования шприца или без него.
По 1 или 3 шприца в контурной ячейковой упаковке из пленки ПВХ или ПЭТ и пленки многослойной или полипропиленовой, или ПЭ, или бумаги упаковочной с полимерным покрытием, или бумаги для упаковывания медицинских изделий. 1 или 2 контурные ячейковые упаковки в пачке из картона.
Пачка с двух сторон заклеивается наклейками из самоклеящегося материала для контроля вскрытия.
Раствор для внутривенного и подкожного введения, 40000 ME. По 0,3 мл (12000 ME), по 1 мл (40000 ME) в шприце стерильном стеклянном градуированном с иглой, защитным колпачком, с дополнительным автоматическим или неавтоматическим устройством для защиты иглы после использования шприца или без него.
По 1, 2 или 3 шприца в контурной ячейковой упаковке из пленки ПВХ или ПЭТ и пленки многослойной или полипропиленовой, или ПЭ, или бумаги упаковочной с полимерным покрытием, или бумаги для упаковывания медицинских изделий. 1 контурная ячейковая упаковка по 1, 2 или 3 шприца или 2 контурные ячейковые упаковки по 2 или 3 шприца в пачке из картона.
Пачка с двух сторон заклеивается наклейками из самоклеящегося материала для контроля вскрытия.
Производитель
ЗАО «ФармФирма «Сотекс». 141345, Россия, Московская обл., Сергиево-Посадский муниципальный р-н, с.п. Березняковское, пос. Беликово, д. 10, д. 11, д. 12.
Юридическое лицо, на имя которого выдано регистрационное удостоверение и организация, принимающая претензии потребителей. ЗАО «ФармФирма «Сотекс». 141345, Россия, Московская обл., Сергиево-Посадский муниципальный р-н, с.п. Березняковское, пос. Беликово, д. 11.
Тел./факс: (495) 956-29-30.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре 2–8 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Регистрационный номер:
Торговое название препарата: Эральфон®
Международное непатентованное название:
Эпоэтин альфа
Лекарственная форма:
раствор для внутривенного и подкожного введения
Состав
1 шприц (1,0 мл) содержит в качестве активного вещества Эпоэтин альфа (эритропоэтин человека рекомбинантный) 40 000 ME
Вспомогательные вещества: альбумина раствор, натрия цитрата пентасесквигидрат или натрия цитрата дигидрат, натрия хлорид, лимонной кислоты моногидрат, вода для инъекций.
Описание: прозрачная бесцветная жидкость.
Фармакотерапевтическая группа:
гемопоэза стимулятор
Код ATX: В03ХА01
Фармакологические свойства
Фармакодинамика
Эпоэтин альфа — гликопротеид, специфически стимулирующий эритропоэз, активирует митоз и созревание эритроцитов из клеток-предшественников эритроцитарного ряда. Рекомбинантный эпоэтин альфа синтезируется в клетках млекопитающих, в которые встроен ген, кодирующий человеческий эритропоэтин. По своему составу, биологическим и иммунологическим свойствам эпоэтин альфа идентичен природному эритропоэтину человека. Введение эпоэтина альфа приводит к повышению уровней гемоглобина и гематокрита, улучшению кровоснабжения тканей и работы сердца. Наиболее выраженный эффект от применения эпоэтина альфа наблюдается при анемиях, обусловленных хронической почечной недостаточностью. В очень редких случаях, при длительном применении эритропоэтина для терапии анемических состояний может наблюдаться образование нейтрализующих антител к эритропоэтину с развитием парциальной красноклеточной аплазии или без неё.
Фармакокинетика
При внутривенном введении эпоэтина альфа у здоровых лиц и больных с уремией период полувыведения составляет 5-6 ч. При подкожном введении эпоэтина альфа его концентрация в крови нарастает медленно и достигает максимума в период от 12 до 18 ч после введения, период полувыведения составляет 16-24 часа. Биодоступность эпоэтина альфа при подкожном введении составляет 25-40 %. Не кумулирует.
Показания к применению
— профилактика и лечение анемий у больных с солидными опухолями, анемия у которых стала следствием проведения противоопухолевой терапии;
— профилактика и лечение анемий у больных с миеломной болезнью, неходжскинскими лимфомами низкой степени злокачественности, хроническим лимфолейкозом;
— в рамках предепозитной программы перед обширным хирургическим вмешательством у больных с уровнем гематокрита, равным 33-39 %, для облегчения сбора аутологичной крови и уменьшения риска, связанного с использованием аллогенных гемотрансфузий, если ожидаемая потребность в переливаемой крови превышает количество, которое можно получить методом аутологичного сбора без применения эпоэтина альфа;
— перед проведением обширной операции с ожидаемой кровопотерей 900-1800 мл у взрослых пациентов, не имеющих анемии или с легкой и средней степенью анемии (концентрация гемоглобина 100-130 г/л) для уменьшения потребности в аллогенных гемотрансфузиях и облегчения восстановления эритропоэза.
Противопоказания
— повышенная чувствительность к препарату или его компонентам;
— парциальная красноклеточная аплазия после ранее проведенной терапии каким-либо эритропоэтином;
— неконтролируемая артериальная гипертензия;
— невозможность проведения адекватной антикоагулянтной терапии;
— при тяжелых окклюзионных заболеваниях коронарных, сонных, мозговых и периферических артерий и их последствиях, включая острый и недавно перенесенный инфаркт миокарда и острое нарушение мозгового кровообращения (в рамках предепозитной программы сбора крови перед хирургическими операциями).
С осторожностью
Злокачественные новообразования, эпилептический синдром (в т.ч. при наличии в анамнезе), тромбоцитоз, тромбоз (в анамнезе), серповидно-клеточная анемия, железо-, В12- или фолиеводефицитные состояния, порфирия, хроническая печеночная недостаточность.
Применение при беременности и в период грудного вскармливания
Так как нет достаточного опыта применения эритропоэтина при беременности и лактации у человека, эпоэтин альфа следует назначать только в том случае, если ожидаемые преимущества для матери от его применения превышают возможный риск для плода. Неизвестно, выделяется ли эпоэтин альфа с грудным м:олоком, поэтому при лечении препаратом Эральфон® необходимо прекратить грудное вскармливание.
Способ применения и дозы
Профилактика и лечение анемии у больных с солидными опухолями
Для лечения анемии у онкологических больных рекомендуется вводить Эральфон® подкожно.
Оптимальная концентрация гемоглобина должна составлять 120 г/л у мужчин и женщин и не должна быть превышена.
Эральфон® может назначаться больным с симптоматической анемией, для профилактики анемии у пациентов, получающих химиотерапию и имеющих исходное низкую концентрацию гемоглобина во время первого курса химиотерапии, (например, исходное содержание гемоглобина 110-130 г/л или снижение более чем на 20 г/л при исходном гемоглобине свыше 130 г/л).
Перед началом лечения рекомендуется провести определение концентрации эндогенного эритропоэтина. При концентрации эритропоэтина в сыворотке крови менее 200 МЕ/мл, начальная разовая доза препарата составляет при внутривенном способе введения 150 МЕ/кг 3 раза в неделю подкожно. В качестве альтернативы начальная доза может составлять или 40 000 ME один раз в неделю подкожно.
Если после четырех недель лечения концентрация гемоглобина повысилась и составляет не менее 10 г/л, или количество ретикулоцитов увеличилось более чем на 40 000 клеток/мкл свыше исходного количества, доза Эральфона® остается прежней.
Если после четырех недель лечения повышение концентрации гемоглобина составляет менее 10 г/л, и повышение количества ретикулоцитов составляет менее 40 000 клеток/мкл по сравнению с исходным количеством, то в течение следующих четырех недель дозу увеличивают до 300 МЕ/кг массы тела три раза в неделю или до 60 000 ME один раз в неделю.
Если после дополнительных четырех недель лечения при дозе Эральфона® 300 МЕ/кг 3 раза в неделю или 60 000 ME один раз в неделю концентрация гемоглобина повысилось и составляет не менее 10 г/л, или количество ретикулоцитов увеличилось более чем на 40 000 клеток/мкл, то сохраняют существующую дозу Эральфона®.
Если после четырех недель лечения в дозе 300 МЕ/кг массы тела или 60 000 ME один раз неделю концентрация гемоглобина повышается менее чем на 10 г/л и повышение количества ретикулоцитов составляет менее 40 000 клеток/мкл по сравнению с исходным количеством, лечение следует прекратить.
В случае повышения концентрации гемоглобина более чем на 20 г/л в течение месяца или достижения концентрации гемоглобина 120 г/л, дозу препарата необходимо уменьшить на 25%. Если содержание гемоглобина превышает 120 г/л, необходимо приостановить лечение до снижения концентрации гемоглобина ниже 120 г/л и затем продолжить введение Эральфона® в дозе на 25% ниже первоначальной.
Терапия Эральфоном® должна продолжаться в течение одного месяца после окончания курса химиотерапии.
Уровень ферритина сыворотки (или уровень сывороточного железа) необходимо определять у всех пациентов до начала и в процессе лечения Эральфоном®. При необходимости назначается дополнительный прием препаратов железа.
Профилактика и лечение анемии у больных с миеломной болезнью, неходжскинскими лимфомами низкой степени злокачественности и с хроническим лимфолейкозом
У этих больных целесообразность лечения эпоэтином альфа обусловливается неадекватным синтезом эндогенного эритропоэтина на фоне развития анемии. При концентрации гемоглобина ниже 100 г/л и содержания эритропоэтина в сыворотке крови ниже 100 МЕ/мл Эральфон® вводят подкожно в стартовой разовой дозе 100 МЕ/кг три раза в неделю или один раз в неделю недельную дозу. Лабораторный контроль гемодинамических показателей проводят еженедельно. При необходимости дозу препарата корректируют в сторону увеличения или уменьшения каждые 3-4 недели. Если при достижении недельной дозы 600 МЕ/кг увеличение концентрации гемоглобина не наблюдается, дальнейшее применение эпоэтина альфа следует отменить как неэффективное.
Взрослые пациенты, участвующие в программе сбора аутологичной крови перед хирургическими вмешательствами.
Рекомендуется использовать внутривенный путь введения препарата. Эпоэтин альфа следует вводить по окончании процедуры сбора крови.
Перед назначением Эральфона® следует учесть все противопоказания к сбору аутологичной крови. Перед хирургическим вмешательством Эральфон следует назначать два раза в неделю в течение трех недель. При каждом посещении врача у больного забирают порцию крови (если гематокрит ≥33% и/или уровень гемоглобина ≥110 г/л) и сохраняют для аутологичной трансфузии. Рекомендуемая доза Эральфона® — 600 МЕ/кг массы тела внутривенно два раза в неделю. Уровень ферритина сыворотки (или уровень сывороточного железа) необходимо определять у всех пациентов до начала и в процессе лечения Эральфоном®. При необходимости назначается дополнительный прием железа.
При наличии анемии ее причина должна быть установлена до начала терапии Эральфоном®. Необходимо в кратчайшие сроки обеспечить адекватное поступление железа в организм, назначив препарат железа в дозе 200 мг/сутки (из расчета на элементарное железо) и поддерживать поступление железа на данном уровне в течение всего курса терапии.
Пациенты в пред- и послеоперационном периоде, не участвующие в программе сбора аутологичной крови.
Рекомендуется использовать подкожный способ введения препарата в дозе 600 МЕ/кг массы тела в неделю на протяжении трех недель, предшествующих операции (21, 14 и 7 дни перед операцией), и в день операции. При необходимости, когда по медицинским показаниям необходимо сократить предоперационный период, Эральфон® можно назначать ежедневно в дозе 300 МЕ/кг массы тела в течение 10 дней до операции, в день операции и в течение 4-х дней после операции. Если содержание гемоглобина в предоперационном периоде достигает 150 г/л и выше, применение эпоэтина следует прекратить. До начала терапии эпоэтином альфа необходимо убедиться в отсутствии у пациентов дефицита железа.
Все пациенты должны получать адекватное количество железа (200 мг/сутки из расчета на элементарное железо) на протяжении всего курса лечения. По возможности следует обеспечить дополнительное поступление железа до начала терапии препаратом Эральфон® для обеспечения адекватного депо железа в организме больного.
Указания по применению
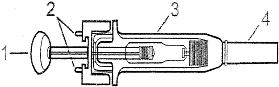
Устройство и порядок работы шприца с автоматическим устройством защиты иглы
|
1 .Перед инъекцией |
2. После инъекции |
 |
 |
Составные части:
1. Шток
2. Зажимы
3. Защитный кожух
4. Защитный колпачок
5. Игла
После завершения инъекции игла и шприц переместятся назад в защитное устройство.
Внимание! Избегайте контакта с зажимами в течение подготовки шприца! Устройство активируется путем нажатия на шток до зажимов.
|
1. |
Внимательно осмотрите преднаполненный стеклянный шприц с защитным устройством. Снимите защитный колпачок с иглы. |
|
2. |
Проведите инъекцию согласно стандартной процедуре. |
|
3. |
Нажмите на шток большим пальцем и удерживайте до тех пор, пока вся доза препарата не будет введена. |
4. |
Извлеките иглу, отпустите шток, позвольте защитному кожуху переместится вперед до тех пор пока игла полностью не будет защищена и заблокирована на месте. |
Порядок работы шприца с неавтоматическим устройством защиты иглы
|
1. |
Проведите инъекцию согласно стандартной процедуре. Внимание! При проведении инъекции держите пальцы на защитном кожухе, чтобы предотвратить преждевременную активацию защитного устройства. |
|
2. |
После инъекции переместите защитное устройство вдоль иглы. Звуковой щелчок укажет на правильность действия. Во время всей процедуры пальцы должны находиться позади иглы. |
Побочное действие
В начале лечения может отмечаться гриппоподобная симптоматика: головокружение, сонливость, лихорадочное состояние, головная боль, миалгия, артралгия.
Со стороны сердечно-сосудистой системы: дозозависимое повышение артериального давления, ухудшение течения артериальной гипертензии (чаще всего у пациентов с хронической почечной недостаточностью), в отдельных случаях — гипертонический криз, резкое повышение артериального давления с симптомами энцефалопатии (головная боль, спутанность сознания) и генерализованными тонико-клоническими судорогами.
Со стороны органов кроветворения: тромбоцитоз, в отдельных случаях — тромбозы шунта или артериовенозной фистулы (у пациентов на гемодиализе со склонностью к артериальной гипотензии или с аневризмой, стенозом и т.д.), аплазия эритроцитарного ростка.
Аллергические реакции: кожная сыпь (слабо или умеренно выраженная), экзема, крапивница, зуд, ангионевротический отек.
Местные реакции: гиперемия, жжение, слабая или умеренная болезненность в месте введения (чаще возникают при подкожном введении).
Со стороны лабораторных показателей: снижение концентрации ферритина в сыворотке, при уремии — гиперкалиемия, гиперфосфатемия.
Прочие: осложнения, связанные с нарушением дыхания или со снижением артериального давления, иммунные реакции (индукция образования антител), обострение порфирии.
Передозировка
Симптомы: усиление побочных эффектов.
Лечение: симптоматическое. При высоком уровне гемоглобина — кровопускание.
Взаимодействие с другими лекарственными средствами
Снижает концентрацию циклоспорина из-за увеличения степени связывания его с эритроцитами (может возникнуть необходимость в коррекции дозы циклоспорина). Фармацевтически несовместим с растворами других лекарственных средств.
Особые указания
Во время лечения необходимо еженедельно контролировать артериальное давление и проводить общий анализ крови (включая тромбоциты, гематокрит, ферритин). В пред- и послеоперационном периоде концентрацию гемоглобина следует контролировать чаще, если исходная концентрация составляла менее 140 г/л. Необходимо помнить, что эпоэтин альфа при лечении анемии не заменяет гемотрансфузию, но снижает необходимость ее повторного применения.
У больных с контролируемой артериальной гипертензией или тромботическими осложнениями в анамнезе может потребоваться повышение дозы гипотензивных лекарственных средств и/или антикоагулянтов соответственно. При назначении пациентам с печеночной недостаточностью возможно замедление метаболизма эпоэтина альфа и выраженное усиление эритропоэза. Безопасность применения препарата у этой категории пациентов не установлена. Хотя препарат стимулирует эритропоэз, нельзя полностью исключить возможность воздействия эпоэтина альфа на рост некоторых типов опухолей, в т.ч. костного мозга.
Следует учитывать возможность того, что предоперационное повышение уровня гемоглобина может служить предрасполагающим фактором к развитию тромботических осложнений. Перед проведением планового хирургического вмешательства пациенты должны получать адекватную профилактическую антиагрегантную терапию. В пред- и послеоперационном периоде препарат не рекомендуют назначать пациентам с исходным уровнем гемоглобина более 150 г/л.
У взрослых пациентов с хронической почечной недостаточночтью, клинически выраженной ишемической болезнью сердца или хронической сердечной недостаточностью концентрация гемоглобина не должна превышать 100-120 г/л.
Перед началом лечения следует исключить возможные причины неадекватной реакции на препарат (дефицит железа, фолиевой кислоты, цианокобаламина, тяжелое отравление солями алюминия, сопутствующие инфекции, воспалительные процессы и травмы, скрытые кровотечения, гемолиз, фиброз костного мозга различной этиологии) и при необходимости скорректировать лечение.
До начала лечения следует оценить запасы железа в организме. У большинства больных с хронической почечной недостаточностью, у онкологических и ВИЧ-инфицированных пациентов концентрация ферритина в плазме уменьшается одновременно с увеличением уровня гематокрита. Концентрацию ферритина необходимо определять в течение всего курса лечения. Если она составляет менее 100 нг/мл, рекомендуется заместительная терапия препаратами железа для приема внутрь из расчета 200-300 мг/сут (100-200 мг/сут для детей). Недоношенным детям пероральная терапия препаратами железа в дозе 2 мг/сутки должна назначаться как можно раньше. Пациенты, сдающие аутологичную кровь и находящиеся в пред- или послеоперационном периоде, должны также получать адекватное количество железа внутрь в дозе 200 мг/сут.
У пациентов с хронической почечной недостаточностью коррекция анемии может вызвать улучшение аппетита и увеличение всасывания калия и белков. Может потребоваться периодическая коррекция параметров диализа для поддержания концентрации мочевины, креатинина и калия в пределах нормы.
У пациентов с хронической почечной недостаточностью необходимо контролировать уровень электролитов в сыворотке крови.
По имеющимся данным, применение эпоэтина альфа у преддиализных пациентов не ускоряет прогрессирование хронической почечной недостаточности. Из-за повышения гематокрита часто требуется увеличить дозу гепарина во время гемодиализа. При неадекватной гепаринизации возможны закупорка диализной системы, тромбоз сосудистого доступа, особенно у больных с тенденцией к гипотензии или с осложнениями артериовенозной фистулы (стеноз, аневризма и др.). У таких больных рекомендуется профилактика тромбозов.
При применении у женщин репродуктивного возраста с анемией на фоне хронической почечной недостаточности возможно возобновление менструаций. Пациентку следует предупредить о возможности наступления беременности и необходимости применения надежных методов контрацепции до начала терапии. В экспериментальных исследованиях на крысах и кроликах не обнаружено тератогенное действие при внутривенном введении в дозах до 500 ЕД/кг массы тела в сутки; в более высоких дозах отмечено слабое, статистически незначимое снижение фертильности.
В период лечения, до установления оптимальной поддерживающей дозы, пациентам с хронической почечной недостаточностью, необходимо соблюдать осторожность при вождении автотранспорта и занятии другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций (увеличение риска повышения артериального давления в начале терапии).
Учитывая возможный более выраженный эффект препарата, его доза не должна превышать дозу рекомбинантного эритропоэтина, использовавшегося в предыдущем курсе лечения. В течение первых двух недель дозу не изменяют, оценивают соотношение доза/ответ. После этого доза может быть уменьшена или увеличена (см. раздел «Способ применения и дозы »).
Форма выпуска
Раствор для внутривенного и подкожного введения 40 000 ME.
По 1,0 мл 40 000 ME в шприц с дополнительным автоматическим или неавтоматическим устройством для защиты иглы после использования шприца или без него.
По 1, 2 или 3 шприца в контурную ячейковую упаковку с покрытием.
1 контурную ячейковую упаковку по 1, 2 или 3 шприца или 2 контурные ячейковые упаковки по 2 или 3 шприца вместе с инструкцией по применению помещают в пачку из картона с наклейками для контроля вскрытия.
Срок годности
2 года. Не использовать по истечении срока годности, указанного на упаковке.
Условия хранения
При температуре от 2 до 8 °С.
Хранить в недоступном для детей месте.
Условия отпуска из аптек
По рецепту.
Производитель
ЗАО «ФармФирма «Сотекс»
141345, Россия, Московская область,
Сергиево-Посадский муниципальный район,
сельское поселение Березняковское,
пос. Беликово, д. 11
Владелец регистрационного удостоверения:
ЗАО «ФармФирма «Сотекс».
Претензии потребителей направлять по адресу производителя.
Эральфон® (Eralfon)
💊 Состав препарата Эральфон®
✅ Применение препарата Эральфон®
Описание активных компонентов препарата
Эральфон®
(Eralfon)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2021.05.11
Владелец регистрационного удостоверения:
Код ATX:
B03XA01
(Эритропоэтин)
Лекарственная форма
| Эральфон® |
Р-р д/в/в и п/к введения 40000 МЕ/1 мл: шприцы 1, 2, 3, 4 или 6 шт. с устройством защиты иглы или без него рег. №: ЛСР-008793/10 |
Форма выпуска, упаковка и состав
препарата Эральфон®
Раствор для в/в и п/к введения прозрачный, бесцветный.
Вспомогательные вещества: натрия хлорид — 5.84 мг, натрия цитрата пентасесквигидрат — 5.8 мг или натрия цитрата дигидрат — 4.776 мг, альбумина раствор (в пересчете на сухой альбумин) — 2.5 мг, лимонной кислоты моногидрат — 0.057 мг, вода д/и — до 1 мл.
1 мл — шприцы (1) — упаковки ячейковые контурные (1) — пачки картонные с контролем первого вскрытия.
1 мл — шприцы (1) с устройством защиты иглы — упаковки ячейковые контурные (1) — пачки картонные с контролем первого вскрытия.
1 мл — шприцы (2) — упаковки ячейковые контурные (1) — пачки картонные с контролем первого вскрытия.
1 мл — шприцы (2) с устройством защиты иглы — упаковки ячейковые контурные (1) — пачки картонные с контролем первого вскрытия.
1 мл — шприцы (2) — упаковки ячейковые контурные (2) — пачки картонные с контролем первого вскрытия.
1 мл — шприцы (2) с устройством защиты иглы — упаковки ячейковые контурные (2) — пачки картонные с контролем первого вскрытия.
1 мл — шприцы (3) — упаковки ячейковые контурные (1) — пачки картонные с контролем первого вскрытия.
1 мл — шприцы (3) с устройством защиты иглы — упаковки ячейковые контурные (1) — пачки картонные с контролем первого вскрытия.
1 мл — шприцы (3) — упаковки ячейковые контурные (2) — пачки картонные с контролем первого вскрытия.
1 мл — шприцы (3) с устройством защиты иглы — упаковки ячейковые контурные (2) — пачки картонные с контролем первого вскрытия.
Фармакологическое действие
Рекомбинантный эритропоэтин человека, представляет собой очищенный гликопротеин. Стимулирует эритропоэз. Синтезируется в клетках млекопитающих, в которые встроен ген, кодирующий эритропоэтин человека. По биологическим и иммунологическим свойствам идентичен эритропоэтину человека, выделяемому из мочи. Синтез эндогенного эритропоэтина осуществляется в почках и зависит от уровня оксигенации крови.
Фармакокинетика
После п/к введения концентрация активного вещества в плазме повышается медленно, достигая максимального уровня через 12-18 ч.
После многократного в/в введения T1/2 у взрослых здоровых пациентов составляет 4 ч, у пациентов с почечной недостаточностью — около 6 ч; у детей — около 6 ч.
Показания активных веществ препарата
Эральфон®
Лечение анемии, связанной с хронической почечной недостаточностью у взрослых и детей, находящихся на гемо- или перитонеальном диализе.
Профилактика и лечение анемии у онкологических больных (получающих или не получающих химиотерапию) при немиелоидных опухолях.
Лечение анемии у ВИЧ-инфицированных пациентов, получающих терапию зидовудином, (при уровне эндогенного эритропоэтина ≤ 500 МЕ/мл).
В рамках предепозитной программы перед обширной хирургической операцией у пациентов с уровнем гематокрита 33-39%, для облегчения сбора аутологичной крови и уменьшения риска, связанного с использованием аллогенных гемотрансфузий (при ожидаемой потребности в переливаемой крови выше, чем количество, которое можно получить без применения эпоэтина альфа).
Перед проведением обширной операции с ожидаемой средней кровопотерей (2-4 единицы или 900-1800 мл) у взрослых пациентов с легкой или средней анемией (гемоглобин >10 и ≤13 г/дл) для уменьшения потребности в аллогенных гемотрансфузиях и улучшения восстановления эритропоэза.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Вводят п/к или в/в. Режим дозирования устанавливают индивидуально, в зависимости от показаний, наличия сопутствующих заболеваний, схемы терапии, возраста пациента.
Побочное действие
Со стороны системы кроветворения: редко — тромбоцитемия, парциальная красноклеточная аплазия (ПККА), опосредованная через антитела к эритропоэтину.
Со стороны иммунной системы: нечасто — реакции повышенной чувствительности; редко — анафилактические реакции.
Со стороны обмена веществ: нечасто — гиперкалиемия; редко — порфирия.
Со стороны нервной системы: часто — головная боль; нечасто — судороги; частота неизвестна — инсульт, включающий церебральный инфаркт и внутримозговое кровоизлияние, транзиторная ишемическая атака, гипертоническая энцефалопатия.
Со стороны органа зрения: частота неизвестна — тромбоз сосудов сетчатки.
Со стороны сердечно-сосудистой системы: часто — венозные или артериальные тромбозы, артериальная гипертензия; частота неизвестна — гипертонический криз.
Со стороны дыхательной системы: часто — кашель; нечасто — застойные явления в дыхательных путях.
Со стороны пищеварительной системы: очень часто — диарея, тошнота, рвота.
Со стороны кожи и подкожных тканей: часто — кожная сыпь; нечасто — крапивница; частота неизвестна — ангионевротический отек.
Со стороны костно-мышечной системы: часто — артралгия, миалгия, боль в костях, боль в конечностях.
Прочие: очень часто — повышение температуры тела; часто — озноб, гриппоподобный синдром, периферические отеки, положительный тест на антитела к эритропоэтину, местные реакции.
Противопоказания к применению
Повышенная чувствительность к эпоэтину альфа; неконтролируемая артериальная гипертензия, парциальная красноклеточная аплазия (ПККА), возникшая после лечения эритропоэтином; пациенты, которые по каким-либо причинам не могут получать эффективное лечение для профилактики тромбозов; пациентам с тяжелой патологией коронарных, сонных, мозговых и периферических сосудов, включая недавно перенесших инфаркт миокарда или острое нарушение мозгового кровообращения (в рамках предепозитной программы сбора крови перед обширной хирургической операцией); беременность, период грудного вскармливания.
С осторожностью
Злокачественные новообразования, эпилептический синдром (в т.ч. в анамнезе), артериальная гипертензия, хроническая печеночная недостаточность, тромбоцитоз, тромбоз (в анамнезе), острая кровопотеря, серповидно-клеточная, гемолитическая анемия, дефицит железа, В12 или фолиевой кислоты, облитерирующие заболевания периферических сосудов и другие сосудистые осложнения, подагра, порфирии, ИБС.
Применение при беременности и кормлении грудью
Противопоказано применение эпоэтина альфа при беременности за исключением тех случаев, когда предполагаемая польза для матери значительно превышает риск для плода. Применение эпоэтина альфа не рекомендовано в период беременности пациенткам, участвующим в программе сбора аутологичной крови перед проведением хирургических операций.
При необходимости применения в период лактации следует решить вопрос о прекращении грудного вскармливания. Применение эпоэтина альфа не рекомендовано у кормящих матерей, участвующих в программе сбора аутологичной крови перед проведением хирургических операций.
Применение при нарушениях функции печени
С осторожностью следует применять у пациентов с хронической печеночной недостаточностью.
Применение при нарушениях функции почек
У пациентов с хронической почечной недостаточностью и клинически выраженной ИБС или застойной сердечной недостаточностью поддерживающий уровень гемоглобина не должен превышать верхний предел оптимального рекомендованного уровня (не более 10-12 г/дл у взрослых).
Применение у детей
Возможно применение у детей по показаниям, в рекомендуемых дозах и схемах.
Особые указания
Эпоэтин альфа следует с осторожностью применять у пациентов с эпилепсией, наличием судорожных припадков в анамнезе или состояниями, предрасполагающими к повышению судорожной готовности, такими как инфекции ЦНС или метастатическое поражение головного мозга.
Увеличение частоты развития тромботических осложнений наблюдалось у пациентов, получающих препараты, стимулирующие эритропоэз. Осложнения включают в себя тромбозы вен и артерий (в т.ч. летальные случаи), такие как тромбоз глубоких вен, эмболию легочной артерии, тромбоз сетчатки глаза и инфаркт миокарда. Также отмечались случаи острого нарушения мозгового кровоснабжения (включая ишемический инсульт, геморрагический инсульт и транзиторную ишемическую атаку). Пациентам с повышенным риском развития тромбоза или других сосудистых осложнений требуется тщательный медицинский контроль.
С осторожностью применяют при подагре.
До начала применения следует убедиться, что пациенты с артериальной гипертензией получали эффективную антигипертензивную терапию.
На фоне применения необходимо контролировать уровень АД, обращая внимание на возникновение или усиление необычных головных болей. При этом может потребоваться коррекция проводимой терапии или назначение антигипертензивных средств. Если несмотря на адекватную терапию АД не снижается, эпоэтин альфа следует отменить.
До начала применения эпоэтина альфа следует оценить состояние депо железа в организме. У большинства больных с хронической почечной недостаточностью, у онкологических и ВИЧ-инфицированных больных уровень ферритина в плазме крови уменьшается одновременно с увеличением гематокрита. Уровень ферритина необходимо определять в течение всего курса лечения. Если он составляет менее 100 нг/мл, рекомендуется заместительная терапия препаратами железа. Пациенты, сдающие аутологичную кровь и находящиеся в пред- или послеоперационном периоде, также должны получать дополнительно адекватное количество железа.
В период применения следует контролировать уровень гемоглобина, по крайней мере, 1 раз в неделю до достижения стабильного уровня, затем несколько реже.
С осторожностью следует применять у пациентов с порфирией. При хронической почечной недостаточности на фоне терапии эпоэтином альфа возможно обострение порфирии.
Пациентам, находящимся на гемодиализе, на фоне терапии эпоэтином альфа часто требуется увеличение дозы гепарина во время диализа из-за повышения гематокрита. При неадекватной дозе гепарина возможна окклюзия диализной системы.
У пациентов с хронической почечной недостаточностью и клинически выраженной ИБС или застойной сердечной недостаточностью поддерживающий уровень гемоглобина не должен превышать верхний предел оптимального рекомендованного уровня (не более 10-12 г/дл у взрослых).
При применении у пациентов с нарушениями функции печени возможно замедление биотрансформации эпоэтина альфа и выраженное усиление эритропоэза.
Нельзя полностью исключить возможность влияния эпоэтина альфа на рост некоторых типов опухолей, особенно на злокачественные новообразования костного мозга.
Следует соблюдать все специальные предупреждения и меры предосторожности, связанные с программой сбора аутологичной крови (это распространяется на всех пациентов, получающих эпоэтин альфа).
Терапевтическая эффективность эпоэтина альфа может уменьшиться при дефиците железа, фолиевой кислоты, витамина B12, интоксикации алюминием, интеркуррентных заболеваниях, скрытом кровотечении, гемолизе, фиброзе костного мозга.
Влияние на способность к управлению транспортными средствами и механизмами
При применении эпоэтина альфа до установления оптимальной поддерживающей дозы пациентам с ХПН следует избегать занятий потенциально опасными видами деятельности из-за увеличения риска развития артериальной гипертензии в начале терапии.
Лекарственное взаимодействие
Действие эпоэтина альфа может усиливаться при одновременном введении препаратов крови.
Одновременное применение препаратов, подавляющих эритропоэз, может приводить к снижению эффективности эпоэтина альфа.
При одновременном применении эпоэтина альфа с циклоспорином возможно снижение концентрации последнего в плазме из-за увеличения степени его связывания с эритроцитами (при применении данной комбинации необходимо контролировать концентрацию циклоспорина в плазме и при необходимости увеличить его дозу).
Эпоэтин альфа нельзя смешивать с растворами других лекарственных средств.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
МНН: Эпоэтин альфа
Производитель: Силаг АГ
Анатомо-терапевтическо-химическая классификация: Erythropoietin
Номер регистрации в РК:
№ РК-БП-5№005836
Информация о регистрации в РК:
15.04.2016 — 15.04.2021
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
79 786.12 KZT
- Скачать инструкцию медикамента
Торговое название
Эпрекс ®
Международное непатентованное название
Эпоэтин альфа
Лекарственная форма
Раствор для внутривенного и подкожного введения 2000 МЕ/0,5 мл,
40000 МЕ/1 мл
Состав
Один шприц содержит
активное вещество — эпоэтина альфа 2000 МЕ (16.8 мкг) или
40000 МЕ (336 мкг)
вспомогательные вещества: натрия хлорид, натрия дигидрофосфата дигидрат, натрия гидрофосфата дигидрат, глицин, полисорбат 80, вода для инъекций.
Описание
Прозрачный бесцветный раствор, практически свободный от посторонних частиц.
Фармакотерапевтическая группа
Препараты влияющие на кроветворение и кровь. Прочие стимуляторы гемопоэза. Эритропоэтин
Код АТХ В03ХА01
Фармакологические свойства
Фармакокинетика
АбсорбцияПосле подкожного введения концентрация препарата в плазме крови достигает пика в промежутке от 12 до 18 часов после применения дозы.
После многократного еженедельного введения 600 МЕ / кг подкожно, накопления препарата не наблюдалось.
Абсолютная биодоступность подкожной инъекции эпоэтина альфа составила приблизительно 20% у здоровых добровольцев.
Распределение
Средний объем распределения составляет 49,3 мл / кг после внутривенного введения 50 и 100 МЕ / кг у здоровых субъектов. После внутривенного введения эпоэтина альфа пациентам с хронической почечной недостаточностью, объем распределения колеблется между 57-107 мл / кг после однократной дозы (12 МЕ / кг) до 42-64 мл / кг после многократного дозирования (48-192 МЕ / кг), соответственно. Таким образом, объем распределения несколько выше, чем в пространстве плазмы.
Выведение
Период полувыведения после многократного внутривенного введения составляет около 4 часов у здоровых добровольцев.
Период полувыведения после подкожного введения составляет примерно 24 часов у здоровых добровольцев.
Средний CL / F при введении 150 МЕ / кг 3 раза в неделю и 40000 МЕ один раз в две недели здоровым добровольцам составляет 31,2 и 12,6 мл / ч / кг, соответственно. Средний CL / F при введении 150 МЕ / кг 3 раза в неделю и 40000 МЕ один раз в две недели онкобольным с анемией составляет 45,8 и 11.3 мл / ч / кг, соответственно. У большинства субъектов с анемией и онкологическими заболеваниями, получающих химиотерапию, циклический CL / F был ниже после подкожного введения в дозах 40000 МЕ один раз в неделю и 150 МЕ / кг 3 раза в неделю по сравнению со здоровыми добровольцами.
Линейность / нелинейность
У здоровых добровольцев, увеличение дозы пропорционально концентрации эпоэтина альфа в сыворотке наблюдалось после внутривенного введения 150 и 300 МЕ / кг, 3 раза в неделю. Введение доз от 300 до 2400 МЕ / кг подкожно привело к линейной зависимости между средней Cmax и дозой и между средней AUC и дозой. Обратная связь между клиренсом и дозой наблюдалась у здоровых добровольцев.
В исследованиях, изучающих увеличение интервала дозирования (40000 МЕ один раз в неделю и 80000, 100000 и 120000 МЕ два раза в неделю), наблюдалось линейная, но не зависимая от дозы пропорциональная зависимость между средним Cmax и дозой, и между средней AUC и дозой в равновесном состоянии.
Соотношение ФК/ФД
Эпоэтин альфа оказывает дозозависимый эффект на гематологические показатели, который зависит от способа введения.
Дети
Период полувыведения составляет примерно 6,2 до 8,7 часов у педиатрических пациентов с хронической почечной недостаточностью после многократного внутривенного введения эпоэтин альфа. Фармакокинетический профиль эпоэтина альфа у детей и подростков схож с таковым у взрослых.
Почечная недостаточность
У пациентов с хронической почечной недостаточностью, период полувыведения внутривенно вводимого эпоэтина альфа увеличивается до 5 часов, по сравнению со здоровыми добровольцами.
Фармакодинамика
Эпрекс® — это оригинальный иммунобиологический препарат.
Механизм действия
Эритропоэтин представляет собой гормон гликопротеин, вырабатываемый в первую очередь почками в ответ на гипоксию и является ключевым регулятором образования эритроцитов. Эритропоэтин участвует во всех этапах развития эритроидов, и оказывает основное действие на уровне эритроидных предшественников. Эритропоэтин связывается с рецепторами клеточной поверхности, активирует пути передачи сигналов, которые мешают апоптозу и стимулирует пролиферацию эритроидных клеток. Рекомбинантый эритропоэтин человека (эпоэтин альфа), вырабатываемый в клетках яичника китайского хомячка, имеет последовательность в 165 аминокислот, идентичную человеческому эритропоэтину в моче; 2 из которых неразличимы в ходе функциональных анализов. Кажущаяся молекулярная масса эритропоэтина составляет от 32000 до 40000 дальтон.
Эритропоэтин является фактором роста, который в первую очередь стимулирует выработку эритроцитов. Рецепторы эритропоэтина могут экспрессироваться на поверхности различных опухолевых клеток.
Фармакодинамические эффекты
Здоровые добровольцы
После однократной дозы (20000 — 160000 МЕ подкожно) эпоэтина альфа, дозозависимый ответ наблюдался среди исследуемых фармакодинамических маркеров: ретикулоцитов, эритроцитов и гемоглобина. Определяемый профиль концентрация — время с пиком и возвратом к исходному уровню отмечался при изменении процента ретикулоцитов. Менее определяемый профиль наблюдался у эритроцитов и гемоглобина. Все фармакодинамические маркеры повысились в линейном порядке и достигли максимального отклика на уровне самой высокой дозы.
Дальнейшие фармакодинамические исследования изучали введение 40000 МЕ один раз в неделю по сравнению с 150 МЕ / кг 3 раза в неделю. Несмотря на различия в профиле концентрация — время фармакодинамический ответ (измеряется как изменение процента ретикулоцитов, гемоглобина, эритроцитов и общего количества эритроцитов) между этими режимами являлся схожим. Дополнительные исследования сравнивали 40000 МЕ эпоэтин альфа один раз в неделю с дозами от 80000 до 120000 МЕ подкожно раз в 2 недели. По результатам фармакодинамических исследований у здоровых добровольцев, режим дозирования 40000 МЕ один раз в неделю представляется более эффективным для выработки эритроцитов, чем введение раз в две недели, несмотря на сходство в выработке ретикулоцитов при введении один раз в неделю и раз в две недели.
Хроническая почечная недостаточность
Эпоэтин альфа стимулирует эритропоэз у пациентов с анемией с ХПН, в том числе находящихся на диализе и до диализа. Первым признаком ответа на эпоэтина альфа является увеличение ретикулоцитов в течение 10 дней с последующим увеличением эритроцитов, гемоглобина и гематокрита, как правило, в пределах от 2 до 6 недель. Ответ гемоглобина зависит от пациента и может зависеть от запасов железа и наличия сопутствующих медицинских состояний.
Анемия, вызванная химиотерапией
Эпоэтин альфа, вводимый 3 раза в неделю или один раз в неделю, повышает гемоглобин и уменьшает необходимость переливания после первого месяца терапии у онкобольных с анемией, получающих химиотерапию.
В сравнительном исследовании режимов лечения: 150 МЕ / кг 3 раза в неделю и 40000 МЕ один раз в неделю у здоровых субъектов и онкобольных с анемией временные профили изменений процента ретикулоцитов, гемоглобина и общего количества эритроцитов были похожи между двумя режимами дозирования у здоровых субъектов и онкобольных с анемией. AUC соответствующих фармакодинамических параметров были похожи между режимами дозирования 150 МЕ / кг 3 раза в неделю и 40000 МЕ один раз в неделю у здоровых добровольцев и онкобольных с анемией.
Взрослые пациенты участвующие в программе предоперационной заготовки аутологичной крови
Эпоэтин альфа стимулирует выработку эритроцитов с целью увеличения количества аутологичной крови, а также ограничения снижения гемоглобина у взрослых пациентов, которым назначена плановая операция, и не ожидается полная послеоперационная потребность в крови. Наибольшие эффекты наблюдаются у пациентов с низким гемоглобином (≤ 13 г / дл).
Лечение взрослых пациентов, которым назначена плановая обширная ортопедическая операция
У пациентов, которым назначена плановая обширная ортопедическая операция, с исходным уровнем гемоглобина > 10 до ≤ 13 г / дл, эпоэтин альфа уменьшает риск получения аллогенных переливаний и ускоряет восстановление эритроцитов (повышенные уровни гемоглобина, гематокрита и ретикулоцитов).
Клиническая эффективность и безопасность
Хроническая почечная недостаточность
Эпоэтин альфа был изучен в клинических испытаниях у взрослых пациентов с анемией и ХПН, в том числе находящихся на гемодиализе и пациентов до диализа, для лечения анемии и поддержания гематокрита в пределах целевой концентрации в диапазоне от 30 до 36%.
В клинических испытаниях при начальной дозе от 50 до 150 МЕ / кг три раза в неделю, около 95% всех пациентов отметили клинически значимое увеличение гематокрита. После примерно двух месяцев терапии, переливание не требовалось практически всем пациентам. После достижения целевого гематокрита, поддерживающая доза была подобрана индивидуально.
В трёх крупнейших клинических исследованиях, проведённых у взрослых пациентов на диализе, средняя доза, необходимая для поддержания гематокрита от 30 до 36% составляла примерно 75 МЕ / кг в 3 раза в неделю.
В двойном слепом, плацебо-контролируемом, многоцентровом исследовании пациентов с ХПН на гемодиализе, качество жизни, клинически и статистически улучшилось у пациентов, получавших эпоэтин альфа по сравнению с группой плацебо при измерении усталости, физических симптомов, отношения и депрессии (Анкета по болезням почек) после шести месяцев лечения. Пациенты из группы, получавшие эпоэтина альфа, также были включены в открытое дополнительное исследование, которое показало улучшение качества жизни, выдерживаемое в течение дополнительных 12 месяцев.
Взрослые пациенты с почечной недостаточностью, не находящиеся на диализе
В клинических испытаниях, проведённых у пациентов с ХПН на диализе, не получавших эпоэтин альфа, средняя продолжительность терапии составила почти пять месяцев. Эти пациенты ответили на терапию эпоэтин альфа аналогично тому, что наблюдалось у пациентов на диализе. Пациенты с ХПН не на диализе, продемонстрировали дозозависимое и устойчивое повышение гематокрита, когда эпоэтин альфа вводили либо внутривенно или подкожно. Схожие темпы роста гематокрита были отмечены, когда эпоэтин альфа вводили обоими способами. Кроме того, дозы эпоэтин альфа от 75 до 150 МЕ / кг поддерживали гематокрит от 36 до 38% в течение шести месяцев.
В 2 исследованиях с удлиненным интервалом дозирования препарата Эпрекс® (3 раза в неделю, один раз в неделю, раз в 2 недели, и один раз в 4 недели) у некоторых пациентов с увеличенным интервалом дозирования не поддерживались адекватные уровни гемоглобина и достигли критериев исключения из протокола на основании уровня гемоглобина (0% один раз в неделю, 3,7% раз в 2 недели, 3,3% раз в 4 недели).
Рандомизированное проспективное исследование (CHOIR) оценивало 1432 пациентов с хронической почечной недостаточностью и анемией, не проходящих диализ. Пациенты были распределены для лечения эпоэтин альфа до достижения целевого поддерживающего уровня гемоглобина 13,5 г / дл (выше рекомендуемого уровня концентрации гемоглобина) или
11,3 г / дл. Основные сердечно-сосудистые явления (смерть, инфаркт миокарда, инсульт или госпитализация вследствие сердечной недостаточности) зарегистрированы среди 125 (18%) из 715 пациентов из группы с более высоким уровнем гемоглобина по сравнению с 97 (14%) из 717 пациентов из группы с низким уровнем гемоглобина (относительный риск [ОР] 1,3, 95% ДИ: 1,0, 1,7, р = 0,03).
Обобщённые ретроспективные анализы клинических исследований лекарственных средств, стимулирующих эритропоэз были проведены у пациентов с хронической почечной недостаточностью (находящихся на диализе, не находящихся на диализе, у пациентов с сахарным диабетом и не страдающих сахарным диабетом). Наблюдается тенденция к увеличению предполагаемого риска для всех причин смертности, сердечно-сосудистой и цереброваскулярных событий, связанных с более высокими кумулятивными дозами лекарственных средств, стимулирующих эритропоэз, независимо от диабета или диализа статуса.
Лечение пациентов с анемией, вызванной химиотерапией
Эпоэтин альфа был изучен в клинических испытаниях у взрослых пациентов с анемией с лимфоидными и солидными опухолями и пациентов, получающих различные режимы химиотерапии, в том числе с или без платины-содержащих препаратов. В этих испытаниях, эпоэтин альфа, вводимый 3 раза в неделю и один раз в неделю, показал повышение гемоглобина и уменьшение необходимости переливания после первого месяца терапии у онкобольных с анемией. В некоторых исследованиях, после двойной слепой фазы проводилась открытая фаза, во время которой все пациенты получали эпоэтин альфа и наблюдалось сохранение эффекта.
Имеющиеся данные свидетельствуют о том, что пациенты с гематологическими злокачественными новообразованиями и солидными опухолями отвечают на лечение эпоэтин альфа эквивалентно пациентам с или без инфильтрации опухоли костного мозга. Сопоставимая интенсивность химиотерапии в группах, получавщих эпоэтин альфа и плацебо в исследовании химиотерапии была продемонстрирована одинаковой площадью под кривой времени нейтрофилов у пациентов, получавших эпоэтин альфа и плацебо, а также аналогичной долей пациентов в группах, получавших эпоэтина альфа и плацебо, у которых абсолютное количество нейтрофилов снизилось до 1000 и 500 клеток / мкл.
В проспективном, рандомизированном, двойном слепом, плацебо-контролируемом исследовании, проведенном у 375 пациентов с анемией и различными не-миелоидными опухолями, получающими химиотерапию без платины, наблюдалось значительное сокращение последствий, связанных с анемией (например, усталость, снижение энергии и уменьшение активности), измеренное с помощью следующих инструментов и шкал: общая шкала функциональной оценки анемии, вызванной лечением рака (FACT-An), шкала усталости FACT-An, линейная аналоговая шкала оценки рака (CLAS). Два других меньших, рандомизированных, плацебо контролируемых исследования не смогли показать значительное улучшение в параметрах качества жизни по шкале EORTC-C30-QLQ или CLAS, соответственно.
Выживание и прогрессия опухоли были рассмотрены в пяти крупных контролируемых исследованиях с участием в общей сложности 2833 пациентов, из которых четыре являлись двойными слепыми плацебо-контролируемыми исследованиями, одно являлось открытым исследованием. Исследования включали пациентов, которые получали химиотерапию (два исследования) или популяции пациентов, которым не назначались лекарственные средства, стимулирующие эритропоэз: онкопациенты с анемией, не получающие химиотерапию, и пациенты с раком головы и шеи, получающие лучевую терапию. Желаемый уровень гемоглобина в двух исследованиях составил > 13 г / дл; в остальных трех исследованиях от 12 до 14 г/дл. В открытом исследовании не выявлено разницы в общей выживаемости между пациентами, получавшими рекомбинантный человеческий эритропоэтина и контрольными пациентами. В четырех плацебо контролируемых исследованиях отношение рисков для общей выживаемости варьировалось между 1,25 и 2,47 в пользу контрольных пациентов. Эти исследования показали последовательное необъяснимое статистически значимое повышение смертности у пациентов с анемией, связанной с различными видами распространенного рака, которые получали рекомбинантный человеческий эритропоэтин по сравнению с контрольной группой. В целом результаты выживаемости в исследованиях не смогли удовлетворительно объяснить различия в частоте развития тромбозов и соответствующих осложнений между группой, получавшей рекомбинантный человеческий эритропоэтин и контрольной группой.
Анализ данных на уровне пациента был проведен с участием более чем 13 900 больных раком (химио-, лучевая-, химио/лучевая- или отсутствие терапии), участвующих в 53 контролируемых клинических исследованиях с участием нескольких эпоэтинов. Мета — анализ данных общей выживаемости показал точечную оценку отношения рисков равную 1,06 в пользу контрольной группы (95% ДИ: 1,00, 1,12; 53 исследования и 13 933 пациентов), для больных раком, получающих химиотерапию, отношение рисков выживаемости в целом составили 1,04 (95% ДИ: 0,97, 1,11; 38 исследований и 10441 пациентов). Мета — анализы также равным образом указывают на значительно повышенный относительный риск тромбоэмболических осложнений у больных раком, получающих рекомбинантный человеческий эритропоэтин.
Программа предварительного забора аутологичной крови
Эффект эпоэтина альфа для облегчения забора аутологичной крови у пациентов с низким гематокритом (≤ 39% и при отсутствии анемии вследствие дефицита железа), которым назначена обширная плановая ортопедическая операция был оценён в двойном слепом, плацебо-контролируемом исследовании, проведённом среди 204 пациентов, и одном слепом плацебо-контролируемом исследовании, проведённом среди 55 пациентов.
В двойном слепом исследовании, пациенты получали эпоэтин альфа в дозе 600 МЕ / кг или плацебо внутривенно один раз в день каждые 3 до 4 дней в течение 3 недель (всего 6 доз). В среднем, у пациентов, получавших эпоэтин альфа забрано значительно больше единиц крови (4,5 единицы), чем у пациентов, получавших плацебо (3,0 единицы).
В одном слепом исследовании пациенты получали эпоэтин альфа в дозе 300 МЕ / кг или 600 МЕ / кг или плацебо внутривенно один раз в день каждые 3 до 4 дней в течение 3 недель (всего 6 доз). У пациентов, получавших эпоэтин альфа забрано значительно больше единиц крови (эпоэтин альфа 300 МЕ/кг = 4,4 единицы; эпоэтин альфа 600 МЕ/кг = 4,7 единиц), чем у пациентов, получавших плацебо (2,9 единицы).
Терапия с эпоэтин альфа снижает риск воздействия аллогенной крови на 50% по сравнению с пациентами, не получавшими эпоэтин альфа.
Обширная плановая ортопедическая операция
Эффект эпоэтина альфа (300 МЕ/кг или 100 МЕ/кг) на устойчивость к переливанию аллогенной крови оценен в плацебо-контролируемого двойном слепом клиническом исследовании у взрослых пациентов без дефицита железа, которым назначена ортопедическая операция на бедре или колене. Эпоэтин альфа вводили подкожно в течение 10 дней до операции, в день операции и в течение четырёх дней после операции. Пациенты были разделены в соответствии с исходным уровнем гемоглобина (≤ 10 г / дл,> 10 ≤ 13 г / дл и > 13 г / дл).
Эпоэтин альфа 300 МЕ / кг значительно снижает необходимость трансфузии аллогенной крови у пациентов с исходным уровнем гемоглобина от > 10 до ≤ 13 г / дл. Шестнадцати процентов пациентов, получавших эпоэтин альфа в дозе 300 МЕ / кг, 23% пациентов, получавших эпоэтин альфа в дозе 100 МЕ / кг и 45% пациентов, получавших плацебо, потребовалось переливание.
Открытое исследование с параллельными группами взрослых субъектов без дефицита железа с исходным уровнем гемоглобина от ≥ 10 ≤ 13 г / дл, которым назначена обширная ортопедическая операция на бедре или колене было проведено для сравнения эпоэтин альфа в дозе 300 МЕ / кг, вводимом подкожно ежедневно в течение 10 дней до операции, в день операции и в течение четырёх дней после операции с эпоэтином альфа в дозе 600 МЕ / кг, вводимом подкожно один раз в неделю в течение 3 недель до операции и в день операции.
Среди пациентов, получавших препарат до операции, среднее увеличение гемоглобина в группе 600 МЕ / кг в неделю (1,44 г / л) в два раза превысило значение в группе 300 МЕ / кг в день (0,73 г / дл). Средние уровни гемоглобина на двух группах лечения являлись схожими на протяжении всего послеоперационного периода.
Эритропоэтический ответ в обеих группах лечения показал схожую частоту переливания (16% в группе 600 МЕ / кг еженедельно и 20% в группе 300 МЕ / кг ежедневно).
Дети
Хроническая почечная недостаточность
Эпоэтин альфа оценивали в открытом, не рандомизированном 52-недельном клиническом исследовании с открытым диапазоном доз у педиатрических пациентов с ХПН, проходящих гемодиализ. Средний возраст пациентов, включенных в исследование составил 11,6 лет (диапазон от 0,5 до 20,1 лет).
Эпоэтин альфа вводили в дозе 75 МЕ / кг / неделю внутривенно в 2 или 3 приема после диализа, с повышением на 75 МЕ / кг / неделю с интервалом в 4 недели (до максимум 300 МЕ / кг / неделю), для достижения 1 г / дл / мес повышения гемоглобина. Требуемый диапазон концентрации гемоглобина составлял 9,6 до 11,2 г / дл. 81% пациентов достигли целевого уровня гемоглобина. Медиана времени до достижения целевого уровня составила 11 недель, средняя доза 150 МЕ / кг / нед. Из пациентов, которые достигли целевого уровня, 90% получали препарат 3 раза в неделю. Через 52 недели, 57% пациентов остались в исследовании, получая среднюю дозу 200 МЕ /кг/ нед.
Показания к применению
— симптоматическая анемия, связанная с хронической почечной недостаточностью (ХПН) у детей в возрасте от 1 до 18 лет и взрослых на гемодиализе, и у взрослых, на перитонеальном диализе
— симптоматическая анемия тяжелой степени тяжести сопровождающаяся клиническими симптомами у взрослых пациентов с почечной недостаточностью без диализа
— для лечения анемии и уменьшения потребности в гемотрансфузиях у взрослых пациентов c солидными опухолями, злокачественной лимфомой или множественной миеломой, которые получают химиотерапию или находятся в группе риска трансфузии согласно оценке общего статуса пациента (например, сердечно-сосудистый статус, сопутствующая анемия в начале химиотерапии)
— в рамках программы предоперационной заготовки аутологичной крови перед обширным плановым хирургическим вмешательством у взрослых пациентов с анемией умеренной степени тяжести (Hb 10-13 г/дл [6,2 – 8,1 ммоль/л] без дефицита железа) в случае недоступности или недостатка процедур сохранения крови перед обширным хирургическим вмешательством, требующим переливания большого объема крови (4 или более единиц крови для женщин либо 5 или более единиц для мужчин).
— перед проведением обширной плановой ортопедической операции у взрослых пациентов без железодефицитной анемии, для уменьшения потребности в аллогенных гемотрансфузиях и облегчения восстановления эритропоэза. Применение ограничено пациентами с анемией средней тяжести (уровень гемоглобина 10-13 г/дл), которые не участвуют в программе предоперационной заготовки аутологичной крови и у которых ожидается умеренная кровопотеря (900–1800 мл).
Способ применения и дозы
Перед началом терапии эпоэтином альфа, а также при принятии решения о повышении его дозы следует провести оценку и лечение других причин анемии (дефицит железа, фолиевой кислоты или витамина B12, интоксикация алюминием, инфекция или воспаление, кровопотеря, гемолиз и фиброз костного мозга любого генеза). В большинстве случаев значения уровня ферритина в сыворотке крови снижаются одновременно с увеличением гематокрита. Для достижения оптимального ответа на эпоэтин альфа следует обеспечить адекватные запасы железа, с введением, при необходимости, дополнительного приёма железосодержащих препаратов/
Лечение симптоматической анемии у взрослых пациентов с хронической почечной недостаточностью
Симптомы анемии и последствия могут варьироваться в зависимости от возраста, пола и сопутствующих заболеваний; необходима оценка врачом клинического течения заболевания и состояние пациента.
Концентрация гемоглобина, которой следует добиваться, должна составлять от 10 до 12 г/дл (6,2-7,5 ммоль/л).
Эпрекс® вводится в целях повышения гемоглобина не более 12 г / дл (7,5 ммоль / л). Следует избегать повышение уровня гемоглобина более чем на 2 г/дл (1.25 ммоль/л) в течение четырех недель. В подобном случае необходима корректировка дозы, как это предусмотрено.
Вследствие вариабельности между пациентами, время от времени могут наблюдаться индивидуальные колебания значений гемоглобина для пациента выше или ниже требуемого уровня гемоглобина. Колебания уровней гемоглобина следует регулировать путем корректировки дозы, сучетом целевого диапазона гемоглобина от 10 г/дл (6.2 ммоль/л) до 12 г/дл (7.5 ммоль/л).
Следует избегать устойчивого уровня гемоглобина, превышающего 12 г/дл (7.5 ммоль/л).
Если уровень гемоглобина повышается более чем на 2 г/дл (1.25 ммоль/л) в месяц, или если уровень гемоглобина составляет более 12 г/дл (7.5 ммоль /л), доза препарата Эпрекс ® должна быть снижена на 25%. Если уровень гемоглобина превышает 13 г/дл (8.1 ммоль/л), следует прекратить лечение, пока он не опустится ниже 12 г/дл (7.5 ммоль /л), после чего возобновить терапию препаратом Эпрекс® в дозе на 25% ниже предыдущей.
Необходим тщательный контроль пациентов для гарантии того, что применяется самая низкая утвержденная эффективная доза препарата Эпрекс®, позволяющая обеспечить адекватный контроль анемии и ее симптомов, при сохранении концентрации гемоглобина на уровне 12 г / дл (7,5 ммоль / л).
Следует проявлять осторожность при эскалации доз лекарственных средств, стимулирующих эритропоэз (erythropoiesis stimulating agents, ESA) у пациентов с хронической почечной недостаточностью. У пациентов с недостаточным ответом гемоглобина на терапию лекарственными средствами, стимулирующими эритропоэз, следует рассмотреть возможность и провести обследование в отношении других возможных причин (см. разделы «Особые указания» и «Фармакологические свойства»).
Лечение препаратом Эпрекс® делится на две фазы – фаза коррекции и поддерживающая фаза.
Взрослые пациенты, находящиеся на гемодиализе
У пациентов, находящихся на гемодиализе, у которых постоянно открыт венозный доступ предпочтительно внутривенное введение препарата Эпрекс®.
Лечение делится на две фазы – фаза коррекции анемии и поддерживающая фаза.
В фазе коррекции анемии Эпрекс® вводится из расчета 50 МЕ/кг массы тела три раза в неделю. При необходимости дозу можно увеличивать (не чаще, чем один раз в 4 недели) на 25 МЕ/кг массы тела три раза в неделю до достижения оптимального уровня гемоглобина от 10 г/дл до 12 г/дл (6.2 ммоль/л — 7.5 ммоль/л).
В поддерживающей фазе рекомендуемая общая недельная доза составляет от 75 до 300 МЕ/кг. Следует проводить необходимую корректировку дозы для того, чтобы поддерживать гемоглобин на требуемом уровне от 10 до 12 г/дл (6.2-7.5 ммоль /л).
Имеющиеся клинические данные показывают, что пациентам, у которых начальный уровень гемоглобина был очень низким (<6 г/дл или <3.75 ммоль /л), могут потребоваться более высокие поддерживающие дозы, чем тем пациентам, которые имели менее тяжелую степень начальной анемии (> 8 г/дл или > 5 ммоль /л).
Взрослые пациенты с хронической почечной недостаточностью, не получающие диализ
Когда венозный доступ затруднен, Эпрекс® можно вводить подкожно.
Фаза коррекции анемии Эпрекс® вводится из расчета 50 МЕ/кг массы тела три раза в неделю. При необходимости дозу можно увеличивать (не чаще, чем один раз в 4 недели) на 25 МЕ/кг массы тела три раза в неделю до достижения оптимального уровня гемоглобина.
В поддерживающей фазе Эпрекс® вводится 3 раза в неделю. В случае подкожного введения Эпрекс® вводится 1 раз в неделю или 1 раз в две недели.
Концентрация гемоглобина, которой следует добиваться, должна составлять от 10 до 12 г/дл (6,2-7,5 ммоль/л). Расширение интервалов может потребовать увеличения дозы.
Максимальная доза не должна превышать 150 МЕ/кг 3 раза в неделю, 240 МЕ/кг (максимум в 20000 МЕ) 1 раз в неделю, 480 МЕ/кг (максимум в 40000 МЕ) 1 раз каждые 2 недели.
Взрослые пациенты, находящиеся на перитонеальном диализе
Когда венозный доступ затруднен, Эпрекс® можно вводить подкожно.
В фазе коррекции анемии препарат вводится из расчета 50 МЕ/кг массы тела два раза в неделю.
Поддерживающая фаза обычная доза для поддержания оптимального уровня гемоглобина составляет от 25-50 МЕ/кг массы тела два раза в неделю путем введения дозы в виде 2 равных инъекций.
При необходимости следует провести коррекцию дозы препарата для поддержания гемоглобина на требуемом уровне от 10 до 12 г/дл (6.2-7.5 ммоль /л).
Лечение анемии, вызванной химиотерапией у взрослых пациентов
Симптомы и осложнения анемии могут варьировать в зависимости от возраста, пола и общей тяжести заболевания; необходимо проведение врачом оценки индивидуального клинического течения заболевания и состояния пациента.
Эпрекс® следует вводить пациентам с анемией (концентрация гемоглобина ≤10 г/дл (6.2 ммоль /л)).
Начальная доза должна составлять 150 МЕ/кг массы тела три раза в неделю подкожно.
В качестве альтернативы начальная доза может составлять 450 МЕ/кг один раз в неделю подкожно.
При необходимости следует провести коррекцию дозы дозы для поддержания гемоглобина на требуемом уровне от 10 до 12 г/дл (6.2-7.5 ммоль /л).
Вследствие вариабельности между пациентами, время от времени могут наблюдаться индивидуальные колебания значений гемоглобина для пациента выше или ниже требуемого уровня гемоглобина. Колебания уровней гемоглобина следует регулировать путем корректировки дозы, с учетом целевого диапазона гемоглобина от 10 г/дл до 12 г/дл (6.2 ммоль/л- 7.5 ммоль/л). Следует избегать устойчивого уровня гемоглобина, превышающего 12 г/дл (7.5 ммоль/л); руководство по соответствующей коррекции дозы при уровнях гемоглобина, превышающих 12 г/дл (7.5 ммоль /л), представлено ниже.
Если уровень гемоглобина увеличился, по крайней мере, на 1 г/дл (>0.62 ммоль/л) или число ретикулоцитов увеличилось на ≥ 40 000 клеток / мкл выше исходного уровня через 4 недели лечения, доза должна оставаться на уровне 150 МЕ/кг 3 раза в неделю или 450 МЕ/кг один раз в неделю.
Если повышение уровня гемоглобина составляет <1 г/дл (<0.62 ммоль /л) и число ретикулоцитов увеличивается на <40000 клеток/мкл по сравнению с исходным уровнем, дозу следует увеличить до 300 МЕ/кг 3 раза в неделю. Если после дополнительных 4 недель лечения при введении 300 МЕ/кг 3 раза в неделю, гемоглобин повышается на ≥ 1 г/дл (≥ 0.62 ммоль/л) или число ретикулоцитов увеличивается на ≥ 40000 клеток/мкл, доза должна оставаться на уровне 300 МЕ/кг 3 раза в неделю. Однако, если уровень гемоглобина повышается на <1 г/дл (<0.62 ммоль/л) и число ретикулоцитов увеличивается на <40 000 клеток/мкл по сравнению с исходным уровнем, терапевтический эффект на введение препарата Эпрекс® у таких пациентов маловероятен и лечение должно быть прекращено.
Коррекция дозы для поддержания концентрации гемоглобина между 10 г/дл-12 г/дл
Если уровень гемоглобина повышается более чем на 2 г/дл (1.25 ммоль/л) в месяц, или если уровень гемоглобина составляет более 12 г/дл (7.5 ммоль /л), доза препарата Эпрекс® должна быть снижена примерно на 25 — 50%. Если уровень гемоглобина превышает 13 г/дл (8.1 ммоль/л), следует прекратить лечение до тех пор, пока он не опустится ниже 12 г/дл (7.5 ммоль /л), после чего возобновить терапию препаратом Эпрекс® в дозе на 25% ниже предыдущей.
Рекомендуемый режим дозирования представлен в следующей диаграмме:
| 012557621477976220_ru.doc | 439 кб |
| 666185671477977461_kz.doc | 480.5 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Eralfon®
Регистрационный номер
Торговое наименование
Эральфон®
Международное непатентованное наименование
Лекарственная форма
раствор для внутривенного и подкожного введения
Состав
|
Действующее вещество: |
|
|
Эпоэтин альфа (эритропоэтин человека рекомбинантный) |
40000 МЕ |
|
Вспомогательные вещества: |
|
|
Натрия хлорид |
5,84 мг |
|
Натрия цитрата пентасесквигидрат или |
5,8 мг |
|
Натрия цитрата дигидрат |
4,776 мг |
|
Альбумина раствор (в пересчёте на сухой альбумин) |
2,5 мг |
|
Лимонной кислоты моногидрат |
0,057 мг |
|
Вода для инъекций |
до 1 мл |
Описание
Прозрачная, бесцветная жидкость.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Эпоэтин альфа представляет собой очищенный гликопротеин, стимулирующий эритропоэз; влияет на деление и дифференциацию клеток-предшественников. Он продуцируется клетками млекопитающих со встроенным геном, кодирующим синтез эритропоэтина человека. По биологическим свойствам эпоэтин альфа не отличается от человеческого эритропоэтина.
Белковая фракция составляет около 58 % от молекулярной массы и состоит из 165 аминокислот. Четыре углеводородных цепи присоединены к белку тремя N-гликозидными связями и одной О-гликозидной связью. Молекулярный вес эритропоэтина составляет приблизительно 32000-40000 дальтон.
Фармакодинамика
После введения препарата количество эритроцитов, ретикулоцитов, уровень гемоглобина и скорость поглощения 59Fe увеличиваются. На культуре клеток костного мозга показано, что эпоэтин альфа избирательно стимулирует эритропоэз, не оказывая влияния на лейкопоэз.
Здоровые добровольцы
После введения единичной дозы эритропоэтина альфа (от 20000 до 160000 МЕ подкожно), наблюдался дозозависимый ответ, оцененный по следующим фармакодинамическим маркерам: содержание ретикулоцитов, эритроцитов и гемоглобина. Профиль концентрация-время с пиком и возвратом к базовой линии наблюдался для изменения числа ретикулоцитов. Менее четкий профиль наблюдался для эритроцитов и гемоглобина. Все фармакодинамические маркеры возрастали в линейной зависимости с максимальным значением ответа при наиболее высоких дозах.
При сравнении введения одной дозы 40000 МЕ и трёх доз 150 МЕ/кг в неделю, несмотря на различие профилей концентрация-время, фармакодинамический ответ был одинаковым для двух режимов дозирования. Дополнительно проводили сравнение режимов при введении один раз в неделю и один раз в две недели. В итоге, основываясь на результатах фармакодинамических исследований, режим 40000 МЕ однократно в неделю показал себя более эффективным, чем при однократном введении в две недели, несмотря на подобие показателей для ретикулоцитов.
Пациенты с хронической почечной недостаточностью (ХПН)
Эритропоэтин альфа способен стимулировать эритропоэз у пациентов с анемией и ХПН, включая находящихся на гемодиализе. Первый очевидный ответ на введение эритропоэтина альфа с повышением числа ретикулоцитов наблюдался через 10 дней, с последующим повышением показателей гематокрита, эритроцитов и гемоглобина, обычно в период от 2 до 6 недель. Ответ для гемоглобина различается для отдельных пациентов и может зависеть от запасов железа и сопутствующих проблем со здоровьем.
Дети с ХПН
В клинических исследованиях с участием пациентов от 0,5 до 18 лет эритропоэтин альфа вводился в режиме 75 МЕ/кг/неделя внутривенно в 2 или 3 дозы, после диализа, титрование дозы производилось на 75 МЕ/кг/неделя с интервалом в 4 недели (до максимальных 300 МЕ/кг/неделя), для достижения роста концентрации гемоглобина 1 г/дл/месяц. 81 % пациентов достигли желаемого значения концентрации гемоглобина: от 9,6 до 11,2 г/дл. При среднем времени лечения 11 недель и средней дозе 150 МЕ/кг/неделя, из пациентов, достигших целевых результатов терапии, 90 % находились на режиме введения 3 раза в неделю.
Пациенты с анемией, вызванной проведением химиотерапии
Эритропоэтин альфа при введении 3 раза в неделю или 1 раз в неделю показал способность повышать гемоглобин и уменьшать потребность в переливании крови через месяц после начала химиотерапии у онкологических пациентов с анемией. Профили AUC фармакодинамических параметров (содержание эритроцитов, ретикулоцитов, гемоглобина) были одинаковы для здоровых добровольцев и для пациентов после химиотерапии.
Взрослые участники программы сбора аутологичной крови перед обширным хирургическим вмешательством
Эритропоэтин альфа доказано стимулирует выработку эритроцитов с целью увеличить объём сбора аутологичной крови и останавливает снижение содержания гемоглобина у взрослых пациентов, направленных на обширные хирургические операции, которые не собираются создавать запас собственной крови.
Взрослые пациенты перед ортопедическими операциями
Для пациентов перед обширным хирургическим вмешательством со значением показателя гемоглобина до лечения от > 10 до ≤ 13 г/дл эритропоэтин альфа снижает риск получения трансфузии чужой крови и ускоряет восстановление числа эритроцитов (повышает уровень гемоглобина, значение гематокрита и число ретикулоцитов).
Фармакокинетика
Период полувыведения при внутривенном введении составляет 5–6 часов, вне зависимости от тяжести заболевания. Объём распределения приблизительно равен объёму плазмы. Концентрация препарата в сыворотке крови при подкожном введении значительно ниже, чем при внутривенном введении. Уровень препарата в сыворотке крови повышается медленно и достигает максимума через 12-18 часов после подкожного введения.
Период полувыведения при подкожном введении составляет примерно 24 часа.
Биодоступность препарата при подкожном введении составляет около 25 %.
Внутривенное введение
Измерение концентрации эритропоэтина альфа после нескольких внутривенных (в/в) инъекций при введении от 50 до 100 МЕ/кг выявило время полувыведения 4 ч у здоровых добровольцев и более долгий период полувыведения у пациентов с ХПН — около 5 ч после доз 50, 100 и 150 МЕ/кг. Для детей период полувыведения составляет 6 ч. При анализах крови с интервалом как минимум 4 дня, ожидаемые значения периода полувыведения от 20,1 до 33,0 ч были отмечены для онкологических пациентов, получавших 667 и 1500 МЕ/кг эритропоэтина альфа в/в.
Подкожное введение
Сывороточные концентрации при подкожном введении эритропоэтина альфа ниже, чем при внутривенном. Сывороточные концентрации нарастали медленно и достигали пиковых значений в период от 12 до 18 ч после подкожного введения. Максимальная сывороточная концентрация при подкожном введении ниже пикового значения при внутривенном введении (примерно на 1/20 от значения).
Накопления не происходит: сывороточные концентрации остаются прежними, как для анализов через 24 ч после первого введения, так и через 24 ч после последнего введения. Профили концентрация-время для недели 1 и недели 4 были одинаковыми при нескольких введениях 600 МЕ/кг/раз еженедельно у здоровых добровольцев.
Время полувыведения при подкожном введении около 24 ч. Средние значения времени полувыведения были 19,4±8,1 и 15,0±6,1 при нескольких введениях дозы 150 МЕ/кг три раза в неделю и 40000 МЕ раз в неделю, соответственно.
В исследованиях сравнивали режимы дозирования эритропоэтина альфа: 40000 МЕ подкожно один раз в неделю с 150 МЕ/кг подкожно три раза в неделю у здоровых пациентов, были оценены следующие параметры. Исходя из сравнения AUC, относительная биодоступность эритропоэтина альфа 40000 МЕ один раз в неделю сравнительно с 150 МЕ/кг три раза в неделю была 176 %.
Биодоступность эритропоэтина альфа при подкожном введении в дозе 120 МЕ/кг была значительно ниже, чем при внутривенном: около 20 %.
Особые группы пациентов
Данные фармакокинетических исследований не выявили существенных различий в периоде полувыведения для пациентов в возрасте 65 лет и старше.
Исследования на 7 новорождённых с низкой массой тела и 10 здоровых взрослых при внутривенном введении эритропоэтина альфа показали, что объём распределения был примерно от 1,5 до 2 раз выше у недоношенных детей, чем у здоровых добровольцев, а клиренс — примерно в 3 раза.
Фармакокинетические показатели для здоровых добровольцев по сравнению с онкологическими пациентами с анемией, вызванной циклической химиотерапией, различались на первой неделе применения (во время получения химиотерапии последними), но были одинаковым на третьей неделе (в отсутствие химиотерапии у пациентов с анемией), режим дозирования 150 МЕ/кг три раза в неделю или 40000 МЕ один раз в неделю.
Эпоэтин альфа обладает минимальной способностью индуцировать образование антител. Исследований канцерогенности не проводилось.
Эпоэтин альфа не вызывает мутаций бактериальных генов (тест Эймса), хромосомных аберраций в клетках млекопитающих, а также мутаций генов локуса HGPRT. В ходе одного исследования было выявлено отсутствие различий в частоте возникновения фиброза костного мозга у пациентов, находившихся на диализе и получавших эпоэтин альфа в течение трёх лет, и у аналогичных пациентов, не получавших эпоэтин альфа. Тератогенность препарата у человека не изучена, у крыс и кроликов тератогенное действие эпоэтина альфа не обнаружено.
Показания
— Анемия, связанная с хронической почечной недостаточностью у взрослых и детей, в том числе у пациентов, находящихся на гемо- или перитонеальном диализе;
— анемия у взрослых онкологических пациентов при солидных (немиелоидных) опухолях, злокачественной лимфоме или множественной миеломе (для профилактики и лечения);
— анемия у взрослых ВИЧ-инфицированных пациентов, получающих терапию зидовудином, при уровне эндогенного эритропоэтина менее 500 МЕ/мл;
— в рамках предепозитной программы перед обширным хирургическим вмешательством у пациентов с уровнем гематокрита, равным 33-39 %, для облегчения сбора аутологичной крови и уменьшения риска, связанного с использованием аллогенных гемотрансфузий, если ожидаемая потребность в переливаемой крови превышает количество, которое можно получить методом аутологичного сбора без применения эпоэтина альфа;
— перед проведением обширной операции с ожидаемой кровопотерей 900-1800 мл у взрослых пациентов, не имеющих анемии или с лёгкой и средней степенью анемии (уровень гемоглобина 100-130 г/л) для уменьшения потребности в аллогенных гемотрансфузиях и облегчения восстановления эритропоэза.
Противопоказания
— Неконтролируемая артериальная гипертензия;
— повышенная чувствительность к компонентам препарата;
— пациентам с тяжёлой патологией коронарных, сонных, мозговых и периферических сосудов, включая недавно перенёсших инфаркт миокарда или острое нарушение мозгового кровообращения (в рамках предепозитной программы сбора крови перед обширной хирургической операцией);
— при беременности и в период грудного вскармливания;
— пациентам, по каким-либо причинам, не имеющим возможности получать адекватную профилактическую антитромботическую терапию;
— пациентам с парциальной красноклеточной аплазией, получавшим терапию каким-либо эритропоэтином.
С осторожностью
Эпоэтин альфа следует применять с большой осторожностью у пациентов с эпилепсией, эпилептическим синдромом (в том числе в анамнезе) или с заболеваниями, которые могут спровоцировать эпилептическую активность (например, инфекции ЦНС или метастазы мозга), тромбоцитозом, тромбозом (в анамнезе), облитерирующими заболеваниями периферических сосудов и другими сосудистыми осложнениями, подагрой, при серповидно-клеточной анемии, железо-, В12— или фолиево-дефицитных состояниях, ишемической болезни сердца.
Если количество ретикулоцитов менее 20000 мм3 (или менее 20000/мкл, или менее 0,5 %), количество тромбоцитов и лейкоцитов в норме и если отсутствуют другие причины потери эффективности, необходимо провести анализ на наличие антител к эритропоэтину и исследование костного мозга для диагностики парциальной красноклеточной аплазии.
В случае если подозревается диагноз парциальной красноклеточной аплазии, следует немедленно прекратить лечение эпоэтином альфа. Не следует назначать аналогичные препараты в связи с возможностью перекрёстной реакции антител к эритропоэтину с другими эритропоэтинами. По показаниям может быть проведена соответствующая терапия (гемотрансфузии).
Эпоэтин альфа, будучи ростовым фактором, может оказывать стимулирующее действие на некоторые типы опухолей, особенно на злокачественные новообразования костного мозга.
Применение при беременности и в период грудного вскармливания
Беременность
Данные о применении эритропоэтина альфа у беременных женщин отсутствуют. Исследования на животных показали наличие у эритропоэтина альфа репродуктивной токсичности. Применение препарата при беременности не рекомендовано.
Период грудного вскармливания
Неизвестно, проникает ли эритропоэтин альфа в грудное молоко. Применение препарата в период грудного вскармливания не рекомендовано.
Способ применения и дозы
Перед применением следует внимательно осмотреть раствор на предмет видимых частиц или изменения цвета. Препарат не следует встряхивать, так как это может привести к денатурации гликопротеина и потере активности препарата. Эральфон® не содержит консервантов, поэтому индивидуальная упаковка предназначена для однократного использования.
Внутривенное введение
Продолжительность инъекции составляет не менее 1-5 минут. Более медленное введение предпочтительнее для пациентов, у которых отмечается гриппоподобный синдром на введение препарата. Пациентам, находящимся на гемодиализе, инъекция препарата производится через иглу в фистулу по завершении процедуры диализа. Для промывания соединительных трубок, а также для обеспечения удовлетворительного введения препарата в систему циркуляции после инъекции препарата Эральфон® вводят 10 мл изотонического раствора хлорида натрия.
Запрещается вводить препарат в виде внутривенной инфузии или смешивать его с другими лекарственными средствами.
Подкожные инъекции
Максимальный объём одной подкожной инъекции не должен превышать 1 мл, при необходимости введения больших объёмов следует использовать несколько точек введения. Препарат вводят под кожу плеча, бедра, передней брюшной стенки.
При изменении способа введения препарат вводят в прежней дозе, затем дозу при необходимости корректируют (для достижения одинакового терапевтического эффекта при подкожном введении требуется доза на 20-30 % меньше, чем при внутривенном введении).
Пациенты с хронической почечной недостаточностью
У пациентов с хронической почечной недостаточностью Эральфон® может применяться внутривенно и подкожно.
Внутривенное введение препарата предпочтительно для пациентов, находящихся на гемодиализе.
У пациентов с хронической почечной недостаточностью, не получающих диализ, и у пациентов, находящихся на перитонеальном диализе, препарат может вводиться подкожно.
Оптимальное содержание гемоглобина для взрослых пациентов составляет 100-120 г/л, для детей — 95-110 г/л.
При наличии у пациентов сопутствующей клинически выраженной ишемической болезни сердца или хронической сердечной недостаточности поддерживаемый уровень гемоглобина не должен превышать верхний предел оптимального значения.
Доза препарата составляет 50 МЕ/кг массы тела. В процессе подбора доза препарата Эральфон® увеличивается, если уровень гемоглобина повышается менее чем на 10 г/л в месяц.
Клинически значимое увеличение уровня гемоглобина обычно не наблюдается в срок менее 2 недель, а некоторым пациентам может потребоваться 6-10 недель.
При достижении нормального значения уровня гемоглобина доза препарата должна быть уменьшена до 25 МЕ/кг для того, чтобы не допустить превышения нормы уровня гемоглобина. Доза должна быть уменьшена при достижении уровня гемоглобина 120 г/л. Уменьшение дозы может быть достигнуто путём отмены одного введения в неделю или уменьшением вводимой дозы.
Взрослые пациенты, находящиеся на гемодиализе
У пациентов, находящихся на гемодиализе, Эральфон® предпочтительно применять внутривенно.
Лечение делится на две фазы — фаза коррекции анемии и поддерживающая фаза.
Фаза коррекции анемии:
Эральфон® вводится из расчёта 50 МЕ/кг массы тела три раза в неделю. При необходимости дозу можно увеличивать (не чаще, чем один раз в 4 недели) на 25 МЕ/кг массы тела три раза в неделю до достижения оптимального содержания гемоглобина.
Поддерживающая терапия:
Обычная доза для поддержания оптимального содержания гемоглобина составляет 30-100 МЕ/кг массы тела три раза в неделю. Имеющиеся данные позволяют предположить, что пациентам с тяжёлой анемией (содержание гемоглобина менее 60 г/л) требуется большая поддерживающая доза.
Взрослые пациенты, находящиеся на перитонеальном диализе
У пациентов, находящихся на перитонеальном диализе возможен как внутривенный, так и подкожный способ введения препарата Эральфон®.
Фаза коррекции анемии:
Препарат вводится из расчёта 50 МЕ/кг массы тела два раза в неделю. При необходимости дозу можно поэтапно увеличивать на 25 МЕ/кг массы тела (не чаще, чем один раз в 4 недели) два раза в неделю до достижения оптимального содержания гемоглобина.
Поддерживающая фаза:
Обычная доза для поддержания оптимального гемоглобина составляет от 25 до 50 МЕ/кг массы тела два раза в неделю.
Взрослые пациенты с хронической почечной недостаточностью, не получающие диализ
У пациентов с хронической почечной недостаточностью, не получающих диализ, возможен как внутривенный, так и подкожный способ введения препарата Эральфон®.
Фаза коррекции анемии:
Эральфон® вводится из расчёта 50 МЕ/кг массы тела три раза в неделю. При необходимости дозу можно увеличивать (не чаще, чем один раз в 4 недели) на 25 МЕ/кг массы тела три раза в неделю до достижения оптимального содержания гемоглобина.
Поддерживающая фаза:
Обычная доза для поддержания оптимального содержания гемоглобина составляет от 17 до 33 МЕ/кг массы тела три раза в неделю.
Дети, находящиеся на гемодиализе, вне зависимости от возраста
Фаза коррекции анемии:
Эральфон® вводится из расчёта 50 МЕ/кг массы тела три раза в неделю внутривенно. При необходимости дозу можно увеличивать (не чаще, чем один раз в 4 недели) на 25 МЕ/кг массы тела три раза в неделю до достижения оптимального содержания гемоглобина.
Поддерживающая фаза:
Обычно детям с массой тела до 30 кг требуется большая поддерживающая доза, чем взрослым и детям с массой тела более 30 кг.
В ходе клинических исследований после шестимесячной терапии эпоэтином альфа были установлены следующие поддерживающие дозы эпоэтина альфа:
|
Масса тела, в кг |
Доза препарата МЕ/кг массы тела три раза в неделю |
|
|
Обычная поддерживающая |
Медиана |
|
|
< 10 |
75-150 |
100 |
|
10-30 |
60-150 |
75 |
|
>30 |
30-100 |
33 |
Имеющиеся данные позволяют предположить, что пациентам с тяжёлой анемией (гемоглобин менее 68 г/л) требуется большая поддерживающая доза, чем пациентам с менее тяжёлой анемией.
Пациенты, страдающие онкологическими заболеваниями
Для лечения анемии у взрослых онкологических пациентов Эральфон вводится подкожно. Оптимальное содержание гемоглобина должно составлять 100-120 г/л у мужчин и женщин и не должно быть превышено.
Начальная доза для профилактики или лечения анемии должна составлять 150 МЕ/кг массы тела три раза в неделю подкожно. В качестве альтернативы начальная доза может составлять 40000 МЕ один раз в неделю подкожно.
Если после четырёх недель лечения содержание гемоглобина повысилось и составляет не менее 10 г/л или количество ретикулоцитов увеличилось более чем на 40000 клеток/мкл выше исходного количества доза препарата Эральфон® остаётся прежней.
Если после четырёх недель лечения повышение содержания гемоглобина составляет менее 10 г/л и повышение количества ретикулоцитов составляет менее 40000 клеток/мкл по сравнению с исходным количеством в течение следующих четырёх недель дозу увеличивают до 300 МЕ/кг массы тела три раза в неделю или до 60000 МЕ один раз в неделю.
Если после дополнительных четырёх недель лечения при дозе препарата Эральфон® 300 МЕ/кг 3 раза в неделю или 60000 МЕ один раз в неделю содержание гемоглобина повысилось и составляет не менее 10 г/л или количество ретикулоцитов увеличилось более чем на 40000 клеток/мкл, то сохраняют существующую дозу препарата Эральфон®.
Если после четырёх недель лечения в дозе 300 МЕ/кг массы тела или 60000 МЕ один раз в неделю содержание гемоглобина повышается менее чем на 10 г/л и повышение количества ретикулоцитов составляет менее 40000 клеток/мкл по сравнению с исходным количеством, лечение следует прекратить.
В случае повышения содержания гемоглобина более чем на 20 г/л в течение месяца или достижения содержания гемоглобина 120 г/л дозу препарата необходимо уменьшить на 25 %. Если содержание гемоглобина превышает 120 г/л, необходимо приостановить лечение до снижения гемоглобина ниже 120 г/л и затем продолжить введение препарата Эральфон® в дозе на 25 % ниже первоначальной.
Терапия препаратом Эральфон® должна продолжаться в течение одного месяца после окончания курса химиотерапии.
ВИЧ-инфицированные пациенты, получающие терапию зидовудином
Рекомендуется до начала лечения препаратом Эральфон® определить исходный уровень эндогенного эритропоэтина в сыворотке крови. Проведённые исследования показывают, что при уровне эритропоэтина более 500 МЕ/мл эффект от терапии препаратом Эральфон® маловероятен.
Фаза коррекции анемии:
Препарат назначается в дозе 100 МЕ/кг массы тела три раза в неделю подкожно или внутривенно в течение восьми недель. Если по истечении восьми недель терапии не удалось достичь удовлетворительного эффекта (например, снизить потребность в гемотрансфузиях или добиться повышения гемоглобина), доза может поэтапно увеличиваться (не чаще, чем один раз в 4 недели) на 50-100 МЕ/кг массы тела три раза в неделю. Если не удалось достигнуть удовлетворительного эффекта от терапии препаратом Эральфон® в дозе 300 МЕ/кг массы тела три раза в неделю, то появление ответа на дальнейшую терапию в более высоких дозах маловероятно.
Поддерживающая фаза:
После достижения удовлетворительного эффекта в фазе коррекции анемии, поддерживающая доза должна обеспечить гематокрит в пределах 30-35 % в зависимости от изменения дозы зидовудина, наличия сопутствующих инфекционных или воспалительных заболеваний.
При гематокрите более 40 %, следует прекратить введение препарата Эральфон® до снижения гематокрита до 36 %.
При возобновлении терапии доза эпоэтина альфа должна быть снижена на 25 % с последующей корректировкой для поддержания требуемого гематокрита.
Содержание гемоглобина у ВИЧ-инфицированных пациентов, получающих терапию зидовудином не должно превышать 120 г/л.
Уровень ферритина сыворотки (или уровень сывороточного железа) необходимо определять у всех пациентов до начала и в процессе лечения препаратом Эральфон®. При необходимости назначается дополнительный приём железа.
Взрослые пациенты, участвующие в программе сбора аутологичной крови перед хирургическими вмешательствами
Рекомендуется использовать внутривенный путь введения препарата. Эпоэтин альфа следует вводить по окончании процедуры сбора крови.
Перед назначением препарата Эральфон® следует учесть все противопоказания к сбору аутологичной крови. При каждом посещении врача у пациента забирают порцию крови (если уровень гематокрита равен 33-39 % и/или уровень гемоглобина равен 100-130 г/л) и сохраняют для аутологичной трансфузии. Рекомендуемая доза препарата Эральфон® — 600 МЕ/кг массы тела внутривенно два раза в неделю в течение трёх недель до операции. Уровень ферритина сыворотки (или уровень сывороточного железа) необходимо определять у всех пациентов до начала и в процессе лечения препаратом Эральфон®. При необходимости назначается дополнительный приём железа.
При наличии анемии её причина должна быть установлена до начала терапии препаратом Эральфон®.
Пациенты в пред- и послеоперационном периоде, не участвующие в программе сбора аутологичной крови
Рекомендуется использовать подкожный способ введения препарата в дозе 600 МЕ/кг массы тела в неделю на протяжении трёх недель, предшествующих операции (21, 14 и 7 дни перед операцией), и в день операции. При необходимости, когда по медицинским показаниям необходимо сократить предоперационный период, Эральфон® можно назначать ежедневно в дозе 300 МЕ/кг массы тела в течение 10 дней до операции, в день операции и в течение 4 дней после операции. При содержании гемоглобина менее 130 г/л рекомендуется назначать препарат Эральфон® в дозировке 300 МЕ/кг в день. Если содержание гемоглобина достигает 150 г/л и выше, применение эпоэтина следует прекратить.
Указания по применению
Устройство и порядок работы шприца с автоматическим устройством защиты иглы
1. Перед инъекцией
2. После инъекции
Составные части:
1. Шток
2. Зажимы
3. Защитный кожух
4. Защитный колпачок
5. Игла
После завершения инъекции игла и шприц переместятся назад в защитное устройство.
Внимание! Избегайте контакта с зажимами в течение подготовки шприца! Устройство активируется путём нажатия на шток до зажимов.
1. Внимательно осмотрите преднаполненный стеклянный шприц с защитным устройством. Снимите защитный колпачок с иглы.
2. Проведите инъекцию согласно стандартной процедуре.
3. Нажмите на шток большим пальцем и удерживайте до тех пор, пока вся доза препарата не будет введена. Защитное устройство не активируется, пока вся доза препарата не будет введена.
4. Извлеките иглу, отпустите шток, позвольте защитному кожуху переместится вперед до тех пор пока игла полностью не будет защищена и заблокирована на месте.
Порядок работы шприца с неавтоматическим устройством защиты иглы
1. Проведите инъекцию согласно стандартной процедуре.
Внимание! При проведении инъекции держите пальцы на защитном кожухе, чтобы предотвратить преждевременную активацию защитного устройства.
2. После инъекции переместите защитное устройство вдоль иглы, звуковой щелчок укажет на правильность действия. Во время всей процедуры пальцы должны находиться позади иглы.
Побочное действие
Во время терапии эпоэтином альфа наиболее часто наблюдается дозозависимое повышение артериального давления или ухудшение течения уже существующей артериальной гипертензии. Необходимо адекватно контролировать артериальное давление, особенно в начале терапии эпоэтином альфа.
Также очень часто наблюдались диарея, тошнота, повышение температуры, рвота. Гриппоподобный синдром чаще всего наблюдался в начале терапии.
У пациентов, получающих эритропоэтин стимулирующие препараты, наблюдалась повышенная частота тромботических сосудистых явлений.
Отмечались реакции гиперчувствительности, включая сыпь, крапивницу, анафилактические реакции и ангионевротический отёк.
Гипертонический криз с энцефалопатией и судорогами, требующий интенсивной терапии, наблюдался во время терапии эритропоэтином у пациентов, ранее имевших нормальное или пониженное артериальное давление. Рекомендуется внимательно наблюдать за возникновением внезапных мигренеподобных головных болей.
Ниже указаны нежелательные реакции, наблюдавшиеся у пациентов.
Частоту нежелательных реакций классифицировали следующим образом: очень частые (≥ 10 %), частые (≥ 1% и < 10%), нечастые (≥ 0,1 % и < 1%), редкие (≥ 0,01 % и < 0,1%) и очень редкие (< 0,01 %) и неустановленной частоты.
Нарушения со стороны кровеносной и лимфатической систем: очень редкие — эритропоэтиновая антитело-опосредованная парциальная красноклеточная аплазия, тромбоцитемия.
Нарушения со стороны нервной системы: частые — головная боль, судороги, неустановленной частоты — цереброваскулярные случаи (в том числе инсульт, включающий церебральный инфаркт и внутримозговое кровоизлияние), транзиторная ишемическая атака, гипертоническая энцефалопатия.
Офтальмологические нарушения: неустановленной частоты — тромбоз сетчатки.
Нарушения со стороны сердечно-сосудистой системы: частые — артериальная гипертензия (в том числе гипертонический криз), артериальные и венозные (в том числе летальные случаи) тромбозы и эмболии: тромбоз глубоких вен, артериальный тромбоз (в том числе инфаркт миокарда), тромбоз артериовенозного шунта аневризмы, эмболия лёгочной артерии.
Нарушения со стороны желудочно-кишечного тракта: очень частые — тошнота, диарея, рвота.
Нарушения со стороны дыхательной системы: частые — кашель, неустановленной частоты — заложенность дыхательных путей.
Нарушения со стороны кожи: частые — кожная сыпь, неустановленной частоты — крапивница, ангионевротический отёк.
Нарушения со стороны костно-мышечной системы и соединительной ткани: частые — миалгия, артралгия, боль в костях, боль в конечностях.
Нарушения метаболизма и питания: нечастые — гиперкалиемия
Другие: очень частые — повышение температуры, частые — гриппоподобный синдром, озноб, периферические отёки, реакции в месте введения препарата, тромбоз шунта (в том числе компонент диализа), неустановленной частоты — порфирия, неэффективность препарата.
Передозировка
При передозировке эпоэтина альфа возникают эффекты, отражающие крайнюю степень выраженности его фармакологического действия. При очень высоком содержании гемоглобина возможно применение кровопусканий.
Взаимодействие с другими лекарственными средствами
Данных о взаимодействии эпоэтина альфа с другими лекарственными средствами нет.
Препараты, которые снижают эритропоэз, могут ослаблять действие эритропоэтина альфа.
Однако возможно влияние на концентрацию циклоспорина при одновременном применении, вследствие этого требуется дополнительный контроль уровня циклоспорина в сыворотке крови с последующей его коррекцией.
Нельзя разводить и переливать препарат из оригинальной в какую-либо другую ёмкость, нельзя вводить Эральфон® в смеси с другими лекарственными средствами.
У пациентов с метастазирующим раком груди, которым назначен одновременный приём эпоэтина альфа подкожно, в дозировке 40000 МЕ/мл и трастузумаба в дозировке 6 мг/кг, введение эпоэтина альфа не влияет на фармакокинетику трастузумаба.
Особые указания
До и после начала терапии препаратом Эральфон® необходимо адекватно контролировать артериальное давление. Препарат Эральфон® следует применять с осторожностью при наличии нелеченой или плохо контролируемой артериальной гипертензии. Во время терапии препаратом Эральфон® может понадобиться назначение антигипертензивной терапии. При невозможности снизить давление антигипертензивными средствами терапию препаратом Эральфон® необходимо прекратить.
Гипертонический криз, сопровождаемый энцефалопатией и судорогами, требующий немедленного медицинского вмешательства, также может произойти во время терапии препаратом Эральфон® у пациентов, ранее имевших нормальное или пониженное артериальное давление. Особое внимание должно быть уделено внезапно возникшей стреляющей мигренеподобной головной боли как возможному сигналу наступления криза (см. «Побочное действие»).
Эпоэтин альфа также следует с осторожностью использовать у пациентов с хронической печёночной недостаточностью. Безопасность эпоэтина альфа у пациентов с нарушением функции печени не установлена. Вследствие сниженного метаболизма у пациентов с нарушением функции печени при применении эпоэтина альфа может происходить усиление эритропоэза.
У пациентов, получавших эритропоэтин стимулирующие препараты, наблюдалось повышение частоты тромботических сосудистых явлений, например, венозные и артериальные тромбозы и эмболии (включая несколько случаев со смертельным исходом), такие как тромбоз глубоких вен, эмболия лёгочной артерии, тромбоз сетчатки и инфаркт миокарда.
Кроме того, отмечались нарушения мозгового кровообращения (включая инфаркт головного мозга, внутримозговое кровоизлияние и транзиторные ишемические атаки). Следует тщательно сопоставлять отмеченный риск тромботических сосудистых явлений и пользу от лечения эпоэтином альфа, в особенности у пациентов с наличием факторов риска. У всех пациентов следует проводить тщательный мониторинг уровня гемоглобина из-за потенциально повышенного риска тромбоэмболических явлений и смертельных исходов, наблюдаемого у пациентов, с повышенным уровнем гемоглобина в случае терапии препаратом Эральфон®.
Безопасность и эффективность терапии эпоэтином альфа у пациентов с фоновыми гематологическими заболеваниями, например, такими как, гемолитическая анемия, серповидноклеточная анемия, талассемия изучена не была.
При лечении препаратом Эральфон® требуется регулярный контроль уровня тромбоцитов, особенно в течение первых 8 недель, так как возможно развитие дозозависимого относительного повышения количества тромбоцитов, которое нормализуется в дальнейшем без отмены терапии; в редких случаях отмечается абсолютное повышение числа тромбоцитов.
Перед началом терапии эпоэтином альфа, а также при принятии решения о повышении его дозы следует провести оценку и лечение других причин анемии (дефицит железа, фолиевой кислоты или витамина B12, интоксикация алюминием, инфекция или воспаление, кровопотеря, гемолиз и фиброз костного мозга любого генеза). В большинстве случаев значения уровня ферритина в сыворотке крови снижаются одновременно с увеличением гематокрита. Для достижения оптимального ответа на эпоэтин альфа следует обеспечить адекватные запасы железа, с введением, при необходимости, дополнительного приёма железосодержащих препаратов:
— Пациентам с хронической почечной недостаточностью рекомендуется дополнительный приём железосодержащих препаратов (элементарного железа 200-300 мг/сутки перорально у взрослых и 100-200 мг/сутки перорально у детей) в случае уровня ферритина сыворотки ниже 100 нг/мл.
— Пациентам с онкологическим заболеванием рекомендуется дополнительный приём железосодержащих препаратов (элементарного железа 200-300 мг/сутки перорально) в случае насыщения трансферрина менее 20 %.
— Пациентам программы сбора аутологичной крови рекомендуется дополнительный приём железосодержащих препаратов (элементарного железа 200 мг/сутки перорально) в течение нескольких недель перед началом сбора аутологичной крови, с целью достижения больших запасов железа перед началом терапии эпоэтином альфа, а также в течение всего курса терапии эпоэтином альфа.
— Пациентам, которым назначена большая плановая ортопедическая операция, рекомендуется дополнительный приём железосодержащих препаратов (элементарного железа 200 мг/сутки перорально) в течение всего курса терапии эпоэтином альфа. При возможности, применение препаратов, содержащих железо, следует начать до начала терапии эпоэтином альфа, чтобы создать достаточные запасы железа.
Очень редко у пациентов, получавших лечение эпоэтином альфа, в начале лечения наблюдались обострения порфирии. У пациентов с порфирией эпоэтин альфа следует использовать с осторожностью.
Средства, стимулирующие эритропоэз не обязательно эквивалентны. Поэтому следует уточнить, что пациентов следует переводить с одного препарата, стимулирующего эритропоэз (такого, как Эральфон® ) на другой только с одобрения лечащего врача.
У пациентов с хронической почечной недостаточностью, получавших лечение подкожным введением эпоэтина очень редко, спустя месяцы и годы лечения, отмечалась антителоопосредованная истинная эритроцитарная аплазия (ИЭА).
Изредка отмечались также случаи этого заболевания у пациентов с гепатитом С, получавших лечение интерфероном и рибавирином, когда одновременно проводилось лечение эритропоэтин стимулирующими препаратами, поэтому они не одобрены для лечения анемии, связанной с гепатитом С.
У пациентов с хронической почечной недостаточностью, у которых возникает внезапное снижение эффективности, определяемое по снижению гемоглобина (1-2 г/дл в месяц) с повышением потребности в трансфузиях, необходимо провести подсчёт количества ретикулоцитов и обследовать на наличие типичных причин отсутствия ответа (например, дефицит железа, фолиевой кислоты или витамина B12, интоксикация алюминием, инфекция или воспаление, кровопотеря, гемолиз и фиброз костного мозга любого генеза).
Если количество ретикулоцитов, скорректированное с учётом анемии (то есть, ретикулоцитарный «индекс») низкое (<20000/мм3 или <20000/мкл или <0,5 %), а количество тромбоцитов и лейкоцитов нормальны, и если не выявлены другие причины снижения эффекта, следует произвести определение уровня антител к эритропоэтину, а также рассмотреть возможность исследования костного мозга с целью диагностики ИЭА.
Если возникает подозрение на ИЭА, опосредованную анти-эритропоэтиновыми антителами, терапию эпоэтином альфа следует немедленно прекратить. Не следует начинать лечение какими-либо иными эритропоэтин стимулирующими препаратами, поскольку существует риск перекрёстной реакции. При наличии показаний пациентам может быть проведена соответствующая терапия, такая как переливание крови.
Пациентам с хронической почечной недостаточностью на фоне лечения препаратом Эральфон®, необходимо регулярно измерять уровень гемоглобина, до тех пор, пока уровень гемоглобина не достигнет стабильных значений, с периодическим контролем в дальнейшем.
Для уменьшения риска возникновения артериальной гипертензии скорость повышения уровня гемоглобина должна составлять приблизительно 10 г/л (максимально 20 г/л) в месяц. Доза должна быть уменьшена, когда уровень гемоглобина достигнет 120 г/л.
У пациентов с хронической почечной недостаточностью поддерживаемый уровень гемоглобина не должен превышать верхней границы указанного диапазона уровня гемоглобина. Уровень гемоглобина 130 г/л или выше может привести к повышенному риску сердечно-сосудистых явлений, включая смерть.
Пациенты с хронической почечной недостаточностью и недостаточным ответом гемоглобина на терапию эритропоэтин стимулирующими препаратами могут подвергаться даже ещё большему риску сердечно-сосудистых явлений и смертности, чем другие пациенты. Исходя из доступной на данный момент информации, применение эпоэтина альфа у пациентов до начала применения диализа (терминальная стадия почечной недостаточности) не повышает скорость прогрессирования почечной недостаточности.
У пациентов на гемодиализе возникали тромбозы шунтов, в особенности — у пациентов с тенденцией к гипотензии, или с осложнениями со стороны артериовенозных фистул (например, стенозы, аневризмы и т.д.). У данных пациентов рекомендуются ранняя проверка шунта и профилактика тромбоза путём введения, например, ацетилсалициловой кислоты.
В отдельных случаях наблюдалась гиперкалиемия, хотя её причинно-следственная связь с применением препарата не установлена. У пациентов с хронической почечной недостаточностью следует производить мониторинг электролитов сыворотки. Если уровень калия сыворотки повышен или нарастает, тогда, в дополнение к надлежащему лечению гиперкалиемии, следует рассмотреть возможность прекращения введения эпоэтина альфа вплоть до корректировки уровня калия сыворотки.
Вследствие повышения гематокрита на фоне терапии эпоэтином альфа пациентам на гемодиализе может потребоваться увеличение дозы гепарина, в противном случае возможна окклюзия диализной системы.
У некоторых пациенток с хронической почечной недостаточностью на фоне лечения эпоэтином альфа отмечалось возобновление менструаций. Возможность наступления беременности и необходимость контрацептивных мер должны быть обсуждены с пациенткой до начала терапии.
Средства, стимулирующие эритропоэз, являются факторами роста, которые стимулируют, в первую очередь, образование эритроцитов. Рецепторы эритропоэтина могут экспрессироваться на поверхности многих опухолевых клеток. Как и в случае всех факторов роста, существуют сомнения в отношении того, что средства, стимулирующие эритропоэз, могут стимулировать рост опухолей.
С точки зрения вышесказанного решение о введении препарата рекомбинантного эритропоэтина должно приниматься на основании оценки отношения риска и пользы с участием конкретного пациента, и должно учитывать конкретную клиническую ситуацию. Факторы, которые следует рассматривать при такой оценке, включают: тип и стадию опухоли; степень тяжести анемии; ожидаемую продолжительность жизни; условия, в которых пациент получает лечение; предпочтения пациента.
У пациентов с онкологическим заболеванием, получающих химиотерапию, при оценке пригодности терапии эпоэтином альфа (в особенности у пациентов, подверженных риску трансфузии) следует учитывать задержку в 2–3 недели между введением средств, стимулирующих эритропоэз и появлением стимулированных эритропоэтином эритроцитов. Если ВИЧ-инфицированный пациент не отвечает или ответ на терапию эпоэтином альфа недостаточный, следует рассмотреть другие возможные причины анемии, включая дефицит железа.
У пациентов, связанных с программой сбора аутологичной крови и получающих дополнительное лечение эпоэтином альфа, следует учитывать все особые предупреждения и особые меры предосторожности, в особенности — обязательное восполнение объёма.
В до- и послеоперационном периоде всегда следует соблюдать надлежащие стандарты контроля показателей крови.
Пациентам, которым назначена большая плановая ортопедическая операция, следует проводить антитромботическую профилактику, поскольку у хирургических пациентов могут возникать тромботические и сосудистые явления, в особенности — у пациентов с фоновым сердечно-сосудистым заболеванием.
Кроме того, следует соблюдать особые меры предосторожности у пациентов с предрасположенностью к развитию тромботических осложнений. Более того, у пациентов с исходным уровнем гемоглобина > 130 г/л (8,1 ммоль/л) нельзя исключить возможности того, что лечение эпоэтином альфа может быть связано с повышенным риском послеоперационных тромботических сосудистых явлений. Следовательно, у пациентов с исходным уровнем гемоглобина > 130 г/л (8,1 ммоль/л) применение эпоэтина альфа не рекомендуется.
Влияние на способность управлять транспортными средствами, механизмами
Влияние на способность управлять транспортными средствами или заниматься другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций не изучалось.
Форма выпуска
Раствор для внутривенного и подкожного введения, 40000 МЕ/мл.
По 0,3 мл (12000 МЕ); по 1,0 мл (40000 МЕ) в шприц стерильный стеклянный градуированный с иглой, защитным колпачком с дополнительным автоматическим или неавтоматическим устройством для защиты иглы после использования шприца или без него.
По 1, 2 или 3 шприца в контурной ячейковой упаковке из плёнки поливинилхлоридной или полиэтилентерефталата и плёнки из комбинированного материала или полипропиленовой, или полиэтиленовой, или бумаги упаковочной с полимерным покрытием, или бумаги для упаковывания медицинских изделий.
1 контурная ячейковая упаковка по 1, 2 или 3 шприца или 2 контурные ячейковые упаковки по 2 или 3 шприца вместе с инструкцией по применению в пачке из картона. Пачка с двух сторон заклеена наклейками из самоклеящегося материала для контроля вскрытия.
Хранение
При температуре от 2 до 8 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
Отпускают по рецепту.