Эсмия® (Esmya®) инструкция по применению
📜 Инструкция по применению Эсмия®
💊 Состав препарата Эсмия®
✅ Применение препарата Эсмия®
📅 Условия хранения Эсмия®
⏳ Срок годности Эсмия®
Описание лекарственного препарата
Эсмия®
(Esmya®)
Основано на листке-вкладыше препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2023 года.
Дата обновления: 2023.03.27
Владелец регистрационного удостоверения:
Контакты для обращений:
ГЕДЕОН РИХТЕР ОАО
(Венгрия)
Код ATX:
G03XB02
(Улипристал)
Лекарственная форма
| Эсмия® |
Таб. 5 мг: 28 или 84 шт. рег. №: ЛП-№(001703)-(РГ-RU) Предыдущий рег. №: ЛП-002000 |
Форма выпуска, упаковка и состав
препарата Эсмия®
Таблетки белого или почти белого цвета, круглые, двояковыпуклые, с гравировкой «ES5» на одной стороне.
Вспомогательные вещества: целлюлоза микрокристаллическая, маннитол, тальк, кроскармеллоза натрия, магния стеарат.
14 шт. — блистеры (2) в комплекте с футляром картонным с картой-памяткой для пациента — пачки картонные.
14 шт. — блистеры (6) в комплекте с футляром картонным с картой-памяткой для пациента — пачки картонные.
Фармакологическое действие
Улипристал — активный при приеме внутрь синтетический селективный модулятор рецепторов прогестерона (СМПР), характеризующийся тканеспецифичным частичным антипрогестероновым эффектом.
Эндометрий
Улипристал оказывает прямое действие на эндометрий. При начале ежедневного приема препарата в дозе 5 мг в течение менструального цикла у большинства женщин (включая пациенток с миомой) заканчивается очередное менструальное кровотечение, а следующее не наступает. Когда прием препарата прекращается, менструальный цикл обычно возобновляется в течение 4 недель. Прямое действие на эндометрий приводит к специфичным для этого класса препаратов изменениям в эндометрии, связанным с воздействием на рецепторы прогестерона (Progesterone Receptor Modulator Associated Endometrial Changes (РАЕС)). Как правило, гистологические изменения представлены неактивным и слабо пролиферирующим эпителием, сопровождающимся асимметрией роста стромы и эпителия, выраженным кистозным расширением желез со смешанными эстрогенными (митотическими) и прогестагенными (секреторными) влияниями на эпителий. Такие изменения отмечались примерно у 60% пациенток, получавших улипристал в течение 3 месяцев. Эти изменения обратимы и исчезают после прекращения лечения, их не следует принимать за гиперплазию эндометрия.
Примерно у 5% пациенток репродуктивного возраста с тяжелыми формами менструальных кровотечений толщина эндометрия больше 16 мм. У 10-15% пациенток, получающих улипристал, эндометрий может утолщаться (> 16 мм) в течение первого 3-месячного курса лечения. При проведении повторных курсов утолщение эндометрия наблюдалось реже (у 4.9% пациенток после второго курса лечения и у 3.5% после четвертого курса). Это утолщение исчезает после прекращения приема препарата и возобновления менструальных кровотечений. Если утолщение эндометрия сохраняется после возобновления менструальных кровотечений во время перерывов в лечении или выявляется спустя 3 месяца после окончания лечения, следует провести дополнительное обследование для исключения других заболеваний.
Лейомиома
Улипристал оказывает прямое действие на лейомиому, подавляя клеточную пролиферацию и индуцируя апоптоз, что приводит к уменьшению их размеров.
Гипофиз
При ежедневном приеме улипристала в дозе 5 мг происходит подавление овуляции у большинства пациенток, о чем свидетельствует поддержание концентрации прогестерона на уровне около 0.3 нг/мл.
При ежедневном приеме улипристала в дозе 5 мг частично снижается концентрация ФСГ, однако концентрация эстрадиола в плазме крови у большинства пациенток поддерживается на уровне средней фолликулярной фазы и соответствует таковой в группе плацебо.
Улипристал не влияет на концентрацию тироксинсвязывающего глобулина (ТСГ), АКТГ и пролактина в плазме крови.
Доклинические данные по безопасности
В доклинических исследованиях фармакологической безопасности, токсичности многократных доз и генотоксичности потенциальных угроз для человека не выявлено. Основные находки связаны с влиянием на рецепторы прогестерона (а также на рецепторы ГКС при применении препарата в более высоких концентрациях), с антипрогестероновой активностью при экспозициях, близких к терапевтическим у человека. Гистологические изменения, сходные с РАЕС, были выявлены при применении в низких дозах. В связи со своим механизмом действия улипристал вызывает гибель плода у различных видов животных. Безопасность препарата в отношении эмбриона человека не установлена. В дозах, достаточно малых для сохранения беременности у животных, тератогенный потенциал не выявлен. При исследовании репродуктивной функции с использованием доз, обеспечивающих такую же экспозицию, как у человека, не выявлено доказательств влияния на репродуктивную способность животных, получавших улипристал, а также на их потомство.
Канцерогенного действия улипристала не выявлено.
Клиническая эффективность и безопасность
Применение в предоперационном периоде
Улипристал в дозах 5 мг/сут и 10 мг/сут вызывает статистически значимое уменьшение объема менструальной кровопотери, что позволяет относительно быстрее и эффективнее проводить коррекцию анемии. У большинства пациенток, получавших улипристал, кровотечение прекращается в течение первой недели приема (развивается аменорея).
У пациенток, получающих улипристал, значительно уменьшается размер миомы матки. У пациенток, которым не была выполнена гистерэктомия или миомэктомия, уменьшение размеров миомы матки можно оценивать с помощью УЗ исследования после 3 месяцев приема улипристала. Обычно оно сохраняется на протяжении 25 недель последующего наблюдения.
Курсовая терапия
Улипристал эффективен в отношении контроля симптомов миомы матки (например, маточное кровотечение) и уменьшения размеров миомы после курсовой терапии. Исследованная продолжительность долгосрочной терапии составила 4 курса лечения.
Влияние на эндометрий
При возобновлении менструаций в перерывах между курсами лечения у большинства женщин с гиперплазией эндометрия происходило спонтанное исчезновение всех ранее зарегистрированных изменений. При последующих курсах лечения частота развития гиперплазии не увеличивается и в среднем соответствует числу случаев у женщин в пременопаузе.
Фармакокинетика
Всасывание
После однократного приема внутрь в дозе 5 мг или 10 мг улипристал быстро всасывается, достигая примерно через 1 ч после приема Cmax 23.5±14.2 нг/мл и 50.0±34.4 нг/мл соответственно. AUC0-∞ составляет 61.3±31.7 и 134.0±83.8 нг×ч/мл соответственно. Улипристал быстро трансформируется в фармакологически активный метаболит, при этом через 1 ч после приема Cmax составляет 9.0±4.4 нг/мл и 20.6±10.9 нг/мл, AUC0-∞ 26.0±12.0 и 63.6 ± 30.1 нг×ч/мл соответственно. Прием улипристала вместе с завтраком с высоким содержанием жиров приводит к снижению средней Cmax примерно на 45%, удлинению Tmax (от медианы 0.75 ч до 3 ч) и 25% увеличению AUC0-∞, по сравнению с приемом натощак. Такие же результаты получены для активного моно-N-деметилированного метаболита. Этот кинетический эффект пищи не расценивается как значимый для ежедневного приема таблеток улипристала.
Распределение
Улипристал в высокой степени (>98%) связывается с белками плазмы, включая альбумин, α1-кислый гликопротеин, ЛПВП и ЛПНП.
Улипристал и его активный N-деметилированный метаболит проникают в грудное молоко; среднее соотношение AUCt для молока/плазмы составляет 0.74±0.32 для улипристала.
Метаболизм
Улипристала ацетат быстро превращается в моно-N-деметилированный и затем в ди-N-деметилированный метаболиты. Данные in vitro показывают, что этот процесс происходит в системе цитохрома P450 с участием изофермента 3A4 (CYP3A4). Исходя из того, что метаболизм улипристала ацетата опосредован цитохромом P450, ожидается влияние печеночной недостаточности на выведение улипристала, что приведет к увеличению его воздействия.
Выведение
Основной путь выведения – через кишечник, менее 10% вещества выводится почками. Конечный T1/2 улипристала ацетата после однократного приема 5 мг или 10 мг составляет примерно 38 ч, средний клиренс около 100 л/ч. Данные in vitro показывают, что в клинически значимых концентрациях улипристала ацетат и его активный метаболит не ингибируют изоферменты CYP1A2, 2A6, 2C9, 2C19, 2D6, 2E1 и 3A4 и не индуцируют изофермент CYP1A2. Таким образом, применение улипристала ацетата не должно влиять на клиренс лекарственных препаратов, которые метаболизируются при участии данных изоферментов.
Данные in vitro показывают, что улипристала ацетат и его активный метаболит не являются субстратами P-гликопротеина (ABCB1).
Показания препарата
Эсмия®
- курсовая терапия симптомов миомы матки средней тяжести и тяжелой степени у взрослых женщин старше 18 лет до наступления менопаузы, для которых эмболизация и/или хирургическое лечение миомы матки не применимы или были неэффективны.
Режим дозирования
Терапию препаратом Эсмия® следует начинать и проводить под контролем врача, имеющего опыт диагностики и лечения миомы матки.
Внутрь по 1 таб. 1 раз/сут, запивая водой, независимо от приема пищи, курсами по 3 месяца каждый.
Начинать лечение можно только при наступлении менструального кровотечения.
Первый курс лечения начинают во время первой недели менструального цикла.
Повторные курсы терапии начинают не раньше первой недели второго менструального цикла после окончания предыдущего курса.
Лечащий врач должен объяснить пациентке необходимость делать перерывы в лечении.
Продолжительность терапии препаратом Эсмия® — не более 4 курсов.
В случае пропуска таблетки следует принять таблетку препарата Эсмия® как можно быстрее. Если прием пропущен более чем на 12 ч, то пропущенная таблетка не принимается, и следует продолжить прием препарата в обычном режиме.
У пациенток с почечной недостаточностью легкой или средней степени коррекция дозы не требуется. Препарат Эсмия® не рекомендован для применения у пациенток с почечной недостаточностью тяжелой степени при отсутствии возможности постоянного наблюдения (см. раздел «Особые указания»).
Дети и подростки до 18 лет. Применение препарата Эсмия® по соответствующим показаниям у детей не предусмотрено. Безопасность и эффективность улипристала ацетата установлены только для женщин от 18 лет и старше.
Побочное действие
Обзор профиля безопасности
Безопасность улипристала оценивалась у 1053 женщин с миомой матки. Наиболее частым наблюдаемым явлением в клинических исследованиях была аменорея (79.2%), которая считается желаемым исходом.
Наиболее частой нежелательной реакцией было появление «приливов». Подавляющее большинство были легкими или умеренными (95.0%), не приводили к прекращению лечения препаратом и разрешались самостоятельно.
Безопасность повторных курсов лечения улипристалом, каждый продолжительностью 3 месяца, оценивалась у 551 женщины с миомой матки (включая пациенток, получивших 4 курса лечения). Полученные данные сопоставимы с профилем безопасности при проведении лечения в рамках одного курса.
Перечень нежелательных реакций
Возможные на фоне терапии улипристалом нежелательные реакции распределены по системно-органным классам с указанием частоты их возникновения, согласно рекомендациями ВОЗ: очень часто (≥1/10); часто (от ≥1/100 до <1/10); нечасто (от ≥1/1000 до <1/100); редко (от ≥1/10 000 до <1/1000); очень редко (<1/10 000); частота неизвестна (невозможно оценить на основании имеющихся данных).
* см. ниже «Описание отдельных нежелательных реакций»
При сравнении курсов лечения общая частота нежелательных реакций была ниже в последующих курсах, чем во время первого, при этом каждая отдельная нежелательная реакция возникала реже или оставалась в одной и той же категории частоты (за исключением диспепсии, которая была классифицирована как нечастая нежелательная реакция в ходе 3 курса терапии, исходя из ее возникновения у одной пациентки).
Описание отдельных нежелательных реакций
Печеночная недостаточность
В пострегистрационном периоде сообщалось о случаях печеночной недостаточности. В нескольких случаях потребовалась трансплантация печени. Частота возникновения и факторы риска печеночной недостаточности неизвестны
Утолщение эндометрия
У 10-15% пациенток, получавших улипристал, может происходить утолщение эндометрия (>16 мм по данным УЗИ или МРТ на момент окончания лечения) к концу первого 3-месячного курса терапии. Во время последующих курсов терапии утолщение эндометрия наблюдалось с меньшей частотой (4.9% и 3.5% пациенток на момент окончания второго и четвертого курсов терапии соответственно). Это явление обратимо после прекращения лечения и возобновления менструального цикла.
Кроме того, обратимые изменения в эндометрии, обозначаемые как PAEC, отличаются от гиперплазии эндометрия. Патоморфолог должен быть информирован о приеме пациенткой улипристала при проведении гистологического исследования при гистерэктомии или биопсии эндометрия.
«Приливы»
«Приливы» отмечались у 8.1% пациенток. В течение первого 3-месячного курса терапии частота «приливов» составила от 5.3% до 5.8%.
Повышенная чувствительность к препарату
Симптомы повышенной чувствительности к препарату, такие как генерализованный отек, кожный зуд, сыпь, отек лица или крапивница отмечались у 0.4% пациенток.
Головная боль
Головная боль легкой или умеренной степени отмечалась у 5.8% пациенток.
Киста яичника
У 1.0% пациенток в ходе лечения были обнаружены функциональные кисты яичника, которые спонтанно исчезли в течение нескольких недель.
Меноррагия
Пациентки с тяжелым менструальным кровотечением, обусловленным лейомиомой матки, находятся в группе риска повышенной кровопотери, что может потребовать хирургического вмешательства. Было несколько таких сообщений, как в ходе терапии, так и через 2-3 месяца после окончания лечения улипристалом.
Противопоказания к применению
- гиперчувствительность к улипристалу или любому из вспомогательных веществ в составе препарата;
- кровотечение из влагалища неясной этиологии или по причинам, не связанным с миомой матки;
- рак матки, шейки матки, яичников или молочной железы;
- тяжелая форма бронхиальной астмы, не поддающаяся коррекции пероральными ГКС;
- сопутствующее заболевание печени;
- беременность;
- период грудного вскармливания;
- возраст до 18 лет.
С осторожностью
У пациенток с почечной недостаточностью, бронхиальной астмой.
Применение при беременности и кормлении грудью
Беременность
Применение препарата Эсмия® в период беременности противопоказано.
Данные о применении улипристала у беременных отсутствуют или ограничены.
Несмотря на то, что в ходе исследований на животных тератогенный потенциал не выявлен, данных в отношении репродуктивной токсичности недостаточно.
Период грудного вскармливания
В исследованиях на животных показано, что улипристал проникает в грудное молоко лактирующих животных. Улипристал выделяется и с женским грудным молоком. Воздействие препарата на новорожденных и детей младшего возраста не изучалось, поэтому нельзя исключить риск для детей в период грудного вскармливания. Улипристал противопоказан в период грудного вскармливания.
Применение при нарушениях функции печени
Противопоказание: сопутствующее заболевание печени.
Применение при нарушениях функции почек
С осторожностью следует назначать препарат при почечной недостаточности.
У пациенток с легкой или умеренной степенью почечной недостаточности коррекции дозы не требуется. Улипристала ацетат не рекомендован для применения у пациенток с тяжелой почечной недостаточностью при невозможности постоянного наблюдения.
Применение у детей
Применение улипристала ацетата по соответствующим показаниям у детей не предусмотрено. Безопасность и эффективность улипристала ацетата установлены только для женщин от 18 лет и старше.
Особые указания
Улипристал назначается только после тщательного обследования. До начала лечения следует исключить беременность. Если до начала нового курса терапии есть подозрение на беременность, необходимо выполнить соответствующий тест.
Контрацепция
В связи с возможностью нежелательного взаимодействия сопутствующее применение только гестагенсодержащих препаратов, гестаген-высвобождающих систем или комбинированных пероральных контрацептивов не рекомендуется. У большинства женщин при применении улипристала, наблюдется ановуляция, рекомендовано дополнительное использование негормонального метода контрацепции в ходе лечения.
Изменения эндометрия
Улипристал оказывает специфическое фармакодинамическое действие на эндометрий, приводящее к характерным для данного класса гистологическим изменениям в эндометрии, которые обозначаются как РАЕС. Эти изменения исчезают после прекращения лечения и не должны быть ошибочно оценены как гиперплазия эндометрия (см. раздел «Фармакологическое действие»). Кроме того, в период лечения может отмечаться обратимое утолщение эндометрия.
При проведении повторных курсов лечения рекомендуется периодический контроль состояния эндометрия, включая ежегодное ультразвуковое исследование, проводимое после возобновления менструальных кровотечений во время периодов прерывания терапии.
При стойком утолщении эндометрия после возобновления менструальных кровотечений во время периодов прерывания терапии или через 3 месяца после окончания курсов терапии и/или изменении характера кровотечений для исключения других заболеваний, например, злокачественного новообразования, следует провести соответствующее обследование, включающее биопсию эндометрия.
При выявлении гиперплазии (без атипии) рекомендуется проведение контроля в соответствии со стандартной клинической практикой (например, контрольное наблюдение через 3 месяца). В случае атипичной гиперплазии обследование и ведение пациента следует проводить в соответствии с принципами стандартной клинической практики.
Продолжительность каждого курса лечения не должна превышать 3 месяцев, т.к. неизвестен риск нежелательного воздействия на эндометрий, в случае если терапия осуществляется без перерывов.
Характер кровотечений
Пациентки должны быть проинформированы о том, что лечение улипристалом обычно приводит к значительному уменьшению менструальной кровопотери или аменорее в течение первых 10 дней лечения. При сохраняющихся чрезмерных кровотечениях пациентке следует обратиться к врачу. Как правило, менструальный цикл возобновляется в течение 4 недель после окончания курса лечения.
Следует провести соответствующее обследование, включающее биопсию эндометрия, для исключения прочих заболеваний (например, злокачественного новообразования эндометрия), если после исходного снижения интенсивности кровотечений или наступления аменореи в ходе повторных курсов лечения выявляется стойкое изменение или непредвиденный характер кровотечений (например, межменструальные кровотечения).
Максимальная исследованная продолжительность применения препарата составляет 4 курса.
Почечная недостаточность
Нет оснований предполагать, что почечная недостаточность может значительно влиять на выведение улипристала. В связи с отсутствием специальных исследований применение препарата Эсмия® не рекомендуется у пациенток с почечной недостаточностью тяжелой степени при отсутствии возможности тщательного контроля их состояния.
Поражение печени
За период пострегистрационного применения препарата были зарегистрированы случаи поражения печени и печеночной недостаточности (см. раздел «Противопоказания»).
До начала лечения необходимо проверить показатели функции печени. Нельзя начинать прием препарата, если активность трансаминаз (АЛТ или ACT) превышает ВГН более чем в 2 раза (изолированно или в сочетании с повышением концентрации билирубина >2×ВГН).
При курсовой терапии показатели функции печени необходимо контролировать ежемесячно в течение первых двух курсов лечения. В дальнейшем функциональные печеночные тесты следует проводить перед каждым новым курсом лечения и по клиническим показаниям.
Если в ходе лечения у пациентки появятся признаки и симптомы, указывающие на поражение печени (утомляемость, астения, тошнота, рвота, боль в правом подреберье, анорексия, желтуха), прием препарата следует прекратить, а пациентку незамедлительно обследовать, включая показатели функции печени.
Пациентки, у которых на фоне лечения активность трансаминаз (АЛТ или ACT) превысит ВГН более чем в 3 раза, должны прекратить, прием препарата и находиться под тщательным наблюдением.
Дополнительный контроль функциональных проб печени необходимо провести через 2-4 недели после прекращения приема препарата.
Сопутствующая терапия
Не рекомендуется сопутствующее применение улипристала и ингибиторов CYP3A4 средней мощности (например, эритромицина, грейпфрутового сока, верапамила) или мощных ингибиторов (например, кетоконазола, ритонавира, нефазодона, итраконазола, телитромицина, кларитромицина).
Не рекомендуется совместное применение улипристала и мощных индукторов CYP3A4 (например, рифампицина, рифабутина, карбамазепина, окскарбазепина, фенитоина, фосфенитоина, фенобарбитала, примидона, зверобоя продырявленного, эфавиренза, невирапина, при долгосрочном применении ритонавира).
Фертильность
У большинства женщин при применении улипристала наблюдается ановуляция, однако фертильность при длительном применении улипристала не изучалась.
Влияние на способность к управлению транспортными средствами и механизмами
Улипристал может оказывать минимальное влияние на способность к управлению транспортными средствами и механизмами, т.к. после приема улипристала может наблюдаться легкое головокружение.
Передозировка
Данные о передозировке улипристала ограничены.
Однократные дозы до 200 мг и ежедневные дозы 50 мг на протяжении 10 дней назначались ограниченному числу добровольцев, при этом не отмечено тяжелых или серьезных нежелательных реакций.
Лекарственное взаимодействие
Возможное влияние других лекарственных препаратов на действие улипристала
Гормональные контрацептивы
Улипристал имеет стероидную структуру и действует как СМПР с преобладающим ингибирующим действием на данные рецепторы. Таким образом, гормональные контрацептивы и гестагены могут снижать эффективность улипристала путем конкурентного воздействия на рецептор прогестерона. Поэтому не рекомендуется одновременное применение препаратов, содержащих гестагены.
Ингибиторы изофермента CYP3A4
После применения ингибитора изофермента CYP3A4 средней мощности эритромицина пропионата (500 мг 2 раза/сут в течение 9 дней) у здоровых женщин-добровольцев значений Cmax и AUC улипристала повышались в 1.2 и 2.9 раза соответственно; величина AUC активного метаболита улипристала повышалась в 1.5 раза, в то время как Cmax активного метаболита снижалась (в 0.52 раза). На фоне применения кетоконазола (400 мг 1 раз/сут, 7 дней), мощного ингибитора CYP3A4, у здоровых женщин-добровольцев, участвовавших в исследовании, отмечалось увеличение показателей Cmax и AUC улипристала в 2 и 5.9 раз соответственно. Отмечалось увеличение показателей AUC для активного метаболита улипристала в 2.4 раза при снижении его Cmax (изменение в 0.53 раза). Коррекции дозы при применении улипристала у пациенток, получающих слабые ингибиторы изофермента CYP3A4, не требуется. Совместное применение ингибиторов средней мощности или мощных ингибиторов изофермента CYP3A4 с улипристалом не рекомендуется.
Индукторы изофермента CYP3A4
На фоне применения мощного индуктора CYP3A4 рифампицина (300 мг 2 раза/сут, 9 дней) у здоровых женщин-добровольцев отмечалось выраженное снижение показателей Cmax и AUC улипристала и его активного метаболита более чем на 90%. Также отмечено снижение T1/2 улипристала в 2.2 раза, что соответствует уменьшению его экспозиции примерно в 10 раз. Сопутствующее применение улипристала и мощных индукторов CYP3A4 (например, рифампицина, рифабутина, карбамазепина, окскарбазепина, фенитоина, фосфенитоина, фенобарбитала, примидона, зверобоя продырявленного, эфавиренза, невирапина, при долгосрочном применении ритонавира) не рекомендуется.
Препараты, влияющие на рН желудочного сока
Применение улипристала (таблетка 10 мг) вместе с ингибитором протонной помпы эзомепразолом (20 мг 1 раз/сут в течение 6 дней) приводит к снижению средней Cmax на 65%, удлинению Tmax (от медианы 0.75 ч до 1.0 ч) и повышению средней AUC на 13%. Такое действие лекарственных препаратов, повышающих рН желудочного сока, не считается клинически значимым для ежедневного приема таблеток улипристала.
Возможное влияние улипристала на действие других лекарственных препаратов
Гормональные контрацептивы
Улипристал снижает эффективность гормональных контрацептивов (пероральных контрацептивов, содержащих только гестаген; высвобождающих гестаген внутриматочных терапевтических систем или комбинированных пероральных контрацептивов) и препаратов гестагена, применяемых по иным показаниям. Поэтому сопутствующее применение лекарственных препаратов, содержащих гестаген, не рекомендовано. Гестагенсодержащие препараты не следует применять в течение 12 дней после прекращения лечения улипристалом.
Субстраты Р-гликопротеина
Данные in vitro показывают, что в клинически значимых концентрациях улипристала в процессе всасывания в стенке ЖКТ может являться ингибитором Р-гликопротеина (P-gp). Одновременное применение улипристала и субстрата P-gp не исследовалось, поэтому нельзя исключить вероятность взаимодействия. Данные in vivo свидетельствуют о том, что прием улипристала (таблетка 10 мг) за 1.5 ч до приема субстрата P-gp фексофенадина (60 мг) не оказывает клинически значимого воздействия на фармакокинетику фексофенадина. Таким образом, рекомендуется соблюдать интервал не менее 1.5 ч между приемом улипристала и субстратов P-gp (например, дабигатрана этексилата, дигоксина, фексофенадина). Пациентка должна сообщить лечащему врачу о всех лекарственных препаратах, которые она принимает, даже если они отпускаются без рецепта.
Условия хранения препарата Эсмия®
Препарат следует хранить в недоступном для детей месте, в оригинальной упаковке (для того, чтобы защитить от света), при температуре не выше 30°С.
Срок годности препарата Эсмия®
Срок годности — 3 года.
Условия реализации
Препарат отпускают по рецепту.
Контакты для обращений
ГЕДЕОН РИХТЕР ОАО
(Венгрия)

|
|
Организация, принимающая претензии от потребителей |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Содержание статьи
- Состав и форма выпуска препарата эсмия
- Показания и противопоказания к приёму препарата эсмия
- Побочное действие препарата эсмия
- Взаимодействие эсмия с другими препаратами
- Эсмия – отзывы при миоме, цена
- Эмболизация маточных артерий
Миому матки гинекологи чаще выявляют у женщин репродуктивного возраста. Для лечения миомы небольших размеров используют лекарственные препараты. Эсмия относится к фармакологической группе модуляторов рецепторов прогестерона. Отзывы о препарате эсмия при миоме противоречивые. Он имеет много противопоказаний, обладает широким спектром побочных эффектов. При неэффективности медикаментозной терапии гинекологи предлагают женщине удалить матку. Не стоит сразу соглашаться на операцию.
При появлении симптомов матки обращайтесь к нам, Вас запишут на приём к лучшим гинекологам. Наши специалисты организуют обследование и лечение в лучших клиниках лечения миомы.
После установки точного диагноза с помощью новейших диагностических методик врачи клиник, с которыми мы сотрудничаем, выполнят эмболизацию маточных артерий. Это инновационная процедура, после которой уменьшаются размеры миоматозных образований, восстанавливается структура матки, либидо и фертильность (способность к рождению детей). Наши специалисты постоянно будут находиться с вами на связи. Вы имеете возможность получить консультацию эксперта по e-mail.
Состав и форма выпуска препарата эсмия
Производитель препарата эсмия – ОАО «Гедеон Рихтер», Венгрия. Лекарственное средство зарегистрировано и разрешено к применению в РФ. Согласно информации, которая содержится в инструкции по применению эсмия, основным действующим веществом препарата является улипристал. В одной таблетке содержится 5мг
улипристала ацетат и вспомогательные компоненты:
- МКЦ;
- маннитол;
- тальк;
- кроскармеллоза натрия;
- магния стеарат.
Таблетки эсмия имеют круглую двояковыпуклую форму. На одной стороне таблетки есть гравировка «ES5». Препарат оказывает антигестагенное действие.
Показания и противопоказания к приёму препарата эсмия
Лекарственное средство эсмия применяют для терапии умеренных и тяжёлых симптомов миомы матки у взрослых женщин репродуктивного возраста старше 18 лет. Длительность терапии не должна превышать двух курсов.
Врачи не назначают эсмия при наличии следующих противопоказаний:
- повышенная чувствительность к улипристалу или вспомогательным веществам;
- беременность и кормление грудью;
- маточное кровотечение неясной природы или по причинам, которые не связаны с миомой матки;
- злокачественная опухоль матки, яичников, шейки матки или молочной железы;
- тяжёлая форма бронхиальной астмы, которая не поддаётся коррекции пероральными глюкокортикостероидами;
- возраст моложе 18 лет.
Препарат с осторожностью назначают пациенткам с почечной или печёночной недостаточностью. Отзывы о лечении большой миомы матки препаратом эсмия хорошие.
Побочное действие препарата эсмия
При миоме матки женщинам назначают эсмия. Отзывы после приёма препарата свидетельствуют о том, что наиболее частой побочной реакцией является появление приливов. Подавляющее большинство побочных эффектов не требуют прекращения лечения препаратом и разрешаются самостоятельно.
При клиническом исследовании препарата зафиксированы следующие наиболее частые осложнения:
- беспокойство, эмоциональные расстройства;
- головная боль;
- увеличение массы тела;
- вертиго (испытываемое больным чувство, что или он, или окружающие его предметы находятся в постоянном движении);
- боли в животе, тошнота;
- повышенная потливость; нечасто — алопеция, сухость кожи.
- боли в костях и мышцах.
Как свидетельствуют отзывы пациентов, у женщин, которые принимают эсмия, часто развивается аменорея, утолщение эндометрия, тазовая боль, киста яичника. Они ощущают болезненность и напряжённость молочных желез. Редко развивается метроррагия, происходит разрыв кисты яичника, появляются выделения из влагалища.
Взаимодействие эсмия с другими препаратами
Улипристал (основное действующее вещество препарата эсмия) обладает стероидной структурой. Он действует как селективный модулятор рецепторов прогестерона с преобладающим тормозящим эффектом в отношении рецепторов прогестерона. Гормональные контрацептивы и гестагены снижают эффективность улипристала путём конкурентного воздействия на рецептор прогестерона.
Эффективность эсмия снижается при приёме препаратов, влияющих на рН желудочного сока – ингибиторов протонной помпы. Улипристал препятствует действию гормональных контрацептивов (гестагенсодержащих таблеток, гестагенвысвобождающих систем или комбинированных пероральных контрацептивов) и препаратов гестагенов, которые пациентки принимают по иным показаниям. При приёме препарата эсмия врачи не рекомендуют принимать алкоголь, поскольку они несовместимы.
Эсмия – отзывы при миоме, цена
При приёме препарата эсмия прекращается формирования эндометриозного слоя матки. Как свидетельствуют отзывы, у женщины прекращаются месячные кровотечения на весь срок приёма препарата. В первый месяц маточные кровотечения скудные впоследствии вовсе прекращаются. С помощью эсмия женщину вводят в искусственную, обратимую менопаузу.
Курс лечения препаратом эсмия 3 месяца. Иногда возникает необходимость в повторном приёме препарата в течение такого же срока. Спустя 4 недели после отмены препарата у женщины полностью восстанавливается менструальный цикл. Через месяц приходит очередная менструация, а через 2 возобновляется овуляторный цикл.
Гинекологи применяют препарат эсмия для предоперационной подготовки, поскольку он уменьшает кровоснабжение матки и создаёт выгодные условия для выполнения оперативного вмешательства. Врачи клиник, с которыми мы сотрудничаем, не применяют лекарственных препаратов до и после эмболизации маточных артерий. В качестве средства терапии миомы матки препарат эсмия применяют при небольших миоматозных узлах или у женщин позднего репродуктивного возраста. В таких случаях препарат назначают, чтобы избавить женщину от кровотечений и болевых ощущений. Отзывы об эсмия в данном случае хорошие.
Цена 28 таблеток эсмия в аптеках Москвы – от 7700 рублей. На 1 курс лечения необходимо 3 упаковки. Повторный курс лечения стоит ещё 22100 рублей. Стоимость эмболизации маточных артерий в Москве от 28 000 рублей. Поэтому экономически выгодней выполнить эмболизацию маточных артерий, после которой исчезнут все симптомы заболевания, чем тратить деньги на приобретение лекарственных препаратов.
Эмболизация маточных артерий
Врачи клиник, с которыми мы сотрудничаем, для лечения миомы матки успешно применяют эмболизация маточных артерий (ЭМА). Процедура представляет собой малоинвазивное вмешательство: эндоваскулярный хирург через прокол в бедренной артерии в кровеносные сосуды, которые питают миому матки, вводит частички специального вещества (эмболы), блокирующие кровоток. Мышечные клетки, которые формируют миому, без кислорода и питательных веществ погибают и замещаются соединительной тканью. После ЭМА дополнительного лечения миомы, в том числе приёма препарата эсмия, не требуется.
Показания и противопоказания к ЭМА
Эмболизацию маточных артерий выполняют у рожавших женщин с симптоматической миомой, пациенток, вступивших в период менопаузы, которые имеют миоматозный узел размером более 2 см. ЭМА предназначена для тех женщин, которые имеют желание сохранить детородную функцию и не хотят делать операцию.
Эмболизацию миомы матки не делают при наличии следующих противопоказаний:
- тяжёлой почечной недостаточности;
- злокачественных новообразований;
- инфекционных заболеваний яичников и матки;
- беременности;
- некорригируемых коагулопатий;
- аутоиммунных заболеваний соединительной ткани;
- острых анафилактических реакций на рентгеноконтрастные препараты.
После консультации гинеколога и эндоваскулярного хирурга пациентке назначают обследование. Женщину госпитализируют в стационар, где уровень комфортности соответствует европейскому. Кожу на бедре в месте прокола обезболивают местным анестетиком. Затем эндоваскулярный хирург вводит в бедренную артерию катетер. Под контролем рентгеноскопии врач сначала устанавливает катетер в левой маточной артерии и выполняет эмболизацию ее ветвей, снабжающих кровью миому, затем. Затем он устанавливает катетер в правой маточной артерии и вводит в неё эмболизирующий препарат.
Иногда пациентки вовремя процедуры ощущают тепло в ногах или животе. Это нормальная реакция организма на введение контрастного препарата. В ряде случаев появляются тянущие боли внизу живота. Эти ощущения быстро проходят.
После окончания эмболизации эндоваскулярный хирург удаляет катетер из бедренной артерии. В большинстве случаев длительность эмболизации маточных артерий не превышает 25 мину. В редких ситуациях при наличии особенности строения сосудистой системы длительность процедуры увеличивается, поскольку больше времени уходит на установку катетера в маточной артерии.
Возможные осложнения эмболизации маточных артерий
В течение первых часов после процедуры пациентку могут беспокоить боли в нижних отделах живота. Они возникают вследствие прекращения кровотока в миоматозных узлах, и свидетельствует об эффективности эмболизации. Всем пациенткам в это время врачи назначают нестероидные противовоспалительные препараты, которые обладают анальгезирующим эффектом. Через 10-15 часов после вмешательства боли стихают. На следующий день после эмболизации маточных артерий врачи выписывают пациентку из стационара.
Полное восстановление после ЭМА занимает в среднем 3-7 дней, в то время, как для восстановления менструальной функции по окончанию терапии препаратом эсмин требуется месяц. После процедуры ЭМА у пациенток в течение 5-10 дней регистрируется незначительное повышение температуры тела. Оно не требует назначения жаропонижающих препаратов. Самым частым осложнением эмболизации маточных артерий является образование гематомы в месте прокола бедренной артерии. Синяк проходит самостоятельно в течение 10-15 дней.
Результаты эмболизации маточных артерий
К первому году после ЭМА миоматозные узлы уменьшаются в объёме в 4 раза, а размеры матки нормализуются. Некоторые миоматозные узлы, расположенные близко к полости матки, могут отделиться от стенки матки и «родиться» естественным путем. Это приводит к более быстрому восстановлению структуры матки.
У пациенток вскоре после ЭМА нормализуется менструальный цикл, исчезают признаки сдавливания соседних органов. После эмболии маточных артерий женщины, страдавшие от бесплодия, связанного с миомой, при желании рожают здоровых детей. Для того чтобы выполнить в кратчайший срок на высоком техническом уровне эмболизацию маточных артерий при миоме матки, обращайтесь к нам.
Список литературы:
- Сидорова И.С. Миома матки (современные аспекты этиологии, патогенеза, классификации и профилактики). В кн.: Миома матки. Под ред. И.С. Сидоровой. М: МИА 2003; 5—66.
- Андроутопулос Г., Декавалас Г. Последние достижения в лечении миомы матки. Перевод с англ. Н. Д. Фирсовой (2018).
- Савицкий Г. А., Иванова Р. Д., Свечникова Ф. А. Роль локальной гипергормонемии в патогенезе темпа прироста массы опухолевых узлов при миоме матки //Акушерство и гинекология. – 1983. – Т. 4. – С. 13-16.
- Кулаков В.И., Адамян JI.B. Современные технологии в диагностике и лечении гинекологических заболеваний. // Современные технологии в диагностике и лечении гинекологических заболеваний.- М., 2004. — 3-19 с.
Гинеколог, кандидат медицинских наук
Акушер-гинеколог, онколог, кандидат медицинских наук
Врач акушер-гинеколог
Эндоваскулярный хирург, кандидат медицинских наук, самый большой персональный опыт ЭМА в России
Каждая таблетка содержит:
Действующее вещество: улипристала ацетат 5,00 мг;
Вспомогательные вещества:
целлюлоза микрокристаллическая, маннитол, тальк, натрия кроскармеллоза, магния стеарат.
Круглые двояковыпуклые таблетки белого или почти белого цвета с гравировкой «ES5» на одной стороне.
Улипристала ацетат — активный при приёме внутрь синтетический селективный модулятор прогестероновых рецепторов, характеризующийся тканеспецифичным частичным антипрогестероновым эффектом.
Эндометрий
Улипристала ацетат оказывает прямое действие на эндометрий. При начале ежедневного приёма препарата в дозе 5 мг в течение менструального цикла у большинства женщин (включая пациенток с миомой) заканчивается очередная менструация, а следующая не наступает до прекращения лечения. Когда приём препарата прекращается, менструальный цикл обычно возобновляется в течение 4 недель. Прямое действие на эндометрий приводит к специфичным для этого класса npeij$P№dB изменениям в эндометрии, связанным с модулятором рецепторов прогесгеронк’ (Wogesterone Receptor Modulator Associated Endometrial Changes (РАЕС)). Как правило, гистологические изменения представлены неактивным и слабо пролиферирующим эпителием, сопровождающимся асимметрией роста стромы и эпителия, выраженным кистозным расширением желёз со смешанными эстрогенными (митотическими) и прогестагенными (секреторными) влияниями на эпителий. Такие изменения отмечались примерно у 60 % пациенток, получавших улипристала ацетат в течение 3 месяцев. Они обратимы и исчезают после прекращения лечения, их не следует принимать за гиперплазию эндометрия.
Примерно у 5 % пациенток детородного возраста с тяжёлыми формами менструальных кровотечений толщина эндометрия больше 16 мм. У 10-15 % пациенток, получающих улипристала ацетат, эндометрий может утолщаться (> 16 мм) в ходе лечения. Это утолщение исчезает после прекращения приёма препарата и возобновления менструальных кровотечений. Если утолщение эндометрия остается в течение более чем 3 месяцев после окончания лечения и восстановления менструаций, следует провести дополнительное обследование для исключения других заболеваний.
Лейомиома
Улипристала ацетат оказывает прямое действие на лейомиомы, подавляя клеточную пролиферацию и индуцируя апоптоз, что приводит к уменьшению их размеров.
Г ипофиз
При ежедневном приёме улипристала ацетата в дозе 5 мг происходит подавление овуляции у большинства пациенток, о чем свидетельствует поддержание концентрации прогестерона на уровне около 0,3 нг/мл.
При ежедневном приёме улипристала ацетата в дозе 5 мг частично снижается концентрация фолликулостимулирующего гормона (ФСГ), однако концентрация эстрадиола в сыворотке крови у большинства пациенток поддерживается на уровне средней фолликулярной фазы и соответствует таковой в группе плацебо.
Улипристала ацетат не влияет на концентрацию тироксинсвязывающего глобулина (ТСГ), адренокортикотропного гормона (АКТГ) и пролактина в сыворотке крови на протяжении 3 месяцев лечения.
Клиническая эффективность и безопасность
Эффективность фиксированных доз улипристала ацетата 5 мг и 10 мг 1 раз в день, оценивалась в двух рандомизированных двойных слепых 13-недельных исследованиях III фазы, в которые были включены пациентки с тяжёлым обильным менструальным кровотечением, связанным с лейомиомой матки. Исследование 1 было двойным слепым и плацебо-контролируемым. В него были включены пациентки с анемией (НЬ < 10,2 г/дл), которые наряду с исследуемым препаратом дополнительно цолучали внутрь препараты, содержащие 80 мг железа. В Исследовании 2 проводилось сравнение с лейпрорелином, который вводили в дозе 3,75 мг 1 раз в месяц внутримышечно (активный контроль). В Исследовании 2 использовался метод «двойного маскирования» (контроль с помощью двух плацебо) в поддержку слепому методу. В обоих исследованиях объём менструальной кровопотери оценивался с помощью Графической шкалы оценки кровопотери (Pictorial Bleeding Assessment Chart (РВАС)). Сумма баллов по РВАС > 100 в течение первых 8 дней менструации считается признаком повышенной менструальной кровопотери.
В Исследовании 1 статистически значимые различия наблюдались в показателях снижения менструальной кровопотери в пользу улипристала ацетата по сравнению с плацебо (см. Таблицу), что обеспечивает более быструю и эффективную коррекцию анемии по сравнению с монотерапией препаратами железа. Аналогичным образом, у пациенток, получавших улипристала ацетат, отмечалось более выраженное уменьшение размеров миомы, что было доказано с помощью магнитно-резонансной томографии (МРТ).
В Исследовании 2 уменьшение менструальной кровопотери было сравнимым для групп пациенток, получавших улипристала ацетат и агонист гонадотропин-рилизинг гормона (лейпрорелин). У большинства пациенток, получавших улипристала ацетат, кровотечение прекратилось в течение первой недели лечения.
Размер трёх самых больших миом оценивался с помощью ультразвукового исследования (УЗИ) в конце курса лечения (Неделя 13) и на протяжении 25 недель последующего наблюдения (без лечения) у пациенток, которым не выполнялась гистерэктомия или миомэктомия. Уменьшение размеров миомы сохранялось в течение периода последующего наблюдения у пациенток, получавших улипристала ацетат. Однако у пациенток, получавших лейпрорелин, наблюдалось небольшое восстановление размеров миом.
В рамках исследования III фазы включавшего 131 пациентку с фибромиомами, которые получали по 2 курса терапии улипристала ацетатом 10 мг продолжительностью 3 месяца, с дозой, в конце первого курса терапии аменорея была достигнута у 79,5% участниц. На фоне второго курса терапии получены сравнимые результаты (88,5% пациенток). Уменьшение объема лейомиомы (средние [медиана] показатели динамики — относительно скрининга), зарегистрированное во время первого курса терапии (-41,9% [-49,9%]) сохранялось и во время второго курса (-43,7 [-63,2%]). С учетом результатов исследований 1 и 2, предполагается, что эффективность дозы 5 мг, полученная на фоне первого курса терапии, будет сохраняться и в ходе второго курса терапии, по аналогии с дозой 10 мг.
Несмотря на ограниченное число пациенток, завершивших четыре 3-х месячных курса терапии (99 пациенток), полученных данных по безопасности достаточно для обоснования одного дополнительного 3-х месячного курса терапии в предоперационном периоде.
Всасывание
После однократного приёма внутрь дозы 5 мг ацетат быстро всасывается, достигая примерно через 1 час приема максимальной концентрации (Стах) 23,5 ± 14,2 нг/мл и 50,0 ± 34,4 нг/мл, соответственно. Площадь под кривой «концентрация-время» (AUCo-оо) составляет 61,3 ± 31,7 и 134,0 ± 83,8 нгч/мл, соответственно. Улипристала ацетат быстро трансформируется в фармакологически активный метаболит, при этом через 1 час после приёма Стах составляет 9,0 ± 4,4 нг/мл и 20,6 ± 10,9 нг/мл, AUCo-oo 26,0 ± 12,0 и 63,6 ± 30,1 нг ч/мл, соответственно. Приём улипристала ацетата в дозе 30 мг вместе с завтраком с высоким содержанием жиров приводит к снижению средней Стах примерно на 45 %, удлинению времени достижения максимальной концентрации (tmax) (от медианы 0,75 ч до 3 ч) и 25 % повышению AUCo-oo, по сравнению с приёмом натощак. Такие же результаты получены для активного moho-N- деметилированного метаболита. Этот кинетический эффект пищи не расценивается как значимый для ежедневного приёма таблеток улипристала ацетата.
Распределение
Улипристала ацетат в высокой степени (> 98 %) связывается с белками плазмы, включая альбумин, а-1-кислый гликопротеин, липопротеин высокой плотности и липопротеин низкой плотности. Улипристала ацетат и его активный моно-Ы-деметилированный метаболит проникают в грудное молоко; среднее соотношение AUCt для молока/плазмы составляет 0,74 +/- 0,32 для улипристала ацетата.
Метаболизм
Улипристала ацетат быстро превращается в моно-Ы-деметилированный и затем в ди-N- деметилированный метаболиты. Данные in vitro показывают, что этот процесс происходит в системе цитохрома Р450 с участием изофермента ЗА4 (CYP3A4). Исходя из того, что метаболизм улипристала ацетата опосредован цитохромом Р450, ожидается влияние печёночной недостаточности на выведение улипристала ацетата, что приведет к увеличению его воздействия.
Выведение
Основной путь выведения — через кишечник, менее 10 % вещества выводится почками. Конечный период полувыведения улипристала ацетата после однократного приёма 5 мг или 10 мг составляет примерно 38 ч, средний клиренс около 100 л/ч. Данные in vitro показывают, что в клинически значимых концентрациях улипристала ацетат и его активный метаболит не ингибируют изоферменты CYP1A2, 2А6, 2С9, 2С19, 2D6, 2Е1 и ЗА4 и не индуцируют изофермент CYP1A2. Таким образом, применение улипристала ацетата не должно влиять на клиренс лекарственных препаратов, которые метаболизируются при участии данных изоферментов.
Данные in vitro показывают, что улипристала ацетат и его активный метаболит не являются субстратами Р-гликопротеина
Улипристала ацетат показан для предоперационной терапии умеренных и тяжёлых симптомов миомы матки у взрослых женщин детородного возраста.
• Гиперчувствительность к улипристала ацетату или любому из вспомогательных веществ;
• Беременность и период лактации;
• Кровотечение из влагалища неясной этиологии или по причинам, не связанным с миомой матки;
• Рак матки, шейки матки, яичников или молочной железы;
С осторожностью: почечная и/или печёночная недостаточность, бронхиальная астма.
Беременность
Улипристала ацетат противопоказан при беременности.
Данные о применении улипристала ацетата у беременных отсутствуют или ограничены. Несмотря на то, что в ходе исследований на животных тератогенный потенциал не выявлен, данных в отношении репродуктивной токсичности недостаточно.
Период лактации
В исследованиях на животных показано, что улипристала ацетат выделяется с грудным молоком. Улипристала ацетат проникает в грудное молоко. Воздействие препарата на новорожденных/детей младшего возраста не изучалось. Нельзя исключить риска для новорожденных/детей младшего возраста. Улипристала ацетат противопоказан во время грудного вскармливания.
Внутрь по одной таблетке 1 раз в день
независимо от приёма пищи
в течение не более 3 месяцев. Допускается однократное повторение 3-х месячного курса терапии. Повторный курс терапии следует начинать как можно раньше во время второго менструального цикла после окончания первого курса терапии.
Лечение следует начинать в течение первой недели менструального цикла.
Данные по безопасности длительных курсов терапии Отсутствуют; таким образом, продолжительность лечения не должна превышать двух курсов продолжительностью по 3 месяца. В случае пропуска дозы следует принять таблетку улипристала ацетата как можно быстрее. Если приём пропущен более чем на 12 часов, то пропущенная доза не принимается, и следует возобновить обычный режим приёма.
Особые группы пациенток
Почечная недостаточность
У пациенток с лёгкой или умеренной степенью почечной недостаточности коррекции дозы не требуется. Улипристала ацетат не рекомендован для применения у пациенток с тяжёлой почечной недостаточностью при невозможности постоянного наблюдения (см. раздел «Особые указания»).
Печёночная недостаточность
У пациенток с лёгкой степенью печёночной недостаточности коррекции дозы не требуется. Улипристала ацетат не рекомендован для применения у пациенток с умеренной или тяжёлой печёночной недостаточностью при невозможности постоянного наблюдения (см. раздел «Особые указания»).
Дети
Применение улипристала ацетата по соответствующим показаниям у детей не предусмотрено. Безопасность и эффективность улипристала ацетата установлены только для женщин от 18 лет и старше.
Обзор профиля безопасности
Безопасность улипристала ацетата оценивалась у 602 женщин с миомами матки, получавших 5 мг или 10 мг улипристала ацетата в ходе исследований III фазы. Наиболее частым наблюдаемым явлением в клинических исследованиях была аменорея (80,8 %), которая считается желаемым исходом.
Наиболее частой побочной реакцией было появление приливов. Подавляющее большинство побочных реакций были лёгкими или умеренными (93,6 %), не приводили к прекращению лечения препаратом (99,5 %) и разрешались самостоятельно.
Безопасность двух курсов терапии с перерывом (продолжительность каждого курса не более 3 месяцев) оценивалась у 131 женщины с фибромиомами; пациентки получали улипристала ацетат в дозе 10 мг в рамках исследования III фазы. Получен профиль безопасности, аналогичный показателям на фоне однократного курса терапии.
Перечень побочных реакций
В ходе двух исследований III фазы у пациенток с ^иомами Матки, пблучавших препарат в течение 3 месяцев, сообщалось о следующи?4.«йабочных реакциях. Неблагоприятные побочные реакции представлены по системно-органным классам в соответствии с классификацией MedDRA и с частотой возникновения: очень часто (> 1/10); часто (от > 1/100 до < 1/10); нечасто (от > 1/1000 до < 1/100); редко (от > 1/10000 до < 1/1000); очень редко (<1/10000); неизвестно (невозможно оценить на основании имеющихся данных).
В пределах каждой частотной группы побочные реакции представлены в порядке убывания серьёзности.
Нарушения психики
Нечастые: беспокойство, эмоциональные расстройства.
Нарушения со стороны нервной системы
Частые: головная боль* (*- см. раздел «Описание отдельных побочных реакций»); Нечастые: головокружение.
Нарушения со стороны органа слуха и равновесия
Частые: вертиго.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Нечастые: носовое кровотечение.
Нарушения со стороны желудочно-кишечного тракта
Частые: боли в животе, тошнота;
Нечастые: диспепсия, сухость во рту, метеоризм, запор.
Нарушения со стороны кожи и подкожной клетчатки
Частые: акне, повышенная потливость;
Нечастые: алопеция, сухость кожи.
Нарушения со стороны костно-мышечной системы и соединительной ткани
Частые: боли в костях и мышцах;
Нечастые: боли в спине.
Нарушения со стороны почек и мочевыводящих путей
Нечастые: недержание мочи.
Нарушения со стороны репродуктивной системы и молочной железы
Очень частые: аменорея, утолщение эндометрия*
Частые: маточные кровотечения*, приливы*, тазовая боль, киста яичника*,
напряженность/болезненность молочных желёз,;
Нечастые: метроррагия, разрыв кисты яичника, выделения из влагалища, увеличение и неприятные ощущения в области молочных желёз.
Общие расстройства
Частые: отёки, повышенная утомляемость;
Нечастые: астения.
Изменения лабораторных показателей
Частые: повышение концентрации холестерина в крови;
Нечастые: повышение концентрации триглицеридов в крови, увеличение массы тела.
Описание отдельных побочных реакций Утолщение эндометрия
У 10-15 % пациенток, получавших улипристала ацетат, может происходить утолщение эндометрия (> 16 мм по данным УЗИ или МРТ на момент окончания лечения). Это явление обратимо после прекращения лечения и возобновления менструального цикла. Кроме того, обратимые изменения в эндометрии, обозначаемые как РАЕС, отличаются от гиперплазии эндометрия. Патоморфолог должен быть информирован о приёме пациенткой улипристала ацетата при проведении гистологического исследования при гистерэктомии или биопсии эндометрия.
Приливы
Приливы отмечались у 9,8 % пациенток, но их частота варьировала в разных исследованиях. В исследовании с активным контролем их частота составила 24 % (10,5 % умеренных или тяжёлых) для группы улипристала ацетата и 60,4 % (39,6 % умеренных или тяжёлых) для группы лейпрорелина. В плацебо-контролируемом исследовании частота приливов составила 1,0 % для улипристала ацетата и 0 % для плацебо. В рамках открытого исследования III фазы частота явления на фоне применения улипристала ацетата составила 4,3%.
Головная боль
Головная боль лёгкой или умеренной степени отмечалась у 6,8 % пациенток.
Киста яичника
У 1,2 % пациенток в ходе лечения были обнаружены функциональные кисты яичника, которые спонтанно исчезли в течение нескольких недель.
Маточное кровотечение
Пациентки с тяжёлым менструальным кровотечением, обусловленным лейомиомой матки, находятся в группе риска повышенной кровопотери, что может потребовать хирургического вмешательства. Было несколько таких сообщений, как в ходе терапии, так и через 2-3 месяца после окончания лечения улипристала ацетатом.
Данные о передозировке улипристала ацетата
Однократные дозы до 200 мг и ежедневные дозы 50 мг на протяжений ТО дней назначались ограниченному числу добровольцев, при этом не отмечено тяжёлых или серьёзных нежелательных реакций.
Гормональные контрацептивы
Улипристала ацетат обладает стероидной структурой и действует как селективный модулятор прогестероновых рецепторов с преобладающим ингибирующим эффектом в отношении прогестероновых рецепторов. Таким образом, гормональные контрацептивы и прогестагены могут снижать эффективность улипристала ацетата путем конкурентного воздействия на прогестероновый рецептор. Поэтому не рекомендуется одновременное применение препаратов, содержащих прогестагены.
Ингибиторы изофермента CYP3A4
После применения умеренного ингибитора изофермента CYP3A4 эритромицина пропионата (500 мг 2 раза в день в течение 9 дней) у здоровых женщин-добровольцев показатели Стах и AUC улипристала ацетата повышались в 1,2 и 2,9 раза, соответственно; величина AUC активного метаболита улипристала ацетата повышалась в 1,5 раза, в то время как Стах активного метаболита снижалась (в 0,52 раза). На фоне применения мощного ингибитора CYP3A4, кетоконазола (400 мг 1 р/сутки, 7 дней) у здоровых женщин — добровольцев отмечалось увеличение показателей Стах и AUC улипристала ацетата в 2 и 5,9 раз соответственно. Отмечалось увеличение показателей AUC для активного метаболита улипристала ацетата в 2,4 раза, при снижении его Стах (0,53 — кратная динамика).. Коррекции дозы при применении улипристала ацетата у пациенток, получающих слабые ингибиторы изофермента CYP3A4, не требуется. Совместное применение умеренных или мощных ингибиторов изофермента CYP3A4 с улипристала ацетатом не рекомендуется.
Индукторы изофермента CYP3A4
На фоне применения мощного индуктора CYP3A4 рифампицина (300 мг 2 р/сутки, 9 дней) у здоровых женщин — добровольцев отмечалось выраженное снижение показателей Стах и AUC улипристала ацетата и его активного метаболита более чем на 90%, со снижением периода полувыведения улипристала ацетата в 2,2j |з^а, ‘что ‘соответствует уменьшению экспозиции улипристала ацетата примерно в Ш—раз.’ Сопутствующее применение улипристала ацетата и мощных индукторов CYP3A4 (например, рифабутина, рифампицина, карбамазепина, окскарбазепина, фенитоина, фосфенитоина, фенобарбитала, примидона, зверобоя продырявленного, эфавиренза, невирапина, ритонавира — на фоне долговременного применения) не рекомендуется. Препараты, влияющие на pH желудочного сока
Применение улипристала ацетата (10 мг/день) вместе с ингибитором протонной помпы эзомепразолом (20 мг 1 раз в день в течение 6 дней) приводит к снижению средней Стах на 65 %, удлинению tmax (от медианы 0,75 ч до 1,0 ч) и повышению средней AUC на 13 %. Такое действие лекарственных препаратов, повышающих pH желудочного сока, не считается клинически значимым для ежедневного приёма таблеток улипристала ацетата.
Возможное влияние улипристала ацетата на действие других лекарственных препаратов:
Г ормональные контрацептивы
Улипристала ацетат может препятствовать действию гормональных контрацептивов (только прогестаген-содержащих таблеток, прогестаген-рилизинг систем или комбинированных пероральных контрацептивов) и препаратов прогестагена, применяемых по иным показаниям. Поэтому сопутствующее применение лекарственных препаратов, содержащих прогестаген, не рекомендовано. Прогестаген-содержащие препараты не следует применять в течение 12 дней после прекращения лечения улипристала ацетатом.
Субстраты Р-гликопротеина
Данные in vitro показывают, что в клинически значимых концентрациях улипристала ацетат в процессе всасывания в стенке желудочно-кишечного тракта может являться ингибитором Р-гликопротеина (P-gp).
Одновременное применение улипристала ацетата и субстрата P-gp не исследовалось. В данном случае нельзя исключить взаимодействий. Результаты исследований in vivo свидетельствуют о том, что улипристала ацетат (таблетка 10 мг, однократно) применявшийся за 1.5 часа до приема субстрата Р^рфексофенадина (60 мг) не оказывает клинически значимого воздействия на фармакокинетику фексофенадина. Таким образом, рекомендуется соблюдать как минимум 1.5 часовой интервал между применением улипристала ацетата и субстратов P-gp (например, дабигатрана этексилата, дигоксина, фексофенадина).
Улипристала ацетат назначается только после тиЩтеггьного обследования:-Дв-нечал а лечения следует исключить беременность.
Контрацепция
В связи с возможностью нежелательных взаимодействий сопутствующее применение только прогестаген-содержащих препаратов, прогестаген-рилизинг систем или комбинированных пероральных контрацептивов не рекомендуется. Хотя у большинства женщин, получавших терапевтические дозы улипристала ацетата, наблюдалась ановуляция, рекомендовано дополнительное использование негормонального метода контрацепции в ходе лечения. Почечная недостаточность
Нет оснований предполагать, что почечная недостаточность может значительно влиять на выведение улипристала ацетата. Не рекомендуется применять улипристала ацетат без постоянного наблюдения у пациенток с тяжёлой почечной недостаточностью, так как специальные исследования не проводились.
Печёночная недостаточность
Отсутствует опыт терапевтического применения улипристала ацетата у пациенток с печёночной недостаточностью. Ожидается, что печёночная недостаточность может влиять на выведение улипристала ацетата, что приведет к увеличению воздействия препарата. Это несущественно для пациенток с печёночной недостаточностью лёгкой степени. Не рекомендуется назначать улипристала ацетат пациенткам с умеренной или тяжёлой печёночной недостаточностью при невозможности постоянного наблюдения. Сопутствующая терапия
Не рекомендуется сопутствующее применение улипристала ацетата и ингибиторов CYP3A4 средней мощности (например, эритромицина, грейпфрутового сока, верапамила) либо мощных ингибиторов (например, кетоконазола, ритонавира, нефазодона, итраконазола, телитромицина, кларитромицина).
Не рекомендуется совместное применение улипристала ацетата и мощных индукторов CYP3A4 (например, рифампицина, рифабутина, карбамазепина, окскарбазепина, фенитоина, фосфенитоина, фенобарбитала, примидона, зверобоя продырявленного, эфавиренза, невирапина, ритонавира — на фоне долгосрочного применения). Бронхиальная астма Не рекомендуется применение препарата у женщин с тяжёлой формой бронхиальной астмы, не поддающейся коррекции пероральными глюкокортикостероидами.
Изменения эндометрия
Улипристала ацетат оказывает а юцифическое’1 : фармако динамическое действие на эндометрий. Может отмечаться увеличение Толпщны эндометрия. Если утолщение эндометрия сохраняется более, чем 3 месяца после окончания лечения и возобновления менструаций, следует провести дополнительное обследование для исключения других заболеваний.
У пациенток, получающих улипристала ацетат, при гистологическом исследовании могут наблюдаться изменения строения эндометрия. Такие изменения обратимы после завершения лечения. Эти гистологические изменения обозначаются как изменения в эндометрии, связанные с модулятором рецепторов прогестерона (РАЕС), и они не должны быть ошибочно оценены как гиперплазия эндометрия. Рекомендуется проводить не более двух курсов терапии. Продолжительность каждого курса не должна превышать 3 месяцев, поскольку риск нежелательного воздействия на эндометрий на фоне более длительной терапии неизвестен.
Кровотечение
Пациентки должны быть проинформированы о том, что лечение улипристала ацетатом обычно приводит к значительному уменьшению менструальной кровопотери или аменорее в течение первых 10 дней лечения. При сохраняющихся чрезмерных кровотечениях пациентке следует обратиться к врачу. Как правило, менструальный цикл возобновляется в течение 4 недель после окончания курса лечения.
Фертильность
У большинства женщин, принимавших улипристала ацетат в терапевтических дозах, наблюдалась ановуляция. Однако фертильность при длительном применении улипристала ацетата не изучалась.
Влияние на способность управлять автотранспортом и на работу с механизмами Улипристала ацетат может оказывать минимальное влияние на способность управления автотранспортом и работу с механизмами, так как после приёма улипристала ацетата может наблюдаться легкое головокружение.
14 таблеток в блистере из ПВХ/ПЭ/ПВДХ — алюминиевой фольги.
2 или 6 блистеров в картонной коробке с инструкцией по применению.
Хранить в оригинальной упаковке при температурит До +30 С, в защищенном от
света месте.
Хранить в недоступном для детей месте!
Товары из категории — Лекарства от гинекологических заболеваний
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 8 832
Немного фактов
Лекарственный препарат, используемый в терапевтическом курсе при миоме матки. Средство способно присоединить прогестероновые молекулы к андрогенным рецепторам, тем самым активируя их и создавая антигестагенный эффект. Средство временно прекращает менструальный цикл, который возобновится в течение 4 недель после последнего приёма лекарства. Эсмия блокирует лейомиомы, которые способствуют делению и разрастанию тканей, запуская процесс разрушения клеток программно и уменьшая лейомиомы в размерах. Всасывание лекарства происходит быстро, в течении одного часа. При высокой концентрации в организме, может связываться с плазменными белками. Лекарственное средство, в основном, выводится через кишечник, а остальное — через почечную систему.
Состав и форма выпуска
Препарат эсмия в качестве главного активного вещества использует улипристал, а дополнительными, полноценно раскрывающими нужные свойства основы, выбраны маннитол, МКЦ, тальк, стеарат магния, кроскармеллоза натрия. Лекарственное средство сформировано в таблетку круглой двояковыпуклой формы, белого оттенка, с гравировкой на одной стороне. Одна таблетка содержит 5 мг средства. Таблетки упаковываются по 14 штук в блистер оранжевого цвета, который покрыт фольгой. Картонная коробка содержит от 2 до 6 блистеров.
Показания к применению
Лекарственное средство используется в качестве профилактического препарата перед операцией при диагностируемом заболевании миома матки в средней и тяжелой форме. Репродуктивным пациенткам, которые старше 18 лет, рекомендовано 2 курса терапии.
Также, препарат эсмия хорошо зарекомендовал себя при устранении симптомов миомы матки, средней и тяжелой формы. Средство используется для репродуктивных женщин совершеннолетнего возраста, количество терапевтических курсов не должно превышать четырех.
Побочные эффекты
Проведенное исследование среди 1000 пациенток показало, что в 80% случаев, употребляя эсмию, в количестве 5 или 10 мг, менструация прекращается на несколько циклов, что считается ожидаемым эффектом. Исследование проводилось на третьей фазе. Период исследования — 2 курса по три месяца.
Самым частым нежелательным действием препарата стали приливы. Впрочем, они были в легкой и умеренной форме, поэтому медикаментозное лечение прерывать не требовалось, поскольку сам организм регулировал баланс.
При употреблении лекарственного средства, у пациенток может возникать беспричинное беспокойство, и психические расстройства на эмоциональном фоне.
Для центральной нервной системы имеется риск возникновения обширной головной боли, острой боли в височных долях, головокружения, а также, изредка, потеря сознания.
Препарат эсмия существенно влияет на процессы метаболизма и усваивания пищи поэтому при миоме матки пациентки, порой, набирают лишний вес за короткий срок.
Органы слуха и вестибулярный аппарат может подвергнуться вертиго — иллюзии вращения тела при его относительном физическом спокойствии. При этом теряется равновесие и, иногда, пропадает слух.
В дыхательной системе наблюдается сбитый ритм и одышка, а также кровотечение в области носа.
Употребление описываемого средства при миоме матки, может спровоцировать рези в желудке, продолжительную тошноту, затруднения в пищеварительном процессе, повышенное газообразование, закупоривание кишечника, возникновение постоянной сухости во рту.
На кожных покровах может проступить воспалительная сыпь, повыситься потоотделение, выпадать волосы, понизиться уровень влаги.
В скелетно-мышечной структуре часто возникают острые боли, а в соединительных тканях — воспалительные процессы.
В мочевыводящей системе под воздействием препарата может возникнуть недержание мочи, но это происходит изредка.
В половых органах и молочных железах во время лечения миомы возникает утолщение слизистой оболочки тела матки, образовывается пузырь с жидкостью в яичнике, болезненные ощущения в тазу и молочных железах, частые выделения крови из матки и влагалища, уплотнения в области паха и молочных желез.
В гормональном фоне есть риск повышения холестерина и триглицерида в крови.
К общим признакам следует отнести слабость организма, отеки конечностей и некоторых частей тела, повышенную нервозность.
Противопоказания
Эсмию не нужно включать в терапевтический курс, если у пациентки выявлена непереносимость к любому компоненту лекарства даже в малейших количествах.
Применение средства не распространяется на диагностируемые выделения и кровотечения из влагалища неизвестной природы, которые не связаны с миомой матки.
Запрещено использовать эсмию при онкологической опухоли в матке, шейке матки, яичниках или молочных железах, на любой диагностируемой стадии.
При хроническом воспалении дыхательных путей, при котором происходит сужение бронх и затруднение дыхания, эсмия также противопоказана.
Лекарственное средство не используется в терапевтическом курсе для устранения миомы матки у пациенток, которые младше 18 лет.
С большой осторожностью необходимо употреблять средство женщинам с сердечной и почечной недостаточностью.
Данных о лечении миомы матки у пациенток пожилого возраста, нет.
Неизвестно, влияет ли эсмия на возможность управления автотранспортом.
Нет никаких объективных данных о безопасности воздействия лекарства при миоме матки у беременных женщин. Поэтому, в целях профилактики, лучше отказаться от прохождения курса с использованием эсмии, для обеспечения полноценного развития плода.
Проводимые на животных эксперименты показали, улипристал попадает в молоко животных, тем самым негативно влияя на неокрепший организм детенышей. Поэтому можно предположить, что такой эффект будет наблюдаться и у кормящих матерей, которым прописана эсмия. Поэтому, в целях обеспечения здоровья ребенка, следует отказаться от лечебного курса с описываемым средством, либо же подыскать альтернативный источник питания для ребенка.
Не следует планировать беременность во время терапии, а также в трехмесячный период после её окончания.
Покупка и хранение
Приобрести препарат можно в любой доступной аптеке специализированного типа, предъявив там рецептный бланк от вашего лечащего врача. Хранить эсмию следует в темном месте со сбалансированной влажностью и температурой воздуха, не превышающей 30-градусную отметку тепла.
Способ и особенности применения
Средство принимается внутренним способом, при необходимости запив таблетку водой. Для пациенток без отягощающих факторов лечения, рекомендуемая доза составляет одну таблетку в день. Допустим терапевтический курс на период, не превышающий трех месяцев. Если по результатам анализов требуется продолжить подобное медикаментозное лечение, то следует приступать ко второму этапу не ранее, чем после второго менструального цикла. Длительность второго курса также не должна превышать трех месяцев. Необходимости в третьем курсе нет, поскольку нет достоверных данных о его безопасности для организма пациента, и, поскольку предыдущее лечение не дало ожидаемых результатов, то проводить еще одно — не имеет смысла.
Необходимо принимать таблетку в одно и то же время. В случае, если время пропуска превышает 12 часов, следует принимать эсмию на следующий день.
На основе показаний лечения пациентов с почечной недостаточностью, следует взять их под особый контроль, периодически сверяя результаты анализов.
Под постоянное наблюдение подпадает категория пациентов с печеночной недостаточностью. Считается, что препарат в данном случае имеет усиленное действие, и труднее выводится из организма. Для легкой формы это допустимо, но средство не подлежит применению к пациенткам со средней и тяжелой формой печеночной недостаточности. При таком исходе, необходимо подобрать альтернативное лекарство.
Перед лечением, согласно инструкции, следует проконсультировать пациенток о том, что лекарственное средство приводит к значительному уменьшению, а то и полному отсутствию, кровопотери при менструальном цикле в первые десять дней курсового лечения. Если наблюдается обратный эффект, следует прервать лечение, для выяснения источника побочных действий и корректировки лечения.
Взаимодействие с другими лекарствами
Противопоказано употреблять средство с лекарствами, которые содержат гестагены, поскольку эффективность улипристала заметно падает.
Комплексная терапия описываемым средством и ингибиторами изоферментов CYP3A4, категорически запрещена, поскольку доза и активность улипристала возрастает в несколько раз.
Совместное применение эсмии со средствами, повышающими показатели желудочного сока, может внести некоторые коррективы в метаболические процессы, но они не существенны для лечения.
Нет объективных данных по взаимодействию лекарственного средства с P-gp субстратами, поэтому нельзя исключать нежелательной реакции. Известно, что улипристал выступает ингибирующим веществом для этих субстратов. Поэтому, пациенткам рекомендуется соблюдать интервал в 1,5-2 часа между приёмами препаратов для сохранения стабильности протекания физиологических процессов в организме.
Также, рекомендовано сообщать вашему лечащему доктору о принятии иных средств лечения, которые отпускаются без рецепта. Так можно заранее выявить потенциальное негативное влияние на организм лекарства, а также найти возможный источник, который вызывает нежелательные побочные действия. Но лучше придерживаться предписаний, которые предоставил вам ваш врач.
МКБ-10
Согласно международному классификатору болезней, эсмия используется для лечения D25 — миомы матки.
Аналоги
Если эсмия не подходит по причине непереносимости или иным объективным факторам, то для лечения подобной болезни, есть следующие альтернативные лекарственные средства:
- визанна;
- сокловагин;
- монтавит;
- агалатес.
Передозировка
На основе показаний немногочисленных опытов, явных нежелательных процессов в организме не наблюдалось. Однако, при сильных неприемлемых реакциях, следует провести симптоматичную терапию до нормализации состояния пациента.
Следует помнить, что легкие побочные эффекты, в идее тошноты и головокружения, не являются достаточным поводом для прерывания терапии, как правило, они устраняются организмом самостоятельно.
Совместимость с алкоголем
Инструкция по применению не содержит информации о том, подвержена ли эсмия влиянию алкоголя. Известно, что алкоголь оказывает сильное воздействие на процесс обмена веществ, а его стабильность важна для полноценного лечения без осложнений. Поэтому алкоголь необходимо исключить на период прохождения терапии. Срок воздержания от алкоголя в постлечебный период следует обсудить с вашим лечащим врачом.
Цены на Эсмия в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 8 832 руб.
Сертификаты и лицензии
Эсмия — инструкция по применению
Синонимы, аналоги
Статьи
В настоящее время препарат не числится в Государственном реестре лекарственных средств или указанный регистрационный номер исключен из реестра.
Регистрационный номер:
ЛП-0002000
Торговое наименование препарата:
Эсмия®
Международное непатентованное наименование:
улипристал
Лекарственная форма:
таблетки
Состав на 1 таблетку:
действующее вещество: улипристала ацетат 5,00 мг;
вспомогательные вещества: целлюлоза микрокристаллическая 93,50 мг, маннитол 43,50 мг, тальк 4,00 мг, кроскармеллоза натрия 2,50 мг, магния стеарат 1,50 мг.
Описание:
Круглые двояковыпуклые таблетки белого или почти белого цвета с гравировкой «ES5» на одной стороне.
Фармакотерапевтическая группа:
рецепторов прогестерона модулятор.
Код АТХ: G03XB02
Фармакологические свойства
Фармакодинамика
Улипристал — активный при приёме внутрь синтетический селективный модулятор рецепторов прогестерона (СМПР), характеризующийся тканеспецифичным частичным антипрогестероновым эффектом.
Эндометрий
Улипристал оказывает прямое действие на эндометрий. При начале ежедневного приёма препарата в дозе 5 мг в течение менструального цикла у большинства женщин (включая пациенток с миомой) заканчивается очередное менструальное кровотечение, а следующее не наступает. Когда приём препарата прекращается, менструальный цикл обычно возобновляется в течение 4 недель. Прямое действие на эндометрий приводит к специфичным для этого класса препаратов изменениям в эндометрии, связанным с антагонистическим действием на рецепторы прогестерона (Progesterone Receptor Modulator Associated Endometrial Changes (PAEC)). Как правило, гистологические изменения представлены неактивным и слабо пролиферирующим эпителием, сопровождающимся асимметрией роста стромы и эпителия, выраженным кистозным расширением желёз со смешанными эстрогенными (митотическими) и прогестагенными (секреторными) влияниями на эпителий. Такие изменения отмечались примерно у 60% пациенток, получавших улипристал в течение 3 месяцев. Эти изменения обратимы и исчезают после прекращения лечения, их не следует принимать за гиперплазию эндометрия.
Примерно у 5% пациенток репродуктивного возраста с тяжёлыми формами менструальных кровотечений толщина эндометрия больше 16 мм. У 10-15% пациенток, получающих улипристал, эндометрий может утолщаться (> 16 мм) в течение первого 3-месячного курса лечения. При проведении повторных курсов утолщение эндометрия наблюдалось реже (у 4,9% пациенток после второго курса лечения и у 3,5% после четвертого курса). Это утолщение исчезает после прекращения приёма препарата и возобновления менструальных кровотечений. Если утолщение эндометрия сохраняется после возобновления менструальных кровотечений во время перерывов в лечении или выявляется спустя 3 месяца после окончания лечения, следует провести дополнительное обследование для исключения других заболеваний.
Лейомиома
Улипристал оказывает прямое действие на лейомиомы, подавляя клеточную пролиферацию и индуцируя апоптоз, что приводит к уменьшению их размеров.
Гипофиз
При ежедневном приёме улипристала в дозе 5 мг происходит подавление овуляции у большинства пациенток, о чем свидетельствует поддержание концентрации прогестерона на уровне около 0,3 нг/мл.
При ежедневном приёме улипристала в дозе 5 мг частично снижается концентрация фолликулостимулирующего гормона (ФСГ), однако концентрация эстрадиола в плазме крови у большинства пациенток поддерживается на уровне средней фолликулярной фазы и соответствует таковой в группе плацебо.
Улипристал не влияет на концентрацию тироксинсвязывающего глобулина (ТСГ), адренокортикотропного гормона (АКТГ) и пролактина в плазме крови.
Доклинические данные по безопасности
В доклинических исследованиях фармакологической безопасности, токсичности многократных доз и генотоксичности потенциальных угроз для человека не выявлено. Основные находки в исследованиях общей токсичности связаны с влиянием на рецепторы прогестерона (а также на рецепторы глюкокортикостероидов при применении препарата в более высоких концентрациях), с антипрогестероновой активностью при экспозициях, близких к терапевтическим у человека. В 39-недельном исследовании на обезьянах с применением низких доз были выявлены изменения, сходные с РАЕС. В связи со своим механизмом действия улипристал вызывает гибель плода у крыс, кроликов (при многократных дозах выше 1 мг/кг), морских свинок и обезьян. Безопасность препарата в отношении эмбриона человека не установлена. В дозах, достаточно малых для сохранения беременности у животных, тератогенный потенциал не выявлен. В исследованиях репродукции у крыс с использованием доз, обеспечивающих такую же экспозицию, как у человека, не выявлено доказательств влияния на репродуктивную способность животных, получавших улипристал, а также на их потомство.
В исследованиях, проведённых на мышах и крысах, канцерогенного действия улипристала не выявлено.
Клиническая эффективность и безопасность
Применение в предоперационном периоде
Эффективность фиксированных доз улипристала 5 мг и 10 мг один раз в сутки оценивалась в двух исследованиях Фазы 3, в которых участвовали пациентки с очень тяжелыми менструальными кровотечениями, вызванными миомой матки. В сравнении с плацебо было выявлено клинически значимое уменьшение объема менструальной кровопотери у пациенток, принимавших улипристал. Это позволяло быстро и более эффективно проводить коррекцию анемии, чем при назначении только препаратов железа. Уменьшение менструальной кровопотери у пациенток группы улипристала было сопоставимо с группой, получавшей агонист гонадотропин-рилизинг гормона (лейпрорелин). У большинства пациенток, получавших улипристал, кровотечение прекращалось в течение первой недели приёма (развивалась аменорея). По данным магнитно-резонансной томографии в группе улипристала было значительно большее уменьшение размеров миомы матки, чем в группе плацебо. У пациенток, которым не была выполнена гистерэктомия или миомэктомия, при УЗ-контроле в конце лечения (Неделя 13) оценивалось уменьшение размеров миомы матки. Как правило, оно сохранялось на протяжении 25 недель последующего наблюдения у пациенток группы улипристала, тогда как в группе, получавшей лейпрорелин, отмечалось некоторое увеличение размеров миомы матки.
Курсовая терапия
Долгосрочная эффективность многократного применения улипристала в фиксированных дозах 5 мг или 10 мг изучена в двух исследованиях Фазы 3, в которых оценивалось максимум четыре 3-месячных курса лечения у пациенток с обильными менструальными кровотечениями, связанными с миомой матки. Исследование PEARL III было открытым с оценкой применения улипристала в дозе 10 мг, в котором после каждого 3-месячного курса терапии следовали 10 дней лечения прогестином или плацебо двойным слепым методом. PEARL IV было рандомизированным двойным слепым исследованием с оценкой применения улипристала в дозах 5 или 10 мг.
В исследованиях PEARL III и IV была отмечена эффективность в отношении контроля симптомов миомы матки (например, маточное кровотечение) и уменьшения размеров миомы после 2 и 4 курсов лечения.
В исследовании PEARL III эффективность лечения наблюдалась в течение >18 месяцев многократных курсов лечения (4 курса с применением дозы 10 мг 1 раз в сутки), на момент окончания 4 курса терапии у 89,7% пациенток была зарегистрирована аменорея. В исследовании PEARL IV у 61,9% и 72,7% пациенток была зарегистрирована аменорея на момент окончания 1 и 2 курса терапии (дозы 5 мг и 10 мг соответственно); у 48,7% и 60,5% пациенток аменорея была зарегистрирована на момент окончания всех четырех курсов терапии (дозы 5 мг и 10 мг соответственно).
Согласно оценке, в конце 4 курса терапии аменорея была зарегистрирована у 158 (69,6%) и 164 (74,5%) пациенток соответственно.
Таблица: Результаты первичной оценки и выборочные результаты вторичной оценки эффективности в исследованиях долгосрочной курсовой терапии III фазы.
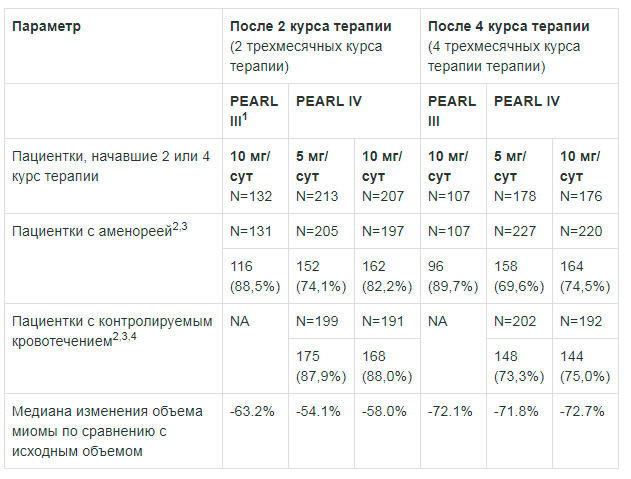
1Оценка на курсе 2 проводилась за период одного трехмесячного курса лечения плюс одного
менструального периода.
2 Пациентки с отсустствующими данными были исключены из анализа.
3N и % включают выбывших пациентов
4Контролируемое кровотечение определялось как отсутствие эпизодов обильного кровотечения и
продолжительностью менструального кровотечения до 8 дней (за исключением дней, когда отмечались
«мажущие» выделения) на протяжении последних двух месяцев каждого курса терапии.
Результаты оценки влияния на эндометрий
Во всех исследованиях Фазы 3 (включая исследования долгосрочной курсовой терапии) среди 789 пациенток было зарегистрировано 7 случаев развития гиперплазии (0,89%), подтвержденной результатами патоморфологического исследования. При возобновлении менструаций в перерывах между курсами лечения в большинстве случаев происходило спонтанное исчезновение всех ранее зарегистрированных изменений эндометрия. При последующих курсах лечения частота развития гиперплазии не увеличивалась. Зарегистрированные значения частоты соответствуют таковым в контрольных группах и распространенности, отмеченной в литературе для женщин этой возрастной группы (средний возраст 40 лет).
Фармакокинетика
Всасывание
После однократного приёма внутрь дозы 5 мг или 10 мг улипристал быстро всасывается, достигая примерно через 1 час после приёма максимальной концентрации (Cmax) 23,5 ± 14,2 нг/мл и 50,0 ± 34,4 нг/мл соответственно. Площадь под кривой «концентрация-время» (AUC0-∞) составляет 61,3 ± 31,7 и 134,0 ± 83,8 нг·ч/мл соответственно. Улипристал быстро трансформируется в фармакологически активный метаболит, при этом через 1 час после приёма Cmax составляет 9,0 ± 4,4 нг/мл и 20,6 ± 10,9 нг/мл, AUC0-∞ 26,0 ± 12,0 и 63,6 ± 30,1 нг·ч/мл соответственно. Приём улипристала в дозе 30 мг вместе с завтраком с высоким содержанием жиров приводит к снижению средней Cmax примерно на 45%, удлинению времени достижения максимальной концентрации (tmax) от медианы 0,75 ч до 3 ч и 25% повышению AUC0-∞, по сравнению с приёмом натощак. Такие же результаты получены для активного моно-N-деметилированного метаболита. Этот кинетический эффект пищи не расценивается как значимый для ежедневного приёма таблеток улипристала.
Распределение
Улипристал в высокой степени (> 98%) связывается с белками плазмы, включая альбумин, α-1-кислый гликопротеин, липопротеины высокой плотности и липопротеины низкой плотности.
Улипристал и его активный N-деметилированный метаболит проникают в грудное молоко; среднее соотношение AUCt для молока/плазмы составляет 0,74 ± 0,32 для улипристала.
Метаболизм
Улипристал быстро превращается в моно-N-деметилированный и затем в ди-N-деметилированный метаболиты. Данные in vitro показывают, что этот процесс происходит в системе цитохрома P450 с участием изофермента 3A4 (CYP3A4). Исходя из того, что метаболизм улипристала опосредован цитохромом P450, ожидается влияние печёночной недостаточности на выведение улипристала, что приведет к увеличению его воздействия.
Выведение
Основной путь выведения — через кишечник, менее 10% вещества выводится почками.
Конечный период полувыведения улипристала после однократного приёма 5 мг или 10 мг составляет примерно 38 ч, средний клиренс около 100 л/ч. Данные in vitro показывают, что в клинически значимых концентрациях улипристал и его активный метаболит не ингибируют изоферменты CYP1A2, 2A6, 2C9, 2C19, 2D6, 2E1 и 3A4 и не индуцируют изофермент CYP1A2. Таким образом, применение улипристала не должно влиять на клиренс лекарственных препаратов, которые метаболизируются при участии данных изоферментов.
Данные in vitro показывают, что улипристал и его активный метаболит не являются субстратами P-гликопротеина (ABCB1).
Показания к применению
— Предоперационная терапия симптомов миомы матки средней тяжести и тяжёлой степени у женщин репродуктивного возраста старше 18 лет.
Курсовая терапия симптомов миомы матки средней тяжести и тяжёлой степени у женщин репродуктивного возраста старше 18 лет, длительность терапии не более 4 курсов.
Противопоказания
• Гиперчувствительность к улипристалу или любому из вспомогательных веществ.
• Беременность и период грудного вскармливания.
• Кровотечение из влагалища неясной этиологии или по причинам, не связанным с миомой матки.
• Рак матки, шейки матки, яичников или молочной железы.
• Возраст < 18 лет.
• Бронхиальная астма, тяжелая форма, не поддающаяся коррекции пероральными глюкокортикостероидами.
С осторожностью:
почечная и/или печёночная недостаточность, бронхиальная астма.
Применение при беременности и в период грудного вскармливания
Беременность
Улипристал противопоказан при беременности.
Данные о применении улипристала у беременных отсутствуют или ограничены.
Несмотря на то, что в ходе исследований на животных тератогенный потенциал не выявлен, данных в отношении репродуктивной токсичности недостаточно.
Период грудного вскармливания
В исследованиях на животных показано, что улипристал проникает в грудное молоко.
Улипристал проникает в женское грудное молоко. Воздействие препарата на новорожденных и детей младшего возраста не изучалось, поэтому нельзя исключить риск для детей в период грудного вскармливания. Улипристал противопоказан в период грудного вскармливания.
Способ применения и дозы
Внутрь по одной таблетке 1 раз в день независимо от приёма пищи курсами по 3 месяца каждый.
Начинать лечение можно только при наступлении менструального кровотечения.
Первый курс лечения начинают во время первой недели менструального цикла.
Повторные курсы терапии начинают как можно раньше в первую неделю второго менструального цикла после окончания предыдущего курса.
Лечащий врач должен объяснить пациентке необходимость делать перерывы в лечении.
Продолжительность терапии препаратом Эсмия® — не более 4 курсов.
В случае пропуска таблетки следует принять таблетку препарата Эсмия® как можно быстрее. Если приём пропущен более чем на 12 часов, то пропущенная таблетка не принимается, и следует продолжить прием препарата в обычном режиме.
Особые группы пациенток
Почечная недостаточность
У пациенток с лёгкой или умеренной степенью почечной недостаточности коррекции дозы не требуется. Препарат Эсмия® не рекомендован для применения у пациенток с тяжёлой почечной недостаточностью при невозможности постоянного наблюдения (см. раздел «Особые указания»).
Печёночная недостаточность
У пациенток с лёгкой степенью печёночной недостаточности коррекции дозы не требуется. Препарат Эсмия® не рекомендован для применения у пациенток с умеренной или тяжёлой печёночной недостаточностью при невозможности постоянного наблюдения (см. раздел «Особые указания»).
Дети
Применение препарата Эсмия® по соответствующим показаниям у детей не предусмотрено. Безопасность и эффективность улипристала установлены только для женщин от 18 лет и старше.
Побочное действие
Обзор профиля безопасности
Безопасность улипристала оценивалась у 1053 женщин с миомами матки, получавших 5 мг или 10 мг улипристала в ходе исследований Фазы 3. Наиболее частым наблюдаемым явлением в клинических исследованиях была аменорея (79,2%), которая считается желаемым исходом.
Наиболее частой побочной реакцией было появление «приливов». Подавляющее большинство побочных реакций были лёгкими или умеренными (95,0%), не приводили к прекращению лечения препаратом (98,0%) и разрешались самостоятельно.
Безопасность повторных курсов лечения улипристалом 5 или 10 мг, каждый продолжительностью 3 месяца, оценивалась в 2 исследованиях Фазы 3 с участием 551 женщины с миомами матки, включая 457 пациенток, получивших 4 курса лечения. Полученные данные сопоставимы с профилем безопасности при проведении лечения в рамках одного курса.
Перечень побочных реакций
В ходе четырех исследований Фазы 3 у пациенток с миомами матки, получавших препарат в течение 3 месяцев, сообщалось о следующих побочных реакциях. Неблагоприятные побочные реакции представлены по системно-органным классам в соответствии с классификацией MedDRA и с частотой возникновения: очень часто (≥ 1/10); часто (от ≥ 1/100 до < 1/10); нечасто (от ≥ 1/1000 до < 1/100); редко (от ≥ 1/10000 до < 1/1000); очень редко (< 1/10000); неизвестно (невозможно оценить на основании имеющихся данных).
В пределах каждой частотной группы побочные реакции, возникшие во время первого курса терапии, представлены в порядке убывания серьёзности.
Нарушения психики
Нечастые: беспокойство, эмоциональные расстройства.
Нарушения со стороны нервной системы
Частые: головная боль* (*- см. раздел «Описание отдельных побочных реакций»).
Нечастые: головокружение.
Нарушения со стороны обмена веществ и питания
Частые: увеличение массы тела.
Нарушения со стороны органа слуха и лабиринтные нарушения
Частые: вертиго.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Редко: носовое кровотечение.
Нарушения со стороны желудочно-кишечного тракта
Частые: боли в животе, тошнота.
Нечастые: сухость во рту, запор.
Редко: диспепсия, метеоризм.
Нарушения со стороны кожи и подкожных тканей
Частые: акне.
Нечастые: алопеция, сухость кожи, повышенная потливость.
Нарушения со стороны скелетно-мышечной системы и соединительной ткани
Частые: боли в костях и мышцах.
Нечастые: боли в спине.
Нарушения со стороны почек и мочевыводящих путей
Нечастые: недержание мочи.
Нарушения со стороны половых органов и молочной железы
Очень частые: аменорея, утолщение эндометрия*.
Частые: «приливы»*, тазовая боль, киста яичника*, напряженность / болезненность молочных желёз.
Нечастые: маточное кровотечение, метроррагия, выделения из влагалища, и неприятные ощущения в области молочных желёз.
Редко: разрыв кисты яичника, увеличение молочных желёз.
Общие расстройства и нарушения в месте введения
Частые: повышенная утомляемость.
Нечастые: отёки, астения.
Изменения лабораторных и инструментальных исследований
Нечастые: повышение концентрации холестерина в крови, повышение концентрации триглицеридов в крови.
При сравнении курсов лечения общая частота побочных реакций была ниже в последующих курсах, чем во время первого, при этом каждая отдельная побочная реакция возникала реже или оставалась в одной и той же категории частоты (за исключением диспепсии, которая была классифицирована как нечастая неблагоприятная побочная реакция в ходе 3 курса терапии, исходя из ее возникновения у одной пациентки).
Описание отдельных побочных реакций
Утолщение эндометрия
У 10-15% пациенток, получавших улипристал, может происходить утолщение эндометрия (> 16 мм по данным УЗИ или МРТ на момент окончания лечения) к концу первого 3-месячного курса терапии. Во время последующих курсов терапии утолщение эндометрия наблюдалось с меньшей частотой (4,9% и 3,5% пациенток на момент окончания второго и четвертого курсов терапии соотвтетственно). Это явление обратимо после прекращения лечения и возобновления менструального цикла.
Кроме того, обратимые изменения в эндометрии, обозначаемые как PAEC, отличаются от гиперплазии эндометрия. Патоморфолог должен быть информирован о приёме пациенткой улипристала при проведении гистологического исследования при гистерэктомии или биопсии эндометрия. «Приливы»
«Приливы» отмечались у 8,1% пациенток, но их частота варьировала в разных исследованиях. В исследовании с активным контролем их частота составила 24% (10,5% средней или тяжёлой степени тяжести) для группы улипристала и 60,4% (39,6% средней или тяжёлой степени тяжести) для группы лейпрорелина. В плацебо-контролируемом исследовании частота «приливов» составила 1,0% для улипристала и 0% для плацебо. В течение первого 3-месячного курса терапии двух долгосрочных исследований Фазы 3 частота «приливов» составила 5,3% и 5,8% соответственно.
Головная боль
Головная боль лёгкой или умеренной степени отмечалась у 5,8% пациенток.
Киста яичника
У 1,0% пациенток в ходе лечения были обнаружены функциональные кисты яичника, которые спонтанно исчезли в течение нескольких недель.
Маточное кровотечение
Пациентки с тяжёлым менструальным кровотечением, обусловленным лейомиомой матки, находятся в группе риска повышенной кровопотери, что может потребовать хирургического вмешательства. Было несколько таких сообщений, как в ходе терапии, так и через 2-3 месяца после окончания лечения улипристалом.
Передозировка
Данные о передозировке улипристала ограничены.
Однократные дозы до 200 мг и ежедневные дозы 50 мг на протяжении 10 дней назначались ограниченному числу добровольцев, при этом не отмечено тяжёлых или серьёзных нежелательных реакций.
Взаимодействие с другими лекарственными средствами
Возможное влияние других лекарственных средств на действие улипристала
Гормональные контрацептивы
Улипристал имеет стероидную структуру и действует как селективный модулятор рецепторов прогестерона с преобладающим ингибирующим действием на данные рецепторы. Таким образом, гормональные контрацептивы и гестагены могут снижать эффективность улипристала путем конкурентного воздействия на рецептор прогестерона. Поэтому не рекомендуется одновременное применение препаратов, содержащих гестагены.
Ингибиторы изофермента CYP3A4
После применения ингибитора средней мощности изофермента CYP3A4 эритромицина пропионата (500 мг 2 раза в день в течение 9 дней) у здоровых женщин-добровольцев показатели Cmax и AUC улипристала повышались в 1,2 и 2,9 раза соответственно; величина AUC активного метаболита улипристала повышалась в 1,5 раза, в то время как Cmaxактивного метаболита снижалась (в 0,52 раза). На фоне применения кетоконазола (400 мг 1 р/сутки, 7 дней), мощного ингибитора CYP3A4, у здоровых женщин-добровольцев исследования отмечалось увеличение показателей Cmax и AUC улипристала в 2 и 5,9 раз соответственно. Отмечалось увеличение показателей AUC для активного метаболита улипристала в 2,4 раза при снижении его Cmax (изменение в 0,53 раза). Коррекции дозы при применении улипристала у пациенток, получающих слабые ингибиторы изофермента CYP3A4, не требуется. Совместное применение ингибиторов средней мощности или мощных ингибиторов изофермента CYP3A4 с улипристалом не рекомендуется.
Индукторы изофермента CYP3A4
На фоне применения мощного индуктора CYP3A4 рифампицина (300 мг 2 р/сутки, 9 дней) у здоровых женщин-добровольцев отмечалось выраженное снижение показателей Cmax и AUC улипристала и его активного метаболита более чем на 90%. Также отмечено снижение периода полувыведения улипристала в 2,2 раза, что соответствует уменьшению его экспозиции примерно в 10 раз. Сопутствующее применение улипристала и мощных индукторов CYP3A4 (например, рифампицина, рифабутина, карбамазепина, окскарбазепина, фенитоина, фосфенитоина, фенобарбитала, примидона, зверобоя продырявленного, эфавиренза, невирапина, ритонавира – на фоне долгосрочного применения) не рекомендуется.
Препараты, влияющие на рН желудочного сока
Применение улипристала (таблетка 10 мг) вместе с ингибитором протонной помпы эзомепразолом (20 мг 1 раз в день в течение 6 дней) приводит к снижению средней Cmax на 65%, удлинению tmax (от медианы 0,75 ч до 1,0 ч) и повышению средней AUC на 13%. Такое действие лекарственных препаратов, повышающих рН желудочного сока, не считается клинически значимым для ежедневного приёма таблеток улипристала.
Возможное влияние улипристала на действие других лекарственных препаратов
Гормональные контрацептивы
Улипристал может препятствовать действию гормональных контрацептивов (только гестагенсодержащих таблеток, гестаген-высвобождающих систем или комбинированных пероральных контрацептивов) и препаратов гестагена, применяемых по иным показаниям. Поэтому сопутствующее применение лекарственных препаратов, содержащих гестаген, не рекомендовано. Гестагенсодержащие препараты не следует применять в течение 12 дней после прекращения лечения улипристалом.
Субстраты Р-гликопротеина
Данные in vitro показывают, что в клинически значимых концентрациях улипристал в процессе всасывания в стенке желудочно-кишечного тракта может являться ингибитором Р-гликопротеина (P-gp). Одновременное применение улипристала и субстрата P-gp не исследовалось, поэтому нельзя исключить вероятность взаимодействий. Данные in vivo свидетельствуют о том, что приём улипристала (таблетка 10 мг) за 1,5 часа до приёма субстрата P-gp фексофенадина (60 мг) не оказывает клинически значимого воздействия на фармакокинетику фексофенадина. Таким образом, рекомендуется соблюдать интервал не менее 1,5 часов между приёмом улипристала и субстратов P-gp (например, дабигатрана этексилата, дигоксина, фексофенадина). Пациентка должна сообщить лечащему врачу о всех лекарственных препаратах, которые она принимает, даже если они отпускаются без рецепта.
Особые указания
Улипристал назначается только после тщательного обследования. До начала лечения следует исключить беременность. Если до начала нового курса терапии есть подозрение на беременность, необходимо выполнить соответствующий тест.
Контрацепция
В связи с возможностью нежелательных взаимодействий сопутствующее применение только гестагенсодержащих препаратов, гестаген-высвобождающих систем или комбинированных пероральных контрацептивов не рекомендуется. Хотя у большинства женщин, получавших терапевтические дозы улипристала, наблюдалась ановуляция, рекомендовано дополнительное использование негормонального метода контрацепции в ходе лечения.
Изменения эндометрия
Улипристал оказывает специфическое фармакодинамическое действие на эндометрий, приводящее к характерным для этого класса препаратов изменениям в эндометрии, PAEC.
Эти изменения исчезают после прекращения лечения и не должны быть ошибочно оценены как гиперплазия эндометрия (см. раздел «Фармакодинамика»). Кроме того, в период лечения может отмечаться обратимое утолщение эндометрия.
При проведении повторных курсов лечения рекомендуется периодический контроль состояния эндометрия, включая ежегодное ультразвуковое исследование, проводимое после возобновления менструальных кровотечений во время периодов прерывания терапии.
При стойком утолщении эндометрия после возобновления менструальных кровотечений во время периодов прерывания терапии или через 3 месяца после окончания курсов терапии и/или изменении характера кровотечений (см. раздел «Характер кровотечений») для исключения других заболеваний, например злокачественного новообразования, следует провести соответствующее обследование, включающее биопсию эндометрия.
При выявлении гиперплазии (без атипии) рекомендуется проведение контроля в соответствии со стандартной клинической практикой (например, контрольное наблюдение через 3 месяца). В случае атипичной гиперплазии обследование и ведение пациента следует проводить в соответствии с принципами стандартной клинической практики.
Продолжительность каждого курса лечения не должна превышать 3 месяцев, так как неизвестен риск нежелательного воздействия на эндометрий, в случае если терапия осуществляется без перерывов.
Характер кровотечений
Пациентки должны быть проинформированы о том, что лечение улипристалом обычно приводит к значительному уменьшению менструальной кровопотери или аменорее в течение первых 10 дней лечения. При сохраняющихся чрезмерных кровотечениях пациентке следует обратиться к врачу. Как правило, менструальный цикл возобновляется в течение 4 недель после окончания курса лечения.
Следует провести соответствующее обследование, включающее биопсию эндометрия, для исключения прочих заболеваний (например, злокачественного новообразования эндометрия), если после исходного снижения интенсивности кровотечений или наступления аменореи в ходе повторных курсов лечения выявляется стойкое изменение или непредвиденный характер кровотечений (например, межменструальныекровотечения).
Максимальная исследованная продолжительность применения препарата составляет 4 курса.
Почечная недостаточность
Нет оснований предполагать, что почечная недостаточность может значительно влиять на выведение улипристала. В связи с отсутствием специальных исследований применение препарата Эсмия® не рекомендуется у пациенток с почечной недостаточностью тяжёлой степени при невозможности тщательного контроля их состояния.
Печёночная недостаточность
Отсутствует опыт терапевтического применения улипристала у пациенток с печёночной недостаточностью. Ожидается, что печёночная недостаточность может влиять на выведение улипристала, что приведет к усилению действия препарата. Это несущественно для пациенток с печёночной недостаточностью лёгкой степени. Применение препарата Эсмия® у пациенток с печёночной недостаточностью средней тяжести и тяжёлой степени не рекомендуется при невозможности тщательного контроля их состояния.
Сопутствующая терапия
Не рекомендуется сопутствующее применение улипристала и ингибиторов CYP3A4 средней мощности (например, эритромицина, грейпфрутового сока, верапамила) или мощных ингибиторов (например, кетоконазола, ритонавира, нефазодона, итраконазола, телитромицина, кларитромицина).
Не рекомендуется совместное применение улипристала и мощных индукторов CYP3A4 (например, рифампицина, рифабутина, карбамазепина, окскарбазепина, фенитоина, фосфенитоина, фенобарбитала, примидона, зверобоя продырявленного, эфавиренза, невирапина, ритонавира – на фоне долгосрочного применения).
Фертильность
У большинства женщин, принимавших улипристал в терапевтических дозах, наблюдалась ановуляция. Однако фертильность при длительном применении улипристала не изучалась.
Влияние на способность к управлению транспортными средствами и механизмами
Улипристал может оказывать минимальное влияние на способность к управлению транспортными средствами и механизмами, так как после приёма улипристала может наблюдаться легкое головокружение.
Форма выпуска
Таблетки, 5 мг. По 14 таблеток в блистере из ПВХ/ПЭ/ПВДХ плёнки оранжевого цвета и алюминиевой фольги. По 2 или 6 блистеров в картонную пачку вместе с инструкцией по применению.
Условия хранения
В защищенном от света месте при температуре не выше 30 °С. Хранить в недоступном для детей месте!
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
Отпускают по рецепту.
Производитель
ОАО «Гедеон Рихтер»
1103 Будапешт, ул. Дёмрёи, 19-21, Венгрия
Претензии потребителей направлять по адресу:
Московское Представительство ОАО «Гедеон Рихтер» 119049 г. Москва, 4-й Добрынинский пер., дом 8.
Купить Эсмия в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)