Rec.INN
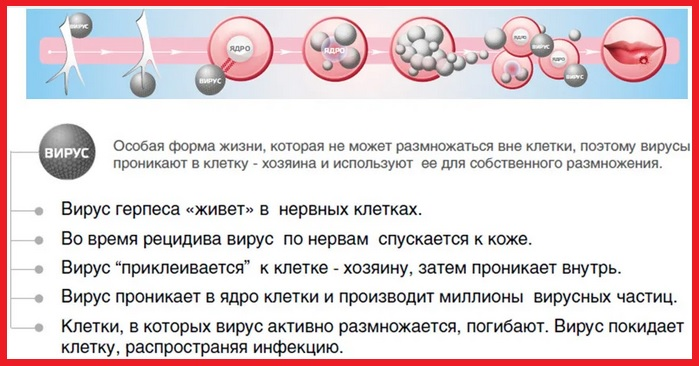
зарегистрированное ВОЗ
Лекарственное взаимодействие
Фармакологическое действие
Противовирусное средство для наружного применения. Оказывает вирусостатическое действие. Подавляет ДНК-полимеразу вирусов. Активен в отношении вирусов Herpes simplex типов 1 и 2, вирусов герпеса млекопитающих, онкогенных вирусов, вируса гриппа A, вируса гепатита B и некоторых ретровирусов.
Показания активного вещества
ФОСКАРНЕТ НАТРИЙ
Инфекционно-воспалительные заболевания кожи и слизистых оболочек, вызванные вирусами герпеса.
Режим дозирования
Наружно применяют 6 раз/сут.
Побочное действие
Редко: покраснение, зуд в месте аппликации.
Противопоказания к применению
Повышенная чувствительность к фоскарнету натрию.
Особые указания
Рекомендуется начинать терапию на стадии продромы (зуд), в этом случае развитие пузырьковой стадии заболевания может быть полностью предотвращено.
Фоскарнет
Foscarnet
Фармакологическое действие
Фоскарнет — противовирусный препарат, активен в отношении вирусов герпеса человека 1 и 2 типа, онкогенных вирусов, вируса гриппа A, вируса гепатита B и некоторых ретровирусов. Может быть использован для лечения пациентов с ВИЧ. Подавляет репликацию и полимеразные реакции вирусов, блокируя синтез вирусной ДНК в поражённых клетках кожи и слизистых оболочек.
Показания
Цитомегаловирусный ретинит, другие цитомегаловирусные инфекции при иммунодефиците (противопоказан при почечной недостаточности), простой герпес, ветряная оспа и опоясывающий лишай при иммунодефиците, устойчивые к ацикловиру.
Противопоказания
Гиперчувствительность.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — C.
Адекватных и строго контролируемых исследований по безопасности применения фоскарнета при беременности у человека не проведено.
Исследования на животных выявили признаки тератогенности (скелетные аномалии).
В случае наступления беременности, отсутствия менструации или при подозрении на возможную беременность пациентка должна сообщить об этом своему лечащему врачу. Если у партнёрши пациента, принимающего фоскарнет, наступает беременность, врачу необходимо сообщить о возможных неблагоприятных эффектах для плода.
Если фоскарнет применяется в период беременности или беременность наступила во время лечения, пациентка должна быть предупреждена о потенциальной опасности для плода.
Применение фоскарнета у беременных женщин противопоказано, за исключением случаев отсутствия альтернатив, когда ожидаемая польза для матери превышает потенциальный риск для плода.
Применение в период грудного вскармливания
Специальных исследований по безопасности применения фоскарнета в период грудного вскармливания не проведено.
Неизвестно, выделяется ли фоскарнет в грудное человеческое молоко. В экспериментальных исследованиях показано, что фоскарнет выделяется с грудным молоком у лактирующих крыс.
Применение фоскарнета в период лактации противопоказано.
Планирование беременности
Пациентам во время лечения и как минимум в течение 6 месяцев после следует использовать надёжные методы контрацепции.
Способ применения и дозы
Дети и взрослые, внутривенная инфузия: начальная доза 60 мг/кг 3 раза в сутки в течение 14–21 суток, поддерживающая доза 90–120 мг/кг 1 раз в сутки.
Классификация
-
АТХ
J05AD01
-
Фармакологическая группа
-
Коды МКБ 10
-
Категория при беременности по FDA
C
(риск не исключается)
Информация о действующем веществе Фоскарнет предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Фоскарнет, содержатся в инструкции производителя, прилагаемой к упаковке.
В переводе с греческого термин «герпес» означает «красться». Именно в 100-м году до нашей эры легендарным Геродотом было названо вирусное заболевание, характеризующееся возникновением на кожных и слизистых покровах мелких пузырьков, заполненных прозрачной жидкостью. На сегодняшний день науке известно 8 типов вируса герпеса, способных поражать человека.
Герпес, или герпетическая инфекция, – это группа заболеваний вирусной природы, способных поражать практически все системы и органы человеческого организма. Возбудителем инфекционных болезней является ВПГ (вирус простого герпеса) из семейства Herpes viridae. По своей генной структуре семейство подразделяется на серотипы, ответственные за возникновение различных форм заболевания.
Первые три серотипа вируса герпеса настолько широко распространены в природе, что их можно рассматривать как мировую пандемию (по статистическим данным, герпесом инфицировано порядка 90–99 % взрослого населения планеты). В то же время симптомы заболевания обнаруживаются только у пятой части инфицированных. Необходимо отметить, что заражение одним типом ВПГ не исключает заражения другим и даже несколькими серотипами герпесвируса.
Вирус простого герпеса весьма контагиозен, то есть он способен легко передаваться при тесном контакте от больного человека здоровому.
К путям передачи инфекции относят:
- воздушно-капельный;
- половой;
- контактный, или транскутанный (через кожу);
- трансплацентарный;
- интранатальный (во время родов, через зараженные околоплодные воды).
Несмотря на то, что существует множество факторов риска и путей передачи инфекции, причина герпеса всего одна – проникновение вируса в организм человека.
Клинические проявления инфекции
Вирус герпеса быстро проникает внутрь клеток и встраивается в их генетический аппарат, таким образом защищая себя от воздействия иммунной системы. Затем возбудитель начинает активно размножаться, используя имеющиеся ресурсы здоровой клетки. Через кровь и лимфу вирус герпеса разносится по всем системам организма, «оседая» преимущественно в окончаниях нервных волокон. Он может годами «дремать» в клетках нервной системы, заявляя о себе лишь при неблагоприятных для человеческого организма факторах (переохлаждении, стрессах, снижении иммунитета, обострении хронических патологий и проч.).
Длительность инкубационного периода простого герпеса в среднем составляет 6 суток.
- На самой ранней (продромальной) стадии, длящейся 24 часа, в месте последующих высыпаний возникает чувство жжения, покалывания и зуда. Именно в этот период, во избежание дальнейшего развития заболевания, необходимо начинать лечение герпеса.
- Впоследствии, при классическом течении герпетической инфекции, наступает стадия воспаления. На кожных и слизистых покровах появляются маленькие болезненные пузырьки (1 или несколько), заполненные прозрачным содержимым, которое впоследствии мутнеет. Помимо возникновения характерных симптомов герпеса возможно ухудшение самочувствия, озноб, повышение температуры тела.
- На стадии изъязвления пузырьки вскрываются (истекающая из них жидкость содержит миллиарды вирусных частиц). Именно в этот период человек наиболее заразен.
- На стадии образования струпа место изъязвления подсыхает и покрывается корочкой.
В зависимости от серотипа вируса, высыпания могут локализоваться на различных участках кожного покрова, в области глаз, на красной кайме губ, а также достаточно часто можно обнаружить простой герпес на органах мочеполовой системы.
При развитии герпетической инфекции, вызванной ВПГ III типа, высыпания, носящие обширный характер, распространяются от средней линии спины по ходу чувствительных нервов, как правило, с одной стороны туловища. Такое состояние сопровождается высокой температурой и сильными болями. При отсутствии адекватного лечения герпеса Зостера возможно разрушение нервной оболочки и развитие хронической невралгии, нередко приводящей к инвалидности.
Вирус герпеса может спровоцировать воспаление слизистой оболочки глотки, глаз (вызывая стойкое помутнение роговицы), поражение мозгового вещества и оболочек головного мозга. Также известны случаи инфицирования других систем и органов организма.
У ВИЧ инфицированных пациентов герпесвирусная инфекция характеризуется злокачественным течением, сопровождающимся частыми рецидивами и некрозом отдельных участков кожных покровов.
Заражение вирусом простого герпеса во время беременности чревато внутриутробным инфицированием плода, выкидышами и врожденными уродствами.
Методы лечения герпеса
К сожалению, панацеи и от вируса простого герпеса нет. Поэтому лечение и контроль распространения инфекции по организму является достаточно сложной, но, тем не менее, решаемой задачей. Терапия герпесвирусной инфекции проводится в комплексе, включающем в себя использование противовирусных препаратов, иммуностимуляторов, общеукрепляющих средств, а также лечебного оптического излучения.
Медикаментозные препараты, применяющиеся при лечении герпеса, подразделяются на 3 основные группы:
- средства паллиативного действия, предназначенные для ослабления симптомов заболевания (зуда, жжения и болей);
- препараты, замедляющие распространение инфекции и/или ускоряющее лечение;
- средства, препятствующие образованию герпетических язв.
Антивирусные препараты
- В 1974 году было синтезировано противовирусное средство Ацикловир. Являясь искусственным аналогом нуклеозида и обладая подавляющим действием против ВПГ I, II и III типов, Ацикловир обрывает внутриклеточный синтез ДНК, тем самым останавливая размножение возбудителя. Препарат, обладающий высокой избирательностью в отношении клеток, инфицированных вирусом простого герпеса, не воздействует на здоровые клетки организма, хорошо переносится и обладает низкой токсичностью. Аналогами Ацикловира являются Валацикловир, Фамцикловир, Ганцикловир и Валганцикловир. Препараты Ацикловира предназначены для местного и системного применения.
- Фоскарнет является альтернативой Ацикловиру. Он гораздо быстрее связывается с ферментной системой вируса простого герпеса и избирательно накапливается в зараженных клетках. Помимо воздействия на ВПГ I-III типов, он способен бороться с другими серотипами, то есть оказывается эффективен там, где Ацикловир «пасует». На основе Фоскарнета выпускаются препараты местного действия, таблетки и инъекционные растворы.
Обезболивающие средства
При лечении простого герпеса для снятия боли, зуда и жжения рекомендуется применять наружные анестезирующие средства, в состав которых входят такие активные компоненты, как лидокаин, тетракаин, камфора, бензиловый спирт, бензокаин и проч. Также, при необходимости могут быть использованы обезболивающие и жаропонижающие нестероидные противовоспалительные препараты системного действия.
Вспомогательные средства, замедляющие образование герпетических язв и ускоряющие их рубцевание
В данную группу входят мази, спреи и кремы, содержащие в своем составе цинк, фенол, лизин, дубильную кислоту и пр. (Пантенол-спрей, Депантенол и их аналоги). Они усиливают эпителизацию кожных покровов и ускоряют заживление ран.
Смягчающие и увлажняющие препараты
Мази и крема, улучшающие гидратацию. В их состав входят липофильные и гидрофильные компоненты, предотвращающие пересыхание и стягивание кожи и снижающие ее чувствительность к раздражающим агентам. Чаще всего при лечении вируса герпеса используется вазелиновое масло и наружные средства, в состав которых входит белый жидкий парафин.
Антисептические препараты
Их рекомендуется использовать при обширных поражениях кожи, во избежание присоединения вторичной бактериальной инфекции. Герпетические высыпания разрешается обрабатывать цинковой мазью, Хлоргексидином, Стрептоцидом, Мирамистином.
Препараты интерферонов и иммуноглобулинов
Иммунотерапия не может полностью заменить противовирусные средства, но, в то же время, одновременное использование иммунных препаратов значительно повышает эффективность лечения герпеса, сокращает длительность применения медикаментов, а также предотвращает развитие резистентности к Ацикловиру и его аналогам.
При лечении вируса простого герпеса используются препараты α-интерферонов. Воздействуя на внутриклеточный вирус, они оказывают этиотропный и патогенетический эффект, а также выступают в качестве базисной терапии изолированного дефицита Т-лимфоцитов, являющихся естественными киллерами.
Препараты иммуноглобулинов, в отличие от интерферонов, действуют на вирионы (внеклеточные вирусы). Также, как и интерфероны, они оказывают патогенетический и этиотропный эффект и являются средством базисной терапии при первичных иммунодефицитах, активизирующих герпесвирусную инфекцию.
Лазерная терапия
Лечение герпеса диодным лазером (длина волны 810 нм) – это наиболее прогрессивная и безопасная методика, разрешенная к использованию практически на всех этапах развития воспаления. На ранней стадии лазерное излучение инактивирует вирус герпеса и устраняет боль. В стадии высыпания данная методика приостанавливает дальнейшее распространение инфекции и ускоряет формирование корочки. На стадии изъязвления лазерный луч способствует устранению боли и воспаления и снижает риск заражения лиц, находящихся в окружении больного, а на этапе образования корочки оказывает биостимулирующий и стерилизационный эффект. Для достижения максимального терапевтического эффекта лазерное лечение герпетических высыпаний должно проводиться в комплексе с другими терапевтическими методиками.
Этапы лечения
- В стадии обострения терапевтическая тактика направлена на купирование местного воспалительного процесса. В данной ситуации для быстрого лечения герпеса назначаются противовирусные средства местного и системного применения, а также препараты и индукторы интерферона. При выраженных симптомах герпеса рекомендуется прием ингибиторов синтеза простагландинов (периферических медиаторов боли). В среднем лечение длится 1-2 недели.
- В стадии ремиссии проводится иммуномодулирующая и иммуностимулирующая терапии. Параллельно короткими курсами назначается прием адаптогенов растительного происхождения (женьшеня, препаратов кошачьего когтя, радиолу розовую, элеутерококка, астрагала и проч.) Длительность лечения – 2-3 недели. Также, при необходимости, проводится санация вторичной бактериальной инфекции.
- Для профилактики рецидивов герпетической инфекции специалисты рекомендуют спустя 2-3 месяца после обострения сделать прививку от простого герпеса. На сегодняшний день чаще всего используется вакцина «Витагерпавак». Данный иммунобиологический препарат, в состав которого входят инактивированные вирусные антигены, эффективен в отношении ВПГ I и II типов. Он стимулирует клеточный иммунитет и снижает степень иммунных расстройств. Вакцинация должна проводиться в лечебном учреждении под контролем специалиста.
- Пациентам, у которых наблюдаются частые обострения герпесвирусной инфекции (более 4 раз в год) рекомендуется диспансерное наблюдение. Каждые 2–6 месяцев должны проводиться плановый осмотр и лабораторно-диагностические исследования, позволяющие определить вероятность возникновения рецидива. При наличии повышенного риска назначается курс профилактического лечения простого герпеса, направленный на укрепление иммунитета.
Дополнительная информация
Лечение герпетической инфекции – достаточно сложный и длительный процесс, который может растянуться на несколько месяцев и даже лет. Облегчить его поможет достижение комплаенса, то есть, соблюдение больным режима назначенной терапии и формирование партнерских отношений между врачом и пациентом. Также при затяжном рецидивирующем течении герпетической инфекции не лишней будет помощь квалифицированного психотерапевта.
Герпесвирусная инфекция (ГИ) является одним из наиболее распространенных и социально-значимых инфекционных заболеваний человека. По прогнозам всемирного банка информации герпесвирусная инфекция на ближайшее будущее определяется как… «глобальная проблема человечества», которая требует всестороннего изучения заболевания и поиска наиболее эффективных средств борьбы с ним.
Несмотря на достигнутый в последние десятилетия прогресс в лечении ГИ, проблема лечения ГИ и по сегодняшний день не утратила своей актуальности. Это в значительной степени связано как с высокой частотой данной патологии и ее глобальным распространением, так и особенностями течения.
Следует напомнить, что ГИ – это хроническое заболевание, которое имеет циклическое течение, когда периоды обострения чередуются с периодами ремиссии.
Среди основных причин появления рецидивов доминирует ослабление иммунитета, возникающее на фоне провоцирующих факторов, индивидуальных для каждого.
К факторам, способствующим снижению иммунитета и манифестации ГИ, относятся: переохлаждение, перегревание, гиперинсоляция, нервно-эмоциональный стресс (связанный с изменением условий жизни в сторону многозадачности, повышения эмоциональных и умственных нагрузок), медицинские и косметологические манипуляции, фоновые и сопутствующие соматические, психосоматические, эндокринные, онкологические, инфекционные заболевания, нерациональное питание, употребление иммунодепрессантов и ряда других лекарственных препаратов. Поэтому в лечении и профилактике рецидивов данного заболевания особое внимание следует уделять состоянию иммунитета, а также предотвращению действия факторов, способствующих его снижению.
ГИ относится к заболеваниям с пожизненной персистенцией возбудителя в организме. Это означает, что после первичного инфицирования полной элиминации (удаления) вируса из организма не происходит. Поэтому в процессе лечения можно лишь предотвратить рецидивы заболевания или сделать их менее частыми, менее выраженными, менее продолжительными, а так же предотвратить развитие возможных осложнений.
Возбудителем ГИ является вирус простого герпеса, одним из основных характеристик которого является пантропность — способность поражать различные органы и ткани организма и приводить к различным клиническим проявлениям: от ограниченных, локализованных поражений слизистых оболочек и кожи до генерализованных форм с поражением различных систем организма. В настоящее время отмечается рост числа атипичных форм заболевания, форм — с полиорганными дисфункциями, протекающих на фоне сниженной иммунореактивности организма и/или на фоне инфицирования несколькими типами вируса простого герпеса и/или инфицирования резистентными штаммами вируса, лечение которых вызывает большие трудности у специалистов.
Для лечения и профилактики рецидивов ГИ используют лекарственные средства с различным механизмом действия и профилем активности, воздействующие как на возбудитель болезни (этиотропная терапия), так и на макроорганизм (патогенетическая, иммунокорригирующая и симптоматическая терапия).
Следует, однако, оговориться, что все существующие препараты от герпеса не способны элиминировать вирус из организма человека и привести к полному излечению. Это обусловлено, в первую очередь, генотипическими особенностями вируса простого герпеса (ВПГ), в частности, молекулярной и иммунной мимикрией, и формированием резистентности.
Поэтому лечение ГИ направлено на предотвращение или восстановление тех нарушений, которые вызывает вирус в организме.
Тактика терапии направлена на подавление репродукции ВПГ в период обострения (купирование рецидива), а также на формирование адекватного иммунного ответа, его коррекцию и длительное сохранение с целью блокирования реактивации ВПГ в очагах персистенции.
Основными задачами терапии при обострении (рецидиве) являются: купирование клинических симптомов заболевания, устранение субъективных ощущений, сокращение продолжительности рецидива и экскреции вируса, предупреждение его передачи окружающим, предупреждение развития возможных осложнений и профилактика последующих рецидивов.
Существуют два основных направления в лечении ГИ
1
Этиопатогенетическая
противовирусная терапия
2
Комплексная терапия
Метод лечения, включающий противовирусную
терапию в сочетании с иммунотерапией
(специфической и неспецифической)
Выбор направления лечения, его длительность и интенсивность, также как и выбор эффективного лекарства от герпеса, зависит от конкретной клинической ситуации и определяются формой и фазой заболевания, тяжестью его течения, состоянием иммунитета у больного, наличием у него осложнений и сопутствующей патологии, а также возрастом.
Препараты от герпеса можно разделить на несколько групп: этиотропные препараты, средства иммунозаместительной и интерферонзаместительной терапии (иммуноглобулины, интерфероны и индукторы интерферонов, иммунотропные препараты), а также средства специфической иммунотерапии (вакцины).
Все препараты от герпеса направлены на решение определенных задач, среди которых можно отметить:
- уменьшение времени везикуляции;
- уменьшение времени эпителизации;
- уменьшение площади поражения;
- уменьшение общеинтоксикационного синдрома и субъективных ощущений;
- уменьшение экскреции вируса;
- уменьшение частоты осложнений;
- увеличение продолжительности ремиссии в 1,5-2 раза и более;
- уменьшение риска передачи вируса окружающим (детям, партнеру, коллегам и др.);
- уменьшение риска возникновения рецидива.
Самостоятельно выбирать препараты
для лечения герпеса не следует,
так как это может лишь усугубить течение заболевания.
Этиопатогенетическая противовирусная терапия
Этиотропные препараты — это препараты, обладающие прямым противовирусным действием и избирательно нарушающие процесс взаимодействия ВПГ и клетки, а также различные фазы репродукции вируса (в том числе, синтез вирусной ДНК и сборку вирусных частиц).
Среди этиотропных средств ведущее место занимают противовирусные химиопрепараты. Противовирусные препараты для лечения герпеса представлены большой группой ациклических аналогов нуклеозидов (ацикловир (Ацикловир, Зовиракс, Виролекс) и его производные (препараты второго поколения) – валацикловир (Валтрекс), пенцикловир (Вектавир) и фамцикловир (Фамвир)).
Ацикловир (АЦВ) – эффективный препарат против герпеса, «золотой стандарт» противогерпетической химиотерапии.
Преимуществами ацикловира являются его высокая избирательность и низкая токсичность, а недостатками — воздействие только на реплицирующийся вирус и возможность формирования резистентности к препарату, низкая биодоступность.
Необходимо отметить, что при пероральном приеме всасывается лишь около 15% действующего вещества, а период полувыведения из плазмы крови составляет 2,0–2,5 часа. Это создает необходимость частого приема препарата (5 раз в сутки по 200 мг), что существенно снижает приверженность больных к терапии. Риск возникновения устойчивости к ацикловиру прямо пропорционален длительности приема препарата и часто отмечается у иммунодефицитных больных.
Ацикловир — первый синтетический аналог дезоксигуанозина, является родоначальником этиотропных противогерпетических препаратов – блокаторов синтеза вирусной ДНК. По химической структуре ацикловир является ациклическим аналогом дезоксигуанозина, естественного компонента ДНК. В результате такой модификации вирусный фермент ДНК-полимераза воспринимает молекулу препарата в качестве субстрата для синтеза вирусной ДНК. В результате ошибки вирусной ДНК-полимеразы препарат, пройдя три этапа фосфорилирования для приобретения биологической активности, встраивается в полинуклеотидную цепь ДНК вируса и прерывает дальнейший синтез молекулы, блокируя тем самым репродукцию вируса. Необходимо отметить, что этот процесс происходит только в инфицированных клетках, что обеспечивает высокую степень избирательности действия ацикловира и низкую токсичность препарата.
Валацикловир (Валтрекс), пенцикловир (Вектавир) и фамцикловир (Фамвир) – это противовирусные препараты от герпеса нового поколения.
На основе ацикловира был разработан более эффективный препарат против герпеса валацикловир (L-валиновый эфир ацикловира). Это так называемое пролекарство, которое превращается в действующее вещество ацикловир под влиянием кишечного и печеночного фермента валацикловир-гидроксилазы. За счет модификации молекулы достигается повышение биодоступности препарата, которая выше, чем у ацикловира в 3–5 раз и составляет 54–70%. Поэтому валацикловир (таблетки) можно применять реже до двух раз в день per os 5 дней, а при супрессивной терапии — 1 раз в день, что делает терапию для больного более удобной.
Фамцикловир по химической природе является диацетатом пенцикловира.
Хорошо всасывается в тонкой кишке и уже в кишечной стенке быстро превращается в активное соединение — пенцикловир (биодоступность составляет около 77%, период полужизни в крови такой же, как и у ацикловира – 2,0-2,5 ч).
Механизм действия фамцикловира аналогичен ацикловиру и состоит в фосфорилировании до пенцикловир-трифосфата с участием вирусной тимидинкиназы и клеточных ферментов, встраивании в полинуклеотидную цепочку ДНК вируса и блокаде дальнейшего удлинения молекулы.
Отличием Фамцикловира является: более выраженная избирательность действия по отношению к зараженным клеткам (тропность тимидинкиназы ВПГ к пенцикловиру в 100 раз выше, чем к ацикловиру) и более длительный период внутриклеточной полужизни (7–20 ч по сравнению с 0,7–1 ч у ацикловира), поэтому эффективность терапии менее зависима от концентрации препарата в сыворотке крови. Фамцикловир — препарат против герпеса в таблетках используется в дозе 3 раза в сутки per os 7 дней. Недостатком фамцикловира является высокая стоимость.
Таким образом, все аналоги нуклеозидов имеют сравнимый механизм действия и клиническую эффективность, ингибируют синтез ДНК только у активных вирусов герпеса, но не влияют на вирусы, находящиеся в латентном состоянии; обладают очень низкой токсичностью, так как не действуют на ДНК-полимеразу клеток человека, высокой избирательностью, так как неактивны в здоровых клетках.
Ацикловир, а также все аналоги нуклеозидов, препараты против герпеса нового поколения (Валацикловир, Фамцикловир) — эффективны при всех формах инфекций, вызванных вирусами простого герпеса 1-го и 2-го типа (оролабиальный, орофациальный, назальный герпес, стоматит, кожный диссеминированный герпес, генитальный герпес, офтальмогерпес и др.).
Ацикловир и препараты против герпеса нового поколения назначают при необходимости быстрого ограничения развития инфекционного процесса – на этапе симптом-предвестник при первичной инфекции и в период обострения ГИ, т.к. они вмешиваются в процессы репродукции вируса, тем самым, замедляя или вовсе прекращая копирование вируса внутри пораженной клетки.
Следует отметить, что во время беременности с целью лечения и профилактики рецидивирования (герпеса на губах, генитального герпеса) и антенатального инфицирования препараты от герпеса в таблетках (Ацикловир, таблетки) назначают, начиная со II триместра гестационного периода.
Препараты для лечения герпеса применяют 2 способами
Эпизодическое назначение препаратов против герпеса предполагает их применение коротким курсом (5-10 дней) в терапевтических дозах при соблюдении кратности и длительности лечения при первичном герпесе и при рецидивах герпеса.
Супрессивная или превентивная терапия – это ежедневный, постоянный прием препарата в более низких дозах вне рецидива в течение нескольких месяцев или лет. Супрессивная терапия позволяет не столько купировать рецидив, сколько предотвратить развитие последующих рецидивов и показана при частых рецидивах локализованного кожно-слизистого герпеса (≥6 раз в течение 1 года), диссеминированном кожном герпесе, при менструальном генитальном герпесе, при редких, но тяжелых рецидивах и др.
Необходимо отметить, что препараты от герпеса производят в форме таблеток для приема внутрь, в виде растворов для парентерального введения, а также форм для локальной обработки пораженной поверхности.
Ацикловир (мазь, крем), Пенцикловир (1% крем Фенистил® Пенцивир)- эффективные средства для наружного применения.
Основное условие эффективного применения – своевременность. Препараты герпеса мазь, крем наносят с помощью ватной палочки непосредственно на пораженные участки кожи ежедневно в период бодрствования 5 раз в сутки в течение 5 дней или до полного исчезновения симптомов заболевания. Лечение начинают при первых признаках заболевания -в период предвестников рецидива или в первые 2-3 суток рецидива.
В данной ситуации местные препараты для лечения герпеса способны привести к значительному сокращению сроков появления и регресса высыпаний (пузырьков) за счет высокой биодоступности активных веществ в локализованном патологическом очаге и их действия — ингибиции цитопатического действия вируса на эпителиальные клетки, в которых и происходит полный цикл репродукции ВПГ и выход полноценных вирионов. Изучение механизмов персистенции и репродукции вируса показало, что ВПГ в период ремиссии находится в местах традиционных клинических проявлений («Locus minoris») в виде провируса интегрированного в геном клетки, в период рецидива – в период формирования пузырьков он активно репродуцируется в эпителиальных клетках и оказывает на них выраженное цитопатическое действие.
Препараты герпеса мазь, крем для наружного применения в большинстве случаев используются больными с ГИ в условиях амбулаторного лечения, т.е. в домашних условиях. Препараты для наружного применения показаны в качестве монотерапии ГИ легкой и средней степени тяжести, при эпизодическом лечении, во время беременности. Следует отметить, что лечение ГИ во время беременности представляет значительные сложности, что связано с потенциальной тератогенностью системного применения противовирусных препаратов для лечения герпеса.
Ацикловир (мазь, крем) – эффективное лекарство от герпеса во время беременности.
1% крем Фенистил® Пенцивир — новый препарат против герпеса показан только для лечения рецидивирующего лабиального герпеса у больных старше 12 лет.
Эффективность препарата связана с быстрой динамикой регресса основных симптомов рецидива. Это связано с большей скоростью и степенью фосфорилирования пенцивира в зараженных ВПГ клетках, чем у ацикловира, значительно более длительным периодом полувыведения, а также его способностью к более легкой диффузии сквозь роговой слой в связи с особенностью химического строения, приводящей к достижению более высоких концентраций в глубоких слоях эпидермиса.
Фенистил® Пенцивир на 20–30% эффективнее крема на основе ацикловира при купировании острых проявлений простого герпеса легкой (1–2 рецидива в год) и средней степени (3–4 обострения в год) тяжести.
Следует отметить, что максимально легкое проникновение пенцикловира в кожу сквозь ороговевшие клетки и корочки обеспечивают входящие в его состав пропиленгликоль и цетомакрогол. Таким образом, 1% крем Фенистил® Пенцивир — эффективное лекарство от герпеса на губах.
Препараты против герпеса в таблетках (Ацикловир, Валтрекс, Фамвир) можно применять в комплексе с противовирусными препаратами для местного лечения. Комбинированная терапия рецидивов ГИ приводит к более высоким результатам, позволяя полностью купировать клиническую симптоматику обострения на стадии предвестников или эритемы у подавляющего числа пациентов.
Общим недостатком ациклических нуклеозидов является их неспособность эрадикации инфекции, неспособность полностью прекратить выделение вируса (даже на фоне супрессивной терапии), предотвратить возникновение рецидива заболевания (отсутствие эффекта последействия), инфицирование родственным или новым типом герпесвируса, неспособность влиять на естественное течение инфекции и корригировать показатели иммунитета, неспособность предотвратить формирование резистентности к препарату. Различают моно- и мультивалентную резистентность, причиной которой могут быть частое и длительное, нерациональное супрессивное применение препаратов против вируса герпеса (более 4 мес.), наличие иммунодефицита, заражение резистентным штаммом вируса.
По данным исследований, проведенных в Англии и США у иммунокомпетентных пациентов (с рецидивирующим генитальным герпесом, кератитом, генерализованной формой герпесвирусной инфекции), получавших АЦВ эпизодически, уровень резистентности изолятов ВПГ к АЦВ составляет 0,1 – 6,4%. У иммунокомпетентных лиц, получавших АЦВ повторно или в режиме длительной профилактической или иммуносупрессивной терапии, уровень резистентности выше и составляет 6,0% -17,0%, у лиц с умеренной степенью иммунодефицита — 3,5% — 10%, у ВИЧ-инфицированных пациентов — 3,5% — 17,0%; у реципиентов органов и тканей – 2,5% — 10,0%, у реципиентов гемопоэтических стволовых клеток – 4,1% — 36,0%.
Риск возникновения устойчивости к препаратам обосновывает необходимость применения этиотропных препаратов с иным механизмом действия, таких как фоскарнет – аналог пирофосфатов; инозин пранобекс, либо раннего подключения иммунотерапии, способной сократить требуемый период использования противовирусного средства.
Фоскарнет (фоскарнет натрий) является ингибитором вирусной ДНК- полимеразы и в меньшей степени — РНК- полимеразы. При этом препарат связывается с пирофосфатом и частично ингибирует нуклеозидтрифосфат, что опосредует терапевтический эффект. Фоскарнет – эффективное лекарство от герпеса при тяжелых органных поражениях, вызванных ВПГ-инфекции, а также при лечении герпеса, обусловленного штаммами вируса, резистентного к Ацикловиру. Относительно высокая токсичность ограничивает широкое применение этого препарата (фоскарнет – лекарство от герпеса второго ряда).
Цидофовир и бривудин — новые препараты против герпеса, относящиеся к группе противогерпетических химиопрепаратов. Эти лекарственные средства обладают более высокой эффективностью, чем ацикловир, однако хуже переносятся, что ограничивает их широкое клиническое применение. Их используют при тяжелых, угрожающих жизни формах герпесвирусных инфекций при условии известной или ожидаемой резистентности к ацикловиру.
Виру-Мерц серол (гель) — препарат нового поколения, главным действующим веществом которого является тромантадина гидрохлорид. Виру-Мерц серол — лекарство от герпеса для наружного применения с противовирусным эффектом в отношении вирусов герпеса 1 и 2 типов. Активное вещество, входящее в состав препарата, блокирует прикрепление вируса к клетке и проникновение внутрь. Преимуществом геля является тот факт, что вирусы не развивают устойчивости к активным действующим компонентам.
Среди других противовирусных препаратов следует упомянуть инозин пранобекс (таблетки), который можно применять per os в дозе 50 мг/кг на протяжении ≥21 дня; алпизарин (таблетки, мазь) — ингибитор растительного происхождения на основе мангиферина вещества ксантоновой природы, получаемого из листьев манго; аллоферон (аллокин-альфа — лиофилизат для приготовления раствора для п/к введения, алломедин гель) – синтетический аналог цитокинподобного пептида аллокина, полученного из насекомых, однако их эффективность намного ниже, чем у ациклических аналогов гуанозина и фоскарнета.
Как лечить герпес, используя медикаментозные препараты противовирусной направленности?
Прежде всего, следует обратить внимание на то, что использование противовирусных препаратов для лечения герпеса должно проводиться только после консультации с врачом и под его наблюдением. Лекарство от герпеса должен выбрать врач в зависимости от конкретной клинической ситуации у больного. Самостоятельное назначение и применение лекарств может негативным образом сказаться на самочувствии больного.
В настоящее время все больше врачей признают ограниченность использования при лечении пациентов с ГИ только противовирусной монотерапии и предлагают включать в схемы их терапии иммунотропные препараты. Это объясняется тем, что при ГИ, как и при других хронических заболеваниях с длительной персистенцией вируса, развиваются иммунодефицитные состояния (вторичные иммунодефициты). У пациентов с различными формами ГИ отмечается снижение общего количества Т- и В-клеток, изменение их функциональной активности, нарушение в макрофагальном звене иммунитета, в системе интерферона (нарушение продукции ИФН-α и ИФН-γ). При наличии вторичных дефектов в системе ИФН у лиц, страдающих рецидивирующей ГИ, частота рецидивов может достигать 16–24 эпизодов в год. В ряде случаев имеют место комбинированные нарушения иммунной системы и ИФН-статуса в тех или иных сочетаниях (например, значительное нарушение индуцированной продукции ИФН-α и/или ИФН-γ, нарушение Т-клеточного звена иммунной системы (дефицит CD3+ и/или CD3+ CD4+, и/или CD3+ CD8+, и/или CD3+ CD56+, повышение количества CD4+CD25+ лимфоцитов) и/или дефицит ЕКК, и/или гуморального звена (дефицит IgG и/или IgM), которые сохраняются как в фазе рецидива, так и в фазе ремиссии. Необходимо отметить, что у больных с системным иммунодефицитом наблюдается снижение местной резистентности кожи и слизистых оболочек в обычных местах высыпания вируса герпеса. Местный иммунодефицит создает предпосылки для незавершенного фагоцитоза вируса и уменьшения продукции ИФН-α — естественного противовирусного вещества, активно участвующего в ингибиции вируса простого герпеса.
Для повышения эффективности терапии ГИ, противовирусные препараты для лечения герпеса необходимо дополнять препаратами, способствующими коррекции нарушений неспецифического и специфического звеньев иммунитета на системном уровне, а также их лекарственными формами для местного применения, способствующими коррекции местного иммунитета. Следует отметить, что иммунотерапия не может полностью заменить противовирусную химиотерапию, однако добавление иммунотерапевтических препаратов позволяет сократить курс терапии, снизить токсическое действие на организм химиопрепаратов и предотвратить формирование резистентности к ним (особенно к Ацикловиру). Иммунотерапия особенно показана больным с часто рецидивирующими, трудно поддающимися лечению формами герпесвирусной инфекции разной локализации.
Основой неспецифической иммунотерапии герпесвирусных инфекций являются иммуноглобулины, препараты интерферонов и их индукторы, препараты, стимулирующие Т- и В-звенья клеточного иммунитета и фагоцитоз.
Иммуноглобулины — группа иммунобиологических препаратов крови, представляющих собой иммунологически активную белковую фракцию плазмы крови здоровых доноров, несущую антительную активность различной специфичности; содержат иммуноглобулины класса G – антитела против различных возбудителей инфекций; обладают иммунозаместительной, иммуномодулирующей, противовирусной активностью. В отличие от интерферонов, препараты иммуноглобулинов действуют преимущественно на внеклеточный вирус. В терапии ГИ могут применяться специфические гамма- и иммуноглобулины: препараты человеческого нормального иммуноглобулина для внутримышечного введения, высокотитражные сывороточные иммуноглобулины, иммуноглобулины для внутривенного введения (интраглобин, пентаглобин), свечевые и пероральные формы иммуноглобулинов (КИП — комплексный иммунный препарат).
Препараты иммуноглобулинов применяют для лечения: тяжёлым форм ГИ с атипичным или молниеносным течением; форм ГИ, когда риски, связанные с приёмом противовирусного препарата для лечения герпеса — Ацикловир, выше, нежели тяжесть имеющейся патологии; форм ГИ, обусловленных АЦВ-резистентными штаммами вируса; при беременности в 1-2 триместрах, когда противопоказаны синтетические противовирусные препараты для системного применения из-за потенциального эмбриотоксического и тератогенного влияния; активных форм ГИ у новорожденных и детей раннего возраста; для профилактики манифестации ГИ у больных в трансплантологии и у больных с иммунодефицитными состояниями.
Препараты иммуноглобулинов применяют как в моноварианте, так и в комбинированной терапии с препаратами из группы ациклических нуклеозидов (например, Ацикловир, Валтрекс) при необходимости быстрого ограничения развития инфекционного процесса. В литературе представлены данные об эффективности тройной терапии рецидива ГИ с поражением органов (ацикловир + ИФН-альфа + иммуноглобулин).
Побочные эффекты при использовании иммуноглобулинов наблюдаются крайне редко. Устранить их можно путем замедления скорости инфузии препарата. Случаи передачи инфекций через препараты иммуноглобулинов не регистрируются с 1986 г., когда были внедрены новые технологии получения и очистки действующего вещества.
В клинической практике для терапии ГИ широкое применение получили интерфероны (ИФН) и индукторы эндогенного интерферона, действие которых направлено на активацию естественного иммунитета, системы цитокинов, фагоцитоза. Применение ИФН и его индукторов показано как при сдвигах в системе иммунитета в целом, так и при нарушениях механизмов местного иммунитета.
Интерфероны — естественные факторы неспецифической защиты и медиаторы иммунитета, индуцируют в клетках состояние резистентности к вирусам и модулируют ответную реакцию иммунной системы, направленную на ингибицию репродукции вирусов внутри клеток или уничтожение инфицированных клеток. ИФН, кроме выраженного противовирусного и иммуномодулирующего действия, обладают противоопухолевым и антипролиферативным эффектами. ИФН обладает положительным отстроченным эффектом (положительная интерферонотерапия), не вызывают формирования резистентных штаммов ВПГ, приводят к синергидному и потенцирующему эффекту при сочетанном применении с АЦВ, вакцинами.
При выраженном дефекте в системе ИФН при ГИ (сниженных или низких уровнях продукции ИФН-α и/или ИФН-γ) показана заместительная и иммуномодулирующая ИФН-терапия, с использованием природного (человеческий лейкоцитарный интерферон (ЧЛИ) или рекомбинантного ИФН (человеческий ИФН-альфа-2).
Человеческий лейкоцитарный интерферон (ЧЛИ) используют в нескольких лекарственных формах:
- капли в нос;
- ЧЛИ для инъекций — смесь интерферонов-альфа, продуцируемых лейкоцитами клинически здоровых доноров (активность одной дозы препарата составляет 100 тыс. ME, 500 тыс. ME, 1 млн ME);
- лейкинферон (для инъекций) природный комплексный препарат, содержащий интерферон-альфа и цитокины (одна доза — 10 тыс. ME);
- интерлок (для инъекций), в 1,0 мл — 50 тыс. ME;
- ЧЛИ в ректальных свечах (в одной свече 40 тыс. ME противовирусной активности).
В настоящее время для лечения различных форм рецидивирующей ГИ часто используют препараты, содержащие рекомбинантный человеческий ИФН-альфа-2. Препараты альфа-интерферонов действуют только на внутриклеточный вирус и оказывают тройное терапевтическое воздействие:
- этиотропный эффект, как прямой виростатический путем непосредственной блокады репликации, транскрипции и трансляции вирусных нуклеиновых кислот, так и опосредованный вирулицидный, благодаря потенцированию реакций спонтанной и антителозависимой клеточно-опосредованной цитотоксичности и активности цитотоксических Т-лимфоцитов;
- являются средством базисной терапии изолированного дефицита естественных киллеров — одного из наиболее распространенных первичных иммунодефицитов, при которых отмечаются рецидивирующие герпесвирусные инфекции;
- патогенетический эффект путем устранения вирус-индуцированной иммуносупрессии.
Такие препараты, в отличие от естественных интерферонов, дешевле и безопаснее в плане передачи инфекций. При этом предпочтение отдается безопасным и высокоэффективным отечественным препаратам в виде суппозиториев Виферон (человеческий рекомбинантный ИФН-α2 в комплексе с антиоксидантами — витаминами Е и С, выпускается в форме ректальных суппозиториев в 4 дозировках (150 тыс. МЕ, 500 тыс. МЕ, 1 млн МЕ и 3 млн МЕ ИФН-α2), мази (в 1 г мази содержится 40 тыс. МЕ ИФН-α2), геля (в 1 г геля — 36 тыс. МЕ ИФН-α2).); Гиаферон (человеческий рекомбинантный ИФН-альфа-2b (500000 МЕ) в комплексе с иммуномодулятором — гиалуронатом натрия), Кипферон – комбинированный препарат, состоящий из комплекса иммуноглобулинов и человеческого рекомбинантного ИФН-альфа-2b (500000 МЕ); Генферон (человеческий рекомбинантный ИФН-альфа-2b 500000 МЕ, 1000000 МЕ в комплексе с таурином и бензокаином).
Эффективность суппозиторных форм рекомбинантного ИФН-α2 связана, прежде всего, с тем, что препараты, оказывающие местное воздействие, более эффективны, т. к. способны обеспечить более высокие концентрации препарата непосредственно в очаге поражения при отсутствии побочных эффектов, развивающихся при системном введении тех же доз ИФН-альфа.
Особый интерес представляет один из новых препаратов против герпеса — Гиаферон (свечи вагинальные и ректальные).
Гиаферон – комплексный препарат для лечения герпеса, обладающий иммуномодулирующим, противовирусным и симптоматическим действием.
При ректальном введении ИФН всасывается через слизистую оболочку, поступает в окружающие ткани, в лимфатическую систему, обеспечивая системное иммуномодулирующее действие. За счет частичной фиксации на клетках слизистой оболочки оказывает также местное действие.
При интравагинальном применении за счет высокой концентрации в очаге инфекции оказывает местный противовирусный и антибактериальный эффект.
Преимуществом Гиаферона является: быстрая доставка действующих веществ в кровоток, достаточная длительность их действия; отсутствие побочных эффектов, наблюдающихся при системном введении ИФН. Необходимо отметить, что наряду с рекомбинантным ИФН-альфа-2b в его состав входит гиалуронат натрия — один из лучших носителей для лекарственных средств и активный иммуномодулятор, который способен ускорять регенерацию тканей, стимулировать ангиогенез. Являясь основным структурным элементом соединительной ткани человека, гиалуронат натрия обеспечивает равномерное пролонгированное проникновение ИФН в кровоток.
Гиаферон показан в комплексной терапии герпесвирусной инфекции и инфекционно-воспалительных заболеваний урогенитального тракта. Об эффективности Гиаферона свидетельствуют следующие результаты. Нами было пролечено 60 больных в возрасте от 19 до 49 лет обоего пола с часто рецидивирующей ГИ (частота рецидивов 6 и более раз в год) в стадии обострения с преимущественной локализацией высыпаний в области гениталий и на коже. Схема лечения: Гиаферон в дозе 500000 МЕ по 1 свече 2 раза в день в течение 10 дней. Заживление элементов сыпи, устранение субъективных ощущений и боли происходили быстрее у пациентов, получавших Гиаферон. Применение Гиаферона сопровождалось сокращением продолжительности рецидива в среднем на 2,3 – 2,5 дня, увеличением продолжительности ремиссии в среднем в 2,5-3 раза (р<0,01). Восстановление индуцированной продукции ИФН-α имело место у 73,3% пациентов, выраженная тенденция к восстановлению — у 20% (12) пациентов. Восстановление уровней индуцированной продукции ИФН-γ выявлено у 76,6% (46) больных. Эффективность терапии Гиафроном составила 78,3%.
Эффективность рекомбинантного человеческого альфа-2а (Виферон — мазь, гель) в виде локальных аппликаций была установлена при кожном герпесе, у пациентов с генитальным и орофациальным герпесом, в том числе и у иммуноскомпрометированных пациентов. Такая терапия ускоряла заживление везикул на 25–42% по сравнению с плацебо, достоверно быстрее устраняла покраснение, боль и парестезии. Аналогичные результаты были получены при использовании Инфагель (мазь). Инфагель – лекарство от герпеса для наружного применения, представляющее сорбированный на гидрогелевой основе Интерферон альфа-2 рекомбинантный. Следует отметить, что эффективность и Виферона, и Инфагеля была более выраженной при их применении в первые 2–3 дня после появления пузырьков.
Наряду с интерферонами в терапии ГИ часто применяют индукторы интерферона. Типичными представителями индукторов интерферона являются: природные полимеры дс-РНК — ридостин, ларифан (мазь, р-р для п/к введения), низкомолекулярные природные растительные полифенолы (кагоцел, мегасин, флакозид, хелепин, алпизарин), синтетические высокомолекулярные полимеры (полудан), синтетические низкомолекулярные флюореноны — циклоферон, неовир, амиксин и др
Препараты от герпеса растительного происхождения, относящиеся к классу полифенолов (алпизарин, флакозид), являясь индукторами ИФ, стимулируют выработку эндогенного ИФН в организме больного, а также обладают противовирусным эффектом. Этим объясняется их положительный терапевтический эффект при рецидивирующем герпесе, в том числе при комплексном лечении герпесвирусных инфекций у больных, страдающих частыми простудными заболеваниями и ОРВИ. Способностью индуцировать выработку эндогенного ИФ обладает большая группа природных и синтетических соединений: левамизол (декарис), дибазол, витамин В12, пирогенал, продигиозан, щироко используемых в комплексной терапии герпеса.
Имея основные свойства ИФН, индукторы не обладают антигенностью, даже при однократном введении обеспечивают длительную циркуляцию синтезированных цитокинов на терапевтическом уровне. Стимулированный синтез эндогенного ИФН не вызывает гиперинтерферонемии и связанных с ней побочных эффектов.
Использование ИФН и его индукторов возможно в виде инстилляций, инъекций, суппозиторий, мази как в моноварианте, так и в комбинации с противовирусными химиопрепаратами, иммуномодуляторами, вакцинами.
Многочисленными исследованиями, выполненными в ведущих научных центрах России и за рубежом, было показано, что комплексное применение препаратов с разным механизмом действия у пациентов с различными формами заболевания (например, ИФН и его индукторов с химиопрепаратами (ацикловиром), вакцинами обладает рядом преимуществ по сравнению с общепринятой терапией: приводит к синергидному и потенцирующему эффекту; позволяет повысить эффективность лечения, сократить продолжительность острого периода болезни и сроков лечения, предотвратить развитие резистентности ВПГ к химиопрепаратам, способствует достижению иммунокорригирующего эффекта.
Препараты, стимулирующие Т- и В-звенья клеточного иммунитета и фагоцитоз.
Для стимуляции Т- и В-звеньев клеточного иммунитета у больных рецидивирующим герпесом применяются препараты, относящиеся к разным фармакологическим группам, в том числе тимусного (Т-активин, тималин, тимоген) и костномозгового (миелопид) происхождения, синтетические аналоги эндогенных веществ (иммунофан).
Как лечить герпес, используя медикаментозные препараты иммунотропной направленности?
Прежде всего, следует обратить внимание на то, что использование иммуннотропных препаратов для лечения герпеса должно проводиться только после консультации с врачом и под его наблюдением. Лекарство от герпеса должен выбрать врач в зависимости от показателей иммунограммы и конкретной клинической ситуации у больного. Лечение проводят под контролем иммунограммы. Самостоятельное назначение и применение имуннотропных лекарств может негативным образом сказаться на самочувствии больного.
Необходимо отметить, что у ряда пациентов с часто рецидивирующими формами ГИ, применение противовирусных препаратов и препаратов неспецифической иммунотерапии не всегда приводит к ожидаемому результату. Несмотря на достигнутый определенный клинический эффект, частота рецидивов заболевания у них остается прежней, что в свою очередь снижает самооценку у многих больных и приводит к депрессии.
Что же делать в таких случаях? Как можно им помочь?
Таким больным для профилактики рецидивов заболевания показано назначение специфической иммунотерапии. В нашей стране разработан новый метод противорецидивного лечения герпеса, который так и называется — метод специфической иммунотерапии и проводится при помощи инактивированной культуральной вакцины «Витагерпавак» («Фирма «ВИТАФАРМА», г. Москва).
Вакцина Витагерпавак предназначена для системного курсового внутрикожного введения для профилактики рецидивов ГИ, обусловленной вирусами простого герпеса 1 и 2 типов. Производство вакцины осуществляется на стандартизованной в мировой практике линии клеток «VERO В», рекомендованной ВОЗ в качестве субстрата для получения вирусных вакцин. В состав вакцины входит иммуномодулятор гиалуронат натрия. Форма выпуска: ампулы по 0,3 мл №5. Вакцина разрешена к применению с 2003 г. Цель вакцинации — активация клеточного иммунитета, его иммунокоррекция и специфическая десенсибилизация организма, уменьшение частоты рецидивирования герпетической инфекции.
Вакцина для профилактики хронической герпесвирусной инфекции.
1 упаковка — полный курс лечения.
Курс вакцинации: 5 инъекций, которые проводят с интервалом в 7-10 дней
Хранить при температуре 2-8 ºС. Допускается транспортирование препарата при температуре 9-18 ºС, но не более 3-х суток.
Показанием к применению вакцины является профилактика рецидивов герпетической инфекции у больных с наличием частых обострений (1/4 и более рецидивов в год), либо меньше при тяжелом течении процесса; подготовка женщин, имеющих в анамнезе частые рецидивы ХГИ, к зачатию и вынашиванию плода; комплексная противорецидивная терапия у больных офтальмогерпесом, перенесших лечебную кератопластику.
Как лечить герпес, используя вакцину Витагерпавак?
С целью профилактики рецидивов герпеса вакцина «Витагерпавак» применяется в период клинико-иммунологической ремиссии заболевания. Вакцинацию с помощью вакцины Витагерпавак проводят пациентам не ранее, чем через 2 недели после исчезновения признаков обострения (при офтальмогерпесе – через 1 мес) пятикратно, с интервалом в 10 дней, по 0,2 мл внутрикожно, ревакцинацию — через 6 месяцев. Противопоказаниями к введению вакцины являются: острые инфекционные и неинфекционные заболевания, хронические заболевания в стадии обострения или декомпенсации, беременность, наличие аллергии на компоненты препарата, злокачественные новообразования, наличие активной симптоматики СПИДа, герпесвирусная инфекция в активной стадии (рецидив). В случае невозможности достижения стойкой ремиссии, возможно проведение вакцинация на фоне супрессивной терапии Ацикловиром либо Валацикловиром. Для стойкого профилактического эффекта необходимо проведение повторных курсов вакцинации.
Вакцинацию осуществляют в соответствии с требованиями Методических рекомендаций МЗ3.3.1.0002-10 «Иммунизация вакциной «Витагерпавак» (герпетическая культуральная инактивированная сухая) для профилактики рецидивов инфекции, обусловленной вирусами простого герпеса 1 и 2 типов» (2010 г).
Лечебный эффект вакцины связан со стимуляцией специфических реакций противовирусного иммунитета, восстановлением функциональной активности иммунокомпетентных клеток и специфической десенсибилизацией организма.
Анализ эффективности применения вакцины «Витагерпавак», проведенный в амбулаторно-поликлинических условиях у 54 пациентов в возрасте от 18 до 59 лет, в том числе у 27 больных с генитальным герпесом (ГГ) и у 27 больных с другими формами ГИ, показал достоверное снижение числа и продолжительности рецидивов, а также удлинение сроков ремиссии на фоне вакцинации у 87% больных (Алимбарова Л.М. и соавт.). Полное отсутствие рецидивов было отмечено у 45% больных. Позитивная динамика восстановления Т-клеточного звена иммунной системы была отмечена в 81,3% случаев. Изучение реакций Т-клеточного иммунитета у вакцинируемых в разные сроки после вакцинации показало увеличение уровня специфической Т-киллерной активности лимфоцитов и активности NK – клеток в среднем в 3 раза у 67% больных на фоне неизменно высокого уровня В-клеточных реакций. Применение вакцины Витагерпавак сопровождалось значительным иммунокорригирующим эффектом, приводящим к снижению степени иммунных расстройств с 3-ей и 2-ой степени до 1-ой степени. После окончания вакцинации у всех больных отмечено прекращение вирусемии по данным ПЦР. При наблюдении за больными в динамике было отмечено снижение количества рецидивов хронической ГИ, длительности и выраженности продромального периода, значительное уменьшение выраженности клинических проявлений в остром периоде и его длительности с 10,9 ± 0,3 дня до 4,2 ± 0,3 дня (р ≤ 0,05), числа очагов заболевания, значимое увеличение длительности ремиссии.
При оценке качества жизни у всех больных до лечения с помощью опросника отмечалось снижение показателей, характеризующих физический и психологический компоненты здоровья. После проведенного лечения выявлялось достоверное улучшение указанных показателей и повышение в целом уровня общего состояния здоровья у 48 (88,8%) больных. В процессе наблюдения и по результатам лабораторно-инструментальных методов обследования серьезных нежелательных явлений у больных с различными формами ГИ, находящихся под наблюдением, зарегистрировано не было. Применение вакцины Витагерпавак не сопровождалось отклонениями от нормальных значений в биохимическом анализе крови (общий белок, амилаза, глюкоза, общий билирубин, АЛТ, АСТ, ЩФ). Удовлетворенность от проводимого лечения была установлена в среднем у 90% больных. Вакцина Витагерпавак, как лекарство от герпеса, показало преимущество его применения для профилактики рецидивов у больных с различными формами герпеса кожи и слизистых оболочек.
Эффективность и безопасность использования вакцины Витагерпавак, как лекарства от герпеса с поражением кожи и слизистых оболочек различной локализации подтверждается также и другими исследователями.
В исследовании, проведенном Баринским И.Ф. и соавт., была изучена эффективность вакцины «Витагерпавак» у 61 больного с часто рецидивирующим генитальным герпесом (ГГ) в возрасте от 21 до 45 лет. Пациенты получали вакцину «Витагерпавак» согласно инструкции по применению в период ремиссии. Схема терапии: 5 инъекций вакцины «Витагерпавак» с интервалом в 7–10 дней. Результаты показали, что через 6 месяцев после вакцинотерапии у 19 (31,1%) больных наблюдалось значительное улучшение (увеличение межрецидивного периода в 3 раза), у 35 (57,3 %) — улучшение (ремиссия увеличивалась в 1,5–2 раза) и только у 7 (11,6 %) терапевтический эффект был слабо выражен или отсутствовал. При этом большинство больных (38 человек) прекратили лечение в связи с наступившим улучшением в результате вакцинации. Рецидивы болезни после вакцинотерапии наблюдались у 41,0% больных, однако длительность течения рецидивов уменьшилась в среднем с 8-ми дней (до вакцинотерапии) до 2–3-х дней (после вакцинотерапии). Рецидивы, возникавшие у больных, получавших «Витагерпавак», носили абортивный характер. У 36 (59,0%) больных ГГ рецидивов заболевания в течение всего срока наблюдения (6 месяцев) не было.
Ранее уже говорилось, что у больных с рецидивирующей ГИ в фазе ремиссии может длительно сохраняться иммунодефицит, в том числе низкий титр сывороточных интерферонов, сниженная продукция ИФН лейкоцитами. В связи с этим, для повышения эффективности вакцинации у таких больных возможно применение вакцины с индукторами ИФН (полуданом, циклофероном, амиксином), препаратами ИФН (гиафероном).
Так, Исаковым В.А. и соавт., было проведено исследование эффективности противогерпетической вакцины в сочетании с циклофероном у 64 больных в возрасте от 21 до 39 лет обоего пола с часто рецидивирующим генитальным герпесом (частота рецидивов 1 раз в 4-6 недель). Курс вакцинотерапии составлял 5 внутрикожных инъекций по 0,2 мл через 72 часа. За сутки до введения вакцины больным назначались инъекции циклоферона (5 инъекций по схеме). Через 10 дней повторяли курс вакцинотерапии совместно с циклофероном. 34 пациента получали вакцину в сочетании с циклофероном, 30 больных — только вакцину. Во время проведения терапии рецидивов заболевания не было. Однако в течение 1 месяца после окончания терапии у 6 больных (17,6%), получавших вакцину и ЦФ, а также у 12 больных (40%), леченных только вакциной, были зарегистрированы рецидивы генитального герпеса. Продолжительность ремиссии после применения вакцины в сочетании с ЦФ увеличилась в 2,5-3,5 раза у 4 больных (11,7%) и у 24 (70,7%) — в 4-5 раз. В группе больных, леченных одной вакциной, продолжительность ремиссии возросла лишь в 2,5-3,5 раза. Разработанный новый подход к использованию противогерпетической вакцины позволил повысить эффективность вакцинации против простого герпеса с 48,7 до 90,8% (р<0,05).
В другом исследовании, проведенном Баринским И.Ф. и соавт., было проведено исследование эффективности вакцины «Витагерпавак» в сочетании с иммуностимулятором Гиаферон у 53 больных с часто рецидивирующим генитальным герпесом (ГГ) в возрасте от 21 до 45 лет. Пациенты первой группы (n=28) получали вакцину «Витагерпавак» в сочетании Гиафероном согласно инструкции по применению в период ремиссии, пациенты второй группы (n=25) – только вакцину. Схема сочетанной терапии: курс Гиаферона по 1-у суппозиторию 2 раза в день в течение 10-ти дней. На 8-е сутки проводили 1-ю инъекцию вакцины «Витагерпавак». Последующие вакцинации проводили с интервалом в 7–10 дней. Увеличение длительности межрецидивного периода в 3 раза оценивали как значительное улучшение, увеличение ремиссий в 1,5–2 раза как улучшение. Сокращение длительности рецидивов менее чем в 1,5 раза при сохранившейся частоте обострений расценивалось как отсутствие терапевтического эффекта. Результаты показали, что через 6 месяцев после вакцинотерапии с гиафероном у 21 (39,3%) больного наблюдалось значительное улучшение (увеличение межрецидивного периода в 3 раза), у 6 (57,1%) — улучшение (ремиссия увеличилась в 1,5–2 раза) и только у 1 (3,6%) терапевтический эффект был слабо выражен или отсутствовал. Эффективность терапии составила 96,4%. Монотерапия вакциной Витагерпавак приводила соответственно к значительному улучшению у 28 (14%), улучшению – у 14 (56%) больных. Эффект отсутствовал у 4 (16%) больных. Эффективность терапии составила 84,0%. Результаты исследования показали преимущество использования комбинированной схемы в профилактике обострений заболевания. Таким образом, вакцина Витагерпавак и иммуностимулятор Гиаферон – эффективные, современные препараты лечения герпеса, которые могут быть как препаратами монотерапии, так и комбинированной терапии.
- Лечение пациентов с применением вакцины Витагерпавак экономически доступно практически для всех пациентов и составляет 850$, в то время как цена годового супрессивного лечения с применением Ацикловира, по данным, представленным на 27-ом конгрессе герпетологов в Лондоне в 2015 г, — 8300$.
- Для профилактики рецидивов заболевания, а также в качестве иммуностимулирующей терапии возможно проведение аутогемотерапии. Данная процедура заключается в том, что больному переливается собственная кровь, которая берется из вены. Затем взятая кровь вводится внутримышечно в область ягодицы. Курс лечения устанавливает лечащий врач.
Патогенетическая и симптоматическая терапия
Патогенетическая и симптоматическая терапия ГИ направлена на восстановление нарушенных функций организма и профилактику осложнений.
При необходимости в схему лечения ГИ включают препараты различных групп: анальгетики, спазмолитики, противовоспалительные, жаропонижающие (парацетамол, эффералган, панадол), антигистаминные средства (супрастин, тавегил), витамины, ферментные препараты, пре- и пробиотики (ацилакт, бифидумбактерин), растительные адаптогены (средства растительного происхождения, которые активируют внутренние ресурсы организма, тонизируют, повышают иммунные силы), антисептические средства.
Антисептические препараты (бриллиантовая зелень 2% (зеленка); метиленовый синий 2%; перекись водорода 1%; фукорцин, мирамистин, хлоргексидин и другие) при непосредственном контакте с инфекционным очагом пораженной кожи оказывают противовирусный, подсушивающий эффекты, тормозят развитие микроорганизмов и особенно показаны при местном лечении. Антисептические средства наносят с помощью ватной палочки или тампона непосредственно на пораженные участки кожи, а также участки вокруг них с целью предупреждения распространения и/или присоединения бактериальной инфекции, от двух до четырех раз в день. По истечению 20-ти минут после высыхания средства на кожу можно нанести противовирусную мазь.
В ряде случаев (при системном поражении, а также при рецидивирующих формах заболевания) для коррекции симптомов ГИ может быть использована альтернативная терапия (ультрафиолетовое и лазерное облучение крови, биорезонансная терапия, акупунктура и др.).
Для повышения эффективности лечения и профилактики терапии ГИ у лиц с ослабленным иммунитетом, наряду с медикаментозным лечением, необходимо уделять внимание укреплению защитных сил организма. Основными мероприятиями, направленными на поддержание иммунитета и профилактику рецидивов ГИ, являются: ведение активного образа жизни; правильный режим труда и отдыха; активные занятия спортом; частое пребывание на свежем воздухе, закаливание; полноценное питание; избегание факторов, снижающих иммунитет (переохлаждения, физического переутомления, психического перенапряжения, стрессов, депрессии, авитаминоза и др.).
В связи с тем, что у 50% больных генитальным герпесом констатируют стойкие личностные отклонения, а у 11,5% — депрессивные синдромы, становится очевидным необходимость психологической реабилитации этих больных.
Комплексное лечение герпеса
Рассмотрев все доступные препараты для лечения инфекций герпеса, следует подчеркнуть, что наиболее выраженный терапевтический эффект может быть достигнут только при комплексном подходе к терапии, который должен включать в себя несколько этапов (Исаков В. А., Ермоленко Д. К., 1991,1996):
I ЭТАП — ЛЕЧЕНИЕ В ОСТРЫЙ ПЕРИОД БОЛЕЗНИ (РЕЦИДИВ). Основная цель — купирование острых проявлений.
- Базовая терапия — противогерпетические препараты (внутривенно, перорально, местно).
Антивирусные (этиотропные) химиопрепараты с различным механизмом действия, химиопрепараты в сочетании с иммунобиологическими средствами: препараты ИФН или его индукторы, иммуномодуляторы. По показаниям назначаются иммуноглобулины. - Природные антиоксиданты (витамины Е и С), гепатопротекторы, курс 10-14 дней.
II ЭТАП — ТЕРАПИЯ В СТАДИИ РЕМИССИИ, ПОСЛЕ СТИХАНИЯ ОСНОВНЫХ КЛИНИЧЕСКИХ ПРОЯВЛЕНИЙ (РАННЯЯ РЕКОНВАЛЕСЦЕНЦИЯ, 8-15-й дни рецидива). Основная цель — подготовка больного к вакцинотерапии.
- Иммуномодуляторы.
- Адаптогены растительного происхождения.
- При выраженной иммуносупрессии — гормоны тимуса (тималин и др.) коротким курсом.
Коррекция ферментативных нарушений, восстановление нормальной микрофлоры кишечника (системная энзимотерапия, про- или пребиотики, витаминотерапия).
III ЭТАП — СПЕЦИФИЧЕСКАЯ ПРОФИЛАКТИКА РЕЦИДИВОВ ГЕРПЕТИЧЕСКОЙ ИНФЕКЦИИ С ИСПОЛЬЗОВАНИЕМГЕРПЕТИЧЕСКИХ ВАКЦИН (в период клинико-иммунологической ремиссии).
Цель вакцинации — активация клеточного иммунитета, его иммунокоррекция и специфическая десенсибилизация организма.
IV ЭТАП — ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ И РЕАБИЛИТАЦИЯ БОЛЬНЫХ ГЕРПЕТИЧЕСКОЙ ИНФЕКЦИЕЙ.
Активное наблюдение с клинико-лабораторным мониторингом, санация хронических очагов инфекции, иммунореабилитация. Симптоматическая (патогенетическая) терапия с учетом состояния пациента (системная энзимотерапия, пребиотики, иммуномодуляторы и т. д.). Повторное использование вакцины с целью профилактики рецидивов ГГИ.
Комплексный подход к терапии имеет ряд преимуществ по сравнению с использованием каждого из методов лечения в отдельности и позволяет значительно улучшить показатели качества жизни больных с герпесвирусной инфекцией.
*автор материала — Алимбарова Л.М. доцент, к.м.н.
Нейропсихиатрические побочные эффекты противовирусных препаратов
Побочные эффекты противовирусных препаратов зависят от дозы и часто обратимы. Нервная система может поражаться под воздействием этих лекарств , и на сегодняшний день опубликовано множество исследований, касающихся токсичности противовирусных средств для центральной нервной системы. Они могут вызывать серьезные нейропсихиатрические осложнения, которые варьируются от легких симптомов, таких как раздражительность и трудности со сном, до тяжелых осложнений, таких как депрессия, психоз и болезненная периферическая невропатия, причем эти побочные эффекты, которые могут потребовать прекращения лечения. Другие противовирусные препараты с выраженным действием на нервную систему включают нуклеозидные ингибиторы обратной транскриптазы, которые связаны с развитием периферической нейропатии после длительного использования (эффект, сильно связанный со старыми препаратами, которые с тех пор попали в немилость, такими как ставудин) и интерфероны, которые могут вызывать депрессию. Правда, трудно определить, можно ли объяснить нейропсихиатрические расстройства самим вирусным заболеванием, иммунным ответом на него или лекарствами, используемыми для его лечения.
Осельтамавир
Результаты исследований, проведенных в США, Испании, Японии, Китае и Южной Корее, связывают осельтамивир со многими нейропсихиатрическими нежелательными явлениями и аномальным поведением, такими как бред и расстройства восприятия, делирий и подобные делирию явления, чувство страха , резкий гнев, бред, депрессивные эпизоды, мания, суицидальные настроения. Кроме того, осельтамивир сиалилирует сывороточный гликолипид, который стимулирует дофаминергический рецептор D2. Этот механизм связан с аномальным поведением, о котором сообщалось у некоторых детей, принимающих осельтамивир. Предполагается, что неизмененный фосфат осельтамивира связан с реакциями центральной нервной системы, такими как резкое изменение поведения, происходящее на ранней стадии лечения. Что касается использования занамивира, серьезных нейропсихиатрических побочных эффектов зарегистрировано не было .
Ацикловир
Ацикловир, валацикловир, фамцикловир — лекарства, используемые для лечения герпетических инфекций. С момента появления ацикловира в начале 80-х годов прошлого века с его использованием были связаны нейропсихиатрические побочные эффекты. Наиболее частыми психоневрологическими побочными эффектами, о которых сообщалось в литературе , являются тремор, зрительные и слуховые галлюцинации, спутанность сознания и кома. Большинство случаев были связаны с острой и хронической почечной недостаточностью, тяжелым заболеванием и одновременным применением других нейротоксических препаратов. Однако есть случаи нейропсихиатрических побочных эффектов, связанных с ацикловиром с нормальной функцией почек. Нейротоксичность ацикловира обычно описывается в течение первых 24-72 часов лечения, а полное выздоровление наступает в течение 2-7 дней после прекращения лечения.
Валацикловир
Валацикловир представляет собой L-валиловый эфир и пероральное пролекарство ацикловира, превращенное в ацикловир и L-валин путем первого прохождения кишечного и / или печеночного метаболизма. Самый высокий уровень (89%) ацикловира выводится с мочой. Валацикловир абсорбируется более эффективно и быстрее увеличивает сывороточные концентрации, чем ацикловир, и эффективен при менее частом применении. Нейропсихиатрические побочные эффекты, связанные с валацикловиром, включают спутанность сознания, галлюцинации, нарушения сознания, атаксию, дизартрию, психоз и манию. Токсичность валацикловира наступает в течение 72 часов после лечения, а выздоровление — через 4 дня после прекращения лечения.
Ганцикловир
Сообщалось об остром психозе у пациента со СПИДом с легким нарушением функции почек, которому внутривенно вводили ганцикловир. Психоз развился через 15 дней приема этого препарата . Прекращение приема ганцикловира и назначение галоперидола привело к выздоровлению. Большинство пациентов с психозом, вызванным структурными аналогами валацикловира, ацикловиром и ганцикловиром, встречаются у пожилых пациентов с ослабленным иммунитетом и плохой функцией почек, которые получают лекарство внутривенно.
Фамцикловир
Что касается использования фамцикловира, серьезных нейропсихиатрических побочных эффектов не описано. Иногда сообщается о головной боли (9-23%), мигрени (<3%) и парестезии (<3%).
Фоскарнет
Фоскарнет (тринатрийфосфоноформиат) — исследуемый аналог пирофосфата, все чаще используется для лечения рефрактерного цитомегаловирусного ретинита и инфекций, вызванных вирусом простого герпеса на слизистой оболочке, у пациентов с ослабленным иммунитетом. Сообщалось, что фоскарнет вызывает отклонения в уровне кальция и фосфата в сыворотке крови, включая случаи фатальной гипокальциемии. Неврологические нежелательные явления, связанные с применением фоскарнета, в основном связывают с гипокальциемией
Лечение вирусного непатита В
Ламивудин и телбивудин связаны с миопатией и периферической невропатией, причем частота этих эффектов была одинаковой для всех возрастных групп и обоих полов . Предлагаемый механизм, лежащий в основе этой реакции, — истощение митохондриальной ДНК . Сообщается о двух случаях дистонии, индуцированной ламивудином, которые реагировали на быстрое введение холинолитиков и не рецидивировали после отмены ламивудина. В другом исследовании трое из шести пациентов с миопатией, ассоциированной с ламивудином или телбивудином, жаловались на онемение в дистальном конце конечностей, что указывает на периферическую невропатию. Наличие невропатии было подтверждено электрофизиологическими исследованиями и биопсией нервов, проведенными исследовательской группой. Из 3500 пациентов, получавших монотерапию телбивудином в клинических испытаниях, 10 (0,28%) имели периферическую невропатию по сравнению с 9 из 48 (18,75%) пациентов, получавших комбинированную терапию пегилированным интерфероном и телбивудином. Кроме того, пациенты, получающие телбивудин, страдают слабостью в верхних и нижних конечностях. Миопатия характеризуется повышением уровня креатинкиназы (КК) наряду с мышечной болью и слабостью. Повышение уровня КК относится к хорошо описанным побочным эффектам аналогов нуклеозидов (НА), но они не специфичны для миопатии и могут быть связаны с физическими нагрузками и многими другими заболеваниями. Кроме того, наиболее частыми побочными эффектами, связанными с применением телбивудина, были утомляемость и головная боль.
Энтекавир — это высокоселективный аналог гуанозиновых нуклеозидов, одобренный FDA в 2005 г. в дозе 0,5 мг для пациентов, ранее не получавших лечения, и 1 мг / сут для пациентов с резистентным к ламивудину хроническогогепатита В . В опубликованных отчетах нежелательные явления психиатрического характера встречаются редко. Наиболее частыми нейропсихиатрическими побочными эффектами в клинических испытаниях были головная боль (17–23%), усталость (10–13%) и головокружение (9%), в то время как 1–10% пациентов, получавших энтекавир, страдали бессонницей. О случаях энтекавир-ассоциированной миопатии и периферической невропатии в литературе сообщалось очень редко. Пациенты, получающие энтекавир с тяжелым лактоацидозом, жалуются на слабость, снижение общего физического состояния и нарушение сознания
Лечение вирусного гепатита С
Ведение пациентов с гепатитом С очень сложное. Психопатологические симптомы во время противовирусной терапии наблюдаются у 30-40% пациентов с хроническим гепатитом , получавших лечение в течение 6-12 месяцев, и вызывают гораздо большее беспокойство из-за их незаметного начала, непредсказуемого характера и потенциально серьезных последствий.
Комбинация пегилированного интерферона и рибавирина была основой лечения инфекции гепатита С до утверждения противовирусных препаратов прямого действия. Лекарства плохо переносились, а психические расстройства были частым нежелательным явлением во время лечения. Интерферон известен своим депрессогенным потенциалом, и пациенты, получавшие его, обычно испытывали апатию, ангедонию, потерю мотивации и подавленное настроение . Использование рибавирина в сочетании с интерфероном или противовирусными препаратами прямого действия может быть связано с большей частотой психических расстройств по сравнению с монотерапией.
Данных о побочных эффектах противовирусного лечения прямого действия относительно мало . Первоначальное увеличение баллов по шкале депрессии Бека было зарегистрировано в одном исследовании после начала лечения, но баллы нормализовались к концу периода исследования (12 недель) . Воздействие этих препаратов на центральную нервную систему может быть более выражено у пациентов с раком печени, поскольку в одном исследовании была обнаружена связь между их применением и аномалиями электроэнцефалограммы.
Наиболее частыми «психиатрическими» побочными эффектами телапревира являются утомляемость и бессонница.Что касается боцепревира, никаких дополнительных психиатрических побочных эффектов не наблюдалось . Хотя два пациента из разных групп покончили жизнь самоубийством, конкретной информации о депрессии не предоставлено. Другие побочные эффекты включали тошноту, головную боль и утомляемость. Было обнаружено, что ледипасвир связан с возникновением головной боли, бессонницы и астении.
Volpato et al. сообщили, что некоторая степень нейропсихиатрических нарушений наблюдалась в отношении лечения схемами на основе софосбувира у пациентов с циррозом, но не у пациентов после трансплантации печени, предполагая, что первые могут быть более чувствительны к легкой нейротоксичности схемы на основе софосбувира. В частности, испытания симепревира / софосбувира демонстрируют более низкие показатели бессонницы и утомляемости по сравнению с показателями боцепревира и телапревира и предполагают, что эти новые препараты могут лучше переноситься.
Противовирусное лечение ВИЧ
Зидовудин — первое лекарство, одобренное для лечения ВИЧ, и с 1990-х годов он был жизненно важным компонентом терапии первой линии. Это было связано с периферической невропатией, связанной с истощением митохондриальной ДНК по механизму, общему для всех подобных препаратов . Риск невропатии, по-видимому, зависит от общего кумулятивного воздействия препарата, при этом люди, проходящие длительный курс лечения высокими дозами, подвергаются большему риску. Эффект, по-видимому, обратимый, с постепенным улучшением симптомов после отмены зидовудина. В современных клинических условиях частота возникновения периферической нейропатии или миопатии во время лечения зидовудином может контролироваться путем отмены препарата при наличии альтернативных вариантов лечения.
Диданозин и ставудин сильнее связаны с периферической невропатией, тогда как зидовудин чаще связан с миопатией и миелотоксичностью. Пролекарство тенофовира алафенамид, которое приводит к более высоким концентрациям активного соединения в лимфоидной ткани по сравнению с другими клетками, может переноситься лучше, чем первоначальная композиция тенофовира дисипроксил фумарата.
Тенофовир дисипроксил фумарат является препаратом первой линии для лечения как ВИЧ-инфекции, так и инфекции, вызванной вирусом гепатита B (HBV), благодаря сходной эффективности и значительно улучшенному профилю безопасности. Периферическая нейропатия при приеме тенофовира встречается реже, чем при применении других препаратов этой группы (особенно ставудина), хотя и возникает. У 8% участников развилась сенсорная нейропатия в южноафриканской когорте из 120 человек, ранее не получавших лечения Психиатрические побочные эффекты при применении тенофовира возникают нечасто, хотя риск может быть выше, если он используется в сочетании с эфавиренцем. Сообщение о девяти случаях нейропсихиатрических осложнений, возникших после начала приема тенофовира у лиц, принимающих эфавиренц, свидетельствует о необходимости дальнейшего мониторинга и особой осторожности при комбинировании этих двух препаратов . Риск этих побочных эффектов может быть снижен за счет использования более селективного пролекарства тенофовира алафенамида, хотя необходимы дальнейшие исследования, чтобы определить, является ли разница в профиле токсичности двух препаратов клинически значимой
Патогенез
Патогенетические механизмы могут включать молекулярные мишени, общие для других центрально активных препаратов, включая моноаминоксидазу-A (MAO-A), серотониновые рецепторы, гамма-аминомасляную кислоту (GABA), рецепторы GABA-A, рецепторы 5-HT2A и 5-HT2C и другие. Известные примеры включают осельтамивир, который может действовать как ингибитор МАО, и эфавиренц, имеющий сродство к рецепторам серотонина 5-HT2 и GABA-A, транспортера серотонина, ферменту МАО и транспортеру везикулярных моноаминов, с субъективными эффектами, которые могут быть аналогичны эффектам психоделического галлюциногена диэтиламида лизергиновой кислоты
Во многих случаях наряду с нейропсихиатрическими побочными эффектами, связанными с применением ацикловира и валацикловира, были описаны высокие концентрации 9-карбоксиметоксиметилгуанина (CMMG) в сыворотке крови и спинномозговой жидкости (CSF) . CMMG — метаболит ацикловира. При почечной недостаточности большая часть ацикловира метаболизируется до 9-карбоксиметоксиметилгуанина (CMMG), вероятно, под действием алкогольдегидрогеназы (ADH) и альдегиддегидрогеназы (ALDH).
Категория сообщения в блог: