Медицинская техника
для профессионалов
Медицинская техника и ветеринарное оборудование, доставка по России и СНГ
ООО «ПрофМТ», Санкт-Петербург, +7(812)946-03-27; +7(812)946-03-26, info@profmt.ru, пн-пт 900-1700 , сб-вс
1. Подсоединить
фотометр к сети и включить тумблер СЕТЬ.
2. Нажать клавишу
ПУСК – на цифровом табло появится символ
Г и соответствующее ему значение длины
волны.
3. Выдержать фотометр
во включенном состоянии 30 минут при
открытой крышке и произвести измерение
и учет нулевого отсчета nо
нажатием
клавиши НУЛЬ. На цифровом табло справа
от мигающей запятой высвечивается
значение nо,
а слева – символ 0. Значение nо
должно быть не менее 0,005 и не более 0,02.
4. Установить в
кюветное отделение кюветы с растворителем
или контрольным раствором, по отношению
к которому производится измерение, и
исследуемым раствором. Кювету с
контрольным раствором установить в
дальнее гнездо кюветодержателя, а кювету
с исследуемым раствором – в ближнее
гнездо кюветодержателя. Перевести
рукоятку в крайнее левое положение.
5. Установить длину
волны, на которой производится измерение
раствора, длина волны высветится на
верхнем световом табло.
6. При закрытой
крышке кюветного отделения нажать
клавишу Г, а потом П (или Е). При этом
слева от мигающей запятой высветится
символ П (Е), а справа – значение 100,0 (или
0,000), означающее, что начальный отсчет
пропускания 100% установился на фотометре
правильно.
7. Перевести рукоятку
вправо до упора, при этом в световой
пучок вводится кювета с исследуемым
раствором. Отсчет на световом табло
справа от мигающей запятой соответствует
коэффициенту пропускания исследуемого
раствора или оптической плотности.
8. По окончании
работы отключить фотометр от сети.
Лабораторная
работа № 1
Построение
калибровочной кривой определения Fe
(III)
фотоколориметрическим
методом с сульфосалициловой кислотой
в кислой среде
В мерные колбы на
50 мл вносят по 1, 2, 3, 5, 6, 8 мл стандартного
раствора железо-аммонийных квасцов
(NH4Fe(SO4)2·12H2O),
в каждую добавляют по 1 мл 2 н. раствора
серной кислоты и по 10 мл раствора с
массовой долей 10% сульфосалициловой
кислоты. Объем доводят до метки
дистиллированной водой и фотометрируют.
Измеряют оптическую
плотность (D) при λ = 510 нм по отношению к
«холостому» раствору, кювета
толщиной 1 см. «Холостой» раствор
готовят следующим образом: в мерную
колбу на 50 мл вносят 1 мл 2 н. раствора
серной кислоты и 10 мл раствора с массовой
долей 10% сульфосалициловой кислоты,
объем доводят дистиллированной водой
до метки. Все стандартные растворы
готовят в двух повторностях.
После фотометрирования
по полученным данным строят калибровочный
график зависимости оптической плотности
(D) от концентрации Fe (III) (C).
Полученные данные
заносят в таблицу 1.
Таблица 1
|
Содержание Fe(III), мкг/мл |
Оптическая |
||
|
D1 |
D2 |
Dср. |
|
Построение
калибровочной кривой определения Fe
(III)
фотоколориметрическим
методом с сульфосалициловой кислотой
в щелочной среде
В мерные колбы на
50 мл вносят по 0, 1, 3, 5, 10 мл стандартного
раствора соли Мора ((NH4)2Fe(SO4)2·6H2O),
что соответствует 0, 5, 15, 25, 50 мкг/мл
железа. В каждую колбу добавляют по
25-30 мл воды, 3-5 капель водного раствора
аммиака (для создания рН 6-8), 1 мл 2 н.
NH4Cl,
1 мл 20% раствора сульфосалициловой
кислоты и 1 мл 10% раствора аммиака. Объем
доводят до метки дистиллированной водой
и через 15 мин. фотометрируют.
Измеряют оптическую
плотность (D) при λ = 416 нм по отношению к
«холостому» раствору, кювета
толщиной 5 см.
«Холостой»
раствор готовят следующим образом: в
мерную колбу на 50 мл вносят 25 мл воды,
3-5 капель водного раствора аммиака (для
создания рН 6-8), 1 мл 2 н. NH4Cl,
1 мл 20% раствора сульфосалициловой
кислоты и 1 мл 10% раствора аммиака. Объем
доводят дистиллированной водой до
метки.
После фотометрирования
по полученным данным строят калибровочный
график зависимости оптической плотности
(D) от концентрации Fe(III) (C).
Предел обнаружения
Fe(III) 0,1мг/л.
Стандартный раствор
готовят следующим образом: 0,351 г соли
Мора растворяют в мерной колбе на 500 мл,
добавляют 5 мл серной кислоты (ρ = 1,84
г/мл) и доводят дистиллированной водой
до метки.
В 1 мл стандартного
раствора содержится 0,1 мг Fe(III).
Стандартный раствор
разбавляют в 20 раз, что соответствует
содержанию 0,005 мг Fe(III) в 1 мл приготовленного
раствора.
Лабораторная
работа № 2
Определение
содержания Fe(III) фотоколориметрическим
методом с
сульфосалициловой кислотой в кислой
среде
К анализируемому
раствору соли железа (III) в мерной колбе
на 50 мл добавляют 1 мл 2 н. раствора серной
кислоты и 10 мл раствора с массовой долей
10% сульфосалициловой кислоты, затем
доводят объем до метки дистиллированной
водой и фотометрируют против «холостой»
пробы при λ = 510 нм. По калибровочному
графику определяют содержание железа,
мкг/мл.
Содержание Fe (III)
в анализируемом образце определяют по
формуле:
m (Fe3+)
= а∙50, (1)
где а – содержание
Fe3+
(мкг/мл), определенное по калибровочному
графику.
Определение
содержания Fe(III) фотоколориметрическим
методом с
сульфосалициловой кислотой в щелочной
среде
К анализируемому
раствору соли железа (III) в мерную колбу
на 50 мл добавляют 1 мл 2 н. NH4Cl,
1 мл 20% раствора сульфосалициловой
кислоты и 1 мл 10% раствора аммиака. Объем
доводят дистиллированной водой до метки
и фотометрируют против «холостой»
пробы при λ = 416 нм. По калибровочному
графику определяют содержание железа,
мкг/мл.
Содержание Fe (III)
в анализируемом образце определяют по
формуле (1).
ФОРМА ОТЧЕТА:
1. Изложить
теоретические основы фотометрических
методов анализа растворов.
2. Заполнить таблицу
1 и постройте калибровочный график в
координатах: D – содержание Fe(III), мкг/мл
(на миллиметровой бумаге).
3. Определить
содержание железа (III) в исследуемом
растворе при помощи калибровочного
графика.
4. Выполнить
статистическую обработку результатов
определения.
5.
ХОД ЗАНЯТИЯ:
Соседние файлы в папке Методичка
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Правила работы на кфк-3
1. Подсоединить фотометр к сети и включить тумблер СЕТЬ.
2. Нажать клавишу ПУСК – на цифровом табло появится символ Г и соответствующее ему значение длины волны.
3. Выдержать фотометр во включенном состоянии 30 минут при открытой крышке и произвести измерение и учет нулевого отсчета nо нажатием клавиши НУЛЬ. На цифровом табло справа от мигающей запятой высвечивается значение nо, а слева – символ 0. Значение nо должно быть не менее 0,005 и не более 0,02.
4. Установить в кюветное отделение кюветы с растворителем или контрольным раствором, по отношению к которому производится измерение, и исследуемым раствором. Кювету с контрольным раствором установить в дальнее гнездо кюветодержателя, а кювету с исследуемым раствором – в ближнее гнездо кюветодержателя. Перевести рукоятку в крайнее левое положение.
5. Установить длину волны, на которой производится измерение раствора, длина волны высветится на верхнем световом табло.
6. При закрытой крышке кюветного отделения нажать клавишу Г, а потом П (или Е). При этом слева от мигающей запятой высветится символ П (Е), а справа – значение 100,0 (или 0,000), означающее, что начальный отсчет пропускания 100% установился на фотометре правильно.
7. Перевести рукоятку вправо до упора, при этом в световой пучок вводится кювета с исследуемым раствором. Отсчет на световом табло справа от мигающей запятой соответствует коэффициенту пропускания исследуемого раствора или оптической плотности.
8. По окончании работы отключить фотометр от сети.
Лабораторная работа № 1
Построение калибровочной кривой определения Fe (III)
фотоколориметрическим методом с сульфосалициловой кислотой
В мерные колбы на 50 мл вносят по 1, 2, 3, 5, 6, 8 мл стандартного раствора железо-аммонийных квасцов (NH4Fe(SO4)2·12H2O), в каждую добавляют по 1 мл 2 н. раствора серной кислоты и по 10 мл раствора с массовой долей 10% сульфосалициловой кислоты. Объем доводят до метки дистиллированной водой и фотометрируют.
Измеряют оптическую плотность (D) при λ = 510 нм по отношению к «холостому» раствору, кювета толщиной 1 см. «Холостой» раствор готовят следующим образом: в мерную колбу на 50 мл вносят 1 мл 2 н. раствора серной кислоты и 10 мл раствора с массовой долей 10% сульфосалициловой кислоты, объем доводят дистиллированной водой до метки. Все стандартные растворы готовят в двух повторностях.
После фотометрирования по полученным данным строят калибровочный график зависимости оптической плотности (D) от концентрации Fe (III) (C).
Источник
Правила работы на фотоэлектроколориметре КФК-3
Фотоэлектроколориметр КФК-3 (рис. 1) предназначен для измерения коэффициентов пропускания (оптической проницаемости) или оптической плотности цветных растворов с целью определения по калибровочному графику концентрации вещества в растворах.
Спектральный диапазон работы КФК-3 от 315 до 990 нм.
Принцип действия фотоэлектроколориметра основан на сравнении светового потока, прошедшего через бесцветный растворитель (Фo), и светового потока, прошедшего через окрашенный раствор (Ф).
Световые потоки Фo и Ф фотоприемника преобразуются в электрические сигналы, которые обрабатываются микроЭВМ прибора и высвечиваются на цифровом табло в виде оптической проницаемости (П, %).
Рис. 1. Вид фотоэлектроколориметра:
1 – тумблер (сеть), 2 – ручка для установления длины волны, 3 – кюветное отделение с кюветодержателем, 4 – рукоятка для ввода светового пучка, 5 – микропроцессор системы, 6 – блок системы
При прохождении света через раствор свет или его компоненты поглощаются или отражаются. По величине поглощения или отражения лучей судят о природе и концентрации вещества.
В соответствии с законом Бугера-Ламберта-Бера зависимость изменения интенсивности потока света, прошедшего через раствор, от концентрации окрашенного вещества в растворе (С), выражается уравнением
где Io и I – интенсивность потока света, падающего на раствор(Io) и прошедшего через раствор(I); e – коэффициент поглощения света, зависящий от природы растворенного вещества, называемый молярным коэффициентом поглощения; l – толщина слоя светопоглощающего раствора.
Измерив изменение интенсивности потока света, можно определить концентрацию анализируемого вещества. Определение проводят на фотоколориметре.
Таким образом, основным показателем для определения концентрации цветных растворов является оптическая плотность раствора (d) или противоположная ей величина – оптическая проницаемость раствора (П), она выражается в % и для оптически прозрачных растворов равна 100 %.
Порядок работы
Присоединить фотоэлектроколориметр (рис. 1) к сети 220 В и включить тумблер 1 СЕТЬ (с правой стороны фотоэлектроколориметра).
Нажать клавишу ПУСК на микропроцессорном блоке 5. На цифровом табло вверху появится значение длины волны. Ниже слева символ «Г» (оптическая плотность), справа – соответствующее ему значение.
Открыть крышку кюветного отделения и установить кювету с растворителем в дальнее гнездо кюветодержателя, а кювету с исследуемым раствором в ближнее гнездо кюветодержателя. Закрыть крышку кюветного отделения.
Установить ручкой (на передней панели слева внизу) длину волны (l), на которой проводится измерение (длина волны высвечивается на верхнем цифровом табло). Устанавливаемая длина волны зависит от цвета раствора.
В световой пучок установить кювету с растворителем, рукоятка перемещения кювет передвигается в крайнее левое положение (она находится на передней панели в центре внизу) (4, рис.1). Нажать клавишу «Г», а затем клавишу «П» (оптическая проницаемость). На нижнем цифровом табло высветится символ «П» и правее значение 100.0±0.2, означающие, что начальный отсчет светопропускания установился на фотометре правильно.
Затем рукоятку перемещения кювет установить вправо до упора, при этом в световой пучок вводится кювета с исследуемым раствором и на световом табло справа появляется значение оптической проницаемости (П, %) исследуемого раствора.
При построении калибровочного графика и определении концентрации растворов необходимо проводить измерения по методике, указанной выше, для каждого раствора в отдельности.
Опыт 1. Определение скорости химической реакции
Необходимо определить скорость реакции взаимодействия тиосульфата натрия (Na2 S2О3) с серной кислотой (Н2 SO4)
В результате реакции выделяется сера в свободном виде, плотность раствора при этом меняется, что фиксируется по изменению оптической проницаемости раствора (до 3 %).
Группы студентов в количестве 2…3 человек получают от преподавателя раствор тиосульфата натрия определенной концентрации, наливают 2 мл этого раствора в кювету и добавляют в неё 2 мл раствора серной кислоты. Отмечают время начала реакции по секундомеру и следят за изменением значений проницаемости (П) или оптической плотности (d) на световом табло. Время протекания реакции записывают в табл. 1.
Время протекания реакции и скорость химического процесса
при определенной концентрации тиосульфата натрия
| Концентрация раствора Na2 Ѕ2О3 С, моль/л | Время протекания реакции t, с | Скорость химической реакции v, моль/л×с |
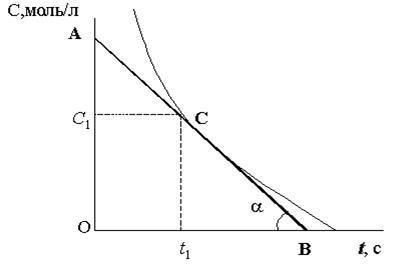
Данные, полученные всеми студентами, используют для построения графика, откладывая по оси ординат концентрации растворов (С, моль/л), а по оси абсцисс – время протекания реакции (t, с). Пример показан на рис. 2.
Итак, каждая группа студентов проводит касательную к точке на кривой, соответствующей исследуемой концентрации и определяет тангенс угла между касательной и абсциссой (tga ).Пример показан на рис. 2.
Например, ваша группа работала с концентрацией тиосульфата натрия С1 (моль/л). По данным, полученным всеми группами и занесенными в табл. 1, начерченную на доске, вы построите график С (моль/л) – t (с). К точке на графике, соответствующей концентрации С1, проводите касательную АВ (рис. 2) и находите тангенс угла наклона касательной к абсциссе (tga).
|
Рис. 2. Зависимость времени протекания реакции от концентрации |
 |
Эта величина в первом приближении равна скорости реакции (tga = v) как отношение отрезка АО : ОВ, что соответствует определению скорости реакции, которая равна отношению изменения концентрации реагирующего вещества (DС) к отрезку времени, за которое протекает реакция (v 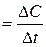
Механическое удерживание земляных масс: Механическое удерживание земляных масс на склоне обеспечивают контрфорсными сооружениями различных конструкций.
Организация стока поверхностных вод: Наибольшее количество влаги на земном шаре испаряется с поверхности морей и океанов (88‰).
Папиллярные узоры пальцев рук — маркер спортивных способностей: дерматоглифические признаки формируются на 3-5 месяце беременности, не изменяются в течение жизни.
Источник