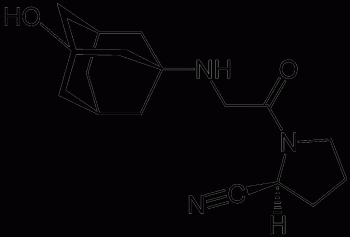
Описание препарата Галвус® (таблетки, 50 мг) основано на официальной инструкции, утверждено компанией-производителем в 2015 году
Дата согласования: 14.08.2015
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Фотографии упаковок

14.08.2015
Действующее вещество
ATX
Фармакологическая группа
Состав
| Таблетки | 1 табл. |
| активное вещество: | |
| вилдаглиптин | 50 мг |
| вспомогательные вещества: МКЦ — 95,68 мг; лактоза безводная — 47,82 мг; карбоксиметилкрахмал натрия — 4 мг; магния стеарат — 2,5 мг |
Описание лекарственной формы
Таблетки: от белого до светло-желтого цвета, круглые, гладкие, со скошенными краями, на одной стороне маркировка «NVR», на другой — «FB».
Фармакологическое действие
Фармакологическое действие
—
гипогликемическое.
Фармакодинамика
Вилдаглиптин — представитель класса стимуляторов островкового аппарата поджелудочной железы, селективно ингибирует фермент дипептидилпептидазу-4 (ДПП-4). Быстрое и полное ингибирование активности ДПП-4 (>90%) вызывает повышение как базальной, так и стимулированной приемом пищи секреции глюкагоноподобного пептида 1-го типа (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП) из кишечника в системный кровоток в течение всего дня.
Повышая концентрацию ГПП-1 и ГИП, вилдаглиптин вызывает повышение чувствительности β-клеток поджелудочной железы к глюкозе, что приводит к улучшению глюкозозависимой секреции инсулина.
При применении вилдаглиптина в дозе 50–100 мг/сут у пациентов с сахарным диабетом (СД) типа 2 отмечается улучшение функции β-клеток поджелудочной железы. Степень улучшения функции β-клеток зависит от степени их исходного повреждения; так у лиц, не страдающих СД (с нормальной концентрацией глюкозы в плазме крови), вилдаглиптин не стимулирует секрецию инсулина и не снижает уровень глюкозы.
Повышая концентрацию эндогенного ГПП-1, вилдаглиптин увеличивает чувствительность α-клеток к глюкозе, что приводит к улучшению глюкозозависимой регуляции секреции глюкагона. Снижение повышенной концентрации глюкагона во время еды в свою очередь вызывает уменьшение инсулинорезистентности.
Увеличение соотношения инсулин/глюкагон на фоне гипергликемии, обусловленное повышением уровней ГПП-1 и ГИП, вызывает уменьшение продукции глюкозы печенью как в прандиальный период, так и после приема пищи, что приводит к снижению концентрации глюкозы в плазме крови.
Кроме того, на фоне применения вилдаглиптина отмечается снижение концентрации липидов в плазме крови, однако этот эффект не связан с его действием на ГПП-1 или ГИП и улучшением функции β-клеток поджелудочной железы.
Известно, что повышение уровня ГПП-1 может приводить к замедлению опорожнения желудка, однако на фоне применения вилдаглиптина подобный эффект не наблюдается.
При применении вилдаглиптина у 5795 пациентов с СД типа 2 в течение от 12 до 52 нед в качестве монотерапии или в комбинации с метформином, производными сульфонилмочевины, тиазолидиндионом или инсулином отмечается достоверное длительное снижение концентрации гликированного гемоглобина (HbA1c) и глюкозы крови натощак.
При применении комбинации вилдаглиптина и метформина в качестве начальной терапии пациентов с СД типа 2 в течение 24 нед отмечалось дозозависимое снижение показателей HbA1c и массы тела в сравнении с монотерапией данными препаратами. Случаи развития гипогликемии были минимальны в обеих группах терапии.
В клиническом исследовании при применении вилдаглиптина в дозе 50 мг 1 раз в сутки в течение 6 мес у пациентов с СД типа 2 с нарушением функции почек средней (скорость клубочковой фильтрации — СКФ — ≥30, но <50 мл/мин/1,73 м2) или тяжелой (СКФ <30 мл/мин/1,73 м2) степени отмечалось клинически значимое снижение HbA1c по сравнению с группой, получающей плацебо.
В клиническом исследовании при применении вилдаглиптина в дозе 50 мг 2 раза в сутки совместно/без метформина в комбинации с инсулином (средняя доза 41 ЕД/сут) у пациентов с СД типа 2 отмечено снижение показателя HbA1c в конечной точке (−0,77%), при исходном показателе в среднем 8,8%. При этом различие с плацебо (−0,72%) было статистически достоверным. Частота гипогликемии в группе, получавшей исследуемый препарат, была сравнима с частотой гипогликемии в группе применения плацебо.
В клиническом исследовании при применении вилдаглиптина в дозе 50 мг 2 раза в сутки одновременно с метформином (≥1500 мг/сут) в комбинации с глимепиридом (≥4 мг/сут) у пациентов с СД типа 2 показатель HbA1c статистически значимо снизился на 0,76% (исходный показатель в среднем 8,8%).
Фармакокинетика
Абсорбция. Вилдаглиптин быстро абсорбируется при приеме внутрь с абсолютной биодоступностью 85%. В терапевтическом диапазоне доз увеличение Cmax вилдаглиптина в плазме и AUC практически прямо пропорционально повышению дозы препарата.
После приема внутрь натощак Tmax вилдаглиптина в плазме крови составляет 1 ч 45 мин. При одновременном приеме с пищей скорость абсорбции препарата снижается незначительно: отмечается уменьшение Сmax на 19% и увеличение Tmax до 2 ч 30 мин. Однако прием пищи не оказывает влияние на степень абсорбции и AUC.
Распределение. Связывание вилдаглиптина с белками плазмы низкое (9,3%). Препарат распределяется эквивалентно между плазмой и эритроцитами. Распределение вилдаглиптина происходит предположительно экстраваскулярно, Vss после в/в введения составляет 71 л.
Метаболизм. Биотрансформация является основным путем выведения вилдаглиптина. В организме у человека подвергается превращению 69% дозы препарата. Основной метаболит — LAY151 (57% дозы) — фармакологически неактивен и является продуктом гидролиза цианокомпонента. Около 4% дозы препарата подвергается амидному гидролизу.
В экспериментальных исследованиях отмечается положительное влияние ДПП-4 на гидролиз препарата. Вилдаглиптин не метаболизируется при участии изоферментов цитохрома Р450. Вилдаглиптин не является субстратом изоферментов CYP450, не ингибирует и не индуцирует изоферменты цитохрома P450.
Выведение. После приема препарата внутрь около 85% дозы выводится почками и 15% — через кишечник, почечная экскреция неизмененного вилдаглиптина составляет 23%. T1/2 после приема внутрь составляет около 3 ч независимо от дозы. Пол, индекс массы тела и этническая принадлежность не оказывают влияние на фармакокинетику вилдаглиптина.
Особые группы пациентов
Нарушение функции печени. У пациентов с нарушением функции печени легкой и средней степени тяжести (6–10 баллов по классификации Чайлд-Пью) после однократного применения препарата отмечается снижение биодоступности вилдаглиптина на 20 и 8% соответственно. У пациентов с нарушением функции печени тяжелой степени (12 баллов по классификации Чайлд-Пью) биодоступность вилдаглиптина повышается на 22%. Увеличение или уменьшение максимальной биодоступности вилдаглиптина, не превышающее 30%, не является клинически значимым. Корреляция между степенью тяжести нарушений функции печени и биодоступностью препарата не выявлена.
Нарушение функции почек. У пациентов с нарушением функции почек легкой, средней или тяжелой степени AUC вилдаглиптина увеличивалась по сравнению со здоровыми добровольцами в 1,4; 1,7 и 2 раза соответственно. AUC метаболита LAY151 увеличивалась в 1,6; 3,2; и 7,3 раза, а метаболита BQS867 — в 1,4; 2,7; и 7,3 раза у пациентов с нарушением функции почек легкой, средней и тяжелой степени соответственно. Ограниченные данные у пациентов с терминальной стадией ХПН указывают на то, что показатели данной группы схожи с таковыми у пациентов с нарушением функции почек тяжелой степени. Концентрация метаболита LAY151 у пациентов с терминальной стадией ХПН увеличивалась в 2–3 раза по сравнению с пациентами с нарушением функции почек тяжелой степени. При применении препарата у пациентов с нарушением функции почек может потребоваться коррекция дозы. Выведение вилдаглиптина при гемодиализе ограничено (через 4 ч после однократного приема составляет 3% при длительности процедуры более 3–4 ч).
Пациенты ≥65 лет. Максимальное увеличение биодоступности препарата на 32% (увеличение Сmax на 18%) у пациентов старше 70 лет не является клинически значимым и не влияет на ингибирование ДПП-4.
Пациенты ≤18 лет. Фармакокинетические особенности вилдаглиптина у детей и подростков младше 18 лет не установлены.
Показания
Сахарный диабет типа 2:
в качестве монотерапии в сочетании с диетотерапией и физическими упражнениями;
в комбинации с метформином в качестве начальной медикаментозной терапии при недостаточной эффективности диетотерапии и физических упражнений;
в составе двухкомпонентной комбинированной терапии с метформином, производными сульфонилмочевины, тиазолидиндионом или инсулином в случае неэффективности диетотерапии, физических упражнений и монотерапии этими препаратами;
в составе тройной комбинированной терапии: в комбинации с производными сульфонилмочевины и метформином, у пациентов ранее получавших терапию производными сульфонилмочевины и метформином на фоне диетотерапии и физических упражнений и не достигших адекватного контроля гликемии;
в составе тройной комбинированной терапии: в комбинации с инсулином и метформином, у пациентов, ранее получавших инсулин и метформин, на фоне диетотерапии и физических упражнений и не достигших адекватного контроля гликемии.
Противопоказания
повышенная чувствительность к вилдаглиптину и любым другим компонентам препарата;
наследственная непереносимость галактозы, недостаточность лактазы глюкозо-галактозная мальабсорбция.
Не рекомендуется применение вилдаглиптина у пациентов с хронической сердечной недостаточностью функционального класса IV по классификации NYHA ввиду отсутствия данных клинических исследований о применении вилдаглиптина у этой группы пациентов.
Эффективность и безопасность применения препарата у детей до 18 лет не установлена.
С осторожностью: тяжелые нарушения функции печени, включая повышенную активность печеночных ферментов (АЛТ или АСТ >2,5 раза выше ВГН — 2,5×ВГН); терминальная стадия хронической почечной недостаточности у пациентов на гемодиализе (поскольку опыт применения ограничен); хроническая сердечная недостаточность III класса по функциональной классификации NYHA (поскольку данные о применении ограничены и не позволяют сделать окончательный вывод).
Применение при беременности и кормлении грудью
В экспериментальных исследованиях при применении в дозах, в 200 раз превышающих рекомендуемые, препарат не вызывал нарушения фертильности и раннего развития эмбриона и не оказывал тератогенное действие на плод. Достаточных данных по применению препарата Галвус у беременных женщин нет, в связи с чем препарат не следует применять при беременности.
Поскольку неизвестно, выделяется ли вилдаглиптин с грудным молоком у человека, препарат Галвус не следует применять в период грудного вскармливания.
Способ применения и дозы
Внутрь, независимо от приема пищи.
Режим дозирования препарата следует подбирать индивидуально, в зависимости от эффективности и переносимости.
Рекомендуемая доза препарата при проведении монотерапии или в составе двухкомпонентной комбинированной терапии с метформином, тиазолидиндионом или инсулином (в комбинации с метформином или без него) — 50 или 100 мг 1 раз в сутки. У пациентов с более тяжелым течением СД типа 2, получающих лечение инсулином, препарат Галвус рекомендуется применять в дозе 100 мг/сут.
Рекомендованная доза препарата Галвус в составе тройной комбинированной терапии (вилдаглиптин + производные сульфонилмочевины + метформин) составляет 100 мг/сут.
Дозу 50 мг/сут следует принимать 1 раз утром, дозу 100 мг/сут следует делить на 2 приема по 50 мг утром и вечером. В случае пропуска приема, следующую дозу препарата следует принять как можно раньше, при этом не следует превышать суточную дозу.
При применении в составе двухкомпонентной комбинированной терапии с производными сульфонилмочевины рекомендуемая доза препарата Галвус составляет 50 мг 1 раз в сутки утром. При назначении в комбинации с производными сульфонилмочевины эффективность терапии препаратом в дозе 100 мг/сут была сходной с таковой в дозе 50 мг/сут.
При недостаточном клиническом эффекте на фоне применения максимальной рекомендуемой суточной дозы 100 мг для лучшего контроля гликемии возможно дополнительное назначение других гипогликемических препаратов — метформина, производных сульфонилмочевины, тиазолидиндиона или инсулина.
Особые группы пациентов
Нарушение функции печени или почек. У пациентов с нарушением функции почек и печени легкой степени тяжести не требуется коррекция режима дозирования препарата. У пациентов с нарушением функции почек средней и тяжелой степени (включая терминальную стадию ХПН на гемодиализе) препарат следует применять в дозе 50 мг 1 раз в сутки.
Пациенты ≥65 лет. У пациентов пожилого возраста не требуется коррекция режима дозирования препарата Галвус.
Применение у пациентов ≤18 лет. Поскольку опыта применения препарата Галвус у детей и подростков младше 18 лет нет, не рекомендуется применять препарат у данной категории пациентов.
Побочные действия
При применении препарата Галвус в качестве монотерапии или в комбинации с другими препаратами большинство нежелательных реакций были слабо выражены, имели временный характер и не требовали отмены терапии. Корреляция между частотой нежелательных явлений (НЯ) и возрастом, полом, этнической принадлежностью, продолжительностью применения или режимом дозирования не выявлена.
Частота развития ангионевротического отека на фоне терапии препаратом Галвус составляла ≥1/10000, <1/1000 (градация редко) и была сходной с таковой в контрольной группе. Наиболее часто ангионевротический отек отмечался при применении препарата в комбинации с ингибиторами АПФ. В большинстве случаев ангионевротический отек был средней степени тяжести и разрешался самостоятельно в ходе продолжения терапии вилдаглиптином.
На фоне терапии препаратом Галвус редко отмечались нарушения функции печени (включая гепатит) бессимптомного течения. В большинстве случаев данные нарушения и отклонения показателей функции печени от нормы разрешились самостоятельно без осложнений после прекращения терапии препаратом. При применении препарата Галвус в дозе 50 мг 1 или 2 раза в сутки частота увеличения активности печеночных ферментов (АЛТ или АСТ ≥3×ВГН) составляла 0,2 или 0,3% соответственно (по сравнению с 0,2% в контрольной группе). Увеличение активности печеночных ферментов в большинстве случаев было бессимптомным, не прогрессировало и не сопровождалось холестазом или желтухой.
Для оценки частоты встречаемости НЯ использовались следующие критерии: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000), включая отдельные сообщения.
Применение препарата Галвус в качестве монотерапии
При применении препарата Галвус в дозе 50 мг 1 или 2 раза в сутки частота отмены терапии в связи с развитием нежелательных реакций (0,2 или 0,1% соответственно) была не выше таковой в группе плацебо (0,6%) или препарата сравнения (0,5%).
На фоне монотерапии препаратом Галвус в дозе 50 мг 1 или 2 раза в сутки частота развития гипогликемии без увеличения степени тяжести состояния составляла 0,5% (2 пациента из 409) или 0,3% (4 из 1082), что сопоставимо с препаратом сравнения и плацебо (0,2%). При применении препарата Галвус в виде монотерапии не отмечалось увеличение массы тела пациентов.
Со стороны ЦНС: часто — головокружение; нечасто — головная боль.
Со стороны пищеварительной системы: нечасто — запор.
Общие расстройства и нарушения в месте введения: нечасто — периферические отеки.
Долгосрочные клинические исследования продолжительностью до 2 лет не выявили каких-либо дополнительных отклонений профиля безопасности или непредвиденных рисков при применении вилдаглиптина в качестве монотерапии.
Применении препарата Галвус в дозе 50 мг 1 или 2 раза в сутки в комбинации с метформином
При применении препарата Галвус в дозе 50 мг 1 раз в сутки в комбинации с метформином частота отмены терапии в связи с развитием нежелательных реакций составляла 0,4% (в группах вилдаглиптин (50 мг 2 раза в сутки) + метформин и плацебо + метформин случаи отмены терапии в связи с развитием нежелательных реакций не отмечались).
При применении препарата Галвус в дозе 50 мг 1 или 2 раза в сутки в комбинации с метформином гипогликемия отмечалась в 0,9 и 0,5% случаев соответственно (в группе плацебо + метформин — 0,4%). В группе применения препарата Галвус не наблюдалось развитие гипогликемии тяжелой степени. Комбинированная терапия вилдаглиптин + метформин не влияла на массу тела пациентов.
Со стороны нервной системы: часто — тремор, головокружение, головная боль.
Долгосрочные клинические исследования продолжительностью до 2 лет не выявили какие-либо дополнительные отклонения профиля безопасности или непредвиденные риски при применении вилдаглиптина в комбинации с метформином.
При применении препарата Галвус в дозе 50 мг 1 раз сутки в комбинации с производными сульфонилмочевины
При применении препарата Галвус в дозе 50 мг 1 раз в сутки в комбинации с глимепиридом частота отмены терапии в связи с развитием нежелательных реакций составляла 0,6% (по сравнению с 0% в группе глимепирид + плацебо).
Частота развития гипогликемии у больных, получавших препарат Галвус в дозе 50 мг 1 раз в сутки вместе с глимепиридом, составила 1,2% (по сравнению с 0,6% в группе плацебо + глимепирид). В группе применения препарата Галвус не наблюдалось развитие гипогликемии тяжелой степени.
При применении препарата Галвус в рекомендованной дозе (50 мг 1 раз в сутки) в комбинации с глимепиридом не отмечалось увеличение массы тела пациентов.
Со стороны нервной системы: часто — тремор, головокружение, головная боль.
Общие расстройства и нарушения в месте введения: часто — астения.
При применении препарата Галвус в дозе 50 мг 1 или 2 раза в сутки в комбинации с производными тиазолидиндиона
При применении препарата Галвус в дозе 50 мг 1 раз в сутки в комбинации с пиоглитазоном частота отмены терапии в связи с развитием нежелательных реакций составляла 0,7% (в группах вилдаглиптин (50 мг 2 раза в сутки) + пиоглитазон и плацебо + пиоглитазон случаи отмены терапии в связи с развитием нежелательных реакций не отмечались).
При применении препарата Галвус в дозе 50 мг 1 раз в сутки в комбинации с пиоглитазоном в дозе 45 мг не отмечалось развитие гипогликемии; в группе вилдаглиптин (в дозе 50 мг 2 раза в сутки) + пиоглитазон (в дозе 45 мг) отмечалось развитие гипогликемии в 0,6% случаев, а у пациентов, получавших плацебо + пиоглитазон в дозе 45 мг, — в 1,9% случаев. В группе применения препарата Галвус не наблюдалось развитие гипогликемии тяжелой степени. Среднее увеличение массы тела по сравнению с плацебо у пациентов, получавших препарат Галвус в дозе 50 мг 1 или 2 раза в сутки вместе с пиоглитазоном, составляло +0,1 или +1,3 кг соответственно. При добавлении препарата Галвус в дозе 50 мг 1 или 2 раза в сутки к пиоглитазону в дозе 45 мг/сут частота развития периферического отека составляла 8,2 и 7% соответственно (по сравнению с 2,5% на фоне монотерапии пиоглитазоном). Однако при назначении начальной комбинированной терапии вилдаглиптином в дозе 50 мг 1 или 2 раза в сутки вместе с пиоглитазоном в дозе 45 мг/сут развитие периферического отека наблюдалось у 3,5 или 6,1% больных соответственно (по сравнению с 9,3% на фоне монотерапии пиоглитазоном в дозе 30 мг/сут).
Общие расстройства и нарушения в месте введения: часто — периферический отек.
Лабораторные и инструментальные данные: часто — увеличение массы тела.
При применении препарата Галвус в дозе 50 мг 2 раза в сутки в комбинации с инсулином
При применении препарата в комбинации с инсулином (в комбинации с метформином или без метформина) частота отмены терапии вследствие развития побочных эффектов была равна 0,3% в группе терапии вилдаглиптином, в группе плацебо случаев отмены терапии не было.
При применении препарата в комбинации с инсулином (в комбинации с метформином или без метформина) не отмечалось увеличение риска развития гипогликемии по сравнению с комбинацией плацебо + инсулин (14% в группе вилдаглиптина и 16,4% в группе плацебо). У 2 пациентов в группе вилдаглиптина и у 6 пациентов в группе плацебо развилась гипогликемия тяжелой степени.
На момент завершения исследования препарат не оказывал влияние на среднюю массу тела (масса тела увеличена на +0,6 кг по сравнению с исходной в группе вилдаглиптина, а в группе плацебо изменения не отмечены).
При применении вилдаглиптина 50 мг 2 раза в день в комбинации с инсулином (с метформином или без него)
Со стороны нервной системы: часто — головная боль.
Со стороны ЖКТ: часто — тошнота, ГЭРБ; нечасто — диарея, метеоризм.
Общие расстройства и нарушения в месте введения: часто — озноб.
Лабораторные и инструментальные данные: часто — гипогликемия.
При применении препарата Галвус в комбинации с препаратами сульфонилмочевины и метформином
Случаи отмены препарата, связанные с НЯ в группе комбинированной терапии вилдаглиптином, метформином и глимепиридом, отмечены не были. В группе комбинированной терапии плацебо, метформином и глимепиридом частота НЯ составила 0,6%.
Гипогликемия отмечалась часто в обеих группах (5,1% в группе комбинированной терапии вилдаглиптином, метформином и глимепиридом и 1,9% в группе комбинированной терапии плацебо, метформином и глимепиридом). В группе вилдаглиптина отмечен один эпизод гипогликемии тяжелой степени.
На момент завершения исследования значимое влияние на массу тела выявлено не было (+0,6 кг в группе вилдаглиптина и −0,1 кг в группе плацебо).
При применении вилдаглиптина 50 мг 2 раза в день в комбинации с метформином и препаратами сульфонилмочевины
Со стороны нервной системы: часто — головокружение, тремор.
Общие расстройства и нарушения в месте введения: часто — утомляемость.
Со стороны обмена веществ и питания: часто — гипогликемия.
Со стороны кожи и подкожных тканей: часто — гипергидроз.
Постмаркетинговые исследования
Во время проведения постмаркетинговых исследований были выявлены следующие побочные реакциипобочные реакции (поскольку сообщения получены в добровольном порядке от популяции неопределенного размера, достоверно определить частоту развития данных НЯ не представляется возможным, в связи с чем они классифицированы как частота неизвестна): гепатит (обратим при прекращении терапии), крапивница, панкреатит, локальное шелушение кожи или образование пузырей.
Если любые из указанных в описании побочных эффектов усугубляются или пациент заметил любые другие побочные эффекты, не указанные в описании, следует сообщить об этом врачу.
Взаимодействие
Препарат Галвус обладает низким потенциалом лекарственного взаимодействия.
Поскольку препарат не является субстратом ферментов цитохрома Р450, а также не ингибирует и не индуцирует эти ферменты, взаимодействие препарата Галвус с лекарственными препаратами, которые являются субстратами, ингибиторами или индукторами цитохрома Р450, маловероятно. При одновременном применении вилдаглиптин также не влияет на скорость метаболизма препаратов, являющихся субстратами ферментов CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 и CYP3A4/5.
Клинически значимое взаимодействие препарата Галвус с препаратами, наиболее часто используемыми при лечении СД типа 2 (глибенкламид, пиоглитазон, метформин) или обладающими узким терапевтическим диапазоном (амлодипин, дигоксин, рамиприл, симвастатин, валсартан, варфарин) не установлено.
Передозировка
Препарат Галвус хорошо переносится при назначении в дозе до 200 мг/сут.
Симптомы: при применении препарата в дозе 400 мг/сут могут наблюдаться боли в мышцах, редко — легкие и транзиторные парестезии, лихорадка, отеки и транзиторное повышение концентрации липазы (выше ВГН в 2 раза). При увеличении дозы препарата Галвус до 600 мг/сут возможно развитие отеков конечностей с парестезиями и повышением концентрации КФК, АЛТ, С-реактивного белка и миоглобина. Все симптомы передозировки и изменения лабораторных показателей исчезают после прекращения применения препарата.
Лечение: выведение препарата из организма с помощью диализа маловероятно. Однако основной гидролизный метаболит вилдаглиптина (LAY151) может быть удален из организма путем гемодиализа.
Особые указания
Сердечная недостаточность
Поскольку данные о применении вилдаглиптина у пациентов с ХСН функционального класса III по классификации NYHA (см. таблицу 1) ограничены и не позволяют сделать окончательный вывод, рекомендуется с осторожностью применять препарат Галвус у данной категории пациентов.
Не рекомендуется применение вилдаглиптина у пациентов с ХСН функционального класса IV по классификации NYHA ввиду отсутствия данных клинических исследований о его применении у этой группы пациентов.
Таблица 1
Классификация NYHA функционального состояния пациентов с ХСН (в модификации), 1964
| Функциональный класс | Ограничение физической активности и клинические проявления |
| I | Ограничений в физической активности нет. Обычная физическая нагрузка не вызывает выраженное утомление, слабость, одышку или сердцебиение |
| II | Умеренное ограничение физической активности. В покое какие-либо патологические симптомы отсутствуют. Обычная физическая нагрузка вызывает слабость, утомляемость, сердцебиение, одышку и другие симптомы |
| III | Выраженное ограничение физической активности. Больной комфортно чувствует себя только в состоянии покоя, но малейшие физические нагрузки приводят к появлению слабости, сердцебиения, одышки и других симптомов |
| IV | Невозможность выполнять какие-либо нагрузки без появления дискомфорта. Симптомы сердечной недостаточности имеются в покое и усиливаются при любой физической нагрузке |
Нарушение функции печени
Поскольку в редких случаях при применении вилдаглиптина отмечалось повышение активности аминотрансфераз (как правило, без клинических проявлений), перед назначением препарата Галвус, а также регулярно в ходе первого года лечения препаратом (1 раз в 3 мес) рекомендуется определять биохимические показатели функции печени. Если у пациента выявлена повышенная активность аминотрансфераз, этот результат следует подтвердить повторным исследованием, а затем регулярно проводить определение биохимических показателей функции печени до тех пор, пока они не нормализуются. Если превышение активности АСТ или АЛТ до 3?ВГН подтверждено повторным исследованием, препарат рекомендуется отменить.
При развитии желтухи или других признаков нарушения функции печени на фоне применения препарата Галвус терапию препаратом следует немедленно прекратить. После нормализации показателей функции печени лечение препаратом возобновлять нельзя. При необходимости инсулинотерапии препарат Галвус применяют только в комбинации с инсулином.
Препарат не следует применять у пациентов с СД типа 1 или для лечения диабетического кетоацидоза.
Влияние на способность управлять транспортными средствами и/или работать с механизмами. Влияние препарата Галвус на способность управлять автотранспортом или работать с механизмами не установлено. При развитии головокружения на фоне лечения препаратом пациентам не следует управлять автотранспортом или работать с механизмами.
Форма выпуска
Таблетки, 50 мг. В блистере, 7 или 14 шт. 2, 4, 8, 12 бл. в картонной пачке.
Производитель
1. Новартис Фарма Штейн АГ, Швейцария.
2. Новартис Фармасьютика С.А., Испания.
Владелец регистрационного удостоверения: Новартис Фарма АГ. Лихтштрассе, 35, 4056 Базель, Швейцария.
Дополнительную информацию о препарате можно получить по адресу: 125315, Москва, Ленинградский пр-т, 72, корп. 3.
Тел.: (495) 967-12-70; факс: (495) 967-12-68.
В случае упаковки в Российской Федерации указывается: фасовка/упаковка/выпускающий контроль качества: ЗАО «ОРТАТ». Россия.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре не выше 30 °C, в оригинальной упаковке.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Состав
В таблетках содержатся активные компоненты: вилдаглиптин и метформина гидрохлорид.
Дополнительные составляющие: гипролоза, гипромеллоза, магния стеарат, титана диоксид, тальк, макрогол 4000, железа оксид жёлтый и красный.
Форма выпуска
Выпускается Галвус Мет в форме таблеток, покрытых плёночной оболочкой, в дозировках 50 мг + 500 мг, 50 мг + 850 мг или 50 мг + 1000 мг. Таблетки расфасованы в блистеры по 6 или 10 штук, по 1, 3, 5, 6, 12, 18, 36 блистеров в упаковке.
Фармакологическое действие
Данное лекарство обладает гипогликемическим фармакологическим действием.
Фармакодинамика и фармакокинетика
Галвус Мет включает в свой состав 2 гипогликемических средства, обладающих различными механизмами действия. При этом вилдаглиптин является ингибитором дипептидилпептидазы-4 (ДПП-4), а метформин гидрохлорида относится к бигуанидам. В комбинации данные компоненты способствуют эффективному контролю в течение суток концентрации глюкозы в составе крови при сахарном диабете типа 2.
Применение данного препарата приводит к статистически значимому стойкому снижению концентрации глюкозы крови. Одновременно с этим отмечаются только единичные случаи развития гипогликемии.
Установлено, что употребление еды не влияет на скорость и степень всасывания препарата, а концентрация активных веществ несколько снижается, но, в общем, зависит от принимаемой дозы.
Абсорбция Галвус Мет происходит быстро, биодоступность компонентов составляет около 85%. Когда лекарство принимают натощак, то присутствие его составляющих в плазме крови выявляется через 1-1,5 часа. В организме препарат преобразуется в метаболиты, которые выводятся при помощи почек и незначительная часть с калом.
Показания к применению лекарства
Основным показанием к приёму Галвус Мет является терапия при сахарном диабете типа 2 в случаях, если:
- монотерапия вилдаглиптином или метформином оказывается не эффективной;
- не удаётся адекватно контролировать гликемию при других вариантах лечения и так далее.
Противопоказания к использованию
Галвус Мет не назначается при:
- высокой чувствительности к его компонентам;
- почечной недостаточности и других нарушений в работе почек;
- острых формах заболеваний, способных вызвать развитие нарушений функций почек – дегидратации, лихорадке, инфекциях, гипоксии и так далее;
- нарушениях функций печени;
- сахарном диабете типа 1;
- хроническом алкоголизме, остром отравлении алкоголем;
- лактации, беременности;
- соблюдении гипокалорийной диеты;
- детском возрасте до 18 лет.
С осторожностью таблетки назначаются пациентам от 60 лет, работающим на тяжелом физическом производстве, так как возможно развитие лактоацидоза.
Побочные эффекты
При лечении Галвус Мет возможно развитие нежелательных явлений, которые проявляются: сильной головной болью, головокружениями, тремором. Также могут возникать нарушения в деятельности ЖКТ: тошнота, диарея, гастроэзофагеальный рефлюкс, метеоризм. Хотя приём данного препарата сводит к минимуму появление гипогликемии, не следует исключать развитие её симптомов.
Галвус Мет, инструкция по применению (Способ и дозировка)
Данный препарат предназначен для приёма внутрь. Дозировка Галвус Мет подбирается индивидуально и зависит от эффективности лечения и переносимости компонентов. Во время терапии рекомендуется строго соблюдать назначенную суточную дозу вилдаглиптина, которая не должна превышать 100 мг.
В начале лечения доза подбирается с учётом продолжительности течения заболевания, уровня гликемии, состояния пациента и применяемой до этого терапевтической схемы. Чтобы снизить выраженность побочных эффектов, связанных с работой пищеварительной системы, лекарство принимается во время еды.
Обычно лечение начинают с одной таблетки 50 мг + 500 мг, которую принимают 2 раза в сутки. Оценив терапевтический эффект, постепенно можно повысить дозирование.
Если монотерапия метформином оказалась неэффективной, то с учётом ранее принимаемого метформина, может быть назначена одна таблетка больше всего подходящей дозировки к приёму 2 раза в сутки.
При назначении начальной дозы препарата пациентам, получавшим комбинированную терапию отдельными таблетками вилдаглиптина и метформина, подбирается максимально близкое дозирование.
В составе комбинированной терапии Галвус Мет и производных сульфонилмочевины или инсулина дозу рассчитывает из количества вилдаглиптина 50 мг × 2 раза, то есть 100 мг в сутки, а метформин в дозировке, приближенной к принимаемой в монолечении.
Передозировка
Как известно, вилдаглиптин в составе данного препарата хорошо переносится при приёме в суточном дозировании до 200 мг. В других случаях возможно появление мышечных болей, отёчности и лихорадки. Обычно симптомы передозировки можно устранить отменой препарата.
В случаях передозировки метформином, симптомы которой могут развиваться при приёме препарата от 50 г, возможно возникновение гипогликемии, лактоацидоза, сопровождаемого тошнотой, рвотой, диарей, понижением температуры тела, болями в животе и мышцах, учащением дыхания, головокружением. Тяжёлые формы приводят к нарушению сознания и развитию коматозного состояния.
При этом проводят симптоматическое лечение, выполняют процедуру гемодиализа и так далее.
Следует отметить, что для пациентов, которые получают инсулин, назначение Галвус Мет не является заменой инсулина.
Взаимодействие
Вилдаглиптин не относится к субстратам ферментов цитохрома Р450, не является ингибитором и индуктором данных ферментов, поэтому практически не взаимодействует с субстратами, индукторами или ингибиторамиР450. При этом его одновременное применение с субстратами некоторых ферментов не влияет на скорость метаболизма этих компонентов.
Также одновременное применение вилдаглиптина и других препаратов, назначаемых при сахарном диабете типа 2, к примеру: Глибенкламида, пиоглитазона, метформина и лекарств с узким терапевтическим диапазоном – амлодипина, дигоксина, рамиприла, симвастатина, Валсартана, варфарина не вызывает клинически значимого взаимодействия.
Сочетание фуросемида и метформина оказывает взаимное влияние на концентрацию этих веществ в организме. Нифедипин повышает всасывание и выведение метформина в составе мочи.
Органические катионы, такие как: Амилорид, Дигоксин, Прокаинамид, Хинидин, Морфин, Хинин, Ранитидин, триметоприм, Ванкомицин, Триамтерен и другие, при взаимодействие с метформином по причине конкурирования за общий транспорт почечных канальцев могут повысить его концентрацию в составе плазмы крови. Поэтому применение Галвус Мет в подобных комбинациях требует осторожности.
Сочетание препарата с тиазидами, другими диуретиками, фенотиазинами, препаратами гормонов щитовидной железы, эстрогенами, пероральными контрацептивами, фенитоином, никотиновой кислотой, симпатомиметиками, антагонистами кальция и изониазида, способно спровоцировать гипергликемию и понизить эффективность гипогликемических средств.
Поэтому когда одновременно назначают или отменяют подобные препараты, требуется тщательный контроль эффективности метформина – его гипогликемического действия и при необходимости коррекция дозировки. От сочетания с даназолом рекомендуется воздержаться, чтобы избежать проявления его гипергликемического действия.
Приём высоких доз хлорпромазина может повысить гликемию, так как он понижает высвобождение инсулина. Проведение лечения нейролептиками также требует коррекции дозирования и контроля концентрации глюкозы.
Комбинированная терапия с йодсодержащими рентгеноконтрастными средствами, например, проведение радиологического исследования с их использованием, нередко вызывает развитие лактоацидоза при сахарном диабете и функциональной почечной недостаточности.
Повысить гликемию способны инъекционные β2-симпатомиметики в результате стимуляции β2-рецепторов. По этой причине нужно контролировать гликемию, возможно назначение инсулина.
Одновременный приём Метформина и производных сульфонилмочевины, инсулина, акарбозы, салицилатов может усилить гипогликемическое действие.
Условия продажи
Лекарство отпускается по рецепту.
Условия хранения
Таблетки нужно хранить в тёмном, сухом месте, недоступном для детей, при температуре до 30°C.
Срок годности
18 мес.
Аналоги Галвус Мет
Совпадения по коду АТХ 4-го уровня:
Основные аналоги препарата представлены лекарствами: Галвус и Вилдаглиптин.
Алкоголь и Галвус Мет
При лечении этим препаратом рекомендуется полный отказ от употребления спиртосодержащих напитков. Как известно, в таких случаях алкоголь вызывает развитие побочных эффектов и приводит к осложнению заболевания.
Отзывы о Галвус Мет
Как показывают отзывы о Галвус Мет (хотя многие ошибочно думают,что название препарата — «Галвус Мед»), это лекарство назначают многим пациентам, страдающим сахарным диабетом типа 2. Однако принимают его обычно те люди, у которых заболевание было диагностировано не так давно. Нередко они отмечают, что подобная терапия позволяет им нормализовать самочувствие и избежать развития нежелательных симптомов, сопровождаемых течение сахарного диабета.
Конечно, часто отзывы о препарате являются подтверждением его эффективности, но при этом пользователи жалуются на высокую стоимость лекарства. Поэтому, несмотря на то, что таблетки многим помогают, они вынуждены другую замену, подешевле.
Одновременно с характеристикой препарата встречаются описания и других способов поддержания нормального состояния при сахарном диабете. Это указывает на то, что терапия в таких случаях должна проводиться комплексно.
Цена Галвус Мет, где купить
Данный препарат можно купить в Москве практически в любой аптеке или интернет-аптеке. При этом цена Галвус 50 мг + 1000 мг за 30 штук варьируется в пределах 1180-1400 рублей.
- Интернет-аптеки РоссииРоссия
ЗдравСити
-
Галвус Мет таблетки п/о плён. 50мг+1000мг 30штООО Новартис Нева
-
Галвус Мет таблетки п/о плён. 50мг+850мг 30штООО Новартис Нева
-
Галвус Мет таблетки п/о плён. 50мг+500мг 30штООО Новартис Нева
Аптека Диалог
-
Галвус Мет таблетки 50мг+1000мг №30Новартис Нева ООО
-
Галвус Мет таблетки 50+500мг №30Novartis/Новартис Нева
-
Галвус Мет таблетки 50+850мг №30Novartis Farma/Новартис Нева ООО
-
Галвус Мет таблетки 50мг+1000мг №30Novartis
-
Галвус Мет таблетки 50+500мг №30Novartis
показать еще

Товары из категории — Эндокринология
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 813
Фармакологические свойства
Препарат Галвус относится к гликемическим средствам, которые назначаются при инсулиннезависимой сахарно-диабетической патологии. Действующее вещество – вилдаглиптин. Это стимулятор островков Лангерганса поджелудочного органа, которые представляют собой гормон-продуцирующую ткань в виде специфических клеток. Он избирательно блокирует неспецифический фермент-протеазу DPP 4 типа, в результате чего повышается базальная и возбужденная приемом продуктов питания секреция инкретинов из полости кишечника в общее русло кровоснабжения на протяжении всего дня.
Увеличивая плотность инкретинов, вилдаглиптин усиливает степень сенсибилизации бета-частиц поджелудочной системы к глюкозе, улучшая, таким образом, глюкозозависимое воспроизводство инсулинового компонента.
В результате введения активного медикамента Галвус в дозировке от 0,05 до 0,1 г в течение суток больным с эндокринным недугом второго типа (СД 2-го типа) наблюдается активизация функционала бета-частиц. Уровень такого ответа часто определяется первоначальным расстройством. Установлено, что у добровольцев, у которых отсутствует подобное заболевание (нормальная плотность сахаров в кровяной плазме), вилдаглиптин не усиливает выработку инсулинового соединения, сохраняя при этом плотность сахаров на стабильном уровне.
Повышение пропорции инсулин/глюкагон при гипергликемии приводит к падению активности печени независимо от времени употребления еды и к снижению плотности сахаров в плазме кровяной субстанции. В инструкции указано, что вилдаглиптин понижает и плотность жиров, особенно после приема пищи. Но данный эффект не объясняется влиянием инкретинов и активацией панкреатических островков внутрисекреторного механизма.
Установлено, что рост плотности инкретинов ГПП-1 ингибирует выход пищевой массы из желудка, но при использовании основного действующего ингредиента подобное явление отсутствует. Внедрение вилдаглиптина и метформина на протяжении полугода при начальной фазе терапии СД 2-го типа приводило к дозозависимому падению плотности гемоглобина по сравнению с однокомпонентной терапией одним из представленных препаратов. Прецеденты развития симптоматики снижения уровня глюкозы при этом не зафиксированы.
Однократное введение Галвус в количестве 50 мг в сутки на протяжении 24 недель больным с эндокринным недугом второго типа и расстройством функционала почек в средней или тяжелой форме вызывало снижение плотности гемоглобина в сравнении с плацебо. Подобные показатели были получены при двукратном употреблении вилдаглиптина в течение суток в вышеназванной дозировке пациентами с почечной дисфункцией средней и тяжелой степени.
Состав и форма выпуска
Основным действующим компонентом препарата является вилдаглиптин, введенный в формулу в дозировке 50 мг. Изготавливается лекарство в форме таблеток, которые упаковываются по 7 и 14 единиц в блистеры. В пачке может содержаться 2, 4, 8 и 12 блистеров.
Показания к применению
Галвус назначается в случае заболевания сахарным диабетическим синдромом второго типа:
Международная классификация болезней (МКБ-10)
Е11 Сахарная диабетическая патология 2 типа, не зависящая от приема инсулина.
Побочные эффекты
Все наблюдавшиеся коллатеральные явления, связанные с введением Галвуса, независимо от того, была это монотерапия или комплексное лечение, имели слабовыраженный и обратимый характер. Отмена курса не требовалась. Взаимосвязь между частотностью нежелательных реакций и возрастными, половыми или расовыми отличиями не обнаружена.
Вероятность формирования ангионевротической отечности в корреляции с использованием медикамента определяется, как очень редкое явление. Исключением являются препараты, замедляющие рост артериального давления. В основном отеки имели средний уровень тяжести и проходили самостоятельно, без прекращения терапии рассматриваемым фармацевтическим продуктом.
Использование медикамента Галвус влияет на работоспособность гепатобилиарной системы, особенно печеночной структуры в форме развития гепатита с отсутствием признаков патологии. После прекращения терапии все отклонения проходят самостоятельно без формирования побочных явлений.
Лечение с внедрением одного лекарства приводит к развитию нарушений со стороны:
В инструкции описаны случаи развития акцидентных явлений и со стороны:
Зарегистрированы случаи развития инфекционных и паразитарных заболеваний, особенно верхних дыхательных органов.
Противопоказания
Как указывает аннотация по использованию, лекарство запрещается к назначению при:
Несовершеннолетним лицам младше 18 лет средство Галвус к употреблению не рекомендовано.
Применение при беременности
Достоверной и проверенной информации по поводу введения медпродукта в период беременности и о возможности его проникновении в грудное молоко не существует. Однако известно о токсическом влиянии вещества на организм в повышенной дозировке.
Способ и особенности применения
Обычная норма введения медикамента составляет 0,05 г в сутки при однократном и 0,1 г – при 2-кратном использовании. В последнем случае эта величина является максимальной суточной нормой. Таблетки принимаются перорально вне зависимости от времени употребления продуктов питания.
Людям, страдающим расстройством почечного состава в легкой и средней форме, коррекция дозы и схемы внедрения не проводится. В случае острого протекания воспаления почечной структуры максимальная доза медикамента составляет не более 0,05 г с однократным введением в течение суток. В аннотации по применению не предусматривается титрование норм возрастным больным старше 65 лет.
Совместимость с алкоголем
Совместное использование алкогольных напитков и таблеток Галвус противопоказано в связи с развитием непредсказуемых осложнений.
Взаимодействие с другими лекарствами
Длительная (в течение года) монотерапия одним лекарством или комплексное его использование вместе с метформином, метаболитами сульфонилмочевины или инсулиновым раствором ведет к стабильному падению уровня гемоглобина и сахаров в кровяной субстанции натощак.
Точно известно о низкой реакционной способности вилдаглиптина, входящего в состав Галвус, поскольку он не относится к числу метаболитов ферментов цитохрома. Материал не замедляет и не генерирует данные ферментативные соединения. Установлено, что фармакологическое изделие не изменяет скорость реакций обмена веществ, которые относятся к продуктам расщепления разных ферментов.
Существенной терапевтической корреляции между фармсредством и лекарствами, которые назначаются при терапии эндокринного нарушения диабетической формы 2 типа, не установлено. Глюкокортикостероидные медикаменты, тиазиды, гормональные средства, назначаемые при заболевании щитовидной железы, влияют на гипогликемические характеристики фармизделя Галвус, понижая его действенность.
Частотность формирования ангионевротической отечности повышалась при комбинированном использовании вилдаглиптина и замедлителей АПФ. Симптомы нежелательной реакции имели среднюю степень осложнения и исчезали без отмены фармвещества.
Передозировка
Тестирование показало, что увеличение дозировки до 200 мг не вызывает серьезных побочных явлений и достаточно хорошо переносится организмом больного человека. Дальнейшее увеличение материала до 0, 4 г способно вызвать болевой синдром в мышечно-скелетной группе, онемение, лихорадочное состояние, отечность и транзиторный рост активизации пищеварительного фермента – липазы. Даже на фоне увеличения овердозы до 0,6 г все коллатеральные симптомы исчезают после отмены терапии.
Галвус не выводится с использованием инструментальных методов очистки крови. Единственным веществом, которое подвергается выведению с помощью гемодиализа, является продукт распада вилдаглиптина — LAY151.
Аналоги
Похожими по клиническим и терапевтическим характеристикам, т.е. аналогами, являются такие средства, как Галвус и Вилдаглиптин. Аналоги Галвуса лучше использовать после консультации с врачом.
Условия продажи
Медпродукт Галвус реализуется в аптечной розничной сети по рецепту врача.
Условия хранения
В соответствии с аннотацией, фармизделие необходимо содержать в сухом и темном месте, недоступном для несовершеннолетних лиц, при температуре на более 30°С. Срок хранения — 3 года.
Цены на Галвус в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 813 руб.
Сертификаты и лицензии
Галвус® (Galvus®)
💊 Состав препарата Галвус®
✅ Применение препарата Галвус®
Описание активных компонентов препарата
Галвус®
(Galvus®)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2020.03.25
Владелец регистрационного удостоверения:
Код ATX:
A10BH02
(Вилдаглиптин)
Лекарственная форма
| Галвус® |
Таб. 50 мг: 14, 28, 56, 84, 112 или 168 шт. рег. №: ЛП-(000761)-(РГ-RU) Предыдущий рег. №: ЛСР-008119/08 |
Форма выпуска, упаковка и состав
препарата Галвус®
Таблетки от белого до светло-желтого цвета, круглые, гладкие, со скошенными краями, с гравировкой «NVR» на одной стороне и «FB» на другой стороне.
Вспомогательные вещества: целлюлоза микрокристаллическая, лактоза, карбоксиметилкрахмал натрия, магния стеарат.
7 шт. — блистеры (2) — пачки×.
7 шт. — блистеры (4) — пачки×.
7 шт. — блистеры (8) — пачки×.
7 шт. — блистеры (12) — пачки×.
14 шт. — блистеры (2) — пачки×.
14 шт. — блистеры (4) — пачки×.
14 шт. — блистеры (8) — пачки×.
14 шт. — блистеры (12) — пачки×.
× допускается наличие контроля первичного вскрытия на картонной пачке.
Фармакологическое действие
Гипогликемическое средство. Вилдаглиптин — представитель класса стимуляторов островкового аппарата поджелудочной железы, селективно ингибирует фермент дипептидилпептидазу-4 (ДПП-4). Быстрое и полное ингибирование активности ДПП-4 (> 90%) вызывает повышение как базальной, так и стимулированной приемом пищи секреции глюкагоноподобного пептида 1 типа (ГПП-1) и глюкозо-зависимого инсулинотропного полипептида (ГИП) из кишечника в системный кровоток в течение всего дня.
Увеличивая уровни ГПП-1 и ГИП, вилдаглиптин вызывает повышение чувствительности β-клеток поджелудочной железы к глюкозе, что приводит к улучшению глюкозозависимой секреции инсулина. При применении вилдаглиптина в дозе 50-100 мг/сут у больных с сахарным диабетом 2 типа отмечается улучшение функции β-клеток поджелудочной железы. Степень улучшения функции β-клеток зависит от степени их исходного повреждения; так у лиц, не страдающих сахарным диабетом (с нормальным уровнем глюкозы в плазме крови) вилдаглиптин не стимулирует секрецию инсулина и не снижает уровень глюкозы.
Повышая уровни эндогенного ГПП-1, вилдаглиптин увеличивает чувствительность α-клеток к глюкозе, что приводит к улучшению глюкозозависимой регуляции секреции глюкагона. Снижение уровня избыточного глюкагона во время еды, в свою очередь, вызывает уменьшение инсулинорезистентности.
Увеличение соотношения инсулин/глюкагон на фоне гипергликемии, обусловленное повышением уровней ГПП-1 и ГИП, вызывает уменьшение продукции глюкозы печенью как в прандиальный период, так и после приема пищи, что приводит к снижению уровня глюкозы в плазме крови.
Кроме того, на фоне применения вилдаглиптина отмечается снижение уровня липидов в плазме крови, однако этот эффект не связан с его действием на ГПП-1 или ГИП и улучшением функции β-клеток поджелудочной железы.
Известно, что повышение уровня ГПП-1 может приводить к замедлению опорожнения желудка, однако на фоне применения вилдаглиптина подобного эффекта не наблюдается.
При применении вилдаглиптина у 5795 больных с сахарным диабетом 2 типа в течение от 12 до 52 недель в качестве монотерапии или в комбинации с метформином, производными сульфонилмочевины, тиазолидиндионом, или инсулином отмечается достоверное длительное снижение концентрации гликированного гемоглобина (HbA1с) и глюкозы крови натощак.
Фармакокинетика
Вилдаглиптин быстро абсорбируется при приеме внутрь с абсолютной биодоступностью 85%. В терапевтическом диапазоне доз увеличение Cmax вилдаглиптина в плазме и AUC практически прямо пропорционально повышению дозы.
После приема внутрь натощак время достижения Cmax вилдаглиптина в плазме крови составляет 1 ч 45 мин. При одновременном приеме с пищей скорость абсорбции снижается незначительно: отмечается уменьшение Cmax на 19% и увеличение времени ее достижения до 2 ч 30 мин. Однако прием пищи не оказывает влияния на степень абсорбции и AUC.
Связывание вилдаглиптина с белками плазмы низкое (9.3%). Эквивалентно распределяется между плазмой и эритроцитами. Распределение вилдаглиптина происходит предположительно экстраваскулярно, Vd в равновесном состоянии после в/в введения составляет 71 л.
Биотрансформация является основным путем выведения вилдаглиптина. В организме у человека подвергается превращению 69%. Основной метаболит — LAY151 (57% дозы) фармакологически неактивен и является продуктом гидролиза циано-компонента. Около 4% подвергается амидному гидролизу. В экспериментальных исследованиях отмечается положительное влияние ДПП-4 на гидролиз активного вещества. Вилдаглиптин не метаболизируется при участии изоферментов цитохрома Р450, не является субстратом, не ингибирует и не индуцирует данные изоферменты.
После приема внутрь около 85% выводится почками и 15% — через кишечник, почечная экскреция неизмененного вилдаглиптина составляет 23%. T1/2 после приема внутрь составляет около 3 ч независимо от дозы.
Показания активных веществ препарата
Галвус®
Сахарный диабет 2 типа: в качестве монотерапии в сочетании с диетотерапией и физическими упражнениями; в составе двухкомпонентной комбинированной терапии с метформином, производными сульфонилмочевины, тиазолидиндионом или с инсулином в случае неэффективности диетотерапии, физических упражнений и монотерапии этими препаратами.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Режим дозирования устанавливают индивидуально в зависимости эффективности, переносимости и схемы терапии.
Разовая доза — 50 мг, суточная доза — 100 мг (по 50 мг 2 раза/сут).
Побочное действие
Со стороны пищеварительной системы: иногда — запоры; редко — нарушения функции печени (включая гепатит) бессимптомного течения; при комбинации с инсулином часто — тошнота, метеоризм, ГЭРБ.
Со стороны ЦНС: часто — тремор, головокружение, головная боль.
Со стороны обмена веществ: часто — гипогликемия, увеличение массы тела.
Аллергические реакции: редко — ангионевротический отек (чаще при комбинации с ингибиторами АПФ).
Прочие: часто — астения, периферические отеки.
Противопоказания к применению
Повышенная чувствительность к вилдаглиптину.
Применение при беременности и кормлении грудью
Адекватных и строго контролируемых клинических исследований безопасности применения вилдаглиптина при беременности и в период лактации не проводилось, поэтому не следует применять вилдаглиптин при беременности и в период грудного вскармливания.
При нарушениях обмена глюкозы у беременных женщин отмечается повышение риска развития врожденных аномалий, а также частоты неонатальной заболеваемости и смертности.
Неизвестно, выделяется ли вилдаглиптин с грудным молоком у человека.
Применение при нарушениях функции печени
Не рекомендуется применять у пациентов с тяжелыми нарушениями функции печени, в т.ч. при повышении активности АЛТ или АСТ > 2.5 раза выше ВГН.
Перед началом лечения, а также регулярно (1 раз в 3 месяца) в ходе первого года лечения, рекомендуется определять биохимические показатели функции печени. В случае выявления повышенной активности аминотрансфераз, этот результат следует подтвердить повторным исследованием, а затем регулярно проводить определение биохимических показателей функции печени до тех пор, пока они не нормализуются. Если превышение активности АСТ или АЛТ в 3 раза и более ВГН подтверждено повторным исследованием, то вилдаглиптин рекомендуется отменить.
При развитии желтухи или других признаков нарушения функции печени терапию вилдаглиптином следует немедленно прекратить. После нормализации показателей функции печени лечение возобновлять нельзя.
Применение при нарушениях функции почек
Не рекомендуется применять у пациентов с умеренными или тяжелыми нарушениями функции почек (включая терминальную стадию почечной недостаточности и необходимостью проведения гемодиализа), т.к. данные о безопасности применения у данной категории пациентов ограничены.
Применение у детей
Эффективность и безопасность применения вилдаглиптина у детей и подростков в возрасте до 18 лет не установлены.
Особые указания
Не рекомендуется применять у пациентов с тяжелыми нарушениями функции печени, в т.ч. при повышении активности АЛТ или АСТ > 2.5 раза выше ВГН.
Не рекомендуется применять у пациентов с умеренными или тяжелыми нарушениями функции почек (включая терминальную стадию почечной недостаточности и необходимостью проведения гемодиализа), т.к. данные о безопасности применения у данной категории пациентов ограничены.
Перед началом лечения, а также регулярно (1 раз в 3 месяца) в ходе первого года лечения, рекомендуется определять биохимические показатели функции печени. В случае выявления повышенной активности аминотрансфераз, этот результат следует подтвердить повторным исследованием, а затем регулярно проводить определение биохимических показателей функции печени до тех пор, пока они не нормализуются. Если превышение активности АСТ или АЛТ в 3 раза и более ВГН подтверждено повторным исследованием, то вилдаглиптин рекомендуется отменить.
При развитии желтухи или других признаков нарушения функции печени терапию вилдаглиптином следует немедленно прекратить. После нормализации показателей функции печени лечение возобновлять нельзя.
При необходимости инсулинотерапии вилдаглиптин применяют только в комбинации с инсулином.
Вилдаглиптин не следует применять для лечения сахарного диабета 1 типа или для лечения диабетического кетоацидоза.
Использование в педиатрии
Эффективность и безопасность применения вилдаглиптина у детей и подростков в возрасте до 18 лет не установлены.
Влияние на способность к управлению транспортными средствами и механизмами
При развитии головокружения на фоне лечения препаратом пациентам не следует заниматься потенциально опасными видами деятельности (в т.ч. управлением транспортными средствами).
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Фармакологическое действие
Гипогликемическое средство — дипептидилпептидазы-4 ингибитор.
Состав и форма выпуска Галвус 50мг 28 шт. таблетки
Таблетки — 1 таб.:
- действующее вещество: вилдаглиптин 50,0 мг;
- вспомогательные вещества: целлюлоза микрокристаллическая — 95,68 мг, лактоза — 47,82 мг, карбоксиметилкрахмал натрия — 4,0 мг, магния стеарат — 2,5 мг.
По 7 или 14 шт. в блистере.
По 2, 4, 8, 12 блистеров вместе с инструкцией по применению в картонной пачке.
Описание лекарственной формы
От белого до светло-желтого цвета, круглые, гладкие таблетки со скошенными краями, с гравировкой “NVR» на одной стороне и “FB” на другой стороне.
Способ применения и дозы
Внутрь, независимо от приема пищи.
Режим дозирования препарата следует подбирать индивидуально, в зависимости от эффективности и переносимости.
Рекомендуемая доза препарата при проведении монотерапии или в составе двухкомпонентной комбинированной терапии с метформином, тиазолидиндионом или инсулином (в комбинации с метформином или без него) — 50 или 100 мг 1 раз в сутки. У пациентов с более тяжелым течением СД типа 2, получающих лечение инсулином, препарат Галвус рекомендуется применять в дозе 100 мг/сут.
Рекомендованная доза препарата Галвус в составе тройной комбинированной терапии (вилдаглиптин + производные сульфонилмочевины + метформин) составляет 100 мг/сут.
Дозу 50 мг/сут следует принимать 1 раз утром, дозу 100 мг/сут следует делить на 2 приема по 50 мг утром и вечером. В случае пропуска приема, следующую дозу препарата следует принять как можно раньше, при этом не следует превышать суточную дозу.
При применении в составе двухкомпонентной комбинированной терапии с производными сульфонилмочевины рекомендуемая доза препарата Галвус составляет 50 мг 1 раз в сутки утром. При назначении в комбинации с производными сульфонилмочевины эффективность терапии препаратом в дозе 100 мг/сут была сходной с таковой в дозе 50 мг/сут.
При недостаточном клиническом эффекте на фоне применения максимальной рекомендуемой суточной дозы 100 мг для лучшего контроля гликемии возможно дополнительное назначение других гипогликемических препаратов — метформина, производных сульфонилмочевины, тиазолидиндиона или инсулина.
Особые группы пациентов
Нарушение функции печени или почек. У пациентов с нарушением функции почек и печени легкой степени тяжести не требуется коррекция режима дозирования препарата. У пациентов с нарушением функции почек средней и тяжелой степени (включая терминальную стадию ХПН на гемодиализе) препарат следует применять в дозе 50 мг 1 раз в сутки.
Пациенты ≥65 лет. У пациентов пожилого возраста не требуется коррекция режима дозирования препарата Галвус.
Применение у пациентов ≤18 лет. Поскольку опыта применения препарата Галвус у детей и подростков младше 18 лет нет, не рекомендуется применять препарат у данной категории пациентов.
Фармакодинамика
Вилдаглиптин — представитель класса стимуляторов островкового аппарата поджелудочной железы, селективно ингибирует фермент дипептидилпептидазу-4 (ДПП-4). Быстрое и полное ингибирование активности ДПП-4 (>90%) вызывает повышение как базальной, так и стимулированной приемом пищи секреции глюкагоноподобного пептида 1-го типа (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП) из кишечника в системный кровоток в течение всего дня.
Повышая концентрацию ГПП-1 и ГИП, вилдаглиптин вызывает повышение чувствительности β-клеток поджелудочной железы к глюкозе, что приводит к улучшению глюкозозависимой секреции инсулина.
При применении вилдаглиптина в дозе 50–100 мг/сут у пациентов с сахарным диабетом (СД) типа 2 отмечается улучшение функции β-клеток поджелудочной железы. Степень улучшения функции β-клеток зависит от степени их исходного повреждения; так у лиц, не страдающих СД (с нормальной концентрацией глюкозы в плазме крови), вилдаглиптин не стимулирует секрецию инсулина и не снижает уровень глюкозы.
Повышая концентрацию эндогенного ГПП-1, вилдаглиптин увеличивает чувствительность α-клеток к глюкозе, что приводит к улучшению глюкозозависимой регуляции секреции глюкагона. Снижение повышенной концентрации глюкагона во время еды в свою очередь вызывает уменьшение инсулинорезистентности.
Увеличение соотношения инсулин/глюкагон на фоне гипергликемии, обусловленное повышением уровней ГПП-1 и ГИП, вызывает уменьшение продукции глюкозы печенью как в прандиальный период, так и после приема пищи, что приводит к снижению концентрации глюкозы в плазме крови.
Кроме того, на фоне применения вилдаглиптина отмечается снижение концентрации липидов в плазме крови, однако этот эффект не связан с его действием на ГПП-1 или ГИП и улучшением функции β-клеток поджелудочной железы.
Известно, что повышение уровня ГПП-1 может приводить к замедлению опорожнения желудка, однако на фоне применения вилдаглиптина подобный эффект не наблюдается.
При применении вилдаглиптина у 5795 пациентов с СД типа 2 в течение от 12 до 52 нед в качестве монотерапии или в комбинации с метформином, производными сульфонилмочевины, тиазолидиндионом или инсулином отмечается достоверное длительное снижение концентрации гликированного гемоглобина (HbA1c) и глюкозы крови натощак.
При применении комбинации вилдаглиптина и метформина в качестве начальной терапии пациентов с СД типа 2 в течение 24 нед отмечалось дозозависимое снижение показателей HbA1cи массы тела в сравнении с монотерапией данными препаратами. Случаи развития гипогликемии были минимальны в обеих группах терапии.
В клиническом исследовании при применении вилдаглиптина в дозе 50 мг 1 раз в сутки в течение 6 мес у пациентов с СД типа 2 с нарушением функции почек средней (скорость клубочковой фильтрации — СКФ — ≥30, но <50 мл/мин/1,73 м2) или тяжелой (СКФ <30 мл/мин/1,73 м2) степени отмечалось клинически значимое снижение HbA1cпо сравнению с группой, получающей плацебо.
В клиническом исследовании при применении вилдаглиптина в дозе 50 мг 2 раза в сутки совместно/без метформина в комбинации с инсулином (средняя доза 41 ЕД/сут) у пациентов с СД типа 2 отмечено снижение показателя HbA1cв конечной точке (−0,77%), при исходном показателе в среднем 8,8%. При этом различие с плацебо (−0,72%) было статистически достоверным. Частота гипогликемии в группе, получавшей исследуемый препарат, была сравнима с частотой гипогликемии в группе применения плацебо.
В клиническом исследовании при применении вилдаглиптина в дозе 50 мг 2 раза в сутки одновременно с метформином (≥1500 мг/сут) в комбинации с глимепиридом (≥4 мг/сут) у пациентов с СД типа 2 показатель HbA1cстатистически значимо снизился на 0,76% (исходный показатель в среднем 8,8%).
Фармакокинетика
Абсорбция. Вилдаглиптин быстро абсорбируется при приеме внутрь с абсолютной биодоступностью 85%. В терапевтическом диапазоне доз увеличение Cmaxвилдаглиптина в плазме и AUC практически прямо пропорционально повышению дозы препарата.
После приема внутрь натощак Tmaxвилдаглиптина в плазме крови составляет 1 ч 45 мин. При одновременном приеме с пищей скорость абсорбции препарата снижается незначительно: отмечается уменьшение Сmaxна 19% и увеличение Tmaxдо 2 ч 30 мин. Однако прием пищи не оказывает влияние на степень абсорбции и AUC.
Распределение. Связывание вилдаглиптина с белками плазмы низкое (9,3%). Препарат распределяется эквивалентно между плазмой и эритроцитами. Распределение вилдаглиптина происходит предположительно экстраваскулярно, Vssпосле в/в введения составляет 71 л.
Метаболизм. Биотрансформация является основным путем выведения вилдаглиптина. В организме у человека подвергается превращению 69% дозы препарата. Основной метаболит — LAY151 (57% дозы) — фармакологически неактивен и является продуктом гидролиза цианокомпонента. Около 4% дозы препарата подвергается амидному гидролизу.
В экспериментальных исследованиях отмечается положительное влияние ДПП-4 на гидролиз препарата. Вилдаглиптин не метаболизируется при участии изоферментов цитохрома Р450. Вилдаглиптин не является субстратом изоферментов CYP450, не ингибирует и не индуцирует изоферменты цитохрома P450.
Выведение. После приема препарата внутрь около 85% дозы выводится почками и 15% — через кишечник, почечная экскреция неизмененного вилдаглиптина составляет 23%. T1/2после приема внутрь составляет около 3 ч независимо от дозы. Пол, индекс массы тела и этническая принадлежность не оказывают влияние на фармакокинетику вилдаглиптина.
Особые группы пациентов
Нарушение функции печени. У пациентов с нарушением функции печени легкой и средней степени тяжести (6–10 баллов по классификации Чайлд-Пью) после однократного применения препарата отмечается снижение биодоступности вилдаглиптина на 20 и 8% соответственно. У пациентов с нарушением функции печени тяжелой степени (12 баллов по классификации Чайлд-Пью) биодоступность вилдаглиптина повышается на 22%. Увеличение или уменьшение максимальной биодоступности вилдаглиптина, не превышающее 30%, не является клинически значимым. Корреляция между степенью тяжести нарушений функции печени и биодоступностью препарата не выявлена.
Нарушение функции почек. У пациентов с нарушением функции почек легкой, средней или тяжелой степени AUC вилдаглиптина увеличивалась по сравнению со здоровыми добровольцами в 1,4; 1,7 и 2 раза соответственно. AUC метаболита LAY151 увеличивалась в 1,6; 3,2; и 7,3 раза, а метаболита BQS867 — в 1,4; 2,7; и 7,3 раза у пациентов с нарушением функции почек легкой, средней и тяжелой степени соответственно. Ограниченные данные у пациентов с терминальной стадией ХПН указывают на то, что показатели данной группы схожи с таковыми у пациентов с нарушением функции почек тяжелой степени. Концентрация метаболита LAY151 у пациентов с терминальной стадией ХПН увеличивалась в 2–3 раза по сравнению с пациентами с нарушением функции почек тяжелой степени. При применении препарата у пациентов с нарушением функции почек может потребоваться коррекция дозы. Выведение вилдаглиптина при гемодиализе ограничено (через 4 ч после однократного приема составляет 3% при длительности процедуры более 3–4 ч).
Пациенты ≥65 лет. Максимальное увеличение биодоступности препарата на 32% (увеличение Сmaxна 18%) у пациентов старше 70 лет не является клинически значимым и не влияет на ингибирование ДПП-4.
Пациенты ≤18 лет. Фармакокинетические особенности вилдаглиптина у детей и подростков младше 18 лет не установлены.
Показания к применению Галвус 50мг 28 шт. таблетки
Сахарный диабет типа 2:
- в качестве монотерапии в сочетании с диетотерапией и физическими упражнениями;
- в комбинации с метформином в качестве начальной медикаментозной терапии при недостаточной эффективности диетотерапии и физических упражнений;
- в составе двухкомпонентной комбинированной терапии с метформином, производными сульфонилмочевины, тиазолидиндионом или инсулином в случае неэффективности диетотерапии, физических упражнений и монотерапии этими препаратами;
- в составе тройной комбинированной терапии: в комбинации с производными сульфонилмочевины и метформином, у пациентов ранее получавших терапию производными сульфонилмочевины и метформином на фоне диетотерапии и физических упражнений и не достигших адекватного контроля гликемии;
- в составе тройной комбинированной терапии: в комбинации с инсулином и метформином, у пациентов, ранее получавших инсулин и метформин, на фоне диетотерапии и физических упражнений и не достигших адекватного контроля гликемии.
Противопоказания
- повышенная чувствительность к вилдаглиптину и любым другим компонентам препарата;
- наследственная непереносимость галактозы, недостаточность лактазы глюкозо-галактозная мальабсорбция.
Не рекомендуется применение вилдаглиптина у пациентов с хронической сердечной недостаточностью функционального класса IV по классификации NYHA ввиду отсутствия данных клинических исследований о применении вилдаглиптина у этой группы пациентов.
Эффективность и безопасность применения препарата у детей до 18 лет не установлена.
С осторожностью: тяжелые нарушения функции печени, включая повышенную активность печеночных ферментов (АЛТ или АСТ >2,5 раза выше ВГН — 2,5×ВГН); терминальная стадия хронической почечной недостаточности у пациентов на гемодиализе (поскольку опыт применения ограничен); хроническая сердечная недостаточность III класса по функциональной классификации NYHA (поскольку данные о применении ограничены и не позволяют сделать окончательный вывод).
Применение Галвус 50мг 28 шт. таблетки при беременности и кормлении грудью
В экспериментальных исследованиях при применении в дозах, в 200 раз превышающих рекомендуемые, препарат не вызывал нарушения фертильности и раннего развития эмбриона и не оказывал тератогенное действие на плод. Достаточных данных по применению препарата Галвус у беременных женщин нет, в связи с чем препарат не следует применять при беременности.
Поскольку неизвестно, выделяется ли вилдаглиптин с грудным молоком у человека, препарат Галвус не следует применять в период грудного вскармливания.
Передозировка
Препарат Галвус хорошо переносится при назначении в дозе до 200 мг/сут.
Симптомы: при применении препарата в дозе 400 мг/сут могут наблюдаться боли в мышцах, редко — легкие и транзиторные парестезии, лихорадка, отеки и транзиторное повышение концентрации липазы (выше ВГН в 2 раза). При увеличении дозы препарата Галвус до 600 мг/сут возможно развитие отеков конечностей с парестезиями и повышением концентрации КФК, АЛТ, С-реактивного белка и миоглобина. Все симптомы передозировки и изменения лабораторных показателей исчезают после прекращения применения препарата.
Лечение: выведение препарата из организма с помощью диализа маловероятно. Однако основной гидролизный метаболит вилдаглиптина (LAY151) может быть удален из организма путем гемодиализа.
Побочные действия Галвус 50мг 28 шт. таблетки
При применении препарата Галвус в качестве монотерапии или в комбинации с другими препаратами большинство нежелательных реакций были слабо выражены, имели временный характер и не требовали отмены терапии. Корреляция между частотой нежелательных явлений (НЯ) и возрастом, полом, этнической принадлежностью, продолжительностью применения или режимом дозирования не выявлена.
На фоне терапии препаратом Галвус редко отмечались нарушения функции печени (включая гепатит) бессимптомного течения. В большинстве случаев данные нарушения и отклонения показателей функции печени от нормы разрешились самостоятельно без осложнений после прекращения терапии препаратом. При применении препарата Галвус в дозе 50 мг 1 или 2 раза в сутки частота увеличения активности печеночных ферментов (АЛТ или АСТ ≥3×ВГН) составляла 0,2 или 0,3% соответственно (по сравнению с 0,2% в контрольной группе). Увеличение активности печеночных ферментов в большинстве случаев было бессимптомным, не прогрессировало и не сопровождалось холестазом или желтухой.
Если любые из указанных в описании побочных эффектов усугубляются или пациент заметил любые другие побочные эффекты, не указанные в описании, следует сообщить об этом врачу.
Лекарственное взаимодействие
Препарат Галвус обладает низким потенциалом лекарственного взаимодействия.
Поскольку препарат не является субстратом ферментов цитохрома Р450, а также не ингибирует и не индуцирует эти ферменты, взаимодействие препарата Галвус с лекарственными препаратами, которые являются субстратами, ингибиторами или индукторами цитохрома Р450, маловероятно. При одновременном применении вилдаглиптин также не влияет на скорость метаболизма препаратов, являющихся субстратами ферментов CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 и CYP3A4/5.
Клинически значимое взаимодействие препарата Галвус с препаратами, наиболее часто используемыми при лечении СД типа 2 (глибенкламид, пиоглитазон, метформин) или обладающими узким терапевтическим диапазоном (амлодипин, дигоксин, рамиприл, симвастатин, валсартан, варфарин) не установлено.
© 2014-2023, ООО «МедРейтинг» ОГРН 1122311003760
Зарегистрировано Федеральной службой по надзору в сфере связи, информационных технологий и массовых коммуникаций (Роскомнадзор). Свидетельство Эл № ФС77-71779 от 08.12.2017 г. Учредитель — ООО «МедРейтинг». Адрес редакции:
350015, Краснодарский край, г. Краснодар, ул. Буденного, д. 182, офис 87
. Телефон: 8 (495) 374-93-56. E-mail: help@medrocket.ru. Главный редактор — C.Р. Федосов.
Информация, представленная на сайте, не может быть использована для постановки диагноза, назначения лечения и не заменяет прием врача.
Для лечения пациентов с сахарным диабетом 2 типа:
у которых не достигнут достаточный гликемический контроль при монотерапии метформина гидрохлоридом в максимальной переносимой дозе;
которые уже получали лечение комбинацией вилдаглиптина и метформина гидрохлорида в виде отдельных препаратов;
в комбинации с препаратами сульфонилмочевины (ПСМ) в качестве вспомогательной терапии к диете и упражнениям для пациентов, у которых не достигнут достаточный гликемический контроль при терапии метформином и ПСМ;
в комбинации с инсулином в качестве вспомогательной терапии к диете и упражнениям для улучшения гликемического контроля у пациентов, у которых монотерапия инсулином или метформином не позволяет достичь необходимого гликемического контроля.
Противопоказания
повышенная чувствительность к вилдаглиптину или метформина гидрохлориду или к любым другим компонентам препарата;
острый или хронический метаболический ацидоз, включая лактоацидоз или диабетический кетоацидоз с или без комы;
почечная недостаточность или тяжелое нарушение функции почек (СКФ < 30 мл/мин);
острые состояния, протекающие с риском развития нарушения функции почек, такие как: дегидратация, тяжелая инфекция, шок, внутривенное введение йодированных контрастных средств;
острые или хронические заболевания, способные вызвать гипоксию тканей, такие
как:сердечная недостаточность, дыхательная недостаточность, недавно
перенесенный инфаркт миокарда, шок;
острая алкогольная интоксикация, алкоголизм;
нарушения функции печени;
детский возраст;
• период грудного вскармливания
Способ применения и дозы
Применение гипогликемической терапии при лечении диабета 2 типа должно быть индивидуализировано на основе эффективности и переносимости. При применении препарата Гальвусмет не следует превышать максимальную суточную дозу вилдаглиптина (100 мг).
Начальная рекомендованная доза препарата должна основываться на дозе вилдаглиптина и/или метформина, принимаемой пациентом. С целью уменьшения побочных эффектов со стороны пищеварительной системы, связанных с применением метформина гидрохлоридом, Гальвусмет следует принимать во время приема пищи.
Начальная доза для пациентов, чье состояние не контролируется надлежащим образом при применении монотерапии вилдаглиптином или метформином.
Лечение препаратом Гальвусмет можно начать с приема таблеток с дозировкой 50 мг / 850 мг или 50 мг / 1000 мг два раза в сутки, постепенно титруя дозы после оценки адекватности ответа на лечение.
Начальная доза для пациентов, которые переходят с комбинированного лечения вилдаглиптином и метформином в виде отдельных препаратов
Основываясь на дозе вилдаглиптина или метформина, которые уже принимаются пациентом, лечение Гальвусмет можно начать с таблеток с дозировкой 50 мг / 850 мг или 50 мг / 1000 мг.
Доза в комбинации с препаратами сульфонилмочевины (ПСМ) или инсулином
Выбранная доза должна обеспечивать применение 50 мг вилдаглиптина два раза в сутки, а также дозу метформина, принимаемую пациентом ранее.
Если Гальвусмет принимается в комбинации с ПСМ, следует рассмотреть возможность назначения более низких доз ПСМ для снижения риска развития гипогликемии (см. раздел «Меры предосторожности).
Пациенты с нарушением функции почек
СКФ следует оценивать до начала лечения метформином-содержащих продуктов (например, Гальвусмет) и по меньшей мере раз в год после. У пациентов с повышенным риском дальнейшего прогрессирования почечной недостаточности и у пожилых людей, функции почек следует оценивать чаще, например, каждые 3 до 6 месяцев.
Максимальная суточная доза метформина предпочтительно должна быть разделена на 2 или 3 приема. Факторы, которые могут увеличить риск развития лактацидоза (см. раздел «Меры предосторожности»), должны быть рассмотрены до начала терапии метформинсодержащими продуктами (например, Гальвусмет) у пациентов с СКФ < 60 мл / мин. Гальвусмет противопоказан пациентам с СКФ < 30 мл/мин из-за метформина (смотри раздел «Противопоказания»),
Следующие рекомендации дозирования применимы к метформину и вилдаглиптину, используемым отдельно или в комбинации у пациентов с нарушением функции почек. Если нет подходящей дозировки Гальвусмета, должны использоваться отдельные компоненты вместо комбинации с фиксированной дозой.
Таблица 1 Корректировка доз у пациентов с нарушением функции почек
| СКФ мл/мин | Метформин | Вилдаглиптин |
| 60-89 | Максимальная суточная доза 3000 мг*. Снижение дозы может быть рассмотрено, если функция почек снижается. | Максимальная суточная доза составляет 100 мг |
| 45-59 | Начальная доза должна быть не более 1000 мг, максимальная суточная доза 2000 мг*. | Максимальная суточная доза составляет 50 мг |
| 30-44 | Начальная доза должна быть не более 500 мг, максимальная суточная доза 1000 мг. | |
| < 30 | Метформин противопоказан. |
* Если дозы метформина выше, чем доступны в Гальвусмете, считается необходимым применение монопрепарата.
Пациенты с нарушением функции печени
Гальвусмет не следует применять пациентам с нарушениями функции печени, включая случаи, когда до лечения уровень аланинаминотрансферазы (АЛТ) или аспартатаминотрансферазы (ACT) превышает верхнюю границу нормы более чем в 3 раза.
Пациенты пожилого возраста (≥ 65 лет)
Учитывая то, что метформин выводится почками, а у пациентов пожилого возраста существует тенденция к снижению функции почек, у пациентов такого возраста, принимающих Гальвусмет, следует регулярно проверять функцию почек.
Побочные реакции
Критерии частоты возникновения побочных реакций: очень частые (≥ 1/10); частые (≥ 1/100, < 1/10); нечастые (≥ 1/1000, < 1/100); редкие (≥ 1/10000, < 1/1000); очень редкие (< 1/10000).
Указанные побочные реакции были выявлены в ходе клинических исследований изучающих применение вилдаглиптина или метформина в виде монотерапии, а также применение метформина в комбинации с вилдаглиптином как отдельных препаратов.
При применении метформина гидрохлорида в комбинации с вилдаглиптином
Со стороны нервной системы: частые — тремор, головокружение, головная боль; нечастые — утомляемость.
Со стороны пищеварительной системы: частые — тошнота.
Метаболические нарушения: частые — гипогликемия.
Побочные реакции, выявленные в ходе клинического изучения применения вилдаглиптина в комбинации с ПСМ (глимепирид) и метформином
Со стороны нервной системы: частые — головокружение, тремор.
Общие расстройства: частые — слабость.
Метаболические нарушения: частые — гипогликемия.
Со стороны кожи и подкожной ткани: частые — избыточное потоотделение.
Побочные реакции, выявленные в ходе клинического изучения применения вилдаглиптина в комбинации с инсулином (применение с метформином или без метформина)
Со стороны нервной системы: частые — головокружение.
Со стороны пищеварительной системы: частые — тошнота, гастроэзофагеальная рефлюксная болезнь, редко — диарея, метеоризм.
Общие нарушения: частые — озноб.
Метаболические нарушения: частые — гипогликемия.
При монотерапии вилдаглиптином
Инфекции и инвазии: очень редкие — инфекции верхних дыхательных путей, назофарингит.
Со стороны нервной системы: частые — головокружение; нечастые — головная боль.
Со стороны пищеварительной системы: нечастые — запор.
Метаболические нарушения: частые — гипогликемия.
Со стороны мышечной и соединительной ткани: нечастые — артралгия.
Сосудистые нарушения: нечастые — периферический отек.
При монотерапии метформином
Со стороны нервной системы: частые — привкус металла.
Со стороны пищеварительной системы: очень частые — тошнота, рвота, диарея, абдоминальная боль, потеря аппетита.
Со стороны гепатобилиарной системы: очень редкие — нарушение биохимических показателей функции печени, гепатит*.
Метаболические нарушения: очень редкие — снижение всасывания витамина В12**, лактоацидоз.
Со стороны кожи и подкожной ткани: очень редкие — кожные реакции типа эритемы, зуда, крапивницы.
* Отдельные случаи аномальных результатов функциональных печеночных проб или гепатита проходили после прекращения приема метформина.
** Уменьшение всасывания витамина В12 со снижением его уровня в сыворотке крови наблюдается очень редко у пациентов, которые получают долгосрочное лечение метформином и, как правило, это отклонение не имеет клинического значения, и проходит после прекращения применения метформина. В случае возникновения у пациента симптомов мегалобластной анемии рекомендовано учитывать возможность того, что она могла быть вызвана метформином.
Нежелательные эффекты со стороны ЖКТ чаще всего возникают в начале лечения и в большинстве случаев проходят спонтанно. С целью их предотвращения рекомендуется принимать ежедневную дозу метформина в 2 приема во время приема пищи. Медленное увеличение дозировки также может помочь улучшить переносимость со стороны пищеварительной системы.
Данные постмаркетингового наблюдения
В постмаркетинговом периоде информация о следующих побочных реакциях на Гальвусмет получены путем спонтанных сообщений и по данным литературы. Поскольку неизвестен размер популяции, из которой исходят эти сообщениях, частоту побочных реакций достоверно определить невозможно, и она расценивалась как неизвестная:
аномальные результаты функциональных печеночных проб или гепатит, обратимые при прекращении применения препарата;
крапивница, буллезные и эксфолиативные поражения кожи, включая буллезный пемфигоид;
панкреатит;
артралгия, иногда тяжёлая.
Передозировка
О случаях передозировки препарата не сообщалось.
Вилдаглиптин
Вилдаглиптин может вызвать явления передозировки при применении в дозах выше 400 мг. Клинические признаки передозировки: боль в мышцах, слабая и преходящая парестезия, лихорадка, отек и временное повышение уровня липазы (до двойной верхней границы нормы). При 600 мг у одного субъекта отмечали отек ступней и кистей, значительное повышение уровня креатинфосфокиназы (КФК), которое сопровождалось увеличением уровня аспартатаминотрансферазы (ACT), С-реактивного белка и миоглобина. У трех других субъектов этой же дозовой группы был отек обеих ступней, который сопровождался в двух случаях парестезией. После прекращения применения исследуемого препарата все симптомы и изменения в лабораторных показателях прошли.
Метформина гидрохлорид
Передозировка метформина гидрохлорида возникает при применении (в том числе пероральном) количеств, превышающих 50 г. Приблизительно в 10 % случаев наблюдали гипогликемию, однако ни одной причинно-следственной связи с метформина гидрохлоридом не было установлено. Передозировка метформина может привести в лактоацидозу, что требует незамедлительной госпитализации.
Лечение. Наиболее эффективным методом выведения метформина из организма является гемодиализ. Вилдаглиптин не подвергается диализу, однако его главный гидролитический метаболит (LAY151) можно удалить путем гемодиализа. В случае передозировки препарата Гальвусмет следует применять поддерживающее лечение соответственно клиническим признакам и симптомам у пациента.
Беременность, грудное вскармливание, фертильность
Беременность
Отсутствуют достаточные данные по применению Гальвусмета у беременных. Исследования вилдаглиптина на животных выявили репродуктивную токсичность в высоких дозах. В исследованиях метформина на животных такой эффект не был показан. Исследования комбинированного применения на животных не показал тератогенности, но была выявлена фетотоксичность в дозах, токсичных для самки. Потенциальный риск у человека неизвестен. Гальвусмет не следует применять во время беременности.
Грудное вскармливание
Неизвестно, проникает ли вилдаглиптин и/или метформин в грудное молоко у человека, поэтому Гальвусмет не следует назначать женщинам в период грудного вскармливания. Фертильность
Исследования вилдаглиптина на крысах в дозах, эквивалентных превышающим в 200 раз дозы у человека, не выявили нарушения фертильности и раннего эмбрионального развития. Исследования влияния Гальвусмета на фертильность у человека не проводились.
Дети
Безопасность и эффективность применения препарата Гальвусмет у детей не установлены, поэтому он не рекомендован для применения у детей.
Меры предосторожности
Гальвусмет не заменяет инсулин для инсулинзависимых пациентов. Препарат не следует применять у пациентов с диабетом 1 типа или для лечения диабетического кетоацидоза. Лактоацидоз
Лактоацидоз представляет собой очень редкое, но тяжелое метаболическое осложнение, наиболее часто возникающее при резком ухудшении функции почек или кардиореспираторной болезни, или сепсисе. Накопление метформина возникает при резком ухудшении функции почек и увеличивает риск лактоацидоза. Лактоацидоз на фоне применения метформина отмечался, в основном, у больных сахарным диабетом с тяжелой почечной недостаточностью.
В случае обезвоживания (например, из-за тяжелой диареи или рвоты, лихорадки или снижения потребления жидкости), пациент должен прекратить прием метформинсодержащих продуктов, (например, Гальвусмета) и немедленно обратится к врачу.
Лекарственные препараты, которые могут резко ухудшить функцию почек (например, гипотензивные, мочегонные и НПВС) следует начинать с осторожностью у пациентов, получавших метформин-содержащие продукты (таких как Гальвусмет). Другими факторами риска лактоацидоза являются чрезмерное употребление алкоголя, нарушение функции печени, плохо контролируемый диабет, кетоз, длительное голодание и любые условия, связанные с гипоксией, а также сопутствующее применение лекарственных средств, которые могут привести к лактоацидозу (см. разделы «Противопоказания» и «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
Пациенты должны быть проинформированы о риске лактоацидоза. При развитии лактоацидоза отмечается одышка, боль в животе, мышечные судороги, астения и гипотермия, за которой следует кома. Если подозреваемые симптомы возникают, пациент должен прекратить прием метформин-содержащих продуктов (таких как Гальвусмет) и немедленно обратиться к врачу. Диагностическую ценность имеют следующие лабораторные показатели: снижение pH крови (< 7,35), увеличение сывороточной концентрации лактата (≥ 5 ммоль/л), а также увеличенный анионный интервал и повышенное соотношение лактат/пируват. При подозрении на метаболический ацидоз лекарственный препарат следует отменить, а пациент должен быть немедленно госпитализирован.
Нарушения функции печени
Следует избегать применения метформин-содержащих препаратов (таких как Гальвусмет) у пациентов с нарушениями функции печени, включая тех, у кого уровни аланинаминотрансферазы или аспартатаминотрансферазы до начала лечения превышают верхнюю границу нормы более чем в 3 раза.
Функциональные печеночные пробы следует проводить до начала лечения препаратом Гальвусмет и каждые три месяца во время лечения в течение первого года терапии, а также периодически после этого.
У пациентов с выявленным повышенным уровнем трансаминаз следует провести повторную оценку функции печени с целью подтверждения выявленных показателей, после чего регулярно проводить функциональные печеночные пробы до тех пор, пока показатели не нормализуются. При продолжительном повышении уровня аспартатаминотрансферазы или аланинаминотрансферазы до 3-кратного и более превышения значений верхней границы нормы рекомендуется прекратить лечение препаратом Гальвусмет. Пациентам, у которых развилась желтуха или возникли другие признаки, свидетельствующие о дисфункции печени, следует прекратить лечение препаратом и немедленно обратиться к своему врачу.
После нормализации уровней печеночных ферментов вследствие прекращения лечения препаратом не следует назначать его повторно.
Сердечная недостаточность
Клиническое исследование вилдаглиптина у пациентов с хронической сердечной недостаточностью (ХСН) функционального класса (ФК) III по классификации NYHA показало, что терапия вилдаглиптином не ассоциировалась с изменением функции левого желудочка или с утяжелением ХСН по сравнению с плацебо. Клинический опыт у пациентов с ФК III по NYHA, принимавших вилдаглиптин, пока ограничен, и его результаты не позволяют сделать однозначный вывод.
Опыт применения вилдаглиптина в клинических испытаниях у пациентов с ХСН ФК IV по NYHA отсутствует, поэтому его применение у таких пациентов не рекомендуется. Метформин противопоказан пациентам с сердечной недостаточностью, поэтому Гальвусмет противопоказан данной популяции пациентов.
Нарушения со стороны кожи
Поскольку в постмаркетинговом опыте сообщалось о случаях буллезных и эксфолиативных поражений кожи, рекомендуется регулярный мониторинг состояния кожи пациентов на наличие нарушений, таких как волдыри или изъязвления.
Панкреатит
Поскольку в постмаркетинговом опыте сообщалось о случаях панкреатита, следует проинформировать пациента о характерном симптоме острого панкреатита: постоянной сильной боли в животе.
Наблюдалось исчезновение симптомов панкреатита после прекращения приема вилдаглиптина.
В случае подозрения на панкреатит, вилдаглиптин следует отменить.
Нарушение функции почек
СКФ следует оценивать до начала лечения и регулярно после этого (см. раздел «Способ применения и дозы»). Метформин-содержащие продукты (такие как Гальвусмет) противопоказаны пациентам с СКФ < 30 мл/ мин и должны быть временно прекращены при наличии условий, которые изменяют функции почек (см. раздел «Противопоказания»). Известно, что метформина гидрохлорид выводится, главным образом, почками. Риск накопления метформина гидрохлорида и лактоацидоза возрастает со степенью нарушения функции почек. Пожилые пациенты с уровнем креатинина в сыворотке крови выше верхней границы нормы из-за своего возраста не должны принимать Гальвусмет. Поскольку пожилой возраст связан со сниженной функцией почек, у пациентов пожилого возраста метформин-содержащие препараты (такие как Гальвусмет) необходимо титровать с большой осторожностью с целью установления минимальной дозы для достижения адекватного антигликемического эффекта; следует регулярно контролировать функцию почек.
Функцию почек следует оценивать и подтверждать ее нормальное состояние перед началом лечения препаратом Гальвусмет, по меньшей мере, раз в год у пациентов с нормальной функцией почек и, по меньшей мере, от двух до четырех раз в год у пациентов с показателем креатинина сыворотки крови на уровне верхней границы нормы. Кроме того, состояние почек необходимо оценивать чаще у пациентов с ожидаемой дисфункцией почек. Лечение препаратом следует прекратить в случае наличия доказательств нарушения функции почек.
Сопутствующие лекарственные средства, способные повлиять на функцию почек или распределение метформина гидрохлорида
Катионные препараты, которые выводятся путем тубулярной секреции в почках, необходимо применять с осторожностью. Гипоксические состояния.
Сердечно-сосудистый коллапс (шок), острая застойная сердечная недостаточность, острый инфаркт миокарда и другие состояния, характеризующиеся сниженным содержимым кислорода в крови, связаны с лактоацидозом и могут также вызвать преренальную азотемию. Если такие явления возникли у пациентов, которые получают метформин-содержащие препараты (такие как Гальвусмет), данный препарат следует немедленно отменить.
Рентгенологические исследования
Внутривенное введение йодированных контрастных веществ при рентгенологическом исследовании может привести к почечной недостаточности. Гальвусмет следует временно отменить до или во время исследования и не возобновлять в течение 48 часов после его проведения. Возобновить прием Гальвусмета можно только после того, как функция почек переоценена и признана стабильной.
Хирургические вмешательства
Метформин-содержащие препараты (такие как Гальвусмет) должны быть отменены на время хирургических операций, проводимых под общей, спинальной или эпидуральной анестезией (за исключением незначительных процедур, не связанных с ограничением приема пищи и жидкостей), и могут снова применяться не раньше 48 часов после операции или после того, как пероральное питание пациента восстановлено, а также функция почек переоценена и признана стабильной.
Употребление алкоголя.
Известно, что алкоголь потенцирует влияние метформина гидрохлорида на метаболизм лактата. Пациентов необходимо предупредить относительно избегания чрезмерного употребления алкоголя во время лечения метформин-содержащими препаратами (такими как Гальвусмет).
Алкогольное опьянение связано с повышенным риском развития лактоацидоза, особенно в случаях голодания, недоедания или нарушением функции печени.
Уровень витамина В12
Во время лечения метформином приблизительно у 7 % пациентов наблюдалось снижение уровня витамина В12 в сыворотке крови без клинических проявлений. Такое отклонение очень редко связано с анемией и является легко обратимым при прекращении приема метформина гидрохлорида и/или дополнительного применения витамина В12.
Пациентам, получающим Гальвусмет, рекомендуется не реже 1 раза в год проводить общий анализ крови и в случае выявления каких-либо нарушений определять их причину и принимать соответствующие меры. По-видимому, у некоторых пациентов (например, у больных с недостаточным потреблением или нарушениями всасывания витамина В12 или кальция) имеется предрасположенность к снижению сывороточной концентрации витамина В12. В подобных случаях можно рекомендовать определять сывороточную концентрацию витамина В12 не реже 1 раза в 2-3 года.
Ухудшение состояния пациентов с сахарным диабетом 2 типа, ранее отвечавших на терапию
Если у пациента с сахарным диабетом 2 типа, ранее отвечавшего на терапию, появились признаки ухудшения состояния (изменение лабораторных показателей или клинические проявления), причем симптоматика выражена нечетко, следует незамедлительно провести анализы для выявления кетоацидоза и/или лактоацидоза. Если ацидоз в той или иной форме подтвержден, следует немедленно отменить Гальвусмет и принять надлежащие меры.
Гипогликемия
Обычно у пациентов, получающих только Гальвусмет, гипогликемия не отмечается, однако она может возникать на фоне низкокалорийной диеты (когда интенсивная физическая нагрузка не компенсируется калорийностью пищи), либо на фоне употребления алкоголя. Гипогликемия наиболее вероятна у пожилых, ослабленных или истощенных больных, а также на фоне гипопитуитаризма, надпочечниковой недостаточности или алкогольной интоксикации. У пожилых пациентов и у лиц, получающих бета-адреноблокаторы, диагностика гипогликемии может быть затруднена. Препараты сульфонилмочевины (ПСМ) вызывают гипогликемию. Пациенты, принимающие вилдаглиптин в комбинации с ПСМ, могут быть подвержены риску развития гипогликемии. Для снижения риска развития гипогликемии следует рассмотреть возможность назначения более низких доз ПСМ.
Потеря контроля над уровнем глюкозы в крови.
При стрессе (лихорадке, травме, инфекции, хирургическом вмешательстве и т.д.), возникшем у пациента, получающего гипогликемические средства по стабильной схеме, возможно резкое снижение эффективности последних на некоторое время. В данном случае может возникнуть необходимость отменить Гальвусмет и назначить инсулин. Возобновить лечение Гальвусметом можно после окончания острого периода.
Влияние на способность управлять автотранспортом или работать с механизмами
Не проводились исследования влияния препарата на скорость реакции при управлении автотранспортом или работе с другими механизмами. Пациенты, у которых возникает головокружение, не должны управлять автотранспортом или работать с механизмами.
Взаимодействие с другими лекарственными средствами и другие виды взаимодействий
Не наблюдалось никакого клинически релевантного фармакокинетического взаимодействия при одновременном введении вилдаглиптина (100 мг один раз в день) и метформина гидрохлорида (1000 мг один раз в сутки). Интенсивно исследовали лекарственные взаимодействия каждого из компонентов препарата Гальвусмет. Однако одновременное применение действующих веществ у пациентов во время проведения клинических исследований и широкое клиническое применение не привели к какому- либо неожиданному взаимодействию.
Ниже приведены сведения, отображающие доступную информацию относительно индивидуальных действующих веществ (вилдаглиптина и метформина).
Вилдаглиптин:
Вилдаглиптин имеет низкую способность к взаимодействию с лекарственными средствами. Поскольку вилдаглиптин не является субстратом ферментов цитохрома Р (CYP) 450 и не тормозит и не индуцирует ферменты системы CYP 450, маловероятно, чтобы вилдаглиптин при одновременном применении взаимодействовал с субстратами, ингибиторами или индукторами этих ферментов. Кроме того, вилдаглиптин не влияет на метаболический клиренс сопутствующих препаратов, которые метаболизируются при участии CYP 1А2, CYP 2С8, CYP 2С9, CYP 2С19, CYP 2D6, CYP 2Е1 и CYP 3А4/5.
При участии пациентов с диабетом 2 типа или для препаратов с узким терапевтическим окном проведено исследование взаимодействия между лекарственными средствами, которые часто назначаются одновременно. Вследствие проведения этих исследований не было выявлено клинически релевантного взаимодействия с другими противодиабетическими средствами (глибенкламидом, пиоглитазоном, метформина гидрохлоридом), амлодипином, дигоксином, рамиприлом, симвастатином, валсартаном или варфарином при одновременном их приеме с вилдалгиптином.
Как в случае и с другими противодиабетическими лекарственными средствами, гипогликемическое действие вилдаглиптина может быть ослаблено такими веществами как тиазиды, кортикостероиды, тиреоидные средства и симпатомиметики.
Метформина гидрохлорид:
Относительно компонента метформина известна такая информация:
Фуросемид — повышает Сюах (максимальную концентрацию в плазме крови) и AUC (площадь под кривой «концентрация в плазме крови — время») метформина в крови без изменения почечного клиренса метформина. Метформин снижает Сmах и AUC фуросемида в крови без изменения почечного клиренса фуросемида.
Нифедипин — повышает всасывание, Сmах и AUC метформина, а также его экскрецию с мочой. Метформин имеет минимальное влияние на нифедипин.
Глибурид — не вызывает изменений в фармакокинетических/фармакодинамических параметрах метформина. Отмечали снижение Сmах, AUC глибурида в крови, однако эти показатели очень вариабельны. Поэтому неясно, имеет ли это влияние клиническое значение.
Катионные препараты, например, амилорид, дигоксин, морфин, прокаинамид, хинидин, хинин, ранитидин, триамтерен, тримеоприм или ванкомицин, которые элиминируются почками путем тубулярной секреции, теоретически способны взаимодействовать с метформином из-за конкуренции за общую систему тубулярного транспорта почек. Так, циметидин повышает концентрации метформина в плазме/крови и AUC на 60 % и 40 % соответственно. Метформин не влияет на фармакокинетику циметидина. Хотя такое взаимодействие остается теоретическим (за исключением циметидина), рекомендован надлежащий мониторинг состояния пациентов и дозирование метформина и таких препаратов.
Другие препараты — Некоторые препараты могут отрицательно повлиять на функцию почек, увеличивая риск лактоацидоза, например НПВС, включая селективные ингибиторы ЦОГ-2, ингибиторы АПФ, антагонисты рецепторов ангиотензина II и диуретики, особенно петлевые диуретики. Начиная или продолжая прием таких препаратов в комбинации с метформин-содержащими препаратами (такими как Гальвусмет), необходим тщательный мониторинг функции почек. Определенные препараты способны вызывать гипергликемию и могут привести к потере контроля над уровнем глюкозы. К таким препаратам принадлежат тиазиды и другие диуретики, кортикостероиды, фенотиазины, препараты щитовидной железы, эстрогены, оральные контрацептивы, фенитоин, никотиновая кислота, симпатомиметики, блокаторы кальциевых каналов, изониазид.
Ингибиторы ангиотензинпревращающего фермента могут уменьшить уровень глюкозы в крови. Рекомендован надлежащий мониторинг контроля уровня глюкозы и, при необходимости, коррекция дозы антигипергликемического препарата при одновременном применении с другими лекарственными средствами или в случае их отмены.
При остром алкогольном отравлении существует повышенный риск развития лактоацидоза (особенно в случае голодания, недостаточного питания или печеночной недостаточности), обусловленный метформином. Необходимо избегать употребления алкоголя и спиртосодержащих лекарственных препаратов.
Фармакологические свойства
Фармакодинамика
Гальвусмет является комбинацией двух антигликемических веществ с разными механизмами действия, улучшающих контроль глюкозы у пациентов с диабетом 2 типа: вилдаглиптин — член семейства ингибиторов дипептидилпептидазы-4 (ДПП-4) и метформина гидрохлорид — член группы бигуанидов.
Клиническую эффективность препарата Гальвусмет не исследовали. Тем не менее, ранее была установлена эффективность и безопасность отдельных его компонентов.
Вилдаглиптин:
Вилдаглиптин принадлежит к селективным ингибиторам ДПП-4. Его введение приводит к быстрому и полному угнетению ферментативной активности ДПП-4 на протяжении 24 часов. Угнетение вилдаглиптином активности ДПП-4 приводит к эндогенному увеличению уровня после приема пищи гормонов глюкагонподобного пептида 1 (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП).
Путем увеличения эндогенных уровней этих гормонов вилдаглиптин повышает чувствительность бета-клеток к глюкозе, вследствие чего улучшается глюкозозависимое выделение инсулина. Степень улучшения функции бета-клеток зависит от начального уровня нарушений; у лиц без диабета (с нормальным уровнем глюкозы) вилдаглиптин не стимулировал секрецию инсулина или снижение уровня глюкозы.
Путем повышения уровня эндогенного ГПП-1 вилдаглиптин увеличивает чувствительность альфа-клеток поджелудочной железы к глюкозе, вследствие чего увеличивается секреция глюкозо-ответственного глюкагона. Снижение избытка неответственного глюкагона во время приема пищи, в свою очередь, ослабляет инсулиновую резистентность.
Усиленное повышение соотношения инсулин/глюкагон во время гипергликемии обуславливает рост уровня инкретинового гормона, что приводит к снижению продукции глюкозы в печени в условиях натощак и после приема пищи, что приводит к снижению уровня глюкозы.
Известный эффект повышенных уровней ГПП-1 с задержкой желудочного сока не наблюдается при лечении вилдаглиптином. Кроме того, наблюдалось уменьшение липемии после приема пищи, что не связано с опосредствованным инкретином эффектом вилдаглиптина из-за улучшения функции островковых клеток поджелудочной железы.
В общем, вилдаглиптин улучшает контроль уровня глюкозы при его применении в режиме монотерапии или в комбинации с метформина гидрохлоридом, как это было определено по клинически значащему снижению уровня HbAjc и по концентрации глюкозы в плазме крови в условиях натощак сравнительно с исходными показателями.
Метформина гидрохлорид:
Метформина гидрохлорид повышает толерантность к глюкозе у пациентов с диабетом 2 типа, снижая базальный уровень глюкозы в плазме крови и уровень глюкозы после приема пищи. Метформина гидрохлорид уменьшает продуцирование глюкозы в печени, уменьшает всасывание глюкозы в кишечнике и повышает чувствительность к инсулину путем увеличения периферического поглощения и утилизации глюкозы. В отличие от ПСМ, метформина гидрохлорид не вызывает гипогликемии у пациентов с диабетом 2 типа или у здоровых добровольцев (за исключением специальных условий) и не вызывает гиперинсулинемии. При лечении метформина гидрохлоридом секреция инсулина остается неизменной на уровне условий натощак, а ответ инсулина в плазме крови в продолжение дня может действительно снизиться.
Метформина гидрохлорид стимулирует внутриклеточный синтез гликогена путем влияния на синтез гликогена и увеличения транспортной способности специфических типов мембранных транспортеров глюкозы (GLUT-1 и GLUT-4).
У людей, независимо от влияния на гликемию, метформина гидрохлорид имеет благоприятный эффект на метаболизм липидов, независимо от его действия на гликемию. Метформина гидрохлорид снижает уровень общего холестерина, липопротеинов низкой плотности и триглицеридов.
Метформина гидрохлорид служит причиной значительного снижения абсолютного риска: осложнений диабета; смертности, связанной с диабетом; инфаркта миокарда и общей смертности.
Фармакокинетика
Всасывание
Гальвусмет
В исследовании биоэквивалентности препарата Гальвусмет таблетки с разной дозировкой (50 мг / 500 мг, 50 мг / 850 мг и 50 мг / 1000 мг) сравнивали с комбинацией отдельных препаратов вилдаглиптина и метформина гидрохлорида в соответствующих дозах. В этих исследованиях была продемонстрирована биоэквивалентность препарата Гальвусмет в комбинациях отдельных препаратов по показателям AUC и Сmах обоих компонентов препарата Гальвусмет — вилдаглиптина и метформина гидрохлорида.
Прием пищи не влияет на объем и степень всасывания вилдаглиптина с препаратом Гальвусмет. Сmах и AUC метформина гидрохлорида при приеме препарата вместе с пищей снижались на 26 % и 7 % соответственно. Всасывание метформина гидрохлорида также задерживалось при приеме препарата во время еды, что отобразилось на Тmах (с 2,0 до 4,0 часов).
Эти изменения в показателях Сmах и AUC были постоянными, однако меньше тех, которые наблюдались при самостоятельном приеме метформина гидрохлорида во время еды. Влияние приема пищи на фармакокинетику обоих компонентов препарата — вилдаглиптина и метформина гидрохлорида — аналогично влиянию на фармакокинетику вилдаглиптина и метформина гидрохлорида при их индивидуальном применении с пищей.
Вилдаглиптин
После перорального приема натощак вилдаглиптин быстро всасывается, пиковые концентрации в плазме крови достигаются через 1,75 часа. Введение вместе с пищей слегка снижает степень всасывания вилдаглиптина, что характеризуется снижением пиковых концентраций на 19 %, а также отдаляет время достижения пиковой концентрации в плазме крови до 2,5 часа. Объем всасывания не изменялся, пища не влияла на экспозицию вообще (AUC).
Метформина гидрохлорид
Абсолютная биодоступность метформина гидрохлорида, таблетки по 500 мг, принятого натощак, составляет приблизительно от 50 % до 60 %. Исследования с применением одноразовых оральных доз метформина гидрохлорида, таблеток от 500 мг до 1500 мг, и от 850 мг до 2550 мг, указывают на отсутствие зависимости с ростом дозы, что обусловлено скорее сниженным всасыванием, чем изменениями в выведении. Прием пищи снижает объем и немного замедляет всасывание метформина гидрохлорида, о чем свидетельствуют приблизительно на 40 % меньшая средняя величина Стах, на 25 % меньшая AUC, а также увеличение на 35 мин времени достижения Ттах после одноразового применения таблетки метформина гидрохлорида 850 мг во время приема пищи, сравнительно с показателями после приема таблетки в таком же дозировании натощак. Клиническое значение такого снижения неизвестно.
Линейность
Вилдаглиптин быстро всасывается, абсолютная биодоступность при оральном приеме составляет 85 %. Пиковые концентрации вилдаглиптина в плазме крови и AUC возрастают в пределах диапазона терапевтических доз приблизительно дозозависимо.
Распределение
Вилдаглиптин
Связывание вилдаглиптина с белками плазмы крови является низким (9,3 %); вилдаглиптин распределяется одинаково между плазмой и красными кровяными тельцами. Средний объем распределения вилдаглиптина в стационарной фазе после внутривенного введения (Vss) составляет 71 л, что указывает на внесосудистое распределение.
Метформина гидрохлорид
Связывание метформина с белками плазмы крови незначительное. Метформин проникает в эритроциты (вероятно усиление этого процесса со временем). Объем распределения (Vd) составляет 63-276 л. При применении метформина по стандартной схеме лечения стационарные концентрации в плазме крови достигаются в течение 24-48 часов и составляют < 1 мкг/мл. Во время проведения контролируемых клинических испытаний метформина гидрохлорида, максимальные концентрации в плазме крови не превышали 5 мкг/мл даже при применении максимальных доз.
Метаболизм
Вилдаглиптин
Метаболизм является основным путем выведения вилдаглиптина у людей, составляя 69 % дозы. Основной метаболит LAY 151 является фармакологически неактивным продуктом гидролиза цианового фрагмента, составляя 57 % дозы; за ним идет продукт гидролиза амидного фрагмента (4 % дозы). ДПП-4 частично причастна к гидролизу вилдаглиптина.
Вилдаглиптин не метаболизируется ферментами цитохрома Р450 до количеств, которые можно определить. В исследованиях in vitro показано, что вилдаглиптин не ингибирует и не индуктирует ферменты цитохрома Р450.
Выведение
Вилдаглиптин
После приема внутрь [14С]-вилдаглиптина приблизительно 85 % дозы выводится с мочой, и 15 % дозы выводится с калом. После приема внутрь 23 %,дозы выводится с мочой в виде неизмененного вилдаглиптина. После внутривенного введения здоровым добровольцам общий клиренс из плазмы и почечный клиренс вилдаглиптина составляет 41 л/час и 13 л/час соответственно. Среднее значение периода полувыведения после внутривенного введения составляет приблизительно 2 часа. Период полувыведения после приема внутрь составляет приблизительно 3 часа и не зависит от дозы.
Метформина гидрохлорид
Метформин выводится почками. Почечный клиренс метформина составляет > 400 мл/мин, что более чем в 3,5 раза выше клиренса креатинина. Это свидетельствует о том, что метформин выводится преимущественно путем клубочковой фильтрации и канальцевой секреции. После приема внутрь приблизительно 90 % абсорбированного препарата выводится почками в течение первых 24 часов. Период полувыведения метформина из плазмы крови составляет приблизительно 6,5 ч. Период полувыведения метформина из цельной крови составляет около 17,6 ч, что указывает на накопление значительной части препарата в эритроцитах.
Особые группы пациентов
Пол
Не наблюдалось никакого различия в фармакокинетических параметрах вилдаглиптина или метформина гидрохлорида у мужчин и женщин с разным диапазоном возраста и индексом массы тела.
Ожирение
Вилдаглиптин
Индекс массы тела не имеет никакого влияния на фармакокинетические параметры вилдаглиптина.
Печеночная недостаточность
Вилдаглиптин
Экспозиция вилдаглиптина (100 мг) после однократной дозы у пациентов со слабой и умеренной печеночной недостаточностью была сниженной (20 % и 8 % соответственно), тогда как экспозиция вилдаглиптина у пациентов с тяжелой недостаточностью возрастала на 22 %. Максимальные изменения (увеличение или уменьшение) в экспозиции вилдаглиптина составляют ~30 %, что не рассматривается как имеющее клиническое значение. Отсутствует корреляция между тяжестью недостаточности печеночной функции и изменениями экспозиции вилдаглиптина.
Метформина гидрохлорид
Не проводили никаких фармакокинетических исследований метформина гидрохлорида у пациентов с печеночной недостаточностью.
Почечная недостаточность
Вилдаглиптин
AUC вилдаглиптина возрастала, в среднем, в 1,4, 1,7 и 2 раза у пациентов со слабыми, умеренными и тяжелыми нарушениями функции почек, соответственно, по сравнению со здоровыми добровольцами. AUC метаболита LAY151 возрастала, в среднем, в 1,6, 3,2 и 7,3 раза, a AUC метаболита BQS867 возрастала, в среднем, в 1,4, 2,7 и 7,3 раза у пациентов со слабыми, умеренными и тяжелыми нарушениями функции почек, соответственно, по сравнению со здоровыми добровольцами. Ограниченные данные для пациентов с терминальной хронической почечной недостаточностью (ESRD) показывают, что у них экспозиция вилдаглиптина аналогична таковой у пациентов с тяжелыми нарушениями функции почек. Концентрации LAY151 у таких пациентов приблизительно в 2-3 раза выше, чем у пациентов с тяжелыми нарушениями функции почек.
Вилдаглиптин в ограниченной степени выводится при гемодиализе (3 % за 3 — 4 часа гемодиализа, который начали через 4 часа после дозирования).
Метформина гидрохлорид
У пациентов со сниженной почечной функцией (на основании определённого клиренса креатинина) период полувыведения метформина гидрохлорида из плазмы и цельной крови удлиняется, а почечный клиренс снижается пропорционально снижению клиренса креатинина.
Пациенты пожилого возраста
Вилдаглиптин
У здоровых добровольцев пожилого возраста (> 70 лет) общая экспозиция вилдаглиптина (100 мг один раз в день) увеличивалась на 32 % с ростом на 18 % пиковой концентрации в плазме крови сравнительно с молодыми здоровыми добровольцами (возрастом от 18 до 40 лет). Эти отличия не считаются клинически значимыми. В возрастных исследованиях показано, что возраст не влияет на угнетение DPP-4 вилдаглиптином.
Метформина гидрохлорид
Ограниченные данные, полученные при проведении контролируемых фармакокинетических исследований метформина гидрохлорида у здоровых добровольцев пожилого возраста, свидетельствуют о том, что общий клиренс метформина гидрохлорида из плазмы крови снижается, период полувыведения удлиняется, Смах возрастает сравнительно с молодыми добровольцами. Эти данные указывают на то, что изменения фармакокинетики метформина гидрохлорида с возрастом, главным образом, объясняются изменениями функции почек.
Лечение препаратом Гальвусмет не следует начинать у пациентов в возрасте > 80 лет, если только определение клиренса креатинина не докажет отсутствие снижения функции почек.
Дети
Нет доступных фармакокинетических данных.
Этнические группы
Отсутствуют какие-либо доказательства влияния этнической принадлежности на фармакокинетику вилдаглиптина или метформина гидрохлорида.
Фармацевтические характеристики
Основные физико-химические свойства
таблетки 50 мг/850 мг: Желтые, овальной формы таблетки, покрытые пленочной оболочкой, со скошенными краями, с оттиском «NVR» на одной стороне таблетки и «SEH» — на обратной стороне.
таблетки 50 мг/1000 мг: Темно-желтые, овальной формы таблетки, покрытые пленочной оболочкой, со скошенными краями с оттиском «NVR» на одной стороне таблетки и «FLO» — на обратной стороне.
Galvus
Регистрационный номер
Торговое наименование
Галвус
Международное непатентованное наименование
Лекарственная форма
таблетки
Состав
Описание
От белого до светло-жёлтого цвета, круглые, гладкие таблетки со скошенными краями, с гравировкой «NVR» на одной стороне и «FB» на другой стороне.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Механизм действия
Вилдаглиптин — представитель класса стимуляторов островкового аппарата поджелудочной железы, селективно ингибирует фермент дипептидилпептидазу-4 (ДПП-4). Быстрое и полное ингибирование активности ДПП-4 (>90 %) вызывает повышение как базальной, так и стимулированной приёмом пищи секреции глюкагоноподобного пептида 1 типа (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП) из кишечника в системный кровоток в течение всего дня.
Повышая концентрацию ГПП-1 и ГИП, вилдаглиптин вызывает повышение чувствительности β-клеток поджелудочной железы к глюкозе, что приводит к улучшению глюкозозависимой секреции инсулина.
Фармакодинамика
При применении вилдаглиптина в дозе 50–100 мг в сутки у пациентов с сахарным диабетом 2 типа (СД 2 типа) отмечается улучшение функции β-клеток поджелудочной железы. Степень улучшения функции β-клеток зависит от степени их исходного повреждения; так у лиц без СД (с нормальной концентрацией глюкозы в плазме крови) вилдаглиптин не стимулирует секрецию инсулина и не снижает концентрацию глюкозы.
Повышая концентрацию эндогенного ГПП-1, вилдаглиптин увеличивает чувствительность α-клеток к глюкозе, что приводит к улучшению глюкозозависимой регуляции секреции глюкагона. Снижение повышенной концентрации глюкагона во время еды, в свою очередь, вызывает уменьшение инсулинорезистентности.
Увеличение соотношения инсулин/глюкагон на фоне гипергликемии, обусловленное повышением концентрации ГПП-1 и ГИП, вызывает уменьшение продукции глюкозы печенью как во время, так и после приёма пищи, что приводит к снижению концентрации глюкозы в плазме крови.
Кроме того, на фоне применения вилдаглиптина отмечается снижение концентрации липидов в плазме крови после приёма пищи, однако этот эффект не связан с его действием на ГПП-1 или ГИП и улучшением функции островковых клеток поджелудочной железы.
Известно, что повышение концентрации ГПП-1 может приводить к замедлению опорожнения желудка, однако на фоне применения вилдаглиптина подобного эффекта не наблюдается.
При применении вилдаглиптина у 5795 пациентов с СД 2 типа в течение 52 недель в монотерапии или в комбинации с метформином, производными сульфонилмочевины, тиазолидиндионом, или инсулином отмечалось достоверное длительное снижение концентрации гликированного гемоглобина (HbA1c) и глюкозы крови натощак.
При применении комбинации вилдаглиптина и метформина в качестве начальной терапии у пациентов с сахарным диабетом 2 типа в течение 24 недель отмечалось дозозависимое снижение концентрации HbA1c в сравнении с монотерапией данными препаратами. Случаи развития гипогликемии были минимальны в обеих группах терапии.
При применении вилдаглиптина в дозе 50 мг 1 раз в сутки в течение 6 месяцев у пациентов с СД 2 типа с нарушением функции почек средней (скорость клубочковой фильтрации (СКФ) ≥30, <50 мл/мин/1,73 м2) или тяжёлой (СКФ <30 мл/мин/1,73 м2) степени отмечалось клинически значимое снижение концентрации HbA1c по сравнению с плацебо.
При применении вилдаглиптина в дозе 50 мг 2 раза в сутки в комбинации с/без метформина и инсулином (средняя доза 41 ЕД/сут) было продемонстрировано снижение показателя HbA1c на 0,77 % от исходного среднего значения 8,8 % со статистически достоверной разницей с плацебо 0,72 %. Частота гипогликемии в группе вилдаглиптина сравнима с таковой в группе плацебо. При применении вилдаглиптина в дозе 50 мг 2 раза в сутки в комбинации с метформипом (≥1500 мг/сут) и глимепиридом (≥4 мг/сут) было показано статистически значимое снижение уровня HbA1c на 0,76 % от исходного среднего значения 8,8 %.
Фармакокинетика
Всасывание
При приёме внутрь натощак вилдаглиптин быстро всасывается, а его максимальная концентрация в плазме крови (Сmax) достигается через 1,75 часа после приёма. При одновременном приёме с пищей скорость абсорбции вилдаглиптина снижается незначительно: отмечается уменьшение Сmax на 19 % и увеличение времени её достижения до 2,5 часов. Однако приём пищи не оказывает влияния на степень абсорбции и площадь под кривой «концентрация–время» (AUC).
Вилдаглиптин быстро всасывается, а его абсолютная биодоступность после приёма внутрь составляет 85 %. Сmax и AUC в терапевтическом диапазоне доз увеличиваются примерно пропорционально дозе.
Распределение
Степень связывания вилдаглиптина с белками плазмы крови низкая (9,3 %). Вилдаглиптин распределяется равномерно между плазмой крови и эритроцитами. Распределение вилдаглиптина происходит, предположительно, экстраваскулярно, объём распределения в равновесном состоянии после внутривенного введения (Vss) составляет 71 л.
Метаболизм
Основным путём выведения вилдаглиптина является биотрансформация. В организме человека 69 % дозы препарата подвергается биотрансформации. Основной метаболит — LAY151 (57 % дозы) фармакологически неактивен и является продуктом гидролиза цианокомпонента. Около 4 % дозы препарата подвергаются амидному гидролизу.
В доклинических исследованиях отмечается положительное влияние ДПП-4 на гидролиз вилдаглиптина. Вилдаглиптин метаболизируется без участия изоферментов цитохрома P450. Вилдаглиптин не является субстратом изоферментов P450 (CYP), не ингибирует и не индуцирует изоферменты цитохрома P450.
Выведение
После приёма препарата внутрь около 85 % дозы выводится почками и 15 % — через кишечник. Почечная экскреция неизменённого вилдаглиптина составляет 23 %. При внутривенном введении средний период полувыведения достигает 2 часов, общий плазменный клиренс и почечный клиренс вилдаглиптина составляют 41 л/ч и 13 л/ч соответственно. Период полувыведения (T½) после приёма внутрь составляет около 3 часов, независимо от дозы.
Фармакокинетика в особых случаях
Пол, индекс массы тела и этническая принадлежность не оказывают влияния на фармакокинетику вилдаглиптина.
Пациенты с нарушением функции печени
У пациентов с нарушением функции печени лёгкой и средней степеней тяжести (6–9 баллов по шкале Чайлд-Пью) после однократного применения препарата отмечается снижение биодоступности вилдаглиптина на 20 % и 8 % соответственно. У пациентов с нарушением функции печени тяжёлой степени (10–12 баллов по шкале Чайлд-Пью) биодоступность вилдаглиптина повышается на 22 %. Увеличение или уменьшение максимальной биодоступности вилдаглиптина, не превышающее 30 %, не является клинически значимым. Корреляции между степенью тяжести нарушений функции печени и биодоступностью препарата не выявлено.
Пациенты с нарушением функции почек
У пациентов с нарушением функции почек лёгкой, средней или тяжёлой степени AUC вилдаглиптина увеличивалась по сравнению со здоровыми добровольцами в 1,4, 1,7 и 2 раза соответственно. AUC метаболита LAY151 увеличивалась в 1,6, 3,2, и 7,3 раза, а метаболита BQS867 — в 1,4, 2,7, и 7,3 раза у пациентов с нарушением функции почек лёгкой, средней и тяжёлой степеней соответственно. Ограниченные данные у пациентов с терминальной стадией хронической болезни почек (ХБП) указывают на то, что показатели данной группы схожи с таковыми у пациентов с нарушением функции почек тяжёлой степени. Концентрация метаболита LAY151 у пациентов с терминальной стадией ХБП увеличивалась в 2–3 раза по сравнению с концентрацией у пациентов с нарушением функции почек тяжёлой степени.
При применении препарата у пациентов с нарушением функции почек может потребоваться коррекция дозы.
Выведение вилдаглиптина при гемодиализе ограничено (через 4 часа после однократного приёма составляет 3 % при длительности процедуры более 3–4 часов).
Применение у пациентов в возрасте ≥65 лет
Максимальное увеличение биодоступности препарата на 32 % (увеличение Сmах на 18 %) у пациентов старше 70 лет не является клинически значимым и не влияет на ингибирование ДПП-4.
Применение у пациентов в возрасте ≤18 лет
Фармакокинетические особенности вилдаглиптина у детей и подростков младше 18 лет не установлены.
Показания
Сахарный диабет 2 типа (в сочетании с диетотерапией и физическими упражнениями):
- в качестве монотерапии в случае неэффективности диетотерапии и физических упражнений у пациентов с противопоказанием к применению метформина или в случае неэффективности метформина;
- в комбинации с метформином в качестве начальной медикаментозной терапии при недостаточной эффективности диетотерапии и физических упражнений;
- в составе двухкомпонентной комбинированной терапии с метформином, производным сульфонилмочевины, тиазолидиндионом или с инсулином в случае неэффективности диетотерапии, физических упражнений и монотерапии этими препаратами;
- в составе тройной комбинированной терапии: в комбинации с производными сульфонилмочевины и метформином, у пациентов, ранее получавших терапию производными сульфонилмочевины и метформином на фоне диетотерапии и физических упражнений и не достигших адекватного контроля гликемии;
- в составе тройной комбинированной терапии: в комбинации с инсулином и метформином, у пациентов, ранее получавших инсулин и метформин на фоне диетотерапии и физических упражнений и не достигших адекватного контроля гликемии.
Противопоказания
- Повышенная чувствительность к вилдаглиптину и любым другим компонентам препарата;
- наследственная непереносимость галактозы, недостаточность лактазы, глюкозо-галактозная мальабсорбция;
- беременность, грудное вскармливание (в связи с недостатком соответствующих данных);
- сахарный диабет 1 типа;
- острый или хронический метаболический ацидоз (включая диабетический кетоацидоз в сочетании с комой или без таковой). Диабетический кетоацидоз должен корректироваться инсулинотерапией. Лактоацидоз (в том числе и в анамнезе);
- нарушения функции печени, включая пациентов с повышенной активностью «печёночных» ферментов (аланинаминотрансферазы (АЛТ) или аспартатаминотрансферазы (ACT) в 3 и более раз выше верхней границы нормы, (3 × ВГН);
- хроническая сердечная недостаточность (ХСН) IV функционального класса (ФК) по функциональной классификации Нью-Йоркской кардиологической ассоциации (NYHA) (ввиду отсутствия данных клинических исследований о применении вилдаглиптина у этой группы пациентов);
- детский возраст до 18 лет (эффективность и безопасность применения препарата не установлены).
С осторожностью
Рекомендуется с осторожностью применять препарат Галвус у пациентов с острым панкреатитом в анамнезе.
Поскольку опыт применения препарата Галвус у пациентов с терминальной стадией ХБП, находящихся на гемодиализе или проходящих процедуру гемодиализа, ограничен, препарат рекомендуется применять с осторожностью у данной категории пациентов. Поскольку данные о применении вилдаглиптина у пациентов с ХСН III ФК по классификации NYHA ограничены и не позволяют сделать окончательный вывод, рекомендуется с осторожностью применять препарат Галвус у пациентов данной категории.
Применение при беременности и в период грудного вскармливания
Достаточных данных по применению препарата Галвус у беременных нет, в связи с чем препарат противопоказан во время беременности. В доклинических исследованиях была выявлена репродуктивная токсичность при применении в высоких дозах, потенциальный риск для человека неизвестен.
Препарат Галвус противопоказан в период грудного вскармливания, поскольку неизвестно, проникает ли вилдаглиптин в грудное молоко у человека.
Способ применения и дозы
Дозу препарата Галвус следует подбирать индивидуально в зависимости от эффективности и переносимости.
Рекомендуемая доза препарата Галвус 50 мг 1 или 2 раза в день. Максимальная суточная доза препарата составляет 100 мг.
Дозу 50 мг/сут следует принимать 1 раз в день утром, дозу 100 мг/сут следует делить на 2 приёма — по 50 мг утром и вечером. В случае пропуска приёма препарата следует принять пропущенную дозу как можно скорее. При этом следует избегать принятия удвоенной дозы в один день.
Препарат Галвус принимают внутрь независимо от приёма пищи.
Рекомендуемая доза препарата в монотерапии или в составе комбинированной терапии с метформином, тиазолидиндионом или инсулином (в комбинации с метформином или без метформина), составляет 50 мг или 100 мг в сутки.
Рекомендуемая доза препарата Галвус в составе двойной комбинированной терапии с препаратами сульфонилмочевины составляет 50 мг 1 раз в сутки утром. В этой популяции пациентов эффективность препарата Галвус в дозе 100 мг в сутки была сходной с таковой в дозе 50 мг в сутки.
Рекомендованная доза препарата Галвус в составе тройной комбинированной терапии (вилдаглиптин + производные сульфонилмочевины + метформин) составляет 100 мг в сутки.
Если цели гликемического контроля не достигнуты на фоне применения максимальной суточной дозы 100 мг, следует рассмотреть возможность добавления к терапии препаратом Галвус других гипогликемических препаратов, таких, как метформин, производные сульфонилмочевины, тиазолидиндион или инсулин.
Пациенты с нарушениями функции почек
У пациентов с нарушением функции почек лёгкой степени (СКФ ≥60 мл/мин/1,73 м2) и средней степени с СКФ 50–60 мл/мин/1,73 м2 не требуется коррекции режима дозирования препарата. У пациентов с нарушением функции почек средней степени с СКФ 30–50 мл/мин/1,73 м2 и тяжёлой степени (СКФ <30 мл/мин/1,73 м2), включая терминальную стадию ХБП у пациентов, находящихся на гемодиализе или проходящих процедуру гемодиализа, препарат следует применять в дозе 50 мг 1 раз в сутки.
Пациенты в возрасте ≥65 лет
У пациентов пожилого возраста не требуется коррекции режима дозирования препарата Галвус.
Пациенты в возрасте ≤18 лет
Поскольку опыта применения препарата Галвус у детей и подростков младше 18 лет нет, не рекомендуется применять препарат у пациентов данной категории.
Побочное действие
При применении препарата Галвус в монотерапии или в комбинации с другими препаратами большинство нежелательных реакций были слабо выражены, имели временный характер и не требовали отмены терапии. Корреляции между частотой нежелательных явлений (НЯ) и возрастом, полом, этнической принадлежностью, продолжительностью применения или режимом дозирования не выявлено.
Частота развития ангионевротического отёка на фоне терапии препаратом Галвус составляла ≥1/10 000, <1/1 000 (градация «редко») и была сходной с таковой в контрольной группе. Наиболее часто случаи ангионевротического отёка отмечались при применении препарата в комбинации с ингибиторами ангиотензинпревращающего фермента. В большинстве случаев ангионевротический отёк был средней степени тяжести и разрешался самостоятельно в ходе продолжения терапии вилдаглиптином.
На фоне терапии препаратом Галвус редко отмечались нарушения функции печени (включая гепатит) бессимптомного течения. В большинстве случаев данные нарушения и отклонения показателей функции печени от нормы разрешились самостоятельно без осложнений после прекращения терапии препаратом. При применении препарата Галвус в дозе 50 мг 1 или 2 раза в сутки частота увеличения активности «печёночных» ферментов (АЛТ или ACT ≥3 × ВГН) составляла 0,2 % или 0,3 % соответственно (по сравнению с 0,2 % в контрольной группе). Увеличение активности «печёночных» ферментов в большинстве случаев было бессимптомным, не прогрессировало и не сопровождалось холестазом или желтухой.
НЯ сгруппированы в соответствии с классификацией органов и систем органов MedDRA. В пределах каждой группы органов и систем органов НЯ перечислены в порядке уменьшения частоты встречаемости. В пределах каждой группы частоты встречаемости НЯ указаны в порядке уменьшения тяжести.
Для оценки частоты встречаемости нежелательных явлений использовались следующие критерии: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1 000, <1/100), редко (≥1/10 000, <1/1 000), очень редко (<1/10 000), отдельные сообщения (частота неизвестна).
При применении препарата Галвус в монотерапии
При применении препарата Галвус в дозе 50 мг 1 или 2 раза в сутки частота отмены терапии в связи с развитием нежелательных реакций (0,2 % или 0,1 % соответственно) была не выше таковой в группе плацебо (0,6 %) или препарата сравнения (0,5 %).
На фоне монотерапии препаратом Галвус в дозе 50 мг 1 или 2 раза в сутки частота развития гипогликемии без увеличения степени тяжести состояния составляла 0,5 % (2 пациента из 409) и 0,3 % (4 из 1082) соответственно, что сопоставимо с препаратом сравнения и плацебо (0,2 %).
Инфекционные и паразитарные заболевания: очень редко — инфекции верхних дыхательных путей, назофарингит.
Нарушения со стороны нервной системы: часто — головокружение; нечасто — головная боль.
Нарушения со стороны желудочно-кишечного тракта: нечасто — запор.
Нарушения со стороны сосудов: нечасто — периферические отёки.
Долгосрочные клинические исследования продолжительностью до 2 лет не выявили каких-либо дополнительных отклонений профиля безопасности или непредвиденных рисков при применении вилдаглиптина в монотерапии.
При применении препарата Галвус в дозе 50 мг 1 или 2 раза в сутки в комбинации с метформином
При применении препарата Галвус в дозе 50 мг/сут в комбинации с метформином частота отмены терапии в связи с развитием нежелательных реакций составляла 0,4 % (в группах вилдаглиптин (50 мг 2 раза в сутки) + метформин и плацебо + метформин случаев отмены терапии в связи с развитием нежелательных реакций не отмечалось).
При применении препарата Галвус в дозе 50 мг 1 или 2 раза в сутки в комбинации с метформином гипогликемия отмечалась в 0,9 % и 0,5 % случаев соответственно (в группе плацебо + метформин — 0,4 %). В группе применения препарата Галвус не наблюдалось развития гипогликемии тяжёлой степени.
Комбинированная терапия вилдаглиптин + метформин не влияла на массу тела пациентов.
Нарушения со стороны нервной системы: часто — тремор, головокружение, головная боль.
Нарушения со стороны желудочно-кишечного тракта: часто — тошнота.
Долгосрочные клинические исследования продолжительностью до 2 лет не выявили каких-либо дополнительных отклонений профиля безопасности или непредвиденных рисков при применении вилдаглиптина в комбинации с метформином.
Изучение применения комбинации вилдаглиптина и метформина в качестве стартовой терапии при сахарном диабете 2 типа не выявило отклонений профиля безопасности или непредвиденных рисков.
При применении препарата Галвус в дозе 50 мг/сут в комбинации с производными сульфонилмочевины
При применении препарата Галвус в дозе 50 мг/сут в комбинации с глимепиридом частота отмены терапии в связи с развитием нежелательных реакций составляла 0,6 % (по сравнению с 0 % в группе глимепирид + плацебо).
Частота развития гипогликемии у пациентов, получавших препарат Галвус в дозе 50 мг/сут вместе с глимепиридом, составила 1,2 % (по сравнению с 0,6 % в группе плацебо + глимепирид). В группе применения препарата Галвус не наблюдалось развития гипогликемии тяжёлой степени.
При применении препарата Галвус в рекомендованной дозе (50 мг/сут) в комбинации с глимепиридом не отмечалось увеличения массы тела.
Инфекционные и паразитарные заболевания: очень редко — назофарингит.
Нарушения со стороны желудочно-кишечного тракта: нечасто — запор.
Нарушения со стороны нервной системы: часто — тремор, головокружение, головная боль, астения.
При применении препарата Галвус в дозе 50 мг 1 или 2 раза в сутки в комбинации с производными тиазолидиндиона
При применении препарата Галвус в дозе 50 мг/сут в комбинации с пиоглитазоном частота отмены терапии в связи с развитием нежелательных реакций составляла 0,7 % (в группах вилдаглиптин 100 мг/сут + пиоглитазон и плацебо + пиоглитазон случаев отмены терапии в связи с развитием нежелательных реакций не отмечалось).
При применении препарата Галвус в дозе 50 мг/сут в комбинации с пиоглитазоном в дозе 45 мг развития гипогликемии не отмечалось; в группе вилдаглиптин (в дозе 50 мг 2 раза в сутки) + пиоглитазон (в дозе 45 мг) отмечалось развитие гипогликемии в 0,6 % случаев, а у пациентов, получавших плацебо + пиоглитазон в дозе 45 мг, — в 1,9 % случаев.
В группе применения препарата Галвус не наблюдалось развития гипогликемии тяжёлой степени. Среднее увеличение массы тела по сравнению с плацебо у пациентов, получавших препарат Галвус в дозе 50 мг 1 или 2 раза в сутки вместе с пиоглитазоном, составляло +0,1 кг или +1,3 кг соответственно.
При добавлении препарата Галвус в дозе 50 мг 1 или 2 раза в сутки к пиоглитазону в дозе 45 мг/сут частота развития периферических отёков составляла 8,2 % и 7% соответственно (по сравнению с 2,5 % на фоне монотерапии пиоглитазоном). Однако при начальной комбинированной терапии вилдаглиптином в дозе 50 мг 1 или 2 раза в сутки вместе с пиоглитазоном в дозе 45 мг/сут развитие периферических отёков наблюдалось у 3,5 % или 6,1 % пациентов соответственно (по сравнению с 9,3 % на фоне монотерапии пиоглитазоном в дозе 30 мг/сут).
Нарушения со стороны сосудов: часто — периферические отёки.
Нарушения со стороны обмена веществ и питания: часто — увеличение массы тела.
При применении препарата Галвус в дозе 50 мг 2 раза в сутки в комбинации с инсулином (с метформином или без него)
При применении препарата в комбинации с инсулином (в комбинации с метформином или без метформина) частота отмены терапии вследствие развития побочных эффектов была равна 0,3 %, в группе терапии вилдаглиптином, в группе плацебо случаев отмены терапии не было.
При применении препарата в комбинации с инсулином (в комбинации с метформином или без метформина) не отмечалось увеличения риска развития гипогликемии по сравнению с комбинацией плацебо + инсулин (14 % в группе вилдаглиптина и 16,4 % в группе плацебо). У 2 пациентов в группе вилдаглиптина и у 6 пациентов в группе плацебо развилась гипогликемия тяжёлой степени.
На момент завершения исследования препарат не оказывал влияния на среднюю массу тела (масса тела увеличена на +0,6 кг по сравнению с исходной в группе вилдаглиптина, а в группе плацебо осталась неизменной).
Нарушения со стороны нервной системы: часто — головная боль, неизвестно — астения.
Нарушения со стороны желудочно-кишечного тракта: часто — тошнота, гастроэзофагеальный рефлюкс; нечасто — диарея, метеоризм.
Общие расстройства и нарушения в месте введения: часто — озноб.
Нарушения со стороны обмена веществ и питания: часто — гипогликемия.
При применении препарата Галвус в дозе 50 мг два раза в день в комбинации с препаратами сульфонилмочевины и метформином
Случаев отмены препарата, связанных с НЯ в группе комбинированной терапии вилдаглиптином, метформином и глимепиридом, отмечено не было. В группе комбинированной терапии плацебо, метформином и глимепиридом частота НЯ составила 0,6 %.
Гипогликемия отмечалась часто в обеих группах (5,1 % в группе комбинированной терапии вилдаглиптином, метформином и глимепиридом и 1,9 % в группе комбинированной терапии плацебо, метформином и глимепиридом). В группе вилдаглиптина отмечен один эпизод гипогликемии тяжёлой степени.
На момент завершения исследования значимого влияния на массу тела выявлено не было (+0,6 кг в группе вилдаглиптина и -0,1 кг в группе плацебо).
Нарушения со стороны нервной системы: часто — головокружение, тремор, астения.
Нарушения со стороны обмена веществ и питания: часто — гипогликемия.
Нарушения со стороны кожи и подкожных тканей: часто — гипергидроз.
Пострегистрационные исследования
Во время проведения пострегистрационных исследований были выявлены следующие побочные реакции (поскольку сообщения получены в добровольном порядке от популяции неопределённого размера, достоверно определить частоту развития данных НЯ не представляется возможным, в связи с чем они классифицированы как частота неизвестна): гепатит (обратим при прекращении терапии), крапивница, панкреатит, буллезное и эксфолиативное поражение кожи, артралгия, в редких случаях выраженная, миалгия, повышение активности «печёночных» ферментов.
Если любые из указанных в инструкции побочных эффектов усугубляются, или Вы заметили любые другие побочные эффекты, не указанные в инструкции, сообщите об этом врачу.
Передозировка
Вилдаглиптин хорошо переносится при применении в дозе до 200 мг/сут.
При применении препарата в дозе 400 мг/сут может наблюдаться боль в мышцах, редко — лёгкие и транзиторные парестезии, лихорадка, отёки и транзиторное повышение активности липазы (выше ВГН в 2 раза). При увеличении дозы вилдаглиптина до 600 мг/сут возможно развитие отёков конечностей, сопровождающихся парестезиями и повышением активности креатинфосфокиназы, С-реактивного белка и миоглобина, активности ACT. Все симптомы передозировки и изменения лабораторных показателей обратимы после прекращения применения препарата.
Выведение препарата из организма с помощью диализа маловероятно. Однако основной гидролизный метаболит вилдаглиптина (LAY151) может быть удалён из организма путём гемодиализа.
Взаимодействие с другими лекарственными средствами
Вилдаглиптин обладает низким потенциалом лекарственного взаимодействия.
Поскольку вилдаглиптин не является субстратом ферментов цитохрома P450 (CYP), а также не ингибирует и не индуцирует эти ферменты, взаимодействие вилдаглиптина с лекарственными препаратами, которые являются субстратами, ингибиторами или индукторами P450 (CYP), маловероятно. При одновременном применении вилдаглиптин также не влияет на скорость метаболизма препаратов, являющихся субстратами ферментов: CYP1A2, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 и CYP3A4/5.
Клинически значимого взаимодействия вилдаглиптина с препаратами, наиболее часто используемыми при лечении СД 2 типа (глибенкламидом, пиоглитазоном, метформином) или обладающими узким терапевтическим диапазоном (амлодипином, дигоксином, рамиприлом, симвастатином, валсартаном, варфарином) не установлено.
Тиазиды, глюкокортикостероиды, препараты гормонов щитовидной железы, симпатомиметики могут снижать гипогликемическое действие вилдаглиптина, как и других пероральных противодиабетических препаратов.
Частота развития ангионевротического отёка была выше при одновременном применении вилдаглиптина с ингибиторами ангиотензинпревращающего фермента, при этом была сходной с таковой в контрольной группе. В большинстве случаев ангионевротический отёк был средней степени тяжести и разрешался самостоятельно в ходе продолжения терапии вилдаглиптином.
Особые указания
В доклинических исследованиях при применении в дозах, в 200 раз превышающих рекомендуемые для человека, препарат не вызывал нарушений фертильности.
При необходимости инсулинотерапии препарат Галвус применяют только в комбинации с инсулином. Препарат противопоказан у пациентов с сахарным диабетом 1 типа или для лечения диабетического кетоацидоза.
Сердечная недостаточность
Поскольку данные о применении вилдаглиптина у пациентов с ХСН III ФК по классификации NYHA (см. Таблицу 1, приведённую ниже) ограничены и не позволяют сделать окончательный вывод, рекомендуется с осторожностью применять препарат Галвус у пациентов данной категории.
Не рекомендуется применение вилдаглиптина у пациентов с ХСН IV ФК по классификации NYHA, ввиду отсутствия данных клинических исследований о применении вилдаглиптина у пациентов этой группы.
Таблица 1. Нью-Йоркская классификация функционального состояния пациентов с хронической сердечной недостаточностью (в модификации), NYHA, 1964.
| Функциональный класс (ФК) | Ограничение физической активности и клинические проявления |
|---|---|
| I ФК | Ограничений в физической активности нет. Обычная физическая нагрузка не вызывает выраженного утомления, слабости, одышки или сердцебиения. |
| II ФК | Умеренное ограничение физической активности. В покое какие-либо патологические симптомы отсутствуют. Обычная физическая нагрузка вызывает слабость, утомляемость, сердцебиение, одышку и другие симптомы. |
| III ФК | Выраженное ограничение физической активности. Больной комфортно чувствует себя только в состоянии покоя, но малейшие физические нагрузки приводят к появлению слабости, сердцебиения, одышки и т. п. |
| IV ФК | Невозможность выполнять какие-либо нагрузки без появления дискомфорта. Симптомы сердечной недостаточности имеются в покое и усиливаются при любой физической нагрузке |
Нарушения функции печени
Поскольку в редких случаях при применении вилдаглиптина отмечалось повышение активности аминотрансфераз (как правило, без клинических проявлений), перед применением препарата Галвус, а также и регулярно в ходе первого года применения препарата (1 раз в 3 месяца), рекомендуется определять биохимические показатели функции печени. При выявлении повышения активности аминотрансфераз следует провести повторное исследование с целью подтверждения результата, а затем регулярно проводить определение биохимических показателей функции печени до их нормализации. Если превышение активности ACT или АЛТ в 3 или более раз выше ВГН подтверждено повторным исследованием, препарат рекомендуется отменить.
При развитии желтухи или других признаков нарушения функции печени на фоне применения препарата Галвус терапию препаратом следует немедленно прекратить. После нормализации показателей функции печени лечение препаратом возобновлять нельзя.
Гипогликемия
Известно, что препараты сульфонилмочевины могут провоцировать развитие гипогликемии. Существует риск развития гипогликемии при одновременном применении вилдаглиптина с препаратами сульфонилмочевины. При необходимости следует рассмотреть возможность снижения дозы препаратов сульфонилмочевины с целью минимизировать риск развития гипогликемии.
Острый панкреатит
Применение вилдаглиптина связано с риском развития острого панкреатита. Следует проинформировать пациента о симптомах, характерных для острого панкреатита. При подозрении на острый панкреатит вилдаглиптин следует отменить. Не следует возобновлять терапию вилдаглиптином, если острый панкреатит был подтверждён. У пациентов с острым панкреатитом в анамнезе применять вилдаглиптин следует с осторожностью.
Влияние на способность управлять транспортными средствами, механизмами
Исследования влияния препарата Галвус на способность управлять транспортными средствами или работать с механизмами не проводились. При развитии головокружения на фоне применения препарата пациентам не следует управлять транспортными средствами или работать с механизмами.
Форма выпуска
Таблетки, 50 мг.
По 7 или 14 шт. в блистере.
По 2, 4, 8, 12 блистеров вместе с инструкцией по применению в картонной пачке.
Хранение
В оригинальной упаковке, при температуре не выше 30 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности.
Условия отпуска из аптек
Отпускают по рецепту.