1. ФАРМАЦЕВТИЧЕСКАЯ РАЗРАБОТКА ICH Q8 (R2)
А.П. Мешковский
ПМГМУ им. Сеченова
[email protected]
2.
Кратко об истории вопроса
• В странах ЕС существовал раздел
регистрационных требований
«фармацевтические аспекты разработки»
(Development pharmaceutics)
• В США также требовалось представить
пояснения о ходе создания продукта
(лекформы)
• Требование о наличии документа в составе
досье — пояснительной записки к прописи и
технологии
3.
В отличие от этого теперь:
• Соответствующие регистрационные
требования изложены в другом документе:
раздел 3.2.P.2 «Общего технического
документа» (ICH M4)
• А фармацевтическая разработка – скорее
методические указания относительно
проведения определенных исследований
4.
Американская инициатива
в сфере GMP — 2002 г.
• Сближение регистрации, производства по GMP и
инспектирования по GMP
• Качество через дизайн, пространство дизайна, РАТ
• Управление рисками
• Системы качества
• Совершенствование практики инспектирования по
GMP
• Международная гармонизация требований GMP
• Международное
сотрудничество
по
всем
направлениям
4
5.
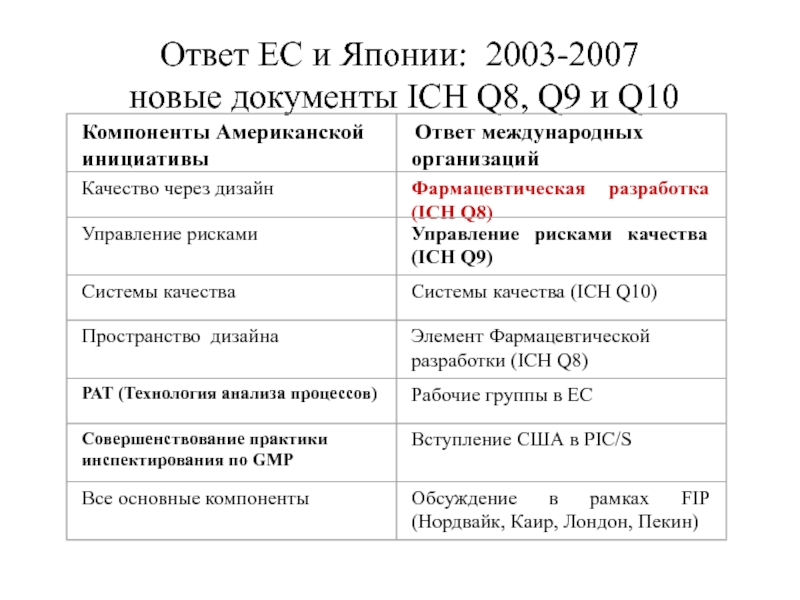
Ответ ЕС и Японии: 2003-2007
новые документы ICH Q8, Q9 и Q10
Компоненты Американской
инициативы
Ответ международных
организаций
Качество через дизайн
Фармацевтическая разработка
(ICH Q8)
Управление рисками качества
(ICH Q9)
Управление рисками
Системы качества
Системы качества (ICH Q10)
Пространство дизайна
Элемент Фармацевтической
разработки (ICH Q8)
РАТ (Технология анализа процессов)
Рабочие группы в ЕС
Совершенствование практики
инспектирования по GMP
Вступление США в PIC/S
Все основные компоненты
Обсуждение
в
рамках
FIP
(Нордвайк, Каир, Лондон, Пекин)
6. Гармонизированное трехстороннее руководство
• МЕЖДУНАРОДНАЯ КОНФЕРЕНЦИЯ ПО
ГАРМОНИЗАЦИИ ТЕХНИЧЕСКИХ
ТРЕБОВАНИЙ ДЛЯ РЕГИСТРАЦИИ
лекарственных продуктов
медицинского назначения (ICH )
• Рекомендовано Руководящим комитетом ICH
для принятия на этапе 4 Процесса ICH
10 ноября 2005
7.
Статус документа Q8
• Текст, утвержденный в ноябре 2005 г., рассматривался
как первая часть будущего документа.
• В 2008 г. принято дополнение Q8(R1)
• В 2009 г. принято дополнение Q8(R2)
• Одновременно пересматривается обзор раздела
«Качество» (Quality Overall Summary — QOS) ОТД.
• Возможен также пересмотр других документов ICH
8.
Дополнения к Q8
—
Приняты в 2008 (R1) и в 2009 (R2) гг.
дальнейшие разъяснения новых понятий:
“качество через дизайн”
“пространство дизайна”
“целевой профиль продукта”
“критические свойства материалов”
“критические параметры процессов”
“стратегия контроля качества”
9.
Рекомендации ВОЗ
• Документ ВОЗ “Фармацевтическая разработка для
дженериков” 2008 г.
• Рассматриваются вопросы:
— стратегии разработки воспроизведенных препаратов
— перичная оценка рисков качества
— выбор компараторов для испытания
биоэквивалентности
— те же разделы, что и для инновационных препаратов
— практические подходы (если не использовать Q8)
10.
Фармацевтическая разработка
• Это действия, выполнение которых необходимо
для подтверждения того, что выбранная
лекформа отвечает своему назначению
• Позволяет выявить аспекты прописи и
процесса, критические для воспроизводимости
серий (внутрипроизводственный контроль
-ВПК)
• Помогает лучше понять дизайн продукта
• Является его научной базой
11. Цели руководства
Описывает содержание раздела 3.2.P.2 заявки на регистрацию в
формате ICH M4 «Общий технический документ» (CTD).
Дает возможность представить информацию, полученную путем
применения научных подходов и управления рисками качества
(Q9) в разработке продукта и производственного процесса.
Первоначально эти данные готовятся для включения в
регистрационное досье;
Они могут обновляться с тем, чтобы отражать новые знания,
полученные в течение жизненного цикла продукта.
Данные предназначены для обеспечения всестороннего
понимания продукта и производственного процесса теми, кто
рассматривает материалы заявки на регистрацию и инспекторами.
12.
Стратегические цели
• Создать продукт высокого качества и соответствующий
производственный процесс,
• Обеспечивать клиническое действие продукта, предусмотренное
его дизайном.
• Информация и знания, полученные в результате исследований в
рамках фармацевтической разработки, а также опыт производства
позволяют достичь научного понимания, достаточного для
обоснования
установленного
пространства
дизайна,
спецификаций, и методов производственного контроля.
• Информация, полученная в результате исследований по
фармацевтической разработке, может быть основанием для
управления рисками качества.
13.
Связь с GMP
Национальный конгресс в Харькове:
“Настоящее и будущее фармации”, апрель 2008 г.
В числе выводов: GMP без фармацевтической
разработки – евроремонт (не более того)
13
14.
Q8: содержание
• Первая часть документа основана на Руководстве ЕС
по фармацевтическим исследованиям (Development
Pharmaceutics).
• Напоминает о тезисе «Качество не может быть
вложено в продукт путем его тестирования после
завершения производственного цикла. Оно должно
быть «встроено» (built in) в него, начиная с концепции
проекта и на протяжении всех этапов производства».
• Тезис сформулирован в США в 60-х годах прошлого
века, в период введения правил GMP
15.
Качество должно быть «встроено»?
• Первоначально понималось, что качество должно быть
«встроено» в процессе производства (GMP)
• Теперь считается, что встраивать нужно начиная с
дизайна продукта (концепции, проекта, задумки) и в
ходе фармацевтической (и аналитической) разработки
• В дальнейшем качество фиксируется через процедуру
регистрации продуктов
• И поддерживается на всех этапах оборота путем
соблюдения правил GMP, GDP, GPP, GSP и др.
16.
Новые понятия
• Целевой профиль качества: желаемые
(фармакокинетические) свойства продукта
(ориентир — фармакопея или потребитель?)
• Качество через дизайн
• Пространство дизайна (PAR & NOR)
• Гибкие регуляторные подходы
• Уточнение понятий: «критические
характеристики и параметры»
16
17. О качестве
• Важно признать, что качество не может быть
достигнуто путем испытания продуктов, иначе говоря,
качество должно cоздаваться, начиная с дизайна
(проекта, задумки) продукта
• Изменения в прописи и в производственных
процессах в ходе разработки и управления жизненным
циклом должны рассматриваться как возможность
получать дополнительные знания, поддерживающие
установление пространства дизайна.
18.
Гибкие регуляторные подходы
• регуляторные решения на основе анализа риска
(рассмотрение заявки и инспектирование);
• усовершенствование производственного процесса в
пределах
одобренного
пространства
дизайна,
описанного в досье, без дальнейшего рассмотрения;
• сокращение заявок на изменение регистрационных
условий;
• проверка качества в реальном времени, ведущая к
сокращению испытаний при выпуске конечного
продукта.
19. Обосновать выбор лекформы, прописи и технолгии
Этот раздел должен содержать данные, подтверждающие, что
выбранная
дозированная форма и предложенная пропись
подходят для предназначенного использования.
Могут прилагаться
таблицы и графики,
облегчающие
рассмотрение заявки.
Должны быть определенны те аспекты лекарственных
субстанций, вспомогательных веществ, упаковочно-укупорочной
системы и производственных процессов, которые являются
критическими для качества продукта.
Критические характеристики прописи и параметры процесса
выявляются через оценку степени влияния их изменений на
качество лекарственного продукта.
20. Кроме того
• Заявитель
может проводить исследования по
фармацевтической разработке, ведущие к увеличению
знаний о действии
продукта в более широком
диапазоне свойств материалов, вариантов выбора
процессов и их параметров.
• Включение этой дополнительной информации дает
возможность демонстрировать более высокую степень
понимания свойств материалов, характеристик
производственных процессов и их контроля.
• В этих ситуациях имеется возможность для введения
более гибких регуляторных подходов.
21. Лекарственная субстанция
Физико-химические и биологические свойства лекарственной
субстанции, могущие повлиять на действие продукта и его
технологичность, или
специально
заложенные в проект
(например,
свойства
твердого
тела),
должны
быть
идентифицированы и обсуждены.
Примеры: физико-химические и биологические свойства растворимость, содержание влаги, размер частиц,
свойства
кристаллов, биологическая активность, и способность проникать
сквозь биологические мембраны.
Эти свойства могут быть взаимосвязаны, в связи с чем может
потребоваться их совместное рассмотрение.
22. Вспомогательные вещества
Необходимо оценить совместимость лекарственной субстанции
с вспомогательными веществами в прописи,
Обсуждение функций каждого вспомогательного вещества, их
концентрации, характеристик, могущих влиять на действие
лекарственного
продукта
(например,
стабильность,
биодоступность) или технологичность,
Должна
также
быть
продемонстрирована
способность
вспомогательных веществ (например, антиоксидантов, веществ
увеличивающих всасывание, способствующих распадаемости,
контролирующих
высвобождение)
обеспечить
их
предназначенные функциональные возможности, и действовать в
течение всего предполагаемого срока годности продукта.
23. Лекарственный продукт
Необходимо представить резюме (обзор) с описанием разработки
прописи, включая идентификацию тех характеристик, которые являются
критическими в отношении качества лекарственного продукта, учитывая
(его) предназначенное использование и способ введения.
Акцент на ходе разработки дизайна прописи, от первоначального
проекта до окончательного варианта.
Выбор компонентов лекарственного продукта (например, свойства
лекарственной субстанции, вспомогательных веществ,
упаковочноукупорочной
системы
и
любых
дозирующих
устройств),
производственный процесс,
Обоснования интервалов в закладке вспомогательных веществ, вошедших
в регламент производства (3.2.P.3.2). Это обоснование часто может
базироваться на опыте, полученном в процессе разработки или
производства.
24. Избыток
• Как правило, не рекомендуется использование избытка
лекарственной субстанции для компенсации разрушения в процессе
производства или хранения продукта, либо для продления срока
годности.
• Любые избытки в производстве лекарственного продукта,
появляются ли они в готовой дозированной форме или нет, должны
быть обоснованы с точки зрения безопасности и эффективности
продукта.
• Должна быть предоставлена информация о 1) количестве избытка, 2)
причинах использования (например, чтобы компенсировать
ожидаемые и документированные производственные потери), и 3)
обоснование величины избытка.
• Избыток должен быть включен в указанное в описании технологии
количество лекарственной субстанции
25. Производственный процесс
Объяснение выбора производственного процесса и видов
контроля.
Рассмотрение критических характеристик прописи, вместе с
возможными вариантами производственного процесса, чтобы
выбрать производственный процесс и подтвердить пригодность
компонентов.
Пригодность оборудования применительно к запланированным
продуктам.
Исследования по разработке производственного процесса
должны обеспечить основание для усовершенствования процесса,
его валидации, непрерывной верификации процесса (где это
применимо) и любых требований в отношении контроля
процесса.
26. Производственный процесс -2
• В соответствующих случаях такие исследования должны быть
направлены на микробиологические, а также на физические и
химические характеристики. Знания, полученные в результате
исследований по разработке производственного процесса, могут
использоваться, при необходимости, для обоснования
спецификации лекарственного продукта
• Программа разработки (или усовершенствования)
производственного процесса должна выделять любые
критические параметры процесса, подлежащие мониторингу или
контролю (например, время окончания грануляции) с тем, чтобы
гарантировать желаемое качество продукта.
27. Упаковочно-укупорочная система
Выбор и основания для выбора
упаковочно-укупорочной
системы закрытия.
Внимание намечаемому использованию лекарственного продукта
и пригодности соответствующей упаковки для хранения и
транспортировки, включая, при необходимости, хранение и
транспортную упаковку для нерасфасованного лекарственного
продукта (балк-продукта).
Выбор материалов для первичной упаковки должен быть
обоснован. Обсуждение должно описать исследования,
выполненные, чтобы продемонстрировать целостность упаковки
(контейнера) и её укупорки. Должно быть рассмотрено возможное
взаимодействие между продуктом и упаковкой или этикеткой.
28. Выбор упаковочных материалов
• Выбор первичных упаковочных материалов должен
быть обоснован, например, выбор материалов,
защищающих от влажности и света, совместимость
упаковки с дозированной формой (включая сорбцию,
извлечение); также необходимо принять во внимание
безопасность материалов упаковки.
• В случаях, когда это имеет значение, необходимо
обосновать выбор вторичной упаковки.
29. Микробиологические свойства
В соответствующих случаях в этом разделе должны быть
рассмотрены микробиологические свойства лекарственного
продукта. Необходимо обосновать, например:
— для нестерильных форм выполнение или невыполнение
испытаний на микробиологическую чистоту
— выбор и эффективность
систем консервантов в продуктах
содержащих антимикробный агент или антибактериальная
эффективность для продуктов, обладающих естественными
антибактериальными свойствами;
• Для стерильных продуктов целостность упаковки, в связи с
предотвращением микробного загрязнения.
30. Совместимость окончательной лекформы
Необходимо обратить внимание на совместимость активного
вещества с растворами для приготовления лекарственной формы
перед применением (например, осаждение, стабильность), чтобы
предоставить соответствующую подтверждающую информацию
для маркировка.
Эта информация должна отображать рекомендованный срок
хранения приготовленной перед использованием лекформы, при
рекомендованной
температуре
хранения
и
возможных
максимальных концентрациях.
Может
возникнуть необходимость рассмотреть варианты с
добавкой (например, «подкалыванием» в инъекционные растворы
большого объема) или разведением перед применением.
31.
Разработка методов контроля
• Отправная точка: желаемые
(фармакокинетические) свойства продукта
• Лабораторный и полупроизводственный
масштаб
• Решение вопросов:
(Состав)
Параметры процесса и ВПК
Спецификация готового продукта
Аналитические методы
32.
ФАРМАЦЕВТИЧЕСКАЯ
РАЗРАБОТКА
Практические аспекты:
опыт производителей
33. Обсуждение руководства
• Практические аспекты
• Опыт производителей
34.
Фармацевтическая разработка:
три вида подхода
Инновационные препараты
Дженерики с улучшенными свойствами
Дженерики – точные копии
инновационных препаратов
34
35.
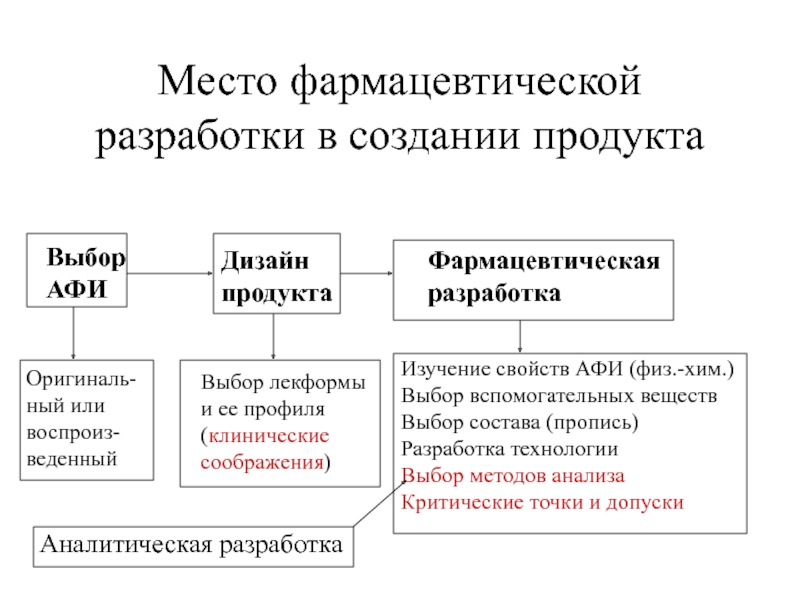
Место фармацевтической
разработки в создании продукта
Выбор
АФИ
Оригинальный или
воспроизведенный
Дизайн
продукта
Выбор лекформы
и ее профиля
(клинические
соображения)
Аналитическая разработка
Фармацевтическая
разработка
Изучение свойств АФИ (физ.-хим.)
Выбор вспомогательных веществ
Выбор состава (пропись)
Разработка технологии
Выбор методов анализа
Критические точки и допуски
36.
Информация, получаемая в ходе
фармацевтической разработки,
• Условно делится на три части:
Раздел «Характеризация» (изучение
свойств)
Раздел «Оптимизация»
Раздел «Верификация»
37.
Раздел «Характеризация»
(изучение свойств)
Предварительное изучение субстанции
(preformulation — физико-химические свойства
АФИ )
Совместимость (compatibility – выбор
вспомогательных веществ)
Пропись (состав)
Процесс (технология и контроль – ВПК)
Аналитические методы
38.
Раздел «Оптимизация»
Устойчивость
Критические параметры
Реалистичные допуски
39.
Раздел «Верификация»
Валидация (включая квалификацию)
Масштабирование
Перенос технологии (на другую
площадку)
Текущее усовершенствование
технологии (оптимизация)
40.
Варианты оптимизации
прописи и технологии
• Целенаправленные исследования по отработке
технологии, включая уточнение прописи
(ограниченное время, до валидации)
• Непрерывное совершенствование на основе
накопляемого опыта, в т.ч. за счет выявления и
устранения причин инцидентов (после
валидации, постоянно, через систему
управления изменениями)
41. Валидация и фармацевтическая разработка
Фармацевтическая разработка
позволяет получить обоснованные
исходные данные для валидации
технологических процессов и
аналитических методик
42.
Пример изучения свойств активной
субстанции Х (preformulation)
• Форма и размер кристаллов: кубическая; D10 2,6 μm; D50 -15 μm; D90 — 48 μm
• Удельная поверхность – 1,5 м2/г
• Сыпучесть: слабая
• Прессуемость: плохая
• Угол контакта: 77º
• Скорость растворения: 1,5 μг/см2/мин.
• Полиморфизм: нет
• Термическая взрывоопасность: нет
43.
Изучение свойств активной
субстанции (раствор)
• Профиль растворимости: макс. 10 μг/мл при рН
1-4 (добавление буферного р-ра)
• Зависимость стабильности от рН: деградация
выше рН 5,5
• Влияние растворителей: добавка ПЭГ 400
(20/80) при рН 4 – 150 μг/мл
• Стерилизация: термическая стерилизация
невозможна – только γ-стерилизация
44.
От свойств АФИ к выбору
вспомогательных веществ
• Для твердых пероральных форм: если
растворимость АФИ менее 1% требуются комплексообразующие или
поверхностно активные вещества
(циклодекстрины)
• При недостаточной стабильности –
использование антиоксидантов
44
45.
Вспомогательные вещества
добавляются в целях:
• Увеличения стабильности лекформы
(антиоксиданты)
• Оптимизации биофармацевтических
свойств (дезинтегранты, оболочка)
• Улучшения технологичности
(наполнители, скользящие в-ва)
• Улучшение принятия пациентами
(вкусовые добавки, красители)
45
46.
Стресс-испытания субстанций и
прописи: примеры
• Температура: в открытом виде увлажненный
материал – 4 недели при 80°C, анализ
еженедельно
• Влажность: в открытом виде 4 недели при 40°C
/100% о.в., анализ через 2 недели
• Окисление: 24 часа, через насыщенный водный
раствор (суспензию) материала пропускается
кислород при перемешивании, анализ каждые 8
часов.
46
47.
Стресс-испытания субстанций и
прописи: примеры
• Температура: в открытом виде увлажненный
материал – 4 недели при 80°C, анализ
еженедельно
• Влажность: в открытом виде 4 недели при 40°C
/100% о.в., анализ через 2 недели
• Окисление: 24 часа, через насыщенный водный
раствор (суспензию) материала пропускается
кислород при перемешивании, анализ каждые 8
часов.
47
48.
Типичные стресс-испытания
Стресс-фактор
Условия (до 10 дней,
окисление до 3 дней)
Концентрация АФИ
Нагревание
60°С
1:1 с наполнителем
Влажность
75% о.в. или выше
чистая субстанция
Кислая среда
0,1 N HCl
2:1 с 0,1 N HCl
Щелочная среда
0,1 N NaCl
2:1 с 0,1 N NaCl
Окисление
3% Н2О2
1:1 с 3% Н2О2
Освещение
Галогеновая, ксеноновая,
ртутная или УФ
флуоресцентная лампа
1:1 с наполнителем
Металлические
ионы
0, 05 М Fe2 или Cu2
1:1 с раствором ионов
48
49.
Типичные стресс-испытания
Стресс-фактор
Условия (до 10 дней,
окисление до 3 дней)
Концентрация АФИ
Нагревание
60°С
1:1 с наполнителем
Влажность
75% о.в. или выше
чистая субстанция
Кислая среда
0,1 N HCl
2:1 с 0,1 N HCl
Щелочная среда
0,1 N NaCl
2:1 с 0,1 N NaCl
Окисление
3% Н2О2
1:1 с 3% Н2О2
Освещение
Галогеновая, ксеноновая,
ртутная или УФ
флуоресцентная лампа
1:1 с наполнителем
Металлические
ионы
0, 05 М Fe2 или Cu2
1:1 с раствором ионов
49
50.
Типичные стресс-испытания
Стресс-фактор
Условия (до 10 дней,
окисление до 3 дней)
Концентрация АФИ
Нагревание
60°С
1:1 с наполнителем
Влажность
75% о.в. или выше
чистая субстанция
Кислая среда
0,1 N HCl
2:1 с 0,1 N HCl
Щелочная среда
0,1 N NaCl
2:1 с 0,1 N NaCl
Окисление
3% Н2О2
1:1 с 3% Н2О2
Освещение
Галогеновая, ксеноновая,
ртутная или УФ
флуоресцентная лампа
1:1 с наполнителем
Металлические
ионы
0, 05 М Fe2 или Cu2
1:1 с раствором ионов
50
51.
Типичные стресс-испытания
Стресс-фактор
Условия (до 10 дней,
окисление до 3 дней)
Концентрация АФИ
Нагревание
60°С
1:1 с наполнителем
Влажность
75% о.в. или выше
чистая субстанция
Кислая среда
0,1 N HCl
2:1 с 0,1 N HCl
Щелочная среда
0,1 N NaCl
2:1 с 0,1 N NaCl
Окисление
3% Н2О2
1:1 с 3% Н2О2
Освещение
Галогеновая, ксеноновая,
ртутная или УФ
флуоресцентная лампа
1:1 с наполнителем
Металлические
ионы
0, 05 М Fe2 или Cu2
1:1 с раствором ионов
51
52.
Лабораторный уровень
• Предварительные исследования
(preformulation)
• Масштаб – 1х
• Изучение физико-химических характеристик
активной субстанции и вспомогательных
веществ (раздельно)
• Выбор и отработка аналитических методик
• Определение критических характеристик
• Выбор стратегии контроля
52
53.
Крупно-лабораторный уровень
Выбор прописи (formulation)
Масштаб – 10х
Совместимость (изучение смесей)
Стресс-испытания выбранной прописи
Стабильность – скрининг (открытое состояние,
4 недели при 40°С/75% о.в.)
• Выбор и оптимизация процесса (технологии)
• Наработка серий для испытания стабильности
53
54.
Уровень опытнонаработочного цеха
• Масштаб – от 100х до 1/10 серийного производства; не
меньше 100 тыс. таблеток (капсул)
• Оборудование – того же типа, что в серийном
производстве
• Отработка технологии (оптимизация)
• Наработка «биосерий» (для клиники, испытания
биоэквивалентности)
• Наработка серий для испытания стабильности (до 12
мес. при 25ºC/60% о.в. и до 6-9 мес. при 30ºC/60% о.в.
по 2-3 сериям)
• Предварительная валидация процесса (десятки серий)
54
55.
Серийное производство
• Первые три (две) серии – валидационные
(подтверждающие – conformance batches)
• Отчет о валидации, утверждение отчета
• Утверждение/отклонение прописи и технологии
• Для регистрационного досье (если не сделано ранее):
результаты анализа серий по предлагаемой
спецификации (5 серий или меньше) с указанием
объема, даты и цели производства
• Оптимизация процесса (постоянно)
55
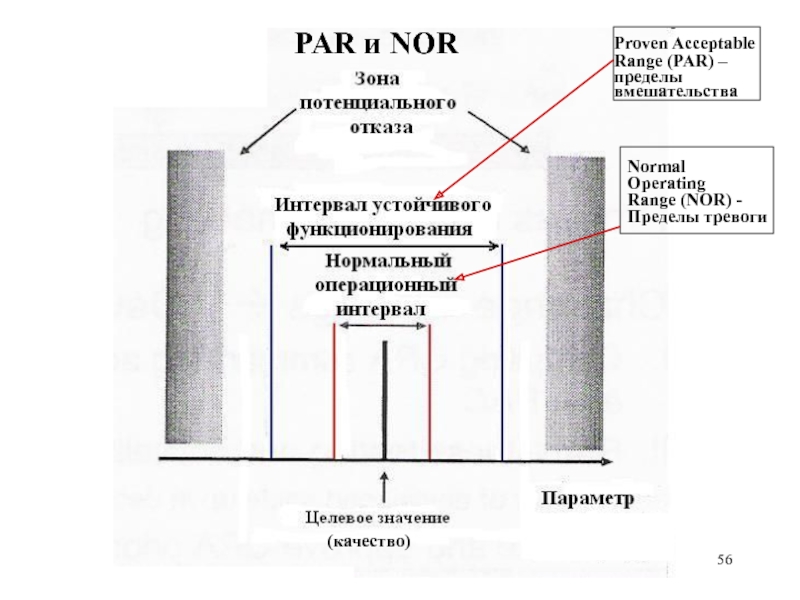
56.
PAR и NOR
Proven Acceptable
Range (PAR) –
пределы
вмешательства
Normal
Operating
Range (NOR) Пределы тревоги
(качество)
56
Фармацевтическая разработка (ICH Q8)
Pharmaceutical Development
Билингва
Тип документа
Руководство
Организация
Страниц в документе
25 страниц
Дата первого принятия
10.11.2005
Дата пересмотра
01.08.2009
Версия перевода от
04.12.2020
Цитировать как
Фармацевтическая разработка (ICH Q8). Перевод: PharmAdvisor, версия перевода от 04.12.2020. URL: https://pharmadvisor.ru/document/tr3614/ (дата обращения: ).
Скачать оригинал
. 2001 Oct-Dec;47(4):264-7.
-
PMID:
11832645
Free article
ICH harmonised tripartite guideline: guideline for good clinical practice. 8. Essential documents for the conduct of a clinical trial
No authors listed.
J Postgrad Med.
2001 Oct-Dec.
Free article
No abstract available
Similar articles
-
ICH Harmonised Tripartite Guideline: Guideline for Good Clinical Practice.
[No authors listed]
[No authors listed]
J Postgrad Med. 2001 Jul-Sep;47(3):199-203.
J Postgrad Med. 2001.PMID: 11832625
No abstract available.
-
Analysis of the compliance of informed consent documents with good clinical practice guideline.
Padhy BM, Gupta P, Gupta YK.
Padhy BM, et al.
Contemp Clin Trials. 2011 Sep;32(5):662-6. doi: 10.1016/j.cct.2011.05.016. Epub 2011 Jun 2.
Contemp Clin Trials. 2011.PMID: 21664297
-
ICH Harmonised Tripartite Guideline: guideline for good clinical practice.
[No authors listed]
[No authors listed]
J Postgrad Med. 2001 Apr-Jun;47(2):121-30.
J Postgrad Med. 2001.PMID: 11832605
No abstract available.
-
[ICH-GCP Guideline: quality assurance of clinical trials. Status and perspectives].
Englev E, Petersen KP.
Englev E, et al.
Ugeskr Laeger. 2003 Apr 14;165(16):1659-62.
Ugeskr Laeger. 2003.PMID: 12756823
Review.
Danish. -
Medical treatment of echinococcosis under the guidance of Good Clinical Practice (GCP/ICH).
Kern P.
Kern P.
Parasitol Int. 2006;55 Suppl:S273-82. doi: 10.1016/j.parint.2005.11.040. Epub 2005 Dec 9.
Parasitol Int. 2006.PMID: 16338164
Review.
Cited by
-
Cohort Profile: South African Population Research Infrastructure Network (SAPRIN).
Collinson MA, Mudzana T, Mutevedzi T, Kahn K, Maimela E, Gómez-Olivé FX, Mngomezulu T, Gareta D, Kabudula CW, Nemuramba R, Tlouyamma J, Tollman S, Herbst K.
Collinson MA, et al.
Int J Epidemiol. 2022 Aug 10;51(4):e206-e216. doi: 10.1093/ije/dyab261.
Int J Epidemiol. 2022.PMID: 34966919
Free PMC article.No abstract available.
-
Protein C zymogen in severe sepsis: a double-blinded, placebo-controlled, randomized study.
Pappalardo F, Crivellari M, Di Prima AL, Agracheva N, Celinska-Spodar M, Lembo R, Taddeo D, Landoni G, Zangrillo A.
Pappalardo F, et al.
Intensive Care Med. 2016 Nov;42(11):1706-1714. doi: 10.1007/s00134-016-4405-5. Epub 2016 Jun 25.
Intensive Care Med. 2016.PMID: 27344436
Clinical Trial.
-
IDegLira Improves Both Fasting and Postprandial Glucose Control as Demonstrated Using Continuous Glucose Monitoring and a Standardized Meal Test.
Holst JJ, Buse JB, Rodbard HW, Linjawi S, Woo VC, Boesgaard TW, Kvist K, Gough SC.
Holst JJ, et al.
J Diabetes Sci Technol. 2015 Oct 6;10(2):389-97. doi: 10.1177/1932296815610124.
J Diabetes Sci Technol. 2015.PMID: 26443290
Free PMC article.Clinical Trial.
-
Effects of calcium carbonate, sevelamer hydrochloride or pantoprazole on the pharmacokinetics of cinacalcet.
Padhi D, Harris R, Sullivan JT.
Padhi D, et al.
Clin Drug Investig. 2014 Aug;34(8):537-44. doi: 10.1007/s40261-014-0206-1.
Clin Drug Investig. 2014.PMID: 24935051
Clinical Trial.
MeSH terms
LinkOut — more resources
-
Full Text Sources
- Medknow Publications and Media Pvt Ltd
-
Medical
- MedlinePlus Health Information
Слайд 1ФАРМАЦЕВТИЧЕСКАЯ РАЗРАБОТКА
ICH Q8 (R2)
А.П. Мешковский
ПМГМУ им. Сеченова
meshkvskijj@mail.ru

Слайд 2Кратко об истории вопроса
В странах ЕС существовал
раздел регистрационных требований «фармацевтические аспекты разработки» (Development
pharmaceutics)
В США также требовалось представить пояснения о ходе создания продукта (лекформы)
Требование о наличии документа в составе досье — пояснительной записки к прописи и технологии

Слайд 3В отличие от этого теперь:
Соответствующие регистрационные требования
изложены в другом документе: раздел 3.2.P.2 «Общего
технического документа» (ICH M4)
А фармацевтическая разработка – скорее методические указания относительно проведения определенных исследований

Слайд 4Американская инициатива
в сфере GMP — 2002
г.
Сближение регистрации, производства по GMP и
инспектирования по GMP
Качество через дизайн, пространство дизайна, РАТ
Управление рисками
Системы качества
Совершенствование практики инспектирования по GMP
Международная гармонизация требований GMP
Международное сотрудничество по всем направлениям

Слайд 5Ответ ЕС и Японии: 2003-2007
новые документы
ICH Q8, Q9 и Q10
Слайд 6Гармонизированное трехстороннее руководство
МЕЖДУНАРОДНАЯ КОНФЕРЕНЦИЯ ПО ГАРМОНИЗАЦИИ
ТЕХНИЧЕСКИХ
ТРЕБОВАНИЙ ДЛЯ РЕГИСТРАЦИИ лекарственных продуктов
медицинского назначения (ICH
)
Рекомендовано Руководящим комитетом ICH для принятия на этапе 4 Процесса ICH
10 ноября 2005

Слайд 7Статус документа Q8
Текст, утвержденный в ноябре 2005
г., рассматривался как первая часть будущего документа.
В
2008 г. принято дополнение Q8(R1)
В 2009 г. принято дополнение Q8(R2)
Одновременно пересматривается обзор раздела «Качество» (Quality Overall Summary — QOS) ОТД.
Возможен также пересмотр других документов ICH

Слайд 8Дополнения к Q8
Приняты в 2008 (R1) и
в 2009 (R2) гг.
дальнейшие разъяснения новых
понятий:
“качество через дизайн”
“пространство дизайна”
“целевой профиль продукта”
“критические свойства материалов”
“критические параметры процессов”
“стратегия контроля качества”

Слайд 9 Рекомендации ВОЗ
Документ ВОЗ “Фармацевтическая разработка для
дженериков” 2008 г.
Рассматриваются вопросы:
— стратегии разработки
воспроизведенных препаратов
перичная оценка рисков качества
выбор компараторов для испытания биоэквивалентности
те же разделы, что и для инновационных препаратов
практические подходы (если не использовать Q8)

Слайд 10Фармацевтическая разработка
Это действия, выполнение которых необходимо для
подтверждения того, что выбранная лекформа отвечает своему
назначению
Позволяет выявить аспекты прописи и процесса, критические для воспроизводимости серий (внутрипроизводственный контроль -ВПК)
Помогает лучше понять дизайн продукта
Является его научной базой

Слайд 11Цели руководства
Описывает содержание раздела 3.2.P.2 заявки
на регистрацию в формате ICH M4 «Общий
технический документ» (CTD).
Дает возможность представить информацию, полученную путем применения научных подходов и управления рисками качества (Q9) в разработке продукта и производственного процесса.
Первоначально эти данные готовятся для включения в регистрационное досье;
Они могут обновляться с тем, чтобы отражать новые знания, полученные в течение жизненного цикла продукта.
Данные предназначены для обеспечения всестороннего понимания продукта и производственного процесса теми, кто рассматривает материалы заявки на регистрацию и инспекторами.

Слайд 12 Стратегические цели
Создать продукт высокого качества
и соответствующий производственный процесс,
Обеспечивать клиническое действие продукта,
предусмотренное его дизайном.
Информация и знания, полученные в результате исследований в рамках фармацевтической разработки, а также опыт производства позволяют достичь научного понимания, достаточного для обоснования установленного пространства дизайна, спецификаций, и методов производственного контроля.
Информация, полученная в результате исследований по фармацевтической разработке, может быть основанием для управления рисками качества.

Слайд 13Связь с GMP
Национальный конгресс в Харькове:
“Настоящее и
будущее фармации”, апрель 2008 г.
В числе выводов:
GMP без фармацевтической
разработки – евроремонт (не более того)

Слайд 14Q8: содержание
Первая часть документа основана на Руководстве
ЕС по фармацевтическим исследованиям (Development Pharmaceutics).
Напоминает о
тезисе «Качество не может быть вложено в продукт путем его тестирования после завершения производственного цикла. Оно должно быть «встроено» (built in) в него, начиная с концепции проекта и на протяжении всех этапов производства».
Тезис сформулирован в США в 60-х годах прошлого века, в период введения правил GMP

Слайд 15Качество должно быть «встроено»?
Первоначально понималось, что
качество должно быть «встроено» в процессе производства
(GMP)
Теперь считается, что встраивать нужно начиная с дизайна продукта (концепции, проекта, задумки) и в ходе фармацевтической (и аналитической) разработки
В дальнейшем качество фиксируется через процедуру регистрации продуктов
И поддерживается на всех этапах оборота путем соблюдения правил GMP, GDP, GPP, GSP и др.

Слайд 16Новые понятия
Целевой профиль качества: желаемые (фармакокинетические) свойства
продукта (ориентир — фармакопея или потребитель?)
Качество через
дизайн
Пространство дизайна (PAR & NOR)
Гибкие регуляторные подходы
Уточнение понятий: «критические характеристики и параметры»

Слайд 17О качестве
Важно признать, что качество не может
быть достигнуто путем испытания продуктов, иначе говоря,
качество должно cоздаваться, начиная с дизайна (проекта, задумки) продукта
Изменения в прописи и в производственных процессах в ходе разработки и управления жизненным циклом должны рассматриваться как возможность получать дополнительные знания, поддерживающие установление пространства дизайна.

Слайд 18Гибкие регуляторные подходы
• регуляторные решения на
основе анализа риска (рассмотрение заявки и инспектирование);
•
усовершенствование производственного процесса в пределах одобренного пространства дизайна, описанного в досье, без дальнейшего рассмотрения;
• сокращение заявок на изменение регистрационных условий;
• проверка качества в реальном времени, ведущая к сокращению испытаний при выпуске конечного продукта.

Слайд 19Обосновать выбор лекформы, прописи и технолгии
Этот раздел
должен содержать данные, подтверждающие, что выбранная дозированная
форма и предложенная пропись подходят для предназначенного использования.
Могут прилагаться таблицы и графики, облегчающие рассмотрение заявки.
Должны быть определенны те аспекты лекарственных субстанций, вспомогательных веществ, упаковочно-укупорочной системы и производственных процессов, которые являются критическими для качества продукта.
Критические характеристики прописи и параметры процесса выявляются через оценку степени влияния их изменений на качество лекарственного продукта.

Слайд 20Кроме того
Заявитель может проводить исследования по фармацевтической
разработке, ведущие к увеличению знаний о действии
продукта в более широком диапазоне свойств материалов, вариантов выбора процессов и их параметров.
Включение этой дополнительной информации дает возможность демонстрировать более высокую степень понимания свойств материалов, характеристик производственных процессов и их контроля.
В этих ситуациях имеется возможность для введения более гибких регуляторных подходов.

Слайд 21Лекарственная субстанция
Физико-химические и биологические свойства лекарственной
субстанции, могущие повлиять на действие продукта и
его технологичность, или специально заложенные в проект (например, свойства твердого тела), должны быть идентифицированы и обсуждены.
Примеры: физико-химические и биологические свойства — растворимость, содержание влаги, размер частиц, свойства кристаллов, биологическая активность, и способность проникать сквозь биологические мембраны.
Эти свойства могут быть взаимосвязаны, в связи с чем может потребоваться их совместное рассмотрение.

Слайд 22Вспомогательные вещества
Необходимо оценить совместимость лекарственной субстанции
с вспомогательными веществами в прописи,
Обсуждение функций
каждого вспомогательного вещества, их концентрации, характеристик, могущих влиять на действие лекарственного продукта (например, стабильность, биодоступность) или технологичность,
Должна также быть продемонстрирована способность вспомогательных веществ (например, антиоксидантов, веществ увеличивающих всасывание, способствующих распадаемости, контролирующих высвобождение) обеспечить их предназначенные функциональные возможности, и действовать в течение всего предполагаемого срока годности продукта.

Слайд 23Лекарственный продукт
Необходимо представить резюме (обзор) с описанием
разработки прописи, включая идентификацию тех характеристик,
которые являются критическими в отношении качества лекарственного продукта, учитывая (его) предназначенное использование и способ введения.
Акцент на ходе разработки дизайна прописи, от первоначального проекта до окончательного варианта.
Выбор компонентов лекарственного продукта (например, свойства лекарственной субстанции, вспомогательных веществ, упаковочно-укупорочной системы и любых дозирующих устройств), производственный процесс,
Обоснования интервалов в закладке вспомогательных веществ, вошедших в регламент производства (3.2.P.3.2). Это обоснование часто может базироваться на опыте, полученном в процессе разработки или производства.

Слайд 24Избыток
Как правило, не рекомендуется использование избытка лекарственной
субстанции для компенсации разрушения в процессе производства
или хранения продукта, либо для продления срока годности.
Любые избытки в производстве лекарственного продукта, появляются ли они в готовой дозированной форме или нет, должны быть обоснованы с точки зрения безопасности и эффективности продукта.
Должна быть предоставлена информация о 1) количестве избытка, 2) причинах использования (например, чтобы компенсировать ожидаемые и документированные производственные потери), и 3) обоснование величины избытка.
Избыток должен быть включен в указанное в описании технологии количество лекарственной субстанции

Слайд 25 Производственный процесс
Объяснение выбора производственного процесса и
видов контроля.
Рассмотрение критических характеристик прописи, вместе с
возможными вариантами производственного процесса, чтобы выбрать производственный процесс и подтвердить пригодность компонентов.
Пригодность оборудования применительно к запланированным продуктам.
Исследования по разработке производственного процесса должны обеспечить основание для усовершенствования процесса, его валидации, непрерывной верификации процесса (где это применимо) и любых требований в отношении контроля процесса.

Слайд 26 Производственный процесс -2
В соответствующих случаях
такие исследования должны быть направлены на микробиологические,
а также на физические и химические характеристики. Знания, полученные в результате исследований по разработке производственного процесса, могут использоваться, при необходимости, для обоснования спецификации лекарственного продукта
Программа разработки (или усовершенствования) производственного процесса должна выделять любые критические параметры процесса, подлежащие мониторингу или контролю (например, время окончания грануляции) с тем, чтобы гарантировать желаемое качество продукта.

Слайд 27Упаковочно-укупорочная система
Выбор и основания для выбора упаковочно-укупорочной
системы закрытия.
Внимание намечаемому использованию лекарственного продукта
и пригодности соответствующей упаковки для хранения и транспортировки, включая, при необходимости, хранение и транспортную упаковку для нерасфасованного лекарственного продукта (балк-продукта).
Выбор материалов для первичной упаковки должен быть обоснован. Обсуждение должно описать исследования, выполненные, чтобы продемонстрировать целостность упаковки (контейнера) и её укупорки. Должно быть рассмотрено возможное взаимодействие между продуктом и упаковкой или этикеткой.

Слайд 28Выбор упаковочных материалов
Выбор первичных упаковочных материалов
должен быть обоснован, например, выбор материалов, защищающих
от влажности и света, совместимость упаковки с дозированной формой (включая сорбцию, извлечение); также необходимо принять во внимание безопасность материалов упаковки.
В случаях, когда это имеет значение, необходимо обосновать выбор вторичной упаковки.

Слайд 29Микробиологические свойства
В соответствующих случаях в этом разделе
должны быть рассмотрены микробиологические свойства лекарственного продукта.
Необходимо обосновать, например:
для нестерильных форм выполнение или невыполнение испытаний на микробиологическую чистоту
выбор и эффективность систем консервантов в продуктах содержащих антимикробный агент или антибактериальная эффективность для продуктов, обладающих естественными антибактериальными свойствами;
• Для стерильных продуктов целостность упаковки, в связи с предотвращением микробного загрязнения.

Слайд 30Совместимость
окончательной лекформы
Необходимо обратить внимание на совместимость активного
вещества с растворами для приготовления лекарственной формы
перед применением (например, осаждение, стабильность), чтобы предоставить соответствующую подтверждающую информацию для маркировка.
Эта информация должна отображать рекомендованный срок хранения приготовленной перед использованием лекформы, при рекомендованной температуре хранения и возможных максимальных концентрациях.
Может возникнуть необходимость рассмотреть варианты с добавкой (например, «подкалыванием» в инъекционные растворы большого объема) или разведением перед применением.

Слайд 31Разработка методов контроля
Отправная точка: желаемые (фармакокинетические) свойства
продукта
Лабораторный и полупроизводственный масштаб
Решение вопросов:
(Состав)
Параметры процесса и
ВПК
Спецификация готового продукта
Аналитические методы

Слайд 32ФАРМАЦЕВТИЧЕСКАЯ РАЗРАБОТКА
Практические аспекты:
опыт производителей

Слайд 33Обсуждение руководства
Практические аспекты
Опыт производителей

Слайд 34Фармацевтическая разработка:
три вида подхода
Инновационные препараты
Дженерики с
улучшенными свойствами
Дженерики – точные копии инновационных препаратов

Слайд 35Место фармацевтической
разработки в создании продукта
Выбор
АФИ
Выбор лекформы
и
ее профиля
(клинические
соображения)
Фармацевтическая
разработка
Дизайн
продукта
Изучение свойств АФИ (физ.-хим.)
Выбор вспомогательных веществ
Выбор
состава (пропись)
Разработка технологии
Выбор методов анализа
Критические точки и допуски
Оригиналь-
ный или
воспроиз-
веденный
Слайд 36Информация, получаемая в ходе фармацевтической разработки,
Условно делится
на три части:
Раздел «Характеризация» (изучение свойств)
Раздел «Оптимизация»
Раздел
«Верификация»

Слайд 37Раздел «Характеризация» (изучение свойств)
Предварительное изучение субстанции (preformulation
— физико-химические свойства АФИ )
Совместимость (compatibility
– выбор вспомогательных веществ)
Пропись (состав)
Процесс (технология и контроль – ВПК)
Аналитические методы

Слайд 38Раздел «Оптимизация»
Устойчивость
Критические параметры
Реалистичные допуски

Слайд 39Раздел «Верификация»
Валидация (включая квалификацию)
Масштабирование
Перенос технологии (на
другую площадку)
Текущее усовершенствование технологии (оптимизация)

Слайд 40Варианты оптимизации
прописи и технологии
Целенаправленные исследования по отработке
технологии, включая уточнение прописи (ограниченное время, до
валидации)
Непрерывное совершенствование на основе накопляемого опыта, в т.ч. за счет выявления и устранения причин инцидентов (после валидации, постоянно, через систему управления изменениями)

Слайд 41Валидация и
фармацевтическая разработка
Фармацевтическая разработка
позволяет получить обоснованные
исходные
данные для валидации
технологических процессов и
аналитических методик

Слайд 42Пример изучения свойств активной субстанции Х (preformulation)
Форма
и размер кристаллов: кубическая; D10 — 2,6
μm; D50 -15 μm; D90 — 48 μm
Удельная поверхность – 1,5 м2/г
Сыпучесть: слабая
Прессуемость: плохая
Угол контакта: 77º
Скорость растворения: 1,5 μг/см2/мин.
Полиморфизм: нет
Термическая взрывоопасность: нет

Слайд 43Изучение свойств активной субстанции (раствор)
Профиль растворимости: макс.
10 μг/мл при рН 1-4 (добавление буферного
р-ра)
Зависимость стабильности от рН: деградация выше рН 5,5
Влияние растворителей: добавка ПЭГ 400 (20/80) при рН 4 – 150 μг/мл
Стерилизация: термическая стерилизация невозможна – только γ-стерилизация

Слайд 44От свойств АФИ к выбору
вспомогательных веществ
Для
твердых пероральных форм: если растворимость АФИ менее
1% — требуются комплексообразующие или поверхностно активные вещества (циклодекстрины)
При недостаточной стабильности – использование антиоксидантов

Слайд 45 Вспомогательные вещества
добавляются в целях:
Увеличения стабильности лекформы
(антиоксиданты)
Оптимизации биофармацевтических свойств (дезинтегранты, оболочка)
Улучшения технологичности (наполнители,
скользящие в-ва)
Улучшение принятия пациентами (вкусовые добавки, красители)

Слайд 46Стресс-испытания субстанций и прописи: примеры
Температура: в открытом
виде увлажненный материал – 4 недели при
80°C, анализ еженедельно
Влажность: в открытом виде 4 недели при 40°C /100% о.в., анализ через 2 недели
Окисление: 24 часа, через насыщенный водный раствор (суспензию) материала пропускается кислород при перемешивании, анализ каждые 8 часов.

Слайд 47Стресс-испытания субстанций и прописи: примеры
Температура: в открытом
виде увлажненный материал – 4 недели при
80°C, анализ еженедельно
Влажность: в открытом виде 4 недели при 40°C /100% о.в., анализ через 2 недели
Окисление: 24 часа, через насыщенный водный раствор (суспензию) материала пропускается кислород при перемешивании, анализ каждые 8 часов.

Слайд 52Лабораторный уровень
Предварительные исследования (preformulation)
Масштаб – 1х
Изучение физико-химических
характеристик активной субстанции и вспомогательных веществ (раздельно)
Выбор
и отработка аналитических методик
Определение критических характеристик
Выбор стратегии контроля

Слайд 53Крупно-лабораторный уровень
Выбор прописи (formulation)
Масштаб – 10х
Совместимость (изучение
смесей)
Стресс-испытания выбранной прописи
Стабильность – скрининг (открытое состояние,
4 недели при 40°С/75% о.в.)
Выбор и оптимизация процесса (технологии)
Наработка серий для испытания стабильности

Слайд 54Уровень опытно-наработочного цеха
Масштаб – от 100х
до 1/10 серийного производства; не меньше 100
тыс. таблеток (капсул)
Оборудование – того же типа, что в серийном производстве
Отработка технологии (оптимизация)
Наработка «биосерий» (для клиники, испытания биоэквивалентности)
Наработка серий для испытания стабильности (до 12 мес. при 25ºC/60% о.в. и до 6-9 мес. при 30ºC/60% о.в. по 2-3 сериям)
Предварительная валидация процесса (десятки серий)

Слайд 55Серийное производство
Первые три (две) серии – валидационные
(подтверждающие – conformance batches)
Отчет о валидации, утверждение
отчета
Утверждение/отклонение прописи и технологии
Для регистрационного досье (если не сделано ранее): результаты анализа серий по предлагаемой спецификации (5 серий или меньше) с указанием объема, даты и цели производства
Оптимизация процесса (постоянно)

Слайд 56
Proven Acceptable
Range (PAR) – пределы вмешательства
Normal
Operating
Range (NOR)
—
Пределы тревоги
(качество)
PAR и
NOR
В открытом доступе на русском языке опубликовано руководство Международного совета по гармонизации (ICH) Q8 «Фармацевтическая разработка», актуальная редакция (R2) которого датируется 2009 г.
Цель фармацевтической разработки состоит в создании качественного препарата и процесса его производства, чтобы на постоянной основе обеспечивать планируемое поведение препарата. В документе Q8 фармацевтическая разработка интерпретируется в узком смысле: в качестве разработки лекарственной формы (=формы дозирования) активного фармацевтического ингредиента.
Фармацевтическая разработка направлена на постижение свойств лекарственной формы, зависимости этих свойств от параметров ее производства и от характеристик активного фармацевтического ингредиента, равно как и вспомогательных веществ, включая различные их соотношения. Фармацевтическая разработка наиболее критична для тех лекарственных препаратов, действующие вещества которых не попадают непосредственно во внутренние среды организма, а нуждаются в дополнительной стадии абсорбции на границе раздела сред, например, как в случае принимаемых внутрь лекарств для системного действия, трансдермальных пластырей или аэрозолей для ингаляций. По этой причине формуляционная стратегия для таких препаратов должна быть хорошо продуманной и желательно опираться на принципы проектирования качества (Quality by Design, QbD).
Принцип QbD является стрежневым в документе ICH Q8 (и всём семействе Q8–Q12) и используется для описания систематизированного подхода к разработке, которая должна начинаться с заранее сформулированных целей и быть сосредоточена на понимании препарата и процесса, а также контроле процесса, основанные на строгих научных принципах и управлении рисками для качества.
Вводимая в документе терминология, включая понятия целевого профиля препарата (Target Product Profile) и целевого профиля качества препарата (Quality Target Product Profile (QTPP)), выходит далеко за пределы фармацевтической разработки и используются во многих направлениях разработки, выведения на рынок и пострегистрационного жизненного цикла лекарственных препаратов.
Важным аспектом документа является наличие в нем рекомендаций по тому, как заполнять раздел 3.2.P.2 «Фармацевтическая разработка» модуля 3 «Качество» в формате общего технического документа (CTD). Рекомендации освещают заполнение этого важного раздела как в случае традиционной (обычной) разработки, так и при использовании принципов проектирования качества, т. е. являются в определенной мере универсальными.
В России документ не принят, в ЕАЭС планируется к принятию в будущем.
Документ опубликован в библиотеке PharmAdvisor, содержащей более 300 нормативно-правовых актов, а также научных и административных руководств ICH, ЕС и США. Данный проект выполнен совместно с Маргаритой Прохоровой из Центра экспертиз и испытаний в здравоохранении Беларуси.