Возможно изменение формы канистры.
Назначение:
Для обеззараживания поверхностей в помещениях, жесткой мебели, санитарно-технического оборудования, наружных поверхностей приборов и аппаратов, изделий медицинского назначения, белья, посуды, в том числе лабораторной, предметов для мытья посуды, предметов ухода за больными, уборочного инвентаря, медицинских отходов, игрушек, обуви из резины, пластмасс и других полимерных материалов, резиновых ковриков; проведение генеральных уборок; для дезинфекции скорлупы пищевых яиц.
Преимущества:
Дезинфицирующее средство в виде раствора убивает вирусные, бактериальные и грибковые инфекции, микробы туберкулеза, возбудителей паразитных болезней.
Область применения:
Учреждения здравоохранения, дезинфекция в лечебно-профилактических учреждениях.
Гипохлор–жидкий хлор
Гипохлор – чистый, концентрированный раствор хлора, обеспечивающий полную дезинфекцию воды и осуществляющий ее защиту от бактериальных загрязнений. – Содержание активного хлора в растворе – 14%; – Предупреждает образование известкового налета; – Антикоррозиен; – Быстрорастворим.
- Описание
- Детали
Описание
Жидкое дезинфицирующее средство, концентрированный раствор хлора. Расфасован в канистры по 20 и 30 литров.
Назначение
Хлорная дезинфекция воды. Быстро и эффективно действует на бактерии, вирусы и грибки, разрушает органические вещества, обуславливающие мутность воды. Подходит для регулярной и ударной дезинфекции воды в бассейне. Оптимально применять через установки автоматического дозирования реагентов, подходит и для небольших бассейнов без автоматических дозаторов. Дополнительно: обеззараживание питьевой воды, очистка технологических линий и оборудования в пищевой промышленности.
Инструкция по применению
Измерьте уровень pН воды и откорректируйте его в пределах 7,0 – 7,4. Отрегулируйте показатель свободного хлора в воде в пределах 0,3-0,5 мг/л
Регулярная дезинфекция:
Используйте автоматическую станцию дозирования реагентов. При ее отсутствии:
- Приготовьте раствор препарата, понижая исходную концентрацию в 5-10 раз. Наливайте препарат в воду но не наоборот
- Добавляйте раствор порциями в бассейн вблизи места подачи воды или в нескольких местах одновременно во время работы циркуляционного насоса.
Ударная дезинфекция:
- Введите раствор из расчета 250-300 мл на 10 м³воды
- Организуйте технологический перерыв в работе бассейна не менее 12 часов
- Отрегулируйте уровень pH и содержание свободного хлора в воде
- Повторяйте ударную дезинфекцию каждые 7-14 дней.
Дозировка
|
Тип дезинфекции |
Дозировка, мл |
Технический перерыв |
||||||
| 10 м3 | 10 м3 | 10 м3 | 10 м3 | 10 м3 | 10 м3 | 10 м3 | ||
| Ударная | 0,20- -0,25 | 0,20- -0,25 | 0,20- -0,25 | 0,20- -0,25 | 0,20- -0,25 | 0,20- -0,25 | 0,20- -0,25 | Не менее 12 часов |
| Регулярная | 0,07- -0,10 | 0,07- -0,10 | 0,07- -0,10 | 0,07- -0,10 | 0,07- -0,10 | 0,07- -0,10 | 0,07- -0,10 | Не менее 2 часов |
| Регулярная | 0,04 | 0,04 | 0,04 | 0,04 | 0,04 | 0,04 | 0,04 | Дезинфекция во время купания |
Хранение и меры безопасности
Хранить в сухом проветриваемом помещении в герметично закрытой упаковке при t не выше +25ºС. Избегать контакта с кислотами, кислородсодержащими веществами, взрывчатыми и легковоспламеняющимися материалами; беречь от нагрева и прямых солнечных лучей. При попадании на кожу и в глаза немедленно промыть большим количеством воды, при необходимости обратиться к врачу.
Срок хранения: 6 месяцев с даты изготовления. По истечении срока хранения допускается использование средства, если значение концентрации активного хлора не ниже 100 г/л.
Состав
Гипохлорит натрия, стабилизатор.
Преимущества
• Содержит 140 г на литр активного хлора
• Действует немедленно после введения в воду, не требует растворения
• Предупреждает образование известкового налета
• Предупреждает коррозию
• Не содержит кальция
• Может использоваться при любой жёсткости воды
• Самое дешевое жидкое дезинфицирующее средство
Детали
| Вес | Н/Д |
|---|---|
| Упаковка |
1 л, 20 л, 3 л, 30 л, 5 л |
Назначение: для обеззараживание поверхностей в помещениях, жесткой мебели, санитарно-технического оборудования, наружных поверхностей приборов и аппаратов, изделий медицинского назначения, белья, посуды, в том числе лабораторной, предметов для мытья посуды, предметов ухода за больными, уборочного инвентаря, медицинских отходов, игрушек, обуви из резин, пластмасс и других полимерных материалов, резиновых ковриков; проведение генеральных уборок; для дезинфекции скорлупы пищевых яиц.
Состав:
- Гипохлорит натрия.
- Вспомогательные компоненты.
Способ применения:
- Для обеззараживания поверхностей 200 мл средства растворить в 10 л воды.
- Полученным раствором потереть поверхность в помещениях (пол, стены, двери, подоконники), жёсткую мебель.
- Раковины, унитазы, обработать дважды.
- Время обеззараживания – 60 мин.
- После дезинфекции помещение проветрить до исчезновения запаха хлора.
Срок годности: 2 года
Дезинфицирующее средство в виде раствора убивает вирусные, бактериальные и грибковые инфекции, микробы туберкулеза, возбудителей паразитных болезней.
СТАТЬИ
ГИПОХЛОРИТ НАТРИЯ. СВОЙСТВА, ТЕОРИЯ И ПРАКТИКА ПРИМЕНЕНИЯ.
(автор: Ген.директор компании «МИРОВЫЕ ВОДНЫЕ ТЕХНОЛОГИИ» — С.В.Черкасов)
1. ОБЩИЕ СВЕДЕНИЯ
2. ОПИСАНИЕ И ОСНОВНЫЕ ХАРАКТЕРИСТИКИ
2.1. Химические свойства ГПХН
Диссоциация, гидролиз и разложение ГПХН в водных растворах
Окислительные свойства ГПХН
2.2. Бактерицидные свойства ГПХН
2.3. Коррозионная активность ГПХН
3. ПРИМЕНЕНИЕ ГИПОХЛОРИТА НАТРИЯ
3.1. Обеззараживание воды плавательных бассейнов хлорированием
3.2. Обработка бытовых и промышленных сточных вод
3.3. Использование гипохлорита натрия в пищевой промышленности
3.4. Использование гипохлорита в рыбоводстве
3.5. Использование гипохлорита в здравоохранении
3.6. Использование ГПХН для отбеливания белья в фабриках-прачечных
3.7. Дезинфекция питьевой воды
3.8. Обеззараживание ГПХН оборудования для очистки воды
1. ОБЩИЕ СВЕДЕНИЯ
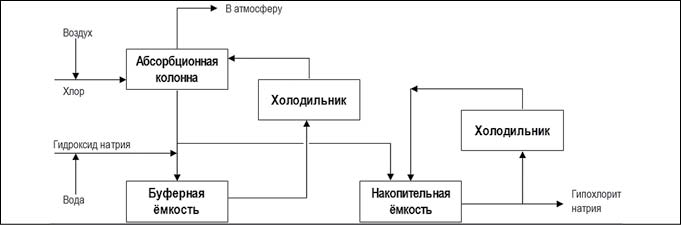
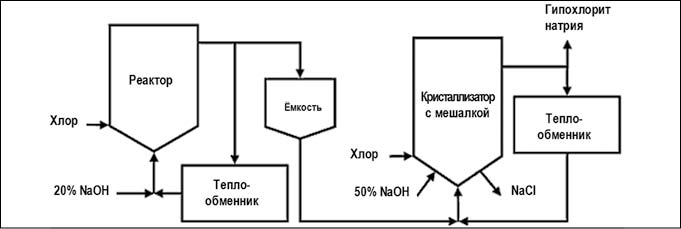
Гипохлорит натрия — NaClO, получают хлорированием водного раствора едкого натра (NaOH) молекулярным хлором (Cl2) или же электролизом раствора поваренной соли (NaCl). Подробно о методах получения гипохлорита натрия (ГПХН) можно прочитать в статье, размещенной на нашем сайте: «Гипохлорит натрия. Процесс получения.».
В РФ состав и свойства ГПХН, выпускаемого промышленностью, или получаемого непосредственно у потребителя в электрохимических установках, должен соответствовать требованиям, предъявляемым в ГОСТе или ТУ. Основные характеристики растворов ГПХН, регламентируемые этими документами, приведены в Таблице 1.
2. ОПИСАНИЕ И ОСНОВНЫЕ ХАРАКТЕРИСТИКИ
Безводный гипохлорит натрия (ГПХН) представляет собой неустойчивое бесцветное кристаллическое вещество.
Элементный состав: Na (натрий) (30,9 %), Cl (хлор) (47,6 %), O (кислород) (21,5 %).
Молекулярная масса NaClO (по международным атомным массам 1971 г.) -74,44.
Хорошо растворим в воде: 53,4 г гипохлорита натрия растворяется в 100 граммах воды при 20°C (или 130 г в 100 г воды при 50°C). Растворимость NaClO представлена в таблице 2.1.
| Температура, °С | — 10 | 0 | 10 | 25 | 30 |
| Растворимость, % | 20,6 | 22,8 | 27,5 | 45,0 | 50,0 |
Плотность водных растворов гипохлорита натрия
| Концентрация, % | 1 | 2 | 4 | 6 | 8 | 10 | 14 |
| Плотность, г/л | 1005,3 | 1012,1 | 1025,8 | 1039,7 | 1053,8 | 1068,1 | 1097,7 |
| Концентрация, % | 18 | 22 | 26 | 30 | 34 | 38 | 40 |
| Плотность, г/л | 1128,8 | 1161,4 | 1195,3 | 1230,7 | 1268,0 | 1308,5 | 1328,5 |
Температура замерзания водных растворов гипохлорита натрия
| Концентрация | 0,8 % | 2 % | 4 % | 6 % | 8 % | 10 % | 12 % | 15,6 % |
| Температура замерзания, °C | − 1,0 | − 2,2 | − 4,4 | − 7,5 | − 10,0 | − 13,9 | − 19,4 | − 29,7 |
Термодинамические характеристики гипохлорита натрия в бесконечно разбавленном водном растворе:
- стандартная энтальпия образования, ΔHo298: − 350,4 кДж/моль;
- стандартная энергия Гиббса, ΔGo298: − 298,7 кДж/моль.
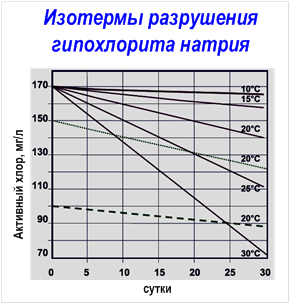
Водные растворы ГПХН весьма неустойчивы и со временем разлагаются даже при обычной температуре (со скоростью 0,08 до 0,1 % в сутки). На скорость распада ГПХН влияет воздействие солнечного излучения, наличие катионов тяжелых металлов и хлоридов щелочных металлов. При этом наличие в водном растворе сульфата магния или кальция, борной кислоты, силикатов и пр. замедляют процесс разложения ГПХН. Следует заметить, что наиболее устойчивы растворы с сильнощелочной средой (значение pH > 10).
У гипохлорита натрия известно три кристаллогидрата:
- моногидрат NaOCl·H2O – крайне неустойчив, разлагается выше 60°C, при более высоких температурах со взрывом.
- кристаллогидрат NaOCl·2,5 H2O – более устойчив, чем моногидрат, плавится при 57,5°C.
- пентагидрат NaOCl·5 H2O – наиболее устойчивая форма, представляет собой белые или бледно-зелёные ромбические кристаллы. Негигроскопичен, хорошо растворим в воде. В воздухе расплывается, переходя в жидкое состояние, из-за быстрого разложения. Температура плавления:18 – 24,4°C. При нагревании до температуры 30 – 50 °C разлагается.
2.1 Химические свойства ГПХН
Диссоциация, гидролиз и разложение ГПХН в водных растворах
Гипохлорит натрия (ГПХН) – неустойчивое соединение, легко разлагающееся с выделением кислорода. Самопроизвольное разложение медленно происходит даже при комнатной температуре: например, за 40 суток наиболее устойчивая форма – пентагидрат ГПХН (NaOCl·5H2O) теряет около 30 % активного хлора:
2 NaOCl → 2 NaCl + O2
При нагревании ГПХН параллельно с его разложением происходит реакция диспропорционирования:
3 NaOCl → NaClО3 + 2NaCl
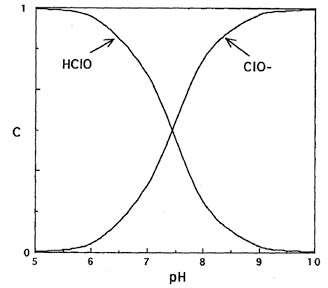
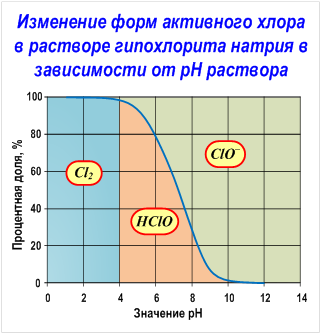
Гипохлорит натрия образует в воде хлорноватистую кислоту и гипохлорит ион в соотношениях, определяемых рН раствора, а именно соотношение между ионом гипохлорита и хлорноватистой кислотой определяется протеканием реакций гидролиза гипохлорита натрия и диссоциации хлорноватистой кислоты (см. Рис. Изменение форм активного хлора в растворе гипохлорита натрия в зависимости от рН раствора).
Растворяясь в воде, ГПХН диссоциирует на катионы натрия и анионы хлорноватистой кислоты:
NaOCl → Na+ + OCl−
Так как хлорноватистая кислота (HOCl) является очень слабой, гипохлорит-ион в водной среде подвергается гидролизу:
OCl− + Н2О ↔ НОСl + ОН−
Так как же происходит разложение ГПХН?
В сильнощелочной среде (pH > 10), когда гидролиз гипохлорит-иона подавлен, разложение происходит следующим образом:
2 OCl− → 2 Cl− + O2
При температурах выше 35°C распад сопровождается реакцией диспропорционирования:
OCl− → ClO3− + 2 Cl−
В среде со значением рН от 5 до 10, когда концентрация хлорноватистой кислоты в растворе заметно выше, разложение протекает по следующей схеме:
HOCl + 2 ClO− → ClO3− + 2 Cl− + H+
HOCl + ClO− → O2 + 2 Cl− + H+
При дальнейшем уменьшении рН, когда в растворе уже нет ClO− ионов, разложение идет следующим путем:
3 HClO → ClO3− + 2 Cl− + 3 H+
2 HClO → O2 + 2 Cl− + 2 H+
В конце концов, когда рН раствора ниже 3, разложение будет сопровождаться выделением молекулярного хлора:
4 HClO → 2 Cl2 + O2 + H2O
Как резюме, изложенному выше можно сказать, что при рН выше 10 происходит кислородное разложение, при рН 5-10 — кислородное и хлоратное, при рН 3-5 — хлорное и хлоратное, при рН меньше 3 — хлорное разложение растворов гипохлорита натрия.
Таким образом, подкисляя раствор гипохлорита натрия соляной кислотой, можно получить хлор:
NaOCl + 2HCl → NaCl + Cl2 + H2O.
Окислительные свойства ГПХН
Водный раствор гипохлорита натрия, являющийся сильным окислителем, вступает в многочисленные реакции с разнообразными восстановителями, независимо от кислотно-щелочного характера среды.
Основные варианты развития окислительно-восстановительного процесса в водной среде мы уже рассмотрели:
в кислой среде:
NaOCl + H+→ Na+ + HOCl
2 HOCl + 2 H+ + 2e− → Cl2↑ + 2 H2O
HOCl + H+ + 2e− → Cl− + H2O
в нейтральной и щелочной среде:
NaOCl → Na+ + OCl−
2 OCl− + 2H2O + 2e− → Cl2↑ + 4OH−
OCl− + H2O + 2e− → Cl− + 2 OH−
Ниже приведены основные окислительно-восстановительные реакции с участием гипохлорита натрия.
Так в слабокислой среде иодиды щелочных металлов окисляются до йода:
NaClO + 2 NaI + H2O → NaCl + I2 + 2 NaOH, (1)
в нейтральной среде до иодата:
3 NaClO + NaI → 3 NaCl + NaIO3,
в щелочной среде до периодата:
4 NaClO + NaI → 4 NaCl + NaIO4
Надо упомянуть, что на реакции (1) основан принцип колориметрического определения хлора в воде.
Под воздействием гипохлорита натрия сульфиты окисляются до сульфатов:
NaClO + K2SO3 → NaCl + K2SO4
нитриты до нитратов:
2 NaClO + Ca(NO2)2 → 2 NaCl + Ca(NO3)2
оксалаты и формиаты до карбонатов:
NaClO + NaOH + CHOONa → NaCl + Na2CO3 + H2O
и т.д.
Фосфор и мышьяк растворяются в щелочном растворе гипохлорита натрия, образуя соли фосфорной и мышьяковой кислот.
Аммиак под действием гипохлорита натрия через стадию образования хлорамина, превращается в гидразин (аналогично реагирует и мочевина). Мы уже рассматривали этот процесс в своей статье «Хлорирование питьевой воды», поэтому здесь приведем только суммарные химические реакции этого взаимодействия:
NaClO + NH3 → NaOH + NH2Cl
NH2Cl + NaOH + NH3 → N2H4 + NaCl + H2O
Приведенные окислительно-восстановительные реакции очень важны, т.к. влияют на потребление активного хлора и переход его в связанное состояние при хлорировании воды. Расчет дозы потребления активного хлора при использовании в качестве хлорагента аналогичен тому, что мы приводили в статье «Хлорирование питьевой воды».
2.2. Бактерицидные свойства ГПХН
Наличие хлорноватистой кислоты в водных растворах гипохлорита натрия объясняет его сильные дезинфицирующие и отбеливающие свойства.
Гипохлорит натрия (NaOCl) на сегодняшний момент одно из лучших известных средств, проявляющих благодаря гипохлорит-аниону сильную антибактериальную активность. Это средство убивает микроорганизмы очень быстро и при достаточно низких концентрациях, поскольку разложение гипохлорита сопровождается образованием ряда активных частиц (радикалов) и, в частности, синглетного кислорода, обладающего высоким биоцидным действием. (подробнее см. в статье «Хлорирование питьевой воды». Образующиеся при распаде ГПХН частицы (радикалы) способствуют в уничтожении микроорганизмов (способных к окислению), разрушая окружающую их биопленку, что приводит к «гибели» микроорганизмов.
Примечание: Исследованиями установлено, описанный выше процесс аналогичен тому, что происходит естественным образом во всех высших организмах. Так, некоторые клетки человека (нейтрофилы, гепатоциты и др.) синтезируют хлорноватистую кислоту и сопутствующие ей высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями.
Наивысшая бактерицидная активность гипохлорита натрия проявляется в нейтральной среде, когда концентрации HClO и гипохлорит-анионов ClO− в процессе гидролиза и диссоциации ГПХН приблизительно равны.
Что касается бактерицидных свойств ГПХН, то можно привести несколько примеров:
- грибки, вызывающие кандидоз, Candida albicans, погибают in vitro в течение 30 секунд при действии 5,0 ± 0,5%-го раствора NaOCl (при концентрации действующего вещества ниже 0,05 % они проявляют устойчивость только спустя 24 часа после воздействия на них ГПХН);
- более резистентные к действию гипохлорита натрия энтерококки. Так, например, патогенный Enterococcus faecalis погибает через 30 секунд после обработки 5,25% -ым раствором или через 30 минут после обработки 0,5%-ым раствором;
- грамотрицательные анаэробные бактерии, такие как Porphyromonas gingivalis, Porphyromonas endodontalis и Prevotella intermedia, погибают в течение 15 секунд после обработки 5,0 ± 0,5%-м раствором NaOCl.
Количественная оценка эффективности химических бактерицидов и их квалификация приведена в Таблице 2.2.
Спектральная активность дезинфицирующих средств по отношению к определенным видам микроорганизмов приведена в Таблице 2.3.
Высокие окислительные свойства гипохлорита натрия позволяют его успешно использовать для обезвреживания различных токсинов (см. Таблицу 2.4).
2.3. Коррозионная активность ГПХН
Гипохлорит натрия оказывает довольно сильное коррозионное воздействие на различные материалы. Это обусловлено его высокими окислительными свойствами, которые были рассмотрены нами ранее. Поэтому при подборе конструкционных материалов для изготовления установок очистки воды это необходимо учитывать. В таблице, которая приводится ниже, представлены данные по скорости коррозии некоторых материалов при воздействии на них растворов гипохлорита натрия различной концентрации и при различной температуре. Более подробную информацию по коррозионной устойчивости различных материалов по отношению к растворам ГПХН можно найти в Таблице химической совместимости (в формате rar-архива), размещенной на нашем сайте.
Не менее важно учитывать и то обстоятельство, что фильтрующие загрузки, которые используются для скорых насыпных фильтров, могут изменять свои фильтрующие свойства при воздействии на них ГПХН, точнее активного хлора, например, при подборе фильтрующей среды для процесса каталитического обезжелезивания – катализаторов обезжелезивания.
Не следует забывать, что активный хлор оказывает негативное влияние на мембранные процессы, в частности он вызывает деструкцию мембран обратного осмоса (об этом мы рассказывали в нашей статье «Обратный осмос. Теория и практика применения.»), а при высоком содержании (более 1 мг/л) отрицательно влияет на процессы ионного обмена.
Что касается материалов, из которых следует изготавливать собственно систему дозирования ГПХН, то здесь надо ориентироваться на концентрации активного хлора в рабочих растворах ГПХН, которые, естественно, существенно выше концентраций в обрабатываемой воде. Об этом мы поговорим немного позже.
Скорость коррозии некоторых материалов при воздействии на них растворов ГПХН
| Материал | Концентрация NaClO, % масс. | Температура, °C | Скорость коррозии, мм/год |
| Алюминий | 10 при pH > 7 | 25 | > 10 |
| Медь | 2 | 20 | < 0,08 |
| 20 | 20 | > 10 | |
| Сталь Ст.3 | 0,1 при pH > 10 | 20 | < 0,1 |
| > 0,1 | 25 | > 10,0 | |
| Сталь 12Х17, 12Х18Н10Т | 5 | 20 | > 10,0 |
| Сталь 10Х17Н13М2Т | < 34 | 40 | < 0,001 |
| Tкип. | 1,0 ÷ 3,0 | ||
| Сталь 06ХН28МДТ | < 34 | 20 ÷ Tкип. | < 0,1 |
| Титан | 10 ÷ 20 | 25 ÷ 105 | < 0,05 |
| 40 | 25 | < 0,05 | |
| Цирконий | 10 | 30 ÷ 110 | < 0,05 |
| 20 | 30 | < 0,05 | |
| Чугун серый | < 0,1 при pH > 7 | 25 | < 0,05 |
| > 0,1 | 25 | > 10,0 | |
| Чугун СЧ15, СЧ17 | < 34 | 25 ÷ 105 | < 1,3 |
| Полиамиды | < 34 | 20 ÷ 60 | стоек |
| Поливинилхлорид | < 34 | 20 | стоек |
| 65 | относит. стоек | ||
| Полиэтилен | < 34 | 20 ÷ 60 | стоек |
| Полипропилен | < 34 | 20 ÷ 60 | стоек |
| Резина на основе бутилкаучука | 10 | 20 ÷ 65 | стоек |
| насыщ. раствор | 65 | стоек | |
| Стекло | < 34 | 20 ÷ 60 | стоек |
| Фторопласт | любая | 20 ÷ 100 | стоек |
3. ПРИМЕНЕНИЕ ГИПОХЛОРИТА НАТРИЯ
Промышленностью РФ ГПНХ выпускается в виде водных растворов различной концентрации.
Гипохлорит натрия различных марок применяют:
- раствор марки А по ГОСТ 11086 – в химической промышленности, для обеззараживания питьевой воды и воды плавательных бассейнов, для дезинфекции и отбелки;
- раствор марки Б по ГОСТ 11086 – в витаминной промышленности, как окислитель для отбеливания ткани;
- раствор марки А по ТУ – для обеззараживания природных и сточных вод в хозяйственно-питьевом водоснабжении, дезинфекции воды рыбохозяйственных водоемов, дезинфекции в пищевой промышленности, получения отбеливающих средств;
- раствор марки Б по ТУ – для дезинфекции территорий, загрязненных фекальными сбросами, пищевыми и бытовыми отходами; обеззараживании сточных вод;
- раствор марки В, Г по ТУ – для дезинфекции воды рыбохозяйственных водоемов;
- растворы марок Э по ТУ – для дезинфекции аналогично марке А по ТУ, а также дезинфекции в медико-санитарных учреждениях, предприятиях общественного питания, объектах ГО и др., а также — обеззараживания питьевой воды, стоков и отбеливания.
К гипохлориту натрия, применяемому вместо жидкого хлора для дезинфекции питьевой воды, предъявляются определенные требования, касающиеся концентрации щелочи и тяжелых металлов, например железа, стабильности, цветности. С основными характеристиками растворов ГПХН, регламентируемые нормативными документами, можно ознакомится здесь.
Давайте вначале обсудим обработку воды гипохлоритом натрия в различных отраслях, а затем вернемся к процессу обеззараживания воды с помощью ГПХН в системах хозяйственно-питьевого водоснабжения.
3.1. Обеззараживание воды плавательных бассейнов хлорированием
В РФ гигиенические требования к устройству и эксплуатации плавательных бассейнов, а также качеству воды в них нормируются СанПиН 2.1.2.1188-03, но поставщики и изготовители импортного оборудования для очистки и обеззараживания воды в бассейнах очень часто ориентируются на требования стандартов DIN 19643.
Системы очистки и обеззараживания воды в бассейнах должны обеспечивать:
- эпидемическую безопасность в отношении грибковых, вирусных, бактериальных и паразитарных заболеваний, передаваемых через воду;
- отсутствие возможности вредного влияния химического состава воды, находящейся в чаше бассейна, на организм человека, в том числе раздражающего действия на слизистые и кожу и интоксикацию при поступлении вредных веществ: при дыхании, через неповрежденную кожу и при заглатывании воды;
- эстетические требования к качеству воды (органолептические показатели: мутность цветность, запах, привкус и т.д.).
Таким образом, установки очистки и обеззараживания воды в бассейне в режиме рециркуляции должны обеспечивать удаление как загрязнений (механических, коллоидных и растворенных), так и микроорганизмов, попадающих в бассейн из воздуха и заносимых купающимися людьми. При этом концентрации вредных веществ, которые могут образовываться в результате химических реакций загрязнений воды с используемыми для обеззараживания и корректировки состава воды реагентами, не должны превышать ПДК. Выполнение указанных требований является достаточно сложной инженерно-экономической задачей.
Основные мероприятия для обеспечения качественной воды в бассейне, которые надо проводить в процессе его эксплуатации, изложены нами на страничке «Эксплуатация бассейнов» нашего сайта. В настоящей публикации мы остановимся только на обеззараживании воды в бассейне хлорированием.
Мы уже знаем, что хлорирование – самый распространенный реагентный метод обеззараживания воды, к тому же самый доступный и недорогой. Хлор является мощным окислительным агентом и обладает очень широким спектром противомикробного действия – т.е. способен разрушать и уничтожать подавляющее большинство известных патогенных микроорганизмов. Важное преимущество хлора – пролонгированность действия, т.е. способность долго сохраняться в активном виде в воде бассейна. Более того, при комбинации с каким-либо другим способом обеззараживания именно хлорирование позволяет достичь максимального эффекта обеззараживания воды в бассейне.
Кратко рассмотрим физико-химический смысл процессов, происходящих в воде бассейна в процессе и после проведения хлорирования. После растворения хлорагента в воде бассейна при оптимальном уровне рН (7,0 – 7,4) образуются гипохлорит-ион и хлорноватистая кислота и называется уровнем свободного хлора, который по действующим санитарным нормам должен поддерживаться на уровне 0,3 – 0,5 мг/л.
Отметим, что указанный уровень рН воды в бассейне для проведения процесса хлорирования выбран не случайно – только в этом интервале рН реакция взаимодействия хлорирующего агента с водой проходит с максимальным «коэффициентом полезного действия», т.е. с максимальным «выходом» свободного хлора.
Свободный хлор вступает в реакции окисления с присутствующими в воде патогенными микроорганизмами и загрязняющими веществами. Главной особенностью процесса хлорирования воды в бассейне является то, что в ней помимо микроорганизмов, являющимися основными объектами обеззараживания, присутствует большое количество органических примесей белковой природы (жир, пот, крема и т.д., заносимые купающимися людьми). Они в результате взаимодействия с активным хлором образуют неорганические и органические хлорамины, образуя связанный хлор. При этом последние очень стабильны и обладают сильным раздражающим действием, что весьма отрицательно сказывается на общем качестве воды в бассейне.
Суммарное содержание в воде бассейна свободного и связанного хлора называется общим хлором. Уровень связанного хлора, который определяется разностью общего и свободного хлора, не должен превышать в воде бассейна 1,2 мг/л.
В качестве хлорагентов для обеззараживания воды, находящейся в бассейне, чаще всего применяют:
- газообразный хлор;
- гипохлориты натрия, кальция или лития;
- хлорпроизводные изоциануровой кислоты: хлор-изоцианураты (натриевая соль дихлоризоциануровой кислоты, трихлоризоциануровая кислота).
В контексте с направлением настоящей публикации мы рассмотрим в сравнении только два хлорагента: газообразный хлор и гипохлорит натрия (ГПНХ).
До определенного времени газообразный хлор являлся безальтернативным хлорагентом, применяемым при обеззараживании воды в бассейне. Но его применение было сопряжено с огромными затратами по обеспечению безопасности процесса хлорирования (подробнее речь об этом пойдет при рассмотрении процесса обеззараживания питьевой воды). Поэтому именно специалисты по бассейновому оборудованию обратились к возможности замены хлора гипохлоритом натрия. Определив оптимальные условия для обеззараживания воды при ее рециркуляции (в основном диапазон рН), требования к технологическому оборудованию и к организации контроля содержания хлора в воде были разработаны технологические схемы для скиммерного и переливного бассейнов и аппаратурное оформление процесса очистки и дезинфекции воды в бассейне в том виде, в котором мы его видим сегодня.
Для обработки воды в бассейне химиками были разработаны стабилизированные составы ГПХН, выпуск которых освоен сейчас многими фирмами. Вот некоторые из них:
| Торговая марка | Фирма-изготовитель | Концентрация NaClO |
| Aquachem Chlorinizor | Sunbelt Chemicals Corp. | 10 % активного хлора |
| Эмовекс | Макропул Кемиклс | не менее 130 г/л (в пересчете на активный хлор) |
| Poolchlor 1 | Hasa Inc. | 10 % активного хлора |
| Гипохлорит жидкий, конц. 14% | Aquatics | не менее 120 г/л (в пересчете на активный хлор) |
| Chemoclor жидкий | Chemoform | 12-15% активного хлора |
| Chlorin flüssig (Хлорин жидкий) | BHM Chemikalienhandel GmbH | 12-15% активного хлора |
| CTX-161 (жидкий хлор) | Europool Chemicals | 15-16% активного хлора |
Девиз процесса очистки воды в бассейне: фильтрация и дезинфекция. На страничках нашего сайта, посвященных эксплуатации бассейнов подробно изложены методы и последовательность операций, позволяющих добиться качественной, прозрачной воды в бассейне. Единственное, что там не указано, как же работать с ГПХН.
Особенностями процесса обеззараживания воды в бассейне с помощью препаратов, содержащих ГПХН (в режиме рециркуляции), являются (перечисляем по степени важности):
- пониженное значение рН (его значение может быть ниже 6,9);
- ограниченное время контакта воды с дезинфектантом (хлорагентом) – как правило, оно исчисляется всего лишь несколькими минутами;
- повышенная температура воды (она достигает 29оС);
- повышенное содержание органических веществ.
И вот в этих «адских» для ГПХН условиях от него нужно добиться максимальной отдачи.
Как это делается на практике? Вообще все начинается еще на этапе проектирования бассейна. При размещении оборудования циркуляционной петли бассейна стараются сделать так, чтобы от точки внесения в воду дезинфектанта до поступления воды в бассейн между ними был бы максимальный временной контакт. Поэтому точкой введения дезинфектанта обычно является напорный трубопровод циркуляционного насоса, т.е. максимально удаленная точка от возвратных форсунок. Там же устанавливается датчик измерения рН, а корректирующий состав вводится на всасывающем патрубке циркуляционного насоса, который служит в этом случае своеобразным узлом смешения. Подогреватель воды в бассейне размещают как можно ближе к возвратным форсункам, чтобы, во-первых, сократить потери тепла, а во-вторых, раньше времени не начинать деструкцию ГПХН.
Ну а теперь опишем алгоритм выполнения операций при эксплуатации бассейна:
- Вначале определяются значения рН и Red-Ox потенциала. Первый показатель необходим для корректировки значения рН до оптимального значения: 7,2 – 7,4. Второй служит своеобразным индексом загрязненности воды, поступающей из бассейна, и предназначен для предварительного определения дозы дезинфектанта, который будет внесен в обрабатываемую воду. Такой контроль можно выполнить как вручную с помощью соответствующих приборов, так и автоматически с помощью встроенных в циркуляционный контур датчиков и вторичных приборов – контроллеров.
- Вторым этапом является собственно корректировка рН, т.е. в зависимости от измеренного значения в воду вносят реагенты, снижающие или повышающие значение рН (последние, как правило, применяются чаще, т.к. в процессе эксплуатации бассейна вода «закисляется»). Контроль значения рН проводят также как и в предыдущем случае. А вот внесение реагентов можно сделать как вручную (для бассейнов с небольшим объемом воды), так и автоматически (что чаще всего применяется для общественных бассейнов). В последнем случае дозирование рН корректирующих реагентов производиться с помощью насосов-дозаторов, которые имеют встроенный рН контроллер.
- И наконец, производят ввод рабочего раствора ГПХН в обрабатываемую воду, который осуществляют методом пропорционального дозирования с помощью насосов-дозаторов. При этом пропорциональное дозирование (управление насосом-дозатором) производится по сигналу датчика хлора, установленного либо непосредственно в трубопроводе (желательно непосредственно перед подогревателем). Существует еще один метод контроля качества дезинфекции воды в бассейне и управления насосом-дозатором – контроль Red-Ox потенциала, т.е. косвенное измерение активного хлора в воде. После узла ввода ГПХН обычно устанавливают динамический смеситель или делают несколько крутых поворотов напорного трубопровода циркуляционного насоса для тщательного перемешивания обрабатываемой воды с рабочим раствором ГПХН. И то и другое вносит дополнительное сопротивление на линии возврата воды в бассейн. Это нужно учитывать при подборе циркуляционного насоса.
Как мы убедились, процесс дезинфекции воды в бассейне достаточно сложен и включает в себя несколько стадий. Поэтому для полной автоматизации этого процесса и исключения из него «человеческого» фактора были разработаны системы дозирования, состоящие из одного, двух или даже трех насосов-дозаторов, контроллеров, датчиков, электрохимических ячеек и т.д. Их описание можно найти на этой страничке.
Дозирование гипохлорита марки «Э» мало чем отличается от дозирования стабилизированных препаратов на основе гипохлорита натрия марки «А». Разве что появляется необходимость отслеживания общего солесодержания воды в бассейне, поскольку гипохлорит марки «Э», содержит поваренную соль (см. описание процесса получения). Поэтому при его дозировании эта соль поступает в обрабатываемую воду и повышает общее солесодержание (с учетом того, что система рециркуляции замкнута, а общий приток свежей воды составляет всего лишь 10% от объема).
3.2. Обработка бытовых и промышленных сточных вод
Очистка сточных вод заключается в их обезвреживании и обеззараживании.
Обеззараживание сточных вод может производиться несколькими методами: хлорированием, озонированием и УФ-излучением.
Обеззараживание (хлором, гипохлоритом натрия, или прямым электролизом) бытовых сточных вод и их смесей с производственными стоками производится после их очистки. При раздельной механической очистке бытовых и производственных вод, но совместной их биологической очистке, допускается (СНиП 2.04.03-85) предусматривать обеззараживание только бытовых вод после их механической очистки с дехлорированием их перед подачей на биологическую очистку. Вопрос об отводе сточных вод, после обеззараживания должен решаться в каждом конкретном случае по согласованию с территориальными учреждениями Госсанэпидслужбы в соответствии требованиями СанПиН 2.1.2.12-33-2005 «Гигиенические требования к охране поверхностных вод».
Перед обеззараживанием сточные воды осветляют, освобождая их от взвешенных частиц (механическая очистка), а затем уже осветленные воды окисляют биологическим путем (биологическая очистка). Биологическая очистка осуществляется двумя методами: 1) интенсивным (искусственная очистка) и 2) экстенсивным (естественная очистка).
Интенсивный метод позволяет очищать сточную жидкость на специальных очистных сооружениях, располагающихся на небольшой территории, но требует затрат электроэнергии, строительства очистных сооружений, квалифицированного персонала для управления ими и хлорирования. К сооружениям интенсивной очистки относятся аэротенки и биоокислители (биологические фильтры, перколяторы).
Экстенсивный метод требует большей территории, но менее дорогой в строительстве и эксплуатации и дает сток, свободный от яиц гельминтов и патогенных бактерий. Хлорирование в этом случае не требуется. К сооружениям экстенсивной очистки относятся биологические пруды, поля орошения и поля фильтрации.
Хлорирование сточных вод.
Хлорирование применяется для обработки бытовых и промышленных вод, для разрушения животных и растительных микроорганизмов, устранения запахов (особенно образующихся из серосодержащих веществ), обезвреживания промышленных стоков, например, от цианистых соединений.
Сточные воды характеризуются высокой степенью органической нагрузки. Эмпирически установленные значения обеззараживающих концентраций активного хлора в сточных водах могут достигать 15 мг/л. Поэтому необходимые дозы активного хлора и продолжительность контакта его со сточной водой определяют пробным хлорированием. Для предварительных расчетов обеззараживания сточных вод принимают следующие дозы активного хлора: после механической очистки – 10 мг/л; после полной искусственной биологической очистки – 3 мг/л, после неполной – 5 мг/л.
Производительность установки для хлорирования рассчитывают на принятую дозу активного хлора с коэффициентом 1,5. Продолжительность контакта хлора с обеззараживаемой водой зависит от формы соединений хлора. Для свободного активного хлора продолжительность контакта составляет 0,5 ч, для связанного активного хлора – 1 ч. Остаточный хлор после контакта со сточной водой должен включать: свободный активный хлор – 1 мг/л, связанный активный хлор – 1,5 мг/л.
Доза активного хлора должна превышать удельную величину хлорпоглощения воды таким образом, чтобы возникающая при этом концентрация активного хлора в воде обеспечивала требуемый технологический эффект (уровень обеззараживания, степень осветления и т.д.). При расчете дозы активного хлора для обработки загрязненной воды должна учитываться величина ее хлорпоглощения, определяемая в соответствии с требованиями стандарта ASTM D 1291-89.
При необходимости борьбы с энтеровирусами предусматривают двойное хлорирование: первичное хлорирование после полной биологической очистки и вторичное — после дополнительного фильтрования или отстаивания воды. Дозы активного хлора для первичного хлорирования при борьбе с энтеровирусами принимают 3 – 4 мг/л при контакте продолжительностью 30 мин, вторичного 1,5 – 2 мг/л при контакте 1,5 – 2 ч.
Хлорирование может быть использовано для обработки воды, содержащей аммоний. Процесс осуществляют при температуре выше 70оС в щелочной среде с добавлением CaCl2 или СаСО3 для разложения соединений аммиака.
В ходе обработки вод, содержащих гуминовые вещества, последние превращаются в хлороформы, дихлоруксусную кислоту, трихлоруксусную кислоту, хлоральдегиды и некоторые другие вещества, концентрация которых в воде значительно ниже.
Для очистки от фенолов (содержание 0,42-14,94 мг/л) используют 9% раствор гипохлорита натрия в количестве 0,2-8,6 мг/л. Степень очистки достигает 99,99%. При хлорировании воды, содержащей фенолы, происходит образование фенолоксифенолов.
Известны данные об использовании гипохлорита натрия для удаления ртути из сточных вод.
Хлорирование сточных вод жидким хлором при помощи хлораторов имеет более широкое применение по сравнению с процессом, где используется ГПХН. Жидкий хлор вводят в сточную воду либо непосредственно (прямое хлорирование), либо при помощи хлоратора. Подробнее об этих процессах мы расскажем при рассмотрении процесса дезинфекции (хлорировании) питьевой воды.
При использовании в качестве хлорагента гипохлорита натрия ввод рабочего раствора ГПХН в обрабатываемую воду осуществляют методом пропорционального дозирования с помощью насосов-дозаторов.
Гигиенические требования к организации и контролю за обеззараживанием сточных вод установлены в методических указаниях МУ 2.1.5.800-99.
3.3. Использование гипохлорита натрия в пищевой промышленности
Высокий риск для здоровья потребителя всегда вызывается испорченными пищевыми продуктами, что ни в коей мере нельзя недооценивать. Чаще всего порча пищевых продуктов вызывается микроорганизмами, которые во время технологического процесса изготовления пищевого продукта попадают на него с плохо очищенных и некачественно продезинфицированных поверхностей технологического оборудования, из плохо подготовленных воды, воздуха, из некачественного сырья, из некорректно отведенных промывных вод, и, наконец, от производственного персонала.
Но основным источником микроорганизмов в пищевой промышленности является пыль. На всех участках пищевого производства обсемененность микроорганизмами возникает в труднодоступных местах: сложного оборудования, крышках баков, емкостей, провисающих трубопроводах, швах, стыках, закруглениях и пр. Поэтому решающее значение для получения продукции хорошего качества в пищевой индустрии имеет строгое соблюдение технологического режима производства, высокое санитарное состояние предприятия и проведение мероприятий по мойке и дезинфекции, как оборудования, так и производственных помещений с систематическим микробиологическим контролем.
Еще в начале восьмидесятых годов ХХ века Институтом биологии и ее применения к проблемам питания (г.Дижоне , Франция) было проведено изучение средств дезинфекции, используемых в пищевой промышленности. При этом ГПХН был оценен среди этих продуктов по первому классу как наиболее пригодный для этих целей и наиболее экономичный. Он показал высокую эффективность в отношении почти всех растительных клеток, спор и бактерий. По этой причине гипохлорит натрия находит широкое применение в пищевой промышленности для дезинфекции с целью уничтожения ракообразных и моллюсков; для различных промывок; для борьбы против бактериофагов в сыроваренной промышленности; для дезинфекции резервуаров, загонов для скота.
Но в пищевой промышленности дезинфицирующие средства выбираются каждый раз целенаправленно в соответствии с предъявляемыми требованиями. Так, требования к дезинфицирующему средству при переработке молока могут отличаться или быть вообще другими, чем, например, в пивоваренном производстве либо при производстве безалкогольных напитков, либо в мясоперерабатывающем производстве. В общем, целью применения определенного вида дезинфектанта для определенной подотрасли пищевой промышленности является уничтожение или редукция не всех микроорганизмов, а исключительно вредных для производимой продукции (влияющих, как правило, на качество и срок хранения продукции), а также патогенных микроорганизмов.
Поэтому в РФ были разработаны санитарные нормы и правила, касающиеся обеспечения микробиологической безопасности для каждой из подотраслей пищевых производств. Приведем некоторые из них:
- СП 3244-85 « Санитарные правила для предприятий пивоваренной и безалкогольной промышленности».
- ИК 10-04-06-140-87 «Инструкция санитарно-микробиологического контроля пивоваренного и безалкогольного производства».
- СанПиН 2.3.4.551-96 «Производство молока и молочных продуктов. Санитарные правила и нормы».
- «Инструкция по санитарной обработке оборудования на предприятиях молочной промышленности».
- «Инструкция по санитарной обработке оборудования при производстве жидких, сухих и пастообразных молочных продуктов детского питания».
- СП 3238-85 «Санитарные правила для предприятий мясной промышленности».
- СП 2.3.4.002-97 «Предприятия пищевой промышленности. Санитарные правила для мясоперерабатывающих предприятий малой мощности».
- «Инструкция по санитарной обработке технологического оборудования и производственных помещений на предприятиях мясной промышленности» (утв. в 2003 г.).
- СанПиН 2.3.4.050-96 «Предприятия пищевой и перерабатывающей промышленности (технологические процессы, сырье). Производство и реализация рыбной продукции. Санитарные правила и нормы».
- «Инструкция по санитарно-микробиологическому контролю производства пищевой продукции из рыбы и морских беспозвоночных.» (№ 5319-91. Л., Гипрорыбфлот, 1991).
- «Инструкция по санитарной обработке технологического оборудования на рыбообрабатывающих предприятиях и судах.» (№ 2981-84. М., Транспорт, 1985).
Помимо своих специфических критериев и соответствующего случаю применения дезинфектанта необходимой эффективности и селективности, химические дезинфицирующие средства в пищевой промышленности выбираются исходя из того, как будут они применяться «открытым» или «закрытым» способом.
При дезинфекции в закрытой системе (метод CIP) в результате использования широко распространенного на сегодняшний день автоматического пропорционального дозирования, а также автоматического управления процессом мойки и дезинфекции, как правило, не происходит прямой контакт между обслуживающим персоналом и химическим продуктом (за исключением момента приготовления рабочего раствора). Поэтому в этом случае нет прямой потенциальной опасности для обслуживающего персонала в отношении опасных и агрессивных сред, какими являются дезинфектанты и их растворы.
При открытом способе дезинфекции, где необходим ручной метод обработки, наблюдается обратная ситуация. Здесь обслуживающий персонал с одной стороны должен следить за тем, чтобы избежать прямого контакта с химическим продуктом, используя средства индивидуальной защиты, а с другой стороны по возможности использовать максимальные дезинфицирующие возможности продукта.
В пищевой промышленности применяются, как правило, не чистые активные дезинфицирующие вещества, а их разбавленные растворы, которые помимо активных веществ содержат некоторое количество вспомогательных средств. Этими веществами могут быть: поверхностно-активные вещества для улучшения смачивания подлежащих дезинфекции поверхностей; комплексообразователи для снижения жесткости воды; эмульгаторы и диспергаторы для равномерного распределения реагента по обрабатываемой поверхности и т.д.
Кроме того, поскольку любой дезинфектант «активно работает» в определенном диапазоне значений рН, то в зависимости от основного вещества (дезинфектанта) готовые к применению дезинфицирующие растворы или их концентраты должны иметь кислую, нейтральную или щелочную среду. Несколько примеров: как мы убедились, гипохлорит натрия и хлорсодержащие соединения проявляют наибольшую активность только в щелочной среде, а надуксусная кислота более эффективна в кислой среде. Четвертичные аммонийные соединения в кислой среде рН резко теряют свои дезинфицирующие свойства, а альдегиды можно использовать и в кислой, и нейтральной средах и т.д.
Дезинфекция с помощью хлорагентов достаточно распространена в пищевой промышленности. В данной публикации мы остановимся только на дезинфицирующих хлорсодержащих препаратах, которые имеют в своем составе гипохлорит натрия.
В самом начале необходимо отметить, что, как правило, все дезинфицирующие средства на основе ГПХН, применяемые в пищевой промышленности, помимо своего основного назначения – разрушения бактерий и вирусов, грибов и плесени, удаляют масла, жиры, белки, остатки крови, пятна чая, кофе, фруктов и т.д., поскольку обладают отбеливающими свойствами. Все дезинфицирующие средства на основе ГПХН поставляются в концентрированном виде, а рабочий раствор готовится на месте путем разбавления концентрата. Как правило, все средства щелочные (значение рН рабочего раствора колеблется в пределах от 11 до 13). Связано это с химическими свойствами ГПХН, которые мы рассматривали ранее. Содержание активного хлора в рабочем растворе колеблется от 60 до 240 мг/л. В таблице приведены некоторые из наиболее популярных дезинфицирующих и моющих средств на основе ГПХН.
| Торговая марка | Состав | Изготовитель | |||||||||
| ГПХН (Ср.р.) |
Щелочь (рН) |
С | П | О | Ф | А | И | СЖ | К | ||
| SR 3000 D | + 2% |
+ рН=12 |
+ | + | HWR-Chemie GmbH, Германия | ||||||
| DM CID | + 2% |
+ рН=12 |
+ | + | + |
Cid Lines NV/SA, |
|||||
| DM CID S | + 2% |
+ рН=12 |
+ | + | + | + | |||||
| Катрил-хлор | + 2% |
+ рН=12 |
+ | + | ЗАО «Экохиммаш», Россия | ||||||
| Катрил-хлор пенный | + 2% |
+ рН=12 |
+ | + | + | ||||||
| Neomoscan® RD-B | + 1% |
+ рН=12 |
+ | Chemische Fabrik DR. WEIGERT GmbH & Co. KG, Германия | |||||||
| Divosan Hypochlolite | + 1% |
+ рН=11 |
+ | + | + | JohnsonDiversey, Великобритания |
|||||
| Калгонит ЦФ 312 |
+ 1% |
+ рН=12 |
+ | Calvatis GmbH, Германия | |||||||
| Калгонит ЦФ 353 |
+ 2,4% |
+ рН=12 |
+ | + | + | ||||||
| Калгонит ЦФ 315 |
+ 1% |
+ рН=12 |
+ | + | |||||||
| Калгонит 6010 |
+ 4% |
+ рН>12 |
+ | ||||||||
| СИП-БЛЮ 5 | + 3% |
+ рН=11 |
+ | + | «НПО СпецСинтез», Россия | ||||||
| АКТИВ – ЛЮКС Д | + 2% |
+ рН=11,5 |
+ |
Принятые в таблице обозначения: С – силикаты; П – поверхностно-активные вещества, О – отдушки; Ф – фосфаты; А – альдегиды; И – ингибиторы коррозии; СЖ – стабилизаторы жесткости; К – комплексообразователи.
Нам хорошо известно, что решающим фактором при приобретении какого-либо пищевого продукта являются его вкусовые характеристики. Поэтому технологи пищевой промышленности неохотно используют средства дезинфекции с хлорсодержащими агентами, поскольку активный хлор уж очень «активно влияет» на вкус и запах продукции. Исключение составляет наружная дезинфекция технологического оборудования, ввиду того, что хлор обладает замечательным пролонгирующим действием. Гипохлорит натрия относится к числу таких средств. Обычно для дезинфекции технологического оборудования применяют раствор ГПХН, содержащий 30-40 мг/л активного хлора. Бактерицидное действие гипохлорита натрия проявляется после нанесения раствора при 20-25оС и его экспозиции в течение 3-5 минут. Правда, в этом случае надо учитывать коррозионную активность растворов ГПХН, поэтому для снижения коррозирующего действия используют смесь гипохлорита натрия, каустической соды и метасиликата натрия (препарат «Гипохлор»). Коррозионная активность этого препарата в 10-15 раз меньше, чем обычного гипохлорита натрия.
Что касается обработки внутренних полостей технологического оборудования пищевой промышленности, то ГПХН активно вытесняется препаратами, не содержащими хлор.
3.4. Использование гипохлорита в рыбоводстве
Рыбоводные пруды, орудия лова, живорыбная тара, рыбоводный инвентарь, а также спецодежда и обувь лиц, участвующих в проведении рыбоводных и ветеринарно-санитарных мероприятий, подлежат периодической очистке и дезинфекции (дезинвазии). Чаще всего для этого используется хлорная известь. Однако в последнее время для этой цели стали использовать гипохлорит натрия в виде разбавленных растворов.
Достаточно активно ГПХН используется при дезинфекции рыболовных сетей, сачков и баков из пластика для хранения рыбы.
При использовании растворов ГПХН в рыбоводстве следует выполнять пересчет концентрации активного хлора, получающейся при использовании растворов хлорной извести и растворов ГПХН. При этом руководствуются: «Ветеринарно-санитарными правилами для рыбоводных хозяйств» и «Инструкцией по ветеринарному надзору за перевозками живой рыбы, оплодотворенной икры, раков и других гидробионтов».
3.5. Использование гипохлорита в здравоохранении
Уже первой мировой войне гипохлорит натрия как антисептик с успехом применяли для перевязок при лечении ран и ожогов. Однако в то время чисто технические трудности массового производства, да и не очень хорошее качество препарата способствовали подписанию ему чуть ли не обвинительного приговора. Кроме того «подоспели» новые, как тогда казалось, более эффективные лекарства, и вскоре о гипохлорите забыли… и вспомнили в 60-е годы ХХ века во время войны во Вьетнаме. Там в обстановке, когда требовалось использовать наиболее действенные средства борьбы с инфекцией, отдавали предпочтение гипохлориту натрия, а не новейшим антибиотикам. Такая симпатия объяснялась не только высокой эффективностью ГПХН, но и универсальностью препарата. Ведь во фронтовых условиях вместо дюжины упаковок лучше иметь под рукой один флакон с раствором, которым можно и рану промыть, и кожу перед операцией продезинфицировать, и инструменты обработать.
Мы как-то привыкли, что за каждым названием лекарства стоит расшифровка его сложной химической формулы. Покупая самые разные препараты, мы не интересуемся этими премудростями, лишь бы помогло. А вот гипохлорит натрия такого внимания заслуживает. Оказывается, что в умеренных концентрациях гипохлорит совершенно безопасен для человека. Гипохлорит, как не странно, удивительно хорошо «вписывается» в работу систем организма, отвечающих за защиту от инфекции и восстановление поврежденных тканей. Они воспринимают его как что-то родное и знакомое. А он действительно «свой»: в малых количествах ГПХН постоянно вырабатывается лейкоцитами, призвание которых как раз в том и состоит, чтобы бороться с инфекцией. Ни для кого не секрет: одни и те же болезнетворные микробы по-разному воздействуют на разных людей: кто-то даже не заметит их нападения, кто-то почувствует легкое недомогание, а у кого-то болезнь принимает тяжелое, подчас фатальное течение. Повышенная восприимчивость к инфекции связана, как известно, с ослаблением защитных сил организма. Гипохлорит в организме человека не только уничтожает микробы, но и «настраивает» иммунную систему на их распознавание (и это одно из важнейших его свойств).
При тяжелых заболеваниях, обширных ранах, ожогах, после длительного сдавления тканей и серьезных операций, как правило, развивается самоотравление организма продуктами распада тканей. Накапливающиеся в организме токсические вещества повреждают органы, ответственные за их нейтрализацию и удаление. Могут значительно нарушиться функции почек, печени, легких, головного мозга. Помочь этому можно только извне. В этом случае обычно проводится гемосорбция – кровь больного пропускают через специальные фильтры-сорбенты. Однако не все токсины поглощаются этими фильтрами или поглощаются не полностью.
Альтернативой гемосорбции послужил метод электрохимической детоксикации – внутривенного введения гипохлорита натрия, которое можно назвать отечественным «ноу-хау» (мы уже упоминали о нем рассматривая бактерицидные свойства гипохлорита натрия. Сегодня трудно точно вспомнить, что послужило толчком к изучению его нашими учеными. Поиски нетрадиционных средств, а может, просто любознательность… Но гипохлориту повезло – сотрудники НИИ физико-химической медицины (а именно в этом институте проводили исследования и активно внедряли в медицинскую практику гемосорбцию, плазмоферез, ультрафиолетовое облучение крови…) «взяли его в оборот». Их интерес к гипохлориту натрия отличала одна существенная особенность: вода, из которой гипохлорит образуется, — неотъемлемая основа всех биологических процессов. Препарат в отличие от других, применяемых в подобных случаях, не выводит яды из организма – он просто расщепляет их до нейтральных молекул, не причиняющих никакого вреда. Токсины стремительно сгорают в активном кислороде гипохлорита, и состояние пациента улучшается на глазах: нормализуются давление, частота сердечных сокращений, работа почек, улучшается дыхание, и человек приходит в сознание… Удается избавиться от токсинов, которые никаким другим путем не удалить из организма. По свидетельству реаниматологов, метод позволяет с высокими шансами на успех оперировать больных, считавшихся ранее безнадежными.
Гипохлорит практически не вызывает столь распространенных в наше время аллергических реакций, чем как раз грешат многие антибиотики. Но в отличие от антибиотиков, избирательно убивающих определенные виды бактерий, гипохлорит натрия уничтожает практически любые болезнетворные микроорганизмы, вплоть до вирусов, а те микробы, которые при контакте с ним «случайно уцелели», резко теряют свою вредоносную активность и становятся легкой добычей других элементов иммунной системы. Интересно, что бактерии, слегка «поврежденные» гипохлоритом, теряют устойчивость и к воздействию антибиотиков.
По данным разных авторов раствор гипохлорита натрия успешно применяется при хирургической гнойной патологии, как в качестве бактерицидного препарата для обработки ран, так и в качестве инфузионного детоксицирующего раствора для внутривенного введения в центральные вены. Гипохлорит натрия может вводиться в организм всеми возможными способами, при этом он выполняет не только детоксикационно-окислительную функцию печени, но также стимулирует биологические и молекулярные механизмы фагоцитоза. Тот факт, что гипохлорит натрия непосредственно образуется в макрофагах при фагоцитозе, позволяет говорить о его естественности и физиологичности и относит применение растворов гипохлорита к экологически чистым немедикаментозным методам лечения.
Причем, применение раствора гипохлорита натрия оказалось эффективным не только в гнойной хирургии, урологии и гинекологии, но и в пульмонологии, фтизиатрии, в гастроэнтерологии, стоматологии, в дерматовенерологии и токсикологии. В последнее время с успехом применяется не только бактерицидное свойство гипохлорита натрия, но и его высокая детоксицирующая активность.
Анализ использования различных биологических детоксицирующих систем (гемосорбция, гемодиализ, форсированный диурез и др.) указал только на перспективность применения системы электрохимического окисления как наиболее эффективного, физиологичного и технически несложного метода детоксикации организма.
Выраженный лечебный эффект гипохлорита натрия при ряде заболеваний и состояний организма связан не только с его детоксикационными свойствами, но и с его способностью улучшать показатели крови, повышать иммунный статус, оказывать противовоспалительное и антигипоксическое воздействия.
Ведущей реакцией, детоксицирующей токсины и продукты метаболизма в организме, является их окисление на специальном детоксицирующем ферменте — цитохроме Р-450. Физиологический эффект обусловлен тем, что окисленные субстанции в организме становятся растворимыми в воде (гидрофобные токсины превращаются в гидрофильные) и благодаря этому активно включаются в процессы других метаболических превращений и выводятся наружу. В общем виде этот процесс в клетках печени представляется как окисление, усиленное молекулярным кислородом и катализированное цитохромом Р-450. Эту важнейшую детоксицирующую функцию печени не способна полностью компенсировать ни одна другая система организма. При тяжелых формах интоксикации печень не справляется полностью со своими дезинтоксикационными функциями, что приводит к отравлению организма и усугублению патологических процессов.
Иммитируя монооксидазную систему организма, гипохлорит натрия оказывает значительную помощь в естественных детоксицирующих функциях организма как при эндотоксикозах, так и при экзотоксикозах, а в случае с токсальбуминами он оказался, просто не заменим.
Растворы гипохлорита натрия и кальция используют взамен хлорной извести при текущей, заключительной и профилактической дезинфекции для обеззараживания различных предметов и выделений в очагах инфекционных заболеваний, а также для обеззараживания специальных объектов. Обеззараживание проводят орошением, протиранием мытьем, замачиванием объектов, не портящихся при таком способе обработки.
Скученность людей на ограниченной площади, недостаточное отопление, повышенная влажность, неполноценное питание, сложность строгого соблюдения адекватного санитарно-противоэпидемического режима – знакомая ситуация в палаточном городке зоны катастроф. В этих условиях доказана эффективность применения лекарственного раствора гипохлорита натрия в хирургии, оториноларингологии, терапии при профилактике заболеваемости, как беженцев, так и медицинского персонала. Простота изготовления рабочего раствора, хорошие результаты в борьбе с многочисленными возбудителями инфекций, иногда устойчивыми к действию практически всех антибиотиков, позволили рекомендовать растворы ГПХН для широкого применения при оказании медицинской помощи.
Лечение растворами гипохлорита натрия позволяет не только равноценно компенсировать острый дефицит ряда дорогих лекарственных средств, но и перейти на качественно новый уровень медицинской помощи. Дешевизна, доступность и универсальность этого лекарственного раствора дает возможность в наше непростое время хотя бы частично восстановить социальную справедливость и обеспечить качественной помощью население и в удаленной сельской больнице, и в любой точке России, где только есть врач.
Эти же достоинства делают его важным компонентом для поддержания высоких гигиенических стандартов во всем мире. Особенно ярко это проявляется в развивающихся странах, где использование ГПХН стало решающим фактором для остановки эпидемий холеры, дизентерии, брюшного тифа и других водных биотических заболеваний. Так, при вспышке холеры в странах Латинской Америки и Карибского бассейна в конце XX века благодаря гипохлориту натрия удалось свести к минимуму заболеваемость и смертность, о чем было сообщено на симпозиуме по тропическим болезням, проводимого под эгидой Института Пастера.
3.6. Использование ГПХН для отбеливания белья в фабриках-прачечных
Считается, что отбеливание белья при промышленной стирке – самая потенциально опасная операция из всех операций, применяемых в стирке белья, а отбеливатель, соответственно, – самое опасное вещество для ткани. Большинство отбеливателей, применяемых при промышленной стирке, являются сильными окислителями, под воздействием которых большинство окрашенных веществ после их окисления становятся или бесцветными, или растворимыми в воде. И как любой окислитель, отбеливатель одновременно «атакует» как пятна, так и волокна ткани. Поэтому всегда при отбеливании побочным процессом будет разрушение волокна ткани. Отбеливатели, применяемые при промышленной стирке, бывают трех типов: пероксидные (перекисные или кислородосодержащие), хлорные и серосодержащие. В рамках данной публикации мы остановимся только на одном из хлорсодержащих отбеливателей тканей – гипохлорите натрия.
Отбеливание тканей с помощью ГПХН имеет более чем двухсотлетнюю историю. Историческое название раствора гипохлорита натрия, применяемого для отбеливания, – лабарракова вода или жавелевая вода. Как это не покажется странным, но за два столетия в технологии отбеливания тканей с помощью растворов ГПХН практически ничего не изменилось. Гипохлорит натрия широко используется в качестве отбеливателя и пятновыводителя в текстильном производстве и промышленных прачечных и химчистках. Он может быть безопасно использован для многих видов тканей, включая хлопок, полиэстер, нейлон, ацетат, лён, вискозу и другие. Он очень эффективен для удаления следов почвы и широкого спектра пятен в том числе, кровь, кофе, трава, горчица, красное вино и т. д.
Отбеливающие свойства гипохлорита натрия основаны на образовании ряда активных частиц (радикалов) и, в частности, синглетного кислорода, обладающего высоким биоцидным и окислительным действием (подробнее см. в статье «Хлорирование питьевой воды»), образующегося при разложении гипохлорита:
NaOCl → NaCl + [O].
Поэтому без гипохлорита натрия не обойтись при отбелке больничного белья или белья, пораженного плесенью.
Отбеливающие (окислительные) свойства растворов гипохлорита натрия зависят от его концентрации, рН раствора, температуры и времени воздействия. И хотя мы их уже рассматривали в разделе 2 настоящей публикации, немного повторимся применительно к процессу отбеливания.
В общем, чем выше концентрация ГПНХ в растворе (больше активность ГПХН) и дольше время воздействия, тем выше эффект отбеливания. А вот зависимость активности воздействия от температуры имеет более сложный характер. Он прекрасно «работает» уже при низких температурах (~ 40°С). При повышении температуры (вплоть до 60°С) активность отбеливателя на основе ГПНХ растет линейно, а при более высокой температуре наблюдается экспоненциальная зависимость роста активности отбеливателя.
Зависимость отбеливающих свойств ГПХН от значения рН напрямую связана с химическими свойствами ГПХН.При высоком значении рН среды (рН>10) активность отбеливателя на основе ГПНХ относительно невелика, т.к. в процессе отбеливания в основном участвует активный кислород – он действует довольно медленно. Если значение рН среды начать уменьшать, то активность отбеливателя вначале увеличивается, достигая максимума при оптимальном значении рН=7 для гипохлорита, а затем ростом кислотности активность снова снижается, но медленнее, чем это наблюдается при росте рН в щелочную сторону.
В промышленной стирке операцию отбеливания обычно совмещают с операциями стирки и полоскания, а не проводят ее отдельно. Это удобнее и быстрее. При этом длительность самих операций увеличивают, чтобы отбеливатель успел бы обработать все вещи закладки равномерно. При этом также следят, чтобы отбеливатель на основе ГПХН не был слишком активным, поскольку при его слишком активной реакции он будет израсходован до того, как сможет проникнуть в центр закладки, что повлияет на процесс выведения пятенв центре закладки,а волокна тканей, находящихся на поверхности закладки,получат дополнительные повреждения.
Британской Ассоциацией «Стирка и Чистка» (British Launderers Research Association, BLRA) были разработаны рекомендации по применению гипохлорита натрия при выведении пятен и отбеливании тканей в процессе промышленной стирки. Приведем некоторые из них:
- Рабочий раствор отбеливателя на основе ГПХН следует использовать с моющей жидкостью, имеющей щелочной рН, или в смеси с мылом или с синтетическим детергентом, чтобы отбеливатель «работал» медленнее и более или менее равномерно пропитывал весь объем закладки.
- Необходимо добавлять такое количество жидкого товарного раствора гипохлорита натрия, чтобы концентрация свободного хлора была примерно равна 160 мг/л для раствора в машине или 950 мг/кг для сухого веса закладки.
- Температура той жидкости, куда вносится отбеливатель, не должна превышать 60°С.
Как утверждают специалисты BLRA, если следовать этим рекомендациям, то в процессе отбеливания при использовании ГПХН удаляется большинство обычных пятен, а ткань получает минимальные повреждения.
3.7. Дезинфекция питьевой воды
Дозу хлора устанавливают технологическим анализом из расчета, чтобы в 1 л воды, поступающей к потребителю, оставалось 0,3…0,5 мг хлора, не вступившего в реакцию (остаточного хлора), который является показателем достаточности принятой дозы хлора. За расчетную следует принимать ту дозу хлора, которая обеспечивает указанное количество остаточного хлора. Расчетная доза назначается в результате пробного хлорирования. Для осветленной речной воды доза хлора обычно колеблется в пределах 1,5 – 3 мг/л; при хлорировании подземных вод доза хлора чаще всего не превышает 1– 1,5 мг/л; в отдельных случаях может потребоваться увеличение дозы хлора из-за наличия в воде закисного железа. При повышенном содержании в воде гуминовых веществ требуемая доза хлора возрастает.
После введения хлорагента в обрабатываемую воду должны быть обеспечены хорошее смешивание его с водой и достаточная продолжительность (не менее 30 мин) его контакта с водой до подачи ее потребителю. Контакт может происходить в резервуаре фильтрованной воды или в трубопроводе подачи воды потребителю, если последний имеет достаточную длину без водозабора. При выключении на промывку или ремонт одного из резервуаров фильтрованной воды, когда не обеспечивается время контакта воды с хлором, доза хлора должна быть увеличена вдвое.
Хлорирование уже осветленной воды обычно производят перед поступлением ее в резервуар чистой воды, где и обеспечивается необходимое для их контакта время.
Вместо хлорирования воды после отстойников и фильтров в практике водоочистки иногда применяют хлорирование ее перед поступлением на отстойники (предварительное хлорирование) – до смесителя, а иногда перед подачей на фильтр.
Предварительное хлорирование способствует коагуляции, окисляя органические вещества, которые тормозят этот процесс, и, следовательно, позволяет уменьшить дозу коагулянта, а также обеспечивает хорошее санитарное состояние самих очистных сооружений. Предварительное хлорирование требует повышения доз хлора, так как значительная часть его идет на окисление органических веществ, содержащихся в еще неосветленной воде.
Вводя хлор до и после очистных сооружений, можно снизить общий расход хлора по сравнению с расходом его при предварительном хлорировании, сохранив преимущества, даваемые последним. Такой метод носит название двойного хлорирования.
Обеззараживание хлором.
Коротко мы уже рассматривали вопрос об аппаратурном оформлении процесса хлорирования воды с использованием жидкого хлора в качестве хлорагента. В данной публикации мы остановимся на тех аспектах, которые нами не были отражены.
Обеззараживание воды жидким хлором имеет пока более широкое применение по сравнению с процессом, где используется ГПХН. Жидкий хлор вводят в обрабатываемую воду либо непосредственно (прямое хлорирование), либо при помощи хлоратора – устройства, которое служит для приготовления раствора хлора (хлорной воды) в водопроводной воде и его дозировании.
Для дезинфекции воды чаще всего применяют хлораторы непрерывного действия, лучшими из них считаются вакуумные, в которых дозируемый газ находится под разрежением. Это предотвращает проникание газа в помещение, что возможно при напорных хлораторах. Вакуумные хлораторы выпускаются двух типов: с жидкостным измерителем расхода хлора и газовым измерителем расхода хлора.
В случае использования прямого хлорирования должно быть обеспечено быстрое распределение хлора в обрабатываемой воде. Для этой цели служит диффузор приспособление, при помощи которого хлор вводится в воду. Слой воды над диффузором должен быть около 1,5 м, но не меньше 1,2 м.
Для смешивания хлора с обрабатываемой водой могут быть применены смесители любого типа, устанавливаемые перед контактными резервуарами. Наиболее простым является ершовый смеситель. Он представляет собой лоток с пятью вертикальными перегородками, поставленными перпендикулярно или под углом 45° против течения воды. Перегородки суживают сечение и вызывают вихреобразное движение, при котором хлорная вода хорошо смешивается с обрабатываемой. Скорость движения воды через суженное сечение смесителя должна быть не менее 0,8 м/сек. Дно лотка смесителя устраивается с уклоном, равным гидравлическому уклону.
Далее смесь обрабатываемой воды и хлорной воды направляется в контактные емкости.
Итак, налицо основные преимущества применения хлора для хлорирования воды:
- Концентрация активного хлора – 100% чистого вещества.
- Качество продукта – высокое, устойчивое, не изменяющееся при хранении.
- Простота реакции и предсказуемость дозы.
- Доступность массовых поставок – может транспортироваться специальными автоцистернами, бочками и баллонами.
- Хранение – легко хранить на складах временного хранения.
Именно поэтому в течение многих десятилетий сжиженный хлор являлся наиболее надежным и универсальным средством обеззараживания воды в системах централизованного водоснабжения населенных мест. Казалось бы – почему же не продолжать использовать хлор для обеззараживания воды? Давайте разберемся вместе…
В ГОСТ 6718-93 указано, что: «Жидкий хлор – жидкость янтарного цвета, обладающая раздражающим и удушающим действием. Хлор относится к высоко опасным веществам. Глубоко проникая в дыхательные пути, хлор поражает легочную ткань и вызывает отек легких. Хлор вызывает острые дерматиты с потением, покраснением и отечностью. Большую опасность для пораженного хлором представляют осложнения — воспаление легких и нарушение со стороны сердечно-сосудистой системы. Предельно допустимая концентрация хлора в воздухе рабочей зоны производственных помещений – 1мг/м3.»
В учебном пособии профессора Слипченко В. А. «Совершенствование технологии очистки и обеззараживания воды хлором и его соединениями» (Киев, 1997, стр.10) о концентрации хлора в воздухе приведена следующая информация:
- Ощутимый запах – 3,5 мг/м3;
- Раздражение горла – 15 мг/м3;
- Кашель – 30 мг/м3;
- Максимально допустимая концентрация при кратковременном воздействии – 40 мг/м3;
- Опасная концентрация, даже при кратковременном воздействии – 40-60 мг/м3;
- Быстрая смерть – 1000 мг/м3;
Не оставляет сомнения, что оборудование, необходимое для дозирования столь смертоносного реагента (об этом почти регулярно свидетельствует статистика) должно обладать целым рядом степеней безопасности.
Поэтому, ПБХ («Правила безопасности при производстве, хранении, транспортировании и применении хлора») предполагают следующее обязательное периферийное оборудование:
- весы для баллонов и контейнеров с хлором;
- отсекающий вентиль на жидкий хлор;
- напорный хлоропровод;
- ресивер для хлоргаза;
- фильтр на хлоргаз;
- скрубберная установка (нейтрализатор хлора);
- анализатор для обнаружения хлоргаза в воздухе,
а при потреблении газообразного хлора из баллонов более 2 кг/час или более 7 кг/час при потреблении хлора из контейнера – испарители хлора, к которым предъявляются особые требования. Они должны быть оснащены автоматическими системами, предотвращающими:
- несанкционированное потребление хлоргаза в объемах, превышающих максимальную производительность испарителя;
- проникновение через испаритель жидкой фазы хлора;
- резкое понижение температуры хлора, находящегося в радиаторе испарителя.
Испаритель должен быть снабжен специальным отсекающим электромагнитным вентилем на входе, манометром и термометром.
Весь процесс обработки воды хлором осуществляется в специальных помещениях – хлораторных, которым также предъявляются особые требования. Хлораторная обычно состоит из блоков помещений: расходного склада хлора, хлордозаторной, вентиляционной камеры, вспомогательных и бытовых помещений.
Хлораторные должны размещаться в отдельно стоящих капитальных зданиях второй степени огнестойкости. Вокруг склада хлора и хлораторной со складом хлора должно быть сплошное глухое ограждение, высотой не менее двух метров, с глухими плотно закрывающимися воротами для ограничения распространения газовой волны и исключения доступа посторонних лиц на территорию склада. Вместимость расходного склада хлора должна быть минимальной и не превышать 15-суточного потребления водопроводной станцией.
Радиус опасной зоны, в пределах которой не допускается располагать объекты жилищного и культурно-бытового назначения, составляет для складов хлора в баллонах 150 м, в контейнерах – 500 м.
Хлораторные должны располагаться в пониженных местах площадки водопроводных сооружений и преимущественно с подветренной стороны преобладающих направлений ветров относительно ближайших населенных пунктов (кварталов).
Расходный склад хлора следует отделять от других помещений глухой стеной без проемов, в складе должно быть два выхода с противоположных сторон помещения. Один из выходов оборудован воротами для транспортирования баллонов или контейнеров. Въезд автомобилей в помещение склада не допускается, должно быть предусмотрено грузоподъемное оборудование для транспорта сосудов с кузова автомобиля на склад. Порожнюю тару надлежит хранить в помещении склада. Двери и ворота во всех помещениях хлораторной должны открываться по ходу эвакуации. На выходах из склада предусматриваются стационарные водяные завесы. Сосуды с хлором должны размещаться на подставках или рамках, иметь свободный доступ для строповки и захвата при транспортировании. В помещении склада хлора располагается оборудование для нейтрализации аварийных выбросов хлора. Должна быть обеспечена возможность подогрева баллонов на складе перед доставкой их в хлораторную. Следует отметить, что при длительной эксплуатации баллонов с хлором в них накапливается чрезвычайно взрывчатый трихлорид азота, и поэтому время от времени баллоны с хлором должны проходить плановую промывку и очистку от хлорида азота.
Хлордозаторные размещать в заглубленных помещениях не допускается, от других помещений они должны быть отделены глухой стеной без проемов и снабжены двумя выходами наружу, при этом один из них через тамбур. Вспомогательные помещения хлораторных должны быть изолированы от помещений, связанных с применением хлора и иметь самостоятельный выход.
Хлораторные оборудуются приточно-вытяжной вентиляцией. Выброс воздуха постоянно действующей вентиляцией из помещения хлордозаторной надлежит осуществлять через трубу высотой на 2 м выше конька кровли самого высокого здания, находящегося в радиусе 15 м, а постоянно действующей и аварийной вентиляцией из расходного склада хлора – через трубу высотой 15 м от уровня земли.
То есть степень опасности хлора минимизируется наличием целого комплекса мер по организации его хранения и использования, в том числе за счет организации санитарно-защитных зон (СЗЗ) складов реагента, радиус которых достигает 1000 м для наиболее крупных сооружений.
Однако по мере роста городов, жилая застройка вплотную приближалась к границам СЗЗ, а в ряде случаев размещалась внутри этих границ. Кроме того увеличилась опасность транспортировки реагента от места производства к месту потребления. Согласно статистическим данным, именно при транспортировке происходит до 70% различных аварий химически опасных веществ. Полномасштабная авария железнодорожной цистерны с хлором способна нанести урон различной степени тяжести не только населению, но и природной среде. В то же время токсичность хлора, усиленная высокой концентрацией реагента, снижает промышленную безопасность и антитеррористическую устойчивость систем водоснабжения в целом.
В последние годы нормативная база в области промышленной безопасности при обращении с хлором ужесточается, что отвечает требованиям дня. В связи с этим у эксплуатирующих служб возникает желание перейти к более безопасному способу обеззараживания воды, т.е. к способу, который не поднадзорен Федеральной службе по экологическому, технологическому и атомному надзору, но обеспечивает выполнение требований СанПиНа по безопасности в эпидемиологическом отношении питьевой воды. С этой целью в качестве хлорсодержащего реагента, наиболее часто используемого при хлорировании (второе место после жидкого хлора), выступает гипохлорит натрия (ГПХН).
Обеззараживание гипохлоритом натрия
В практике водоснабжения для обеззараживания питьевой воды используются концентрированный гипохлорит натрия марки А с содержанием активной части 190 г/л и низкоконцентрированный гипохлорит натрия марки Э с содержанием активной части около 6 г/л.
Обычно в систему водоочистки товарный гипохлорит натрия вводят после предварительного разбавления. После разбавления в 100 раз гипохлорита натрия, содержащего 12,5% активного хлора и имеющего рН = 12-13, происходит понижение рН до 10-11 и концентрации активного хлора до 0,125 (в действительности величина рН имеет более низкое значение). Чаще всего для обработки питьевой воды применяется раствор гипохлорита натрия, характеризующийся показателями, перечисленными в Таблице:
| Содержание активного хлора, % | 5 |
| Содержание свободной щелочи, % | 2 |
| Нерастворимая часть, % | 0,01 |
| Mg, мг/л | 1 |
| As, мг/л | 1 |
| Pb, мг/л | 1 |
Таким образом, в отличие от хлора растворы ГПХН имеют щелочной характер и могут применяться для повышения уровня рН обрабатываемой воды.
С изменением значения рН обрабатываемой воды меняются соотношения между хлорноватистой кислотой и ионами гипохлорита. Проведенные в Японии исследования показали, что при использовании гипохлорита натрия для дезинфекции воды необходимо учитывать концентрацию щелочи в гипохлорите и поддерживать ее ниже определенного уровня. С возрастанием рН хлорноватистая кислота распадается на ионы Н+ и ClO–. Так, например, при рН = 6 доля HСlO составляет 97%, а доля ионов гипохлорита 3%. При рН = 7 доля HСlO составляет 78%, а гипохлорита – 22%, при рН = 8 доля HСlO – 24%, гипохлорита — 76%. Таким образом, при высоких значениях рН в воде HСlO превращается в гипохлорит ион.
Значит, повышение значения рН раствора товарного гипохлорита натрия проводят из-за того, что щелочной раствор гипохлорита натрия более устойчив. С другой стороны «защелачивая» обрабатываемую воду, мы снижаем активность хлорагента. Кроме того, на границе взаимодействия обрабатываемой воды и рабочего раствора ГПХН образуется осадок гидрооксида магния и диоксида кремния, забивающий водные каналы. Поэтому концентрация щелочи в гипохлорите натрия должна быть такой, чтобы не вызывать образования этого осадка. Экспериментально установлено, что оптимальный диапазон рН воды при ее обработке гипохлоритом натрия находится в пределах от 7,2 до 7,4.
Помимо значения рН на дезинфицирующие свойства ГПНХ оказывают влияние температура и содержание свободного активного хлора в рабочем растворе. Данные по избытку активного хлора, необходимому для полной стерилизации питьевой воды, при различных температурах, времени воздействия и величине рН приведены в Таблице.
| Температура воды, оС | Время воздействия, мин | Требуемый избыток хлора, мг/л | ||
| pН 6 | рН 7 | рН 8 | ||
| 10 | 5 | 0,50 | 0,70 | 1,20 |
| 10 | 0,30 | 0,40 | 0,70 | |
| 30 | 0,10 | 0,12 | 0.20 | |
| 45 | 0,07 | 0,07 | 0.14 | |
| 60 | 0,05 | 0,05 | 0,10 | |
| 20 | 5 | 0,30 | 0,40 | 0,70 |
| 10 | 0,20 | 0.20 | 0,40 | |
| 15 | 0,10 | 0,15 | 0,25 | |
| 30 | 005 | 0,06 | 0,12 | |
| 45 | 0,04 | 0,04 | 0,08 | |
| 60 | 0,03 | 0,03 | 0,06 |
Потерю активности растворов ГПХН со временем наглядно иллюстрирует следующая таблица:
| Концентрация NaOCl, % | Период полураспада, сутки | |
| 25 °C | 35 °C | |
| 15 | 144 | 39 |
| 12 | 180 | 48 |
| 9 | 240 | 65 |
| 6 | 360 | 97 |
| 3 | 720 | 194 |
| 1 | 2160 | 580 |
Ввод рабочего раствора ГПХН в обрабатываемую воду осуществляют методом пропорционального дозирования с помощью насосов-дозаторов. При этом пропорциональное дозирование (управление насосом-дозатором) может производиться как с использованием импульсных счетчиков воды, так и по сигналу датчика хлора, установленного либо непосредственно в трубопроводе, либо после контактной емкости. После узла ввода ГПХН или на входе в контактную емкость обычно устанавливают динамический смеситель для тщательного перемешивания обрабатываемой воды с рабочим раствором ГПХН.
Гипохлорит натрия электролизный марки «Э», полученный на бездиафрагменных электролизерах, подается в поток обрабатываемой воды либо посредством прямого ввода (в случает применения электролизеров проточного типа), либо через накопительную емкость (в случае применения электролизеров непроточного типа), оборудованную автоматической или управляемой вручную системой дозирования. Управление системой дозирования может производиться как с использованием импульсных счетчиков воды, так и по сигналу датчика хлора, установленного либо непосредственно в трубопроводе, либо после контактной емкости.
Таким образом, казалось бы, преимущества применения гипохлорита натрия перед хлором при хлорировании воды, достаточно явные: он значительно безопаснее – не горюч и не взрывоопасен; нет необходимости в дополнительном оборудовании, обеспечивающего безопасность процесса хлорирования, кроме наличия: 6-кратной вентиляции, резервуара для сбора вытекшего гипохлорита натрия и емкости с нейтрализующим раствором (тиосульфат натрия). Применяемое при использовании ГПХН оборудование для обеспечения процесса обеззараживания на станциях водоподготовки не относится к категории промышленно опасного и не поднадзорно Федеральной службе по экологическому, технологическому и атомному надзору. Это облегчает жизнь эксплуатационникам.
Но так ли это? Давайте вернемся к свойствам ГПХН.
Мы уже неоднократно говорили о том, что растворы ГПХН неустойчивы и подвержены разложению. Так вот по данным Мосводоканала выяснено, что гипохлорит натрия марки «А» теряет до 30% от первоначального содержания активной части в результате хранения по истечении 10 суток. К этому добавляется и то обстоятельство, что он замерзает в зимнее время при температуре -25°С, а в летнее время наблюдается выпадение осадка, что приводит к необходимости использования железнодорожных цистерн с термоизоляцией для перевозки реагента.
Кроме того,произошло увеличение объемов применения реагента в 7-8 раз по сравнению с хлором за счет низкого содержания активной части и, как следствие, увеличение объема транспортировки железнодорожных цистерн (ежедневно по одной цистерне объемом 50 т на каждую станцию), что повлекло за собойнеобходимость наличия складов значительного объема для хранения запасов реагента в соответствии с требованиями нормативных документов (запас 30 суток).
И как оказалось, в настоящее время существующие мощности производства концентрированного гипохлорита натрия в Европейской части России не обеспечивают перспективные потребности Мосводоканала в объеме около 50 тысяч кубометров в год.
Что касается гипохлорита натрия марки «Э», то Мосводоканал обращает внимание на то, что требуются значительные расходы сырья: около 20 т/сут поваренной соли на каждой станции (на 1 кг активного хлора приходится от 3 до 3,9 кг поваренной соли). При этом качество поваренной соли (отечественного сырья) не соответствует требованиям, предъявляемым производителями электролизеров. И самое главное, электролизные установки для получения низкоконцентрированных растворов гипохлорита натрия имеют ограниченное применение и недостаточный опыт эксплуатации (города Иваново и Шарья Костромской области).
И если опыт по эксплуатации электролизных установок можно накопить, то со свойствами ГПХН не поспоришь. Тем более имеются более неблаговидные примеры: когда гипохлорит оказывался между двумя закрытыми запорными устройствами, то постоянные газовыделения в ходе естественного разложения ГПХН приводили к взрывам шаровых клапанов, фильтров, и других устройств с выделением хлора.
У эксплуатационников возникли проблемы и с подбором оборудования, и с его эксплуатацией в среде растворов ГПХН, обладающих очень высокой коррозионной активностью. Потребовались дополнительные мероприятия и по предотвращению кальцинации арматуры, особенно точек ввода инжекторов и диффузоров.
Не сбросишь со счетов и человеческий фактор: самая большая утечка хлора на станции водоподготовки (выше 5 тонн) была вызвана применением ГПХН. Это произошло на одной из крупнейших станций вод подготовки США на востоке страны, когда водитель автоцистерны с хлорным железом (рН=4) ошибочно слил продукт в резервуар с раствором ГПХН. Это привело к мгновенному выбросу хлора.
Вот такие «страшилки»…
Но давайте не забывать о том, что это мнение специалистов Мосводоканала, на станциях которого ежечасно обрабатываются тысячи тонн воды и где изначально обеспечена промышленная безопасность. Ну а если речь идет о маленьких городках, поселках и пр. Здесь организация «хлораторных» «влетит в копеечку». Плюс к этому недостаточная разветвленность дорог, а подчас полное их отсутствие, поставит под сомнение безопасность транспортировки такого опасного вещества как хлор. Поэтому как бы то ни было, надо ориентироваться на то, что гипохлорит натрия, а в его лице хлорирование воды найдет там применение, тем более что его можно получить на месте.
Вывод:
Пока хлорирование остается основным методом обеззараживания воды, а какой хлорагент применить: хлор или гипохлорит натрия, надо определять по количеству обрабатываемой воды, ее составу и возможностям организации безопасного процесса производства в каждом конкретном случае. Это задача для проектировщиков.
3.8. Обеззараживание ГПХН оборудования для очистки воды
При обеспечении населения питьевой водой безупречно чистой в микробиологическом отношении не только сама вода должна быть очищена от патогенных бактерий, вирусов и паразитов, но и оборудование, используемое для водоснабжения: трубопроводы, емкости (резервуары), арматура, фильтры и насосы, которые используются при обработке воды и находятся в непосредственном контакте с ней.
Уже на стадии проектирования при выборе строительных и конструкционных материалов (арматура, трубы, уплотняющие материалы, краска и т.д.) нужно обращать внимание на свойства этих материалов, и ориентироваться на те, которые способствуют предотвращению или сокращению роста микробиологических загрязнений. В то же время эти материалы должны быть устойчивыми к методам и реагентам, используемым для обеззараживания воды.
На стадии строительства и монтажа систем водоснабжения должны соблюдаться меры предосторожности, препятствующие проникновению микроорганизмов монтируемую систему из воздуха, от персонала, с рабочих инструментов и т.д. Во время монтажа оборудования и строительных работ в системе водоснабжения необходимо вести профилактические работы с целью предотвращения возможного микробиологического заражения частей системы.
Обеззараживание всего оборудования необходимо проводить перед началом его эксплуатации, после каждого ремонта всего оборудования или его отдельных узлов или после длительных перерывов в эксплуатации. Во всех этих случаях необходимо провести обеззараживание оборудования, чтобы предотвратить угрозу загрязнения питьевой воды патогенными микроорганизмами после ввода системы очистки воды в эксплуатацию.
Методы обеззараживания (дезинфекции) систем питьевого водоснабжения выбираются исходя из местных условий, однако в любом случае должны включать в себя определенные стадии. Чаще всего для обеззараживания оборудования всей системы водоснабжения используются любые средства, обладающие пролонгирующим действием. Само собой разумеется, это требование исключает использование озона и ультрафиолетового излучения.
Коротко рассмотрим алгоритм проведения дезинфекции отдельных технологических элементов, которые, как правило, включаются в состав технологической цепочки систем очистки воды.
Так для резервуаров с питьевой водой должны быть включены следующие стадии очистки и дезинфекции:
- Предварительная очистка внутренней поверхности резервуаров питьевой воды (механическая или гидравлическая) для удаления с нее налета и рыхлых отложений. Такую очистку надо проводить, по возможности, сразу же после слива воды из резервуаров. Для сокращения времени очистки и облегчения работы на сегодняшний день существует широкий выбор химических веществ (так называемых, технических моющих средств), которые способствуют отслоению от поверхности емкостей даже сильно приставших загрязнений. Правда при выборе таких веществ надо ориентироваться на их химическую и коррозионную активность, т.е. химическую совместимость конструкционных материалов емкости с техническими моющими средствами. Эти вещества наносятся на поверхность емкости с последующей экспозицией или добавляются в воду при гидравлической очистке.
- Тщательная промывка резервуаров питьевой воды после предварительной очистки (чаще всего направленной струей воды (из брандспойта)). Если при промывке резервуаров использовались химические реагенты, то отмывку от них необходимо проводить в строгом соответствии с инструкцией по применению используемого реагента.
- Выбор метода обеззараживания зависит от объема резервуара, его конструкции и используемого дезинфицирующего средства. Обработка всех поверхностей резервуара после предварительной очистки дезинфицирующими средствами на основе ГПХН является наиболее дешевым и надежным методом. Так, например, в пустую, предварительно очищенную емкость может быть залит раствор гипохлорита натрия, с концентрацией активного хлора не более 10 мг/л. После 24-и часовой экспозиции (минимально), раствор сливается, а резервуар снова наполняется водой. Главным недостатком этого метода является то, что крышка и верхняя часть стен емкости остаются необработанными, поскольку рабочий объем любого резервуара составляет 70 – 80% от полного объема. Кроме того большой объем резервуара потребует соответственно большое количество обеззараживающего реагента, который после использования должен быть утилизирован без угрозы нанесения вреда окружающей среде.
Во избежание повышенного расхода дезинфектанта в емкость устанавливают специальные моющие головки (форсунки), которые позволяют при распылении дезинфицирующего раствора обработать всю поверхность емкости. При этом резко снижается расход дезинфектанта, и появляется возможность работы в режиме рециркуляции дезраствора через систему CIP (от англ. Clean In Place – очистка на месте) – безразборной автоматической мойки. При этом содержание активного хлора в растворе может составлять от 50 до 200 мг/л.
Для обеззараживания резервуаров небольшого объема могут быть использованы передвижные хлорирующие установки.
Аналогические меры (операции) следует предпринимать после монтажа и ремонта трубопроводов водопроводной сети, а также при вводе в эксплуатацию трубопровода, который долго не использовался (более 48 часов).
При ремонтных работах все используемые трубы, детали и запорная арматура должны быть обработаны слабым раствором дезинфектанта: растворами гипохлорита натрия или кальция, или слабым раствором перекиси водорода. В случае из отсутствия может быть использован раствор перманганата калия.
Для труб с малым внутренним сечением простая тщательная промывка их чистой водой может сделать последующую дезинфекцию ненужной. Но в этом случае очень важно, чтобы скорость потока воды в трубе при промывке была не менее 1 м/с, а количество промывной воды превышало общий объем трубопровода как минимум в три раза.
Последнее утверждение весьма не однозначно, поскольку, если при промывке (очистке внутренней поверхности) трубопроводов использовались химические реагенты, то отмывку труб от них необходимо проводить в строгом соответствии с инструкцией по применению используемого реагента.
Если эти условия при промывке трубопроводов (по скорости потока и объему промывной воды) не достигаются или результаты бактериологического исследования после промывки не удовлетворительные, необходимо будет провести дополнительную дезинфекцию трубопровода.
Специальное обеззараживание насосов, как правило, не требуется, поскольку большая скорость воды в корпусе насоса обуславливает высокую степень очистки уже в пробном режиме с чистой водой. Если же, несмотря на это, обеззараживание насосов необходимо, то оно должно быть проведено одновременно с дезинфекцией трубопроводов и запорной арматуры.
Отдельного рассмотрения требует процесс дезинфекции фильтрующего оборудования, поэтому этому вопросу нами была посвящена статья: «Проблемы микробиологических загрязнений систем водоснабжения».
Д. А. Меркулов, к.х.н., зав. кафедрой фундаментальной и прикладной химии, ФГБОУ ВПО «Удмуртский государственный университет», г. Ижевск
Введение
Гипохлоритами называют соли хлорноватистой кислоты HClO. Наиболее распространенными из них являются гипохлорит натрия, гипохлорит кальция и гипохлорит калия. Гипохлориты широко применяются для обеззараживания питьевой воды, отбеливания, дегазации и дезинфекции. Гипохлориты являются одними из самых важных химических соединений.
Таблица 1. Наиболее распространенные гипохлориты.
| Систематическое наименование | Традиционное название | Хим. формула | CAS № | М, г/моль |
|---|---|---|---|---|
| Гипохлорит натрия | Хлорноватистокислый натрий, лабарракова вода (гипохлорит натрия в смеси с хлоридом натрия и гидроксидом натрия) | NaClO | 7681–52–9 | 74,44 |
| Гипохлорит калия | Хлорноватистокислый калий,
жавелевая вода (гипохлорит калия в смеси с гидрокарбонатом калия и хлоридом калия) |
KClO | 7778–66–7 | 90,55 |
| Гипохлорит кальция | Хлорноватистокислый кальций, хлорная известь (гипохлорит кальция в смеси с хлоридом кальция, оксихлоридом кальция и гидроксидом кальция) | Ca(ClO)2 | 7778–54–3 | 142,98 |
История открытия
В 1774 г. шведский химик Карл Вильгельм Шееле получил хлор (Cl2) в результате взаимодействия оксида марганца(IV) MnO2 и соляной кислоты (HCl). Позже, в 1785 г. французский химик Клод Луи Бертолле обнаружил, что водный раствор газообразного хлора («хлорная вода»), содержащий хлорноватистую и хлороводородную кислоты, может отбелить белье, и сообщил о своих выводах Французской академии наук.
Cl2 + H2O = HClO + HCl
Знания об отбеливающих свойствах хлора были незамедлительно использованы Джеймсом Уаттом на текстильной фабрике в Глазго. Несмотря на то, что отбеливание с использованием хлора был значительно эффективнее традиционных способов отбеливания солнечным светом, слабыми растворами кислот и щелочей, применение хлора ограничивалось его токсичностью и разрушающим действием на ткани. Для стабилизации раствора газообразного хлора в воде и безопасности его применения, в 1787 г. на Парижском предприятии Societe Javel хлор стали пропускать через водный раствор карбоната калия (поташа)
Cl2 + K2СO3 = 2KHCO3 + KClO + KCl.
Глава предприятия Леонард Альбан назвал новый продукт «Eau de Javel» («жавелевая вода»), и вскоре белильная жидкость стала популярной во Франции и Англии.
В 1820 г. француз Антуан Лабаррак усовершенствовал способ получения отбеливателя, заменив поташ на более дешевый гидроксид натрия (каустическую соду). Полученный раствор гипохлорита и хлорида натрия получил название «Eau de Labarraque» («лабарракова вода»).
Cl2 + 2NaOH = NaClO + NaCl + H2O.
Широкое применение гипохлоритов для обеззараживания питьевой воды и дезинфекции стало возможным гораздо позже, в начале XX века, благодаря развитию промышленного производства хлора электролизом поваренной соли.
Физические свойства
Гипохлориты встречаются нам преимущественно в виде водных растворов, хотя некоторые из них можно выделить в твердом виде. Так, известен безводный гипохлорит натрия, который представляет собой неустойчивое бесцветное кристаллическое вещество. Из кристаллогидратов наиболее устойчивой формой является NaClO×5H2O. Это соединение представляет собой белые или бледно-зеленые ромбические кристаллы, расплывающиеся на воздухе. При нагревании пентагидрата гипохлорита натрия до температуры 24,4°С, он плавится. Кристаллогидрат NaClO×2,5H2O плавится при температуре 57,5°С. Моногидрат крайне неустойчив и разлагается выше 60°С, при более высоких температурах разложение протекает со взрывом.
Таблица 2. Плотности и температуры замерзания водных растворов гипохлорита натрия.
| Концентрация, % | 1 | 2 | 4 | 6 | 8 | 10 | 14 |
| Плотность, г/мл (18 °С) | 1,0053 | 1,0121 | 1025,8 | 1,0397 | 1,0538 | 1,0681 | 1,0977 |
| Концентрация, % | 18 | 22 | 26 | 30 | 34 | 38 | 40 |
| Плотность, г/мл (18 °С) | 1,1288 | 1,1614 | 1,1953 | 1,2307 | 1,2680 | 1,3085 | 1,3285 |
| Концентрация, % | 2 | 4 | 6 | 8 | 10 | 12 | 15,6 |
| tзам, °С | – 2,2 | – 4,4 | – 7,5 | – 10,0 | – 13,9 | – 19,4 | –29,7 |
В отличие от гипохлорита калия, известного только в растворах, гипохлорит кальция можно выделить в форме бесцветных кристаллов, устойчивых в сухой атмосфере без углекислого газа. Из водных растворов гипохлорит кальция можно выделить в виде кристаллогидратов Ca(ClO)2×2H2O, Ca(ClO)2×3H2O, Ca(ClO)2×4H2O.
Кислотно-основное равновесие между хлорноватистой кислотой и гипохлорит-ионом описывается обратимой реакцией с константой равновесия Ka = 2,63×10–8 при 20°С.
HClO = H+ + ClO–.
Используя константу равновесия Ka, можно рассчитать мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от рН (рис.1).
Данные свидетельствуют, что при подкислении растворов гипохлоритов увеличивается доля неустойчивой хлорноватистой кислоты. При рН < 7,58 в растворе присутствует преимущественно хлорноватистая кислота, а при рН > 7,58 существуют преимущественно гипохлорит-ионы.
Рис. 1. Мольное долевое распределение хлорноватистой кислоты и гипохлорит-ионов в зависимости от кислотности среды.
Химические свойства
Гипохлориты являются неустойчивыми соединениями, легко разлагающимися с выделением кислорода. Разложение твердых гипохлоритов натрия и кальция можно представить уравнениями
2NaClO = 2NaCl + O2↑ и 2Сa(ClO)2 = СaCl2 + O2↑.
Процессы при комнатной температуре происходят медленно, а при нагревании могут протекать со взрывом. Параллельно реакциям, сопровождающимся образованием хлоридов и свободного кислорода, могут протекать реакции диспропорционирования
3NaClO = NaClO3 + 2NaCl и 3Сa(ClO)2 = Ca(ClO3)2 + 2СaCl2.
Разложение гипохлоритов в водных растворах зависит от кислотности раствора и его температуры. В сильнокислых средах при рН ≤ 3 хлорноватистая кислота при комнатной температуре разлагается до хлора и кислорода
4HClO = 2Cl2↑ + O2↑ + 2H2O.
Если при подкислении используется соляная кислота или в растворе присутствуют хлориды, образование кислорода не происходит
HClO + HCl = Cl2↑ + H2O.
Хлорноватистая кислота очень слабая, поэтому она может быть вытеснена из раствора ее солей действием углекислого газа
ClO– + CO2 + H2O = HCO3– + HClO.
В слабокислых и нейтральных средах при 3 < рН < 7,5 протекает следующая окислительно-восстановительная реакция
2HClO = 2HCl + O2↑.
В нейтральных и щелочных растворах имеет место конкурирующая реакция образования хлоридов и хлоратов
3ClO– = ClO3– + 2Cl–.
При комнатной температуре реакция диспропорционирования протекает медленно, но при температурах выше 70°С эта реакция становится преобладающей.
В щелочных средах при рН > 7,5 в растворах преобладают гипохлорит-ионы, разлагающиеся следующим образом:
2ClO– = 2Cl– + O2↑.
Стабилизация гипохлоритов в водных растворах. Соли хлорноватистой кислоты значительно устойчивее самой кислоты. С ростом рН уменьшается мольная доля хлорноватистой кислоты в растворе и тем самым повышается стабильность гипохлоритов (рис. 1). В области рН > 11 содержание хлорноватистой кислоты крайне низкое, однако, и при этой кислотности наблюдается медленное разложение соединений хлора(I). Протекающие реакции можно записать в виде:
2ClO– = ClO2– + Cl–, (1)
ClO2– + ClO– = ClO3– + Cl–, (2)
2ClO– = O2 + 2Cl–. (3)
Около 95% от общего количества гипохлорит-ионов разлагается в результате последовательных реакций (1) и (2), причем реакция (1) является самой медленной (лимитирующей) и определяет общую скорость процесса. Реакция (3) не является основной, но отвечает за выделение кислорода, количество которого может быть значительным.
В присутствии некоторых ионов металлов, например, меди, никеля, кобальта наблюдается каталитическое разложение гипохлорит-ионов. Ионы железа обладают слабым каталитическим действием и являются сокатализаторами в сочетании с другими ионами металлов. В простейшем случае, при содержании ионов меди(II) в растворе в концентрации 1мг/кг порядки гомогенной реакции по гипохлориту и по меди(II) равны единице.
Гетерогенный катализ металлами и их нерастворимыми соединениями, является сложным и плохо воспроизводимым. Из нерастворимых катализаторов наибольшее мешающее влияние оказывает никель и его оксиды, которые попадают в растворы гипохлоритов при их контакте с легированными никелевыми сталями, используемыми для изготовления трубопроводов и резервуаров.
На константы скорости реакций (1)-(3) большое влияние оказывает ионная сила растворов. Высокие концентрации электролитов уменьшают константы скорости реакций и обеспечивают разумную стабильность при хранении растворов электролитов. Увеличение концентрации гипохлорит-ионов, напротив, уменьшает их стабильность в водных растворах. На рис. 2 показан феномен «кривой пересечения». Растворы гипохлорита натрия с концентрацией 9% и 5% при хранении разлагаются настолько, что через 50 недель показывают одинаковую концентрацию вещества, а через 100 недель первоначально более концентрированный раствор содержит гипохлорит-ионов меньше, чем разбавленный.
Рис. 2. Разложение гипохлорита натрия различных концентраций при 30°С.
Повышение температуры способствует ускорению процессов разложения гипохлоритов, поэтому целесообразно хранить растворы гипохлоритов в прохладном месте для обеспечения срока годности (рис. 3).
Рис. 3. Влияние температуры на разложение 5%-ного раствора NaClO.
Для стабилизации водных растворов гипохлоритов, а так же продуктов на их основе, каждый производитель применяет собственные методы, которые редко публикуются в виде статей. Однако известны некоторые запатентованные методы, которые, не претендуя на полноту, можно представить следующим списком:
- удаление хлорид-ионов, сопутствующих гипохлорит-ионам, методом кристаллизации;
- приготовление хлорноватистой кислоты, свободной от хлорид-ионов, методами электродиализа, дистилляции и жидкостной экстракции с последующей нейтрализацией щелочью;
- добавление многоатомных спиртов (например галактита, маннита, сорбита, инозита и пентаэритрита);
- добавление амидов;
- осаждение и фильтрация после добавления соединений щелочноземельных металлов;
- добавление перйодатов или перйодат-образующих соединений, способных образовывать комплексы с ионами металлов – катализаторов разложения гипохлоритов;
- добавление силикатов совместно с добавками или без добавок;
- добавление бромидов;
- добавление арилсульфаниламидов или их производных;
- увеличение светостойкости гипохлоритов путем добавления солей имидодисульфатов; солей церия и ЭДТА; феррицианидов; изоциануровой кислоты и цитрата натрия;
- добавление избытка хлорида железа с последующей фильтрацией;
- добавление гептоната натрия или боргептоната натрия;
- добавление 2-оксазолидинонов;
- добавление фосфата натрия;
- добавление бихромата калия;
- добавление солей кальция;
- добавление полидентатных гетероароматических соединений.
Направление окислительно-восстановительных процессов с участием гипохлорит-ионов и хлорноватистой кислоты обусловлены значениями стандартных электродных потенциалов полуреакций в водной среде:
в кислой среде
2HClO + 2H+ + 2e– = Cl2↑ + 2H2O, E° = 1,630 В,
HClO + H+ + 2e– = Cl– + H2O, E° = 1,500 В.
в нейтральной и щелочной среде
ClO– + H2O + 2e– = Cl– + 2OH–, E° = 0,890 В,
2ClO– + 2H2O + 2e– = Cl2↑ + OH–, E° = 0,421 В.
Таким образом, гипохлорит-ионы и хлорноватистая кислота обладают выраженными окислительными свойствами, причем их окисляющая способность в кислой среде значительно выше, чем в нейтральной и щелочной средах.
Дезинфицирующее действие
Гипохлориты являются одними из лучших антибактериальных средств. Они убивают микроорганизмы очень быстро даже при очень низких концентрациях.
Наивысшее бактерицидное действие гипохлоритов проявляется в нейтральной среде, когда концентрации хлорноватистой кислоты и гипохлорит-ионов приблизительно равны (рис. 1). Образующиеся при разложении гипохлоритов активные частицы (атомарный кислород и хлор) обладают высоким биоцидным действием. Они уничтожают микроорганизмы, взаимодействуя с биополимерами в их структуре, способными к окислению. Аналогичным образом, например, действуют клетки человека нейтрофилы, гепатоциты и др., которые синтезируют хлорноватистую кислоту и сопутствующие высокоактивные радикалы для борьбы с микроорганизмами и чужеродными субстанциями.
Бактерицидная активность гипохлоритов настолько велика, что они способны привести к гибели дрожжеподобных грибов, вызывающих кандидоз, Candida albicans, в течение 30 секунд при действии 5,0 – 0,5%-го гипохлоритного раствора. Патогенный Enterococcus faecalis погибает через 30 секунд после обработки 5,25%-ым раствором и через 30 минут после обработки 0,5%-ым раствором. Грамотрицательные анаэробные бактерии, такие как Porphyromonas gingivalis, Porphyromonas endodontalis и Prevotella intermedia, погибают в течение 15 секунд после обработки 5,0 – 0,5%-м раствором гипохлорит-ионов.
Несмотря на высокую биоцидную активность гипохлоритов, некоторые потенциально опасные простейшие организмы, например, возбудители лямблиоза или криптоспоридиоза, к сожалению, устойчивы к его действию.
При помощи гипохлорит-ионов можно успешно обезвреживать различные токсины (табл. 3).
Таблица 3. Результаты инактивации токсинов при 30-минутной экспозиции различных концентраций гипохлорита натрия («+» – токсин инактивирован; «–» – токсин остался активен).
| Токсин | 2,5% NaClO + 0,25 н. NaOH | 2,5% NaClO | 1,0% NaClO | 0,1% NaClO |
|---|---|---|---|---|
| Т-2 токсин | + | – | – | – |
| Бреветоксин | + | + | – | – |
| Микроцистин | + | + | + | – |
| Тетродотоксин | + | + | + | – |
| Сакситоксин | + | + | + | + |
| Палитоксин | + | + | + | + |
| Рицин | + | + | + | + |
| Ботулотоксин | + | + | + | + |
Методы анализа
Качественными реакциями на гипохлорит-ион могут служить:
- окисление йодид-иона до йода в сильнокислой среде;
- выпадение коричневого осадка метагидроксида таллия(III) (TlO(OH)) при действии щелочного раствора соли таллия (I);
- цветная реакция с 4,4´-тетраметилдиаминодефенилметаном или N,N´-диокситрифенил метаном в присутствии бромата калия.
Наиболее распространенным методом количественного анализа гипохлорит-иона является титриметрический метод с использованием йодида калия. Для проведения испытания водный раствор или водную суспензию, содержащие гипохлорит-ион, смешивают с избытком раствора йодида калия в сернокислой среде. Выдерживают герметично закрытую смесь в течение 5 минут в темном месте. Выделившийся йод титруют стандартизированным раствором тиосульфата натрия. В качестве индикатора вблизи точки эквивалентности используют крахмальный раствор.
При количественном определении гипохлорит-иона косвенным йодометрическим методом результаты анализа пересчитывают на концентрацию «активного хлора» в ыделившегося при реакции
2H+ + ClO– + Cl– = Cl2↑ + H2O.
Альтернативным методом количественного определения гипохлорит-иона является потенциометрический анализ с использованием бром-ионселективного электрода. Концентрацию гипохлорит-иона находят методом добавок анализируемого раствора к стандартному раствору или методом уменьшения концентрации анализируемого раствора при его добавлении к стандартному раствору.
Способы получения наиболее важных товарных продуктов
Крупнотоннажными гипохлоритсодержащими продуктами являются гипохлорит натрия и гипохлорит кальция. Их глобальный объем производства превышает 1 млн тонн/год. При этом почти половина этого объема используется в быту, а другая половина в промышленности. Гипохлорит калия, являющийся исторически первым гипохлоритом, нашедшим промышленное применение, производится в ограниченном количестве.
Для промышленного производства гипохлорита натрия используются химический и электрохимический методы. При химическом методе производится хлорирование водных растворов гидроксида натрия. Суть химического превращения не изменилась со времен его открытия и применения Лабарраком
Cl2 + 2NaOH = NaClO + NaCl + H2O.
Существуют две производственные схемы данного метода:
- основной процесс, в результате которого производится 16%-ный раствор гипохлорита натрия в смеси с хлоридом натрия и гидроксидом натрия (рис. 4).
- низко-солевой или концентрированный процесс позволяет получить концентрированные растворы (25–40%) гипохлорита натрия с меньшим содержанием примесей. Его отличие от основного способа заключается в добавлении второй стадии хлорирования. Во второй реактор подается не гидроксид натрия, а раствор гипохлорита натрия из первого реактора, в результате происходит концентрирование готового продукта (рис. 5).
Рис. 4. Химический метод получения гипохлорита натрия основным процессом (рис. с сайта https://ru.wikipedia.org)
Рис. 5. Химический метод получения гипохлорита натрия концентрированным процессом (рис. с сайта https://ru.wikipedia.org)
При электрохимическом методе получения гипохлорита натрия водный раствор хлорида натрия подвергается электролизу в электролизере с открытыми электродными зонами (бездиафрагменный способ). Гидроксид натрия, образующийся на катоде, и хлор, выделяющийся на аноде, беспрепятственно смешиваются в ходе электрохимического процесса
NaCl + H2O = NaClO + H2↑(суммарная реакция).
Гипохлорит кальция производится в виде хлорной извести, представляющей собой смесь целевого продукта с хлоридом кальция и гидроксидом кальция. В качества сырья для получения хлорной извести используется порошкообразный гидроксид кальция (пушенка), содержащий менее 1% свободной влаги и разбавленный влажным воздухом хлор. Небольшая влажность исходных веществ обеспечивает начало реакции гидролиза хлора, сопровождающейся нейтрализацией образующихся кислот известью. Затем реакция продолжается за счет воды, выделяющейся из гидроксида кальция при хлорировании
2Сa(OH)2 + 2Cl2 = Сa(ClO)2 + СaCl2 + 2H2O (суммарно).
Хлорирование пушенки осуществляется в аппаратах непрерывного действия – механических полочных камерах Бакмана.
Таблица 4. Производители гипохлорита натрия в России.
| Название предприятия | Сайт предприятия |
|---|---|
| «Каустик» ЗАО, г. Стерлитамак | www.kaus.ru/ |
| «Каустик» ОАО, г. Волгоград | www.kaustik.ru/ |
| «Новомосковский хлор» ООО, г. Новомосковск | www.hlor.biz/ |
| «Сода-хлорат» ООО, г. Березняки | www.soda.perm.ru/ |
Характеристика товарных гипохлоритов, обращение, хранение и транспортировка
В Российской Федерации гипохлориты производятся в соответствии с ГОСТ 11086–76 «Гипохлорит натрия. Технические условия» и ГОСТ 1692–85 «Известь хлорная. Технические условия». Гипохлорит натрия по назначению и показателям выпускается двух марок «А» и «Б» (табл. 5).
Таблица 5. Физико-химические показатели и назначение гипохлорита натрия по ГОСТ 11086–76
| Наименование показателя |
Марка А |
Марка Б |
|---|---|---|
| Внешний вид |
Жидкость зеленовато-желтого цвета |
|
| Коэффициент светопропускания, % не менее |
20 |
20 |
| Массовая концентрация активного хлора, г/дм3, не менее |
190 |
170 |
| Массовая концентрация щелочи в пересчете на NaOH, г/дм3 |
10–20 |
40–60 |
| Массовая концентрация железа, г/дм3, не более |
0,02 |
0,06 |
| Область применения |
В химической промышленности для обеззараживания питьевой воды и воды плавательных бассейнов, для дезинфекции и отбелки |
В витаминной промышленности как окислитель и для отбеливания ткани |
Гипохлорит натрия должен храниться в специальных полиэтиленовых, стальных гуммированных или других, покрытых коррозионно-стойкими материалами ёмкостях, наполненных на 90% объёма и оборудованных воздушником для сброса образующегося при распаде кислорода. Емкости с гипохлоритом натрия хранят в защищённых от света закрытых складских неотапливаемых помещениях. Перевозка продукции осуществляется в соответствии с правилами транспортировки опасных грузов.
Хлорная известь в зависимости от способа получения выпускается двух марок «А» и «Б» и трех сортов для каждой марки (табл. 6).
Таблица 6. Физико-химические показатели и способ получения хлорной извести по ГОСТ 1692–85
|
Наименование показателя |
Марка А | Марка Б | ||||
| 1-й сорт | 2-й сорт | 3-й сорт | 1-й сорт | 2-й сорт | 3-й сорт | |
|
Внешний вид |
Порошок белого цвета или слабоокрашенный, с наличием комков |
|||||
|
Массовая концентрация активного хлора, %, не менее |
28 | 25 | 20 | 35 | 32 | 27 |
|
Коэффициент термостабильности, не менее |
0,90 | 0,90 | 0,80 | 0,75 | 0,70 | 0,60 |
|
Способ получения |
Хлорирование пушенки в кипящем слое | Хлорирование пушенки в аппаратах Бакмана |
Хлорную известь упаковывают в полиэтиленовые мешки и стальные барабаны, окрашенные со всех сторон химически стойкой краской. Хлорную известь хранят в закрытых складских неотапливаемых, затемненных и хорошо проветриваемых помещениях. Не допускается хранение с хлорной известью взрывчатых веществ, огнеопасных грузов и баллонов со сжатыми газами. Гарантийный срок хранения хлорной извести марки А 1-го и 2-го сортов – 3 года со дня изготовления, марки А 3-го сорта и марки Б – 1 год со дня изготовления. Перевозка продукции осуществляется в соответствии с правилами транспортировки опасных грузов.
Требования безопасности
Гипохлориты являются окислителями, вызывающими раздражение кожных покровов и слизистых оболочек. Гипохлориты при попадании на кожу могут вызвать ожоги, а при попадании в глаза – слепоту. При попадании гипохлоритов на кожные покровы необходимо обмывать их обильной струей воды в течение 10–15 мин. При попадании гипохлоритов в глаза следует немедленно промыть их обильным количеством воды и направить пострадавшего к врачу. Приём внутрь разбавленных растворов (3 – 6%) гипохлоритов приводит обычно только к раздражению пищевода и иногда ацидозу, в то время как концентрированные растворы способны вызвать довольно серьёзные повреждения, вплоть до перфорации желудочно-кишечного тракта. При работе с гипохлоритами следует иметь специальные средства защиты: защитные очки, резиновые сапоги, резиновые перчатки, фартук из прорезиненной ткани и противогаз, а также использовать специальную одежду.
Несмотря на свою высокую химическую активность, безопасность гипохлоритов для человека документально подтверждена исследованиями токсикологических центров Северной Америки и Европы. Результаты показывают, что гипохлориты не являются мутагенными, канцерогенными и тератогенными соединениями, а также кожными аллергенами. Международное агентство по изучению рака пришло к выводу, что питьевая вода, прошедшая обработку гипохлоритом натрия, не содержит человеческих канцеро- генов.
При нагревании выше 35°С растворы гипохлоритов разлагаются с образованием хлоратов и выделением кислорода. Слабощелочной раствор достаточно устойчив. Растворы гипохлоритов негорючи и невзрывоопасны. Однако в процессе высыхания гипохлориты могут вызвать загорание органических продуктов и горючих веществ. При взаимодействии гипохлоритов с кислотами выделяется токсичный хлор (раздражающий и удушающий эффект), поэтому не допускается смешение и совместное хранение данных веществ.
При работе с гипохлоритами производственные помещения должны быть оборудованы приточно-вытяжной вентиляцией. Оборудование должно быть герметичным. Негерметичные узлы должны быть снабжены местными вентиляционными отсосами.
Применение в средствах бытовой химии
Применение гипохлоритов в средствах бытовой химии обусловлено их окислительными и дезинфицирующими свойствами. Гипохлориты являются основными действующими веществами в химических отбеливателях, пятновыводителях, средствах для обеззараживания воды в бассейнах, в чистящих и моющих средствах с дезинфицирующим эффектом.
Отбеливатели
Мировое производство гипохлорита натрия оценивается в 5 миллионов тонн. Более половины всего производимого гипохлорита натрия используется в качестве отбеливателя и пятновыводителя для тканей. Гипохлорит натрия может быть использован для многих видов тканей, включая хлопок, полиэстер, нейлон, ацетат, лен, вискозу и другие. Он эффективен для удаления следов почвы и широкого спектра пятен, в том числе, от кофе, крови, травы, горчицы, ягодных и фруктовых соков и т.д.
Содержание гипохлорита натрия в отбеливателях и пятновыводителях для тканей обычно находится в диапазоне от 2,5 до 10%. В большинстве случаев эти средства выпускаются в жидкой форме в пластиковых бутылках или канистрах. Дополнительными компонентами отбеливателей являются поверхностно-активные вещества, модификаторы реологии, оптические отбеливатели, стабилизаторы разложения и др.
Преимуществами отбеливателей на основе гипохлоритов являются:
- быстрое и качественное отбеливание;
- использование отбеливателя без нагревания и даже в холодной воде;
- доступная цена;
- более удобная форма выпуска: не «пылят», в отличие от порошков и легко дозируются;
- многофункциональность, так как помимо отбеливания и удаления пятен подходят для дезинфекции различных поверхностей.
Недостатками отбеливателей на основе гипохлоритов являются:
- активное использование хлорсодержащих отбеливателей приводит к тому, что ткани быстрее изнашиваются и, как следствие, легко рвутся;
- невозможность отбеливания шёлковых, шерстяных и некоторых синтетических волокон из-за интенсивного разрушения;
- относительно короткий срок хранения;
- невозможность использования в автоматической стиральной машине, особенно в сочетании с современными порошками;
- сильный специфичный запах хлора.
Моющие и чистящие средства с дезинфицирующими свойствами
Гипохлориты используются во многих жидких и порошкообразных средствах:
- для автоматических посудомоечных машин;
- для ухода за ванными комнатами, душевыми и туалетами;
- для очистки кухонных плит;
- для мытья каменных и бетонных полов;
- для очистки коптилен и грилей;
- очистки канализационных сливов;
- для уборки поверхностей в кухнях и столовых и др.
Эффективность очистки средствами, содержащими гипохлорит-ионы, обусловлена их сильным окисляющим действием. При деструкции крупных молекул загрязнителей образуются низкомолекулярные продукты разложения, характеризующиеся высокой растворимостью, отсутствием окраски и запаха. Одновременно с очищающим действием, гипохлориты проявляют высокую дезинфицирующую способность. В целом эффективность гипохлоритов возрастает с увеличением концентрации и температуры раствора, а так же при понижении кислотности раствора.
Гипохлоритсодержащие средства с дезинфицирующими свойствами обладают следующими достоинствами:
- эффективны в отношении различных бактерий, грибов и вирусов;
- дезинфицирующая активность мало зависит от жесткости воды;
- при использовании не образуют побочных токсичных продуктов;
- выпускаются в жидкой, порошкообразной и гранулированной формах.
К недостаткам можно отнести:
- нестабильность и потерю активности с увеличением температуры и при взаимодействии с органическими веществами;
- снижение биологической активности с увеличением кислотности среды;
- коррозия нержавеющей стали и других металлов, что допускает лишь кратковременный контакт с поверхностями и оборудованием из металлов;
- потеря активности при хранении на свету;
- ограниченный перечень поверхностно-активных веществ, комплексообразователей, красителей, отдушек, способных быть устойчивыми в композиции моющего или чистящего средства, содержащего гипохлориты.
В заключение следует отметить, что рост производства и потребления гипохлоритов составляет более 2,5% ежегодно. Причем более половины всех произведенных гипохлоритов используется для бытовых целей, а менее половины для промышленных. Широкое использование гипохлоритов в средствах бытовой химии стало возможным благодаря их коммерческой доступности и высокой эффективности. Гипохлорит натрия является безусловным лидером среди других солей хлорноватистой кислоты, занимая 91% мирового рынка. Почти 9% остается за гипохлоритом кальция. Использование гипохлорита калия имеет историческое значение, однако, объемы его современного применения незна- чительные.
Источники
- Handbook of detergents. Part A: Properties/ Edited by Guy Broze. New York: Marsell Dekker, 1999. 809 p.
- Фурман Л. А. Хлорсодержащие окислительно-отбеливающие и дезинфицирующие вещества. М.: Химия, 1976. 88 с.
- Ушакова В.Н. Мойка и дезинфекция. Пищевая промышленность, торговля, общественное питание. – СПб.: Профессия, 2009. 288 с.
- ГОСТ 1692–85. Известь хлорная. Технические условия.
- ГОСТ 11086–76. Гипохлорит натрия. Технические условия.
- Лидин Р.А. и др. Константы неорганических веществ: справочник / Под ред. проф. Р.А. Лидина. М.: Дрофа, 2000. 480 с.
- Химическая энциклопедия/ Гл. ред. И.Л. Кнунянц. М.: Советская энциклопедия, 1992. Т. 3. 555 с.
- Вредные вещества в промышленности. Справочник для химиков, инженеров и врачей/ Под ред. проф. Н.В. Лазарева и проф. И.Д. Гадаскиной. Л.: Химия, 1977. Т. 3. 608 с.
- https://ru.wikipedia.org/wiki/Гипохлорит_натрия