Гроприносин® (Groprinosin) инструкция по применению
📜 Инструкция по применению Гроприносин®
💊 Состав препарата Гроприносин®
✅ Применение препарата Гроприносин®
📅 Условия хранения Гроприносин®
⏳ Срок годности Гроприносин®
Описание лекарственного препарата
Гроприносин®
(Groprinosin)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2023
года, дата обновления: 2023.03.22
Владелец регистрационного удостоверения:
Контакты для обращений:
ГЕДЕОН РИХТЕР ОАО
(Венгрия)
Код ATX:
J05AX05
(Инозин пранобекс)
Активное вещество:
инозин пранобекс
(inosine pranobex)
BAN
принятое к употреблению в Великобритании
Лекарственная форма
| Гроприносин® |
Таб. 500 мг: 20, 30 или 50 шт. рег. №: ЛП-(000277)-(РГ-RU) Предыдущий рег. №: П N005951/01 |
Форма выпуска, упаковка и состав
препарата Гроприносин®
Таблетки белого или почти белого цвета, продолговатые, двояковыпуклые, с риской на одной стороне.
Вспомогательные вещества: крахмал картофельный, повидон К25, магния стеарат.
10 шт. — блистеры (2) — пачки картонные.
10 шт. — блистеры (3) — пачки картонные.
10 шт. — блистеры (5) — пачки картонные.
Фармакологическое действие
Инозин пранобекс — синтетическое производное пурина, представляет собой комплекс, содержащий инозин и N,N-диметиламино-2-пропанол в молярном соотношении 1:3. Обладает иммуностимулирующей активностью и неспецифическим противовирусным действием. Эффективность комплекса определяется присутствием инозина, второй компонент повышает его доступность для лимфоцитов.
Восстанавливает функции лимфоцитов в условиях иммунодепрессии, повышает бластогенез в популяции моноцитов, стимулирует экспрессию мембранных рецепторов на поверхности Т-хелперов, предупреждает снижение активности лимфоцитов под влиянием глюкокортикоидов, нормализует включение в них тимидина. Инозин пранобекс стимулирует активность Т-лимфоцитов и естественных киллеров, функции Т-супрессоров и Т-хелперов, повышает продукцию иммуноглобулина G (IgG), интерферона гамма, интерлейкинов ИЛ-1 и ИЛ-2, снижает образование противовоспалительных цитокинов — ИЛ-4 и ИЛ-10, потенцирует хемотаксис нейтрофилов, моноцитов и макрофагов.
Препарат проявляет противовирусную активность in vivo в отношении вируса простого герпеса, цитомегаловируса, вируса кори, вируса Т-клеточной лимфомы человека (тип III), полиовирусов, вирусов гриппа А и В, ЕСНО-вируса (энтероцитопатогенного вируса человека), вирусов энцефаломиокардита и конского энцефалита. Механизм противовирусного действия инозина пранобекса связан с ингибированием вирусной РНК и дигидроптероатсинтетазы, участвующей в репликации некоторых вирусов, усиливает подавленный вирусами синтез мРНК лимфоцитов, что сопровождается уменьшением синтеза вирусной РНК и трансляции вирусных белков, повышает продукцию лимфоцитами обладающих противовирусными свойствами альфа и гамма интерферонов. При комбинированном назначении усиливает действие интерферона альфа, ацикловира и зидовудина.
Фармакокинетика
Всасывание и распределение
После приема внутрь препарат хорошо всасывается из ЖКТ. Cmax ингредиентов в плазме крови определяется через 1-2 ч.
Не обнаружено кумуляции препарата в организме.
Метаболизм и выведение
Быстро подвергается метаболизму и выделяется через почки. Метаболизируется аналогично эндогенным пуриновым нуклеотидам с образованием мочевой кислоты. N,N-диметиламино-2-пропанол метаболизируется до N-оксида, а 4-ацетамидобензоат — до o-ацилглюкуронид.
Т1/2 составляет 3.5 ч для N,N-диметиламино-2-пропанола и 50 мин — для 4-ацетамидобензоата. Инозин пранобекс и его метаболиты из организма выводятся почками в течение 24-48 ч.
Показания препарата
Гроприносин®
- грипп и острые респираторные вирусные инфекции;
- инфекции, вызванные вирусом простого герпеса 1, 2, 3 и 4 типов: генитальный и лабиальный герпес, герпетический кератит, опоясывающий лишай, ветряная оспа, инфекционный мононуклеоз, вызванный вирусом Эпштейна-Барр;
- цитомегаловирусная инфекция;
- корь тяжелого течения;
- папилломавирусная инфекция: папилломы гортани и голосовых связок (фиброзного типа), генитальные папилломавирусные инфекции у мужчин и женщин, бородавки;
- подострый склерозирующий панэнцефалит;
- контагиозный моллюск.
Режим дозирования
Препарат принимают внутрь, через равные промежутки времени (8 или 6 ч) 3-4 раза/сут.
Таблетки принимают после еды, запивая небольшим количеством воды.
Взрослым назначают от 6 до 8 таб./сут в 3-4 приема.
Детям в возрасте от 3 лет и старше (масса тела выше 15-20 кг) назначают в дозе 50 мг/кг массы тела/сут (по 1/2 таб. на 5 кг массы тела), разделенной на 3-4 приема.
Как у взрослых, так и у детей, при тяжелых инфекционных заболеваниях доза может быть увеличена индивидуально до 100 мг/кг массы тела/сут, разделенных на 4-6 приемов. Максимальная суточная доза у взрослых составляет 3-4 г, максимальная суточная доза у детей в возрасте от 3 лет и старше — 50 мг/кг.
При острых заболеваниях лечение обычно продолжается от 5 до 14 дней. После исчезновения симптомов лечение следует продолжить в течение 1-2 дней или более, в зависимости от показаний. При необходимости длительность лечения может быть увеличена индивидуально под контролем врача.
При хронических рецидивирующих заболеваниях лечение у взрослых и детей проводится курсами продолжительностью 5-10 дней с интервалами 8 дней.
Длительность поддерживающего лечения может составить до 30 дней, при этом доза может быть снижена до 500-1000 мг/сут.
Герпетические инфекции: лечение продолжается в течение 5-10 дней до исчезновения симптомов. Для уменьшения числа рецидивов в бессимптомный период препарат назначают по 500 мг 2 раза/суть на протяжении 30 дней.
Папилломавирусные инфекции: в качестве монотерапии препарат назначается на протяжении 14-28 дней взрослым в дозе 1000 мг 3 раза/сут, детям — 250 мг (1/2 таб.) на 5 кг массы тела 3-4 раза/сут.
Рецидивирующие остроконечные кондиломы: в качестве монотерапии или в комбинации с хирургическим лечением препарат назначается взрослым в дозе 1000 мг 3 раза/сут, детям — в дозе 250 мг на 5 кг массы тела в 3-4 приема. Проводят 3 курса по 14-28 дней с интервалом 1 месяц.
Дисплазия шейки матки, ассоциированная с папилломавирусом человека: 2-3 курса по 1000 мг 3 раза/сут в течение 10 дней с интервалом 10-14 дней.
Необходимости в коррекции дозы у пациентов пожилого возраста (старше 65 лет) нет, препарат применяется так же, как у пациентов среднего возраста. Следует учитывать, что у пожилых пациентов чаще происходит повышение концентрации мочевой кислоты в сыворотке крови и в моче, чем у пациентов среднего возраста.
У пациентов с почечной и печеночной недостаточностью на фоне лечения препаратом Гроприносин® следует каждые 2 недели проводить контроль содержания мочевой кислоты в сыворотке крови и в моче. Контроль активности печеночных ферментов рекомендуется проводить каждые 4 недели при длительных курсах лечения препаратом.
Побочное действие
Частота развития нежелательных реакций после применения препарата классифицирована согласно рекомендациям ВОЗ: очень часто (≥1/10); часто (от ≥1/100 до <1/10); нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (<1/10000), частота неизвестна (невозможно определить на основании имеющихся данных).
Со стороны иммунной системы: нечасто — ангионевротический отек, крапивница; частота неизвестна — реакции гиперчувствительности, анафилактические реакции, анафилактический шок.
Со стороны нервной системы: часто — головная боль, головокружение, утомляемость, плохое самочувствие, слабость; нечасто — нервозность, сонливость, бессонница.
Со стороны ЖКТ: часто — снижение аппетита, тошнота, рвота, боль в эпигастрии; нечасто — диарея, запор.
Со стороны печени и желчевыводящих путей: часто — временное повышение активности трансминаз и ЩФ в плазме крови.
Со стороны кожи и подкожно-жировой клетчатки: часто — зуд, сыпь; нечасто — макуло-папулезная сыпь; частота неизвестна — эритема.
Со стороны мочевыделительной системы: нечасто — полиурия.
Со стороны костно-мышечной системы: часто — боль в суставах, обострение подагры.
Лабораторные и инструментальные данные: очень часто — повышение концентрации мочевины в плазме крови, повышение концентрации мочевины в моче; часто — повышение концентрации азота мочевины крови.
Противопоказания к применению
- подагра;
- мочекаменная болезнь;
- хроническая почечная недостаточность;
- аритмия;
- детский возраст до 3 лет (масса тела до 15-20 кг);
- беременность;
- период лактации (грудного вскармливания);
- повышенная чувствительность к инозину пранобексу и другим компонентам препарата.
С осторожностью следует назначать препарат одновременно с ингибиторами ксантиноксидазы, диуретиками, зидовудином; при острой печеночной недостаточности.
Применение при беременности и кормлении грудью
Препарат противопоказан при беременности и в период грудного вскармливания, т.к. его безопасность применения у данной категории пациентов не установлена.
Применение при нарушениях функции печени
С осторожностью следует назначать препарат при острой печеночной недостаточности.
Применение при нарушениях функции почек
Препарат противопоказан при мочекаменной болезни, хронической почечной недостаточности.
Применение у детей
Противопоказано применение препарата в детском возрасте до 3 лет (масса тела до 15-20 кг).
Применение у пожилых пациентов
Необходимости в коррекции дозы у пациентов пожилого возраста (старше 65 лет) нет.
Особые указания
Инозин пранобекс, как и другие противовирусные средства, наиболее эффективен при острых вирусных инфекциях, если лечение начато на ранней стадии болезни (лучше с первых суток).
После 2 недель применения препарата следует провести контроль концентрации мочевой кислоты в сыворотке крови и моче.
При длительном приеме (после 4 недель применения) целесообразно каждый месяц проводить контроль функции печени и почек (активность трансаминаз, уровень креатинина, мочевой кислоты в сыворотке крови).
Пациенты со значительно повышенной концентрацией мочевой кислоты в организме могут одновременно принимать препараты, понижающие ее концентрацию. На фоне лечения необходимо контролировать концентрацию мочевой кислоты в сыворотке крови при назначении препарата одновременно с лекарственными средствами, увеличивающими концентрацию мочевой кислоты или препаратами, нарушающими функцию почек.
Инозин пранобекс следует с осторожностью применять у пациентов с острой печеночной недостаточностью, поскольку препарат подвергается метаболизму в печени.
Влияние на способность к управлению транспортными средствами и механизмами
Влияние инозина пранобекса на психомоторные функции организма и способность управлять транспортными средствами и движущимися механизмами не исследовалось. При применении препарата следует учитывать возможность возникновения головокружения и сонливости.
Передозировка
При передозировке показано промывание желудка и симптоматическая терапия.
Лекарственное взаимодействие
Иммунодепрессанты ослабляют иммуностимулирующий эффект инозина пранобекса.
Инозин пранобекс следует применять с осторожностью пациентам, принимающим одновременно ингибиторы ксантиноксидазы (аллопуринол) или препараты, способные блокировать канальцевую секрецию мочевой кислоты, например, «петлевые» диуретики (фуросемид, торасемид, этакриновая кислота), т.к. это может приводить к повышению концентрации мочевой кислоты в сыворотке крови.
Совместное применение инозина пранобекса с зидовудином приводит к увеличению концентрации зидовудина в плазме крови и удлиняет его Т1/2. Таким образом, при совместном применении инозина пранобекса с зидовудином может потребоваться коррекция дозы зидовудина.
Условия хранения препарата Гроприносин®
Препарат следует хранить в недоступном для детей месте при температуре не выше 25°C.
Срок годности препарата Гроприносин®
Срок годности — 3 года. Не применять после истечения срока годности.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
ГЕДЕОН РИХТЕР ОАО
(Венгрия)

|
|
Организация, принимающая претензии от потребителей |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Кафедра акушерства и гинекологии Тульского государственного университета
Захарова Т.В.
Кафедра акушерства и гинекологии Тульского государственного университета
Опыт применения гроприносина для лечения пациенток с заболеваниями шейки матки при инфекции вирусом папилломы человека
Авторы:
Волков В.Г., Захарова Т.В.
Как цитировать:
Волков В.Г., Захарова Т.В. Опыт применения гроприносина для лечения пациенток с заболеваниями шейки матки при инфекции вирусом папилломы человека. Российский вестник акушера-гинеколога.
2012;12(2):90‑92.
Volkov VG, Zakharova TV. Experience in using groprinosin to treat patients with diseases of the cervix uteri in human papillomavirus infection. Russian Bulletin of Obstetrician-Gynecologist. 2012;12(2):90‑92. (In Russ.)

Заболеваемость раком шейки матки (РШМ) в России продолжает оставаться на одном из первых мест и увеличилась за последние десять лет с 15,1 до 17, 3 на 100 000 населения [6]. Возрастной пик заболеваемости падает на возраст 45-55 лет, хотя отмечается быстрое нарастание частоты РШМ среди женщин моложе 30 лет. Исследования отечественных и зарубежных авторов [1, 4, 9 ] свидетельствуют о значимости вируса папилломы человека в развитии рака и диспластических процессов в шейке матки.
Главной особенностью инфекции вирусом папилломы человека (ВПЧ-инфекции) считают ее широкое распространение среди подростков и молодых женщин преимущественно до 25 лет [2]. Низкая сексуальная культура населения, частая смена половых партнеров, неиспользование презервативов, вредные привычки (курение, токсикомания, алкоголизм) увеличивают риск развития ВПЧ-инфекции, что способствует росту числа воспалительных заболеваний генитального тракта, нарушению репродуктивной функции, невынашиванию беременности и внутриутробному инфицированию плода, а также формированию цервикальной интраэпителиальной неоплазии шейки матки. Вместе с тем отмечено, что у подростков и молодых женщин происходит более быстрое самопроизвольное очищение (элиминация) от ВПЧ и регрессия имеющейся ВПЧ-ассоциированной патологии по сравнению с женщинами более позднего возраста. По наблюдениям С.И. Роговской и В.Н. Прилепской [5], в возрасте 18-25 лет этот период увеличивается до 1,5-2 лет у каждой второй пациентки. Большинство исследователей отмечают значительное разнообразие типов папилломавирусов. Чаще всего обнаруживается вирус 16-го типа, следующим по частоте является вирус 18-го типа. На долю этих вирусов приходится около 50% от общего числа ВПЧ-инфекций. Вирус папилломы человека может оказывать продуктивное (с образованием кондилом и папиллом) и непродуктивное действие на эпителий. Результатом непродуктивного действия являются такие внутриэпителиальные поражения, как цервикальная интраэпителиальная неоплазия, рак [2, 8].
Наиболее уязвимым участком для воздействия вируса является зона трансформации — участок замещения цилиндрического эпителия плоским. Возможно, тропность ВПЧ к клеткам, претерпевающим метаплазию, связана с их повышенной чувствительностью к вирусной инфекции [7, 8], поэтому наличие осложненной эктопии и других заболеваний на фоне вирусной инфекции является отягощающим обстоятельством для развития рака шейки матки.
Многообразие типов вирусов, возможность вызывать как продуктивное, так и непродуктивное действие на эпителий, формирование различных патологических процессов на шейке матки и наружных половых органах, сочетание вирусов с другими инфекционными агентами требуют дифференцированного подхода к консервативному лечению и избирательной оценки необходимости инвазивных методик.
Эффективность терапии во многом зависит от выбора метода лечения, использования иммунокорригирующей терапии и целесообразности комбинированного лечения с применением деструктивного воздействия на шейку матки. Большинство исследователей подчеркивают неудачу методов локальной деструкции, отмечают частые рецидивы ВПЧ-инфекции на фоне иммунодефицита, обосновывают целесообразность иммунотерапии [1, 5].
В.Н. Прилепская и С.И. Роговская [2, 3, 5] предлагают комбинированное деструктивное лечение папилломавирусных поражений шейки матки проводить на фоне приема иммунопрепаратов, снижающих активность вируса и повышающих иммунитет. Разумная иммунокоррекция повышает эффективность терапии и снижает вероятность рецидива.
Наиболее широкое применение получили интерфероны и их индукторы, иммуномодуляторы. Эти препараты стимулируют неспецифический иммунитет, усиливают продукцию интерлейкинов, повышая синтез антител, стимулируют хемотаксическую и фагоцитарную активность моноцитов, макрофагов и полиморфно-ядерных клеток.
В настоящее время имеется большой выбор препаратов — активаторов иммунитета. Противовирусный препарат гроприносин (производства «Гедеон Рихтер», Венгрия), содержит активное вещество — инозин пранобекс, который подавляет репликацию ДНК и РНК вирусов посредством связывания с рибосомой клетки и изменения ее стереохимического строения. Кроме противовирусного действия, препарат обладает и иммуномодулирующим свойством за счет комплекса инозина, что повышает его доступность для лимфоцитов; стимулирует биохимические процессы в макрофагах, увеличивает продукцию интерлейкинов, повышает синтез антител, усиливает пролиферацию Т-лимфоцитов, в том числе Т-хелперов, естественных клеток-киллеров.
Цель настоящего исследования — изучение эффективности монотерапии и комбинированного лечения (этиотропный препарат гроприносин и радиоволновая деструкция) у пациенток с патологией шейки матки на фоне ВПЧ-инфекции.
Материал и методы
Всего были обследованы 56 пациенток в возрасте от 18 до 29 лет (средний возраст 23,4±0,2 года) с гистологически подтвержденными субклиническими формами ПВИ и CIN I (что трактуется в современной литературе как плоскоклеточное интраэпителиальное поражение слабой степени выраженности — LSIL).
Всем женщинам проведено комплексное обследование, включающее изучение анамнеза, общий и гинекологический осмотр, расширенную кольпоскопию, бактериоскопию вагинальных мазков, окрашенных по Граму, типирование с помощью полимеразной цепной реакции (ПЦР), цитологическое исследование соскобов с шейки матки.
У 39 (69,6%) пациенток менархе отмечено до 14 лет, у 16 (28,6%) после 14 лет, причем у каждой третьей наблюдалось позднее менархе. У большинства женщин — 41 (73,2%) менструальный цикл имел регулярный характер, у каждой пятой месячные были нерегулярными (опсо- или гиперполименорея). Проведена оценка среднего возраста начала половой жизни, количества и частоты смены половых партнеров. Анализ показал, что средний возраст начала половой жизни составил 15,9±0,1 года. Только каждая третья пациентка имела постоянного полового партнера, у каждой четвертой отмечена полигамность половых связей (более 5 партнеров).
При изучении соматического анамнеза установлено, что хронический тонзиллит и другие очаги инфекции носоглотки имели место у 17 (30,3%) пациенток, заболевания желудочно-кишечного тракта — у 15 (26,8%), вегето-сосудистая дистония — у 19 (33,9%). Индекс соматических заболеваний составил 1,2 на 1 пациентку. Изучение анамнеза перенесенных детских инфекций показало, что каждая вторая женщина переболела ветряной оспой, каждая третья — коревой краснухой; респираторно-вирусные инфекции были у 29 (51,8%) пациенток. Высокий инфекционный индекс, составляющий более 1,5 на 1 пациентку, свидетельствует о возможных изменениях иммунного статуса.
Особый интерес представляло изучение гинекологического анамнеза, при котором установлено, что воспалительные процессы наружных и внутренних половых органов составили более 85%. Несмотря на молодой возраст обследуемых, у 3 (5,3%) имел место острый эндометрит, у 16 (28,6%) — воспалительный процесс придатков матки и у 43 (76,8%) отмечался вульвовагинит. При всех эпизодах воспалительных заболеваний ранее проводилось лечение.
При гинекологическом осмотре в 100% выявлена патология шейки матки (осложненная эктопия, цервицит, лейкоплакия и т.д.). Определение инфекций, передаваемых половым путем, методом ПЦР и бактериоскопии, позволило установить не только различное типирование ВПЧ-инфекции, но и многофакторные причины воспалительных изменений на шейке матки. Бактериальный вагиноз был выявлен у 32 (57,1%), Mycoplasma hominis у 16 (28,6%), а Ureaplasma urealyticum — у 22 (39,3%), вирус герпеса — у 9 (16,1%), условно-патогенная флора в высоких концентрациях определялась у 24 (42,9%) женщин. Грибы рода Candida определены у каждой третьей — у 17 (30,4%), хламидии — у 8 (14,3%), трихомонады выявлены у 2 (3,6%).
Следует подчеркнуть, что у 100% женщин результаты обследования продемонстрировали наличие микстинфекций, т.е. сочетания ВПЧ с другими инфекционными агентами. Cочетание ВПЧ с одной инфекцией имело место лишь у 5 (8,9%), с двумя инфекционными факторами отмечены у 31 (55,4%) пациентки, с тремя и более инфекционными агентами — у 20 (35,7%) обследуемых. На одну пациентку приходилось 3,6 вида возбудителя.
Чаще всего определялся вирус папилломы человека 16, 18-го типа, который выявлен в 93,9%; ВПЧ 31, 33-го типов и ВПЧ 6, 11-го типов установлены в 14,3 и 17,9% соответственно.
Всем пациенткам до начала лечения и после него проводилась простая и расширенная кольпоскопия. На начальном этапе обследования выявлены разнообразные кольпоскопические картины: низкоатипическая зона трансформации в виде лейкоплакии, ацетобелого эпителия, йоднегативные зоны, мозаика, пунктация в различных сочетаниях друг с другом и признаками очагового и диффузного хронического цервицита.
При цитологическом исследовании соскобов с шейки матки I тип цитограммы установлен у 26,8% обследованных, II тип — у 73,2%. Высокий процент инфицированности, наличие цитограммы воспаления значительно повышают риск развития цервикальной интраэпителиальной неоплазии.
Все пациентки были разделены на основную группу (n=36), где применялось комбинированное лечение с использованием гроприносина и радиоволновой деструкции и контрольную группу (n=20), где проводилась только локальная монодеструкция очагов LSIL после курса этиотропного лечения.
После верификации инфекции проводилась специфическая терапия основного инфекционного заболевания. Этиотропная терапия базировалась на европейских рекомендациях по лечению ИППП и не различалась у двух групп пациенток. Использовались антибактериальные препараты, при кандидозе — противогрибковые, при бактериальном вагинозе — коррекция микробиоценоза по общим терапевтическим схемам.
Радиоволновая деструкция проводилась, как правило, сразу после менструации — на 5-8-й день менструального цикла. После проведения противовоспалительного лечения в основной группе гроприносин назначали по 2 таблетки (1000 мг) 3 раза в сутки на протяжении 5 дней за 7-10 дней до деструкции очагов, а затем еще два курса по 2 таблетки (1000 мг) 3 раза в день на протяжении 5 дней с перерывом между курсами 1 мес.
Эффективность лечения оценивалась через 3 мес и полгода.
Результаты и обсуждение
Полученные нами данные свидетельствуют о том, что эффективность комбинированного лечения с применением гроприносина была выше и составила 86,1%, в то время как при монодеструкции — 65%. Важно, что рецидивирование папилломавирусной инфекции к 6-му месяцу наблюдения выявлено у 5,6 и у 25% женщин основной и контрольной групп соответственно. Симптоматика воспалительного процесса на шейке матки наблюдалась только при рецидиве ВПЧ-инфекции. Кроме того, при комплексной схеме лечения выявили более высокую частоту очищения от ВПЧ через 6 мес (66,7 и 45% в основной и контрольной группах соответственно) и более качественную эпителизацию. Неудачи лечения почти у 35% больных в основной группе можно объяснить тем, что локальная деструкция очагов субклинического проявления ПВИ на фоне хронического цервицита позволяет воздействовать только на участок эпителия, где произошла клиническая манифестация инфекции, при этом в окружающих тканях остаются резервуары ВПЧ или других возбудителей в латентном состоянии, которые могут являться основой для дальнейшего рецидива цервицита и персистенции инфекции. Адекватная иммунотерапия способствует более полной элиминации возбудителей и полноценной эпителизации шейки матки, что и снижает частоту рецидивов и повышает эффективность терапии ВПЧ-ассоциированных заболеваний шейки матки.
Кроме клинической эффективности, проведена оценка переносимости гроприносина. Установлено, что у 3 (5,4%) пациенток отмечалось легкое недомогание и тошнота, которые купировались на 2-й день приема препарата и не потребовали его отмены. Других побочных проявлений и аллергических реакций не отмечено.
Выводы
1. Большинство пациенток с папилломавирусной инфекцией имели отягощенный соматический и гинекологический анамнез.
2. Папилломавирусная инфекция чаще сочетается с другими оппортунистическими заболеваниями (бактериальным вагинозом, наличием Mycoplasma hominis и Ureaplasma urealyticum и кандидозом) и ИППП, которые в совокупности составляют более 90% от всех других возбудителей.
3. Гроприносин является высокоэффективным препаратом для лечения ВПЧ-инфекции при заболеваниях шейки матки.
4. При использовании гроприносина в сочетании с радиоволновой терапией эффективность достигает 86,1% при контроле через полгода, несмотря на выраженные первоначальные морфологические изменения шейки матки.
5. Учитывая высокую эффективность препарата, хорошую переносимость и отсутствие побочных явлений, гроприносин может быть использован при лечении ВПЧ-ассоциированных заболеваний шейки матки у женщин.
Состав
В составе 1 таблетки Гроприносина (Groprinosin) содержится:
- инозин пранобекс — 500 мг (активное вещество);
- вспомогательные вещества: повидон К25, стеарат магния, крахмал картофельный.
Форма выпуска
Таблетки Гроприносин белые (иногда почти белые), имеют продолговатую форму и риску на одной стороне. Данный препарат выпускается по 10 таблеток в блистере, к картонной упаковке может быть 2 или 5 блистеров.
Фармакологическое действие
Лекарство используется как иммуностимулирующее и противовирусное средство.
Фармакодинамика и фармакокинетика
Гроприносин является иммуностимулирующим препаратом, обладающим так же противовирусным действием. Данный препарат эффективен благодаря содержащемуся в нем инозину, а второй его компонент (соль пара-ацетамидобензойной кислоты) способен увеличивать уровень доступности инозина для лимфоцитов. Он блокирует размножение частиц вируса.
Гроприносин так же может назначаться в качестве дополнительного лечебного средства при поражении вирусом Herpes simplex кожного покрова и слизистых оболочек. В таком случае наблюдается более быстрое заживление, уменьшается тяжесть и длительность заболевания при наружном применении препарата.
Таблетки быстро и на более чем 90% всасываются, имею высокую биологическую доступность. Через 1 час достигается максимальная концентрация активного вещества в плазме, период полураспада составляет около 50 минут. Действие препарата начинается примерно через 30 минут после его принятия и длится 6 часов.
Показания к применению
Гроприносин следует принимать в следующих случаях:
- при возникновении следующих инфекционных заболеваний: грипп, корь, аденовирусные и риновирусные инфекции, парагрипп, острые респираторные заболевания, бронхит вирусной этиологии, паротит эпидемический;
- при заболеваниях, спровоцированных вирусом Herpes simplex типа I или типа II (герпес кожного покрова лица, губ, рук, слизистой оболочки рта, офтальмогерпес), вирусом Varicella zoster;
- при хронических рецидивах возникновения инфекций мочеполовой системы и дыхательных путей у пациентов, имеющих ослабленный иммунитет (хламидиоз и др.).
Противопоказания
Гроприносин имеет следующие противопоказания:
- повышенная чувствительность к одному из компонентов препарата;
- артимии;
- мочекаменная болезнь;
- подагра;
- хроническая почечная недостаточность;
- беременность и кормление грудью;
- детям до 3 лет.
С особой осторожностью лекарство можно применять одновременно с ингибиторами ксантиноксидазы, зидовудином, диуретиками, а так же при острой печеночной недостаточности.
Побочные действия
Применение данного препарата может вызывать некоторые побочные эффекты:
- утомляемость, головокружение, головная боль, иногда – бессонница, нервозность, сонливость;
- сыпь, зуд;
- обострение подагры, боль в суставах;
- тошнота, снижение аппетита, рвота, иногда – запор, диарея;
- аллергические реакции;
- полиурия;
- повышение уровня концентрации кислоты мочевой в моче и крови.
Инструкция по применению Гроприносина (Способ и дозировка)
Лекарство принимается внутрь, после еды, запивать его необходимо небольшим количеством воды 3-4 раза в день через равное количество времени (6-8 ч.).
Инструкция для взрослых: 6-8 таблеток, употреблять 3-4 раза в день.
Инструкция по Гроприносину для детей от 3 до 12 лет: 3-4 употребления по 50 мг/кг в день.
При тяжелых инфекциях можно увеличить дозу. Для взрослых максимальная доза в сутки составляет 3-4 г. в 4-6 приемов, для детей – 50 мг/кг в день.
При острых заболеваниях курс длится от 5 до 14 дней, курс необходимо продолжить еще на 2-3 дня для профилактики и после исчезновения симптомов.
При рецидивирующих хронических болезнях сеанс лечения может составлять 5-10 суток с возможными интервалами в 8 суток. Общая длительность лечения составляет 30 дней, при этом можно снизить дозу до 500 мг в сутки.
При лечении инфекций, которые вызваны вирусом герпеса, для детей и взрослых проводится курс длительностью 5-10 лечебных дней до исчезновения симптомов. Для снижения возможности рецидива, рекомендуется проводить дополнительные курсы по 1 таблетке дважды на протяжении суток в течение 30 дней.
Гроприносин 500 детям до 3 лет категорически противопоказан. Для пожилых людей суточная доза такая же, как и людей среднего возраста. При лечении Гроприносином людей, страдающим почечной и печеночной недостаточностью, следует раз в 14 дней проводить процедуру проверки контроля уровня вхождения мочевой кислоты в сыворотку крови и мочу. При более продолжительном лечении препаратом каждые 4 недели рекомендуют контролировать активность печеночных ферментов.
Передозировка
При исследованиях случаев передозировки не наблюдалось. Передозировка может привести к повышенному уровню концентрации мочевой кислоты в кровяной сыворотке и мочи. В таком случае рекомендована симптоматическая терапия и промывание желудка.
Взаимодействие
Иммуностимулирующий эффект лекарство может быть снижен при одновременном употреблении с антидепрессантами. При совместном употреблении с зидовудином может потребоваться коррекция величины его дозы. С повышенной осторожностью следует применять Гроприносин одновременно с ингибиторами ксантиноксдазы или петлевыми диуретиками.
Условия продажи
В аптеках препарат продается по рецепту.
Условия хранения
Таблетки рекомендуют хранить при температуре не более чем 30 °С в месте, недоступном для детей.
Срок годности
Длительность хранения составляет 3 года.
Аналоги Гроприносина
Совпадения по коду АТХ 4-го уровня:
Аналогом данного лекарства является Изопринозин. Цена на аналог колеблется от 70 до 400 грн. в зависимости от числа таблеток в упаковке. Аналогов дешевле у Гроприносина нет.
Что лучше Изопринозин или Гроприносин?
В составе Гроприносина то же активное вещество, что и в Изопринозина, но в нем содержатся другие вспомогательные вещества, которые смягчают воздействие Гроприносина на организм, поэтому его можно употреблять и пожилым людям.
Гроприносин и алкоголь
Одновременное употребление Гроприносина с алкоголем может отрицательно сказаться на состоянии печени пациента. При необходимости, следует сделать перерыв меджу приемом лекарства и алкоголя не менее 2 часов, чтобы смягчить последствия для организма.
Отзывы о Гроприносине
Среди покупателей большая часть отмечает, что препарат эффективный, однако у многих замечены такие побочные эффекты, как тошнота и потеря аппетита. Нередко можно встретить отзывы о том, как принимать детям до 3 лет, хотя по инструкции это запрещено.
Это довольно щадящее лекарство, поэтому при назначении Гроприносина детям, отзывы в основном положительные. При четком соблюдении установленной дозы лекарства для детей, отзывы сводятся к тому, что есть положительный эффект и проявляется минимум побочных действий.
По поводу эффективности Гроприносина при ВПЧ, отзывы положительные, после курса приема препарата у многих пациентов снизился уровень ВПЧ в мазке.
Цена на Гроприносин, где купить
Средняя цена на таблетки Гроприносин по 50 шт. в упаковке в Москве составляет 1000 рублей.
Цена в Украине на таблетки по 20 штук в упаковке в среднем составляет 98 грн, по 50 штук – 260 грн.
В Беларуси, и в частности в Минске, цена в зависимости от общего числа таблеток в упаковке варьируется от 70 000 до 176 000 рублей.
- Интернет-аптеки РоссииРоссия
ЛюксФарма* специальное предложение
-
Гроприносин (Изопринозин) таблетки 500мг №50
ЗдравСити
-
Гроприносин таблетки 500мг 20штГедеон Рихтер Польша ООО
-
Гроприносин — рихтер сироп 50мг/мл 150млГедеон Рихтер
-
Гроприносин таблетки 500мг 30штГедеон Рихтер Польша ООО
-
Гроприносин таблетки 500мг 50штГедеон Рихтер Польша ООО
Аптека Диалог
-
Гроприносин таблетки 500мг №20Gedeon-Richter
-
Гроприносин таблетки 500мг №30Gedeon-Richter
-
Гроприносин-Рихтер (сироп 50мг/мл 150мл)Гедеон Рихтер Румыния А.О.
-
Гроприносин таблетки 500мг №50Gedeon-Richter
показать еще
Рак шейки матки (РШМ) остается одной из наиболее распространенных злокачественных опухолей у женщин, занимая 7–е место (9,8%) в структуре женской онкологической заболеваемости и 3–е место среди новообразований органов репродуктивной системы после рака молочной железы и эндометрия [18,21,31]. Проведенный эпидемиологический анализ позволил выделить ряд факторов риска для рака шейки матки. К ним относятся: раннее начало половой жизни, высокая сексуальная активность, частая смена половых партнеров, несоблюдение половой гигиены, инфекции, передающиеся половым путем, в том числе вирусные, курение табака, иммунодефицитные состояния, дефицит витаминов А и С в пище, использование оральных контрацептивов. Следует отметить, что большинство из перечисленных выше факторов имеют опосредованное влияние на развитие опухолевого процесса, являются социально–зависимыми и могут быть реализованы в основном в условиях низкого уровня социальной культуры, недостаточной медико–просветительской работы, отсутствия должной информации о мерах профилактики венерических инфекций [3,16,17,30].
В настоящее время наиболее значимым фактором риска признана папилломавирусная инфекция, возбудителем которой является ДНК–содержащий вирус, относящийся к роду Alphapapillomavirus семейства Papillomaviridae и поражающий базальные клетки эпидермиса и базальные мембраны слизистых оболочек. Современные исследования доказали, что в 72–90% случаев основной причиной развития рака шейки матки является именно ВПЧ [1,4,20,29].
Эпидемиологические и молекулярно–биологические данные указывают на важную роль вируса папилломы человека в возникновении цервикальных интраэпителиальных неоплазий и рака шейки матки [2,7,8,28]. В настоящее время идентифицировано более сотни разновидностей этого вируса, большинство из которых передаются половым путем. В мировом масштабе около 630 млн человек инфицировано HPV–инфекцией [11,13,27]. Так, например, до 82% женщин считаются инфицированными уже через два года после сексуального дебюта, при этом, даже имея одного полового партнера, около 20% женщин заражены [41,47]. В Европе ВПЧ выявляется у 60–80% сексуально активных молодых женщин до 30 лет. При этом инфицированность популяции увеличивается с возрастом, достигая пика в 20–29 лет (40%) и постепенно снижается к 50 годам, после которых не превышает 5% [15,16,26,35]. После заражения вирусом возможна самостоятельная элиминация его из организма с течением времени, но у части женщин отмечается его персистирующее носительство.
Особенностью HPV–инфекции является тот факт, что в силу эпителиофильности вируса он не обнаруживается в крови, а выработка антител иммунной системой отмечается далеко не у всех инфицированных [42,46]. При этом уровень антител очень низок и не способен обеспечить длительный и надежный иммунитет. Таким образом, ДНК ВПЧ сохраняется в эпителии шейки матки длительное время, что в конечном итоге приводит к атипической трансформации эпителиальных клеток. На фоне персистирующей папилломавирусной инфекции зависимость вероятности развития злокачественной опухоли сгруппирована следующим образом: вирусы низкого онкологического риска: 6, 11, 40, 42–44, 61; среднего риска: 30, 35, 39, 45, 52, 53, 56, 58; высокого риска: 16, 18, 31, 33. На долю ВПЧ высокого риска приходится около 70% случаев рака шейки матки, ануса и наружных половых органов [26,32,34,36].
Полимеразная цепная реакция и метод Hybrid Capture II выявляют ДНК высокоонкогенных вирусов у 70–78% женщин с дисплазией шейки матки I степени, у 83–89% – с дисплазией III степени и внутриэпителиальным раком и у 95–100% больных с инвазивными формами рака. При этом отмечается зависимость вирусной инфекции и гистотипа опухоли: при плоскоклеточном раке чаще выявляется 16 тип ВПЧ, а при аденокарциноме и низкодифференцированном раке шейки матки – ВПЧ 18 типа [43,45]. В настоящее время доказано, что вирусная инфекция может оставаться латентной в течение нескольких лет, при этом ее наличие повышает риск развития рака шейки матки в среднем в 300 раз. По данным эпидемиологических исследований, в Российской Федерации наиболее распространены 16, 18, 31, 45 типы HPV [19,24,33].
Таким образом, очевидно, что, имея четкую вирусную основу, рак шейки матки является потенциально предотвратимым при своевременном адекватном лечении на этапе предраковой патологии.
Местом внедрения HPV и зоной развития предраковых состояний является область контакта многослойного плоского и призматического эпителия шейки матки. До 94% папиллом располагаются в этой так называемой «зоне трансформации» или дистальнее нее [2,4,44]. Повреждения шейки матки, вызванные HPV, в виде цервикальной интраэпителиальной неоплазии (CIN) могут быть легкой, умеренной и тяжелой степени. Женщины с CIN легкой степени подвержены риску перехода в CIN тяжелой степени и заболевания раком шейки матки. Однако CIN 1 не всегда прогрессирует в CIN 2–3. Имеет значение возраст. Возраст женщин с CIN 2–3 обычно на 5–10 лет старше, чем с CIN 1, что свидетельствует о прогрессии изменений эпителия шейки матки с возрастом [5,10]. Именно онкогенные типы HPV–инфекции, поражающие шейку матки, вероятно, и определяют риск развития у женщин CIN тяжелой степени [9,12].
Внимание исследователей привлекает изучение возможного синергизма разных вирусов в инициации неопластических изменений в эпителии шейки матки: вируса простого герпеса, цитомегаловируса и HPV. Показано, что цервикальная дисплазия чаще обнаруживается у женщин, инфицированных вирусом иммунодефицита человека. При этом дисплазия прогрессирует быстрее. Это указывает на то, что присутствие нескольких генитальных инфекций действительно ускоряет развитие цервикальной дисплазии.
HPV внедряется в незрелые клетки базального слоя эпителия кожи и слизистых оболочек [6,8,14]. Это усиливает пролиферацию клеток, но продукции вирусных частиц при этом не происходит, так как пролиферирующие клетки эпителия не способны поддержать полный жизненный цикл вирусов. Репликация папилломавируса происходит только в высокоспециализированных клетках многослойного плоского эпителия – зернистых, шиповатых клетках кожи, поверхностных эпителиоцитах слизистой шейки матки.
Канцерогенез шейки матки, инициируемый вирусами папиллом, можно условно разделить на не-сколько этапов [23,25]:
1) первичная инфекция вирусом;
2) персистенция генома вируса папиллом в эписомальной форме и возможность продукции вирусных частиц с последующей вторичной инфекцией;
3) интеграция вирусной ДНК в клеточный геном без видимой специфичности сайта интеграции; на стадиях 2 и 3 начинают проявляться функции онкобелков Е6 и Е7, нарушающих контроль деления клеток;
4) индукция мутаций в клеточной ДНК, вызывающая нестабильность клеточного генома;
5) селекция клона клеток с мутантной ДНК, содержащих интегрированную ДНК вирусов папилломы;
6) активное размножение данного клона клеток и рост опухоли. Такой механизм объясняет тот факт, что от момента вирусной инфекции до появления опухоли проходит длительный срок – 5–10 лет.
Одним из перспективных направлений в создании новых подходов к лечению вирус–ассоциированного предрака и рака шейки матки является применение в комплексной терапии препаратов иммуномодулирующего действия. В связи со сложностью и длительностью лечения папилломавирусной инфекции человека необходимо воздействие как на микро–, так и на макроорганизм.
Современные способы терапии включают локальное лечение папиллом в сочетании с применением различных методов системной иммуномодулирующей терапии.
Целью настоящего исследования было изучение клинической эффективности иммуномодулирующего препарата Гроприносин в комплексном лечении вирус–ассоциированного предрака и рака шейки матки.
Материал и методы
В исследование включены 75 больных в возрасте от 16 до 40 лет, которые были разделены на 2 группы: в 1 группу вошли 35 вирус–ассоциированных больных с предраком и раком шейки матки, из них у 16 пациенток был верифицирован рак шейки матки стадий различной степени дифференцировки, у 19 больных имелась тяжелая дисплазия шейки матки (CIN 3). Вторую группу составили 40 больных также с вирус–ассоциированной патологией шейки матки. Всем больным было проведены общеклиническое обследование, цитологическое исследование мазков, расширенная кольпоскопия, биопсия шейки матки, морфологическое исследование биоптатов, а также забор поверхностного эпителия с шейки матки для проведения ПЦР–диагностики.
Определение ДНК папилломавирусной инфекции проводили путем исследования цервикальных соскобов до начала лечения. Генотипирование проводилось на 12 онкотропных типов (16, 18, 31, 33, 35, 39, 45, 51, 52, 56, 58, 59) с определением вирусной нагрузки методом ПЦР–диагностики в режиме реального времени с применением диагностических наборов «RoterGeen 6 000» фирмы «CorbetResearch» (Австралия). Определяли клинически значимую концентрацию ДНК в ткани шейки, которая служит прогностическим критерием развития рака шейки матки и определяет тактику врача.
Все больные получали лечение в отделении онкогинекологии НИИ онкологии СО РАМН (Томск). Больным с CIN III проводилось лечение в объеме широкой конусовидной резекции шейки матки. Все больные раком шейки матки получали комбинированное лечение: хирургическое в объеме расширенной экстирпации матки с придатками (с транспозицией яичников в репродуктивном возрасте) с последующим курсом сочетанной лучевой терапии по радикальной программе, либо курс химиолучевого лечения по радикальной программе в объеме: 2–х курсов неоадъювантной полихимиотерапии по схеме гемцитабин + цисплатин и курса сочетанной лучевой терапии – дистанционной лучевой терапии в суммарной очаговой дозе (СОД) 46 Гр., внутриполостной лучевой терапии в СОД 50 Гр.
Всем пациенткам 1–й группы было проведено лечение препаратом Гроприносин в предоперационном периоде либо перед началом курса сочетанной лучевой терапии. Проводили лечение препаратом Гроприносин по следующей схеме: 2 таблетки 3 раза в сутки перорально в течение 5 дней с интервалом 28 дней, 3 курса.
В группе сравнения (n=40) иммуномодулирующую терапию не проводили.
Результаты и обсуждение
В ходе исследования было выявлено достаточно разнообразное клиническое течение папилломавирусной инфекции. Среди обследованных пациенток наиболее часто выявлялось латентное течение инфекции – 72,5%, реже всего встречалась клинически выраженная форма – 5,8%. Клинически выраженная форма инфекции обнаружена у 18,4% пациенток с предопухолевой патологией шейки матки. Среди больных раком шейки матки клинически выраженная форма обнаружена у 12,6% больных. Выявленные папилломатозные образования представляли собой наиболее распространенные классические остроконечные кондиломы. У некоторых больных расположенные на слизистой оболочке шейки матки папилломы были одиночными, в виде бледно–розовых сосочков на широком основании, возвышающиеся над слизистой оболочкой, полиморфные (лепестковые, округлые). Поверхность папиллом была покрыта многослойным плоским эпителием, при этом кондиломатозные образования были множественными, округлой формы, с гладкой или шершавой поверхностью.
Всем больным проводилась кольпоскопия, которая оценивалась по четырем основным признакам: контуры и поверхность эпителия, цвет, сосудистый рисунок, реакция на окраску йодом. Необходимо отметить, что кольпоскопическая картина цервикальной HPV–инфекции онкогенных типов отличалась значительной вариабельностью (рис. 2б). Наиболее выраженные кольпоскопические признаки злокачественности эпителия шейки матки наблюдались в группе больных раком шейки матки (89%), чаще всего кольпоскопические картины были представлены атипичным эпителием (мозаикой и пунктацией), атипической зоной превращения с правильными четкими отчетливыми краями, зоной атипичных сосудов, ацетобелым эпителием. При проведении пробы с уксусом эпителий покрывался плотным уксусно–белым налетом, который быстро появлялся и медленно исчезал. При окраске йодом наблюдались негативные зоны горчично–желтого цвета вследствие полного отсутствия гликогена. Кроме того, чаще всего наблюдались сложные сочетанные кольпоскопические картины (72%).
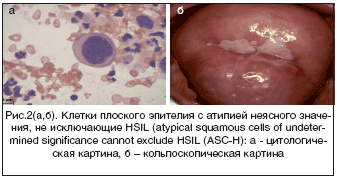
В группе больных с тяжелой дисплазией шейки матки (CIN 3) эндоскопические признаки чаще всего (87%) характеризовались значительным разнообразием, атипичностью эпителия разной степени выражен-ности, сложными полиморфными картинами (рис. 1б). Что касается цитологического метода исследования, ВПЧ–поражение выявлено только у 51,9% больных (рис. 1а, 2а). Из них койлоцитоз выявлен у 76%, гиперкератоз у 6%, паракератоз у 11%, акантоз у 3%, папилломатоз у 4% пациенток.
Таким образом, как цитологическая, так и кольпоскопическая картина папилломавирусной инфекции имела широкий спектр проявлений, которые взаимосвязаны с морфологическими изменениями эпителия шейки матки.
При проведении кольпоскопии после лечения ВПЧ–инфекции Гроприносином выявлено, что у 16 больных наблюдалось полное выздоровление (исчезновение атипического эпителия), у 11 – положительная клиническая динамика в виде уменьшения площади поражения и степени выраженности рельефа патологического процесса, состояние эпителия остальных 8 больных осталось без изменения. По данным морфологического исследования, у 15 пациенток, получавших Гроприносин, отмечена абсолютная эффективность лечения (исчезновение койлоцитоза), у 8 – регрессия койлоцитоза от выраженного до легкого, у 7 – регрессия койлоцитоза от умеренного до легкого, у 1 – регрессия от дисплазии до легкого койлоцитоза, у 4 больных динамики не наблюдалось. Положительные клинические изменения у больных, получавших Гроприносин, по сравнению с больными, не получавшими иммуномодулирующую терапию, были достоверными (р=0,01).
Оценка эффективности лечения рака и предрака шейки матки выявила, что у больных с тяжелой дисплазией шейки матки в группе исследования прогрессирования процесса не наблюдалось, тогда как у 4 больных с CIN 3 из группы контроля в течение 2–х лет при динамическом наблюдении был выявлен инвазивный рак шейки матки. Что касается больных раком шейки матки, то при проведении оценки общей безрецидивной и безметастатической выживаемости были выявлены достоверные различия результатов: в группе исследования трехлетняя безрецидивная выживаемость составила 82%, безметастатическая – 78%. При этом в контрольной группе эти показатели составили 71 и 69% соответственно (р<0,05). Показатели общей выживаемости в сравниваемых группах достоверно не различались, но имелась тенденция к улучшению показателей у больных на фоне лечения Гроприносином.
Таким образом, комплексное лечение вирус–позитивных больных с предраковой и раковой патологией шейки матки позволяет добиться выраженного противовирусного и иммуномодулирующего эффекта. На основании результатов настоящего исследования можно рекомендовать проведение курса комплексного лечения препаратом Гроприносин всем больным с вирус–ассоциированным предраком и раком шейки матки, что позволит значительно повысить эффективность и улучшить отдаленные результаты лечения. При этом своевременное применение иммуномодулирующей терапии является важным фактором для снижения заболеваемости новообразованиями шейки матки, оно открывает большие перспективы в сохранении здоровья женщин.
Литература
1. Вишневский А.С., Сафронникова Н.Р. Дискуссионные вопросы лечения папилломавирусной инфекции шейки матки. //Практическая Онкология.–2002.–Т.3(3).–С.166–172.
2. Глик Б., Пастернак Дж. Молекулярная биотехнология. Принципы и применение. – М., 2002. – С. 349–368.
3. Дубинский В.В. Урогенитальная папилломавирусная инфекция (обзор литературы) // Российский журнал кожных и венерических болезней.– 2000.–№ 5.– С. 50–55.
4. Евстигнеева Н.П. Папилломавирусная инфекция урогенитального тракта женщин: эпидемиология, факторы персистенции, оптимизация ранней диагностики и профилактики онкогенеза: Автореф. дис…д–ра мед. Наук / Н.П. Евстигнеева.– Москва, 2007.– 42 с.
5. Киселев В. И., Дмитриев Г. А., Латыпова М. Ф. Полимеразная цепная реакция в диагностике урогенитальных инфекций: Пособие для врачей. – М. 2000.
6. Киселев В.И. Вирусы папилломы человека в развитии рака шейки матки / В.И. Киселев // М.; 2004.– с.184.
7. Киселев Ф.Л. Генетические и эпигенетические факторы прогрессии опухолей шейки матки / Ф.Л. Киселев // Вестн. Росс. АМН.– 2007.– №11.–С.25–32.
8. Киселев Ф.Л. Молекулярные маркеры рака шейки матки / Ф.Л.Киселев, Н.Н.Мазуренко, Н.Ф.Киселева и др. // Вестник РАМН.– 2002.–№1.– С.8–14.
9. Киселев Ф.Л. Статус ДНК вируса папиллом человека в карциномах шейки матки / Ф.Л.Киселев, Н.Ф.Киселева, О.Кобзева и др. // Мол. биол.– 2002.–№35.–С.470–476.
10. Киселев Ф.Л., Киселева Н.Ф. Эпигенетические изменения в опухолевых клетках. В кн.: Канцерогенез. М.: Научный мир; 2001.–С.93–106.
11. Кулаков В.И. и др. Современные подходы к диагностике папилломавирусной инфекции гениталий женщин и их значение для скрининга рака шейки матки// Гинекология.– 2000.–№2.–С. 4–8.
12. Лолор Г.– младший, Фишер Т., Адельман Д. Клиническая иммунология и аллергология (перевод с английского).– М.: «Практика», 2000.– 806
13. М.А.Башмакова, А.М.Савичева. Папилломавирусная инфекция (Пособие для врачей) Москва, 2003.
14. Мазуренко Н.Н. Потеря гетерозиготности на хромосоме 6 как маркер ранних генетических нарушений в интраэпителиальных неоплазиях шейки матки и микроинвазивных карциномах / Н.Н.Мазуренко, Ю.Блиев, Б.Биджиева и др. // Мол. Биол.– 2006.– 40.– 436–447.
15. Мазуренко Н.Н. Роль вирусов папиллом в канцерогенезе шейки матки / Н.Н.Мазуренко // Соврем. онкология.– 2003.– Т.05.– №1.– С.
16. Молчанов Д. Вирус папилломы человека и рак шейки матки: уникальная взаимосвязь и вызов современной медицине / Д. Молчанов // Здоровье Украины. – 2007.– №1.– С.3.
17. Новик В.И. Эпидемиология рака шейки матки, факторы риска, скрининг // Практ.онкология. – 2002. – Т. 3., № 3. – С. 156 – 162.
18. Прилепская В.Н. Патология шейки матки и генитальные инфекции / М., «Медпресс–информ», 2008.
19. Прилепская В.Н., Кондриков Н.И., Бебнева Т.Н. Патология шейки матки. Диагностические возможности цитологического скрининга// Акуш. и гин.– 1999.–№ 3.–С.45–50
20. Роговская СИ. Папилломавирусная инфекция нижних отделов гениталий, клиника, диагностика, лечение. Дис. … д–ра мед. наук. М., 2003.
21. Чиссов В.И., Старинский В.В., Ковалев Б.Н., Петрова Г.В. Эпидемиология гормонозависимых новообразований в России и результаты научных исследований по их диагностике и лечению / // Сибирский онкологический журнал – 2002.– №3 – 4. – C. 109 – 114.
23. Antonsson A, Karanfilovska S, Lindqvist PG, Hansson BG. General acquisition of human papillomavirus infections of skin occurs in early infancy //J Clin Microbiol.– 2003.–№41.–Р.2509–2514.
24. Auborn K.J. Treatment of HPV–infection.// Clinics in Lab.Med.–2000.–v.20(2).–P.407–421/
25. Braga E. Critical Tumor suppressor gene regions on chromosom 3p in majior humanepithelial malignancies: allelotyping and quatitative real–time PCR / Е.Braga, V.Chernenko, I. Bazov et al. // Cancer.– 2002.– 100.– P.534–551.
26. Castellsague X, Munoz N. Cofactors in human papillomavirus carcinogenesis–role of parity, oral contraceptives, and tobacco smoking// J Natl Cancer Inst Monogr.– 2003.–№31.–Р. 20–28.
27. Chernenko V. Deletion mapping using quatitative real–time PCRidentifies two distinct 3p21.3 regions affected in most cervical cfrcinomas / V.Chernenko, N.Mazurenko et al. // Oncogene.–2003.– 22.– P.2984–2992.
28. Epidemiologic classification of human papillomavirus types associated with cervical cancer / N. Munoz, F.X. Bosch, S. de Sanjose, R. Herrero, X. Castellsague, K.V. Shah et al. // N Engl. J. Med.– 2003.–Vol.348.–P.518–52.
29. GLOBOCAN database. – http: // www–dep.iarc.fr/ last access 25.01.2007.
30. Globocan. Cancer incidence, mortality and prevalence world wide. Last access 25.01.2007.IARC WHU Press Release 151 IARC confirms efficacy of cervix cancer screening for women 25–65 in reducing mortality, 03 May 2004.
32. Kaufman R.N., Adam E., Vonka N. HPV–infection and cervical carcinoma. // Clin. Obstet. Gynecol. – 2000.–v.43(2).–P.363–380.
33. Koutsky L., Ault K., Wheeler C. Et al. A controlled trial of a human papillomavirus type 16 vaccine // N Engl J Med .–2002.–№ 347.–Р.1645–1651
34. Moberg M., Gustavsson I, Wilander E. Et al.High viral loads of human papillomavirus predict risk of invasive cervical carcinoma // Br J Cancer.– 2005.–№92.–Р.891–894
35. Munoz N., Bosch F., Sanjos S. Et al. International Agency for Research on Cancer Multicenter Cervical Cancer Study Group. Epidemiologic classification of human papillomavirus types associatedwith cervical cancer // N Engl J Med. .–2003.–V6, №348.–Р. 518–527.
36. Parkin DM, Bray F. The burden of HPV–related cancers// Vaccine.– 2006.–24 (Suppl 3).–Р.11–25.
37. Pat. EP0406542 A Method for detecting precancerous and cancerous cervical intraepithelium. Patent EP0523391 Use of HPV–16 E6 and E7–gene derivated peptides for the diagnostic purpose.
38. Perez L.A. GenitalHPV: Links to Cervical Cancer, Treatment and Prevention.//Clinical Lab.Sci.–2001.–v.14(3).–P.183–186.
39. Rintala MA, Grenman SE, Jarvenkyla ME, Syrjanen KJ, Syrjanen SM. High–risk types of human papillomavirus (HPV) DNA in oral and genital mucosa of infants during their first 3 years of life: experience from the Finnish HPV Family Study// Clin Infect Dis.– 2005.–№41.–Р.1728–1733.
40. Rintala MA, Grenman SE, Puranen MH, Isolauri E, Ekblad U, Kero PO et al. Transmission of high–risk human papillomavirus (HPV) between parents and infant: a prospective study of HPV in families in Finland. J Clin Microbiol // 2005.–№43.–Р.376–381.
41. Smith J.S., Lindsay L., Hoots B. Et al. Human papillomavirus type distribution in invasivе cancer and high–grade cervical lesions: A meta–analysis update // Int J Cancer.– 2007.–№ 121.–Р. 621–632.
42. Tindle T. W. Immune evasion in human papillomavirus–associ–ated cervical cancer // Nature Rev. –2002. –Vol. 2. –P. 1–7.
43. Tjiong M. / M.Tjiong, T.Out, J.Ter Schegget et al. // Int.Gynecol.Cancer.–2001.– 11.– P.9–17.
44. Woodman C. The natural history of cervical HPV infection unresolved issuis / C.Woodman, S.Collins, L.Young // Nat.Rev.Cancer.–2007.–7.–P/11–22.
45. World Health Organization (WHO). Comprehensive Cervical Cancer Control. A guide to essential practice. Geneva: WHO 2006.
46. zur Hausen H. Papillomaviruses causing cancer: evasion from host–cell control in early events in carcinogenesis.//J.Natl. Cancer Inst.–2000.–v.92(9).–p.690–698.
47. zur Hauzen H. Papillomavirus and cancer: from basic stadies to clinical application / H. zur Hauzen // Nar.Rev.Cancer.– 2002.–2.–P.342–350.