| II.1. Номенклатура и классификация врожденных пороков сердца К.А. Токмакова, А.А. Купряшов |
| II.2. Аномалии формирования и положения сердца. Эктопия сердца. Аномалии дренажа системных вен И.В. Кокшенёв |
| II.3. Аномалии развития предсердного сегмента |
| II.3.1. Дефект межпредсердной перегородки. Частичный аномальный дренаж легочных вен А.А. Купряшов |
| II.3.2. Тотальный аномальный дренаж легочных вен А.И. Ким (глава написана при участии С.Н. Метлина) |
| II.3.3. Стенозы и гипоплазия легочных вен С.В. Горбачевский |
| II.3.4. Трехпредсердное сердце К.В. Шаталов (глава написана при участии Р.Р. Ахтямова) |
| II.3.5. Врожденные аневризмы предсердий И.В. Кокшенёв |
| II.4. Аномалии атриовентрикулярного соединения |
| II.4.1. Общий атриовентрикулярный канал С.В. Горбачевский |
| II.4.2. Врожденная патология митрального клапана К.В. Шаталов, И.В. Арнаутова |
| II.4.3. Аномалия Эбштейна Л.А. Бокерия, А.А. Свободов |
| II.4.4. Бивентрикулярное прикрепление атриовентрикулярных клапанов. Смещенные атриовентрикулярные клапаны А.А. Купряшов |
| II.5. Аномалии желудочкового сегмента |
| II.5.1. Дефект межжелудочковой перегородки А.А. Купряшов |
| II.5.2. Двухкамерный правый желудочек И.В. Кокшенёв |
| II.5.3. Criss-cross сердце М.М. Зеленикин |
| II.5.4. Врожденные дивертикулы сердца Д.О. Беришвили |
| II.6. Аномалии выхода из левого желудочка |
| II.6.1. Обструкция выхода из левого желудочка К.В. Шаталов (глава написана при участии И.В. Арнаутовой) |
| II.6.2. Аортолевожелудочковый тоннель. Аневризма синусов Вальсальвы С.В. Горбачевский |
| II.7. Аномалии выхода из правого желудочка |
| II.7.1. Изолированная обструкция выводного отдела правого желудочка. Аномалии развития легочных артерий. Сообщения между легочными артериями и левым предсердием И.В. Кокшенёв |
| II.7.2. Атрезия легочной артерии с интактной межжелудочковой перегородкой Д.О. Беришвили |
| II.7.3. Агенезия клапана легочной артерии И.В. Кокшенёв |
| II.8. Аномалии конотрункуса |
| II.8.1. Тетрада Фалло И.В. Кокшенёв, К.В. Шаталов |
| II.8.2. Атрезия легочной артерии с дефектом межжелудочковой перегородки И.В. Кокшенёв, К.В. Шаталов |
| II.8.3. Транспозиция магистральных сосудов Л.А. Бокерия, А.И. Ким (глава написана при участии В.П. Дидык) |
| II.8.4. Двойное отхождение магистральных сосудов от желудочков сердца А.А. Купряшов |
| II.8.5. Общий артериальный ствол Л.А. Бокерия, А.И. Ким (глава написана при участии Т.Р. Григорьянца) |
| II.8.6. Аортолегочное окно. Аномальное отхождение одной из легочных артерий от аорты А.А. Купряшов |
| II.9. Атриовентрикулярная и вентрикулоартериальная дискордантность И.В. Кокшенёв |
| II.10. Пороки с одножелудочковой гемодинамикой. Операции обхода правого сердца Л.А. Бокерия, М.М. Зеленикин, А.А. Свободов |
| II.11. Синдром гипоплазии левых отделов сердца Л.А. Бокерия, Д.О. Беришвили |
| II.12. Аномалии коронарных артерий Л.А. Бокерия, К.В. Шаталов, И.В. Арнаутова |
| II.13. Открытый артериальный проток А.А. Есаян |
| II.14. Сосудистые кольца и сосудистые петли К.В. Шаталов (глава написана при участии Н.С. Турдиевой) |
| II.15. Коарктация аорты. Перерыв дуги аорты. Гипоплазия дуги аорты
А.А. Есаян |
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Иванова Ю.Ю.
1
1 Оренбургский государственный медицинский университет
Ишемическая болезнь сердца (ИБС) — патологическое состояние, характеризующееся относительным или абсолютным нарушением кровоснабжения миокарда вследствие поражения коронарных артерий. Хирургическое лечение ишемической болезни сердца является одним из главных феноменов медицины XX века. В группе больных с ишемической дисфункцией миокарда операция реваскуляризации приводит к улучшению гемодинамических показателей: снижению конечного диастолического давления в левом желудочке, увеличению сердечного и ударного выбросов, а также фракции изгнания левого желудочка. Результаты большинства исследований показали, что значительное улучшение состояния или полное исчезновение стенокардии наблюдаются у 75-95% оперированных больных.
ишемическая болезнь сердца
реваскуляризация миокарда
1. Курс лекций по топографической анатомии И.И. Кагана. Лекция №9 Операции на сердце.
2. Лекции по сердечно-сосудистой хирургии. Под ред. Л. А. Бокерия. В 2-х т. Т. 2. -М.: Издательство НЦССХим. А. Н. Бакулева РАМН, 1999. — 194с.
3. Мыш Г.Д., Непомнящих Л.М. Ишемия миокарда и реваскуляризация сердца. — Новосибирск: Наука, 1980. — 296с.
4. Руководство по кардиологии : Учебное пособие в 3 т. / Под ред. Г.И. Сторожакова, А.А. Горбаченкова. — 2008. — 672 с.
5. Сердечно-сосудистая хирургия: руководство/ В. И. Бураковский, Л. А. Бокерия и др.; Под ред. акад. АМН СССР В. И. Бураковского, проф. Л. А. Бокерия.— М.: Медицина, 1989.—752 с
6. Топографическая анатомия и оперативная хирургия: учебник: в 2т. / под ред. И.И. Кагана, И.Д. Кирпатовского. — М. : ГЭОТАР-Медиа, 2012. — Т.2 — 576с.
7. Техника операции аорто-коронарного шунтирования 3-5 венечных артерий сердца. // Грудная хирургия. / Под ред. В. С. Работникова, Г. П. Власова, Э. Н. Казакова, Э. Н. Керцмана. — 1985.
8. Хирургическое лечение недостаточности коронарного кровообращения. // Труды Всесоюзной сессии АМН совместно с Томским медицинским институтом; / Под ред. Д. П. Демихова. — 1953.
Показания к операции реваскуляризации миокарда, как и показания к операции в любой области хирургии, базируются на трех «китах»: клинической картине заболевания, анатомии поражения и функции органа.
Классическим клиническим показанием к хирургическому лечению пациента является тяжелая стенокардия, резистентная к медикаментозной терапии. Однако тяжесть клинических проявлений не всегда коррелирует с тяжестью поражения коронарного русла. Кроме того, современная медикаментозная терапия обладает высокой эффективностью за счет резкого снижения потребления миокардом кислорода и воздействия на ряд патогенетических звеньев формирования синдрома «грудной жабы».
Поэтому в последние годы на первый план выходят анатомические показания к операции, а именно — локализация, степень сужения коронарных артерий и количество пораженных сосудов. [2, с.58]
Основными анатомическими показаниями являются:
- Значимый стеноз левой коронарной артерии;
- Значимый (более 70%) проксимальный стеноз передней межжелудочковой ветви (ПМЖВ) и проксимальный стеноз огибающей ветви;
- Трехсосудистое поражение;
- Двухсосудистое поражение при наличии значимого проксимального стеноза ПМЖВ в сочетании с фракцией выброса левого желудочка менее 50% или с ишемией, подтвержденной неинвазивным тестированием;
- Одно- или двухсосудистое поражение со стенозом проксимального отдела ПМЖВ, выраженной картиной ИБС;
Виды операций при ИБС [1,9]
A. Непрямые методы реваскуляризации
- симпатэктомия
- кардиопексии
- оментокардиопексия
- пневмокардиопексия
- перикардиопексия
- операция Фиески
- операция Вайнберга
B. Прямые методы реваскуляризации
- аортокоронарное шунтирование
- маммарно-коронарное шунтирование
- анастомоз с желудочно-сальниковой артерией
- аутопластика коронарных артерий
- стентирование коронарных артерий
- баллонная дилатация венечных артерий
- эндартерэктомия
Непрямые методы реваскуляризации
Возникли на заре коронарной хирургии и были связаны с отсутствием искусственного кровообращения, способного защитить организм и миокард от ишемии. Вместе с тем, ряд методик применяются и в настоящее время при невозможности, по каким-либо причинам, осуществить прямую реваскуляризацию. [ 2, с.55]
Первые операции были направлены на ликвидацию болевого синдрома, снижения основного обмена или на фиксацию к миокарду органов и тканей, богатых кровеносными сосудами и коллатералями.
Симпатэктомия. Это хирургическая операция, задачей которой является прекращение передачи нервного импульса по симпатическим нервным волокнам, расположенным в адвентиции сосудистой стенки. Эта идея была высказана 100 лет назад французским физиологом Франсуа-Франком, предположившим, что резекция шейно-грудных симпатических ганглиев может привести к устранению стенокардии. На практике эта идея была реализована в 1916 г. Т. Jonnesco. [2, с.55]
В дальнейшем были предложены и другие методики, направленные на устранение стенокардии путем прерывания афферентных болевых импульсов, — задняя ризотомия (пересечение задних корешков спинного мозга), различные виды симпатических блокад. Эти операции были подвергнуты резкой критике, поскольку они устраняли болевые приступы, предупреждающие больного об опасности. С другой стороны, по мнению ряда исследователей, подобные нейрохирургические вмешательства приводили к снижению потребления миокардом кислорода, что благотворно сказывалось на течении заболевания. [2, с.55]
Кардиопексии. Наибольшее распространение получили операции непрямой реваскуляризации миокарда, направленные на создание дополнительного источника кровоснабжения сердца. Впервые Л. Moritz и С. Hudson в 1932 г. предложили в этих целях использовать перикард. Beck С. в 1935 г. выполнил скарификацию эпикарда, полагая, что в результате образования сращений между перикардом и эпикардом произойдет прорастание перикардиальных сосудов в миокард. Наибольшее распространение получил метод S. Thompson, который заключается в распылении талька в полости перикарда с целью образования сращений. Эти вмешательства были названы кардиоперикардиопексией. Однако этот вид хирургического метода лечения ИБС не получил широкого распространения.
В 1937 г. L. O’Shaughnessy впервые использовал тканевой трансплантат для реваскуляризации миокарда. Он подшил к эпикарду лоскут большого сальника на ножке. Эта операция, названная оментокардиопексией, привела к разработке целого ряда подобных методов. С целью создания дополнительного источника кровоснабжения сердца хирурги использовали ткань легкого, грудные мышцы, медиастинальный жир, кожный лоскут и даже участок тонкой кишки. [2, с.55]
Операция Фиески. Это операция двусторонней перевязки внутренних грудных артерий (ВГА), предложенная итальянским хирургом D. Fieschi в 1939 г. По мнению автора, перевязка ВГА тотчас ниже отхождения перикардодиафрагмальной ветви усиливает кровоток по этой артерии, имеющей анастомозы с ветвями коронарных артерий. [2, с.56]
Автор с успехом провёл операцию на больной стенокардией. Затем это вмешательство было забыто и только после 50-х гг. возрождено М. Баттезати. [3, с.71]
Операция Вайнберга. Занимает промежуточную позицию между непрямыми и прямыми методами реваскуляризации миокарда и заключается в имплантации кровоточащего дистального конца внутренней грудной артерии в толщу миокарда, что приводит вначале к формированию внутримиокардиальной гематомы, а в последующем к развитию анастомозов между ВГА и ветвями коронарных артерий. Основным недостатком метода Вайнберга являлось отсутствие немедленного эффекта реваскуляризации. [4, с.537]
Прямые методы реваскуляризации
С середины 50-х годов при ишемической болезни сердца хирурги начали использовать способы прямой реваскуляризации. Под операциями прямой реваскуляризации миокарда принято понимать прямые вмешательства на коронарных артериях. Первым таким вмешательством была коронарная эндартерэктомия (ЭАЭ). [2, с.56]
Коронарная эндартерэктомия. Пионером ее стал американский хирург С. Bailey. Он разработал три методики ЭАЭ: прямую, антеградную и ретроградную – через устья коронарных артерий в условиях искусственного кровобращения. С. Bailey разработал также специальный инструментарий для осуществления этой процедуры, в том числе микрокюретки для коронарных артерий. [2, с.56]
Эндартерэктомия заключается в удалении внутреннего слоя стенки артериального сосуда, включающей атеросклеротически измененную интиму и часть медии, и была разработана на периферических артериях в 1948 году Дос Сантосом. Эндартерэктомия нередко осложнялась тромбозом коронарной артерии с развитием ИМ, и летальность при этих вмешательствах была очень высока. Эта процедура сохранила известное значение до настоящего времени. При диффузном поражении коронарных артерий иногда приходится выполнять ЭАЭ в сочетании с АКШ. [4, с.537]
Маммарно-коронарное шунтирование. В 1964 г., русский хирург В. И. Колесов выполнил первую в мире успешную операцию маммарно-коронарного анастомоза (МКА). В настоящее время приоритет В.И. Колесова признан во всем мире, и знаменитый американский хирург D. Eggeer назвал его пионером коронарной хирургии. Колесов В.И. накладывал МКА без использования искусственного кровообращения, на работающем сердце. [2, с.57] ( Рис. 1)
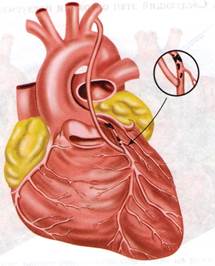
Рис. 1. Грудовенечный анастомоз по Колёсову
Основные этапы операции:
1) доступ к сердцу, осуществляемый обычно путем срединной стернотомии;
2) выделение ВГА; забор аутовенозных трансплантатов, выполняемый другой бригадой хирургов одновременно с производством стернотомии;
3) канюляция восходящей части аорты и полых вен и подключение ИК;
4) пережатие восходящей части аорты с кардиоплегической остановкой сердца;
5) наложение дистальных анастомозов с коронарными артериями;
6) снятие зажима с восходящей части аорты;
7) профилактика воздушной эмболии;

9) наложение проксимальных анастомозов;
10) отключение ИК;
11) деканюляция;
12) ушивание стернотомического разреза с дренированием полости перикарда.
Внутреннюю грудную артерию выделяют на лоскуте или скелетизируют. (Рис. 2) Преимущество скелетизированной ВГА заключается в ее большей длине. В то же время при выделении ВГА на лоскуте уменьшается риск травматизации стенки сосуда. Для удобства при выделении ВГА используют специальный ретрактор. С целью снятия сосудистого спазма в просвет ВГА вводят раствор папаверина и окутывают ВГА салфеткой, смоченной так же раствором папаверина. Операцию проводят в условиях умеренно гипотермического ИК (28-30°С). [2, с.59]
Преимущества метода:
— большее соответствие диаметров внутренней грудной и коронарной артерии;
— анастомоз накладывают между однородными тканями;
— вследствие небольшого диаметра внутренней грудной артерии объемный кровоток по ней меньше, чем по аутовенозному шунту, но линейная скорость больше, что теоретически должно снизить частоту возникновения тромбозов;
— нужно накладывать только один анастомоз, что сокращает время операции;
— внутренняя грудная артерия редко поражается атеросклерозом.
Ограничения применения метода:
— имеются только две внутренние грудные артерии, что ограничивает возможность реваскуляризации нескольких артерий;
— выделение внутренней грудной артерии является более сложной процедурой.
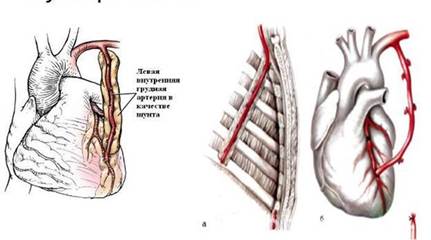
Рис. 2. маммарно-коронарное шунтирование
Аортокоронарное шунтирование. Идея создать обходной шунт между аортой или системной артерией и коронарным сосудом в обход пораженного и суженного атеросклерозом участка клинически была реализована Рене Фавалоро в 1967 г. Ранее, в 1962 г., Дэвид Сабистон (Дьюкский университет), используя в качестве сосудистого протеза большую подкожную вену, наложил шунт между аортой и коронарной артерией. Однако сообщение об этой операции появилось в 1973 г., т. е. через 9 лет. [5, с.533]
Аортокоронарное шунтирование ( Рис. 3) относится к разряду эффективных операций при хирургическом лечении ишемической болезни сердца. Операцию аортокоронарного шунтирования сегментом большой подкожной вены бедра выполняют в условиях искусственного кровообращения. Оперативный доступ: чаще срединная продольная стернотомия, которая позволяет подойти к нисходящим ветвям правой и левой коронарных артерий. Операцию начинают с выделения коронарной артерии, перевязки её выше места окклюзии. Накладывают дистальный артериовенозный анастомоз. Следующий этап операции предусматривает наложение проксимального аортовенозного анастомоза путём бокового отжатия восходящей аорты, в которой иссекают овальное отверстие диаметром 1*0,3см, и накладывают анастомоз «конец в бок». Кроме большой подкожной вены бедра, применяют внутреннюю грудную, лучевую, нижнюю надчревную аутоартерии. При множественном поражении коронарных артерий выполняют несколько шунтов (от 2 до 6). [ 6, с.179]
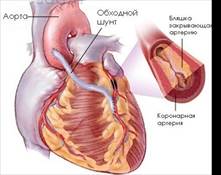
Рис. 3. Аортокоронарное шунтирование
Существует несколько технических вариантов коронарного шунтирования (Рис. 4, 5) :
1. «Змеевидный» или секвенциальный шунт
Так называют шунт с последовательными анастомозами, то есть посредством одного трансплантата шунтируют несколько коронарных артерий или коронарную артерию на двух уровнях. При этом накладывают последовательные анастомозы «бок в бок» между трансплантатом и реваскуляризируемым сосудом и один дистальный анастомоз «конец в бок». Описаны случаи шунтирования одним аутовенозным трансплантатом до 5 коронарных артерий. Оптимальным вариантом является шунтирование двух, максимум трех ветвей с помощью одного трансплантата.
2. У-образный шунт
Его создают путем вшивания проксимального анастомоза одного из шунтов в бок другому. Используется при значительном истончении стенки восходящей части аорты или при небольшой площади аорты и большом количестве реваскуляризированных сосудов. [2, с.59]
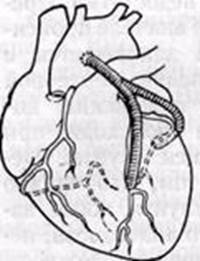
Рис. 4 У-образный шунт
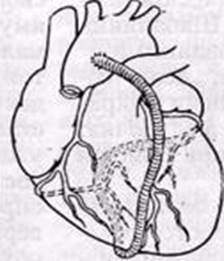
Рис.5 «Змеевидный» или секвенциальный шунт
Коронарное стентирование. Это операция, позволяющая восстановить кровоток в коронарных артериях путём имплантации стентов в месте сужения коронарной артерии. Стент – внутрисосудистый протез для поддержания стенки пораженного сосуда и сохранения диаметра его просвета. Конструкция стента представляет собой тонкий сетчатый каркас из инертного металлического сплава высочайшего качества, раскрываемый баллоном внутри сосуда до нужного диаметра. [2, с.79]
Виды стентов:
· Металлический стент (Bare Metal Stent) – внутрисосудистый протез из нержавеющей стали или кобальт-хромового сплава. Использование металлических стентов связано с риском тромбоза в первые 30 дней и требует двойной антитромбоцитарной терапии в течении 1 месяца, а также 20-30% риском рестеноза (повторного сужения сосуда) в течение 6-9 месяцев после имплантации.
· Стент с лекарственным антипролиферативным покрытием — внутрисосудистый протез из кобальт-хромового сплава с покрытием, высвобождающее лекарственное вещество, препятствующее повторному сужению сосуда. Лекарственный слой в последствии растворяется.
Техника стентирования коронарных артерий. ( Рис. 6)
На стадии коронарографии определяется характер, месторасположение и степень сужения коронарных артерий, после чего переходят к операции.
Под рентгеноскопическим контролем стент подводится к стенозу, после чего хирург раздувает баллон, на который одет стент, шприцом с манометром (индефлятором) до определенного давления. Баллон раздувается, стент расширяется и вдавливается во внутреннюю стенку, тем самым образуя жесткий каркас. Для полной уверенности в том, что стент полностью расправлен, баллон раздувается несколько раз. Затем баллон сдувается и удаляется из артерии вместе с проводником и катетером. Стент остается и сохраняет просвет сосуда. В зависимости от протяженности поражения артерии могут использоваться один или несколько стентов. [2, с.79]

Рис. 6. Этапы стентирования артерии
Несмотря на низкую частоту осложнений, проведение коронарного стентирования сопряжено с определенным риском.
Основные осложнения, встречающиеся при проведении стентирования, — это цереброваскулярные (0,22%), сосудистые (от 2%), летальный исход (1,27%). Основным фактором, лимитирующим эффективность коронарного стентирования, является процесс рестенозирования. Рестеноз – повторное сужение просвета сосуда, приводящее к снижению кровотока. In-stent рестеноз – повторное сужение просвета коронарного сосуда внунтри стента.
Факторами риска рестеноза являются:
— генетическая предрасположенность к повышенной пролиферации неоинтимы;
— сахарный диабет;
— параметры пораженного сегмента: диаметр сосуда, длина повреждение, тип стеноза;
— особенности течения процедуры: протяженность повреждения сосуда, остаточная диссекция, количество имплантируемых стентов, диаметр стента и соотношение его площади с поверхностью сосуда. [2, с.79]
Баллонная ангиопластика коронарных артерий. В последние 10—15 лет в лечении ИБС используют реваскуляризацию миокарда путем транслюминальной балонной дилатации (ангиопластики) стенозированных венечных артерий. В кардиологическую практику метод был внедрен в 1977 г. A. Gruntzig. Показанием к ангиопластике венечных артерий у больных ИБС служит гемодинамически значимое поражение коронарной артерии в ее проксимальных отделах при условии отсутствия выраженного кальциноза и поражения дистального русла этой артерии. [5, с. 532]
Для выполнения ангиопластики венечных артерий используют систему двух катетеров: катетер-проводник и дилатационный катетер. После выполнения коронарографии обычным методом ангиографический катетер заменяют катетером-проводником, через который проводят дилатационный катетер в стенозированную венечную артерию. Максимальный диаметр баллончика 3—3,7 мм при его наполнении, в спавшемся состоянии его диаметр составляет 1,2— 1,3 мм. Катетер проводят в стенозированную артерию. Дистальнее области стеноза антеградное давление в артерии падает и тем самым фиксируется перфузионное давление дистальнее стеноза (за счет коллатерального кровотока). При достижении баллончиком стенозированного сегмента последний под давлением 5 атм. заполняют 30% раствором контрастного вещества. В таком состоянии баллончик находится в течение 5—60 с, после чего его опорожняют и вновь измеряют перфузионное давление ниже стеноза. При необходимости баллончик можно наполнить несколько раз. Уменьшение градиента давления служит основным ориентиром для прекращения процедуры. Повторный ангиографический контроль позволяет определить степень остаточного стеноза.
Основным критерием успеха считается уменьшение степени стеноза после ангиопластики более чем на 20%. По сводным данным национального института сердца, легких и крови (США), суммарный положительный результат баллонной дилатации коронарных артерий достигается примерно у 65% больных. Вероятность успеха при этой процедуре возрастает у больных молодого возраста с непродолжительным анамнезом стенокардии и при проксимальных поражениях артерий.
Основными осложнениями ангиопластики венечных артерий являются
· острый инфаркт миокарда (5,3%)
· окклюзия коронарной артерии (4,6%)
· спазм коронарной артерии (4,5%)
· фибрилляция желудочков (1,8%)
Клинический эффект ангиопластики венечных артерий заключается в исчезновении или значительном урежении приступов стенокардии примерно у 80% больных с успешным результатом процедуры, в повышении толерантности к физическим нагрузкам более чем у 90%, улучшении сократительной способности миокарда и его перфузии. [5, с. 532]
Библиографическая ссылка
Иванова Ю.Ю. ХИРУРГИЧЕСКОЕ ЛЕЧЕНИЕ ИШЕМИЧЕСКОЙ БОЛЕЗНИ СЕРДЦА // Международный студенческий научный вестник. – 2015. – № 6.
;
URL: https://eduherald.ru/ru/article/view?id=14267 (дата обращения: 20.05.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Цель исследования. Изучить современные методы в кардиохирургии.
Материал и методы. Системный анализ источников литературы по базам данных PubMed, Scopus, eLIBRARY, CYBERLENINKA, библиографии ключевых статей.
Результаты.
Среди многочисленных инновационных технолологий в кардиохирургии особое развитие претерпевают методы, направленные на реваскуляризацию миокарда при ишемической болезни сердца, такие как аортокоронарное шунтирование (АКШ) и перкутанное коронарное вмешательство (ПКВ), а также их комбинации с заменой клапанов и операциями при нарушениях ритма. К альтернативным методам лечения пациентов с высоким риском относятся гибридные операции. Минимально инвазивная кардиохирургия — промежуточное направление между традиционной хирургией открытого сердца и интервенционной кардиологией. Немалое значение помимо плановых операций имеет неотложная кардиохирургия, основным условием которой является оптимизация маршрута пациента. Трансплантация сердца является методом выбора при терминальной сердечной недостаточности, когда исчерпаны другие методы.
Заключение. Кардиохирургические методы на современном этапе достаточно разнообразны и требуют дальнейшего совершенствования.
Ключевые слова:
реваскуляризация миокарда, аортокоронарное шунтирование, роботизированная кардиохирургия, кардиохирургия клапанов сердца, гибридные операции в кардиохирургии, неотложная кардиохирургия, трансплантация сердца.
Aim of the study. To study modern methods in cardiac surgery.
Material and methods. Systematic analysis of literature sources on databases PubMed, Scopus, eLIBRARY, CYBERLENINKA, bibliography of key articles.
Results. Among the numerous innovative technologies in cardiac surgery, methods aimed at myocardial revascularization in coronary heart disease, such as coronary artery bypass grafting (CABG) and percutaneous coronary intervention (PCI), as well as their combinations with valve replacement and operations for arrhythmias, are undergoing special development. Alternative treatments for high-risk patients include hybrid surgeries. Minimally invasive cardiac surgery is an intermediate direction between traditional open heart surgery and interventional cardiology. In addition to planned operations, emergency cardiac surgery is of considerable importance, the main condition of which is the optimization of the patient’s route. Heart transplantation is the method of choice for end-stage heart failure when other methods have been exhausted.
Conclusion. Cardiosurgical methods at the present stage are quite diverse and require further improvement.
Keywords:
myocardial revascularization, coronary artery bypass grafting, robotic cardiac surgery, cardiac valve surgery, hybrid operations in cardiac surgery, emergency cardiac surgery, heart transplantation.
Введение
Современная интервенционная кардиология и кардиохирургия имеют в своем распоряжении прогрессивные методики, которые постоянно совершенствуются. По мере накопления опыта расширяется круг пациентов, которым возможно выполнение качественного вмешательства по минимально инвазивной технологии. Конечно, эффективность лечения во многом зависит от профессионализма медицинского персонала. Подобные операции должны выполняться в кардиохирургических центрах, имеющих весь комплекс возможностей для оказания специализированной помощи. Однако из-за инертности врачей смежных специальностей путь пациента от начала заболевания к клиническому лечению часто оказывается неоправданно долгим и переполненным страданиями [1].
Основной целью существования кардиохирургической службы является снижение заболеваемости и смертности от сердечно-сосудистых заболеваний путем полного и своевременного обеспечения населения специализированной кардиологической и кардиохирургической помощью [2].
Реваскуляризация миокарда
Ишемическая болезнь сердца (ИБС) является одним из наиболее распространенных и вместе с тем одним из наиболее опасных для человека заболеваний. На сегодняшний день наиболее эффективными методами лечения ишемии миокарда являются аортокоронарное шунтирование (АКШ) и перкутанное коронарное вмешательство (ПКВ). Выбор оперативного вмешательства при ИБС определяется после проведения коронарографии и экспертной оценки степени поражения коронарных артерий сердца.
Методы реваскуляризации постоянно совершенствуются, например, при АКШ систематически используются артериальные кондуиты, появились стенты. За это время ПКВ стало одним из наиболее частых терапевтических вмешательств в медицине, заметен прогресс в постоянном уменьшении количества перипроцедурных нежелательных явлений и отличные результаты при использовании обоих методов. Тем не менее, нужно понимать разницу между двумя методами реваскуляризации. При АКШ сосудистый шунт накладывают на средние сегменты коронарных сосудов ниже пораженного участка, что придает дополнительные источники кровоснабжения миокарду, а также защищает его от последствий обструкции. Целью установки коронарных стентов, напротив, является восстановление нормального кровообращения нативного сосуда путем местного лечения обструктивных поражений без профилактики нового заболевания проксимальнее стента [3].
Пациенты с ИБС до реваскуляризации должны получить оптимальную медикаментозную терапию согласно клиническим рекомендациям, поскольку доказано, что это положительно влияет на прогноз заболевания и облегчение симптомов. Стеноз коронарных артерий с нарушением кровотока может являться показанием к реваскуляризации путем ПКВ или АКШ с целью уменьшения ишемии миокарда и его неблагоприятных клинических проявлений. Показаниями к реваскуляризации у пациентов с ИБС являются сохранение симптомов, несмотря на медикаментозную терапию, и/или ухудшение прогноза. Следовательно, следует рассматривать реваскуляризацию и медикаментозную терапию как дополняющие друг друга стратегии лечения, а не конкурирующие между собой [4].
Стенокардия сопровождается ухудшением качества жизни, уменьшением физической выносливости, депрессией, повторными госпитализациями и визитами к врачу. Реваскуляризация путем ПКВ или АКШ устраняет стенокардию, уменьшает потребность в применении антиангинальных лекарственных средств, а также повышает толерантность к физическим нагрузкам и качество жизни эффективнее оптимальной медикаментозной терапии.
Важно отметить, что наилучшие результаты ПКВ были получены при использовании стентов с медикаментозным покрытием (DES) и АКШ с максимальным использованием шунтов. Хотя реваскуляризация связана с риском развития во время операции спонтанного инфаркта миокарда с повышением уровня биомаркеров, несколько исследований указывают на то, что именно повышение биомаркеров перед операцией ПКВ, а не после нее, является фактором, который неблагоприятно влияет на прогноз. Хотя хорошо известно, что спонтанный инфаркт миокарда неблагоприятно влияет на прогноз и связан со значительной смертностью, последние исследования говорят о том, что ПКВ связано с меньшим риском развития инфаркта миокарда, чем медикаментозная терапия [5].
В мета-анализе 7 РКИ было установлено преимущество АКШ над первичной медикаментозной терапией в отдельных подгруппах больных с ИБС. Было обнаружено, что АКШ повышает выживаемость у пациентов со стенозом ствола левой коронарной артерии (ЛКА) или с трехсосудистым поражением, особенно при вовлечении проксимального отдела нисходящей ветви ЛКА. Этот эффект был сильнее выражен у пациентов с тяжелыми симптомами, ранними положительными результатами тестов нагрузки и сниженной функцией левого желудочка. Важно отметить, что в этих ранних исследованиях только 10 % пациентов было проведено маммаро-коронарное шунтирование (МКШ), что является важным прогностическим фактором. Более того, 40 % пациентов, получавших медикаментозную терапию, в течение периода наблюдения перешли в группу АКШ. В более позднем мета-анализе говорится о снижении риска смерти в группе АКШ по сравнению с группой медикаментозной терапии [6].
В исследовании MASS II медикаментозную терапию в произвольном порядке сравнивали с ПКВ и АКШ. Через 10 лет АКШ по сравнению с медикаментозной терапией сопровождалось меньшими показателями сердечной смертности, развития ИМ и стенокардии. В исследовании STICH приняли участие 1212 пациентов с ИБС и фракцией выброса левого желудочка (ФВЛЖ) ≤ 35 %, рандомизированных по группам медикаментозной терапии и АКШ. Пациенты с поражением ствола ЛКА были исключены из исследования. В конце периода наблюдения 17 % пациентов, получавших медикаментозную терапию, было проведено АКШ и 6 % пациентов — ПКВ. В анализе, в зависимости от назначенного лечения, общая смертность в группе АКШ не была значительно ниже, чем в группе МТ. Однако среди пациентов с АКШ уровень общей смертности или госпитализации по сердечно-сосудистым причинам был ниже, чем в группе МТ. Вторичные клинические последствия также свидетельствовали в пользу АКШ. Кроме того, при АКШ снижался риск первичного результата, смерти, в анализе «по факту лечения» [7].
Большое количество исследований, в которых сравниваются эти два метода реваскуляризации, свидетельствует, что ни ПКВ, ни АКШ не может стать методом выбора для всех пациентов с ИБС, нуждающихся в реваскуляризации. Однако АКШ обеспечивает более полную реваскуляризацию, чем ПКВ, а установка обходных шунтов на средние ветви коронарных артерий снижает влияние поражения проксимальных ветвей, особенно в случаях хронических проксимальных окклюзий [8].
В течение нескольких десятков лет АКШ рассматривается как стандарт лечения значительной окклюзии ствола ЛКА у пациентов, у которых можно выполнять оперативное вмешательство. Это положение основывается на реестре CASS. Считается, что вероятность успеха ПКВ при поражении ствола ЛКА снижают две важные патофизиологические черты этой патологии: у 80 % пациентов стеноз ствола ЛКА распространяется на бифуркацию, что, как известно, повышает риск повторного стеноза; 80 % пациентов со стенозом ствола ЛКА также страдают многососудистым поражением, при котором АКШ повышает выживаемость независимо от наличия поражения ствола ЛКА [9].
Также совместно с АКШ иногда применяется хирургическая реконструкция желудочка (ХРЖ). Цель хирургической реконструкции желудочка (ХРЖ) состоит в удалении рубцовой ткани из стенки ЛЖ с помощью эндовентрикулопластики с использованием внутрижелудочковой заплатки, что тем самым позволяет восстановить физиологический объем ЛЖ, и в восстановлении эллиптической, а не сферической формы. Решение о дополнительном проведении ХРЖ вместе с АКШ должно основываться на тщательной оценке симптомов (симптомы сердечной недостаточности должны иметь приоритет над проявлениями стенокардии), измерении объема ЛЖ и оценке степени трансмурального рубцевания ткани миокарда, и должно производиться только в центрах с высоким хирургическим опытом [10].
АКШ является вмешательством выбора для реваскуляризации среди пациентов с сахарным диабетом и множественным поражением сосудов при ИБС; тем не менее можно рассматривать ПКВ как альтернативный способ лечения для пациентов с сахарным диабетом, множественным поражением сосудов и низкой оценкой по шкале SYNTAX (≤ 22 баллов) [11].
Не существует четких рандомизированных данных в пользу или против создания у пациентов с сахарным диабетом анастомоза с одной внутренней грудной артерией (ВГА) по сравнению с двумя. Вероятное повышение риска развития глубоких грудинных раневых осложнений при использовании обоих ВГА все еще является предметом обсуждения, хотя пациенты с сахарным диабетом имеют особую склонность к развитию грудинных инфекционных осложнений при двусторонних вмешательствах на ВГА. Тем не менее данные обсервационных исследований с периодами наблюдения до 30 лет указывают на улучшение долгосрочных последствий при двусторонних вмешательствах на ВГА [12].
В идеале общепринятое определение полноты миокардиальной реваскуляризации включает: размер сосуда, тяжесть поражения, ишемическая нагрузка, вызванная поражением, и жизнеспособность соответствующей зоны миокарда. Текущая хирургическая практика основывается на анатомическом определении полной реваскуляризации, которая определяется как обходное шунтирование всех эпикардиальных сосудов диаметром 1,5 мм с уменьшением диаметра на 50 %, по крайней мере на одной проекции ангиограммы. Тем не менее, в других клинических испытаниях использовались разные определения полноты реваскуляризации. Последствия неполной реваскуляризации для пациентов, проходивших АКШ, были такими же или хуже последствий для пациентов с полной реваскуляризацией. Базовое исследование вмешательства выявило лучшие результаты ФРК-управляемой функционально полной реваскуляризации, чем результаты, полученные для анатомически полной реваскуляризации методом ПКВ. На сегодняшний день, тем не менее, эти результаты нельзя экстраполировать на всю указанную группу пациентов, прошедших АКШ [13].
При АКШ на открытом сердце применяется специальное оборудование, позволяющее снизить колебания сердца при шунтировании коронарных артерий. Доступ к сердцу выполняется путем полной срединной стернотомии. Используются специальные стабилизаторы миокарда — фиксатор верхушки сердца и стабилизатор операционного поля [14].
Хирургическая система «Da Vinci» — это сложная роботизированная платформа, предназначенная для выполнения оперативных вмешательств через малоинвазивный доступ. При выполнении эндоскопического шунтирования с применением хирургической робот-системы «Da Vinci» хирург выполняет несколько небольших проколов между ребрами, через которые вводятся инструменты и эндоскоп. Для выполнения операции на сердце без остановки используется современная технология стабилизации сердца [15].
Операции на клапанном аппарате сердца
В целом у 40 % пациентов с пороками клапанов сердца наблюдается сопутствующая ИБС. Рекомендуется проводить коронарную ангиографию всем пациентам с пороками клапанов сердца при необходимости хирургического вмешательства на клапане, за исключением пациентов молодого возраста (мужчины менее 40 лет и женщины в предменопаузальный период) без факторов риска ИБС или если риски при ангиографии превышают пользу (например, в случаях расслаивающей аневризмы аорты, значительных вегетаций аорты впереди устья коронарной артерии или окклюзионного тромбоза протеза, что приводит к нестабильному гемодинамическому состоянию).
У пациентов, проходящих протезирование аортального клапана (ПАК), которые также страдают выраженной ИБС, комбинация АКШ с хирургическим вмешательством на аортальном клапане уменьшает частоту периоперационного ИМ, уровень периоперационной смертности, поздней летальности и частоту осложнений, по сравнению с пациентами, которые не поддаются одномоментному АКШ. Тем не менее, эта комбинированная операция несет повышенный риск летальности по сравнению с проведением только протезирования аортального клапана. В современном анализе масштабной выборки больший риск комбинированной операции, чем при протезировании аортального клапана, связан с предварительным наличием ишемического поражения миокарда и сопутствующими заболеваниями. У пациентов с тяжелыми сопутствующими заболеваниями может делаться выбор в пользу транскатетерного вмешательства на клапане (TAVI) [16].
Гибридные операции
К альтернативным методам лечения пациентов с высоким риском также относятся «гибридные» процедуры, включающие комбинацию планового хирургического вмешательства по поводу замены клапана с плановым ПКВ по поводу реваскуляризации миокарда. Однако, сведения о «гибридных» процедурах вмешательства на клапане/ПКВ очень ограничены, сводятся к описанию отдельных клинических случаев и небольших серий случаев. Индивидуальный план лечения таких сложных пациентов должен быть сформулирован командой кардиохирургов.
Гибридная реваскуляризация миокарда является запланированным вмешательством, которое комбинирует кардиохирург с катетерным вмешательством, проводимым в предопределенное время. Процедуры могут проводиться одновременно в «гибридной» операционной или последовательно в отдельных помещениях с соответствующей подготовкой кардиохирургов по хирургическому вмешательству и ПКВ. Решения команды кардиологов и разработка общей стратегии имеют критическое значение для пациентов. Гибридные процедуры, состоящие из шунтирования от ВГА до передней нисходящей ветви ЛКА и ПКВ на других участках, считаются оправданными, если ПКВ на передней нисходящей ветви ЛКА не является вариантом или наоборот предполагает хороший результат в долгосрочной перспективе, или если достижение полной реваскуляризации во время АКШ может быть связано с повышением риска хирургического вмешательства. Хотя в большинстве лечебных центров количество гибридных процедур сравнительно мало, остается важным рассматривать, когда они клинически показаны [17].
Возможные варианты:
- Отдельные пациенты с поражением только передней нисходящей ветви ЛКА, или с многососудистым поражением, но недостаточными показаниями для хирургического вмешательства, кроме поражения территории, кровоснабжающейся передней нисходящей ветвью ЛКА, у которых возможно проведение малоинвазивного прямого аортокоронарного шунтирования (МИПАКШ) для шунтирования передней нисходящей ветви ЛКА с использованием левой внутренней грудной артерии (ЛВГА). Остальные поражения на других сосудах после этого лечатся путем ПКВ.
- Пациенты, которые предварительно проходили АКШ, а теперь нуждаются в хирургическом вмешательстве на клапане, и которые уже имеют хоть один важный стент (например, в области от ВГА до передней нисходящей ветви ЛКА) и один или два окклюдированных стента из собственного сосуда, приемлемых для ПКВ.
- Комбинация реваскуляризации с хирургическим вмешательством на клапане без стернотомии (например, ПКВ и малоинвазивное восстановление митрального клапана или ПКВ и трансапикальная имплантация аортального клапана).
Кроме того, некоторые пациенты со сложным многососудистым поражением и инфарктом миокарда с элевацией сегмента ST в первую очередь нуждаются в первичном ПКВ на причинной артерии, но затем им может потребоваться полная хирургическая реваскуляризация. Подобная ситуация возникает, когда пациентам с сочетанным заболеванием клапана и ИБС необходима неотложная реваскуляризация и ПКВ. Наконец, когда в операционном зале хирург определяет сильно кальцинированную аорту, он может избрать прекращение попыток полной реваскуляризации и предложить отложить ПКВ.
Хирургические процедуры для лечения фибрилляции предсердий и
инсульта
Оригинальная процедура разрезания и сшивания «лабиринт» для лечения ФП, описанная Коксом (Cox) и соавт., предусматривает удаление или перевязку ушка левого предсердия (LAA). Кроме того, ретроспективный анализ показал, что хирургическая окклюзия LAA независимо от хирургического лечения ФП во время основной операции уменьшает риск инсульта. Аналогичным образом транскатетерная окклюзия LAA в исследовании под названием PROTECT AF оказалась не менее эффективной, чем применение пероральных антикоагулянтов — антагонистов витамина К у пациентов с ФП. Способность хирургической облитерации LAA (для которой не используются протезы, находящиеся в непосредственном контакте с кровью, что потенциально исключает потребность в применении длительной антитромбоцитарной/антикоагуляционной терапии) уменьшать риск инсульта пока не была изучена в рандомизированных проспективных исследованиях.
Сегодня можно рассматривать целесообразность одновременной хирургической облитерации LAA для уменьшения риска инсульта у пациентов после АКШ с наличием ФП в анамнезе, однако для окончательного решения этого вопроса необходимы рандомизированные исследования. Удаление или перекрытие LAA следует рассматривать как дополнение, а не альтернативу лечению антикоагулянтами вплоть до появления большего количества данных, собранных в течение более продолжительных периодов [17].
Минимально инвазивная кардиохирургия
Минимально инвазивная кардиохирургия — новое направление, которое можно рассматривать как промежуточное между традиционной хирургией открытого сердца и интервенционной кардиологией.
Для выполнения операций без искусственного кровообращения на работающем сердце необходимым условием является критический стеноз или окклюзия шунтированных артерий и наличие коллатералей. Критическим считается сужение просвета коронарной артерии более чем на 75 %. В этих случаях ниже места стеноза резко падает магистральный кровоток и для поддержания жизнедеятельности миокарда необходимо образование коллатералей — дистальных перетоков из бассейнов других артерий. При наличии указанных факторов можно пережимать артерию ниже стеноза во время операции сроком до 15–20 мин. Этого времени вполне достаточно для наложения коронарного анастомоза. Удлинение периода ишемии миокарда может привести к его острой дисфункции.
Среди преимуществ операций на работающем сердце перед традиционными можно выделить: малую травматичность; отсутствие искусственного кровообращения и его последствий; сокращение времени искусственной вентиляции легких; уменьшение кровопотери и потребности в донорской крови; уменьшение вероятности возникновения синдрома низкого сердечного выброса; уменьшение системной воспалительной реакции; снижение частоты послеоперационных аритмий и неврологических осложнений; сокращение сроков пребывания пациента в клинике; экономичность; расширение границ и объема хирургического лечения [18].
Главными составляющими минимально инвазивной реваскуляризации миокарда (МИРМ) являются мобилизация артериального шунта и мини-доступ для наложения анастомоза. Основным показанием к операции является поражение передней межжелудочковой артерии (ПМЖА). Наибольший мировой опыт накоплен именно по реваскуляризации ПМЖА путем передней мини-торакотомии. Выбор этой артерии и доступа не случаен. Анатомическое расположение на переднебоковой стенке левого желудочка позволяет создать хорошую экспозицию из мини-доступа для хирурга, а левая ВГА наиболее предпочтительна именно для выполнения анастомоза из ПМЖА. Второй по частоте шунтирования является правая КА. Доля пациентов с поражением одной артерии сердца невелика и составляет 5–12 % всех оперированных больных, а пациенты с поражением двух артерий составляют 35–40 %. По мере накопления первичного опыта появляется все большее количество сообщений о возможности выполнения минимально инвазивной реваскуляризации у этой категории больных. Увеличение числа операций коронарного шунтирования в мире связано в первую очередь с повторными вмешательствами, в то же время относящимися к операциям повышенного риска. Таким образом, большое значение имеет применение МИРМ у повторно оперированных больных.
Неотложная кардиохирургическая помощь
К патологии, требующей экстренной и неотложной кардиохирургической помощи, относятся врожденные пороки сердца (ВПС), приобретенные пороки сердца (ППС) и нарушения ритма сердца (НРС).
Среди ВПС, требующих экстренных и неотложных кардиохирургических вмешательств, — структурные критические ВПС (критический аортальный стеноз, критическая коарктация аорты, полный разрыв дуги аорты, транспозиция магистральных артерий с интактной межжелудочковой перегородкой и т. п.) и врожденные НРС (повторная желудочковая тахикардии, синдром удлиненного интервала QT, врожденная атриовентрикулярная блокада сердца).
Критический ВПС — это патология развития сердца, которая препятствует адекватному сердечному выбросу с достаточным для поддержания жизни давлением и насыщением крови кислородом и приводит в отсутствие экстренной кардиохирургической помощи к смерти в первые дни жизни.
Одной из актуальных проблем детской кардиологии и кардиохирургии является ранняя диагностика ВПС, особенно критических. Своевременная пренатальная диагностика критических ВПС позволяет определить пренатальную тактику, спланировать рождение ребенка вблизи кардиохирургического стационара, подготовить медицинский персонал, операционную, палату интенсивной терапии, поскольку именно от этих факторов зависит успех хирургической коррекции и жизни пациента.
В особом внимании и неотложных действиях медицинского персонала нуждаются пациенты с острой расслаивающей аневризмой аорты (РАА), инфекционным эндокардитом (ИЭ) с массивными вегетациями на структурах сердца и больные с острым коронарным синдромом (ОКС). Именно эти пациенты нуждаются в четкой диагностике и оказании высокоспециализированной неотложной помощи. Основная цель — сократить время ожидания операции и оптимизировать маршрут пациента, снизить риск преждевременной смерти. В частности, этим задачам отвечает создание «гибридной» операционной, позволяющей проводить диагностику и оперативное вмешательство в одном помещении, сразу после установления окончательного диагноза [19].
К опасным для жизни состояниям, возникающим вследствие патологии клапанов сердца, относят критический митральный стеноз, критический аортальный стеноз, ИЭ при наличии массивных вегетаций с угрозой фрагментации и эмболии жизненно важных органов, повреждения клапанного аппарата сердца при остром инфаркте миокарда (ОИМ) и ИЭ (разрыв створок клапана, отрыв хорд и папиллярных мышц). Отдельно следует отметить опасные для жизни состояния, возникающие после операций на сердце, а именно тромбоз и дисфункция искусственного клапана сердца.
Экстренная или неотложная помощь пациентам с ИБС может быть оказана как интервенционным кардиологом, так и кардиохирургом. В последние годы углубляется сотрудничество между этими специалистами для оказания скорой и эффективной помощи больным с опасными для жизни поражениями КА.
Трансплантация сердца
Трансплантация сердца всегда была ограниченной опцией для пациентов в конечной стадии ХСН. Рост количества пациентов с рефрактерной ХСН и неготовность общества к донорству органов обусловливают длительное пребывание в списке ожидания трансплантации. Более 60 % трансплантаций выполняют в Европе у пациентов по высокоургентным показаниям, оставляя мало шансов дождаться пациентам с менее ургентными состояниями. В три раза больше пациентов попадают в лист ожидания, чем реально выполняют трансплантации. Последние данные свидетельствуют о том, что находящиеся на поддержке ПДЛЖ пациенты имеют лучшие показатели выживаемости в ожидании трансплантации. В связи с этим устройства МПК, особенно ПДЛЖ, все чаще рассматривают как альтернативу трансплантации сердца. Сначала ПДЛЖ разрабатывали как кратковременный мост к трансплантации, теперь их применяют в течение месяцев и даже лет у больных, которым приходится долго ждать (на сегодняшний день только 10 % пациентов с устройствами МПК в качестве моста к трансплантации получают донорский орган в течение 1 года), или как пожизненную терапию у больных, не являющимися кандидатами для трансплантации. Высокие показатели 2–3-летней выживаемости тщательно отобранных пациентов, которым имплантируют современные модели устройств постоянного кровотока, сопоставимы с ранней выживаемостью после трансплантации сердца [20].
Заключение
На сегодняшний день АКШ представляет собой одну из наиболее распространенных операций в кардиохирургии, позволяющую пациентам с ИБС добиться значительного клинического улучшения в короткие сроки и вернуться к привычному ритму жизни. Актуальные направления уменьшения инвазивности кардиохирургии: выполнение операций на работающем сердце без искусственного кровообращения, пережима аорты и кардиоплегии, а также использование альтернативных доступов вместо стернотомии. Трансплантация сердца остается единственным методом в кардиохирургии, который позволяет увеличить выживаемость пациентов с терминальной стадией сердечной недостаточности, с выраженными симптомами и неблагоприятным прогнозом, когда исчерпаны альтернативные возможности терапии.
Литература:
- Шалдыбин П. Д., Матвеева Е. С., Давыдов И. В. Кардиохирургия от момента её зарождения до наших дней // Вестник Совета молодых учёных и специалистов Челябинской области. — 2018. — № 3. — С. 40–45.
- Бокерия Л. А. Современные тенденции развития сердечно-сосудистой хирургии (20 лет спустя) // Анналы хирургии. — 2016. — № 21. — С. 10–18.
- Абзалова Г. Ф., Маянская С. Д., Терегулов Ю. Э., Абашин И. О., Хайруллин Р. Н. Изменения сердечной гемодинамики в зависимости от метода хирургической реваскуляризации миокарда. Вестник современной клинической медицины. 2015;8(4):7–12.
- Семенюк О. А. Сравнительная оценка клинической эффективности различных методик коронарного шунтирования: диссертация… кандидата Медицинских наук: 14.01.05 / Семенюк Оксана Андреевна; [Место защиты: Российский университет дружбы народов], 2016. — 115 с.
- Акчурин Р. С., Ширяев А. А., Васильев В. П., Галяутдинов Д. М., Власова Э. Е. Современные тенденции в коронарной хирургии. Патология кровообращения и кардиохирургия. 2017;21(3S):34–44.
- Aldea G. S., Bakaeen F. G., Pal J. The Society of Thoracic Surgeons clinical practice guidelines on arterial conduits for coronary artery bypass grafting. Ann Thorac Sur. 2016;101:801–9.
- Neumann FJ, Sousa-Uva M, Ahlsson A, Alfonso F, Banning AP, Benedetto U, et al. 2018 ESC/EACTS Guidelines on myocardial revascularization. Eur Heart J. 2019 Jan 7;40(2):87–165.
- Тунгусов Д. С., Кондратьев Д. А., Мотрева А. П., Исаев М. Н., Екимов С. С., Чернов И. И. Сравнительная оценка медицинской и экономической эффективности двух методов коронарного шунтирования у пожилых пациентов: на работающем сердце без искусственного кровообращения и в условиях искусственного кровообращения. Анналы хирургии. 2014;4:13–19.
- Зотов А. С., Клыпа Т. В., Борисов Д. В., Ильин М. В. Реваскуляризация миокарда в условиях вспомогательного искусственного кровообращения у пациентов с высокой степенью риска. Клиническая практика. 2016;3:48–52.
- Рекомендации ESC/EACTS по реваскуляризации миокарда 2018 // Российский кардиологический журнал. — 2019. — № 8. — С.151–226.
- Amouzeshi A, Amouzeshi Z, Teshnizi MA, Moeinipour AA, Maleki MH. Off-Pump Versus On-Pump Coronary Artery Bypass Graft Surgery Outcomes During 6 Years: A Prospective Cohort Study. Acta Medica Iranica. 2017;55(9):578–84.
- Жбанов И. В. Реконструктивная хирургия осложненных форм ишемической болезни сердца / И. В. Жбанов, А. В. Молочков, Б. В. Шабалкин. — М.: Практика, 2013. — 152 c.
- Чернявский А. М., Несмачный А. С., Бобошко А. В., Николаев Д. А., Бобошко В. А., Эфендиев В. У. Хирургическое лечение ишемической болезни сердца у пациентов с низкой фракцией выброса левого желудочка на работающем сердце в условиях искусственного кровообращения: непосредственные результаты. Патология кровообращения и кардиохирургия. 2015;19(1):51–8.
- Alexander J. H., Smith P. K. Coronary-Artery Bypass Grafting. N Engl J Med. 2016;374:1954–64.
- Cao C, Indraratna P, Doyle M, et al. A systematic review on robotic coronary artery bypass graft surgery. Ann Cardiothorac Surg. 2016; 5(6): 530–543. doi:10.21037/acs.2016.11.08.
- Baumgartner H, Falk V, Bax JJ, De Bonis M, Hamm C, Holm PJ, et al. 2017 ESC/EACTS Guidelines for the management of valvular heart disease. Eur Heart J. 2017;38:2739–91.
- Bonatti J, Wallner S, Crailsheim I, Grabenwöger M, Winkler B. Minimally invasive and robotic coronary artery bypass grafting-a 25-year review. J Thorac Dis. 2021; 13(3): 1922–1944. doi:10.21037/jtd-20–1535.
- Доути Д. Б. Кардиохирургия. Техника выполнения операций / Д. Б. Доути. — М.: МЕДпресс-информ, 2014. — 628 c.
- Болезни сердца по Браунвальду. Руководство по сердечно-сосудистой медицине. В 4 томах. Том 1. — М.: Рид Элсивер, 2018. — 624 c.
- Шалдыбин П. Д., Злaкомaновa О. Н., Давыдов И. В. Трансплантация сердца — проблема нашего времени // Вестник Совета молодых учёных и специалистов Челябинской области. — 2018. — № 3. — С. 46–50.
Основные термины (генерируются автоматически): пациент, LAA, АКША, медикаментозная терапия, хирургическое вмешательство, передняя нисходящая ветвь, трансплантация сердца, аортальный клапан, CYBERLENINKA, операция.
Детская кардиохирургия: Руководство для врачей — Л. А. Бокерия, К. В. Шаталова

Книга «Детская кардиохирургия: Руководство для врачей»
Авторы: Л. А. Бокерия, К. В. Шаталова
ISBN 978-5-7982-0356-7
В руководстве обобщены современные представления о хирургическом лечении заболеваний; сердца у детей. Рассмотрены возрастные особенности физиологии и патофизиологии сердечно-сосудистой системы. Изложены современные взгляды на диагностику заболеваний, анестезиологическое и перфузионное обеспечение безопасности операции, интенсивную терапию после операции. Представлены условия и результаты применения систем экстракорпоральной поддержки сердечно-сосудистой системы и трансплантации сердца у детей. Большое место отводится рассмотрению анатомии, гемодинамики, семиотики и естественного течения врожденных пороков сердца, показаний, способов, а также результатов хирургического лечения врожденных заболеваний сердца. Особо выделен раздел по лечению нарушений ритма сердца и проводимости у детей.
Раздел I. Общие вопросы
I.1. Кровообращение плода. Семиотика заболеваний сердца
I.2. Организация кардиологической помощи детям
I.3. Возможности эхокардиографии плода
I.4. Современные методы визуализации в детской кардиохирургии
I.5. Общие вопросы хирургии врожденных пороков сердца
I.6. Трансплантация сердца и сердечно-легочного комплекса у детей
I.7. Имплантаты в детской кардиохирургии
I.8. Эндоваскулярное лечение больных с врожденными пороками сердца
I.9. Анестезиологическое обеспечение в детской кардиохирургии
I.10. Интенсивная терапия в раннем послеоперационном периоде у детей после кардиохирургических вмешательств
I.11. Искусственное кровообращение у детей
I.12. Современные стратегии защиты миокарда у детей
I.13. Вспомогательное кровообращение у детей
Раздел II. Врожденные пороки сердца
II.1. Номенклатура и классификация врожденных пороков сердца
II.2. Аномалии формирования и положения сердца. Эктопия сердца. Аномалии дренажа системных вен
II.3. Аномалии развития предсердного сегмента
II.3.1. Дефект межпредсердной перегородки. Частичный аномальный дренаж легочных вен
II.3.2. Тотальный аномальный дренаж легочных вен
II.3.3. Стенозы и гипоплазия легочных вен
II.3.4. Трехпредсердное сердце
II.3.5. Врожденные аневризмы предсердий
II.4. Аномалии атриовентрикулярного соединения
II.4.1. Общий атриовентрикулярный канал
II.4.2. Врожденная патология митрального клапана
II.4.3. Аномалия Эбштейна
II.4.4. Бивентрикулярное прикрепление атриовентрикулярных клапанов. Смещенные атриовентрикулярные клапаны
II.5. Аномалии желудочкового сегмента
II.5.1. Дефект межжелудочковой перегородки
II.5.2. Двухкамерный правый желудочек
II.5.3. Criss-cross сердце
II.5.4. Врожденные дивертикулы сердца
II.6. Аномалии выхода из левого желудочка
II.6.1. Обструкция выхода из левого желудочка
II.6.2. Аортолевожелудочковый тоннель. Аневризма синусов Вальсальвы
II.7. Аномалии выхода из правого желудочка
II.7.1. Изолированная обструкция выводного отдела правого желудочка. Аномалии развития легочных артерий.
Сообщения между легочными артериями и левым предсердием
II.7.2. Атрезия легочной артерии с интактной межжелудочковой перегородкой
II.7.3. Агенезия клапана легочной артерии
II.8. Аномалии конотрункуса
II.8.1. Тетрада Фалло
II.8.2. Атрезия легочной артерии с дефектом межжелудочковой перегородки
II.8.3. Транспозиция магистральных сосудов
II.8.4. Двойное отхождение магистральных сосудов от желудочков сердца
II.8.5. Общий артериальный ствол
II.8.6. Аортолегочное окно. Аномальное отхождение одной из легочных артерий от аорты
II.9. Атриовентрикулярная и вентрикулоартериальная дискордантность
II.10. Пороки с одножелудочковой гемодинамикой. Операции обхода правого сердца
II.11. Синдром гипоплазии левых отделов сердца
II.12. Аномалии коронарных артерий
II.13. Открытый артериальный проток
II.14. Сосудистые кольца и сосудистые петли
К.В. Шаталов (глава написана при участии Н.С. Турдиевой)
II.15. Коарктация аорты. Перерыв дуги аорты. Гипоплазия дуги аорты
Раздел III. Другие заболевания сердца
III.1. Педиатрическая аритмология
III.1.1. Фетальные аритмии
III.1.2. Нарушения ритма сердца у детей
II.2. Гипертензионная сосудистая болезнь легких, ассоциированная с врожденными пороками сердца
III.3. Первичные опухоли сердца
III.4. Инфекционный эндокардит у детей
| Автор | Л. А. Бокерия, К. В. Шаталова |
| ISBN | 978-5-7982-0356-7 |
| Вес | 2.6 кг |
| Год | 2016 |
Детская кардиохирургия: Руководство для врачей — Л. А. Бокерия, К. В. Шаталова отзывы
Оставьте отзыв об этом товаре первым!
История просмотренных товаров
Ишемическая болезнь сердца (ИБС) лидирует среди причин смертности трудоспособного населения развитых стран. Поиск оптимальных методов ее лечения является задачей жизненной важности. Вот уже почти полвека метод прямой реваскуляризации миокарда – коронарное шунтирование (КШ) является основой лечения этой болезни. Впервые примененное в клинической практике в конце 1960-х гг. КШ стало наиболее изучаемым из хирургических вмешательств; в наши дни в мире ежегодно выполняется более полумиллиона операций, и количество их продолжает расти.
Показания
В течение почти 30 лет КШ оставалось единственным методом коронарной реваскуляризации; в этот период показания к КШ формировались исходя из возможностей медикаментозной терапии того времени и сравнения его результатов с результатами КШ в разных клинических группах [1]. Однако с развитием научно-технического прогресса и внедрением в практику чрескожных коронарных вмешательств (ЧКВ) появился выбор среди способов реваскуляризации; эндоваскулярные методы прочно заняли свое место в лечении ИБС и стали альтернативой хирургии. Кроме того, в течение последнего десятилетия медикаментозная терапия ИБС претерпела значительные преобразования и показала улучшение результатов, особенно в случаях стабильного течения болезни. Это привело к переосмыслению показаний к хирургической реваскуляризации (в сторону их сужения), особенно при учете возможных церебральных осложнений. И все-таки, основываясь на последних рандомизированных клинических исследованиях (РКИ), в которых принимали участие наиболее тяжелые больные и изучался более широкий спектр конечных клинических исходов, можно утверждать, что КШ остается «золотым стандартом» ведения больных со стенозом ствола левой коронарной артерии и трехсосудистым поражением венечного русла [2].
Коронарная реваскуляризация преследует 2 цели: облегчение клинических проявлений, или повышение качества жизни, и улучшение прогноза – как ближайшего, так и отдаленного. Отсюда следует, что показания к реваскуляризации (и ЧКВ, и КШ) могут быть классифицированы на клинические и анатомические (или прогностические).
Клиническими показаниями к коронарной реваскуляризации принято считать:
– наличие тяжелой стенокардии, сохраняющейся несмотря на оптимальную медикаментозную терапию; другими словами – отсутствие эффекта от медикаментозной терапии;
– недостаточность кровообращения на фоне доказанной ишемии;
– острый коронарный синдром.
Анатомические, или прогностические, показания к реваскуляризации определяют приоритет КШ перед ЧКВ в таких случаях, как:
– стеноз ствола левой коронарной артерии (ССЛКА) >50%;
– эквивалент ССЛКА (проксимальные стенозы передней нисходящей артерии и огибающей артерии) >70%;
– трехсосудистое поражение коронарного русла в сочетании с дисфункцией левого желудочка (ЛЖ) сердца (фракция выброса ЛЖ <50%);
– трехсосудистое поражение коронарного русла с доказанным большим объемом ишемизированного миокарда;
– двухсосудистое поражение с обязательным вовлечением проксимального отдела передней нисходящей артерии в сочетании с дисфункцией ЛЖ (фракция выброса ЛЖ <50%).
Формирование показаний к реваскуляризации происходило на основании сравнения результатов медикаментозного, эндоваскулярного и хирургического лечения больных разных клинических групп, отраженных в многочисленных РКИ, метаанализах и крупных наблюдательных регистрах последнего десятилетия [3, 4]. Наиболее убедительное сопоставление ЧКВ и КШ проведено в рандомизированной подгруппе (n=705) исследования SYNTAX: КШ характеризовалось достоверно более высоким риском церебральных осложнений (2,7% против 0,3%), но значительно более редкой частотой повторных реваскуляризаций (6,7% против 12,0%, p<0,02) [5].
Необходимо подчеркнуть, что в наши дни формулировка показаний к применению того или иного метода реваскуляризации в каждом конкретном случае не основывается на догме, а складывается с учетом анализа эффективности и побочных эффектов проводимой медикаментозной терапии, коронарной анатомии, подтвержденной ишемии, доступных результатов сравнений ЧКВ и КШ в подобных ситуациях [6], оценки технических возможностей и опыта операторов, а также выбора самого больного. При любом выборе реваскуляризации лечение больного будет комбинированным (реваскуляризация + оптимальная медикаментозная терапия).
Стратификация риска
Шкалы Parsonnet, Society of Thoracic Surgeons (STS), Mayo Clinic Risk Score, ACEF score, Euroscore, Euroscore II разработаны для предсказания риска хирургической смертности; некоторые из них включают в число детерминант не только возраст и фракцию выброса ЛЖ, но и уровень креатинина [7]. Каждый хирург перед операцией осознает, что шкалы имеют лишь рекомендательный характер и окончательное решение относительно тактики принимается командой врачей. КШ становится целесообразным и показанным, если его ожидаемая польза превосходит потенциальные опасности и жизнеугрожающие риски. Сегодня в повседневной клинической практике наиболее используемой системой является Euroscore II.
Подготовка к КШ
Предоперационное обследование больного предполагает детализацию клинической ситуации с целью формулировки показаний к КШ и стратификации риска. Сопутствующие заболевания (сахарный диабет (СД), ожирение, хроническая обструктивная болезнь легких, патология щитовидной железы) должны быть диагностированы и максимально компенсированы на догоспитальном этапе. Вероятным осложнением операции с применением аппарата искусственного кровообращения (ИК) и системной гепаринизации является желудочно-кишечное кровотечение при наличии его потенциальных источников. Мы настаиваем на 100-процентном проведении предоперационной гастроскопии даже при отсутствии клиники язвенной болезни – для выявления «немых» эрозивно-язвенных поражений; при их обнаружении КШ должно быть отложено до достижения эндоскопической ремиссии. Не вызывает сомнений факт повышения риска инфекционных послеоперационных осложнений при наличии не санированных перед операцией очагов инфекции. Поэтому поиск и излечение очагов инфекции при наличии маркеров воспаления обязательны. Санация полости рта даже без видимых признаков воспаления показана всем без исключения кандидатам на КШ.
Важную роль при подготовке к КШ мы отводим диагностике и детализации неврологического дефицита: как у пациентов со стенозами в каротидном бассейне, так и без них [8]. Для оценки и эффективного снижения риска неврологических осложнений пациенты должны быть дообследованы (допплероскопия ветвей дуги аорты, магнитно-резонансная томография головного мозга в ангиографическом режиме), при необходимости – консультированы неврологом с целью дифференцированного назначения предоперационной подготовки и соответствующего лечения начиная с первых суток послеоперационного периода.
Техника операции
Операцию КШ проводят для формирования нового пути кровотока в обход пораженных участков коронарных артерий, обычно в его эпикардиальной части. В качестве шунтов чаще всего используют левую внутреннюю грудную (маммарную) артерию (ЛВГА) и фрагменты большой подкожной вены (БПВ) голени и бедра. Применение правой внутренней грудной (ПВГА), лучевой (ЛА), правой желудочно-сальниковой артерий (ЖСА) и малой подкожной вены считается альтернативным и имеет свои ограничения.
Наиболее часто реваскуляризацию миокарда проводят с использованием ИК. Операцию начинают одновременным выделением сосудистых трансплантатов и выполнением срединной стернотомии. Вены нижних конечностей выделяют из отдельных разрезов преимущественно обеих голеней. ЛА выделяют в комплексе с сопутствующими венами, используя меры профилактики артериального спазма – наружное орошение раствором папаверина.
Артериальные ветви ЛА клипируют.
После выполнения стандартной срединной стернотомии внутренние грудные артерии выделяют до вскрытия перикарда, мобилизируя ножку трансплантата с окружающими тканями.
После разведения краев грудины ранорасширителем Т-образно вскрывают перикард и подшивают его к краям раны. После полной гепаринизации (300–400 Ед./кг веса) аортальную канюлю устанавливают несколько проксимальнее отхождения брахиоцефального ствола, для венозного дренажа чаще используют одну двухпросветную канюлю, проведенную через ушко правого предсердия в нижнюю полую вену. Полное ИК проводят с умеренной гипотермией до 28–32oС. В восходящий отдел аорты устанавливают кардиоплегическую канюлю. После стабилизации параметров гемодинамики в расчетном режиме выполняют поперечное пережатие аорты дистальнее кардиоплегической канюли и производят кардиоплегию введением 400–500 мл холодного калиевого раствора. В полость перикарда помещают замороженный до кашицеобразной консистенции физиологический раствор.
Выбор сосудов для шунтирования и ориентировочной локализации анастомозов обусловлен топографией поражения коронарного русла. Под оптическим увеличением острым скальпелем вскрывают эпикард над внешней поверхностью артерии в зоне анастомоза, затем – просвет артерии. Качественный оптический контроль при этой манипуляции позволяет выбрать место вскрытия артерии вне зоны атеросклеротической бляшки и предотвратить возможное ранение задней стенки артерии. Далее разрез артерии расширяют продольно специализированными изогнутыми по ребру ножницами до 4–8 мм. Формируют соустье аутовенозного или артериального трансплантата, соответствующее по размерам артериотомии. Для сосудистого шва аутовенозно-коронарного анастомоза используют нить 7/0 или 8/0, ayоартериально-коронарного – нить 8/0 (пролен) с атравматическими колющими иглами. Непрерывным швом сшивают только стенки сосудов, окружающие ткани вовлекаются в анастомоз в случаях истончения стенки коронарной артерии и угрозы прорезывания.
При тяжелом диффузном атеросклеротическом процессе в коронарных сосудах, отсутствии адекватного для выполнения анастомоза просвета или выраженном кальцинозе приходится использовать методику эндартерэктомии. Путем удаления измененной интимы из коронарной артерии добиваются того, чтобы в дистальном направлении были освобождены все русло, а также боковые и септальные ветви. После выполнения эндартерэктомии на всем протяжении артериотомного разреза выполняют шов с коронарным шунтом. Протяженность такого анастомоза может быть более 3 см.
Все более широкое внедрение секвенциальных («бок в бок») анастомозов, множественного аутоартериального КШ, использование бимаммарных Т- и У-образных конструкций, ЖСА настоятельно требуют повышения прецизионности вмешательств и обусловливают перспективность применения методов микрохирургии.
Использование микрохирургической техники и операционного микроскопа в коронарной хирургии существенно улучшают качество выполнения дистальных анастомозов. В своей практике мы используем операционный микроскоп потолочного или напольно-штативного крепления. Оптическое увеличение меняется в диапазоне 4–48 крат, для комфортной работы достаточно 6–12 крат. Преимуществами перед общепринятыми лупами-очками являются:
– единое поле зрения хирурга и ассистента;
– переменное увеличение для исключения технических ошибок;
– хорошая визуализация измененной сосудистой стенки;
– возможность применения микрошовного материала (нити 8–9/0) и микрохирургических инструментов.
Надо отметить, что особенностью данной технологии является непрямое видение операционного поля для хирурга и ассистента и, как следствие, – непривычная мануальная координация выполнения дистальных анастомозов. Ограниченное рабочее поле (поле зрения 4–5 см) требует навыка работы инструментами с минимальными движениями кистей рук.
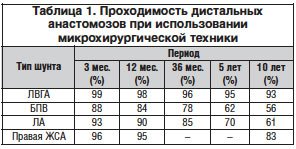
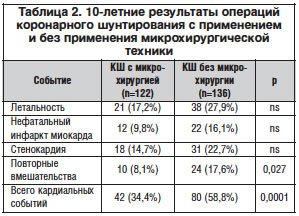
Опыт выполненных нами более 6500 операций прямой реваскуляризации миокарда с использованием операционного микроскопа позволяет рекомендовать кардиохирургам шире использовать микрохирургическую технику в коронарной хирургии. В таблицах 1 и 2 приведены результаты выполненного нами исследования 10-летнего наблюдения за пациентами, оперированными в 1998–2001 гг.
Для формирования проксимальных анастомозов после снятия поперечного зажима с аорты производят боковое отжатие аорты, формируют овальные перфорационные отверстия несколько больше диаметра аутовенозных шунтов, ориентированные соответственно функционально выгодной позиции шунта. Аутовенозные трансплантаты с аортой анастомозируют непрерывным швом нитью 6/0.
После реваскуляризации миокарда и стабилизации гемодинамики прекращают ИК, деканюлируют аорту и правые отделы сердца, дренируют переднее средостение, полость перикарда и, при необходимости, вскрытые плевральные полости. Остеосинтез грудины выполняют преимущественно проволочными серкляжными швами. Мягкие ткани раны ушивают послойно синтетическим шовным материалом.
Не будет преувеличенным утверждение о том, что внедрение маммарокоронарного шунтирования (МКШ) в 1970-х гг. ознаменовало новую эру коронарной хирургии, когда удалось значительно улучшить как ближайшие, так и отдаленные результаты КШ. Революция в хирургии, произошедшая с приходом МКШ, сравнима по значимости с другой, более поздней революцией, произошедшей в интервенционной кардиологии с появлением стентов с лекарственным покрытием. Отдаленная проходимость (10–15 лет) маммарных шунтов превышает 90%, что дает существенное увеличение выживаемости [9]. В наши дни применение МКШ является «золотым стандартом» коронарной хирургии.
Бимаммарное шунтирование, без сомнения, увеличивает потенциальную пользу операции, однако не всегда может быть использовано у больных с СД и ожирением, т. к. ассоциируется с более высоким риском раневой инфекции из-за деваскуляризации грудины. ПВГА может быть использована на ножке, т. е. с сохранением своего анатомического источника, а может быть и свободным артериальным трансплантатом. К сожалению, достаточного количества РКИ, доказывающих преимущество бимаммарного шунтирования перед использованием только ЛВГА, пока нет. Отдаленные результаты обоих вмешательств в ближайшем будущем будут проанализированы в Arterial Revascularisation Trial [10].
Первоначальный опыт использования левой ЛА в качестве шунта показал худшие, чем при венозном шунтировании, результаты и вызвал пессимизм. Однако с улучшением техники выделения и применением способов борьбы со спазмом ситуация изменилась, и результаты ряда РКИ это подтвердили [11]. Во многих клиниках изучалась возможность использования ЖСА, перспективы ее рутинного применения пока исследуются.
Клиническая практика показывает, что у молодых пациентов, не страдающих СД и ожирением, выполнение мультиартериального шунтирования является весьма оправданным и дает надежду на хороший отдаленный результат.
С целью минимизации кровопотери используется аутотрансфузия концентрированных отмытых эритроцитов до, во время и после ИК с использованием технологии Cell Saver. Это позволяет сократить потребность в донорской крови, снизить частоту трансфузионных, легочных, почечных и мозговых осложнений, а также уменьшить время пребывания пациентов в стационаре на 25–30%.
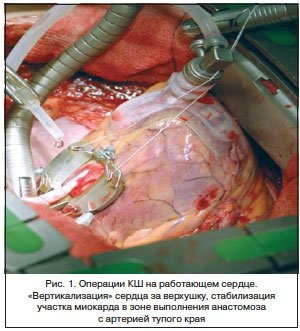
КШ без ИК (off-pump)
Вмешательство проводится без применения ИК на работающем сердце, при этом локальная стабилизация участка миокарда в зоне дистального анастомоза достигается с помощью специально разработанных устройств (рис. 1).
Первоначально данная методика была предложена как хирургическое вмешательство с заведомо более низким риском периоперационного инсульта. В нашем исследовании (оно было проведено в 2007–2008 гг.) это нашло подтверждение. Мы провели сравнение частоты церебральных осложнений при КШ с ИК и без ИК среди больных старше 70 лет. В этой группе, где особенно оправдан выбор техники операции без ИК, инсульт развивался в 3, а энцефалопатия – в 2 раза реже, чем при «традиционном» КШ. В некоторых РКИ, однако, не было получено достоверного снижения частоты неврологических осложнений при выполнении КШ на бьющемся сердце. Преимущество этой технологии еще ждет своего убедительного подтверждения или опровержения. Принято, что КШ off-pump является технологически не рутинным, а сложным вмешательством, и рекомендовано для проведения только в высокоспециализированных центрах.
Результаты и осложнения
Летальность в специализированных клиниках составляет <2%. В неосложненной группе пациентов моложе 65 лет, без нарушения функции ЛЖ и клинических признаков недостаточности кровообращения 30-дневная летальность не превышает 1%. Необходимо заметить, что такой уровень летальности сохраняется уже длительное время, несмотря на то, что контингент оперированных стал значительно тяжелее и старше. Это объясняется накоплением опыта и прогрессом в анестезиологии, перфузиологии, хирургической технике, послеоперационном наблюдении и медикаментозном ведении.
Кровотечение после КШ является нечастым, но грозным осложнением и развивается на фоне массивной гепаринизации вследствие нарушений гемостаза и функции тромбоцитов при ИК. Средний объем кровопотери при неосложненном КШ составляет 400–600 мл, что обычно возмещается с помощью кровосохраняющих технологий (аппарат «Сell Saver» и его отечественные аналоги) и трансфузий; рестернотомия и хирургическая остановка кровотечения необходимы в 0,5–2% случаев.
Наиболее частыми клинически значимыми и влияющими на прогноз ранними осложнениями КШ являются церебральные расстройства, раневая инфекция и почечная дисфункция, реже развиваются периоперационный инфаркт и тромбоз глубоких вен.
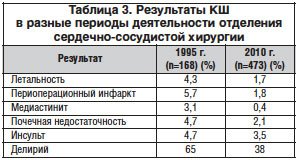
К неблагоприятным неврологическим исходам КШ относят инсульт, делирий и так называемое нарушение когнитивных функций [12]. Несмотря на прогресс в технологии, частота их, к сожалению, остается довольно высокой и устойчивой. Для иллюстрации мы сравнили результаты нашей годичной деятельности в разные периоды работы – за 1995 и 2010 гг. (табл. 3). Сопоставление только результатов КШ показало, что за 15 лет почти втрое возросло количество операций, и мы сумели достичь заметного снижения госпитальной летальности, частоты периоперационного инфаркта, медиастинита и даже почечной недостаточности. Однако в борьбе с церебральными осложнениями наши успехи оказались гораздо более скромными. Наиболее значимыми причинами церебральных осложнений являются снижение церебральной перфузии и эмболия, а реализуются эти причины в результате 3-х основных моментов: собственно ИК, манипуляций на аорте и нарушений ритма сердца. Сочетанное поражение магистральных артерий головы мы рассматриваем как крайне неблагоприятный фон, на котором реализуется действие указанных механизмов.
Медиастинит развивается в 1–2% случаев, факторами риска являются тяжелый диабет, высокий индекс массы тела, использование стероидов и рестернотомия. Современная антибиотикотерапия и применение препаратов, содержащих иммуноглобулины, часто позволяют справиться с инфекцией при так называемом закрытом ведении.
Почечная дисфункция, требующая заместительной терапии, возникает у 1–5% пациентов и в большинстве случаев может быть предсказана; наиболее частым ее субстратом являются диабетическая нефропатия и гипоперфузия. Развитие острой почечной недостаточности в значительной степени влияет на прогноз, удлиняет пребывание больного в реанимации и отделении, повышает стоимость лечения.
К наиболее частым послеоперационным проблемам мы относим нарушения ритма сердца (фибрилляция предсердий), легочные осложнения (плеврит, ателектазы, пневмония), постперикардиотомный синдром, анемию и нарушение заживления ран.
Послеоперационная реабилитация
Активизация больного начинается с 1-х сут послеоперационного периода (полулежачее и пассивное сидячее положение – в 1-е сут, активное сидячее положение в постели, пересаживание на кресло, переход в вертикальное положение и ходьба по палате – со 2-х сут). Особое внимание уделяется раннему началу дыхательной гимнастики.
С целью профилактики нарушений ритма и проводимости в течение первых 5–7 сут после операции необходим постоянный контроль электролитных нарушений; поддержание сывороточной концентрации электролитов на нормальном уровне в большинстве случаев обеспечивает удержание синусового ритма. Наиболее частым вариантом нарушения ритма в послеоперационном периоде является фибрилляция предсердий.
В стандартном случае медикаментозная терапия в периоде восстановления включает в себя:
а) базисные препараты, использование которых является обязательным и 100-процентным (низкомолекулярный гепарин, ацетилсалициловая кислота, антибиотик, противогрибковый антибиотик, противоязвенный препарат);
б) препараты, которые являются не обязательными, но значительно востребованными в послеоперационном периоде (β-блокаторы и препараты калия);
в) различные препараты для симптоматического лечения (анальгетики, муко- и бронхолитики, антиаритмики, железо, эпоэтин β).
Результаты внедрения нами «программы ускоренной реабилитации» показали, что значительное укорочение госпитального послеоперационного периода – до 7–8 сут – возможно [13]. Однако при современном составе больных только 15–20% пациентов (неосложненные случаи КШ) могут действительно войти в эту программу; остальные требуют более длительного восстановления в отделении и продолжения реабилитации вне отделения хирургии. Наш опыт показывает, что для успеха хирургического лечения сегодняшнего контингента больных необходимо предусмотреть период пребывания в реабилитационном учреждении, желательно специализированном, длительностью не менее 14–20 сут. Цели такого долечивания: окончательное восстановление физической активности и адаптация к жизни, приобретение уверенности в себе и знаний о своем состоянии и окончательный подбор медикаментозной терапии перед выпиской (при необходимости терапии антикоагулянтами, тяжелом диабете и переходе с инсулина на пероральные препараты, для долечивания неврологических осложнений, анемии и др.). Уже на этой стадии реабилитации больной начинает вторичную профилактику заболевания, которая будет продолжаться дальше. В большинстве западных стран эту фазу реабилитации определяют как временной интервал – от 3 до 6 нед. после выписки.
Патогенез изменений в организме при регулярных физических нагрузках изучен, польза их не подвергается сомнению. По нашему мнению и опыту, необходимо соблюдать следующие важнейшие требования к планированию физических тренировок: регулярность, дискретность, т. е. плавное ступенчатое наращивание нагрузки, и обязательный учет состояния миокарда и наличия аритмий при выборе модели физических тренировок (умеренные или интенсивные).
Обычно индивидуальная программа физических тренировок определяется на основании результатов нагрузочной пробы. При исследованиях эффективности КШ еще в 1980–1990-х гг. стало очевидным, что большинство больных способны выполнить нагрузочную пробу на 12–14-е сут послеоперационного периода, причем в подавляющем большинстве случаев – со значительным приростом двойного произведения в сравнении с дооперационным результатом [14]. В подавляющем большинстве случаев критерием прекращения нагрузочной пробы после операции является физическая усталость пациента, реже – достижение субмаксимальной частоты сердечных сокращений. Результаты нагрузочной пробы становятся отправной точкой при наращивании объема двигательной активности и определении необходимости лекарственной поддержки этого процесса. Повторные тесты с физической нагрузкой проводятся как контроль адаптации. Физические тренировки могут проходить в виде индивидуальных и групповых занятий с методистом, пешеходных прогулок (т. е. дозированной ходьбы), велотренировок, плавания в бассейне и занятий на тренажерах. Наиболее приемлемыми видами физических тренировок мы считаем ходьбу, в т. ч. подъем по лестнице, а также велотренажер. Мы придерживаемся классических принципов активизации: сначала наращивать объем нагрузки, а уже потом – ее интенсивность. В применении к ходьбе это означает: сначала наращивать дистанцию, а потом, при уверенном преодолении 4–5 км без отдыха, – и темп ходьбы.
Медикаментозная терапия в фазе реабилитации, вторичная профилактика ИБС после КШ
Грамотно организованный реабилитационный этап у больных, перенесших КШ, становится началом вторичной профилактики атеросклероза. Вторичная профилактика, или кардиопротективная стратегия, или 3-я фаза кардиореабилитации – это не только программа продолжения физического тренинга. Сюда включаются контроль факторов риска атеросклероза (дислипидемия, курение, гипергликемия, артериальная гипертония (АГ), ожирение), адекватный амбулаторный медицинский контроль и психосоциальная поддержка (рис. 2).
Адекватный амбулаторный медицинский контроль предполагает назначение антитромботической терапии, соответствующей ситуации и требованиям времени; эффективной и безопасной гиполипидемической терапии (статины, статины + эзетимиб, фибраты) с обязательным достижением рекомендованных для больных высокого риска целевых уровней холестерина, холестерина липопротеидов низкой плотности и триглицеридов; по показаниям – плазмаферез, раннее выявление стенозирования и/или тромбоза шунтов и прогрессии коронарного атеросклероза на основании регулярного неинвазивного обследования; своевременное решение о проведении повторной ангиографии и ЧКВ.
Организация специализированной медицинской реабилитации больных ИБС после операций КШ – это новое направление в здравоохранении РФ. Важность данной проблемы, имеющей не только медицинское, но и большое социально-экономическое значение, отмечена в приказе Министерства здравоохранения и социального развития РФ № 44 от 2006 г. «О долечивании (реабилитации) больных в условиях санатория». В документе говорится о необходимости формирования концепции реабилитации этой категории больных в условиях специализированных центров восстановительной медицины. К сожалению, на сегодняшний день вопрос взаимодействия между кардиохирургическими центрами и амбулаторными медицинскими учреждениями остается далеким от окончательного разрешения.
Литература
1. Igbal J., Serruys P.W., Taggart D.P. Optimal revascularisation for complex coronary artery disease // Nat Rev Cardiol. 2013. Vol. 10. P. 635–647.
2. Wijns W., Kolh P., Danchin N. et al. Task Force on Myocardial Revascularisation of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Guidelines on myocardial revascularisation // Eur. Heart J. 2010. Vol. 31 P. 2501–2555.
3. Shomig A., Mehilli J., de Waha A., Seyfarth M., Pache J., Kastrati A. A meta-analysis of 17 randomised trials of a percutaneous coronary intervention-based strategy in patients with stable coronary artery disease // J Am Coll Card. 2008. Vol. 52. Р. 894–904.
4. Naik H., White A.J., Chakravarty T., Forrester J., Fontana G., Kar S., Shah P.K., Weiss R.E., Makkar R. A meta-analysis of 3773 patients treated with percutaneous coronary intervention or surgery for unprotected left main coronary artery stenosis // JACC Cardiovasc Interv. 2009. Vol. 2. Р. 739–747.
5. Mohr F.W., Morice M.C., Kappetein P.A. et al. Coronary artery bypass graft surgery versus percutaneous coronary intervention in patients with three vessel disease and left main coronary disease: five-year follow-up of the randomised, clinical SYBTAX Trial // Lancet. Vol. 381 (2013). P. 629–638.
6. Акчурин Р.С., Ширяев А.А., Галяутдинов Д.М., Васильев В.П., Руденко Б.А., Колегаев А.С., Черкашин Д.И., Емельянов А.В., Вдовенко Ю.В. Коронарное шунтирование при рецидиве стенокардии после ангиопластики со стентированием коронарных артерий // Кардиологический вестник. 2013. № 2. С. 12–17.
7. Nashef S.A., Roques F., Michel P., Gauducheau E., Lemeshow S., Salamon R. European system for cardiac operative risk evaluation (EuroSCORE) // Eur J Cardiothorac Surg. 1999. Vol. 16. Р. 9–13.
8. John R., Choudhri A. F., Weinberg A. D., Ting W., Rose E. A., Smith C. R. Multicenter review of preoperative risk factors for stroke after coronary artery bypass grafting // Annals of Thoracic Surgery. 2000. Vol. 69. Р. 30–35.
9. Loop F.D., Lytle B.W., Cosgrove D.M. et al. Influence of the internal mammary-artery graft on 10-year survival and other cardiac evebts // N Engl J Med. 1986. Vol. 314. P. 1–6.
10. Taggart D.P., Lees B., Grey A., Altman D.G., Flather M., Channon K. Protocol for the Arterial Revascularisation Trial (ART) / A randomiset trial to compare survival following bilateral versus single internal mammary grafting in coronary revascularization // Trials. 2006. Vol. 7. P. 7.
11. Achouh P., Isselmou K., Boutekadjirt R. et al. Reappraisal of a 20-year experience with the radial artery as a conduit for coronary bypass grafting // Eur. J. Cardiothorac. Surg. 2012. Vol. 41 (1). P. 87–92.
12. Gottesman R.F., Sherman P.M., Grega M.A. et al. Whatershed strokes after cardiac surgery: diagnosis, ethiology, and outcome // Stroke. 2006. Vol. 37. Р. 2306–2311.
13. Власова Э.Е., Комлев А.Е., Васильев В.П., Ширяев А.А., Лепилин М.Г., Акчурин Р.С. Опыт ранней реабилитации больных после операций коронарного шунтирования // Ангиология и сосудистая хирургия. 2010. № 1. С. 21–34.
14. Акчурин Р.С., Агапов А.А., Власова Э.Е., Покровский С.Н., Павлов Н.А., Творогова М.Г. Аутовенозное коронарное шунтирование: риск ранних и годичных окклюзий шунтов при дислипидемии // Грудная и сердечно-сосудистая хирургия. 1996. № 2. С. 31–34.