libcats.org
Главная →
Руководство к практическим занятиям по пропедевтике внутренних болезней. Расспрос и физические методы исследования
Руководство к практическим занятиям по пропедевтике внутренних болезней. Расспрос и физические методы исследования
, Сипарова Л.С., Федоренко Н.М.
Состоит из двух частей. В первой описываются методы субъективных исследований, во второй — объективных. Прн этом большое внимание уделяется правилам И технике таких диагностических приемов, как расспрос, осмотр, пальпация. перкуссия, аускультация. Определенное место отводится вопросу, касающемуся медицинской деонтологии.
Популярные книги за неделю:
Только что пользователи скачали эти книги:
Представлена структура практических занятий по темам I семестра курса общей патологии. Каждое занятие сопровождается постановкой цели, списком основных теоретических вопросов и вопросов для самостоятельной работы студентов, перечнем макро- и описанием микропрепаратов, разбираемых в ходе занятия. К каждой теме прилагаются примеры ситуационных задач и контрольные вопросы. Руководство иллюстрировано оригинальными микрофотографиями, включает лабораторные работы, список рекомендуемой литературы и сетевых электронных ресурсов.
Учебное пособие «Руководство к практическим занятиям по общей патологии», подготовлено по дисциплине «Общая патология: патологическая анатомия, патофизиология» в соответствии с Федеральным государственным образовательным стандартом высшего профессионального образования для студентов, обучающихся по основным образовательным программам – программам специалитета по специальностям: 060601.65 – Медицинская биохимия, 060602.65 – Медицинская биофизика, 060609.65 – Медицинская кибернетика.
свернуть
Текущая страница: 1 (всего у книги 5 страниц) [доступный отрывок для чтения: 1 страниц]
Владимир Коничев, Н. С. Стволинская, Татьяна Архипова
Руководство к практическим занятиям по цитологии
© Архипова Т. В., Коничев В. С., Стволинская Н. С., 2016
© Издательство «Прометей», 2016
Предисловие
Настоящее пособие предназначено для студентов, преподавателей и технического персонала в качестве методического руководства при подготовке и проведении лабораторных занятий по цитологии со студентами – бакалаврами по направлению подготовки «Педагогическое образование и биология».
Переход на двухступенчатую систему высшего образования приводит к изменению учебного процесса. Бакалавры изучают цитологию в течение первого семестра на протяжении 18 недель. Данное пособие включает методические разработки 18 практических занятий, перечень постоянных препаратов для световой микроскопии, список электронно-микроскопических фотографий и примерный перечень теоретических вопросов к зачету или экзамену.
Данное пособие полностью соответствует государственному стандарту для бакалавров по указанному направлению и профилю образовательных университетов.
Целью лабораторных занятий является подробное изучение морфологии клеток, их химического состава, функциональной активности внутриклеточных структур, процессов деления клеток, а также развитие половых клеток.
Каждое занятие построено по определенному принципу, в основе которого прослеживается последовательность этапов проведения занятия. Начинается занятие с опроса студентов по заданной теме, объяснения преподавателя в виде краткого обобщающего изложения темы занятия с акцентом на сложные теоретические вопросы. Затем следуют указания для проведения самостоятельной лабораторной работы, а также задание для подготовки к следующему занятию. Кроме того, даются методические указания для проведения самостоятельной внеаудиторной работы согласно рабочей программе дисциплины «Цитология».
Лабораторные занятия проводятся на основе сочетания методов световой и электронной микроскопии. На первом занятии студенты знакомятся с современными световыми микроскопами и правилами работы с ними при большом увеличении (40×15). Это является необходимым этапом для дальнейшей грамотной работы студентов в лаборатории. В большинстве случаев для световой микроскопии используются готовые цитологические препараты, имеющиеся в продаже. Одно из занятий, посвященное изучению растительной клетки, построено на приготовлении временных препаратов руками студентов, при этом используются распространенные комнатные растения.
В качестве основных источников электронно-микроскопических фотографий используется «Атлас по биологии клетки» Ж.-К. Ролана, А. Селоши и Д. Селоши (Москва: Мир, 1978). На занятиях демонстрируются также электронно-микроскопические фотографии из коллекции кафедры.
В качестве основных учебников студентам рекомендуются издание «Основы общей цитологии» В. А. Верещагиной (Москва: Академия, 2007) и учебник для бакалавров по направлению подготовки «Педагогическое образование и биология» «Цитология», автор Н. С. Стволинская (Москва: Прометей, 2012). В пособии имеется также список дополнительной литературы.
В результате прохождения курса практических занятий по цитологии студенты не только закрепляют знания, полученные на лекциях и с помощью учебной литературы, но и получают устойчивые навыки анализа цитологических препаратов на уровне световой и электронной микроскопии, а также навыки приготовления временных препаратов для световой микроскопии.
Занятие № 1
Тема занятия: «Световая микроскопия как обязательный цитологический метод. Морфологическое разнообразие эукариотических клеток».
Цель занятия:
1. Ознакомить студентов с основными принципами световой микроскопии; рассмотреть понятие «разрешающая способность светового микроскопа».
2. Изучить общий план строения эукариотических клеток на уровне световой микроскопии, оценить размеры клеток животных. Студенты должны усвоить морфологические понятия: ядро, цитоплазма, мембрана, оболочка, зернистость цитоплазмы, кариоплазма, ядрышко, глыбки хроматина, многоядерные клетки.
3. Показать морфологическое разнообразие эукариотических клеток животных в зависимости от их функций.
Объяснение преподавателя
Основы световой микроскопии
Любой современный световой микроскоп имеет в своем составе три оптические системы, работающие совместно: конденсор, объектив и окуляр. Конденсор представляет собой систему линз, которые позволяют сфокусировать источник освещения и осветить объект снизу так, чтобы лучи света проходили через тонкий срез. Конденсор имеет диафрагму, которая позволяет регулировать интенсивность освещения, делая его ярче или слабее.
Лучи света, пройдя через срез, фокусируются объективом. Именно объектив создает первичное увеличение объекта, дает его разрешение, позволяет увидеть мельчайшие структуры клетки. Окуляр увеличивает изображение, построенное объективом, и направляет его в глаз исследователя. Разрешение объекта остается таким, каким его сформировал объектив. Общее увеличение объекта будет равно произведению увеличения объектива на увеличение окуляра. На занятиях по цитологии чаще всего используется объектив с увеличением ×40 и окуляр, дающий увеличение в 15 раз, тогда общее увеличение будет записываться: 40×15. Нетрудно посчитать, что это увеличение в 600 раз. Принято записывать увеличение препарата 40×15, такая запись показывает разрешение объекта, какие детали должны быть выявлены на препарате, объектив с каким увеличением использовался для анализа препарата.
Световой микроскоп, как любой оптический прибор, имеет важную характеристику – разрешающую способность. Это минимальное расстояние между двумя точками, которые видны раздельно. Для современных световых микроскопов разрешающая способность для биологических объектов равна 0,2 мкм, что соответствует средним размерам митохондрий. То есть под световым микроскопом при максимальном его разрешении митохондрии будут видны в виде точек с минимальными размерами. Примерно также будут выглядеть и многие другие органеллы цитоплазмы животной клетки. В растительной клетке есть более крупные структуры – хлоропласты и другие пластиды, которые имеют размер несколько микрометров.
Причиной того, что мелкие структуры клетки видны в световой микроскоп нечетко, является эффект оптической дифракции. В микроскопе яркая точка будет увеличена и выглядит как яркое пятно. Два близлежащих точечных объекта дают перекрывающиеся изображения пятен, которые сливаются и воспринимаются как одно пятно. Разрешающая способность светового микроскопа ограничена, прежде всего, длиной волны света, используемого для освещения объекта, а также способностью оптической системы воспринимать то или иное количество света.
Студенческий микроскоп имеет два объектива с увеличением ×10 и ×40. Объективы, дающие увеличение не более чем в 40 раз, являются воздушными, и показатель преломления воздуха равен единице. Большее увеличение достигается объективами, где преломляющей средой являются вода или иммерсионное масло.
При работе с микроскопами следует учитывать, что объективы рассчитаны на определенную длину тубуса, поэтому не следует переносить объективы с одного типа микроскопа на другой.
Каждый объектив характеризуется определенной величиной рабочего расстояния. Это расстояние от объектива до препарата, оно выражается в миллиметрах. Объектив с увеличением ×10 имеет рабочее расстояние около 1 см, а объектив ×40 – 0,41 мм. Поэтому в процессе работы следует очень осторожно пользоваться винтом фокусировки объектива, особенно при работе с объективом, дающим большое увеличение.
Механический узел микроскопа состоит из станины, на которой крепится предметный столик с препаратоводителем, револьвер с объективами и тубус с окуляром. Микроскоп имеет винтовые механизмы для фокусировки микроскопа и перемещения конденсора. Грубая и точная фокусировки осуществляются разными винтами.
Основные правила работы с микроскопом
1. Микроскоп ставят на стол так, чтобы окуляр приходился против левого глаза наблюдателя, направо на столе располагают альбом для рисунков и карандаши.
2. Переносить микроскоп можно только двумя руками. Одной рукой поддерживают основание штатива микроскопа, а другой – берутся за изгиб тубусодержателя.
3. Каждый раз, когда наблюдатель прерывает работу с микроскопом, осветитель выключают. Это позволяет сохранить лампочку накаливания от быстрого перегорания.
4. Прежде всего следует убедиться, что препарат лежит покровным стеклом вверх. Начинать микроскопию необходимо с малого увеличения (объектив ×10). При переходе к большому увеличению (объектив ×40) следует слегка приподнять объективы с помощью макровинта и перевести револьвер с объективами на нужное увеличение. После этого опустить объектив с помощью макровинта до соприкосновения со стеклом, глядя на объектив сбоку, и только затем начинать фокусировку микровинтом, осторожно поднимая объектив, постоянно глядя в окуляр. Рабочее расстояние от объектива до препарата составляет примерно 0,4 мм. При необходимости препарат передвигают с помощью винтов препаратоводителя.
5. Для изучения препаратов огромное значение имеет освещение объекта. При хорошем освещении видны границы клеток. Добиваются наиболее равномерного освещения поля зрения под микроскопом, устанавливая или убирая откидную линзу конденсора. При малом увеличении пользуются матовым стеклом. Для повышения контрастности изображения слегка прикрывают диафрагму конденсора.
6. После окончания работы препарат снимают со столика, объективы ставят в нерабочее положение.
Вопросы
1. Перечислите компоненты микроскопа, задействованные в построении изображения. Какую функцию они выполняют?
2. Что такое разрешающая способность светового микроскопа? От чего она зависит?
Лабораторная работа
Общий план строения эукариотической клетки животных на уровне световой микроскопии
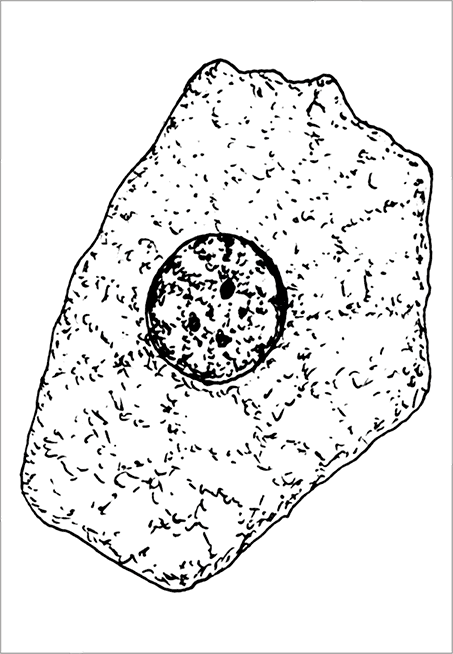
Постоянный препарат «Клетки печени аксолотля». Окраска: гематоксилин – эозин, размер клеток – около 60 мкм, увеличение 40×15 (рис. 1).
Рис. 1. Общий план строения эукариотической клетки под световым микроскопом. Клетка печени аксолотля. В ядре выявляются три ядрышка и небольшие глыбки хроматина, цитоплазма зернистая
В результате анализа препарата с помощью микроскопа студенты графически изображают две-три клетки, соприкасающиеся друг с другом. Для передачи цвета используются цветные карандаши. Рисунок должен быть детальным.
На рисунке отметить: границы клетки, цитоплазму, зернистость цитоплазмы, которая отражает наличие органоидов, ядро, ядрышки, глыбки хроматина, ядерный сок.
Задание выполняется под руководством преподавателя.
Самостоятельная лабораторная работа студентов
Морфологическое разнообразие эукариотических клеток
Изучить особенности строения дифференцированных эукариотических клеток человека и животных на примере следующих препаратов: 1. Нейрон спинного мозга собаки, размер клетки 50–60 мкм. Окраска – серебрение. Отметить: отростки нейрона, зернистость цитоплазмы, ядро, ядрышко. 2. Эритроцит лягушки, размер клетки 18–20 мкм. Окраска – гематоксилин – эозин. Отметить: гомогенную цитоплазму, ядро, крупные глыбки хроматина. 3. Эритроцит человека, размер клетки 7 мкм. Окраска гематоксилин – эозин. Отметить: гомогенную цитоплазму, отсутствие ядра. 4. Многоядерная клетка поперечно-полосатой мышечной ткани языка кролика, продольное сечение. Диаметр клетки более 20 мкм. Окраска – гематоксилин железный. Отметить: множественные ядра, сократительный аппарат в виде поперечной исчерченности, границы мышечного волокна.
С каждого препарата при увеличении 40×15 делается рисунок одной клетки. Отметить размеры, красители, особенности морфологии, а также функцию. Клетки с разных препаратов изображаются в масштабе друг относительно друга в соответствии с их размерами. На листе с рисунками необходимо кратко в письменной форме сделать вывод, в котором отмечается, что общего в строении всех указанных клеток и с чем связаны отличия в их строении.
Например, эукариотические клетки животных имеют размеры от 7 до 60 мкм; форма клеток разнообразна и зависит от выполняемой функции; обязательные структуры эукариотических клеток, выявляемые с помощью световой микроскопии при увеличении 40×15: ядро, цитоплазма, границы клеток, зернистость цитоплазмы, соответствующая клеточным органеллам; структуры ядра: ядерная оболочка, кариоплазма, ядрышко, глыбки хроматина. Форма клетки определяется функцией, которую она выполняет. Эритроциты человека, как и других млекопитающих, высокоспециализированные клетки, утрачивают ядро в процессе дифференцировки.
Задание на дом: история цитологии, клеточная теория, клетки прокариот и эукариот, стволовые клетки, тотипотентные и полипотентные клетки, клеточный цикл.
Задание на дом для самостоятельной работы. Выполняется письменно в тетради в виде конспекта учебника. Тема: «Основы микроскопической техники».
Вопросы для самостоятельной работы
1. Что такое микроскопическая техника?
2. Что такое фиксация и для чего она используется? Примеры фиксаторов.
3. Перечислить основные этапы приготовления постоянных препаратов
4. Что такое артефакт?
Литература
1. Верещагина В. А. Основы общей цитологии. – М.: Академия, 2007.
2. Стволинская Н. С. Цитология. – М.: Прометей, 2012.
3. Ченцов Ю. С. Цитология с элементами целлюлярной патологии. – М.: Медицинское информационное агентство, 2010.
Занятие № 2
Опрос по предыдущей теме: история цитологии, клеточная теория, клетки прокариот и эукариот, растений и животных, микроскопическая техника, клеточный цикл, стволовые клетки.
Тема занятия: «Изучение клеток с помощью световой микроскопии и специфических методов окрашивания».
Цель занятия:
1. Ознакомить студентов с методами цитохимии.
2. С помощью световой микроскопии изучить препараты, окрашенные на жир и гликоген.
Объяснение преподавателя
Специфические методы окрашивания, или цитохимия
Цитохимия – это область цитологии, которая изучает содержание и распределение химических соединений внутри клетки, а также динамику их превращений в процессе жизнедеятельности.
Методы цитохимии подразделяются на две большие категории. К первой группе относятся методы, основанные на использовании специфических красителей, взаимодействующих с конкретными химическими соединениями, образуя прочные химические связи. Например, при окрашивании суданом черным в клетках выявляются жиры в виде черных капель, структуры ядра и цитоплазмы остаются бесцветными.
Вторая группа методов цитохимии основана на проведении химической реакции непосредственно на срезе на предметном стекле. Реакция проводится таким образом, чтобы гидролизовать изучаемое химическое соединение, но при этом должны образоваться специфические реакционные группы, способные взаимодействовать с определенным красителем. Условия гидролиза для каждого соединения подбираются индивидуально. Например, обесцвеченное основание фуксина, взаимодействуя с альдегидными группами, образует прочное соединение, которое в присутствии сернистой кислоты окрашивается в красный цвет. Это свойство обесцвеченного основания фуксина используется для специфического окрашивания гликогена или ДНК в клетках, но гидролиз проводится так, чтобы именно на ДНК или на гликогене образовались свободные альдегидные группы. Для выявления ДНК гидролиз проводится при нагревании в соляной кислоте. При окрашивании на гликоген реакцию проводят при комнатной температуре в растворе периодата калия.
В частности, для выявления полисахарида гликогена, мономером которого является глюкоза, предметное стекло с тонкими срезами ткани помещают в раствор периодата калия при комнатной температуре. Такая обработка приводит к разрушению гликогена в клетках и образованию свободных альдегидных групп на глюкозе. Затем препарат помещают в раствор бесцветного основания фуксина, который образует прочное соединение с альдегидными группами. После отмывания препарата в слабом растворе сернистой кислоты места локализации гликогена окрашиваются в красный цвет. Ядро останется бесцветным.
Вопросы
1. Что такое цитохимия?
2. Как можно выявить в клетках жир?
3. Как окрасить клетки на гликоген?
Самостоятельная лабораторная работа студентов
Анализ препаратов, окрашенных разными цитохимическими методами.
С каждого препарата делается цветной рисунок участка ткани, содержащий 3–4 клетки. Предварительно препарат анализируют при увеличении 10×15, затем переходят на большое увеличение (40×15).
Рис. 1. Жировые включения в клетках печени аксолотля. Окраска суданом черным, затем препарат докрашен эозином. Отметить капли жира, ядра клеток.
Жир может накапливаться в различных клетках животных и растений. На данном препарате он выявляется в клетках печени в виде черных капель, адсорбировавших краситель. Капли могут быть разного размера, их количество варьирует на различных препаратах.
Рис. 2. Выявление гликогена в клетках печени аксолотля. Реакция на гликоген, после чего окрашивание фуксинсернистой кислотой, затем препарат докрашен гематоксилином для выявления ядер. Отметить гликоген, ядра клеток со структурами.
В печени депонируются сахара в виде нерастворимого углеводного полимера – гликогена, который является веществом запаса животной клетки. С помощью цитохимической реакции гликоген выявляется в виде глыбок красного цвета непосредственно в цитоплазме.
Задание на дом. Особенности морфологии растительной и животной клетки.
Занятие № 3
Теоретические вопросы: особенности организации клеток растений и животных.
Тема занятия: «Многообразие растительных клеток на примере клеток эпидермиса Setcreasea purpurea».
Цель занятия:
1. Изучить общий принцип организации растительной клетки с помощью световой микроскопии.
2. Показать морфологическое разнообразие клеток листа в зависимости от выполняемых функций.
Объяснение преподавателя
Эпидермис пурпурного листа сеткреазии, близкой родственницы традесканции, представляет собой сложную ткань, имеющую в своем составе клетки, выполняющие две главные функции: регуляцию газообмена и защиту от неблагоприятных условий среды. Это – основные эпидермальные клетки и устьичный аппарат, представленный замыкающими клетками устьиц и околоустьичными клетками. Кроме того, листья сеткреазии обильно опушены с обеих сторон длинными многоклеточными трихомами, видимыми невооруженным глазом. Морфология всех типов клеток различна и связана с их функциями.
Основные эпидермальные клетки сеткреазии схожи по морфологии. Они имеют 5–6-угольную форму, могут быть изодиаметрическими или удлиненными. Их боковые стенки прямые. Размеры основных эпидермальных клеток этих растений значительно превышают средние показатели для высших растений (10–100 мкм) и составляют 160–180 мкм, что связано с произрастанием во влажном и теплом климате.
Нижняя сторона листа сеткреазии окрашена в пурпурный цвет. При рассмотрении эпидермиса под микроскопом видно, что окрашены не все основные эпидермальные клетки, а лишь отдельные. Окрашенные клетки собраны в группы по 2–3 или рассеяны по одиночке. Окраска связана с наличием антоцианового пигмента в клеточном соке вакуолей. В клетках хорошо выявляется структурированное ядро диаметром 16 мкм. Хлоропласты немногочисленны, в клетках нижней стороны листа их количество больше. Форма хлоропластов может быть шарообразной или вытянутой, диаметр 5–7 мкм. В основных эпидермальных клетках сеткреазии хлоропласты часто обособлены в цитоплазматических кармашках, несколько штук в группе. В некоторых клетках имеются лейкопласты разнообразных форм: палочковидные, двояковыпуклые, гантелеобразные, их средний размер 6–12 мкм, обычно они собраны вместе по нескольку штук. Достаточно часто в основных эпидермальных клетках выявляются включения разнообразной формы. Это соли оксалата кальция, которые находятся в полости центральной вакуоли и, скорее всего, представляют собой конечный продукт жизнедеятельности, образующийся как приспособление для выведения из обмена веществ излишков кальция.
Устьичный аппарат расположен на нижней стороне листа выше уровня основных эпидермальных клеток в виде приподнятых устьиц. Такие устьица характерны для растений, произрастающих в условиях избыточного увлажнения. Высокоспециализированные замыкающие клетки устьиц содержат многочисленные хлоропласты. Клетки имеют бобовидную форму, которая может изменяться, что влияет на размер устьичной щели, а следовательно, на интенсивность транспирации. Размер замыкающих клеток – 40–50 мкм в длину. Они окружены четырьмя околоустьичными клетками, которые отличаются по форме и строению от основных эпидермальных клеток. Их размер 40–80 мкм, хлоропласты и лейкопласты отсутствуют, антоциановые пигменты не выявляются.
Трихомы сеткреазии являются длинными многоклеточными однорядными. Это мертвые волоски, клетки которых заполнены пузырьками воздуха. Длина волосков 3–4 мм. Трихомы, состоящие из мертвых клеток, образуют покров на поверхности листа, отражая часть солнечных лучей, уменьшая нагрев, снижая транспирацию.
Вопросы
1. Сколько типов растительных клеток в эпидермисе листа сеткреазии?
2. Какие функции выполняют эти клетки?
3. В каких клетках можно увидеть центральную вакуоль, окрашенную антоциановыми пигментами? Отложение солей кальция? Лейкопласты?
4. В каких клетках отсутствуют хлоропласты?
Самостоятельная работа студентов
Задание для самостоятельной практической работы: приготовить тонкий поверхностный срез эпидермиса с нижней стороны листа сеткреазии, поместить его в каплю воды на предметное стекло, накрыть покровным стеклом и рассмотреть под микроскопом живые неокрашенные клетки при закрытой диафрагме конденсора. На малом увеличении найти разнообразные типы клеток. Затем перевести препарат на большое увеличение и детально проанализировать структуру клеток. Зарисовать, соблюдая пропорциональные размеры, замыкающие устьичные клетки с хлоропластами и ядром, основные эпидермальные клетки с окрашенной центральной вакуолью, лейкопластами и ядром. Желательно найти и зарисовать основную эпидермальную клетку с включениями оксалатов кальция. На рисунках отметить указанные структуры. На листе с рисунками выписать название структур, характерных только для растительных клеток.
Задание на дом: методы современной цитологии (электронная микроскопия, метод клеточных культур, фракционирование клеток, конфокальная микроскопия).
Т. В. АРХИПОВА, В. С. КОНИЧЕВ, Н. С. СТВОЛИНСКАЯ. РУКОВОДСТВО К ПРАКТИЧЕСКИМ ЗЯТИЯМ ПО ЦИТОЛОГИИ
Название: Руководство к практическим занятиям по общественному здоровью и здравоохранению
Автор: Денисов И.Н., Кича Д.И., Чернов В.И.
Издательство: МИА
Год выпуска: 2009
Страниц: 375
Формат: pdf
Размер: 53,5 мб
Язык: Русский
Представленная книга излfгает полный курс общественного здоровья и здравоохранения с его статистическим анализом и оценкой с учетом использования современных компьютерных технологий. Доступное изложение с большим количеством примеров основных статистических показателей общественного здоровья, медицины и системы здравоохранения, вариации анализа данных, вопросы планирования научного эксперимента позволяют студентам, врачам и организаторам здравоохранения освоить данную дисциплину.

52.82
Г 809
ГРЕЦКИЙ, ВАЛЕРИЙ МИХАЙЛОВИЧ.
РУКОВОДСТВО К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ ПО ТЕХНОЛОГИИ ЛЕКАРСТВЕННЫХ ФОРМ / В. М. ГРЕЦКИЙ, В. С. ХОМЕНОК. — 2-Е ИЗД., ПЕРЕРАБ. И ДОП. — М. : МЕДИЦИНА, 1991. — 319 С. — (УЧЕБНАЯ ЛИТЕРАТУРА . ДЛЯ УЧАЩИХСЯ ФАРМАЦЕВТИЧЕСКИХ УЧИЛИЩ). — ISBN 5-225-00849-6 : 1.90 р.
ЗАГЛ. КОРЕШКА : ПРАКТИЧЕСКИЕ ЗАНЯТИЯ ПО ТЕХНОЛОГИИ ЛЕКАРСТВЕННЫХ ФОРМ . — ЗАГЛ. 1-ГО ИЗД.: РУКОВОДСТВО К ПРАКТИЧЕСКИМ ЗАНЯТИЯМ ПО ТЕХНОЛОГИИ ЛЕКАРСТВ
ББК 52.82
Рубрики: Лекарственные формы—Приготовление—Учебники и пособия
Доп.точки доступа:
ХОМЕНОК, ВЕРА СТЕПАНОВКА
Экземпляры:
Всего: 2, Отдел книгохранения — 1 экз., Абонемент — 1 экз.
Свободны:
Отдел книгохранения — 1 экз.: (Инв. С 1325491),
Абонемент — 1 экз.: (Инв. С 1327286)