Московский государственный университет
Исследовательский центр им.Алмазова
НЦ вирусологии и биотехнологии «Вектор»
Институт медико-биологических проблем РАН
Институт Цитологии и Генетики СО РАН
Институт физиологии им. Павлова
Сеченовский Университет
МНТК Микрохирургии глаза им.Федорова
МФТИ
Институт экспериментальной медицины
Исследовательский центр им. Дмитрия Рогачева
НИЦ Курчатовский институт
Петербургский институт ядерной физики им. Б.П.Константинова
НИИ глазных болезней им. Гельмгольца
НЦ акушерства, гинекологии и перинатологии им.Кулакова
ИЭФБ РАН им.Сеченова
Национальный исследовательский университет Лобачевского
Томский научный исследовательский медицинский центр
Казанский Федеральный Университет
СЗГМУ им.Мечникова
Балтийский федеральный университет
Научный центр неврологии
Северо-Кавказский федеральный университет
Дальневосточный федеральный университет
ФНКЦ физико-химической медицины
ФНКЦ реаниматологии и реабилитологии
Сибирский федеральный университет
Институт биологии гена РАН
ФИЦ Питания и биотехнологий
Сибирский медицинский университет
Институт биофизики клетки РАН
НИПИ им. Бехтерева
Институт Фундаментальных Проблем Биологии РАН
Институт токсикологии ФМБА России
НИИ Акушерства и гинекологии им. Отта
НИИ Психического здоровья
РМАПО
Красноярский медицинский университет им. Войно-Ясенецкого
Алтайский медицинский университет
Ниармедик
Волгоградский медицинский университет
Новосибирский медицинский университет
РНИОИ
ИБХ РАН им. акад. Шемякина и Овчинникова
Петровакс Фарм
Южно-Уральский государственный университет
ПИМУ
ФНЦ Пищевых систем им.Горбатова РАН
В статье представлены результаты исследования комплексной характеристики клинико-лабораторных показателей, концентрации интерлейкинов и cпецифических антител у пациентов с эритемной формой иксодового клещевого боррелиоза. Показано, что у данных больных выраженность иммунопатологических сдвигов связана с лихорадочными реакциями, ЭКГ-изменениями, повышенным содержанием в сыворотке IL-17A, IL-35 и ранней выработкой специфических IgM и IgG.
Введение
Иксодовый клещевой боррелиоз (ИКБ) (болезнь Лайма, боррелиозная инфекция) — природно-очаговое трансмиссивное инфекционное заболевание, вызываемое грамотрицательными спирохетами генокомплекса Borrelia burgdorferi sensu lato, передающееся клещами рода Ixodes, характеризующееся полиморфизмом клинических проявлений [1–12].
В России абсолютные показатели заболеваемости ИКБ за 2000–2017 гг. варьировали от 5715 до 9957 случаев в год, относительные показатели — от 4,00 до 7,02 случая на 100 тыс. населения [16]. Кировская область находится на севере Волго-Вятского региона России и является активным природным очагом боррелиозной инфекции. Относительные показатели заболеваемости ИКБ в Кировской области за 2010–2017 гг. ежегодно превышали среднероссийские в 2,6–6,6 раза (рис. 1) [16].
Особое внимание в современных научных исследованиях уделяется изучению взаимосвязей клинических и иммунологических особенностей у пациентов с боррелиозной инфекцией при различных формах и стадиях заболевания [8–11].
В настоящее время многочисленные научные работы,
в т. ч. и в области изучения ИКБ, включают многомерный статистический анализ данных [12–15]. Многофакторный анализ позволяет определить взаимосвязи между множеством имеющихся показателей и выявить факторы, влияющие на изменчивость всей совокупности данных [15].
Целью настоящего исследования являлось определение взаимосвязей клинико-лабораторных особенностей, уровней специфических антител и иммунорегуляторных цитокинов (интерлейкины IL-17A, IL-23, IL-33, IL-35) у пациентов с эритемной формой боррелиозной инфекции с использованием метода многофакторного анализа.
Задачи исследования:
Изучение клинико-эпидемиологических особенностей у больных с эритемной формой ИКБ в Кировской области.
Анализ динамики концентрации цитокинов (IL-17А, IL-23, IL-33, IL-35) в периоде разгара и реконвалесценции у пациентов с эритемной формой.
Определение взаимосвязей клинико-лабораторных показателей, концентрации специфических антител и иммунорегуляторных цитокинов в сыворотке крови у больных с эритемной формой.
Материал и методы
В исследовании с 2011 по 2014 г. приняли участие 30 па-
циентов с эритемной формой ИКБ в возрасте 25–67 лет (средний возраст — 48,4±12,2 года). Среди больных мужчины составили 53,3%, женщины — 46,7%. Больные проходили курс стационарного лечения в КОГБУЗ «Инфекционная клиническая больница» (г. Киров). Исследование было одобрено локальным этическим комитетом Кировского ГМУ, соответствовало законодательству РФ и международным этическим нормам. При постановке диагноза ИКБ учитывались сведения эпидемиологического анамнеза, клинико-лабораторные и серологические данные. При анализе клинических проявлений боррелиозной инфекции использована классификация Е. Asbring (1988 г.) с дополнениями Н.Н. Воробьевой (2013 г.) [1–4]. Подтверждение диагноза ИКБ у больных включало определение IgM и IgG к антигенам B. afzelii, B. garinii в сыворотке крови методом иммунного блоттинга в лаборатории ФГБУН ЦНИИ Эпидемиологии Роспотребнадзора. Концентрации интерлейкинов в сыворотке крови исследованы у больных в разгаре инфекционного процесса и в период реконвалесценции. Группа сравнения состояла из 30 здоровых доноров, сопоставимых по полу и возрасту с группой обследуемых больных. Исследование концентрации цитокинов в сыворотке крови проводилось в лаборатории направленного регулирования межмикробных взаимодействий в экзо- и эндоэкологических системах ФГБОУ ВО Кировский ГМУ Минздрава России. В работе применялся автоматический иммуноферментный анализатор Personal Lab, использовались реактивы Вender MedSystems, Uscscn Life Science Ins. Wuhan. Для статистического анализа результатов исследования использованы программы Microsoft Exel 2007 и StatSoft Statistica v 10.0. При обработке качественных данных вычислялись относительные показатели (%) с 95% доверительными интервалами (95% ДИ) — метод Уилсона. Анализ таблиц сопряженности включал определение критерия χ2. Распределение количественных показателей оценивалось путем построения гистограмм и определения критерия Шапиро — Уилка. При наличии нормального распределения количественных данных вычислялись среднее арифметическое значение (М) и среднеквадратичное отклонение (σ). В случае нормального распределения количественных показателей проводилось попарное сравнение по параметрическому t-критерию Student (t-Test). При отличном от нормального распределении количественных данных определялись медиана (Me), нижний (Q 25,00) и верхний (Q 75,00) квартили. Для установления достоверности различий независимых выборок использовался непараметрический U-критерий Манна — Уитни. Для определения достоверности различий зависимых выборок вычислялся критерий Вилкоксона. При статистическом изучении связи двух рядов количественных данных определялся непараметрический коэффициент Спирмена. Различия значений являлись достоверными при критическом уровне значимости более 95% (р<0,05).
Результаты исследования
Нами установлено, что среди пациентов с боррелиозной инфекцией лица трудоспособного возраста встречались достоверно чаще, чем пенсионеры (76,7±1,43% и 23,3±0,26%; р<0,001). 16,7% (95% ДИ: 4,18; 29,22) больных отрицали присасывание клеща, но посещали дачные участки на пригородных территориях в сроки инкубационного периода (1–35 сут). У пациентов выявлены микст-
инфекция B. afzelii и B. garinii в 86,7% (95% ДИ: 75,33; 98,14) случаев; а также моноинфекция (B. garinii) — в 10,0% (95% ДИ: 0,00; 20,11) случаев, B. afzelii — в 3,3% (95% ДИ: 0,00; 9,33) случаев.
Инкубационный период не был определен у 5 пациентов с эритемной формой боррелиозной инфекции — в 16,7% (95% ДИ: 4,18; 29,22) случаев, у 25 (83,3% (95% ДИ:
70,80; 95,86)) больных инкубационный период составил от 0 до 20 сут (в среднем 6,6±1,24 дня). Средняя степень тяжести заболевания развилась у 80,0% больных (95% ДИ: 66,60; 93,47). Пациенты были госпитализированы через 4,0±0,72 сут от начала клинических проявлений заболевания. Тяжесть состояния больных определяли симптомы общеинфекционного характера. Интоксикационно-воспалительный синдром развился у 29 больных (96,7% (95% ДИ: 90,68; 102,73)). Лихорадочные реакции отмечены у пациентов с частотой 80,0% (95% ДИ: 6,60; 93,47); общая слабость — 96,7% (95% ДИ: 90,68; 100,00), головная боль — 56,7% (95% ДИ: 40,06; 73,35), озноб — 26,7% (95% ДИ: 11,85; 41,56). Средняя длительность лихорадочного периода у пациентов составила 3,3±0,6 дня.
У больных определена патология сердечно-сосудистой системы. Изменения в электрокардиограмме (ЭКГ) выявлены у 30% пациентов (95% ДИ: 14,64; 45,43). При объективном обследовании у 10,0% (95% ДИ: 0,00; 20,11) больных определена приглушенность тонов сердца. По результатам ЭКГ выявлена синусовая брадикардия — у 10,0% (95% ДИ: 0,00; 20,11) пациентов, синусовая тахикардия — у 6,7% (95% ДИ:
0,00; 15,08), атриовентрикулярная блокада — у 3,3%
(95% ДИ: 0,00; 9,39), изменения реполяризации различных отделов миокарда — у 6,7% (95% ДИ: 0,00; 15,08).
У пациентов с ЭКГ-нарушениями микст-инфекция (B. afzelii, B. garinii) выявлена в 26,7% случаев (95% ДИ: 11,87; 41,59), моноинфекция (B. garinii) — в 3,3% (95% ДИ: 0; 9,33).
Регионарный лимфаденит определен у 4 пациентов с микст-инфекцией B. afzelii, B. garinii — в 13,3% (95% ДИ: 1,94; 24,78). В 6,7% случаев (95% ДИ: 0,00; 15,08) у пациентов определены клинико-лабораторные признаки безжелтушного гепатита (повышение уровней аланинаминотрансферазы (АЛТ) 44,3–65,6 Ед/л) и микст-инфекция (B. afzelii, B. garinii). Жалобы на боли в суставах беспокоили 6,7% (95% ДИ: 0,00; 15,08) больных с микст-инфекцией (B. afzelii, B. garinii).
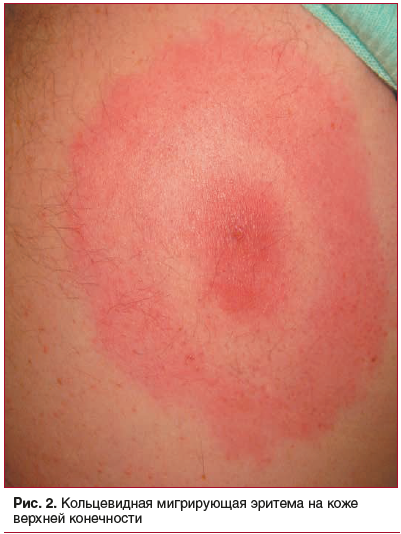
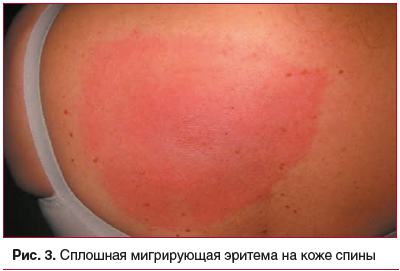
У всех пациентов имелся патогномоничный симптом
боррелиозной инфекции — мигрирующая эритема диаметром более 5 см с наличием следа после присасывания клеща в центре (рис. 2, 3). Наличие эритемы у пациентов
сопровождалось субъективными симптомами: зудом кожи — у 70,0% (95% ДИ: 56,64; 85,43), жжением — у 36,7% (95% ДИ: 20,54; 52,92), болезненностью — у 33,3% (95% ДИ: 17,50; 49,16), отечностью — у 26,7% (95% ДИ: 11,87; 41,59). Размеры эритем варьировали от 5 до 45 см. Сплошные эритемы встречались чаще кольцевидных (73,3±1,54% и 26,7±1,48%; р<0,001). Яркая гиперемия эритемы определялась в 36,7% (95% ДИ: 20,54; 52,92) случаев, бледная окраска эритемы — также в 36,7% случаев (95% ДИ: 20,54; 52,92). Длительность сохранения эритемы составила от 2 до 29 сут, в среднем — 9,6±5,04 сут. Эритемы угасали бесследно в 56,7% (95% ДИ: 40,09; 73,38) случаев, а также с остаточными явлениями: шелушением — в 23,3% (95% ДИ: 9,13; 37,53) и пигментацией — в 20,0% (95% ДИ: 6,60; 33,47) случаев.
Пациенты с эритемной формой получили курсы антибактериальной терапии: раствор цефтриаксона — 93,3% (95% ДИ: 84,93; 100,00), раствор бензилпенициллина — 6,7% (95% ДИ: 0,00; 15,13).
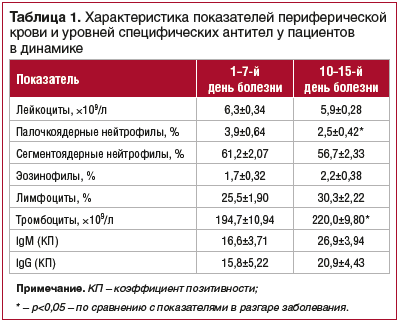
Объективным отражением течения инфекционного процесса у пациентов с ИКБ являлись изменения в лабораторных показателях периферической крови, а также концентрации специфических сывороточных антител к антигенам B. afzelii, B. garinii (табл. 1).
В ходе стационарного лечения у пациентов наблюдалось достоверное понижение содержания палочкоядерных нейтрофилов по сравнению с показателями при госпитализации. Уровни тромбоцитов в периферической крови пациентов с эритемной формой достоверно повышались от разгара к реконвалесценции инфекционного процесса. У больных с ИКБ наблюдалась тенденция к повышению выраженности реакций гуморального иммунитета, необходимая для эффективного завершения инфекционного процесса.
Таким образом, эпидемиологическими особенностями у пациентов с эритемной формой ИКБ в Кировской области являются преобладание среди заболевших лиц трудоспособного возраста, частое выявление микст-инфекции (B. afzelii, B. garinii). Особенностями клинической картины у больных являются нарушения сердечной деятельности в виде ЭКГ-изменений (30,0%), реже определяются лимфаденит, артралгический синдром и синдром цитолиза. Лабораторные показатели периферической крови у пациентов с эритемной формой отражают наличие интоксикационного синдрома в разгаре заболевания. К периоду реконвалесценции у больных с эритемной формой наблюдаются восстановление системы гемостаза и фибринолиза, а также повышение выраженности реакций гуморального иммунитета.
IL-23 играет важную роль в дифференцировке Т-хелперов 1 типа и выработке нейтрофилов, является провоспалительным цитокином в эпителиальной и нервной ткани [17]. Концентрации IL-23 (Me (Q 25,00; Q 75,00)) в сыворотке крови у пациентов с эритемной формой в периоде разгара составили 249,05 (64,23; 485,56) пг/мл, в периоде реконвалесценции — 276,75 (97,60; 524,27) пг/мл, что в обоих случаях достоверно превышало показатели группы сравнения (24,89 (17,56; 40,20) пг/мл; р1<0,001; р2<0,001). Итак, у больных с эритемной формой повышенные уровни IL-23 в сыворотке крови указывали на активность воспалительных реакций, направленных на элиминацию боррелий.
Провоспалительный IL-33 повышает выделение цитокинов Т-хелперами 2 типа [18]. Концентрации IL-33 (Me (Q 25,00; Q 75,00)) в сыворотке крови у больных с эритемной формой в периоде разгара (45,80 (18,99; 85,56) пг/мл) и в периоде реконвалесценции (50,65 (21,44; 101,65) пг/мл)
достоверно превышали показатели здоровых доноров (6,79 (4,35; 11,67) пг/мл; р1<0,001; р2<0,001).
IL-17A способствует развитию воспалительных процессов в нервной и соединительной ткани [19]. В проведенном исследовании у больных с эритемной формой в сыворотке крови выявлены повышенные концентрации IL-17А по сравнению с показателями группы сравнения. Уровни IL-17А (Me (Q 25,00; Q 75,00)) у пациентов с эритемной формой в периоде разгара (0,74 (0,22; 3,19) пг/мл) и реконвалесценции (0,49 (0,22; 8,31) пг/мл) достоверно превышали показатели контрольной группы (0,10 (0,00; 0,64) пг/мл; р1<0,001; р2<0,001). Повышенные концентрации IL-17A в сыворотке крови у пациентов с эритемной формой свидетельствовали о выраженности воспалительных реакций в связи с наличием очага гиперэргического воспаления в коже.
IL-35 является противовоспалительным цитокином, выделяется Т-лимфоцитами супрессорами [20]. Функция IL-35 состоит в подавлении продукции провоспалительного IL-17A. Концентрации IL-35 (Me (Q 25,00; Q 75,00)) в сыворотке крови у больных с эритемной формой в периоде разгара (22,99 (5,12; 50,62) пг/мл) и в периоде реконвалесценции (24,29 (9,49; 44,63) пг/мл) умеренно превышали показатели здоровых доноров (21,24 (13,68; 29,44) пг/мл).
В ходе исследования использован метод многофакторного анализа (метод главных компонент) профиля IL-17A, IL-23, IL-33, IL-35 в сыворотке крови у пациентов с эритемной формой боррелиозной инфекции. В нашей работе главными компонентами являлись «форма» и «лечение», оказывающие влияние на изменчивость лабораторно-иммунологических показателей у больных. На первом этапе исследования был проведен многофакторный анализ концентрации IL-17A, IL-23, IL-33, IL-35 у пациентов в период разгара и реконвалесценции инфекционного процесса (рис. 4).
При оценке результатов многофакторного анализа наибольшее влияние на изменчивость статуса цитокинов у больных оказывала главная компонента F1 («лечение»). У пациентов наблюдались динамические изменения статуса всех исследуемых цитокинов с перемещением факторов «IL-17A», «IL-23», «IL-33», «IL-35» из отрицательной в положительную область значений системы координат главных компонент «форма» и «лечение». Итак, выявленные изменения концентрации IL-17A,
IL-23, IL-33, IL-35 у больных в периоде реконвалесценции являлись благоприятными прогностическим признаками для выздоровления.
В исследовании формализованно — в виде точечных сообществ представлены функциональные состояния (по концентрациям интерлейкинов в сыворотке крови) пациентов с эритемной формой боррелиозной инфекции в периоде разгара и реконвалесценции (рис. 5). Маркировка исследуемой группы: Э — пациенты с эритемной формой ИКБ в периоде разгара и реконвалесценции.
Каждая точка представляла функциональное состояние лица из группы пациентов по совокупности выработки IL-17A, IL-23, IL-33, IL-35 периферической крови (рис. 5).
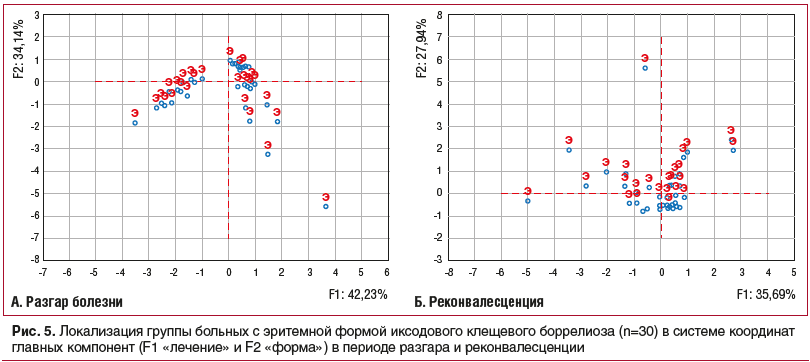
В работе обнаружена прямая средняя корреляционная связь — зависимость между концентрациями IL-23 и IL-33 сыворотки крови у больных с эритемной формой в периоде разгара (r=0,65; p<0,05) и реконвалесценции (r=0,67; p<0,05). У больных с эритемной формой содержание IL-17А и IL-35 находилось в прямой средней корреляционной связи в периоде разгара (r=0,58; p<0,05) и реконвалесценции (r=0,53; p<0,05). Следовательно, у пациентов выявлена взаимосвязь воспалительных реакций и иммуносупрессивных процессов в динамике заболевания, обусловливающая благоприятный исход инфекционного процесса. Итак, эффективному завершению инфекционного процесса у пациентов способствовал выраженный комбинированный Th1/Th2 тип иммунного ответа с уравновешенными провоспалительными и иммуносупрессивными процессами. Выявленные особенности цитокинового профиля (IL-17A, IL-23, IL-33, IL-35) у больных с эритемной формой являлись благоприятным прогностическим критерием для выздоровления.
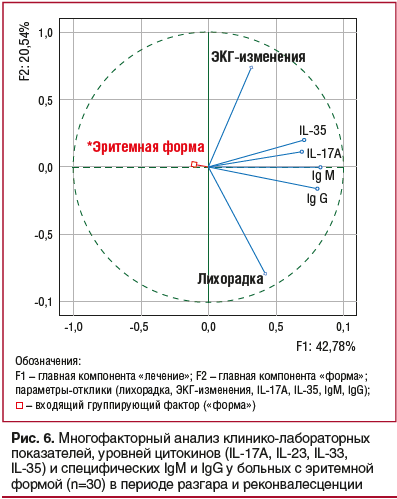
Применение системного подхода при анализе клинико-
лабораторных показателей, уровней специфических антител и цитокинов (IL-17A, IL-23, IL-33, IL-35) в периферической крови позволило выявить наиболее информативные клинико-иммунологические факторы у пациентов с эритемной формой и динамику иммунологических сдвигов в ходе проведенного лечения (рис. 6).
По результатам многофакторного анализа иммунопатологические сдвиги у больных с эритемной формой в динамике инфекционного процесса ассоциировались с лихорадочными реакциями, ЭКГ-патологией, изменением концентрации в сыворотке крови IL-17A, IL-35 и повышением выработки специфических IgM и IgG (рис. 6).
Обсуждение
Кировская область является природным очагом боррелиозной инфекции [1, 2, 7]. Область входит в число наиболее неблагополучных регионов по заболеваемости ИКБ (относительные показатели заболеваемости в последние годы достигали 35,5 случая на 100 тыс. населения), наряду с Вологодской областью (40,5 случая на 100 тыс. населения) и Пермским краем (39,9 случая на 100 тыс. населения) [3, 16, 21–24]. Высокие показатели заболеваемости ИКБ на территории Кировской области связаны с географическими и климатическими особенностями (расположение в подзоне средней и южной тайги, умеренно-континентальный климат) [1, 2, 5, 7]. Среди заболевших преобладают лица трудоспособного возраста. Подобная тенденция определена в других регионах РФ (от 56% лиц трудоспособного возраста с ИКБ в Московской области до 79,6% пациентов в Приморском крае) [23, 24].
Большинство заболевших указывали на факт присасывания клеща. Отсутствие факта присасывания клеща в анамнезе у больных не исключает вероятность трансмиссивного пути передачи, т. к. больные могли не заметить присасывание нимф и самцов иксодовых клещей [1, 2]. У пациентов часто определялась микст-инфекция B. afzelii, B. garinii (86,7% случаев). О широком распространении в РФ и странах Евразии боррелиозной микст-инфекции свидетельствует ряд научных исследований [5, 21, 22].
В исследовании длительность инкубационного периода у больных составила в среднем 6,6 дня. В различных регионах РФ продолжительность инкубационного периода у пациентов с эритемной формой составляет от 6,2 сут (Приморский край) до 6,5 сут (Краснодарский край) [23, 25].
У наблюдаемых нами больных имелись частые жалобы на общую слабость, наличие лихорадочных реакций, также определялись ЭКГ-изменения и синдром цитолиза.
По результатам отечественных исследований у пациентов часто развиваются лихорадка (30,1–89,7%), головная боль (15,7–63,5%), общая слабость (51,0–56,8%), артралгии (9,2–29,6%), регионарный лимфаденит (21,6–52,3%), безжелтушный гепатит (11,8–25%). В различных регионах РФ патология ЭКГ определяется у пациентов с эритемной формой в 25,1–78,7% случаев, при этом нарушения внутрисердечной проводимости встречаются в 5,5–7,1% случаев [1–5, 23–25].
При анализе показателей периферической крови у больных выявленное повышение содержания нейтрофильных гранулоцитов в начале инфекционного процесса могло быть связано с выполнением барьерной функции, которая заключается в способности клеток к фагоцитозу боррелий и секреции воспалительных цитокинов. При боррелиозной инфекции возможно развитие системных васкулитов с нарушениями в системе гемостаза и фибринолиза, активацией воспалительных реакций макроорганизма [3, 4]. Cдвиги системы гомеостаза характерны для ИКБ как генерализованного инфекционного процесса [3, 4, 26].
Реакция со стороны органов иммунной системы и иммунологические сдвиги клеточного и гуморального звеньев иммунитета являются важными звеньями патогенеза ИКБ [9, 10, 27, 28]. В настоящее время исследуются особенности выработки интерлейкинов в сыворотке крови у пациентов с различными формами и стадиями боррелиозной инфекции [9–11, 27, 28]. В нашей работе у больных с эритемной формой обнаружены выраженность воспалительных реакций (повышенные концентрации IL-23 и IL-33 сыворотки крови), а также взаимосвязь воспалительных реакций и иммуносупрессивных процессов (содержание IL-17А и IL-35) в динамике заболевания. Итак, эффективному завершению инфекционного процесса у пациентов способствовал комбинированный Th1/Th2 тип иммунного ответа с уравновешенными провоспалительными и иммуносупрессивными процессами. Выраженность реакций Th1/Th2 типов иммунного ответа с повышенной выработкой цитокинов (интерфероны ИФНα, ИФНβ, ИФНγ, ФНОα; IL-1α, IL-1β, IL-4, IL-6,
IL-8, IL-10, IL-12, IL-13, IL-17A, IL-22, IL-23, IL-27) у больных с ИКБ выявлена и в других научных работах [9, 10, 27, 28]. Отмечено, что успешный исход инфекционного процесса с эффективной элиминацией боррелий взаимосвязан с ранним сильным воспалительным Th-1 типом иммунного ответа, уравновешенным противовоспалительными реакциями и более поздним Th-2 иммунным ответом [28].
Выводы
В Кировской области отмечается высокий уровень заболеваемости ИКБ, превышающий среднероссийские показатели в 2,6–6,6 раза. У больных с эритемной формой микст-инфекция (B. afzelii и B. garinii) определяется в 86,7% случаев. Особенностями клинической картины у больных являются ЭКГ-изменения (30%), реже определяются лимфаденит, артралгический синдром и синдром цитолиза.
У больных с боррелиозной инфекцией в периоде разгара и реконвалесценции выявлены нарушения в цитокиновом профиле со стойкой гиперпродукцией IL-23 и IL-33, а также определено изменение концентрации IL-17A и IL-35.
По результатам многофакторного анализа у больных с эритемной формой в динамике инфекционного процесса иммунопатологические сдвиги взаимосвязаны с лихорадочными реакциями, ЭКГ-патологией, изменением содержания сывороточных IL-17A, IL-35 и ранней выработкой специфических IgM и IgG.
Азелтин
МНН: Азитромицина дигидрата (эквивалентно азитромицину)
Производитель: Биофарма Илач Сан. ве Тидж. А.Ш.
Анатомо-терапевтическо-химическая классификация: Azithromycin
Номер регистрации в РК:
№ РК-ЛС-5№024821
Информация о регистрации в РК:
18.11.2020 — 18.11.2025
- Скачать инструкцию медикамента
Торговое наименование
Азелтин
Международное непатентованное название
Азитромицин
Лекарственная
форма, дозировка
Порошок
для приготовления суспензии для приема внутрь,
200мг/ 5мл
Фармакотерапевтическая группа
Противоинфекционные
препараты для системного использования.
Антибактериальные препараты
для системного использования.
Макролиды,
линкозамиды и стрептограмины. Азитромицин.
Код АТХ
J01FA10
Показания к применению
Азитромицин
показан для лечения следующих инфекций, которые установлены или могут
быть вызваны одним или несколькими чувствительными микроорганизмами:
—
бронхит
—
внебольничная
пневмония
—
синусит
—
фарингит/тонзиллит
—
средний
отит
—
инфекции
кожи и мягких тканей
—
неосложненные
половые инфекции, вызванные
Chlamydia
trachomatis
и
Neisseria
gonorrhoeae
Следует
принять во внимание официальные рекомендации по надлежащему
применению антибактериальных препаратов.
Перечень
сведений, необходимых до начала применения
Противопоказания
—
повышенная чувствительность к азитромицину, эритромицину или
макролидным и кетолидным антибиотикам, или другим компонентам
препарата
—
тяжелые нарушения функции печени и почек
—
редкие наследственные формы непереносимости фруктозы, дефицит
сахаразы-изомальтазы или синдром глюкозо-галактозной мальабсорбции
(из-за содержания сахарозы)
—
детский возраст до 6 месяцев
—
беременность и период лактации
Взаимодействия
с другими лекарственными препаратами
Антациды:
при изучении влияния одновременного применения антацидов на
фармакокинетику азитромицина, не отмечалось изменения его
биодоступности, хотя максимальная концентрация азитромицина в плазме
крови снижалась на 24 %.
Цетиризин:
у здоровых добровольцев, совместный 5-дневный прием азитромицина с
цетиризином в дозе 20 мг не привел к фармакокинетическому
взаимодействию и значимому изменению интервала QT.
Диданозин:
совместный прием 1200 мг/сут азитромицина и 400 мг/сут диданозина у 6
ВИЧ-положительных больных, не повлиял на фармакокинетику диданозина в
сравнении с плацебо.
Дигоксин
и колхицин: сообщалось,
чтобы у отдельных пациентов, некоторые антибиотики из группы
макролидов влияли на метаболизм дигоксина в кишечнике. Поэтому, в
случае одновременного применения азитромицина и дигоксина, следует
помнить о возможном повышении концентрации дигоксина и проводить
мониторинг его уровня в крови.
Зидовудин:
при однократном применении 1000 мг и многократном применении доз
азитромицина 1200 мг или 600 мг, выявлено незначительное влияние на
фармакокинетику и выведение с мочой зидовудина и его глюкуронидных
метаболитов, однако прием азитромицина, повышал концентрацию
фосфорилированного зидовудина (клинически активного метаболита) в
мононуклеарах периферической крови. Остаётся неопределенной,
клиническая значимость данных показателей, но возможно, они могут
быть важны для пациентов. Азитромицин не взаимодействует с системой
цитохрома печени Р450, он не участвует в фармакокинетическом
лекарственном взаимодействии, как эритромицин и другие макролиды.
Азитромицин не индуцирует или инактивирует цитохром P450 с помощью
комплекса цитохром-метаболит.
Производные
эрготамина:
из-за теоретической возможности развития эрготизма, одновременное
назначение азитромицина с производными спорыньи не рекомендуется.
Фармакокинетические исследования были проведены с азитромицином и
препаратами с известным цитохром Р450-опосредованным метаболизмом.
Аторвастатин:
совместный прием аторвастатина (10 мг ежедневно) и азитромицина (500
мг ежедневно), не изменяет концентрации аторвастатина в плазме крови
(на основе анализа HMG CoA-редуктазы).
Карбамазепин:
в исследовании фармакокинетического взаимодействия азитромицина на
здоровых добровольцах, препарат не оказал значительного влияния на
уровень карбамазепина в плазме крови или на его активные метаболиты.
Циметидин:
изменение фармакокинетики азитромицина не отмечалось в
фармакокинетическом исследовании, изучающем действие разовой дозы
циметидина, принятой за 2 часа до азитромицина.
Пероральные
антикоагулянты кумаринового ряда:
в фармакокинетических исследованиях взаимодействия, азитромицин не
меняет антикоагулянтный эффект однократной дозы 15 мг варфарина,
принятой здоровыми добровольцами. В постмаркетинговом периоде,
получены сообщения об усилении антикоагулянтного действия, после
совместного приема азитромицина и пероральных кумариновых
антикоагулянтов. Хотя причинно-следственная связь не установлена,
следует контролировать протромбиновое время, при назначении
азитромицина больным, получающим пероральные антикоагулянты, типа
кумарина.
Циклоспорин:
в фармакокинетическом исследовании на здоровых добровольцах, которые
в течение 3 дней перорально получали 500 мг/день азитромицина, а
затем однократно перорально 10 мг/кг циклоспорина, Cmax и AUC0-5
циклоспорина оказались значительно повышенными. Следовательно,
следует проявлять осторожность, прежде чем рассматривать возможность
одновременного назначения этих препаратов. Если совместный прием этих
препаратов необходим, следует контролировать уровни циклоспорина и
при необходимости проводить коррекцию дозы.
Эфавиренз:
совместный прием однократной суточной дозы азитромицина 600 мг и
400 мг эфавиренза в течение 7 дней не приводило к клинически значимым
фармакокинетическим взаимодействиям.
Флуконазол:
совместный прием однократной дозы 1200 мг азитромицина не изменяет
фармакокинетику однократной дозы 800 мг флуконазола. Общее
воздействие и период полувыведения азитромицина не изменялись при
совместном введении с флуконазолом, однако, наблюдалось клинически
незначительное снижение Cmax (18%) азитромицина.
Индинавир:
совместный прием однократной дозы 1200 мг азитромицина не оказал
статистически значимого воздействия на фармакокинетику индинавира,
принимаемого в дозировке 800 мг три раза в день в течение 5 дней.
Метилпреднизолон:
в исследовании фармакокинетического взаимодействия у здоровых
волонтеров азитромицин не оказывал значительного влияния на
фармакокинетику метилпреднизолона.
Мидазолам:
у здоровых добровольцев, одновременный прием азитромицина 500
мг/сутки в течение 3-х дней не вызывал клинически значимых изменений
фармакокинетики и фармакодинамики одной дозы мидазолама 15 мг.
Нелфинавир:
совместный прием азитромицина (1200 мг) и нелфинавира в дозе 750 мг,
три раза в день привело к повышению концентрации азитромицина.
Клинически значимых побочных эффектов не наблюдалось, поэтому
коррекция дозы не требуется.
Рифабутин:
одновременное применение азитромицина и рифабутина не повлияло на
концентрацию этих препаратов в плазме крови.
При
одновременном применении азитромицина и рифабутина отмечалась
нейтропения. Развитие нейтропении было связано с применением
рифабутина, причинная связь с одновременным приемом азитромицина не
была установлена.
Силденафил:
у нормальных здоровых мужчин-добровольцев, не получено доказательств
влияния азитромицина (500 мг ежедневно в течение 3 дней) на AUC и
Cmax силденафила или его основного циркулирующего метаболита.
Терфенадин:
в фармакокинетических исследованиях не сообщалось о взаимодействии
между азитромицином и терфенадином. В некоторых случаях, трудно
полностью исключить вероятность взаимодействия, тем не менее, не было
получено конкретных доказательств того, что такое взаимодействие
имело место.
Теофиллин:
азитромицин не влиял на фармакокинетику теофиллина при одновременном
приеме азитромицина и теофиллина здоровыми волонтерами.
Триазолам:
14 здоровых добровольцев одновременно принимавшие 500 мг
азитромицина в 1-й день, 250 мг во 2-й день одновременно с 0,125 мг
триазолама во 2-й день не оказало существенного влияния на
фармакокинетические показатели триазолама (в сравнении с триазоламом
и плацебо).
Триметоприм/сульфаметоксазол:
одновременное
применение в течение 7 дней триметоприма/ сульфаметоксазола DS (160
мг/800 мг) с азитромицином 1200 мг, на 7 день не оказало
существенного влияния на максимальную концентрацию, общее воздействие
или выведение триметоприма или сульфаметоксазола. Концентрации
азитромицина в сыворотке были похожи на концентрации, которые
отмечались в других исследованиях.
Специальные
предупреждения
Длительность
применения препарата не должна превышать сроки, указанные в
инструкции.
Гиперчувствительность
Как
и при приеме других макролидов, сообщалось о развитии редких
серьезных аллергических реакций, таких как отек Квинке и анафилаксия
(в исключительных случаях со смертельным исходом). Некоторые из этих
реакций ведут к развитию рецидивирующих симптомов и требуют более
длительного наблюдения и лечения.
Гепатотоксичность
Печень
является основным органом, где происходит метаболизм азитромицина,
поэтому Азелтин
необходимо
с осторожностью назначать пациентам с тяжелым заболеванием печени. В
случае появления признаков и симптомов дисфункции печени, таких как
быстро развивающаяся астения, связанная с желтухой, темная моча,
склонность к кровотечениям или печеночная энцефалопатия, необходимо
немедленно провести функциональные пробы печени/анализы. При развитии
дисфункции печени, прием препарата Азелтин
необходимо прекратить и обратиться к врачу.
Алкалоиды
спорыньи и азитромицин
У
пациентов, получающих производные спорыньи, появление эрготизма
провоцируется одновременным приемом некоторых макролидных
антибиотиков. Нет данных, относительно возможности взаимодействия
между производными спорыньи и азитромицином, тем не менее, из-за
теоретической возможности развития эрготизма, азитромицин и
производные спорыньи должны приниматься раздельно.
Удлинение
интервала QT
Следует
соблюдать осторожность при применении препарата Азелтин
у пациентов с риском развития аритмии (особенно у пожилых
пациентов), а также:
—
при врожденном или приобретенном удлинении интервала QT,
—
у пациентов, принимающих антиаритмические препараты классов IА
(хинидин, прокаинамид) и III (дофетилид, амиодарон и соталол),
цизаприд, терфенадин, антипсихотические препараты (пимозид),
антидепрессанты (циталопрам), фторхинолоны (моксифлоксацин и
левофлоксацин),
—
при нарушении водно-электролитного баланса, особенно в случае
гипокалиемии или гипомагниемии,
—
при клинически значимой брадикардии, аритмии сердца или тяжелой
сердечной недостаточности.
Псевдомембранозный
энтероколит
Как
и при применении любых других антибиотиков, рекомендуется наблюдение
за признаками суперинфекции, вызванной резистентными
микроорганизмами, включая грибы. Лечение антибактериальными
препаратами изменяет нормальную флору кишечника, что ведет к
чрезмерному росту C.
difficile.
Диарея, вызванная Clostridium
difficile отмечалась
при применении всех антибактериальных препаратов, включая азитромицин
и может варьировать от легкой диареи до тяжелого колита.
Псевдомембранозный энтероколит должен рассматриваться у всех больных,
которые обращаются с диареей, после применения антибиотиков. В этих
случаях, необходим тщательный сбор анамнеза, особенно если диарея
появилась в течение первых двух месяцев после применения
антибактериального препарата.
Стрептококковая
инфекция
Азитромицин
не является препаратом первого выбора, для эмпирического лечения
инфекций в районах, имеющих большую распространенность резистентных
штаммов (составляющую 10% или более). В районах с высоким уровнем
заболеваемости и устойчивостью к эритромицину, особенно важно
учитывать изменение чувствительности к азитромицину и другим
антибиотикам. Что касается других макролидов, высокие показатели
резистентности азитромицина к Streptococcus
pneumoniae
(>
30%) были зарегистрированы в некоторых европейских странах. Это
следует учитывать, при лечении инфекций, вызванных Streptococcus
pneumoniae.
Почечная
недостаточность
У
пациентов с тяжелой почечной недостаточностью (скорость клубочковой
фильтрации <10 мл/мин) наблюдалось увеличение системного
воздействия азитромицина на 33%.
Миастения
Применение
препарата Азелтин
может спровоцировать развитие миастении или вызвать ее обострение.
Диабет
Препарат
Азелтин
содержит сахарозу, это необходимо учитывать пациентам с
наследственной непереносимостью фруктозы, глюкозы или галактозы,
недостаточностью сахаразы-изомальтазы и пациентам с диабетом, которые
не должны принимать данный препарат.
Беременность
и период лактация
Азитромицин
можно применять во время беременности, только в случаях, когда
ожидаемая польза для матери превышает потенциальный риск для плода.
Не
имеются данные о выделении препарата с материнским молоком. Так как
многие препараты выводятся из организма с материнским молоком,
Азелтин
не следует применять для лечения кормящей женщины, если потенциальная
польза для матери, не превышает возможный риск для ребенка.
Особенности
влияния препарата на способность управлять транспортным средством или
потенциально опасными механизмами
Нет
никаких доказательств влияния препарата Азелтин
на способность к управлению автотранспортом или проведению работ с
движущимися механизмами.
Рекомендации
по применению
Режим
дозирования
Азелтин
следует принимать в виде разовой суточной дозы.
Азелтин
можно принимать с пищей или без.
Дети
и подростки с массой тела более 45 кг, взрослые и пожилые
Для
детей с массой тела более 45 кг и взрослых, в том числе пациентов
пожилого возраста, общая доза препарата Азелтин составляет 1500 мг,
которую следует принять в течение трех дней (по 500 мг один раз в
день).
При
неосложненных генитальных инфекциях (хламидиозе), рекомендуется
однократная разовая доза 1000 мг. Для чувствительных штаммов
гонококковой инфекции, рекомендуемая доза составляет 1000 мг или
2000 мг препарата Азелтин в комбинации с 250 мг или 500 мг
цефтриаксона (в соответствии с действующими руководствами по
применению антибактериальных препаратов). Для пациентов, страдающих
аллергией на пенициллин и / или цефалоспоринов, назначающие следует
проконсультироваться принципы местного лечения.
Дети
Дети
и подростки с массой тела менее 45 кг
Отсутствует
информации по применению азитромицина у детей младше 6-месяцев. Доза
для детей составляет 10 мг/кг, препарат применяется в виде
однократной суточной дозы в течение 3-х дней.
Для
детей с массой тела более 15 кг
суспензию Азелтина следует принимать с помощью ложки, в соответствии
со следующей инструкцией:
Детям
с массой тела 15-25 кг (3-7 лет): 5 мл (200 мг), один раз в день в
течение 3-х дней.
Детям
с массой тела 26-35 кг (8-11 лет): по 7,5 мл (300 мг), один раз в
день в течение 3-х дней.
Детям
с массой тела 36-45 кг (12-14 лет): по 10 мл (400 мг), один раз в
день в течение 3-х дней.
Для
детей, с массой тела более 45 кг: доза соответствующая взрослым
пациентам.
Детям
с массой тела более 45 кг: доза как для взрослых.
Пациенты
с почечной недостаточностью
Пациентам
с легкой и умеренной почечной недостаточностью (скорость клубочковой
фильтрации 10-80 мл/мин) коррекция дозы не требуется.
Азелтин
должен применяться с осторожностью у больных с тяжелой почечной
недостаточностью (скорость клубочковой фильтрации <10 мл/мин).
Пациенты
с печеночной недостаточностью
Пациентам
с легкой и умеренно выраженной печеночной недостаточностью,
корректировка дозы не требуется. Поскольку азитромицин
метаболизируется в печени и выводится с желчью, препарат не следует
применять пациентам с тяжелым заболеванием печени. Нет доступной
информации о применении препарата при более тяжелых нарушениях печени
Способ
применения
Азелтин
предназначена только для перорального применения.
Рекомендуется
обращаться за консультацией к медицинскому работнику для разъяснения
способа применения лекарственного препарата
Описание
нежелательных реакций, которые
проявляются при стандартном применении ЛП и меры, которые следует
принять в этом случае (при необходимости)
Очень
часто
—
диарея,
боли в животе, тошнота, метеоризм
Часто
—
анорексия
—
головокружение, головная боль, парастезия, дисгевзия (извращение
вкуса)
—
нарушение четкости зрения
—
глухота
—
рвота, диспепсия
-зуд,
сыпь
—
артралгия
—
усталость
—
уменьшение количества лимфоцитов, увелечение количества эозинофилов,
снижение бикарбоната крови
Нечасто
-
кандидоз,
кандидоз полости рта, вагинальные инфекции -
лейкопения,
нейтропения -
отек
Квинке, повышенная чувствительность -
нервозность
-
гипоэстезия,
сонливость, бессоница -
расстройство
слуха, шум в ушах -
ощущение
сердцебиения -
гастрит,
запор -
гепатит
-
синдром
Стивенса-Джонсона, реакции фоточувствительности, крапивница -
боли
в грудной клетке, отеки, недомогание, астения -
наушение
содержания калия в крови, повышение аспартат-аминотрансферазы,
аланинаминотрансферазы, билирубина крови, мочевины и креатинина
крови
Редко
-
ажитация
(возбуждение) -
головокружение
-
нарушение
функции печени -
токсический
эпидермальный некролиз
Очень
редко
-
реакция
на лекарственный препарат с эозинофилией и системными проявлениями
(DRESS-синдром)
Не
известно
-
псевдомембранозный
колит -
тромбоцитопения,
гемолитическая анемия -
анафилактическая
реакция -
метоболизм
и нарушения питания -
агрессия,
тревожность -
обморок,
судороги, психомоторная гиперактивность, аносмия (потеря обоняния),
паросмия (неправильное определение запахов), миастения, агевзия
(нарушение вкусового восприятия) -
пируэтная
тахикардия, аритмия (включая желудочковую тахикардию) -
гипотензия
-
панкреатит,изменение
цвета языка -
печеночная
недостаточность (которая редко приводила к смерти), фульминантный
гепатит, некроз печени, холестатическая желтуха -
болезни
соединительной ткани, мультиформная эритема -
острая
почечная недостаточность, интерстициальный нефрит -
удлинение
интервала QT
на
электрокардиограмме
При
возникновении нежелательных лекарственных реакций обращаться к
медицинскому работнику, фармацевтическому работнику или напрямую в
информационную базу данных по нежелательным реакциям (действиям) на
лекарственные препараты, включая сообщения о неэффективности
лекарственных препаратов
РГП
на ПХВ «Национальный Центр экспертизы лекарственных средств и
медицинских изделий» Комитет контроля качества и безопасности
товаров и услуг Министерства здравоохранения Республики Казахстан
http://www.ndda.kz
Дополнительные
сведения
Состав
лекарственного препарата
5 мл
суспензии содержат
активное
вещество — азитромицина дигидрат 209.64 мг
(эквивалентно азитромицину 200 мг)
вспомогательные
вещества: сахароза, тринатрия фосфат
безводный, натрия бензоат, гидроксипропилцеллюлоза, камедь
ксантановая, натрия сахарин, ароматизатор банановый, ароматизатор
малиновый.
Описание
внешнего вида, запаха, вкуса
Порошок
белого цвета с характерным запахом банана и малины.
Готовая
суспензия представляет собой однородную суспензию белого цвета с
желтоватым оттенком.
Форма выпуска и упаковка
По
12.56 г порошка для приготовления суспензии помещают в непрозрачные
полиэтиленовые флаконы белого цвета объемом 15 мл, укупоренные
пластиковой крышкой.
По
1 флакону вместе с мерной ложкой объемом 5 мл, мерным стаканчиком
объемом 7.5 мл и инструкцией по медицинскому применению на казахском
и русском
языках помещают в пачку из картона.
Срок хранения
2 года
Не
применять
по истечении
срока годности.
Условия хранения
Хранить
в защищенном от света месте при температуре не выше 25˚С.
Готовую
суспензию хранить при температуре не выше
25˚С,
не более 5-ти дней.
Хранить
в недоступном для детей месте.
Условия отпуска из аптек
По
рецепту
Сведения
о производителе
Биофарма
Илач Сан. ве Тидж. А.Ш.,
г.
Стамбул,
Санджактепе, район Акпинар, ул.
Османгази,
№156, Турция
тел:
+90 216 398 10 63;
факс:
+90 216 398 10 20;
e—mail:
YurtDisiRuhsat@biofarma.com.tr
Держатель
регистрационного удостоверения
Биофарма
Илач Сан. ве Тидж. А.Ш.,
г.
Стамбул,
Санджактепе, район Акпинар, ул.
Османгази,
№156, Турция
тел:
+90 216 398 10 63;
факс:
+90 216 398 10 20;
e—mail:
YurtDisiRuhsat@biofarma.com.tr
Наименование,
адрес и контактные данные (телефон, факс, электронная почта)
организации
на
территории Республики Казахстан, принимающей претензии (предложения)
по качеству лекарственных средств от потребителей и
ответственной
за пострегистрационное наблюдение за безопасностью лекарственного
средства
ТОО
«Altes Pharm
(Алтес Фарм)»,
050000, Республика Казахстан, г.Алматы, ул. Толе би
83, Бизнес центр «Ambassador»,
офис 777.
Тел./факс
+7-727-292-26-08
E—mail:
pvkz@altesgroup.com
| Азелтин_пор.ЛВ_каз_.doc | 0.14 кб |
| Азелтин_ЛВ_суспензия_03.11_.2020_.docx | 0.06 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Vitamin D3
Регистрационный номер
Торговое наименование
Витамин Д3
Международное непатентованное наименование
Лекарственная форма
капли для приёма внутрь масляные
Состав
Описание
Прозрачная бесцветная или от слегка желтоватого до светло-жёлтого цвета вязкая жидкость с характерным запахом.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Колекальциферол является противорахитическим средством, восполняющим дефицит витамина D3. Он участвует в регуляции кальций-фосфорного обмена, усиливает всасывание кальция в кишечнике и реабсорбцию фосфатов в почках, способствует минерализации костей и является необходимым для нормального функционирования паращитовидных желёз.
Дефицит кальция и/или витамина D3 вызывает гиперсекрецию паратгормона. Вследствие этого вторичного гиперпаратиреоза возникает усиление ремоделирования костной ткани, что приводит к хрупкости и переломам костей.
Применение кальция и витамина D3 в рекомендуемом диапазоне доз вызывает снижение секреции паратгормона.
Фармакокинетика
Абсорбция
Витамин D3 (колекальциферол) при пероральном приёме практически полностью всасывается (80 %) в тонкой кишке. Максимальная концентрация в тканях достигается через 4–5 часов, после чего концентрация несколько снижается, сохраняясь длительное время на постоянном уровне.
Распределение
Колекальциферол в плазме крови связывается с колекальциферол-связывающим белком и транспортируется в печень, где происходит микросомальное гидроксилирование с образованием неактивного метаболита 25-гидроксиколекальциферола (кальцифедиол). Концентрация циркулирующего в крови кальцифедиола является показателем уровня витамина D3 в организме.
Метаболизм
Затем кальцифедиол поступает в почки, где подвергается повторному гидроксилированию с образованием активного метаболита 1,25-дигидроксиколекальциферола (кальцитриола). Витамин D3 и его метаболиты могут накапливаться в мышечной и жировой тканях, где их концентрация может сохраняться до нескольких месяцев. После приёма высоких доз витамина D3 концентрация кальцифедиола в сыворотке крови может сохраняться повышенной в течение нескольких месяцев. Гиперкальциемия вследствие передозировки витамином D3 может сохраняться в течение нескольких недель.
Выведение
Кальцитриол подвергается дальнейшему гидроксилированию перед выведением из организма. Основным путём выведения витамина D3, а также его гидроксилированных и сульфатных производных является желчь (кал), и не менее 2 % указанных веществ выделяется с мочой. Колекальциферол проникает через плацентарный барьер и выделяется с грудным молоком.
Показания
- Профилактика и лечение дефицита витамина D.
- Профилактика и лечение рахита.
- В комплексном лечении остеопороза, в том числе, менопаузального.
Противопоказания
Гиперчувствительность к колекальциферолу и/или к любому из вспомогательных веществ, входящих в состав препарата; гипервитаминоз витамина D; повышенная концентрация кальция в крови (гиперкальциемия); повышенное выделение кальция с мочой (гиперкальциурия); мочекаменная болезнь (образование кальциевых оксалатных камней); почечная остеодистрофия с гиперфосфатемией; псевдогипопаратиреоз; саркоидоз; острые и хронические заболевания печени и почек, почечная недостаточность, активная форма туберкулёза лёгких, детский возраст до 4-х недель.
С осторожностью
Приём дополнительных количеств колекальциферола и кальция (например, в составе других препаратов), при нарушениях экскреции кальция и фосфатов с мочой, при лечении иммобилизированных пациентов, при одновременном приёме тиазидов, сердечных гликозидов (особенно гликозидов наперстянки), производных бензотиадиазина, у пациентов с атеросклерозом; в период беременности и грудного вскармливания.
У грудных детей при предрасположенности к раннему зарастанию родничков (когда от рождения установлены малые размеры переднего темечка).
Применение при беременности и в период грудного вскармливания
В период беременности не следует принимать витамин D в высоких дозах из-за возможности проявления тератогенного эффекта в случае передозировки.
Не следует превышать рекомендованные дозы препарата, так как, возможно развитие гиперкальциемии, которая может привести к задержке умственного и физического развития плода.
В период грудного вскармливания витамин D следует назначать с осторожностью, так как, препарат, применяемый в высоких дозах матерью, может вызвать симптомы передозировки у ребёнка.
Способ применения и дозы
Перорально.
Препарат принимается в ложечке жидкости.
Профилактические дозы:
- доношенные новорождённые с 4-х недель жизни до 2–3 лет при правильном уходе и достаточном пребывании на свежем воздухе: 500 ME (1 капля) в сутки.
- недоношенные дети с 4-х недель жизни, близнецы, младенцы, находящиеся в плохих жизненных условиях: 1000–1500 ME (2–3 капли) в сутки.
В летнее время года дозу можно ограничить до 500 ME (1 капля) в сутки.
- у взрослых лиц без нарушения всасывания: 500 ME (1 капля) в сутки.
- у взрослых пациентов при синдроме мальабсорбции: 3000 ME (6 капель) — 5000 ME (10 капель) в сутки.
- беременные женщины: ежедневная доза 500 ME (1 капля) на время всего периода беременности, либо 1000 ME (2 капли) в сутки, начиная с 28 недели беременности.
- в постменопаузальном периоде 500–1000 ME (1–2 капли) в сутки. Терапевтические дозы.
При рахите: ежедневно 1000–5000 ME (2–10 капель), в зависимости от степени тяжести рахита (I, II или III) и варианта протекания, на протяжении 4–6 недель, под тщательным контролем за клиническим состоянием и исследованием биохимических показателей (кальция, фосфора, щелочной фосфатазы) крови и мочи. Начинать следует с 1000 ME (2 капли) в течение 3–5 дней. Затем, при хорошей переносимости, дозу повышают до индивидуальной лечебной дозы (чаще всего 3000 ME (6 капель).
Доза 5000 ME (10 капель) назначается только при выраженных костных изменениях. По мере необходимости после одной недели перерыва, можно повторить курс лечения.
Лечение проводится до чёткого лечебного эффекта, с последующим переходом на профилактическую дозу 500–1500 ME в сутки.
В комплексном лечении постменопаузального остеопороза: 500–1000 ME (1–2 капли) в сутки.
Дозировка, как правило, назначается с учётом количества витамина D, поступающего с пищей.
Побочное действие
Нарушения со стороны иммунной системы: реакции гиперчувствительности, такие, как ангионевротический отёк или отёк гортани.
Нарушения со стороны обмена веществ и питания: гиперкальциемия, гиперкальциурия, снижение аппетита.
Нарушения со стороны желудочно-кишечного тракта: запор, вздутие живота, тошнота, абдоминальная боль, диарея.
Нарушения со стороны кожи и подкожной клетчатки: реакции гиперчувствительности, такие как, зуд, сыпь, крапивница.
Нарушения со стороны нервной системы: головная боль.
Нарушения со стороны скелетно-мышечной и соединительной ткани: артралгия, миалгия.
Нарушения со стороны почек и мочевыводящих путей: нарушения функции почек, полиурия.
Передозировка
Симптомы
Острая и хроническая передозировка витамином D может привести к гиперкальциемии, которая может иметь персистирующий характер и потенциально угрожать жизни. Симптомы носят общий характер и могут включать сердечные аритмии, жажду, тошноту, рвоту, запор, полидипсию, полиурию, дегидратацию, гиперкальциурию с формированием почечных камней, нефрокальциноз, мышечную слабость, адинамию и спутанность сознания. Более того, хроническая передозировка может привести к отложению кальция в сосудах и тканях.
Передозировка приводит к увеличению уровней фосфора в сыворотке крови и моче, а также к гиперкальциемическому синдрому и последующему отложению кальция в тканях, прежде всего в почках (мочекаменная болезнь, нефрокальциноз) и сосудах. Симптомы интоксикации имеют общий характер и проявляются в виде тошноты, рвоты, также первоначально в виде диареи, позже — в виде запора, потери аппетита, слабости, головной боли, боли в мышцах, боли в суставах, мышечной слабости, постоянной сонливости, полидипсии и полиурии и, на завершающей стадии, в виде обезвоживания организма. Типичные биохимические данные включают гиперкальциемию, гиперкальциурию, а также повышение в сыворотке крови концентрации 25-гидроксиколекальциферола.
Лечение
Прежде всего, необходимо прекратить приём витамина D. Для устранения гиперкальциемии, вызванной интоксикацией витамином D, требуется несколько недель.
В зависимости от степени гиперкальциемии, в качестве мер лечения назначают диету с низким содержанием кальция или полностью без кальция, потребление большого количества жидкости, форсированный диурез с применением фуросемида, а также глюкокортикоиды и кальцитонин.
При надлежащем функционировании почек уровень кальция может быть значительно снижен путём инфузии изотонического раствора хлорида натрия (3–6 литров в течение 24 часов) с добавлением фуросемида и, в некоторых случаях, также натрия эдетата в дозе 15 мг/кг/ч, при одновременном постоянном мониторинге уровня кальция и данных ЭКГ.
При олигоанурии, напротив, необходимо повести гемодиализ (диализат без кальция).
Специфического антидота не существует.
Рекомендуется обращать внимание пациентов на симптомы возможной передозировки при длительном потреблении высоких доз витамина D (тошнота, рвота, также первоначально диарея, позже — запор, анорексия, слабость, головная боль, боль в мышцах, боль в суставах, мышечная слабость, сонливость, азотемия, полидипсия и полиурия).
Взаимодействие с другими лекарственными средствами
Одновременный приём противосудорожных лекарственных препаратов (таких как фенитоин) или барбитуратов (и, возможно, других лекарственных средств, индуцирующих ферменты печени) может снизить эффективность колекальциферола за счёт увеличения скорости биотрансформации колекальциферола в неактивные метаболиты.
Сопутствующая терапия препаратами глюкокортикостероидов может снижать эффективность колекальциферола.
Пероральный приём колекальциферола может усилить терапевтический эффект и токсический потенциал наперстянки и других сердечных гликозидов (риск развития аритмии) за счёт развития гиперкальциемии.
Требуется тщательное медицинское наблюдение, контроль показателей ЭКГ и уровней кальция в плазме крови и моче, и, при необходимости, корректировка дозы сердечных гликозидов.
В случае сопутствующей терапии тиазидными диуретиками, которые уменьшают экскрецию кальция с мочой, рекомендуется контролировать содержание кальция в сыворотке крови и моче.
Одновременное лечение ионообменными смолами (такими, как колестирамин), препаратами орлистата или слабительными средствами (такими, как парафиновое масло) может уменьшать всасывание колекальциферола в пищеварительном тракте. Одновременный приём рифампицина и изониазида может снизить эффективность препарата из-за увеличения скорости биотрансформации колекальциферола.
На фоне одновременного приёма антацидов, содержащих алюминий, и колекальциферола может повышаться концентрация магния в крови.
На фоне одновременного приёма антацидов, содержащих алюминий, и колекальциферола может повышаться концентрация алюминия в крови, что увеличивает риск токсического воздействия алюминия.
Особые указания
При одновременном назначении других препаратов, содержащих колекальциферол, следует учитывать дозу колекальциферола, содержащегося в препарате «Витамин Д3». Дополнительное применение колекальциферола или кальция следует проводить только под наблюдением врача. Применение высоких доз витамина D3 может вызвать хронический гипервитаминоз D3.
Определение суточной потребности ребёнка в витамине D и способа его применения должны устанавливаться врачом индивидуально и каждый раз подвергаться коррекции во время периодических обследований, особенно в первые месяцы жизни. Необходимо контролировать концентрацию кальция в крови и моче. Препарат не следует применять при псевдогипопаратиреозе, поскольку в фазе нормальной чувствительности к колекальциферолу потребность в колекальцифероле может уменьшаться, что приводит к риску развития отсроченной передозировки. В таких случаях лучше использовать активные метаболиты витамина D, позволяющие более точно регулировать дозировку.
Препарат следует с осторожностью принимать у пациентов с нарушенной экскрецией кальция и фосфатов с мочой, при лечении производными бензотиазидина и у иммобилизированных пациентов (риск развития гиперкальциемии и гиперкальциурии). У таких пациентов следует контролировать концентрацию кальция в плазме крови и моче.
При длительном лечении колекальцитриолом следует контролировать концентрацию кальция в плазме крови и моче, а также проводить оценку функции почек путём измерения концентрации сывороточного креатинина.
Это особенно важно для пациентов пожилого возраста и при сопутствующем лечении сердечными гликозидами и диуретиками.
Влияние на способность управлять транспортными средствами, механизмами
Исследования по влиянию на способность управлять транспортным средством и работу с механизмами не проводились.
Форма выпуска
Капли для приёма внутрь масляные 20000 МЕ/мл.
По 10, 15, 20 мл во флаконы коричневого стекла, укупоренные пробками- капельницами и крышками с контролем первого вскрытия из полиэтилена.
Каждый флакон вместе с инструкцией по применению помещают в пачку из картона для потребительской тары.
Хранение
В защищённом от света месте при температуре не выше 25 °C.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности.
Условия отпуска из аптек
Без рецепта.
Производитель
Марбиофарм, ОАО,
Российская Федерация
Владелец регистрационного удостоверения /Производитель/
Организация, принимающая претензии от потребителей
ОАО «Марбиофарм»,
424006, Россия, Республика Марий Эл, г. Йошкар-Ола, ул. К. Маркса, д. 121,
тел.: (8362) 42-03-12, факс: (8362) 45-00-00
Илсира® (Ilsira) инструкция по применению
📜 Инструкция по применению Илсира®
💊 Состав препарата Илсира®
✅ Применение препарата Илсира®
📅 Условия хранения Илсира®
⏳ Срок годности Илсира®
Описание лекарственного препарата
Илсира®
(Ilsira)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2023 года.
Дата обновления: 2022.11.11
Владелец регистрационного удостоверения:
Контакты для обращений:
БИОКАД АО
(Россия)
Код ATX:
L04AC
(Ингибиторы интерлейкина)
Лекарственная форма
| Илсира® |
Р-р д/п/к введения 180 мг/1 мл: шприцы 0.9 мл 2 или 4 шт. в компл. с салфетками рег. №: ЛП-006244 |
Форма выпуска, упаковка и состав
препарата Илсира®
Раствор для п/к введения прозрачный, желто-коричневого цвета; возможно наличие легкой опалесценции.
* предварительно наполненный шприц.
Вспомогательные вещества: натрия ацетата тригидрат — 0.392 мг, глицин — 6.8 мг, маннитол — 20.7 мг, кислота уксусная ледяная — до pH 5.0, вода д/и — до 0.9 мл.
0.9 мл — шприцы трехкомпонентные из бесцветного стекла (1) — упаковки ячейковые контурные (2) в комплекте с салфетками спиртовыми (2 шт.) — пачки картонные.
0.9 мл — шприцы трехкомпонентные из бесцветного стекла (1) — упаковки ячейковые контурные (4) в комплекте с салфетками спиртовыми (4 шт.) — пачки картонные.
На каждый шприц наклеивают самоклеящуюся этикетку.
Фармакологическое действие
Левилимаб — рекомбинантное моноклональное антитело подкласса IgG1, высокогомологичное нативным человеческим антителам, связывающееся с α-субъединицей рецептора к интерлейкину-6 (ИЛ-6). Молекула левилимаба содержит вариабельные фрагменты легких и тяжелых цепей глубокой оптимизации и константные домены с полностью человеческой последовательностью. Левилимаб связывается и блокирует как растворимые (рИЛ6Р), так и мембранные рецепторы ИЛ-6 (мИЛ6Р). Блокада обеих форм рецептора позволяет предотвратить реализацию ИЛ-6-ассоциированного провоспалительного каскада, препятствует активации антиген-представляющих клеток, В- и Т-лимфоцитов, моноцитов и макрофагов, эндотелиальных клеток и фибробластов, и избыточной продукции других провоспалительных цитокинов. ИЛ-6 является ключевым элементом синдрома массивного высвобождения цитокинов (синдрома «цитокинового шторма», гемофагоцитарного лимфогистиоцитоза или синдрома активации макрофагов), который может привести к острому респираторному дистресс-синдрому, полиорганной недостаточности и являться причиной летального исхода. Массивное высвобождение цитокинов («цитокиновый шторм») наблюдается у пациентов, получающих иммуносупрессивную терапию, включая деплецирующие агенты (в частности моноклональные антитела к рецепторам Т- и В-лимфоцитов), а также при тяжелых инфекционных заболеваниях, в т.ч. у пациентов с COVID-19. Высокий уровень ИЛ-6 в крови ассоциирован с более тяжелым течением новой коронавирусной инфекции и выраженными изменениями легких, что обусловливает потребность в интенсивной терапии и увеличивает риск летального исхода при COVID-19. ИЛ-6 – единственный цитокин, непосредственно индуцирующий синтез острофазовых белков в гепатоцитах: С-реактивного белка (СРБ), фибриногена, сывороточного амилоидного белка А-SAA, гепсидина, лептина. Кроме того, ИЛ-6 участвует в активации и поддержании местных воспалительных реакций (образование паннуса в синовии, стимуляция остеокластогенеза — эрозии хрящевой ткани, остеопороз), что наблюдается в патогенезе ревматоидного артрита.
Специфическая противовоспалительная активность левилимаба продемонстрирована в тестах in vitro и in vivo. Левилимаб оказывает антипролиферативное действие на культуру клеток DS-1, вызывая дозозависимое ингибирование роста клеток. На модели коллаген-индуцированного артрита у яванских макак (Macaca fascicularis) многократное (1 раз в неделю в течение 7 недель) п/к введение левилимаба сопровождается снижением выраженности воспалительной реакции в суставах, что подтверждено при гистологическом исследовании (значимое снижение выраженности воспалительных и дегенеративных изменений хрящевой ткани).
Изменение параметров фармакодинамических маркеров (нарастание концентрации рИЛ6Р, насыщение мИЛ6Р, нарастание концентрации ИЛ-6) свидетельствует о высокоэффективной дозозависимой нейтрализации препаратом левилимаб обеих форм рецептора ИЛ-6, что в свою очередь сопровождается быстрым и выраженным снижением сывороточной концентрации СРБ, отражающим эффективное подавление воспалительного процесса. В клинических исследованиях левилимаба продемонстрировано блокирование до 90% мембранных рецепторов к ИЛ-6 в течение первых 2 часов от момента однократного п/к введения препарата в дозе 1.6 мг/кг и более.
Фармакокинетика
Всасывание и распределение
При однократном п/к введении левилимаба наблюдается дозозависимый рост его концентрации в сыворотке крови. После введения препарат начинает обнаруживаться в сыворотке крови пациентов через 2-12 ч, и его концентрация нарастает, достигая максимальных значений через 96 [72-168] ч. Дозы препарата, превышающие 2.0 мг/кг, продемонстрировали двухфазный характер увеличения концентрации: первый пик наблюдался в период 48-72 ч, второй – к 168 ч с последующим снижением до неопределяемых значений к 70 дню.
После однократного п/к введения препарата в дозе 162 мг Cmax левилимаба в сыворотке крови составляла 17543 [10975; 28323] нг/мл, а значения показателя AUC, рассчитанного в период 0-168 ч (AUC0-168) – 1866231 [1297632-3719014] нг/мл×ч.
При многократном введении левилимаба пациентам с ревматоидным артритом значения суммарной AUC, рассчитанной в период 0-2016 ч после введения (AUC0-2016), составили 189580779 [134794695; 230680771] нг/мл×ч при введении 1 раз в неделю и 50763951 [34465213.5; 65810194.5] нг/мл×ч при введении 1 раз в 2 недели. Показатель Сmax-mult при повторных введениях нарастал и достигал значений 201024 [151563-246408] нг/мл при еженедельном введении препарата и 51570 [37201-71740] нг/мл при введении 1 раз в 2 недели. При этом Tmax составляло 1848 [1512; 2016] ч при еженедельном введении препарата и 1848 [1512; 1848] ч при введении 1 раз в 2 недели соответственно. Стационарный Vd составил 7871.029 [4226.795; 13363.547] мл при введении препарата 1 раз в неделю и 7130.453 [5532.978; 11387.959] мл при введении 1 раз в 2 недели.
При повторных введениях отмечается накопление препарата, с ростом Cmax в 6.5-14.2 раза при еженедельном введении и в 1.9-4.2 раза при введении препарата 1 раз в 2 недели. Коэффициент кумуляции (AR) составил 10.932 [6.446; 14.178] для еженедельного введения препарата и 2.593 [1.902; 4.164] для введения 1 раз в 2 недели.
Таким образом, у пациентов с ревматоидным артритом многократное п/к введение левилимаба 1 раз в неделю обеспечивает более высокую сывороточную концентрацию и экспозицию по сравнению с введением 1 раз в 2 недели.
Выведение
Общий клиренс (Cl) левилимаба после однократного введения в дозе 2.2 мг/кг составил 35.288±11.7 мл/ч, а в дозе 2.9 мг/кг показатель Cl – 25.974±1.1 мл/ч. T1/2 однократной п/к дозы 2.9 мг/кг составил 133.683 [92.754; 197.197] ч. Значения показателей, характеризующих период элиминации, обладают дозозависимостью (показатели среднего времени пребывания препарата в организме (MRT) и T1/2 нарастают с увеличением введенной дозы, а Cl – снижается), что говорит о нелинейной фармакокинетике препарата, обусловленной мишень-опосредованными распределением и элиминацией.
Фармакокинетика у особых групп пациентов
Пациенты с почечной и печеночной недостаточностью: специальных исследований у данной категории пациентов не проводилось; фармакокинетические данные у больных с почечной и печеночной недостаточностью отсутствуют.
Пациенты в возрасте старше 65 лет: фармакокинетические данные у лиц в возрасте старше 65 лет отсутствуют.
Показания препарата
Илсира®
Новая коронавирусная инфекция (COVID-19)
- патогенетическая терапия синдрома высвобождения цитокинов при тяжелом течении новой коронавирусной инфекции (CОVID-19).
Ревматоидный артрит
- ревматоидный артрит умеренной или высокой степени активности у взрослых с отсутствием адекватного ответа на терапию одним или несколькими болезнь-модифицирующими противоревматическими препаратами, в т.ч. для торможения рентгенологической прогрессии. Левилимаб применяется в комбинированной терапии с метотрексатом и/или другими синтетическими базисными противовоспалительными препаратами.
Режим дозирования
Для п/к введения.
Препарат Илсира® предназначен для введения как в амбулаторно-поликлинических, так и в стационарных условиях.
Применение левилимаба должно осуществляться под контролем врача. В случае длительного применения препарата, в частности для терапии ревматоидного артрита, если врач считает это возможным, после соответствующего обучения технике п/к инъекций пациенты могут самостоятельно вводить себе препарат.
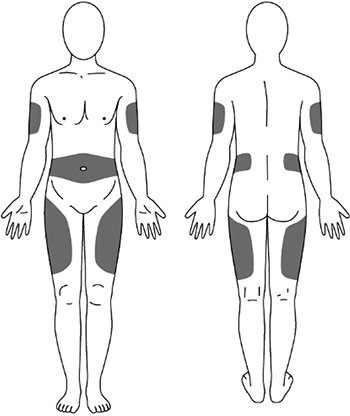
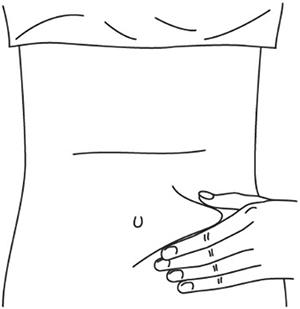
Препарат Илсира® вводят п/к с помощью преднаполненного шприца в область передней брюшной стенки (отступая не менее 5 см от пупка), передней и боковой поверхности бедра или средней трети наружной части плеча.
Не следует вводить препарат в места с поврежденной или измененной кожей (с наличием уплотнений, покраснений, новообразований, гиперпигментаций или повышенной чувствительности).
С целью патогенетической терапии синдрома высвобождения цитокинов при тяжелом течении новой коронавирусной инфекции (CОVID-19) рекомендуемая доза препарата Илсира® составляет 324 мг однократно в виде двух п/к инъекций по 162 мг каждая. В случае недостаточного эффекта первой дозы левилимаба возможно повторное введение препарата через 48–96 ч в дозе 324 мг в виде двух п/к инъекций по 162 мг каждая. Решение о необходимости повторного введения принимается исключительно врачом.
Для терапии ревматоидного артрита рекомендуемая доза препарата Илсира® составляет 162 мг 1 раз в неделю.
При достижении ремиссии заболевания возможно применение в режиме 162 мг п/к 1 раз в 2 недели. Пациентам, не достигшим ремиссии, рекомендовано продолжить применение препарата в дозе 162 мг п/к 1 раз в неделю. Пациентам, имеющим нарастание активности заболевания после снижения кратности введений, рекомендовано возобновить применение препарата в дозе 162 мг п/к 1 раз в неделю.
При развитии нежелательных явлений в ходе терапии ревматоидного артрита, связанных с изменением лабораторных показателей, следует провести коррекцию дозы и режима введения в соответствии с рекомендациями в таблицах 1, 2 и 3.
Таблица 1. Рекомендации по коррекции дозы при повышении активности печеночных ферментов АЛТ или АСТ
Таблица 2. Рекомендации по коррекции дозы при снижении абсолютного числа нейтрофилов (АЧН)
Таблица 3. Рекомендации по коррекции дозы при снижении количества тромбоцитов
Пропуск дозы при терапии ревматоидного артрита
При пропуске очередного введения по любой причине инъекция препарата Илсира® должна быть произведена как можно быстрее. Новый отсчет для даты следующего введения начинают с момента фактически проведенной инъекции препарата Илсира®.
Указания по применению
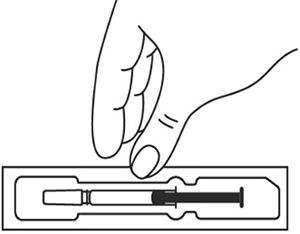
Подготовка к проведению п/к инъекции
- Тщательно вымойте руки.
img_ilsira_0.tif|jpg
- Извлеките упаковку со шприцем из холодильника. Затем извлеките шприц с лекарственным препаратом из картонной пачки. Осмотрите шприц, а также лекарственный препарат, находящийся в нем. Нельзя использовать шприц в случае:
- помутнения раствора, наличия в препарате посторонних видимых частиц;
- изменения цвета;
- повреждения любых частей шприца;
- истечения срока годности (годен до …), указанного на картонной пачке, а также на этикетке шприца.
- Оставьте шприц при комнатной температуре приблизительно на 25-30 мин. Не следует согревать шприц с препаратом каким-либо другим способом.
img_ilsira_2-1.tif|jpg
- Подготовьте спиртовую салфетку/ватный тампон.
На данном этапе не следует снимать колпачок шприца.
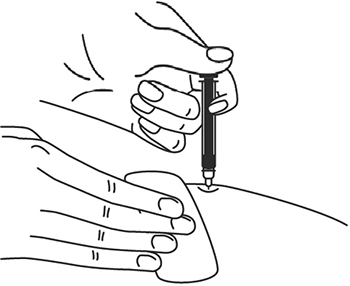
Техника выполнения п/к инъекции препарата Илсира® в преднаполненном шприце
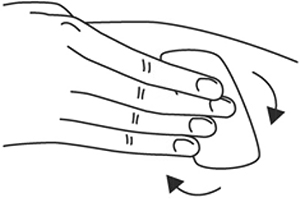
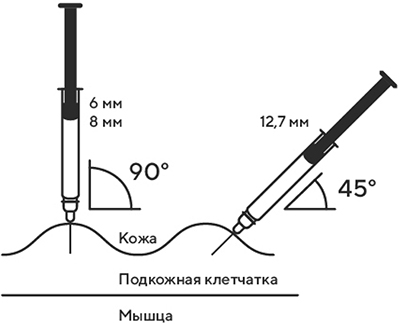
1. Выберите место инъекции (передняя брюшная стенка (отступая не менее 5 см от пупка), передняя и боковая поверхность бедра или средняя треть наружной части плеча (возможные места для инъекций закрашены на рисунке ниже)).
2. Нельзя вводить препарат в место на коже, где имеется болезненность, покраснение, уплотнение или кровоподтек. Эти признаки могут указывать на наличие инфекции. Также не следует вводить препарат в места родинок, гиперпигментаций и шрамов.
3. Место укола необходимо обработать спиртовой салфеткой круговыми движениями.
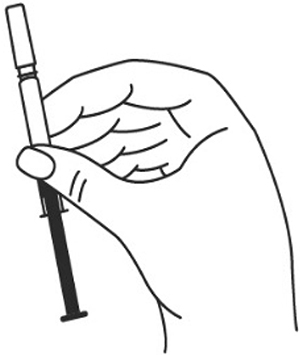
4. Шприц не встряхивать.
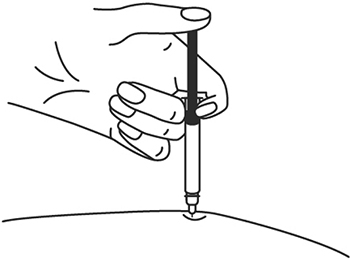
5. Снимите колпачок с иглы, не дотрагиваясь до иглы и избегая прикосновения к другим поверхностям.
6. Одной рукой возьмите в складку обработанную кожу.
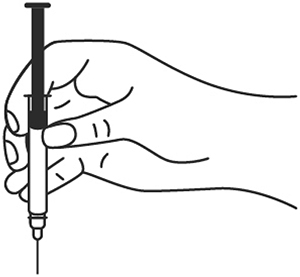
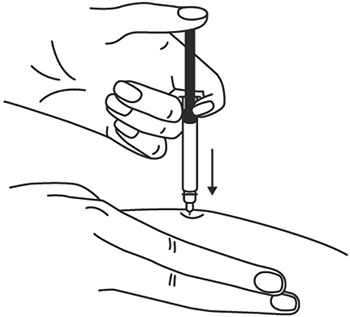
7. В другую руку возьмите шприц, держа его градуированной поверхностью вверх. Введение препарата необходимо осуществлять под углом 45 или 90 градусов к поверхности кожи в зависимости от толщины кожи и выраженности подкожно-жирового слоя (у худощавых пациентов введение препарата осуществляется под углом 45 градусов, у пациентов с толщиной кожной складки более 1.5 см допустимо введение под углом 90 градусов).
8. Одним быстрым движением полностью введите иглу в кожную складку.
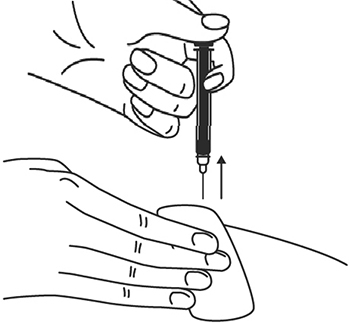
9. После введения иглы отпустите складку кожи.
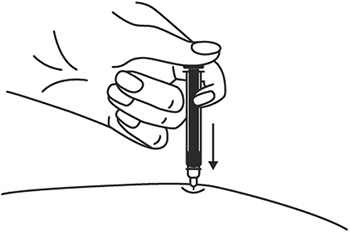
10. Введите весь раствор медленным постоянным надавливанием на поршень шприца в течение 2-5 сек.
11. Когда шприц будет пустым, выньте иглу из кожи под тем же углом.
12. Кусочком марли слегка прижмите область инъекции в течение 10 сек, но ни в коем случае не трите поверхность. Из места инъекции может выделиться небольшое количество крови. При желании можно воспользоваться пластырем.
13. После инъекции шприц повторно не использовать.
14. Вторую инъекцию препарата Илсира® для достижения общей дозы 324 мг выполнить аналогичным образом.
15. При последующих инъекциях следует менять место введения.
Утилизация расходного материала
Неиспользованный раствор препарата, использованные шприцы, салфетки/ватные тампоны и другие расходные материалы подлежат утилизации с применением закрывающегося контейнера, устойчивого к проколам для острых предметов из пластика или стекла.
Не допускать хранения использованных шприцев в местах, доступных для детей.
Побочное действие
В рамках проведенных клинических исследований у здоровых добровольцев, пациентов с ревматоидным артритом и тяжелым течением новой коронавирусной инфекции (COVID-19) препарат Илсира® показал благоприятный профиль безопасности. Наиболее частыми нежелательными реакциями в проведенных клинических исследованиях были повышение активности АЛТ и АСТ, нейтропения и повышение уровня липидов в крови. Спектр зарегистрированных нежелательных явлений, связанных с применением препарата Илсира®, был ожидаемым для класса ингибиторов рецепторов ИЛ-6. Летальных исходов, связанных с терапией препаратом Илсира®, в ходе клинических исследований не было.
В данной инструкции нежелательные реакции представлены в соответствии с международным словарем нежелательных реакций MedDRA. Ниже приведен перечень нежелательных реакций, зарегистрированных у пациентов, получавших левилимаб в рамках клинических исследований, и имеющих определенную, вероятную или возможную степень связи с приемом препарата. Частота указана с учетом следующих критериев: очень часто (≥1/10), часто (от ≥1/100 до <1/10), нечасто (от ≥1/1000 до <1/100), редко (от ≥1/10000 до <1/1000), очень редко (≤10000).
* В клинических исследованиях регистрировались местные реакции в виде эритемы и кожного зуда.
** Данное НР проявлялось повышением АСТ и АЛТ и не сопровождалось другими симптомами токсического гепатита на фоне множественной лекарственной терапии.
Также в ходе клинической разработки регистрировались единичные нежелательные явления, для которых в настоящее время связь с применением левилимаба не установлена достоверно: воспаление очага кожного поражения, астения, анемия, лимфаденит, лимфоцитоз, отклонение от нормы процедуры визуализации легких, снижение активности АСТ.
В качестве нарушений со стороны иммунной системы в пострегистрационном периоде наблюдались единичные реакции гиперчувствительности (анафилактический шок, ангиоотек), что согласуется с известным профилем безопасности препаратов класса ингибиторов рецепторов ИЛ-6.
Противопоказания к применению
- гиперчувствительность к левилимабу, а также к любому из вспомогательных веществ препарата;
- клинически значимые активные инфекции, включая туберкулез;
- сепсис, обусловленный патогенами, отличными от COVID-19;
- вирусный гепатит В;
- нейтропения менее 0.5×109/л;
- тромбоцитопения менее 50×109/л;
- повышение активности АСТ или АЛТ более чем в 5 раз;
- печеночная недостаточность тяжелой степени (класс С по классификации Чайлд-Пью);
- почечная недостаточность тяжелой степени и в терминальной стадии (СКФ менее 30 мл/мин);
- детский и подростковый возраст до 18 лет;
- беременность;
- период грудного вскармливания;
- комбинированное применение с ингибиторами ФНОα или применение в течение 1 месяца после терапии моноклональными антителами к ФНОα.
С осторожностью
Следует соблюдать осторожность при назначении левилимаба следующим категориям пациентов:
- с хроническими и рецидивирующими инфекциями или с указаниями в анамнезе на них;
- с сопутствующими заболеваниями, предрасполагающими к развитию инфекций;
- в периоде ранней реконвалесценции после тяжелых и среднетяжелых инфекционных заболеваний;
- после недавно проведенной вакцинации живыми аттенуированными вакцинами;
- с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью);
- с почечной недостаточностью средней степени тяжести (СКФ <60 мл/мин и ≥30 мл/мин);
- с дивертикулитом, дивертикулезом и язвенным поражением органов ЖКТ, в т.ч. в анамнезе, в связи с риском перфорации ЖКТ;
- с демиелинизирующими заболеваниями;
- у получающих иммуносупрессивную терапию после трансплантации органов.
В связи со способностью левилимаба подавлять реакции острой фазы воспаления следует проявлять особую осторожность в отношении раннего выявления инфекционных заболеваний на фоне терапии.
В связи с ограниченными данными клинических исследований о применении левилимаба у пациентов пожилого возраста следует соблюдать осторожность при назначении препарата пациентам этой возрастной группы.
Применение при беременности и кормлении грудью
Беременность
Исследований влияния на плод у беременных женщин не проводилось. Известно, что моноклональные антитела могут проникать через плацентарный барьер. Препарат Илсира® противопоказан к применению во время беременности. Женщины детородного возраста и их половые партнеры должны использовать эффективные средства контрацепции в период проведения терапии левилимабом.
Период грудного вскармливания
Неизвестно, проникает ли левилимаб в грудное молоко. Учитывая то, что иммуноглобулины класса G, к которым относится левилимаб, могут выделяться с грудным молоком, препарат Илсира® противопоказан к применению в период грудного вскармливания.
Фертильность
Данные о влиянии препарата на фертильность у людей отсутствуют.
Применение при нарушениях функции печени
Противопоказано применение препарата при печеночной недостаточности тяжелой степени (класс С по классификации Чайлд-Пью).
С осторожностью следует назначать препарат пациентам с печеночной недостаточностью легкой и средней степени тяжести (класс А и В по классификации Чайлд-Пью).
Применение при нарушениях функции почек
Противопоказано применение препарата при почечной недостаточности тяжелой степени и в терминальной стадии (СКФ менее 30 мл/мин).
С осторожностью следует назначать препарат пациентам с почечной недостаточностью средней степени тяжести (СКФ <60 мл/мин и ≥30 мл/мин).
Применение у детей
Противопоказано применение препарата в детском и подростковом возрасте до 18 лет.
Применение у пожилых пациентов
Следует соблюдать осторожность при назначении препарата пациентам пожилого возраста.
Особые указания
Прослеживаемость
В целях улучшения прослеживаемости биотехнологических лекарственных препаратов наименование и номер серии назначаемого лекарственного препарата левилимаб должны указываться в медицинской документации пациента.
Инфекции
Наличие таких потенциально тяжелых инфекций как ВИЧ, активный гепатит В, сифилис, туберкулез, относится к противопоказаниям для назначения левилимаба. Левилимаб не следует применять у пациентов с активным течением инфекционных заболеваний, включая локализованные инфекции. Учитывая иммуносупрессивное действие левилимаба, терапия этим препаратом потенциально может приводить к обострению хронических инфекций и повышению риска первичного инфицирования.
При реактивации гепатита В или развитии серьезных инфекций терапию левилимабом следует прекратить и назначить соответствующую этиотропную терапию.
Соблюдение осторожности требуется в отношении пациентов с рецидивирующими инфекционными заболеваниями в анамнезе, а также лиц, имеющих факторы риска развития инфекций в виде сопутствующих заболеваний или сопутствующей терапии.
С учетом подавления левилимабом реакций острой фазы воспаления симптомы инфекционного заболевания могут быть стерты, что следует учитывать при раннем выявлении серьезных инфекций у пациентов, получающих препарат Илсира®. При появлении любых симптомов, свидетельствующих о развитии инфекционного заболевания на фоне применения левилимаба, пациенту следует немедленно обратиться к врачу для своевременной диагностики и назначения терапии.
Туберкулез
Пациентам с активным туберкулезом терапия препаратом Илсира® противопоказана. Перед назначением препарата Илсира® и в ходе терапии необходимо проводить стандартный скрининг на туберкулез. Пациентам с латентным туберкулезом рекомендуется пройти стандартный курс противотуберкулезной терапии перед началом терапии препаратом Илсира®.
Лабораторные показатели
Нейтропения. В клинических исследованиях препарата Илсира® отмечалось снижение числа нейтрофилов. При длительной терапии пациентов с ревматоидным артритом снижение АЧН не сопровождалось более высокой частотой развития инфекций, в т.ч. серьезных. Следует соблюдать осторожность при лечении препаратом Илсира® пациентов с АЧН <2×109/л. При снижении АЧН <0.5×109/л терапию препаратом Илсира® следует отменить. Следует оценивать число нейтрофилов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Тромбоцитопения. В клинических исследованиях препарата Илсира® отмечалось снижение числа тромбоцитов. При длительной терапии пациентов с ревматоидным артритом снижение числа тромбоцитов не сопровождалось развитием кровотечений. Следует соблюдать осторожность при назначении терапии препаратом Илсира® при числе тромбоцитов ниже 100×103/мкл. Лечение не рекомендуется при числе тромбоцитов <50×103/мкл. Следует оценивать число тромбоцитов через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Ферменты печени. В клинических исследованиях препарата Илсира® отмечалось повышение активности печеночных трансаминаз без признаков печеночной недостаточности. Частота возникновения подобных изменений может возрастать при совместном использовании с препаратами, обладающими потенциальным гепатотоксическим действием (например, метотрексатом, антибактериальными препаратами и другими). Следует соблюдать осторожность при назначении терапии препаратом Илсира® у пациентов с показателями АЛТ или АСТ, превышающими ВГН более чем в 1.5 раза. Следует оценивать показатели активности печеночных трансаминаз (АЛТ и АСТ) через 4-8 недель после начала терапии, а в дальнейшем в соответствии с клинической практикой.
Изменение показателей липидного обмена. В клинических исследованиях препарата Илсира® отмечалось повышение концентрации липидов (холестерин общий и/или ТГ). Следует оценивать показатели липидного обмена через 4-8 недель после начала терапии левилимабом, а в дальнейшем в соответствии с клинической практикой. При ведении пациентов с гиперлипидемией следует учитывать национальные рекомендации.
Реакции гиперчувствительности
При использовании левилимаба потенциально возможно развитие реакции гиперчувствительности. В рамках проведенных клинических исследований левилимаба реакций гиперчувствительности не зарегистрировано. В ходе пострегистрационного периода оценки препарата Илсира® описаны единичные случаи анафилактических реакций и реакций гиперчувствительности. При возникновении анафилактических или других серьезных аллергических реакций применение препарата Илсира® следует немедленно прекратить и начать соответствующую симптоматическую терапию.
Злокачественные новообразования
У пациентов с РА наблюдается повышенный риск злокачественных новообразований, который может усугубляться при длительном применении иммуносупрессивных лекарственных средств. Объем клинических данных по препаратам класса ингибиторов рецептора ИЛ-6 в целом и левилимабу в частности недостаточен для установления частоты развития злокачественных образований и подтверждение наличия причинно-следственной связи с терапией. Продолжается изучение безопасности левилимаба в ходе долгосрочного применения.
Наличие алкогольной или наркотической зависимости
Наличие алкогольной или наркотической зависимости, а также психических расстройств может стать причиной несоблюдения пациентом графика лечения левилимабом, что, в свою очередь может привести к снижению эффективности терапии. Необходимо более тщательное наблюдение за пациентами с указанными состояниями в связи с отсутствием результатов клинических исследований у данной категории пациентов и возможностью повышенного риска развития гепатотоксичности и других неблагоприятных последствий.
Иммуногенность
В ходе клинических исследований препарата Илсира®, в т.ч. при долгосрочном (в течение года) лечении ревматоидного артрита, выработки связывающих антител к левилимабу выявлено не было.
Пациенты в возрасте старше 65 лет
Данные об эффективности и безопасности препарата у пациентов в возрасте старше 65 лет ограничены. Не предполагается наличия существенных возрастных различий в распределении и выведении препарата.
Пациенты с нарушениями функции почек и печени
Эффективность и безопасность препарата у данной категории пациентов не изучались.
Использование в педиатрии
Исследование эффективности и безопасности препарата у детей и подростков в возрасте до 18 лет не проводилось.
Вакцинация
Не следует проводить иммунизацию живыми аттенуированными вакцинами в ходе лечения препаратом Илсира®, т.к. клиническая оценка безопасности данного взаимодействия в рамках клинических исследований не проводилась. Вакцинация живыми аттенуированными вакцинами до начала терапии препаратом Илсира®, а также интервал между вакцинацией и началом терапии должны соответствовать действующим клиническим рекомендациям.
Демиелинизирующие заболевания
С учетом данных по профилю безопасности препаратов класса ингибиторов рецепторов ИЛ-6 следует соблюдать осторожность при применении левилимаба у пациентов с демиелинизирующими заболеваниями. Необходимо тщательно контролировать появление симптомов, указывающих на развитие демиелинизирующего заболевания ЦНС, несмотря на то, что способность левилимаба вызывать демиелинизирующие заболевания ЦНС в настоящее время не установлена.
Влияние на способность к управлению транспортными средствами и механизмами
Отсутствуют данные о влиянии препарата Илсира® на способность управлять транспортными средствами и работать с машинами и/или механизмами. Учитывая то, что при терапии другими ингибиторами рецептора ИЛ-6 отмечались эпизоды головокружения, пациентам, испытывающим головокружение при применении препарата Илсира®, не рекомендуется управлять транспортными средствами и механизмами до тех пор, пока головокружение не прекратится.
Передозировка
Клинические данные о передозировке препарата Илсира® отсутствуют. Максимальная переносимая доза левилимаба для человека не установлена. В клинических исследованиях при п/к введении левилимаба в максимальной суточной дозе 324 мг двукратно с интервалом 48-96 ч новых нежелательных реакций, изменяющих представление о профиле безопасности препарата, не зарегистрировано.
Лечение: специфический антидот отсутствует; проводят симптоматическую терапию.
Лекарственное взаимодействие
Сведений о наличии неблагоприятного лекарственного взаимодействия левилимаба с другими лекарственными препаратами до настоящего времени не получено.
Смешивание препарата с другими лекарственными средствами строго запрещено.
Условия хранения препарата Илсира®
Препарат следует хранить в защищенном от света, недоступном для детей месте при температуре от 2° до 8°С; не замораживать.
Срок годности препарата Илсира®
Срок годности — 2 года. Не применять по истечении срока годности.
Условия реализации
Препарат отпускают по рецепту.
Контакты для обращений
БИОКАД АО
(Россия)

|
|
198515 Санкт-Петербург, |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код