Состав
Состав препаратов интерферона зависит от их формы выпуска.
Форма выпуска
Препараты интерферона имеют следующие формы выпуска:
- лиофилизированный порошок для приготовления глазных и назальных капель, инъекционного раствора;
- инъекционный раствор;
- глазные капли;
- глазные пленки;
- назальные капли и спрей;
- мазь;
- дерматологический гель;
- липосомы;
- аэрозоль;
- пероральный раствор;
- ректальные суппозитории;
- вагинальные суппозитории;
- имплантаты;
- микроклизмы;
- таблетки (в таблетках интерферон выпускается под торговой маркой Энтальферон).
Фармакологическое действие
Препараты IFN относятся к группе лекарственных средств противовирусного и иммуномодулирующего действия.
Все IFN обладают противовирусным и противоопухолевым действием. Не менее важным считается и их свойство стимулировать к действию макрофаги — клетки, играющие важную роль в инициации клеточного иммунитета.
IFN способствуют повышению резистентности организма к проникновению вирусов, а также блокируют репродукцию вирусов при их проникновении в клетку. Последнее обусловливается способностью IFN подавлять трансляцию матричной (информационной) РНК вируса.
При этом противовирусное действие IFN не направлено против определенных вирусов, то есть IFN не характеризуются вирусоспецифичностью. Именно этим и объясняется их универсальность и широкий спектр противовирусной активности.
Интерферон — что это такое?
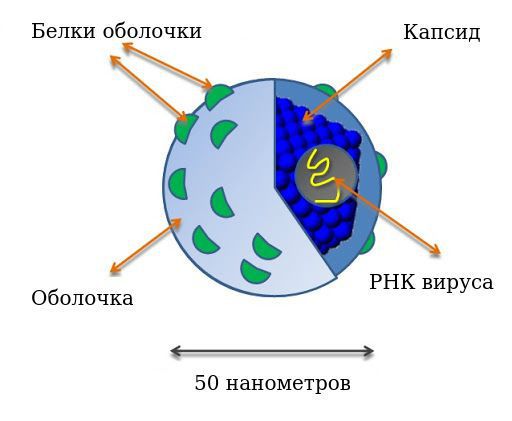
Интерфероны — это класс обладающих сходными свойствами гликопротеинов, которые вырабатываются клетками позвоночных в ответ на воздействие различного рода индукторов как вирусной, так и не вирусной природы.
Согласно Википедии, чтобы биологически активное вещество было квалифицировано в качестве интерферона, оно должно иметь белковую природу, обладать выраженной противовирусной активностью по отношению к различным вирусам, как минимум, в гомологичных (подобных) клетках, «опосредованных клеточными метаболическими процессами, включающими синтез РНК и белка».
Классификация IFN, предложенная ВОЗ и интерфероновым комитетом, основывается на отличиях в их антигенных, физических, химических и биологических свойствах. Кроме того, она учитывает их видовую принадлежность и клеточное происхождение.
По антигенности (антигенной специфичности) IFN принято делить на кислотоустойчивые и кислотолабильные. К кислотоустойчивым относятся альфа и бета интерфероны (их еще называют IFN I типа). Кислотолабильным является интерферон гамма (γ-IFN).
α-IFN продуцируют лейкоциты периферической крови (лейкоциты В- и Т-типа), поэтому ранее он обозначался как лейкоцитарый интерферон. В настоящее время насчитывается по крайней мере 14 его разновидностей.
β-IFN вырабатывают фибробласты, поэтому его также называют фибробластным.
Прежнее обозначение γ-IFN — иммунный интерферон, вырабатывают же его стимулированные лимфоциты Т-типа, NK-клетки (нормальные (натуральные) киллеры; от английского “natural killer”) и (предположительно) макрофаги.
Основные свойства и механизм действия IFN
Все без исключения IFN характеризуются полифункциональной активностью в отношении клеток-мишеней. Наиболее общим их свойством является способность индуцировать в них противовирусное состояние.
Интерферон используется как лечебно-профилактическое средство при различных вирусных инфекциях. Особенностью препаратов IFN является то, что их действие ослабевает при повторных инъекциях.
Механизм действия IFN связан с его способностью сдерживать вирусные инфекции. В результате лечения препаратами интерферона в организме пациента вокруг очага инфекции образуется своеобразный барьер из устойчивых к вирусу неинфицированных клеток, который препятствует дальнейшему распространению инфекции.
Взаимодействуя с еще неповрежденными (интактными) клетками, он препятствует реализации репродуктивного цикла вирусов за счет активации определенных клеточных ферментов (протеинкиназ).
Наиболее важными функциями интерферонов считают способность подавлять гемопоэз; модулировать иммунный ответ организма и реакцию воспаления; регулировать процессы пролиферации и дифференциации клеток; подавлять рост и препятствовать размножению вирусных клеток; стимулировать экспрессию поверхностных антигенов; подавлять отдельные функции лейкоцитов В- и Т-типа, стимулировать активность NK-клеток и т.д..
Использование IFN в биотехнологии
Разработка методов синтеза и высокоэффективной очистки лейкоцитарного и рекомбинантного интерферонов в количествах, достаточных для производства лекарственных препаратов, позволили открыть возможность применения препаратов IFN для лечения пациентов, у которых диагностирован вирусный гепатит.
Отличительной особенностью рекомбинантных IFN является то, что их получают вне человеческого организма.
Так, например, рекомбинантный интерферон бета-1а (IFN β-1а) получают из клеток млекопитающих (в частности, из клеток яичников китайского хомячка), а сходный с ним по своим свойства интерферон бета-1b (IFN β-1b) вырабатывается принадлежащей к семейству энтеробактерий кишечной палочкой (Escherichia coli).
Препараты-индукторы интерферона — что это такое?
Индукторами IFN являются препараты, которые сами не содержат интерферон, но при этом стимулируют его выработку.
Индукторами интерферона являются Актавирон, Кагоцел, Неовир, Ридостин, Тилорон, Циклоферон и др.
Фармакодинамика и фармакокинетика
Основным биологическим эффектом α-IFN является ингибирование синтеза вирусных белков. Противовирусное состояние клетки развивается в течение нескольких часов после применения препарата или индукции выработки IFN в организме.
При этом IFN не оказывает влияния на ранние стадии репликативного цикла, то есть на стадии адсорбции, проникновения вируса в клетку (пенетрацию) и высвобождения внутреннего компонента вируса в процессе его «раздевания».
Антивирусное действие α-IFN проявляется даже в случае заражения клеток инфекционными РНК. IFN не проникает в клетку, а только вступает во взаимодействие со специфическими рецепторами на мембранах клеток (ганглиозидами или сходными с ними структурами, в которых содержатся олигосахара).
Механизм активности IFN альфа напоминает действие отдельных гликопептидных гормонов. Он стимулирует активность генов, часть из которых участвует в кодировании образования продуктов с прямым противовирусным действием.
β-интерфероны также обладают противовирусным действием, которое связано сразу с несколькими механизмами действия. Бета-интерферон активирует N0-синтетазу, что в свою очередь способствует повышению концентрации оксида азота внутри клетки. Последний играет ключевую роль в подавлении размножения вирусов.
β-IFN активирует вторичные, эффекторные функции атуральных киллеров, лимфоцитов В-типа, моноцитов крови, тканевых макрофагов (мононуклеарных фагоцитов) и нейтрофильных лейкоцитов, которые характеризуются антителозависимой и антителонезависимой цитотоксичностью.
Помимо этого β-IFN блокирует высвобождение внутреннего компонента вируса и нарушает процессы метилирования РНК вируса.
γ-IFN участвует в регуляции иммунного ответа и регулирует выраженность воспалительных реакций. Несмотря на то, что он обладает самостоятельным антивирусным и противоопухолевым эффектом, гамма интерферон очень слаб. При этом он в значительной степени усиливает активность α- и β-IFN.
После парентерального введения максимальная концентрация IFN в плазме крови отмечается через 3-12 ч. Показатель биодоступности — 100% (причем как после введения под кожу, так и после введения в мышцу).
Длительность периода полувыведения Т½ составляет от 2 до 7 часов. Следовые концентрации IFN в плазме крови не обнаруживаются через 16–24 часа.
Показания к применению
IFN предназначен для лечения вирусных заболеваний, поражающих респираторный тракт.
Кроме того, препараты интерферона назначают пациентам с хроническими формами гепатитов В, С и Дельта.
Для лечения вирусных заболеваний и, в частности, гепатита С, используется преимущественно IFN-α (причем обе его формы — IFN-альфа 2b и IFN-альфа 2а). “Золотым стандартом” лечения гепатита С принято считать пегилированные интерфероны альфа-2b и альфа-2а. В сравнении с ними обычные интерфероны менее эффективны.
Гепатит С генотипа 1 рекомендуется лечить, применяя пэгилированный IFN альфа-2а или пэгилированный IFN альфа-2b (выпускаются под торговыми марками Пегасис или Пегинтрон) в комбинации с Рибавирином.
Генетический полиморфизм, отмечающийся в гене IL28B, который отвечает за кодирование IFN лямбда-3, вызывает существенные отличия в эффекте лечения.
Пациенты с генотипом 1 гепатита С с обычными аллелями указанного гена, имеют больше шансов достичь более длительных и более выраженных результатов лечения в сравнении с другими пациентами.
IFN также нередко назначают пациентам с онкологическими заболеваниями: злокачественной меланомой, панкреатическими эндокринными опухолями, неходжкинской лимфомой, карциноидными опухолями, саркомой Капоши, обусловленной СПИДом, волосатоклеточным лейкозом, множественной миеломой, раком почки и т.д.
Целесообразным считается его использование при тромбоцитемии, поражениях глаз, спровоцированных герпетической инфекцией и аденовирусами, опоясывающем лишае (γ-IFN), рассеянном склерозе (IFN β-1a), а также для профилактики гриппа и ОРВИ.
Противопоказания
Интерферон не назначают пациентам с повышенной чувствительностью к нему, а также детям и подросткам, страдающим от тяжелых психических расстройств и расстройств нервной системы, которые сопровождаются мыслями о самоубийстве и попытками самоубийства, тяжелыми и затяжными депрессиями.
В комбинации с противовирусным препаратом Рибавирином IFN противопоказан пациентам, у которых диагностированы серьезные нарушения в работе почек (состояния, при которых КК менее 50 мл/мин).
Препараты интерферона противопоказаны при эпилепсии (в тех случаях, когда соответствующая терапия не дает ожидаемого клинического эффекта).
Побочные действия
Интерферон относится к категории препаратов, способных вызвать большое количество побочных реакций со стороны различных систем и органов. В большинстве случаев они являются следствием введения интерферона в/в, п/к или в/м, однако спровоцировать их могут и другие фармацевтические формы препарата.
Наиболее частыми побочными реакциями на прием IFN являются:
- анорексия;
- тошнота;
- озноб;
- дрожь в теле.
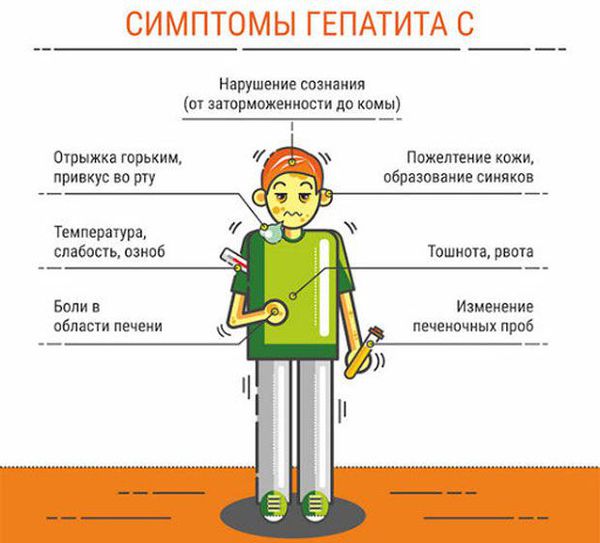
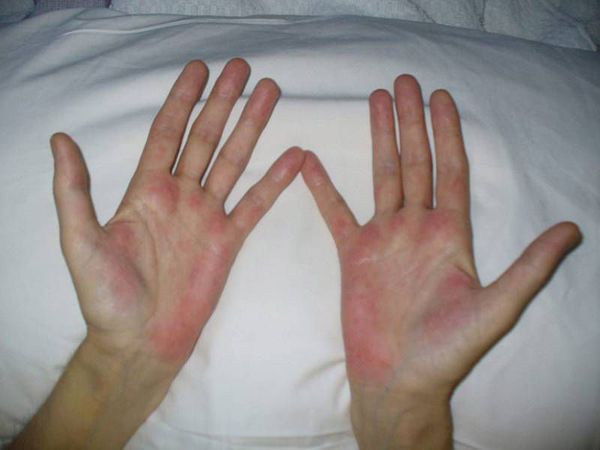
Несколько реже отмечаются рвота, повышенная сонливость, чувство сухости во рту, выпадение волос (алопеция), астения; неспецифические симптомы, напоминающие симптомы гриппа; боль в спине, депрессивные состояния, скелетно-мышечные боли, мысли о суициде и попытке суицида, общее недомогание, нарушение вкуса и концентрации внимания, повышенная раздражительность, расстройства сна (часто бессонница), артериальная гипотензия, спутанность сознания.
К редким побочным эффектам относятся: боли справа в верхней части живота, высыпания на теле (эритематозные и макулопапулезные), повышенная нервозность, болезненность и выраженное воспаление в месте введения препарата в инъекционной форме, вторичная вирусная инфекция (в том числе инфицирование вирусом простого герпеса), повышенная сухость кожного покрова, зуд, резь в глазах, конъюнктивит, помутнение зрения, нарушение функции слезных желез, тревожность, лабильность настроения; психотические расстройства, включая галлюцинации, повышенную агрессию и т.д.; гипертермия, диспепсические симптомы, респираторные нарушения, потеря веса, тахикардия, неоформленный стул, миозит, гипер- или гипотиреоз, нарушения слуха (вплоть до полной его потери), образование инфильтратов в легких, повышение аппетита, кровоточивость десен, судороги в конечностях, диспноэ, нарушение функции почек и развитие почечной недостаточности, периферическая ишемия, гиперурикемия, нейропатии и т.д.
Лечение препаратами IFN может спровоцировать нарушение репродуктивной функции. Исследования на приматах показали, что интерферон нарушает менструальный цикл у женщин. Кроме того, у женщин, проходивших курс лечения препаратами IFN-α, снижался уровень эстрогена и прогестерона в сыворотке крови.
По этой причине в случае назначения интерферона женщинам детородного возраста следует использовать барьерные средства контрацепции. Мужчин репродуктивного возраста также рекомендуется информировать о потенциальных побочных эффектах.
В редких случаях лечение интерфероном может сопровождаться офтальмологическими расстройствами, которые выражаются в виде кровоизлияний в сетчатку глаза, ретинопатии (включая в том числе отек макулы), очаговые изменения сетчатки, снижения остроты зрения и/или ограничения полей зрения, отек дисков зрительных нервов, неврит глазного (второго черепно-мозгового) нерва, обструкция артерий или вен сетчатки.
Иногда на фоне приема интерферона могут развиваться гипергликемия, симптомы нефротического синдрома, диабета, почечной недостаточности. У пациентов с сахарным диабетом может ухудшаться клиническая картина заболевания.
Не исключается вероятность возникновения колита, панкреатита, цереброваскулярной геморрагии, инфаркта миокарда, мультиформной эритемы, некроза тканей в месте инъекции, кардиальной и цереброваскулярной ишемии, гипертриглицеридермии, саркоидоза (или же обострения его течения), синдромов Лайелла и Стивенса-Джонсона.
Использование интерферона в монотерапии или в сочетании с Рибавирином в единичных случаях может спровоцировать апластическую анемию (АА) или даже ПАККМ (полную аплазию красного костного мозга).
Зафиксированы также случаи, когда на на фоне лечения препаратами интерферона у пациента развивались различные аутоиммунные и иммуноопосредованные расстройства (в том числе болезнь Верльгофа и болезнь Мошковица).
Интерферон, инструкция по применению (Способ и дозировка)
Инструкция по применению интерферонов альфа, бета и гамма указывает, что перед тем, как назначить пациенту препарат, рекомендуется определить, насколько чувствительна к нему микрофлора, ставшая причиной заболевания.
Способ введения интерферона лейкоцитарного человеческого определяется в зависимости от поставленного пациенту диагноза. В большинстве случаев его назначают в виде подкожных инъекций, но в ряде случаев препарат допускается вводить в мышцу или вену.
Дозу для лечения, поддерживающую дозу и продолжительность лечения определяют в зависимости от клинической ситуации и ответа организма пациента на назначенную ему терапию.
Под «детским» интерфероном подразумевается препарат в виде свечей, капель и мази.
Инструкция по применению интерферона для детей рекомендует использовать этот препарат как лечебное, так и как профилактическое средство. Дозу для грудничков и детей более старшего возраста подбирает лечащий врач.
В профилактических целях INF применяют в виде раствора, для приготовления которого используют дистиллированную или кипяченую воду комнатной температуры. Готовый раствор окрашен в красный цвет и опалесцирует. Хранить его следует в холоде не более 24-48 часов. Препарат закапывают в нос детям и взрослым.
При вирусных офтальмологических заболеваниях препарат назначают в форме капель для глаз.
Рекомендованная доза для закапывания в конъюнктивальную полость пораженного инфекцией глаза — 2 капли (капают их через каждые два часа). Кратность закапываний — не менее 6 в сутки.
Как только выраженность симптомов заболевания уменьшается, объем инстилляций следует уменьшить до одной капли. Курс лечения — от 7 до 10 дней.
Для лечения поражений, вызванных герпесвирусами, мазь тонким слоем наносят на пораженные участки кожи и слизистых два раза в сутки, выдерживая 12-часовые интервалы. Курс лечения — от 3 до 5 дней (пока полностью не восстановится целостность нарушенного кожного покрова и слизистых).
Для профилактики ОРЗ и гриппа необходимо смазывать мазью носовые ходы. Кратность процедур в течение 1-й и 3-й недели курса — 2 раза в сутки. В период 2-й недели рекомендуется сделать перерыв. В профилактических целях интерферон следует использовать в течение всего периода эпидемии респираторных заболеваний.
Свечи интерферон вводят ректально. Рекомендованная инструкцией доза — 1 суппозиторий 1 или 2 раза в сутки. Курс лечения — от 5 до 10 дней.
Длительность реабилитационного курса у детей, у которых часто возникают рецидивирующие вирусно-бактериальные инфекции респираторного тракта, ЛОР-органов, рецидивирующая инфекция, вызванная вирусом простого герпеса, составляет два месяца.
Таблетки интерферона рекомендуется принимать в дозе, равной 2050 МЕ на каждый килограмм веса пациента (но не более 1000000 МЕ).
Как разводить и как применять интерферон в ампулах?
Инструкция по применению интерферона в ампулах указывает, что перед употреблением ампулу необходимо вскрыть, влить в нее воду (дистиллированную или кипяченую) комнатной температуры до отметки на ампуле, соответствующей 2-м мл.
Содержимое осторожно встряхивают до полного растворения. Раствор вводят в каждый носовой ход дважды в сутки по пять капель, выдерживая между введениями интервалы не менее шести часов.
В лечебных целях IFN начинают принимать при появлении первых симптомов гриппа. Эффективность препарата тем выше, чем раньше пациент начнет его прием.
Наиболее эффективным считается ингаляционный способ (через нос или рот). Для одной ингаляции рекомендуется брать содержимое трех ампул препарата, растворенное в 10-ти мл воды.
Воду предварительно подогревают до температуры не более +37 °С. Процедуры ингаляции проводят дважды в сутки, выдерживая между ними интервал не менее одного-двух часов.
При распылении или закапывании содержимое ампулы растворяют в двух миллилитрах воды и вводят по 0,25 мл (или по пять капель) в каждый носовой ход от трех до шести раз в день. Длительность лечения — 2-3 дня.
Капли в нос для детей в профилактических целях закапывают (по 5 капель) два раза в день, на начальной стадии развития заболевания частоту инстилляций увеличивают: препарат следует вводить не менее пяти-шести раз в сутки через каждые час или два.
Многих интересует можно ли капать в глаза раствор интерферона. Ответ на этот вопрос утвердительный.
Передозировка
Случаи передозировки интерфероном не описаны.
Взаимодействие
β-IFN совместим с кортикостероидными препаратами и АКТГ. Не следует принимать его в период лечения миелосупрессивными лекарственными средствами, в т.ч. цитостатиками (это может спровоцировать аддитивный эффект).
С осторожностью β-IFN назначают со средствами, клиренс которых в значительной степени зависит от системы цитохрома Р450 (противоэпилептические препараты, некоторые антидепрессанты и др.).
Не следует одновременно принимать α-IFN и Телбивудин. Одновременное применение α-IFN провоцирует взаимное усиление действия в отношении ВИЧ. При совместном применении с фосфазидом может взаимно повышаться миелотоксичность обоих препаратов (рекомендуется тщательно следить за изменениями количества гранулоцитов и уровня гемоглобина).
Условия продажи
Для отпуска препарата требуется рецепт.
Условия хранения
Интерферон хранят в прохладном, защищенном от солнечных лучей месте при температуре от +2 до +8 °С. Список Б.
Срок годности
24 месяца. Готовый раствор интерферона при комнатной температуре сохраняет стабильность в течение 3-х суток.
Аналоги
Совпадения по коду АТХ 4-го уровня:
Каждый тип интерферона имеет аналоги:
- Препараты интерферона альфа-2a: Реаферон-ЕС, Роферон, Инфагель.
- Рекомбинантный человеческий интерферон альфа-2b выпускается под торговыми марками: Гриппферон, Интрон-А, Виферон, Альтевир, Альфарона.
- Используемые в клинике препараты интерферона альфа-2c это: Берофор, Эгиферон, Велферон.
- Препараты интерферона бета-1a: Ребиф, Тебериф, Генфаксон, СинноВекс, Авонекс.
- Препараты интерферона бета-1b: Бетаферон, Ронбетал, Инфибета, Экставиа.
- Препараты интерферона гамма: Ингарон, Гаммаферон, Иммуноферон, Имукан.
Интерферон для детей
Согласно инструкции, детям препараты интерферона показаны:
- при инфекционно-воспалительных заболеваниях респираторной системы;
- при менингите;
- при сепсисе;
- для лечения детских вирусных инфекций (например, паротита или ветряной оспы);
- для лечения хронических вирусных гепатитов.
Также IFN используют в терапии, целью которой является реабилитация часто болеющих респираторными инфекциями детей.
Наиболее оптимальный вариант приема для детей- капли в нос: интерферон при таком использовании не проникает в ЖКТ (перед тем как развести препарат для носа, воду следует подогреть до температуры 37 °С).
Для грудничков инструкция рекомендует назначение интерферона при различного рода инфекционных заболеваниях, включая заболевания респираторной системы и внутриутробные инфекции.
Для грудничков интерферон назначают в форме суппозиториев (150 тысяч МЕ). Свечи для детей следует вводить по одной 2 раза в сутки, выдерживая между введениями 12-часовые интервалы. Курс лечения — 5 дней. Чтобы полностью вылечить у ребенка ОРВИ, как правило, достаточно одного курса.
В профилактических целях рекомендована мазь. Ею необходимо смазывать ребенку нос два раза в сутки через каждые 12 часов.
Для лечения следует брать по 0,5 г мази два раза в сутки. Лечение длится в среднем 2 недели. На протяжении следующих 2-4 недель мазь применяют 3 раза в неделю.
Многочисленные положительные отзывы о препарате свидетельствуют о том, что в этой лекарственной форме он также зарекомендовал себя как эффективное средство для лечения стоматита и воспалившихся миндалин. Не менее эффективными являются и ингаляции с интерфероном для детей.
Эффект от применения препарата в разы увеличивается, если для его введения используется небулайзер (необходимо использовать прибор, распыляющий частички с диаметром более 5 мкм). Ингаляции через небулайзер имеют свою специфику.
Во-первых, интерферон необходимо вдыхать через нос. Во-вторых, перед использованием прибора в нем необходимо отключить функцию подогрева (IFN — это белок, при температуре более 37 °С он разрушается).
Для ингаляций в небулайзере содержимое одной ампулы разводят в 2-3 мл дистиллированной или минеральной воды (можно также использовать для этих целей физраствор). Полученного объема хватает на одну процедуру. Кратность процедур в течение суток — от 2 до 4.
Важно помнить, что длительное лечение детей интерфероном не рекомендовано, поскольку к нему развивается привыкание и, следовательно, не развивается ожидаемый эффект.
Интерферон при беременности
Интерферон не рекомендуется использовать при беременности и в период кормления ребенка грудью.
Исключение могут составлять случаи, когда ожидаемая польза терапии для будущей матери будет превышать риск возникновения побочных реакций и вредное воздействие на развитие плода.
Не исключена возможность выделения компонентов рекомбинантного IFN с грудным молоком. В связи с тем, что не исключается вероятность воздействия на плод через молоко, IFN не назначают кормящим женщинам.
В крайнем случае, когда избежать назначения IFN нельзя, во время терапии женщине рекомендуется отказаться от кормления грудью. Чтобы смягчить побочное действие препарата (возникновение симптомов, сходных с симптомами гриппа), рекомендуется одновременное назначение с IFN Парацетамола.
Отзывы об Интерфероне
Большинство отзывов об интерферонах альфа, бета и гамма — положительные. Средство рекомендует более 95% пациентов, применявших эти препараты для лечения.
Отзывы об интерфероне для детей позволяют сделать вывод, что препарат не только позволяет вылечить уже заболевшего ребенка, но и существенно повышает его иммунитет, что в дальнейшем позволяет детскому организму противостоять инфекциям.
Цена Интерферона, где купить
Цена Интерферона в ампулах зависит от объема ампул, от того, какая фармацевтическая компания производит данный препарат, а также от того, в какой аптеке он продается.
- Интернет-аптеки РоссииРоссия
ЗдравСити
-
Крем жировой с интерфероном альфа-2b Риновир банка 10гАО ФИРМА ВИТАФАРМА
Аптека Диалог
-
Альтевир (интерферон альфа 2-b) ампулы 3млн.МЕ/мл 1мл №5Фармапарк ООО/ФС-Уфавита
показать еще
Статьи
Опубликовано в:
Вирусные гепатиты: Достижения и перспективы
Информационный бюллетень
Н.П.Блохина, Н.Н.Цурикова, Клиническая инфекционная больница №1, Гепатологический центр, г. Москва
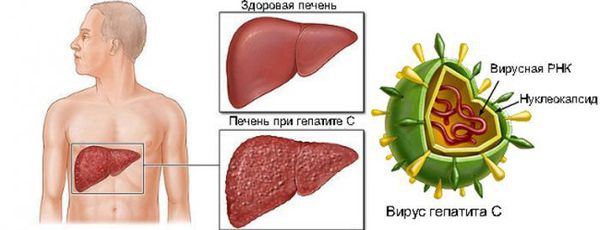
Вирусные гепатиты были и остаются важной проблемой здравоохранения. В настоящее время HCV-инфекция получает все большее распространение. В некоторых регионах мира гепатитом С поражено до 10% взрослого населения. Темпы инфицирования вирусом гепатита С в России с каждым годом растут: показатель заболеваемости гепатитом С вырос с 3,2 на 100 тысяч населения в 1994 году до 20,73 — в 2000 году. В г. Москве в 2001 году заболеваемость острым гепатитом С (ОГС) остается на высоком уровне — 18,6 на 100 тысяч населения. Эпидемиологические закономерности вирусных гепатитов в России позволяют предполагать, что в ближайшие годы будет продолжаться рост заболеваемости гепатитом С. В настоящее время наиболее часто поражаемым контингентом являются подростки 15-19 лет и лица в возрасте 20-29 лет. Принимая психоактивные вещества внутривенно, HCV-инфекцией может заразиться каждый третий субъект.
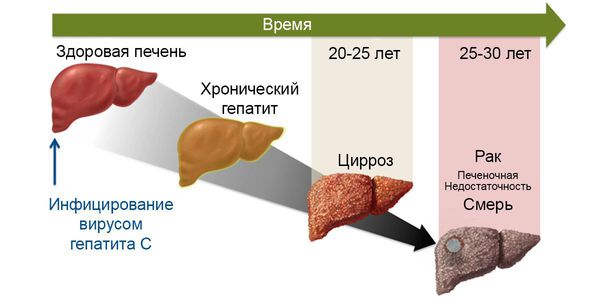
Гепатит С обладает высоким хрониогенным потенциалом, являясь причиной формирования широкого спектра хронических заболеваний печени: хронического гепатита, цирроза печени, гепатоцеллюлярной карциномы. Учитывая отсутствие .вакцины против HCV-инфекции, гетерогенность вируса, способность его к ускользанию из-под иммунного контроля, а также высокий уровень хронизации, это заболевание является серьезной проблемой во всем мире.
За последние 8-10 лет в клинической практике различных стран неоднократно применялись попытки лечения больных ОГС препаратами интерферона с целью предотвращения высокого риска развития хронического гепатита С.
В первых работах, как правило, использовались альфа и бета интерфероны в дозе 3 — 4,5 млн. ME, которые вводились внутримышечно или подкожно 3 раза в неделю на протяжении не более 1 месяца (7, 24, 25). В этих исследованиях оценка стабильного эффекта проводилась только по биохимическому ответу (нормализация активности трансаминаз) через 6 месяцев после окончания лечения (7, 24) и составляла 50 — 75%. Аналогичная схема лечения ОГС применялась также и в более поздних работах (3, 8), в которых авторы в понятие стойкой ремиссии процесса включали как нормализацию активности аланиновой (АЛТ) и аспарагиновой (ACT) трансаминаз, так и исчезновение РНК ВГС из крови в периоде наблюдения от 6 до 22 месяцев после окончания терапии. Частота достижения стойкой ремиссии процесса колебалась от 95% до 25% (3, 8). Только одно из этих исследований было контролированным и рандомизированным. Эффективность терапии острого гепатита С препаратами бета интерферона, по данным авторов работы, составила 25% (8). Проделанный этап исследований по лечению интерферонами ОГС в течение 1 месяца выявил, что эти препараты могут способствовать как нормализации уровня активности трансаминаз, так и исчезновению РНК ВГС из крови. Однако небольшая длительность лечения ассоциировалась, как правило, с большой вероятностью рецидива болезни.
Эти наблюдения послужили основанием для проведения последующих работ по оценке эффективности интерферонотерапии, проводимой в дозе 3 млн. ME и продолжавшейся более длительный срок — не менее 3 месяцев, при сохранении прежнего режима введения препарата (3 раза в неделю). Анализ 5 рандомизированных, контролированных и 4 нерандомизированных исследований (9) показал, что при данном исследуемом режиме введения препарата через 12 месяцев после окончания ИФН-терапии эффективность лечения острого гепатита С не превышала в целом 44%. Можно отметить тенденцию к снижению эффективности терапии до 22 — 26 % в тех работах, в которых авторы оценивали ее через 1,5-2 года после окончания специфического лечения (15, 16, 18). Создается впечатление, что 3-месячный курс «стандартной» ИФН-терапии сопряжен с высокой частотой так называемых поздних рецидивов через 1 год наблюдения после ее окончания. Особое положение среди ряда исследований, посвященных лечению ОГС, в которых применялся вышеописанный режим, занимает работа, выполненная Li X. W., 1993 (19), где отмечен очень высокий процент эффективности терапии при использовании интерферона альфа-2в — 93,8%, которая оценивалась как по биохимическим, так и по вирусологическим параметрам. Такой высокий результат терапии, возможно, связан с ограниченным числом исследуемых больных.
Дальнейшие попытки повышения эффективности терапии позволили выделить 3 направления:
1. увеличение длительности ИФН-терапии до 6 месяцев, сохраняя дозу препаратов и режим введения «стандартным» — 3 млн. ME трижды в неделю;
2. использование повышенных доз — 6 млн. ME в «стандартном» режиме (3 раза в неделю) на протяжении 3-6-12 месяцев;
3. использование индукционных доз интерферона, т.е. ежедневное введение на протяжении 4-8 недель.
Что касается первого направления, то имеются немногочисленные работы, посвященные лечению больных с ОГС на протяжении 6 месяцев «стандартными дозами» (10, 12, 28, 32). Все они отличаются небольшим количеством наблюдаемых больных (18-20 человек) и являются неконтролированными. В этих работах указывается примерно одинаковый уровень эффективности лечения — 31 — 36%. Выявленная примерно одинаковая частота достижения стойкой ремиссии процесса в случаях различного периода наблюдения (от 6 месяцев до 5 лет), позволяет предположить, что 6-месячный курс лечения более надежно предотвращает риск рецидива болезни по сравнению с 3-месячным. Однако отсутствие контролированных рандомизированных мультицентровых исследований данного режима лечения, их малочисленность не позволяет сделать вывод о преимуществе указанной схемы лечения.
Следующее направление поиска повышения эффективности ИФН-терапии при остром гепатите С связано с использованием увеличенных доз интерферона, превышающих «стандартные». Так, при применении 6 млн. ME интерферона альфа-2в (ИФН альфа-2b, Шеринг-Плау/США) 3 раза в неделю на протяжении 3 месяцев авторы одного из исследований обнаружили наличие эффекта от проведенной терапии у половины больных, однако количество наблюдений в этой работе не превышает 20 человек (15).
В других работах (4, 26, 28, 32), также неконтролированных и нерандомизированных, авторы используют повышенные дозы интерферона на протяжении 6 месяцев и 12 месяцев лечения. При оценке результатов терапии через 6 месяцев отмечается тенденция к росту частоты стойкого ответа на терапию по данным указанных работ, особенно с увеличением ее длительности: 44% при 6-месячном курсе против 70-98% при 12-месячной продолжительности лечения.
Одной из попыток увеличить эффективность ИФН-терапии явилось применение индукционных схем, т.е. ежедневного введения интерферона в различных дозах на протяжении 4-8 недель. С учетом дозы интерферона все проведенные исследования можно разделить на 2 группы:
1. схемы с использованием 3-6 млн. ME интерферона;
2. схемы с использованием 10 млн. ME интерферона.
При анализе исследований, в которых применялась индукционная схема введения интерферона, в целом эффективность терапии колебалась от 44% до 90% (13, 28, 31). Хотелось бы обратить внимание на тот факт, что положительные результаты терапии, зафиксированные после ее завершения, отмечались практически с одинаковой частотой как при применении 3-6 млн. ME, так и при использовании более высоких доз препарата — 10 млн. ME, что ставит под сомнение целесообразность применения высоких доз интерферона.
В одном из исследований авторы применили комбинированный режим введения препарата интерферонового ряда: до 21 дня от начала лечения применялась индукционная схема с использованием альфа интерферона в дозе 10 млн. ME ежедневно, а с 22-го дня — продолжали терапию введением по 3 млн. ME альфа интерферона трижды в неделю до 3 месяцев (29). Эффективность терапии была оценена через 6 месяцев после ее завершения и составила 50%. Однако число наблюдений было очень мало — 10 человек, что не позволяет статистически оценить результаты лечения.
В работе Jaekel E. и соавторов, 2001 (17) применялся ИФН альфа-2b в дозе 5 млн. ME в сутки ежедневно в течение 4 недель, а затем 3 раза в неделю в той же дозе в течение еще 20 недель. Авторы отметили, что у 42 из 43 больных, завершивших исследование (98%), через 6 месяцев наблюдения после окончания лечения в сыворотке крови не определялась РНК ВГС и была нормальной активность аланиновой трансаминазы.
Особое место занимает исследование, в котором использовался индукционный режим с введением 10 млн. ME интерферона альфа-2в (ИФН альфа-2b, Шеринг-Плау/США) в течение 4-6 недель (31). Автор статьи указывает, что при достаточно длительном периоде наблюдения (18 месяцев) эффективность терапии сохранялась очень высокой — 81% и практически не было зафиксировано рецидивов заболевания (20/22). Однако это единичное исследование не было рандомизированным, контролированным и в последующем не имеет аналогов.
Подводя итог вышесказанному, можно отметить, что при лечении острого гепатита С препаратами интерферона проведенные исследования характеризуются малым числом наблюдений, отсутствием данных об отдаленных результатах, существованием большого множества различных схем лечения, значительным разбросом данных при оценке эффективности терапии, что не позволяет в настоящее время дать конкретных рекомендаций по лечению пациентов в острой фазе этого заболевания.
На базе Консультативного специализированного гепатологического отдела (КСГО) Инфекционной клинической больницы (ИКБ) № 1 г. Москвы предложена схема лечения острого гепатита С, которая включает назначение препаратов рекомбинантного альфа интерферона в дозе 3 млн. ME трижды в неделю на протяжении не менее 6 месяцев, а при исчезновении РНК ВГС из крови через 6 месяцев от начала терапии — лечение целесообразно продолжить до 12 месяцев с целью профилактики рецидива заболевания. Отмечено, что в целом эффективность данного режима интерферонотерапии по результатам отдаленных наблюдений составила 54%.
Важное место в оценке результатов ИФН-терапии помимо биохимических и вирусологических данных занимает морфологическое исследование ткани печени. Однако этот вид исследования пока носит очень ограниченный характер при ОГС, учитывая в целом небольшой опыт интерферонотерапии в этой фазе болезни. Анализ подобных работ свидетельствует, что использование интерферонов как в дозе 3 млн. ME, так и 6 млн. ME и при длительности лечения как 1, так и 12 месяцев имеет позитивное влияние на морфологию ткани печени при остром гепатите С. Так, в ряде работ авторы отмечают уменьшение степени активности воспаления в печени после проведения лечения интерферонами (24,30).
Отечественные исследования, посвященные морфологии ткани печени при остром гепатите С, в настоящее время остаются единичными. Преимущество назначения ИФН-терапии в острой фазе гепатита С перед уже сформировавшимся хроническим гепатитом С прослежено в отечественной работе, в которой авторы исследуют образцы биопсийного материала, взятые у больных острым и хроническим гепатитом С, получавших лечение интерферонами (4). Исследователи выявили достоверно меньший средний индекс гистологической активности процесса и степени выраженности фиброза после проведения лечения у больных с ОГС по сравнению с показателями, которые имелись у больных с хроническим процессом в печени. Авторы приходят к выводу, что у больных острым гепатитом С, по сравнению с пациентами с хроническим гепатитом С, в случае монотерапии обеих групп препаратом интерферонового ряда, при одинаковом дозовом и временном режимах лечения имеется меньшая воспалительная активность процесса и степень выраженности фиброза. Имеющиеся на сегодняшний день результаты демонстрируют положительный потенциал подобного лечения, что делает целесообразным продолжение такого рода исследований.
Анализ результатов морфологических исследований, проведенный в КСГО ИКБ № 1, показал, что лечение ОГС препаратами интерферонового ряда существенно улучшает гистологическую картину ткани печени по сравнению с результатами у пациентов, не получавших ИФН-терапию. Проведение специфического лечения в остром периоде гепатита С способствует уменьшению индекса гистологической активности и степени выраженности фиброза ХГС, в случаях его развития, по сравнению с хроническим гепатитом С у больных, не леченных препаратами интерферона.
Необходимо отметить, что практически неизученным остается вопрос о тактике ведения больных острым гепатитом С, в крови которых тестируются аутоиммунные антитела. Имеющиеся в настоящее время единичные работы не позволяют дать конкретных рекомендаций по терапевтической тактике в отношении этой категории пациентов. Выбор оптимального варианта лечения таких больных требует оценки проявлений заболевания, обусловленных как самим вирусом, так и аутоиммунными нарушениями. Необходимо учитывать клиническую картину болезни (в том числе внепеченочные аутоиммунные проявления), лабораторные показатели (уровни гамма-глобулинов, Ig G, титр аутоиммунных антител), результаты биопсии печени (преобладание вирусных или аутоиммунных признаков). В зависимости от преобладания аутоиммунного или вирусного компонента назначаются иммунодепрессанты или противовирусные препараты.
Трудности в лечении интерферонами больных с HCV-инфекцией, имеющих аутоантитела в крови, связаны прежде всего с тем, что интерфероны могут сами по себе индуцировать аутоиммунные нарушения, такие, как поражение щитовидной железы (5, 6, 11, 22, 27), дебют аутоиммунного гепатита (14). В связи с этим в клинической практике рекомендуется провести исследование крови больного на наличие аутоиммунных антител до начала лечения интерферонами, в целях обеспечения безопасности проводимой терапии (20, 22). Одним из противопоказаний к назначению ИФН-препаратов у больных с хроническим гепатитом С является наличие аутоиммунных заболеваний, в частности аутоиммунного тиреоидита. Относится ли эта ограничительная мера к лечению больных с ОГС, остается неясным.
Прежде всего, это связано с отсутствием в доступной нам литературе исследовательских работ, посвященных интерферонотерапии острого гепатита С, проведенных с оценкой динамики наличия аутоиммунных антител в крови. Кроме того, имеющиеся к настоящему времени работы (21, 23) свидетельствуют о транзиторном характере появления аутоантител, таких, как ANA, SMA, антиLSР, антиLКМ-1. Эти антитела выявлялись в остром периоде гепатита С достаточно редко (4 — 5% случаев) и в низком титре. Однако авторы считают, что появление аутоиммунных антител в крови в остром периоде вирусного гепатита может ассоциироваться с формированием в последующем хронического процесса. Указанные выше работы, посвященные изучению данного аспекта заболевания, являются единичными и ограничены небольшим количеством исследуемых больных. Вопросы ИФН-терапии лиц, у которых имеется как активная HCV-инфекция, так и аутоантитела в крови, остаются открытыми как в отношении эффективности, так и безопасности.
Анализ накопленного опыта работы КСГО ИКБ № 1 позволил рассматривать наличие аутоиммунных антител в крови с острого периода болезни в качестве неблагоприятного признака, ассоциирующегося с повышенным риском развития хронического гепатита С. При исключении аутоиммунного заболевания назначение данной категории пациентов препаратов интерферона позволяет существенно уменьшить риск формирования хронического процесса.
Как отмечалось выше, в последние годы имеется значительное увеличение числа больных острым гепатитом С, заражение которых происходит в результате внутривенного употребления психоактивных наркотических средств. Проблема лечения гепатита С у лиц, употребляющих наркотические вещества, остается пока еще малоизученной. Одним из объяснений этого факта можно считать то, что само наличие активной наркомании является противопоказанием к ИФН-терапии и тем самым резко ограничивает использование этих препаратов у данной категории больных с гепатитом С.
Лечебный процесс у лиц, употребляющих внутривенные психоактивные средства, отличается сложностью, связанной с их психологической характеристикой. В процессе лечения пациентов, употребляющих наркотические вещества, нередко возникают проблемы с соблюдением необходимого режима, отказом от диспансерного наблюдения и отсутствием критического отношения к болезни, как к вирусному гепатиту, так и к наркомании. По мнению ряда исследователей, занимающихся вопросами ИФН-терапии, противовирусное лечение у данных больных следует начинать только после длительного воздержания от употребления психоактивных наркотических средств — не менее 6 месяцев. Накопленный к настоящему времени в мире опыт лечения парентеральных гепатитов у пациентов, употребляющих психоактивные средства, свидетельствует, что терапия интерферонами у лиц с отягощенным наркологическим анамнезом целесообразна только в тех случаях, когда использование наркотических веществ было на нерегулярной основе, в результате эпизодического или случайного их употребления. Для большей части пациентов с вирусными гепатитами, которые употребляют наркотические вещества регулярно, препараты интерферона становятся малодоступными и ограниченно эффективными из-за возобновления наркотизации и перерывов в лечении, а также повторного инфицирования другими генотипами вируса гепатита С или вирусами гепатита В, Д.
В единичных исследованиях приводятся данные успешного лечения препаратами интерферонового ряда пациентов, употребляющих наркотические средства, после купирования абстинентного синдрома, и делается попытка обоснования назначения ИФН-препаратов у этой категории больных. Так, в одной из работ после купирования абстинентного синдрома 21 пациенту провели лечение ИФН альфа-2b в дозе 3 млн. ME 3 раза в неделю в течение 3 недель (3). При этом исследователями было установлено, что у 95% больных по окончании интерферонотерапии отсутствовали признаки репликации вируса гепатита С в крови, сопровождавшиеся нормальным уровнем трансаминаз. Пациенты, получавшие интерферонотерапию, наблюдались исследователями в течение 6 месяцев: РНК ВГС не определялась в крови также в 95% случаев. Одним из результатов стандартной терапии абстинентного синдрома, проводимой вместе со специфическим противовирусным лечением, явилось формирование ремиссии опийной наркомании длительностью не менее 6 месяцев. Авторы пришли к выводу, что применение интерферона может ускорить коррекцию нарушенного иммунного статуса больных вирусным гепатитом и способствовать формированию стойкой ремиссии при опийной наркомании.
Интересные результаты были получены и в другом исследовании, в котором из 24 человек, принявших участие, 19 пациентов были внутривенными наркоманами. Пациентам назначалась индукционная схема лечения с применением 10 млн. ME интерферона альфа-2в (ИФН альфа-2b, Шеринг-Плау/США) (32). Авторы отметили высокий процент стойкого ответа на интерферонотерапию у этой категории пациентов через 18 месяцев после ее завершения. Только 2 пациента потребовали отмены терапии в связи с несоблюдением режима.
Хочется отметить, что оба эти исследования не были контролированными и рандомизированными, но в них отчетливо прослеживается тот факт, что у пациентов с отягощенным наркологическим анамнезом лечение интерферонами может быть эффективным. Полученные результаты в значительной мере отличаются от данных других авторов (1, 2), которые сообщают о низкой эффективности интерферонотерапии у данной категории больных.
На базе КСГО И КБ № 1 г. Москвы было проведено исследование по оценке эффективности противовирусного лечения препаратами альфа интерферона у пациентов с острым гепатитом С, имеющих парентеральный анамнез, отягощенный употреблением наркотических веществ. Терапия препаратами интерферона начиналась сразу после постановки диагноза острого гепатита С при условии, что больной обязывался не употреблять психоактивные средства в ходе курса лечения. По данным проведенных исследований на базе КСГО И КБ № 1 было выявлено, что положительный результат лечения альфа интерферонами ОГС у больных, употреблявших внутривенные наркотические вещества, прямо связан с прекращением их приема в ходе специфической противовирусной терапии. Частота достижения стойкой ремиссии процесса у этой категории пациентов составила 72,4%. При возобновлении приема психоактивных средств во время проведения интерферонотерапии в абсолютном большинстве случаев в исходе болезни у пациентов развивался хронический гепатит и лечение было неэффективным. В ходе проведения исследования также было отмечено, что пациенты с ОГС, употреблявшие до заболевания наркотические препараты и получавшие интерферонотерапию, реже возобновляли прием психоактивных токсических веществ, чем те, кто не лечился в остром периоде болезни специфическими средствами.
Вопросы лечения пациентов с острым гепатитом С, и особенно лиц, употребляющих наркотические вещества, остаются изучены недостаточно. Данная проблема в настоящее время становится все более актуальной в практическом здравоохранении и требует выработки конкретных рекомендаций по тактике ведения этой многочисленной категории больных с острым гепатитом С. Несмотря на несомненную перспективность проведения ИФН-терапии в остром периоде болезни с целью снижения риска развития ХГС и надежного купирования инфекционного процесса, контролированных рандомизированных исследований по использованию препаратов интерферона при этом заболевании проведено немного. Полученные обнадеживающие результаты по лечению острого гепатита С, позволяющему предотвратить хронизацию процесса, требуют проведения дальнейших исследований, направленных на совершенствование тактики ведения больных с этим заболеванием.
Литература:
1. ЖмуровскаяЛ.С., Ключарева А.А. — Вирусные гепатиты сочетанной этиологии у лиц, использующих введение психоактивных веществ внутривенно. // Мир вирусных гепатитов, 2000, № 12, с. 2-5.
2. Кожевникова Г.М., Ющук Н.Д. — Вирусные гепатиты у наркоманов. // Журн. «Леч. врач», 2000, № 2, с. 4-6.
3. Нестеров Н.Н., Пирумов П.А., Семиков В.А. и др. -Опыт лечения больных с опийной зависимостью, инфицированных вирусами гепатитов. // Терра медика нова. — 2000, №2, с. 12-14.
4. Никитин И.Г., Кузнецов С.Л., Сторожаков Г.И., Петренко Н.В. — Отдаленные результаты интерферонотерапии острого HCV-гепатита. // Росс. журн. гастроэнтерологии, гепатологии, колопроктологии., 1999, т. IX, № 1, с. 50-53.
5. Панько С.С. — Аутоантитела к щитовидной железе при хронических гепатитах. // Русс. мед. журн., 1998, № 1, с.12-14.
6. Эттингер О.А., Никитин И.Г., Сторожаков Г.И. — Эндокринная дисфункция у пациентов с хроническим гепатитом С на фоне лечения интерфероном-альфа. // Тезисы докладов IV Российской науч. — практ. конференции «Гепатит В, С и Д — проблемы диагностики, лечения и профилактики.» — Москва, 2001, с. 400-401.
7. Almasio P., Mirto S., Malleo С. et al. — Recombinant interferon alpha -2b for acute posttransfusion hepatitis in myeloid leukemia. // Haematologica. — 1991, v. 76 (5), p. 429-430.
8. Calleri G., Colombatto M., Gozzelini M. et al. — Natural beta interferon in acute type-C hepatitis patients: a randomised controlled trial. // Ital. J. Gastroenterol. Hepatol. — 1998, v. 30, p.181-184.
9. Camma С., Almasio P., Craxi A. — Interferon as treatment for acute hepatitis C. A meta-analysis. // Dig. Dis. Sci. — 1996, ?41, p.1248-1255.
10. Chapel H., Christie J., Peach V. et al.. — Five-year follow-up of patients with primary antibody deficiencies following an outbreak of acute hepatitis С. // Clin. Immunol. — 2001, v. 99 (3), p.320-324.
11. Deutsch M., Dourakis S., Manesis E.K. — Thyroid abnormalities in chronic viral hepatitis and their relationship to interferon alfa therapy. // Hepatology-1997, v. 26, ? 1, p. 206-210.
12. Fried M., Hoofnagle J. — Therapy of hepatitis C. // Semin Liver Dis.- 1995,v. 15 (1), p. 82-91.
13. Fukui S., Tohyama H., Iwabuchi S.. — Interferon therapy for acute hepatitis C: changes in serum markers associated with HCVand clinical effects. // Nippon Rinsho. — 1994, v. 52 (7), p. 1847-1851.
14. Garcia-Buey L, Garcia-Monzon C., Rodriguez S. et al. -Latent autoimmune hepatitis triggered during interferon therapy in patients with chronic hepatitis C.// Gastroenterology, 1995,v. 108, p. 1770-1777.
15. Gursoy M., Gur G., Arslan H. et al. — Interferon therapy in haemodialysis patiens with acute hepatitis C virus infection and factors that predict response to treatment. // J. Viral Hepat. -2001, Jan., 8(1), p. 70-73.
16. Hwang S.J., Lee S.D. Chau C.-Y. et al. — A randomized controlled trial of recombinant interferon alpha-2b in the treatment of Chinese patients with acute posttransfusion hepatitis C. //J. Hepatol., 1997, v. 21,? 1, p. 31-36.
17. Jaekel E., Cornberg M., Manns M. et al. -Therapy of acute hepatitis C with interferon — alpha-2b. // N. Engl. J. Med., 2001, November 15, p.29-35.
18. Lampertico P., Rumi M., Romeo R. et al. — A multicenter randomized controlled trial of recombinant interferon-alpha2b in patients with acute transfusion-associated hepatitis С. // Hepatology — 1994, v. 19, p. 19-22.
19. Li X.W. — Areport on the therapy of interferon alpha-2b in patients with acute hepatitis. // C hin. J. Inter. Med. — 1993, № 32, p.409-411.
20. Manns M.P. — Viruses and autoimmune hepatitis. // New trends in hepatology. Falk symposium № 92, Dordrecht, KluwerAcad. Pub. — 1997, p. 32-44.
21. Manns M., Arnold W.. — Studies on antiLSPautoantibodies in acute and chronic non-B hepatitis — evidence for the lack of antiLSP in non-A, non-B (NANB) viral hepatitis. // Klin Wochenschr. — 1981, v. 59 (12), p. 685-689.
22. Manns M.P., Rambusch E.G. — Autoimmunity and extra-hepatic manifestations in hepatitis C virus infection. // J. of Hepatology-1999, v. 31, Suppl. № 1, p. 39-43.
23. McFarlane В., Bridger C., Tibbs C. et al. — Virus-induced autoimmunity in hepatitis C virus infections: a rare event. // J. Med. Virol, -1994, v. 42 (1), p. 66-72,
24. Ohnishi К., Nomura F, Nakano M. — Interferon therapy for acute posttransfusion non-A, non-B hepatitis: response with respect to anti-hepatitis C virus antibody status. // Am. J. Gastroenterol. — 1991, v. 86 (8), p. 1041-1049.
25. Omata M., Yokosuka O., Takano S. et al. — Resolution of acute hepatitis C after therapy with natural beta interferon. // Lancet. 1991, № 338, p. 914-915.
26. Pimstone N.R., Powell J.S., Kotfila R. et al. — High dose (780 miu / 52 weeks) interferon monotherapy is highly effective treatment for acute hepatitis С. // Gastroenterology 2000, № 118,p.973A.
27. Piquer S., Hernandez C., Enriquez J. et al. — Islet cell and thyroid antibody prevalence in patients with hepatitis C virus infection: effect of treatment with interferon. // J. lab. din. med.-2001,v. 137 (1), p. 38-42.
28. Quin J.W. — Interferon therapy for acute hepatitis C viral infection — a review by meta-analysis. // Aust. NZ J. Med. -1997,v. 27, p.611-618.
29. Strakle V, Konig J., Pokorny A. at al. — The medical treatment of acute hepatitis C viral infection by interferon alpha.// J. Viral Hep., 1999, № 4, p. 273-278.
30. Viladomiu L., Genesca J., Esteban J.I. et al. — Interferon-alfa in acute posttransfusion hepatitis C: a randomized controlled trial. //J. of Hepatology, 1992, v. 15, p. 767-769.
31. Vogel W. — Treatment of acute hepatitis C virus infection. // J.ofHepatology-1999,v.31,Suppl.Jo 1,p. 189-193.
32. Vogel W., Graziadei I., Umlauft R, et al. — High-dose interferon-alpha 2b treatment prevents chronicity in acute hepatitis C a pilot study // Dig, Dis. Sci. — 1996, v. 41, ? 12, p.81-85.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
В осенне-зимний сезон как никогда актуальны противовирусные средства. Детский и взрослый иммунитет ослабевают, свежих овощей и фруктов нет. А магазинная продукция стоит дорого. Естественно, начинают «липнуть» всякие болячки. И в этот период очень важно своевременно защитить организм от болезней. Помогут в этом иммуномодуляторы, такие как интерферон.
Общая информация
Интерферон — российское противовирусное средство. Иммунитет укрепляется за счет содержания четырех активных компонентов интерферона (alfa, alfa-2b, beta-1b, gamma). Благодаря активному действию, укрепляется не только общее здоровье, но и останавливается рост опухолей. А свойство интерферона стимулировать макрофаги — еще один существенный плюс.
Лекарственная форма
Препарат Интерферон альфа-2b выпускается почти во всех известных формах. Для каждой категории населения — своя, наиболее подходящая. Не все могут нормально переносить таблетки или порошки. Та или иная форма приобретается исходя из клиники болезни, возраста и предпочтений:
- Порошковая смесь для приготовления глазных и носовых капель, а также раствора для инъекции.
- Раствор для уколов.
- Назальный раствор и пластинки для глаз.
- Назальные капли и аэрозоль.
- Дерматологические средства.
- Сферы с лекарственно-жировым раствором.
- Аэрозоль.
- Аэрозоль для орошения.
- Ректальные и вагинальные свечи.
- Мини-клизмы.
- Таблеточная форма.
Лекарственное действие
Интерферон обладает свойством защищать организм от губительного действия различных вирусов. Иммунитет начинает лучше сопротивляться болезням, активируя собственные ресурсы организма.
Благодаря комбинированному действию групп интерферона, организм блокирует дальнейшее развитие и размножение вирусов. Препарат универсален, так как не действует против определенных групп или видов.
Описание IFN как иммуномодулятора
Общее краткое описание гласит, что IFN относится к гликопротеинам. Это белки, отвечающие за выработку иммунитетом иммуноглобулина. Данное вещество — белок, который используется иммунитетом для того чтобы распознать и снизить пагубное влияние бактерий и вирусов.
Определение IFN как в Википедии, так и ВОЗ немного отличаются. Так, первая говорит о том, что интерферон в первую очередь — белок, активно сопротивляющийся вирусам. Если верить ВОЗ, интерферон отличается от других групп IFN по многим свойствам.
Основные функции и действие на иммунную сопротивляемость
Даже при выписке врачом иммуномодулятора, не стоит полностью переходить на такой тип лекарств. Он помогает, но 100 %-ной защитой от болезней не является.
ВАЖНО: Важная особенность интерферона — снижение активного действия при последующих уколах.
Все IFN помогают активировать в клетках-мишенях противовирусное состояние. Он помогает сдержать развитие вирусов. Если пациент все же успел заболеть, то в месте скопления инфекции образуется защита из незараженных им клеток. Они устойчивы к нему и не позволяют вирусу распространиться по всему организму.
ИНТЕРЕСНО: Механизм действия интерферона схож с внешним образованием гноя вокруг раны, когда в месте пореза скапливаются лейкоциты.
Когда лекарство взаимодействует в незараженными клетками, он не дает вирусу пройти полный цикл развития. Происходит это за счет активности протеинкиназ. Ценные свойства препаратов группы IFN:
- Подавлять повышенное производство кровяных клеток.
- Не допускать активного развития воспаления из-за повышения собственных сил организма.
- Подавлять рост и деление инфицированных клеток.
Препараты IFN применяют также для лечения гепатита, спровоцированного вирусом. Источник IFN в этом случае — яичники китайского хомячка (beta-1a) и кишечная палочка (beta-1b).
Не каждое противовирусное является интерфероном. Некоторые лекарства его не содержат, но при приеме он вырабатывается организмом.
Лечебное действие и всасывание
Как только человек заболевает, самый первый шаг — как можно быстрее не допустить развития инфекции. Конечно, можно выпить нагретого пива или съесть чеснок, но лекарства действуют лучше и быстрее.
Если замечены первые признаки вирусного заражения, быстрее примите интерферон. Он препятствует развитию полного цикла. Клетка защищена от инфекции уже через несколько часов после приема.
ИНТЕРЕСНО: Отличительная особенность препаратов группы IFN — не лечить, а сдерживать. Даже если через некоторое время клинические симптомы не так проявлены, все равно идите к врачу.
Максимальное содержание IFN в кровяной плазме — от 3 до 12 часов. Выводится от 2 до 7 часов. Полностью — до суток.
Кто нуждается в приеме
Не каждая категория пациентов подходит для терапии интерфероном. И не все группы влияют на ту или иную инфекцию. Основное направление интерферона — терапия респираторно-вирусных заболеваний. Так, например, гепатит С лечится группой alfa.
Неплохо показал себя препарат при лечении онкологических заболеваний: миеломы, опухоли, лимфомы, саркомы и т. д. Если у пациента вирусные заболевания глаз, лишай, рассеянный склероз или повышенное содержание тромбоцитов — IFN тоже применяется.
Кому нельзя
Каждый организм по-своему реагирует на тот или иной компонент. Если у вас есть хоть малейшее нарушение в системах организма, аллергия — не принимайте медикамент.
Если у пациента гиперчувствительность к IFN — его не назначают. Также запрещено принимать его детям и подросткам с нарушениями психики и склонностью к суициду, а также депрессией.
Не все интерфероны можно комбинировать с другими медикаментами противовирусного спектра. Особенно при наличии сопутствующих заболеваний. Так, при недостаточном КК IFN не принимают вместе с Рибавирином. Нельзя лечиться им при эпилепсии (при отсутствии терапевтического эффекта).
Побочные явления
Если активный компонент все силы направляет на клетки вируса, он также может угнетающе действовать и на другие системы организма. IFN вводится и под кожу, и в вену, и перорально. Во многих случаях это приводит к побочным реакциям, таким как:
- Рвотные позывы.
- Ощущение холода.
- Телесный тремор.
- Резкая и стойкая потеря веса и аппетита.
Иногда при приеме наблюдается рвота. Человек может часто хотеть спать. Во рту сухость, волосы выпадают. Возникают симптомы, которые можно перепутать с гриппом. Фактически со всех систем (ЦНС, ССС, скелета, мышц) наблюдается та или иная «побочка».
Самые редкие реакции — со стороны кожного покрова: сыпь, болезненность в месте укола, сухость, зуд. Начинает страдать зрение: резь, мутность, человек не может заплакать. Настроение меняется по несколько раз в день: от тревожности до агрессии.
С осторожностью назначают медикамент женщинам, которые не могут зачать. Прием интерферона приводит к нарушению цикла менструации. Если женщины им лечились, это снижало женские половые гормоны. Но если терапия все же необходима, лучше применять барьерные контрацептивы (презервативы, спермициды). Мужчину тоже следует предупредить.
Более полный список побочных реакций можно прочитать в описании к препарату.
Инструкция по применению
Назначение этого препарата сопряжено с некоторыми нюансами. Пациент должен пройти дополнительную проверку. Во-первых, необходимо знать, насколько чувствителен к той или иной группе IFN сам вирус.
Во-вторых, если интерферон — из человеческой группы, чаще всего его назначают п/к, в/м или в/в. Способ зависит от точного диагноза. Дозировка подбирается исходя из симптоматики и ответной реакции организма на лечение заболевания.
Если больной — ребенок, ему прописывают мазь, капли или суппозитории. IFN рекомендуют прописывать детям в качестве общей профилактики организма. Для детей грудного и подросткового возраста — своя доза. Определяемая врачом.
Если цель — профилактика, удобнее всего раствор, приготовленный на основе дистилированной или кипяченой воды. Приготовленную субстанцию хранят не более двух суток. Применяют: в качестве назальных капель.
Для лечения болезней глаз прописывают глазные капли (доза — пара капель в зараженный глазной мешок. Частота — шесть раз в день). После явного улучшения капают по одной капле. Длительность курса — до одной декады.
При герпесе или других кожных заболеваниях, на больное место тонко наносят мазь. Интервал — 12 часов. Длительность курса — около пяти дней, до полного заживления кожи.
В качестве предотвращения заболеваниями ОРВИ и ОРЗ, нос смазывают мазью. Длительность — 3 недели, причем вторую делают перерывом. Частота смазывания — пару раз в сутки. Что касается свечей, их вводят через задний проход, в расчете 1 свеча до двух раз в сутки. Длительность — до 10 дней.
IFN в ампулах: способ приготовления и применения
Некоторые группы уместнее применять назально или ингаляционно. В первом случае ампулу осторожно вскрывают и добавляют в нее кипяченую или дистилированную воду, до отметки 2 мл. Потом встряхивают, пока все полностью не растворится и закапывают в каждую ноздрю по 5 капель. Перерыв — 6 часов. Основное назначение — устранение симптомов гриппа.
Но носовые или ротовые ингаляции работают эффективнее. Для однократной процедуры берут раствор из трех ампул, который растворяют в двух чайных ложках воды. Сначала ее греют до + 37. Процедуры делают пару раз в день. Перерывом — два часа и выше.
Если используется аэрозоль или капли, содержимое разводят в воде (половина чайной ложки) и вводят по пять капель в ноздрю. Частота — до 6 раз в день. Курс — до трех дней. При болезнях глаз раствор тоже применяется.
Случаи передозировки
Таких случаев не наблюдается.
Взаимодействие с другими лекарствами
Если у вас онкология и вы применяете миелосупрессивные препараты, группа beta противопоказана. Не стоит принимать ее людям с болезнями ЦНС и нарушениями психики (депрессия, эпилепсия).
Прочая информация
Интерферон не купишь просто так. Для этого врач должен выписать рецепт. После покупки храните его в холодильнике. Лекарство хранят 2 года. Если вы приготовили раствор, он годен трое суток при комнатной температуре.
Применение детьми
При определенных заболеваниях IFN очень полезен при терапии дыхательных заболеваний, сопровождающихся воспалением и поражением кожи.
Список:
- Воспаление мозговых оболочек.
- Общее поражение организма.
- «Свинка», ветрянка.
- Вирусный гепатит в хронической форме.
Если дети часто болеют ОРВИ и ОРЗ, интерферон применяется в комплексной терапии. Его назначают назально. Грудным детям прописывают свечи. Частота — одна свеча, два раза в сутки, с перерывом 12 часов. Длительность — не более 5 дней.
Медикамент успешно показал себя в лечении стоматита и тонзиллита (мазь). Чтобы быстрее убрать симптомы, применяют ингаляции через небулайзер. Способ ингаляции — носовое дыхание. Но перед применением нужно отключить подогрев. При температуре свыше +37° IFN разрушится.
Чтобы приготовить ингаляцию, содержимое одной ампулы разводят в чайной ложке воды. Частота ингаляции — до четырех в сутки.
При беременности и ГВ
Женщинам, вынашивающим ребенка или на ГВ, использовать интерферон нельзя. Его можно принимать только если ожидается эффект успешного лечения. Рекомбинантный может выделяться в грудное молоко, поэтому при лактации его не рекомендуют. Если лечение строго необходимо, от ГВ на его период отказываются. Дополнительно назначают парацетамол.
Интерферон цена
Отзывы
Отзывы об IFN любой группы носят положительный характер. Редко какое лекарство советуют почти 100 %-но. Детский интерферон успешно применяется не только в лечении заболевшего ребенка, но и повышении местного иммунитета. Ребенок становится более здоровым и крепким.
Купить интерферон можно в любой аптеке. Цена зависит от формы выпуска, компании-производителя и конкретной аптеки. Примерная цена — от 200 рублей.
ВАЖНО: Помните, что не стоит назначать иммуномодуляторы самостоятельно. Ведите смолоду здоровый образ жизни, не имейте вредных привычек, закаляйтесь, принимайте поливитамины. И избегайте стрессов.
Описание препарата Пегасис® (раствор для подкожного введения, 0.27 мг/мл) основано на официальной инструкции, утверждено компанией-производителем в 2010 году
Дата согласования: 31.08.2010
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав и форма выпускa
- Описание лекарственной формы
- Фармакологическое действие
- Характеристика
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Условия хранения
- Срок годности
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Состав и форма выпускa
| Раствор для подкожного введения | 1 шпр.-тюб. |
| пэгинтерферон альфа-2а (40 кДа) | 135 мкг/0,5 мл |
| 180 мкг/0,5 мл | |
| вспомогательные вещества: натрия хлорид; спирт бензиловый; натрия ацетат; кислота уксусная ледяная; полисорбат 80; натрия ацетата раствор 10%; кислота уксусная 10%; вода для инъекций |
в шприц-тюбиках по 0,5 мл; в пачке картонной 1 шт. (в комплекте с 1 иглой).
Описание лекарственной формы
Прозрачный раствор от бесцветного до светло-желтого цвета.
Фармакологическое действие
Фармакологическое действие
—
иммуномодулирующее.
Характеристика
Пегилированный интерферон альфа-2а (Пегасис®) представляет собой конъюгат ПЭГ (бис-монометоксиполиэтиленгликоля) с интерфероном альфа-2а. Интерферон альфа-2а производится биосинтетическим методом по технологии рекомбинантной ДНК и является производным продуктом клонированного гена человеческого лейкоцитарного интерферона, введенного и экспрессирующегося в клетках E. coli.
Интерферон альфа-2а конъюгирован с бис-монометоксиполиэтиленгликолем со степенью замещения одного моля полимера одним молем протеина.
Фармакодинамика
Структура ПЭГ непосредственно влияет на клинико-фармакологические характеристики Пегасиса®. В частности, размер и степень разветвленности ПЭГ с молекулярной массой 40 кДа определяет показатели всасывания, распределения и выведения пэгинтерферона альфа-2а.
Активность Пегасиса® не следует сравнивать с другими пегилированными или непегилированными белками того же терапевтического класса.
Так же как интерферон альфа-2а, Пегасис® обладает противовирусной и антипролиферативной активностью in vitro.
У пациентов с хроническим гепатитом С (ХГС) снижение уровня РНК вируса гепатита С (ВГС) при ответе на терапию Пегасисом® в дозе 180 мкг происходит в 2 фазы. Первая фаза отмечается через 24–36 ч после первой инъекции препарата, вторая фаза наступает в течение следующих 4–16 недель у пациентов с устойчивым вирусологическим ответом.
Рибавирин не оказывает значительного воздействия на кинетику вируса в течение первых 4–6 нед у тех пациентов, которые получают комбинированную терапию рибавирином и пегилированным интерфероном альфа-2а или интерфероном альфа.
Фармакокинетика
Всасывание. После однократного подкожного введения 180 мкг пэгинтерферона альфа-2а здоровым лицам концентрация препарата в сыворотке начинает определяться через 3–6 ч.
Сывороточная концентрация достигает 80% от максимальной через 24 ч. Всасывание пэгинтерферона альфа-2а продолжительное, Cmax в сыворотке отмечаются через 72–96 ч после введения препарата. Абсолютная биодоступность пэгинтерферона альфа-2а — 84% и аналогична таковой у интерферона альфа-2а.
Распределение. Пэгинтерферон альфа-2а обнаруживается преимущественно в крови и внеклеточной жидкости. Объем распределения в равновесном состоянии (Vss) после внутривенного введения составляет 6–14 л. По данным масс-спектрометрии, распределения по тканям и ауторадиолюминографии, полученным в исследованиях на крысах, пэгинтерферон альфа-2а обнаруживается в высокой концентрации в крови и также в печени, почках и костном мозге.
Метаболизм. Особенности метаболизма пэгинтерферона альфа-2а изучены не полностью; однако исследования на крысах свидетельствуют, что радиомаркированный препарат выводится преимущественно почками.
Выведение. Системный клиренс пэгинтерферона альфа-2а у человека в 100 раз ниже, чем аналогичный показатель для интерферона альфа-2а. После внутривенного введения терминальный T1/2 у здоровых добровольцев 60–80 ч, по сравнению с 3–4 ч для обычного интерферона. После подкожного введения терминальный T1/2 около 160 ч (от 84 до 353 ч). Терминальный T1/2 после подкожного введения может показывать не выведение, а продолжительность всасывания пэгинтерферона альфа-2а.
При введении пэгинтерферона альфа-2а 1 раз в неделю наблюдается дозозависимое увеличение системного воздействия у здоровых добровольцев и у пациентов с хроническим гепатитом В или С. У больных хроническим гепатитом В и С через 6–8 нед терапии пэгинтерфероном альфа-2а один раз в неделю достигается равновесная концентрация, которая в 2–3 раза выше, чем после однократного введения. После 8-й недели лечения при введении препарата один раз в неделю дальнейшей кумуляции не происходит. Через 48 недель терапии соотношение Cmax и Cmin составляет 1,5 –2,0. Концентрации пэгинтерферона альфа-2а в сыворотке поддерживаются в течение всей недели (168 ч) после введения (см. рисунок).
Рисунок. Средние равновесные концентрации пэгинтерферона альфа-2а у больных хроническим гепатитом С, получавших монотерапию Пегасис® 180 мкг/нед или комбинацию Пегасис®/рибавирин.
На рисунке указаны:
1) монотерапия, 48 нед.
2) комбинация с рибавирином, 48 нед.
Ось X: время (дни) после введения Пегасиса® 1 раз в неделю.
Ось Y: средняя равновесная концентрация (нг/мл).
Фармакокинетика в особых популяциях больных
Больные с нарушением функции почек
Нарушение функции почек ассоциируется с незначительным снижением клиренса (Cl/F) и увеличением T1/2.
У пациентов с Cl креатинина 20–40 мл/мин отмечается снижение клиренса пэгинтерферона альфа-2а на 25% по сравнению с пациентами без нарушения функции почек. У пациентов с терминальной стадией хронической почечной недостаточности, получающих сеансы гемодиализа, отмечается снижение клиренса пэгинтерферона альфа-2а на 25–45%. Фармакокинетика препарата была сходной при назначении Пегасиса® в дозе 135 мкг больным с терминальной стадией хронической почечной недостаточности и при назначении 180 мкг пациентам без нарушения функции почек.
Пол. Фармакокинетические показатели Пегасиса® у женщин и мужчин после однократной подкожной инъекции сопоставимы.
Пожилой возраст. У пациентов старше 62 лет всасывание Пегасиса® после однократной подкожной инъекции 180 мкг было замедленным, однако устойчивым, по сравнению с молодыми здоровыми добровольцами (Tmax — 115 ч против 82 ч ). AUC слегка увеличивается у пациентов старше 62 лет (1663 против 1295 нг×ч/мл), но Cmax у пациентов моложе и старше 62 лет одинаковы (9,1 и 10,3 нг/мл соответственно). На основании данных экспозиции, фармакодинамического ответа и переносимости снижения начальной дозы препарата у таких пациентов не требуется.
Больные с циррозом и без цирроза. Фармакокинетика Пегасиса® у здоровых лиц и больных гепатитом В или С одинакова. У больных с компенсированным циррозом фармакокинетические характеристики такие же, как у больных без цирроза (класс А по шкале Чайлд-Пью).
Место инъекции. Подкожное введение Пегасиса® должно быть ограничено областью передней брюшной стенки и бедер, поскольку степень всасывания, на основании AUC, была на 20–30% выше при инъекции в эти области. Концентрация препарата была ниже в исследованиях, в которых Пегасис® вводили подкожно в область плеча.
Показания
хронический гепатит С (у взрослых с положительной РНК ВГС, без цирроза или с компенсированным циррозом, в т.ч. и с клинически стабильной ко-инфекцией ВИЧ (монотерапия или комбинация с рибавирином).
Комбинация с рибавирином у пациентов, ранее не получавших терапию, или при неэффективности предшествующей монотерапии интерфероном альфа (пегилированным или непегилированным) или комбинированной с рибавирином терапии.
хронический гепатит В (HBeAg-позитивный или HBeAg-негативный у взрослых пациентов с компенсированным поражением печени и признаками вирусной репликации, повышенной АЛТ и гистологически подтвержденным воспалением печени и/или фиброзом).
Противопоказания
повышенная чувствительность к альфа-интерферонам, к генно-инженерным препаратам, полученным с помощью E. coli, к полиэтиленгликолю или любому другому компоненту препарата;
аутоиммунный гепатит;
тяжелая печеночная недостаточность или декомпенсированный цирроз печени;
цирроз с суммой баллов ≥6 по шкале Чайлд-Пью у пациентов с ко-инфекцией ВИЧ-ХГС;
гипо-, гипертиреоз, сахарный диабет в стадии декомпенсации;
тяжелые сердечно-сосудистые заболевания в фазе декомпенсации, в т.ч. с нестабильным, плохо контролируемым течением в предшествующие 6 мес;
детский возраст до 3 лет (в связи с содержанием в качестве вспомогательного вещества бензилового спирта);
беременность;
период кормления грудью.
Дополнительно для комбинации Пегасиса® с рибавирином
Необходимо учитывать противопоказания для рибавирина.
С осторожностью:
сердечно-сосудистые заболевания;
аутоиммунные заболевания;
псориаз;
депрессии в анамнезе;
нейтрофилы — <1500 клеток/мкл, тромбоциты — <90000 клеток/мкл, гемоглобин — <12 г/дл, в комбинации с миелотоксичными препаратами; CD4+-лимфоциты — <200 клеток/мкл или CD4+-лимфоциты — менее 100 клеток/мкл, а РНК ВИЧ-1 — >5000 копий/мл (ВИЧ-1 Monitor Test, v.5) у пациентов с ко-инфекцией ВИЧ-ХГС.
Применение при беременности и кормлении грудью
Категория С. Влияние Пегасиса® на фертильность не изучалось. При назначении пэгинтерферона альфа-2а, как и других альфа-интерферонов отмечено удлинение менструального цикла, со снижением и более поздним наступлением максимальных концентраций 17β-эстрадиола и прогестерона у животных. После отмены препарата наблюдалась нормализация менструального цикла.
Влияние пэгинтерферона альфа-2а на фертильность мужчин не изучалось. Однако введение интерферона альфа-2а в течение 5 мес не влияло на фертильность у животных.
Тератогенные эффекты Пегасиса® не изучались. Применение интерферона альфа-2а приводило к достоверному увеличению числа спонтанных абортов у макак-резус. У потомства, рожденного в срок, никаких тератогенных эффектов не отмечалось. Однако при лечении Пегасисом®, как и другими альфа-интерферонами, женщинам детородного возраста следует применять эффективные методы контрацепции.
Пегасис® не следует назначать при беременности.
Неизвестно, выводится ли Пегасис® или компоненты препарата с грудным молоком. Для исключения нежелательного воздействия Пегасиса® или рибавирина на ребенка во время лактации следует прекратить либо грудное вскармливание, либо терапию, с учетом потенциальных преимуществ терапии для матери.
Для комбинации с рибавирином: категория Х.
У рибавирина в исследованиях на животных выявлены выраженные тератогенные эффекты и способность вызывать смерть плода. Рибавирин противопоказан беременным и мужчинам, партнерши которых беременны.
Терапию рибавирином не следует назначать до получения отрицательного теста на беременность, проведенного непосредственно перед предполагаемым началом терапии. Женщины, способные к деторождению, или мужчины, партнерши которых способны к деторождению, должны быть проинформированы о тератогенных эффектах рибавирина и необходимости проведения эффективной контрацепции (не менее 2 способов) во время лечения и в течение 6 мес после окончания терапии (см. инструкцию по медицинскому применению рибавирина).
Способ применения и дозы
Для лиц старше 18 лет
Лечение Пегасисом® должно проводиться под наблюдением квалифицированного врача, имеющего опыт проведения терапии у пациентов с хроническим гепатитом В и С. В случае использования Пегасиса® в комбинации с рибавирином также следует ознакомиться с инструкцией по медицинскому применению рибавирина.
Стандартный режим дозирования
Препарат вводят подкожно (п/к) в область передней брюшной стенки или бедра 1 раз в неделю.
Перед введением препарат необходимо осматривать на предмет отсутствия посторонних примесей и изменения цвета.
Больных следует тщательно инструктировать о важности правильного хранения и уничтожения использованных материалов и предостерегать от повторного использования любых игл и шприцев.
ХГВ
При HBeAg-позитивном и HBeAg-негативном хроническом гепатите В — 1 раз в неделю в течение 48 нед в разовой дозе 180 мкг.
ХГС
Пациенты, ранее не получавшие лечение
Рекомендованная доза Пегасиса® составляет 180 мкг 1 раз в неделю, п/к в область передней брюшной стенки или бедра в комбинации с рибавирином (перорально) или в виде монотерапии.
Режим дозирования рибавирина, который следует использовать в комбинации с Пегасисом®, приведен в таблице 1. Рибавирин следует принимать во время еды.
Продолжительность терапии
При комбинированной с рибавирином терапии продолжительность терапии и доза рибавирина зависят от генотипа вируса (см. таблицу 1).
Таблица 1
Режим дозирования Пегасиса® и рибавирина у пациентов с ХГС
| Генотип | Доза | Длительность лечения, нед |
|
| Пегасиса® | Рибавирина | ||
| Генотип 1 с низкой вирусной нагрузкой и быстрым вирусологическим ответом * |
180 мкг | Масса тела <75кг — 1 мг | 24 или 48 |
| Масса тела ?75кг — 1,2 мг | |||
| Генотип 1 с высокой вирусной нагрузкой и быстрым вирусологическим ответом* |
180 мкг | Масса тела <75кг — 1 мг | 48 |
| Масса тела ?75кг — 1,2 мг | |||
| Генотип 4 с быстрым вирусологическим ответом* | 180 мкг | Масса тела <75кг — 1 мг | 24 или 48 |
| Масса тела ?75кг — 1,2 мг | |||
| Генотип 1 или 4 без быстрого вирусологического ответа* | 180 мкг | Масса тела <75кг — 1 мг | 48 |
| Масса тела?75кг — 1,2 мг | |||
| Генотип 2 или 3 без быстрого вирусологического ответа** | 180 мкг | 800 мг | 24 |
| Генотип 2 или 3 с низкой вирусной нагрузкой и быстрым вирусологическим ответом** |
180 мкг | 800 мг | 16 или 24 |
| Генотип 2 или 3 с высокой вирусной нагрузкой и быстрым вирусологическим ответом** |
180 мкг | 800 мг | 24 |
* Быстрый вирусологический ответ (РНК ВГС не определяется) на 4-й и 24-й нед лечения
** Быстрый вирусологический ответ (результат определения РНК ВГС отрицательный) к 4-й нед лечения
Низкая вирусная нагрузка = ?800000 МЕ/мл; высокая вирусная нагрузка = >800000 МЕ/мл
Продолжительность терапии у пациентов с генотипом 1, у которых на 4-й нед лечения определяется РНК ВГС, должна составлять 48 нед независимо от исходной вирусной нагрузки.
Продолжительность терапии в течение 24 нед можно рассматривать у пациентов:
— с генотипом 1 и исходно низкой вирусной нагрузкой (?800000 МЕ/мл);
— с генотипом 4, у которых на 4-й нед результат определения РНК ВГС отрицательный и остается отрицательным на 24-й нед.
Однако общая продолжительность терапии в течение 24 нед может быть ассоциирована с большим риском рецидива, чем 48-недельная продолжительность лечения. При решении вопроса о продолжительности терапии у таких пациентов следует учитывать переносимость комбинированной терапии и такие дополнительные прогностические факторы, как степень фиброза. С еще большей осторожностью следует подходить к вопросу о сокращении продолжительности терапии у пациентов с генотипом 1 и исходно высокой вирусной нагрузкой (>800000 МЕ/мл), у которых на 4-й неделе результат определения РНК ВГС отрицательный и остается отрицательным на 24-й нед, поскольку ограниченные доступные данные предполагают, что сокращение продолжительности терапии может крайне негативно повлиять на устойчивый вирусологический ответ. У пациентов с генотипом 2 или 3 и определяющейся РНК ВГС на 4-й нед лечения независимо от исходной вирусной нагрузки продолжительность терапии должна составлять 24 нед.
Возможно сокращение терапии до 16 нед в отдельных группах пациентов с генотипом 2 или 3, низкой вирусной нагрузкой (исходно ?800000 МЕ/мл), не определяющейся РНК ВГС к 4-й нед и остающейся отрицательной до 16-й нед. При 16-недельной продолжительности терапии возможно увеличение риска рецидива по сравнению с 24-недельной терапией. При решении вопроса о продолжительности терапии у таких пациентов следует учитывать переносимость комбинированной терапии и такие дополнительные клинические и прогностические факторы, как степень фиброза. С еще большей осторожностью следует подходить к вопросу о сокращении продолжительности терапии у пациентов с генотипом 2 или 3 и исходно высокой вирусной нагрузкой (>800000 МЕ/мл), у которых к 4-й нед результат определения РНК ВГС отрицательный, поскольку ограниченные данные предполагают, что сокращение продолжительности терапии мoжeт крайне негативно повлиять на устойчивость вирусологического ответа. Клинические данные по пациентам с генотипом 5 и 6 ограничены, рекомендуется комбинированная терапия Пегасисом® и рибавирином (1000/1200 мг) в течение 48 нед. Рекомендуемая длительность монотерапии Пегасисом® составляет 48 нед.
Пациенты, ранее получавшие лечение
Рекомендованная доза Пегасиса® в комбинации с рибавирином составляет 180 мкг один раз в неделю, подкожно. Доза рибавирина составляет 1 мг в сутки (масса тела <75 кг) и 1,2 мг (масса тела ?75 кг).
При обнаружении вируса на 12-й нед лечения терапию следует прекратить. Рекомендуемая общая продолжительность терапии составляет 48 нед. При решении вопроса о лечении пациентов с генотипом 1, не ответивших на предшествующее лечение пегилированным интерфероном и рибавирином, рекомендуемая общая продолжительность терапии должна составлять 72 нед.
Ко-инфекция ВИЧ-ХГС
180 мкг один раз в неделю в качестве монотерапии или в комбинации с рибавирином (800 мг) в течение 48 нед, независимо от генотипа. Безопасность и эффективность комбинированной терапии с рибавирином в дозе более 800 мг и продолжительностью менее 48 нед изучена недостаточно.
Прогнозирование эффективности лечения
Пациенты, ранее не получавшие лечение
Определение раннего вирусологического ответа (снижение вирусной нагрузки ниже порога определения или не менее чем на 2log10) на 12-й нед терапии может прогнозировать достижение устойчивого вирусологического ответа (см. таблицу 2). Прогностическая ценность отсутствия устойчивого вирусологического ответа (УВО) при монотерапии Пегасисом® составляет 98%. Сходная прогностическая ценность отсутствия УВО обнаружена у пациентов с ко-инфекцией ВИЧ-ХГС, получавших монотерапию Пегасисом или комбинированную терапию Пегасисом® и рибавирином (100% (130/130) и 98% (83/85), соответственно). При ко-инфекции ВИЧ-ХГС прогностическая ценность УВО 45% (50/110) и 70% (59/84) выявлена, соответственно, у пациентов с генотипами 1 и 2/3, получавших комбинированную терапию.
Таблица 2
Прогностическая ценность вирусологического ответа на 12-й нед комбинированной терапии в рекомендованном режиме
| Генотип | Отрицательный результат | Положительный результат | ||||
| Отсутствие ответа на 12-й нед | Отсутствие устойчивого ответа | Прогностическая ценность | Ответ на 12-й нед | Устойчивый ответ | Прогностическая ценность | |
| Генотип 1 (п=569) | 102 | 97 | 95% (97/102) | 467 | 271 | 58% (271/467) |
| Генотип 2 и З (п=96) |
3 | 3 | 100% (3/3) | 93 | 81 | 87% (81/93) |
Пациенты, ранее получавшие лечение
У пациентов, ранее не ответивших на лечение, при повторном лечении в течение 48 или 72 нед было показано, что супрессия вируса на 12-й нед (РНК ВГС ниже 50 МЕ/мл) является прогностическим критерием УВО. Вероятность отсутствия УВО после 48 или 72 нед лечения в случае, если подавление вируса не было отмечено на 12-й нед, составила 96% (363 из 380) и 96% (324 из 339) соответственно. Вероятность достижения УВО после 48 или 72 нед лечения в случае, если супрессия вируса была отмечена на 12-й нед, составила 35% (20 из 57) и 57% (57 из 100), соответственно.
Указания по коррекции дозы в связи с побочным действием
Общие
Если коррекция дозы требуется из-за клинических или лабораторных реакций средней и тяжелой степени, обычно достаточно снизить дозу препарата до 135 мкг. Однако в некоторых случаях требуется уменьшить дозу до 90 или 45 мкг. После разрешения побочных реакций можно рассмотреть вопрос об увеличении дозы препарата, вплоть до первоначальной (см. «Особые указания» и «Побочное действие»).
Гематологические
Уменьшение дозы рекомендуется при снижении числа нейтрофилов менее 750 клеток/мкл. У больных с АЧН менее 500 клеток/мкл лечение следует прервать до тех пор, пока этот показатель не превысит 1000 клеток/мкл. Применение Пегасиса® следует возобновить в дозе 90 мкг под периодическим контролем числа нейтрофилов (периодичность контроля определяется врачом в каждом конкретном случае индивидуально).
Уменьшение дозы до 90 мкг рекомендуется при снижении числа тромбоцитов менее 50000 клеток/мкл. У больных с числом тромбоцитов менее 25000 клеток/мкл препарат нужно отменить.
Рекомендации по лечению анемии, возникшей во время терапии:
1) доза рибавирина снижается до 600 мг/сут (200 мг утром и 400 мг вечером) в одной из следующих ситуаций:
— уровень гемоглобина (Hb) снижается до <10 г/дл, но остается >8,5 г/дл у пациентов без сопутствующей сердечно-сосудистой патологии;
— уровень Hb снижается на 2 г/дл или более в течение любых 4 нед терапии у пациентов со стабильным сердечно-сосудистым заболеванием.
Не рекомендуется увеличивать дозу рибавирина до первоначальной.
2) Прием рибавирина должен быть прекращен в одной из следующих ситуаций:
— уровень Hb снижается до менее 8,5 г/дл у пациентов без сопутствующей сердечно-сосудистой патологии;
— уровень Hb остается менее 12 г/дл через 4 нед, несмотря на снижение дозы, у пациентов со стабильным сердечно-сосудистым заболеванием.
После прекращения приема рибавирина и разрешения побочного действия возможно возобновить его прием в дозе 600 мг/сут с последующим повышением до 800 мг/сут по усмотрению врача. Не рекомендуется увеличивать дозу рибавирина до первоначальной (1000 или 1200 мг). При непереносимости рибавирина следует продолжить монотерапию Пегасисом®.
Таблица 3
Коррекция дозы при возникновении побочного действия (дополнительную информацию см. выше в тексте)
| Показатели | Снижение дозы рибавирина до 600 мг | Приостановление приема рибавирина | Уменьшение дозы Пегасиса® до 135/90/45 мкг |
Приостановление приема Пегасиса® | Отмена комбинированного лечения |
| Абсолютное число нейтрофилов, клеток/мкл |
<750 | <500 | |||
| Число тромбоцитов, клеток/мкл | <50000; >25 000 | <25000 | |||
| Уровень Hb, г/дл Отсутствие сердечно-сосудистого заболевания |
<10 и ?8,5 | <8,5 | |||
| Уровень Hb Стабильное сердечно-сосудистое заболевание | снижение на ?2 г/дл в течение любых 4 нед терапии | <12 г/дл, даже через 4 нед терапии в сниженной дозе |
Связанные с нарушением функции печени
Для пациентов с ХГС характерны колебания в отклонениях от нормы результатов печеночных проб. Как и при терапии другими препаратами интерферона альфа, при терапии Пегасисом® наблюдается повышение АЛТ выше показателя до лечения, в т.ч. и у пациентов с вирусологическим ответом.
В клинических исследованиях у 8 из 451 пациентов с ХГС, получавших комбинированную терапию, наблюдалось изолированное повышение АЛТ (превышающее верхнюю границу нормы в ?10 раз; или превышающее исходный уровень >2 раз для пациентов с исходным уровнем АЛТ в 10 раз выше верхней границы нормы), которое исчезло без изменения дозы. При прогрессирующем повышении АЛТ по сравнению с показателями до лечения дозу Пегасиса® нужно вначале уменьшить до 135 мкг. Если активность АЛТ, несмотря на снижение дозы, продолжает увеличиваться или сопровождается повышением концентрации билирубина, или признаками декомпенсации печеночного процесса, препарат следует отменить.
У пациентов с ХГВ возможно преходящее увеличение уровня АЛТ, иногда превышающее верхнюю границу нормы в 10 раз, которое может свидетельствовать об иммунном клиренсе. Лечение обычно не следует начинать, если уровень АЛТ превышает верхнюю границу нормы более чем в 10 раз. Продолжение терапии требует более частого контроля уровня АЛТ. При снижении дозы или временной отмене Пегасиса® терапия может быть восстановлена после нормализации активности АЛТ.
Особые группы больных
Почечная недостаточность. Рекомендуется снижение дозы Пегасиса® — до 135 мкг у пациентов с терминальной стадией почечной недостаточности. Независимо от начальной дозы и степени тяжести почечной недостаточности таких пациентов необходимо тщательно наблюдать и снижать дозу в случае возникновения побочных реакций.
Печеночная недостаточность. У больных с компенсированным циррозом печени (класс А по Чайлд-Пью) Пегасис®эффективен и безопасен. У больных с декомпенсированным циррозом (класс В/С по Чайлд-Пью или кровотечение из варикозно-расширенных вен пищевода) применение Пегасиса® не изучалось (см. «Особые указания»).
Пожилой возраст. У больных пожилого возраста коррекция рекомендуемой дозы (180 мкг, один раз в неделю) не требуется.
Дети. Безопасность и эффективность препарата у лиц моложе 18 лет не установлены. Раствор Пегасиса® для подкожного введения содержит бензиловый спирт, способный вызывать у новорожденных и детей до 3 лет неврологические и другие осложнения, иногда фатальные.
Больные после трансплантации печени. безопасность и эффективность монотерапии Пегасисом® или его комбинации с рибавирином у больных после трансплантации печени не установлены.
Побочные действия
Данные клинических исследований
ХГС
Частота и степень тяжести наиболее распространенных побочных реакций при лечении Пегасисом®и интерфероном альфа-2а одинаковы.
Самые распространенные побочные реакции при лечении Пегасисом® в дозе 180 мкг выражены, как правило, легко или умеренно и не требуют коррекции дозы или отмены препарата.
ХГВ
На протяжении курса терапии (48 нед) и во время наблюдения без лечения (24 нед) профиль безопасности Пегасиса® был сходным с таковым при ХГС, хотя частота побочных эффектов при ХГВ была значительно меньше, за исключением частоты возникновения лихорадки. У 88% пациентов, получавших Пегасис®, были отмечены нежелательные явления по сравнению с 53% пациентами, получавшими ламивудин. Серьезные нежелательные явления были зарегистрированы у 6 и 4% пациентов соответственно. У 5% пациентов, получавших Пегасис®, и менее чем у 1% пациентов, получавших ламивудин, терапия была отменена из-за нежелательных явлений. Частота отмены препарата не отличается у пациентов с циррозом и без цирроза печени.
ХГС-пациенты, ранее не ответившие на лечение
В целом профиль безопасности Пегасиса® в комбинации с рибавирином у пациентов, ранее не ответивших на лечение, был сходным с таковым у пациентов, ранее не получавших лечение.
В клиническом исследовании, включавшем 72- и 48-недельное лечение пациентов, не ответивших на ранее проводившуюся терапию пегилированным интерфероном альфа-2b/рибавирином, лабораторные отклонения или нежелательные явления приводили к отмене Пегасиса® у 12% больных, а к отмене рибавирина — у 13% больных, получавших лечение в течение 72 нед. В группе больных, получавших лечение в течение 48 нед, лабораторные отклонения или нежелательные явления приводили к отмене Пегасиса® в 6%, а отмене рибавирина — в 7% случаев. Аналогично у пациентов с циррозом частота отмены терапии Пегасисом® и рибавирином была выше в группе больных, получавших лечение в течение 72 нед (13 и 15%), чем в группе больных, получавших лечение в течение 48 нед (6 и 6%). В исследование не включались пациенты с отменой ранее проводимой терапии (пегилированным интерфероном альфа-2b/рибавирином) по причине гематологической токсичности.
В другое 48-недельное клиническое исследование были включены пациенты с выраженным фиброзом или циррозом (от 3 до 6 баллов по шкале Ishak), ранее не ответившие на терапию и имевшие исходное число тромбоцитов ≥50000 клеток/мкл. В первые 20 нед исследования наблюдались следующие лабораторные отклонения со стороны гематологических показателей: анемия (уровень гемоглобина менее 10 г/дл — у 26% пациентов); нейтропения (абсолютное число нейтрофилов (АЧН) менее 750 клеток/мкл — у 30% пациентов); тромбоцитопения (число тромбоцитов менее 50000 клеток/мкл — у 13% пациентов).
Ко-инфекция ВИЧ-ХГС
Профиль безопасности Пегасиса® (монотерапия или комбинация с рибавирином) у пациентов с ко-инфекцией ВИЧ-ХГС сходен с таковым у пациентов с ХГС. К другим нежелательным явлениям, встречавшимся у ≥1–≤2% пациентов с ко-инфекцией ВИЧ-ХГС при лечении Пегасисом®/рибавирином, относятся: гиперлактацидемия/ лактат-ацидоз, грипп, пневмония, эмоциональная лабильность, апатия, звон в ушах, боли в горле и гортани, хейлит, приобретенная липодистрофия и хроматурия. Терапия Пегасисом® ассоциировалась со снижением абсолютного количества CD4+-лимфоцитов в первые 4 нед лечения без изменения их процентного содержания. Количество CD4+-лимфоцитов возвращалось к исходному при снижении дозы или после отмены терапии. Назначение Пегасиса® не влияло отрицательно на показатель вирусной нагрузки ВИЧ во время терапии и в период наблюдения после окончания терапии.
Данные по применению у пациентов с количеством CD4+-лимфоцитов менее 200 клеток/мкл ограничены.
Побочные реакции при монотерапии Пегасисом® ХГВ и ХГС а также при терапии Пегасисом® в комбинации с рибавирином ХГС
Для описания частоты побочных реакций используются следующие категории: очень часто (≥1/10), часто (≥1/100; <1/10), нечасто (≥1/1000; <1/100), редко (≥1/10000; <1/1000); очень редко (<1/10000).
Инфекции: часто — инфекции верхних дыхательных путей, бронхит, кандидоз полости рта, простой герпес, грибковые и бактериальные инфекции; нечасто — пневмония, инфекции кожи; редко — эндокардит, наружный отит.
Доброкачественные и злокачественные новообразования: нечасто — новообразование печени.
Система крови и лимфатическая система: часто — тромбоцитопения, анемия, лимфаденопатия; редко — панцитопения; очень редко — апластическая анемия.
Иммунная система: нечасто — саркоидоз, тиреоидит; редко — анафилаксия, системная красная волчанка, ревматоидный артрит; очень редко — идиопатическая или тромботическая тромбоцитопеническая пурпура, ангионевротический отек.
Эндокринная система: часто — гипотиреоз, гипертиреоз; нечасто — сахарный диабет; редко — диабетический кетоацидоз.
Метаболические нарушения: очень часто — анорексия; нечасто — дегидратация.
Психические нарушения: очень часто — депрессия,* беспокойство, бессонница*; часто — эмоциональные расстройства, изменения настроения, агрессивность, нервозность, снижение либидо; нечасто — суицидальные мысли, галлюцинации; редко — суицид, психические расстройства.
Нервная система: очень часто — головная боль, головокружение*, нарушение концентрации внимания; часто — нарушение памяти, синкопальные состояния, слабость, мигрень, гипестезия, гиперестезия, парестезия, тремор, нарушение вкусовых ощущений, ночные кошмары, сонливость; нечасто — периферическая невропатия; редко — кома, судороги, неврит лицевого нерва.
Орган зрения: часто — нарушение зрения, боль в глазном яблоке, воспалительные заболевания глаз, ксерофтальмия; нечасто — кровоизлияние в сетчатку; редко — неврит зрительного нерва, отек соска зрительного нерва, поражения сосудов сетчатки, ретинопатия, язва роговицы; очень редко — потеря зрения.
Орган слуха: часто — вертиго, боль в ухе; нечасто — потеря слуха.
Сердечно-сосудистая система: часто — тахикардия, сердцебиение, периферические отеки; нечасто — артериальная гипертензия; редко — инфаркт миокарда, застойная сердечная недостаточность, стенокардия, суправентрикулярная тахикардия, аритмия, фибрилляция предсердий, перикардит, кардиомиопатия, кровоизлияние в головной мозг, васкулит.
Органы дыхания: очень часто — одышка, кашель; часто — одышка при физической нагрузке, носовое кровотечение, назофарингит, отек пазух заложенность носа, ринит, боли в горле; нечасто — свистящее дыхание; редко — интерстициальный пневмонит (включая случаи с летальным исходом), эмболия легочной артерии.
Органы ЖКТ: очень часто — диарея*, тошнота*, боль в животе*; часто — рвота, диспепсия, дисфагия, изъязвление слизистой полости рта, кровоточивость десен, глоссит, стоматит, метеоризм, сухость слизистой полости рта; нечасто — желудочно-кишечное кровотечение; редко — пептическая язва, панкреатит.
Гепатобилиарные нарушения: нечасто — нарушение функции печени; редко — печеночная недостаточность, холангит, жировая дистрофия печени.
Кожа и ее придатки: очень часто — алопеция, дерматит, зуд, сухость кожи; часто — сыпь, повышенное потоотделение, псориаз, крапивница, экзема, кожные реакции, реакции фотосенсибилизации, ночные поты; очень редко — токсический эпидермальный некролиз, синдром Стивенса-Джонсона, мультиформная эритема.
Опорно-двигательный аппарат: очень часто — миалгии, артралгии; часто — боли в спине, шее, костях, артрит, мышечная слабость, костно-мышечная боль, мышечные судороги; редко — миозит.
Мочевыделительная система: редко — почечная недостаточность.
Репродуктивная система: часто — импотенция.
Организм в целом: очень часто — лихорадка, дрожь*, боль*, астения, слабость, раздражительность*, реакции в месте инъекции*; часто — боли в грудной клетке, гриппоподобный синдром, недомогание, заторможенность, приливы, жажда, снижение веса.
*Эти побочные реакции встречались часто (≥1/100; <1/10) у пациентов с ХГВ, получавших монотерапию Пегасисом®.
Постмаркетинговые наблюдения
Нервная система: ишемический инсульт (частота не известна).
Орган зрения: как и при назначении других интерферонов альфа, при применении Пегасиса® зарегистрированы серьезные случаи отслойки сетчатки (частота не известна).
Опорно-двигательный аппарат: рабдомиолиз (частота не известна).
Лабораторные показатели: терапия Пегасисом® сопровождалась следующими изменениями лабораторных показателей — повышением АЛТ, гипербилирубинемией, электролитными нарушениями (гипокалиемия, гипокальциемия, гипофосфатемия), гипо- и гипергликемией, гипертриглицеридемией.
При монотерапии Пегасисом® и комбинированной терапии с рибавирином у 2% пациентов наблюдался повышенный уровень АЛТ, что приводило к уменьшению дозы или прекращению лечения.
Терапия Пегасисом® ассоциировалась со снижением гематологических показателей (лейкопенией, нейтропенией, лимфопенией, тромбоцитопенией и снижением уровня гемоглобина), которые улучшались при изменении дозы и возвращались к исходному уровню через 4–8 нед после прекращения терапии. У 24% (216/887) пациентов, получавших 180 мкг Пегасиса® и 1000–1200 мг рибавирина в течение 48 нед, наблюдалась нейтропения средней степени тяжести (АЧН: 0,749−0,5·109/л), а у 5% (41/887) пациентов — тяжелая нейтропения (АЧН: <0,5·109/л).
Антитела к интерферону: у 1–5% пациентов, получавших Пегасис®, отмечалось образование нейтрализующих антител к интерферону. Как и при терапии другими интерферонами, нейтрализующие антитела к интерферону чаще наблюдались при ХГВ. Однако корреляция между появлением антител и эффективностью лечения не выявлена.
Функция щитовидной железы: терапия Пегасисом® ассоциировалась с клинически значимыми изменениями лабораторных показателей функции щитовидной железы, которые потребовали медицинского вмешательства. Частота возникновения (4,9%) этих изменений при терапии Пегасисом® и другими интерферонами одинакова.
Лабораторные показатели при ко-инфекции ВИЧ-ХГС
Несмотря на то, что явления гематологической токсичности (нейтропения, тромбоцитопения, анемия) у пациентов с ко-инфекцией ВИЧ-ХГС встречаются чаще, большинство из них корректируются изменением дозы и использованием факторов роста, и преждевременная отмена терапии требуется редко. Снижение абсолютного числа нейтрофилов ниже 500 клеток/мкл наблюдалось у 13% пациентов, получавших монотерапию Пегасисом®, и 11% пациентов, получавших терапию Пегасисом®/рибавирином. Снижение тромбоцитов ниже 50000 клеток/мкл наблюдалось при монотерапии Пегасисом® у 10% пациентов, а при комбинированной терапии — у 8%. У 7% больных, получавших монотерапию Пегасисом®, и у 14% больных, получавших Пегасис®/ рибавирин, была зарегистрирована анемия (уровень Hb — <10 г/дл).
Взаимодействие
Исследования по изучению взаимодействия проводились только у взрослых. Не выявлено фармакокинетического взаимодействия между Пегасисом® и рибавирином у пациентов с ХГС и Пегасисом® и ламивудином у пациентов с ХГВ.
Терапия Пегасисом® (180 мкг/неделю в течение 4 нед) не влияла на фармакокинетический профиль толбутамида, мефенитоина, дебргаохина и дапсона у здоровых мужчин-добровольцев, что свидетельствует о том, что Пегасис® in vivo не оказывает влияние на метаболическую активность изоферментов цитохрома Р4502С9, 2C19, 2D6 и 3A4.
Пегасис® является умеренным ингибитором активности изофермента 1А2 цитохрома Р450, выявлено увеличение AUC теофиллина примерно на 25%. У больных, одновременно получающих теофиллин и Пегасис®, необходимо контролировать концентрацию теофиллина в сыворотке и проводить соответствующую коррекцию дозы теофиллина. Взаимодействие между теофиллином и Пегасисом®, по-видимому, достигает максимума более чем через 4 нед терапии Пегасисом®.
В фармакокинетическом исследовании у 24 пациентов с ХГС терапия Пегасисом® (180 мкг/неделю в течение 4 нед) сопровождалась увеличением средних уровней метаболитов метадона (одновременная терапия метадоном в дозе от 30 до 150 мг; медиана дозы — 95 мг) на 10–15%. Клиническое значение этого взаимодействия не определено, рекомендуется тщательно контролировать симптомы интоксикации метадоном. В частности, у пациентов, принимающих высокие дозы метадона, имеется риск удлинения интервала QTc.
Ко-инфекция ВИЧ-ХГС
В дополнительном 12-недельном фармакокинетическом исследовании у 47 пациентов с ко-инфекцией ВИЧ-ХГС, целью которого было определить влияние рибавирина на внутриклеточное фосфорилирование некоторых нуклеозидных ингибиторов обратной транскриптазы (НИОТ) (ламивудин и зидовудин или ставудин), очевидных доказательств межлекарственного взаимодействия не обнаружено. Однако из-за существенных колебаний значений доверительные интервалы были достаточно широки. Одновременный прием НИОТ, очевидно, не влиял на экспозицию рибавирина в плазме. Не рекомендуется комбинация диданозина и рибавирина. Рибавирин увеличивает экспозицию диданозина и его активного метаболита (дидеоксиаденозин-5-трифосфат) in vitro, что может приводить к развитию фатальной печеночной недостаточности, периферической невропатии, панкреатита, симптоматической гиперлактатемии/ лактат-ацидозу.
При использовании зидовудина в комплексной терапии ВИЧ сообщалось об ухудшении анемии, связанной с рибавирином. Однако точный механизм этого явления еще подлежит определению. Из-за повышенного риска возникновения анемии одновременное применение рибавирина и зидовудина не рекомендуется. Если комбинированная антиретровирусная терапия уже проводится, следует рассмотреть возможность замены зидовудина, особенно у пациентов, имевших в анамнезе анемию, вызванную зидовудином.
Комбинация телбивудина в дозе 600 мг/сут и Пегасиса® в дозе 180 мкг 1 раз в неделю ассоциируется с повышенным риском развития периферической невропатии, механизм развития которой неизвестен. Нельзя исключить повышенный риск развития периферической невропатии и для других интерферонов (как стандартных, так и пегилированных). Кроме того, в настоящее время не установлена польза комбинации телбивудина и интерферонов альфа (пегилированных или стандартных).
Фармацевтическая несовместимость
Запрещается смешивать Пегасис® с другими ЛС, поскольку исследования по совместимости отсутствуют.
Передозировка
Симптомы: описаны случаи передозировки Пегасиса® при введении препарата в течение 2 дней подряд (без соблюдения недельного интервала) и при ежедневном введении на протяжении 1 нед (суммарная доза 1260 мкг в неделю). Каких-либо необычных, серьезных и влияющих на лечение нежелательных явлений не отмечено. В клинических исследованиях при раке почки и хроническом миелолейкозе препарат вводили в дозах до 540 и 630 мкг в неделю. Признаками токсичности, ограничивающими дальнейшее применение в этих дозах, были слабость, повышение активности печеночных ферментов, нейтропения и тромбоцитопения, которые могут возникнуть и при лечении обычными интерферонами.
Лечение: специфический антидот отсутствует. Гемодиализ и перитонеальный диализ неэффективны.
Особые указания
Нервно-психические расстройства
У некоторых больных, как во время лечения Пегасисом®, так в течение 6 мес после прекращения лечения, наблюдались тяжелые побочные реакции со стороны ЦНС, в частности: депрессия, суицидальная настроенность и суицидальные попытки. При терапии интерферонами альфа наблюдались и другие побочные реакции со стороны ЦНС, в т.ч. агрессивное поведение (иногда направленное против других людей), спутанность сознания, нарушение психического статуса. Следует внимательно наблюдать за состоянием пациентов для выявления признаков или симптомов психических расстройств. Если такие симптомы возникают, то врач должен помнить о потенциальной серьезности этих нежелательных явлений и необходимости соответствующего лечения. В случае если симптомы психических расстройств сохраняются или ухудшаются или выявляется суицидальная настроенность, рекомендуется отменить терапию Пегасисом® и провести необходимое лечение.
Пациенты с тяжелыми психическими заболеваниями (в т.ч. в анамнезе). Если принято решение о необходимости лечения Пегасисом® пациентов с тяжелыми психическими заболеваниями (в том числе в анамнезе), то терапию следует начинать только после проведения соответствующего обследования и лечения психического расстройства.
Если Пегасис® будет применяться в комбинации с рибавирином, обязательно следует ознакомиться также с инструкцией по медицинскому применению рибавирина.
Всем пациентам перед включением в клинические исследования ХГС проводилась биопсия печени, однако в отдельных случаях (например, у пациентов с генотипом 2 или 3) лечение возможно и без гистологического подтверждения.
Необходимо учитывать текущие клинические рекомендации для определения необходимости биопсии печени перед началом лечения.
У пациентов с нормальным уровнем АЛТ прогрессирование фиброза происходит обычно медленнее, чем у пациентов с повышенным уровнем АЛТ. Это необходимо учитывать наряду с другими факторами (генотип вируса гепатита С, внепеченочные проявления, риск передачи инфекции и т.п.), влияющими на принятие решения о целесообразности проведения лечения.
Лабораторные показатели до и во время лечения
До начала лечения Пегасисом® всем больным рекомендуется пройти стандартные общие клинические и биохимические анализы крови.
Инициация терапии возможна при следующих исходных показателях:
— число тромбоцитов >90000 клеток/мкл,
— абсолютное число нейтрофилов >1500 клеток/мкл,
— компенсированная дисфункция щитовидной железы (ТТГ и Т4 в пределах нормальных показателей).
После начала терапии общий клинический анализ крови необходимо повторить через 2 и 4 нед , а биохимический — через 4 нед; лабораторные анализы следует проводить периодически во время терапии.
В клинических исследованиях при лечении Пегасисом® снижалось как общее количество лейкоцитов, так и АЧН, обычно со второй недели терапии. Прогрессирующее снижение АЧН через 8 нед терапии встречалось нечасто. Снижение АЧН было обратимым после уменьшения дозы или отмены препарата, у большинства пациентов показатель АЧН достигал нормального значения через 8 нед и возвращался к исходному значению у всех пациентов примерно через 16 нед. Терапия Пегасисом®связана со снижением числа тромбоцитов, которое возвращалось к исходному уровню в течение периода наблюдения после лечения. В некоторых случаях может потребоваться изменение дозы.
В клинических исследованиях при комбинированном лечении Пегасисом® и рибавирином возникновение анемии (уровень Hb <10 г/дл) наблюдалось у 15% пациентов с ХГС. Частота возникновения анемии зависит от длительности курса терапии и дозы рибавирина. У женщин риск развития анемии выше.
Как и при использовании других интерферонов, нужно соблюдать осторожность при назначении Пегасиса® в комбинации с другими миелотоксичными препаратами.
Необходимо взвесить потенциальный риск и пользу перед началом терапии у больных ХГС с неудачей ранее проводимой терапии и прервавших терапию в связи с гематологическими нежелательными явлениями, поскольку использование Пегасиса® у таких пациентов недостаточно изучено.
Эндокринная система
При использовании интерферонов альфа, в т.ч. Пегасиса®, наблюдались нарушения функции щитовидной железы или ухудшение ранее существовавших заболеваний щитовидной железы. Перед началом терапии Пегасисом® следует исследовать уровни ТТГ и Т4. Лечение Пегасисом® может быть начато или продолжено, если уровень ТТГ может поддерживаться в пределах нормальных значений медикаментозно. При возникновении клинических симптомов возможной дисфункции щитовидной железы необходимо исследовать ТТГ во время терапии.
Как и при терапии другими интерферонами, при применении Пегасиса® наблюдались гипогликемия, гипергликемия и сахарный диабет. Пациенты с вышеперечисленными состояниями, которые не поддаются адекватной коррекции, не должны начинать монотерапию Пегасисом® или комбинированную терапию Пегасисом®/рибавирином, а в случае развития подобных состояний во время лечения терапию следует прекратить.
Сердечно-сосудистая система
Артериальная гипертензия, суправентрикулярная аритмия, застойная сердечная недостаточность, боль в грудной клетке и инфаркт миокарда ассоциировались с терапией интерферонами альфа, включая Пегасис®. Пациентам с сердечно-сосудистой патологией перед началом терапии рекомендуется делать ЭКГ. В случае ухудшения сердечно-сосудистого статуса терапию следует прервать или отменить. У пациентов с сердечно-сосудистыми заболеваниями анемия может привести к необходимости снизить дозу или прекратить прием рибавирина.
Нарушение функции печени
При развитии печеночной недостаточности Пегасис® следует отменить. Так же, как и при терапии другими интерферонами альфа, увеличение уровня АЛТ по сравнению с исходным значением наблюдалось во время терапии Пегасисом®, включая пациентов с вирусологическим ответом. При прогрессирующем или клинически значимом увеличении уровня АЛТ, несмотря на снижение дозы или если это увеличение сопровождается повышением уровня прямого билирубина, терапию следует отменить.
В отличие от ХГС, при ХГВ обострение заболевания печени встречается нередко и сопровождается преходящим и потенциально значимым повышением уровня АЛТ. В клинических исследованиях внезапное выраженное повышение АЛТ при терапии Пегасисом® у пациентов с ХГВ сопровождалось легкими изменениями других лабораторных показателей без признаков декомпенсации функции печени. В половине случаев внезапного повышения уровня АЛТ, в 10 раз превышающего верхнюю границу нормы, доза Пегасиса® была снижена или терапия была временно отменена до нормализации показателя, в то время как у второй половины пациентов терапию продолжали без изменений. Рекомендуется более часто контролировать функцию печени во всех случаях.
Реакции гиперчувствительности
При терапии интерфероном альфа редко наблюдаются серьезные реакции гиперчувствительности немедленного типа (например крапивница, ангионевротический отек, бронхоспазм, анафилаксия). В случаях развития подобных реакций терапию отменяют и немедленно назначают соответствующую медикаментозную терапию.
Преходящая сыпь не требует отмены терапии.
Аутоиммунные заболевания
При лечении интерферонами альфа описано возникновение аутоантител и аутоиммунных заболеваний. В группе повышенного риска находятся пациенты с предрасположенностью к развитию аутоиммунных заболеваний. Пациенты с признаками или симптомами, сходными с признаками аутоиммунных заболеваний, должны проходить тщательное обследование и повторную оценку соотношения пользы и риска от продолжения терапии интерфероном.
Лихорадка и инфекции
Несмотря на то, что лихорадка может быть связана с гриппоподобным синдромом, часто возникающим при терапии интерфероном, необходимо исключить другие причины персистирующей лихорадки (в частности, серьезные бактериальные, вирусные и грибковые инфекции), особенно у пациентов с нейтропенией. При приеме интерферонов альфа, включая Пегасис®, сообщалось о серьезных инфекциях (бактериальных, вирусных, грибковых). Следует немедленно назначить соответствующую специфическую терапию и отменить Пегасис®.
Офтальмологические изменения
Как и при терапии другими интерферонами, при лечении Пегасисом® в редких случаях отмечалась ретинопатия, включая кровоизлияния в сетчатку, «ватные» экссудаты, отек диска зрительного нерва, неврит зрительного нерва и тромбоз артерий или вен сетчатки.
Всем пациентам перед назначением терапии необходимо провести офтальмологическое обследование для выявления патологии глазного дна. При появлении жалоб на ухудшение остроты зрения или сужение полей зрения следует немедленно провести полное офтальмологическое обследование. Пациентам с сопутствующими заболеваниями органа зрения (например диабетическая или гипертоническая ретинопатия) необходимо проводить дополнительные осмотры во время терапии Пегасисом®. При возникновении или ухудшении офтальмологического заболевания терапию следует отменить.
Изменения со стороны органов дыхания
Как и при терапии интерферонами альфа, при лечении Пегасисом® наблюдались побочные реакции со стороны органов дыхания, включая одышку, легочные инфильтраты, пневмонию и пневмонит. При появлении персистирующих (стойких) инфильтратов или инфильтратов неясного генеза или нарушении функции дыхания терапию следует отменить.
Изменения со стороны кожи
Применение интерферонов альфа ассоциировалось с обострением или индуцированием псориаза и саркоидоза. Больным псориазом Пегасис® следует назначать с осторожностью, а при появлении или обострении заболевания рассмотреть вопрос об отмене терапии.
Ко-инфекция ВИЧ-ХГС
Перед началом лечения следует внимательно ознакомиться с возможными побочными эффектами антиретровирусных препаратов, которые пациент будет принимать совместно с препаратами для терапии ХГС. У пациентов, одновременно получавших ставудин и интерферон с или без рибавирина, частота возникновения панкреатита и/или лактат-ацидоза составила 3% (12/398).
Пациенты с ко-инфекцией ВИЧ-ХГС, получающие высокоактивную антиретровирусную терапию (ВААРТ), могут находиться в группе риска в отношении развития лактат-ацидоза.
Поэтому следует соблюдать осторожность при добавлении Пегасиса® и рибавирина к ВААРТ (см. инструкцию по медицинскому применению рибавирина).
У пациентов с ко-инфекцией и выраженным циррозом, получающих ВААРТ, при комбинированной терапии рибавирином и интерферонами, включая Пегасис®, повышен риск развития фатальной печеночной недостаточности. Исходные показатели, которые могут быть связаны с печеночной декомпенсацией у пациентов с ко-инфекцией и циррозом, включают в себя: повышенный сывороточный билирубин, сниженный Hb, повышенную ЩФ или пониженный уровень тромбоцитов, и лечение диданозином.
Одновременное применение рибавирина и зидовудина не рекомендуется из-за повышенного риска возникновения анемии.
У пациентов с ко-инфекцией во время терапии необходимо тщательно контролировать функцию печени путем оценки количества баллов по шкале Чайлд-Пью. Терапию следует немедленно отменить при показателе >7 баллов по шкале Чайлд-Пью.
Следует проявлять осторожность при назначении Пегасиса® пациентам с низким уровнем CD4+-лимфоцитов (из-за недостаточности данных по эффективности и безопасности применения Пегасиса® у пациентов с ко-инфекцией ВИЧ-ХГС с количеством CD4+-лимфоцитов менее 200 клеток/мкл).
Стоматологические изменения
У пациентов, получающих комбинированную терапию Пегасисом® и рибавирином, наблюдалась патология зубов и пародонта, которая может привести к потере зубов. Кроме того, длительный курс лечения Пегасисом® и рибавирином может вызывать сухость в полости рта, разрушающе воздействующую на зубы и слизистую оболочку ротовой полости. Пациенты должны тщательно чистить зубы дважды в день и регулярно проходить обследование у стоматолога. У некоторых пациентов может возникать рвота, после которой рекомендуется тщательно полоскать рот.
Использование пэгинтерферона в качестве длительной поддерживающей терапии (использование вне зарегистрированных показаний)
В рандомизированном, контролируемом исследовании (HALT-C) у пациентов с ХГС и фиброзом различной стадии, не ответивших на предшествующую терапию, при монотерапии Пегасисом® в дозе 90 мкг в неделю в течение 3,5 лет не отмечалось значимого сокращения скорости прогрессирования фиброза или связанных клинических явлений.
Влияние на способность к вождению транспортных средств и работу с машинами и механизмами. Пегасис® оказывает слабое влияние на способность к вождению транспортных средств и работу с машинами и механизмами. При возникновении головокружения, сонливости, спутанности сознания и слабости, следует отказаться от вождения транспортного средства или работы с машинами и механизмами.
Условия хранения
В защищенном от света месте, при температуре 2–8 °C (не замораживать).
Транспортировать при температуре 2–8 °C, в зазищенном от свете месте, не замораживая.
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
1 ампула содержит активное вещество — интерферон альфа — не менее 1000 ME.
Характеристика препарата
Препарат представляет собой группу белков (интерфероны альфа), синтезированных лейкоцитами здоровых доноров, в ответ на воздействие вируса-индуктора интерферона (вирус болезни Ньюкасла или вирус Сендай). Препарат не содержит консервантов и антибиотиков. Поверхностный антиген вируса гепатита В и антитела к ВИЧ 1, ВИЧ 2, вирусу гепатита С отсутствуют.
Пористая аморфная масса или порошок белого или от светло-желтого до розового цвета, гигроскопичен.
Иммуномодуляторы. Иммуностимуляторы.
Интерфероны. Интерферон альфа естественный. Код ATX: [L03AB01].
Фармакологические свойства
Интерферон альфа обладает способностью стимулировать фагоцитарную активность макрофагов, а также цитотоксическую активность Т-клеток и NK-клеток, оказывает непрямое противовирусное действие, индуцируя в клетках состояние резистентности к вирусным инфекциям и модулируя ответную реакцию иммунной системы, направленную на нейтрализацию вирусов или уничтожение инфицированных ими клеток.
Фармакокинетика
Интерферон быстро всасывается через слизистые оболочки. Из организма выводится в виде естественных метаболитов.
Профилактика и лечение гриппа и других острых респираторных вирусных инфекций.
Повышенная чувствительность к препаратам белкового происхождения.
Детям с неонатального периода (с рождения) препарат применяется интраназально (путем распыления или закапывания). Для детей с 3-х лет и взрослых — дополнительно в виде ингаляции.
Интраназально
Ампулу с препаратом вскрывают непосредственно перед применением. Стерильную дистиллированную или охлажденную до комнатной температуры кипяченую воду добавляют в ампулу до черты, указанной на ампуле, соответствующей 2 мл, осторожно встряхивают до полного растворения содержимого. Растворенный препарат — прозрачная или слегка опалесцирующая жидкость, бесцветная или от светло-желтого до розового цвета. Растворенный препарат можно хранить при температуре от 2 до 8 °C в течение 1 сут.
Препарат применяют путем закапывания (с помощью медицинской пипетки или шприца без иглы) или распыления. Распыление производится распылителями любой системы или с помощью прилагаемой насадки-распылителя.
Для профилактики введение препарата следует начинать при непосредственной угрозе заражения и продолжать до тех пор, пока опасность заражения сохраняется. Препарат применяют интраназально путем закапывания по 5 капель или распыления по 0,25 мл в каждый носовой ход 2 раза в сутки с интервалом не менее 6 часов.
Для лечения препарат применяют на ранней стадии заболевания при появлении первых клинических симптомов интраназально по 0,25 мл (5 капель) в каждый носовой ход через 1-2 ч не менее 5 раз в сутки. Эффективность препарата тем выше, чем раньше начато его применение.
Правила применения насадки-распылителя:
Надеть иглу на шприц, наполнить его растворенным препаратом в объеме 0,25 мл (отметка 10 по шкале 40 ед. или отметка 25 по шкале 100 ед.).
Снять иглу и плотно надеть насадку-распылитель.
Поднести вплотную к носовому ходу насадку-распылитель и резким нажатием на поршень шприца впрыснуть препарат в носовой ход.
Снять насадку-распылитель, надеть иглу и набрать в шприц 0,25 мл препарата из ампулы.
Снять иглу, снова плотно надеть насадку-распылитель и ввести препарат в другой носовой ход в соответствии с пунктом 3.
Насадку-распылитель вводят на глубину 0,5 см в носовые ходы, предварительно очищенные от слизи. Пациент при этом должен находиться в сидячем положении со слегка запрокинутой головой и оставаться в этом положении в течение 1 минуты после введения препарата. Допускается использование одной насадки только у одного пациента.
Особые указания
Введение препарата путем инъекций категорически запрещается.
Применять с осторожностью лицам с аллергическими заболеваниями.
Применение в педиатрии
Детям с неонатального периода (с рождения) препарат применяется путем распыления и закапывания.
Применение в период беременности и лактации
Данных по опыту применения у беременных нет. Поэтому препарат применяют по назначению врача с учетом соотношения ожидаемой пользы для матери и возможного риска для плода и ребенка.
В период лактации ограничений по применению нет.
Особенности влияния лекарственного средства на способность управлять транспортным средством и потенциально опасными механизмами
Не влияет.
Особенности влияния лекарственного средства у лиц с нарушением функции печени и почек и в геронтологической практике
Не выявлено особенностей применения лекарственного препарата у лиц с нарушением функции печени и почек. Не выявлено особенностей применения в геронтологической практике
Аллергические реакции. Если Вы заметили любые побочные эффекты, не указанные в инструкции, сообщите об этом врачу. При аллергических реакциях немедленного типа проводить симптоматическую терапию.
Случаи передозировки не описаны.
Применяют в комплексной терапии с другими лекарственными средствами. Допускается использовать одновременно с другими противовирусными и сосудосуживающими средствами для местного применения.
Форма выпуска
По 1000 ME в ампуле. По 10 ампул с ножом или скарификатором ампульным и инструкцией по применению в картонной коробке. При упаковке ампул, имеющих насечку, кольцо или точку облома, нож или скарификатор ампульный не вкладывают.
Хранить при температуре от 2 до 8 °C в защищенном от света и недоступном для детей месте.
2 года. Не использовать по истечении срока годности, указанного на упаковке.
Отпускается без рецепта.
Предприятие — производитель/организация, принимающая претензии
Предприятие-производитель.
ФГУП «НПО «Микроген» Минздрава России
Россия, 115088, г. Москва, ул. 1-ая Дубровская, д. 15, тел.: (495) 710-37-87, факс: (495) 783-88-04, e-mail: .
Адрес производства:
Россия, 450014, Республика Башкортостан, г. Уфа, ул. Новороссийская, д. 105, тел.: (347) 229-92-01.
Дата публикации 16 октября 2017Обновлено 14 февраля 2022
Определение болезни. Причины заболевания
Вирусный гепатит С — острое или хроническое инфекционное заболевание, вызываемое различными типами вируса гепатита С, которые поражают в основном гепатоциты (клетки печени) и вызывают развитие воспалительного процесса в печени. При сочетании ряда факторов, образа жизни и отсутствии адекватного лечения вирусы гепатита С приводят к цирротической перестройке ткани и раку печени (гепатоцеллюлярной карциноме).
Краткое содержание статьи — в видео:
Этиологический агент — вирус гепатита С (ВГС). Вирус был впервые выделен американскими учёными в 1989 году.
Таксономическая структура:
- царство — вирусы
- семейство — Flaviviridae
- род — Hepacivirus
- вид — вирус гепатита С (hepatitis C virus, HCV) — 7 генотипов и 67 подтипов
Этиологические и морфологические свойства вируса
Диаметр вириона (вирусной частицы) — 50 нанометров. Имеет внешнюю белково-липидную оболочку. Оболочка вирусной частицы образуется в том числе за счёт взаимодействия вируса с липопротеидами низкой плотности хозяина, что позволяет ему ускользать из под иммунной атаки и проникать в клетки.
Генетическая структура представляет собой линейную однонитевую молекулу рибонуклеиновой кислоты (РНК), её размер примерно 9400 нуклеотидов. В ней выделяют следующие зоны: шифрующие структурные (Е1 и Е2 белки) и неструктурные (функциональные) белки — NS2, NS3, NS4A, NS4B, NS5A, NS5B, отвечающие за различные функции в жизни вируса. Структурные белки определяют прямой цитопатический эффект (повреждение клеток), полиморфизм (многообразие) вируса, участвуют в эффекте проникновения и выхода из клетки. Неструктурные белки участвуют в процессе развития и размножения вируса, определяют развитие резистентности (устойчивости) к интерферонам (NS5A). Встраивания вирусной РНК в геном клеток человека не замечено.
Вирус неоднороден (есть его различные подвиды — генотипы). Это обусловлено тем, что скорость его репликации огромна (за сутки 1011-1012) и в результате возникает большое число ошибок — вирус быстро мутирует. Такие мутации позволяют вирусу ускользать от иммунного ответа человека и длительно находиться в организме, а также сопротивляться воздействию лекарственных препаратов. Основной резервуар вируса — это клетки печени, однако он способен размножаться и в клетках иммунной системы (макрофагах, моноцитах и др.).
В целом вирус малоустойчив в окружающей среде. Под воздействием хлороформа, спирта, хлоргексидина и других дезинфицирующих средств погибает практически мгновенно, инактивируется при температуре 100 °С за 2 минуты, при температуре 60 °С за 30 минут. При комнатной температуре живёт не более четырёх суток, под действием ультрафиолета погибает за 30 минут. В плазме, эритроцитарной массе и др. может сохраняться до года. На культурах клеток не культивируется, не имеет гемагглютинирующей (склеивающей эритроциты) и гемолитической (разрушающей эритроциты) активности [2][8][10][11].
Передача вируса гепатита С
Передача вируса осуществляется только через кровь. Инфицирующая доза в несколько десятков раз больше, чем при гепатите В, т. е. для заражения нужны видимые следы крови. А вот пути заражения бывают различны:
- употребление наркотиков;
- медицинские манипуляции (в том числе пирсинг, тату и др.);
- половой путь (незащищённый половой контакт, в среднем около 1,5 % в гетеросексуальной семье);
- от матери к ребёнку в родах;
- бытовой путь (использование общих бритв, ножниц, зубных щёток).
При поцелуях, рукопожатиях, через посуду, сухие пятна крови на одежде, через воду, при кашле, чихании, потении, сидении рядом, по воздуху и т. д. гепатит С не передаётся. Заразиться через грудное молоко также нельзя, но заражение возможно при попадании крови матери на повреждённые губы ребёнка. Есть незначительный риск при попадании инфицированной крови в глаза, однако это единичные случаи. Заразиться при переливании крови практически невозможно, т. к. кровь на гепатит С тестируют методом ПЦР (полимеразной цепной реакции) с высокой чувствительностью.
Нет никаких научных оснований ограничивать выбор профессии, работы и круг общения людей с гепатитом С — передача осуществляется только через кровь, поэтому ограничений в работе (например учителем, врачом, няней), контактах с родственниками и т. п. быть не должно.
Территориальное распределение
Гепатит С распространен во всем мире. Наиболее часто он встречается в Регионе ВОЗ Восточного Средиземноморья и Европейском регионе ВОЗ, где в 2015 г. распространенность HCV, по оценкам, составила соответственно 2,3% и 1,5%. Общее количество больных вирусным гепатитом С в мире не менее 150 млн, в Российской Федерации — неизвестно (по некоторым данным ориентировочное количество больных — не менее 2 млн человек). По состоянию на 2016 год в США было заражено не менее 2,4 млн человек (по другим данным — не менее 4 млн). По самым скромным подсчётам в этой стране в 2018 году от гепатита С умерли не менее 15 тыс. человек. В РФ превалирующее распространение имеют генотипы 1b и За, но частота их выявления может значительно колебаться в зависимости от региона [4][7][9].
В настоящее время вирусный гепатит С распространяется в общей популяции, т. е. заболеванию подвержены люди всех возрастов и социальных слоёв, однако наибольший риск имеют следующие категории:
- потребители инъекционных наркотиков;
- ВИЧ-инфицированные;
- пациенты отделений гемодиализа;
- лица, подвергшиеся трансплантации органов (в настоящее время менее значимо);
- медработники;
- дети, рождённые от матерей с гепатитом С;
- маргинальные слои общества, работники секс-индустрии.
После перенесённого острого вирусного гепатита С примерно 30 % людей самоизлечиваются, т. е. полностью избавляются от вируса, в остальных случаях формируется хронический гепатит. Предикторы (прогностические параметры) самоизлечения — желтуха, высокий уровень АЛТ, молодой возраст, женский пол, 1 генотип вируса, наличие гепатита В с HbsAg (антигеном вируса гепатита В). У каждого 5-25 человека из 100 в течение 10-20 лет от момента инфицирования при хронизации развивается цирроз печени и у них имеется 1-4 % годовой вероятности развития рака печени.
Провоцирующие факторы развития цирроза печени:
- мужской пол;
- возраст более 50 лет;
- злоупотребление алкоголем;
- коинфекция ВИЧ, гепатита В или стеатогепатита;
- иммуносупрессивная терапия.
Гепатитом С можно заразиться после выздоровления от предыдущего случая (даже тем же генотипом), можно заразиться другим генотипом, даже если человек уже имеет гепатит С какого-либо генотипа (суперинфекция). В этом случае наблюдается борьба между генотипами за доминирование. Побеждает, как правило, какой-то один, а другой может сохраняться на минимальных степенях репликации. При этом существует риск ошибки при определении генотипа.
Иммуногенность вируса слабая, т. е. антитела, которые должны вырабатываться в ответ на заражение, появляются медленно (не ранее чем через 3 недели от заражения) и не обладают явным вируснейтрализующим действием [2][4][8][9].
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы гепатита С
Скрытый (инкубационный) период гепатита С может составлять от 2 недель до 6 месяцев. В это время может не быть никаких признаков заражения и развивающегося заболевания. Однако коварство гепатита С в том, что даже по прошествии этого времени может не возникнуть никаких явных симптомов и проявлений (большинство больных вообще не имеет симптомов или их нельзя связать с гепатитом). Даже если симптомы и возникают, то зачастую они настолько незначительны, что человек абсолютно не придаёт им значения и не обращается за медицинской помощью до развития осложнений. Чаще всего информация о болезни появляется после прохождения рутинных исследований для операции или донорства крови.
Симптомы вирусного гепатита С в остром и хроническом периоде:
- снижение или отсутствие аппетита;
- общая слабость, ухудшение самочувствия, повышенная утомляемость, депрессия (один из основных симптомов);
- тошнота;
- тяжесть и дискомфорт в правом подреберье;
- боли в животе, небольшое расстройство пищеварения;
- боли в суставах;
- в редких случаях — пожелтение склер глаз, кожи, потемнение мочи или осветление кала.
Повышение температуры отмечается редко. Возможен различный характер течения хронического заболевания, в большинстве случаев на протяжении десятков лет больной испытывает незначительную усталость, периодический дискомфорт в правом подреберье, иногда связанный с погрешностями в диете. Примечательно, что чёткого продолжительного периода ухудшения самочувствия обычно нет. Лишь на завершающей стадии заболевания (через несколько десятков лет) человек испытывает резкое ухудшение самочувствия, нарастание отёков, в том числе у него наблюдается накопление жидкости в брюшной полости (асцит), повышенная кровоточивость, похудание, желтуха. Зачастую толчком к этому служит принятие алкоголя на праздники в значительных дозах. В этом коварство вирусного гепатита С — мнимый период благополучия даже при высокоактивном инфекционном процессе («ласковый убийца», как длительное время его называли).
Гепатит С у беременных
Каких-либо значимых различий в течении вирусного гепатита С при беременности нет, как правило, происходит даже минимизация клинических и лабораторных изменений. Риск заражения ребёнка имеется лишь в родах, причём чем выше количество вируса в мл крови (вирусная нагрузка), тем выше риск. Выбор способа родоразрешения может влиять на риск передачи вируса при высокой вирусной нагрузке (свыше 8 х 10^5 МЕ/мл): при естественных родах риск до 8 %, при плановом кесаревом сечении — до 1 % (некоторые исследователи не подтверждают это). При коинфекции ВИЧ у матери риск передачи значительно возрастает — до 15 %.
Гепатит С у детей
После рождения от матерей с гепатитом С у 100 % детей выявляются материнские антитела к вирусу до 18 месяцев в максимальном исчислении (это нормально). Если заражения не произошло, в течение этого срока антитела исчезают и у ребёнка больше не будет никаких следов контакта. Если происходит заражение, то уже через 1-2 месяца в крови будет выявляться вирусная РНК в ПЦР исследовании (требует повторения даже при первичном отрицательном результате). Как правило, течение гепатита у детей малоактивное и не приводит к выраженным изменениям печени и самочувствия до момента возможного современного лечения и выражается только периодическим повышением АЛТ/АСТ [2][3][8][9].
Патогенез гепатита С
Проникая в организм, вирус гепатита С не оставляет никаких следов в месте внедрения. С током крови он быстро попадает в клетки печени, где оказывает неярко выраженное прямое разрушающее действие на клетки-мишени и в большей степени вызывает иммуноопосредованное поражение клеток на фоне репликации вируса. При использовании одного из исследований — ультрачувствительного ПЦР (полимеразной цепной реакции) — РНК вируса в крови может обнаруживаться уже через 2 недели от момента заражения. Значений, которые выявляются всеми тест-системами, как правило, вирусная нагрузка достигает через 1,5 месяца после заражения.
Нарушается баланс продукции цитокинов (белков, которые оказывают комплексное регулирующее влияние на воспаление и иммунитет):
- усиливается выработка интерлейкинов IL-4 и IL-10 (сигнальных веществ, которые вырабатываются клетками иммунной системы и служат для регуляции активности других клеток);
- снижается образование интерферонов IL-2 (белков с противовирусной и иммуномодулирующей активностью);
- подавляется активация СD4+ лимфоцитов (клеток, которые отражают работу иммунной системы).
Возможность нахождения и размножения вируса в клетках иммунной и нервной систем делает его недоступным для иммунного контроля. Главенствующая частота перехода вирусного гепатита С в хроническую форму (около 70 %) обусловлена не только различными особенностями самого вируса, но и обязательным участием (или вернее неадекватным участием) иммунной системы:
- наличием внепечёночного размножения вируса (главным образом в моноцитарной системе);
- наличием множества генотипов с подтипами и частыми мутациями (перестановками составляющих генома вируса);
- запуском иммунопатологических реакций, которые участвуют и во внепечёночных поражениях при гепатите С, в том числе в клетках эндотелия сосудов головного мозга;
- низкой иммуногенностью вируса;
- участием в патогенезе процессов перекисного окисления липидов.
После заражения и малосимптомного протекания острой фазы заболевания при отсутствии самоизлечения (около 30 %) наступает хронизация инфекции — длительный латентный период (до 10-30 лет, иногда более длительно). В течение этого периода человек ведёт обычный образ жизни, не испытывает никаких явных признаков заболевания, а появляющееся чувство усталости вполне логично списывает на интенсивный современный ритм жизни.
Длительность латентного периода зависит от свойств вируса, его реактивности, развития иммунопатологических реакций иммунной системы, образа жизни человека и других факторов. Однако рано или поздно наступает переломный момент в системе взаимодействия патогенного микроорганизма и восприимчивого человеческого макроорганизма. Несмотря на широкие регенераторные возможности печени происходит нарушение её восстановительных сил. Вследствие постоянного некупируемого воспалительного процесса активная функциональная ткань печени замещается жировой и далее соединительной тканью (рубцовой). При этом нарушается нормальное функционирование органа и по механизму обратной связи происходит прогрессирующее ухудшение работы печени и жизнедеятельности организма в целом [2][4][10][11].
Классификация и стадии развития гепатита С
Острый вирусный гепатит С
Периоды:
- Инкубационный период — от 3 недель до 4-6 месяцев. Полное отсутствие симптоматики.
- Преджелтушный (продромальный) период — от 4 суток до 3 недель. Симптомы малозаметны, может быть депрессивное настроение, слабость, дискомфорт в животе, неустойчивый стул.
- Период паренхиматозного гепатита (желтушный) — от 1 до 3 недель. Бывает редко, чаще отмечается незначительное желтушное окрашивание склер в совокупности с предыдущими признаками.
- Период выздоровления (реконвалесценции) или переход в малоактивное хроническое течение — от 3 до 6 месяцев.
По (МКБ-10): B17.1 Острый гепатит С.
По клинической форме:
- Манифестная:
- желтушная (типичная);
- безжелтушная.
- Бессимптомная:
- субклиническая (симптомы выражены очень слабо);
- инаппарантная (симптомов нет, возможны лишь лабораторные изменения).
По степени тяжести:
- Лёгкая — незначительная интоксикация до 5 дней, отсутствие или незначительная желтушность до 7 дней, отсутствие лихорадки, нормальные или незначительно увеличенные размеры печени, общий билирубин до 85-100 мкмоль/л, протромбиновый индекс (ПТИ) до 80 %, АЛТ до 500 ед/л.
- Средней тяжести — умеренная интоксикация до 7 дней, умеренная желтушность до 10 дней, субфебрилитет (повышение температуры тела в пределах от 37,1 до 38,0 °С) в начальном периоде до 5 дней, увеличение печени до 4 см, общий билирубин 100-170 мкмоль/л, ПТИ 80-60 %, АЛТ до 1000 ед/л.
- Тяжёлая — резко выраженная интоксикация 15 и более дней, интенсивная желтушность кожи 3 недели и более, фебрильная температура весь начальный и период разгара болезни, тахикардия, увеличение печени на 6 см и резкое её уменьшение в размерах на фоне прогресса болезни, общий билирубин от 170 мкмоль/л, ПТИ менее 60 %, АЛТ более 1000 ед/л.
По длительности течения:
- острый гепатит С (циклический — до 3 месяцев, острый затяжной — 3-6 месяцев);
- хронический гепатит С — продолжительностью более 6 месяцев.
Классификации хронических форм не разработаны, могут применяться различные составляющие на основании выраженности цитолитического синдрома, уровня повышения печёночных ферментов, морфологических изменений печени, наличию осложнений и др. [2][10][11].
Осложнения гепатита С
В остром периоде гепатита С возможно развитие «печёночной комы» — резкого выраженного угнетения функции печени вследствие массивной гибели печёночных клеток и накопления в организме токсичных продуктов обмена различных веществ. Это состояние характеризуется заторможенностью, потерей сознания, нарушением витальных (жизненно важных) функций. Однако встречаемость данного осложнения крайне низкая.
В хронической фазе болезни (или, по мнению части исследователей, конечной фазе заболевания) наиболее частым осложнением является развитие цирроза печени — замещения функционального долькового строения печёночной ткани грубым соединительнотканным образованием, что приводит к неадекватному функционированию органа. Определённое время печень способна выполнять функцию даже на стадии цирроза, но со временем при воздействии вируса наступает декомпенсация работы. Это состояние характеризуется нарушением кровотока в печени, повышением давления в системе воротной вены, расширением вен пищевода и желудка, увеличением селезёночной вены. Прогрессивно снижается уровень выработки белков, факторов свёртывания крови, фильтрационная способность. Появляются отёки, асцит (скопление жидкости в брюшной полости), кровотечения различной интенсивности, ухудшается общее состояние, интеллектуально-мнестические характеристики. В конечном итоге возможен летальный исход из-за массивного кровотечения и полиорганной недостаточности.
Не менее значимое осложнение хронической фазы гепатита С — развитие гепатоцеллюлярной карциномы (опухолевое перерождение). Согласно основной гипотезе, злокачественное перерождение возникает в результате повышенного распада клеток печени и последующего их восстановления, что приводит к повышенному числу мутаций. На ранних стадиях принципиальных отличий от течения хронического гепатита нет, в запущенных случаях возникает стремительное ухудшение состояния, нарастание асцита, желтухи, неспецифических желудочно-кишечных симптомов, потери веса, анорексии.
У 10-15 % больных с хроническим вирусным гепатитом С возможно развитие аутоиммунных заболеваний, наиболее частыми из которых являются аутоиммунный гепатит (АИГ) и криоглобулинемия. АИГ — это иммуноопосредованное поражение печени. Внешне оно мало отличается от проявлений гепатитов другой этиологии, но зачастую имеет более агрессивное течение и поддаётся терапии только длительными курсами иммуносупрессивных препаратов. Криоглобулинемия — накопление в малых и средних кровеносных сосудах специфических белков, которые вызывают затруднение в них тока крови и приводят к специфическим проявлениям.
Также определена связь гепатита С с развитием сахарного диабета, неходжкинской лимфомы и кожной порфирии Тарда [2][8][9][10].
Диагностика гепатита С
Вариантов первичного выявления вируса и заболевания множество, однако чаще всего гепатит С выявляется в ходе планового обследования при сопутствующем заболевании (операции или госпитализации). Как правило, обнаруживают повышенный уровень АЛТ или антитела к гепатиту С (HCVAb). Это служит поводом для направления такого пациента к врачу-инфекционисту для углублённого обследования.
На приёме врач-инфекционист (гепатолог) осматривает пациента, в части случаев (в различных сочетаниях) выявляет характерное изменение цвета ладоней (печёночные ладони), увеличение размеров печени. В продвинутых случаях заболевания врач отмечает расширение вен области передней брюшной стенки («голова медузы»), отёчность (в том числе асцит как причина увеличения размеров живота), сосудистые звездочки и др.
Прохождение тестирования на гепатит С
При лабораторном обследовании в первую очередь должно быть назначено исследование на АЛТ, РНК вируса методом ПЦР качественно с чувствительностью 15-60 МЕ и антитела к вирусу гепатита С суммарные. При отрицательном результате ПЦР и положительном анализе на антитела диагноз гепатита С не подтверждается. Согласно действующему в РФ законодательству, такой человек должен быть поставлен на учёт к инфекционисту на срок 2 года с обязательным обследованием методом ПЦР раз в 6 месяцев. При отрицательном результате наблюдение прекращается с диагнозом паст-инфекция гепатита С (выздоровление). При положительном результате ПЦР происходит подтверждение диагноза — острый или хронический вирусный гепатит С — и назначается дополнительное обследование в целях уточнения текущего состояния. Необходимо помнить, что выявление суммарных антител в иммуноферментном анализе (ИФА) говорит лишь о прошлой встрече с инфекцией и не даёт практически никакой информации о наличии заболевания в текущий момент. Антитела могут сохраняться пожизненно.
Обязательно должны быть назначены следующие исследования:
- Развернутый клинический анализ крови + СОЭ (скорость оседания эритроцитов). Для гепатита С характерны: лейкопения (снижение количества лейкоцитов), лимфо- и моноцитоз (увеличение числа лимфоцитов и моноцитов), уменьшение СОЭ, тромбоцитопения (снижение количества тромбоцитов);
- Биохимический анализ крови:
- аланинаминотрансферраза (АЛТ) — возможен нормальный уровень или периодическое повышение;
- аспартатаминотрансферраза (АСТ) — норма или повышение;
- гамма-глутамилтранспептидаза (ГГТ) — норма или повышение;
- щелочная фосфатаза (ЩФ) — повышение при ухудшении процесса;
- общий билирубин — норма или повышение;
- общий белок — снижение при нарушении функции печени;
- протеинограмма — повышение гамма-глобулинов;
- протромбиновый индекс (ПТИ) — снижение при прогрессировании процесса;
- креатинин, амилаза, сахар.
- Онкомаркеры. Альфафетопротеин — повышение при прогрессировании процесса и развитии рака печени.
- Общий анализ мочи — появление уробилина, белка.
- УЗИ органов брюшной полости — возможно увеличение размеров печени и селезёнки, изменение структуры печени, размера внутренних сосудов.
- ФГДС — исследование пищевода, желудка и двенадцатиперстной кишки. Выявляется расширение вен пищевода при развитии портальной гипертензии — осложнение цирроза печени.
- Фиброскан — метод оценки фиброза печени, который позволяет определить тяжесть заболевания без биопсии (F0 – отсутствие фиброза, F4 — цирроз).
- ПЦР на гепатите С — качественный и при необходимости количественный тест.
- Генотипирование — определение генотипа вируса гепатита С.
- Мутации лекарственной резистентности NS3, NS5A и NS5B регионов генома вируса гепатита С (при неудаче в лечении препаратами прямого действия или высоком риске такой неудачи до лечения).
- Анализы на маркеры сопутствующих вирусных гепатитов (HbsAg, HbcorAb total, anti-Hbs).
- Анализ на ВИЧ.
При необходимости список исследований может расширяться. Стоит подчеркнуть, что грамотное назначение обследования и его интерпретация возможны исключительно врачом-инфекционистом (гепатологом). Врач назначит лишь необходимое, тем самым поможет пациенту сэкономить деньги, даст грамотную оценку полученных данных, что чрезвычайно важно в планировании дальнейшего лечения и его исхода [2][5][6][9][12].
Дифференциальная диагностика
- Вирусные и невирусные гепатиты другой этиологии. Связаны с путешествиями, любыми повреждениями кожи и слизистых, употреблением заражённых пищи и воды. Отличаются выраженностью симптоматики. Для уточнения диагноза проводятся специфические серологические тесты ИФА и ПЦР.
- Токсическое поражение печени. Связано с недавним значительным употреблением алкоголя или токсинов. Проводятся специфические серологические тесты ИФА и ПЦР, выявляется чрезмерное повышение ГГТ (фермент, маркер поражения печени).
- Паразитарные заболевания печени (например описторхоз, эхинококкоз). Связаны с проживанием в эндемичном регионе, употреблением плохо приготовленной рыбы, контактом с собаками. Характеризуются выраженной эозинофилией (увеличением уровня эозинофилов) периферической крови. Проводятся специфические серологические тесты, выявление яиц паразитов, инструментальные исследования.
- Первичный или метастатический рак печени. Изучаются данные анамнеза о сопутствующих заболеваниях, учитываются результаты инструментальной и лабораторной диагностики [2][4][10][11].
Надо ли проверяться на гепатит С здоровому человеку
Регулярное обследование на гепатит С при отсутствии симптомов следует проводить медработникам, пациентам отделений гемодиализа, частым посетителям стоматолога, больным хроническими заболеваниями с частыми парентеральными вмешательствами (внутривенно, подкожно и внутримышечно) и лицам, часто меняющим половых партнёров.
Лечение гепатита С
Основу любого лечебного воздействия составляет правильно подобранная диета. В отношении вируса гепатита С этот метод как никогда актуален, однако он зачастую игнорируется как пациентами, так и самими врачами.
Диета при гепатите С
Самое главное условие — полный отказ от алкоголя. Ничто так не вредит печени, как алкоголь. Именно он может стать тем фактором, который запускает цепь патологических реакций и переводит гепатит из вялотекущего процесса в высокоактивный, ускоряя наступление цирротической стадии гепатита. В отношении других продуктов питания и напитков следует соблюдать золотую середину: питание должно быть разнообразным, всего должно быть в меру, без злоупотреблений «тяжёлой» пищей (ограничение жирного, жареного, солёного, копчёного) с учётом отсутствия или наличия сопутствующих заболеваний.
Большое значение имеет поддержание разумной физической активности и контроль веса (индекс массы тела не должен превышать 25 кг/м2).
Какие врачи лечат гепатит С
Лечением гепатита С занимаются врачи-инфекционисты.
Медикаментозная терапия Гепатита С
Медикаментозное лечение гепатита С зависит от фазы развития заболевания, индивидуальных особенностей и возможностей организма. В остром периоде широко применяется инфузионная терапия (введение растворов) с привлечением различных дезинтоксикационных (очищение организма от вредных веществ) и питательных лечебных растворов.
Роль специфической противовирусной терапии острого гепатита С окончательно не решена и возможна лишь в индивидуальном порядке, например при угрозе хронизации или при фульминантном течении болезни (тяжёлом варианте воспалительно-некротического поражения печени). При невозможности радикального лечения гепатита С в хронической фазе вполне приемлема поддерживающая терапия так называемой группой гепатопротекторов (фосфолипиды, аминокислоты, антиоксиданты и др.). Данные средства не имеют чётко доказанной эффективности, однако широко применяются на практике и в некоторых случаях способны несколько задержать прогрессирование заболевания. Хороший эффект даёт нормализация функции ЖКТ и улучшение микрофлоры кишечника.
Попытки воздействия на вирус предпринимались с момента его открытия. Вначале это было изолированное применение препаратов интерферона короткого действия, затем комбинации интерферона короткого действия и рибавирина (препарата общевирусного действия). Их сменила комбинация интерферона пролонгированного действия и рибавирина.
К концу интерфероновой эпохи были достигнуты значительные успехи в процессе лечения и избавления человеческого организма от вируса гепатита С. Однако терапия была длительной, процент излечения достигал не более 70 % в среднем по генотипам, и курс лечения имел серьёзные побочные эффекты, иногда приводя к последствиям намного серьёзнее, чем сам гепатит С. Это обстоятельство дало толчок к разработке принципиально новых лекарственных средств, характеризующихся прямым противовирусным действием, сочетающих высокую эффективность (до 99 %), высокий профиль безопасности (минимальные побочные эффекты), простоту и удобство дозирования и небольшую длительность (2-3 месяца). В основу механизма действия легло подавление ключевых этапов размножения вируса, в первую очередь протеазы и полимеразы вируса гепатита С. Проведённые испытания препаратов показали высокие результаты, и, начиная с 2013 года, данная группа последних эффективных разработок с успехом применяется во всём мире. В некоторых странах одобрено лечение детей современными препаратами начиная с 3 лет (в зависимости от генотипа) с соответствующими взрослым показателями успеха.
Можно ли вылечить гепатит С полностью
В 2016 году Всемирная организация здравоохранения (ВОЗ) объявила гепатит С полностью излечимым заболеванием.
На 2020 год в мире доступны следующие виды и комбинации лекарственных препаратов прямого противовирусного действия для лечения гепатита С:
- Софосбувир.
- Даклатасвир.
- Элбасвир и Гразопревир.
- Глекапревир и Пибрентасвир.
- Ледипасвир и Софосбувир.
- Омбитасвир / Паритапревир / Ритонавир.
- Омбитасвир / Паритапревир / Питонавир / Дасабувир.
- Симепревир.
- Софосбувир и Велпатасвир.
- Софосбувир / Велпатасвир / Воксилапревир (комбинация не зарегистрирована в РФ).
Как лечить гепатит С в домашних условиях
Назначение противовирусной терапии должно осуществляться врачом, хорошо ориентирующимся в множестве применяемых для терапии гепатита С лекарств, после изучения всех составляющих процесса, возможных противопоказаний, взаимодействий с уже принимаемыми препаратами, особенностей диеты и образа жизни [1][5][8][9]. Гепатит С — тяжёлое инфекционное заболевание, которое может привести к циррозу и раку печени, поэтому самолечение опасно для жизни.
Схемы лечения гепатита С в России
В России на сегодняшний день для лечения гепатита С используется преимущественно устаревшее лечение интерферонами (чаще бесплатно или со скидкой), в редких случаях — препаратами прямого противовирусного действия (чаще платно со скидкой).
Прогноз. Профилактика
Если лечение гепатита начать до того, как разовьётся цирроз печени, то прогноз будет благоприятным: как правило, наступает полное излечение. При запущенных стадиях (цирроз и рак печени) прогноз зависит от множества факторов, обычно при начальном циррозе больные при должном лечении могут жить дальше без каких-либо серьёзных проблем со здоровьем, при декомпенсированном процессе прогноз неблагоприятный.
Прогноз при отсутствии лечения гепатита С
В среднем без лечения при отсутствии пагубных привычек и здоровом образе жизни в течение 20 лет примерно у 10-20 % больных разовьются цирроз и рак печени, при регулярном злоупотреблении алкоголем, наркотиками и токсинами (в том числе лекарствами) доля таких тяжёлых осложнений составит до 30-40%.
Из-за повышенной мутационной способности вируса существует ряд технических сложностей в создании вакцины — на данный момент её не существует (ведутся разработки). Поэтому меры профилактики распространения вируса гепатита С направлены на разрывы механизмов и путей передачи вируса, санитарное информирование и обучение населения.
Первичная профилактика
- Предупреждение возможности заражения в медицинских учреждениях:
- гигиена и обработка рук, инструментария, использование перчаток;
- тестирование донорской крови, плазмы и компонентов;
- тестирование донорских органов;
- надлежащее проведение медицинских инъекций;
- обучение медицинского персонала;
- обследование доноров, беременных, госпитализированных.
- Предупреждение полового пути заражения
- обучение правильному и своевременному использованию презервативов;
- тестирование перед вступлением в брак.
- Выдача стерильного инструментария потребителям инъекционных наркотиков (не во всех странах).
Вторичная профилактика
- Проведение противовирусной терапии (в идеале при выявлении заболевания, т. к. это предупреждает дальнейшее распространение инфекции).
- Матерям с гепатитом С (если он не был пролечен до беременности) следует внимательно следить за состоянием целостности кожи сосков и рта ребёнка, при наличии повреждений необходимо прекращать грудное вскармливание на время до их заживления [2][7][9][12].
Что делать, если член семьи болен гепатитом С
Самое важное, что следует сделать, чтобы предотвратить заражение вирусом — это избегать контакта с кровью инфицированного человека. Кровь может быть заразной, даже если она сухая. Надевайте перчатки, если вам нужно прикасаться к использованным бинтам. После контакта с кровью тщательно вымойте руки, даже если вы были в перчатках.
Некоторые предметы личной гигиены могут иногда содержать небольшое количество крови. Не следует совместно использовать зубную щётку, бритву или маникюрные ножницы.
Деятельность ВОЗ
В мае 2016 г. Всемирная ассамблея здравоохранения приняла первую «Глобальную стратегию сектора здравоохранения по вирусному гепатиту на 2016–2021 гг. Главной целью стратегии является снижение к 2030 г. числа новых случаев инфицирования вирусным гепатитом на 90 % и смертности от вирусного гепатита на 65 %. Для реализации этой стратегии ВОЗ занимается повышением осведомлённости о заболевании и его профилактике и расширяет охват услугами по скринингу, оказанию помощи и лечению гепатита С [13].