Изопринозин (Isoprinosine) инструкция по применению
📜 Инструкция по применению Изопринозин
💊 Состав препарата Изопринозин
✅ Применение препарата Изопринозин
📅 Условия хранения Изопринозин
⏳ Срок годности Изопринозин
Описание лекарственного препарата
Изопринозин
(Isoprinosine)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для печатного издания справочника Видаль 2019 года.
Дата обновления: 2018.11.28
Владелец регистрационного удостоверения:
Контакты для обращений:
ТЕВА
(Израиль)
Код ATX:
J05AX05
(Инозин пранобекс)
Активное вещество:
инозин пранобекс
(inosine pranobex)
BAN
принятое к употреблению в Великобритании
Лекарственная форма
| Изопринозин |
Таб. 500 мг: 20, 30 или 50 шт. рег. №: П N015167/01 |
Форма выпуска, упаковка и состав
препарата Изопринозин
Таблетки белого или почти белого цвета, продолговатые, двояковыпуклой формы, с легким аминовым запахом, с риской на одной стороне.
Вспомогательные вещества: маннитол, крахмал пшеничный, повидон, магния стеарат.
10 шт. — блистеры (2) — пачки картонные.
10 шт. — блистеры (3) — пачки картонные.
10 шт. — блистеры (5) — пачки картонные.
Фармакологическое действие
Изопринозин — синтетическое комплексное производное пурина, обладающее иммуностимулирующей активностью и неспецифическим противовирусным действием. Восстанавливает функции лимфоцитов в условиях иммунодепрессии, повышает бластогенез в популяции моноцитарных клеток, стимулирует экспрессию мембранных рецепторов на поверхности Т-хелперов, предупреждает снижение активности лимфоцитарных клеток под влиянием глюкокортикостероидов, нормализует включение в них тимидина. Изопринозин оказывает стимулирующее влияние на активность цитотоксических Т-лимфоцитов и естественных киллеров, функции Т-супрессоров и Т-хелперов, повышает продукцию IgG, интерферона гамма, интерлейкинов (ИЛ)-1 и ИЛ-2, снижает образование провоспалительных цитокинов — ИЛ-4 и ИЛ-10, потенцирует хемотаксис нейтрофилов, моноцитов и макрофагов.
Препарат проявляет противовирусную активность in vivo в отношении вирусов Herpes simplex, цитомегаловируса и вируса кори, вирус Т-клеточной лимфомы человека тип III, полиовирусов, гриппа А и В, ЕСНО-вирус (энтероцитопатогенный вирус человека), энцефаломиокардита и конского энцефалита. Механизм противовирусного действия Изопринозина связан с ингибированием вирусной РНК и фермента дигидроптероатсинтетазы, участвующего в репликации некоторых вирусов. Усиливает подавленный вирусами синтез мРНК лимфоцитов, что сопровождается подавлением биосинтеза вирусной РНК и трансляции вирусных белков, повышает продукцию лимфоцитами интерферонов альфа и гамма, обладающих противовирусными свойствами.
При комбинированном назначении усиливает действие интерферона альфа, противовирусных средств ацикловира и зидовудина.
Фармакокинетика
Всасывание
После приема внутрь хорошо всасывается из ЖКТ. Cmax активного вещества в плазме крови определяется через 1-2 ч.
Метаболизм
Быстро подвергается метаболизму. Метаболизируется аналогично эндогенным пуриновым нуклеотидам с образованием мочевой кислоты, N-N-диметиламино-2-пропранолон метаболизируется до N-оксида, а пара-ацетамидобензоат — до o-ацилглюкуронид. Не обнаружено кумуляции препарата в организме.
Выведение
T1/2 составляет 3.5 ч для N-N-диметиламино-2-пропранолона и 50 мин — для пара-ацетамидобензоата. Выводится почками. Элиминация препарата и его метаболитов из организма происходит в течение 24-48 ч.
Показания препарата
Изопринозин
- лечение гриппа и других ОРВИ;
- инфекции, вызываемые вирусом Herpes simplex типов 1, 2, 3 и 4: генитальный и лабиальный герпес, герпетический кератит;
- опоясывающий лишай, ветряная оспа;
- инфекционный мононуклеоз, вызванный вирусом Эпштейна-Барр;
- цитомегаловирусная инфекция;
- корь тяжелого течения;
- папилломавирусная инфекция: папилломы гортани/голосовых связок (фиброзного типа), папилломавирусная инфекция гениталий у мужчин и женщин, бородавки;
- контагиозный моллюск.
Режим дозирования
Таблетки принимают после еды, запивая небольшим количеством воды.
Рекомендуемая суточная доза для взрослых и детей в возрасте 3 лет и старше (с массой тела от 15-20 кг) составляет 50 мг/кг массы тела в 3-4 приема (для взрослых — 6-8 таб./сут, для детей — по 1/2 таб. на 5 кг массы тела/сут).
При тяжелых формах инфекционных заболеваний доза может быть увеличена индивидуально до 100 мг/кг массы тела/сут, разделенных на 4-6 приемов. Максимальная суточная доза для взрослых 3-4 г/сут, для детей — 50 мг/кг/сут.
Продолжительность лечения при острых заболеваниях у взрослых и детей обычно составляет от 5 до 14 дней. Лечение необходимо продолжать до момента исчезновения клинических симптомов и в течение еще 2 дней уже при отсутствии симптомов. При необходимости длительность лечения может быть увеличена индивидуально под контролем врача.
При хронических рецидивирующих заболеваниях у взрослых и детей лечение необходимо продолжать несколькими курсами по 5-10 дней с перерывом в приеме в 8 дней.
Для проведения поддерживающей терапии доза может быть снижена до 500-1000 мг/сут (1-2 таб.) в течение 30 дней.
При герпетической инфекции взрослым и детям препарат назначают в течение 5-10 дней до исчезновения симптомов заболевания, в бессимптомный период — по 1 таб. 2 раза/сут в течение 30 дней для уменьшения числа рецидивов.
При папилломавирусной инфекции взрослым препарат назначают по 2 таб. 3 раза/сут, детям — по 1/2 таб. на 5 кг/массы тела/сут в 3-4 приема в течение 14-28 дней в виде монотерапии.
При рецидивирующих остроконечных кондиломах взрослым препарат назначают по 2 таб. 3 раза/сут, детям — по 1/2 таб. на 5 кг/массы тела/сут в 3-4 приема, либо в качестве монотерапии или в комбинации с хирургическим лечением в течение 14-28 дней, далее с трехкратным повторением указанного курса с интервалами в 1 месяц.
При дисплазии шейки матки, ассоциированной с вирусом папилломы человека, назначают по 2 таб. 3 раза/сут в течение 10 дней, далее проводят 2-3 аналогичных курса с интервалом 10-14 дней.
Побочное действие
Частота развития побочных эффектов после применения препарата классифицирована согласно рекомендациям ВОЗ: часто (≥1%, <10%), иногда (≥0.1%, <1%).
Со стороны ЖКТ: часто — тошнота, рвота, боль в эпигастрии; иногда — диарея, запор.
Со стороны печени и желчевыводящих путей: часто — временное повышение активности трансаминаз и щелочной фосфатазы в плазме крови, повышение концентрации мочевины в плазме крови.
Дерматологические реакции: часто — зуд.
Со стороны нервной системы: часто — головная боль, головокружение, слабость; иногда — сонливость, бессонница.
Со стороны мочевыделительной системы: иногда — полиурия.
Со стороны опорно-двигательного аппарата и соединительной ткани: часто — боль в суставах, обострение подагры.
Противопоказания к применению
- мочекаменная болезнь;
- подагра;
- аритмии;
- хроническая почечная недостаточность;
- детский возраст до 3 лет (масса тела до 15-20 кг);
- повышенная чувствительность к компонентам препарата.
Применение при беременности и кормлении грудью
Безопасность применения Изопринозина при беременности и в период лактации не установлена, поэтому применение препарата не рекомендуется.
Применение при нарушениях функции печени
После 4 недель применения целесообразно каждый месяц проводить контроль функции печени (активность трансаминаз).
Применение при нарушениях функции почек
Противопоказан при хронической почечной недостаточности, мочекаменной болезни.
После 4 недель применения целесообразно каждый месяц проводить контроль функции почек (уровень креатинина, мочевой кислоты).
Применение у детей
Противопоказание: детский возраст до 3 лет (масса тела до 15-20 кг).
Особые указания
После 2 недель применения Изопринозина рекомендуется провести контроль содержания мочевой кислоты в сыворотке крови и в моче.
При длительном приеме после 4 недель применения целесообразно каждый месяц проводить контроль функции печени и почек (активность трансаминаз в плазме крови, уровень креатинина, мочевой кислоты).
Необходимо контролировать уровень мочевой кислоты в сыворотке крови при назначении Изопринозина в сочетании с препаратами, увеличивающими уровень мочевой кислоты или препаратами, нарушающими функцию почек.
Влияние на способность к управлению транспортными средствами и механизмами
Нет специальных противопоказаний.
Передозировка
Случаи передозировки Изопринозина не описаны.
Лекарственное взаимодействие
При одновременном применении иммунодепрессанты могут снижать эффективность Изопринозина.
Ингибиторы ксантиноксидазы и урикозурические средства (в т.ч. диуретики) могут способствовать риску повышения уровня мочевой кислоты в сыворотке крови пациентов, принимающих Изопринозин.
Условия хранения препарата Изопринозин
Препарат следует хранить в недоступном для детей, сухом, защищенном от света месте при температуре не выше 25°C.
Срок годности препарата Изопринозин
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
ТЕВА
(Израиль)

|
|
Тева ООО 115054 Москва, Валовая ул. 35 |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Большую проблему для практического врача представляют собой хронические цервициты и вагиниты. В зарубежной литературе существует особый термин, который объединяет различную патологию, сопровождающуюся основной жалобой – синдром вагинальных выделений. Воспалительные процессы гениталий у женщин представляют собой распространенную патологию, частота которой не имеет тенденции к снижению. Практически при любой вагинальной инфекции в воспалительный процесс вовлекается шейка матки, поэтому под термином «вагинит» нередко подразумевают воспаление влагалища в сочетании с экзоцервицитом и эндоцервицитом, хотя в ряде ситуаций встречаются их локальные поражения. Эндоцервицитом принято считать воспаление слизистой оболочки цервикального канала, экзоцервицитом – наружной порции шейки матки, они нередко являются следствием деформации шейки матки, послеродовых разрывов, вагинита, эндометрита, сальпингоофорита. Симптоматика их даже в острой стадии бывает слабо выраженной.
В динамике воспаления возникают взаимосвязанные нарушения местного иммунитета, кровоснабжения подлежащей стромы и клеточного обновления эпителиального пласта, способствующие рецидивирующему течению процесса, то есть хронизации.
Лечение хронических воспалительных процессов нижних отделов гениталий нередко малоэффективно и требует от врача и пациентки значительных усилий. Трудность этого обусловлена прежде всего тем, что этиология их различна и однозначно выявить причину удается не всегда, при этом роль вирусов может оставаться завуалированной. Хронические цервициты нередко играют важную роль в генезе рака шейки матки, частота которого, по данным Минздрава РФ, составляет 15,2 на 100 тыс. женского населения (2002) и на протяжении последних десятилетий меняется незначительно.
Инициирующую роль в развитии хронических воспалительных процессов шейки матки могут играть разные специфические и неспецифические микробные и вирусное агенты. Первые относятся к инфекциям, передаваемым половым путем (ИППП). В частности, ими могут быть трихомонады, способные вызывать многоочаговые длительные поражения урогенитального тракта как у женщин, так и у мужчин. Актуальной остается гонорея, которая также характеризуется многоочаговостью поражений и часто протекает в виде микстинфекций, но самой распространенной формой поражения у женщин остается гонорейный цервицит.
Бактериальный вагиноз при превалировании анаэробной флоры способен вызывать полиморфные жалобы, чаще всего связанные с постоянными выделениями из влагалища, сопровождающимися неприятным запахом. Почти в половине случаев вагиноза имеются ассоциации с другими возбудителями, при этом у 80% женщин диагностируются воспалительные процессы экзоцервикса [Bhalla P, Kaushika A, 1998]. Грибы рода Candida, которые являются аэробами и обладают тропизмом к тканям, богатым гликогеном, часто сапрофитируют на слизистой оболочке влагалища и шейки матки и вызывают сочетанные поражения вульвы, влагалища и экзоцервикса.
Противоречивы данные о роли микоплазм в развитии хронических процессов половых органов у женщин, однако превалирует мнение о том, что данные возбудители в их различных формах представляют собой этиологический фактор развития хронических воспалительных процессов и осложнений течения беременности и родов [Кира Е.Ф., 1996, Скрипкин Ю.К., 1999]. Значительную долю среди ИППП занимает урогенитальный хламидиоз, вызываемый облигатным внутриклеточным паразитом, который часто ассоциируется с вирусом герпеса, уреаплазмой, грибами и т.д. Хламидиям отводится роль кофактора в развитии предраковых и раковых процессов шейки матки, их нередко определяют при цервицитах и другой доброкачественной патологии шейки матки.
За последние годы отмечено увеличение частоты поражений урогенитального тракта вирусом герпеса, при этом основным резервуаром считают слизистую оболочку шейку матки, поскольку вне клинических проявлений там этот вирус обнаруживают у 15% женщин [Скрипкин Ю.К., Мордовцев В.Н., 1999]. Диагностика и лечение герпесвирусных поражений экзоцервикса трудна, особенно если принять во внимание наличие его атипичных форм [Марченко Л.А., 2000].
В генезе хронических цервицитов важную роль может также играть неспецифическая банальная условно–патогенная флора. По данным В.И. Краснопольского (2001), частота вагинитов, обусловленных бактериальным инфицированием, составляет 40–50%, кандидозом – 20–25%, трихомониазом –10–15%, у 15–20% – наблюдается смешанная инфекция. Реже ведущим фактором являются золотистый стафилококк, гемолитический стрептококк, встречаются также вагиниты, обусловленные недостатком эстрогенов и коллагеновыми болезнями. В последние годы этиология изменилась: чаще выявляются грамотрицательные аэробы (кишечная палочка, протей, клебсиелла, энтерококки) и неклостридиальные анаэробы (пептококки, бактероиды). Частота вирусных поражений, по данным разных авторов, колеблется в пределах от 7 до 80% ввиду трудностей в диагностике.
Несомненной на сегодняшний день представляется ведущая роль вируса папилломы человека (ВПЧ) в генезе рака шейки матки. ВПЧ также может инициировать и, по–видимому, поддерживать хронические воспалительные процессы нижнего отдела гениталий, поскольку при ВПЧ–индуцированном изменении структуры эпителия создаются предпосылки для манифестации вирусных, бактериальных, протозойных, грибковых и других инфекций. Роль данного вируса в генезе хронических цервицитов продолжает уточняться. Вирусом папилломы является ДНК–содержащий вирус, икосаэдрический по форме, который является строго эпителиотропным, то есть поражает только эпителий кожи и слизистых оболочек гениталий и других органов (гортань, ротовая полость, глаза и др.).
Вирус папилломы способен индуцировать экзофитные кондиломы (бородавки) и субклинические или эндофитные формы, при которых поражение эпителия не сопровождается наружными разрастаниями. Частота последних недооценивается, поскольку они могут маскироваться под личиной других инефкций. По нашим данным, разные формы папилломавирусной инфекции гениталий встречаются у 44,3% пациенток, обращающихся в гинекологическую клинику по различным причинам. По данным биопсий шейки матки субклинические формы инфекции выявляются у 8,1% женщин [Роговская С.И., Прилепская В.Н., Кондриков Н.И., Ежова Л.С., 2003].
Инфицированность папилломавирусом превалирует в группе молодых женщин 15–25 лет, уменьшаясь с возрастом. Вместе с тем отмечено, что у подростков и молодых женщин происходит более быстрые самопроизвольное очищение (элиминация) от ВПЧ и регрессия имеющейся ВПЧ–ассоциированной патологии по сравнению с женщинами более позднего возраста. Подсчитано, что среднее время элиминации ВПЧ у подростков составляет 8 месяцев (CDC, 1999), по нашим наблюдениям за женщинами 18–25 лет – 1,5–2 года у более половины пациенток. Этот процесс во многом зависит от наличия сопутствующих воспалительных процессов и успешности их лечения.
Как известно, в основе патогенеза любого воспаления, как сосудисто–тканевой (мезенхимальной) защитно–приспособительной реакции организма, лежат несколько основных стадий:
– альтерация ткани с последующим выделением медиаторов;
– сосудистая реакция с последующей экссудацией, нарушением микроциркуляции, миграцией лейкоцитов, выработкой иммунных клеток, простагландинов, ферментов, различных ионов, кининов, изменения Рh тканей;
– пролиферация – репаративная стадия.
Нарушения в структуре соединительной ткани при хроническом вагините неизбежно ведут к появлению дистрофических изменений в клетках многослойного плоского эпителия с последующей вакуолизацией ядер и цитоплазмы и изменению ферментативных процессов, уменьшению и даже полному временному исчезновению гликогена в тканях. При хроническом процессе в большой мере поражается строма: происходит инфильтрация ее клетками, сосуды полнокровны и расширены.
При распространении процесса на подлежащие шеечные железы содержимое их становится гноевидным, на поверхности перерастянутых желез можно наблюдать выраженную сеть варикознорасширеннных сосудов. Пролиферация фиброзной ткани приводит к тому, что шейка при хроническом цервиците нередко выглядит гипертрофированной. Ввиду инфильтрации и утолщения соединительнотканых сосочков на обширных участках слизистой оболочки можно наблюдать мелкие точечные вкрапления и возвышения, продолжавшие существовать длительный период времени, что во многом определяет соответствующую картину при кольпоскопии, которая является одним из ведущих методов диагностики цервицитов.
Репаративный процесс характеризуется регенерацией, которая: по словам Саркисова Д.С. (1987), «в процессе развития во всех своих деталях доведена до совершенства». Однако при воздействии ряда экзо– и эндогенных факторов регенерация может замедляться и извращаться, поэтому полноценного разрешения не происходит, нормальная структура тканей не восстанавливается, остается клеточная инфильтрация, полнокровность капилляров, в результате чего образуются наботовы кисты, капсула которых уплотняется и фиброзируется, вследствие чего создаются значительные затруднения для попадания внутрь антибактериальных средств, что обусловливает неэффективность терапевтических мер.
Поэтому и воспалительные процессы шейки матки и влагалища редко бывают изолированными и часто сочетаются с самыми различными видами патологических процессов (эктопиями, полипами, участками гиперкератоза, дисплазиями и т.д.), что обусловливает наличие порочного круга. Не ликвидировав один процесс, трудно справиться с другим. Этот факт рассматривается как причина того, что деструктивные методы лечения также нередко бывают малоэффективными.
Хронические цервициты нередко беспокоят женщину на протяжении месяцев и даже лет. Клинически они сопровождаются постоянными белями, кратковременным и неполным эффектом противовоспалительной терапии. Такие пациентки нередко обращаются к разным врачам, неоднократно получают антибактериальную терапию, при этом спектр выявляемых возбудителей может изменяться.
Диагностика хронических воспалительных процессов шейки матки сложна. Для этиологической верификации используются бактериоскопический метод (самый доступный и дешевый), микробиологический культуральный метод с подбором антибактериальных средств, серологический, ПЦР. В ряде ситуаций полезной может быть провокация различными методами, аминный тест при вагинозе, ИФА, методы прямой и непрямой флуоресценции, а также кольпоскопия, цитологический метод и другие.
Цитологический метод диагностики позволяет оценить клиническую ситуацию и дифференцировать воспалительный процесс от злокачественного. Цитологическое заключение при цервиците может быть разным в зависимости от интенсивности процесса. При слабовыраженном воспалении картина может не отличаться от таковой при норме, может также содержать клетки, отражающие картину некробиоза: клетки плоского эпителия с дистрофическими изменениями ядер, в т.ч. парабазальных (анизонуклеоз, пикноз, кариорексис), и цитоплазмы (слабая эозинофилия, вакуолизация, цитолиз). Могут определяться гистиоциты, лимфоциты, лейкоциты.
При воспалительном процессе большой давности ячеистые структуры цилиндрического эпителия приобретают расплывчатые контуры, границы клеток становятся нечеткими. Наличие парабазальных клеток с крупными ядрами и ядрышками в мазках и признаки дегенерации цитоплазмы не должны сразу рассматриваться, как неоплазия, поскольку после лечения воспаления клетки с псевдодискариозом исчезают, появляются метапластические клетки. Однако если после противовоспалительной терапии подобные изменения цитологически продолжают определяться, следует производить биопсию из участков с кольпоскопически наиболее выраженной картиной воспаления.
Многочисленными работами показано, что клинические проявления хронического цервицита, сопровождающегося наличием ВПЧ, характеризуются изменениями системного и локального иммунитета, что проявляется, например, снижением выработки фактора некроза опухоли и повышением интерлейкина–10 клетками эпителия, снижением индукции g–интерферона и повышением сывороточного интерферона в периферической крови, а также менее понятными изменениями клеточного иммунитета. Более выраженные изменения наблюдаются при наличии высокоонкогенных типов ВПЧ. Это обусловливает целесообразность выявления последних, обследования системы иммунитета с возможным подбором иммуномодуляторов по чувствительности клеток крови.
Терапия хронических цервицитов должна быть комплексной, поэтапной и принимать во внимание возможность микстинфекции. Но лечение следует назначать только после полноценной постановки диагноза. Деструктивное лечение эндофитных форм папилломавирусной инфекции шейки матки и влагалища нередко бывает малоэффективным и часто сопровождается рецидивами. В связи с этим поиски новых более эффективных средств лечения продолжаются.
Первоочередным методом терапии хронических цервицитов представляется этиотропное лечение, основаннное на данных обследования, стандартные схемы которых изложены во многих отечественных и зарубежных клинических рекомендациях. Безусловно, важное значение имеет коррекия биоценоза влагалища и лечение сопутствующих бактериальных инфекций с учетом данных микробиологических исследований. Различные методики коррекции микробиоценоза также широко публикуются. Среди них применяются бифидумбактерин, хилак, флорадофилюс, ацилакт, солкотриховак и другие. Однако при хронизации воспалительных процессов этих средств оказывается недостаточно. В частности, учитывая нарушение микроциркуляции в тканях, пораженных хроническим воспалительным процессом, предлагаются различные методики физитерапии. Поскольку дисбаланс гормонов приводит к выраженным нарушениям в дифференцировке клеточных пластов и дистрофии эпителия, хороший эффект может дать коррекция гормональных нарушений, на фоне которых процесс хронизируется.
Предлагаются методы комбинированного деструктивного лечения эндофитных папилломавирусных поражений шейки матки с одновременным назначением иммунопрепаратов, снижающих активность вируса и повышающих иммунитет. В настоящее время препаратов, избирательно воздействующих на вирус папилломы человека, не существует. Наиболее часто для лечения ВПЧ–инфекции применяют интерфероны и различные иммуномодуляторы. Однако даже длительная интерферонотерапия зачастую не приводит к излечению. Эффективность лечения напрямую зависит от уровня синтеза онкобелка Е7, который нейтрализует противовирусную активность интерферонов.
На российском аптечном рынке представлено множество препаратов–активаторов иммунитета. Мы имеем опыт использования препарата Изопринозин, противовирусного средства (активное вещество – инозиплекс – inosine pranobex), который подавляет репликацию ДНК и РНК вирусов посредством связывания с рибосомой клетки и изменения ее стереохимического строения. Кроме противовирусного действия, препарат обладает и иммуномодулирующим свойством за счет комплекса инозина, что повышает его доступность для лимфоцитов. Препарат стимулирует неспецифический иммунитет, усиливает продукцию интерлейкинов, повышая синтез антител, стимулирует хемотаксическую и фагоцитарную активность моноцитов, макрофагов и полиморфно–ядерных клеток. Фармакокинетика препарата хорошо изучена. Максимальная концентрация Изопринозина достигается через 1 ч после приема 1500 мг препарата. Первый период полувыведения (50 мин) связан с образованием мочевой кислоты. Второй период полувыведения 3–5 ч, при этом метаболиты выводятся почками. Во время приема Изопринозина не рекомендуется применять иммунодепрессанты и аналогичные препараты, а также лекарственные средства, обладающие нефротоксическим действием.
Показаниями для применения Изопринозина являются вирусные инфекции у пациентов с нормальной и ослабленной иммунной системой, в т.ч. заболевания, вызванные вирусами Herpes simplex типов 1 и 2, Varicella zoster (включая ветряную оспу), вирусами кори, паротита, цитомегаловирусом, вирусом Эпштейна–Барра; вирусный бронхит; острые и хронические вирусные гепатиты B и C; заболевания, вызванные вирусом папилломы человека; подострый склерозирующий панэнцефалит; хронические инфекционные заболевания мочевыводящей и дыхательной систем; профилактика инфекций при стрессовых ситуациях и др. В литературе имеются данные о его успешном применении при лечении остроконечных кондилом, генитального герпеса, папилломавирусной инфекции шейки матки [Забелев А.В. с соавт, 2005], CIN и даже рака шейки матки. Так, Кедрова А.Г. с соавт, (2005) указывают, что на первом этапе лечения больные по поводу CIN и рака шейки матки должны по показаниям подвергаться электрокоагуляции, криодеструкции, лазеровапаризации, электроконизации. На втором этапе должно обязательно проводиться противовирусное лечение, так как персистенция вируса является ключевым фактором для возникновения рецидива заболевания. По их данным, применение противовирусного препарата Изопринозин до операции (1000 мг 3 раза в сутки в течение 10 дней) сопровождается значительным снижением активности вируса HPV 16 и 18 типов, определяемых при ПЦР–диагностике. Указывают, что уже после первого курса лечения тест на вирус отрицателен у 77,8% больных.
Эффективность комбинированного лечения (этиотропный препарат, Изопринозин и аблация) была изучена нами в поликлиническом отделении Центра на группе больных (n=64) с гистологически подтвержденными субклиническими формами ПВИ, CIN I (что трактуется в современной литературе, как плоскоклеточное интраэпителиальное поражение низкой степени – LSIL) на фоне хронического цервицита сочетанной этиологии. Кольпоскопическая картина у всех пациенток представляла собой низкоатипическую зону трансформации и хронический цервицит. У 8 пациенток был диагностирован хламидиоз, у 2 – гонорея, 19 – кандидоз, 37 – бактериальный вагиноз, микоплазмы были выявлены у 37 женщин, вирус герпеса – у 16, условно–патогенная флора в высоких концентрациях выявлялась у 22 женщин. Следует подчеркнуть, что у 100% женщин данные обследования продемонстрировали наличие микстинфекции, то есть сочетания ВПЧ с другими инфекционными агентами. Этиотропная терапия базировалась на европейских рекомендациях по лечению ИППП и не различалась у двух групп пациенток.
Все пациентки были разделены на основную группу, где применялось комбинированное лечение с Изопринозином и этиотропным средством, и контрольную группу, где проводилась только локальная монодеструкция очагов LSIL после курса этиологического лечения. Деструкция проводилась, как правило, сразу после менструации на 5–8–й дни менструального цикла. Изопринозин назначали по 2 таблетки (1000 мг) 3 раза в сутки на протяжении 5 дней за 7–10 дней до деструкции очагов.
Последующее наблюдение за пациентками и полученные нами данные свидетельствуют о том, что эффективность комбинированного лечения с применением Изопринозина была выше и составила 87,5%, в то время как при монодеструкции – 65,6%. Важно, что частота рецидивирования папилломавирусной инфекции к 6–му месяцу наблюдения составила 9,4 и 28,1% соответственно. Симптоматика воспалительного процесса на шейке матки наблюдалась только при рецидиве ВПЧ–инфекции. Кроме того, при комплексной схеме лечения выявили более высокую частоту очищения от ВПЧ через 6 месяцев (65,6 и 46,9% соответственно) и более качественную эпителизацию.
Представляется очевидным, что локальная деструкция очагов субклинического проявления ПВИ на фоне хронического цервицита позволяет воздействовать только на участок эпителия, где произошла клиническая манифестация инфекции. При этом в окружающих тканях остаются резервуары ВПЧ в латентном состоянии или других возбудителей, которые могут являться основой для дальнейшего рецидива цервицита и персистенции инфекции. Адекватная иммунотерапия способствует более полной элиминации возбудителей и полноценной эпителизации шейки матки, что и снижает частоту рецидивов и повышает эффективность терапии такой сложной патологии, как хронический цервицит.
Учитывая высокую стоимость деструктивного лечения шейки матки при LSIL и возможность их спонтанного регресса некоторые зарубежные стандарты ведения пациенток с данной патологией рекомендуют не деструктивное лечение, а наблюдение с регулярным цитологическим контролем. Возможно, в ряде случаев папилломавирусной инфекции это более правильная и менее дорогостоящая тактика. Однако при сочетании хронического цервицита и ВПЧ–инфекции больные, как правило, предъявляют жалобы на постоянные бели и настоятельно требуют помощи.
В связи с этим мы предприняли аналогичную консервативную терапию у 29 женщин с LSIL на фоне хронического цервицита без аблации. Всем пациенткам была рекомендована этиотропная терапия в соответствии с данными обследования в сочетании с Изопринозином по схеме 1000 мг 3 раза в сутки на протяжении 10 дней без аблации. У всех пациенток в анамнезе уже были курсы антибактериальной терапии с кратковременным эффектом не более 3 недель. Мы наблюдали данных женщин в течение 3–х и более месяцев и отметили, что после одного курса лечения Изопринозином бели исчезли у 21 больной (72,4%), а тест на ВПЧ стал отрицательным у 19 из них (65,5%). При этом клинически значимых побочных эффектов мы не наблюдали.
К настоящему времени нами накоплен значительный опыт использования Изопринозина в лечении неспецифических цервицитов и вагинитов, когда при наличии длительных белей при обследовании не представляется возможным выявить какую–либо специфическую патологию, а при посевах обнаруживается обычная условно–патогенная флора типа стафилококков, стрептококков, и т.д. В курс лечения антибиотиками и физиотерапевтическими средствами мы включали Изопринозин по схеме 1000 мг 3 раза в сутки в течение 10 дней. В сравнении с контрольной группой с аналогичной терапией без иммуномодуляторов эффективность излечения и в последующем частота рецидивов была меньше.
Таким образом, по нашему мнению, включение антивирусного иммуномодулирующего препарата Изопринозин в курс лечения больных хроническими цервицитами и вагинитами можно считать обоснованным и перспективным.
Литература
1. Заболевания шейки матки, влагалища и вульвы. Под редакцией проф. В. Н. Прилепской. МЕДпресс, 1999. Москва
2. Новиков АИ, Кононов АВ, Ваганова ИГИППП и экзоцервикс, Москва, Медицина,2002,174стр.
3. Кедрова АГ, Подистов ЮИ с соавт. Гинекология, 2005, т 7, nh/170–174/
4. Костава МН. Лечение заболеваний шейки матки, обусловленных воспалительными процессами нижнего отдела генитального тракта. Гинекология,2000,т 2, N3, стр. 89/
5. Русакевич ПС Заболевания шейки матки. Минск, «Вышэйшая школа»,2000.
6. Фофанова ИЮ. Роль микоплазменной инфекции в акушерстве и гинекологииГинекология,2000,т.3,N3,стр.70–72.
7. Европейские стандарты диагностики и лечения заболеваний, передаваемых половым путем.–М.Медлит.2004–272с.
8. American Cancer Society Guidline for early detection of cervical neoplasia and cancer./ CA Cancer О Clin 2002,52,342–362
9. Guidelines 2002 for treatment of sexually transmitted diseases. CDC.Alanta.USA.– 400 p.
10. Russomano F, Reis A, Camargo M et al. Efficacy in treatment of subclinical cervical HPV infections without CIN. Systemic review. San Paulo Mtd J // Rev Paul Med.–2000.–Vol.118., N 4.–p.109–115.
Опыт применения Изопринозина при заболеваниях шейки матки на фоне папилломавирусной инфекции у подростков и молодых женщин
Статьи
Опубликовано в журнале:
«РУССКИЙ МЕДИЦИНСКИЙ ЖУРНАЛ»; ТОМ 16; № 19; 2008; стр. 1-4.
Л.И. Линаск, Е.Е. Григорьева
ГОУ ВПО «Алтайский государственный медицинский университет»
Комитет по делам здравоохранения администрации, Барнаул,
МУЗ «Детская городская поликлиника № 9», Барнаул
Последние десятилетия характеризуются высоким ростом вирусной инфекции, вследствие чего возрастает частота папилломавирусных поражений шейки матки. Вирус папилломы человека (ВПЧ) инициирует и поддерживает хронические воспалительные процессы нижнего отдела гениталий. Исследования отечественных и зарубежных авторов свидетельствуют о значимости вируса папилломы человека в развитии диспластических процессов шейки матки.
Главной особенностью ВПЧ-инфекции считают ее широкое распространение среди подростков и молодых женщин преимущественно до 25 лет [3]. Низкая сексуальная культура населения, частая смена половых партнеров, незащищенный секс, вредные привычки (курение, токсикомания, алкоголизм) увеличивают риск развития ВПЧ-инфекции, что способствует росту числа воспалительных заболеваний генитального тракта, нарушению репродуктивной функции, невынашиванию беременности и внутриутробного инфицирования плода, а также формированию цервикальной интраэпителиальной неоплазии шейки матки. Вместе с тем отмечено, что у подростков и молодых женщин происходит более быстрое самопроизвольное очищение (элиминация) от ВПЧ и регрессия имеющейся ВПЧ-ассоциированной патологии по сравнению с женщинами более позднего возраста. По результатам исследований, среднее время элиминации ВПЧ у подростков составляет 8 месяцев (CDC, 1999). По наблюдениям С.И. Роговской и В.Н. Прилепской (2006), в возрасте 18-25 лет этот период увеличивается до 1,5-2 лет у каждой второй пациентки. Локальные показатели инфицированности взаимосвязаны с другими генитальными инфекциями: трихомониазом, хламидиозом, микоуреаплазмозом, кандидозом и т.д. [7,8].
Большинство исследователей отмечают значительное разнообразие типов папилломавирусов. Чаще всего обнаруживается вирус 16 типа, следующим по частоте является вирус типа 18. На долю этих вирусов приходится около 50% от общего числа ВПЧ. Вирус папилломы человека может оказывать продуктивное (с образованием кондилом и папиллом) и непродуктивное действие на эпителий. Результатом непродуктивного действия являются внутриэпитеальные поражения, такие как цервикальная интраэпителиальная неоплазия, рак [3,11].
Наиболее уязвимым участком для воздействия вируса является зона трансформации — участок замещения цилиндрического эпителия плоским. Возможно, тропность ВПЧ к клеткам, претерпевающим метаплазию, связана с их повышенной чувствительностью к вирусной инфекции [9,11], поэтому наличие эктопии и других заболеваний на фоне вирусной инфекции является отягощающим обстоятельством для развития рака шейки матки.
Многообразие типов вирусов, возможность вызывать как продуктивное, так и непродуктивное действие на эпителий, формирование различных патологических процессов на шейке матки и наружных половых органах, сочетание вирусов с другими инфекционными агентами требуют дифференцированного подхода к консервативному лечению и избирательной оценке необходимости инвазивных методик.
По результатам исследований Е.Б. Рудаковой (2001), частота псевдоэрозий в структуре гинекологической заболеваемости женщин разных возрастных групп составляет 38,8%. При наличии гинекологических заболеваний этот процент повышается до 49,2, а у подростков и нерожавших женщин до 24 лет составляет от 52,2 до 90%. Наряду с нарушением гормонального баланса, воспалением, травмой, в генезе псевдоэрозий шейки матки существенное значение имеет нарушение местного иммунитета. Авторами доказана роль местного иммунитета в защите от возникновения и прогрессирования рака шейки матки.
По мнению В.А. Головановой и соавт. (1998), высокая частота патологии шейки матки у подростков и юных женщин связана с биологической незрелостью шейки матки, небольшим промежутком времени между менархе и началом половой жизни, ранним половым дебютом, наличием более 5 половых партнеров, что может стать фактором риска развития цервикальной интраэпителиальной неоплазии. Значимыми факторами риска для возникновения папилломавирусной инфекции являются эктопия и бактериальный вагиноз.
Комплексная диагностика ВПЧ-инфекции применительна к патологии шейки матки, хорошо разработана и предполагает использование следующих методов: клинико-визуальный, кольпоскопия, ВПЧ-тест и один из морфологических методов (цитологический -РАР-тест или гистологическое исследование прицельно взятого биоптата шейки матки).
Несмотря на расширение диапазона методов лечения (химио-, крио-, лазеро-, электродеструкция), которые применяются при доброкачественных заболеваниях шейки матки, не существует единых подходов к выбору метода и значимых критериев преимущества одной методики перед другой. Эффективность терапии во многом зависит от выбора метода лечения, использования иммунокорригирующей терапии и целесообразности комбинированного лечения с применением деструктивного воздействия на шейку матки. Большинство исследователей подчеркивают неудачу методов локальной деструкции, отмечают частые рецидивы ВПЧ инфекции на фоне иммунодефицита, обосновывают целесообразность иммунотерапии [2].
В.Н. Прилепская и С.И. Роговская предлагают комбинированное деструктивное лечение папилломавирусных поражений шейки матки проводить на фоне приема иммунопрепаратов, снижающих активность вируса и повышающих иммунитет. Разумная иммунокоррекция повышает эффективность терапии и снижает вероятность рецидива [3,4,7].
Наиболее широкое применение получили интерфероны и их индукторы, иммуномодуляторы. Эти препараты стимулируют неспецифический иммунитет, усиливают продукцию интерлейкинов, повышая синтез антител, стимулируют хемотаксическую и фагоцитарную активность моноцитов, макрофагов и полиморфно-ядерных клеток.
В настоящее время имеется большой выбор препаратов — активаторов иммунитета. Противовирусный препарат Изопринозин (производства «Тева фармацевтические предприятия Лтд.», Израиль), содержит активное вещество — инозин пранобекс, который подавляет репликацию ДНК и РНК вирусов посредством связывания с рибосомой клетки и изменения ее стереохимического строения. Кроме противовирусного действия, препарат обладает и иммуномодулирующим свойством за счет комплекса инозина, что повышает его доступность для лимфоцитов.
Целью настоящего исследования явилось изучение клинической эффективности препарата Изопринозин в монотерапии и комплексном лечении заболеваний шейки матки при ВПЧ-инфекции у подростков и юных женщин.
Материалы и методы
Всего обследовано 74 пациентки с патологией шейки матки на фоне ВПЧ-инфекции в возрасте от 15 до 25 лет (средний возраст 19,4±0,2 лет). Всем пациенткам проведено комплексное обследование, включающее изучение анамнеза, общий и гинекологический осмотр, расширенную кольпоскопию, бактериоскопию вагинальных мазков, окрашенных по Граму, ПЦР-типирование, цитологическое исследование соскобов с шейки матки.
Всем обследованным в монотерапии или при комбинированном лечении назначался Изопринозин.
Возрастная структура обследуемых: подростки в возрасте до 18 лет — 35 (47,3%), молодые женщины 19-25 лет — 38 (51,9%), в основном учащаяся молодежь (студентки ВУЗов и колледжей).
Нами проведена оценка среднего возраста начала половой жизни, количества и частоты смены половых партнеров. Анализ показал, что средний возраст начала половой жизни составил 15,9±0,1 лет. На рисунках 1 и 2 представлены диаграмма полового дебюта и полигамности половых связей. Только каждая третья имела постоянного полового партнера, у каждой четвертой отмечена полигамность половых связей (более 5 партнеров). У 52 (70,3%) менархе отмечено до 14 лет, у 22 (29,7%) после 14 лет, причем у каждой третьей наблюдалось позднее менархе. У большинства женщин — 54 (72,9%) менструальный цикл имел регулярный характер, у каждой пятой месячные были нерегулярные (опсо- или гиперполименореи).
Рис. 1. Возраст сексуального дебюта у девушек-подростков и молодых женщин (n=74)
Рис. 2. Число сексуальных партнеров у девочек-подростков и молодых женщин (n=74)
При изучении соматического анамнеза установлено, что хронический тонзиллит и другие очаги инфекции носоглотки имели место у 21 (28,4%) пациентки, заболевания желудочно-кишечного тракта — у 20 (27%), вегето-сосудистая дистония — у 25 (33,8%). Индекс соматических заболеваний составил 1,2 на 1 пациентку. Изучение анамнеза перенесенных детских инфекций показал, что каждая вторая девочка-подросток и молодая женщина переболела ветряной оспой, каждая третья — коревой краснухой; респираторно-вирусные инфекции были у 38 (51,3%) пациенток. Высокий инфекционный индекс, составляющий более 1,5 на 1 пациентку, свидетельствует о возможных изменениях иммунного статуса.
Особый интерес представляло изучение гинекологического анамнеза, при котором установлено, что воспалительные процессы наружных и внутренних половых органов составили более 85%. Несмотря на молодой возраст обследуемых, у 5 (6,8%) имел место острый эндометрит, у 3 (4,1%) — воспалительный процесс придатков матки и у 56 (75,7%) отмечался вульвовагинит. При всех эпизодах воспалительных заболеваний ранее проводилось лечение.
При гинекологическом осмотре в 100% выявлена патология шейки матки (эрозия, цервициты, лейкоплакии и т.д.). Определение инфекций, передаваемых половым путем, методом ПЦР и бактериоскопии, позволило установить не только различное типирование ВПЧ-инфекции, но и многофакторные причины воспалительных изменений на шейке матки. Моноинфекция имела место лишь у 18 (24,3%), два инфекционных фактора отмечены у 31(41,9%) пациентки, три и более инфекционных агента выявлены у 25 (33,8%) обследуемых. На одну пациентку приходится 2,4 возбудителя.
Как видно из таблицы 1, чаще всего определялся вирус папилломы человека 16,18 типа, который выявлен в 93,2%; ВПЧ 31,33 типа и ВПЧ 6,11 установлены в 14,9 и 17,6% соответственно. Следует отметить, что вирус папилломы человека, как моноинфекция, был только у каждой четвертой, у остальных 75% наиболее частыми сочетаниями являлись уреа — и микоплазменные возбудители. Процент микоплазмоза составил 28,4, а уреаплазмоза — 39,2. Хламидии определены у каждой пятой, трихомонады выявлены у 3 (4%), кандиды — у 11 (14,9%).
Таблица 1.
Основные виды ИППП
| Вид инфекции | Всего (n=74) | |
| абс. | % | |
| Трихомониаз | 3 | 4,1 |
| Микоплазмоз | 21 | 28,4 |
| Уреаплазмоз | 29 | 39,2 |
| Хламидиоз | 14 | 18,9 |
| ВПЧ 16,18 | 69 | 93,2 |
| ВПЧ 31,33 | 11 | 14,9 |
| ВПЧ 6,11 | 13 | 17,6 |
| ВПГ 1,2 | 5 | 6,8 |
| Кандидоз | 11 | 14,9 |
Всем пациенткам до начала лечения и после него проводилась простая и расширенная кольпоскопия. На начальном этапе обследования выявлены разнообразные кольпоскопические картины: эктопия с зоной трансформации, множественными открытыми и закрытыми протоками желез, признаки очагового и диффузного кольпита, зона трансформации с атипичным эпителием в виде лейкоплакии, йоднегативные зоны, мозаика в различных сочетаниях друг с другом. При цитологическом исследовании соскобов с шейки матки I тип цитограммы установлен у 39,2% обследованных, II тип — у 60,8%.
Высокий процент инфицированности, наличие цитограммы воспаления значительно повышают риск развития дисплазий. Учитывая молодой возраст пациенток, гистологическое исследование проводилось лишь по особым показаниям при осложненных формах эктопии, лейкоплакии и цитологически установленной дисплазии. Дисплазия установлена у 6 (8,1%), причем умеренно выраженная дисплазия составила 33,3%, то есть имела место у каждой третьей из шести. Также у каждой третей из всех обследованных имела место лейкоплакия. Проведенные углубленные исследования (кольпоскопическая визуализация и цитологическая диагностика) явились показанием для взятия гистологических исследований у 28 (37,8%) юных и молодых женщин. В подавляющем большинстве определена простая лейкоплакия, прогрессирующий эндоцервикоз.
Несмотря на то, что у всех пациенток выявлена ВПЧ инфекция, специфическая противовирусная терапия Изопринозином назначалась сразу только 18 пациенткам, остальным потребовались антибактериальная и санационная терапии, направленные на элиминацию возбудителей патогенной и условно-патогенной флоры. При верификации инфекции проводилась специфическая терапия основного инфекционного заболевания. При урео- и микоплазмозе, хламидиозе использовались антибактериальные препараты, при кандидозе -противогрибковые, при бактериальном вагинозе — коррекция биоценоза по общим терапевтическим схемам.
После проведения противовоспалительного лечения и контрольной кольпоскопии пациенткам назначался Изопринозин по 1,0 г 3 раза в сутки в течение 10 дней. По основному заболеванию шейки матки 31-й (41,9%) из обследованных женщин потребовалось комбинированное лечение с использованием радиоволновой терапии.
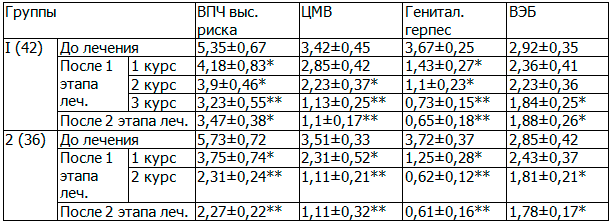
Эффективность монотерапии Изопринозином оценивалась по лабораторным исследованиям ПЦР-диагностики ВПЧ-инфекции через 1,5-2 месяца по окончанию терапии. Полученные результаты свидетельствуют, что полная элиминация вируса составила 95,3%, что подтверждено клинико-лабораторным выздоровлением в 41 случае из 43-х, что свидетельствует о высокой эффективности препарата.
При проведении комбинированной терапии с использованием радиоволновой методики воздействия на шейку матки и иммунокорригирующих препаратов эффективность лечения оценивалась через 2 месяца и полгода. Кольпоскопия показала, что у 30 (96,8%) обследуемых установлена нормальная кольпоскопическая картина, рецидив ВПЧ-инфекции имел место лишь в одном случае.
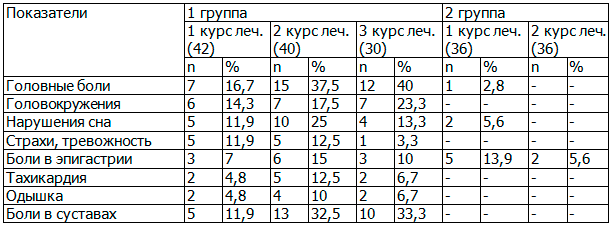
Кроме клинической эффективности, проведена оценка переносимости препарата Изопринозин. Установлено, что у 4 (5,4%) пациенток отмечалось легкое недомогание и тошнота, которые купировались на второй день приема препарата и не потребовали его отмены. Две пациентки жаловались на кратковременную головную боль, возможно, связанную с приемом препарата (рис. 3.). Других побочных проявлений и аллергических реакций не отмечено.
Рис. 3. Характер побочных реакций применения Изопринозина
Таким образом, исследование, проведенное в группе подростков и молодых женщин с заболеваниями шейки матки на фоне папилломавирусной инфекции, и оценка эффективности изопринозина в монотерапии и комбинированном лечении позволяет сделать следующие выводы:
1. Большинство пациенток с папилломавирусной инфекцией имели отягощенный соматический и гинекологический анамнезы.
2. Папилломавирусная инфекция чаще сочетается с уреаплазмозом, микоплазмозом и кандидозом, которые в совокупности составили более 80% всех других возбудителей.
3. Изопринозин является высокоэффективным препаратом для лечения ВПЧ-инфекции при заболеваниях шейки матки у подростков и молодых женщин.
4. Эффективность в монотерапии Изопринозином составляет 95,3%. При использовании Изопринозина в сочетании с радиоволновой терапией эффективность достигает 96,8% при контроле через полгода, несмотря на выраженные первоначальные морфологические изменения шейки матки.
5. Учитывая высокую эффективность препарата, хорошую переносимость и отсутствие побочных явлений, Изопринозин может быть использован при лечении девочек-подростков и юных женщин.
Литература
1. Голованова В.А., Гуркин Ю.А., Новик В.И. // Актуальные вопросы детской и подростковой гинекологии: материалы и тез. докл. Всерос. науч.-практ. конф. — Новосибирск, 1998. — С. 148-150.
2. Минкина Г.Н. Предрак шейки матки /Г.Н. Минкина, И.Б. Манухин, Г.А. Франк. — М., 2001. -С. 69-72.
3. Прилепская В.Н. Генитальные инфекции и патология шейки матки. Клинические лекции / B.Н. Прилепская, Е.Б. Рудакова. — Омск: ИПЦ ОмГМА, 2004. — 212 с.
4. Прилепская В.Н. Заболевания шейки матки, влагалища и вульвы/В.Н. Прилепская. — М.: МЕД пресс-информ, 2005. — 432 с.
5. Прилепская В.Н. Вирус папилломы человека: современный взгляд на проблему / В.Н. Прилепская // Медицинский вестник. — 2007. — № 29 (414). — С. 9-10.
6. Рудакова Е.Б. Псевдоэрозии шейки матки: автореф. дис…. д-ра мед. наук/Е.Б. Рудакова. — Омск, 1996. — 34 с.
7. Роговская С.И. Оптимизация лечения хронических цервицитов с помощью изопринозина / C.И. Роговская, В.Н. Прилепская//Гинекология. — 2006. — Т. 8, № 1. — С. 4-7.
8. Тихонова Л.И. Общий обзор ситуации с инфекциями, передаваемыми половым путем / Л.И. Тихонова// Вестн. дерматологии и венерологии. — 1999. — № 2. — С. 4-7.
9. Auborn K.J. Treatment of human papillomavirus gynecologic infections/K.J. Auborn, T.H. Carter // Clin Lab Med. — 2000. — Vol. 20, N 2. — P 407-422.
10. Guidelines 2002 for treatment of sexually transmitted diseases / CDC Alanta. — USA. — 400 p. Workowski, K.A. Sexually Transmitted Diseases Treatment Guidelines — 2002/K.A. Workowski, W.C. Levine//MMWR Recomm Rep. — 2002.-Vol. 51 (RR-6). — P. 1-78.
11. Nagai Y. Persistence of human papillomavirus infection after therapeutic conization for CIN 3: is it an alarm for disease recurrence?/ Y. Nagai, T. Maehama, T. Asato, K. Kanazawa // Gynecol Oncol. — 2000. — Vol. 79, N 2. — P. 294-299.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Основными проблемами в тактике ведения женщин с заболеваниями шейки матки, ассоциированными с вирусом папилломы человека (ВПЧ), являются несвоевременная и некачественная диагностика, отсутствие четких алгоритмов при принятии решения, а также недостаточная приверженность пациенток к лечению, в основном связанная с полным или частичным невыполнением рекомендаций врача.
По оценкам Центров по контролю заболеваемости (англ. Centers for Disease Control and Prevention, CDC) в США ВПЧ инфицируются до 5,5 млн человек в год [1]. В Европе в год регистрируется 554 000 случаев заболеваний, вызванных этими вирусами, в том числе: цервикальных внутриэпителиальных (интраэпителиалъных) неоплазий (cervical intraepithelial neoplasia — CIN) легкой степени (CIN I), генитальных бородавок, CIN средней и тяжелой степени (CIN II и III), рака шейки матки (РШМ). Несмотря на современные методы диагностики и лечения предраковых заболеваний шейки матки, ежегодно в мире фиксируют 470 тыс. новых случаев РШМ, из которых 233 тыс. заканчиваются смертельным исходом [2]. По данным российских ученых папилломавирусная инфекция (ПВИ) гениталий встречается у 44,3% женщин, обращающихся в гинекологические клиники [3], а заболевания шейки матки, ассоциированные с ВПЧ, встречаются у 50–80% населения и 99,7% случаев подтвержденного РШМ.
Течение ВПЧ-инфекции зависит от состояния иммунной системы и может быть транзиторным, латентным и персистирующим [4–8]. Возможно самоизлечение латентных и начальных субклинических форм ПВИ, для чего важен врожденный компонент иммунной системы. Главное значение имеют клеточные, рецепторные и молекулярные механизмы защиты. Наиболее неблагоприятное течение — персистирующее. При этом ВПЧ «обманывает» иммунную систему макроорганизма, что позволяет ему длительно персистировать ввиду своих эволюционно приобретенных особенностей — репликационный цикл ограничен эпителием, нет виремии и цитолиза, имеется локальная иммуносупрессия за счет вирусных белков [9–11]. Длительная персистенция высокоонкогенных типов ВПЧ более двух лет является наиболее опасным фактором прогрессии предрака шейки матки [12]. При персистенции ВПЧ 16-го типа риск развития CIN составляет 40–50%, 26-го типа — 30–40%, 31-го, 58-го, 82-го типов — по 20–30%, 18-го, 33-го, 35-го, 51-го, 52-го типов — по 10–20% [12]. При обследовании молодых женщин с ПВИ персистенция ВПЧ через 1 год выявлялась у 30%, через 2 года — у 9%, в то время как у женщин старшего возраста — у 50% [13].
В мировой практике используются различные классификации ПВИ и ассоциированных с ней заболеваний. Ориентировочная классификация ПВИ представлена J. Handley и соавт. [14]:
Аногенитальная ВПЧ-инфекция и ассоциированные с ВПЧ заболевания
ВПЧ-инфекция
1. Клинические формы (видимые невооруженным глазом или невидимые, но при наличии соответствующей симптоматики):
- бородавки (остроконечные кондиломы, плоские кондиломы, вульгарные бородавки);
- симптоматические CIN на ранних стадиях — койлоцитоз, дискератоз при отсутствии дисплазии (плоские кондиломы).
2. Субклинические формы (невидимые невооруженным глазом и бессимптомные, выявляемые только при кольпоскопии и/или цитологическом или гистологическом исследовании):
- асимптоматические CIN на ранних стадиях — койлоцитоз, дискератоз при отсутствии дисплазии.
3. Латентные формы (отсутствие морфологических или гистологических изменений при обнаружении ДНК ВПЧ).
Заболевания, ассоциированные с ВПЧ
Клинические и субклинические формы:
- CIN на ранних стадиях — слабо выраженная дисплазия ± койлоцитоз, дискератоз (CIN I);
- CIN на поздних стадиях — выраженная дисплазия ± койлоцитоз, дискератоз (CIN II);
- CIN на поздних стадиях — тяжелая дисплазия или карцинома in situ ± койлоцитоз, дискератоз (CIN III или CIS);
- микроинвазивная плоскоклеточная карцинома.
Кроме этого, в литературе при описании поражений шейки матки, ассоциированных с ВПЧ, применяют классификацию по Папаниколау — в зависимости от степени изменений в мазках выделяют 5 классов. ВОЗ рекомендует использовать терминологическую систему Бетесда (The Bethesda System — TBS) — норма, ASCUS (Atypical squamous cells of undertermined significance (атипичные клетки плоского эпителия неясного значения)), LSIL (Low grade squamous intraepithelial lesion (интраэпителиальное плоскоклеточное поражение низкой степени тяжести)), HSIL (High grade squamous intraepithelial lesion (интраэпителиальное плоскоклеточное поражение высокой степени тяжести)), карцинома. Однако TBS не исключает использование терминов CIN и «дисплазия».
Согласно существующим принципам по ведению больных с клиническими проявлениями, связанными с ВПЧ, лечение аногенитальных ВПЧ-поражений направлено на разрушение тем или иным методом папилломатозных очагов, возникающих на месте внедрения вируса. Именно такой подход приведен во всех основных рекомендациях по ведению больных с ВПЧ-инфекцией (CDC, Европейских рекомендациях, рекомендациях ВОЗ). Такой подход представлен и в рекомендациях Российского общества дерматовенерологов и косметологов.
Как для лечения клинических проявлений ВПЧ-инфекции, так и ассоциированных с ней заболеваний (в первую очередь это касается CIN II и CIN III), применяют деструктивные методы — хирургические, физические (крио-, электро- или лазеротерапия, радиоволновая хирургия) и химические.
При CIN I тактика может различаться в зависимости от величины поражения шейки матки, наличия другой патологии и возможностей самой пациентки [15]. Также в этом вопросе нет единогласия и ввиду возможности регресса данного заболевания. Общеизвестно, что хирургическое лечение может повлечь за собой до 40% осложнений (шеечное кровотечение, стриктуры цервикального канала, экстравазаты и субэпителиальные гематомы, истмико-цервикальную недостаточность, эндометриоз и др.), поэтому однозначность такого подхода при CIN I у женщин, зачастую еще не реализовавших репродуктивный потенциал, подлежит сомнению [16]. Установили, что прогностическими критериями течения CIN I могут служить анамнестические данные (возраст пациенток, возраст начала половой жизни, интервал между возрастом менархе и возрастом начала половой жизни) и данные клинико-лабораторных методов исследования — уровни вирусной нагрузки ВПЧ 16/18, клинико-кольпоскопического и иммуногистохимического индекса p16ink4a [16].
Одним из главных методов, позволяющих снизить заболеваемость РШМ, являются профилактические осмотры с проведением активного скрининга, направленного на выявление патологии шейки матки.
В ходе профилактического осмотра основными диагностическими методиками являются цитологическое исследование, кольпоскопия и определение ВПЧ.
С введения государственных программ ранней диагностики РШМ накоплен большой опыт по цитологическому скринингу, изложенный во множестве публикаций [17]. Одним из критериев оценки эффективности скрининга является изменение структуры патологии шейки матки за счет увеличения количества ранних предраковых состояний эпителия. Анализ литературы показывает, что при хорошо организованном цитологическом скрининге с широким охватом населения эффективность его очень высока и популяция женщин, прошедших обследование, имеет низкий риск развития РШМ. У них в 5 раз снижена вероятность обнаружения рака и в 10 раз — смертность по сравнению с группой необследованных женщин [18]. При этом вероятность пропуска заболевания на его начальном этапе составляет 1–2%, что связывают с недостаточной чувствительностью цитологических исследований [18]. Неправильный забор материала или недостаточная квалификация врача-цитолога могут приводить к большому количеству ложноотрицательных ответов, требующих дополнительных уточняющих методик. Накопленный опыт в нашей стране показал наилучшие результаты обследований в системах ведомственных лечебных учреждений, где охват прикрепленного контингента женщин достигает 100%, что в результате приводит к отсутствию случаев инвазивного РШМ в течение 2–5 лет [17].
Следующим после цитологического исследования важным диагностическим методом профилактического осмотра женщин является кольпоскопия. Среди задач, поставленных Министерством здравоохранения РФ на ближайшие годы, по внедрению стандартов диагностики и лечения в повседневную клиническую практику кольпоскопическое исследование является обязательным для первичных пациенток женских консультаций с ненормальными цитологическими мазками, женщин с патологией шейки матки и любыми заболеваниями влагалища, вульвы, шейки (код кольпоскопии А03.20.001) [17]. Таким образом, кольпоскопия является одним из ведущих методов обследования женщин, дополняющих цитологическое исследование.
Поскольку основная роль в генезе заболеваний шейки матки принадлежит ВПЧ, то тестирование на этот вирус является также важнейшим инструментом профилактических мероприятий. Особую озабоченность представляют пациентки с длительной персистенцией высокоонкогенных типов ВПЧ в сочетании с ASCUS. Женщинам, инфицированным ВПЧ, особенно типами высокого онкологического риска, требуется более активная диагностическая и терапевтическая тактика, соблюдение курсов терапии, строгий комплаенс.
В ряде исследований предложено использовать вирусную нагрузку в качестве маркера, с помощью которого можно определить клинически значимую концентрацию вируса. На основании проведенных отечественных и зарубежных исследований были определены пороговые значения концентрации ВПЧ в образце: 3 логарифма (или 103) геномов ВПЧ на 100 тыс. клеток человека — порог клинической значимости, 5 логарифмов ВПЧ (или 105) на 100 тыс. клеток — порог прогрессии [19]. Данные о корреляции вирусной нагрузки и тяжести заболевания противоречивые. Так, P. Gravitt [20] доказал, что величина вирусной нагрузки ВПЧ 16-го типа ассоциируется со степенью CIN. В то же время показано, что значения величины вирусной нагрузки в мазках без цитологических изменений и с СIN сильно перекрываются, поэтому не применимы для клинических анализов [21, 22]. Ряд авторов полагают, что вирусная нагрузка может оказаться чувствительным, но неспецифичным маркером [23]. В исследовании C. Constandinou-Williams и соавт. [22] определено прогностическое значение изменения вирусной нагрузки: 10-кратное увеличение ВПЧ с течением времени ассоциируется со значительным увеличением риска развития CIN II. Однако стоит отметить, что это относится к периоду вирусоносительства до обнаружения цитологических изменений в мазках. В исследовании, проведенном в ФГБУ НЦАГиП им. акад. В. И. Кулакова [24], определена вирусная нагрузка при ВПЧ-ассоциированных заболеваниях шейки матки у 137 ВПЧ-позитивных женщин, которые были разделены на 5 групп: 1-я — 40 (21,2%) — ВПЧ-носительство, 2-я — 24 (12,7%) — с субклиническими формами ПВИ, 3-я — 34 (18%) — LSIL, 4-я — 53 (28%) — HSIL, 5-я — 11 (5,8%) — РШМ. Вирусная нагрузка была достоверно выше при РШМ по сравнению со всеми остальными группами (p < 0,01). При ВПЧ-носительстве вирусная нагрузка была достоверно ниже, чем при LSIL (p = 0,021), HSIL (p = 0,001) и РШМ (p = 7,0 × 10-5). Таким образом, величина вирусной нагрузки ассоциируется со степенью тяжести поражения шейки матки, поскольку у женщин с субклиническими формами ПВИ, LSIL, HSIL и РШМ отмечено достоверное повышение вирусной нагрузки.
При активном выявлении заболеваний шейки матки в ходе профилактических осмотров, а также при их ранней диагностике у женщин, самостоятельно обратившихся к гинекологу, чрезвычайно важным является выделение группы пациенток с минимальными субклиническими формами болезни для своевременного лечения и диспансерного наблюдения в женских консультациях [17]. В этой связи важное значение приобретает необходимость длительного контроля и фармакотерапии, направленной на подавление вируса, а также готовность пациентки следовать рекомендованному лечению.
Ранняя диагностика и принципы лечения начальных проявлений CIN остаются одной из дискутабельных проблем в акушерско-гинекологической практике. При небольшом поражении чаще рекомендуют оставить женщину под наблюдением и периодически выполнять обследования — тесты на ВПЧ, кольпоскопию, цитологию. Очень важно при этом диагностировать и лечить воспалительные, дисгормональные и другие заболевания урогенитального тракта. Большую роль в определении тактики ведения больных в этих случаях имеет желание пациентки и ее возможность регулярного посещения врача для проведения обследования и желание следовать рекомендациям врача в выборе медикаментозной терапии. Выжидательная тактика при ПВИ часто связана с тем, что носительство и персистенция свидетельствуют не о предраковом процессе как таковом, а о многократно повышенном риске возникновения последнего, усугубляющегося при дополнительных факторах риска у ряда пациенток [25]. Так, G. Но и соавт. [10] показали, что персистенция ВПЧ более 6 мес встречалась с увеличением возраста женщины и обусловлена типом ВПЧ.
Появление патологических изменений в цитологических мазках возрастает по мере персистенции ВПЧ высокого канцерогенного риска у большинства женщин. Согласно данным литературы после инфицирования ВПЧ CIN II–III развивается уже через 3 года у 27% женщин. При анализе исходов CIN, ассоциированных с ВПЧ, было показано, что при CIN I регрессия наблюдается в 57%, персистенция — в 32%, прогрессия — 11%, а развитие инвазивного рака — только в 1% случаев. При CIN II регрессия наблюдается в 43%, персистенция — в 35%, прогрессия — в 22%, а развитие инвазивного рака — в 5% случаев. В то же время при CIN III малигнизация происходит более чем в 12% случаев, а регрессия — лишь в 32% [26, 27].
В связи с вышесказанным, другим подходом в тактике ведения пациенток с начальными проявлениями CIN может быть назначение противовирусной терапии и контроль со стороны врача за четким выполнением рекомендаций и схем медикаментозной терапии.
Этиопатогенез минимальных изменений эпителия (легкая дисплазия или атипические изменения неясной причины) связан с ВПЧ, который на этой стадии заболевания еще находится в клетке в эписомальном состоянии и не повреждает ее геном. Следовательно, именно на этом этапе развития системный и местный иммунитет будет играть ведущую роль в прогнозе развития болезни. По данным биопсий шейки матки латентные формы инфекции выявляются у 8,1% женщин, а субклинические у 40–60% [25, 28]. Именно поэтому медикаментозная терапия при начальных формах поражения эпителия должна быть направлена на подавление вируса при соблюдении комплаенса, понимании пациенткой необходимости завершения курса для повышения эффективности лечения.
В своем исследовании R. Richard и B. Barron [29] показали, что среднее время для развития карциномы in situ составляет примерно 5 лет для больных со слабой дисплазией, 3 года — с умеренной и 1 год — с выраженной дисплазией. Это позволило предположить, что 66% всех дисплазий будет прогрессировать до карциномы, но достаточно длительное время, которое необходимо использовать для раннего выявления и лечения. В клинической ситуации, несмотря на то, что имеется достаточный период безопасного времени для динамического наблюдения, многие врачи и пациентки после информирования о диагнозе не хотят длительно наблюдаться даже с начальной патологией эпителия. Женщины хотят быть излеченными сразу, что часто предопределяет активную тактику ведения больных, включая деструкцию активной зоны трансформации и иммуно/противовирусную терапию [29–33].
Таким образом, у пациенток с «минимальным» повреждением эпителия шейки матки, например ASCUS, с наличием цитоплазматического эффекта ВПЧ (койлоцитоз при цитологическом исследовании) и положительном ВПЧ-тесте и его высоком титре, может оказаться актуальным применение препарата с двойным противовирусным действием — инозин пранобекс (Изопринозин).
Это один из немногих иммунотропных и противовирусных препаратов, в инструкции по применению которого указана терапия заболеваний, вызванных ВПЧ. Он также входит в Европейскую классификацию методов лечения аногенитальных бородавок [34]. В настоящее время накоплен огромный опыт применения Изопринозина, так как используется он с 1970-х гг. и зарегистрирован в большинстве стран Европы.
Изопринозин — иммуномодулятор, стимулирующий противовирусную защиту организма. Помимо иммунотропного, Изопринозин обладает прямым противовирусным действием, угнетая синтез вирусов путем встраивания инозин-оротовой кислоты в полирибосомы пораженной вирусом клетки и нарушая присоединение адениловой кислоты к вирусной РНК.
Таким образом, обладая противовирусным действием и оказывая влияние на противовирусный иммунитет, Изопринозин прямо и косвенно способен подавлять репликацию ВПЧ и образование вирусных белков. Эти эффекты могут изменять механизм взаимодействия ВПЧ и макроорганизма, препятствуя переходу вируса из транзиторной в персистирующую форму, а также влияя на клиническую манифестацию инфекции.
Одним из показаний применения препарата являются инфекции, вызванные вирусом папилломы человека: остроконечные кондиломы, ПВИ вульвы, вагины и шейки матки (в составе комплексной терапии).
При инфекциях, вызванных ВПЧ, Изопринозин назначают по 3 г/сут (2 таблетки 3 раза в сутки) как дополнение к местной терапии или хирургическому вмешательству в течение 14–28 дней или 5 дней в неделю последовательно в течение 1–2 недель в месяц в течение 3 месяцев. При дисплазии шейки матки, ассоциированной с ВПЧ: по 2 таблетки (1000 мг) 3 раза в сутки в течение 10 дней, далее 2–3 курса с интервалом 10–14 дней.
Улучшение морфологической картины эпителия вульвы показано в исследовании Sun Kuie Tay [32]. Инозин пранобекс назначали по 1 г 3 раза в сутки в течение 6 недель. Положительный эффект был достигнут у 63,5% больных, а в группе, принимавшей плацебо, — у 16,7%.
В другом исследовании при монотерапии Изопринозином по 3 г в сутки у 44 женщин с CIN I (длительность лечения 10 дней) и CIN II (длительность лечения 21 день) установлено, что выраженный клинический эффект наблюдался у 88,6% пациенток — полностью исчезало поражение эпителия экзоцервикса, что подтверждалось кольпоскопически и гистологически [35].
В работе Т. В. Клинышковой и соавт. [36] показана высокая частота регресса CIN I (70%) и прекращения выделения ВПЧ (83,3%) при использовании Изопринозина в режиме монотерапии и комбинированного лечения в сочетании с деструкцией у пациенток с ВПЧ-ассоциированными поражениями шейки матки. Изопринозин назначали по 3 г в сутки двумя 10-дневными курсами — за 1 месяц до деструкции и с 1-го дня деструкции при четком контроле за выполнением курса лечения.
В. Н. Прилепская сообщает о прекращении выделения ВПЧ у 65,6% больных после комбинированной терапии (Изопринозин + деструкция очагов) CIN низкой степени [3]. При использовании только деструкции очагов этот результат был достигнут у 46,9% больных. Изопринозин назначали по 1 г 3 раза в сутки в течение 5 дней за 7–10 дней до проведения деструкции.
Похожие результаты — прекращение выделения ВПЧ у 77% больных — показаны в исследовании И. В. Шевниной (2009 г.) при комбинированной терапии женщин с CIN и аногенитальными бородавками. Изопринозин назначали по 1 г 3 раза в сутки в течение 10 дней, затем по 0,5 грамма 3 раза в сутки в течение 20 дней.
В другом исследовании Изопринозин назначали женщинам с патологией шейки матки, ассоциированной с ВПЧ [37]. Препарат назначали после проведения обследования и противовоспалительной терапии по 3 г в сутки в течение 10 дней. Элиминация ВПЧ достигнута у 95,3% пациенток.
Есть и другие исследования, в которых показано прекращение выделения ВПЧ из очагов поражения у 69,6–97,8% женщин, принимавших Изопринозин [30, 38, 39].
Представленные данные свидетельствуют о возможной эффективности монотерапии Изопринозином при бессимптомном вирусовыделении, когда применение деструктивных методик не показано.
Сравнительная оценка лечения с применением Изопринозина и без него показала преимущество дополнительной лекарственной терапии вне зависимости от степени онкологического риска. Так, в группе женщин с начальными изменениями эпителия самостоятельное улучшение после санации влагалища достигнуто в 64,9% наблюдений, а при применении Изопринозина в 80,4% случаев [17]. У пациенток с изменениями легкой степени тяжести, выявленными при кольпоскопическом или цитологическом исследованиях, даже в случаях отсутствия самостоятельных улучшений более 3 мес Изопринозин был эффективен почти в 85% наблюдений [17].
Результаты исследования, проведенного в ФГБУ НЦАГиП им. акад. В. И. Кулакова [40, 41], показали, что инозин пранобекс подавляет репликацию высокоонкогенных типов ВПЧ и способствует исчезновению койлоцитарной атипии у 94% пациенток с поражением эпителия шейки матки.
При использовании Изопринозина в режиме монотерапии и в комбинации с деструкцией у пациенток с ВПЧ-ассоцированными поражениями низкой степени получена высокая частота регресса CIN I, прекращение выделения ВПЧ, снижение вирусной нагрузки, активация интерферонового ответа в сравнении с традиционными подходами [16]. Через 4 мес у пациенток, принимавших Изопринозин, в 2 раза снизилась частота экспрессии онкобелка Е7 по сравнению с контрольной группой. Кроме этого были отмечены и другие значимые позитивные изменения в отличие от контрольной группы, где имелась лишь тенденция к этому. Выявленные различия позволяют расценивать их как патогенетические предпосылки неполного клинического эффекта и отдаленного рецидивирования заболевания у пациенток контрольной группы. Эффективность лечения в группе пациенток, принимавших Изопринозин, по окончании лечения была в 1,4 раза выше, чем при традиционном лечении.
Заключение
Таким образом, основными профилактическими мероприятиями, направленными на раннее выявление и преодоление прогрессирования ВПЧ-ассоциированной патологии шейки матки, могут быть:
- регулярный цитологический скрининг;
- кольпоскопическое исследование;
- определение ВПЧ и вирусной нагрузки;
- противовирусная терапия Изопринозином при начальных изменениях эпителия шейки матки, направленная на нормализацию цитологической картины и подавление вирусной активности.
Многочисленные исследования, проведенные во многих странах мира, в том числе и в России, показали, что при применении Изопринозина (в комбинации с деструкцией или в виде монотерапии), благодаря его двойному противовирусному и иммуномодулирующему действию, подавляющему репликацию ВПЧ, повышается эффективность терапии заболеваний шейки матки, ассоциированных с ПВИ.
Для достижения этих результатов важным является соблюдение дозировок и продолжительности лечения. Как было указано выше, наиболее опасной с точки зрения прогрессирования дисплазии является персистенция ВПЧ, при которой вирус встраивается в геном эпителиальной клетки. Противовирусное действие при этом должно продолжаться несколько месяцев, чтобы захватить несколько циклов полного обновления эпителия. Именно поэтому для консервативной терапии дисплазий предлагается длительное многокурсовое лечение — два-три 10-дневных курса с интервалом 10–14 дней. Такие курсы, как показали результаты многочисленных исследований, приведенные в данной работе, позволяют достичь высокой эффективности лечения. Чем ниже уровень выполнения пациентками предписаний врача, тем ниже уровень эффективности лечения и выше риск рецидивирования и прогрессирования патологии.
Литература
- Armstrong G. L. et al. // Am J Epidemiol. 2001; 153: 912–992.
- Pierry D., Weiss G., Lack B. et al. Intracellular Human Papillomavirus E6, E7 mRNA quantification predicts CIN 2+ in cervical biopsies Better than Papanicolaou Screening for women regardless of age // Arch Pathol Lab Med. 2012, 136: 956–960.
- Прилепская В. Н., Роговская С. И. Возможности Изопринозина в лечении хронических цервицитов и вагинитов // РМЖ. 2007; 16 (3): 14.
- Аполихина И. А., Кулаков В. И. Папилломавирусная инфекция гениталий: актуальная проблема современной гинекологии и пути ее решения. М., 2006.
- Ашрафян Л. А., Киселев В. И. Опухоли репродуктивных органов (этиология и патогенез). М.: Дмитрейд График Групп, 2008; с. 216.
- Прилепская В. Н. Заболевания шейки матки, влагалища, вульвы. М.: МЕДпресс-информ, 2005.
- Роговская С. И. Папилломавирусная инфекция у женщин и патология шейки матки: в помощь практикующему врачу. 2-е изд. М.: Гэотар-Медиа, 2008.
- Прилепская В. Н., Роговская С. И., Кондриков Н. И., Сухих Г. Т. Папилломавирусная инфекция: диагностика, лечение и профилактика. М.: МЕДпресс-информ, 2007.
- Стерн П. Л., Китченер Г. С. Пер. с англ. Под общ. ред. Г. Т. Сухих, В. Н. Прилепской. Вакцина для профилактики РШМ. М.: МЕДпресс-информ, 2009.
- Ho G., Bierman R., Beardsley L. et al. Natural history of cervicovaginal HPV infections in young women // NEJM. 1998; 338: 423–428.
- Philip J., Creasman W. T. Клиническая онкогинекология. Пер. с англ. Под ред. Е. Г. Новиковой. М.: Рид Элсивер, 2011. Т. 1.
- Wheeler C. M. et al. Human papillomavirus genotypes and the cumulative 2-year risk of cervical precancer // J Infect Dis. 2006: 194: 1291–1299.
- Saslow D. еt al. American Cancer Society Guideline for the Early Detection of Cervical Neoplasia and Cancer // CA Cancer J Clin. 2002; 52: 342–62.
- Handley J. M., Dinsmore W. // J Eur Acad Dermatol Venerol. 1994; 3 (3): 251–265.
- Роговская С. И. Папилломаиврусная инфекция у женщин и патология шейки матки. М.: Гэотар-медиа, 2011, 22 с.
- Клинышкова Т. В. Возможности терапии цервикального предрака, ассоциированного с папилломавирусной инфекцией // Женская консультация. 2012. 3: 13.
- Кедрова А. Г., Леваков С. А., Челнокова Н. Н. с соавт. Роль профилактических осмотров и первичного приема врача в женской консультации в выявлении субклинических и латентных форм папилломавирусной инфекции шейки матки и их мониторинг // Гинекология. 2011. Т. 14 (1): 56–62.
- Gilles C., Manigart Y., Konopnicki D. et al. Management and outcome of cervical intraepithelial neoplasia lesions: a study of matched cases according to HIV status // Gynecol Oncol. 2005; 96 (1): 112–118.
- Куевда Д. А., Шипулина О. Ю., Минкина Г. Н., Пиксасова О. Современные требования к диагностике генитальной папилломавирусной инфекции: количественный подход. Тезисы 2-го Всероссийского конгресса дерматовенерологов. СПб, 2007.
- Gravitt P. E., Kovacic M. B., Herrero R. et al. High load for most high risk human papillomavirus genotypes is associated with prevalent cervical cancer precursors but only HPV16 load predicts the development of incident disease // Int J Cancer. 2007; 121: 2787–2793.
- Boulet G. A., Horvath C. A., Berghmans S. et al. Human Papillomavirus in cervical cancer screening: important role as biomarker // Cancer Epidemiol Biomarkers Prev. 2008; 17: 810–817.
- Constandinou-Williams C., Stuart I. Collins, Roberts S. et al. Is Human Papillomavirus Viral Load a Clinically Useful. Predictive Marker? A Longitudinal Study // Cancer Epidemiol Biomarkers Prev. 2010; 19: 832–837.
- Hesselink A. T., Berkhof J., Heideman D. A. et al. High-risk human papillomavirus DNA load in a population-based cervical screening cohort in relation to the detection of high-grade cervical intraepithelial neoplasia and cervical cancer // Int J Cancer. 2009; 124: 381.
- Бестаева Н. В., Назарова Н. М., Прилепская В. Н. с соавт. Папилломавирусная инфекция: новые взгляды на диагностику и лечение (обзор литературы) // Гинекология. Т. 15 (1): 104–107.
- Александрова Ю. Н., Лыщев А. А., Сафронникова Н. Р. и др. Папилломавирусная инфекция у здоровых женщин Санкт-Петербурга // Вопр. онкол. 2000; 46 (2): 175–179.
- Кулаков В. И., Прилепская В. Н., Паавонен Й. Профилактика рака шейки матки. Руководство для врачей. М.: МЕДпресс-информ, 2008.
- Сухих Г. Т., Прилепская В. Н. Профилактика рака шейки матки. Руководство для врачей. 3-е изд. М.: МЕДпресс-информ, 2012.
- Russomano F., Reis A., Camargo M. et al. Efficacy in treatment of subclinical cervical HPV infections without CIN. Systemic review // San Paulo Mtd J Rev Paul Med. 2000; 118 (4): 109–15. К11.
- Richart R. M., Barron B. A. A follow-up study of patients with cervical dysplasya // Amer J Obstet Gynecol. 1969; 105: 386–393.
- Кедрова А. Г., Подистов Ю. И., Кузнецов В. В. и соавт. Роль противовирусной терапии в комплексном лечении больных эпителиальными дисплазиями и преинвазивным раком шейки матки // Гинекология. 2005; 7 (3): 170–174.
- Concalves M. A., Donadi E. A. Immune cellular response to HPV current concepts // Braz J Infect Dis. 2004; 8: 1–9.
- Tay S. K. Efficacy of inosine pranobex oral therapy in subclinical human papillomavirus infection of the vulva: a randomized double blinde placebo-controlled study // Int J STD & AIDS. 1996; 7: 276–280.
- Земсков В. М. Иммуномодулирующие свойства препаратов инозина и их аналогов // Успехи современной биологии. 1989; 107: 69–78.
- Кацамбас А. Д., Лотти Т. М. Европейское руководство по лечению дерматологических болезней. МЕДпресс-информ, 2009; 84–88.
- Потапов В. А., Демченко Т. В., Стрельцова Т. Р. и соавт. Клинико-лабораторная оценка эффективности Изопринозина в лечении папилломавирусной инфекции, ассоциированной с цервикальной интраэпителиальной неоплазией // Репродуктивное здоровье женщины. 2006; 1 (25).
- Клинышкова Т. В., Каратюк Т. И., Турчанинов Д. В. и соавт. Дифференцированный подход к ведению больных с цервикальной интраэпителиальной неоплазией с позиции прогнозирования // Гинекология. 2009; 13 (4): 40–44.
- Линаск Л. И., Григорьева Е. Е. Опыт применения Изопринозина при заболеваниях шейки матки на фоне папилломавирусной инфекции у подростков и молодых женщин // Русский медицинский журнал. 2008; 16 (19): 1–4.
- Долгушина В. Ф., Ахматова А. Н., Беренда М. А. Эффективность изопринозина в лечении хронического цервицита, ассоциированного с папилломавирусной инфекцией // Фарматека. 2009; 14: 73–76.
- Макаров И. О., Шеманаева Т. В., Шешукова Н. А. Опыт применения изопринозина в лечении патологии шейки матки воспалительной этиологии // Consilium Medicum. 2010; 13 (6): 16–18.
- Костава М. Н., Прилепская В. Н. Возможности терапии папилломавирусной инфекции // Рус. мед. журн. 2009; 17 (1): 9–16.
- Шварц Г. Я., Прилепская В. Н., Мынбаев О. А. Изопринозин в лечении папилломавирусной инфекции в гинекологической практике. М., 2011.
А. М. Соловьев*, кандидат медицинских наук
Д. В. Логвинова**
*ГБОУ ВПО МГМСУ им. А. И. Евдокимова МЗ РФ, Москва
**НПЦДК ДЗМ, Москва
Контактная информация об авторах для переписки: doctorsolovyov@mail.ru
Аналоги Изопринозин
Товары из категории — Лекарства для иммунитета
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 811
Форма выпуска, состав и упаковка
Изопринозин – медикамент, выпускаемый в таблетированной форме. Овальные, объемные пилюли окрашены в белый оттенок, обладают легким аммиачным запахом.
В состав медикамента входят следующие компоненты:
- инозин;
- димепранол ацедобен;
- манит;
- крахмал пшеницы;
- кросповидон;
- стеариновокислый магний.
Лекарственное средство продается в упаковках из картона по 20, 30 и 50 штук. Каждая пилюля упакована в отдельную ячейку блистера. В комплекте идет инструкция. Цена на Изопринозин начинается от 625 рублей за 20 штук. Согласно отзывам, Изопринозин нормально переносится пациентами и дает положительные результаты за короткий промежуток времени.
Аналоги Изопринозина: Гроприносин, Нормомед.
Фармакологическое действие
Изопринозин – синтетическое лекарственное средство, относящееся к классу производных пуринов. Медикамент является иммуномодулятором, укрепляющим иммунную систему и оказывающим пагубное воздействие на штаммы вирусов.
Благодаря действию препарата нормализуется работа лимфоцитов при угнетении иммунитета, увеличивается формирование моноцитов, восстанавливается уровень пиримидиновых нуклеозидов.
Медикамент активно противостоит ряду распространенных вирусных штаммов:
- герпес;
- цитомегаловирусная инфекция;
- РНК-вирус кори;
- Т-лимфотропный вирус человека 3 типа;
- вирус полиомелита;
- вирус гриппа тип А, В;
- эховирусы;
- энцефалит Менго;
- лошадиный энцефалитный вирус.
Медикамент блокирует вирусные штаммы, не позволяя им размножаться в организме. Они погибают под действием компонентов.
Фармакокинетические свойства
После внутреннего приема лекарство быстро из желудка попадает в кровоток. Содержание в крови наибольшее фиксируется спустя час после употребления. Метаболизм происходит в печени.
Время полувыведения остаточных компонентов из организма составляет 3,5 часа. Частицы средства выводятся через почки с мочой. Для полного освобождения организма от лекарства потребуется двое суток.
Показания Изопринозин
Лекарственное средство рекомендовано к применению при:
- гриппоподобных заболеваниях;
- острых респираторно-вирусных инфекциях;
- герпесе любого типа;
- герпетическом воспалении роговицы;
- опоясывающем герпесе;
- ветрянке;
- доброкачественном лимфобластозе, спровоцированном вирусом Эпстайна — Барр;
- цитомегаловирусе;
- кори;
- папилломавирусе человека;
- контагиозный моллюск.
Противопоказания
Медикамент не рекомендуется назначать пациентам при обнаружении ряда заболеваний и нарушений в работе внутренних органов:
- уролитиаз;
- подагрический артрит;
- нарушение сердечного ритма;
- нарушение функций почек;
- индивидуальная непереносимость компонентов.
Кроме этого, лекарство противопоказано детям, возраст которых меньше трех лет или при недостаточной массе тела (до 20 кг).
Дозировка
Лекарственное средство принимается внутрь. Пить таблетки следует после приема пищи. Пить пилюли нужно целиком, запивая достаточным количеством питьевой воды. Нельзя ломать, жевать, растворять, толочь средство перед употреблением.
Средняя дозировка составляет 50 мг на каждый килограмм веса в сутки, разделенные на четыре приема. В среднем, взрослый человек выпивает от шести до восьми штук за день. Детская дозировка рассчитывается иначе: на каждые 5 килограмм веса приходится половина пилюли. Нельзя назначать средство детям, масса тела которых меньше 20 кг.
Если инфекция проникла в организм глубоко и переросла в тяжелую стадию, дозировка может быть увеличена лечащим врачом до 100 мг на килограмм веса взрослого человека. Повышенную дозировку разделяют на шесть приемов. Максимально разрешенная доза для детей составляет 50 мг на килограмм веса в сутки. Взрослым нельзя принимать в день больше 4 грамм.
Курсовой прием длится около двух недель. При легкой степени инфекционного заболевания терапия будет продолжаться около недели. Прием медикамента необходимо продолжать до полного исчезновения симптоматических проявлений болезни. В профилактических целях средство принимают ее пару дней после исчезновения симптомов. Если врач посчитает нужным, он может пересмотреть график приема и увеличить продолжительность курса. Может понадобиться комплексная терапия.
При хронической форме инфекции или рецидивах пациенту назначают сразу несколько курсов. Продолжительность каждого курса составляет от пяти до десяти дней. Между курсовыми приемами делают недельный перерыв.
В качестве профилактической меры средство принимают в течение месяца по одной или две штуки в день.
Если у пациента взрослого или детского возраста обнаружен герпес, медикамент принимают в течение недели до полного исчезновения признаков. Затем терапию продолжают в качестве превентивной меры в течение месяца по одной или две штуки в день.
При папилломавирусе взрослые пациенты принимают шесть пилюль в сутки, разделенные на три приема. Детская дозировка составляет половину таблетки на каждые пять килограмм веса, разделенные на четыре приема. Продолжительность курса варьируется от двух недель до месяца.
При генитальных бородавках в рецидиве взрослые пациенты принимают по шесть штук в день, разделенные на три приема. Детская доза составляет половину пилюли на каждые пять килограмм веса, разделенные на четыре приема. Продолжительность терапии колеблется от двух недель до месяца. Курс необходимо пропить трижды, делая месячный перерыв между приемами. Возможно дополнительно хирургическое вмешательство.
При цервикальной интраэпителиальной неоплазии, вызванной папилломавирусом, необходимо принимать по шесть штук в день, разделенные на три приема. Продолжительность терапии составляет десять дней. Затем делают двухнедельный перерыв, а затем курс повторяют.
Побочные действия
Медикамент может стать причиной проявления побочных реакций организма со стороны работы разных систем жизнедеятельности организма человека:
- желудок и кишечник: рвотные позывы, гастрит, жидкий стул, затрудненная дефекация;
- печень и желчные пути: увеличение активной деятельности печеночных амино-трансфераз, повышение щелочной фосфатазы, увеличение содержания карбамида в сыворотке крови;
- кожные покровы: зуд;
- нервная система: боли в голове, вестибулярные расстройства, вялость, бессилие, нарушения сна;
- мочевая система: увеличенное образование мочи;
- костно-мышечная система: суставные боли, экзацербация подагрического артрита.
Передозировка
Данных о передозировке медикаментом нет.
Лекарственное взаимодействие
Медикамент нельзя принимать одновременно с иммуносупрессивными препаратами, так как это может привести к понижению действенности Изопринозина.
При одновременно применении с ингибиторами ксантиноксидоредуктазы или мочегонными средствами повышается вероятность увеличения мочевой кислоты в кровотоке.
Особые указания
При продолжительном использовании медикамента необходимо следить за показателями работы печени и почек.
После четырнадцатидневного употребления нужно проверить уровень мочевой кислоты в кровотоке и урине.
Если одновременно в терапии используются другие средства, об их использовании нужно сообщить лечащему врачу во избежание конфликта компонентов, которые могут привести к нарушению в работе печени или почек.
Медикамент не обладает влиянием на психомоторные реакции и внимательность, поэтому в период прохождения терапии ограничений по вопросу управления транспортом или выполнения сложной работы, требующей концентрации внимания, нет.
Изопринозин можно купить в аптеке по рецептурному листу из медицинского учреждения. Изопринозин можно заказать в Москве с доставкой на дом через интернет.
Беременность и лактация
Противовирусный медикамент не следует принимать в период вынашивания ребенка или грудного выкармливания младенца, так как данных о безопасности использования средства в эти периоды нет.
Применение в детском возрасте
Медикамент нельзя назначать детям, возраст которых меньше трех лет, а также детям с весом до 20 кг.
При нарушениях функции почек
Лекарственное средство нельзя назначать пациентам при наличии нарушений в работе почек. После месячного курса необходимо пройти обследование, и проверить показатели работы органа.
При нарушениях функции печени
Нельзя назначать препарат при тяжелых формах заболевания печени. После месячного приема необходимо пройти обследование, и проверить показатели работы органа.
Условия и сроки хранения
Хранить медикамент рекомендуется в изолированном от досягаемости детьми месте при температуре, не превышающей 25 градусов. Срок хранения лекарства – пять лет с даты изготовления.
Отзывы
Согласно отзывам, медикамент хорошо переносится пациентами и дает положительные результаты за короткий промежуток времени.
Цены на Изопринозин в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 811 руб.
Сертификаты и лицензии
Поиск путей решения проблемы широкого распространения ВПЧ (вирус папилломы человека)-инфекции остается важнейшей медико-социальной проблемой современного здравоохранения. Низкая сексуальная культура населения, частая смена половых партнеров, незащищенный секс увеличивают риск развития ВПЧ-инфекции, способствуя росту числа воспалительных заболеваний генитального тракта, нарушению репродуктивной функции, а также формированию цервикальной интраэпителиальной неоплазии шейки матки. Длительное персистирование ВПЧ сопровождается развитием вторичных иммунодефицитных состояний, обусловленных истощением и как следствие – недостаточной работой звеньев иммунной системы. В настоящее время не существует единой этиотропной терапии и практически отсутствует системное лечение пациентов с ВПЧ-ассоциированной инфекцией. В статье представлены данные об основных принципах лечения данной группы заболеваний, следование которым позволяет достигать наилучших результатов; приводятся данные о лекарственном препарате Изопринозин (инозин пранобекс), сочетающем отчетливые иммуномодулирующие свойства с противовирусной активностью.
Поиск путей решения проблемы широкого распространения ВПЧ-инфекции – важнейшая медико-социальная проблема современного здравоохранения. Низкая сексуальная культура населения, частая смена половых партнеров, незащищенный секс увеличивают риск развития ВПЧ-инфекции, способствуя росту числа воспалительных заболеваний генитального тракта, нарушению репродуктивной функции, а также формированию цервикальной интра-эпителиальной неоплазии шейки матки [1, 2].
Ряд штаммов папилломавируса человека высокоонкогенный: в 70% случаев штаммы 16 и 18 ассоциированы с раком шейки матки (РШМ), в 10% – штаммы 31 и 45 [1]. В исследованиях Международного агентства по изучению рака, включивших 3085 случаев инвазивного цервикального рака, ВПЧ-16 был выявлен в 54% случаев сквамозноклеточных карцином и в 42% – аденокарцином, а ВПЧ-18 – в 11 и 37% случаев соответственно [2–4].
Большинство мужчин и женщин, ведущих половую жизнь, инфицируются ВПЧ, при этом главной особенностью данной инфекции считают ее широкое распространение среди подростков и молодых женщин преимущественно до 25 лет. Более чем у 80% женщин ВПЧ диагностируют уже через 2 года после начала половой жизни, при этом при наличии одного полового партнера вирусом заражаются до 20% [2]. ВПЧ обнаруживают у 99,7% женщин с гистологически подтвержденным диагнозом РШМ. Риск инфицированности одним штаммом ВПЧ не снижает риска инфицированности филогенетически родственным типом вируса [3].
По данным современных исследований, 85% женщин с типичными кондиломами вульвы и промежности имеют дополнительные очаги папилломавирусной инфекции во влагалище или на шейке матки, в 10–25% случаев ассоциированные с цервикальными интраэпителиальными неоплазиями (CIN – Cervical intraepithelial neoplasia) различных степеней тяжести [5].
Зачастую папилломавирусная инфекция выявляется совместно с другими заболеваниями, передающимися половым путем: урогенитальным хламидиозом, микоплазмозом, цитомегаловирусной и герпетической инфекциями, что оказывает заметное влияние на клинические проявления, особенности течения и прогноз.
С ВПЧ ассоциированы такие заболевания урогенитального тракта, как хронический эндоцервицит и вагинит, кондиломы шейки матки и наружных половых органов, CIN, РМШ, внутриэпителиальные неоплазии вульвы (VIN – Vulvar Intraepithelial Neoplasia) и вагины (VaIN – Vaginal intraepithelial neoplasia), простатическая интраэпителиальная неоплазия (PIN – Prostate intraepithelial neoplasia) и анальная интраэпителиальная неоплазия (AIN – Anal intraepithelial neoplasia) [6].
Длительное персистирование ВПЧ сопровождается развитием вторичных иммунодефицитных состояний, обусловленных истощением и как следствие недостаточной работой звеньев иммунной системы. На сегодняшний день установлено, что ВПЧ не инфицируют антигенпредставляющие клетки, и является причиной отсутствия прямого пути активации системы иммунитета при данной патологии. Ранние вирусные белки ВПЧ локализуются преимущественно в ядрах инфицированных клеток, не приводя к формированию полноценного иммунного ответа [2]. В то же время ранние белки ВПЧ активно синтезируются и инициируют процессы малигнизации инфицированных эпителиальных клеток. Поздние гены ВПЧ содержат кодоны, которые редко используются млекопитающими, из-за чего синтез капсидных белков вируса протекает медленно и в небольших количествах, тормозя развитие противовирусного иммунитета. Таким образом, в процессе эволюции сложился механизм, с помощью которого вирусная инфекция защищается от системного воздействия иммунитета хозяина.
Активация цитотоксических лимфоцитов выступает ведущим механизмом защиты в организме человека на внедрение ВПЧ-инфекции. Цитотоксическая иммунная реакция при CIN включает четыре этапа: фагоцитоз и презентацию антигенов ВПЧ цервикальными макрофагами, активацию хелперов Th1, активацию цитотоксических Т-лимфоцитов и уничтожение пораженных вирусом клеток. Доказательством актуальности клеточного иммунитета при ВПЧ служит факт сочетания спонтанного регресса, например бородавок с инфильтрацией окружающих их тканей лимфоцитами и макрофагами. Однако при супрессии клеточного звена иммунитета и уменьшении числа клеток Лангерганса происходит активация папилломавирусной инфекции. Длительной персистенции ВПЧ способствует установленная в ряде исследований способность вируса «ускользать» от системного иммунного надзора [6, 7]. Хотя ВПЧ, как уже было отмечено, инфицирует преимущественно базальные клетки, репликация вируса и сборка вирусных частиц происходят в дифференцированных клетках поверхностного слоя эпителиальных клеток. После репликации вирус выходит из клеток, подвергающихся последующему апоптозу, и указанный процесс не сопровождается признаками воспаления. Эффекторные клетки иммунной системы продуцируют ряд цитокинов, в т.ч. интерфероны-α, -β и -γ, которые снижают транскрипцию генов Е6 и Е7 у ВПЧ 16-го, 18-го и 33-го типов в трансформированных вирусами клетках [7].
В настоящее время не существует единой этиотропной терапии и практически отсутствует системное лечение пациентов с ВПЧ-ассоциированной инфекцией. Тем не менее сформулировано несколько принципов лечения данной группы заболеваний, следование которым позволяет достигать наилучших результатов.
Первым принципом лечения ВПЧ-ассоциированных заболеваний является комплексный подход, включающий использование различных методов деструкции гипер- и неопластических образований. Данные методы включают применение цитотоксических препаратов (подофиллин, подофиллотоксин и др.); химическую (трихлор-уксусная кислота, Солкодерм и др.) и физическую деструкцию (криодеструкция, лазеродеструкция, диатермокоагуляция, электрохирургический метод, фотодинамическая терапия).
Доказанное участие иммунных механизмов в развитии ВПЧ-инфекции, проявляющееся вторичным иммунодефицитом, служит обоснованием к использованию в ее терапии иммуномодулирующих лекарственных средств [7]. В связи с этим вторым принципом терапии ВПЧ-ассоциированных заболеваний является включение в план лечения иммунотропных средств разных групп и механизмов действия, позволяющих существенно повышать эффективность терапии, снижать частоту рецидивов и способствовать элиминации/эрадикации вируса. Необходимо отметить, что в числе иммуномодулирующих средств, применяемых для профилактики РШМ, в последние годы используют также и вакцину против ВПЧ.
Современная классификация иммуномодулирующих средств включает иммуномодуляторы микробного происхождения, природные и синтетические иммуномодуляторы, иммуномодуляторы на основе цитокинов. На сегодняшний день единственным иммуномодулирующим средством, рекомендованным европейским руководством по лечению дерматологических болезней, является инозин пранобекс, что указывает не только на особенности механизма его действия, но и на клиническую значимость этого лекарственного препарата [16].
Возможности применения препарата инозин пранобекс
Инозин пранобекс (Изопринозин), лекарственный препарат, сочетающий отчетливые иммуномодулирующие свойства с противовирусной активностью, был разработан компанией «Newport Pharmaceutical».
По химическому строению инозин пранобекс является комплексным синтетическим препаратом, представляющим собой молекулярный комплекс, включающий инозин (гипоксантин-рибозид): пара-ацетиламинобензойная кислота (ацидобен): N,N-диметиламино-2-пропанол (димепранол)=1:3:3 комплекс.
Изопринозин относят к классу иммунофармакологических (иммунотропных) лекарственных препаратов, к группе иммуномодуляторов. Его основное действие – иммуномодулирующее, проявляется в восстановлении сниженной функции важнейших клеток иммунной системы – Т-лимфоцитов и моноцитов периферической крови. Следует отметить, что по физико-химическим свойствам препарат отличается от индивидуальных компонентов, образующих его структуру, что определяет различия в их фармакодинамике и фармакокинетике. Он более растворим, чем инозин, что улучшает его абсорбцию в желудочно-кишечном тракте и обладает заметно более высокой биологической активностью [8].
В клинических исследованиях препарат нормализует дефицит или дисфункцию клеточного иммунитета за счет повышения активности Th1-клеточного типа реакций, которые запускают созревание и дифференцировку Т-лимфоцитов, потенцируют лимфопролиферативные реакции в ответ на действие митогенов или клеток, активированных антигенами [7]. Кроме того, Изопринозин оказывает модулирующее влияние на цитотоксические эффекты Т-лимфоцитов и клеток – природных киллеров (NK-клеток), функции субпопуляций Т8-супрессоров и Т4-хелперов, повышает формирование на их плазматических мембранах поверхностных маркеров иммуноглобулина G и комплемента, нормализует соотношение между субпопуляциями Т-хелперов и Т-супрессоров, что рассматривается как восстановление иммунорегуляторного индекса CD4/CD8. Действие препарата сопровождается повышением продукции цитокинов иммунокомпетентными клетками, в частности, увеличивается образование интерлейкина-1 (ИЛ-1) и ИЛ-2, образование рецепторов к ИЛ-2. Его важными свойствами являются увеличение секреции эндогенного интерферона-γ, а также снижение биосинтеза ИЛ-4. Имеются данные о том, что Изопринозин потенцирует хемотаксис и фагоцитирующую активность нейтрофилов, моноцитов и макрофагальных клеток [9].
Молекулярные механизмы действия Изопринозина, в т.ч. определяющие противовирусные свойства, включают усиление подавленного/сниженного синтеза мРНК в лимфоцитах и осуществление в этих клетках процессов трансляции. Кроме того, Изопринозин в высоких концентрациях способен ингибировать активность цГМФ-фосфодиэстеразы. Указанные механизмы определяют противовирусную активность препарата, которая носит неспецифический характер и установлена в отношении значительного числа вирусов – простого герпеса I и II типов, герпеса Zoster, вируса Эпштейна–Барр, цитомегаловируса и др. [10].
Изопринозин относится к малотоксичным веществам и в этом отношении имеет преимущества перед другими синтетическими иммуномодулирующими средствами с противовирусной активностью. Фармакокинетика Изопринозина определяется строением и свойствами образующих его молекулу компонентов [11].
Препарат не обладает аллергизирующими, мутагенными, канцерогенными и эмбриотоксическими свойствами. Разрешен к применению детям и взрослым [12].
В медицинской практике Изопринозин начал применяться с 1973 г. в США, а с 1978 г. – в странах Европейского Союза. Под различными торговыми названиями препарат зарегистрирован в 73 странах в качестве лекарственного средства для лечения ряда вирусных и иммунодефицитных заболеваний, всего по 22 показаниям.
В Российской Федерации Изопринозин («Тева Фармацевтические предприятия Лтд.») был зарегистрирован в 1997 г.
Клинические исследования продемонстрировали хорошую переносимость Изопринозина. Побочные эффекты при его применении проявляются редко и представлены главным образом головными болями, тяжестью в области желудка, приливами жара. В отдельных случаях зарегистрировано небольшое повышение уровня мочевой кислоты в крови. Побочные эффекты устраняются при прекращении применения препарата [13].
Согласно инструкции по медицинскому применению Изопринозина, утвержденной Минздравсоцразвития РФ, показаниями к его применению в нашей стране является лечение гриппа и других ОРВИ; инфекции, вызванные вирусом герпеса 1-го, 2 и 3-го и 4-го типов: генитальный и лабиальный герпес, герпетический кератит, опоясывающий лишай, ветряная оспа, инфекционный мононуклеоз, вызванный вирусом Эпштейна–Барр; цитомегаловирусная инфекция; корь тяжелого течения; папилломавирусная инфекция: папилломы гортани/голосовых связок (фиброзного типа), папилломавирусная инфекция гениталий у мужчин и женщин, бородавки; контагиозный моллюск. Противопоказания к применению Изопринозина: повышенная чувствительность к компонентам препарата; подагра; мочекаменная болезнь; аритмии, хроническая почечная недостаточность; детский возраст до 3 лет (масса тела до 15–20 кг) [10, 19].
В ряде рандомизированных плацебо-контролируемых клинических исследований установлена высокая эффективность применения Изопринозина в лечении инфекций, вызываемых вирусом простого герпеса. Монотерапия в дозах 3–4 г/сут как короткими курсами (5–10 дней) до исчезновения симптомов заболевания, в бессимптомный период – по 1 таблетке 2 раза в день в течение 30 дней для уменьшения числа рецидивов [19]. Длительный прием на протяжении 6 месяцев в непрерывном режиме ведет к сокращению сроков острого периода, предупреждает повторные обострения в течение 12–24 месяцев [14]. При этом действие Изопринозина достоверно отличается от плацебо и по эффективности сопоставимо с действием противовирусного препарата ацикловир. Также выявлено, что препарат оказывает терапевтическое и профилактическое действия на ряд пациентов с герпетической инфекцией, устойчивой к терапии традиционными противовирусными препаратами [8].
Клинические исследования, посвященные моно- и комбинированной терапии Изопринозином кондилом наружных половых органов у мужчин и женщин (остроконечных, вульвовагинальных и эндоцервикальных кондилом, ассоциированных с ВПЧ), указывают на его 100%-ную эффективность, что связано с воздействием препарата на ВПЧ не только в труднодоступных для хирургического или лазерного воздействия участках локализации кондилом, но и в нервных ганглиях.
В острую фазу Изопринозин назначают по 50 мг/кг массы тела больного (6–8 таблеток в сутки, разделенных на 3–4 приема) в течение 14–28 дней, далее с трехкратным повторением указанного курса с интервалами в 1 месяц [11, 15, 19].
Изопринозин был изучен клинически и при обычных бородавках на руках и лице, плоских бородавках стопы. Установлено, что при использовании препарата в дозе 50 мг/кг/сут в течение от 7 до 60 дней (до очищения кожи от бородавок) его применение сопровождалось уменьшением либо отпадением бородавок указанных типов и очищением кожи. В рамках исследований было установлено также повышение в периферической крови числа Т-хелперов – CD4-лимфоцитов – и повышение соотношения клеток CD4/CD8-хелперов, подавляющих цитотоксические клетки иммунной системы [16].
Проведено клиническое изучение эффективности Изопринозина (50 мг/кг/сут) при папилломах гортани/голосовых связок (фиброзного типа) в комбинации с хирургическим удалением (лазерная хирургия) последних. Установлено, что прием препарата в течение 2 дней до операции и в течение последующих 8 дней сопровождается достоверным уменьшением частоты осложнений лазерной терапии, отсутствием кровотечения при выполнении операции, отсутствием или в незначительной степени выраженным отеком тканей гортани, устранением необходимости трахеотомии и улучшением голоса и речи пациентов после операции, а также снижением частоты рецидивов заболевания. Дополнительными результатами применения Изопринозина в комбинации с оперативным лечением являются упрощение и бóльшая эффективность оперативного удаления папиллом гортани [16]. Имеются данные, свидетельствующие об эффективном применении препарата детьми и взрослыми при лечении передающегося половым и бытовым путями инфекционного заболевания – контагиозного моллюска. Использование Изопринозина в дозе 50 мг/кг/сут в течение 10 дней как в монотерапии, так и в комбинации со стандартными методами наружной терапии приводит к разрешению кожных высыпаний как в острых, так и в хронических случаях заболевания. Эффективность терапии достигает более 75% [17].
Заключение
Таким образом, ВПЧ-ассоцииро-ванные заболевания гениталий являются широко распространенным видом патологии, имеющим большую медико-социальную значимость из-за высокого риска развития неопластических процессов, прежде всего РШМ. Экспериментальные и клинические исследования свидетельствуют о том, что иммунные механизмы играют важную роль в патогенезе ВПЧ-ассоциированных заболеваний и обусловленных ими вторичных иммунодефицитов, что позволило включить иммуномодулирующие лекарственные средства в арсенал терапевтических мероприятий при данных заболеваниях [18]. Результаты многочисленных клинических исследований свидетельствуют о том, что Изопринозин является препаратом, обладающим иммуномодулирующей активностью и неспецифическими противовирусными свойствами, показаниями к применению которого является ряд вирусных и иммунодефицитных заболеваний, в т.ч. ВПЧ-ассоциированных, и в гинекологической практике.
1. Dunne E.F., Unger E.R., Sternberg M., et al. Prevalence of HPV infection among females in the Unated States. JAMA. 2007;297:813–19.
2. Insinga R.P., Dasbach E.J., Elbasha E.H. Epidemiologic natural history and clinical management of human papillonavirus (HPV) disease: a critical and systematic review of the literature in the development of an HPV dynamic transmission model. BMC Infect Dis. 2009;9:119–26.
3. Роговская С.И. Папилломавирусная инфекция у женщин и патология шейки матки. Руководство для практикующего врача. М., 2005. 193 с.
4. Кедрова А.Г., Подистов Ю.И., Кузнецов В.В. и др. Роль противовирусной терапии в комплексном лечении больных эпителиальными дисплазиями и преинвазивным раком шейки матки. Гинекология. 2005;7(3):27–31.
5. Белоусова Т.А., Горячкина М.В. Папилломавирусная инфекция кожи и слизистых оболочек. Фарматека. 2010;1:32–6.
6. Moscicki A.B. HPV vaccines: today and in the future. J. Adolesc. Health. 2008;43(Suppl. 4):26–40.
7. Нестерова И.В. Стратегия и тактика иммунотерапии вторичных иммунодефицитов с инфекционным синдромом. Вестник МЕДСИ. 2009;3:24–32.
8. Прилепская В.Н., Костава М.Н., Назарова Н.М., Фофанова И.Ю. Эффективность применения Изопринозина при лечении вульводинии, обусловленной инфекционно-воспалительными процессами. РМЖ. 2009;17(16):1046–48.
9. Зарубаев В.В., Калинина И.А., Анфимов П.М. и др. Изучение противовирусной активности препарата Изопринозин в отношении респираторных вирусов. Отчет о НИР, НИИ Гриппа РАМН, СПб., 2008.
10. Левин Д.В. Лечение инфекции ВПЧ: настоящее и будущее (обзор зарубежной литературы). Инфекции, передаваемые половым путем. 2004;4:25–9.
11. Прилепская В.Н., Роговская С.И. Возможности Изопринозина в лечении хронических цервицитов и вагинитов. РМЖ. 2007;16(3):5–9.
12. Маркова Т.П. Применение изопринозина для профилактики повторных респираторных инфекций у часто болеющих детей // Фарматека, 2009. № 6. С.46–9.
13. Логинова С.Я., Борисевич С.В., Максимов В.А., Бондарев В.П. Оценка токсичности неспеци-фических противовирусных средств, предназначенных для профилактики и лечения опасных и особо опасных вирусных инфекций. Антибиотики и химиотерапия. 2009;54(3–4):11–4.
14. Georgala S., Katoulis AC., Befon A., et al. Oral inosiplex in the treatment of cervical condylomata acuminata: a randomised placebo-controlled trial. BJOG. 2006;113:10881091.
15. Линаск Л.И., Григорьева Е.Е. Опыт применения Изопринозина при заболеваниях шейки матки на фоне папилломавирусной инфекции у подростков и молодых женщин. РМЖ. 2008;16(19):1–4.
16. Mascaro J.M., Mascaro J.M. Бородавки и кондиломы. Европейское руководство по лечению дерматологических болезней. Пер с англ. / Под ред. А.Д. Кацамбаса, Т.М Лотти М., 2008. 84–8.
17. Долгушина В.Ф., Ахматова А.Н., Беренда М.Л. Эффективность Изопринозина в лечении хронического цервицита, ассоциированного с папилломавирусной инфекцией. Фарматека. 2009;14:51–4.
18. Роговская С.И., Прилепская В.Н. Оптимизация лечения хронических цервицитов с помощью изопринозина. Гинекология. 2006;8(1):4–7.
19. Инструкция по медицинскому применению препарата Изопринозин.
Автор для связи: В.Т. Тютюнник – д.м.н., зав. 1-м акушерским физиологическим отделением ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. академика В.И. Кулакова» Минздрава России, Москва; e-mail: tioutiounnik@mail.ru
Актуальность. Вирусные инфекции гениталий – одна из актуальных проблем современного акушерства и гинекологии. Нередко именно наличие вирусных инфекций обуславливают развитие многих патологических процессов шейки матки [4,8,12-14]. Так, папилломавирусная инфекция провоцирует формирование йоднегативных очагов, гиперкератозов шейки матки [4,12]. Вирус-индуцированные патологические процессы шейки матки диктуют необходимость коррекции вирусоносительства или остро протекающих вирусных поражений слизистой шейки матки и влагалища, и в то же время не теряет актуальности применение деструктивных методов лечения патологических процессов шейки матки [2,9].
В настоящее время в терапии папилломавирусной инфекции нередко применяют иммуностимулирующий препарат изопринозин. Однако при его длительном применении обращается внимание исследователей на ряд возникающих побочных эффектов, отягощающих состояние больных [6,7,10]. Нередко применяют другие иммуномодуляторы и противовирусные препараты [5,11]. Эти аспекты определяют необходимость поиска других терапевтических подходов к лечению пациенток данной категории.
Цель исследования. Разработать эффективные методы терапии пациенток с выявленной папилломавирусной и другими вирусными инфекциями.
Материалы и методы. Наблюдались 78 пациенток с вирус-индуцированными патологическими процессами шейки матки (ШМ). Больные были разделены в две группы в зависимости от получаемого лечебного комплекса. Лечение проводилось в два этапа. На первом этапе женщины получали противовирусное лечение. Так, в первой группе наблюдения (42 человека) назначался изопринозин курсами по 10 дней в дозировке по 2 таб. 3 раза в день (при массе тела до 80 кг) и по 2 таб. 4 раза в день (при массе тела более 80 кг), перерывы между курсами приема препарата составляли 1 мес. Во второй группе (36 пациенток) назначался изоприназин по 2 таб. 3 раза в день (при массе тела до 80 кг) и по 2 таб. 4 раза в день (при массе тела более 80 кг), курс лечения — 10 дней; всего – 1 курс лечения, в сочетании с приемом препарата лавомакс (тилорон) по 125 мг 2 дня подряд, затем по 125 мг через день, на курс – 20 табл. Количество курсов приема изопринозина и лавомакса определялось нами при обследовании после каждого проведенного курса терапии. Критерием необходимости прекращения или продолжения приема препаратов были показатели полимеразной цепной реакции (ПЦР) и наличие сохраняющейся вирусной инфекции. На втором этапе лечения всем пациенткам проводилось радиоволновое хирургическое воздействие на ШМ.
Всем женщинам оценивались жалобы, проводилось гинекологическое исследование, микроскопия отделяемого из половых органов. Оценивалось состояние вагинального биоценоза по данным ПЦР-диагностики, проводимого для выявления трансмиссивных инфекций (ТСИ). При ПЦР оценивалось наличие хламидиоза, микоплазмоза, уреаплазмоза, вируса папилломы человека (ВПЧ) высокого риска, вируса Эпштейн-Бара (ВЭБ), герпеса, цитомегалловирусную инфекцию (ЦМВ), гарднерелез, трихомониаз, кандидоз до лечения, после каждого курса медикаментозной терапии и после окончания проводимого лечения [1]. До начала курсовой терапии по поводу выявленных при ПЦР-диагностике бактериальных инфекций всем пациенткам было проведено противовоспалительное лечение. Всем женщинам оценивалось состояние ШМ по данным кольпоскопии [3].
Результаты. Возраст женщин составлял в среднем 34,2±6,7 года. Все женщины предъявляли жалобы на выделения из половых путей, которые имели различные оттенки в отношении цветового диапазона – желтоватые, грязно-серые, молочно-белые, прозрачные или беловато-прозрачные. После проведения первого этапа курсового лечения у всех пациенток практически прекратились желтоватые или грязно-серые выделения из половых путей, отмечалось уменьшение слизисто-белых белей, а у части женщин бели подобного характера исчезли после курсового лечения, причем более заметно – во второй группе.
Боли при менструации, определяемые исходно у трети больных в каждой группе наблюдения, после обоих этапов курсового лечения уменьшались незначительно.
У женщин первой группы первый этап медикаментозного лечения был наиболее длительным. В большинстве случаев при приеме изопринозина у женщин наблюдались побочные эффекты: головные боли, боли в правом подреберье и верхних отделах эпигастрия, приступы тахикардии, выраженные боли в суставах и др. Первый курс приема изопринозина сопровождался подобными побочными эффектами только у части больных (табл. 1).
Таблица 1. Симптомы побочного действия курсового применения изопринозина
При приеме второго курса изопринозина патологические проявления усугублялись; две пациентки первой группы даже вынуждены были прервать второй курс приема изопринозина из-за нарастающей симптоматики побочных явлений. 10 пациенток первой группы в связи с плохо купируемыми побочными симптомами отказались от третьего курса приема изопринозина.
Во второй группе наблюдения на фоне приема изопринозина назначался лавомакс. При подобном сочетании препаратов у наблюдаемых нами больных побочные эффекты, характерные для приема изопринозина, отсутствовали полностью, что послужило поводом для рассмотрения вопроса о возможном сокращении курсов приема изопринозина.
Всем пациенткам после курсовой терапии проводилось гинекологическое исследование. Ни у одной женщины после первого медикаментозного этапа лечения не определялись воспалительные изменения тканей вульвы и влагалища. В то же время при осмотре ШМ в зеркалах у всех наблюдаемых пациенток во всех группах наблюдения после первого этапа проводимого лечения продолжали определяться патологические процессы ШМ по типу эрозий или белесоватых очагов по поверхности ШМ. После второго этапа лечения с использованием радиохирургического воздействия ни в одном случае наблюдения не было выявлено визуально определяемых признаков эрозий или белесоватых очагов по поверхности ШМ.
При оценке данных бактериоскопического исследования мазков влагалищного секрета IV и III степень чистоты влагалищных мазков после первого же этапа лечения не определялась ни у одной пациентки; II степень была у 9 женщин первой группы (21,5%), 7 – второй (16,7%). У остальных женщин уже после окончания первого этапа лечения определялась I степень чистоты влагалищных мазков. Эти же параметры сохранялись и после второго этапа курсовой терапии.
При ПЦР-диагностике до лечения выявлялся ряд бактериальных инфекций и во всех случаях наблюдения — вирусные инфекции. При обнаружении уреаплазмоза (у 46% женщин), гарднерелеза (у 37%), микоплазмоза (у 2,4% человек), хламидиоза (у 4,8%), кандидоза (у 58%) пациенткам до начала противовирусного лечения назначалось необходимое специфическое лечение. Затем назначалась противовирусная терапия.
После получения медикаментозной терапии и предварительного антибактериального лечения при ПЦР-диагностике случаи хламидиоза и микоплазмоза не были обнаружены. Значительно уменьшилась частота встречаемости уреаплазмоза, кандидоза, гарднерелеза.
После каждого курса медикаментозной терапии на первом этапе лечения оценивались данные ПЦР-диагностики в отношении вирусных инфекций. Обращало на себя внимание, что в первой группе наблюдения после приема первого курса изопринозина значительно уменьшилось содержание герпеса, снизились показатели цитомегалловирусной инфекции, ВПЧ высокого риска; почти не менялись значения данных по вирусу Эпштейн-Бара.
После второго курса приема изоприназина наблюдалось заметное снижение показателей при оценке уровня ВПЧ высокого риска и ЦМВ. После приема третьего курса изопринозина исследуемые вирусные инфекции у пациенток не выявлялись.
Во всех случаях наблюдения значительно снизился уровень показателей вирусных инфекций после всего этапа медикаментозной терапии у женщин первой группы.
Во второй группе наблюдения повторное проведение ПЦР-диагностики было выполнено после первого курса приема изопринозина в сочетании с первым курсом лавомакса. При ПЦР у пациенток второй группы были выявлены единичные случаи сохранившихся повышенных значений ВПЧ высокого риска, ЦМВ и ВЭБ; герпес не определялся ни в одном случае наблюдения (табл.2). В связи с этими изменениями, прием лавомакса был продолжен; все пациентки второй группы дополнительно получили еще 10 табл. лавомакса по 1 табл. через день; при этом повторный курс приема изопринозина не назначался.
Таблица 2. Уровни показателей трансмиссивных инфекций при ПЦР-диагностике
Примечания: показатели в сравнении с данными до лечения * — p<0,05; ** — p<0,01; *** — p<0,001.
После окончания второго курса приема лавомакса ПЦР была проведена повторно. При этом исследовании вирусные инфекции у пациенток не выявлялись.
После первого этапа медикаментозной терапии у всех пациенток при простой кольпоскопии продолжали выявляться эктопии, нередко — зоны трансформации ШМ с открытыми и закрытыми железами, у части женщин – с четко контурированными очагами белесоватости; однако воспалительные изменения после применения тех или иных вариантов противовоспалительного лечения у пациенток обеих групп не определялись. При расширенной кольпоскопии во всех случаях наблюдения при оценке данных пробы с уксусной кислотой отмечалась положительная реакция поверхностного эпителия ШМ с сокращением подслизистых сосудов как до, так и после первого этапа курсовой терапии. У всех пациенток после первого этапа лечения продолжала определяться положительная проба Шиллера с выявлением очагов лейкоплакии, мозаики и пунктации с достаточно четкими контурами и непрокрашиеваемыми поверхностями. При наличии зон эктопии очаги цилиндрического эпителия также не прокрашивались раствором Люголя.
После радиохирургического лечения патологические процессы шейки матки при простой и расширенной кольпоскопии не определялись ни сразу после лечения, ни через 12 месяцев наблюдения.
Заключение. Таким образом, исследование состояния больных с вирус-индуцированными патологическими процессами шейки матки позволило сделать ряд интересных выводов. Прежде всего, в результате проведенной работы подтверждена необходимость локального деструктивного воздействия на шейку матки при любых вариантах предшествующего антибактериального и противовирусного лечения. Нами выяснено, что антибактериальная терапия и противовирусное лечение не провоцируют каких-либо ярко-выраженных репаративных процессов при наличии изменений эпителиальных покровов ШМ.
Кроме того, несмотря на высокую эффективность изопринозина в терапии вирусных инфекций, и, в частности, ВПЧ высокого риска, установлен ряд побочных эффектов и осложнений при приеме данного препарата со стороны различных органов и систем. Нами выявлено, что сочетание высокоэффективного иммуномодулятора (изопринозин) с препаратом, обладающим выраженным противовирусным действием (лавомакс) значительно уменьшают вероятность побочных эффектов и осложнений при приеме этих медикаментозных средств, сокращают количество курсов приема изопринозина, уменьшают длительность противовирусного лечения в целом.
Таким образом, сочетанное применение иммуномодулятора изопринозина и противовирусного препарата лавомакс более целесообразно и эффективно, чем использование препарата с иммуностимулирующими и иммуномодулирующими свойствами без выраженного противовирусного действия.