«Икант» (Ycanth, кантаридин) — новый лекарственный препарат, предназначенный для лечения контагиозного моллюска у пациентов в возрасте от 2 лет.
«Икант», разработанный «Веррика фармасьютикалс» (Verrica Pharmaceuticals), дожидается одобрения Управления по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA), которое должно принять решение до конца мая 2022 года.
«Икант» станет первым лекарственным средством против контагиозного моллюска, утвержденным американским регулятором. Сейчас лечение этой кожной инфекции осуществляется в режиме офф-лейбл (вне инструкции).
Со временем «Икант» расширит спектр назначений, подключив лечение бородавок и остроконечных кондилом.
Появление препарата «Икант» могло бы состояться много раньше, но «Веррика» уже дважды столкнулась с отказом FDA. Так, в июле 2020 года регулятор отклонил регистрационную заявку, запросив дополнительную информацию, относящуюся к разделу «Химические свойства, процесс производства и контроль качества» (CMC). В сентябре 2021 года регулятор выявил недостатки на площадке контрактной «Стерлинг», не связанные с производством «Иканта».
Согласно оценкам отраслевых обозревателей, спрос на «Икант» в 2026 году перешагнет отметку в четверть миллиарда долларов.
Контагиозный моллюск — это широко распространенная вирусная инфекции, поражающая кожу и подкожные слои и проявляющаяся обычно в виде единичных или мелкогрупповых безболезненных пупырчатых телесного цвета папул диаметром 3–5 мм.
Контагиозный моллюск обычно встречается в трех группах населения: дети дошкольного и младшего школьного возраста, сексуально активные подростки или молодые взрослые, дети или взрослые с ослабленным иммунитетом (к примеру, больные ВИЧ или недавно прошедшие химиотерапию). Первые заражаются через тесный физический контакт с другими инфицированными детьми или фомитами (зараженными предметами). Вторые — при половом контакте. Третьи — при физическом или половом контакте и характеризуются более многочисленными, диффузными и крупными поражениями.
Пациенты с атопическим дерматитом подвергаются повышенному риску заражения контагиозным моллюском.
Распространенность контагиозного моллюска в мире среди детей оценивается в пределах 5–11%. Контагиозный моллюск является третьей самой частой кожной инфекцией у детей и входит в пятерку ведущих кожных заболеваний в мире. [1] [2]
Контагиозный моллюск вызывается вирусом контагиозного моллюска (Molluscum contagiosum virus, MCV) — двухцепочечным ДНК-поксвирусом, относящимся к роду Molluscipoxvirus семейства Poxviridae. Идентифицировано минимум 4 подтипа MCV, при этом самым распространенным (75–96% случаев) является 1-й подтип (MCV-1), за ним следует 2-й подтип (MCV-2). Последний ассоциирован с иммунодефицитными состояниями и ВИЧ (у больных ВИЧ встречается в 60% случаев). Инкубационный период MCV составляет от 2 недель до 6 месяцев.
Персистирование поражений, оставляемых без лечения, на протяжении многих недель (обычно 6–9 месяцев, но возможно и до 2 лет) предполагает, что вирус контагиозного моллюска уклоняется от иммунного ответа путем экспрессии ряда белков, препятствующим таковому. Так, например, MC159 и MC160 подавляют апоптоз моллюсковых тел путем ингибирования TRAIL и NF-κB; MC54L предотвращает воспаление посредством связывания интерлейкина 18 (IL-18); MC148 препятствует дифференцировке инфицированных кератиноцитов; MC80R вмешивается в процессы презентации MCV-специфических пептидов и цитотоксичности зараженных клеток; глутатионпероксидаза предотвращает опосредованное лейкоцитами окислительное повреждение. [2] [3]
В отличие от герпесвирусов, которые могут оставаться неактивными в организме в течение месяцев или лет, прежде чем появиться вновь, вирус контагиозного моллюска не сохраняется в организме после исчезновения кожных поражений. Иммунитет к вирусу контагиозного моллюска временный, возможны повторные заражения.
У большинства иммунокомпетентных лиц контагиозный моллюск не требует какого-либо лечения, самостоятельно разрешаясь в течение 6–13 месяц. Для предотвращения вирусного распространения следует избегать сексуальных контактов, вовлекающих пораженные области кожи.
Лечение контагиозного моллюска рекомендовано в следующих случаях: для облегчения зуда или иных симптомов, для устранения косметических проблем (включая социальную стигму, связанную с видимыми поражениями кожи, что отрицательно влияет на качество жизни), для сдерживания самозаражения (при расчесывании, бритье), для предотвращения передачи инфекции другим (особенно при поражении половых органов у сексуально активных людей).
Возможные варианты лечения контагиозного моллюска представлены фармакотерапией (топическими и системными препаратами), хирургическими и другими процедурами. [4] [5] [6] [7] [8]
Среди топических лекарственных средств, доказанно эффективных в лечении контагиозного моллюска: кантаридин (cantharidin), подофиллотоксин (podophyllotoxin), имихимод (imiquimod).
Среди хирургических и других способов лечения контагиозного моллюска: кюретаж (прокалывание центра папулы и выскабливание ее содержимого), удаление сердцевины с помощью экстрактора комедонов, криотерапия.
- Способы лечения контагиозного моллюска с ограниченными доказательствами пользы или сопровождающиеся неблагоприятными последствиями следующие: гидроксид калия (potassium hydroxide), салициловая кислота (salicylic acid), экстракт листьев мирта (myrtle leaf extract), бензоилпероксид (benzoyl peroxide), сочетание повидон-йода (povidone iodine) и салициловой кислоты (salicylic acid), третиноин (tretinoin), гликолевая кислота (glycolic acid), нитрат серебра (silver nitrate), цидофовир (cidofovir), циметидин (cimetidine), интерферон альфа (interferon alfa), лазерные процедуры, пилинг трихлоруксусной кислотой (trichloroacetic acid).
В настоящее время в США нет никакого одобренного FDA способа лечения контагиозного моллюска, и «Икант» должен стать первым таковым.
«Икант»: механизм действия кантаридина
Кантаридин (cantharidin) — химический везикант (кожно-нарывное вещество), выделенный из жуков-нарывников, к которым относится хорошо известная шпанская мушка (Lytta vesicatoria).
После того как кантаридин поглощен липидными мембранами эпидермальных клеток его механизм действия включает активацию или высвобождение эпидермальных сериновых протеаз, разрушающих десмосомальные бляшки (клеточные структуры, участвующие в межклеточной адгезии), что приводит к отслоению тонофиламентов (удерживают клетки вместе). Этот процесс отражается потерей клеточных связей (акантолиз), в конечном итоге вызывая внутриэпидермальные волдыри и воспаление, способствующие отслоению инфицированных кератиноцитов и клиренсу вируса. [1]
Кантаридин широко используется в лечении контагиозного моллюска и бородавок с 1950-х годов. Преимущества кантаридина перед другими методами лечения включают быстрое наступление терапевтического эффекта и отсутствие серьезно выраженных болевых ощущений во время применения. После того как в 1962 году Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) начало требовать предоставления данных об эффективности одобренных лекарственных препаратов, а производители кантаридина их не предоставили, он был изъят с рынка. В 1997 году кантаридин был вновь представлен в качестве нерасфасованной фармацевтической субстанции, что позволило врачам применять его в клинической практике. Однако неоднозначность FDA-статуса кантаридина приводит к ряду проблем, в том числе с его доступностью. [2]
Несмотря на повсеместное клиническое применение и зарегистрированную безопасность кантаридина, были необходимы надежные клинические испытания, которые окончательно подтвердили бы эффективность и безопасность кантаридина с последующим одобрением его в качестве лекарственного средства против контагиозного моллюска и бородавок.
«Веррика» это сделала первой, предложив топический препарат «Икант» (Ycanth), известный под кодовым обозначением VP-102, содержащий 450 мкл раствора с 0,7 об. % кантаридина и реализованный одноразовым аппликатором с 1-мм наконечником. В состав «Иканта» входит краситель генцианвиолет (кристаллический фиолетовый), облегчающий идентификацию уже обработанных и еще не обработанных поражений.
«Икант»: эффективность и безопасность кантаридина в лечении контагиозного моллюска
Одинаковые по дизайну опорные клинические исследования CAMP-1 (NCT03377790) и CAMP-2 (NCT03377803) фазы III (рандомизированные, двойные слепые, плацебо-контролируемые, многоцентровые) охватили пациентов (n=528) в возрасте 2 лет и старше с контагиозным моллюском.
Возраст участников в основном укладывался в пределы 2–11 лет, мужчин и женщин было поровну, период от постановки диагноза до начала экспериментального лечения составил в среднем 4,2 месяца, приблизительно треть пациентов ранее проходили лечение контагиозного моллюска, число изначальных поражений составило в среднем 21,5.
Испытуемым назначали плацебо или «Икант», которые наносили на все очаги поражения и оставляли на срок 24 часов. Такую процедуру повторяли до 4 раз с интервалом в 21 день.
К первичной конечной точке эффективности лечения контагиозного моллюска, установленной пропорцией пациентов с полным исчезновением всех поддающихся лечению поражений (изначальных и новых) на 84-й день, вышли 46,3% и 54,0% получавших «Икант» участников CAMP-1 и CAMP-2 — против 17,9% и 13,2% в группах плацебо (p<0,0001).
По окончании лечения число поражений (имевшихся и новых) уменьшилось в среднем на 69% и 83% — против его увеличения на 20% и 19% (p<0,05).
Применение «Иканта» отразилось быстрым наступлением терапевтического эффекта: статистически значимое расхождение с группой плацебо наблюдалось уже после первого курса лечения, продолжая улучшаться при последующем использовании препарата.
При объединении результатов клинических испытаний к первичной конечной точке вышли 50% пациентов, лечившихся кантаридином, — против 15,6%, проходивших терапию плацебо (p<0,0001).
По завершении лечения число поражений (имевшихся и новых) уменьшилось в среднем на 76% — против 0,3% (p<0,0001).
Если рассматривать излечение контагиозного моллюска в контексте локализации поражений, результаты следующие: поражения полностью исчезли на голове/шее у 81,8% получавших «Икант» и у 39,6% получавших плацебо, на спине/ягодицах — у 75,2% против 37,4%, на груди/животе — у 71,1% против 37,3%, в паху — у 85,7% против 52,0%, на верхних конечностях — у 66,5% против 33,6%, на нижних конечностях — у 64,0% против 33,3%.
Профиль безопасности «Иканта» характеризовался приемлемой переносимостью: лечение полностью завершили 93,6% пациентов — против 95,4% в контрольных группах. Среди наиболее распространенных нежелательных явлений, возникших в ходе лечения, были побочные реакции по месту применения: везикулы, зуд, боль, эритема, струпья, депигментация, сухость. Все они носили в основном легко-умеренную степень выраженности.
«Икант»: что дальше
«Веррика» намеревается расширить спектр показаний «Иканта», подключив лечение обыкновенных бородавок, остроконечных кондилом (аногенитальных бородавок) и подошвенных бородавок — распространенных кожных инфекций, вызываемых вирусами папилломы человека (ВПЧ).
Так, клиническое испытание COVE-1 (NCT03487549) фазы II проверило кантаридин в лечении обыкновенных бородавок. Применение препарата привело к полному исчезновению кожных поражений у 51,4% пациентов.
Клиническое испытание CARE-1 (NCT03981822) фазы II оценило кантаридин в задаче лечения остроконечных кандилом. Назначение препарата обеспечило полное исчезновение кожных поражений в среднем у 35,1% пациентов, число остроконечных кондилом сократилось в среднем на 76,9%.
Проведен обзор современных методов лечения инфекции, вызванной контагиозным моллюском. Наиболее подходящий терапевтический подход во многом зависит от клинической ситуации и распространенности контагиозного моллюска. Консервативное лечение с применением различных кремов, мазей, растворов не всегда эффективно и зачастую помогает только при единичных или маленьких вновь появившихся элементах. Ни один из методов наружной терапии не показал достоверных результатов по сравнению с плацебо, но может быть использован как пробный вариант, особенно при категоричном отказе самих пациентов и/или их родителей от механического удаления. К наиболее эффективным методам можно отнести кюретаж, или механическое удаление контагиозного моллюска, который при адекватном местном обезболивании хорошо переносится. Отмечено, что выжидательная тактика не обоснованная, т.к. чаще всего происходит распространение элементов путем аутоакуляции вируса на другие участки кожи за счет травм и трения.
Введение
Контагиозный моллюск – одно из самых распространенных заболеваний кожи и слизистых детей и подростков [1], реже встречающееся у взрослых и протекающее с образованием мелких полушаровидных папул с пупковидным вдавлением в центре. Заболевание обусловлено эпидермотропным вирусом (Molluscum contagiosum virus), который относится к семейству оспенных вирусов (Poxviridae). При исследовании генотипа этого вируса было выявлено четыре типа MCV-1–4, наиболее часто из которых встречается I тип. Последний вызывает 96,6% инфекций. На долю вируса II типа приходятся 3,4% случаев заболеваний, однако не было обнаружено взаимосвязи между типом вируса и морфологией поражения или анатомическим распределением высыпаний [1]. Вирусы III и IV типов встречаются редко и чаще верифицируются у пациентов с иммуннодефицитными состояниями [2].
Контагиозный моллюск редко встречается у детей моложе 1 года, основной же пик заболеваемости приходится на возраст от 2 до 5 лет и связан со случайными прямыми контактами с больными детьми либо передачей инфекции опосредованно через игрушки или предметы обихода. Способ заражения подростков объясняется активностью сексуальных контактов [3, 4]. Мужчины болеют несколько чаще, чем женщины. Распространенность данного заболевания изучена мало, но в последние годы отмечается рост заболеваемости не только в России, но и во многих странах Европы и Америки [5]. При этом выявлено, что у людей с иммуннодефицитными состояниями высыпания более обильные, а заболеваемость гораздо выше. Установлено, что порядка 5–18% всех больных с иммунодефицитом подвержены этому вирусу, а тяжесть инфекции обратно пропорциональна количеству лимфоцитов CD4 [6]. У пациентов с различными хроническими заболеваниями кожи, сопровождающимися сухостью (например, атопический дерматит и экзема), вирус контагиозного моллюска активизируется, иногда вызывая генерализацию процесса [5]. Более развернутая клиническая картина по количеству высыпных элементов, площади пораженной кожи и устойчивости инфекции также отмечается у пациентов, получающих преднизон и метотрексат. Кроме того, описаны случаи активизации вируса в виде диссеминации контагиозного моллюска при лечении экземы, атопического дерматита, витилиго мазью такролимус 1% [7, 8].
Возбудитель передается опосредованным путем через постельное и нательное белье, полотенца, посуду, игрушки, мочалки, при контактных видах спорта, массаже, посещении бассейна, принятии общих ванн, либо прямым контактным способом во время половых контактов взрослых и подростков [1, 9, 10]. Инкубационный период обычно составляет 2–7 недель, но может удлиняться до 6 месяцев. Это связано с тем, что, хотя вирусные частицы первично локализуются в базальном слое, репликация вирусной ДНК и образование новых вирусных частиц не происходят до тех пор, пока не будут задействованы шиповатый и зернистый слои эпидермиса. Вирус контагиозного моллюска не имеет латентного периода и не существует в организме постоянно как вирус герпеса. Для отсутствия формирования стойкого иммунного ответа важно то, что он вырабатывает вирус-специфические белки, которые помогают ему избегать агрессии со стороны иммунной системы. Таким образом, если после излечения у пациента снова появились очаги контагиозного моллюска, значит, он снова вступил в контакт с инфицированным человеком или объектом.
Высыпания можно обнаружить на любом участке кожи, но у детей очаги контагиозного моллюска обычно возникают на груди, руках, туловище, ногах и лице. Множественные элементы также могут развиваться в подмышечных и паховых областях. Крайне редко встречаются единичные элементы на слизистых оболочках губ, век, языка и слизистой рта. У взрослых контагиозный моллюск чаще всего ограничен областями промежности, гениталий, нижней части живота или ягодиц.
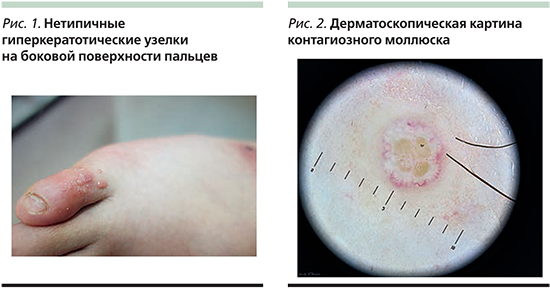
Клинически на неизмененной коже выявляются изолированные полушаровидные с жемчужным блеском узелки величиной от 1–3 до 5–10 мм в диаметре, имеющие цвет нормальной кожи или бледно-розовый, чаще всего располагающиеся группами, но могут встречаться и в виде единичного элемента. В центре некоторых элементов наблюдается пупкообразное вдавление, заполненное роговыми массами. При вскрытии и надавливании из центрального углубления выделяется белесое вещество творожистой консистенции, состоящее из ороговевших клеток эпидермиса и овоидных телец. Как правило, высыпания не беспокоят, но иногда они могут сопровождаться зудом, экзематозной реакцией и за счет травмы начинают появляться новые очаги, что ведет к распространению заболевания. В клинической практике надо также учитывать, что у 10% пациентов с контагиозным моллюском встречаются атипичные высыпания, например, на тыльной или боковой поверхностях стоп и кистей, они чаще всего выглядят как сухие гиперкератотические узелки (рис. 1), а в ряде случаев в нижней трети лица и на шее могут имитировать акнеформные элементы.
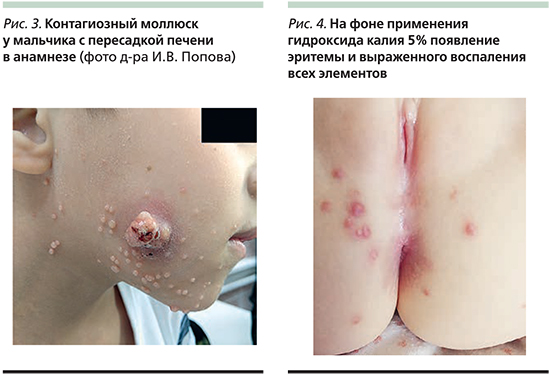
Пока элементы существуют на коже, пациент считается заразным для окружающих. Появление выраженной воспалительной реакции отдельных элементов может говорить о последующей элиминации вируса или же о его травматизации и последующем распространении. Как правило, процесс протекает без осложнений заболевания, но иногда могут быть такие, как присоединение бактериальной инфекции (требует назначения антибактериальных препаратов), рубцевание (чаще встречается при постоянной травматизации ряда элементов или после недостаточно корректного удаления элементов), конъюнктивит или кератит (при наличии элементов на лице в области глаз). В последнем случае пациенты могут ощущать боль, отмечать покраснение и отечность, а также болезненность, слезотечение и светочувствительность глаз. Еще одно редкое осложнение контагиозного моллюска – рожистое воспаление – встречается у пациентов, инфицированных вирусом иммунодефицита человека [11]. Диагноз контагиозного моллюска чаще всего устанавливается при простом осмотре кожных покровов, иногда приходится прибегать к дерматоскопии образований, в ряде случаев проводят микроскопию или даже гистологическое исследование элементов.
При дерматоскопии контагиозного моллюска можно выявить следующие особенности (рис. 2):
- папула с углублением в центральной области, в которой также могут наблюдаться оранжевые или желтоватые роговые массы;
- гомогенные белесовато-розовые глобулы в центральной области (при сильном нажатии белые);
- множественные линейные или извитые сосуды по периферии очага.
Дифференциальный диагноз проводят с бородавками, папилломами, ветряной оспой, эпидермальной кистой, гиперплазией сальной железы, дерматофибромами, бородавчатым красным плоским лишаем, пиогенной гранулемой, в редких случаях – с раком кожи.
Лечение
Терапевтические возможности лечения контагиозного моллюска включают применение различных наружных средств, механические способы, электрокоагуляцию, крио- или лазерное удаление, пероральные лекарственные средства. Но часто одного сеанса терапии не хватает из-за недостаточной активности препаратов, рецидива или появления новых элементов.
Консервативное лечение с применением различных кремов, мазей, растворов (имиквимод, ретиноиды, 5–10%-ные растворы гидроксида калия и др.) не всегда эффективны и зачастую помогают только при единичных или маленьких вновь появившихся элементах. Спонтанное излечение наблюдается чрезвычайно редко (при единичных элементах) и происходит в период до 18 месяцев после появления, описаны единичные случаи саморазрешения элементов в течение 4 лет.
В большинстве случаев родители детей выбирают выжидательную тактику и не лечат контагиозный моллюск, что чаще всего приводит к распространению элементов и заражению других людей, находящихся в окружении. Выжидательная тактика особенно опасна для людей с различными иммуннодефицитными состояниями, т.к. упущенное время может приводить к масштабному распространению процесса с последующей необходимостью применения общего наркоза для удаления элементов [11]. В некоторых случаях специалисты предлагают при лечении совмещать несколько способов, т.к. не всегда представляется возможным очистить кожу от контагиозного моллюска, применяя только один метод лечения [12].
Наиболее подходящий терапевтический подход во многом зависит от клинической ситуации и распространенности контагиозного моллюска. Для здоровых детей основная цель – ограничить дискомфорт, травматизацию и привести к ограничению распространения. Для взрослых, чаще всего готовых к лечению, эффективны криотерапия, электрокоагуляция или кюретаж отдельных элементов, и они их хорошо переносят.
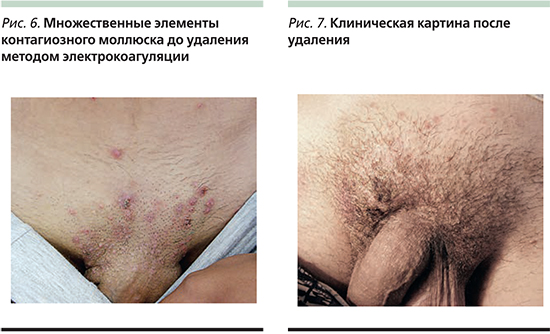
У лиц с ослабленным иммунитетом высыпания при контагиозном моллюске могут быть весьма обширными и трудно поддающимися лечению (рис. 3). Цель может заключаться в лечении самых больших, раздраженных или сливающихся высыпаний. В тяжелых случаях этим пациентам могут потребоваться более агрессивная деструкция лазером, противовирусная терапия или их комбинация [13]. Эффективная антиретровирусная терапия пациентов с синдромом приобретенного иммунодефицита делает терапию контагиозного моллюска намного более эффективной.
Топические препараты, используемые в терапии заболевания, перечислены ниже.
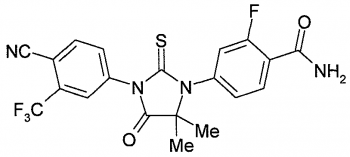
Гидроксид калия (Молютрекс 5%, Молюсдерм 10%) – средство в виде раствора. Применяется местно для лечения контагиозного моллюска, разрушает клетки кожи, инфицированные вирусом, позволяя выработать адекватный иммунный ответ. Раствор наносят 2 раза в день на каждый элемент, добиваясь появления признаков воспаления и разрешения очагов после этого в течение нескольких недель. Обработку прерывают на несколько недель сразу при появлении воспаления (рис. 4, 5). Если при применении в течение 14 дней признаков воспаления нет, стоит делать перерыв и препарат не использовать. К побочным эффектам данных препаратов относят легкое жжение, покраснение, зуд, которые обычно уходят через несколько минут после нанесения лекарства на кожу [14, 15]. В Кокрановской базе данных опубликован обзор результатов исследования, в которых изучалось влияние нескольких наружных, системных и гомеопатических средств [16]. Среди полученных результатов исследователи не обнаружили статистически значимых различий между лечением плацебо и терапией гидроксидом калия или между лечением плацебо и различными гомеопатическими препаратами.
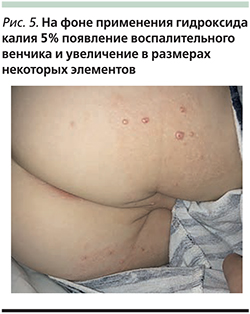
Имиквимод (Алдара, Кераворт, Вартоцид) – это крем, используемый для обработки больших зон или крупных скоплений элементов. Лечебный эффект препарата обусловлен его стимулирующим воздействием на иммунную систему. Крем наносится 3 раза в неделю на ночь, а утром смывается через 6–10 часов. Требуется несколько недель терапии для появления результата. Общие побочные эффекты имиквимода включают шелушение кожи, образование выраженных корок, покраснение и отек, ощущение жжения и зуда, иногда головные боли. Данные осложнения обычно разрешаются в течение 2 недель после прекращения лечения и дополнительной коррекции не требуют. Позднее установлено, что имиквимод не эффективен в виде монотерапии контагиозного моллюска и применяется только в комбинации с другими методами лечения [16–21].
Бензоил пероксид (Базирон АС, Продерм, Десквам, Экларан) – крем или гель. Его наносят тонким слоем на элементы 1 или 2 раза в день после душа или умывания на сухую чистую кожу. Бензоил пероксид может усилить чувствительность к солнечному свету, поэтому следует избегать чрезмерного воздействия солнечного и ультрафиолетового света или использовать солнцезащитный крем. К побочным эффектам бензоил пероксида относят покраснение и сухость, шелушение кожи, жжение и зуд в местах нанесения препарата. Обычно не требуется дополнительных способов лечения, элементы полностью разрешаются самостоятельно после завершения терапии.
Третиноин (Ретин-А, Весаноид, Локацид) доступен в виде жидкости и крема, которые применяются 1 или 2 раза в день на отдельные элементы. Как и в случае с бензоил пероксидом, третиноин может усилить чувствительность кожи к солнечному свету и ультрафиолетовому излучению. Наиболее распространенные побочные эффекты третиноина – это легкое раздражение и жжение кожи. С момента начала лечения до улучшения обычно проходит более 2 недель. В случаях нанесения третиноина на обширные участки кожи он может вызывать выраженную экзематизацию и воспаление окружающей кожи, что, наоборот, может приводить к аутоакуляции (самораспространение).
Кантаридин относится к раздражающим средствам (низкомолекулярный токсин), при нанесении на кожу через 2–5 часов вызывает образование волдырей, пузырьков, и пока они целые, боли не отмечается, после же вскрытия возникают раздражение, жжение, боль. Чаще всего используется в сочетании с имиквимодом.
В ряде исследований показана высокая эффективность такой комбинации. При этом первично назначается нанесение только на несколько элементов, чтобы проверить реакцию пациента на терапию [22, 23]. Кантаридин не одобрен Управлением по контролю за продуктами и лекарствами США, но долгое время американскими дерматологами использовался как безопасный и эффективный препарат [24, 25]. Различные виды кислот (би- и трихлоруксусная, салициловая, молочная, гликолевая) рекомендуют применять только под контролем специалиста, т.к. самостоятельное нанесение нередко приводит к рубцеванию и пигментации (рис. 3), помимо этого во многих исследованиях показано, что эффективны достаточно высокопроцентные растворы кислот – от 15% [26].
Антивирусные препараты для перорального приема (цидофовир, ритонавир). Предположительно противовирусные препараты могут препятствовать репликации вируса контагиозного моллюска. Из-за их дороговизны, длительной схемы лечения и возможных побочных действий их относят к препаратам выбора только для пациентов с ослабленным иммунитетом [27].
В некоторых исследованиях показано, что постепенное удаление контагиозного моллюска возможно путем приема циметидина, говорится о возможности его применения детьми, т.к. он безопасен, безболезнен и хорошо переносится, в то же время данных о его применении при контагиозном моллюске совсем мало, помимо этого препарат предназначен в первую очередь для лечения язвенной болезни желудка и, как предполагается, его действие при инфекции, вызванной контагиозным моллюском, опосредованно за счет влияния на иммунную систему.
В России допустимый возраст применения данного препарата от 14 лет, что делает невозможным его применение в педиатрической практике [28].
Управление по контролю за продуктами и лекарствами США не одобрило ни одного из местных или пероральных средств лечения контагиозного моллюска.
Другие методы лечения всегда должны выполняться квалифицированным специалистом.
Криотерапия включает замораживание очагов жидким азотом для их удаления. Каждый элемент замораживается в течение 5–10 секунд. Некоторые авторы с успехом применяют криодеструкцию для удаления контагиозного моллюска [29]. Обычно требуется несколько сеансов криотерапии, прежде чем все элементы полностью уйдут. А между процедурами рекомендуется делать перерыв не менее 10 дней, чаще – 2–3 недели, поэтому данный метод может увеличить сроки лечения.
Электрокоагуляция (диатермокоагуляция) использует тепло для удаления элементов. Перед удалением применяют местную анестезию в виде аппликаций растворов, кремов или мазей или местных инъекций анестетиками (лидокаин, прокаин или ультракаин). При обширных высыпаниях данный метод, как и любой другой метод деструкции, болезненен даже при применении местного обезболивания (рис. 6, 7).
Механическое удаление проводится острой кюреткой (малой ложкой Фолькмана) или пинцетом с тупыми концами. После выдавливания очаги обрабатывают 5%-ным спиртовым раствором йода. Как и при электрокоагуляции, до удаления используют местную анестезию [30, 31].
Лазерная деструкция – относительно новый тип лечения контагиозного моллюска. Во время и после процедуры может наблюдаться дискомфорт в зоне удаления, жжение, изменение цвета кожи. Обычно эти проявления уходят в течение нескольких недель. Чаще всего одной процедуры оказывается недостаточно [32–36].
Повторное обследование после любого способа терапии рекомендуется проводить через 2–4 недели, и, как правило, требуется повторное лечение. Если элементы плохо поддаются той или иной терапии, рекомендовано рассматривать комбинированную терапию несколькими методами [13]. Рецидивы возникают у 35% пациентов после первого избавления от всех элементов и могут представлять собой реинфекцию, обострение продолжающегося заболевания или новые поражения, возникающие после длительного инкубационного периода.
В результате поисков наиболее действенного лечения контагиозного моллюска в отношении детей проведено проспективное рандомизированное исследование, в котором сравнивались эффективность и побочные эффекты четырех ранее признанных методов лечения контагиозного моллюска у 124 детей [37]. В первой группе применяли кюретаж, во второй – кантаридин, в третей – комбинацию салициловой и молочной кислот, в четвертой – имиквимод. Установлено, что кюретаж – наиболее эффективный метод лечения, имеет самый низкий уровень побочных эффектов, но требует адекватной анестезии. Кантаридин менее эффективен, как правило, хорошо переносится, но имеет умеренные осложнения в виде пузырьковых высыпаний. Комбинация салициловой и молочной кислот вызывает слишком сильное раздражение, поэтому плохо переносится пациентами детского возраста. Имиквимод вообще не показал эффективности в отношении контагиозного моллюска в составе монотерапии и не рекомендован авторами исследования к применению.
Заключение
Исходя из проведенного обзора существующих методов лечения, можно сделать следующие выводы:
- Кюретаж, или механическое удаление контагиозного моллюска, наиболее эффективен для всех возрастных групп пациентов, а при адекватном местном обезболивании хорошо переносится.
- Пациентам с иммунодефицитами рекомендовано применение комбинации методов, чаще это лазерное удаление параллельно с адекватной противовирусной терапией.
- Ни один из методов наружной терапии не показал достоверных результатов по сравнению с плацебо, но может быть использован как пробный вариант, особенно при категоричном отказе самих пациентов и/или их родителей от механического удаления, чтобы не провоцировать появления новых элементов, или же для обработки мелких только появившихся элементов диаметром до 2 мм, пока не имеющих казеозного содержимого.
- Выжидательная тактика не обоснованна, т.к. чаще всего происходит распространение элементов путем аутоакуляции вируса на другие участки кожи за счет травм и трения.
1. Brown J., Janniger C.K., Schwartz R.A., Silverberg N.B.Childhood molluscum ontagiosum. Int J Dermatol. 2006;45(2):93–9. Doi: 10.1111/j.1365-4632.2006.02737.x.
2. Scholz J., Rosen-Wolff A., Bugert J., et al. Epidemiology of molluscum contagiosum using genetic analysis of the viral DNA. J Med Virol. 1989;27(2):87–90.
3. Laxmisha C., Thappa D.M., Jaisankar T.J. Clinical profile of molluscum contagiosum in children versus adults. Dermatol Online J. 2003;9(5):1.
4. Dohil M.A., Lin P., Lee J., et al. The epidemiology of molluscum contagiosum in children. J Am Acad Dermatol. 2006 Jan. 54(1):47–54. Doi: 10.1016/j.jaad.2005.08.035.
5. Berger E.M., Orlow S.J., Patel R.R., Schaffer J.V. Experience with Molluscum Contagiosum and associated Inflammatory Reactions in pediatric dermatology practice: The bump That Rashes. Arch. Dermatol. 2012;148(11):1257–64. Doi: 10.1001/archdermatol.2012.2414.
6. Zichichi L., Maniscalco M., The challenges of neglected STI: Molluscum contagiosum. G. Ital. Dermatol. Venereol. 2012;147(5):447–53.
7. Ahn B.K., Kim B.D., Lee S.J., Lee S.H. Molluscum contagiosum infection during the treatment of vitiligo with tacrolimus ointment. J Am Acad Dermatol. 2005;52(3 Pt 1):532–33.
8. Fery-Blanco C., Pelletier F., Humbert P., Aubin F. Disseminated molluscum contagiosum during topical treatment of atopic dermatitis with tacrolimus: efficacy of cidofovir. Ann Dermatol Venereol. 2007;134 (5 Pt 1):457–59.
9. Choong K.Y., Roberts L.J. Molluscum contagiosum, swimming and bathing: a clinical analysis. Australas J Dermatol. 1999;40(2):89–92,
10. Connell C.O., Oranje A., Van Gysel D., Silverberg N.B. Congenital molluscum contagiosum: report of four cases and review of the literature. Pediatr Dermatol. 2008;25(5):553–56. Doi:10.1111/j.1525-1470.2008.00730.x.
11. Freeman C.L., Moriarty A.T. Molluscum contagiosum presenting as cellulitis in an AIDS patient: cytologic and ultrastructural features. Diagn Cytopathol. 199;12(4):345–49.
12. Rush J., Dinulos J.G. Childhood skin and soft tissue infections: new discoveries and guidelines regarding the management of bacterial soft tissue infections, molluscum contagiosum, and warts. Curr Opin Pediatr. 2016;28(2):250–57. Doi: 10.1097/MOP.0000000000000334.
13. Nguyen H.P., Franz E., Stiegel K.R., et al. Treatment of molluscum contagiosum in adult, pediatric, and immunodeficient populations. J Cutan Med Surg. 2014;18(5):299–306.
14. Romiti R., Ribeiro A.P., Grinblat B.M., et al. Treatment of molluscum contagiosum with potassium hydroxide: a clinical approach in 35 children. Pediatr Dermatol. 1999;16(3):228–31.
15. Romiti R., Ribeiro A.P., Romiti N. Evaluation of the effectiveness of 5% potassium hydroxide for the treatment of molluscum contagiosum. Pediatr Dermatol. 2000;17(6):495.
16. Van der Wouden J.C., van der Sande R., van Suijlekom-Smit L.W., Berger M., Butler C., Koning S. Interventions for cutaneous molluscum contagiosum. Cochrane Database Syst Rev. 2009;7(4):CD004767.
17. Katz K.A., Swetman G.L. Imiquimod, molluscum, and the need for a better “best pharmaceuticals for children” act. Pediatrics. 2013;132(1):1–3. Doi: 10.1542/peds.2013-0116.
18. Katz K.A. Dermatologists, imiquimod, and treatment of molluscum contagiosum in children: righting wrongs. JAMA Dermatol. 2015;151(2):125–26. doi:10.1001/jamadermatol.2014.3335.
19. Katz K.A. Imiquimod is not an effective drug for molluscum contagiosum. Lancet Infect Dis. 2014;14(5):372–73. Doi:10.1016/S1473-3099(14)70728-5
20. Guzman A.K., Schairer D.O., Garelik J.L., Cohen S.R.Safety and efficacy of topical cantharidin for the treatment of pediatric molluscum contagiosum: a prospective, randomized, double-blind, placebo-controlled pilot trial. Int J Dermatol. 2018;57(8):1001–6.
21. Go U., Nishimura-Yagi M., Miyata K., Mitsuishi T. Efficacy of combination therapies of topical 5% imiquimod and liquid nitrogen for penile molluscum contagiosum. J Dermatol. 2018 Apr 18. Doi: 10.1111/1346-8138.14319.
22. Ross G.L, Orchard D.C. Combination topical treatment of molluscum contagiosum with cantharidin and imiquimod 5% in children: a case series of 16 patients. Australas J Dermatol. 2004;45(2):100–2. Doi 10.1111/j.1440-0960.2004.00066.x.
23. Mathes E.F., Frieden I.J. Treatment of molluscum contagiosum with cantharidin: a practical approach. Pediatr Ann. 2010;39(3):124–28, 130. https://doi.org/10.3928/00904481-20100223-03
24. Silverberg N.B., Sidbury R., Mancini A.J. Childhood molluscum contagiosum: experience with cantharidin therapy in 300 patients. J Am Acad Dermatol. 2000;43(3):503–7. Doi: 10.1067/mjd.2000.106370.
25. Cathcart S., Coloe J., Morrell D.S. Parental satisfaction, efficacy, and adverse events in 54 patients treated with cantharidin for molluscum contagiosum infection. Clin Pediatr (Phila). 2009;48(2):161–65. Doi:10.1177/0009922808326085.
26. Potassium hydroxide 5% for the treatment of molluscum contagiosum. Drug Ther Bull. 2014;52(10):118–20. Doi: 10.1136/dtb.2014.10.0285.
27. Hicks C.B., Myers S.A., Giner J. Resolution of intractable molluscum contagiosum in a human immunodeficiency virus infected patient after institution of anti-retroviral therapy with ritonavir. Clin Infect Dis 1997;24:1023–25.
28. Dohil M., Prendiville J.S. Treatment of molluscum contagiosum with oral cimetidine: clinical experience in 13 patients. Pediatr Dermatol. 1996;13:310–12. Doi: 10.1111/j.1525-1470.1996. tb01247.x.
29. Zimmerman E.E., Crawford P. Cutaneous cryosurgery. Am. Fam. Physician. 2012;86(12):1118–24.
30. Martin-Garcia R.F., Garcia M.E., Rosado A. Modified curettage technique for molluscum contagiosum. Pediatr Dermatol. 2007;24(2):192–94.
31. Simonart T, De Maertelaer V. Curettage treatment for molluscum contagiosum: a follow-up survey study. Br J Dermatol. 2008;159(5):1144–47. http://reference.medscape.com/medline/abstract/17461823
32. Binder B., Weger W., Komericki P., Kopera D. Treatment of molluscum contagiosum with a pulsed dye laser: Pilot study with 19 children. J Dtsch Dermatol Ges. 2008;6(2):121–25.
33. Chatproedprai S., Suwannakarn K., Wananukul S., et al. Efficacy of pulsed dyed laser (585 nm) in the treatment of molluscum contagiosum subtype 1. Southeast Asian J Trop Med Public Health. 2007;38(5):849–54.
34. Hammes S., Greve B., Raulin C. Molluscum contagiosum: treatment with pulsed dye laser. Hautarzt. 2001;52(1):38–42.
35. Hughes P.S. Treatment of molluscum contagiosum with the 585-nm pulsed dye laser. Dermatol Surg. 1998;24(2):229–30. Doi: 10.1111/j.1524-4725.1998.tb04141.x.
36. Michel J.L. Treatment of molluscum contagiosum with 585 nm collagen remodeling pulsed dye laser. Eur J Dermatol. 2004;14(2):103–6.
37. Hanna D., Hatami A., Powell J., et al. A prospective randomized trial comparing the efficacy and adverse effects of four recognized treatments of molluscum contagiosum in children. Pediatr Dermatol. 2006;23(6):574–79.
Автор для связи: Н.С. Сирмайс – к.м.н., доцент кафедры дерматовенерологии и косметологии, Институт повышения квалификации ФМБА, Москва, Россия; e-mail: Natsirmais@mail.ru
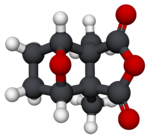
Кантаридин
Cantharidin
Фармакологическое действие
Кантаридин — кератолитическое средство, для наружного применения.
Показания
Лечение контагиозного моллюска.
Противопоказания
- Повышенная чувствительность к кантаридину,
- родинки в месте нанесения,
- недиагностированные поражения кожи,
- беременность,
- лактация.
С осторожностью
Сахарный диабет, заболевания периферических сосудов, бородавки в области гениталий и ануса.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — N.
Адекватных и строго контролируемых исследований по безопасности применения препарата при беременности не проведено. Неизвестно, оказывает ли препарат немедленное или отсроченное негативное воздействие на плод. Применение противопоказано.
Применение в период грудного вскармливания
Специальных исследований по безопасности применения препарата в период грудного вскармливания не проведено. Применение противопоказано.
Способ применения и дозы
Наружно.
Побочные действия
Аллергические реакции.
Классификация
-
Код МКБ 10
-
Категория при беременности по FDA
N
(не классифицировано FDA)
Информация о действующем веществе Кантаридин предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Кантаридин, содержатся в инструкции производителя, прилагаемой к упаковке.

Товары из категории — Препараты для лечения онкологических заболеваний
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 175 350
Фармакологические свойства
Кстанди – медицинский препарат, который предназначен для терапии опухолей и новообразований предстательной железы в тяжелой форме, когда оперативное вмешательство или лечение медикаментами не помогает и не способствует понижению андрогенов.
Активный действующий компонент медикамента – энзалутамид. Это искусственно созданный антиандроген, действие которого направлено на блокировку использования организмом любых гормонов, вырабатываемых мужскими и женскими половыми железами, и корой надпочечников.
Рак предстательной железы – заболевание, которое характерно для представителей мужского пола, опухоль формируется ниже мочевика непосредственно перед прямой кишкой. Под воздействием мужского гормона тестостерона и других гормонов репродуктивной системы опухоль растет и развивается.
Если терапевтическое действие направить на понижение числа андрогенов в организме мужчины, то можно добиться уменьшения новообразования и замедления ее развития вплоть до полной остановки. Кстанди способствует понижению активной деятельности половых гормонов, и как следствие, замедляет рост и развитие опухоли.
После проведенных многочисленных исследований препарата было установлено, что он эффективно борется с раковыми опухолями, уменьшая риск их развития. Прием препарата, содержащего энзалутамид, способствует уменьшению смертности из-за онкологических заболеваний предстательной железы. Многим пациентам, которые вовремя начали прием медикамента, не понадобилось лечение инфекционных, опухолевых заболеваний с помощью воздействия на больные участки химическими препаратами.
Состав и форма выпуска
Медикаментозное средство выпускается в виде непрозрачных капсул, имеющих белый цвет. На одной из сторон таблетки имеется гравировка черного цвета в виде буквенных изображений. Внутри каждой капсулы содержится действующее вещество в виде тягучей маслообразной жидкости желтоватого оттенка.
В состав препарата входят:
Препарат продается в картонных упаковках по 28 таблеток в блистере. В комплекте идет инструкция.
Показания к применению
Медикаментозное средство используется для терапии опухолей предстательной железы в тяжелой форме. Производитель гарантирует эффективность лекарственного средства в борьбе с раком простаты, когда хирургическое вмешательство не приносит результатов или не может быть выполнено.
Международная классификация болезней (МКБ-10)
С.61. Злокачественное новообразование предстательной железы;
С79.8. Вторичное злокачественное новообразование других уточненных локализаций.
Побочные эффекты
Прием медикаментозного средства Кстанди может привести к проявлению ряда побочных признаков:
При появлении следующих симптоматических признаков стоит прекратить прием медикамента, содержащего энзалутамид:
Прием медикамента может привести к снижению скорости реакции, потери сознания и рассеянности, поэтому следует воздержаться от управления транспортными средствами и выполнения работы, требующей концентрации внимания.
Перед приёмом медикамента необходимо сообщить лечащему врачу о наличии следующих проблем со здоровьем: заболевания сердечно-сосудистой системы, эпилептические припадки, перенесенные травматические повреждения головы, острое нарушение мозгового кровообращения, опухоли мозга, непроизвольные сокращения мышц.
Противопоказания
Медикаментозное средство не рекомендуется принимать пациентам, у которых обнаружена непереносимость к энзалутамиду или другим компонентам препарата. С осторожностью следует принимать медикамент детям, пожилым людям, пациентам с почечными и печеночными заболеваниями, так как нет клинических данных и показаний о воздействии медикамента на эти группы больных.
Применение при беременности
Медикаментозное средство предназначено для лечения представителей мужского пола, однако прием медикамента мужчиной во время зачатия ребенка может оказать влияние на плод и привести к риску возникновения врожденных дефектов и отставанию в развитии плода. Во время применения медикамента, а также спустя три месяца после, следует использовать надежные средства контрацепции.
Способ и особенности применения
Медикаментозное средство следует принимать только по назначению лечащего врача, после проведения всех необходимых медицинских обследований, сдачи всех анализов, а также точного определения клинической картины заболевания.
Согласно инструкции по применению, рекомендуемая суточная доза составляет четыре таблетки по 40 мг. ежедневно. Принимают медикамент независимо от времени употребления пищи внутрь, запивая достаточным количеством жидкости.
При пропуске таблетки необходимо восполнить пробел в этот же день, если прошло больше суток, то не стоит увеличивать ежедневную дозировку.
Точную дозировку и продолжительность курса лечения назначает пациенту лечащий врач.
Взаимодействие с другими лекарствами
При приеме других медикаментов следует сообщить об этом лечащему врачу, который примет решение о возможности совмещения препаратов или об отмене одного из них в случае несовместимости. Это касается не только сильнодействующих лекарственных препаратов, но и биологически активных добавок, витаминов, гомеопатических средств.
При приеме следующих видов лекарственных средств и Кстанди следует соблюдать осторожность и находиться под наблюдением медицинского персонала:
Передозировка
При передозировке медикаментозным средством или энзалутамидом следует незамедлительно сообщить об этом лечащему врачу. При чрезмерном употреблении медикамента следует незамедлительно прекратить его применение. Полный вывод средства из организма происходит в течение 6 дней. Передозировка медикаментом может привести к риску проявления побочных эффектов в острой форме, а также к судорогам.
Аналоги
Аналогами медикамента Кстанди по составу, а также фармакологическому воздействию являются:
Решение о замене медикамента, а также его отмене принимает исключительно лечащий врач.
Условия продажи
Медикаментозное средство продается в аптечных пунктах по назначению лечащего врача при наличии рецептурного листа.
Условия хранения
Медикамент Кстанди следует хранить в недоступном для доступа детей месте при комнатной температуре, не превышающей 30 ° С. В инструкции содержатся более подробные сведения о нормах и правилах хранения медикамента в открытом и запечатанном виде.
Цены на Кстанди в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 175 350 руб.
Сертификаты и лицензии
Владелец регистрационного удостоверения:
АлексАнн, ООО
(Россия)
Официальный дистрибьютор на территории рф:
ХЕЛВЕТ ООО
(Россия)
Контакты для обращений:
ХЕЛВЕТ ООО
(Россия)
Лекарственная форма
|
|
КАНТАРЕН |
Таблетки рег. №ПВР-2-8.6/01899 |
Форма выпуска, состав и упаковка
Таблетки круглые, плоские, от белого до светло-желтого цвета; массой 0.1 г.
Вспомогательные вещества: сахарная крупка, кальция стеарат.
Расфасованы по 10 таблеток в блистерах из фольги алюминиевой или по 50 таблеток в банках из оранжевого стекла, закрытых полиэтиленовыми крышками, или банках полимерных для лекарственных средств соответствующей вместимости. Блистеры упаковывают в картонную коробку по 2 блистера в каждой.
Каждую банку или коробку с блистерами маркируют с указанием наименования организации-производителя, ее адреса и товарного знака, наименования лекарственного средства, названия и содержания действующих веществ, надписей «Для ветеринарного применения», «Гомеопатическое», количества таблеток, условий хранения, номера серии, даты изготовления, срока годности, обозначения настоящих ТУ.
Фармакологические (биологические) свойства и эффекты
Гомеопатический препарат. Кантарен оказывает салуретическое, противовоспалительное, спазмолитическое и диуретическое действие.
По степени воздействия на организм Кантарен относится к веществам малоопасным (4 класс опасности по ГОСТ 12.1.007-76), не оказывает местно-раздражающего и сенсибилизирующего действия.
Показания к применению препарата КАНТАРЕН
- лечение урологического синдрома и мочекаменной болезни кошек.
Порядок применения
Раствор для инъекций вводят котам и кошкам для лечения урологического синдрома и мочекаменной болезни кошек в/м или п/к в дозе 1 мл на животное: в острых случаях — ежедневно 1-2 раза/сут до исчезновения клинических признаков; при подостром и хроническом течении болезни — 1-3 раза в неделю в течение 10 дней. При необходимости курс лечения повторяют.
Таблетки назначают внутрь котам и кошкам для лечения урологического синдрома и мочекаменной болезни кошек по 1 таб. на животное 2-3 раза/сут до появления положительного эффекта. Продолжительность курса лечения устанавливается ветеринарным врачом, но не более 1 месяца.
Побочные эффекты
Не вызывает побочного действия и осложнений при применении в соответствии с настоящей инструкцией.
Особые указания и меры личной профилактики
Применение Кантарена не исключает использования других лекарственных средств.
При работе с Кантареном следует соблюдать общие правила безопасности, предусмотренные при работе с лекарственными средствами.
Запрещается использовать флаконы из-под раствора для инъекций или таблеток для пищевых целей.
Условия хранения КАНТАРЕН
Раствор для инъекций следует хранить в защищенном от света и недоступном для детей месте при температуре от 0° до 25°С.
Срок годности КАНТАРЕН
Срок годности — 3 года со дня изготовления.
Таблетки следует хранить в защищенном от света и недоступном для детей месте при температуре от -3°C до +25°С. Срок годности — 5 лет.
Контакты для обращений
|
|
141700 Московская обл. |
КАНТАРЕН отзывы
Помогите другим с выбором, оставьте отзыв об КАНТАРЕН
Оставить отзыв
Московский научно-практический Центр дерматовенерологии и косметологии Департамента здравоохранения, Москва
Материкин А.И.
ГБУЗ «Клинический кожно-венерологический диспансер» Министерства здравоохранения Краснодарского края, Краснодар
Контагиозный моллюск: старая проблема — новые решения
Авторы:
Круглова Л.С., Материкин А.И.
Как цитировать:
Круглова Л.С., Материкин А.И. Контагиозный моллюск: старая проблема — новые решения. Клиническая дерматология и венерология.
2017;16(3):76‑81.
Kruglova LS, Materikin AI. Molluscum contagiosum: old problems, new solutions. Klinicheskaya Dermatologiya i Venerologiya. 2017;16(3):76‑81. (In Russ.)
https://doi.org/10.17116/klinderma201716376-81

Вирусные инфекции кожи — распространенные заболевания в практике дерматолога. Инфекции наиболее часто вызваны герпесвирусами, вирусами папилломы человека и контагиозного моллюска (ВКМ). Среди вирусных инфекций особое место занимает заболеваемость контагиозным моллюском (КМ) в связи с высокой распространенностью в детском возрасте. Так, по данным S. Seo [1, 2], инфицированность детей школьного возраста ВКМ составляет 2—8%. По данным K. Kyriakis [3], общая относительная заболеваемость среди 162 детей амбулаторного приема составляет 3,2%, при этом основную часть составляют дети в возрасте от 3 до 5 лет.
Дерматотропный поксвирус представляет собой крупный (200—300 нм), прямоугольный, двуспиральный ДНК-вирус, который размножается в цитоплазме инфицированных эпителиальных клеток. По меньшей мере, насчитывают четыре генотипа (MCV 1—4), самым распространенным из которых во всем мире является 1-й тип. Причем у детей КМ, как правило, провоцируется ортопоксвирусом 1-го типа (MCV-1), а у взрослых — вирусом 2-го типа (MCV-2). Подобная ситуация обусловлена тем, что вирус 1-го типа передается в основном контактным и опосредованным путем, через общие предметы, а вирус 2-го типа — через половые контакты. Однако все типы вируса вызывают одинаковые клинические проявления [4—6]. Есть несколько заслуживающих особого внимания характеристик ВКМ, которые делают его уникальным по сравнению с хорошо изученными представителями рода ортопоксвирусов. Во-первых, ВКМ вызывает хроническую инфекцию с минимальными проявлениями или без признаков воспаления. В отличие от него вирус оспы обезьян и вирус ветряной оспы вызывают острые заболевания, которые имеют значительно более высокие показатели заболеваемости и смертности по сравнению с КМ. Во-вторых, ВКМ поражает и персистирует только в кератиноцитах, в то время как вирусы различных типов оспы поражают другие виды клеток и тканей. В-третьих, молекулы, кодируемые ВКМ, отличны от тех, которые кодируются членами рода ортопоксвирусов. Эта разница в продуцируемых ими молекулах, вероятно, отражает различие тропизма к тканям этих вирусов и фенотипическую разновидность болезней, которые они вызывают. ВКМ — единственный вирус в отличие от вирусов различных видов оспы, который является патогенным исключительно для человека. В связи с победой над вирусом натуральной оспы, прививка от этого заболевания была ликвидирована из прививочного календаря вакцинации; таким образом, ВКМ остается единственным циркулирующим поксвирусом, заражающим людей по всему миру. Вместе с тем ВКМ имеет присущие поксвирусам свойства, проявляющиеся в высокой контагиозности и патогенности [7].
Так, A. Kawahar и M. Yoshida [8] обнаружили ДНК ВКМ с помощью полимеразной цепной реакции (ПЦР) в образцах кожи без высыпаний у 17 из 20 исследуемых пациентов, что говорит о передаче вируса с инфицированных очагов видимо непораженной кожи. Также возможно инфицирование через одежду, полотенца, игрушки, которых касается пациент. У 10 пациентов была обнаружена ДНК вируса в коже пальцев обеих кистей. Также результаты исследований подтвердили непрямой путь передачи через другие предметы: вирусная ДНК была обнаружена на письменном столе, шкафу, ящике с игрушками и кране, который находился в общем пользовании у детей в школе.
Общеизвестно, что ВКМ адаптировался с точки зрения роста и устойчивости к местным иммунным системам в коже человека. Он поражает только кожу и реже слизистые оболочки [9].
Вирус «разработал» эффективный механизм роста в дифференцирующейся клетке эпидермиса человека и хорошо приспособился к человеческому организму. Не пересекая базальной мембраны, вирус уклоняется от иммунного надзора; он не вызывает системного иммунного ответа на протяжении большей части периода инфекции; он вызывает только местную реакцию, что приводит к сероконверсии. Понимание и изучение, каким образом ВКМ уклоняется от иммунной защиты кожи, и почему инфекция, вызываемая ВКМ, ограничена только поражением кератиноцитов человека, может принести большую пользу для вирусологии. Вероятно, речь идет о выявлении новых механизмов уклонения от иммунной системы, а также особенностях вирусного тропизма. Эти данные позволили бы улучшить наше понимание происходящих иммунных процессов при этой инфекции, а исследование вирусных белков в системе иммунного уклонения — определить новые клеточные механизмы, которые регулируют сигнальные пути, критические для активации иммунной системы [5—7].
Клиническая картина данного заболевания описана почти 200 лет назад, проведено множество клинических и фундаментальных исследований, оценено негативное влияние на качество жизни пациента. КМ — это вирусная инфекция с доброкачественным течением, характеризующаяся образованием восковидных папул телесного цвета, куполообразной формы, в среднем 3—5 мм в диаметре [10].
Папулы содержат воскообразный материал, который состоит из клеточного детрита и многочисленных частиц вируса. Элементы К.М. обычно располагаются группами в одном или двух кожных регионах, но также они встречаются и в рассеянном виде, редко поражаются ладони и подошвы, слизистые оболочки, например, губ, щек, конъюнктивы. Заболевание может развиться в любом возрасте, но в большинстве случаев у детей и молодых взрослых. У большинства иммунокомпетентных пациентов обычно обнаруживают меньше 20 папул, но у некоторых их может быть до нескольких сотен. Поражения, как правило, бессимптомны, но иногда они вызывают зуд, вокруг них может развиться воспалительная реакция [11].
Нарушение кожного барьера может объяснить рост распространенности и большого количества высыпаний у больных с атопическим дерматитом [12, 13]. У пациентов с атопическим дерматитом, в связи сухостью кожи и нарушением эпидермального барьера, часто встречаются диссеминированные формы заболевания [14]. Применение топических кортикостероидов и ингибиторов кальциневрина в связи с их иммуносупрессивным действием является одним из провоцирующих факторов в развитии заболевания у больных атопическим дерматитом [15].
Явление воспаления вокруг очагов поражения служит результатом реакции хозяина в ответ на вирус. Однако связанный с ними зуд может также способствовать распространению и внедрению вирусов через поврежденную кожу. Ограниченный дерматит вокруг папул, как правило, регрессирует спонтанно.
Постановка диагноза при данном заболевании обычно не вызывает трудностей, устанавливается клинически и не требует специальных методов диагностики. При гистологическом исследовании определяется вирусная акантома, а в цитоплазме кератиноцитов — эозинофильные тельца-включения (тельца Гендерсона—Патерсона) [14]. Заболевание характеризуется доброкачественным течением, высокой контагиозностью и ограниченной продолжительностью течения [16—18]. У некоторых пациентов происходит спонтанная инволюция в течение 6—9 мес, однако зачастую поражения могут сохраняться годами [16]. Пораженные участки имеют неэстетичный вид, вызывают обостренное восприятие высыпаний окружающими и родителями ребенка [18].
Заживление происходит, как правило, без возникновения рубцов. В подавляющем большинстве случаев заболевание поражает детей школьного возраста до 12 лет [17]. Особенно это относится к южным регионам, в которых до 10% школьников страдают КМ, причем в качестве факторов, способствующих заболеванию, могут рассматриваться тесный физический контакт, плотно прилегающая одежда и плохая гигиена [18].
Несмотря на многочисленные возможности лечения, специфическая противовирусная терапия КМ до сих пор отсутствует. Один из самых распространенных методов лечения — удаление моллюсков с помощью кюретки или пинцета [19], но при значительной диссеминации моллюсков и их неблагоприятной локализации (например, на лице, шее или генитальной области), а также в случае малого возраста ребенка, возникают большие трудности в применении этого метода. Благодаря чрезкожной анестезии с помощью лидокаин-прилокаиновой мази [19], нанесенной за 30—60 мин до операции, безболезненное удаление моллюсков иногда возможно, однако во многих случаях, а особенно если ребенок неспокоен, обойтись без седации или общего наркоза не удается. Предварительное ожиривание кожного покрова мазью перед удалением моллюсков также значительно затрудняет механические манипуляции, поскольку бранши пинцета соскальзывают с элементов моллюска, что затрудняет техническое выполнение задачи.
Криотерапия жидким азотом хотя и менее болезненный метод, но требует больше времени, чем удаление моллюсков с помощью кюретки или пинцета, и редко позволяет достичь эффекта за одну аппликацию — необходимо проведение нескольких процедур [20].
Применяемые иногда импульсные углекислотные лазеры [21], а также электрокоагуляторы не обладают явными преимуществами с точки зрения практичности и переносимости. При наличии рекомендованных консервативных методов терапии имеются многочисленные альтернативные методы, из которых каждый по себе требует высокой степени лояльности, а также терпения со стороны родителей лечащегося ребенка.
Последний обзор Cochrane по лечению КМ опубликован в 2009 г. В нем рассмотрены 11 рандомизированных контролируемых исследований с 495 участниками [22]. В обзор не вошли пациенты с ИППП и ВИЧ. Мало доказательств эффективности следующих препаратов: нитрит натрия в сочетании с салициловой кислотой по сравнению с салициловой кислотой, масло австралийского лимонного мирта по сравнению с оливковым маслом, и крем бензоила пероксида по сравнению с кремом третиноин [22]. Большинство из широко используемых процедур (например, кюретаж) были исключены из обзора Cochrane. Из него было исключено проспективное рандомизированное исследование Hanna, поскольку его результаты показывали крайне небольшую частоту улучшения после нескольких посещений и не давали информацию о том, когда произошло посещение [23]. В обзоре Cochrane были опубликованы три рандомизированных исследования, а одно все еще продолжается [24]. Результаты испытаний показали отсутствие существенной разницы между аблационной и иммуномодулирующей терапией, а также химическими методами.
Салициловая кислота в виде пластыря [25] или ретиноевая кислота (третиноин) [26] иногда успешно применяются, однако могут привести к значительной ирритации участков кожи, расположенных по периферии очага поражения. Кроме того, эти средства недоступны в России.
Эффективность топической аппликации иммунного модулятора имиквимода недостаточно изучена, препарат не разрешен к применению у детей, недостаточно изучен вопрос о необходимой длительности лечения, а стоимость терапии является крайне высокой [27].
N. Al-Mutairi и соавт. [28] в 16-недельном исследовании с участием 37 пациентов показали, что нет существенных отличий между криотерапией и аппликациями 5% крема имиквимод (34 из 37, или 92%). S. Seo и соавт. [29] сравнили эффект 10% раствора гидроксида калия с таковым у 5% крема имиквимода; обе процедуры были эффективны (57 и 77% соответственно), однако авторы наблюдали высокую частоту местных побочных эффектов, связанных с раздражающим действием 10% раствора гидроксида калия.
Дальнейшие консервативные методы терапии, применяемые с разным успехом, включают топическую аппликацию подофиллотоксина [30], применение кантаридина [31], трихлоруксусной кислоты, фенола, нитрата серебра [31] или йода [25]. Следует предположить, что некоторые из применяемых химических веществ путем поражения эпидермиса и обусловленной этим индукции иммунного ответа вызывают уничтожение вируса [32].
Также были сообщения о достигнутых успехах при использовании оральной циметидиновой терапии, причем предполагалось наличие у субстанции иммуномодулирующих свойств (блокирование супрессорной функции лимфоцитов и улучшение иммунитета Т-клеток) [33].
В настоящий момент имеется множество доказательств того, что для лечения КМ в детском возрасте пригоден гидроксид калия. Так, R. Romiti и соавт. [34] описывали топическую аппликацию 10% раствора гидроксида калия, который используют для изготовления микологических нативных препаратов, для лечения у детей инфекции КМ. В то же время та же самая рабочая группа показала, что благодаря применению 5% раствора гидроксида калия, также наносимого 2 раза в день, у 20 детей с КМ были достигнуты сравнимые показатели эффективности лечения (в среднем в течение 6 нед) при значительно уменьшенном профиле побочных явлений [32, 35].
B. Mahajan и соавт. [36] сообщают о применении 20% раствора гидроксида калия при лечении 27 детей в возрасте от 8 мес до 14 лет.
D. Hinostroza-Da-Conceicao и соавт. [37] изучали эффект воздействия 15% раствора гидроксида калия, наносимого каждый вечер, на 46 пациентов различного возраста.
В Англии K. Short и соавт. недавно представили первое двойное слепое плацебо-контролируемое исследование по применению 10% раствора гидроксида калия у детей в возрасте от 2 до 12 лет [32].
Однако во всех выше описанных исследованиях наблюдали довольно высокую частоту побочных эффектов в виде жжения, изъязвления элементов, появления пигментаций и рубцов.
F. Neri и соавт. [38] попытались снизить частоту побочных эффектов и провели испытание 5% раствора гидроксида калия. Во время лечения чувство жжения отсутствовало или было минимальным, ни в одном случае не наблюдалось нарушений пигментации в конце данного исследования. Главный вывод, который был сделан в результате данного исследования, что 5% водный раствор гидроксида калия оказался таким же эффективным, как и 10% раствор гидроксида калия, но вызывал меньшее раздражение. Данное исследование также подчеркивает эффективность применения 5% гидроксида калия в лечении КМ, защищая детей от более агрессивных физических методов лечения [32].
В исследовании эффективности и безопасности 5% гидроксида калия T. Jansen и соавт. [39] принял участие 21 ребенок, при этом у 14 пациентов отмечался атопический дерматит, а у 3 пациентов была атопическая экзема. Наиболее распространенным побочным эффектом, наблюдаемым у 76,2% пациентов, было временное небольшое жжение непосредственно после наружного применения. У 2 пациентов развилась поствоспалительная гиперпигментация, разрешившаяся через 1—3 мес [32].
Обсуждение
В настоящий момент существует множество различных методов терапии КМ, такие как кюретаж, механическое удаление, электрокоагуляция или криотерапия, аппликации салициловой кислоты и третиноина, которые часто бывают болезненными и вызывают достаточно большое количество побочных эффектов в виде воспалительной реакции, образования рубцов и гиперпигментации.
Применение стабилизированного 5% раствора гидроксида калия хорошо изучено в многочисленных исследованиях, его эффективность не уступает гидроксиду калия в более высоких концентрациях, но при этом 5% раствор не вызывает побочные эффекты при правильном применении.
В России зарегистрирован 5% раствор гидроксида калия как медицинское изделие, класс 1, под торговой маркой Молютрекс (производство Дерматологической лаборатории «АСМ», Франция). Технология производства Молютрекс позволяет стабилизировать раствор таким образом, чтобы активность и pH раствора оставались константными в течение 1 мес после вскрытия упаковки, что отличает это средство от просто приготовленного раствора 5% гидроксида калия.
Данный 5% раствор гидроксида калия следует аккуратно наносить c помощью кисточки или тонкого аппликатора (входит в комплект) утром и вечером только на элементы КМ, избегая при этом попадания на здоровую кожу. Средство не следует смывать — оно должно высохнуть. Рекомендовано наносить 5% раствор гидроксида калия до возникновения покраснения (воспаления) папул КМ, после чего применение раствора следует прекратить (обычно покраснение возникает в период от 2 до 10 дней использования). Покрасневшие элементы свидетельствуют о том, что образования КМ в ближайшем будущем исчезнут приблизительно в течение 2—6 нед после покраснения. Нельзя применять 5% раствор гидроксида калия более 14 дней, наносить на воспаленные элементы КМ и на другие образования кожи (бородавки, папилломы и т. д.).
Выводы
Таким образом, данные многочисленных клинических исследований подтверждают высокую эффективность и хорошую переносимость стабилизированного 5% раствора гидроксида калия (Молютрекс) при лечении детей, страдающих КМ, в том числе у пациентов с атопическим дерматитом. Легкость применения, безопасность, а также фармакоэкономические характеристики позволяют использовать его в домашних условиях как средство первой линии терапии контагиозного моллюска.
Авторы заявляют об отсутствии конфликта интересов.
From Wikipedia, the free encyclopedia

|
|
|
|
| Names | |
|---|---|
| Preferred IUPAC name
(3aR,4S,7R,7aS)-3a,7a-Dimethylhexahydro-4,7-epoxy[2]benzofuran-1,3-dione |
|
| Other names
Cantharidin, Spanish fly |
|
| Identifiers | |
|
CAS Number |
|
|
3D model (JSmol) |
|
|
Beilstein Reference |
85302 |
| ChEBI |
|
| ChEMBL |
|
| ChemSpider |
|
| ECHA InfoCard | 100.000.240 |
| EC Number |
|
| KEGG |
|
|
PubChem CID |
|
| UNII |
|
|
CompTox Dashboard (EPA) |
|
|
InChI
|
|
|
SMILES
|
|
| Properties | |
|
Chemical formula |
C10H12O4 |
| Molar mass | 196.202 g·mol−1 |
| Density | 1.41 g/cm3 |
| Melting point | 212 °C (414 °F; 485 K) |
| Pharmacology | |
| Legal status |
|
| Hazards | |
| Occupational safety and health (OHS/OSH): | |
|
Main hazards |
Highly toxic |
| GHS labelling: | |
|
Pictograms |
 
|
|
Signal word |
Danger |
|
Hazard statements |
H300, H315, H319, H335 |
|
Precautionary statements |
P261, P264, P270, P271, P280, P301+P310, P302+P352, P304+P340, P305+P351+P338, P312, P321, P330, P332+P313, P337+P313, P362, P403+P233, P405, P501 |
| NFPA 704 (fire diamond) |
4 1 1 |
| Lethal dose or concentration (LD, LC): | |
|
LD50 (median dose) |
0.03–0.5 mg/kg (human) |
|
Except where otherwise noted, data are given for materials in their standard state (at 25 °C [77 °F], 100 kPa).
Infobox references |
Cantharidin is an odorless, colorless fatty substance of the terpenoid class, which is secreted by many species of blister beetles.[a] It is a burn agent or a poison in large doses, but preparations containing it were historically used as aphrodisiacs (Spanish fly). In its natural form, cantharidin is secreted by the male blister beetle, and given to the female as a copulatory gift during mating. Afterwards, the female beetle covers her eggs with it as a defense against predators.
Poisoning from cantharidin is a significant veterinary concern, especially in horses, but it can also be poisonous to humans if taken internally (where the source is usually experimental self-exposure). Externally, cantharidin is a potent vesicant (blistering agent), exposure to which can cause severe chemical burns. Properly dosed and applied, the same properties have also been used therapeutically, for instance, for treatment of skin conditions, such as molluscum contagiosum infection of the skin.
Cantharidin is classified as an extremely hazardous substance in the United States, and is subject to strict reporting requirements by facilities that produce, store, or use it in significant quantities.[1]
Chemistry[edit]
Structure and nomenclature[edit]
Cantharidin, from the Greek kantharis, for beetle,[2] is an odorless, colorless natural product with solubility in various organic solvents,[specify] but only slight solubility in water.[3] Its skeleton is tricyclic, formally, a tricyclo-[5.2.1.02,6]decane skeleton. Its functionalities include a carboxylic acid anhydride (−CO−O−CO−) substructure in one of its rings, as well as a bridging ether in its bicyclic ring system.
Biosynthesis from farnesol — bonds to be formed and major atoms to be added are in blue; while bonds to be broken and atoms/structural segments to be removed are in red.
The complete mechanism of the biosynthesis of cantharidin is unknown. Its framework formally consists of two isoprene units.[4] However, feeding studies indicate that the biosynthetic process is more complicated, and not a simple product of geranyl pyrophosphate or related ten-carbon parent structure, as the seeming monoterpene nature would suggest. Instead, there is a farnesol (15-carbon) precursor from which certain carbon segments are later excised.[5]
Distribution and availability[edit]
The level of cantharidin in blister beetles can be quite variable. Among blister beetles of the genus Epicauta in Colorado, E. pennsylvanica contains about 0.2 mg, E. maculata contains 0.7 mg, and E. immaculata contains 4.8 mg per beetle; males also contain higher levels than females.[6]
Males of Berberomeloe majalis have higher level of cantharidin per beetle: 64.22 ± 51.28 mg/g (dry weight) and 9.10 ± 12.64 mg/g (d. w.). Cantharidin content in haemolymph is also higher in males (80.9 ± 106.5 µg/g) than in females (20.0 ± 41.5 µg/g).[7]
History[edit]
Lytta vesicatoria (a.k.a «Spanish fly»), a beetle that secretes cantharidin.
Aphrodisiac preparations[edit]
Preparations made from blister beetles (particularly «Spanish fly») have been used since ancient times as an aphrodisiac, possibly because their physical effects were perceived to mimic those of sexual arousal,[8] and because they can cause prolonged erection or priapism in men.[9] These preparations were known as cantharides, from the Greek word for “beetle.”
Examples of such use found in historical sources include:
- The ancient Roman historian Tacitus relates that a cantharid preparation was used by the empress Livia, wife of Augustus Caesar, to entice members of the imperial family or dinner guests to commit sexual indiscretions (thus, providing her information to hold over them).[10]
- The German emperor Henry IV (1050–1106) is said to have consumed cantharides.[11]
- The French surgeon Ambroise Paré (1510–1590) described a case in 1572 of a man suffering from “the most frightful satyriasis” after taking a potion composed of nettles and a cantharid extract.[12] This is perhaps the same man of whom Paré relates that a courtesan sprinkled a cantharid powder on food she served to him, after which the man experienced «violent priapism» and anal bleeding, of which he later died. Paré also cites the case of a priest who died of hematuria after swallowing a dose of cantharides, which he intended to fortify his sex drive.[13]
- Cantharides were in widespread use among the upper classes in France in the 1600s, despite being a banned substance. Police searches in connection with a rash of poisonings around 1680 turned up many stashes of “bluish flies,” which were known to be used in the preparation of aphrodisiac potions.[13]
- The French sorceress Catherine Monvoisin (known as “La Voisin,” c. 1640–1680) was recorded in the 1670s as having prepared a love charm made from Spanish fly mixed with dried mole’s blood and bat’s blood.[14]
- Aphrodisiac sweets presumably laced with cantharides were circulated within libertine circles during the 1700s in France. They were multicolored tablets nicknamed “pastilles de Richelieu,” after the Maréchal de Richelieu, a notorious libertine (not to be confused with his great-uncle, the Cardinal Richelieu) who procured sexual encounters for King Louis XV.[13][15]
- The French writer Donatien Alphonse François — notoriously known as the Marquis de Sade (1740–1814) — is said to have given aniseed-flavored pastilles laced with Spanish fly to two prostitutes at a pair of orgies in 1772, poisoning and nearly killing them. He was sentenced to death for that (and for the crime of sodomy), but was later reprieved on appeal.[16][17]
Non-aphrodisiac uses[edit]
- The Spanish clergyman Juan de Horozco y Covarrubias (es) (c. 1540–1610) reported the use of blister beetles as a poison as well as an aphrodisiac.[18]
- Preparations of dried blister beetles were at one time used as a treatment for smallpox.[19] As late as 1892, Andrew Taylor Still, the founder of osteopathy, recommended inhaling a tincture of cantharidin as an effective preventative and treatment for smallpox, decrying vaccination.[20]
Pharmaco-chemical isolation[edit]
Cantharidin was first isolated as a chemically pure substance in 1810 by Pierre Robiquet,[21] a French chemist then living in Paris. Robiquet isolated cantharidin as the active ingredient in pharmacological preparations of Lytta vesicatoria, a.k.a. “Spanish fly,” a species of blister beetle. This was one of the first historical instances of the identification and extraction of a simple active principle from a complex medicine.
Robiquet found cantharidin to be an odorless and colorless solid at room temperature. He demonstrated that it was the active principle responsible for the aggressively blistering properties of the coating of the eggs of the blister beetle, and additionally established that cantharidin had toxic properties comparable in degree to those of the most virulent poisons known in the 19th century, such as strychnine.[22]
Other uses of the pharmacological isolate[edit]
- Diluted solutions of cantharidin can be used as a topical medication to remove warts[23][24] and tattoos, and to treat the small papules of molluscum contagiosum.[25]
- In Santería rituals, cantharides are used in incense.[26]
Veterinary issues[edit]
Poisoning by Epicauta species from cantharidin is a significant veterinary concern, especially in horses; species infesting feedstocks depend on region—e.g., Epicauta pennsylvanica (black blister beetle) in the U.S. midwest; and E. occidentalis, temexia, and vittata species (striped blister beetles) in the U.S. southwest—where the concentrations of the agent in each can vary substantially.[3] Beetles feed on weeds, and occasionally move into crop fields used to produce livestock feeds (e.g., alfalfa), where they are found to cluster and find their way into baled hay, e.g., a single flake (4–5 in. section[27]) may have several hundred insects, or none at all.[3] Horses are very sensitive to the cantharidin produced by beetle infestations: the LD50 for horses is roughly 1 mg/kg of the horse’s body weight. Horses may be accidentally poisoned when fed bales of fodder with blister beetles in them.[28]
Great bustards, a strongly polygynous bird species,[29] are not immune to the toxicity of cantharidin; they become intoxicated after ingesting blister beetles. However, cantharidin has activity also against parasites that infect them.[30][31] Great bustards may eat toxic blister beetles of the genus Meloe to increase the sexual arousal of males.[32]
Human medical issues[edit]
General risks[edit]
As a blister agent, cantharidin has the potential to cause adverse effects when used medically; for this reason, it has been included in a list of “problem drugs” used by dermatologists[33] and emergency personnel.[34]
Despite being widely used, cantharidin has never been and is not currently FDA approved.[35] It is currently in Phase 3 clinical trials for the treatment of molluscum.[36] However, when compounded properly and applied in the clinic topically by a medical provider familiar with its effects and uses, cantharidin can be safely and effectively used to treat some benign skin lesions, like warts and molluscum.[37]
When ingested by humans, the LD50 is around 0.5 mg/kg, with a dose of as little as 10 mg being potentially fatal. Ingesting cantharidin can initially cause severe damage to the lining of the gastrointestinal and urinary tracts, and may also cause permanent renal damage. Symptoms of cantharidin poisoning include blood in the urine, abdominal pain, and rarely prolonged erections.[33]
Risks of aphrodisiac use[edit]
The extreme toxicity of cantharidin makes any use as an aphrodisiac highly dangerous.[38][39] As a result, it is illegal to sell (or use) cantharidin or preparations containing it without a prescription in many countries.[34]
Research[edit]
Mechanism of action[edit]
|
|
This section is missing information about toxicological mechanism when ingested. Please expand the section to include this information. Further details may exist on the talk page. (September 2022) |
Topical cantharidin is absorbed by the lipid membranes of epidermal cells, causing the release of serine proteases, enzymes that break the peptide bonds in proteins. This causes the disintegration of desmosomal plaques, cellular structures involved in cell-to-cell adhesion, leading to detachment of the tonofilaments that hold cells together. The process leads to the loss of cellular connections (acantholysis), and ultimately results in blistering of the skin. Lesions heal without scarring.[37][40]
Pharmaceutical use[edit]
VP-102, an experimental drug-device combination that includes cantharidin delivered via a single-use applicator, is being studied for the treatment of molluscum contagiosum, common warts, and genital warts.[41]
Bioactivities[edit]
Cantharidin appears to have some effect in the topical treatment of cutaneous leishmaniasis in animal models.[42] In addition to topical medical applications, cantharidin and its analogues may have activity against cancer cells.[43][44][45]
Laboratory studies with cultured tumor cells suggest that this activity may be the result of PP2A inhibition.[46][47]
References[edit]
Explanatory notes
- ^ Including broadly in genus Epicauta, genus Berberomeloe, and in species Lytta vesicatoria (Spanish fly). False blister beetles, cardinal beetles, and soldier beetles also produce cantharidin.
Sources
- ^ As defined in Section 302 of the U.S. Emergency Planning and Community Right-to-Know Act (42 U.S.C. 11002). See «40 C.F.R.: Appendix A to Part 355—The List of Extremely Hazardous Substances and Their Threshold Planning Quantities» Archived 2012-02-25 at the Wayback Machine (PDF) (July 1, 2008 ed.). U.S. Government Printing Office. Retrieved October 29, 2011.
- ^ A Dictionary of Entomology. CABI. 2011. p. 253.
- ^ a b c Schmitz, David G. (2013). «Overview of Cantharidin Poisoning (Blister Beetle Poisoning)». In Aiello, Susan E.; Moses, Michael A. (eds.). The Merck Veterinary Manual. Kenilworth, NJ, USA: Merck Sharp & Dohme. ISBN 978-0911910612. Archived from the original on 22 December 2015. Retrieved 14 December 2015.
- ^ Richard J. Petroski, Susan P. McCormick (2012). Secondary-Metabolite Biosynthesis and Metabolism. Springer Science & Business Media.
- ^ Jiang, Ming; Lü, Shumin; Zhang, Yalin (2017). «The Potential Organ Involved in Cantharidin Biosynthesis in Epicauta chinensis Laporte (Coleoptera: Meloidae)». J Insect Sci. 17 (2): 52. doi:10.1093/jisesa/iex021. PMC 5633858. PMID 28423415.
- ^ Capinera, J. L.; Gardner, D. R.; Stermitz, F. R. (1985). «Cantharidin Levels in Blister Beetles (Coleoptera: Meloidae) Associated with Alfalfa in Colorado». Journal of Economic Entomology. 78 (5): 1052–1055. doi:10.1093/jee/78.5.1052.
- ^ Bravo, C.; Mas-Peinado, P.; Bautista, L. M.; Blanco, G.; Alonso, J. C.; García-París, M. (2017). «Cantharidin is conserved across phylogeographic lineages and present in both morphs of Iberian Berberomeloe blister beetles (Coleoptera, Meloidae)». Zoological Journal of the Linnean Society. 180 (4): 790–804. doi:10.1093/zoolinnean/zlw016. hdl:10261/153832.
- ^ John L. Capinera, Encyclopedia of Entomology, Volume 4, Springer Science & Business Media, 2008. p.2010
- ^ Peter V. Taberner, Aphrodisiacs: The Science and the Myth, Springer Science & Business Media, 2012, pp.100ff
- ^ James, Peter (1995). Ancient Inventions. Ballantine Books. p. 177. ISBN 978-0-345-40102-1.
- ^ Eplett, Layla (13 March 2012). «When Sparks Fly: Aphrodisiacs and the Fruit Fly». Scientific American. Retrieved 18 November 2014.
- ^ Milsten, Richard (2000). The Sexual Male: Problems and Solutions. W. W. Norton & Company. p. 170. ISBN 978-0-393-32127-2.
- ^ a b c Augustin Cabanès, Remèdes d’autrefois, Paris: A. Maloine, 1910, p. 498ff.
- ^ Richard Cavendish, The Black Arts (London: Pan Books, 1969), p. 333.
- ^ Jacques Levron, Le Maréchal de Richelieu, un libertin fastueux (Paris, Perrin, 1971).
- ^ Ford, Peter; Howell, Michael (1985). The beetle of Aphrodite and other medical mysteries. New York: Random House. ISBN 978-0-394-54797-8.
- ^ Schaeffer, Neil (2000). The Marquis de Sade: A Life, Cambridge, MA, USA: Harvard University Press, p. 58.
- ^ Covarrubias-Horozco, S. (2006). Tesoros de la lengua castellana o española. Universidad de Navarra — Iberoamericana — Vervuert.
- ^ Johann Friedrich Closs (1767). A New Method of Curing the Small-pox … with a Specimen of Miscellaneous Observations on Medical Subjects; from the Latin … by a Physician. Hawes. Cantharides referred to throughout the book.
- ^ Andrew Taylor Still, The philosophy and mechanical principles of osteopathy, 1892, chapter 12: «Smallpox». The 1902 edition is available here Archived 2019-07-14 at the Wayback Machine.
- ^ Wolter, H. (1995). Kompendium der Tierärztlichen Homöopathie. Enke. ISBN 978-3432978925.
- ^ Robiquet, P. J. (1810). «Expériences sur les cantharides». Annales de Chimie. 76: 302–322.
- ^ Epstein, W. L.; Kligman, A. M. (1958). «Treatment of warts with cantharidin». AMA Archives of Dermatology. 77 (5): 508–511. doi:10.1001/archderm.1958.01560050014003. PMID 13519856.
- ^ Bacelieri, R.; Johnson, S. M. (2005). «Cutaneous warts: An evidence-based approach to therapy». American Family Physician. 72 (4): 647–652. PMID 16127954. Archived from the original on 2008-07-09. Retrieved 2012-12-02.
- ^ «Molluscum contagiosum». Merck Manuals. November 2005. Retrieved 2007-10-21.
- ^ Gonzalez-Wippler, Migene (2002). Santería: The Religion. Llewellyn Publications. p. 221. ISBN 978-1-56718-329-0.
- ^ Rockett, Jody; Bosted, Susanna (2015). Veterinary Clinical Procedures in Large Animal Practices. Boston, MA, USA: Cengage Learning. p. 65. ISBN 978-1305537651. Retrieved 14 December 2015.
- ^ «Blister Beetle Poisoning / Cantharidin toxicosis». Retrieved 2010-12-31.
- ^ Alonso, J.C.; Magaña, M.; Palacín, C.; Martín, C.A. (2010). «Correlates of male mating success in great bustard leks: the effects of age, weight, and display effort». Behavioral Ecology and Sociobiology. 64 (10): 1589–1600. doi:10.1007/s00265-010-0972-6. hdl:10261/76985. S2CID 8741416.
- ^ Bravo, C.; Bautista, L.M.; García-París, M.; Blanco, G.; Alonso, J.C. (2014). «Males of a Strongly Polygynous Species Consume More Poisonous Food than Females». PLOS ONE. 9 (10): e111057. Bibcode:2014PLoSO…9k1057B. doi:10.1371/journal.pone.0111057. PMC 4206510. PMID 25337911.
- ^ Sánchez-Barbudo, I. S.; Camarero, P.; García-Montijano, M.; Mateo, R. (2012). «Possible cantharidin poisoning of a great bustard (Otis tarda)». Toxicon. 59 (1): 100–103. doi:10.1016/j.toxicon.2011.10.002. hdl:10261/143513. PMID 22001622.
- ^ Heneberg, P. (2016). «On Otis tarda and Marquis de Sade: what motivates male Great Bustards to consume Blister Beetles (Meloidae)?». Journal of Ornithology. 57 (4): 1123–1125. doi:10.1007/s10336-016-1369-8. S2CID 17325635.
- ^ a b Binder, R. (1979). «Malpractice—in dermatology». Cutis; Cutaneous Medicine for the Practitioner. 23 (5): 663–666. PMID 456036.
- ^ a b Karras, D. J.; Farrell, S. E.; Harrigan, R. A.; Henretig, F. M.; Gealt, L. (1996). «Poisoning from «Spanish fly» (cantharidin)». The American Journal of Emergency Medicine. 14 (5): 478–483. doi:10.1016/S0735-6757(96)90158-8. PMID 8765116.
While most commonly available preparations of Spanish fly contain cantharidin in negligible amounts, if at all, the chemical is available illicitly in concentrations capable of causing severe toxicity. Symptoms of cantharidin poisoning include burning of the mouth, dysphagia, nausea, hematemesis, gross hematuria, and dysuria. Mucosal erosion and hemorrhage is seen in the upper gastrointestinal (GI) tract. Renal dysfunction is common and related to acute tubular necrosis and glomerular destruction.
- ^ https://www.fda.gov/downloads/Drugs/…/PharmacyCompounding/UCM467373.pdf[bare URL PDF]
- ^ «Cantharidin Application in Molluscum Patients — Full Text View — ClinicalTrials.gov». 28 May 2020.
- ^ a b Moed, L.; Shwayder, T. A.; Chang, M. W. (2001). «Cantharidin revisited: A blistering defense of an ancient medicine». Archives of Dermatology. 137 (10): 1357–1360. doi:10.1001/archderm.137.10.1357. PMID 11594862.
- ^ Shamloul, R. (2010). «Natural aphrodisiacs». The Journal of Sexual Medicine. 7 (1 Pt 1): 39–49. doi:10.1111/j.1743-6109.2009.01521.x. PMID 19796015.
- ^ Sandroni, P. (2001). «Aphrodisiacs past and present: A historical review». Clinical Autonomic Research. 11 (5): 303–307. doi:10.1007/BF02332975. PMID 11758796. S2CID 32348540.
Cantharidin («Spanish fly») is a chemical with vesicant properties derived from blister beetles, which has been used for millennia as a sexual stimulant by both sexes. Its mode of action is by inhibition of phosphodiesterase and protein phosphatase activity and stimulation of β-receptors, inducing vascular congestion and inflammation. Morbidity from its abuse is significant. The gastrointestinal tract sustains the brunt of toxicity, resulting in fatal hemorrhages. Renal toxicity is a result of its renal excretion, which may lead to acute tubular necrosis. Cardiac effects are most likely due to hemorrhagic shock, but they also can be due to myofibril degeneration, mitochondrial swelling, and pericardial and subendocardial hemorrhages.
- ^ Bertaux, B.; Prost, C.; Heslan, M.; Dubertret, L. (1988). «Cantharide acantholysis: endogenous protease activation leading to desmosomal plaque dissolution». British Journal of Dermatology. 118 (2): 157–165. doi:10.1111/j.1365-2133.1988.tb01769.x. PMID 3279999. S2CID 45714898.
- ^ «Verrica Pharmaceuticals Announces Extension of FDA Review Period of its NDA for VP-102 for the Treatment of Molluscum Contagiosum». drugs.com. May 28, 2021.
- ^ Ghaffarifar, F. (2010). «Leishmania major: In vitro and in vivo anti-leishmanial effect of cantharidin». Experimental Parasitology. 126 (2): 126–129. doi:10.1016/j.exppara.2010.04.004. PMID 20435039.
- ^ Ratcliffe, N. A.; Mello, C. B.; Garcia, E. S.; Butt, T. M.; Azambuja, P. (2011). «Insect natural products and processes: New treatments for human disease». Insect Biochemistry and Molecular Biology. 41 (10): 747–769. doi:10.1016/j.ibmb.2011.05.007. PMID 21658450.
- ^ Chen, Y. N.; Cheng, C. C.; Chen, J. C.; Tsauer, W.; Hsu, S. L. (2003). «Norcantharidin-induced apoptosis is via the extracellular signal-regulated kinase and c-Jun-NH2-terminal kinase signaling pathways in human hepatoma HepG2 cells». British Journal of Pharmacology. 140 (3): 461–470. doi:10.1038/sj.bjp.0705461. PMC 1574052. PMID 12970086.
- ^ Zhang, C.; Peng, Y.; Wang, F.; Tan, X.; Liu, N.; Fan, S.; Wang, D.; Zhang, L.; Liu, D.; Wang, T.; Wang, S.; Zhou, Y.; Su, Y.; Cheng, T.; Zhuang, Z.; Shi, C. (2010). «A synthetic cantharidin analog for the enhancement of doxorubicin suppression of stem cell-derived aggressive sarcoma». Biomaterials. 31 (36): 9535–9543. doi:10.1016/j.biomaterials.2010.08.059. PMID 20875681.
- ^ Dorn, D. C.; Kou, C. A.; Png, K. J.; Moore, M. A. S. (2009). «The effect of cantharidins on leukemic stem cells». International Journal of Cancer. 124 (9): 2186–2199. doi:10.1002/ijc.24157. PMID 19123473. S2CID 38088568.
- ^ Li, W.; Xie, L.; Chen, Z.; Zhu, Y.; Sun, Y.; Miao, Y.; Xu, Z.; Han, X. (2010). «Cantharidin, a potent and selective PP2A inhibitor, induces an oxidative stress-independent growth inhibition of pancreatic cancer cells through G2/M cell-cycle arrest and apoptosis». Cancer Science. 101 (5): 1226–1233. doi:10.1111/j.1349-7006.2010.01523.x. PMID 20331621. S2CID 24345174.
Further reading[edit]
- Dupuis, Gérard & Berland, Nicole (2004). «Cantharidin: Origin and synthesis,» Lille, FR: Lycée Faidherbe, see [1], accessed 13 December 2015.
External links[edit]
- Cantharidin
- Molecule of the Month
- Cantharidin Revisited: Blistering Defense of an Ancient Medicine