Международное непатентованное наименование (МНН):
Rec.INN
зарегистрированное ВОЗ
Входит в состав препаратов:
список
Фармакологические (биологические) свойства и эффекты
НПВП, производное пропионовой кислоты. Обладает противовоспалительным, анальгезирующим и жаропонижающим действием. В цикле арахидоновой кислоты карпрофен преимущественно ингибирует ЦОГ-2, в результате чего блокируется синтез простагландинов, вызывающих воспаление, отек и боль. В терапевтических дозах карпрофен значительно слабее действует на ЦОГ-1, благодаря чему не влияет на синтез протективных простагландинов. Таким образом, карпрофен не препятствует нормальным физиологическим процессам в тканях, желудке, кишечнике, почках и тромбоцитах.
При пероральном применении быстро всасывается из ЖКТ, достигая максимальной концентрации в плазме крови через 1-3 ч после введения. Биодоступность — более 90%. При парентеральном введении быстро всасывается из места инъекции, поступает в кровь и большинство органов и тканей. Карпрофен более чем на 99% связывается с белками плазмы крови. Метаболизируется в печени, выделяется в основном с фекалиями (около 80%) и частично с мочой. Период полувыведения карпрофена из организма собак составляет около 8-10 ч, у кошек — около 19 ч.
По степени воздействия на организм относится к умеренно опасным веществам (3 класс опасности по ГОСТ 12.1.007).
Показания к применению препарата КАРПРОФЕН
Собакам и кошкам при острых и хронических заболеваниях опорно-двигательного аппарата (артрозы, артриты, вывихи, грыжи межпозвоночных дисков); для снятия воспалительных и болевых реакций в послеоперационном периоде; во время премедикации или при проведении анестезии.
Порядок применения
Вводят в/в и п/к или применяют перорально. Раствор для инъекций запрещается вводить в/м.
Режим дозирования устанавливают в зависимости от вида животного, показаний, применяемой лекарственной формы.
Продолжительность курса лечения при заболеваниях опорно-двигательного аппарата зависит от состояния животного.
Побочные эффекты
В рекомендуемых дозах карпрофен хорошо переносится собаками и кошками. В некоторых случаях, как и при применении других НПВП, у животного могут наблюдаться апатия, потеря аппетита, рвота, диарея, изменение биохимических показателей функции почек. Указанные симптомы после отмены препарата в большинстве случаев обычно проходят самостоятельно. В редких случаях возможно развитие воспалительного процесса в месте инъекции.
При развитии аллергических реакций животному назначают антигистаминные и симптоматические средства.
При передозировке карпрофена у животного может наблюдаться апатия, рвота, диарея, бледность слизистых оболочек, в редких случаях — желудочно-кишечные кровотечения. Специфический антидот отсутствует, животному назначают симптоматические средства и поддерживающую терапию.
Противопоказания к применению препарата КАРПРОФЕН
Индивидуальная повышенная чувствительность животного к карпрофену, язва желудка и двенадцатиперстной кишки, геморрагический синдром, тяжелая форма почечной недостаточности; запрещается применение у беременных самок.
Животным с заболеваниями сердца, почек и печени, гиповолемией карпрофен следует применять с осторожностью, под наблюдением ветеринарного врача.
Особые указания и меры личной профилактики
Карпрофен совместим с лекарственными препаратами, применяемыми для премедикации и анестезии.
Не следует применять карпрофен одновременно с другими НПВП, диуретиками, антикоагулянтами, глюкокортикоидами и другими лекарственными средствами с высокой степенью связывания с белками плазмы, а также в течение 24 ч до их применения и 24 ч после окончания их применения (вероятность взаимного усиления токсического действия).
Возможность применения карпрофена животным в период лактации и щенкам моложе 6-недельного возраста определяет ветеринарный врач на основании оценки соотношения предполагаемой пользы и потенциального риска от применения препарата.
Карпрофен не предназначен для применения продуктивным животным.
При применении карпрофена следует соблюдать общие правила личной гигиены и техники безопасности, предусмотренные при работе с лекарственными препаратами для животных.
Карпрофен
(Carprophenum)
Содержание
-
Структурная формула
-
Русское название
-
Английское название
-
Латинское название
-
Химическое название
-
Брутто формула
-
Код CAS
Структурная формула
Русское название
Карпрофен
Английское название
Carprofen
Латинское название
Carprophenum (род. Carpropheni)
Химическое название
(+-)-6-Хлор-альфа-метилкарбазол-2-уксусная кислота
Брутто формула
C15H12ClNO2
Код CAS
53716-49-7
Наш сайт использует файлы cookie, чтобы улучшить работу сайта, повысить его эффективность и удобство. Продолжая использовать сайт rlsnet.ru, вы соглашаетесь с условиями использования файлов cookie.
Нестероидный противовоспалительный препарат
 |
|
| Клинические данные | |
|---|---|
| AHFS / Drugs.com | Профессиональная информация о лекарствах FDA |
| Код ATCvet |
|
| Правовой статус | |
| Правовой статус |
|
| Фармакокинетические данные | |
| Связывание с белками | Высокая (99%) |
| Период полувыведения | Приблизительно 8 часов (диапазон 4,5–9,8 часов) у собак |
| Идентификаторы | |
Название IUPAC
|
|
| Номер CAS |
|
| PubChem CID |
|
| IUPHAR / BPS |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| KEGG |
|
| ChEBI |
|
| ChEMBL |
|
| CompTox Dashboard (EPA ) |
|
| ECHA InfoCard | 100.053.357 |
| Химические и физические данные | |
| Формула | C15H12ClNO 2 |
| Молярная масса | 273,72 г · моль |
| 3D-модель (JSmol ) |
|
| Хиральность | Рацемическая смесь ure |
УЛЫБКИ
|
|
InChI
|
|

Карпрофен, продается под многими торговыми марками по всему миру находится нестероидный противовоспалительный препарат (НПВП), который ветеринары назначают в качестве поддерживающего лечения различных состояний у животных. Он обеспечивает ежедневное лечение боли и воспаления от различных видов боли в суставах, а также послеоперационной боли. Карпрофен уменьшает воспаление путем ингибирования COX-1 и COX-2 ; его специфичность в отношении ЦОГ-2 варьируется от вида к виду.
Содержание
- 1 Использование у собак
- 1.1 Побочные эффекты
- 2 Использование человеком
- 3 Использование лошадьми
- 4 Торговые марки и лекарственные формы для использование в ветеринарии
- 5 Ссылки
Использование у собак
Побочные эффекты
Большинство собак хорошо реагируют на прием карпрофена, но, как и все НПВП, он может вызывать проблемы с желудочно-кишечным трактом, печенью и почками. некоторые пациенты.
В 1999 г. FDA получило более 6000 анекдотических сообщений о внезапной смерти животных после использования карпрофена марки Pfizer Rimadyl. В результате FDA потребовало, чтобы Pfizer сообщал потребителям в своей рекламе, что смерть является возможным побочным эффектом. Pfizer отказалась и отозвала свою рекламу; однако теперь они включают смерть как возможный побочный эффект на этикетке препарата. Планируется, что ветеринарам будет отправлено письмо «Уважаемый доктор» и лист безопасности, приложенный к упаковкам таблеток.
Среди побочных эффектов:
- потеря аппетита
- рвота
- диарея
- усиление жажды
- учащение мочеиспускания
- Усталость и / или вялость (сонливость )
- Нарушение координации
- Судороги
- Нарушение функции печени: желтуха (пожелтение глаз)
- Кровь или темный дегтеобразный материал в моче или стуле
- Летаргия
- Шатание, спотыкание, слабость или частичный паралич, полный паралич
- Изменение кожи (покраснение, струпья или царапины)
- Изменение поведения (например, снижение или повышение уровня активности, припадок или агрессия)
Последствия передозировки включают гастрит и образование язв.
У здоровых собак, получавших карпрофен, не сообщалось о периоперационных неблагоприятных воздействиях на сердечно-сосудистую систему в рекомендуемых дозах. Периоперационное введение карпрофена кошкам не влиял на частоту дыхания после операции и частоту сердечных сокращений.
Карпрофен не следует назначать одновременно особенно со стероидами, так как это может вызвать язву желудка. Собакам следует прекратить прием карпрофена в течение трех полных дней перед приемом стероидов (таких как преднизолон ). Карпрофен не следует назначать одновременно с другими лекарствами, такими как другие НПВП (аспирин, этодолак, деракоксиб, мелоксикам, тепоксалин ) или стероиды, такие как дексаметазон, триамцинолон, кортизон или преднизон.
Карпрофен следует применять с осторожностью под наблюдением ветеринара у собак с заболеваниями печени или почек, обезвоживанием, недостаточным кровотечением или другими проблемами со здоровьем. Он не рекомендуется для собак с нарушениями свертываемости крови (такими как болезнь фон Виллебранда ), поскольку безопасность для собак с этими нарушениями не установлена. Не установлено, можно ли безопасно применять карпрофен беременным собакам, собакам, используемым в разведении, или кормящим сукам.
Было проведено несколько лабораторных исследований и клинических испытаний, чтобы установить безопасность использования карпрофена. Клинические исследования были проведены на почти 300 собаках разных пород. Собак лечили Римадилом в рекомендованной дозе в течение 2 недель. Согласно этим исследованиям, препарат клинически хорошо переносился, и у обработанных собак не было более высокой частоты побочных реакций по сравнению с контрольной группой.
Ряд факторов может способствовать высокой частоте нежелательных сообщений. получен для карпрофена Центром ветеринарной медицины в конце 1990-х. К ним относятся:
- тип наркотика;
- широкое употребление;
- продолжительность употребления. Хотя известно, что побочные эффекты карпрофена возникают в течение короткого периода времени после приема, считается, что длительное использование может фактически привести к более высокому риску побочных реакций;
- Использование пожилых собак. Старые собаки, как правило, более склонны к побочным эффектам, вызываемым карпрофеном.
Использование человеком
Карпрофен применялся людьми почти 10 лет, начиная с 1988 года. состояния, как у собак, а именно боль в суставах и воспаление. Побочные эффекты, как правило, были легкими, обычно включали тошноту или желудочно-кишечные боли и диарею. Карпрофен был доступен только по рецепту в дозах от 150 до 600 мг. Дозировка более 250 мг предназначалась только для облегчения боли после тяжелой травмы, такой как послеоперационное воспаление. Дозы 150 мг обычно применялись для облегчения боли при артрите, тогда как дозы 200 мг обычно назначались в случаях тяжелого артрита или сильной воспалительной боли. Препарат принимали внутрь. Компания Pfizer добровольно удалила его с рынка для использования людьми по коммерческим причинам.
Использование лошадьми
Карпрофен можно вводить внутривенно лошадям. Было показано, что однократная доза снижает выработку простагландина E2 и воспалительный экссудат на срок до 15 часов, хотя эффект на продукцию эйкозаноидов меньше, чем у НПВП, таких как фенилбутазон или флуниксин. Простагландин E2 и воспалительный экссудат также уменьшаются, а лейкотриен B4 подавляется. Карпрофен также можно вводить перорально, но внутримышечное введение может вызвать повреждение мышц.
Торговые марки и лекарственные формы для ветеринарного использования
Он продается под многими торговыми марками, включая: Acticarp, Artriofin, Austiofen, Bomazeal., Canidryl, Carporal, Carprieve, Carprocow, Carprodolor, Carprodyl, Carprofelican, Carprofen, Carprofène, Carprofeno, Carprofenum, Carprogesic, Carprosol, Carprotab, Carprox, Comforion, Dolagis, Dolocarpropofen, Norcovurpofen, Norcovurpodia, Остифен, Пролет, Квеллин, Репровал, Римадил, Римифин, Рофенифлекс, Ровера, Рикарфа, Сканодил, Тергив, Ветпрофен и Кселкор.
Ветеринарные лекарственные формы включают таблетки по 25, 75 и 100 мг, а также 50 мг на мл инъекционной формы.
Ссылки
From Wikipedia, the free encyclopedia

Carprofen molecule |
|
| Clinical data | |
|---|---|
| AHFS/Drugs.com | FDA Professional Drug Information |
| Routes of administration |
Oral, injection |
| ATCvet code |
|
| Legal status | |
| Legal status |
|
| Pharmacokinetic data | |
| Protein binding | High (99%) |
| Elimination half-life | Approximately 8 h (range 4.5–9.8 h) in dogs |
| Identifiers | |
|
IUPAC name
|
|
| CAS Number |
|
| PubChem CID |
|
| IUPHAR/BPS |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| KEGG |
|
| ChEBI |
|
| ChEMBL |
|
| CompTox Dashboard (EPA) |
|
| ECHA InfoCard | 100.053.357 |
| Chemical and physical data | |
| Formula | C15H12ClNO2 |
| Molar mass | 273.72 g·mol−1 |
| 3D model (JSmol) |
|
| Chirality | Racemic mixture |
|
SMILES
|
|
|
InChI
|
|
| (verify) |
A 100 mg Rimadyl tablet approximately 19 mm (0.75 in) wide by 8.6 mm (0.34 in) thick, as sold in the USA.
Carprofen is a non-steroidal anti-inflammatory drug (NSAID) of the carbazole and propionic acid class that was previously for use in humans and animals, but is now only available to veterinarians for prescribing as a supportive treatment for various conditions in only animals.[1] Carprofen reduces inflammation by inhibition of COX-1 and COX-2; its specificity for COX-2 varies from species to species.[1] Marketed under many brand names worldwide,[2] carprofen provides day-to-day treatment for pain and inflammation from various kinds of joint pain, as well as post-operative pain.[1]
Human use[edit]
Carprofen was used in humans for almost ten years, starting in 1988. It was used for the same conditions as in dogs, namely joint pain and inflammation. Side effects tended to be mild, usually consisting of nausea or gastrointestinal pain and diarrhoea. It was available only by prescription in 150 mg to 600 mg doses.[3] Dosage over 250 mg was only for relieving pain after severe trauma, such as post-surgery inflammation. 150 mg doses were commonly used to relieve the pain of arthritis, while 200 mg doses were commonly prescribed in cases of severe arthritis or severe inflammation pain. The drug was taken orally. Pfizer voluntarily removed it from the market for human use on commercial grounds.[3]
Veterinary medicine[edit]
Canine use[edit]
Carprofen is one of eleven approved non-steroidal anti-inflammatory drugs for use in dogs.[4] These are non-steroidal anti-inflammatory drugs that aid in the relief of inflammation, pain, and fever. Carprofen can be administered in a pill, chewable tablet, or injection form.[5]
Often, Carprofen is used as a long-term pain management drug, or after a surgical procedure for acute relief of pain and inflammation during the healing process. When using long-term, osteoarthritis is often the targeted condition, since it is common in canine patients, varying across breed, size, and age.[5][6]
For patients in need of acute or chronic pain management, Carprofen is seen to improve energy, activity level, comfort, and general wellbeing of the dog.[6]
Adverse effects[edit]
Most dogs respond well to carprofen use, but like all NSAIDs, it may cause gastrointestinal, liver, and kidney problems in some patients.[7]
In 1999, the Food and Drug Administration (FDA) in the USA had more than 6000 anecdotal reports of sudden animal death after usage of Pfizer’s Rimadyl brand of carprofen. As a result, the FDA requested that Pfizer advise consumers in their advertising that death is a possible side effect.[8] Pfizer refused and pulled their advertising; however, they now include death as a possible side effect on the drug label. Plans call for a ‘Dear Doctor’ letter to advise veterinarians, and a safety sheet attached to pill packages.
Adverse effects should be monitored and brought to your local veterinarian’s attention when a patient is on an NSAID for chronic pain management.[9]
Adverse effects include:
- Loss of appetite
- Vomiting
- Diarrhea
- Increase in thirst
- Increase in urination
- Fatigue and / or lethargy (drowsiness)
- Loss of coordination
- Seizures
- Liver dysfunction: jaundice (yellowing of eyes)
- Blood or dark tar-like material in urine or stools
- Lethargy
- Staggering, stumbling, weakness or partial paralysis, full paralysis[10]
- Change in skin (redness, scabs, or scratching)
- Change in behavior (such as decreased or increased activity level, seizure or aggression)[11]
- In rare situations, death has been associated with some of the adverse reactions listed above.[12]
Effects of overdose include gastritis and ulcer formation.[13]
In healthy dogs given carprofen, no perioperative adverse effects on the cardiovascular system have been reported at recommended dosages.[14][15] Perioperative administration of carprofen to cats did not affect postoperative respiratory rate nor heart rate.[16]
Carprofen should not be administered concurrently with steroids, as this can cause ulcers in the stomach. Dogs should be taken off carprofen for three full days before ingesting a steroid (such as prednisolone). Carprofen should not be given at the same time with other types of medications, such as other NSAIDs (aspirin, etodolac, deracoxib, meloxicam, tepoxalin), or steroids such as dexamethasone, triamcinolone, cortisone, or prednisone.[medical citation needed]
Carprofen must be used with caution within the supervision of a veterinarian in dogs with liver or kidney disease, dehydration, bleeding deficits, or other health problems. It is not recommended for use in dogs with bleeding disorders (such as Von Willebrand’s disease), as safety has not been established in dogs with these disorders.[17] It has not been established whether carprofen can be safely used in pregnant dogs, dogs used for breeding purposes, or in lactating dogs.
Several laboratory studies and clinical trials have been conducted to establish the safety of using carprofen. Clinical studies were conducted in nearly 300 dogs of different breeds. The dogs were treated with Rimadyl at the recommended dose for two weeks. According to these studies, the drug was clinically well tolerated, and the treated dogs did not have a greater incidence of adverse reactions when compared to the control group.[18][medical citation needed]
A number of factors may contribute to the high incidence of adverse reports received for carprofen by the Center for Veterinary Medicine in the late 1990s. These include:
- The type of drug;
- Wide use;
- Duration of use. Long-term use can result in a higher risk for adverse reactions. It is recommended that blood tests for liver and kidney function are performed both prior to starting and regularly while on NSAIDs to monitor the patient’s tolerance;[19]
- Senior dog use. Older dogs are generally more prone to side effects caused by carprofen.[medical citation needed]
Equine use[edit]
Carprofen may be administered intravenously to horses.[20] A single dose has been shown to reduce prostaglandin E2 production and inflammatory exudate for up to 15 hours,[21] although there was less effect on eicosanoid production when compared to the effects produced by NSAIDs such as phenylbutazone or flunixin.[22] Prostaglandin E2 and inflammatory exudate are also reduced and leukotriene B4 is inhibited. Carprofen can also be given orally, but intramuscular use may produce muscle damage.[23]
Brands and dosage forms for veterinary use[edit]
It is marketed under many brand names including: Acticarp, Artriofin, Austiofen, Bomazeal, Canidryl, Carporal, Carprieve, Carprocow, Carprodolor, Carprodyl, Carprofelican, Carprofen, Carprofène, Carprofeno, Carprofenum, Carprogesic, Carprosol, Carprotab, Carprox, Comforion, Dolagis, Dolocarp, Dolox, Eurofen, Kelaprofen, Librevia, Norocarp, Norodyl, Novocox, Ostifen, Prolet, Quellin, Reproval, Rimadyl, Rimifin, Rofeniflex, Rovera, Rycarfa, Scanodyl, Tergive, Vetprofen, and Xelcor.[2]
Veterinary dosage forms include 25 mg, 75 mg, and 100 mg tablets, and 50 mg per mL injectable form.[1][24]
References[edit]
- ^ a b c d e «Rimadyl (carprofen) prescribing information leaflet» (PDF). www2.ZoetisUS.com. Zoetis Inc. Retrieved 5 February 2022.
- ^ a b «International brand names for Carprofen». www.Drugs.com. Drugs.com. Retrieved 4 October 2017.
- ^ a b «Committee for Veterinary Medicinal Products: Carprofen» (PDF). www.EMA.Europa.eu. European Agency for the Evaluation of Medicinal Products. 2009.
- ^ «Animal Drugs @ FDA — NSAID labels». AnimalDrugsAtFDA.FDA.gov. US FDA. Retrieved 16 November 2021.
- ^ a b Burke, Anna (10 November 2016). «Rimadyl for Dogs – uses, side effects & alternatives». www.AKC.org. American Kennel Club. Retrieved 16 November 2021.
- ^ a b «Rimadyl». www.ZoetisPetCare.com. Retrieved 16 November 2021.
- ^ Reimer, Michele E.; Johnston, Spencer A.; Leib, Michael S.; Duncan, Robert B.; Reimer, David C.; Marini, Michele; Gimbert, Kimberly (September 1999). «The gastroduodenal effects of buffered aspirin, carprofen, and etodolac in healthy dogs». Journal of Veterinary Internal Medicine. 13 (5): 472–477. doi:10.1111/j.1939-1676.1999.tb01465.x. ISSN 0891-6640. PMID 10499732.
- ^ «Update on Rimadyl». www.FDA.gov. FDA’s Center for Veterinary Medicine. 1 December 1999. Archived from the original on 8 September 2014. Retrieved 16 December 2019.
- ^ Luna, Stelio P. L.; Basílio, Ana C.; Steagall, Paulo V. M.; Machado, Luciana P.; Moutinho, Flávia Q.; Takahira, Regina K.; Brandão, Cláudia V. S. (1 March 2007). «Evaluation of adverse effects of long-term oral administration of carprofen, etodolac, flunixin meglumine, ketoprofen, and meloxicam in dogs». American Journal of Veterinary Research. 68 (3): 258–264. doi:10.2460/ajvr.68.3.258. PMID 17331014.
- ^ «A review of signs of a potentially life-threatening reaction to Rimadyl». www.srdogs.com. Retrieved 20 May 2010.
- ^ «Dog owner information about Rimadyl (carprofen)». www.Rimadyl.com. Pfizer. Retrieved 20 May 2010.
- ^ «Carprofen For Dogs: Dosage, Side Effects, And Alternatives». Relievet. Retrieved 2022-07-21.
- ^ «Generic dog Rimadyl online». RimadylOnline.com. Archived from the original on 15 July 2011. Retrieved 15 July 2011.
- ^ Boström IM, Nyman GC, Lord PE, Häggström J, Jones BE, Bohlin HP (May 2002). «Effects of carprofen on renal function and results of serum biochemical and hematologic analyses in anesthetized dogs that had low blood pressure during anesthesia». American Journal of Veterinary Research. 63 (5): 712–21. doi:10.2460/ajvr.2002.63.712. PMID 12013473.
- ^ Frendin JH, Boström IM, Kampa N, Eksell P, Häggström JU, Nyman GC (December 2006). «Effects of carprofen on renal function during medetomidine-propofol-isoflurane anesthesia in dogs». American Journal of Veterinary Research. 67 (12): 1967–1973. doi:10.2460/ajvr.67.12.1967. PMID 17144795.
- ^ Höglund OV, Dyall B, Gräsman V, Edner A, Olsson U, Höglund K (October 2018). «Effect of non-steroidal anti-inflammatory drugs on postoperative respiratory and heart rate in cats subjected to ovariohysterectomy». Journal of Feline Medicine and Surgery. 20 (10): 980–984. doi:10.1177/1098612X17742290. PMID 29165006. S2CID 30649716.
- ^ «Rimadyl (Carprofen)». www.VetDepot.com. Vet Depot. Archived from the original on 23 May 2010. Retrieved 20 May 2010.
- ^ «Rimadyl [package insert]» (PDF). www.Rimadyl.com. New York: Pfizer Animal Health. 2007. Retrieved 13 August 2014.
- ^ «Get the facts about pain relievers for pets». www.FDA.gov. Center for Veterinary Medicine. 3 November 2020.
- ^ McIlwraith CW, Frisbie DD, Kawcak CE (2001). «Nonsteroidal Anti-Inflammatory Drugs». Proc. AAEP (47): 182–187.
- ^ Lees P, McKellar Q, May SA, Ludwig B (May 1994). «Pharmacodynamics and pharmacokinetics of carprofen in the horse». Equine Veterinary Journal. 26 (3): 203–208. doi:10.1111/j.2042-3306.1994.tb04370.x. PMID 8542839.
- ^ Lees P, Ewins CP, Taylor JB, Sedgwick AD (1987). «Serum thromboxane in the horse and its inhibition by aspirin, phenylbutazone and flunixin». The British Veterinary Journal. 143 (5): 462–476. doi:10.1016/0007-1935(87)90024-8. PMID 3119142.
- ^ McKellar QA, Bogan JA, von Fellenberg RL, Ludwig B, Cawley GD (July 1991). «Pharmacokinetic, biochemical and tolerance studies on carprofen in the horse». Equine Veterinary Journal. 23 (4): 280–284. doi:10.1111/j.2042-3306.1991.tb03718.x. PMID 1915228.
- ^ «Carprofen (Veterinary – Systemic)» (PDF). The United States Pharmacopeial Convention. 2007.
External links[edit]
Media related to Carprofen at Wikimedia Commons
 |
|
| Клинические данные | |
|---|---|
| AHFS / Drugs.com | Информация о профессиональных лекарствах FDA |
| Код ATCvet | |
| Правовой статус | |
| Правовой статус | |
| Фармакокинетические данные | |
| Связывание с белками | Высокая (99%) |
| Ликвидация Период полураспада | Примерно 8 часов (от 4,5 до 9,8 часов) у собак |
| Идентификаторы | |
|
Название ИЮПАК
|
|
| Количество CAS | |
| PubChem CID | |
| IUPHAR / BPS | |
| DrugBank | |
| ChemSpider | |
| UNII | |
| КЕГГ | |
| ЧЭБИ | |
| ЧЭМБЛ | |
| CompTox Dashboard ( EPA ) | |
| ECHA InfoCard |
100.053.357 |
| Химические и физические данные | |
| Формула | C 15 H 12 Cl N O 2 |
| Молярная масса | 273,72 г · моль -1 |
| 3D модель ( JSmol ) | |
| Хиральность | Рацемическая смесь |
|
Улыбки
|
|
|
ИнЧИ
|
|
|
(проверить) |
Таблетка Римадила 100 мг шириной примерно 19 мм (0,75 дюйма) и толщиной 8,6 мм (0,34 дюйма), продаваемая в США.
Карпрофен , продаваемый под многими торговыми марками по всему миру, представляет собой нестероидный противовоспалительный препарат (НПВП), который ветеринары назначают в качестве поддерживающего лечения различных состояний у животных. Это обеспечивает лечение изо дня в день для боли и воспаления из различных видов совместной боли, а также послеоперационную боль. Карпрофен уменьшает воспаление за счет ингибирования ЦОГ-1 и ЦОГ-2 ; его специфичность к ЦОГ-2 варьируется от вида к виду.
Использование у собак
Побочные эффекты
Большинство собак хорошо реагируют на прием карпрофена, но, как и все НПВП, у некоторых пациентов он может вызывать проблемы с желудочно-кишечным трактом, печенью и почками.
В 1999 году FDA было более чем 6000 анекдотические сообщения о внезапной смерти животных после использования Пфайзер Римадиле марки «s из карпрофена. В результате FDA потребовало, чтобы Pfizer сообщал потребителям в своей рекламе, что смерть является возможным побочным эффектом. Pfizer отказалась и отозвала свою рекламу; однако теперь они включают смерть как возможный побочный эффект на этикетке препарата. Планируется, что ветеринарам будет отправлено письмо «Уважаемый доктор», а к упаковкам таблеток приложен лист безопасности.
Побочные эффекты включают:
- Потеря аппетита
- Рвота
- Диарея
- Усиление жажды
- Учащение мочеиспускания
- Утомляемость и / или вялость ( сонливость )
- Потеря координации
- Судороги
- Нарушение функции печени: желтуха (пожелтение глаз)
- Кровь или темный дегтеобразный материал в моче или стуле
- Вялость
- Пошатывание, спотыкание, слабость или частичный паралич , полный паралич
- Изменение кожи (покраснение, струпья или царапины)
- Изменение поведения (например, снижение или повышение уровня активности, припадки или агрессия)
Последствия передозировки включают гастрит и образование язв.
У здоровых собак, получавших карпрофен, не сообщалось о периоперационных побочных эффектах на сердечно-сосудистую систему в рекомендуемых дозах. Периоперационное введение карпрофена кошкам не повлияло на послеоперационную частоту дыхания и частоту сердечных сокращений.
Карпрофен не следует назначать одновременно со стероидами, так как это может вызвать язву желудка. Собакам следует прекратить прием карпрофена в течение трех полных дней перед приемом стероидов (например, преднизолона ). Карпрофен не следует назначать одновременно с другими типами препаратов , таких как другие НПВС ( аспирин , этодолака , деракоксиб , мелоксикам , tepoxalin ) или стероиды , такие как дексаметазон , триамцинолон , кортизон или преднизон .
Карпрофен следует применять с осторожностью под наблюдением ветеринара у собак с заболеваниями печени или почек, обезвоживанием , недостаточным кровотечением или другими проблемами со здоровьем. Он не рекомендуется для собак с нарушениями свертываемости крови (такими как болезнь фон Виллебранда ), поскольку безопасность для собак с этими нарушениями не установлена. Не установлено, можно ли безопасно использовать карпрофен у беременных собак, собак, используемых в целях разведения, или у кормящих собак.
Было проведено несколько лабораторных исследований и клинических испытаний, чтобы установить безопасность использования карпрофена. Клинические исследования были проведены на почти 300 собаках разных пород . Собак лечили Римадилом в рекомендованной дозе в течение 2 недель. Согласно этим исследованиям, препарат клинически хорошо переносился, и у обработанных собак не было большей частоты побочных реакций по сравнению с контрольной группой.
Ряд факторов может способствовать высокой частоте нежелательных сообщений о карпрофене, полученных Центром ветеринарной медицины в конце 1990-х годов. Они включают:
- Тип препарата;
- Широкое использование;
- Продолжительность использования. Хотя известно, что побочные эффекты карпрофена возникают в течение короткого периода времени после приема, считается, что длительное применение может фактически привести к более высокому риску побочных реакций;
- Использование пожилых собак. Старые собаки обычно более подвержены побочным эффектам, вызванным карпрофеном.
Использование человеком
Карпрофен применялся для лечения людей почти 10 лет, начиная с 1988 г. Его применяли при тех же состояниях, что и у собак, а именно при болях в суставах и воспалениях. Побочные эффекты, как правило, были легкими, обычно состояли из тошноты или желудочно-кишечных болей и диареи. Карпрофен отпускался только по рецепту врача в дозах от 150 до 600 мг. Дозировка более 250 мг предназначена только для снятия боли после тяжелой травмы, такой как послеоперационное воспаление. Дозы 150 мг обычно применялись для облегчения боли при артрите, тогда как дозы 200 мг обычно назначались в случаях тяжелого артрита или сильной воспалительной боли. Препарат принимали внутрь. Компания Pfizer добровольно удалила его с рынка для использования людьми по коммерческим причинам.
Использование лошадей
Карпрофен можно вводить лошадям внутривенно . Было показано, что однократная доза снижает выработку простагландина E2 и воспалительный экссудат на срок до 15 часов, хотя эффект на выработку эйкозаноидов меньше, чем у НПВП, таких как фенилбутазон или флуниксин . Простагландин E2 и воспалительный экссудат также уменьшаются, а лейкотриен B4 ингибируется. Карпрофен также можно вводить перорально, но внутримышечное введение может вызвать повреждение мышц.
Марки и лекарственные формы для ветеринарии
Он продается под многими торговыми марками, в том числе: Acticarp, Artriofin, Austiofen, Bomazeal, Canidryl, Carporal, Carprieve, Carprocow, Carprodolor, Carprodyl, Carprofelican, Carprofen, Carprofène, Carprofeno, Carprofenum, Carprolprogesic, Carprogésic , Долокарп, Долокс, Еврофен, Келапрофен, Либревия, Норокарп, Нородил, Новококс, Остифен, Пролет, Квеллин, Репровал, Римадил, Римифин, Рофенифлекс, Ровера, Рикарфа, Сканодил, Тергив, Ветпрофен и Кселкор.
Ветеринарные лекарственные формы включают таблетки по 25, 75 и 100 мг и инъекционные формы по 50 мг на мл.
Ссылки
Лазаренко Л.В.
1
1 ФКОУ ВО Пермский институт ФСИН России
Исследована роль провоспалительного цитокина – фактора некроза опухоли α (TNFα) – в развитии панкреатопатии, модель которой получили путем применения карпрофена (группа селективных НПВП) в течение 21 дня. Опыт проводился на экспериментальных животных (крысах), опытные группы получали разные дозировки препарата: 4 мг/кг (рекомендована производителем), 8 мг/кг,
20 мг/кг, 40 мг/кг. Изучали экспрессию рецепторов TNFα на мембранах клеток поджелудочной железы животных иммуногистохимическим методом. Полученные результаты сравнивали с материалом, полученным от интактных животных контрольной группы. Выявлено, что экспрессия рецепторов TNFα (TNFαR1) выявляется в эндокринной части поджелудочной железы и имеет локальный характер. Было обнаружено проявление экспрессии TNFαR1 у интактных животных. Анализ результатов показал,
что у животных опытных групп размер площади экспрессии TNFαR1 зависит от дозировки препарата. Максимальная площадь экспрессии наблюдалась в группе, получавшей дозу карпрофена, рекомендованную производителем. У животных, которым применяли пятикратную и десятикратную дозы препарата, размер площади экспрессии был меньше по сравнению с контрольной группой. Обнаруженные при проведении эксперимента изменения обусловлены действием карпрофена на поджелудочную железу.
карпрофен
экспрессия рецепторов
фактор некроза опухоли-α
1. Лесная О.А., Русанова Е.И., Прокофьева Е.Б., Фрейре да Сильва Т. Рациональное применение НПВП в свете клинических рекомендаций и данных новых исследований // Трудный пациент. 2019. Т. 17. № 10. С. 31-34.
2. Ельцова А.А., Бойко Т.В. Результаты анализа факторов, определяющих рациональное назначение нестероидных противовоспалительных лекарственных препаратов для животных // Вестник КрасГАУ. 2019. № 1 (142). С. 107-111.
3. Римадил Р инструкция по применению. Vidal. Справочник лекарственных средств. [Электронный ресурс]. URL: https://www.vidal.ru/veterinar/rimadyl-28016 (дата обращения: 12.11.2022).
4. Калашникова О.В. Отравление НПВП // Ветеринарный Петербург. 2021. № 2. [Электронный ресурс]. URL: https://spbvet.info/zhurnaly/2-2021/otravlenie-npvp/ (дата обращения: 12.11.2022).
5. Hussain N., Akram Z., Okachi Oparanma C., Sheheryar S. Role of NSAIDs in the Prevention of Post-ERCP Pancreatitis: A Narrative Review. Arch Intern Med Res. 2021. no. 4 (2). P. 134-141. DOI: 10.26502 / aimr.0064.
6. Тарасенко В.С., Кубышкин В.А., Демин Д.Б., Волков Д.В., Смолягин А.И., Чукина О.В. Иммунологические нарушения при панкреонекрозе и их коррекция // Хирургия. Журнал им. Н.И. Пирогова. 2013. № 1. С. 88-95.
7. Подолужный В.И. Острый панкреатит: современные представления об этиологии, патогенезе, диагностике и лечении // Фундаментальная и клиническая медицина . 2017. № 4. С. 62-71.
8. Bradley J.R. TNF-mediated inflammatory disease. J. Pathol. 2008. vol. 214. no. 2. P. 149-160. DOI: 10.1002/path.2287.
9. Воронина Е.В., Лобанова Н.В., Яхин И.Р., Романова Н.А., Серегин Ю.А. Роль фактора некроза опухолей-альфа в иммунопатогенезе заболеваний различной этиологии и его значимость в развитии антицитокиновой терапии моноклональными антителами // Медицинская иммунология. 2018. № 6. С. 797-806.
10. Лазаренко Л.В., Косарева П.В. Изменения ткани поджелудочной железы, индуцированные приемом карпрофена у экспериментальных животных // Современные проблемы науки и образования. 2017. № 6. [Электронный ресурс]. URL: https://science-education.ru/ru/article/view?id=27329 (дата обращения: 12.11.2022)..
11. Stendahl J.C., Kaufman D.B., Stupp S.I. Extracellular Matrix in Pancreatic Islets: Relevance to Scaffold Design and Transplantation. Cell Transplant. 2009. no. 18 (1). P. 1-12. DOI: 10.3727/096368909788237195.
12. Kalliolias G.D., Ivashkiv L.B. TNF biology, pathogenic mechanisms and emerging therapeutic strategies. Nat. Rev. Rheumatol. 2016. vol. 12. no. 1. P. 49-62. DOI: 10.1038/nrrheum.2015.169.
13. Винокурова Л.В., Дроздов В.Н., Березина О.И., Шулятьев И.С., Варванина Г.Г., Немежинский В.И. Особенности течения сахарного диабета при хроническом панкреатите // Экспериментальная и клиническая гастроэнтерология. 2011. № 7. С. 59-63.
14. Лазаренко Л.В., Косарева П.В. Оценка экспрессии рецептора фактора некроза опухоли в ткани поджелудочной железы у животных при НПВП-ассоциированной панкреатопатии // Вестник Пермского университета. Серия Биология. 2017. № 4. С. 262-267.
Назначение нестероидных противовоспалительных препаратов (НПВП) длительным курсом достаточно часто сопровождается побочными реакциями в органах пищеварительной системы. Тем не менее НПВП, как традиционные, так и селективные ингибиторы фермента циклооксигеназы-2 (ЦОГ-2), до настоящего времени являются главными средствами выбора при лечении воспаления и боли [1], в том числе у животных. Животным НПВП назначают при травмах, сопровождающихся болевым синдромом, болезнях костной и мышечной систем, после оперативного вмешательства [2].
По имеющейся статистике, препараты, в состав которых включен карпрофен, назначаются животным чаще по сравнению с другими аналогами [2]. Карпрофен является селективным НПВП – влияет преимущественно на ЦОГ-2, которая индуцируется в ответ на развитие воспаления [3]. По данным авторов, этот препарат чаще всего вызывает побочные эффекты. При использовании карпрофена в терапевтических дозировках формирование нежелательных реакций у животных наблюдается в 17,7% случаев, в том числе – развитие токсического гепатита [2]. Чаще всего гепатопатия развивается в первые три недели приема препаратов, продолжение приема может привести к прогрессированию поражения печени [4].
В современных научных источниках содержится мало информации о том, что НПВП могут провоцировать патологические изменения поджелудочной железы и быть причиной острого панкреатита [5]. Эта проблема представляет бесспорный интерес, так как препараты данной группы назначают как средство для снятия боли при панкреатите.
По настоящее время механизм развития панкреатопатии, вызванной применением НПВП, до конца не изучен. Работы, посвященные изучению патогенеза панкреатитов, обнаруживают, что развитие воспаления происходит при участии цитокинов. Под влиянием различных факторов в панкреацитах активируются ферменты, приводящие к высвобождению провоспалительных цитокинов (в том числе фактора некроза опухоли, TNFα), а затем формируется местная воспалительная реакция [6, 7].
Первоначально TNFα был описан как фактор, который может вызывать некроз опухолей, в дальнейшем он предопределяется как основной регулятор воспалительной реакции. Многочисленные исследования, направленные на изучение биологических функций TNFα, установили, что данный цитокин играет основную роль в иммунопатогенезе многих заболеваний [8, 9]. Несмотря на сведения, накопленные в области изучения различных функций TNFα, исследования этого цитокина являются актуальными.
Цель исследований. В условиях эксперимента с использованием иммуногистохимических методов исследовать роль фактора некроза опухоли альфа (TNFα) в развитии панкреатопатии, модель которой была получена в результате длительного применения карпрофена лабораторным крысам.
Материалы и методы исследования. Для моделирования патологии поджелудочной железы использовали препарат ветеринарного назначения «Римадил Р» (некоммерческое название – карпрофен) производства «Pfizer Animal Health» (США) курсом 21 день. Опытные группы формировали из взрослых нелинейных (гетерозиготных) белых крыс. Для изучения полной картины патогенеза экспериментальным животным вводили разные дозировки препарата – терапевтическую и дозы, превышающие ее в два, пять и десять раз. Представлена схема эксперимента (рис. 1).
Рис. 1. Схема эксперимента
Эвтаназию экспериментальных животных проводили на 22-й день опыта путем перерезки спинного мозга с применением эфирного наркоза. После эвтаназии для гистологических исследований отбирали кусочки поджелудочной железы, которые фиксировали в 10%-ном забуференном растворе формалина (pH 7,2), затем обезвоживали и обезжиривали в соответствии со стандартными гистологическими методиками, после чего осуществляли их заливку в парафин (HISTOMIX®). Для оценки патоморфологических изменений паренхимы органа использовали метод окрашивания депарафинированных срезов гематоксилином и эозином.
Проведение иммуногистохимических исследований. Участие TNFα в развитии панкреатопатии изучали по проявлению экспрессии рецепторов цитокина – TNFαR1, локализующихся на клеточной мембране. Применяли непрямой иммуногистохимический метод. Для выявления рецепторов использовали антитела TNFR1 (poly) RabbitAnti-TNF Receptor I PolyclonalAntibody (Bioss) производства компании «Santa Cruz Biotechnology» (США). Для обнаружения антител применяли системы детекции UnoVue detection system.
Гистологические препараты изготавливали на стеклах с адгезивным покрытием Menzel (Германия). Гистологические срезы получали из ранее исследованных фрагментов поджелудочной железы, в которых находили характерные патоморфологические нарушения. Для восстановления антигенных детерминант после формалиновой фиксации тканей железы использовали способ теплового демаскирования антигенов. После экспозиции с антителами гистологические срезы окрашивали DAB (3,3′-диаминобензидином) и докрашивали гематоксилином Майера.
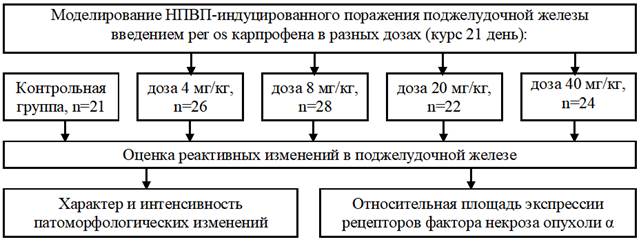
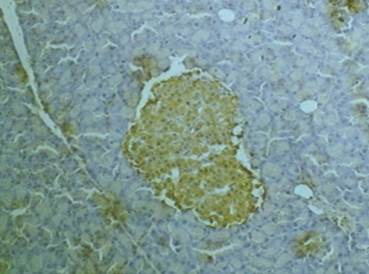
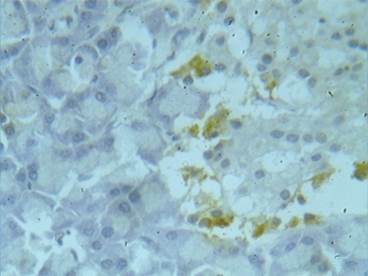
Экспрессию рецепторов на мембране клеток выявляли по коричневой окраске при просмотре препаратов. При изучении гистологических препаратов выявили, что антигенпозитивные окрашенные клетки распределялись только в эндокринной части поджелудочной железы, при этом экспрессия TNFαR1 имела локализованный характер (преимущественно по краям эндокринных островков). По этой причине для количественной оценки экспрессии определяли относительную площадь (в процентах), которую занимали окрашенные клетки, по отношению к площади островка. Для измерения площади экспрессии рецепторов использовали программное обеспечение «измерение произвольной площади» (программа ImageJ, Bio Vision 4.0, Австрия) (рис. 2).
Рис. 2. Измерение произвольной площади экспрессии рецепторов (программное обеспечение Bio Vision), х 150
Для фотосъемки использовали светооптический микроскоп Micros и программу ScopePhoto (CamV 200, Австрия). Для статистической обработки результатов исследования применяли критерий Стьюдента.
Эксперименты проводили в соответствии с «Правилами лабораторной практики в Российской Федерации» (приказ Министерства здравоохранения РФ №708н от 23 августа 2010 г.) и «Европейской конвенцией о защите позвоночных животных, используемых для экспериментов или в иных научных целях» от 18 марта 1986 г.
Результаты исследования и их обсуждение. Гистологические исследования. В соответствии с целью исследования, вначале изучали характер и интенсивность патоморфологических изменений паренхимы поджелудочной железы у животных опытных групп. В результате обнаружили, что длительное применение карпрофена приводит к развитию повреждений в тканях железы, характерных для токсического поражения. В экзокринной части железы наблюдали патоморфологические изменения, такие как отеки межацинарной и междольковой соединительной ткани, белковая и жировая дистрофия, некрозы, появление двуядерных клеток. Нарушения выявляли у животных всех четырех опытных групп, получавших различные дозировки карпрофена (в том числе терапевтическую дозу). Выявили, что при повышении дозы препарата степень нарушений возрастала, таким образом, мы наблюдали дозозависимый эффект. Со стороны эндокринных островков видимых нарушений морфологической структуры при просмотре препаратов не выявлялось [10].
Иммуногистохимические исследования. Изучение гистологических препаратов показало, что проявления экспрессии рецепторов TNFαR1 в эндокринных островках поджелудочной железы наблюдались у животных всех экспериментальных групп, в том числе у интактных (контроль). При этом у животных контрольной группы относительная площадь экспрессии TNFαR1 составляла 8,49±2,23%. Обнаружение экспрессии TNFαR1 у интактных животных можно объяснить тем, что TNFα рассматривается не только как медиатор воспалительных процессов при различных заболеваниях, но и как цитокин, играющий важную роль в регуляции физиологической дифференцировки, роста и метаболизма различных клеток [8]. Научная информация о действии TNFα в эндокринной части поджелудочной железы крайне немногочисленна. Например, имеется предположение, что в границах физиологической нормы инсулин образуется путем активации ядерного фактора NF-kB (NF-kB контролирует различные клеточные реакции, в том числе экспрессию генов апоптоза). Активация ядерного фактора NF-kB выполняется через рецепторы TNFα [11].
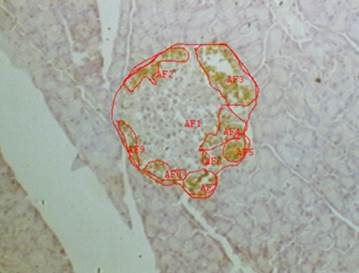
Представлены результаты измерения относительной площади экспрессии TNFαR1 у животных опытных групп, которым применяли карпрофен в разных дозах, по сравнению с группой контроля (рис. 3).
Рис. 3. Относительная площадь экспрессии TNFαR1 (в % от площади островка). Примечания: р – по отношению к результатам контрольной группы: опытная 1 – р=0,084; опытная 2 – р=0,905; опытная 3 – р=0,179; опытная 4 – р=0,069
Оценка размеров экспрессии рецепторов выявила определенную зависимость от дозировки препарата. Из полученных результатов видно, что максимальная площадь экспрессии – 14,51±2,48% – наблюдалась у крыс, получавших 4,0 мг/кг карпрофена, то есть минимальную дозу. В опытных группах, получавших высокие дозы препарата (20,0 и 40 мг/кг), относительная площадь экспрессии была меньше, чем в контроле.
Приведены примеры проявления экспрессии TNFαR1 у животных, получавших терапевтическую (рис. 4) и пятикратную (рис. 5) дозировки карпрофена.
Рис. 4. Экспрессия TNFαR1 в эндокринных островках (поджелудочная железа). Крыса, опытная группа (карпрофен в дозе 4,0 мг/кг, в течение 21 дня). Окраска 3,3′-диаминобензидином и гематоксилином Майера. Увеличение х150
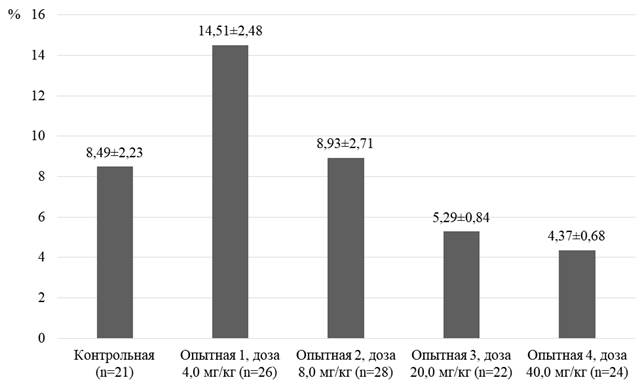
Рис. 5. Экспрессия TNFαR1 в эндокринных островках (поджелудочная железа). Крыса, опытная группа (карпрофен в дозе 20,0 мг/кг, в течение 21 дня). Окраска 3,3′-диаминобензидином и гематоксилином Майера. Увеличение х600
По нашему мнению, изменения площади экспрессии TNFαR1 в эндокринных островках железы у животных опытных групп связаны с действием препарата. В своей работе G.D. Kalliolias, L.B. Ivashkiv (2016) указывают, что сигнальные пути и биологические клеточные эффекты TNFα осуществляются через рецепторы, которые экспрессируются на клетках и обеспечивают различные пути передачи сигналов. Воздействие TNFα на клетку запускает разнообразные сигнальные каскады, которые приводят к целому ряду клеточных реакций, они включают апоптоз клеток, их дифференцировку или пролиферацию [12]. Экспериментально выявленное нами увеличение площади экспрессии TNFaR1 у животных, которым применяли терапевтическую (минимальную) дозу препарата, вероятно, вызвано готовностью эндокринных клеток к апоптозу.
Можно допустить, что уменьшение площади экспрессии рецепторов в островках железы у животных, которым применяли высокие дозы, связано как со снижением количества рецепторов TNFαR1 на мембране клеток, так и с изменением их структуры вследствие развития дистрофических и воспалительных процессов в паренхиме железы. Этот факт подтверждается тем, что деструкция и формирование фиброза ткани поджелудочной железы приводят к поражениям ее островковой части [13].
Представленные результаты эксперимента, целью которого было изучить влияние карпрофена на экспрессию рецепторов TNFα в поджелудочной железе, согласуются с результатами, полученными в экспериментальной серии, проведенной нами ранее, где в аналогичных условиях изучали побочное действие нимесулида [14]. Согласованность результатов, полученных в двух сериях опытов, обнаруживает определенную закономерность, которая проявляется влиянием TNFα на патогенез панкреатопатии, индуцированной длительным приемом НПВП.
Заключение. В результате исследований установлено, что экспрессия рецепторов TNFα (TNFαR1) обнаруживается только лишь в эндокринных островках и имеет ограниченный характер. Проявления экспрессии TNFαR1 были обнаружены у животных всех экспериментальных групп, в том числе у интактных. Установлено, что у животных опытных групп размер площади экспрессии рецепторов в эндокринных островках зависел от дозировки препарата. Максимальная площадь экспрессии отмечалась у животных, которым давали карпрофен в терапевтической дозе 4,0 мг/кг. У животных, которым давали увеличенные дозировки препарата (пятикратную и десятикратную), площадь экспрессии была меньше по сравнению с контрольной группой.
 |
|
| Клинические данные | |
|---|---|
| AHFS /Drugs.com | Информация о профессиональных лекарствах FDA |
| Код ATCvet |
|
| Легальное положение | |
| Легальное положение |
|
| Фармакокинетический данные | |
| Связывание с белками | Высокая (99%) |
| Устранение период полураспада | Примерно 8 часов (от 4,5 до 9,8 часов) у собак |
| Идентификаторы | |
|
Название ИЮПАК
|
|
| Количество CAS |
|
| PubChem CID |
|
| IUPHAR / BPS |
|
| DrugBank |
|
| ChemSpider |
|
| UNII |
|
| КЕГГ |
|
| ЧЭБИ |
|
| ЧЭМБЛ |
|
| Панель управления CompTox (EPA) |
|
| ECHA InfoCard | 100.053.357 |
| Химические и физические данные | |
| Формула | C15ЧАС12ClNО2 |
| Молярная масса | 273.72 г · моль−1 |
| 3D модель (JSmol ) |
|
| Хиральность | Рацемическая смесь |
|
Улыбки
|
|
|
ИнЧИ
|
|
| (проверять) |
Таблетка Римадила 100 мг шириной примерно 19 мм (0,75 дюйма) и толщиной 8,6 мм (0,34 дюйма), продается в США.
Карпрофен, продается под многими торговыми марками по всему миру,[1] это нестероидный противовоспалительный препарат (НПВП), что ветеринары назначают в качестве поддерживающего лечения различных состояний у животных.[2] Он обеспечивает ежедневное лечение боли и воспалений, вызванных различными видами заболеваний. соединение боль, а также послеоперационная боль.[2] Карпрофен уменьшает воспаление, подавляя СОХ-1 и СОХ-2; его специфичность к ЦОГ-2 варьируется от вида к виду.[2]
Использование у собак
|
|
Эта секция нужны дополнительные цитаты для проверка. Пожалуйста помоги улучшить эту статью к добавление цитат в надежные источники. Материал, не полученный от источника, может быть оспорен и удален. (Июль 2009 г.) (Узнайте, как и когда удалить этот шаблон сообщения) |
Побочные эффекты
Большинство собак хорошо реагируют на прием карпрофена, но, как и все НПВП, у некоторых пациентов он может вызывать проблемы с желудочно-кишечным трактом, печенью и почками.
В 1999 г. FDA имел более 6000 анекдотических сообщений о внезапной смерти животных после использования Pfizer Бренд карпрофена Rimadyl. В результате FDA потребовало, чтобы Pfizer сообщал потребителям в своей рекламе, что смерть является возможным побочным эффектом.[3] Pfizer отказалась и отозвала свою рекламу; однако теперь они включают смерть как возможный побочный эффект на этикетке препарата. Планируется, что ветеринарам будет отправлено письмо «Уважаемый доктор», а к упаковкам таблеток приложен лист безопасности.
Побочные эффекты включают:
- Потеря аппетита
- Рвота
- Диарея
- Усиление жажды
- Учащение мочеиспускания
- Утомляемость и / или летаргия (сонливость )
- Потеря координации
- Судороги
- Нарушение функции печени: желтуха (пожелтение глаз)
- Кровь или темный смолистый материал в моча или же табуреты
- Вялость
- Пошатывание, спотыкание, слабость или частичная паралич, полный паралич[4]
- Изменение в кожа (покраснение, струпья или царапины)
- Изменение поведения (например, снижение или повышение уровня активности, захват или агрессия)[5]
Последствия передозировки включают: гастрит и образование язв.[6]
У здоровых собак, получавших карпрофен, не сообщалось о периоперационных побочных эффектах на сердечно-сосудистую систему в рекомендуемых дозах.[7][8]Периоперационное введение карпрофена кошкам не повлияло на послеоперационную частоту дыхания и частоту сердечных сокращений.[9]
Карпрофен не следует назначать одновременно со стероидами, так как это может вызвать язву желудка. Собакам следует прекратить прием карпрофена в течение трех полных дней перед приемом стероидов (например, преднизолон ). Карпрофен не следует назначать одновременно с другими лекарствами, такими как НПВП (аспирин, этодолак, деракоксиб, мелоксикам, тепоксалин ) или же стероиды Такие как дексаметазон, триамцинолон, кортизон или же преднизон.
Карпрофен следует применять с осторожностью под наблюдением ветеринара у собак с заболеваниями печени или почек. обезвоживание, дефицит кровотечения или другие проблемы со здоровьем. Не рекомендуется для собак с нарушениями свертываемости крови (такими как Болезнь фон Виллебранда ), поскольку безопасность у собак с этими заболеваниями не установлена.[10] Не установлено, можно ли безопасно использовать карпрофен у беременных собак, собак, используемых в целях разведения, или у кормящих собак.
Было проведено несколько лабораторных исследований и клинических испытаний, чтобы установить безопасность использования карпрофена. Клинические исследования были проведены на почти 300 собаках разных породы. Собак лечили Римадилом в рекомендованной дозе в течение 2 недель. Согласно этим исследованиям, препарат клинически хорошо переносился, и у обработанных собак не было большей частоты побочных реакций по сравнению с контрольной группой.[11]
Ряд факторов может способствовать высокому количеству сообщений о побочных эффектах карпрофена, полученных Центром ветеринарной медицины в конце 1990-х годов. К ним относятся:
- Тип препарата;
- Широкое использование;
- Продолжительность использования. Хотя известно, что побочные эффекты карпрофена возникают в течение короткого периода времени после приема, считается, что длительное применение может фактически привести к более высокому риску побочных реакций;[нужна цитата ]
- Использование пожилых собак. Старые собаки, как правило, более подвержены побочным эффектам, вызванным карпрофеном.
Человеческое использование
Карпрофен использовался в люди в течение почти 10 лет, начиная с 1988 года. Его применяли при тех же заболеваниях, что и у собак, а именно при болях в суставах и воспалениях. Побочные эффекты, как правило, были легкими, обычно состояли из тошноты или желудочно-кишечных болей и диареи. Карпрофен был доступен только рецепт в дозах от 150 до 600 мг.[12] Дозировка более 250 мг предназначалась только для облегчения боли после тяжелой травмы, такой как послеоперационное воспаление. Дозы 150 мг обычно применялись для облегчения боли при артрите, тогда как дозы 200 мг обычно назначались в случаях тяжелого артрита или сильной воспалительной боли. Препарат принимали внутрь. Компания Pfizer добровольно удалила его с рынка для использования людьми по коммерческим причинам.[12]
Использование лошадей
Карпрофен можно вводить внутривенно лошадям.[13] Было показано, что однократная доза снижает простагландин E2 выработка и воспалительный экссудат до 15 часов,[14] хотя на эйкозаноид производство по сравнению с эффектами, производимыми НПВП, такими как фенилбутазон или же флуниксин.[15] Простагландин E2 и воспалительный экссудат также уменьшаются и лейкотриен B4 заблокировано. Карпрофен также можно вводить перорально, но внутримышечное введение может вызвать повреждение мышц.[16]
Марки и лекарственные формы для ветеринарного применения
Он продается под многими торговыми марками, в том числе: Acticarp, Artriofin, Austiofen, Bomazeal, Canidryl, Carporal, Carprieve, Carprocow, Carprodolor, Carprodyl, Carprofelican, Carprofen, Carprofène, Carprofeno, Carprofenum, Carprolprogesic, Carprogésic , Долокарп, Долокс, Еврофен, Келапрофен, Либревия, Норокарп, Нородил, Новококс, Остифен, Пролет, Квеллин, Репровал, Римадил, Римифин, Рофенифлекс, Ровера, Рикарфа, Сканодил, Тергив, Ветпрофен и Кселкор.[1]
Ветеринарные лекарственные формы включают таблетки по 25, 75 и 100 мг и инъекционные формы по 50 мг на мл.[17]
Рекомендации
- ^ а б Drugs.com Международные торговые марки Carprofen Доступ к странице 4 октября 2017 г.
- ^ а б c Карпрофен / Римадил (Карпрофен) инструкция по назначению
- ^ «Новости о Римадиле». Центр ветеринарной медицины FDA. 1 декабря 1999 г. Архивировано с оригинал 8 сентября 2014 г.. Получено 16 декабря, 2019.
- ^ «Обзор признаков потенциально опасной для жизни реакции на римадил». Получено 2010-05-20.
- ^ «Информация владельца собаки о Римадиле (карпрофене)». Получено 2010-05-20.
- ^ «Общий Собака Римадил Интернет». Архивировано из оригинал на 2011-07-15. Получено 2011-07-15.
- ^ Бострем И.М., Нюман Г.К., Лорд П.Е., Хэггстрём Дж., Джонс Б.Э., Болин Х.П. (май 2002 г.). «Влияние карпрофена на функцию почек и результаты биохимических и гематологических анализов сыворотки крови у анестезированных собак, у которых было пониженное артериальное давление во время анестезии». Американский журнал ветеринарных исследований. 63 (5): 712–21. Дои:10.2460 / ajvr.2002.63.712. PMID 12013473.
- ^ Френдин Дж. Х., Бострем И. М., Кампа Н., Экселл П., Хэггстрем Ю. Ю., Найман Г. К. (декабрь 2006 г.). «Влияние карпрофена на функцию почек во время анестезии медетомидин-пропофол-изофлуран у собак». Американский журнал ветеринарных исследований. 67 (12): 1967–73. Дои:10.2460 / ajvr.67.12.1967. PMID 17144795.
- ^ Höglund OV, Dyall B, Gräsman V, Edner A, Olsson U, Höglund K (октябрь 2018 г.). «Влияние нестероидных противовоспалительных препаратов на послеоперационную респираторную систему и частоту сердечных сокращений у кошек, подвергшихся овариогистерэктомии». Журнал кошачьей медицины и хирургии. 20 (10): 980–84. Дои:10.1177 / 1098612X17742290. PMID 29165006. S2CID 30649716.
- ^ «Римадил (Карпрофен)». Архивировано из оригинал на 2010-05-23. Получено 2010-05-20.
- ^ «Римадил [вкладыш в упаковке]» (PDF). Нью-Йорк: Pfizer Animal Health. 2007 г.. Получено 2014-08-13.
- ^ а б Комитет по ветеринарным лекарственным препаратам: Карпрофен, Европейское агентство по оценке лекарственных средств
- ^ Макилрайт CW, Фрисби DD, Кавкак CE. Нестероидные противовоспалительные препараты. Proc. AAEP 2001 (47): 182–87.
- ^ Лис П., Маккеллар К., Мэй С.А., Людвиг Б. (май 1994 г.). «Фармакодинамика и фармакокинетика карпрофена у лошади». Ветеринарный журнал лошадей. 26 (3): 203–08. Дои:10.1111 / j.2042-3306.1994.tb04370.x. PMID 8542839.
- ^ Лис П., Эвинс С. П., Тейлор Дж. Б., Седжвик А. Д. (1987). «Сывороточный тромбоксан у лошади и его ингибирование аспирином, фенилбутазоном и флуниксином». Британский ветеринарный журнал. 143 (5): 462–76. Дои:10.1016/0007-1935(87)90024-8. PMID 3119142.
- ^ Маккеллар QA, Боган JA, фон Фелленберг RL, Людвиг B, Cawley GD (июль 1991). «Фармакокинетические, биохимические исследования и исследования переносимости карпрофена у лошадей». Ветеринарный журнал лошадей. 23 (4): 280–84. Дои:10.1111 / j.2042-3306.1991.tb03718.x. PMID 1915228.
- ^ Карпрофен (ветеринарный — системный) Фармакопейная конвенция США 2007 г.
Нестероидные противовоспалительные препараты (НПВП) — важнейший класс препаратов, используемых для купирования острой и контроля хронической боли в терапевтической практике. НПВП отличает сочетание анальгетического, противовоспалительного и жаропонижающего действия, что обеспечивает их преимущество в сравнении с парацетамолом и опиоидами [1–3].
В настоящее время в России зарегистрировано девятнадцать различных НПВП. Это «международные непатентованные наименования», т. е. химические субстанции, а конкретных коммерческих препаратов больше на целый порядок. К сожалению, ни один из современных НПВП не может считаться идеальным: если какой-либо препарат имеет преимущество по тому или иному параметру, скорее всего, у него найдутся и серьезные недостатки.
Основным различием между разными представителями группы НПВП является их безопасность. До последнего времени главной проблемой этих лекарств считалось развитие осложнений со стороны желудочно-кишечного тракта (ЖКТ). Все НПВП являются ингибиторами циклооксигеназы (ЦОГ) 2, однако, помимо этого действия, они могут подавлять близкий по структуре фермент ЦОГ-1. Работа последнего необходима для поддержания защитного потенциала слизистой оболочки ЖКТ, поэтому его блокада может приводить к развитию опасной патологии ЖКТ — т. н. НПВП-гастропатии и НПВП-энтеропатии [4].
Селективность в отношении ЦОГ-2, а следовательно, риск развития патологии ЖКТ, стала основой разделения НПВП на две группы: «традиционные», или неселективные (н-НПВП), и селективные (с-НПВП). с-НПВП, т. н. «коксибы», были созданы в конце 90-х годов прошлого века как более безопасная для ЖКТ альтернатива «традиционным» НПВП. Но, как оказалось, «коксибы» имеют серьезный недостаток: селективная блокада ЦОГ-2 способна нарушать баланс факторов, влияющих на свертывание крови, — синтез тромбоксана А2 и простациклина, что определяет протромботический эффект. У пациентов с болезнями сердечно-сосудистой системы (ССС) это чревато повышением риска тромбоэмболических осложнений, таких как инфаркт миокарда (ИМ) и ишемический инсульт [4].
Эта проблема возродила интерес практикующих врачей к «традиционным» НПВП, применение которых, как представлялось, ассоциируется с существенно меньшей опасностью кардиоваскулярных (КВ) осложнений.
Но далеко не все н-НПВП безопасны в отношении ССС. Так, риск КВ-осложнений при использовании наиболее популярного в России представителя «традиционных» НПВП диклофенака весьма высок. Этот факт показывает метаанализ 25 популяционных исследований, проведенных в 18 независимых популяциях и представляющих индивидуальный риск КВ-осложнений для разных НПВП. Критерием оценки была частота ИМ, развитие которого было отмечено у ~100 000 пациентов. Минимальный риск ИМ был показан для напроксена (отношение шансов (ОШ) — 1,06) и целекоксиба (ОШ — 1,12); для диклофенака этот показатель составил 1,38 [5].
Существенно меньший риск КВ-осложнений демонстрирует другой популярный н-НПВП — кетопрофен. Этот препарат появился в Европе в 1971 г. и быстро завоевал репутацию эффективного и надежного анальгетика [6]. За сорок лет клинического применения он не утратил своего значения. P. Sarzi-Puttini и соавт. подчеркивают этот факт в обзоре с весьма характерным названием: «Боль и кетопрофен: его роль в клинической практике», который был опубликован в 2010 году. Они указывают на огромную базу доказательств его эффективности, широкий спектр показаний — по сути, все патологические процессы, сопровождающиеся ноцицептивной болью, и хорошую репутацию у врачей [7].
Интерес к кетопрофену можно оценить по росту его назначений в странах Европы. Так, M. Venegoni и соавт. показали, что на фоне небольшого, но явного снижения общих продаж «рецептурных» НПВП в Италии за период с 2006 по 2009 гг. популярность кетопрофена выросла почти в 2 раза (на 93%). Если в 2006 г. кетопрофен приобрели 263 897 жителей этой страны, то в 2009 г. — уже 508 699 [8].
Многие эксперты связывают высокий анальгетический потенциал кетопрофена с особенностями его молекулы. Липофильность и относительно небольшие размеры кетопрофена определяют его способность легко проникать в воспаленную ткань (например, в синовиальную полость при артрите), создавая высокую концентрацию [7, 9]. Большое значение придается диффузии кетопрофена через гематоэнцефалический барьер и его действию на центральные структуры болевой системы. Экспериментальные данные подтверждают равновесие концентрации несвязанной фракции кетопрофена в плазме крови и ликворе. При этом центральный эффект этого препарата связывается не только с блокадой ЦОГ-2, но и иными механизмами, в частности, с его влиянием на серотонинергическую антиноцицептивную систему [10].
Как было отмечено выше, опыт использования кетопрофена включает все заболевания и патологические состояния, при которых назначение НПВП представляется целесообразным. Работу с кетопрофеном облегчает наличие полного спектра лекарственных форм: раствора для внутривенного (в/в) и внутримышечного (в/м) введения, стандартных таблеток, капсул контролируемого высвобождения, форм для местного применения, ректальных свечей.
Кетопрофен — весьма удачное средство для ургентного обезболивания. В 2009 г. были опубликованы данные метаанализа Cochrane, оценивающего результаты однократного приема кетопрофена в дозе 25–100 мг при острой послеоперационной боли. Материалом послужили данные 14 рандомизированных контролируемых исследований (РКИ) (968 больных, получавших кетопрофен, 520 плацебо), а основным критерием оценки было снижение боли > 50% на срок от 4 до 6 часов. Исследователи использовали индекс NNT (number need to treat), показывающий число больных, которых необходимо пролечить для достижения значимого отличия от плацебо. Этот индекс составил 2,4–3,3, что показывает достаточно высокую эффективность препарата [11].
Недавно опубликованы данные масштабного исследования (n = 338), в котором изучалось действие однократного внутривенного введения парекоксиба 40 мг и кетопрофена 100 мг для купирования острой почечной колики. Кетопрофен, выступавший в роли препарата сравнения, нисколько не уступал представителю «коксибов»: снижение боли (по визуальной аналоговой шкале — ВАШ) через 30 мин после инъекции составило 35,2 ± 26,0 и 33,8 ± 24,6 мм [12].
Работа S. Karvonen и соавт. является примером успешного применения кетопрофена в хирургической практике. Здесь кетопрофен в дозе 300 мг/сут был использован у 60 больных, перенесших ортопедические операции. Контроль составили пациенты, получавшие плацебо или парацетамол 4 г/сутки. Критерием эффективности, кроме снижения выраженности боли, была оценка «опиоид-сберегающего» действия, которое определялось при сравнении необходимой для стойкой анальгезии дозы фентанила. Этот эффект был отмечен лишь в группе кетопрофена: средняя доза фентанила здесь оказалась на 22% меньше по сравнению с группой плацебо и на 28% меньше в сравнении с группой парацетамола [13].
Хорошие результаты были отмечены при использовании кетопрофена в стоматологии. J. Olson N. и соавт. провели исследование, в ходе которого 239 пациентам после удаления 3-го моляра был назначен кетопрофен в минимальной дозе (25 мг), ибупрофен 400 мг или парацетамол 1000 мг; «пассивным» контролем являлось плацебо. Главным методом оценки являлось сравнение числа пациентов, у которых спустя 6 часов после экстракции зуба боль полностью отсутствовала. Этот результат был достигнут почти у всех больных, получивших кетопрофен, — 99%, у 96% получивших ибупрофен и 88% — парацетамол (разница недостоверна). Все активные препараты превосходили плацебо, на фоне которого боль купировалась лишь у одной трети пациентов (33,6%). Как видно, даже минимальная доза кетопрофена дает столь же выраженное (и даже несколько большее) облегчение боли, как стандартные терапевтические дозы ибупрофена и парацетамола [14].
Удачной демонстрацией преимущества кетопрофена стала работа I. Jokhio и соавт., которые сравнили его с диклофенаком у 180 пациентов, испытывающих выраженные боли (среднее значение по ВАШ ~70 мм) вследствие травмы или острой патологии мягких тканей ревматической природы. При этом была использована т. н. «ступенчатая» терапия: в первый день НПВП применяли в виде в/м инъекций, а затем перорально. Соответственно, половина пациентов получила две инъекции кетопрофена по 100 мг, а затем принимали этот препарат по 100 мг 2 раза в день. Вторая группа больных получила две инъекции диклофенака по 75 мг, а в дальнейшем принимали его по 50 мг 3 раза в день внутрь. Курс лечения составил 2 недели. К концу периода наблюдения кетопрофен демонстрировал лучшие результаты (рис. 1). При этом 72% больных, получавших кетопрофен, оценили его переносимость как «хорошую или отличную»; такую оценку диклофенаку дали лишь 50% пациентов [15].
Одним из последних доказательств высокой анальгетической эффективности кетопрофена стала работа итальянских ученых P. Sarzi-Puttini и соавт. — метаанализ 13 РКИ (n = 898), в которых сравнивалось действие кетопрофена 50–200 мг/сут с ибупрофеном 600–1800 мг/сут или диклофенаком 75–100 мг/сут у больных с разными ревматическими заболеваниями. Кетопрофен показал достоверное превосходство над препаратами сравнения в 9 из 13 РКИ. При этом вероятность достижения благоприятного эффекта при назначении кетопрофена была почти в 2 раза выше (ОШ 0,459: 0,33–0,58, p = 0,000) [16].
Кетопрофен показал себя действенным средством для купирования приступа мигрени. Согласно результатам исследования M. Dib и соавт., он не уступал золмитриптану — представителю группы триптанов, которые являются важнейшим патогенетическим средством для лечения этого заболевания. В этой работе 235 пациентов с мигренью однократно приняли кетопрофен 75 или 150 мг или золмитриптан. Во всех группах отмечался практически одинаковый результат: через 2 часа боль прекратилась у 62,6%, 61,6% и 66,8% пациентов соответственно [17].
Необходимо отметить, что кетопрофен обладает хорошим противовоспалительным потенциалом. Наилучшей моделью оценки противовоспалительного эффекта НПВП является купирование подагрического артрита, при котором выраженная боль определяется острой воспалительной реакцией. «Золотым стандартом» лечения этой патологии долгое время считался индометацин, обладающий выраженными противовоспалительными свойствами. Кетопрофен, как показали R. Altman и соавт., успешно прошел сравнение с этим препаратом. В ходе исследования 59 пациентов с острым подагрическим артритом в течение 7 дней принимали кетопрофен 100 мг 3 раза в день или индометацин 50 мг 3 раза в день. Кетопрофен обеспечил значимое облегчение боли в первый же день лечения у 92% больных; в контрольной группе их оказалось 91%. Через неделю лечения приступ был полностью купирован у 24% и 22% пациентов. Как видно, кетопрофен не уступал индометацину по эффективности. Но при этом он отчетливо превосходил его по безопасности — на фоне приема индометацина какие-либо побочные эффекты были отмечены у 20% больных, а в группе кетопрофена — лишь у 11% [18].
Помимо экстренного обезболивания, кетопрофен оказался эффективным средством для длительного контроля боли при хронических заболеваниях опорно-двигательного аппарата.
Важным доказательством достоинств кетопрофена стало европейское проспективное открытое исследование, охватившее около 20 тыс. больных с различной ревматической патологией, в основном остеоартрозом (ОА). Через 1 месяц более 70% пациентов, принимавших кетопрофен в дозе 200 мг/сут, отметили хороший или превосходный результат; при этом ЖКТ-осложнения суммарно возникли у 13,5%, а язвы и кровотечения всего у 0,03% [19].
Работа M. Schattenkirchner и соавт. показала хорошую переносимость кетопрофена при длительном использовании. В их исследовании 823 больных ОА и ревматоидным артритом получали кетопрофен в течение года. На фоне лечения осложнения со стороны ЖКТ возникли у 28% пациентов (лишь у 1,7% серьезные), а со стороны ССС — у 3,2%, что относительно немного, учитывая преимущественно пожилой возраст пациентов и тяжелый коморбидный фон [20].
Удачные результаты были получены при использовании кетопрофена у больных анкилозирующим спондилоартритом (АС). При АС НПВП играют роль основного терапевтического агента, позволяющего контролировать развитие болезни. В исследовании M. Dougados и соавт. 246 больных АС в течение 6 недель принимали целекоксиб 200 мг, кетопрофен 200 мг или плацебо. Достоверной разницы по обезболивающему действию обоих НПВП не было, при этом они существенно превосходили плацебо. Особый интерес представляет влияние НПВП на такие симптомы, как ночная боль и утренняя скованность, которые в большей степени отражают противовоспалительный эффект. Действие кетопрофена и целекоксиба практически не различалось: уменьшение ночных болей составило в среднем 21 и 27 мм ВАШ (в группе плацебо увеличилось на 13 мм), утренняя скованность уменьшилась на 16 и 17 минут (в группе плацебо не изменилась). Таким образом, кетопрофен оказывает четкое противовоспалительное действие при АС. Интересно, что число ЖКТ-осложнений на фоне приема «коксиба» и кетопрофена не различалось: они возникли у 13% и 14% больных (8% на плацебо) [21]. Обсуждая безопасность кетопрофена, нельзя обойти вниманием тот факт, что ряд популяционных исследований демонстрируют для этого препарата существенный риск ЖКТ-осложнений. Так, J. Castellsague и соавт. провели метаанализ 28 эпидемиологических работ (1980–2011 гг.), в которых оценивалось развитие ЖКТ-осложнений при использовании разных НПВП. Наименьший риск был отмечен для целекоксиба — ОШ 1,45, ацеклофенака 1,4 и ибупрофена — 1,84. Существенно выше опасность была при использовании диклофенака — 3,34, мелоксикама — 3,47 и нимесулида — 3,83. Кетопрофен вошел в «тройку» препаратов с наибольшим риском — 3,92, как и напроксен — 4,1 и индометацин — 4,14 [22].
С другой стороны, одно из наиболее крупных популяционных исследований показало для кетопрофена относительно низкий риск ЖКТ-осложнений. Эта работа финских ученых A. Helin-Salmivaara и соавт., основанная на оценке причин 9191 случая ЖКТ-кровотечения, язв и перфорации, отмеченных с 2000 по 2004 гг. Контроль составили 41 780 лиц, соответствующих по полу и возрасту. Риск ЖКТ-осложнений при использовании кетопрофена оказался ниже, в сравнении с диклофенаком: ОШ 3,7 и 4,2 соответственно. Любопытно, что кетопрофен демонстрировал аналогичный или даже меньший риск развития патологии ЖКТ, чем более селективные НПВП (за исключением целекоксиба). Так, ОШ для мелоксикама, нимесулида и эторикоксиба составило 3,4, 4,0 и 4,4 соответственно [23].
Следует отметить, что в России накоплен большой собственный опыт применения кетопрофена. В частности, в нашей стране был проведен ряд клинических исследований, результаты которых показали не только хороший терапевтический потенциал этого препарата, но и низкую частоту осложнений [24, 25].
Среди них следует выделить работу Л. Б. Лазебника и соавт., в которой проводилось 3-месячное сравнение 4 НПВП: лорноксикама, нимесулида, целекоксиба и кетопрофена у 132 больных ОА. Авторы изучали риск осложнений со стороны ЖКТ, суточную динамику артериального давления (АД). Кетопрофен демонстрировал хорошую переносимость: число больных с эрозиями и язвами после использования лорноксикама составило 66% (!), нимесулида — 13,5%, кетопрофена — 13,0%, целекоксиба — 8,3%. Повышение АД свыше 130/90 мм рт. ст. было отмечено лишь у 2% больных, получавших кетопрофен. В отношении лорноксикама и нимесулида ситуация оказалась совсем иной — у пациентов, принимавших эти препараты, повышение АД было отмечено у 11% и 13% [26] (рис. 2). Эта работа показывает одно из наиболее ценных преимуществ кетопрофена — относительно низкий риск осложнений со стороны ССС.
Связь между приемом кетопрофена и КВ-катастрофами определялась в нескольких эпидемиологических исследованиях. Так, низкий риск ИМ при использовании кетопрофена был показан американскими учеными G. Singh и соавт. Проанализировав причины 15 343 эпизодов ИМ (61 372 человека составили соответствующий контроль), авторы сопоставили частоту этого осложнения у лиц, принимавших НПВП. Оказалось, что прием кетопрофена ассоциировался с наименьшим риском ИМ (ОШ 0,88), даже в сравнении с напроксеном (ОШ 1,08), который традиционно считается препаратом, наиболее безопасным в отношении ССС [27].
Близкие результаты были получены M. Solomon и соавт., сравнившими использование различных НПВП у 4425 больных, у которых развился ИМ, и 17 700 лиц без данного осложнения. Согласно полученным данным, разницы по приему кетопрофена в этих группах не было: его получали 53 больных, развивших ИМ (1,2%), и 190 лиц, составлявших контроль (1,1%). Таким образом, использование кетопрофена, по данным этого исследования, не повышало риск развития КВ-катастроф [28].
Низкий риск КВ-осложнений для кетопрофена показали и результаты популяционного исследования финских ученых A. Helin-Salmivaara и соавт. Их работа была основана на сопоставлении данных о приеме НПВП у 33 309 лиц, перенесших ИМ, и 138 949 здоровых людей. Оказалось, что прием кетопрофена фактически не увеличивал опасность развития КВ-катастроф (ОШ 1,11) [29].
В 2012 г. была опубликована масштабная работа ученых из Тайваня, изучавших КВ-риск при использовании различных НПВП в собственной популяции. Исследуемый материал был получен с использованием данных национальной системы здравоохранения, где имелась информация о 13,7 млн лиц, использовавших НПВП, из которых 8354 перенесли инфаркт миокарда. Пероральный кетопрофен демонстрировал минимальный уровень риска (ОШ 1,17). Он оказался более безопасным, чем подавляющее большинство других НПВП (рис. 3).
Следует отметить, что парентеральное использование НПВП (это был отдельный раздел анализа) ассоциировалось с более высоким риском КВ-осложнений. Так, для кетопрофена риск был повышен более чем вдвое: ОШ 2,34; близкое значение было получено для диклофенака: 1,88, и значительно более высокое — для кеторолака: 4,27 [30].
Таким образом, кетопрофен — универсальный анальгетик, который может с успехом использоваться как для купирования острой, так и длительного контроля хронической боли. Благоприятные фармакологические свойства определяют его преимущества в сравнении с другими НПВП при ургентном обезболивании, когда быстрота облегчения страданий имеет принципиальное значение. Наличие в арсенале врача разных лекарственных форм помогает при выборе стратегии обезболивающей терапии: для получения максимально быстрого эффекта в первые дни лечения может быть оправдано применение парентеральных форм кетопрофена, с последующим переходом на регулярный пероральный прием. Позитивным моментом является также наличие на фармакологическом рынке качественных и недорогих генериков кетопрофена, таких как Фламакс® (Сотекс), доступных большинству пациентов.
Конечно, кетопрофен не лишен недостатков; основной из них, типичный для всех «традиционных» НПВП, — возможность развития патологии ЖКТ. Однако тщательный учет факторов риска перед назначением НПВП и — если соответствующие факторы присутствуют — профилактическое использование гастропротекторов (ингибиторов протонной помпы) позволяют значительно снизить эту опасность. Но при этом кетопрофен показывает низкий риск осложнений со стороны сердечно-сосудистой системы. Это несомненное преимущество, которое расширяет возможность применения данного препарата у лиц пожилого возраста, многие из которых имеют кардиоваскулярные факторы риска.
Литература
- Насонов Е. Л. Анальгетическая терапия в ревматологии: путешествие между Сциллой и Харибдой // Клин. фармакол. терапия. 2003; 12 (1): 64–69.
- Боль (практическое руководство для врачей). Под ред. Яхно Н. Н., Кукушкина М. Л. М.: Издательство РАМН, 2012. 512 c.
- Lee Y. Effect and treatment of chronic pain in inflammatory arthritis // Curr Rheumatol Rep. 2013; 15 (1): 300.
- Каратеев А. Е., Яхно Н. Н., Лазебник Л. Б. и др. Применение нестероидных противовоспалительных препаратов. Клинические рекомендации. М.: ИМА-ПРЕСС, 2009. 167 с.
- Varas-Lorenzo C., Riera-Guardia N., Calingaert B. et al. Myocardial infarction and individual nonsteroidal anti-inflammatory drugs meta-analysis of observational studies // Pharmacoepidemiology and Drug Safety. 2013; 22: 559–570.
- Veys E. 20 years’ experience with ketoprofen // Scand J Rheumatol Suppl. 1991; 90: Suppl 1–44.
- Sarzi-Puttini P., Atzeni F., Lanata L. et al. Pain and ketoprofen: what is its role in clinical practice? // Reumatismo. 2010, 62 (3): 172–188.
- Venegoni M., Da Cas R., Menniti-Ippolito F., Traversa G. Effects of the European restrictive actions concerning nimesulide prescription: a simulation study on hepatopathies and gastrointestinal bleedings in Italy // Ann Ist Super Sanita. 2010; 46 (2): 153–157.
- Kokki H. Ketoprofen pharmacokinetics, efficacy, and tolerability in pediatric patients // Paediatr Drugs. 2010; 12 (5): 313–329.
- Díaz-Reval M., Ventura-Martínez R., Déciga-Campos M. et al. Evidence for a central mechanism of action of S- (+)-ketoprofen // Eur J Pharmacol. 2004; 483 (2–3): 241–248.
- Barden J., Derry S., McQuay H., Moore R. Single dose oral ketoprofen and dexketoprofen for acute postoperative pain in adults // Cochrane Database Syst Rev. 2009, Oct 7; (4): CD007355.
- Glina S., Damiao R., Afif-Abdo J. et al. Efficacy and safety of parecoxib in the treatment of acute renal colic: a randomized clinical trial // Int Braz J Urol. 2011; 37 (6): 697–705.
- Karvonen S., Salomäki T., Olkkola K. Efficacy of oral paracetamol and ketoprofen for pain management after major orthopedic surgery // Methods Find Exp Clin Pharmacol. 2008, 30 (9): 703–706.
- J. Olson N., Otero A., Marrero I. et al. Onset of analgesia for liquigel ibuprofen 400 mg, acetaminophen 1000 mg, ketoprofen 25 mg, and placebo in the treatment of postoperative dental pain // Clin Pharmacol. 2001, 41 (11): 1238–1247.
- Jokhio I., Siddiqui K., Waraich T. et al. Study of efficacy and tolerance of ketoprofen and diclofenac sodium in the treatment of acute rheumatic and traumatic conditions // J Pak Med Assoc. 1998; 48: 373–376.
- Sarzi-Puttini P., Atzeni F., Lanata L., Bagnasco M. Efficacy of ketoprofen vs. ibuprofen and diclofenac: a systematic review of the literature and meta-analysis // Clin Exp Rheumatol. 2013 Sep-Oct; 31 (5): 731–8. Epub 2013 May 17.
- Dib M., Massiou H., Weber M. et al. Efficacy of oral ketoprofen in acute migraine: a double-blind randomized clinical trial // Neurology. 2002, 58 (11): 1660–1665.
- Altman R., Honig S., Levin J., Lightfoot R. Ketoprofen versus indomethacin in patients with acute gouty arthritis: a multicenter, double blind comparative study // J Rheumatol. 1988, 15 (9): 1422–1426.
- Le Loet X. Safety of ketoprofen in the elderly: a prospective study on 20,000 patients // Scand J Rheumatol Suppl. 1989; 83: 21–27.
- Schattenkirchner M. Long-term safety of ketoprofen in an elderly population of arthritic patients // Scand J Rheumatol Suppl. 1991; 91: 27–36.
- Dougados M., Béhier J., Jolchine I. et al. Efficacy of celecoxib, a cyclooxygenase 2-specific inhibitor, in the treatment of ankylosing spondylitis: a six-week controlled study with comparison against placebo and against a conventional nonsteroidal antiinflammatory drug // Arthritis Rheum. 2001, 44 (1):180–185.
- Castellsague J., Riera-Guardia N., Calingaert B. et al. Individual NSAIDs and upper gastrointestinal complications: a systematic review and meta-analysis of observational studies (the SOS project) // Drug Saf. 2012; 35 (12): 1127–1146.
- Helin-Salmivaara A., Saarelainen S., Gronroos J. et al. Risk of upper gastrointestinal events with the use of various NSAIDs: A case-control study in a general population // Scan J Gastroenterol. 2007; 42: 923–932.
- Чичасова Н. В., Иммаметдинова Г. Р., Каратеев А. Е. и соавт. Эффективность и безопасность кетопрофена (кетонал) при ревматоидном артрите (клинико-эндоскопическое исследование) // Научно-практическая ревматология. 2001; 1; 47–52.
- Осипова Н. А., Петрова В. В., Ермолаев П. М., Береснев В. А. Нестероидные противовоспалительные препараты в лечении послеоперационной боли у онкологических больных // Фарматека. 2006, № 6, 121.
- Лазебник Л. Б., Дроздов В. Н., Коломиец Е. В. Сравнительная эффективность и безопасность применения кетопрофена, лорноксикама, нимесулида и целекоксиба у больных остеоартрозом // РМЖ. 2004, 12 (14), 844–847.
- Singh G., Mithal A., Triadafilopoulos G. Both selective COX-2 inhibitors and non-selective NSAIDs increase the risk of acute myocardial infarction in patients with arthritis; selectivity is with patients, not the drug // Ann Rheum Dis. 2005, 64 (suppl 3), 85.
- Solomon D., Glynn R., Levin R., Avorn J. Nonsteroidal Anti-inflammatory Drug Use and Acute Myocardial Infarction. Arch Intern Med. 2002; 162: 1099–1104
- Helin-Salmivaara A., Virtanen A., Vesalainen R. et al. NSAID use and the risk of hospatalisation for first myocardial infarction in the general population: a national case-control study from Finland // Eur Heart J. 2006; 27: 1657–1663.
- Shau W., Chen H., Chen S. et al. Risk of new acute myocardial infarction hospitalization associated with use of oral and parenteral non-steroidal anti-inflammation drugs (NSAIDs): a case-crossover study of Taiwan’s National Health Insurance claims database and review of current evidence // BMC Cardiovasc Disord. 2012, Feb 2; 12: 4. doi: 10.1186/1471–2261–12–4.
А. Е. Каратеев, доктор медицинских наук, профессор
ФГБУ НИИР им. В. А. Насоновой РАМН, Москва
Контактная информация: aekarateev@rambler.ru