Изложена история становления лучевой терапии злокачественных опухолей, охарактеризованы способы облучения и технические средства для лучевого лечения. Показаны роль, место и эффективность лучевой терапии в лечении злокачественных опухолей головы и шеи: носоглотки, орофарингеальной зоны, гортани. Описаны пути дальнейшего совершенствования этого метода.
The paper outlines the history of radiation therapy for malignant tumors, characterizes the modes of radiation and equipment of radiation treatment. It shows the role, place, and efficiency of radiation therapy in the treatment of malignant tumors of the head and neck: nasopharynx, oropharyngeal area, larynx. Ways of further improvement of this method are described.
А.П. Кондратьева – канд. мед. наук, доцент кафедры РМА ПО, Москва
A.P.Kondratyeva, Candidate of Medical Sciences, Associate Professor, Department of Oncology, Russian Medical Academy of Postgraduate Training
Два года назад мировая общественность отметила 100-летие одного из величайших достижений науки – открытия рентгеновских лучей, которые сразу же нашли применение и заняли прочные позиции в лучевой диагностике. С 1896 г. началось применение рентгеновских лучей в лечении кожных заболеваний, а чуть позже были предприняты попытки их использования и для лечения злокачественных опухолей. В том же году французский физик Анри Беккерель открыл радиоактивность солей урана, а в 1898 г. супругам Кюри удалось выделить из 8 т смоляной урановой руды 1 г нового химического элемента, радиоактивность которого оказалась в миллион раз выше, чем у урана. Элемент получил название «радий», что означает «лучистый». Открытие радия и исследование его излучения, свойства которого во многом сходны с таковыми рентгеновского излучения, явилось новым скачком в развитии атомной физики. В последующие 20 лет были открыты все другие естественные радиоактивные элементы. В 1934 г. супруги Жолио-Кюри впервые получили в лаборатории искусственные радиоактивные изотопы, которые значительно расширили возможность использования ионизирующих излучений как в лучевой диагностике, так и в терапии злокачественных опухолей.
Первые попытки применения рентгеновского излучения для лечения злокачественных опухолей основывались на первоначальных сведениях о повреждающем действии этого излучения на ткани. Почти 100 лет отделяют нас от первого опыта использования рентгеновских лучей в онкологической практике. За этот период сильно изменились и технические возможности использования различных видов излучений и оценка их действия на биологические ткани.
Внедрение в клиническую практику источников высоких энергий, искусственных радиоактивных изотопов существенно расширило возможности лучевого лечения и обеспечило заметное повышение его результативности.
В последние годы накоплен богатый клинический опыт, расширились исследования в области клинической радиобиологии, произошел скачок в техническом оснащении онкологических учреждений, и, таким образом, созданы предпосылки для рационального использования скрытых резервов лучевой терапии.
Существующие способы облучения больного можно разделить на две основные группы – способы дистанционного, или наружного, облучения и способы контактного облучения, при котором источники излучения размещаются либо в полости органа, либо внутри опухолевой ткани (соответственно внутриполостная или внутритканевая лучевая терапия). Сочетание двух способов облучения или двух видов излучений принято называть сочетанной лучевой терапией.
Основными источниками дистанционного облучения служат гамма-терапевтические установки различной конструкции («Агат-Р; «Агат-С»; «Рокус») или ускорители электронов, которые дают тормозное или фотонное излучение с энергией от 4 до 20 МэВ и электроны разной энергии, которую подбирают в зависимости от глубины залегания опухоли. Генераторы нейтронов, ускорители протонов и других ядерных частиц пока находят ограниченное применение.
Для контактной лучевой терапии, или, как ее все чаще называют, брахитерапии, имеется серия шланговых аппаратов разной конструкции, позволяющих автоматизированным способом размещать источники вблизи опухоли и осуществлять ее прицельное облучение («Агат-В», «Агат-ВУ» с источниками 60 Со, «Селектрон» с источником 137 Cs, «Микроселектрон» с источником 192 Jr, «Анет-В» с источником 252 Cf и др.).
В основе применения ионизирующих излучений в лучевой терапии злокачественных опухолей лежат глубокие знания биологического действия ионизирующих излучений на различные органы, ткани и опухоли, которое представляет собой чрезвычайно сложный процесс, сопровождающийся определенными морфологическими и функциональными изменениями облучаемой ткани. При этом отчетливо прослеживается сочетание регрессивных явлений с восстановительными, находящимися в тесной зависимости от поглощенной энергии и времени, прошедшего после облучения. Четкие представления об этих процессах послужили основой для успешного применения излучений в лечебных целях как средства, позволяющего уничтожить опухолевую ткань и подавить ее рост, и в то же время избежать необратимых постлучевых изменений окружающих опухоль нормальных органов и тканей [1].
Различные опухоли по-разному реагируют на облучение, поскольку имеют разную гистологическую природу, степень дифференцировки клеток, содержат разное количество кислорода и активно пролиферирующих клеток, находящихся в разных стадиях митотического цикла. Именно эти параметры в основном и определяют радиочувствительность опухоли, что, несомненно, принимается в расчет при решении вопроса об индивидуальных показаниях к лучевой терапии.
Основными методами лечения больных со злокачественными опухолями на современном этапе являются хирургический, лучевая терапия, противоопухолевая химиотерапия и гормонотерапия (при опухолях, содержащих гормональные рецепторы). Различные варианты их комбинаций и составляют суть комбинированной и комплексной терапии.
Среди основных методов лечения злокачественных опухолей лучевая терапия и в настоящее время занимает важное место. Примерно две трети онкологических больных нуждаются в лучевой терапии. Положительную роль в применении ионизирующих излучений с лечебной целью играют и такие особенности их биологического действия, как неощутимость воздействия и безболезненность сеансов облучения.
При местно-распространенных нерезектабельных опухолях лучевая терапия как самостоятельный метод или в сочетании с другими способами консервативного лечения позволяет расширить показания к специализированной помощи за счет комплекса противоопухолевых воздействий.
При генерализованных формах опухоли лучевая терапия в комплексе с другими воздействиями может дать значительный паллиативный или симптоматический эффект, способствуя как увеличению длительности выживания, так и улучшению качества жизни онкологических больных.
Роль и место лучевой терапии в лечении различных злокачественных опухолей определяются целым рядом обстоятельств – прежде всего биологическими особенностями конкретной опухоли, ее локализацией, степенью распространения, радиочувствительностью, возрастом пациента и другими факторами, а также наличием и характером лечебной альтернативы.
Лучевая терапия среди возможных вариантов лечения злокачественных опухолей нередко оказывается методом выбора. Так, несмотря на многообразие методов лечения опухолей головы и шеи лучевая терапия играет существенную роль, а при некоторых формах является основным методом лечения.
В этой небольшой обзорной работе, носящей в основном ознакомительный характер и адресованной врачам общей практики, будет сделана попытка осветить роль и возможности лучевого лечения основных локализаций опухолей головы и шеи без детализации методик лучевой терапии.
Одной из таких локализаций является рак носоглотки, при котором лучевая терапия оказывается методом выбора. Это объясняется не столько тем, что в связи с ограничениями технического и общеонкологического плана хирургическое лечение практически не применяют, а в основном тем, что большинство новообразований носоглотки, независимо от морфологической структуры, характеризуется высокой радиочувствительностью.
Как самостоятельный метод лечения используют дистанционное облучение, реже применяют сочетание наружного облучения с внутриполостным. Большинство опухолей носоглотки часто и рано метастазирует в регионарные лимфатические узлы, которыми являются заглоточные, глубокие яремные и далее – надключичные. Частота метастатического поражения лимфатических узлов может достигать 30 – 85%, а метастазы в области шеи нередко являются первым заметным симптомом рака носоглотки [2].
Однако несмотря на значительное локорегионарное распространение рака носоглотки современная лучевая терапия в большинстве случаев приводит к полной регресии опухоли.
При этом наружное облучение осуществляют с нескольких полей мегавольтным излучением гамма-терапевтических установок, тормозным излучением ускорителя электронов, реже быстрыми нейтронами. Учитывая высокую частоту регионарного метастазирования, в объем облучения обязательно включают все пути лимфооттока не только с лечебной, но и с профилактической целью. Лечебная доза при опухолях носоглотки варьирует от 60 до 70 – 75 Гр, доза профилактического облучения регионарного лимфатического коллектора составляет 45 – 50 Гр. Наиболее часто используют режим классического фракционирования дозы, ежедневно облучая разовой очаговой дозой 2 Гр.
Лучевая терапия является эффективным методом лечения рака носоглотки, обеспечивая 5-летнюю выживаемость при I – II стадии заболевания на уровне 70%. У пациентов с низкодифференцированными формами опухоли, имеющими большую склонность не только к лимфогенному, но и гематогенному метастазированию, лучевая терапия используется по тому же принципу, что и при дифференцированных формах, но в сочетании с химиотерапией.
Большая роль отводится лучевой терапии в лечении рака органов полости рта и ротоглотки. Эти злокачественные опухоли среди опухолей головы и шеи занимают второе место после рака гортани. Рак слизистой полости рта и ротоглотки чаще всего развивается в возрасте 40 – 60 лет, преимущественно у мужчин. Наиболее часто опухоль локализуется в области языка, слизистой дна полости рта и миндалин. Характерным свойством рака органов полости рта является раннее и почти исключительно лимфогенное метастазирование, частота которого достигает 40 – 70%.
Применяемое в настоящее время хирургическое лечение рака полости рта, даже с использованием различных вариантов пластических замещений удаленных тканей, сопряжено с различными косметическими и функциональными дефектами. Кроме того, несмотря на обширный характер операций достаточно высок процент рецидивов заболевания. В случае необходимости хирургического лечения для снижения частоты рецидивов используют лучевую терапию или в предоперационном, или в послеоперационном периоде, т.е. лечение носит комбинированный характер.
На ранних стадиях рака полости рта помимо наружного облучения в ряде случаев есть возможность осуществить внутритканевое введение радиоактивных препаратов, что позволяет подвести к опухоли дозу излучения, достаточную для полного излечения. Такой метод сочетанной лучевой терапии может стать адекватной альтернативой на ранних стадиях заболевания, отдаленные результаты комбинированного лечения и сочетанной лучевой терапии примерно одинаковы.
При местно-распространенных процессах, как правило, сложно или даже невозможно проведение контактной внутритканевой терапии, а с помощью только дистанционного облучения трудно достигнуть полной эрадикации опухоли в связи с относительно невысокой радиочувствительностью опухолей языка и слизистой оболочки полости рта и неблагоприятными радиобиологическими особенностями окружающих тканей. Поэтому при лучевой терапии распространенных форм рака слизистой полости рта полная регрессия опухоли достигается значительно реже, лечение чаще дает лишь паллиативный эффект.
По клиническому течению злокачественные опухоли ротоглотки отличаются от новообразований полости рта более высокой агрессивностью, быстрым темпом роста первичной опухоли, более ранним и обширным метастазированием в регионарные лимфатические узлы.
Лучевая терапия опухолей ротоглотки является основным, а у подавляющего большинства больных единственным методом лечения. В зависимости от индивидуальных особенностей опухолевого процесса лучевая терапия используется или как самостоятельный метод, или, реже , в сочетании с хирургическим вмешательством. При опухолях с низкой степенью дифференцировки, а они в этой области встречаются чаще, чем в полости рта, применяют обычно лучевую терапию в сочетании с химиотерапией, что способствует улучшению результатов лечения.
Учитывая высокую частоту метастазирования в регионарные лимфатические узлы, в объем облучения помимо первичной опухоли обязательно включают зоны регионарного лимфооттока.
Лучевое лечение злокачественных новообразований полости рта и ротоглотки, как правило, сопровождается развитием лучевых реакций со стороны нормальных тканей в зоне облучения. Кожные реакции, проявляющиеся чаще всего только развитием эритемы и локальной эпиляцией в области полей облучения, неприятных ощущений больному не доставляют. Иначе обстоит дело с реакциями слизистых оболочек. Они возникают сравнительно рано, проявляются гиперемией, отеком слизистой, затем островковым или даже сливным эпителиитом. Последний сопровождается болевыми ощущениями, затрудняющими речь и прием пищи, что в отдельных случаях приводит к ухудшению общего состояния. Сроки и тяжесть местных лучевых реакций во многом обусловлены исходным состоянием слизистых оболочек, выраженностью сопровождающего опухоль воспалительного процесса, наличием кариозных зубов, пародонтоза и др. В связи с этим в целях профилактики лучевых реакций в обязательном порядке должна проводиться тщательная санация полости рта. В случае развития выраженных реакций в полости рта и ротоглотки необходимо временно прекратить облучение и провести симптоматическую терапию, сходную с лечением банальных стоматитов.
В лечении рака гортани лучевая терапия также играет весьма существенную роль. Среди злокачественных опухолей ЛОР-органов примерно половина приходится на рак гортани. Заболевают раком гортани преимущественно в возрасте 40 лет и старше. В подавляющем большинстве случаев это плоскоклеточный рак с ороговением или без ороговения.
Лечение рака гортани в ранних стадиях как хирургическим методом с использованием операций различного типа, так и чисто лучевой терапией обеспечивает высокий процент излечения больных и 5-летняя выживаемость составляет 80 – 70%. Лучевая терапия дает такие же результаты, как хирургическое лечение, но при этом имеет такие преимущества, как меньшие травматичность и риск, а также сохранение органа и его функций.
Для высокой эффективности лечения чрезвычайно важно установление диагноза на раннем этапе развития заболевания.
Первые признаки заболевания в подавляющем большинстве случаев может заметить только сам больной, поэтому от его осведомленности зависят сроки обращения к врачу и соответственно возможность диагностирования рака гортани на ранних стадиях развития.
Клинические проявления рака гортани довольно разнообразны и зависят прежде всего от локализации и распространенности опухолевого поражения. Симптоматика рака надскладочного отдела скудна, вначале отмечаются в основном неприятные ощущения или незначительная боль в гортани. При поражении голосовых складок ранним и основным признаком является постепенно нарастающая охриплость. Лишь рак подскладочного отдела длительное время протекает скрыто, затруднение дыхания усиливается постепенно и охриплость нарастает медленно.
Распространяется рак гортани в основном по протяжению в пределах слизистой оболочки или в подслизистом слое, инфильтрируя постепенно и подлежащие ткани, мышцы гортани, хрящи. Метастазирует в основном лимфогенным путем. В зависимости от отдела гортани, в котором локализуется первичная опухоль, и некоторых ее биологических особенностей частота метастазирования в лимфатические узлы шеи колеблется от 5 до 75% [2].
Выбор метода лечения рака гортани определяется рядом обстоятельств. Вообще на протяжении всей истории терапии рака гортани прослеживается стремление достичь двух трудно сочетаемых между собой целей – обеспечить радикальное излечение и сохранить гортань и ее функцию. Этому требованию в наибольшей степени отвечает условно-комбинированный метод с лучевой терапией на первом этапе [3].
В объем облучения включают обычно всю гортань и зоны ближайшего возможного субклинического лимфогенного метастазирования. Применяют наружное облучение в основном классическим фракционированием дозы. После подведения около 40 Гр, что составляет примерно 2/3 условно канцерицидной дозы, оценивают предварительный результат по степени регрессии опухоли, которая главным образом определяется индивидуальной радиочувствительностью опухоли конкретного пациента. При высокой радиочувствительности опухоли, раннем начале и быстрых темпах ее регрессии продолжают лучевую терапию, проводят второй ее этап до суммарной дозы 65 – 70 Гр, что позволяет достичь полной регрессии опухоли и стойкого излечения у 80 – 70% больных в I – II стадии. Больным с незначительной регрессией опухоли после первого этапа лучевой терапии наиболее целесообразно провести оперативное лечение после стихания лучевых реакций в нормальных тканях.
В случае более распространенного опухолевого поражения, особенно с глубоким инфильтративным ростом и ограничением подвижности гортани (III стадия), эффективность лучевой терапии как самостоятельного метода не столь высока и 5-летняя выживаемость колеблется в пределах 25 – 40%. На этой стадии заболевания наиболее целесообразно планировать комбинированное лечение с предоперационной лучевой терапией. В случае выявления индивидуальной высокой радиочувствительности даже у больных с обширным местным распространением процесса возможно продолжение лучевой терапии до подведения полной лечебной дозы 60 – 70 Гр. Таким образом, выделив при III стадии рака гортани группу больных с благоприятным прогнозом в отношении эффективности лучевой терапии, можно достигнуть 5-летней выживаемости на уровне 55% при использовании консервативного метода, сохраняющего гортань.
В последние годы существенно увеличилась возможность консервативного лечения рака гортани за счет комбинации лучевой терапии с наиболее эффективными для этой локализации схемами химиотерапии с включением препаратов 5-фторурацила, платины, блеомицетина. Комплексное лечение позволило значительно расширить контингент больных, у которых прогноз после консервативного лечения благоприятен, 5-летняя выживаемость в этой группе составляет 80%.
Таким образом, лучевая терапия в сочетании с современной лекарственной терапией позволила значительно увеличить число больных, излеченных от рака гортани консервативным методом с сохранением гортани и ее функции.
Больным с прогностически неблагоприятными в отношении успеха консервативного лечения признаками, при недостаточной регрессии опухоли на первом этапе лечения наиболее целесообразно на втором этапе выполнять оперативное вмешательство.
В лечении других злокачественных опухолей головы и шеи лучевая терапия также играет немаловажную роль, однако в рамках этой статьи нет возможности рассмотреть эти вопросы детально.
Современная лучевая терапия, как правило, не приводит к возникновению тяжелых осложнений или грубых постлучевых изменений со стороны окружающих нормальных тканей и органов. Однако для онкологических больных противопоказаны, независимо от давности и области облучения, интенсивная ультрафиолетовая инсоляция, общие тепловые, грязевые и большинство физиотерапевтических процедур на ранее облучавшихся участках тела.
В последующем, в случае повышения эффективности может возрасти роль лучевой терапии в лечении не только опухолей головы и шеи, большинство которых характеризуется умеренной радиочувствительностью и относительно неглубокой расположенностью, но и опухолей с большей радиорезистентностью или глубоким расположением.
Наметились два пути повышения эффективности лучевой терапии [4]. Прежде всего это продолжающееся совершенствование радиотерапевтической техники. В 50-х годах на смену рентгентерапевтическим аппаратам пришли аппараты для дистанционной гамма-терапии, которая к настоящему времени достигла большого совершенства.
Однако наличие только одного вида излучений – гамма-квантов с энергией около 1,25 МэВ, необходимость периодической замены радионуклида и радиационная опасность для персонала при работе с радионуклидами диктуют необходимость внедрения новой техники. Наиболее приемлемыми и доступными для широкого использования на современном уровне аппаратостроения являются ускорители электронов, которые позволяют в значительно большей степени осуществить основной принцип лучевой терапии – максимально сконцентрировать дозу в патологическом очаге при минимальной дозе в окружающих нормальных тканях. В перспективе возможно также более широкое внедрение протонных ускорителей и генераторов нейтронов.
Параллельно совершенствуется технология контактного внутриполостного и внутритканевого облучения за счет создания серии аппаратов с последовательным автоматизированным введением направляющих проводников и источников излучения, которые можно перемещать во время сеанса облучения для формирования индивидуального дозного поля.
Кроме того, разработаны специальная рентгеновская аппаратура (симуляторы), компьютерные томографы и планирующие системы для предлучевой топометрии. Это позволяет точно определить границы подлежащей облучению мишени, создать оптимальные программы облучения, что переводит лучевую терапию в разряд высокоточных дисциплин.
Второй путь повышения эффективности лучевой терапии связан с внедрением в клиническую практику достижений современной радиобиологии, благодаря которым появилась возможность управления радиочувствительностью опухолевых и нормальных тканей. Уже начато применение радиомодифицирующих агентов, т.е. различных физических и химических факторов, способных ослаблять радиопоражаемость нормальных тканей или усиливать радиочувствительность опухоли. Кроме того, разрабатываются математические модели оптимального ритма облучения для опухолей с различными биологическими характеристиками.
Литература:
1. Руководство «Лучевая терапия злокачественных опухолей» под ред. проф. Киселевой Е.С.
2. Пачес А.И. Опухоли головы и шеи. – М.: Медицина, 1983.
3. Руководство «Комбинированное и комплексное лечение больных со злокачественными опухолями» под. ред. чл.-кор. АМН СССР Чиссова В.И.
4. Голдобенко Г.В. Актуальные проблемы радиационной онкологии и пути их решения. – Москва, 1994.
2023. 496 с. Твердый переплет. 659 р.
«Русская трагедия» (2002) – последний социологический роман классика русской литературы, всемирно известного писателя Александра Александровича Зиновьева (1922–2006). В книге рассматривается один из самых трагических периодов новейшей отечественной истории, когда «поголовное предательство правящего… (Подробнее)
2023. 160 с. Твердый переплет. 869 р.
Эта книга — трогательная история для взрослых о поиске себя. Большая Панда и Маленький Дракон отправляются в путешествие по временам года. Они часто теряются, как и многие из нас. Но, заблудившись, делают для себя множество прекрасных открытий. (Подробнее)
URSS. 2023. 272 с. Мягкая обложка. 799 р.
В 2001 г. за разработку новой технологии производства посадочного материала методом зеленого черенкования Михаилу Трофимовичу Тарасенко была присуждена Государственная премия Российской Федерации в области науки и техники.
В настоящей книге обобщены результаты полувековых исследований автора… (Подробнее)
URSS. 2023. 312 с. Мягкая обложка. 879 р.
Вниманию читателей предлагается книга одного из наиболее выдающихся экономистов XX века Йозефа Шумпетера, в которую вошли биографические и одновременно теоретико-экономические статьи о жизни и творчестве ученых, ставших классиками экономической науки. Автор обобщает колоссальный объем знаний… (Подробнее)
URSS. 2023. 448 с. Мягкая обложка. 969 р.
Вниманию читателей предлагается книга, в которой собраны наиболее значительные произведения Фридриха Энгельса по военным вопросам. В книге содержатся статьи и извлечения из работ Энгельса, посвященные общетеоретическим проблемам военного дела, оперативно-стратегическим и военно-техническим… (Подробнее)
2023. 672 с. Твердый переплет. 999 р.
Примерно половина населения мира разговаривает на языках, ведущих свое происхождение от общего предка — праиндоевропейского языка. Но кем были носители этого древнего наречия и как им удалось расселиться по земному шару? До недавнего времени их идентичность оставалась загадкой для лингвистов и археологов…. (Подробнее)
2023. 476 с. Интегральный переплет. 539 р.
Книга выпущена в рамках издательской программы Института системно-стратегических исследований (рук. А.И. Фурсов). 2022 год во всех смыслах стал переломным. Военная фаза длительного украинского конфликта стала продолжением деструкции политического, социально-экономического и культурного (в самом… (Подробнее)
URSS. 2023. 208 с. Мягкая обложка. 539 р.
Вниманию читателей предлагается книга советского историка и публициста М.П.Павловича. цель которой — облегчить читателям изучение некоторых вопросов, затронутых В.И.Лениным в работах, статьях или речах, посвященных этим вопросам. С этой точки зрения рассматриваются ленинская критика воззрений… (Подробнее)
URSS. 2023. 512 с. Мягкая обложка. 1139 р.
Широкое внедрение алгебраических методов в теоретическую физику не является новостью. Калибровочные поля и их интерпретация на языке расслоенных пространств, суперсимметричные расширения полевых теорий, возникновение теорий Великого объединения, струнных моделей, квантовой петлевой гравитации —… (Подробнее)
2023. 1896 с. Твердый переплет. 3499 р.
Стивен Коткин, всемирно известный историк, профессор Принстонского университета (США), предпринял успешную попытку написать тотальную историю сталинского режима и его воздействия на Евразию и остальной мир. В первом томе — «Парадоксы власти» — изучается история жизни и деятельности Сталина от рождения… (Подробнее)
Книжные памятники Свет
Обратная связь
Версия для слабовидящих
Войти
НЭБ
-
Коллекции и спецпроекты
-
Новости
-
Электронные читальные залы
-
Информация для библиотек
-
Вопросы и ответы
-
Обратная связь
Наши продукты
Книжные памятники
Свет
Мы в соцсетях
Версия для слепых
Лучевая терапия злокачественных опухолей : руководство для врачей / Киселева Е.С. [и др.] ; под ред. Киселевой Е.С.
Лучевая терапия злокачественных опухолей : руководство для врачей / Киселева Е.С. [и др.] ; под ред. Киселевой Е.С.
1996
Год издания
Москва : Медицина
Место издания
О произведении
Библиотека
Белгородская государственная уиверсальная научная библиотека
Еще
Ближайшая библиотека с бумажным экземпляром издания
Пожалуйста, авторизуйтесь
Вы можете добавить книгу в избранное после того, как
авторизуетесь на портале. Если у вас еще нет учетной записи, то
зарегистрируйтесь.
1. Бохман Я.В. Руководство по онкогинекологии. СПб., 2002.
2. Вишневская Е.Е. Предопухолевые заболевания и злокачественные опухоли женских половых органов. Минск, 2002.
3. Давыдов М.И., Аксель Е.М. Злокачественные новообразования в России и странах СНГ в 2002 М., 2004.
4. Ермакова Н.А. Роль химиотерапии на различных этапах лечения рака шейки матки // Практ. онкол. 2002. Т. 3. №3. С. 211-219.
5. Ермаков Н.А. Роль химиотерапии на различных этапах лечения рака шейки матки // Практ. Онкол. – 2002. №3(3). – С. 211-219.
6. Киселева Е.С., Голобенко В., Канаев С.В. Лучевая терапия злокачественных опухолей: Руководство для врачей. М.: Медицина, 1996. 464 с.
7. Киселева Е.С., Голобенко В., Канаев С.В. Лучевая терапия злокачественных опухолей: Руководство для врачей. М.: Медицина, 1996. 464 с.
8. Новик В.И. Эпидемиология рака шейки матки, факторы риска, скрининг // Практ. онкол. 2002. Т. 3. №3. С. 156-165.
9. Столярова И.В. Проблемы больных после лечения рака шейки матки (профилактика и лечение постлучевых осложнений) // Практ. онкол. 2002. Т. 3. №3. С. 220-227.
10. Тюляндин С.А., Марьина Л.А. Химиолучевая терапия местнораспространенного рака шейки матки // Материалы VII Российского онкологического конгресса. М., 2003. С. 111-115.
11. Jammell J.K., Rao VS., Cawkwell L. Drew P.J. Radioresistance in carcinoma of the breast // Breast. 2004. – Vol. 13. №6. – P. 452-460.
12. Leborgne F. et al. Induction chemotherapy and radiotherapy of advanced cancer of the cervix : A pilot study and phase III randomized trial // Int J Radiat Oncol Biol Phys. – 1997. – Vol. 37. – P. 343-50.
13. Mmagawa Y. et al. Outcome of radiation therapy in elderly patients with advanced cervical cancer // In J Gyn Obst. – 1997. – Vol. 58. – P. 305-309.
14. Morris M. et al. Pelvic radiation with concurrent chemotherapy compared with pelvic and para-aortic radiation for high-risc cervical cancer // N Engl J Med. – 1999. – Vol. 340. – P. 1175-1178.
15. Rose PG, Locally advanced cervical cfrcinoma: the role of chemoradietion // Semin Oncol. – 1994. – Vol. 21. – P. 47-52.
16. Rose P.G. et al. Concurrent cisplatin-based radiotherapy and chemotherapy for locally advanced cervical cancer // N Engl J Med. – 1999. – Vol. 340. – P. 1144-1153.
17. Tattersall M.H.N. et al. Neoadjuvant gemcitabine and cisplatin chemotherapy fpllpwed by pelvic radiation in locallyadvanced cervical cancer // J Clin oncol. – 1995. – Vol. 13. – P. 444-451.
18. Vanderwilt C.L., Marinelli A., Pinedo H.M. et al. The effect of different routes of administration of 5-fluoruracil on thymidlate synthase inhibition in the rat // Europ. J. Cancer. 1995. Vol. 31. P. 743-760.
Рак шейки матки (РШМ) – одна из наиболее частых злокачественных опухолей женских гениталий. По данным ВОЗ, ежегодно в мире РШМ заболевают свыше 500000, а умирают от него – около 200000 женщин.
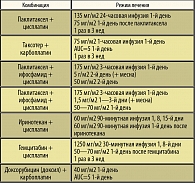
Таблица 1. Комбинации цитостатиков, применяемых при РШМ

Таблица 2. Результаты неоадъювантной ХТ при РШМ

Таблица 3. Результаты рандомизированных исследований ЛТ и ХЛЛ при РШМ
В развивающихся странах заболеваемость РШМ занимает первое место среди новообразований гениталий, в экономически развитых странах – третье после рака тела матки и яичников. В Африке, Центральной и Южной Америке и Азии (за исключением Японии) на долю РШМ приходится 20–30% всей онкологической патологии у женщин, в Северной Америке, Австралии, Северной и Западной Европе – 4-6%.
В России РШМ занимает пятое место в структуре заболеваемости злокачественными новообразованиями (5,2% всех злокачественных новообразований) и второе место (после рака тела матки) в структуре заболеваемости злокачественными опухолями гениталий. Заболеваемость РШМ в 2002 году составила 11,60/0000, смертность – 5,10/0000. Несмотря на визуальную локализацию, РШМ III–IV стадий выявлен у 39,8% больных. Высокой остается летальность в течение первого года с момента установления диагноза (20,3%), что свидетельствует о поздней диагностике и не всегда адекватном лечении.
Особенности клинического течения
У 70–80% больных инвазивным РШМ диагностируют плоскоклеточный рак, у 10–20% – аденокарциному и у 10% – низкодифференцированный рак. Частота других злокачественных опухолей шейки матки (ШМ) составляет не более 1%.
РШМ метастазирует лимфогенно и гематогенно. Переход опухоли от местноинфильтративного роста к лимфогенному распространению прогностически неблагоприятно. К сожалению, значительная часть больных РШМ при первичном обращении уже имеют лимфогенные метастазы.
Ведущим фактором, определяющим лимфогенное метастазирование, является глубина инвазии опухоли. При глубине инвазии опухоли до 1 мм метастазов в регионарных лимфатических узлах не бывает. При инвазии опухоли до 3 мм (IА1 стадия) лимфогенные метастазы обнаруживают у 1% больных, при глубине инвазии 3–5 мм (IА2 стадия) – уже у 5–8%. Дальнейший рост опухоли приводит к проявлению раковых эмболов в лимфатических сосудах, что резко увеличивает частоту лимфогенных метастазов. По данным разных авторов, частота лимфогенных метастазов при РШМ IВ стадии составляет 15–18%, II стадии – 25–30%, III стадии – 50–60%. Следует отметить, что РШМ в течение длительного времени имеет местное или местно-регионарное распространение.
Местно-регионарное распространение опухоли ведет к гематогенному метастазированию. При РШМ чаще всего поражаются легкие, печень и кости. Гематогенные метастазы РШМ без лимфогенных встречаются крайне редко.
Диагностика
Профилактическое обследование женщины включает визуальный осмотр наружных половых органов, влагалища, влагалищной части ШМ, бимануальное ректовагинальное исследование и цитологическое исследование мазков с экто- и эндоцервикса. При выявлении фоновой патологии ШМ дополнительно проводят кольпоскопию, биопсию всех подозрительных участков ШМ (при необходимости) и выскабливание цервикального канала. Эти мероприятия позволяют своевременно диагностировать дисплазию ШМ, преинвазивный и микроинвазивный РШМ. Если диагноз инвазивного РШМ верифицирован, последующие диагностические мероприятия направлены на уточнение степени распространенности опухоли и определение стадии заболевания. По данным разных авторов, частота ошибок при клиническом стадировании РШМ достигает 36%.
Лечение
Выбор метода лечения РШМ определяется индивидуально и зависит от распространенности процесса и тяжести сопутствующей патологии. Возраст больной имеет меньшее значение. Традиционными методами лечения РШМ являются хирургический, лучевой и их комбинации. В настоящее время активно изучаются возможности лекарственной терапии и химиолучевого лечения (ХЛЛ).
Хирургическое лечение
История хирургического лечения инвазивного РШМ насчитывает более 100 лет. Первые операции были выполнены в Европе и России во второй половине XIX в. Приоритет разработки и внедрения радикальных хирургических вмешательств при РШМ, безусловно, принадлежит австрийскому гинекологу Э. Вертгейму. Впервые он выполнил операцию, которая впоследствии будет названа его именем в 1902 году. В монографии 1911 года «Расширенная абдоминальная операция при раке шейки матки» Э. Вертгейм описал результаты 500 расширенных гистерэктомий. Многие выдающиеся отечественные и зарубежные гинекологи внесли большой вклад в усовершенствование техники расширенных операций и повышение их радикальности. Усилиями А.Т. Губарева, И.Л. Брауде, Л.Л. Окинчица, Н.Н. Никольского, А.И. Сереброва, В.П. Тобилевича, Л.А. Новиковой, Я.В. Бохмана, В.П. Козаченко техника расширенной гистерэктомии при РШМ прочно укоренилась в отечественной онкогинекологии, а ее широкое внедрение позволило излечить десятки тысяч женщин. Весомый вклад в разработку отдельных этапов операции Вертгейма внесли зарубежные исследователи – H. Okabayashi (1921), J. Meigs (1944, 1951) и др.
При тяжелой дисплазии и внутриэпителиальном РШМ, или РШМ in situ, (CIN III) выполняется раздельное диагностическое выскабливание полости матки и цервикального канала и конизация ШМ. Техника этой операции хорошо известна и описана во многих хирургических руководствах. Конизация ШМ может быть выполнена при помощи скальпеля, электроножа или луча лазера. Ножевая конизация позволяет получить наиболее полную и точную морфологическую картину удаленного конуса ШМ и должна применяться при всех спорных морфологических заключениях при дисплазии и микроинвазивном РШМ. При гистологическом подтверждении диагноза CIN III, а также микроинвазивного РШМ данный объем хирургического вмешательства считается адекватным. Если при опухоли с глубиной инвазии в строму ШМ до 3 мм обнаруживаются опухолевые эмболы в кровеносных или лимфатических сосудах, больной следует выполнять модифицированную расширенную экстирпацию матки с придатками (или без придатков). Модифицированная расширенная экстирпация матки также выполняется при глубине инвазии опухоли в строму ШМ 3–5 мм (IA2 стадия).
В настоящее время во всем мире для лечения инвазивного РШМ IB–IIA стадий применяется расширенная экстирпация матки с придатками (или без придатков), известная как операция Вертгейма.
В США хирургические вмешательства, выполняемые при инвазивном РШМ, делят на 5 типов:
- I тип – экстрафасциальная экстирпация матки;
- II тип – модифицированная радикальная экстирпация матки (включает удаление медиальной половины кардинальных и крестцово-маточных связок);
- III тип – радикальная экстирпация матки (предусматривает удаление большей части кардинальных, крестцово-маточных связок, верхней трети влагалища и лимфатических узлов таза); в США при инвазивном РШМ чаще всего выполняется именно эта операция;
- IV тип – расширенная радикальная экстирпация матки (удаляются периуретеральные ткани, резецируется верхняя пузырная артерия и три четверти влагалища);
- V тип – передняя экзентерация малого таза (предусматривает удаление дистальных отделов мочеточников и мочевого пузыря; выполняется при прорастании опухоли в мочевой пузырь).
Пятилетняя выживаемость после хирургического лечения микроинвазивного РШМ составляет 97-98%. Выживаемость больных РШМ IВ стадии без регионарных метастазов при хирургическом, лучевом и комбинированном лечении одинакова и равна 85-90%, а, по данным отдельных авторов, достигает 95%.
Комбинированное лечение
Комбинированное лечение, включающее операцию и лучевую терапию (ЛТ) в разной последовательности, проводят при РШМ IВ-IIА стадий. Отдельные авторы допускают его применение при РШМ IIВ стадии.
Предоперационное облучение имеет ряд преимуществ перед послеоперационным. Снижается диссеминация опухолевых клеток и частота рецидивов заболевания. Предоперационную ЛТ проводят при РШМ IВ2-IIA стадий, а также при РШМ IB1 стадии при наличии эхографических признаков метастазов в лимфатических узлах таза и при РШМ IIB стадии при наличии небольшого пришеечного инфильтрата.
Основная цель послеоперационного облучения – воздействие на опухолевые клетки в зоне первичной опухоли и регионарных лимфатических узлов. Многие авторы считают, что проведение послеоперационного облучения при РШМ целесообразно. Послеоперационное облучение проводят больным, имеющим противопоказания к предоперационной ЛТ (беременность, воспалительный процесс или объемные образования придатков матки), при наличии факторов риска прогрессирования (метастазы в лимфатических узлах таза, глубокая инвазия опухоли, низкая степень дифференцировки, патоморфоз I-III степени, наличие раковых эмболов в лимфатических щелях), а также в тех случаях, когда при исследовании препарата, удаленного во время операции, выявлена более глубокая инвазия, чем предполагалось до операции.
Важнейший фактор прогноза у операбельных больных РШМ IВ-IIА стадий – наличие метастазов в регионарных лимфатических узлах. Пятилетняя выживаемость при поражении лимфатических узлов таза снижается на 50% и не превышает 25% при метастазах в поясничных лимфатических узлах. При двухсторонних множественных метастазах риск регионарного рецидива РШМ в 2 раза выше, чем при поражении 1-3 лимфатических узлах таза с одной стороны. Если первичная опухоль менее 2 см, то 5-летняя выживаемость составляет 90%, 2-4 см – только 40% (Kenneth D., Hatch Yao S. Fu, 1996).
По нашим данным, 5-летняя общая и безрецидивная выживаемость больных РШМ IВ1 стадии после комбинированного лечения составляет 94,8 и 93,6% соответственно, IВ2 стадии – 86,2 и 85,7% соответственно. Пятилетняя выживаемость больных РШМ IB клинической стадии достоверно снижается при выявлении во время операции метастатического поражения регионарных лимфатических узлов таза, опухолевой инфильтрации параметральной клетчатки и глубокой инвазии стромы ШМ. Проведение предоперационной ЛТ достоверно улучшает отдаленные результаты лечения больных РШМ IB клинической стадии с метастазами в регионарных лимфатических узлах таза и больных РШМ IВ2 стадии.
По данным мировой литературы, 5-летняя выживаемость после комбинированного лечения РШМ IB стадии составляет 92-70,2%, II стадии – 80-52,9%. Следует отметить, что ряд авторов не отмечают достоверных различий 5-летней выживаемости больных РШМ IВ-IIА стадий, подвергнутых только хирургическому или комбинированному лечению.
Несмотря на очевидные успехи хирургического, лучевого и комбинированного методов лечения, выживаемость больных местнораспространенным РШМ продолжает оставаться стабильной. Это связано, прежде всего, с ограниченными возможностями хирургического лечения больных РШМ IIВ-IIIА стадий.
Химиотерапия
В последнее десятилетие многие ведущие клиники применяют при местнораспространенном РШМ химиотерапию (ХТ). ХТ местнораспространенного РШМ является сложной клинической задачей, что обусловлено, прежде всего, относительной резистентностью плоскоклеточного гинекологического рака к большинству имеющихся цитостатиков. Широкое практическое внедрение получили лишь некоторые из них. Эффективность цисплатина при РШМ составляет 23%, карбоплатина – 15%, ифосфамида – 22%, циклофосфамида – 15%, блеомицина – 10%, фторурацила – 20%, доксорубицина – 17%, митомицина – 14%, метотрексата – 18%, винкристина – 18% (Манзюк Л.В., 2000).
Наиболее активным цитостатиком при РШМ является ЦИСЛАТИН. Он эффективен в дозе 50 мг/м2 1 раз в 3 недели. Доза 100 мг/м2 дает небольшое, но статистически достоверное увеличение эффекта. Введение ЦИСЛАТИНА в дозе 100 мг/м2 в виде 24-часовой инфузии не улучшает результатов лечения, но менее токсично.
Второй по активности препарат – ИФОСФАМИД (применяется с уропротектором местной). Изучены разные режимы введения ИФОСФАМИДА:
- 1,5 г/м2/сут, 8-часовая инфузия, 3 сут.;
- 1,5 г/м2/сут, 1-часовая инфузия, 5 сут.;
- 5 г/м2/сут, 1-часовая инфузия, 1 сут.
Эффективность ИФОСФАМИДА у нелеченных пациенток составляет 21-50%, после ЛТ или ХТ – 0-11%. Активность доксорубицина при РШМ, по данным GOG, составляет 20%. Из новых цитостатиков заслуживают внимания таксаны (ПАЛИТАСКЕЛ, ДОЦЕТАКСЕЛ), иринотекан, винорельбин, гемцитабин.
В настоящее время монохимиотерапия при распространенном РШМ практически не применяется. Лечение обычно проводят разными лекарственными комбинациями, включающими цисплатин. Чаще используют двухкомпонентные комбинации: цисплатин и ифосфамид, цисплатин и фторурацил. Применяют и другие, более сложные лекарственные комбинации, например: цисплатин, этопозид и митомицин (МЕР), цисплатин, ифосфамид и фторурацил (PIF) и т. д.
В последние годы производные платины комбинируют с новыми цитостатиками (таблица 1).
В исследовании Zanetta at al., (2000) цисплатин в дозе 50 мг/м2 вводился больным, ранее получавшим ЛТ, а в дозе 75 мг/м2 – больным, которым облучение не проводилось. Эффективность лечения у больных после ЛТ составила 52,1% по сравнению с 75% во второй группе. Десять пациенток с полной клинической регрессией в дальнейшем были прооперированы, причем у 6 из них полная ремиссия подтверждена морфологически.
Перспективным является внедрение в практику лечения больных РШМ ХТ в сочетании с ЛТ и/или хирургическим лечением. Подобный подход имеет ряд теоретических обоснований. Противоопухолевые препараты усиливают лучевое повреждение опухолевых клеток за счет нарушения механизма репарации ДНК, синхронизации вступления опухолевых клеток в фазы клеточного цикла, уменьшения числа опухолевых клеток, находящихся в фазе покоя, и способности девитализировать резистентные к облучению опухолевые клетки, находящиеся в состоянии гипоксии. Кроме того, сами противоопухолевые препараты обладают цитостатическим эффектом не только в отношении первичной опухоли и регионарных метастазов, но и способны воздействовать на отдаленные метастазы. Опухоль может быть более химиочувствительна перед ЛТ или операцией и уменьшение объема опухоли после ХТ может повышать эффективность ЛТ или способствовать выполнению радикальной операции. Использование неоадъювантной ХТ снижает риск интраоперационной диссеминации опухолевых клеток .
Химиотерапия и последующее хирургическое лечение
С конца 80-х годов прошлого столетия несколько групп исследователей из Аргентины, Австралии, Кореи и Италии опубликовали предварительные результаты применения платиносодержащих комбинаций в качестве предоперационной ХТ у пациентов РШМ IB2-IIIB стадий. Терапевтический эффект был отмечен у 66,6-89% больных. При гистологическом исследовании наиболее выраженная регрессия наблюдалась в опухоли, локализующейся на стенке влагалища, менее выраженная – в опухоли, локализующейся на шейке матки, еще менее выраженная – в параметральном опухолевом инфильтрате. Хотя уровень гистологически доказанных полных регрессий был достаточно низок (0-13%), метастазы в лимфатических узлах во время операции у больных, получавших предоперационную ХТ, обнаруживались реже (8-33%), чем у больных, не получавших ее (40-80%). Таким образом, ХТ, по-видимому, влияет не только на первичную опухоль, но и на метастазы в лимфатических узлах. Если это действительно так, то хирургическим путем можно удалять потенциально резистентные очаги и улучшать тем самым безрецидивную выживаемость. Многофакторный анализ, проведенный Benedetti-Panici et al. (1994) показал, что ответ на неоадъювантную ХТ может служить независимым фактором прогноза выживаемости, наряду с клинической стадией, размером опухоли и наличием инфильтратов в параметриях.
К сожалению, в специальной литературе в основном описаны нерандомизированные и пилотные исследования, результаты которых очень трудно интерпретировать из-за небольшого числа наблюдений, короткой прослеженности или отсутствия четких критериев отбора пациентов.
В исследование Namkoong et al. (1995) включено 230 пациенток РШМ IB2, IIA и IIB стадий. Длительность наблюдения составила 4 года. Девяносто двум больным проведено лечение по схеме: предоперационная ХТ (винбластин + блеомицин + цисплатин каждые 3 нед., 2-5 курсов в зависимости от эффекта) + радикальная операция. Группу сравнения составили 138 пациенток, которые были радикально оперированы. Частота метастазов в лимфатических узлах была меньше в группе больных, получивших предоперационную ХТ (17% по сравнению с 34%, p=0,005). То же можно сказать и о частоте рецидивов заболевания (18,5% по сравнению с 35,5%, р=0,004). Отмечено также удлинение безрецидивного периода (р=0,0067).
Наиболее важные результаты рандомизированных исследований представлены в таблице 2.
В исследовании Sardi JE et al. (1997) приведена окончательные данные о лечении пациенток РШМ IB1-B2 стадий. В этом исследовании группа больных, подвергнутых неоадъювантной ХТ с последующими операцией и облучением, сравнивалась с группой больных, прооперированных на первом этапе и получавших затем ЛТ. ХТ проводилась по схеме винкристин, 1 мг/м2 в 1-й день, цисплатин, 50 мг/м2 в 1-й день, блеомицин, 25 мг/м2 6-часовая инфузия в 1-3-й дни. Проводилось 3 курса лечения с интервалом 10 дней. Общая выживаемость при РШМ IB стадии оказалась значительно выше среди больных, подвергнутых неоадъювантной ХТ (81% по сравнению с 66% в контрольной группе после 8 лет наблюдения, p < 0,05). Кроме того, в контрольной группе было значительно выше число рецидивов в малом тазу (17% по сравнению с 7%, p < 0,001), хотя частота отдаленных метастазов достоверно не отличалась (8% по сравнению с 5%). При РШМ IB2 стадии резектабельность была выше у больных, подвергнутых неоадъювантной ХТ (100% по сравнению с 85%, p<0,01). Морфологические факторы риска, такие, как наличие опухолевых эмболов в лимфатических и кровеносных сосудах, инфильтрация параметриев и метастатическое поражение лимфатических узлов, у большинства больных, подвергнутых неоадъювантной ХТ, отсутствовали (p<0,001).
Клинические исследования по использованию индукционной ХТ с последующим хирургическим лечением показали, что уменьшение объема опухоли под воздействием лекарственного лечения позволяет выполнить радикальную операцию у большинства изначально неоперабельных больных. Предоперационная ХТ не увеличивает число интра- и послеоперационных осложнений. Доказано, что неоадъювантная ХТ снижает частоту метастазов в лимфатических узлах при РШМ.
Химиолучевое лечение
Sardi JE et al. (1998) исследовал возможности неоадьювантной ХТ в сочетании с ЛТ при местнораспространенном РШМ. Семидесяти двум больным РШМ IIB стадии на I этапе лечения проведено 3 курса ХТ по схеме PVB: винкристин, 1 мг/м2 в 1-й день, блеомицин, 25 мг/м2 в 1-3-й дни, цисплатин, 50 мг/м2 в 1-й день. Интервал между курсами составлял 10 дней. На 2 этапе проводилась сочетанная ЛТ (дистанционное облучение малого таза до суммарной дозы 50 Гр (разовая доза 1,8-2,0 Гр и затем брахитерапия до суммарной дозы на точку А 35-40 Гр за 1-2 сеанса). Контрольную группу составили 73 пациентки РШМ IIB стадии, которым проводилась сочетанная ЛТ до указанных выше доз. Пятилетняя выживаемость в основной группе составила 54%, в контрольной – 48%. Частота рецидивов была значительно ниже в группе, получавшей ХТ, по сравнению с контрольной группой (25 и 41% соответственно, p<0,04).
В исследовании Keys H.M. et al. (1999) больные РШМ IB2 стадии на первом этапе получали либо ЛТ (186 больных), либо ЛТ совместно с введением цисплатина (183 больных). Суммарная доза на первичную опухоль составляла 75 Гр, на зоны регионарного метастазирования – 55Гр. Цисплатин в дозе 40 мг/м2 вводили еженедельно течение 6 недель на протяжении всего курса ЛТ. Совместное назначение ЛТ и цитостатиков хорошо переносилось и не приводило к увеличению продолжительности лечения. Трехлетняя выживаемость в группе больных, подвергнутых ХЛЛ и ЛТ, составили 85 и 74% соответственно (р=0,008). Сочетанное применение ЛТ и цисплатина снижало риск смерти от РШМ на 46%.
Исследование Rose P.G. et al. (1999) посвящено лечению 526 больных РШМ более поздних стадий (IIB-IVA). Им проводилась ЛТ с одновременным введением гидроксимочевины, 3 г/м2 2 раза в неделю в течение 6 недель (1-я группа), либо цисплатина, 40 мг/м2 еженедельно в течение 6 недель (2-я группа), либо комбинации цисплатина, 50 мг/м2 в 1-й и 29-й дни, фторурацила, 4 г/м2 в/в инфузия в течение 96 часов в 1-й и 29-й дни, и гидроксимочевины, 2 г/м2 внутрь 2 раза в неделю в течение 6 недель (3-я группа). Дистанционная ЛТ проводилась до суммарной дозы 40,8 или 51 Гр с последующим проведением брахитерапии через 3 недели в дозе 40 Гр при IIB стадии и 30 Гр при III–IVA стадиях. Трехлетняя выживаемость была достоверно выше в группах больных, получавших цисплатин (65,5%), по сравнению с группой, получавшей гидроксимочевину (47%). Относительный риск смерти больных, получавших только цисплатин или цисплатин в комбинации с другими препаратами, составил 0,61 и 0,58 соответственно (риск смерти в группе больных, получавших гидроксимочевину, принят за 1). Принимая во внимание меньшую токсичность и простоту введения цисплатина по сравнению с комбинацией цисплатин + фторурацил + гидроксимочевина, авторы отдают предпочтение первой схеме ХЛЛ.
В 1999 году опубликованы результаты рандомизированного исследования, проведенного GOG, в котором показано улучшение выживаемости больных местнораспространенным РШМ (IIB-IVA стадии), получавших ХЛЛ по сравнению с сочетанной ЛТ (Whitney C.W. et al., 1999). Цисплатин вводили в дозе 50 мг/м2 в 1-й и 29-й дни, фторурацил, 1000 мг/м2 в 2-5-й и 30-33-й дни во время дистанционной ЛТ. Дозы ЛТ были одинаковы в обеих группах. Пятилетняя выживаемость в группе больных, которым проведена ХТ, составила 55% по сравнению с 43% в группе больных после сочетанной ЛТ.
Сводные данные рандомизированных исследований эффективности ЛТ и ХЛЛ местнораспространенного РШМ представлены в таблице 3.
Таким образом, представленные данные свидетельствуют о целесообразности совместного проведения ХТ и ЛТ у больных местнораспространенным РШМ. Поскольку данные рандомизированных исследований о преимуществах какой-либо из лекарственных комбинаций отсутствуют, можно применять наименее токсичный режим – еженедельное введение цисплатина в дозе 40-50 мг/м2. Следует продолжать поиск хорошо сочетающихся с ЛТ, эффективных и малотоксичных комбинаций цитостатиков, в том числе с включением таких препаратов, как ифосфамид, блеомицин, таксаны и т. д. Цели ХТ зависят от стадии заболевания. На ранних стадиях она в первую очередь потенцирует местный эффект ЛТ, на более поздних, кроме того, подавляет отдаленное метастазирование.
Материалы и методы
Мы располагаем опытом комплексного лечения 42 первичных больных РШМ T2bN0M0 и T2bN1M0. На I этапе всем больным было проведено ХЛЛ, которое начинали с 2 курсов лекарственной терапии с трехнедельным перерывом (цисплатин, 100 мг/м2 в/в в 1-й день с предварительной гипергидратацией на фоне противорвотных средств, блеомицин, 15 мг в/в в 1, 3, 5, 8-й дни, фторурацил, 450 мг/м2 в/в в 1 и 8-й дни, циклофосфан, 400 мг в/в в 1, 3, 5, 8-й дни). На II этапе (через 3 недели после окончания ХТ) проводили дистанционную ЛТ (суммарная очаговая доза на первичную опухоль и зоны регионарного метастазирования 30-40 Гр). На III этапе (через 2-3 недели после завершения ЛТ) выполняли расширенную экстирпацию матки с придатками. После операции при наличии факторов риска (метастазы в лимфатических узлах таза, глубокая инвазия опухоли, низкая степень дифференцировки, патоморфоз I-III степени, наличие раковых эмболов в лимфатических сосудах) проводили ЛТ до индивидуально запланированных терапевтических доз.
Для сравнения эффективности комплексного лечения нами были изучены результаты комбинированного лечения 50 больных местнораспространенным РШМ T2bN0M0 и T2bN1M0. На I этапе все больные этой группы получили предоперационную дистанционную ЛТ в суммарной очаговой дозе на первичную опухоль и зоны регионарного метастазирования 30-40 Гр. На II этапе выполняли расширенную экстирпацию матки с придатками, на III этапе проводили дистанционную или сочетанную ЛТ до индивидуально запланированных терапевтических доз. В анализ включены только больные, которым после предоперационной ЛТ удалось выполнить хирургическое вмешательство.
При гистологическом исследовании операционных препаратов у всех больных оценена степень лечебного патоморфоза опухоли. Полная регрессия первичной опухоли (патоморфоз IV степени) установлен у 33,3% больных, подвергнутых ХЛЛ, и 10% больных после ЛТ (р<0,05), регрессия опухоли более 50% (патоморфоз III степени) – у 35,7 и 28% больных соответственно, регрессия опухоли менее 50% (патоморфоз I-II степени) – у 28,6 и 38% больных соответственно. И, наконец, первичная опухоль не имела признаков лечебного патоморфоза у 2,4% больных после ХЛЛ и у 24% больных после предоперационной ЛТ (p<0,05). Таким образом, ХЛЛ оказывает более выраженное тумороцидное действие на первичную опухоль по сравнению с ЛТ.
Применение неоадъювантной ХТ в комплексном лечении РШМ не увеличивает частоту и выраженность лучевых и послеоперационных осложнений по сравнению с комбинированным лечением.
Пятилетняя общая, определяемая опухолью (disease-specific) выживаемость больных после комплексного лечения соcтавила 88,3%, после комбинированного лечения – 66,1% (p<0,05). Пятилетняя безрецидивная выживаемость больных, которым проведено комплексное лечение, выше этого показателя у пациенток, подвергнутых комбинированному лечению, – 79,1 и 63,2% соответственно.
В первые 5 лет после лечения признаки местного прогрессирования РШМ выявлены у 24% больных после комбинированного лечения и у 9,5% пациенток после комплексного лечения (p<0,05), отдаленные метастазы – у 14 и 2,4% пациенток соответственно (p<0,05). Если после предоперационной ЛТ или ХЛЛ отмечался лечебный патоморфоз первичной опухоли IV степени, отдаленные метастазы, местное и регионарное прогрессирование не возникали. Нами установлено, что применение ХЛЛ улучшает прогноз больных с метастазами РШМ в регионарные лимфатических узлах таза.
Таким образом, представленные данные свидетельствуют о целесообразности проведения неоадъювантной ХТ при РШМ, что требует дальнейшего многоцентрового исследования этого аспекта с использованием иммуногистохических и современных биологических критериев и пересмотру общепринятых лечебных подходов и методических рекомендаций.










