РУКОВОДСТВО ПО КЛИНИЧЕСКИМ ИССЛЕДОВАНИЯМ ВНУТРЕННИХ БОЛЕЗНЕЙ
Николаев Н. А.

Издательство:
Академия Естествознания
Год издания: 2015
ISBN: 978-5-91327-355-0
В руководстве рассмотрены современные методы клинических исследований в области лекарственной терапии больных хроническими соматическими заболеваниями. Показано, как результаты лечения могут быть измерены количественно. Описаны методики интегральной оценки и прогноза приверженности больных к лечению, расчёта показателей рациональности и выгодности лекарственной терапии. Приведены алгоритмы повышения качества и минимизации затрат при лечении больных хроническими заболеваниями в клинике внутренних болезней (на рус. и англ. яз.).
Для студентов, аспирантов, докторантов, клинических исследователей, врачей – клинических исследователей, клинических фармакологов, практических врачей, руководителей медицинских организаций, организаторов здравоохранения.
ВВЕДЕНИЕ
ГЛАВА 1. Выбор модели клинического исследования: рандомизированное клиническое испытание, или циркулярная модель?
ГЛАВА 2. Принципы и методы статистического исследования
ГЛАВА 3. Стандартные методы фармакоэкономических исследований
ГЛАВА 4. Прогноз приверженности участника клинического исследования к постоянной лекарственной терапии
ГЛАВА 5. Исследование рациональности постоянной лекарственной терапии
ГЛАВА 6. Исследование выгодности постоянной лекарственной терапии
ГЛАВА 7. Вопросы интерпретации результатов клинических исследований и возможности их использования в практическом здравоохранении
СПИСОК ЛИТЕРАТУРЫ
СПИСОК СОКРАЩЕНИЙ
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)

Скачать PDF
Следующая статья: Правильные ответы и вопросы
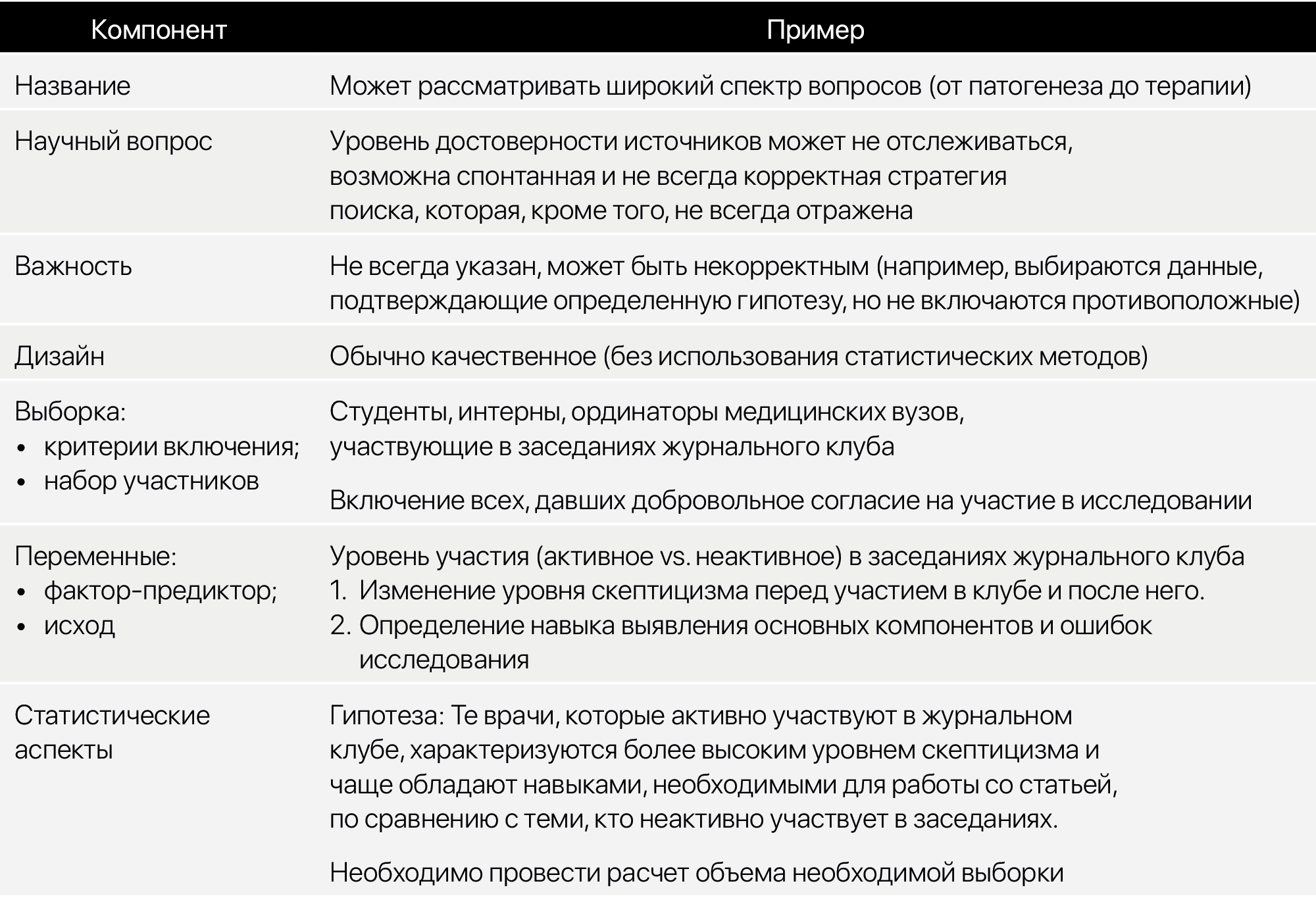
Из этой статьи вы узнаете, из каких частей состоит клиническое исследование (Clinical Research), то есть разберетесь в основных составляющих или «органах» исследования (его анатомии) и в том, как эти «органы» работают вместе (физиологии).
Основные составляющие/элементы — это научный вопрос, дизайн, выборка и методология («весы и линейки»). Описание составляющих мы можем найти в протоколе исследования. Протокол — это по сути план. Обычно исследователи пишут его, чтобы получить финансирование на свою работу (т. е. выиграть грант); тем не менее, протокол важен не только для этого, подготовка протокола позволяет логически структурировать работу, акцентируя внимание на самом главном. Задача исследователей — создать такую комбинацию этих элементов, при сложении которых получится реалистичный и эффективный проект за справедливую цену (не только в денежном эквиваленте) и с минимальным набором ошибок, что в итоге приведет к валидным (т. е. обоснованным и применимым на практике) выводам. Валидные выводы могут быть получены, если методы и результаты соответствуют задачам.
Планирование исследования начинается с научного вопроса об интересующей популяции, затем выбирается дизайн и формируется специфический план (где описываются выборка и методология), затем исследование проводится в реальной жизни. Далее происходит обратный процесс: в результате реального исследования получаются выводы, которые сопоставляются с планом, после чего делается заключение о «внутренней» валидности (сопоставление ожидание vs. реальность); затем данные примеряют на популяцию, т. е. оценивается «внешняя» валидность (выборка vs. популяция). «Внутренняя» валидность (Internal Validity) отражает то, насколько корректны выводы, которые исследователи сделали на основании полученных результатов. Чтобы оценить «внутреннюю» валидность, нужно задать вопрос: не было ли преувеличения или искажений при интерпретации собственных результатов, насколько реальное исследование соответствует изначальному плану. «Внешняя» валидность (т. е. обобщающие выводы о популяции) отражает, насколько полученные результаты могут быть применимы к общей популяции (за рамками исследования). «Внешняя» валидность (External Validity) тем выше, чем точнее научный вопрос, чем корректнее сформирована выборка и подобраны «весы и линейки» и чем более точно следовали изначальному плану при проведении исследования.
Ниже более детально рассмотрим каждый элемент.
Научный вопрос — это объект (предмет) исследования; это та неопределенность, которую исследователи пытаются устранить с помощью своих научных изысканий.
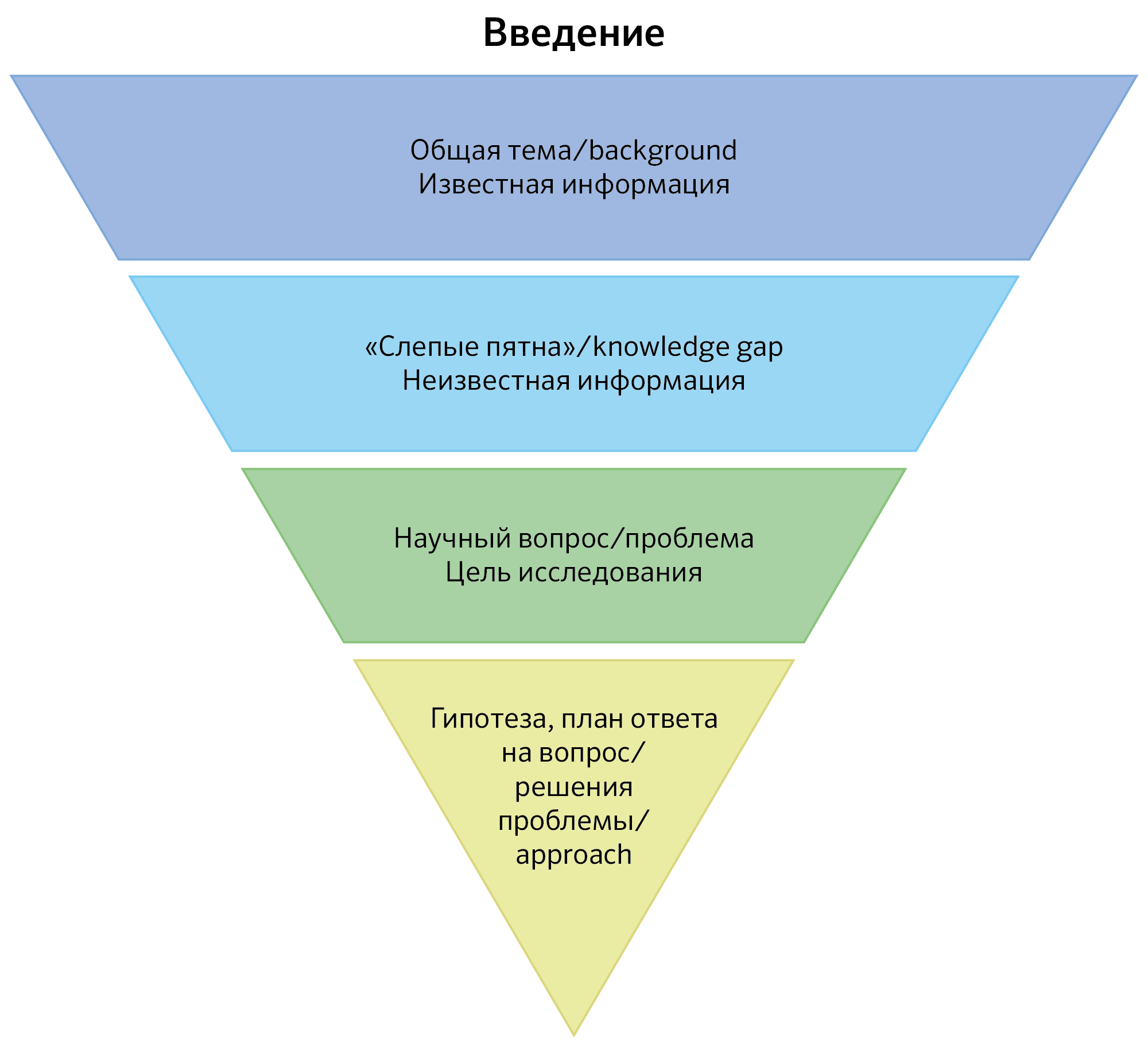
Часто научный вопрос начинается с общего вопроса, который постепенно сужается до конкретного и превращается в научную гипотезу. Успех ученого или врача при поиске доказательств кроется прежде всего в умении задавать «правильные» вопросы, логично выстраивая цепочку рассуждений. Проследить и оценить ход мысли исследователей в научной статье можно в разделе «Введение», который, образно выражаясь, представляет собой перевернутый конус: сверху (более широкая часть) находится общий вопрос, снизу (самая узкая) — это четкая научная гипотеза или решение конкретной задачи в рамках общего вопроса.
Рисунок 1 | Введение в тему исследования
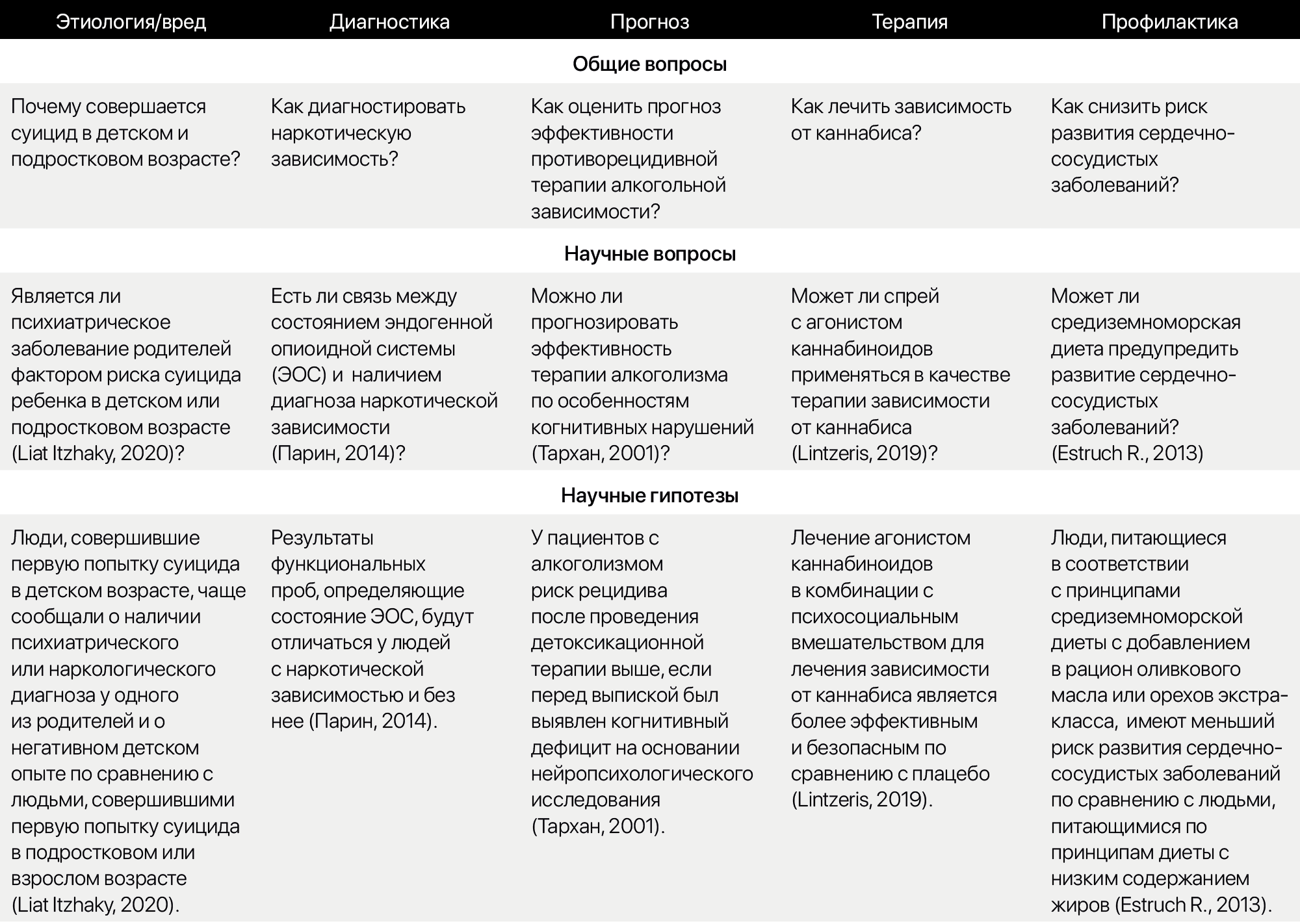
Например, общая тема — COVID-19, более узкая — лечение COVID-19. Более узкая тема, как правило, включает слово-действие, например, влияние, развитие, лечение. Общий вопрос состоит из двух компонентов: 1) основной вопрос (кто, что, где, когда, как, почему); 2) предмет исследования (заболевание, диагностический тест, лечение или другие аспекты медицинской помощи). Например, «Как лечить COVID-19?». Научный вопрос отличается от общего специфичностью, он направлен на исследование «слепых пятен», то есть неизвестного: «Можно ли использовать существующие лекарства, применяемые при других инфекционных заболеваниях, например, ВИЧ-инфекции, для лечения COVID-19?». Научная гипотеза — это предложение конкретного и детализированного решения научной проблемы. Гипотеза состоит из четырех компонентов, которые легко запомнить с помощью мнемонической аббревиатуры PICO (Sackett, 1991; van Loveren, 2007; Groves, 2009): (1) изучаемая выборка (Population), (2) изучаемое воздействие/интервенция (Intervention), (3) группа сравнения (Control), 4) критерии оценки исходов (Outcome). Тем не менее, не всегда есть достаточное количество предыдущих работ, на основании которых можно построить детализированную и специфическую гипотезу, поэтому бывает такое, что в исследовании нет гипотез. В этом случае исследование является поисковым или так называемым Fish Expedition, когда исследователи «закидывают невод в море» и смотрят, что удалось выявить. Такие исследования являются важными, так как именно они дают почву для построения будущих гипотез.
Таблица 1 | Примеры общих и научных вопросов и соответствующих гипотез
Если рассматривать научный проект как стартап, то часть «Введение» — это презентация стартапа, на основании которой потенциальные инвесторы могут оценить рациональность исследования, то есть ответить себе на вопрос «Стоит ли на это тратить деньги?». Чтобы «продать стартап», важно ответить на вопросы о том, что уже известно, почему так важно найти ответ именно на этот вопрос, какие ответы планируемое исследование может нам дать (какие выгоды), какие проблемы в исследовании были ранее (какие есть известные риски), что еще не удалось постигнуть, может ли новое исследование решить эти прошлые проблемы и добавить в этот паззл новый кусок информации, а также повлиять на то, как врачи ведут своих пациентов или на то, как организована система здравоохранения. Это называется прагматизм (т. е. когда мы отказываемся от «воздушных замков» в пользу того, что действительно важно).
Во-первых, «правильным» является вопрос, ответ на который позволит глубже понять мир и улучшит жизнь людей (в медицине — сделает людей более здоровыми), то есть имеет теоретическую или практическую значимость. Во-вторых, это вопрос, на который можно ответить с помощью научных методов без нарушения этических норм и правил. Навык формирования научного вопроса — это не только умение спросить что-то о неизвестном и ранее не изученном (или малоизученном), но способность трансформировать вопрос в план исследования, которое можно претворить в жизнь и найти искомый ответ. Таким образом, правильный научный вопрос должен пройти тест на «So what?» (т. е. ответить на вопрос «И что?»), быть практически реализуемым, интересным, новым, этичным и релевантным. Чтобы запомнить характеристики правильного научного вопроса, воспользуемся англоязычным акронимом FINER — feasible, interesting, novel, ethical & relevant.
Feasible, или Практически реализуемый проект — это значит, что в исследование планируют включить адекватное количество участников, для проведения есть все необходимое (техническая оснащенность, время и деньги), и перед исследователями ограниченное количество реалистичных задач. Исследователи не фантазеры, а очень практичные люди. Они моделируют в голове ход исследования, прикидывают, сколько человек нужно набрать (в этом помогает статистик, который может рассчитать размер выборки), оценивают собственные силы: есть ли у них «доступ к телу»; обязательно учитывают, что не все захотят принять участие в исследовании, и, вероятно, кто-то откажется от участия; понимают, что не все включенные участники смогут «дойти до конца» (особенно это важно для продольных исследований, где оценка проводится не один, а несколько раз на протяжении какого-либо времени). Хотя следует помнить, что обычно исследователи — это те же люди, которым при планировании свойственен оптимизм, поэтому даже при аккуратном планировании на бумаге все красивее, чем в реальной жизни. Чтобы застраховать себя от таких рисков, полезно проведение «пилотного», т. е. тестового исследования для «обкатки» всех процедур. Если понятно, что нужное количество участников не наберется, надо подумать: может, стоит изменить критерии включения, или убрать ненужные критерии невключения, или расширить «зону» исследования и сделать его мультицентровым, или поменять дизайн. Другой аспект, который оценивают ученые, — это оценка собственных ресурсов: хватит ли навыков, оборудования, уровня компетенции, чтобы сделать задуманное, собрать и проанализировать данные. Поэтому наука — это командная работа. Важно, чтобы в команде был человек с опытом проведения исследований и статистик. В идеале применяются методы, которые уже известны и хорошо себя зарекомендовали, однако, если вся суть исследования — попробовать новый метод, то в команду включают человека, который понимает, как с этим методом грамотно обращаться. Планирование времени и денег позволит оценить, не слишком ли дорогим выходит проект, и, может быть, стоит что-то модифицировать. Ограниченное количество задач позволяет ученым не распыляться и сосредоточить все силы на основные и самые важные задачи.
Interesting, или Интересный — это значит, что полученный ответ на научный вопрос интригует умы ученых…
… или именно на эту идею дают финансирование. Или все-таки это действительно то, что очень интересует ученого и его коллег (или и то, и другое).
Novel, или Новый — это значит, что исследование подтверждает, опровергает или расширяет ранее полученные данные или дает совершенно новые знания. Хотя оригинальные исследования в приоритете, повторение старого исследования (с учетом предыдущих ошибок) может быть также расценено как новое. Есть базы данных, по которым можно узнать, какие исследования проводятся в настоящее время, чтобы не повторяться.
Ethical, или Этичный — это значит, что исследование одобрено этическим комитетом. Если исследование может навредить, то ученые должны подумать, как минимизировать или убрать этот вред для участников. Обычно все это описано в протоколе исследования.
Relevant, или Релевантный — это значит, что ответ на научный вопрос исследования важен/нужен для расширения научного знания, для клинической деятельности или здравоохранения или дает почву для будущих исследований. Хороший научный вопрос — это тот вопрос, ответ на который можно использовать дальше для расширения теоретических представлений или для практического применения.
Идея книги с говорящим названием «Кради как художник» воплощается также и в исследованиях. Ученые берут идеи из своих и чужих предыдущих работ. Любой научный вопрос порождает новые вопросы, и тут все ограничивается фантазией ученого и теми характеристиками, которые описаны выше (FINER). Основная масса клинических исследований отвечает на простые вопросы: способен ли препарат А снизить риск заболеть болезнью Б / лечить болезнь Б (и делать это безопасно)? По сути это оценка эффективности и безопасности препаратов или других профилактических/терапевтических вмешательств (интервенций). Однако такой простой вопрос может легко разрастаться другими: как долго нужно давать препарат А, на какой стадии заболевания Б надо начинать принимать препарат, какой лучший способ предупредить побочный эффект препарата А, есть ли различия по эффективности препарата у пациентов в зависимости от мутации гена? Следует упомянуть также о довольно «новых» неклассических типах исследованиях — трансляционных, которые направлены на устранение важной пропасти между наукой и реальной жизнью. Различают два типа трансляционных исследований: 1) когда результаты лабораторных исследований переносят на клинические исследования (Bench-to-Bedside Research) и 2) данные клинических исследований переносят на общество через изменение политики здравоохранения (Implementation Science). Несмотря на то, что данные исследования позволяют улучшить жизнь человека, а не просто остаются на бумаге, проведение таких исследований является непростой задачей и требует коллаборации разных специалистов, которые по сути разговаривают на разных языках, а хороших «переводчиков» среди них довольно мало.
Стоит ли просто понаблюдать или обязательно надо поставить эксперимент? Выбор подходящего дизайна — это то, что позволяет за минимально короткое время получить максимально валидный результат. Дизайн — это стратегия для поиска ответа на поставленный научный вопрос.
Например, зададимся вопросом «Сколько врачей периодически читают научные статьи?». На этот вопрос невозможно найти идеально точный ответ, т. к. невозможно исследовать всех врачей на планете, и у нас нет идеального способа, чтобы понять, насколько чтение статьи действительно состоялось (т. е. произошло не просто формальное чтение букв, а был проведен критический анализ прочитанного); таким образом, у нас не идеальные выборка и инструменты для оценки. Поэтому, чтобы можно было это выяснить, исследователи могут изменить вопрос на следующий: «Сколько врачей среди тех, которые работают в настоящее время в моем университете, читают научные статьи?». Таким образом, один из компонентов трансформации от научного вопроса к исследованию — это ответ на вопрос, какая выборка будет наиболее репрезентативной, т. е. той, которая будет отражать популяцию, интересующую исследователей, и к какой выборке у ученого есть «доступ», т. е. какие географически-временные характеристики у этой выборки (место — мой университет, время — настоящее). Это вынужденный компромисс, так как в итоге мы лишь найдем ответ на вопрос, сколько именно в нашем университете таких врачей, но не среди всех врачей. Другой компонент — это переменные, которые отражают изучаемый феномен. В нашем примере это «чтение научных статей». Переменные выбираются исходя из их природы и бюджета. Это может быть самоотчет участника (например, ответы на вопрос «Читали ли Вы периодически научные статьи в течение прошлого года?») — самый дешевый и быстрый способ получения информации, но не идеально точный. Нет достоверного способа узнать, читает человек периодически статьи или нет. Поэтому на этапе планирования исследования также создаются ограничения для того, чтобы сделать идеально точные выводы; они будут основаны лишь на определенной выборке и на неидеальных методах. Однако по сравнению с научным вопросом план исследования более практичен. Просто нужно помнить, что за практичность мы можем поплатиться получением неверных результатов.
Разберемся с основными классификациями исследований и их дизайнов для того, чтобы понять, какой дизайн подходит для нашего вопроса и какими преимуществами и недостатками он обладает.
Биомедицинские исследования подразделяют на следующие категории.
1. В зависимости от того, есть четкая научная гипотеза или нет:
- поисковые — четкой гипотезы нет. Это, образно говоря, «рыбалка» (англ. Fish Expedition), задача которой «выловить» интересные тренды, чтобы на их основе построить гипотезу. Иногда поисковые исследования могут быть частью подтверждающего, например, с целью ответа на вопрос «Почему гипотеза не подтвердилась?»;
- подтверждающие — ставят перед собой четкую гипотезу и подтверждают или опровергают ее.
2. В зависимости от роли исследователя:
- наблюдательные (обсервационные) — пассивная роль наблюдателя. Для ответов на вопросы о частоте тех или иных заболеваний/состояний, факторах риска и прогнозе, иногда — о причинно-следственной связи. В таких исследованиях интервенции отсутствуют. Наиболее популярные типы наблюдательных исследований:
• когортные — когда наблюдение за группой субъектов ведется в течение некоторого временнОго промежутка:
— проспективные — начало наблюдения в настоящем, окончание — в будущем;
— ретроспективные — анализируются данные, собранные в прошлом;
• кросс-секционные — «одномоментное» наблюдение или срез данных (Snapshot);
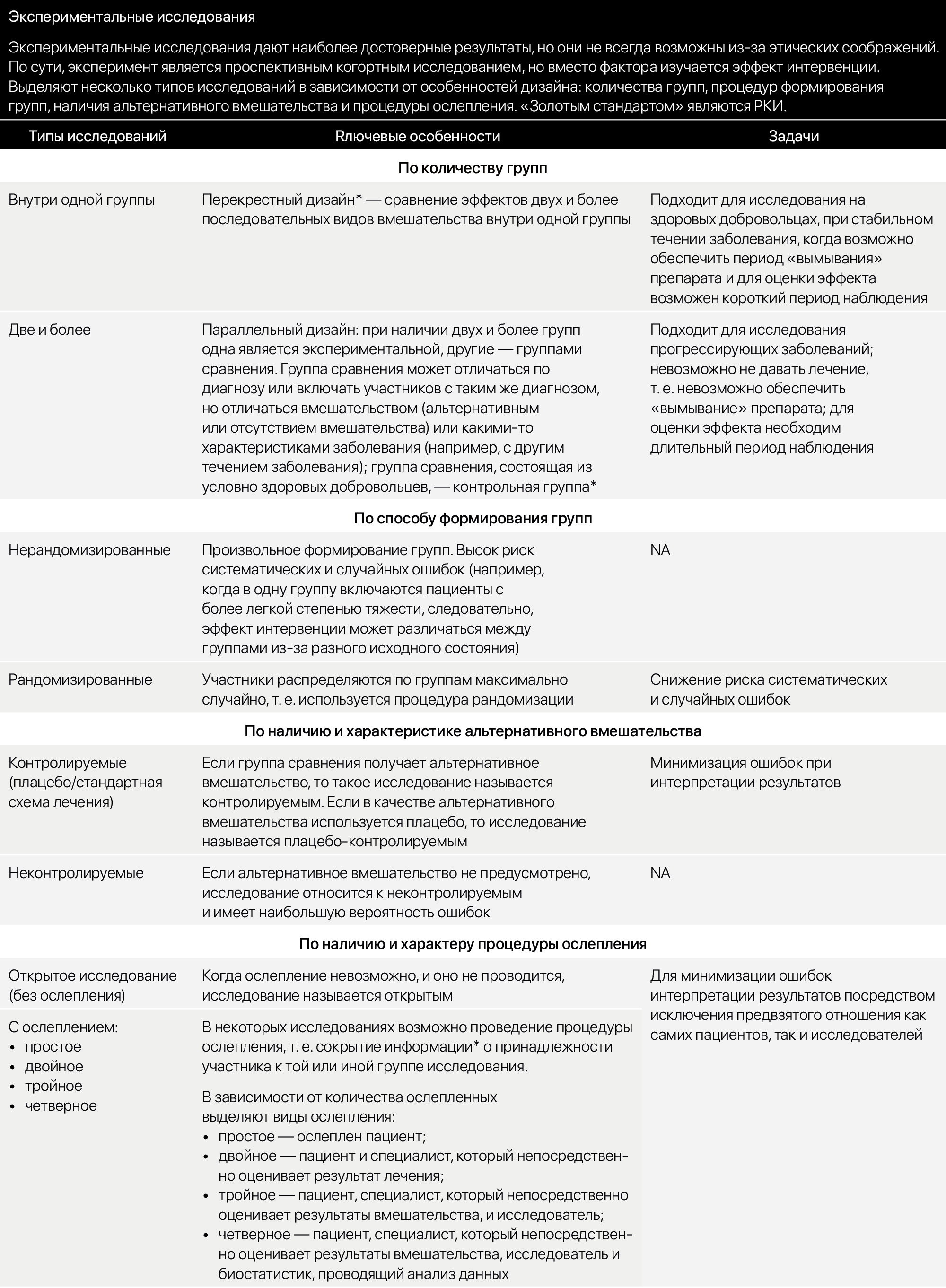
• по типу «случай-контроль» — сравнивается группа людей с болезнью X с группой людей без болезни X; - экспериментальные — активная роль экспериментатора. Для ответов на вопросы о причинно-следственной связи и оценке эффективности вмешательств.
При этом сам эксперимент может проводиться:
• in vivo — в живом организме: на человеке или лабораторных животных; исследования на животных, как правило, менее затратны, имеют меньше этических ограничений, но несмотря на преимущества, результаты не всегда можно транслировать на человека (т. е. если мышь удалось вылечить от алкоголизма, не факт, что такой же эффект будет у человека). Отметим, что клиническими принято называть любые биомедицинские исследования, проводимые с участием человека в качестве субъекта. Обычно самым лучшим дизайном являются рандомизированные клинические исследования (РКИ) с «ослеплением»;
• in vitro — «в пробирке», т. е. вне живого организма (например, при изучении изолированных тканей/клеток);
• in silico — когда применяется математическое моделирование ситуации; в частности, моделирование широко распространено в эпидемиологии; оно позволяет ответить на вопросы, например, о пике заболеваемости коронавирусной инфекцией или о времени наступления «второй волны»; - обобщающие — у исследователя остается только роль аналитика. Ответ на вопросы находится путем синтеза и анализа результатов ранее проведенных исследований. Такие исследования, в отличие от наблюдательных и экспериментальных, еще называют вторичными, так как они «перерабатывают» уже имеющееся «сырье», полученное из результатов наблюдений и экспериментов (первичные исследования).
3. В зависимости от типа регистрируемых данных:
- количественные: для ответов на вопрос «сколько?» или «как часто?», т. е. количественной оценки эффектов на здоровье различных факторов или интервенций; проверка гипотез и сбор данных осуществляются с помощью «жестких» структурированных методов (опросники, тесты, результаты лабораторных и инструментальных исследований, записи из медицинских документов);
- качественные: для ответов на вопросы «почему?» и «как?», т. е. для понимания и описания субъективной реальности индивида или группы лиц (как правило, медико-психосоциальная направленность исследования); подразумевают изучение феномена более «гибкими» полуструктурированными методами, например, интервью, фокус-группы, наблюдение за участниками);
- смешанные: сочетание количественных и качественных методов.
4. По «эволюционному» развитию:
- дескриптивные — обычно с этого вида наблюдательных исследований начинается изучение чего-то нового. Вспомните начало коронавирусной эпидемии: именно дескриптивные данные стали доступны первыми (и до сих пор находятся на главных страницах новостей); это данные о том, сколько новых случаев заражения, сколько людей выздоровело и сколько умерло;
- аналитические — дескриптивные исследования обычно перерастают в аналитические (тоже наблюдательные), целью которых является проведение анализа взаимосвязей (например, есть ли связь между ношением маски и заражением) для получения предварительных выводов о причинно-следственной связи;
- клинические исследования (Clinical Trials) — обычно являются финальной ступенью исследования, когда происходит оценка эффективности интервенции (например, какая эффективность у «Спутника»). Обычно это самой дорогой и долгий тип исследований, который отвечает на очень специфический научный вопрос, возникший благодаря результатам обсервационных исследований.
Бывают такие дизайны, которые не вписываются идеально в одну категорию, описанную выше, и часто описание дизайна вызывает трудности. Однако это задача авторов статей — четко описать ключевые характеристики дизайна своего исследования.
Вернемся к вопросу — как понять, что дизайн выбран «правильно». Основное требование — дизайн должен соответствовать научному вопросу. Нет идеального дизайна на все случаи жизни. При выборе дизайна нужно ответить на вопрос, какая стратегия была бы самой эффективной для поиска ответа. Дизайн исследования выбирается исходя из исследовательской задачи, распространенности изучаемого заболевания/фактора, этических аспектов и доступности ресурсов (временных, финансовых, человеческих и т. д.). Для критического анализа статьи важно понимать, каким задачам может соответствовать тот или иной дизайн исследования, в чем его особенности, преимущества и ограничения (см. таблицу 2).
Таблица 2 | Характеристики основных типов дизайнов количественных исследований
В связи с тем, что любое исследование (даже РКИ) имеет свои ограничения, была разработана методология, помогающая эти ограничения минимизировать и преодолевать: систематические обзоры и мета-анализы (таблица 3).
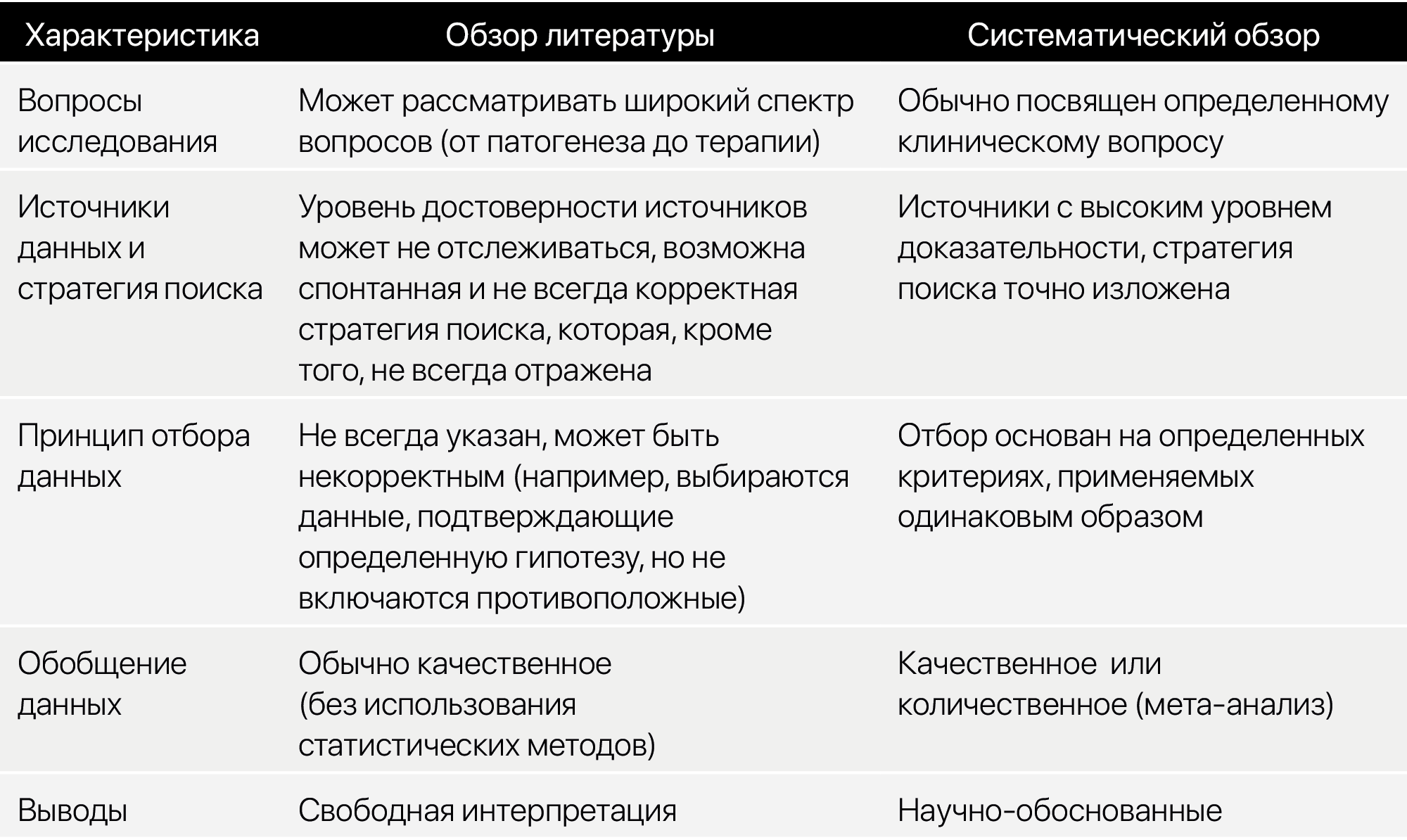
Систематические обзоры — это научные исследования, где объектом изучения служат результаты отобранных оригинальных исследований. Они синтезируют результаты этих исследований, используя подходы, уменьшающие возможность систематических и случайных ошибок. Эти подходы включают в себя всесторонний поиск публикаций по определенному вопросу и использование точных, воспроизводимых критериев отбора статей для обзора (Cook DJ, 1995). Далее производятся оценка структуры и особенностей оригинальных исследований, обобщение данных и интерпретация полученных результатов.
Приведем несколько уточнений.
- Следует разделять систематический и литературный обзоры.
Таблица 3 | Различия между обзором литературы и систематическим обзором - Мета-анализ — это частный случай систематического обзора, где для объединения результатов двух или более исследований используются статистические методы.
Как уже было сказано, научный вопрос отличается от общего специфичностью. Именно специфичность придает исследованию статистическую силу и отличает его от философских раздумий и риторических вопросов. Определение целевой группы исследования — необходимое условие, чтобы сделать вопрос специфичным.
«Правильная выборка» — это выборка, которая является наиболее точным отражением изучаемой популяции. Если выборка репрезентативна (т. е. обладает теми же свойствами/характеристиками, что и общая популяция, например, такой же % мужчин), тем больше шансов, что полученные данные можно будет экстраполировать на общую популяцию.
Популяция — это люди, которые объединены по каким-то признакам (например, географическому — популяция России), выборка — это мини-популяция, какое-то количество из популяции. В исследовании выборка формируется по наличию определенных признаков: клинических (например, жители РФ с астмой), социодемографических (например, жители РФ с астмой и женщины) и пространственно-временных (например, жители РФ с астмой и женщины в Питере в 2020 г.). Клинический признак ограничивает ключевую группу, которая интересует исследователя (Target Population), а пространственно-временные признаки определяют доступ исследователя к выборке (Accessible Population).
В статье легко понять, насколько «разборчивы» были исследователи при формировании выборки. Наличие четких и специфических критериев включения и невключения является хорошим показателем. Однако стоит обратить внимание, КАК и КТО эти критерии оценивал. Должны применяться только выверенные инструменты (например, если критерий включения — рост от 180 см, то неправильно установленный ростомер — это залог ошибки проведения исследования).
Другой важный аспект — это стратегии набора пациентов. Обычно набор участников в одном месте, куда обращаются люди с необходимыми признаками включения и невключения, может облегчить жизнь исследователям, но негативно отразиться на интерпретации выводов (из-за потенциальной ошибки выборки или Selection Bias) и ограничить их применение для всей популяции (Generalizability). Однако рандомный набор людей с подходящими критериями включения по всей стране — это слишком долго и дорого. Одно из известных исследований — Framingham Study — является олицетворением классической ошибки при выборе стратегии набора участников. Стратегия была такая: позвать каждого второго взрослого жителя города участвовать в исследовании. Такой подход не является рандомным, хоть и довольно «систематичен». Другая проблема — две трети жителей отказались участвовать, и исследователи включали в выборку тех, кто слышал про исследование и согласен был участвовать. Т. к. обычно те, кто хотят участвовать в исследовании, здоровее тех, кто отказывается, особенно когда это добровольно, можно предположить, что выборка отличается от популяции. Хотя каждая выборка отличается от популяции, важно понять, насколько это «плохо» для интерпретации. Вроде для результатов это не так важно — вывод исследования о том, что гипертензия — это фактор развития хронической сердечной недостаточности, может быть экстраполирован и на всех жителей города. Но можно ли сделать такой вывод о популяции? Для этого нужно понять, похож ли город на другие города США, Северной Америки, мира. Перенос выводов на бОльшую популяцию (на американцев) исходит из того, что Фрамингем является довольно типичным американским городом, где преимущественно живут представители среднего класса. Кроме того, в исследовании показано, что гипертензия — риск развития ХСН вне зависимости от расы, т. е. появились биологические основания для «переноса» выводов на Человека.
Исследователи обычно стоят перед выбором: какими инструментами воспользоваться, чтобы правильно измерить интересующее явление.
В аналитических исследованиях, где изучается связь между событием X и событием Y, чтобы сделать выводы о возможной причинно-следственной связи, одно событие рассматривается как предиктор, или причина, или фактор риска, другое — как исход. Обычно выбирается множество предикторов и несколько исходов. В клинических же исследованиях изучается эффект интервенции (предиктор) на исходы. Обычно выделяют первичные и вторичные исходы. Чтобы контролировать эффекты каких-то других переменных, которые могут влиять на возникновение исхода (конфаундеры или вмешивающиеся переменные) применяют метод рандомизации, цель которой — постараться сделать группы максимально схожими по третьим переменным. Например, не допустить, чтобы в одной из групп были исключительно молодые и более здоровые люди по сравнению с другой.
Одного человека достаточно, чтобы сделать научный вывод? А 100? А 1000? С одной стороны, все знают, что чем больше наблюдений, тем лучше. Но чем больше, тем дороже, а исследование должно быть прагматичным. Нужно набрать столько участников, сколько будет достаточно, чтобы можно было сделать выводы. Не больше, не меньше. Для этого есть методы, позволяющие рассчитать размер выборки — количество субъектов, необходимых для того, чтобы увидеть ожидаемые различия между наблюдаемыми группами с достаточной вероятностью (т. е. достаточной статистической силой). Чтобы сделать вычисления, нужно определиться с гипотезой, которую можно проверить.
Для дескриптивных исследований подсчет выборки не нужен: там не применяются тесты для проверки статистический значимости, и не нужна гипотеза. Однако дескриптивное исследование на 10 людях может быть недостаточным, чтобы рассчитать достаточно узкий доверительный интервал для средних, пропорций и других показателей дескриптивной статистики.
Планирование исследования начинается с одного предложения — научного вопроса. Далее необходимо описать основные элементы исследования на одной странице (резюме исследования, Proposal или Outline, таблица 3), используя стандартизированный чек-лист, который помогает описать логику исследования. Затем пишется протокол исследования (на 5–30 страниц или более), который обычно подается в дополнение к грантовой заявке. И последнее — это описание стандартных операционных процедур (СОП), четкие инструкции, описывающие каждую процедуру исследования, инструкцию для проведения опроса и другие материалы, функцией которых является обеспечить универсальность при проведении исследования (т. е. в исследовании все участники равны, все будут проходить через одни и те же процедуры).
Научный вопрос и резюме пишутся как можно раньше, чтобы витиеватые идеи превратить в конкретный план действий. Резюме позволяет увидеть, какие ошибки могут возникнуть, когда будут получены результаты, и на их основе можно будет сделать выводы. Для этого нужно сразу подумать, насколько возможные ответы могут отличаться от заданного научного вопроса и что нужно сделать, чтобы это изменить и найти ответ на свой научный вопрос. Часто помогает проведение пилотного исследования, чтобы убедиться, что «все работает», как планируется, что правильно выбраны стратегии для набора и методы измерения.
Таблица 4 | Резюме исследования
Основная проблема — это несоответствие между планом на бумаге и его исполнением в реальной жизни. Проблема эта не всегда зависит от исследователя и не устраняется его прилежностью. Например, не все врачи в нашем воображаемом университете практикуют, некоторые врачи указали в отделе кадров свой неправильный телефон, и с ними невозможно связаться для приглашения в исследование, некоторые просто отказались от исследования. Те врачи, которые согласились принять участие в опросе, могут иметь некоторые характеристики, которые будут отличать их от тех, кто отказался. Таким образом, наша выборка уже отличается от той, которую мы планировали. Также может быть проблематичным применение вопроса «Вы читаете периодически научные статьи?». Каждый может понять вопрос по-своему, например, для кого-то периодически — это раз в год, для другого — раз в неделю; возможно, кто-то боится показаться неграмотным и обманет исследователя, а кто-то невнимательно прочтет вопрос и поймет его наоборот или поставит галочку не в правильном месте для ответа… Таким образом, полученные ответы отличаются от тех, которые мы хотели бы получить, а значит, это влияет на то, насколько достоверный вывод на свой научный вопрос мы получим.
Может возникнуть проблема валидности, когда на основании взаимосвязи между предиктором и исходом делается вывод о причинно-следственной связи. Если получится найти взаимосвязь между тем, что врач читает научные статьи, и тем, что у него быстрее поправляются пациенты, важно понять: являются эти события причиной и следствием или чтение статей — это всего лишь случайная находка, просто дополнительный фактор, повышающий вероятность оказания более качественной помощи, но не причина этого. Оценка причинно-следственной связи в наблюдательных исследованиях должна быть очень аккуратной, и при планировании исследований важно учитывать много других факторов, которые могут стать вмешивающимися переменными.
Нет ни одного исследования без ошибок. Ошибки — это врожденная характеристика исследований. Важно не притворяться и не тешить себя иллюзиями. Перед ученым стоит несколько задач в связи с ошибками: 1) профилактика, 2) устранение, 3) признание. Профилактика — это те меры, которые предпринимаются на этапе планирования и проведения исследования. Это основное! Однако следует понимать, что профилактика ошибок полностью невозможна. Исследователи всегда оказываются перед выбором, где с одной стороны валидность результатов, с другой — выполнимость исследования, и иногда приходиться идти на жертвы. Поэтому тут важно найти баланс: с одной стороны, провести такое исследование, которое позволит адекватно ответить на вопрос, с другой — сделать его выполнимым с допустимым количеством ошибок. Иногда изначальный план не работает так, как представляется изначально, и для ученого важно признать, что что-то не работает, и уметь начать все сначала. Полное устранение ошибок, как правило, также невозможно, однако их можно учесть при анализе. Признание — это описание ошибок в публикации и учет ошибок при интерпретации результатов.
Ошибки бывают двух типов: рандомные (случайные) и систематические. Их важно различать, т. к. они по-разному профилактируются и лечатся. Случайные и систематические ошибки могут касаться как выборки, так и способа измерения, что влияет на выводы.
Рандомная ошибка — это неправильный результат из-за случайности, стечения обстоятельств, которые меняют результаты на противоположные. Предположим, на самом деле 20 % врачей читает научные статьи периодически. Таким образом, нам надо опросить 100 врачей, и среди них 20 ответят утвердительно на наш вопрос. Однако в реальности мы столкнемся с ситуацией, что «да» ответило 18, 19, 21 или 22 врача. Также мы можем получить и совершенно другие цифры — 12 или 28. Есть много стратегий для устранения таких вот случайных ошибок, но самая верная — увеличение количества участников. Чем больше выборка, тем меньше места случайности и выше точность (абсолютная точность, Precision) измерения, т. е. степень, в которой наблюдаемый процент будет около 20 с каждой новой выборкой. С другой стороны, случайно в исследование может быть включен один и тот же врач, который читает статьи, что также влияет на выводы.
Систематическая ошибка
— это неправильный результат из-за… ошибки, из-за создания обстоятельств, при которых наши результаты кардинально противоположны истинным. Например, если провести исследование в медицинском университете, где журнальные клубы с разбором научных статей являются частью образовательной культуры, то, скорее всего, процент будет больше 20 %. И увеличением выборки тут делу не помочь. Для увеличения точности (правильности, Accuracy) измерения необходимо на этапе дизайна продумать источники таких ошибок и устранить их. Например, провести такое исследование в нескольких университетах и в нескольких городах. Другой пример — это систематическая ошибка способа измерения, например, разным врачам по-разному читали вопрос, а значит, и понимание вопроса могло различаться.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
История клинических исследований лекарственных средств в их современном понимании начинается во второй половине XX века. Начало этого этапа было связано, с одной стороны, с бурным развитием фарминдустрии, широким и быстрым внедрением разработок в клиническую практику, с другой — с ростом числа рисков в медицине, обусловленных современными биотехнологиями, а также увеличением властного ресурса медицины в целом.
Первый печальный опыт применения новых лекарственных форм был связан с введением в клиническую практику в 1937 году компанией M.E. Massengill жидкой формы сульфаниламида для детей. Поскольку сульфаниламиды плохо растворимы в обычных растворителях (вода, этиловый спирт), то было решено с этой целью использовать этиленгликоль, в котором сульфаниламид хорошо растворяется.
Клинических исследований не проводилось. Токсичность на животных не изучалась. Сульфаниламид за несколько лет применения у пациентов уже хорошо себя зарекомендовал. Поэтому ограничились изучением органолептических свойств новой микстуры (сульфаниламид + этиленгликоль + вода + вкусовые добавки).
В октябре 1937 года после вывода нового лекарства на рынок США в соответствующую службу контроля поступило сообщение о смерти 8 детей и 1 взрослого пациента после приема новой микстуры. Фармацевтическая компания и власти в кратчайшие сроки изъяли препарат из продажи и известили население об опасности применения этой микстуры. Однако новая микстура унесла жизни 107 человек, в основном детей.
В 1938 году как ответ на серию смертей от лекарств, в США был принят Акт о пищевых продуктах, лекарствах и косметических средствах, который требовал, чтобы новые лекарства были очищенными и безопасными.
Самая страшная из известных человечеству трагедий в истории современной лекарственной терапии разыгралась в 1959–1961 годы, и она была связана с распространением талидомида.
Талидомид впервые появился на полках аптек многих стран мира в 1957 году. Препарат был отрекомендован своими создателями как великолепное средство для устранения беспокойства, бессонницы и утренней тошноты, столь часто докучающим женщинам во время беременности. По всей видимости, препарат действительно имел обещанный производителем эффект, поскольку талидомид очень скоро стал одним из популярных лекарственных средств среди беременных женщин во многих странах Европы, в Канаде, Австралии и Японии.
В 1961 году врачами Германии, Великобритании и Австралии было отмечено значительное увеличение количества детей, появляющихся на свет с тяжелыми врожденными уродствами верхних и нижних конечностей. Комплекс аномалий у таких детей чаще всего состоял из двусторонних грубых деформаций костей предплечья и кисти с формированием «ластоподобных» верхних конечностей. Аналогичные пороки развития костей встречались и на нижних конечностях. Ученые многих стран взялись за изучение возможных причин столь заметного прироста количества детей с тяжелой врожденной патологией. Результатов исследований долго ждать не пришлось. Очень скоро был обнаружен фактор, объединявший разношерстную группу несчастных матерей, дети которых родились с грубыми дефектами. Оказалось, что в первой половине беременности все эти женщины принимали не что иное, как талидомид.
Первые же эксперименты на лабораторных животных показали, что талидомид является сильнейшим тератогеном.
Как ответ на талидомиловую трагедию, в 1962 году в США принимается поправка Кефаувера-Харриса к Закону о пищевых продуктах, лекарствах и косметических средствах. Смысл поправок заключался в установлении правил предоставления информации о побочных реакциях и клиническом тестировании новых лекарств.
В шестидесятые годы ХХ века вслед за США и многие другие страны мира принимают практику обязательного лицензирования лекарственных средств и иных мер контроля перед их выпуском на рынок.
Во второй половине XX века также начинают внедряться этические нормы и правила в практику клинических исследований.
В 1964 году Всемирная медицинская ассоциация приняла Хельсинкскую декларацию. Данная декларация является документом, которым призваны руководствоваться врачи и другие специалисты при проведении научных исследований с участием человека в качестве объекта.
Медицинские научные исследования с привлечением людей в качестве объектов должны, как гласит п. 11 Декларации, отвечать общепринятым принципам проведения научных исследований, базироваться на глубоком знании современной медицинской литературы и на информации из других источников, учитывать результаты всесторонних лабораторных исследований и, при необходимости, исследований на животных.
Декларация провозглашает в качестве принципа деятельности комитета по этике его независимость от исследователей, спонсоров, иного влияния извне в какой-либо форме.
Многие страны на основе положений Хельсинкской декларации стали в ближайшие годы создавать свои нормативно закрепленные правила клинических исследований.
Клинические исследования имеют первостепенное значение для выведения на рынок нового эффективного и безопасного лекарственного средства, а также для получения разрешения регуляторных органов на новые показания к применению уже зарегистрированного лекарства. Новые лекарственные препараты и новые показания не будут одобрены, если не проведены научные исследования, соответствующие выработанным правилам GCP (качественной клинической практики).
Основные требования к проведению клинических исследований установлены статьями 38 – 44 Закона «Об обращении лекарственных средств». Следует также отметить, что по сравнению с действовавшим до 1 сентября 2010 года Законом «О лекарственных средствах» нормативная база нового Закона «Об обращении лекарственных средств» в отношении регулирования клинических исследований существенно переработана и расширена.
Статья 4 Закона «Об обращении лекарственных средств» определяет клиническое исследование лекарственного препарата как изучение диагностических, лечебных, профилактических, фармакологических свойств лекарственного препарата в процессе его применения у человека, животного, в том числе процессов всасывания, распределения, изменения и выведения, путем применения научных методов оценок в целях получения доказательств безопасности, качества и эффективности лекарственного препарата, данных о нежелательных реакциях организма человека, животного на применение лекарственного препарата и об эффекте его взаимодействия с другими лекарственными препаратами и (или) пищевыми продуктами, кормами.
При этом Закон в отличие от обычного клинического исследования, проводимого разработчиком лекарственного препарата в целях его государственной регистрации выделяет:
многоцентровое клиническое исследование лекарственного препарата для медицинского применения — клиническое исследование лекарственного препарата для медицинского применения, проводимое разработчиком лекарственного препарата в двух и более медицинских организациях по единому протоколу клинического исследования лекарственного препарата;
международное многоцентровое клиническое исследование лекарственного препарата для медицинского применения — клиническое исследование лекарственного препарата для медицинского применения, проводимое разработчиком лекарственного препарата в различных странах по единому протоколу клинического исследования лекарственного препарата.
Кроме того, Законом определяется пострегистрационное клиническое исследование лекарственного препарата для медицинского применения — клиническое исследование лекарственного препарата для медицинского применения, проводимое производителем лекарственного препарата, гражданский оборот которого осуществляется после государственной регистрации, в целях дополнительного сбора данных о его безопасности и эффективности, расширения показаний к применению данного лекарственного препарата, а также выявления нежелательных реакций пациентов на его действие.
Закон также устанавливает упрощенные виды клинического исследования для воспроизведенных лекарственных препаратов, так называемых дженериков. В отношении указанных препаратов проводятся:
исследование биоэквивалентности лекарственного препарата — вид клинического исследования лекарственного препарата, проведение которого осуществляется для определения скорости всасывания и выведения фармацевтической субстанции, количества фармацевтической субстанции, достигающего системного кровотока, и результаты которого позволяют сделать вывод о биоэквивалентности воспроизведенного лекарственного препарата в определенных лекарственной форме и дозировке соответствующему оригинальному лекарственному препарату;
исследование терапевтической эквивалентности лекарственных препаратов — вид клинического исследования лекарственных препаратов, проведение которого осуществляется для выявления одинаковых свойств лекарственных препаратов определенной лекарственной формы, а также наличия одинаковых показателей безопасности и эффективности лекарственных препаратов, одинаковых клинических эффектов при их применении.
Клинические исследования лекарственных препаратов для медицинского применения, в том числе международные многоцентровые, многоцентровые, пострегистрационные, проводятся для государственной регистрации лекарственных препаратов и иного предназначения в одной или нескольких медицинских организациях в соответствии с правилами клинической практики, утвержденными уполномоченным федеральным органом исполнительной власти, соответственно в следующих целях:
1) установление безопасности лекарственных препаратов для здоровых добровольцев и (или) переносимости их здоровыми добровольцами, за исключением таких исследований лекарственных препаратов, произведенных за пределами Российской Федерации;
2) подбор оптимальных дозировок лекарственного препарата и курса лечения для пациентов с определенным заболеванием, оптимальных доз и схем вакцинации иммунобиологическими лекарственными препаратами здоровых добровольцев;
3) установление безопасности лекарственного препарата и его эффективности для пациентов с определенным заболеванием, профилактической эффективности иммунобиологических лекарственных препаратов для здоровых добровольцев;
4) изучение возможности расширения показаний для медицинского применения и выявления ранее неизвестных побочных действий зарегистрированных лекарственных препаратов.
«Правила клинической практики в Российской Федерации» утверждены Приказом Министерства здравоохранения Российской Федерации от 19.06.2003 N 266. При использовании данных Правил следует понимать, что Правила утверждены Минздравом около 8-ми лет назад и во многом не соответствуют новым требованиям нового Закона «Об обращении лекарственных средств». В соответствии с этим обстоятельством данные Правила должны применяться исключительно в части, не противоречащей нормам статей 38 – 44, 20 – 22 Закона «Об обращении лекарственных средств».
В отношении воспроизведенных лекарственных препаратов для медицинского применения проводятся исследования биоэквивалентности и (или) терапевтической эквивалентности в порядке, установленном уполномоченным федеральным органом исполнительной власти.
Под воспроизведенным лекарственным средством (дженериком) Закон об обращении лекарственных средств» понимает лекарственное средство, содержащее такую же фармацевтическую субстанцию или комбинацию таких же фармацевтических субстанций в такой же лекарственной форме, что и оригинальное лекарственное средство, и поступившее в обращение после поступления в обращение оригинального лекарственного средства.
Методические указания «Проведение качественных исследований биоэквивалентности лекарственных средств» утверждены Минздравсоцразвития РФ 10 августа 2004 года.
Организацию проведения клинических исследований лекарственного препарата для медицинского применения вправе осуществлять:
1) разработчик лекарственного препарата или уполномоченное им лицо;
2) образовательные учреждения высшего профессионального образования и (или) образовательные учреждения дополнительного профессионального образования;
3) научно-исследовательские организации.
К организации проведения клинических исследований разработчиком лекарственного препарата могут привлекаться юридические лица любой организационно-правовой формы при условии обеспечения соответствия этих исследований требованиям Закона «Об обращении лекарственных средств».
Клинические исследования лекарственных препаратов для медицинского применения проводятся в медицинских организациях, аккредитованных уполномоченным федеральным органом исполнительной власти в порядке, установленном Правительством Российской Федерации.
Правила аккредитации медицинских организаций на право проведения клинических исследований лекарственных препаратов для медицинского применения утверждены Постановлением Правительства РФ от 3 сентября 2010 г. N 683.
Перечень медицинских организаций, имеющих право проводить клинические исследования лекарственных препаратов для медицинского применения, и реестр выданных разрешений на проведение клинических исследований лекарственных препаратов опубликовываются и размещаются уполномоченным федеральным органом исполнительной власти в установленном им порядке на своем официальном сайте в сети «Интернет».
Порядок получения разрешения на проведение клинических исследований лекарственных препаратов для медицинского применения установлен статьями 20 — 22 Закона «Об обращении лекарственных средств».
Порядок выдачи разрешения на проведение клинического исследования лекарственного препарата для медицинского применения утвержден Приказом Минздравсоцразвития РФ от 26 августа 2010 г. N 748н.
Порядок получения разрешения на проведение международного многоцентрового клинического исследования лекарственного препарата для медицинского применения или пострегистрационного клинического исследования лекарственного препарата для медицинского применения установлен статьей 39 Закона «Об обращении лекарственных средств».
Порядок организации и проведения этической экспертизы возможности проведения клинического исследования лекарственного препарата для медицинского применения и формы заключения совета по этике утвержден Приказом Минздравсоцразвития РФ от 26 августа 2010 г. N 753н.
Проведение клинического исследования. Руководитель медицинской организации, которая проводит клиническое исследование лекарственного препарата для медицинского применения, назначает исследователя, ответственного за проведение такого исследования и имеющего лечебную специальность, соответствующую проводимому клиническому исследованию лекарственного препарата, со стажем работы по программам клинических исследований лекарственных препаратов не менее чем пять лет и по его предложению назначает соисследователей из числа врачей этой медицинской организации.
Исследователь осуществляет выбор пациентов, которые по медицинским показаниям могут быть привлечены к участию в клиническом исследовании лекарственного препарата для медицинского применения.
Исследователь и соисследователи должны быть ознакомлены с результатами доклинического исследования лекарственного средства, содержащимися в брошюре исследователя, проектом протокола клинического исследования лекарственного препарата для медицинского применения, разработанным разработчиком лекарственного препарата или иным юридическим лицом, привлекаемым к организации проведения клинического исследования лекарственного препарата для медицинского применения, и другими материалами такого исследования.
При проведении клинического исследования лекарственного препарата для медицинского применения допускается забор у пациентов биологических материалов (образцы биологических жидкостей, тканей, секретов и продуктов жизнедеятельности человека, физиологических и патологических выделений, мазков, соскобов, смывов, микроорганизмов, биопсийный материал) для их изучения на территории Российской Федерации и (или) за пределами территории Российской Федерации.
Правила ввоза на территорию Российской Федерации и вывоза за пределы территории Российской Федерации биологических материалов, полученных при проведении клинического исследования лекарственного препарата для медицинского применения, установлен Постановлением Правительства РФ от 3 сентября 2010 г. N 673.
Клиническое исследование лекарственного препарата для медицинского применения проводится в соответствии с договором о проведении клинического исследования лекарственного препарата для медицинского применения, заключаемым между организацией, получившей разрешение уполномоченного федерального органа исполнительной власти на организацию проведения такого исследования, и медицинской организацией, осуществляющей проведение такого исследования.
Договор о проведении клинического исследования лекарственного препарата для медицинского применения должен содержать:
1) условия и сроки проведения данного исследования;
2) определение общей стоимости программы данного исследования с указанием суммы, предназначающейся для выплат исследователям, соисследователям;
3) определение формы представления результатов данного исследования в уполномоченный федеральный орган исполнительной власти.
Финансовое обеспечение клинического исследования лекарственного препарата для медицинского применения может осуществляться за счет:
1) средств федерального бюджета;
2) средств организаций, получивших разрешение на организацию проведения данного исследования, в соответствии с условиями договора о его проведении;
3) иных не запрещенных законодательством Российской Федерации источников.
Участие пациентов в клиническом исследовании лекарственного препарата для медицинского применения является добровольным. Пациент или его законный представитель должен быть информирован в письменной форме:
1) о лекарственном препарате для медицинского применения и сущности клинического исследования этого лекарственного препарата;
2) о безопасности лекарственного препарата для медицинского применения, его ожидаемой эффективности и степени риска для пациента;
3) об условиях участия пациента в клиническом исследовании лекарственного препарата для медицинского применения;
4) о цели или целях и продолжительности клинического исследования лекарственного препарата для медицинского применения;
5) о действиях пациента в случае непредвиденных эффектов влияния лекарственного препарата для медицинского применения на состояние его здоровья;
6) об условиях обязательного страхования жизни, здоровья пациента;
7) о гарантиях конфиденциальности участия пациента в клиническом исследовании лекарственного препарата для медицинского применения.
Добровольное согласие пациента на участие в клиническом исследовании лекарственного препарата для медицинского применения подтверждается его подписью или подписью его законного представителя на информационном листке пациента.
Пациент или его законный представитель имеет право отказаться от участия в клиническом исследовании лекарственного препарата для медицинского применения на любой стадии проведения такого исследования.
Проведение клинического исследования лекарственного препарата для медицинского применения с участием в качестве пациентов детей допускается только с согласия в письменной форме их родителей, усыновителей. Дети могут рассматриваться в качестве потенциальных пациентов такого исследования, только если его проведение необходимо для укрепления здоровья детей или профилактики инфекционных заболеваний в детском возрасте либо если целью такого исследования является получение данных о наилучшей дозировке лекарственного препарата для лечения детей. В этих случаях такому исследованию должно предшествовать клиническое исследование лекарственного препарата для медицинского применения на совершеннолетних гражданах.
Запрещается проведение клинического исследования лекарственного препарата для медицинского применения с участием в качестве пациентов:
1) детей-сирот и детей, оставшихся без попечения родителей;
2) женщин в период беременности, женщин в период грудного вскармливания, за исключением случаев, если проводится клиническое исследование лекарственного препарата, предназначенного для указанных женщин, при условии необходимости получения информации только во время проведения соответствующих клинических исследований и принятия всех необходимых мер по исключению риска нанесения вреда женщине в период беременности, женщине в период грудного вскармливания, плоду или ребенку;
3) военнослужащих, за исключением случаев проведения клинического исследования лекарственного препарата, специально разработанного для применения в условиях военных действий, чрезвычайных ситуаций, профилактики и лечения заболеваний и поражений, полученных в результате воздействия неблагоприятных химических, биологических, радиационных факторов. Клиническое исследование такого лекарственного препарата может проводиться с участием в качестве пациентов военнослужащих, за исключением военнослужащих, проходящих военную службу по призыву, с соблюдением требований, установленных настоящим Федеральным законом в отношении гражданских лиц;
4) сотрудников правоохранительных органов;
5) лиц, отбывающих наказание в местах лишения свободы, а также лиц, находящихся под стражей в следственных изоляторах.
Допускается проведение клинического исследования лекарственного препарата для медицинского применения, предназначенного для лечения психических заболеваний, с участием в качестве пациентов лиц с психическими заболеваниями, признанных недееспособными в порядке, установленном законодательством Российской Федерации. Клиническое исследование лекарственного препарата в этом случае проводится при наличии согласия в письменной форме законных представителей указанных лиц.
Организация, получившая разрешение на организацию проведения клинического исследования лекарственного препарата для медицинского применения, обязана в качестве страхователя страховать риск причинения вреда жизни, здоровью пациента в результате проведения клинического исследования лекарственного препарата для медицинского применения за свой счет путем заключения договора обязательного страхования.
Объектом обязательного страхования является имущественный интерес пациента, связанный с причинением вреда его жизни или здоровью в результате проведения клинического исследования лекарственного препарата для медицинского применения.
Страховым случаем по договору обязательного страхования является смерть пациента или ухудшение его здоровья, в том числе влекущее за собой установление инвалидности, при наличии причинно-следственной связи между наступлением этого события и участием пациента в клиническом исследовании лекарственного препарата.
Требования о возмещении вреда, причиненного жизни или здоровью пациента, предъявляются в течение сроков исковой давности, установленных гражданским законодательством.
Порядок страхования пациентов при проведении клинических исследований и правила возмещения вреда жизни или здоровью пациентов, участвующих в клинических исследованиях определяется нормами статьи 44 Закона «Об обращении лекарственных средств», общими нормами гражданского законодательства, а также утвержденными Постановлением Правительства РФ от 13 сентября 2010 г. N 714 Типовыми правилами обязательного страхования жизни и здоровья пациента, участвующего в клинических исследованиях лекарственного препарата.
Клиническое исследование лекарственного препарата для медицинского применения может быть приостановлено или прекращено, если в процессе его проведения обнаружена опасность для жизни, здоровья пациентов. В случае возникновения опасности для жизни, здоровья пациента, участвующего в клиническом исследовании лекарственного препарата для медицинского применения, исследователи обязаны проинформировать об этом руководителя медицинской организации и организацию, получившую разрешение уполномоченного федерального органа исполнительной власти на организацию проведения клинического исследования лекарственного препарата. Решение о приостановлении клинического исследования лекарственного препарата для медицинского применения принимают руководитель медицинской организации и (или) организация, получившая разрешение уполномоченного федерального органа исполнительной власти на организацию проведения клинического исследования лекарственного препарата для медицинского применения, решение о прекращении такого исследования принимает уполномоченный федеральный орган исполнительной власти на основании сообщения в письменной форме руководителя медицинской организации или организация, получившая разрешение уполномоченного федерального органа исполнительной власти на организацию проведения клинического исследования лекарственного препарата для медицинского применения.
Отчет о результатах клинического исследования лекарственного препарата для медицинского применения составляется организацией, имеющей право на организацию клинических исследований в соответствии с частью 3 статьи 38 Закона «Об обращении лекарственных средств», на основании заключений медицинских организаций, проводивших это исследование, и представляется в уполномоченный федеральный орган исполнительной власти, выдавший разрешение на проведение этого исследования, в срок, не превышающий трех месяцев со дня его завершения, приостановления или прекращения, в порядке, установленном уполномоченным федеральным органом исполнительной власти.
Нарушение правил клинической практики, а также фальсификация результатов клинических исследований лекарственных средств влекут ответственность в соответствии с законодательством Российской Федерации. Специальной ответственности за нарушения правил клинической практики и фальсификацию результатов клинических исследований действующим законодательством не предусмотрено. В случае, если нарушения правил клинической практики или фальсификация результатов клинических исследований привели к последствиям, создающим опасность для жизни и здоровья людей, возможно привлечение виновных лиц к уголовной ответственности по статьям 237 «Сокрытие информации об обстоятельствах, создающих опасность для жизни или здоровья людей» и 293 «Халатность» Уголовного кодекса РФ.
Особенности проведения клинических исследований лекарственного препарата для ветеринарного применения установлены статьей 12 Закона «Об обращении лекарственных средств».
Автор: Милушин М.И., директор юридической компании «Юнико-94», к.ю.н.
Источник: unico94.ru
Врачи всегда чувствовали, что их решения были основаны на доказательствах; таким образом, нынешний термин «доказательная медицина» является чем-то неправильным. Однако, для многих клиницистов «доказательство» является часто смутной комбинацией припоминаемых стратегий, эффективных у предыдущих пациентов, советы наставников и коллег и общее впечатление от того «что делается», основанное на случайных журнальных статьях, рефератах, симпозиумах и рекламы. Такая практика приводит к различиям в стратегиях для диагностики и управлению аналогичными состояниями, даже при наличии убедительных доказательств в пользу одной конкретной стратегии в сравнении с другой. Существуют варианты в разных странах, разных регионах, разных больницах и даже внутри отдельных групповых практик. Данные вариации привели к призыву создать более систематический подход к определению наиболее подходящей стратегии для конкретного пациента. Такой подход называется доказательной медициной (ДМ). ДМ строится на обзорах соответствующей медицинской литературы и следует дискретному ряду шагов.
ДM не слепое применение советов, почерпнутых из недавно опубликованных в литературе по проблемам конкретного пациента. Она не подразумевает универсальной модели медицинской помощи. Доказательная медицина требует применения определенных этапов сбора достаточного объема необходимой информации для ответа на четко поставленный вопрос в отношении конкретного пациента. Скорее ДМ требует использования ряда шагов, чтобы собрать достаточно полезной информации для тщательного ответа доказательной медицины, также включает систему ценностей пациента, куда входят такие вещи, как понесенные расходы, религиозные или моральные убеждения пациента и самостоятельность пациента. Применение принципов доказательной медицины обычно включает в себя следующие этапы:
-
Формулирование клинического вопроса
-
Сбор доказательств, чтобы ответить на вопрос
-
Оценка качества и достоверности доказательств
-
Принятие решения о том, чтобы применить полученные результаты для лечения определенного пациента
Вопросы должны быть конкретными. Конкретные вопросы скорее всего должны быть рассмотрены в медицинской литературе. Хорошо разработанный вопрос определяет население, вмешательство (диагностический тест, лечение), сравнение (лечение А против лечения B) и результат. «Какой наилучший способ оценки пациента с болью в животе?» не является слишком полезным вопросом для литературного поиска. Лучшим, более конкретным вопросом может быть такой: «Является ли КТ или УЗИ предпочтительнее для диагностики острого аппендицита у 30-летнего мужчины с острой болью внизу живота?»
Обзор литературы предоставляет широкий выбор соответствующих исследований. Для поиска используют стандартные ресурсы (например, MEDLINE или PubMed для первичных справочных материалов, Кокрановского сообщества [варианты лечения, часто отвечают на конкретные вопросы], ACP Journal Club).
Не все научные исследования имеют равную ценность. Различные типы исследований имеют различную научную силу и легитимность, и для любого данного типа исследования отдельные примеры часто отличаются по качеству методологии внутренних действий, а также обобщению результатов и применимостью к конкретному пациенту (внешняя валидность).
Уровень достоверности оценивается от 1 до 5 в порядке убывания качества. Формы обучения на каждом уровне несколько изменяются в зависимости от клинического вопроса (например, о диагностике, лечении или экономическом анализе), но обычно включают в себя следующее:
-
Доказательства 1 уровня (высокое качество): систематические обзоры или мета-анализ рандомизированных контролируемых исследований и высококачественных единичных рандомизированных контролируемых исследований
-
2 уровень: тщательно спланированные когортные исследования
-
3 уровень: тщательно отрецензированные исследования с применением методики «случай–контроль»
-
4 уровень: исследования серий случаев и менее качественные когортные исследования, а также исследования с применением методики «случай–контроль»
-
Уровень 5: экспертное заключение, основанное не на критической оценке, а на доводах физиологии, доклинических исследований или основополагающих принципов.
Для анализа ДM выбирают самый высокий уровень из всех имеющихся данных. В идеале, имеется значительное количество крупных, хорошо проведенных исследований 1 уровня. Тем не менее, поскольку количество высококачественных, рандомизированных, контролируемых испытаний исчезающе мало по сравнению с числом возможных клинических вопросов, менее надежные свидетельства 4 или 5 уровня очень часто все, что доступно. Низкое качество доказательств не означает, что процессу ДМ не возможно использовать только потому, что сила выводов слабее.
Поскольку наилучшие доступные доказательства могут быть получены от групп пациентов с характеристиками, отличными от таковых у данного пациента, при применении результатов рандомизированного исследования к конкретному пациенту требуется значительная оценка. Кроме того, должны быть приняты во внимание пожелания пациента относительно агрессивных или инвазивных диагностических исследований и лечения, а также их терпимость к дискомфорту, риски и неопределенности. К примеру, даже если обзор ДМ может убедительно показать выгоду 3 месяца выживаемости от агрессивной химиотерапии при лечении определенной формы рака, пациенты могут иметь расхождения относительно того, предпочитают ли они получить дополнительное время жизни или хотят избежать дополнительных неудобств. Стоимость тестов и лечения может также влиять на принятие решений врачом и пациентом, особенно когда некоторые из вариантов значительно дороже для пациента. Два общих момента, вызывающих обеспокоенность, заключаются в том, что пациенты, которые добровольно участвуют в клинических испытаниях, не являются такими же, как пациенты в реальной клинической практике, и медицинский уход, оказываемый в условиях клинических испытаний, не идентичен реальному уходу в медицинском сообществе.
В оживленной практике врачи в течение даже одного дня сталкиваются с десятками клинических вопросов. Хотя некоторые из них могут быть предметом существующего обзора ДМ, доступного для ознакомления, большинство из них нет, и подготовка формального анализа ДM слишком затратна по времени, чтобы быть полезной при ответе на немедленный клинический вопрос. Даже когда время не является проблемой, по многим клиническим вопросам отсутствуют соответствующие исследования в медицинской литературе.
Клинические руководства стали широко доступными в медицинской практике; многие профессиональные организации уже опубликовали такие руководства. Большинство хорошо продуманных клинических рекомендаций разрабатываются с использованием указанного метода, который включает в себя принципы ДM и консенсус или процесс Дельфи рекомендаций группы экспертов. Хотя Клинические рекомендации могут описывать идеализированную практику, сами по себе они не могут устанавливать стандарт медицинской помощи для конкретного пациента.
Некоторые Клинические рекомендации следуют правилу «если, то» (например, если у пациента наблюдается лихорадка и нейтропения, то следует прописать антибиотики широкого спектра). Более сложные, многоступенчатые правила могут быть оформлены в виде алгоритма. Руководства и алгоритмы, как правило, просты и удобны в использовании, но должны применяться только к тем пациентам, чьи клинические характеристики (например, демографические данные, сопутствующие заболевания, клинические признаки) аналогичны характеристикам группы пациентов, используемых для создания руководства. Кроме того, руководящие принципы не принимают во внимание степень неопределенности, присущей результатам испытаний, вероятность успешного лечения и относительные риски и преимущества каждого курса действий. Для того чтобы включить неопределенность и значимость медицинских результатов в процесс принятия клинических решений, часто лечащим врачам приходится применять принципы количественных или аналитических врачебных решений (см. также Стратегии принятия клинических решений [Clinical Decision-Making Strategies] Стратегия принятия клинического решения Одна из наиболее часто используемых стратегий для медицинского принятия решений отражает научный метод гипотезы поколения с последующей проверкой гипотезы. Диагностические гипотезы принимаются… Прочитайте дополнительные сведения ). Кроме того, многие организации, публикующие руководства, требуют использования данных только рандомизированных исследований, что часто является существенным ограничением.
ПРИМЕЧАНИЕ:
Это — Профессиональная версия.
ПОЛЬЗОВАТЕЛИ:
Просмотреть пользовательскую версию

Авторское право © 2023 Merck & Co., Inc., Rahway, NJ, США и ее аффилированные лица. Все права сохранены.


Клинические исследования
Направление пациентов на бесплатные консультации, обследования и лечение в рамках клинических исследований по изучению инновационных лекарственных препаратов

-
Абсолютно бесплатно
-
Доступ к инновационным препаратам
-
Комплексное обследование
-
Наблюдение в процессе лечения
КОНТАКТЫ: Email: mnioi.trials@mail.ru
Для подачи заявки необходимо прислать:
Ф.И.О. пациента диагноз номер протокола исследования выписку из истории болезни.
Что надо знать о клинических исследованиях?

Что такое клинические исследования
В клинической практике стало нормой использовать новейшие противоопухолевые препараты, которые в результате лечения онкологических больных показывают очень эффективные результаты. В соответствии с общепринятыми правилами новые препараты до их официальной регистрации могут быть доступны для больных только в рамках клинических исследований. Именно поэтому клинические исследования являются неотъемлемой частью в разработке новейших инновационных лекарственных препаратов. Абсолютно все клинические исследования проходят с соблюдением специальных международных правил — GCP (Good Clinical Practice). Следование этим правилам служит гарантией того, что права пациентов, которые участвуют в исследованиях, защищены, а их результаты достоверны.

Фазы клинических исследований
Прежде чем препарат допускается к клиническим исследованиям, ему всегда предшествует процесс изучения в лабораториях в пробирках, или на лабораторных животных. Если в ходе доклинических исследований получены положительные результаты по безопасности и эффективности, препарат допускается на стадию клинических исследований.
Клинические исследования проходят в несколько фаз.
На первоначальной фазе экспериментальный препарат тестируется с участием небольшой группы пациентов — 20-30 больных. Врачи оценивают его токсичность, определяют безопасную дозировку, идентифицируют побочные эффекты.
Во второй фазе расширяется контингент участников эксперимента от 100 до 300 пациентов. Проверяется его эффективность при конкретном заболевании и подробно оцениваются риски применения.
В третьей фазе в исследовании принимают участие от нескольких сотен, до нескольких тысяч пациентов (от одной до трех и более), чтобы на большой группе больных подтвердить эффективность препарата при определенном заболевании, выявить возникающие побочные эффекты и сравнить со стандартными способами лечения.
На четвёртой, заключительном этапе, который, как правило, проводится уже после регистрации препарата, получают дополнительную информацию о его безопасности, эффективности и оптимальном применении. Кроме того, пациенты получают возможность бесплатно проходить обследования и лечение, которые согласуются с принятыми международными стандартами.

Проведение исследований
В протоколе исследования описан подробный план проведения исследования. В нем указывается продолжительность исследования, критерии включения и исключения участников, расписание приема препаратов. В протоколе обязательно указывается перечень и расписание обследований и анализов, которые должен пройти и сдать пациент. Чтобы исследование могло начаться, протокол сначала должен пройти этическую экспертизу и получить одобрение Минздрава России, где «Совет по этике» осуществляют контроль за безопасностью пациентов, которые участвуют в исследовании на всём его протяжении. В ходе исследования с Комитетом по этике согласовываются все изменения в протоколе, а также в документах, которые предназначены для пациентов

Рекомендации пациенту
Чтобы стать участником клинического исследования пациент должен ознакомиться со всеми аспектами этого процесса. В случае своего согласия пациент подписывает «Форму информированного согласия», после чего врач включает его в исследование. В течении всего исследования пациенты должны чётко следовать предписаниям протоколов: регулярно, в строго установленное время приходить в клинику для сдачи анализов, обследований и осмотров врачом. Это необходимо для более эффективной и безопасной оценки нового препарата. Врач в протоколе исследований устанавливает необходимый для лечения алгоритм посещений, что в обязательном порядке фиксируется в протоколе исследования. График визитов к врачу и все проводимые процедуры и обследования описываются в информированном согласии. Подписывая этот документ, пациент соглашается со всеми предложенными процедурами и графиком визитов.
Возможные риски и польза
Польза: качественно разработанные и проведенные клинические исследования для пациентов, соответствующих критериям для участия, позволяют получить доступ к инновационным препаратам и методам лечения, до того, как они станут широко доступными; получать высококвалифицированную медицинскую помощь в ведущих учреждениях здравоохранения в период проведения исследования; помочь другим, внося свой вклад в медицинские исследования.
Риски: существуют риски, связанные с клиническими исследованиями могут потребовать дополнительного времени и внимания по сравнению с обычным лечением, включая более частые визиты к врачу исследовательского центра, дополнительные приемы препаратов, пребывание в центре, ведение дневников приема препаратов или сложные схемы приема препаратов.
Также экспериментальное лечение может быть неэффективным для участника, могут возникать побочные эффекты экспериментального лечения. Перед участием в исследовании пациенту следует поговорить с врачом, оценить потенциальные риски и пользу, связанные с участием, однако, если всё удовлетворяете критериям отбора в исследование, окончательное решение об участии пациент должен принять самостоятельно.
Противоопухолевая лекарственная терапия, которая предлагается пациенту в рамках клинического исследования, всегда основана на международных стандартах по ведению пациентов с конкретным онкологическим заболеванием. Лечение проводится в отделениях клиники Московского научно-исследовательского онкологического института имени П.А. Герцена — филиале ФГБУ «НМИЦ радиологии» Минздрава России.Текст
Компания «Adlai Nortye USA Inc.». Код протокола: AN2025H0301 (BURAN) Фаза: III
Исследование бупарлисиба (AN2025) в комбинации с паклитакселом в сравнении с монотерапией паклитакселом у пациентов с рецидивирующей или метастазирующей плоскоклеточной карциномой головы и шеи
Исследуемый препарат: Лекарственный препарат бупарлисиб (AN2025)
Прим.: у пациентов запросят архивные или новые образцы опухолевой ткани для анализа биомаркеров.
Компания «РадиоМедСинтез», Код протокола: FET-02-21
Программа диагностики для пациентов с глиальными опухолями головного мозга.
Многоцентровое, проспективное, рандомизированное, открытое, сравнительное исследование по изучению диагностической эффективности, безопасности и переносимости радиофармацевтического лекарственного препарата «РадиоМедФторТирозин» (Фторэтилтирозин [18F]), раствор для внутривенного введения (Общество с ограниченной ответственностью «РадиоМедСинтез», Россия) у пациентов с глиальными опухолями головного мозга
Компания «РадиоМедСинтез», Код протокола: ПСМА-08-21
Программа диагностики для пациентов с верифицированным раком предстательной железы: «Многоцентровое, проспективное, несравнительное, открытое исследование по изучению диагностической эффективности, безопасности и переносимости радиофармацевтического лекарственного препарата «РадиоМедФторПСМА» (18F-ПСМА1007), раствор для внутривенного введения (Общество с ограниченной ответственностью «РадиоМедСинтез», Россия) у пациентов с верифицированным раком предстательной железы с наличием биохимического рецидива после первичного радикального лечения.
Код протокола № NTI1GSA. Фаза I. Разработчик: ООО «Генная Хирургия»
Открытое многоцентровое исследование безопасности, переносимости и фармакокинетики различных доз препарата АнтионкоРАН-М на фоне инфузий препарата Цимевен® (ганцикловир) у пациентов с солидными опухолями поздних стадий
Препарат: АнтионкоРАН-М (Стимотимаген кополимерплазмид)
Прим.: должна быть исчерпана стандартная терапия, наличие кожных или пальпируемых подкожных образований опухолевой природы (первичная опухоль, метастазы)
ПОКАЗАНИЯ
Метастатический кастрационно-резистентный РПЖ (мКРРПЖ)
Критерии мКРРПЖ — уровень тестостерона в сыворотке крови <50 нг/дл или <1,7 нмоль/л в сочетании с одним из критериев:
- биохимическим прогрессированием: 3 последовательных повышения уровня ПСА с разницей в 1 неделю, с увеличением на 50% в двух измерениях от надира, при уровне ПСА >2,0 нг/мл;
- радиологическое/рентгенологическое прогрессирование на фоне первой линии терапии, согласно критериям RECIST в течение не более 12 недель:
- появление новых очагов: два и более новых очага в костной ткани или очаг в мягких тканях;
- увеличение размеров ранее выявленных очагов.
Наличие костных метастазов (≥ 6) по данным ОСГ, подтверждённых рентгенологическими методами, и отсутствие висцеральных метастазов по данным ПЭТ/КТ с лигандами к ПСМА давностью не более месяца.
ПРОТИВОПОКАЗАНИЯ
Абсолютных противопоказаний для проведения РНТ с 223Ra не существует, однако, имеют место следующие относительные противопоказания:
- тяжелые заболевания кишечника (неспецифический язвенный колит, болезнь Крона);
- тяжелое общее состояние пациента (статус по шкале Карновского 50 % и ниже);
- прогноз продолжительности жизни ˂6 мес;
- патологический перелом позвоночника с синдромом компрессии спинного мозга;
- наличие внекостных метастазов, метастазов в висцеральные органы и головной мозг, крупных метастазов в лимфатические узлы размером ≥3 см в максимальном измерении, отдаленные метастазы в лимфатические узлы;
- любые острые состояния или обострения хронических заболеваний, требующие срочного медицинского вмешательства;
- моложе 18 лет
Наличие сопутствующих злокачественных заболеваний в анамнезе не является противопоказанием.
Не рекомендовано одновременное применение 223Ra с доцетакселом, абиратерона ацетататом (с преднизолоном).
Исследования комбинации 223Ra с энзалутамидом в процессе изучения.
Клиническое исследование нового лекарственного препарата Вазолам используемого для лечения острой гипотонии (шока вследствие кровопотери, ранения, отравления, вегетососудистой дистонии и т.д.).
Вазолам — новое вазопрессорное средство, разработанное для оказания экстренной помощи при острых гипотонических расстройствах. Препарат прошёл все необходимые фазы доклинических исследований, где продемонстрировал высокую эффективность и безопасность.
Действующим его веществом является оригинальное соединение – гидробромид 1-циклогексаноил-2-изотиомочевины (патент RU2552529 от 29.11.2013, патентообладатель: МРНЦ им. А.Ф. Цыба – филиал ФГБУ «НМИЦ радиологии» Минздрава России) – Т1059.
Для участия в исследовании приглашаются здоровые добровольцы (мужчины) от 18 до 45 лет, не имеющие вредных привычек, у которых за последние 6 месяцев не было оперативных вмешательств. Утверждено Минздравом и Этическим комитетом.
Добровольцу будет необходимо пройти первичное обследование, далее, если он проходит по критериям включения необходима госпитализация в МРНЦ имени А.Ф. Цыба. Время наблюдения пациента в Центре составит 5 дней после введения препарата.
За участие в исследовании добровольцу предусмотрена компенсация в размере 10 005 рублей. Оплата производится в соответствии с заключённым договором.
Контакты для связи:
Поповкина Ольга Ефимовна
Телефон: +7 (910) 912-42-25; +7 (494) 399-30-26
Почта: popovkinaoe@vursol
Кучеров Валерий Владимирович
Телефон: +7 (977) 342-85-69; +7 (484) 399-33-40
Клинические исследования проходят под руководством ведущих специалистов ФГБУ «НМИЦ радиологии» Минздрава России, докторов медицинских наук, имеющих неоценимый опыт в проведении научных работ.
Обязательным условием клинических исследований является соблюдение специальных международных правил надлежащей клинической практики. Выполнение этих правил гарантирует права пациентов, участвующих в исследовании, а также обеспечивает достоверность полученных результатов.
Пациент, участвующий в клинических исследованиях, получает полный доступ к бесплатному обеспечению инновационными лекарственными препаратами, и к обследованиям.
В течение всего исследования пациенты должны чётко следовать предписаниям протокола: принимать препараты в соответствии с указаниями, регулярно приходить в клинику для сдачи анализов.