Изобретение относится к медицинской технике и может быть использовано для больных с ожогами и для профилактики пролежней. Кровать содержит камеру, реле времени, поддон, неподвижный наружный каркас, подвижный внутренний каркас с электродвигателем и защитный подвижный каркас из пластин и прорезиненной ткани, который выполнен в виде колпака для прикрывания больного. В поддоне размещен кварцевый облучатель и труба. Через трубу установка подает теплый воздух. Неподвижный наружный каркас состоит из рамы с натянутыми поперек эластичными упорами. Внутренний каркас состоит из рамы, шпилек с отверстиями для закрепления несущих эластичных упоров и направляющих втулок для вертикального возвратно-поступательного движения. 2 з.п. ф-лы, 4 ил.
Изобретение относится к медицине, а именно к медицинской технике, и предназначено для лечения больных с ожогами и для профилактики пролежней. Существует несколько разновидностей устройств, для лечения больных с ожогами и предупреждения пролежней:
1. Противопролежневый матрас из прорезиненной ткани, в котором противопролежневый эффект создается путем попеременно раздуваемых камер при помощи компрессора, что приводит к попеременному контакту стенок камеры с поверхностью тела.
2. Надувной матрас (водяной матрас) способствует уменьшению давления с контактируемой поверхностью за счет равномерного распределения давления с контактируемой поверхностью (поверхность тела).
3. Кровать — сетка, ложе из сетчатой ткани (рыболовная сеть, тюль и др.), натянутое на «балканской раме», с установленными электровентиляторами для подсушивания ожоговой раны.
1. Противопролежневый матрас с попеременно раздуваемыми воздушными камерами изготовлен из прорезиненной ткани, что ограничивает доступ воздуха к коже и приводит к ее мацерации, вызывает промокание раны с развитием инфекции и углубление ран;
— невозможно эффективно согревать больного;
— нет возможности подсушить ожоговую поверхность, значит, и получить сухой сформированный струп на ожоговой поверхности.
2. Надувные и водяные матрасы изготовлены из прорезиненной ткани, целлофана, клеенок и др., что абсолютно препятствует доступу воздуха к ранам, вызывая мацерацию кожи, углубление ран;
— не исключает образование пролежней.
3. Кровать — сетка, несмотря на хорошую аэрацию, не исключает образование пролежней. В качестве прототипа нами взята кровать «Клинитрон» (Медицинская техника, Сб. информационных материалов, 1998).
КЛИНИТРОН — эта установка, противопролежневый эффект в которой создается «псевдожидкостью» под натянутой специальной простыней. Мощный воздушный поток приводит в движение огромное количество микросфер в закрытой камере, что способствует возникновению эффекта невесомости или плавучести с предельным уменьшением давления контакта с поверхностью тела больного.
К недостаткам прототипа можно отнести следующие:
— ограниченная доступность установки из-за ее дороговизны;
— необходимость в постоянной нагрузке;
— трудоемкость обслуживания установки и ухода за больными;
— энергоемкость;
— дороговизна расходуемых материалов;
— необходимость периода адаптации при переводе больных на обычную кровать.
Целью изобретения является улучшение качества лечения больных с обширными поверхностными и глубокими ожогами, предупреждение или значительное снижение риска возникновения тяжелых последствий (углубление и инфицирование ран, возникновение пролежней и т.д.), достижение экономии за счет сокращения койкодней в отделении реанимации и интенсивной терапии.
Сущность изобретения: КМП-O представляет собой кровать-камеру (фиг.1, 2, 3), состоящую из неподвижного наружного и подвижного внутреннего каркасов, который приводится в движение с помощью электродвигателя.
Наружный каркас (фиг.2) состоит из неподвижной рамы, натянутой поперек эластичных упоров (фиг.2, поз.7) с поперечным сечением 5-6 мм. Внутренний подвижный каркас (фиг.2, поз.1) состоит из рамы, шпилек с отверстиями для закрепления несущих эластичных упоров и направляющих втулок для вертикального возвратно-поступательного движения. Упоры закреплены поперечно, параллельно друг другу через каждые 20 мм.
Корпус (фиг.2, поз.6) изготовлен в виде коробки из легкообрабатываемого материала, облицован пластиком с отверстиями для установки панели управления (фиг.1, поз.4), трубы для теплоподачи (фиг.1, поз.7.) и двух дверей (фиг.1, поз.3) для обслуживания больного и санитарной обработки полости камеры. Привод для приведения в движение внутреннего каркаса состоит из реверсионного электродвигателя (фиг.2, поз.9), червячного редуктора (фиг.2, поз.5), конических (фиг.2, поз.4) и винтовых передач (фиг.2, поз.3). Вращения от электродвигателя предаются червячному редуктору и от него через вал (фиг.2, поз.8) на конические редукторы и винтовые подъемники, закрепленные между верхней и нижней рамами. При включении электродвигателя подъемники перемещают вверх-вниз внутренний подвижный каркас, установленный на направляющих втулках наружного неподвижного каркаса, приводя в движение ложе из лесок (фиг.1, поз.5). Защитные планки (фиг.1, поз.6) служат для предотвращения попадания каких-либо предметов на движущие части КМП-O. Откидной манипуляционный столик (фиг.1, поз.9) служит для обслуживания больного.
Сверху кровать закрыта каркасом (фиг.1, поз.2) из прорезиненной ткани и в виде колпака прикрывает больного до шеи. Каркас колпака изготовлен из легкого и достаточно прочного (дюроалюминовые пластины) материала, легко откидывается и удерживается в вертикальном положении амортизаторами (фиг.1, поз.10). Каркас защищает больного от воздействия факторов внешней среды, сохраняет тепло, способствуя формированию струпа на ожоговой поверхности, и создает индивидуальный микроклимат. Теплый воздух от установки АТУ-3 подается в КМП-O через трубу (фиг.1, поз.7) с диаметром 100 мм, с отверстиями 15 мм и длиной 200 см, установленную в поддоне кровати. Температура подаваемого воздуха регулируется датчиками установки АТУ-3 и составляет 37-38°С.
Для дезинфекции и ультрафиолетового облучения ран больного в поддоне кровати установлен кварцевый облучатель ОБН-150 (фиг.1, поз.8). Снаружи у головного конца кровати установлен откидной манипуляционный столик (фиг.1. поз.9).
ПРИНЦИП РАБОТЫ АВТОМАТИКИ И ЭЛЕКТРИЧЕСКОГО ПРИВОДА
Пульт управления (фиг.3) обеспечивает автоматическую работу КМП-O. Электрическая схема пульта управления КМП-O указана на фиг.3а. Подача напряжения на пульт управления производится включением автоматического выключателя GF (внутри ящика) и клавишного выключателя SA (на дверце пульта управления). О наличии напряжения в сети сигнализирует лампа HLI.
Работа установки начинается с одного из крайних положений, для этого необходимо нажать кнопку вверх на панели управления (фиг.3, поз.3), если подвижная рама находится в нижнем положении, или кнопку вниз (фиг.3, поз.1), если рама находится в верхнем положении. С этого момента КМП-O работает в автоматическом режиме, который поддерживается электронным блоком с установленным в нем реле времени. Реле времени регулирует время контакта упоров с поверхностью тела больного и устанавливается вручную. В электронной схеме установки предусмотрена автоматическая блокировка пускателей на случай одновременного (ошибочного) нажатия обеих кнопок.
КМП-O работает следующим образом: включение клавишного включателя (фиг.3. поз.7), находящегося на панели управления, запускает реле времени (фиг.3, поз.16) с установленным заранее временем, которое запускает пускатель (фиг.3, поз.14). Внутренний каркас с рамой и несущими упорами перемещается вверх, принимая больного с неподвижной рамы на себя. Таким образом, больной полностью перемещается с упоров неподвижной рамы на упоры подвижной рамы и находится на них столько времени, сколько установлено на реле времени. Наиболее оптимальным является время 10-12 мин, это время, необходимое для восстановления кровообращения на участках, контактирующих с упорами рам. Через установленное время внутренняя рама начинает движение вниз, тело больного перемещается на упоры неподвижной рамы. Таким образом, происходит смена контактирующих участков тела больного, что способствует восстановлению кровообращения на участках, контактирующих с упорами, наиболее опасными для возникновения пролежней.
Дезинфекцию кровати КМП-O проводят обычными дезинфекционными средствами с дополнительным включением 2 кварцевых ламп ультрафиолетового облучения (УФО).
Пример использования кровати медицинской противопролежневой ожоговой
На КМП-О пролечено 19 больных с обширными поверхностными и глубокими ожогами в возрасте от 16 до 72 лет, из них 7 женщин и 12 мужчин.
ПРИМЕР: 1. Б-й М. 21 года, И.Б. №41/0414, поступил 04.12.02 года. Диагноз: Термический (пламенем) ожог ЗАБ ст. 85% (20%) пов. тела. Термоингаляционная травма. Шок III ст.
Сразу же после поступления больной помещен на КМП-O. После соответствующей терапии явления шока ликвидированы по истечении вторых суток. Ожоговая поверхность в течение первых суток покрылась сухим струпом. На 12 сутки отмечено спонтанное заживление поверхностных ожогов под струпом на площади около 65% поверхности тела. На 15 день произведена первая операция аутодермопластика. На 20 день без признаков воспаления ран и пролежней переведен в общую палату. В тот же день произведена вторая операция. Приживление аутотрансплантатов 100%, выписан на 37 день с выздоровлением.
Признаки изобретения, отличительные от прототипа:
1. КМП-O отличается от прототипа тем, что для профилактики пролежней используют эластичные, параллельно расположенные упоры «ложе из лесок», с попеременной сменой места контакта с телом. В прототипе имеет место постоянный контакт с поверхностью тела.
2. Время контакта упоров с телом больного регулируется при помощи реле времени.
3. Для создания воздушного потока теплого воздуха используется аэротерапевтическая установка (АТУ-3) с фильтрами, очищающими воздух, и с реле контроля температуры воздуха.
4. Устройство снабжено встроенными лампами УФО для ультрафиолетового облучения ран (обширных ожоговых поверхностей) и дезинфекции камеры кровати.
5. Имеется защитный, подвижный каркас.
6. КМП-O снабжен откидным манипуляционным столиком и дверцами для обслуживания больного, проведения дезинфекционной обработки и ухода за полостью корпуса.
7. Защитный подвижный каркас способствует созданию индивидуального микроклимата для больного, защищает органы дыхания и лицо от нагретого воздушного потока и ультрафиолетового облучения.
Положительный эффект от использования изобретения.
Постоянный поток теплого очищенного воздуха вокруг тела больного способствует созданию оптимального микроклимата, исключает мацерацию кожи, способствует раннему формированию сухого струпа, что препятствует потере плазмы, предохраняет рану от инфицирования и способствует первичной эпителизации поверхностных ожогов. Вертикальное возвратно-поступательное движение упоров КМП-O предупреждает образование пролежней за счет попеременной смены места давления на тело. Лечение обширных термических поражений открытым безповязочным методом экономит перевязочный материал, лекарственные средства. При переводе больных с КМП-О на обычную кровать не требуется период адаптации больных.
Литература
Кровать «Клинитрон» (Медицинская техника. Сб. информационных материалов, 1998). Прототип.
1. Кровать медицинская, противопролежневая, ожоговая, содержащая неподвижный наружный каркас и подвижный внутренний каркас, связанный с электродвигателем, отличающаяся тем, что дополнительно имеет защитный, подвижный каркас из пластин и прорезиненной ткани, выполненный в виде колпака для прикрывания больного, камеру, реле времени, поддон, размещенный в поддоне кварцевый облучатель и установку для подачи теплого воздуха через установленную в поддоне трубу, при этом неподвижный наружный каркас состоит из рамы с натянутыми поперек эластичными упорами, а внутренний каркас состоит из рамы, шпилек с отверстиями для закрепления несущих эластичных упоров и направляющих втулок для вертикального возвратно-поступательного движения.
2. Кровать по п.1, отличающаяся тем, что между верхней и нижней рамой закреплены конические редукторы и винтовые подъемники, на которые передается вращение от электродвигателя через червячный редуктор и вал.
3. Кровать по п.1, отличающаяся тем, что у головного конца имеет откидной манипуляционный столик.
Проблема эпидермолитических заболеваний кожи на сегодняшний день сохраняет актуальность ввиду высокой летальности, тяжести клинических проявлений и возможной инвалидизации пациентов. Токсический эпидермальный некролиз — острая тяжелая токсико-аллергическая реакция, характеризующаяся обширным поражением кожи и слизистых оболочек, чаще всего индуцированная приемом лекарственных препаратов. Характеризуется некрозом эпидермиса всего кожного покрова с последующим его отслоением [1, 2].
A. Lyell выделил четыре варианта токсического эпидермального некролиза: лекарственный, стафилококковый, смешанный и идиопатический. По современным представлениям, причиной развития токсического эпидермального некролиза в основном являются лекарственные средства [1].
Среди лекарственных препаратов, вызывающих синдром Лайелла, наиболее часто выделяют сульфаниламидные препараты (особенно пролонгированного действия, Бисептол) и антибиотики. Реже заболевание развивается на фоне применения противосудорожных препаратов (фенобарбитал, карбамазепин, фенитоин, триметадион), противотуберкулезных средств (особенно изониазида), аллопуринола, витаминов и др., независимо от дозы. Придается значение наследственному дефекту детоксикации лекарственных метаболитов. Острый эпидермальный некролиз представляет собой своеобразную тяжелую форму токсикодермии, финальный вариант поливалентной сенсибилизации инфекционного и лекарственного характера [1, 2].
Заболеваемость эпидермолитическими лекарственными реакциями (ЭЛР) оценивается как 1–6 случаев на миллион человек. ЭЛР могут возникать в любом возрасте, риск развития заболеваний возрастает у лиц в возрасте старше 40 лет, у ВИЧ-позитивных пациентов, больных системной красной волчанкой и онкологическими заболеваниями. Чем старше возраст пациента, серьезнее сопутствующее заболевание и обширнее поражение кожи, тем хуже прогноз заболевания. Смертность от ЭЛР составляет 5–12% [1–3].
Клинические проявления синдрома Лайелла начинаются с продромальной симптоматики. Дерматологические проявления характеризуются появлением обильной диссеминированной пятнистой сыпи или диффузной эритемы, формированием крупных пузырей, эрозий, отторжения эпидермиса. Симптом Никольского резко положительный. Общее состояние пациентов крайне тяжелое [1, 2].
Современные подходы к лечению предполагают использование гемосорбции, плазмофереза и глюкокортикостероидов (2–3 мг/кг в перерасчете на преднизолон). Так, Федеральные клинические рекомендации по ведению больных синдромом Стивенса–Джонсона/токсическим эпидермальным некролизом (Москва, 2015) предполагают использование глюкокортикостероидов как основного компонента лечения — преднизолон 90–150 мг/дексаметазон 12–20 мг/сут внутримышечно или внутривенно. Федеральные клинические рекомендации по ведению больных токсикодермиями (Москва, 2015) советуют применение глюкокортикостероидов при тяжелых формах токсикодермий; дозы зависят от тяжести клинических проявлений, но не менее 30–35 мг/сут в пересчете на преднизолон [3, 4].
Данные зарубежной литературы указывают на необходимость поддерживающей терапии и сохранения гемодинамического равновесия и профилактики угрожающих жизни осложнений. «Среди ученых нет однозначного мнения о применении системных глюкокортикостероидов. Некоторые работы показывают, что такая терапия, если ее назначать в ранней фазе, способна предупредить дальнейшее распространение заболевания. Другие исследователи приходят к выводу о том, что стероиды не останавливают прогресс заболевания и даже ассоциируются с повышенной смертностью и нежелательными эффектами, в частности сепсисом. Более того, отмечается ряд примеров развития заболевания у пациентов, прежде уже получавших терапию глюкокортикостероидами, что свидетельствует о возможном увеличении риска возникновения эпидермального некролиза при применении глюкокортикостероидов. Таким образом, глюкокортикостероиды нельзя рекомендовать в качестве основной терапии токсического эпидермального некролиза» [5].
В настоящее время эффективность глюкокортикостероидов как главного компонента базовой терапии синдрома Лайелла ставится под сомнение: высокие дозы глюкокортикостероидов замедляют эпителизацию, способствуют деструктивным изменениям на слизистых; увеличивается процент септических осложнений; начало лечения высокими дозами глюкокортикостероидов не всегда приводит к торможению прогрессирования синдрома Лайелла [6].
Поэтому выдвигается альтернативный метод лечения, который предусматривает ведение пациентов с синдромом Лайелла по протоколу лечения ожоговых больных, без применения глюкокортикостероидов. Как альтернатива, в надежде на их большую эффективность, предлагаются циклоспорин А, методы экстракорпоральной детоксикации [3, 4].
Лечение синдрома Стивенса–Джонсона проводит врач-дерматовенеролог, терапию более тяжелых форм ЭЛР осуществляют другие специалисты; врач-дерматовенеролог привлекается в качестве консультанта [3].
При выявлении эпидермолитической лекарственной реакции врач, независимо от его специализации, обязан оказать больному неотложную медицинскую помощь и обеспечить его транспортировку в ожоговый центр (отделение) либо в реанимационное отделение [1–4].
В повседневной клинической практике ожоговые и реанимационные отделения обычно оснащены так называемыми флюидизирующими кроватями.
В упомянутое техническое средство встроен уникальный модуль дегидратации, работающий по принципу конденсации. Выделения пациента (раневой экссудат, кровь, урина, пот) скапливаются в виде конденсата в специальном поддоне, в котором они нагреваются особенным способом с целью уничтожения бактерий, а затем испаряются в окружающую среду. Встроенный в модуль дегидратации компрессор обеспечивает превосходное осушение воздуха, используемого для флюидизации, при температуре в помещении до 33 °C и влажности до 85% (рис. 1) [7].
Флюидизирующая кровать первоначально разработана и активно применялась для профилактики и лечения пролежней. Однако скоро в научной литературе стали появляться публикации об успешном применении этого технического средства и в лечении ожогов. В то же время накапливаемый практический опыт позволил констатировать и новые возможности технического средства. Проведенные в дальнейшем исследования W. D. Winters (1990) доказали, что включение в флюидизирующий слой гранул, обладающих бактерицидным действием, создает благоприятные условия для подавления инфекции на поверхности ран. Кроме того, как показали опубликованные материалы Л. О. Шкроб с соавт. (1989), у больных отмечена ранняя нормализация иммунного статуса, увеличение числа «активных» Т-лимфоцитов и теофиллинрезистентных Т-лимфоцитов (помощников), заметное сокращение числа теофиллинчувствительных Т-лимфоцитов (супрессоров), снижение уровня циркулирующих иммунных комплексов, а также нормализация содержания иммуноглобулина E. Положительная динамика изменения состояния иммунной системы позитивно влияла на процессы регенерации и общее состояние пациентов. Ускорялось время эпителизации поверхностных ожогов и подготовки ран к оперативному восстановлению кожного покрова при глубоких ожогах. Существенно снижался риск образования пролежней. Как показали исследования D. W. Ryan (1995), пребывание пациента в постоянном теплом микроклимате благотворно влияло на постепенное расширение кровеносных сосудов в шоке, снижение скорости обмена веществ, изменение катаболизма после операции, снижение боли [7].
В качестве примера использования флюидизирующей кровати у пациентов дерматологического профиля рассмотрим два клинических случая терапии ЭЛР на базе ожогового отделения Сургутской городской клинической больницы.
Клинический случай 1
Пациентка Т., 1967 г. р. (30 лет), поступила в ожоговое отделение 17.02.1997 г. через 7 суток после начала заболевания. При поступлении выставлен диагноз: «Синдром Лайелла. Беременность 9 недель». Четкой причинно-следственной связи развития заболевания установить не удалось. На момент поступления состояние пациентки расценивалось как крайне тяжелое, отмечалась тотальная десквамация эпидермиса на всех участках тела и слизистых оболочках, вялые пузыри с серозным содержимым, обширные эрозии (рис. 2). Симптом Никольского положительный.
Ведение пациентки: лечение в условиях палаты интенсивной терапии, на флюидизирующей кровати. Комплексная интенсивная терапия, аналогичная медикаментозной терапии, применявшейся при лечении ожогов с развитием ожогового шока III степени. Наружно обработка пораженных кожных покровов водными растворами антисептиков, аэрозоль гидрокортизон + тетрациклин. От предложенного прерывания беременности пациентка категорически отказалась. Стоит отметить, что в лечении пациентки применение системных глюкокортикостероидов было сведено к минимальным дозам — преднизолон 30 мг в сутки.
Исход: на 14-е сутки после начала лечения наблюдалась полная эпителизация эрозий на пораженных участках кожного покрова (рис. 3). Беременность удалось сохранить, с последующим разрешением физиологическими родами.
Клинический случай 2
Пациент К., 1975 г. р. (40 лет), поступил в ожоговое отделение 25.11.2015 г. переводом из Сургутского клинического противотуберкулезного диспансера. При поступлении выставлен диагноз: «Эпидермолитическое токсико-аллергическое поражение кожных покровов, обусловленное приемом внутрь лекарственных препаратов. Состояние эритродермии. Вторичная пиодермия. Диссеминированный туберкулез легких. ВИЧ-инфекция 4В стадии. Хронический вирусный гепатит С высокой степени активности». ЭЛР развилась на фоне приема противотуберкулезных препаратов. Состояние пациента расценивалось как крайне тяжелое, поражение кожи составляло 100% в виде диффузной яркой эритемы, выраженного крупнопластинчатого шелушения, линейных трещин, обширных эрозий, серозно-гнойных и геморрагических корок.
Ведение пациента: лечение в условиях палаты интенсивной терапии, на флюидизирующей кровати. Комплексная инфузионно-трансфузионная терапия в объеме 2 л/сутки, антибактериальная терапия, наружно повязки с гелем Пронтосан. Учитывая активность инфекционного процесса (наличие туберкулеза легких, ВИЧ-инфекции и вирусного гепатита С), глюкокортикостероиды в лечении пациента не применялись.
Исход: на 10-е сутки после госпитализации отмечено значительное улучшение состояния пациента, эпителизация эрозий на большей части тела, ликвидация гнойного отделяемого. Незначительное шелушение сохранялось в области коленных суставов. Пациент активен в пределах палаты. Динамика по кожным проявлениям положительная. Пациент переведен в СКПТД для дальнейшего лечения основного процесса.
Заключение
Исходя из вышесказанного, считаем целесообразным применение флюидизирующих кроватей для комплексной терапии пациентов с эпидермолитическими заболеваниями, что в дальнейшем, возможно, может улучшить результаты лечения и значительно сократить сроки госпитализации, позволит сократить дозы и длительность использования системных глюкокортикостероидов, тем самым уменьшив риск их побочных эффектов. Кроме того, не исключено, что использование флюидизирующих кроватей, возможно, будет полезным также в комплексной терапии других дерматологических заболеваний.
Литература
- Елькин В. Д., Митрюковский Л. С., Седова Т. Г. Избранная дерматология. Редкие дерматозы и дерматологические синдромы. Иллюстрированный справочник по диагностике и лечению дерматозов. Пермь, 2004. 946 с
- Скрипкин Ю. К., Мордовцева В. Н. Кожные и венерические болезни. Рук-во для врачей. М: Медицина, 1999. Т. 1. С. 800–803.
- Федеральные клинические рекомендации по ведению больных синдромом Стивенса–Джонсона/токсическим эпидермальным некролизом. М., 2015.
- Федеральные клинические рекомендации по ведению больных токсикодермиями. М., 2015.
- Вольф К., Голдсмит Л. А., Кац С. И., Джилкрест Б. А., Паллер Э. С., Леффель Д. Дж. Фицпатрик в клинической дерматологии. М.: Изд-во Панфилова, БИНОМ, 2012. Т. 1. С. 1154–1155; 1630–1647.
- Чичерина Е. Н., Малых С. В., Акшенцева М. В. Синдром Лайелла (клиника, диагностика, современные методы лечения) // Вятский медицинский вестник. 2008, № 3–4.
- Скворцов Ю. Р., Соколов В. А., Титов А. С. Применение аэротерапевтических кроватей в лечении ожогов // Приволжье (Нижний Новгород). 2012, № 2, с. 18–21.
И. Л. Агапов*, кандидат медицинских наук
А. А. Зорькин**, кандидат медицинских наук
Е. Н. Ефанова**, 1, кандидат медицинских наук
А. А. Шапилов**
К. В. Шапилова**
* БУ ХМАО-Югры Сургутская ГКБ, Сургут
** БУ ВО ХМАО-Югры СурГУ, Сургут
1 Контактная информация: el.efanova2011@yandex.ru
Использование флюидизирующей кровати в комплексной терапии эпидермолитических заболеваний кожи/ И. Л. Агапов, А. А. Зорькин, Е. Н. Ефанова, А. А. Шапилов, К. В. Шапилова
Для цитирования: Лечащий врач № 5/2018; Номера страниц в выпуске: 53-55
Теги: токсический эпидермальный некролиз, поражение кожи, токсико-аллергическая реакция
проходят значительно быстрее, и через 3-4 недели происходит практически полное заживления раны.
Таким образом, анализ полученных результатов дает основание считать, что наиболее эффективным средством для наружного лечения хронических инфицированных ран является препарат «Антиран», в котором содержится оптимальная концентрация терпенсодер-
жащих соединений, обеспечивающая бактериостатиче-ское и цитопротекторное действие (7). Применение этого препарата в сочетании с УЗК значительно улучшает результаты лечения, что обусловлено более быстрым очищением раны от девитализированных тканей за счет их механического удаления и бактерицидного эффекта ультразвука.
ЛИТЕРАТУРА
1. Коган А.С., Куликов Л.К., Морозов С.А. Длительно незаживающие раны. — Иркутск: Изд-во Иркут. ун-та, 1988. — С. 3-20.
2. Куликов Л.К. Сочетанное применение пролонгированной энзимотерапии и хирургических методов при лечении длительно незаживающих ран: Дис. … канд. мед. наук. — Омск, 1984. — С.9-33.
3. Патент 2113218 РФ, МКИ6 А 61 К9/00, 31/215 Средство для лечения ран / Полтавченко Ю.А., Рютин, Н.П., Гармашов В.И. и др (РФ; ТОО НПФ «Левес-А» и Институт гигиены труда и профзаболеваний ВСНЦ СО РАМН ). —№93042363; Заявл. 20.08.93
4. Патент на изобретение № 2189814 МКИ6 А 61 К9/00,
31/215 Способ лечения хронических раневых процессов Куликов Л.К., Казанков С.С., Гармашов В.И. — № 2001106893; Заявл. 13.03.2001
5. Перцов С.С. Изучение роли интерлейкина 1р в механизме устойчивости к острому эмоциональному стрессу: Дис. … канд. мед. наук. — М., 1995. — 149 с.
6. Платонова И.А. Роль стресс — реализующей нейроим-муноэндокринной системы в патогенезе ишемического инсульта: Дис. . канд. мед. наук. — М., 2004. — 217 с.
7. Рютин Н.П. Модификация течения раневого и воспалительного процесса уксусными эфирами борнеола: Дис. … канд. биолог. наук. — Иркутск, 1995. — С. 51-53.
Адрес для переписки: Смирнов Алексей Анатольевич — канд.мед.наук, ассистент кафедры хирургии, тел.раб. (3952)638-176; Surarcher@rambler.ru, Васильева Людмила Сергеевна — зав. каф. гистологии, профессор
© РЫБАКОВ А.А., ЕРШОВ А.В., ДОЛГИХ В.Т. — 2009
ЭФФЕКТИВНОСТЬ ИСПОЛЬЗОВАНИЯ УСТАНОВКИ «КЛИНИТРОН» В КОМПЛЕКСНОМ ЛЕЧЕНИИ БОЛЬНЫХ С ТЕРМИЧЕСКИМИ ОЖОГАМИ
А.А. Рыбаков, А.В. Ершов, В.Т. Долгих (Омская государственная медицинская академия, ректор — д.м.н., проф. А.И. Новиков, кафедра патофизиологии с курсом клинической патофизиологии, зав. — д.м.н., проф. В.Т. Долгих; Городская клиническая больница скорой медицинской помощи № 1, гл. врач — д.м.н., проф. С.И. Филиппов)
Резюме. Обследовано и пролечено 26 больных с термическими ожогами II-III степени тяжести с определением индекса тяжести ожоговой травмы, уровня эндотоксикоза и фагоцитарной активности лейкоцитов. Установлено, что включение установки «Клинитрон» в комплекс интенсивной терапии обожженных больных приводит к снижению уровня интоксикации, а также способствует нормализации фагоцитарной активности лейкоцитов, что снижает вероятность развития инфекционно-токсических осложнений ожоговой болезни, сокращает пребывание в отделении реанимации и интенсивной терапии. Использование установки «Клинитрон» в комплексе со стандартной схемой интенсивной терапии способствует более быстрому высушиванию струпа, обеспечивает температурный комфорт, предельно низкое контактное давление на раны улучшает условия для приживления пересаженных кожных лоскутов и эпителизации ран, уменьшает тяжесть эндотоксикоза и повышает неспецифическую резистентность организма, сокращая сроки пребывания больных в отделении реанимации.
Ключевые слова: термические ожоги, интоксикация, клинитрон, неспецифическая резистентность.
COMPLEX TREATMENT OF PATIENTS WITH THERMAL BURNS
A.A. Ribakov, A.V. Ershov, V.T. Dolgikh (Omsk State Medical Academy, Municipal Clinical Hospital of First Aid № 1. Omsk)
Summary. There have been examined and treated 26 patients with thermal burns of II and III degrecs of severity with definition of severity index of thermal trauma, level of endotoxicosis and phagocital activity of leukocytes. It was established that including the device «Clinitron» in the complex intensive therapy of burned patients leads to decrease of intoxication level, as well as promotes normalization of phagocital activity of leukocytes, that decreases probability of development of infectional and toxic complications of burn disease, reduces stay at units of resuscitation and inteusive therapy.
toy words: thermal burn, intoxication, «Clinitron», nonspecific resistance.
Одним из ведущих патогенетических факторов летальных исходов обожженных служит присоединившаяся инфекция и эндогенная интоксикация [1], обусловленная веществами низкой и средней молекулярной массы (ВНСММ) и олигопептидами (ОП). Их рассматривают как универсальные маркеры эндогенной интоксикации [5], образующиеся в процессе протеолиза в поврежденных тканях, а также в самой плазме при выходе в кровь протеолитических ферментов. Одновременно с эндогенной интоксикацией у обожженных больных развивается иммуносупрессия, усугубляющая течение и прогноз ожоговой болезни. В этой связи выбор методов лечения больных с тяжелой термической травмой в условиях недостаточной изученности ведущих патогенетических факторов ожоговой болезни, а также
определение оптимальной тактики интенсивной терапии пострадавших заслуживает дальнейших клинических исследований. Цель работы — оценить изменения параметров интоксикации и фагоцитарной активности лейкоцитов у больных с ожогами П-Ш степени тяжести при включении в схему стандартной терапии установки «Клинитрон».
Материалы и методы
Критериями включения служили: возраст больных (20-40 лет), термическая травма П-Ш степени, вызванная пламенеем или кипятком, площадь ожогов в пределах 20-40%, отсутствие сопутствующей соматической патологии. Критерии исключения: больные с химиче-
Таблица 1
Общая характеристика обожженных больных (М±У)
Показатели Группы обожженных больных
I (п=12) II (п=14)
Возраст, лет 34,5±5,5 37,8±4,2
Мужчины, чел 8 (66,7%) 8 (57,1%)
Женщины, чел 4 (33,3%) 6 (42,9%)
Ожог пламенем 4 (33,3%) 6 (42,9%)
Ожог кипятком 8 (66,7%) 8 (57,1%)
Индекс Франка, балл 75±15,4 78±22,9
Летальные исходы 3 (25,0%) 1 (7,8%)
скими ожогами и электротравмой, больные с поверхностными (I степени) и тяжелыми (IV степени) ожогами. В исследование вошло 26 пациентов с ожоговой травмой, которые были разделены на 2 группы: I группа (п=12) — больные, получавшие стандартную терапию; II группа (п=14) — больные, получавшие, помимо стандартной терапии, лечение на установке «Клинитрон» (табл. 1). III группу контроля (п=10) составили практически здоровые лица. Тяжесть состояния больного и прогноз термической травмы оценивали по индексу Франка [8].
Интенсивная терапия включала противошоковую инфузионно-трансфузионную терапию растворами гидроксиэтилкрахмала, Рингера, 5% раствором глюкозы, свежезамороженной плазмой. Коррекцию системы гемостаза осуществляли гепарином; профилактику острых стрессовых язв — омепразолом; инотропную поддержку — допмином.
Парентеральное питание осуществляли 20% раствором глюкозы, растворами аминокислот (аминоплазмаль, аминосол) и жировыми эмульсиями (20% липофундин). Для нутритивной поддержки применялся «нутризон стандарт» или «нутризон энергия». Расчет суточной потребности в энергии осуществлялся по формуле Сиггегу: 25 ккал У масса тела (кг) + 40 ккал У площадь ожога (%). 50% суточной потребности в энергии удовлетворялось углеводами, а 30% — жирами. Потребность в азоте (в граммах) рассчитывали по формуле: суточная потребность в энергии (ккал)/100. Коррекция проводимого парентерального и энтерального питания осуществлялась с помощью определения азотистого баланса, а также содержания азота мочевины в суточном диурезе.
Локализация ожогов: верхние и нижние конечности, грудь, живот, спина, ягодицы. В I группе (на 7-11-е сутки) погибло 3 пациента, а во II группе — один пациент умер на 10-е сутки от сепсиса. В обеих группах применялись отсроченные некрэктомии (после первых 5 суток). Фагоцитарную активность лейкоцитов определяли с помощью люминолзависимой пирогеналиндуцирован-ной хемилюминесценции цельной крови на хемилюми-нометре «ХЛ-003» [9]. Лейкоцитарный индекс интоксикации (ЛИИ) рассчитывали по Кальф-Калифу [4]. Показатели эндотоксемии исследовали по уровню веществ низкой и средней молекулярной массы (ВНСММ) и олигопептидов (ОП) в плазме и на эритроцитах [6,7]. Больных обследовали при поступлении, на 3-е, 7-е и 14-е сутки пребывания в стационаре.
Статистическая обработка полученных результатов проводилась с помощью пакета статистических программ «Вю81а1». Расчету статистических показателей предшествовало исследование характера распределения. Для сравнения средних величин использовался критерий Стьюдента. При выявлении отклонения полученных значений в вариационном ряде от нормального (гауссовского) распределения использовали непараметрический метод статистики, применявшийся для сравнения двух выборок — критерий Манна-Уитни [3].
Результаты и обсуждение
Пациенты обоих групп значимо не различались по возрасту, половой принадлежности, этиологии термической травмы и индексу тя-
жести поражения, оценивающему тяжесть термической травмы (табл. 1). При поступлении в отделение (табл. 2) общее состояние пациентов характеризовалось как тяжелое: индекс Франка в I группе достигал 75±15,4 балла, а у больных II группы — 78±22,9 балла. Лишь к 7-м суткам у пострадавших группы II наблюдалась положительная динамика общего состояния по сравнению с тяжестью состояния пациентов I группы. Столь отсроченный положительный эффект от включения установки «Клинитрон» в стандартную схему терапии ожоговой болезни, по-видимому, связан с тем, что высушивание ожогового струпа (основной терапевтический эффект установки «Клинитрон») наблюдалось только к 3-4-м суткам.
Вероятно, более быстрое образование и высушивание ожогового струпа при использовании установки «Клинитрон» позволяло значительно снизить потери белка с ожоговой поверхности и уменьшить резорбцию токсинов, что положительным образом сказывалось на концентрации токсинов в организме пострадавших. При изучении маркеров эндогенной интоксикации больных обеих групп выявлено значительное увеличение содержания ВНСММ в плазме крови и на мембранах эритроцитов уже при поступлении: в плазме содержание ВНСММ превышало контрольные значения в 1,7-1,8 раза, а на эритроцитах — в 2,6 раза. Это свидетельствовало о развитии второй фазы эндогенной интоксикации — фазы накопления токсичных продуктов [7].
В группе I на третьи сутки наблюдения выявляли максимальные концентрации ВНСММ и олигопептидов на эритроцитах, превышавшие контрольные значения в 2,5 и 4 раза соответственно при незначительном снижении их концентрации в плазме. В дальнейшем (7-14-е сутки) содержание ВНСММ на эритроцитах умеренно снижалось, а в плазме на 7-е сутки отмечалась тенденция к незначительному увеличению по сравнению с 3-ми сутками, что свидетельствовало о развитии четвертой фазы эндогенной интоксикации — фазы несостоятельности систем гомеостаза и декомпенсации органов детоксикации [7].
У больных II группы при использовании в комплексном лечении установки «Клинитрон» уже с третьих суток отмечалось существенное снижение содержания ВНСММ и олигопептидов как в плазме крови, так и на эритроцитах, а через 2 недели их значения не отличались от контроля. Характерно, что на всем протяжении наблюдения содержание ВНСММ на эритроцитах пациентов I группы было в среднем на 64% больше, чем в
Таблица 2
Динамика тяжести общего состояния, содержания ВНСММ и ОП в биологических средах исследуемых групп (Ме±Q)
Сроки наблюдения, сУт Обследуемые группы
Показатель I (п=12) II (п=14) III (п=10)
ВНСММ на эритроцитах, усл. ед. 1 3 7 14 21,6±0,9* 31,8±2,1* 22,6±1,7* 19,2±1,8* 23,6±1,2* 18,1±1,2*л 15,3±0,9* л 14,9±1,2Л 13,0±0,5
ВНСММ в плазме, усл. ед. 1 3 7 14 31,3±2,1* 28,3±1,9* 29,9±2,1* 18,1±1,0* 31,9±2,5* 24,1±1,2*л 18,4±1,1*л 14,3±1,1Л 12,0±2,0
Олигопептиды на эритроцитах, г/л 1 3 7 14 0,90±0,02* 1,50±0,10* 0,90±0,03* 0,88±0,05* 0,87±0,04* 1,10±0,01*л 0,60±0,02*л 0,36±0,01Л 0,38±0,03
Олигопептиды в плазме, г/л 1 3 7 14 0,74±0,08* 1,29±0,09* 0,92±0,02* 0,54±0,02* 0,79±0,09* 0,89±0,02*л 0,77±0,01*л 0,35±0,01л 0,33±0,03
Примечание: * — значимость различий по отношению к контролю (р<0,05);
л — достоверность различий по отношению к группе I (р<0,05).
Динамика ЛИИ у обожженных больных (М±У)
Обследуемые группы Сроки наблюдения, сутки
1 3 7 14
I (n=12) 6,4±1,27 6,2±1,23* 3,7±0,84* 3,9±0,67*
II (n=14) 6,4±1,27 4,9±0,79*л 3,1±0,77*л 2,4±0,56*л
III (n=10) 1,6±0,50л 1,6±0,51 1.6+0,51 1,6±0,50
Примечание. * — значимость различий по отношению к контролю (р<0,05);
л — значимость различий по отношению к группе I (р<0,05).
группе II, а в плазме — на 19%.
Содержание олигопептидов в плазме крови и на эритроцитах у обожженных обеих групп при поступлении превышало контрольные значения более чем в 2 раза с последующим 3-4-кратным нарастанием их концентрации к 3-м суткам, особенно у больных I группы (табл.
2). Спустя неделю в обеих группах отмечалось снижение тяжести эндогенной интоксикации, о чем свидетельствовало уменьшение концентрации ВНСММ и олигопептидов в плазме и на эритроцитах, особенно у пациентов II группы. Снижение содержания олигопептидов в плазме крови и на мембранах эритроцитов при использовании установки «Клинитрон» может свидетельствовать об уменьшении процессов протеолиза у этой категории пострадавших [7].
При термических ожогах образование факторов вторичной аутоагрессии из ВНСММ и олигопептидов оказалось более выраженным у умерших больных. Именно у них выявлялось значительное увеличение содержания ВНСММ и олигопептидов как в плазме, так и на эритроцитах, превышавшее к исходу первых суток на 83,8% и 79,5% одноименные показатели выживших больных I группы и на 56,8% и 62,5% — показатели больных II группы.
Таблица 3 отражает динамику ЛИИ пациентов I и II групп — показателя, позволяющего судить о состоянии гемопоэза и проницаемости костномозгового барьера для лейкоцитов при системном воспалительном ответе [2]. При поступлении отмечалось 4-кратное увеличение ЛИИ по сравнению с контролем. В дальнейшем, в процессе лечения ЛИИ уменьшался, что являлось прогностически благоприятным признаком. Через 2 недели он превышал контрольные значения в I группе в 2,4 раза, а во II группе — в 1,5 раза. Характерно, что у пациентов II группы ЛИИ оказался значимо более низким во все периоды ожоговой болезни.
При поступлении у больных обеих групп отмечалось 4-кратное снижение люминолзависимой хемилю-
Таблица 3 в условиях максимально выраженной эндогенной интоксикации наблюдалось резкое уменьшение фагоцитарной активности лейкоцитов: спонтанная и индуцированная хемилюминесценция уменьшалась соответственно в 12,9 раз и в 4 раза в группе I и в 10,5 раз и в 2,6 раза в группе II. Клиническое улучшение, наблюдаемое в динамике с конца первой недели в обеих группах, сопровождалось повышением фагоцитарной активности лейкоцитов, особенно у больных II группы, при лечении которых использовалась установка «Клинитрон».
Анализ полученных результатов показал, что включение установки «Клинитрон» в комплекс интенсивной терапии обожженных пациентов способствует снижению уровня интоксикации, что проявлялась уменьшением содержания ВНСММ и олигопептидов в плазме и на эритроцитах. Это обусловлено более быстрым высушиванием ожогового струпа, предельно низким контактным давлением на раны (не более 12 мм рт.ст.), что способствует уменьшению тяжести эндотоксикоза, обеспечивает лучшие условия для приживления пересаженных кожных лоскутов и улучшает эпителизацию ран.
Использование данной установки обеспечивает температурный комфорт для тяжело обожженного (32-34оС), уменьшает действие стрессорных факторов
Таблица 4
Параметры хемилюминесценции цельной крови больных исследуемых групп (Ме±Q)
Показатель Сроки наблюдения, сУт Группы обследуемых
I (n=12) II (n=14) III (n=10)
Светосумма люминолзависимой ХЛ крови, усл. ед.хмин 4731 5,1±0,77* 1,7±0,16* 3,3±0,46* 9,2±2,01* 5,5±0,96* 2,1±0,07* 8,0±2,95*л 18,0±2,11л 22,1±2,90
Светосумма люминолзависимой ХЛ крови после инкубации, усл. ед.хмин 1 3 7 14 154,2±8,5*6 25,2±2,01* 39,1±2,79* 49,2±3,21* 161,5±7,25* 39,7±2,47*л 48,3±2,15*л 68,1±3,11*л 102,1±3,78
Примечание: * — значимость различий по отношению к контролю (р<0,05); л — значимость различий по отношению к группе I (р<0,05).
минесценции цельной крови (табл. 4). На третьи сутки
[8], уменьшает как резорбционный, так и продукционный механизм развития эндогенной интоксикации. Снижение содержания ВНСММ и олигопептидов в крови уменьшает их иммуносупрессивный эффект, что способствует повышению (по сравнению с третьими сутками) фагоцитарной активности лейкоцитов закономерно снижает вероятность развития инфекционнотоксических осложнений ожоговой болезни и сокращает на 2-3 суток пребывание пациентов в отделении реанимации и интенсивной терапии для ожоговых больных.
ЛИТЕРАТУРА
1. Вазина И.Р., Бугров С.Н. Основные причины смерти обожженных в восьмидесятые и девяностые годы двадцатого века // Актуальные проблемы термической травмы. — СПб., 2002. — С. 4044.
2. Гусев Е.Ю., Черешнев В.А., ЮрченкоЛ.Н. Системное воспаление с позиции теории типового патологического процесса // Цитокины и воспаление. — 2007. — № 4. — С. 9-21.
3. Зайцев В.М., Ляфляндский В.Г., Маринкин В.И. Прикладная медицинская статистика. — СПб.: Фолиант, 2003. — 432 с.
4. Кальф-Калиф Я.Я. О «лейкоцитарном индексе интоксикации» и его практическое значение (сообщение первое) // Врач. дело. — 1941. — № 1. — С. 31-40.
5. Келина Н.Ю., Васильков В.Г., Безручко Н.В. Методология до-
казательной биохимической оценки развития эндотоксикоза // Вестник интенсивной терапии. — 2002. — № 4. — С. 13-17.
6. Малахова М.Я. Методы биохимической регистрации эндогенной интоксикации // Эфферентная терапия. — 1995. — № 1. — С. 61-64.
7. Малахова М.Я. Эндогенная интоксикация как отражение компенсаторной перестройки обменных процессов в организме // Эфферентная терапия. — 2000. — №4. — С. 3-14.
8. Парамонов Б.А., Порембский Я.О., Яблонский В.Г. Ожоги: Руководство для врачей. — СПб., 2000. — 480 с.
9. Фархутдинов Р.Р., Лиховских В.А. Хемилюминесцентные методы исследования свободно-радикального окисления в биологии и медицине. — Уфа, 1998. — С. 7-90.
Адрес для переписки: 644043, Омск-43, ул. Ленина, 12. ОГМА, кафедра патофизиологии с курсом клинической патофизиологии. Тел. 8 (3812) 23-03-78. prof_dolgih@mail.ru Долгих Владимир Терентьевич — зав. кафедрой, д.м.н., профессор. E-mail: prof_dolgih@mail.ru
НИИ скорой помощи имени Н.В. Склифосовского
Огромный накопленный в мире опыт местного лечения больных с ожогами, изучение обширной литературы, посвященной ожоговой патологии (Т.Я. Арьев, 1971; Н.И. Атясов, 1972; В. Рудовский и соавт., 1980; М.И. Кузин и соавт., 1982; Б.С. Вихриев, В.М. Бурмистров, 1986), позволяет в настоящее время сформулировать некоторые неоспоримые постулаты.
• Местное лечение поверхностных ожогов I-II степени, даже обширных, не представляет серьезных трудностей. Они при лечении любыми средствами заживают в течение 7-12 дней.
• Cубдермальные ожоги IIIА степени нуждаются в более длительной консервативной терапии, которое не исключает возможности применения хирургического лечения у ограниченного числа больных. Подобные ожоги заживают в сроки от 3 до 6 нед.
• Глубокие ожоги IIIБ — IV cтепени нуждаются в хирургическом лечении.
• Местное консервативное лечение глубоких ожогов является лишь вспомогательным, оно преследует цель в кратчайшие сроки подготовить ожоговую рану к свободной пересадке кожи — заключительному этапу по восстановлению утраченного кожного покрова.
Исходя из вышеизложенного, представляется целесообразным поделиться нашим многолетним опытом местного лечения глубоких ожогов. В настоящей работе приведена лишь небольшая часть средств для местного лечения ожогов, которые применялись наиболее часто. Весь перечень подобных препаратов весьма велик и вряд ли целесообразно их перечислять.
На догоспитальном этапе необходимо проводить криообработку (охлаждение) ожоговых поверхностей.
На догоспитальном этапе при наличии ограниченных ожогов лучшей первичной повязкой является сухая асептическая повязка, при обширных ожогах для этих целей используют стандартные контурные повязки или стерильные простыни. Первичная повязка не должна содержать жиры и масла в связи с возникающими впоследствии трудностями при туалете ран, а также красители, т.к. они могут затруднить распознавание глубины поражения. Самым действенным мероприятием на догоспитальном этапе является криообработка ожоговых поверхностей. Это достигается обливанием пораженного участка в течение 10-15 мин холодной водой или использованием для этих целей льда, снега в чистом целлофановом пакете или готового криопакета. Криообработка прекращает действие термического агента на ткани пострадавшего и способствует благоприятному течению ожогов в последующем.
При поступлении в ожоговый центр пострадавшим выполняют первичную обработку ожоговых ран, характер и объем которой зависит от площади и глубины ожогового поражения. При наличии ограниченных поверхностных ожогов (не более 20% поверхности тела) без признаков ожогового шока обычно выполняют тщательный туалет ожоговых ран, заключающийся в удалении десквамированного эпидермиса, инородных тел, пузырей, в обильном промывании антисептическими растворами и наложении мазевой повязки. Если имеются обширные ожоги кожи, сопровождающиеся шоком, первичную обработку при поступлении не выполняют. Больного заворачивают в стерильную простыню, а отсроченный первичный туалет производят после стабилизации общего состояния. Глубокие ожоги обрабатывают так же, как и поверхностные, с той лишь разницей, что накладывается повязка с антисептическими растворами.
Нередко уже при поступлении может возникнуть необходимость в срочном оперативном вмешательстве. Подобная ситуация возникает при наличии циркулярных ожогов шеи, конечностей или грудной клетки. В этих случаях скальпелем без дополнительного обезболивания делают продольное рассечение струпа (некротомия) до жизнеспособных кровоточащих тканей. Такая простая манипуляция приводит к улучшению кровоснабжения пораженных участков, предупреждает углубление ожогового поражения, а при ожогах грудной клетки в значительной степени улучшает дыхательные экскурсии.
Местное лечение глубоких ожогов имеет свои конкретные задачи в разных фазах течения раневого процесса. Вскоре после получения ожога в период острого воспаления и нагноения лечение направлено на борьбу с раневой инфекцией и должно способствовать ускоренному отторжению некротических тканей. Для этого проводят частые (вплоть до ежедневных) перевязки с растворами йодсодержащих препаратов (йодопирон, йодовидон, повидон-йод и др.), хлоргексидина, диоксидина, фурацилина, повиаргола, лавасепта, плевасепта и т.п. Для борьбы с инфекцией в настоящее время хорошо себя зарекомендовал современный отечественный антисептик мирамистин, который применяется в 0,01% концентрации (С.В. Смирнов, Л.П. Логинов, 2000). В первой фазе раневого процесса при наличии влажных струпов или в период активного механического удаления их, используются углеродные перевязочные материалы. Эти материалы обладают хорошей сорбционной способностью, что приводит к уменьшению гнойного отделяемого, подсушиванию струпов и, как следствие, значительному уменьшению интоксикации организма. В конце данной фазы раневого процесса для борьбы с инфекцией также используют мази на водорастворимой основе (левомеколь, диоксиколь, сильвацин и др.).
С целью отторжения омертвевших тканей используются протеолитические ферменты животного происхождения (трипсин, хемотрипсин, панкреатин), бактериальные ферменты (стрептокиназа, коллагеназа, террилитин и др.), растительные ферменты (папаин и др.). Следует учитывать тот факт, что ферменты не действуют на плотный ожоговый струп. Поэтому применение ферментов наиболее показано в процессе механического удаления некрозов либо при наличии влажных струпов.
Кератолитические средства (молочная, салициловая, карболовая кислоты, мочевина) в нашей практике находят ограниченное применение, поскольку они усиливают местный воспалительный процесс в ране, вызывающий усиление интоксикации. Эти средства используются нами лишь при ограниченных ожогах у пострадавших, не подлежащих оперативному лечению по тем или иным причинам (отказ от операции, тяжелая сопутствующая патология).
При консервативном лечении глубоких ожогов самопроизвольное отторжение нежизнеспособных тканей можно ожидать лишь через 4-6 нед после травмы. Такие длительные сроки подготовки ожоговых ран к свободной пересадке кожи — конечному этапу хирургического лечения обожженных — непозволительны, так как за это время состояние больных может ухудшиться за счет присоединения осложнений, и выполнение операции у многих из них становится проблематичным. Поэтому мы, как и комбустиологи всего мира, стремимся выполнить закрытие ран аутотрансплантатами в максимально короткие сроки. Это достигается хирургическими методами лечения: некротомией, некрэктомией и свободной пересадкой кожи. Идеальным методом хирургического лечения глубоких ожогов является радикальное иссечение нежизнеспособных тканей с одномоментной кожной пластикой образовавшегося дефекта в первые 2-3 дня после получения ожогов. Однако трудность диагностики глубины поражения, травматичность самой операции, отсутствие уверенности в полном удалении мертвых тканей приводят к тому, что ее возможно выполнять лишь у ограниченного числа обожженных с площадью глубокого ожога не более 10% поверхности тела.
При более обширных поражениях хирургическое удаление ожоговых струпов, как правило, выполняют в несколько этапов. Обычно на 3-5 сутки после купирования ожогового шока и стабилизации основных показателей гомеостаза под общим обезболиванием выполняют первый этап некрэктомии, при которой с помощью роторного дерматома либо ножа Гамби удаляют часть струпов. Площадь удаляемых одномоментно струпов определяется возрастом, состоянием больного и общей площадью глубокого ожога. Обычно при обширных ожогах в первый этап удаляют 1/2-1/4 часть струпов, во второй и третий этапы удаляются оставшиеся струпы. Операция выполняется с обязательным возмещением интраоперационной кровопотери. За последние 8-10 лет отмечается резкое увеличение пострадавших с тяжелой и крайне тяжелой ожоговой травмой. В связи с этим калечащие операции (ампутации конечностей) стали в ожоговых стационарах обычным явлением.
Для удаления остатков нежизнеспособных тканей используются частые (вплоть до ежедневных) перевязки с антисептическими растворами, ферментами, антибиотиками. В дальнейшем при начинающемся росте грануляционной ткани переходют на мазевые повязки (2% фурацилиновая мазь, левомеколь, диоксиколь и др.). Хорошо себя зарекомендовала мазь Лавендула, содержащая антисептик мирамистин и фермент бактериального происхождения ультрализин. Мирамистин хорошо подавляет грамотрицательную и грамположительную микрофлору, а ультрализин способствует протеолизу и удалению оставшихся мертвых тканей.
В этот же период применяются различные мази на трикотажной сетчатой основе. Среди них заслуживают внимания однослойные мазевые повязки с 5% диоксидиновой мазью. Обычно после 2-3 перевязок мы могли отметить уменьшение гнойного отделяемого, активизацию роста грануляционной ткани, снижение микробной обсемененности ожоговых ран. Важным преимуществом данной повязки является также то, что она легко и безболезненно удаляется с поверхности раны на очередной перевязке.
Местное консервативное лечение глубоких ожогов проводится для подготовки к свободной пересадке кожи.
В этой же фазе раневого процесса (регенерация) с используются препараты, стимулирующие рост грануляций: салфетки с гиалуроновой кислотой, бальзамические повязки и т.п. Не потеряла своего значения ксенотрансплантация свиной кожи для временного покрытия обширных ожоговых поверхностей с целью защиты их от внутрибольничной инфекции и уменьшения потерь белков, электролито и, жидкостей.
Показателем готовности раны к закрытию ее аутотрансплантатами считается наличие ярко-красного грануляционного покрова с необильным гнойным отделяемым с выраженной каймой краевой эпителизации, отсутствие остатков нежизнеспособных тканей.
Обязательным условием для выполнения операции свободной пересадки кожи является отсутствие гипопротеинемии (общий белок не менее 60 г/л), гипоальбуминемии (белковый коэффициент не менее 1), анемии (гемоглобин не ниже 90 г/л). Временным противопоказанием к операции считается наличие в ране b-гемолитического стрептококка. К удалению грануляций перед аутодермопластикой мы прибегаем крайне редко, так как почти всегда удается добиться хорошего состояния последних и есть надежда на хорошее приживление трансплантатов.
Ожоговые раны на площади до 15-20% поверхности тела обычно закрываем в один этап, более обширные ожоговые раны нуждаются в 2-3-, а иногда и в 4-5-этапных операциях. Срезание кожных лоскутов выполняем дерматомами с ручным или электрическим приводом под общим обезболиванием. Проблема дефицита донорских ресурсов при этом решается с помощью сетчатых аутодермотрансплантатов с коэффициентом растяжения от 1:2 до 1:6. Повторное срезание кожных лоскутов с зажившего донорского участка также позволяет решать проблему дефицита донорских ресурсов. Быстрой эпителизации донорских ран способствует наложение после операции однослойных мазевых повязок с 5% диоксидиновой мазью: при толщине срезанных трансплантатов 0,3 мм донорские раны эпителизировались за 10-12 дней. Закрытие всех ожоговых ран аутотрансплантатами производим за 2-2,5 месяца с момента ожогового поражения.
В послеоперационном периоде местное лечение также не утратило своей значимости. Речь идет о больных, у которых имеет место частичное расплавление кожных лоскутов и образование между ними множества гранулирующих ран. В данной ситуации полезными оказываются различные губчатые покрытия (коласпон, дигиспон, биотравм, гешиспон и др.), которые способны не только реально стимулировать репаративные процессы, но и обладают противовоспалительным действием. К сожалению, в настоящее время многие из них в связи с тяжелой экономической ситуацией в стране не выпускаются отечественной промышленностью. Для борьбы с избыточными грануляциями применяем мази с гидрокортизоном.
Описанное выше хирургическое лечение обширных глубоких ожогов укладывается в понятие “активная хирургическая тактика”, сформулированное 40 лет назад Н.И. Атясовым. В процессе оперативного лечения обожженных не потеряли своего значения и физические методы воздействия на раневой процесс (УВЧ, УФО, лазеротерапия, кровати “Клинитрон”, потолки с инфракрасным излучением и т.п.). Местное лечение обширных глубоких ожогов проводится на фоне интенсивной инфузионно-трансфузионной терапии, позволяющей поддерживать показатели гомеостаза в пределах нормальных значений.
Первый опыт применения для закрытия ран после глубоких ожогов эпидермальных кератиноцитов, выращенных вне организма больного, показал его перспективность в решении проблемы дефицита донорских ресурсов (А.В.Васильев и соавт., 1994). Теоретически этот метод предполагает создание безграничных донорских ресурсов, т.к. из маленького кусочка кожи выращиваются эпителиальные пласты, превышающие площадь этой кожи в 100 и более раз. Однако трудоемкость, сложность и большая стоимость выращивания кератиноцитов не позволяют в настоящее время внедрить этот метод в практическую медицину.
Активная хирургическая тактика позволила улучшить результаты лечения тяжело обожженных, расширить границы выживаемости при крайне тяжелых ожогах, сохранять жизнь некоторым больным с глубокими ожогами на площади 50 — 60% и более поверхности тела.
Литература:
1. Т.Я. Арьев. Ожоги и отморожения. “Медицина”, 1971.
2. Н.И. Атясов. Система активного хирургического лечения тяжело обожженных. Г., 1972.
3. В. Рудовский и соавт. Теория и практика лечения ожогов М., “Медицина”, 1980.
4. М.И. Кузин и соавт. Ожоговая болезнь. М., “Медицина”, 1982.
5. Б.С. Вихриев, В.М. Бурмистров. Ожоги. Л., “Медицина”, 1986.
6. С.В. Смирнов, Л.П. Логинов. Результаты лечения ожоговых ран с использованием отечественного антисептика мирамистина. В мат. симпоз. “Мирамистин — новый отечественный антисептик широкого спектра действия”. М., 2000, с.17
7. А.В. Васильев и соавт. Применение выращенных эпителиальных пластов для лечения обожженных. Травматология и ортопедия, 1994; 4: 34-9.
Главная
Удаление рубцов и шрамов
Устранение послеожоговых рубцов и контрактур на современном оборудовании для хирургических операций
Ожоговые отделения (взрослое и детское), совместно с отделением анестезиологии и реанимации ожоговых больных учреждения здравоохранения «Городская клиническая больница скорой медицинской помощи» являются базой Республиканского ожогового центра, который был и остается организационно-методическим и лечебным центром по проблеме лечения термических поражений и их последствий. Ожоговый центр располагает четырьмя операционными, оснащенными современным оборудованием для выполнения хирургических операций.
Удаление рубцов и шрамов стало одним из главных направлений в работе ожогового отделения в г. Минске. Благодоря 40-ка летнему опыту, внедрена активная хирургическая тактика удаления глубоких ожогов, рубцов и шрамов.
Широко применяется декомпрессионная некротомия, ранняя некрэктомия с одномоментной или отсроченной аутодермопластикой, несвободная пластика полнослойными лоскутами на питающей ножке, различные виды пластик при операциях по удалению рубцов, послеожоговых рубцовых контрактур и деформаций различной локализации.
Цены
Стоимость оперативного лечения 191$
Применяемые методики лечения
При лечении послеожоговых рубцовых деформаций и контрактур широко применяются различные современные хирургические методики:
- рассечение и иссечение рубцов с комбинированной пластикой;
- пластикой местными тканями;
- различные виды пластик полнослойными лоскутами на питающей ножке.
В практике лечения ожоговых ран широко применяются современные атравматичные раневые отечественного и зарубежного производства.
Почему выбирают нас?
За время существования ожогового центра его сотрудниками опубликовано более 400 научных работ, защищено 5 кандидатских диссертаций.
- Ожоговое отделение (детское) является единственным специализированным отделением в Республике Беларусь для лечения детей с термической травмой. Отделение оснащено 2 противоожоговыми флюидизирующими кроватями «Клинитрон».
- Операционная детского отделения оснащена самым современным оборудованием: перфораторами кожи, электродерматомами, некротомами, электрокоагуляторами, радиохирургическим скальпелем, наркозно-дыхательной аппаратурой высокого класса, что позволяет применять передовые методы хирургического лечения детей с термической травмой и её последствиями.
- Благодаря открытию в 2007 году реанимационного отделения для больных с обширной ожоговой травмой и внедрению современных высокотехнологичных методов лечения, удалось сократить сроки лечения больных, уменьшить количество осложнений, увеличить выживаемость больных с обширными ожогами.
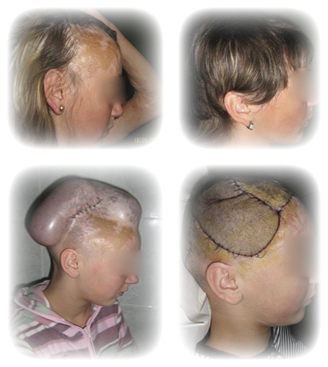
- Внедрение метода экспандерной пластики позволило закрывать раневые и рубцовые дефекты местными тканями в местах, где имеется дефицит здоровых окружающих тканей (раны с дефектом костей черепа, в функционально активных областях), что значительно улучшило как функциональный, так и косметический эффект операции.
Основная патология
- термические и химические ожоги, их последствия (рубцовые деформации лица, шеи, туловища, конечностей);
- отморожение и общее переохлаждение;
- электротравма, электроожоги различной локализации и их последствия;
- отравлением угарным газом;
Спектр хирургических вмешательств
- ранняя некрэктомия с одномоментной или отсроченной алло- и аутодермопластикой;
- свободная пластика ран полнослойными лоскутами на питающей ножке;
- экспандерная пластика;
- пластика рубцовых выворотов век;
- устранение микростомий;
- различные виды пластик по устранению послеожоговых рубцовых деформаций;
- различные виды пластик по устранению послеожоговых рубцовых контрактур суставов;
- пластика методом хронической дерматензии по устранению послеожоговых рубцовых деформаций туловища и конечностей с применением метода хронической дерматензии.
Телефоны справочной:
(+375 17) 287-89-26
заказать обратный звонок
- Программы лечения
- Цены
- План лечения
- Подать заявку на лечение
- О нас
- Статьи
- Программы лечения
- Эндопротезирование тазобедренного сустава
- Эндопротезирование коленного сустава
- Операции по удалению опухолей
- Удаление рубцов и шрамов
- Хирургическое лечение болезней печени, поджелудочной железы и желчных протоков
- Ангиография, коронарография, стентирование сосудов
- Медицинская реабилитация
- Нейрохирургические операции
- Гипербарическая оксигенация
- Дентальная имплантация и синус-лифтинг зубов
- Абдоминопластика
- Компьютерная томография
- Цены
- План лечения
- Подать заявку на лечение
- О нас
- Статьи



.jpg)