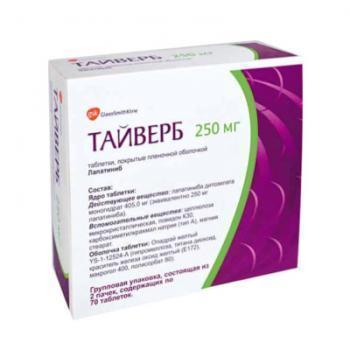
Тайверб — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер :
ЛСР-000782/08
Действующее вещество :
Лапатиниб
Лекарственная форма :
таблетки, покрытые пленочной оболочкой
Состав :
|
Компонент |
Содержание в 1 таблетке, |
|
мг |
|
|
Ядро таблетки: |
|
|
Действующее вещество: |
|
|
Лапатиниба дитозилата |
405,0 |
|
моногидрат, в пересчете на лапатиниб |
250,0 |
|
Вспомогательные вещества: |
|
|
Целлюлоза микрокристаллическая |
387,0 |
|
Повидон К30 |
58,5 |
|
Карбоксиметилкрахмал натрия (тип А) |
40,5 |
|
Магния стеарат |
9,0 |
|
Вода очищенная1 |
q.s. |
|
Оболочка таблетки: |
|
|
Опадрай* желтый YS-1-12524-A, содержащий: |
27,0 |
|
— гипромеллоза |
17,23 |
|
— титана диоксид |
7,13 |
|
— краситель железа оксид красный (Е172) |
0,005 |
|
— краситель железа оксид желтый (Е172) |
0,21 |
|
— макрогол-400 |
2,16 |
|
— полисорбат-80 |
0,27 |
1 — удаляется в процессе производства.
Описание :
Таблетки овальной формы, двояковыпуклые, от светло-желтого до желтого цвета, покрытые пленочной оболочкой. Одна сторона таблетки гладкая, на другой выгравирована надпись «GS XJG».
Фармакотерапевтическая группа :
Противоопухолевое средство. Обратимый ингибитор тирозинкиназы.
АТХ :
L.01.X.E.07
Фармакодинамика :
Механизм действия
Лапатиниб — это новый обратимый, селективный ингибитор внутриклеточной тирозинкиназы, связывающийся с EGFR (epidermal growth factor receptor, рецептор эпидермального фактора роста, ErbBl) и HER2 (human epidermal growth factor receptor, рецептор эпидермального фактора роста человека, ЕгЬВ2) рецепторами. Отличается от других быстрообратимых ингибиторов тирозинкиназы более медленной диссоциацией с ErbB 1 и ЕrbВ2 рецепторами (период диссоциации 50 % лиганда из лиганд-рецепторного комплекса составляет приблизительно 300 мин).
Помимо собственной активности in vitro была показана аддитивная активность лапатиниба и фторурацила (активный метаболит капецитабина) при использовании в комбинации на четырех линиях опухолевых клеток. Ингибирующий эффект оценивался на обработанных трастузумабом клетках. Комбинация лапатиниба и трастузумаба может обеспечить аддитивный механизм действия, а также возможные непараллельные механизмы преодоления резистентности к анти-НЕR терапии.
Лапатиниб продемонстрировал значительную активность на линиях НЕR2-позитивных опухолевых клеток в средах, содержащих
трастузумаб, и в комбинации с трастузумабом проявлял в данных клеточных линиях синергичное действие. Эти результаты демонстрируют отсутствие перекрестной резистентности между двумя лигандами рецептора HER2 (ЕrbВ2).
Фармакокинетика:
Всасывание
Абсорбция лапатиниба после приема внутрь неполная и вариабельная. Коэффициент вариабельности площади под фармакокинетической кривой «концентрация — время» (AUC) составляет от 50 % до 100 %. Лапатиниб определяется в системном кровотоке в среднем через 0,25 часа (диапазон 0-1,5 ч). Максимальная концентрация лапатиниба в плазме крови (Сmaх) достигается примерно через 4 часа после приема.
Сmах в равновесном состоянии при ежедневном приеме 1250 мг составляет в среднем 2,43 (1,57-3,77) мкг/мл, a AUC — 36,2 (23,4-56,0) мкг х час / мл.
Системная экспозиция лапатиниба увеличивается при приеме препарата одновременно с пищей.
При приеме с пищей с низким (5 % жира или 500 калорий) или высоким (50 % жира или 1000 калорий) содержанием жиров AUC возрастает в 3 и 4 раза (Сmах — приблизительно в 2,5 и 3 раза), соответственно.
Распределение
Лапатиниб обладает высокой степенью связывания (более чем 99 %) с альбумином и альфа1-кислым гликопротеином плазмы крови. Исследования in vitro показали, что
лапатиниб является субстратом для переносчиков BCRP (белок резистентности рака молочной железы, ABCG2 — АТФ-связывающий кассетный транспортер G2) и Р-гликопротеина (АВСВ1 АТФ-связывающий кассетный транспортер В1). Также in vitro
лапатиниб оказывал ингибирующий эффект в отношении данных переносчиков. Клиническое значение этих эффектов и влияние на фармакокинетику других препаратов, а также препаратов, обладающих противоопухолевой активностью, пока неизвестно.
Лапатиниб незначительно ингибирует транспортер органических анионов (ОАТ) или транспортер органических катионов (ОСТ).
Метаболизм
Лапатиниб подвергается интенсивному метаболизму, главным образом, изоферментами CYP3A4 и CYP3A5, в меньшей степени изоферментами CYP2C19 и CYP2C8 с образованием различных окисленных метаболитов.
Лапатиниб в клинически значимых концентрациях ингибирует изоферменты CYP3A и CYP2C8 in vitro.
Лапатиниб незначительно ингибирует следующие микросомальные ферменты печени: CYP1A2, CYP2C9, CYP2C19 и CYP2D6.
У здоровых добровольцев, получающих
кетоконазол (ингибитор изофермента CYP3A4) в дозе 200 мг 2 раза/сут в течение 7 дней, системное распределение лапатиниба увеличивалось примерно в 3,6 раза, период полувыведения — в 1,7 раза.
У здоровых добровольцев, получающих
карбамазепин (индуктор изофермента CYP3A4) в дозе 100 мг 2 раза/сут в течение 3 дней и 200 мг 2 раза/сут в течение 17 дней, системное распределение лапатиниба снижалось на 72 %.
Выведение
Период полувыведения лапатиниба (Т 1/2) увеличивается дозозависимо при приеме однократных доз. Равновесное состояние достигается через 6-7 суток приема лапатиниба, Т1/2 равновесного состояния составляет 24 часа.
Лапатиниб в основном выводится через кишечник: в среднем 27 % (от 3 % до 67 %) в неизмененном виде, менее 2 % принятой дозы выводится почками в неизмененном виде и в виде метаболитов.
Особые группы пациентов
Пациенты с нарушением функции почек
Фармакокинетика лапатиниба у пациентов с нарушением функции почек или пациентов, находящихся на гемодиализе, специально не изучалась. Однако маловероятно влияние нарушения функции почек на фармакокинетику лапатиниба, т.к. почками выводится менее 2 % введенной дозы (в виде лапатиниба и его метаболитов).
Пациенты с нарушением функции печени
Фармакокинетика лапатиниба изучалась при умеренных (n=8) и тяжелых (n=4) нарушениях функции печени. AUC лапатиниба после приема однократной дозы 100 мг внутрь увеличивается приблизительно на 56 % и 85 % у пациентов с умеренными и тяжелыми нарушениями функции печени, соответственно. Назначать
лапатиниб пациентам с нарушением функции печени необходимо с осторожностью. Пациентам с тяжелой печеночной недостаточностью в анамнезе рекомендуется снижение дозы лапатиниба. Необходима отмена терапии лапатинибом, без последующего возобновления его применения, пациентам с тяжелой гепатотоксичностью, развившейся на фоне его применения.
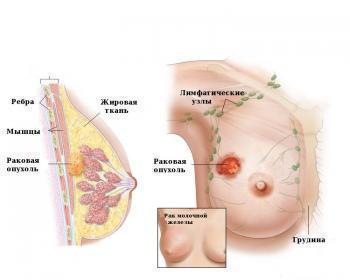
Показания к применению
Местно-распространенный или метастатический рак молочной железы с гиперэкспрессией HER2:
— в комбинации с капецитабином у пациентов, получавших ранее антрациклины и таксаны, у которых имело место прогрессирование на фоне или после терапии трастузумабом, назначавшейся по поводу метастатического рака.
Метастатический рак молочной железы с гиперэкспрессией HER2:
— в комбинации с трастузумабом у пациентов с отсутствием экспрессии гормональных рецепторов, у которых имело место прогрессирование на фоне или после терапии трастузумабом в комбинации с химиотерапией, назначавшейся по поводу метастатического рака.
Метастатический рак молочной железы с гиперэкспрессией HER2 и экспрессией гормональных рецепторов:
— в комбинации с ингибитором ароматазы у пациентов в постменопаузе.
Противопоказания
Повышенная чувствительность к лапатинибу или любому другому компоненту препарата. Беременность и период кормления грудью. Детский возраст (отсутствие опыта применения).
С осторожностью :
Состояния, которые могут приводить к левожелудочковой недостаточности.
Нарушения функции печени умеренной или тяжелой степени (7 баллов и более по шкале Чайлд-Пью).
Возраст старше 65 лет.
Тяжелая почечная недостаточность.
Следует избегать одновременного приема индукторами или мощными ингибиторами изофермента CYP3A4, грейпфрутовым соком.
Одновременный прием с умеренными ингибиторами изофермента CYP3A4. Следует избегать одновременного приема с лекарственными препаратами, являющимися субстратами изоферментов CYP3A4 и CYP2C8 с узким терапевтическим диапазоном.
Следует избегать одновременного приема с лекарственными препаратами, повышающими pH желудочного сока (снижение растворимости и абсорбции лапатиниба).
Беременность и лактация :
Фертильность
Нет данных.
Беременность
Не проводилось соответствующих и хорошо контролируемых исследований лапатиниба с участием беременных женщин. Влияние лапатиниба на плод неизвестно. Женщины репродуктивного возраста должны использовать надежные средства контрацепции, а также избегать наступления беременности в период лечения лапатинибом.
Лапатиниб не обладал тератогенными свойствами в исследованиях на беременных крысах и кроликах, но, в то же время, был причиной возникновения некоторых нарушений в развитии при применении в дозах, токсичных для матери.
Период грудного вскармливания
Неизвестно, выделяется ли
лапатиниб в грудное молоко. В связи с тем, что многие препараты поступают в грудное молоко, во время терапии лапатинибом рекомендуется прекратить грудное вскармливание из-за возможного возникновения характерных нежелательных реакций у грудного ребенка.
Способ применения и дозы
Препарат Тайверб принимают за 1 час до еды или через 1 час после — еды. Рекомендуемую суточную дозу нельзя делить на приемы.
Пропущенные дозы лапатиниба не восполняются, т.е. принимать пропущенные дозы, уменьшая интервалы между приемами, не следует.
Местно-распространенный или метастатический рак молочной железы с гиперэкспрессией HER2
В комбинации с капецитабином
Рекомендуемая доза лапатиниба составляет 1250 мг (пять таблеток) однократно в сутки, ежедневно в комбинации с капецитабином. Рекомендуемая доза капецитабина — 2000 мг/м2 сут, в 2 приема (каждые 12 часов) ежедневно с 1 по 14 день каждого 21 дневного цикла терапии. Рекомендуется принимать
капецитабин с пищей или в течение 30 мин после приема пищи.
В комбинации с трастузумабом
Рекомендуемая доза лапатиниба составляет 1000 мг (четыре таблетки) однократно в сутки, ежедневно в комбинации с трастузумабом.
Рекомендуемая доза трастузумаба — 4 мг/кг, в виде внутривенной нагрузочной дозы, затем 2 мг/кг внутривенно один раз в неделю.
Гормон-рецептор-позитивный метастатический рак молочной железы с гиперэкспрессией HER2
Рекомендуемая доза лапатиниба составляет 1500 мг (шесть таблеток) однократно в сутки, ежедневно в комбинации с ингибитором ароматазы.
Рекомендуемая доза летрозола (одного из возможных препаратов — ингибиторов ароматаз) при приеме в комбинации с лапатинибом составляет 2,5 мг однократно в сутки, ежедневно. В случае, если
лапатиниб назначен в комбинации с другим ингибитором ароматазы, необходимо изучить режим дозирования соответствующего препарата данной группы.
Приостановление приема лапатиниба или уменьшение дозы (все показания)
Нарушения со стороны сердечнососудистой системы
Лечение лапатинибом должно быть прекращено в случае появления симптомов снижения фракции выброса левого желудочка (ФВЛЖ) до 3 степени или больше (согласно общим критериям токсичности Национального онкологического института США) или в случае снижения ниже границы допустимой нормы. Лечение лапатинибом может быть возобновлено не ранее, чем через 2 недели в меньшей дозе (уменьшенной с 1000 мг/сут до 750 мг/сут при назначении комбинации с трастузумабом, с 1250 мг/сут до 1000 мг/сут при назначении комбинации с капецитабином или с 1500 мг/сут до 1250 мг/сут при назначений с ингибитором ароматазы), если ФВЛЖ находится в пределах нормы, и у пациента отсутствуют симптомы сердечной недостаточности. По имеющимся данным, большая часть случаев снижения ФВЛЖ происходит в течение первых 12 недель лечения, однако пока недостаточно данных о длительном воздействии лапатиниба.
Интерстициальная болезнь легких и /или пневмониты
Лечение лапатинибом должно быть прекращено в случае появления легочных симптомов, свидетельствующих о развитии интерстициальной болезни легких и/или пневмонита 3-й степени или выше (согласно общим критериям токсичности Национального онкологического института США).
Диарея
Лечение лапатинибом должно быть приостановлено у пациентов с диареей 3-й степени, либо 1-ой или 2-ой степени с осложненными симптомами (согласно общим критериям токсичности Национального онкологического института США) (спастические боли в животе от умеренной до тяжелой степени, тошнота или рвота 2-й степени или выше (согласно общим критериям токсичности Национального онкологического института США), снижение работоспособности, лихорадка, сепсис, нейтропения, выраженные кровотечения или обезвоживание). Лечение лапатинибом может быть возобновлено в более низкой дозе (снижение с 1000 мг/сут до 750 мг/сут, с 1250 мг/сут до 1000 мг/сут или с 1500 мг/сут до 1250 мг/сут) если выраженность диареи уменьшилась до 1-й степени и ниже. Лечение лапатинибом должно быть полностью прекращено у пациентов с диареей 4-й степени (согласно общим критериям токсичности Национального онкологического института США).
Прочие проявления токсичности препарата
Решение о прекращении лечения или перерыве в лечении препаратом может быть принято, когда выраженность развивающихся токсических эффектов выше или равна 2-й степени (согласно общим критериям токсичности Национального онкологического института США). Лечение может быть возобновлено с дозы 1000мг/сут при назначении в комбинации с трастузумабом, 1250мг/сут при назначении в комбинации с капецитабином или 1500 мг/сут при назначении в комбинации с ингибитором ароматазы, если выраженность токсических эффектов уменьшилась до 1-й степени и ниже. В случае повторного возникновения токсических эффектов доза лапатиниба должна быть снижена с 1 ООО мг/сут до 750 мг/сут при назначении в комбинации с трастузумабом, с 1250 мг/сут до 1000 мг/сут при назначении в комбинации с капецитабином или с 1500 мг/сут до 1250 мг/сут при назначении в комбинации с ингибитором ароматазы.
Особые группы пациентов
Дети
Нет опыта применения.
Пациенты пожилого возраста
Недостаточно данных о применении лапатиниба у пациентов старше 65 лег.
Пациенты с нарушением функции почек
Нет опыта применения лапатиниба у пациентов с тяжелыми нарушениями функции почек, однако маловероятно, что будет требоваться коррекция режима дозирования в связи с тем, что менее 2 % введенной дозы выводится почками.
Пациенты с нарушением функции печени
Лапатиниб метаболизируется в печени. Умеренные и тяжелые нарушения функции печени ассоциированы с повышением системной экспозиции на 56 % и 85 %, соответственно. Следует с осторожностью назначать
лапатиниб пациентам с нарушением функции печени. У пациентов с тяжелыми нарушениями функции печени (класс С по шкале Чайлд-Пью) необходимо снижать дозу лапатиниба. Уменьшение дозы с 1250мг/сут до 750мг/сут (при назначении в комбинации с капецитабином ) или с 1500 мг/сут до 1 ООО мг/сут (при применении в комбинации с ингибитором ароматазы) у таких пациентов приводит к нормализации AUC. При развитии тяжелых проявлений гепатотоксичности во время применения лапатиниба необходима отмена препарата, повторное назначение недопустимо.
Побочное действие
Безопасность лапатиниба оценивалась в ходе клинических исследований как при монотерапии, так и при применении в комбинации с трастузумабом, капецитабином и летрозолом. Пострегистрационные данные соответствуют данным, полученным в ходе клинических исследований.
Нежелательные явления, представленные ниже, перечислены в соответствии с поражением органов, систем органов и частотой встречаемости. Частота встречаемости определяется следующим образом: очень часто (? 1/10), часто (? 1/100 и < 1/10), нечасто (? 1/1 000 и < 1/100), редко (? 1/10 000 и < 1/1 000), очень редко (< 1/10 000, включая отдельные случаи).
Монотерапия лапатинибом
Нарушения со стороны обмена веществ и питания
Очень часто: анорексия,
Нарушения со стороны сердца
Часто: снижение ФВЛЖ отмечалось приблизительно у 1 % пациентов, получавших
лапатиниб, и протекало бессимптомно более чем в 70 % случаев. После отмены лапатиниба, более чем в 70 % случаев наблюдались нормализация или улучшение со стороны ФВЛЖ. Симптомное снижение ФВЛЖ наблюдалось приблизительно у 0,3 % пациентов, получавших
лапатиниб. Нежелательные явления, наблюдавшиеся при этом, включали одышку, сердечную недостаточность, сердцебиение.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Нечасто: интерстициальная болезнь легких / пневмонит.
Нарушения со стороны желудочно-кишечного тракта
Очень часто: диарея (которая может приводить к дегидратации, однако, в большинстве случаев диарея 1-й или 2-й степени не приводила к отмене препарата), тошнота, рвота.
Нарушения со стороны печени и желчевыводящих путей
Нечасто: гипербилирубинемия, гепатотоксичность. Повышение концентрации билирубина возможно вследствие угнетения лапатинибом конъюгации в печени ОАТР1В1 (полипептид, переносящий органические анионы1В1) или угнетения выделения билирубина с желчью посредством Р-гликопротеина или BCRP.
Нарушения со стороны кожи и подкожных тканей
Очень часто: сыпь (включая акнеформный дерматит, в большинстве случаев проходящий, не требующий отмены препарата).
Часто: поражение ногтей, включая паронихию.
Нарушения со стороны иммунной системы
Редко: реакции гиперчувствительности, включая анафилаксию.
Общие расстройства и нарушения в месте введения
Очень часто: слабость,
Назначение лапатиниба в комбинации с капецитабином
Дополнительно к нежелательным явлениям, наблюдавшимся на фоне монотерапии лапатинибом, следующие нежелательные явления наблюдались на фоне применения лапатиниба в комбинации с капецитабином с частотой выше 5 % по сравнению с монотерапией капецитабином.
Нарушения со стороны желудочно-кишечного тракта
Очень часто: диспепсия.
Нарушения со стороны кожи и подкожных тканей
Очень часто: сухость кожи.
Нежелательные явления, наблюдавшиеся при применении лапатиниба в комбинации с капецитабином с той же частотой встречаемости, что и при монотерапии капецитабином.
Нарушения со стороны желудочно-кишечного тракта
Очень часто: стоматит, запор, боль в животе.
Нарушения со стороны кожи и подкожных тканей
Очень часто: ладонно-подошвенный синдром.
Нарушения со стороны скелетно-мышечной и соединительной ткани
Очень часто: боль в конечностях, боль в спине.
Нарушения со стороны нервной системы
Часто: головная боль.
Нарушения со стороны психики
Очень часто: бессонница.
Общие расстройства и нарушения в месте введения
Очень часто: воспаление слизистой оболочки рта.
Назначение лапатиниба в комбинации с трастузумабом
При применении лапатиниба в комбинации с трастузумабом дополнительных нежелательных явлений, связанных с лапатинибом, отмечено не было. Наблюдалась повышенная частота возникновения кардиотоксичности. но данные явления по характеру и тяжести были аналогичны ранее наблюдаемым явлениям в программе клинических исследований лапатиниба.
Назначение лапатиниба в комбинации с летрозолом
Дополнительно к нежелательным явлениям, наблюдающимся на фоне монотерапии лапатинибом, следующие нежелательные явления наблюдались при применении лапатиниба в комбинации с летрозолом с частотой выше 5 % по сравнению с монотерапией летрозолом.
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Очень часто: носовое кровотечение.
Нарушения со стороны кожи и подкожных тканей
Очень часто: алопеция, сухость кожи.
Передозировка :
Не существует специфического антидота для ингибирования EGFR (ERBB1) и/или HER2/neu (ERBB2) фосфорилирования тирозина.
Максимальная суточная доза в клинических исследованиях составляла 1800 мг.
В клинических исследованиях было показано, что более частый прием препарата может приводить к повышению концентраций лапатиниба в сыворотке крови, поэтому не следует принимать пропущенные дозы, уменьшая интервалы между приемами. Прием препарата необходимо возобновлять, начиная со следующей запланированной суточной дозы.
Симптомы
Бессимптомные и симптоматические признаки передозировки отмечались у пациентов, принимавших
лапатиниб. Наблюдавшиеся симптомы включали последствия, связанные с побочными действиями лапатиниба, и в некоторых случаях изъязвление кожи, синусовую тахикардию (тем не менее, с нормальной ЭКГ) и/или поражение слизистой оболочки.
Лечение
Симптоматическая терапия. Выведение лапатиниба почками незначительно в связи с высокой связью с белками плазмы крови. Поэтому ожидается, что гемодиализ будет не эффективен для усиления выведения лапатиниба.
Дальнейшее лечение следует проводить по клиническим показаниям или по рекомендациям национального токсикологического центра, если имеется.
Взаимодействие
Ингибиторы или индукторы изофермента CYP3A могут влиять на фармакокинетику лапатиниба. При одновременном применении лапатиниба и некоторых ингибиторов изофермента CYP3A4 (например, кетоконазола, итраконазола, грейпфрутового сока) необходимо соблюдать осторожность и тщательно наблюдать за клиническим состоянием пациента и возможными нежелательными явлениями. При необходимости одновременного применения пациентом мощного ингибитора изофермента CYP3A4 необходимо уменьшить дозу лапатиниба до 500 мг/сут, рассчитанную таким образом, чтобы скорректировать AUC лапатиниба до величины, соответствующей применению лапатиниба без ингибиторов. Однако в настоящее время нет клинических данных о применении лапатиниба при такой коррекции дозы у пациентов, получающих мощный ингибитор изофермента CYP3A4. После отмены мощного ингибитора, только после выведения его из организма, спустя приблизительно 1 неделю следует вновь увеличивать дозу лапатиниба до рекомендованной.
При одновременном применении лапатиниба и известных индукторов изофермента CYP3A4 (например, рифампицина, карбамазепина, фенитоина, зверобоя продырявленного) необходимо соблюдать осторожность и тщательно наблюдать за клиническим состоянием пациента и возможными нежелательными явлениями. При необходимости одновременного применения пациентом мощного индуктора изофермента CYP3A4 дозу лапатиниба необходимо подбирать, основываясь на переносимости, постепенно повышая ее с 1250 мг/сут до 4500 мг/сут или с 1500 мг/сут до 5500 мг/сут. Эта доза рассчитывается так, чтобы скорректировать AUC лапатиниба до величины, соответствующей применению лапатиниба без индукторов изофермента CYP3A4. Однако в настоящее время нет клинических данных о применении лапатиниба у пациентов, получающих сильный индуктор изофермента CYP3A4. После отмены мощного индуктора изофермента, только спустя приблизительно 2 недели следует вновь уменьшить дозу лапатиниба до рекомендованной. Растворимость лапатиниба зависит от pH. Следует избегать сопутствующего применения веществ, увеличивающих pH желудочного сока, так как растворимость и абсорбция лапатиниба может уменьшаться. Ранее проводимое лечение ингибитором протонной помпы (например, эзомепразолом) снижало активность лапатиниба в среднем на 27 % (в пределах от 6 % до 49 %). Этот эффект уменьшается с увеличением возраста примерно от 40 лет до 60 лет. Поэтому следует с осторожностью назначать
лапатиниб пациентам, принимавшим ингибиторы протонной помпы.
Лапатиниб ингибирует in vitro изофермент CYP3A4 в клинически значимых концентрациях. Одновременное применение лапатиниба с перорально назначаемым мидазоламом приводит к повышению AUC мидазолама примерно на 45 %. При внутривенном введении мидазолама не обнаруживалось клинически значимого повышения AUC. Необходима осторожность при одновременном применении лапатиниба с перорально назначаемыми препаратами с узким терапевтическим диапазоном, являющимися субстратами изофермента CYP3A4.
Лапатиниб ингибирует CYP2C8 in vitro в клинически значимых концентрациях. Следует с осторожностью применять лапатиниб при одновременном применении с препаратами с узким терапевтическим диапазоном, которые являются субстратами CYP2C8.
Одновременное применение лапатиниба с паклитакселом повышает воздействие паклитаксела на 23 % в связи с ингибированием лапатинибом CYP2C8 и/или Р-гликопротеина (Pgp). Повышение частоты встречаемости и выраженности диареи и нейтропении наблюдалось при использовании комбинации лапатиниба и паклитаксела в клинических исследованиях. Рекомендуется с осторожностью применять лапатиниб одновременно с паклитакселом.
Одновременное применение лапатиниба с доцетакселом не оказывало значительного влияния на AUC или Сmах каких-либо активных веществ. Однако отмечалось повышение частоты возникновения вызванной доцетакселом нейтропении. Одновременное применение лапатиниба с иринотеканом (при введении в рамках схемы лечения FOLFIRI) приводило к повышению AUC активного метаболита иринотекана, SN-38, примерно на 40 %. Точный механизм данного взаимодействия неизвестен. Рекомендуется с осторожностью применять лапатиниб одновременно с иринотеканом.
Лапатиниб является субстратом для транспортных белков Pgp и BCRP. Ингибиторы и индукторы данных белков могут изменять активность и/или распределение лапатиниба.
Лапатиниб ингибирует транспортный белок Pgp in vitro в клинически значимых концентрациях. Одновременное применение лапатиниба с дигоксином приводит к повышению AUC дигоксина примерно на 98 %. Следует с осторожностью применять лапатиниб при одновременном применении с препаратами с узким терапевтическим диапазоном, которые являются субстратами PgP.
Лапатиниб ингибирует транспортные белки BCRP и ОАТР1В1 in vitro. Клиническое значение данных эффектов не изучалось, но не исключено, что
лапатиниб может влиять на фармакокинетику субстратов BCRP (например, топотекана) и ОАТР1В1 (например, розувастатина).
Применение лапатиниба в комбинации с капецитабином, летрозолом или трастузумабом не влияет на фармакокинетические параметры указанных препаратов. Биодоступность лапатиниба зависит от приема пищи.
Особые указания :
Лечение лапатинибом следует проводить только под контролем специалиста, имеющего опыт применения противоопухолевых препаратов.
Кардиотоксичность
Применение лапатиниба сопровождалось снижением ФВЛЖ. Перед началом лечения необходимо обязательно определять ФВЛЖ, чтобы убедиться, что ФВЛЖ находится в допустимых пределах. Во время лечения лапатинибом контроль ФВЛЖ должен быть продолжен, чтобы не пропустить ее снижение за пределы допустимых значений. Небольшое, зависимое от концентрации увеличение интервала QTc наблюдали в неконтролируемом открытом исследовании с повышением дозы лапатиниба у пациентов с распространенным опухолевым процессом. Следует соблюдать осторожность при назначении лапатиниба пациентам, у которых уже имеется или может возникнуть удлинение интервала QTc, включая пациентов с гипокалиемией или гипомагниемией, врожденным синдромом удлиненного интервала QT; пациентов, принимающих антиаритмические препараты или другие лекарственные средства, которые приводят к удлинению интервала QT. Гипокалиемию, гипокальциемию или гипомагниемию следует устранить перед началом применения лапатиниба.
Интерстициальная болезнь легких и пневмонит
Имеются сообщения о случаях развития интерстициальной болезни легких и пневмонита в связи с приемом лапатиниба. Пациенты должны находиться под наблюдением специалиста для исключения возникновения легочных симптомов, свидетельствующих о развитии интерстициальной болезни легких и/или пневмонита.
Диарея
Имеются сообщения о случаях диареи, в том числе диареи тяжелой степени, при лечении лапатинибом. Диарея может носить тяжелый характер, были описаны случаи со смертельным исходом. Как правило, диарея возникала на ранних этапах лечения лапатинибом, при этом почти у половины таких пациентов диарея возникала в течение первых 6 дней. Диарея обычно длится 4- 5 дней. Лапатиниб-индуцированная диарея проявляется, как правило, в легкой степени; диарея 3-ей и 4-ой степени (согласно общим критериям токсичности Национального онкологического института США) наблюдается менее чем у 10 % и менее чем у 1 % пациентов, соответственно. Раннее выявление и своевременное лечение имеют большое значение для оптимального контроля диареи. Пациентов необходимо проинструктировать о том, что они немедленно должны сообщать о любых симптомах нарушения со стороны кишечника. Рекомендуется своевременное лечение диареи противодиарейными средствами (например, лоперамидом) после первого случая неоформленного стула. При диарее тяжелой степени может потребоваться назначение электролитов и жидкости для поддержания адекватного водно-солевого обмена (перорально или внутривенно), использование антибиотиков, таких как фторхинолоны (особенно, если диарея длится более 24 часов; если наблюдается лихорадка или нейтропения 3-й или 4-й степени), приостановление приема или отмена препарата.
Контрацепция
Во время терапии лапатинибом и как минимум в течение 3-х месяцев после ее окончания необходимо использовать надежные методы контрацепции.
Гепатотоксичность
Проявления гепатотоксичности (активность аланинаминотрансферазы (АЛТ) или аспартатаминотрансферазы (ACT), превышающие верхнюю границу нормы в 3 раза; содержание общего билирубина, превышающее верхнюю границу нормы в 1,5 раза) наблюдались в клинических исследованиях (менее 1 % пациентов) и в пострегистрационном периоде. Гепатотоксичность может быть тяжелой. Случаи с летальным исходом были зарегистрированы, хотя причинно- следственная связь с приемом лапатиниба не была установлена. Гепатотоксичность может возникать в период от нескольких дней до нескольких месяцев после начала терапии. Необходимо проводить контроль лабораторных показателей функции печени (трансаминазы, билирубина и щелочной фосфатазы) до начала терапии, далее каждые 4-6 недель в течение курса лечения и по клиническим показаниям. При возникновении тяжелой степени нарушения функции печени необходима отмена лапатиниба, повторное назначение препарата недопустимо.
Пациенты, носители аллелей HLA DQA1 * 02:01 и DRB1 * 07:01, имеют повышенный риск возникновения гепатотоксичности, связанный с применением лапатиниба. У пациентов, применявших
лапатиниб в качестве монотерапии, общий риск развития тяжелой степени нарушения функции печени (АЛТ более чем в 5 раз выше границы нормы, 3-я степень (согласно общим критериям токсичности Национального онкологического института США)) был выше (около 8 %) у носителей DQA1 *02:01 и DRB1*07:01, чем у не носителей (0,5%).
Носительство аллели HLA свойственно (от 15 % до 25 %) европеоидной, азиатской, африканской и латиноамериканской популяциям, но ниже (1 %) в японской популяции.
При назначении лапатиниба пациентам с имеющимися нарушениями функции печени тяжелой степени в анамнезе рекомендовано применение лапатиниба в снижененной дозе. У пациентов с выраженной гепатоксичностью, возникшей в ходе терапии, необходимо отменить
лапатиниб и не возобновлять его применение.
Одновременное применение ингибиторов или индукторов CYP3A4
Необходимо с осторожностью назначать
лапатиниб совместно с ингибиторами или индукторами изофермента CYP3A4 из-за риска повышения или понижения (соответственно) системного воздействия лапатиниба.
Влияние на способность управлять транспортным средством :
Влияние на способность управлять транспортными средствами и заниматься другими видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, не изучалось. Исходя из механизма действия лапатиниба, нельзя предположить неблагоприятное влияние препарата на такие виды деятельности. Однако следует принимать во внимание общее состояние пациента и профиль побочных действий лапатиниба, необходимо соблюдать осторожность при управлении транспортными средствами и занятиях другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций.
Форма выпуска :
Таблетки, покрытые пленочной оболочкой по 250 мг.
Упаковка :
По 10 таблеток в блистере из двойной алюминиевой фольги. Каждый блистер перфорирован разделительной линией на 2 части. В каждой из частей находится по 5 таблеток.
По 7 блистеров вместе с инструкцией по применению в картонной пачке.
По 2 картонные пачки в групповой упаковке.
В случае первичной, вторичной упаковки и осуществления выпускающего контроля качества на производственной прощадке «Глаксо Вэллком С.А.»: по 140 таблеток во флаконе из полиэтилена высокой плотности с устройством против вскрытия детьми. Флакон укупорен завинчивающейся крышкой и снабжен мембраной из бумаги и алюминиевой фольги, полиэстера и полиэтилена. По 1 флакону вместе с инструкцией по применению в картонной пачке.
Условия хранения :
Хранить при температуре ниже 30° С.
Хранить в недоступном для детей месте!
Срок годности :
2 года.
Не использовать после истечения срока годности, указанного на упаковке.
Условия отпуска из аптек :
По рецепту
Владелец регистрационного удостоверения :
Владелец Регистрационного удостоверения:ГлаксоСмитКляйн Хелскер, ЗАО
Производитель
GLAXO WELLCOME OPERATIONS Великобритания
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Rec.INN
зарегистрированное ВОЗ
Лекарственное взаимодействие
Входит в состав препаратов:
список
Фармакологическое действие
Противоопухолевое средство, обратимый, селективный ингибитор внутриклеточной тирозинкиназы. Связывается с рецепторами эпидермального фактора роста (epidermal growth factor receptor — EGFR/ErbB1 и human epidermal growth factor receptor — HER2+/neu/ЕrbВ2+). Отличается от других быстрообратимых ингибиторов тирозинкиназы более медленной диссоциацией с ErbB1- и ЕrbВ2-рецепторами (период диссоциации 50% лиганда из лиганд-рецепторного комплекса составляет приблизительно 300 мин).
Помимо собственной активности in vitro была показана аддитивная активность лапатиниба и 5-фторурацила (активный метаболит капецитабина) при использовании в комбинации на четырех линиях опухолевых клеток. Ингибирующий эффект оценивался на обработанных трастузумабом клетках. Лапатиниб продемонстрировал значительную активность на линиях иммортализованных опухолевых клеток в средах, содержащих трастузумаб, что показывает отсутствие перекрестной резистентности между двумя лигандами HER2+/neu/ErbB2+.
Согласно результатам исследований лапатиниб является активным лекарственным препаратом, при его назначении в качестве монотерапии пациенткам с метастатическим раком молочной железы. Результаты исследования показали, что сочетанное применение лапатиниба с капецитабином при лечении пациенток с ЕrbВ2-позитивным распространенным раком молочной железы увеличивает время до прогрессирования и достоверно и значимо снижает риск прогрессирования заболевания.
Были выявлены тенденция к улучшению показателя выживаемости, и снижение риска летального исхода.
Фармакокинетика
Абсорбция после приема внутрь неполная и вариабельная. Коэффициент вариабельности AUC составляет примерно от 50 до 100%. Определяется в системном кровотоке в среднем через 0.25 ч (диапазон 0-1.5 ч). Сmax достигается примерно через 4 ч после приема лапатиниба.
Cssmax при ежедневном приеме в дозе 1250 мг составляет в среднем 2.43 (1.57-3.77) мкг/мл, AUC — 36.2 (23.4-56) мкг × ч/мл.
Биодоступность лапатиниба зависит от приема пищи. Системная экспозиция лапатиниба увеличивается при приеме препарата одновременно с пищей. AUC возрастает в 3 и 4 раза, Cmax приблизительно в 2.5 и 3 раза выше при приеме с пищей с низким или высоким содержанием жиров, соответственно.
Лапатиниб обладает высокой степенью связывания (более чем 99%) с альбумином и кислым альфа1-гликопротеином плазмы крови.
Лапатиниб подвергается интенсивному метаболизму, главным образом с помощью CYP3A4 и CYP3A5, в меньшей степени с CYP2C19 и CYP2C8 с образованием различных окисленных метаболитов.
In vitro лапатиниб в клинически значимых концентрациях ингибирует CYP3Aи CYP2C8. Лапатиниб незначительно ингибирует следующие микросомальные ферменты печени: CYP1A2, CYP2C9, CYP2C19 и CYP2D6.
T1/2 увеличивается дозозависимо при приеме однократных доз. Равновесное состояние достигается через 6-7 суток приема, T1/2 в равновесном состоянии составляет 24 ч.
В основном выводится кишечником — в среднем 27% в неизмененном виде, менее 2% принятой дозы выводится почками в неизмененном виде и в виде метаболитов.
Маловероятно влияние нарушения функции почек на фармакокинетику лапатиниба.
Фармакокинетика лапатиниба изучалась при умеренных (7-9 баллов по классификации Чайлд-Пью, n=8) и тяжелых (>9 баллов по классификации Чайлд-Пью, n=4) нарушениях функции печени. AUC лапатиниба после приема однократной дозы 100 мг увеличивается на 56% и 85% соответственно.
Показания активного вещества
ЛАПАТИНИБ
Распространенная и/или метастазирующая злокачественная опухоль молочной железы с гиперэкспрессией ErbB2+(HER2+)-рецепторов, в составе сочетанной терапии с капецитабином, у больных, ранее получавших терапию, включавшую трастузумаб.
Режим дозирования
Лапатиниб применяют в комбинации с капецитабином.
Рекомендуемая доза лапатиниба составляет 1250 мг 1 раз/сут, ежедневно. Лапатиниб принимают за 1 ч до или через 1 ч после приема пищи.
Пропущенные дозы лапатиниба не восполняются, т.е. принимать пропущенные дозы, уменьшая интервалы между приемами, не следует.
Одновременно применяют капецитабин по специальной схеме.
Лечение лапатинибом должно быть прекращено в случае появления симптомов снижения фракции выброса левого желудочка до 3 степени или больше (по классификации нежелательных явлений Национального Онкологического Института), или в случае снижения ниже границы допустимой нормы. Лечение лапатинибом может быть возобновлено не ранее чем через 2 недели в меньшей дозе (1000 мг/сут) и только если уровень фракции выброса левого желудочка находится в допустимых границах нормы.
Лечение лапатинибом должно быть прекращено в случае появления легочных симптомов свидетельствующих о развитии интерстициального легочного процесса/пневмонита 3 степени или больше (по классификации нежелательных явлений Национального Онкологического Института).
Решение о прекращении применения или изменении дозы лапатиниба может быть принято, когда уровень развивающихся токсических эффектов соответствует 2 степени и более по классификации нежелательных явлений Национального Онкологического Института. При снижении уровня токсических эффектов снизился до 1 степени и менее лечение может быть возобновлено в дозе 1250 мг/сут. В случае повторного возникновения токсических эффектов дозу лапатиниба следует уменьшить до 1000 мг/сут.
Побочное действие
Монотерапия лапатинибом
Со стороны пищеварительной системы: очень часто — анорексия, диарея (которая может приводить к дегидратации), тошнота, рвота; иногда — гипербилирубинемия, повышение уровня АЛТ, АСТ, ЩФ.
Со стороны сердечно-сосудистой системы: часто — снижение фракции выброса левого желудочка (90% — симптоматическое). Разрешалось спонтанно у 60% пациентов после отмены препарата. Симптоматическое снижение фракции выброса левого желудочка наблюдалось у 0.1% пациентов (диспноэ, сердечную недостаточность, ощущение сердцебиения).
Со стороны дыхательной системы: иногда — интерстициальный легочный процесс/пневмонит.
Дерматологические реакции: очень часто — сыпь (включая акне).
Со стороны организма в целом: очень часто — слабость.
Лапатиниб в комбинации с капецитабином
Со стороны пищеварительной системы: очень часто — диспепсия.
Дерматологические реакции: очень часто — сухость кожи.
Наблюдавшиеся с одинаковой частотой в группе лапатиниб + капецитабин и в группе капецитабина
Со стороны пищеварительной системы: очень часто — стоматит, запор, боли в абдоминальной области, гипербилирубинемия.
Дерматологические реакции: очень часто — ладонно-подошвенная эритродизестезия.
Со стороны организма в целом: очень часто — мукозит.
Со стороны костно-мышечной системы: очень часто — боли в спине и конечностях.
Со стороны ЦНС: очень часто — бессонница; часто — головная боль.
Противопоказания к применению
Беременность, период лактации (грудного вскармливания), повышенная чувствительность к лапатинибу.
Применение при беременности и кормлении грудью
Противопоказан при беременности и в период лактации (грудного вскармливания).
Применение при нарушениях функции печени
С осторожностью следует применять при нарушениях функции печени умеренной или тяжелой степени (7 и более баллов по шкале Чайлд-Пью).
У пациентов с нарушениями функции печени недостаточно данных для формирования конкретных рекомендаций по коррекции режима дозирования.
Применение при нарушениях функции почек
Пациентам с нарушениями функции почек не требуется коррекции режима дозирования.
Применение у детей
Опыта применения препарата у детей нет
Применение у пожилых пациентов
Не отмечено различий в эффективности, переносимости и безопасности лапатиниба в зависимости от возраста (пожилые пациенты).
Особые указания
Лечение лапатинибом следует проводить только под контролем специалиста, имеющего опыт проведения химиотерапии.
С осторожностью следует применять при состояниях, которые могут приводить к левожелудочковой недостаточности, нарушениях функции печени умеренной или тяжелой степени (7 и более баллов по шкале Чайлд-Пью).
Следует учитывать информацию о имеющихся противопоказаниях и безопасности применения капецитабина при сочетанном применении с лапатинибом.
Перед началом лечения необходимо оценить уровень фракции выброса левого желудочка. Во время лечения следует контролировать уровень фракции выброса левого желудочка, чтобы не допустить снижения данного показателя ниже допустимых значений. Лечение лапатинибом следует прекратить в случае снижения фракции выброса до 3 степени или более, или в случае снижения ниже границы допустимой нормы. Лечение лапатинибом может быть возобновлено не ранее чем через 2 недели в меньшей дозе (1000 мг/сут и только если уровень фракции выброса левого желудочка находится в допустимых границах нормы). Постоянное снижение фракции выброса левого желудочка в течение 9 недель лечения, как правило, ограничивает длительность проводимой терапии.
В период лечения пациенты должны находиться под наблюдением для выявления легочных симптомов, свидетельствующих о развитии интерстициального легочного процесса/пневмонита.
При первых симптомах диареи рекомендуется назначение противодиарейных препаратов. При диарее тяжелой степени может потребоваться назначение электролитов и жидкости для предупреждения дегидратации (внутрь или в/в), приостановление приема лапатиниба или его отмена.
До начала лечения, затем ежемесячно, либо по клиническим показаниям следует контролировать показатели функции печени (активность трансаминаз, ЩФ, содержание билирубина). При тяжелом нарушении функции печени лечение лапатинибом следует прекратить, повторное лечение не проводят. Известны случаи гепатотоксичности при назначении ингибиторов тирозинкиназы. У пациентов с нарушениями функции печени недостаточно данных для формирования конкретных рекомендаций по коррекции режима дозирования.
Использование в педиатрии
Опыта применения препарата у детей нет.
Влияние на способность к управлению транспортными средствами и механизмами
Механизм действия лапатиниба позволяет предположить отсутствие влияния на способности к концентрации внимания. Тем не менее, следует учитывать общее клиническое состояние пациента и возможное развитие нежелательных явлений при оценке способностей к управлению автомобилем и работе с механизмами, требующих быстроты реакции.
Лекарственное взаимодействие
Ингибиторы или индукторы CYP3A могут влиять на фармакокинетику лапатиниба. При одновременном применении лапатиниба и известных ингибиторов CYP3A (например, кетоконазол, итраконазол, грейпфрутовый сок) необходимо соблюдать осторожность и тщательно наблюдать за клиническим состоянием пациента и возможными нежелательными реакциями. При необходимости одновременного назначения пациенту сильного ингибитора CYP3A4 необходимо уменьшить дозу лапатиниба до 500 мг/сут, рассчитанной так, чтобы скорректировать AUC лапатиниба до величины, соответствующей применению лапатиниба без ингибиторов. Однако, в настоящее время нет клинических данных о применении лапатиниба при такой коррекции дозы у пациентов, получающих мощный ингибитор CYP3A4. После отмены сильного ингибитора, только после выведения его из организма, спустя приблизительно 1 неделю следует вновь увеличивать дозу лапатиниба до рекомендованной.
При одновременном применении лапатиниба и известных индукторов CYP3A4 (например, рифампицин, карбамазепин, фенитоин) и необходимо соблюдать осторожность и тщательно наблюдать за клиническим состоянием пациента и возможными нежелательными реакциями.
При необходимости одновременного назначения пациенту сильного индуктора CYP3A4 дозу лапатиниба следует подбирать основываясь на переносимости, постепенно повышая ее с 1250 мг/сут до 4500 мг/сут. Эта доза рассчитывается так, чтобы скорректировать AUC лапатиниба до величины, соответствующей применению лапатиниба без индукторов. Однако в настоящее время нет клинических данных о применении лапатиниба у пациентов, получающих сильный индуктор CYP3A4. После отмены сильного индуктора, только спустя приблизительно 2 недели следует вновь уменьшить дозу лапатиниба до рекомендованной.
Лапатиниб ингибирует in vitro CYP3A4 и CYP2C8 в клинически значимых концентрациях. Необходима осторожность при одновременном назначении лапатиниба и препаратов с узким терапевтическим диапазоном, являющихся субстратами этих ферментов. Лапатиниб является субстратом для транспортных белков гликопротеин P и BCRP. Ингибиторы и индукторы данных белков могут изменять действие и/или распределение лапатиниба.
Не исключено, что лапатиниб может влиять на фармакокинетику субстратов гликопротеина P (например, дигоксина), BCRP (например, топотекана) и ОАТР1В1 (например, розувастатина).
Тайверб
МНН: Лапатиниб
Производитель: Глаксо Оперэйшенс Великобритания Лтд. Глаксо Веллком Оперэйшенс
Анатомо-терапевтическо-химическая классификация: Lapatinib
Номер регистрации в РК:
№ РК-ЛС-5№013294
Информация о регистрации в РК:
28.06.2018 — 28.06.2023
Информация о реестрах и регистрах
Информация по ценам и ограничения
Предельная цена закупа в РК:
4 726.95 KZT
- Скачать инструкцию медикамента
Торговое название
Тайверб
Международное непатентованное название
Лапатиниб
Лекарственная форма
Таблетки, покрытые пленочной оболочкой, 250 мг
Состав
Одна таблетка содержит
активное вещество — лапатиниба дитозилата моногидрат 405 мг (эквивалентно 250 мг лапатиниба),
вспомогательные вещества: целлюлоза микрокристаллическая, повидон К30, натрия крахмала гликолят (тип А), магния стеарат,
состав оболочки: краситель Oпадрай® желтый YS-1-12524-A (гипромеллоза (E464), титана диоксид (Е171), железа оксид красный (Е172), железа оксид желтый (Е172), макрогол 400, полисорбат 80).
Описание
Таблетки, покрытые пленочной оболочкой от кремового до желтого цвета, овальной формы, двояковыпуклые, гладкие с одной стороны и с гравировкой GS XJG на другой стороне.
Фармакотерапевтическая группа
Противоопухолевые препараты другие. Ингибиторы протеинкиназы.
Лапатиниб.
Код АТХ L01XE07
Фармакологические свойства
Фармакокинетика
Всасывание
Абсолютная биодоступность лапатиниба после приема внутрь является неполной, коэффициент вариабельности площади пика под кривой «концентрация – время» (АUC) составляет от 50 % до 100 %. Определяется в системном кровотоке в среднем через 0.25 часа (диапазон 0 – 1.5 часов), максимальная концентрация лапатиниба в плазме крови (Сmах) достигается примерно через 4 часа после приема суточной дозы 1250 мг и составляет в среднем 2.43 (1.57 — 3.77) мкг/мл; AUC – 36.2 (23.4 — 56) мкг.ч/мл.
При приеме препарата одновременно с пищей увеличивается системная экспозиция лапатиниба, AUC возрастает в 3 или 4 раза, а его Cmax увеличивается в 2.5 или 3 раза, в зависимости от насыщения пищи жирами.
Распределение
Лапатиниб обладает высокой степенью связывания с белками плазмы крови альбуминами и альфа-1 гликопротеинами (более чем 99%).
Результаты in vitro показали, что лапатиниб является субстратом для транспортных белков ВСRP (белок резистентности рака молочной железы), ABCGI (АТФ-связывающий кассетный транспортер G1), Pgp (гликопротеин П) и ABCB1 (АТФ-связывающий кассетный транспортер B1). Лапатиниб также показал тенденцию к ингибированию Pgp (IC50 2.3 мкг/мл), BCRP (IC50 0.014 мкг/мл) и печеночного транспортера ОАТР1В1 (IC50 2.3 мкг/мл). Клиническое значение данных эффектов на фармакокинетику других лекарственных средств или фармакологическую активность онкологических препаратов неизвестно. Лапатиниб не оказывает значительного влияния на снижение показателей почечных транспортеров ОАТ и ОСТ (in vitro IC50 ≥ 6.9 мкг/мл).
Метаболизм
Лапатиниб подвергается интенсивному метаболизму, главным образом, с помощью CYP3A4 и CYP3A5, в меньшей степени — с CYP2C19 и CYP2C8 с образованием различных окисленных метаболитов, количество которых не превышает 14% от дозы, выделенной с фекалиями, или 10% от концентрации лапатиниба в плазме крови.
Лапатиниб in vitro подавляет CYP3A (Ki 0.6 – 2.3 мкг/мл) и CYP2C8 (0.3 мкг/мл) в клинически значимых концентрациях. Лапатиниб не оказывает значительного влияния на следующие энзимы: CYP1A2, CYP2С9, CYP2С19, CYP2D6 или UGT энзимы (in vitro IC50 ≥ 6.9 мкг/мл).
У здоровых волонтеров, принимавших кетоконазол (CYP3A4 ингибитор) в дозе 200 мг два раза в день в течение 7 дней, системная экспозиция лапатиниба увеличивалась примерно в 3.6 раза, а период полувыведения – в 1.7 раз.
У здоровых волонтеров, принимавших карбамазепин (CYP3A4 индуктор) в дозе 100 мг два раза в день на протяжении трех дней и 200 мг дважды в сутки в течение 17 дней, системная экспозиция лапатиниба снижалась примерно на 72%.
Выведение
Период полувыведения (T½) увеличивается дозозависимо при повышении однократных доз. Равновесное состояние достигается через 6 – 7 суток приема, T½ составляет 24 часа.
Лапатиниб преимущественно выводится посредством метаболизма CYP3A4/5, в основном — через желудочно-кишечный тракт, в среднем 27% (от 3 до 67%) препарата выводится в неизмененном виде. Менее 2% от принятой дозы выводится почками в неизмененном виде и в виде метаболитов.
Нарушение функции почек
Фармакокинетика лапатиниба у пациентов с почечной недостаточностью или у пациентов на гемодиализе не изучалась, но, учитывая механизм выведения препарата (почками выводится менее 2% от принятой дозы), влияние нарушения функции почек на фармакокинетику лапатиниба маловероятно.
Нарушение функции печени
У пациентов с нарушением функции печени лапатиниб должен назначаться с осторожностью в связи с увеличением системной экспозиции препарата (от 56% до 85% у пациентов со средней и тяжелой степенью печеночной недостаточностью, соответственно, после приема 100 мг препарата). Рекомендуется снижение стандартной дозы у пациентов с существующими тяжелыми формами печеночной недостаточности и, в случае развития печеночной интоксикации, лапатиниб должен быть отменен и пациенты не должны повторно принимать данный препарат.
Фармакодинамика
Тайверб – это ингибитор 4-анилиноквиназолинкиназы, обратимый, селективный ингибитор внутриклеточной тирозинкиназы, связывающийся с ErbB1(EGFR) (рецепторы эпидермального фактора роста) и ErbB2 (HER2/neu) (рецептор эпидермального фактора роста человека, ErbB2+) рецепторами.
Отличается от других быстрообратимых ингибиторов тирозинкиназы более медленной диссоциацией с ErbB1 и с ErbB2 рецепторами (период диссоциации 50% лиганда из лиганд-рецепторного комплекса составляет приблизительно 300 минут).
Помимо собственной активности, in vitro была показана аддитивная активность Тайверба и 5-фторурацила (активный метаболит капецитабина) при использовании в комбинации на четырех линиях опухолевых клеток.
Тайверб продемонстрировал значительную активность на линиях иммортализованных опухолевых клеток в средах, содержащих трастузумаб, что показывает синергизм и отсутствие перекрестной резистентности между двумя лигандами HER2/neu (ErbB2).
Были выявлены тенденция к улучшению показателя выживаемости и снижение риска летального исхода.
Гормонально зависимые раковые клетки молочной железы (эстроген рецептор положительный (ЕР+) и /или прогестерон рецептор положительный (PgR+) при экспрессии ErbB2 имеют тенденцию к появлению резистентности к установленной эндокринной терапии.
Изначальный недостаток ErbB1 или ErbB2 в гормонально зависимых раковых клетках молочной железы увеличивает регулирование данными рецепторами по мере того, как опухоль становится резистентной к эндокринной терапии. В гормонально зависимых метастазирующих случаях рака молочной железы ErbB2 или ErbB1 тирозинкиназные ингибиторы могут улучшить клиническую эффективность, при совместном использовании с эндокринной терапией.
Сочетанное применение Тайверба с капецитабином при лечении пациенток с ErbB2-позитивным распространенным раком молочной железы увеличивает время до начала прогрессирования заболевания, значимо снижает риск прогрессии болезни и выживаемость без прогрессирования заболевания (ВбПЗ) увеличилась на 43% по сравнению с приемом только капецитабина.
ВбПЗ, (КПО) коэффициент полного ответа (27,9% и 14,8% соответственно) и показатели (ЧКУ) частоты клинического улучшения (47,7% и 28,7% соответственно) у женщин, получавших летрозол вместе с Тайвербом выше, чем у женщин, принимающих летрозол с плацебо.
Показания к применению
— распространенная или метастатическая опухоль молочной железы с гиперэкспрессией ErbB2 (HER2/neu) в составе сочетанной терапии с капецитабином у больных с прогрессированием заболевания при начальной терапии метастатических состояний атрациклинами, таксанами и трастузумабом
— лечение гормонально негативного метастатического рака молочной железы с гиперэкспрессией рецепторов опухоли ErbB2 (HER2/neu) в комбинации с трастузумабом и химиотерапией при прогрессировании заболевания на начальной терапии трастузумабом
— лечение гормонально позитивного рака молочной железы с гиперэкспрессией рецепторов опухоли ErbB2 (HER2) в сочетании с ингибиторами ароматазы у женщин в период постменопаузы, не получающих химиотерапию
Способ применения и дозы
Курс лечения Тайвербом может проводиться только специалистом, имеющим опыт в применении противоопухолевых препаратов.
Перед началом лечения необходимо определить HER2 (ErbB2) статус, используя точные и валидированные методы диагностики.
Перед началом и во время всего курса терапии необходимо определять уровень фракции выброса левого желудочка, чтобы не допустить его снижения ниже пределов допустимых значений.
Тайверб необходимо принимать как минимум за час до или через час после еды, суточная доза препарата должна приниматься одномоментно.
Пропущенные дозы Тайверб не восполняются, т.е. принимать пропущенные дозы, уменьшая интервалы между приемами, не следует.
Максимальная суточная доза не должна превышать 1500 мг.
При комбинированной терапии рекомендуется ознакомиться с инструкциями препаратов, назначаемых параллельно на предмет противопоказаний и информации о безопасности.
Тайверб в комбинации с капецитабином
Рекомендуемая доза Тайверба составляет 1250 мг (пять таблеток) однократно в сутки, постоянно. Принимают за 1 час до еды или через 1 час после еды вместе с капецитабином.
Рекомендуемая доза капецитабина – 2000 мг/м2/сут, которая назначается в 2 приёма каждые 12 часов, ежедневно с 1 по 14 дни цикла, который составляет 21 день. Рекомендуется принимать капецитабин с едой или в течение 30 мин после еды (см. инструкцию по применению препарата капецитабин).
Тайверб в комбинации с трастузумабом
Рекомендуемая доза Тайверба составляет 1000 мг (четыре таблетки) однократно в сутки, постоянно.
Рекомендуемая доза трастузумаба составляет 4 мг/кг, вводимая в виде нагрузочной внутривенной инъекции, и затем 2 мг/кг – еженедельно (см. инструкцию по применению препарата трастузумаб).
Тайверб в сочетании с ингибиторами ароматазы
Рекомендуемая доза препарата 1500 мг (шесть таблеток) один раз в день, постоянно.
При приеме препарата Тайверб совместно с ингибитором ароматазы летрозолом, рекомендуемая доза летрозола составляет 2,5 мг один раз в день.
Если Тайверб принимается совместно с другими ингибиторами ароматазы, следует внимательно прочитать инструкцию данного медицинского препарата в отношении деталей дозирования.
Приостановление приема Тайверб или уменьшение дозы
Нарушения со стороны сердечно-сосудистой системы
Лечение Тайвербом должно быть прекращено в случае появления симптомов снижения фракции выброса левого желудочка до 3 степени или выше (по классификации нежелательных явлений Национального Онкологического Института), или в случае ее снижения ниже границы допустимой нормы. Лечение Тайвербом может быть возобновлено не ранее, чем через 2 недели, и в меньшей дозе (750 мг/сутки при назначении с трастузумабом, 1000 мг/сутки при сочетании с капецитабином или 1250 мг/сутки — в сочетании с ингибиторами ароматазы), и только в случае, если уровень фракции выброса левого желудочка находится в допустимых границах нормы и при отсутствии характерных симптомов. По имеющимся данным, большинство случаев снижения фракции выброса левого желудочка наблюдается в первые 12 недель терапии Тайвербом, данные по долгосрочному применению препарата ограничены.
Интерстициальный легочный процесс/пневмониты
Лечение Тайвербом должно быть прекращено в случае появления легочных симптомов, свидетельствующих о развитии интерстициального легочного процесса/пневмонита 3 степени или выше (по классификации нежелательных явлений Национального Онкологического Института).
Диарея
Прием Тайверба должен быть приостановлен у пациентов с диареей 3 степени или 1-2 степеней при наличии сопутствующих симптомов (спазмы в области живота средней или тяжелой степеней тяжести, тошнота или рвота 2 степени или выше по классификации нежелательных явлений Национального Онкологического Института, лихорадка, сепсис, нейтропения, открытые кровотечения, дегидратация). Терапия Тайвербом может быть возобновлена меньшими дозами препарата при улучшении состояния пациента до степени диареи 1 или ниже (750 мг/сутки при назначении с трастузумабом, 1000 мг/сутки при сочетании с капецитабином или 1250 мг/сутки — в сочетании с ингибиторами ароматазы). Тайверб должен быть полностью отменен без последующего возобновления при развитии диареи 4 степени.
Другие проявления токсичности препарата
Решение о приостановке, прекращении применения или изменении дозирования препарата может быть принято, когда уровень развивающихся токсических эффектов больше или равен 2 степени по классификации нежелательных явлений Национального Онкологического Института. Лечение может быть возобновлено с обычных доз (1000 мг/сутки при назначении с трастузумабом, 1250 мг/сутки при сочетании с капецитабином или 1500 мг/сутки — в сочетании с ингибиторами ароматазы), если уровень токсических эффектов снизился до 1 степени и меньше. В случае повторного возникновения токсических эффектов, лечение Тайвербом должно возобновляться более низкими дозами (750 мг/сутки при назначении с трастузумабом, 1000 мг/сутки при сочетании с капецитабином или 1250 мг/сутки — в сочетании с ингибиторами ароматазы).
Дети
Не рекомендуется детям и подросткам до 18 лет в связи с отсутствием опыта применения препарата у данной когорты.
Пожилые пациенты
Данные по применению препарата у пациентов старше 65 лет ограничены. Не отмечено различий в эффективности, переносимости и безопасности Тайверба в сочетании с летрозолом в зависимости от возраста.
Пациенты с нарушением функции почек
Не требуется коррекции режима дозирования у пациентов с легкой и средней степенью почечной недостаточности. Необходимо соблюдать осторожность при применении препарата у пациентов с тяжелой степенью почечной дисфункции в связи с отсутствием опыта применения Тайверба у данной популяции.
Пациенты с нарушением функции печени
Так как лапатиниб метаболизируется посредством печеночного механизма, у пациентов со значительными нарушениями функции печени (индекс Чайлд-Пью С) необходимо отменить терапию Тайвербом без последующего возобновления приема.
Пациентам со средней и тяжелой степенью тяжести печеночной недостаточности следует соблюдать осторожность при приеме Тайверба в связи с увеличением экспозиции лапатиниба и недостаточностью данных для корректирования дозы у данной когорты пациентов.
Снижение дозы Тайверба до с 1250 мг до 750 мг/сутки и с 1500 мг до 1000 мг/сутки в сочетании с ингибиторами ароматазы нормализует показатели AUC до оптимальных.
Побочные действия
Безопасность Тайверба оценивалась у более чем 20000 пациентов как при монотерапии, так и при сочетанном применении с капецитабином (198 пациентов), с трастузумабом (149 пациентов) и летрозолом (654 пациента).
Наиболее распространенными побочными реакциями (> 25%) во время терапии лапатинибом были расстройства со стороны желудочно-кишечного тракта (диарея, тошнота и рвота) и сыпь. При назначении лапатиниба с капецитабином наблюдалась ладонно-подошвенная эритродизестезия (> 25%). Частота возникновения ладонно-подошвенной эритродизестезии схожа с группами пациентов, принимающих лапатиниб с капецитабином и капецитабин в качестве монотерапии. Диарея является наиболее распространенной побочной реакцией, приводящей к прекращению лечения, когда лапатиниб принимался в сочетании с капецитабином или летрозолом.
Не сообщалось о каких-либо дополнительных побочных реакциях, связанных с приемом лапатиниба в сочетании с трастузумабом. Наблюдалось увеличение случаев кардиотоксичности, но по своей сути и тяжести эти осложнения сопоставимы с осложнениями, зарегистрированными в клинической программе лапатиниба. Эти данные основаны на воздействии этой комбинации у 149 пациентов в базовом исследовании.
Частота возникновения нежелательных явлений классифицировалась следующим образом: очень часто (1/10), часто (1/100, <1/10), иногда (1/1000, <1/100), редко (1/10 000, <1/1000), очень редко (<1/10 000), включая отдельные случаи.
Побочные реакции, связанные с приемом Тайверба
Очень часто
— анорексия
— диарея1, которая может приводить к дегидратации (чаще при степени диареи 1-2), тошнота, рвота сыпь1 (включая дерматит в виде акне)
— приливы
— слабость, усталость
Часто
— снижение фракции выброса левого желудочка (наблюдалось приблизительно у 1% пациентов, принимавших Тайверб, и в более чем 70% случаев было асимптоматичным. В 70% случаях разрешалось спонтанно — у 60% пациентов после отмены препарата, у 40% — при продолжении терапии. У 0.3% пациентов, принимавших Тайверб в качестве монотерапии или в комбинации с другими противоопухолевыми препаратами, наблюдались диспноэ, сердечная недостаточность, ощущение сердцебиения. Данная патология наблюдалась у 2.5% пациентов, принимавших Тайверб в комбинации с капецитабином, по сравнению с 1% пациентов, принимавших капецитабин в виде монотерапии, у 3.1% пациентов, принимавших Тайверб в комбинации с летрозолом, по сравнению с 1.3% пациентов, принимавших летрозол и плацебо, а также у 6.7% пациентов, принимавших Тайверб в комбинации с трастузумабом, по сравнению с 2.1% пациентов, принимавших Тайверб в виде монотерапии.
— нарушения ногтевой пластины, включая паронихии
Иногда
— интерстициальные заболевания легких, пневмонит
— гипербилирубинемия (повышение уровня билирубина возможно в связи с подавлением функции печени ОАТР1В1 или подавлением выработки желчи Pgc/BCRP) , гепатотоксичность (риск развития гепатотоксичности ассоциируется с носительством аллели HLA DQA1*02:01 и DRB1*07:01)
Редко
— реакции гиперчувствительности, включая анафилактические реакции
Дополнительно к вышеописанным, следующие нежелательные реакции наблюдались на фоне сочетанного применения Тайверба и капецитабина с частотой на 5% больше, по сравнению с монотерапией капецитабином
Очень часто
— диспепсия
— сухость кожи
Побочные реакции, наблюдавшиеся с одинаковой частотой в группе Тайверб + капецитабин и в группе капецитабина
Очень часто
— стоматит, запор, боли в области живота
— головная боль
— ладонно-подошвенный синдром (эритродизестезия)
— воспаление слизистых оболочек
— носовые кровотечения, кашель, одышка
— боли в спине и конечностях, артралгии
— бессонница
Часто
— запоры
— гипербилирубинемия, гепатотоксичность
— поражения ногтей (паранихия)
Следующие дополнительные нежелательные реакции наблюдались на фоне сочетанного применения Тайверба и летрозола с частотой на 5% больше, по сравнению с монотерапией летрозолом
Очень часто
— носовое кровотечение
— алопеция
— сухость кожи
1 Диарея и сыпь, в основном, имели низкую степень тяжести (1-2) и не требовали отмены препарата. Диарея регулируется правильными профилактическими мероприятиями, сыпь в большинстве случаев была преходящей; тем не менее, было выявлено несколько случаев острой почечной недостаточности в связи с развитием тяжелой дегидратации на фоне диареи. У пациентов с чувствительной кожей рекомендуется применять солнцезащитный крем с защитным фактором более 30. В случае возникновения кожных реакций, пациент должен проходить полный осмотр на протяжении месяца после разрешения инцидента.
Противопоказания
— повышенная чувствительность к лапатинибу или любому другому компоненту препарата
— беременность и период лактации
— детский и подростковый возраст до 18 лет
Необходимо обратить внимание на информацию об имеющихся противопоказаниях сопутствующих препаратов, если они применяются в сочетании с Тайвербом.
С осторожностью
— состояния, которые могут приводить к левожелудочковой недостаточности
— нарушения функции печени тяжелой степени (индекс Чайлд-Пью 7 и выше)
Лекарственные взаимодействия
Тайверб преимущественно метаболизируется посредством системы цитохрома CYP3A, таким образом, ингибиторы или индукторы CYP3A могут влиять на фармакокинетику лапатиниба. Одновременного применения препарата Тайверб и сильных ингибиторов CYP3A (например, ритонавир, саквинавир, телитромицин, вориконазол, позаконазол, нефазодон, кетоконазол, итраконазол) следует избегать. Одновременного применения препарата Тайверб и ингибиторов CYP3A средней степени необходимо соблюдать осторожность и тщательно наблюдать за клиническим состоянием пациента и возможными нежелательными реакциями.
Одновременного применения препарата Тайверб и индукторов CYP3A4 (например, рифампицин, рифабутин, карбамазепин, фенитоин, зверобой продырявленный) следует избегать.
Предварительное применение препаратов из группы ингибиторов протоновой помпы (эзомепразол) снижает экспозицию лапатиниба в среднем на 27% (от 6 до 49%), особенно у пациентов в возрасте 40-60 лет. Таким образом, необходимо соблюдать осторожность при сочетанном применении Тайверба и препаратов из группы ингибиторов протоновой помпы.
Тайверб ингибирует in vitro CYP3A4 и CYP2C8 в клинически значимых концентрациях. Не рекомендуется его одновременное назначение с препаратами с узким терапевтическим диапазоном, являющимися субстратами этих ферментов (мидазолам (АUC мидазолама может увеличиваться до 45%), цизаприд, пимозид, квинидин, репаглинид).
Лапатиниб является субстратом для транспортных белков гликопротеина П (кетоконазол, итраконазол, квинидин, верапамил, циклоспроин, эритромицин), BCRP (рифампицин, топотекан, зверобой продырявленный) и ОАТР1В1 (розувастатин). Ингибиторы и индукторы данных белков могут изменять действие и/или распределение лапатиниба. Лапатиниб подавляет гликопротеин П в клинически значимых концентрациях. При совместном назначении с дигоксином AUC последнего увеличивается на 98%, в связи с чем Тайверб следует назначать с осторожностью с препаратами с узким терапевтическим диапазоном, являющимися субстратами гликопротеина П, BCRP и ОАТР1В1.
Растворимость лапатиниба является рН-зависимой, в связи с чем, совместное назначение препаратов, повышающих рН желудочного сока, не допустимо, так как может привести к повышенной растворимости и абсорбции препарата.
Лапатиниб ингибирует CYP3A4 и CYP2C8 in vitro в клинически значимых концентрациях. Одновременное применение Тайверба с мидазоламом, принимаемым перорально, приводит к увеличению АUC мидазолама приблизительно на 45%). Не наблюдалось клинически значимого увеличения АUC при внутривенном введении мидазолама. Совместное применение препарата Тайверб с пероральными препаратами с узким терапевтическим действием, являющимися субстратами CYP3A4 (например, цизаприд и квинидин) не рекомендуется.
Лапатиниб ингибирует CYP2C8 in vitro в клинически значимых концентрациях. Совместное применение препарата Тайверб с препаратами с узким терапевтическим действием, являющимися субстратами CYP2C8 (например, репаглинид), не рекомендуется.
Совместное применение Тайверба и паклитаксела, вводимого внутривенно, увеличивает экспозицию паклитаксела на 23% в связи с ингибированием лапатиниба CYP2C8 и/или гликопротеином П. При совместном применении данных препаратов наблюдалось увеличение частоты и тяжести диареи и нейтропении, в связи с чем необходимо соблюдать осторожность при назначении данной комбинации.
Совместное назначение Тайверба и доцетаксела, применяемого внутривенно, не оказывало значительного влияния на AUC и Cmax активных субстанций обоих препаратов, тем не менее, отмечалась увеличение случаев развития доцетаксел-индуцированной нейтропении.
При совместном применении Тайверба с иринотеканом наблюдается увеличение AUC активного метаболита иринотекана SN-38 приблизительно на 40%, в связи с чем необходим тщательный мониторинг побочных реакций и рассмотрение возможности снижения дозы иринотекана.
Лапатиниб ингибирует транспортный белок Pgp in vitro в клинически значимых концентрациях. Одновременное применение лапатиниба с дигоксином, принимаемым перорально, приводит к увеличению АUC дигоксина приблизительно на 80%. Следует с осторожностью назначать лапатиниб совместно с препаратами с узким терапевтическим действием, являющихся субстратами Pgp, а также рассмотреть возможность снижения дозы субстрата Pgp.
Лапатиниб ингибирует транспортные белки BCRP и OATP1B1 in vitro. Клиническое значение данных результатов не было определено. Не исключается воздействие лапатиниба на фармакокинетику субстратов BCRP (напр., топотекан) и ОАТР1В1 (напр., розувастатин).
Сочетанное применение Тайверба с летрозолом, капецитабином или трастузумабом не влияет на фармакокинетические параметры препаратов.
Биодоступность Тайверба зависит от приема пищи и ее насыщенности жирами (может возрастать в 4 раза).
Грейпфрутовый сок не применяется вместе с Тайвербом, так как может приводить к увеличению биодоступности лапатиниба.
Особые указания
Лечение Тайвербом следует проводить только под контролем специалиста, имеющего опыт проведения химиотерапии.
Кардиотоксичность
Необходимо соблюдать осторожность при назначении Тайверба пациентам с клиническими состояниями, которые могут привести к ухудшению функции левого желудочка, в том числе пациентам, принимающим параллельно потенциально кардиотоксичные препараты. Перед началом и во время лечения необходимо обязательно определять уровень фракции выброса левого желудочка, чтобы не допустить его снижения ниже пределов допустимых значений.
Во время клинических исследований было выявлено снижение фракции выброса левого желудочка приблизительно у 1% пациентов, принимавших Тайверб; у 0.3% пациентов развивались симптомы снижения фракции выброса левого желудочка. При сочетанном применении Тайверба с трастузумабом развитие сердечных патологий было выше (7%) по сравнению с назначением Тайверба в качестве монотерапии (2%). Тяжесть и природа выявленных симптомов была одинакова в обеих группах.
Лечение Тайвербом должно быть прекращено в случае снижения фракции выброса до 3 степени или больше, или в случае снижения ниже границы допустимой нормы. В некоторых случаях снижение фракции выброса левого желудочка может иметь выраженную степень и приводить к развитию сердечной недостаточности и даже смерти.
При назначении Тайверба наблюдалось дозо-зависимое удлинение интервала QT, в связи с чем необходимо соблюдать осторожность при назначении Тайверба пациентам с состояниями, способными влиять на продолжительность QT интервала (гипокалиемия, гипомагниемия, врожденный синдром удлинения QT интервала, сопутствующее применение препаратов с механизмом действия, приводящего к удлинению QT интервала). Такие состояния, как гипокалиемия и гипомагниемия должны быть скорректированы до начала терапии Тайвербом. Перед началом и в процессе лечения необходимо проводить анализ ЭКГ с измерением интервала QT.
Гепатотоксичность
Применение Тайверба сопровождается токсическим влиянием препарата на печень, что в редких случаях может привести к летальному исходу, о чем пациенты должны быть предупреждены в начале терапии. Токсическое поражение может развиться в период от нескольких дней до нескольких месяцев от начала терапии. Функцию печени (уровень аминотрансфераз, билирубина и щелочной фосфатазы) следует контролировать до начала лечения, а затем каждые 4 недели, либо по клиническим показаниям. Лечение Тайвербом следует прекратить без последующего возобновления при развитии печеночной недостаточности тяжелой степени.
Риск развития гепатотоксичности ассоциируется с носительством аллели HLA DQA1*02:01 и DRB1*07:01. В клинических исследованиях при назначении Тайверба в качестве монотерапии (1194 пациента) общая частота поражения печени составила 2.8% на протяжении года лечения. Частота поражения печени у пациентов-носителей аллели DQA1*02:01 и DRB1*07:01 составила 10.3 %, у пациентов с отсутствием данной аллели – 0.5 %. Частота носительства HLA DQA1*02:01 и DRB1*07:01 составляет от 15 до 25 % у европейцев, азиатов, африканцев и латиноамериканцев, но незначительна (1 %) у японцев.
В случае применения Тайверба у пациентов с легкой и средней степенью поражения печени, рекомендуется назначать препарат с осторожностью.
Почечная недостаточность
Применять с осторожностью у пациентов с тяжелой степенью почечной недостаточности.
Влияние на легочную ткань
Имеются сообщения о случаях развития интерстициального легочного процесса и пневмонита в связи с приемом Тайверба, что может привести к развитию легочной недостаточности и даже смерти. Пациенты должны находиться под наблюдением на предмет возникновения легочных симптомов (одышка, кашель, лихорадка), свидетельствующих о развитии интерстициального легочного процесса. Лечение Тайвербом должно быть прекращено в случае появления легочных симптомов, свидетельствующих о развитии интерстициального легочного процесса/пневмонита 3 степени или выше (по классификации нежелательных явлений Национального Онкологического Института).
Легочная токсичность может быть тяжелой и привести к дыхательной недостаточности. Были зарегистрированы фатальные случаи.
Диарея
Применение Тайверба может приводить к развитию диареи, включая диарею тяжелой степени тяжести, что может привести к угрожающим жизни состояниям и к смертельному исходу, если сочетается с дегидратацией, почечной недостаточностью, нейтропенией и/или электролитным дисбалансом. Диарея чаще возникает в первые 6 дней от начала лечения и продолжается в течение 4-5 дней. Лапатиниб-индуцированная диарея чаще относится к легкой степени тяжести, диарея 3 и 4 степени выявляется у <10 % и 1 % пациентов соответственно. Необходимо раннее выявление расстройств желудочно-кишечного тракта и его симптомов (лихорадка, спазмы, тошнота, рвота, головокружение, жажда). Регулирование диареи является критичным, поэтому в случае возникновения любых изменений со стороны ЖКТ пациенты должны немедленно сообщить об этом лечащему врачу.
В случае подозрения на тяжелую диарею необходимо измерить количество нейтрофилов и температуру тела пациента. Рекомендуется назначение антидиарейных препаратов (лоперамид) при первом развитии симптомов. При диарее тяжелой степени может потребоваться назначение электролитов и жидкости для предупреждения дегидратации (перорально или внутривенно), назначение антибиотиков (фторхинолины), особенно в случае диареи, продолжающейся более 24 часов с наличием лихорадки и нейтропении 3-4 степени, приостановление приема Тайверба или полная отмена препарата.
Совместное назначение с ингибиторами или индукторами CYP3A
Совместного назначения Тайверба с ингибиторами или индукторами CYP3A следует избегать в связи с риском увеличения экспозиции Тайверба.
Не следует применять грейпфрутовый сок совместно с Тайвербом.
Совместное применение препарата Тайверб с препаратами с узким терапевтическим действием, являющимися субстратами CYP3A4 и/или CYP2С8 не рекомендуется.
Совместное применение с препаратами, повышающими рН желудочного сока, не рекомендуется, так как это может повлиять на растворимость и всасывание лапатиниба.
Фертильность
Нет данных об использовании Тайверба у женщин детородного возраста.
Беременность и период лактации
Женщинам детородного возраста во время терапии препаратом Тайверб необходимо использовать надежные методы контрацепции.
Нет соответствующих данных об использовании Тайверба у беременных женщин. Исследования на животных показали наличие репродуктивной токсичности. Потенциальный риск для человека неизвестен.Безопасность применения препарата Тайверб при грудном вскармливании изучена не была. Неизвестно, проникает ли лапатиниб в грудное молоко. Грудное вскармливание должно быть прекращено на время терапии Тайвербом.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами
Механизм действия Тайверба позволяет предположить отсутствие влияния на способности к концентрации внимания. Тем не менее, следует учитывать общее клиническое состояние пациента и возможное развитие нежелательных явлений при оценке способностей к управлению автомобилем и работе с механизмами, требующими быстроты реакции.
Передозировка
Максимальная суточная доза в исследованиях составляла 1800 мг.
Более частый прием препарата может приводить к повышению концентраций лапатиниба в сыворотке крови, поэтому не следует принимать пропущенные дозы, уменьшая интервалы между приемами.
Симптомы: зарегистрировано сообщение о приеме 5000 мг лапатиниба с развитием побочных симптомов, соответствующих профилю препарата, в некоторых случаях – изъязвление и воспаление слизистых. При приеме 9000 мг лапатиниба было выявлено развитие синусовой тахикардии.
Лечение: симптоматическая терапия в токсикологическом отделении. Гемодиализ неэффективен. Специфического антидота не существует.
Форма выпуска и упаковка
Таблетки, покрытые пленочной оболочкой, 250 мг.
По 70, 84 или 140 таблеток помещают во флакон из полиэтилена высокой плотности.
По 1 флакону вместе с инструкцией по медицинскому применению на государственном и русском языках помещают в пачку из картона.
Условия хранения
Хранить при температуре не выше 30 °С.
Хранить в недоступном для детей месте!
Срок хранения
2 года
Не использовать по истечении срока годности.
Условия отпуска из аптек
По рецепту
Производитель
Глаксо Оперэйшенс Великобритания Лтд. Глаксо Веллком Оперэйшенс, Великобритания
(Priory Street, Ware, Hertfordshire SG12 0DJ)
Упаковщик
Глаксо Веллком С.А., Испания
(Avenida Extremadura 3, 09400 Aranda de Duero, Burgos)
Владелец регистрационного удостоверения
Новартис Фарма АГ, Швейцария
Адрес организации, принимающей претензии от потребителя по качеству продукта (товара) и ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства на территории Республики Казахстан
Филиал Новартис Фарма Сервисэз АГ в Казахстане
050051 г. Алматы, ул. Луганского, 96
тел.: (727) 258-24-47
факс: (727) 244-26-51
e-mail: drugsafety.cis@novartis.com
| 041065001477976775_ru.doc | 134 кб |
| 715362391477977934_kz.doc | 140 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
Активное вещество: лапатиниба дитозилата моногидрат.
1 таблетка, покрытая пленочной оболочкой, содержит 405 мг лапатиниба дитозилата моногидрат, что эквивалентно 250 мг лапатиниба.
Вспомогательные вещества: целлюлоза микрокристаллическая, повидон КЗО, натрия крахмалгликолят (тип А), магния стеарат; оболочка: Опадрай желтый YS-1-12524-A (гипромеллоза, титана диоксид (Е 171), железа оксид красный (Е172), железа оксид желтый (Е172), макрогол 400, полисорбат 80).
Таблетки овальной формы, двояковыпуклые, желтого цвета, покрытые пленочной оболочкой. Одна сторона таблетки гладкая, на другой выгравирована надпись «GS XJG».
Противоопухолевые средства. Ингибиторы протеинкиназы.
Код ATX: L01XE07
Фармакодинамика
Механизм действия
Лапатиниб, 4-анилинохиназолин, — это ингибитор внутриклеточной тирозинкиназы, связывающийся с EGFR (epidermal growth factor receptor; рецептор эпидермального фактора роста, ЕrbВ1) и HER2 (human epidermal growth factor receptor; рецептор эпидермального фактора роста человека, ЕгbВ2) рецепторами (Kia₽₽ величины 3 нМ и 13 нМ, соответственно). Отличается от других обратимых ингибиторов тирозинкиназы более медленной диссоциацией с ЕгbВ1 и с ЕгbВ2 рецепторами (период диссоциации 50% лиганда из лиганд- рецепторного комплекса составляет не менее 300 мин). Лапатиниб ингибирует рост опухолевых клеток, вызванный ЕгbВ, как in vitro, так и в ряде моделей исследования на животных.
Комбинация лапатиниба и трастузумаба может проявлять взаимодополняющий механизм действия, а также обеспечивать неперекрещивающиеся механизмы преодоления резистентности. Ингибирующий эффект лапатиниба оценивался на обработанных трастузумабом клеточных линиях. Лапатиниб сохранял значительную активность in vitro в отношении линий HER-2-амплифицированных опухолевых клеток, выбранных для долгосрочного роста в средах, содержащих трастузумаб, и действовал синергично с трастузумабом в данных линиях клеток.
Влияние пищи на экспозицию лапатиниба
Биодоступность лапатиниба и, следовательно, его концентрация в плазме увеличиваются при приеме пищи в зависимости от содержания пищи и времени ее приема. Прием лапатиниба через один час после еды приводит к увеличению системной экспозиции лапатиниба примерно в 2-3 раза, по сравнению с приемом за час до еды.
Фармакокинетика
Всасывание
Абсолютная биодоступность после приема внутрь точно не известна, однако является неполной и вариабельной. Коэффициент вариабельности площади под кривой «концентрация — время» (AUC) составляет около 70%. Определяется в системном кровотоке в среднем через 0,25 часа (диапазон 0-1,5 ч). Максимальная концентрация лапатиниба в плазме крови (Сmах) достигается примерно через 4 часа после приема.
Сmах
в равновесном состоянии при ежедневном приеме 1250 мг составляет в среднем 2,43 (76%) мкг/мл, a AUC — 36,2 (79%) мкг × час/мл.
Системная экспозиция лапатиниба увеличивается при приеме одновременно с пищей. AUC возрастает примерно в 3 и 4 раза, Сmах
— приблизительно в 2,5 и 3 раза выше при приеме с пищей с низким (5% жиров [500 калорий]) или высоким (50% жиров [1000 калорий]) содержанием жиров, соответственно, по сравнению с приемом лекарственного средства натощак. Системная экспозиция лапатиниба также зависит от времени назначения лекарственного средства по отношению к приему пищи. При приеме лапатиниба за один час до завтрака с низким содержанием жиров средние величины AUC приблизительно в 2 и 3 раза выше по сравнению с приемом лапатиниба через час после еды с низким или высоким содержанием жиров, соответственно.
Распределение
Лапатиниб обладает высокой степенью связывания (более чем 99%) с альбумином и альфаг кислым гликопротеином плазмы крови. Исследования in vitro показали, что лапатиниб является субстратом для переносчиков BCRP (ABCG1) и р-гликопротеина (АВСВ1). Также in vitro было продемонстрировано, что лапатиниб ингибирует эти эффлюксные переносчики, а также переносчик ОАТР 1В1 печеночного захвата в клинически значимых концентрациях (IC50 = 2,3 мкг/мл). Клиническое значение данных эффектов на фармакокинетику других лекарственных средств или фармакологическую активность других противораковых препаратов не известно.
Метаболизм
Лапатиниб подвергается интенсивному метаболизму, главным образом изоферментами CYP3A4 и CYP3A5, в меньшей степени изоферментами CYP2C19 и CYP2C8 с образованием различных окисленных метаболитов, ни один из которых не составляет более 14% дозы, обнаруживаемой в кале или 10% концентрации лапатиниба в плазме.
Лапатиниб в клинически значимых концентрациях ингибирует изоферменты CYP3A (Ki 0,6 — 2,3 мкг/мл) и CYP2C8 (0,3 мкг/мл) in vitro.
Лапатиниб незначительно ингибирует следующие микросомальные ферменты печени: CYP1A2, CYP2C9, CYP2C19 и CYP2D6 или ферменты UGT (величины IC50/n vitro были не менее 6,9 мкг/мл).
Выведение
Период полувыведения (Т1/2) увеличивается дозозависимо при приеме однократных доз. Равновесное состояние достигается через 6-7 суток приема, Т1/2 равновесного состояния составляет 24 часа. Лапатиниб в основном выводится с помощью CYP3A4/5. Частично выводится печенью.
В основном выводится кишечником — в среднем 27% (3 — 67%) в неизмененном виде, менее 2% принятой дозы выводится почками в неизмененном виде и в виде метаболитов.
Пациенты с нарушением функции почек
Не проводилось отдельных исследований фармакокинетики лапатиниба у пациентов с почечной недостаточностью или пациентов, находящихся на гемодиализе. Имеющиеся данные позволяют предположить, что не требуется коррекции дозы у пациентов с почечной недостаточностью легкой или умеренной степени.
Пациенты с нарушением функции печени
Фармакокинетика лапатиниба изучалась при умеренных (n=8) и тяжелых (n=4) нарушениях функции печени (7-9 баллов по шкале Чайлд-Пью или более 9 баллов, соответственно), а также на 8 здоровых добровольцах в качестве группы контроля. AUC лапатиниба после приема однократной дозы 100 мг внутрь увеличивается на 56% и 85% у пациентов с умеренными и тяжелыми нарушениями функции печени, соответственно. Лапатиниб следует с осторожностью применять у пациентов с печеночной недостаточностью.
Тайверб показан для лечения взрослых пациенток с раком молочной железы с гиперэкспрессией HER2 (ЕгbВ2):
— в составе комбинированной терапии с капецитабином у пациенток с распространенным или метастатическим раком с прогрессированием после предшествующей терапии, включавшей антрациклины, таксаны и трастузумаб в соответствии со схемой лечения метастатических опухолей;
— в составе комбинированной терапии с трастузумабом у пациенток с метастатическим раком и негативным гормонорецепторным статусом с прогрессированием после предшествующей терапии трастузумабом в сочетании с химиотерапией;
— в составе комбинированной терапии с ингибитором ароматазы у женщин в постменопаузальном периоде с метастатическим раком и позитивным гормонорецепторным статусом, которым не показана химиотерапия. Пациенты в регистрационном исследовании не проходили предшествующее лечение трастузумабом или ингибитором ароматазы (см. раздел «Меры предосторожности»). Данных о сравнительной эффективности указанной комбинации и сочетанной терапии трастузумабом и ингибитором ароматазы не получено.
Повышенная чувствительность к лапатинибу или любому другому компоненту препарата.
Данных о применении лапатиниба во время беременности недостаточно. Исследования на животных показали наличие репродуктивной токсичности. Потенциальный риск для человека не известен.
Тайверб не следует применять во время беременности за исключением случаев, когда это явно необходимо. Женщины детородного возраста должны быть предупреждены о необходимости использования эффективной контрацепции (методы, при использовании которых вероятность наступления беременности менее 1%) в период лечения лапатинибом, а также в течение не менее 5 дней после приема последней дозы препарата.
Безопасность Тайверба во время грудного вскармливания не установлена. Неизвестно, выводится ли лапатиниб в грудное молоко. У детенышей крыс, подверженных воздействию лапатиниба через грудное молоко, была зафиксирована задержка роста. Поскольку многие препараты передаются с грудным молоком и в связи с возможностью развития серьезных нежелательных реакций у грудных детей из-за лапатиниба, женщинам рекомендуется не осуществлять грудное вскармливание во время терапии лапатинибом, а также в течение не менее 5 дней после приема последней дозы препарата.
Адекватных данных о влиянии Тайверб на фертильность женщин детородного возраста не получено.
Лечение лапатинибом следует начинать только под контролем специалиста, имеющего опыт применения противоопухолевых лекарственных средств.
HER2 (ЕгbВ2) позитивными считаются опухоли с IHC3+ статусом, IHC2+ с амплификацией гена или только с амплификацией гена. HER2 статус опухоли должен быть определен с использованием точных и валидных методик.
Рекомендуемую суточную дозу препарата нельзя делить на приемы. Лапатиниб принимают за 1 час до еды или через 1 час после еды. Рекомендуется стандартизировать прием препарата по отношению к приему пищи, например, каждый день принимать препарат за час до еды.
Пропущенные дозы лапатиниба не восполняются, т.е. следующую дозу препарата следует принять согласно графику приема.
При приеме Тайверба с другими лекарственными средствами следует ознакомиться с инструкцией по их применению, в которой представлена подробная информация о режиме дозирования, включая снижение дозы, противопоказания и информацию о безопасности.
Комбинированная терапия Тайвербом и капецитабином
Рекомендуемая доза Тайверба — 1250 мг (пять таблеток) 1 раз в сутки, ежедневно.
Рекомендуемая доза капецитабина — 2000 мг/м2/сут в 2 приёма (каждые 12 часов) ежедневно с 1 по 14 дни цикла продолжительностью 21 день. Капецитабин следует принимать с пищей или в течение 30 мин после приема пищи. Следует ознакомиться с инструкцией по медицинскому применению капецитабина.
Комбинированная терапия Тайвербом и трастузумабом
Рекомендуемая доза Тайверба — 1000 мг (четыре таблетки) 1 раз в сутки, ежедневно.
Рекомендуемая доза трастузумаба — 4 мг/кг внутривеннно в качестве нагрузочной дозы, затем 2 мг/кг внутривенно еженедельно. Следует ознакомиться с инструкцией по медицинскому применению трастузумаба.
Комбинированная терапия Тайвербом и ингибитором ароматазы
Рекомендуемая доза Тайверба -1500 мг (шесть таблеток) 1 раз в сутки, ежедневно. Следует ознакомиться с инструкцией по медицинскому применению совместно назначаемого ингибитора ароматазы для получения деталей дозирования.
Приостановление приема лапатиниба или уменьшение дозы
Нарушения со стороны сердечно-сосудистой системы
Лечение лапатинибом должно быть прекращено в случае появления симптомов снижения фракции выброса левого желудочка до 3 степени или выше (по классификации нежелательных явлений Национального онкологического института США) или в случае снижения ниже границы допустимой нормы. Лечение лапатинибом может быть возобновлено не ранее, чем через 2 недели в меньшей дозе (750 мг/сутки при назначении с трастузумабом, 1000 мг/сутки при назначении с капецитабином или 1250 мг/сутки при назначении с ингибитором ароматазы) и только, если фракция выброса левого желудочка находится в пределах нормы, а симптомы исчезли.
Интерстициальная болезнь легких/пневмониты
Лечение лапатинибом должно быть прекращено в случае появления легочных симптомов 3 степени или выше (по классификации нежелательных явлений Национального онкологического института США).
Диарея
Дозирование Тайверба должно быть прекращено у пациенток с диареей 3 степени (по классификации нежелательных явлений Национального онкологического института США) или 1-2 степени с отягощающими признаками (умеренная и сильная острая боль в животе; тошнота или рвота, соответствующие или выше 2 степени; сниженный функциональный статус; лихорадка; сепсис; нейтропения; явное кровотечениие или дегидратация). Применение Тайверба может быть возобновлено в более низкой дозе (сниженной с 1000 мг/сутки до 750 мг/сутки, с 1250 мг/сутки до 1000 мг/сутки или с 1500 мг/сутки до 1250 мг/сутки), когда диарея уменьшится до 1 степени и ниже. Лечение Тайвербом должно быть окончательно прекращено у пациенток с диареей 4 степени.
Тяжелые кожные реакции (см. Меры предосторожности)
Применение Тайверба следует прекратить у пациентов с тяжелой прогрессирующей кожной сыпью с образованием блистеров или поражением слизистых оболочек.
Прочие проявления токсичности препарата
Решение о прекращении применения или изменении дозирования препарата может быть принято,
когда выраженность развивающихся токсических эффектов выше или равна 2 степени по классификации нежелательных явлений Национального онкологического института США. Лечение может быть начато снова с дозы 1000 мг/сут при назначении в комбинации с трастузумабом, 1250 мг/сут в случае комбинации с капецитабином или 1500 мг/сут в случае комбинации с ингибитором ароматазы, если выраженность токсических эффектов снизилась до 1 степени и ниже. В случае повторного возникновения токсических эффектов доза лапатиниба должна быть снижена до 750 мг/сут при назначении в комбинации с трастузумабом, 1000 мг/сут в комбинации с капецитабином или 1250 мг/сут в комбинации с ингибитором ароматазы.
Пациенты с нарушением функции почек
Коррекции режима дозирования не требуется у пациентов с легкой и умеренной почечной недостаточностью. Рекомендуется с осторожностью применять препарат у пациентов с тяжелой почечной недостаточностью, так как нет опыта применения Тайверба у данной группы пациентов.
Пациенты с нарушением функции печени
При развитии тяжелых проявлений гепатотоксичности необходима отмена препарата, повторное назначение недопустимо. Следует с осторожностью назначать Тайверб пациентам с умеренной и тяжелой печеночной недостаточностью, в связи с увеличением воздействия лекарственного средства. Недостаточно клинических данных для предоставления рекомендаций по коррекции дозы у пациентов с печеночной недостаточностью.
Применение у детей
Тайверб не рекомендуется для применения у детей до 18 лет в связи с недостаточностью данных по безопасности и эффективности.
Применение у пожилых пациентов
Данные о применении Тайверба в сочетании с капецитабином или трастузумабом у пациентов в возрасте после 65 лет ограничены.
В ходе фазы III клинического исследования применения Тайверба в комбинации с летрозолом 44% из группы пациентов с гормоночувствительным метастатическим раком молочной железы (общее количество пациентов — 642) были пациенты в возрасте после 65 лет. Каких- либо различий в эффективности и безопасности комбинированной терапии Тайверба и летрозола в данной группе пациентов по сравнению с пациентами младше 65 лет выявлено не было.
Безопасность лапатиниба оценивалась как в монотерапии, так и при комбинированном применении с другими препаратами химиотерапии для лечения различных форм рака на более чем 20 000 пациентах, включая 198 пациентов, которые получали лапатиниб в комбинации с капецитабином, 149 пациентов — в комбинации с трастузумабом и 654 — в комбинации с летрозолом.
Наиболее часто (>25%) в ходе терапии лапатинибом возникали побочные реакции со стороны желудочно-кишечного тракта (такие как диарея, тошнота, рвота) и сыпь. При комбинированном применении с капецитабином частой побочной реакцией (>25%) была ладонно-подошвенная эритродизестезия. Частота данной побочной реакции была схожа в группе комбинированного приема лапатиниба и капецитабина и группе монотерапии капецитабином. При комбинированном применении лапатиниба с капецитабином или летрозолом наиболее частой реакцией, приводящей к отмене препарата, была диарея.
О дополнительных побочных реакциях, связанных с комбинацией лапатиниба и трастузумаба, не сообщалось. Имело место повышенная частота кардиотоксичности, но она была сопоставима по характеру и тяжести с реакциями, о которых сообщалось по результатам клинического изучения лапатиниба. Эти данные основаны на результатах применения указанной комбинации у 149 пациентов в основном исследовании.
Частота возникновения нежелательных явлений классифицировалась следующим образом: очень часто (≥1/10), часто (≥1/100, <1/10), нечасто (≥1/1000, <1/100), редко (≥1/10 000, <1/1000), очень редко (<1/10 000), частота неизвестна (частота не может быть оценена по имеющимся данным).
В рамках каждой группы частоты побочные реакции приведены в порядке снижения степени серьезности.
Была установлена причинно-следственная связь между применением лапатиниба в качестве монотерапии или в комбинации с капецитабином, трастузумабом или летрозолом и перечисленными ниже побочными реакциями.
Со стороны иммунной системы: редко — реакции гиперчувствительности, включая анафилаксию (см. раздел «Противопоказания»).
Метаболические нарушения и нарушения питания:
очень часто — анорексия.
Психические нарушения: очень часто — бессонница*.
Нарушения со стороны нервной системы: очень часто — головная боль**, часто — головная боль*.
Со стороны сердечно-сосудистой системы: часто — снижение фракции выброса левого желудочка (см. разделы «Способ применения и дозы» и «Меры предосторожности»).
Нарушения со стороны сосудов: очень часто — приливы крови**.
Со стороны дыхательной системы, органов грудной клетки и средостения: очень часто — носовое кровотечение**, кашель**, одышка**; нечасто — интерстициальная болезнь легких/ пневмонит.
Со стороны желудочно-кишечного тракта: очень часто — диарея (которая может приводить к дегидратации, см. разделы «Способ применения и дозы» и «Меры предосторожности»), тошнота, рвота, диспепсия*, стоматит*, запор*, боль в животе*; часто — запор**.
Со стороны печени и желчевыводящих путей:
часто — гипербилирубинемия, гепатотоксичность (см. раздел «Меры предосторожности»).
Со стороны кожи и подкожно-жировой клетчатки: очень часто — сыпь (включая акнеформный дерматит, см. раздел «Меры предосторожности»); сухость кожи***, ладонноподошвенная эритродизестезия*, алопеция**, зуд**; часто — поражение ногтей, включая паронихии.
Со стороны мышечно-скелетной и соединительной ткани: очень часто — боль в конечностях***, боль в спине***, артралгия**.
Со стороны организма в целом: очень часто — утомляемость, воспаление слизистых*, астения**.
*Данные побочные реакции регистрировались при приеме лапатиниба в комбинации с капецитабином. ** Данные побочные реакции регистрировались при приеме лапатиниба в комбинации с летрозолом.
Описание отдельных побочных реакций
Снижение фракции выброса левого желудочка и удлинение интервала QT
Снижение фракции выброса левого желудочка наблюдалось у 1% пациентов, получавших лапатиниб, и в более чем 70% случаев протекало бессимптомно. Данная побочная реакция разрешилась или ее проявление уменьшилось в более чем 70% случаев (в 60% — после отмены лапатиниба, в 40% случаев прием лапатиниба был продолжен). Снижение фракции выброса левого желудочка проявлялось клинически у 0,3% пациентов, получавших лапатиниб в качестве монотерапии или в комбинации с другими противораковыми препаратами. Наблюдаемые симптомы включали одышку, сердечную недостаточность и сердцебиение. У 58% из этих пациентов симптомы разрешились. О снижении фракции выброса левого желудочка сообщалось у 2,5% пациентов, получавших лапатиниб в комбинации с капецитабином, по сравнению с 1,0% пациентов, находящихся на монотерапии капецитабином. Также о данной побочной реакции сообщалось у 3,1 % пациентов, получавших лапатиниб в комбинации с летрозолом, по сравнению с 1,3% пациентов, получавших летрозол и плацебо. О снижении фракции выброса левого желудочка сообщалось у 6,7% пациентов, получавших лапатиниб в комбинации с трастузумабом, по сравнению с 2,1 % пациентов, получавших монотерапию лапатинибом.
В ходе неконтролируемого исследования фазы I наблюдалось небольшое зависящее от концентрации увеличение интервала QTc, поэтому возможность лапатиниба влиять на удлинение интервала QT исключить нельзя.
Диарея
О случаях диареи сообщалось у приблизительно 65% пациентов, получавших лапатиниб в комбинации с капецитабином, у 64% пациентов, получавших лапатиниб в комбинации с летрозолом и у 62% пациентов, получавших лапатиниб в комбинации с трастузумабом. В большинстве случаев наблюдалась диарея 1 или 2 степени, не приводившая к отмене препарата. Рекомендуется проактивное управление диареей. Однако сообщалось о нескольких случаях острой почечной недостаточности, возникшей вследствие тяжелой дегидратации, вызванной диареей.
Сыпь
Сыпь наблюдалась у приблизительно 28% пациентов, получавших лапатиниб в комбинации с капецитабином, у 45% пациентов, получавших лапатиниб в комбинации с летрозолом и у 23 % пациентов, получавших лапатиниб в комбинации с трастузумабом. Как правило, проявление сыпи расценивалось низкой степенью тяжести и не приводило к отмене лапатиниба. Врачам рекомендуется проводить осмотр кожных покровов перед началом лечения и регулярно в ходе лечения. При появлении кожных реакций пациентов необходимо проинструктировать о необходимости избегать воздействия солнечных лучей и применять защитные средства широкого спектра с фактором защиты (SPF) ≥30. При возникновении кожных реакций полный осмотр кожных покровов должен проводиться при каждом визите пациента в течение одного месяца после разрешения побочной реакции. Пациентов с обширными или длительными кожными реакциями необходимо направлять на консультацию дерматолога.
Гепатотоксичность
Риск появления гепатотоксичности при приеме лапатиниба был связан с носительством аллелей HLA DQA1 *02:01 и DRB1*07:01 (см. раздел «Меры предосторожности»).
Данные пострегистрационного применения:
Нарушения со стороны сердца:
Частота неизвестна — желудочковые аритмии/пируэтная тахикардия, удлинение интервала QT на электрокардиограмме;
Нарушения со стороны кожи и подкожных тканей:
Частота неизвестна: — тяжелые кожные нежелательные реакции, включая синдром Стивенса-Джонсона (ССД) и токсический эпидермальный некролиз (ТЭН)
Информирование о подозреваемых побочных реакциях
Предоставление информации о подозреваемых побочных реакциях, выявленных после регистрации, имеет большое значение, так как позволяет проводить постоянный мониторинг баланса пользы и риска лекарственного средства. Сообщить о любых подозреваемых побочных реакциях специалисты области здравоохранения могут посредством национальной системы информирования.
Специфического антидота для ингибирования EGFR (Еrb1) и/или HER2(ErbB2) фосфорилирования тирозина нет. Максимальная доза лапатиниба, которая принималась внутрь в ходе клинических исследований, составляла 1800 мг один раз в сутки.
Бессимптомные случаи передозировки и передозировки, проявляющиеся симптомами, отмечались у пациентов, принимавших лапатиниб. У пациентов, принявших до 5000 мг лапатиниба, наблюдавшиеся симптомы представляли собой известные побочные реакции лапатиниба, и в некоторых случаях наблюдались изъязвления кожи и/или поражение слизистой оболочки. В единичном случае, когда пациент принял 9000 мг Тайверба, наблюдалась синусовая тахикардия (тем не менее, с нормальной ЭКГ).
Лапатиниб выводится почками в незначительной степени и имеет высокую степень связывания с белками плазмы, поэтому гемодиализ не является эффективным методом выведения лапатиниба. Дальнейшее лечение представляет собой симптоматическую терапию или, если применимо, должно соответствовать принятым рекомендациям.
Воздействие других лекарственных средств на лапатиниб
Лапатиниб подвергается интенсивному метаболизму, главным образом изоферментами CYP3A4.
У здоровых добровольцев, получающих кетоконазол (мощный ингибитор изофермента CYP3A4) в дозе 200 мг 2 раза/сут в течение 7 дней, системное воздействие лапатиниба (100 мг/сут) увеличивалось примерно в 3,6 раза, период полувыведения в 1,7 раза. Следует избегать совместного применения Тайверба с мощными ингибиторами CYP3A4 (ритонавир, саквинавир, телитромицин, кетоконазол, итраконазол, вориконазол, позаконазол, нефазодон). Следует с осторожностью применять Тайверб в сочетании с умеренными ингибиторами CYP3A4 при тщательном мониторинге побочных реакций.
У здоровых добровольцев, получающих карбамазепин (индуктор изофермента CYP3A4) в дозе 100 мг 2 раза/сут в течение 3 дней и 200 мг 2 раза/сут в течение 17 дней, системное воздействие лапатиниба снижалось на 72%. Следует избегать комбинированной терапии Тайвербом с известными индукторами CYP3A4 (рифампицин, рифабутин, карбамазепин, фенитоин или зверобой продырявленный).
Лапатиниб является субстратом транспортных белков Pgp и BCRP. Ингибиторы (кетоконазол, итраконазол, квинидин, верапамил, циклоспорин, эритромицин) и индукторы (рифампицин, зверобой продырявленный) этих белков могут изменять воздействие и/или распределение лапатиниба.
Растворимость лапатиниба зависит от pH. Следует избегать совместного применения препарата с веществами, увеличивающими pH желудочного сока, в связи с возможностью снижения растворимости и абсорбции лапатиниба. Предшествующее лечение ингибитором протонового насоса (эзомепразол) снижало воздействие лапатиниба в среднем на 27% (в диапазоне от 6% до 49%). Данный эффект снижается с увеличением возраста приблизительно с 40 до 60 лет.
Воздействие лапатиниба на другие лекарственные средства
Лапатиниб ингибирует in vitro изофермент CYP3A4 в клинически значимых концентрациях. Одновременное применение лапатиниба с перорально назначаемым мидазоламом приводит к повышению AUC мидазолама примерно на 45%. При внутривенном введении мидазолама не обнаруживалось клинически значимого повышения AUC. Следует избегать одновременного назначения лапатиниба с перорально назначаемыми препаратами с узким терапевтическим диапазоном, являющимися субстратами изофермента CYP3A4 (цизаприд, пимозид, квинидин).
Лапатиниб ингибирует CYP2C8 in vitro в клинически значимых концентрациях. Следует избегать назначения лапатиниба при одновременном применении с препаратами с узким терапевтическим диапазоном, которые являются субстратами CYP2C8 (репаглинид).
Одновременное применение лапатиниба с внутривенно вводимым паклитакселом повышает воздействие паклитаксела на 23% в связи с ингибированием лапатинибом CYP2C8 и/или Р- гликопротеина (Рgp). Повышение частоты встречаемости и выраженности диареи и нейтропении наблюдалось при использовании комбинации лапатиниба и паклитаксела в клинических исследованиях. Рекомендуется с осторожностью назначать лапатиниб совместно с паклитакселом.
Одновременное применение лапатиниба с внутривенно вводимым доцетакселом не оказывало значительного влияния на AUC или Сmах каких-либо активных веществ. Однако отмечалось повышение частоты возникновения вызванной доцетакселом нейтропении.
Одновременное применение лапатиниба с иринотеканом (при введении в рамках схемы лечения FOLFIRI) приводило к повышению AUC SN-38, активного метаболита иринотекана, примерно на 40%. Точный механизм данного взаимодействия неизвестен, однако предполагается, что он связан с ингибированием одного или нескольких транспортных белков лапатинибом. При совместном применении Тайверба и иринотекана следует проводить тщательный мониторинг побочных реакций и рассмотреть возможность снижения дозы иринотекана.
Лапатиниб ингибирует транспортный белок Pgp in vitro в клинически значимых концентрациях. Одновременное применение лапатиниба с перорально вводимым дигоксином приводит к повышению AUC дигоксина примерно на 80%. Следует с осторожностью назначать лапатиниб при одновременном применении с препаратами с узким терапевтическим диапазоном, которые являются субстратами Рgp. Необходимо рассмотреть вопрос о снижении дозы субстратов Рgp.
Лапатиниб ингибирует транспортные белки BCRP и ОАТР1В1 in vitro. Клиническое значение данного воздействия не изучалось, но не исключено, что лапатиниб может влиять на фармакокинетику субстратов BCRP (например, топотекана) и ОАТР1В1 (например, розувастатина).
Комбинированное применение лапатиниба с капецитабином, летрозолом или трастузумабом не влияет на фармакокинетические параметры этих препаратов (или метаболитов капецитабина) или лапатиниба.
Взаимодействие с пищей и напитками
Биодоступность лапатиниба повышается до четырех раз при приеме пищи, в зависимости от содержания жиров в еде. Кроме того, в зависимости от вида пищи биодоступность лапатиниба приблизительно в 2-3 раза выше при приеме через 1 час после еды по сравнению с назначением за 1 час до первого приема пищи.
Грейпфрутовый сок может ингибировать CYP3A4 в кишечной стенке и увеличивать биодоступность лапатиниба, в связи с чем следует избегать употребления грейпфрутового сока при терапии лапатинибом.
Данные указывают на то, что Тайверб в комбинации с химиотерапией, является менее эффективным, чем трастузумаб в комбинации с химиотерапией. Тайверб не показан для применения в качестве адъювантной терапии.
Кардиотоксичность
При приеме лапатиниба поступали сообщения о снижении фракции выброса левого желудочка. Применение лапатиниба у пациентов с симптомами сердечной недостаточности не оценивалось. Тайверб с осторожностью следует назначать пациентам при наличии факторов, которые могут ослаблять функцию левого желудочка (включая совместное применение с потенциально кардиотоксическими препаратами). Перед началом лечения необходимо оценить сердечную функцию, включая определение фракции выброса левого желудочка, и убедиться в том, что показатели фракции в норме. Контроль фракции выброса левого желудочка должен быть продолжен во время лечения лапатинибом, чтобы исключить его снижение ниже пределов допустимых значений. В некоторых случаях снижение фракции выброса левого желудочка может принимать тяжелую степень и приводить к сердечной недостаточности. Было зафиксировано несколько смертельных случаев, причина наступления смерти точно не установлена. В исследованиях программы клинического развития лапатиниба нарушения со стороны сердца, включая снижение фракции выброса левого желудочка, наблюдались у 1% пациентов. Клинически выраженное снижение фракции выброса левого желудочка проявлялось у 0,3% пациентов, получавших лапатиниб. Однако, когда лапатиниб применялся в комбинации с трастузумабом для лечения метастического рака, частота нарушений со стороны сердца, включая снижение фракции выброса левого желудочка, была выше (7%), чем при монотерапии лапатинибом (2%) в основном исследовании. Нарушения со стороны сердца, зафиксированные в данном исследовании, были сопоставимы по характеру и тяжести с реакциями, которые ранее регистрировались при приеме лапатиниба.
Увеличение продолжительности интервала QTc в зависимости от концентрации лапатиниба наблюдалось в ходе специализированного плацебо-контролируемого перекрестного исследования, проводившегося среди пациентов с распространенными солидными опухолями. Тайверб с осторожностью следует назначать пациентам при наличии факторов, которые могут привести к удлинению QTc (включая гипокалиемию, гипомагниемию, врожденный синдром удлинения интервала QT), при комбинированной терапии с другими лекарственными средствами, которые способствуют удлинению интервала QT, а также при комбинированной терапии с сильными ингибиторами CYP3A4, которые увеличивают воздействие лапатиниба. Гипокалиемия и гипомагниемия должны быть откорректированы до начала лечения. Перед началом применения Тайверба, а также в ходе лечения необходимо проведение электрокардиографии с измерением QT.
Интерстициальная болезнь легких и пневмонит
Имеются сообщения о случаях развития интерстициальной болезни легких и пневмонита в связи с приемом лапатиниба. Пациенты должны находиться под наблюдением на предмет возникновения легочных симптомов (одышка, кашель, повышение температуры тела), свидетельствующих о развитии интерстициальной болезни легких/пневмонита. При возникновении симптомов 3 степени или выше (по классификации нежелательных явлений Национального института США) лечение лапатинибом должно быть прекращено. Легочная токсичность может проявляться в тяжелой форме и приводить к остановке дыхания. Было зафиксировано несколько смертельных случаев, частота смертности не известна.
Диарея
В ходе лечения Тайвербом сообщалось о случаях развития диареи, включая тяжелую диарею. Диарея может представлять угрозу для жизни пациента, если сопровождается дегидратацией, почечной недостаточностью, нейтропенией и/или электролитным дисбалансом. Были зафиксированы случаи с летальным исходом. Как правило, диарея возникает на ранних стадиях лечения Тайвербом, у практически половины пациентов с диареей данная побочная реакция впервые возникает в течение 6 дней после начала лечения и длится в течение 4-5 дней. Диарея, вызванная приемом Тайверба, как правило, легкой степени, в то время как диарея тяжелой степени (3 и 4 по классификации нежелательных явлений Национального онкологического института США) наблюдается у <10% и <1% пациентов, соответственно. Перед началом терапии следует изучить состояние кишечника и определить любые другие симптомы (например, повышение температуры тела, схваткообразная боль, тошнота, рвота, головокружение, чувство жажды), для того, чтобы иметь возможность выявления изменений в ходе лечения, а также определить пациентов с повышенным риском развития диареи. Пациентов следует проинформировать о необходимости немедленно сообщать о любых изменениях в состоянии кишечника. В потенциально тяжелых случаях диареи следует рассмотреть необходимость мониторинга количества нейтрофилов и изменения температуры тела. Важно проводить проактивное лечение диареи с помощью противодиарейных препаратов. При диарее тяжелой степени может потребоваться назначение электролитов и жидкости (перорально или внутривенно), применение антибиотиков, таких как фторхинолоны (в особенности, если диарея длится более 24 часов, у пациента наблюдается лихорадка или нейтропения 3 или 4 степени), а также приостановление приема лапатиниба или отмена препарата.
Тяжелые кожные реакции
Имелись сообщения о тяжелых кожных реакциях при применении лапатиниба. Следует прекратить лечение Тайвербом при подозрении на мультиформную эритему или жизнеугрожающие реакции, такие как синдром Стивенса-Джонсона и токсический эпидермальный некролиз (напр., при наличии прогрессирующей кожной сыпи, часто с блистерами или поражением слизистых) (см. Способ применения и дозы).
Гепатотоксичность
При применении Тайверба были зафиксированы случаи гепатотоксичности, в редких случаях — с летальным исходом. Гепатотоксичность может проявляться через несколько дней или месяцев после начала лечения. Перед началом терапии пациентов следует предупредить о возможной гепатотоксичности.
Необходимо проводить контроль лабораторных показателей функции печени (аминотрансферазы, билирубина и щелочной фосфатазы) до начала терапии, далее ежемесячно в течение курса лечения или по клиническим показаниям. При возникновении тяжелых нарушений функции печени необходима отмена лапатиниба, повторное назначение препарата недопустимо. Пациенты, являющиеся носителями аллелей HLA DQA1*02:01 и DRB1*07:01, подвержены повышенному риску гепатотоксичности, вызванной приемом Тайверба. В большом рандомизированном клиническом исследовании монотерапии Тайвербом (N=1194) общая частота тяжелых поражений печени (уровень АЛТ, более чем в 5 раз превышающий верхнюю границу нормы, степень 3 по классификации Национального онкологического института США) на первом году лечения составила 2,8%. Общая частота данной реакции составила 10,3% у лиц, являющихся носителями аллелей HLA DQA1*02:01 и DRB1*07:01, и 0,5% у пациентов, не являющихся носителями вышеуказанных аллелей. Риск носительства аллелей HLA является схожим (15-25%) в европеиодной, азиатской, африканской и латиноамериканской популяциях, однако ниже (1%) в японской популяции. Тайверб следует с осторожностью назначать пациентам с нарушениями функции печени умеренной и тяжелой степени.
Тайверб рекомендуется с осторожностью назначать пациентам с тяжелыми нарушениями функции почек.
Сопутствующее лечение ингибиторами или индукторами CYP3A4
Следует избегать одновременного приема лапатиниба с индукторами CYP3A4 в связи с риском снижения воздействия лапатиниба.
Следует избегать одновременного приема лапатиниба с мощными ингибиторами изофермента CYP3A4 в связи с риском увеличения воздействия лапатиниба.
При терапии Тайвербом следует избегать употребления грейпфрутового сока.
Следует избегать одновременного приема Тайверба с пероральными лекарственными препаратами с узким терапевтическим диапазоном, являющимися субстратами изофермента CYP3A4 и/или CYP2C8.
Следует избегать одновременного приема лапатиниба с лекарственными препаратами, повышающими pH желудочного сока в связи с возможностью снижения растворимости и абсорбции лапатиниба.
Исходя из механизма действия лапатиниба, нельзя предположить неблагоприятное влияние препарата на способность управлять транспортными средствами и заниматься другими видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. Однако следует принимать во внимание общее состояние пациента и профиль побочных эффектов лапатиниба при принятии решения о способности пациента выполнять вышеуказанные действия.
По 70 таблеток во флаконе из полиэтилена высокой плотности с устройством против вскрытия детьми. Флакон укупорен завинчивающейся крышкой и снабжен мембраной из бумаги и алюминиевой фольги, сополимера этилена и винилацетата, ламинированного на полистирол и полиэтилена. Флакон вместе с инструкцией по применению помещают в картонную пачку.
Хранить при температуре ниже 30° С.
Хранить в недоступном для детей месте!
3 года.
Не использовать после истечения срока годности, указанного на упаковке.
По рецепту
Производитель
С.С. Сандоз С.Р.Л, ул. Ливезени 7А, 540472, Таргу-Муреш, округ Муреш, Румыния/
S.C. Sandoz S.R.L., str. Livezeni nr. 7A, 540472 Targu Mures, Jud. Mures, Romania
За дополнительной информацией обращаться:
Представительство АО «Novartis Pharma Services AG» (Швейцария) в Республике Беларусь 220123 г. Минск, ул. В. Хоружей, 32а.
Тел./факс + 375 17 396 47 66.
При возникновении нежелательных явлений и/или наличии претензий к качеству, пожалуйста, сообщите об этом по тел. +375 (17) 360 03 65 или по электронной почте на адрес druqsafety.cis@novartis.com.
Немного фактов
Тайверб антибластомный средство, относящееся к химиотерапевтическим цитостатическим препаратам. Принцип действия основан на присоединении интермедиатов к дезоксирибонуклеиновой кислоте, которое приводит к нарушению митоза среди раковых клеток. Применяется в онкологической практике при лечении местно-распространенных и метастатических злокачественных новообразований в молочной железе.
Международная классификация болезней (МКБ-10)
Противоопухолевый препарат является ингибитором тирозин-специфичной протеинкиназы. Предназначен для лечения онкологических болезней класса С50 (Злокачественные новообразования молочной железы).
Лекарственная форма и состав
Алкилирующее цитостатическое лекарство выпускается в виде овальных таблеток светло-желтого цвета, на поверхности которых есть маркировка GS XJG. В них содержатся следующие компоненты:
- активное вещество лапатиниб (250.0 мг);
- неактивные вещества поливинилпирролидон, натрий-карбоксиметилкрахмал, гипромеллоза, пищевые добавки Е171 и Е172, оксид железа, макроголь 400, оксиэтилированные сорбитаны, дистиллированная вода, магния стеарат.
Продолговатые таблетки фасуются в серебристые блистеры по 10 штук. В бело-розовой пачке содержится 7 пластин с таблетками и официальной инструкцией по применению антибластомного средства.
Терапевтические свойства
Лапатиниб обратимый ингибитор ферментов подкласса протеинкиназ, относящихся к группе фосфотрансфераз. Обладает специфическим принципом действия по отношению к раковым клеткам. Проникая в железистую ткань, связывается с рецепторами типа ErbB1 и ErbB2, стимулирующими деление и дифференцировку клеток эпителия. За счет этого замедляется митоз раковых клеток, что предупреждает дальнейшее развитие злокачественных новообразований.
В медицинских испытаниях типа in vitro был доказан аддитивный эффект при применении алкилирующего лекарства в сочетании с действующими метаболитами Капецитабина. Компоненты Тайверба сохраняют терапевтическую активность на линиях раковых клеток в железистой ткани при высоких концентрациях Трастузумаба. Из этого следует, что между лигандами ErbB2 отсутствуют факт перекрестной резистентности.
Фармакокинетические свойства
При пероральном приеме антибластомного медпрепарата предельная концентрация лапатиниба в плазме наступает в течение 3-4 часов. Экспозиция возрастает в случае употребления пищи. Скорость всасывания активных компонентов при приеме нежирной пищи увеличивается в 2.5 раза.
Более 90% метаболитов лапатиниба связываются с альбуминами. Расщеплению подвергается под влиянием ферментов типа CYP3A5 и CYP3A4. Число каждого окисленного метаболита не превышает 15%. Продукты распада выводятся из организма вместе с каловыми массами.
В ходе исследований in vitro было установлено, что Тайверб угнетает биосинтез печеночных ферментов CYP2С9, CYP2D6 и т.д. На период полувыведения действующих веществ влияет прием нестероидных противовоспалительных препаратов, а также индукторов CYP3A4.
Условия назначения
Таблетки антибластомного действия используется в терапии пациенток со злокачественными опухолями в молочной железе. Ингибитор тирозинкиназы назначается в следующих случаях:
- комплексное лечение с Капецитабином при метастатических и местно-распространенных раковых опухолях в молочной железе;
- химиотерапия с Трастузумабом при диагностировании гормон-отрицательного и метастатического рака;
- комплексное лечение с ингибиторами ароматазы у пациенток в период менопаузы при наличии гормон-положительного и метастатического рака.
Инструкция не запрещает комбинирование антибластомного средства с Летрозолом в терапии метастазирующих злокачественных новообразований с гиперэкспрессией HER2 у пациенток в период после наступления менопаузы.
Режим дозирования
Рекомендуется принимать таблетки за 50-60 минут до или через 50-60 минут после приема пищи. Дневную дозу лапатиниба нежелательно делить на несколько приемов. В случае пропуска приема таблетки не принимают, т.к. уменьшение интервала между приемами цитостатиков может сопровождаться побочными эффектами.
Дозировка определяется особенностями течения онкологической болезни и распространенностью раковых новообразований:
- местно-распространенные и метастазирующие новообразования с гиперэкспрессией HER2 1250.0 мг в день за один прием в сочетании с Капецитабином;
- гормоночувствительные раковые новообразования с гиперэкспрессией HER2 1500.0 мг в день за один прием в сочетании с ингибиторами ароматазы.
Оптимальная дневная доза ингибиторов ароматазы и Летрозола составляет 2.5 мг за один прием. Прежде чем использовать другие алкилирующие антибластомные медикаменты нужно изучить особенности их дозирования.
Беременность и лактация
Согласно результатам медицинских испытаний на млекопитающих, Тайверб не обладает тератогенной активностью. Однако в 94% случаев он являлся причиной возникновения нарушений во внутриутробном развитии эмбриона. Неизвестно, экскретируются ли метаболиты действующих веществ в грудное молоко.
Противоопухолевые таблетки не назначаются при беременности, а также во время лактации. Это связано с достаточно высоким риском развития пороков у плода, а также замиранием беременности на поздних сроках.
Совместимость с алкоголем
В инструкции не содержится информация о взаимодействии лапатиниба с этанолом. Тем не менее врачи не советуют при прохождении противоопухолевого лечения употреблять алкоголь.
Взаимодействие с медикаментами
Активные компоненты антибластомного средства расщепляются под воздействием фермента CYP3A. В связи с этим индукторы и ингибиторы упомянутого вещества оказывают влияние на фармакокинетические свойства лапатиниба.
При параллельном использовании таблеток с Кетоконазолом и ингибиторами CYP3A системная экспозиция действующих веществ возрастает почти в 4 раза, а период их полувыведения почти в 2 раза. Категорически не рекомендуется комбинировать Тайверб с Нефазодом, Саквинавиром, Итраконазолом и т.д.
Лапатиниб обладает рН-зависимой растворимостью, поэтому при прохождении курса терапии нежелательно использовать медикаменты, которые увеличивают pH желудка. Применение Эзомепразола и других ингибиторов протонного насоса сопровождается резким снижением экспозиции противоопухолевого средства на 28%. Выраженность эффекта у пациентов в возрасте после 40 лет уменьшается.
В терапевтически значимых концентрациях антибластомное лекарство угнетает биосинтез транспортных белков. По этой причине нужно с осторожностью использовать медикаменты с узким фармакотерапевтическим индексом, которые представляют собой подходящий субстрат для белковых соединений типа Pgp.
Особые указания
В ходе медицинских испытаний выяснилось, что цитостатическое средство обладает гепатотоксичностью. При нарушении функций гепатобилиарной системы нужно не реже 1 раза в 1.5 месяца проверять уровень билирубина, печеночных ферментов и щелочной фосфатазы в крови. В случае тяжелых изменений в структуре паренхимы противоопухолевую терапию лапатинибом нужно прекратить.
Фармакокинетические свойства медпрепарата у пациентов с нарушением функций почек не изучена. Вероятность какого-либо влияния почечной недостаточности на фармакокинетику лапатиниба не превышает 5%, т.к. не более 2% метаболитов лекарства выводятся почками.
В первые несколько недель терапии у пациентов часто наблюдаются нарушения стула. Для предупреждения обезвоживания рекомендуется принимать противодиарейные медикаменты. При тяжелом течении диареи назначаются электролиты и лекарства для предотвращения дегидратации.
Применение антибластомного препарата в педиатрической практике запрещено. Связано это с тем, что алкилирующие агенты обладают цитотоксичностью по отношению не только к раковым, но и к здоровым клеткам. Особой чувствительностью к повреждающему эффекту обладают лабильные клетки, из которых состоит костный мозг, слизистая ЖКТ, внутренняя поверхность дыхательных путей, герминативные ткани яичников и т.д. В связи с этим при приеме цитостатиков нередко возникает лейкопения, мукозит, уретрит, снижение фертильности и вторичные иммунодефициты.
Передозировка
Предельная дневная доза антибластомного средства составляет 1800 мг. Превышение указанной дозировки сопровождается ростом концентрации лапатиниба в крови, о чем свидетельствуют такие побочные реакции:
- синусовидная тахикардия;
- астенический синдром;
- полиморфная сыпь на коже;
- воспаление слизистых оболочек.
Гемодиализ никак не сказывается на скорости выведения действующих веществ из организма. Симптоматическое лечение должно проводиться под наблюдением специалиста.
Побочные реакции
Безопасность противоопухолевого средства определялась как при монотерапии, так и в случае параллельного использования Капецитабина. Чаще всего нежелательные эффекты возникают со стороны кожи, ЖКТ, сердечно-сосудистой, иммунной и дыхательной систем:
- сердечная недостаточность;
- пневмонит;
- нарушение сердечного ритма;
- рвотные позывы;
- жидкий стул;
- гипербилирубинемия;
- акнеморфный дерматит;
- анафилаксия;
- алопеция;
- хроническая усталость;
- диспепсия;
- носовые кровотечения.
В комбинации с Летрозом частота обострения побочных реакций увеличивается на 5-7%. Наиболее тяжелые осложнения возникают при сочетанном использовании лекарства с ингибиторами ароматазы.
Противопоказания
Категорически не рекомендуется применять алкилирующий медпрепарат при повышенной чувствительности к лапатинибу. Аллергия может сопровождаться ангионевротическим отеком тканей, дыхательной недостаточностью и образованием экссудативных пузырьков на поверхности тела.
С осторожностью назначают антибластомные таблетки при органическом поражении паренхимы и желчного пузыря. При назначении лапатиниба людям в возрасте от 60 лет нужно не менее 1 раза в месяц проходить комплексное обследование у врача и делать биохимический анализ крови.
Аналоги
Аналогами Тайверба являются алкилирующие средства, которые применяются в терапии раковых заболеваний молочной железы:
- Холоксан;
- Ломустин;
- Мелфалан;
- Лейкеран;
- Цитоксан;
- Тиотепа-Тиоплекс;
- Эндоксан.
В состав вышеперечисленных медикаментов входят алкилирующие цитостатические агенты, которые повреждают ДНК раковых клеток. В связи с этим нарушается митоз и, как следствие, процесс разрастания злокачественных новообразований в железистых тканях.
Условия продажи и хранения
Противоопухолевое цитостатическое средство отпускается по предписанию врача-онколога. Срок годности таблеток в оригинальной блистерной упаковке составляет 24 месяца с момента производства. Хранить их нужно в сухом и недоступном для маленьких детей месте при температуре до 30 градусов по Цельсию.
Цены на Тайверб в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 34 000 руб.
Сертификаты и лицензии
 |
Международное непатентованное название? Лапатиниб |
 |
Действующее вещество: Лапатиниб 250,0 мг.Вспомогательные вещества: целлюлоза микрокристаллическая — 387,0 мг, повидон КЗО — 58,5 мг, карбоксиметилкрахмал натрия (тип А) — 40,5 мг, магния стеарат — 9,0 мг. |
 |
Противоопухолевые средства — ингибиторы протеинкиназы |
 |
ПроизводителиГлаксо Вэллком Оперэйшенс/Глаксо Вэллком(Великобритания), С.К. Сандоз(Румыния), Глаксо Вэллком Оперэйш(Великобритания) |
 |
Показания к применению Тайверб таблетки 250мгМестно-распространенный или метастатический рак молочной железы с гиперэкспрессией HER2/neu (ErbB2): в комбинации с капецитабином у пациентов, получавших ранее антрациклины и таксаны, с прогрессированием на фоне или после терапии трастузумабом, применявшейся по поводу метастатического рака молочной железы.Метастатический рак молочной железы с гиперэкспрессией HER2/neu (ЕгЬВ2): в комбинации с трастузумабом у пациентов с отсутствием экспрессии гормональных рецепторов, с прогрессированием на фоне или после терапии трастузумабом в комбинации с химиотерапией, применявшейся по поводу метастатического рака молочной железы.Метастатический гормонозависимый рак молочной железы с гиперэкспрессией HER2/neu (ErbB2): в комбинации с ингибитором ароматазы у пациенток в постменопаузе. |
 |
Способ применения и дозировка Тайверб таблетки 250мгПрепарат Тайверб следует принимать не позднее чем за 1 час до еды или не ранее чем через 1 час после еды. Рекомендуемую суточную дозу не следует делить на несколько приемов. Не следует принимать пропущенные дозы лапатиниба, прием препарата необходимо возобновить со следующей планируемой суточной дозой. Местно-распространенный или метастатический рак молочной железы с гиперэкспрессией HER2В комбинации с капецитабином. Рекомендуемая доза лапатиниба составляет 1250 мг (пять таблеток) 1 раз в сутки. Рекомендуемая доза капецитабина 2000 мг/кв.м/сут, в 2 приема (каждые 12 часов) ежедневно с 1 по 14 день каждого 21-дневного цикла терапии. Рекомендуется принимать капецитабин с пищей или в течение 30 мин после приема пищи.В комбинации с трастузумабом. Рекомендуемая доза лапатиниба составляет 1000 мг (четыре таблетки) 1 раз в сутки в комбинации с трастузумабом. Рекомендуемая доза трастузумаба 4 мг/кг, в виде внутривенной нагрузочной дозы, затем 2 мг/кг внутривенно 1 раз в неделю.В комбинации с ингибитором ароматазы. Рекомендуемая доза лапатиниба составляет 1500 мг (шесть таблеток) 1 раз в сутки в комбинации с ингибитором ароматазы. Рекомендуемая доза летрозола, ингибитора ароматазы, в составе комбинированной терапии с лапатинибом составляет 2,5 мг 1 раз в сутки.При комбинированной терапии с другим препаратом — ингибитором ароматазы, необходимо изучить режим дозирования соответствующего препарата данной группы.Приостановление приема лапатиниба или уменьшение дозы (все показания). Нарушения со стороны сердечно-сосудистой системы.Необходимо прекратить терапию препаратом в случае появления симптомов, ассоциированных со снижением величины ФВЛЖ до 3 степени и более (согласно стандартным терминологическим критериям оценки нежелательных явлений Национального института онкологии США, NCI СТСАЕ), или при снижении данной величины ниже допустимых пределов нормы. Возможно восстановление терапии препаратом в уменьшенной дозе (снижение с 1000 мг/сут до 750 мг/сут, с 1250 мг/сут до 1000 мг/сут или с 1500 мг/сут до 1250 мг/сут) не ранее чем через 2 недели при условии нормализации величины ФВЛЖ и купирования симптомов. По доступным на данный момент данным большинство случаев снижения ФВЛЖ отмечается в первые 12 недель терапии препаратом, данные по длительной терапии ограничены. Интерстициальная болезнь легких и /или пневмониты. Следует прекратить терапию препаратом при появлении легочных симптомов, свидетельствующих о развитии интерстициальной болезни легких и/или пневмонита 3-й степени и выше (согласно NCI СТСАЕ).Диарея. Лечение препаратом следует приостановить у пациентов с диареей 3-й степени (согласно NCI СТСАЕ), либо 1-ой или 2-ой степени, осложненной симптомами (спастические боли в животе от умеренной до тяжелой степени, тошнота или рвота 2-й степени или выше (согласно NCI СТСАЕ), снижение работоспособности, лихорадка, сепсис, нейтропения, появление крови в кале или обезвоживание). При уменьшении выраженности диареи до 1 степени и ниже возможно возобновление терапии лапатинибом в уменьшенной дозе (снижение с 1000 мг/сут до 750 мг/сут, с 1250 мг/сут до 1000 мг/сут или с 1500 мг/сут до 1250 мг/сут). Лечение лапатинибом следует прекратить полностью у пациентов с диареей 4-й степени (согласно NCI СТСАЕ).Тяжелые кожные реакции. Лечение лапатинибом следует прекратить при развитии тяжелой прогрессирующей кожной сыпи с волдырями или поражением слизистых оболочек.Прочие проявления токсичности препарата. При развитии иных проявлении токсичности 2 степени или выше согласно NCI СТСАЕ следует рассмотреть возможность приостановления или прекращения терапии препаратом. При уменьшении выраженности степени проявлений токсичности до 1 степени и менее согласно NCI СТСАЕ возможно возобновление терапии в стандартной дозе (1000 мг/сут, 1250 мг/сут или 1500 мг/сут). При повторном развитии проявлений токсичности возобновлять терапию препаратом следует в уменьшенной дозе (сниженной с 1000 мг/сут до 750 мг/сут, с 1250 мг/сут до 1000 мг/сут или с 1500 мг/сут до 1250 мг/сут).Особые группы пациентов. Дети. Нет опыта применения.Пациенты пожилого возраста. Недостаточно данных о применении лапатиниба у пациентов старше 65 лет. Пациенты с нарушением функции почек: Нет опыта применения лапатиниба у пациентов с тяжелыми нарушениями функции почек, однако маловероятно, что будет требоваться коррекция режима дозирования в связи с тем, что менее 2 % введенной дозы (в виде лапатиниба или метаболитов) выводится почками.Пациенты с нарушением функции печени: Лапатиниб метаболизируется в печени. Нарушение функции печени средней и тяжелой степени ассоциированы с увеличением системной экспозиции на 56% и 85% соответственно. Следует с осторожностью применять лапатиниб у пациентов с нарушением функции печени в связи с повышением системной экспозициилапатиниба. У пациентов с нарушением функции печенитяжелой степени (класс С по классификации Чайлд-Пыо) дозупрепарата необходимо снизить. У пациентов с нарушениемфункции печения тяжелой степени ожидается изменение AUCдо пределов нормы при коррекции дозы с 1250 мг/сут до750 мг/сут или с 1500 мг/сут до 1000 мг/сут. Тем не менее,клинические данные по коррекции дозы лапатиниба у пациентов с нарушением функции печени тяжелой степени отсутствуют. |
 |
Противопоказания Тайверб таблетки 250мгПовышенная чувствительность к лапатинибу или любому другому компоненту препарата. Беременность и период грудного вскармливания. Детский возраст (отсутствие опыта применения).С ОСТОРОЖНОСТЬЮСостояния, которые могут приводить к левожелудочковой недостаточности. Удлинение или риск удлинения интервала QTc,гипокалиемия или гипомагниемия, врожденный синдромом удлинения интервала QT; одновременная терапияантиаритмическими препаратами или другимилекарственными средствами, которые приводят к удлинениюинтервала QT. Нарушение функции печени средней или тяжелойстепени (7 баллов и более по шкале Чайлд-Пью). Возраст старше 65 лет. Нарушение функции почек тяжелой степени. Следует избегать одновременного применения с индукторами или мощными и умеренными ингибиторами изофермента CYP3A4, грейпфрутовым соком. Следует избегать одновременного применения с лекарственными препаратами, являющимися субстратами изоферментов CYP3A4 и CYP2C8 с узким терапевтическим диапазоном. Следует избегать одновременной терапии лекарственными препаратами, повышающими pH желудочного сока (снижение растворимости и абсорбции лапатиниба).ПРИМЕНЕНИЕ ПРИ БЕРЕМЕННОСТИ И В ПЕРИОД ГРУДНОГО ВСКАРМЛИВАНИЯ. Беременность. Не проводилось соответствующих и хорошо контролируемых исследований применения лапатиниба во время беременности.Влияние лапатиниба на плод неизвестно. Пациенткам с сохраненным репродуктивным потенциалом следует использовать надежные способы контрацепции, а также избегатьнаступления беременности в период лечения лапатинибом.Лапатиниб не обладал тератогенными свойствами в исследованиях у животных, однако вызывал возникновение незначительных пороков развития при применении в дозах, токсичных для материнского организма.Период грудного вскармливания. Неизвестно, проникает ли лапатиниб в грудное молоко. В связи с тем, что многие препараты поступают в грудное молоко, во время терапии лапатинибом рекомендовано прекратить грудноевскармливание из-за возможного возникновения характерныхнежелательных реакций у грудного ребенка. |
 |
Фармакологическое действиеПротивоопухолевое средство. Фармакодинамика. Лапатиниб — новый мощный обратимый селективный ингибиторвнутриклеточной тирозинкиназы, связывающийся с рецепторамиEGFR (epidermal growth factor receptor, рецептор эпидермальногофактора роста, ErbBI) и рецепторами HER2 (human epidermal growth factor receptor, рецептор эпидермального фактора ростачеловека, ЕгЬВ2), характеризующийся медленной диссоциацией с данными рецепторами (период полудиссоциацин равен 300 минили более). По сравнению с другими изученными ингибиторамитирозинкиназы лапатиниб характеризуется более медленнойдиссоциацией с рецепторами. Лапатиниб ингибирует рост опухолевых клеток, инициированный влиянием ЕгЬВ, как invitro, так и у различных животных моделей. Помимо собственной активности in vitro лапатиниб продемонстрировал аддитивный эффект при комбинированном применении с 5-фторурацилом (активным метаболитом капецитабина) в четырех линиях опухолевых клеток. Комбинация лапатиниба и трастузумаба может обеспечить взаимодополняемый механизм действия, а также возможные неперекрестные механизмы преодоления резистентности к анти- HER2 терапии. Ингибирующие эффекты лапатиниба изучены в клеточных моделях, подвергшихся воздействию трастузумаба. Лапатиниб сохранял значительную активность при изучении долгосрочного роста линий НЕЯ2-позитивных опухолевых клеток в средах, содержащих трастузумаб, и в комбинации с трастузумабом проявлял в данных клеточных линиях синергичное действие. Эти результаты демонстрируют отсутствие перекрестной резистентности между двумя лигандами рецептора HER2 (ЕгЬВ2).Фармакодинамические эффекты. Влияние лапатиниба на длину интервала QT оценено в перекрестном клиническом исследовании при применении трех доз лапатиниба по 2000 мг после приема трех последовательных доз плацебо с 12-часовым интервалом между приемом каждой дозы. Максимальное среднее отклонение интервала QTcF отмечалось через 10 часов после приема последней дозы лапатиниба и составляло в оцениваемой популяции 8,75 мс (4,08 — 13,42 мс, 90% доверительный интервал). Данные, полученные в данной популяции, соответствуют полученным в популяции изучения фармакодинамики, в котором максимальное среднее отклонение интервала QTcF составляло 7,91 мс (4,13 — 11,68 мс, 90% доверительный интервал). Данные фармакокинетического и фармакодинамического анализа подтверждают зависимость величины отклонения интервала QTcF от концентрации лапатиниба в плазме крови. Фармакокинетика. Всасывание. Всасывание лапатиниба после приема внутрь неполное и варьирует с коэффициентом вариабельности площади подфармакокинетической кривой «концентрация — время» (AUC) от 50% до 100%. Лапатиниб определяется в системном кровотоке в среднем через 0,25 часа (диапазон 0-1,5 ч). Максимальная концентрация лапатиниба в плазме крови (Смах) достигается примерно через 4 часа после приема. Смах в равновесном состоянии при ежедневном приеме 1250 мг составляет в среднем 2,43 (1,57-3,77) мкг/мл, a AUC — 36,2 (23,4- 56,0) мкг х час / мл. Системная экспозиция лапатиниба увеличивается при приеме препарата одновременно с пищей. При приеме с пищей с низким (5 % жира или 500 калорий) или высоким (50 % жира или 1000 калорий) содержанием жиров AUC возрастает в 3 и 4 раза (Смах — приблизительно в 2,5 и 3 раза), соответственно.Распределение. Лапатиниб обладает высокой степенью связывания (более чем 99%) с альбумином и альфа1кислым гликопротеином плазмы крови. Исследования in vitro показали, что лапатиниб является субстратом для переносчиков BCRP (белок резистентности рака молочной железы, ABCG2 — АТФ-связывающий кассетный транспортер G2) и Р-гликопротеина (АВСВ1 АТФ-связывающий кассетный транспортер В1). Также in vitro лапатиниб оказывал ингибирующий эффект в отношении данных переносчиков. Клиническое значение этих эффектов и влияние на фармакокинетику других препаратов, а также препаратов, обладающих противоопухолевой активностью, пока неизвестно. Лапатиниб незначительно ингибирует активность переносчика органических анионов (ОАТ) или переносчика органических катионов (ОСТ). Метаболизм. Лапатиниб подвергается интенсивному метаболизму главнымобразом изоферментами CYP3A4 и CYP3A5 с минимальнымучастием изоферментов CYP2C19 и CYP2C8 с образованием различных окисленных метаболитов, на долю каждого из которыхприходится не более 14% дозы, выводимой через кишечник, или 10% концентрации в плазме крови. Лапатиниб в клинически значимых концентрациях ингибирует изоферменты CYP3A и CYP2C8 in vitro и незначительно ингибирует следующие микросомальные ферменты печени: CYP1A2, CYP2C9, CYP2C19 и CYP2D6 или уридиндифосфатглюкоронозилтрансферазу (УГТ).Выведение. Период полувыведения лапатиниба увеличивается дозозависимо при приеме однократных доз. Равновесное состояние достигается через 6-7 суток приема лапатиниба, период полувыведения равновесного состояния составляет 24 часа. Лапатиниб в основном выводится через кишечник: в среднем 27 % (от 3 % до 67 %) в неизмененном виде, менее 2 % принятой дозы выводится почками в неизмененном виде и в виде метаболитов. Особые группы пациентов.Пациенты с нарушением функции почек. Фармакокинетика лапатиниба у пациентов с нарушением функции почек или пациентов, находящихся на гемодиализе, специально не изучалась. Однако маловероятно влияние нарушения функции почек на фармакокинетику лапатиниба, т.к. почками выводится менее 2 % введенной дозы (в виде лапатиниба и его метаболитов). Пациенты с нарушением функции печени. Фармакокинетику лапатиниба изучали у пациентов с нарушением функции печени средней и тяжелой степени. AUC лапатиниба после приема однократной дозы 100 мг внутрь увеличивается приблизительно на 56% и 85% у пациентов с нарушением функции печени средней и тяжелой степени. |
 |
Побочное действие Тайверб таблетки 250мгБезопасность лапатиниба оценена в ходе клиническихисследований как при монотерапии, так и при применении вкомбинации, в том числе с трастузумабом, капецитабином илетрозолом. Нежелательные явления (НЯ) перечисленыв соответствии с поражением органов, систем органов и частотойвстречаемости. Частота встречаемости определяется следующим образом: очень часто (>1/10), часто (>1/100 и <1/10), нечасто (>1/1000 и <1/100), редко (>1/10 000 и <1/1000), очень редко (<1/10 000, включая отдельные случаи). Монотерапия лапатинибом.Нарушения со стороны обмена веществ и питани: очень часто анорексия.Нарушения со стороны сердца: часто снижение ФВЛЖ отмечалось приблизительно у 1% пациентов, получавших лапатиниб, и протекало бессимптомно более чем в 70% случаев. Нормализация или улучшение данного показателя наблюдалось более чем в 70% случаев после прекращения терапии препаратом. Снижение ФВЛЖ, сопровождавшееся симптомами, наблюдалось приблизительно у 0,3% пациентов, получавших лапатиниб. НЯ, наблюдавшиеся при этом, включали одышку, сердечную недостаточность и ощущение «сердцебиения».Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: нечасто интерстициальная болезнь легких / пневмонит.Нарушения со стороны желудочно-кишечного тракта: очень часто диарея, которая может приводить к дегидратации (вбольшинстве случаев отмечена диарея 1-й или 2-й степени), тошнота, рвота.Нарушения со стороны печени и желчевыводящих путей: нечасто гипербилирубинемия, гепатотоксичность. Повышение концентрации билирубина возможно вследствие угнетения лапатинибом конъюгации в печени ОАТР1В1 (полипептид, переносящий органические анионы 1В1) или угнетения выделения билирубина с желчью посредством Р-гликопротеина (Pgp) или BCRP.Нарушения со стороны кожи и подкожных тканей: очень часто кожная сыпь (включая акнеформный дерматит); часто поражение ногтей, включая паронихию.Нарушения со стороны иммунной системы: редко реакции гиперчувствительности, включая анафилаксию.Общие расстройства и нарушения в месте введения: очень часто слабость.Комбинированная терапия с капецитабином. Дополнительно к НЯ, наблюдавшимся на фоне монотерапии лапатинибом, следующие НЯ наблюдались на фоне применения лапатиниба в комбинации с капецитабином с частотой более 5% чем в мопотерапни капецитабином.Нарушения со стороны желудочно-кишечного тракта: очень часто диспепсия.Нарушения со стороны кожи и подкожных тканей: очень часто сухость кожи.НЯ, наблюдавшиеся при применении лапатиниба в комбинации скапецитабином с той же частотой, что и при монотерапиикапецитабином.Нарушения со стороны желудочно-кишечного тракта:очень часто стоматит, запор, боль в животе.Нарушения со стороны кожи и подкожных тканей: очень часто синдром ладонно-подошвенной эритродизэстезии.Нарушения со стороны скелетно-мышечной и соединительной ткани: очень часто боль в конечностях, боль в спине.Нарушения со стороны нервной системы: часто головная боль.Нарушения со стороны психики: очень часто бессонница.Общие расстройства и нарушения в месте введения: очень часто воспаление слизистой оболочки полости рта.Комбинированная терапия с трастузумабом. При применении лапатиниба в комбинации с трастузумабом дополнительных нежелательных явлений, связанных с лапатинибом, отмечено не было. Отмечено увеличение частоты встречаемости явлений кардиотоксичности, однако характер и тяжесть данных НЯ были сравнимы с аналогичными данными, полученными в клинических исследованиях лапатиниба.Комбинированная терапия с летрозолом. Дополнительно к НЯ, наблюдающимся на фоне монотерапии лапатинибом, следующие НЯ наблюдались при применении лапатиниба в комбинации с летрозолом с частотой более 5% чем в монотерапии летрозолом.Нарушения со стороны дыхательной системы, органов грудной клетки и средостения: очень часто носовое кровотечение.Нарушения со стороны кожи и подкожных тканей: очень часто алопеция, сухость кожи.При применении препарата Тайверб в клинической практике в пострегистрационном периоде, в спонтанных сообщениях и в литературных источниках сообщалось о следующих НЯ (в связи с тем, что спонтанные сообщения о НЯ поступают в добровольном порядке из популяции неопределенного размера, для данных реакций использована категория «частота неизвестна». НЯ сгруппированы в соответствии с классификацией органов и систем органов MedDRA.Нарушения со стороны сердца: желудочковая аритмия, желудочковая тахикардия типа «пируэт». Удлинение интервала QT по данным электрокардиографии (ЭКГ)Нарушения со стороны кожи и подкожных тканей: тяжелые нежелательные явления со стороны кожи, включая синдром Стивенса-Джонсона и токсический эпидермальный некролиз.В клинических исследованиях лапагиниба НЯ со стороны сердца, включая уменьшение ФВЛЖ, отмечались приблизительно у 1% пациентов. Уменьшение ФВЛЖ, сопровождающееся симптомами, отмечено менее, чем у 0,3% пациентов, получавших лапатиниб. В клинических исследованиях при применении препарата в комбинации с трастузумабом по поводу метастатического рака НЯ со стороны сердца, включая уменьшение ФВЛЖ, отмечены у 7% пациентов но сравнению с монотерапией лапатннибом (2% пациентов). Характер и степень тяжести данных НЯ сравнимы с аналогичными данными, полученными в исследовании монотерапии лапатинибом. |
 |
ПередозировкаНе существует специфического антидота для ингибированияфосфорилирования тирозина EGFR (ERbBl) и/или HER2/neu(ERbB2). Максимальная суточная доза в клинических исследованиях составляла 1800 мг внутрь. В клинических исследованиях показано, что более частый приемпрепарата может приводить к увеличению концентрациилапатиниба в сыворотке крови, поэтому не следует приниматьпропущенные дозы, уменьшая интервал между приемами. Прием препарата необходимо возобновлять, начиная со следующей запланированной суточной дозы.Симптомы. У пациентов, получавших терапию лапатинибом, отмечались как бессимптомные случаи передозировки, а также и случаи, сопровождавшиеся симптомами. Наблюдавшиеся симптомы соответствовали изученным побочным явлениям лапатиниба, и в некоторых случаях включали изъязвление кожи головы, синусовую тахикардию (ЭКГ в пределах нормы по остальным параметрам) и/или поражение слизистой оболочки.Лечение. Симптоматическая терапия. Выведение лапатиниба почками незначительно в связи с высокой степенью связывания белками плазмы крови в связи с чем ожидается, что гемодиализ будет неэффективен для ускорения выведения лапатиниба.Дальнейшее лечение следует проводить по клиническимпоказаниям или в соответствии с местными клиническимирекомендациями. |
 |
Взаимодействие Тайверб таблетки 250мгМетаболизм лапатиниба осуществляется главным образом сучастием изофермента CYP3A. Ингибиторы или индукторы изофермента CYP3A могут влиять на фармакокинетику лапатиниба. При одновременном применении лапатиниба и некоторых ингибиторов изофермента CYP3A4 , например кетоконазола, итраконазола, грейпфрутового сока, необходимо соблюдать осторожность и тщательно контролировать клиническое состояние пациента и развитие возможных НЯ. У здоровых добровольцев, получающих кетоконазол (ингибитор нзофермента CYP3A4) в дозе 200 мг 2 раза/суг в течение 7 дней, системная экспозиция лапатиниба увеличивалась примерно в 3,6 раза, период полувыведения — в 1,7 раза. При необходимости одновременного применения мощного ингибитора изофермента CYP3A4 следует рассмотреть возможность уменьшения дозы лапатиниба до 500 мг/сут, что приведет к изменению AUC до величины, соответствующей применению лапатиниба без ингибиторов указанного изофермента. В настоящее время нет клинических данных о применении лапатиниба при такой коррекции дозы у пациентов, получающих мощный ингибитор изофермента CYP3A4. При отмене одновременной терапии обратное увеличение дозы лапатиниба до рекомендованной следует проводить только через 1 неделю после отмены для обеспечения полного выведения мощного ингибитора изоферменга CYP3A4 из организма.При одновременном применении лапатиниба и известных индукторов изофермента CYP3A4 (например, рифампицина,карбамазепина, фенитоина, зверобоя продырявленного) необходимо соблюдать осторожность и тщательно контролировать клиническое состояние пациента и развитие возможных НЯ. У здоровых добровольцев, получающих карбамазепин (индуктор изофермента CYP3A4) в дозе 100 мг 2 раза/сут в течение 3 дней и 200 мг 2 раза/сут в течение 17 дней, системная экспозиция лапатиниба снижалась на 72%. При необходимости одновременного применения мощного индуктора изофермента CYP3A4 дозу лапатиниба необходимо подбирать, основываясь на переносимости, постепенно повышая ее с 1250 мг/сут до 4500 мг/сут или с 1500мг/сут до 5500 мг/сут. Ожидается, что указанная коррекция дозы приведет к изменению AUC до величины, соответствующей применению лапатиниба без индукторов изофермента CYP3A4. В настоящее время, однако, нет клинических данных о применении лапатиниба у пациентов, получающих мощный индуктор изофермента CYP3A4. При отмене индукторов изофермента CYP3A4 обратное уменьшение дозы лапатиниба до рекомендованной следует проводить в течение 2 недель. Растворимость лапатиниба зависит от pH. Следует избегать одновременного применения веществ, увеличивающих pH желудочного сока, так как растворимость и всасывание лапатиниба может уменьшаться. Ранее проводимое лечение ингибитором протонной помпы (например, эзомепразолом) снижало экспозицию лапатиниба в среднем на 27% (в пределах от 6% до 49%). Этот эффект уменьшается с увеличением возраста примерно от 40 лет до 60 лет. В связи с вышесказанным следует с осторожностью применять препарат у пациентов, принимающих ингибиторы протонной помпы. Лапатиниб ингибирует in vitro изофермент CYP3A4 в клинически значимых концентрациях. Одновременное применение лапатиниба с мидазоламом при приеме последнего внутрь приводит к повышению AUC мидазолама примерно на 45%. При в/в введении мидазолама не обнаруживалось клинически значимого увеличения AUC. Необходима осторожность при одновременном применении лапатиниба с препаратами для перорального приема с узким терапевтическим диапазоном, являющимися субстратами изофермента CYP3A4. Лапатиниб ингибирует изофермент CYP2C8 in vitro в клиническизначимых концентрациях. Следует с осторожностью применятьлапатиниб одновременно с препаратами, которые являютсясубстратами изофермента CYP2C8, с узким терапевтическимдиапазоном. Одновременное в/в применение паклитаксела с лапатинибом приводит к увеличению экспозиции паклитаксела на 23%, что обусловлено ингибированием изофермента CYP2C8 и/или Pgp лапатинибом. В клинических исследованиях при применении лапатиниба с паклитакселом отмечено увеличение частоты и степени тяжести диареи и нейтропении. Следует соблюдать осторожность при одновременном применении препарата с паклитакселом. При одновременном применении доцетаксела в/в и лапатиниба не отмечено изменения AUC или Смах обоих действующих веществ, при этом отмечено увеличение частоты развития нейтропении, индуцированной доцетакселом. Одновременное применение лапатиниба с иринотеканом (при введении в рамках схемы лечения FOLFIRI) приводило к повышению AUC активного метаболита иринотекана, SN-38, примерно на 40 %. Точный механизм данного взаимодействия неизвестен. Рекомендуется с осторожностью применять лапатиниб одновременно с иринотеканом. Лапатиниб является субстратом для транспортных белков Pgp и BCRP. Ингибиторы и индукторы данных белков могут изменять активность и/или распределение лапатиниба. Лапатиниб ингибирует транспортный белок Pgp in vitro в клинически значимых концентрациях. Одновременное применение лапатиниба с дигоксином приводит к повышению AUC дигоксина примерно на 98 %. Следует с осторожностью применять лапатиниб при одновременном применении с препаратами с узким терапевтическим диапазоном, которые являются субстратами Pgp с узким терапевтическим диапазоном.Лапатиниб ингибирует транспортные белки BCRP и ОАТР1В1 in vitro. Клиническое значение данных эффектов не изучалось, но не исключено, что лапатиниб может влиять на фармакокинетику субстратов BCRP (например, топотекана) и ОАТР1В1 (например,розувастатина). Применение лапатиниба в комбинации с капецитабином, летрозолом или трастузумабом не влияет на фармакокинетические параметры указанных препаратов. Биодоступность лапатиниба зависит от приема пищи. |
 |
Особые указанияЛечение препаратом должен начинать и проводить только врачс опытом применения противоопухолевых препаратов. Кардиотоксичность. Зарегистрированы сообщения о случаях снижения ФВЛЖ в связи с приемом лапатиниба. Следует соблюдать осторожность при применении препарата у пациентов с заболеваниями, которые могут вызывать нарушения функции левого желудочка. Перед началом применения препарата следует определить величину ФВЛЖ удостоверившись, что исходное значение ФВЛЖ находится в допустимых пределах нормы. Следует проводить контроль ФВЛЖ на всем протяжении терапии препаратом для предотвращения снижения данной величины ниже допустимых границ нормы. В перекрестном клиническом исследовании у пациентов с распространенными солидными опухолями отмечалось увеличение интервала QTc, зависящее от концентрации лапатиниба. Следует соблюдать осторожность при применении препарата у пациентов с удлинением или риском удлинения интервала QTc,а также у пациентов с гипокалиемией или гипомагниемией,врожденным синдромом удлинения интервала QT; пациентов,принимающих антиаритмические препараты или другиелекарственные средства, которые приводят к удлинению интервала QT. Перед применением препарата следует скорректировать гипокалиемию, гипокальциемию или гипомагниемию.Интерстициальная болезнь легких и пневмонит. Прием лапатиниба был ассоциирован с сообщениями обинтерстициальной болезни легких и пневмоните. Следуеттщательно наблюдать пациента с целью выявления симптомов,свидетельствующих о развитии интерстициальной болезни легкихи/или пневмонита. Диарея. Имеются сообщения о случаях диареи, в том числе тяжелой степени, на фоне терапии лапатинибом. Диарея может носить тяжелый характер, были описаны случаи со смертельным исходом. Как правило, диарея возникала на ранних этапах лечения лапатинибом, при этом почти у половины таких пациентов состояние развивалось в течение первых 6 дней, продолжительность явления как правило составляет 4-5 дней. Диарея, индуцированная приемом лапатиниба, как правило легкой степени, при этом 3 и 4 степень согласно NCI СТСАЕ отмечались менее, чем у 10% и 1% пациентов соответственно. Ранняя диагностика и своевременное лечение имеют большое значение для оптимального контроля данного состояния. Следует проинформировать пациента о необходимости немедленного обращения за медицинской помощью при первых признаках изменения характера дефекации. Коррекцию состояния противодиарейными препаратами (например, лоперамидом) рекомендовано начинать после первого случая неоформленного стула. При диарее тяжелой степени может потребоваться пероральное или внутривенное применение электролитов и жидкости, антибиотиков, таких как фторхинолоны (особенно в случае, если состояние сохраняется более 24 часов при лихорадке или нейтропенин 3-й или 4-й степени), а также приостановление приема или отмена препарата. Тяжелые кожные реакции. Зарегистрированы сообщения о тяжелых кожных реакциях в связи с приемом лапатиниба. При подозрении на развитие мультиформной эритемы или таких жизнеугрожающих состояний, как синдром Стивенса-Джонсона или токсический эпидермальный некролиз (например, прогрессирующей кожной сыпи, сопровождающейся возникновением волдырей, или при вовлечении слизистых оболочек) лечение препаратом следует отменить. Контрацепция. Во время терапии лапатинибом и как минимум в течение 3-х месяцев после ее окончания женщинам и мужчинам необходимо использовать надежные методы контрацепции. Гепатотоксичность. В клинических исследованиях (менее чем у 1% пациентов), а также в пострегистрационном периоде получены сообщения о явлениях гепатотоксичности, таких как увеличение активности аланинаминотрансферазы (АЛТ) или аспартатаминотрансферазы (ACT) в 3 раза выше верхней границы нормы или увеличение концентрации билирубина в 1,5 раза выше верхней границы нормы. Состояние может носить тяжелый характер, отмечены случаи с летальным исходом, четкая причинно-следственная связь с приемом лапатиниба не установлена. Состояние может развиваться в период от нескольких дней до нескольких месяцев после начала терапии. Необходимо проводить контроль лабораторных показателей функции печени (трансаминазы, билирубин и щелочная фосфатаза) до начала терапии, и далее каждые 4- 6 недель в течение курса лечения и по клиническим показаниям. При развитии нарушения функции печени тяжелой степени терапию препаратом следует отменить без повторного возобновления. У пациентов, являющихся носителями аллелей HLA DQA1 *02:01 и DRB1 *07:01, повышен риск возникновения гепатотоксичности, связанной с применением лапатиниба. У пациентов, получавших монотерапию лапатинибом, общий риск развития нарушения функции печени тяжелой степени (активность АЛТ более чем в 5 раз, превышающая верхнюю границу нормы, что соответствует 3-ей степени согласно NCI СТСАЕ) составлял 2%, при этом у носителей аллелей DQA1*02:01 и DRB1*07:01 риск развития данного состояния был выше (около 8%), чем у пациентов, не являющихся носителями данных аллелей (0,5%). Носительство аллели HLA распространено среди представителей (от 15% до 25%) европеоидной, азиатской, африканской и латиноамериканской популяции, и ниже (1%) в японской популяции. У пациентов с нарушением функции печени тяжелой степени в анамнезе препарат следует применять в уменьшенной дозе. При развитии гепатотокснчносги тяжелой степени на фоне терапии лапатинибом препарат следует отменить без повторноговозобновления терапии.ВЛИЯНИЕ НА СПОСОБНОСТЬ УПРАВЛЯТЬ ТРАНСПОРТНЫМИСРЕДСТВАМИ, МЕХАНИЗМАМИ. Влияние на способность управлять транспортными средствами и заниматься другими видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций, не изучалось. Исходя из механизма действия лапатиниба, нельзя предположить неблагоприятное влияние препарата на такиевиды деятельности, однако следует принимать во внимание общее состояние пациента и профиль побочных действий лапатиниба. Необходимо соблюдать осторожность при управлении транспортными средствами и занятиях другими потенциально опасными видами деятельности, требующими повышенной концентрации внимания и быстроты психомоторных реакций. |
 |
Условия храненияХранить при температуре ниже 30° С, в недоступном для детей месте. |