Ласмидитан
Lasmiditan
Фармакологическое действие
Ласмидитан — антимигреневое средство, агонист рецептора серотонина 5-HT1F.
Механизм действия
Ласмидитан обладает высоким сродством к рецептору 5-HT1F. Ласмидитан, по-видимому, оказывает свой терапевтический эффект при лечении мигрени посредством агонистических эффектов на рецептор 5-HT1F, однако точный механизм действия неизвестен.
Доклинические токсикологические исследования на мышах не выявили признаков канцерогенеза, мутагенеза или нарушения фертильности при концентрациях в плазме, значительно превышающих концентрации, наблюдаемые у людей.
Фармакокинетика
Всасывание
После перорального приёма ласмидитан быстро абсорбируется с TCmax (время достижения максимальной концентрации в плазме крови) порядка 1,8 часа. У пациентов с мигренью абсорбция или фармакокинетика ласмидитана не отличались во время приступа мигрени по сравнению межприступным периодом.
Совместный приём ласмидитана с пищей с высоким содержанием жиров повышал Cmax (максимальная плазменная концентрация) и AUC (Area under the plasma drug concentration-time curve — площадь под кривой «концентрация-время») для ласмидитана на 22 % и 19 % соответственно и увеличивал TCmax на 1 час.
Распределение
Связывание ласмидитана с белками плазмы крови человека составляет 55–60 %.
Выведение
Период полувыведения (T½) ласмидитана составляет приблизительно 5,7 ч. При ежедневном приёме накопление ласмидитана не наблюдалось. Почечная экскреция — незначительный путь клиренса ласмидитана.
Биотрансформация
Ласмидитан подвергается печёночному и внепеченочному метаболизму, главным образом, ферментами не-CYP. Следующие ферменты не участвуют в метаболизме ласмидитана: МАО-А, МАО-В, флавинмонооксигеназа 3, редуктаза CYP450, ксантиноксидаза, алкогольдегидрогеназа, альдегиддегидрогеназа и альдо-кеторедуктазы. Ласмидитан также метаболизируется до М7 (окисление в пиперидиновом кольце) и М18 (комбинация путей М7 и М8). Эти метаболиты считаются фармакологически неактивными.
Экскреция
Выявление неизменённого ласмидитана в моче было низким и составляло приблизительно 3 % от введённой дозы. Метаболит S-M8 составлял примерно 66 % дозы в моче.
Показания
Лечение мигрени с или без ауры у взрослых.
Противопоказания
Гиперчувствительность к ласмидитану.
Беременность и грудное вскармливание
Применение при беременности
Категория действия на плод по FDA — N.
Адекватных и строго контролируемых исследований по безопасности применения ласмидитана при беременности не проведено.
Наличие активной мигрени в период беременности не влияет на течение самой беременности и развитие плода, однако повышает риск преэклампсии и гестационной артериальной гипертензии.
Экспериментальные исследования, проведённые на животных, при введении ласмидитана во время органогенеза выявили увеличение частоты аномалий развития плода, повышение смертности эмбриона и потомства, снижение массы тела плода, при воздействии на беременных животных в дозах эквивалентных меньшему (кролики) и большему (крысы) значению относительно максимально рекомендованных для человека.
В случае наступления беременности, отсутствия менструации или при подозрении на возможную беременность пациентка должна сообщить об этом своему лечащему врачу.
Применение в период грудного вскармливания
Специальных исследований по безопасности применения ласмидитана в период грудного вскармливания не проведено.
Неизвестно, выделяется ли ласмидитан с грудным человеческим молоком.
Экспериментальные исследования показали выделение ласмидитана в молоко лактирующих животных (крысы).
Применение при нарушениях функции печени
У пациентов с лёгкой и средней степенью тяжести печёночной недостаточности (класс A и B по классификации Чайлд-Пью) — коррекция дозы не требуется.
Пациенты с печёночной недостаточностью тяжёлой степени тяжести (класс С по классификации Чайлд-Пью) — не рекомендуется.
Применение при нарушениях функции почек
Лёгкая, умеренная или тяжёлая почечная недостаточность — коррекция дозы не требуется.
Применение в детском возрасте
Эффективность и безопасность у детей и подростков не установлены.
Применение у пожилых пациентов
Как правило, начальная доза в нижней части диапазона доз для пожилых пациентов.
Головокружение возникало чаще у пациентов в возрасте старше 65 лет (19 % против 2 % в группе плацебо) по сравнению с пациентами в возрасте до 65 лет (14 % против 3 % в группе плацебо).
Более значительное повышение систолического артериального давления также наблюдалось у пациентов в возрасте >65 лет по сравнению с лицами в возрасте <65 лет.
Способ применения и дозы
Перорально (внутрь).
50 мг, 100 мг или 200 мг в сутки. Не следует принимать более одной дозы в сутки.
Безопасность лечения в среднем >4 приступов мигрени за 30 дней не установлена.
Побочные действия
Определение частоты побочных эффектов: очень часто (≥1/10); часто (≥1/100 и <1/10); нечасто (≥1/1 000 и <1/100); редко (≥1/10 000 и <1/1 000); очень редко (<1/10 000, включая отдельные случаи).
Очень часто — головокружение (9–17 %).
Часто — парестезия (3–9 %), седация (6–7 %), усталость (4–6 %), тошнота и/или рвота (3–4 %), мышечная слабость (1–2 %), <2 % — нарушение координации, зрительное нарушение, сердцебиение, беспокойство, тремор, бессонница, аномальные сновидения, мышечные спазмы, дискомфорт в конечностях, когнитивные изменения, эйфорическое настроение, дискомфорт в груди, речевые аномалии, одышка, галлюцинации.
Постмаркетинговые данные
Чувство жара или холода.
Злоупотребление
В терапевтических дозах ласмидитан вызывал побочные эффекты в виде эйфории и галлюцинаций в большей степени, чем плацебо. Однако эти события происходили с низкой частотой (около 1 % пациентов).
Зависимость
Физическая абстиненция не наблюдалась у здоровых добровольцев после резкого прекращения приёма ласмидитана.
Взаимодействие
Препараты, угнетающие ЦНС
Совместный приём ласмидитана с алкоголем или другими ЦНС-депрессантами не был изучен в ходе клинических исследований. Поскольку ласмидитан может вызывать седативный эффект, а также другие когнитивные и/или психоневрологические побочные реакции, ласмидитан следует использовать с осторожностью в сочетании с алкоголем или другими препаратами, угнетающими ЦНС.
Серотонинергические препараты
Совместный приём ласмидитана с препаратами, повышающими уровень серотонина, например, ингибиторы обратного захвата серотонина, ингибиторы обратного захвата норадреналина и серотонина, трициклические антидепрессанты, ингибиторы МАО, тразодон, декстрометорфан), препараты на основе зверобоя, могут повышать риск развития серотонинового синдрома.
Препараты для снижения сердечного ритма
Ласмидитан может вызывать снижение частоты сердечных сокращений. Совместный приём 200 мг ласмидитана с пропранололом снижал частоту сердечных сокращений дополнительно на 5 ударов в минуту по сравнению с группой пропранолола. Ласмидитан следует использовать с осторожностью у пациентов, принимающих сопутствующие препараты, которые снижают частоту сердечных сокращений.
Белки множественной лекарственной резистентности
Ласмидитан ингибирует P-gp и BCRP in vitro. Следует избегать одновременного использования ласмидитана и лекарственных средств, которые являются субстратами P-gp или BCRP.
Особые указания
Серотониновый синдром
В клинических испытаниях проявления серотонинового синдрома были зарегистрированы у пациентов, получавших ласмидитан. Серотониновый синдром может также возникать при совместном приёме ласмидитана с серотонинергическими лекарственными средствами. Симптомы серотонинового синдрома могут включать в себя изменения психического статуса (возбуждение, галлюцинации, кома), вегетативную нестабильность (тахикардия, лабильное АД, гипертермия), нервно-мышечные проявления (гиперрефлексия, нарушение координации) и/или желудочно-кишечные симптомы (тошнота, рвота, диарея). Манифестация симптомов обычно происходит в течение нескольких минут или часов после приёма серотонинергического препарата. Прекратите приём ласмидитан при подозрении на развитие серотонинового синдрома.
Головная боль от чрезмерного использования лекарств
Злоупотребление лекарственными средствами от острой мигрени (например, эрготаминами, триптанами, опиоидами или комбинацией этих препаратов в течение 10 или более дней в месяц) может привести к обострению головной боли — головной боли при чрезмерном употреблении лекарств. Головная боль от чрезмерного употребления препаратов может проявляться как ежедневные головные боли, подобные мигрени, или как заметное увеличение частоты приступов мигрени. Детоксикация пациентов, включая отмену чрезмерно потребляемых лекарств и лечение абстинентного синдрома (который часто включает временное ухудшение головной боли), может быть необходимым средством избавления от данного типа головной боли.
Условия хранения
При комнатной температуре.
Влияние на способность к вождению автотранспорта и управлению механизмами
Ласмидитан может привести к значительному нарушению способности управлять автомобилем. В ходе исследований приём ласмидитана в дозе 50 мг, 100 мг или 200 мг значительно ухудшало способность водителя управлять автомобилем. Кроме того, сообщалось о развитии выраженной сонливости через 8 часов после однократного приёма ласмидитана по сравнению с плацебо. Пациенты, принимающие ласмидитан, должны избегать потенциально опасных видов деятельности, включая вождение автомобиля, в течение не менее 8 часов после каждого приёма ласмидитана.
Классификация
-
АТХ
N02CC08
-
Коды МКБ 10
-
Категория при беременности по FDA
N
(не классифицировано FDA)
Информация о действующем веществе Ласмидитан предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения о применении препаратов, содержащих активное вещество Ласмидитан, содержатся в инструкции производителя, прилагаемой к упаковке.
Введение.
Мигрень
— форма головной боли, симптомами которой являются приступы боли пульсирующего
характера, сопровождающиеся тошнотой, рвотой, гиперчувствительностью к свету и
звукам. Приступам мигрени подвержены порядка 10% людей во всем мире.
FDA
одобрило новый препарат ласмидитан (lasmiditan) для лечения острого приступа
мигрени. Он является пероральным агонистом серотониновых 5-HT1F рецепторов.
Методы.
В
двух рандомизированных двойных слепых плацебо-контролируемых исследования
участвовали 3177 взрослых пациента с мигренью в анамнезе. Приступы, протекающие
с аурой или без нее, купировали при помощи ласмидитана. За исключением
опиоидов, барбитуратов, триптанов и эоготов, пациентам было разрешено принимать
другие лекарственные вещества для облегчения симптомов через два часа после
приема ласмидитана. 22% пациентов принимали препараты для профилактики мигрени.
Результат.
В
обоих исследованиях ласмидитан показал эффективность во всех дозировках в
сравнении с плацебо. В течение двух часов после приема у пациентов прекращалась
боль и облегчались симптомы мигрени.
Наиболее частыми побочными эффектами были
головокружение, усталость, парестезии и седация. В связи с побочным действием,
не рекомендуется водить машину как минимум в течение 8 часов после приема
ласмидитана. Также препарат не следует принимать с алкоголем или другими
средствами, вызывающими угнетение ЦНС.
Источник https://www.fda.gov/news-events/press-announcements/fda-approves-new-treatment-patients-migraine

Скачать в PDF
Мигрень — это нарушающее работоспособность первичное заболевание, выражающееся в виде головной боли, которое напрямую воздействует на миллион людей по всему миру. Несмотря на широкую распространенность, мигрень остается плохо диагностируемой и плохо поддающейся лечению болезнью. Чтобы облегчить принятие клинически значимых решений, авторы собрали Европейскую панель экспертов, призванную разработать десятишаговый подход к диагностике и терапии мигрени. Каждый шаг был установлен путем консенсуса экспертов и поддержан обзором современной литературы, а совместное заключение поддержано Европейской федерацией головной боли и Европейской Академией неврологии. В данном консенсусном заявлении авторы описывают типичные клинические проявления, диагностические критерии и дифференциальную диагностику мигрени. Далее они подчеркивают сосредоточенность на пациенте и его информировании c целью обеспечения строгого соблюдения схемы лечения и удовлетворенности медицинским уходом. Авторы также обрисовывают наилучшие способы неотложного и превентивного лечения в различных популяциях пациентов, включая взрослых, детей и подростков, беременных и кормящих грудью женщин, а также пожилых людей. Наконец, в статье обсуждается лечение осложнений и сопутствующих патологий, а также важность планирования дальнейшего врачебного наблюдения на протяжении длительного времени.
▶ Материал по теме: Подкаст о мигрени, выпущенный Medical Channel совместно с Novartis
Мигрень — это сильно нарушающее трудоспособность заболевание, выражающееся в головной боли, распространенность которого в общей популяции в течение года составляет 15 % [1, 2]. Согласно глобальному исследованию уровня заболеваемости, в мире мигрень является вторым по частоте встречаемости неврологическим нарушением; она отвечает за большее снижение трудоспособности, чем все прочие неврологические заболевания, вместе взятые [2, 3].
Клинически мигрень проявляется повторяющимися приступами головной боли, сопровождающимися рядом прочих симптомов [4]. Примерно у трети лиц, страдающих от мигрени, головной боли в некоторых или во всех случаях предшествуют неустойчивые неврологические симптомы, называемые мигренозной аурой [5, 6]. Кроме того, у небольшой доли таких лиц развивается хроническая мигрень, при которой приступы становятся очень частыми [7]. Широко распространено мнение, что патогенез мигрени включает периферическую и центральную активацию тригеминоваскулярной системы [8], а распространяющаяся корковая депрессия считается основным нейропсихологическим субстратом мигренозной ауры [9]. Так или иначе, точные процессы патогенеза во многом остаются неясными, и в настоящее время возможностей лечения на основе понимания механизма мигрени мало [10].
Способы лечения мигрени включают в себя неотложное и превентивное медикаментозное воздействие и ряд нефармакологических терапевтических подходов [10]. Несмотря на данные имеющиеся возможности и детальные диагностические критерии, лечебная работа остается неоптимальной: неправильная постановка диагноза и недостаточное лечение мигрени являются значительной проблемой общественного здоровья [11, 12]. Данные популяционного масштаба из Европы указывают на то, что превентивную лекарственную терапия используют только 2–14 % пациентов с мигренью [11], а это тревожный результат, требующий масштабных действий [12]. Нужен всесторонний подход для улучшения правильности постановки диагноза и научно обоснованного лечения.
В данном консенсусном заявлении авторы предлагают десятишаговый подход к диагностике и лечению мигрени (рис. 1). Разработка этого подхода была инициирована Датским обществом головной боли, а Консенсусное заявление поддержано Европейской федерацией головной боли (EHF) и Европейской академией неврологии (EAN). Цель подхода в равной степени состоит в поддержании ведения пациентов и принятия клинически значимых решений медработниками, оказывающими первичную медицинскую помощь, неврологами и специалистами в области головной боли.
Датское общество головной боли и его представители (A.K.E., H.A., H.W.S. and M.Ashina) сформулировали Европейское Консенсусное заявление, касающееся диагностики и лечения мигрени. Было подготовлено формальное предложение, включающее предположительный список авторов, которое было подписано Советом директоров EHF, председателями группы специалистов по головной боли в EAN и председателем Научного комитета EAN. Предложение было одобрено единогласным решением, и для разработки данного Консенсусного заявления была собрана Европейская экспертная организация. Трое авторов (H.A., T.J.S. and M.Ashina) в переписке по электронной почте определили 10 важнейших шагов в деле диагностики и лечения мигрени. После согласования этих шагов семь авторов (A.K.E., H.A., S.K., H.-C.D., H.W.S., T.J.S. and M.Ashina) написали начальную версию проекта.
Для каждого из 10 шагов в апреле 2020 года был выполнен структурированный анализ литературы с использованием базы данных PubMed. Для поиска авторы использовали слово «мигрень» в комбинации с терминами «диагноз», «лечение», «терапия», «результаты лечения» или «прогноз». Публикации не на английском языке были исключены из исследования. Авторы таже выбрали ряд дополнительных статей из списков литературы найденных источников, которые они сочли релевантными. Материалы рассчитаны на широкий круг читателей в среде медицинских работников, оказывающих первичную медицинскую помощь, неврологов и специалистов по головной боли.
В продолжительной переписке по электронной почте авторы обсуждали изначальную версию проекта; все авторы также внесли вклад во все последующие версии. Там, где это возможно, рекомендации основаны на интерпретации результатов систематических обзоров и метаанализов и полагаются на мнение экспертов только в том случае, если научные доказательства ограничены или недоступны. Учитывались взгляды каждого из авторов, и пересмотр происходил до тех пор, пока не было достигнуто единогласное мнение. Для достижения консенсуса потребовалось четыре раунда таких рассмотрений.
Рисунок 1 | Десятишаговый подход к диагностике и лечению мигрени
CGRP — calcitonin gene-related peptide; ЛИГБ — лекарственно-индуцированная головная боль; НПВП — нестероидные противовоспалительные препараты.
aВальпроат натрия категорически противопоказан женщинам, планирующим иметь детей.
bМоноклональные антитела к CGRP действуют на CGRP или на его рецептор
В третьем издании Международной классификации болезней, связанных с головной болью (МКГБ-3) выделяют три основных типа мигрени [4]: мигрень без ауры, мигрень с аурой и хроническую мигрень. Для точной постановки диагноза важно учитывать клинические характеристики каждого типа.
Мигрень без ауры. Мигрень без ауры характеризуется повторяющимися приступами головной боли, длящимися 4–72 ч [4]. Характерные черты приступа включают в себя унилатеральную локацию, пульсирующий характер боли, ее умеренную или высокую интенсивность и затруднения рутинной физической активности [4, 13]. Кроме того, нередко встречается двусторонняя боль; согласно данным популяционного уровня, ~ 40 % лиц с мигренью жалуются на двустороннюю боль в ходе приступов [5]. Из сопутствующих симптомов наиболее характерны светобоязнь, фонофобия, тошнота и рвота [4, 13]. Среди предшествующих боли симптомов встречаются подавленное настроение, зевота, слабость, желание есть непривычную пищу [14]. После прекращения боли в течение 48 ч могут присутствовать постдромальные симптомы, такие как усталость, трудности с концентрацией внимания и ригидность затылочных мышц [15].
Мигрень с аурой. Примерно у трети людей, страдающих мигренью, наблюдается аура [5], которая может присутствовать при каждом приступе или только при некоторых. Ауру описывают как преходящие фокальные неврологические симптомы, которые обычно предшествуют, а иногда и сопровождают фазу головной боли при приступе мигрени [4]. У более > 90 % лиц с мигренозной аурой она проявляется визуально [4, 16], в классическом случае — в виде мерцательной скотомы [4]. Сенсорные симптомы появляются в ~ 31 % случаев, преимущественно в виде односторонней парестезии (ощущения покалывания и/или онемения), которая постепенно распространяется по лицу и рукам [16].
Более редкие симптомы ауры включают афазическое расстройство речи, нарушения работы ствола мозга (такие как дизартрия и головокружение), моторная слабость (при гемиплегической мигрени), ретинальные симптомы (например, повторяющиеся монокулярные зрительные нарушения) [4]. Симптомы ауры могут быть сходными с таковыми при транзиторной ишемической церебральной атаке (TИA); отличие в том, что симптомы ауры часто распространяются постепенно (в течение ≥ 5 мин) и появляются последовательно, в то время как симптомы ТИА возникают внезапно и одновременно [4].
Примечательно, что мигрень с аурой и мигрень без ауры могут сосуществовать друг с другом. Многие лица с мигренью с аурой также испытывают приступы, которым аура не предшествует. В таких случаях следует диагностировать и мигрень с аурой, и мигрень без ауры.
Хроническая мигрень. Мигрень считается хронической, если имеют место ≥ 15 дней головной боли в течение > 3 месяцев, и выполняются критерии Международной классификации головных болей (МКГБ-3) для мигрени ≥ 8 дней в месяц [4]. Хроническая мигрень — явление не статичное, и нередко происходит возвращение к эпизодической форме. Сходным образом может происходить и обратный переход эпизодической мигрени в хроническую [17].
Семейный анамнез мигрени. Мигрень имеет значительную генетическую составляющую и на фоне популяции в целом преобладает главным образом у людей, чьи ближайшие родственники также страдают от этого заболевания [18, 19]. Таким образом, семейная история представляет собой важную часть анамнеза и часто положительна у пациентов с мигренью, хотя часто может замалчиваться пациентами [20].
Рекомендации
- Мигрень без ауры следует подозревать у лиц с повторяющейся умеренной или сильной головной болью, особенно если боль односторонняя и/или пульсирующая, и наблюдаются сопутствующие симптомы в виде светобоязни, фонофобии, тошноты и/или рвоты.
- Мигрень с аурой следует подозревать у лиц с вышеуказанными симптомами и повторяющимися длительными зрительными и/или хемосенсорными нарушениями.
- Хроническую мигрень следует подозревать у лиц с ≥ 15 днями головной боли в месяц.
- Подозрение на мигрень следует усиливать семейной историей данного заболевания и в случае, если симптомы появились в пубертатный период или около него.
Блок 1 | Диагностические критерии МКГБ-3 для нарушений, связанных с первичной головной болью [4]
Анамнез является основой диагностики мигрени; с помощью ряда диагностических средств (см. раздел «Средства диагностики») полный анамнез позволяет систематически применять критерии, установленные МКГБ-3. Подтверждением наиболее часто служит медицинский осмотр; иногда для подтверждения или опровержения подозрений на вторичные причины головных болей используются дополнительные исследования (например, нейровизуализация, анализы крови или люмбальная пункция).
Анамнез. Необходимый анамнез должен содержать по меньшей мере следующее: возраст начала головной боли; продолжительность эпизодов головной боли; частота эпизодов головной боли; характеристики боли (например, локация, качество, интенсивность, усугубляющие и снижающие боль факторы); сопутствующие симптомы (например, светобоязнь, фонофобия, тошнота и рвота); симптомы ауры (если имеются); а также опыт острого или превентивного медикаментозного лечения. Все это необходимо для применения критериев МКГБ-3.
Диагностические критерии. Критерии МКГБ-3 [4] (блок 1), разработанные Национальным обществом головной боли, устанавливают клинические признаки, которые определяют диагноз «мигрень», его типы и подтипы. Эти критерии ставят специфичность в приоритет перед чувствительностью, поэтому для диагностики возможной мигрени добавлены критерии, определяемые как «мигренеподобные приступы, у которых отсутствует один из признаков, необходимых для выполнения всех критериев для типа или подтипа мигрени» [4]. Возможная мигрень — это диагноз, который ставят до подтверждения в ходе ранних этапов дальнейшего врачебного наблюдения.
Средства диагностики. Дневники головной боли — полезные диагностические средства, которые также в случае необходимости можно использовать для пересмотра диагноза (блок 2). Ежедневные записи позволяют регистрировать информацию о распределении и частоте головных болей и сопровождающих их симптомов (таких как тошнота, светобоязнь и фонофобия), а также об использовании неотложной лекарственной терапии (блок 2). Дневники не стоит путать с календарями головной боли, в которых обычно содержится меньше информации, но которые полезны в ходе дальнейшего врачебного наблюдения. Календари головной боли нужно использовать для регистрации, как минимум, частоты мигрени, частоты и интенсивности головных болей и связанных с ней событий, таких как неотложное и превентивное использование лекарственных средств и менструация (блок 2).
Блок 2 | Средства диагностики и инструменты наблюдения
Пример дневника головной боли | Образец каледаря головной боли
Появление и усовершенствование электронных дневников головной боли — это важный шаг, который, скорее всего, обеспечит получение более детальной информации без явного несоблюдения предписаний. Такое несоблюдение в случае дневников головной боли может быть проблемой, особенно при обращении за амбулаторной медицинской помощью; так, в одном популяционном исследовании из всех пациентов, предъявлявших жалобы на частые головные боли, только 46 % участников завершили исследование [21].
Диагностике мигрени также может способствовать использование способов обследования, которые оценивают, позволяют ли проявляющиеся у пациента симптомы предположить мигрень (блок 2). После применения этих методов диагноз должен быть подтвержден анализом анамнеза и/или использованием диагностического дневника головной боли. Надежные способы обследования включают Трехчастный идентификационный опросный лист по мигрени (three-item ID-Migraine questionnaire) [22] и Пятичастный опросный лист для скрининга мигрени (five-item Migraine Screen Questionnaire [MS-Q]) [23]. Чувствительность первого — 0,81, специфичность — 0,75, прогностическая ценность — 0,93 по сравнению с диагнозом специалиста по головной боли, основанным на МКГБ-3 [22]. Метод MS-Q обладает чувствительностью 0,93, специфичностью 0,81 и прогностической ценностью 0,38 [23]. Оба опросных листа были переведены и одобрены для использования на нескольких языках [24, 25, 26, 27].
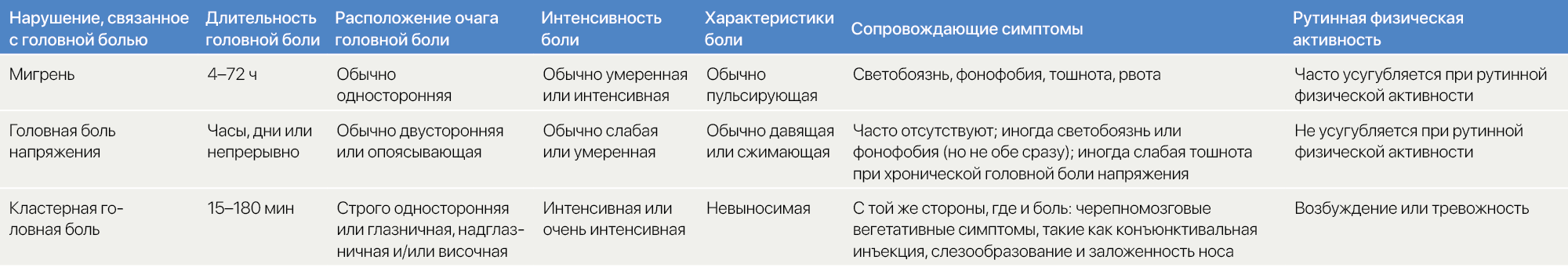
Дифференциальная диагностика. Для мигрени дифференциальные диагнозы включают в себя прочие первичные нарушения, связанные с головной болью (таблица 1), и некоторые вторичные нарушения (тaблица 2). Поиск отличий мигрени от других первичных нарушений служит предпосылкой для успешного лечения, в то время как от вторичных — играет ключевую роль в силу того, что некоторые из таких заболеваний являются серьезными и могут потенциально угрожать жизни пациента (например, менингит и субарахноидальное кровоизлияние) (тaблица 2).
Головная боль напряжения (ГБH) — единственная из прочих проявляющихся припадками головных болей, которая преобладает в общей популяции [28]. У ГБН отсутствуют симптомы, сопровождающие мигрень; боль обычно двусторонняя, от слабой до умеренной, давящего или сжимающего характера и не усиливается при рутинной физической активности (тaблица 1).
Кластерная головная боль среди первичных нарушений, связанных с головной болью, преобладает в значительно меньшей степени и поражает ~ 0,1 % от oбщей популяции [29]. Ее признаки очень характерны и включают часто повторяющиеся, но короткие приступы (15–180 мин) строго односторонней интенсивной или очень интенсивной боли. Боль в голове сопровождается черепномозговыми вегетативными симптомами с той же стороны, такими как конъюнктивальная инъекция, слезообразование и заложенность носа (тaблица 1).
Лекарственно-индуцированная головная боль (ЛИГБ) — вторичное нарушение, связанное с головной болью, которое представляет собой важный дифференциальный диагноз для хронической мигрени [30] (блок 1). Она обычно развивается при чрезмерном использовании средств неотложной лекарственной терапии для лечения приступов мигрени; таким образом, эти два заболевания сливаются (для получения более подробной информации про ЛИГБ см. Шаг 8).
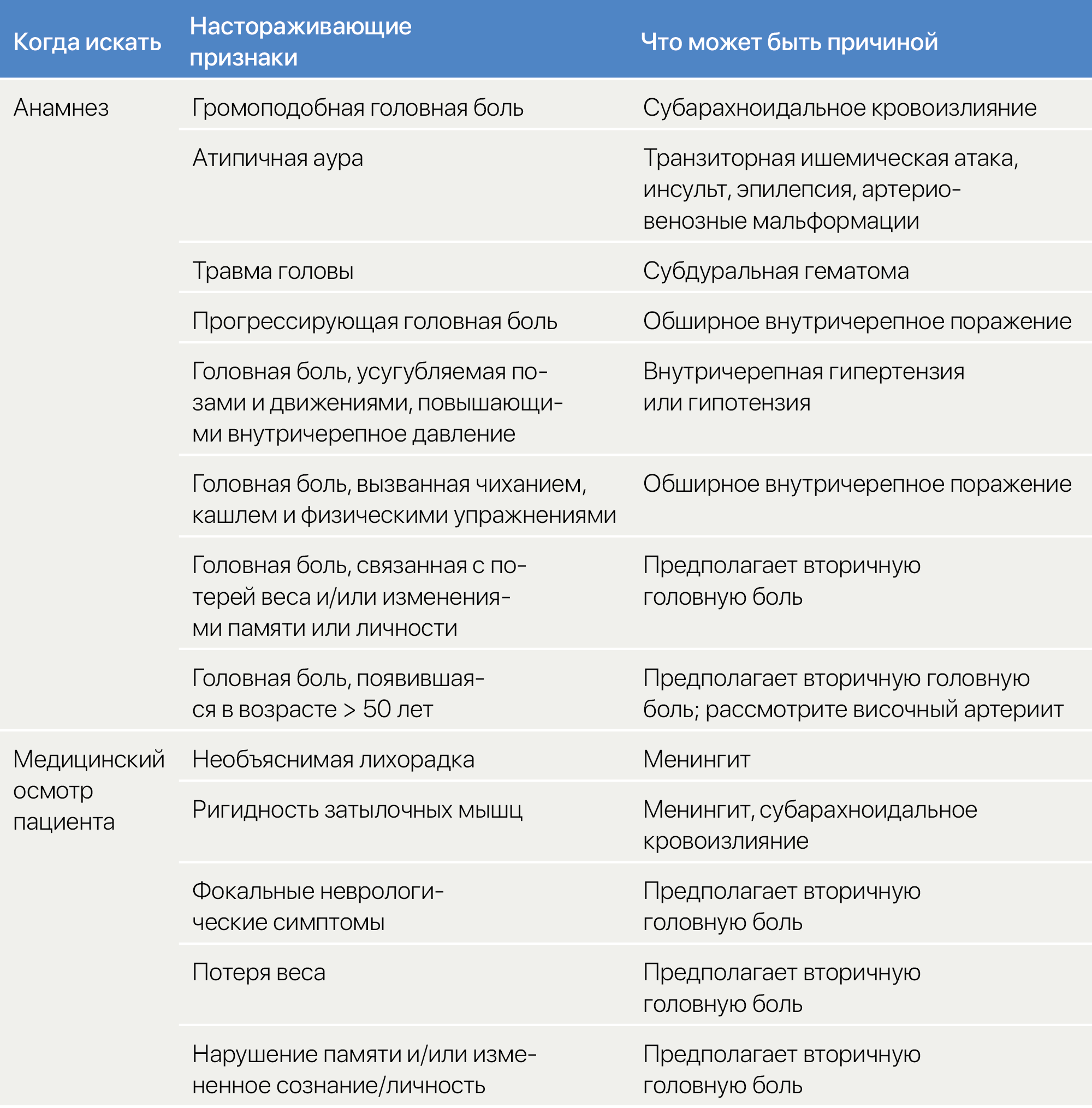
Некоторые другие вторичные нарушения, связанные с головной болью, могут иметь сходные с мигренью проявления, но существуют специфические настораживающие признаки (таблица 2). К ним относятся громоподобная головная боль, атипичная аура или травма головы. При медицинском осмотре настораживающие признаки включают необъяснимую лихорадку, нарушения памяти и очаговую неврологическую симптоматику (таблица 2). Все они указывают на необходимость дальнейшего обследования, включая проведение нейровизуализации, взятие крови на анализ и люмбальной пункции [31].
Необходимость нейровизуализации. Единственная роль нейровизуализации в диагностике головной боли состоит в подтверждении или исключении причин вторичной головной боли на основании настораживающих признаков в анамнезе и/или при медицинском осмотре [32, 33]. В остальном потребность в нейровизуализации редко возникает в ходе диагностического обследования пациентов с головной болью; более того, она способна наносить вред, поскольку пациент может подвергаться воздействию ионизирующего излучения [33, 34]. При необходимости исследовать возможные вторичные нарушения, связанные с головной болью, МРТ предпочтительнее КТ, поскольку обладает большим разрешением и не включает в себя воздействие ионизирующего излучения [35, 36]. Однако МРТ может выявить клинически незначительные аномалии (например, поражения белого вещества, арахноидальные кисты и менингиомы), которые могут встревожить пациента и привести к дальнейшему обследованию, в котором нет необходимости [33, 37, 38].
Рекомендации:
- Тщательно изучите анамнез с учетом критериев МКГБ-3.
- Используйте надежные диагностические средства и методы обследования, такие как дневники головной боли, Трехчастный идентификационный опросный лист по мигрени и Пятичастный опросный лист для скрининга мигрени.
- Учитывайте дифференциальные диагнозы, в том числе прочие первичные и вторичные нарушения, связанные с головной болью.
- Используйте нейровизуализацию только в случаях подозрения на вторичные нарушения, связанные с головной болью.
Таблица 1 | Характеристики первичных нарушений, связанных с головной болью
В лечении мигрени пациентоцентричность и информирование играют важную роль. И действительно, без достаточного внимания к этим аспектам оптимальные исходы лечения маловероятны.
Объяснение, ободрение и цели. Удовлетворенность пациента — важный момент, от которого зависит успех ведения и лечения, но большинство людей, страдающих от мигрени, сообщают по крайней мере об одной неудовлетворенной потребности в лечении [39]. Нереалистичные ожидания представляют собой значительное препятствие на пути к достижению удовлетворенности пациентов: среди них распространено заблуждение, что эффективное лечение означает избавление от мигрени [32, 40]. Таким образом, лечащий врач должен вывести пациента из этого заблуждения, при этом без излишнего пессимизма. Реалистичная цель — это возвращение контроля от болезни к пациенту с помощью терапии, которая облегчает вызванную приступами потерю трудоспособности (путем снижения частоты приступов, их продолжительности и/или интенсивности боли) в степени, позволяющей пациенту продолжать жить с наименьшим числом затруднений.
Несоблюдение врачебных предписаний служит еще одним препятствием для эффективного лечения мигрени [41] и нуждается в дополнительных мерах. Решением является информирование: врачи должны предоставлять пациентам информацию о природе мигрени и принципах ее эффективной терапии, включая инструкции по правильному использованию лекарственных средств, возможные побочные эффекты и что можно предпринять в случае их появления, важность избегания чрезмерного применения лекарств. Подобное информирование требует времени, которое не всегда есть в распоряжении врачей; но пользу могут принести и информационные буклеты, находящиеся в свободном доступе [32].
Факторы предрасположенности и пусковые механизмы. Вопреки популярному мнению, роль предрасположенности и пусковых факторов при мигрени ограничена и часто преувеличивается [42]. Важное исключение представляет собой менструация, и у некоторых женщин приступы мигрени исключительно или часто связаны с ней. Истинные пусковые факторы часто очевидны. Более того, усугубляющие факторы не следует смешивать с факторами предрасположенности. Первые (например, физическая активность) усиливают боль при приступах мигрени, в то время как вторые (например, низкое качество сна, плохая физическая форма или стресс) увеличивают склонность к развитию приступа.
Тем не менее, если предрасполагающие и пусковые факторы удается правильно определить и в последующем избежать (что часто невозможно), некоторой степени контроля головной боли можно достичь без дальнейших вмешательств [43]. Например, изменения образа жизни могут быть благоприятны для пациентов с низким качеством сна или плохой физической формой; однако любые изменения не должны приводить к излишнему поведению избегания, которое само по себе снижает качество жизни.
Персонализированная терапия. Для лечения мигрени доступно множество эффективных неотложных и превентивных средств. Цель при выборе этих средств — обеспечение каждого пациента тем способом лечения, который приведет к наилучшему результату именно в данном случае. К сожалению, в настоящее время для такого выбора, по крайней мере в вопросе неотложной терапии, не существует уже готовой базы. Таким образом, персонализированная терапия наилучшим образом достигается при использовании пошагового подхода, изложенного в разделе «Шаг 4».
Рекомендации
- Обеспечьте каждого пациента подробной информацией о мигрени как о заболевании и о принципах ее лечения.
- Рассмотрите предрасполагающие и пусковые факторы, но имейте в виду, что истинные пусковые факторы самоочевидны.
- Придерживайтесь принципов пошагового лечения для достижения оптимального качества персонализированной терапии (см. Шаг 4).
Taблица 2 | Настораживающие признаки, связанные со вторичными головными болями [31, 32]
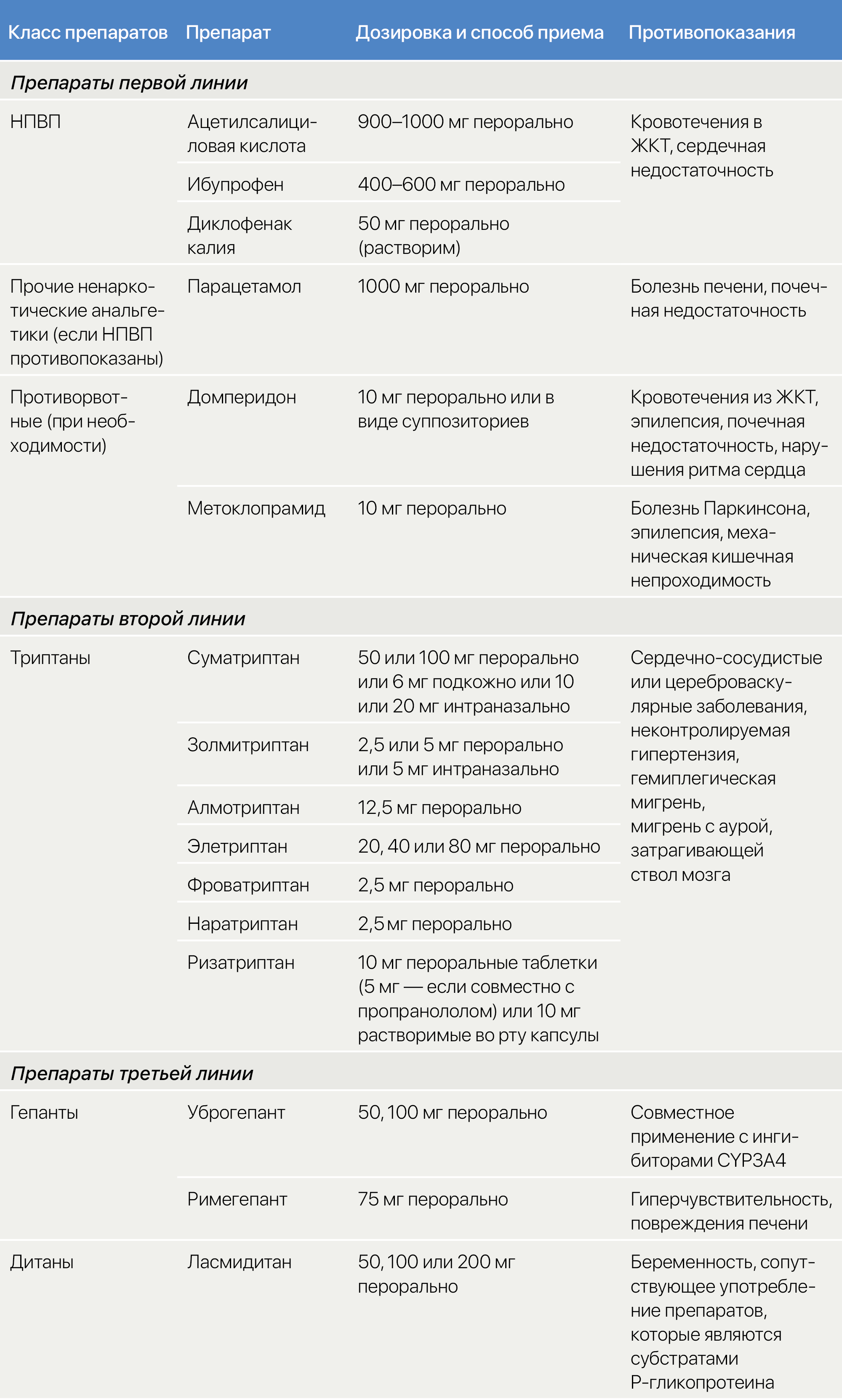
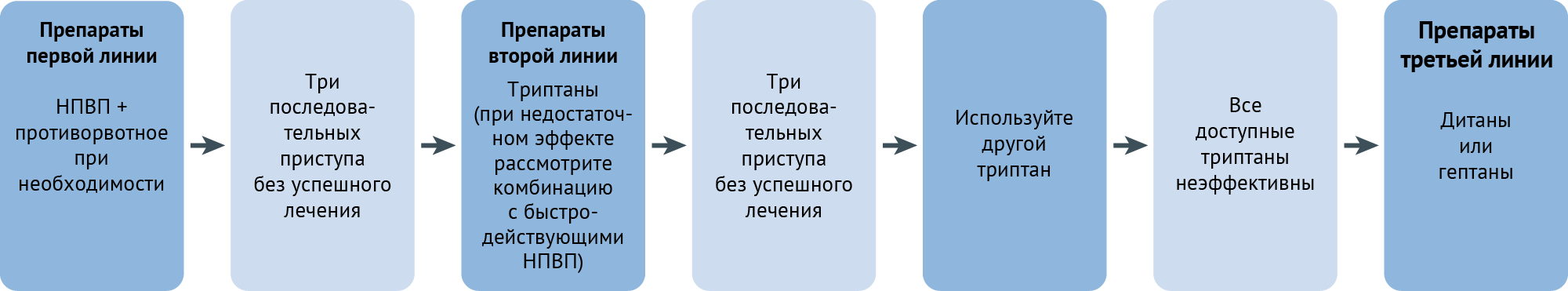
Неотложную терапию можно разделить на терапию первой, второй, третьей линии и вспомогательную (тaблица 3). Ее следует применять с помощью пошагового подхода [32] (рис. 2). Рекомендации авторов касательно каждого типа терапии очерчены ниже. Лекарственные препараты на каждой стадии были выбраны на основе их эффективности, переносимости, безопасности, стоимости и доступности.
Препараты первой линии. Для острого лечения мигрени по всему миру используются анальгетики, отпускаемые без рецепта [44]. К тем из них, которые обладают доказанной эффективностью, относятся нестероидные противовоспалительные препараты (НПВП). Наиболее доказана эффективность в качестве препаратов первой линии у ацетилсалициловой кислоты, ибупрофена и диклофенака калия [45, 46, 47]. У парацетамола эффективность ниже [48], и его следует применять только лицам с непереносимостью НПВП.
Препараты второй линии. Пациентам, которым безрецептурные анальгетики не дают нужной степени ослабления головной боли, можно предложить триптан. Все триптаны имеют хорошо задокументированную эффективность, но доступность того или иного из них варьирует между разными странами. Наиболее эффективны триптаны тогда, когда их принимают в начале приступа, пока боль еще слабая [49, 50]. Однако доказательств в пользу применения триптанов в фазу ауры при приступе мигрени нет. Если один из триптанов неэффективен, остальные могут облегчить состояние пациента [51, 52]. Если неэффективны все прочие триптаны, или же для тех пациентов, у которых интенсивность боли так быстро достигает пика, что они не могут принимать триптаны перорально из-за рвоты, может быть полезна подкожная инъекция суматриптана [53].
У некоторых пациентов происходят рецидивы, которые описываются как возвращение симптомов в течение 48 ч после кажущегося успешным лечения. При рецидиве пациенты могут повторять лечение триптаном или комбинировать триптан с одновременным применением быстродействующих лекарственных форм: напроксена натрия, ибупрофена лизина и диклофенака калия [54, 55]. Тем не менее, следует предупредить пациентов, что повторный прием этих препаратов не предотвращает будущие рецидивы и в конечном счете увеличивает риски развития ЛИГБ.
Препараты третьей линии. Если доступные триптаны в ходе соответствующего периода лечения не приносят результаты (отсутствует ответ на терапию, или же он недостаточен в ходе по крайней мере трех приступов подряд), или их применение противопоказано, на сегодняшний день остается мало альтернатив. Можно использовать дитаны или гепанты, но в настоящее время их доступность крайне ограничена. Ласмидитан — единственный дитан, а уброгепант и римегепант — единственные гепанты, одобренные для острого лечения мигрени. Непрямое сравнение данных рандомизированных контролируемых исследований позволяет предполагать, что эффективность ласмидитана сравнима с таковой у триптанов [56, 57, 58], но их применение связано со снижением способности к вождению, что ограничивает широкое применение. Люди, принимающие ласмидитан, могут терять способность оценивать свою компетентность в деле вождения автомобиля и должны воздерживаться от него в течение по крайней мере 8 ч после приема препарата.
Вспомогательная терапия. Для пациентов, которые во время приступа мигрени испытывают тошноту и/или рвоту, в качестве вспомогательных лекарственных средств обозначаются принимаемые перорально противорвотные прокинетики, такие как домперидон и метоклопрамид.
Препараты, которых следует избегать. Пероральные алкалоиды спорыньи малоэффективны и потенциально токсичны, и их не следует применять как замену триптанам [59]. Эффективность опиоидов и барбитуратов находится под вопросом; обе группы препаратов связаны со значительными побочными эффектами и могут вызывать зависимость [60]. Всех этих лекарственных средств, таким образом, следует избегать при неотложном лечении мигрени.
Рекомендации
- Предлагайте лекарственные средства для неотложной терапии всем, кто страдает от приступов мигрени.
- Рекомендуйте применение препаратов для неотложной терапии в фазе головной боли, так как эффективность зависит от своевременного получения нужной дозы.
- Сообщайте пациентам, что частое повторное использование препаратов для неотложной терапии повышает риски развития ЛИГБ.
- Используйте НПВП (ацетилсалициловую кислоту, ибупрофен или диклофенак) как препараты первой линии.
- Используйте триптаны как препараты второй линии.
- Рассмотрите комбинированное применение триптанов и быстродействующих НПВП для предотвращения регулярных рецидивов.
- Рассмотрите применение дитанов и гепантов как препаратов третьей линии.
- Используйте противорвотные прокинетики (домперидон или метоклопрамид) как вспомогательные средства против тошноты и/или рвоты.
- Избегайте перорального применения алкалоидов спорыньи, опиатов и барбитуратов.
Начало и окончание. Для тех пациентов, которым мигрень продолжает ухудшать качество жизни несмотря на оптимизированное неотложное лечение, следует рассмотреть дополнительную превентивную терапию (тaблица 4). На практике пациенты, которым предлагают превентивную терапию, продолжают испытывать неприятные ощущения по крайней мере два раза в месяц [32], но это не следует рассматривать как абсолютное правило [32]. Помимо частоты приступов, клиницистам следует также принимать во внимание такие факторы, как тяжесть приступов, их продолжительность (например, ассоциированные с менструацией приступы обычно длятся дольше) и связанную с мигренью потерю трудоспособности. Еще одним указанием на потребность в превентивной терапии служит злоупотребление лекарствами для неотложной терапии.
Эффективность превентивного лечения редко рассматривают безотлагательно; она выясняется лишь спустя несколько недель или месяцев. Поэтому следует убеждать пациентов не бросать лечение на ранних стадиях из-за кажущейся неэффективности [32]. Если пероральное лекарственное средство в терапевтической дозе оказывается неэффективным спустя 2–3 месяца, следует попробовать альтернативные варианты [32, 61, 62]. В случае лечения моноклональными антителами, мишенью которых является пептид CGRP (calcitonin gene-related peptide) или его рецептор, эффективность можно оценивать только через 3–6 месяцев. В случае онаботулотоксина А этот срок составляет 6–9 месяцев.
Неэффективность одного способа лечения не означает, что терапия с использованием других классов лекарств тоже не принесет успеха — за исключением тех случаев, когда безуспешность связана с несоблюдением врачебных предписаний, с которым можно бороться с помощью создания упрощенных схем приема лекарств (раз в день или меньше) [32]. Для большинства превентивных лекарственных средств клинический опыт предполагает, что возможность паузы можно рассматривать в случае, если лечение было успешным на протяжении 6–12 месяцев [32]. Цель такой паузы — понять, следует ли прекратить превентивную терапию, что минимизирует лекарственное воздействие, в котором нет необходимости, и позволит некоторым пациентам лечить мигрень только с помощью лекарств неотложной терапии. Полезный способ количественно оценить степень успеха превентивного лечения — рассчитать процентное снижение числа дней с мигренью или головной болью от умеренной до высокой интенсивности в месяц. Так или иначе, необходим прагматический подход, и врачам следует принимать решение о приостановке превентивной терапии в каждом отдельном случае.
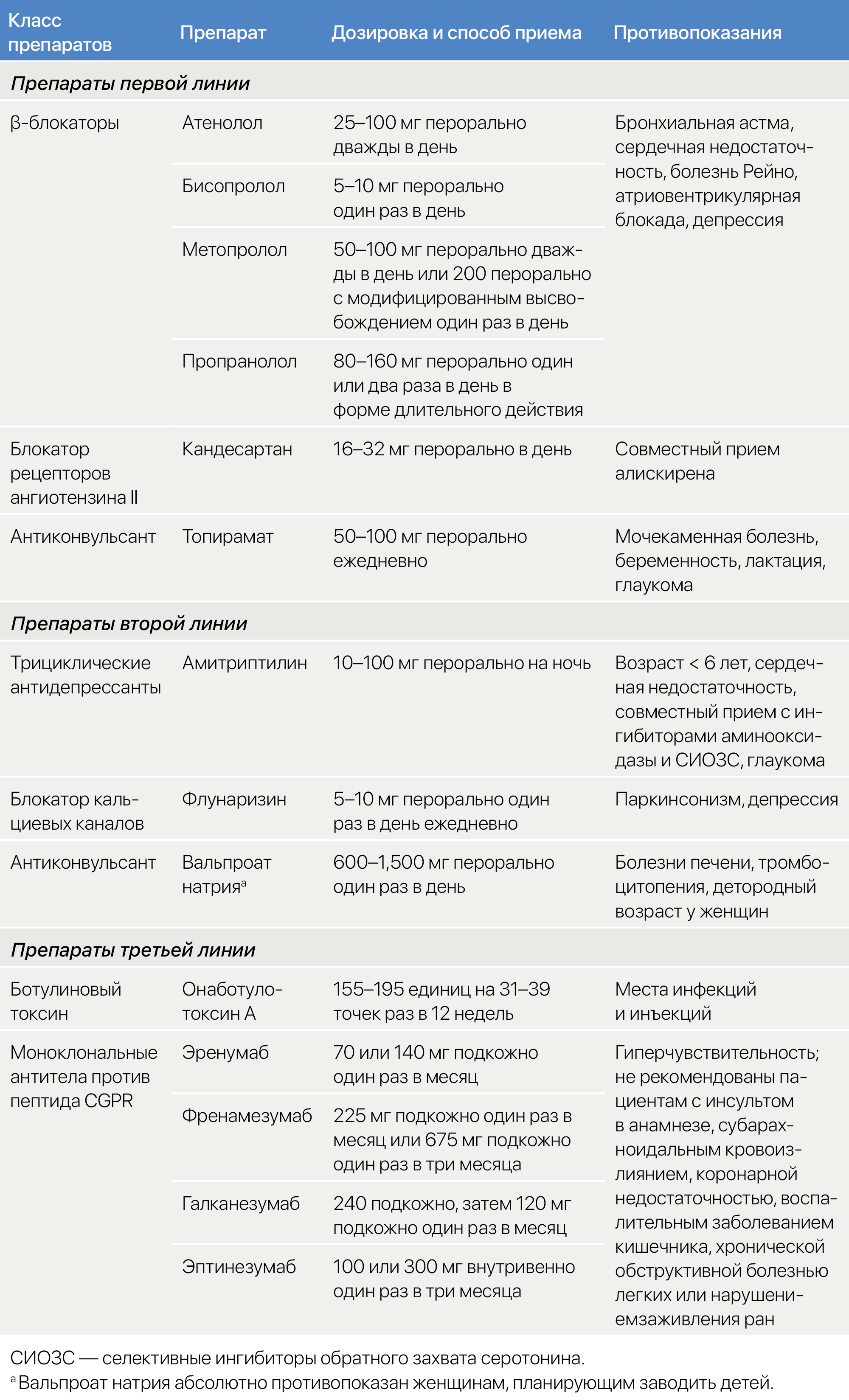
Текущий стандарт медицинского обслуживания. Как и препараты неотложной терапии, превентивные лекарства можно разделить на средства первой, второй и третьей линии (тaблица 4). Так или иначе, выбор препарата и порядок использования зависят от местных практических руководств и местной доступности лекарств, цен и политики финансовой компенсации.
Taблица 3 | Неотложная терапия мигрени
Таблица 4 | Превентивное лечение мигрени
Препараты первой линии — это β-блокаторы без внутренней симпатомиметической активности (атенолол, бисопролол, метопролол или пропранолол) [63], топирамат [64] и кандесартан [65, 66]. Если они оказываются неэффективны, можно рассмотреть препараты второй линии, включающие флунаризин [67], амитриптилин [68] и вальпроат натрия [69]. Надо учитывать, что вальпроат строго противопоказан женщинам, планирующим заводить ребенка, что сильно ограничивает его пользу в вопросе лечения мигрени [70, 71, 72]. К препаратам третьей линии относят четыре моноклональных антитела к CGRP: эренумаб, фреманезумаб, галканезумаб и эптинезумаб. Эти антитела были одобрены для превентивной терапии мигрени в последние несколько лет [61]. В Европе нормативные ограничения сужают круг их применения до тех пациентов, для кого прочие превентивные препараты оказались неэффективны или противопоказаны [61].
Нефармакологические методы лечения. Ряд нефармакологических терапевтических подходов можно использовать как дополнение к неотложной или превентивной лекарственной терапии или вместо нее, если лекарства противопоказаны. Существуют доказательства в пользу применения неинвазивных нейромодуляторных устройств [73], биоповеденческой терапии [74] и акупунктуры [75], хотя исследование последней указывает на то, что эффект от нее не превосходит таковой при имитируемой акупунктуре [76]. Вопреки популярному представлению, малочисленны или отсутствуют доказательства эффективности физиотерапии [77], мануальной терапии и диетических подходов [78]. Авторы не дают рекомендаций относительно прочих вариантов терапии, таких как применение мелатонина, магния и рибофлавина, поскольку доказательства их эффективности труднодоступны; использование их в клинической практике ограничено.
Рекомендации
- Рассмотрите применение превентивной терапии у тех пациентов, которые страдают от мигрени ≥ 2 дней в месяц, несмотря на оптимально подобранную неотложную терапию.
- Используйте β-блокаторы (атенолол, бисопролол, метопролол или пропранолол), топирамат или кандесартан как препараты первой линии.
- Используйте флунаризин, амитриптилин или (для мужчин) вальпроат натрия в качестве препаратов второй линии.
- Рассмотрите моноклональные антитела к CGRP как препараты третьей линии.
- Рассмотрите применение нейромодуляторных устройств, биоповеденческой терапии и акупунктуры как дополнительных средств для острой и превентивной лекарственной терапии либо отдельно в качестве превентивных терапевтических средств, если лекарства противопоказаны.
Рисунок 2 | Пошаговая медицинская помощь при приступах мигрени.
Дополнительно на любой стадии может быть показана превентивная терапия. В целом, начало превентивной терапии рекомендуется пациентам, испытывающим неблагоприятные воздействия ≥ 2 дней в месяц, несмотря на острую терапию, оптимизированную в соответствии с пошаговым подходом. НПВП — нестероидный противовоспалительный препарат.
Пожилые люди. Часто мигрень затихает с наступлением пожилого возраста, в то время как частота многих вторичных головных болей возрастает [79, 80, 81]. Начало выраженной мигрени после пятидесятилетнего возраста должно, таким образом, настораживать и порождать вопрос о глубинной причине. У лиц, чья мигрень сохраняется с периода молодости до поздних лет, на практике терапия часто остается неизменной. В отношении пожилых людей с мигренью доступно мало формальных доказательств для терапевтического подхода.
Тем не менее, следует принимать во внимания известные или, возможно, неизвестные сопутствующие заболевания, а также вред, который может быть вызван специфическими побочными эффектами лекарств [82], к которым пожилые люди в целом более восприимчивы. Так, использование триптанов пожилыми людьми часто не рекомендуется из-за большой вероятности наличия у данных пациентов сердечно-сосудистых заболеваний и/или факторов сердечно-сосудистого риска. Однако для использования триптана самого по себе нет строгих доказательств повышения риска цереброваскулярных или сердечно-сосудистых заболеваний у пожилых людей [83]. Тем не менее, врачам следует регулярно отслеживать кровяное давление у пожилых пациентов с мигренью, принимающих триптаны, а также периодически оценивать факторы развития сердечно-сосудистых заболеваний [84].
Дети и подростки. Мигрень обычна среди детей и еще более обычна среди подростков. Как и у взрослых, диагноз прежде всего базируется на анамнезе, хотя критерии немного отличаются: продолжительность приступов мигрени может быть от 2 до 72 ч [4]. Клинические проявления мигрени у детей и подростков также имеют некоторые отличия от таковых у взрослых — приступы обычно короче [4], головная боль чаще двусторонняя и реже — пульсирующая, нарушения работы желудочно-кишечного тракта обычно хорошо выражены [32]. Данные проявления надежнее описываются взрослыми, нежели детьми. Также родители лучше описывают факторы образа жизни, которые тоже может быть важно учитывать [86].
В случае детей и подростков клиническая тактика обычно требует активной помощи со стороны членов семьи и преподавателей [86], поэтому последних необходимо информировать. Детям, которые испытывают непродолжительные приступы, может быть достаточно просто постельного режима. При необходимости в качестве лекарства первой линии можно рекомендовать ибупрофен, доза которого должна быть рассчитана с учетом веса [32]. При тошноте у подростков 12–17 лет можно применять домперидон [87], однако пероральный прием, как правило, не предотвращает рвоту.
Доказательную базу эффективности использования лекарственных препаратов детьми и подростками подрывает показанный в клинических испытаниях высокий уровень ответа на плацебо [88, 89]. Как следствие, явный терапевтический выигрыш низок; этот эффект, возможно, объясняет, почему польза триптанов не продемонстрирована на детях. В случае подростков 12–17 лет для острого лечения мигрени были одобрены различные НПВП и триптаны [90, 91]; существуют доказательства, которые указывают, что суматриптан и золтриптан в форме назальных спреев наиболее эффективны [92]. Если неотложная лекарственная терапия не приносит облегчения, следует направить пациента к специалисту [32]. Для превентивной терапии на практике применяют пропранолол, амитриптилин и топирамат, хотя эффективность этих препаратов для детей и подростков не была подтверждена в клинических испытаниях [88, 89].
Беременные и кормящие грудью женщины. Мигрень часто ослабляется в течение беременности, но если лечение продолжается, особое внимание нужно уделять потенциальному вреду для плода [93]. Несмотря на относительно невысокую эффективность, для острого лечения мигрени при беременности в качестве лекарственного препарата первой линии следует применять парацетамол [48]: НПВП можно использовать только во втором триместре [93, 94]. Триптаны следует применять только под строгим наблюдением специалиста, так как данные по их безопасности ограничены и собраны из пострегистрационного наблюдения; большинство данных касается использования суматриптана [32]. При ассоциированной с мигренью тошноте в ходе беременности можно применять метоклопрамид [94, 95].
Превентивной лекарственной терапии при беременности лучше избегать в силу возможного вреда для плода. Если все же применение превентивной терапии рассматривается из-за частых и снижающих трудоспособность приступов мигрени, больше всего доступных данных по безопасности говорят в поддержку пропранолола или, если пропранолол противопоказан, амитриптилина. Оба препарата следует принимать под контролем специалиста, чтобы адекватно отслеживать возможный вред для плода [32]. Топирамат, кандесартан и вальпроат натрия противопоказаны; известно, что вальпроат натрия является тератогеном, и использовать его не следует [70, 94], а применение топирамата и кандесартана связано с побочными эффектами для плода.
Медикаментозная терапия мигрени в послеродовой период также требует осторожности в силу возможных рисков для младенца. Для острого лечения предпочтителен парацетамол, хотя ибупрофен и суматриптан тоже считаются безопасными [94]. Если требуется превентивная лекарственная терапия, прежде всего рекомендуется выбирать пропранолол, поскольку он обладает наилучшим профилем безопасности [94]. Более детально фармакотерапия мигрени в ходе беременности и кормления грудью описана в других источниках [94].
Женщины с менструальной мигренью. Около 8 % женщин, страдающих от мигрени, испытывают приступы, связанные исключительно с менструацией; такая мигрень считается подлинно менструальной мигренью [96, 97]. Если для таких пациенток оптимизированная неотложная лекарственная терапия недостаточна, следует рассмотреть перименструальное превентивное лечение. Данный подход в типичном случае включает ежедневный прием НПВП длительного действия (например, напроксена) или триптана (например, фроватриптана или наратриптана) в течение пяти дней, начиная за два дня до ожидаемого первого дня менструации [98, 99, 100, 101]. Для некоторых женщин с подлинно менструальной мигренью без ауры эффективно непрерывное применение комбинированных гормональных контрацептивов. И напротив, для женщин, страдающих от мигрени с аурой, применение комбинированной гормональной контрацепции противопоказано вне зависимости от какой-либо связи с менструальным циклом, поскольку оно связано с повышением риска инфаркта [32].
Рекомендации
- Если у пациента выраженные признаки мигрени появились в позднем возрасте, следует предположить глубинную причину этого заболевания.
- В случае пожилых людей принимайте во внимание повышенные риски вторичных головных болей, сопутствующих состояний и побочных эффектов.
- Для страдающих от мигрени детей и подростков постельного режима может быть достаточно; если нет, используйте ибупрофен для неотложной терапии и пропранолол, амитриптилин или топирамат для предупреждения.
- В случае беременных и кормящих женщин принимайте парацетамол для острой терапии и избегайте превентивных лекарственных средств, если это возможно.
- Для женщин с менструальной мигренью рассмотрите применение перименструальной превентивной терапии НПВП длительного действия или триптаном.
Активный катамнез — единственный адекватный способ определения результатов терапии, который позволяет анализировать диагноз и стратегии лечения. Ответ на терапию следует оценивать в течение 2–3 месяцев после начала лечения или изменения его схемы и регулярно делать это и после, не обязательно через короткие интервалы (например, через 6–12 месяцев). Измерение терапевтического ответа должно включать в себя анализ эффективности, побочных эффектов и соблюдения врачебных предписаний.
Ключевые меры оценки эффективности лечения — это частота приступов, их интенсивность и связанная с мигренью потеря трудоспособности [32]. Частоту приступов обычно измеряют в количестве дней с головной болью или мигренью в месяц. Интенсивность обычно выражается как степень боли, а не функциональные последствия, которые надо оценивать отдельно. Календари головной боли очень полезны для проведения таких измерений и не требуют много времени, если заполнять их только в дни появления симптомов [32]. Кроме того, календари головной боли полезны для мониторинга применения лекарственных препаратов неотложной терапии. Для катамнестических оценок можно использовать Опросный лист для оптимизации лечения мигрени (mTOQ-4) для самостоятельного заполнения, с помощью которого можно измерять эффективность острой лекарственной терапии [102], в то время как Опросный лист HURT (Headache Under-Response to Treatment) из восьми частей можно применять для оценки эффективности врачебного вмешательства и внесения предлагаемых изменений в схему лечения, чтобы улучшить ее эффективность (блок 3).
Если лечение безуспешно. Вывод о том, что лечение не достигло успеха, следует делать с осторожностью и всегда предварять детальным анализом лежащих в основе этого причин. В некоторых случаях явные неудачи поправимы — например, если причиной является недостаточное соблюдение схемы лечения или использование неоптимальных доз [32]. В то время как для некоторых пациентов наибольшую пользу приносят высокие дозы, другим могут быть полезны более низкие, поскольку они вызывают меньше побочных эффектов, и такого плана лечения проще придерживаться. Альтернативы в случае неэффективности неотложной терапии первой линии описаны выше (см. «Шаг 4» и «Шаг 5»). Если неэффективными оказались все способы лечения, возникает вопрос о правильности постановки диагноза, и пациент должен быть направлен к специалисту [32].
Когда требуется обращение к специалисту. Приблизительно 90 % людей, обращающихся за профессиональной помощью по поводу мигрени, следует оказывать первичную медицинскую помощь. Обращаться к специалисту нужно тем немногим, чье состояние тяжелое, трудноизлечимое или осложняется сопутствующими заболеваниями [32]. Специализированная медицинская помощь обладает большей компетентностью, в основе которой лежит опыт и многопрофильность. Тем не менее, специализированная помощь имеет ограничения по вместимости, а цена ее намного выше [105].
Рекомендации
- Оценивайте ответ на терапию вскоре после начала (через 2–3 месяца) или изменения схемы лечения и регулярно в дальнейшем (каждые 6–12 месяцев).
- Измеряйте эффективность лечения путем оценки частоты приступов, их интенсивности и связанной с мигренью потерей трудоспособности.
- Если результаты неоптимальны, пересмотрите диагноз, стратегию лечения, дозировку и следование пациента врачебным предписаниям.
- Если все способы лечения не приносят результатов, поставьте диагноз под вопрос и рассмотрите обращение к специалисту.
Блок 3 | Инструменты для оценки ответа на лечение
Опросный лист HURT
Лекарственно-индуцированная головная боль. ЛИГБ представляет собой хроническое нарушение, характеризующееся присутствием головной боли ≥ 15 дней в месяц. Оно может развиваться в течение различного периода времени у пациентов с уже существующей головной болью как результат регулярного злоупотребления лекарственными средствами для острого или симптоматического лечения головной боли [4]. Примерно две трети случаев ЛИГБ составляют пациенты с мигренью, хотя оценка основана на ограниченных доказательствах и может оказаться заниженной [106].
Прекращение злоупотребления лекарственными препаратами — необходимое и единственное средство устранить ЛИГБ [107]. По согласованному мнению экспертов, острая отмена предпочтительнее постепенной, если речь не идет об опиатах [30]. Процесс отмены можно осуществить на уровне первичной медицинской помощи, если только речь не идет о препаратах, вызывающих зависимость, таких как опиаты [108, 109]. Здесь очень важным является информирование пациента, поскольку при отмене часто улучшению состояния предшествует ухудшение [30, 110]. Для лечения такой продромной головной боли подойдет превентивная терапия (как медикаментозная, так и немедикаментозная), которую можно начать параллельно с отменой препаратов неотложной терапии или при возвращении головной боли [30]. Однако этот вопрос остается спорным [111, 112].
Переход в хроническую мигрень. Некоторые оценки указывают на то, что каждый год вплоть до 3 % пациентов с эпизодической мигренью испытывают ее переход в хроническую [113]. Такие оценки не очень надежны в силу того, что хроническая мигрень часто сочетается с ЛИГБ [114], однако трансформация в хроническую форму имеет место. Известные факторы риска включают женский пол, высокую частоту головных болей, неадекватное лечение, злоупотребление препаратами неотложной терапии и ряд сопутствующих состояний, включая депрессию, тревожность и ожирение [115, 116, 117, 118]. Распознавание этих факторов риска — немаловажный момент при лечении, а их модификация может предотвратить трансформацию.
Когда хроническая мигрень уже развилась, лечение ее становится затруднительным, и обычно необходима специализированная медицинская помощь [32]. Если ЛИГБ, часто дающая симптомы, которые позволяют предположить хроническую мигрень, может быть исключена, следует использовать превентивную терапию [114]. Страдающих от хронической мигрени людей также следует информировать о возможности влиять на факторы риска, чтобы они могли соответствующим образом изменять образ жизни; это, в свою очередь, может облегчить их состояние.
Среди препаратов превентивной терапии, эффективность которых доказана при хронической мигрени — топирамат [119], онаботулотоксин А [120] и моноклональные антитела к CGPR [121]. Топирамат наиболее предпочтителен благодаря намного более низкой стоимости. Нормативные предписания в целом ограничивают применение онаботулотоксина А и антител против CGPR пациентами, у которых лечение двумя или другими превентивными препаратами оказалось безуспешным, несмотря на тот факт, что топирамат является единственным из прочих средств с доказанной эффективностью. Три антитела против CGPR (эренумаб, фреманезумаб и галканезумаб) доказанно работают у тех пациентов, у которых два других превентивных лекарственных средства не дали результата [122, 123, 124]. В случае эпизодической мигрени выбор препаратов для превентивной терапии и порядок их использования определяются локальными руководствами, доступностью, стоимостью и политикой возмещения затрат. Для β-блокаторов, кандесартана или амитриптилина в качестве превентивных препаратов при хронической мигрени отсутствуют строгие доказательства на основе рандомизированных контролируемых исследований, однако они широко применяются в клинической практике.
Рекомендации
- Информируйте пациентов с мигренью о риске ЛИГБ при частом злоупотреблении препаратами неотложной терапии.
- При установившейся ЛИГБ используйте сопровождаемую объяснением отмену лекарственных средств, которыми злоупотребляет пациент; предпочтительнее резкая отмена, если речь не идет об опиатах.
- Распознавайте и по возможности модифицируйте факторы риска перехода эпизодической мигрени в хроническую форму.
- Направляйте пациентов с хронической мигренью в специализированные клиники.
- Если ЛИГБ исключена, начинайте превентивную лекарственную терапию хронической мигрени; варианты с доказанной эффективностью включают топирамат, онаботулотоксин А и моноклональные антитела против CGRP.
Мигрень ассоциирована с тревожностью, депрессией, нарушениями сна и состояниями, сопровождающимися хронической болью (например, боль в шее и пояснице) [125, 126, 127, 128, 129]. Эта связь более выражена у людей с хронической мигренью, нежели у людей с эпизодической [130]. Ожирение также служит важным фактором риска для перехода от эпизодической мигрени к хронической и должно учитываться при ее клинической оценке [131]. Кроме того, у женщин мигрень с аурой ассоциирована с сердечно-сосудистыми заболеваниями [132].
Распознавание сопутствующих состояний при мигрени важно, поскольку влияет на выбор лекарств. Например, для пациентов с ожирением предпочтителен топирамат, так как его прием связан со снижением веса. Для пациентов, страдающих депрессией или расстройствами сна, наибольшую пользу должен принести амитриптилин. Определение коморбидностей также важно, поскольку их ослабление может улучшить результаты лечения мигрени, и наоборот.
Рекомендации
- Убедитесь, что у пациента с мигренью идентифицированы сопутствующие состояния, поскольку они могут влиять на выбор схемы лечения и на результаты.
- Подбирайте терапию соответственно и имейте в виду возможные взаимодействия побочных эффектов лекарственных препаратов и профиля сопутствующих заболеваний пациента.
Долгосрочная терапия пациентов с мигренью должна происходить в рамках оказания первичной медицинской помощи. Возвращение от узкоспециализированной медицинской помощи к первичной следует проводить своевременно, по согласованию с врачом общей практики и в сопровождении схемы комплексной терапии, включающей повторную оценку и шаги, которые следует предпринять при каждом из вероятных исходов. В целом, своевременное возвращение к оказанию первичной медицинской помощи можно проводить, когда превентивная терапия имеет устойчивую эффективность на протяжении вплоть до шести месяцев и не сопровождается существенными побочными эффектами.
При оказании первичной медицинской помощи главная цель последующего врачебного наблюдения — стабильное поддержание благоприятных исходов, достигнутых как в учреждениях первичной помощи, так и в специализированных, и адекватно реагировать на любые изменения, которые могут требовать внимания. Ни одна из этих задач не требует регулярного рутинного контакта с пациентом и, таким образом, его следует избегать за исключением тех случаев, когда он необходим в контексте коррекции лекарственной терапии. Вместо этого врачам общей практики следует сделать акцент на информировании пациента и уверенности в собственных силах в тех случаях, когда повторный визит необходим.
Рекомендации
- Учреждения первичной медицинской помощи должны нести ответственность за долговременное наблюдение страдающих мигренью пациентов, поддерживая стабильное состояние и реагируя на изменения.
- Возвращение от специализированной медицинской помощи к первичной следует проводить своевременно и в сопровождении комплексной схемы лечения.
- Пациент может возвращаться к первичной медицинской помощи, когда превентивная терапия стабильно сохраняет эффективность вплоть до шести месяцев и не сопровождается значительными побочными эффектами.
Мигрень — широко распространенное неврологическое заболевание, которое вносит существенный вклад в глобальное бремя болезни. Несмотря на существование комплексных диагностических критериев и множества возможных методов лечения, диагностика и терапия мигрени в мире остается далекой от идеала. Эксперты из Европы разработали Консенсусное заявление, чтобы обеспечить надлежащие рекомендации для диагностики и терапии и содействовать наилучшим клиническим практикам. Рекомендации основаны на опубликованных доказательствах и экспертном мнении и будут обновляться при появлении новой информации или способов лечения.
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Ласмидитан является селективным агонистом рецептора серотонина 1F, не обладающим вазоконстрикторной активностью. Управление по санитарному надзору за качеством пищевых продуктов и медикаментов США (FDA) одобрило пероральные таблетки ласмидитана для лечения мигрени у взрослых.
В рандомизированных исследованиях ласмидитан был более эффективен по сравнению с плацебо для снятия головной боли через два часа. Так как препарат имеет относительно высокий уровень побочных эффектов, включая головокружение и сонливость, пациенты не должны водить автомобиль или заниматься опасными видами деятельности в течение как минимум восьми часов после приема препарата. Ласмидитан показан пациентам, которые не поддаются лечению другими лекарствами от острой мигрени, а также пациентам с относительными противопоказаниями к триптанам из-за факторов риска сердечно-сосудистых заболеваний.
Истлочники: J Headache Pain. 2019 Aug 29;20(1):90. doi: 10.1186/s10194-019-1044-6.
Cephalalgia. 2019 Oct;39(11):1343-1357. doi: 10.1177/0333102419864132.
https://www.fda.gov/news-events/press-announcements/fda-approves-new-treatment-patients-migraine
Shapiro RE et al
BACKGROUND:
In addition to the increased risk for cardiovascular (CV) disease and CV events associated with migraine, patients with migraine can also present with a number of CV risk factors (CVRFs). Existing treatment options can be limited due to contraindications, increased burden associated with monitoring, or patient avoidance of side effects. Safe and effective migraine treatment options are needed for patients with migraine and a history of CV or cerebrovascular disease or with increased risk for CV events. This analysis was designed to evaluate the safety and efficacy of oral lasmiditan, a selective serotonin 5-hydroxytryptamine 1F receptor agonist, in acute treatment of migraine attacks in patients with CVRFs.
METHODS:
SAMURAI and SPARTAN were similarly designed, Phase 3, randomized, double-blind, placebo-controlled trials in adults treating a single migraine attack with lasmiditan 50, 100, or 200 mg. Both studies included patients with CVRFs, and SPARTAN allowed patients with coronary artery disease, clinically significant arrhythmia, or uncontrolled hypertension. Efficacy and safety of lasmiditan in subgroups of patients with differing levels of CVRFs are reported. For efficacy analyses, logistic regression was used to assess treatment-by-subgroup interactions. For safety analyses, Cochran-Mantel-Haenszel test of general association evaluated treatment comparisons; Mantel-Haenszel odds ratio assessed significant treatment effects.
RESULTS:
In this pooled analysis, a total of 4439 patients received ≥1 dose of study drug. A total of 3500 patients (78.8%) had ≥1 CVRF, and 1833 patients (41.3%) had ≥2 CVRFs at baseline. Both trials met the primary endpoints of headache pain freedom and most bothersome symptom freedom at 2 h. The presence of CVRFs did not affect efficacy results. There was a low frequency of likely CV treatment-emergent adverse events (TEAEs) overall (lasmiditan, 30 [0.9%]; placebo, 5 [0.4%]). There was no statistical difference in the frequency of likely CV TEAEs in either the absence or presence of any CVRFs. The only likely CV TEAE seen across patients with ≥1, ≥ 2, ≥ 3, or ≥ 4 CVRFs was palpitations.
CONCLUSIONS:
When analyzed by the presence of CVRFs, there was no statistical difference in lasmiditan efficacy or the frequency of likely CV TEAEs. Despite the analysis being limited by a single-migraine-attack design, the lack of differences in efficacy and safety with increasing numbers of CVRFs indicates that lasmiditan might be considered in the treatment algorithm for patients with CVRFs. Future studies are needed to assess long-term efficacy and safety.
PubMed
Brandes JL et al
OBJECTIVES:
To address the need for long-term lasmiditan data, the GLADIATOR study evaluated the safety (primary) and efficacy (secondary) of lasmiditan for the intermittent, acute treatment of migraine attacks for up to 1 year.
METHODS:
In this prospective, randomized, open-label, Phase 3 study, patients who had completed either of two single-attack studies were offered the opportunity to be randomized 1:1 to lasmiditan 100 mg or 200 mg. Patients were asked to use lasmiditan as the first treatment for each new migraine attack of at least moderate severity. Assessments occurred at baseline and at prespecified time increments up to 48 hours after each dose of study drug using an electronic diary, and safety was assessed throughout the study. Migraine Disability Assessment (MIDAS) was assessed at each visit.
RESULTS:
As of the cut-off date for this interim analysis (6 March 2018), 1978 patients had received ≥ 1 lasmiditan dose and treated 19,058 migraine attacks. Overall, treatment-emergent adverse events (TEAEs) were similar to those in the single-attack studies and included dizziness (18.6%), somnolence (8.5%), and paresthesia (6.8%). The frequency of TEAEs generally decreased with subsequent attacks. No treatment-related serious adverse events and no cardiovascular TEAEs potentially due to vasoconstriction were observed. For both lasmiditan doses, efficacy measures were generally consistent over study quarters and treated attacks. Overall, across all treated attacks at 2 hours post-dose, pain freedom was observed in 26.9% of the attacks treated with lasmiditan 100 mg and 32.4% of the attacks treated with lasmiditan 200 mg. MIDAS total scores decreased over time.
CONCLUSIONS:
The interim results of this long-term study showed intermittent lasmiditan (100 mg and 200 mg) to be generally well tolerated and efficacious for the acute treatment of migraine over a 1-year period. Trial registration number: NCT02565186; clinicaltrials.gov/ct2/show/NCT02565186.
PubMed
For Immediate Release:
October 11, 2019
The U.S. Food and Drug Administration today approved Reyvow (lasmiditan) tablets for the acute (active but short-term) treatment of migraine with or without aura (a sensory phenomenon or visual disturbance) in adults. Reyvow is not indicated for the preventive treatment of migraine.
“Reyvow is a new option for the acute treatment of migraine, a painful condition that affects one in seven Americans,” said Nick Kozauer, M.D., acting deputy director of the Division of Neurology Products in the FDA’s Center for Drug Evaluation and Research. “We know that the migraine community is keenly interested in additional treatment options, and we remain committed to continuing to work with stakeholders to promote the development of new therapies for the acute and preventive treatment of migraine.”
Migraine headache pain is often described as an intense throbbing or pulsing pain in one area of the head. Additional symptoms include nausea and/or vomiting and sensitivity to light and sound. Approximately one-third of individuals who suffer from migraine also experience aura shortly before the migraine. An aura can appear as flashing lights, zig-zag lines, or a temporary loss of vision. Migraines can often be triggered by various factors including stress, hormonal changes, bright or flashing lights, lack of food or sleep, and diet. Migraine is three times more common in women than in men and affects more than 10% of people worldwide.
The effectiveness of Reyvow for the acute treatment of migraine was demonstrated in two randomized, double-blind, placebo-controlled trials. A total of 3,177 adult patients with a history of migraine with and without aura treated a migraine attack with Reyvow in these studies. In both studies, the percentages of patients whose pain resolved and whose most bothersome migraine symptom (nausea, light sensitivity, or sound sensitivity) resolved two hours after treatment were significantly greater among patients receiving Reyvow at all doses compared to those receiving placebo. Although patients were allowed to take a rescue medication two hours after taking Reyvow, opioids, barbiturates, triptans and ergots were not allowed within 24 hours of the study drug’s administration. Twenty-two percent of patients were taking a preventive medication for migraine.
There is a risk of driving impairment while taking Reyvow. Patients are advised not to drive or operate machinery for at least eight hours after taking Reyvow, even if they feel well enough to do so. Patients who cannot follow this advice are advised not to take Reyvow. The drug causes central nervous system (CNS) depression, including dizziness and sedation. It should be used with caution if taken in combination with alcohol or other CNS depressants.
The most common side effects that patients in the clinical trials reported were dizziness, fatigue, a burning or prickling sensation in the skin (paresthesia), and sedation.
The FDA granted the approval of Reyvow to Eli Lilly and Company.
The FDA, an agency within the U.S. Department of Health and Human Services, protects the public health by assuring the safety, effectiveness, and security of human and veterinary drugs, vaccines and other biological products for human use, and medical devices. The agency also is responsible for the safety and security of our nation’s food supply, cosmetics, dietary supplements, products that give off electronic radiation, and for regulating tobacco products.
Итомед : инструкция по применению
- Состав•
- Описание•
- Фармакотерапевтическая группа•
- Фармакологические свойства•
- Показания к применению•
- Способ применения и дозы•
- Противопоказания•
- Побочное действие•
- Взаимодействие с другими лекарственными средствами•
- Особые указания•
- Беременность и период лактации•
- Передозировка•
- Влияние на способность вождения автотранспорта и управления механизмами•
- Упаковка•
- Условия хранения•
- Срок годности•
- Условия отпуска из аптек•
- Цены•
1 таблетка, покрытая оболочкой, содержит 50 мг итоприда гидрохлорида Вспомогательные вещества: моногидрат лактозы, прежелатинизированный кукурузный крахмал, натрия кроскармеллоза, диоксид кремния коллоидный безводный, магния стеарат
Оболочка Opadry II 85F18422 белый:
частично гидролизованный поливиниловый спирт, диоксид титана, макрогол 3350, тальк.
Белые или почти белые, двояковыпуклые таблетки, покрытые оболочкой, с риской с одной стороны.
Риска способствует разламыванию таблетки с целью облегчения ее проглатывания, а не для деления ее на две дозы.
Прокинетик. АТС код: A03FA07
Фармакодинамические свойства
Итоприда гидрохлорид усиливает моторику ЖКТ за счет антагонизма D2-допаминовых рецепторов и ингибирования ацетилхолинэстеразы. Итоприд активирует высвобождение ацетилхолина и подавляет его разрушение.
Обладает противорвотным эффектом за счет взаимодействия с D2-рецепторомами, находящимися в триггерной зоне. Вызывает дозозависимое подавление рвоты, вызванной апоморфином. Активирует пропульсивную моторику желудка за счет антагонизма с D2-рецепторами и дозозависимого ингибирования активности ацетилхолинэстеразы.
Итоприд оказывает весьма специфическое воздействие на верхний отдел желудочно-кишечного тракта, ускоряет транзит по желудку, улучшает его опорожнение. Итоприд не влияет на концентрацию гастрина в плазме крови.
Фармакокинетические свойства
Абсорбция
Итоприд быстро и почти полностью абсорбируется в желудочно-кишечном тракте. Относительная биологическая доступность, составляющая приблизительно- 60%, в основном обусловлена метаболизмом при первом прохождении через печень (first- pass effect). Пища не влияет на биологическую доступность лекарственного средства. Максимальная плазматическая концентрация достигается через 30-50 минут после приема 50 мг итоприда.
Повторное пероральное применение дозы 50-200 мг 3 раза в сутки на протяжении 7 дней показало, что итоприд и его метаболиты имеют линейную фармакокинетику с минимальной аккумуляцией.
Распределение
Связывается с белками плазмы (в основном, с альбумином) на 96% с αl-кислым гликопротеином — менее чем на 15%. Активно распределяется в тканях и обнаруживается в высоких концентрациях в почках, тонком кишечнике, печени, надпочечниках, желудке. Объем распределения составляет 6,1 л/кг. В терапевтических дозах незначительно проникает в головной и спинной мозг, в грудное молоко.
Метаболизм
Метаболизируется в печени. Индетифицированы 3 метаболита, один из которых проявляет незначительную активность: 2-3 % от активности итоприда.
Метаболизируется флавинмонооксигеназой (FMO3). Количество и эффективность изоферментов человека может быть связано с генетическим полиморфизмом, что в редких случаях приводит к развитию аутосомно-рецессивного состояния, известного как триметиламинурия (синдром рыбного запаха). Период полувыведения препарата у пациентов с триметиламинурией может быть увеличен. По данным фармакокинетических исследований in vivo итоприд не оказывает ингибирующего или индуцирующего действия на CYP2C19 и CYP2E1. Применение итоприда не оказывает влияния на активность уридиндифосфатглюкоронил-трансферазы.
Выведение
Итоприд и его метаболиты выделяются главным образом с мочой. Период полувыведения итоприда составляет приблизительно 6 часов.
Итомед предназначен для лечения функциональных гастроинтестинальных симптомов, функциональной диспепсии с ощущениями вздутия живота, переполненного желудка, от дискомфорта до болезненного ощущения в области эпигастрия.
Таблетки следует глотать целиком, запивая достаточным количеством жидкости.
Дозировка
Рекомендуемая суточная доза для взрослых составляет 150 мг, т.е. по 1 таблетке 3 раза в сутки перед едой. Доза может быть уменьшена в зависимости от заболевания. Точная дозировка и продолжительность лечения зависят от клинического состояния пациента. В клинических испытаниях максимальный период применения лекарственного средства составлял 8 недель.
Пациенты с нарушением функции печени или почек
Пациенты с нарушением функции печени или почек, должны находиться под тщательным контролем врача, а в случае неблагоприятных реакций, необходимо снизить дозу или прекратить лечение.
Пожилые пациенты
Частота возникновения побочных реакций у пациентов старше 65 лет выше, чем у остальных пациентов. В связи с этим, необходимо соблюдать осторожность при применении лекарственного средства у лиц пожилого возраста.
Дети и подростки
Безопасность применения препарата Итомед 50 мг у педиатрической популяции в возрасте до 18 лет не была установлена.
— повышенная чувствительность к итоприду, а также к любому из вспомогательных веществ лекарственного средства;
— детский возраст;
— усиленная гастроинтестинальная моторика, гастроинтестинальное кровотечение, механическая обструкция или наличие перфорации;
— беременность и период кормления грудью.
Наблюдаемые побочные явления можно сгруппировать по частоте встречаемости:
Очень часто (>1/10), часто (>1/100, <1/10), нечасто (>1/1000, <1/100), редко (>1/10000, <1/1000), очень редко (<1/100000), включая единичные случаи, неизвестные (невозможно определить исходя из — доступных данных)
Со стороны ЦНС:
нечасто — головные боли, нарушение сна, головокружение
неизвестно — тремор, раздражительность
Со стороны пищеварительной системы:
Нечасто — запор, понос, боли в животе, повышенное слюноотделение
Неизвестно — тошнота
Со стороны мочевыделительной системы:
Нечасто — повышение мочевинного азота в крови и креатинина
Со стороны опорно-двигательного аппарата и соединительной ткани:
Нечасто — боли в груди или в области спины
Со стороны эндокринной системы:
Нечасто — повышение уровня пролактина (в случае появления самопроизвольного истечения молока лечение необходимо прервать или совсем прекратить)
Со стороны кровеносной и лимфатической систем:
Нечасто — лейкопения (особое внимание следует уделять пациентам во время гематологического обследования. При появлении побочных реакций лечение должно быть приостановлено)
Неизвестно — тромбоцитопения
Со стороны кожи и подкожной ткани
Редко — кожная сыпь, покраснение, зуд
Со стороны иммунной системы:
Неизвестно — анафилактические реакции
Общие нарушения и реакции в месте аппликации
Нечасто — усталость
Со стороны печени и желчных протоков:
Неизвестно — желтуха
Изменения лабораторных показателей:
Неизвестно — повышение активности аспартатаминотрансферазы (ACT), аланинаминотрансферазы (АЛТ), гамма-глютамилтранспептидазы (ГГТП), щелочной фосфатазы и уровня билирубина.
Сообщения о нежелательных реакциях
Важно сообщать о подозреваемых нежелательных реакциях после регистрации лекарственного средства с целью обеспечения непрерывного мониторинга соотношения польза/риск лекарственного средства. В случае возникновения нежелательных реакций, перечисленных в данном листке- вкладыше, а также не упомянутых в нем, или в случае неэффективности лекарственного средства необходимо, в первую очередь, незамедлительно сообщить об этом лечащему врачу. Также можно позвонить по телефону компании-производителя лекарственного средства, либо сообщить о нежелательной реакции/неэффективности в Республиканское унитарное предприятие «Центр экспертиз и испытаний в здравоохранении» (https://www.rceth.by).
Сообщая о нежелательных реакциях, вы помогаете получить больше сведений о безопасности лекарственного средства.
Антихолинергические вещества снижают эффективность итоприда.
Взаимодействий при одновременном приеме итоприда с варфарином, диазепамом, диклофенаком, тиклопидином, нифедипином и никардипином не обнаружено.
Итоприд усиливает моторику желудка, поэтому он может повлиять на всасывание других лекарственных средств, которые назначают внутрь. Особую осторожность следует соблюдать при применении лекарственных средств с низким терапевтическим индексом, а также форм с замедленным высвобождением активного вещества или с кишечно-растворимой оболочкой. Противоязвенные средства, такие как циметидин, ранитидин, гепронон и цетрексат не влияют на. прокинетическую эффективность итоприда.
Взаимодействие на уровне цитохрома Р450 не предполагается.
Применение итоприда усиливает действие ацетилхолина и может вызывать побочные холинергические реакции.
Лекарственное средство содержит лактозу, в связи с этим пациентам, страдающим редкими наследственными заболеваниями, такими как непереносимость галактозы, дефицит лактазы Лаппа или синдром мальабсорбции глюкозы и галактозы, не следует принимать данное лекарственное средство.
Данные о долговременном применении Итомеда отсутствуют.
Безопасность применения лекарственного средства во время беременности не была установлена. Поэтому, во время беременности и в случае предполагаемой беременности, применение итоприда возможно только в случае, когда терапевтические преимущества превышают потенциальный риск.
Из-за отсутствия данных о проникновении итоприда в грудное молоко, применение данного лекарственного средства в период кормления грудью не рекомендуется.
Данные о передозировке лекарственного средства отсутствуют. При передозировке рекомендуется проводить промывание желудка и симптоматическую терапию.
Хотя влияний лекарственного средства на способность вождения автотранспорта и управления механизмами не было обнаружено, при его применении нельзя исключить снижения концентрации внимания в связи с тем, что в очень редких случаях прием препарата может сопровождаться возникновением головокружений.
Блистер по 20 таблеток из ПВХ/ПВДХ/алюминевой фольги, 2 и 5 блистеров вместе с инструкцией по применению в картонной коробке.
Не требует специальных условий хранения. Хранить в недоступном для детей месте.
5 лет. Не применять после окончания срока годности!
Отпускается без рецепта врача.
Название и адрес изготовителя и импортера
PRO.MED.CS Praha a.s.
Telcska 377/1, Michie, 140 00 Praha 4
Чешская Республика