LВ-комплекс
Особенности состава пробиотика «LB-комплекс»
- Жидкий биокомплекс лакто- и бифидобиктерий. В состав биокомплекса входят 3 штамма лактобацилл видов L.рlantarum, L.fermentun и 3 штамма бифидобактерий видов B.bifidum, B.longum в 1 мл которого содержится не менее 109 живых микробных клеток (патент РФ — № 2517734 от 13.12.2012).
- В качестве основы пробиотика использован гидролизат обезжиренного молока, представляющий собой гипоаллергенный раствор аминокислот и простейших пептидов. Несомненным достоинством биокомплекса является то, что стартерные культуры образуют устойчивую систему, обладающую высоким антагонизмом по отношению к патогенным и условно-патогенным бактериям,
- Состав биокомплекса подобран таким образом, что имеет высокую резистентность к действию антибактериальных препаратов. При применении одновременно с антибиотиками гарантированно выживают более 2х видов лакто- и бифидобактерий.
- Штаммы лактобацилл, входящие в пробиотик, обладают высоким уровнем β-галактозидазной активности, что позволяет использовать пробиотик при лактазной недостаточности.
- Жидкий пробиотик «LB-комплекс» содержит живые активные бактерии и продукты жизнедеятельности, в том числе витамины и летучие жирные кислоты. Поэтому при их приёме происходит нормализация кишечной среды, создаются оптимальные условия для жизнедеятельности и восстановления собственной нормофлоры.
Таким образом, жидкий пробиотик «LB-комплекс» – это комплексный препарат, он создает в кишечнике временный искусственный микробиоценоз, позволяющий возродиться собственной микрофлоре.
Теоретически обоснована и экспериментально подтверждена целесообразность использования пробиотика LB-комплекс в качестве средства неспецифической профилактики аденовирусной инфекции (ОРВИ) и гриппа, кроме того LB-комплекс рекомендуется применять для защиты собственной микрофлоры с первого дня приема антибиотиков, назначаемых при тяжелом течении гриппа и ОРВИ, что поможет избежать нежелательных побочных эффектов в виде развития и усугубления дисбиоза кишечника, аллергических реакций и др.
Показания к применению LВ-комплекса:
Прямые
- дисбиотические нарушения микрофлоры кишечника разной этиологии, т.ч. связанные с приемом антибиотиков;
- хронические заболевания желудочно-кишечного тракта;
- острые и хронические кишечные инфекции;
другие инфекционные заболевания, в том числе хронические (туберкулез, гепатиты и др.); - соматические заболевания, требующие длительного лечения антибиотиками, химио- и гормональными препаратами;
- онкологические заболевания — на фоне лучевой и химиотерапии;
- часто болеющие дети (не менее 2 раз в год в комплексе с общеукрепляющими средствами; витаминами, микроэлементами и др.), в том числе при аллергических заболеваниях.
- новорожденные дети, лишенные грудного вскармливания, недоношенные, получающие антибактериальные средства по поводу различных патологических состояний;
- дети, матери которых в период беременности или кормления ребенка грудью получали антибиотики и химиопрепараты;
- дети, матери которых в период беременности и родов были отнесены к группе повышенного риска по развитию гнойно-воспалительных заболеваний;
- женщины детородного возраста из группы риска по невынашиванию и внутриутробному инфицированию плода;
- беременные женщины при подготовке к родам;
- дети и взрослые, проживающие на экологически неблагоприятных территориях (1-3 раза в год в качестве профилактики).
Косвенные
- для повышения резистентности к ОРВИ;
- для лечения язвенной болезни желудка (вне обострений)
- для снижения риска поражения атеросклерозом;
- для профилактики осложнений в комплексной терапии рака или снижения риска заболевания;
- для профилактики иммунных нарушений с кожными проявлениями (нейродермит, дерматозы, экзема и т.п.);
- для нормализации микрофлоры полости рта после стоматитов и гингивитов;
- для больных с эндокринной патологией — для иммуностимуляции и коррекции микробиоценоза ЖКТ;
- при хронических заболеваниях печени в период ремиссии, при хронических панкреатитах — для профилактики обострений;
- для профилактики интоксикационных поражений печени, кишечника, нервной системы у людей, работающих на вредных производствах;
- для стабилизации микрофлоры при работе в экстремальных условиях (шахтеры, подводники, космонавты, полярники и т.п.).
Клинические испытания
Высокая эффективность LB-комплекса подтверждена клиническими испытаниями, проведенными на базе лечебно-профилактических учреждений города Нижнего Новгорода: МЛПУ «Детская клиническая больница № 27 «Айболит», отделения патологии новорожденных, гастроэнтерологии, пульмонологии; МЛПУ «Городская клиническая больница № 39», детское отделение; Государственное учреждение здравоохранения «Нижегородский областной противотуберкулезный диспансер», детское отделение; в Гастроэнтерологическом центре отделенческой больницы ст. Горький-Сортировочный и Городской больнице № 5 им. Пятницкого на фоне антихеликобактерной терапии при язвенной болезни желудка и двенадцатиперстной кишки; в ООО «Санаторий им. ВЦСПС» больным в период восстановительного лечения после ушивания перфоративной язвы двенадцатиперстной кишки и после холецистэктомии. Также клинические испытания проводились в дошкольных общеобразовательных учреждениях Автозаводского района г. Нижнего Новгорода и г. Санкт-Петербурга среди часто болеющих детей.
Противопоказания
Индивидуальная непереносимость компонентов продукта.
Способ применения и дозы
Применяется во время еды с пищей: грудным молоком, кисломолочными продуктами (кефир, йогурт, творог и др.), киселями, компотами, соками, кашами и др., температура которых не выше 30°С. В одной упаковке препарата находится курс из 25 флаконов.
Дозы
Детям
- от 5 дней до 2 месяцев — по 0,5 мл 3 раза в день;
- от 2 месяцев до 1 года — по 2 мл 1 раз в день;
- от 1 года до 7 лет — по 2,5 мл 1 раз в день;
- старше 7 лет — 5 мл в день на 1 или 2 приема;
Взрослым
- 5 мл в день на 1 или 2 приема.
Продолжительность приема 25 дней (минимальный рекомендуемый курс).
Возможна индивидуальная непереносимость компонентов БАД. Перед применением необходимо проконсультироваться со специалистом.
Условия хранения
При температуре 4±2°С в невскрытой заводской упаковке.
Срок годности
60 суток в невскрытой заводской упаковке.
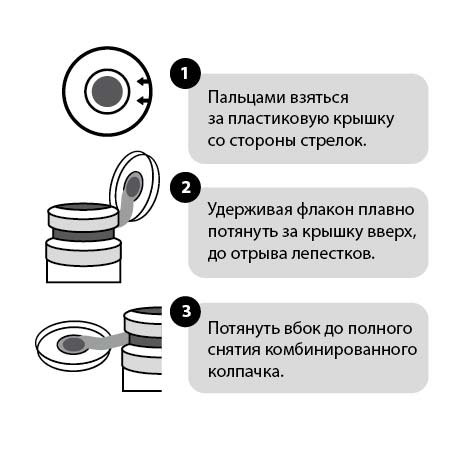
Инструкция по вскрытию флаконов

Свидетельство о государственной регистрации №RU77.99.88.003.E.000946.01.15 от 26.01.2015
Качество продукции обеспечено сертификационной системой менеджмента безопасности пищевой продукции ГОСТ Р ИСО 22000-2007 (ISO 22000: 2005), включающей принципы ХАССП.
Изготовитель: ФБУН ННИИЭМ им. академика И.Н. Блохиной Роспотребнадзора, 603950, г. Нижний Новгород, ул. Малая Ямская, д. 71 (адрес производства: 603126, г. Нижний Новгород, ул. Родионова, д. 192, к. 1), Российская Федерация.
Официальный дистрибьютор по РФ и СНГ: ООО «АЙВОС», ИП Мокеев Юрий Валерьевич, 603105, г. Нижний Новгород, ул. Республиканская, д.14.
Перейти в каталог
Перейти на сайт изготовителя
Жидкость во флаконах по 0,5 мл, 2,5 мл, 5,0 мл.
Номер свидетельства
Форма выпуска
Жидкость во флаконах по 0,5 мл, 2,5 мл, 5,0 мл.
Состав
Bifidobacterium bifidum, Lactobacillus plantarum, Lactobacillus fermentum.
Область применения
В качестве биологически активной добавки к пище — источника пробиотических микроорганизмов (бифидобактерий и лактобацилл)
Рекомендации по применению
Детям от 5 дней до 2 месяцев по 0,5 мл 3 раза в день по назначению врача, детям старше 2 месяцев до 1 года по 2 мл 1 раз в день по назначению врача, детям старше 1 года до 7 лет по 2,5 мл 1 раз в день по назначению врача, детям старше 7 лет и взрослым по 5 мл в день в 1 или 2 приёма во время еды с пищей (молоко, йогурт, кефир и т.п., температура которых не выше 30 °C). Продолжительность приёма — 25 дней.
Противопоказания
Индивидуальная непереносимость компонентов продукта.
Условия хранения
Хранить при температуре (4 ± 2)°C.
Срок годности
60 суток в невскрытой заводской упаковке.
Производитель
603950, г. Нижний Новгород, ул. Малая Ямская, д. 71 (адрес производства: 603126, г. Нижний Новгород, ул. Родионова, д. 192, к. 1)
Подробнее по теме
Ознакомьтесь с дополнительными сведениями о биологически активной добавке LB-комплекс:
- Отзывы
- Вопросы
Информация о биологически активной добавке LB-комплекс предназначена для медицинских и фармацевтических специалистов, исключительно в справочных целях. Инструкция не предназначена для замены профессиональной медицинской консультации, диагностики или лечения. Содержащаяся здесь информация может меняться с течением времени. Наиболее точные сведения содержатся в инструкции производителя, прилагаемой к упаковке БАД.
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Точилина А.Г.
1
Белова И.В.
1
Соловьева И.В.
1
Жирнов В.А.
1
Иванова Т.П.
1
Мартюхина О.К.
2
Чикина Н.А.
2
1 ФБУН ННИИЭМ им. академика И.Н. Блохиной Роспотребнадзора
2 ГБУЗ НО «Детская городская клиническая больница №27 «Айболит»
В статье представлены результаты изучения особенностей формирования микрофлоры детей первого года жизни, доказано, что дисбиоз кишечника и репродуктивного тракта беременных женщин являются факторами пренатального риска. Установлено, что в 94% дети рождаются с бактериальной флорой ЖКТ, причем в первые 24 часа жизни преобладают микроорганизмы родов Lactobacillus и Lactococcus, а также бактерии родов Staphylococcus и Escherichia. Показано, что другие условно-патогенные микроорганизмы присутствуют в микрофлоре здоровых новорожденных в 8,1% случаев. Далее происходит нарастание количества лактобацилл, лактококков и бифидобактерий, а также кишечных палочек, энтерококков и других УПМ. Установлено, что с наибольшей частотой – в 92% случаев – УПМ в значимых количествах выделяются в группе здоровых детей в возрасте от 1 месяца до 1 года. Показана эффективность включения авторских пробиотиков группы «LB-КОМПЛЕКС» в диетотерапию беременных для профилактики формирования ранних дисбиотических состояний у новорожденных, а также в комплексные программы выхаживания недоношенных новорожденных и детей с гастроэнтерологической патологией, осложненной дисбиозом ЖКТ с преимущественным выделением грибов рода Candida.
микроорганизмы
онтогенез
микрофлора кишечника ребенка
толстая кишка
возрастные группы
1. Банержи А. Медицинская статистика понятным языком: вводный курс / пер. с англ. под ред. В.П. Леонова. – М. : Практическая медицина, 2007. – 287 с.
2. Бондаренко B.М. Роль условно-патогенных бактерий кишечника в полиорганной патологии человека. – М. – Тверь : ООО «Издательство «Триада», 2007. – 64 с.
3. Бондаренко В.М., Шапошникова Л.И. Клинический эффект жидких симбиотических биокомплексов, содержащих физиологически активные клетки бифидобактерий и лактобацилл. – М. – Тверь : ООО «Издательство «Триада», 2007. – 95 с.
4. Боровик Т.Э., Ладодо К.С., Яцык Г.В. и др. Национальная стратегия вскармливания детей первого года жизни в Российской Федерации. Организация прикорма // Практика педиатра. – 2008. – № 9. – С. 81-87.
5. Бочков И.А., Юрко Л.П., Юдицкая Н.М. Состояние микрофлоры толстой кишки у детей раннего возраста (по материалам амбулаторных исследований) // Инфекционные болезни. – 2004. – Т. 2, № 3. – С. 83-85.
6. Вельтищев Ю.Е., Ветров В.П. Объективные показатели нормального развития и состояния здоровья ребенка (нормативы детского возраста). – М., 2000. – 96 с.
7. Глушкова О.А. Роль биоценоза кишечника беременной женщины во внутриутробном инфицировании плода и пути его коррекции : дис. … канд. мед. наук. – Н. Новгород, 2000. – 202 с.
8. Диагностика и биокоррекция нарушений антиинфекционного гомеостаза в системе «мать-дитя» : книга для практического врача / под ред. проф. Ефимова Е.И., Соколовой К.Я. – Н. Новгород : НГМА, 2004. – 376 с.
9. Методические указания по контролю биологических и микробиологических факторов. Система предрегистрационного доклинического изучения безопасности препаратов. Отбор, проверка и хранение производственных штаммов, используемых при производстве пробиотиков : методические указания № 4.2.2602-10. – М. : Роспотребнадзор, 2011. – 80 с.
10. Никитенко Н.И., Захаров В.В., Бородин А.В. Роль транслокации бактерий в патогенезе хирургической инфекции // Хирургия. – 2001. – № 2. – С. 63–66.
11. Сидорова И.С., Воробьев А.А., Боровкова Е.И. Микробиоценоз половых путей женщин репродуктивного возраста // Акушерство и гинекология. – 2005. – № 2. — С. 7-9.
Важным и определяющим звеном в процессе формирования микробиоценоза является первичная колонизация бактериями новорожденного, так как в дальнейшем состояние здоровья индивидуума и резистентность к целому ряду заболеваний во многом зависят от характера кишечной микрофлоры и ее активности.
До недавнего времени считалось, что формирование микробиоценоза начинается в момент рождения и обусловлено видовым составом микрофлоры родовых путей матери. Однако с конца 80-х годов прошлого века в зарубежной литературе стали появляться работы, демонстрирующие контакт микрофлоры матери с плодом in utero. Открытие отечественными учеными [10] «феномена бактериальной транслокации» еще в большей степени подвергло сомнению убеждение о стерильности желудочно-кишечного тракта плода. В работе И.А. Бочкова [5] была установлена идентичность кишечных штаммов новорожденного и материнской микрофлоры. Эти факты свидетельствуют в пользу того, что внутриутробно развивающийся плод не является стерильным, а получает от матери какое-то количество индигенных микроорганизмов.
При проведении совместных исследований с ФГБУ «Нижегородский НИИ детской гастроэнтерологии» было выявлено, что среди беременных с дисбиозом кишечника 70% имели отклонение в течении беременности, родов и послеродового периода. У 50% детей, родившихся от них, отмечались отклонения в состоянии здоровья, причем процент их увеличивался до 78% в зависимости от выраженности изменений и состава биоценоза [7].
В связи с этим следует осознавать важность состояния здоровья матери, параметров биоценоза ее кишечника и родовых путей, поскольку она является первичным источником колонизации, а в ряде случаев и инфицирования ребенка [11].
Цель исследования: установить особенности формирования микрофлоры кишечника человека в онтогенезе, подтвердить зависимость между состоянием микробиоты беременной женщины и состоянием новорожденного, а также разработать тактику коррекции нарушений микрофлоры кишечника с использованием авторских пробиотиков группы «LB-комплекс».
Материалы и методы исследования. Было проведено исследование микрофлоры просвета толстой кишки 3268 «здоровых» и «больных» людей различных возрастных групп. Группы людей были сформированы по критериям здоровья, определенным для каждой возрастной группы в отдельности. Проверка данных на нормальность распределения проводилась с применением статистических критериев Колмогорова-Смирнова и Шапиро-Уилка. Для статистической обработки полученных результатов использовались непараметрические критерии Mann — Whitney и Kruskal — Wallis [1]. Многомерный кластерный анализ данных проведен методом Варда, результаты кластеризации проанализированы с помощью метода К-средних, критический уровень значимости р принимался за 0,05. В случае множественных сравнений производилась корректировка критического уровня значимости с помощью поправки [1].
Изучение микрофлоры толстой кишки проводилось по методу, разработанному Р.В. Эпштейн-Литвак и Ф.Л. Вильшанской и модифицированному в Нижегородском НИИЭМ [8].
Результаты исследования и их обсуждение
Группы «здоровых» детей были сформированы по критериям здоровья, определенным для каждой возрастной группы в отдельности: «здоровые» (0-1 месяц) — дети, рожденные от здоровых матерей, в анамнезе не имеющих вредных привычек, хронических соматических и инфекционных заболеваний, анемий, болезней мочеполовой системы (в том числе кольпитов), без отягощенного акушерско-гинекологического анамнеза (инфекционных осложнений при предыдущих беременностях, привычного невынашивания и т.п.), родоразрешившихся естественным путем, без кровотечений в послеродовом периоде, не получавших антибактериальную терапию в течение всего периода беременности, в родах и послеродовом периоде.
Дети доношенные, рожденные в срок, весом от 2,6 до 4,0 кг, ростом от 46 до 54 см, оценка по шкале Апгар 8-10 баллов, без врожденных аномалий развития, не испытывавшие хроническую внутриутробную гипоксию, асфиксию в родах, не получившие травм в родах, не имевшие синдрома дыхательных расстройств, не получающие антибактериальную терапию, находящиеся на естественном или смешанном вскармливании.
Материал на исследование отбирался в период санитарно-эпидемиологического благополучия в родильных домах.
Другие группы «здоровых» детей (старше 1 месяца) были отобраны соответственно принятым нормативам детского возраста [6]. Это дети, получавшие прикорм согласно возрастным нормам [4], не имевшие на момент обследования проявлений каких-либо заболеваний, в том числе респираторных, и в течение 2 месяцев до обследования не принимавшие антибиотики.
К группе «больных» детей (0-1 месяц) были отнесены доношенные дети без врожденных уродств и выраженной патологии, отнесенные к подгруппе риска по развитию гнойно-воспалительных заболеваний по клиническим показателям состояния здоровья новорожденного по шкале Апгар (менее 8 баллов) и факторам пренатального риска у матери.
Группы «больных» в возрасте от 1 месяца и более были сформированы по следующим критериям: «больные» – пациенты, в анамнезе которых на момент обследования отмечались хронические заболевания в стадии обострения или клинические проявления острой формы, на фоне применения антибактериальных и/или других лекарственных средств, так и при первичном обращении до назначения этиотропной терапии, а также все не вошедшие в группу «здоровые».
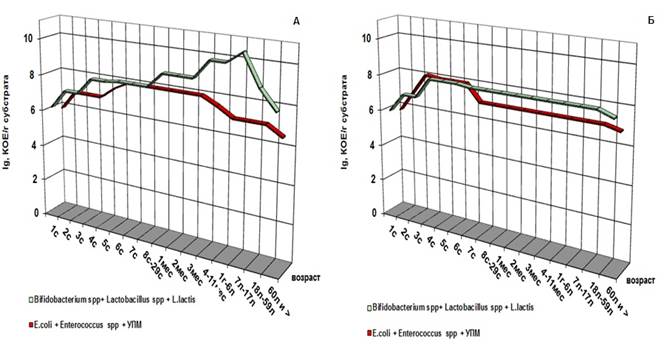
Обобщив данные, полученные по каждой возрастной группе, можно представить процесс формирования микрофлоры у здоровых и больных людей в течение жизни (рис. 1).
Рис. 1. Характеристика численности аэробной и анаэробной симбионтной микрофлоры толстой кишки «здоровых» (А) и «больных» (Б) людей разных возрастных групп (количество микроорганизмов приведено в усредненных значениях)
На рисунке видно, что в первые сутки жизни в процессе формирования микрофлоры кишечника как у здоровых, так и у больных младенцев участвуют как аэробные, так и анаэробные микроорганизмы, причем в равных соотношениях с первого часа жизни, процесс нарастания анаэробной компоненты (представители родов Lactobacillus, Lactococcus и Bifidobacterium) идет параллельно с ростом условно-патогенных микроорганизмов, E.coli и бактерий рода Enterococcus до уровня 105-107 КОЕ/мл.
Начиная с шестых суток жизни у детей обеих групп анаэробная флора начинает преобладать. Но у здоровых детей она выделяется в количестве 109-1010 КОЕ/мл, а у больных — 106-107КОЕ/мл, причем если преобладание количества лакто- и бифидобактерий над УПМ и кишечной палочкой у здоровых детей идет на 2-3 порядка, то у больных детей эта разница наблюдается в пределах одного порядка.
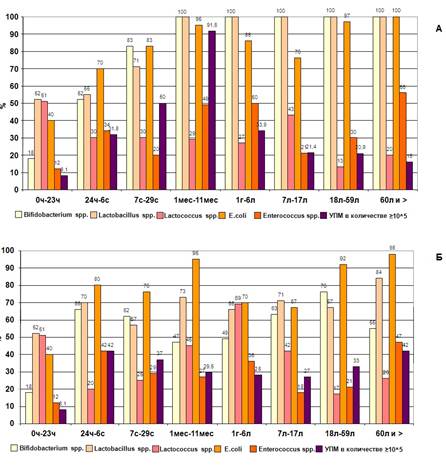
Также было отмечено, что общее количество микроорганизмов, выделяемых из просвета толстой кишки «больных» людей, на два порядка ниже, чем у «здоровых». В пожилом и старческом возрасте таких различий не обнаруживается (группа 60 лет и более) (рис. 2).
Рис. 2. Частота выделения представителей кишечной микрофлоры и УПМ из кишечника «здоровых» (А) и «больных» (Б) людей разных возрастных групп
Проанализировав данные о частоте встречаемости отдельных представителей микробиоценоза просвета толстой кишки в микрофлоре «здоровых» людей различных возрастных групп, следует отметить, что в 94% дети рождаются с бактериальной флорой ЖКТ, причем в первые 24 часа жизни преобладающей флорой являются микроаэрофильные микроорганизмы родов Lactobacillus и Lactococcus, а также факультативно-анаэробные микроорганизмы родов Staphylococcus и Escherichia. Условно-патогенные микроорганизмы уже присутствуют в микрофлоре здоровых новорожденных в 8,1% случаев. Далее во время пребывания в родильном доме (1-7 сутки) и в домашних условиях (от 7 суток до 1 года) происходит нарастание количества как лакто-, лактококков и бифидобактерий, так и E.coli, энтерококков, УПМ. Установлено, что с наибольшей частотой – в 92% случаев – УПМ в значимых количествах выделяются в группе здоровых детей в возрасте от 1 месяца до 1 года. Высокий уровень обсемененности условно-патогенной флорой можно объяснить тем, что этот период жизни ребенка отмечен самыми активными изменениями в структуре питания, развития организма и др. До года проходят все четыре стадии сукцессии: первая стадия — грудное вскармливание, вторая стадия — начало дачи прикорма, третья стадия — начало дачи твердой пищи, четвертая — отмена грудного вскармливания. В данном конкретном случае под сукцессией понимается изменение качественного и количественного состава микроорганизмов у детей в соответствии с изменениями факторов внешней среды: питания, режима, развития организма и др. и функционального состояния иммунной системы. Частота обнаружения УПМ в микрофлоре толстой кишки здорового человека начинает снижаться после первого года жизни и составляет 21,4% в возрастной группе 7-17 лет.
Проанализировав данные о частоте встречаемости отдельных представителей микробиоценоза просвета толстой кишки в микрофлоре «больных» людей различных возрастных групп, следует отметить, что у детей в возрасте до 1 года наблюдается резкое снижение частоты выделения представителей анаэробной части флоры (лактобацилл и бифидобактерий), а также условно-патогенных видов в значимых количествах (105 КОЕ/г и более) по сравнению с детьми из подгруппы «здоровых». Особенно это заметно в возрастных группах 7 с. – 29 с. и 1 мес. – 11 мес. (37 и 50%, 29,5 и 91,6% соответственно). В более старших возрастных группах частота обнаружения УПМ в группе «больных» достоверно выше, чем у «здоровых», частота выделения анаэробов снижена.
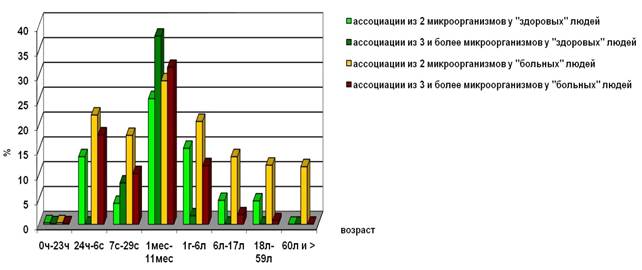
В ассоциациях УПМ выделялись чаще у «больных» детей, чем у «здоровых», во всех возрастных группах, кроме группы детей от 1 месяца до 1 года (рис. 3).
Рис. 3. Частота обнаружения ассоциаций УПМ у «здоровых» и «больных» людей разного возраста
Полученные результаты можно объяснить с точки зрения процесса формирования местной толерантности к резидентной микрофлоре и существующей теорией эндогенного инфицирования, описанных в трудах зарубежных и отечественных ученых, когда своя микрофлора воспринимаются организмом человека как чужеродная. В связи с этим возникновение патологического процесса можно объяснить не количеством выделяемых УПМ, а их измененными свойствами и подавлением лакто- и бифидобактерий [2].
Ввиду того что бактерии рода Lactobacillus и Bifidobacterium являются симбионтами кишечника человека с периода новорожденности, для восстановления нарушенной микроэкологии и иммунных реакций целесообразно использовать пробиотические препараты, содержащие именно этих представителей микрофлоры.
В настоящее время на рынке представлены как пробиотики в лиофильно высушенном виде, так и препараты в жидкой форме. Препараты в сухой форме имеют ряд положительных черт, например длительный срок годности, удобство хранения и реализации. Но процесс лиофилизации бактерий оказывает негативное влияние на структуру их поверхностных белков, активность адгезии, а также приводит к разрушению ценных бактериальных метаболитов. В сухих препаратах бактерии находятся в неактивном состоянии, для восстановления свойств необходим период времени от 8 до 10 часов, в то время как у младенцев и детей раннего возраста процесс пищеварения занимает 4-6 часов. Жидкая форма пробиотиков, напротив, способствует реализации положительных свойств штаммов-продуцентов в полной мере, так как бактерии находятся в активном физиологическом состоянии и способны эффективно колонизировать слизистую кишечника. Кроме того, в жидкой среде сохраняются все бактериальные метаболиты [3].
Основной недостаток жидких форм – короткий срок хранения, необходимость учета вкусовых характеристик и относительное неудобство применения. Тем не менее их преимущества вполне компенсируют перечисленные недостатки. На сегодняшний день на рынке представлено достаточное количество пробиотиков в жидкой форме: «Наринэ» (Армения), «Биовестин-лакто» (Россия, Новосибирск), «Нормофлорин Л» (Россия, Москва) и др.
В Нижегородском НИИЭМ им. академика И.Н Блохиной Роспотребнадзора разработана линия жидких пробиотиков «LB-комплекс». Это бактериальные концентраты, содержащие симбиотические штаммы лактобацилл видов L. plantarum, L. fermentum (пробиотик «LL-комплекс»), а также лактобацилл L. plantarum, L. fermentum и бифидобактерий видов B. bifidum, B. longum («LB-комплекс»). В качестве основы пробиотиков использован гидролизат молока, представляющий собой гипоаллергенный раствор аминокислот и простейших пептидов. Штаммы лактобацилл, входящие в состав БАД, обладают высоким уровнем β–галактозидазной активности, что позволяет использовать пробиотики при лактазной недостаточности. Штаммы-продуценты образуют устойчивую систему, обладающую высоким уровнем антагонистической активности по отношению к патогенным и условно-патогенным микроорганизмам и высоким уровнем антибиотикорезистентности не трансмиссивного типа. В 1 мл пробиотиков содержится 109-1011 КОЕ/мл живых микробных клеток. Штаммы, входящие в их состав, всесторонне изучены и отвечают требованиям, регламентированным современными нормативными документами — МУК 4.2.2602.-10.4.2. и МУ 2.3.2.2789-10 [9].
Пробиотики группы «LB-комплекс» использовались в 22 лечебно-профилактических учреждениях в качестве пробиотической составляющей диетотерапии в программах комплексного лечения больных с различными нозологическими формами заболеваний, осложненных дисбиозом.
Пробиотик был использован в качестве диетотерапии в комплексном лечении акушерской и сопутствующей патологии 30 женщин (гестационный срок 28-30 недель), находящихся на стационарном лечении в отделении патологии беременных. Группу сравнения составили 30 женщин, получавших базовую терапию и плацебо. Основная группа и группа сравнения были сопоставимы по возрасту и форме патологии (акушерско-гинекологические нарушения в сочетании с сопутствующей патологией и дисбиозом кишечника и влагалища).
Эффективность включения «LB-комплекса» в диетотерапию беременных для профилактики формирования ранних дисбиотических состояний у новорожденных
|
Показатели |
Частота выявления признака, % |
||
|
Основная группа |
Группа сравнения |
||
|
женщины |
Слабая родовая деятельность |
8,4% |
18,3% |
|
Инфицирование околоплодных вод |
0% |
12,6% |
|
|
Инфекция в родах |
7,1% |
17,8% |
|
|
новорожденные |
Гнойный конъюнктивит новорожденных |
0% |
11% |
|
Клинические признаки ВУИ |
0% |
11% |
|
|
Апгар 8-9 |
92% |
73% |
|
|
Апгар 7 |
8% |
27% |
|
|
Выписка из роддома клинически здоровыми |
76% |
54% |
Установлено, что у родильниц основной группы отмечается более гладкое течение родов и послеродового периода, в то время как в группе сравнения слабость родовой деятельности наблюдалась в 18,3% случаев (в основной – в 8,4%); инфицирование околоплодных вод – в 12,6% случаев было только у рожениц этой группы. Также в группе сравнения в 2,5 раза чаще наблюдали инфекцию в родах и раннем послеродовом периоде (7,1% и 17,8% соответственно). Новорожденных наблюдали с момента рождения и в раннем неонатальном периоде. У 11% детей группы сравнения был диагностирован конъюнктивит, наблюдалась клиника внутриутробной инфекции (ВУИ). Клинически здоровыми из роддома вышли 76% новорожденных основной группы и только 54% из группы сравнения (таблица).
Таким образом, включение пробиотика «LB-комплекс» в диетотерапию при комплексной терапии акушерской патологии улучшает показатели здоровья матери и ребенка.
В отделении патологии новорожденных и недоношенных детей детской городской клинической больницы № 27 «Айболит» г. Нижнего Новгорода в течение 10 лет «LB-комплекс» включен в программу комплексного лечения и выхаживания недоношенных новорожденных (всего пробиотик получили 3 574 ребенка).
Ранее нами были проведены исследования, показывающие эффективность использования пробиотика: «LB-комплекс» получали дети, поступающие в отделение (30 детей) в течение всего срока пребывания в стационаре (от 20 до 45 дней). Для оценки эффективности была выделена группа сравнения, получавшая плацебо (30 детей).
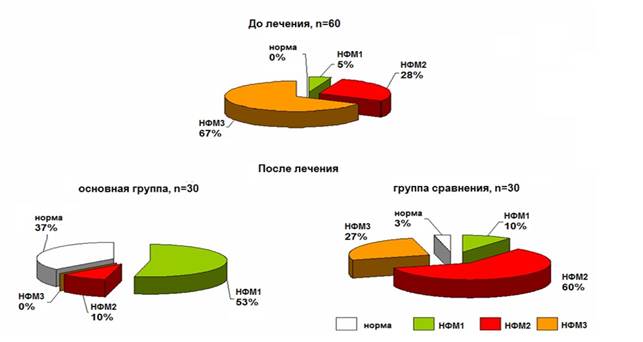
У всех детей на момент поступления имелись нарушения процесса формирования микробиоты II и III степени. Микрофлора характеризовалась отсутствием или сниженным содержанием анаэробного компонента на фоне значительного обсеменения условно-патогенными микроорганизмами. После курса лечения пробиотиком в основной группе ни у одного ребенка не было выявлено нарушений формирования микрофлоры III степени, в то время как в группе сравнения у части детей продолжали выявляться выраженные нарушения в микробном пейзаже (рис. 4).
Рис. 4. Состояние микрофлоры кишечника недоношенных новорожденных при поступлении и после курса лечения: базовая терапия с плацебо и базовая терапия с пробиотиком «LB-комплекс»
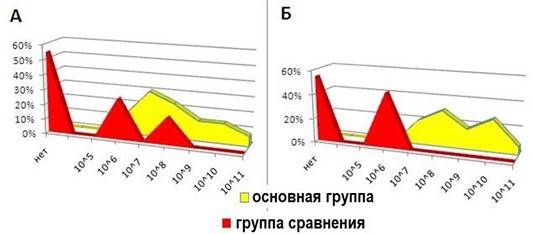
У детей основной группы после лечения титр лакто- и бифидобактерий составил 108 – 1011 КОЕ/мл, в то время как в группе сравнения наблюдается их выраженное снижение (рис. 5).
Рис. 5. Количество бифидобактерий (А) и лактобацилл (Б) после курса лечения в основной группе и группе сравнения
Опыт использования «LB-комплекса» в отделении патологии новорожденных и недоношенных детей показал его выраженную клиническую эффективность: улучшалось общее состояние детей, повышалась двигательная активность, ежесуточная прибавка массы тела возросла с 10,0-20,0 до 30,0-40,0 г. За период введения пробиотика в комплексную терапию в отделении в два раза снизилось количество детей с гнойно-септическими проявлениями (конъюнктивит, пиодермия, отит), ни у одного ребенка не наблюдали диарейный синдром.
В последние годы в педиатрической практике увеличилась частота дисбиозов с избыточным ростом грибов рода Candida, причем у 10,4% больных выявляются признаки микогенной сенсибилизации. Реализация патологического процесса при неинвазивном кандидозе кишечника происходит за счет интенсивного размножения Candida spp. в просвете пищеварительной трубки, при этом индуцируется ступенчатое углубление дефицита облигатной микробиоты и присоединение микст-инфекции (при этом угнетается анаэробная флора на фоне выделения ассоциации УПМ). В гастроэнтерологическом отделении этого же стационара пробиотик был включен в диетотерапию при комплексном лечении детей с гастроэнтерологической патологией и атопическими дерматитами. Поскольку у 77,3% детей был выявлен дисбиоз, ассоциированный с C. albicans, в алгоритм лечения детей с данной патологией был включен авторский препарат «LL-комплекс» с антимикотической активностью. Были выделены: основная группа — 33 ребенка на фоне базовой терапии, получавшие «LL-комплекс» по 5 мл в сутки, и группа сравнения — 33 человека, на фоне базовой терапии получавших плацебо.
Необходимо отметить, что в данном случае часто встречались ассоциации грибов рода Candida с представителями семейства Enterobacteriaceae, Staphilococcaceae, Pseudomonadaceae, Bacillaceae (Clostridium spp.).
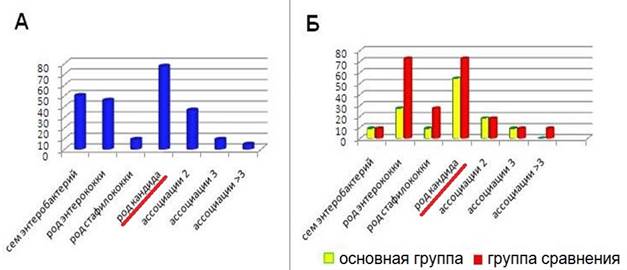
В результате проведенного исследования установлено, что после курса лечения в основной группе в 4,2 раза снизилась частота выделения C. albicans — с 77,3% (в количестве более 104 КОЕ/мл) до 54,5% (в количествах 102 и менее КОЕ/мл), тогда как в группе сравнения частота выделения грибов осталась на том же уровне (рис. 6).
Рис. 6. Частота выделения УПМ до лечения (А) и после курса проведенного лечения в основной и контрольной группах (Б)
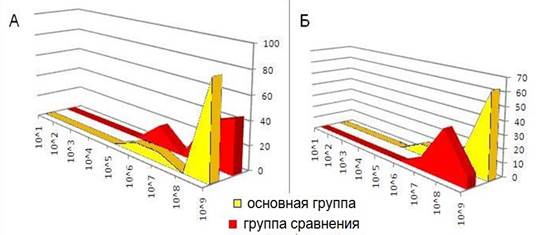
Количество лакто- и бифидобактерий в основной группе по сравнению с контрольной значительно выросло (рис. 7).
Рис. 7. Количество бифидобактерий (А) и лактобацилл (Б) после курса лечения
Таким образом, в ходе работы подтверждена эффективность включения пробиотика «LL-комплекс» в алгоритм лечения детей с дисбиозами, ассоцированными с C. albicans.
Таким образом, в ходе работы установлены закономерности формирования микробиоты кишечника детей в онтогенезе. Показано, что в 94% дети рождаются с бактериальной флорой ЖКТ, причем в первые 24 часа жизни преобладающей флорой являются микроаэрофильные микроорганизмы родов Lactobacillus и Lactococcus, а также факультативно-анаэробные микроорганизмы родов Staphylococcus и Escherichia. Условно-патогенные микроорганизмы уже присутствуют в микрофлоре здоровых новорожденных в 8,1% случаев. Далее во время пребывания в родильном доме (1-7-е сутки) и в домашних условиях (от 7 суток до 1 года) происходит нарастание количества как лакто-, лактококков и бифидобактерий, так и E. coli, энтерококков, УПМ. Установлено, что с наибольшей частотой – в 92% случаев – УПМ в значимых количествах выделяются в группе здоровых детей в возрасте от 1 месяца до 1 года.
В результате проведенных исследований доказано, что наиболее рациональной и эффективной профилактикой нарушений формирования микрофлоры у новорожденных является своевременная профилактика и лечение дисбиоза влагалища и кишечника у женщин в период беременности.
Полученные результаты доказывают эффективность применения пробиотиков группы «LB-комплекс» в качестве средств коррекции дисбиоза кишечника.
Необходимо отметить важность грамотного включения пробиотиков в комплекс базовой терапии в качестве пробиотической составляющей диеты с учетом фармакокинетики применяющихся препаратов. Необходимо назначать пробиотики в промежутке между приемом антибактериальных средств и других химиопрепаратов, причем разница по времени должна быть не менее 2 часов.
Библиографическая ссылка
Точилина А.Г., Белова И.В., Соловьева И.В., Жирнов В.А., Иванова Т.П., Мартюхина О.К., Чикина Н.А. ФОРМИРОВАНИЕ МИКРОФЛОРЫ КИШЕЧНИКА РЕБЕНКА В ОНТОГЕНЕЗЕ И ПРОФИЛАКТИКА РАЗВИТИЯ ДИСБИОЗОВ С ПОМОЩЬЮ АВТОРСКИХ ПРОБИОТИКОВ ГРУППЫ «LB-КОМПЛЕКС» // Современные проблемы науки и образования. – 2016. – № 5.
;
URL: https://science-education.ru/ru/article/view?id=25437 (дата обращения: 20.05.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
|
Название |
Цена |
Наличие |
Срок годности |
| Свободы площадь, 2 | 1 755 ₽ |
от 2 до 5 шт. |
10.07.2023 |
| Ленина проспект, 60 | 1 700 ₽ |
от 2 до 5 шт. |
10.07.2023 |
| Краснодонцев, 9 | 1 820 ₽ |
от 2 до 5 шт. |
27.05.2023 |
| Дружбы, 33 | 1 755 ₽ |
1 шт. |
10.07.2023 |
| Карла Маркса, 46 | 1 755 ₽ |
1 шт. |
10.07.2023 |
| Адмирала Васюнина, 2 | 1 776 ₽ |
1 шт. |
10.07.2023 |
| Чаадаева, 6 | 1 783 ₽ |
1 шт. |
10.06.2023 |
| Светлоярская, 21 | 1 785 ₽ |
1 шт. |
27.05.2023 |
| Минина, 5 | 1 870 ₽ |
1 шт. |
10.07.2023 |
| Героев проспект, 60 | 1 899 ₽ |
1 шт. |
16.05.2023 |
Показания
Рекомендуется в качестве биологически активной добавки к пище — источника пробиотических микроорганизмов (живых бифидобактерий и лактобацилл).
Противопоказания
Индивидуальная непереносимость компонентов продукта
Способ применения и дозы
Детям
•от 5 дней до 2 месяцев — по 0,5 мл 3 раза в день;
•от 2 месяцев до 1 года — по 2 мл 1 раз в день;
•от 1 года до 7 лет — по 2,5 мл 1 раз в день;
•старше 7 лет — 5 мл в день на 1 или 2 приема;
Взрослым
•5 мл в день на 1 или 2 приема.
Продолжительность приема: 25 дней (минимальный курс). В одной упаковке препарата находится курс из 25 флаконов.
Состав
Bifidobacterium bifidum, Bifidobacterium longum, Lactobacillus plantarum, Lactobacillus fermentum.
Условия хранения
Хранить при температуре (4±2)°С
Добавить отзыв
Поделитесь своим мнением о сети аптек «Госаптека», или возможно о какой-то конкретной
аптеке сети. Расскажите о том что нравится, а что надо исправить. Нам важна ваша точка зрения, чтобы
становиться лучше.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ БЕЗОПАСНОСТИ НОВОГО ИММОБИЛИЗОВАННОГО СИНБИОТИКА «LB-КОМПЛЕКС Л» НА ЖИВОТНЫХ
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Белова И.В.
1
Точилина А.Г.
1
Соловьева И.В.
1
Жиленкова О.Г.
2
Мелихова А.В.
2
Беляева Е.В.
1
Ермолина Г.Б.
1
Борискина Е.В.
1
Жирнов В.А.
1
Иванова Т.П.
1
1 ФБУН ННИИЭМ им. академика И.Н. Блохиной Роспотребнадзора
2 ФБУН МНИИЭМ им. Г.Н. Габричевского Роспотребнадзора
В статье представлены результаты доклинической апробации жидкого иммобилизованного синбиотика в виде БАД к пище «LB-комплекс Л». Основой пробиотика является гидролизат казеина с пребиотической сотавляющей – фруктоолигосахаридом раффинозой, консорциум штаммов Lactobacillus и Bifidobacterium, иммобилизованный на минеральном сорбенте – цеолите. Свойства отдельных компонентов комплексного пробиотика (сорбента, штаммов-продуцентов, питательной основы, пребиотической составляющей) могут отличаться от свойств композиции в целом. Поэтому безопасность синбиотика «LB-комплекс Л» должна быть установлена в процессе доклинических испытаний на лабораторных животных. При изучении острой и хронической токсичности, безвредности, вирулентности, токсигенности и местно-раздражающего действия в соответствии с требованиями МУК 4.2.2602-10 в течение 30 дней было проведено 7 серий экспериментов. В качестве экспериментальной модели были выбраны мелкие лабораторные животные (мыши, морские свинки, кролики). В результате установлено, что сорбированный синбиотик «LB-комплекс Л» не обладает вирулентностью при пероральном введении в дозе 3,78х107 КОЕ на 1 г веса животного, не обладает токсигенностью, не оказывает острого или хронического токсического действия, хорошо переносится и полностью безвреден при пероральном применении, а также не вызывает местно-раздражающего действия. Таким образом, «LB-комплекс Л» был рекомендован для использования в качестве биологически активной добавки к пище – источника пробиотических микроорганизмов (бифидобактерий и лактобацилл) и цеолитов (энтеросорбента), повышающих неспецифическую резистентность организма, оказывающих детоксицирующее действие.
иммобилизованный пробиотик
цеолит
штаммы-продуценты
доклиническая апробация
1. Соловьева И.В., Точилина А.Г., Белова И.В., Ефимов Е.И., Новикова Н.А., Иванова Т.П. Конструирование иммобилизованной формы жидкого пробиотика // Вестник Нижегородского государственного университета им. Н.И. Лобачевского. – 2012. – № 2, ч. 3. – С. 85–93.
2. Белова И.В., Точилина А.Г., Соловьева И.В., Новикова Н.А., Ефимов Е.И., Иванова Т.П., Жирнов В.А. Использование цеолитов в составе иммобилизованных мультипробиотиков // Медицинский альманах. – 2014. – № 2 (32). – С. 74–77.
3. Боровик Т.Э., Макарова С.Г., Дарчия С.Н. и др. Роль смесей – гидролизатов белка в прифилактике и диетотерапии пищевой аллергии у детей раннего возраста // Вопросы современной педиатрии. – 2010. – Т. 9, № 1. – С. 150–156.
4. Макарова С.Г., Боровик Т.Э., Шихов С.Н. и др. Использование продуктов на основе гидролизата молочного белка при пищевой аллергии у детей раннего возраста // Лечащий врач. – 2008. – № 1. – С. 23–29.
5. Пат. 2441907 Российская Федерация, МПК C12N 1/20, A61K 35/74, A23C 9/127. Способ приготовления лечебно-профилактического препарата из живых штаммов микроорганизмов лакто- и бифидобактерий «LB-комплекс Л» / Соловьева И.В., Белова И.В., Точилина А.Г., Ефимов Е.И., и др. – № 2010132024/10; заявл. 29.07.2010, опубл. 10.02.2012, Бюл. № 4. С. 2.
6. Осипова И.Г., Евлашкина В.Ф., Давыдов Д.С., Саканян Е.И. Общие фармакопейные статьи на препараты пробиотики для государственной фармакопеи РФ XIII издания – первый опыт в мировой фармакопейной практике // Международный журнал прикладных и фундаментальных исследований. – 2016. – № 6. – С. 272–276.
7. Методические указания по контролю биологических и микробиологических факторов. Система предрегистрационного доклинического изучения безопасности препаратов. Отбор, проверка и хранение прозводственных штаммов, используемых при производстве пробиотиков: методические указания № 4.2.2602-10. – М.: Роспотребнадзор, 2011. – 80 с.
8. ГОСТ 12.1.007-76 Система стандартов безопасности труда. Вредные вещества. Классификация и общие требования безопасности. – М.: Стандартинформ, 2007. – 7 с.
9. Методические указания по контролю биологических и микробиологических факторов. Методы микробиологического контроля продуктов детского, лечебного питания и их компонентов: методические указания № 4.2.577-96. – М.: Госкомсанэпиднадзор, 1996. – 56 с.
В настоящее время пробиотики являются неотъемлемым компонентом лечения и профилактики широкого спектра нозологических форм заболеваний и могут использоваться как в качестве дополнительного лечебного средства, так и в качестве пробиотической составляющей диеты. В связи с этим вопрос разработки и внедрения в клиническую практику современных пробиотиков в виде БАД к пище не теряет своей актуальности.
«LB-комплекс Л» представляет собой жидкий сорбированный синбиотик IV поколения, в качестве стартерных культур которого использованы штаммы Lactobacillus plantarum, Lactobacillus fermentum, Bifidobacterium bifidum, Bifidobacterium longum, иммобилизованные на матрице-носителе – цеолите. Композиция штаммов подобрана с учетом их пробиотического потенциала и биологических свойств: антагонистической активности, устойчивости к низкой рН желудочного сока и действию желчных кислот, адгезивных свойств, антибиотикорезистентности нетрансмиссивного типа и биосовместимости [1].
Цеолит, использованный в качестве сорбента-носителя, разрешен для использования в медицинской практике (№ KZ 16.01.76.003.Е.004706.08.15) [2]. Питательная основа, содержащая гидролизат пищевого казеина и пребиотическую составляющую – фруктоолигосахарид раффинозу, не обладает иммуногенностью, что обеспечивает хорошую переносимость пробиотика [3–5].
Тем не менее, клинические испытания и дальнейшее применение нового пробиотика в форме БАД к пище невозможны без этапа доклинической апробации, в процессе которой должна быть установлена его безопасность. Это связано с тем, что свойства многокомпонентных мультиштаммовых пробиотиков могут отличаться от свойств отдельных составляющих – сорбента, штаммов-продуцентов и питательной основы.
Согласно общей фармакопейной статье «Безопасность пробиотиков в тестах in vivo» для определения безопасности испытуемого препарата используют биологические методы in vivo, которыми определяют следующие показатели: безвредность, вирулентность, токсичность, токсигенность [6]. МУК 4.2.2602-10 также регламентирует проведение тестов на острую и хроническую токсичность и местно-раздражающие свойства пробиотика [7].
Материалы и методы исследования
Установление безопасности пробиотической БАД к пище «LB-комплекс Л» включало в себя изучение безвредности, вирулентности, токсигенности, токсичности, в том числе острой и хронической, и местно-раздражающего действия. Определение безвредности, вирулентности, токсигенности, острой и хронической токсичности проводили согласно МУК 4.2.2602-10 «Система предрегистрационного доклинического изучения безопасности препаратов. Отбор, проверка и хранение производственных штаммов, используемых при производстве пробиотиков», местно-раздражающее действие оценивали согласно ГОСТ 1.12.007-76 [7, 8].
Экспериментальной моделью для изучения безопасности БАД к пище служили мелкие лабораторные животные – белые мыши SH -линии обоего пола, массой тела 10,0–14,0 г; морские свинки массой тела 250,0–400,0 г; кролики породы шиншилла массой тела 2,5–3,5 кг. Группы животных формировались по массе тела и возрасту. Животные содержались в виварии на стандартном рационе, который содержал все необходимые для нормальной жизнедеятельности животных компоненты согласно ИСО 10992 от 02.12.2009 г. Всего было сформировано 13 групп состоящих из 95 мышей, 6 морских свинок и 3 кроликов породы шиншилла, 10 экспериментальных и 3 контрольные группы. Было проведено 7 серий экспериментов.
На начальном этапе работы было определено количество живых микроорганизмов-продуцентов в готовой форме БАД и титруемой кислотности по Тернеру (МУК 4.2.577-96, МУК 4.2.2602-10) [7, 9].
Для определения безвредности и «острой токсичности» были сформированы опытные группы 10 и 11 по 5-ти животных в каждой. Отбирали клинически здоровых белых мышей, средний вес животных составлял 15,0 ± 5 г. Взвесь биологически активной добавки в концентрации 108–109 КОЕ/мл в объеме 0,5 мл вводили каждой мыши перорально при помощи зонда. За 2 часа до манипуляций у животных убирались корм и вода, кормление возобновлялось через 2 часа после проведения процедуры. В качестве контроля контрольной группе перорально вводили физиологический раствор (С080812 годен до 09.2017 г.). Наблюдение за мышами осуществлялось в течение 7 суток. Во время опыта ежедневно фиксировались вес и состояние животных.
Для определения вирулентности были сформированы 3 группы по 10 мышей в каждой: 2 опытные и 1 контрольная группа (масса тела мышей 10–14 г). Биологически активную добавку вводили животным перорально в концентрации 109 КОЕ/мл (первая опытная группа) и 108 КОЕ/мл (вторая опытная группа) в объеме 0,5 мл. Контрольной группе был введен перорально физиологический раствор (С080812 годен до 09.2017) по 0,5 мл. Наблюдение за животными осуществлялось в течение 14 суток, ежедневно в протоколе отмечалось количество павших и выживших животных.
Для определения токсигенности была сформирована опытная группа из 10-ти клинически здоровых белых мышей, средний вес которых составлял 13,1 ± 1 г.
Для накопления возможных токсических продуктов проводили культивирование 20 % посева пробиотика (10 мл продукта в 200 мл стерильной бифидум-среде) в течение 10 дней в термостате при 37,5 ± 1 °С, при этом кислотность увеличилась до 100 ° Т, а количество жизнеспособных колониеобразующих единиц снизилось до 3×106 КОЕ/мл. Далее центрифугировали полученную культуру при 5000 об/мин в течение 20 минут при температуре 4 ± 2 °С. Надосадочную часть образцов фильтровали через апирогенные фильтры Minisart® (Sartorius Stedium Biotech) с диаметром пор 0,20 μm для удаления остатков бактериальной массы. Далее, каждому животному вводили 0,5 мл фильтрата (в котором должно было содержаться 1,5×106 КОЕ) внутрибрюшинно, время наблюдения составляло 14 суток. Ежедневно фиксировали состояние животных, активность, окраску слизистых оболочек, массу тела, характер стула. Контрольной группе был введен физиологический раствор (С080812 годен до 09.2017) внутрибрюшинно по 0,5 мл.
Для определения токсичности была сформирована опытная группа из 10-ти клинически здоровых белых мышей, средний вес животных составлял 15,0 ± 1 г.
Для инактивации бактерий пробиотик в объеме 75 мл прогревали на водяной бане при температуре 110 °С в течение 10 минут. После охлаждения до комнатной температуры продукт центрифугировали при 5000 об/мин в течение 20 минут при температуре 4 ± 2 °С, надосадочную жидкость собирали в стерильную центрифужную пробирку. Отсутствие роста в надосадке подтверждали путем высева на полужидкую питательную бифидум-среду с последующей инкубацией при 37 °С в течение трех суток.
Прогретый препарат в нативном виде вводили внутрибрюшинно животным в объеме 0,5 мл. Каждому животному опытной группы было введено 109 КОЕ/мл. Наблюдение за животными осуществляли 14 дней. Ежедневно фиксировали состояние животных, состояние шерсти, активность, окраску слизистых оболочек, массу тела, характер стула. Контрольной группе был введен физиологический раствор (С080812 годен до 09.2017) внутрибрюшинно по 0,5 мл. Следует отметить, что контрольная группа была сформирована из 10-ти мышей и являлась контролем одновременно в экспериментах по определению вирулентности, токсигенности, токсичности, так как они проводились параллельно в один отрезок времени.
Для определения хронической токсичности сформировали опытную группу из 20 животных, которые получали брикетированный корм производства ООО «Лабораторкорм», предназначенный для лабораторных животных, и воду. Пробиотик вводили перорально 1 раз в сутки в течение 30 дней в дозе, эквивалентной рекомендуемой суточной дозе в качестве биологически активной добавки к пище для человека (для мышей весом 14 г – 0,5×107 КОЕ). Животным контрольной группы вводили перорально физиологический раствор (С080812 годен до 09.2017 г).
Наблюдения за животными проводили в течение периода введения препарата – 30 дней и последующие 7 суток. Ежедневно фиксировали состояние животных, состояние шерсти, активность, окраску слизистых оболочек, массу тела, характер стула.
После окончания опыта проводили забой животных хлороформным наркозом, осуществляли вскрытие и осмотр и взвешивание внутренних органов, определяли «коэффициент массы внутренних органов» делением массы органа в миллиграммах на массу тела в граммах. Согласно ГОСТ Р 50855-96 в случае получения достоверной разницы между опытной и контрольной группами по двум из исследуемых показателей – добавка признается токсичной.
Местно-раздражающее действие оценивали на кроликах (3 особи) при многократных аппликациях, наносимых окклюзивно в течение 14 дней на предварительно выстриженных участках кожи размером 8×9 см согласно ГОСТ 1.12.007-76, время экспозиции – 2 часа 1 раз в сутки. При этом на левый бок животного (контрольный) наносили аналог потовой жидкости в количестве 10 мл, на правый бок – исследуемую БАД в объеме 10 мл. Воздействие оценивали по наличию эритемы, температуры тела, толщине кожной складки, сыпи и других признаков. Степень выраженности раздражающего действия оценивали по балльной шкале С.В. Суворовой.
Результаты исследования и их обсуждение
При микробиологическом исследовании БАД к пище «LB-комплекс Л» посторонней микрофлоры, грибов и плесеней не обнаружено. Установлено, что концентрация микроорганизмов родов Lactobacillus и Bifidobacterium соответствует заявленному в документации и составляет не менее 5×108 КОЕ/мл, кислотность продукта – 60 °Т. После осаждения носителя в надосадочной жидкости остается 4×107 КОЕ/мл.
В ходе исследования безвредности, токсигенности, токсичности и острой токсичности выявлено, что на протяжении всего опыта у животных опытной и контрольной групп отсутствовали признаки нарушения здоровья и потери массы тела к концу срока наблюдения, что подтверждает, что БАД безвредна для белых мышей SHK-линии обоего пола, при введении дозы, эквивалентной дозе, получаемой человеком, то есть «LB-комплекс Л» не обладает токсичностью и не является токсигенным.
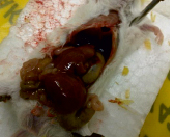
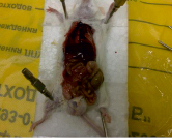
А В
Результаты вскрытия мышей опытной (А) и контрольной (В) групп
Таблица 1
Определение хронической токсичности БАД к пище «LB-комплекс Л» по «коэффициентам массы внутренних органов»
|
№ п/п |
Масса тела мыши, г |
Масса печени животного, г |
Коэф. печени |
Масса селезенки животного, г |
Коэф. селезенки |
|
Опытная группа |
|||||
|
1 |
26,65 |
1,6261 |
61,02 |
0,1897 |
7,12 |
|
2 |
24,25 |
2,0068 |
82,75 |
0,2865 |
11,87 |
|
3 |
23,14 |
1,7252 |
74,33 |
0,2435 |
6,00 |
|
4 |
28,38 |
1,9862 |
69,98 |
0.1110 |
3,91 |
|
5 |
28,90 |
2,1858 |
75,63 |
0,1982 |
6,85 |
|
Ср. |
26,26 ± 2,7 |
– |
72,74 ± 11,7 |
– |
7,15 ± 4,7 |
|
Контрольная группа |
|||||
|
1 |
20,85 |
1,5251 |
73,14 |
0,3002 |
1,43 |
|
2 |
24,35 |
1,5753 |
64,69 |
0,1921 |
7,88 |
|
3 |
23,43 |
1,3921 |
59,41 |
0,1992 |
8,50 |
|
4 |
21,79 |
1,3134 |
60,27 |
0,2751 |
12,62 |
|
5 |
24,25 |
1,7491 |
72,12 |
0,2019 |
8,32 |
|
Ср. |
– |
– |
65,34 ± 5,6 |
– |
9,43 ± 3,8 |
Таблица 2
Показатели функционального состояния кожи кроликов после многократных аппликаций биологически активной добавки к пище «LB-комплекс Л»
|
Показатели, ед. измерения |
Контрольная площадь поверхности тела |
Опытная площадь поверхности тела |
|
Эритема, баллы |
0 |
0 |
|
Толщина кожной складки, мм |
2,05 ± 0,06 |
2,06 ± 0,04 |
|
Температура кожи, °С |
36,3 ± 0,8 |
36,1 ± 0,2 |
|
рН кожи |
6,0 ± 0,2 |
6,0 ± 0,2 |
Примечание. Р > 0,05.
В результате исследования вирулентности установлено, что как в 1-й группе, получившей дозу 3,78×107 КОЕ на 1 г веса мыши, так и во второй группе, где доза бифидобактерий и лактобацилл составляла 3,57×106 КОЕ на 1 г веса животного, и в контрольной группе по истечении 14 суток не пало ни одно животное. Это означает, штаммы-продуценты, входящие в состав БАД к пище «LB-комплекс Л», не являются вирулентными для белых мышей SHK-линии обоего пола в дозе, эквивалентной рекомендуемой для человека.
В ходе проведения эксперимента на выявление хронической токсичности были получены сходные результаты: у всех животных, взятых в исследование, контролируемые показатели (состояние шерсти, активность, окраска слизистых, характер стула) в течение всего времени проведения опыта оставались без изменений, все животные были здоровы и прибавляли в весе. При вскрытии визуальных изменений внутренних органов, в том числе лимфоузлов, обнаружено не было (рисунок).
Достоверных различий «коэффициентов массы внутренних органов» в опытной и контрольной группах не наблюдалось (табл. 1).
Следовательно, биологически активная добавка к пище «LB-комплекс Л» при пероральном введении не обладает хронической токсичностью для белых мышей SHK-линии обоего пола в дозе (для мышей массой 14 г – 0,5×107 КОЕ), эквивалентной предлагаемой для человека.
При изучении местно-раздражающего действия БАД к пище на всем протяжение эксперимента визуальных изменений функционального состояния кожи у животных не происходило (табл. 2).
Из табл. 2 видно, что у животных не было выявлено признаков местно-раздражающего действия при воздействии биологически активной добавки к пище «LB-комплекс Л» на кожные покровы. Толщина кожной складки, температура кожи и водородный показатель кожных покровов (рН) на опытной и контрольной кожных поверхностях кроликов не отличались между собой. Отсутствовали также эритема, отек, сухость, сыпь и другие признаки местной реакции кожи.
Заключение
В ходе проведенной работы подтверждена хорошая переносимость и полная безвредность биологической активной добавки к пище «LB-комплекс Л» для организма животных. Показано, что препарат не обладает токсигенностью, токсичностью, не вызывает хроническую и острую токсичность при пероральном введении. Не обладает вирулентностью при пероральном введении в дозе 3,78×107 КОЕ на 1 г массы животного, не оказывает местно-раздражающего действия.
Библиографическая ссылка
Белова И.В., Точилина А.Г., Соловьева И.В., Жиленкова О.Г., Мелихова А.В., Беляева Е.В., Ермолина Г.Б., Борискина Е.В., Жирнов В.А., Иванова Т.П. РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ БЕЗОПАСНОСТИ НОВОГО ИММОБИЛИЗОВАННОГО СИНБИОТИКА «LB-КОМПЛЕКС Л» НА ЖИВОТНЫХ // Международный журнал прикладных и фундаментальных исследований. – 2018. – № 2.
– С. 85-89;
URL: https://applied-research.ru/ru/article/view?id=12113 (дата обращения: 20.05.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)