Миома матки
Версия: Клинические протоколы МЗ РК — 2016 (Казахстан)
Категории МКБ:
Лейомиома матки (D25)
Разделы медицины:
Акушерство и гинекология
Общая информация
Краткое описание
Одобрено
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения и социального развития
от «9» июня 2016 года
Миома матки (лейомиома) – моноклональная доброкачественная опухоль из гладкомышечных волокон матки [1].
Соотношение кодов МКБ-10 и МКБ-9
| Коды МКБ-10 | Коды МКБ-9 |
|
D25 Лейомиома матки D25.0 Подслизистая лейомиома матки D25.1 Интрамуральная лейомиома матки D25.2 Субсерозная лейомиома матки D25.9 Лейомиома матки неуточненная |
39.7944 Эндоваскулярная эмболизация сосудов тазовых органов, маточных артерий. 68.4110 Лапароскопическая консервативная миомэктомия или гистерорезекция субмукозных узлов. 68.51 Лапароскопическая вагинальная гистерэктомия. 68.411 Лапароскопическая полная гистерэктомия. 67.30 Другие виды иссечения или деструкции пораженного участка или ткани шейки матки. 67.39 Другие методы иссечения или деструкции пораженного участка или ткани шейки матки. 68.31 Лапароскопическая надвлагалищная экстирпация матки. 68.41 Лапароскопическая полная абдоминальная гистероэктомия. 68.29 Другие виды иссечения или деструкции пораженного участка матки. 68.30 Надвлагалищная абдоминальная ампутация матки. 68.39 Другие и неопределенные абдоминальные гистерэктомии. 68.40 Полная абдоминальная экстирпация матки. 68.49 Другие и неопределенные полные абдоминальные гистерэктомии. 68.50 Влагалищная экстирпация матки. 68.59 Другие вагинальные гистероэктомии. 68.81 Экстирпация матки с перевязкой внутренних подвздошных артерий. 68.90 Другая и неуточненная экстирпация матки. 69.09 Другие виды дилатации и кюретажа матки. |
Дата разработки протокола: 2013 года (пересмотрен 2016 г.).
Пользователи протокола: ВОП, акушер-гинекологи, онкологи.
Категория пациентов: взрослые.
Шкала уровня доказательности:
Соотношение между степенью убедительности доказательств и видом научных исследований.
| Уровень доказательности | Классификация рекомендаций | ||
| I | Доказательства, полученные, по меньшей мере от одного тщательно рандомизированного контролируемого исследования | А | Высокий уровень доказательности для применения клинических превентивных действий. |
| II-1 | Данные из хорошо разработанных контролируемых исследований без рандомизации | В | Хороший уровень доказательности для применения клинических превентивных действий |
| II-2 | Данные полученные из хорошо разработанных когортных исследований (проспективных или ретроспективных) или исследованиях случай-контроль, предпочтительно полученных из нескольких научных медицинских центров или нескольких исследовательских групп | С | Данное доказательство конфликтует и не позволяет дать конкретную рекомендацию за или против применения клинических превентивных действий |
| II-3 | Доказательства, полученные посредством сравнения количества или места локализации с или без вмешательства. Очевидные результаты в неконтролируемых исследованиях (такие как результаты лечения пенициллином в 1940-е годы) также могут быть включены в эту категорию | D | Хороший уровень доказательности не рекомендующий применение клинических превентивных действий |
| III | Мнения авторитетных специалистов, основанные на клиническом опыте, наглядных исследованиях или отчеты экспертных комитетов | E | Высокий уровень доказательности против применения клинических превентивных действий |
| L | Недостаточный уровень доказательности (в качестве или количестве) для того чтоб дать рекомендации, однако другие факторы могут повлиять на принятие решения |
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
По локализации и направлению роста:
· подбрюшинная (субсерозная) — рост миоматозного узла в сторону брюшной полости под серозную оболочку матки;
· подслизистая (субмукозная) — рост миоматозного узла в стороны полости органа под слизистую оболочку матки;
· внутристеночная (интерстициальная) — рост узла в толще мышечного слоя матки.
Согласно FIGO (2011 г.) [2].
По клиническим проявлениям:
· бессимптомная миома матки (50-80% случаев) – без клинических проявлений;
· симптомная миома матки (20-50% случаев) – с клиническими проявлениями.
Диагностика (амбулатория)
ДИАГНОСТИКА НА АМБУЛАТОРНОМ УРОВНЕ
Диагностические критерии (УД — III)
Жалобы:
· аномальные маточные кровотечения;
· тазовая боль;
· тяжесть внизу живота;
· увеличение живота;
· нарушение функции мочевого пузыря (дизурия);
· нарушение функции кишечника (дисхезия)
· бесплодие.
Анамнез:
Значимыми моментами анамнеза являются:
· отсутствие беременности и родов;
· раннее менархе,
· увеличение частоты менструации;
· длительность дисменореи;
· отягощенная наследственность;
· повышенная масса тела;
· артериальная гипертензия;
· сахарный диабет;
· возраст (пик заболеваемости 40-50 лет).
Физикальное обследование:
Бимануальное влагалищное исследование:
· матка увеличена в размерах, с неровными контурами за счет плотноватых узлов.
Лабораторные исследования:
· ОАК – снижение гемоглобина (анемия различной степени выраженности) при отсутствии экстрагенитальной патологии.
Инструментальные исследования:
· УЗИ (трансвагинальное, трансабдоминальное, трансвагинальное соногистерография с контрастированием):
− чувствительность и специфичность 98-100%. (УД — А);
− небольшие гетерогенные эхо-сигналы в пределах границ миометрия;
− гипоэхогенная и гетерогенная эхоструктура матки с неровными контурами;
− признаком нарушения питания миоматозного узла, является наличие кистозных областей в пределах миом.
NB! при размерах миомы матки больше 12 недель предпочтительно производить трансабдоминальное УЗИ (УД — С).
NB! трансвагинальная соногистерография с контрастированием (введение физиологического раствора в полость матки), имеет высокую диагностическую значимость при субмукозных узлах и позволяет дифференцировать от полипов эндометрия.
NB! субмукозная миома матки имеет меньшую эхогенность, чем полипы и окружающий эндометрий и тщательный осмотр позволяет визуализировать ее «продолжение» в окружающем миометрии.
· МРТ – при наличии атипичных форм образований малого таза и брюшной полости. (УД — С).
Диагностический алгоритм:
Диагностика (скорая помощь)
ДИАГНОСТИКА НА ЭТАПЕ СКОРОЙ НЕОТЛОЖНОЙ ПОМОЩИ
Диагностические мероприятия:
Жалобы:
· кровянистые выделения из половых путей, боли внизу живота.
Физикальный осмотр:
· бледность кожных покровов и видимых слизистых;
· снижение артериального давления, тахикардия.
Осмотр и пальпация живота:
· щадящее положение женщины;
· болезненность при пальпации нижних отделов живота;
· положительные симптомы раздражения брюшины при перекруте ножки узла и некрозе узла.
Диагностика (стационар)
ДИАГНОСТИКА НА СТАЦИОНАРНОМ УРОВНЕ
Диагностические критерии на стационарном уровне: смотрите диагностические критерии на амбулаторном уровне.
Диагностический алгоритм:
Перечень основных диагностических мероприятий:
· ОАК.
Перечень дополнительных диагностических мероприятий:
· УЗИ малого таза трансвагинально и /или абдоминально,
· гистеросонография малого таза;
· гистероскопия;
· МРТ малого таза.
NB! В условиях стационара могут проводиться все виды лечебно-диагностических мероприятий при обоснованности и вынесении показаний с учетом имеющихся основных и сопутствующих заболеваний в рамках существующих клинических протоколов.
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований
| Диагноз | Обоснование для дифференциальной диагностики | Обследование | Критерии исключения диагноза |
| Аденомиоз | Одинаковая клиническая картина, отсутствие специфических симптомов |
УЗИ, МРТ Гистологическое исследование |
Характерно отсутствие кровотока в ЦДК режиме при аденомиозе, утолщение переходной зоны эндометрия; |
| Рак матки/Саркома матки | Отсутствие специфических симптомов | Анамнез, УЗИ, МРТ | Быстрый рост опухоли, атипичная сонографическая картина и на МРТ, как нечеткие границы и прорастание в смежные органы |
| Полип эндометрия | Отсутствие специфических симптомов | УЗИ, МРТ | Хорошо очерченное полиповидное образование с структурой схожей с эндометрием. |
Лечение
Препараты (действующие вещества), применяющиеся при лечении
| Аскорбиновая кислота (Ascorbic acid) |
| Гестоден (Gestodene) |
| Даназол (Danazol) |
| Дезогестрел (Desogestrel) |
| Декстроза (Dextrose) |
| Диеногест (Dienogest) |
| Железа сульфат (Ferric sulfate) |
| Железа сульфат (Ferric sulfate) |
| Ибупрофен (Ibuprofen) |
| Калия хлорид (Potassium chloride) |
| Калия хлорид (Potassium chloride) |
| Кальция хлорид (Calcium chloride) |
| Напроксен (Naproxen) |
| Натрия ацетат (Sodium acetate) |
| Натрия ацетата тригидрат (Sodium acetate trihydrate) |
| Натрия гидрокарбонат (Sodium bicarbonate) |
| Натрия хлорид (Sodium chloride) |
| Натрия хлорид (Sodium chloride) |
| Транексамовая кислота (Tranexamic acid) |
| Улипристал (Ulipristal) |
| Этинилэстрадиол (Ethinylestradiol) |
| Этинилэстрадиол (Ethinylestradiol) |
Лечение (амбулатория)
ЛЕЧЕНИЕ НА АМБУЛАТОРНОМ УРОВНЕ
Тактика лечения
Лечение женщин с миомой/лейомиомой должно быть индивидуализированным на основе симптоматики, размера и расположения миомы, возраста, желания пациента, потребности в сохранении способности к деторождению или матки, доступности терапии, а также опыт врача (УД-IIIB) [1,4,5].
Немедикаментозное лечение: нет.
Медикаментозное лечение:
Показания к медикаментозной терапии миомы матки:
· желание больной сохранить репродуктивную функцию;
· миома матки, которая не превышает размеров 12 недель беременности;
· миома, сопровождающаяся экстрагенитальными заболеваниями с высоким анестезиологическим и хирургическим риском;
· медикаментозной терапии как подготовительный этап к операции или как реабилитационная терапия в послеоперационном периоде после консервативной миомэктомии.
Эффективное лечение женщин с аномальным маточным кровотечением, вызванное миомой, включает: левоноргестрел-содержащие внутриматочные системы (УД — I) аналоги гонадолиберина, (УД-I) селективные модуляторы рецепторов прогестерона, (УД — I) оральные контрацептивы, (УД — II-2) прогестины, (УД – II-2) и даназол (УД — II2) [1].
NB! Эффективными методами лечения симптомной миомы матки являются селективные модуляторы прогестиновых рецептора и гонадотропин-рилизинг гормона аналогов. (УД — I).
NB! Лечение а-ГнРГ эффективно уменьшает размер узлов и маточное кровотечение, но применяется не более 6 месяцев в связи с развитием синдрома медикаментозной менопаузы при длительном применении (УД — А).
NB! Улипристала ацетат эффективно останавливает маточное кровотечение, уменьшает объем миомы матки и увеличивает время предоперационной подготовки пациентов, что важно при наличии анемии у пациентов и/или наличии сопутствующей экстрагенитальной патологии (УД — А).
NB! ОК и ВМС-ЛНГ эффективны в отношении маточных кровотечений, но неэффективны в уменьшении объемов миоматозных узлов.
NB! Даназол – уменьшает объем узлов на 20-25%, эффективно снижает объем тяжелых менструальных кровотечений, однако недостаточно данных в отношении эффективности длительной терапии миомы.
NB! Медикаментозная терапия является методом выбора у женщин, не подлежащих хирургическому лечению или отказывающихся от него. Стоит отметить, что размеры миомы возвращаются к прежним в течение 6 месяцев после прекращения терапии (УД — С).
Перечень основных лекарственных средств:
· улипристала ацетат – 5 мг;
· А-ГнРг – 11,25 мг;
· ВМС с левоноргестрелом – 52 мг;
· Даназол;
· этинилэстрадиол диеногест 2 мг;
· этинилэстрадиол гестоден 75 мг;
· этинилэстрадиол дезогестрел 150 мкг.
Перечень дополнительных лекарственных средств:
· НПВС;
· препараты железа;
· тренакса.
Алгоритм действий при неотложных ситуациях на амбулаторном уровне:
Другие виды лечения, оказываемые на амбулаторном уровне: нет
Таблица – 1. Таблица сравнения препаратов:
| Наименование ЛС | УД |
Прекращение Симптомов |
Уменьшение размеров узла | Максим-я длительность терапии | Возможные побочные эффекты |
| Улипристала ацетат | А | + | + | 4 курса по 3 мес | Головная боль, тошнота, изменение настроения, PAEC |
| А-ГнРг | А | + | + | 6 мес | Симптомы медикаментозной менопаузы |
| ВМС с ЛНГ | В | + | — | 5 лет | Нерегулярные мажущие выделения, экспельсия |
| КОК | В | + | — | Не ограничена, если нет противопоказаний со стороны ЭГЗ | Тошнота, головная боль, масталгия |
| Даназол | А | Исследований мало | + | 6 мес | Андрогенный побочный эффект |
| Прогестагены с выраженным влиянием на эндометрий | В | + | Воздействие не доказано | 6 мес | Тошнота, головная боль, масталгия |
Показания для консультации специалистов:
· консультация онкогинеколога – при подозрении на гиперпластические процессы эндометрия или саркому матки.
· консультация терапевта – при анемии, для определения консервативного лечения.
· консультации смежных специалистов при наличии экстрагенитальных заболеваний.
Профилактические мероприятия: нет.
Мониторинг состояния пациента:
· женщины с бессимптомным течением миомы размерами до 12 недель при отсутствии других патологических образований органов малого таза требуют дальнейшего углубленного обследования для выявления другой патологии, с которой возможно связано развитие миомы матки, и соответственно, необходимо проводить ее лечение;
· они должны обращаться к врачу 1 раз в год, или в случае возникновения симптомов заболевании чаще (УД — С);
· женщины с бессимптомной миомой более 12 недель должны консультироваться у специалистов индивидуально в согласованном режиме наблюдения, но не реже одного раза в год и получать консервативную терапию (УД-С) в случае отказа от операции или при наличии противопоказаний к ней.
Индикаторы эффективности лечения:
· уменьшение или исчезновение симптомов заболевания;
· уменьшение размеров миомы матки или отсутствие роста узлов;
· предотвращение рецидивов заболевания.
Лечение (скорая помощь)
ЛЕЧЕНИЕ НА ЭТАПЕ СКОРОЙ НЕОТЛОЖНОЙ ПОМОЩИ
Медикаментозное лечение, оказываемое на этапе скорой неотложной помощи:
Инфузионная терапия кристаллоидами при массивном кровотечении:
· раствор натрия хлорид;
· натрия ацетат;
· натрия гидрокарбонат;
· калия хлорид;
· натрия ацетата тригидрат,
· калия хлорид;
· раствор Рингера Локка;
· раствор глюкозы.
· обезболивание при выраженном болевом синдроме:
· напроксен таблетки 0,25 мг и 0,5 мг;
· ибупрофен 5мг/ 2 мл, ампулы; таблетка, 5 мг.
· антифибринолитическая терапия – для уменьшения кровопотери:
тренакса таблетки 250 мг, 500 мг; 5 мл ампулы.
Лечение (стационар)
ЛЕЧЕНИЕ НА СТАЦИОНАРНОМ УРОВНЕ
Тактика лечения
Немедикаментозное лечение: нет.
Медикаментозное лечение:
· антибактериальная профилактика послеоперационных инфекционных осложнений;
· антибиотикотерапия при экстренной госпитализации по поводу некроза или перекрута ножки узла;
· адекватная обезболивающая терапия;
· инфузионная терапия кристаллоидами и коллоидами по показаниям;
· коррекция анемии;
· профилактика тромбоэмболических осложнений в послеоперационном периоде.
Перечень основных лекарственных средств
Антифибринолитические прапараты:
· транексамовая кислота таблетки 250 мг, 500 мг; 5 мл ампулы.
Препараты железа:
· железа (II) сульфат сухой + аскорбиновая кислота таблетка 320 мг/60мг;
· железа (II) сульфата гептагидрат + аскорбиновая кислота сироп, 100 мл, железа сульфат капли, 25 мл, флаконы.
Коллоидные и кристаллоидные растворы (в суммарном объеме до 1500-2000 мл):
· раствор натрия хлорид;
· натрия гидрокарбонат;
· калия хлорид;
· натрия ацетата тригидрат;
· калия хлорид;
· раствор глюкозы.
Анальгетики:
· напроксен таблетки 0,25 мг и 0,5 мг;
· ибупрофен 5мг/2 мл, ампулы; таблетка, 5мг.
Перечень дополнительных лекарственных средств:
· СМПР (улипристал ацетат 5 мг);
· гемотрансфузия (в соответствии с показаниями).
NB! Анемия должна быть коррегирована до плановой операции (УД – II-2А). Селективные модуляторы рецепторов прогестерона и агонисты гонадотропин-рилизинг гормона эффективны при коррекции анемии и их следует применять до операции (УД-I-А).
NB! Использование вазопрессина, бупивакаина и адреналина, мизопростола, пери-цервикального жгута или тромбиновые матрицы уменьшают потерю крови при миомэктомии и должны быть предусмотрены (УД-I-А).
Хирургическое вмешательство
Хирургическое планирование должно быть основано на точной установке местоположения, размера и количества миоматозных узлов [УД-III-A]. В случаях необходимости использования морцеляции для удаления миоматозного узла из брюшной полости, пациент должен быть проинформирован о возможных рисках и осложнениях, в том числе о том факте, что в редких случаях миомы могут содержать элементы злокачественности и что лапароскопическая морцелляция может распространять рак, потенциально ухудшая их прогноз [УД – III-B].
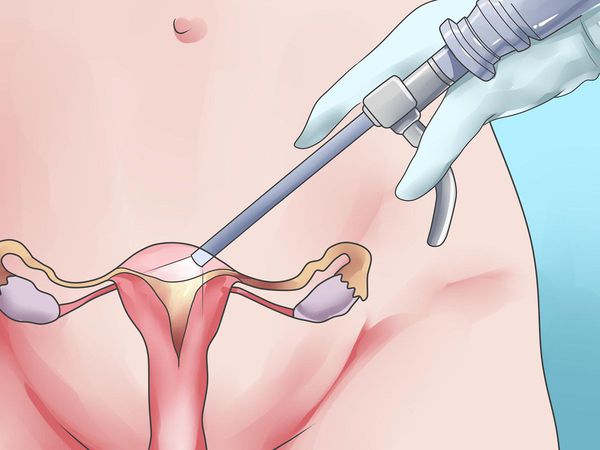
Выскабливание полости матки:
Показания:
· при маточном кровотечении/
Гистерэктомия
Показания:
· женщины, завершившие детородную функцию;
· быстрый рост миомы в менопаузе у женщин, не применяющих заместительную гормональную терапию (даже при отсутствии симптоматики);
· подозрение на наличие лейомиосаркомы.
NB! Женщинам с бессимптомной миомой матки, при низком уровне подозрения на злокачественный процесс, удаление матки не показано [1].
NB! Гистерэктомию не нужно рекомендовать в качестве профилактики возможного будущего роста миомы.
Виды гистерэктомии:
· вагинальной гистерэктомии;
· абдоминальной гистерэктомии;
· существуют четкие показания и противопоказания;
· ВГ с лапароскопической асистенции.
NB! Выбор вида гистерэктомии, вне зависимости от доступа (влагалищный, лапароскопический или лапаротомный), должен быть основан на опыте, предпочтениях хирурга и объективному статусу пациентки (размеры и количество миоматозных узлов, предшествующие оперативные вмешательства, экстрагенитальная патология и т.п.). По возможности, предпочтительнее использовать наименее инвазивный подход к лечению.
Миомэктомия
Показания: женщины, страдающие невынашиванием беременности или бесплодием, с наличием одного или более миоматозного узла, деформирующего полость матки (наиболее часто подслизистой миомы), миомэктомия может способствовать повышению фертильности и успешного исхода беременности [1].
NB! Миомэктомия, как хирургический метод лечения, позволяет сохранять фертильность, эффективно устраняя симптомы, связанные с миомой матки. [УД -C].
Это вариант лечения для женщин, которые хотели бы сохранить орган или фертильную функцию, но несет риск, возможного дальнейшего вмешательства (УД-II2). Нет никаких доказательств того, что лапароскопический доступ для осуществления миомэктомии является более эффективным в сравнении с лапаротомным [УД -C]. Миомэктомия является альтернативой гистерэктомии для женщин, желающих сохранить орган, независимо от детородных планов [1]. Женщины должны быть информированы о риске возможного расширения объема операции до гистерэктомии во время плановой миомэктомии. Это будет зависеть от интраоперационных находок и хода операции.
Гистероскопическая миомэктомия
Показания: симптоматическая внутриполостная миома матки, подслизистые миомы (типы 0, I и II), до 4-х до 5 см в диаметре [1].
NB! Cледует с осторожностью проводить в случаях, когда толщина между миомой матки и серозной оболочкой менее чем 5 мм.
Лапароскопическая миомэктомия:
Показания: миомы в сложных локализациях (нижний сегмент или шейка матки), множественных узлов и/ или больших размеров узлов (> 10 см).
Лапароскопическая миомэктомия имеет преимущества перед лапаротомной миомэктомией с точки зрения меньшей кровопотери, послеоперационной болью, меньшим количеством общих осложнений, быстрым восстановлением и значительным косметическим преимуществом [УД — B]
Разрывы матки во время беременности и в родах после лапароскопической миомэктомии связаны с неадекватным ушиванием глубоких дефектов при интрамуральной форме миомы или чрезмерном применении электрохирургических энергии [УД — С]. Соблюдение 6 месячного интервала от миомэктомии до наступления беременности, способствует лучшему восстановлению миометрия.
Другие виды лечения:
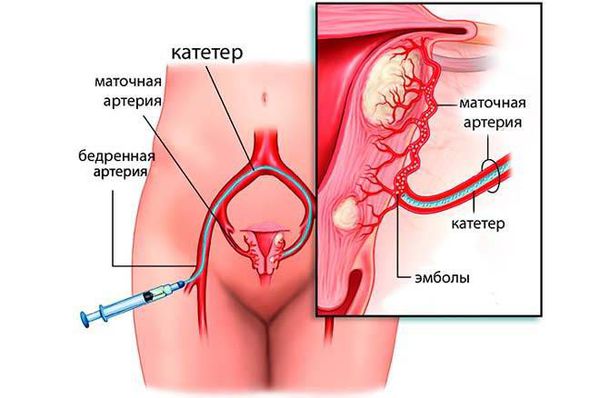
Эмболизация маточных артерий:
Показания: симптомная миома матки, при желании пациенток, которые желают сохранить орган, но не планирующих в последующем беременность.
NB! Женщин, выбирающих ЭМА для лечения миомы, следует проконсультировать относительно возможного риска, снижения фертильности и исходов беременности [УД-II-3A].
Высокоинтенсивный сфокусированный ультразвук с МРТ ассистенцией (ФУЗ-абляция)
Показания: размер миомы матки меньше или равной 10 см и общий размер матки меньше или равный 24 недель.
Показания для консультации специалистов:
Показания для перевода в отделение интенсивной терапии и реанимации:
· острая сердечно-сосудистая и дыхательная недостаточность;
· острый ДВС-синдром;
· нарушения сознания, судороги;
· ранний послеоперационный период.
Индикаторы эффективности лечения:
· уменьшение размеров миомы матки (при ЭМА, ФУЗ абляции);
· уменьшение или исчезновение симптомов заболевания;
· удаление миомы матки и/или матки.
Дальнейшее ведение
Специфической профилактики нет. Пациенткам рекомендуется обязательное обращение к врачу при появлении аномального маточного кровотечения, патологических выделений из половых органов и других симптомов повторного возникновения миомы матки после лечения.
Госпитализация
Показания для плановой госпитализации:
· симптомная миома (с геморрагическим и болевым синдромом, наличием анемии, симптомов сдавления смежных органов) у женщин завершивших репродуктивную функцию;
· размер миомы 13-14 недель и более;
· наличие субмукозного узла;
· подозрение на нарушение питания узла;
· наличие субсерозного узла миомы на ножке (в связи с возможностью перекрута узла);
· быстрый рост (на 4-5 недель в году и более) или резистентность к терапии а-ГнРГ);
· миома в сочетании с гиперпластическим процессом эндометрия и /или опухолью яичников;
· бесплодие и/или невынашивание беременности вследствие миомы матки, деформирующей полость матки.
Показания для экстренной госпитализации:
· маточное кровотечение;
· клиника острого живота (некроз узла, перекрут ножки узла);
· выраженные болевые синдромы (схваткообразные боли внизу живота при рождающейся миоме матки).
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗСР РК, 2016
- 1. SOGC CLINICAL PRACTICE GUIDELINE. The Management of Uterine Leiomyomas. J Obstet Gynaecol Can 2015;37(2):157–178
2. Munro MG, Critchley HO, Broder MS, Fraser IS. The FIGO Classification System (“PALM-COEIN”) for causes of abnormal uterine bleeding in non-gravid women in the reproductive years, including guidelines for clinical investigation. Int J Gynaecol Obstet 2011;113:3–13
3. http://bestpractice.bmj.com/best-practice/monograph/567/diagnosis/differential.html
4. SOGC guideline on the management of uterine fibroids in women with otherwise unexplained infertility 2015
5. Миома матки: курс на органосохранение. Информационный бюллетень / В.Е. Радзинский, Г.Ф. Тотчиев. — М.: Редакция журнала StatusPraesens, 2014.
- 1. SOGC CLINICAL PRACTICE GUIDELINE. The Management of Uterine Leiomyomas. J Obstet Gynaecol Can 2015;37(2):157–178
Информация
Сокращения, используемые в протоколе
| СОЭ | – | скорость оседания эритроцитов |
| УЗИ | – | ультразвуковое исследование |
| МРТ | – | магнитно-резонансная томография |
| ЗГТ | – | заместительная гормональная терапия |
| а- ГнРГ | – | агонисты-гонадотропин рилизинг гормонов |
| КОК | – | комбинированные оральные контрацептивы |
| ОК | – | оральные контрацептивы |
| ВМС | – | внутриматочная система |
| ДВС | – | синдром – синдром внутрисосудистого свертывания |
| ВГ | – | вагинальная гистерэктомия |
| АГ | – | абдоминальная гистерэктомия |
| НПВС | – | нестероидные противовоспалительные средства |
| ЭМА | – | эмболизация маточных артерий |
| АД | – | артериальное давление |
| АЧТВ | – | активированное частичное тромбопластиновое время |
| ПВ | – | протромбиновое время |
| АЛТ | – | аланинаминотрансфераза |
| АСТ | – | аспартатаминотрансфераза |
| СМРП | – | селективный модулятор рецепторов прогестерона |
| ЭГЗ | – | экстрагенитальная патология |
| PAEC | – | Progesterone Receptor Modulator Associated Endometrial Changes (изменения в эндометрии, связанные с антагонистическим действием на рецепторы прогестерона) |
Список разработчиков протокола с указанием квалификационных данных:
1) Дощанова Айкерм Мжаверовна – доктор медицинских наук, профессор, врач высшей категории, заведующая кафедрой акушерства и гинекологии по интернатуре АО «Медицинский университет Астана».
2) Токтарбеков Галымжан Кабдулманович – врач акушер-гинеколог высшей категории, филиал КФ «UMC» ННЦМД.
3) Тулетова Айнур Серикбаевна – PhD, врач первой категории, ассистент кафедры акушерства и гинекологии АО «Медицинский университет Астана».
4) Мажитов Талгат Мансурович – доктор медицинских наук, профессор, АО «Медицинский университет Астана», врач клинический фармаколог высшей категории.
Конфликта интересов: нет.
Список рецензентов: Калиева Лира Каббасовна – доктор медицинских наук, заведующая кафедрой акушерства и гинекологии №2, РГП на ПХВ «Казахский национальный медицинский университет имени С.Д. Асфендиярова».
Указание условий пересмотра протокола: Пересмотр протокола через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Дата публикации 17 октября 2017Обновлено 26 апреля 2021
Определение болезни. Причины заболевания
Миома матки — это хроническое заболевание матки, проявляющееся образованием в ней единичных или множественных узлов различной локализации, ограниченное во времени репродуктивным периодом.
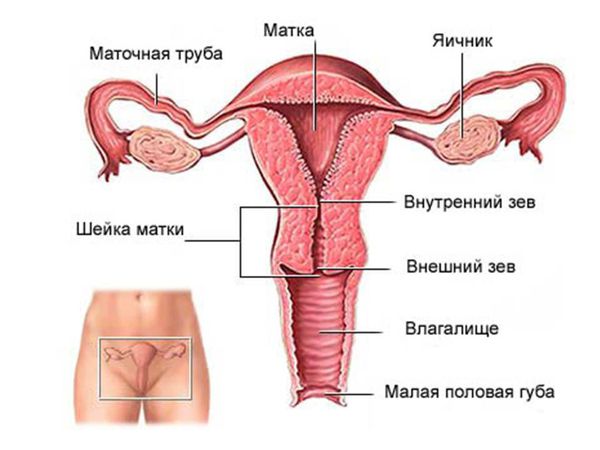
Как устроена женская репродуктивная система:
Миома матки не встречается до начала менструаций и регрессирует после менопаузы. Ранее миому матки считали истинной доброкачественной опухолью матки, однако в результате исследований было установлено, что она не в полной мере соответствует критериям опухоли, поэтому миому стали называть опухолеподобным образованием.
Миома матки — довольно распространенное заболевание, частота встречаемости достигает 70-80%, однако в большинстве случаев заболевание протекает бессимптомно. Только в 30-40% случаев наблюдаются клинические проявления миомы.[1][2]
До сих пор неизвестны причины возникновения миомы матки. Ранее предполагалось, что к её развитию миомы приводят гормональные нарушения, однако эта теория была полностью опровергнута. Миома матки образуется в гормонзависимой ткани и поэтому чувствительна к влиянию половых гормонов, но её рост не запускается нарушением гормонального фона.
Кто подвержен наибольшему риску
Предполагается, что существует наследственная предрасположенность к развитию миомы матки. Миома матки никогда не превращается в злокачественную опухоль и не имеет никакого отношения к развитию злокачественных заболеваний матки.
Миома матки чаще всего диагностируется в возрасте 30-40 лет, однако может встречаться у более молодых женщин в 16-18 лет.
Чем миома отличается от фибромы
Фиброма матки и миома матки — два названия одного и того же заболевания. Если в миоме преобладает фиброзная ткань, такую миому могут называть фибромой, но термин «фиброма» в этом случае будет «просторечным», правильнее всего все миомы называть миомами, независимо от состава. Структура миомы никак не влияет на выбор метода лечения.
Чем опасна миома матки
К осложнениям миомы матки относятcя железодефицитная анемия, сложности с зачатием и вынашиванием, нарушение оттока мочи и повреждение почек.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы миомы матки
Симптомы на ранних стадиях:
В большинстве случаев на ранних стадиях миома матки никак себя не проявляет. Только в 30-40 % случаев она может нарушить качество жизни женщины.
Развитие симптомов миомы матки зависит от локализации узла или узлов, а также от их размера. Чем дальше узел от полости матки, тем больше вероятность того, что заболевание будет протекать бессимптомно. Даже условно небольшие, сантиметровые узлы, деформирующие или полностью расположенные в полости матки, могут приводить к обильным менструациям, в то время как узел такого размера в стенке матки или снаружи нее сделает заболевание бессимптомным. Крупные узлы по 6-8-10 и более сантиметров уже начинают увеличивать общие размеры матки, то есть проявляться увеличением живота, а также давлением на мочевой пузырь или прямую кишку. При этом могут быть и обильные менструации за счет увеличения размеров полости матки и нарушения процессов сокращения матки в конце менструации.
Клиническая картина миомы матки:
- Обильные менструации.
- Чувство давления на мочевой пузырь (учащенное мочеиспускание), давление на прямую кишку (затруднения при дефекации).
- Боли в животе, спине, боли при половой жизни.
- Увеличение живота.
- Бесплодие (редко).
- Невынашивание беременности.
Патогенез миомы матки
Миома матки представляет из себя округлое образование различного размера, состоящее из разного сочетания гладкомышечных и соединительнотканных волокон. Крупные узлы миомы могут достигать 20 см, а сама матка с узлами — размера, соответствующего доношенной беременности.
Миома матки бывает единичной и множественной, то есть в матке может быть несколько небольших узлов или сочетание небольших узлов и нескольких больших или единичный большой узел.
Известно, что каждый узел в матке растет независимо друг от друга из одной-единственной клетки, которая получает дефект, запускающий процесс деления. Женские половые гормоны являются основным фактором роста миомы матки. Эстрогены стимулируют образование рецепторов прогестерона на клетках миомы, в то время как прогестерон запускает деление клеток. Другими словами, два женских гормона дополняют друг друга, но основным гормоном, стимулирующим рост узлов миомы матки, является прогестерон.
Узлы миомы матки растут с непредсказуемой скоростью: одни могут расти достаточно быстро — до нескольких сантиметров в месяц, другие очень медленно — 5-7 мм в год. Часть узлов может прекратить рост и несколько лет не увеличиваться в размере. Некоторые узлы способны самостоятельно нарушить свое кровоснабжение и вызвать некроз, в результате чего узел погибает, уменьшается в размере и больше не растет.
Нет никаких научных доказательств влияния внешних факторов на рост миомы матки. То есть бани, сауны, массажи, загар и физиопроцедуры не оказывают стимулирующего воздействия на рост миомы матки.
В целом поведение миомы матки непредсказуемо, известно лишь, что часть узлов начинает активно расти во время беременности, а после родов уменьшаются в размере, миома матки не растет после наступления менопаузы и подвергается обратному развитию и не встречается до начала менструаций (менархе).
Классификация и стадии развития миомы матки
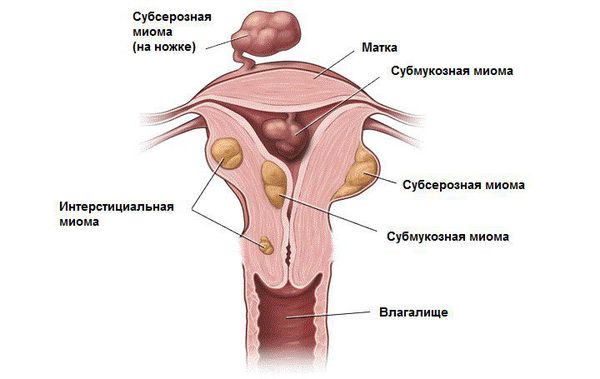
В зависимости от локализации миома матки бывает:
- Интрамуральная (межмышечная) — растущая в толще стенки матки
- Субсерозная (подбрюшинная) — располагается снаружи матки;
- Субмукозная (подслизистая) — растущая в полости матки
- Шеечная — из шейки матки
Существуют смешанные локализации, к примеру: интрамурально-субсерозная миома, то есть узел растет из стенки матки, но частично смещен наружу. Кроме этого у узлов описывают направление роста относительно полости матки. Так, миома матки может быть с центрипетальным ростом, то есть расти в сторону полости, или с центрифугальным, то есть наружу.
Узлы субмукозной (подслизистой) и субсерозной локализации также делят на типы в зависимости от их локализации по отношению к полости матки или наружному контуру. Если узел полностью расположен в полости матки — это 0 тип миомы, на 50% — 1-й тип, менее чем на 30% — 2 -й тип. Аналогично называют и субсерозные узлы. Нулевой тип субсерозного узла также называют “миомой на ножке”, при этом ножка может быть как тонкой, так и достаточно широкой.
До сих пор в нашей стране применяют классификацию миомы матки, основанную на соответствии размеров матки срокам беременности в неделях. К примеру, можно встретить такое заключение: “миома матки 11-12 недель”. Эта классификация крайне субъективна и совершенно не информативна. Матка с наличием нескольких мелких узлов или при наличии небольшого субмукозного узла может не увеличиваться в размере. Крупные узлы несимметрично увеличивают в размере матку, и разные доктора будут по-разному оценивать общий размер матки, что может привести к неправильной интерпретации динамики роста узлов. Эта классификация не описывает количество и локализацию узлов, что определяет тактику лечения заболевания.
Миома матки бывает единичной и множественной. От чего зависит, сколько узлов образуется, и с какой скоростью они будут расти — неизвестно. В целом динамика роста узлов непредсказуема. Кроме периода беременности, когда большая часть узлов начинает расти под воздействием прогестерона, нет ни одного научно доказанного фактора, влияющего на рост миомы матки. После наступления менопаузы миома матки подвергается обратному развитию — узлы должны начать уменьшаться в размерах, в них наступают дистрофические изменения.
Некоторые узлы могут самостоятельно погибнуть за счет нарушения своего кровоснабжения. Такого рода “суицид” узла следует рассматривать как благоприятный исход заболевания.
Осложнения миомы матки
Наиболее распространенным осложнением миомы матки является железодефицитная анемия, которая развивается на фоне постепенного увеличения объема менструальной кровопотери. Её проявления не всегда вовремя замечаются пациенткой. На фоне анемии нарастает слабость, снижается трудоспособность, когнитивные функции, ухудшается состояние кожи, ногтей, волос. Нередко именно с этими жалобами пациентка обращается к терапевтам, которые диагностируют анемию и отправляют ее на осмотр к гинекологу, где диагностируется миома матки.
Наличие миомы матки может осложнять реализацию репродуктивной функции. При локализации в полости матки или существенно деформируя ее, миома может препятствовать зачатию или вынашиванию беременности. При крупных узлах или множественной миоме увеличенная в размере матка может занимать большую часть брюшной полости, сдавливая мочеточники, что приводит к нарушению оттока мочи и повреждению почек.
Беременность с миомой матки в ряде случаев может сопровождаться отставанием в развитии плода, преждевременными родами, преждевременным разрывом плодных оболочек, низким весом плода, слабостью родовой деятельности.
Диагностика миомы матки
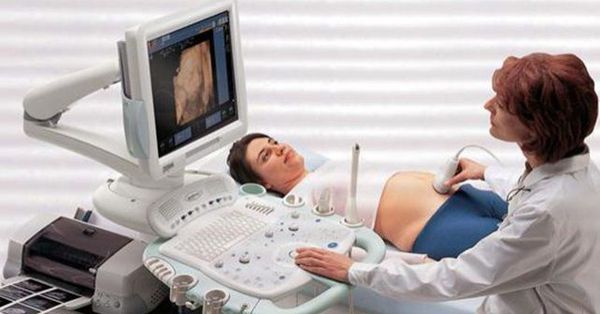
Диагностика миомы матки не представляет трудностей. Уже во время осмотра на кресле доктор может заподозрить наличие миомы матки, обнаружив увеличение матки и ее бугристость, но осмотр руками не информативен в плане количества, размера и локализации узлов. Золотым стандартом диагностики миомы матки является УЗИ.
В подавляющем большинстве случаев этого метода бывает достаточно, чтобы описать заболевание. УЗИ обязательно следует выполнять двумя датчиками: влагалищным и абдоминальным (через живот), чтобы не пропустить субсерозные узлы, которые могут располагаться на небольшом удалении от матки. Помимо подробного описания размеров и локализации всех узлов необходимо выполнить графическое изображение расположения узлов миомы матки относительно стенок матки и ее полости, проще говоря, нарисовать, как эти узлы располагаются в матке. Это важно для выбора правильной тактики лечения заболевания, так как только словесное описание может быть истолковано по-разному.
Если размер матки настолько велик, что возможности УЗИ не позволяют полностью оценить ее — рекомендуется проведение МРТ малого таза. Этот метод подробно отображает всю картину заболевания и позволяет оценить размер и точную локализацию узлов.
В некоторых случаях для уточнения локализации узла прибегают к гистероскопии — эндоскопическому методу, при котором в полость матки вводят камеру и визуально оценивают полость матки.
Лечение миомы матки
Не во всех случаях миомы матки требуется проводить лечение. Бессимптомные миомы матки в лечении не нуждаются, но только при соблюдении следующих критериев:
- У пациентки нет признаков железодефицитной анемии
- Возраст пациентки старше 35 лет и нет планов на беременность
- Узлы или не растут, или скорость роста отдельных узлов (субсерозной или интрамурально-субсерозной локализации) не превышает 1 см в год
Во всех остальных случаях требуется лечение.
Какой врач лечит миому матки
Диагностикой и медикаментозным лечением миомы матки занимается гинеколог. Удаление миомы выполняется только эндоваскулярными хирургами, роль гинекологов заключается в определении показаний, подготовке и последующему ведению пациентов.
Так как сама по себе миома матки не опасна, еще раз повторю: она никогда не превращается в злокачественную опухоль.
Вот основные цели в лечении миомы матки:
- Прекратить кровопотерю во время менструации
- Прекратить давление матки на мочевой пузырь, прямую кишку, убрать увеличение живота
- Обеспечить возможность забеременеть и родить ребенка
- Прекратить прогрессивный рост узлов.
Таким образом, перед началом лечения миомы матки надо четко решить, какую задачу вы преследуете, так как от этого будет зависеть выбор метода лечения.
Для лечения миомы матки сегодня оптимально применять следующие методы:
- Миомэктомия — хирургическое удаление узлов миомы матки.
- Эмболизация маточных артерий — метод, при котором прекращается кровоснабжение миоматозных узлов, в результате чего они погибают).
- Лечение миомы без хирургии — медикаментозная терапия мифепристоном.
Все остальные методы лечения или не имеют научных доказательств эффективности (пиявки, гомеопатия, фитотерапия, БАДы), или недостаточно эффективны, то есть эффект временный (ФУЗ аблация, агонисты ГнРГ ) или неэффективны совсем (спираль “Мирена”, контрацептивы).
При выборе метода лечения важно учитывать следующие данные:
- Возраст пациентки.
- Репродуктивные планы: желание забеременеть в настоящий момент (ближайшее время), когда-нибудь или нет планов на беременность.
- Поставленная цель (см. п.2).
Ультразвуковой метод, или ФУЗ (фокусированный ультразвук)
Когда метод только появился на него возлагали большие надежды, так как можно было воздействовать на миому без нарушения кожного покрова. Суть метода в фокусированном тепловом расплавлении узла. Однако в процессе использования оказалось, что метод себя не оправдал и от него сейчас практически отказались. После ФУЗ аблации практически во всех случаях возникают рецидивы, так как узел расплавляется не полностью, кроме этого существует множество ограничений для этого метода, которые не позволяют его использовать у большинства пациентов.
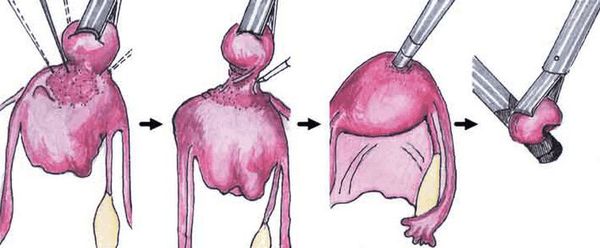
Хирургическое лечение миомы матки
Хирургическое лечение подразумевает удаление из матки миоматозных узлов различными способами: лапароскопически (под контролем камеры через несколько небольших проколов в животе), гистероскопически (так удаляются узлы, расположенные в полости матки. Инструмент и миниатюрная камера вводятся в полость матки через шейку со стороны влагалища) и лапаротомически (через разрез в животе, сейчас применяется все реже и реже). В зависимости от мастерства хирурга из матки можно удалить любое количество узлов практически любого размера, но само удаление узлов не является задачей в лечении миомы матки, так как во многих случаях наличие узлов в матке ничему не мешает.
Применение хирургического удаления узлов оптимально только при наличии у пациентки в настоящий момент репродуктивных планов при условии, что миома матки мешает их реализации. При этом в результате удаления узлов матка не должна получить серьезных повреждений (множества рубцов). Как правило, для хирургического лечения подходят субсерозные или субмукозные узлы 0 типа, интрамурально-субсерозные узлы неглубокого залегания в стенку матки. Существенным и значимым недостатком хирургического лечения является высокий риск рецидива заболевания — 7-14% в год [6], а также риск образования спаек вокруг маточных труб, что может привести к трубному фактору бесплодия или повысить риск внематочной беременности. Кроме этого, хирургическое лечение сопряжено с общими рисками полостной операции под общим наркозом.[6][12]
Показания к операционному лечению миомы матки:
1. Наличие симптомов миомы матки — обильные менструации, анемия, выявленная в анализах крови, давление на смежные органы (мочевой пузырь, прямую кишку), увеличение живота.
2. Невозможность забеременеть или выносить беременность с имеющимися узлами.
3. Прогрессивный рост узлов.
4. Рост узлов после наступления менопаузы.
Противопоказания к оперированию миомы матки: воспалительные заболевания органов малого таза, пограничные или злокачественные заболевания органов малого таза, нарушения свёртывающей системы, нарушения функции почек, сердечная недостаточность.
Гистерэктомия
Полное удаление матки — гистерэктомия также относится к хирургическим методам лечения миомы матки. Удаление матки объективно показано только в случае гигантских миом, когда общий размер матки соответствует 20-25 неделям беременности, однако бывают исключения. Во всех остальных случаях миому матки можно вылечить без удаления органа, используя описанные выше три метода лечения.
Метод эмболизации маточных артерий (ЭМА)
Эмболизация маточных артерий — малоинвазивный метод лечения миомы матки, заключающийся в прекращении кровоснабжения всех миоматозных узлов в матке, что вызывает гибель этих узлов. Суть метода в следующем: под местным обезболиванием производится пункция бедренной артерии, в сосуд вводят катетер, через который под рентгеновским контролем поочередно вводят микрошарики (эмболы), размером 700-900 микрон, состоящие из инертного полимера, которые блокируют патологический кровоток в матке, в результате чего кровоснабжение узлов миомы матки прекращается и все узлы погибают. Эффективность данного метода составляет 94-96%, все узлы необратимо уменьшаются в размере на 30-60%, проходят обильные менструации и давление на мочевой пузырь.
Появление новых узлов после ЭМА случается крайне редко, менее 0,1%. Эта процедура выполняется под местной анестезией, занимает не более 15-20 минут и требует не более 3х дней госпитализации. ЭМА способна решить любую из описанных выше задач в лечении миомы матки. Оптимально применять ЭМА при множественных узлах, узлах глубокого залегания в тело матки, крупных субмукозных узлах. ЭМА не влияет на репродуктивную функцию женщины, поэтому может быть рекомендована пациенткам, планирующим беременность, особенно если беременность планируется отсроченно. В этом отношении ЭМА имеет преимущество перед миомэктомией, так как не сопряжена с рецидивом заболевания и при ЭМА нет риска повреждения маточных труб спаечным процессом.[13][17]
Прогноз. Профилактика
Прогноз у миомы матки в большинстве случаев благоприятный. Только при запущенных случаях не удается сохранить орган или восстановить репродуктивную функцию. Миома матки чаще всего растет медленно. Как правило, сами пациенты годами не посещают гинеколога, что не позволяет вовремя диагностировать заболевание на начальном этапе и провести лечение. В то же время нередко и сами доктора длительно наблюдают за постепенным ростом узлов, не предпринимая никаких мер, а после предлагают только удаление органа.
Так как причина развития миомы матки неизвестна, никаких профилактических мероприятий не предложено. Некоторые исследования показали, что прием гормональных контрацептивов снижает вероятность появления миомы матки на 24%.[18] Воздержание от массажа, загара, спорта и посещения бань не снижает вероятность заболеть миомой матки.
Если проходить УЗИ органов малого таза 1 раз в год начиная с 21 года, можно вовремя выявить начальную стадию заболевания и провести превентивное лечение.
Миома матки: современные практические аспекты заболевания
Авторы:
Аганезова Н.В., Аганезов С.С., Шило М.М.
Как цитировать:
Аганезова Н.В., Аганезов С.С., Шило М.М. Миома матки: современные практические аспекты заболевания. Проблемы репродукции.
2022;28(4):97‑105.
Aganezova NV, Aganezov SS, Shilo MM. Uterine fibroids: modern practical aspects of the disease. Russian Journal of Human Reproduction. 2022;28(4):97‑105. (In Russ.)
https://doi.org/10.17116/repro20222804197

Введение
Описанная в 1793 г. патологоанатомом Мэтью Бэйли доброкачественная опухоль — миома (лейомиома, фибромиома, фиброма) матки в настоящее время диагностируется у 70% женщин [1]. Лейомиома матки лидирует среди невоспалительных заболеваний женских половых органов и занимает второе место в структуре гинекологической патологии [2, 3]. Частота выявления миомы матки неуклонно растет, что связано с внедрением более совершенных и доступных методов диагностики. Несмотря на достижения современной фармакологии, фибромиома матки остается преимущественно хирургической патологией. При наличии показаний к оперативному лечению, описанных в клинических рекомендациях Министерства здравоохранения Российской Федерации «Миома матки» (2020), некоторые женщины, желающие реализовать репродуктивную функцию, подвергаются органосохраняющим операциям [4]. Наиболее эффективной хирургической манипуляцией является миомэктомия, проводимая с применением различных доступов, однако частота рецидивов миоматозных узлов составляет 11,7—84,4% [5]. Радикальное лечение миомы матки, гистерэктомия, выполняется в 50—70% случаев от общего числа заболеваний матки, из них в 30% случаев — у пациенток репродуктивного возраста [6].
В настоящее время возрастает частота регистрации случаев лейомиомы матки у пациенток репродуктивного возраста до 35 лет. Вместе с тем среди современных женщин прослеживается тенденция к все более позднему деторождению в связи с повышением их социальной активности и ориентацией на реализацию в профессиональной деятельности [7]. Данные обстоятельства диктуют необходимость определения эффективности медикаментозных методов воздействия на клинические проявления фибромы матки у пациенток репродуктивного возраста с целью сохранения их фертильности и улучшения качества жизни.
Клиническая картина и патогенез миомы матки
Примерно у 60% больных миомой матки возникают клинические проявления заболевания, которые зависят от локализации и размеров миоматозных узлов. Классификация миомы матки разработана Международной федерацией гинекологии и акушерства (The International Federation of Gynecology and Obstetrics — FIGO) в 2011 г. и является актуальной в настоящее время [8]. Лейомиому матки подразделяют на субмукозную, которая в свою очередь имеет три типа: тип 0 — миоматозный узел в полости матки «на ножке»; тип 1 — меньше 50% составляет интрамуральный компонент; тип 2, в котором 50% и более узла расположено интрамурально. Миоматозный узел типа 3 контактирует с эндометрием, однако он полностью (100%) локализован в миометрии. Другие миоматозные узлы: тип 4 — интрамуральный узел; тип 5 — интрамурально-субсерозный с преобладающей (50% и более) интрамуральной частью; тип 6 — интрамурально-субсерозный с преобладающей субсерозной частью (интрамуральная — менее 50%); тип 7 — субсерозный миоматозный узел «на ножке»; тип 8 — миоматозные узлы других локализаций. Отдельно выделяют тип 2-5 — гибридная миома, контактирующая и с эндометрием, и с серозной оболочкой.
Одним из часто встречающихся симптомов миомы матки являются аномальные маточные кровотечения [9]. В настоящее время для систематизации основных причин аномальных маточных кровотечений у небеременных женщин репродуктивного возраста принято использовать классификацию FIGO PALM-COEIN (2011) [8], согласно которой маточные кровотечения при фибромиоме матки относятся к группе кровотечений с органическими причинами. В большинстве случаев данный симптом ассоциирован с миоматозными узлами субмукозной и/или интерстициальной локализации (F0—F5). Описаны несколько механизмов, приводящих к длительным и обильным маточным кровотечениям при миоме матки: нарушение микроциркуляции вследствие деформации полости матки; нарушение сократительной способности матки, растяжение полости матки и увеличение «менструирующей» поверхности при множественной миоме матки с интерстициальным расположением миоматозных узлов; нарушение процесса отторжения функционального слоя эндометрия и замедление регенерации кровоточащей поверхности слизистой матки после десквамации функционального слоя. Вследствие рецидивирующих обильных и/или длительных менструаций у женщин с лейомиомой матки ухудшаются гематологические показатели, в частности снижается уровень гемоглобина, то есть развивается хроническая постгеморрагическая анемия. Обмороки, головокружение, слабость и быстрая утомляемость, будучи клиническими проявлениями анемии, значительно снижают качество жизни женщин [10].
Крайне разнообразен по выраженности и локализации болевой синдром при миоме матки. Миоматозный узел ретроперитонеальной локализации, ущемляя крестцовые нервы, вызывает вторичный ишиас с корешковой болью. Ноющая боль в пояснично-крестцовой области характерна для субсерозного миоматозного узла, расположенного по задней стенке матки, схваткообразная — для субмукозного. Болевая симптоматика может быть обусловлена венозным застоем и даже тромбозом вен малого таза и нижних конечностей, чему способствует сдавление венозных сплетений при параметральном росте фибромиомы матки. У некоторых пациенток с расположением узла/узлов лейомиомы в области перешейка матки развиваются нарушения мочеиспускания за счет сдавления мочевого пузыря и нарушения его иннервации. Реже других встречается такое осложнение, как перекрут ножки субсерозного узла с развитием дегенеративных осложнений в нем, что является показанием к неотложному хирургическому лечению [11].
В XXI веке значительно возросла распространенность миомы матки среди женщин в возрасте до 35 лет. Вместе с тем увеличивается возраст первых и последующих родов, в том числе у женщин с лейомиомой матки. Совокупность данных факторов приводит в целом к снижению фертильности. Репродуктивные неудачи у женщин с миомой матки могут быть связаны с изменением ангиогенеза в миометрии [12]; нарушением функциональных характеристик мерцательного эпителия маточных труб вследствие близлежащего расположения к ним миоматозных узлов [13]; изменением структуры эндометрия при субмукозной и интрамурально-субмукозной локализации миоматозных узлов [14]; наличием аномальной сократительной активности миометрия, которая препятствует оплодотворению и имплантации плодного яйца в толщу функционального слоя эндометрия [15]. Описаны различные варианты нарушения рецептивности эндометрия у женщин с бесплодием при наличии клинически значимой миомы матки (диаметр миоматозного узла более 40 мм) [16]. Помимо отрицательного влияния на репродуктивную функцию, миома матки повышает частоту осложнений беременности [17]. Развитию преэклампсии и задержке роста плода при наличии у пациентки фибромиомы матки могут способствовать аномальный неоангиогенез и неполноценность волн трофобластической инвазии. Возможно формирование неправильного положения плода и предлежания плаценты при множественной фиброме матки с миоматозными узлами различного диаметра и локализации. Истмико-цервикальная недостаточность, развившаяся как осложнение беременности при шеечной и шеечно-перешеечной локализации узлов лейомиомы, в ряде случаев приводит к преждевременным родам. Несвоевременное излитие околоплодных вод и аномалии родовой деятельности чаще наблюдаются у женщин с миомой матки. Наиболее грозными осложнениями фибромиомы матки во время беременности являются некроз миоматозного узла и разрыв матки, к которому предрасполагает наличие рубца после проведенной ранее миомэктомии. Перечисленные клинические ситуации являются показаниями к проведению экстренного оперативного вмешательства, а также могут привести к потере беременности.
Аномальные маточные кровотечения, хронические тазовые боли и бесплодие/невынашивание беременности, ассоциированные с миомой матки, и даже знание об опухоли, находящейся в организме, негативно влияет на качество жизни женщин. Снижение социального функционирования и трудоспособности отмечают 53,7% пациенток с миомой матки, отрицательные моменты сексуальной жизни — 42,9% женщин [18]. Применение различных технологий, как хирургических, так и медикаментозных, направленных на уменьшение клинических проявлений миомы матки, позитивно влияет на все стороны жизни пациенток. Среди хирургических методов лечения эмболизация маточных артерий улучшает качество жизни женщин на 50,9%, миомэктомия с последующим шестимесячным применением гормональной контрацепции, профилактикой венозных тромбоэмболических осложнений и спаечного процесса — на 44,2%, миоэктомия без курса реабилитации — на 36,7% [19]. Изолированное использование ряда лекарственных препаратов также в различной степени повышает показатели качества жизни у женщин с лейомиомой матки, однако подобные исследования немногочисленны.
Фибромиома матки является моноклональной опухолью матки, то есть развивается из одной аномальной клетки. Согласно актуальным теориям, клетка-предшественница миомы матки возникает в результате дефекта клетки во время онтогенетического развития или после повреждения клетки в сформировавшейся матке.
Начиная с XX века в источниках литературы регулярно появляются публикации, свидетельствующие о роли половых стероидных гормонов в формировании и развитии миоматозных узлов. В фундаментальном исследовании Г.А. Савицкого (1991) описана гормональная зависимость процессов образования и роста миоматозных узлов, главным индуктором которых считался эстрадиол [20]. Установлена прямая связь между количеством рецепторов эстрадиола и содержанием гладкомышечной ткани в миоматозных узлах. Как следствие, зарегистрирована положительная зависимость между количеством рецепторов эстрогенов и величиной опухоли; большее содержание эстрогеновых рецепторов отмечено в центральной части крупных миом [21].
В настоящее время большое значение в патогенезе миомы матки отводится прогестерону [22]. Результаты клинических и биохимических исследований подтверждают способность прогестерона повышать частоту соматических мутаций в клетках миометрия и способствовать развитию фибромиомы матки. Прогестерон участвует в гормонопосредованной стимуляции роста миоматозных узлов. Более 90% клеток узлов лейомиомы содержат рецепторы прогестерона, которые взаимодействуют с сигнальными факторами роста и активируют их [23]. В результате активации различных ростовых факторов, таких как основной фактор роста фибробластов (basic fibroblast growth factor — bFGF), эпидермальный фактор роста (EGF), инсулиноподобный фактор роста (IGF)и трансформирующий фактор роста (TGF), нарушается баланс процессов пролиферации и апоптоза миоцитов в миометрии, и возникает очаговая (локальная) гиперплазия миометрия с последующим формированием миоматозных узлов. В узлах лейомиомы также отмечена повышенная экспрессия ингибиторов апоптоза: протоонкогена bcl-2 и регулятора клеточной пролиферации ki-67 [24]. Полученные доказательства об уменьшении размеров опухоли на фоне использования антипрогестагенов служат подтверждением значимой роли прогестерона в патогенезе миомы матки [25]. Как прогестерон, так и эстрогены способны стимулировать избыточное накопление внеклеточного матрикса, который, в свою очередь, служит «резервуаром» профибротических факторов роста и усиливает их активность [26].
В работе А.Н. Стрижакова и соавт. (2011) установлено, что в миоматозных узлах повышено количество ассоциированной микробной флоры по сравнению с окружающими тканями матки, и описаны зоны роста миомы матки в виде пучковой пролиферации гладкомышечных клеток вокруг воспалительных инфильтратов [27]. Аналогичные данные получены в исследовании А.Л. Тихомирова и соавт. (2021), в результате которого выявлено наличие воспалительной реакции на Nocardia spp, Prevotella spp, Kingella spp., Clostridium ramosum, Peptostreptococcus anaerobius, Eubacterium spp. при анализе биоптатов миоматозных узлов и определении микробиоценоза в данном материале. При микроскопии срезов тканей маток с наличием эндомиометрита зарегистрировано формирование «зачатков» узлов лейомиомы вокруг воспалительных очагов в околососудистых зонах миометрия [28]. Результаты описанных исследований могут свидетельствовать о существенной роли инфекционных факторов в патогенезе фибромиомы матки.
Быстрый темп роста миомы матки зарегистрирован у женщин с высоким уровнем тревожности и депрессией. Эмоциональная лабильность приводит к спазму сосудов и гипоксии ткани, в том числе и в миоматозных узлах. В работе М.Л. Добрыниной и соавт. (2013) стрессовое состояние отмечено как первостепенный фактор развития лейомиомы матки [29].
Наследственную предрасположенность к развитию миомы матки вследствие генетически детерминированного увеличения экспрессии эстрогенов в миометрии отражает распространенность семейных форм заболевания. Исследования показывают, что у ближайших родственниц лейомиома матки диагностируется в 2—3 раза чаще, чем в популяции, и риск формирования миоматозных узлов выше у монозиготных близнецов, чем у дизиготных [1]. Наличие миомы матки у родственницы первой генерации в 4,2 раза увеличивает вероятность развития заболевания.
Риск формирования миоматозных узлов увеличивается при индексе массы тела пациентки более 24 кг/м2 и возрастает на 21% на каждые 10 кг прибавки массы тела. С 1894 г. принадлежность к негроидной расе рассматривается как фактор развития фибромиомы матки [30]. Основным предиктором заболевания является фермент катехол-О-метилтрансфераза, который участвует в метаболизме эстрогенов и встречается у 47% афроамериканок и только у 19% женщин европеоидной расы. Определено, что представительницы негроидной расы в 3—9 раз более подвержены развитию миомы матки [31]. Прием антиэстрогенного препарата тамоксифена, который в 20% случаев действует как агонист рецепторов эстрогенов в матке и тем самым увеличивает пролиферативную активность в эндометрии и миометрии, также рассматривают как фактор риска лейомиомы матки. Повышенная вероятность возникновения миоматозных узлов связана с наличием в анамнезе прерванной беременности (артифициальный аборт) и/или спонтанных потерь, а также с наступлением беременности в позднем репродуктивном периоде. Данные причины приводят к отсутствию и/или сокращению периодов физиологической аменореи (беременность, лактация), а следовательно, к более продолжительному циклическому воздействию половых гормонов в течение жизни женщины. Риск развития миомы матки уменьшается соразмерно числу доношенных беременностей: так, среди женщин, родивших 5 детей, в 4 раза реже отмечается регистрация случаев фибромиомы матки.
В литературе опубликованы результаты ряда исследований, свидетельствующих о наличии протективного эффекта комбинированных гормональных контрацептивов в отношении миомы матки. Одно из масштабных и пролонгированных во времени исследований проведено в Великобритании с 1974 по 1986 г. Первоначально в исследование включены 17 032 женщины, каждая из которых использовала комбинированные гормональные контрацептивы в течение не менее 5 мес до начала исследования, возраст пациенток составлял от 25 до 39 лет. Частота визитов женщины к врачу-исследователю составляла не реже одного раза в год; число выбывших пациенток из исследования не превышало 3% в год. Спустя 11 лет наблюдения у 538 испытуемых диагностирована миомы матки, контрольную группу сформировали из 535 здоровых женщин. В 1986 г. опубликованы результаты данного исследования, которые продемонстрировали снижение риска развития миомы матки на 17% при 5-летней продолжительности использования комбинированных оральных контрацептивов, при 10-летней — на 31% [32].
С 1986 по 1997 г. в Италии проводилось исследование по типу «случай — контроль». Основную группу составили 843 женщины в возрасте от 18 до 54 лет с гистологически подтвержденным диагнозом миомы матки вследствие хирургического лечения заболевания в анамнезе. Показаниями к оперативному вмешательству послужили рецидивирующие маточные кровотечения и диаметр миоматозных узлов более 10 см по данным эхографического исследования. В контрольную группу включены 1557 пациенток, которым проведено медицинское обследование и исключен диагноз лейомиомы матки. Для получения информации использованы анкеты, включающие разделы с вопросами о личностных характеристиках и привычках, данные акушерско-гинекологического анамнеза и подробную историю использования комбинированных оральных контрацептивов. Результаты проведенного исследования, опубликованные в 1999 г., показали, что прием комбинированных гормональных контрацептивов в течение 4—6 лет способствовал снижению риска развития миомы матки на 17—20%, в течение 7 и более лет — на 50% [33].
В Оксфордском проспективном исследовании Ассоциации планирования семьи (L.M. Marshall и соавт., 1998) осуществлялось наблюдение за 95 061 пациенткой в течение 6—10 лет. За 326 116 человеко-лет наблюдения зарегистрировано 3006 случаев миомы матки. В процессе статистической обработки результатов исследования продемонстрировано снижение риска развития лейомиомы матки при увеличении продолжительности приема комбинированных оральных контрацептивов [34].
Три представленных выше исследования включены в метаанализ (J. Qin и соавт., 2013), который остается актуальным и подтверждает более низкую распространенность миомы матки среди женщин, когда-либо применявших монофазные комбинированные оральные контрацептивы [35]. Отечественное исследование под руководством А.Л. Тихомирова и соавт. (2011) проведено методом ретроспективного анализа данных анамнеза 1400 женщин с миомой матки. Результаты этой работы сходны с ранее представленными данными и показывают, что лейомиома матки чаще диагностируется у женщин, не использовавших в прошлом и настоящем сколько-нибудь продолжительную комбинированную гормональную контрацепцию [36].
Несмотря на значительное количество исследований, патогенез миомы матки остается до конца не изученным. Наиболее актуальной в настоящее время остается гормональная теория патогенеза данной патологии (в частности, влияние прогестерона).
Терапевтические подходы к ведению пациенток с миомой матки
При отсутствии показаний к оперативному лечению миомы матки может быть использована лекарственная терапия для уменьшения выраженности симптомов заболевания. Медикаментозное воздействие направлено на стабилизацию/уменьшение размеров миоматозных узлов, однако не способствует их полной редукции и полному излечению пациенток с лейомиомой матки [37]. В настоящее время прогестерон рассматривают как ключевой фактор в развитии миомы матки, что позволяет успешно применять антигестагены для регулирования уровня экспрессии рецепторов прогестерона [38]. На фоне использования препаратов данной группы у большей части женщин развивается аменорея, что является положительным эффектом у пациенток с фибромиомой матки, страдающих аномальными маточными кровотечениями. После курса мифепристона в дозе 50 мг ежедневно в течение 3 мес зарегистрировано уменьшение диаметров миоматозных узлов на 58%. Антипрогестины уменьшают степень выраженности болевого синдрома у 83,7% пациенток [39]. Положительное влияние на качество жизни женщин с миомой матки при использовании данных препаратов описано в исследовании Я.А. Лебедевой и соавт. (2019) [40].
В качестве предоперационной подготовки используют агонисты гонадотропин-рилизинг-гормона в течение 3—6 мес. Данные препараты, вызывая атрофические процессы в эктопическом и эутопическом эндометрии, являются индукторами уменьшения размеров миоматозных узлов и средствами, способствующими снижению объема кровотечения. В то же время, приводя к супрессии синтеза эстрогенов, агонисты гонадотропин-рилизинг-гормона ведут к развитию синдрома, сходного с климактерическим, что ограничивает срок их использования [41].
Установка внутриматочной рилизинг-системы, содержащей левоноргестрел, не влияет на стабилизацию и уменьшение размеров миоматозных узлов [42]. Однако данный метод контрацепции оказался эффективным средством лечения геморрагического синдрома при миоме матки, что положительно влияет на качество жизни женщин [43].
Нестероидные противовоспалительные препараты за счет снижения активности циклооксигеназы 2-го типа нивелируют симптомы лейомиомы матки. Препараты данной группы способствуют уменьшению объема кровопотери в среднем на 124 мл за цикл, а также уменьшают интенсивность болевого синдрома [44]. Еще одним терапевтическим средством, приводящим к уменьшению менструальной кровопотери при фиброме матки на 40%, являются препараты транексамовой кислоты.
Основным митогенным фактором в развитии миоматозных узлов, как указано ранее, считается прогестерон, эстрогены осуществляют вспомогательную функцию. Комбинированные гормональные контрацептивы, применяемые с целью защиты от нежелательной беременности, не только оказывают мощный протективный эффект, но и успешно используются для нивелирования клинических проявлений миомы матки [45]. Препараты данной группы подавляют фолликулогенез и овуляцию, и, как следствие, ежемесячные циклические процессы в эндометрии и миометрии; ликвидируют колебания половых гормонов в связи с отсутствием естественного менструального цикла. Согласно 5-й редакции руководства Всемирной организации здравоохранения «Медицинские критерии приемлемости использования методов контрацепции» (2015) (Medical eligibility criteria for contraceptive use, 5th ed. Geneva: World Health Organization; 2015), миома матки относится к 1-й категории приемлемости для использования гормональных методов контрацепции (не является ограничением для использования данной группы противозачаточных препаратов) [46]. В настоящее время в Российской Федерации зарегистрированы низкодозированные монофазные комбинированные гормональные контрацептивы, доза этинилэстрадиола в которых не превышает 35 мкг/сут; лекарственные формы представлены таблетированными препаратами, влагалищной и трансдермальной рилизинг-системами. Помимо монофазных комбинированных контрацептивов, можно использовать низкодозированный трехфазный оральный контрацептив. Последний содержит этинилэстрадиол, доза которого составляет 35 мкг/сут в 1—7 таблетках и 30 мкг/сут в 8—21 таблетке, и дезогестрел. Дезогестрел является метаболически нейтральным 19-норстероидом 3-го поколения, в составе препарата его доза ступенчато изменяется от 50 до 150 мкг/сут (7+7+7), что позволяет снизить цикловую доза прогестина на 40%. Применяются также гормональные контрацептивы с эстрогенами, биоидентичными натуральным. Использование комбинированных гормональных контрацептивов является высокоэффективным методом контрацепции, исключая аборт как один из факторов риска развития миомы матки. При применении эстроген-гестагенных контрацептивов женщинами с лейомиомой матки отмечен ряд положительных неконтрацептивных эффектов.
Аномальные маточные кровотечения являются самым частым клиническим проявлением фибромиомы матки и существенно нарушают качество жизни женщин. Комбинированные гормональные контрацептивы в целом уменьшают объем кровянистых выделений в дни менструальноподобной реакции и в ряде случаев успешно применяются для лечения аномальных маточных кровотечений у женщин с миомой матки, что способствует снижению частоты оперативных вмешательств по поводу данной патологии [47].
При применении комбинированных оральных контрацептивов отмечена стабилизация размеров миоматозных узлов диаметром до 15 мм, что отражено в результатах исследования А.Л. Тихомирова (2013) [23]. Использование препаратов данной группы при миоматозных узлах диаметром 15 мм и более, но не являющихся показанием к оперативному лечению, может приводить как к стабилизации размеров узлов, так и к их увеличению [23]. Ряд положительных неконтрацептивных эффектов эстроген-гестагенных контрацептивов позволяет считать их препаратами, способствующими сохранению фертильности и соматического здоровья женщин.
Известно, что симптомная миома матки, снижая качество жизни пациенток, отрицательно влияет на психоэмоциональную составляющую здоровья женщин. В настоящее время для оценки качества жизни, учитывающей субъективную точку зрения пациентки, используется опросник SF-36 «Оценка качества жизни». Данный опросник применяется в США и европейских странах; он переведен на русский язык и валидирован в нашей стране. Результаты 40 исследований по оценке качества жизни женщин с миомой матки с использованием опросника SF-36 показали статистически значимое снижение всех доменов анкеты по сравнению со здоровыми женщинами. В 2017 г. В.Н. Прилепской и соавт. проведено исследование качества жизни пациенток с лейомиомой матки и аномальными маточными кровотечениями в анамнезе на фоне использования комбинированных гормональных контрацептивов, в результате отмечено повышение ежедневной активности и работоспособности женщин [48]. Работы по изучению качества жизни пациенток с симптомной миомой матки при применении/неприменении комбинированной гормональной контрацепции в сравнительном аспекте в настоящее время не представлены.
Заключение
Лейомиома матки остается распространенной гинекологической патологией. Неуклонно увеличивается возраст первых родов, вместе с тем миома матки все чаще диагностируется у женщин 20—25 лет. Наличие миоматозных узлов неблагоприятно отражается на репродуктивной функции женщин, отрицательно влияет на соматическое здоровье пациенток и на качество их жизни. Гормональная теория патогенеза фибромиомы матки является наиболее актуальной; главным инициатором роста опухоли считается прогестерон. Хирургические органосохраняющие методы лечения не исключают рецидивов заболевания. В настоящее время не разработаны специфические медикаментозные методы лечения миомы матки. Используемые группы лекарственных препаратов приводят лишь к облегчению клинических проявлений миомы матки и в ряде случаев к стабилизации размеров узлов лейомиомы. Результаты проведенных исследований по изучению комбинированных гормональных контрацептивов свидетельствуют о наличии ряда положительных неконтрацептивных эффектов данных препаратов в отношении фибромы матки. Эстроген-гестагенные контрацептивы уменьшают объем кровянистых выделений, снижают выраженность болевого синдрома и препятствуют возникновению аномальных маточных кровотечений у женщин с лейомиомой матки. Опубликованы описания случаев (case report) и серии случаев, отражающие данные о стабилизации и уменьшении размеров миоматозных узлов на фоне использования комбинированных гормональных средств контрацепции. Однако результатов проведенных исследований недостаточно для достоверной оценки влияния данных препаратов на риск возникновения фибромиомы матки и темпы роста миоматозных узлов, а также на качество жизни женщин с миомой матки. Учитывая высокую частоту выявления лейомиомы матки и ее негативное влияние на различные сферы жизни пациенток, следует отметить необходимость дальнейшего изучения влияния различных медикаментозных препаратов, в том числе комбинированных гормональных контрацептивов, на клиническое течение миомы матки и качество жизни пациенток.
Участие авторов:
Концепция и дизайн исследования — Аганезова Н.В., Аганезов С.С.
Сбор и обработка материала — Шило М.М., Аганезова Н.В., Аганезов С.С.
Написание текста — Шило М.М., Аганезов С.С.
Редактирование — Аганезова Н.В.
Авторы заявляют об отсутствии конфликта интересов.
Миома (лейомиома) матки остается самой часто встречающейся опухолью репродуктивной системы уженщин. Согласно статистике, более 50% отчисла всех пациенток отделений оперативной гинекологии составляют женщины смиомой матки. Частота данной патологии колеблется от25 до35% уженщин репродуктивного возраста, возрастая до43–52% уженщин вперименопаузальном возрасте [1–3]. Внастоящее время неявляется редкостью выявление миоматозных узлов уженщин в20-30-летнем возрасте.
Миому относят к моноклональной доброкачественной гладкомышечной опухоли, рост которой вызывается комплексом факторов, влияющих на процессы пролиферации, апоптоза и ангиогенеза. Многочисленные исследования, посвященные патогенезу опухолевого роста, показывают, что центральная роль в регуляции роста миомы матки отводится половым стероидам — эстрогенам, прогестерону и их рецепторам — в моделировании роста, дифференцировки и функции миометрия [4–6].
Некоторые авторы [6–8] рассматривают лейомиому матки как местное проявление сложных изменений, происходящих в организме женщины, как болезнь дезадаптации, выражающуюся в нарушении взаимоотношений в системе гипоталамус-гипофиз-яичники-матка со своеобразной гиперплазией миометрия на фоне нарушенных гормональных взаимоотношений и/или измененной рецепторной чувствительности эффекторного органа [4].
Определенную роль в возникновении лейомиомы матки играет нарушение гемодинамики, иннервации и водно-электролитного баланса, при которых уменьшается эластичность стенок кровеносных сосудов миометрия, возникает стаз, снижается крово- и лимфоотток и коэффициент Na/K, возникает тканевая гипоксия. Это приводит к нарушению дифференциации клеток миометрия, которые приобретают способность к пролиферативному росту, что, в свою очередь, способствует формированию лейомиомы матки даже в условиях сохраненного гормонального статуса [4, 6].
Е. М. Вихляева считает, что не существует бессимптомной миомы матки. И действительно, если у женщин на начальных стадиях отсутствуют кровотечения, боли, нарушения функции смежных органов, то это не говорит о том, что не будет роста опухоли в скором времени. Считается, что миома — опухоль доброкачественного происхождения, но не следует забывать о том, что может произойти ее злокачественное перерождение в любом возрасте. В настоящее время гинекологи склоняются к мнению, что в репродуктивном возрасте опасность развития онкологического процесса в опухоли наиболее реальна у тех женщин, у которых помимо лейомиомы матки определяются еще 2–3 фактора риска, особенно при наличии метаболических нарушений [9]. В период перименопаузы и менопаузы миома матки является самостоятельным фактором риска, особенно если имеются другие признаки гиперэстрогении или эндокринно-метаболических нарушений [4]. Я. В. Бохман однозначно определял роль миомы матки как маркера злокачественных новообразований [9]. Не зря во многих классификациях миому выделяют как пограничную опухоль, способную к малигнизации.
Многообразие вариантов клинического течения миомы матки, возрастной диапазон от раннего репродуктивного до постменопаузального, частое сочетание с другими гинекологическими заболеваниями диктуют необходимость индивидуального выбора метода лечения этих женщин.
Тактика ведения женщин с миомой матки детородного возраста различна, т. к. во многом зависит от необходимости сохранения репродуктивной функции.
Миома матки не является абсолютным показанием к хирургическому лечению. Пациенток молодого репродуктивного возраста с размерами миомы до 4 см без клинических проявлений можно лечить консервативно с применением низкодозированных оральных контрацептивов.
Однако длительное бездействие и применение гормональных препаратов в лечении миомы матки у женщин, планирующих беременность, может ухудшить состояние репродуктивной функции и повысить риск потери органа за счет денервации, гиперплазии миометрия и разрушения рецепторного аппарата миоцитов. Поэтому консервативное ведение может длиться не более 3 лет с обязательным диспансерным наблюдением.
Хотя беременность и ее благоприятное завершение при миоме матки вполне возможны, у 20% женщин миома является причиной бесплодия. Беременность при миоме матки, роды и послеродовый период нередко имеют осложненное течение и в ряде наблюдений заканчиваются потерей плода и матки. Наиболее частыми гестационными осложнениями в настоящее время являются: угроза прерывания беременности в различные сроки, фетоплацентарная недостаточность и синдром задержки роста плода, неправильное положение и предлежание плода, отслойка плаценты, особенно в тех случаях, когда она частично расположена в области миоматозного узла, быстрый рост опухоли, которые могут развиться в любом сроке гестации. Нередким осложнением беременности при миоме матки является некроз узла, который при лабораторном, клиническом и ультразвуковом подтверждении является абсолютным показанием к хирургическому лечению. Наиболее частыми осложнениями родов и послеродового периода являются: несвоевременное излитие околоплодных вод, аномалии сократительной активности матки, плотное прикрепление плаценты, гипотоническое кровотечение, субинволюция матки, некроз узла [10].
В связи с вышеизложенным задача акушера-гинеколога на амбулаторном этапе заключается в прогнозировании возможных осложнений беременности при миоме матки у каждой конкретной пациентки и создании условий для благоприятного вынашивания беременности, течения родов и послеродового периода.
Наш многолетний опыт показывает, что репродуктивные исходы у женщин с миомой матки, планирующих беременность, напрямую зависят от своевременно и качественно проведенной прегравидарной подготовки, которая должна включать: топическую диагностику миомы с составлением прогноза ее роста во время беременности; предоперационную подготовку с санацией инфекционных очагов и лечение анемии; своевременную миомэктомию при размерах узлов больше 4–5 см с соблюдением хирургической технологии, обеспечивающей благоприятные условия для формирования полноценного рубца (рубцов) на матке; комплексную послеоперационную реабилитацию.
В настоящее время предложено довольно большое количество дополнительных методов исследований, позволяющих диагностировать миому матки, оценить особенности ее развития, провести дифференциальную диагностику, определить тактику ведения больной и определить наиболее рациональный метод лечения [5].
Ключевое значение для своевременной диагностики миомы имеет УЗИ, ставшее рутинным в наше время и вошедшее в практику лечебных учреждений. Применение ультразвукового сканирования позволяет с точностью до 97% выявить миому матки, правильно определить количество узлов миомы, их размер, локализацию, отношение узлов к сосудистым пучкам матки, наличие в них дистрофических и некротических изменений. Исследование кровотока в сосудах новообразований, которые имеют свои характерные особенности, позволяет считать цветовое допплеровское картирование (ЦДК) важным методом в дифференциальной диагностике доброкачественных и злокачественных опухолей матки [8, 11, 12]. Зарегистрированный с помощью ЦДК уровень васкуляризации позволяет прогнозировать быстроту роста выявленного образования [12–14].
Вопрос о выборе хирургического доступа для миомэктомии по-прежнему остается одним из наиболее дискутабельных. Мы считаем, что открытый абдоминальный и лапароскопический доступы не являются конкурирующими, а каждый из них имеет свои показания и преимущества. Большие интралигаментарные и атипически расположенные узлы миомы, возможность более тщательного послойного сопоставления краев раны при чревосечении и отсутствие коагуляционного некроза тканей при данном методе делают лапаротомию методом выбора доступа при проведении миомэктомии у пациенток, планирующих и не исключающих беременность в дальнейшем [15].
Показаниями к миомэктомии на этапе планирования беременности являются:
- объем узлов (узла), превышающих половину объема нормальной матки (больше 4 см);
- маточные кровотечения, приводящие к анемизации и обусловленные миомой матки;
- большие и гигантские размеры опухоли (превышающие 12 нед. беременности) даже при отсутствии жалоб;
- опухоли любых размеров при наличии симптомов сдавления соседних органов (учащенное или затрудненное мочеиспускание, нарушение акта дефекации);
- атипичное расположение узлов (шеечная, перешеечная и интралигаментарная локализация узлов миомы матки);
- быстрый рост опухоли;
- нарушение кровообращения в узле;
- наличие субсерозных миоматозных узлов больше 4–5 см;
- бесплодие при наличии миомы матки.
Особенностями хирургической техники являются: внутрикапсульное вылущивание узла миомы; тщательный гемостаз за счет сдавления сосудов тканями; исключение для гемостаза энергетических воздействий; зашивание раны отдельными швами синтетическим длительнорассасывающимся шовным материалом; проведение противоспаечных мероприятий.
Удаление миоматозных узлов можно считать лишь одним из этапов комплексного лечения миомы матки, т. к. рецидивы чаще всего возникают у больных с множественными миоматозными узлами, сочетанной гинекологической патологией, при отсутствии гормональной терапии в послеоперационном периоде.
Послеоперационная реабилитация является важнейшим этапом в прегравидарной подготовке пациенток после миомэктомии. В комплекс реабилитационных послеоперационных мероприятий целесообразно включать гормональную, иммуномодулирующую, противовоспалительную, антианемическую терапию и препараты, улучшающие репаративные процессы в матке.
Нами в качестве гормональной составляющей используются следующие группы препаратов: агонисты гонадотропин-рилизинг-гормона (а-ГнРГ) и комбинированные оральные контрацептивы. Показаниями для назначения гормональной терапии в послеоперационном периоде являются: наличие множественной миомы матки, атипичное расположение узлов, сочетание миомы с аденомиозом или наружно-внутренним эндометриозом, бесплодие, в тех случаях, когда оперативное вмешательство сопровождалось вскрытием полости матки, а также наличие пролиферативно-активной лейомиомы без сопутствующих гинекологических заболеваний [16].
Для устранения гипоэстрогенных состояний и лучшей переносимости а-ГнРГ на этапе реабилитации после органосохраняющих операций целесообразно назначение изофлавонов красного клевера.
Динамическое УЗИ в сочетании с допплерометрией (через 3 и 6 мес. после операции) позволяет контролировать эффективность проведенной операции и консервативной терапии с учетом оценки течения репаративных процессов и состоятельности рубца на оперированной матке.
После окончания комплексной терапии менструальная функция восстанавливается в первые 1–3 мес.
Планирование беременности разрешается в среднем через 6 мес. после операции с учетом того, что репродуктивная функция повышается сразу после окончания действия гормональной терапии. Для женщин возрастной группы старше 35 лет при отсутствии наступления самопроизвольной беременности в течение полугода после органосохраняющей операции и проведенной гормональной реабилитации целесообразно рекомендовать использование вспомогательных репродуктивных технологий.
Таким образом, прегравидарная подготовка пациенток с миомой матки и репродуктивными проблемами, включающая своевременное и тщательное обследование на этапе планирования беременности, обоснование четких показаний к миомэктомии, проведение комплексной послеоперационной реабилитации, способствует улучшению качества жизни пациенток, повышает частоту наступления беременности и снижает частоту рецидива заболевания.
Пациенткам, реализовавшим свою детородную функцию, но желающим сохранить менструальную, выполняется миомэктомия с последующим применением комбинированных оральных контрацептивов или внутриматочной гормональной системы «Мирена». Даже при достаточно технически сложной хирургической ситуации мы являемся сторонниками проведения органосберегающих операций с последующей реабилитацией у всех пациенток детородного возраста, и только при категорическом отказе пациенток, имеющих детей, от проведения органосберегающей операции расширяем объем до гистерэктомии [15].
А. Л. Тихомиров и соавт. [17] предлагают двухэтапную схему лечения женщин с симптомной миомой матки размерами от 2 до 4 см. На первом этапе больным назначается курс терапии а-ГнРГ или антигестагенами (мифепристон).
Мифепристон является блокатором рецепторов прогестерона, поэтому оказывает угнетающее влияние на рост миоматозных узлов и приводит к их регрессии. В сыворотке крови больной на фоне приема мифепристона не изменяются уровни эстрогенов и прогестерона, т. е. препарат действует на локальном уровне. Мифепристон не вызывает псевдоменопаузу, что позволяет применять его длительно, не дополняя заместительную терапию эстрогенами. По данным А. Л. Тихомирова и соавт. [17], применение мифепристона в дозе 50 мг/сут в течение 3 мес. позволило уменьшить размеры миоматозных узлов в среднем на 50–60%. Если ограничиться только первым этапом лечения, то полученный эффект может быть недостаточным в связи с большой вероятностью последующего роста узлов. В связи с этим исследователи рекомендуют на втором этапе лечения больным назначать стабилизирующую терапию в виде комбинированных оральных контрацептивов или внутриматочной гормональной системы «Мирена» [3, 17, 18]. Рекомендуемая двухэтапная схема лечения патогенетически обоснованна. Понятно, что при миомах матки более 12 нед. беременности и маточных кровотечениях гормонотерапия малоэффективна.
Перименопаузальный период характеризуется глубокой возрастной перестройкой всего женского организма, в т. ч. нейроэндокринной системы, на фоне прогрессирующего угасания функции яичников. Возрастное снижение уровня секреции эстрогенов и прогестерона в постменопаузе не свидетельствует о полном прекращении функции яичников — гормоны в женском организме претерпевают качественные изменения [19].
С наступлением менопаузы лейомиома матки в 85–90% случаев может регрессировать, особенно при небольших размерах и интерстициально-субсерозной локализации узлов [8].
Нерегрессирующая миома матки в постменопаузе может служить своеобразным опухолевым маркером по возникновению онкозаболеваний в репродуктивной системе: в эндометрии, миометрии и яичниках.
Считается, что лейомиому матки следует относить к числу факторов риска по развитию атипической гиперплазии эндометрия и рака тела матки, причем вероятность возникновения последних нарастает по мере увеличения длительности существования опухоли и возраста больных [19–21].
После 45 лет миома матки часто сочетается с другими гинекологическими заболеваниями, и в силу высокого онкологического риска необходимо проводить обследование на онкомаркеры, расширенную кольпоскопию, цитологическое исследование мазков из цервикального канала и влагалищной части шейки матки на наличие атипичных клеток, раздельное диагностическое выскабливание или аспирационную биопсию эндометрия с последующим гистологическим исследованием. Вследствие часто встречающейся атрезии цервикального канала у женщин в постменопаузе выполнить раздельное диагностическое выскабливание сложно, бесспорный приоритет принадлежит ультразвуковому сканированию.
Важное значение придают определению величины переднезаднего размера М-эха, учитывая наибольшую прогностическую ценность данного критерия при патологических состояниях эндометрия. Ультразвуковое изображение миоматозных узлов в период постменопаузы зависит от вида морфологических процессов, происходящих в нем: фиброз — разрастание соединительной ткани и облитерация сосудов; или некроз — нарушение питания в узле и, соответственно, нарушения крово- и лимфообращения; или процессы пролиферации. При ЦДК чаще видны сосуды, располагающиеся по периферии миоматозного узла. В наружной трети толщи миоматозного узла визуализируются расширенные вены, а сосуды, локализующиеся по наружному контуру узла, чаще представлены артериями. В центральной части узлов сосуды визуализируются значительно реже. Выявление интенсивного внутриопухолевого кровотока миоматозного узла в период постменопаузы позволяет выявить группу больных с признаками пролиферации в миоматозных узлах, злокачественного перерождения узла [8, 11, 12].
Если женщина вступает в постменопаузу с большими размерами опухоли, высокой эстрогенной насыщенностью, явлениями патологии шейки матки, то, без сомнения, ей требуется оперативное вмешательство в объеме пангистерэктомии. В перименопаузе вопрос об удалении придатков решается индивидуально в зависимости от состояния яичников.
Показаниями к операции являются:
- большие размеры миомы матки с симптомом кровотечения;
- аденокарцинома эндометрия;
- множественная миома матки с болевым симптомом;
- миома матки с симптомом сдавления смежных органов и нарушением их функции;
- атипичное расположение миоматозных узлов;
- сочетание миомы матки с опухолями придатков, гиперплазией эндометрия, наружно-внутренним эндометриозом;
- повторное развитие симптомов заболевания после консервативного лечения и частых раздельно-диагностических выскабливаний.
Для женщин, у которых наблюдаются пременопаузальные расстройства менструального цикла, т. е. для тех, кто стоит на пороге менопаузы, в данной клинической ситуации возможно длительное назначение а-ГнРГ или мифепристона с целью перевода этих больных из искусственной менопаузы в естественную [17, 18]. При отсутствии сопутствующих гинекологических заболеваний, небольших размерах опухоли (до 4 см) и отсутствии симптоматики миомы пациентки в лечении не нуждаются и могут находиться под динамическим наблюдением.
Таким образом, единой тактики ведения пациенток с миомой матки не существует, выбор метода лечения должен быть индивидуальным и во многом определяется возрастом, состоянием преморбидного фона, клиническими проявлениями заболевания, риском развития онкологического процесса и особенностями морфогенеза опухоли.
Литература
- Актуальные вопросы акушерства, гинекологии и репродуктологии / Под ред. Е.В. Коханевич. М., 2006. 480 с.
- Савельева Г.М., Бреусенко В.Г. Гинекология. 3-е изд. М.: ГЭОТАР-Медиа, 2007. 432 с.
- Тихомиров А.Л., Лубнин Д.М. Миома матки. М.: МИА, 2006. 176 с.
- Дамиров М.М. Современные подходы к тактике ведения больных с лейомиомой матки. Пособие для врачей, 2014. 92 с.
- Ищенко А.И., Ботвин М.А., Ланчинский В.И. Миома матки: этиология, патогенез, диагностика, лечение. М.: Издательский дом «Видар-М», 2010. 244 с.
- Вихляева Е.М. Руководство по диагностике и лечению лейомиомы матки. М.: МЕДпресс-информ, 2004. 400 с.
- Дамиров М.М. Гиперпластические процессы в матке: роль фосфоинозитидов в патогенезе, диагностике и оценке результатов лечения: автореф. дис. …д-ра мед. наук. СПб, 2000. 34 с.
- Сидорова И.С., Зайратьянц О.В., Леваков С.И. и др. Простая и пролиферирующая миома матки: морфологические особенности // Врач. 2004. № 4. С. 30–31.
- Бохман Я.В. Руководство по онкогинекологии. СПб.: Фолиант, 2002. 542 с.
- Кулаков В.И., Шмаков Г.С. Миомэктомия и беременность. М.: МЕДпресс-информ, 2001. 344 с.
- Митьков В.В., Медведева М.В. Клиническое руководство по ультразвуковой диагностике. М.: Видар, 1997. С. 30–38.
- Сидорова И.С., Капустина И.Н., Леваков С.А. Цветовое допплеровское картирование у больных с миомой матки // Ультразвуковая диагностика в акушерстве, гинекологии и педиатрии. 1999. Т. 7. № 4. С. 308–311.
- Зыкин Б.И. Ультразвуковая диагностика в гинекологии: Атлас. М.: Видар, 1994. 29 с.
- Сидорова И.С., Капустина И.Н., Левакова С.А., Саранцев А.Н. Цветовое допплеровское картирование в диагностике опухолей матки // Акушерство и гинекология. 1999. № 3.
- Краснопольский В.И., Буянова С.Н., Щукина Н.А., Попов А.А. Оперативная гинекология. М.: МЕДпресс-информ, 2010. 320 с.
- Петракова С.А. Особенности прегравидарной подготовки больных с миомой матки: дис. … канд. мед. наук. М., 2009. 176 с.
- Тихомиров А.Л., Лубнин Д.М. Оптимизация лечения больных миомой матки // Акушерство и гинекология. 2005. Т.4. № 5–6. С. 2–8.
- Тихомиров А.Л., Олейник Ч.Г. // Проблемы репродукции. 2006. Т.12. №5. С. 39–42.
- Сидорова И.С. Миома матки (современные проблемы этиологии, патогенеза, диагностики и лечения). М.: МИА, 2003. 256 с.
- Справочник по акушерству, гинекологии и перинатологии / Под ред. Г.М. Савельевой. М., 2006. 720 с.
- Урманчеева А.Ф. Практическая онкогинекология: избранные лекции Урманчеева А.Ф., Тюляндина С.А., Моисеенко Г.Н. СПб.: Центр ТОММ, 2008. 400 с.