| № по каталогу | Наименование и краткое описание | Количество определений |
|---|---|---|
|
В-9554 |
Контроль белков РУ № РЗН 2022/17306 Контрольный материал специфических белков |
1х1 мл, 1х1 мл |
|
В-9529 |
Калибратор белков РУ № РЗН 2022/16448 Калибратор специфических белков |
1х1 мл |
|
B-8225 |
Контроль СК/СК-МВ РУ № РЗН 2021/15931 Контроль общей креатинкиназы и ее МВ фракции |
1х3 мл |
|
B-8227 |
Мультикалибратор-Ф (1) № РЗН 2019/8665 Мультикалибратор на основе сыворотки крови человека для ферментов, лиофилизированный. Предназначен для автоматических биохимических анализаторов при выполнении исследований с использованием наборов производства АО «Вектор-Бест». |
1х3 мл |
|
B-8223 |
Контрольная моча – Ново № РЗН 2019/8644 Набор образцов контрольной мочи на основе мочи человека, аттестованный по 12 показателям, двух уровней концентрации |
5х5 мл, 5х5 мл |
|
B-8222 |
Контрольная моча – Ново № РЗН 2019/8644 Набор образцов контрольной мочи на основе мочи человека, аттестованный по 12 показателям, двух уровней концентрации |
1х5 мл, 1х5 мл |
|
B-8213 |
Контрольная сыворотка, уровень1 № РЗН 2022/16774 Набор сывороток контрольных лиофилизированных на основе сыворотки крови человека, аттестованных приблизительно по 30 показателям, нормальный уровень |
5×5 мл |
|
B-8214 |
Контрольная сыворотка, уровень 1 № РЗН 2022/16774 Набор сывороток контрольных лиофилизированных на основе сыворотки крови человека, аттестованных приблизительно по 30 показателям, нормальный уровень |
10×5 мл |
|
B-8216 |
Контрольная сыворотка уровень 2 № РЗН 2022/16774 Набор сывороток контрольных лиофилизированных на основе сыворотки крови человека, аттестованных приблизительно по 30 показателям, патологический уровень |
5×5 мл |
|
B-8217 |
Контрольная сыворотка уровень 2 № РЗН 2022/16774 Набор сывороток контрольных лиофилизированных на основе сыворотки крови человека, аттестованных приблизительно по 30 показателям, патологический уровень |
10×5 мл |
|
B-8208 |
Мочевой контроль-Ново № РЗН 2017/6025 Набор водных контрольных растворов компонентов мочи, содержащий белок, глюкозу двух уровней концентраций с аттестованным значением рН |
3×10 мл, 3×10 мл |
|
B-8212 |
Мочевой контроль-Ново № РЗН 2017/6025 Набор водных контрольных растворов компонентов мочи, содержащий белок, глюкозу двух уровней концентраций с аттестованным значением рН |
3×25 мл, 3×25 мл |
|
B-8231 |
Мультикалибратор — СЭ № РЗН 2017/6026 Мультикалибратор на основе человеческой сыворотки крови для субстратов и электролитов, лиофилизированный. Предназначен для автоматических биохимических анализаторов при выполнении исследований с использованием наборов производства АО «Вектор-Бест». |
1×4 мл |
|
B-8232 |
Мультикалибратор — СЭ № РЗН 2017/6026 Мультикалибратор на основе человеческой сыворотки крови для субстратов и электролитов, лиофилизированный. Предназначен для автоматических биохимических анализаторов при выполнении исследований с использованием наборов производства АО «Вектор-Бест». |
5×4 мл |
Цена:
1 055 руб.
Дополнительное описание
Набор водных контрольных растворов мочи, содержащей белок, глюкозу, кетоновые тела двух уровней концентрации (1 и 2). Набор предназначен для контроля правильности и воспроизводимости результатов определения концентрации компонентов мочи наиболее используемыми методами анализа в клини-кодиагностических лабораториях и научно-исследовательской практике. Количество аттестованных показателей: глюкоза, белок, кетоновые тела, рН. Фасовка: 3×25 мл; 3×25 мл. Срок годности после вскрытия флаконов 3 мес. (2-8°C). Срок годности набора 24 мес. (2-8°C).
В-8074 Мочевина-Ново (200). Ферментативное определение мочевины в сыворотке крови и моче, Россия (Вектор-Бест)
РУ №ФСР 2007/01468 от 18.05.2017г
Покупайте также наборы для открытых систем:
| 8079 | АЛТ-УФ-Ново жидкая форма (500)УФ-кинетический метод без пиридоксальфосфата.Образец для анализа: сыворотка крови, плазма крови.Форма выпуска: жидкий биреагент.Реагент 1: 2 шт. объемом по 200 мл каждый.Реагент 2: 2 шт. объемом по 50 мл каждый. Предел линейности 400 Е/л.Стабильность рабочего реагента 1 мес |
| 8081 | АСТ-УФ-Ново жидкая форма (500)в сыворотке и плазме крови кинетическим УФ методом без пиридоксальфосфата, IFCC. Форма выпуска: жидкий биреагент. Объем реагента: Реагент 1 2х200 мл, Реагент 2 2х50 мл. Линейность в диапазоне от 20 до 800 Е/л. Стабильность реагента после вскрытия на протяжении всего срока годности при температуре 2-8°C |
| 8074 | 8074 Мочевина-Ново (200),для ферментативного определения мочевины в сыворотке крови и моче. 1х200 мл. Состав набора: Реагент 1 (Р1) – раствор уреазы в фосфатном буфере, 1х2 мл . Реагент 2 (Р2) – раствор натрия салицилата и натрия нитропруссида, 1х200 мл. Реагент 3 (Р3) – раствор натрия гипохлорита и натрия гидроокиси, готовый к использованию, 1х40 мл. Калибратор – калибровочный раствор мочевины, 8,33 ммоль/л, готовый к использованию, 1х3 мл |
| 8012 | Протеин — Ново (500) для определения концентрации общего белка в сыворотке и плазме крови колориметрическим биуретовым методом. Форма выпуска: жидкий монореагент. Объем реагента: 2 х 250 мл. Линейность в диапазоне от 10 до 120 г/л. Имеется калибратор. Стабильность реагента после вскрытия в течение 12 мес |
| 8056 | Глюкоза-Ново (500)для определения глюкозы в сыворотке, плазме крови (цельной крови) и моче глюкозооксидазным (GOD-PAP) методом. Форма выпуска: жидкий монореагент. Объем реагента: 2х250 мл. Линейность в диапазоне от 0,7 до 30 ммоль/л. Имеется калибратор. |
| 8070 | 8070 Холестерин-Ново (500)Набор реагентов для определения концентрации общего холестерина в сыворотке и плазме крови.Метод — ферментативный колориметрический. Форма выпуска: жидкий монореагент.Объем набора: 2 фл ×250 мл. Линейность в диапазоне 1,5 -20 ммоль/л |
| 8059 | Амилаза-Ново-1 (100)Набор реагентов для определения активности aльфа-амилазы в сыворотке, плазме крови и моче кинетическим методом, субстрат CNP-олигосахарид. Форма выпуска: жидкий монореагент (5×20 мл) |
| 8097 | Мочевая кислота-Ново жидкая форма (100)Набор реагентов для определения концентрации мочевой кислоты в сыворотке, плазме крови и моче ферментативным колориметрическим методом. Состав набора: жидкий монореагент 2 флакона объемом по 50 мл. Набор содержит калибратор |
| 8021 | Билирубин-Ново (общий,100 ), Набор реагентов для определения концентрации общего билирубина в сыворотке и плазме крови колориметрическим методом Йендрашика-Грофа. Форма выпуска: жидкие реагенты (2×100 мл, 1×10 мл |
| 8091/8092 | Мочевина-УФ-Ново жидкая форма (200/500)для определения мочевины в сыворотке, плазме крови и моче УФ- кинетическим уреазным/ глутаматдегидрогеназнымметодом.Форма выпуска: жидкий биреагент. Объем реагента: Реагент 1 2х200 мл, Реагент 2 2х50 мл. Линейность в диапазоне от 2,0 до 50,0 ммоль/л. Имеется калибратор |
| 8322 | 8322 Триглицериды-Ново (жидкая форма) (100), Набор реагентов для определения концентрации триглицеридов в сыворотке и плазме крови ферментативным колориметрическим методом (GPO-PAP). Форма выпуска: жидкий монореагент (2×50 мл |
| 8338 | Калий-Ново (50)Набор реагентов для определения концентрации общего холестерина в сыворотке и плазме крови.Метод — ферментативный колориметрический. Форма выпуска: жидкий монореагент. Объем набора: 2 фл ×250 мл. Линейность в диапазоне 1,5 -20 ммоль/л |
Самые выгодные условия на покупку. Купить эту продукцию можно, позвонив по телефону+7(925)52-49-303, отправив письмо по электронной почте zakazmmp@gmail.com, а также заполнив форму обратной связи на сайте http://trio-medical.ru/
*Актуальную цену уточняйте у менеджеров по телефону: +7(925)52-49-303 или e—mail: zakazmmp@gmail.com
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Невзорова М.С.
1
Высотин С.А.
1
Сайфитова А.Т.
1
1 ФГБОУ ВО ПГМУ им. акад. Е.А. Вагнера
Цель исследования: сравнить результаты определения антител к вирусу гепатита С в сыворотке крови методом ИФА двух тест-систем Материалы и методы. Для достижения поставленной цели было проведено скрининговое обследование 7814 человек на обнаружение анти-HCV АТ методом ИФА. Для выявления в сыворотках крови антител к ВГС (IgG и IgМ) применялись 2 тест — системы: «Бест-анти ВГС (комплект 1/стрип)» и Monolisa “Anti — НСV PLUS Version 2”. Для сравнительного анализа двух тест — систем было поставлено параллельно 57 тестов. Полученные результаты подверглись статистической обработке определения экстенсивных показателей с помощью программы Microsoft Excel 2010.В результате исследования было установлено, что АТ к вирусу гепатита С обнаружены в 7 % случаев (у 537 из 7 814 пациентов). Анти — НСV АТ были обнаружены у 213 мужчин, что составило 10% и у 324 женщин, что составляет 6%. Ложноположительная реакция наблюдалась у 42 пациентов. Параллельное исследование показало, что в 28 % случаев, набор Monolisa “Anti — НСV PLUS Version 2” дал отрицательный результат, набор «Бест — анти ВГС» — положительный. В подтверждающей тест-системе в большинстве образцов крови присутствовал только нуклеокапсидный белок соге или только неструктурные белки NS3 — NS5 т. е. систематическое использование данной тест-системы для диагностики гепатита С может привести к снижению выявления антител к вирусу. Заключение. Алгоритм диагностики гепатита С должен строго соблюдаться, в соответствии с СП 3.1.3112 — 13 «Профилактика вирусного гетита С». Наличие антител к вирусу гепатита С должно быть подтверждено с помощью специального подтверждающего диагностического набора.
гепатит с
диагностика
тест-система
1. Бушманова А.Д., Сухорук А.А., Иванова Н.В., Эсауленко Е.В. Характеристика вирусного гепатита А на фоне хронического вирусного гепатита С // Казанский медицинский журнал. 2017. Т.98. №4. С.521-526
2. Воропаев Е.В., Воропаева А.В., Зубов С.В., Павлович И.Л., Калинин А.Л., Жаворонок С.В. Использование метода иммуноферментного анализа для контроля за спектром антител к антигенам вируса гепатита С // Иммунопатология, аллергология, инфектология. 2000. №3. С.73-74
3. Дерябин Н.Г. Гепатит С: современное состояние и перспективы // Вопросы вирусологии. 2012. №S1. С.91-103
4. Ершова О.Н., Шахгильдян И.В., Коленова Т.В., Кузин С.Н., Самохвалов Е.И., Кириллова И.Л., Розова А.В. Естественные пути передачи вируса гепатита С – современный взгляд на проблему // Детские инекции. 2006. №1. С.16-18
5. Кудрявцева Е.Н., Ястребова О.Н.. Растегаева А.И., Корабельникова М.И., Кузина Л.Е., Брагинский Д.М., Мартынюк А.П., Лебедева Е.И., Сметанникова М.А., Туманова О.Ю., Кузин С.Н. О проблеме верификации результатов скрининговых исследований по определению антител к вирусу гепатита С // Альманах клинической медицины. 2011. №4. С.53-59
6. Кудрявцева Е.Н., Корабельникова М.И., Кузина Л.Е. Региональная программа внешней оценки качества определения антител к вирусу гепатита С // Альманах клинической медицины. 2012. №26. С.39-44
7. Николаева Л.И., Петрова Е.В., Макашова В.В., Токмалаев А.К., Рослый И.М. Динамика специфических антител при интерферонотерапии больных вирусным гепатитом С // Инфекционные болезни. 2004. Т.2. №;. С.22-46
8. Николаева Л.И., Макашова В.В., Петрова Е.В., Шипулин Г.А., Самохвалов Е.И., Токмалаев А.К., Львов Д.К. Снижение содержания антител к вирусу гепатита С при антивирусной терапии // Биомедицинская химия. 2009. Т.55. №2. С.201-212
9. Попонин Д.М., Горовиц Э.С., Тимашева О.А. Динамика титров специфических антител к белкам вируса гепатита С у лиц с острым вирусным гепатитом С на разных стадиях инфекционного процесса // ПМЖ. 2015 Т.22. №2. С.37-42
10. СП 3.1.3112 – 13 «Профилактика вирусного гепатита С» от 22.12.2013
В настоящее время в Российской Федерации, как и в большинстве стран, сложилась неблагоприятная эпидемиологическая ситуация по парентеральному вирусному гепатиту. С 2001 года в нашей стране наблюдается тенденция к снижению заболеваемости острым гепатитом С (ОГС) [4]. После 2004 года выявление людей с хроническим гепатитом С (ХГС) стало снижаться. Однако до 2006 года наблюдалось увеличение числа больных ХГС среди детей. По данным специалистов, 1,4 — 2,4% граждан РФ заражены вирусом гепатита С (ВГС), при этом большинство этих людей уже имеют хроническую форму инфекции. ХГС характеризуется прогрессирующим течением, приводящим к циррозу печени (до 30%), первичной гепатоклеточной карциноме (до 15%) и экстракорпоральным проявлениям (до 74%) [9]. Вирус гепатита С — уникальный патоген, который может уйти от иммунного контроля, создавая новые генетические и антигенные варианты, задерживая образование Т-хелперного и Т-киллерного ответа при остром гепатите С и вызывать повторную инфекцию у выздоровевших людей. Интенсивное изучение инфекции HCV началось после идентификации её возбудителя в 1989 году и в первую очередь преследовало главную цель — создание профилактической вакцины [3, 5].
ВГС — вирусное заболевание, которое чаще всего возникает в виде посттрансфузионного гепатита с преобладанием безжелтушной и легких форм и склонно к хроническому протеканию процесса [7, 8]. Возбудитель — ВГС, содержит РНК. Геном HCV представлен одноцепочечной положительно заряженная РНК, которая кодирует 3 структурных (нуклеокапсидный белок core и нуклеопротеиды оболочки E1 — E2) и 5 неструктурных (NS1, NS2, NS3, NS4, NS5) белков. Антитела (АТ), обнаруженные в крови пациентов с ВГС, синтезируют к каждому из этих белков.
Отличительной особенностью ВГС является волнообразное течение заболевания, при котором выделяют три фазы: острую, латентную и фазу реактивации. Острая фаза характеризуется повышенной активностью печеночных ферментов в сыворотке крови, содержащей классы AT IgM и IgG (к нуклеокапсидному белку core) к HCV с ростом титров, а также РНК HCV. Латентная фаза характеризуется отсутствием клинических проявлений, наличием в крови АТ класса IgG (к нуклеокапсидному белку core и неструктурным белкам NS1 — NS5) к HCV в высоких титрах, отсутствии AT класса IgM и РНК HCV или их присутствии в низких концентрациях на фоне небольшого увеличения активности печеночных ферментов в периоды обострения. Фаза реактивации характеризуется появлением клинических признаков, повышенной активностью печеночных ферментов, наличием AT класса IgG (к нуклеотидному белку core и неструктурным белкам NS) в высоких титрах, наличием HCV РНК и ростом титров AT класса IgM до HCV в динамике [6, 9].
AT к HCV в сыворотке крови в норме отсутствует. Диагноз ВГС на основан выявлении суммарных АТ к HCV методом ИФА, которые появляются в первые 2 недели заболевания и указывают на возможное заражение вирусом или перенесенной инфекцией. Анти-HCV AT может сохраняться в крови реконвалесцентов в течение 8 — 10 лет с постепенным снижением их концентрации. Обнаружить АТ можно более года и более после заражения [1, 2]. При хронической ВГС АТ определяют постоянно и в более высоких титрах. Большинство тест-систем, используемых в настоящее время для диагностики ВГС, основаны на определении AT класса IgM, что позволяет верифицировать активную инфекцию. АТ класса IgM можно обнаружить не только при ОГС, но и при ХГС. Снижение их числа во время лечения пациентов ХГС может свидетельствовать об эффективной лекарственной терапии. В острой фазе инфекции отношение AT IgMIgG составляет от 3 до 4 (преобладание AT IgM указывает на высокую активность процесса). По мере выздоровления это соотношение уменьшается в 1,5-2 раз, что указывает на минимальную репликационную активность [9].
Выявление суммарных AT IgG к HCV методом ИФА недостаточно для диагностики ВГС, необходимо подтвердить их наличие методом иммуноблоттинга, чтобы исключить ложноположительный результат исследования. Пациента исследуют на наличие IgG класса AT к различным белкам HCV и IgM класса AT к HCV в динамике. Результаты серологического исследования вместе с клинико-эпидемиологическими данными позволяют установить диагноз и стадию заболевания, что играет важную роль для правильного выбора метода лечения. В основе ИФА лежит иммунная реакция взаимодействия антиген с антителом. Для обнаружения образовавшихся иммунных комплексов используют фермент, который предварительно метется узнающий компонент (антиген или антитело). Сам фермент визуализируют с использованием хромогенного медиатора, продуцирующего цвет. Превращение бесцветного хромогена в окрашенное вещество хромофор, который несет цвет, происходит под действием фермента, для которого хромоген является субстратом [2].
Цель исследования: сравнить результаты определения антител к вирусу гепатита С в сыворотке крови методом ИФА двух тест-систем.
Материалы и методы.
Для достижения поставленной цели было проведено скрининговое обследование 7814 человек на обнаружение анти-HCV АТ методом ИФА. Было обследовано 2266 мужчин, что составило 29% и 5548 женщин (71%), дети в возрасте до 15 лет составили ,4% (267 человек). Иммуноферментный анализ проводит в несколько этапов:
1) проведение иммунной реакции: получение иммунохимического комплекса в результате поэтапного или одномоментного добавления иммунных реагентов, один из которых содержит ферментную резку;
2) промывка твердой фазы, целью которой является удаление не связавшихся компонентов;
3) проведение ферментативной реакции, начинающейся после добавления раствора субстрата и хромогена с последующим внесением стоп-реагента для остановки реакции;
4) учет результатов анализа;
5) оценка результатов анализа.
Регистрация результатов иммуноферментного анализа заключается в оценке степени окрашивания основной части индикаторной полоски, измерении оптической плотности окрашенных растворов или интенсивности флуоресценции и хемилюминесценции. При исследовании, для выявления в сыворотках крови антител к ВГС (IgG и IgМ) применялись 2 тест — системы:
- «Бест-анти ВГС (комплект 1/стрип)»
- Monolisa “Anti — НСV PLUS Version 2
Для сравнительного анализа двух тест — систем было поставлено параллельно 57 тестов исследования уровня антител к ВГС методом ИФА наборами «Бест — анти ВГС» и Monolisa «Anti — НСV PLUS Version 2». Полученные результаты подверглись статистической обработке определения экстенсивных показателей с помощью программы Microsoft Excel 2010.
Результаты исследования и их обсуждения.
Тест — системы представляют собой набор реагентов, основой которых являются рекомбинантные антигены ВГС, соответствующие участкам белков, кодируемых структурной (соге) и неструктурной (NS) областью генома ВГС, иммобилизированные на поверхности лунок полистироловых планшетов. Основным свойством набора является способность выявлять в сыворотках крови человека антитела к ВГС (IgG b IgМ) за счет их взаимодействия с рекомбинантными антигенами, иммобилизированными на поверхности лунок планшета. Образование комплекса антиген — антитело вызывают с помощью иммуноферментного конъюгата.
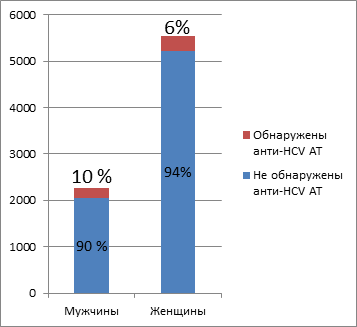
Полученные результаты обследования 7814 человек установили, что антитела к вирусу гепатиту С были обнаружены в 7 % случаев (537 человек). Из 537 человек анти — НСV АТ были обнаружены у 213 мужчин, что составило 40 % и у 324 женщин, что составляет 60%. При сопоставлении исследуемых по полу результаты исследований показали, что у обследованных женщин (6%) 1,5 раза реже, чем у мужчин (10%) обнаруживаются анти — НСV АТ (Рисунок 1).
Рисунок 1. Выявляемость положительных результатов при ВГС – скрининге в зависимости от пола
Положительная реакция на антитела подтверждалась тест-системой «Бест анти-ВГС» (набор реагентов для подтверждения наличия иммуноглобулинов классов G и М к вирусу гепатита С). Данный набор предполагает дифференцированное определение антител к структурным (соте) и неструктурным (NS 3-5) белкам вирусной частицы.
Одновременное присутствие соге и NS белков в крови наблюдалось у 76,5% мужчин и у 66 % женщин. В то же время антитела только к ядерным белкам были обнаружены у 15% женщин и у 8% мужчин. Только NS антитела выявлены у 12% женщин и 6% мужчин. Из 537 положительных исследований наличие антител к вирусу гепатита С было подтверждено у 495 пациентов. В 42 (22 женщины и 20 мужчин) случаях наблюдалась ложноположительная реакция, которая не была подтверждена в подтвердающем тесте.
В 57 образцах сыворотки крови определение антител было выполнено параллельно в двух тест-системах: «Бест — анти ВГС» и Monolisa “Anti — НСV PLUS Version 2. При проведении сравнительно скрининга двух систем были получены следующие результаты. В обоих тест-системах в 72 % случаях, в 41 из 57 образцов – реакция на антитела положительная. В подтверждающем тесте наличие антител подтверждено. В 16 тестах, что составило 28 %, было установлено несоответствие результатов исследования уровня антител к ВГС наборами «Бест — анти ВГС» и Monolisa “Anti — НСV PLUS Version 2.
При анализе несоответствующих результатов было установлено: в 14 тестах (87%) набор Monolisa “Anti — НСV PLUS Version 2 дал отрицательный результат, набор «Бест — анти ВГС» — положительный. В подтверждающей тест-системе в этих образцах сывороток крови присутствовал только нуклеокапсидный белок соге или только неструктурные белки NS3 — NS5; и только в одном образце были обнаружены оба вида антител.
В 2 образцах сыворотки набор Monolisa “Anti — НСV PLUS Version 2” дал положительный результат на антитела к ВГС, при отрицательном результате в подтверждающей тест-системе (нуклеокапсидный белок соге и неструктурные белки NS3 — NS5 не обнаружены).
Таблица № 1
|
№ пробы |
Monolisa «Anti — НСV PLUS Version 2» |
«Бест — анти ВГС» (подтверждающий тест) |
|
1 |
0,188 «-» |
«+» NS + |
|
2 |
0,178 «-» |
«+» NS + |
|
3 |
0,094 «-» |
«+» NS + |
|
4 |
0,164 «-» |
«+» NS + core + |
|
5 |
0,331 «-» |
«+» NS + |
|
6 |
0,291 «-» |
«+» NS + |
|
7 |
0,290 «-» |
«+» NS + |
|
8 |
0,265 «-» |
«+» NS + |
|
9 |
0,059 «-» |
«+» NS + core — |
|
10 |
0,050 «-» |
«+» NS + |
|
11 |
0,047 «-» |
«+» NS + |
|
12 |
0,398 «-» |
«+» NS + core — |
|
13 |
0,186 «-» |
«+» NS + core — |
|
14 |
0,281 «-» |
«+» NS + |
|
15 |
0,305 «+» |
«-» NS + core — |
|
16 |
0,277 «+» |
«-» NS + core — |
Заключение
Таким образом, было установлено, что АТ к вирусу гепатита С обнаружены в 7 % случаев (у 537 из 7 814 пациентов). Анти — НСV АТ были обнаружены у 213 мужчин, что составило 10% и у 324 женщин, что составляет 6%. В 495 случаях наличие антител было подтверждено при помощи специального набора реагентов для подтверждения наличия иммуноглобулинов классов IgG и IgМ к вирусу гепатита С. Ложноположительная реакция наблюдалась у 42 пациентов. Алгоритм диагностики гепатита С должен строго соблюдаться, в соответствии с СП 3.1.3112 — 13 «Профилактика вирусного гетита С» [10]. Наличие антител к вирусу гепатита С должно быть подтверждено с помощью специального подтверждающего диагностического набора. Параллельное исследование сывороток крови в двух диагностических тест-системах «Бест — анти ВГС (комплект 1/ стрип)» и Monolisa “Anti — НСV PLUS Version 2” показало, что в 28 % случаев, набор Monolisa “Anti — НСV PLUS Version 2” дал отрицательный результат, набор «Бест — анти ВГС» — положительный. В подтверждающей тест-системе в большинстве образцов крови присутствовал только нуклеокапсидный белок соге или только неструктурные белки NS3 — NS5 т. е. систематическое использование данной тест-системы для диагностики гепатита С может привести к снижению выявления антител к вирусу.
Библиографическая ссылка
Невзорова М.С., Высотин С.А., Сайфитова А.Т. СРАВНИТЕЛЬНАЯ ХАРАКТЕРИСТИКА ТЕСТ-СИСТЕМ «ВЕКТОР-БЕСТ» И «MONOLISA» ДЛЯ ОПРЕДЕЛЕНИЯ АНТИТЕЛ К ВИРУСУ ГЕПАТИТА С // Международный студенческий научный вестник. – 2020. – № 1.
;
URL: https://eduherald.ru/ru/article/view?id=19876 (дата обращения: 21.05.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)