ВВЕДЕНИЕ
Распространенность анкилозирующего спондилита (АС) зависит от частоты HLA-B27 [HLA — Human Leukocyte Antigens) — лейкоцитарных антигенов главного комплекса гистосовместимости человека в конкретной популяции, а последняя нарастает от экватора (0%) к приарктическим регионам (25-40%) Земли. Соответственно, распространенность болезни в экваториальных странах составляет практически 0%, а в приарктических популяциях Скандинавии, Чукотки, Аляски достигает 1,5-2%. Среди жителей средних широт и европеоидной расы распространенность АС колеблется от 0,1 до 0,2%. По последним эпидемиологическим данным, в России распространенность болезни составляет 0,1-0,2%. Эти цифры значительно отличаются от официальных статистических данных, согласно которым в России в 2009 г. было зарегистрировано 39,4 тыс. больных АС (0,034%) при ежегодном выявлении 4-6 тыс. новых случаев. Пик заболеваемости АС приходится на возрастной интервал 25-35 лет. Болезнь дебютирует в 10-20% случаев до 18-летнего возраста, а в возрасте старше 50 лет заболевают не более 5-7%. Мужчины в 3-6 раз чаще болеют, чем женщины. Однако в последние годы, с развитием учения о спондилоартритах, это соотношение все больше приближается к 2:1 и даже к 1:1 при ранних формах.
Исходы у больных АС обычно благоприятнее, чем при РА, хотя частота инвалидизации примерно одинаковая. У существенной части пациентов заболевание носит хронический характер и постепенно прогрессирует, приводя к выраженной функциональной недостаточности и инвалидизации вследствие поражения осевого скелета и не в последнюю очередь — тазобедренных суставов (коксит). Продолжительность жизни пациентов с АС практически не отличается от таковой в популяции в целом, за исключением тех, у кого имеется тяжелое течение болезни или развиваются осложнения со стороны внутренних органов — сердца, почек и др.
Лечение АС проводят на протяжении всей жизни пациента, основу его составляет сочетание нефармакологических и фармакологических методов терапии. Целью лечения является достижение стойкой клинической, лабораторной и МРТ-ремиссии или (альтернативная цель) как минимум стойко низкой активности болезни, что обеспечивает стабилизацию функциональных возможностей пациента, сохранение качества жизни и трудоспособности. Современная стратегия лечения АС строится по принципу «Лечение до достижения цели» (Treat to target) и подразумевает активное назначение НПВП с момента установления диагноза, объективный контроль за состоянием пациента, изменение схемы лечения при отсутствии достаточного ответа на терапию вплоть до достижения целей лечения, после чего проводят постоянное динамическое наблюдение.
ТЕРМИНЫ И ОПРЕДЕЛЕНИЯ
АС — хроническое воспалительное заболевание из группы спондилоартритов, характеризующееся обязательным поражением крестцово-подвздошных суставов (КПС) и/или позвоночника с потенциальным исходом их в анкилоз, с частым вовлечением в патологический процесс энтезисов и периферических суставов.
Аксиальный спондилоартрит — спондилоартрит с преимущественным поражением позвоночника и периферических суставов. Группа аксиальных спондилоартритов подразделяется на две клинические категории — нерентгенологический аксиальный спондилоартрит и АС. Диагноз устанавливается на основании классификационных критериев Международной группы по изучению спондилоартритов (2009) (ASAS — Assessment of SpondyloArthritis international Society) для аксиального спондилоартрита.
Нерентгенологический аксиальный спондилоартрит — аксиальный спондилоартрит, имеющий сходную клиническую картину с АС при отсутствии рентгенологических признаков достоверного сакроилеита.
Энтезит — воспалительный процесс в точке прикрепления сухожильных волокон.
Дактилит — воспалительный ограниченный процесс, который затрагивает отдельные пальцы кистей и стоп.
Теносиновит — воспалительный процесс, который поражает соединительнотканные оболочки, расположенные рядом с сухожилием.
Другие термины и определения представлены в главе 1.
Ингибиторы ФНО-α — искусственно синтезированные моноклональные антитела и гибридные белки, блокирующие активность провоспалительного цитокина ФНО.
КЛАССИФИКАЦИЯ ЗАБОЛЕВАНИЯ ИЛИ СОСТОЯНИЯ
Специальной классификации АС в настоящее время не существует, для использования в ежедневной клинической практике предлагается временная клиническая классификация.
-
Основной диагноз: АС (М45).
-
Клиническая стадия.
-
Ранняя (нерентгенологическая) стадия: отсутствуют достоверные рентгенологические изменения в КПС (сакроилеит двусторонний II стадии и выше или односторонний III стадии и выше, оцениваемый по методу Келлгрена) и в позвоночнике (синдесмофиты), но имеется достоверный сакроилеит по данным МРТ.
-
Развернутая стадия: на обзорной рентгенограмме костей таза определяется достоверный сакроилеит (сакроилеит двусторонний II стадии и выше или односторонний III стадии и выше, оцениваемый по методу Келлгрена), но отсутствуют четкие структурные изменения в позвоночнике в виде синдесмофитов.
-
Поздняя стадия: на обзорной рентгенограмме костей таза определяется достоверный сакроилеит (сакроилеит двусторонний II стадии и выше или односторонний III стадии и выше, оцениваемый по методу Келлгрена) и имеются четкие структурные изменения в позвоночнике (синдесмофиты).
-
-
Активность болезни определяется по индексу активности АС (AS-DAS — Ankylosing Spondylitis Disease Activity Score) и Батскому индексу активности АС (BASDAI — Bath Ankylosing Spondylitis Disease Activity Index) (табл. 2.1).
-
Внеаксиальные проявления:
-
артрит (отдельно отмечается коксит);
-
энтезит;
-
дактилит.
-
-
Внескелетные проявления:
-
увеит;
-
воспалительные заболевания кишечника (болезнь Крона, язвенный колит);
-
псориаз;
-
IgA-нефропатия;
-
нарушение проводимости сердца и аортит.
-
-
Дополнительная иммуногенетическая характеристика — HLA-B27:
-
HLA-B27-позитивный;
-
HLA-B27-негативный.
-
-
ФК:
-
I — полностью сохранены самообслуживание, непрофессиональная и профессиональная деятельность;
-
II — сохранены самообслуживание, профессиональная деятельность, ограничена непрофессиональная деятельность;
-
III — сохранено самообслуживание, ограничены непрофессиональная и профессиональная деятельность;
-
IV — ограничены самообслуживание, непрофессиональная и профессиональная деятельность.
-
-
Осложнения:
-
вторичный системный амилоидоз;
-
ОП (системный);
-
атеросклероз;
-
аортальный порок сердца;
-
нарушение ритма сердца;
-
перелом синдесмофита;
-
подвывих в атланто-аксиальном суставе, в том числе с миелопатией, нестабильностью шейного отдела позвоночника;
-
анкилоз височно-нижнечелюстных суставов;
-
контрактура периферических суставов;
-
нарушение функций тазобедренных суставов (межлодыжечное расстояние <70 см);
-
шейно-грудной кифоз (расстояние «затылок-стена» >5 см).
-
Таблица 2.1. Активность анкилозирующего спондилита
| Активность | ASDAS | BASDAI (по числовой рейтинговой шкале 0-10) |
|---|---|---|
|
Низкая |
<1,3 |
<2,0 |
|
Умеренная |
От ≥ 1,3 до <2,1 |
От ≥ 2,0 до <4,0 |
|
Высокая |
От ≥ 2,1 до <3,5 |
От ≥ 4,0 до <7,0 |
|
Очень высокая |
≥ 3,5 |
≥ 7,0 |
Комментарии к классификации анкилозирующего спондилита
К рубрике «Основной диагноз»
Диагноз АС устанавливается согласно модифицированным Нью-Йоркским критериям (1984) при наличии рентгенологического критерия и хотя бы одного клинического критерия.
-
Клинические критерии.
-
Боль в нижней части спины, уменьшающаяся после физических упражнений, но сохраняющаяся в покое (в течение >3 мес).
-
Ограничение движений в поясничном отделе позвоночника, как в сагиттальной, так и во фронтальной плоскостях.
-
Ограничение дыхательной экскурсии грудной клетки в сравнении с показателями у здоровых лиц.
-
-
Рентгенологический критерий.
-
Сакроилеит: двусторонний (стадия >II) или односторонний (стадия III-IV).
-
Развернутая характеристика сакроилеита [14].
-
0 стадия — рентгенологическая норма:
-
нормальная, равномерная ширина суставных щелей;
-
суставные поверхности четкие, ровные;
-
вдоль суставной щели с двух сторон определяется узкая полоска кортикальной кости, имеющая четкий и ровный контур;
-
субхондральный остеосклероз не выявляется.
-
-
I стадия — подозрительные изменения:
-
субхондральный остеосклероз слабовыраженный, чаще определяющийся в центральных отделах или на отдельных участках суставов, больше со стороны подвздошных костей;
-
суставная щель — обычно равномерная на всем протяжении;
-
суставные поверхности — отмечается нечеткость и/или неровность суставных поверхностей костей;
-
распространенность патологических изменений — изменения определяются на ограниченных, незначительных по протяженности участках суставов со стороны крестца и/или подвздошных костей, чаще в центральных и нижних отделах КПС.
-
-
II стадия — минимальные изменения:
-
субхондральный остеосклероз незначительный или умеренно выраженный распространенный остеосклероз, определяющийся с обеих сторон суставной щели;
-
суставная щель — отдельные участки с незначительным или умеренно выраженным расширением, чередующиеся с участками сужения;
-
суставные поверхности — различные по протяженности участки с неровностью и нечеткостью (размытостью) контуров на всем протяжении;
-
распространенность патологических изменений — изменения определяются в центральных и нижних отделах КПС на большом протяжении суставных поверхностей, как со стороны крестца, так и со стороны подвздошных костей.
-
-
III стадия — умеренные изменения:
-
субхондральный остеосклероз — типичным является выраженный распространенный остеосклероз, определяющийся с обеих сторон суставной щели, возможен вариант невыраженного остеосклероза, но с обязательным выраженным эрозивным процессом в суставах;
-
суставная щель — участки расширения, чередующиеся с участками сужения (значительное частичное или на всем протяжении расширение щели говорит о выраженных деструктивных изменениях в суставах), в отдельных случаях при резко выраженном субхондральном остеосклерозе щели суставов могут не определяться, но замыкательная пластина тазового кольца в нижней части сустава не сливается в единый костный блок;
-
суставные поверхности — выявляются множественные эрозии (проявлением которых служат неровные контуры на всем протяжении), часто неровность сочетается с нечеткостью (размытостью) контуров суставных поверхностей;
-
распространенность патологических изменений — локализуются в центральных, верхних и нижних отделах КПС на большом протяжении суставных поверхностей, как со стороны крестца, так и со стороны подвздошных костей;
-
иногда могут выявляться крупные кисты в субхондральном отделе КПС;
-
в процессе эволюции этой стадии сакроилеита на конечных этапах остеосклероз обычно регрессирует: уменьшаются распространенность и выраженность субхондрального остеосклероза (со стороны как крестца, так и подвздошных костей), могут появляться единичные или множественные, различные по выраженности костные мостики (частичный костный анкилоз суставов), а сохраненные суставные щели чаще сужены, реже расширены.
-
-
IV стадия — выраженные (терминальные) изменения:
-
субхондральный остеосклероз отсутствует (полностью регрессирует) и/или незначительно выражен на отдельных участках в проекции суставных щелей КПС;
-
суставная щель и суставные поверхности — полный костный анкилоз суставов; в верхней половине суставов могут определяться нечетко выраженные участки суставных поверхностей. В нижней половине суставы полностью анкилозированы.
-
К рубрике «Клиническая стадия»
Ранняя (нерентгенологическая) стадия может быть установлена на основании классификационных критериев ASAS (2009) для аксиального спондилоартрита при выявлении сакроилеита методом МРТ [активное воспаление (остеит) в области КПС, характерное для сакроилеита при спондилоартрите] и наличия одного клинического признака и более, характерного для спондилоартрита [воспалительная боль в спине, артрит, энтезит (пяточный), увеит, дактилит, псориаз, болезнь Крона/язвенный колит, хороший ответ на НПВП, семейный анамнез спондилоартрита, HLA-B27, повышенный уровень СРБ].
Развернутая и поздняя стадии соответствуют диагнозу АС, установленному по модифицированным Нью-Йоркским критериям (1984).
К рубрике «Активность болезни»
В качестве базового метода оценки активности рекомендуется применять индекс BASDAI (рис. 2.1).
Расчет индекса BASDAI:
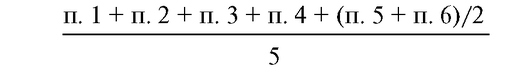
Допустимо использование других методов подсчета активности:
-
ASDAS СРБ — с использованием лабораторного маркера воспаления СРБ, определяемого количественным методом (мг/л);
-
ASDAS СОЭ — с использованием лабораторного маркера воспаления СОЭ, определяемой методом Вестергрена (мм/ч).
ASDAS СРБ является предпочтительным индексом, но ASDAS СОЭ может быть использован в том случае, если исследование СРБ недоступно.
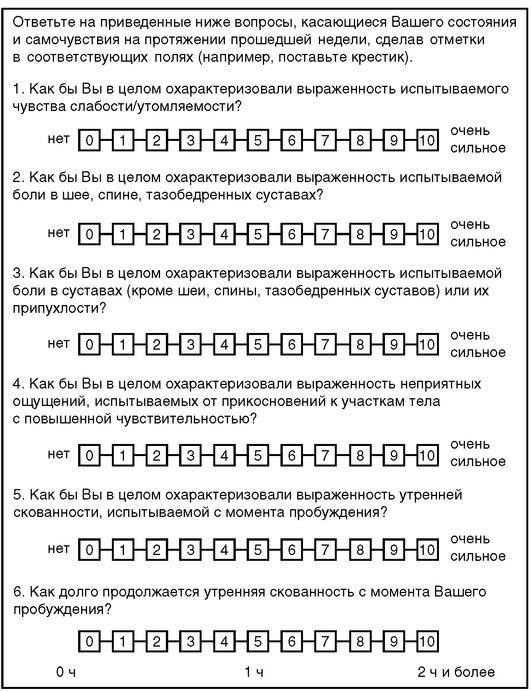
Рис. 2.1. Батский индекс активности анкилозирующего спондилита (BASDAI — Bath Ankylosing Spondylitis Disease Activity Index)
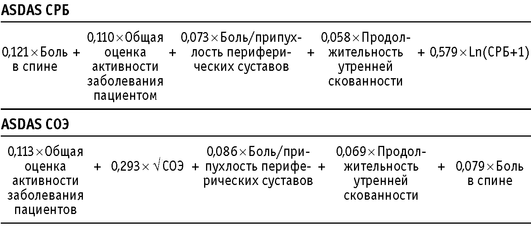
Оценка ответа на терапию:
-
клинически значимое улучшение — снижение ASDAS М,1;
-
значительное улучшение — снижение ASDAS >2,0.
К рубрике «Функциональный класс»
Описание характеристик для определения ФК.
-
Самообслуживание: одевание, принятие пищи, уход за собой и т.д.
-
Непрофессиональная деятельность: элементы отдыха, досуга, занятия спортом и так далее с учетом пола и возраста.
-
Профессиональная деятельность: работа, учеба, ведение домашнего хозяйства (для домработников) с учетом пола и возраста.
ДИАГНОСТИКА И ЛЕЧЕНИЕ
Примеры формулировок клинических диагнозов.
-
АС, ранняя стадия, очень высокая активность (BASDAI — 7,8; ASDAS СРБ — 3,7), с внеаксиальными (энтезиты пяток, артрит) и внескелетными (увеит) проявлениями, HLA-B27-позитивный, ФК II.
-
АС, развернутая стадия, активность высокая (BASDAI — 5,8; ASDAS СРБ — 2,5), с внеаксиальными проявлениями (двусторонний коксит), HLA-B27-позитивный, ФК II.
-
АС, поздняя стадия, активность умеренная (BASDAI — 3,8; ASDAS СРБ — 2,0), HLA-B27-позитивный, ФК II.
-
Шейно-грудной кифоз (расстояние «затылок-стена» — 10 см).
Диагноз/группа диагнозов в соответствии с МКБ-10.
-
М45. АС.
Виды, формы, условия оказания медицинской помощи
Виды оказания медицинской помощи — специализированная, в том числе высокотехнологичная, а также скорая.
Формы медицинской помощи — плановая, неотложная.
Условия оказания помощи — амбулаторно, в дневном стационаре, стационарно.
Графическое представление (схема процесса) ведения пациента с данным заболеванием или состоянием изображено на рис. 2.2.
image::pic_0010.jpg]
Рис. 2.2. Алгоритм ранней диагностики анкилозирующего спондилита на разных этапах оказания медицинской помощи
Критерии воспалительной боли в спине ASAS (2009) (хроническая боль в спине).
-
Возраст начала менее 40 лет.
-
Постепенное начало.
-
Улучшение после выполнения физических упражнений.
-
Отсутствие улучшения в покое.
-
Ночная боль (с улучшением при пробуждении).
Боль в спине считается воспалительной при наличии минимум четырех признаков из пяти.
Классификационные критерии ASAS для аксиального спондилоартрита (2009) представлены на рис. 2.3.
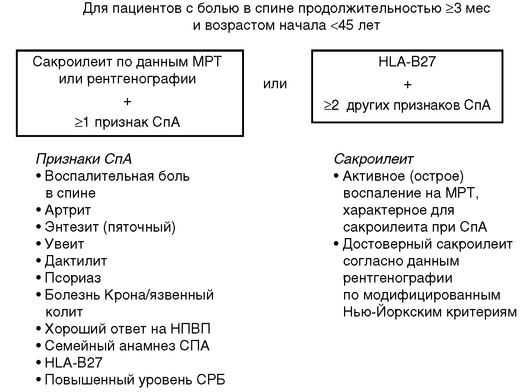
Рис. 2.3. Классификационные критерии аксиального спондилоартрита
Методы диагностики заболевания/состояния
Диагностика заболевания основана на анализе жалоб, анамнеза, общего осмотра и данных лабораторно-инструментальных методов исследования с учетом классификационных критериев АС.
-
Центральное место в клинической картине АС занимает поражение аксиального скелета (позвоночника, КПС и тазобедренных суставов).
-
Для АС характерно воспалительное поражение периферических суставов (артрит) и энтезисов (энтезит).
-
При АС нередко развивается поражение других (помимо опорно-двигательного аппарата) органов, в первую очередь глаз [увеиты (острый передний)], кожи (псориаз), кишечника (воспалительные заболевания кишечника), сердца (аортит, нарушение проводимости сердца) и почек.
-
Специфические лабораторные тесты для диагностики АС не разработаны.
-
Нет существенных половых различий в клинической картине или рентгенографических изменениях, хотя частота как самого заболевания, так и его тяжелых форм выше среди мужчин.
-
АС не оказывает отрицательного влияния на фертильность, течение беременности и родов.
В настоящее время диагноз АС считается ранним, если он установлен на нерентгенологической стадии заболевания, то есть если отсутствует достоверный сакроилеит на рентгенограммах (стадия II и более по Келлгрену) либо если он установлен в течение первых 2 лет от начала клинической картины (которую можно соотнести с дебютом болезни).
-
Дебютом заболевания называется срок, когда появился первый клинический признак, который можно соотнести с диагнозом АС или спондилоартрита. Наиболее часто им является воспалительная боль в спине.
-
Боль в спине у больных АС имеет хронический характер, то есть ее длительность составляет 3 мес и более. Однако в начале заболевания боль может быть кратковременной (<3 мес), рецидивирующей через различные интервалы времени, обычно не менее 6 мес от момента окончания предыдущего обострения.
-
-
Характерно постепенное (в течение нескольких недель или месяцев) нарастание интенсивности боли в спине, начало ее как бы исподволь, часто без четкого указания на момент появления и провоцирующие факторы.
-
Усиление интенсивности боли и скованности происходит после длительного периода обездвиживания (отдыха), а ее уменьшение — после физической активности или через 24-48 ч после приема суточной дозы НПВП.
-
Часто во время обострения больные просыпаются из-за боли во второй половине ночи или в ранние утренние часы и даже встают ночью, для того чтобы подвигаться и/или принять НПВП для облегчения боли.
-
При воспалительной боли в спине часто встречается утренняя скованность в спине и/или суставах.
-
Одним из ранних симптомов, характеризующих воспаление в области КПС, является перемежающаяся боль в ягодицах, возникающая попеременно то с одной, то с другой стороны, иногда становясь со временем стойкой и двусторонней.
-
У некоторых больных отмечается иррадиация боли по задней поверхности бедра, которая может имитировать радикулярную боль, но при этом неврологическое обследование не выявляет патологических изменений, а боль локализуется преимущественно выше колена.
-
Артрит в дебюте АС обычно носит моно- или олигоартикулярный характер. В большинстве случаев поражаются суставы нижних конечностей, чаще асимметрично. Помощь в дифференциальной диагностике может оказать выявление характерных симптомов патологии в спине, других внеаксиальных и внескелетных проявлений, отсутствие РФ в сыворотке крови, наличие HLA-B27 или семейного анамнеза.
-
-
Воспаление энтезисов (энтезит), то есть мест прикрепления к кости сухожилий, связок, суставных капсул, — одно из основных клинических проявлений АС. Наиболее часто поражаются энтезисы области пяток (места прикрепления ахиллова сухожилия, подошвенного апоневроза), костей таза (гребни, передние и задние ости подвздошных костей).
-
АС нередко начинается с таких внескелетных проявлений, как увеит, псориаз и воспалительные заболевания кишечника. Они должны быть диагностированы соответствующим специалистом. Появление на их фоне жалоб на боли в спине, вне зависимости от пола и возраста, требует обязательного исключения АС или других спондилоартритов.
Клиническое исследование
Анамнез
Данные анамнеза рекомендуется систематизировать следующим образом.
-
Характер боли в спине в прошлом и настоящем: следует установить тип боли (воспалительная или механическая), длительность болей (<3 мес или >3 мес), причину возникновения и провоцирующие факторы (травмы, инфекции и т.п.), иррадиацию болей (вероятность корешковых болей), наличие перемежающейся боли в ягодицах (большая вероятность наличия активного сакроилеита), распространение боли на отделы позвоночника, влияние боли на повседневную активность и трудоспособность, наличие ограничений функциональных возможностей.
-
Предшествующие обращения к врачам (каких специальностей), результаты проведенных ранее диагностических и лечебных мероприятий.
-
Наличие артрита, энтезита, дактилита и внескелетных проявлений.
-
Наследственный анамнез по РЗ, болям в спине, увеиту, псориазу, воспалительным заболеваниям кишечника.
-
Другие заболевания — наличие неврологической симптоматики, СД, онкологических, инфекционных заболеваний (в первую очередь, туберкулеза, бруцеллеза), болезней ЖКТ, сердечно-сосудистой (ССС) и мочеполовой систем (возможность применения НПВП и других лекарственных препаратов), других болезней опорно-двигательного аппарата (дисплазии, болезни Шейермана-Мау, синдрома гипермобильности, фибромиалгии и т.д.), которые могут оказать влияние на выбор дополнительных диагностических мероприятий и терапевтическую тактику.
Физикальное обследование
Физикальное обследование должно включать следующее.
-
Оценку внешнего вида больного (телосложение, дефицит массы тела, лихорадочный румянец, повышенная потливость, состояние кожного покрова, ногтей, конъюнктив, увеличение лимфатических узлов).
-
Оценку осанки и походки больного.
-
Осанка — усиление или выпрямление физиологических изгибов позвоночника: «поза просителя» или «поза гордеца», определение фиксированности грудного кифоза, наличие сколиоза и состояние паравертебральных мышц (повышение тонуса, гипотрофия, болезненность при пальпации).
-
Походка больного (наличие хромоты, утиной походки, использование палки или костылей), причина нарушения походки (боли в области КПС, тазобедренных или периферических суставов нижних конечностей, пяток; атрофия или слабость мышц нижних конечностей в связи с корешковым поражением; истинное или из-за сколиоза укорочение одной нижней конечности).
-
-
Функциональные тесты для определения ограничения движений в позвоночнике (для этого в настоящее время используют всего пять тестов).
-
Для выявления ограничения движений в поясничном отделе в сагиттальной плоскости используют модифицированный тест Шобера. Выполняют в положении пациента стоя прямо: по средней линии спины отмечают точку на воображаемой линии, соединяющей задневерхние ости подвздошных костей. Затем отмечают вторую точку на 10 см выше первой. После этого просят пациента нагнуться максимально вперед, не сгибая колен, и в этом положении с помощью сантиметровой ленты измеряют расстояние между двумя точками. В норме это расстояние больше 15 см. Измерение проводят дважды. Записывают результат наилучшей попытки.
-
Для оценки подвижности в поясничном отделе позвоночника во фронтальной плоскости используют измерение бокового сгибания в этом отделе. У пациента, стоящего у стены с прижатыми к ней пятками, ягодицами и лопатками, с помощью сантиметровой ленты сначала определяют расстояние между кончиком среднего пальца руки и полом, затем пациент выполняет наклон вбок, и снова измеряют это расстояние. Оценивают разницу между исходным расстоянием и расстоянием после наклона. В норме эта разница должна составлять не менее 10 см. Измерение проводят дважды для каждой из сторон. Записывают результат наилучшей попытки.
-
Для оценки степени выраженности шейного кифоза используется расстояние «козелок-стена» и «затылок-стена»: больного ставят спиной к стене и просят прижать к ней лопатки, ягодицы и пятки. Подбородок поддерживается на обычном уровне. Пациент пытается максимально приблизить затылок к стене, не запрокидывая при этом голову назад. С помощью сантиметровой ленты измеряют расстояние от затылка до стены и козелка до стены. Измерение проводят дважды для расстояния «затылок-стена» и для каждой из сторон при измерении расстояния «козелок-стена». Записывают результат наилучшей попытки.
-
Ротацию в шейном отделе позвоночника измеряют с помощью гониометра, и в норме угол поворота должен быть не менее 70°.
-
Максимальное расстояние между лодыжками (см) измеряется для определения патологии тазобедренных суставов. Для этого при положении больного лежа на спине просят его максимально раздвинуть ноги и измеряют расстояние между медиальными лодыжками. Нормой считается расстояние 100 см и выше. Измерение проводят дважды. Записывают результат наилучшей попытки.
-
-
Отдельно проводят оценку дыхательной экскурсии грудной клетки. Экскурсия грудной клетки определяется как разница между ее окружностью при глубоком вдохе и полном выдохе на уровне четвертого межреберья. В норме она должна быть не менее 5 см. Измерение проводят дважды. Записывают результат наилучшей попытки.
-
Осмотр, пальпация и определение объема движений в суставах позволяют выявить артрит, дактилит, деформацию и подвывихи суставов, гипермобильность суставов. При АС используется счет 44 суставов (правый и левый грудино-ключичные, ключично-акромиальные, плечевые, локтевые, лучезапястные, коленные, голеностопные, 10 ПЯФ, 10 проксимальных межфаланговых суставов кистей и 10 ПЛФ).
-
Отдельно проводят осмотр и пальпацию энтезисов (правый и левый грудино-ключичные, ключично-акромиальные, плечевые, локтевые, лучезапястные, коленные, голеностопные суставы, 10 ПЯФ, 10 проксимальных межфаланговых суставов кистей и 10 ПЛФ суставов).
-
Общетерапевтический осмотр для выявления патологии кожи, ЖКТ, легких, ССС.
Лабораторные исследования
Результаты лабораторных методов исследования используются:
-
для диагностики заболевания;
-
определения активности заболевания;
-
анализа эффективности терапии.
Специфические лабораторные тесты для диагностики АС не разработаны. Определение HLA-B27 имеет вспомогательную роль в диагностике АС, но не является специфическим тестом для этого заболевания.
При АС традиционные лабораторные показатели, отражающие активность системного воспаления (СОЭ и СРБ), более чем у 50% больных не соответствуют клинической активности заболевания.
Методы визуализации
-
Инструментальное исследование у пациентов с подозрением на АС следует начинать с проведения стандартной рентгенографии костей таза.
-
После установления диагноза рентгенографию костей таза следует проводить не чаще 1 раза в 2 года при отсутствии коксита.
-
При наличии клинических показаний (боли воспалительного ритма в нижней части спины и относительно небольшой давности заболевания — до 2-3 лет) и отсутствии достоверных признаков сакроилеита на рентгенограммах целесообразно проведение МРТ КПС с обязательным использованием Т1— и T2-FatSat-импульсных (или STIR-импульсных) последовательностей в полукоронарной плоскости с толщиной среза не более 4 мм.
-
КТ КПС целесообразно проводить в случае наличия сомнительных изменений по данным рентгенографии и отсутствия МРТ-признаков достоверного сакроилеита.
Рентгенография.
-
Рентгенография является основным методом инструментальной диагностики АС.
-
Рентгенография является основным методом выявления структурных изменений в КПС (сакроилеит) и позвоночнике [квадратизация позвонков, поражение Романуса (эрозии, остеосклероз или «сияющие углы»), синдесмофиты] и мониторинга прогрессирования.
КТ-диагностика.
-
КТ имеет вспомогательную роль в диагностике АС.
-
КТ позволяет преодолеть затруднения, встречающиеся при интерпретации данных обычной рентгенографии (ранние стадии, неполное закрытие зон роста у лиц моложе 21 года, болезнь Форестье и др.).
МРТ-диагностика.
-
МРТ может использоваться для диагностики АС у взрослых, оценки локальной активности болезни и определения эффективности лечебных мероприятий.
-
Для диагностики сакроилеита при АС основное значение имеет выявляемый при МРТ отек костного мозга в прилежащих к суставу костях — достоверный сакроилеит. Наличие только синовита КПС, капсулита или энтезита без субхондрального отека костного мозга/остеита согласуется с диагнозом активного сакроилеита, но не является достаточным для его постановки.
-
Достоверный сакроилеит при МРТ — не менее двух участков субхондрального отека костного мозга в области КПС или по одному участку, но на двух последовательных МРТ-срезах и более.
-
Отек костного мозга по МРТ — гиперинтенсивный сигнал на томограммах в STIR-режиме или T1 с подавлением сигнала от жировой ткани (fat-saturated) и контрастным усилением. Чем сильнее гиперинтенсивный сигнал, тем с большей вероятностью он отражает активное воспаление (интенсивность гиперинтенсивного сигнала аналогична таковому у кровеносных сосудов или ликвора). Отек костного мозга выглядит как гипоинтенсивный сигнал в T1-взвешенном режиме. Пораженные области костного мозга расположены периартикулярно.
-
Отек костного мозга является характерным для активного сакроилеита, но может обнаруживаться и при другой патологии КПС и костей таза (инфекционном сакроилеите, заболеваниях крови).
-
При отсутствии сакроилеита на рентгенографии МРТ является основным методом диагностики сакроилеита.
-
При МРТ можно выявить и другие признаки воспалительного поражения опорно-двигательного аппарата, такие как синовит и энтезит.
-
Синовит — гиперинтенсивный сигнал в Т1-взвешенном режиме с подавлением сигнала от жировой ткани и контрастным усилением в синовиальной части КПС (аналогичный сигналу от кровеносных сосудов). STIR-режим не позволяет отличить воспаление синовиальной оболочки от жидкости в полости сустава.
-
Энтезит — гиперинтенсивный сигнал в STIR-режиме или в T1-взвешенном изображении с подавлением сигнала от жировой ткани и контрастным усилением в местах прикрепления связок и сухожилий к кости, включая область за суставом (межкостные связки). Сигнал может распространяться на костный мозг и мягкие ткани.
-
УЗИ.
-
УЗИ обладает более высокой чувствительностью при выявлении энтезита по сравнению с клиническим исследованием;
-
УЗИ тазобедренных суставов — информативный метод выявления воспалительного поражения сустава. Наличие выпота в тазобедренном суставе диагностируется, если расстояние между поверхностью шейки бедренной кости и суставной капсулой превышает 7 мм. Важным моментом при исследовании контралатеральных суставов является наличие асимметрии шеечно-капсулярного пространства. Разница значений с двух сторон более чем 1,5 мм (даже если при этом шеечно-капсулярное пространство не превышает 7 мм) считается признаком патологии.
Оценка факторов риска неблагоприятных исходов, определяющих тактику ведения больных
Факторами неблагоприятного прогноза являются клинические признаки, которые утяжеляют течение болезни, ускоряют инвалидизацию или значительно сокращают продолжительность жизни пациента. Они оказывают существенное влияние на выбор терапевтической тактики.
Факторами неблагоприятного прогноза при АС являются:
-
начало болезни в детском возрасте;
-
коксит (воспаление тазобедренного сустава);
-
раннее формирование кифоза шейного отдела позвоночника;
-
стойкий периферический артрит нижних конечностей;
-
внескелетные проявления (рецидивирующий или хронический увеит, аортит, выраженные нарушения проводимости сердца);
-
стойкая высокая лабораторная активность (увеличение СОЭ, СРБ);
-
неэффективность или плохая переносимость НПВП.
Для прогноза функциональной недостаточности имеют значение быстрота развития клинико-рентгенологических изменений позвоночного столба и степень их выраженности в течение первых 10 лет болезни, характер проводимой терапии, ее переносимость и результаты.
Неблагоприятный вариант течения АС, если в течение первых 10 лет имеются:
-
ФК III-IV или вынужденная перемена профессии; и/или
-
стойкий болевой синдром со стороны позвоночника с ограничениями функции (уменьшение в целом функции позвоночника на 50%); и/или
-
стойкий или часто рецидивирующий периферический артрит; и/или
-
внескелетные проявления (увеит, поражение сердца); и/или
-
развитие осложнений (амилоидоз, переломы костей скелета и др.).
Модели пациента
-
Больной АС (код по МКБ-10 — М45), старше 18 лет, ранняя стадия заболевания, активность высокая или очень высокая с внеаксиальными и/или внескелетными проявлениями — специализированная, в том числе высокотехнологичная, медицинская помощь в условиях стационара с переходом на этап амбулаторной помощи и/или дневного стационара.
-
Больной АС, старше 18 лет, ранняя стадия заболевания, активность высокая — специализированная, в том числе высокотехнологичная, медицинская помощь в амбулаторных условиях и/или условиях дневного стационара.
-
Больной АС, старше 18 лет, развернутая или поздняя стадия заболевания, активность высокая или очень высокая с внеаксиальными и/или внескелетными проявлениями — специализированная, в том числе высокотехнологичная, медицинская помощь в условиях стационара с переходом на этап амбулаторной помощи и/или дневного стационара.
-
Больной АС, старше 18 лет, развернутая или поздняя стадия заболевания, активность умеренная или высокая/очень высокая с наличием осложнений — специализированная, в том числе высокотехнологичная, медицинская помощь в условиях стационара с переходом на этап амбулаторной помощи и/или дневного стационара, при необходимости — реабилитация с применением ортопедо-хирургической помощи.
Методы лечения заболевания
Основные методы ведения больных АС.
-
АС — потенциально тяжелое заболевание с разнообразными клиническими проявлениями, обычно требующее мультидисциплинарного терапевтического подхода, который должен координировать ревматолог.
-
Терапия должна быть оптимальной и основываться на взаимопонимании врача и больного.
-
Оптимальная терапия АС базируется на комбинации нефармакологических и фармакологических методов лечения.
Лечение больных АС должно быть индивидуальным согласно:
-
имеющимся на момент осмотра клиническим проявлениям болезни (поражение осевого скелета, периферических суставов, энтезисов и других органов и тканей);
-
выраженности этих симптомов и наличия факторов неблагоприятного прогноза;
-
общему клиническому статусу (пол, возраст, коморбидность, проводимая терапия, психосоциальные факторы).
Лечение всеми противоревматическими препаратами может сопровождаться развитием НЛР, которые могут ухудшать течение болезни и требуют быстрого их выявления и коррекции. Перед назначением противоревматических препаратов у всех пациентов с АС необходимо выявить потенциальные факторы риска НЛР (или осложнений) на фармакотерапию (глава 1).
Нефармакологические методы лечения анкилозирующего спондилита
Нефармакологические методы лечения АС следующие.
-
Среди нефармакологических методов лечения АС основное место занимают образование пациентов (школы больных) и регулярные физические упражнения — лечебная физкультура (ЛФК) (уровень доказательности А).
-
ЛФК больной должен заниматься постоянно, однако, если она проводится в группах под присмотром инструктора, ее эффективность несколько выше, чем в домашних условиях (уровень доказательности В).
-
Систематические занятия ЛФК улучшают течение и прогноз болезни (уровень доказательности A).
-
В настоящее время имеются данные о краткосрочной эффективности применения различных видов гидротерапии, мануальной терапии, чрескожной электронейростимуляции, акупунктуры, но все исследования характеризуются низким уровнем доказательности. Именно поэтому в реальной клинической практике они должны использоваться с учетом потенциальной пользы и возможных рисков для пациента (уровень доказательности D).
-
Основу обучения составляет представление основной информации о заболевании, принципах терапии. Необходимо обучение больных в школах АС технике самоконтроля (уровень доказательности A).
Медикаментозная терапия
Основными целями лекарственной терапии являются уменьшение (купирование) воспаления, улучшение самочувствия, увеличение функциональных возможностей и замедление (предотвращение) структурных повреждений.
К лекарственным средствам, которые активно используются и рекомендуются при АС, относятся:
-
НПВП;
-
анальгетики;
-
ГК;
-
стандартные БПВП;
-
ингибиторы ФНО-α.
Нестероидные противовоспалительные препараты
-
АС является единственным РЗ, при котором длительный прием НПВП патогенетически обоснован, высокоэффективен и не имеет альтернативы, кроме лечения ингибиторами ФНО-α (уровень доказательности B).
-
НПВП являются препаратами первой линии при наличии боли и скованности у пациентов с АС (уровень доказательности B).
-
НПВП должны быть назначены больному АС сразу после установления диагноза (табл. 2.2), независимо от стадии заболевания (уровень доказательности A).
-
Постоянный прием НПВП рекомендован пациентам с наличием факторов риска прогрессирования заболевания (BASDAI >4,0, повышение уровня СРБ в 3 раза и более, наличие синдесмофитов, воспалительных и поствоспалительных изменений позвонков по данным МРТ позвоночника), с высоким риском развития осложнений АС и/или наличием предикторов хорошего ответа на терапию (небольшая длительность заболевания — <10 лет от времени первого появления симптомов), значением индекса BASDAI <4,0, быстрым (в течение месяца — снижение уровня СРБ и СОЭ) разрешением воспалительных изменений позвоночника при МРТ без формирования поствоспалительных изменений. Длительное применение НПВП при АС предпочтительнее коротких курсов в связи с возможной способностью НПВП предотвращать структурные изменения. Уменьшение частоты приема НПВП или отмена препарата возможны после достижения клинической (согласно индексу ASDAS), лабораторной и МРТ-ремиссии [полное исчезновение острых воспалительных изменений в позвоночнике, КПС и тазобедренных суставах (при наличии коксита)] (уровень доказательности D).
Таблица 2.2. Эквивалентная доза нестероидных противовоспалительных препаратов, используемых при анкилозирующем спондилите (в пересчете на диклофенак)
| НПВП | Доза НПВП, мг, сопоставимая с 150 мг диклофенака |
|---|---|
|
Ацеклофенак |
200 |
|
Ибупрофен |
2400 |
|
Индометацин |
150 |
|
Кетопрофен |
200 |
|
Мелоксикам |
15 |
|
Напроксен |
1000 |
|
Нимесулид |
200 |
|
Пироксикам |
20 |
|
Теноксикам |
20 |
|
Целекоксиб |
400 |
|
Этодолак |
600 |
|
Эторикоксиб |
90 |
-
Отсутствие факторов риска прогрессирования заболевания и/или наличие полного анкилоза позвоночника являются показанием к назначению НПВП в режиме «по требованию» (уровень доказательности D).
-
Неэффективность или неполная эффективность первого НПВП является показанием к замене другим. Не рекомендуется одновременное использование двух НПВП и более (уровень доказательности D).
-
Перед назначением НПВП необходимо оценить риск возникновения или ухудшения течения существующей желудочно-кишечной, сердечно-сосудистой или почечной патологии и учесть риск нарушений в тромбоцитарном звене гемостаза (уровень доказательности B).
-
Пациентам с высоким риском желудочно-кишечных осложнений рекомендовано назначение неселективных НПВП в сочетании с ингибиторами протонной помпы (ИПП) или ЦОГ-2-селективных НПВП с ИПП без них. При низком риске развития НПВП-гастропатии возможно использование любых НПВП, с учетом длительности применения — желательно с ИПП (уровень доказательности B).
-
При длительном назначении НПВП необходимо регулярно мониторировать безопасность лечения: общий анализ крови, АЛТ и АСТ, Y-глутамилтранспептидаза, эзофагогастродуоденоскопия, контроль за АД, функции почек (общий анализ мочи, мочевина, креатинин с расчетом скорости клубочковой фильтрации), число тромбоцитов в крови, при необходимости — исследование коагулограммы (уровень доказательности B).
-
Перевод на стандартные БПВП или ГИБП не является основанием для отмены НПВП (уровень доказательности D).
-
Назначение НПВП пациентам с аксиальным спондилоартритом, соответствующим критериям ASAS, проводят по тем же принципам, что и пациентам с АС, соответствующим модифицированным Нью-Йоркским критериям (уровень доказательности D).
Анальгетики
Анальгетики, такие как парацетамол и трамадол, могут быть использованы в качестве дополнительного краткосрочного симптоматического лечения, особенно в тех случаях, когда терапия боли с помощью НПВП неэффективна, противопоказана и/или плохо переносится (уровень доказательности D).
Глюкокортикоиды
-
Системное применение ГК (в таблетках) как при аксиальной форме АС, так и при наличии периферического артрита (артритов) не рекомендуется. Исключение: сочетание АС с воспалительными заболеваниями кишечника (язвенным колитом, болезнью Крона) (уровень доказательности D).
-
При периферическом артрите, сакроилеите и энтезитах можно использовать локальное введение ГК (уровень доказательности D).
-
Местное лечение ГК эффективно при увеите (уровень доказательности B).
-
Применение высоких доз ГК (пульс-терапия) имеет краткосрочный эффект и может быть использовано в отдельных клинических ситуациях (уровень доказательности D).
Базисные противовоспалительные препараты
Для лечения АС только с поражением аксиального скелета не рекомендуется назначение синтетических БПВП, таких как СУЛЬФ, МТ или ЛЕФ (уровень доказательности C).
У пациентов с периферическим артритом рекомендуется лечение СУЛЬФ (в дозе до 3 г/сут). Эффективность терапии оценивается не ранее чем через 3 мес (уровень доказательности B).
Ингибиторы фактора некроза опухоли-α и другие генно-инженерные биологические препараты
-
Эффективность всех разрешенных к использованию при АС ингибиторов ФНО-α (ИНФ, АДА, ЭТЦ, ГЛМ, ЦЗП) в отношении основных клинических проявлений АС (боли, скованности, периферических артритов, энтезитов) практически одинакова (уровень доказательности А).
-
Терапия ингибиторами ФНО-α должна быть назначена больному при стойкой высокой активности АС, которая сохраняется несмотря на терапию НПВП при аксиальном варианте, и применении СУЛЬФ и локальной терапии ГК при периферическом артрите (уровень доказательности В).
-
При аксиальном варианте АС необязательно назначение синтетических БПВП перед терапией ингибиторами ФНО-α и одновременно с ней (уровень доказательности С).
-
При терапии ингибиторами ФНО-α следует учитывать наличие вне-позвоночных и внескелетных проявлений, вероятность развития НЛР и предпочтительный способ введения препарата. Так, при увеите более эффективны моноклональные антитела, чем этанерцепт. В то же время при невозможности применения моноклональных антител к ФНО-α у больных АС с увеитом целесообразно назначение ЭТЦ. При воспалительных заболеваниях кишечника назначение ЭТЦ противопоказано, тогда как при высоком риске активации туберкулезной инфекции их применение более предпочтительно, чем моноклональных антител к ФНО-α (уровень доказательности B).
-
При потере эффективности одного из ингибиторов ФНО-α (вторичная неэффективность) целесообразно назначение другого ингибитора ФНО-α (уровень доказательности B).
-
Эффективность терапии ингибиторами ФНО-α выше на ранней стадии болезни и при ее высокой активности, но и при развернутой и поздней стадии заболевания лечение ингибиторами ФНО-α часто дает хороший клинический эффект. Назначение ингибиторов ФНО-α пациентам с аксиальным спондилоартритом, соответствующим критериям ASAS, проводится по тем же принципам, что и пациентам с АС, соответствующим модифицированным Нью-Йоркским критериям (уровень доказательности А).
-
Имеются данные об улучшении функциональных возможностей у больных АС даже при полном анкилозе позвоночника по данным рентгенологического исследования (уровень доказательности В).
При отсутствии противопоказаний ингибиторы ФНО-α следует назначать больным с установленным диагнозом АС в следующих случаях.
-
При высокой активности болезни (BASDAI >4,0 или ASDAS >2,1) и при резистентности (или непереносимости) двух предшествующих НПВП, назначенных последовательно в полной терапевтической дозе с длительностью применения в целом не менее 4 нед; у больных с периферическим артритом при резистентности (или непереносимости) к терапии СУЛЬФ в дозе не менее 2 г в течение не менее чем 3 мес и внутрисуставных инъекций ГК (>2).
-
При наличии у пациента с достоверным диагнозом АС рецидивирующего (или резистентного к стандартной терапии) увеита, без учета активности болезни.
-
При наличии у пациента с достоверным диагнозом АС быстропрогрессирующего коксита, без учета активности болезни.
Рекомендации, касающиеся диагностики туберкулеза и ведения пациентов с латентной туберкулезной инфекцией, представлены в главе 22.
Коды по анатомо-терапевтическо-химической классификации и фармакотерапевтические группы
Коды по АТХ и фармакотерапевтические группы Государственного реестра лекарственных средств представлены в табл. 2.3.
Таблица 2.3. Коды по анатомо-терапевтическо-химической классификации и фармакотерапевтические группы синтетических и биологических базисных противовоспалительных препаратов
| МНН | Фармакотерапевтическая группа Государственного реестра лекарственных средств | Код по АТХ ВОЗ |
|---|---|---|
|
Диклофенак |
НПВП |
M01AB05 |
|
Ацеклофенак |
НПВП |
M01AB16 |
|
Индометацин |
НПВП |
S01BC01 |
|
Ибупрофен |
НПВП |
M01AE01 |
|
Кетопрофен |
НПВП |
M02AA10 |
|
Мелоксикам |
НПВП |
M01AC06 |
|
Напроксен |
НПВП |
M01AE02 |
|
Нимесулид |
НПВП |
M01AX17 |
|
Пироксикам |
НПВП |
M01AC01 |
|
Теноксикам |
НПВП |
M01AC02 |
|
Целекоксиб |
НПВП |
M01AH01 |
|
Этодолак |
НПВП |
M01AB08 |
|
Эторикоксиб |
НПВП |
M01AH05 |
|
МТ |
Противоопухолевое средство — антиметаболит |
L01BA01 |
|
СУЛЬФ |
Противомикробное и противовоспалительное кишечное средство |
A07EC01 |
|
ИНФ |
Иммунодепрессивное средство — антитела моноклональные |
L04AB02 |
|
АДА |
Иммунодепрессивное средство |
L04AB04 |
|
ЭТЦ |
Иммунодепрессивное средство |
L04AB01 |
|
ГЛМ |
Ингибиторы ФНО-α |
L04AB06 |
|
ЦЗТ |
Антитела моноклональные |
L04AB05 |
* В низких дозах, применяемых для лечения РА, не влияет на метаболизм клеток.
Реабилитационные мероприятия, меры по профилактике заболевания
Первичная профилактика АС не разработана. Следует рекомендовать пациентам избегать факторов, которые могут спровоцировать обострение болезни (интеркуррентные инфекции, стресс, травмы и др.), отказаться от курения (уровень доказательности С). Можно проводить медико-генетическое консультирование, чтобы определить риск возникновения АС у ребенка, который рожден от родителей, больных этим заболеванием.
Целесообразны скрининговые мероприятия в целях ранней диагностики АС среди лиц в возрасте менее 30 лет с хроническими болями в нижней части спины, у которых имеется риск развития данного заболевания (наличие АС или других заболеваний из группы спондилоартритов у родственников первой степени родства или др.).
Список литературы
-
Braun J., Sieper J. Ankylosing spondylitis // Lancet. 2007. Vol. 369. P. 1379-1390.
-
Brent L.H., Kalagate R. Ankylosing spondylitis and undifferentiated spondyloarthropathy, 2010. URL: http.://emedicine.medscape.com; eMedicine Specialties >Rheumatology Spondyloarthropathies.
-
Khan M A. AS: introductory comments on its diagnosis and treatment // Ann. Rheum. Dis. — 2002. — Vol. 61. — P. 1-2.
-
Бочкова А.Г. Левшакова А.Г. Почему диагноз анкилозирующего спондилита ставится поздно? // Неврология, нейропсихиатрия, психосоматика. 2009. № 3. С. 19-24.
-
Эрдес Ш.Ф., Дубинина Т.В., Лапшина С.А. и др. Современные принципы медикаментозной терапии анкилозирующего спондилита // Практическая медицина. 2015. Т. 2, № 4. С. 175-180.
-
Smolen J.S. et al. Treating spondyloarthritis, including ankylosing spondylitis and psoriatic arthritis, to target: recommendations of an international task force // Ann. Rheum. Dis. 2014. Vol. 73, N 1. P. 6-16.
-
Braun J., van den Berg R., Baraliakos X. et al. 2010 update of the ASAS/ EULAR recommendations for the management of ankylosing spondylitis // Ann. Rheum. Dis. 2011. Vol. 70, N 6. P. 896-904.
-
Miedany Y.E., Treat to target in spondyloarthritis: the time has come // Curr. Rheumatol. Rev. 2015. Vol. 10, N 2. P. 87-93.
-
Эрдес Ш.Ф., Бадокин В.В., Бочкова А.Г. и др. О терминологии спондилоартритов // Науч.-практ. ревматология. 2015. Т. 53, № 6. С. 657-660. doi: 10.14412/1995-4484-2015-657-660.
-
Rudwaleit M., van der Heijde D., Landewe R. et al. The development of Assessment of SpondyloArthritis international Society classification criteria for axial spondyloarthritis (Pt II): validation and final selection // Ann. Rheum. Dis. 2009. Vol. 68. P. 777-783. doi: 10.1136/ard.2009.108233.
-
Насонов Е.Л. Ревматология : клинические рекомендации. 2-е изд., испр. и доп. М. : ГЭОТАР-Медиа, 2010. 752 с.
-
Sieper J., Rudwaleit M., Baraliakos X. et al. The Assessment of Spondylo-Arthritis international Society (ASAS) handbook: a guide to assess spondyloarthri-tis // Ann. Rheum. Dis. 2009. Vol. 68, suppl. II. P. 1-44.
-
Van der Linden S., Valkenburg H.A., Cats A. Modified New York criteria 1984 (Evaluation of diagnostic criteria for ankylosing spondylitis: a proposal for modification of the New York criteria) // Arthritis Rheum. 1984. Vol. 27. P. 361368.
-
Смирнов А.В., Эрдес Ш.Ф. Оптимизация рентгенодиагностики анкилозирующего спондилита в клинической практике — значимость обзорного снимка таза // Науч.-практ. ревматология. 2015. Т. 53, № 2. С. 175-181.
-
Агабабова Э.Р. Анкилозирующий спондилит // Рос. мед. журн. 1999. 6. С. 38-41.
-
Khan M.A. Ankylosing Spondylitis: the Facts. Oxford : Oxford University Press, 2003. 193 p.
-
Дубинина Т.В., Эрдес Ш.Ф. Причины поздней диагностики анкилозирующего спондилита в клинической практике // Науч. практ. ревматология. 2010. № 2. С. 43-48.
-
Мясоутова Л.И., Лапшина С.А., Васильев А.Г., Салихов И.Г. Диагностика и клиническая характеристика анкилозирующего спондилита по данным городского ревматологического центра г. Казани // Науч. практ. ревматология. 2012. Т. 50, № 1. С. 38-41.
-
Braun A., Saracbasi E., Grifka J. et al. Identifying patients with axial spon-dyloarthritis in primary care: how useful are items indicative of inflammatory back pain? // Ann. Rheum. Dis. 2011. Vol. 70. P. 1782-1787.
-
Machado P., Landewe R., van der Heijde D. Endorsement of Definitions of Disease Activity States and Improvement Scores for the Ankylosing Spondyli-tis Disease Activity Score: Results from OMERACT 10. // J. Rheumatol. 2011. Vol. 38, N 7. P. 1502-1506.
-
Левшакова А., Бочкова А., Бунчук Н. Рентгеновская компьютерная томография в диагностике сакроилеита у больных ранними спондилоартритами // Вестн. рентгенол. 2009. № 1 (3). С. 27-30.
-
Rudwaleit M., Jurik A.G., Hermann K.G. et al. Defining Active Sacroiliitis on Magnetic Resonance Imaging (MRI) for Classification of Axial spondyloarthri-tis a Consensual Approach by the ASAS/OMERACT MRI Group // Ann. Rheum Dis. 2009. Vol. 68, N 10. P. 1520-1527.
-
Левшакова А.В., Бочкова А.Г., Бунчук Н.В. Магнитно-резонансная томография позвоночника в оценке эффективности терапии анкилозирующего спондилита // Лучевая диагностика и терапия. 2010. № 2. C. 61-63.
-
Бочкова А.Г., Левшакова А.В., Бунчук Н.В. Воспалительные изменения позвоночника у больных анкилозирующим спондилитом по данным магнитно-резонансной томографии // Науч.-практ. ревматология. 2008. 5. C. 17-25.
-
Aydin S.Z., Karadag O., Filippucci E. et al. Monitoring Achilles enthesitis in ankylosing spondylitis during TNF-(alpha) antagonist therapy: an ultrasound study // Rheumatology (Oxford). 2010. Vol. 49, N 3. P. 578-582.
-
Дубинина Т.В., Демина А.Б., Смирнов А.В., Эрдес Ш.Ф. Диагностика коксита при анкилозирующем спондилите // Науч.-практ. ревматология. 2015. Т. 53, № 6. С. 624-631. doi: 10.14412/1995-4484-2015-624-631.
-
Doran M.F., Brophy S., MacKay K. et al. Predictors of longterm outcome in ankylosing spondylitis // J. Rheumatol. 2003. Vol. 30. P. 316-320.
-
Baraliakos X., Braun J. Hip involvement in ankylosing spondylitis. What is the verdict? // Rheumatology. 2010. Vol. 49, N 1. P. 3-4.
-
Burgos-Vargas R. Juvenile onset spondyloarthropathies: therapeutic aspects // Ann. Rheum. Dis. 2002. Vol. 61. P. iii33-iii39.
-
Boonen A., Cruyssen B.V., de Vlam K. et al. Spinal radiographic changes in ankylosing spondylitis: association with clinical characteristics and functional outcome // J. Rheumatol. 2009. Vol. 36. P. 1249-1255.
-
Amor B., Santos R.S., Nahal R. et al. Predictive factors for the longterm outcome of spondyloarthropathies // J. Rheumatol. 1994. Vol. 21. P. 1883-1887.
-
Эрдес Ш.Ф., Бочкова А.Г., Дубинина Т.В. и др. Ранн диагностика анкилозирующего спондилита // Науч.-практ. ревматология. 2013. № 4. С. 365-367.
-
Schoels M.M., Braun J., Dougados M. et al. Treating axial and peripheral spondyloarthritis, including psoriatic arthritis, to target: results of a systematic literature search to support an international treat-to-target recommendation in spondyloarthritis // Ann. Rheum. Dis. 2014. Vol. 73, N 1. P. 238-242. doi: 10.1136/annrheumdis-2013-203860.
-
Smolen J.S., Braun J., Dougados M. et al. Treating spondyloarthritis, including ankylosing spondylitis and psoriatic arthritis, to target: recommendations of an international task force // Ann. Rheum. Dis. 2014. Vol. 73, N 1. P. 6-16. doi: 10.1136/annrheumdis-2013-203419.
-
Rohekar S., Chan J., Tse S.M. et al. 2014 Update of the Canadian Rheumatology Association/spondyloarthritis research consortium of Canada treatment recommendations for the management of spondyloarthritis. Part I: principles of the management of spondyloarthritis in Canada // J. Rheumatol. 2015. Vol. 42, N 4. P. 654-664.
-
Karapolat H., Eyigor S., Zoghi M. et al. Are swimming or aerobic exercise better than conventional exercise in ankylosing spondylitis patients? A randomized controlled study // Eur. J. Phys. Rehabil. Med. 2009. Vol. 45. P. 449-457.
-
Dagfinrud H., Kvien T.K., Hagen K.B. Physiotherapy interventions for ankylosing spondylitis // Cochrane Database Syst. Rev. 2008. Vol. 1. CD002822.
-
Sieper J., Braun J., Rudwaleit M. et al. Ankylosing spondylitis: an overview // Ann. Rheum. Dis. 2002. Vol. 61, suppl. III. P. 8-18. doi: 10.1136/ard.61. suppl_3.iii8.
-
Helliwell P.S., Abbot C.A., Chamberlain M.A. A randomised trial of three different physiotherapy regimes in ankylosing spondylitis // Physiotherapy. 1996. Vol. 82. P. 85-90.
-
Kraag G., Stokes B., Groh J. et al. The effects of comprehensive home physiotherapy and supervision on patients with AS — an 8-months follow up // J. Rheumatol. 1994. Vol. 21. P. 261-263.
-
Lubrano E., D’Angelo S., Parsons W.J. et al. Effectiveness of rehabilitation in active ankylosing spondylitis assessed by the ASAS response criteria // Rheumatology (Oxford). 2007. Vol. 46, N 11. P. 1672-1675.
-
Каратеев А.Е., Эрдес Ш.Ф. Применение нестероидных противовоспалительных препаратов при анкилозирующем спондилите: долго и упорно! // Тер. арх. 2014. Т. 52, № 5. С. 513-519.
-
Escalas C., Trijau S., Dougados M. Evaluation of the treatment effect of NSAIDs/TNF blockers according to different domains in ankylosing spondylitis: results of a metaanalysis // Rheumatology (Oxford). 2010. Vol. 49. P. 1317-1325.
-
Wanders A., Heijde D., Landewe R. et al. Nonsteroidal antiinflammatory drugs reduce radiographic progression in patients with ankylosing spondylitis: a randomized clinical trial // Arthritis Rheum. 2005. Vol. 52. P. 1756-1765.
-
Van der Heijde D., Baraf H.S., Ramos-Remus C. et al. Evaluation of the efficacy of etoricoxib in ankylosing spondylitis: results of a fifty-two-week, randomized, controlled study // Arthritis Rheum. 2005. Vol. 52. P. 1205-1215.
-
Sieper J., Klopsch T., Richter M. et al. Comparison of two different dosages of celecoxib with diclofenac for the treatment of active ankylosing spondylitis: results of a 12-week randomised, double-blind, controlled study // Ann. Rheum. Dis. 2008. Vol. 67. P. 323-329.
-
Эрдес Ш.Ф. Основные принципы терапии анкилозирующего спондилита (болезни Бехтерева) // Науч.-практ. ревматология. 2013. Т. 51, № 6. С. 686-695.
-
Braun J., Pham T., Sieper J. et al. ASAS Working Group. International ASAS consensus statement for the use of antitumournecrosis factor agents in patients with ankylosing spondylitis // Ann. Rheum. Dis. 2003 Sep. Vol. 62, N 9. P. 817-824. Review.
-
Dagfinrud H., Kvien T.K., Hagen K.B. Physiotherapy interventions for ankylosing spondylitis // Cochrane Database Syst. Rev. 2008 Jan 23. Vol. 1. CD002822.
-
Gaydukova I.Z., Rebrov A.P. Efficiency and safety of different etoricoxib regimens in patients with axial spondyloarthritis, including ankylosing spondyli-tis // Ter. Arkh. 2015. Vol. 87, N 3. P. 77-82.
-
Gaidukova I.E. et al. Etoricoxib in the treatment of active sacroiliitis in patients with axial spondyloarthritis, including ankylosing spondylitis // Ter. Arkh. 2014. Vol. 86, N 12. P. 42-47.
-
Akkos N., van der Linden S., Khan M.A. Ankylosing spondylitis and symptom-modifying vs disease-modifying therapy // Best Pract. Res. Clin. Rheumatol. 2006. Vol. 20, N 3. P. 539-557.
-
Furst D.E., Keystone E.C., Braun J. et al. Updated consensus statement on biological agents for the treatment of rheumatic diseases, 2011 // Ann. Rheum. Dis. 2012 Apr. Vol. 71, suppl. 2. P. i2-i45.
-
Dongxue W., Li M., Donghai Wu. Efficacy of etanercept in ankylosing spondylitis hip lesions. Letters to the Editor // Jt Bone Spine. 2011. Vol. 78. P. 528-537. doi: 10.1016/j.jbspin.2011.03.023.
-
Эрдес Ш.Ф. Применение голимумаба при анкилозирующем спондилите // Науч.-практ. ревматология. 2012. № 52, прил. 3. С. 11-16.
-
Эрдес Ш.Ф. Этанерцепт в терапии анкилозирующего спондилита // Науч.-практ. ревматология. 2012. № 53, прил. 4. С. 28-34.
-
Haroon N., Inman R.D., Learch T.J. et al. The Impact of TNF-inhibitors on radiographic progression in Ankylosing Spondylitis // Arthritis Rheum. doi: 10.1002/art.38070. (Accessed Jun 20, 2013).
-
Van den Bosch F., Kruithof E., Baeten D. et al. Effects of a loading dose regimen of three infusions of chimeric monoclonal antibody to tumour necrosis factor a (infliximab) in spondyloarthropathy: an open pilot study // Ann. Rheum. Dis. 2000 Jun. Vol. 59, N 6. P. 428-433.
-
Brandt J., Haibel H., Sieper J. et al. Treatment of patients with severe ankylosing spondylitis with infliximab — a one year follow up // Arthritis Rheum. 2001 Dec. Vol. 44, N 12. P. 2936-2937.
-
Kruithof E., Van den Bosch F., Baeten D. et al. Repeated infusions of infliximab, a chimeric anti-TNF-a monoclonal antibody, in patients with active spon-dyloarthropathy: one year follow up // Ann. Rheum. Dis. 2002 Mar. Vol. 61, N 3. P. 207-212.
-
Marzo-Ortega H., McGonagle D., O’Connor P., Emery P. Efficacy of etan-ercept in the treatment of the entheseal pathology in resistant spondylarthropathy: a clinical and magnetic resonance imaging study // Arthritis Rheum. 2001 Sep. Vol. 44, N 9. P. 2112-2117.
-
Inman R.D., Davis J.C.Jr., Heijde D.V. et al. Efficacy and safety of goli-mumab in patients with ankylosing spondylitis: results of a randomized, double-blind, placebo-controlled, phase III trial // Arthritis Rheum. 2008 Nov. Vol. 58, N 11. P. 3402-3412. doi: 10.1002/art.23969.
-
Spadaro A., Scarno A., Carboni A. et al. Rapid effectiveness of certolizum-abpegol in non-radiographic axial spondyloarthritis // Reumatismo. 2013 Jul 24. Vol. 65, N 3. P. 134-137. doi: 10.4081/reumatismo.2013.134.
-
Braun J., Pham T., Sieper J. et al. International ASAS consensus statement for the use of anti-tumour necrosis factor agents in patients with ankylosing spondylitis // Ann. Rheum. Dis. 2003 Sep. Vol. 62, N 9. P. 817-824. Review.
-
Hei de van der D., Sieper J., Maksymowych W.P. et al. For the Assessment of SpondyloArthritis international Society. 2010 Update of the international ASAS recommendations for the use of anti-TNF agents in patients with axial spondyloarthritis // Ann. Rheum. Dis. 2011. Vol. 70, N 6. P. 905-908. doi: 10.1136/ard.2011.151563.
-
Maxwell L.J., Zochling J., Boonen A. et al. TNF-alpha inhibitors for ankylosing spondylitis // Cochrane Database Syst. Rev. 2015 Apr 18. Vol. 4. CD005468. doi: 10.1002/14651858.CD005468.pub2.
-
Rudwaleit M., Van den Bosch F., Kron M. et al. Effectiveness and safety of adalimumab in patients with ankylosing spondylitis or psoriatic arthritis and history of anti-tumor necrosis factor therapy // Arthritis Res. Ther. 2010. Vol. 12. P. R117.
-
Dougados M., Combe B., Braun J. et al. A randomised, multicentre, double-blind, placebo-controlled trial of etanercept in adults with refractory heel en-thesitis in spondyloarthritis: the HEEL trial // Ann. Rheum. Dis. 2010. Vol. 69. P. 1430-1435.
-
Braun J., Baraliakos X., Hermann K.-G.A. et al. The effect of two golim-umab doses on radiographic progression in ankylosing spondylitis: results through 4 years of the GO-RAISE trial // Ann. Rheum. Dis. 2014. Vol. 73. P. 1107-1113. doi: 10.1136/annrheumdis-2012-203075.
-
Song I.H., WeiB A., Hermann K.G. et al. Similar response rates in patients with ankylosing spondylitis and non-radiographic axial spondyloarthritis after 1 year of treatment with etanercept: results from the ESTHER trial // Ann. Rheum. Dis. 2013 Jun. Vol. 72, N 6. P. 823-825.
-
Song I.H., Hermann K., Haibel H. et al. Effects of etanercept versus sulfasalazine in early axial spondyloarthritis on active inflammatory lesions as detected by whole-body MRI (ESTHER): a 48-week randomised controlled trial // Ann. Rheum. Dis. 2011 Apr. Vol. 70, N 4. P. 590-659.
-
Sieper J., Lenaerts J., Wollenhaupt J. et al. Efficacy and safety of infliximab plus naproxen versus naproxen alone in patients with early, active axial spondy-loarthritis: results from the double-blind, placebo-controlled INFAST study. Pt 1 // Ann. Rheum. Dis. 2014. Vol. 73, N 1. P. 101-107. doi: 10.1136/annrheumdis-2012-203201.
-
Бочкова А.Г., Румянцева О.А., Дубинина Т.В. и др. Первый опыт применения адалимумаба у больных анкилозирующим спондилитом: клиническое и МРТ-сопоставление результатов терапии // Науч.-практ. ревматология. 2010. № 1. С. 67-74.
-
Vastesaeger N., van der Heijde D., Inman R.D. et al. Predicting the outcome of ankylosing spondylitis therapy // Ann. Rheum. Dis. 2011. Vol. 70, N 6. P. 973-981. doi: 10.1136/ard.2010.147744.
-
Poddubnyy D.Axial spondyloarthritis: is there a treatment of choice? //Ther. Adv. Musculoskelet. Dis. 2013 Feb. Vol. 5, N 1. P. 45-54.
-
Bennett N., McGonagle D., O’Connor P. et al. Severity of Baseline Magnetic Resonance Imaging-Evident Sacroiliitis and HLA-B27 Status in Early Inflammatory Back Pain Predict Radiographically Evident Ankylosing Spondylitis at Eight Years // Arthritis Rheum. 2008 Nov. Vol. 58, N 11. P. 3413-3418.
-
Poddubnyy D., Rudwaleit M. Rates and predictors of radiographic sacroili-itis progression over 2 years in patients with axial spondyloarthritis // Ann. Rheum. Dis. 2011 Aug. Vol. 70, N 8. P. 1369-1374.
-
Poddubnyy D., Sieper J. Radiographic progression in ankylosing spondyli-tis/axial spondyloarthritis: how fast and how clinically meaningful? // Curr. Opin. Rheumatol. 2012 Jul. Vol. 24, N 4. P. 363-369.
-
Arends S., van der Veer E., Kamps F.B. et al. Patient-tailored dose reduction of TNF-a blocking agents in ankylosing spondylitis patients with stable low disease activity in daily clinical practice // Clin. Exp. Rheumatol. 2015 Mar-Apr. Vol. 33, N 2. P. 174-180.
-
Olivieri I.D., Angelo S., Padula A. et al. Can we reduce the dosage of biologics in spondyloarthritis? // Autoimmun. Rev. 2013 May. Vol. 12, N 7. P. 691-3. doi: 10.1016/j.autrev.2012.08.013.
-
Song I.H., Haibel H., Poddubnyy D. et al. Withdrawal of biologic therapy in axial spondyloarthritis: the experience in early disease // Clin. Exp. Rheumatol. 2013 Jul-Aug. Vol. 31, N 4. Suppl. 78. P. S37-S42.
-
Spadaro A., Punzi L., Marchesoni A. et al. Switching from infliximab or etanercept to adalimumab in resistant or intolerant patients with spondyloarthritis: a 4-year study // Rheumatology (Oxford). 2010 Jun. Vol. 49, N 6. P. 1107-1111.
-
Румянцева О.А., Бочкова А.Г., Кузикянц К.Х. и др. Опыт длительной терапии инфликсимабом у больных анкилозирующим спондилитом // Науч.-практ. ревматология. 2010. № 6. С. 16-22.
-
Braun J., Sieper J. Remission and possible discontinuation of biological therapy in axial spondyloarthritis // Clin. Exp. Rheumatol. 2013. Vol. 31, suppl. 78. P. S33-S36.
-
Song I.H., Althoff C.E., Haibel H. et al. Frequency and duration of drug-free remission after 1 year of treatment with etanercept versus sulfasalazine in early axial spondyloarthritis: 2 year data of the ESTHER trial // Ann. Rheum. Dis. 2012 Jul. Vol. 71, N 7. P. 1212-1215.
-
Wu D., Guo Y.Y., Xu N.N. et al. Efficacy of anti-tumor necrosis factor therapy for extra-articular manifestations in patients with ankylosing spondylitis: a metaanalysis // BMC Musculoskelet. Disord. 2015 Feb 10. Vol. 16. P. 19. doi: 10.1186/s12891-015-0489-2.
-
Эрдес ШФ. Эффективность адалимумаба при увеитах у больных анкилозирующим спондилитом // Соврем. ревматология. 2012. № 1. С. 65-68.
-
Emi Aikawa N., de Carvalho J.F., Artur Almeida Silva C., Bonfa E. Immu-nogenicity of Anti-TNF-alpha agents in autoimmune diseases // Clin. Rev. Allergy Immunol. 2010 Apr. Vol. 38, N 2-3. P. 82-89. doi: 10.1007/s12016-009-8140-3.
-
Arends S., Lebbink H.R., Spoorenberg A. et al. The formation of autoantibodies and antibodies to TNF-а blocking agents in relation to clinical response in patients with ankylosing spondylitis // Clin. Exp. Rheumatol. 2010 Sep-Oct. Vol. 28, N 5. P. 661-668.
-
Plasencia C., Pascual-Salcedo D., Nuno L. et al. Influence of immunoge-nicity on the efficacy of longterm treatment of spondyloarthritis with infliximab // Ann. Rheum. Dis. 2012 Dec. Vol. 71, N 12. P. 1955-1960. doi: 10.1136/annrheumdis-2011-200828.
-
Murdaca G., Spano F., Contatore M. et al. Immunogenicity of infliximab and adalimumab: what is its role in hypersensitivity and modulation of therapeutic efficacy and safety? // Expert Opin. Drug Saf. 2016 Jan. Vol. 15, N 1. P. 43-52. doi: 10.1517/14740338.2016.1112375.

Ревматология
В номере РМЖ. Ревматология № 7, 2020 представлены практические рекомендации по ведению пациентов с остеоартритом суставов кистей. Освещены вопросы диагностики и лечения: ультразвуковая диагностика в ревматологии; тактика ведения остеоартрита; роль неомыляемых соединений авокадо/сои в лечении отсеоартрита. Опубликованы клинические наблюдения: волчаночноподобные маски крупноклеточной лимфомы кожи; болезнь Стилла взрослых. Освещены смежные проблемы ревматологии: возраст-ассоциированные заболевания и остеоартрит; сердечно-сосудистая безопасность фебуксостата; кроворазжижающие эффекты хондроитина сульфата.
Данный информационный сайт предназначен исключительно для медицинских, фармацевтических и иных работников системы здравоохранения.
Вся информация сайта www.rmj.ru (далее — Информация) может быть доступна исключительно для специалистов системы здравоохранения. В связи с этим для доступа к такой Информации от Вас требуется подтверждение Вашего статуса и факта наличия у Вас профессионального медицинского образования, а также того, что Вы являетесь действующим медицинским, фармацевтическим работником или иным соответствующим профессионалом, обладающим соответствующими знаниями и навыками в области медицины, фармацевтики, диагностики и здравоохранения РФ. Информация, содержащаяся на настоящем сайте, предназначена исключительно для ознакомления, носит научно-информационный характер и не должна расцениваться в качестве Информации рекламного характера для широкого круга лиц.
Информация не должна быть использована для замены непосредственной консультации с врачом и для принятия решения о применении продукции самостоятельно.
На основании вышесказанного, пожалуйста, подтвердите, что Вы являетесь действующим медицинским или фармацевтическим работником, либо иным работником системы здравоохранения.
Читать дальше
Войти
Полноэкранный режим
Для цитирования:
Каратеев А.Е., Насонов Е.Л., Ивашкин В.Т., Мартынов А.И., Яхно Н.Н., Арутюнов Г.П., Алексеева Л.И., Абузарова Г.Р., Евсеев М.А., Кукушкин М.Л., Копенкин С.С., Лила А.М., Лапина Т.Л., Новикова Д.С., Попкова Т.В., Ребров А.П., Скоробогатых К.В., Чичасова Н.В. РАЦИОНАЛЬНОЕ ИСПОЛЬЗОВАНИЕ НЕСТЕРОИДНЫХ ПРОТИВОВОСПАЛИТЕЛЬНЫХ ПРЕПАРАТОВ. КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ. Научно-практическая ревматология. 2018;56:1-29. https://doi.org/10.14412/1995-4484-2018-1-29
For citation:
Karateev A.E., Nasonov E.L., Ivashkin V.T., Martynov A.I., Yakhno N.N., Arutyunov G.P., Alekseeva L.I., Abuzarova G.R., Evseev M.A., Kukushkin M.L., Kopenkin S.S., Lila A.M., Lapina T.L., Novikova D.S., Popkova T.V., Rebrov A.P., Skorobogatykh K.V., Chichasova N.V. RATIONAL USE OF NONSTEROIDAL ANTI-INFLAMMATORY DRUGS. CLINICAL GUIDELINES. Rheumatology Science and Practice. 2018;56:1-29.
(In Russ.)
https://doi.org/10.14412/1995-4484-2018-1-29
Просмотров: 10144
Ревматоидный артрит
Версия: Клинические рекомендации РФ 2021 (Россия)
Категории МКБ:
Другие ревматоидные артриты (M06), Серопозитивный ревматоидный артрит (M05)
Разделы медицины:
Ревматология
Общая информация
Краткое описание
Профессиональные ассоциации:
- Ассоциация ревматологов России
- ОООИ «Российская ревматологическая ассоциация «Надежда»»
Клинические рекомендации
Ревматоидный артрит
МКБ 10: М05, М06
МКБ 11: FА20
Возрастная категория: взрослые
ID: КР250
1. Краткая информация по заболеванию или состоянию (группе заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Ревматоидный артрит (РА) — иммуновоспалительное (аутоиммунное) ревматическое заболевание, характеризующееся прогрессирующей деструкцией суставов и поражением внутренних органов, развитие которого определяется сложным взаимодействие факторов внешней среды и генетической предрасположенности, ведущих к глобальным нарушениям в системе гуморального и клеточного иммунитета [1, 2]. Гетерогенность патогенетических механизмов РА находит свое отражение в существовании широкого спектра фенотипов и эндотипов заболевания, что позволяет рассматривать его не как «одну болезнь», а как клинико-иммунологический синдром [3, 4].
При отсутствии эффективной терапии продолжительность жизни у больных РА ниже на 3 года у женщин и на 7 лет у мужчин, в первую очередь за счет высокого риска развития коморбидных заболеваний — кардиоваскулярной патологии, остеопороза, тяжелых инфекций, интерстициального заболевания легких, онкологических заболеваний [5]. У многих пациентов с РА жизненный прогноз столь же неблагоприятен, как и при лимфогранулематозе, сахарном диабете 2-го типа, трехсосудистом поражении коронарных артерий и инсульте. РА вызывает стойкую потерю нетрудоспособности у половины пациентов в течение первых 3-5 лет от начала болезни, а через 20 лет треть пациентов становятся полными инвалидами.
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
Серопозитивный ревматоидный артрит (М05)
М05.0 Синдром Фелти
М05.1 — Ревматоидная болезнь легкого (199.0)
М05.2 — Ревматоидный васкулит
М05.3 — Ревматоидный артрит с вовлечением др. органов и систем
М05.8 — Другие серопозитивные ревматоидные артриты
М05.9 — Серопозитивный ревматоидный артрит неуточненный
Другие ревматоидные артриты (М06)
М06.0 — Серонегативный ревматоидный артрит
М06.1 — Болезнь Стилла, развившаяся у взрослых
М06.2 — Ревматоидный бурсит
М06.3 — Ревматоидный узелок
М06.4 — Воспалительная полиартропатия
М06.8 — Другие уточненные ревматоидные артриты
М06.9 — Ревматоидный артрит неуточненный
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Клиническая классификация ревматоидного артрита [10].
- Ревматоидный артрит серопозитивный
- Ревматоидный артрит серонегативный
-
Особые клинические формы ревматоидного артрита:
- Синдром Фелти
- Болезнь Стилла взрослых
- Ревматоидный артрит вероятный
Серопозитивность и серонегативность РА определяется в зависимости от обнаружения РФ и/или АТ (Б, для определения которых необходимо использовать стандартизованные лабораторные методы.
- Очень ранняя стадия: длительность болезни <6 месяцев
- Ранняя стадия: длительность болезни 6 мес. — 1 год
- Развернутая стадия: длительность болезни >1 года при наличии типичной симптоматики РА
- Поздняя стадия: длительность болезни 2 года и более + выраженная деструкции мелких (III-IV рентгенологическая стадия) и крупных суставов, наличие осложнений
- 0 = ремиссия (disease activity score — DAS28 < 2,6)
- 1= низкая (2,6 ≤ DAS28 ≤ 3,2)
- 2 = умеренная (3,2 < DAS28 ≤ 5,1)
- 3 = высокая (DAS28 > 5,1)
Оценка активности воспаления при РА (см. Приложение Г2)
4. Внесуставные (системные) проявления:
- ревматоидные узелки
- кожный васкулит (язвенно-некротический васкулит, инфаркты ногтевого ложа, дигитальный артериит)
- васкулиты других органов
- нейропатия (мононеврит, полинейропатия)
- плеврит (сухой, выпотной), перикардит (сухой, выпотной)
- миокардит
- синдром Шегрена
- поражение глаз (склерит, эписклерит)
- интерстициальное заболевание легких (ИЗЛ)
- генерализованная миопатия
- поражение системы крови (анемия, нейтропения)
5. Инструментальная характеристика:
-
Наличие эрозий с использованием рентгенографии, возможно магнитно-резонансной томографии (МРТ) и ультразвукового исследования (УЗИ):
- Неэрозивный
- Эрозивный
- Рентгенологическая стадия (по Штейнброкеру, в модификации):
1 стадия — околосуставной остеопороз
2 стадия — остеопороз + сужение суставной щели, могут быть единичные эрозии
3 стадия — признаки предыдущей стадии + множественные эрозии + подвывихи в суставах
4 стадия — признаки предыдущей стадии + костный анкилоз
Развернутая характеристика рентгенологических стадий (определяется по рентгенограммам суставов кистей и стоп):
Небольшой околосуставной остеопороз. Единичные кистовидные просветления костной ткани. Незначительное сужение суставных щелей в отдельных суставах.
Умеренный (выраженный) околосуставной остеопороз. Множественные кистовидные просветления костной ткани. Сужение суставных щелей. Единичные эрозии суставных поверхностей (1-4). Небольшие деформации костей.
Умеренный (выраженный) околосуставной остеопороз. Множественные кистовидные просветления костной ткани. Сужение суставных щелей. Множественные эрозии суставных поверхностей (5 и более). Множественные выраженные деформации костей. Подвывихи и вывихи суставов.
Умеренный (выраженный) околосуставной (распространённый) остеопороз. Множественные кистовидные просветления костной ткани. Сужение суставных щелей. Множественые эрозии костей и суставных поверхностей. Множественные выраженные деформации костей. Подвывихи и вывихи суставов. Единичные (множественные) костные анкилозы. Субхондральный остеосклероз. Остеофиты на краях суставных поверхностей.
6. Дополнительная иммунологическая характеристика — антитела к циклическому цитруллинированному пептиду (АЦЦП):
- АЦЦП — позитивный
- АЦЦП — негативный
I — полностью сохранены: самообслуживание, непрофессиональная и профессиональная деятельность
II — сохранены: самообслуживание, профессиональная деятельность, ограничена: непрофессиональная деятельность
III — сохранено: самообслуживание, ограничены: непрофессиональная и профессиональная деятельность
IV — ограничены: самообслуживание, непрофессиональная и профессиональная деятельность
- вторичный амилоидоз
- вторичный остеоартроз
- системный остеопороз
- атеросклеротическое поражение сосудов
- остеонекроз
- туннельные синдромы (синдром запястного канала, синдромы сдавления локтевого, большеберцового нервов)
- подвывих атланто-аксиального сустава, в том числе с миелопатией, нестабильность шейного отдела позвоночника
Этиология и патогенез
1.2 Этнология и патогенез заболевания или состояния (группы заболеваний или состояний)
Хотя этиология РА неизвестна, риск развития заболевания связан с широким спектром генетических, гормональных и внешнесредовых (курение, загрязнение воздуха, инфекционные агенты) и метаболических (дефицит витамина D, ожирение, низкое потребление полиненасыщенных жирных кислот) факторов, а также нарушениями микробиоты кишечника (ротовая полость, легкие). Патогенез РА определяется сложным взаимодействием факторов внешней среды и генетической предрасположенности, ведущих к глобальным нарушениям в системе врожденного и приобретенного иммунитета, которые выявляются задолго до развития клинических симптомов болезни [3, 6].
Суть патологического процесса при РЛ составляет системное аутоиммунное воспаление, которое с максимальной интенсивностью затрагивает синовиальную
оболочку суставов. Эволюция РА включает несколько последовательно (или дискретно) развивающихся стадий: «преклиническая», которая трансформируются в «симптоматическую», завершающуюся формированием клинико-лабораторного симптомокомплекса, характерного для раннего, а затем развернутого РА. Предполагается, что развитие «субклинического» синовита наблюдается уже в «преклинической» стадии РА и связано с локальной микротравмой, повреждением микрососудов суставов, активацией системы комплемента и/или патогенным действием аутоантител (или иммунных комплексов), вызывающих активацию периартикулярных остеокластов, экспрессирующих цитруллинированные белки, которые вызывают деструкцию костной ткани, синтезом «провоспалительных» медиаторов, индуцирующих развитие боли и воспаления. В синовиальной ткани при РА выявляется массивная инфильтрация «иммунными» клетками (Т-лимфоциты, В-лимфоциты, плазматические клетки, макрофаги, тучные клетки, активированные стромальные клетки и синовиальные фибробласты), характер взаимодействия которых между собой и профиль синтеза «провоспалительных» медиаторов, существенно варьирует в зависимости от стадии болезни.
РА — классическое В-клеточное аутоиммунное заболевание, наиболее характерным проявлением которого является синтез широкого спектра аутоантител с различной специфичностью, которые обнаруживаются более, чем у 90% пациентов, страдающих РА. Кроме того, В-клетки участвуют в ко-стимуляции Т-клеток, вызывают активацию остеокластов (ОК) и синтезируют широкий спектр «провоспалительных» цитокинов — фактор некроза опухоли альфа (ФНОα), лимфотоксин, интерлейкин (ИЛ) 6 и др. Наиболее характерными для РА аутоантителами являются ревматоидные факторы (РФ) IgG, IgM и IgA изотипов, реагирующие с Fс-фрагментом молекулы IgG, и аутоантитела, реагирующие с антигенными эпитопами, универсальной характеристикой которых является пост-трансляционная модификация (цитруллинирование, карбамилирование, ацетилирование, перекисное окисление и др.). Основное значение придают цитруллинированию, которое представляет собой биохимический процесс, опосредованный ферментом петидил-аргинин дезаминазой (ПАД) 2 и 4, заключающийся в конверсии положительно заряженной аминокислоты аргинин в аминокислоту цитруллин, обладающую нейтральным зарядом. Гиперпродукция антител к цитрулинированным белкам (АЦБ) (особенно в комбинации с IgM и IgA РФ) ассоциируется с активностью заболевания, прогрессированием деструкции суставов, экстраартикулярными (системными) проявлениями, риском общей летальности, связанной с развитием коморбидных состояний, в первую очередь, кардиоваскулярных осложнений, «резистентностью» или напротив «чувствительностью» к фармакотерапии. Выделяют два основных клинико-иммунологических субтипа РА: АЦБ-позитивный и АЦБ-негативный. Они отличаются по молекулярным механизмам патогенеза, факторам генетической предрасположенности и внешней среды, тяжести течения и эффективности проводимой терапии. IgM РФ и АЦБ выявляются не только в сыворотках пациентов с РА, а также у пациентов с артралгией или неспецифическими мышечно-скелетными симптомами за много лет до развития РА, что рассматривается как важное доказательство существования «преклинической» системной «аутоиммунной» фазы этого заболевания. АЦБ (и РФ) являются не только чувствительными и специфичным биомаркерами РА, но могут иметь патогенетическое значение, выступая в роли дополнительных медиаторов воспаления и деструкции костной ткани. Это в свою очередь зависит от воздействия дополнительных экзогенных или эндогенных факторов (так называемый «второй сигнал» — зесопс! Ьк), усиливающих «провоспалительный» потенциал аутоантител. Развитие хронического воспаления суставов может быть связано с формированием так называемого «провоспалителыюго фенотипа» аутоантител, особенностями которого является нарушение гликозилирования (процесс присоединения моносахаридов к белку) Fc- и Fab- фрагментов молекулы иммуноглобулина.
Рассматривая механизмы, индуцирующие цитруллинирование, как потенциальный механизм формирования аутоантигенного репертуара, в первую очередь обращается внимание на курение, приводящее к избыточному образованию цитруллинированных белков в ткани легких. Наряду с тканью легких, важным местом образования ПТМ белков является ткань десен. Установлено увеличение распространенности РА у пациентов с периодонтитом, а также связь между развитием периодонтита, увеличением титров РФ и АЦБ и активностью РА. Полагают, что это связано со способностью Porphyromonas gingivalis
(периодонтальный патоген) активировать НАД, вызывающих цитруллинирование белков-мишеней для АЦБ (фибриноген, а-энолазы). В последние годы большое значение в иммунопатогенезе РА придают дисбиозу микробиома, который, как полагают, может приводить к локальному воспалению, потере барьерной функции кишечника и траслокации кишечной бактериальной флоры в кровяное русло.
В генетических исследованиях системы HLA и при полногеномном поиске ассоциаций (genome-wide association studies — GWAS) выявлено более 100
однонуклеотидных полиморфизмов (single-nucleotide polymorphism — SNP), связанных с риском развития и прогрессирования РА. Особе значение имеет носительство антигенов II класса главного комплекса гистосовместимости — HLA-DR01/04, характерной особенностью которых является наличие общей аминокислотной последовательности (лейцин-глютамин-лизин-аргинин-аланин) в третьей гипервариабильной области HLA-DRβ цепей, которая получила название «общий эпитоп» (Shared Epitope — SE). Носительство HLA-DRB1 *0401 выявляется у 50-61% пациентов с РА (ОР = 5-11), а НLА- DRB 1*0404 — у 27-37% (ОР = 5-14). Молекулярной основой для этой ассоциации является тот факт, что положительный заряд этого участка молекулы НLА-DR блокирует связывание аргинин-содержащих пептидов, но облегчает (и усиливает аффинность) взаимодействие с цитруллинированными пептидами, нейтральный заряд. Доказана связь между носительством «общего эпитопа», факторами риска РА, индуцирующими цитруллинирование белков и гиперпродукцией РФ и АЦБ. Определенный вклад в предрасположенность к развитию РА вносят генетические полиморфизмы молекул, участвующих в ко-стимуляции Т-клеток (CD28, CD40, хемокины), гены рецепторов цитокинов (например, ИЛ6 и др.), ферментов, регулирующими пост-трансляционную модификацию белков, и гены различных белков — РТРN22 (Protein tyrosine phosphatase, non-receptor type 22), TNFAIP3 (Тиmог песrоsis factor, alpha-induced protein 3), SТАТЗ (signal transducer and activator of transcription 3), участвующих в иммунном ответе.
Развитие поражение суставов при РА, проявляющееся пролиферацией синовиальной ткани и деструкцией суставов, является сложным процессом в развитии которого принимают участие все элементы иммунной системы, включая Т и В лимфоциты, антиген-презентирующие клетки (В- клетки, макрофаги, дендритные клетки), которые синтезируют широкий спектр медиаторов воспаления и тканевой деструкции. Фундаментальный механизм развития РА связан с нарушением баланса между синтезом «провоспалительных» и «антивоспалительных» цитокинов, которые вызывают поляризацию иммунного ответа по Thelper (h) 1 и Th17 типам. Характерным морфологическим признаком РА является избыточный рост и пролиферация синовиальной ткани (панус), приводящей к образованию эрозий и деструкции костной ткани сустава. Внутренний (выстилающий) слой синовиальной ткани содержит 2 основных типа клеток: макрофагоподобные (тип А) и фибробластоподобные (тип В) синовиоциты. Макрофагоподобные синовиоциты (МПС) имеют гемопоэтическое, а фибробластоподобные синовиоциты (ФПС) — мезенхимальное происхождение. При РА синовиальная оболочка представляет собой гиперпластическую инвазивную ткань, формирование которой связано с усиленной миграцией этих клеток из костного мозга и кровотока, соответственно. МПС синтезируют широкий спектр «провоспалительных» медиаторов (цитокины, хемокины, факторы роста и др.), которые активируют ФПС, которые в свою очередь начинают активно синтезировать «провоспалительные» медиаторы и матриксные металлопротеиназы (ММП). Этот процесс способствует хронизации синовита и деструкции компонентов сустава. ФПС обладают выраженной способностью к инвазии, синтезу ММП и устойчивостью к апоптозу, связанному с гиперэкспрессией антиапоптотических белков. Хотя механизмы деструкции суставов чрезвычайно гетерогенны и связаны с синтезом «провоспалительных» медиаторов различными иммунными клетками (макрофаги, нейтрофилы, тучные клетки), доминирующую роль играют ФПС, экспрессирующие молекулу адгезии кадгерин-11, синтезирующие ММП, в первую очередь коллагеназу и стромелизин. Эрозия костной ткани опосредуется созреванием и активацией ОК, связанной с воздействием RANKL (гесеptor activator of nuclear factor-kB), который синтезируется Т-клетками, а также ФНОα, ИЛ-6 и ИЛ-1, синтезирующихся макрофагами и ФПС. Деструктивная свойства активированных ОК связаны с синтезом широкого спектра протеаз, в первую очередь катепсина К (основной протеолитический фермент ОК). Кроме того, АЦБ, взаимодействуя с виментином, присутствующим на мембране предшественников ОК, обладают способностью индуцировать дифференцировку ОК и тем самым стимулировать резорбцию костной ткани.
О роли гормональных нарушений (связанных с половыми гормонами, пролактином) свидетельствует тот факт, что в возрасте до 50 лет РА наблюдают примерно
в 2-3 раза чаще у женщин, чем у мужчин, а в более позднем возрасте эти различия нивелируются. У женщин прием пероральных контрацептивов и беременность снижают риск развития заболевания, а в послеродовом периоде, во время кормления грудью (гиперпролактинемия) риск заболеть существенно повышается.
Эпидемиология
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
РА является частым и одним из наиболее тяжелых иммуновоспалительных заболеваний человека, что определяет большое медицинское и социально-экономическое значение этой патологии [6]. Распространённость РА среди взрослого населения в разных геофафических зонах мира колеблется от 0,5 до 2% [2, 7]. По данным официальной статистики, в 2017 году в России зарегистрировано более 300 тысяч пациентов с РА, в то время как по данным Российского эпидемиологического исследования РА страдает около 0,6% от общей популяции [8, 9]. Соотношение женщин к мужчинам — 3:1. Заболевание встречается во всех возрастных группах, но пик заболеваемости приходится на наиболее трудоспособный возраст — 40-55 лет. РА вызывает стойкую потерю трудоспособности у половины пациентов в течение первых 3-5 лет от начала болезни и приводит к существенному сокращению продолжительности их жизни, как за счет высокой частоты коморбидных заболеваний, в первую очередь инфекционных осложнений, так и характерных для РА внесуставных (системные) проявлений (ВП) и осложнений, связанных с системным иммуновоспалительным процессом — ревматоидный васкулит, АА амилоидоз и др. [1,6].
Клиническая картина
Cимптомы, течение
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
Примерно в половине случаев заболевание начинается с постепенного (в течение месяцев) нарастания болей и скованности преимущественно в мелких суставах кистей и стоп. В дебюте заболевания клинические проявления бывают выражены умеренно и часто носят субъективный характер. Только у некоторых больных с очень активным течением заболевания выявляют классические признаки воспаления суставов, такие как повышение температуры кожи над суставами и их отек (чаще коленных, реже — проксимальных межфаланговых и запястья). Иногда заболевание дебютирует как острый моноартрит крупных суставов, напоминающий септический или микрокристаллический артрит. Болезнь может начинаться с рецидивирующих бурситов и тендосиновитов, особенно
часто локализующихся в области лучезапястных суставов, приводя к развитию синдрома запястного канала. У лиц пожилого возраста начало заболевания может проявиться в виде острого полиартрита мелких и крупных суставов с генерализованной полиартралгией или симптомов, напоминающих ревматическую полимиалгию. Для большинства пациентов характерно симметричное поражение суставов кистей (проксимальных межфаланговых, пястно-фаланговых и лучезапястных), а также плюснефаланговых суставов. Наиболее частый и характерный признак воспаления синовиальной оболочки суставов при РА —
утренняя скованность. Ее длительность обычно тесно связана с выраженностью синовита и составляет не менее 1 ч.
Поражения суставов при РА артрите можно разделить на 2 категории: потенциально обратимые (обычно ранние), связанные с развитием синовита, и необратимые структурные, развивающиеся на поздних стадиях болезни. Это разделение имеет значение для оценки стадии заболевания, прогноза и тактики лечения. Следует иметь в виду, что структурные повреждения могут развиваться очень быстро, уже в течение первых 2 лет от начала болезни.
РА — системное иммуновоспалительное ревматическое заболевание, поэтому у многих больных возникают различные внесуставные проявления. Некоторые из них наблюдаются уже в дебюте заболевания, и они могут (хотя и очень редко) преобладать в клинической картине болезни. Факторы риска развития системных проявлений: тяжелое поражение суставов, высокие титры РФ, АЦБ. Наиболее частыми системными (эксраартикулярными) проявления РА являются коституциональные симптомы (особенно депрессия), кардиоваскулярные осложнения, связанные с артериальной гипертензией и атеросклеротическим поражением сосудов, интерстициальное заболевание легких (ИЗЛ), ревматоидные узелки, лимфаденопатия, остеопороз, синдром Шегрена, которые ассоциируется с развитием тяжелого серопозитивного по РФ и АЦБ РА.
Диагностика
2. Диагностика заболевания или состояния (группы заболеваний или состояний), показания и противопоказания к применению методов диагностики
Критерии установления диагноза (см. Приложение Г1):
2.1. Жалобы и анамнез
- При сборе анамнеза рекомендуется у всех пациентов с подозрением на РА уточнять продолжительность симптомов артрита, длительность утренней скованности, наличие суточного ритма боли в суставах, стойкость признаков поражения суставов [11].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
Комментарии: клинически выраженному поражению суставов может предшествовать продромальный период длительностью от нескольких недель до нескольких месяцев. В этот период пациента могут беспокоить повышенная утомляемость, похудание, артралгии, субфебрильная температура тела.
— начало заболевания характеризуется разнообразием, условно выделяют следующие варианты дебюта РА:
- симметричный полиартрит с постепенным (в течение нескольких месяцев) нарастанием боли и скованности, преимущественно в мелких суставах кистей (в половине случаев);
- острый полиартрит с преимущественным поражением суставов кистей и стоп, выраженной утренней скованностью (обычно сопровождается ранним появлением РФ в крови);
- моно-олигоартрит коленных или плечевых суставов с последующим быстрым вовлечением в процесс мелких суставов кистей и стоп;
- острый моноартрит крупных суставов, напоминающий септический или микрокристаллический артрит;
- острый олиго- или полиартрит с системными явлениями (фебрильная лихорадка, лимфаденопатия, гепатоспленомегалия). Чаще наблюдается у молодых пациентов (напоминает болезнь Стилла у взрослых);
- «палиндромный ревматизм»: множественные рецидивирующие атаки острого симметричного полиартрита суставов кистей, реже — коленных и локтевых суставов, длящихся несколько часов или дней и заканчивающихся полным выздоровлением;
- рецидивирующий бурсит и теносиновит, особенно часто лучезапястных суставов;
- острый полиартрит у пожилых: множественные поражения мелких и крупных суставов, выраженные боли, диффузный отёк и ограничение подвижности суставов. Получил название «RS3PE синдром» (Remitting Seronegative symmetric synovitis with Pitting Edema — ремитирующий серонегативный симметричный синовит с «подушкообразным» отёком);
- генерализованная миалгия, скованность, депрессия, двухсторонний синдром запястного канала, похудание. Обычно наблюдают в пожилом возрасте. Напоминает ревматическую полимиалгию. Характерные клинические признаки РА развиваются позднее.
— наиболее ярким признаком воспаления суставов при РА является утренняя скованность, длительность которой обычно коррелирует с выраженностью синовита и составляет не менее 1 часа;
— у значительной части пациентов РА дебютирует с нехарактерных клинических проявлений, в связи с чем, диагноз по существующим критериям не может быть установлен при первичном обследовании. Такое состояние обычно классифицируется как недифференцированный артрит (НДА). Среди пациентов с НДА в течение 1 года наблюдения не менее 30% развивает типичный РА. В практике чаще всего встречаются следующие клинические варианты НДА:
- олиго артрит крупных суставов (коленные, голеностопные, плечевые, тазобедренные)
- асимметричный артрит суставов кистей
- серонегативный по РФ олигоартрит суставов кистей
- нестойкий полиартрит
2.2 Физикальное обследование
- При проведении физикального обследования суставов у всех пациентов с НДА или РА рекомендуется оценивать [12]:
— Припухлость суставов и локальную гипертермию кожи
— Болезненность суставов при пальпации и движении
— Объем активных и пассивных движений в суставах
— Наличие деформаций суставов за счет пролиферации тканей, подвывихов и контрактур
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
Комментарии: характерным для РА считается симметричное полиартикулярное воспаление ПФС и ПМФС кистей, лучезапястных суставов. В ряде случаев поначалу превалирует поражение ПЛФС или крупных суставов;
— наиболее типичные проявление в дебюте заболевания:
- боль (при пальпации и движении) и припухлость (связана с выпотом в полость сустава) поражённых суставов;
- усиление боли в суставах в ранние утренние часы;
- положительный тест «поперечного сжатия» кисти;
- ослабление силы сжатия кисти (пациенту трудно или невозможно сэ/сать руку в кулак);
- утренняя скованность в суставах >30 мин (длительность зависит от выраженности синовита);
- атрофия межкостных (червеобразных) мышц (наблюдается своеобразное похудание тыла кисти).
- дебют РА следует заподозрить у пациентов с артралгиями с максимальной интенсивностью в утренние часы, поражением ПФС, утренней скованностью более 1 часа, наличием РА у кровных родственников, невозможностью сжать кисть кулак и положительным тестом «поперечного сжатия» [13].
— наиболее типичные проявления в развёрнутой и финальной стадиях заболевания:
- кисти: локтевая («ульнарная») девиация кисти с отклонением пальцев в сторону локтевой кости («плавник моржа»), обычно развивающаяся через 1-5 лет от начала болезни; поражение пальцев кистей по типу «бутоньерки» (сгибание в ПМФС и переразгибание дистальных межфаланговых суставов) ш и «шеи лебедя» (сгибательная контрактура ПФС, переразгибание ПМФС и сгибание дистальных межфаланговых суставов); деформация кисти по типу «лорнетки» (сложная сгибательная контрактура пальцев с множественными подвывихами); 2- образная деформация большого пальца (подвывих в межфаланговых суставах); анкилозы запястно-пястных суставов;
- локтевые суставы: ограничение сгибания и разгибания с образованием контрактуры в положении полусгибания и полупронации;
- коленные суставы: сгибателъная/разгибательная или комбинированные варианты контрактуры, варусная или вальгусная
- деформация стопы: опускание переднего свода; подвывихи головок плюснефаланговых суставов с формированием молоткообразной деформации пальцев; латеральная девиация; деформация большого пальца (hallux valgus); появление «натоптышей» и некрозов кожи над суставами;
- шейный отдел позвоночника: подвывихи в области атлантоаксиального сустава, изредка осложняющиеся компрессией спинного мозга или позвоночной артерии;
- перстневидно-черпаловидный сустав: огрубение голоса, одышка, дисфагия, рецидивирующий бронхит;
- височно-нижнечелюстной сустав: ограничение открывания рта;
- связочный аппарат и синовиальные сумки: тендосиновит в области лучезапястного сустава и кисти; бурсит, чаще в области локтевого сустава; синовиальная киста на задней стороне коленного сустава (киста Бейкера).
- При проведении физикального обследования у всех пациентов с подозрением на РА и установленным диагнозом РА рекомендуется оценивать наличие и выраженность ВП [14].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
Комментарии: ВП встречаются почти у 50% больных РА. Типичные для РА ВП представлены в. разделе 1.5. Развитие ВП считают фактором риска неблагоприятного прогноза в вязи с увеличением летальности.
- Синдром Фелти — очень редкая (1%) клиническая форма длительно протекающего серопозитивного РА [15], чаще встречается у женщин (соотношение женщин и мужчин 3:1) старше 40—50 лет. Симптомокомплекс включает стойкую гранулоцитопению (<2000/мм3), спленомегалию, гепатомегалию, тяжёлое поражение суставов, внесуставные проявления (васкулит, нейропатия, лёгочный фиброз, синдром Шёгрена), гиперпигментацию кожи нижних конечностей, сопровождается высоким риском инфекционных осложнений.
- Болезнь Стилла взрослых — заболевание, характеризующееся рецидивирующей фебрильной лихорадкой, артритом, нейтрофильным лейкоцитозом, макулопапулёзной сыпью, высокой лабораторной активностью, серонегативностью по РФ и АЦЦП [16].
2.3. Лабораторные диагностические исследования
2.3.1 Лабораторные лиагностические исследования для постановки диагноза
- Определение содержания антител к циклическому цитрулиновому пептиду (анти-ССР) в крови (АЦЦП), определение содержания РФ в крови рекомендуется всем пациентам с НДА и подозрением на РА с целью диагностики заболевания [17, 18, 181].
Уровень убедительности рекомендации В (уровень достоверности доказательств 1)
Комментарии: положительные результаты определения IgM РФ и АЦЦП в сыворотке крови входят в число классификационных критериев РА [18,19];
— определение содержания РФ в крови в высоких титрах служит для прогнозирования быстропрогрессирующего деструктивного поражения суставов и развития внесуставных проявлений при РА;
— определение АЦЦП имеет большое значение для диагностики раннего РА, серонегативного (по РФ) РА, дифференциальной диагностики РА с другими
заболеваниями, прогнозирования тяжелого эрозивного поражения суставов и риска кардиоваскулярных осложнений;
- Общий (клинический) анализ крови развернутый и исследование уровня СРВ в сыворотке крови количественным методом рекомендуется всем пациентам с НДА и РА с целью проведения дифференциальной диагностики с невоспалительными заболеваниями суставов и оценки активности воспаления [11, 12].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
Комментарии: СОЭ — высокочувствительный, но неспецифичный и нестабильный маркер системного воспаления.
— факторами повышения СОЭ являются анемия, гиперхолестеринемия, беременность, воспаление, женский пол, пожилой возраст;
— факторами уменьшения СОЭ — серповидноклеточная анемия, сфероцитоз, акантоцитоз, полицитемия, лейкоцитоз, микроцитоз, гипофибриногенемия, гипербилирубинемия, застойная сердечная недостаточность, кахексия;
— СРБ — классический острофазовый белок сыворотки крови, рассматривающийся как наиболее чувствительный лабораторный биомаркер воспаления, инфекции и тканевого повреждения;
— СРБ является более стабильным и воспроизводимым биомаркером воспаления, чем СОЭ;
— повышение СОЭ и концентрации СРБ отражает локальный и системный воспалительный процесс при РА. Эти показатели, входят в число классификационных критериев РА [10, 19, 20];
— СОЭ и СРБ, являются компонентами индексов активности РА [21].
- Исследование синовиальной жидкости (цитологическое исследование синовиальной жидкости, исследование химических свойств синовиальной жидкости, исследование уровня белка в синовиальной жидкости, исследование физических свойств синовиальной жидкости) рекомендуется в качестве дополнительного метода обследования всем пациентам с моноартритом и подозрением на РА с целью дифференциальной диагностики РА с микрокристаллическими или септическими артритами [11, 12].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
Комментарии: для пациентов с РА характерно снижение вязкости синовиальной жидкости, рыхлые муциновые сгустки, зернистый осадок, цитоз (3,0-75,0×109/л), преобладание полиморфно-ядерных нейтрофилов (до 85%), повышение уровня общего белка (30-60 мг/л), увеличение уровня глюкозы (1,0-2,0 ммоль/л), уровня СРБ и РФ.
- Определение содержания антинуклеарных антител к Sm-антигену в сыворотке крови (уровня антител к Ro/SS-А и Lа/SS-В) рекомендуется всем пациентам с РА с подозрением на синдром Шегрена [22].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
Комментарии: определение содержания антинуклеарных антител к Sm-антигену (антител к Rо/SS-А и Lа/SS-В) целесообразно для диагностики первичного или вторичного синдрома Шегрена, которые входят в классификационные критерии этого заболевания [22].
2.3.2. Лабораторные диагностические исследования для оценки безопасности перед назначением терапии и на фоне лечения, оценки эффективности терапии
Перед назначением противоревматических препаратов у всех пациентов с РА, наряду с оценкой активности воспалительного процесса и характера ВП, важно выявлять потенциальные факторы риска НЛР или осложнений фармакотерапии [23, 24]. К ним относятся маркеры (или факторы риска) хронических инфекций (туберкулез, инфекции вирусом гепатита В и С, вирус иммунодефицита человека — ВИЧ и др.); сердечнососудистых заболеваний; нарушение функции почек, прием алкоголя, статус вакцинации, планирование беременности; вираж туберкулиновой пробы Манту.
- Для выявления противопоказаний, потенциальных факторов риска развития НЛР перед назначением противоревматической терапии (все группы препаратов) всем пациентам с РА рекомендуется проводить лабораторное обследование в следующем объеме [1, 23, 24, 182, 183, 184]:
— общий (клинический) анализ крови;
— общий (клинический) анализ мочи;
— анализ крови биохимический общетерапевтический;
— определение антигена (HbsAg) вируса гепатита В (Hepatitis В virus) в крови;
— определение антител к вирусу гепатита С (Hepatitis C virus) в крови;
— определение антител классов М, G (IgМ, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV 1) в крови;
— Определение антител классов М, G (IgМ, IgG) к вирусу иммунодефицита человека ВИЧ-2 (Human immunodeficiency virus HIV 2) в крови.
Мониторинг безопасности на фоне лечения (см. приложение Г5).
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
- Внутрикожную пробу с туберкулезным аллергеном (реакция Манту или с аллергеном туберкулезном рекомбинантный в стандартном разведении (внутрикожный диагностический тест, который представляет собой рекомбинантный белок, содержащий два связанных между собой антигена — ESAT6 и СFР10, характерных для вирулентных штаммов микобактерий туберкулеза) или квантифероновый тест (QuantiFERON) или Т- спот (Т-SРОТ®.ТВ)) рекомендуется проводить всем пациентам с РА с целью выявления противопоказаний, потенциальных факторов риска развития НЛР перед назначением и каждые 6 мес. на фоне лечения ГИБП и тсБПВП [23,24,25,184].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
- Исследование уровня хорионического гонадотропина рекомендуется проводить женщинам фертильного возраста с РА перед назначением противоревматических препаратов, запрещенных к применению в период гестации и кормления грудью [26, 27].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
- Перед назначением ингибиторов ИЛ6 (ТЦЗ**, СРЛ**, ОЛК**) и ингибиторов Янус-киназ (ТОФА**, БАРИ**, УПА**) рекомендуется проводить анализ крови по оценке нарушений липидного обмена биохимический (холестерин, ЛПВП, ЛПНП, ТГ) в связи с риском развития дислипопротеинемии на фоне терапии [23,28, 29].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
- Перед назначением РТМ** рекомендуется исследовать уровень иммуноглобулина А, М и G в крови для оценки риска иммунодефицитных НЛР [23, 30].
Уровень достоверности доказательств — С (уровень убедительности рекомендаций — 5)
- Рекомендуется проводить общий (клинический) анализ крови развернутый и исследование уровня СРБ в сыворотке крови для оценки эффективности терапии не реже 1 раза в 3 месяца до достижения ремиссии/низкого уровня активности РА. После достижения ремиссии/низкого уровня активности РА — не реже 1 раза в 6 месяцев [12, 18].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
2.4. Инструментальные диагностические исследования
Рентгенографическое исследование суставов используется для:
— выявления ранних структурных повреждений суставов, которые позволяют уточнить диагноз в случаях, когда классификационные критерии не позволяют поставить достоверный диагноз РА;
— характеристики РА на поздней стадии болезни, когда активность воспалительного процесса может быть низкой и преобладают признаки деструкции и анкилоза суставов;
— определения характера прогрессирования деструкции суставов для оценки прогноза;
— оценки эффективности терапии сБПВП, ГИБП и тсБПВП;
— характеристики повреждений суставов перед ортопедическим и хирургическим лечением и ортезированием.
- Рентгенография кистей и рентгенография плюсны и фаланг пальцев стопы рекомендуется проводить исходно при установлении диагноза и далее всем пациентам с развернутой стадией РА каждые 12 месяцев с целью оценки прогрессирования деструкции суставов [18,31].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
- Рентгенография кистей и рентгенография плюсны и фаланг пальцев стопы пациентам с поздней стадией РА рекомендуется назначать при наличии клинических показаний [1, 31].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
Комментарии: пациентам в поздней стадии РА, имеющим 3 и 4 стадии поражения суставов (по Штейнброкеру), частота рентгенологического исследования суставов определяется клиническими показаниями (подозрение на септический артрит, подготовка к оперативному вмешательству и др.);
— для РА характерно множественное и симметричное поражение мелких суставов кистей и стоп;
— при остром начале и активном воспалении при РА околосуставной остеопороз и единичные кисты могут быть обнаружены в течение 1 месяца заболевания;
множественные кисты, сужение суставных щелей и единичные эрозии через 3 до б месяцев от начала заболевания, особенно в отсутствии лечения БПВП;
— ранние рентгенологические признаки артрита обнаруживаются: во 2-х и 3-х пястно- фаланговых суставах; 3-х проксимальных межфаланговых суставах; в суставах запястий; лучезапястных суставах; шиловидных отростках локтевых костей; 5-х плюснефаланговых суставах;
— типичными для РА являются симметричные рентгенологические изменения в пястно- фаланговых суставах, проксимальных межфаланговых суставах; в суставах запястий; плюснефаланговых суставах и 1-х межфаланговых суставах стоп;
— при более выраженных рентгенологических стадиях РА (3 и 4 стадии по Штейнброкеру) изменения могут обнаруживаться в дистальных межфаланговых суставах кистей и проксимальных межфаланговых суставах стоп;
— РА не начинается с поражения дистальных межфаланговых суставов кистей и стоп; проксимальных межфаланговых суставов стоп;
— костные анкилозы при РА выявляются только в межзапястных суставах; 2-5-х запястно-пястных суставах и, реже, в суставах предплюсны;
— костные анкилозы при РА не формируются в межфаланговых, пястно-фаланговых и плюснефаланговых суставах кистей, в 1-х запястно-пястных суставах;
— характерных для РА рентгенологических изменений в других суставах верхних и нижних конечностей, в суставах осевого скелета не наблюдают.
Особенности рентгенологических изменений в суставах при РА в пожилом возрасте
— околосуставной .остеопороз может быть проявлением постменопаузального остеопороза;
— могут обнаруживаться признаки остеоартроза (сужение суставных щелей, кисты) в дистальных межфаланговых суставах кистей, крупных суставах, реже в ПФС;
— при несоответствии классификационным критериям для подтверждения диагноза РА необходимо выявить эрозии в типичных для РА суставах (запястья, ПЛФС, ПФС).
- Рентгенография плечевого сустава, рентгенография локтевого сустава, рентгенография таза, рентгенография коленного сустава, рентгенография голеностопного сустава при РА в качестве рутинного метода не рекомендуется и проводится только при наличии особых показаний (подозрение на остеонекроз, септический артрит, перелом, новообразования) [1].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
- Прицельную рентгенографию органов грудной клетки рекомендуется проводить всем пациентам с РА с целью выявления ревматоидного поражения органов дыхания и сопутствующих заболеваний лёгких при первичном обследовании и затем ежегодно (более частое проведение возможно при наличии клинических показаний) [1, 185].
Уровень убедительности рекомендации С (уровень достоверности доказательств 4)
- Компьютерную томографию (КТ) органов грудной полости рекомендуется проводить пациентам с РА, имеющим клинические признаки поражения легких с или без рентгенологических изменений, выявленных при рентгенографии органов грудной клетки, с целью уточнения характера изменений (интерстициальное или очагового (ревматоидные узлы) поражение лёгких) и проведения дифференциальной диагностики с другими заболеваниями [1, 186, 187].
Уровень убедительности рекомендации В (уровень достоверности доказательств 2)
- МРТ суставов кистей рекомендуется использовать у пациентов с ранним РА в качестве дополнительного к клиническому осмотру метода выявления синовита с целью подтверждения диагноза в сложных клинических ситуациях [31-33].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
Комментарии:
— МРТ является более чувствительным методом выявления синовита в дебюте РА, чем стандартная рентгенография суставов;
— МРТ признаки артрита неспецифичны; сходные с РА МРТ изменения могут присутствовать при других воспалительных заболеваниях суставов и выявляться у лиц, не страдающих заболеваниями суставов;
— изменения, выявляемые с помощью МРТ (синовит, теносиновит, остеит и эрозии костной ткани), позволяют прогнозировать прогрессирование деструкции суставов’,
— показатели МРТ (в особенности счет синовита) могут являться дополнительными и независимыми признаками воспалительной активности РА на ранней стадии болезни.
- УЗИ суставов кистей и стоп с использованием УЗИ (энергетический доплер) рекомендуется назначать как дополнительный метод мониторинга активности заболевания и эффективности проводимой терапии [31, 33, 34].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
- Применение МРТ и УЗИ суставов кистей не рекомендуется использовать для подтверждения диагноза или выбора терапевтической тактики в связи с недостаточной стандартизацией данных методов при РА [31-34].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
2.5. Иные диагностические исследования
- ЭГДС рекомендуется выполнять всем пациентам с РА (не реже 1 раза в год), регулярно получающим НПВП и/или ГК, наличии анемии с целью исключения эрозивно-язвенного поражения желудка и двенадцатиперстной кишки [35].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
- ЭКГ рекомендуется проводить всем пациентам с РА не реже 1 раза в год [36,37].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
ЭхоКГ рекомендуется проводить пациентам с РА при подозрении на перикардит, миокардит легочную артериальную гипертензию, поражения сердца, связанных с атеросклерозом [36-39].
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
- Рентгеноденситометрия поясничого отдела позвоночника и шейки бедра рекомендуется всем пациентам с РА каждые 12 месяцев при наличии следующих показаний [37,40,41]:
— возраст старше 50 лет для женщин и 60 лет для мужчин;
— ранняя менопауза у женщин
— высокая активность заболевания (стойкое увеличение СРВ более 20 мг/л);
— рентгенологическая стадия Ш-1У по Штейнброкеру или значение индекса НАР более 1,25;
— масса тела менее 60 кг;
— прием ГК (более Зх месяцев в дозе более 5 мг/сут).
Уровень убедительности рекомендации С (уровень достоверности доказательств 4)
- Консультации специалистов рекомендуются с целью диагностики или определения тактики лечения заболеваний, которые могут оказать влияние на выбор терапии и прогноз при РА [10,36,37]:
— врача-кардиолога — при развитии кардиоваскулярных осложнений на фоне прогрессирования РА;
— врача-эндокринолога — для диагностики заболеваний эндокринной системы, главным образом, сахарного диабета, что может повлиять на выбор терапии РА;
— врача-гастроэнтеролог а — при развитии гастороэнтерологических осложнений на фоне лечения РА;
— врача-фтизиатра — при назначении ГИБП в случае подозрения на наличие латентной туберкулезной инфекции;
— врача-онколога — при развитии злокачественных новообразований т разработки тактики ведения пациентов
— врача-окулиста — для диагностики поражения глаз на фоне РА;
— врача-стоматолога — для диагностики ксеростомии и поражения слюнных желез;
— врача-невролога — для диагностики туннельных синдромов, миелопатии, невропатии и других неврологических патологий на фоне РА;
— врача-нефролога — для диагностики амилоидоза и других патологий почек на фоне РА;
— врача-пульмонолога — для диагностики ИЗЛ и других патологий лёгких на фоне РА;
— врача-травматолога-ортопеда — всем пациентам с РА, имеющим показания к хирургическому лечению (значительное нарушение функций тазобедренных, коленных суставов, суставов кистей и стоп и др., включая контрактуры, анкилоз, остеонекроз) или ортезированию;
— врача-акушера-гинеколога — пациенткам, планирующим беременность или беременным с целью выработки тактики лечения и родовспоможения.
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
- В случае выявления у пациентов с РА симптомов, позволяющих предполагать наличие психических расстройств, и при положительном результате скринингового обследования на психическое расстройство рекомендуется направление на консультацию к врачу- психиатру для психопатологической диагностики психического расстройства в соответствии с критериями МКБ-10 и назначения психофармакотерапии/психотерапии [42,43].
Уровень убедительности рекомендации С (уровень достоверности доказательств 4)
Лечение
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
- При лечении всех пациентов с РА рекомендуется достигать ремиссии или низкой активности (альтернативная цель) заболевания [44-46] (приложение Г2).
Уровень убедительности рекомендации С (уровень достоверности доказательств 5)
Комментарии: у пациентов, находящихся в ремиссии (или имеющих низкую активность), функциональный статус, трудоспособность и прогноз заболевания (снижение риска преждевременной летальности) лучше, чем у пациентов, у которых сохраняется умеренная или высокая активность заболевания [47];
— Снижение активности РА на фоне лечения в течение первых 3-х месяцев, ассоциируется с развитием ремиссии, через 12-24 месяца. [48, 49]
- Лечение РА рекомендуется основывать на стратегии «Лечения до достижения цели» (“Treat to target”): активное назначение противовоспалительной терапии, включающей сБПВП, ГИБП, тсБПВП, НПВП, ГК, контроль над состоянием пациента с момента постановки диагноза частый (каждые 3 мес. до достижения ремиссии, каждые 6 мес. после достижения ремиссии) и объективный (с применением количественных методов), изменение схемы лечения при отсутствии приемлемого эффекта терапии [12, 45-55] (приложение Г4, Г5).
Уровень убедительности рекомендации С (уровень достоверности доказательств 3)
Комментарии: раннее начало терапии сБПВП ассоциируется с более благоприятными исходами РА в отношении потери трудоспособности, развития инвалидности, потребности в протезировании суставов и летальности [52-55];
— лечение противоревматическими препаратами может сопровождаться развитием НЛР, которые требуют тщательного мониторинга, поскольку могут ухудшать прогноз болезни [24, 54] (приложение Гб).
3.1 Консервативное лечение
- Для уменьшения болей в суставах рекомендуется применять НПВП, которые оказывают удовлетворительный симптоматический (анальгетический) эффект [56-59].
Уровень убедительности рекомендации А (уровень достоверности доказательств 1)
Комментарии: несмотря на уменьшение боли и скованности на фоне лечения НПВП, они не влияют на прогрессирование деструкции суставов;
— практически все НПВП могут уменьшать боль при назначении в дозах, значительно меньших, чем те, что требуются для подавления воспаления;
— одновременное использование 2-х и более НПВП увеличивает риск развития НЛР;
- При умеренной вероятности развития осложнений со стороны ЖКТ рекомендуется использовать селективные НПВП (с-НПВП) без дополнительной профилактики или неселективные НПВП (н-НПВП) на фоне медикаментозной профилактики НР (ингабиторы протонного насоса (ИПП) [56, 59, 60].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
- Не рекомендуется назначать НПВП пациентам с РА и очень высоким риском кардиоваскулярных осложнений (индекс SCORE ≥5%) [56, 188].
Уровень убедительности рекомендаций — В (уровень достоверности доказательств — 2)
- сБПВП (аналоги фолиевой кислоты, кишечные противовоспалительные препараты аминосалициловая кислота и аналогичные препараты, селективные иммунодепрессанты, противомалярийные препараты) рекомендуется назначать всем пациентам с РА (включая пациентов с высокой вероятностью развития РА) с момента постановки диагноза [61-63].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1)
- МТ** рекомендуется всем пациентам с диагнозом РА, как препарат «первой линии» терапии [64-74] (приложение Г6 и Г7).
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1)
- МТ** рекомендуется пациентам с НДА при высокой вероятности развития РА [75, 76].
Уровень убедительности рекомендаций — В (уровень достоверности доказательств — 2)
Комментарии: необходимо информировать пациентов о достоинствах терапии и возможных НИР);
— рекомендации по профилактике и лечению НИР, связанных с приемом МТ** суммированы в приложение Г7.
- МТ** рекомендуется назначать пациентам с РА индивидуализировано в зависимости от активности заболевания и риска развития НЛР [77, 78].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 4)
Комментарии: при отсутствии риска НЛР (пожилой возраст, нарушение функции почек, печени, гематологические нарушения и др.) лечение МТ** следует начинать с дозы 10—15 мг/нед с быстрым увеличением дозы (по 2,5-5 мг каждые 2-4 нед) до 25 мг/нед в зависимости от эффективности и переносимости [77, 78];
-лечение МТ** следует прервать при превышении концентрацией АЛТ/АСТвыше верхней границы нормы (ВГН) более чем в 3 раза и возобновить лечение в более низкой дозе после нормализации лабораторных показателей;
— при стойком увеличении уровня АСТ/АЛТ>3 ВГН следует скорректировать дозу МТ**;
— при сохранении увеличения уровня АСТ/АЛТ>3 ВГН после отмены МТ**, следует провести соответствующие диагностические процедуры;
— к факторам риска НЛР (в первую очередь «гепатотоксичности») МТ** относятся отсутствие приема фолиевой кислоты**, наличие сахарного диабета, ожирение,
гиперлипидемия (гиперлипидемия, ожирение и сахарный диабет — факторы риска неалкогольного стеатоза печени), интеркуррентные инфекции, пожилой возраст, избыточное потребление алкоголя.
- МТ** не рекомендуется назначать беременным или планирующим беременность женщинам с РА в связи с высоким риском развития НЛР и нежелательных неонатальных исходов [27, 66-68, 78].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 3)
- На фоне лечения МТ** рекомендуется прием фолиевой кислоты** (не менее 5 мг/неделя), которую следует назначать не ранее, чем через 24 ч после перорального приема или парентерального введения МТ** [79, 80].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1)
- При недостаточной эффективности или плохой переносимости таблетированной формы МТ** до смены терапии сБПВП (аналоги фолиевой кислоты, кишечные противовоспалительные препараты аминосалициловая кислота и аналогичные препараты, селективные иммунодепрессанты, противомалярийные препараты) и назначения ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) или тсБПВП (селективные иммунодепресанты: БАРИ**, ТОФА**, УПА**), рекомендуется перевести пациентов на подкожную форму препарата [81, 82].
Уровень убедительности рекомендаций — В (уровень достоверности доказательств — 1)
- У пациентов с высокой активностью РА (DАS28≥5.1), которым показано назначение высокой дозы МТ** (≥15 мг) рекомендуется начинать лечение с подкожной формы препарата [82-84].
Уровень убедительности рекомендаций — В (уровень достоверности доказательств — 2)
Комментарии: подкожная форма МГ** превосходит пероралъпые формы МГ** по биодоступности и фармакокинетическим параметрам при применении в дозе >15 мг/нед [78];
— монотерапия МГ не уступает по эффективности комбинированной терапии МТ** с ГХ**, МГ** с СУЛЬФ**, МТ** с СУЛЬФ** и ГХ** при раннем РА, проведение которой связано с увеличением риска НЛР [85,86].
- При наличии противопоказаний для назначения МТ** или плохой переносимости препарата рекомендуется назначить ЛЕФ** (20 мг/день) или СУЛЬФ** (2-3 г/день) [1, 189].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1.)
- Терапию стандартными сБПВП (аналоги фолиевой кислоты, кишечные противовоспалительные препараты аминосалициловая кислота и аналогичные препараты, селективные иммунодепрессанты, противомалярийные препараты) рекомендуется продолжить в течение следующих 3-х месяцев, если через 3 месяца терапии достигнут умеренный эффект (снижение индекса DAS28>0,6 балла от исходного при сохранении умеренной активности болезни и снижение индекса DAS28>1,2 балла от исходного при сохранении высокой активности болезни по критериям EULAR [1,46]
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
- При наличии показаний ССЗ** и ГХ** могут быть рекомендованы к применению в монотерапии во время беременности в случае низкой активности заболевания [27,28].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
- Назначение и последующую терапию ГК при РА рекомендуется проводить только врачами-ревматологами [81-83].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
- При РА лечение ГК следует проводить в комбинации с МТ** (или другами сБПВП (кишечные противовоспалительные препараты аминосалициловая кислота и аналогичные препараты, селективные иммунодепрессанты, противомалярийные препараты)) в течение времени, необходимого для развития эффекта сБПВП (bridge-терапия), и коротким курсом при обострении заболевания в любой стадии РА [84-94].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1)
Комментарии: применение ГК в комбинации с МТ** при РА позволяет повысить эффективность и улучшить переносимость терапии по сравнению с монотерапией МТ**;
— комбинированная терапия МТ** и ГК не уступает по эффективности комбинированной терапии МТ** и ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) при раннем РА [72, 79, 80];
— назначение ГК следует проводить индивидуализировано с учетом известных факторов развития НЛР (развитие иммунодефицитных состояний, эрозивно-язвенные заболевания ЖКТ, серьезные заболевания сердечно-сосудистой системы, дислипедемия, сахарный
диабет, системный остеопороз и др.);
— длительное применение ГК в дозе более 10 мг/сут (особенно в комбинации с сБПВП (аналоги фолиевой кислоты, кишечные противовоспалительные препараты аминосалициловая кислота и аналогичные препараты, селективные иммунодепрессанты, противомалярийные препараты), ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) и тсБПВП (селективные иммунодепресанты: БАРИ**, ТОФА**, УПА**) и высокая кумулятивная доза ассоциируются с нарастание риска инфекционных осложнений;
— ГК следует отменить как можно быстрее (желательно не позднее, чем через 3-6 месяцев от начала терапии), а при необходимости более длительного применения, поддерживающая доза ГК не должна превышать 7.5 мг/сут [46, 82];
-преимущества и недостатки различных схем применения ГК (дозы, форма препарата и др.) при РА требуют дальнейшего изучения.
- Рекомендуется проводить профилактику (препараты кальция и витамина D) и, при необходимости, лечение (бисфосфонаты) глюкокортикоидного остеопороза у всех пациентов РА, принимающих ГК (> 3-х месяцев, в дозе > 5 мг/день) [41, 95]
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
- При обострении мон/олигоартрита на фоне лечения сБПВП (аналоги фолиевой кислоты, кишечные противовоспалительные препараты аминосалициловая кислота и аналогичные препараты, селективные иммунодепрессанты, противомалярийные препараты), рекомендуется проведение локальной инъекционной терапии ГК (внутрисуставное или периартикулярно при теносиновите введение) [96-101].
Уровень убедительности рекомендаций — В (уровень достоверности доказательств — 2)
Комментарии: повторное введение ГК рекомендуется проводить не чаще 1 раза в 3 мес.;
— количество инъекций в разные суставы четко не регламентировано;
— частое внутрисуставное введение ГК приводит к развитию локальных и системых НЛР.
- При отсутствии противопоказаний терапию ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) или тсБПВП (селективные иммунодепресанты: БАРИ**, ТОФА**, УПА**) рекомендуется назначать пациентам с РА при наличии факторов риска неблагоприятного прогноза (раннее развитие эрозий суставов, очень высокие титры РФ и АЦЦП, высокая клиническая и лабораторная активность) и/или недостаточной эффективности (сохранение умеренной/высокой активности в течение не менее 3 месяцев) и/или плохой переносимости МТ** (включая подкожную форму препарата) и/или комбинированной терапии МТ** с сБПВП [102-112].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1)
Комментарии: до назначения ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) и тсБПВП (селективные
иммунодепресанты: БАРИ**, ТОФА**, УПА**), МТ** (включая подкожную форму) в монотерапии или комбинации со стандартными сБПВП (кишечные
противовоспалительные препараты аминосалициловая кислота и аналогичные препараты, селективные иммунодепрессанты, противомалярийные препараты) должен применяться в адекватных дозах;
— все ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) и тсБПВП (селективные иммунодепресанты: БАРИ**, ТОФА**,
УПА**) (в комбинации с МТ) обладают одинаковой эффективностью и безопасностью [55, 61-63, 72, 74, 76, 102-107, 112]
-алгоритм применения, клинические проявления инфузионных реакций и их профилактики на фоне лечения ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) представлены в приложении Г8 и приложение Г9;
— рекомендации, касающиеся предотвращения и дополнительного обследования пациентов с РА до начала терапии ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) и тсБПВП (селективные иммунодепресанты: БАРИ**, ТОФА**, УПА**), суммированы в приложение ПО и Г11;
- Лечение ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) или тсБПВП (селективные иммунодепресанты: БАРИ**, ТОФА**, УПА**) рекомендуется проводить в комбинации с МТ** с целью увеличения эффективности терапии, так же возможна их комбинация с другими сБПВП (кишечные противовоспалительные препараты аминосалициловая кислота и аналогичные препараты, селективные иммунодепрессанты, противомалярийные препараты) [61, 112]
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 1)
- При недостаточной эффективности монотерапии МТ** и при отсутствии противопоказаний и факторов неблагоприятного прогноза рекомендовано переключение» на монотерапию СУЛЬФ** или ЛЕФ** или назначение комбинированной терапии МТ**, СУЛЬФ** и ГХ** [45, 52-54]
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
- При наличии противопоказания для назначения и плохой переносимости МТ** (включая подкожную форму препарата) и других сБПВП (СУЛЬФ**, ЛЕФ**, ГХ**) рекомендовано проведение монотерапии ГИБП, которые официально зарегистрированы для монотерапии РА, в первую очередь ингибиторами интерлейкина (ТЦЗ**, СРЛ**, ОЛК**) или тсБПВП (селективные иммунодепресанты: БАРИ**, ТОФА**, УПА**) [46,112-116].
Уровень убедительности рекомендаций — В (уровень достоверности доказательств — 1)
- При отсутствии улучшения (критерии EULAR) через 3 месяца или не достижении ремиссии/низкой активности РА (в зависимости от выбранной цели терапии) через 6 месяцев от начала терапии ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) (или тсБПВП (БАРИ**, ТОФА**, УПА**) рекомендуется «переключить» (switch) пациента на лечение ГИБП с другим механизмом действия или тсБПВП при «первичной» неэффективности ГИБП или тсБПВП, В случае вторичной неэффективности (ускользания/потери эффекта) возможно переключение на ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) как одной группы, так и с иным механизмом действия или тсБПВП.( БАРИ**, ТОФА**, УПА**) [46, 116, 118],
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
- В случае достижения ремиссии (длительность не менее 12 месяцев на фоне терапии), после отмены ГК (или продолжения их приема в дозе < 5 мг/день), рекомендуется постепенное тщательно контролируемое снижение («титрование») дозы или отмена ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) [118-128].
Уровень убедительности рекомендаций — В (уровень достоверности доказательств — 2)
Комментарии: возможность отмены ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) более вероятна у пациентов с ранним РФ/АЦЦП негативным вариантом РА;
— для поддержания ремиссии после снижения дозы (или отмены) ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты)
необходима адекватная терапия МТ**, включая применение подкожной формы препарата;
— при развитии обострения заболевания на фоне уменьшения дозы (или отмены) ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты), повторное назначение тех же препаратов (или других ГИБП) в стандартной дозе приводит к быстрому подавлению активности воспаления у большинства пациентов;
— при развернутом РФ/АЦЦП позитивном варианте РА отмена ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) может чаще приводить к развитию обострения, в связи с этим должна проводиться более постепеннно и осторожно.
- При достижении длительной стойкой ремиссии (не менее 12 месяцев) после прекращения лечения ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) рекомендуется рассмотреть возможность снижения дозы сБПВП (МТ**, СУЛЬФ**, ЛЕФ**, ГХ**) по согласованию с пациентом [44, 51].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
Комментарии: у пациентов с развернутой и поздней стадиями РА отмена стандартных сБПВП (МТ**, СУЛЬФ**, ЛЕФ**, ГХ**) нецелесообразна, т.к. достаточно часто приводит к обострению заболевания [124, 129].
Применение биоаналогов ГИБП при РА [130-132]
- Выбор оригинального ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) или его биоаналога для лечения пациентов рекомендуется проводить с учетом:
— мнения квалифицированного врача-ревматолога;
— принципов доказательной медицины (доказанная терапевтическая эффективность и безопасность биоаналога), т.к. эффективность и безопасность биоаналогов при разных заболеваниях может отличаться от соответствующих показателей
— оригинальных ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные оригинальный ГИБП не может автоматически заменяться на его биоаналог: замена препаратов может осуществляться только на основе консенсуса врача-ревматолога и пациента [130-132].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
3.2 Хирургическое лечение
- Эндопротезирование или артродез суставов рекомендуется при наличии выраженных структурных изменений, сопровождающихся стойкой болью и нарушениями функции суставов [133, 134,190].
Уровень убедительности рекомендаций — В (уровень достоверности доказательств — 3)
- Проведение лаважа с использованием артроскопии или синовэктомии рекомендуется пациентам с РА при наличии стойкого синовита сустава и отсутствии эффекта от консервативной терапии [135,191-194].
Уровень убедительности рекомендаций — В (уровень достоверности доказательств — 3)
Комментарии: рекомендации, касающиеся лечения пациентов с РА в периоперационном периоде, суммированы в приложении Г13 и Г14.
7. Дополнительная информация (в том числе факторы, влияющая на течение и исход заболевания)
7.1. Комопбидность
Характер сопутствующих (коморбидных) заболеваний имеет важнейшее значение для выбора тактики лечения с точки зрения, как эффективности, так и безопасности терапии. [37, 158,159]
- Профилактическая противовирусная терапия (энтекавир, тенофовир) рекомендовано а назначать всем пациентам, являющимся носителями хронической (HBsАg++ve) и окультной (HBaАg-ve, Anti-HBc+ve, HBV DNA+ve) инфекции вирусом гепатита В, которые нуждаются в терапии ГИБП или тБПВП. У пациентов с излеченной инфекцией вирусом гепатита В (HBsАg-ve, Anti-HBc+ve, но HBV DNA-ve) профилактическое лечение не показано, за исключением планирования применения РТМ**. У пациентов, не получающих противовирусную терапию, рекомендуется назначать СУЛЬФ** и ГХ**, а не МТ** и ЛЕФ** [54,160-165]
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
- Всем пациентам с РА и латентной туберкулезной инфекцией перед назначением ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) и тсБПВП (селективные иммунодепресанты: БАРИ**, ТОФА**, У ПА**) рекомендуется проводить профилактическое туберкулостатическое лечения изониазидом** или рифампицином** (выбор схемы профилактического лечения осуществляется врачом- фтизиатром с учетом противопоказаний, лекарственных взаимодействий и рисков НЛР у конкретного пациента); лечение ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) рекомендуется начинать не раньше, чем через 1 месяц после начала туберкулостатической профилактики латентной туберкулезной инфекции. [25, 166-168] (Приложение Г14).
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
Комментарии. риск реактивации латентной туберкулезной инфекции на фоне лечения ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные
иммунодепресанты) и тсБПВП (селективные иммунодепресанты: БАРИ**, ТОФА**, УПА**) [169, 170]: высокий: ИНФ**, АДА**, ГЛМ**, ЦЗП**; умеренный: ЭТЦ**,АБЦ**, ТЦЗ**, СЛР**; низкий: РТМ** и тсБПВП (селективные иммунодепресанты: БАРИ**, ТОФА**, УПА**)
- Пациентам с РА, страдающим любыми злокачественными новообразованиями, лечение сБПВП (за исключением ГХ** и СУЛЬФ**) и ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) рекомендуется приостановить на время проведения химиотерапии и радиотерапии и в последующем проводить при консультативной поддержке врача-онколога [54]
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
- сБПВП (МТ**, СУЛЬФ**, ЛЕФ**, ГХ**), ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) и тсБПВП (селективные иммунодепресанты: БАРИ**, ТОФА**, УПА**) у пациентов с РА с немеланомным раком кожи и солидными опухолями в анамнезе рекомендуется применять с осторожностью [54].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
- У пациентов с РА, имеющих анамнестические данные о наличии лимфопролиферативных заболеваний, рекомендуется прием ГХ**, СУЛЬФ**, РТМ**; лечение иФНОα не рекомендуется; другае сБПВП (МТ**), ГИБП (ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) и тсБПВП (селективные иммунодепресанты: БАРИ**, ТОФА**, УПА**) следует назначать с осторожностью [54].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
- Всем пациентам с РА при отсутствии противопоказаний до начала лечения (МТ**, СУЛЬФ**, ЛЕФ**, ГХ**), ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) и тсБПВП (селективные иммунодепресанты: БАРИ**, ТОФА**, УПА**) рекомендуется проведение вакцинации инактивированными вакцинами против инфекции вирусом гриппа и инактивированными вакцинами против пневмококковой инфекции [171-173].
Уровень убедительности рекомендаций — В (уровень достоверности доказательств — 2)
- Пациентам с РА проведение вакцинации против инфекции вирусом гепатита А и В рекомендуется в группах высокого риска (медицинские работники и др.). В случаях верифицированного контакта с инфекцией, обусловленной вирусом гепатита В (инфицированные иглы, укушенные раны и т. д.), показана бустерная вакцинация или пассивная иммунизация [171-173].
Уровень убедительности рекомендаций -С (уровень достоверности доказательств — 5)
- Проведение вакцинации против инфекции вирусом опоясывающего герпеса (herpes zoster) рекомендуется пациентам с РА, старше 60 лет, в первую очередь которым планируется терапия тсБПВП (селективные иммунодепресанты: БАРИ**, ТОФА**, УПА**) [171-174].
Уровень убедительности рекомендаций — В (уровень достоверности доказательств — 2)
- Проведение вакцинации живыми вакцинами (корь, краснуха, паротит, полиомиелит, ротавирусы, желтая лихорадка и др.) на фоне лечения ГИБП (иФНОа, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) не рекомендуется [171-173].
Уровень убедительности рекомендаций — В (уровень достоверности доказательств — 2)
- Назначение живых аттенуированных вакцин не рекомендуется в течение первых 6 мес. жизни детям, рожденным от матерей с РА, получавших ГИБП (иФНОа, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) во второй половине беременности [171-173].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
- Рекомендуется планировать беременность у больных РА, поскольку его течение на фоне гестации и исходы последней в значительной степени определяются активностью заболевания и проводимой терапией [27, 175].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
- Наступление беременности рекомендуется в период ремиссии или минимальной клиниколабораторной активности заболевания, продолжающейся не менее 3-6 месяцев до предполагаемой даты зачатия при отсутствии симптомов функциональной недостаточности внутренних органов на фоне оптимальной лекарственной терапии [26, 27, 176,177].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
- Осмотр ревматолога рекомендуется беременным пациенкам с РА не реже 1 раза в I триместр и после родоразрешения [178].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 53)
Комментарии: рекоммендации, касающиеся применения противоревматических препаратов во время беременности и лактации суммированы в приложении Г15.
Медицинская реабилитация
4. Медицинская реабилитация и санаторно-курортное лечение, медицинские показания и противопоказания к применению методов реабилитации, в том числе основанных на использовании природных лечебных факторов
- Рекомендуется проводить образование пациентов, том числе в рамках школ пациентов, страдающих РА [136-138].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 3)
Комментарии: образовательные программы, направленные на поддержание трудоспособности и функционального статуса, помогающие справиться с болью и
снизить инвалидность являются дополнительным компонентом комплексного лечения пациентов с РА;
— пациента необходимо обеспечить информацией о характере заболевания (включая коморбидную патологию), принципах терапии и исходах, достоинствах и
потенциальных недостатках терапии, физической активности в повседневной жизнедеятельности;
— образовательные программы повышают уровень знаний пациентов о РА, социальную адаптацию, возможность самоконтроля над заболеванием, приверженность к медикаментозной терапии, регулярным занятиям ЛФК, в том числе на ранней стадии заболевания.
Результаты научных исследований, накопленный клинический опыт в целом свидетельствуют об эффективности использования нефармакологических методов
лечения при РА. Однако это касается в первую очередь таких вмешательств как лечебная физкультура и отдельные методы физиотерапии.
- С момента установления диагноза пациентам с РА рекомендуется назначение ЛФК, включая аэробные тренировки, сначала под руководством инструктора по ЛФК, затем дома с профессиональной поддержкой, которые могут сочетаться с силовыми упражнениями, комплексами для улучшения подвижности кистей [139-147].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 3)
Комментарии: динамические, силовые и аэробные тренировки, адаптированные к потребностям и возможностям пациента, улучшают силу мышц, аэробные
возможности, психологическое состояние и общий физический статус без усиления активности заболевания и деструкции суставов в краткосрочной перспективе;
— регулярная физическая активность улучшает функциональный статус и способствует сохранению трудоспособности пациентов и снижает риск коморбидных заболеваний в первую очередь сердечно-сосудистой системы.
- Эрготерапия (ЭТ) рекомендована как дополнение к медикаментозному лечению. При функциональных ограничениях при РА необходима ЭТ, обучающая правильному поведенческому стереотипу [143,144].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 3)
Комментарии: ЭТ оказывает положительное влияние на функциональный и психологический статусы, повышает «самоэффективность», уровень бытовой
активности, социальную и профессиональную адаптацию;
— раннее обучение методам защиты суставов, стратегиям энергосбережения, изменение поведенческого стереотипа, применение вспомогательных устройств улучшают функциональный статус в долгосрочной перспективе.
- При боли и/или деформациях суставов стопы рекомендуется использовать ортопедические стельки и ортопедическую обувь [1, 146].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
- Бальнеотерапия (БТ) рекомендуется в качестве дополнительного метода лечения пациентов с низкой активностью РА при наличии показаний [148]
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 1)
Комментарии: исследования по использованию различных природных ресурсов при РЗ малочисленны, их методологический уровень низкий (небольшие группы пациентов, разнородные методы оценки), улучшения, достигнутые в ходе их применения незначительны, независимо от типа вмешательства, что не позволяет сделать однозначных выводов о преимуществах использования того или иного природного ресурса и, самое главное, его безопасности.
— пациенты должны быть проинформированы о существующих физиотерапевтических методах, но доказательной базы их эффективности недостаточно, в выборе физиотерапевтического метода должны учитываться предпочтения пациента;
— БТможет применяться у пациентов с РА с низкой активностью для уменьшения боли и улучшения, функциональный статуса.
Госпитализация
6. Организация оказания медицинской помощи
- Лечение пациентов с РА настоятельно рекомендуется проводить ревматологами (в виде исключения — врачами-терапевтами и врачами общей практики (семейный врач), но при консультативной и организационной поддержке врача-ревматолога) с привлечением других специалистов (травматолог-ортопед, врач по медицинской реабилитации, врач- кардиолог, врач-офтальмолог, врач-невролог и др.) и основываться на тесном взаимодействии врача и пациента [149-152].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
Комментарии: функциональное состояние и прогноз у пациентов, находящихся под наблюдением у ревматологов, лучше, чему врачей общей практики [153-155];
— мулътидисциплинарный подход к ведению пациентов с РА позволяет снизить негативное влияние коморбидной патологии на течение заболевания, эффективность фармакотерапии и прогноз заболевания.
6.1 Показания к направлению к врачу-ревматологу
- Рекомендуется пациента с клиническим подозрением на РА направлять на консультацию к врачу-ревматологу для уточнения диагноза и назначения терапии [149- 152].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
Комментарии: клиническое подозрение на РА формируется врачом «первого контакта» (врачом общей практики (семейный врач), терапевтом или врачом другой специальности) на основании следующих симптомов: припухлость >1 сустава на момент осмотра, утренняя скованность продолжительностью >30 минут, положительные симптомы «сжатия» кистей и/или стоп [19, 156]. Дополнительными признаками, позволяюшими заподозрить РА, являются: стойкие (длительностью более 6 недель) полиартралгии, выявление при обследовании повышения СОЭ, СРБ, ревматоидного фактора, АЦЦП.
6.2 Показания к госпитализации в специализированное отделение по профилю «ревматология»:
- диагностика РА/проведение дифференциальной диагностики и подбор терапии
- высокая степень клинической и лабораторной активности РА с или без внесуставных проявлений
- подбор и, при необходимости, коррекция дозы сБПВП (МТ**, СУЛЬФ**, ЛЕФ**, ГХ**)
- решение вопроса о назначении ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) и тсБПВП (селективные иммунодепресанты: БАРИ**, ТОФА**, УПА**) и инициация данных методов терапии
- развитие осложнений РА или тяжелых НЛР у пациента, получающего ГК, сБПВП (МТ**, СУЛЬФ**, ЛЕФ**, ГХ**), ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) и тсБПВП (селективные иммунодепресанты: БАРИ**, ТОФА**, УПА**), при необходимости коррекции терапии из-за развития НЛР
- программная терапия (курсовое лечение) с применением ГИБП (иФНОα, ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты) и тсБПВП (селективные иммунодепресанты: БАРИ**, ТОФА**, УПА**) в условиях круглосуточного и дневного стационара.
6.3. Критерии выписки пациентов из стационапа
— Уменьшение числа болезненных и припухших суставов, общей оценки активности по мнению врача, острофазовых показателей (СОЭ, СРБ) на 20% и более
(улучшение как минимум двух показателей из перечисленных, является обязательным).
— проведение в полном объеме запланированного лечения в случае госпитализации в рамках программной терапии (курсового лечения)
Диагноз РА следует стремиться поставить как можно раньше, желательно в течении первых 1-3 месяца от появления первых симптомов болезни [11,12]. Для постановки диагноза рекомендуется учитывать классификационные критерии РА ACR/EULAR. [19] (Приложение Г1).
При поставке диагноза РА необходимо учитывать три основных фактора:
1. Выявить у пациента хотя бы один припухший сустав при клиническом обследовании.
2. Исключить другие заболевания, которые могут проявляться воспалением суставов.
3. Набрать не менее 6 баллов из 10 возможных по 4 позициям, характеризующих поражение суставов и лабораторные нарушения, характерные для РА.
- Основное значением имеет определение числа воспаленных суставов, которое учитывает, как припухлость, так и болезненность сустава, выявляемых при объективном исследовании.
- Оценка статуса пациента основывается на выделении 4 категорий суставов:
— Не учитываются изменения дистальных межфаланговых суставов, первых запястно-пястных суставов и первых плюснефаланговых суставов
— Плечевые, локтевые, тазобедренные, коленные, голеностопные
Пястнофаланговые, проксимальные межфаланговые, 2-5 плюснефаланговые, межфаланговые суставы больших пальцев кистей, лучезапястные суставы
— Суставы, которые могут быть поражены при РА, но не включены ни в одну из перечисленных выше групп (например, височно-нижнечелюстной, акромиально-
ключичный, грудинно-ключичный и др.)
- Условно выделяют четыре категории пациентов, имеющих высокую вероятность развития РА, но которые не соответствуют критериям диагноза РА (ACR/EULAR, 2010) на момент первичного обследования:
- Пациенты, у которых при рентгенологическом исследовании выявляются «типичные» для РА эрозии в мелких суставах кистей и/или стоп.
- Пациенты с развернутым РА, которые ранее соответствовали классификационным критериям этого заболевания [157]
- Пациенты с ранней стадией РА, которые на момент осмотра не полностью соответствуют классификационным критериям РА. В этом случае диагноза РА основывается на кумулятивной оценке клинико-лабораторных признаков РА, выявленных за весь период наблюдения.
- Пациенты с НДА, характер поражения суставов у которых не соответствует критериям РА (или какой-либо другого заболевания) в течение длительного времени. У этих пациентов необходимо учитывать наличие факторов риска развития РА, основными из которых являются обнаружение РФ и/или АЦБ.
6.5 Примеры формулировки клинических диагнозов:
— РА серопозитивный, развернутая стадия, активность 2, эрозивный (рентгенологическая стадия II), АЦЦП позитивный, ФК-П, (М05.8).
— РА серонегативный, ранняя стадия, активность 3, неэрозивный (рентгенологическая стадия 1), АЦЦП позитивный, ФК-1, (М06.0).
— РА серопозитивный, поздняя стадия, актиность — 3 с системными проявлениями (ревматоидные узелки), эрозивный (рентгенологическая стадия III), АЦЦП
позитивный, ФК- И, осложнения: вторичный амилоидоз с поражением почек, (М05.3).
— Вероятный РА, серонегативный, ранняя стадия, активность — 2, неэрозивный (рентгенологическая стадия 1), АЦЦП негативный, ФК — 1, (М06.9).
Профилактика
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
- Для первичной профилактики прогрессирования РА пациентам рекомендуется избегать факторов, которые могут провоцировать обострение болезни (интеркуррентные инфекции, стресс и др.), отказ от курения и ограничить прием алкоголя, поддержание нормальной массы тела, соблюдение гигиены полости рта [1,12].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
Комментарии: курение, ожирение и пародонтит — факторы риска развития и прогрессирования РА, снижения эффективности лечения сБПВП (МГ**, СУЛЬФ**,
ЛЕФ**, ГХ**) и иФНОα, увеличения летальности, в том числе обусловленной сердечнососудистыми заболеваниями.
- Рекомендуется проведение вторичной профилактики прогрессирования РА и развития коморбидной патологии, которая должна быть основана на подавлении активности воспаления [37,149-152].
Уровень убедительности рекомендаций — А (уровень достоверности доказательств — 2)
Комментарии; достижение низкой активности или ремиссии приводит к снижению преждевременной летальности при РА [37]
- В качестве основного метода оценки активности воспаления при РА рекомендуется применять индекс DAS28 [21] (Приложение Г2)
Уровень убедительности рекомендаций — С (уровень достоверности доказательств -т5)
- У всех пациентов с РА рекомендуется оценивать эффективность терапии с использованием стандартизованных индексов активности (DAS 28, SDAI, CDAI) каждые 1 — 3 месяца до достижения состояния ремиссии (или низкой активности), а затем каждые 3- 6 месяцев и функциональные нарушения каждые 6 мес. с помощью Опросника Состояния Здоровья (Health Assessment Questionnaire — HAQ) (Приложение ГЗ) [44].
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
Комментарии: при оценке активности РА и эффективности проводимого лечения наиболее часто используются критерии EULAR, основанные на динамике индекса DAS28- СОЭ или DAS28-СРБ, упрощенные (SDAI — Simplified Disease Activity Index) и клинический (СDАI — Clinical Disease Activity Index) индексы активности заболевания.
- Для оценки ремиссии рекомендуется использовать критерии ACR/EULAR [21] (Приложение Г1).
Уровень убедительности рекомендаций — С (уровень достоверности доказательств — 5)
Информация
Источники и литература
-
Клинические рекомендации Ассоциации ревматологов России (Общероссийская общественная организация)
- Насонов ЕЛ, Каратеев ДЕ, Балабанова РМ. Ревматоидный артрит. В кн.:
Ревматология. Национальное руководство. Под ред. Е.Л. Насонова, В.А. Насоновой.
Москва: ГЭОТАР-Медиа; 2008.С. 290-3318 . Фоломеева ОМ, Галушко ЕА, Эрдес ШФ. Распространенность ревматических
заболеваний в популяциях взрослого населения России и США. Научно-
практическаяревматология. 2008;46(4):4-13. 001:10.14412/1995-4484-2008-529
9. Общая заболеваемость взрослого населения России в 2017 г. Статистические
материалы, часть IV, Москва.2018.10. Каратеев Д.Е., Олюнин Ю.А. О классификации ревматоидного артрита. Научно-
практическая ревматология. 2008;46(1):5-16. 25. Чичасова НВ, Насонов Е31. Безопасность применения генно-инженерных
биологических препаратов при ревматоидном артрите. Современная ревматология. 2010;
1:46-58.39. Кириллова И.Г., Новикова Д.С., Попкова Т.В., Удачкина Е.В., Маркелова Е.И.,
Горбунова Ю.Н., Корсакова Ю.О., Глухова С.Н. Хроническая сердечная недостаточность
у больных ранним ревматоидным артритом до назначения базисной
противоревматической терапии. Рациональная Фармакотерапия в Кардиологии
2020; 16(1 ):51 -58. DOI:10.20996/1819-6446-2020-01 -02
42. 31исицына Т. А., Вельтищев Д. Ю., Серавина О. Ф., Ковалевская О. Б., Зелтынь
А. Е., Фофанова Ю. С., Новикова Д. С., Попкова Т. В., Насонов Е. 31. Психические
расстройства у больных ревматоидным артритом // Научно-практическая ревматология.
2011. №3.
45. Насонов Е.Л. Фармакотерапия ревматоидного артрита: Российские и
международные рекомендации. Научно-практическая ревматология.
52. Насонов Е31, Мазуров ВИ, Каратеев ДЕ и др. Проект рекомендаций по лечению
ревматоидного артрита Общероссийской общественной организации «Ассоциация
ревматологов России» — 2014 (часть 1). Научно-практическая ревматология. 2014;52:477-
494.
53. Насонов Е31, Каратеев ДЕ, Чичасова НВ. Рекомендации ЕULAR по лечению
ревматоидного артрита — 2013: общая характеристика и дискуссионные проблемы.
Научно-практическая ревматология. 2013;51:609-622. 56. Насонов ЕЛ, Лхно НН, Каратеев АЕ, Алексеева ЛИ, Баринов АН, и соавт.
Общие принципы лечения скелетно-мышечной боли: междисциплинарный консенсус.
Научно-практическая ревматология.
- Насонов ЕЛ, Каратеев ДЕ, Балабанова РМ. Ревматоидный артрит. В кн.:
Информация
Список сокращений
АБЦ — абатацепт**
АДА — адалимумаб**
АЛА — анти-лекарственные антитела
АЛТ — аланинаминотрансфераза
АСТ — аспартатаминотрансфераза
АЦБ — антитела к циклическим цитруллинированным белкам
АЦЦП — антитела к циклическому цитруллинированному пептиду
БАРИ — барицитиниб**
сБПВП — синтетические базисные противовоспалительные препараты
ВАШ — визуально-аналоговая шкала
ВГН — верхняя граница нормы
ВИЧ — вирус иммунодефицита человека
ВП — внесуставные проявления
ГИБП — генно-инженерные биологические препараты
ГК — глюкокортикоиды
ГЛМ — голимумаб**
ГХ — гидроксихлорохин**
ИБС — ишемическая болезнь сердца
ИЗЛ — интерстициальное заболевание легких
ИЛ — интерлейкин
иФНОα- ингибиторы фактора некроза опухоли альфа (ФНО-альфа)
ИНФ — инфликсимаб**
IgG — иммуноглобулин G
ЛЕФ — лефлуномид**
ЛПВП — липопротеины высокой плотности
ЛПНП — липопротеины низкой плотности
ЛФК — лечебная физкультура
ММП — матриксные металлопротеиназы
МПС — макрофагоподобные синовиоциты
МРТ — магнитно-резонансная томография
МТ — метотрексат**
НЛР — нежелательные лекарственные реакции
НПВП — нестероидные противовоспалительные препараты
ОБП — оценка боли пациентом
ОК — остеокласты
ОЛК — олокизумаб
ООЗП — общая оценка заболевания пациентом
ПЛФС — плюснефаланговый сустав
ПМФС — проксимальный межфаланговый сустав
ПФС — пястнофаланговый сустав
РА — ревматоидный артрит
РКИ — рандомизированные клинические исследования
РТМ — ритуксимаб**
РФ — ревматоидный фактор
СИР — стандартные инфузионные реакции
СКВ — системная красная волчанка
СОЭ — скорость оседания эритроцитов
СРБ — С-реактивный белок
СРЛ — сарилумаб**
СУЛЬФ — сульфасалазин**
ТГ — триглецириды
ТОФА — тофацитиниб**
тсБПВП — таргетные синтетические БПВП
ТЦЗ — тоцилизумаб**
ФНОα — фактор некроза опухоли-α
ФПС — фибробластополобные синовиоциты
УЗИ — ультразвуковое исследование
ЧБС — число болезненных суставов
ЧПС — число припухших суставов
УПА — упадацитиниб* *
ХСН — хроническая сердечная недостаточность
ЦЗТ — цертолизумаба пэгол**
ЭГДС — эзофагогастродуоденоскопия
ЭТ — эрготерапия
ЭТЦ — этанерцепт**
АСR — American College of Rheumatology
СDАI — Clinical Disease Activity Index
DAS — Disease Activity Index
EULAR -European League Against Rheumatism
НАQ -Health Assessment Questionnaire
NICE -National Institute for Health and Care Excellence
SDAI — Simplified Disease Activity Index
Термины и определения
Недифференцированный артрит (НДА) — воспалительное поражение одного или нескольких суставов, которое не может быть отнесено к какой-либо определенной нозологической форме, поскольку не соответствует классификационным критериям ревматоидного артрита (РА) или какого-либо другого заболевания.
Ранний РА — длительность менее 12 месяцев (с момента появления симптомов болезни, а не постановки диагноза РА).
Развернутый РА — длительность более 12 месяцев, соответствующий классификационным критериям РА (ASR/EULAR, 2010 г).
Клиническая ремиссия РА — отсутствие признаков активного воспаления, критерии ремиссии: — число болезненных суставов (ЧБС), число припухших суставов
(ЧПС), С-реактивный белок (СРБ, мг/%) и общая оценка заболевания пациентом (ООЗП, по ВАШ) меньше или равно 1 или СDАI меньше или равно 2,8 (критерии AСR/EULAR, 2011 г).
Стойкая ремиссия РА — клиническая ремиссия длительностью 6 месяцев и более.
Противоревматические препараты — противовоспалительные препараты с различной структурой, фармакологическими характеристиками и механизмами действия, использующиеся для лечения РА и других ревматических заболеваний.
Нестероидные противовоспалительные препараты (НПВП) — группа синтетических лекарственных средств, обладающих симптоматическим обезболивающим, жаропонижающим и противовоспалительным эффектами, связанными в первую очередь с ингибицией активности циклооксигеназы — фермента, регулирующего синтез простагландинов.
Глюкокортикоиды (ГК) — синтетические стероидные гормоны, обладающие естественной противовоспалительной активностью.
Низкие дозы ГК — Низкие дозы ГК — менее 7,5 мг/день преднизолона (или эквивалентная доза другого ГК).
Средние дозы ГК — 7.5 — 30 мг/день преднизолона (или эквивалентная доза другого ГК).
Высокие дозы ГК — более 30 мг/день преднизолона (или эквивалентная доза другого ГК).
Синтетические базисные противовоспалительные препараты (сБПВП) — группа синтетических противовоспалительных лекарственных препаратов химического происхождения, подавляющих воспаление и прогрессирование деструкции суставов.
Генно-инженерные биологические препараты (ГИБП) — группа лекарственных средств биологического происхождения, в том числе моноклональные антитела (химерные, гуманизированные, полностью человеческие) и рекомбинантные белки (обычно включают Fс фрагмент IgG человека), полученные с помощью методов генной инженерии, специфически подавляющие иммуновоспалительный процесс и замедляющие прогрессирование деструкции суставов.
Ревматоидные факторы (РФ) — аутоантитела IgM, реже IgA и IgG изотипов, реагирующие с Fс-фрагментом IgG.
Антитела к цитруллинированным белкам (АЦБ) — аутоантитела, которые распознают антигенные детерминанты аминокислоты цитруллина, образующейся в
процессе посттрансляционной модификации белков, наиболее часто определяются антитела к циклическому цитруллинированному пептиду (АЦЦП) и антитела к модифицированному цитруллинированному виментину (АМЦВ).
Нежелательная лекарственная реакция (НЛР) — любое неблагоприятное явление, которое развивается в момент клинического использования лекарственного
препарата и не относится к его заведомо ожидаемым терапевтическим эффектам.
Липидный профиль — биохимический анализ, позволяющий объективизировать нарушения в жировом обмене организма, к которому относятся холестерин (ХС), липопротеиды высокой плотности (ЛПВП), липопротеиды низкой плотности (ЛПНП), триглицериды (ТГ).
Стандартные инфузионные реакции (СИР) — НЛР, связанные с проведением инфузии лекарственного препарата.
Таргетные синтетические БПВП (тсБПВП) — группа синтетических противовоспалительных лекарственных средств химического происхождения, по механизму действия специфически блокирующих функционирование внутриклеточных сигнальных путей «провоспалительных» и иммунорегуляторных цитокинов.
Критерии оценки качества медицинской помощи
Приложение А1. Состав рабочей группы по разработке и пересмотру клинических рекомендаций
1. Насонов Евгений Львович — научный руководитель федерального государственного бюджетного научного учреждения «Научно-исследовательский институт ревматологии им. В.А. Насоновой», доктор мед наук, профессор, академик РАН, г. Москва, президент Общероссийской общественной организации «Ассоциация ревматологов России»;
2. Лила Александр Михайлович — директор федерального государственного бюджетного научного учреждения «Научно-исследовательский институт ревматологии им. В.А. Насоновой», заведующий кафедрой ревматологии федерального государственного бюджетного образовательного учреждения дополнительного последипломного образования «Российская медицинская академия непрерывного профессионального образования» Министерства здравоохранения Российской Федерации, доктор мед наук, профессор, г. Москва, член Правления и Президиума Общероссийской общественной организации «Ассоциация ревматологов России»;
3. Каратеев Дмитрий Евгеньевич — руководитель Московского областного ревматологического центра, заведующий отделением ревматологии отдела терапии профессор кафедры терапии факультета усовершенствования врачей государственного бюджетного учреждения здравоохранения московской области «Московский областной научно-исследовательский клинический институт им. М.Ф. Владимирского», доктор медицинских наук, г. Москва, член Правления и Президиума Общероссийской общественной организации «Ассоциация ревматологов России»;
4. Мазуров Вадим Иванович — заведующий кафедрой терапии, ревматологии, экспертизы временной нетрудоспособности и качества медицинской помощи им.
Э.Э.Эйхвальда федерального государственного бюджетного образовательного учреждения высшего образования «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Министерства здравоохранения Российской Федерации, заведующий научно-исследовательской лаборатории ревматологии федерального государственного бюджетного учреждения «Национальный медицинский исследовательский центр имени В. А. Алмазова» Министерства здравоохранения Российской Федерации, доктор медицинских наук, профессор, академик РАН, г. Санкт- Петербург, вице-президент Общероссийской общественной организации «Ассоциация ревматологов России»;
5. Амирджанова Вера Николаевна — ведущий научный сотрудник лаборатории патофизиологии боли и полиморфизма скелетно-мышечых заболеваний федерального государственного бюджетного научного учреждения «Научно-исследовательский институт ревматологии им. В.А. Насоновой», доктор медицинских наук, г. Москва, член Правления и Президиума Общероссийской общественной организации «Ассоциация ревматологов России»;
6. Белов Борис Сергеевич — заведующий лаборатории изучения роли инфекций федерального государственного бюджетного научного учреждения «Научно-
исследовательский институт ревматологии им. В.А. Насоновой», доктор медицинских наук, г. Москва, член Правления Общероссийской общественной организации «Ассоциация ревматологов России»;
7. Гордеев Андрей Викторович — заведующий лаборатории ранних артритов федерального государственного бюджетного научного учреждения «Научно-
исследовательский институт ревматологии им. В.А. Насоновой», доктор медицинских наук, профессор, г. Москва, член Правления и Президиума Общероссийской общественной организации «Ассоциация ревматологов России»;
8. Галушко Елена Андреевна — ведущий научный сотрудник лаборатории ранних артритов федерального государственного бюджетного научного учреждения «Научно- исследовательский институт ревматологии им. В.А. Насоновой», доктор медицинских наук, г. Москва, член Правления и Президиума Общероссийской общественной организации «Ассоциация ревматологов России»;
9. Дубинина Татьяна Васильевна — заведующая лабораторией медико-социальных проблем ревматологии федерального государственного бюджетного научного учреждения «Научно-исследовательский институт ревматологии им. В.А. Насоновой», кандидат медицинских наук, г. Москва, и.о. генерального секретаря Общероссийской общественной организации «Ассоциация ревматологов России»;
10. Жиляев Евгений Валерьевич — главный врач Европейского медицинского центра, доктор медицинских наук, профессор, г. Москва, член Правления и Президиума Общероссийской общественной организации «Ассоциация ревматологов России»;
11. Лукина Галина Викторовна — руководитель отдела ревматологии государственного бюджетного учреждения здравоохранения «Московский Клинический Научно- практический Центр имени А.С. Логинова» департамента здравоохранения г. Москва, доктор медицинских наук, профессор, г. Москва, член Правления и Президиума Общероссийской общественной организации «Ассоциация ревматологов России»;
12. Муравьев Юрий Владимирович — ведущий научный сотрудник изучения коморбидных инфекций и мониторинга безопасности лекарственной терапии
федерального государственного бюджетного научного учреждения «Научно- исследовательский институт ревматологии им. В.А. Насоновой», доктор медицинских наук, профессор, г. Москва, член Общероссийской общественной организации «Ассоциация ревматологов России»;
13. Пчельникова Полина Игоревна — член Президиума ОООИ «Российская ревматологическая ассоциация «Надежда»», член Правления EULAR PARE, Ph.D., г.
Москва.
14. Чичасова Наталья Владимировна — старший преподаватель учебно-методического отдела федерального государственного бюджетного научного учреждения «Научно- исследовательский институт ревматологии им. В.А. Насоновой», доктор медицинских наук, профессор, г. Москва, член Правления и Президиума Общероссийской общественной организации «Ассоциация ревматологов России»;
Конфликт интересов: все члены рабочей группы заявляют об отсутствии конфликта интересов при подготовке клинических рекомендаций по РА.
Приложение А2. Методология разработки клинических рекомендаций
Клинические рекомендации по оказанию медицинской помощи пациентам с РА составлены в соответствии с требованиями по разработке клинических рекомендаций медицинскими профессиональными некоммерческими организациями, часть 2 статьи 76 Федерального закона от 21.11.2011г. № 323-ФЗ «Об основах охраны здоровья граждан в Российской Федерации», приказом Министерства здравоохранения Российской Федерации №103н от 28.02.2019г. «Об утверждении порядка и сроков разработки клинических рекомендаций, их пересмотра, типовой формы клинических рекомендаций и требований к их структуре, составу и научной обоснованности включаемой в клинические рекомендации информации». Клинические рекомендации основаны на доказательном клиническом опыте, описывающем действия врача, по диагностике, дифференциальной диагностике, лечению, реабилитации и профилактике РА.
Целевая аудитория данных клинических рекомендаций:
1. Врач-ревматолог;
2. Врач-терапевт;
3. Врач общей практики (семейный врач);
4. Врачи других специальностей, занимающихся диагностикой и ведением пациентов с РА
Медицинским работникам следует придерживаться данных рекомендаций в процессе принятия клинических решений. В то же время, рекомендации не заменяют личную ответственность медицинских работников при принятии клинических решений с учетом индивидуальных особенностей течения РА и мнения пациентов. Настоящие рекомендации учитывают накопленный российский и международный опыт ведения пациентов с РА и базируются на клинических рекомендациях, опубликованных Общероссийской общественной организации «Ассоциация ревматологов России» [52], Европейской антиревматической Лиги (EULAR -European League Against Rheumatism) 2016 г [12, 44, 46], Британского ревматологического общества [24] и клинических рекомендациях Американского колледжа ревматологов [54].
Приложение А2-1 Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
Приложение А2-2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
Приложение А2-3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
Механизм обновления клинических рекомендаций предусматривает их систематическую актуализацию — не реже чем один раз в три года, а также при появлении
новых данных с позиции доказательной медицины по вопросам диагностики, лечения, профилактики и реабилитации конкретных заболеваний, наличии обоснованных дополнений/замечаний к ранее утверждённым КР, но не чаще 1 раза в 6 месяцев.
Приложение АЗ. Справочные материалы, включая соответствие показаний к применению и противопоказаний, способов применения и доз лекарственных препаратов инструкции по применению лекарственного препарата
АЗ-1 Предварительная номенклатура базисных противовоспалительных препаратов* [44]
*Общепринятая в России номенклатура противоревматических препаратов. эквивалентная термину «болезнь-модифицирующие антиревматические препараты (disease-modifying antirheumatic drugs — DMARDs), принятому за рубежом
Приложение Б. Алгоритмы действий врача
Ревматоидный артрит
Приложение В. Информация для пациентов
Ревматоидный артрит — иммуновоспалительное (аутоиммунное) ревматическое заболевание, характеризующееся хроническим эрозивным артритом и системным поражением внутренних органов.
Ревматоидный артрит — довольно распространенное заболевание, в России им страдает около 1% населения. Заболеть ревматоидным артритом может и ребенок, и взрослый, но преимущественно заболевание развивается у женщин активного возраста (женщины заболевают ревматоидным артритом в 2-3 раза чаще, чем мужчины). Пик начала заболевания — 40-55 лет.
Врачам до сих пор не ясно, что является причиной заболевания. Известно, что некоторые люди генетически предрасположены к ревматоидному артриту, однако болезнь не передается от родителей к детям. У 20-30% пациентов болезнь начинается после перенесенной инфекции, чаще всего носоглоточной. В то же время многолетние поиски специфического микроорганизма, вызывающего ревматоидный артрит, не привели к успеху, поэтому нет оснований считать эту болезнь инфекционной. Также доказано, что курение увеличивает риск развития ревматоидного артрита. Примерно у трети пациентов первые симптомы появляются без видимой причины.
Несмотря на то, что истинная причина ревматоидного артрита неизвестна, ученым- медикам удалось выявить многие глубокие механизмы развития болезни. При ревматоидном артрите нарушается работа иммунной системы. В результате некоторые иммунные клетки начинают вырабатывать слишком много веществ, вызывающих воспалительную реакцию, и тем самым повреждают свои собственные ткани. Это очень важный момент, который должны понимать пациенты, — в основе ревматоидного артрита лежит не «пониженный иммунитет», а избыточная иммунная реакция. Поэтому терапия заключается не в «поднятии иммунитета», как многие думают, а в нормализации работы иммунной системы путем избирательного подавления ненормально активных клеток.
Ревматоидный артрит приводит к хроническому воспалению суставов, поражаются околосуставные и некоторые другие ткани и, органы. Поэтому ревматоидный артрит относят к системным (поражающим весь организм, а не какой-либо один орган) заболеваниям. Эта болезнь, как правило, имеет прогрессирующее течение, изредка прерывающееся ремиссиями (периодами временного улучшения). После стрессов, простуд или переохлаждений состояние пациента может существенно ухудшаться. Со временем к поражению суставов присоединяются различные осложнения. Может развиваться поражение сердца, легких, сосудов и других органов. При отсутствии активного современного лечения почти половина пациентов в течение первых пяти лет после постановки диагноза получает инвалидность. Из-за ревматоидного артрита может развиться атеросклероз, который нередко приводит к инфаркту миокарда или инсульту, укорачивая продолжительность жизни на 8-10 лет.
Основными симптомами в начале болезни, как правило, являются боль, отечность, утренняя скованность в симметричных суставах кистей, лучезапястных суставов, они могут становиться горячими на ощупь. Со временем в процесс могут вовлекаться стопы, голеностопные, коленные, локтевые суставы. У некоторых пациентов, наоборот, первыми поражаются суставы ног (коленные, голеностопные), и только потом — руки. Эти признаки легко спутать с симптомами других заболеваний суставов, поэтому точный диагноз устанавливает только врач-ревматолог на основании детального клинического осмотра, инструментального обследования и специфических лабораторных показателей.
Воспаление сустава проявляется его опуханием, болезненностью и иногда краснотой. Хроническое воспаление сустава приводит к разрушению суставного хряща и возникновению деформации сустава, что, в свою очередь, нарушает его функцию — возникают боли при движении и тугоподвижность.
Симптомы ревматоидного артрита обычно бывают стойкими и без лечения не исчезают, но на короткое время в начале заболевания возможны периоды некоторого улучшения самочувствия. Самопроизвольная ремиссия (то есть состояние длительного значительного улучшения) возникает очень редко. Без лечения закономерно наступает обострение, активность заболевания возрастает — и самочувствие снова ухудшается. Периоды обострения характеризуются слабостью, потерей аппетита, повышением температуры, мышечными и суставными болями, а также скованностью суставов, обычно наиболее выраженной в утренние часы после пробуждения или после периодов отдыха.
Внесуставные (системные) проявления ревматоидного артрита чаще развиваются у длительно болеющих пациентов, но иногда встречаются с самого начала болезни. Специфическим симптомом ревматоидного артрита являются ревматоидные подкожные узелки, которые чаще всего образуются на локтях, но могут появиться и в других местах. Редким тяжелым осложнением ревматоидного артрита является васкулит (воспаление сосудов). Данное заболевание нарушает кровоснабжение органов и тканей, чаще всего васкулит проявляется образованием темных некротических областей и язв на пальцах рук и на ногах. Иногда к ревматоидному артриту присоединяется «синдром Шегрена» — при этом заболевании воспаляются железы глаз и слизистой рта, что приводит к сухости этих
органов. Ревматоидное воспаление оболочки легких (плевры) называется плеврит, но клинически редко проявляется. В основном это обнаруживается при рентгенологическом обследовании. Подобное воспаление может наблюдаться и в сердечной оболочке (перикардит). Сами легкие тоже могут подвергаться воспалению, в них образуются ревматоидные узелки.
Хроническое воспаление при ревматоидном артрите может привести к снижению гемоглобина в крови — развитию анемии. Иногда повышается (при обострениях) и понижается число лейкоцитов (белых кровяных клеток).
Такое разнообразие симптомов и вариантов болезни нередко делает диагностику сложной, поэтому хочется еще раз подчеркнуть: грамотно установить может только квалифицированный специалист-ревматолог.
При развитии боли и припухания суставов необходимо как можно скорее обратиться к ревматологу.
Из практики хорошо известно, что многие пациенты при возникновении первых симптомов артрита долго занимаются самолечением, обращаются к врачам других специальностей (терапевтам, хирургам, травматологам, неврологам), поэтому точный диагноз устанавливается поздно — через 5-6 месяцев, а то и позже. За эти полгода в воспалительный процесс часто вовлекаются новые суставы, в них формируются необратимые изменения (эрозии, контрактуры). Поэтому раннее обращение к ревматологу и раннее начало терапии — ключевой момент для успешного лечения. По современным рекомендациям, для максимальной эффективности терапию нужно начинать в течение 6- 12 недель от появления первых симптомов.
Ревматолог проводит осмотр суставов, кожи, других органов и систем. Затем назначает определенный спектр анализов и другие методы исследования — в частности, рентген, УЗИ и другие. Диагноз ставится на основании степени поражения суставов, обнаружения эрозий суставных поверхностей при рентгенологическом исследовании, выявления в сыворотке крови ревматоидного фактора (особого белка, который появляется у большинства пациентов). В крови повышается СОЭ, уровень фибриногена, С-реактивного белка.
К сожалению, абсолютно специфических (патогномоничных) признаков ревматоидного артрита не существует, однако при обнаружении ревматоидного фактора и антител к цитруллинированным белкам вероятность ревматоидного артрита сушественно повышается. Поэтому диагностика всегда осуществляется по комплексу данных, полученных при обследовании, а не с помощью какого-либо одного анализа или исследования.
У 30% пациентов с подозрением на ревматоидный артрит диагноз не удается уточнить при первом визите к1 врачу, требуется проведение повторных обследований, наблюдение за пациентом.
Медикаментозное лечение
Медикаментозная терапия является главным методом лечения ревматоидного артрита. Это единственный способ, позволяющий затормозить развитие воспалительного процесса и сохранить подвижность в суставах. Все другие методики лечения — физиотерапия, диета, лечебная физкультура — вспомогательные и без медикаментозного лечения не способны существенно повлиять на течение болезни.
Основная цель лечения — замедлить и, возможно, остановить прогрессирование болезни, сохранить функцию суставов и улучшить качество жизни пациента. Для этого необходимо подавить воспалительный процесс, снять боль, предупредить обострения и осложнения. При условии ранней диагностики и раннего начала медикаментозной терапии современными противоревматическими препаратами более чем у 50% пациентов удается добиться клинической ремиссии, то есть состояния, когда активное воспаление в суставах отсутствует, а пациент чувствует себя практически здоровым. В то же время ревматоидный артрит — хроническое заболевание, склонное к обострениям, поэтому для поддержания достигнутого успеха требуется длительная терапия поддерживающими дозами лекарств, а вопрос о возможности полного излечения до сих пор остается открытым.
Основные лекарства для лечения РА — базисные противовоспалительные препараты. К ним относят большое число разнообразных по химической структуре и
фармакологическим свойствам лекарственных средств, таких как, метотрексат**, лефлуномид**, сульфасалазин** и т.д. Их объединяет способность в большей или меньшей степени и за счет различных механизмов подавлять воспаление и/или патологическую активацию системы иммунитета.
Наиболее активный базисный противовоспалительный препарат — метотрексат**, с него обычно начинается терапия ревматоидного артрита. Генно-инженерные биологические препараты, как правило, добавляются к метотрексату при недостаточной эффективности. Лечебное действие метотрексата** развивается медленно (за 1,5-2 месяца и дольше), но зато является очень стойким. Максимальное улучшение достигается обычно к шестому месяцу лечения, хороший клинический эффект наблюдается у 60-70% пациентов. Для улучшения переносимости лечения или более быстрого достижения эффекта рекомендуется применение подкожной лекарственной формы метотрексата**. На фоне лечения метотрексатом** обязателен прием фолиевой кислоты** не менее 5 мг в неделю, не ранее чем через сутки после приема метотрексата**.
При наличии противопоказаний для применения метотрексата или плохой переносимости лечения, возможно назначение лефлуномида** или сульфасалазина**.
Для сохранения достигнутого улучшения поддерживающие (низкие) дозы этих препаратов пациент должен принимать длительно (при необходимости — несколько лет). В целом, лечение этими препаратами хорошо переносится, однако требует контроля показателей крови и функции печени.
Современным методом лечения ревматоидного артрита является применение так генно- инженерных биологических препаратов и таргетных синтетических базисных противовоспалительных препаратов. Генно-инженерные биологические препараты (не путать с биологически активными добавками) — это белковые молекулы, получаемые с использованием сложнейших биотехнологий, которые избирательно подавляют активность веществ (медиаторов), участвующие в развитии хронического воспаления. В России для лечения ревматоидного артрита зарегистрировано несколько генно-инженерных биологических препаратов: инфликсимаб**, адалимумаб**, этанерцепт**, голимумаб**, цертолизумаба пэгол, абатацепт**, тоцилизумаб**, ритуксимаб**. ГИБП применяются в виде подкожных инъекций или внутривенных вливаний. В настоящее время все шире применяются таргетные синтетические базисные противовоспалительные препараты, ингибирующие активность Янус киназы (тофацитиниб, барицитиниб, упадацитиниб), которые назначаются в виде таблеток, но по действию они близки к генно-инженерным биологическим препаратам.
Быстрый противовоспалительный эффект могут давать глюкокортикоидные гормоны. Обычно такие препараты (преднизолон** или метилпреднизолон**) назначают при высокой активности болезни в низких дозах (не более 2 таблеток в день), с последующим снижением дозы до 1 или менее таблеток, или полностью отменяют при достижении эффекта. Существует мнение о том, что глюкокортикоидная гормональная терапия опасна, но оно в целом не обосновано. В то же время глюкокортикоидные гормоны требуют очень грамотного обращения (например, нельзя быстро отменять препарат), поэтому решение о назначение гормональной терапии принимается индивидуально у каждого пациента. При очень высокой активности болезни может применяться пульс-терапия (введение высокой дозы гормонов внутривенно) для снятия обострения.
Нестероидные противовоспалительные препараты (сокращенно «НПВП») представляют собой важный компонент лечения ревматоидного артрита. Наиболее часто применяются диклофенак**, нимесулид, мелоксикам, кетопрофен**, целекоксиб для уменьшения боли и скованности в суставах. НПВП назначаются на раннем этапе болезни, когда эффект от лечения базисными противовоспалительными препаратами еще не успел развиться и необходимо контролировать симптомы, чтобы дать пациенту возможность двигаться, работать, обслуживать себя. После того, как достигнуто полноценное улучшение на фоне терапии базисными противовоспалительными препаратами, НПВП многим пациентам отменяют. В то же время значительное число пациентов, особенно с тяжелой стадией ревматоидного артрита, вынуждены продолжать лечение НПВП длительно из-за постоянной боли.
Нередко пациенты самостоятельно начинают принимать эти лекарства и считают, что они хорошо помогают. Однако надо иметь в виду, что НПВП справляются с симптомами, но не оказывают влияния на течение болезни. Кроме того, они могут вызывать язву желудка и желудочно-кишечные кровотечения, повышение артериального давления и другие побочные эффекты. В зоне риска — пожилые пациенты, курящие, страдающие заболеваниями желудочно-кишечного тракта и сердечно-сосудистой системы. Поэтому для назначения или смены НПВП нужна консультация ревматолога.
Наблюдение за состоянием пациента и контроль безопасности лечения.
Лечение ревматоидного артрита медикаментозными препаратами может давать очень хорошие результаты, но требует регулярного контроля со стороны квалифицированного ревматолога.
Разработана специальная система такого контроля. Для получения наилучших результатов терапии ревматолог осуществляет периодическую оценку ее эффективности. Пациент должен посещать врача не реже чем раз в 3 месяца в начале лечения. Он также сдает анализы крови и ежегодно делает рентгеновские снимки суставов, чтобы врач мог оценить течение болезни.
В зависимости от активности воспалительного процесса и других показателей схема лечения по решению ревматолога может корректироваться (снижается или повышается доза лекарств, добавляются или меняются препараты и т.д.). При этом чрезвычайно важны доверительные отношения между пациентом и врачом, понимание того, что лечение — сложная и серьезная работа, часто требующая усилий и терпения. После достижения хорошего эффекта от терапии на фоне поддерживающих доз препаратов рекомендуется показываться ревматологу не реже чем раз в полгода.
Другая сторона контроля — оценка показателей, позволяющих обеспечить безопасность лечения. Схема контроля безопасности зависит от того, какие препараты назначены пациенту.
Так, при приеме метотрексата** или лефлуномида** контролируют функцию печени, число кровяных клеток.
При назначении генно-инженерных биологических препаратов их внутривенное введение проводится в условиях специально оборудованного процедурного кабинета под наблюдением врача. Все генно-инженерные биологические препараты и таргетные синетические базисные противовоспалительные препараты (тофацитиниб, барицитиниб, упадацитиниб) могут снижать сопротивляемость к инфекциям. Для пациентов, длительно принимающих НПВП, при необходимости должна проводится гастроскопия.
Имеются ограничения, связанные с лечением. На фоне терапии метотрексатом** и лефлуномидом** не рекомендуется пить алкоголь. Целесообразно избегать контакт с инфицированными пациентами. Большинство противовоспалительных препаратов не совместимы с беременностью (она возможна после отмены лечения).
Существует ряд методов, улучшающих переносимость некоторых лекарств. Для уменьшения негативного влияния на желудок вместе с НПВП могут назначать
ингибиторы протонной помпы — но их прием требует контроля со стороны врача. Для улучшения переносимости метотрексата** рекомендуют применение фолиевой кислоты**. При назначении глюкокортикоидов параллельно прописывают препараты кальция и другие средства для профилактики остеопороза — ослабления костной ткани, которое может возникать при длительной гормональной терапии. Для защиты от инфекций применяются специальные вакцины.
К сожалению, во многих случаях пациенты с излишней опаской относятся к лекарственной терапии, считая, что «химия одно лечит, другое калечит». Это в корне неверно по целому ряду причин. Во-первых, несмотря на возможное возникновение нежелательных реакций, вероятность их развития относительно невелика. Во-вторых, для большинства медикаментозных препаратов система контроля хорошо разработана (она описана детально в справочниках и вкладышах в упаковке) и позволяет активно выявлять нежелательные реакции еще до того, как они становятся опасными для здоровья. В- третьих, риск развития осложнений самого заболевания гораздо серьезнее риска развития нежелательных реакций терапии.
Нефармакологические методы лечения
Помимо медикаментозного лечения, пациентам рекомендуют следить за питанием и выполнять лечебные упражнения.
Диета пациента, страдающего ревматоидным артритом, должна быть полноценной, с достаточным количеством белка и кальция. Это важно по нескольким причинам:
1) при активном воспалении в организме повышен расход энергии и белка;
2) при ревматоидном артрите быстро развиваются мышечные атрофии (резкое похудание и ослабление мышц), которые способствуют деформации суставов;
3) противовоспалительные препараты способны ослаблять слизистую оболочку желудка и кишечника, и естественная защита в этом случае — достаточное количество белка в пище;
4) Полноценное питание, с достаточным содерданием витамина D и кальция — профилактика остеопороза (нарушения структуры костной ткани, сопровождающего артрит). Предпочтение отдается белкам животного происхождения — это молоко, кисломолочные продукты, сыр, яйца, мясо, рыба. Следует избегать острых блюд. Блюда из мяса и рыбы лучше варить, готовить на пару, тушить или запекать.
Рекомендуется обеспечить рацион растительными маслами, содержащими полиненасыщенные жирные кислоты — это может способствовать более благоприятному течению воспалительного процесса.
Рекомендуется достаточное количество овощей, несладких фруктов и ягод.
Регулярные физические упражнения помогают поддерживать подвижность суставов и укрепляют мышцы. Важно тренироваться правильно, чрезмерная нагрузка или неправильное выполнение упражнений может навредить суставам.
Оптимальный вид физической активности для пациентов с РА — плавание, поскольку оно устраняет гравитационную нагрузку на суставы.
Настоятельно рекомендуется участие в специальных школах для пациентов с ревматоидным артритом. В рамках таких школ эксперты рассказывают о лечении,
упражнениях, эрготерапии, о психологических аспектах заболевания, о защите прав пациентов, об их насущных проблемах и главных вопросах, которые беспокоят большинство пациентов. Информация о заболевании и понимание того, как его можно контролировать, играют важную роль в успешном лечении и сохранении качества жизни.
Приложение Г1-Г16. Шкалы оценки, вопросники и другие оценочные инструменты состояния пациента, приведенные в клинических рекомендациях
Приложение Г 1 . Классификационные критерии РА (АСR/EULAR[19]
Для того чтобы поставить диагноз РА необходимо выполнить три условия:
1. Определить наличие у пациента хотя бы одного припухшего сустава по данным физикального осмотра.
2. Исключить другие заболевания, которые могут сопровождаться воспалительными изменениями суставов.
3. Набрать как минимум 6 баллов из 10 возможных по 4 позициям, описывающим особенности картины болезни у данного пациента.
Приложение Г2. Определение активности РА
Приложение Г2.1 Индекс DAS28
Название на русском языке: индекс активности РА, включающий 28 суставов
Оригинальное название (если есть): DAS28 (Disease activity score)
Источник (официальный сайт разработчиков, публикация с валидацией) [21].
Назначение: оценка активности РА
Содержание: DAS28 = (0,56 (ЧБС))+ (0,28 (ЧПС))+ (0,70In(СОЭ))+(0,01400СЗ)
где ЧБС — число болезненных суставов, ЧПС — число припухших суставов из следующих 28: плечевые, локтевые, лучезапястные, пястно-фаланговые, проксимальные межфаланговые, коленные, которые поражаются при РА в первую очередь и хорошо доступны для объективного исследования.
СОЭ — скорость оседания эритроцитов по методу Вестергрена,
ООСЗ — общая оценка пациентом состояния здоровья в мм по 100 миллиметровой визуальной аналоговой шкале
• Ремиссия — DAS28<2.6
• Низкая активность — 2,6 ≤1DAS28 ≤ 3,2
• Умеренная активность -3,2 < DAS28 ≤ 5,1
• Высокая активность — DAS28 >5.1
Общепризнанный метод оценки эффективности терапии РА основан на оценке исходного индекса DAS28 и динамики этого показателя на фоне терапии (критерии EULAR)
Приложение Г2.2 Индекс СDАI
Название на русском языке: клинический индекс активности болезни
Оригинальное название (если есть): СDАI (Clinical Disease Activity Index)
Источник (официальный сайт разработчиков, публикация с валидацией) [21].
Назначение: оценка активности РА
Содержание: СDАI=ЧПС+ЧБС+ООАВ+ООЗБ, где ЧБС — число болезненных суставов, ЧПС — число припухших суставов, ООАВ — общая оценка активности врачом по ВАШ (см), ООЗБ — общая оценка заболевания больным по ВАШ (см)
- Ремиссия: ≤ 2.8
- Низкая активность: 2.8 — 10
- Умеренная активность: 10-22
- Высокая активность:> 22
Оценка эффективности терапии по индексу СDАI:
- Удовлетворительный эффект — снижение СDАI на 7 баллов
- Хороший эффект — снижение СDАI на 15 баллов
Приложение Г2.3 Индекс SDАI
Название на русском языке: упрощенный индекс активности болезни
Оригинальное название (если есть): SDАI (Simplified Disease Activity Index)
Источник (официальный сайт разработчиков, публикация с валидацией) [21].
Назначение: оценка активности РА
Содержание: SDАI=ЧПС+ЧБС+OOАВ+OO3Б+СРБ„ где ЧБС — число болезненных суставов, ЧПС — число припухших суставов, ООАВ — общая оценка активности врачом по ВАШ (см), ООЗБ — общая оценка заболевания больным по ВАШ (см), СРБ измеряется в мг/дл
- Ремиссия ≤3.3
- Низкая активность 3,3 -11
- Умеренная активность 11,1 -26
- Высокая активность > 26
Оценка эффективности терапии по индексу SDАI:
- Удовлетворительный эффект — снижение SDАI на 7 баллов
- Хороший эффект — снижение SDАI на 17 баллов
Приложение ГЗ. Опросник НАQ для оценки функциональной способности в повседневной жизни у пациентов РА
Название на русском языке: анкета оценки состояния здоровья, функциональный индекс
Оригинальное название (если есть): НАQ (Health Assessment Questionnaire), FDI (functional desease index)
Источник (официальный сайт разработчиков, публикация с валидацией) [179].
Назначение: самооценка больным РА основных функциональных нарушений
Анкета оценки здоровья (НАQ). Функциональный индекс (FDI)
Ф.И.О______________________________ Дата____________________________
В этом разделе мы стремимся узнать, как заболевание влияет на Ваши функциональные возможности в повседневной жизни. Вы можете расширить ответы дополнительными комментариями на дополнительных листах.
Пожалуйста, отметьте только один вариант ответа, который наиболее точно описывает Вашу обычную способность к самообслуживанию и выполнению других функций ЗА ПЕРИОД ПРОШЕДШИЙ НЕДЕЛИ.
Ключ (интерпретация): НАQ включает в себя 20 вопросов, относящихся к активности в повседневной жизни, сгруппированных в 8 шкал: I — одевание и уход за собой, II — вставание, III — прием пищи, ГУ — прогулки, V — гигиена, VI — достижимый радиус действия, VII — сила кистей, VIII — прочие виды деятельности. На каждый вопрос ответы кодируются в баллах от 0 до 3: «0»- без труда, «1»- с небольшим затруднением, «2»- с большим трудом, «3»- не могу выполнить совсем. Максимальные ответы каждой шкалы суммируются.
Значения от 0 до 1,0 представляют «минимальные», от 1,1 до 2,0 — «умеренные», от 2,1 до 3,0 — выраженные» нарушения жизнедеятельности [180].
Эквивалентами НАQ являются: «без труда’— от 0,0 до 0,49 баллов; «с небольшим трудом»= от 0,5 до 2,49 баллов; «не в состоянии выполнить» = от 2,5 до 3,0 баллов.
Приложение Г4. Общая характеристика лекарственных препаратов применяемых для лечения РА
Приложение Г6 Нежелательные реакции, связанные с приемом МТ**.
Приложение Г7 Рекомендации по профилактике и лечению нежелательных реакций, связанных с приемом МТ**
Приложение Г8. Клинические проявления инфузионных реакций и гнперчувствительности (анафилаксия) на фоне лечения ГИБП (ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресаиты)
Приложение Г9 Профилактика и лечение инфузионных и анафилактических реакций, возникших на фоне введения ГИБП (ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресаиты)
Приложение Г10 Рекомендации по предотвращению и лечению НЛР, развивающихся на Фоне лечения ГИБП (ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты)
Приложение Г11 Рекомендации по дополнительному обследованию пациентов до начала терапии ГИБП (ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты)
Приложение Г12 Фармакотерапия РА в периоперационном периоде
Приложение Г13 Рекомендации по времени проведения оперативных вмешательств на фоне лечения ГИБП (ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты)
Приложение Г14 Применение лекарственных препаратов до и во время беременности и лактации
1 Данные ограничены; 2 Только для здоровых доношенных младенцев; 3 Фертильность может быть повышена отменой СУЛЬФ** за 3 месяца до предполагаемой даты зачатия; 4 Непреднамеренное лечение в I триместре, вероятно, неопасно. Вероятно, безопасно.
Приложение Г15. Коды АТХ и фармако-терапевтические группы сБПВП (МТ**. СУЛЬФ**, ЛЕФ**, ГХ**), ГИБП (ингибиторы ИЛ, моноклональные антитела, селективные иммунодепресанты), тсБПВП (БАРИ**, ТОФА**, У ПА**)
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Скачать бесплатно Насонов Е.Л., Насонова В.А. — Ревматология. Национальное руководство. pdf
Название: Ревматология. Национальное руководство.
Автор: Насонов Е.Л., Насонова В.А.
Год издания: 2008
Размер: 107.92 МБ
Формат: pdf
Язык: Русский
В представленной книге «Ревматология» из серии «Национальное руководство» рассмотрены основные вопросы современной ревматологии, необходимые для успешной практической деятельности врача. В книге рассмотрена история развития ревматологии, представлены 4 основных раздела, в которых освещены такие вопросы, как методы диагностики в ревматологии, методы лечения в ревматологии — фармакотерапия и немедикаментозные методы лечения, хирургические методы лечения; клинические рекомендации по синдромам и заболеваниям в ревматологической практике.
Эта книга удалена по требованию правообладателя

Также рекомендуем скачать
Название: Справочник врача-ревматолога.
Автор: Каратеев Д.Е., Лучихина Е.Л.
Год издания: 2021
Размер: 8.97 МБ
Формат: pdf
Язык: Русский
Описание: Книга «Справочник врача-ревматолога» — поликлинически ориентированное издание для врачей-ревматологов, содержащее информацию по основам диагностики и лечения ревматических заболеваний. Книга также буд… Скачать книгу бесплатно
Название: Практическое руководство по детской ревматологии
Автор: Геппе Н.А., Подчерняева Н.С., Лыскина Г.А.
Год издания: 2011
Размер: 17.84 МБ
Формат: pdf
Язык: Русский
Описание: Практическое руководство «Практическое руководство по детской ревматологии» под ред., Геппе Н.А., и соавт., рассматривает общие вопросы диагностики ревматических заболеваний в педиатрии, изложены особ… Скачать книгу бесплатно
Название: Боли в суставах. Дифференциальная диагностика
Автор: Филоненко С.П., Якушин С.С.
Год издания: 2010
Размер: 47.54 МБ
Формат: pdf
Язык: Русский
Описание: Книга «Боли в суставах. Дифференциальная диагностика» под ред., Филоненко С.П., и соавт., рассматривает алгоритмы дифференциальной диагностики болевого синдрома в практике ревматолога, терапевта, трав… Скачать книгу бесплатно
Название: Локальная инъекционная терапия при поражениях суставов и периартикулярных тканей
Автор: Тер-Вартаньян С.Х., Яременко О.Б., Худина В.С.
Год издания: 1997
Размер: 1.84 МБ
Формат: pdf
Язык: Русский
Описание: Практическое пособие «Локальная инъекционная терапия при поражениях суставов и периартикулярных тканей» под ред., Тер-Вартаньян С.Х., и соавт., рассматривает вопросы внутрисуставной терапии в практике… Скачать книгу бесплатно
Название: Клиника и иммунопатология ревматических болезней
Автор: Насонов Е.Л.
Год издания: 1994
Размер: 2.06 МБ
Формат: pdf
Язык: Русский
Описание: Практическое руководство «Клиника и иммунопатология ревматических болезней» под ред., Насонова Е.Л., рассматривает краткие сведенья об основных патологических состояниях в практике врача ревматолога. … Скачать книгу бесплатно
Название: Справочник по ревматологии
Автор: Насонова В.А.
Год издания: 1995
Размер: 2.62 МБ
Формат: pdf
Язык: Русский
Описание: Учебное пособие «Справочник по ревматологии» под ред., Насоновой В.А., рассматривает краткие сведенья о основных патологических состояниях в практике врача ревматолога. Изложены вопросы диагностики и … Скачать книгу бесплатно
Название: Васкулиты и васкулопатии
Автор: Насонов Е.Л.
Год издания: 1999
Размер: 4.8 МБ
Формат: djvu
Язык: Русский
Описание: В практическом руководстве «Васкулиты и васкулопатии» под ред., Насонова Е.Л., рассматриваются актуальные материалы о принципах классификации, патогенетических особенностях, этиологии, клинических про… Скачать книгу бесплатно
Название: Ревматология
Автор: Шостак Н.А.
Год издания: 2012
Размер: 24.2 МБ
Формат: djvu
Язык: Русский
Описание: В учебном руководстве «Ревматология» под ред., Шостак Н.А., рассмотрены вопросы характеризующие ревматические заболевания в практике практических докторов. Описаны заболеваемость, факторы риска, патом… Скачать книгу бесплатно
Название: Диффузные болезни соединительной ткани — системные ревматические заболевания.
Автор: Сигидин Я.А., Гусева Н.Г., Иванова М.М.
Год издания: 2004
Размер: 197.81 МБ
Формат: pdf
Язык: Русский
Описание: В рассматриваемом руководстве для врачей «Диффузные болезни соединительной ткани» освещены системные ревматические заболевания (коллагенозы). Общая часть книги рассматривает основные патологические пр… Скачать книгу бесплатно
Название: Ревматология. Клинические рекомендации.
Автор: Насонов Е.Л.
Год издания: 2008
Размер: 27.21 МБ
Формат: pdf
Язык: Русский
Описание: В представленной книге рассмотрены клинические рекомендации для практикующих докторов по специальности «Ревматология», освещены не только наиболее распространенные заболевания ревматологического профи… Скачать книгу бесплатно






















































