Витамин D
— Зачем он нужен?
Витамин D помогает организму использовать кальций и фосфор; способствует формированию крепких зубов и костей.
Исследования последних лет показывают, что дефицит витамина D играет роль в развитии эндокринных, сердечно-сосудистых, аутоиммунных и онкологических болезней, а также инфекционной патологии.
— Как организм получает витамин D?
Больше всего витамина D вырабатывается в коже под действием солнечного света, однако он может поступать в организм и с некоторыми продуктами питания (молоко, жирная рыба, яичный желток, сливочное масло и др.).
Однако, немногие (особенно дети первых лет жизни) употребляют вышеуказанные продукты и в нашей полосе не так много солнечных дней. Кроме того, нахождение под прямыми солнечными лучами увеличивает риск фотостарения и развития рака кожи, поэтому необходимо использовать солнцезащитные средства, что также затрудняет выработку витамина D.
— Анализ крови на определение уровня витамина D, нужен ли?
Детям всех возрастов рекомендован приём профилактических доз витамина D, которые назначаются без определения его уровня в крови.
Если же ребенку требуется назначение лечебных доз витамина D, тогда врач назначает данный анализ, чтобы правильно подобрать дозу препарата.
— Значения уровня витамина D (содержание 25(OH)D) в крови:
- абсолютно токсичный уровень: >200нг/мл;
- уровень с возможным проявлением токсичности: >100нг/мл;
- норма: 30-100 нг/мл;
- недостаточность: 21-29 нг/мл;
- дефицит: менее 20 нг/мл.
— Сколько нужно принимать витамин D?
В 2021 году была обновлена национальная программа по коррекции недостаточности витамин D у детей и подростков в Российской Федерации, согласно которой установлены следующие профилактические дозы, вне зависимости от вида вскармливания (не требуется пересчета дозы для детей на смешанном или искусственном вскармливании):
0-1мес: 500МЕ/сут
1мес-1год: 1000МЕ/сут
1-3года: 1500МЕ/сут
3-18лет: 1000МЕ/сут
Отдельно рассматриваются дети из групп риска (недоношенные и маловесные дети, дети с избыточной массой тела и ожирением, дети с клиническими признаками рахита, дети с хроническими заболеваниями почек и печени и др.), а также имеет значение регион проживания, поэтому перед началом приема препарата обязательно проконсультируйтесь с врачом.
Источники: Национальная программа «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции», 2021
Подробную информацию вы можете прочитать в брошюре для родителей Витамин D
Коллектив авторов
Год издания: 2021
Количество страниц: 116
ISBN:
978-5-6045953-3-6
Вес: 397 гр.
Издательство: ПедиатрЪ
Целями настоящей Национальной программы, подготовленной группой экспертов разных специальностей, представляющих ведущие клинические и научно-исследовательские центры и профессиональные ассоциации детских врачей, диетологов-нутрициологов, фармакогенетиков и др., являются представление для педиатров и других специалистов последних данных литературы о значении витамина D в организме и обновление рекомендаций по диагностике, профилактике и коррекции недостаточности витамина D у детей разного возраста и разного состояния здоровья.
Настоящее издание представляет собой вторую редакцию Национальной программы «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции», увидевшей свет в 2018 году. За последние 3 года были инициированы новые исследования по изучению этого «витамина жизни», в частности, научные работы по оценке эффективности профилактики и лечения новой коронавирусной инфекции у пациентов с разным статусом по витамину D.
Программа предназначена для специалистов медицинского профиля (врачей-педиатров, нутрициологов, детских эндокринологов, ортопедов, детских нефрологов, фтизиатров и врачей других специальностей), а также студентов медицинских и фармацевтических вузов и колледжей.
Содержание
Предисловие
Введение
Основные положения программы
1. История представлений о витамине D
2. Метаболизм и биологические функции витамина D в организме человека
3. Содержание активных метаболитов витамина D в сыворотке крови как показатель
обеспеченности витамином D
4. Клинические проявления низкого статуса витамина D
4.1. Костные (кальциемические) проявления низкой обеспеченности организма витамином D
4.1.1. Рахит
4.1.2. Остеопороз
4.2. Внекостные (некальциемические) проявления низкой обеспеченности организма
витамином D
4.2.1. Роль витамина D в регуляции иммунной функции организма
4.2.2. Роль витамина D в противоинфекционной защите
4.2.3. Эффективность сапплементации рациона витамином D с целью предотвращения и/или снижения инфекционных заболеваний
4.2.4. Роль витамина D в генезе и течении аллергической патологии у детей и подростков
4.2.5. Роль витамина D в патогенезе аутоиммунных заболеваний
4.2.6. Противоопухолевые эффекты витамина D
4.2.7. Дефицит витамина D и эндокринные заболевания
4.2.8. Дефицит витамина D и сердечно-сосудистые заболевания
4.2.9. Дефицит витамина D и заболевания почек
4.2.10. Витамин D и рахитоподобные заболевания
4.2.11. Витамин D и мочекаменная болезнь
4.2.12. Когнитивный и нейропластический потенциал витамина D
5. Распространенность низкой обеспеченности витамином D на территории Российской Федерации в разных возрастных группах
5.1. Распространенность низкой обеспеченности витамином D среди детей раннего возраста на территории Российской Федерации
5.2. Оценка обеспеченности витамином D детей старшей возрастной группы
6. Профилактика и коррекция низкого статуса витамина D
6.1. Пищевые источники и градация доз витамина D
6.2. Обогащенные витаминами пищевые продукты
6.3. Применение витамина D во время беременности
6.4. Коррекция низкого статуса витамина D его повышенными дозами
7. Витамин D у новорожденных и недоношенных детей
7.1. Гиповитаминоз D у новорожденных и недоношенных детей: частота и факторы риска
7.2. Особенности метаболизма витамина D у новорожденных и недоношенных детей
7.3. Клинические проявления дефицита витамина D у новорожденных и недоношенных детей
7.4. Профилактика и коррекция дефицита витамина D у новорожденных и недоношенных детей
7.5. Мониторирование уровня 25(ОН)D у новорожденных и недоношенных детей
8. Коррекция низкой обеспеченности витамином D пациентов разных возрастных групп на территории Российской Федерации
8.1. Компенсация недостаточности витамина D в раннем детском возрасте
8.1.1. Анализ эффективности схемы профилактики и коррекции гиповитаминоза D у детей раннего возраста
8.1.2. Безопасность схемы профилактики и лекарственной коррекции гиповитаминоза D у детей раннего возраста
8.2. Коррекция недостаточности витамина D у детей старшей возрастной группы
9. Безопасность дотации витамина D на примере гиперкальциемии
10. Влияние витамина D на течение COVID-19
11. Распространенные мифы о витамине D
Приложение
Файлы cookie, необходимые для выполнения веб-сайтом важнейших функций и задач
Эти файлы cookie абсолютно необходимы для надлежащей работы нашего сайта.
Они гарантируют его безопасность и правильное отображение контента.
Файлы, улучшающие работу веб-сайта
Эти файлы cookie позволяют нам улучшить работу веб-сайта и сделать его удобнее. Например,
с их помощью мы можем определить, способен ли ваш браузер выполнять на веб-сайте небольшие
программы (скрипты), расширяющие его функциональность, или сохранить ваши предпочтения,
такие как размер шрифта или язык.
Рекламные файлы cookie и технологии
Эти файлы cookie используются для сбора информации о том, как посетители используют наш веб-сайт,
и позволяют показывать им рекламу, отвечающую их интересам, на нашем и других сайтах. Эти файлы
cookie и технологии позволяют вам делиться страницами и материалами, которые заинтересовали вас на
нашем сайте, через социальные сети и другие сторонние ресурсы. Компании, использующие такие файлы
cookie и технологии, могут предоставлять ваши сведения третьим лицам и/или использовать их для
демонстрации вам целевой рекламы на других веб-сайтах. Некоторые файлы cookie, создаваемые с этой
целью, могут храниться до 24 месяцев с момента последнего посещения вами нашего сайта.
Файлы cookie и технологии, расширяющие функциональность веб-сайта
Такие файлы cookie используются для добавления на наш веб-сайт функций, предоставляемых сторонними
поставщиками. Без них посетителям будут недоступны некоторые возможности нашего сайта. Данные,
собираемые нашими поставщиками услуг с этой целью, могут предоставляться в анонимизированной форме
третьим сторонам и использоваться для показа целевой рекламы.
Аналитические файлы cookie и технологии
Эти файлы cookie используются для сбора информации о том, как посетители работают с нашим сайтом.
Мы используем эти сведения для создания отчетов и улучшения сайта. Эти файлы cookie собирают
анонимную информацию, в том числе о количестве посетителей сайта, ресурсах, с которых они
перешли, и страницах, которые они посмотрели.
Файлы cookie для обеспечения безопасности
Эти файлы cookie помогают повысить безопасность нашего сайта и защищают его от вредоносных действий
посетителей. Данные, собираемые нашими поставщиками услуг с этой целью, могут предоставляться в
анонимизированной форме третьим сторонам и использоваться для показа целевой рекламы.
РИМ-2022-0417
Аннотация
Данный проект клинических рекомендаций по диагностике, лечению и профилактике дефицита витамина D является обновлением предыдущего документа 2016 г. Проведен анализ соответствующих литературных данных с особым вниманием к метаанализам, рандомизированным клиническим исследованиям и систематическим обзорам, опубликованным за последние 5 лет. Сформулированные обновленные рекомендации были обсуждены и скорректированы совместно с ведущими эндокринологами Российской Федерации, являющимися экспертами в данной проблеме.
Пересмотрена классификация уровней 25(ОН)D (в частности, конкретизирован целевой диапазон значений 25(ОН)D), разработаны рекомендации по скринингу ассоциированных с дефицитом витамина D заболеваний. Также внедрены понятие ассоциированной с витамином D токсичности и рекомендации по ее диагностике и профилактике, обозначены показания к исследованию других метаболитов витамина D, помимо 25(ОН)D — основного маркера статуса витамина D.
Раздел по лечению дефицита витамина D был расширен и претерпел ряд изменений. Основные дополнения коснулись восполнения дефицита и недостаточности дефицита витамина D у отдельных категорий пациентов (в частности, при хронической болезни почек, при аутоиммунных заболеваниях, у беременных), а также контроля эффективности и безопасности проводимой терапии; скорректированы показания к назначению препаратов активных метаболитов витамина D. Пересмотрены рекомендации по профилактике дефицита витамина D в общей популяции с учетом крупных рандомизированных клинических исследований, метаанализов и систематических обзоров последних лет.
Настоящая публикация представляет собой развернутую версию федеральных клинических рекомендаций.
Ключевые слова
Для цитирования:
Дедов И.И., Мельниченко Г.А., Мокрышева Н.Г., Пигарова Е.А., Поваляева А.А., Рожинская Л.Я., Белая Ж.Е., Дзеранова Л.К., Каронова Т.Л., Суплотова Л.А., Трошина Е.А. Проект федеральных клинических рекомендаций по диагностике, лечению и профилактике дефицита витамина D. Остеопороз и остеопатии. 2021;24(4):4-26. https://doi.org/10.14341/osteo12937
For citation:
Dedov I.I., Mel’nichenko G.A., Mokrysheva N.G., Pigarova E.A., Povaliaeva A.A., Rozhinskaya L.Y., Belaya Z.E., Dzeranova L.K., Karonova T.L., Suplotova L.A., Troshina E.А. Draft federal clinical practice guidelines for the diagnosis, treatment, and prevention of vitamin D deficiency. Osteoporosis and Bone Diseases. 2021;24(4):4-26.
(In Russ.)
https://doi.org/10.14341/osteo12937
СПИСОК СОКРАЩЕНИЙ
- 1,25(OH)2D — 1,25-дигидроксивитамин D (кальцитриол)
- 25(OH)D — 25-гидроксивитамин D (кальцидиол)
- МЕ — международная единица
- МПК — минеральная плотность кости
- ПТГ — паратиреоидный гормон
- РКИ — рандомизированное клиническое исследование
- СКФ — скорость клубочковой фильтрации
- ХБП — хроническая болезнь почек
- УФ — ультрафиолет
- FGF23 — фактор роста фибробластов 23
Перерасчет концентрации 25(ОН)D: нг/мл × 2,496 => нмоль/л.
Перерасчет дозы колекальциферола: 1 мкг = 40 МЕ.
1. КРАТКАЯ ИНФОРМАЦИЯ ПО ЗАБОЛЕВАНИЮ ИЛИ СОСТОЯНИЮ (ГРУППЕ ЗАБОЛЕВАНИЙ ИЛИ СОСТОЯНИЙ)
1.1. Определение
Дефицит витамина D — это состояние, характеризующееся снижением концентрации 25(ОН)D в сыворотке крови ниже оптимальных значений, которое может потенциально приводить к снижению всасывания кальция в кишечнике, развитию вторичного гиперпаратиреоза и повышению риска переломов, особенно у пожилых лиц.
1.2. Этиология и патогенез
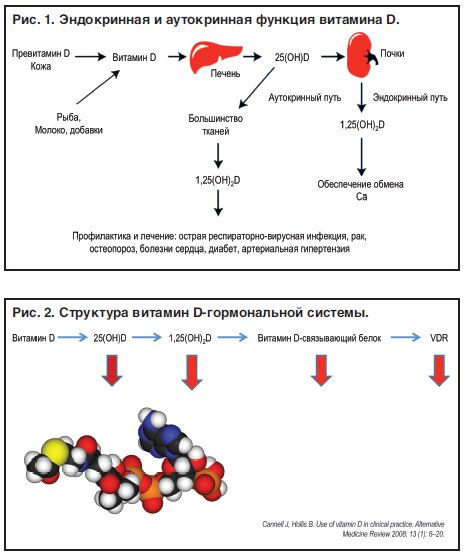
Витамин D, который поступает в организм человека из продуктов питания и в виде пищевых добавок, а также образуется в коже при инсоляции, биологически инертен. Для активации и превращения в активную форму D-гормона [ 1,25(ОН)2D ] в организме он должен пройти 2 этапа гидроксилирования [1].
В результате 1-го этапа гидроксилирования, который происходит в печени, нативный витамин D превращается в 25-гидроксивитамин D [ 25(OH)D], также известный как кальцидиол (рис. 1). Второй этап гидроксилирования происходит преимущественно в почках с участием фермента CYP27B1 (1α-гидроксилазы), и его результатом является синтез физиологически активного D-гормона, 1,25-дигидроксивитамина D [ 1,25(OH)2D], или кальцитриола. Сывороточный уровень кальцитриола преимущественно зависит от активности CYP27B1 в почках, которая находится под контролем паратиреоидного гормона (ПТГ), а также жестко регулируется отрицательной обратной связью. Последняя замыкается ингибированием CYP27B1 высокими концентрациями самого кальцитриола и фактора роста фибробластов 23 (FGF23). Фермент CYP24A1 (24-гидроксилаза) превращает 25(OH)D и 1,25(OH)2D в не обладающие биологической активностью метаболиты, выводимые из организма с желчью. Процесс 24-гидроксилирования регулируется реципрокно 1α-гидроксилированию. Описаны также другие, второстепенные метаболические пути витамина D. Например, под действием 3-эпимеразы образуются метаболиты, обладающие частичной биологической активностью. Основные этапы метаболизма витамина D указаны на рисунке 1.
Рис. 1. Метаболизм витамина D в организме человека.
Витамин D естественным образом присутствует лишь в очень ограниченном количестве продуктов питания (табл. 1), а синтез в организме человека возможен только в определенных условиях, когда ультрафиолетовые (УФ) лучи солнечного света попадают на кожу.
Низкое содержание витамина D в большинстве продуктов питания само по себе представляет риск дефицита, развитие которого становится еще более вероятным при аллергии на молочный белок, непереносимости лактозы, ововегетарианстве и строгом вегетарианстве. Таким образом, основным источником витамина D становится образование его под действием УФ-лучей, однако имеющиеся на сегодняшний день рекомендации по уменьшению времени пребывания на солнце и применению солнцезащитных кремов, снижающих синтез витамина D в коже на 95–98% [4], существенно снижают его эффективность. Способность кожи к продукции витамина D уменьшается с возрастом, и у пожилых лиц ниже по крайней мере в 3 раза в сравнении с молодыми людьми [5]. Люди с темным тоном кожи имеют естественную защиту от ультрафиолетового излучения, и им требуется как минимум в 3–5 раз более длительная экспозиция солнечного излучения, чтобы выработать такое же количество витамина D, как человеку со светлой кожей [6]. Рахит больше распространен среди выходцев из Азии, Африки и Ближнего Востока, что может быть обусловлено культурными особенностями, которые уменьшают воздействие солнечных лучей на кожу, а также генетическими различиями в метаболизме витамина D [7][8].
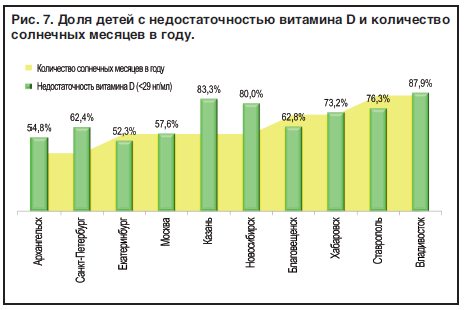
Вклад в развитие дефицита витамина D в нашей стране может вносить географическое расположение большей части Российской Федерации в северной широте выше 35 параллели, при котором из-за более острого угла падения солнечных лучей и их рассеивания в атмосфере в период с ноября по март кожа практически не вырабатывает витамин D, вне зависимости от времени, которое проводится человеком на солнце [9, 10]. Например, Москва имеет координаты 55°45′, Санкт-Петербург — 59°57′, Сочи — 43°35′, Владивосток — 43°07′ северной широты. Также свой вклад вносят сравнительно небольшое количество солнечных дней в большинстве регионов страны и средняя годовая температура, не позволяющая обеспечить облучение достаточной поверхности кожи для синтеза необходимого количества витамина D.
Увеличение числа лиц с избыточной массой тела приводит к повышению распространенности дефицита витамина D [11], что связывают с депонированием витамина D в подкожножировой клетчатке и его недоступностью для центрального кровотока [12].
Другими причинами дефицита витамина D являются нарушение его усваивания с пищей при различных синдромах мальабсорбции [13–15], в том числе у пациентов после бариатрических операций [16][17], а также потеря витамина D с мочой в комплексе со связывающим его белком при нефротическом синдроме [18]. При выраженной печеночной недостаточности развитие дефицита витамина D может происходить по ряду причин: снижаются уровни транспортных белков сыворотки, нарушается 25-гидроксилирование витамина D в печени и ускоряется его катаболизм, кроме того, часто усугубляют ситуацию неполноценное питание и малое пребывание на солнце [19]. При хронических гранулематозных заболеваниях, первичном гиперпаратиреозе, некоторых видах лимфом может наблюдаться повышенное превращение 25(ОН)D в 1,25(ОН)2D, что приводит к повышенному расходу запасов витамина D [20][21]. Снижение уровня 25(OH)D может быть ассоциировано с приемом ряда лекарственных препаратов, которые оказывают значимое влияние на метаболизм витамина D в организме [22]. Таким образом, выделены группы риска дефицита витамина D, которые представлены в таблице 2.
Таблица 1. Источники витамина D в пище. Составлено на основе [2][3]
|
Естественные пищевые источники |
МЕ витамина D (D2 или D3) |
|
Дикий лосось |
600–1000 МЕ на 100 г |
|
Лосось, выращенный на ферме |
100–250 МЕ на 100 г |
|
Сельдь |
294–1676 МЕ на 100 г |
|
Сом |
500 МЕ на 100 г |
|
Консервированные сардины |
300–600 МЕ на 100 г |
|
Консервированная скумбрия |
250 МЕ на 100 г |
|
Консервированный тунец |
236 МЕ на 100 г |
|
Рыбий жир |
400–1000 МЕ на 1 ст. ложку |
|
Грибы, облученные УФ |
446 МЕ на 100 г |
|
Грибы, не облученные УФ |
10–100 МЕ на 100 г |
|
Сливочное масло |
52 МЕ на 100 г |
|
Молоко |
2 МЕ на 100 г |
|
Молоко, обогащенное витамином D |
80–100 МЕ на стакан |
|
Сметана |
50 МЕ на 100 г |
|
Яичный желток |
20 МЕ в 1 шт. |
|
Сыр |
44 МЕ на 100 г |
|
Говяжья печень |
45–15 МЕ на 100 г |
Таблица 2. Группы лиц с высоким риском тяжелого дефицита витамина D, которым показан биохимический скрининг
|
Заболевания костей |
Рахит Остеомаляция Остеопороз |
|
Заболевания околощитовидных железы |
Гиперпаратиреоз |
|
Пожилые лица (>60 лет) |
Падение в анамнезе Низкоэнергетический перелом в анамнезе |
|
Ожирение |
ИМТ 30 кг/м2 и более |
|
Беременные и кормящие женщины |
Имеющие факторы риска или не желающие принимать профилактически препараты витамина D |
|
Темный оттенок кожи |
Африканское, азиатское или латиноамериканское происхождение |
|
Хроническая болезнь почек |
СКФ <60 мл/мин |
|
Печеночная недостаточность |
Стадии II–IV |
|
Синдром мальабсорбции |
Воспалительные заболевания кишечника (болезнь Крона, язвенный колит) Целиакия Муковисцидоз Пациенты после бариатрических операций Радиационный энтерит |
|
Гранулематозные заболевания |
Саркоидоз Туберкулез Гистоплазмоз Бериллиоз Кокцидиомикоз |
|
Лимфопролиферативные заболевания |
Лимфомы |
|
Прием лекарственных препаратов |
Глюкокортикоиды Антиретровирусные препараты Противогрибковые препараты Противоэпилептические препараты Холестирамин Орлистат |
1.3. Эпидемиология
Недостаточность витамина D, как определяемая уровнями 25(OH)D менее 30 нг/мл, так и менее 20 нг/мл, имеет широкое распространение во всем мире и затрагивает большую часть общей популяции. Однако обобщенный анализ проведенных эпидемиологических исследований затруднен в силу недостаточного внедрения в исследовательскую практику стандартизированных измерений концентрации 25(OH)D. В исследовании NHANES III (1988–1994) среди более 18 000 жителей Северной Америки уровни 25(ОН)D ниже 12, 20 и 30 нг/мл наблюдались у 4, 22 и 55% соответственно, а по результатам переоценки данных с применением протоколов Vitamin D Standardization Program (VDSP) доли увеличились до 6, 31 и 71% соответственно [23]. Полученные данные были подтверждены в NHANES 2000–2004 [24]. В большинстве европейских стран также очень высока распространенность низких уровней 25(ОН)D. Для более достоверной оценки распространенности дефицита витамина D в Европе протоколы VDSP были применены к данным 14 популяционных исследований; полученные результаты были проанализированы совместно с 4 ранее стандартизованными исследованиями: среди 55 844 европейских жителей различного возраста уровень 25(ОН)D ниже 12 нг/мл наблюдался у 13% обследованных (при этом отмечались выраженные сезонные отличия — доля составила 18% в период с октября по март и 8% с апреля по ноябрь), уровни ниже 20 нг/мл отмечены у 40% лиц [25].
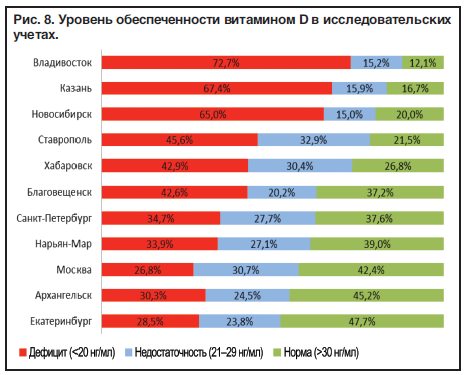
Результаты проведенных в Российской Федерации исследований согласуются с мировыми данными: уровни 25(ОН)D менее 30 нг/мл выявляются в среднем у 70–95% взрослых лиц [26–34], при этом в ряде исследований показаны сезонные различия [31][32][34]. По результатам первого многоцентрового регистрового исследования, охватившего большую часть территории страны, уровни ниже 20 нг/мл отмечены у 56% обследованных взрослых лиц в весенний период (с марта по май) и у 26% лиц в осенний период (октябрь-ноябрь), а уровни ниже 30 нг/мл — у 84% и 62% соответственно [35–37]. Следует отметить, что беременные и кормящие женщины даже при приеме пренатальных витаминных комплексов и препаратов кальция все равно остаются в зоне риска дефицита витамина D [34][38–40].
1.4. Особенности кодирования по Международной статистической классификации болезней и проблем, связанных со здоровьем
Е21.1 Вторичный гиперпаратиреоз.
E55 Недостаточность витамина D.
E55.9 Недостаточность витамина D неуточненная.
M83 Остеомаляция у взрослых.
1.5. Классификация
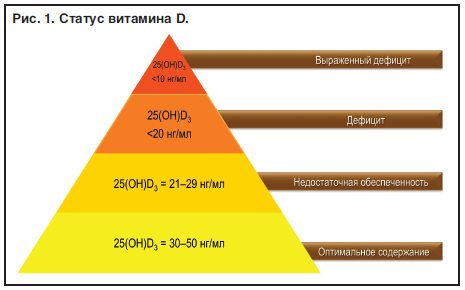
Классификация уровней 25(ОН)D представлена в таблице 3.
Таблица 3. Интерпретация концентраций 25(OH)D, принимаемая Российской ассоциацией эндокринологов
|
Классификация |
Уровни 25(OH)D в крови, нг/мл (нмоль/л) |
|
Выраженный дефицит витамина D |
<10 нг/мл |
|
Дефицит витамина D |
<20 нг/мл |
|
Недостаточность витамина D |
≥20 и <30 нг/мл |
|
Целевые уровни витамина D |
30–60 нг/мл |
|
Адекватные уровни витамина D |
30–100 нг/мл |
|
Уровни с возможным проявлением токсичности витамина D |
>100 нг/мл |
|
Витамин D — ассоциированная токсичность (гиперкальциемия, гиперкальциурия, нефрокальциноз, нефролитиаз, эктопическая кальцификация) |
NB! Любые уровни 25(ОН)D |
1.6. Клиническая картина
Дефицит витамина D приводит к нарушению кальций-фосфорного обмена и костного метаболизма. Вследствие снижения всасывания в кишечнике поступающего с пищей кальция увеличивается уровень паратиреоидного гормона (ПТГ) и развивается вторичный гиперпаратиреоз, который поддерживает нормальный уровень кальция сыворотки крови за счет мобилизации его из скелета [41][42]. ПТГ повышает активность остеокластов и тем самым приводит к снижению минеральной плотности кости (МПК), остеопении и остеопорозу. Повышение экскреции фосфора с мочой при повышенной продукции ПТГ, а также сниженное всасывание в кишечнике могут приводить к снижению его сывороточной концентрации. Изменение кальций-фосфорного соотношения приводит к нарушению процесса минерализации скелета [43]. В связи с тем, что эпифизарные зоны роста у взрослых закрыты, запасы кальция в скелете сравнительно большие для предотвращения деформаций вследствие дефекта минерализации, развитие остеомаляции, как правило, длительное время не диагностируется. Ее проявлениями могут быть изолированные или генерализованные боли, неприятные ощущения в костях и мышцах [44, 45].
Дефицит витамина D может приводить к миопатии, которая проявляется мышечной слабостью, особенно в проксимальных группах мышц, трудностями при ходьбе, поддержании равновесия и склонностью к падениям [46][47], что закономерно увеличивает риск переломов. Каких-либо особенных физикальных изменений при дефиците витамина D нет. Могут наблюдаться деформации скелета, характерные для перенесенного рахита в детстве («башенный» череп, дугообразно изогнутые длинные кости нижних конечностей, реберные «четки», деформация грудной клетки и др.).
2. ДИАГНОСТИКА, МЕДИЦИНСКИЕ ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ МЕТОДОВ ДИАГНОСТИКИ
Критерии установления диагноза:
- концентрация 25(ОН)D в сыворотке крови <10 нг/мл (<25 нмоль/л) соответствует выраженному дефициту витамина D;
- концентрация 25(ОН)D в сыворотке крови <20 нг/мл (<50 нмоль/л) соответствует дефициту витамина D;
- концентрация 25(ОН)D в сыворотке крови в диапазоне ≥20 и <30 нг/мл (≥50 и <75 нмоль/л) соответствует недостаточности витамина D.
2.1. Жалобы и анамнез
- Рекомендуется сбор анамнеза, направленный на выявление факторов риска дефицита витамина D, перечисленных в таблице 2.
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 4).
Комментарии: см. раздел «Клиническая картина».
2.2. Физикальное обследование
- Специфическое физикальное обследование не рекомендуется.
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 4).
Комментарии: см. раздел «Клиническая картина».
2.3. Лабораторные диагностические исследования
- Широкий популяционный скрининг дефицита витамина D не рекомендуется. Скрининг на дефицит витамина D рекомендуется только пациентам, имеющим факторы риска его развития (табл. 2) [3][48][49].
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 1).
Комментарии. Проведение популяционного скрининга, направленного на выявление недостатка витамина D, не рекомендуется ввиду отсутствия доказательной базы по преимуществу такого подхода, а также его высокой стоимости [3][48][49]. Проведение скрининга дефицита витамина D является целесообразным среди лиц с высоким риском его развития (табл. 2).
- Рекомендуется проводить оценку статуса витамина D путем определения концентрации общего 25(ОН)D в сыворотке крови [2][50][51].
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 2).
Комментарии. Концентрация общего 25(ОН)D в сыворотке крови является общепризнанным лучшим маркером для оценки статуса витамина D, так как представляет собой основную циркулирующую форму витамина D с временем полужизни порядка 2–3 недель, а также отражает как поступление витамина D с пищей и нативными препаратами витамина D, так и синтезированный в коже под воздействием УФ-облучения [2, 50]. Вместе с этим, поскольку концентрация общего 25(OH)D не подвержена жесткой физиологической регуляции, в последнее время активно обсуждаются другие потенциальные маркеры, в частности, свободный 25(OH)D (не связанный с белками-носителями) или соотношение 25(OH)D/24,25(OH)2D [51], однако для внедрения этих показателей в рутинную клиническую практику требуются разработка стандартизированных методов измерения и дополнительные исследования, подтверждающие связь с клиническими исходами.
- Для оценки уровня 25(ОН)D рекомендуется использование метода, стандартизированного в соответствии с требованиями VDSP [23][25][52–55].
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 1).
Комментарии. Все клинические анализы, включая измерения концентрации 25(OH)D, подвержены изменчивости. Существует множество методик измерения 25(OH)D, которые можно разделить на две большие группы: основанные на иммуноанализе (радиоиммуноанализ, хемилюминесцентный иммуноанализ, иммуноферментный анализ, электрохемилюминесцентный иммуноанализ) и хроматографические (масс-спектрометрия с жидкостной хроматографией) [52].
Стандартизация — это процесс, при котором все лаборатории и используемые ими методы определения вещества приводятся в соответствие с «истинной концентрацией» на основе референсных измерительных процедур («золотых стандартов») и сертифицированных референсных материалов [53]. Показано, что применение стандартизированных методов может привести к получению радикально иных результатов в индивидуальных исследованиях [25][54]. Недостаточный охват методов определения 25(OH)D стандартизацией является важнейшей проблемой, которая затрудняет разработку критериев интерпретации статуса витамина D во всем диапазоне от дефицита до токсичности [23].
Для решения этой проблемы в 2010 г. была создана Программа стандартизации витамина D (Vitamin D Standardization Program, VDSP) — международное сотрудничество, целью которой является стандартизация лабораторного определения уровня витамина D [55]. Согласно рекомендациям VDSP, для обеспечения согласованности результатов различных методов определения 25(OH)D производителям тест-систем и крупным коммерческим или клиническим лабораториям следует участвовать в программе сертификации, разработанной Centers for Disease Control and Prevention (CDC), а для менее крупных лабораторий функционируют схемы тестирования производительности и программы внешней оценки качества, такие как DEQAS (Vitamin D External Quality Assessment Scheme), а также разработанная CAP (College of American Pathologists).
- При определении концентрации 25(OH)D в динамике рекомендовано использование одного и того же метода [56].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 2).
Комментарии. Из-за преимуществ автоматизации и быстрого получения результатов иммуноаналитические методы являются наиболее часто используемыми для измерения концентрации 25(ОН)D в клинических лабораториях. Существенным недостатком этих методов является перекрестная реактивность между различными метаболитами (в частности, с 24,25(OH)2D), что способно снизить специфичность анализа. С другой стороны, при использовании хроматографических методов не всегда отделяется 3‐epi‐25‐(OH)D, в результате чего снижается чувствительность метода [56]. В условиях недостаточной доступности стандартизированных методов может быть оправдано использование одного и того же метода для динамической оценки уровня 25(ОН)D.
- Рекомендуется определять дефицит витамина D как концентрацию 25(ОН)D <20 нг/мл (<50 нмоль/л), недостаточность — как концентрацию 25(ОН)D ≥20 и <30 нг/мл (≥50 и <75 нмоль/л), адекватные уровни — как 30–100 нг/мл (75–250 нмоль/л), целевые уровни — как 30–60 нг/мл (75–150 нмоль/л) [2][3][46][51][54][57–71,].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 1).
Комментарии. Определение дефицита витамина D является предметом дебатов в международном сообществе. Уровни 25(OH)D ниже 12 нг/мл (30 нмоль/л) признаются явно недостаточными для всех возрастов, поскольку ассоциированы с повышением риска рахита и остеомаляции [51]. В отношении трактовки достаточных концентраций 25(ОН)D существуют разногласия: рядом международных сообществ рекомендовано придерживаться уровней выше 20 нг/мл (50 нмоль/л) [2][57][58], тогда как другие эксперты рекомендуют уровни выше 30 нг/мл (75 нмоль/л) [3][51], по крайней мере для отдельных категорий (например, для пожилых лиц, имеющих повышенный риск переломов и падений) [58].
Для оценки нижней точки достаточности уровня витамина D используются различные маркеры, основные из которых — подавление избыточной секреции ПТГ, уровень абсорбции кальция, минеральная плотность костной ткани, снижение риска переломов. При анализе около 70 работ, посвященных исследованию взаимосвязи уровня ПТГ и 25(ОН)D, в большинстве из них уровни ПТГ начинали снижаться при повышении 25(OH)D до 15–20 нг/мл и максимально подавлялись при уровнях 25(ОН)D порядка 30–40 нг/мл [59]. По данным ряда исследований, адекватная абсорбция кальция в кишечнике у большинства людей происходит при уровнях 25(OH)D крови в диапазоне 12–20 нг/мл [2], однако имеются полученные независимыми группами данные в пользу порогового уровня для максимальной абсорбции кальция выше 30 нг/мл [60][61]. В работе Priemel M. и соавт., по результатам исследования костных биопсий, было показано, что при уровнях 25(OH)D выше 30 нг/мл не регистрируются патологические дефекты минерализации костной ткани, а у 21% условно здоровых лиц с уровнями в диапазоне 20–30 нг/мл повышено содержание неминерализованного остеоида [62]. Данные наблюдательных и кросс-секционных исследований, рассмотренные в ряде метаанализов, предполагают, что уровни 25(OH)D ниже 20 нг/мл повышают риск падения у пожилых и ассоциированы с большей частотой переломов [63–65]. В крупном РКИ, проведенном в Великобритании, при повышении уровня 25(OH)D крови от 21 до 29 нг/мл наблюдалось суммарное снижение основных остеопоротических переломов на 33% [66]. Метаанализы Bischoff-Ferrari и соавт. показывают, что снижение частоты переломов при приеме препаратов витамина D не наблюдается при уровнях 25(OH)D ниже 30 нг/мл, а для некоторых переломов — ниже 40 нг/мл [46][67].
Открытие повсеместной экспрессии 1α-гидроксилазы в организме, возможности локального синтеза активной формы витамина D, а также колоссального количества генов, имеющих витамин D-чувствительный элемент (около 3% генома человека), повлекло за собой активное изучение неклассических эффектов витамина D, в частности, влияния на клеточный рост, нервно-мышечную проводимость, иммунитет и воспаление. Показана ассоциация низких уровней витамина D с различными заболеваниями человека, включая более высокий риск различных онкологических заболеваний, инфекций, аутоиммунных и сердечно-сосудистых заболеваний [54]. Полученные данные вызвали большой интерес в отношении возможного положительного эффекта при приеме добавок витамина D. К сожалению, проведенные в последние годы крупные РКИ, посвященные этому вопросу, не позволили ответить на него утвердительно [68–70], однако нужно отметить, что включенные пациенты в большинстве своем не имели дефицита витамина D: средние исходные уровни в VIDA составили 24,2 нг/мл, VITAL — 30,8 нг/мл, D2d — 28,2 нг/мл. Таким образом, по мнению экспертов, доказательная база в отношении необходимости поддержания более высоких уровней 25(ОН)D, чем 30 нг/мл, в настоящее время недостаточна. Для оценки оптимальных пороговых значений 25(OH)D в отношении внекостных эффектов требуется проведение дополнительных исследований с включением пациентов с более низкими уровнями витамина D и более продолжительным периодом наблюдения.
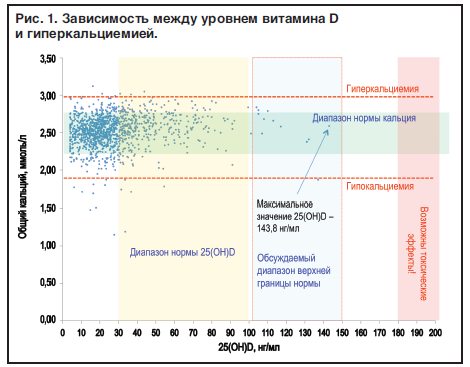
Большинством экспертов и регуляторных органов в качестве безопасной верхней границы концентрации 25(ОН)D, позволяющей избежать развития гиперкальциемии — основного проявления токсичности витамина D, предлагается концентрация, равная 100 нг/мл (250 нмоль/л) [2][3][51]. При коррекции дефицита витамина D эксперты рекомендуют придерживаться более узкого диапазона целевых значений 25(ОН)D — 30–60 нг/мл (75–150 нмоль/л) в связи с отсутствием доказательной базы по дополнительному положительному влиянию при более высокой концентрации 25(ОН)D, а также редким превышением этих значений естественным путем у человека, даже в популяциях с круглогодичным воздействием естественного обилия солнечного света [71].
- При выявлении дефицита витамина D (25(OH)D <20 нг/мл) рекомендуется оценить уровни кальция, скорректированного на альбумин, фосфора, щелочной фосфатазы, ПТГ, креатинина (с расчетом СКФ), магния сыворотки крови [13–15][17–22][72–80].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 3).
Комментарии. При обнаружении сниженного уровня 25(OH)D целесообразен клинический и лабораторный скрининг состояний, для которых продемонстрирована ассоциация с дефицитом витамина D (табл. 2) [13–15][17–22][72–74]. Данное обследование также позволяет получить более точную оценку кальций-фосфорного обмена и повысить эффективность назначаемого лечения. Так, низкие уровни магния могут быть ассоциированы с приемом таких достаточно часто назначаемых препаратов, как ингибиторы протонной помпы [75]. Имеются данные о том, что уровень употребления магния может иметь обратную ассоциацию с риском дефицита и недостаточности витамина D [76]. В свою очередь, дефицит магния может приводить к снижению уровня 1,25(OH)2D и ПТГ, а также к развитию витамин D-резистентной гипокальциемии; описаны случаи магний-зависимого витамин D-резистентного рахита [77–79].
Корректировка кальция на уровень альбумина крови необходима с целью исключения ложно завышенных или ложно заниженных показателей кальциемии при изменении концентрации плазменных белков, особенно при уровне альбумина менее 40 г/л и более 45 г/л [80].
Формулы для расчета альбумин-скорректированного кальция:
— общий кальций плазмы (ммоль/л) = измеренный уровень общего кальция плазмы (ммоль/л) + 0,02 × (40 — измеренный уровень альбумина плазмы (г/л));
— общий кальций плазмы (мг/дл) = измеренный уровень общего кальция плазмы (мг/дл) + 0,8 × (4 — измеренный уровень альбумина плазмы (г/дл));
— коэффициент пересчета: [кальций] мг/дл × 0,25 ==> [кальций] ммоль/л.
- Измерение уровня 1,25(ОН)2D в сыворотке крови не рекомендуется для оценки статуса витамина D, но может быть применено в качестве дополнительного метода исследования при некоторых заболеваниях, ассоциированных с врожденными и приобретенными нарушениями метаболизма витамина D и фосфора, — в частности, при дифференциальной диагностике гипофосфатемического синдрома, при состояниях, сопровождающихся экстраренальной активностью фермента 1α-гидроксилазы (например, при гранулематозных или лимфопролиферативных заболеваниях) [81][82].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 3).
Комментарии. 1,25(ОН)2D циркулирует в крови в концентрациях до 1000 раз ниже, чем 25(ОН)D, и имеет время полужизни около 4 ч, жестко регулируется уровнями ПТГ, FGF23, кальция и фосфора крови и не отражает запасы витамина D в организме, поэтому не рекомендуется для определения статуса витамина D и его мониторинга. При дефиците витамина D и/или кальция в организме сывороточные уровни 1,25(ОН)2D, как правило, в норме или даже выше референсных значений, что является следствием развития вторичного гиперпаратиреоза. Определение 1,25(ОН)2D может быть целесообразным при врожденных или приобретенных нарушениях метаболизма витамина D и фосфора, хронических гранулематозных заболеваниях и некоторых лимфомах, когда может иметь место дефицит или, наоборот, избыток активности фермента 1α-гидроксилазы [81][82].
- Измерение уровня 24,25(ОН)2D в сыворотке крови с расчетом соотношения 25(ОН)D к 24,25(ОН)2D рекомендуется при подозрении на дефицит активности фермента 24-гидроксилазы или токсичность витамина D, а также в качестве дополнительного параметра оценки статуса витамина D [83–89].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 3).
Комментарии. Не менее 20% случаев идиопатической гиперкальциемии остаются неразрешенными. Одной из возможных причин может являться дефицит активности 24-гидроксилазы, обусловленный генетическими вариантами CYP24A1 с потерей функции и клинически характеризующийся развитием гиперкальциемии, нефролитиаза и нефрокальциноза. Поскольку частота этого генетического дефекта пока недостаточно изучена, определение 24,25(ОН)2D и расчет соотношения 25(ОН)D к 24,25(ОН)2D могут быть использованы при подозрении на дефицит 24-гидроксилазы в качестве скринингового, более дешевого, чем генетическое исследование, метода. При этом состоянии сывороточные уровни 24,25(ОН)2D будут низкими, а соотношение 25(ОН)D к 24,25(ОН)2D — повышенным (в качестве порогового значения для данного соотношения рассматривается уровень, равный 80 и выше, однако диагностические критерии требуют уточнения в крупных выборках) [83–87]. Аналогичная картина наблюдается при дефиците витамина D, который сопровождается физиологической инактивацией катаболического пути витамина D [85]. В связи с этим соотношение 25(ОН)D к 24,25(ОН)2D может быть рассмотрено в качестве дополнительного маркера достаточности витамина D в организме, этом параметр также продемонстрировал ассоциацию с клиническими исходами в пилотных исследованиях (в частности, с МПК и риском переломов) [88][89]. При гипервитаминозе витамина D, напротив, даже при высоких значениях 25(ОН)D соотношение 25(ОН)D к 24,25(ОН)2D сохраняется нормальным в силу пропорционального повышения продукции неактивного метаболита [87]. Таким образом, данное исследование является весьма информативным в дифференциальной диагностике гиперкальциемии, ассоциированной с витамином D.
2.4. Инструментальные диагностические исследования
- Для определения спектра и тяжести костных нарушений пациентам с наличием клинических признаков рахита или остеомаляции рекомендуется рентгенологическая оценка структурных изменений скелета, включая обзорную рентгенографию тазовых костей, рентгенографию длинных трубчатых костей [90–93].
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 4).
Комментарии. Основные рентгенологические проявления алиментарного рахита и остеомаляции заметны при рутинном рентгенографическом исследовании: общее снижение видимой плотности кости, деформации позвонков (двояковогнутая деформация, или деформация по типу «рыбьих позвонков») и псевдопереломы (или зоны Лоозера). Самым ранним рентгенологическим проявлением ПТГ-опосредованной резорбции кости является общее истончение кортикального слоя длинных костей. Более поздние изменения включают поднадкостничную резорбцию кости (лучше всего видна на радиальной стороне средних фаланг, пястных костей и плюсневых костей) и «бурые» опухоли (фиброзно-кистозный остеит) и наблюдаются в более запущенных случаях тяжелого гиперпаратиреоза [90][91]. Хотя последние костные аномалии могут исчезнуть после терапии витамином D, истончение кортикального слоя сохраняется вместе с увеличенным риском перелома; псевдопереломы могут также прогрессировать до полного перелома [92][93].
2.5. Иные диагностические исследования
Не применяются.
3. ЛЕЧЕНИЕ, ВКЛЮЧАЯ МЕДИКАМЕНТОЗНУЮ И НЕМЕДИКАМЕНТОЗНУЮ ТЕРАПИИ, ДИЕТОТЕРАПИЮ, ОБЕЗБОЛИВАНИЕ, МЕДИЦИНСКИЕ ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ МЕТОДОВ ЛЕЧЕНИЯ
3.1. Медикаментозное лечение
- Для лечения дефицита и недостаточности витамина D рекомендуется использование колекальциферола** (D3) [94–96].
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 1).
Комментарии. При лечении дефицита/недостаточности витамина D, предпочтение отдается форме D3 (колекальциферол**), которая обладает сравнительно большей эффективностью в достижении и сохранении целевых значений 25(OH)D в сыворотке крови [94–96]. Зарегистрированные в РФ препараты колекальциферола** приведены в таблице 4.
- Лечение дефицита витамина D (уровень 25(ОН)D в сыворотке крови <20 нг/мл) у взрослых рекомендуется начинать с суммарной насыщающей дозы колекальциферола** 400 000 МЕ с использованием одной из предлагаемых схем, с дальнейшим переходом на поддерживающие дозы (табл. 5). Выбор схемы (ежедневный, еженедельный, ежемесячный прием) определяется индивидуально с учетом предпочтений пациента и максимальной ожидаемой приверженности к лечению [69][97–106].
Таблица 4. Нативные препараты витамина D
|
Название препарата |
Форма выпуска |
Дозировка |
|
Колекальциферол** Код ATX: A11CC05 (Colecalciferol) |
Масляный раствор |
20 000 МЕ (500 мкг) в 1 мл |
|
Водный раствор |
15 000 МЕ (375 мкг) в 1 мл |
|
|
Таблетки |
500 МЕ, 1000 МЕ, 2000 МЕ |
|
|
Капсулы |
2000 МЕ, 4000 МЕ, 10 000 МЕ |
* — NB! Объем капель и, таким образом, доза препарата, содержащегося в одной капле, зависят от многих факторов (характер растворителя (водный или масляный раствор), температура раствора, тип пипетки/встроенной капельницы, колебаний пузырька при отмеривании дозы и др.).
Таблица 5. Схемы лечения дефицита и недостаточности витамина D
|
Коррекция дефицита витамина D (уровень 25(OH)D <20 нг/мл) |
|
•50 000 МЕ еженедельно в течение 8 недель внутрь •200 000 МЕ ежемесячно в течение 2 месяцев внутрь •150 000 МЕ ежемесячно в течение 3 месяцев внутрь •6000–8000 МЕ в день — 8 недель внутрь |
|
Коррекция недостатка витамина D (уровень 25(OH)D ≥20 и <30 нг/мл) |
|
•50 000 МЕ еженедельно в течение 4 недель внутрь •200 000 МЕ однократно внутрь •150 000 МЕ однократно внутрь •6000–8000 МЕ в день — 4 недели внутрь |
|
Поддержание уровней витамина D ≥30 нг/мл |
|
•1000 — 2000 МЕ ежедневно внутрь •6 000–14 000 МЕ однократно в неделю внутрь |
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2).
Комментарии. В отношении коррекции дефицита витамина D у взрослых продемонстрированы эффективность и безопасность начальной болюсной дозы витамина D, а также еженедельного перорального приема 50 000 МЕ витамина D в течение 8 нед [97][98]. Поскольку эффективность достижения целевого уровня 25(OH)D не изменяется при различном режиме приема витамина D (ежедневный, еженедельный или ежемесячный) [99][100], альтернативным подходом может являться ежедневный прием эквивалентной дозы витамина D (6000–8000 МЕ в течение 8 нед), что подтверждено результатами отечественных исследований [101]. Для достижения максимальной приверженности лечению при выборе схемы следует учитывать индивидуальные особенности и пожелания пациента.
Продолжительность поддерживающей терапии и эффективная поддерживающая терапия для взрослых с целевым достигнутым или исходным уровнем витамина D четко не определены. Прием 50 000 МЕ витамина D каждые 2 нед (что эквивалентно 3500 МЕ в сутки) показал эффективность в поддержании уровня 25(OH)D в целевом диапазоне выше 30 нг/мл и отсутствие значимых побочных эффектов при наблюдении до 6 лет [102][103]. Суточной дозы в 2000 МЕ, по данным ряда исследований, может оказаться недостаточно для достижения таких показателей [104][105], но в некоторых исследованиях оказались эффективными и более низкие дозы (900–1800 МЕ в сутки) [106], что подтверждается опытом отечественных экспертов. Важно отметить, что в исследовании VITAL при пятилетнем наблюдении пациентов, получавших 2000 МЕ витамина D ежедневно, не было отмечено проблем с безопасностью в отношении гиперкальциемии, камней в почках или почечной недостаточности [69]. По данным отечественных исследований, при приеме 10 000 МЕ колекальциферола** в неделю уровни выше 30 нг/мл сохраняются у 70% пациентов, а при приеме 2000 МЕ в сутки — у 50% [101]. В связи с отсутствием данных, свидетельствующих о необходимости приема более высоких доз, эксперты не рекомендуют назначение суточных доз выше 2000 МЕ в общей популяции при отсутствии значимых факторов риска дефицита витамина D.
- Коррекция недостаточности витамина D (уровень 25(ОН)D в сыворотке крови ≥20 и <30 нг/мл) рекомендуется с использованием половинной суммарной насыщающей дозы колекальциферола**, равной 200 000 МЕ, с дальнейшим переходом на поддерживающие дозы (табл. 5) [97][105].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2).
Комментарии. Изменение концентрации 25(OH)D в сыворотке крови при любой используемой дозе достаточно индивидуально и, по данным клинических исследований, зависит от исходного уровня — чем ниже исходный уровень, тем больше прирост [97]. Вместе с тем фармакокинетические исследования, характеризующие «доза-эффект», указывают на то, что скорость повышения концентрации 25(OH)D является линейной и составляет примерно 0,4 нг/мл/мкг/сут, то есть прием каждых дополнительных 100 МЕ витамина D в сутки увеличивает уровень 25(OH)D в сыворотке менее чем на 1 нг/мл [105]. В связи с этим для коррекции недостаточности витамина D (уровень 25(ОН)D 20–29 нг/мл) рекомендуется использовать насыщающие дозы с дальнейшим переходом на поддерживающую терапию c применением половины суммарной насыщающей дозы, применяемой для коррекции дефицита витамина D (табл.. 5).
- Пациентам с ожирением, синдромами мальабсорбции, а также принимающим препараты, нарушающие метаболизм витамина D, рекомендуется прием более высоких (в 2–3 раза) насыщающих доз колекальциферола** для лечения дефицита (800 000–1 200 000 МЕ) и недостаточности витамина D (400 000–600 000 МЕ) с переходом на поддерживающую дозу не менее 3000–6000 МЕ в сутки [107–116].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2).
Комментарии. В метаанализах РКИ продемонстрировано, что ожирение снижает эффективность терапии колекальциферолом**, уменьшая прирост уровня 25(ОН)D примерно на 15 нг/мл [107]. Исследования «доза-эффект» также подтверждают сниженный ответ на терапию колекальциферолом** при ожирении [108][109] и свидетельствуют о том, что повышение 25(OH)D при приеме колекальциферола** напрямую зависит от дозы и массы тела: на каждую единицу прироста 25(OH)D (1 нг/мл) требуется около 2,5 МЕ/кг [108]. При этом болюсная доза может быть менее эффективна, чем еженедельный прием [110]. У пациентов с синдромом мальабсорбции сохраняется высокий риск дефицита витамина D, несмотря на получаемое лечение [111]. Сходная ситуация отмечается у пациентов, получающих лекарственную терапию, влияющую на метаболизм витамина D (в частности, противоэпилептические препараты) [112][113]. Этим пациентам требуются более высокие дозы для поддержания адекватных уровней 25(OH)D [114–116].
- У пациентов с ХБП рекомендуется коррекция дефицита и недостаточности витамина D с использованием стандартных для общей популяции режимов [117–125].
Уровень убедительности рекомендаций А (уровень достоверности доказательств — 2).
Комментарии. Согласно данным метаанализов обсервационных исследований среднего и высокого качества, у пациентов с ХБП более высокие уровни 25(OH)D ассоциированы со значимым снижением смертности от всех причин и снижением сердечно-сосудистой смертности у диализных пациентов — 14–22% на каждые 10 нг/мл увеличения уровня 25(ОН)D [117–119]. При этом снижение риска у диализных пациентов было непрерывным в диапазоне уровней 25(OH)D от 5 до 40 нг/мл, а у предиализных пациентов максимальное снижение риска достигалось при уровнях 25(OH)D, равных 25–30 нг/мл [119]. Оптимальные уровни 25(ОН)D у предиализных пациентов достигались при использовании суточных доз колекальциферола** более 2000 МЕ в большинстве клинических исследований [120], при этом терапия не сопровождалась значимым изменением сывороточных уровней кальция и фосфора, эпизоды гиперкальциемии и гиперфосфатемии были редкими (2–3% и 0,8-7% соответственно) и разрешались при коррекции терапии [121]. Терапия колекальциферолом** у диализных пациентов способствовала поддержанию более высоких уровней 25(ОН)D, но позволила достигнуть рекомендованных уровней только у 57% пациентов, при этом используемые дозы колекальциферола** широко варьировали (от 6000 до 200 000 МЕ в неделю). Данная терапия не сопровождалась развитием гиперкальциемии, но приводила к значимому увеличению сывороточного фосфора [122]. Сердечно-сосудистые эффекты терапии колекальциферолом** при ХБП не изучались прицельно в РКИ, а ретроспективный анализ существующих РКИ не продемонстрировал доказательств того, что прием колекальциферола** влияет на смертность пациентов с ХБП [123], но в ретроспективном обсервационном исследовании лечение дефицита витамина D у предиализных пациентов было ассоциировано со значительным снижением частоты сердечно-сосудистых событий [124]. Таким образом, в настоящее время специфический протокол восполнения дефицита и недостаточности витамина D не разработан, при этом клинические рекомендации Kidney Disease Improvement Global Outcomes (KDIGO) 2017 г. предполагают коррекцию с использованием стратегии, принятой для общей популяции [125], что соотносится с позицией отечественных экспертов.
- Для лечения и профилактики аутоиммунных заболеваний не рекомендуется использование колекальциферола**. У пациентов с аутоиммунными заболеваниями рекомендуется коррекция дефицита и недостаточности витамина D с использованием стандартных для общей популяции режимов [126–153].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 2).
Комментарии. В метаанализах продемонстрирована ассоциация низких уровней 25(ОН)D с рядом аутоиммунных заболеваний, в частности, с сахарным диабетом 1 типа [126–129], системной красной волчанкой [130–132], заболеваниями щитовидной железы [133–135], витилиго [136], несколько менее убедительная ассоциация продемонстрирована для рассеянного склероза [137][138], ревматоидного артрита [139–141], синдрома Шегрена [142][143]. Также показаны положительные эффекты приема витамина D на некоторые параметры течения основного заболевания — для сахарного диабета 1 типа [144], рассеянного склероза [145][146], системной красной волчанки [147], аутоиммунного тиреоидита [148]. В систематическом обзоре Cochrane 2018 г. и более позднем метаанализе не получено убедительных подтверждений улучшения течения рассеянного склероза при приеме витамина D [149][150], метаанализ 2019 г. также не продемонстрировал значимых эффектов витамина D на течение системной красной волчанки [151]. Post-hoc анализ исследования VITAL продемонстрировал снижение заболеваемости аутоиммунными заболеваниями на 25–30% в группе приема витамина D [154], однако специально запланированные интервенционные исследования для оценки влияния витамина D на риск развития аутоиммунных заболеваний не проводились. Таким образом, на момент составления настоящих рекомендаций эксперты согласны с заключением Европейского общества клинических и экономических аспектов остеопороза и остеоартрита (ESCEO) и метаанализом 2017 г. об отсутствии достаточной доказательной базы для использования препаратов витамина D с целью профилактики и лечения внескелетных хронических заболеваний, а также с необходимостью дальнейшего подтверждения результатов, полученных в отношении аутоиммунных заболеваний (включая сахарный диабет 1 типа, рассеянный склероз и системную красную волчанку), сердечно-сосудистых заболеваний и общего снижения смертности, в РКИ достаточной мощности с длительным периодом наблюдения и клинически значимыми конечными точками [152][153].
- У беременных рекомендуется коррекция дефицита и недостаточности витамина D с использованием доз не выше 4000 МЕ в сутки в I триместре, на более поздних сроках — стандартными для общей популяции схемами [155–160].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 3).
Комментарии. Проведены лишь единичные исследования с участием беременных женщин, в которых оценивалась безопасность добавок витамина D (4000 МЕ в сутки или 200 000 МЕ однократно), при этом не сообщалось о побочных эффектах данных доз [155][156]. В ряде других работ, оценивавших влияние высоких доз колекальциферола** на исходы беременности, также не зарегистрировано побочных эффектов, связанных с токсичностью витамина D [157–159]. Результаты систематического обзора Cochrane свидетельствуют о том, что прием беременными женщинами доз витамина D в диапазоне выше общепринятых профилактических (от 600 до 4000 МЕ в сутки) может снизить риск гестационного диабета, однако не оказывает значимого влияния на риск преэклампсии, преждевременных родов и низкой массы тела при рождении, тогда как прием беременными женщинами витамина D в количестве, превышающем текущий верхний предел (4000 МЕ в сутки и выше), по-видимому, не оказывает значимого влияния на оцениваемые исходы [160]. При этом срок начала приема препаратов значительно варьировал между исследованиями, и лишь в нескольких исследованиях прием был начат на очень ранних сроках беременности, в то время как в большинстве исследований препараты были добавлены во II триместре, в нескольких исследованиях — начиная с III триместра. В связи с этим, с учетом ограниченного количества данных о безопасности применения высоких доз колекальциферола** в I триместре беременности, не рекомендуется использование доз, превышающих 4000 МЕ в сутки, у таких пациентов.
- Рутинное динамическое исследование концентрации 25(ОН)D при приеме колекальциферола** не рекомендуется. Повторная оценка уровня витамина D рекомендуется через 8–12 нед у пациентов с исходным тяжелым дефицитом витамина D или сохраняющимся риском тяжелого дефицита (например, синдром мальабсорбции, метаболические заболевания костей, морбидное ожирение, прием лекарственных средств), у остальных пациентов — не ранее чем через 6 мес лечения [161–163].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 3).
Комментарии. Фармакокинетика витамина D достаточно сложна, и эффективность лечения ассоциирована со множеством факторов [161]. При построении регрессионной модели основным предиктором уровня 25(OH)D после лечения являлся ИМТ, который объяснял 21,6% вариабельности концентрации 25(OH)D [162]. У подавляющего большинства пациентов с синдромом мальабсорбции может наблюдаться сниженное всасывание стандартной дозы колекальциферола** [163]. Таким образом, мониторинг концентрации 25(OH)D во время приема препаратов витамина D не требуется большинству пациентов, но целесообразен у пациентов с исходным тяжелым дефицитом витамина D, нарушениями всасывания или метаболизма витамина D, а также при подозрении на плохое соблюдение режима приема препарата. У пациентов с риском стойкого снижения уровня 25(OH)D оправданно проведение повторного тестирования через 8–12 нед для определения дальнейшей тактики ведения. У остальных пациентов повторное тестирование следует проводить не ранее чем 6 мес приема добавок витамина D.
- При неэффективности стандартных схем лечения дефицита витамина D рекомендуется обследование, направленное на исключение вторичных причин дефицита витамина D (табл. 2).
Уровень убедительности рекомендаций С (уровень достоверности доказательств — 5).
Комментарии. Если стандартные схемы лечения дефицита витамина D оказались неэффективными, до наращивания доз препаратов витамина D целесообразно проведение дополнительного обследования для выявления факторов риска дефицита витамина D, которые отражены в таблице 2. Объем необходимого обследования определяется индивидуально в соответствии с клиническим контекстом.
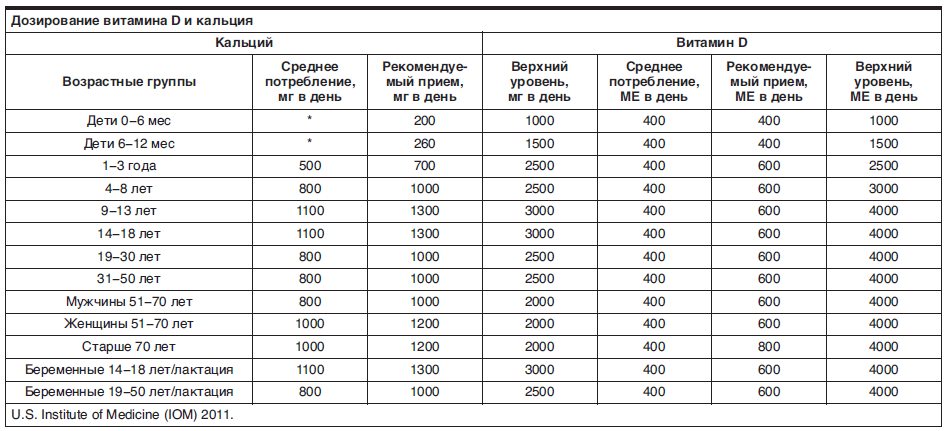
- Всем лицам рекомендуется адекватное возрасту потребление кальция с пищей. При недостаточном потреблении кальция с продуктами питания рекомендуется применение добавок кальция для обеспечения суточной потребности в этом элементе [2][51][164–174].
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 1).
Комментарии. Кальций является строительным материалом для костной ткани, основным участником кальций-фосфорного обмена. Действие витамина D в основном направлено на оптимизацию гомеостаза кальция в организме, в том числе для целей минерализации костного матрикса, но возможности его не безграничны, и в условиях критического дефицита кальция проявления дефицита витамина D в виде рахита/остеомаляции резко возрастают. Предполагается, что ключевым патофизиологическим следствием низкого потребления кальция является повышение образования 1,25(ОН)2D [51]. Имеются доказательства того, что ответ на терапию остеопороза может быть более выражен, если обеспечивается достаточное употребление витамина D и кальция [164][165].
Таким образом, адекватное поступление кальция необходимо для максимальной реализации функций витамина D. Кальций содержится во многих продуктах питания, поэтому следует стремиться к максимальному обеспечению суточной потребности в кальции путем достаточного употребления его с пищей. Рекомендуемая суточная доза потребления кальция варьирует в зависимости от возраста, пола и отдельных физиологических или патологических состояний, составляя для взрослых, как правило, от 1000 до 1300 мг (табл. 6). Это рекомендованное потребление, однако, не всегда достигается диетой. Основные причины недостаточного содержания кальция в рационе и его усваивания — это наличие в пище фитатов (содержатся в семенах злаковых, бобовых, масличных культур) и оксалатов (содержатся в щавеле и ревене, киноа, чайных листьях), которые связывают содержащийся в этих продуктах кальций и препятствуют его всасыванию [166][167], увеличение потребления бутилированной воды с низким содержанием минеральных веществ, снижение потребления молочных продуктов с целью контроля уровня холестерина [168] либо в связи с непереносимостью лактозы [169] и, особенно в детстве, рост распространенности аллергии на коровье молоко [170].
Таблица 6. Возрастные нормы потребления кальция [2]
|
Возрастная группа |
Норма потребления кальция (мг) |
|
Дети от 1 до 3 лет |
700 |
|
Дети от 4 до 8 лет |
1000 |
|
Дети от 9 до 13 лет |
1300 |
|
Подростки от 14 до 18 лет |
1300 |
|
Лица от 19 лет и до 50 лет |
1000 |
|
Лица от 51 года и до 70 лет |
1200 (женщины) |
|
Лица старше 70 лет |
1200 |
Молочные продукты являются основным источником биодоступного кальция, и лишь некоторые другие продукты содержат столько же кальция (например, кунжут, амарант, лесной орех, миндаль), которые вряд ли можно употреблять в той же пропорции, что и молоко [2]. Чтобы восполнить суточную потребность в кальции, взрослому человеку необходимо потреблять не менее 3 порций молочных продуктов в день. К примеру, одной порцией считается 150 г творога, 200 мл молока или кисломолочных продуктов (кефир, ряженка, айран и др.), 150 г йогурта или 30 г твердого сыра [171]. Для людей, не получающих достаточное количество кальция с пищей, рекомендуется дополнительный прием препаратов в дозах, необходимых для обеспечения суточной нормы потребления, однако предпочтительным источником являются продукты питания. По данным крупных метаанализов, оценивавших взаимосвязь потребляемого кальция со смертностью от различных причин, большее употребление кальция с пищей ассоциировано со снижением смертности от всех причин, тогда как данные об ассоциации общего потребления кальция и потребления кальция из добавок со смертностью оказались дискордантными в этих работах [172][173]. В частности, при субанализе исследований с периодом наблюдения более 10 лет продемонстрировано значимое повышение смертности от сердечно-сосудистых заболеваний при более высоком общем потреблении кальция, тогда как в другой работе продемонстрирована обратная взаимосвязь; потребление кальция из добавок было ассоциировано со смертностью только в одном из метаанализов. В настоящее время не доказаны преимущества приема кальция в виде какой-либо конкретной его соли, однако для корректного усваивания препарата может иметь значение соблюдение режима приема (в частности, карбонат кальция должен приниматься во время или после еды, поскольку для адекватного всасывания необходима кислая среда желудка, тогда как цитрат кальция не требует этого) [174].
- Рутинное назначение препаратов витамина К при лечении дефицита и недостаточности витамина D не рекомендуется [175][176].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 1).
Комментарии. Данные экспериментальных работ свидетельствуют о том, что витамин D и витамин К могут обладать синергией в отношении поддержания здоровья костной ткани, преимущественно за счет влияния на синтез остеокальцина. Кроме того, предполагается, что витамин К может оказывать положительное влияние на процесс кальцификации сосудистой стенки, наблюдаемый у пациентов с терминальной стадией ХБП, ассоциированной с недостаточностью витамина К (в настоящее время продолжаются клинические исследования, оценивающие влияние приема препаратов витамина К у пациентов с ХБП, получающих лечение гемодиализом) [175]. Метаанализ РКИ, посвященный влиянию комбинированного приема витамина D и витамина К на состояние скелета в общей популяции, продемонстрировал некоторые преимущества такого назначения (увеличение общей МПК, снижение уровня недодекарбоксилированного остеокальцина), однако не позволяет сделать однозначных выводов о его пользе [176]. В связи с этим требуется проведение дополнительных исследований для оценки эффекта от комбинированного воздействия этих витаминов на здоровье костей, особенно в популяциях с более высоким риском дефицита витамина К (например, пациенты с ХБП), с более четким формулированием конечных точек (в частности, оценка риска переломов).
- Для исключения гиперкальциемии рекомендовано исследование уровня кальция крови, скорректированного на альбумин, в следующих ситуациях: после лечения дефицита и недостаточности витамина D, при уровнях 25(ОН)D выше 60 нг/мл, перед назначением препаратов витамина D при гранулематозных заболеваниях, при подозрении на дефицит 24-гидроксилазы. При выявлении гиперкальциемии рекомендовано также исследование уровня ПТГ [2][3][50][177–182].
Уровень убедительности рекомендаций В (уровень достоверности доказательств — 3).
Комментарии. Несмотря на то что токсичность витамина D является достаточно редким явлением в абсолютных значениях, в последние годы повсеместно наблюдается явный тренд по увеличению частоты регистрируемых случаев [177]. По оценкам, проведенным в США, в сравнении с 2000 г. ежегодно стало регистрироваться в 17 раз больше случаев [178].
Причинами витамин D-опосредованной гиперкальциемии может являться избыточное употребление препаратов витамина D (в частности, бесконтрольный прием больших доз биологически активных добавок в течение длительного времени), эктопическая продукция активного метаболита витамина D (1,25-дигидроксивитамина D) или снижение активности 24-гидроксилазы в связи с наличием инактивирующей мутации CYP24A1. Основными лабораторными находками при интоксикации витамином D, обусловливающими клиническую симптоматику, являются гиперкальциемия и гиперкальциурия, также отмечаются гиперфосфатемия и супрессия уровня ПТГ. Несмотря на то что точный отрезной порог для концентрации 25(ОН)D, сопровождающейся риском токсичности, неизвестен, эксперты склоняются к тому, что концентрации 25(OH)D выше 80 нг/мл в сочетании с гиперкальциемией и анамнезом приема высоких доз витамина D следует рассматривать как интоксикацию витамином D [179].
Около 3% взрослых в США регулярно принимают добавки витамина D в дозе выше 4000 МЕ в сутки [180], которая общепризнанно считается максимальным уровнем регулярного суточного потребления, не сопровождающимся нежелательными эффектами [2][3][50]. Вместе с тем повышение уровня кальция может иметь место даже при приеме умеренных доз колекальциферола**: среди пациентов с дефицитом витамина D, которые принимали 800–2000 МЕ колекальциферола** в сутки в течение 1 года, эпизоды гиперкальциемии наблюдалась у 9% [181]. При назначении препаратов колекальциферола** следует также помнить, что нарушения метаболизма витамина D (в частности, инактивирующие мутации фермента 24-гидроксилазы или эктопическая активность 1α-гидроксилазы при гранулематозных заболеваниях) могут изменять потребность в витамине D и приводить не только к избыточной продукции активной формы витамина D и гиперкальциемии, но и к развитию нефрокальциноза [182]. Кроме того, после восполнения дефицита витамина D может проявиться гиперкальциемия вследствие первичного гиперпаратиреоза, которая до лечения была замаскирована дефицитом витамина D. Таким образом, хотя витамин D-опосредованная гиперкальциемия является относительно редкой по сравнению с первичным гиперпаратиреозом и онкогенной гиперкальциемией, истинная распространенность ее неизвестна и, вероятно, может увеличиваться с увеличением потребления витамина D среди населения в целом и появлением новой информации о распространенности мутаций CYP24A1. В связи с этим целесообразен скрининг гиперкальциемии после завершения приема колекальциферола** в лечебной дозе, у пациентов с супрафизиологическими концентрациями витамина D и при назначении витамина D пациентам с известным или предполагаемым нарушением метаболизма витамина D.
- Рутинное назначение активных метаболитов витамина D (альфакальцидол**, кальцитриол**) не рекомендуется для лечения дефицита витамина D, однако их применение рекомендуется при наличии показаний у пациентов с установленным нарушением метаболизма витамина D, в том числе в комбинированной терапии с препаратами нативного витамина D [183][184].
Уровень убедительности рекомендаций A (уровень достоверности доказательств — 1).
Комментарии. Альфакальцидол нуждается только в одном гидроксилировании в печени посредством 25-гидроксилазы для превращения в D-гормон, в связи с чем он остается эффективным у пациентов с терминальной стадией ХБП, сопровождающейся снижением активности 1α-гидроксилазы. Кальцитриол эффективен даже при тяжелых поражениях печени, поскольку не нуждается в дополнительных этапах метаболизма для обретения биологической активности. Активные метаболиты витамина D и их аналоги не определяются в значимых количествах при исследовании концентрации витамина D в сыворотке крови, в связи с чем на фоне приема этих препаратов необходимо контролировать содержание кальция в сыворотке крови и моче, а также проводить коррекцию дозы препарата в случае гиперкальциемии/гиперкальциурии.
Таким образом, ввиду значительно более высокой стоимости и необходимости мониторирования кальциемии и кальциурии не рекомендуется использование активных метаболитов витамина D в тех случаях, когда возможно эффективное применение нативного витамина D [183]. Назначение активных метаболитов витамина D и их аналогов рекомендуется у пациентов с установленным нарушением метаболизма витамина D по абсолютным и относительным показаниям [184], приведенным в таблице 7. Вместе с тем при установленном снижении концентрации 25(OH)D его коррекция нативным витамином D является обязательным этапом лечения и должна проводиться, в том числе, пациентам с терминальной стадией почечной недостаточности и наследственными нарушениями метаболизма витамина D.
Таблица 7. Показания к назначению активных метаболитов витамина D
|
Абсолютные |
Относительные |
|
•Вторичный гиперпаратиреоз при терминальной стадии ХБП •Гипопаратиреоз •Псевдогипопаратиреоз •Витамин D-резистентный рахит •Витамин D-зависимый рахит •Выраженная гипокальциемия |
•Вторичный гиперпаратиреоз при ХБП (СКФ менее 60 мл/мин) •В комбинированной терапии остеопороза |
3.2. Иное лечение
Не применяется.
4. МЕДИЦИНСКАЯ РЕАБИЛИТАЦИЯ И САНАТОРНО-КУРОРТНОЕ ЛЕЧЕНИЕ, МЕДИЦИНСКИЕ ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ МЕТОДОВ МЕДИЦИНСКОЙ РЕАБИЛИТАЦИИ, В ТОМ ЧИСЛЕ ОСНОВАННЫХ НА ИСПОЛЬЗОВАНИИ ПРИРОДНЫХ ЛЕЧЕБНЫХ ФАКТОРОВ
В настоящее время нет убедительных научных доказательств эффективности санаторно-курортного лечения как метода стойкого безопасного поддержания оптимальных уровней витамина D.
5. ПРОФИЛАКТИКА И ДИСПАНСЕРНОЕ НАБЛЮДЕНИЕ, МЕДИЦИНСКИЕ ПОКАЗАНИЯ И ПРОТИВОПОКАЗАНИЯ К ПРИМЕНЕНИЮ МЕТОДОВ ПРОФИЛАКТИКИ
- Рекомендуемыми препаратами для профилактики дефицита витамина D являются колекальциферол** (D3) и эргокальциферол (D2) [185–187].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 1).
Комментарии. Витамин D3 и D2 часто называют «нативными», при этом витамин D3 синтезируется в коже человека и поступает из животных продуктов питания, а D2 поступает из продуктов растительного происхождения, в связи с чем может быть предпочтителен у приверженцев веганского питания [185]. Обе формы не обладают исходной активностью и способны накапливаться в жировой ткани, создавая депо, с чем и связаны их низкая токсичность, широкий терапевтический диапазон и возможность применения в высоких дозах. При этом D3 показал сравнительно большую эффективность в отношении поддержания стабильной концентрации 25(ОН)D при длительном приеме [186, 187]. Нативный витамин D может применяться с едой или натощак, не требует дополнительного содержания в пище жиров для абсорбции.
- Взрослым лицам для профилактики дефицита витамина D рекомендуется поступление 800–1000 МЕ витамина D в сутки [2][3][188–200].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 1).
Комментарии. В 2010 г. Институт медицины США признал общепринятую до этого норму суточного потребления витамина D 200 МЕ недостаточной и рекомендовал новые нормы, составляющие 400 МЕ в сутки для младенцев, 600 МЕ в сутки для детей, подростков и взрослых и 800 МЕ в сутки для взрослых старше 70 лет [2]. Эти пороговые значения одобрены большинством клинических рекомендаций, поскольку позволяют достичь уровней 25(OH)D более 20 нг/мл у 97% индивидуумов, обеспечивающих оптимальное состояние костно-мышечной системы [3][188][189]. Однако более поздние исследования, основанные на анализе данных отдельных участников РКИ, свидетельствуют о том, что необходимое для достижения этих целей потребление витамина D выше и составляет около 1000 МЕ в сутки [190].
За последние годы было выполнено 4 метаанализа, посвященных оценке пользы витамина D для профилактики переломов [191–194]. Только в одном из них обнаружено значимое снижение общего числа переломов на 15% (ОР=0,85; 95% ДИ 0,73–0,98) и переломов бедра на 30% (ОР=0,70; 95% ДИ 0,56–0,87) для ежедневного приема витамина D и кальция [192]. Три других метаанализа не продемонстрировали пользу витамина D, однако, чтобы передать эти результаты в клиническую практику, важно понимать цели и целевые группы этих работ. В метаанализах Zhao и соавт. [191] и Рабочей группы США по профилактике (USPTF) [194] обеими группами авторов отмечено, что результаты применимы только к взрослым людям без установленного остеопороза, дефицита витамина D или высокого риска падений. Таким образом, результаты не применимы к большому сегменту пожилых людей, у которых есть эти факторы риска. Четвертый метаанализ Bolland и соавт. [193] включил работы по первичной и вторичной профилактике среди взрослых в возрасте 50 лет и старше, однако при этом не включались работы, изучающие комбинированный прием кальция и витамина D (примерно 40% высококачественных исследований). Фактически, ре-анализ с включением исследований дозы витамина D 800–1000 МЕ при соблюдении приверженности к лечению более 50%, а также исключением исследований ежегодного приема высоких доз, значимое снижение общего числа переломов на 14% (ОР=0,86; 95% ДИ 0,75–0,98) и падений на 12% (ОР=0,88; 95% ДИ 0,81–0,95) [195]. Субанализы РКИ указывают на то, что нецелевой прием витамина D пожилыми людьми может не нести клинически значимой пользы для МПК, тогда как при исходном выраженном дефиците витамина D (менее 12 нг/мл) наблюдается существенное улучшение костной плотности [196][197]. Ежегодный прием высоких доз витамина D (300 000–500 000 МЕ 1 раз в год) показал неэффективность в отношении профилактики падений и переломов и даже потенциальное увеличение риска, в связи с чем не рекомендуется для профилактики дефицита витамина D [198][199].
Что касается влияния приема витамина D на другие органы и системы, крупный систематический обзор US Preventive Task Force, включивший проведенные в последние годы крупные РКИ (в частности, Vitamin D Assessment (VIDA), Vitamin D and Omega-3 (VITAL) и Vitamin D and Type 2 Diabetes (D2d)), сделал вывод об отсутствии значимой пользы для здоровья от дополнительного приема витамина D у лиц без имеющегося его дефицита или с бессимптомным дефицитом [200]. Однако нет оснований утверждать, по результатам этих исследований, что витамин D не влияет на риск развития рака, на сердечно-сосудистую систему или развитие сахарного диабета. Для ответа на этот вопрос требуется проведение дополнительных исследований, включающих группы с более низкими исходными уровнями витамина D. Кроме того, для таких конечных точек, как рак и сердечно-сосудистые заболевания, необходимо проводить исследования с длительным периодом наблюдения (более 5 лет). Нужно отметить, что, по мнению экспертов, выбор тактики в отношении дополнительного приема витамина D с точки зрения повседневной практики зависит от ряда факторов, как клинических, так и окружающей среды, в связи с чем затруднено транслирование рекомендаций между отдельными популяциями [3][189].
- Беременным и кормящим женщинам для профилактики дефицита витамина D рекомендуется получать 800–2000 МЕ витамина D в сутки [2][155][160][201–204].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2).
Комментарии. Дефицит витамина D очень широко распространен среди беременных кормящих женщин во всем мире, несмотря на действующие рекомендации по его профилактике [201]. Согласно результатам систематического обзора Cochrane, данные 22 исследований с участием 3725 беременных женщин предполагают, что прием витамина D во время беременности может обладать некоторыми положительными эффектами в отношении исходов беременности (снижать риск преэклампсии, гестационного диабета и риск рождения ребенка с низким весом при рождении, но не влияет значимо на риск преждевременных родов), а прием витамина D с кальцием может снижать риск преэклампсии, но при этом повышать риск преждевременных родов [202]. При этом указанные эффекты отмечались преимущественно при более высоких дозах, чем 600 МЕ в сутки, что было ранее рекомендовано Институтом медицины и Обществом акушеров-гинекологов США [2][160][203]. Возможность назначения больших профилактических доз витамина D продемонстрирована в рандомизированных контролируемых исследованиях [155][204]. В частности, в крупном РКИ Hollis и соавт., включившем почти 500 беременных женщин, получавших 400, 2000 или 4000 МЕ витамина D в день, достоверных различий в безопасности приема витамина D в группах не отмечено [155].
- На длительный период (более 6 мес) без лабораторного контроля не рекомендуется назначение доз витамина D более 4000 МЕ в сутки лицам без факторов риска дефицита витамина D и 10 000 МЕ в сутки — лицам, имеющим факторы риска [2][3][51][84][205–208].
Уровень убедительности рекомендаций B (уровень достоверности доказательств — 2).
Комментарии. Большинство экспертов считают, что развитие токсических проявлений витамина D является очень редким явлением и связано преимущественно с непреднамеренным приемом внутрь очень высоких доз витамина, в сотни и тысячи раз превышающих максимально допустимые в течение продолжительного периода времени [205].
Все же некоторые группы пациентов могут быть более чувствительны к приему витамина D. Это, прежде всего, пациенты с гранулематозными заболеваниями, включающими саркоидоз, туберкулез, хронические грибковые инфекции, некоторые лимфомы с активированными макрофагами, нерегулируемо продуцирующими 1,25(ОН)2D [206], а также пациенты с дефицитом 24-гидроксилазы, у которых нарушается инактивация метаболитов витамина D [84]. У таких пациентов назначение препаратов витамина D должно проводиться с осторожностью, под контролем показателей кальций-фосфорного обмена крови, ввиду повышенного риска гиперкальциемии и гиперкальциурии, которые чаще наблюдаются у таких пациентов при уровнях 25(OH)D более 30 нг/мл.
На сегодняшний день регуляторным органам трудно рекомендовать конкретный уровень максимальной безопасной дозы для профилактического приема, но большинство из них остановились на 4000 МЕ в сутки в качестве безопасного верхнего уровня потребления витамина D [2][51]. Однако для пациентов, имеющих факторы риска дефицита витамина D (в особенности синдром мальабсорбции или ожирение) и, соответственно, большую потребность в витамине D, граница токсичности также может быть выше, что признается рядом экспертов [3][207]. По результатам трехлетнего наблюдения в РКИ, профиль безопасности витамина D оказался аналогичен для суточных доз 400, 4000 и 10 000 МЕ [208]. Гиперкальциемия встречалась редко в абсолютных значениях (отмечена у 15 участников, что соответствовало 4%), при этом чаще встречалась у получающих более высокие дозы, была умеренной (кальций общий в диапазоне 2,56–2,64 ммоль/л) и транзиторной во всех случаях. Гиперкальциурия встречалась достаточно часто (отмечена у 23% участников) и чаще возникала при приеме более высоких доз (17, 22 и 31% соответственно, р=0,011), однако не являлась причиной прекращения участия в исследовании.
Таким образом, для взрослого населения при невозможности лабораторного контроля уровня 25(OH)D и кальция во время длительного (более 6 мес) лечения рекомендуется придерживаться доз не выше 4000 МЕ в сутки для лиц без факторов риска недостаточности витамина D и не более 10 000 МЕ в сутки для лиц с риском дефицита витамина D. Подобное ограничение не касается случаев подтвержденного дефицита/недостаточности витамина D, для лечения которых может потребоваться прием более высоких доз для достижения целевого значения уровня 25(ОН)D в крови.
6. ОРГАНИЗАЦИЯ ОКАЗАНИЯ МЕДИЦИНСКОЙ ПОМОЩИ
Оказание медицинской помощи пациентам с дефицитом и недостаточностью дефицита витамина D осуществляется в амбулаторном порядке. Некоторым пациентам может быть показана госпитализация в стационар по поводу фонового заболевания (см. раздел «Этиология и патогенез»).
ДОПОЛНИТЕЛЬНАЯ ИНФОРМАЦИЯ
Конфликт интересов. Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи.
Участие авторов. Все авторы одобрили финальную версию статьи перед публикацией, выразили согласие нести ответственность за все аспекты работы, подразумевающую надлежащее изучение и решение вопросов, связанных с точностью или добросовестностью любой части работы.
ПРИЛОЖЕНИЕ А. МЕТОДОЛОГИЯ
Настоящие рекомендации в предварительной версии были рецензированы независимыми экспертами. Проект клинических рекомендаций был также представлен на обсуждение широкому кругу специалистов, обсуждался среди специалистов профессорско-преподавательского состава, организаторов здравоохранения в области эндокринологии и практических врачей.
Шкалы оценки уровней достоверности доказательств (УДД) для методов диагностики, лечения и профилактики и шкала оценки уровне убедительности рекомендаций (УРР) для методов профилактики, лечения и диагностики представлены в Таблицах 1–3, соответственно.
Таблица 1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением метаанализа |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением метаанализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица 2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД |
Расшифровка |
|
1 |
Систематический обзор РКИ с применением мета-анализа |
|
2 |
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением метаанализа |
|
3 |
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
|
5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица 3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР |
Расшифровка |
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Список литературы
1. Bikle DD. Vitamin D metabolism, mechanism of action, and clinical applications. Chem Biol. 2014;21(3):319-329. doi: https://doi.org/10.1016/j.chembiol.2013.12.016
2. Cameron ID, Dyer SM, Panagoda CE, et al. Dietary Reference Intakes for Calcium and Vitamin D. Washington, D.C.: National Academies Press; 2011. doi: https://doi.org/10.17226/13050
3. Holick MF, Binkley NC, Bischoff-Ferrari HA, et al. Evaluation, treatment, and prevention of vitamin D deficiency: An Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2011;96(7):1911-1930. doi: https://doi.org/10.1210/jc.2011-0385
4. Matsuoka LY, Ide L, Wortsman J, MacLaughlin JA, Holick MF. Sunscreens suppress cutaneous vitamin D3 synthesis. J Clin Endocrinol Metab. 1987;64(6):1165-1168. doi: https://doi.org/10.1210/jcem-64-6-1165
5. Wacker M, Holick MF. Sunlight and Vitamin D: A global perspective for health. Dermatoendocrinology. 2013;5(1):51-108. doi: https://doi.org/10.4161/derm.24476
6. Clemens TL, Henderson SL, Adams JS, Holick MF. Increased Skin Pigment Reduces the Capacity of Skin To Synthesise Vitamin D3. Lancet. 1982;319(8263):74-76. doi: https://doi.org/10.1016/S0140-6736(82)90214-8
7. Hong J, Hatchell KE, Bradfield JP, et al. Transethnic Evaluation Identifies Low-Frequency Loci Associated with 25-Hydroxyvitamin D Concentrations. J Clin Endocrinol Metab. 2018;103(4):1380-1392. doi: https://doi.org/10.1210/jc.2017-01802
8. Mao S, Huang S. Vitamin D receptor gene polymorphisms and the risk of rickets among Asians: A meta-analysis. Arch Dis Child. 2014;99(3):232-238. doi: https://doi.org/10.1136/archdischild-2013-304379
9. Webb AR, Kline L, Holick MF. Influence of season and latitude on the cutaneous synthesis of vitamin D3: exposure to winter sunlight in Boston and Edmonton will not promote vitamin D3 synthesis in human skin. J Clin Endocrinol Metab. 1988;67(2):373-378. doi: https://doi.org/10.1210/jcem-67-2-373
10. Chen TC, Chimeh F, Lu Z, et al. Factors that influence the cutaneous synthesis and dietary sources of vitamin D. Arch Biochem Biophys. 2007;460(2):213-217. doi: https://doi.org/10.1016/j.abb.2006.12.017
11. Pereira-Santos M, Costa PRF, Assis AMO, et al. Obesity and vitamin D deficiency: A systematic review and meta-analysis. Obes Rev. 2015;16(4):341-349. doi: https://doi.org/10.1111/obr.12239
12. Wortsman J, Matsuoka LY, Chen TC, et al. Decreased bioavailability of vitamin D in obesity. Am J Clin Nutr. 2000;72(3):690-693. doi: https://doi.org/10.1093/ajcn/72.3.690
13. Yang L, Weaver V, Smith JP, Bingaman S, Hartman TJ, Cantorna MT. Therapeutic effect of vitamin D supplementation in a pilot study of Crohn’s patients. Clin Transl Gastroenterol. 2013;4(4):e33. doi: https://doi.org/10.1038/ctg.2013.1
14. Nuti R, Martini G, Valenti R, et al. Prevalence of undiagnosed coeliac syndrome in osteoporotic women. J Intern Med. 2001;250(4):361-366. doi: https://doi.org/10.1046/j.1365-2796.2001.00895.x
15. Gilman J, Shanahan F, Cashman KD. Determinants of vitamin D status in adult Crohn’s disease patients, with particular emphasis on supplemental vitamin D use. Eur J Clin Nutr. 2006;60(7):889-896. doi: https://doi.org/10.1038/sj.ejcn.1602395
16. Chakhtoura M, Nakhoul N, Shawwab K, et al. Hypovitaminosis D in Bariatric Surgery: A Systematic Review of Observational Studies. Metabolism. 2016;65(4):574-585. doi: https://doi.org/10.1016/j.metabol.2015.12.004
17. Aasheim ET, Björkman S, Søvik TT. Vitamin status after bariatric surgery: A randomized study of gastric bypass and duodenal switch (American Journal of Clinical Nutrition (2009) 90, (15-22)). Am J Clin Nutr. 2010;91(1):15-22. doi: https://doi.org/10.3945/ajcn.2009.28846
18. Schmidt-Gayk H, Grawunder C, Tschöpe W, et al. 25-Hydroxy-Vitamin-D in Nephrotic Syndrome. Lancet. 1977;310(8029):105-108. doi: https://doi.org/10.1016/S0140-6736(77)90118-0
19. Stokes CS, Volmer DA, Grünhage F, Lammert F. Vitamin D in chronic liver disease. Liver Int. 2013;33(3):338-352. doi: https://doi.org/10.1111/liv.12106
20. Karakelides H, Geller JL, Schroeter AL, et al. Vitamin D-mediated hypercalcemia in slack skin disease: Evidence for involvement of extrarenal 25-hydroxyvitamin D 1α-hydroxylase. J Bone Miner Res. 2006;21(9):1496-1499. doi: https://doi.org/10.1359/jbmr.060608
21. Grey A, Lucas J, Horne A, Gamble G, Davidson JS, Reid IR. Vitamin D Repletion in Patients with Primary Hyperparathyroidism and Coexistent Vitamin D Insufficiency. JCEM. 2015;90:2122-2126. doi: https://doi.org/10.1210/jc.2004-1772
22. Robien K, Oppeneer SJ, Kelly JA, Hamilton-Reeves JM. Drug-Vitamin D Interactions: A Systematic Review of the Literature. Nutr Clin Pract. 2013;28(2):194-208. doi: https://doi.org/10.1177/0884533612467824
23. Binkley N, Dawson-Hughes B, Durazo-Arvizu R, et al. Vitamin D Measurement Standardization: The Way Out of the Chaos. J Steroid Biochem Mol Biol. 2016;(12):S0960-0760. doi: https://doi.org/10.1016/j.jsbmb.2016.12.002
24. Looker AC, Pfeiffer CM, Lacher DA, et al. Serum 25-hydroxyvitamin D status of the US population: 1988-1994 versus 2000-2004. Am J Clin Nutr. 2009;88(6):1519-1527. doi: https://doi.org/10.3945/ajcn.2008.26182
25. Cashman KD, Dowling KG, Škrabáková Z, et al. Vitamin D deficiency in Europe: pandemic? Am J Clin Nutr. 2016;103(4):1033-1044. doi: https://doi.org/10.3945/ajcn.115.120873
26. Каронова Т.Л., Гринева Е.Н., Никитина И.Л., и др. Уровень обеспеченности витамином D жителей Северо-Западного региона РФ (г. Санкт-Петербург и г. Петрозаводск) // Остеопороз и остеопатии. — 2013. — Т. 16. — №3. — С. 3-7. doi: https://doi.org/10.14341/osteo201333-7
27. Маркова Т.Н., Марков Д.С., Маркелова Т.Н., и др. Распространенность дефицита витамина D и факторов риска остеопороза у лиц молодого возраста // Вестник Чувашского Университета. — 2012. — Т. 234. — №3. — С. 441-446.
28. Агуреева О.В., Жабрева Т.О., Скворцова Е.А., и др. Анализ уровня витамина D в сыворотке крови пациентов в Ростовской области // Остеопороз и остеопатии. — 2016. — Т. 19. — №2. — С. 47. doi: https://doi.org/10.14341/osteo2016247-47
29. Борисенко Е.П., Романцова Е.Б., Бабцева А.Ф. Обеспеченность витамином D детского и взрослого населения Амурской области // Бюллетень физиологии и патологии дыхания. — 2016. — №60. — С. 57-61. doi: https://doi.org/10.12737/20121
30. Малявская С.И., Кострова Г.Н., Лебедев А.В., и др. Уровни витамина D у представителей различных групп населения города Архангельска // Экология человека. — 2018. — Т. 25. — №1. — С. 60-64. doi: https://doi.org/10.33396/1728-0869-2018-1-60-64
31. Нурлыгаянов Р.З., Сыртланова Э.Р., Минасов Т.Б., Борисов И.В. Уровень витамина D у лиц старше 50 лет, постоянно проживающих в республике Башкортостан, в период максимальной инсоляции. Остеопороз и остеопатии. 2015;18(1):7-9. doi: https://doi.org/10.14341/osteo201517-9
32. Нурлыгаянов Р.З., Сыртланова Э.Р. Распространённость дефицита витамина D у лиц старше 50 лет, постоянно проживающих в республике Башкортостан, в период минимальной инсоляции. Остеопороз и остеопатии. 2012;15(3):7-9. doi: https://doi.org/10.14341/osteo201237-9
33. Спасич Т.А., Лемешевская Е.П., Решетник Л.А., и др. Гигиеническое значение дефицита витамина D у населения Иркутской области и пути его профилактики // Бюллетень ВСНЦ СО РАМН. — 2014. — Т. 6. — №100. — С. 44-47.
34. Хазова Е.Л., Ширинян Л.В., Зазерская И.Е., и др. Сезонные колебания уровня 25- гидроксихолекальциферола у беременных, проживающих в Санкт–Петербурге. Гинекология. — 2015. — Т. 17. — №4. — С. 38-42.
35. Суплотова Л.А., Авдеева В.А., Пигарова Е.А., и др. Первое российское многоцентровое неинтервенционное регистровое исследование по изучению частоты дефицита и недостаточности витамина D в Российской Федерации у взрослых // Терапевтический архив. — 2021. — Т. 93. — №10. — С. 1209-1216. doi: https://doi.org/10.26442/00403660.2021.10.201071
36. Суплотова Л.А., Авдеева В.А., Пигарова Е.А., и др. Дефицит витамина D в России: первые результаты регистрового неинтервенционного исследования частоты дефицита и недостаточности витамина D в различных географических регионах страны // Проблемы эндокринологии. — 2021. — Т. 67. — №2. — С. 84-92. doi: https://doi.org/10.14341/probl12736
37. Пигарова Е.А., Рожинская Л.Я., Катамадзе Н.Н., и др. Распространенность дефицита и недостаточности витамина D среди населения, проживающего в различных регионах Российской Федерации: результаты 1-го этапа многоцентрового поперечного рандомизированного исследования // Остеопороз и остеопатии. — 2021. — Т. 23. — №4. — С. 4-12. doi: https://doi.org/10.14341/osteo12701
38. Hollis BW, Wagner CL. Vitamin D requirements during lactation: high-dose maternal supplementation as therapy to prevent hypovitaminosis D for both the mother and the nursing infant. Am J Clin Nutr. 2004;80(S6):1752-1758. doi: https://doi.org/10.1093/ajcn/80.6.1752s
39. Lee JM, Smith JR, Philipp BL, et al. Vitamin D deficiency in a healthy group of mothers and newborn infants. Clin Pediatr (Phila). 2007;46(1):42-44. doi: https://doi.org/10.1177/0009922806289311
40. Bodnar LM, Simhan HN, Powers RW, et al. High prevalence of vitamin D insufficiency in black and white pregnant women residing in the northern United States and their neonates. J Nutr. 2007;137(2):447-452. doi: https://doi.org/10.1093/jn/137.2.447
41. Heaney RP. Functional indices of vitamin D status and ramifications of vitamin D deficiency. Am J Clin Nutr. 2004;80(S6):1706-1709. doi: https://doi.org/10.1093/ajcn/80.6.1706s
42. Holick MF, Siris ES, Binkley N, et al. Prevalence of Vitamin D Inadequacy among Postmenopausal North American Women Receiving Osteoporosis Therapy. J Clin Endocrinol Metab. 2005;90(6):3215-3224. doi: https://doi.org/10.1210/jc.2004-2364
43. Minisola S, Colangelo L, Pepe J, et al. Osteomalacia and Vitamin D Status: A Clinical Update 2020. JBMR Plus. 2021;5(1). doi: https://doi.org/10.1002/jbm4.10447
44. Plotnikoff GA, Quigley JM. Prevalence of Severe Hypovitaminosis D in Patients with Persistent, Nonspecific Musculoskeletal Pain. Mayo Clin Proc. 2003;78(12):1463-1470. doi: https://doi.org/10.4065/78.12.1463
45. Malabanan AO, Turner AK, Holick MF. Severe generalized bone pain and osteoporosis in a premenopausal black female: Effect of vitamin D replacement. J Clin Densitom. 1998;1(2):201-204. doi: https://doi.org/10.1385/JCD:1:2:201
46. Bischoff-Ferrari HA, Willett WC, Wong JB, et al. Fracture Prevention With Vitamin D Supplementation. JAMA. 2005;293(18):2257-2264. doi: https://doi.org/10.1001/jama.293.18.2257
47. Bischoff-Ferrari HA, Dawson-Hughes B, Staehelin HB, et al. Fall prevention with supplemental and active forms of vitamin D: A meta-analysis of randomised controlled trials. BMJ. 2009;339(7725):843. doi: https://doi.org/10.1136/bmj.b3692
48. Krist AH, Davidson KW, Mangione CM, et al. Screening for Vitamin D Deficiency in Adults: US Preventive Services Task Force Recommendation Statement. JAMA. 2021;325(14):1436-1442. doi: https://doi.org/10.1001/jama.2021.3069
49. Cesareo R, Attanasio R, Caputo M, et al. Italian association of clinical endocrinologists (AME) and Italian chapter of the American association of clinical endocrinologists (AACE) position statement: Clinical management of vitamin D deficiency in adults. Nutrients. 2018;10(5):1-22. doi: https://doi.org/10.3390/nu10050546
50. Giustina A, Adler RA, Binkley N, et al. Consensus statement from 2nd International Conference on Controversies in Vitamin D. Rev Endocr Metab Disord. 2020;21(1):89-116. doi: https://doi.org/10.1007/s11154-019-09532-w
51. Giustina A, Bouillon R, Binkley N, et al. Controversies in Vitamin D: A Statement From the Third International Conference. JBMR Plus. 2020;4(12):1-13. doi: https://doi.org/10.1002/jbm4.10417
52. Máčová L, Bičíková M. Vitamin D: Current challenges between the laboratory and clinical practice. Nutrients. 2021;13(6). doi: https://doi.org/10.3390/nu13061758
53. Miller WG, Myers GL, Gantzer M Lou, et al. Roadmap for harmonization of clinical laboratory measurement procedures. Clin Chem. 2011;57(8):1108-1117. doi: https://doi.org/10.1373/clinchem.2011.164012
54. Bouillon R, Marcocci C, Carmeliet G, et al. Skeletal and Extraskeletal Actions of Vitamin D: Current Evidence and Outstanding Questions. Endocr Rev. 2019;40(4):1109-1151. doi: https://doi.org/10.1210/er.2018-00126
55. Sempos CT, Vesper HW, Phinney KW, et al. Vitamin D status as an international issue: National surveys and the problem of standardization. Scand J Clin Lab Invest. 2012;72(S.243):32-40. doi: https://doi.org/10.3109/00365513.2012.681935
56. Carter GD, Jones JC, Shannon J, et al. 25-Hydroxyvitamin D assays: Potential interference from other circulating vitamin D metabolites. J Steroid Biochem Mol Biol. 2016;164:134-138. doi: https://doi.org/10.1016/j.jsbmb.2015.12.018
57. Aspray TJ, Bowring C, Fraser W, et al. National osteoporosis society vitamin D Guideline Summary. Age Ageing. 2014;43(5):592-595. doi: https://doi.org/10.1093/ageing/afu093
58. Rizzoli R, Boonen S, Brandi M-L, et al. Vitamin D supplementation in elderly or postmenopausal women: a 2013 update of the 2008 recommendations from the European Society for Clinical and Economic Aspects of Osteoporosis and Osteoarthritis (ESCEO). Curr Med Res Opin. 2013;29(4):305-313. doi: https://doi.org/10.1185/03007995.2013.766162
59. Sai AJ, Walters RW, Fang X, Gallagher JC. Relationship between Vitamin D, Parathyroid Hormone, and Bone Health. J Clin Endocrinol Metab. 2011;96(3):E436-E446. doi: https://doi.org/10.1210/jc.2010-1886
60. Heaney RP, Dowell MS, Hale C a, Bendich A. Calcium absorption varies within the reference range for serum 25-hydroxyvitamin D. J Am Coll Nutr. 2003;22(2):142-146. doi: https://doi.org/10.1080/07315724.2003.10719287
61. Barger-Lux MJ, Heaney RP. Effects of above average summer sun exposure on serum 25-hydroxyvitamin D and calcium absorption. J Clin Endocrinol Metab. 2002;87(11):4952-4956. doi: https://doi.org/10.1210/jc.2002-020636
62. Priemel M, von Domarus C, Klatte TO, et al. Bone mineralization defects and vitamin D deficiency: histomorphometric analysis of iliac crest bone biopsies and circulating 25-hydroxyvitamin D in 675 patients. J Bone Miner Res. 2010;25(2):305-312. doi: https://doi.org/10.1016/S0084-3873(10)79798-4
63. Boonen S, Vanderschueren D, Haentjens P, Lips P. Calcium and vitamin D in the prevention and treatment of osteoporosis — A clinical update. J Intern Med. 2006;259(6):539-552. doi: https://doi.org/10.1111/j.1365-2796.2006.01655.x
64. Boonen S, Lips P, Bouillon R, et al. Need for additional calcium to reduce the risk of hip fracture with vitamin D supplementation: Evidence from a comparative metaanalysis of randomized controlled trials. J Clin Endocrinol Metab. 2007;92(4):1415-1423. doi: https://doi.org/10.1210/jc.2006-1404
65. Bouillon R, Van Schoor NM, Gielen E, et al. Optimal vitamin D status: A critical analysis on the basis of evidence-based medicine. J Clin Endocrinol Metab. 2013;98(8):E1283-E1304. doi: https://doi.org/10.1210/jc.2013-1195
66. Trivedi DP, Doll R, Khaw KT. Effect of four monthly oral vitamin D3 (cholecalciferol) supplementation on fractures and mortality in men and women living in the community: randomised double blind controlled trial. BMJ. 2003;326(7387):469. doi: https://doi.org/10.1136/bmj.326.7387.469
67. Bischoff-Ferrari HA, Willett WC, Wong JB, et al. Prevention of Nonvertebral Fractures With Oral Vitamin D and Dose Dependency. Arch Intern Med. 2009;169(6):551. doi: https://doi.org/10.1001/archinternmed.2008.600
68. Pittas AG, Dawson-Hughes B, Sheehan P, et al. Vitamin D Supplementation and Prevention of Type 2 Diabetes. N Engl J Med. 2019;381(6):520-530. doi: https://doi.org/10.1056/nejmoa1900906
69. Manson JE, Bassuk SS, Buring JE. Principal results of the VITamin D and OmegA-3 TriaL (VITAL) and updated meta-analyses of relevant vitamin D trials. J Steroid Biochem Mol Biol. 2020;198:105522. doi: https://doi.org/10.1016/j.jsbmb.2019.105522
70. Scragg R. The Vitamin D Assessment (ViDA) study – Design and main findings. J Steroid Biochem Mol Biol. 2020;198:105562. doi: https://doi.org/10.1016/j.jsbmb.2019.105562
71. Luxwolda MF, Kuipers RS, Kema IP, et al. Traditionally living populations in East Africa have a mean serum 25-hydroxyvitamin D concentration of 115nmol/l. Br J Nutr. 2012;108(9):1557-1561. doi: https://doi.org/10.1017/S0007114511007161
72. Khan NB, Nawaz MA, Ijaz A, et al. Biochemical spectrum of parathyroid disorders diagnosed at a tertiary care setting. J Pak Med Assoc. 2020;70(2):243-247. doi: https://doi.org/10.5455/JPMA.302643153
73. Salman-Monte TC, Torrente-Segarra V, Vega-Vidal AL, et al. Bone mineral density and vitamin D status in systemic lupus erythematosus (SLE): A systematic review. Autoimmun Rev. 2017;16(11):1155-1159. doi: https://doi.org/10.1016/j.autrev.2017.09.011
74. Davidson ZE, Walker KZ, Truby H. Do glucocorticosteroids alter vitamin D status? A systematic review with meta-analyses of observational studies. J Clin Endocrinol Metab. 2014;97(3):738-744. doi: https://doi.org/10.1210/jc.2011-2757
75. Kieboom BCT, Kiefte-De Jong JC, Eijgelsheim M, et al. Proton Pump Inhibitors and Hypomagnesemia in the General Population: A Population-Based Cohort Study. Am J Kidney Dis. 2015;66(5):775-782. doi: https://doi.org/10.1053/j.ajkd.2015.05.012
76. Deng X, Song Y, Manson JAE, et al. Magnesium, vitamin D status and mortality: Results from US National Health and Nutrition Examination Survey (NHANES) 2001 to 2006 and NHANES III. BMC Med. 2013;11(1):1. doi: https://doi.org/10.1186/1741-7015-11-187
77. Rude RK, Adams JS, Ryzen E, et al. Low Serum Concentrations of 1,25-Dihydroxyvitamin D in Human Magnesium Deficiency. J Clin Endocrinol Metab. 1985;61(5):933-940. doi: https://doi.org/10.1210/jcem-61-5-933
78. Reddy V, Sivakumar B. Magnesium-dependent vitamin-D-resistant rickets. Lancet. 1974;303(7864):963-965. doi: https://doi.org/10.1016/S0140-6736(74)91265-3
79. Allgrove J, Adami S, Fraher L, et al. Hypomagnesaemia: Studies of Parathyroid Hormone Secretion and Function. Clin Endocrinol (Oxf). 1984;21(4):435-449. doi: https://doi.org/10.1111/j.1365-2265.1984.tb03230.x
80. Thode J, Juul-Jørgensen B, Bhatia HM, et al. Comparison of serum total calcium, albumin-corrected total calcium, and ionized calcium in 1213 patients with suspected calcium disorders. Scand J Clin Lab Investig. 1989;49(3):217-223. doi: https://doi.org/10.1080/00365518909089086
81. Liberman UA. Vitamin D-resistant diseases. J Bone Miner Res. 2007;22(S.2):105-107. doi: https://doi.org/10.1359/jbmr.07s210
82. Bergwitz C, Jüppner H. Disorders of phosphate homeostasis and tissue mineralisation. In: Calcium and Bone Disorders in Children and Adolescents; 2009. 300 p.
83. Azer SM, Vaughan LE, Tebben PJ, Sas DJ. 24-Hydroxylase Deficiency Due to CYP24A1 Sequence Variants: Comparison With Other Vitamin D−mediated Hypercalcemia Disorders . J Endocr Soc. 2021;5(9):1-10. doi: https://doi.org/10.1210/jendso/bvab119
84. Schlingmann KP, Kaufmann M, Weber S, et al. Mutations in CYP24A1 and Idiopathic Infantile Hypercalcemia. N Engl J Med. 2011;365(5):410-421. doi: https://doi.org/10.1056/NEJMoa1103864
85. Kaufmann M, Gallagher JC, Peacock M, et al. Clinical utility of simultaneous quantitation of 25-hydroxyvitamin D and 24,25-dihydroxyvitamin D by LC-MS/MS involving derivatization with DMEQ-TAD. J Clin Endocrinol Metab. 2014;99(7):2567-2574. doi: https://doi.org/10.1210/jc.2013-4388
86. Kaufmann M, Morse N, Molloy BJ, et al. Improved Screening Test for Idiopathic Infantile Hypercalcemia Confirms Residual Levels of Serum 24,25-(OH)2D3 in Affected Patients. J Bone Miner Res. 2017;32(7):1589-1596. doi: https://doi.org/10.1002/jbmr.3135
87. Kaufmann M, Schlingmann KP, Berezin L, et al. Differential diagnosis of vitamin D–related hypercalcemia using serum vitamin D metabolite profiling. J Bone Miner Res. 2021;36(7):1340-1350. doi: https://doi.org/10.1002/jbmr.4306
88. Ginsberg C, Hoofnagle AN, Katz R, et al. The Vitamin D Metabolite Ratio Is Associated With Changes in Bone Density and Fracture Risk in Older Adults. J Bone Miner Res. 2021;36(12):2343-2350. doi: https://doi.org/10.1002/jbmr.4426
89. Ginsberg C, Katz R, de Boer IH, et al. The 24,25 to 25-hydroxyvitamin D ratio and fracture risk in older adults: The cardiovascular health study. Bone. 2018;107:124-130. doi: https://doi.org/10.1016/j.bone.2017.11.011
90. Bhadada SK, Padala RK, Bhansali A, et al. Visual vignette. Endocr Pract. 2009;15(7):767. doi: https://doi.org/10.4158/EP09157.VVR
91. Bereket A, Casur Y, Firat P, Yordam N. Brown tumour as a complication of secondary hyperparathyroidism in severe long-lasting vitamin D deficiency rickets. Eur J Pediatr. 2000;159(1-2):70-73. doi: https://doi.org/10.1007/PL00013807
92. Parfitt AM, Rao DS, Stanciu J, et al. Irreversible bone loss in osteomalacia. Comparison of radial photon absorptiometry with iliac bone histomorphometry during treatment. J Clin Invest. 1985;76(6):2403-2412. doi: https://doi.org/10.1172/JCI112253
93. Dhanwal DK, Sahoo S, Gautam VK, Saha R. Hip fracture patients in India have vitamin D deficiency and secondary hyperparathyroidism. Osteoporos Int. 2013;24(2):553-557. doi: https://doi.org/10.1007/s00198-012-1993-y
94. Tripkovic L, Lambert H, Hart K, et al. Comparison of vitamin D2 and vitamin D3 supplementation in raising serum 25-hydroxyvitamin D status: a systematic review and meta-analysis. Am J Clin Nutr. 2012;95(6):1357-1364. doi: https://doi.org/10.3945/ajcn.111.031070.1
95. Binkley N, Gemar D, Engelke J, et al. Evaluation of ergocalciferol or cholecalciferol dosing, 1,600 IU daily or 50,000 IU monthly in older adults. J Clin Endocrinol Metab. 2011;96(4):981-988. doi: https://doi.org/10.1210/jc.2010-0015
96. Romagnoli E, Mascia ML, Cipriani C, et al. Short and long-term variations in serum calciotropic hormones after a single very large dose of ergocalciferol (vitamin D2) or cholecalciferol (vitamin D3) in the elderly. J Clin Endocrinol Metab. 2008;93(8):3015-3020. doi: https://doi.org/10.1210/jc.2008-0350
97. Hassan AB, Hozayen RF, Alotaibi RA, Tayem YI. Therapeutic and maintenance regimens of vitamin D3 supplementation in healthy adults: A systematic review. Cell Mol Biol. 2018;64(14):8-14. doi: https://doi.org/10.14715/cmb/2018.64.14.2
98. Schleck ML, Souberbielle JC, Jandrain B, et al. A randomized, double-blind, parallel study to evaluate the dose-response of three different vitamin D treatment schemes on the 25-hydroxyvitamin D serum concentration in patients with vitamin D deficiency. Nutrients. 2015;7(7):5413-5422. doi: https://doi.org/10.3390/nu7075227
99. Fassio A, Adami G, Rossini M, et al. Pharmacokinetics of oral cholecalciferol in healthy subjects with vitamin D deficiency: A randomized open-label study. Nutrients. 2020;12(6):1-12. doi: https://doi.org/10.3390/nu12061553
100. De Niet S, Coffiner M, Da Silva S, et al. A randomized study to compare a monthly to a daily administration of vitamin D3 supplementation. Nutrients. 2018;10(6):1-9. doi: https://doi.org/10.3390/nu10060659
101. Рожинская Л.Я., Пигарова Е.А., Багрецова А.А., и др. Применение высокодозных препаратов колекальциферола для лечения дефицита витамина D: результаты открытого многоцентрового сравнительного рандомизированного исследования // Остеопороз и остеопатии. — 2021. — Т. 23. — №3. — С. 4-16. doi: https://doi.org/10.14341/osteo12697
102. AlAteeq MA, AlShail A, AlZahrani A, et al. Effect of Monthly and Bi-Monthly 50,000 International Units (IU) Maintenance Therapy With Vitamin D3 on Serum Level of 25-Hydroxyvitamin D in Adults: A Randomized Controlled Trial. Cureus. 2021;25(3). doi: https://doi.org/10.7759/cureus.13929
103. Pietras SM. Vitamin D2 Treatment for Vitamin D Deficiency and Insufficiency for Up to 6 Years. Arch Intern Med. 2009;169(19):1806. doi: https://doi.org/10.1001/archinternmed.2009.361
104. Sadat-Ali M, Al-Anii FM, Al-Turki HA, et al. Maintenance Dose of Vitamin D: How Much Is Enough? J Bone Metab. 2018;25(3):161. doi: https://doi.org/10.11005/jbm.2018.25.3.161
105. Heaney RP, Davies KM, Chen TC, et al. Human serum 25-hydroxycholecalciferol response to extended oral dosing with cholecalciferol. Am J Clin Nutr. 2003;77(1):204-210. doi: https://doi.org/10.1093/ajcn/77.1.204
106. Venugopal Y, Wan Muhamad SF, Musa N, et al. Maintenance vitamin D3 dosage requirements in Chinese women with post menopausal osteoporosis living in the tropics. Asia Pac J Clin Nutr. 2017;26(3):412-420. doi: https://doi.org/10.6133/apjcn.042016.10
107. de Oliveira LF, de Azevedo LG, da Mota Santana J, et al. Obesity and overweight decreases the effect of vitamin D supplementation in adults: systematic review and meta-analysis of randomized controlled trials. Rev Endocr Metab Disord. 2020;21(1):67-76. doi: https://doi.org/10.1007/s11154-019-09527-7
108. Drincic A, Fuller E, Heaney RP, Armas LAG. 25-Hydroxyvitamin D response to graded vitamin D3 supplementation among obese adults. J Clin Endocrinol Metab. 2013;98(12):4845-4851. doi: https://doi.org/10.1210/jc.2012-4103
109. Dhaliwal R, Mikhail M, Feuerman M, Aloia JF. The vitamin D dose response in obesity. Endocr Pract. 2014;20(12):1258-1264. doi: https://doi.org/10.4158/EP13518.OR
110. Sayadi Shahraki M, Khalili N, Yousefvand S, et al. Severe obesity and vitamin D deficiency treatment options before bariatric surgery: a randomized clinical trial. Surg Obes Relat Dis. 2019;15(9):1604-1611. doi: https://doi.org/10.1016/j.soard.2019.05.033
111. Mahlay NF, Verka LG, Thomsen K, et al. Vitamin D status before roux-en-Y and efficacy of prophylactic and therapeutic doses of vitamin D in patients after roux-en-Y gastric bypass surgery. Obes Surg. 2009;19(5):590-594. doi: https://doi.org/10.1007/s11695-008-9698-1
112. Krishnamoorthy G, Nair R, Sundar U, et al. Early predisposition to osteomalacia in Indian adults on phenytoin or valproate monotherapy and effective prophylaxis by simultaneous supplementation with calcium and 25-hydroxy vitamin D at recommended daily allowance dosage: A prospective study. Neurol India. 2010;58(2):213-219. doi: https://doi.org/10.4103/0028-3886.63796
113. Zhou C, Assem M, Tay JC, et al. Steroid and xenobiotic receptor and vitamin D receptor crosstalk mediates CYP24 expression and drug-induced osteomalacia. J Clin Invest. 2006;116(6):1703-1712. doi: https://doi.org/10.1172/JCI27793
114. Carlin AM, Rao DS, Yager KM, et al. Treatment of vitamin D depletion after Roux-en-Y gastric bypass: a randomized prospective clinical trial. Surg Obes Relat Dis. 2009;5(4):444-449. doi: https://doi.org/10.1016/j.soard.2008.08.004
115. Goldner WS, Stoner JA, Lyden E, et al. Finding the optimal dose of vitamin d following roux-en-y gastric bypass: A prospective, randomized pilot clinical trial. Obes Surg. 2009;19(2):173-179. doi: https://doi.org/10.1007/s11695-008-9680-y
116. Collins N, Maher J, Cole M, et al. A prospective study to evaluate the dose of vitamin d required to correct low 25-hydroxyvitamin D levels, calcium, and alkaline phosphatase in patients at risk of developing antiepileptic drug-induced osteomalacia. Qjm. 1991;78(2):113-122. doi: https://doi.org/10.1093/oxfordjournals.qjmed.a068530
117. Pilz S, Iodice S, Zittermann A, et al. Vitamin D status and mortality risk in CKD: A meta-analysis of prospective studies. Am J Kidney Dis. 2011;58(3):374-382. doi: https://doi.org/10.1053/j.ajkd.2011.03.020
118. Zhang Y, Darssan D, Pascoe EM, et al. Vitamin D status and mortality risk among patients on dialysis: A systematic review and meta-analysis of observational studies. Nephrol Dial Transplant. 2018;33(10):1742-1751. doi: https://doi.org/10.1093/ndt/gfy016
119. Jayedi A, Soltani S, Shab-Bidar S. Vitamin D status and all-cause mortality in patients with chronic kidney disease: A systematic review and dose-response meta-analysis. J Clin Endocrinol Metab. 2017;102(7):2136-2145. doi: https://doi.org/10.1210/jc.2017-00105
120. Alvarez JA, Wasse H, Tangpricha V. Vitamin D supplementation in pre-dialysis chronic kidney disease. Dermatoendocrinol. 2012;4(2):118-127. doi: https://doi.org/10.4161/derm.20014
121. Kandula P, Dobre M, Schold JD, et al. Vitamin D supplementation in chronic kidney disease: A systematic review and meta-analysis of observational studies and randomized controlled trials. Clin J Am Soc Nephrol. 2011;6(1):50-62. doi: https://doi.org/10.2215/CJN.03940510
122. Xu C, Li YC, Zhao SM, Li ZX. Evaluation of responses to vitamin D3 (cholecalciferol) in patients on dialysis: A systematic review and meta-analysis. J Investig Med. 2016;64(5):1050-1059. doi: https://doi.org/10.1136/jim-2015-000032
123. Lu RJ, Zhu SM, Tang FL, et al. Effects of Vitamin D or its analogues on the mortality of patients with chronic kidney disease: An updated systematic review and meta-analysis. Eur J Clin Nutr. 2017;71(6):683-693. doi: https://doi.org/10.1038/ejcn.2017.59
124. Lishmanov A, Dorairajan S, Pak Y, et al. Treatment of 25-OH vitamin D deficiency in older men with chronic kidney disease stages 3 and 4 is associated with reduction in cardiovascular events. Am J Ther. 2013;20(5):480-486. doi: https://doi.org/10.1097/MJT.0b013e3182211b3b
125. Ketteler M, Block GA, Evenepoel P, et al. Diagnosis, evaluation, prevention, and treatment of chronic kidney disease-mineral and bone disorder: Synopsis of the kidney disease: Improving global outcomes 2017 clinical practice guideline update. Ann Intern Med. 2018;168(6):422-430. doi: https://doi.org/10.7326/M17-2640
126. Feng R, Li Y, Li G, Li Z. Lower serum 25 (OH) D concentrations in type 1 diabetes : A meta-analysis. Diabetes Res Clin Pract. 2015;108(3):e71-e71. doi: https://doi.org/10.1016/j.diabres.2014.12.008
127. Shen L, Zhuang Q-S, Ji H-F. Assessment of vitamin D levels in type 1 and type 2 diabetes patients: Results from metaanalysis. Mol Nutr Food Res. 2016;60(5):1059-1067. doi: https://doi.org/10.1002/mnfr.201500937
128. Liu C, Lu M, Xia X, et al. Correlation of serum vitamin D level with type 1 diabetes mellitus in children : a meta-analysis. Nutr Hosp. 2015;32(4):1591-1594. doi: https://doi.org/10.3305/nh.2015.32.4.9198
129. Hou Y, Song A, Jin Y, Xia Q, Song G, Xing X. A dose–response meta-analysis between serum concentration of 25-hydroxy vitamin D and risk of type 1 diabetes mellitus. Eur J Clin Nutr. 2021;75(7):1010-1023. doi: https://doi.org/10.1038/s41430-020-00813-1
130. Guan SY, Cai HY, Wang P, et al. Association between circulating 25-hydroxyvitamin D and systemic lupus erythematosus: A systematic review and meta-analysis. Int J Rheum Dis. 2019;22(10):1803-1813. doi: https://doi.org/10.1111/1756-185X.13676
131. Bae S-C, Lee YH. Association between Vitamin D level and/or deficiency, and systemic lupus erythematosus: a meta-analysis. Cell Mol Biol (Noisy-le-grand). 2018;64(1):7-13. doi: https://doi.org/10.14715/cmb/2018.64.1.2
132. Islam MA, Khandker SS, Alam SS, et al. Vitamin D status in patients with systemic lupus erythematosus (SLE): A systematic review and meta-analysis. Autoimmun Rev. 2019;18(11):102392. doi: https://doi.org/10.1016/j.autrev.2019.102392
133. Wang J, Lv S, Chen G, et al. Meta-analysis of the association between vitamin D and autoimmune thyroid disease. Nutrients. 2015;7(4):2485-2498. doi: https://doi.org/10.3390/nu7042485
134. Taheriniya S, Arab A, Hadi A, et al. Vitamin D and thyroid disorders: a systematic review and Meta-analysis of observational studies. BMC Endocr Disord. 2021;21:171. doi: https://doi.org/10.1016/j.clnesp.2018.12.085
135. Xu MY, Cao B, Yin J, et al. Vitamin D and graves’ disease: A meta-analysis update. Nutrients. 2015;7(5):3813-3827. doi: https://doi.org/10.3390/nu7053813
136. Upala S, Sanguankeo A. Low 25-hydroxyvitamin D levels are associated with vitiligo: a systematic review and meta-analysis. Photodermatol Photoimmunol Photomed. 2016;32(4):181-190. doi: https://doi.org/10.1111/phpp.12241
137. Martínez-Lapiscina EH, Mahatanan R, Lee CH, et al. Associations of serum 25(OH) vitamin D levels with clinical and radiological outcomes in multiple sclerosis, a systematic review and meta-analysis. J Neurol Sci. 2020;411(5):116668. doi: https://doi.org/10.1016/j.jns.2020.116668
138. Ismailova K, Poudel P, Parlesak A, et al. Vitamin D in early life and later risk of multiple sclerosis — A systematic review, meta-analysis. PLoS One. 2019;14(8):1-18. doi: https://doi.org/10.1371/journal.pone.0221645
139. Lee YH, Bae S-C. Vitamin D level in rheumatoid arthritis and its correlation with the disease activity: a meta-analysis. Clin Exp Rheumatol. 2016;34:827-833.
140. Hiraki LT, Arkema EV, Cui J, et al. Circulating 25-hydroxyvitamin D level and risk of developing rheumatoid arthritis. Rheumatol (United Kingdom). 2014;53(12):2243-2248. doi: https://doi.org/10.1093/rheumatology/keu276
141. Lin J, Liu J, Davies ML, Chen W. Serum Vitamin D level and rheumatoid arthritis disease activity: Review and meta-analysis. PLoS One. 2016;11(1):1-17. doi: https://doi.org/10.1371/journal.pone.0146351
142. Li L, Chen J, Jiang Y. The association between vitamin D level and Sjögren’s syndrome: A meta-analysis. Int J Rheum Dis. 2019;22(3):532-533. doi: https://doi.org/10.1111/1756-185X.13474
143. Kuo CY, Huang YC, Lin KJ, Tsai TY. Vitamin d deficiency is associated with severity of dry eye symptoms and primary sjögren’s syndrome: A systematic review and meta-analysis. J Nutr Sci Vitaminol (Tokyo). 2020;66(4):386-388. doi: https://doi.org/10.3177/jnsv.66.386
144. Gregoriou E, Mamais I, Tzanetakou I, et al. The effects of vitamin D supplementation in newly diagnosed type 1 diabetes patients: Systematic review of randomized controlled trials. Rev Diabet Stud. 2017;14(2-3):260-268. doi: https://doi.org/10.1900/RDS.2017.14.260
145. McLaughlin L, Clarke L, Khalilidehkordi E, et al. Vitamin D for the treatment of multiple sclerosis: a meta-analysis. J Neurol. 2018;265(12):2893-2905. doi: https://doi.org/10.1007/s00415-018-9074-6
146. Berezowska M, Coe S, Dawes H. Effectiveness of vitamin D supplementation in the management of multiple sclerosis: A systematic review. Int J Mol Sci. 2019;20(6). doi: https://doi.org/10.3390/ijms20061301
147. Sousa JR, Rosa ÉPC, Nunes IF de OC, Carvalho CMRG de. Effect of vitamin D supplementation on patients with systemic lupus erythematosus: a systematic review. Rev Bras Reumatol (English Ed. 2017;57(5):466-471. doi: https://doi.org/10.1016/j.rbre.2017.08.001
148. Wang S, Wu Y, Zuo Z, et al. The effect of vitamin D supplementation on thyroid autoantibody levels in the treatment of autoimmune thyroiditis: a systematic review and a meta-analysis. Endocrine. 2018;59(3):499-505. doi: https://doi.org/10.1007/s12020-018-1532-5
149. Jagannath VA, Filippini G, Di Pietrantonj C, et al. Vitamin D for the management of multiple sclerosis. Cochrane Database Syst Rev. 2018;2018(9). doi: https://doi.org/10.1002/14651858.CD008422.pub3
150. Yuan X, Guo L, Jiang C, et al. The Effect of Different Administration Time and Dosage of Vitamin D Supplementation in Patients with Multiple Sclerosis: A Meta-Analysis of Randomized Controlled Trials. Neuroimmunomodulation. 2021;28(3):118-128. doi: https://doi.org/10.1159/000515131
151. Zheng R, Gonzalez A, Yue J, et al. Efficacy and Safety of Vitamin D Supplementation in Patients With Systemic Lupus Erythematosus: A Meta-analysis of Randomized Controlled Trials. Am J Med Sci. 2019;358(2):104-114. doi: https://doi.org/10.1016/j.amjms.2019.04.020
152. Cianferotti L, Bertoldo F, Bischoff-Ferrari HA, et al. Vitamin D supplementation in the prevention and management of major chronic diseases not related to mineral homeostasis in adults: research for evidence and a scientific statement from the European society for clinical and economic aspects of osteoporosis. Endocrine. 2017;56:245-261. doi: https://doi.org/10.1007/s12020-017-1290-9
153. Autier P, Mullie P, Macacu A, et al. Effect of vitamin D supplementation on non-skeletal disorders: a systematic review of meta-analyses and randomised trials. Lancet Diabetes Endocrinol. 2017;5(12):986-1004. doi: https://doi.org/10.1016/S2213-8587(17)30357-1
154. Hahn J, Cook N, Alexander E, et al. Vitamin D and Marine n-3 Fatty Acid Supplementation and Prevention of Autoimmune Disease in the VITAL Randomized Controlled Trial [abstract]. Arthritis Rheumatol. 2021;73(S.10)
155. Hollis BW, Johnson D, Hulsey TC, et al. Vitamin D supplementation during pregnancy: Double-blind, randomized clinical trial of safety and effectiveness. J Bone Miner Res. 2011;26(10):2341-2357. doi: https://doi.org/10.1002/jbmr.463
156. Yu CKH, Sykes L, Sethi M, et al. Vitamin D deficiency and supplementation during pregnancy. Clin Endocrinol (Oxf). 2009;70(5):685-690. doi: https://doi.org/10.1111/j.1365-2265.2008.03403.x
157. Karamali M, Beihaghi E, Mohammadi AA, Asemi Z. Effects of high-dose Vitamin D supplementation on metabolic status and pregnancy outcomes in pregnant women at risk for pre-eclampsia. Horm Metab Res. 2015;47(12):867-872. doi: https://doi.org/10.1055/s-0035-1548835
158. Rostami M, Tehrani FR, Simbar M, et al. Effectiveness of prenatal Vitamin D deficiency screening and treatment program: A stratified randomized field trial. J Clin Endocrinol Metab. 2018;103(8):2936-2948. doi: https://doi.org/10.1210/jc.2018-00109
159. Yap C, Cheung NW, Gunton JE, et al. Vitamin D supplementation and the effects on glucose metabolism during pregnancy: A randomized controlled trial. Diabetes Care. 2014;37(7):1837-1844. doi: https://doi.org/10.2337/dc14-0155
160. Palacios C, Trak-Fellermeier MA, Martinez RX, et al. Regimens of vitamin D supplementation for women during pregnancy. Cochrane Database Syst Rev. 2019;2019(10). doi: https://doi.org/10.1002/14651858.CD013446
161. Amiri Z, Nosrati M, Sharifan P, et al. Factors determining the serum 25-hydroxyvitamin D response to vitamin D supplementation: Data mining approach.. BioFactors. 2021;47(5):828-836. doi: https://doi.org/10.1002/biof.1770
162. Tepper S, Shahar DR, Geva D, Ish-Shalom S. Predictors of serum 25(Oh)D increase following bimonthly supplementation with 100,000 IU vitamin D in healthy, men aged 25-65 years. J Steroid Biochem Mol Biol. 2014;144(PART A):163-166. doi: https://doi.org/10.1016/j.jsbmb.2013.12.005
163. Davies M, Mawer EB, Klass HJ, et al. Vitamin D deficiency, osteomalacia, and primary biliary cirrhosis — Response to orally administered vitamin D3. Dig Dis Sci. 1983;28(2):145-153. doi: https://doi.org/10.1007/BF01315144
164. Carmel AS, Shieh A, Bang H, Bockman RS. The 25(OH)D level needed to maintain a favorable bisphosphonate response is ≥33 ng/ml. Osteoporos Int. 2012;23(10):2479-2487. doi: https://doi.org/10.1007/s00198-011-1868-7
165. Peris P, Martínez-Ferrer A, Monegal A, et al. 25 hydroxyvitamin D serum levels influence adequate response to bisphosphonate treatment in postmenopausal osteoporosis. Bone. 2012;51(1):54-58. doi: https://doi.org/10.1016/j.bone.2012.03.026
166. Heaney RP, Weaver CM. Oxalate: effect on calcium absorbability. Am J Clin Nutr. 1989;50(4):830-832. doi: https://doi.org/10.1093/ajcn/50.4.830
167. Borghi L, Schianchi T, Meschi T, et al. Comparison of Two Diets for the Prevention of Recurrent Stones in Idiopathic Hypercalciuria. N Engl J Med. 2002;346(2):77-84. doi: https://doi.org/10.1056/NEJMoa010369
168. Nuzzo V, de Milita AM, Ferraro T, et al. Analysis of Skeletal Status by Quantitative Ultrasonometry in a Cohort of Postmenopausal Women with High Blood Cholesterol Without Documented Osteoporosis. Ultrasound Med Biol. 2009;35(5):717-722. doi: https://doi.org/10.1016/j.ultrasmedbio.2008.11.003
169. Corgneau M, Scher J, Ritie-Pertusa L, et al. Recent advances on lactose intolerance: Tolerance thresholds and currently available answers. Crit Rev Food Sci Nutr. 2017;57(15):3344-3356. doi: https://doi.org/10.1080/10408398.2015.1123671
170. Dupont C, Chouraqui JP, Linglart A, et al. Nutritional management of cow’s milk allergy in children: An update. Arch Pediatr. 2018;25(3):236-243. doi: https://doi.org/10.1016/j.arcped.2018.01.007
171. Calcium calculator [Internet]. Available from: https://www.osteoporosis.foundation/educational-hub/topic/calcium/list-of-calcium-content-of-common-foods [cited: 28.07.2021].
172. Naghshi S, Naemi M, Sadeghi O, et al. Total, dietary, and supplemental calcium intake and risk of all-cause cardiovascular, and cancer mortality: a systematic review and dose-response meta-analysis of prospective cohort studies. Crit Rev Food Sci Nutr. 2021;346(2):1-12. doi: https://doi.org/10.1080/10408398.2021.1890690
173. Asemi Z, Saneei P, Sabihi SS, et al. Total, dietary, and supplemental calcium intake and mortality from all-causes, cardiovascular disease, and cancer: A meta-analysis of observational studies. Nutr Metab Cardiovasc Dis. 2015;25(7):623-634. doi: https://doi.org/10.1016/j.numecd.2015.03.008
174. Wood RJ, Serfaty-Lacrosniere C. Gastric Acidity, Atrophic Gastritis, and Calcium Absorption. Nutr Rev. 2009;50(2):33-40. doi: https://doi.org/10.1111/j.1753-4887.1992.tb02510.x
175. Ziemińska M, Sieklucka B, Pawlak K. Vitamin k and d supplementation and bone health in chronic kidney disease—apart or together? Nutrients. 2021;13(3):1-34. doi: https://doi.org/10.3390/nu13030809
176. Kuang X, Liu C, Guo X, et al. The combination effect of vitamin K and vitamin D on human bone quality: A meta-analysis of randomized controlled trials. Food Funct. 2020;11(4):3280-3297. doi: https://doi.org/10.1039/c9fo03063h
177. Taylor PN, Davies JS. A review of the growing risk of vitamin D toxicity from inappropriate practice. Br J Clin Pharmacol. 2018;84(6):1121-1127. doi: https://doi.org/10.1111/bcp.13573
178. Spiller HA, Good TF, Spiller NE, Aleguas A. Vitamin D exposures reported to US poison centers 2000-2014. Hum Exp Toxicol. 2016;35(5):457-461. doi: https://doi.org/10.1177/0960327115595685
179. Tebben PJ, Singh RJ, Kumar R. Vitamin D-mediated hypercalcemia: Mechanisms, diagnosis, and treatment. Endocr Rev. 2016;37(5):521-547. doi: https://doi.org/10.1210/er.2016-1070
180. Rooney M, Harnack L, Michos E, et al. Trends in Use of High Dose Vitamin D Supplements Exceeding 1,000 or 4,000 International Units Daily, 1999-2014. JAMA. 2017;317(23):2448-2450. doi: https://doi.org/10.1001/jama.2017.4392.Trends
181. Gallagher JC, Smith LM, Yalamanchili V. Incidence of hypercalciuria and hypercalcemia during vitamin D and calcium supplementation in older women. Menopause. 2014;21(11):1173-1180. doi: https://doi.org/10.1097/gme.0000000000000270
182. Jones G, Prosser DE, Kaufmann M. Cytochrome P450-mediated metabolism of vitamin D. 2014;55:13-31. doi: https://doi.org/10.1194/jlr.R031534
183. O’Donnell S, Moher D, Thomas K, et al. Systematic review of the benefits and harms of calcitriol and alfacalcidol for fractures and falls. J Bone Miner Metab. 2008;26(6):531-542. doi: https://doi.org/10.1007/s00774-008-0868-y
184. Richy F, Dukas L, Schacht E. Differential effects of D-hormone analogs and native vitamin D on the risk of falls: A comparative meta-analysis. Calcif Tissue Int. 2008;82(2):102-107. doi: https://doi.org/10.1007/s00223-008-9102-0
185. Demetriou ETW, Travison TG, Holick MF. Treatment with 50 000 IU vitamin D2 every other week and effect on serum 25-hydroxyvitamin D2, 25-hydroxyvitamin D3, and total 25-hydroxyvitamin D in a clinical setting. Endocr Pract. 2012;18(3):399-402. doi: https://doi.org/10.4158/EP11268.OR
186. Logan VF, Gray AR, Peddie MC, et al. Long-term vitamin D3 supplementation is more effective than vitamin D2 in maintaining serum 25-hydroxyvitamin D status over the winter months. Br J Nutr. 2013;109(6):1082-1088. doi: https://doi.org/10.1017/S0007114512002851
187. Oliveri B, Mastaglia SR, Brito GM, et al. Vitamin D3 seems more appropriate than D2 to sustain adequate levels of 25OHD: A pharmacokinetic approach. Eur J Clin Nutr. 2015;69(6):697-702. doi: https://doi.org/10.1038/ejcn.2015.16
188. German Nutrition Society. New reference values for Vitamin D. Ann Nutr Metab. 2012;60(4):241-246. doi: https://doi.org/10.1159/000337547
189. Pludowski P, Karzczmarewicz E, Bayer M, Al E. Practical Guidelines for the Supplementation of Vitamin D and the Treatment of Deficits in Central Europe. Endokrynol Pol. 2013;64(4):319-327. doi: https://doi.org/10.5603/EP
190. Cashman K, Ritz C, Kiely M. Improved Dietary Guidelines for Vitamin D: Application of Individual Participant Data (IPD)-Level Meta-Regression Analyses. Nutrients. 2017;9(5):469. doi: https://doi.org/10.3390/nu9050469
191. Zhao JG, Zeng XT, Wang J, Liu L. Association between calcium or Vitamin D supplementation and fracture incidence in community-dwelling older adults a systematic review and meta-analysis. JAMA. 2017;318(24):2466-2482. doi: https://doi.org/10.1001/jama.2017.19344
192. Weaver CM, Alexander DD, Boushey CJ, et al. Calcium plus vitamin D supplementation and risk of fractures: an updated meta-analysis from the National Osteoporosis Foundation. Osteoporos Int. 2016;27(1):367-376. doi: https://doi.org/10.1007/s00198-015-3386-5
193. Bolland MJ, Grey A, Avenell A. Effects of vitamin D supplementation on musculoskeletal health: a systematic review, meta-analysis, and trial sequential analysis. Lancet Diabetes Endocrinol. 2018;6(11):847-858. doi: https://doi.org/10.1016/S2213-8587(18)30265-1
194. Grossman DC, Curry SJ, Owens DK, et al. Vitamin D, calcium, OR combined supplementation for the primary prevention of fractures in community-dwelling adults us Preventive Services Task Force recommendation statement. JAMA. 2018;319(15):1592-1599. doi: https://doi.org/10.1001/jama.2018.3185
195. Bischoff-Ferrari HA, Orav EJ, Abderhalden L, et al. Vitamin D supplementation and musculoskeletal health. Lancet Diabetes Endocrinol. 2019;7(2):85. doi: https://doi.org/10.1016/S2213-8587(18)30347-4
196. Macdonald HM, Reid IR, Gamble GD, et al. 25-Hydroxyvitamin D Threshold for the Effects of Vitamin D Supplements on Bone Density: Secondary Analysis of a Randomized Controlled Trial. J Bone Miner Res. 2018;33(8):1464-1469. doi: https://doi.org/10.1002/jbmr.3442
197. Reid IR, Horne AM, Mihov B, et al. Effect of monthly high-dose vitamin D on bone density in community-dwelling older adults substudy of a randomized controlled trial. J Intern Med. 2017;282(5):452-460. doi: https://doi.org/10.1111/joim.12651
198. Sanders KM, Stuart AL, Williamson EJ, et al. Annual high-dose oral vitamin D and falls and fractures in older women: A randomized controlled trial. JAMA. 2010;303(18):1815-1822. doi: https://doi.org/10.1001/jama.2010.594
199. Smith H, Anderson F, Raphael H, et al. Effect of annual intramuscular vitamin D on fracture risk in elderly men and women — A population-based, randomized, double-blind, placebo-controlled trial. Rheumatology. 2007;46(12):1852-1857. doi: https://doi.org/10.1093/rheumatology/kem240
200. Kahwati LC, Leblanc E, Weber RP, et al. Screening for Vitamin D Deficiency in Adults: Updated Evidence Report and Systematic Review for the US Preventive Services Task Force. JAMA. 2021;325(14):1443-1463. doi: https://doi.org/10.1001/jama.2020.26498
201. Palacios C, Gonzalez L. Is vitamin D deficiency a major global public health problem? J Steroid Biochem Mol Biol. 2014;144(PART A):138-145. doi: https://doi.org/10.1016/j.jsbmb.2013.11.003
202. Cristina P, Lia K K, Juan Pablo P-R. Vitamin D supplementation for women during pregnancy. Cochrane Database Syst Rev. 2019;7(7):CD008873. doi: https://doi.org/10.1016/j.explore.2019.10.002
203. Yu CKH, Sykes L, Sethi M, et al. Vitamin D deficiency and supplementation during pregnancy. Obstet Gynecol. 2011;118(1):197-198. doi: https://doi.org/ 10.1111/j.1365-2265.2008.03403.x
204. Grant CC, Stewart AW, Scragg R, et al. Vitamin D During Pregnancy and Infancy and Infant Serum 25-Hydroxyvitamin D Concentration. Pediatrics. 2014;133(1):e143-e153. doi: https://doi.org/10.1542/peds.2013-2602
205. Galior K, Grebe S, Singh R. Development of Vitamin D Toxicity from Overcorrection of Vitamin D Deficiency: A Review of Case Reports. Nutrients. 2018;10(8):953. doi: https://doi.org/10.3390/nu10080953
206. Dashant K, John DB, Dhanwada R, et al. Elevated 1,25-dihydroxyvitamin D levels are associated with protracted treatment in sarcoidosis. Respir Med. 2010;104(4):564-570. doi: https://doi.org/10.1016/j.rmed.2009.12.004
207. Bolanowski M, Bednarczuk T, Bobek-Billewicz B, et al. Practical guidelines for the supplementation of vitamin D and the treatment of deficits in Central Europe — recommended vitamin D intakes in the general population and groups at risk of vitamin D deficiency. Endokrynol Pol. 2013;64(6):480-493. doi: https://doi.org/10.5603/EP
208. Billington EO, Burt LA, Rose MS, et al. Safety of High-Dose Vitamin D Supplementation: Secondary Analysis of a Randomized Controlled Trial. J Clin Endocrinol Metab. 2020;105(4):1261-1273. doi: https://doi.org/10.1210/clinem/dgz212
Об авторах
И. И. Дедов
ФГБУ НМИЦ эндокринологии Минздрава России
Россия
Дедов Иван Иванович — доктор медицинских наук, профессор, академик РАН; eLibrary SPIN: 5873-2280.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Г. А. Мельниченко
ФГБУ НМИЦ эндокринологии Минздрава России
Россия
Мельниченко Галина Афанасьевна — доктор медицинских наук, профессор, академик РАН; eLibrary SPIN: 8615-0038.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Н. Г. Мокрышева
ФГБУ НМИЦ эндокринологии Минздрава России
Россия
Мокрышева Наталья Георгиевна — доктор медицинских наук, профессор, член-корреспондент РАН; eLibrary SPIN: 5624-3875.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Е. А. Пигарова
ФГБУ НМИЦ эндокринологии Минздрава России
Россия
Пигарова Екатерина Александровна — доктор медицинских наук; eLibrary SPIN: 6912-6331.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
А. А. Поваляева
ФГБУ НМИЦ эндокринологии Минздрава России
Россия
Поваляева Александра Александровна; eLibrary SPIN: 1970-2811.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Л. Я. Рожинская
ФГБУ НМИЦ эндокринологии Минздрава России
Россия
Рожинская Людмила Яковлевна — доктор медицинских наук, профессор; Researcher ID: B-6618-2017; Scopus Author ID: 55121221200; eLibrary SPIN: 5691-7775.
117292, Москва, ул. Дмитрия Ульянова, д. 11
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Ж. Е. Белая
ФГБУ НМИЦ эндокринологии Минздрава России
Россия
Белая Жанна Евгеньевна — доктор медицинских наук; eLibrary SPIN: 4746-7173.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Л. К. Дзеранова
ФГБУ НМИЦ эндокринологии Минздрава России
Россия
Дзеранова Лариса Константиновна — доктор медицинских наук; eLibrary SPIN: 2958-5555.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Т. Л. Каронова
ФГБУ НМИЦ им. В.А. Алмазова Минздрава России
Россия
Каронова Татьяна Леонидовна — доктор медицинских наук, профессор; eLibrary SPIN: 3337-4071.
Санкт-Петербург
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Л. А. Суплотова
ФГБОУ ВО Тюменский государственный медицинский университет Минздрава России
Россия
Суплотова Людмила Александровна — доктор медицинских наук, профессор; eLibrary SPIN: 1212-5397.
Тюмень
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Е. А. Трошина
ФГБУ НМИЦ эндокринологии Минздрава России
Россия
Трошина Екатерина Анатольевна — доктор медицинских наук, профессор, член-корреспондент РАН; eLibrary SPIN: 8821-8990.
Москва
Конфликт интересов:
Авторы декларируют отсутствие явных и потенциальных конфликтов интересов, связанных с содержанием настоящей статьи
Дополнительные файлы
|
|
1. Рис. 1. Метаболизм витамина D в организме человека. |
| Тема | |
| Тип | Исследовательские инструменты |
|
Посмотреть (295KB) |
Метаданные |
Рахит
Версия: Клинические протоколы МЗ РК — 2015 (Казахстан)
Категории МКБ:
Недостаточность витамина D (E55)
Разделы медицины:
Педиатрия
Общая информация
Краткое описание
Рекомендовано
Экспертным советом
РГП на ПХВ «Республиканский центр
развития здравоохранения»
Министерства здравоохранения
и социального развития
Республики Казахстан
от «27» ноября 2015 года
Протокол №17
Название протокола: Рахит
Рахит – это группа заболеваний детского организма, связанная с недостаточным поступлением витамина D или нарушением процессов его метаболизма, приводящая к нарушению многих видов обмена веществ и в первую очередь фосфорно- кальциевого(КФО), что обусловливает поражение многих органов и систем, но главным образом, костного скелета (Майданник В.Г., 2014 г).
Витамин D-дефицитный рахит – заболевание интенсивно растущего детского организма, обусловленное нарушением регуляции КФО и минерализации костной ткани в результате дефицита витамина D (Майданник В.Г., 2014 г)
Код протокола:
Код(ы) МКБ-10:
Е55 Рахит активный
Сокращения, используемые в протоколе:
КФО — Кальций-фосфорный обмен
ЛС –лекарственные средства
МЕМеждународные единицы
МЗСР –Министерство здравоохранения и социального развития
МНН –международное непатентованное название (генерическое название)
ОАК –общий анализ крови
ОАМ –общий анализ мочи
РКИ –
Рандомизированное клиническое исследование
ЩФ –Щелочная фосфатаза
ЭКГ –электрокардиография
ЭХОКГ –эхокардиография
ЭЭГ –электроэнцефалография
1,25(OH)2D –1,25-дигидроксихолекальциферол
25-ОН-D –25-гидроксихолекальциферол
Дата разработки протокола: 2015 год.
Категория пациентов: дети.
Пользователи протокола: врач скорой помощи, фельдшер, врач общей практики, педиатр.
Оценка на степень доказательности приводимых рекомендаций.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор РКИ или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортных или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С |
Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). Результаты, которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов. |
| GPP | Наилучшая фармацевтическая практика. |
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Клиническая классификация: Дулицкий С.О.,1947 г.
| Тяжесть | Течение | Период |
|
I легкая II средней тяжести III тяжелое |
Острое Подострое Рецидивирующее |
Начальных проявлений Разгара Реконвалесценции Остаточных изменений |
Вторичный рахит часто возникает:
· присиндромахмальабсорбции;
· при хронических болезнях почек или желчевыводящих путей;
· приболезняхобменавеществ (тирозинемия, цистинурия и др.);
· вызванныйдлительнымприменениемпротивосудорожныхсредств (дифенин, фенобарбитал), диуретиков, глюкокортикоидов, а также, парентеральнымпитанием.
Витамин D-зависимый рахит:
· Тип I — генетический дефект синтеза в почках 1,25-дигидроксивитамина D — 1,25(OH)2D.
· Тип II — генетическая резистентность рецепторов органов-мишеней к 1,25(OH)2D.
Витамин D-резистентный рахит:
· Фосфат-диабет;
· Синдром де Тони — Дебре — Фанкони (de Toni-Debré-Fanconi);
· Гипофосфатазия;
· Почечный тубулярный ацидоз.
Клиническая картина
Cимптомы, течение
Диагностические критерии [1,8-10]:
Жалобы и анамнез:
Жалобы: беспокойство, пугливость, раздражительность, гиперестезия, снижение аппетита, нарушение сна, вздрагивание при засыпании, громком звуке, вспышке света; повышенная потливость, ребенок трет голову о подушку, облысение затылка;деформация костей головы, грудной клетки, позвоночника, конечностей; отставание в физическом развитии, запаздывание прорезывания зубов
Анамнез: заболевание выявляется с 3-4 месячного возраста, хотя первые симптомы могут появиться в 1 – 1,5 месяца. Выявление факторов риска
Физикальное обследование:
Клинические критерии:
· Симптомы остеомаляции (размягчение, обеднения кальцием кости – преобладают при остром течении рахита) – податливость костей черепа, краев родничка, краниотабес, брахицефалия, деформация костей черепа, конечностей, ключиц, плоский таз, эрозии и кариес зубов.
· Симптомы остеоидной гиперплазии (преобладают при подостром течении рахита) – лобные и теменные бугры, реберные «четки», надмыщелковые утолщения голеней, «браслетки» на предплечьях, «нити жемчуга» на пальцах.
· Симптомы гипоплазии костной ткани – задержка роста с характерной «коротконогостью», позднее прорезывание молочных и постоянных зубов, позднее закрытие родничка.
· Симптомы мышечной гипотонии – искривление позвоночника со спино-поясничным кифозом, сколиозом, деформацией грудной клетки с развернутой нижней апертурой, вялость и дряблость мышц, разболтанность суставов, «лягушачий» живот.
· Задержка статических и локомоторных функций.
I – лёгкая– соответствует начальному периоду рахита.
Незначительные нарушения общего состояния: нервная возбудимость, беспокойство, вздрагивания при резком звуке, вспышке света, нарушения ритма сна, поверхностный «тревожный» сон. Потливость (липкий пот с кислым запахом), зуд кожи, ребенок трет затылком о подушку, что приводит к облысению затылка. Со стороны костной системы: податливость краев большого родничка.
II – средней тяжести — умеренно выраженные изменения костной системы и внутренних органов.отчётливые деформации черепа, грудной клетки, небольшое увеличение печени и селезёнки, умеренная анемия;
· со стороны ЦНС – задерживается развитие статических и локомоторных функций, позже начинает поднимать голову, сидеть, вставать и ходить, пассивные движения обычно вызывают у них отрицательную реакцию, нарушается поведение, сон, аппетит;
· со стороны мышечной системы– выраженная мышечная гипотония и слабость связочного аппарата: в положении на спине легко притягивают ногу к голове, сосут первый палец на стопе, кладут стопу на плечо; большой, распластанный «лягушачий» живот, дряблость мышц брюшной стенки; расхождение прямых мышц живота; предрасположенность к воспалению легких, выявляются дистрофические изменения в сердце;
· гипохромная анемия, преимущественно железодефицитная, но может быть вследствие дефицита аминокислот, меди и цинка;
· со стороны костной ткани:
симптомы остеоидной гиперплазии: лобные и теменные бугры, реберные «четки», надмыщелковые утолщения голеней, «браслетки» на запястьях, «нити жемчуга» на пальцах;
· симптомы гипоплазии костной ткани: задержка роста из-за отставания роста трубчатых костей в длину, позднее прорезывание молочных и постоянных зубов, позднее закрытие родничков, плоский таз;
· костные деформации: деформации грудной клетки с развернутой нижней апертурой, «гаррисонова борозда», килевидная («куриная» грудь) или воронкообразная («грудь сапожника») деформация.
III – тяжёлая – поражение нескольких отделов костной системы, тяжёлое поражение внутренних органов и нервной системы, отставание в физическом и психическом развитии, деформация нижних конечностей – О-образное (genuvarum), X-образное (genuvalgum) и другие (coxavara, genurecurvatum). Искривления позвоночника в виде сколиоза, лордоза, поясничного кифоза.
Начальный период наиболее чётко начинает проявляться в возрасте 3-4 месяцев, однако первые симптомы могут возникать и раньше – в 1-1,5 месяца, но они не специфичны и часто могут проходить мимо внимания родителей. На первое место выступают неврологические и вегетативные изменения. Ребёнок проявляет беспокойство, капризность, нарушается сон –дети плохо засыпают и часто просыпаются, появляется пугливость, раздражительность, дети часто вздрагивают от громкого звука или яркого света. Заметно снижается аппетит – ребёнок с неохотой и на короткое время берёт грудь, вялососёт – иногда бывают запоры. Кроме того, обращают на себя внимания такие вегетативные проявления как потливость, особенно во сне, и повышение сосудистой возбудимости кожи, которое проявляется в виде усиления интенсивности и длительности красного дермографизма. Наиболее интенсивно, вызывая у ребёнка сильный зуд, потеет волосистая часть головы, которой ребёнок постоянно трётся о подушку, это и приводит к специфичному для рахита облысению затылка. Также обращает на себя внимание характерный резкий и кислый запах пота. Возможно некоторое снижение тонуса мышц ребёнка. Костные изменения для начального периода рахита не характерны, однако иногда может обнаруживаться некоторая податливость краёв большого родничка. Начальный период болезни длится, как правило, от 2 до 4 недель.
В период разгара прогрессируют изменения костной системы: остеомаляция грудной клетки, нижних конечностей, избыточный остеогенез (рахитические «чётки», «браслетки», лобные и теменные бугры черепа). Ребёнок может отставать в физическом и психическом развитии.
При рахите тяжелой степени нарушены функциональное состояние печени, желудочно – кишечного тракта, белковый, липидный обмен, имеется дефицит витаминов В1, В6, В5, А, Е, С, меди, цинка, магния.
У большинства детей с рахитом 1 и 2 степени наблюдаются явления гипохромной анемии.
В период реконвалесценции (выздоровления) постепенно исчезают клинические и лабораторные симптомы рахита. Возникшие при рахите деформации скелета остаются и вовзрослом возрасте: нарушение осанки, изменения грудной клетки, костей нижних конечностей. Перенесенный рахит может способствовать поражению зубов ( развитию множественного кариеса), развитию близорукости, плоскостопия, сужению, деформации костей таза.
· Острое течение – бурное развитие всех симптомов, яркие неврологические и вегетативные расстройства, значительнаягипофосфатемия, высокий уровень ЩФ, преобладание процессов остеомаляции.
· Подострое течение – свойственны умеренно выраженные или малозаметные неврологические и вегетативные нарушения, превалирование процессов остеоидной гиперплазии.
· Рецидивирующее течение – типичны смены периодов обострения и стихания процесса с сохраняющимися остаточными явлениями. При рентгенографии зон роста обнаруживается несколько полос обызвествления в метафизах.
Диагностика
Диагностические исследования:
Основные (обязательные) диагностические обследования, проводимые на амбулаторном уровне:
· ОАК;
· ОАМ;
· определение в крови уровня кальция и фосфора;
· активность ЩФ в сывороткекрови;
· проба по Сулковичу (качественное определение степени кальциурии).
Дополнительные диагностические обследования, проводимые на амбулаторном уровне:
· Концентрация 25(ОН)Dв сыворотке крови(основной тест для определения уровня дефицита витаминаD).
· Рентгенорафия костей (при выраженных костных изменениях для дифференциальной диагностики).
· Денситометрия(для дифференциальной диагностики- степени определения остеопороза).
Минимальный перечень обследования, который необходимо провести при направлении на плановую госпитализацию: согласно внутреннему регламенту стационара с учетом действующего приказа уполномоченного органа в области здравоохранения.
Основные (обязательные) диагностические обследования, проводимые на стационарном уровне (при экстренной госпитализации):
· ОАК (контроль по показаниям- при наличии патологических изменений в анализе при поступлении);
· ОАМ (контроль по показаниям-при наличии патологических изменений в анализе при поступлении);
· биохимический анализ крови (кальций, фосфор, ЩФ);
· анализ мочи по Сулковичу
Дополнительные диагностические обследования, проводимые на стационарном уровне:
· ЭЭГ – при спазмофилии для дифференцировки с эпилепсией.
· Эхокардиографияи ЭКГ – при появлении симптомов нарушения сердечной деятельности.
Рентгенография костей (при выраженных костных изменениях для дифференциальной диагностики с другими рахитопобобными заболеваниями).
Инструментальное обследование:
· Рентгенография костей. На рентгенограмме костей в местах наиболее интенсивного роста, особенно энхондрального окостенения, выявляется и усиливается остеопороз; зона обызвествления становится не выпуклой, а более горизонтальной, постепенно сглаживается, делается неровной, бахромчатой; щель между эпифизом и диафизом увеличивается за счет расширяющегося метафиза; эпифиз приобретает блюдцеобразную форму. Точки окостенения мелких костей выявляются своевременно, но на рентгенограмме выявляются менее отчетливо. Нередко выявляются поднадкостничные переломы по типу зеленой веточки. При тяжелом рахите наблюдаются зоны Лозера – поперечно расположенные прозрачные зоны (полосы) шириной в несколько миллиметров. В начльном периоде – незначительный остеопороз.
· Денситометрия (информативный тест без лучевой нагрузки, по показаниям- для определения степени выраженности остеопороза) .
Показания для консультации узких специалистов:
· консультации узких специалистов (по показаниям) – сопутствующие соматические заболевания иили патологические состояния.
Лабораторная диагностика
Лабораторное обследование
:
строгой корреляции между клиническими признаками рахита и лабораторными изменениями нет, так только у 50% детей с гиповитаминозом D наблюдается полное соответствие биохимических и рентгенологических данных (Мальцев С.В.,1987 г).
· Концентрация фосфора в сыворотке крови может снижаться до 0,65-0,8 ммоль/л (при норме у детей до 1 года 1,5-1,8 ммоль/л).
· Концентрация кальция – до 2,0-2,2 ммоль/л (при норме 2,2-2,7 ммоль/л).
· Концентрация ионизированного кальция менее 1.0 ммольл.
· Соотношение между уровнями кальция и фосфора в сыворотке крови в норме равное 2:1, в период разгара рахита повышается до 3:1-4:1. В начальном периоде рахита и в периоде разгара остеомаляционных явлений количество кальция может быть нормальным.
· ПовышениеактивностиЩФ в сыворотке крови в 1.5-2 раза ( абсолютные показатели нормы зависят от метода её определения).
· Снижение 25-ОН-Д в крови (в норме 20 нгмл)снижение до 10 нг/мл свидетельствует о дефиците витамина D, а содержание ниже 5 нг/мл об авитаминозе (ІІ В).
| Критерии оценки статуса обеспеченности витамином Д на основании концентрации 25(ОН)Дtotal в сыворотке крови Practical guidelines for supplementation of Vitamin D and treatment of deficits in Central Europe, 2013 г. | |
|
Концентрация 25(ОН)Дtotal в сыворотке, нг/мл (нмоль/л), 1 нг/мл=2,5 нмоль/л |
Клиническаяинтерпретация |
| менее 20 нг/мл (50) | отражает дефицит витамина Д; требует медикаментозного лечения. |
| 20-30 нг/мл (50-70) | отражает субоптимальный статус обеспеченности витамином Д; требует умеренного повышения дневной дозы витамина Д. |
| 30-50 нг/мл(75-125) | отражает адекватный статус обеспеченности витамином Д; требует сохранения применяемой схемы обеспечения витамином Д и принимаемой дозы. |
| 50-100 нг/мл (125-250) | отражает высокий уровень поступления витамина Д; требует поддержания принимаемой дозы обеспечения витамином Д при низких значениях этого интервала или умеренного снижения дозы – при высоких значениях интервала. |
· Повышенная экскреция аминокислот (аминоацидурия — выше 10мг/кг в сутки) – ранний признак рахита.
· Гиперфосфатурия и повышенный клиренс фосфатов мочи (в норме 0,1-0,25 млсек, при рахите до 0,5-1,0 млсек).
· Повышение содержания остеокальцина в сыворотке крови до 90-170 нгмл.
Дифференциальный диагноз
Дифференциальный диагноз [8-10]:
Таблица 1 – Дифференциальная диагностика рахита с рахитоподобными заболеваниями и остеопатиями.
|
Заболевание |
Основные дифференцирующие признаки |
|
|||
|
Сроки манифестации |
Клинические проявления |
Рентгено- |
Обменные нарушения |
||
|
Рахит детей раннего возраста (классический) |
В 3-6 мес |
· Костные деформации, обусловленные остеомаляцией и гиперплазией остеоидной ткани |
· «Блюдцеобразные» расширенные метафизы |
В крови: |
Мульти- |
|
Витамин-D-зависимый рахит |
В 3-6 мес |
Выраженные костные деформации, характерные для «цветущего» классического рахита: |
• Системный остеопороз |
• В крови: уровень фосфора снижен или в норме, кальция — резко снижен, активность щелочной фосфатазы резко повышена |
Аутосомно-рецессивный |
|
Витамин-D-резистентный рахит (фосфатдиабет) |
В 1-1,5 года |
• быстропрогрессирующие варусные (0-образные) деформации ног, нарушение походки, «рахитические четки, браслеты» |
•Грубые бокаловидные деформации метафизов искривления и утолщения длинных трубчатых костей за счет одностороннего (медиального) утолщения коркового слоя периоста |
• В крови: |
Доминантный, сцепленный с Х-хромосомой |
|
Болезнь де Тони-Дебре-Фанкони |
В 1-2 года |
• Смешанные (Х- и 0-образные) деформации ног |
• Выраженный остеопороз |
• В крови: |
Аутосомно-рецессивный |
|
Почечный тубулярный (канальцевый) ацидоз |
В 5-6 месяцев –2-3 года |
• Выраженное отставание росто-весовых показателей |
• Общий системный остеопороз |
• В крови: уровни фосфора, кальция, калия и натрия снижены |
Аутосомно-рецессивный |
|
Несовершенный остеогенез |
На первом году жизни |
• Множественные костные переломы со смещением |
• Выраженный остеопороз |
В крови: |
В большинстве случаев аутосомно-доминантный, при врожденных формах — аутосомно-рецессивный |
|
Хондродистрофия |
На первом году жизни |
• Укорочение рук и ног при нормальной длине туловища, кисть в виде трезубца, поясничный лордоз |
Длинные трубчатые кости укорочены, интенсивно «затемнены», головки их увеличены, грибовидно вздуты, утолщены |
В крови: |
Встречаются формы с аутосомно-доминантным и аутосомно-рецессивным типами наследования |
|
Гипофосфатазия |
На первом году жизни |
• Шаровидная форма черепа, гипофосфатемия (краниотабес) |
• Системный резкий остеопороз, кости почти не контурируются |
В крови: уровни кальция и фосфора повышены или в норме, активность щелочной фосфатазы снижена |
Аутосомно-рецессивный |
Лечение
Цели лечения:
· устранение нарушений ФКО;
· устранение и минимализация костно-мышечных нарушений;
· стабилизация состояния пациента.
Тактика лечения [3-10,12-20]:
Лечение рахита как правило амбулаторное. В случае неэффективности амбулаторного лечения, тяжелом течении заболевания решается вопрос о госпитализации.
Немедикаментозное лечение:
· диетотерапия;
· массаж, ванны, пребывание на свежем воздухе;
Терапевтический эффект при рахите достигается только при сочетании витамин-Д- терапии с рационализацией вскармливания ребенка, сбалансированного поступления солей кальция и фосфора, нормализацией режима сна и бодрствования, длительного пребывания на свежем воздухе, других оздоровительных мероприятий
В организации питания при лечении рахита рекомендуется сбалансированная диета по содержанию белков, жиров и углеводов, преобладание продуктов, богатых витаминами и минеральными веществами, в частности, кальцием, фосфором, магнием и т. д. Следует ограничивать в питании каши и мучные изделия, своевременно вводить овощные и фруктовые соки,пюре.К овощному пюре необходимо добавлять сваренный вкрутую желток, богатый жирорастворимыми витаминами и витаминами группы В, а также фосфором,кальцием, микроэлементами.При искусственном вскармливании важно учитывать содержание витамина D в заменителях грудного молока — адаптированных молочных смесях.Потребность в кальцие для здорового ребенка первых 6—12 месяцев составляет 500—600 мг в сутки.
При рахите в период репарации и при выраженных остаточных явлениях полезны соляные, хвойные, соляно – хвойные ванны, песочные, морские и солнечные ванны.Солевые ванны показаны пастозным детям, хвойные — детям со сниженным питанием. Обязательны общий массаж и гимнастика
Назначение массажа до назначения медикаментозной терапии может оказать отрицательный эффект (П.В.Новиков,2011г).
Медикаментозное лечение:
Для лечения используют препараты витамина D в виде водного и масляного раствора. Назначают водный раствор витамина D3 (в одной капле 500 МЕ) или масляные растворы витамина D3 (в одной капле 500 МЕ) и Эргокальциферол(в одной капле 625, 1250 МЕ) в дозе 2000-5000 МЕ курсами 30-45 дней (УД – В).
При отсутствии возможности определения уровня 25(ОН)Dподбор лечебных доз витамина D проводится в соответствии с особенностями клинической картины рахита, степенью его тяжести и динамикой заболевания. Дозы и длительность терапии рахита вариабельны и зависят от многих факторов, в том числе – от индивидуальных особенностей организма.
· Для лечения витамин Д-дефицитного рахита применяется витамин Д в дозе от 2000 до 5000 МЕ/сут на протяжении 30-45 дней. Лечение рекомендуется начинать с дозы 2000 МЕ с постепенным еѐ увеличением до индивидуальной лечебной дозы под контролем пробы Сулковича (проводят до начала лечения, а затем каждые 7-10 дней − в процессе лечения). При резко положительном результате пробы витамин Д отменяют. Дозу в 5000 МЕ/сут назначают только при выраженных костных изменениях. В зависимости от степени тяжести заболевания: суточная доза витамина Д при I степени рахита – 1000-1500 МЕ в течение 30 дней, при II степени – 2000-2500 МЕ в течение 30 дней, при III степени – 3000-4000 МЕ в течение 45 дней(С.В. Мальцев (1997 г.)
· После достижения клинического эффекта (проявляется нормализацией мышечного тонуса, исчезновением краниотабеса и вегетативных расстройств, отсутствием прогрессирования костных деформаций, началом прорезывания зубов) и нормализации лабораторных показателей (щелочная фосфатаза, кальций, фосфор в крови) переходят на профилактическую дозу витамина Д (400-500 МЕ), которую ребѐнок получает ежедневно в течение первых 2-х лет жизни и зимой на 3-ем году.
· Детям из групп социального риска, из категории часто и длительно болеющих, возможно проведение противорецидивного курса специфического лечения рахита спустя 3 месяца после окончания основного курса в аналогичных дозах в течение 3-4 недель.
На время лихорадки при острых заболеваниях у больных рахитом (ОРВИ, пневмонии, кишечной инфекции, отите и других) приём витамина D следует прекратить на 2-3 дня. После нормализации температуры продолжить лечение (УД –В).
При возможности определения уровня 25(ОН)Дtotal( менее 20 нг/мл соответствует дефициту витамина Д) рекомендованы следующие лечебные дозы лекарственных средств на основе витамина Д (при избыточной массе тела/ожирении пациента применяют дозы, близкие к верхним границам указанного диапазона):
· новорождѐнные дети (в возрасте до 1 месяца) – 1000 МЕ/сут;
· дети 1-12 месяцев – 1000-3000 МЕ/сут;
· дети 1-18 лет – 3000-5000 МЕ/сут.
Общая нагрузочная доза 300 000 МЕ и выше не рекомендуется даже в случае лечения тяжѐлого дефицита.(«Practical guidelines for supplementation of Vitamin D and treatment of deficits in Central Europe»,2013г.
Длительность лечения составляет 1-3 месяца и зависит от степени тяжести дефицита витамина Д. После достижения пациентом лабораторно подтверждѐнных целевых концентраций обеспеченности витамином Д (30-50 нг/мл, оптимальный статус) назначается поддерживающая доза лекарственного средства. Целесообразно повторно определить концентрацию 25(ОН)Дtotal спустя 3-4 месяца после еѐ нормализации, а затем контролировать 1 раз в 6 месяцев, особенно – при наличии у ребѐнка описанных ранее факторов риска. В процессе лечения осуществляют мониторинг сывороточных концентраций кальция, фосфора, активности общей щелочной фосфатазы, количественное определение кальциурии (расчѐт кальций-креатининового коэффициента).
При применении лечебных доз витамина D необходимо постоянно осуществлять контроль за состояниемребенка поскольку существует широкий диапазон индивидуальной чувствительности к витамину D. Признаками гипервитаминоза D являются рвота, боли в животе, жажда, гиперкальциурия. Для своевременного выявления гиперкальциемии, проводят пробу по Сулковичу (качественная реакция определяющая выделение кальция с мочой) 1 раз в неделю, оценивают содержание кальция в плазме крови – 1 раз в месяц. (ІІ В)
Коррекция фосфорно-кальциевого обмена, вторичного гиперпаратиреоза.
Витамина D назначают в сочетании с витаминами группы В(В1, В2, В6), С, А, Е. Особенно важна комбинация с витаминами В2 и С, так как при их дефиците эффекта от лечения витамином D может и не быть (ІІ В).
С целью снижения выработки паратгорморна в паращитовидных желёзах и уменьшения выраженности вегетативных симптомов в комплекс медикаментозного лечения при ІІ и ІІІ степени рахита включают препараты калия и магния из расчёта 10 мг/кг массы тела в сут в течение 3-4 нед.
Для устранения мышечной гипотонии и улучшения метаболических процессов назначают карнитина гидрохлорид 50 мгкг массы в течение 20-30 дней(ІІІ В).
Недоношенным младенцам и доношенным, находящимся на естественном вскармливании в течение 2-3 недель рекомендуют прием препаратов кальция (глицерофосфат кальция 0,05-0,1 г в сутки, кальция глюконат 0.25-0.75 г в сутки). Для коррекции обмена фосфора используют кальция глицерофосфат в течение 3-4 недель (УД – В).
Улучшает всасывания солей кальция и фосфора в кишечнике цитратная смесь (кислота лимонная 2,1 г; натрия цитрат 3,5 г; вода дистиллированная 100 мл) в течение 10-12 дней по 1 ч. л. 3 раза в день. Лимонная кислота способствует поддержанию кислой реакции в кишечнике, образует растворимый и легкоусвояемый комплекс цитрата кальция.
Обнаружение у ребенка, особенно с отягощенной наследственностью по мочекаменной болезни, тубулоинтерстициальному нефриту на фоне метаболических нарушений, в период лечения витамином D снижения антикристаллообразующей способности мочи, положительной пробы Сулковича, оксалатной и (или) фосфатной, кальциевой кристаллурии служит основанием для коррекции дозы витамина D.
Индикаторы эффективности лечения:
· устранение клинических и лабораторных проявлений.
Препараты (действующие вещества), применяющиеся при лечении
| Аскорбиновая кислота (Ascorbic acid) |
| Витамин E (Vitamin E) |
| Кальция глицерофосфат (Calcium glycerophosphate) |
| Кальция глюконат (Calcium gluconate) |
| Карнитин (Carnitine) |
| Колекальциферол (Kolekaltsiferol) |
| Пиридоксин (Pyridoxine) |
| Ретинол (Retinol) |
| Рибофлавин (Riboflavin) |
| Тиамин (Thiamin) |
| Эргокальциферол (Ergocalciferol) |
Госпитализация
Показания для госпитализациис указанием типа госпитализации: (плановая, экстренная):
Показания для плановой госпитализации:
· Рахит III степени тяжести в периоде разгара.
· Рахит II степени тяжести в периоде разгара, не поддающийся обычной комплексной терапии.
· Выраженные рахитические деформации, появляющиеся у ребенка в конце первого и в начале второго года жизнис целью дифференцировки с рахитоподобными заболеваниями. Тяжесть состояния ребенка, полиурия, полидипсия, выраженные признаки поражения вегетативного отдела центральной нервной системы, резкая мышечная гипотония у ребенка первых месяцев жизни с явлениями рахита также для дифференцировки диагностики с рахитоподобными заболеваниями.
Показания для экстренной госпитализации:
· Гипервитаминоз D, развившийся при специфическом лечении рахита любой степени.
· Спазмофилия.
Профилактика
Профилактические мероприятия [8-10]:
Антенатальная профилактика рахита:
Необходимо соблюдение режима дня беременной женщины, в том числе достаточно продолжительный сон днем и ночью. Рекомендуются прогулки на свежем воздухе не менее 2—4 часов ежедневно, в любую погоду. Чрезвычайно важно организовать рациональное питание беременной (ежедневно употреблять не менее 180 г мяса, 100 г рыбы — 3 раза в неделю, 100—150 г творога, 30—50 г сыра, 300 г хлеба, 500 г овощей, 0,5 л молока или кисломолочных продуктов). Вместо молока можно применять специальные молочные напитки, предназначенные для беременных и кормящих женщин и способные предупредить нарушения фосфорно-кальциевого обмена у плода и матери во время беременности и в период лактации. Беременным женщинам из группы риска (нефропатии, сахарный диабет, гипертоническая болезнь, ревматизм и др.) начиная с 28–32-й недели беременности необходимо дополнительно назначать витамин D в дозе 500—1000 МЕ в течение 8 недель вне зависимости от времени года.
Постнатальная профилактика рахита:
Необходимо соблюдать условия правильного вскармливания ребенка. Наилучшим для младенца первого года жизни является грудное молоко при условии правильного питания кормящей женщины. Суточный рацион женщины в период лактации должен быть разнообразным и включать необходимое количество белка, в том числе и животного происхождения; жира, обогащенного полиненасыщенными жирными кислотами, углеводов, обеспечивающих организм энергией, а также витаминов и микроэлементов.
При искусственном вскармливании ребенку необходимо подобрать молочную смесь, максимально приближенную к женскому молоку, содержащую 100%-ную лактозу, усиливающую всасывание кальция, холекальциферол и имеющую соотношение кальция и фосфора, равное 2. В молочных смесях допускается соотношение между кальцием и фосфором, равное 1,2—2, однако в грудном молоке оно равно 2,0.
Лечебная физкультура, массаж должны проводиться систематически, регулярно, длительно, с постепенным и равномерным увеличением нагрузки.
Постнатальная специфическая профилактика рахита:
проводитсявитамином D, минимальная профилактическая доза которого составляет для здоровых доношенных детей раннего возраста 500 ЕД в сутки. Эта доза назначается начиная с 4—5-й недели жизни в осенне-зимне-весенний период с учетом условий жизни ребенка и факторов риска развития заболевания. Специфическая профилактика рахита у доношенных детей проводится в осенне-зимне-весенний период на первом и втором году жизни. Дети из группы риска по рахиту в осенне-зимне-весенний период первые два года жизни должны ежедневно получать витамин D в дозе 1000 МЕ .
Недоношенным детям при I степени недоношенности витамин D назначается с 10–14-го дня жизни, по 400—1000 МЕ ежедневно в течение 2 лет, исключая лето. При недоношенности II степени витамин D назначается в дозе 1000—2000 МЕ ежедневно в течение года, исключая летний период, на втором году жизни доза витамина D снижается до 400—1000 МЕ.
Эквиваленты:
1 МЕ = 0,025 мкг холекальциферола;
1 мкг холекальциферола = 40 МЕ витамина D3.
Противопоказания к назначению профилактической дозы витамина D:
· идиопатическая кальциурия (болезнь Вильямса—Бурне);
· гипофосфатазия;
· органическое поражение ЦНС с симптомами микроцефалии и краниостеноза.
Дети с малыми размерами родничка имеют лишь относительные противопоказания к назначению витамина D. Специфическая профилактика рахита у них проводится, начиная с 3—4 месяцев под контролемразмеровбольшогородничка и окружностиголовы.
Дальнейшее ведение (после стационара):
дети, перенёсшие рахит I степени, наблюдаются врачом общей врачебной практики (семейным врачом) или педиатром до 2 лет, а перенёсшие рахит П-ІП степени – в течение 3 лет. Осмотры проводят 1 раз в 3 месяца.
По показаниям врач общей практики (семейный врач) или педиатр может назначить биохимическое исследование крови (определение содержания кальция общего и ионизированного, фосфора и щелочной фосфатазы), денситометрию или рентгенографию костей, проконсультировать ребёнка у ортопеда, хирурга.
Специфическая профилактика проводится в течение 2-го года жизни в осенне-зимний-весенний периоды, а на 3 году жизни только зимой.
Рахит не является противопоказанием для проведения профилактических прививок.
Информация
Источники и литература
-
Протоколы заседаний Экспертного совета РЦРЗ МЗСР РК, 2015
- Список использованной литературы:
1. Авдеева Т.Г., Коровина Н.А. Рахит.//Педиатрия. Национальное руководство. Том 1. – М: «ГЕОТАР-Медиа». 2009, глава 11. – С.261 – 278.
2. Ершова О.Б., Белова К.Ю., Назарова А.В. Кальций и витамин D: всё ли мы о них знаем?// РМЖ. Клинические рекомендации и алгоритмы для практикующих врачей. 2011, № 12. Сайт: info@rmj.ru
3. Захарова И.Н, Дмитриева Ю.А, Васильева С.В, Евсеева Е.А. Что нужно знать педиатру о витамине D: новые данные о его роли в организме (часть 1). //Педиатрия, 2014, том 93, № 3. – С.111-117.
4. Костылева М.Н. Место препаратов, содержащих кальций в профилактике гипокальциемии у детей (обзор литературы). // РМЖ. Педиатрия, 2008, № 6. Сайт: info@rmj.ru
5. Мальцев С.В., Зиатдинова Н.В., ФофановВ.Б. Рентгеноденситометрия костной ткани у детей с различными формами рахита. //Казанский медицинский журнал, 2003 г, том LXXXIV (84), № 1. – С 41– 42.
6. Почкайло А.С., В.Ф. Жерносек, Э.В. Руденко, Н.В. Почкайло, Е.В. Ламеко //Современные подходы к диагностике, лечению и профилактике рахита у детей/ учебно-методическое пособие, 2014 ,Минск 72 с.
7. Новиков, П.В. Современный рахит (классификация, методы диагностики, лечения и профилактики) : лекция для врачей ,2-е . – издание, Москва, 2011. – 71 с.
8. ПрокопцеваН. Л. Рахит у детей. (Лекция) // Сибирское медицинское обозрение, 2013, № 5. – С. 88 – 98.
9. Рациональное вскармливание недоношенных детей. Методические указания (Издание третье, дополненное и переработанное). Москва: «Союз педиатров России», 2012. – 41с.
10. Спиричев В.Б.О биологических эффектах витамина D.//Педиатрия, 2011, том 90, № 6. – С.113 –119.
11. Яцык Г.В., Беляева И.А., Шатская С.Ю. Применение витамина D при рахите у недоношенных детей //Российский педиатрический журнал. 2013, № 5. – С.45 – 49.
12. Kelishadi R., Sharifi-Ghazvini F., Poursafa P., Mehrabian F., Farajian S., Yousefy H., Movahedian M., Sharifi-Ghazvini S. DeterminantsofhypovitaminosisDinpregnantwomenandtheirnewbornsinasunnyregion // IntJ. Endocrinol. 2013; 2013:460970. doi: 10.1155/2013/460970. Epub 2013 Jul 1.
13. Luz Maria De-Regil, Cristina Palacios, Ali Ansary , Regina Kulier , Juan Pablo Peña-Rosas. VitaminDsupplementation for women during pregnancy /Editorial Group: Cochrane Pregnancy and Childbirth Group Published Online: 15 FEB 2012 Assessed as up-to-date: 16 DEC 2011DOI: 10.1002/14651858.CD008873.pub2 Copyright © 2012 The Cochrane Collaboration. Published by John Wiley & Sons, Ltd.
14. MittalH., RaiS., ShahD., MadhuS.V., MehrotraG., MalhotraR.K. Gupta P. 300,000 IU or 600,000 IU of oral vitamin D3 for treatment of nutritional rickets: a randomized controlled trial. // Indian Pediatr. 2014, Apr; 51(4): 265-72.
- Список использованной литературы:
Информация
Разработчики:
1. Рамазанова Лаззат Ахметжановна – кандидат медицинских наук АО. « Медициский университет Астана», доцент кафедры интернатуры детских болезней
2. Макаровская Евгения Александровна – врач высшей категории, заведующая детским отделением поликлиники «Междунардного казахско-турецкого университета».
3. Мустафина КенжегульАхметовна – кандидат медицинских наук РГП на ПХВ «Южно-Казахстанская государственная фармацевтическая академия», доцент кафедры педиатрии и детской хирургии.
4. Литвинова Лия Равильевна – клинический фармаколог «Национальный научный кардиохирургический центр».
Конфликта интересов: отсутсвует.
Рецензенты:
Скосарев Иван Александрович – доктор медицинских наук, профессор РГП на ПХВ «Карагандинский Государственный медицинский университет», заведующий кафедрой детских болезней №1, врач педиатр высшей категории.
Условия пересмотра протокола: пересмотр протокола через 3 года после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
В ходе симпозиума обсуждались последние данные по роли витамина D в рамках витамин D-гормональной системы, распространенность его недостаточности среди детей и взрослых, а также результаты исследований, посвященных разным эффектам этого витамина. В последние годы ведутся дискуссии вокруг уровней концентрации 25(ОН)D, которые можно считать нормой. Приведены данные исследований, обосновывающих границы нормы витамина D. В настоящее время заканчивается российское исследование РОДНИЧОК, задачами которого является уточнение распространенности недостаточности витамина D, а также необходимые меры профилактики и преодоления разной степени недостаточности этого витамина. На основании международного опыта и отечественных данных разработана российская программа «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции».
Ключевые слова: витамин D, концентрация витамина D в крови, дозирование витамина D, Аквадетрим.
Для цитирования: Роль витамина D в формировании здоровья ребенка. Национальная программа по обеспеченности витамином D. Обзор симпозиума. Эксперты: Громова О.А., Мальцев С.В., Захарова И.Н., Намазова-Баранова Л.С. Consilium Medicum. Pediatrics (Suppl.). 2015; 1: 5–13.
The role of vitamin D in the formation of child health. The National Program of vitamin D provision. Symposium overview
Experts: Gromova O.A., Maltsev S.V., Zakharova I.N., Namazova-Baranova L.S.
The symposium discussed the recent data on the role of vitamin D in the framework of the vitamin D-hormone system, the prevalence of deficiency among children and adults, as well as the results of studies on the various effects of this vitamin. In recent years, there have been discussions about the concentration levels of 25(OH)D, and the norms. The data of studies which supports the normal limit of vitamin D, is presented as well. At the present time the Russian study called RODNICHOK with the aims of clarifying the prevalence of vitamin D, as well as the necessary measures to prevent and overcome the varying degrees of deficiency of this vitamin, is coming to its conclusion. Based on international experience and domestic data the Russian program “Vitamin D deficiency in children and adolescents of the Russian Federation: modern approaches to correction” is being developed.
Key words: vitamin D, vitamin D concentrations in blood, dosing of vitamin D, Akvadetrim.
For citation: The role of vitamin D in the formation of child health. The National Program of vitamin D provision. Experts: Gromova O.A., Maltsev S.V.,
Zakharova I.N., Namazova-Baranova L.S. Symposium overview. Consilium Medicum. Pediatrics (Suppl.). 2015; 1: 5–13.
Актуальные аспекты клинической и молекулярной фармакологии витамина D
Выступление клинического фармаколога профессора Ольги Алексеевны Громовой (РСЦ Институт микроэлементов ЮНЕСКО, Москва; кафедра фармакологии и клинической фармакологии ГБОУ ВПО Ивановская государственная медицинская академия Минздрава России) было посвящено оценке влияния витамина D на разные системы и функции организма с точки зрения современной науки и подходам в разработке норм содержания витамина D в крови у детей и взрослых. Интерес в научном сообществе к витамину D чрезвычайно велик. Изучаются как распространенность недостаточности этого витамина, так и разные аспекты его влияния на организм человека.
Солнце – уникальный источник витамина D. Под воздействием B-спектра солнечного излучения в коже активируется 7-дегидрохолестерол с образованием холекальциферола (D3). При участии ферментных систем печени образуется 25(ОН)D3, затем в почках образуется активная форма витамина D – 1,25(ОН)2D3 (кальцитриол). Кальцитриол в свою очередь действует на рецепторы витамина D (VDR).
Условиями для выработки витамина D в коже являются инсоляция кожных покровов ультрафиолетовыми лучами (спектр B) с 11:00 до 16:00 (лучше с 11:00 до 14:00 и в летние месяцы), отсутствие защитного крема, плотной одежды, оптимальный наклон солнечных лучей. Кроме того, на уровне выработки витамина D сказываются тип кожи, степень ее пигментации, физическая активность человека и его обеспеченность другими витаминами. Есть такие термины, как «солнцеулавливающее поведение» и «витамин D-улавливающая диета». Под первым понимаются прогулки в солнечные дни, под вторым – активное включение в рацион продуктов, наиболее богатых витамином D: рыбы, икры и яиц.
Витамин D – привычное название, которое полностью не отражает всю многогранность ролей этого вещества. Исследования последних лет доказали, что витамин D – это прегормон, одна из молекул метаболома, оказывающая мощное влияние на геном, а VDR расположены в самых разных органах и тканях. Влияние витамина D превосходит действие всех других витаминов. Однако выполнение функции витамина D возможно лишь при условии выполнения всей цепочки превращений витамина и воздействии кальцитриола на VDR. VDR может активировать 7835 генов и соответствующих белков. Ответ клеток на кальцитриол может быть быстрым и медленным. Клетки, дающие быстрый ответ на стимуляцию кальцитриолом, – это, например, b-клетки поджелудочной железы, адипоциты, миоциты сосудов, интестинальные моноциты, остеокласты; медленный ответ характерен для клеток соединительной ткани, кожи, центральной нервной системы, скелетной мускулатуры, миокарда, молочной железы, легких, кишечника и яичников.
Обеспеченность витамином D принципиально важна для профилактики разнообразных заболеваний, поскольку витамин D активирует VDR и контролирует защитные гены. Это доказано клинико-эпидемиологическими исследованиями на сотнях тысяч пациентов (категория доказательности класса А). Однако в случае недостаточной обеспеченности витамином D плотность VDR постепенно сокращается, что рано или поздно сказывается на функции клеток, тканей, органов и систем.
Витамин D оказывает влияние на состояние иммунной, нервной, сердечно-сосудистой и других систем. Так, один из генов, которые активируются витамином D, является компонентом витамин D-зависимого врожденного антимикробного иммунитета и отвечает за синтез пептида кателицидина. Кателицидин – это так называемый нанобелок, оказывающий бактерицидное действие на микобактерии туберкулеза. В исследовании установлено, что существует 70% вероятность более высокого уровня витамина D в сыворотке крови у любого человека по сравнению с больным туберкулезом [1].
Витамин D повышает нейропластичность, стимулируя дифференциацию нейронов и рост аксонов. Проведено исследование, показавшее зависимость между дефицитом витамина D у беременных и рождением детей, особенностью которых является алекситимия [2]. Подтверждена зависимость между течением нейродегенеративных заболеваний, мозговых инсультов и концентрацией витамина D в сыворотке крови.
Витамин D составляет альянс с антиоксидантами, нормализующими медиаторы воспаления, и сдерживает натиск так называемых «inflamm–aging» (континуума «воспаление–возраст»).
От присутствия витамина D зависит огромное количество белков, отвечающих за контроль над онкопролиферацией и противодействующих ряду проонкологических программ. Эти взаимодействия являются дозозависимыми: так, каждые дополнительные 10 нмоль/мл витамина D в крови снижают на 6% риск рака толстого кишечника, и это подтверждено рядом исследований. Также подтверждено снижение риска развития рака молочной железы, смертности от других онкологических заболеваний.
Поиск оптимальной концентрации витамина D в сыворотке и дозы для перорального применения
В настоящее время активно обсуждаются вопросы диапазона содержания витамина D в сыворотке, который можно считать нормой, и подбора дозы витамина D для его дотации.
Нормы концентрации витамина D в крови, принятые в настоящее время, приведены в таблице.
Следует отметить, что как верхняя, так и нижняя границы нормы – предмет постоянных дискуссий среди ученых. Диапазон между верхней и нижней границами нормы подразумевает достаточность содержания витамина D и отсутствие токсичности. Этот диапазон – это то, к чему мы должны стремиться. В настоящее время полный диапазон референсных значений для витамина D не может быть представлен. Это связано с отсутствием надежных биомаркеров для определения достаточных уровней витамина D для реализации его внекостных, неклассических эффектов (по данным разных источников, они должны быть выше костных); кроме того, терапевтический диапазон витамина D достаточно широк, а уровень, сопровождаемый токсическими эффектами, в высокой степени индивидуален.
В настоящее время физиологически обоснованными представляются сывороточные уровни 25(ОН)D между 30 и 100 нг/мл (75–250 нмоль/л).
Обсуждение нижней границы нормы
По результатам обсуждений недавно нижняя граница нормы была повышена с 20 до 30 нг/мл. Однако, возможно, эти цифры не окончательные. Так, эндокринологи предлагают с 15 лет жизни нижней границей нормы считать 38–40 нг/мл, что имеет ряд научных обоснований, сделанных на основе исследования костных эффектов витамина D.
Обсуждение верхней границы нормы
Верхняя граница нормы зависит от возможных токсических эффектов витамина D (развитие гиперкальциемии), достижения гарантированного подавления избыточной секреции паратгормона у большинства индивидуумов и трудности превышения уровня витамина D более 100 нг/мл [3, 4]. В любом случае принятие за верхнюю границу нормы концентрации 80 нг/мл можно считать устаревшим мнением. Имеющиеся данные клинических исследований показывают, что гиперкальциемия отмечается у единичных пациентов только при приближении уровня 25(ОН)D к значениям 180–200 нг/мл [5, 6]. Опубликован метаанализ, показавший, что неблагоприятные последствия приема витамина D наблюдаются только при однократном приеме мегадоз витамина D – более 400 000 МЕ [7].
Российские исследователи также обсуждают оптимальную верхнюю границу нормы. Так, по результатам, полученным в ходе исследования РОDНИЧОК, анализировалась зависимость между высоким уровнем витамина D (100–150 нг/мл) и гиперкальциемией (рис. 1).
Из рис. 1 видно, что гиперкальциемия никак не связана с этим диапазоном.
Оптимальные дозировки
Наша собственная аналитическая работа показала, что достижение высокого уровня витамина D в сыворотке возможно только при условии применения высоких доз витамина D курсами не менее 4 мес при сохранении высокого комплаенса. По результатам другой работы даже при условии назначения врачом витамина D, применение до 80% доз пропускается, поэтому ожидать, что у таких пациентов будет нормальная концентрация витамина D, не стоит. Выполнение рекомендаций нужно отслеживать, не уставая вырабатывать дисциплину у больных и их родителей.
Витамин D должен применяться длительными курсами и достаточно высокими дозами. Так, результаты одного из сравнительных исследований показали, что в течение 12 мес применения витамина D в дозировке 200 МЕ/сут норма практически не достигается; при применении витамина D в дозе 2000 МЕ/сут преодолевается порог концентраций 20 нг/мл у более 90% подростков, а порог 30 нг/мл – у более 60% [8].
Оптимальная форма для перорального применения витамина D
Витамин D – это жирорастворимый витамин. Для осуществления своих разносторонних биологических эффектов жирорастворимый витамин D должен эффективно всосаться в кровь, а затем поступить в другие ткани организма. Скорость кишечного всасывания витамина D наиболее высока в проксимальных и средних сегментах тонкой кишки. Всасывание витамина D существенно зависит от присутствия других веществ (жиры, желчные кислоты). Возможно ли «растворить» жирорастворимый витамин в воде? Да, при использовании технологии мицеллирования (эмульгации).
В физической химии мицеллы (от лат. mica – крупинка) – частицы коллоидных систем, образующие мелкодисперсную взвесь в большом объеме растворителя. Мицеллы – наночастицы (10…1000 нм в диаметре) с «жировой начинкой» (содержащей витамин D) и гидрофильной оболочкой, которая позволяет наночастицам равномерно распределяться по всему объему водного раствора. Эмульгаторы – основа образования мицелл. В водной среде мицеллы образуются особыми амфифильными молекулами (поверхностно-активными веществами или эмульгаторами); рис. 2.
Эмульгатор – молекула, имеющая гидрофобный «хвост» (выталкиваемый из водного раствора вследствие сил поверхностного натяжения) и гидрофильную «голову» (наоборот, обладающую повышенным сродством к водному раствору). Мицеллообразование – энергетически выгодно, поскольку гидрофобные хвосты амфифильных молекул выталкиваются из водного раствора, энергетически выгодной является такая конфигурация, в которой гидрофобные концы «скрыты» от растворителя, а гидрофильные концы молекул, наоборот, максимально взаимодействуют с молекулами воды.
АкваДетрим® – это единственный препарат водорастворимой формы витамина D, чья технология производства предполагает построение этих мицелл.
В АкваДетриме мицеллирование осуществляется за счет субстанций, полученных из касторового масла. Молекула витамина D в мицеллах играет роль жирорастворимого ядра, «спрятанного» от воды с помощью гиброфильных «хвостов». Распределение полученных мицелл в воде равномерно за счет взаимного их отталкивания и не зависит от объема жидкости. Мицеллирование в качестве помощника всасывания витамина D в кишечнике имеет множество плюсов, поскольку исключает из неблагоприятных факторов этого процесса неправильное питание, нарушения со стороны билиарного тракта и другие изменения работы пищеварительной системы, являющиеся следствием возраста и заболеваний.
Для выбора препарата витамина D можно воспользоваться следующим алгоритмом: пациенты с нормальным пищеварением (т.е. физиологическим мицеллированием) могут использовать и водную форму препарата мицелл витамина D3, и масляную его форму. Если же больной страдает нарушениями пищеварения (у него снижена способность к эндогенному мицеллированию), тогда может рекомендоваться только водная форма витамина D3 (рис. 3).
Для достижения нормального уровня витамина D у лиц любого возраста требуется ежедневное применение соответствующего препарата. АкваДетрим® – оптимальная форма препарата для всех групп пациентов.
Новое о витамине D
Новым данным о роли витамина D в организме человека, особенностям индивидуальных реакций на витамин D, теме международных дискуссий касательно дозировок витамина D у взрослых и детей посвятил свое сообщение доктор медицинских наук, профессор, заведующий кафедрой педиатрии с курсом поликлинической педиатрии ГБОУ ДПО Казанская государственная медицинская академия Минздрава России Станислав Викторович Мальцев.
Витамин D обладает универсальным механизмом воздействия на здоровье. H.De Luca 40 лет назад впервые подробно описал метаболизм витамина D, его классический путь воздействия на органы-мишени. Очень долго считалось, что влияние витамина D на организм исчерпывается воздействием на фосфорно-кальциевый обмен совместно с паратгормоном и кальцитонином. Около 20 лет назад в костях и мышцах были открыты рецепторы витамина D (VDR). Эти данные стали во многом решающими для дальнейшего изучения механизмов воздействия витамина D на функции организма. Многочисленные исследования показали, что большинство органов и тканей имеют VDR, а его действие необходимо рассматривать с позиций оценки витамин D-гормональной системы, включающей витамин D, его два метаболита – печеночный и почечный, витамин D-связывающий белок и многочисленные VDR (рис. 1–2).
Это система, оказывающая разнообразное воздействие на органы и ткани.
За последнее 10-летие в мире проводятся многочисленные исследования, посвященные влиянию витамина D на рост и развитие, пролиферацию, апоптоз, ангиогенез, воздействию на отдельные системы – иммунную, сердечно-сосудистую, эндокринную и т.д. Таким образом, теперь известно, что эффекты витамина D не ограничиваются только метаболизмом кальция и фосфатов, а являются фактором обеспечения важнейших физиологических функций.
Витамин D – это стероидный гормон с эндокринным, паракринным и аутокринным эффектами.
Дефицит витамина D
Недостаточность витамина D – одна из причин развития большинства болезней цивилизации. Роль педиатров в обеспечении детей витамином D и профилактике последствий его недостаточности очень велика.
Причины дефицита витамина D:
1. Нарушение поступления, недостаточная инсоляция и снижение синтеза витамина D в коже.
2. Недостаток в питании продуктов, содержащих витамин D.
3. Ряд причин, которые вызывают нарушение обмена витамина D, когда при достаточном поступлении нарушается его метаболизм в органах и тканях, и в итоге мы имеем его эндогенную недостаточность (снижение синтеза 25(ОН)D при заболеваниях печени, уменьшение синтеза 1,25(ОН)2D в почках, синдром мальабсорбции, резистентность органов-мишеней и т.д.).
Последствия дефицита витамина D
В настоящее время доказано негативное воздействие, которое оказывает на функционирование систем организма недостаточность витамина D. В настоящее время это влияние рассматривается с точки зрения эпигенетики. Эпигенетическая регуляция экспрессии генов определяет развитие в будущем сердечно-сосудистых (артериальная гипертензия, ишемическая болезнь сердца), аллергических заболеваний, сахарного диабета, психических заболеваний у детей и взрослых, онкологическую и другую патологию.
Анализ показывает, что снижение пребывания на солнце в течение последних 40 лет приводит к большинству болезней во всем мире. Достоверно доказано, что увеличение концентрации витамина D в крови снижает уровень частоты:
• рака молочной железы;
• сахарного диабета;
• рахита, остеопении, остеопороза;
• проблем беременности, заболеваний репродуктивной системы;
• гриппа;
• переломов в результате падений;
• когнитивных нарушений;
• болей в спине;
• ревматоидного артрита;
• паркинсонизма.
Связаны с низким уровнем витамина D:
• аллергия, астма, анемия;
• аутизм;
• болезнь Альцгеймера;
• целиакия;
• хроническая усталость;
• хроническая обструктивная болезнь легких;
• депрессия;
• болезни сердца;
• метаболический синдром;
• туберкулез;
• псориаз;
• ожирение.
При перечисленных патологических состояниях не только констатируется факт сниженного уровня витамина D, но выявлены и изучены патогенетические механизмы, приводящие к изменениям здоровья вследствие недостаточности витамина D.
В 2014 г. опубликована работа, показавшая, что снижение 25(ОН)D в крови лишь на 10 нг/мл увеличивает риск смерти от всех причин на 16%*.
Следует сказать, что результаты изучения последствий дефицита витамина D неоднозначны, а среди исследователей в разных научных центрах мира нет полного единодушия. Число проводимых работ огромное, и они показывают иногда достаточно противоречивые результаты. Возможно, это связано с тем, что витамин D-зависимая гормональная система работает у различных людей при разнообразных заболеваниях совершенно по-разному. Так, на сегодня известно, что имеет место полиморфизм генов как витамин D-связывающего белка, так и генов VDR. Варианты витамин D-связывающего белка характеризуются разным сродством к 25(ОН)D, а с полиморфизмом генов VDR связана разная чувствительность к витамину D. Распространенность тех или иных вариантов различается у разных рас, этносов, популяций, имеются и гендерные особенности. На одну и ту же дозу солнечного облучения возможен индивидуальный подъем уровня витамина D в крови. Вариативность ответа на одну и ту же дозу витамина D у разных людей следует учитывать в своей работе.
Подбор нижней границы нормы диапазона витамина D в крови
Какой уровень витамина D считать достаточным – 20 или 30 нг/мл – это также тема для обсуждения. Если принять за нижнюю границу нормы 25(ОН)D 20 нг/мл, то статистически 25−30% населения попадает в группу с низкой обеспеченностью витамином D. Если за норму принять 30 нг/мл, то 90% населения должны считаться дефицитными и получать дотацию витамина D. Необходимо взвешенно подойти к принятию решения о нормативах уровня обеспеченности, учитывая социальные, экономические, фармакоэкономические данные и последствия этой оценки. Окончательное решение должно быть принято на основании дальнейших исследований и обсуждений этого вопроса.
Кальций и витамин D
Все серьезные научные исследования увязывают дозу рекомендуемого витамина D и приема кальция с пищей. Именно поэтому в таблицах, которые приводят дозы витамина D для разных возрастных групп, обязательно указываются и рекомендуемые дозы кальция.
Приведенная таблица должна быть настольной для каждого врача, назначающего витамин D.
Баланс уровня витамина D и кальция обязательно должен быть идеальным, поскольку всякий дисбаланс вызывает нарушения. Кальций крови − это очень строгая константа, которая практически мало меняется, и диапазон нормы очень узок. Именно поэтому, когда доза витамина D существенно увеличивается, должна быть уменьшена доза кальция. Повышение и кальция, и витамина D может привести к гиперкальциурии и гиперкальциемии со всеми выходящими последствиями.
Обсуждение дозирования витамина D 
Самое, пожалуй, интересное в мировой литературе, посвященной изучению витамина D, – это противоречие между разными учеными относительно рекомендуемых доз приема витамина D. Так, известный ученый в области изучения метаболизма витамина D Майкл Холик, эндокринолог из Бостонского университета, оппонирует группе ученых, возглавляемой Клиффордом Розеном из Центрального медицинского исследовательского института (Мэн, США). Тема дискуссии – возможные и оптимальные дозировки витамина D.
Представители Центрального медицинского исследовательского института более осторожны в плане назначения витамина D: рекомендуют детям на первом году жизни 400 МЕ, иногда до 2000 МЕ, а после года и у взрослых до 4000 МЕ. Эндокринологи, которых возглавляет профессор Холик, предлагают значительно более высокие дозы: у взрослых до 10 000 МЕ, а у детей до 1 года – до 2000 МЕ. Это означает, что и новорожденные, в том числе и недоношенные дети, имеющие незрелые органы и ткани, в том числе по регуляции обмена фосфатов и кальция, витамин D-гормональную систему, тоже должны получать, по мнению этих специалистов, такие высокие дозы витамина D. Это кажется достаточно опрометчивым. Для обеспечения внескелетного действия витамина D дозы, конечно, должны быть увеличены − это общепризнано. Очевидно, что доза витамина D должна быть не минимальной, а оптимальной, достаточной для реализации скелетных и внескелетных эффектов (внескелетные эффекты требуют более высокой концентрации витамина D). Однако необходим контроль за уровнем 25(ОН)D и реакцией организма (уровень кальция в крови и моче). Индивидуальный контроль этих показателей должен войти в рутинную практику.
В заключение своего выступления профессор С.В.Мальцев обратил внимание слушателей на то, что создание программы «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции», несомненно, является важнейшим шагом вперед как в науке, так и в практической педиатрической деятельности. Данная программа позволит грамотно проводить профилактику нарушений минерального обмена и многих хронических заболеваний как в детском возрасте, так и в отдаленном периоде.
Обеспеченность витамином D детей раннего возраста в Российской Федерации. Результаты фармакоэпидемиологического исследования РОDНИЧОК
Выступление профессора, доктора медицинских наук, заведующей кафедрой педиатрии ГБОУ ДПО РМАПО Минздрава России, главного педиатра Центрального федерального округа России Ирины Николаевны Захаровой было посвящено российскому исследованию РОDНИЧОК (фармакоэпидемиологическое исследование по оценке обеспеченности детского населения младшей возрастной группы витаминОм D в Российской Федерации и аНализ фармакотерапии рахИта и недостатоЧности витамина D в ширОкой Клинической практике), ставшему одним из важных информационных элементов для создания проекта национальной программы «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции».
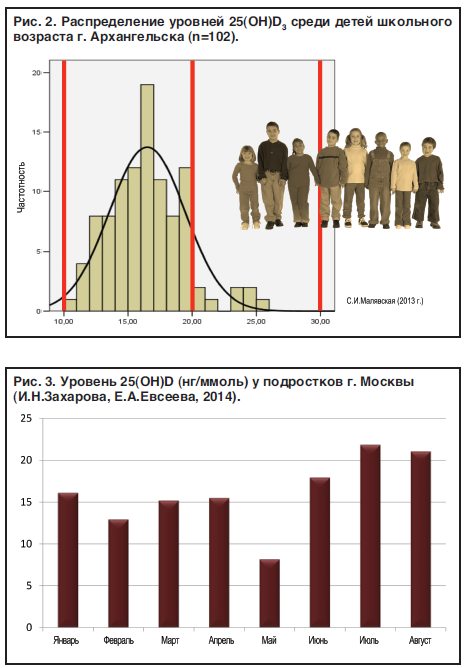
Для многих регионов России характерно малое количество солнечных дней в году; кроме того, жители страны недостаточно используют возможности для инсоляции.
Среди факторов, определяющих риск развития недостаточности витамина D, для нас имеет значение:
• география места жительства;
• сезон года;
• интенсивность пигментации кожи;
• использование обогащенных витамином D продуктов;
• нутритивный статус ребенка;
• наличие сопутствующих заболеваний.
Критерии обеспеченности витамином D, в соответствии с которыми оценивались полученные результаты, были приняты в ходе их обсуждения российскими специалистами и с учетом согласованного мнения европейских ученых (рис. 1).
Отдельные исследования проводились в ряде регионов России.
Республика Коми. У школьников, проживающих в Республике Коми и Пермском крае, средние значения концентрации 25(ОН)D3 в сыворотке крови варьируют в пределах 12,5–19,9 нг/мл. Дефицит обнаружен у 47% подростков Пермского края. В республике Коми пониженное содержание витамина D в осенний период выявлено у 68% обследованных, ранней весной – практически у всех детей (98%).
Архангельск. Обследованы дети в возрасте 7 лет.
У большинства детей уровень витамина D ниже
20 нг/мл (профессор С.И.Малявская); рис. 2.
Москва. Нами проведено исследование содержания в крови 25(ОН)D у 100 девочек-подростков в возрасте от 10 до 17 лет, обучающихся на базе ФГКОУ Московский кадетский корпус Пансион воспитанниц Министерства обороны РФ в феврале 2013 г. У 98% девочек обнаружен дефицит витамина D (уровень ниже 20 нг/мл), среднее значение составило 12 нг/мл. Показатели варьировали в пределах от 5,47 до 24 нг/мл. Ни у одной воспитанницы не было зарегистрировано нормальной концентрации 25(ОН)D.
Другое исследование, проведенное нами среди подростков Москвы, оценивало уровень витамина D по месяцам в течение года. Результат получен схожий: большинство подростков г. Москвы имеют уровень витамина D ниже 20 нг/мл практически в течение всего года (рис. 3).
Даже в летние месяцы он не достигал нормальных показателей, а лишь немного перешагнул за 20 нг/мл, не достигнув нормы. Наиболее неблагополучным оказался май, исследование показало уровень витамина D, оцениваемый как авитаминоз.
Фармакоэпидемиологическое исследование РОDНИЧОК
Исследование началось в декабре 2013 г., закончилось в октябре 2014 г. Оно проводилось в соответствии с правилами надлежащей эпидемиологической практики (GEP); надлежащей клинической практики (GCP); правилами проведения качественных клинических испытаний в РФ (ОСТ 42-511-99). До начала исследования было получено одобрение локального этического комитета при ГБОУ ДПО РМАПО.
Основные задачи исследования (на данный момент они еще не все выполнены):
• Оценка обеспеченности витамином D детского населения в возрасте от 1 мес до 3 лет в разных регионах РФ.
• Изучение факторов риска развития недостаточности витамина D в РФ на современном этапе.
• Анализ реальной практики лечения и профилактики недостаточности витамина D в популяции детей младшего возраста в РФ.
• Разработка и внедрение современных рекомендаций (национальная программа) по диагностике, профилактике, коррекции недостаточности витамина D у детей младшей возрастной группы в РФ.
К настоящему моменту разработан проект российских рекомендаций. Это рабочий документ, требующий дальнейших обсуждений и доработки.
Организаторы исследования: ГБОУ ДПО РМАПО Минздрава России.
Спонсор исследования: ОАО «Химико-фармацевтический комбинат Акрихин».
Главный исследователь: И.Н.Захарова – д-р мед. наук, проф., зав. каф. педиатрии ГБОУ ДПО РМАПО, гл. педиатр ЦФО России, засл. врач РФ.
Ведущие специалисты из разных городов, представленных в исследовании:
• Москва: И.Н.Захарова, М.В.Мозжухина, Е.А.Евсеева, С.В.Васильева, Т.Э.Боровик, Г.В.Яцык.
• Казань: С.В.Мальцев.
• Архангельск: С.И.Малявская.
• Екатеринбург: И.В.Вахлова.
• Владивосток: Т.А.Шуматова.
• Санкт-Петербург: Ф.П.Романюк.
• Ставрополь: Л.Я.Климов, В.А.Курьянинова.
• Новосибирск: Н.И.Пирожкова.
• Благовещенск: Е.Б.Романцова.
• Хабаровск: С.М.Колесникова.
В качестве объектов исследования были:
• Врачи-педиатры амбулаторно-поликлинического звена, врачи-педиатры стационаров исследовательских центров; всего проходили анкетирование 3 тыс. человек.
• Дети в возрасте от 1 мес до 3 лет; всего – 1230 детей.
• Мамы детей, находящихся в стационарах исследовательских центров, – около 1 тыс. человек (проходило их анкетирование).
Критерии включения детей:
• Возраст 0 мес – 3 года.
• Условно здоровые дети.
• Дети, поступающие в стационар, – возможность взятия крови.
• Без органической патологии и генетических синдромов.
• Постоянные жители регионов, участвующих в проекте.
Критерии исключения детей:
• Дети с установленным диагнозом «рахит».
• Дети, имеющие нарушения печеночной функции (желтуха, диарея).
• Дети, имеющие нарушения почечной функции.
• Дети с нарушениями психического развития.
Использовался метод анкетирования мам и педиатров. У детей исследовались уровни витамина D [25(ОН)D], фосфора неорганического, кальция общего, щелочной фосфатазы. Также проводились анализы данных экологических факторов в разных регионах РФ: количество солнечных дней в году, метеосводки, загазованность.
В ходе исследования образцы крови транспортировались в единую лабораторию с соблюдением всех необходимых правил.
Анкетирование врачей
Анкета для врачей-педиатров содержала 15 вопросов, позволяющих оценить диагностику дефицита/недостаточности витамина D у детей в рутинной практике; понимание врачом критериев дефицита/недостаточности витамина D; мнение врача относительно методов профилактики недостаточности витамина D; документы, которыми руководствуются врачи широкой клинической практики при выборе методов терапии и профилактики недостаточности витамина D; лекарственные препараты и дозировки витамина D, которые применяются в рутинной практике педиатров на территории РФ.
Анализ ответов показал, что основным источником получения информации по тактике лечения/ профилактике рахита/недостаточности витамина D являлись медицинские представители фармацевтических компаний. Врачи (73%) получали информацию на сертификационных циклах, более 50% – на конференциях и конгрессах. Почти 1/2 (47,3%) респондентов ответили, что показатель 25(ОН)D в сыворотке крови на уровне 12–20 нг/мл соответствует недостаточности витамина D. На вопрос, у кого чаще встречается недостаточность/дефицит витамина D, практически все ответили – у недоношенных детей, а также у детей из регионов с малым уровнем инсоляции, детей из многодетных семей, часто болеющих детей и т.д. Эффективной профилактикой недостаточности витамина D, по мнению врачей, становятся использование препаратов витамина D (96,2%), инсоляция в летний период (55,5%), применение адаптированных смесей (31,5%), грудное молоко (29,1%).
На вопрос «В каких случаях следует проводить профилактику дефицита витамина D?»: 71,6% врачей ответили – до 2 лет; 61,4% – у детей из группы риска.
Комментарий: в реальной практике мы видим резкое снижение уровня витамина D в крови, а к 3 годам только 10% детей имеют нормальную обеспеченность витамином D, потому что после года практически все перестают его назначать и применять.
На вопрос «Чем руководствуются врачи при назначении витамина D?»: 66,1% врачей ответили, что руководствуются методическими рекомендациями «Профилактика и лечение рахита у детей (1991 г.)».
Комментарий: данные рекомендации были приняты в 1991 г., и к настоящему времени, конечно, устарели. Большинство используют собственный опыт, который часто бывает субъективным.
На вопрос «Какие лекарственные препараты и дозировки витамина D, которые применяются в рутинной практике педиатров на территории РФ?»: 87,7% врачей указали водорастворимый витамин D, жирорастворимый – в 16,6%, однако не все врачи вспомнили название применяемых препаратов.
Вопрос о применяемых дозировках витамина D для лечения рахита: дозировка 2000–5000 МЕ – 25% врачей, 2000 МЕ – 13%, 1000 МЕ – 4%, не дали ответа 11%, а другие дозировки назначали 46% опрошенных.
Вопрос о дозах для профилактики рахита: 39% опрошенных рекомендуют дозу 500 ЕД/сут; 37% – от 500 до 1000 МЕ; 4% – 500–1500 МЕ.
Вопрос о возрастном периоде назначения препаратов витамина D: 8% опрошенных назначают витамин D детям от 1 мес до 1 года; 38% – детям до 2 лет, 48% – детям до 3 лет.
Комментарий: опыт показывает, что реальная практика назначений отличается от того, что показал опрос.
Анкетирование матерей
Анкета содержала 22 вопроса, касающихся факторов риска со стороны матери, кормления малыша (грудное молоко, смеси, прикорм), наличия у ребенка признаков недостаточности витамина D, получения ребенком препаратов витамина D, поливитаминов, препаратов кальция и т.д.
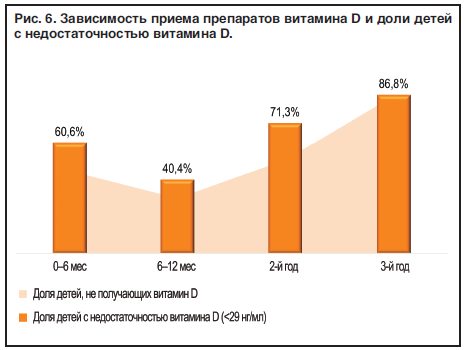
Вопрос «Гуляет ли мама с ребенком?»: у 87% есть возможность гулять с ребенком, у 11% – нет возможности, у остальных – нет ответа.
Вопрос о наличии симптомов недостаточности витамина D: 43,7% ответили отрицательно; к симптомам недостаточности 27% отнесли беспокойство и нарушение сна, 21,1% – потливость и другие симптомы.
Вопрос «Получает ли ребенок препараты витамина D?»: 71% мам ответили утвердительно (АкваДетрим® – 44,9%; Вигантол – 18,6%), не принимают 26%, и 3% не дали ответа. По опросу мам, 23,4% детей до 6 мес не получали витамин D.
Комментарий: возможно, это было связано с тем, что дети находились на грудном вскармливании. Раньше существовала практика не назначать витамин D детям на грудном вскармливании, однако, по данным кандидатской диссертации Ю.А.Дмитриевой, защищенной на кафедре педиатрии ГБОУ ДПО РМАПО, дети с самым тяжелым рахитом – это дети на грудном вскармливании.
Вопрос о побочных явлениях со стороны витамина D: 80% мам ответили, что они не видят побочных явлений, у 18% – нет ответа и 2% – положительный ответ.
Вопрос о длительности приема препаратов витамина D: до 1 года – 28%, до 2 лет – 25%, до 3 лет – 14%, нет ответа у 28% опрошенных матерей.
Комментарий: расчеты показали, что в Екатеринбурге самая большая доля детей, получающих витамин D, и самая маленькая доля с недостаточностью. В Новосибирске, Ставрополе, наоборот, доля детей, получающих витамин D, мала, а недостаточность – высокая.
Во Владивостоке и Казани при среднем показателе доли детей, получающих витамин D, уровень недостаточности высокий. Значит, в этих городах еще какой-то значимый фактор, влияющий на долю детей с недостаточностью витамина D. Так, в Казани по опросу мам только 4% из числа опрошенных принимали препараты кальция во время беременности. Данные о числе детей с недостаточностью витамина D и применении препаратов витамина D приведены на рис. 4, 5.
По данным анкетирования мам и лабораторных тестов, с возрастом число детей, получающих витамин D, падает, и возрастает доля детей с недостаточностью витамина D. Зависимость между получением витамина D и его недостаточностью отражена на рис. 6.
Лабораторное обследование детей: уровень обеспеченности витамином D
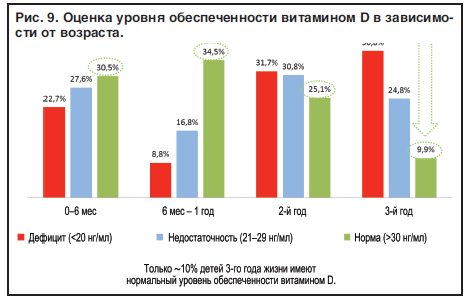
Результаты лабораторного обследования детей показали, что по уровню обеспеченности витамином D [25(ОН)D] лишь 34% детей имеют показатели нормы (выше 30 нг/мл), 24% детей относятся к группе с недостаточностью (21–29 нг/мл) и у 42% наблюдается дефицит витамина D (менее 20 нг/мл). Итого 66% детей в РФ характеризуются недостаточным уровнем витамина D. Данные по отдельным исследовательским центрам приведены на рис. 8.
Обобщенные данные по обеспеченности витамином D в зависимости от возраста: дети первых 6 мес – норму имеют лишь 1/3 детей. Поскольку, по нашим данным, врачи назначают витамин D, в этой группе детей, возможно, страдает комплаенс, либо применяются недостаточные дозы.
В возрасте от 6 мес и до года – лишь 34% имеют норму, на 2-м году – 25% детей, а на 3-м году норма только у 10% (рис. 9).
В предыдущих докладах говорилось о влиянии витамина D на разные системы, в том числе иммунную. Возможно, нормализация уровня витамина D у российских детей положительно скажется на общем уровне их заболеваемости.
В Ставрополе проводилось исследование уровня витамина D у доношенных и недоношенных новорожденных. Результат: дефицит (<20 нг/мл) выявлен у 97% доношенных и 93% недоношенных; в группе доношенных детей нормальные уровни 25(ОН)D не обнаружены; в группе недоношенных детей – в 3,5% случаев. Новорожденные дети, матери которых не принимали витамины во время беременности, имели тотальный дефицит витамина D при рождении. Эти результаты показывают, что педиатры должны работать совместно с гинекологами с тем, чтобы нормализовать применение витамина D беременными.
В завершении своего сообщения профессор И.Н.Захарова привела слова И.П.Павлова: «Как ни совершенно крыло птицы, оно никогда не могло бы поднять ее ввысь, не опираясь на воздух. Факты – это воздух ученого. Без них вы никогда не сможете взлететь». Создание новых национальных рекомендаций возможно только на основании национальных исследований.
Национальная программа по обеспеченности витамином D детей и подростков в Российской Федерации
Доктор медицинских наук, профессор Лейла Сеймуровна Намазова-Баранова, директор НИИ профилактической педиатрии и восстановительного лечения ФГБНУ «Научный центр здоровья детей», заведующая кафедрой аллергологии и клинической иммунологии педиатрического факультета ГБОУ ВПО «Первый МГМУ им. И.М.Сеченова», заведующая кафедрой факультетской педиатрии №1 педиатрического факультета ГБОУ ВПО «РНИМУ им. Н.И.Пирогова», представила участникам симпозиума рабочую версию национальной программы «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции».
Интерес к теме воздействия витамина D на здоровье детей и взрослых, а также высокая распространенность недостаточности этого витамина в российской популяции стали поводом для создания национальной программы. В настоящее время это не окончательная версия документа, а лишь его проект, который предложен вниманию детских врачей. В течение месяца на сайте Союза педиатров России (http://www.pediatr-russia.ru) будут приниматься замечания и предложения от врачей, и после доработки текст программы станет официальным документом. По действующим правилам все принятые документы должны пересматриваться в печатной версии не реже 1 раза в 2 года, а в электронной версии – 1 раз в год.
В создании этого документа принимала участие большая группа ведущих специалистов из разных регионов РФ.
Программа включает в себя историю представлений о витамине D, обширные современные данные о нем, показатели обеспеченности витамином D, рекомендации по его дозированию в разных клинических ситуациях и многое другое.
Профессор Л.С.Намазова-Баранова обратила внимание слушателей на то, что рекомендации по дозированию витамина D не могут быть едиными для всей нашей страны с ее географическим многообразием.
Дефицит витамина D – значительная проблема здравоохранения. И в нашей стране, и за рубежом проводятся исследования в этой области. Опубликованы результаты работ, показавших огромное влияние витамина D на развитие разных заболеваний и на их прогноз. Все это свидетельствует о необходимости заниматься данной темой, поскольку она чрезвычайно актуальна.
Витамин D является необычным по сравнению с другими витаминами, так как помимо поступления с пищей он может синтезироваться в коже под действием ультрафиолетового облучения, а в организме путем последовательного гидроксилирования превращается в гормон. Рецептор витамина D находится во многих клетках организма (кроме остеобластов), включая бета-клетки и клетки, участвующие в иммунной модуляции (мононуклеарные клетки и активированные Т- и В-лимфоциты), и в большинстве органов организма, включая мозг, сердце, кожу, гонады, простату, молочные железы и кишечник. Эпидемиологические и контролируемые исследования часто обнаруживают связь между дефицитом витамина D и заболеваниями (диабет 1 и 2 типа, заболевания соединительной ткани, воспалительные заболевания кишечника, хронический гепатит, пищевая аллергия, астма и респираторные инфекции, а также рак) [1]. Хотя интервенционные исследования не всегда подтверждают причинно-следственную связь, благодаря множеству своих плейотропных и полезных внескелетных эффектов в организме, не вызывает сомнения необходимость обеспечения адекватного уровня потребления витамина D и соответственно его оптимальной концентрации в крови. Данные о механизмах действия витамина D можно найти в многочисленных обзорах [2]. Далее будут рассмотрены данные нутрициологии, касающиеся обеспеченности витамином D разных возрастных групп детского населения в России и за рубежом, проведен сравнительный анализ величин рекомендуемого суточного потребления витамина D, принятый в разных странах, охарактеризовано содержание витамина D в натуральных и обогащенных им пищевых продуктах, а также обозначены критерии отнесения препаратов холекальциферола к биологически активным добавкам к пище и лекарственным средствам, обсуждена эффективность разных форм витамина D для коррекции дефицита.
Критерии обеспеченности организма витамином D
Показателем, отражающим обеспеченность организма витамином D, является концентрация 25(ОН)D в сыворотке крови. В качестве критериев обеспеченности используют следующие градации концентраций: менее 20 нг/мл — дефицит; 21–29 нг/мл — недостаточность, более 30 нг/мл адекватная обеспеченность организма. Содержание 25(OH)D на уровне более 50 нг/мл обеспечивает не только костные, но и внекостные функции этого витамина в организме человека. Избыточным считается уровень витамина D в крови выше 100–120 нг/мл. В то же время в Японии критерием недостаточности витамина D у детей считается уровень 25(ОН)D в сыворотке крови от 12 до 20 нг/мл, дефицит витамина D — уровень 25(OH)D в сыворотке менее 12 нг/мл [3].
Физиологическая потребность и рекомендуемое потребление витамина D
Согласно МР 2.3.1.2432-08, «норма физиологической потребности — усредненная величина необходимого поступления пищевых и биологически активных веществ, обеспечивающих оптимальную реализацию физиолого-биохимических процессов, закрепленных в генотипе человека, достаточная для удовлетворения физиологических потребностей не менее чем 97,5% населения с учетом возраста, пола, физиологического состояния и физической активности». На основании исследования физиологической потребности организма в витамине D в каждой стране устанавливают величину рекомендуемого потребления витамина для детей разного возраста и взрослых. В табл. 1 приведены величины рекомендуемого в разных странах потребления витамина D для детей.
Как следует из табл. 1, величины рекомендуемого потребления витамина D для детей в разных странах различаются. Это объясняется разными подходами к установлению этой величины, а также географическим расположением страны.
Самые низкие величины рекомендуемого потребления приняты в Австралии (координаты от 10° до 39° южной широты) [13] и Омане (от 16° до 26° северной широты), географическое расположение которых благоприятно для эндогенного синтеза витамина D [14], а также в Японии, для жителей которой характерно высокое потребление морской рыбы.
В Великобритании расчеты Научно-консультативного комитета по вопросам питания (SACN — Scientific Advisory Cоmmitee on Nutrition) рекомендуемого потребления (RNI) были основаны только на поддержании функций опорно-двигательного аппарата [7]. Как известно, поддержание нормального состояния костной ткани обеспечивается более низкими концентрациями 25(ОН)D в сыворотке крови. В качестве критерия в этой стране была использована пороговая концентрация 25(ОН)D в сыворотке крови 25 нмоль/л. Эта концентрация представляет собой «защитный уровень», т. е. величину, ниже которой повышается риск нарушения здоровья опорно-двигательного аппарата и выше которого риск, наоборот, снижается. В расчетах исходили из того, чтобы у большинства населения (97,5%) концентрация 25(OH)D в сыворотке превышала 25 нмоль/л в течение всего года. При таком подходе величина рекомендуемого потребления витамина D как для взрослых, так и детей старше 4 лет при минимальном воздействии солнечного света составила 10 мкг/сут.
В последние годы стало очевидно, что для поддержания концентрации циркулирующей формы витамина D 25-гидроксихолекальциферола (25(ОН)D) в сыворотке крови на уровне, обеспечивающем оптимальное функционирование зависящих от витамина D внекостных биохимических процессов (более 50 нмоль/л), требуется и более высокое потребление этого витамина с пищей. Это привело к тому, что в странах, в которых исходили из того, что при оптимальном статусе витамина D концентрация в сыворотке крови 25(ОН)D должна превышать 50 нмоль/л, и учитывали недостаточный вклад эндогенного синтеза витамина D в коже под действием солнечной инсоляции, были рекомендованы более высокие уровни потребления витамина D.
В соответствии с рекомендациями Института медицины США (Institute of Medicine, 2011 г.) рекомендуемое суточное потребление витамина D для детей старше 1 года составляет 600 МЕ (15 мкг/сут) [9]. Такое же потребление (15 мкг/сут) было рекомендовано Европейским агентством по безопасности продуктов Комиссии по диетическим продуктам, питанию и аллергии Комитета по продовольствию Европейского ведомства по безопасности пищевых продуктов (Committee on Food Scientific Panel on Dietetic Products, Nutrition and Allergies of European Food Safety Authority — EFSA) в 2017 г. [11].
Верхний безопасный уровень потребления для младенцев от рождения до 6 месяцев составляет 25 мкг/сут, для детей 6–12 мес — 35 мкг/сут [16].
Таким образом, в последние годы наметилась тенденция к увеличению норм рекомендуемого потребления витамина D.
Пищевые источники витамина D
Витамин D3 не содержится в пище растительного происхождения. Хорошими источниками витамина D3 в рационе россиян являются печень трески, рыба, яйца, печень, сливочное масло. Помимо холекальциферола значительный вклад в витаминную ценность мясных и молочных продуктов вносит 25-гидроксихолекальциферол (25(ОН)D), который эффективнее холекальциферола примерно в 5 раз. В грибах содержится витамин D2.
В табл. 2 приведено содержание витамина D в пищевых продуктах, которые вносят заметный вклад в потребление этого витамина. Анализ данных этой таблицы показывает, что достигнуть адекватного уровня потребления этого витамина за счет традиционных пищевых продуктов достаточно сложно.
Сохранность витамина D3, 25(OH)D3 и витамина D2 при приготовлении пищи колеблется от 40% до 88%.
Дети раннего возраста получают витамин D c грудным молоком матери или специализированными пищевыми продуктами для питания детей раннего возраста — адаптированными молочными смесями, а затем последующими смесями и продуктами прикорма на зерновой основе. Все эти продукты, предназначенные для питания детей, как правило, обогащены витамином D. В соответствии с регламентами ЕС диапазон уровней обязательного обогащения адаптированных молочных смесей и последующих смесей составляет 1,2–2,1 мкг витамина D3 на 100 г, продуктов прикорма — 0,8–2,43 мкг на 100 г [16]. Анализ литературы показывает, что использование в питании детей раннего возраста обогащенных молочных напитков и последующих смесей служит надежным источником витамина D и других микронутриентов [18].
Распространенность дефицита витамина D
Распространенность дефицита витамина D варьирует среди детей — жителей разных стран в широком диапазоне (табл. 3). Так, среди детей младше 5 лет встречаемость дефицита составила 73,1% в Афганистане, 10–12% в США и 6,2% в Испании [19]. Среди 121 обследованного ребенка в возрасте старше 1 года, проживающего в Северной Италии, 46% имели дефицит витамина D, а 9% — глубокий дефицит [20]. Дефицит витамина D отмечен более чем у 72% детей, проживающих в Китае [20]. В то же время среди 13 997 обследованных детей в возрасте до 18 лет, проживающих в Юго-Восточном Китае, дефицит и недостаточность витамина D встречалась гораздо реже — у 23,3% [21]. Из 960 обследованных детей в возрасте 6–30 месяцев в Индии дефицит витамина D имели 34,5% [22].
В 2013 г. было проведено мультицентровое, проспективное, когортное эпидемиологическое обследование обеспеченности витамином D детского населения младшей возрастной группы Российской Федерации под названием «РОДНИЧОК» [24]. Для создания репрезентативной выборки в исследование были включены дети, проживающие в городах (от 65 до 130 детей в возрасте от 0 до 3 лет), расположенных на разных географических широтах и соответственно с разным количеством солнечных дней в году (табл. 4).
Наиболее высокая частота дефицита (примерно у 2/3 обследованных) витамина D у детей была выявлена во Владивостоке, Казани, Новосибирске. Почти половина детей имела дефицит этого витамина в Ставрополе. Самая низкая частота дефицита витамина D (примерно у 1/3 обследованных) была зарегистрирована в Москве, Екатеринбурге и Архангельске. Недостаточность витамина D зарегистрирована почти у каждого третьего ребенка, проживающего в Москве, Ставрополе, Хабаровске и Санкт-Петербурге. В целом в Российской Федерации только каждый третий ребенок имел достаточный уровень витамина D в крови (> 30 нг/мл). Дефицит витамина D (< 20 нг/мл) встречался у 35,2% детей до 6 мес, у 20,4% детей до 1 года, у 45,1% детей в возрасте 2 года и у 62,1% детей в возрасте 3 года. Нормальный уровень витамина D у детей первого полугодия выявлен у 39,5%, у детей с 6 мес до 1 года — у 59,6%, у детей второго года — у 28,7% и лишь у 13,2% детей третьего года жизни. В летнее время нормальная обеспеченность витамином D отмечалась только у 44,4% детей. Полученные данные свидетельствуют о высокой частоте недостаточности и дефицита витамина D во всех регионах РФ, независимо от географического положения и уровня инсоляции.
При обследовании детей и подростков от 7 до 14 лет из Центрального и Северо-Западного регионов России (n = 790) было выяснено, что выраженный дефицит (25(OH)D — 10–20 нг/мл) имеется у 44% обследованных, умеренный дефицит (20–30 нг/мл) — у 39% обследованных, обеспечены витамином D оказались не более 10% детей [25]. Недостаточность витамина D была обнаружена у 70% из 188 детей в возрасте 6 лет, посещающих не менее 3 лет дошкольное образовательное учреждение (ДОУ) [26].
Группы риска дефицита витамина D среди детей
К группам риска дефицита витамина D относятся дети 2–3 лет при переходе на питание с общего стола, дети с пищевой непереносимостью и аллергией; дети, находящиеся на элиминационных диетах (вегетарианцы [27] и др.), дети с ожирением (редуцированные по калорийности диеты [28]), дети с заболеваниями желудочно-кишечного тракта (получающие щадящие диеты), дети, получающие лекарственную терапию, ранний пубертатный возраст (табл. 5).
Дефицит витамина D у детей с ожирением был выявлен у 92% обследованных [28]. У детей с синдромом дефицита внимания и гиперактивностью концентрация 25(OH)D в сыворотке крови была ниже, чем у здоровых детей [29]. Был сделан вывод о том, что более низкий статус витамина D в значительной степени связан с вероятностью развития этого заболевания.
Обогащенные витамином D пищевые продукты
Во многих странах было отмечено, что потребление витамина D из обычного рациона не достаточно для достижения оптимальной обеспеченности организма и должно дополняться приемом витамина D или включением в рацион обогащенных этим витамином пищевых продуктов массового потребления (спроса) или специализированных пищевых продуктов, специально предназначенных для различных категорий населения.
В табл. 6 представлены средние данные о содержании витамина D в пищевых продуктах из торговой сети некоторых европейских стран (Италия, Дания, Финляндия, Великобритания, Германия), используемых в питании детей раннего возраста.
Как следует из табл. 6, обогащение витамином D приводит к существенному увеличению потребления детьми этого витамина за счет того или иного продукта.
В Финляндии, Канаде и США жидкие молочные продукты подлежат обязательному, т. е. законодательно закрепленному, обогащению витамином D (табл. 7). В итоге 28–63% этого витамина поступает именно с этими пищевыми продуктами [37].
В США и Канаде около 60% витамина D поступает из обогащенных продуктов, в том числе за счет питьевого молока — до 44%. В Великобритании до 40% витамина D поступает из обогащенных им маргаринов и кулинарных жиров [37]. Расчеты, проведенные в Великобритании, показали, что молоко, обогащенное витамином D в дозе 2 мкг/100 г, позволит достигнуть адекватного, но не чрезмерного потребления этого витамина для большинства детей [39].
В Ирландии при анализе питания 500 детей 1–4 лет было установлено, что продукты, обогащенные витамином D (молоко, йогурты, готовые зерновые завтраки), потребляют 77% дошкольников [40].
Среди 56 детей, потребляющих только необогащенное коровье молоко (не менее 300 мл в день), процент детей с неадекватным потреблением железа (59% против 0%) и витамина D (95% против 31%) был выше по сравнению с детьми, потреблявшими коровье молоко и 100 г последующей формулы для детей младшего возраста с витаминами и минеральными веществами (n = 29) [40]. Было признано, что увеличение потребления обогащенных молочных напитков — самый простой путь, обеспечивающий соответствие потребления микронутриентов возрастной потребности детей преддошкольного и дошкольного возраста [18, 41].
В Индии было показано, что включение в течение 12 недель в питание школьников 10–14 лет обогащенного молока (200 мл в день с дозой 600 МЕ и 1000 МЕ витамина D3) привело к улучшению обеспеченности витамином D [42]. Обогащенные витамином D жидкое молоко и маргарин увеличивают его потребление у детей в возрасте 4 лет с 176 до 360 МЕ/сут (с 4,4 до 9 мкг/сут), что сопровождается повышением концентрации 25(OH)D в сыворотке крови с 55 до 65 нмоль /л. Через 6 месяцев обогащения муки для лепешек (600 МЕ/100 г) уровень 25(OH)D в плазме крови детей повысился с 12,5 нмоль/л приблизительно до 48 нмоль/л [43].
Градации доз витамина D
В России хотя и можно обнаружить в торговой сети обогащенный витаминами аналог практически любого пищевого продукта, но производство их крайне недостаточно [44]. В таких условиях для улучшения обеспеченности целесообразен дополнительный прием витамина D. В связи с эти необходимо напомнить, что витамины не являются лекарственными средствами, однако их часто назначают для устранения дефицита.
Различают физиологические и лечебные (фармакологические) дозы витаминов. Физиологические дозы — это дозы, близкие к физиологической потребности организма или рекомендуемому потреблению, их использование предназначено для предотвращения гиповитаминозов и полного обеспечения потребности организма в витаминах. Лечебные (терапевтические) дозы превышают физиологическую потребность в 10–100 раз, такие дозы, разумеется, не только быстро ликвидируют авитаминоз, но и выступают в роли фармакологических веществ, оказывая положительный эффект, особенно при некоторых патологических процессах (витаминотерапия) [45].
Зависимость многих физиологических показателей от дозы поступающего витамина имеет U-образную форму (соответственно обратная ей куполообразная зависимость от уровня витамина в крови). Это означает, что как недостаточное, так и избыточное потребление витамина имеет отрицательные последствия для здоровья. Для жирорастворимого витамина D пределы безопасного потребления не велики.
Обсуждая эффективные дозы витамина D, чрезвычайно важно помнить о существовании и верхнего допустимого уровня потребления этого жирорастворимого витамина, который не вызывает нежелательных последствий и побочных эффектов [46].
Верхний допустимый уровень потребления — наибольший уровень суточного потребления витаминов, который не представляет опасности развития неблагоприятных воздействий на показатели состояния здоровья практически у всех лиц из общей популяции. Верхний предел безопасного потребления — величина потребления пищевых веществ, которая безопасна для большинства здоровых людей и выше которой у части людей через какое-либо время могут проявляться побочные явления и симптомы токсичности. При оценке безопасности любого микронутриента, в том числе витамина, принимают во внимание все источники их поступления с рационом: пища, обогащенные пищевые продукты, биологически активные добавки (БАД) к пище и/или витаминно-минеральные комплексы [15].
Увеличенные по сравнению с 2006 г. обновленные величины безопасного уровня потребления витамина D для детей разного возраста представлены в табл. 8 [16, 11].
В свете вышесказанного следует обратить внимание, что даже в научной литературе дозы витамина D путаются. К профилактическим относят суточную дозу 1000 МЕ (25 мкг/сут) [2, 24], которая для младенцев от 0 до 6 мес рассматривается в настоящее время как допустимый верхний уровень потребления этого витамина для детей этого возраста. На наш взгляд, представляется целесообразным найти минимальную дозу витамина D, обеспечивающую максимальный положительный эффект.
Для профилактики рахита рекомендуется 400 МЕ витамина D в день для всех детей от рождения и 600 МЕ во время беременности [47]. В рандомизированных контролируемых исследованиях имеются доказательства того, что у детей, получающих по 400 мкг витамина D в день, уровень 25(OH)D в сыворотке крови может превысить 50 нмоль/л [48].
В то же время такая доза может оказаться недостаточной для детей старшего возраста. Ежедневный прием по 400 МЕ витамина D в течение 18 месяцев не позволил увеличить концентрацию 25(ОН)D в сыворотке крови китайских школьников 9–15 лет более 20 нг/мл [49]. После приема витамина D в дозе 1500 МЕ c ноября по апрель 82 итальянскими детьми, 12% из них по-прежнему имели дефицит витамина D (уровень 25(OH)D не достиг 20 н/мл или 50 нмоль/л), а 1,2% — глубокий дефицит (< 10 нг/мл или 25 нмоль/л) [20]. Хотя встречаемость недостатка витамина D была статистически значимо (в 3,8 и 7,5 раз) ниже, чем среди детей, не принимавших витамин D, достигнуть полного исчезновения дефицита витамина D не удалось. Причиной этого может быть не только недостаточность дозы витамина D, но и дефицит других витаминов, а также магния.
Витамин D. Биологически активная добавка к пище или лекарственное средство?
Витамин D в зависимости от дозы и фармакологической формы может быть официально зарегистрирован в России либо в качестве биологически активной добавки к пище, либо в качестве лекарственного средства. Рассмотрим основные отличия этих двух форм государственной регистрации.
При государственной регистрации к биологически активным добавкам к пище предъявляются очень жесткие требования и проводится контроль на соответствие требованиям ТР ТС 021/2011 «О безопасности пищевой продукции», ТР ТС 022/2011 «Пищевая продукция в части ее маркировки». Он включает проверку нормативно-технической документации на соответствие производства требованиям ISO, НАССР, проверку всех ингредиентов рецептуры (разрешенные формы витаминов и минеральных веществ, натуральность ароматизаторов, отсутствие подсластителей, отсутствие запрещенных компонентов и т. д.) на соответствие техническим регламентам ТР ТС 021/2011 «О безопасности пищевой продукции», ТР ТС 022/2011 «Пищевая продукция в части ее маркировки» и ТР ТС 029/2012 «Требования безопасности пищевых добавок, ароматизаторов и технологических вспомогательных средств», в которых регламентированы перечисленные показатели. На следующем этапе проводится обязательный контроль содержания биологически активного вещества (витамина) аналитическими официально утвержденными методами в аккредитованной на их проведение лаборатории.
Обязательным условием регистрации БАД является аналитическое определение и соответствие показателей безопасности, а именно микробиологической чистоты, содержания токсичных элементов, хлорорганических пестицидов, полихлорированных бифенилов, показателей окислительной порчи (кислотное, перекисное число), требованиям ТР ТС 021/2011 «О безопасности пищевой продукции». Достоверная информация о биологически активных добавках, прошедших государственную регистрацию и разрешенных к ввозу и обороту на территории Российской Федерации, а также сведения об их гигиенической характеристике, области применения, дозировке и способе применения, противопоказаниях к применению размещена в Интернете на официальном сайте Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека (Роспотребнадзор) — http://fp.crc.ru/.
Согласно «Единым санитарно-эпидемиологическим и гигиеническим требованиям к товарам, подлежащим санитарно-эпидемиологическому надзору (контролю)» Таможенного Союза ЕврАзЭС, «суточная доза БАД к пище для детей старше 3 лет не должна превышать (в % от суточной физиологической потребности в указанных веществах, установленной национальным законодательством государств — членов Таможенного Союза): для витамина D — 100%», «для детей от 1,5 до 3 лет не должна превышать 50% от суточной физиологической потребности, установленной национальным законодательством государств — членов Таможенного Союза».
В этом состоит одно из принципиальных отличий БАД от лекарственного средства, содержание витамина D в котором может существенно превышать физиологическую потребность ребенка в этом витамине. В качестве примера приведем состав и дозы некоторых распространенных форм витамина D (табл. 9). Данные взяты из Реестра свидетельств о государственной регистрации и инструкций по применению. Вигантол и капли Детримакс Бэби и Детримакс Актив одинаковы по своему композиционному составу, витамин D в том и в другом случае растворен в триглицеридах среднецепочных жирных кислот, однако доза холекальциферола в Вигантоле столь высока, что не позволяет зарегистрировать его в качестве БАД к пище. Масляные растворы витамина D Д-Сан и Детримакс универсальны по дозе и композиционному составу и пригодны как для взрослых, так и детей. Аквадетрим содержит несколько пищевых добавок (имеющих индекс Е), что обеспечивает перевод витамина D в мицеллярную форму, и консервант бензиловый спирт, который входит в Перечень пищевых добавок, разрешенных для применения при производстве пищевой продукции (Приложение 2 к техническому регламенту «Требования безопасности пищевых добавок, ароматизаторов и технологических вспомогательных средств» (ТР ТС 029/2012)), но не входит в список разрешенных при производстве пищевой продукции для детей. К тому же 1 капля содержит 500 МЕ холекальциферола, что превышает разрешенную в составе БАД дозу для детей. Таким образом, этот раствор витамина D мог быть зарегистрирован только в качестве лекарственного средства.
Жевательные таблетки VITime® KidZoo Витамин D3 по содержанию витамина и составу предназначены специально для детей старше 3 лет. Жевательные таблетки Д-Сан в связи с наличием в их составе подсластителей ксилита и сорбита предназначены только для взрослых.
Факторы, влияющие на обеспеченность организма витамином D и эффективность дополнительного приема холекальциферола
Всасывание витамина D происходит в тонком кишечнике. В среднем абсорбируется примерно 78% (55–99%) перорально поступившего витамина. Процесс всасывания более эффективен при наличии в просвете тонкой кишки солей желчных кислот и жира.
Эффективность усвоения будет зависеть от состояния организма (наличие или отсутствие патологий желудочно-кишечного тракта, избыточная масса тела, обеспеченность другими микронутриентами) и используемой формы витамина D. При ожирении эффективность применения витамина D3 снижается [50].
Высказывается предположение, что линолевая и линоленовая кислоты могут увеличивать растворимость витамина D в мицеллах, что в свою очередь может увеличивать размер мицелл, и, как следствие, витамин D может дольше оставаться в мицеллах, что отрицательно сказывается на всасывании [50].
Действительно, недавно в сравнительных исследованиях эффективности микрокапсулированной, мицеллярной и масляной форм витамина D, проведенных на лабораторных крысах, было обнаружено, что микрокапсулированная и масляная формы витамина D3 обладают лучшей биодоступностью по сравнению с мицеллярным витамином D3 [51]. У здоровых взрослых витамин D в масляном растворе оказывал больший эффект на повышение уровня 25(OH)D, чем витамин D в порошке или растворенный в этаноле [52].
Эффективность витамина D зависит от его дозы и продолжительности приема (эффект проявляется через 3–6 месяцев). При физиологических дозах витамина зависимость скорости гидроксилирования витамина D3 в печени представляет собой кривую насыщения. Т. е. в диапазоне физиологических доз витамина D3 происходит постепенное повышение уровня 25(ОН)D, затем при дальнейшем повышении дозы холекальциферола концентрация витамина D в сыворотке увеличивается и реакция переключается с первого порядка на нулевой порядок, а избыток витамина D накапливается в жировой ткани в виде нативного соединения, откуда медленно высвобождается [53].
В образовании как транспортной, так и гормональных форм витамина D существенная роль принадлежит витаминам С, В2 и другим витаминам [54, 55], а также магнию, которые необходимы для гидроксилирования исходной молекулы витамина D [56, 57]. При недостаточной обеспеченности организма этими микронутриентами снижается синтез транспортной и гормональной форм витамина D, что уменьшает эффективность выполнения витамином D своих физиологических функций. Дефицит витамина В2 у крыс приводил к снижению концентрации в сыворотке крови 25(OH)D. Дефицит витамина С у морских свинок усиливал глубину алиментарного недостатка витамина D. Дефицит витаминов С, В2, В6 затруднял восстановление обеспеченности организма витамином D [55].
Применение поливитаминного комплекса (в виде сухого напитка), разовая порция которого содержит 10 мкг (400 ME) витамина D3 и комплекс витаминов (А, С, Е, К, В1, В2, В6, В12, никотинамид, пантотенат, фолацин, биотин), у больных с сердечно-сосудистой патологией в течение 1 месяца обеспечило такой же прирост биомаркера D-витаминного статуса, как и применение водорастворимого витамина D в суточной дозе, равной 1000 ME [58].
Подводя итоги, следует отметить, что эффективность дополнительного приема витамина D зависит от многих перечисленных и часто разнонаправленных факторов, некоторые из которых упомянуты выше, но в любом случае обогащение рациона этим витамином принесет несомненную пользу для здоровья ребенка. Однако, к сожалению, не только в России, но и в других странах (например, в Великобритании) только около четверти опрошенных родителей дают своему ребенку витаминно-минеральные комплексы или витамин D [44, 59].
Заключение
Для детского населения России в силу географического положения и недостаточного потребления рыбы характерна неудовлетворительная обеспеченность витамином D. В связи с отсутствием программ обязательного обогащения пищевых продуктов (молоко) витамином D и недостаточным объемом их производства для устранения или профилактики гиповитаминоза D необходим его круглогодичный прием в дозе, близкой к физиологической потребности. Дозы витамина D должны быть адекватными для поддержания витаминного статуса организма на оптимальном уровне, но не чрезмерно высокими. При выборе витамина D необходимо ориентироваться на дозу и композиционный состав, а также форму добавки, соответствующую возрастным потребностям и приемлемую для потребления детьми. Длительный срок применения витаминов служит надежной профилактикой заболеваний, приводит к снижению заболеваемости, сокращению продолжительности болезни, повышению физической и умственной работоспособности.
Литература
- Marino R., Misra M. Extra-Skeletal Effects of Vitamin D // Nutrients. 2019; 11 (7). Pii: E1460. Doi: 10.3390/nu11071460.
- Пигарова Е. А., Поваляева А. А., Дзеранова Л. К., Рожинская Л. Я. Роль витамина D для профилактики и лечения рахита у детей // Consilium Medicum. Педиатрия. (Прил.). 2019; 03: 40–45.
- Michigami T. Rickets/Osteomalacia. Consensus on Vitamin D Deficiency and Insufficiency in Children // Clin Calcium. 2018; 28 (10): 1307–1311. DOI: CliCa181013071311.
- Nutrient Reference Values for Australia and New Zealand Including Recommended Dietary Intakes 2006. Version 1.2, Updated September 2017.
- Food Based Dietary Guidelines Technical background and description Task force for the development and implementation of the Omani Food Based Dietary Guidelines. 2008. https://www.semanticscholar.org/paper/Food-Based-Dietary-Guidelines-Technical-background-Alasfoor-Rajab/ed3ca440d8a081e98ee0a17e98a4a654fa75bd29 (дата обращения 11.12.2019).
- Overview of Dietary Reference Intakes for Japanese. 2015. https://www.mhlw.go.jp/file/06-Seisakujouhou-10900000-Kenkoukyoku/Overview.pdf (дата обращения 11.12.2019).
- Draft Vitamin D and Health report Scientific consultation: 22 July to 23 September 2015. https://www.gov.uk/government/consultations/consultation-on-draft-sacn-vitamin-d-and-health-report (дата обращения 11.12.2019).
- German N. S. New reference values for vitamin D // Annals of nutrition & metabolism, 2012, 60 (4), 241-246.
- Dietary Reference Intakes (DRIs): Recommended Dietary Allowances and Adequate Intakes, Vitam http ins Food and Nutrition Board, Institute of Medicine, National Academies, 2015 http://nationalacademies.org/hmd/~/media/Files/Report%20Files/2019/DRI-Tables-2019/2_RDAAIVVE.pdf?la=en (дата обращения 11.12.2019).
- Nordic Nutrition Recommendations 2012. Integrating nutrition and physical activity ISBN 978–92–893–2670–4. http://dx.doi.org/10.6027/Nord2014-002. ISSN 0903–7004. Nordic Council of Ministers. 2014. Layout and ebook production: Narayana Press.
- EFSA (European Food Safety Authority), 2017. Dietary reference values for nutrients: Summary report. EFSA supporting publication. 2017: e15121. 92 p. DOI: 10.2903/sp.efsa.2017.e15121.
- Dietary reference values for vitamin D // EFSA Journal. 2016; 14 (10): 4547. DOI: 10.2903/j.efsa.2016.4547.
- Di Marco N., Kaufman J., Rodda C. P. Shedding light on vitamin d status and its complexities during pregnancy, infancy and childhood: An australian perspective // International journal of environmental research and public health. 2019. 16 (4), 538.
- Dietary Reference Intakes for Calcium and Vitamin D Institute of Medicine (US) Committee to Review Dietary Reference Intakes for Vitamin D and Calcium. In: A. C. Ross, C. L. Taylor, A. L. Yaktine, H. B. Del Valle (eds). Washington, DC: National Academies Press, 2011. URL: https://www.ncbi.nlm.nih.gov/books/NBK56070/.
- Vitamin and mineral supplements: a risk management model // ERNA. 2004. 25 p. http://www.erna.org/sites/0009/uploads/content/publications/vitamin-and-mineral-supplements.pdf.
- Update of the tolerable upper intake level for vitamin D for infants // EFSA Journal. 2018; 16 (8): 5365. https://doi.org/10.2903/j.efsa.2018.5365 http://onlinelibrary.wiley.com/doi/10.2903/sp.efsa.2018.EN-1456/full.
- Коденцова В. М., Мендель О. И., Хотимченко С. А., Батурин А. К., Никитюк Д. Б., Тутельян В. А. Физиологическая потребность и эффективные дозы витамина D для коррекции его дефицита. Современное состояние проблемы // Вопр. питания. 2017. Т. 86. № 2. С. 47–62. 10.24411/0042-8833-2017-00067.
- Коденцова В. М. Обогащенные молочные напитки для коррекции витаминной недостаточности у детей преддошкольного и дошкольного возраста // Вопросы современной педиатрии. 2017; 16 (2): 118–125. DOI: 10.15690/vsp.v16i2.1712.
- Yakoob M. Y., Salam R. A., Khan F. R., Bhutta Z. A. Vitamin D supplementation for preventing infections in children under five years of age // Cochrane Database Syst Rev. 2016, Nov; 2016 (11): CD008824. DOI: 10.1002/14651858.CD008824.
- Mazzoleni S., Magni G., Toderini D. Effect of vitamin D3 seasonal supplementation with 1500 IU/day in north Italian children (DINOS study) // Ital J Pediatr. 2019, 28; 45 (1): 18. DOI: 10.1186/s13052-018-0590-x.
- Wang S., Shen G., Jiang S., Xu H., Li M., Wang Z., Yu Y. Nutrient status of vitamin D among Chinese children // Nutrients. 2017. 9 (4), 319.
- Abdullah Al-Taiar, Abdur Rahman, Reem Al-Sabah, Lemia Shaban, Anwar Al-Harbi. Vitamin D status among adolescents in Kuwait: a cross-sectional study // BMJ Open. 2018; 8 (7): e021401. DOI: 10.1136/bmjopen-2017-021401.
- Chowdhury R., Taneja S., Bhandari N., Sinha, Upadhyay R. P., Bhan M. K., Strand T. A Vitamin D deficiency predicts infections in young north Indian children: A secondary data analysis // PLoS One. 2017; 12 (3): e0170509. DOI: 10.1371/journal.pone.0170509.
- Национальная программа «Недостаточность витамина D у детей и подростков Российской Федерации: современные подходы к коррекции». Союз педиатров России и др. М.: ПедиатрЪ, 2018. 96 с.
- Торшин И. Ю., О. А. Громова О. А., Лиманова О. и др. Роль обеспеченности микронутриентами в поддержании здоровья детей и подростков: анализ крупномасштабной выборки пациентов посредством интеллектуального анализа данных // Педиатрия. Журнал им. Г. Н. Сперанского. 2015. Т. 94, № 6. С. 68–78.
- Ямбулатов А. М., Устинова О. Ю. Развитие гиповитаминозов у детей дошкольного возраста, подвергающихся комплексному воздействию химических факторов промышленного происхождения // Вестник Пермского университета. Серия: Биология. 2017. № 1. С. 118–126.
- Ясаков Д. С., Макарова С. Г., Коденцова В. М. Пищевой статус и здоровье вегетарианцев: что известно из научных исследований последних лет? // Педиатрия. Журнал имени Г. Н. Сперанского. 2019; 98 (4): 221–228. DOI: 10.24110/0031-403X-2019-98-4-221-228.
- Павловская Е. В., Строкова Т. В., Сурков А. Г., Багаева М. Э., Коденцова В. М., Сокольников А. А. Обеспеченность витамином D детей с ожирением // Вопросы детской диетологии. 2018; 16 (5): 16–22. DOI: 10.20953/1727-5784-2018-5-16-22.
- Khoshbakht Y., Bidaki R., Salehi-Abargouei A. Vitamin D status and attention deficit hyperactivity disorder: A systematic review and meta-analysis of observational studies // Adv Nutr. 2018; 9 (1): 9–20. DOI: 10.1093/advances/nmx002.
- Venturini E., Facchini L., Martinez-Alier N., Novelli V., Galli L., de Martino M., corresponding author and Chiappini E. Vitamin D and tuberculosis: a multicenter study in children// BMC Infect Dis. 2014; 14: 652. DOI: 10.1186/s12879-014-0652-7.
- Gou X., Pan L., Tang F., Gao H., Xiao D. The association between vitamin D status and tuberculosis in children: A meta-analysis // Medicine (Baltimore). 2018; 97 (35): e12179. DOI: 10.1097/MD.0000000000012179.
- Buonsenso D., Sali M., Pata D., Masiello E., Salerno G., Ceccarelli M., Delogu G., Valentini P. Vitamin D levels in active TB, latent TB, non-TB pneumonia and healthy children: a prospective observational study // Fetal Pediatr Pathol. 2018, 37 (5): 337–347. DOI: 10.1080/15513815.2018.1509407.
- Pappa H. M., Mitchell P. D., Jiang H., Kassiff S., Filip-Dhima R., DiFabio D., Quinn N., Lawton R. C., Varvaris M., van Straaten S., Gordon C. M. Treatment of vitamin D Insufficiency in children and adolescents with inflammatory bowel disease: a randomized clinical trial comparing three regimens // J Clin Endocrinol Metab. 2012, Jun; 97 (6): 2134–214. DOI: 10.1210/jc.2011–3182.
- Громова О. А., Торшин И. Ю., Пронин А. В. Особенности фармакологии водорастворимой формы витамина D на основе мицелл // Фарматека. 2015. № 1 (294). С. 28–35. https:// pharmateca.ru/ru/archive/article/30707.
- Мальцев С. В., Мансурова Г. Ш. Метаболизм витамина D и пути реализации его основных свойств // Практическая медицина. Педиатрия. 2014, № 9. http://mfvt.ru/metabolizm-vitamina-d-i-puti-realizacii-ego-osnovnyx-funkcij/.
- Chau Y.-Y., Kumar J. Vitamin D in Chronic Kidney Disease Indian // J Pediatr. 2012 Aug; 79 (8): 1062–1068. DOI: 10.1007/s12098-012-0765-1.
- Itkonen S. T., Erkkola M., Lamberg-Allardt C. J. Vitamin D fortification of fluid milk products and their contribution to vitamin D intake and vitamin D status in observational studies — A review // Nutrients. 2018. 10 (8), 1054. DOI: 10.3390/nu10081054.
- Коденцова В. М., Саркисян В. А., Воробьева В. М., Воробьева И. С., Кочеткова А. А., Рисник Д. В. Обогащение пищевых продуктов витамином D: международный опыт и новые тенденции // Пищевая промышленность. 2019. № 9. С. 70–74.
- Cribb V. L., Northstone K., Hopkins D., Emmett P. M. Sources of vitamin D and calcium in the diets of preschool children in the UK and the theoretical effect of food fortification // J Hum Nutr Diet. 2015; 28 (6): 583–592. DOI: 10.1111/jhn.12277.
- Hennessy Á., Browne F., Kiely M., Walton J., Flynn A. The role of fortified foods and nutritional supplements in increasing vitamin D intake in Irish preschool children // European journal of nutrition. 2017. 56 (3), 1219-1231. DOI: 10.1007/s00394-016-1171-7.
- Vieux F., Brouzes C. M., Maillot M., Briend A., Hankard R., Lluch A., Darmon N. Role of Young Child Formulae and Supplements to Ensure Nutritional Adequacy in U.K. Young Children // Nutrients. 2016; 8 (9). Pii: E539. DOI: 10.3390/nu8090539.
- Khadgawat R., Marwaha R. K., Garg M. K., Ramot R., Oberoi A. K., Sreenivas V., Gahlot M., Mehan N., Mathur P., Gupta N. Impact of vitamin D fortified milk supplementation on vitamin D status of healthy school children aged 10–14 years // Osteoporos Int. 2013; 24 (8): 2335–2343. DOI: 10.1007/s00198-013-2306-9.
- Munns C. F., Shaw N., Kiely M., Specker B. L., Thacher T. D., Ozono K., Ramos-Abad L Global consensus recommendations on prevention and management of nutritional rickets // Hormone research in paediatrics. 2016; 85 (2), 83-106. DOI: 10.1210/jc.2015–2175.
- Коденцова В. М., Вржесинская О. А., Рисник Д. В., Никитюк Д. Б., Тутельян В. А. Обеспеченность населения России микронутриентами и возможности ее коррекции. Состояние проблемы // Вопр. питания. 2017. Т. 86. № 4. С. 113–124. DOI: 10.24411/0042-8833-2017-00067.
- Коденцова В. М., Вржесинская О. А. Научно обоснованные подходы к выбору и дозированию витаминно-минеральных комплексов // Традиционная медицина. 2011. № 5. С. 351-357.
- Коденцова В. М. Градации уровней потребления витаминов: возможные риски при чрезмерном потреблении // Вопр. питания. 2014. Т. 83, № 3. С. 41–51.
- Uday S., Högler W. Nutritional rickets and osteomalacia in the twenty-first century: revised concepts, public health, and prevention strategies // Curr Osteoporos Rep. 2017; 15 (4): 293-302. DOI: 10.1007/s11914-017-0383-y.
- Shaw N. J. Prevention and treatment of nutritional rickets // J Steroid Biochem Mol Biol. 2016; 164: 145-147. DOI: 10.1016/j.jsbmb.2015.10.014.
- Zhang R., Muyiduli X., Su D., Zhou B., Fang Y., Jiang S., Wang S., Huang L., Mo M., Li M., Shao B., Yu Y. Effect of low-dose vitamin D supplementation on serum 25(OH)D in school children and white-collar workers // Nutrients. 2017; 9 (5): 505. DOI: 10.3390/nu9050505.
- Mazahery H., von Hurst P. R. Factors Affecting 25-Hydroxyvitamin D Concentration in Response to Vitamin D Supplementation // Nutrients. 2015; 7 (7): 5111–5142.
- Šimoliunas E., Rinkunaite I., Bukelskiene Z. , Bukelskiene V. Bioavailability of Different Vitamin D Oral Supplements in Laboratory Animal Model // Medicina (Kaunas). 2019; 55 (6): 265. DOI: 10.3390/medicina55060265.
- Grossmann R. E., Tangpricha V. Evaluation of vehicle substances on vitamin D bioavailability: a systematic review // Molecular nutrition & food research. 2010. 54 (8), 1055-1061. DOI: 10.1002/mnfr.200900578.
- Heaney R. P., Armas L. A., Shary J. R., Bell N. H., Binkley N., Hollis B. W. 25-Hydroxylation of vitamin D3: relation to circulating vitamin D3 under various input conditions // Am J Clin Nutr. 2008; 87 (6): 1738-1742.
- Спиричев В. Б., Громова О. А. Витамин D и его синергисты // Земский врач. 2012. № 2. С. 33–38.
- Коденцова В. М., Вржесинская О. А. Влияние дефицита витаминов на обеcпеченность организма витамином D // Вопросы биологической, медицинской и фармацевтической химии. 2018; 21 (7): 42−46. https://doi.org/10.29296/25877313-2018-07-07.
- Rosanoff A., Dai Qi, Shapses S. A. Essential Nutrient Interactions: Does low or suboptimal magnesium status interact with vitamin D and/or calcium status? // Adv Nutr. 2016. Vol. 7, № 1. P. 25–43. DOI: 10.3945/an.115.008631.
- Dai Q., Zhu X., Manson J. E., Song Y., Li X., Franke A. A., Costello R. B., Rosanoff A., Nian H., Fan L., Murff H., Ness R. M., Seidner D. L., Yu C., Shrubsole M. J. Magnesium status and supplementation influence vitamin D status and metabolism: results from a randomized trial // Am J Clin Nutr. 2018, 1; 108 (6): 1249-1258. DOI: 10.1093/ajcn/nqy27.
- Кучер А. С., Мойсеенок Е. А., Морголь А. С., Янковская Л. В., Шатнюк Л. Н., Спиричев В. Б., Мойсеенок А. Г. Комплекс витаминов группы В потенцирует биодоступность холекальциферола у пациентов с хронической сердечной недостаточностью // Вопросы питания. 2016. 85 (S2): 104.
- Day R. E., Krishnarao R., Sahota P., M. S. Christian M. S. We still don’t know that our children need vitamin D daily: a study of parents’ understanding of vitamin D requirements in children aged 0-2 years // BMC Public Health. 2019; 19: 1119. DOI: 10.1186/s12889-019-7340-x.
В. М. Коденцова*, 1, доктор биологических наук, профессор
Д. В. Рисник**, кандидат биологических наук
* ФГБУН ФИЦ питания и биотехнологии, Москва
** ФГБОУ ВО МГУ им. М. В. Ломоносова, Москва
Контактная информация: kodentsova@ion.ru
DOI: 10.26295/OS.2020.95.40.007
Обеспеченность детей витамином D. Сравнительный анализ способов коррекции/ В. М. Коденцова, Д. В. Рисник
Для цитирования: Лечащий врач № 2/2020; Номера страниц в выпуске: 35-43
Теги: питание, микронутриенты, дефицит внимания, гиперактивность