1
Первый слайд презентации: Поставка незамерзающей контактирующей жидкости для рельсовой дефектоскопии
По итогам аукциона к заключению договора на право поставки незамерзающей контактирующей жидкости для рельсовой дефектоскопии для ОАО «РЖД» победителем объявлена компания ООО «АХП» (г. Новосибирск) с незамерзающей контактирующей жидкостью НКЖ «СИБИРЬ»
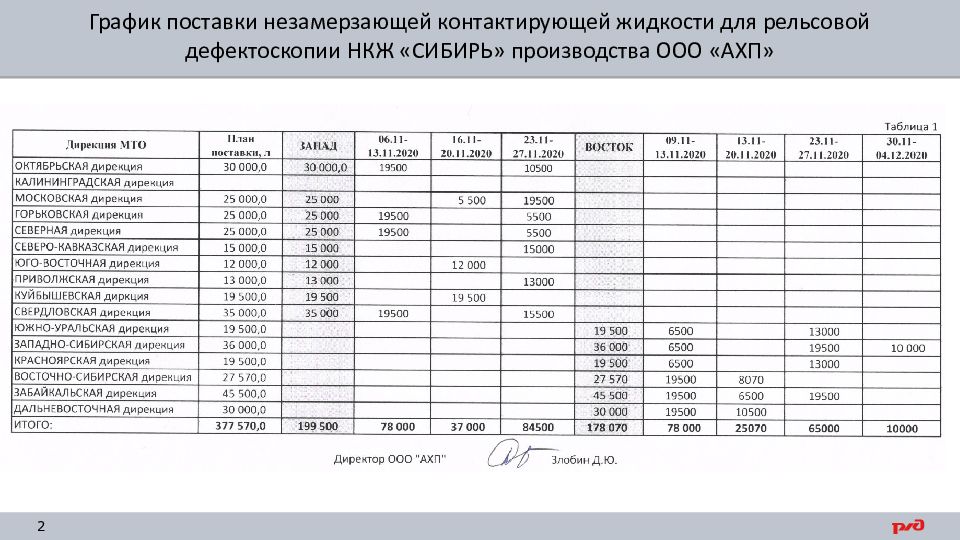
Разнарядка на отгрузку 377 570 л направлена производителю НКЖ
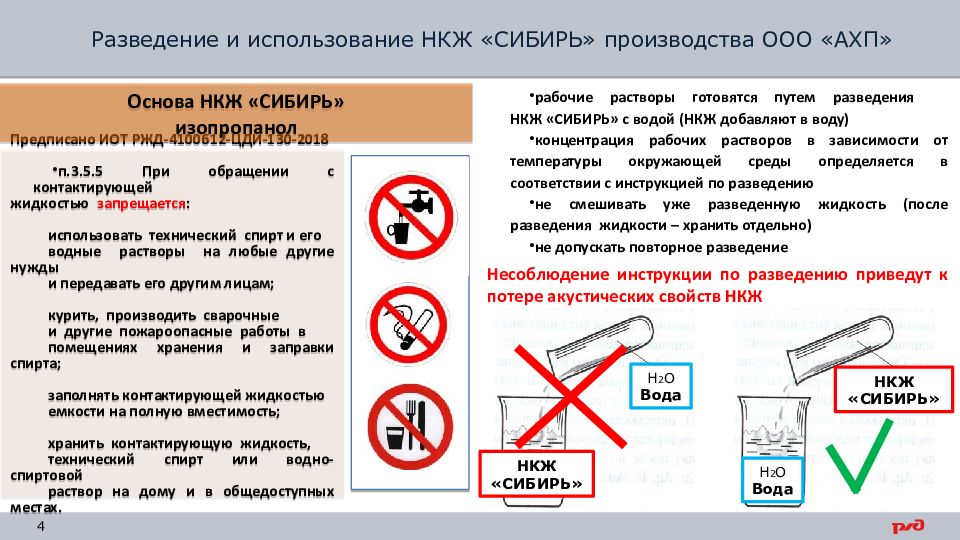
Основа НКЖ «СИБИРЬ» — изопропанол (80%)
15-20 ноября 2020 г. первая партия НКЖ «СИБИРЬ» поступит в дирекции инфраструктуры
Приоритет отгрузки: ДВОСТ, ЗАБ, В-СИБ, КРАС, З-СИБ, Ю-УР, СВЕРД, ГОРЬК и ОКТ ДИ
Изображение слайда
График поставки незамерзающей контактирующей жидкости для рельсовой дефектоскопии НКЖ «СИБИРЬ» производства ООО «АХП»
Изображение слайда
3
Слайд 3: О допуске к применению незамерзающей контактирующей жидкости НКЖ «СИБИРЬ» производства ООО «АХП»
Допуск жидкости НКЖ «СИБИРЬ» производства ООО «АХП» Согласован:
Департаментом безопасности
Департаментом технической политики
Центральной дирекцией инфраструктуры
Управлением пути и сооружений
Дирекцией диагностики и мониторинга инфраструктуры
АО «ВНИИЖТ»
Проектно-конструкторским бюро по инфраструктуре
НКЖ «СИБИРЬ» производства ООО «АХП» прошла испытания в АО «ВНИИЖТ» по утвержденной Департаментом технической политики методике приемочных (квалификационных) испытаний
Изображение слайда
4
Последний слайд презентации: Поставка незамерзающей контактирующей жидкости для рельсовой дефектоскопии: Разведение и использование НКЖ «СИБИРЬ» производства ООО «АХП»
Предписано ИОТ РЖД-4100612-ЦДИ-130-2018
п.3.5.5 При обращении с контактирующей
жидкостью запрещается :
использовать технический спирт и его
водные растворы на любые другие нужды
и передавать его другим лицам;
курить, производить сварочные
и другие пожароопасные работы в
помещениях хранения и заправки спирта;
заполнять контактирующей жидкостью
емкости на полную вместимость;
хранить контактирующую жидкость,
технический спирт или водно-спиртовой
раствор на дому и в общедоступных местах.
Основа НКЖ «СИБИРЬ»
изопропанол
рабочие растворы готовятся путем разведения НКЖ «СИБИРЬ» с водой (НКЖ добавляют в воду)
концентрация рабочих растворов в зависимости от температуры окружающей среды определяется в соответствии с инструкцией по разведению
не смешивать уже разведенную жидкость (после разведения жидкости – хранить отдельно)
не допускать повторное разведение
Несоблюдение инструкции по разведению приведут к потере акустических свойств НКЖ
НКЖ
«СИБИРЬ»
H 2 O
Вода
НКЖ
«СИБИРЬ»
H 2 O
Вода
Изображение слайда
Контактная жидкость для дефектоскопии НКЖ
Контактная жидкость для дефектоскопии НКЖ
Предназначена для обеспечения акустического контакта при ультразвуковом неразрушающем контроле рельсов, стрелочных переводов и сварных стыков съемными средствами дефектоскопии при отрицательной температуре атмосферного воздуха.
Обеспечивает превосходный акустический контакт и имеет экстремально низкую температуру застывания (–60°С). Полностью заменяет собой этиловый спирт.
| Продукт | Контактная жидкость для дефектоскопии НКЖ |
|---|---|
| Температура начала кристаллизации, °С, не выше | -60 |
| Температура вспышки, определяемая в закрытом тигле, °С | 45 |
| Температура воспламенения, °С | 23 |
| Температура самовоспламенения, °С | 458 |
| Плотность при температуре +20°С, кг/м3, не более | 780 |
| Коэффициент трения скольжения на рельсе после нанесения НКЖ | 0,18 |
| Разница между значениями условной чувствительности по СО-ЗР, определяемой при применении НКЖ и этилового спирта при температуре атмосферного воздуха не выше -15°С, дБ | 2 |
| Коррозийная устойчивость металлов и сплавов к воздействию НКЖ (сталь — 10, латунь — Л63, алюминиевый сплав — АМг5) | Выдерживает |
Виды транспортировки
Описание препарата Сибри® Бризхалер® (капсулы с порошком для ингаляций, 50 мкг) основано на официальной инструкции, утверждено компанией-производителем в 2018 году
Дата согласования: 19.02.2018
Особые отметки:
Содержание
- Фотографии упаковок
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Фотографии упаковок
19.02.2018
Действующее вещество
ATX
Фармакологическая группа
Состав
| Капсулы с порошком для ингаляций | 1 капс. |
| активное вещество: | |
| гликопиррония основание | 50 мкг |
| (эквивалентно 63 мкг гликопиррония бромида) | |
| вспомогательные вещества: лактозы моногидрат — 24,9 мг; магния стеарат — 0,037 мг | |
| оболочка: гипромеллоза — 45,59 мг; вода — 2,7 мг; каррагинан — 0,42 мг; натрия хлорид — 0,18 мг; краситель «Солнечный закат» желтый (Е110) — 0,12 мг | |
| чернила черные: шеллак; краситель железа оксид черный; пропиленгликоль; натрия гидроксид |
Описание лекарственной формы
Твердые капсулы № 3 с прозрачными крышечкой и корпусом оранжевого цвета, с маркировкой ? под черной полосой на крышечке и надписью «GPL50» черными чернилами над черной полосой на корпусе.
Содержимое капсул: порошок белого или почти белого цвета.
Фармакологическое действие
Фармакологическое действие
—
м-холинолитическое, бронходилатирующее.
Фармакодинамика
Препарат Сибри® Бризхалер® — ингаляционный длительно действующий препарат. Гликопиррония бромид — м-холиноблокатор, механизм действия которого основан на блокировании бронхоконстрикторного действия ацетилхолина на гладкомышечные клетки дыхательных путей, что приводит к бронходилатирующему эффекту. В организме человека выявлено 5 подтипов мускариновых рецепторов (М1–5). Известно, что только подтипы М1–3 задействованы в физиологической функции дыхательной системы. Гликопиррония бромид, являясь антагонистом мускариновых рецепторов, обладает высоким сродством именно к рецепторам подтипов М1–3. При этом гликопиррония бромид обладает в 4–5 раз большей селективностью в отношении М1— и М3-подтипов рецепторов, по сравнению с М2-подтипом рецепторов. Это приводит к быстрому возникновению терапевтического эффекта после ингаляции препарата, что подтверждено клиническими исследованиями. Продолжительность действия препарата после ингаляции обусловлена длительным поддержанием терапевтической концентрации препарата в легких, что подтверждается более длительным T1/2 препарата после ингаляционного применения по сравнению с в/в введением. В многочисленных клинических исследованиях было показано, что на фоне применения гликопиррония бромида у пациентов с ХОБЛ существенно улучшается легочная функция (оценка проводилась с помощью измерения ОФВ за 1 мин (ОФВ1): терапевтический эффект возникает в течение первых 5 мин после ингаляции, со значимым повышением ОФВ1 от исходных показателей в пределах 0,091 до 0,094 л, бронходилатирующий эффект гликопиррония бромида после ингаляции сохраняется более 24 ч. По данным клинических исследований, отсутствуют свидетельства развития тахифилаксии к бронходилатирующему эффекту препарата на фоне регулярного применения вплоть до 52 нед.
Не наблюдалось изменений ЧСС и продолжительности интервала QTс на фоне применения препарата Сибри® Бризхалер® в дозе 200 мкг у пациентов с ХОБЛ.
Фармакокинетика
Абсорбция. После ингаляции гликопиррония бромид быстро абсорбируется в системный кровоток и достигает Cmax в плазме крови через 5 мин. Абсолютная биодоступность гликопиррония бромида после ингаляционного применения примерно 40%. Около 90% системной экспозиции гликопиррония бромида приходится на абсорбцию в легких и 10% — на абсорбцию в ЖКТ. Абсолютная биодоступность после перорального применения глиропиррония бромида оценивается в 5%. На фоне регулярных ингаляций (1 раз в день) равновесное состояние гликопиррония бромида достигается в течение 1 нед. Cmax гликопиррония бромида в равновесном состоянии (ингаляция 50 мкг 1 раз в день) и концентрация гликопиррония бромида в плазме крови непосредственно перед приемом следующей дозы равны 166 и 8 пг/мл соответственно. Экскреция с мочой в равновесном состоянии по сравнению с первым введением позволяет предположить, что системная кумуляция не зависит от дозы в диапазоне доз 25–200 мкг.
Распределение. После в/в введения Vss гликопиррония бромида составил 83 л и Vd в терминальной фазе (Vz) — 376 л. Кажущийся Vz после ингаляции (Vz/F) составил 7310 л, что отражает более медленное выведение препарата после ингаляции. In vitro связь гликопиррония бромида с белками плазмы крови человека составила 38–41% при концентрации 1–10 нг/мл. Эти концентрации как минимум в 6 раз выше, чем таковые в равновесном состоянии, достигаемые в плазме на фоне применения препарата в дозе 50 мкг 1 раз в день.
Метаболизм. Было отмечено, что гидроксилирование гликопиррония бромида приводит к образованию различных моно- и бис-гидроксилированных метаболитов, а прямой гидролиз приводит к образованию производных карбоновой кислоты (M9). Исследования in vitro показали, что изоферменты CYP вносят свой вклад в окислительную биотрансформацию гликопиррония бромида. Гидролиз до M9, по-видимому, катализируется ферментами семейства холинэстераз. Так как исследования in vitro не выявили метаболизма действующего вещества в легких и М9 вносит незначительный вклад в циркуляцию (4% от Cmax и AUC гликопиррония бромида) после в/в введения, предполагается, что М9 образуется из абсорбируемой из ЖКТ (после ингаляции) фракции действующего вещества путем пресистемного гидролиза и/или при первичном прохождении через печень. После ингаляции или в/в введения только минимальное количество М9 было обнаружено в моче (≤0,5% введенной дозы). Глюкуроновые конъюгаты и/или сульфаты гликопиррония бромида были обнаружены в моче человека после повторных ингаляций в количестве приблизительно 3% от дозы. Исследования ингибирования in vitro продемонстрировали, что гликопиррония бромид не принимал значимое участие в ингибировании изоферментов CYP1A2, CYP2A6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 или CYP3A4/5, транспортеров MDR1, MRP2 или MXR и транспортеров OATP1B1, OATP1B3, OAT1, OAT3, OCT1 или OCT2. Исследования индукции ферментов in vitro не выявили значимую индукцию гликопиррония бромидом какого-либо из протестированных изоферментов цитохрома P450, а также в отношении UGT1A1 и транспортеров MDR1 и MRP2.
Выведение. Выведение гликопиррония бромида почками достигает 60–70% от общего плазменного клиренса, 30–40% выводится другими путями — с желчью или за счет метаболизма. После однократной и повторных ингаляций гликопиррония бромида в диапазоне от 50 до 200 мкг 1 раз в день здоровым добровольцам и пациентам с ХОБЛ средний почечный клиренс находился в пределах 17,4–24,4 л/ч. Активная тубулярная секреция вносит свой вклад в выведение почками гликопиррония бромида. До 20% от принятой дозы обнаруживается в моче в неизмененном виде. Плазменная концентрация гликопиррония бромида снижается многофазно. Средний конечный T1/2 более продолжителен после ингаляционного пути введения (33–57 ч), чем после в/в введения (6,2 ч) и перорального применения (2,8 ч). Характер элиминации позволяет предположить длительную абсорбцию в легких и/или проникновение гликопиррония бромида в системный кровоток во время и после 24 ч после ингаляции. У пациентов с ХОБЛ системная экспозиция, а также общая экскреция с мочой гликопиррония бромида в равновесном состоянии повышалась пропорционально дозе в диапазоне от 50 до 200 мкг.
Особые группы пациентов
Популяционный фармакокинетический анализ данных у пациентов с ХОБЛ выявил, что масса тела и возраст являются факторами, влияющими на межиндивидуальные различия в системной экспозиции препарата. Препарат Сибри® Бризхалер® в дозе 50 мкг 1 раз в день может безопасно применяться в любой возрастной группе и при любой массе тела.
Пол, курение и исходные показатели ОФВ1 не оказывают видимого влияния на системную экспозицию гликопиррония бромида.
Нарушение функции печени. Клинические исследования у пациентов с нарушением функции печени не проводились. Выведение гликопиррония бромида происходит главным образом за счет экскреции почками. Предполагается, что ухудшение печеночного метаболизма гликопиррония бромида не приведет к клинически значимому повышению системной экспозиции.
Нарушение функции почек. Системная экспозиция гликопиррония бромида зависит от состояния функции почек. Умеренное повышение общей системной экспозиции (AUC) до 1,4 раза наблюдалось у пациентов с нарушением функции почек легкой и средней степени тяжести и до 2,2 раза у пациентов с нарушением функции почек тяжелой степени или терминальной стадией заболевания почек. Использование популяционного фармакокинетического анализа позволило сделать вывод, что у пациентов с ХОБЛ и нарушением функции почек легкой и средней степени тяжести (оцениваемой по СКФ ≥30 мл/мин/1,73 м2) препарат Сибри® Бризхалер® может применяться в рекомендуемых дозах.
Показания
Поддерживающая терапия нарушений бронхиальной проводимости у пациентов с хронической обструктивной болезнью легких.
Противопоказания
повышенная чувствительность к гликопиррония бромиду или любым другим компонентам, входящим в состав препарата;
одновременный прием с ингаляционными ЛС, содержащими другие м-холиноблокаторы;
непереносимость галактозы, дефицит лактазы или глюкозо-галактозная мальабсорбция (препарат содержит лактозу);
возраст до 18 лет.
С осторожностью: закрытоугольная глаукома; заболевания, сопровождающиеся задержкой мочи; тяжелая почечная недостаточность (СКФ ниже 30 мл/мин/1,73 м2), включая терминальную стадию почечной недостаточности, требующую проведения гемодиализа (препарат Сибри® Бризхалер® должен применяться только в случае, если ожидаемая польза превышает потенциальный риск); нестабильная ишемическая болезнь сердца; инфаркт миокарда в анамнезе; нарушения сердечного ритма; удлинение интервала QTc (QT скорректированный >0,44 с).
Применение при беременности и кормлении грудью
В доклинических исследованиях было показано отсутствие у препарата тератогенного эффекта после ингаляционного применения. В связи с отсутствием клинических данных по применению препарата Сибри® Бризхалер® у беременных женщин препарат может применяться во время беременности, только если предполагаемая польза применения для пациентки превышает потенциальный риск для плода.
Неизвестно, проникает ли гликопиррония бромид в грудное молоко у человека. Применение препарата Сибри® Бризхалер® при грудном вскармливании должно рассматриваться, только если польза для матери превышает любой потенциальный риск для младенца.
Ни исследования репродуктивной токсичности, ни другие исследования на животных не дают оснований полагать, что препарат может влиять на фертильность у мужчин или женщин.
Способ применения и дозы
Ингаляционно.
Препарат представляет собой капсулы с порошком для ингаляций, которые следует применять только для ингаляций через рот с помощью специального устройства для ингаляций Бризхалер®, который входит в комплект упаковки. Препарат нельзя принимать внутрь. Капсулы с порошком для ингаляций должны храниться в блистере и извлекаться из него непосредственно перед применением.
Рекомендуемая доза препарата Сибри® Бризхалер® составляет 50 мкг (содержимое 1 капс.) 1 раз в сутки. Ингаляцию препарата проводят ежедневно 1 раз в сутки в одно и то же время. В случае пропуска ингаляции следующую дозу необходимо ингалировать как можно быстрее. Пациенты должны быть проинструктированы о необходимости не применять более 1 дозы препарата (50 мкг) в сутки.
Перед началом применения препарата Сибри® Бризхалер® пациенты должны быть проинструктированы о правильном использовании ингалятора.
При отсутствии улучшения функции дыхания следует удостовериться, правильно ли пациент применяет препарат. Препарат следует вдыхать, а не глотать.
Особые группы пациентов
Почечная недостаточность. У пациентов с нарушением функции почек легкой и средней тяжести может применяться рекомендуемая доза препарата Сибри® Бризхалер®. У пациентов с нарушением функции почек тяжелой степени или терминальной стадией заболевания почек, требующей проведения гемодиализа, препарат Сибри® Бризхалер® должен применяться в рекомендуемой дозе только в случае, если предполагаемая польза превышает потенциальный риск.
Печеночная недостаточность. Специальные клинические исследования у пациентов с нарушением функции печени не проводились. Препарат Сибри® Бризхалер® выводится преимущественно путем почечной экскреции, поэтому значимое увеличение экспозиции у пациентов с нарушением функции печени не предполагается. У пациентов с нарушением функции печени может применяться рекомендуемая доза препарата Сибри® Бризхалер®.
Пожилой возраст. Препарат Сибри® Бризхалер® может применяться в рекомендуемой дозе у пациентов 75 лет и старше.
Указания по применению ингалятора
Каждая упаковка препарата Сибри® Бризхалер® содержит:
— 1 ингаляционное устройство — Бризхалер®;
— блистеры с капсулами с порошком для ингаляций.
Капсулы с порошком для ингаляций нельзя принимать внутрь.
Ингаляционное устройство Бризхалер®, находящееся в упаковке, предназначено для использования только вместе с капсулами препарата.
Для ингаляции капсул, находящихся в упаковке, используется только ингаляционное устройство Бризхалер®.
Не использовать капсулы препарата с каким-либо другим ингаляционным устройством и, в свою очередь, не использовать Бризхалер® для ингаляции других препаратов.
Через 30 дней использования Бризхалер® следует выбросить.
Как использовать ингалятор
1. Снять крышку.
2. Открыть Бризхалер®: чтобы открыть ингалятор, следует крепко взять его за основание и наклонить мундштук.
3. Приготовить капсулу: отделить 1 бл. от блистер-упаковки, оторвав ешл по перфорации; взять 1 бл. и снять с него защитную пленку, чтобы высвободить капсулу; не выдавливать капсулу через защитную пленку.
4. Вынуть капсулу: капсулы следует хранить в блистере и вынимать только непосредственно перед применением; вытереть руки насухо и вынуть капсулу из блистера; не глотать капсулу.
5. Вставить капсулу в Бризхалер®: положить капсулу в камеру для капсул; никогда не класть капсулу непосредственно в мундштук.
6. Закрыть Бризхалер®: плотно закрыть ингалятор; когда он закроется до конца, должен раздаться щелчок.
7. Проткнуть капсулу: удерживать Бризхалер® в вертикальном положении так, чтобы мундштук был направлен вверх; одновременно нажать до конца на обе кнопки; при прокалывании капсулы должен раздаться щелчок; не нажимать на кнопки для прокалывания капсулы более 1 раза.
8. Полностью отпустить кнопки ингалятора Бризхалер® с обеих сторон.
9. Сделать выдох; перед тем как вставить мундштук в рот, сделать полный выдох; никогда не дуть в мундштук.
10. Вдохнуть лекарственный препарат: удерживать Бризхалер® в руке так, чтобы кнопки оказались слева и справа (а не сверху и снизу); вложить мундштук ингалятора Бризхалер® в рот и плотно сжать губы вокруг него; сделать быстрый, равномерный, максимально глубокий вдох; не нажимать на кнопки прокалывающего устройства.
11. Обратить внимание. При вдыхании через ингалятор должен быть слышен характерный дребезжащий звук, создаваемый вращением капсулы в камере и распылением порошка. Пациент может почувствовать сладковатый привкус препарата во рту. Если дребезжащий звук не слышен, это может означать, что капсула застряла в камере ингалятора. В этом случае следует открыть ингалятор и аккуратно освободить капсулу, постучав по основанию устройства. Чтобы освободить капсулу, не следует нажимать на кнопки для прокалывания капсулы. При необходимости повторить этапы 9 и 10.
12. Задержать дыхание: если при вдыхании слышен характерный звук, задержать дыхание как можно дольше (чтобы не испытывать неприятных ощущений) и в это же время вынуть мундштук изо рта; после этого сделать выдох. Открыть Бризхалер® и посмотреть, не остался ли в капсуле порошок. Если в капсуле остался порошок, закрыть Бризхалер® и повторить этапы 9–12. Большинство людей могут опорожнить капсулу за 1 или 2 ингаляции. У некоторых людей в течение небольшого времени после ингаляции лекарственного препарата отмечается кашель, не следует при этом волноваться. Если порошка в капсуле не осталось, значит, пациент получил полную дозу препарата.
13. Вынуть капсулу: после принятия суточной дозы препарата Сибри® Бризхалер®, отклонив мундштук, вынуть пустую капсулу, постучав по ингалятору, и выбросить ее. Закрыть мундштук ингалятора Бризхалер® и закрыть Бризхалер® крышкой. Не хранить капсулы в ингаляторе Бризхалер®.
Важная информация
Не глотать капсулы с порошком для ингаляций.
Использовать только Бризхалер®, находящийся в упаковке.
Капсулы должны храниться в блистере и извлекаться непосредственно перед использованием.
Никогда не вкладывать капсулу в мундштук ингалятора Бризхалер®.
Не нажимать на прокалывающее устройство более 1 раза.
Никогда не дуть в мундштук ингалятора Бризхалер®.
Всегда прокалывать капсулу до ингаляции.
Не мыть Бризхалер®. Хранить его сухим (см. Как чистить Бризхалер®).
Не разбирать Бризхалер®.
Начиная новую упаковку препарата, для ингаляции капсул всегда использовать новый Бризхалер®, находящийся в упаковке.
Не хранить капсулы в ингаляторе Бризхалер®.
Всегда хранить блистеры с капсулами и Бризхалер® в сухом месте.
Дополнительная информация
В очень редких случаях небольшое количество содержимого капсул может попасть в рот.
Не следует волноваться при вдохе или проглатывании препарата.
При прокалывании капсулы более 1 раза возрастает риск ее разламывания.
Как чистить Бризхалер®
Чистить Бризхалер® 1 раз в неделю. Протереть мундштук снаружи и внутри чистой сухой тканью. Никогда не использовать воду для чистки ингалятора Бризхалер®. Сохранять его сухим.
Побочные действия
Профиль безопасности препарата Сибри® Бризхалер® характеризуется симптомами, связанными с м-холиноблокирующим действием, включающим сухость слизистой оболочки полости рта (2,2%), в то время как другие эффекты со стороны ЖКТ и признаки задержки мочеиспускания были нечастыми.
Нежелательные лекарственные реакции (НЛР), связанные с местной переносимостью препарата, включали раздражение глотки, назофарингит, ринит и синусит. В рекомендованных дозах препарат Сибри® Бризхалер® не оказывает влияния на АД и ЧСС.
Безопасность и переносимость препарата Сибри® Бризхалер® была исследована при применении у 1353 пациентов с ХОБЛ в рекомендованной дозе 50 мкг 1 раз в день, из них 842 пациента получали лечение препаратом не менее 26 нед и 351 — не менее 52 нед.
НЛР сгруппированы в соответствии с классификацией органов и систем органов MedDRA, перечислены в порядке уменьшения частоты встречаемости.
Для оценки частоты встречаемости НЛР использованы следующие критерии: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000).
Инфекционные и паразитарные заболевания: часто — назофарингит; нечасто — ринит, цистит.
Со стороны обмена веществ и питания: нечасто — гипергликемия.
Нарушения психики: часто — бессонница.
Со стороны нервной системы: часто — головная боль; нечасто — гипестезия.
Со стороны сердца: нечасто — фибрилляция предсердий, ощущение сердцебиения.
Со стороны дыхательной системы, органов грудной клетки и средостения: нечасто — застойные явления в придаточных пазухах носа, продуктивный кашель, першение в горле, носовое кровотечение.
Со стороны пищеварительной системы: часто — сухость слизистой оболочки полости рта, гастроэнтерит; нечасто — диспепсия, кариес зубов.
Со стороны кожи и подкожных тканей: нечасто — кожная сыпь.
Со стороны скелетно-мышечной системы и соединительной ткани: нечасто — боль в конечностях, скелетно-мышечная боль в грудной клетке.
Со стороны почек и мочевыводящих путей: часто — инфекция мочевыводящих путей; нечасто — дизурия, задержка мочи.
Общие расстройства и нарушения в месте введения: нечасто — усталость, астения.
В клиническом исследовании длительностью 12 мес были выявлены следующие дополнительные НЛР, которые встречались более часто при применении препарата Сибри® Бризхалер® по сравнению с плацебо: назофарингит (9 против 5,6%), рвота (1,3 против 0,7%), мышечная боль (1,1 против 0,7%), боль в области шеи (1,3 против 0,7%), сахарный диабет (0,8 против 0%).
Ниже перечислены НЛР, выявленные в ходе пострегистрационных исследований и по данным литературы. Поскольку информация о данных НЛР получена методом спонтанных сообщений и точное число пациентов, принимавших препарат, не определено, оценить частоту возникновения данных реакций не представляется возможным, в связи с чем для данных НЛР указано, что частота неизвестна. НЛР сгруппированы в соответствии с классификацией органов и систем органов MedDRA, перечислены в порядке уменьшения значимости.
Со стороны иммунной системы: ангионевротический отек, гиперчувствительность.
Со стороны органов грудной клетки и средостения: парадоксальный бронхоспазм, дисфония.
Со стороны кожи и подкожных тканей: кожный зуд.
Особые группы пациентов
У пожилых пациентов старше 75 лет частота развития инфекций мочевыводящих путей и головной боли при применении препарата Сибри® Бризхалер® была выше, чем в группе плацебо (3 против 1,5% и 2,3 против 0% соответственно).
Если любые из указанных в описании побочных эффектов усугубляются или пациент заметил любые другие побочные эффекты, не указанные в описании, следует сообщить об этом врачу.
Взаимодействие
Одновременное применение препарата с другим ЛС для ингаляционного применения, содержащими м-холиноблокаторы, не изучено, в связи с чем одновременное применение вышеуказанных средств противопоказано.
Одновременное ингаляционное применение гликопиррония бромида и индакатерола, агониста бета2-адренорецепторов, не влияет на фармакокинетику обоих препаратов.
Несмотря на то что не проводились клинические исследования по изучению лекарственного взаимодействия, в клинической практике не отмечено клинических проявлений лекарственного взаимодействия при одновременном применении препарата Сибри® Бризхалер® с другими ЛС, широко применяемыми для лечения ХОБЛ, в т.ч. бета-адреномиметиками, метилксантинами, ГКС для ингаляционного и перорального применения.
В клинических исследованиях у здоровых добровольцев циметидин, ингибитор транспортеров органических катионов, влияющих на почечный клиренс гликопиррония бромида, повышал общую экспозицию (AUC) гликопиррония бромида на 22% и снижал почечный клиренс на 23%. Основываясь на данных показателях, не предполагается клинически значимое взаимодействие при одновременном применении препарата Сибри® Бризхалер® с циметидином или другими ингибиторами транспортеров катионов.
Исследования in vitro показали, что препарат Сибри® Бризхалер®, вероятно, не влияет на метаболизм других ЛС.
Ингибирование или индукция метаболизма гликопиррония бромида не приводит к значимым изменениям системной экспозиции препарата.
Передозировка
Применение высоких доз гликопиррония может привести к развитию симптомов, связанных с м-холиноблокирующим действием, и потребовать проведения соответствующей симптоматической терапии.
У пациентов с ХОБЛ регулярное ингаляционное введение препарата Сибри® Бризхалер® в общей дозе 100 и 200 мкг 1 раз в день в течение 28 дней хорошо переносилось.
Острая интоксикация при случайном проглатывании капсулы препарата Сибри® Бризхалер® маловероятна вследствие низкой биодоступности гликопиррония бромида при пероральном применении (около 5%).
Cmax в плазме крови и общая системная экспозиция после в/в введения 150 мкг гликопиррония бромида (эквивалентно 120 мкг гликопиррония) у здоровых добровольцев были приблизительно в 50 и 6 раз выше соответственно, чем Cmax в плазме крови и общая системная экспозиция в равновесном состоянии, достигаемые при применении препарата Сибри® Бризхалер® ингаляционно в рекомендуемых дозах (50 мкг 1 раз в день). Признаков передозировки при этом не выявлялось.
Особые указания
Препарат Сибри® Бризхалер® не рекомендован для купирования острых эпизодов бронхоспазма.
Реакции гиперчувствительности. Были зарегистрированы случаи развития реакций гиперчувствительности немедленного типа после применения препарата Сибри® Бризхалер®. Если имеются признаки, свидетельствующие о развитии аллергической реакции, в т.ч. ангионевротического отека (включая затрудненное дыхание или глотание, отек языка, губ и лица), крапивницы или кожной сыпи, препарат необходимо отменить и подобрать альтернативную терапию.
Парадоксальный бронхоспазм. Как и в случаях другой ингаляционной терапии, применение препарата Сибри® Бризхалер® может приводить к парадоксальному бронхоспазму, что может представлять угрозу для жизни. В случае возникновения парадоксального бронхоспазма применение препарата Сибри® Бризхалер® должно быть немедленно прекращено и применена альтернативная терапия.
м-Холиноблокирующий эффект. Как и другие м-холиноблокирующие ЛС препарат Сибри® Бризхалер® должен с осторожностью применяться у пациентов с закрытоугольной глаукомой или задержкой мочи. Пациенты должны быть проинформированы о признаках и симптомах острого приступа закрытоугольной глаукомы и необходимости прекратить применение препарата Сибри® Бризхалер®, а также незамедлительно сообщать своему врачу в случае развития любого из этих признаков или симптомов.
Тяжелая почечная недостаточность. Пациенты с нарушением функции почек (СКФ менее 30 мл/мин/1,73м2), включая пациентов с терминальной стадией заболевания, нуждающихся в гемодиализе, должны тщательно наблюдаться на предмет развития возможных НЛР.
Препарат Сибри® Бризхалер® предназначен для поддерживающего лечения пациентов с ХОБЛ. В связи с тем обстоятельством, что в общей популяции ХОБЛ существенно преобладают пациенты старше 40 лет, при применении препарата у пациентов до 40 лет требуется спирометрическое подтверждение диагноза ХОБЛ.
Влияние на способность управлять транспортными средствами, механизмами. Препарат Сибри® Бризхалер® не оказывает отрицательное влияние на способность управлять транспортными средствами, механизмами.
Форма выпуска
Капсулы с порошком для ингаляций, 50 мкг. По 6 или 10 капс. в блистере из ПА/алюминия/ПВХ и алюминиевой фольги. 1, 2, 3, 4 или 5 бл. вместе с устройством для ингаляций (бризхалер) в картонной пачке.
Мультиупаковка: 3 пачки по 3 или 5 бл., 4 пачки по 4 бл., 15 или 25 пачек по 1 бл. вместе с устройством для ингаляций (бризхалер) в картонной коробке.
Производитель
Новартис Фарма Штейн АГ, Шаффхаузерштрассе, 4332 Штейн, Швейцария/Novartis Pharma Stein AG, Schaffhauserstrasse, 4332 Stein, Switzerland.
Первичная упаковка: Конафарма АГ, Им Ванненбоден 16, 4133 Праттельн, Швейцария/Konapharma AG, Im Wannenboden 16, 4133 Pratteln, Switzerland;
Новартис Фармасьютика С.А., Ронда де Санта Мария, 158, 08210 Барбера Дель Валлес, Барселона, Испания/Novartis Farmaceutica S.A., Ronda de Santa Maria, 158, 08210 Barbera del Valles, Barсelona, Spain.
Вторичная/потребительская упаковка: Новартис Фарма Штейн АГ, Швейцария; Конафарма АГ, Швейцария; Новартис Фармасьютика С.А., Испания; ООО «Новартис Нева», 194362, Россия, Санкт-Петербург, Дорога в Каменку, 40, корп. 3, лит. А, Б.
Выпускающий контроль качества: Новартис Фарма Штейн АГ, Швейцария; Новартис Фармасьютика С.А., Испания; ООО «Новартис Нева», Россия.
Наименование и адрес юридического лица, на имя которого выдано регистрационное удостоверение: Новартис Фарма АГ, Лихтштрассе 35, 4056 Базель, Швейцария/Novartis Pharma AG, Lichtstrasse 35, 4056 Basel, Switzerland.
Получить дополнительную информацию о препарате, а также направить претензии и информацию о НЯ можно по следующему адресу в России: ООО «Новартис Фарма», 125315, Москва, Ленинградский пр-т, 72, корп. 3.
Тел. (495) 967-12-70; факс (495) 967-12-68.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре не выше 25 °C, в оригинальной упаковке (блистер в пачке).
Хранить в недоступном для детей месте.
Срок годности
2 года.
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
16 часов назад, DFX сказал:
А машинное масло чем плохо?
Хочу обратить внимание, что коэффициент трения после нанесения НКЖ болжен быть не МЕНЕЕ 0,15, т.е. от 0,15 выше. Думаю масло, машинное, или вазелиновое, или любое другое коэффициент трения будет снижать.
1 час назад, Кхн сказал:
Конечно хотелось бы дешевле
Подскажите, а у раствора глицерина, можно как то снизить вязкость? Да, я забыл указать диапазон рабочих температур для НКЖ: НКЖ должна свободно поступать через шланги подачи жидкости к искательным системам (блокам преобразователей) дефектоскопного оборудования и обеспечивать его работоспособность, полноту и достоверность выявляемых дефектов при температуре атмосферного воздуха от плюс 100 С до минус 400 С
Сибри® Бризхалер® (Seebri Breezhaler)
💊 Состав препарата Сибри® Бризхалер®
✅ Применение препарата Сибри® Бризхалер®
Описание активных компонентов препарата
Сибри® Бризхалер®
(Seebri Breezhaler)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2022.11.24
Владелец регистрационного удостоверения:
Код ATX:
R03BB06
(Гликопиррония бромид)
Лекарственная форма
| Сибри® Бризхалер® |
Капс. с порошком д/ингаляций 50 мкг: 6, 10, 12, 18, 20, 24, 30, 40, 50, 54, 90, 96, 150, 160 или 250 шт. в компл. с устройством д/ингаляций (бризхалером) рег. №: ЛП-002244 |
Форма выпуска, упаковка и состав
препарата Сибри® Бризхалер®
Капсулы с порошком для ингаляций твердые, размер №3, с прозрачными крышечкой и корпусом оранжевого цвета, с маркировкой 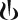
Вспомогательные вещества: лактозы моногидрат — 24.9 мг, магния стеарат — 0.037 мг.
Состав оболочки капсулы: гипромеллоза — 45.59 мг, вода — 2.7 мг, каррагинан — 0.42 мг, натрия хлорид — 0.18 мг, краситель солнечный закат желтый (Е110) — 0.12 мг.
Состав чернил: шеллак, краситель железа оксид черный, пропиленгликоль, натрия гидроксид.
6 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (1) в комплекте с устройством для ингаляций (бризхалер) — пачки картонные.
6 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (2) в комплекте с устройством для ингаляций (бризхалер) — пачки картонные.
6 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (3) в комплекте с устройством для ингаляций (бризхалер) — пачки картонные.
6 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (4) в комплекте с устройством для ингаляций (бризхалер) — пачки картонные.
6 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (5) в комплекте с устройством для ингаляций (бризхалер) — пачки картонные.
10 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (1) в комплекте с устройством для ингаляций (бризхалер) — пачки картонные.
10 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (2) в комплекте с устройством для ингаляций (бризхалер) — пачки картонные.
10 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (3) в комплекте с устройством для ингаляций (бризхалер) — пачки картонные.
10 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (4) в комплекте с устройством для ингаляций (бризхалер) — пачки картонные.
10 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (5) в комплекте с устройством для ингаляций (бризхалер) — пачки картонные.
Мультиупаковка.
6 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (1) — пачки картонные (15) в комплекте с устройством для ингаляций (бризхалер) — коробки картонные.
6 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (1) — пачки картонные (25) в комплекте с устройством для ингаляций (бризхалер) — коробки картонные.
6 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (3) — пачки картонные (3) в комплекте с устройством для ингаляций (бризхалер) — коробки картонные.
6 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (4) — пачки картонные (4) в комплекте с устройством для ингаляций (бризхалер) — коробки картонные.
6 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (5) — пачки картонные (3) в комплекте с устройством для ингаляций (бризхалер) — коробки картонные.
10 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (1) — пачки картонные (15) в комплекте с устройством для ингаляций (бризхалер) — коробки картонные.
10 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (1) — пачки картонные (25) в комплекте с устройством для ингаляций (бризхалер) — коробки картонные.
10 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (3) — пачки картонные (3) в комплекте с устройством для ингаляций (бризхалер) — коробки картонные.
10 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (4) — пачки картонные (4) в комплекте с устройством для ингаляций (бризхалер) — коробки картонные.
10 шт. — блистеры из ПА/Ал/ПВХ и алюминиевой фольги (5) — пачки картонные (3) в комплекте с устройством для ингаляций (бризхалер) — коробки картонные.
Фармакологическое действие
Бронходилатирующее средство, м-холиноблокатор. Механизм действия основан на блокировании действия ацетилхолина на гладкомышечные клетки дыхательных путей, что приводит к бронходилатирующему эффекту.
Гликопиррония бромид, являясь м-холиноблокатором, обладает высоким сродством к м-холинорецепторам подтипа M1-3. При этом гликопиррония бромид обладает в 4-5 раз большей селективностью в отношении M1 и М3 подтипа рецепторов, по сравнению с М2 подтипом рецепторов.
Продолжительность действия гликопиррония бромида после ингаляции обусловлена длительным поддержанием его терапевтической концентрации в легких, что подтверждается более длительным T1/2 активного вещества после ингаляционного применения, по сравнению с в/в введением. В многочисленных клинических исследованиях было показано, что на фоне применения гликопиррония бромида у пациентов с ХОБЛ существенно улучшается легочная функция (оценка проводилось с помощью изменения ОФВ1): терапевтический эффект возникает в течение первых 5 мин после ингаляции, со значимым повышением ОФВ1 от исходных показателей в пределах 0.091 л до 0.094 л, бронходилатирующий эффект гликопиррония бромида после ингаляции сохраняется более 24 ч.
Фармакокинетика
После ингаляции гликопиррония бромид быстро абсорбируется в системный кровоток и достигает Cmax через 5 мин.
Абсолютная биодоступность гликопиррония бромида после ингаляционного применения составляет примерно 40%. Около 90% системной экспозиции гликопиррония бромида приходится на абсорбцию в легких, и 10% на абсорбцию из ЖКТ. Абсолютная биодоступность после перорального применения гликопиррония бромида оценивается в 5%. На фоне регулярных ингаляций (1 раз/сут) равновесное состояние гликопиррония бромида достигается в течение 1 недели. Cssmax гликопиррония бромида (ингаляция 50 мкг 1 раз/сут) и концентрация гликопиррония бромида в плазме крови непосредственно перед приемом следующей дозы составляют 166 пг/мл и 8 пг/мл соответственно.
После в/в введения Vss гликопиррония бромида составил 83 л и объем распределения в терминальной фазе (Vz) — 376 л. Кажущийся Vz после ингаляции (Vz/F) составил 7310 л, что отражает более медленное выведение гликопиррония бромида после ингаляции.
Связывание гликопиррония бромида с белками плазмы крови человека in vitro составила 38-41% при концентрации 1-10 нг/мл. Эти концентрации как минимум в 6 раз выше, чем Css, достигаемые в плазме на фоне применения препарата в дозе 50 мкг 1 раз/сут.
Было отмечено, что гидроксилирование гликопиррония бромида приводит к образованию различных моно- и бис-гидроксилированных метаболитов, а прямой гидролиз приводит к образованию производных карбоновой кислоты (М9). Исследования in vitro показали, что изоферменты CYP450 вносят свой вклад в окислительную биотрансформацию гликопиррония бромида. Гидролиз до М9, по-видимому, катализируется ферментами семейства холинэстераз. Т.к. в исследованиях in vitro не выявлен метаболизм активного вещества в легких, и М9 вносит незначительный вклад в циркуляцию (4% от Cmax и AUC гликопиррония бромида) после в/в введения, предполагается, что М9 образуется из абсорбируемой из ЖКТ (после ингаляции) фракции действующего вещества путем пресистемного гидролиза и/или при «первом прохождении» через печень. После ингаляции или в/в введения только минимальное количество М9 было обнаружено в моче (<0.5% введенной дозы). Глюкуроновые конъюгаты и/или сульфаты гликопиррония бромида были обнаружены в моче человека после повторных ингаляций в количестве приблизительно 3% от дозы. Исследования ингибирования in vitro продемонстрировали, что гликопиррония бромид не вызывал существенного ингибирования изоферментов CYP1A2, CYP2A6, CYP2C8, CYP2C9, CYP2C19, CYP2D6, CYP2E1 или CYP3A4/5, транспортеров MDR1, MRP2 или MXR, и транспортеров ОСТ1 или ОСТ2. В исследованиях индукции ферментов in vitro не выявлено значимой индукции гликопиррония бромидом какого-либо из протестированных изоферментов цитохрома Р450, а также в отношении UGT1A1 и транспортеров MDR1 и MRP2.
Выведение гликопиррония бромида почками достигает 60-70% от общего плазменного клиренса, 30-40% выводится другими путями — с желчью или за счет метаболизма. После однократной и повторных ингаляций гликопиррония бромида в диапазоне от 50 до 200 мкг 1 раз/сут здоровым добровольцам и пациентам с ХОБЛ, средний почечный клиренс находился в пределах 17.4-24.4 л/ч. Активная тубулярная секреция вносит свой вклад в выведение почками гликопиррония бромида. До 20% от принятой дозы обнаруживается в моче в неизмененном виде. Плазменная концентрация гликопиррония бромида снижается многофазно. Средний конечный T1/2 более продолжителен после ингаляционного пути введения (33-57 ч) чем после в/в введения (6.2 ч) и перорального применения (2.8 ч). Характер элиминации позволяет предположить длительную абсорбцию в легких и/или проникновение гликопиррония бромида в системный кровоток во время и после 24 ч после ингаляции.
У пациентов с ХОБЛ системная экспозиция, а также общая экскреция с мочой гликопиррония бромида в равновесном состоянии повышалась пропорционально дозе в диапазоне от 50 мкг до 200 мкг.
Показания активных веществ препарата
Сибри® Бризхалер®
Поддерживающая терапия нарушений бронхиальной проходимости у пациентов с ХОБЛ.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Предназначен только для ингаляционного применения в соответствующей лекарственной форме.
Рекомендуемая доза — 50 мкг 1 раз/сут.
Побочное действие
Со стороны дыхательной системы: часто — назофарингит; нечасто — ринит, застойные явления в пазухах, продуктивный кашель, раздражение глотки, носовое кровотечение.
Со стороны пищеварительной системы: часто — сухость во рту, гастроэнтерит, рвота; нечасто — диспепсия, зубной кариес.
Со стороны нервной системы: часто — головная боль, бессонница; нечасто — гипестезия.
Со стороны обмена веществ: нечасто — гипергликемия, сахарный диабет.
Со стороны сердечно-сосудистой системы: нечасто — фибрилляция предсердий, ощущение сердцебиения.
Со стороны кожи и подкожных тканей: нечасто — кожная сыпь.
Со стороны костно-мышечной системы: часто — мышечная боль; нечасто — боль в конечностях, боль в скелетных мышцах грудной клетки.
Со стороны мочевыделительной системы: часто — инфекция мочевыводящих путей; нечасто — цистит, дизурия, задержка мочи.
Общие нарушения: часто — боль в области шеи; нечасто — усталость, астения.
Противопоказания к применению
Одновременное применение с ингаляционными лекарственными средствами, содержащими другие м-холиноблокаторы; детский и подростковый возраст до 18 лет; повышенная чувствительность к гликопиррония бромиду.
Применение при беременности и кормлении грудью
Применение при беременности и в период лактации (грудного вскармливания) возможно только в случаях, когда ожидаемая польза терапии для матери превышает потенциальный риск для плода или грудного ребенка.
Клинические данные по применению гликопиррония бромида при беременности отсутствуют. Неизвестно, выделяется ли гликопиррония бромид с грудным молоком у человека.
В доклинических исследованиях было показано отсутствие у препарата тератогенного эффекта после ингаляционного применения. Ни исследования репродуктивной токсичности, ни другие исследования на животных не дают оснований полагать, что гликопиррония бромид может влиять на фертильность у мужчин или женщин.
Особые указания
С осторожностью следует применять при закрытоугольной глаукоме, заболеваниях, сопровождающихся задержкой мочи, почечной недостаточности тяжелой степени (СКФ ниже 30 мл/мин/1.73 м2), включая терминальную стадию, при которой требуется проведение гемодиализа, при нестабильной ИБС, инфаркте миокарда в анамнезе, нарушениях сердечного ритма, удлинении интервала QTc (QT скорректированный >0.44 с). При необходимости применения в таких случаях требуется наблюдение врача.
Гликопиррония бромид не рекомендован для купирования острых эпизодов бронхоспазма.
В общей популяции ХОБЛ существенно преобладают пациенты в возрасте старше 40 лет, поэтому при необходимости применения у пациентов в возрасте до 40 лет требуется спирометрическое подтверждение диагноза ХОБЛ.
Лекарственное взаимодействие
В клинических исследованиях у здоровых добровольцев циметидин, ингибитор транспортеров органических катионов, влияющих на почечный клиренс гликопиррония бромида, увеличивал AUC гликопиррония бромида на 22% и снижал почечный клиренс на 23%. Основываясь на данных показателях, не предполагается клинически значимого взаимодействия при одновременном применении гликопиррония бромида с циметидином или другими ингибиторами транспортеров катионов.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
фото: Наталья Владимирова
Новая незамерзающая контактирующая жидкость, предназначенная для работы дефектоскопов, уже поступила на сеть. И, как показала обратная связь от дистанций пути, железнодорожники оказались не готовы к нововведению.
На Дальневосточной железной дороге до конца декабря продолжается спецоценка рабочих мест, проводимая по инициативе технической инспекции труда Дорпрофжел. Напомним, летом на замену этиловому спирту, который использовался операторами дефектоскопных тележек при ультразвуковом неразрушающем контроле рельсов, стрелочных переводов и сварных стыков при низких температурах, поступила незамерзающая контактирующая жидкость «Лукойл» (НКЖ) производства ООО «Интесмо». Из-за содержащихся в ней токсических веществ она относится к третьему классу опасности. И, соответственно, при работе с ней требуются специальные условия: отдельные помещения, оборудованные хорошей вентиляцией, отсутствие соседства с окислителями, кислотами, щелочами и прочими активными химическими элементами, а также дополнительные средства индивидуальной защиты – перчатки, респираторы, очки.
– Для приготовления раствора, а жидкость смешивают с водой, и нужны такие помещения. Ведь чем выше концентрация раствора, тем сильнее раздражают выделяемые пары и запах глаза, дыхательные пути человека, кожу, – рассказывает технический инспектор труда Владивостокского филиала Дорпрофжел на Дальневосточной железной дороге Александр Лашин. – Значит, наряду с повышением эффективности в работе дефектоскопистов, при использовании новой жидкости появились и сложности, связанные с охраной труда. Дистанции Владивостокского региона, например, только начали работу по поиску и переоборудованию помещений.
По словам специалиста по охране труда Сибирцевской дистанции пути Ольги Ковалец, особых жалоб от дефектоскопистов при работе с новой жидкостью не поступало.
– Собственно, в Приморье ещё не пришли морозы, погода радует плюсовой температурой. Поэтому «незамерзайку» пока можно разводить на улице. В мастерских на станции Сибирцево присмотрели подходящее место, где это можно делать, соблюдая требования охраны труда. А вот на отдалённых ветках возникла проблема с помещениями, поэтому вопрос пока остаётся открытым, – комментирует Ольга Ковалец. – Что касается средств индивидуальной защиты: большое спасибо профсоюзу дистанции, он нас обеспечил всем, что нужно. Но необходимы централизованные поставки.
По мнению Александра Лашина, одним из шагов решения проблемы станет получение заключения Роспотребнадзора по Приморскому краю о воздействии на организм работника низкотемпературной жидкости.
– Мы сделали соответствующий запрос, ждём результата. Кроме этого профсоюзная организация Уссурийской дистанции пути планирует провести дополнительную независимую оценку новой незамерзающей жидкости, – уточнил Александр Лашин. – И уже от полученных результатов будем выстраивать дальнейшую работу. Пока же дистанции должны готовить цеха к работе с этой жидкостью. Инструкции в виде презентаций, подготовленные службой охраны труда и промышленной безопасности Дальневосточной железной дороги, разосланы в ПЧ.
В свою очередь председатель Роспрофжела Николай Никифоров на днях направил обращение начальнику Центральной дирекции инфраструктуры Геннадию Верховых по вопросу применения НКЖ операторами дефектоскопных средств.
На фото: С новой жидкостью работники дистанции пути должны работать строго по инструкции, чтобы не причинить себе вред
Наталья Владимирова
действующее вещество: экстракт спиртовой сухого корневища с корнями элеутерококка колючего (измельченного) (1:1); вспомогательное вещество: спирт этиловый 40 %.
Жидкость темно-коричневого цвета, в тонком слое прозрачная, со специфическим запахом. При хранении допускается образование осадка.
В состав корневищ с корнями входят элеутерозиды А, В, В], С, D, Е, F и G, производные кумарина, флавоноиды, эфирное масло, растительный воск, смолы, крахмал. Благодаря наличию элеутерозидов Элеутерококк повышает физическую и умственную работоспособность, устойчивость к неблагоприятным факторам внешней среды, повышает остроту зрения, стимулирует сердечно-сосудистую систему, ослабляет стрессовые реакции, обладает некоторым стимулирующим гонадотропным и гипогликемическим действием.
Препарат хорошо всасывается в пищеварительном тракте, выводится из организма, главным образом, почками.
Физическое и умственное переутомление, неврастении и психостении, артериальная гипотензия, функциональное истощение центральной нервной системы, сопровождающееся снижением работоспособности, раздраженностью и бессонницей.
В составе комплексной терапии при вегетоневрозах, после тяжелых хирургических операций, при острой и хронической лучевой болезни.
Повышенная чувствительность к компонентам препарата. Гипертермический синдром, артериальная гипертензия, повышенная возбудимость, острые инфекционные заболевания, инфаркт миокарда, аритмии, бессонница, нейроциркуляторная дистония, лихорадка, эпилепсия, алкоголизм, церебрально — сосудистая патология, хронические заболевания печени, цирроз печени. Беременность и период кормления грудью. Детский возраст до 12 лет.
Перед применением взбалтывать. Элеутерококк назначают внутрь за 30 мин до употребления пищи: взрослым — по 20 — 40 капель 2-3 раза в сутки, детям в возрасте от 12 лет назначают из расчета 1 капля на 1 год жизни ребенка 2 раза в сутки. Курс лечения составляет 25 — 30 дней; при необходимости повторяют через 1 — 2 недели.
Со стороны центральной нервной системы: бессонница, повышенная возбудимость, головная боль.
Со стороны сердечно-сосудистой системы: повышение артериального давления, нарушение ритма сердца, тахикардия.
Со стороны кожи: сыпь, покраснение кожи, зуд.
Длительное применение может вызвать нарушения со стороны пищеварительного тракта.
Симптомы: возможно повышение артериального давления, нарушение ритма сердца, повышенная возбудимость, нарушение сна.
Лечение. Терапия симптоматическая.
Препарат усиливает действие стимуляторов центральной нервной системы и аналептиков, является физиологическим антагонистом средств, угнетающих центральную нервную систему (в том числе барбитуратов, транквилизаторов, противоэпилептических средств).
Экстракт элеутерококка может потенцировать действие гипогликемических средств.
Способность влиять на скорость реакции при управлении автотранспортом или работе с другими механизмами.
В связи с возможностью возникновения побочных реакций со стороны центральной нервной системы и из-за того, что препарат содержит этанол 40 %, нужно воздержаться от управления автотранспортом или работы с другими механизмами, влияющими на скорость реакции.
Дети. Не применяют детям в возрасте до 12 лет.
По 50 мл во флаконах, с вложением в пачку.
Хранить в защищенном от света месте при температуре от 8 °С до 15 °С.
Хранить в недоступном для детей месте.
4 года. Не использовать по истечении срока годности!