Рекомендации МАКМАХ «Определение чувствительности микроорганизмов к антимикробным препаратам (2021)»
Новая версия 2021-01
Скачать (PDF, 6.74 Мб)
Рекомендации подготовлены:
- Научно-исследовательским институтом антимикробной химиотерапии ФГБОУ ВО «Смоленский государственный медицинский университет» Министерства Здравоохранения Российской Федерации, Смоленск (Козлов Р.С., Сухорукова М.В., Эйдельштейн М.В., Иванчик Н.В., Склеенова Е.Ю., Романов А.В., Микотина А.В., Веселов А.В., Дехнич А.В.).
- ФГБУ «Детский научно-клинический центр инфекционных болезней Федерального медико-биологического агентства», Санкт-Петербург (Сидоренко С.В., Партина И.В., Гостев В.В., Агеевец В.А.).
- ФБУН «Санкт-Петербургский научно-исследовательский институт эпидемиологии и микробиологии им. Пастера» Федеральной службы по надзору в сфере защиты прав потребителей и благополучия человека, Санкт-Петербург (Кафтырева Л.А., Егорова С.А., Макарова М.А.).
- Научно-исследовательский институт медицинской микологии им. П.Н.Кашкина ФГБОУ ВО «Северо-Западный государственный медицинский университет им. И.И. Мечникова» Министерства здравоохранения Российской Федерации, Санкт-Петербург (Васильева Н.В., Климко Н.Н., Богомолова Т.С., Выборнова И.В., Рябинин И.А., Борзова Ю.В.).
- ФГБУ «Национальный исследовательский центр эпидемиологии и микробиологии имени почетного академика Н.Ф. Гамалеи» Министерства Здравоохранения Российской Федерации, Москва (Тартаковский И.С.).
Определение чувствительности микроорганизмов к антимикробным препаратам (2018)
Версия 2018-03
Скачать (PDF, 5.0 Мб)
Определение чувствительности микроорганизмов к антимикробным препаратам (2015)
Версия, зарегистрированная в Федеральной медицинской библиотеке в 2016 году
Скачать (PDF, 4.63 Мб)
Рекомендации утверждены:
- Расширенное совещание Межрегиональной ассоциацией по клинической микробиологии и антимикробной химиотерапии (Москва, 22.05.2014 г.)
Рекомендации подготовлены:
- Научно-исследовательским институтом антимикробной химиотерапии ГБОУ ВПО «Смоленский государственный медицинский университет» Министерства Здравоохранения РФ, г. Смоленск (Козлов Р.С., Сухорукова М.В., Эйдельштейн М.В., Иванчик Н.В., Склеенова Е.Ю., Тимохова А.В., Дехнич А.В.)
- ФГБУ «НИИ детских инфекций федерального медико-биологического агентства России», г. Санкт-Петербург (Сидоренко С.В., Партина И.В., Гостев В.В., Агеевец В.А.)
- ФБУН НИИ эпидемиологии и микробиологии имени Пастера, г. Санкт-Петербург (Кафтырева Л.А., Егорова С.А., Макарова М.А.)
- Научно-исследовательский институт медицинской микологии им. П.Н. Кашкина ГБОУ ВПО «Северо-Западный государственный медицинский университет» Министерства Здравоохранения РФ, г. Санкт-Петербург (Васильева Н.В., Климко Н.Н., Богомолова Т.С., Рауш Е.Р., Выборнова И.В.)
- ФГБУ «Федеральный научно-исследовательский центр эпидемиологии и микробиологии имени почётного академика Н.Ф. Гамалеи» Министерства Здравоохранения РФ, г. Москва (Тартаковский И.С.)
Клинические рекомендации обсуждены и одобрены на экспертном совещании профильной комиссии по специальности «Клиническая микробиология и антимикробная резистентность» (г. Саратов, 17.10.2015 г.)
Определение чувствительности микроорганизмов к антимикробным препаратам (2014)
Зарегистрировано в Федеральной медицинской библиотеке в 2014 году
Скачать (PDF, 4.7 Мб)
Рекомендации утверждены:
- Расширенное совещание Межрегиональной ассоциацией по клинической микробиологии и антимикробной химиотерапии (Москва, 23.05.2014 г.)
- Совещание рабочей группы по медицинской микробиологии профильной комиссии МЗ РФ по КЛД (г. Санкт-Петербург, 10.05.2014 г.)
Рекомендации подготовлены:
- Научно-исследовательским институтом антимикробной химиотерапии ГБОУ ВПО «Смоленская государственная медицинская академия» Министерства Здравоохранения РФ, Смоленск (Козлов Р.С., Сухорукова М.В., Эйдельштейн М.В., Иванчик Н.В., Склеенова Е.Ю., Тимохова А.В., Дехнич А.В.)
- ФГБУ «НИИ детских инфекций федерального медико-биологического агентства России», Санкт-Петербург (Сидоренко С.В., Партина И.В., Гостев В.В., Агеевец В.А.)
- ФБУН НИИ эпидемиологии и микробиологии имени Пастера, Санкт-Петербург (Кафтырева Л.А., Егорова С.А., Макарова М.А.)
- Научно-исследовательский институт медицинской микологии им. П.Н. Кашкина ГБОУ ВПО «Северо-Западный государственный медицинский университет» Министерства Здравоохранения РФ, Санкт-Петербург (Васильева Н.В., Климко Н.Н., Богомолова Т.С., Рауш Е.Р., Выборнова И.В.)
- ФГБУ «НИИ эпидемиологии и микробиологии им. Н.Ф. Гамалеи» Министерства Здравоохранения РФ, Москва (Тартаковский И.С.)
Клинические рекомендации по выделению, идентификации и определению чувствительности Helicobacter pylori к антимикробным препаратам
Скачать (PDF, 512 Кб)
Настоящие клинические рекомендации определяют алгоритмы микробиологической диагностики геликобактерной инфекции и определения чувствительности Helicobacter pylori к антимикробным препаратам. Версия: октябрь 2017
ВВЕДЕНИЕ
Современная терапия респираторных инфекций немыслима без назначения антибактериальных препаратов. Однако, несмотря на наличие в арсенале врачей большого количества лекарственных средств, активных в отношении практически всех патогенных микроорганизмов, выбор антимикробного препарата в конкретной клинической ситуации нередко вызывает у врача много вопросов. Это объясняется невозможностью в большинстве случаев этиологической расшифровки инфекционного процесса, меняющимися представлениями об этиологии инфекционно-воспалительных заболеваний дыхательных путей, ростом резистентности микроорганизмов. Затрудняют выбор антибиотика в ряде случаев и недостаточные знания практикующих врачей об особенностях фармакокинетики, спектрах антимикробной активности и токсичности современных антибактериальных препаратов. Согласно некоторым международным исследованиям, более 60% назначений антибиотиков производится необоснованно или нерационально[1–3].
Ниже будут рассмотрены принципы, которые должны помочь врачу быстро принять решение при выборе эффективной антибактериальной терапии.
УСТАНОВЛЕНИЕ ТОЧНОГО ДИАГНОЗА
Основное показание для назначения антибиотиков — бактериальное воспаление.
Серьезной проблемой терапии инфекций верхних и нижних дыхательных путей является неоправданно частое назначение антимикробных препаратов без соответствующих показаний, в первую очередь их применение при вирусных инфекциях. Распространенность респираторных инфекций неуклонно растет с каждым годом, что обусловливает частую обращаемость пациентов к врачам разных специальностей. По данным отечественных и зарубежных источников, взрослый пациент переносит до 2–3 эпизодов в год так называемых простуд[4, 5].
Развитию заболеваний способствуют стресс, снижение иммунитета и неблагоприятная эпидемиологическая обстановка, особенно в холодное время года, а также хроническая фоновая патология. Большинство острых заболеваний имеет вирусное происхождение, переносится пациентом достаточно легко и при адекватной терапии заканчивается благополучно[6].
Ошибки могут быть вызваны как неправильной трактовкой симптоматики (врач принимает ОРВИ за бактериальную инфекцию), так и стремлением не допустить бактериального осложнения вирусной инфекции. Антибиотики не предотвращают бактериальную суперинфекцию, более того, они способствуют селекции более агрессивных патогенов и развитию нежелательных побочных явлений. Нерациональное использование антибактериальной терапии имеет серьезные последствия[7].
ЗНАНИЕ ЭТИОЛОГИИ ЗАБОЛЕВАНИЙ
Если бактериальная этиология заболевания высоковероятна, то вторым шагом является выбор препарата, активного в отношении потенциального возбудителя инфекционного заболевания. В подавляющем большинстве случаев антимикробная терапия назначается эмпирически, т. е. возбудитель и его чувствительность к антибиотикам не устанавливаются.
Спектр антимикробной активности препарата должен включать большинство вероятных бактериальных возбудителей инфекции данной локализации. В случае бактериальной инфекции дыхательных путей препарат должен проявлять активность в отношении наиболее частых возбудителей (Streptococcus pneumoniae, Haemophilus influenzae, Moraxella catarrhalis, Streptococcus pyogenes).
Пневмококк (S. pneumoniae) — самый распространенный бактериальный возбудитель респираторных инфекций. Во всем мире заболевания, вызываемые пневмококками, представляют собой одну из серьезнейших проблем для общественного здравоохранения. К настоящему времени выделено более 90 различных серотипов (иммунологических вариантов) пневмококков. Все они потенциально патогенны, тяжелые инфекции вызывают примерно два десятка из них. По статистике, до 70% всех пневмоний, около 25% средних отитов, 5–15% гнойных менингитов, около 3% эндокардитов вызываются пневмококком[8–10].
Гемофильная палочка (H. influenzae) длительное время считалась возбудителем гриппа, так как инфекция, вызываемая этим патогеном, наиболее часто протекает в форме ринофарингита или ОРВИ без специфических особенностей, что и обусловило название микроорганизма. Но H. influenzae способна вызывать и тяжелые заболевания (пневмонии, обострения ХОБЛ, синусит, менингит, сепсис)[11].
M. catarrhalis участвует в развитии респираторных инфекций, особенно у детей. Возбудитель часто присутствует в комбинации с гемофильной палочкой и пневмококком. Это второй по частоте возбудитель бактериальных обострений ХОБЛ[12].
β-гемолитический стрептококк группы А (пиогенный стрептококк, S. pyogenes) становится причиной множества заболеваний, таких как ангина, фарингит, скарлатина, рожистое воспаление, паратонзиллярный абсцесс, флегмона шеи, сепсис, отит, менингит, стрептодермия, ревматизм, гломерулонефрит[13].
УЧЕТ УРОВНЯ УСТОЙЧИВОСТИ ВОЗБУДИТЕЛЯ В СТРАНЕ И РЕГИОНЕ
Основным ограничением эффективности антимикробных препаратов является способность микроорганизмов формировать резистентность (устойчивость) к их действию. Этот естественный процесс многократно ускоряется при необоснованном и избыточном применении антибиотиков в качестве средств профилактики и самолечения. Угроза формирования и распространения антибактериальной резистентности была осознана научным сообществом практически сразу же после появления первых антибиотиков, однако в течение многих лет проблема решалась за счет разработки и внедрения новых препаратов, преодолевающих устойчивость[14]. По некоторым прогнозам, потери, ассоциированные с антибиотикорезистентностью, к 2050 г. составят около 100 трлн долларов США. Еще более пугающими выглядят потери человеческих жизней — до 10 млн в год[15].
Важной проблемой, связанной с возбудителями внебольничных инфекций дыхательных путей, в течение последних 10 лет в РФ является устойчивая тенденция увеличения доли резистентных штаммов пневмококков к β-лактамам и макролидам. Так, чувствительность пневмококков к пенициллину в последние годы снизилась до 96,3%, к цефтриаксону — до 91,9%. Согласно информации, полученной с помощью открытой онлайн-платформы анализа данных по резистентности к антибиотикам (AMRmap), в настоящее время в России при внебольничных инфекциях устойчивость пневмококков (как основного бактериального возбудителя инфекций дыхательных путей) к современным макролидам уже превышает 30%[16].
Основной механизм резистентности H. influenzae связан с продукцией β-лактамаз, гидролизующих аминопенициллины. Как показывает одно из последних исследований, уровень устойчивости к аминопенициллинам среди клинических штаммов H. influenzae в РФ составляет 19%[17].
В настоящее время подавляющее большинство клинических изолятов M. catarrhalis продуцируют β-лактамазы, которые ингибируются клавулановой кислотой[18].
Роль индивидуальных факторов риска инфицирования резистентным возбудителем
Микробный пейзаж внебольничных инфекций может включать индивидуальные устойчивые штаммы микроорганизмов. Именно поэтому при выборе того или иного антибиотика необходимо прогнозировать риски наличия резистентных патогенов. Методология такого прогнозирования заключается в стратификации пациентов по факторам риска. Ключевыми параметрами стратификации выступают прием антибиотиков в течение последних 3 месяцев и наличие сопутствующей патологии. Такой подход позволяет изначально сделать выбор в пользу препаратов, способных преодолеть возможные механизмы резистентности возбудителей[19].
Факторы риска инфицирования лекарственно-устойчивыми возбудителями[19]:
- прием антибиотиков в течение предшествующих 3 месяцев;
- госпитализация в течение предшествующих 3 месяцев;
- пребывание в домах длительного ухода;
- лечение в дневных стационарах поликлиник;
- контакт с детьми, посещающими дошкольные учреждения;
- иммунодепрессивные заболевания/состояния;
- множественная коморбидность;
- хронические заболевания органов дыхания (бронхиальная астма, ХОБЛ);
- СД;
- алкоголизм;
- лечение гемодиализом;
- недавние путешествия.
ОЦЕНКА ЭФФЕКТИВНОСТИ И ПРОДОЛЖИТЕЛЬНОСТЬ АНТИМИКРОБНОЙ ТЕРАПИИ
Первоначальная оценка эффективности терапии должна проводиться через 48–72 ч после начала лечения. Целесообразен телефонный контакт с пациентом на следующий день после начала терапии. Критериями эффективности в эти сроки являются снижение температуры, уменьшение симптомов интоксикации и других проявлений (например, одышки). Если у пациента сохраняются высокая температура и интоксикация или симптоматика прогрессирует, лечение следует признать неэффективным. В этом случае необходимо пересмотреть тактику антибактериальной терапии и повторно оценить целесообразность госпитализации пациента[20].
До настоящего времени оптимальная длительность лечения пациентов с респираторными инфекциями остается предметом обсуждения. Например, при нетяжелой внебольничной пневмонии ключевым критерием отмены антибактериальной терапии считается стойкая нормализация температуры тела на протяжении 48–72 ч при положительной динамике других симптомов и отсутствии признаков клинической нестабильности. При таком подходе длительность лечения обычно не превышает 7 дней.
К критериям адекватности антибактериальной терапии эксперты относят стойкое снижение температуры тела ≤ 37,2 °С, отсутствие симптомов интоксикации, дыхательной недостаточности (частота дыхательных движений (ЧДД) менее 20/мин), гнойной мокроты; положительную динамику показателей периферической крови (количество лейкоцитов в крови < 10 × 109/л, нейтрофилов < 80%, юных форм < 6%), а также отсутствие отрицательной динамики на рентгенограмме[20].
Сохранение отдельных клинических, лабораторных или рентгенологических признаков пневмонии не является абсолютным показанием к продолжению антибактериальной терапии или ее модификации. В подавляющем большинстве случаев их разрешение происходит самостоятельно или под влиянием симптоматической терапии. Длительно сохраняющийся субфебрилитет не является признаком бактериальной инфекции.
Рентгенологические проявления при пневмонии разрешаются медленнее клинических симптомов, поэтому контрольная рентгенография грудной клетки не может служить критерием для определения длительности антибактериальной терапии. Вместе с тем при длительно сохраняющейся клинической, лабораторной и рентгенологической симптоматике необходимо провести дифференциальную диагностику с такими заболеваниями, как рак легкого, туберкулез, застойная сердечная недостаточность и др.[21].
СООТВЕТСТВИЕ ПРОВОДИМОЙ АНТИМИКРОБНОЙ ТЕРАПИИ КЛИНИЧЕСКИМ РЕКОМЕНДАЦИЯМ
Наибольшее количество антимикробных препаратов назначается врачами первичного звена, прежде всего для лечения острых респираторных инфекций. Поэтому определяющие составляющие сдерживания антибиотикорезистентности — ограничение потребления антибиотиков в амбулаторной практике и рационализация их использования. Этому способствует в немалой степени как обучение врачей первичного звена здравоохранения основам рационального применения антибиотиков, так и неукоснительное соблюдение врачами рекомендаций по выбору антибиотика с учетом ситуации с антибиотикорезистентностью в стране и регионе, сопутствующей патологии, оценки у пациента риска инфекции, вызванной антибиотикорезистентными возбудителями, а также определение адекватного дозирования антибиотика.
Согласно Федеральному закону № 489-ФЗ от 25.12.2018 г. «О внесении изменений в статью 40 Федерального закона «Об обязательном медицинском страховании в Российской Федерации» и Федеральный закон «Об основах охраны здоровья граждан в Российской Федерации» по вопросам клинических рекомендаций», клинические рекомендации, утвержденные Минздравом РФ, являются обязательными при оказании медицинской помощи населению. Оценка качества лечения напрямую зависит от степени выполнения клинических рекомендаций. Клинические рекомендации разрабатываются национальной профессиональной некоммерческой организацией, утвержденной для этих целей, и одобряются научным советом. Минздрав определил перечень заболеваний, по которым должны быть разработаны (или пересмотрены) клинические рекомендации.
Так, Российское респираторное общество — профессиональная организация, определенная для разработки клинических рекомендаций по внебольничным пневмониям, ХОБЛ, бронхиальной астме. Национальная медицинская ассоциация оториноларингологов утверждена Минздравом РФ в качестве разработчика клинических рекомендаций по ЛОР-болезням. Информация о действующих клинических рекомендациях расположена на официальном сайте Министерства здравоохранения Российской Федерации[22].
В рекомендациях последнего пересмотра отмечается изменение парадигмы антибактериальной терапии внебольничных инфекций нижних дыхательных путей и ЛОР-органов. Так, макролиды потеряли позиции стартовых препаратов в подавляющем большинстве случаев. Они могут быть рекомендованы при непереносимости пациентом β-лактамных антибиотиков или при подозрении на инфекцию, вызванную атипичными возбудителями.
Во всем мире отмечается неуклонный рост резистентности бактериальных возбудителей к незащищенным аминопенициллинам. К настоящему времени эти препараты утратили свое значение в лечении многих инфекций, в этиологической структуре которых преобладают бактерии с высоким уровнем вторичной резистентности, прежде всего за счет продукции β-лактамаз. Это объясняется тем, что аминопенициллины, как и природные пенициллины, подвержены гидролизу всеми известными β-лактамазами. Незащищенные аминопенициллины могут рассматриваться в качестве препаратов стартовой терапии только у пациентов без факторов риска инфицирования лекарственно-устойчивыми возбудителями[23–27].
В клинических рекомендациях по лечению пневмонии у взрослых и детей отсутствуют некоторые пероральные цефалоспорины III поколения (цефиксим, цефтибутен). ВОЗ не рекомендует использовать данные антибиотики для лечения респираторных инфекций. Это обусловлено низкой активностью указанных препаратов в отношении главного возбудителя респираторных инфекций — пневмококка. Согласно заключению Европейского комитета по тестированию антимикробной чувствительности, все штаммы пневмококка могут оцениваться как резистентные к цефиксиму, поэтому определение чувствительности пневмококка к цефиксиму не рекомендуется[28, 29].
В рекомендациях по лечению респираторных инфекций важное место занимает амоксициллин/клавуланат. Этот препарат успешно используется в клинической практике на протяжении почти 40 лет. За этот период он надежно доказал свою высокую эффективность и безопасность у детей и взрослых.
Препарат обладает высокой стабильной активностью в отношении основных бактериальных возбудителей инфекций респираторной системы и ЛОР-органов: S. pneumoniae, S. aureus, H. influenzae, M. catarrhalis, анаэробов (табл. 1). Амоксициллин/клавуланат — препарат выбора у больных с факторами риска инфицирования лекарственно-устойчивыми возбудителями и/или высокой вероятностью участия β-лактамаз-продуцирующих возбудителей[23–29].
Таблица 1
Амоксициллин/клавуланат (Амоксиклав) обладает высокой активностью в отношении основных возбудителей респираторных инфекций[28]
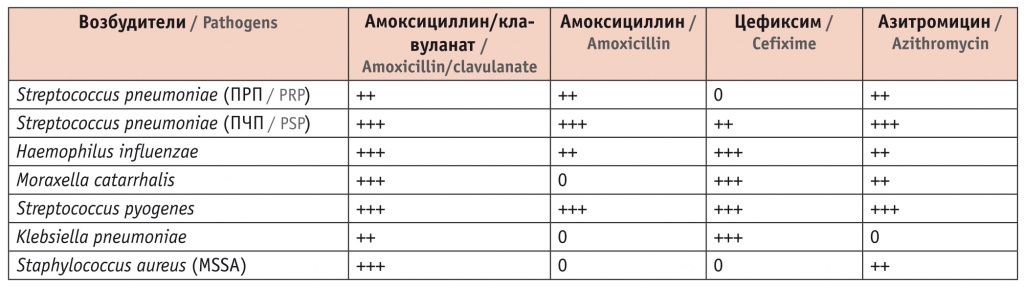
Примечание: +++ — высокая активность, ++ — хорошая активность, 0 — отсутствие клинически значимой активности, ПРП — пенициллин-резистентные пневмококки, ПЧП — пенициллин-чувствительные пневмококки, MSSA — метициллин-чувствительные Staphylococcus aureus.
Приведем два клинических примера, иллюстрирующих роль амоксициллина/клавуланата в лечении респираторных инфекций.
КЛИНИЧЕСКИЙ ПРИМЕР 1
Пациент Т., 59 лет, обратился к врачу-терапевту с жалобами на повышение температуры тела до 37,8 °С, кашель с желтой мокротой, слабость.
Из анамнеза известно, что заболел остро 4 дня назад, когда отметил повышение температуры тела до 37,5 °С. Самостоятельно принимал жаропонижающие препараты, однако температура не снижалась. Через 2 дня присоединились кашель и боль в грудной клетке слева при глубоком дыхании.
Пациент не курит, алкоголем не злоупотребляет. Профессиональных вредностей нет. Аллергоанамнез не отягощен.
В анамнезе: АГ и СД 2 типа (постоянно принимает глибенкламид).
При осмотре: состояние средней тяжести, температура тела — 37,5 °С. ЧДД — 20/мин. При перкуссии незначительное притупление перкуторного звука в нижних отделах левого легкого. Дыхание везикулярное, слева в нижних отделах несколько ослаблено, там же выслушивается крепитация. Сатурация — 96%.
Тоны сердца приглушены, ритмичные. ЧСС — 78 уд/мин, АД — 130/80 мм рт. ст.
Клинический анализ крови: лейкоциты — 10,7 × 109/л, нейтрофилы сегментоядерные — 70%, нейтрофилы палочкоядерные — 4%, СОЭ — 28 мм/ч.
Биохимический анализ крови: глюкоза — 4,5 ммоль/л, СРБ — 115 мг/л, общий белок — 76 мг/л, креатинин — 81 мкмоль/л.
Анализ мочи без особенностей.
При рентгенографии органов грудной клетки на фоне нормального легочного рисунка в нижних отделах левого легкого выявлено затенение (инфильтрация) легочной ткани (рис. 1).
Рис. 1. Рентгенограмма пациента Т. при первичном обращении в прямой и боковой проекции. Иллюстрации Яниной А.А.
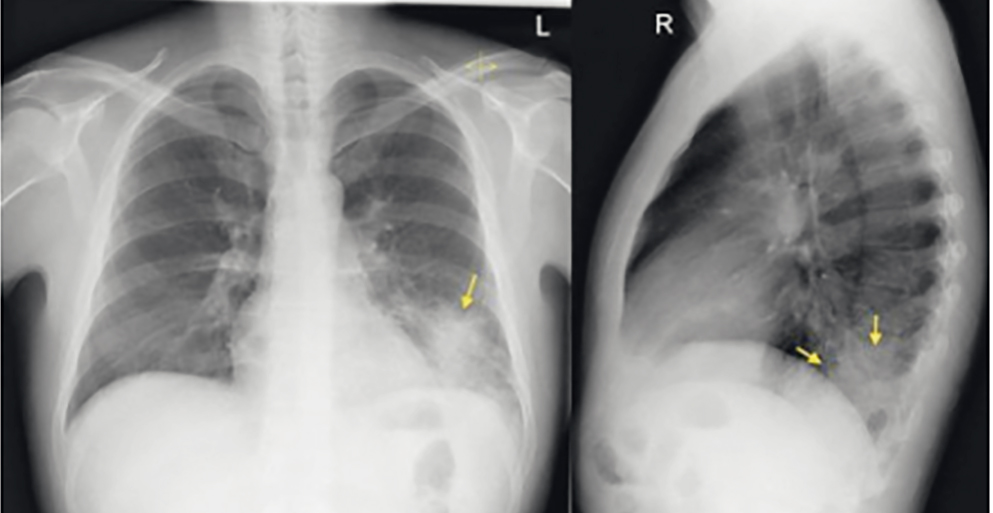
Данные анамнеза, осмотра и выполненного обследования позволили установить диагноз: Внебольничная пневмония нижней доли левого легкого нетяжелого течения неуточненной этиологии.
Основываясь на рекомендациях по ведению лиц с внебольничной пневмонией и учитывая наличие у больного СД, являющегося фактором риска инфицирования лекарственно-устойчивым возбудителем пневмонии, врач назначил пациенту принимать в течение 7 дней амоксициллин/клавуланат (Амоксиклав® Квиктаб) в дозе 1000 мг 2 раза в день (табл. 2)[22].
Таблица 2
Антибактериальная терапия внебольничной пневмонии у взрослых[22]
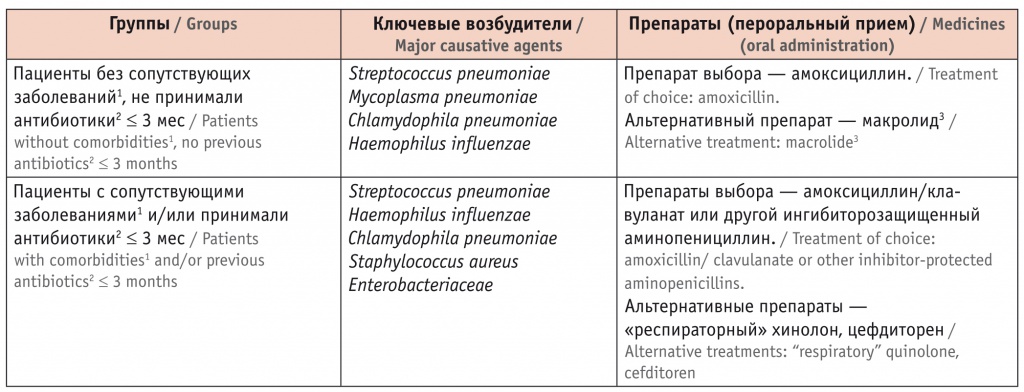
1 Хроническая обструктивная болезнь легких, сахарный диабет, хроническая сердечная недостаточность, хроническая болезнь почек, цирроз печени, алкоголизм, наркомания, истощение.
2 Прием ≥ 2 дней.
3 Нецелесообразно использование в регионах с уровнем резистентности > 25% (Москва, Санкт-Петербург).
При осмотре через 3 дня отмечено улучшение состояния больного. Нормализовалась температура тела, исчезли слабость и боль в грудной клетке при дыхании, прекратился кашель. При аускультации некоторое ослабление дыхания слева в нижних отделах.
При рентгенографии органов грудной клетки, выполненной через 14 дней, отсутствовала инфильтрация на фоне некоторого усиления легочного рисунка, корни легких структурны, синусы свободны (рис. 2).
Рис. 2. Рентгенограмма пациента Т. в прямой и боковой проекции после проведенного курса лечения. Иллюстрации Яниной А.А.
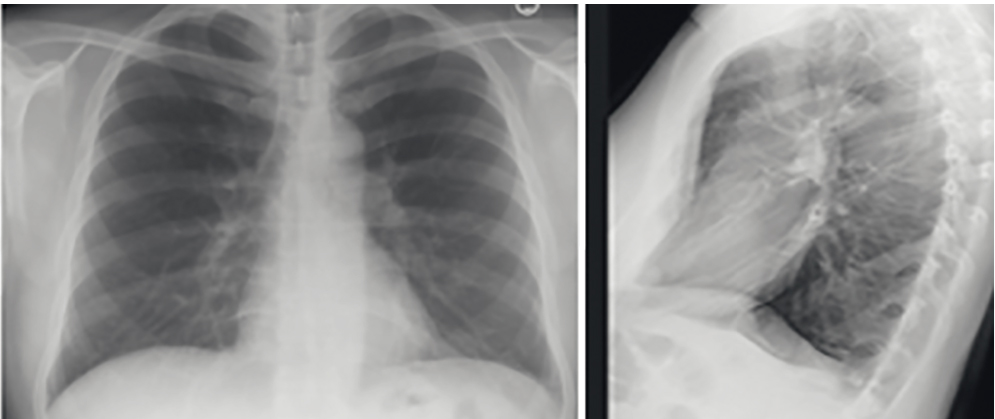
Пациенту рекомендованы наблюдение участковым терапевтом, эндокринологом, пульмонологом в течение года, вакцинация против гриппа, пневмококка.
КЛИНИЧЕСКИЙ ПРИМЕР 2
Пациент К., 53 лет, по профессии строитель-монтажник, обратился к врачу-терапевту с жалобами на сильную одышку, усиливающуюся при минимальной нагрузке, постоянный кашель, отделение мокроты зеленого цвета, слабость.
Из анамнеза известно, что кашель с небольшим количеством мокроты беспокоит больного на протяжении 25 лет, в течение 15 лет отмечает одышку при привычных физических нагрузках. Около 10 лет назад диагностирована ХОБЛ (объем форсированного выдоха за 1-ю секунду — 55%). Пациенту были рекомендованы ингаляции пролонгированного М-холинолитика. Ухудшения самочувствия отмечает 2–3 раза в год. Они проявляются усилением кашля, увеличением количества мокроты.
Настоящее ухудшение состояния началось 4 дня назад после переохлаждения, когда отметил резкое усиление одышки, кашля, отделение вязкой мокроты желто-зеленого цвета, слабость, снижение аппетита.
Пациент курит около 35 лет по 1,5–2 пачки в день. Имеет профессиональные вредности (работа на холоде, контакт с красками, растворами, строительными материалами).
При осмотре: состояние удовлетворительное. Кожные покровы обычной окраски, повышенной влажности. Температура тела — 37,5 °С. Бочкообразная форма грудной клетки. Передне-задний размер грудной клетки увеличен. Вспомогательные мышцы участвуют в акте дыхания. ЧДД — 26/мин. При перкуссии коробочный звук над всей поверхностью грудной клетки. При аускультации дыхание значительно ослаблено над всеми отделами, выслушиваются сухие свистящие и жужжащие хрипы. Сатурация — 95%. Тоны сердца приглушены, ЧСС — 90 в мин, АД — 145/80 мм рт. ст.
Клинический анализ крови: гемоглобин — 17,8 г/л, лейкоциты — 10,5 × 109/л, (в формуле — без особенностей), тромбоциты — 332 × 109/л, СОЭ — 21 мм/ч.
Анализ мокроты: нейтрофилы густо покрывают поле зрения.
При рентгенографии органов грудной клетки данные об очаговых или инфильтративных изменениях не получены.
У пациента диагностирована ХОБЛ, преимущественно бронхитический вариант, среднетяжелая степень бронхиальной обструкции, обострение.
Основываясь на рекомендациях по ведению лиц с ХОБЛ и учитывая степень бронхиальной обструкции, врач назначил пациенту на 10 дней амоксициллин/клавуланат (Амоксиклав Квиктаб) в дозе 1000 мг 2 раза в день (табл. 3).
Таблица 3
Антибактериальная терапия инфекционного обострения хронической обструктивной болезни легких (ХОБЛ)[23]
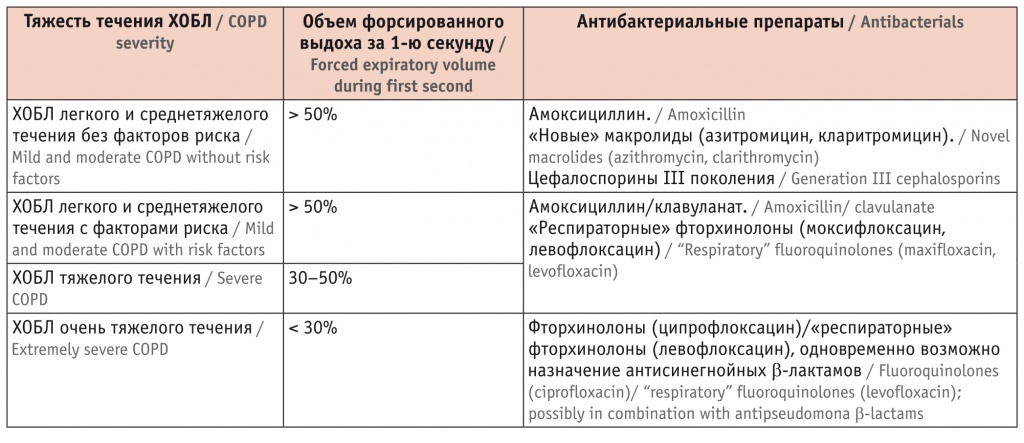
При осмотре через 3 недели состояние больного существенно улучшилось. Нормализовалась температура тела. Сохраняется небольшая одышка при умеренной физической нагрузке. Мокрота приобрела светлую окраску, количество ее уменьшилось. В легких жужжащие хрипы отсуттвуют, сохраняются единичные сухие.
Пациенту рекомендованы отказ от курения, вакцинация против гриппа, пневмококка, ингаляция «двойного» бронхолитика длительного действия.
ЗАКЛЮЧЕНИЕ
Ведение пациентов с внебольничными инфекциями дыхательных путей должно соответствовать клиническим рекомендациям, утвержденным Минздравом РФ. Основными принципами успешной антимикробной терапии являются точное установление диагноза, выбор стартового антибиотика с учетом возбудителя, участвующего в развитии заболевания, уровня резистентности в стране и регионе, а также индивидуальных факторов риска инфицирования резистентными возбудителями; соблюдение точной дозировки препарата; корректная оценка эффективности и продолжительности антимикробной терапии.
Поступила: 15.06.2020
Принята к публикации: 06.07.2020
ММА имени И.М. Сеченова, НИИ урологии МЗ РФ, Москва
Инфекции мочевыводящих путей
Верхние отделы
Пиелонефрит острый и хронический
Пиелонефрит острый и хронический
Нижние отделы
Цистит острый и рецидивирующий
Простатит острый и хронический
Уретрит негонококковый
Симптомы инфекций мочевыводящих путей
- Лихорадка свыше 38°С
- Ознобы
- Интоксикация
- Боли в пояснице
- Дизурия
- Болезненность внизу живота
- Гематурия
Симптомы простатита:
- Затрудненное и частое мочеиспускание
- Задержки мочеиспускания
- Ослабление струи мочи
- Тупые боли в промежности
Острый цистит
Этиология:
В 90% – кишечная палочка, в остальных случаях – другие грамотрицательные бактерии
Симптомы:
- Рези и жжение при мочеиспускании
- Частое мочеиспускание
- Позывы на мочеиспускание
- Дискомфорт или болезненность внизу живота
- Гематурия
Диагностика:
- Характерная клиническая картина
- Экспресс–тест – полоски:
Лейкоциты +
Эритроциты +
Нитриты + - Микроскопия осадка:
Лейкоциты
Эритроциты
Бактерии - Диагностически значимой является бактериурия >=102 КОЕ/мл.
Микробиологическая диагностика при остром цистите у небеременных женщин нецелесообразна
Лечение:
- Амбулаторное
- Достаточный прием жидкости (не менее 1,5 л в сутки)
- Избегать половых контактов в течение 5–7 дней
- Антибактериальная терапия
Антибактериальная терапия
Внутрь в течение 3 дней:
- Офлоксацин 200 мг с интервалом 12 ч
- Норфлоксацин 400 мг с интервалом 12 ч
- Ципрофлоксацин 250 мг с интервалом 12 ч
- Левофлоксацин 500 мг с интервалом 24 ч
- Пефлоксацин 400 мг х 2 р с интервалом 12 ч
Альтернатива:
- Ко–тримоксазол 960 мг с интервалом 12 ч
Внутрь в течение 5 дней:
- Амоксициллин/клавуланат 375 мг с интервалом 8 ч
- Цефуроксим аксетил 250 мг с интервалом 12 ч
Альтернатива:
- Фурагин 100 мг с интервалом 6–8 ч
- Фурадонин 100 мг с интервалом 6 ч
Эффективен в однократной дозе:
- Фосфомицина трометамол 3 г
В настоящее время доказана эффективность коротких курсов (3 дня) антибактериальной терапии. При наличии факторов риска целесообразно применение 7–дневного курса терапии
Факторы риска:
- Возраст старше 65 лет
- Беременность
- Сахарный диабет
- Рецидив цистита
Острый цистит у беременных
Микробиологическая диагностика обязательна:
- До начала терапии
- После окончания терапии
Антибактериальная терапия
Внутрь в течение 7 дней:
- Амоксициллин/клавуланат 375 мг с интервалом 8 ч
- Цефуроксим аксетил 250 мг с интервалом 12 ч
Альтернатива:
- Фурагин 100 мг с интервалом 6–8 ч
- Фурадонин 100 мг с интервалом 6 ч
- Фосфомицина трометамол 3 г (однократно)
Антибактериальные препараты, которые противопоказаны при беременности:
- Фторхинолоны
- Ко–тримоксазол
- Доксициклин
Рецидивирующий цистит
Диагностика: см. острый цистит
Дополнительное обследование:
- Микробиологическое исследование мочи до и после лечения
- УЗИ почек и органов малого таза
- Глюкоза в крови
Лечение:
- Достаточный прием жидкости
- Поддержание низкого рН мочи (клюква, брусника, метионин)
- Опорожнение мочевого пузыря сразу после полового контакта
Антибактериальная терапия
Внутрь в течение 7–дней:
- Офлоксацин 100 или 200 мг с интервалом 12 ч
- Левофлоксацин 500 мг с интервалом 24 ч
- Норфлоксацин 400 мг с интервалом 12 ч
- Ципрофлоксацин 100 или 250 мг с интервалом 12 ч
- Ломефлоксацин 400 мг с интервалом 24 ч
- Пефлоксацин 400 мг с интервалом 12 ч
Альтернатива:
- Цефуроксим аксетил 250 мг с интервалом 12 ч
- Амоксициллин/клавуланат 375 мг с интервалом 8 ч
- Цефиксим 400 мг с интервалом 24 ч
Профилактика рецидивов
При обострениях, связанных с половым актом – прием одной дозы антибиотика после коитуса:
- Пефлоксацин 400 мг
- Норфлоксацин 400 мг
- Ципрофлоксацин 250 мг
- Ко–тримоксазол 480 мг
Острый простатит
Симптомы:
- Лихорадка, ознобы, интоксикация
- Боли в промежности, в пояснице или над лобком
- Жжение и боль при мочеиспускании
- Затрудненное и учащенное мочеиспускание
- Ослабление струи мочи
- Иногда – слизисто–гнойные выделения из уретры
Диагностика:
- Общий анализ мочи
- Лейкоциты (>10 в п/зр) и бактерии в первой и средней порциях мочи при трехстаканной пробе
- В посеве мочи – бактериурия >103 КОЕ/мл
- УЗИ предстательной железы
Лечение:
- Постельный режим
- Гидратация
- Анальгетики и спазмолитики
- Избегать половых контактов
- Антибактериальная терапия
Антибактериальная терапия (в течение 3–4 недель)
При тяжелом течении антибиотики внутривенно (Через 3-5 дней после улучшения симптоматики возможен перевод на пероральную терапию.) :
- Левофлоксацин 500 мг с интервалом 24 ч
- Моксифлоксацин 400 мг с интервалом 24 ч
- Офлоксацин 200 мг с интервалом 12 ч
- Ципрофлоксацин 200 мг с интервалом 12 ч
- Пефлоксацин 400 мг с интервалом 12 ч
При нетяжелом течении антибиотики внутрь:
- Левофлоксацин 500 мг с интервалом 24 ч
- Моксифлоксацин 400 мг с интервалом 24 ч
- Норфлоксацин 400 мг с интервалом 12 ч
- Офлоксацин 400 мг с интервалом 12 ч
- Пефлоксацин 400 мг с интервалом 12 ч
- Ципрофлоксацин 500 мг с интервалом 12 ч
- Ко–тримоксазол (В последние годы наблюдается снижение чувствительности возбудителей к ко-тримоксазолу.) 960 мг с интервалом 12 ч
Хронический бактериальный простатит
Симптомы:
- Дискомфорт и болезненность в промежности, крестце
- Дискомфорт и болезненность при мочеиспускании и эякуляции
- Учащенное или затрудненное мочеиспускание
- Ослабление струи мочи
- Гематоспермия
- Рецидивирующие инфекции мочевыводящих путей
Диагностика:
- Общий анализ мочи
- Лейкоциты (>10 в п/зр) и бактерии в третьей порции мочи и секрете простаты при четырехстаканной пробе по методу Meares и Stamey
- В посеве мочи – бактериурия >103 КОЕ/мл
- УЗИ предстательной железы
Лечение:
- Антибактериальная терапия
- Нестероидные противовоспалительные препараты
- Физиотерапия
- Диета с исключением острой пищи и алкоголя
Антибактериальная терапия
Внутрь в течение 30 дней:
- Левофлоксацин 500 мг с интервалом 24 ч
- Моксифлоксацин 400 мг с интервалом 24 ч
- Норфлоксацин 400 мг с интервалом 12 ч
- Офлоксацин 400 мг с интервалом 12 ч
- Пефлоксацин 400 мг с интервалом 12 ч
- Ципрофлоксацин 500 мг с интервалом 12 ч
Альтернатива:
- Ко–тримоксазол 960 мг с интервалом 12 ч
Микробиологический контроль через 1–2 недели после окончания лечения. При необходимости – повторный курс в течение 2–4 недель.
Бессимптомная бактериурия
Критерии диагноза:
Бактериурия 105 КОЕ/мл и выше в двух пробах мочи, полученных с интервалом 3–7 дней при отсутствии клинических и лабораторных признаков инфекции мочевыводящих путей.
Показания к антибактериальной терапии:
- Девочки подросткового возраста
- Беременные
- Предстоящая операция на органах мочевыделительной системы
- Сахарный диабет
Антибактериальная терапия
Внутрь в течение 3 дней (У больных сахарным диабетом целесообразен 5-7-дневный курс терапии.) :
- Амоксициллин/клавуланат 375 мг с интервалом 8 ч (При терапии амоксициллином/клавуланатом показан 5-дневный курс терапии.)
- Цефуроксим аксетил 250 мг с интервалом 12 ч
- Фурагин 100 мг с интервалом 6–8 ч
- Триметоприм 100 мг с интервалом 12 ч
- Офлоксацин 200 мг с интервалом 12 ч (не применяется у беременных и пациентов моложе 16 лет)
- Норфлоксацин 400 мг с интервалом 12 ч (не применяется у беременных и пациентов моложе 16 лет)
- Ко–тримоксазол 960 мг с интервалом 12 ч (не применяется в последнем триместре беременности)
У беременных после лечения целесообразно исследовать мочу 1 раз в месяц для выявления возможных рецидивов.
Пиелонефрит
Симптомы:
- Лихорадка >= 38°С, ознобы
- Интоксикация
- Боли в пояснице в покое, при пальпации и поколачивании
Диагностика:
- Экспресс–тест – полоски:
Лейкоциты ++
Эритроциты ±
Нитриты + - Микроскопия осадка:
Лейкоциты
Эритроциты
Цилиндры
Бактерии - Диагностически значимой является бактериурия >=104 КОЕ/мл
- Анализ крови
лейкоцитоз
сдвиг формулы влево
СРБ
креатинин - Микробиологическое исследование мочи
- Гемокультура
- УЗИ почек и органов малого таза
Лечение:
- Амбулаторное или стационарное
- Ограничение двигательной активности
- Достаточный питьевой режим
- Противовоспалительные средства
- Антибактериальные средства
Антибактериальная терапия пиелонефрита
Острый или обострение хронического (вне стационара)
Острый или обострение хронического (вне стационара)
Антибиотики внутрь в течение 10–14 дней (Контрольное бактериологическое исследование мочи проводится после окончания антибактериальной терапии. При персистировании возбудителя показано проведение дополнительного 2-3-недельного курса антибактериальной терапии с учетом чувствительности микрофлоры.) :
- Пефлоксацин 400 мг с интервалом 12 ч
- Офлоксацин 200 мг с интервалом 12 ч
- Левофлоксацин 500 мг с интервалом 24 ч
- Моксифлоксацин 400 мг с интервалом 24 ч
- Ципрофлоксацин 250 мг с интервалом 12 ч
- Амоксициллин/клавуланат 625 мг с интервалом 8 ч
- Цефуроксим/аксетил 250 мг с интервалом 8 ч
- Ломефлоксацин 400 мг с интервалом 24 ч
- Норфлоксацин 400 мг с интервалом 12 ч
- Цефиксим 400 мг с интервалом 24 ч
- Цефтибутен 400 мг с интервалом 24 ч
- Ко–тримоксазол 960 мг с интервалом 12 ч
Обострение хронического (в стационаре)
Антибиотики парентерально (Внутривенное введение антибиотиков осуществляется в течение 3-5 дней до нормализации температуры, после чего больной переводится на пероральный препарат до окончания полного срока терапии. При применении парентеральных цефалоспоринов больной может быть переведен на пероральный фторхинолон, например, офлоксацин в дозе 200 мг с интервалом 12 ч, левофлоксацин 500 мг с интервалом 24 ч, или пефлоксацин 400 мг с интервалом 12 ч.) . Длительность терапии – 2–3 недели1:
- Пефлоксацин 400 мг с интервалом 12 ч
- Офлоксацин 200 мг с интервалом 12 ч
- Ципрофлоксацин 200 мг с интервалом 12 ч
- Левофлоксацин 500 мг с интервалом 24 ч
- Моксифлоксацин 400 мг с интервалом 24 ч
- Цефтриаксон 2 г с интервалом 24 ч
- Цефотаксим 2 г с интервалом 8 ч
- Цефтазидим 1 г с интервалом 8 ч
- Цефепим 1–2 г с интервалом 12 ч
- Амоксициллин/клавуланат 1,2 г с интервалом 8 ч.
Резюме.
СВЕДЕНИЯ О СОСТАВЕ
РАБОЧЕЙ ГРУППЫ, РАЗРАБАТЫВАВШЕЙ РЕКОМЕНДАЦИИ:
1.
Современные проблемы и распространение
антибиотикорезистентности в Российской Федерации
Представители порядка Enterobacterales в
совокупности являются наиболее частыми возбудителями нозокомиальных инфекций в
России на протяжении последних лет. В 2015-2016
гг. доля изолятов Enterobacterales среди всех бактериальных возбудителей нозокомиальных
инфекций составляла 48,2%, в 2020 г. она достигла 53,2%. Энтеробактерии характеризуются высоким уровнем устойчивости к антимикробным препаратам. На сегодняшний день
наибольшее клиническое значение имеет высокая распространенность резистентности
нозокомиальных штаммов энтеробактерий к цефалоспоринам и карбапенемам. По данным ранее проведенных исследований,
устойчивость к цефалоспоринам среди госпитальных штаммов энтеробактерий в России достигла уровня >80%,
главным образом вследствие эпидемического распространения штаммов, продуцирующих бета-лактамазы расширенного
спектра действия (БЛРС), преимущественно CTX-M-15. Результаты предыдущих
исследований показали отчетливую тенденцию к повышению уровня резистентности к карбапенемам среди нозокомиальных
энтеробактерий, в том числе опосредованную продукцией карбапенемаз. Наиболее
частыми видами энтеробактерий, вызывающими нозоко- миальные инфекции в 2018-2019
гг., являлись K. pneumoniae (26,7%) и E. coli (14,6%). Большинство нозокомиальных изолятов
энтеробактерий в 2018-2019
гг. являлись резистентными (в подавляющем большинстве за счет продукции
БЛРС) к оксиимино-бета- лактамам:
к цефотаксиму – 74,1% (K. pneumoniae – 88,4%,
E. coli – 64,4%), цефтазидиму – 63,0% (K. pneumoniae – 84,0%, E. coli – 45,7%), цефепиму – 60,9% (K. pneumoniae – 83,7%,
E. coli – 41,0%) и азтреонаму – 65,6% (K. pneumoniae – 83,9%, E. coli – 55,4%) [https://amrmap.ru/?id=vmgwR36vt04vt10].
В 2020 г. устойчивость K. pneumoniae и E. coli к цефтазидиму
составила 85,3% и 45,1% соответственно. Резистентность нозокомиальных изолятов энтеробактерий в 2018-2019 гг. к
карбапенемам – имипенему, меропенему и эрта- пенему составила соответственно 18,8% (K. pneumoniae – 31,1%, E. coli – 4,3%), 20,3% (K. pneumoniae – 35,1%, E. coli – 4,4%)
и 36,6% (K. pneumoniae – 63,8%, E. coli – 6,5%)
[https://amrmap.ru/?id=vmgwR36vt04vt10].
В 2020 г. частота устойчивости к карбапенемам
повысилась: к меропенему и эртапенему были резистентны 50,4% и 68,7% штаммов K. pneumoniae
и 4,7% и 5,8% штаммов E. coli, соответственно.
В 2018-2019 гг. у 31,8% изоля- тов энтеробактерий была выявлена продукция
карбапенемаз (K. pneumoniae – 55,6%, E. Coli – 0,04%). Из них большинство
(62,9%) относились к молекулярному классу D группы OXA- 48; 27,3% относились к классу B группы NDM-1; 4,4% – к классу А группы KPC; 3,8% од- новременно продуцировали NDM и OXA-48
карбапенемазы, 1,1% — одновременно KPC и OXA-48
карбапенемазы [11, https://amrmap.ru/?id=6ILer58j205j210].
Большинство карбапенемазопродуцирующих изолятов K. pneumoniae относились
к международным клонам высокого
риска: CG395, CG11, CG147 и CG307. Наиболее высокую активность в отношении
нозокомиальных энтеробактерий показали цефтазидим/авибактам (доля резистентных
к нему изолятов, в основном за счет
продукции карбапенемаз группы NDM, в 2018-2019 гг. составила 10,4%) и азтреонам/авибактам (МПК50 и МПК90
составили 0,06 и 0,25 мг/л, соответственно) [https://amrmap.ru/?id=SPzyV13kf44kf06]. Среди не-β-лактамных
антибиотиков наиболее высокую активность in
vitro проявлял колистин, резистентными к которому в 2018-2019 гг. были 14,3% изолятов
[https://amrmap.ru/?id=frRma55ri45ri06]. Отмечена
относительно высокая активность тигециклина в отношении
E. coli (6,7% резистентных изолятов) при достаточно умеренной его
активности в отношении K. pneumoniae (МПК50
и МПК90 1 и 4 мг/л,
соответственно) [https://amrmap.ru/?id=0LvZ4117M487M06].
Проблемой
также является не только антибиотикорезистентность нозокомиальных штаммов энтеробактерий, но и рост
устойчивости штаммов, вызывающих внебольничные
инфекции. Так, в 2018-2019 гг. к цефотаксиму, цефтазидиму и цефепиму
были устойчивы 32,2%, 22,6% и 19,7%
изолятов E.coli, выделенных у
взрослых пациентов с внебольничны- ми
инфекциями, в основном за счет продукции БЛРС; частота устойчивости к
амоксицил- лину/клавуланату
составляла 41,4%, к ципрофлоксацину – 37,2%, к тигециклину – 7,0%, к цефтолозану/тазобактаму – 3,8%, к эртапенему – 1,0% [https://amrmap.ru/?id=DWtlP37nc22nc08].
В 2020 г. была ситуация с антибиотикорезистентностью внебольничных изолятов значимо
не изменилась.
– 40,4%,
цефтолозану/тазобактаму – 42,9%, амикацину – 46,7%, меропенему – 52,5%, цефе- пиму – 52,8%, цефтазидиму – 55,0%,
имипенему – 57,9%, пиперациллину/тазобактаму –
61,1%, ципрофлоксацину – 63,2% [https://amrmap.ru/?id=VsCh7022q112q09]. У 42,4% изолятов
выявлены гены приобретенных карбапенемаз, из них: металло-бета-лактамазы (МБЛ) групп VIM и IMP – 83,2% и 0,8%,
соответственно; сериновые карбапенемазы группы
GES-5 – 15,2%; одновременно МБЛ и сериновые карбапенемазы продуцировали
0,8% изо- лятов [https://amrmap.ru/?id=P4C8S48UD11UD09]. Продуценты МБЛ проявляли
высокую устойчивость ко всем антибиотикам,
кроме азтреонама и полимиксинов;
продуценты GES-5
Устойчивость к карбапенемам (имипенему и меропенему) в
2018-2019 гг. составила соответственно
88,4% и 85,5% [https://amrmap.ru/?id=RqPL409wO13wO09].
У 90,5% изолятов A. baumannii выявлено
наличие генов приобретенных карбапенемаз, в основном относящихся к
молекулярному классу D (98,6%): OXA-24/40 – 60,5%, OXA-23 – 35,6%, OXA- 24/40+OXA-23 – 2,4%. Металло-карбапенемазы
группы NDM составляли 1,3%, сериновые карбапенемазы группы GES-5 – 0,1% [https://amrmap.ru/?id=EFAiB4993139309]. Большинство продуцентов карбапенемаз
относились к международным клонам высокого риска: CC92/208OXF/CC2PAS, CC944OXF/CC78PAS и CC109/231OXF/CC1PAS. Подавляющее большинство изолятов A. baumannii в 2018-2019 гг. были
устойчивыми к ципрофлоксацину (98,1%),
амикацину (91,8%) и гентамицину (82,7%). Частота резистентности к тобрамицину и триметоприму/сульфаметоксазолу была
различной у штаммов разных генотипов, в целом
составляя 64,5% для тобрамицина и 52,8% для котримоксазола. Наиболее
высокой актив- ностью in vitro обладали полимиксины (1,1% резистентных изолятов)
[https://amrmap.ru/?id=nG5jp4856145609].
Штаммы других видов Acinetobacter spp.
были более чувствительны к различным антибиотикам [11, www.AMRmap.ru].
K. pneumoniae, P. aeruginosa, A. baumannii
и Escherichia coli [https://amrmap.ru/?id=YGQdd00O916O909].
Таким образом, роль S. aureus в
этиологии нозокомиальных инфекций
снизилась в сравнении
с более ранним
периодом.
2.
Методы выявление наиболее значимых
фенотипов/детерминант антибиотикорези- стентности
2.1.
Выявление устойчивости к карбапенемам представителей порядка Enterobacterales
Таблица
1. Сравнительная характеристика наиболее распространенных методов оп- ределения
продукции карбапенемаз и их типирования
|
Метод |
Исследуемый материал |
Преимущества |
Ограничения |
|
Метод |
Чистая культура микроорганизма |
Простота Позволяет предположить на- личие редких или новых кар- |
Необходимость Длительность «Классический» дифференцировать серино- |
|
вые и металлоферменты). |
|||
|
Иммунохромато- графические |
Чистая культура микроорганизма |
Простота выполнения. Позволяют определять тип карбапенемаз. |
Отсутствие возможности вы- явления новых вариантов карбапенемаз. |
|
Молекулярно- генетические |
Нативный клиниче- ский |
Быстрое получение результа- та. Возможность проведения Позволяют определять тип карбапенемаз. |
Необходимость наличия спе- циального оборудования и обученного персонала. Сравнительно Отсутствие возможности вы- явления новых карбапенемаз. |
Выявление продукции карбапенемаз у Acinetobacter spp. имеет исключительно
эпидемиологическое и научное значение и не рекомендуется в рутинной практике
для выбора режима антибиотикотерапии у конкретного пациента.
2.4. Выявление β-лактамаз расширенного спектра (БЛРС)
у энтеробактерий
Рекомендуемые методы
выявления БЛРС у энтеробактерий.
Препаратом
выбора для определения чувствительности к бета-лактамам (кроме цефтаролина)
диско-диффузионным методом является цефокситин ввиду того, что он является
наиболее чувствительным и специфичным маркером mecA/mecC-опосредованной резистентности. Для подтверждения наличия
генов mecA или mecC, особенно в случае сомнительных результатов фенотипических тестов,
рекомендуется проводить молекулярно- генетическое исследование с целью
выявления генов mecA или mecC.
3. Принципы рационального использования антимикробных препаратов (АМП)
Реализация этих принципов является
единственным действенным механизмом ограничения использования АМП, поскольку
обеспечивает основу для исключения неэффективного, бесполезного, а нередко
и опасного назначения антибиотиков. В клинической практике выполнить эти условия в полной мере сложно. В момент
назначения АМП врач обычно не знает
возбудителя и его свойства, во время проведения терапии у него нет возможности
контролировать концентрацию АМП в очаге, а развитие побочных эффектов тоже носит
вероятностный характер. Но это не означает, что использование АМП не должно соответствовать этим постулатам, просто
эти требования предполагают выполнение ряда правил,
которые обязательно должен соблюдать врач, когда проводит антимикробную терапию.
3.1. Констатация развития
инфекции
3.2.
Идентификация возбудителя инфекции, с определением его
чувствительности к антимикробным препаратам
3.3. Выбор оптимального антимикробного препарата
3.4. Путь введения
препарата
3.5. Оценка эффективности антимикробной терапии
3.6. Длительность антимикробной терапии
4. Алгоритм
назначения эмпирической антимикробной терапии с учетом стратифика- ции пациентов
по риску антибиотикорезистентности
4.1.
Факторы риска инфекции
, вызванных полирезистентными штаммами микроорганизмов
4.1.1. Факторы риска
инфекции, вызванных энтеробактериями продуцентами БЛРС
— предшествующая (в течение 3 месяцев)
госпитализация с выполнением хирургических вмешательств
и инвазивных процедур (особенно с имплантацией искусственных материалов и/или устройств);
4.1.4. Факторы риска инфекций,
вызванных карбапенеморезистентными энтеробактериями [10,
44]:
4.2. Стратификация
пациентов по риску наличия резистентных возбудителей и инвазивного кандидоза
5.
Схемы антибактериальной терапии
инфекций, вызванных полирезистентными микроорганизмами
6. Рекомендации
по дозированию антимикробных препаратов у пациентов в критиче- ском состоянии
7. Антибактериальная терапия
инфекций в особых случаях
7.2.
Применение антимикробных препаратов у пациентов с
почечной и печеночной недостаточностью,
а также при проведении экстракорпоральной мембранной оксигенации
Таблица 2. Режимы дозирования антимикробных средств при проведении экстракорпоральной мембранной
оксигенации
|
Препарат |
Режим дозирования |
|
Меропенем |
1 г в/в нагрузочная доза |
|
Имипенем/циластатин |
1 г (в |
|
Пиперациллин/тазобактам |
4,5 г в/в |
|
Цефепим |
1 г в/в каждые 8 ч в виде |
|
Цефтазидим |
2 г в/в нагрузочная доза (30-60 мин), |
|
Ванкомицин |
25-30 мг/кг |
|
Амикацин |
30 мг/кг в/в каждые 24 ч |
|
Гентамицин |
7–10 мг/кг в/в каждые 24 ч |
8. Профилактика, диагностика и лечение инвазивных микозов
8.2. Диагностика и лечение инвазивного аспергиллеза
8.3. Диагностика и лечение мукормикоза
9. Критерии качества
оказания помощи с использованием лекарственных средств для лечения
инфекций, вызванных полирезистенными микроорганизмами
|
п/п |
Критерии качества |
Оценка |
|
1. |
Наличие |
Да/Нет |
|
2 |
Наличие |
Да/Нет |
|
3 |
Определена продукция карбапенемаз при выявлении карбапе- неморезистентных штаммов Enterobacterales |
Да/Нет |
|
4 |
Проведена |
Да/Нет |
|
5 |
При |
Да/Нет |
|
6 |
Проведена коррекция дозы антибактериальных препаратов с учетом тяжести состояния больного (при необходимости) |
Да/Нет |
|
7 |
Проведена |
Да/Нет |
|
Инфекции, вызванные грам (+) микроорганизмами |
||||
|
Инфекции, вызванные MRSA и MR-CNS |
||||
|
№ |
МНН |
Рекомендуемые до- зы АМП |
ЖНВЛП |
Условия применения (УП) и примечания |
|
1 |
Ванкомицин |
1,0 г х 2 р/сут. в/в в течение |
Да |
УП. При МПК ванкомицина ≤ 1 мг/л – у пациентов без сепсиса при инфекциях кроме пневмонии — стандартный режим дозирования; у пациентов с сепсисом или пневмонией — увеличение дозы по решению врачебной комиссии (ВК) — нагрузочная доза 25–30 мг/кг, 20 мг/кг с интервалом Прим. Оптимальным способом выбора режима Не рекомендован при инфекциях, вы- званных МSSA |
|
2 |
Тейкопланин |
400 мг каждые 12 часов для первых 3х доз, затем в/в 1 р/сут. |
Нет |
Прим. Профиль безопасности более бла- гоприятный, чем у ванкомицина. Воз- можно не только в/в, но и в/м введение. |
|
3 |
Линезолид |
600 мг х 2 |
Да |
Прим. Применение при бактериемии, инфекционном эндокардите не опти- мально. |
|
4 |
Цефтаролина фосамил |
600 мг х 2 р/сут. в/в в течение 1 ч. |
Да |
Прим. В случае решению ВК. |
|
5 |
Даптомицин |
6 мг/кг х 1 р/сут. в/в |
Да |
Прим. При бактериемии и бактериаль- ном эндокардите по решению ВК увели- чение нация с цефтаролином по решению |
|
6 |
Телаванцин |
10 мг /кг х 1 р/сут. в/в |
Да |
Прим. |
|
7 |
Тедизолид |
200 мг х 1 р/сут. в/в в течение 1 ч. |
Да |
— |
|
8 |
Тигециклин |
Первая нагрузочная доза 100 мг в/в в течение |
Да |
Прим. Возможно применение в виде монотерапии при смешанных инфекци- ях, вызванных MRSA и грамотрицатель- ными микроорганизмами, чувствитель- ными к тигециклину (за исключением пневмонии, бактериемии и ИМП). |
|
Инфекции, вызванные ванкомицинорезистентными энтерококками (VRE) |
||||
|
9 |
МНН |
Рекомендуемые до- зы АМП |
ЖНВЛП |
Условия применения (УП) и примечания |
|
10 |
Линезолид |
600 мг х 2 |
Да |
Прим. Применение при инфекционном эндокардите не опти- мально. |
|
11 |
Тедизолид |
200 мг х 1 |
Да |
— |
|
12 |
Тигециклин |
Первая нагрузочная доза 100 мг в/в в течение 1 ч., затем по 50 мг х 2 р/сут. в/в в течение |
Да |
Прим. Возможно применение в виде монотерапии при смешанных инфекци- ях, вызванных VRE и грамотрицатель- ными микроорганизмами, чувствитель- ными к тигециклину. |
|
13 |
Даптомицин |
10-12 мг/кг х 1 р/сут. в/в струйно в течение двух минут или в/в инфузия |
Да |
Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, При эндокардите желательно в |
|
Инфекции, вызванные пенициллинорезистентными пневмококками (ПРП) |
||||
|
1 |
Цефтаролина фосамил |
600 мг х 2 р/сут. в/в в течение 1 ч. |
Да |
Прим. Предпочтительная терапевтиче- ская опция. |
|
2 |
Линезолид |
600 мг х 2 |
Да |
— |
|
3 |
Моксифлокса- цин |
400 мг х 1 р/сут или внутрь |
Да |
— |
|
4 |
Ванкомицин |
1,0 г х 2 р/сут. в/в в течение 1 ч. |
Да |
— |
|
5 |
Тейкопланин |
400 мг х 2 – первые 3 дозы), затем |
Нет |
Прим. Профиль безопасности более бла- гоприятный, чем у ванкомицина. Воз- можно не только в/в, но и в/м введение. |
|
Инфекции, вызванные грам |
||||
|
Инфекции, вызванные полирезистентными штаммами Enterobacterales |
||||
|
Klebsiella pneumoniae, продуцирующие β-лактамазы расширенного спектра дей- |
||||
|
№ |
МНН |
Рекомендуемые до- зы АМП |
ЖНВЛП |
Условия применения (УП) и примечания |
|
Базовые препараты |
||||
|
1 |
Эртапенем |
1 г |
Да |
Прим. Более высокий Потенциальное Обосновано применение в монотерапии. |
|
2 |
Меропенем |
1 г |
Да |
Прим. можно — 2 г в/в |
|
ственно перед первой инфузией введе- ние нагрузочной дозы 2 г в/в болюсно). Обосновано применение в монотерапии. |
||||
|
3 |
Дорипенем |
1 г х 3 |
Нет |
Прим. При тяжелых инфекциях* пред- почтительно введение в виде продлен- ной инфузии (в течение 4 часов, в пер- вые сутки непосредственно перед Прим. Превышение максимальной су- точной дозы в первые Обосновано применение в монотерапии. |
|
4 |
Имипенем/ Циластатин |
0,5-1 г х 4 |
Да |
Прим. При тяжелых инфекциях* пред- почтительный режим дозирования 1 г х 4 р/сут Обосновано применение в монотерапии. |
|
5 |
Биапенем |
0,6 г х 2-3 |
Нет |
Прим. Обосновано Учитывая возможное превышение дози- ровки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
5 |
Тигециклин |
Первая |
Да |
Прим. Препарат для альтернативного выбора при невозможности использова- ния β-лактамных Не рекомендуется использовать при пневмонии, бактериемии, инфекциях мочевых Обосновано применение в монотерапии. |
|
6 |
Цефепим /сульбактам |
1-2 г х 3 р/сут. в/в |
Нет |
Прим. Большинство штаммов K. pneumoniae устойчиво. При лечении пиперациллину/тазобактаму или цефто- лозану/тазобактаму |
|
Антибиотики для комбинации с базовыми препаратами1 |
||||
|
1 |
Амикацин |
15-20 мг/кг х 1 р/сут. |
Да |
Прим. Возможно применение совместно с одним из «базовых» препаратов при доказанной или предполагаемой бакте- Возможно применение в монотерапии при инфекциях мочевых путей (при из- вестной Учитывая возможное превышение дози- ровки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
2 |
Гентамицин |
5-7 мг/кг |
Да |
Прим. Возможно применение совместно с одним из «базовых» препаратов при доказанной или предполагаемой бакте- Возможно возможное превышение дозировки, ре- |
|
комендованной в инструкции к препара- ту, назначение производится по реше- нию ВК. |
||||
|
3 |
Фосфомицин |
4 г в/в инфузия |
Да |
Прим. В случае Использовать в комбинации с одним из базовых препаратов при |
|
Escherichia coli, продуцирующие β-лактамазы расширенного спектра действия |
||||
|
№ |
МНН |
Рекомендуемые до- зы АМП |
ЖНВЛП |
Условия применения (УП) и примечания |
|
Базовые препараты |
||||
|
1 |
Эртапенем |
1 г х 1 |
Да |
Прим. Более высокий В случае Обосновано применение в монотерапии. |
|
2 |
Цефепим /сульбактам |
1-2 г х 2-3 р/сут. в/в или в/м |
Нет |
Прим. При тяжелых Обосновано применение в монотерапии. |
|
3 |
Пиперацил- лин/тазобактам |
4,5 г х 3-4 |
Нет |
— |
|
4 |
Меропенем |
1 г |
Да |
Прим. При тяжелых инфекциях* пред- почтительный режим дозирования — 2 г в/в инфузия в течение 3 часов х 3 р/сут. Обосновано применение в монотерапии. |
|
5 |
Дорипенем |
0,5 г х 3 р/сут. |
Нет |
Прим. При тяжелых инфекциях* 1 г 3 р/сут. предпочтительно введение в виде продленной инфузии (в течение 4 часов, в первые сутки Прим. Превышение максимальной су- точной дозы в первые Обосновано применение в монотерапии. |
|
6 |
Имипенем/ Циластатин |
0,5 г х 4 р/сут. |
Да |
Прим. При тяжелых р/сут. в/в. |
|
Обосновано применение в монотерапии. |
||||
|
7 |
Биапенем |
0,6 г х 2-3 |
Нет |
Прим. Учитывая возможное превыше- ние дозировки, рекомендованной в инст- рукции к препарату, назначение произ- водится по решению ВК. |
|
8 |
Тигециклин |
Первая |
Да |
Прим. Препарат альтернативного выбо- ра при невозможности назначения β- лакактамных антибиотиков при интра- Не рекомендуется использовать при пневмонии, бактериемии, инфекциях мочевых |
|
Антибиотики для комбинации с базовыми препаратами1 |
||||
|
1 |
Амикацин |
15-20 мг/кг х 1 р/сут. |
Да |
Прим. Возможно применение совместно с одним из «базовых» препаратов при тяжелых формах инфекции* Возможно применение в монотерапии при инфекциях мочевых путей (при из- вестной препарату, назначение производится по решению ВК. |
|
2 |
Гентамицин |
5-7 мг/кг х 1 р/сут. в/в |
Да |
Прим. Возможно применение совместно с одним из «базовых» препаратов при тяжелых формах инфекции* Возможно применение в монотерапии при инфекциях мочевых путей (при из- вестной принимается ВК. |
|
3 |
Фосфомицин |
4 г в/в инфузия |
Да |
Прим. В случае Использовать ческом шоке. |
|
Карбапенеморезистентные штаммы2 Enterobacterales (Klebsiella spp., Escherichia coli, |
||||
|
№ |
МНН |
Рекомендуемые до- зы АМП |
ЖНВЛП |
Условия применения (УП) |
|
Базовые препараты |
||||
|
1 |
Цефтази- дим/авибактам |
2,5 г х 3 стью в течение 120 |
Да |
УП. При инфекциях, вызванных Enterobacterales, продуцирующими кар- бапенемазы ОХА-48 + MBL показана комбиниро- |
|
мин. |
ванная терапия цефтази- дим/авибактам+азтреонам [47]. |
|||
|
2 |
Тигециклин |
Первая |
Да |
УП. В Прим. В случае 23]. Не рекомендовано применение в моно- терапии при пневмонии, бактериемии, инфекциях мочевых путей [47]. |
|
3 |
Меропенем |
2 г в/в инфузия г в/в болюсно). |
Да |
УП. Возможно применение при устой- чивости к эртапенему и имипенему и сохраненной чувствительности к меро- пенему Прим. Превышение максимальной су- точной дозы в первые |
|
4 |
Дорипенем |
1 г в течение ной дозы 1 г в/в бо- люсно). |
Нет |
УП. Возможно применение при устой- чивости к эртапенему и имипенему и сохраненной чувствительности к дори- пенему 66]. Прим. Превышение максим точной дозы в первые сутки |
|
Антибиотики для комбинации с базовыми препаратами1 |
||||
|
1 |
Азтреонам |
По 2,0 г х 3 |
Нет |
УП. Комбинация с цефтазиди- мом/авибактамом при инфекциях, вы- званных катетера или через различный |
|
2 |
Полимиксин В |
2,5 мг/кг/сут. в/в, доза делится на |
Да |
УП. Избегать одновременного назначе- ния с аминогликозидами, колистимета- том Прим. Более предпочтительная фарма- кокинетика по сравнению с колистином. |
|
3 |
Колистиметат натрия |
9 млн ЕД |
Нет |
УП. Избегать одновременного назначе- ния с аминогликозидами, полимиксином и другими нефротоксичными препара- тами ввиду Предпочтительнее Прим. При жизнеугрожающих инфек- циях нагрузочная доза составляет 9 млн ЕД, затем суточная доза |
|
4 |
Амикацин |
15-20 мг/кг |
Да |
Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, Избегать одновременного назначения с полимиксином В и колистиметатом на- трия ввиду увеличения риска нефроток- сичности. Возможно применение в монотерапии при инфекциях мочевых путей |
|
5 |
Гентамицин |
5-7 мг/кг х 1 р/сут. в/в |
Да |
Прим. Избегать одновременного назна- чения с полимиксином В и колистимета- том натрия ввиду увеличения риска неф- ротоксичности. Возможно применение в монотерапии при инфекциях мочевых путей |
|
6 |
Фосфомицин |
4 г в/в инфузия в течение 1 часа |
Да |
Прим. В случае пациентов с сердечной недостаточно- стью, ОПП и |
|
Карбапенеморезистентные (CPR) Примеры схем |
||||
|
№ |
МНН |
Рекомендуемые до- зы АМП |
ЖНВЛП |
Условия применения (УП) и примечания |
|
Базовые препараты |
||||
|
1 |
Цефтолозан/ Тазобактам |
1,5 г в/в х 3 р/сут. |
Да |
УП. При инфекции, вызванной CPR P. aeruginosa при отсутствии продукции карбапенемаз, подтвержденной культу- При подтвержденной чувствительности in vitro возможно проведение монотера- пии. |
|
2 |
Цефтазидим/ авибактам |
2,5 г в/в в виде ин- дые 8 часов. |
Да |
УП. При |
|
3 |
Азтреонам |
2 г х |
Нет |
УП. При инфекциях, вызванных P. aeruginosa, продуцирующей карбапене- мазы группы MBL. |
|
4 |
Полимиксин В |
2,5 мг/кг/сут. в/в, доза делится на |
Да |
УП. Избегать одновременного назначе- ния с аминогликозидами и колистимета- том натрия ввиду увеличения риска неф- ротоксичности. Прим. Более предпочтительная фарма- кокинетика по сравнению с колистином. |
|
5 |
Колистиметат натрия |
9 млн ЕД |
УП. Избегать одновременного назначе- ния с аминогликозидами и полимикси- ном ввиду увеличения риска нефроток- сичности. Предпочтительнее Прим. При нагрузочная доза 9 млн ЕД, |
|
|
Антибиотики для |
||||
|
1 |
Фосфомицин |
4 г х 4 р/сут. |
Да |
Прим. В случае сердечной недостаточностью, ОПП и ХБП) |
|
2 |
Амикацин |
15-20 мг/кг х 1 р/сут. |
Да |
УП. Может быть Учитывая возможное превышение до- зировки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
3 |
Меропенем |
2 г в/в в течение 3 часов х 3 р/сут. ной дозы 2 г |
Да |
УП. При устойчивости к Прим. Превышение максимальной су- точной дозы в первые |
|
4 |
Дорипенем |
1 г в течение 4 ча- сов в/в болюсно). |
Нет |
УП. При устойчивости к Прим. Превышение максимальной су- точной дозы в первые |
|
5 |
Имипенем/ Циластатин |
1 г 4 р/сут. |
Да |
При инфекциях, вызванных P. aeruginosa с чувствительностью к имипенему/циластатину при |
|
Карбапенеморезистентные Примеры схем |
||||
|
№ |
МНН |
Рекомендуемые до- зы АМП |
ЖНВЛП |
Примечание |
|
Базовые препараты |
||||
|
1 |
Полимиксин В |
2,5 мг/кг доза делится |
Да |
УП. Избегать одновременного назначе- ния с аминогликозидами и колистимета- |
|
введения |
том Возможно комбинированное примене- ние с сульбактам-содержащими препа- Прим. Более предпочтительная фарма- кокинетика по сравнению с колистином. |
|||
|
2 |
Колистиметат натрия |
9 млн ЕД |
Нет |
УП. Избегать одновременного назначе- ния с аминогликозидами и полимикси- ном ввиду увеличения риска нефроток- сичности. Предпочтительнее Возможно комбинированное примене- ние с сульбактам-содержащими препа- Прим. При тяжелых формах инфекции нагрузочная доза 9 млн. ЕД, затем су- точная. |
|
3 |
Ампициллин/ сульбактам |
По 2 г (по сульбак- таму) |
Да |
УП. Только в составе комбинированной терапии. |
|
4 |
Цефепим/ сульбактам |
По 2 г (по |
Да |
УП. Только в Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
5 |
Цефоперазон/ сульбактам |
По 2 г (по сульбак- таму) |
Да |
УП. Только в составе комбинированной терапии. Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
Антибиотики для |
||||
|
1 |
Тигециклин |
Первая нагрузочная доза 200 мг, затем |
Да |
Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
2 |
Ко-тримоксазол |
10-15 мг/кг/сут. (по триметоприму) в 2- 3 введения |
Да |
Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
3 |
Меропенем |
2 г в/в в ной дозы 2 г в/в бо- люсно). |
Да |
УП. При Прим. Превышение максимальной су- точной дозы в первые |
|
4 |
Дорипенем |
1 г в течение средственно перед |
Нет |
УП. При рованной терапии |
|
первой инфузией введение нагрузоч- ной дозы 1 г в/в бо- люсно). |
[12, |
|||
|
5 |
Амикацин |
20-30 мг/кг х 1 р/сут. в/в в течение 30 мин. |
Да |
Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
Stenotrophomonas maltophilia [ https://www.idsociety.org/practice-guideline/amr-guidance-2.0/] |
||||
|
№ |
МНН |
Рекомендуемые до- зы АМП |
ЖНВЛП |
Условия применения (УП) и примечание |
|
1 |
Ко-тримоксазол |
10-15 мг/кг/сут. (по триметоприму) 3 введения, в/в. |
Да |
УП. При нетяжелых инфекциях возмож- на монотерапия, при тяжелых инфекци- ях* – в комбинации с тигециклином или левофлоксацином. Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
2 |
Тигециклин |
Первая |
Да |
УП. При – в Прим. Учитывая превышение дозиров- ки, рекомендованной в инструкции к препарату, назначение производится по решению ВК. |
|
3 |
Левофлоксацин |
500 мг |
Да |
УП. При нетяжелых инфекциях возмож- на монотерапия, при тяжелых инфекциях – в комбинации с ко-тримоксазолом или тигециклином. |
|
4 |
Цефтази- дим/авибактам |
По 2,5 г в/в в виде инфузии объемом 100 мл с постоян- ной скоростью в течение 120 мин. каждые 8 часов. |
УП. Только одновременно с Азтреона- мом (2 г х 3 р/сут.) через разные порты катетера или через различный венозный доступ. Прим. При неэффективности других режимов терапии. |
|
№ |
МНН |
Возрастная категория |
Рекомендуемые дозы АМП |
|
1 |
Ванкомицин |
0-18 лет |
40-60 мг/кг/сут. в 3-4 в/в введения |
|
2 |
Линезолид |
0-12 лет |
10 мг/кг |
|
12-18 лет |
10 мг/кг |
||
|
3 |
Цефтаролин |
2 мес.-2 года |
10 мг/кг |
|
2-18 лет |
12 мг/кг |
||
|
4 |
Цефтазидим /авибактам |
3 мес.- 6 мес. |
40 мг/кг (по цефтазидиму) 3 р/сут., в/в инфузия |
|
6 мес.-18лет |
50 мг/кг инфузия |
||
|
5 |
Азтреонам |
9 мес-18 лет |
30 мг/кг |
|
6 |
Полимиксин В |
0-1 год |
4 мг/кг/сут. в 2 введения |
|
2-18 лет |
1,5-2,5 мг/кг/сут. в/в в 2 введения |
||
|
7 |
Меропенем |
3 мес.-12 лет |
10-20 мг/кг 3 р/сут. |
|
8 |
Имипенем |
3 мес. — 18 |
15 мг/кг 4 р/сут. |
|
9 |
Фосфомицин |
С 0 мес. |
200-400 мг/кг введения) |
|
10 |
Тигециклин |
8-11 лет |
1,2 мг/кг |
|
12-18 лет |
50 мг в/в |
||
|
11 |
Цефоперазон /сульбактам |
С 0 мес. |
40-80 мг/кг/сут в 2-4 введения; при тяже- лых, инфекциях — по 160 мг/кг/сут. Мак- симальная суточная доза сульбакткма не должна превышать — 80 мг/кг/сут. |
|
12 |
Цефепим/сульбактам |
2 мес. – |
50 мг/кг |
|
13 |
Тримето- прим/сульфаметоксазол |
С 3-х |
6 мг/кг/сут. по тримептоприму в два в/в введения |
|
12-18 лет |
960 мг в/в |
||
|
14 |
Пиперациллин /тазобактам |
С 2 лет |
100/12,5 мг/кг |
|
15 |
Амикацин |
С 0 мес. |
10- |
|
№ |
МНН |
Рекомендуемые дозы АМП |
ЖНВЛП |
Примечание |
|
1 |
Анидулафун- гин |
взрослые: в/в в 1-е сутки дети старше 1 месяца: в/в в 1-е сутки р/сут. (не |
Нет |
Препарат выбора |
|
2 |
Каспофунгин |
взрослые: в/в в 1-е сутки 70 мг, затем по 50 мг 1 р/сут. дети: в/в в 1-е сутки 70 мг/м2, затем |
Да |
Препарат выбора ИА — |
|
3 |
Микафунгин |
взрослые: в/в 100 мг 1 р/сут. дети с массой дети с массой тела > 40 кг в/в |
Да |
Препарат выбора |
|
4 |
Вориконазол |
взрослые: в/в в 1-е сутки дети с 2 до 12 в/в в 1-е сутки 9 мг/кг 2 р/сут., затем 8 мг/кг 2 р/сут. |
Да |
Препарат выбора ИК, вызванный чувствитель- ными к вориконазолу Candida spp., менингит и эндофтальмит, де-эскалационная терапия. |
|
5 |
Изавуконазол |
взрослые: в/в в 1-2-е сутки 200 мг 3 раза, |
Нет |
Препарат выбора для терапии аспергиллеза. Лечение мукормикоза при не- возможности или неэффектив- ности пациента. |
|
6 |
Флуконазол |
взрослые: в/в или перорально в 1-е в/в или перорально в 1-е |
Да |
Клинически стабильный паци- ент, возбудитель – C. albicans или другие чувствительные к флуконазолу Candida spp., ме- нингит и эндофтальмит, деэс- |
|
7 |
Липосомаль- ный амфоте- |
взрослые: в/в 3-10 мг/кг/сут. дети старше 1 месяца: в/в 3-10 |
Да |
Препарат выбора — при неэффективности, ток- изавуконазола. |
|
8 |
Липидный комплекс ам- фотерицина В |
взрослые: в/в 5 мг/кг/сут. дети: в/в 5 мг/кг/сут. |
Да |
Препарат выбора нокандинов, вориконазола и изавуконазола. |
Ссылки
Литература
22.
Cornely O., Alastruey-Izquierdo A., Arenz D. et al. Global guideline for the diagnosis and
management of mucormycosis: An
initiative of the European Confederation of Medical Mycology in cooperation
with the Mycoses Study Group
Education and Research Consortium // The Lancet Infect Dis. – 2019. – Vol. 12.
– e405-e421 doi: 10.1016/S1473-3099(19)30312-3
59.
Ullmann A.J., Aguado J.M., Arikan-Akdagli
S. et al. Diagnosis and management of
Aspergillus diseases: executive summary of the 2017 ESCMID-ECMM-ERS guideline
// Clin Microbiol Infect. – 2018. – Vol. 24 (Suppl 1). – e1-e38. doi: 10.1016/j.cmi.2018.01.002.
Как назначать антибактериальную терапию
Как назначать антибактериальную терапию
Материалы предназначены исключительно для врачей и специалистов с высшим медицинским образованием. Статьи носят информационно-образовательный характер. Самолечение и самодиагностика крайне опасны для здоровья. Автор статей не дает медицинских консультаций: клинический фармаколог — это врач только и исключительно для врачей.
Автор раздела: Трубачева Елена Сергеевна, врач – клинический фармаколог, более 15 лет занимающаяся практическими вопросами лечения и профилактики внутрибольничных инфекций и эпидемиологического надзора. Автор множества печатных работ на указанную тематику.
«Идея «Азбуки антибиотиков» вынашивалась в течение трех лет как способ донести сложные вещи максимально понятным языком для тех, кто только начинает постигать этот действительно сложный раздел практической медицины, и дать импульс к дальнейшему изучению, не продираясь через дебри терминологии и смежных дисциплин, теряя интерес по дороге.»
Итак, познакомившись с основными возбудителями (хотя некоторое количество микробов еще будет дописано), мы подошли к самому интересному – как все эти знания использовать в реальной ежедневной практике лечения пациентов
26.10.2020
Сегодня поговорим еще об одной часто встречающейся (статистика говорит, что это каждый третий случай обращения) проблеме – инфекциях кожи и мягких тканей. Причем поговорим в том числе и через призму отделений гнойной хирургии
28.03.2022
Продолжаем тему правильного использования антибактериальных препаратов в реальной клинической практике. Сегодня речь пойдет об абдоминальной хирургии.
23.05.2022



