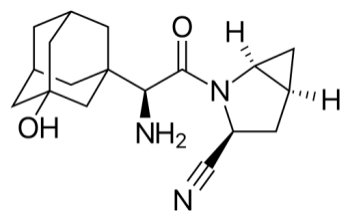
Описание препарата Онглиза® (таблетки, покрытые пленочной оболочкой, 2.5 мг) основано на официальной инструкции, утверждено компанией-производителем в 2012 году
Дата согласования: 02.10.2012
Особые отметки:
Содержание
- Действующее вещество
- ATX
- Фармакологическая группа
- Нозологическая классификация (МКБ-10)
- Состав
- Описание лекарственной формы
- Фармакологическое действие
- Фармакодинамика
- Фармакокинетика
- Показания
- Противопоказания
- Применение при беременности и кормлении грудью
- Способ применения и дозы
- Побочные действия
- Взаимодействие
- Передозировка
- Особые указания
- Форма выпуска
- Производитель
- Условия отпуска из аптек
- Условия хранения
- Срок годности
- Заказ в аптеках Москвы
- Отзывы
Действующее вещество
ATX
Фармакологическая группа
Состав
| Таблетки, покрытые пленочной оболочкой | 1 табл. |
| активное вещество: | |
| саксаглиптин (в виде саксаглиптина гидрохлорида) | 2,5 мг |
| 5 мг | |
| вспомогательные вещества: лактозы моногидрат — 99 мг*; МКЦ — 90 мг; кроскармеллоза натрия — 10 мг; магния стеарат — 1 мг**; 1М раствор хлористоводородной кислоты*** — q.s.; Opadry II белый — 26 мг (спирт поливиниловый — 40%, титана диоксид — 25%, макрогол (ПЭГ 3350) — 20,2%, тальк — 14,8%); Opadry II желтый — 7 мг (спирт поливиниловый — 40%, титана диоксид — 24,25%, макрогол (ПЭГ 3350) — 20,2%, тальк — 14,8%, краситель оксид железа желтый (E172) — 0,75%) (для дозировки 2,5 мг); Opadry II розовый — 7 мг (спирт поливиниловый — 40%, титана диоксид — 24,25%, макрогол (ПЭГ 3350) — 20,2%, тальк — 14,8%, краситель оксид железа красный (E172) — 0,75%) (для дозировки 5 мг); чернила Opacode синий — q.s. | |
| * Количество лактозы может варьировать в зависимости от используемого количества магния стеарата. | |
| ** Количество магния стеарата может варьировать в пределах 0,5–2 мг, оптимальное количество 1 мг. | |
| *** В случае необходимости для доведения рН может использоваться 1М натрия гидроксид. | |
| состав чернил Opacode синий: шеллак 45% в спирте этиловом — 55,4%; FD&C Blue#2/индиго карминовый алюминиевый пигмент (E132) — 16%; спирт н-бутиловый — 15%; пропиленгликоль — 10,5%; спирт изопропиловый — 3%; 28% аммония гидроксид — 0,1% | |
| очень небольшие количества шеллака и FD&C Blue#2/индиго карминового алюминиевого пигмента остаются на таблетках при нанесении маркировки, растворители, входящие в состав чернил, удаляются в процессе производства |
Описание лекарственной формы
Таблетки, покрытые пленочной оболочкой, 2,5 мг: круглые двояковыпуклые, покрытые пленочной оболочкой от бледно-желтого до светло-желтого цвета, с надписями «2,5» на одной стороне и «4214» — на другой стороне, нанесенными синим красителем.
Таблетки, покрытые пленочной оболочкой, 5 мг: круглые двояковыпуклые, покрытые пленочной оболочкой розового цвета, с надписями «5» на одной стороне и «4215» — на другой стороне, нанесенными синим красителем.
Фармакологическое действие
Фармакологическое действие
—
гипогликемическое.
Фармакодинамика
Саксаглиптин — мощный селективный обратимый конкурентный ингибитор дипептидилпептидазы-4 (ДПП-4). У пациентов с сахарным диабетом типа 2 (СД2) прием саксаглиптина приводит к подавлению активности фермента ДПП-4 в течение 24 ч. После приема глюкозы внутрь ингибирование ДПП-4 приводит к 2–3-кратному увеличению концентрации глюкагоноподобного пептида-1 (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП), уменьшению концентрации глюкагона и усилению глюкозозависимой ответной реакции бета-клеток, что приводит к повышению концентрации инсулина и С-пептида. Высвобождение инсулина бета-клетками поджелудочной железы и снижение высвобождения глюкагона из панкреатических альфа-клеток приводит к снижению гликемии натощак и постпрандиальной гликемии.
Эффективность и безопасность применения саксаглиптина при приеме в дозах 2,5, 5 и 10 мг 1 раз в сутки изучены в шести двойных слепых плацебо-контролируемых исследованиях с участием 4148 пациентов с СД2. Прием препарата сопровождался статистически значимым улучшением показателей гликозилированного гемоглобина (HbA1c), глюкозы плазмы крови натощак (ГПН) и постпрандиальной глюкозы (ППГ) плазмы крови по сравнению с контролем.
Саксаглиптин назначался в виде монотерапии или комбинированной терапии. Комбинированная терапия саксаглиптином назначалась дополнительно пациентам, некомпенсированным при проведении монотерапии метформином, глибенкламидом, тиазолидиндионами или инсулином, или в качестве стартовой комбинации с метформином пациентам, некомпенсированным на диете и физических упражнениях. При приеме саксаглиптина в дозе 5 мг снижение HbA1с было отмечено через 4 нед и ГПН — через 2 нед.
В группе пациентов, получавших саксаглиптин в комбинации с метформином, глибенкламидом или тиазолидиндионами, снижение HbA1с также отмечалось через 4 нед и ГПН — через 2 нед.
В исследовании комбинированной терапии саксаглиптином и инсулином (в т.ч. в комбинации с метформином) с участием 455 пациентов с СД2 продемонстрировано существенное снижение HbA1с и ППГ по сравнению с плацебо.
Влияние саксаглиптина на липидный профиль сходно с таковым плацебо. На фоне терапии саксаглиптином не отмечено увеличение массы тела.
В прямом сравнительном исследовании с участием 858 пациентов с СД2 добавление препарата Онглиза® 5 мг к метформину по сравнению с добавлением глипизида к метформину продемонстрировало сравнимое снижение HbA1c, однако было ассоциировано с достоверно меньшим числом эпизодов гипогликемии — 3% случаев по сравнению с 36,3% при добавлении глипизида, а также отсутствием увеличения массы тела у пациентов, получающих терапию саксаглиптином (−1,1 кг от исходного уровня в группе саксаглиптина, +1,1 кг в группе глипизида).
Фармакокинетика
У пациентов с СД2 и здоровых добровольцев отмечены сходные параметры фармакокинетики саксаглиптина и его основного метаболита. Саксаглиптин быстро абсорбируется после приема внутрь натощак с достижением Cmax саксаглиптина и основного метаболита в плазме в течение 2 и 4 ч соответственно. При увеличении дозы саксаглиптина было отмечено пропорциональное увеличение Cmax и величины AUC саксаглиптина и его основного метаболита. После однократного приема саксаглиптина внутрь в дозе 5 мг здоровыми добровольцами средние значения AUC саксаглиптина и его основного метаболита составили 78 и 214 нг·ч/мл, а значения Cmax в плазме — 24 и 47 нг/мл соответственно.
Средняя продолжительность конечного T1/2 саксаглиптина и его основного метаболита составила 2,5 и 3,1 ч соответственно, а средняя величина T1/2 ингибирования ДПП-4 плазмы — 27 ч. Ингибирование активности ДПП-4 в плазме в течение по крайней мере 24 ч после приема саксаглиптина обусловлено его высоким сродством к ДПП-4 и длительным связыванием с ним. Заметной кумуляции саксаглиптина и его основного метаболита при длительном приеме препарата 1 раз в день не наблюдалось. Не было выявлено зависимости клиренса саксаглиптина и его основного метаболита от дозы препарата и длительности терапии при приеме саксаглиптина 1 раз в день в дозах от 2,5 до 400 мг на протяжении 14 дней.
Всасывание
После приема внутрь всасывается не менее 75% принятой дозы саксаглиптина. Прием пищи не оказывал существенное влияние на фармакокинетику саксаглиптина у здоровых добровольцев. Прием пищи с высоким содержанием жиров не оказывал влияние на Cmax саксаглиптина, тогда как AUC увеличивалась на 27% по сравнению с приемом натощак. Tmax для саксаглиптина увеличивалось приблизительно на 0,5 ч при приеме препарата вместе с пищей по сравнению с приемом натощак. Однако эти изменения не являются клинически значимыми.
Распределение
Связывание саксаглиптина и его основного метаболита с белками сыворотки крови незначительно, поэтому можно предположить, что распределение саксаглиптина при изменениях белкового состава сыворотки крови, отмечающихся при печеночной или почечной недостаточности, не будет подвержено значительным изменениям.
Метаболизм
Саксаглиптин метаболизируется главным образом при участии изоферментов цитохрома Р450 CYP3A4/5 с образованием активного основного метаболита, ингибирующее действие которого в отношении ДПП-4 выражено в 2 раза слабее, чем у саксаглиптина.
Выведение
Саксаглиптин выводится с мочой и желчью. После однократного приема дозы 50 мг меченного 14C-саксаглиптина 24% дозы выводились почками в виде неизмененного саксаглиптина и 36% — в виде основного метаболита саксаглиптина. Общая радиоактивность, обнаруженная в моче, соответствовала 75% принятой дозы препарата. Средний почечный клиренс саксаглиптина составил около 230 мл/мин, среднее значение клубочковой фильтрации — примерно 120 мл/мин. Для основного метаболита почечный клиренс был сопоставим со средними значениями клубочковой фильтрации.
Около 22% общей радиоактивности было обнаружено в фекалиях.
Фармакокинетика в особых клинических ситуациях
Нарушение функции почек. У пациентов с легкой степенью почечной недостаточности величина AUC саксаглиптина и его основного метаболита были соответственно в 1,2 и 1,7 раза выше, чем аналогичные показатели у лиц с нормальной функцией почек. Данное увеличение значений AUC не является клинически значимым, поэтому коррекция дозы не требуется.
У пациентов с почечной недостаточностью умеренной и тяжелой степени, а также у пациентов на гемодиализе величины AUC саксаглиптина и его основного метаболита были соответственно в 2,1 и 4,5 раза выше, чем аналогичные показатели у лиц с нормальной функцией почек. Для пациентов с умеренным и тяжелым нарушением функции почек, а также для пациентов на гемодиализе доза саксаглиптина должна составлять 2,5 мг 1 раз в сутки (см. «Способ применения и дозы», «Особые указания»).
Нарушение функции печени. У пациентов с легким, умеренным и тяжелым нарушением функции печени не было выявлено клинически значимых изменений параметров фармакокинетики саксаглиптина, поэтому коррекция дозы для таких пациентов не требуется.
Пациенты пожилого возраста. У пациентов 65–80 лет не было выявлено клинически значимых различий параметров фармакокинетики саксаглиптина по сравнению с пациентами более молодого возраста (18–40 лет), поэтому коррекция дозы у пожилых пациентов не требуется. Однако следует учитывать, что у этой категории пациентов более вероятно снижение функции почек (см. «Способ применения и дозы», «Особые указания»).
Показания
Сахарный диабет типа 2 в дополнение к диете и физическим упражнениям для улучшения гликемического контроля в качестве монотерапии; стартовой комбинированной терапии с метформином; добавления к монотерапии метформином, тиазолидиндионами, производными сульфонилмочевины, инсулином (в т.ч. в комбинации с метформином) при отсутствии адекватного гликемического контроля на данной терапии (см. «Противопоказания», С осторожностью и «Особые указания»).
Противопоказания
повышенная индивидуальная чувствительность к любому компоненту препарата;
серьезные реакции повышенной чувствительности (анафилаксия или ангионевротический отек) к ингибиторам ДПП-4;
сахарный диабет типа 1 (применение не изучено);
диабетический кетоацидоз;
врожденная непереносимость галактозы, лактазная недостаточность и глюкозо-галактозная мальабсорбция;
беременность;
лактация;
возраст до 18 лет (безопасность и эффективность не изучены).
С осторожностью: почечная недостаточность умеренной и тяжелой степени; пожилые пациенты; совместное применение с производными сульфонилмочевины или инсулином; пациенты с панкреатитом в анамнезе (связь между приемом препарата и повышенным риском развития панкреатита не установлена).
Применение при беременности и кормлении грудью
В связи с тем, что применение саксаглиптина в период беременности не изучено, не следует назначать препарат в период беременности.
Неизвестно, проникает ли саксаглиптин в грудное молоко. В связи с тем, что не исключена возможность проникновения саксаглиптина в грудное молоко, следует прекратить грудное вскармливание на период лечения саксаглиптином или отменить терапию, учитывая соотношение риска для ребенка и пользы для матери.
Способ применения и дозы
Внутрь, независимо от приема пищи.
Монотерапия: рекомендуемая доза саксаглиптина составляет 5 мг 1 раз в сутки.
Комбинированная терапия: рекомендуемая доза саксаглиптина составляет 5 мг 1 раз в сутки в комбинации с метформином, тиазолидиндионами, производными сульфонилмочевины или инсулином (в т.ч. в комбинации с метформином).
При стартовой комбинированной терапии с метформином рекомендуемая доза саксаглиптина составляет 5 мг 1 раз в сутки, начальная доза метформина — 500 мг/сут. В случае неадекватного ответа доза метформина может быть увеличена.
При пропуске приема препарата Онглиза® пропущенную таблетку следует принять сразу, как только пациент об этом вспомнит, однако не следует принимать двойную дозу препарата в течение одних суток.
Применение у особых групп пациентов
Пациенты с нарушением функции почек. Для пациентов с почечной недостаточностью легкой степени (Cl креатинина >50 мл/мин) коррекция дозы не требуется. Для пациентов с умеренной или тяжелой почечной недостаточностью (Cl креатинина ≤50 мл/мин), а также для пациентов, находящихся на гемодиализе, рекомендуемая доза препарата Онглиза® составляет 2,5 мг 1 раз в сутки. Препарат следует принимать по окончании сеанса гемодиализа.
Применение саксаглиптина у пациентов на перитонеальном диализе не изучено.
Перед началом терапии саксаглиптином и в процессе лечения рекомендуется проводить оценку функции почек.
Пациенты с нарушением функции печени. При нарушении функции печени легкой, умеренной и тяжелой степени коррекция дозы не требуется.
Пациенты пожилого возраста. Коррекция дозы у пожилых пациентов не требуется. Однако при выборе дозы следует учитывать, что у этой категории пациентов более вероятно снижение функции почек.
Дети. Безопасность и эффективность применения препарата у пациентов младше 18 лет не изучалась.
Одновременное применение с мощными ингибиторами CYP3A4/5
При одновременном применении с мощными ингибиторами CYP3A4/5, такими как кетоконазол, атазанавир, кларитромицин, индинавир, итраконазол, нефазодон, нелфинавир, ритонавир, саквинавир и телитромицин, рекомендуемая доза препарата Онглиза® составляет 2,5 мг 1 раз в сутки.
Побочные действия
В таблице приведены побочные эффекты, выявленные у пациентов с СД2 при приеме препарата Онглиза® в дозе 5 мг в ходе клинических исследований. Общая частота нежелательных явлений при приеме препарата Онглиза® в дозе 5 мг в режиме монотерапии и в режиме добавления к терапии метформином, тиазолидиндионом или глибенкламидом была сопоставима с таковой в группе плацебо.
Шкала частоты побочных реакций: очень часто (?1/10); часто (?1/100, но <1/10); нечасто (?1/1000, но <1/100); редко (?1/10000, но <1/1000); очень редко (<1/10000).
Таблица
Побочные эффекты по данным объединенного анализа 5 плацебо-контролируемых клинических исследований препарата Онглиза®
| Побочные эффекты | Частота побочных эффектов |
| Инфекции и инвазии: | |
| Инфекции верхних дыхательных путей | Часто |
| Инфекции мочевыводящих путей | Часто |
| Гастроэнтерит | Часто |
| Синусит | Часто |
| Со стороны ЖКТ: | |
| Рвота | Часто |
| Со стороны нервной системы: | |
| Головная боль | Часто |
Частота реакций гиперчувствительности, отмеченных к 24-й неделе терапии, составила 1,5% у пациентов, получавших препарат Онглиза® 5 мг, и 0,4% у пациентов, получавших плацебо. Реакции гиперчувствительности, возникшие у пациентов, принимавших препарат Онглиза®, не требовали госпитализации и были расценены лечащими врачами как не представлявшие угрозу жизни.
Побочные эффекты препарата Онглиза® при комбинированной терапии
В исследовании по комбинированному применению саксаглиптина и глибенкламида частота подтвержденных эпизодов гипогликемии в группе саксаглиптина 5 мг (0,8%) и плацебо (0,7%) статистически не различалась. Частота подтвержденных эпизодов гипогликемии у пациентов, получавших препарат Онглиза® 5 мг в ходе двух исследований саксаглиптина в режиме монотерапии, исследовании по комбинированной терапии саксаглиптином и метформином, а также в исследовании по комбинированному применению саксаглиптина и тиазолидиндионов, была сопоставима с таковой на фоне плацебо.
В исследовании по применению комбинации саксаглиптина и инсулина общая частота развития гипогликемии составила 18,4% в группе саксаглиптина 5 мг и 19,9% в группе плацебо.
В исследовании по применению саксаглиптина совместно с тиазолидиндионами частота периферических отеков была выше в группе саксаглиптина 5 мг по сравнению с группой плацебо (8,1 и 4,3% соответственно). Периферические отеки были слабо или умеренно выраженными и не приводили к прекращению лечения. Частота периферических отеков у пациентов, принимавших препарат Онглиза® в дозе 5 мг в ходе клинических исследований монотерапии саксаглиптином и комбинированной терапии с метформином или глибенкламидом, была сопоставима с таковой на фоне плацебо (1,7 и 2,4% соответственно).
При стартовой комбинированной терапии саксаглиптином в дозе 5 мг и метформином часто отмечались случаи назофарингита и головной боли. Частота назофарингита была выше на фоне комбинированной терапии (6,9%) по сравнению с монотерапией саксаглиптином 10 мг (4,2%) и метформином (4%). Головная боль была чаще в группе пациентов на комбинированной терапии метформином и саксаглиптином 5 мг (7,5%) по сравнению с группами монотерапии саксаглиптином 10 мг (6,3%) и метформином (5,2%).
Постмаркетинговое применение
В ходе постмаркетингового применения саксаглиптина зарегистрированы следующие побочные эффекты: острый панкреатит и реакции гиперчувствительности, включая анафилаксию, ангионевротический отек, сыпь и крапивницу. Достоверно оценить частоту развития данных явлений невозможно, поскольку сообщения получены спонтанно, от популяции неустановленного размера (см. «Противопоказания», «Особые указания»).
Лабораторные исследования
В клинических исследованиях частота изменений лабораторных показателей при приеме саксаглиптина в дозе 5 мг и плацебо была сопоставимой. Отмечалось небольшое снижение числа лимфоцитов, при этом среднее абсолютное число лимфоцитов оставалось стабильным и в пределах нормальных значений при ежедневном приеме саксаглиптина продолжительностью до 102 нед. Уменьшение количества лимфоцитов не сопровождалось клинически значимыми нежелательными реакциями. Клиническое значение уменьшения числа лимфоцитов на фоне терапии саксаглиптином неизвестно.
Взаимодействие
Анализ данных клинических исследований позволяет предполагать, что риск клинически значимых взаимодействий саксаглиптина с другими ЛС при их совместном применении невелик.
Метаболизм саксаглиптина преимущественно опосредован системой изоферментов цитохрома Р450 CYP3A4/5. В исследованиях in vitro было показано, что саксаглиптин и его основной метаболит не ингибируют изоферменты CYP1A2, 2А6, 2В6, 2С9, 2С19, 2D6, 2Е1 и 3А4 и не индуцируют изоферменты CYP1A2, 2В6, 2С9 и 3А4.
В исследованиях с участием здоровых добровольцев фармакокинетические показатели саксаглиптина и его основного метаболита значимо не изменялись под влиянием метформина, глибенкламида, пиоглитазона, дигоксина, симвастатина, дилтиазема, кетоконазола, омепразола, комбинации алюминия гидроксида, магния гидроксида и симетикона, а также фамотидина. Саксаглиптин значимо не изменяет фармакокинетические показатели метформина, глибенкламида, пиоглитазона, дигоксина, симвастатина, дилтиазема, кетоконазола или перорального комбинированного (эстроген+гестаген) контрацептивного средства.
Влияние индукторов изоферментов CYP3A4/5 на фармакокинетику саксаглиптина не изучено. Однако совместное применение саксаглиптина и индукторов изоферментов CYP3A4/5, таких как карбамазепин, дексаметазон, фенобарбитал, фенитоин и рифампицин, может приводить к уменьшению концентрации саксаглиптина в плазме и увеличению концентрации его основного метаболита.
Изучение влияния курения, диетического питания, приема растительных препаратов и употребления алкоголя на терапию саксаглиптином не проводилось.
Передозировка
Симптомов интоксикации не описано при длительном приеме препарата в дозах, до 80 раз превышающих рекомендованные.
Лечение: в случае передозировки следует применять симптоматическую терапию. Саксаглиптин и его основной метаболит выводятся из организма при помощи гемодиализа (скорость выведения: 23% дозы за 4 ч).
Особые указания
Применение препарата Онглиза® в составе тройной терапии с метформином и тиазолидиндионами или метформином и производными сульфонилмочевины не изучалось.
Пациенты с нарушением функции почек. Рекомендуется коррекция дозы для пациентов с умеренной и тяжелой почечной недостаточностью, а также для пациентов на гемодиализе. Перед началом терапии и периодически в процессе лечения препаратом рекомендуется проводить оценку функции почек.
Применение в комбинации с препаратами, которые могут вызвать гипогликемию. Производные сульфонилмочевины могут вызвать гипогликемию, поэтому для уменьшения риска гипогликемии при одновременном применении с препаратом Онглиза® может потребоваться снижение дозы производных сульфонилмочевины или инсулина.
Реакции гиперчувствительности. В ходе постмаркетингового применения саксаглиптина отмечены серьезные реакции гиперчувствительности, включая анафилаксию и ангионевротический отек. При развитии серьезной реакции гиперчувствительности следует прекратить применение препарата, оценить другие возможные причины развития явления и назначить альтернативную терапию сахарного диабета (см. «Противопоказания», «Побочные действия»).
Панкреатит. В рамках постмаркетингового применения препарата получены спонтанные сообщения о случаях острого панкреатита. Пациенты, принимающие препарат Онглиза®, должны быть проинформированы о характерном симптоме острого панкреатита — продолжительная, интенсивная боль в области живота. При подозрении на развитие панкреатита следует прекратить прием препарата Онглиза® (см. «Противопоказания», С осторожностью, «Побочные действия»).
Пациенты пожилого возраста. По данным клинических исследований, показатели эффективности и безопасности у пациентов в возрасте 65 лет и старше не отличались от аналогичных показателей у пациентов более молодого возраста. Однако нельзя исключить повышенную индивидуальную чувствительность к саксаглиптину у некоторых пациентов пожилого возраста. Саксаглиптин и его основной метаболит частично выводятся почками, поэтому необходимо учитывать, что у пациентов пожилого возраста более вероятно снижение функции почек.
Препарат Онглиза® содержит лактозу. Пациенты с врожденной непереносимостью галактозы, лактазной недостаточностью и глюкозо-галактозной мальабсорбцией не должны принимать этот препарат.
Влияние на способность управлять автомобилем или выполнять работы, требующие повышенной скорости физических и психических реакций. Исследования по изучению влияния саксаглиптина на способность к вождению автотранспорта и управлению механизмами не проводились. Следует учитывать, что саксаглиптин может вызывать головокружение.
Форма выпуска
Таблетки, покрытые пленочной оболочкой, 2,5 мг и 5 мг. По 10 табл. в блистере из алюминиевой фольги; по 3 блистера в картонной пачке. На блистер нанесена перфорация, разделяющая его на 10 прямоугольных зон по числу таблеток. Места вскрытия картонной пачки заклеены двумя защитными прозрачными бесцветными стикерами; на среднюю часть каждого стикера, ограниченную линиями отрыва, нанесен рисунок в виде желтой сетки.
Производитель
Владелец регистрационного удостоверения: Бристол-Майерс Сквибб Компани, США.
345, Парк-авеню, Нью-Йорк, штат Нью-Йорк, США.
Производитель: Бристол-Майерс Сквибб Компани, США.
4601 Хайуэй 62, Ист Маунт Вернон, Индиана 47620, США.
Выпускающий контроль качества: Бристол-Майерс Сквибб Компани, 4601 Хайуэй 62, Ист Маунт Вернон, Индиана 47620, США; Бристол-Майерс Сквибб С.р.Л., Локалита Фонтана дел Черазо, 03012 Ананьи (ФР), Италия.
Претензии потребителей направлять по адресу: ООО «Бристол-Майерс Сквибб».
105064, Москва, ул. Земляной Вал, 9.
Тел.: (495) 755-92-67; факс: (495) 755-92-63.
Условия отпуска из аптек
По рецепту.
Условия хранения
При температуре не выше 30 °C.
Хранить в недоступном для детей месте.
Срок годности
Не применять по истечении срока годности, указанного на упаковке.
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Онглиза® (Onglyza®) инструкция по применению
📜 Инструкция по применению Онглиза®
💊 Состав препарата Онглиза®
✅ Применение препарата Онглиза®
📅 Условия хранения Онглиза®
⏳ Срок годности Онглиза®
Описание лекарственного препарата
Онглиза®
(Onglyza®)
Основано на официальной инструкции по применению препарата, утверждено компанией-производителем
и подготовлено для электронного издания справочника Видаль 2012
года, дата обновления: 2017.11.23
Код ATX:
A10BH03
(Саксаглиптин)
Лекарственные формы
| Онглиза® |
Таб., покр. пленочной оболочкой, 2.5 мг: 30 шт. рег. №: ЛП-(000475)-(РГ-RU) |
|
|
Таб., покр. пленочной оболочкой, 5 мг: 30 шт. рег. №: ЛП-(000475)-(РГ-RU) |
Форма выпуска, упаковка и состав
препарата Онглиза®
Таблетки, покрытые пленочной оболочкой от бледно-желтого до светло-желтого цвета, круглые, двояковыпуклые, с надписями «2.5» на одной стороне и «4214» — на другой стороне, нанесенными синим красителем.
Вспомогательные вещества: лактозы моногидрат — 99 мг*, целлюлоза микрокристаллическая — 90 мг, кроскармеллоза натрия — 10 мг, магния стеарат — 1 мг**, хлористоводородная кислота 1 М или натрия гидроксида раствор 1 М — необходимое количество, Опадрай II белый (% вес/вес) — 26 мг (спирт поливиниловый 40%, титана диоксид 25%, макрогол (ПЭГ 3350) 20.2%, тальк 14.8 %), Опадрай II желтый (% вес/вес) — 7 мг (спирт поливиниловый 40%, титана диоксид 24.25%, макрогол (ПЭГ 3350) 20.2%, тальк 14.8%, краситель оксид железа желтый (Е172) 0.75%), чернила Опакод синий*** — необходимое количество.
10 шт. — блистеры из алюминиевой фольги (3) — пачки картонные.
* Количество лактозы может варьировать в зависимости от используемого количества магния стеарата.
** Количество магния стеарата может варьировать в пределах 0.5-2 мг. Оптимальное количество 1 мг.
*** Состав чернил Опакод синий (% вес/вес): шеллак 45% в спирте этиловом 55.4%, FD&C Blue #2/индигокарминовый алюминиевый пигмент (Е132) 16%, спирт н-бутиловый 15%, пропиленгликоль 10.5%, спирт изопропиловый 3%, 28% аммония гидроксид 0.1%. Очень небольшие количества шеллака и FD&C Blue #2/индигокарминового алюминиевого пигмента остаются на таблетках при нанесении маркировки. Растворители, входящие в состав чернил, удаляются в процессе производства.
Таблетки, покрытые пленочной оболочкой розового цвета, круглые, двояковыпуклые, с надписями «5» на одной стороне и «4215» — на другой стороне, нанесенными синим красителем.
Вспомогательные вещества: лактозы моногидрат — 99 мг*, целлюлоза микрокристаллическая — 90 мг, кроскармеллоза натрия — 10 мг, магния стеарат — 1 мг**, хлористоводородная кислота 1 М или натрия гидроксида раствор 1 М — необходимое количество, Опадрай II белый (% вес/вес) — 26 мг (спирт поливиниловый 40%, титана диоксид 25%, макрогол (ПЭГ 3350) 20.2%, тальк 14.8%), Опадрай II розовый (% вес/вес) — 7 мг (спирт поливиниловый 40%, титана диоксид 24.25%, макрогол (ПЭГ 3350) 20.2%, тальк 14.8%, краситель оксид железа красный (Е172) 0.75%), чернила Опакод синий*** — необходимое количество.
10 шт. — блистеры из алюминиевой фольги (3) — пачки картонные.
* Количество лактозы может варьировать в зависимости от используемого количества магния стеарата.
** Количество магния стеарата может варьировать в пределах 0.5-2 мг. Оптимальное количество 1 мг.
*** Состав чернил Опакод синий (% вес/вес): шеллак 45% в спирте этиловом 55.4%, FD&C Blue #2/индигокарминовый алюминиевый пигмент (Е132) 16%, спирт н-бутиловый 15%, пропиленгликоль 10.5%, спирт изопропиловый 3%, 28% аммония гидроксид 0.1%. Очень небольшие количества шеллака и FD&C Blue #2/индигокарминового алюминиевого пигмента остаются на таблетках при нанесении маркировки. Растворители, входящие в состав чернил, удаляются в процессе производства.
Фармакологическое действие
Саксаглиптин — мощный селективный обратимый конкурентный ингибитор дипептидилпептидазы-4 (ДПП-4).
У пациентов с сахарным диабетом 2 типа прием саксаглиптина приводит к подавлению активности фермента ДПП-4 в течение 24 ч. После приема глюкозы внутрь ингибирование ДПП-4 приводит к 2-3 кратному увеличению концентрации глюкагоноподобного пептида-1 (ГПП-1) и глюкозо-зависимого инсулинотропного полипептида (ГИП), уменьшению концентрации глюкагона и усилению глюкозозависимой ответной реакции бета-клеток, что приводит к повышению концентрации инсулина и С-пептида.
Высвобождение инсулина бета-клетками поджелудочной железы и снижение высвобождения глюкагона из панкреатических альфа-клеток приводит к снижению гликемии натощак и постпрандиальной гликемии.
Эффективность и безопасность применения саксаглиптина при приеме в дозах 2.5 мг, 5 мг и 10 мг 1 раз/сут изучены в шести двойных слепых плацебо-контролируемых исследованиях с участием 4148 пациентов с сахарным диабетом 2 типа. Прием препарата сопровождался статистически значимым улучшением показателей гликозилированного гемоглобина (HbA1c), глюкозы плазмы крови натощак (ГПН) и постпрандиальной глюкозы (ППГ) плазмы крови по сравнению с контролем.
Пациентам, у которых целевой уровень гликемии не удалось достигнуть при приеме саксаглиптина в виде монотерапии, дополнительно назначался метформин, глибенкламид или тиазолидиндионы. При приеме саксаглиптина в дозе 5 мг снижение HbA1c было отмечено через 4 недели и ГПН — через 2 недели. В группе пациентов, получавших саксаглиптин в комбинации с метформином, глибенкламидом или тиазолидиндионами, снижение HbA1c также отмечалось через 4 недели и ГПН — через 2 недели.
Влияние саксаглиптина на липидный профиль сходно с таковым плацебо. На фоне терапии саксаглиптином не отмечено увеличения массы тела.
Фармакокинетика
У пациентов с сахарным диабетом 2 типа и у здоровых добровольцев отмечены сходные параметры фармакокинетики саксаглиптина и его основного метаболита.
Саксаглиптин быстро абсорбируется после приема внутрь натощак с достижением Cmax саксаглиптина и основного метаболита в плазме в течение 2 ч и 4 ч соответственно. При увеличении дозы саксаглиптина было отмечено пропорциональное увеличение Cmax и AUC саксаглиптина и его основного метаболита. После однократного приема саксаглиптина внутрь в дозе 5 мг здоровыми добровольцами средние значения AUC саксаглиптина и его основного метаболита составили 78 нг × ч/мл и 214 нг × ч/мл, а значения Cmax в плазме — 24 нг/мл и 47 нг/мл соответственно.
Средняя продолжительность конечного T1/2 саксаглиптина и его основного метаболита составила 2.5 ч и 3.1 ч соответственно, а средняя величина ингибирования T1/2 ДПП-4 плазмы – 26.9 ч. Ингибирование активности ДПП-4 в плазме в течение, по крайней мере, 24 ч после приема саксаглиптина обусловлено его высоким сродством к ДПП-4 и длительным связыванием с ним. Заметной кумуляции саксаглиптина и его основного метаболита при длительном приеме препарата 1 раз/сут не наблюдалось. Не было выявлено зависимости клиренса саксаглиптина и его основного метаболита от дозы препарата и длительности терапии при приеме саксаглиптина 1 раз/сут в дозах от 2.5 мг до 400 мг на протяжении 14 дней.
Всасывание
После приема внутрь всасывается не менее 75% принятой дозы саксаглиптина. Прием пищи не оказывал существенного влияния на фармакокинетику саксаглиптина у здоровых добровольцев. Прием пищи с высоким содержанием жиров не оказывал влияния на Cmax саксаглиптина, тогда как AUC увеличивалась на 27% по сравнению с приемом натощак. Время достижения Cmax для саксаглиптина увеличивалось приблизительно на 0.5 ч при приеме препарата вместе с пищей по сравнению с приемом натощак. Однако эти изменения не являются клинически значимыми.
Распределение
Связывание саксаглиптина и его основного метаболита с белками сыворотки крови незначительно, поэтому можно предположить, что распределение саксаглиптина при изменениях белкового состава сыворотки крови, отмечающихся при печеночной или почечной недостаточности, не будет подвержено значительным изменениям.
Метаболизм
Саксаглиптин метаболизируется главным образом при участии изоферментов цитохрома Р450 3А4/5 (CYP 3A4/5) с образованием активного основного метаболита, ингибирующее действие которого в отношении ДПП-4 выражено в 2 раза слабее, чем у саксаглиптина.
Выведение
Саксаглиптин выводится с мочой и с желчью. После однократного приема 50 мг меченного 14C-саксаглиптина 24% дозы выводились почками в виде неизмененного саксаглиптина и 36% — в виде основного метаболита саксаглиптина. Общая радиоактивность, обнаруженная в моче, соответствовала 75% принятой дозы препарата. Средний почечный клиренс саксаглиптина составил около 230 мл/мин, среднее значение клубочковой фильтрации — примерно 120 мл/мин. Для основного метаболита почечный клиренс был сопоставим со средними значениями клубочковой фильтрации.
Около 22% общей радиоактивности было обнаружено в фекалиях.
Фармакокинетика в особых клинических случаях
У пациентов с легкой степенью почечной недостаточности величина AUC саксаглиптина и его основного метаболита были соответственно в 1.2 и 1.7 раза выше, чем аналогичные показатели у лиц с нормальной функцией почек. Данное увеличение значений AUC не является клинически значимым, поэтому коррекции дозы не требуется.
У пациентов с почечной недостаточностью умеренной и тяжелой степени, а также у пациентов на гемодиализе величины AUC саксаглиптина и его основного метаболита были соответственно в 2.1 и 4.5 раз выше, чем аналогичные показатели у лиц с нормальной функцией почек. Для пациентов с умеренным и тяжелым нарушением функции почек, а также для пациентов на гемодиализе доза саксаглиптина должна составлять 2.5 мг 1 раз/сут.
У пациентов с легким, умеренным и тяжелым нарушением функции печени не было выявлено клинически значимых изменений параметров фармакокинетики саксаглиптина, поэтому коррекции дозы для таких пациентов не требуется.
У пациентов в возрасте 65-80 лет не было выявлено клинически значимых различий параметров фармакокинетики саксаглиптина по сравнению с пациентами более молодого возраста (18-40 лет), поэтому коррекции дозы у пожилых пациентов не требуется. Однако следует учитывать, что у этой категории пациентов более вероятно снижение функции почек.
Показания препарата
Онглиза®
Сахарный диабет 2 типа в дополнение к диете и физическим упражнениям для улучшения гликемического контроля в качестве:
- монотерапии;
- стартовой комбинированной терапии с метформином;
- добавления к монотерапии метформином, тиазолидиндионами, производными сульфониломочевины, при отсутствии адекватного гликемического контроля на данной терапии.
Режим дозирования
Препарат назначают внутрь, независимо от приема пищи.
При монотерапии рекомендуемая доза саксаглиптина составляет 5 мг 1 раз/сут.
При комбинированной терапии рекомендуемая доза саксаглиптина составляет 5 мг 1 раз/сут в комбинации с метформином, тиазолидиндионами или производными сульфонилмочевины.
При стартовой комбинированной терапии с метформином рекомендуемая доза саксаглиптина составляет 5 мг 1 раз/сут, начальная доза метформина — 500 мг/сут. В случае неадекватного ответа доза метформина может быть увеличена.
При пропуске приема препарата Онглиза® пропущенную таблетку следует принять сразу, как только пациент об этом вспомнит, однако не следует принимать двойную дозу препарата в течение одних суток.
Для пациентов с почечной недостаточностью легкой степени (КК >50 мл/мин) коррекции дозы не требуется. Для пациентов с умеренной или тяжелой почечной недостаточностью (КК ≤50 мл/мин), а также для пациентов, находящихся на гемодиализе, рекомендуемая доза препарата Онглиза® составляет 2.5 мг 1 раз/сут. Препарат следует принимать по окончании сеанса гемодиализа. Применение саксаглиптина у пациентов, находящихся на перитонеальном диализе, не изучено. Перед началом терапии саксаглиптином и в процессе лечения рекомендуется проводить оценку функции почек.
При нарушении функции печени легкой, умеренной и тяжелой степени коррекции дозы не требуется.
Коррекции дозы у пожилых пациентов не требуется. Однако при выборе дозы следует учитывать, что у этой категории пациентов более вероятно снижение функции почек.
Безопасность и эффективность применения препарата у пациентов младше 18 лет не изучалась.
При одновременном применении с мощными ингибиторами CYP 3A4/5, такими как кетоконазол, атазанавир, кларитромицин, индинавир, итраконазол, нефазодон, нелфинавир, ритонавир, саквинавир и телитромицин, рекомендуемая доза препарата Онглиза® составляет 2.5 мг 1 раз/сут.
Побочное действие
Общая частота нежелательных явлений при приеме препарата Онглиза® 5 мг в режиме монотерапии и в режиме добавления к терапии метформином, тиазолидиндионом или глибенкламидом была сопоставима с таковой в группе плацебо.
Шкала частоты побочных реакций: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10 000, <1/1000); очень редко (<1/10 000).
В таблице приведены побочные эффекты, выявленные у пациентов с сахарным диабетом 2 типа при приеме препарата Онглиза® в дозе 5 мг в ходе клинических исследований. Побочные эффекты представлены по данным объединенного анализа пяти плацебо-контролируемых клинических исследований препарата Онглиза®.
Частота реакций гиперчувствительности, отмеченных к 24 неделе терапии, составила 1.5% у пациентов, получавших препарат Онглиза® 5 мг, и 0.4% у пациентов, получавших плацебо. Реакции гиперчувствительности, возникшие у пациентов, принимавших препарат Онглиза®, не требовали госпитализации и были расценены лечащими врачами как не представлявшие угрозу жизни.
Побочные эффекты препарата Онглиза® при комбинированной терапии
В исследовании по комбинированному применению саксаглиптина и глибенкламида частота подтвержденных эпизодов гипогликемии в группе саксаглиптина 5 мг (0.8%) и плацебо (0.7%) статистически не различалась. Частота подтвержденных эпизодов гипогликемии у пациентов, получавших препарат Онглиза® 5 мг в ходе двух исследованиях саксаглиптина в режиме монотерапии, исследовании по комбинированной терапии саксаглиптином и метформином, а также в исследовании по комбинированному применению саксаглиптина и тиазолидиндионов, была сопоставима с таковой на фоне плацебо.
В исследовании по применению саксаглиптина совместно с тиазолидиндионами частота периферических отеков была выше в группе саксаглиптина 5 мг по сравнению с группой плацебо (8.1% и 4.3% соответственно). Периферические отеки были слабо или умеренно выраженными и не приводили к прекращению лечения. Частота периферических отеков у пациентов, принимавших препарат Онглиза® в дозе 5 мг в ходе клинических исследований монотерапии саксаглиптина и комбинированной терапии с метформином или глибенкламидом, была сопоставима с таковой на фоне плацебо (1.7% и 2.4% соответственно).
При стартовой комбинированной терапии саксаглиптином в дозе 5 мг и метформином часто отмечались случаи назофарингита и головной боли. Частота назофарингита была выше на фоне комбинированной терапии (6.9%) по сравнению с монотерапией саксаглиптином 10 мг (4.2%) и метформином (4%). Головная боль была чаще в группе пациентов на комбинированной терапии метформином и саксаглиптином 5 мг (7.5%) по сравнению с группами монотерапии саксаглиптином 10 мг (6.3%) и метформином (5.2%).
Лабораторные исследования: в клинических исследованиях частота изменений лабораторных показателей при приеме саксаглиптина в дозе 5 мг и плацебо была сопоставимой. Отмечалось небольшое снижение числа лимфоцитов, при этом среднее абсолютное число лимфоцитов оставалось стабильным и в пределах нормальных значений при ежедневном приеме саксаглиптина продолжительностью до 102 недель. Уменьшение количества лимфоцитов не сопровождалось клинически значимыми нежелательными реакциями. Клиническое значение уменьшения числа лимфоцитов на фоне терапии саксаглиптином не известно.
Противопоказания к применению
- сахарный диабет 1 типа (применение не изучено);
- применение совместно с инсулином (не изучено);
- диабетический кетоацидоз;
- врожденные непереносимость галактозы, лактазная недостаточность и глюкозо- галактозная мальабсорбция;
- беременность;
- лактация;
- возраст до 18 лет (безопасность и эффективность не изучены);
- повышенная индивидуальная чувствительность к любому компоненту препарата.
С осторожностью следует назначать препарат при почечной недостаточности умеренной и тяжелой степени, пожилым пациентам, а также совместно с производными сульфонилмочевины.
Применение при беременности и кормлении грудью
В связи с тем, что применение саксаглиптина при беременности не изучено, не следует назначать препарат в этот период.
Неизвестно, проникает ли саксаглиптин в грудное молоко. В связи с тем, что не исключена возможность проникновения саксаглиптина в грудное молоко, следует прекратить грудное вскармливание на период лечения саксаглиптином или отменить терапию, учитывая соотношение риска для ребенка и пользы для матери.
Применение при нарушениях функции печени
При нарушении функции печени легкой, умеренной и тяжелой степени коррекции дозы не требуется.
Применение при нарушениях функции почек
Для пациентов с почечной недостаточностью легкой степени (КК >50 мл/мин) коррекции дозы не требуется. Для пациентов с умеренной или тяжелой почечной недостаточностью (КК <50 мл/мин), а также для пациентов на гемодиализе рекомендуемая доза препарата Онглиза® составляет 2.5 мг 1 раз/сут. Препарат следует принимать по окончании сеанса гемодиализа. Применение саксаглиптина у пациентов на перитонеальном диализе не изучено. Перед началом терапии саксаглиптином и в процессе лечения рекомендуется проводить оценку функции почек.
Применение у детей
Противопоказан в детском и подростковом возрасте до 18 лет.
Применение у пожилых пациентов
С осторожностью следует назначать препарат пожилым пациентам.
Особые указания
Применение препарата Онглиза® в комбинации с инсулином, а так же в составе тройной терапии с метформином и тиазолидиндионами или метформином и производными сульфонилмочевины, не изучалось.
Пациенты с нарушением функции почек
Рекомендуется коррекция дозы для пациентов с умеренной и тяжелой степенью почечной недостаточностью, а также для пациентов, находящихся на гемодиализе. Перед началом терапии и периодически в процессе лечения препаратом рекомендуется проводить оценку функции почек.
Применение в комбинации с препаратами, которые могут вызвать гипогликемию
Производные сульфонилмочевины могут вызвать гипогликемию, поэтому для уменьшения риска гипогликемии при одновременном применении с препаратом Онглиза® может потребоваться снижение дозы производных сульфонилмочевины.
Реакции гиперчувствительности
Препарат не следует назначать пациентам, у которых были отмечены серьезные реакции гиперчувствительности при применении других ингибиторов ДПП-4.
Пациенты пожилого возраста
По данным клинических исследований, показатели эффективности и безопасности у пациентов в возрасте 65 лет и старше не отличались от аналогичных показателей у пациентов более молодого возраста. Однако нельзя исключить повышенную индивидуальную чувствительность к саксаглиптину у некоторых пациентов пожилого возраста.
Саксаглиптин и его основной метаболит частично выводятся почками, поэтому необходимо учитывать, что у пациентов пожилого возраста более вероятно снижение функции почек.
Препарат Онглиза® содержит лактозу. Пациенты с врожденной непереносимостью галактозы, лактазной недостаточностью и глюкозо-галактозной мальабсорбцией не должны принимать этот препарат.
Влияние на способность к управлению транспортными средствами и механизмами
Исследований по изучению влияния саксаглиптина на способность к вождению автотранспорта и управлению механизмами не проводилось.
Следует учитывать, что саксаглиптин может вызывать головокружение.
Передозировка
Симптомы интоксикации не описаны при длительном приеме препарата в дозах, до 80 раз превышающих рекомендованные.
Лечение: в случае передозировки следует применять симптоматическую терапию. Саксаглиптин и его основной метаболит выводятся из организма при помощи гемодиализа (скорость выведения: 23% дозы за 4 ч).
Лекарственное взаимодействие
Анализ данных клинических исследований позволяет предполагать, что риск клинически значимых взаимодействий саксаглиптина с другими лекарственными средствами при их совместном применении невелик.
Метаболизм саксаглиптина преимущественно опосредован системой изоферментов цитохрома Р450 3А4/5 (CYP3A4/5). В исследованиях in vitro было показано, что саксаглиптин и его основной метаболит не ингибируют изоферменты CYP 1A2, 2А6, 2В6, 2С9, 2С19, 2D6, 2Е1 и 3А4 и не индуцируют изоферменты CYP 1A2, 2В6, 2С9, и ЗА4. В исследованиях с участием здоровых добровольцев фармакокинетические показатели саксаглиптина и его основного метаболита значимо не изменялись под влиянием метформина, глибенкламида, пиоглитазона, дигоксина, симвастатина, дилтиазема, кетоконазола, омепразола, комбинации алюминия гидроксида, магния гидроксида и симетикона, а также фамотидина. Саксаглиптин значимо не изменяет фармакокинетические показатели метформина, глибенкламида, пиоглитазона, дигоксина, симвастатина, дилтиазема или кетоконазола.
Влияние индукторов изоферментов CYP 3A4/5 на фармакокинетику саксаглиптина не изучено. Однако совместное применение саксаглиптина и индукторов изоферментов CYP 3A4/5, таких как карбамазепин, дексаметазон, фенобарбитал, фенитоин и рифампицин, могут приводить к уменьшению концентрации саксаглиптина в плазме и увеличению концентрации его основного метаболита.
Изучения влияния курения, диетического питания, приема растительных препаратов и употребления алкоголя на терапию саксаглиптином не проводилось.
Условия хранения препарата Онглиза®
Препарат следует хранить в недоступном для детей месте при температуре не выше 30°С.
Срок годности препарата Онглиза®
Срок годности — 3 года.
Не применять по истечении срока годности, указанного на упаковке.
Условия реализации
Препарат отпускается по рецепту.
Контакты для обращений
АСТРАЗЕНЕКА ФАРМАСЬЮТИКАЛЗ ООО
(Россия)

|
|
123112 Москва, |
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Состав
В составе этого препарата присутствует активный компонент саксаглиптин (форма гидрохлорида), также дополнительные компоненты: МКЦ, лактозы моногидрат, кроскармеллоза натрия, стеарат магния, кислота хлористоводородная 1 М или раствор натрия гидроксида 1 М, красители.
Форма выпуска
Это лекарство выпускается в виде таблеток с пленочной оболочкой.
- Таблетки 2,5 мг: цвет оболочки желтый, таблетки двояковыпуклые, круглые, с одной стороны надпись «2.5», с другой стороны — «4214». Надписи нанесены синим цветом. Таблетки упакованы в блистеры из фольги, в картонных пачках – по 3 блистера.
- Таблетки 5 мг: цвет оболочки розовый, таблетки двояковыпуклые, круглые, с одной стороны надпись «5», с другой стороны — «4215». Надписи нанесены синим цветом. Таблетки упакованы в блистеры из фольги, в картонных пачках – по 3 блистера.
Фармакологическое действие
Препарат Онглиза в составе имеет активное вещество саксаглиптин, которое является очень сильным селективным конкурентным обратимым ингибитором дипептидилпептидазы-4.
Если препарат принимают пациенты, которые болеют сахарным диабетом, у них на протяжении 24 часов активность фермента ДПП-4 подавляется.
После того, как пациент принял глюкозу внутрь, вследствие ингибирования ДПП-4 происходит к 2-3-кратный рост концентрации глюкозозависимого инсулинотропного полипептида, глюкагоноподобного пептида-1. Снижается концентрация глюкагона и усиление ответной глюкозозависимой реакции бета-клеток. В итоге в организме увеличивается концентрация инсулина и С-пептида.
Благодаря высвобождению инсулина бета-клетками поджелудочной железы и уменьшению высвобождения глюкагона из панкреатических альфа-клеток происходит понижение гликемии натощак, уменьшение постпрандиальной гликемии.
В процессе приема саксаглиптина у пациентов не наблюдается увеличение веса.
Фармакокинетика и фармакодинамика
В организме саксаглиптин всасывается быстро после приема до еды. После перорального приема всасывается около 75% дозы. С белками крови саксаглиптин и его метаболит связываются незначительно.
Максимальная концентрация саксаглиптина и его основного метаболита отмечается в плазме соответственно на протяжении 2 часов и 4 часов.
В среднем, длительность конечного полувыведения и его метаболита равна соответственно 2.5 часов и 3.1 часов. Выводится с желчью и с мочой.
Показания к применению
Лекарство Онглиза показано к применению при сахарном диабете второго типа как дополнительное средство к физической активности и диетическому питанию с целью улучшения гликемического контроля. Может назначаться в следующем качестве:
- с целью монолечения;
- для стартового комбинированного лечения с препаратом Метформин;
- как добавление к монолечению тиазолидиндионами, Метформином, производными сульфониломочевины, если отсутствует адекватный гликемический контроль на таком лечении.
Противопоказания
Противопоказано применение Онглизы в таких случаях:
- больным с сахарным диабетом первого типа;
- применение лекарства совместно с приемом инсулина;
- лактазная недостаточность, непереносимость галактозы, глюкозо-галактозная мальабсорбция врожденные;
- диабетический кетоацидоз;
- беременность и кормление грудью;
- усиленная чувствительность к любому из составляющих препарата.
Осторожно назначают лекарство людям, страдающим умеренной и тяжелой почечной недостаточностью, пожилым пациентам, а также тем, кто принимает производные сульфонилмочевины.
Побочные действия
Проявляются следующие побочные эффекты в процессе приема препарата Онглиза:
- инфекции мочевыводящих путей и верхних дыхательных путей;
- синусит;
- гастроэнтерит;
- рвота;
- головные боли.
На фоне комбинированного лечения с Метформином может проявляться назофарингит, головные боли.
Онглиза, инструкция по применению (Способ и дозировка)
Следует принимать средство перорально, независимо от периода приема еды.
Если пациенту назначается монолечение, ему рекомендуется принимать таблетки из расчета 5 мг саксаглиптина один раз в день.
Если назначено комбинированное лечение, необходимо принимать 5 мг саксаглиптина один раз в день, комбинируя прием с тиазолидиндионами и Метформином, с лекарствами производными сульфонилмочевины.
В начале комбинированного лечения с Метформином доза саксаглиптина равна 5 мг, а доза Метформина — 500 мг в сутки.
Если пациент пропустил прием Онглизы, необходимо принимать таблетку сразу же, как только человек вспоминает об этом. Двойную дозу пить не следует.
Пациенты с легкой степенью почечной недостаточности могут не корректировать дозу. Пациентам с тяжелой или умеренной почечной недостаточностью, а также тем, кто находится на гемодиализе, нужно принимать в сутки 2.5 мг лекарства. Следует пить таблетки после гемодиализа.
Если пациент одновременно применяет сильные ингибиторы CYP 3A4/5, доза Онглизы должна составлять в сутки 2.5 мг.
Передозировка
Нет описания симптомов интоксикации при продолжительном приеме больших доз средства. При передозировке практикуют симптоматическое лечение. Из организма активное вещество и его метаболит можно вывести с помощью гемодиализа.
Взаимодействие
Согласно с данными исследований, существует относительно небольшой риск значимого клинически взаимодействия саксаглиптина с другими препаратами.
При одновременном применении с индукторами изоферментов CYP 3A4/5 (Дексаметазона, Карбамазепина, Фенобарбитала, Рифампицина, Фенитоина) может уменьшаться концентрация основного метаболита саксаглиптина.
Так как производные сульфонилмочевины могут спровоцировать проявление гипогликемии, чтобы снизить риск, возможно, понадобится снижение дозы лекарств — производных сульфонилмочевины при одновременном приеме с Онглизой.
Условия продажи
Продается Онглиза по рецепту.
Условия хранения
Нужно беречь Онглизу от детей, при этом t не должна быть выше 30°С.
Срок годности
Хранить таблетки Онглиза можно 3 года.
Особые указания
Следует учитывать, что использование лекарства Онглиза совместно с инсулином и в составе тройного лечения (Метформин, тиазолидиндионы, производные сульфонилмочевины) на данный момент не изучалось.
Не проводилось исследований касательно воздействия препарата на способность к вождению транспорта и работе с точными механизмами. Тем не менее, следует учесть, что после приема препарата может проявиться головокружение.
Аналоги Онглизы
Совпадения по коду АТХ 4-го уровня:
Аналоги Онглизы по действующему веществу отсутствуют. Схожее воздействие на организм оказывают средства Несина, Янувия, Гальвус, Тражента, Комбоглиза XR. Категорически нельзя принимать эти лекарства без назначения врача.
Детям
Не назначается пациентам до 18-летнего возраста.
При беременности и лактации
Так как использование саксаглиптина для лечения беременных не изучалось, лекарство женщинам в период вынашивания плода не назначают. Так как нет данных о проникновении саксаглиптина в грудное молоко, в период естественного вскармливания таблетки Онглиза также не назначают.
Отзывы об Онглизе
В отзывах часто идет речь о том, что Онглиза позволяет диабетикам обеспечить эффективный контроль уровня глюкозы. Отмечается, что лекарство удобно в применении, побочные реакции в процессе лечения проявляются редко. Негативным моментом для пользователей является высокая стоимость препарата.
Цена Онглизы, где купить
Купить Онглизу можно в аптеке по рецепту. Стоимость упаковки таблеток (30 шт.) составляет 1700-1800 рублей.
- Интернет-аптеки РоссииРоссия
ЗдравСити
-
Онглиза таблетки п/о плен. 5мг 30штАстраЗенека Фармасьютикалс ЛП/АстраЗенека ЮК Лимитед
Аптека Диалог
-
Онглиза таблетки 5мг №30Bristol Myers
показать еще
Онглиза — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛСР-008697/10
Торговое название:
Онглиза® (ONGLYZA®)
Международное непатентованное название:
саксаглиптин
Лекарственная форма:
таблетки, покрытые плёночной оболочкой
СОСТАВ
Одна таблетка, покрытая плёночной оболочкой содержит:
активные вещества: саксаглиптина 2,5 мг или 5,0 мг в виде саксаглиптина гидрохлорида;
вспомогательные вещества: лактозы моногидрат 99,0 мг*, целлюлоза микрокристаллическая 90,0 мг, кроскармеллоза натрия 10,0 мг, магния стеарат 1,0 мг**, 1 М раствор хлористоводородной кислоты*** — необходимое количество, Опадрай II белый (% вес/вес) 26,0 мг [спирт поливиниловый 40 %, титана диоксид 25 %, макрогол (ПЭГ 3350) 20,2 %, тальк 14,8 %], Опадрай II желтый (% вес/вес) 7,0 мг [спирт поливиниловый 40 %, титана диоксид 24,25 %, макрогол (ПЭГ 3350) 20,2 %, тальк 14,8 %, краситель оксид железа желтый (Е172) 0,75 %] (для дозировки 2,5 мг), Опадрай II розовый (% вес/вес) 7,0 мг [спирт поливиниловый 40 %, титана диоксид 24,25 %, макрогол (ПЭГ 3350) 20,2 %, тальк 14,8 %, краситель оксид железа красный (Е172) 0,75 %] (для дозировки 5,0 мг), чернила Опакод синий**** — необходимое количество.
* Количество лактозы может варьировать в зависимости от используемого количества магния стеарата.
** Количество магния стеарата может варьировать в пределах 0,5 — 2 мг. Оптимальное количество 1 мг.
*** В случае необходимости для доведения рН может использоваться 1 М натриягидроксид.
****Состав чернил Опакод синий (% вес/вес): шеллак 45 % в спирте этиловом 55,4 %, FD&C Blue #2 /индиго карминовый алюминиевый пигмент (E132) 16 %, спирт н-бутиловый 15 %, пропиленгликоль 10,5 %, спирт изопропиловый 3 %, 28 % аммония гидроксид 0,1 %. Очень небольшие количества шеллака и FD&C Blue #2 / индиго карминового алюминиевого пигмента остаются на таблетках при нанесении маркировки. Растворители, входящие в состав чернил, удаляются в процессе производства.
ОПИСАНИЕ
Таблетки, покрытые плёночной оболочкой 2,5 мг: круглые двояковыпуклые таблетки, покрытые плёночной оболочкой от бледно-желтого до светло-желтого цвета, с надписями «2.5» на одной стороне и «4214» на другой стороне, нанесенными синим красителем.
Таблетки, покрытые плёночной оболочкой 5 мг: круглые двояковыпуклые таблетки, покрытые пленочной оболочкой розового цвета, с надписями «5» на одной стороне и «4215» на другой стороне, нанесенными синим красителем.
Фармакотерапевтическая группа:
гипогликемическое средство — дипептидилпептидазы-4
ингибитор
Код АТХ: A10BH03
ФАРМАКОЛОГИЧЕСКИЕ СВОЙСТВА
Фармакодинамика
Механизм действия
Саксаглиптин – мощный селективный обратимый конкурентный ингибитор
дипептидилпептидазы-4 (ДПП-4). У пациентов с сахарным диабетом 2 типа (СД2) прием саксаглиптина приводит к подавлению активности фермента ДПП-4 в течение 24 ч. После приема глюкозы внутрь ингибирование ДПП-4 приводит к 2-3 кратному увеличению концентрации глюкагоноподобного пептида-1 (ГПП-1) и глюкозозависимого инсулинотропного полипептида (ГИП), уменьшению концентрации глюкагона и усилению глюкозозависимой ответной реакции бета-клеток, что приводит к повышению концентрации инсулина и С-пептида. Высвобождение инсулина бета-клетками поджелудочной железы и снижение высвобождения глюкагона из панкреатических альфа-клеток приводит к снижению гликемии натощак и постпрандиальной гликемии.
Клиническая эффективность и безопасность
В двойных слепых рандомизированных контролируемых клинических исследованиях терапию саксаглиптином получали более 17000 пациентов с СД2.
Гликемический контроль
Эффективность и безопасность применения саксаглиптина при приеме в дозах 2,5 мг, 5 мг и 10 мг 1 раз в сутки изучены в шести двойных слепых плацебоконтролируемых исследованиях с участием 4148 пациентов с СД2. Прием препарата сопровождался статистически значимым улучшением показателей гликозилированного гемоглобина (HbA1c), глюкозы плазмы крови натощак (ГПН) и постпрандиальной глюкозы (ППГ) плазмы крови по сравнению с контролем.
Саксаглиптин назначался в виде монотерапии или комбинированной терапии.
Комбинированная терапия саксаглиптином назначалась дополнительно пациентам, некомпенсированным при проведении монотерапии метформином, глибенкламидом, тиазолидиндионами или инсулином, или в качестве стартовой комбинации с метформином пациентам, некомпенсированным на диете и физических упражнениях. При приеме саксаглиптина в дозе 5 мг снижение HbA1с было отмечено через 4 недели и ГПН – через 2 недели.
В группе пациентов, получавших саксаглиптин в комбинации с метформином, глибенкламидом или тиазолидиндионами, снижение HbA1с также отмечалось через 4 недели и ГПН – через 2 недели.
В исследовании комбинированной терапии саксаглиптином и инсулином (в том числе, в комбинации с метформином) с участием 455 пациентов с СД2 продемонстрировано значимое снижение HbA1с и ППГ по сравнению с плацебо.
В исследовании терапии саксаглиптином в комбинации с метформином и производными сульфонилмочевины с участием 257 пациентов с СД2 продемонстрировано значимое снижение HbA1c и ППГ по сравнению с плацебо в комбинации с метформином и производными сульфонилмочевины.
Влияние саксаглиптина на липидный профиль сходно с таковым плацебо. На фоне терапии саксаглиптином не отмечено увеличения массы тела.
В прямом сравнительном исследовании с участием 858 пациентов с СД2 добавление препарата Онглиза® 5 мг к метформину по сравнению с добавлением глипизида к метформину продемонстрировало сравнимое снижение HbA1c, однако было ассоциировано с достоверно меньшим числом эпизодов гипогликемии – 3% случаев по сравнению с 36,3% при добавлении глипизида, а также отсутствие увеличения массы тела у пациентов, получающих терапию саксаглиптином (-1,1 кг от исходного уровня в группе саксаглиптина, +1,1 кг в группе глипизида). К 104 неделе терапии, по меньшей мере, один эпизод гипогликемии возник у 3,5% пациентов в группе саксаглиптина и метформина, и у 38,4% в группе глипизида и метформина; изменение массы тела от исходного уровня составило -1,5 кг и +1,3 кг, соответственно.
Сердечно—сосудистые исходы
В исследовании SAVOR (Оценка сердечно-сосудистых исходов у пациентов с сахарным диабетом, принимающих саксаглиптин) были изучены сердечно-сосудистые исходы у 16492 пациентов с СД2 (12959 пациентов с подтвержденными сердечно-сосудистыми заболеваниями (ССЗ), 3533 пациента с множественными факторами риска сердечнососудистых осложнений) и значениями 6,5% ≤ HbA1c <12%. Пациенты были рандомизированы в две группы для терапии саксаглиптином (8280 пациентов) или плацебо (8212 пациентов) в дополнение к стандартной для каждого региона терапии, направленной на контроль гликозилированного гемоглобина и факторов сердечнососудистого риска.
Было показано, что саксаглиптин не увеличивает риск сердечно-сосудистых осложнений (таких как смерть от ССЗ, нефатальный инфаркт миокарда, нефатальный ишемический инсульт) по сравнению с плацебо при добавлении к стандартной базовой терапии (относительный риск [ОР] 1,00; 95% доверительный интервал [ДИ] 0,89, 1,12).
Также было показано, что добавление саксаглиптина к базовой терапии не увеличивает риск комбинированной конечной точки, включавшей в себя смерть от ССЗ, нефатальный инфаркт миокарда, нефатальный ишемический инсульт, госпитализацию по поводу хронической сердечной недостаточности, нестабильной стенокардии или реваскуляризации коронарных артерий по сравнению с плацебо (ОР 1,02; 95% ДИ 0,94, 1,11). Общая смертность была сопоставимой в группах саксаглиптина и плацебо (ОР 1,11; 95% ДИ 0,96, 1,27).
В исследовании было отмечено увеличение частоты госпитализации по поводу хронической сердечной недостаточности в группе саксаглиптина (3,5%, 289 пациентов) по сравнению с группой плацебо (2,8%, 228 пациентов) с номинальной статистической значимостью (то есть без выполнения поправки для множественных конечных точек) (ОР 1,27; 95% ДИ 1,07, 1,51; P=0,007). У пациентов с хронической сердечной недостаточностью или почечной недостаточностью, получавших саксаглиптин, не было отмечено более высокой частоты первичной конечной точки, вторичной конечной точки и общей смертности по сравнению с группой плацебо.
В группе саксаглиптина динамика значения HbA1c была достоверно более выраженной, а процент пациентов, достигших целевого значения HbA1c, был выше, чем в группе плацебо. При этом интенсификация гипогликемической терапии или добавление инсулина в группе саксаглиптина потребовались значительно меньшему количеству пациентов, чем в группе плацебо.
Фармакокинетика
У пациентов с СД2 и у здоровых добровольцев отмечены сходные параметры фармакокинетики саксаглиптина и его основного метаболита. Саксаглиптин быстро абсорбируется после приема внутрь натощак с достижением максимальной концентрации саксаглиптина и основного метаболита в плазме (Cmax) в течение 2 ч и 4 ч соответственно. При увеличении дозы саксаглиптина было отмечено пропорциональное увеличение Cmax и величины площади под кривой «концентрация-время» (AUC) саксаглиптина и его основного метаболита. После однократного приема саксаглиптина внутрь в дозе 5 мг здоровыми добровольцами средние значения AUC саксаглиптина и его основного метаболита составили 78 нг×ч/мл и 214 нг×ч/мл, а значения Cmax в плазме -24 нг/мл и 47 нг/мл соответственно.
Средняя продолжительность конечного периода полувыведения (t1/2) саксаглиптина и его основного метаболита составила 2,5 ч и 3,1 ч соответственно, а средняя величина t1/2 ингибирования ДПП-4 плазмы — 27 ч. Ингибирование активности ДПП-4 в плазме в течение, по крайней мере, 24 ч после приема саксаглиптина обусловлено его высоким сродством к ДПП-4 и длительным связыванием с ним. Заметной кумуляции саксаглиптина и его основного метаболита при длительном приеме препарата 1 раз в день не наблюдалось. Не было выявлено зависимости клиренса саксаглиптина и его основного метаболита от дозы препарата и длительности терапии при приеме саксаглиптина один раз в день в дозах от 2,5 мг до 400 мг на протяжении 14 дней.
Всасывание
После приема внутрь всасывается не менее 75% принятой дозы саксаглиптина. Прием пищи не оказывал существенного влияния на фармакокинетику саксаглиптина у здоровых добровольцев. Прием пищи с высоким содержанием жиров не оказывал влияния на Cmax саксаглиптина, тогда как AUC увеличивалась на 27% по сравнению с приемом натощак. Время достижения Cmax (Tmax) для саксаглиптина увеличивалось приблизительно на 0,5 ч при приеме препарата вместе с пищей по сравнению с приемом натощак. Однако, эти изменения не являются клинически значимыми.
Распределение
Связывание саксаглиптина и его основного метаболита с белками сыворотки крови незначительно, поэтому можно предположить, что распределение саксаглиптина при изменениях белкового состава сыворотки крови, отмечающихся при печеночной или почечной недостаточности, не будет подвержено значительным изменениям.
Метаболизм
Саксаглиптин метаболизируется главным образом при участии изоферментов цитохрома Р450 ЗА4/5 (CYP3A4/5) с образованием активного основного метаболита, ингибирующее действие которого в отношении ДПП-4 выражено в 2 раза слабее, чем у саксаглиптина.
Выведение
Саксаглиптин выводится с мочой и с желчью. После однократного приема дозы 50 мг меченного 14С-саксаглиптина 24% дозы выводились почками в виде неизмененного саксаглиптина и 36% — в виде основного метаболита саксаглиптина. Общая радиоактивность, обнаруженная в моче, соответствовала 75% принятой дозы препарата.
Средний почечный клиренс саксаглиптина составил около 230 мл/мин, среднее значение клубочковой фильтрации — примерно 120 мл/мин. Для основного метаболита почечный клиренс был сопоставим со средними значениями клубочковой фильтрации.
Около 22% общей радиоактивности было обнаружено в фекалиях.
Фармакокинетика в особых клинических ситуациях
Нарушение функции почек
У пациентов с легкой степенью почечной недостаточности величина AUC саксаглиптина и его основного метаболита были соответственно в 1,2 и 1,7 раза выше, чем аналогичные показатели у лиц с нормальной функцией почек. Данное увеличение значений AUC не является клинически значимыми, поэтому коррекции дозы не требуется.
У пациентов с почечной недостаточностью умеренной и тяжелой степени, а также у пациентов на гемодиализе величины AUC саксаглиптина и его основного метаболита были соответственно в 2,1 и 4,5 раз выше, чем аналогичные показатели у лиц с нормальной функцией почек. Для пациентов с умеренным и тяжелым нарушением функции почек, а также для пациентов на гемодиализе доза саксаглиптина должна составлять 2,5 мг 1 раз в сутки (см. разделы «Способ применения и дозы» и «Особые указания»).
Нарушение функции печени
У пациентов с легким, умеренным и тяжелым нарушением функции печени не было выявлено клинически значимых изменений параметров фармакокинетики саксаглиптина, поэтому коррекции дозы для таких пациентов не требуется.
Пациенты пожилого возраста
У пациентов 65-80 лет не было выявлено клинически значимых различий параметров фармакокинетики саксаглиптина по сравнению с пациентами более молодого возраста (18-40 лет), поэтому коррекции дозы у пожилых пациентов не требуется. Однако следует учитывать, что у этой категории пациентов более вероятно снижение функции почек (см. разделы «Способ применения и дозы» и «Особые указания»).
ПОКАЗАНИЯ
Сахарный диабет 2 типа в дополнение к диете и физическим упражнениям для улучшения гликемического контроля в качестве:
- монотерапии;
- стартовой комбинированной терапии с метформином;
- добавления к монотерапии метформином, тиазолидиндионами, производными сульфониломочевины, инсулином (в том числе в комбинации с метформином) при отсутствии адекватного гликемического контроля на данной терапии;
- добавления к комбинации метформина и производных сульфонилмочевины при отсутствии адекватного гликемического контроля на данной терапии.
ПРОТИВОПОКАЗАНИЯ
- Повышенная индивидуальная чувствительность к любому компоненту препарата;
- Серьезные реакции повышенной чувствительности (анафилаксия или ангионевротический отек) к ингибиторам ДПП-4;
- Сахарный диабет 1 типа (применение не изучено);
- Диабетический кетоацидоз;
- Врожденные непереносимость галактозы, лактазная недостаточность и глюкозо-галактозная мальабсорбция;
- Беременность, лактация;
- Возраст до 18 лет (безопасность и эффективность не изучены).
С осторожностью: почечная недостаточность умеренной и тяжелой степени; пожилые пациенты; совместное применение с производными сульфонилмочевины или инсулином, пациенты с панкреатитом в анамнезе (связь между приемом препарата и повышенным риском развития панкреатита не установлена).
ПЕРИОД БЕРЕМЕННОСТИ И КОРМЛЕНИЯ ГРУДЬЮ
В связи с тем, что применение саксаглиптина в период беременности не изучено, не следует назначать препарат в период беременности.
Неизвестно, проникает ли саксаглиптин в грудное молоко. В связи с тем, что не исключена возможность проникновения саксаглиптина в грудное молоко, следует прекратить грудное вскармливание на период лечения саксаглиптином или отменить терапию, учитывая соотношение риска для ребенка и пользы для матери.
СПОСОБ ПРИМЕНЕНИЯ И ДОЗЫ
Внутрь, независимо от приема пищи. Таблетки следует проглатывать целиком, не разжевывая, не измельчая и не разламывая.
Монотерапия: рекомендуемая доза саксаглиптина составляет 5 мг 1 раз в сутки.
Комбинированнаятерапия: рекомендуемая доза саксаглиптина составляет 5 мг 1 раз в сутки в комбинации с метформином, тиазолидиндионами, производными сульфонилмочевины, инсулином (в том числе в комбинации с метформином); при добавлении к комбинации метформина и производных сульфонилмочевины рекомендуемая доза саксаглиптина составляет 5 мг 1 раз в сутки.
При стартовой комбинированной терапии с метформином
рекомендуемая доза саксаглиптина составляет 5 мг 1 раз в сутки, начальная доза метформина – 500 мг в сутки. В случае неадекватного ответа доза метформина может быть увеличена. При пропуске приема препарата Онглиза ® пропущенную таблетку следует принять сразу, как только пациент об этом вспомнит, однако не следует принимать двойную дозу препарата в течение одних суток.
Применение у особых групп пациентов Пациенты с нарушением функции почек
Для пациентов с почечной недостаточностью легкой степени (КК >50 мл/мин) коррекция дозы не требуется.
Для пациентов с умеренной или тяжелой почечной недостаточностью (КК ≤ 50 мл/мин), а также для пациентов на гемодиализе рекомендуемая доза препарата Онглиза® составляет 2,5 мг 1 раз в сутки. Препарат следует принимать по окончании сеанса гемодиализа.
Применение саксаглиптина у пациентов на перитонеальном диализе не изучено.
Перед началом терапии саксаглиптином и в процессе лечения рекомендуется проводить оценку функции почек.
Пациенты с нарушением функции печени
При нарушении функции печени легкой, умеренной и тяжелой степени коррекции дозы не требуется.
Пациенты пожилого возраста
Коррекции дозы у пожилых пациентов не требуется. Однако при выборе дозы следует учитывать, что у этой категории пациентов более вероятно снижение функции почек.
Дети
Безопасность и эффективность применения препарата у пациентов младше 18 лет не изучалась.
Одновременное применение с мощными ингибиторами CYP3A4/5
При одновременном применении с мощными ингибиторами CYP3A4/5, такими как кетоконазол, атазанавир, кларитромицин, индинавир, итраконазол, нефазодон, нелфинавир, ритонавир, саквинавир и телитромицин, рекомендуемая доза препарата Онглиза® составляет 2,5 мг 1 раз в сутки.
ПОБОЧНОЕ ДЕЙСТВИЕ
Побочные эффекты препаратаОнглиза® висследованиях контроля гликемии
В таблице приведены побочные эффекты, выявленные у пациентов с СД2 при приеме препарата Онглиза® в дозе 5 мг в ходе клинических исследований. Общая частота нежелательных явлений при приеме препарата Онглиза® 5 мг в режиме монотерапии и в режиме добавления к терапии метформином, тиазолидиндионом или глибенкламидом была сопоставима с таковой в группе плацебо.
Шкала частоты побочных реакций: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000).
Таблица 1. Побочные эффекты по данным объединенного анализа пяти плацебоконтролируемых клинических исследований препарата Онглиза®
|
Инфекции и инвазии |
|
|
Инфекции верхних дыхательных путей |
Часто |
|
Инфекции мочевыводящих путей |
Часто |
|
Гастроэнтерит |
Часто |
|
Синусит |
Часто |
|
Со стороны желудочно-кишечного тракта |
|
|
Рвота |
Часто |
|
Со стороны нервной системы |
|
|
Головная боль |
Часто |
Частота реакций гиперчувствительности, отмеченных к 24 неделе терапии, составила 1,5% у пациентов, получавших препарат Онглиза® 5 мг, и 0,4% у пациентов, получавших плацебо. Реакции гиперчувствительности, возникшие у пациентов, принимавших препарат Онглиза®, не требовали госпитализации и были расценены лечащими врачами как не представлявшие угрозу жизни.
Побочные эффекты препарата Онглиза® при комбинированной терапии в исследованиях контроля гликемии
В исследовании по комбинированному применению саксаглиптина и глибенкламида частота подтвержденных эпизодов гипогликемии составила 0,8% в группе саксаглиптина 5 мг и 0,7% в группе плацебо. Частота подтвержденных эпизодов гипогликемии у пациентов, получавших препарат Онглиза ® 5 мг в ходе двух исследований саксаглиптина в режиме монотерапии, исследовании по комбинированной терапии саксаглиптином и метформином, а также в исследовании по комбинированному применению саксаглиптина и тиазолидиндионов, была сопоставима с таковой на фоне плацебо.
В исследовании по применению комбинации саксаглиптина и инсулина общая частота развития гипогликемии составила 18,4% в группе саксаглиптина 5 мг и 19,9% в группе плацебо, при этом частота подтвержденных эпизодов гипогликемии, сопровождаемых симптомами, составила 5,3% и 3,3%, соответственно.
В исследовании по применению саксаглиптина в комбинации с метформином и производными сульфонилмочевины общая частота развития гипогликемии составила 10,1% у пациентов, получавших препарат Онглиза ® 5 мг, и 6,3% у пациентов, получавших плацебо, частота подтвержденных случаев гипогликемии составила 1,6% и 0%, соответственно.
В исследовании по применению саксаглиптина совместно с тиазолидиндионами частота периферических отеков была выше в группе саксаглиптина 5 мг по сравнению с группой плацебо (8,1% и 4,3%, соответственно). Периферические отеки были слабо или умеренно выраженными и не приводили к прекращению лечения. Частота периферических отеков у пациентов, принимавших препарат Онглиза ® в дозе 5 мг в ходе клинических исследований монотерапии саксаглиптином и комбинированной терапии с метформином или глибенкламидом, была сопоставима с таковой на фоне плацебо (1,7% и 2,4%, соответственно).
При стартовой комбинированной терапии саксаглиптином в дозе 5 мг и метформином часто отмечались случаи назофарингита и головной боли. Частота назофарингита была выше на фоне комбинированной терапии (6,9%) по сравнению с монотерапией саксаглиптином 10 мг (4,2%) и метформином (4,0%). Головная боль отмечалась чаще в группе пациентов на комбинированной терапии метформином и саксаглиптином 5 мг (7,5%) по сравнению с группами монотерапии саксаглиптином 10 мг (6,3%) и метформином (5,2%).
Побочные эффекты препаратаОнглиза® в исследовании SAVOR
В исследовании SAVOR 8240 пациентов получали препарат Онглиза ® в дозе 2,5 мг или 5 мг один раз в сутки, а 8173 пациента получали плацебо. Средняя длительность терапии препаратом Онглиза® независимо от перерывов в лечении составила 1,8 лет. У 3698 пациентов (45%) длительность терапии препаратом Онглиза® составила 2-3 года. Общая частота нежелательных явлений в этом исследовании в группе пациентов, принимавших препарат Онглиза® (72,5%), была сопоставима с частотой нежелательных явлений в группе плацебо (72,2%). Частота отмены терапии из-за нежелательных явлений была сопоставима у пациентов, принимавших препарат Онглиза ® (4,9%) и плацебо (5%).
В исследовании SAVOR оценивалось влияние препарата Онглиза ® на частоту сердечнососудистых осложнений. Было показано, что добавление препарата Онглиза® к терапии не увеличивает риск сердечно-сосудистых осложнений (таких как сердечно-сосудистая смертность, нефатальный инфаркт миокарда, нефатальный ишемический инсульт) у пациентов с СД2 по сравнению с плацебо (ОР 1,00; 95% ДИ 0,89, 1,12; P<0,001 для гипотезы сопоставимости саксаглиптина и плацебо).
Частота панкреатита, подтвержденного в соответствии с протоколом исследования, составила 0,3% в группах саксаглиптина и плацебо в популяции всех рандомизированных пациентов.
Частота реакций гиперчувствительности составила 1,1% в группах препарата Онглиза ® и плацебо. Гипогликемия
Общая частота случаев гипогликемии (отмеченных в дневниках пациентов) в исследовании SAVOR составила 17,1% в группе препарата Онглиза® и 14,8% в группе плацебо.
Доля пациентов, у которых на фоне терапии возникла тяжелая гипогликемия (гипогликемия, потребовавшая помощи третьих лиц), была выше в группе саксаглиптина по сравнению с группой плацебо (2,1% и 1,6%, соответственно).
Повышенный риск гипогликемии в целом, а также тяжелой гипогликемии в группе саксаглиптина, главным образом, отмечен у пациентов, получавших препараты сульфонилмочевины, но не у пациентов, получавших инсулин или метформин в качестве базовой терапии.
Повышенный риск гипогликемии в целом, а также тяжелой гипогликемии, главным образом, отмечен у пациентов с исходным значением HbA1c < 7%.
Постмаркетинговое применение
В ходе постмаркетингового применения саксаглиптина зарегистрированы следующие побочные эффекты: острый панкреатит, артралгия и реакции гиперчувствительности, включая анафилаксию, ангионевротический отек, сыпь и крапивницу. Достоверно оценить частоту развития данных явлений невозможно, поскольку сообщения получены спонтанно, от популяции неустановленного размера (см. разделы «Противопоказания» и «Особые указания»).
Лабораторные исследования
В клинических исследованиях частота изменений лабораторных показателей при приеме саксаглиптина в дозе 5 мг и плацебо была сопоставимой. Отмечалось небольшое снижение числа лимфоцитов, при этом среднее абсолютное число лимфоцитов оставалось стабильным и в пределах нормальных значений при ежедневном приеме саксаглиптина продолжительностью до 102 недель. Уменьшение количества лимфоцитов не сопровождалось клинически значимыми нежелательными реакциями. Клиническое значение уменьшения числа лимфоцитов на фоне терапии саксаглиптином не известно. В исследовании SAVOR снижение количества лимфоцитов в группе препарата Онглиза ® отмечено у 0,5% пациентов, в группе плацебо – у 0,4% пациентов.
ПЕРЕДОЗИРОВКА
Симптомов интоксикации не описано при длительном приеме препарата в дозах, до 80 раз превышающих рекомендованные.
В случае передозировки следует применять симптоматическую терапию. Саксаглиптин и его основной метаболит выводятся из организма при помощи гемодиализа (скорость выведения: 23% дозы за 4 ч).
ВЗАИМОДЕЙСТВИЕ С ДРУГИМИ ЛЕКАРСТВЕННЫМИ СРЕДСТВАМИ И ДРУГИЕ ВИДЫ ВЗАИМОДЕЙСТВИЯ
Анализ данных клинических исследований позволяет предполагать, что риск клинически значимых взаимодействий саксаглиптина с другими лекарственными средствами при их совместном применении невелик.
Метаболизм саксаглиптина преимущественно опосредован системой изоферментов цитохрома P450 3A4/5 (CYP3A4/5). В исследованиях in vitro было показано, что саксаглиптин и его основной метаболит не ингибируют изоферменты CYP1A2, 2A6, 2B6, 2С8, 2C9, 2C19, 2D6, 2E1 и 3A4 и не индуцируют изоферменты CYP1A2, 2B6, 2C9, и 3A4. В исследованиях с участием здоровых добровольцев фармакокинетические показатели саксаглиптина и его основного метаболита значимо не изменялись под влиянием метформина, глибенкламида, пиоглитазона, дигоксина, симвастатина, дилтиазема, кетоконазола, омепразола, комбинации алюминия гидроксида, магния гидроксида и симетикона, а также фамотидина. Саксаглиптин значимо не изменяет фармакокинетические показатели метформина, глибенкламида, пиоглитазона, дигоксина, симвастатина, дилтиазема, кетоконазола или перорального комбинированного (эстроген+гестаген) контрацептивного средства.
Влияние индукторов изоферментов CYP3A4/5 на фармакокинетику саксаглиптина не изучено. Однако, совместное применение саксаглиптина и индукторов изоферментов CYP3A4/5, таких как карбамазепин, дексаметазон, фенобарбитал, фенитоин и рифампицин, могут приводить к уменьшению концентрации саксаглиптина в плазме и увеличению концентрации его основного метаболита.
Изучения влияния курения, диетического питания, приема растительных препаратов и употребления алкоголя на терапию саксаглиптином не проводилось.
ОСОБЫЕ УКАЗАНИЯ
Применение препарата Онглиза® в составе тройной терапии с метформином и тиазолидиндионами не изучалось.
Пациенты с нарушением функции почек
Рекомендуется коррекция дозы для пациентов с почечной недостаточностью средней и тяжелой степени тяжести, а также для пациентов на гемодиализе. Перед началом терапии и периодически в процессе лечения препаратом рекомендуется проводить оценку функции почек.
Применение в комбинации с препаратами, которые могут вызвать гипогликемию
Производные сульфонилмочевины и инсулин могут вызвать гипогликемию, поэтому для уменьшения риска гипогликемии при одновременном применении с препаратом Онглиза® может потребоваться снижение дозы производных сульфонилмочевины или инсулина.
Реакции гиперчувствительности
В ходе постмаркетингового применения саксаглиптина отмечены серьёзные реакции гиперчувствительности, включая анафилаксию и ангионевротический отек. При развитии серьёзной реакции гиперчувствительности следует прекратить применение препарата, оценить другие возможные причины развития явления и назначить альтернативную терапию сахарного диабета (см. разделы «Противопоказания» и «Побочное действие»).
Панкреатит
В рамках постмаркетингового применения препарата получены спонтанные сообщения о случаях острого панкреатита. Пациенты, принимающие препарат Онглиза ®, должны быть проинформированы о характерных симптомах острого панкреатита: продолжительная, интенсивная боль в области живота. При подозрении на развитие панкреатита следует прекратить прием препарата Онглиза® (см. разделы «С осторожностью» и «Побочное действие»).
Частота панкреатита в исследовании SAVOR, подтвержденного в соответствии с протоколом исследования, составила 0,3% в группах саксаглиптина и плацебо в популяции всех рандомизированных пациентов.
Пациенты пожилого возраста
Из 16492 пациентов, рандомизированных в исследовании SAVOR, 8561 пациент (51,9%) был в возрасте 65 лет и старше, и 2330 пациентов (14,1%) были в возрасте 75 лет и старше. Из них 4290 пациентов в возрасте 65 лет и старше и 1169 пациентов в возрасте 75 лет и старше получали саксаглиптин.
По данным клинических исследований, показатели эффективности и безопасности у пациентов в возрасте 65 лет и старше, 75 лет и старше не отличались от аналогичных показателей у пациентов более молодого возраста. Саксаглиптин и его основной метаболит частично выводятся почками, поэтому необходимо учитывать, что у пациентов пожилого возраста более вероятно снижение функции почек.
Сердечная недостаточность
В исследовании SAVOR было отмечено увеличение частоты госпитализации по поводу сердечной недостаточности в группе саксаглиптина по сравнению с группой плацебо, хотя причинно-следственная связь не установлена. Следует соблюдать осторожность при применении препарата Онглиза ® у пациентов с факторами риска госпитализации по поводу сердечной недостаточности, такими как сердечная недостаточность или почечная недостаточность умеренной и тяжелой степени в анамнезе. Пациенты должны быть проинформированы о характерных симптомах сердечной недостаточности и необходимости немедленно сообщать о таких симптомах (см. раздел «Фармакодинамика», Клиническая эффективность и безопасность).
Артралгия
В постмаркетинговых сообщениях описана боль в суставах, в том числе сильная, при применении ингибиторов ДПП-4. У пациентов наблюдалось облегчение симптомов после прекращения приема препарата, а у отдельных пациентов отмечался рецидив симптомов при возобновлении применения того же или другого ингибитора ДПП-4. Возникновение симптомов после начала применения препарата может быть быстрым или отмечаться на фоне длительной терапии. При развитии сильной боли в суставах следует оценить продолжение приема препарата в каждом отдельном случае (см. раздел «Побочное действие»).
Препарат Онглиза® содержит лактозу. Пациенты с врожденной непереносимостью галактозы, лактазной недостаточностью и глюкозо-галактозной мальабсорбцией не должны принимать этот препарат.
ВЛИЯНИЕ НА СПОСОБНОСТЬ К ВОЖДЕНИЮ АВТОТРАНСПОРТА И УПРАВЛЕНИЮ МЕХАНИЗМАМИ
Исследований по изучению влияния саксаглиптина на способность к вождению автотранспорта и управлению механизмами не проводилось.
Следует учитывать, что саксаглиптин может вызывать головокружение.
ФОРМА ВЫПУСКА
Таблетки, покрытые плёночной оболочкой 2,5 мг и 5 мг.
По 10 таблеток в блистере из алюминиевой фольги; по 3 блистера с инструкцией по применению в картонной пачке с контролем первого вскрытия. На блистер нанесена перфорация, разделяющая его на 10 прямоугольных зон по числу таблеток.
УСЛОВИЯ ХРАНЕНИЯ
При температуре не выше 30ºС. Хранить в недоступном для детей месте.
СРОК ГОДНОСТИ
3 года.
Не применять по истечении срока годности, указанного на упаковке.
УСЛОВИЯ ОТПУСКА ИЗ АПТЕК
По рецепту.
НАИМЕНОВАНИЕИЮРИДИЧЕСКИЙАДРЕСДЕРЖАТЕЛЯ (ВЛАДЕЛЬЦА) РЕГИСТРАЦИОННОГО УДОСТОВЕРЕНИЯ
АстраЗенека ЮК Лимитед, Великобритания
2 Кингдом Стрит, Лондон W2 6BD, Великобритания
AstraZeneca UK Limited, United Kingdom
2 Kingdom Street, London W2 6BD, United Kingdom
ПРОИЗВОДИТЕЛЬ
АстраЗенека Фармасьютикалс ЛП, США
4601 Хайуэй 62 Ист, Маунт Вернон, Индиана, 47620, США
AstraZeneca Pharmaceuticals LP, USA
4601 Highway 62 East, Mount Vernon, Indiana, 47620, USA
ФАСОВЩИК (ПЕРВИЧНАЯУПАКОВКА),УПАКОВЩИК (ВТОРИЧНАЯ (ПОТРЕБИТЕЛЬСКАЯ) УПАКОВКА), ВЫПУСКАЮЩИЙ КОНТРОЛЬ КАЧЕСТВА
1. Бристол-Майерс Сквибб С.р.л., Италия
Л ок. Фонтана дель Черазо, 03012 Ананьи (ФР), Италия
Bristol-Myers Squibb S.r.l., Italy
Loc. Fontana del Ceraso, 03012 Anagni (FR), Italy
2. АстраЗенека ЮК Лимитед, Великобритания
Cилк Роуд Бизнес Парк, Макклcфилд, Чешир SK 10 2NA, Великобритания
AstraZeneca UK Limited, United Kingdom
Silk Road Business Park, Macclesfield, Cheshire SK 10 2NA, United Kingdom
Наименование, адрес организации, уполномоченной держателем или владельцем регистрационного удостоверения лекарственного препарата для медицинского применения на принятие претензий от потребителя:
Представительство АстраЗенека ЮК Лимитед, Великобритания, в г. Москве и
ООО АстраЗенека Фармасьютикалз
125284 Москва, ул. Беговая д. 3, стр. 1
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
В таблице приведены побочные эффекты, выявленные у пациентов с СД2 при приеме препарата Онглиза® в дозе 5 мг в ходе клинических исследований. Общая частота нежелательных явлений при приеме препарата Онглиза® в дозе 5 мг в режиме монотерапии и в режиме добавления к терапии метформином, тиазолидиндионом или глибенкламидом была сопоставима с таковой в группе плацебо.
Шкала частоты побочных реакций: очень часто (≥1/10); часто (≥1/100, но <1/10); нечасто (≥1/1000, но <1/100); редко (≥1/10000, но <1/1000); очень редко (<1/10000).
Таблица
Побочные эффекты по данным объединенного анализа 5 плацебо-контролируемых клинических исследований препарата Онглиза®
| Побочные эффекты | Частота побочных эффектов |
| Инфекции и инвазии: | |
| Инфекции верхних дыхательных путей | Часто |
| Инфекции мочевыводящих путей | Часто |
| Гастроэнтерит | Часто |
| Синусит | Часто |
| Со стороны ЖКТ: | |
| Рвота | Часто |
| Со стороны нервной системы: | |
| Головная боль | Часто |
Частота реакций гиперчувствительности, отмеченных к 24-й неделе терапии, составила 1,5% у пациентов, получавших препарат Онглиза® 5 мг, и 0,4% у пациентов, получавших плацебо. Реакции гиперчувствительности, возникшие у пациентов, принимавших препарат Онглиза®, не требовали госпитализации и были расценены лечащими врачами как не представлявшие угрозу жизни.
Побочные эффекты препарата Онглиза® при комбинированной терапии
В исследовании по комбинированному применению саксаглиптина и глибенкламида частота подтвержденных эпизодов гипогликемии в группе саксаглиптина 5 мг (0,8%) и плацебо (0,7%) статистически не различалась. Частота подтвержденных эпизодов гипогликемии у пациентов, получавших препарат Онглиза® 5 мг в ходе двух исследований саксаглиптина в режиме монотерапии, исследовании по комбинированной терапии саксаглиптином и метформином, а также в исследовании по комбинированному применению саксаглиптина и тиазолидиндионов, была сопоставима с таковой на фоне плацебо.
В исследовании по применению комбинации саксаглиптина и инсулина общая частота развития гипогликемии составила 18,4% в группе саксаглиптина 5 мг и 19,9% в группе плацебо.
В исследовании по применению саксаглиптина совместно с тиазолидиндионами частота периферических отеков была выше в группе саксаглиптина 5 мг по сравнению с группой плацебо (8,1 и 4,3% соответственно). Периферические отеки были слабо или умеренно выраженными и не приводили к прекращению лечения. Частота периферических отеков у пациентов, принимавших препарат Онглиза® в дозе 5 мг в ходе клинических исследований монотерапии саксаглиптином и комбинированной терапии с метформином или глибенкламидом, была сопоставима с таковой на фоне плацебо (1,7 и 2,4% соответственно).
При стартовой комбинированной терапии саксаглиптином в дозе 5 мг и метформином часто отмечались случаи назофарингита и головной боли. Частота назофарингита была выше на фоне комбинированной терапии (6,9%) по сравнению с монотерапией саксаглиптином 10 мг (4,2%) и метформином (4%). Головная боль была чаще в группе пациентов на комбинированной терапии метформином и саксаглиптином 5 мг (7,5%) по сравнению с группами монотерапии саксаглиптином 10 мг (6,3%) и метформином (5,2%).
Постмаркетинговое применение
В ходе постмаркетингового применения саксаглиптина зарегистрированы следующие побочные эффекты: острый панкреатит и реакции гиперчувствительности, включая анафилаксию, ангионевротический отек, сыпь и крапивницу. Достоверно оценить частоту развития данных явлений невозможно, поскольку сообщения получены спонтанно, от популяции неустановленного размера (см. «Противопоказания», «Особые указания»).
Лабораторные исследования
В клинических исследованиях частота изменений лабораторных показателей при приеме саксаглиптина в дозе 5 мг и плацебо была сопоставимой. Отмечалось небольшое снижение числа лимфоцитов, при этом среднее абсолютное число лимфоцитов оставалось стабильным и в пределах нормальных значений при ежедневном приеме саксаглиптина продолжительностью до 102 нед. Уменьшение количества лимфоцитов не сопровождалось клинически значимыми нежелательными реакциями. Клиническое значение уменьшения числа лимфоцитов на фоне терапии саксаглиптином неизвестно.
Действующее вещество : саксаглиптин;
1 таблетка, покрытая оболочкой, содержит 2,5 мг или 5 мг саксаглиптину гидрохлорида в пересчете на саксаглиптин;
Вспомогательные вещества : лактоза моногидрат, целлюлоза микрокристаллическая, натрия кроскармеллоза, магния стеарат и красители для 2,5 мг Опадрай ИИ белый, Опадрай ИИ желтый, Опакод синий;
Красители для 5 мг Опадрай ИИ белый, Опадрай ИИ розовый, Опакод синий.
Таблетки, покрытые пленочной оболочкой.
Основные физико-химические свойства:
таблетки по 2,5 мг двояковыпуклые круглые таблетки, покрытые пленочной оболочкой, от бледно-желтого до светло-желтого цвета, с надписью 2.5 с одной стороны и надписью 4214 с другой, сделанные синими чернилами;
таблетки по 5 мг двояковыпуклые круглые таблетки, покрытые пленочной оболочкой, розового цвета, с надписью 5 с одной стороны и надписью 4215 с другой, сделанные синими чернилами.
Пероральные гипогликемизирующие препараты. Ингибитор дипептидилпептидазы (ингибитор ДПП-4). Саксаглиптин. Код АТХ A10B H03.
Фармакологические.
Механизм действия и фармакодинамические эффекты.
Саксаглиптин — высокомощный (Ки: 1,3 нМ) селективный обратимый конкурентный ингибитор ДПП-4. У пациентов с сахарным диабетом II типа применения саксаглиптину приводит к ингибированию ферментной активности ДПП-4 в течение 24-часового периода. После приема нагрузки глюкозой такое ингибирование ДПП-4 приводило к росту в 2-3 раза уровней циркулирующих активных гормонов-инкретинов, в том числе глюкагоноподобного пептида-1 (ГПП-1) и глюкозозависимый инсулинотропный полипептида (ГИП), снижение концентраций глюкагона и рост глюкозозависимый реактивности бета-клеток, приводило к повышению концентраций инсулина и С-пептида. Усиленный выброс инсулина бета-клетками и снижению синтеза глюкагона альфа-клетками поджелудочной железы ассоциировалось с более низкими концентрациями глюкозы натощак и уменьшением колебаний уровня глюкозы после приема нагрузки глюкозой или приема пищи. Саксаглиптин улучшает контроль гликемии за счет снижения концентраций глюкозы натощак и после еды у пациентов с сахарным диабетом II типа.
Клиническая эффективность и безопасность.
Всего в 6 двойных слепых контролируемых клинических исследованиях безопасности и эффективности, которые проводились с целью оценки влияния саксаглиптину на контроль гликемии, были рандомизированы 4148 пациентов с сахарным диабетом II типа, в том числе 3021 пациент, получавший лечение саксаглиптином. В этих исследованиях 634 пациенты имели возраст от 65 лет, а 59 пациентов — от 75 лет. Лечение саксаглиптином 5 мг 1 раз в сутки обеспечивало клинически и статистически значимое улучшение показателей гемоглобина А1с (HbA1c), глюкозы плазмы крови натощак и после еды по сравнению с плацебо на фоне монотерапии, в комбинации с метформином (начальная или дополнительная терапия), в сочетании с сульфонилмочевины и в комбинации с тиазолидиндионы (см. Таблицу 3). Очевидных изменений массы тела, ассоциированной с саксаглиптином, также не наблюдалось. Снижение уровней HbA1c отмечалось во всех подгруппах, включая подгруппы по полу, возрасту, расовой принадлежности и индексом массы тела (ИМТ) на начальном уровне; высокий уровень HbA1c ассоциировался с большей скорректированной средней изменением по сравнению с исходным уровнем при применении саксаглиптину.
Саксаглиптин в виде монотерапии.
Две двойные слепые плацебо-контролируемые исследования продолжительностью 24 недели были проведены с целью оценки эффективности и безопасности саксаглиптину в виде монотерапии у пациентов с сахарным диабетом II типа. В обоих исследованиях прием саксаглиптину 1 раз в сутки обеспечивал статистически значимое улучшение показателя HbA1c (см.таблицу 3). Данные этих исследований подтверждаются результатами двух последующих 24-недельных региональных (Азия) исследований монотерапии, в которых саксаглиптин 5 мг сравнивали с плацебо.
Саксаглиптин в качестве дополнения к терапии метформином.
Плацебо-контролируемое исследование саксаглиптину в качестве дополнения к метформина продолжительностью 24 недели проводили с целью оценки эффективности и безопасности саксаглиптину в комбинации с метформином у пациентов с недостаточным контролем гликемии (HbA1c 7-10%) на фоне лечения только метформином. Саксаглиптин (n = 186) обеспечивал статистически значимое улучшение показателей Hb1Ac, глюкозы натощак и после еды по сравнению с плацебо (n = 175). Улучшение показателей HbA1c, глюкозы после еды и натощак после лечения саксаглиптином 5 мг и метформином хранилось в течение 102 недель исследования. Изменение HbA1c у пациентов, принимавших саксаглиптин 5 мг в комбинации с метформином (n = 31) по сравнению с теми, кто получал плацебо и метформин (n = 15), составляла 0,8% в Неделя 102.
Саксаглиптин в качестве дополнения к метформина по сравнению с сульфонилмочевины в качестве дополнения к метформина.
52-недельное исследование проводили с целью оценки эффективности и безопасности саксаглиптину 5 мг в комбинации с метформином (428 пациентов) по сравнению с сульфонилмочевины (глипизид, 5 мг с постепенным увеличением дозы до 20 мг при необходимости, средняя доза составляла 15 мг) в комбинации с метформином (430 пациентов) с участием 858 пациентов с недостаточным контролем гликемии (HbA1c 6,5% -10%) на фоне лечения только метформином. Средняя доза метформина в каждой из групп лечения составляла примерно 1900 мг. Через 52 недели в группах саксаглиптину и глипизиду наблюдалось близкое по значению снижение по сравнению с исходным значением показателя HbA1c по результатам проведенного в соответствии с протоколом анализа (-0,7% против -0,8% соответственно, среднее начальное значение HbA1c 7,5% в обеих группах). Анализ в популяции пациентов, которым предназначалось исследуемое лечение, дал такие же результаты. Саксаглиптин обеспечивал статистически значимую меньшую долю пациентов с гипогликемией, а именно — 3% (19 явлений у 13 пациентов) против 36,3% (750 явлений в 156 пациентов) в группе глипизиду.
У пациентов, получавших лечение саксаглиптином, отмечалось значительное снижение от начального уровня массы тела по сравнению с увеличением массы тела у пациентов, принимавших глипизид (-1,1 кг против +1,1 кг).
Саксаглиптин в качестве дополнения к метформина по сравнению с ситаглиптином в качестве дополнения к метформина.
18-недельное исследование проводили с целью оценки эффективности и безопасности саксаглиптину 5 мг в комбинации с метформином (403 пациента) по сравнению с ситаглиптином 100 мг в комбинации с метформином (398 пациентов) с участием 801 пациентов с недостаточным контролем гликемии на фоне лечения только метформином. После 18 недель исследуемого лечения саксаглиптин НЕ уступал по эффективности ситаглиптину относительно среднего снижения от начального уровня HbA1c как для популяции в соответствии с протоколом, так и для полной популяции анализа. Снижение от начального уровня HbA1c соответственно для саксаглиптину и ситаглиптину по результатам первичного анализа согласно протоколу составило 0,5% (среднее и медианное значение) и -0,6% (среднее и медианное значение). Согласно данным для полной выборки подтверждающего анализа среднее снижение показателя составило -0,4% и -0,6% соответственно для саксаглиптину и ситаглиптину с медианным снижением 0,5% для обеих групп.
Саксаглиптин в комбинации с метформином в качестве начальной терапии.
24-недельное исследование проводили с целью оценки эффективности и безопасности саксаглиптину 5 мг в сочетании с метформином в качестве начальной комбинированной терапии у пациентов с недостаточным контролем гликемии (HbA1c 8-12%), которые ранее не получали никакого лечения. Начальная терапия с использованием комбинации саксаглиптину 5 мг и метформина (n = 306) обеспечила значимое улучшение показателей HbA1c, глюкозы натощак и глюкозы после еды по сравнению с применением монотерапии саксаглиптином (n = 317) или метформином (n = 313) в качестве начальной терапии. Уменьшение показателя HbA1вид начального уровня до Недели 24 наблюдалось во всех оцениваемых подгруппах, определенных по начальным показателям HbA1c; более выраженное понижение отмечалось у пациентов, на начальном уровне имели показатель HbA1c ≥10% (см. Таблицу 3). Улучшение показателей HbA1c, глюкозы после еды и натощак после начального лечения саксаглиптином 5 мг и метформином сохранялось до Недели 76. Изменение HbA1c у пациентов, принимавших саксаглиптин 5 мг в комбинации с метформином (n = 177) по сравнению с теми, кто получал метформин и плацебо (n = 147), составляла 0,5% в Неделю 76.
Саксаглиптин в качестве дополнения к терапии глибенкламидом.
Плацебо-контролируемое исследование продолжительностью 24 недели проводили с целью оценки эффективности и безопасности саксаглиптину в комбинации с глибенкламидом у пациентов с недостаточным контролем гликемии (HbA1c 7,5-10%) на момент отбора на фоне лечения только глибенкламидом в субмаксимальная дозах. Саксаглиптин в комбинации с сульфонилмочевины в фиксированной промежуточной дозе (глибенкламид 7,5 мг) сравнивали с титрованием до высшей дозы глибенкламида (примерно в 92% пациентов в группе плацебо и глибенкламида осуществляли титрование до окончательной общей суточной дозы 15 мг). Саксаглиптин (n = 250) обеспечивал значимое улучшение показателей Hb1Ac, глюкозы натощак и после еды по сравнению с титрованием глибенкламида в высшей дозы (n = 264). Улучшение показателей HbA1c и глюкозы после еды после лечения саксаглиптином 5 мг сохранялось до Недели 76. Изменение со стороны HbA1c у пациентов, принимавших саксаглиптин 5 мг (n = 56) по сравнению с теми, кто получал растущие в высшей дозы глибенкламида и плацебо ( n = 27), составляла -0,7% в Неделю 76.
Саксаглиптин в качестве дополнения к комбинированной инсулинотерапии (с метформином или без).
Всего 455 пациентов с сахарным диабетом II типа приняли участие в 24-недельном рандомизированном двойном слепом плацебо-контролируемом исследовании с целью оценки эффективности и безопасности саксаглиптину в комбинации со стабильной дозой инсулина (в среднем на начальном уровне: 54,2 единицы) у пациентов с недостаточным контролем гликемии (HbA1c ≥7,5% и ≤ 11%) на фоне только инсулина (n = 141) или инсулина в сочетании со стабильной дозой метформина (n = 314). Саксаглиптин 5 мг в качестве дополнения к инсулину с метформином (или без) обеспечивал статистически значимое улучшение показателей HbA1c и глюкозы после еды после 24 недель применения по сравнению с добавлением плацебо к инсулину с метформином или без. Близко по значению уменьшения показателя HbA1c по сравнению с плацебо было достигнуто у пациентов, принимавших саксаглиптин 5 мг в качестве дополнения к инсулину независимо от использования метформина (-0,4% для обеих подгрупп). Улучшение от начального уровня показателя HbA1c хранилось в группе добавления саксаглиптину к инсулину по сравнению с группой добавления плацебо к инсулину с метформином или без к Неделе 52. Изменение со стороны HbA1c для группы саксаглиптину (n = 244) по сравнению с плацебо (n = 124) составила — 0,4% в Неделю 52.
Саксаглиптин в качестве дополнения к терапии Тиазолидиндионы.
Плацебо-контролируемое исследование продолжительностью 24 недели проводили с целью оценки эффективности и безопасности саксаглиптину в сочетании с Тиазолидиндионы (ТСД) у пациентов с недостаточным контролем гликемии (HbA1c 7-10,5%) на фоне лечения только ТСД. Саксаглиптин (n = 183) обеспечивал значимое улучшение показателей Hb1Ac, глюкозы натощак и после еды по сравнению с плацебо (n = 180). Улучшение показателей HbA1c и глюкозы натощак и после еды после лечения саксаглиптином 5 мг сохранялось до Недели 76. Изменение со стороны HbA1c у пациентов, принимавших саксаглиптин 5 мг (n = 82) по сравнению с теми, кто получал ТСД и плацебо (n = 53), составляла -0,9% в Неделю 76.
Саксаглиптин в качестве дополнения к комбинированной терапии метформином и сульфонилмочевины.
Всего 257 пациентов с сахарным диабетом II типа приняли участие в 24-недельном рандомизированном двойном слепом плацебо-контролируемом исследовании с целью оценки эффективности и безопасности саксаглиптину (5 мг 1 раз в сутки) в комбинации с метформином и сульфонилмочевины (СС) у пациентов с недостаточным контролем гликемии (HbA1c ≥7% и ≤10%). Саксаглиптин (n = 127) обеспечивал значимое улучшение показателей Hb1Ac и глюкозы после еды по сравнению с плацебо (n = 128). Изменение со стороны HbA1c для группы саксаглиптину сравнению с плацебо составила -0,7% в Неделю 24.
Пациенты с нарушением функции почек.
12-недельное многоцентровое рандомизированное двойное слепое плацебо-контролируемое исследование проводили для оценки эффекта лечения саксаглиптином 2,5 мг 1 раз в сутки по сравнению с плацебо в 170 пациентов (85 пациентов в группе лечения саксаглиптином и 85 пациентов в группе плацебо) с сахарным диабетом II типа (HbA1c 7,0-11%) и нарушением функции почек (умеренным [n = 90], тяжелым [n = 41] или ТСНН (терминальная стадия почечной недостаточности) [n = 39]). В этом исследовании 98,2% пациентов получали другое антигипергликемический лечения (75,3% — инсулин и 31,2% — пероральные антигипергликемический средства, некоторые пациенты получали и то, и другое). Саксаглиптин обеспечивал значимое снижение уровня HbA1c по сравнению с плацебо; изменение HbA1c для саксаглиптину составила -0,9% в Неделю 12 (изменение HbA1c -0,4% для плацебо). Частота подтвержденных явлений гипогликемии была несколько выше в группе саксаглиптину (9,4%) по сравнению с группой плацебо (4,7%), хотя количество пациентов с любыми гипогликемическими явлениями не отличалась для двух групп лечения. Нежелательного влияния на функцию почек, определялся по рассчитанной скоростью клубочковой фильтрации или CrCL в Неделю 12 и Неделя 52, не наблюдалось.
Таблица 3. Ключевые результаты лечения Онглиза 5 мг в сутки в плацебо-контролируемых исследованиях монотерапии и исследованиях препарата в качестве дополнения к комбинированной терапии
| Среднее значение на начальном уровне HbA1c (%) |
Среднее изменение 2 от начального уровня HbA1c (%) в Неделя 24 | Среднее изменение HbA1c (%) с поправкой на плацебо в Неделю 24 (95% ДИ) |
|
| ИССЛЕДОВАНИЕ МОНОТЕРАПИИ | |||
|
8,0 |
|
|
|
7,9 |
|
|
| (N = 70) | 7,9 |
|
|
| ИССЛЕДОВАНИЕ ПРЕПАРАТА В качестве дополнения / КОМБИНИРОВАННОЙ ТЕРАПИИ | |||
|
8,1 |
|
|
|
8,5 |
|
|
|
8,4 |
|
|
|
8,4 |
|
|
Общая популяция (n = 306) |
9,4 10,8 |
|
|
Общая популяция (n = 300) |
8,7 |
|
|
n = количество рандомизированных пациентов (первичный анализ эффективности в популяции всех пациентов, которым назначали исследуемое лечение), для которых имеются данные.
1 В группе плацебо происходило титрования глибенкламида от общей суточной дозы 7,5 мг до 15 мг.
2 Среднее изменение от исходного уровня с поправкой на значение на первоначальном уровне (ANCOVA).
3 p <0,0001 по сравнению с плацебо.
4 p = 0,0059 по сравнению с плацебо.
5 p = 0,0157 по сравнению с плацебо.
6 Титрование метформина от 500 до 2000 мг в сутки при условии переносимости.
7 Среднее изменение HbA1c — это разница между группами комбинации саксаглиптин с метформином и только метформин (p <0,0001).
8 Среднее изменение HbA1c — это разница между группами комбинации саксаглиптин + метформин и только метформин.
Дети.
Европейское агентство лекарственных средств сняло обязательства по предоставлению результатов исследований препарата Онглиза в одной или нескольких подгруппах детей для лечения сахарного диабета II типа (см. Раздел «Особенности применения», где приведена информация о применении детям).
Фармакокинетика.
Фармакокинетика саксаглиптину и его основного метаболита была подобной у здоровых добровольцев и у пациентов с сахарным диабетом II типа.
Всасывания.
Саксаглиптин быстро всасывался после приема в состоянии натощак с максимальными плазменными концентрациями (C max ) саксаглиптину и его основного метаболита, достигались в течение 2 и 4:00 (T max ) соответственно. Значение C max и AUC саксаглиптину и его основного метаболита росли пропорционально величине увеличения дозы саксаглиптину; такая пропорциональность дозе наблюдалась в диапазоне до 400 мг. После однократного приема саксаглиптину в дозе 5 мг здоровыми добровольцами средние значения AUC плазмы для саксаглиптину и его основного метаболита составляли 78 нг · ч / мл и 214 нг · ч / мл соответственно. Соответствующие значения плазменной C maxсоставили 24 нг / мл и 47 нг / мл соответственно. Коэффициенты вариации для C max и AUC саксаглиптину у одного пациента были ниже 12%.
Ингибирования активности ДПП-4 плазмы крови под влиянием саксаглиптину менее 24 часов после приема саксаглиптину объясняется высокой мощностью, высокой аффинностью и активным связыванием с активными участками.
Взаимодействие с пищей.
Еда оказывает относительно незначительное влияние на фармакокинетику саксаглиптину у здоровых людей. Прием вместе с пищей (с высоким содержанием жира) не вызывало изменений C max и вызывало рост AUC на 27% по сравнению с состоянием натощак. Время, в течение которого достигается C max (T max ), увеличивался примерно на 0,5 часа после приема вместе с пищей по сравнению с состоянием натощак. Эти изменения оцениваются как клинически незначимыми.
Распределение.
Связывание саксаглиптину и его основного метаболита с белками in vitro в сыворотке крови человека незначительно. Таким образом, маловероятно, что изменения уровней белка в крови вследствие различных патологических состояний (например, нарушение функции печени или почек) влиять на распределение саксаглиптину.
Метаболизм.
Метаболизм саксаглиптину происходит преимущественно с участием цитохрома P450 3A4 / 5 (CYP3A4 / 5). Основной метаболит саксаглиптину также является селективным обратимым конкурентным ингибитором ДПП-4, мощность которого составляет половину мощности саксаглиптину.
Вывод.
Период полувыведения из плазмы (t 1/2 ) саксаглиптину и его основного метаболита составляет 2,5 часа и 3,1 часа соответственно, а среднее значение t 1/2 для ингибирования ДПП-4 плазмы крови равнялось 26,9 часа. Саксаглиптин выводится с помощью как почечного, так и печеночного метаболических путей. После однократного приема дозы 50 мг 14 C-саксаглиптину 24%, 36% и 75% дозы выводится с мочой в виде саксаглиптину, его основного метаболита и общего радиоактивного материала соответственно. Средний почечный клиренс саксаглиптину (~ 230 мл / мин) был выше средней рассчитанной скорости клубочковой фильтрации (~ 120 мл / мин), что в определенной степени свидетельствует об активном выведение почками. Значение почечного клиренса для основного метаболита были сопоставимыми с рассчитанной скоростью клубочковой фильтрации. Всего 22% принятого радиоактивного материала было обнаружено в кале, что соответствует фракции дозы саксаглиптину, что выводится с желчью и / или в виде неабсорбированного лекарственного средства из желудочно-кишечного тракта.
Линейность.
C max и AUC саксаглиптину и его основного метаболита росли пропорционально дозе саксаглиптину. Существенного накопления саксаглиптину или его основного метаболита на фоне многократного приема 1 раз в сутки для одного из уровней дозировки не наблюдалось. Зависимость клиренса саксаглиптину и его основного метаболита от дозы и времени в течение 14-дневного приема саксаглиптину 1 раз в сутки в диапазоне дозирования от 2,5 мг до 400 мг не наблюдалось.
Особые категории пациентов.
Нарушение функции почек.
Открытое исследование с однократным приемом исследуемого препарата проводили для оценки фармакокинетики саксаглиптину после приема в дозе 10 мг у пациентов с различной степени хронической почечной недостаточностью по сравнению с пациентами с нормальной функцией почек. В исследовании принимали участие пациенты с нарушением функции почек, классифицировали в зависимости от клиренса креатинина (по формуле Кокрофта-Голта) как легкое (> 50 — ≤80 мл / мин), умеренное (≥30 — ≤50 мл / мин) или тяжелой ( <30 мл / мин), а также пациенты с ТСНН на гемодиализе.
Степень нарушения функции почек не влияет на C max саксаглиптину и его основного метаболита. У пациентов с легким нарушением функции почек средние значения AUC саксаглиптину и его основного метаболита были в 1,2 и 1,7 раза выше соответственно, чем средние значения AUC у пациентов с нормальной функцией почек. Поскольку рост этой величины не имеет клинического значения, коррекция дозы у пациентов с легким нарушением функции почек не рекомендуется. У пациентов с умеренным или тяжелым нарушением функции почек или у пациентов с ТСНН на гемодиализе значение AUC саксаглиптину и его основного метаболита были выше в 2,1 и 4,5 раза соответственно, чем значение AUC у пациентов с нормальной функцией почек. У пациентов с умеренным или тяжелым нарушением функции почек дозу препарата Онглиза следует уменьшить до 2,5 мг 1 раз в сутки (см. Разделы «Способ применения и дозы» и «Особенности применения»).
Нарушение функции печени.
У пациентов с легким (класс А по Чайлд-Пью), умеренным (класс В по Чайлд-Пью) или тяжелым (класс С по Чайлд-Пью) нарушением функции печени экспозиция саксаглиптину была в 1,1; 1,4 и 1,8 раза выше соответственно, а экспозиция BMS-510849 — на 22%, 7% и 33% ниже соответственно, чем у здоровых людей.
Люди пожилого возраста (≥ 65 лет).
У пациентов пожилого возраста (65-80 лет) наблюдалась примерно на 60% больше AUC саксаглиптину, чем у молодых пациентов (18-40 лет). Эта разница оценивается как клинически незначимые, поэтому коррекция дозы препарата Онглиза на основании только возраста не рекомендуется.
Препарат Онглиза показан взрослым пациентам больным сахарным диабетом II типа для улучшения контроля гликемии:
в виде монотерапии:
- пациентам с недостаточным контролем только с помощью диеты и физических упражнений, а также тем, кому не подходит метформин из-за наличия противопоказаний или непереносимости;
в виде двойной пероральной терапии в комбинации с:
- метформином, если метформин в виде монотерапии, с диетой и физическими упражнениями не обеспечивают достаточный контроль гликемии;
- сульфонилмочевины, если сульфонилмочевина в виде монотерапии, с диетой и физическими упражнениями не обеспечивают достаточный контроль гликемии у пациентов, которым не подходит лечения метформином;
- Тиазолидиндионы, если тиазолидиндион в виде монотерапии, с диетой и физическими упражнениями не обеспечивают достаточный контроль гликемии у пациентов, которым подходит лечение Тиазолидиндионы;
в виде тройной пероральной терапии в комбинации с:
- метформином и сульфонилмочевины, если такая схема сама по себе, вместе с диетой и физическими упражнениями не обеспечивает достаточный контроль гликемии;
в виде комбинированной терапии с инсулином (с метформином или без), если такая схема сама по себе, вместе с диетой и физическими упражнениями не обеспечивает достаточный контроль гликемии.
Гиперчувствительность к действующему веществу или любому из вспомогательных веществ или серьезные реакции гиперчувствительности в анамнезе, в том числе анафилактические реакции, анафилактический шок и ангионевротический отек к любому ингибитора дипептидилпептидазы 4 (ДПП4) (см. Разделы «Особенности применения» и « побочные реакции »).
Приведенные ниже клинические данные свидетельствуют, что риск клинически значимых взаимодействий с лекарственными средствами, применяют одновременно, является низким.
Метаболизм саксаглиптину происходит преимущественно с участием цитохрома P450 3A4 / 5 (CYP3A4 / 5). В исследованиях in vitro саксаглиптин и его основной метаболит вызывали ни ингибирования CYP1A2, 2A6, 2B6, 2C9, 2C19, 2D6, 2E1 или 3A4, ни индукции CYP1A2, 2B6, 2C9 или 3A4. В исследованиях с участием здоровых добровольцев не наблюдалось значимых изменений фармакокинетики саксаглиптину и его основного метаболита под влиянием метформина, глибенкламида, пиоглитазона, дигоксина, симвастатина, омепразола, антацидов или фамотидина. Кроме того, саксаглиптин не оказывал значимого влияния на фармакокинетику метформина, глибенкламида, пиоглитазона, дигоксина, симвастатина, действующих веществ комбинированных оральных контрацептивов (этинилэстрадиола и норгестимат), дилтиазема или кетоконазола.
В случае одновременного применения саксаглиптину с умеренно мощным ингибитором CYP3A4 / 5 дилтиаземом C max и AUC саксаглиптину росли соответственно на 63% и в 2,1 раза, а соответствующие показатели для активного метаболита снижались на 44% и 34% соответственно.
В случае одновременного применения саксаглиптину с мощным ингибитором CYP3A4 / 5 кетоконазолом C max и AUC саксаглиптину росли на 62% и в 2,5 раза соответственно, а соответствующие показатели для активного метаболита снижались на 95% и 88% соответственно.
В случае одновременного применения саксаглиптину с мощным индуктором CYP3A4 / 5 рифампицином C max и AUC саксаглиптину снижались на 53% и 76% соответственно. Экспозиция активного метаболита и ингибирования активности ДПП4 плазмы крови в пределах интервала дозирования не претерпевали изменения под влиянием рифампицина (см. Раздел «Особенности применения»).
Одновременное применение саксаглиптину и индукторов CYP3A4 / 5, кроме рифампицина (таких как карбамазепин, дексаметазон, фенобарбитал и фенитоин) не изучалось и может приводить к снижению плазменной концентрации саксаглиптину и рост концентрации его основного метаболита. В случае одновременного применения саксаглиптину и мощных индукторов CYP3A4 необходим тщательный контроль гликемии.
Влияние курения, диеты, продуктов растительного сырья и употребления алкоголя на фармакокинетику саксаглиптину специально не изучали.
Общие.
Препарат Онглиза не следует применять пациентам с сахарным диабетом I типа или для лечения диабетического кетоацидоза.
Онглиза не заменяет инсулин у пациентов, нуждающихся в лечении инсулином.
Панкреатит.
В процессе послерегистрационного наблюдения случались спонтанные сообщения о побочных эффектах в виде острого панкреатита. Пациентов следует проинформировать о характерный симптом острого панкреатита: непрерывный сильную боль в животе. После отмены лечения саксаглиптином симптомы панкреатита проходили. В случае подозрения на панкреатит применение препарата Онглиза и других потенциально подозреваемых лекарственных средств следует прекратить.
Нарушение функции почек.
Для пациентов с умеренным или тяжелым нарушением функции почек рекомендуется одноразовая коррекция дозы. Саксаглиптин следует с осторожностью применять пациентам с тяжелыми нарушениями функции почек и не рекомендуется применять пациентам с терминальной стадией почечной недостаточности (ТСНН), которым необходим гемодиализ. Рекомендуется проводить оценку функции почек до начала лечения Онглиза и в соответствии со стандартами лечения — в дальнейшем следует периодически проводить обследование почек (см. Разделы «Способ применения и дозы» и «Фармакокинетика»).
Нарушение функции печени.
Саксаглиптин следует с осторожностью применять пациентам с умеренным нарушением функции печени и не рекомендуется применять пациентам с тяжелыми нарушениями функции печени (см. Раздел «Способ применения и дозы»).
Применение с лекарственными средствами с известной способностью вызывать гипогликемию.
Как известно, сульфонилмочевина и инсулин вызывают гипогликемию. Поэтому в случае применения в комбинации с препаратом Онглиза может возникнуть необходимость в уменьшении доз сульфонилмочевины или инсулина для снижения риска гипогликемии.
Реакции гиперчувствительности.
Препарат Онглиза не следует применять пациентам с серьезными реакциями гиперчувствительности к ингибиторам дипептидилпептидазы 4 (ДПП 4).
В процессе послерегистрационного наблюдения, включая спонтанные сообщения и данные клинических исследований, на фоне применения саксаглиптину наблюдались следующие нежелательные реакции: серьезные реакции гиперчувствительности, в том числе анафилактические реакции, анафилактический шок и ангионевротический отек. Если возникает подозрение на серьезную реакцию гиперчувствительности к саксаглиптину, следует прекратить прием препарата Онглиза, оценить другие потенциальные причины явления и применить альтернативное лечение сахарного диабета (см. Разделы «Противопоказания» и «Побочные реакции»).
Пациенты пожилого возраста.
Опыт применения препарата пациентам в возрасте от 75 лет очень ограничен, поэтому при лечении пациентов этой категории необходима осторожность (см. Разделы «Фармакологические» и «Фармакокинетика»).
Со стороны кожи.
В доклинических токсикологических исследованиях на конечностях у обезьян наблюдались язвенные и некротические кожные поражения. Хотя частота поражения кожи в клинических исследованиях не была повышенной, опыт применения препарата пациентам с кожными осложнениями сахарного диабета ограничен. Описанные послерегистрационные сообщение о высыпания на фоне применения класса ингибиторов ДПП4. Высыпания указаны также как нежелательное явление (НЯ) препарата Онглиза (см. Раздел «Побочные реакции»). Поэтому в процессе рутинного лечения пациентов с диабетом рекомендуется осуществлять мониторинг поражений кожи, таких как образование пузырьков, язв или высыпания.
Сердечная недостаточность.
Опыт применения препарата пациентам с сердечной недостаточностью I-II класса по классификации Нью-Йоркской ассоциации кардиологов (NYHA) ограничен, а опыт применения саксаглиптину в клинических исследованиях у пациентов с сердечной недостаточностью III-IV класса по NYHA отсутствует.
Пациенты с нарушением функции иммунной системы.
Пациенты с нарушением функции иммунной системы, например пациенты, перенесшие трансплантацию органов или пациенты, у которых диагностирован синдром иммунодефицита, не принимали участия в исследованиях в рамках программы клинической разработки препарата Онглиза. Поэтому профили эффективности и безопасности саксаглиптину у таких пациентов не установлены.
Применение с мощными индукторами CYP3A4.
Применение таких индукторов CYP3A4 как карбамазепин, дексаметазон, фенобарбитал, фенитоин и рифампицин может уменьшать сахароснижающий эффект препарата Онглиза (см. Раздел «Взаимодействие с другими лекарственными средствами и другие виды взаимодействий»).
сердечная недостаточность
Опыт применения препарата пациентам с сердечной недостаточностью класса III-IV по классификации Нью-Йоркской ассоциации кардиологов (NYHA) до сих пор ограничен. В исследовании SAVOR было замечено небольшое повышение частоты госпитализаций из-за сердечной недостаточности в группе пациентов, получавших саксаглиптин по сравнению с показателем в группе плацебо, хотя причинно-следственной связи не установлено. Результаты дополнительного анализа не указывали на различия эффекта в зависимости от класса по классификации NYHA. Следует с осторожностью применять препарат пациентам с известными факторами риска госпитализации из-за сердечной недостаточности, такими как наличие в анамнезе сердечной недостаточности или умеренного или тяжелого нарушения функции почек. Пациентов следует предупредить о характерные симптомы сердечной недостаточности и посоветовать им немедленно сообщать о таких симптомах.
артралгия
В течение послерегистрационного периода поступали сообщения о случаях боли в суставах, иногда тяжелого, на фоне применения ингибиторов ДПП-4. После отмены выраженность симптомов уменьшалась. У некоторых пациентов наблюдался рецидив симптомов после возобновления терапии тем же или другим ингибитором ДПП-4. Симптомы могут возникать вскоре после начала терапии или через более длительный промежуток времени. В случае сильной боли в суставах целесообразности продолжения терапии следует оценивать в индивидуальном порядке.
Лактоза.
Таблетки содержат лактоза. Пациентам с такими редкими наследственными проблемами как непереносимость галактозы, лактазная недостаточность Лаппа или синдром мальабсорбции глюкозы и галактозы не следует принимать этот препарат.
Применение в период беременности или кормления грудью.
Беременность.
Применение саксаглиптину беременным женщинам не изучали. Результаты исследований на животных показали наличие репродуктивной токсичности при применении препарата в высоких дозах. Потенциальный риск для человека неизвестен. Препарат Онглиза нельзя назначать в период беременности, за исключением случаев, когда в этом есть необходимость.
Кормления грудью.
Неизвестно, выводится саксаглиптин в грудное молоко. Исследования на животных показали, что саксаглиптин и / или его метаболит выводится в молоко. Риск для грудного младенца нельзя исключить. Решение о прекращении грудного вскармливания или терапии препаратом следует принимать, учитывая пользу грудного кормления для ребенка и пользу терапии для женщины.
Фертильность.
Влияние саксаглиптину на фертильность человека не изучали. Влияние на фертильность наблюдался у самцов и самок крыс, получавших препарат в высоких дозах, вызывали явные признаки токсичности.
Способность влиять на скорость реакции при управлении автотранспортом или другими механизмами.
Препарат Онглиза может оказать незначительное влияние на способность управлять транспортными средствами и работать с механизмами.
Никакие специальные исследования по изучению влияния препарата на способность управлять транспортными средствами и работать с механизмами не проводились. Однако, управляя транспортными средствами или работая с механизмами, следует учитывать вероятность головокружения, о котором сообщали в исследованиях саксаглиптину. Кроме того, пациенты должны знать о риске гипогликемии, возникает в случае применения препарата Онглиза в комбинации с другими гипогликемическими лекарственными средствами, что, как известно, могут вызывать гипогликемию (например инсулин, сульфонилмочевина).
Дозировки.
Рекомендуемая доза Онглиза составляет 5 мг 1 раз в сутки. Таблетки Онглиза нельзя делить или разрезать. Если Онглизу применять в комбинации с инсулином или сульфонилмочевины, может потребоваться меньшая доза инсулина или сульфонилмочевины, чтобы снизить риск гипогликемии (см. Раздел «Особенности применения»).
Безопасность и эффективность саксаглиптину в виде тройной пероральной терапии в комбинации с метформином и Тиазолидиндионы не установлены.
Особые категории пациентов.
Люди пожилого возраста (≥ 65 лет).
Коррекция дозы только на основании возраста не рекомендуется. Опыт применения препарата пациентам в возрасте от 75 лет очень ограничен, поэтому при лечении пациентов этой категории необходима осторожность (см. Также разделы «Особенности применения», «Фармакологические свойства», «Фармакокинетика»).
Нарушение функции почек.
Коррекция дозы для пациентов с нарушениями функции почек легкой степени не рекомендуется.
У пациентов с умеренным или тяжелым нарушением функции почек дозу препарата Онглиза следует уменьшить до 2,5 мг 1 раз в сутки.
Опыт применения препарата пациентам с тяжелыми нарушениями функции почек очень ограничен. Итак, саксаглиптин следует с осторожностью применять у этой популяции. Онглиза не рекомендуется пациентам с терминальной стадией почечной недостаточности (ТСНН), которым необходим гемодиализ (см. Раздел «Особенности применения»).
Поскольку дозу Онглиза следует ограничивать 2,5 мг на основе функции почек, рекомендуется проводить оценку функции почек до начала лечения Онглиза и, в соответствии со стандартами лечения, обследования почек следует периодически проводить в дальнейшем (см. Разделы «Особенности применения» и «Фармакокинетика »).
Нарушение функции печени.
Коррекция дозы для пациентов с нарушением функции печени легкой или умеренной степени не требуется (см. Раздел «Фармакокинетика»). Саксаглиптин следует с осторожностью применять пациентам с умеренным нарушением функции печени и не рекомендуется применять пациентам с тяжелыми нарушениями функции печени (см. Раздел «Особенности применения»).
Способ применения.
Препарат Онглиза принимать независимо от приема пищи в любое время дня. Если прием дозы пропущен, препарат следует принять сразу, как только пациент об этом вспомнит. Не следует принимать двойную дозу в тот же день.
Дети.
Безопасность и эффективность применения у детей не установлены, поэтому Онглизу не следует применять детям. Данные отсутствуют.
Доказано, что препарат Онглиза является безопасным и хорошо переносимым и не оказывает клинически значимого влияния на интервал QTc или частоту сердечных сокращений при применении внутрь в дозе до 400 мг в сутки течение 2 недель (в 80 раз выше рекомендуемой дозы). В случае передозировки следует назначить соответствующее поддерживающее лечение, определяется клиническим состоянием пациента. Саксаглиптин и его основной метаболит можно выводить путем гемодиализа (23% дозы в течение 4:00).
Обобщенный профиль безопасности
В плацебо-контролируемых исследованиях чаще всего зарегистрированными побочными эффектами, наблюдавшиеся у ≥ 5% пациентов, получавших препарат Онглиза в дозе 5 мг, и с большим частотой, чем в группе применения плацебо, были инфекции верхних дыхательных путей (7,7%), инфекции мочевых путей (6,8%) и головная боль (6,5%).
В общем 4148 пациентов с сахарным диабетом 2-го типа, из которых 3021 получал Онглизу, были рандомизированы в шесть дважды слепых, контролируемых клинических исследований безопасности и эффективности, проведенных с целью оценки влияния саксаглиптину на контроль гликемии. В рандомизированных контролируемых, дважды слепых клинических исследованиях (включая период разработки и опыт послерегистрационного применение) более 17000 пациентов с сахарным диабетом 2-го типа получали лечения Онглиза.
По результатам совместного анализа данных 1681 пациента с диабетом 2-го типа, из которых 882 принимали Онглизу в дозе 5 мг, рандомизированного до пяти дважды слепых, плацебо-контролируемых клинических исследований безопасности и эффективности, проведенных для оценки влияния саксаглиптину на контроль гликемии, общая частота нежелательных явлений на фоне применения саксаглиптину в дозе 5 мг была подобна частоты в группе плацебо. Прекращение терапии из-за нежелательных явления в группе применения саксаглиптину в дозе 5 мг случалось чаще, чем в группе плацебо (3,3% и 1,8% соответственно).
Табличный перечень нежелательных реакций
Нежелательные реакции, зарегистрированные в ≥ 5% пациентов, принимавших саксаглиптин в дозе 5 мг, и чаще, чем в группе плацебо, или реакции, зарегистрированные в ≥ 2% пациентов, принимавших саксаглиптин в дозе 5 мг, и на ≥ 1% с большей частотой, чем в группе плацебо, по результатам совместного анализа данных пяти исследований контроля гликемии и дополнительного активно-контролируемого исследования начальной комбинированной терапии с метформином, приведены в таблице 1.
Нежелательные реакции перечислены по системно-органными классами и абсолютной частотой. По частоте реакции распределены следующим образом: очень часто (≥ 1/10), часто (≥ 1/100 до <1/10), нечастые (≥ 1/1000 до 1/100), жидкие (≥ 1/10000 до 1/1000) , очень редко (<1/10000), и неизвестной частоты (частоту невозможно определить по имеющимся данным).
Таблица 1. Частота нежелательных явлений системно-органными классами по данным клинических исследований и опыта послерегистрационного применения
| Системно-органный класс нежелательные реакции |
Частота нежелательных реакций в зависимости от схемы лечения | ||||
| Саксаглиптин в качестве монотерапии | Саксаглиптин и метформин 1 | Саксаглиптин и сульфонилмочевина (глибенкламид) | Саксаглиптин и тиазолидиндион | Саксаглиптин как дополнение к комбинации метформина с сульфонил-мочевиной | |
| Инфекции и инвазии | |||||
| Инфекции верхних дыхательных путей | часто | часто | часто | часто | |
| Инфекции мочевых путей | часто | часто | часто | часто | |
| гастроэнтерит | часто | часто | часто | часто | |
| синусит | часто | часто | часто | часто | |
| назофарингит | часто 2 | ||||
| Со стороны иммунной системы | |||||
| Реакции гиперчувствительности † ‡ | нечасто | нечасто | нечасто | нечасто | |
| Анафилактические реакции, в том числе анафилактический шок † ‡ | редко | редко | редко | редко | |
| Расстройства метаболизма и питания | |||||
| гипогликемия | Очень часто 3 | ||||
| дислипидемия | нечасто | ||||
| гипертриглицеридемия | нечасто | ||||
| Со стороны нервной системы | |||||
| головокружение | часто | часто | |||
| Головная боль | часто | часто | часто | часто | |
| Со стороны желудочно-кишечного тракта | |||||
| Боль в животе † | часто | часто | часто | часто | |
| диарея 4 | часто | часто | часто | часто | |
| диспепсия | часто | ||||
| метеоризм | часто | ||||
| гастрит | часто | ||||
| тошнота † | часто | часто | часто | часто | |
| рвота | часто | часто | часто | часто | |
| панкреатит † | нечасто | нечасто | нечасто | нечасто | |
| запор † | неизвестно | неизвестно | неизвестно | неизвестно | неизвестно |
| Со стороны кожи и подкожной клетчатки | |||||
| сыпь † | часто | часто | часто | ||
| дерматит † | нечасто | нечасто | нечасто | нечасто | |
| зуд † | нечасто | нечасто | нечасто | нечасто | |
| крапивница † | нечасто | нечасто | нечасто | нечасто | |
| Ангионевротический отек † ‡ | редко | редко | редко | редко | |
| Со стороны скелетной мускулатуры и соединительной ткани | |||||
| артралгия * | нечасто | ||||
| миалгия 5 | часто | ||||
| Со стороны репродуктивной системы и молочных желез | |||||
| эректильная дисфункция | нечасто | ||||
| Общие нарушения и состояние места введения | |||||
| утомляемость | часто | нечасто | часто | ||
| периферический отек | часто |
1 В том числе саксаглиптин как дополнение к метформина и в составе начальной комбинированной терапии с метформином.
2 Только при начальной комбинированной терапии.
3 Статистически значимой разницы с группой плацебо не наблюдалось. Случаи подтвержденной гипогликемии были нечастыми в группе применения Онглизы в дозе 5 мг (0,8%) и плацебо (0,7%).
4 Частота диареи составила 4,1% (36/882) в группе применения саксаглиптину 5 мг и 6,1% (49/799) в группе плацебо.
5 На фоне начальной комбинированной терапии с метформином миалгия зарегистрирована нечасто.
† Нежелательные реакции были обнаружены в период послерегистрационного наблюдения.
‡ См. разделы «Противопоказания» и «Особенности применения».
* Явление также зарегистрировано в период послерегистрационного наблюдения (см. Раздел «Особенности применения»).
Результаты исследования SAVOR
К испытанию SAVOR были набраны 8240 пациентов, принимавших препарат Онглиза в дозе 5 мг или 2,5 мг один раз в сутки, и 8173 пациентов, получавших плацебо. Общая частота нежелательных явлений в группе применения Онглизы в этом исследовании была подобной частоты в группе плацебо (72,5% и 72,2%, соответственно).
Частота случаев подтвержденного панкреатита в популяции пациентов, которым было назначено лечение (intent-to-treat), составила 0,3% как в группе применения препарата Онглиза, так и в группе применения плацебо.
Частота реакций гиперчувствительности составила 1,1% в группе применения препарата Онглиза и в группе применения плацебо.
Общая частота сообщений о случаях гипогликемии (по данным дневников пациентов) составляла 17,1% в группе применения препарата Онглиза и 14,8% в группе плацебо. Доля пациентов, у которых на фоне лечения были зарегистрированы случаи серьезной гипогликемии (которую определяли как явление, требовало помощи другого человека), в группе саксаглиптину была больше, чем в группе плацебо (2,1% и 1,6% соответственно). Повышенный риск гипогликемии в целом и серьезной гипогликемии, отмечен в группе применения саксаглиптину, наблюдался преимущественно у пациентов, которые в исходном этапе применяли препараты сульфонилмочевины, но не в тех, кто на исходном этапе получал монотерапию инсулином или метформином. Повышенный риск гипогликемии целом и серьезной гипогликемии угрожал преимущественно пациентам с исходным уровнем A1C <7%.
Пониженное количество лимфоцитов была зарегистрирована в 0,5% пациентов группы применения Онглизы и 0,4% пациентов группы применения плацебо.
Госпитализация за сердечной недостаточности в группе саксаглиптину случалась чаще (3,5%), чем в группе плацебо (2,8%), с номинальной статистической значимости в пользу плацебо [соотношение рисков (ОР) = 1,27; 95% ДИ: 1,07, 1,51) P = 0,007].
Описание отдельных нежелательных реакций
гипогликемия
Частоту гипогликемии подсчитывали по всем сообщениям о гипогликемию сопутствующего измерения уровня глюкозы не требовалось.
При применении препарата в качестве дополнения к комбинации метформина с сульфонилмочевины общая частота зарегистрированных случаев гипогликемии составляла 10,1% в группе препарата Онглиза в дозе 5 мг и 6,3% в группе плацебо.
При применении препарата в качестве дополнения к инсулину (с метформином или без) общая частота зарегистрированных случаев гипогликемии составляла 18,4% в группе применения Онглизы в дозе 5 мг и 19,9% в группе плацебо.
Результаты лабораторных исследований
В клинических исследованиях частота таких нежелательных явлений как изменения лабораторных показателей была подобной у пациентов, получавших саксаглиптин в дозе 5 мг, и у тех, кто получал плацебо. Наблюдалось небольшое уменьшение абсолютного количества лимфоцитов. Согласно результатам анализа совокупных данных плацебо-контролируемых исследований, среднее снижение абсолютного количества лимфоцитов составляло примерно 100 клеток / мкл по сравнению с показателями группы плацебо при исходной абсолютной количества лимфоцитов примерно 2200 клеток / мкл. Средняя абсолютное количество лимфоцитов оставалась стабильной при ежедневном применении в течение до 102 недель. Снижение количества лимфоцитов не сопровождалось клинически значимыми побочными эффектами. Клиническая значимость такого снижения количества лимфоцитов по сравнению с показателями группы плацебо неизвестна.
Сообщение о подозрении на нежелательные реакции
Сообщение о подозреваемых нежелательные реакции после регистрации лекарственного средства имеют важное значение. Они позволяют продолжать мониторинг соотношения польза / рисков, связанных с применением препарата. Медицинских работников просят сообщать о любых подозреваемые нежелательные реакции.
Хранить при температуре не выше 30 ° С. Хранить в недоступном для детей месте.
По 10 таблеток в блистере. По 3 блистера в картонной коробке.
Товары из категории — Эндокринология
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 1 813
Фармакологические свойства
Препарат Онглиза используется для смягчения проявлений сахарного диабетического синдрома 2 типа, как в форме монотерапии, так и при комплексном введение с метформином. Основным действующим веществом лекарства является активный избирательный и обратимый замедлитель мембранного фермента, который гидролизует пептидные связи с N-конца пролина. Введение химвещества обеспечивает угнетение активности ферментизации на протяжении суток и вызывает:
Секреция инсулинового материала β-частицами поджелудочного органа и уменьшение выработки гормона-глюкагона из α-клеточных структур формирует понижение базальной и постпрандиальной гликемии.
Проводилось изучение влияния Онглизы на организм в тестированиях с участием нескольких тысяч людей с инсулиннезависимым сахарным диабетическим синдромом. В результате установлено значительное улучшение значений гемоглобина, низкомолекулярных углеводов перед едой и постпрандиальных углеводов в плазме кровяной жидкости в сравнении с контрольными показателями.
В случае отсутствия результативности от монотерапии дополнительно к саксаглиптину назначалось введение метформина, глибенкламида или тиазолидиндионов. Воздействие препарата на липидный обмен тождественен контрольным тестам. Увеличение весовых показателей тела при использовании средства не отмечено.
Состав и форма выпуска
В формуле лекарства Онглиза основная роль отведена активному сахаропонижающему материалу – саксаглиптин гидрохлорида. Изготавливается он в форме таблеток с пленочным покрытием в дозировке 2,5 мг и 5 мг действующего компонента. Фасуются таблетки в блистеры из алюминиевой фольги по три единицы в упаковке.
Показания к применению
Назначение препарата производится при диабетической патологии второго типа, как дополнение к спецпитанию и необременительным спортивным занятиям в случае:
Международная классификация болезней (МКБ-10)
E11 Сахарная диабетическая патология второго типа (инсулиннезависимая).
Побочные эффекты
В ходе осуществления терапевтических мероприятий с употреблением фармпродукта Онглиза вероятно развитие следующих коллатеральных явлений в форме инфекционных патологий системы мочевыделения, органов дыхания и пищеварительного тракта, а именно:
Одновременное использование саксаглиптина и метформина может вызвать раздражение питуитарной поверхности носоглотки.
Противопоказания
По инструкции запрещается назначать средство при:
Также запрещается использование препарата на этапе вынашивания плода, природного кормления новорожденного, несовершеннолетним пациентам и при повышенном уровне сенситивности к составляющим лекарства. Внимательно следует его назначать в случае проблем с почками и системой мочевыведения, а также возрастным больным, которым уже исполнилось 60 лет.
Применение при беременности
Достоверных данных о влиянии саксаглиптина на здоровье матери и плода не существует. Это связано с невозможностью проведения опытов на людях во время беременности. Такая же ситуация обстоит и с использованием сахаропонижающего химпродукта при кормлении младенца грудным молоком. Неизвестно, проникает, или нет активный компонент препарата в лактозу, поэтому на время лечения новорожденного лучше всего перевести на искусственное кормление.
Способ и особенности использования
Онглиза употребляется перорально и независимо от времени принятие продуктов питания. Начальная норма в случае монолечения равняется 5 мг с однократным введением на протяжении 24 часов. При комплексной терапии с параллельным использованием метформина, тиазолидиндионов, или метаболитов сульфонилмочевины первоначальная дозировка саксаглиптина – 5 мг один раз в 24 часа. Начальное количество метформина не должно превышать 0, 5 г один раз в день. При неадекватной реакции схема терапии изменяется.
В инструкции по применению оговаривается случай пропуска принятия химпрепарата. Тогда пилюлю следует немедленно употребить, но в двойной дозе. Людям с почечной дисфункцией легкой формы коррекция нормы не проводится. При средней и тяжелой форме почечной деструкции количество уменьшается наполовину. При этом таблетку нужно принять после процедуры гемодиализа. Что касается перитонеального диализа, то его влияние на сахаропонижающие характеристики средства не установлено. До начала курса лечения и на его протяжении периодически пациента направляют на специальную процедуру для оценки состояния работоспособности почек.
При дисфункции гепатобилиарной системы любой степени сложности коррекция дозы Онглизы не требуется. Это же касается и пациентов старшей возрастной категории, но с учетом внимательного отношения к введению препарата вследствие пониженной функциональности почечной структуры. Влияние медвещества на организм пациентов до 18 лет не изучено.
Взаимодействие с другими лекарствами
На основании оценки клинического тестирования медики делают вывод об отсутствии вероятности серьезных отклонений при одновременном введении других фармакологических продуктов. Обмен саксаглиптина в организме имеет непрямой характер и обусловлен влиянием системы изотипов цитохрома. Тесты внутри организма показали, что активный компонент не замедляет многие изоэнзимы CYP 1A2, 2А6, 2В6 и не генерирует изоформы CYP 2С9 и ЗА4.
Одновременное ведение лекарства Онглиза и таких мощных блокаторов изоэнзимов, как ритонавир, телитромицин, требует уменьшения обычной дозы в два раза, то есть до 2,5 мг при однократном суточном приеме. Участие здоровых добровольных пациентов в тестировании саксаглиптина позволило определить, что фармакокинетические параметры действующего ингредиента и его продуктов распада не подвергались трансформации под действием метформина, омепразола, фамотидина. Подобное заключение касается и обратного влияния саксаглиптина на фармакокинетические характеристики всех вышеперечисленных лекарственных форм.
Воздействие регуляторов экспрессии изоэнзимов на фармакокинетику Онглизы не исследовано. Вместе с тем известно, что при одновременном ее введении с карбамазепином, дексаметазоном, фенобарбиталом, рифампицином и другими индукторами изоформ CYP 3A4/5 может наблюдаться снижение плотности саксаглиптина и повышение плотности его основного продукта расщепления.
Степень вреда после использования табачных изделий или алкогольных напитков при лечении с введением саксаглиптина не определена по причине отсутствия подобных экспериментов.
Передозировка
Известны прецеденты употребления медикамента Онглиза в дозах, превышающих норму в 80 раз. Достоверного описания последствий нет. Поэтому эффективное лечение заключается в проведении своевременной процедуры гемодиализа. За 4 часа выводится почти 25% активного компонента лекарства. Для исключения подобных случаев рекомендовано строгое отношение к процессу лечения с обязательным периодическим посещением лечащего врача.
Аналоги
Препараты, похожие по составу на средство Онглиза, отсутствуют. Существуют лишь аналоги по терапевтическому механизму воздействия. К ним относится Янувия, Тражента, Гальвус и другие. Категорически запрещается прием данных препаратов без назначения доктора.
Условия продажи
Химсредство разрешается к продаже исключительно на основании врачебного рецепта.
Условия хранения
Согласно инструкции, лекарство необходимо содержать в недоступном для несовершеннолетних лиц месте. Также на таблетки не должны попадать солнечные лучи. Срок хранения составляет до 3 лет при температуре не более 30°С. При обнаружении на упаковке повреждений или каких-либо дефектов средство немедленно утилизируют. По истечению срока годности употреблять вещество запрещается.
Цены на Онглиза в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 1 813 руб.