Применение и способности препарата Онколан
Препарат, который считается сильнейшим иммуномодулятором – Онколан изготавливается на основе травянистого растения аконита. Хоть официальная медицина еще не изучила все свойства растения, аконит широко используется в народной (нетрадиционной медицине). Чем же так известен препарат? Свое применение Онколан нашел в лечении весьма серьезных заболеваний, таких как рак желудка, легких, щитовидной железы, а также при острых инфекционных и воспалительных процессах. Но давайте по порядку. Рассмотрим «волшебные» свойства растения аконита и изучим инструкцию по применению самого препарата.
«Черты характера» аконита
Так как в состав Онколана входит растение рода аконитовых, стоит рассмотреть его свойства. В наших широтах эту траву называют «козьей смертью» и «черным зельем». Такие грозные названия связаны с ядовитыми свойствами растения. Его корни содержат алкалоидный аконитин – одно из самых ядовитых веществ в мире. А вот выглядит растение деликатным и беззащитным – прямые высокие стебли, темно-сиреневые, синие, реже – белые цветы замысловатой формы создают обманчивое впечатление, ведь один грамм растения способен убить взрослого человека.
Это важно! Для изготовления 5 мл настойки используется около 1 грамма аконита. Так что перед применением Онколана стоит детально ознакомиться с инструкцией и четко следовать дозировке.
Собственно, именно ядовитые свойства растения делают его мощным борцом со сложными недугами. Алкалоид, входящий в состав корня растения, можно сказать, «агрессивно воздействует» на метастазы. За счет чего препарат используют в лечении онкологических заболеваний и после изнуряющих курсов химиотерапий.
«Умения» препарата – от лечения диабета до полиартрита
Выпускается Онколан в виде 10% настойки из клубней (корней) или листьев, соцветьев аконита. Применяется он как вспомогательное средство для лечения:
- Сепсиса и прочих инфекционных заболеваний острого характера;
- Почечных и колик в печени;
- Невралгии;
- Полиартрита;
- Туберкулеза и заболеваний легочной системы.
- Сахарного диабета разного типа.
- Злокачественных образований щитовидной, молочной железы, ЖКТ, кожных и образований в легочной системе.
Также используют Онколан для лечения доброкачественных образований в щитовидной железе, позвоночнике, кишечнике, легких, мастопатии кистозно-фиброзного происхождения.
Это важно! Наружно настойку можно использовать для лечения ревматизма, поражений суставов, в качестве альтернативы «горчичникам» в период бронхита и вирусных инфекций, при псориазе, ушибах и кожных язвах. В таком случае экстракт нужно наносить на марлевую повязку, как бы пропитывая ее, и прикладывать к больному участку.
Отдельно скажем о том, что настойка применяется в качестве альтернативного «борца» с онкологией. Здесь важным моментом является то, что сам Онколан не способен уничтожить клетки опухоли. Его действие нацелено на то, чтобы уменьшить рост опухоли и снизить вероятность образования метастаз. Также обладает препарат еще одним свойством – обезболивающим. За счет чего использоваться он может и в качестве анальгетика. Больные 4 стадией рака, принимающие настойку, отказываются от стандартных наркотических анальгетиков.
Схема применения Онколана
Первое правило применения препарата – настойку нужно разводить с водой из расчета 1 мл эссенции на 100 мл воды. Следуя инструкции, в первые дни капли можно разводить в 150 мл воды. Жидкость поможет организму сосредоточить все свои силы на борьбе с воспалительным процессом. Инструкция по применению Онколана будет следующей:
Для лечения злокачественных опухолей стоит использовать принцип «горки». В первый день вы выпиваете по 1 капле Онколана 3 раза в сутки, во второй – по две, в третий – по три капельки и таким образом доходите до 10 дней. Со следующего (11 дня) нужно снижать количество капель. Полный курс составит 20 дней.
Согласно инструкции, для получения максимально эффективного результата стоит пропить Онколан тремя курсами с перерывом в 11-14 дней. В случае если онкологическое заболевание прогрессирует перерыв между курсами стоит сократить до недели.
В качестве поддерживающей терапии Онколан нужно использовать таким образом: раз в сутки принимать по капельке настойки по принципу «горки». Дойти до 10 дней, затем уменьшать количество капель. Такая схема подойдет для лечения онкологии у пожилых людей и детей.
Принимать настойку Онколана нужно за 30 минут до еды. Следуя инструкции, полный курс лечения составит порядка 3 месяцев (20 дней – лечение и перерыв в 7-14 дней). «Ускоренный» курс приема составит 20 дней. При этом Онколан с первого дня можно принимать по 3 капельки. После этого проходить повторный курс не нужно.
Это важно! Согласно исследованиям, полный курс применения препарата на основе аконита уменьшил рост метастаз более чем на 70%. Развитие опухолей снижалось в среднем на 64%. (Данные исследования проводились на животных).
Противопоказания и передозировка
Независимо от того, в какой дозировке и по какой схеме вы будете принимать Онколан, обращайте внимание на реакцию организма. Если появились такие симптомы, как:
- головокружение;
- тошнота;
- рвота;
- резкое падение давления;
- слабость в ногах.
Не повышайте дозу, а, наоборот, снизьте до одной капельки. Согласно инструкции, в некоторых случаях такие симптомы могут появиться при приеме 5-8 капель в день. Не пугайтесь. Это ответная реакция организма на сильный яд. Значит, вам нужно постепенно снижать дозу.
Следуя инструкции, принимать Онколан не стоит в период грудного вскармливания и людям, которые страдают гипотонией. Нельзя принимать капли одновременно с другими ядами и сильнодействующими анальгетиками. Такие предостережения необходимы, чтобы избежать передозировки ядовитыми компонентами Онколана.
Настойка на этиловом спирту корня казахстанского растения Аконит Джунгарский с добавлением очищенной воды — онколан — используется в народной медицине в качестве действенного иммуномодулятора при онкологических и прочих заболеваниях, а также для профилактики.
Содержание
- Распространенные инструкции по применению онколана
- Альтернативные виды применения
- Что лечит спиртовая настойка онколан
- Растение Аконит Джунгарский
Распространенные инструкции по применению онколана
Для приема средства существует специальная инструкция В.В. Тищенко (известный онко-фитотерапевт):
- Онколан полагается разбавлять достаточным количеством воды — вода продлевает время всасывания лекарства, и организм его легче принимает.
- В день прием онколана производится 1 раз.
- Начинать курс приема следует с дозы в одну каплю настойки на 100 мл воды, ежедневно по капле настойки и по 10 мл воды увеличивая количество составляющих в растворе, дойдя до 10 капель онколана и 200 мл воды к середине курса. Затем, постепенно уменьшая дозу, нужно возвратиться к первоначальной пропорции настойки (1 капля) и воды (100 мл).
- Разбавленные водой капли пьют за час до поступления пищи в желудок.
- Курс протекает 20 дней, эффективное применение подразумевает, что подряд будут проведены 3 курса.
- Между курсами нужно устраивать перерывы от 5 до 10 дней (при онкологии перерыв короче).
- Один курс можно провести для профилактики, даже не имея болезней.
- Методика Тищенко допускает применение настойки для лечения ослабленных больных детей, но лучше предварительно посетить консультацию врача.
При высоком иммунном потенциале у больных желательно более интенсивное применение средства, используется другая инструкция:
- Суточный прием онколана становится трехразовым.
- Доза для каждого из 3-х раз начинается с капли настойки (в течение первого дня суммарно выпивают 3 капли настойки, в 3 приема по 1-й за прием) и с каждым днем увеличивается по капле до 10-го дня. В 10 и 11 день 3 раза выпивают по 10 капель. С 12-го дня число капель одной дозы начинает ежедневно уменьшаться на 1. Получается, что в последний (20-й день) курса в каждый из трех подходов онколан пьют по 1 капле.
- Правильное применение предполагает, что капли настойки каждый раз разбавляются в 50 мл воды в начале и конце курса, и в 100 мл ближе к его середине.
- Проводится 3 курса с короткими пятидневными перерывами.
Если самочувствие на определенном этапе курса ухудшилось или проявилось отравление (тошнит, кружится голова, ощущается слабость) — максимальная для организма доза онколана достигнута, даже если она далека от максимальной дозировки середины курса. Следовательно, наступил момент, с которого количество капель настойки нужно снижать.
При ярко выраженных симптомах отравления (рвота, резко упало давление) средством онколан, применение рекомендуется немедленно прекратить и восстанавливаться в течение трех дней молочным раствором марганцовки или водным раствором белой глины. До нового курса после этого нужно отсчитать от 5 дней до недели.
Альтернативные виды применения
При наличии в молочной или щитовидной железах узловых и кистозных образований, нерастворенной настойке олколан находят применение в виде растирки.
Инструкция:
- Налить в ладонь 1/2 чайной ложки настойки прямо из пузырька.
- Растирая, нанести на больное место на ночь.
- Мылом со щеткой помыть руки (или использовать перчатки с самого начала).
- Утром промыть место, на которое делалась растирка, теплой водой, используя мыло.
При присутствии в матке новообразований, в течение 10 дней проводят спринцевания раствором из настойки онколан (5мл) и теплой воды (500 мл). Разрешено повторение курса через неделю.
Микроклизмы с 1 мл онколана, растворенным в 50 мл воды, делают при полипах и опухолях в кишечнике. Проводится десятидневный курс с недельным перерывом.
В неразбавленном виде находит онколан применение и для точечного воздействия на новообразования на коже — средство обеспечивает прижигающий эффект.
Это важно! При неправильном употреблении настойка становится ядовитой. Приложите все усилия для организации абсолютной недоступности пузырька с онколаном для детей.
Чтобы компенсировать ядовитость онколана, его применение следует сопровождать приемом травяных сборов, выводящих токсины. Травяные сборы назначаются в соответствии с диагнозом.
Что лечит спиртовая настойка онколан
За счет химического состава настойки онколан применение ее направлено против опухолей, инфекций, боли, спазмов, беспокойства и на стимуляцию иммунитета.
Онколан чаще всего принимают при следующих заболеваниях:
- доброкачественные и злокачественные опухоли
- узлы и кисты щитовидной железы
- плеврит
- диабет
- скарлатина
- фиброзно-кистозная мастопатия
- полиартрит
- невралгия
- паралич
- заболевания сердца, печени, сосудов, кишечника, почек, желудка
- сифилис
- дифтерия
- сепсис
- острые инфекции
Случаи, когда применение онколана нежелательно:
- Беременность
- Кормление грудным молоком
- Давление ниже нормы
- Тяжелые дисфункции печени
- Перенесенный анафилактический шок
- Одновременное лечение другими ядами
Растение Аконит Джунгарский
Составляющий растительную основу настойки онколан 
Корневище аконита в качестве сырья заготавливают весной, когда снег сошел, но еще не стало жарко, и осенью до выпадения снега. Для приготовления настойки Аконита подходят как сушеные корни, так и свежесобранные или пролежавшие недолгое время.
Материалы размещенные на данном сайте носят ознакомительный, информационный характер, и не являются окончательным руководством к действию.
Статья на конкурс «Био/Мол/Текст»: Корректировка диеты часто применяется для лечения и профилактики заболеваний. Онкологические заболевания — не исключение: правильное питание может служить не только профилактической мерой, но и повышать эффективность терапии. Здесь мы предлагаем обсудить «вкусовые предпочтения» раковых клеток и разобраться в том, как отдельные питательные вещества могут помочь бороться с опухолью.
Конкурс «Био/Мол/Текст»-2021/2022
Эта работа опубликована в номинации «Свободная тема» конкурса «Био/Мол/Текст»-2021/2022.
Партнер номинации — компания SkyGen: передовой дистрибьютор продукции для life science на российском рынке.
Генеральный партнер конкурса — международная инновационная биотехнологическая компания BIOCAD.
Генеральный партнер конкурса — компания «Диаэм»: крупнейший поставщик оборудования, реагентов и расходных материалов для биологических исследований и производств.
«Книжный» спонсор конкурса — «Альпина нон-фикшн»
Введение: на вкус и цвет товарищей нет
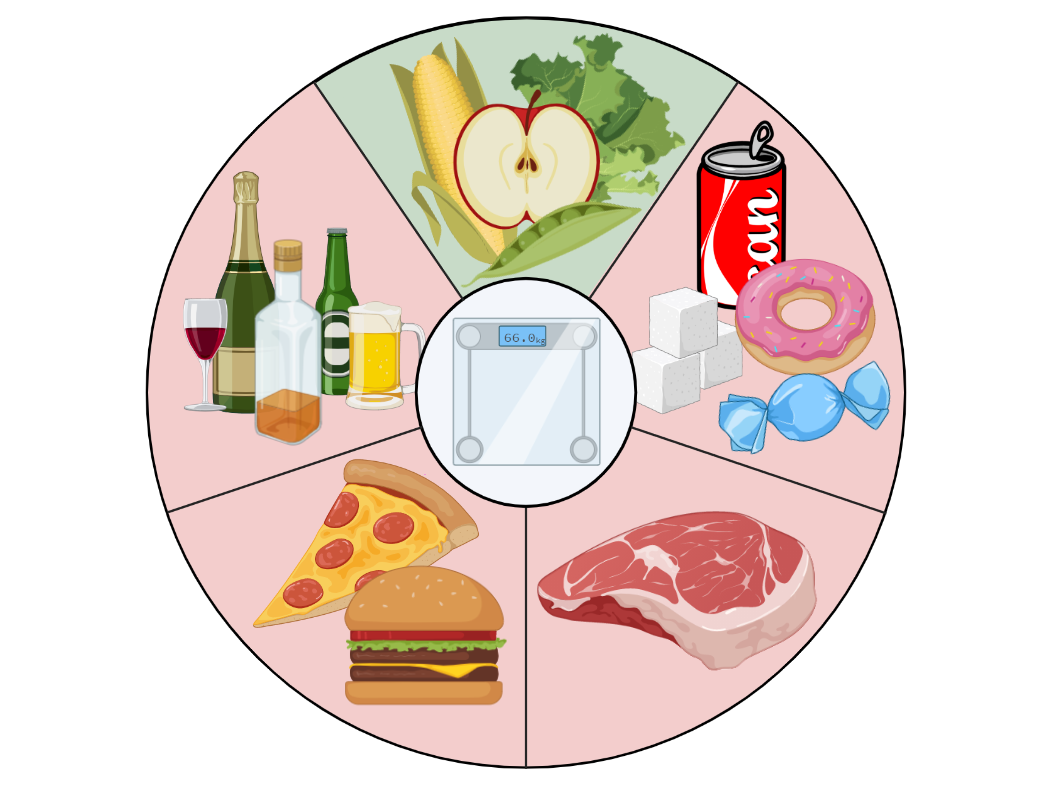
С начала 1980-х годов ведущие организации здравоохранения выпускают рекомендации по питанию и образу жизни, которые позволяют снизить индивидуальный риск развития рака. Данные рекомендации основаны на результатах метаанализов эпидемиологических исследований (иными словами, анализ многолетнего опыта миллионов людей, которые питались тем или иным образом). Эти рекомендации универсальны и просты в исполнении: они не требуют подсчета калорий, строгого контроля состава продуктов, а лишь предлагают общую схему и принцип питания для поддержания здорового веса (рис. 1).
Рисунок 1. Рекомендации по питанию, которые направлены на снижение вероятности возникновения онкологических заболеваний. Ежедневный рацион должен включать фрукты, овощи, бобовые культуры, цельнозерновые крупы. По возможности, необходимо ограничивать употребление красного мяса, сахара, сладких газированных напитков и алкоголя. Следование данным советам позволит поддерживать здоровый вес в течение всей жизни и снизить индивидуальный риск развития рака.
коллаж авторов статьи. Создан с помощью BioRender.com
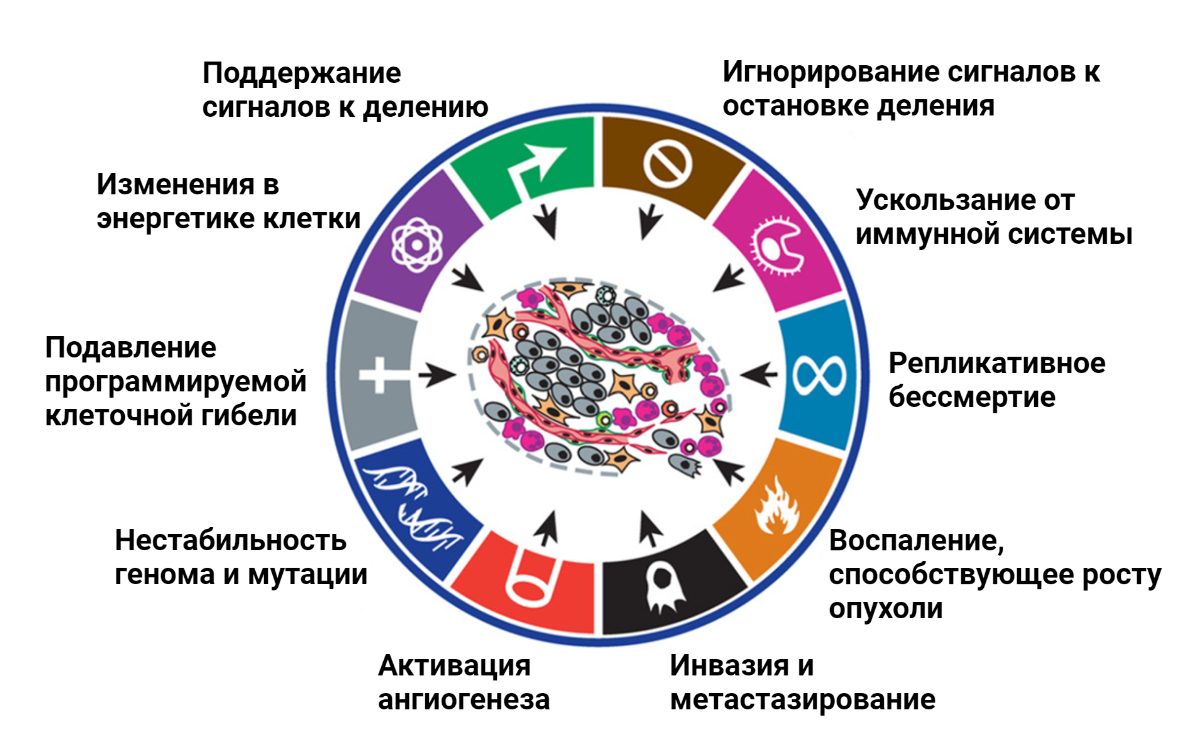
Подобного рода советы относятся к здоровым людям, тогда как для людей, страдающих онкологическими заболеваниями, стандартных рекомендаций по питанию не существует. В то же время, питание пациентов может сильно влиять на успешность терапии злокачественных образований [1]. Почему для людей, больных раком, нельзя составить универсальные рекомендации по составу пищи? Ответ на этот вопрос следует из принципов, согласно которым развиваются все опухоли [2]. Изначально клетка, которая в будущем даст начало опухоли, ничем не отличается от своих соседей. По мере накопления мутаций нормальные клетки могут постепенно эволюционировать и приобретать черты раковых клеток [3], [4]. В 2000 году среди многочисленных особенностей рака, в легендарном обзоре Hallmarks of cancer [3] были обозначены основные признаки, которые определяют биологию опухолевой клетки (рис. 2).
Рисунок 2. Особенности опухолевых клеток (hallmarks of cancer), которые отличают их от нормальных. Были сформулированы в 2000 году [3] и затем дополнены в 2011 [4].
адаптировано из [4]
Важнейшей особенностью всех раковых клеток является нестабильность генома, которая приводит к огромному генетическому разнообразию опухолей. Несмотря на ряд свойств, присущих всем раковым клеткам, каждая опухоль обладает уникальным набором мутаций, которые и определяют ее агрессивность, скорость роста, эффективность терапии. Генетическое разнообразие опухолей является основной преградой для составления универсальных рекомендаций по питанию для пациентов.
В последнее время исследователи активно изучают влияние питательных веществ на прогрессию опухоли и эффективность лечения. В основном проводятся экспериментальные работы на животных моделях, но есть и немногочисленные клинические исследования. Мы предлагаем читателям познакомиться поближе с особенностями метаболизма опухолевой клетки. Попытаемся разобраться, как вещества, потребляемые с пищей, могут влиять на опухоль и ее окружение. И, наконец, попробуем ответить на вопрос: может ли диета помочь в борьбе с раком?
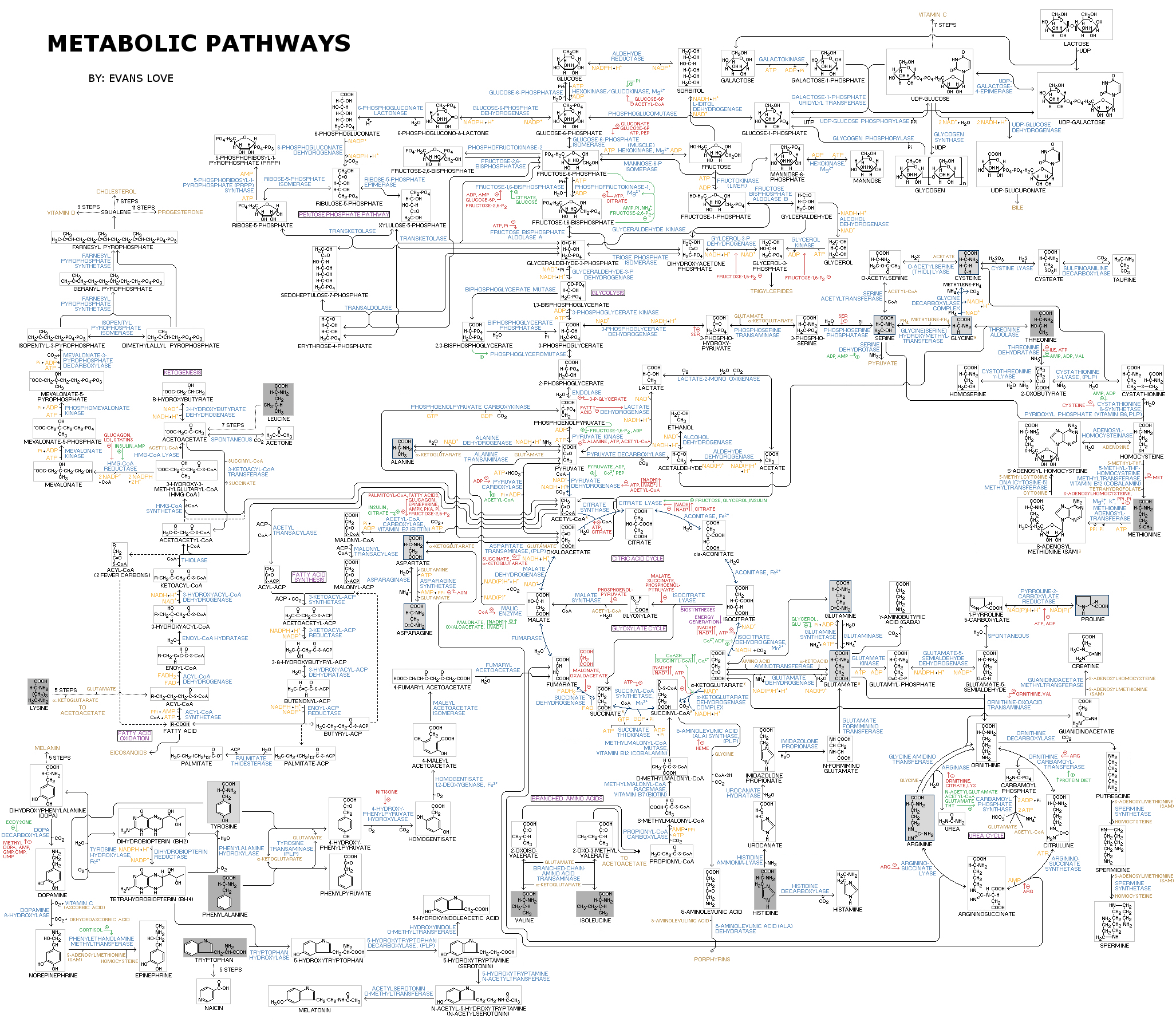
Для того, чтобы разобраться в тонкостях метаболизма раковой клетки, кратко вспомним основные принципы и термины биоэнергетики. Метаболизм — это совокупность химических превращений в клетке, которые направлены на получение энергии и необходимых веществ. Только посмотрите, какое бесчисленное количество реакций включает в себя метаболизм (рис. 3)! Все метаболические пути можно условно разделить на биодеградацию (катаболизм) и биосинтез (анаболизм) [5]. Катаболизм приводит к получению энергии в виде макроэргических соединений (таких как АТФ), а также NADH, NADPH и FADH2 — коферментов, участвующих в окислительно-восстановительных реакциях. Анаболические процессы используют запасенную энергию для синтеза молекул, необходимых для жизни клетки: жиров, нуклеотидов, белков, углеводов.
Рисунок 3. Метаболическая карта — схема, объединяющая основные метаболические пути в клетке.
Метаболизм тесно связан с питанием: ежедневно мы потребляем питательные вещества, которые, с одной стороны, участвуют в катаболических реакциях и поставляют энергию клеткам, а с другой — необходимы для синтеза собственных молекул. Углеводы, белки и жиры, которые мы потребляем, разрушаются в пищеварительном тракте до мономерных единиц: углеводы до моносахаридов (глюкоза, фруктоза и др.), жиры до жирных кислот и глицерина, белки до аминокислот. Эти молекулы поступают в клетки организма и принимают участие в метаболических процессах.
В раковой клетке зачастую увеличена активность некоторых метаболических ферментов или целых метаболических путей, а значит, и потребность в питательных веществах у клеток опухоли может отличаться от нормальных клеток [6]. Эти особенности могут быть учтены при лечении опухоли: исключение из рациона пациента определенных компонентов пищи приведет к понижению их содержания в плазме крови, а следовательно, и в окружении раковых клеток, что негативно скажется на их размножении. Кроме этого, некоторые элементы питания могут непосредственно влиять на противоопухолевый иммунитет, что также должно быть учтено при составлении диеты.
Глюкоза
Глюкоза является основным источником энергии для живых организмов. В нормальном рационе человека она встречается как в свободном виде, так и в составе олиго- и полисахаридов (например, в сахарозе, лактозе и мальтозе). Одним из важнейших биоэнергетических путей в клетке является гликолиз — последовательность химических реакций, в результате которых из 1 молекулы глюкозы получается 2 молекулы пировиноградной кислоты, 2 молекулы АТФ и 2 молекулы NADH. Затем пировиноградная кислота может быть вовлечена в цикл трикарбоновых кислот (цикл Кребса) — биохимический процесс, протекающий в митохондриях, который поставляет NADH и FADH2 что, в конечном счете, делает возможным синтез АТФ посредством окислительного фосфорилирования. При этом из 1 молекулы глюкозы можно получить приблизительно 36 молекул АТФ, что гораздо более выгодно с точки зрения энергетики, нежели просто гликолиз. Вследствие этого большинство клеток активно использует цикл трикарбоновых кислот и окислительное фосфорилирование для получения энергии.
Тем не менее, известно множество случаев, когда по разным причинам клетки смещают баланс в сторону гликолиза, используя этот путь в качестве основного источника энергии, ингибируя ферменты цикла трикарбоновых кислот или активируя ферменты гликолиза.
Давно известно, что опухолевые клетки активно используют гликолиз, несмотря на его относительно низкую эффективность с точки зрения энергетической выгоды. Это явление было открыто Отто Генрихом Варбургом в 1924 году. Сам Варбург считал, что нарушение клеточного дыхания — главная причина развития опухоли. Однако оказалось, что клеточное дыхание в большинстве опухолевых клеток не нарушено, а просто подавляется из-за активного гликолиза. Сейчас понятно, что активный гликолиз дает преимущество опухолевым клеткам. Во-первых, гликолиз протекает без кислорода, и, по-видимому, во многом является адаптацией к гипоксии, которая развивается по мере удаления опухолевых клеток от кровеносных сосудов. Частично эта проблема также решается тем, что раковые клетки могут способствовать ангиогенезу — прорастанию сосудов в опухоль за счет продукции ангиогенных факторов, например фактора роста эндотелия сосудов (VEGF, Vascular endothelial growth factor). Во-вторых, активный гликолиз сопряжен с образованием большого количества молочной кислоты, что приводит к закислению среды, тем самым способствуя инвазии опухоли за счет разрушения нормальных популяции клеток и деградации внеклеточного матрикса.
В то же время, нельзя не отметить тот факт, что эффект Варбурга наблюдается не только в опухолевых клетках, но и вообще во всех активно пролиферирующих клетках. Глюкоза — один из основных источников углерода в клетке, и ее полное окисление в цикле трикарбоновых кислот идет вразрез с потребностями пролиферирующей клетки. Некоторая часть глюкозы, а точнее, ее метаболитов, должна быть направлена на пути биосинтеза аминокислот, нуклеотидов и жирных кислот. Важную роль в производстве предшественников нуклеотидов и аминокислот, а также NADPH, необходимого для синтеза жирных кислот, играет пентозофосфатный путь — альтернативный путь окисления глюкозы, который также имеет ключевое значение в поддержании роста раковых клеток.
Итак, глюкоза особенно необходима раковым клеткам в связи с их активным размножением; при этом она служит не только источником энергии, но и важным предшественником для синтеза аминокислот, нуклеотидов и жирных кислот. Однако помимо непосредственной роли глюкозы в клеточном метаболизме, важным физиологическим аспектом также является эффект инсулина на опухолевые клетки.
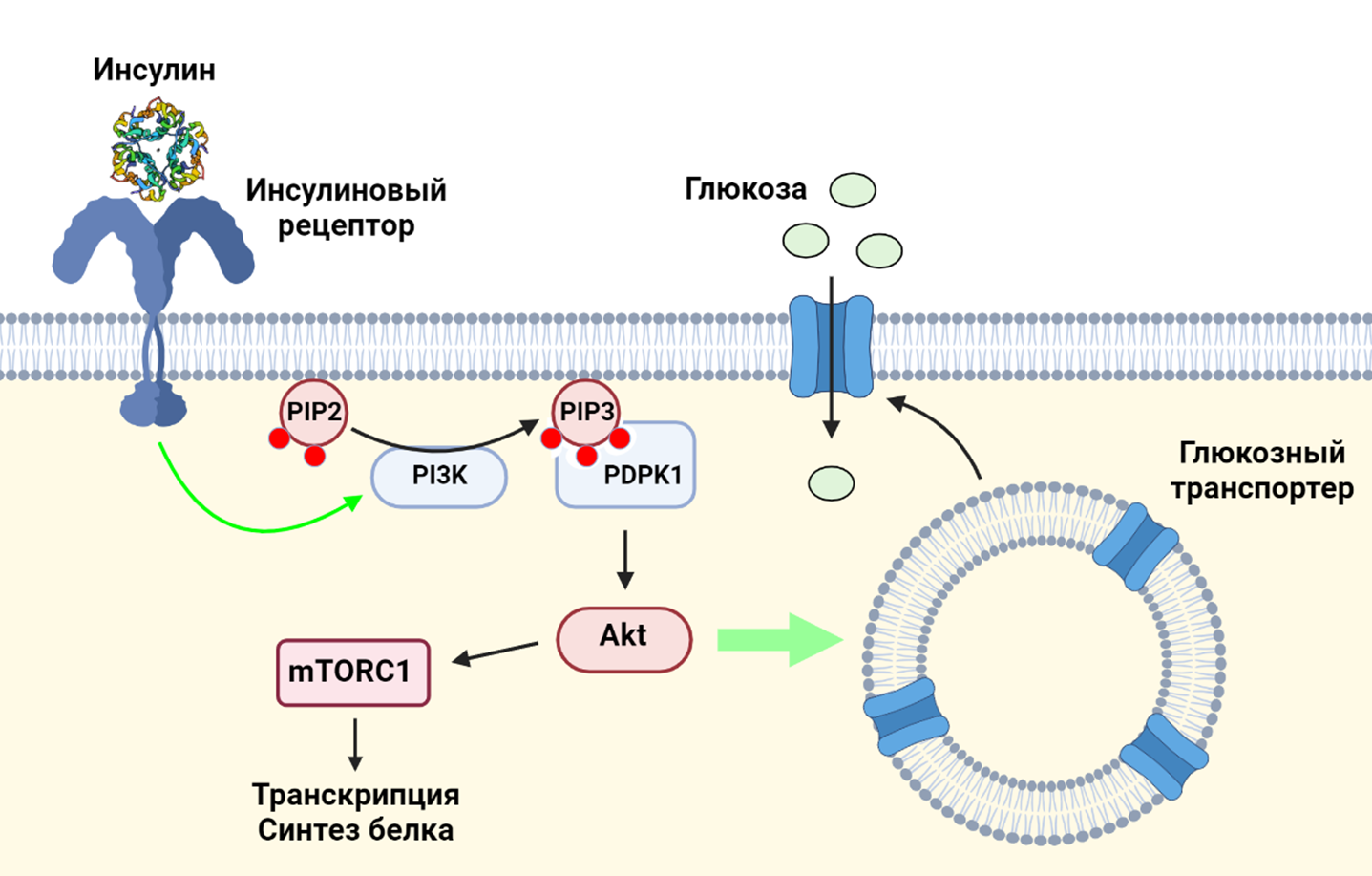
Как известно, повышение уровня глюкозы в крови вызывает секрецию гормона инсулина бета-клетками поджелудочной железы. Инсулин, в свою очередь, взаимодействует с инсулиновыми рецепторами на поверхностях клеток. Взаимодействие инсулина с его рецептором приводит к активации фосфатидилинозитол-3-киназы (PI3K) — ключевого фермента PI3K/AKT/mTOR сигнального пути: работа PI3K делает возможным фосфорилирование протеинкиназы Akt, что приводит, с одной стороны, к транслокации глюкозных транспортеров на клеточную мембрану (и, как следствие, к увеличению поглощения глюкозы клетками), а с другой стороны — к активации протеинкиназы mTORС1, важнейшего регулятора клеточного метаболизма и роста [1].
Рисунок 4. Взаимодействие инсулина и его рецептора приводит к активации фосфатидилинозитол-3-киназы (PI3K), которая фосфорилирует фосфатидилинозитолдифосфат (PIP2). Образовавшийся фосфатидилинозитолтрифосфат (PIP3) нужен для того, чтобы фосфоинозитид-зависимая киназа-1 (PDPK1) активировала протеинкиназу Akt. Akt необходима для стыковки внутриклеточных везикул, несущих глюкозный транспортер, с клеточной мембраной. Также Akt активирует mTORC1.
коллаж авторов статьи. Создан с помощью BioRender.com
Сигнальный путь PI3K/AKT/mTOR играет важную роль в раковых клетках, которые могут активно экспрессировать рецепторы к инсулину и, получая сигналы при их стимуляции, увеличивать темпы роста и размножения.
Снижение уровня глюкозы в крови пациентов рассматривается как одна из потенциальных диетических стратегий при терапии рака. Такой подход ограничит доступность глюкозы для раковых клеток и понизит секрецию инсулина бета-клетками поджелудочной железы. Как можно понизить содержание глюкозы в крови пациентов? Конечно, уменьшение калорийности пищи приведет к снижению уровня глюкозы в крови, но такой способ не может быть оптимальным, так как поставит под угрозу общее состояние пациента. Куда более выгодной стратегией может стать кетогенная диета, которая предполагает ограничение потребления углеводов с одновременным увеличением доли жиров в рационе. Действительно, есть данные доклинических исследований и немногочисленные клинические испытания, которые говорят, что такая диета может способствовать благоприятному исходу болезни — например, при глиобластоме [7]. Однако важно отметить, что некоторые типы опухолей, наоборот, зависят от жирных кислот, а значит, диета, богатая жирами, может опосредовать проканцерогенный эффект [1], о чем мы поговорим чуть далее.
А что насчет других углеводов?
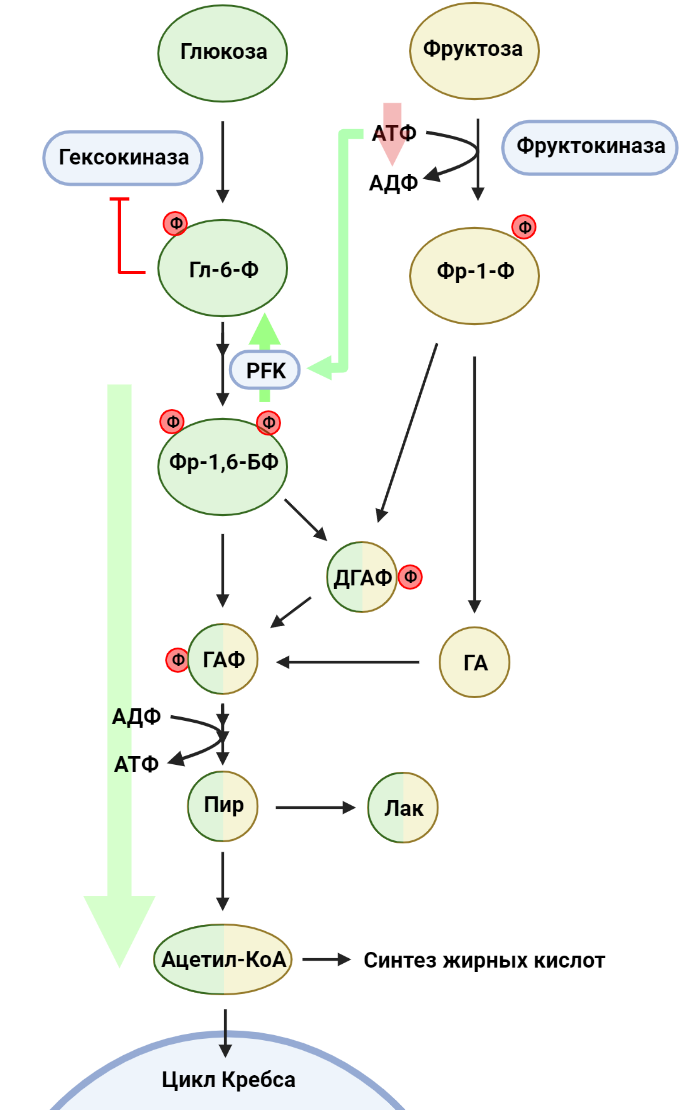
Рисунок 5. Метаболизм фруктозы. В первой стадии гликолиза глюкоза фосфорилируется до глюкозо-6-фосфата (Гл-6-Ф). Параллельно фруктоза фосфорилируется до фруктозо-1-фосфата (Фр-1-Ф). Фруктоза-1,6-бисфосфат (Фр-1,6-БФ), продукт фосфофруктокиназы (PFK), распадается на глицеральдегидфосфат (ГАФ) и дигидроксиацетонфосфат (ДГАФ), а Фр-1,6-БФ расщепляется на ДГАФ и глицеральдегид (ГА). ДГАФ и ГА переходят в ГАФ, который в оставшихся реакциях гликолиза превращается в пируват (ПИР). ПИР может восстановиться до лактата (ЛАК) или подвергаться превращению в ацетил-КоА, соединение, использующееся в многих биохимических процессах.
коллаж авторов статьи. Создан с помощью BioRender.com
Помимо глюкозы, в наш ежедневный рацион входит множество других углеводов. Например, фруктоза, один из наиболее распространенных в природе сахаров, встречается в пище как в свободном виде, так и в составе олигосахаридов, например, сахарозы. Эпидемиологи связывают рост потребления сахаросодержащих напитков с увеличением частоты заболеваемости раком [8]. Более того, оказывается, что даже умеренное потребление фруктозы (эквивалентное одной банке газировки в день) оказывает негативное воздействие и может способствовать росту опухоли, что было отмечено в экспериментах с мышами на примере колоректального рака [9]. Глюкоза эффективно поглощается эпителиальными клетками тонкого кишечника за счет специальных белков, осуществляющих совместный транспорт глюкозы и ионов натрия. При этом транспорт фруктозы опосредуется пассивным транспортером GLUT5 и потому менее эффективен. В результате значительная часть потребляемой фруктозы проходит тонкую кишку и попадает в толстый кишечник. В случае колоректального рака фруктоза становится одним из потенциальных питательных веществ для опухолевых клеток: действительно, раковые клетки в кишечнике активно экспрессируют как GLUT5, так и ферменты, метаболизирующие фруктозу. Глюкоза и фруктоза похожи между собой с точки зрения строения молекул, однако с точки зрения их метаболизма они немного отличаются (рис. 5). Если говорить про глюкозу, то первая стадия гликолиза представляет собой фосфорилирование глюкозы с затратой АТФ и образованием глюкозо-6-фосфата, причем активность гексокиназ (ферментов, осуществляющих эту реакцию) зависит от концентрации глюкозо-6-фосфата в среде: чем больше продукта для фермента, тем менее активно он работает. Это явление — пример отрицательной обратной связи, важного аспекта регуляции активности метаболических путей. Фруктоза же в первую очередь фосфорилируется фруктокиназой до фруктозо-1-фосфата (Фр-1-Ф), также с затратой АТФ, однако в данном случае активность фермента не зависит от концентрации продукта. Это значит, что киназа будет фосфорилировать всю доступную фруктозу, вне зависимости от того, сколько Фр-1-Ф уже было сделано. Следовательно, при повышенной концентрации фруктозы клетка будет тратить много АТФ на ее фосфорилирование. В ответ на понижение уровня АТФ активируется фермент глизолиза фосфофруктокиназа (PFK), а также, помимо этого, продукты расщепления Фр-1-Ф в конечном счете попадают в реакции гликолиза. Таким образом, фруктоза усиливает гликолиз, что на руку раковым клеткам: в случае колоректального рака активация гликолиза способствует индукции синтеза жирных кислот, необходимых для роста опухоли [9].
Надо отметить, что фруктоза, хоть и способствует росту опухолей в случае колоректального рака, для роста и выживания нормальных клеток вовсе не обязательна, так что фармакологическое подавление переносчиков фруктозы и ферментов, участвующих в ее метаболизме (например, фруктокиназы) может препятствовать прогрессии колоректального рака. И конечно же, исключение фруктозы из рациона пациента также может оказывать благотворный эффект на течение болезни. Однако клинических данных, подтверждающих это, пока недостаточно [1].
Еще один любопытный пример связан с маннозой, моносахаридом, который также часто встречается в рационе как в свободном виде, так и в составе полисахаридов. Манноза поглощается теми же транспортерами, что и глюкоза, но затем накапливается в клетках в виде маннозо-6-фосфата и дальше почти не метаболизируется. В то же время, маннозо-6-фосфат ингибирует некоторые ферменты гликолиза (гексокиназу и глюкозоизомеразу), а также глюкозо-6-фосфатдегидрогеназу — первый фермент пентозофосфатного пути, альтернативного способа окисления глюкозы. Таким образом, накопление маннозо-6-фосфат влечет за собой подавление метаболизма глюкозы, что негативно сказывается на жизнеспособности раковых клеток. Однако не все опухоли чувствительны к маннозе. Дело в том, что в клетках есть фермент маннозо-6-фосфат—изомераза (PMI), который катализирует превращение маннозо-6-фосфата в фруктозо-6-фосфат, метаболит гликолиза. Казалось бы, накопление маннозо-6-фосфата перестает быть проблемой для клетки, но дело в том, что разные опухоли имеют разную активность PMI, и если в каких-то опухолевых клетках его активность понижена, то манноза будет подавлять рост опухоли. Оказалось, что колоректальные опухоли обычно имеют очень низкие уровни PMI, и действительно, на мышиной модели колоректального рака было показано, что биодобавки, содержащие маннозу, значительно подавляют рост опухолей и не оказывают отрицательный эффект на здоровье и вес мышей [10]. Возможно, применение маннозы в виде добавок к пище будет повышать эффективность терапии колоректального рака и у людей, но клинических исследований на этот счет еще не проводилось [1].
Жирные кислоты
Жирные кислоты являются важнейшим источником энергии в клетке, особенно для «энергозатратных» тканей вроде скелетной и сердечной мышечных тканей. При окислении жирных кислот (которое в основном происходит в ходе процесса β-окисления) образуются NADH и FADH2, а также ацетил-КоА — вещества, необходимые для синтеза АТФ при окислительном фосфорилировании. Более того, если сравнить между собой жирные кислоты и углеводы, то окажется, что по отношению к своей сухой массе жирные кислоты обеспечивают больше АТФ, чем углеводы, а значит, они лучше подходят на роль запасного питательного вещества (жирные кислоты запасаются в форме триглицеридов в жировой ткани). Разумеется, не могло бы случиться такого, чтобы не нашлось опухолевых клеток, активно использующих жирные кислоты как источник энергии и восстановительных эквивалентов. Действительно, описаны процессы, когда раковая клетка переходит на β-окисление, а также отдельные опухоли, для которых основной источник энергии — это жиры, а не углеводы [1], [11].
Так, было показано, что окисление жирных кислот критично для клеток рака груди при их откреплении от матрикса. Протоки молочных желез выстланы слоем эпителиальных клеток, которые дают начало опухоли. На ранних стадиях развития рака молочной железы опухолевые клетки открепляются от матрикса, покидают свои ниши, начинают пролиферировать в просветах полых железистых структур, заполняя их. Эпителиальные клетки имеют на своей поверхности рецепторы эпидермального фактора роста (epidermal growth factor receptor, EGFR). При стимуляции EGFR, помимо прочего, происходит активация сигнального пути PI3K/AKT/mTOR, что приводит к росту, пролиферации, а также способствует поглощению глюкозы и подавлению апоптоза. Для эпителиальной клетки очень важен контакт с внеклеточным матриксом. Если клетка по какой-либо причине теряет контакт с матриксом, то экспрессия EGFR падает, и, как одно из следствий, клетка начинает испытывать дефицит в глюкозе. В норме эта череда событий непременно приведет к нехватке АТФ, окислительному стрессу, и наконец — к аноикису— гибели клетки, происходящей в ответ на открепление от матрикса. Но опухолевая клетка не так проста и активно пытается спастись от апоптоза. Активность ряда онкогенов в данном случае способствует активации окисления жирных кислот, что обеспечивает клетку энергией и предотвращает гибель [12].
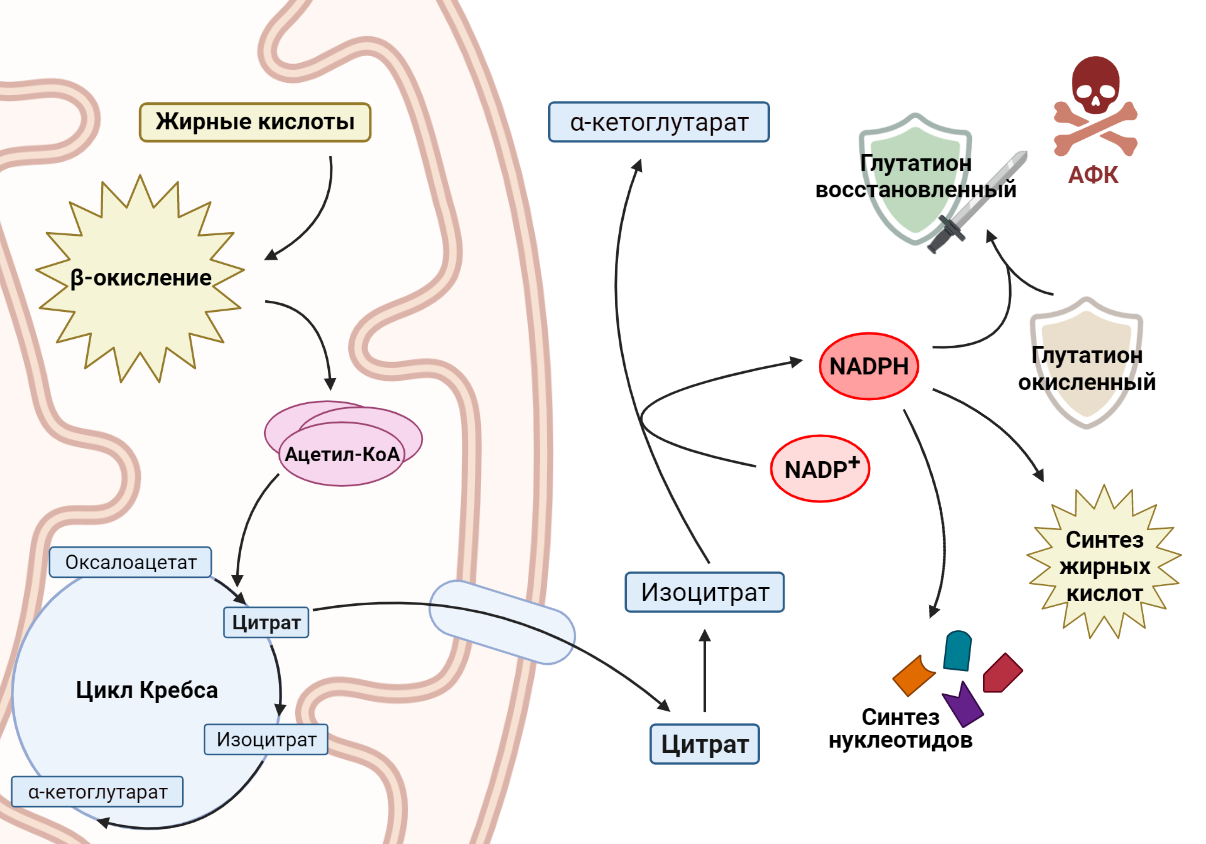
Другой важный пример роли жирных кислот в раковых клетках связан с никотинамидадениндинуклеотидфосфатом (NADPH) — веществом, которое выполняет две основные функции. С одной стороны, он участвует в защите клетки от токсичных активных форм кислорода (АФК), обеспечивая регенерацию антиоксиданта глутатиона (GSH), что особенно важно для выживания раковых клеток в условиях метаболического стресса. С другой стороны, NADPH необходим для синтеза жирных кислот и нуклеотидов, необходимых для поддержания роста и пролиферации клеток, что является неотъемлемой частью биологии опухолевой клетки. Зачастую рост раковой клетки ограничен уровнями NADPH, следовательно, изменения в метаболизме раковой клетки должны учитывать этот важный аспект. Как связаны между собой окисление жирных кислот и производство NADPH? Основным продуктом окисления жиров является ацетил-КоА, который вступает в цикл Кребса и превращается в цитрат. Цитрат может остаться воволеченным в цикл Кребса, а может покинуть митохондрию и выйти в цитоплазму. Там он превратится в изоцитрат, который является субстратом для NADP-зависимой изоцитратдегидрогеназы [13]. Этот фермент окисляет изоцитрат, при этом происходит перенос водорода на NADP+ и образуется NADPH, необходимый раковым клеткам. Например, в клетках глиомы, в которых ингибируется окисление жирных кислот, значительно понижается уровень NADPH, что приводит к накоплению АФК и, как следствие, клеточной гибели [14].
Рисунок 6. Ацетил-КоА, продукт окисления жирных кислот, поступает в цикл Кребса. В то же время цитрат, промежуточное соединение цикла Кребса, покидает митохондрию, где превращается в изоцитрат. При окислении изоцитрата происходит перенос водорода на NADP+, образуется NADPH, необходимый клеткам для множества процессов.
коллаж авторов статьи. Создан с помощью BioRender.com
Из данных примеров мы видим, что в некоторых случаях жирные кислоты способствуют выживанию и метастазированию опухолевых клеток. Это значит, что для отдельных пациентов диета с низким содержанием жиров может оказаться полезной. В то же время, кетогенная диета, которую мы обсуждали в главе про глюкозу, может вызывать непредвиденные проканцерогенные эффекты и способствовать росту опухоли. Таким образом, режим питания пациентов должен подбираться индивидуально с учетом стадии опухоли, ее локализации и особенностей метаболизма.
Аминокислоты
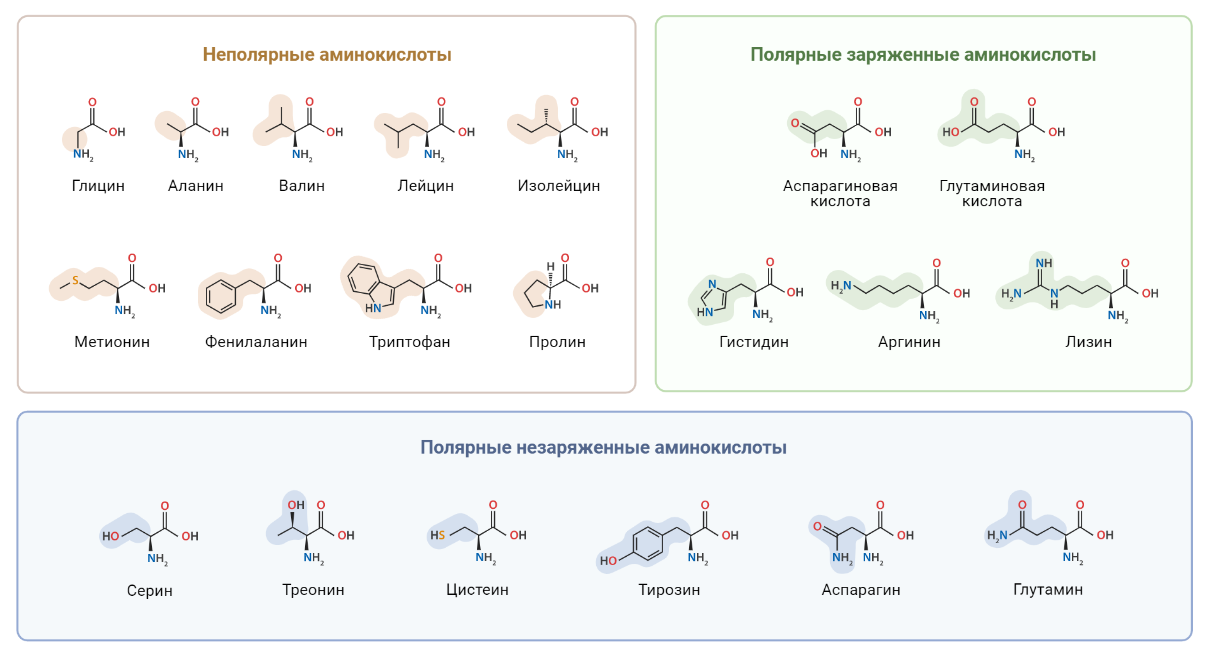
Как известно, белки принимают участие в большинстве клеточных процессов: поддерживают форму клетки, обеспечивают ее подвижность, контролируют работу генов, регулируют метаболические процессы и многое-многое другое. Аминокислоты являются строительными мономерными блоками для белков. Удивительно, что при огромном разнообразии белков, все они построены из довольно ограниченного набора аминокислот (рис. 7).
Рисунок 7. 20 классических аминокислот.
С пищей в организм попадают белки, после чего в желудочно-кишечном тракте они деградируют до отдельных аминокислот. Смесь аминокислот всасывается в тонком кишечнике, поступает в кровь и разносится к каждой клетке организма. В клетках аминокислоты используются уже для синтеза собственных белков, которые необходимы для нормального функционирования организма. Важно отметить, что некоторые из аминокислот клетки нашего организма умеют синтезировать сами (так называемые заменимые аминокислоты), а некоторые непременно должны поступать с пищей (незаменимые аминокислоты). Итак, аминокислоты, которые попали в клетку, могут войти в состав белков, но для нас более интересен тот факт, что отдельные аминокислоты могут выполнять специальные метаболические функции. Далее мы будем рассматривать роль конкретных аминокислот в метаболизме раковых клеток, а также возможные диетические стратегии для пациентов с онкологическими заболеваниями, основанные на ограничении или биодобавках данных аминокислот в рационе.
Метионин
Метионин относится к незаменимым аминокислотам для клеток человека. При этом раковые клетки для своего роста требуют бóльшие количества метионина по сравнению с нормальными клетками. Дело в том, что метионин выполняет ряд регуляторных функций. В клетке есть специальные сенсоры, которые в ответ на высокий уровень метионина (а точнее, его производного — S-аденозилметионина) способны активировать протеинкиназу mTORC1. Эта протеинкиназа крайне важна для раковых клеток: она активирует процесс синтеза белка и, как следствие, ускоряет рост и деление клетки [15]. Кроме этого, S-аденозилметионин является главным донором метильной группы в клетке, то есть обеспечивает метилирование. Метилирование ДНК и гистонов (белков, связанных с ДНК) позволяет «включать» и «выключать» определенные гены. Изменения статуса метилирования гистонов и ДНК регулируют экспрессию генов и вносят свой вклад в рост и развитие опухоли [16]. Начиная с 1990 года проводятся исследования на животных, которые демонстрируют, что ограничение потребления метионина улучшает исход лечения опухолей [1], [17]. Совсем недавно было проведено первое клиническое исследование, которое показало, что снижение количества метионина в рационе пациентов позволяет замедлить прогрессирование опухоли [18]. Таким образом, диетическое ограничение метионина у людей, страдающих онкологическими заболеваниями, является весьма многообещающим подходом [1]. Важно уточнить, что диетическое ограничение тех или иных аминокислот можно осуществить только за счет «искусственных» диет, при которых основным источником белковой пищи являются протеиновые напитки/батончики без содержания определенных аминокислот. Именно такой режим питания соблюдали пациенты, принявшие участие в клиническом испытании диеты с низким содержанием метионина: 75% белковой пищи представляли из себя протеиновые напитки без метионина [18].
Серин
Аминокислота серин принимает участие во множестве метаболических процессов: в синтезе нуклеотидов и липидов; она может превращаться в пируват и поступать в цикл Кребса, и так далее. Серин относится к заменимым аминокислотам и может синтезироваться в нормальных клетках из глюкозы и глицина (самой простой аминокислоты). Для раковых клеток, которые активно используют гликолиз и, соответственно, остро нуждаются в глюкозе, синтез серина из глюкозы непременно обернется потерями в количестве АТФ и скорости размножения. Именно поэтому можно сказать, что для опухолевых клеток серин является незаменимой аминокислотой, то есть обязательно должен поступать извне. Путь синтеза серина из глицина для раковых клеток тоже крайне нежелателен, так как глицин принимает непосредственное участие в синтезе нуклеотидов, а значит, превращение глицина в серин опять же ставит под угрозу скорость деления раковых клеток. Таким образом, ограничение потребление серина действительно может помочь в терапии опухолей. Эффективность такой диеты уже была показана в экспериментах на мышах, но клинических исследований пока не проводилось [1].
Аргинин
В нормальных клетках аргинин способен образовываться de novo, то есть является заменимой аминокислотой. В опухолевых клетках меланомы, гепатоцеллюлярной карциномы и рака простаты синтез аргинина сильно снижен. Это связано с низким уровнем фермента аргининосукцинатсинтетазы, участвующем в образовании аргиинина. Выходит, что некоторые раковые опухоли требуют поступление аргинина извне (для клеток этих опухолей аргинин — незаменимая аминокислота). «Аргининовая зависимость» опухолей может быть использована для терапии, причем как в фармакологических подходах, так и в простом диетическом ограничении аргинина. Про фармакологическое снижение аргинина в раковых клетках уже кое-что известно из научных работ: так, например, препараты, снижающие уровень аргинина в плазме крови пациентов, оказались эффективными при лечении гепатоцеллюлярной карциномы и меланомы [19].
Однако аргинин может негативно сказываться на противоопухолевом иммунитете. Важнейшими клетками, участвующими в борьбе с опухолью, являются T-лимфоциты. Аргинин активно поглощается активированными T-клетками, затем метаболизируется, что приводит к увеличению выживаемости клеток и усилению противоопухолевого Т-клеточного ответа. В мышиной модели рака кожи увеличение количества потребляемого с пищей аргинина привело к уменьшению размера опухолей, способствовало выживанию мышей [20].
Не менее важную роль в противоопухолевом иммунитете играют NK-клетки (Natural killer cells, натуральные киллеры) — иммунные клетки, способные уничтожать опухолевые клетки. Исследования показали, что потребление аргинина с пищей увеличивает количество и активность NK-клеток [21], и, наоборот, дефицит аргинина угнетает работу и жизнеспособность натуральных киллеров [22], что может негативно сказаться на борьбе с опухолью.
Таким образом, аргинин необходим как некоторым опухолям для роста, так и иммунным клеткам, сражающимся с опухолью. По-видимому, только масштабные клинические испытания помогут понять, в каких случаях стоит исключать или, наоборот, увеличивать содержание аргинина в пище для достижения максимального эффекта терапии.
Цистин и цистеин
Одна из важнейших функций аминокислоты цистеина в клетке — защита от активных форм кислорода (например, перекиси водорода), которые повреждают ДНК, липиды и белки, вызывая в клетке окислительный стресс. Раковые клетки, по сравнению с нормальными, испытывают сильный окислительный стресс и требуют большого количества цистеина. Действительно, для некоторых опухолевых клеток снижение уровня цистеина губительно: клетки «сгорают» из-за накопленных активных форм кислорода. Цистеин образуется из неклассической аминокислоты цистина, которая поступает в клетку из плазмы крови [1]. Препараты, снижающие уровень цистина в плазме крови, тормозят рост опухолей с мутантным рецептором эпидермального фактора роста (например, немелкоклеточного рака легких) у мышей [23]. Теоретически, достичь снижения уровня цистина в плазме крови пациентов можно при помощи корректировки диеты, без применения препаратов, но такой подход пока не исследован.
Гистидин
При деградации гистидина в клетке тратится тетрагидрофолат — кофактор, который необходим для синтеза нуклеотидов, а значит, определяет скорость деления раковых клеток. Чем больше в раковую клетку поступает гистидина, тем больше тетрагидрофолата тратится на распад гистидина и тем медленнее клетка делится. Применение гистидина вместе с пищей может помочь в терапии некоторых видов опухолей. В частности, такой диетический подход может стать особенно эффективным при лечении рака химиотерапевтическим агентом — метотрексатом (часто применяется для лечения злокачественных заболеваний крови). Метотрексат нарушает синтез тетрагидрофолата, что приводит к остановке синтеза нуклеотидов и к гибели раковых клеток. Оказалось, что эффективность лечения лейкемии метотрексатом заметно увеличивается при добавлении к пище аминокислоты гистидина — это было показано на мышиной модели [24].
Биодобавки фолиевой кислоты
В заключение мы хотим уделить внимание витаминам. Витамины необходимы для протекания многих биохимических реакций и должны поступать в организм с пищей. Существует распространенное заблуждение о том, что прием витаминных биодобавок может послужить защитой от рака и других заболеваний. На самом деле, витамины должны поступать исключительно с пищей, а дополнительный прием витаминов здоровым людям в основном не рекомендован (за некоторыми редкими исключениями). Регулярный прием биодобавок может оказаться не только неэффективными, но и вредным, особенно людям, страдающим онкологическими заболеваниями. Давайте рассмотрим пример того, как дополнительный прием витаминов способствует росту опухоли.
Фолиевая кислота (фолат, витамин B9) является необходимым веществом для синтеза нуклеотидов. Опухолевые клетки быстро делятся и нуждаются в больших количествах нуклеотидов для синтеза ДНК, поэтому активно потребляют фолат. Еще в 1948 году стало известно, что биодобавки фолиевой кислоты способствуют росту некоторых видов опухолей [25]. На сегодняшний день метаболизм фолиевой кислоты является фармакологической мишенью для терапии рака: упоминавшийся ранее химиотерапевтический препарат метотрексат нарушает метаболизм фолата и ингибирует пути синтеза нуклеотидов. Надо подчеркнуть, что антифолиевая терапия рака пока что является сугубо фармакологической и не предполагает корректировки диеты [1].
Однако потенциальные негативные эффекты фолата в опухолевой прогрессии на этом не заканчиваются. Ряд исследований показал, что присутствие в крови неметаболизированной фолиевой кислоты, связанное с ее избыточным потреблением, влекло за собой снижение количества и активности NK-клеток [26-28]. Упоминавшиеся ранее NK-клетки — это иммунные клетки, одна из основных функций которых состоит в защите организма от раковых клеток. Следовательно, снижение числа и подавление активности NK-клеток может повлечь за собой повышенный риск образования и прогрессии рака, хотя конкретных исследований о влиянии высоких доз фолата на противоопухолевый иммунитет не проводилось.
Таким образом, витамины необходимы для поддержания функций организма, однако чрезмерное потребление некоторых из них может привести к негативным последствиям, в том числе и к прогрессии опухоли, как в случае с витамином B9. Возможно, диета с низким содержанием фолата будет полезной для некоторых пациентов.
Заключение
Мы постарались кратко охарактеризовать некоторые особенности метаболизма опухолевых клеток и роль питательных веществ в прогрессии рака. В заключение мы хотели бы еще раз обратить внимание на то, что не существует какой-либо универсальной диеты для людей, страдающих онкологическими заболеваниями. Это связано с тем, что опухоли сильно различаются по своему метаболизму. Перечисленные диетические подходы пока что не могут использоваться повсеместно, так как перед внедрением любого из них для каждого типа рака, его локализации и стадии заболевания должны быть проведены масштабные клинические испытания, подтверждающие безопасность и эффективность нового метода лечения. Однако, ввиду многообещающих результатов исследований, модификации диеты являются перспективным подходом к лечению рака. Мы уверены, что в скором времени контроль состава диеты пациентов станет важной частью терапии онкологических заболеваний и поможет спасти многие жизни. А пока что давайте просто стараться питаться правильно и вести здоровый образ жизни. Будьте здоровы!
- Naama Kanarek, Boryana Petrova, David M. Sabatini. (2020). Dietary modifications for enhanced cancer therapy. Nature. 579, 507-517;
- Путь клетки «из греков в варяги». Малигнизация: причины и следствия;
- Douglas Hanahan, Robert A Weinberg. (2000). The Hallmarks of Cancer. Cell. 100, 57-70;
- Douglas Hanahan, Robert A. Weinberg. (2011). Hallmarks of Cancer: The Next Generation. Cell. 144, 646-674;
- Метаболизм клетки;
- Вослед Варбургу — последние достижения в изучении биоэнергетики рака;
- Colin E. Champ, Joshua D. Palmer, Jeff S. Volek, Maria Werner-Wasik, David W. Andrews, et. al.. (2014). Targeting metabolism with a ketogenic diet during the treatment of glioblastoma multiforme. J Neurooncol. 117, 125-131;
- Julie K. Bassett, Roger L. Milne, Dallas R. English, Graham G. Giles, Allison M. Hodge. (2020). Consumption of sugar‐sweetened and artificially sweetened soft drinks and risk of cancers not related to obesity. Int. J. Cancer. 146, 3329-3334;
- Marcus D. Goncalves, Changyuan Lu, Jordan Tutnauer, Travis E. Hartman, Seo-Kyoung Hwang, et. al.. (2019). High-fructose corn syrup enhances intestinal tumor growth in mice. Science. 363, 1345-1349;
- Pablo Sierra Gonzalez, James O’Prey, Simone Cardaci, Valentin J. A. Barthet, Jun-ichi Sakamaki, et. al.. (2018). Mannose impairs tumour growth and enhances chemotherapy. Nature. 563, 719-723;
- Arkaitz Carracedo, Lewis C. Cantley, Pier Paolo Pandolfi. (2013). Cancer metabolism: fatty acid oxidation in the limelight. Nat Rev Cancer. 13, 227-232;
- Zachary T. Schafer, Alexandra R. Grassian, Loling Song, Zhenyang Jiang, Zachary Gerhart-Hines, et. al.. (2009). Antioxidant and oncogene rescue of metabolic defects caused by loss of matrix attachment. Nature. 461, 109-113;
- Alessandra Castegna, Pasquale Scarcia, Gennaro Agrimi, Luigi Palmieri, Hanspeter Rottensteiner, et. al.. (2010). Identification and Functional Characterization of a Novel Mitochondrial Carrier for Citrate and Oxoglutarate in Saccharomyces cerevisiae. Journal of Biological Chemistry. 285, 17359-17370;
- Lisa S. Pike, Amy L. Smift, Nicole J. Croteau, David A. Ferrick, Min Wu. (2011). Inhibition of fatty acid oxidation by etomoxir impairs NADPH production and increases reactive oxygen species resulting in ATP depletion and cell death in human glioblastoma cells. Biochimica et Biophysica Acta (BBA) — Bioenergetics. 1807, 726-734;
- Xin Gu, Jose M. Orozco, Robert A. Saxton, Kendall J. Condon, Grace Y. Liu, et. al.. (2017). SAMTOR is an
S
-adenosylmethionine sensor for the mTORC1 pathway. Science. 358, 813-818; - Samantha J. Mentch, Mahya Mehrmohamadi, Lei Huang, Xiaojing Liu, Diwakar Gupta, et. al.. (2015). Histone Methylation Dynamics and Gene Regulation Occur through the Sensing of One-Carbon Metabolism. Cell Metabolism. 22, 861-873;
- Raghu Sinha, Timothy K. Cooper, Connie J. Rogers, Indu Sinha, William J. Turbitt, et. al.. (2014). Dietary methionine restriction inhibits prostatic intraepithelial neoplasia in TRAMP mice. Prostate. 74, 1663-1673;
- Xia Gao, Sydney M. Sanderson, Ziwei Dai, Michael A. Reid, Daniel E. Cooper, et. al.. (2019). Dietary methionine influences therapy in mouse cancer models and alters human metabolism. Nature. 572, 397-401;
- Francesco Izzo, Paolo Marra, Gerardo Beneduce, Giuseppe Castello, Paolo Vallone, et. al.. (2004). Pegylated Arginine Deiminase Treatment of Patients With Unresectable Hepatocellular Carcinoma: Results From Phase I/II Studies. JCO. 22, 1815-1822;
- Roger Geiger, Jan C. Rieckmann, Tobias Wolf, Camilla Basso, Yuehan Feng, et. al.. (2016). L-Arginine Modulates T Cell Metabolism and Enhances Survival and Anti-tumor Activity. Cell. 167, 829-842.e13;
- K.G.M. Park, P.D. Hayes, O. Eremin, H. Sewell, K.G.M. Park, P.J. Garlick. (1991). Stimulation of lymphocyte natural cytotoxicity by L-arginine. The Lancet. 337, 645-646;
- Bruno Lamas, Juliette Vergnaud-Gauduchon, Nicolas Goncalves-Mendes, Olivier Perche, Adrien Rossary, et. al.. (2012). Altered functions of natural killer cells in response to L-Arginine availability. Cellular Immunology. 280, 182-190;
- Ioannis Poursaitidis, Xiaomeng Wang, Thomas Crighton, Christiaan Labuschagne, David Mason, et. al.. (2017). Oncogene-Selective Sensitivity to Synchronous Cell Death following Modulation of the Amino Acid Nutrient Cystine. Cell Reports. 18, 2547-2556;
- Naama Kanarek, Heather R. Keys, Jason R. Cantor, Caroline A. Lewis, Sze Ham Chan, et. al.. (2018). Histidine catabolism is a major determinant of methotrexate sensitivity. Nature. 559, 632-636;
- Sidney Farber, Louis K. Diamond, Robert D. Mercer, Robert F. Sylvester, James A. Wolff. (1948). Temporary Remissions in Acute Leukemia in Children Produced by Folic Acid Antagonist, 4-Aminopteroyl-Glutamic Acid (Aminopterin). N Engl J Med. 238, 787-793;
- Hathairat Sawaengsri, Junpeng Wang, Christina Reginaldo, Josiane Steluti, Dayong Wu, et. al.. (2016). High folic acid intake reduces natural killer cell cytotoxicity in aged mice. The Journal of Nutritional Biochemistry. 30, 102-107;
- Aron M. Troen, Breeana Mitchell, Bess Sorensen, Mark H. Wener, Abbey Johnston, et. al.. (2006). Unmetabolized Folic Acid in Plasma Is Associated with Reduced Natural Killer Cell Cytotoxicity among Postmenopausal Women. The Journal of Nutrition. 136, 189-194;
- Clovis Paniz, Juliano Felix Bertinato, Maylla Rodrigues Lucena, Eduardo De Carli, Patrícia Mendonça da Silva Amorim, et. al.. (2017). A Daily Dose of 5 mg Folic Acid for 90 Days Is Associated with Increased Serum Unmetabolized Folic Acid and Reduced Natural Killer Cell Cytotoxicity in Healthy Brazilian Adults. The Journal of Nutrition. 147, 1677-1685.
Артроз коленного сустава — это дегенеративно-дистрофическое заболевание хрящевой ткани, которое приводит к обнажению костных головок и нарушению подвижности в суставе. Болезнь имеет невоспалительную природу и медленно прогрессирует — переход от начальной стадии к инвалидности занимает от нескольких лет до нескольких десятилетий. Остеоартроз коленного сустава входит в 5-ку самых распространенных причин инвалидности и утраты трудоспособности по всему миру.
Артрозу колена (гонартрозу) подвержено свыше 20% людей старше 55 лет, однако болезнь стремительно молодеет — все чаще ее симптомы проявляются в возрасте уже 25 лет.

Вовремя начатое лечение артроза коленного сустава поможет избежать осложнений и разрушения хрящевой ткани.
Признаки артроза коленного сустава
Износ суставного хряща сопровождается характерными признаками, интенсивность которых зависит от стадии заболевания. Чаще всего больные жалуются на:
- утреннюю скованность и уменьшение подвижности в суставе (по пробуждении требуется разминка);
- боль и дискомфорт в коленях, которые усиливаются после физических нагрузок (длительной ходьбы, бега или стояния) и идут на спад при отдыхе;
- на 2-й стадии — т.н. стартовые боли, которые возникают после длительного пребывания в одной позе;
- повышенную утомляемость, которую часто списывают на возрастные изменения;
- сухой грубый хруст, который регулярно повторяется при сгибании-разгибании коленей;
- отеки и другие симптомы воспаления, которые появляются на 2-й стадии заболевания из-за травматизации околосуставных тканей;
- метеочувствительность, усиление симптомов в холодное время года.
При попытках согнуть пораженное гонартрозом колено до упора возникает резкая боль и чувство физического препятствия. На поздних этапах даже при наличии лечения артроза коленного сустава у больных нарушается походка (становится ковыляющей, пациенты ходят на негнущихся ногах), появляется деформация нижних конечностей в форме букв “О” или “Х”.
Коварство болезни заключается в том, что она может протекать в скрытой форме годами, а первые значительные симптомы часто появляются лишь на 2-й стадии — когда полное восстановление синовиального хряща уже невозможно.
Поэтому важно обращаться к врачу при первых признаках дискомфорта в коленях — например, слабых, как бы тянущих болях, которые возникают при недостаточной выработке синовиальной жидкости. Запомните: боль в коленях не является нормой вне зависимости от возраста. Своевременное обследование же и лечение артроза коленного сустава 1 степени может полностью оградить вас от мучительных болей в суставах в преклонном возрасте.
Что будет, если не лечить артроз колена?
При самолечении, несоблюдении рекомендаций врача или отсутствии лечения остеоартроз коленного сустава прогрессирует в среднем в 3-8 раз быстрее, чем при комплексной терапии. Если гонартроз протекает агрессивно, утратить способность нормального передвигаться больной может еще до наступления пенсионного возраста.
Особенно важно эффективное лечение артроза коленей в стадии обострения. Спровоцировать ее может сырая холодная погода, физический или эмоциональный стресс, аллергия, отравление, переезд в регион с другим климатом — словом, любая встряска для организма. Обострение артроза протекает с разрушением большого количества хондроцитов. В ответ на это организм вырабатывает ферменты, которые призваны переработать и удалить мертвые клетки. Однако, если их концентрация слишком высока, страдают и здоровые участки хряща — клеточные мембраны истончаются, на синовиальной выстилке сустава появляются очаги эрозии. Этот процесс, если его не остановить при помощи лечения артроза колена препаратами, может протекать в течение нескольких недель, а при хроническом стрессе, недосыпании или недостаточном рационе — постоянно.
В конечном итоге без лечения остеоартроз колена приводит к полному сокращению просвета суставной щели из-за разрастания остеофитов. Зазор, необходимый для нормального движения, смыкается, и больной не может согнуть ногу даже на 30-45°. Трудность представляет не только подъем по лестнице, но и попытка встать с дивана или обычное передвижение. Это состояние сопровождается болями, от которых не помогают обычные анальгетики. В подобных случаях остается один вариант лечения артроза коленного сустава — хирургический, с полной заменой суставной архитектуры на протез и последующей длительной реабилитацией. Но и в этом случае большинству больных не удается вернуться к полностью нормальной жизни.
Лечение остеоартроза коленного сустава
В зависимости от стадии болезни и состояния сустава применяется консервативное или хирургическое лечение артроза коленного сустава.
Лечение артроза коленного сустава 1 степени всегда проводится консервативными методами — при успешном стечении обстоятельств и хорошей самодисциплине пациента можно добиться ухода болезни или стойкой ремиссии.
Лечение артроза коленного сустава 2 степени, как правило, строится на применении всех способов консервативного воздействия, однако врач может принять решение о незначительных оперативных вмешательствах в сустав, если болезнь развивается агрессивно или с осложнениями.
Лечение артроза коленного сустава 3 степени почти всегда подразумевает операцию.
Комплексное консервативное лечение артроза коленного сустава подразумевает снятие боли и воспаления, восстановление хрящевой ткани, увеличение объема движений в суставе. Для этого больному назначают ортопедический режим нагрузок и отдыха, лекарственные препараты системного и местного действия (гормональные и негормональные противовоспалительные, анальгетики, хондропротекторы и другие). Получают распространение и инновационные биологические методы — уколы препаратов для лечения артроза коленного сустава непосредственно в суставную сумку. При это используются PRP-инъекции (плазма крови, обогащенная тромбоцитами), а также инъекции стволовых клеток, полученных из собственной жировой ткани пациента. Параллельно подключают вспомогательные и реабилитационные методики — физиотерапию, массаж, мануальную терапию, лечебную гимнастику.
Хирургическое лечение остеоартроза коленного сустава проводится в тех случаях, когда медикаменты оказываются бессильны. При этой патологии врач может назначить следующие вмешательства:
- Артроскопия коленного сустава. Собирательное название для группы малоинвазивных операций, направленных на удаление отколовшегося участка суставной ткани или остеофита, или частичного иссечения суставной оболочки. Она позволяет отсрочить или исключить протезирование, а также устранить дискомфорт на ранних стадиях болезни. Используется преимущественно для лечения артроза колена у пациентов моложе 60 лет.
- Остеотомия. Операция по урезанию части кости и коррекции оси нагрузки на больное колено, которая позволяет замедлить дегенеративные изменения. Обычно проводится при лечении артроза коленного сустава 2 степени.
- Эндопротезирование. Частичная или полная замена коленного сустава на титановый имплант, который служит 15-20 лет. Эта методика является крайней мерой, поскольку несет определенные риски. Рекомендована для пациентов старше 55 лет.
Все эти операции требуют восстановительного периода и имеют ряд противопоказаний, поэтому лучшим вариантом остается профилактика (ЛФК, хондропротекторы) и лечение артроза коленного сустава на ранних стадиях.
Помимо основных лечебных методик используется диетотерапия и другие способы снижения массы тела. Чтобы разгрузить больной сустав, используются бандажи и дргие ортезы (трости для ходьбы, ортопедические стельки и прочее).
Лечение артроза колена назначает врач-ревматолог или ортопед. На первом приеме он пальпирует сустав, делает двигательные тесты, после чего направляет пациента на томографию или рентгенографию.
Лечебная гимнастика при артрозе колена
Лечебная физкультура для конечностей нижнего пояса считается самым эффективным методом снижения болевого синдрома и лечения артроза коленного сустава 1 степени. Первые результаты от лечебной гимнастики наступают спустя 2-4 недели непрерывных занятий. Непрерывность в лечении артроза коленного сустава является одним из главных факторов, которые влияют на эффективность ЛФК. Полноценное занятие проводится 1 раз в день ежедневно, также рекомендовано делать как минимум 3-4 разминки в течение дня.

Лечебная гимнастика при артрозе колена в периоды ремиссий поможет снять болевой синдром.
Главная задача физических упражнений при лечении остеоартроза коленного сустава заключается в укреплении мышц бедра и голени, поддержании эластичности связок и сухожилий, а также борьбе с атрофией мышц, которая характерна для артрозов. Это позволяет перенести нагрузку с сустава на околосуставные структуры — и, тем самым, замедлить механическое истирание хряща, уменьшить воспаление.
Упражнения для лечения артроза колена выполняются для обеих ног! При появлении резкой боли занятие следует прекратить или продолжить в более щадящем темпе.
- Исходное положение — лежа на спине. Одна нога вытянута на полу, другая поднята согнута на 90° (голень параллельна полу). Выполняем движения голенью вверх-вниз, насколько позволяет амплитуда движений в суставе.
- Исходное положение — лежа на спине. Выполняем упражнение “велосипед”.
- Исходное положение — лежа на животе. По очереди болтаем ногами, стараясь привести пятки как можно ближе к ягодицам.
- Исходное положение — лежа на боку, рука согнута под головой или вытянута над головой по одной линии с телом. Другая рука упирается в бок. Делаем махи вверх прямой ногой. Меняем сторону.
- Исходное положение — лежа на спине. Тянем ноги по полу вперед пяткой (от себя), носки смотрят “на себя”.
- Исходное положение — лежа на животе. Делаем упражнение “лодочка”. Если физическая подготовка не позволяет, кладем ладони по обе стороны от груди и по очереди отводим ноги назад, испытывая напряжение в задней поверхности бедра и голени.
- Исходное положение — лежа на спине. Поочередно вращаем стопами, стараясь описать носками максимально полный круг.
- Исходное положение — стоя у стены. Медленно и плавно приседаем, не отрываясь спиной от стены, чтобы распределить нагрузку. Когда ноги согнуты в коленях на 90°, начинаем плавное движение вверх.
- Исходное положение — стоя. Поочередно делаем махи ногами вперед, назад и вбок.
Обратите внимание: лечебная гимнастика после операций на суставе имеет свою специфику и меняется в зависимость от того, сколько дней прошло со времени оперативного вмешательства. Ее назначает врач — хирург или реабилитолог.
Массаж при артрозе колена
Лечебный массаж при артрозе колена проводится на обе ноги. На первых порах стандартно требуется не менее 10-12 сеансов у массажиста-реабилитолога или при помощи оборудования для гидромассажа, однако простой общеукрепляющий массаж можно выполнять и в домашних условиях. Он включает следующие виды движений:
- поверхностные поглаживания и растирания (вверх-вниз, по и против часовой стрелки);
- прощупывание и растягивание кончиками пальцев более глубоких тканей;
- пощипывание и постукивание по коже.

Массаж при артрозе колена должен делаться специалистом, который не навредит больному суставу
Самомассаж можно сочетать с лечением артроза коленного сустава препаратами: не лишним будет нанесение разогревающей мази или бальзама до или во время сеанса. Также перед процедурой можно принять теплую ванну.
Важно: массаж противопоказан больным с симптомами воспаления (остеоартрита или обострения артроза). В этом случае требуется терапия острой фазы.
Диетотерапия при артрозе
Стандартный протокол питания при лечении артрозе коленного сустава требует:
- ограничить продукты и блюда, богатые простыми углеводами (белый хлеб, кондитерские изделия, снеки, конфеты, картофель, сахар);
- исключить процессированные (готовые к употреблению) и богатые солью блюда — фастфуд, полуфабрикаты, колбасные изделия;
- отказаться от алкоголя, декофеинизированного кофе и жирного мяса.
Вместо этого следует включить в меню:
- блюда из пророщенных и цельнозерновых злаков;
- жирную рыбу северных морей и диетическое мясо птицы;
- хрящи (уши, нюшки, ноги и другие богатые коллагеном части сельхозживотных), холодцы и желе;
- богатые витаминами и антиоксидантами овощи и фрукты (в особенности, витаминами А, В12, С, Е);
- орехи и другие источники жирных омега-кислот и ценных минералов.

Диета при артрозе коленного сустава обеспечивает сбалансированное питание, которое способствует восстановлению хрящевой ткани.
Также рекомендовано лечение артроза коленного сустава препаратами — витаминно-минеральными комплексами (2 курса ежегодно).
Физиотерапия для лечения остеоартроза колена
Для эффективного лечения артроза коленей и усиления действия медикаментов используются следующие физиотерапевтические процедуры:
- магнитотерапия;
- лазерная терапия;
- УВЧ;
- ультразвуковая терапия;
- амплипульс;
- электрофорез (в т.ч. лекарственный — с анальгином, новокаином или химотрипсином);
- озокерит и парафиновые аппликации;
- термотерапия (криотерапия, индуктотермия);
- фонофорез (в частности, с гидрокортизоном);
- бальнеологическая терапия (серные, сероводородные ванны).
Иглорефлексотерапия в лечении артроза коленного сустава 2 степени, как правило, не применяется.
Перед посещением процедур необходимо проконсультироваться с лечащим врачом — многие виды физиотерапии противопоказаны при обострении болезни.
Лекарства для лечения артроза коленного сустава
Лечение артроза коленного сустава препаратами проводится симптоматически и с учетом индивидуальной реакции пациента на выбранные лекарства. Медикаментозная терапия — уколы, мази или таблетки для лечения артроза коленного сустава — обычно назначается курсами или по мере необходимости.

Для того, чтобы правильно подобрать лекарства для лечения артроза коленного сустава обратитесь к врачу, который после исследований подберет нужные медикаменты.
В лечении артроза коленного сустава препаратами существует несколько направлений: облегчение жизни пациента, улучшение питания хряща, регенерация хрящевой ткани, поддержание в норме мышечно-связочного аппарата.
Нестероидные противовоспалительные средства
Для снятия обострений НПВП в таблетках или капсулах принимают курсами (около 12 дней) или по необходимости, в зависимости от интенсивности болевого синдрома. Бесконтрольный прием НПВП с нарушением инструкции или рекомендаций врача чреват язвой желудка или кишечника. Следует крайне осторожно принимать их в сочетании с глюкокортикостероидами и препаратами, влияющими на свертываемость крови. Дополнительные факторы риска — возраст старше 65 лет, курение, прием алкоголя во время курса. В этих случаях врачи обычно рекомендуют инъекционное введение препаратов, минуя ЖКТ. Вместе с НПВС желательно принимать гастропротекторы (к примеру, омепразол).
К числу НПВС относятся: Артралол, Диклофенак, Кетонал, Мелоксикам, Целекоксиб, Ибупрофен, Нимесулид, Лорноксикам, Индометацин.
Максимального эффекта удается достичь при сочетании системных НПВП (для внутреннего приема) и наружных — в виде мазей, кремов или гелей. Второй вариант обеспечивает точечное воздействие на пораженный сустав и при этом минимально воздействует на пищеварение.
Для наружного применения выпускают: Фастум, Вольтарен, Репарил, Кетонал, Диклофенак, Никофлекс, Индометациновую мазь.
Кортикостериды (стероидные препараты для лечения артроза коленного сустава)
Гормональные средства (ГК) обычно используются для т.н. стероидной блокады колена в тех случаях, когда НПВС недостаточно, чтобы унять боль и воспаление.
Инъекции глюкокортикоидов считаются крайней мерой в лечении артроза коленного сустава лекарствами. Они обеспечивают облегчение уже спустя 20 минут после введения, но могут повлечь гормональные нарушения и повреждение хрящевой ткани при нарушении правил приема. Из-за побочных эффектов многие ортопеды предпочитают операцию на колене продолжительной терапии ГК.
Гормональные лекарства в лечении артроза коленного сустава представлены следующими препаратами: Гидрокортизон, Дипроспан, Преднизолон, Метилпреднизолон.
Хондропротекторы при лечении артроза коленного сустава
Хондропротективные средства на основе экстрактов из жил и хрящей крупного рогатого скота, морской рыбы и моллюсков способствуют восстановлению синовиального хряща, а потому незаменимы для эффективного лечения артроза коленей. Хондропротекторы содержат большое число гликозаминогликанов — природных полимеров, из которых и строится хрящевая ткань. Поэтому они делают хондроциты (хрящевые клетки) более устойчивыми, способствуют их росту, обогащают синовиальную жидкость.
В отличие от противовоспалительных средств, хондропротекторы практически не имеют противопоказаний. Они обеспечивают накопительный, пролонгированный эффект — первые улучшения наступают через 1-3 месяца приема, а продолжительность курса составляет 3-6 месяцев.
Наиболее перспективны в лечении артроза коленного сустава препаратами: Артракам
Кожно-раздражающие средства
Наружные препараты для лечения артроза колена с местнораздражающим эффектом улучшают кровообращение и питание сустава, а также отвлекают пациента от болевых ощущений. С этой целью применяются мази, гели, кремы и бальзамы на основе натуральных ингредиентов — пчелиного (Апизартрон, Живокост) или змеиного (Випросал, Кобратоксан, Наятокс) яда, экстракта жгучего перца (Капсаициновая мазь, Эспол).
При наличии аллергической реакции (стойкое покраснение и болезненность кожи, сыпь), во время беременности и лактации, а также при наличии других противопоказаний лучше избегать разогревающих мазей для лечения артроза коленного сустава и ограничиться теплыми ваннами, аппликациями и наружными противовоспалительными.
Протезы синовиальной жидкости
Если синовиальной жидкости в суставе слишком мало, нарушается скольжение суставных поверхностей. А главное — начинается голодание хряща, ведь суставная жидкость, которая напитывает его, как губку, в норме поставляет питательные вещества для роста и поддержания хрящевой ткани. Чтобы предотвратить клеточное разрушение и механическое истирание коленного хряща, врач может назначить инъекции высокомолекулярных производных гиалурона. Уколы препарата при лечении артроза коленного сустава (вискосуплементация) делаются непосредственно в суставную сумку, что приводит к быстрому облегчению, которое держится от 3 до 12 месяцев по завершении курса. Однако при введении протезов сохраняется риск некротических изменений или инфекции в суставе.
На отечественном рынке можно приобрести такие протезы синовиальной жидкости, как: Синвиск, Вископлюс, Дьюралан, Суплазин, Ферматрон, Рипарт, Остенил, Синокром и другие.
Спазмолитики, анальгетики, миорелаксанты
В случаях, когда спазмы и мышечное напряжение мешают пациенту уснуть, создают боль при движении, врач назначает спазмолитики и миорелаксанты. К их числу относятся: Cирдалуд, Баклофен, Мидокалм, Толперизон, Но-шпа и другие.
Простые анальгетики в лечении артроза коленного сустава не применяются, поскольку маскируют боль, но не снимают воспаление. Пользоваться ими или доступными НПВС (например, ибупрофеном) без назначения врача можно до 10 дней, после чего требуется обследование.
Форма выпуска препаратов для лечения артроза коленного сустава
Для удобства пациентов лекарства для лечения артроза коленного сустава выпускают в различных формах. Есть ли между ними разница и какую выбрать?
Препараты для лечения артроза колена имеют несколько форм выпуска: саше, уколы, мази, таблетки. Выберете то, что больше всего подходит именно вам.
Капсулы, саше и таблетки для лечения артроза коленного сустава
Нестероидные противовоспалительные средства, кортикостероиды, хондропротекторы и миорелаксанты выпускаются в формах для перорального приема. В этом случае их легко дозировать, прием возможен без участия медицинского работника, легко контролировать, какая часть курса уже пройдена. При приеме внутрь хондропротекторы и НПВС обладают достаточно высокой биодоступностью (особенно — в форме саше). При приеме Артракама (глюкозамин) в околосуставную область, ткани получают свыше 95% полезных веществ из препарата.
Растворы для инъекций
В виде уколов можно принимать уже упомянутые НПВС, ГК, хондропротекторы и миорелаксанты, а также протезы синовиальной жидкости. Этот способ лечения артроза коленного сустава препаратами демонстрирует максимальную биодоступность.
Этот способ лечения артроза колена препаратами безопасен для пищеварения, но желательно, чтобы уколы (внутривенно, внутримышечно в область сустава или внутрисуставно) ставил квалифицированный медперсонал. Внутримышечные уколы в ягодицу или бедро можно делать и самостоятельно.
Средства для наружного применения
Наружно применяются местнораздражающие, противовоспалительные и хондропротективные мази для лечения артроза коленного сустава. Преимущество такого приема препаратов заключается в прямом воздействии на пораженные ткани. Но на пути действующих веществ встает барьер кожи — увы, зачастую лишь 5% активных ингредиентов достигает нужных слоев тканей.
Надеемся, что смогли помочь. Уверенной Вам походки!
Images designed by Freepik
ВАЖНО!
СТАТЬЯ НОСИТ ОЗНАКОМИТЕЛЬНЫЙ ХАРАКТЕР. НЕОБХОДИМА КОНСУЛЬТАЦИЯ СО СПЕЦИАЛИСТОМ.
Календулы настойка (Calendulae tinctura) инструкция по применению
📜 Инструкция по применению Календулы настойка
💊 Состав препарата Календулы настойка
✅ Применение препарата Календулы настойка
📅 Условия хранения Календулы настойка
⏳ Срок годности Календулы настойка
Описание лекарственного препарата
Календулы настойка
(Calendulae tinctura)
Основано на официально утвержденной инструкции по применению препарата и подготовлено для электронного издания справочника Видаль 2014 года, дата обновления: 2021.10.25
Владелец регистрационного удостоверения:
Код ATX:
V03AX
(Прочие лечебные средства)
Лекарственная форма
| Календулы настойка |
Настойка (10 г/100 мл): фл. 25 мл, 40 мл, 50 мл или 100 мл рег. №: ЛП-000408 |
Форма выпуска, упаковка и состав
препарата Календулы настойка
Экстрагент: этанол 70%.
25 мл — флаконы темного стекла (1) — пачки картонные.
40 мл — флаконы темного стекла (1) — пачки картонные.
50 мл — флаконы темного стекла (1) — пачки картонные.
100 мл — флаконы темного стекла (1) — пачки картонные.
Фармакологическое действие
Настойка календулы оказывает антисептическое, желчегонное, спазмолитическое и местное противовоспалительное действие.
Показания препарата
Календулы настойка
Применяют наружно как антисептическое и противовоспалительное средство при порезах, ушибах, экземах; местно — для полоскания при воспалительных заболеваниях горла (тонзиллит, фарингит, ларингит) и слизистой оболочки полости рта (стоматит, гингивит, пародонтит).
Внутрь настойку календулы применяют при холецистите, холангите.
Режим дозирования
Наружно, местно, внутрь. Участки с поверхностными повреждениями кожных покровов (порезы) обрабатывают настойкой с помощью тампона. При ушибах и экземе применяют водный раствор настойки (1 чайную ложку на стакан воды) в виде примочек. Для полоскания горла и слизистой оболочки полости рта используют 1/4-1 стакан водного раствора настойки. Курс лечения — 1-2 недели.
Внутрь за 15 мин до еды применяют по 10-20 капель, разведенных в 1/4 стакана воды, 3 раза в день. Курс лечения — 3-4 недели.
Побочное действие
Возможны аллергические реакции (в т.ч. кожный зуд). При приеме внутрь — изжога, тошнота, горечь во рту, боль в животе.
Противопоказания к применению
Повышенная индивидуальная чувствительность к компонентам препарата. При применении внутрь — острый гастрит, язвенная болезнь желудка и двенадцатиперстной кишки в период обострения, калькулезный холецистит, беременность, период лактации, возраст до 18 лет.
С осторожностью. Заболевания печени, алкоголизм, черепно-мозговая травма, заболевания головного мозга.
Особые указания
Содержание абсолютного спирта в максимальной разовой дозе препарата составляет 0.23 г, в максимальной суточной дозе – 0.7 г.
В период применения препарата необходимо соблюдать осторожность при потенциально опасных видах деятельности, требующих особого внимания и быстрых реакций (управление автотранспортом, работа с движущимися механизмами, работа диспетчера и оператора и т.п.).
Условия хранения препарата Календулы настойка
В защищенном от света месте при температуре от 15 до 25°С. Хранить в недоступном для детей месте.
Срок годности препарата Календулы настойка
Срок годности — 4 года. Не применять по истечении срока годности.
Условия реализации
Препарат разрешен к применению в качестве средства безрецептурного отпуска.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Аналоги препарата
Календулы настойка
(ЯРОСЛАВСКАЯ ФАРМАЦЕВТИЧЕСКАЯ ФАБРИКА, Россия)
Календулы настойка
(КИРОВСКАЯ ФАРМАЦЕВТИЧЕСКАЯ ФАБРИКА, Россия)
Календулы настойка
(РОСТОВСКАЯ ФАРМФАБРИКА, Россия)
Календулы настойка
(РОСБИО, Россия)
Календулы настойка
(ЭКОЛАБ, Россия)
Календулы настойка
(МОСКОВСКАЯ ФАРМАЦЕВТИЧЕСКАЯ ФАБРИКА, Россия)
Календулы настойка
(КАМЕЛИЯ НПП, Россия)
Календулы настойка
(ВАТХЭМ-ФАРМАЦИЯ, Россия)
Календулы настойка
(ТВЕРСКАЯ ФАРМАЦЕВТИЧЕСКАЯ ФАБРИКА, Россия)
Календулы настойка
(ДАЛЬХИМФАРМ, Россия)
Все аналоги