Острая почечная недостаточность (острое почечное повреждение)
Версия: Клинические протоколы МЗ РК — 2019 (Казахстан)
Категории МКБ:
Острая почечная недостаточность (N17), Подготовительные процедуры для проведения диализа (Z49.0), Экстракорпоральный диализ (Z49.1)
Разделы медицины:
Нефрология
Общая информация
Краткое описание
Одобрен
Объединенной комиссией по качеству медицинских услуг
Министерства здравоохранения Республики Казахстан
от «24» июня 2021 года
Протокол №141
Острое повреждение почек – синдром, который развивается вследствие быстрого (часы-дни) снижения скорости клубочковой фильтрации, приводящей к накоплению азотистых (включая мочевину, креатинин) и неазотистых продуктов метаболизма (с нарушением уровня электролитов, кислотно-щелочного равновесия, объема жидкости), экскретируемых почками. Контраст-индуцированное острое повреждение почек (контраст -индуцированная нефропатия) – ятрогенное острое повреждение почек (ОПП), возникающее после внутрисосудистого введения йодсодержащего рентген-контрастного препарата, при исключении других альтернативных причин [1].
КЛИНИЧЕСКИЙ ПРОТОКОЛ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
ОСТРАЯ ПОЧЕЧНАЯ НЕДОСТАТОЧНОСТЬ (ОСТРОЕ ПОВРЕЖДЕНИЕ ПОЧЕК)
ВВОДНАЯ ЧАСТЬ
Код(ы) МКБ-10:
| Код | Название |
| N17 | Острая почечная недостаточность (включено острое повреждение почек) |
| N17.0 |
Острая почечная недостаточность с тубулярным некрозом Тубулярный некроз: без дополнительного уточнения; острый почечный. |
| N17.1 |
Острая почечная недостаточность с острым кортикальным некрозом Кортикальный некроз: БДУ; острый; почечный. |
| N17.2 |
Острая почечная недостаточность с медуллярным некрозом Медуллярный (папиллярный) некроз: БДУ; острый; почечный |
| N17.8 | Другая острая почечная недостаточность |
| N17.9 | Острая почечная недостаточность неуточненная |
| Z49.0 | Подготовительные процедуры для проведения диализа |
| Z49.1 | Экстракорпоральный диализ Диализ (почечный) БДУ |
Дата разработки/пересмотра протокола: 2014 год (пересмотр 14.03.2020 г.)
Сокращения, используемые в протоколе:
| AKIN | – | Acute Kidney Injury Network – группа по изучению острого почечного повреждения |
| ANCA | – | антинейтрофильные антитела |
| LVAD | – | Left Ventricular Assist Device |
| MDRD | – | Modification Diet of Renal Disease |
| RIFLE | – | риск, повреждение, недостаточность, утрата, тХПН |
| RVAD | – | Right Ventricular Assist Device |
| sCr | – | креатинин сыворотки |
| АDQI | – | инициатива по улучшению качества острого диализа |
| АNА | – | антинуклеарные антитела |
| АД | – | артериальное давление |
| БДУ | – | без дополнительного уточнения |
| БРА-II | – | блокаторы рецептора ангиотензина-II |
| ГРС | – | гепаторенальный синдром |
| ГУС | – | гемолитико-уремический синдром |
| ЖКК | – | желудочно-кишечное кровотечение |
| ЗПТ | – | заместительная почечная терапия |
| И-АПФ | – | ингибиторы ангиотензин-превращающего фермента |
| ИВЛ | – | искусственная вентиляция легких |
| ИГД | – | интермиттируюший (периодический) гемодиализ |
| КИ– ОПП | – | контраст — индуциованное ОПП |
| КЩС | – | кислотно-щелочное состояние |
| НПВП | – | нестероидные противовоспалительные препараты |
| ОИТ | – | отделение интенсивной терапии |
| ОПН | – | острая почечная недостаточность |
| ОПП | – | острое повреждение почек |
| ОТИН | – | острый тубулоинтерстициальный нефрит |
| ОТН | – | острый тубулярный некроз |
| ОЦК | – | объем циркулирующий крови |
| ПВВГД | – | продолженный вено-венозный гемодиализ |
| ПВВГДФ | – | продолженная вено-венозная гемодиафильтрация |
| ПГФ | – | продолженная вено-венозная гемофильтрация |
| ПЗПТ | – | продолженная заместительная почечная терапия |
| СКФ | – | скорость клубочковой фильтрации |
| ТХПН | – | терминальная хроническая почечная недостаточность |
| ХБП | – | хроническая болезнь почек |
| ХПН | – | хроническая почечная недостаточность |
| ЦВД | – | центральное венозное давление |
| ЭКМО | – | экстракорпоральная мембранная оксигенация |
Пользователи протокола: врач общей практики, терапевт, нефролог, анестезиолог-реаниматолог, токсиколог, уролог, акушер-гинеколог, инфекционист.
Категория пациентов: взрослые и беременные женщины.
Шкала уровня доказательности:
| А | Высококачественный мета-анализ, систематический обзор рандомизированных клинических исследований (РКИ) или крупное РКИ с очень низкой вероятностью (++) систематической ошибки результаты которых могут быть распространены на соответствующую популяцию. |
| В | Высококачественный (++) систематический обзор когортных или исследований случай-контроль или Высококачественное (++) когортное или исследований случай-контроль с очень низким риском систематической ошибки или РКИ с невысоким (+) риском систематической ошибки, результаты которых могут быть распространены на соответствующую популяцию. |
| С | Когортное или исследование случай-контроль или контролируемое исследование без рандомизации с невысоким риском систематической ошибки (+). результаты которых могут быть распространены на соответствующую популяцию или РКИ с очень низким или невысоким риском систематической ошибки (++ или +), результаты которых не могут быть непосредственно распространены на соответствующую популяцию. |
| D | Описание серии случаев или неконтролируемое исследование или мнение экспертов |
| GPP | Наилучшая клиническая практика. |
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Классификация [2,3]:
Причины и классификации ОПП:
По основному механизму развития ОПП разделяется на 3 группы:
- преренальное;
- ренальное;
- постренальное.
Рисунок 1. Классификация основных причин ОПП
Преренальные причины:
Рисунок 2. Причины преренального острого почечного повреждения
Морфологическая классификация основана на характере морфологических изменений и локализации процесса:
- острый тубулярный некроз;
- острый кортикальный некроз;
- острый тубулоинтерстициальный нефрит.
В зависимости от величины диуреза выделяют 2 формы ОПП:
- олигурическую (диурез менее 500 мл/сут);
- неолигурическую (диурез более 500 мл/сут).
Дополнительно различают:
- некатаболическая форма (ежесуточный прирост мочевины крови менее 3,33 ммоль/л);
- гиперкатаболическая форма (ежесуточный прирост мочевины крови более 3,33 ммоль/л).
NB! При подозрении на ОПН/ОПП, в случаях отсутствия информации об исходном состоянии функции почек, уровень креатинина на момент осмотра, соотнесенный к возрасту и полу пациента, рассчитывается при заданном уровне СКФ (75 мл/мин) по формуле MDRD с использованием предложенной экспертами ADQI (таб.1) [2].
Расчетный базальный креатинин (ADQI с сокращением) — таблица 1
| Возраст, лет | Мужчины, мкмоль/л | Женщины, мкмоль/л |
| 20-24 | 115 | 88 |
| 25-29 | 106 | 88 |
| 30-39 | 106 | 80 |
| 40-54 | 97 | 80 |
| 55-65 | 97 | 71 |
| Старше 65 | 88 | 71 |
Классификация ОПП по классам RIFLE (R – risk, I – injury, F – failure, L- lost function, E – End Stage Renal Disease) — таблица 2
| Классы | Критерии по клубочковой фильтрации | Критерии по диурезу |
| Риск – R | ↑Scr* в 1,5 раза или ↓ КФ** на 25% | <0,5 мл/кг/час ≥6 часов |
| Повреждение- I | ↑Scr в 2 раза или ↓ КФ на 50% | <0,5 мл/кг/час ≥12 часов |
| Недостаточность – F | ↑Scr в 3 раза или ↓ КФ на75% или Scr≥354 мкмоль/л с нарастанием не менее 44,2 мкмоль/л | <0,3 мл/кг/час ≥24 часов или анурия ≥12 часов |
| Потеря почечной функции – L | Стойкая ОПП; полная потеря почечной функции >4 недель | |
| Терминальная почечная недостаточность — E | ТХПН>3мес |
Scr*- креатинин сыворотки крови, КФ**- клубочковая фильтрация
Таблица 3. Стадии ОПП (KDIGO, 2012)
| Стадии | Креатинин плазмы | Объем выделяющий мочи |
| 1 | В 1,5-1,9 раза выше исходного или повышение на 0,3мг/дл (≥26,5мкмоль/л). | <0,5 мл/кг/час за 6-12 часов |
| 2 | В 2,0-2,9 раза выше исходного. | <0,5 мл/кг/час за ≥ 12 часов |
| 3 |
В 3,0 раза выше исходного или повышение до ≥4,0мг/дл (≤353,6 мкмоль/л) или начало ЗПТ или у пациентов <18лет, снижение расчетной СКФ до <35 мл/мин/1,73м2. |
<0,3 мл/кг/час за ≥ 24 часа или анурия в течение ≥12 часов |
Диагностика
МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ [1]
Диагностические критерии:
Жалобы:
- олигоурия/анурия;
- периферические отеки;
- одышка;
- жажда;
- сухость во рту;
- слабость;
- тошнота, рвота;
- отсутствие аппетита.
Жалобы специфические – в зависимости от этиологии ОПП.
Анамнез:
- причины гиповолемии (кровотечение, диарея, сердечная недостаточность, операции, травмы, гемотрансфузии, гастроэнтерит, ГУС, особенно у детей);
- наличие системных заболеваний, болезней сосудов (возможен стеноз почечных артерий), эпизоды лихорадки, возможность постинфекционного гломерулонефрита;
- наличие артериальной гипертонии, сахарного диабета или злокачественных новообразований (вероятность гиперкальциемии);
- признаки постренальной обструкции, при заболеваниях предстательной железы у мужчин. Почечная колика при нефролитиазе;
- уточнить прием лекарственных средств (иАПФ, БРА-II, НПВП, аминогликозиды, введение рентгенконтрастных веществ). Выяснить контакт с токсическими, отравляющими веществами;
- симптомы повреждения мышц (боль, опухание мышц, повышение креатинкиназы, миоглобинурия в прошлом), наличие метаболических заболеваний могут указывать на рабдомиолиз;
- сведения о заболеваниях почек и артериальной гипертонии, и случаях повышения креатинина и мочевины в прошлом.
NB! Обратить внимание на:
- наличие нарушения функции почек: ОПП или ХБП?
- нарушение почечного кровотока – артериального или венозного;
- есть ли нарушения оттока мочи вследствие обструкции?
- заболевание почек в анамнезе, точный диагноз?
Физикальное обследование:
- оценка степени гидратации – жажда, сухость кожи, слизистых или наличие отеков, потеря или прибавка в весе, уровень ЦВД, одышка;
- цвет кожи, наличие высыпаний. Термометрия;
- оценка состояния ЦНС;
- оценка состояния легких (отек, хрипы, кровотечение и др.);
- оценка сердечно-сосудистой системы (гемодинамика, АД, пульс. Пульсация на крупных сосудах);
- осмотр глазного дна;
- гепатоспленомегалия, уменьшение размеров печени;
- увеличенные почки при поликистозах, увеличенный мочевой пузырь при опухолях, обструкции уретры;
- оценка диуреза (олигурия, анурия, полиурия, никтурия).
Начальный период: превалируют симптомы основного заболевания.
Период развития олигурии:
- олигурия (снижение суточного диуреза менее 400 мл при условии сохранения поступления жидкости в организм и обычном уровне экстраренальных потерь), анурия (полное отсутствие выделения мочи или ее уменьшение);
- периферические и полостные отеки;
- клинические проявления азотемии – анорексия, запах аммиака изо рта; уремический перикардит;
- быстро нарастающая гипонатриемия с тошнотой, судорогами с головной болью и дезориентацией является предвестником отека мозга;
- гиперкалиемия – судороги, жизнеугрожающие нарушения ритма сердца;
- острая надпочечниковая недостаточность – прогрессирующая мышечная слабость, адинамия, желудочно-кишечные нарушения – тошнота, рвоат, запор, сменяющийся анорексией, «бронзовая окраска кожи», артериальная гипотония; никтурия, гиперкалиемия, гипонатриемия, умеренный метаболический ацидоз и преренальная азотемия);
- метаболический ацидоз или тяжелый алкалоз;
- некардиогенный отек легких;
- респираторный дистресс-синдром взрослых;
- профузное желудочно-кишечное кровотечение (у 10-30% больных, вызвано ишемией слизистой оболочки, эрозивным гастритом, энтероколитом на фоне дисфункции тромбоцитов и ДВС- синдрома);
- умеренная анемия;
- активация условно-патогенной флоры (бактериальной или грибковой, на фоне уремического иммунодефицита развивается более чем у 50% больных с ренальной ОПП. Типично поражение легких, мочевых путей, характерны стоматит, паротит, инфицирование операционных ран);
- генерализованные инфекции с септицемией, инфекционным эндокардитом, перитонитом, кандидосепсисом.
Период восстановления диуреза:
- полиурия (5-8 литров в сутки);
- явления дегидратации;
- гипонатриемия;
- гипокалиемия (риск аритмии);
- гипокальциемия (риск тетании и бронхоспазма);
- нормализация (возможно сохраняющееся нарушение) азотовыделительной функции почек.
Лабораторные исследования:
ОАК: развернутый с подсчетом ретикулоцитов и тромбоцитов (повышение СОЭ, анемия, изменения в лейкоцитарной формуле).
ОАМ: протеинурия от умеренной 0,5 г/сут до тяжелой – более 3,0г/сутки, макро/микрогематурия, цилиндрурия, снижение относительной плотности мочи.
Биохимический анализ крови: креатинин сыворотки крови, мочевина сыворотки крови, калий, натрий, общий белок сыворотки крови и белковые фракции, АЛТ, АСТ, общий и прямой билирубин, СРБ (гиперкреатининемия, снижение СКФ, гиперкалиемия, гипонатриемия, гипокальциемия).
Коагулограмма: ПВ-МНО, АЧТВ, фибриноген (гипо- или гиперкоагуляция);
КЩС крови: ацидоз, снижение уровня бикарбонатов.
Инструментальные исследования:
ЭКГ: нарушения ритма и сердечной проводимости.
Рентгенография органов грудной клетки: скопление жидкости в плевральных полостях, отек легких.
Ангиография: для исключения сосудистых причин ОПП (стеноза почечной артерии, расслаивающей аневризмы брюшной аорты, восходящего тромбоза нижней полой вены).
УЗИ почек, брюшной полости: увеличение объема почек, наличие конкрементов в почечных лоханках или мочевыводящих путях, диагностика различных опухолей.
Компьютерная и магнитно-резонансная томография, с контрастированием по показаниям.
Биопсия почки по показаниям: используется при ОПП в сложных диагностических случаях, показана при ренальной ОПП неясной этиологии, ОПП с затянувшимся более 4 недель периодом анурии, ОПП, ассоциированной с нефротическим синдромом, острым нефритическим синдромом, диффузным поражением легких по типу некротизирующего васкулита.
Примечания:
- все ургентные поступления пациентов, планируемые рентген-контрастные исследования, а также операционные вмешательства, должны оцениваться на предмет риска развития ОПП;
- все ургентные поступления, должны сопровождаться анализом мочевины, креатинина и уровня электролитов;
- при ожидаемом развитии ОПП пациент должен быть осмотрен нефрологом в течение первых 12 часов, определены показания к ЗПТ, прогноз, а пациент должен быть направлен в многопрофильный стационар с наличием отдела экстракорпоральной гемокоррекции-диализа.
Показания для консультации специалистов:
- консультация ревматолога – при появлении новых симптомов или признаков системного заболевания;
- консультация гематолога – для исключения болезней крови;
- консультация токсиколога – в случае отравления;
- консультация реаниматолога – послеоперационные осложнения, ОПП, вследствие шока, неотложные состояния;
- консультация отоларинголога – для выявления очага инфекции с последующей санацией;
- консультация хирурга – при подозрении на хирургическую патологию;
- консультация уролога – при диагностике и лечении постренальной ОПП;
- консультация травматолога – при травмах;
- консультация акушер-гинеколога – у беременных; при подозрении на гинекологическую патологию, с целью выявления очагов инфекции, и их последующей санацией;
- консультация окулиста – для оценки изменений глазного дна;
- консультация кардиолога – в случае тяжелой артериальной гипертензии, нарушений со стороны ЭКГ;
- консультация невролога – при наличии неврологической симптоматики;
- консультация инфекциониста – при наличии вирусных гепатитов, зоонозных и др. инфекций;
- консультация психотерапевта – обязательная консультация пациентов в сознании, поскольку «привязанность» пациента к аппарату искусственной почки и боязнь «зависимости» от него, может негативно повлиять на психическое состояние больного, привести к сознательному отказу от лечения;
- консультация клинического фармаколога – для коррекции дозировки и комбинации лекарственных препаратов, с учетом клиренса креатинина, при назначении лекарственных средств с узким терапевтическим индексом.
Диагностический алгоритм: (схема)
Диагностический алгоритм согласно критериям RIFLE, KDIGO!
(см. таблицы 2,3).
Причины ложной олигурии, анурии
| Высокие экстраренальные потери | Уменьшение поступления жидкости в организм | Выход мочи через неестественные пути |
|
Жаркий климат Лихорадка Диарея Гастростома ИВЛ |
Психогенная олигодипсия Дефицит воды Опухоли пищевода Руминация Ахалазия пищевода Стриктуры пищевода Тошнота Ятрогенное |
Клоака (мочепузырно-прямокишечное соустье) Травмы мочевых путей Протекание мочи при нефростоме |
Дифференциальный диагноз
Дифференциальный диагноз и обоснование дополнительных исследований [1]:
| Исследование | Обоснование |
| биохимический анализ крови (белковые фракции, М-градиент, кальций общий и ионизированный, фосфор, липидные спектр) |
— исключить миеломную болезнь, — выявление нарушений фосфорно-кальциевого обмена в случае дифференцирования ОПП с ХБП, — для подтверждения ишемической болезни почек |
|
С-реактивный белок (количественный анализ); Прокальцитонин |
Определение сепсиса |
|
иммунологические анализы: ANA, ENA, a-DNA, ANCA, антифосфолипидные антитела, антитела к кардиолипиновому антигену, фракции комплемента С3, С4, СН50; ревматоидный фактор; |
Скрининг аутоиммунной патологии |
| свободный гемоглобин в крови и в моче; | Определение гемолиза |
| УЗДГ сосудов почек; | Исключить стеноз/окклюзию почечных артерий/вен |
|
УЗИ органов брюшной полости. |
Определение свободной жидкости в брюшной полости, исключение объемных образований, абдоминального компартмент – синдрома. |
Дифференциально-диагностические лабораторные признаки [1].
| Исследования | Характеристика | Причины ОПП |
| Мочи |
|
Гломерулярные болезни Васкулиты ТМА |
|
ОТИН | |
|
ОТИН Атероэмболическая болезнь |
|
|
Постренальные причины Острый ГН Травма |
|
|
Заболевания с пигментуриями, краш-синдром |
|
|
ОТН Острый ГН, васкулит |
|
| Кровь |
|
Кровотечение, гемолиз ХБП |
|
ГУС | |
|
Сепсис | |
| Биохимические исследования крови |
|
ОПП, ХБП |
|
Нефротический синдром, цирроз печени | |
|
Миеломная болезнь и др. парапротеинемии | |
|
Синдром лизиса опухоли | |
|
ГУС | |
|
Травмы и метаболические болезни | |
| Биохимические |
|
Преренальное и ренальное ОПП |
|
Множественная миелома | |
| Специфические иммунологические исследования |
|
СКВ |
|
Васкулит мелких сосудов | |
|
Анти-ГБМ-нефрит (синдром Гудпасчера) | |
|
Постстрептококковый ГН | |
|
Криоглобулинемия (эссенциальная или при разных заболеваниях) | |
|
АФС-синдром | |
|
СКВ, инфекционный эндокардит, шунт-нефрит | |
|
Постстрептококковый ГН | |
|
Эссенциальная смешанная криоглобулинемия | |
|
МПГН II типа | |
|
Сепсис | |
| Исследование мочи |
|
Ранняя диагностика ОПП |
Дифференциальная диагностика острой ишурии и анурии
| Критерии | Острая ишурия | Анурия |
| Пол | Чаще мужчины | Мужчины и женщины в равной степени |
| Этиология | Конкремент уретры или шейки мочевого пузыря; операции на мочевом пузыре, уретре, предстательной железе, спином мозге, сахарный диабет, рассеянный склероз, травмы позвоночника, органов малого таза | Шок различной этиологии, заболевания почек воспалительного и иммунного характера, обструкция мочеточников, чашечно-лоханочной системы, чаще при мочекаменной болезни |
| Боли внизу живота | Есть всегда, различной интенсивности, чаще — тупые, ноющие | Не характерны |
| Частые болезненные позывы на мочеиспускание | характерны | Не характерны |
| Мочевой пузырь при пальпации | Больших размеров, плотной консистенции, чаще болезненный | Не пальпируется, область пальпации безболезненная |
| УЗИ мочевой системы | Гидронефроз, увеличенный мочевой пузырь; нередко – эхопозитивная тень (конкремент, опухоль, инородное тело) мочевого пузыря; иногда -патологические изменения предстательной железы; эхопозитивная тень (конкремент, опухоль, сгусток крови) у уретре | Нередко – синдром выделяющихся пирамид; признаки нефросклероза или увеличение размеров почек, чаще без гидронефротической трансформации (возможно при постренальной обструкции), мочевой пузырь пустой |
| Выделение мочи | Нет или небольшая порция | Нет или небольшая порция (до 200 мл/сутки) |
| ОАМ, если моча выделяется небольшой порцией | Анализ нормальный или эритроцитурия, лейкоцитурия, протеинурия (всегда легкая, реже – умеренная), глюкозурия (при СД) | Всегда эритроцитурия, цилиндрурия, протеинурия (умеренная или выраженная), часто –лейкоцитурия, редко возможна глюкозурия (признак канальцевой дисфункции или сахарного диабета) |
| Катетеризация мочевого пузыря | Не затруднена (при нервно-рефлекторной дисфункции); затруднена при инфравезикальной обструкции); по катетеру выделение мочи в большом объеме (более 400 мл) | Не затруднена, по катетеру выделения мочи не наблюдается или небольшой объем мочи(30-50 мл) |
| Креатинин, мочевина | Нормальные, иногда повышены | Повышены всегда |
Дифференциальный диагноз ОПП и ХБП [1].
| Признаки | ОПП | ХБП |
| Диурез | Олиго-, анурия →полиурия | Полиурия → Анурия |
| Моча | Обычная, кровянистая | Бесцветная |
| Артериальная гипертензия | В 30% случаев, без ГЛЖ и ретинопатии | в 95% случаев с ГЛЖ и ретинопатией |
| Периферические отеки | часто | Не характерны |
| Размер почек (УЗИ) | нормальный | Уменьшен |
| Прирост креатинина | Более 0,5 мг/дл/сут | 0,3-0,5 мг/дл/сут |
| Почечный анамнез | отсутствует | Часто многолетний |
Для подтверждения диагноза ОПП в первую очередь исключают ее постренальную форму. Для выявления обструкции мочевых путей на первом этапе обследования применяют УЗИ почек и мочевого пузыря. В стационаре для верификации обструкции используют хромоцистоскопию, цифровую внутривенную урографию, КТ и МРТ, антеградную пиелографию. Для диагностики окклюзии почечной артерии показаны УЗДГ, почечная рентген контрастная ангиография.
Дифференциальный диагноз ОПП, ОПП на ХБП и ХБП [1].
| Диагноз | Обоснование для дифференциальной диагностики | Обследования | Критерии исключения диагноза |
| ОПП |
Причинный фактор (шок, травма, сепсис, токсины и др.) Острый прирост креатинина >44 мкмоль/л. Снижение темпа почасового диуреза <0,5 мл/кг/час ≥6 часов Размеры почек по УЗИ – нормальные или увеличены |
Контроль почасового и суточного диуреза Креатинин, мочевина, калий УЗИ почек |
Длительный почечный анамнез, наличие нефросклероза |
| ХБП |
Наличие любых клинических маркеров повреждения почек, включая изменения состава мочи и крови, подтвержденных с интервалом не менее 3 мес. Любые маркеры необратимых структурных изменений органа, выявленные однократно при прижизненном морфологическом исследовании органа или при его визуализации. Снижение СКФ <60 мл/мин/1,73м2 в течение 3 и более мес, вне зависимости от наличия других признаков повреждения почек. Креатинин постепенно нарастает. АГ – часто, СД – часто. |
Контроль почасового и суточного диуреза Креатинин, мочевина, калий УЗИ почек |
Отсутствие причинного повреждающего фактора, Несоответствие критериям RIFLE |
| ОПП на ХБП |
Анамнез почечного заболевания длительный, Креатинин в крови до ОПП повышен. Креатинин в крови на фоне ОПП повышен, Полиурия почти всегда, Полиурия в анамнезе до ОПП длительная, АГ часто, СД вероятно, никтурия в анамнезе есть, Причинный фактор (шок, травма, сепсис и др) — да, Острый прирост креатинина >44 мкмоль/л — да, Размеры почек УЗИ- в норме или уменьшены. |
Контроль почасового и суточного диуреза Креатинин, мочевина, калий УЗИ почек |
Наличие причинного повреждающего фактора, Острое начало заболевания, наличие факторов риска и почечного анамнеза. Увеличенные почки по УЗИ. |
| Признаки | ОПП | ОПП на ХБП | ХБП |
| Анамнез почечного заболевания | Нет или короткий | Длительный | Длительный |
| Креатинин в крови до ОПП | Нормальный | Повышен | Повышен |
| Креатинин в крови на фоне ОПП | повышен | Значительно повышен | Повышен |
| Полиурия | Редко | нет | Почти всегда |
| Полиурия в анамнезе до ОПП | Нет | длительная | Длительная |
| АГ | Редко | Часто | Часто |
| СД | Редко | нередко | Нередко |
| Никтурия в анамнезе | Нет | есть | Есть |
| Вызывающий фактор (шок, травма..) | Часто | часто | Редко |
| Острый прирост креатинина >44 мкмоль/л | Всегда | всегда | Никогда |
| Размеры почек УЗИ | Нормальные или увеличены | Нормальные или уменьшены | Уменьшены |
Дифференциальная диагностика преренального и ренального ОПП [1].
| Показатели | ОПП | |
| преренальное | Ренальное | |
| Относительная плотность мочи | > 1020 | < 1010 |
| Осмолярность мочи (мосм/кг) | > 500 | < 350 |
| Отношение осмолярности мочи к осмолярности плазмы | > 1,5 | < 1,1 |
| Концентрация натрия мочи (ммольл) | < 20 | > 40 |
| Экскретируемая фракция Na (FENa)1 | < 1 | > 2 |
| Плазматическое мочевина/ креатининовое отношение | > 10 | < 15 |
| Отношение уровня мочевины мочи к мочевине плазмы | > 8 | < 3 |
| Отношение креатинина мочи к креатинин у плазмы | > 40 | < 20 |
| Индекс почечной недостаточности2 | < 1 | > 1 |
1* (Na+ мочи/ Na+ плазмы) / (креатинин мочи/креатинин плазмы) х 100
2* (Na+ мочи/ креатинин мочи) / (креатинин плазмы) х 100
Также необходимо исключить причины ложной олигурии, анурии.
|
Высокие экстраренальные потери |
Уменьшение поступления жидкости в организм | Выход мочи через неестественные пути |
|
Жаркий климат Лихорадка Диарея Гастростома ИВЛ |
Психогенная олигодипсия Дефицит воды Опухоли пищевода Руминация Ахалазия пищевода Стриктуры пищевода Тошнота ятрогенное |
Клоака (мочепузырно-прямокишечное соустье) Травмы мочевых путей Протекание мочи при нефростоме |
Лечение (амбулатория)
ТАКТИКА ЛЕЧЕНИЯНА АМБУЛАТОРНОМ УРОВНЕ:
- соблюдение режима (устранение переохлаждений, стрессов, физических перегрузок);
- соблюдение диеты;
- завершение лечения (санация очагов инфекции, антигипертензивная терапия) диспансерное наблюдение в течение 5 лет (в первый год – измерение АД ежеквартально, анализ крови, мочи, определение содержания креатинина сыворотки крови и расчет СКФ по креатинину – формула Кокрофта-Голта).
- При сохранении экстраренальных признаков более чем 1 месяц (артериальная гипертензия, отеки), выраженного мочевого синдрома или утяжелении их необходимо проведение биопсии почки.
- При сохранении/прогрессировании признаков нарушения функции почек (Стадии ОПП: Потеря почечной функции – L Терминальная почечная недостаточность — E) перевод на программную ЗПТ.
Лечение (стационар)
ТАКТИКА ЛЕЧЕНИЯ НА СТАЦИОНАРНОМ УРОВНЕ
Немедикаментозное лечение:
Режим: в зависимости от тяжести состояния пациента.
Диета: ограничение поваренной соли (главным образом, натрия) и жидкости (объём получаемой жидкости рассчитывают с учётом диуреза за предыдущий день + 300 мл) при достаточном калораже и содержании витаминов. При наличии отеков, особенно в период их нарастания, содержание поваренной соли в пище ограничивается до 0,2-0,3 г в сутки, содержание белка в суточном рационе ограничивается до 0,5-0,6 г/кг массы тела в основном за счет белков животного, происхождения.
При проведении нутритивной поддержки у больных с любой стадией ОПП рекомендуется обеспечивать потребление белка в пределах 0,8-1,2 г/кг/сут (2D) и калорий (с учетом введения, например, растворов глюкозы, жировых эмульсий) не ниже 20-30 ккал/кг (2С).
Однако, оптимальная потребность в белках у больных с ОПП не установлена. Избыточное поступление белка при ОПП может способствовать усугублению метаболического ацидоза и азотемии и, таким образом привести к необходимости проведения ЗПТ или потребовать увеличения дозы диализа. Таким образом, потребление белка более 2 г/кг/сут и менее 0,8 г/кг/сут нецелесообразно. Рекомендуется назначать 0,8- 1,0 г/кг/сут белка пациентам с ОПП без признаков гиперкатаболизма и/или не нуждающимся в ЗПТ; 1,0-1,5 г/кг/сут пациентам с ОПП, получающим ЗПТ. Нормализованная скорость катаболизма белков у пациентов с ОПП, получающих продленную ЗПТ составляет 1,4-1,8 г/кг/сут. [Fiaccadori E. и соавт. 2013]. Поэтому больным, получающим продленную ЗПТ или при наличии признаков гиперкатаболизма мы рекомендуем увеличить количество белка до 1,7 г/кг/сут (2D).
Медикаментозное лечение.
Медикаментозное лечение ОПП должно осуществляться в соответствии с этиологией ОПП. Специфической медикаментозной терапии ОПП не существует, возможна консервативная коррекция осложнений ОПП на начальном этапе развития болезни.
Цель лечения:
Коррекция осложнений ОПП, восстановление водовыделительной и азотовыделительной функции почек.
При необходимости проведения ЗПТ при ОПП, длительность диализной терапии зависит от восстановления водовыделительной и азотовыделительной функции почек. В случае отсутствия восстановления функции почек – перевод на амбулаторный диализ по месту жительства.
Лечение разделяют на:
- консервативное (этиологическое, патогенетическое, симптоматическое);
- хирургическое (урологическое, сосудистое);
- заместительная почечная терапия — диализные методы (ЗПТ).
Принципы лечения ОПП.
| Форма ОПП | Лечение | Методы лечения |
| Преренальная | Консервативное | Инфузионная и противошоковая терапия |
| Контраст-индуцированная нефропатия | Консервативное | Инфузионная терапия |
| БПГН, аллергический ОТИН | Консервативное | Иммуносупрессивная терапия, плазмаферез |
| Постренальная | Хирургическое (урологическое) | Устранение острой обструкции мочевых путей |
| Ишемическая болезнь почек (ИБП) | Хирургическое | Ангиопластика почечных артерий |
| ОКН, миоренальный синдром, ПОН | Диализное | Острый ГД, гемодиафильтрация (ГДФ), острый ПД |
- при гиперкалиемии: антагонист калия – кальция глюконат или хлорид 10% 20 мл в/в в течение 2-3 минут №1 (при отсутствии изменений на ЭКГ, повторное введение в той же дозе, при отсутствии эффекта – гемодиализ); а также — 20% глюкоза 500 мл + 40 МЕ инсулина растворимого человеческого короткого действия в/в кап 15-30 ЕД каждые 3 часа 1-3 суток, до нормализации уровня калия в крови;
- при ацидозе: натрия гидрокарбонат 4% вв кап. Расчет дозы по формуле: Х= ВЕ*вес (кг)*0,6, Натрия гидрокарбонат 8,4% вв кап. Расчет дозы по формуле: Х= ВЕ*0,3* вес (кг);
- 5% декстроза 500 мл вв кап до восполнения дефицита ОЦК;
- натрия хлорид 0,9% вв кап 500 мл или 10% 20 мл вв 1-2 раза в сутки -до восполнения дефицита ОЦК;
- фуросемид 40-80 мг в/в болюсно, затем по 5-20 мг/час в/через перфузор (200-400 мг), изменение скорости подачи под контролем почасового диуреза. При отсутствии эффекта – прекратить введение фуросемида! Ввиду анурии – начать проведение заместительной почечной терапии.
Перечень основных лекарственных средств (имеющих 100% вероятность применения):
| Фармако-терапевтическая группа | МНН | Показания | Способ применения | Уровень доказательности |
| Преренальное ОПП | ||||
| Растворы, влияющие на водно-электролитный баланс | 0,9% раствор хлорида натрия | Поддержание объема ОЦК при отсутствии геморрагического шока | в/в | 2В* |
|
Прочие ирригационные растворы (В05СХ01) |
Глюкоза, раствор для инфузий 5% | Поддержание объема ОЦК при отсутствии геморрагического шока | в/в | 2В* |
| Адренергетики и допаминомиметики | Норэпинефрин, эпинефрин, Допамин, добутамин | При сосудистом шоке в комбинации с кристаллоидными растворами | в/в | 1С* |
| Контраст-индуцированное ОПП | ||||
| Растворы, влияющие на водно-электролитный баланс | 0,9% раствор хлорида натрия | Восполнение объема ОЦК у пациентов с риском КИ-ОПП | в/в | 2В* |
| Муколитики (R05CB) | N-ацетилцистеин | У пациентов с риском КИ-ОПП в сочетании с в/в введением солевых растворов | Перорально | 2D* |
| Медикаментозное лечение осложнений ОПП | ||||
|
«Петлевые» диуретики (С03С) |
Фуросемид | Только для случаев перегрузки объемом при наличии ответа | в/в | 2С* |
| Препараты для лечения сахарного диабета (A10) | Инсулин короткого действия | В сочетании с раствором глюкозы для коррекции гиперкалиемии | в/в | 1В** |
| Селективные бета-2-адреномиметики | Сальбутамол | Коррекция гиперкалиемии | Впрыск через дозатор (спрей) | 1В** |
| Электролитные растворы (B05XA07) | Кальция хлорид /глюконат 10% | Коррекция гиперкалиемии | в/в | 4С** |
| Антиацидемическое средство | 4% бикарбонат натрия | Коррекция метаболического ацидоза | в/в | 4С** |
| Противоподагрическое средство, ксантиноксидазы ингибитор | Аллопуринол | Лечение и профилактика подагры и гиперурикемии различного генеза | Перорально | С |
*- Клинические Практические Рекомендации KDIGO по Острому Почечному Повреждению, 2012
**- Руководство «Хроническая болезнь почек» Российской Ассоциации Нефрологов, 2019
Перечень дополнительных лекарственных средств (менее 100% вероятности применения): нет.
Клинические Практические Рекомендации KDIGO по Острому Почечному Повреждению, 2012г.:
3.4.1: Мы рекомендуем не использовать диуретики для предотвращения развития ОПП. (IB)
3.5.1: Мы рекомендуем не использовать низкие дозы допамина для предотвращения или лечения ОПП. (1A)
3.5.2: Мы предлагаем не использовать фенолдопам для предотвращения или лечения ОПП. (2C)
3.5.3: Мы предлагаем не использовать предсердный натрийуретический пептид (ПНП) для предотвращения (2C) или лечения (2B) ОПП.
3.8.1: Мы предлагаем не использовать аминогликозиды для лечения инфекций, за исключением ситуаций, когда недоступны альтернативные менее нефротоксичные препараты. (2A)
3.8.3: Мы рекомендуем контролировать концентрацию аминогликозидов в плазме крови в тех случаях, когда используется многократное введение препаратов в течение более 24 часов. (1A)
3.8.4: Мы предлагаем контролировать концентрацию аминогликозидов в плазме крови в тех случаях, когда терапия этими препаратами с однократным введением в течение суток продолжается более чем 48 часов. (2C)
3.8.6: Мы предлагаем использовать амфотерицин В в виде липидного комплекса, а не стандартную форму этого препарата. (2А)
3.8.7: Мы рекомендуем при лечении системных микозов или паразитарных инфекций использовать азольные противогрибковые препараты и/или эхинокандиновые препараты, а не стандартный амфотерицин B, если при этом может быть достигнут сопоставимый терапевтический эффект. (1A)
3.9.2: Мы предлагаем не использовать N-ацетилцистеин (N-АЦ) для предотвращения развития ОПП у пациентов в критическом состоянии с гипотонией. (2D)
3.9.3: Мы рекомендуем не использовать N-АЦ перорально или внутривенно для предотвращения развития послеоперационного ОПП. (1A)
4.4.4: Мы рекомендуем не использовать теофиллин для предотвращения КИ-ОПП. (2C)
4.4.5: Мы рекомендуем не использовать фенолдопам для предотвращения КИ-ОПП. (IB)
Хирургическое вмешательство:
Гемодиализ для пациентов с ОПП:
- обеспечение временного сосудистого доступа;
- имплантация перитонеального катетера для острого диализа;
- устранение обструкции мочевыводящих путей при постренальном ОПП (относится к разделу урологии).
Показаниями для экстренного проведения внепочечного очищения крови у пациентов с ОПП являются:
- прогрессирующее ренальное ОПП с гиперкатаболизмом при стадии F (недостаточность) по RIFLE;
- олигурия (диурез <0,3 мл/кг/ч за 24 часа) или анурия в течение 12 часов и более и/или повышение креатинина сыворотки крови в 3 раза выше нормы (снижение СКФ более чем на 75% от исходной) и/или повышение мочевины крови более 30 ммоль/л;
- неконтролируемые гиперкалиемия (более 6,0 ммоль/л), гипернатриемия (более 150ммоль/л), гипонатриемия (менее 130ммоль/л);
- выраженная гипергидратация с развитием анасарки и/или отека легких, резистентная к диуретикам;
- метаболический ацидоз со снижением рН артериальной крови <7,2;
- уремический выпот в перикарде, плевре/ уремическая энцефалопатия.
Показаниями для проведения продолженных методик ЗПТ (ПВВГД, ПВВГФ, ПВВГДФ) являются:
ОПП:
- у беременных и рожениц, в том числе при развитии преэклампсии;
- у пациентов кардиохирургического и нейрохирургического профиля (ХСН III-IV стадия, сопровождающаяся тяжелой гипонатриемией, угроза отека мозга при неконтролируемой гипернатриемии);
- при сепсисе;
- при синдроме полиорганной недостаточности;
- ОПП на фоне высокого гиперкатаболизма (панкреатит, мезентериальный тромбоз и др.);
- объемная перегрузка, обеспечение инфузионной терапии;
- при остром респираторном дистресс синдроме;
- массивный рабдомиолиз, ожоговая болезнь;
- гиперосмолярные комы.
Показания к ПЗПТ подразделяются на 2 группы:
Ренальные:
- ОПП/ ПОН у больных с тяжелой кардиореспираторной недостаточностью (ОИМ, высокие дозы инотропной поддержки, рецидивирующий интерстициальный отек легких, острое легочное повреждение);
- ОПП/ПОН на фоне высокого гиперкатаболизма (сепсис, панкреатит, мезентериальный тромбоз и др.).
Внепочечные:
- объемная перегрузка, обеспечение инфузионной терапии;
- септический шок;
- ОРДС или риск ОРДС;
- тяжелый панкреатит;
- массивный рабдомиолиз, ожоговая болезнь;
- гиперосмолярные комы, преэклампсия беременных.
К относительным показаниям для проведения сеансов ЗПТ относятся резкое и прогрессирующее увеличение уровня азота мочевины и креатинина крови без очевидных признаков реконвалесценции, когда есть реальная угроза развития клинических проявлений уремической интоксикации.
Показаниями к проведению «почечной поддержки» методами ЗПТ являются: обеспечение полноценного питания и инфузионной терапии при олигоанурии, удаление жидкости при застойной сердечной недостаточности, и поддержание адекватного гидробаланса у пациента с полиорганной недостаточностью.
По продолжительности терапии существуют следующие виды ЗПТ:
интермитирующие (прерывистые) методики ЗПТ продолжительностью не более 8 часов с перерывом больше, чем длительность очередного сеанса (в среднем 4 часа) (см. МЭТ гемодиализ стационарный)
продленные методы ЗПТ (ПЗПТ), предназначенные для замещения функции почек в течение длительного времени (24 часов и более).
Методы ЗПТ:
Гемодиализ интермиттирующий,
Гемодиализ продленный:
- медленный низкопоточный гемодиализ (МНГД) (slow low effective dialysis — SLED) при лечении ОПП — возможность контроля гидробаланса пациента без колебаний гемодинамики за более короткий промежуток времени (6-8 ч — 16-24 ч);
- продленная вено-венозная гемофильтрация (ПГФ);
- продленная вено-венозная гемодиафильтрация (ПВВГДФ).
По рекомендациям KDIGO (2012 г.) при ПЗПТ предлагают использовать в отличие от ИГД регионарную антикоагуляцию цитратом вместо гепарина, при отсутствии противопоказаний к цитрату (класс доказательности 2С). Этот тип антикоагуляции очень полезен у пациентов с гепарин индуцированной тромбоцитопенией и/или с высоким риском кровотечения (ДВС синдром, коагулопатии), когда системная антикоагуляция абсолютно противопоказана.
Один из критериев смены расходного материала (в частности гемофильтра/ гемодиализатора) – уровень трансмембранного давления более 250 мм.рт.ст. в течение более 5 минут.
Продолженная вено-венозная гемофильтрация (ПГФ) представляет собой экстракорпоральный контур с насосом крови, высокопоточным или высокопористым диализатором и замещающей жидкостью.
Продолженная вено-венозная гемодиафильтрация (ПВВГДФ) – экстракорпоральный контур с насосом крови, высокопоточным или высокопористым диализатором, а также с замещающей и диализирующей жидкостями.
По последним данным рекомендуется использовать бикарбонат (не лактат) в качестве буфера в диализате и замещающей жидкости для ЗПТ у пациентов с ОПП, особенно у пациентов с ОПП и циркуляторным шоком, также с печеночной недостаточностью и/или лактат ацидозом.
KDIGO рекомендует у пациентов с ОПП при интермиттирующих или продленных режимах ЗПТ обеспеченную дозу kt/v – 3,9 в неделю (класс доказательности 1А), обеспеченный объем эффлюента 25 – 35 мл/кг/час (класс доказательности 1А), т.е. больший расчетный объем эффлюента.
Оптимальный уровень скорости ультрафильтрации – не более 13 мл/кг/час, ввиду снижения риска кардиоваскулярных событий (Fly the et al kidney international, 2011).
Абсолютные противопоказания к проведению процедур ЗПТ – нет.
Относительные противопоказания к проведению процедур ЗПТ:
- геморрагический синдром любого происхождения;
- выраженная сердечно-сосудистая или полиорганная недостаточность;
- нарушения психического состояния пациента.
Дальнейшее ведение:
Пациенты с ОПП должны наблюдаться в течение 3 месяцев на предмет оценки степени восстановления функции почек, повторного эпизода ОПП или ухудшения течения имевшей место прежде ХБП [KDIGO (2012)].
Если у больного имеется ХБП, то его лечение должно осуществляться в соответствии с Практическими рекомендациями KDOQI по ведению ХБП.
Если у больного нет ХБП, следует иметь в виду, что у такого пациента повышен риск развития ХБП, и его следует вести в соответствии с Практическими рекомендациями KDOQI».
Пациенты с риском развития ОПП должны наблюдаться с тщательным контролем креатинина и объема мочи. Больных рекомендуется разделить на группы в соответствии со степенью риска развития ОПП. Ведение их зависит от предрасполагающих факторов. В первую очередь пациенты должны обследоваться для выявления обратимых причин ОПП, что позволит незамедлительно устранить эти факторы (например, постренальные).
Стабилизация состояния, отмена вазопрессоров, стабилизация уровня мочевины, креатинина, кислото-основного и водно-электролитного балансов.
При сохраняющейся анурии, отеках, умеренной азотемии, перевод в стационар областного или городского уровня, с присутствием в клинике аппарата искусственной почки (не только простых диализных аппаратов, но и аппаратов для продленной заместительной терапии с функцией гемофильтрации, гемодиафильтрации).
Наблюдение и режимы ЗПТ у больных с ОПП должно проводиться отдельно от пациентов с ТХПН (ХБП 5 стадия), находящихся на программном диализе.
Также необходимо ежедневное наблюдение за суточным гидробалансом, показателями уремии, электролитами, проведение ЗПТ, а также выбор метода ЗПТ – проводить индивидуально, согласно состоянию пациента, основной и сопутствующей патологии.
Амбулаторное наблюдение нефролога по месту жительства, ежемесячное обследование показателей функции почек.
Обязательная постоянная карта с отметкой об ОПП, длительности, количества и вида процедур ЗПТ, уровне СКФ, проведении рентгенконтрастных исследований.
Индикаторы эффективности лечения и безопасности методов диагностики и лечения:
- снижение мочевины за процедуру не менее чем на 25 %;
- уменьшение явлений уремической интоксикации;
- уменьшение признаков гипергидратации (при наличии).
Дополнительными критериями адекватности при проведении продолженных процедур ЗПТ при ОПП являются:
- поток эффлюента не менее 25-35 мл/кг*ч, суммарный объем замещения/диализата за процедуру – не менее 20л;
- длительность процедуры не менее 12 час;
- обеспеченная недельная доза kt/v – не менее 3,9.
Госпитализация
ПОКАЗАНИЯ ДЛЯ ГОСПИТАЛИЗАЦИИ С УКАЗАНИЕМ ТИПА ГОСПИТАЛИЗАЦИИ:
Показания для плановой госпитализации:
нет.
Показания для экстренной госпитализации:
- все больные с впервые выявленным ОПП, согласно диагностическим критериям, подлежат экстренной госпитализации в стационар, располагающий возможностью экстракорпоральных методов гемокоррекции (диализная терапия).
Показания для перевода в отделение интенсивной терапии и решения вопроса о продленной заместительной почечной терапии: тяжесть состояния (олигоурия, азотемия, массивные отеки вплоть до анасарки); осложненная экстраренальная патология (гипертонический криз, острое нарушение мозгового кровообращения, острая сердечная и/или печеночная недостаточность, сепсис т.д.) [3].
Группы риска развития ОПП:
- пожилой возраст;
- гипертензия;
- сосудистые заболевания (мультифокальный атеросклероз);
- ранее установленная почечная недостаточность;
- застойная сердечная недостаточность;
- сахарный диабет;
- миеломная болезнь;
- хроническая инфекция и сепсис;
- миелопролиферативные заболевания;
- пациенты после рентген-контрастного исследования;
- пациенты на ЭКМО, с LVAD/RVAD;
- пациенты с олигурией/анурией;
- пациенты, принимающие НПВП, цитостатики;
- применение пищевых добавок (протеиновые добавки, креатин, энергетические напитки, кола, соки с консервантами и т.д.).
- пациенты с коронавирусной инфекцией (COVID-19).
Информация
Источники и литература
-
Протоколы заседаний Объединенной комиссии по качеству медицинских услуг МЗ РК, 2019
- 1) KDIGO, AKI. «Work Group: KDIGO clinical practice guideline for acute kidney injury.» Kidney Int Suppl 2.1 (2012): 1-138.
2) Lewington, Andrew, and Suren Kanagasundaram. «Renal association clinical practice guidelines on acute kidney injury.» Nephron Clinical Practice 118.Suppl. 1 (2011): c349-c390.
3) Chionh, Chang Yin, et al. «Acute peritoneal dialysis: what is the ‘adequate’dose for acute kidney injury?.» Nephrology Dialysis Transplantation (2010): gfq178.
4) KDIGO, AKI. «Work Group: KDIGO clinical practice guideline for acute kidney injury.» Kidney Int Suppl 2.1 (2012): 1-138.
5) Lewington, Andrew, and Suren Kanagasundaram. «Renal association clinical practice guidelines on acute kidney injury.» Nephron Clinical Practice 118.Suppl. 1 (2011): c349-c390.
6) Chionh, Chang Yin, et al. «Acute peritoneal dialysis: what is the ‘adequate’dose for acute kidney injury?.» Nephrology Dialysis Transplantation (2010): gfq178.
7) Canadian Association of Radiologists, Consensus Guidelines for the Prevention of Contrast Induced Nephropathy, 17.06.2011.
UC San Diego Health System, Intravenous Contrast Media Guidelines – Adult, аpproved by P&T Committee 6/18/2014.
- 1) KDIGO, AKI. «Work Group: KDIGO clinical practice guideline for acute kidney injury.» Kidney Int Suppl 2.1 (2012): 1-138.
Информация
ОРГАНИЗАЦИОННЫЕ АСПЕКТЫ ПРОТОКОЛА
Список разработчиков протокола:
- Алтынова Венера Ханапиевна – кандидат медицинских наук, Корпоративный фонд «University Medical Center» заместитель медицинского директора – директор департамента по медицинским и регуляторным вопросам.
- Ногайбаева Асем Толегеновна – магистр медицинских наук, ТОО «B.B.NURA», член экспертного совета заместительной почечной терапии РОО «Общество нефрологов, врачей диализа и трансплантологов Республики Казахстан», врач нефролог первой категории.
- Карибаев Еркебулан Абильбаевич – ТОО «Fresenius Medical Care Казахстан», медицинский директор, врач-нефролог.
- Гуляев Александр Евгеньевич – доктор медицинских наук, профессор, National Laboratory Astana, АОО «Назарбаев Университет», ведущий научный сотрудник лаборатории микробиома человека и долголетия, врач клинический фармаколог.
- Сергазы Шынгыс Даулетханулы – PhD фармакология, National Laboratory Astana, АОО «Назарбаев Университет» старший научный сотрудник лаборатории микробиома человека и долголетия, клинический фармаколог.
Указание на отсутствие конфликта интересов: нет.
Список рецензентов:
- Шепетов Абай Мусаевич – доктор медицинских наук, НАО «Казахский национальный медицинский университет имени С.Д. Асфендиярова» заведующий кафедрой нефрологии.
- Туганбекова Салтанат Кенесовна – доктор медицинских наук, профессор АО «Национальный научный медицинский центр» заведующий отделом терапии и клеточных технологий, руководитель РОО «Нефрологов, врачей диализа и трансплантологов Казахстана», главный внештатный специалист по профилю «Нефрология (взрослая, детская)» МЗ РК
Указание условий пересмотра протокола: пересмотр протокола через 5 лет после его опубликования и с даты его вступления в действие или при наличии новых методов с уровнем доказательности.
Приложение 1
ДИАГНОСТИКА И ЛЕЧЕНИЕ НА ЭТАПЕ СКОРОЙ НЕОТЛОЖНОЙ ПОМОЩИ:
Диагностические мероприятия:
- сбор жалоб и анамнеза, данных в отношении контакта с токсическим веществом;
- данные о гидробалансе, диурезе;
- физикальный осмотр;
- измерение АД;
- коррекция АД, согласно клиническому протоколу диагностики и лечения «Артериальная гипертензия».
Оказание неотложной помощи при отеке легких согласно соответствующему клиническому протоколу диагностики и лечения.
Приложение 2
Особенности ведения, контраст-индуцированного ОПП
(контраст-индуцированной нефропатии — КИН)
Определение риска контраст-индуцированной нефропатии [1]
Рекомендации
1) Факторы риска КИН, связанные с особенностями пациента (УД – 2 А):
- возраст более 75 лет;
- заболевание почек в анамнезе (альбуминурия/протеинурия, стойкие изменения в осадке мочи, изменения почек при визуализирующих методах исследования, стойкое снижение СКФ <60 мл/мин /1,73м2 ;
- трансплантация почки, единственная почка, рак почки, операции на почке;
- сахарный диабет;
- известное или подозреваемое ОПП;
- гиповолемия, дегидратация, нестабильная гемодинамика, гипотензия, шок;
- хроническая сердечная недостаточность (NYHA класс 3-4), низкая фракция выброса левого желудочка;
- острый инфаркт миокарда (<24 ч);
- множественная миелома;
- анемия различной этиологии;
- конкурирующее применение нефротоксических препаратов.
2) Факторы риска КИН, связанные с лучевой процедурой (УД – 2 С):
- большой объем рентген-контрастного препарата (РКП);
- повторное введение йодсодержащего РКП за короткий промежуток времени – менее 24 часов (за исключением экстренных ситуаций) или многократное применение в течение нескольких дней;
- внутриартериальное введение РКП в сравнении с внутривенным;
- применение высоко-осмолярных РКП;
- осложнения при предыдущем применении РКП.
3) Всем пациентам, которым планируется процедура с внутрисосудистым (внутривенным или внутриартериальным) введением йодсодержащего РКП, необходимо оценить риск развития КИН и проводить обследование на предмет наличия предсуществующего нарушения функции почек (УД – 1С).
4) Пациентам, не имеющим вышеперечисленных факторов риска развития КИН, которым планируется стандартное рентгеноконтрастное исследование, не требуется определение исходного уровня SCr перед внутрисосудистым введением йодсодержащего РКП (УД – 2А).
5) У пациентов с высоким риском развития КИН следует рассмотреть возможность использования альтернативных визуализирующих методов диагностики, в частности, лучевых методов исследования без использования йодсодержащих РКП при условии, если они смогут обеспечить требуемую информацию (УД – 2 В).
6) Не рекомендуется использовать гадолиний-содержащие РКП при проведении рентгенографии, компьютерной томографии или ангиографии для того, чтобы избежать риска нефропатии, связанной с введением йодсодержащих РКП (УД – 1С).
7) У всех пациентов, имеющих риск нефротоксического действия РКП, до его введения должен быть известен или определен исходный уровень SCr, если процедура может быть отложена до тех пор, пока ее результат станет доступен без вреда для пациента. Исключением являются ситуации, когда польза от экстренного контрастного исследования /вмешательства перевешивает риск его отсрочки (УД – 1А).

9) Рекомендуется избегать внутрисосудистого введения йодсодержащего РКП пациентам с ОПП, особенно подверженным нефротоксическому воздействию (УД – 2В).
10) Пациенты на ЗПТ не входят в группу риска КИН, и им может проводиться внутрисосудистое введение йодсодержащего РКП (УД – 2D).
11) Риск развития КИН зависит от факторов риска и возрастает пропорционально увеличению их количества (УД – 2В).
Модифицируемые факторы риска КИН:
1) Не рекомендуется применять РКП у пациентов с циркуляторным коллапсом или сердечной недостаточностью (СН), электролитными нарушениями до тех пор, пока не будет скорректирован гемодинамический статус и уровень электролитов в сыворотке крови (УД –1 А).
2) Рекомендуется отменить прием потенциально нефротоксичных препаратов за 1 -2 дня (оптимально за 3-4 дня) перед процедурой исследования с РКП (УД – 2 С).
3) Пациентам с сахарным диабетом (СД), принимающим метформин: – не рекомендуется прерывать лечение метформином при СКФ > 45 мл/мин /1,73м2 без известных сопутствующих заболеваний на период исследования с внутривенными йодсодержащими РКП, а также контролировать уровень SCr после завершения исследования. (1 А) – лечение метформином должно быть временно прекращено при СКФ 30-44 мл/мин /1,73м2 на период проведения рентгенконтрастного исследования сроком на 48 часов (УД – 1 А):
- после проведения исследования рекомендуется контролировать показатели почечной функции до тех пор, пока они не станут благоприятными для возобновления лечения метформином (УД – 1 А);
- рекомендуется у пациентов высокого риска мониторировать симптомы молочнокислого ацидоза (сонливость, вялость, гиперпноэ, жажда, анорексия, рвота, диарея, рН <7,25, лактат плазмы ≥5 ммоль /л) (УД – 2 А);
- применение метформина и йодсодержащих РКП противопоказано при СКФ<30 мл/мин /1,73м2, наличии интеркуррентных заболеваний с нарушением функции печени, сердечной недостаточностью, ишемией миокарда или периферических мышц, сепсисом, тяжелыми инфекциями (УД – 1 А).
4) У пациентов высокого риска повторное определение креатинина сыворотки (SCr) проводится через 48 и 72 часа после рентгенконтрастного исследования. (УД – 2D).
5) У пациентов с факторами риска развития КИН рекомендуется использовать изо-осмолярные (Iodixanol ) или гипо-осмолярные (Iopamidol) йодсодержащие РКП (УД – 1 В).
6) У пациентов со значительным нарушением функции почек предпочтительно назначение изо-осмолярных йодсодержащих РКП (УД – 2С).
7) Не рекомендуется у пациентов высокого риска с нарушенной функцией почек использовать гадолиний -содержащие РКП (более нефротоксичны, чем йодсодержащие контрасты, в дозах, обеспечивающих сопоставимый уровень рентгенконтрастности (УД – 2 В).

Среди факторов риска, связанных с РКП, имеют значение: тип контрастного препарата (его осмолярность и вязкость), технология применения – объем (доза), способ введения (внутриартериальный или внутривенный), повторное использование в течение короткого промежутка времени , наличие осложнений при предыдущем применении.
РКП не реабсорбируется в почечных канальцах, его период полувыведения при внутрисосудистом применении у пациентов с нормальной функцией почек составляет около 2 часов и в течение 4 часов экскретируется 75%, а в течение 24 часов – 98% назначенной дозы. Приблизительно через 150 минут концентрация РКП стремительно снижается у пациентов с нормальной почечной функцией, но у пациентов с выраженным нарушением функции почек эта фаза отсрочена.
Классификация РКП:
— ионные и неионные,
— мономеры и димеры.
Контрастные средства первой генерации или ионные высокоосмолярные (осмолярность >2000 mOsm/кгH2O) – (например, диатризоат) имеют самый высокий процент различных побочных реакций (10-12% у пациентов с неотягощенным анамнезом и до 50% у пациентов группы риска).
Контрастные средства второй генерации или неионные низкоосмолярные с высокой вязкостью (осмолярность 600-1000 mOsm/кгH2O) – (например, йогексол и йопромид) обладают меньшим количеством побочных реакций, меньшей острой токсичностью и широко используются в клинической практике . Различные побочные реакции отмечены у 1-3% больных с неотягощенным анамнезом и у 16% пациентов группы риска.
РКП третьей генерации или изоосмолярные неионные ( осмолярность 290 mOsm/kg – изоосмолярное крови при всех концентрациях) — йодиксанол , вызывает меньший осмотический диурез , натриурез и, соответственно , меньшее снижение эффективного внутрисосудистого объема. При его применении не снижается уровень АД, не возникают
нарушения ритма сердца и редко встречаются аллергические реакции.
Если назначение контраста считают соответствующим у пациентов с высоким риском (почечная недостаточность, СД и нарушение функции почек), наиболее важно использовать гипо — или изоосмолярные РКП, снижающие риск КИН по сравнению с высокоосмолярны ми контрастами (13) .
В связи с риском развития нефрогенного системного фиброза (НСФ) у пациентов с заболеваниями почек с ХБП 4-5ст. противопоказано введение хелатов гадолиния.
Таблица №1. Виды контрастных веществ, используемых в интервенционной ангиологии
| Виды контрастных веществ | Международное название | |
|
|
Мономеры (высокоосмолярные) | Амидотриозат |
| Метриозат | ||
| Йокситаламат | ||
| Димеры (низкоосмолярные) | Йоксаглат | |
|
|
Мономеры (низкоосмолярные) |
|
| Йопромид | ||
| Йогексол | ||
| Йоверсол | ||
| Йобитридол | ||
| Димеры изоосмолярные | Йодиксанол |
Настоятельно рекомендуется по возможности минимизировать объем РКП и избегать повторного введения РКП в течение последующих 72 часов от первого РКИ [10]
Формула расчета объема рентген-контрастного препарата (РКП):
Рекомендуемое максимальное количество РКП для введения при нормальной и сниженной почечной функции рассчитывается по формуле:
объем РКП = расчетная СКФ х 2,39.
Фармакологические стратегии профилактики:
У пациентов с низким риском КИН рекомендуется использовать пероральный путь гидратации при уверенности адекватного потребления жидкости и соли (УД – 2 C).
Пациентам с повышенным риском развития КИН рекомендуется не ограничиваться только пероральным введением жидкости, проведение инфузионной терапии предпочтительней, чем отказ от нее (УД – 2 C).
У пациентов с повышенным риском КИН рекомендуется адекватное внутривенное восполнение объема 0,9% физиологическим раствором хлорида натрия со скоростью 1,0 -1,5 мл/кг /ч в течение 6 -12 часов до и после процедуры (УД – 1 A).
Гидратация 0,9% раствором хлорида натрия в сравнении с 0,45% является предпочтительной (УД – 1 В).
У пациентов с высоким риском КИН возможна альтернативная гидратация раствором бикарбоната натрия (154 mEq /l в 5 % растворе глюкозы — (containing 3 ampoules/154 mmol of sodium bicarbonate in 0.85 litres 5% dextrose)) со скоростью 3 мл/кг /ч за 1 час до и 1 мл/кг /ч в течение 6 часов после введения йодсодержащего РКП (УД – 1 A).
Пациентам с сахарным диабетом инфузионная терапия раствором бикарбоната натрия не может быть рекомендована (УД – 1 В).
Не рекомендуется использовать для предотвращения или лечения КИН:
- низкие дозы допамина (УД – 1 A);
- фенолдопам (УД – 1 С);
- предсердный натриурический пептид (УД – 1 C);
- антагонисты аденозина (теофиллин ) (УД – 2 C);
- блокаторы кальциевых каналов (УД – 1С).
Использование петлевых диуретиков и маннитола увеличивают риск развития КИН, применение их в профилактике КИН не оправдано (УД – 1 B).
Не рекомендовано использовать мочегонные средства для увеличения количества мочи при установленном ОПП за исключением управления объемной перегрузкой (УД – 2 C).
Пациентам с анурией вследствие терминальной ХПН, находящихся на ЗПТ диализом, может проводиться внутрисосудистое введение йодсодержащего РКП без риска дополнительного повреждения почек (УД – 1А).
У диализных пациентов следует избегать осмотической перегрузки вследствие внутрисосудистого введения йодсодержащего РКП и перегрузки жидкостью (УД – 1А).
Гидратацию у пациентов на ПД следует проводить только после оценки состояния водного баланса (УД –1 В).
При введении йодсодержащего РКП нет необходимости корреляции времени инъекции препарата с последующей сессией ГД (УД –1 А).
Нет необходимости в дополнительной сессии ГД по удалению йодсодержащих РКП (УД – 1А).
Превентивный гемодиализ или гемодиафильтрация:
Рекомендации:
- Профилактический ГД у пациентов с предшествующим нарушением функции почек, снижая концентрацию РКП в плазме, не уменьшает риск развития КИН (УД – 1 С).
- Гемофильтрация перед и после рентгеноконтрастного исследования пациентам группы очень высокого риска с ХБП 5 стадии более эффективна в предупреждении ОПП, чем гидратация солевыми растворами .
- Не использовать с профилактической целью удаления РКП интермиттирующий гемодиализ или гемодиафильтрацию (УД – 1 C).
Документация.
Любое введение контраста должно быть зафиксировано документально, документация должна включать следующую информацию:
- дата и время введения РКП;
- тип применяемого контраста;
- проводилась ли профилактика КИН;
- объем введенного РКП;
- любые реакции;
- другое лечение.
Приложение 3
КЛИНИЧЕСКИЙ ПРОТОКОЛ МЕДИЦИНСКОГО ВМЕШАТЕЛЬСТВА
ПРОДЛЕННАЯ ЗАМЕСТИТЕЛЬНАЯ ПОЧЕЧНАЯ ТЕРАПИЯ (МОДИФИКАЦИИ) И ЭКСТРАКОРПОРАЛЬНАЯ ДЕТОКСИКАЦИЯ (ГЕМОСОРБЦИЯ / ПЛАЗМОСОРБЦИЯ / ПЛАЗМООБМЕН / ОДНОПОТОЧНЫЙ АЛЬБУМИНОВЫЙ ДИАЛИЗ)
1. ВВОДНАЯ ЧАСТЬ
- Код(ы) МКБ-10
| Код | Название |
| Z49.0 | Подготовительные процедуры для проведения диализа |
| Z49.1 | Экстракорпоральный диализ |
- Дата разработки протокола 14.03.2020
- Сокращения, используемые в протоколе
| KDIGO | Kidney Disease Improving Global Outcomes – Инициатива по улучшению глобальных исходов заболеваний почек |
| ГС | Гемосорбция |
| ПО | Плазмообмен |
|
ПС |
Плазмосорбция |
|
Spad |
Single pass albumin dialysis (однопроточный альбуминовый диализ) |
| СПОН/ПОН | Синдром полиорганной недостаточности/полиорганная недостаточность |
- Пользователи протокола: нефрологи, нефрологи диализа, врачи реаниматологи.
- Категория пациентов: пациенты с острым почечным повреждением, СПОН, тХБП, сепсисом, гепаторенальным синдромом, аллергическими заболеваниями, аутоиммунной патологией, отравлениями и т.д.
- Определения и термины
Для целей реализации настоящих клинических рекомендаций устанавливаются следующие основные понятия и термины:
1. Заместительная терапия функции почек (ЗПТ) – замещение утраченных функций почек экстракорпоральными или интракорпоральными специализированными методами лечения или трансплантацией почки.
2. Гемодиафильтрация продленная – специализированный полуселективный мембранный метод экстракорпорального диализа с использованием модифицированных аппаратов «искусственная почка». Метод основан на принципе диффузионного, фильтрационного и конвекционного переноса через высокопроницаемую, высокопоточную мембрану воды и растворенных в ней молекул за счет градиента концентрации и давления, обеспечивающий эффективное удаление из крови воды и низко- и средне молекулярных субстанций плазмы крови. Характерными особенностями является: использование низких скоростей кровотока (100-200 мл/мин), потока диализата (12-18 л/ч) массивная ультрафильтрация с одновременным замещением сбалансированным раствором приготовляемым непосредственно аппаратом (онлайн) из диализирующего раствора повышенной очистки (ультрачистого) в процессе проведения процедуры.
3. Гемодиализ продолжительный — специализированный полуселективный мембранный метод экстракорпорального диализа с использованием аппаратов для продолжительных методов диализа, основанный на принципе диффузионного и фильтрационного переноса через полупроницаемую высоко поточную мембрану воды и растворенных в ней молекул за счет градиента концентрации и давления, обеспечивающий эффективное удаление из крови воды и низкомолекулярных компонентов крови.
4. Гемофильтрация крови продолжительная – специализированный полуселективный мембранный метод экстракорпорального диализа, основанный на принципе фильтрационного и конвекционного переноса через высоко поточную, высокопроницаемую мембрану воды и растворенных в ней молекул за счет градиента давления, обеспечивающий эффективное удаление из крови воды и низко — и средне молекулярных субстанций плазмы крови.
5. Гемосорбция — метод экстракорпорального очищения цельной крови от токсических веществ путём адсорбции токсинов и других патологических веществ на поверхности сорбента. Используется для удаления из крови различных токсических продуктов, в основном, гидрофобных субстанций, тогда как при гемодиализе удаляются гидрофильные вещества.
6. Плазмосорбция — метод экстракорпорального очищения плазмы от токсических веществ путём адсорбции токсинов и других патологических веществ на поверхности сорбента. Используется для удаления из крови различных токсических продуктов, в основном, гидрофобных субстанций, тогда как при гемодиализе удаляются гидрофильные вещества.
7. Терапевтический плазмообен — процедура, заключающаяся в удалении плазмы из крови пациента с последующим ее замещением солевыми растворами, альбумином или донорской плазмой.
1.8 Клиническая классификация.
Таблица 1. Классификация ОПП по классам RIFLE (R – risk, I – injury, F – failure, L- lost function, E – End Stage Renal Disease) — таблица 2
| Классы | Критерии по клубочковой фильтрации | Критерии по диурезу |
| Риск – R | ↑Scr* в 1,5 раза или ↓ КФ** на 25% | <0,5 мл/кг/час ≥6 часов |
| Повреждение- I | ↑Scr в 2 раза или ↓ КФ на 50% | <0,5 мл/кг/час ≥12 часов |
| Недостаточность – F | ↑Scr в 3 раза или ↓ КФ на75% или Scr≥354 мкмоль/л с нарастанием не менее 44,2 мкмоль/л | <0,3 мл/кг/час ≥24 часов или анурия ≥12 часов |
| Потеря почечной функции – L | Стойкая ОПП; полная потеря почечной функции >4 недель | |
| Терминальная почечная недостаточность – E | ТХПН>3мес |
Scr*-креатинин сыворотки крови, КФ**- клубочковая фильтрация
Таблица 2. Стадии ОПП (KDIGO, 2012)
| Стадии | Креатинин плазмы | Объем выделяющий мочи |
| 1 | В 1,5-1,9 раза выше исходного или повышение на 0,3мг/дл (≥26,5мкмоль/л). | <0,5 мл/кг/час за 6-12 часов |
| 2 | В 2,0-2,9 раза выше исходного. | <0,5 мл/кг/час за ≥ 12 часов |
| 3 |
В 3,0 раза выше исходного или повышение до ≥4,0мг/дл (≤353,6 мкмоль/л) или начало ЗПТ или у пациентов <18лет, снижение расчетной СКФ до <35 мл/мин/1,73м2. |
<0,3 мл/кг/час за ≥ 24 часа или анурия в течение ≥12 часов |
Классификация гепаторенального синдрома:
Выделяют 2 типа гепаторенального синдрома.
- гепаторенальный синдром I типа;
- гепаторенальный синдром II типа.
По этиологии СПОН подразделяют на два основных вида:
- ПОН, возникшая в связи с утяжелением какой-либо патологии, когда одна или несколько жизненных функций повреждаются настолько, что требуется их искусственное замещение;
- ятрогенная ПОН.
Классификация сепсиса по степени тяжести (3 международный консенсус по определению сепсиса и септического шока [Сепсис-3]):
- сепсис (подозревая инфекция, 2 балла по шкале qSOFA, прирост на 2 и более балла по шкале SOFА);
- септический шок (сепсис + вазопрессоры + лактат >2 ммоль/л).
2. МЕТОДЫ, ПОДХОДЫ И ПРОЦЕДУРЫ ДИАГНОСТИКИ И ЛЕЧЕНИЯ
2.1 Цель проведения процедуры/вмешательства:
- ПЗПТ — восстановление водовыделительной и азотовыделительной функции почек, в случае отсутствия восстановления функции почек – перевод на амбулаторный диализ по месту жительства;
-
Экстракорпоральные методы дектоксикации — детоксикация и удаление патологических иммунокомплексов.
- Показания и противопоказания к процедуре/ вмешательству:
- Показания к процедуре/ вмешательству:
Показаниями для экстренного проведения внепочечного очищения крови у пациентов с ОПН являются:
1) ренальная ОПН с гиперкатаболизмом (прирост мочевины в сутки более 5 ммоль/л, креатинина – более 88 — 177, калия – более 0,5 ммоль/л);
2) олигурия (диурез < 0,3 мл/кг/ч за 24 часа) или анурия в течение 12 часов и более и/или повышение креатинина сыворотки крови в 3 раза выше нормы (снижение СКФ более чем на 75% от исходной) и/или повышение мочевины крови более 30 ммоль/л);
3) неконтролируемые гиперкалиемия (более 6,0 ммоль/л), гипернатриемия, гипонатриемия;
4) отек легких, резистентный к диуретикам;
5) метаболический ацидоз со снижением рН артериальной крови < 7,2;
6) уремический перикардит/ уремическая энцефалопатия.
Показаниями для проведения продолженных методик ЗПТ – продленный вено-венозный гемодиализ, продленная вено-венозная гемофильтрация, продленная вено-венозная гемодиафильтрация являются:
1) ОПП:
- у беременных и рожениц, в том числе при развитии преэклампсии;
- у пациентов кардиохирургического и нейрохирургического профиля (ХСН III-IV стадия, сопровождающаяся тяжелой гипонатриемией, угроза отека мозга при неконтролируемой гипернатриемии);
- при сепсисе;
- при синдроме полиорганной недостаточности;
- ОПП на фоне высокого гиперкатаболизма (панкреатит, мезентериальный тромбоз и др.);
- объемная перегрузка, обеспечение инфузионной терапии;
- при остром респираторном дистресс синдроме;
- массивный рабдомиолиз, ожоговая болезнь;
- гиперосмолярные комы.
2) пациенты с тХБП:
- выраженная интрадиализная гипотензия,
- угроза дисэквилибрум-синдрома,
- отек легких при нестабильной гемодинамике
- при необходимости внутривенной инфузии больших объемов растворов (включая парентеральное питание) и лекарственных препаратов.
Показания к гемосорбции и плазмосорбции – удаление цитокинов, эндотоксинов в зависимости от вида и типа сорбента.
Терапевтический плазмообмен: гипербилирубинемия, аутоиммунные патологии, детоксикация (в зависимости от типа плазмафильтра).
Однопоточный альбуминовый диализ: печеночно-почечная недостаточность, гипербилирубинемия.
- Противопоказания к процедуре/вмешательству:
Абсолютные противопоказания к проведению процедур ПЗПТ – нет.
Относительные противопоказания к проведению процедур ПЗПТ:
- геморрагический синдром любого происхождения;
- выраженная сердечно-сосудистая или полиорганная недостаточность;
- нарушения психического состояния пациента.
Применение диализных методик в разных стадиях ОПП (ориентировочная схема):
| Проявления и стадии ренальной ОПП | Методы лечения и профилактики |
| Доклиническая стадия с идентификацией экзонефротоксина | Интермиттирующая ГФ, ПГФ, ПА, ГС |
|
Ранняя гиперкалиемия (рабдомиолиз, гемолиз) Ранний декомпенсированный ацидоз (метанол) Гиперволемическая гипергидратация (диабет) Гиперкальциемия (отравление витамином D, множественная миелома) |
Интермиттирующая ГФ
|
| ОПП | Интермиттирующий ГД, острый ПД, ПГФ |
| ОППН |
Плазмосорбция, гемофильтрация, гемодиафильтрация, Альбуминовый диализ |
Сравнение методов ЗПТ
|
Терапевтическая цель |
Гемодинамика | Предпочтительный метод ЗПТ |
| Удаление жидкости |
Стабильная Нестабильная |
Изолированная УФ МНУФ |
| Клиренс мочевины |
Стабильная Нестабильная |
ИГД ПЗПТ: ПВВГД, ПВВГФ, ПВВГДФ |
| Угрожающая гиперкалиемия | Стабильная/нестабильная | Интермиттирующий ГД |
| Угрожающий метаболический ацидоз |
Стабильная
|
ИГД
|
| Тяжелая гиперфосфатемия | Стабильная/нестабильная | ПЗПТ |
| Отек мозга | Нестабильная | ПЗПТ |
2.5. Перечень основных и дополнительных диагностических мероприятий: лабораторно-инструментальные исследования для проведения процедур ПЗПТ на уровне круглосуточного стационара смотреть в соответствии с КП «Острое повреждение почек».
2.6. Требования к проведению процедуры/вмешательства:
Подготовка к сеансам ПЗПТ, ПО, ГС, ПС:
• предварительно у пациента устанавливается временный катетер.
• системная антикоагуляция (гепаринизация) производится с учетом состояния свертывающей системы пациента, массы тела, наличия скрытых очагов кровотечения. Предпочтение отдается дозированной гепаринизации, при которой болюсно вводится часть дозы 25-50 ЕД/кг нагрузочная доза и остальное вводится дозировано в течение всего диализа при помощи гепаринового насоса 10ЕД/кг/час, или гепарин непрерывно вводится 20 до 30 МЕ/кг/ч через артериальную линию. Тщательно должно мониторироваться время свертывание крови, особенно при вводном гемодиализе. При индивидуальной непереносимости гепарина применяются препараты низкомолекулярного ряда. Низкомолекулярный гепарин можно вводить в дозе 1 мг/кг в виде болюса в начале сеанса диализа.
- Регионарная антикоагуляция может проводиться введением гепарина в экстракорпоральный контур с последующей инактивацией раствором протамина сульфата при возврате крови в сосудистое русло. Альтернативой является применение цитратной антикоагуляции.
При подключении пациента к аппарату врач, проводящий процедуру, выставляет параметры:
- при ПЗПТ — скорости кровотока, потока диализирующего раствора/субституата, ультрафильтрации, режима пре-, пост- или микст-дилюции и температуры нагревателя индивидуально;
- при ПО — скорости кровотока, потока свежезамороженной плазмы/альбумина/субституата, плазмотока, целевого объема эксфузии плазмы и температуры нагревателя индивидуально;
- при ПС — скорости кровотока, плазмотока, времени процедуры и температуры нагревателя индивидуально;
- при ГС — скорости кровотока, времени процедуры индивидуально;
- при однопоточном альбуминовом диализе — скорости кровотока, потока диализирующего альбуминового диализата, ультрафильтрации и температуры нагревателя индивидуально;
- проверяется надежность и правильность всех соединений, после чего включается насос крови и устанавливается необходимая скорость кровотока в зависимости от возможностей сосудистого доступа и состояния сердечно-сосудистой системы;
- возврат крови после окончания процедуры осуществляется путем вытеснения ее стерильным 0,9% раствором хлорида натрия, объем которого должен учитываться при программировании ультрафильтрации, затем останавливается перфузионный насос и пережимается венозная магистраль;
- контроль биохимических показателей крови до и после процедуры гемодиализа производится не реже одного раза в сутки.
Аппаратура для ПЗПТ включает опции для проведения гемосорбции и плазмопроцедур.
Для обеспечения проведения процедур ПЗПТ, гемосорбции и плазмотерапии применяются мобильные аппараты для ПЗПТ.
Расходные материалы для процедур ПЗПТ:
- к расходным материалам, необходимым для проведения сеанса ПВВГД относятся: высокопоточный/низкопоточный диализатор, артериальная и венозная кровопроводящие магистрали, магистраль ультрафильтрации, магистраль диализата, а так же стерильные заводские гемофильтрационные растворы в пакетах объемом по 5 литров.
- к расходным материалам, необходимым для проведения сеанса ПВВГФ относятся: высокопоточный диализатор/гемофильтр, артериальная и венозная кровопроводящие магистрали, магистраль ультрафильтрации, магистраль субституата/замещения, а так же стерильные заводские гемофильтрационные растворы в пакетах объемом по 5 литров.
- к расходным материалам, необходимым для проведения сеанса ПВВГДФ относятся: высокопоточный диализатор, артериальная и венозная кровопроводящие магистрали, магистраль ультрафильтрации, магистраль диализата, магистраль субституата/замещения, а так же стерильные заводские гемофильтрационные растворы в пакетах объемом по 5 литров.
Диализатор должен иметь максимальную площадь соответственно весу пациента.
Эффективность и безопасность сеанса процедур связаны с индивидуально подобранным диализатором, определяемым по массе тела, величине артериального давления, выраженности уремической интоксикации и прочим клинико-лабораторным показателям.
К расходным материалам, необходимым для проведения сеанса ГС относятся: артериальная и венозная кровопроводящие магистрали, гемосорбент.
К расходным материалам, необходимым для проведения сеанса ПС относятся: артериальная и венозная кровопроводящие магистрали, плазмофильтр, магистраль удаления плазмы, плазмосорбент.
К расходным материалам, необходимым для проведения сеанса ПО относятся: артериальная и венозная кровопроводящие магистрали, плазмофильтр, магистраль удаления плазмы, магистраль замещения, заместительный раствор (раствор человеческого альбумина, свежезамороженная плазма, физ раствор)
К расходным материалам, необходимым для проведения сеанса однопоточного альбуминового диализа относятся: сверхвысокопоточный диализатор, артериальная и венозная кровопроводящие магистрали, магистраль ультрафильтрации, магистраль диализата, а так же стерильные заводские гемофильтрационные растворы в пакетах объемом по 5 литров, 10% альбумин.
Лечение осложнений процедур ПЗПТ:
Артериальная гипотензия во время сеанса гемодиализа:
1) перевод пациента в позицию Тренделенбурга;
- подача увлажненного 30% кислорода;
- отключить ультрафильтрацию на аппарате искусственной почки;
- болюсное введение 100-150 мл 0,9% раствора хлорида натрия/ гипертонического 10% раствора хлорида натрия / 40% раствора декстрозы/коллоидных растворов в венозную магистраль.
Артериальная гипертензия:
1) Достижение сухого веса пациента.
2) Купирование гипертонического криза: блокаторы кальциевых каналов короткого типа действия, препараты центрального типа действия альфа-адреноблокаторы.
- Мышечные судороги — 0,9% раствор хлорида натрия / гипертонический раствор (10-20%) хлорида натрия / 40% раствор декстрозы внутривенно.
- Головная боль. Может быть первым симптомом начинающегося отека головного мозга при синдроме нарушенного осмотического равновесия, реже – опухолей головного мозга. Лечение заключается в нормализации артериального давления, снижении скорости кровотока (при этом следует увеличить время диализа), введении анальгетиков внутрь или парентерально.
- Боль за грудиной и нарушения ритма сердца — коррекция ад, снижение скорости кровотока и ультрафильтрации, подача увлажненного кислорода.
- Аллергические реакции — применение седативных лекарственных средств в сочетании с антигистаминными средствами.
2.7. Индикаторы эффективности процедур ПЗПТ:
Критериями адекватности процедур продленной ЗПТ являются:
- снижение мочевины за процедуру не менее чем на 30 %;
- поток эффлюента не менее 25мл/кг*ч, суммарный объем замещения/субституата за процедуру — не менее 20л;
- длительность процедуры не менее 12ч.
2.7. Индикаторы эффективности процедур ПО, ПС, ГС, однопоточного альбуминового диализа:
- снижение билирубинемии за процедуру не менее чем на 30%,
- снижение уровня прокальцитонина, пресепсина, СРБ не менее чем на 20%.
Приложение 4
Алгоритм подготовки и проведения гемодиализа на стационарном аппарате искусственной почки
Приготовить комплект одноразовых расходных материалов:
- гемодиализатор (низкопоточный/высокопоточный) -1;
- магистраль венозная -1;
- магистраль артериальная -1;
- концентрат А;
- бикарбонатный картридж;
- 1000,0 мл физ р-ра пак. — 1
Подготовка аппарата «искусственной почки» к сеансу гемодиализа.
Предварительно у пациента готовится один из видов сосудистого доступа – устанавливается наружный катетер или формируется подкожная артериовенозная фистула. Сеанс гемодиализа проводится при нахождении больного в кровати либо в полусидячем кресле с подлокотниками для фиксации конечности с артерио-венозной фистулой. Аппарат “искусственная почка” располагается непосредственно у больного рядом с кроватью или креслом. Диализное место обеспечивается подводкой электричества, магистрали с химически чистой водой от системы водоподготовки и канализационной системой для слива отработанного диализирующего раствора.
Непосредственно перед сеансом готовится концентрат диализирующего раствора и в соответствующих промаркированных канистрах доставляется к аппарату “искусственная почка” (вместо канистры с концентратом Б, возможно использование специальных бикарбонатных картриджей).
Перед началом гемодиализа аппарат должен пройти обязательное автоматическое тестирование по заданной программе, обеспечивающей проверку годности всех блоков аппаратуры.
После каждой процедуры необходимо провести гигиеническую обработку поверхности аппарата “искусственная почка”, дезинфекцию (декальцификацию) гидравлики.
Этапы подключения и отключения больного от аппарата «искусственная почка».
Подключение сосудов больного к магистралям аппарата “искусственная почка” производится в асептических условиях.
- С этой целью под обработанную антисептиками конечность с фистулой помещается стерильная пеленка, которой после пункции фистулы иглами и соединения их с магистралями аппарата “искусственная почка” закрывается участок сосудистого доступа.
- При отсутствии особых указаний в инструкции к диализатору и заглушек на коннекторах диализирующего контура подсоединение магистралей диализирующего раствора аппарата “искусственная почка” происходит до подготовки кровопроводящего контура.
- Диализатор располагается в держателе вертикально так, чтобы надписи на этикетке были доступны для прочтения и диализирующий раствор после подсоединения магистралей аппарата “искусственная почка” двигался снизу-вверх.
- После вытеснения воздуха из контура диализирующего раствора диализатор переворачивается на 1800 и подсоединяются кровопроводящие магистрали так, чтобы кровь и диализирующий раствор двигались в противотоке.
- Предварительная подготовка контура кровообращения заключается в заполнении и промывании диализатора и магистралей 0,9% раствором хлорида натрия в строгом соответствии с инструкцией по применению диализатора. Для этого артериальная магистраль подсоединяется к флакону или мешку с 1 л стерильного 0,9% раствора хлорида натрия, в который добавляется выбранный для данного пациента антикоагулянт в дозе, равной болюсной (таблица 6). Включается перфузионный насос и со скоростью 150-180 мл/мин раствор начинает поступать по артериальной линии в кровопроводящий контур диализатора, вытесняя из него воздух. Для облегчения вытеснения воздуха следует осуществлять краткие пережатия артериальной магистрали. Для удаления возможных остатков стерилизующих веществ и пластификаторов первые 300-500 мл необходимо слить. Этим обеспечивается профилактика возможных анафилактоидных реакций.
- После заполнения магистралей раствором и слива первой порции производится остановка перфузионного насоса и подсоединение конца венозной магистрали к флакону или мешку с 0,9% раствором хлорида натрия.
- Обороты насоса увеличиваются до 300 мл/мин и обеспечивается рециркуляция раствора в системе в течение 10-15 минут с многократным кратковременным пережатием артериальной магистрали.
- Последующее заполнение магистралей и диализатора кровью пациента осуществляется только после тщательной промывки и вытеснения воздуха из кровопроводящего контура стерильным физиологическим раствором.
- Антикоагуляция (гепаринизация) производится с учетом состояния свертывающей системы пациента, массы тела, наличия скрытых очагов кровотечения. Предпочтение отдается дозированной гепаринизации, при которой болюсно вводится часть дозы (5000 ЕД), остальное вводится дозировано в течение всего диализа при помощи гепаринового насоса. При индивидуальной непереносимости гепарина применяются препараты низкомолекулярного ряда – надропарин, дальтепарин, эноксапарин. При высоком риске кровотечения – возможно применения натрия цитрата в качестве антикоагулянта, либо – проведение диализа без применения антикоагулянтов.
- При подключении больного к аппарату “ИП” врач, проводящий гемодиализ, контролирует либо выставляет параметры скорости кровотока (150-350 мл/мин), потока диализирующего раствора (500 мл/мин), проводимости и температуры диализирующего раствора (36-380), времени и объема ультрафильтрации. Объем ультрафильтрации устанавливается исходя из разницы между текущим и сухим весом, которая определяется путем взвешивания пациента до и после процедуры, предстоящим объемом инфузии.
- После того, как аппарат “искусственная почка” полностью готов к работе (пройден первоначальный тест, кровопроводящий контур заполнен и промыт 0,9% раствором хлорида натрия, вытеснен воздух из контура крови и контура диализирующего раствора) в асептических условиях производится подключение пациента, которое должно происходить в соответствии с требованиями, регламентирующими порядок работы с кровью.
- Пункция артерио-венозной фистулы. Пункция осуществляется фистульной иглой срезом вниз под углом приблизительно 30◦ к поверхности кожи. При пункции срезом вверх под углом 45◦ после попадания в просвет фистулы иглу необходимо повернуть по оси на 180◦ для предотвращения повреждения задней стенки сосуда. Следует избегать повторных пункций в одну и ту же точку, что ведет к образованию аневризм, а также прямого прокола кожи и сосуда (после прокола кожи игла должна пройти через подкожную клетчатку, затем попасть в сосуд). Артериальная игла (забор крови) должна располагаться по возможности навстречу току крови, венозная (возврат крови) – наоборот, по току крови. Расстояние между иглами должно составлять не менее 5 см, что предотвращает рециркуляцию и ухудшение качества очищения крови. При использовании двухпросветного диализного катетера забор и возврат крови должен осуществляться в соответствии с маркировкой коннектеров на катетере: красный — артериальный, синий — венозный.
- Болюсное введение антикоагулянта производится в венозную иглу сразу после пункции (либо в венозный отвод катетера), дозированное введение начинается параллельно заполнению магистралей кровью.
- После соединения артериальной магистрали с артериальной иглой включается насос крови и начинается вытеснение 0,9% раствора хлорида натрия из системы магистралей и диализатора кровью пациента при скорости не более 150-180 мл/мин. Раствор хлорида натрия вытесняется до тех пор, пока не появляется окрашивание кровью дистального отдела венозной магистрали (современные аппараты имеют специальный детектор ниже венозной ловушки воздуха), после чего насос крови останавливается, венозная магистраль пережимается и соединяется с венозной иглой.
- Проверяется надежность и правильность всех соединений, после чего включается насос крови и устанавливается необходимая скорость кровотока в зависимости от возможностей сосудистого доступа и состояния сердечно-сосудистой системы. Типичной является скорость кровотока в пределах 200-300 мл/мин.
- Возврат крови после окончания процедуры осуществляется путем вытеснения ее стерильным 0,9% раствором хлорида натрия, объем которого должен учитываться при программировании ультрафильтрации. При этом после остановки перфузионного насоса артериальная игла извлекается, а конец артериальной магистрали подсоединяется к емкости с раствором. Перфузионный насос включается вновь и нагнетает в систему стерильный раствор хлорида натрия, вытесняющий кровь. После попадания промывающего раствора хлорида натрия в диализатор следует многократно кратковременно пережать артериальную магистраль до полной очистки диализатора от крови. Полностью возвращается пациенту кровь, затем останавливается перфузионный насос и пережимается венозная магистраль.
- После извлечения игл места пункций прижимаются свернутыми стерильными салфетками (при отсутствии специальных пластырей) до полной остановки кровотечения, после чего накладывается сухая повязка.
- Контроль биохимических показателей уремии производится в зависимости от состояния пациента и стабильности параметров процедуры (эффективный кровоток в диализаторе, эффективное время диализа), но не реже одного раза в месяц. Оцениваются, главным образом, преддиализные показатели, позволяющие вносить коррекцию в режимы очищения крови.
Утилизировать использованные магистрали согласно правилам обращения с медицинскими отходами.
Приложение 5
Алгоритм процедуры гемодиализа на аппарате для ПЗПТ
Приготовить комплект одноразовых расходных материалов:
- гемофильтр/ высокопоточный гемодиализатор -1;
- магистраль венозная -1;
- магистраль артериальная -1;
- магистраль ультрафильтрата -1;
- магистраль замещения -1;
- 2 пустых мешка.
Растворы:
- 5 л.диализирующего раствора (содержание калия – 0,0 ммоль/л; 2,0 ммоль/л; 4,0 ммоль/л ) — 2;
- 2 л. физ раствор — 1;
- 250 мл физ.раствора (для окончания процедуры) -1.
Подготовка растворов, шприца с гепарином.
- Смешать 2- литровый стандартный раствор Na Cl 0,9% с 2500 ЕД гепарина;
- Приготовить мешки субституата.
- Установить шприц с гепарином на перфузоре.
Подготовить аппарат к работе:
- Подключить систему к источнику питания.
- Включить аппарат.
- Выбор типа процедуры.
- Аппарат проходит самотестирование.
- После завершения самотестирования необходимо начать навешивание одноразовых расходных материалов.
- На весы установить два пакета с диализирующим р-ром – на правую сторону, один мешок с 2,0 л физ.рР-ра на левую сторону, пакет для сбора ультрафильтрата положить на основание аппарата.
- Во время процедуры заполнения появится сообщение «перевернуть фильтр нижней стороной вверх».
- Установить необходимые параметров для проведения процедуры (возможна установка до заполнения или после, непосредственно перед процедурой).
- Затем аппарат проходит тестирование на герметичность собранной системы. В течение заполнения и промывки выполняются следующие тесты: тест весов, тест воздушного детектора, тест насоса диализата(МР3), тест нагревателя, разовый тест утечки, тестрегулировки уровня, и калибровка насосных констант.
- Промывка и заполнение контура крови раствор Na Cl. 0,9%.
- Снять пакет с физ р-ром с весов, повесить пакеты для сбора ультрафильтрата на держатель весов.
- Присоединить артериальную и венозные магистрали к соответствующему порту сосудистого доступа пациента и начать процедуру.
Завершение процедуры:
Отключение пациента от аппарата:
- После подтверждения окончания процедуры, остановить насос кровообращения, подключить артериальную магистраль к флакону с 250 мл раствора Na Cl 0,9% и начать возврат крови.
- После окончания процедуры отсоединить венозную магистраль от сосудистого доступа пациента.
- Снять использованные расходные материалы с аппарата.
- Утилизировать использованные магистрали согласно.
Приложение 6
Алгоритм процедуры гемофильтрации на аппарате для ПЗПТ
Приготовить комплект одноразовых расходных материалов:
- гемофильтр/ высокопоточный гемодиализатор -1;
- магистраль венозная -1;
- магистраль артериальная -1;
- магистраль ультрафильтрата -1;
- магистраль замещения -1;
- 2 пустых мешка.
Растворы:
- 5 л. диализирующего раствора (содержание калия – 0,0 ммоль/л; 2,0 ммоль/л; 4,0 ммоль/л) — 2;
- 2 л. Физ. раствор — 1;
- 250 мл физ. раствора (для окончания процедуры) -1.
Приготовить раствор для промывки системы:
Смешать 2- литровый стандартный раствор Na Cl 0,9% с 2500 ЕД гепарина.
Подготовить аппарат к работе:
- подключить систему к источнику питания;
- включить аппарат;
- выбор новой процедуры;
- после включения аппарат проходит самотестирование;
- после завершения самотестирования необходимо начать навешивание одноразовых расходных материалов;
- установить шприц с гепарином;
- навесить мешок фильтрата;
- установить необходимые параметров для проведения процедуры;
- затем аппарат проходит тест на герметичность собранной системы;
- промывка и заполнение контура крови раствор Na Cl 0,9%;
- ультрафильтрационная промывка;
- гигиена рук;
- присоединить артериальную и венозные магистрали к соответствующему порту сосудистого доступа пациента и начать процедуру.
Завершение процедуры:
Отключение пациента от аппарата:
- После подтверждения окончания процедуры, остановить насос кровообращения, подключить артериальную магистраль к флакону с 250 мл раствора Na Cl 0,9% и начать возврат крови;
- после окончания процедуры отсоединить венозную магистраль от сосудистого доступа пациента;
- снять использованные расходные материалы с аппарата;
- утилизировать использованные магистрали согласно правилам обращения, с медицинским отходами;
- гигиена рук.
Приложение 7
Карта гемодиализа
Карта №___________ Журнал №__________ ИБ №___________ Дата __________________
ФИО пациента _________________________________________________________________
Дата рождения _______________________ Отделение ________________________________
Начало процедуры ________________ Окончание процедуры__________________
Длительность терапии ___________час/мин
Гемодиализатор ________________ Гепарин всего на процедуру _________ ЕД
Натрий ___________ Ультрафильтрация __________ мл Кровоток __________ мл/мин.
Поток диализата ___________ мл/мин
| Время, час:мин | ||||||
| Показатели | До процедуры | 1час | 2час | 3час | 4 час | Окончание процедуры |
|
АД |
||||||
| Пульс |
|
|||||
| АСТ | ||||||
| Скорость кровотока, мл/мин | ||||||
| Гепарин, ЕД/час | ||||||
| 4% калия хлорид ____ мл, скорость _______ мл/час в/в | ||||||
|
Дополнительно |
|
|||||
|
|
||||||
|
|
Вес до ГД кг Вес после ГД кг
Одноразовые расходные материалы (класс В) утилизированы и окончательная обработка аппарата произведена
Врач: _____________________ ССД: ________________________
_____________________ ________________________
Приложение 8
Карта гемодиафильтрации
Карта № _______ Журнал №________ ИБ №___________ Дата____________________
ФИО пациента ______________________________________________________________
Дата рождения___________________ Отделение _______________________
Начало процедуры___________ Окончание процедуры ___________
Длительность терапии ___________ час/мин
Гемодиализатор _______________ Гепарин всего на процедуру ___________ЕД.
Натрий _________ Кровоток ________ мл/мин. Заместительный раствор_________________________ мл.
Объем замещения______________ мл. Поток замещения_____________ мл/час.
Ультрафильтрация общая _____________ мл. Ультрафильтрация фактическая___________ мл.
Поток диализата ______________ мл/мин.
| Время ,ч:мин | |||||||
| Гемодинамика | До процедуры | 1час | 2час | 3час | 4 час | 5 час | После процедуры |
|
АД |
|
||||||
| Пульс |
|
||||||
|
АСТ |
|||||||
| Скорость кровотока, мл/мин | |||||||
| Поток замещения | |||||||
| Гепарин, ЕД/час | |||||||
|
______________ 5000 ml |
|||||||
| 4% калия хлорид ____ мл, скорость _______ мл/час в/в | |||||||
|
Дополнительно |
|
||||||
|
|
|||||||
|
|
Вес до ГД ____________кг Вес после ГД ____________ кг
Одноразовые расходные материалы (класс В) утилизированы и окончательная обработка аппарата произведена
Врач:___________________________ ССД:__________________________
___________________________ _________________________
Приложение 9
Карта гемодиализа с цитратной антикоагуляцией №
Карта № ____________ Журнал №___________ ИБ № ____________ Дата _____________________
ФИО пациента ___________________________________________
Дата рождения _____________________ Отделение ________________________________
Начало процедуры___________________ Окончание процедуры_____________________
Длительность терапии ___________часа Кровоток _______ мл/мин. Натрий ______
Гемодиализатор ______________ Натрия цитрат 4% 250 мл №_______ Кальция хлорид 10% _______ мл. Магния сульфат 25% _________ мл Заместительный раствор _____________ мл.
Ультрафильтрация общая ___________ мл. Ультрафильтрация фактическая_________ мл.
Поток диализата _____________ мл/мин
| Время, час:мин | ||||||
| Время терапии | ||||||
|
АД, мм рт ст |
||||||
|
ЧСС, уд/мин |
||||||
| Поток замещения, мл/час | ||||||
| Натрия цитрат 4%, мл/час | ||||||
| Кальция хлорид 10%, мл/час | ||||||
| Магния сульфат 10%, мл/час | ||||||
| Скорость общей ультрафильтрации, мл/час | ||||||
| Скорость ультрафильтрации фактической, мл/час | ||||||
| Общий объем ультрафильтрации, мл | ||||||
| Скорость кровотока, мл/мин | ||||||
|
Дополнительно |
Вес до ГД _________кг Вес после ГД ________кг
Одноразовые расходные материалы (класс В) утилизированы и окончательная обработка аппарата произведена
Врач:___________________________ ССД:__________________________
___________________________ __________________________
Приложение 10
Карта гемодиафильтрации с цитратной антикоагуляцией №
Карта № ____________ Журнал №___________ ИБ № ____________ Дата _____________________
ФИО пациента ___________________________________________
Дата рождения _____________________ Отделение ________________________________
Начало процедуры___________________ Окончание процедуры_____________________
Длительность терапии ___________часа Кровоток _______ мл/мин. Натрий ______
Гемодиализатор ______________ Натрия цитрат 4% 250 мл №_______ Кальция хлорид 10% _______ мл. Магния сульфат 25% _________ мл Заместительный раствор _____________ мл.
Объем замещения________________________ мл. Поток замещения __________ мл/час
Ультрафильтрация общая ___________ мл. Ультрафильтрация фактическая_________ мл.
Поток диализата _____________ мл/мин
| Время, час:мин | ||||||
| Время терапии | ||||||
|
АД, мм рт ст |
||||||
|
ЧСС, уд/мин |
||||||
| Поток замещения, мл/час | ||||||
| Натрия цитрат 4%, мл/час | ||||||
| Кальция хлорид 10%, мл/час | ||||||
| Магния сульфат 10%, мл/час | ||||||
| Скорость общей ультрафильтрации, мл/час | ||||||
| Скорость ультрафильтрации фактической, мл/час | ||||||
| Общий объем ультрафильтрации, мл | ||||||
| Скорость кровотока, мл/мин | ||||||
|
Дополнительно |
Вес до ГД _________кг Вес после ГД ________кг
Одноразовые расходные материалы (класс В) утилизированы и окончательная обработка аппарата произведена
Врач:___________________________ ССД:__________________________
___________________________ __________________________
Приложение 11
Карта гемосорбции № ____/______
Карта № ______ Журнал №_______ ИБ №__________ Дата_____________
ФИО пациента _______________________________________________________________________ Дата рождения___________________ Отделение _________________________________
Диагноз_________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Гемосорбент : ___________________________
Промывка:________________________________________________________________________
0,9% натрия хлорид на подготовку__________мл Гепарин: на подготовку______________ЕД. Гепарин на процедуру ________________ ЕД.
Другой антикоагулянт_____________________ Доза_______________________
Начало процедуры_________ Окончание процедуры ___________
Длительность терапии ______ ч:мин Кровоток ________ мл/мин.
| Время терапии |
До процедуры |
После процедуры |
||||||
|
АД |
|
|||||||
| Пульс |
|
|||||||
|
Кровоток, мл/мин |
||||||||
| Гепарин ____ЕД на ____ мл NaCl 0.9% | ||||||||
|
Скорость ЕД/час |
||||||||
|
АСТ, сек |
||||||||
| Дополнительно |
Одноразовые расходные материалы (класс В) утилизированы, окончательная обработка аппарата произведена
Врач:___________________________ ССД:__________________________
___________________________ __________________________
Приложение 12
Карта гемофильтрации / гемодиафильтрации
Карта № __________ Журнал №__________ Аппарат_____________________
Набор_______________________ Гемодиализатор ____________________ Замещающая жидкость_________________________________
Фамилия_____________________________________Имя_________________________________Отчество________________________________
Дата рождения_____________________________ Код №_____________________________ История №____________________
Домашний адрес __________________________________________________________________________________________________________
Диагноз_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
__________________________________________________________________________________________________________________________________________
Начало процедуры ________час ________мин. Дата «______» __________201___ год ЧСС______ уд/мин. АД ___________мм. рт. ст.
Окончание процедуры _______час_______мин. Дата «______» __________201___ год ЧСС______ уд/мин. АД____________мм. рт. ст.
Время терапии:_____________ Общий объем ультрафильтрации___________ мл. Объем диализата ______________ мл.
Объем замещения постдилюция/предилюция _________________ мл.
Общая доза антикоагулянта за процедуру ______________________ЕД.
Одноразовые расходные материалы (класс В) утилизированы и окончательная обработка аппарата произведена
Врач: ______________________________ ССД: ______________________ / ______________________
______________________________ ______________________ / ______________________
Приложение 13
Карта гемофильтрации / гемодиафильтрации с цитратной антикоагуляцией
Карта № __________ Журнал №__________ Аппарат_____________________
Набор________________ Гемодиализатор ______________ Замещающая жидкость __________________________
Фамилия_____________________________________Имя_________________________________Отчество________________________________
Дата рождения_____________________________ Код №_____________________________ История №____________________
Домашний адрес __________________________________________________________________________________________________________
Диагноз_____________________________________________________________________________________________________________________________________________________________________________________________________________________________________________________
Начало процедуры _________час _______мин. Дата «____» _________201___ год ЧСС_________ уд/мин. АД _________мм. рт. ст.
Окончание процедуры ______час ______мин. Дата «____» _________201___з год ЧСС_________ уд/мин. АД _________мм. рт. ст.
Время терапии:_____________ Общий объем ультрафильтрации___________ мл.
Объем диализата _________________мл. Объем замещения _________________мл.
4% натрия цитрат 250 мл №_________ за процедуру_________ мл
Кальция хлорид/глюконат 10% ________ мл за процедуру.
Магния сульфат 25% _________________________ мл за процедуру.
Фактическая ультрафильтрация_______ мл.
Одноразовые расходные материалы (класс В) утилизированы и окончательная обработка аппарата произведена
Врач: ____________________ Процедурные м/с (м/б): ____________________________
Приложение 14
Карта центрифужного плазмафереза/плазмообмен
Процедура: №_________________ Журнал: № _____________ Дата:
Ф.И.О. пациента: ____________________
Дата рождения:_________________________ Отделение: ______________________________
АЛЛЕРГОАНАМНЕЗ:_______________________________________________________________
_________________________________________________________________________________
Аппарат:_______________________________________________
Заместительный раствор:__________________________________________________________
Инфузия до: ______________________________________ ____________ мл. в/в кап., в/в стр.
Инфузия после: ___________________________________ ___________ мл. в/в кап., в/в стр.
4 % цитрат натрия 250 мл. № _________ Использованный объем: _____________________ мл
Другой антикоагулянт:_____________________________ Общая доза__________
Объем эксфузии: __________________ мл. Объем обработанной крови: ___________________ мл
Начало процедуры: ___________ ч/мин. Конец процедуры: ___________ ч/мин.
Время процедуры: ___________ ч/мин.
| до процедуры | конец процедуры | через 15 мин после процедуры | ||||
| АД | ||||||
| пульс | ||||||
| температура |
Сосудистый доступ: ___________________________________________________________________
Осложнение: _________________________________________________________________________
Особенности: ________________________________________________________________________
Дополнительное лечение: ___________________________________________________________
Врач: ____________________________ ССД: _______________________________
Приложение 15
Карта мембранного плазмообмена
Карта № ______ Журнал №_______ ИБ №__________ Дата_____________
ФИО пациента ________________________________________ Дата рождения_______________
Отделение _______________________ Кит№ _________
Плазмафильтр ____________ Гепарин всего на процедуру ___________ЕД.
Начало процедуры_________ Окончание процедуры ___________ Длительность терапии _______
Кровоток ________ мл/мин. Плазмоток _________ мл/мин. Объем замещения __________ мл.
Заместительный раствор ______________________ Гепарин ___________ ЕД мл/ч
Объем эксфузии __________________ мл.
| Время, ч:мин | ||||||
| Время терапии |
До про цедуры |
После процедуры |
||||
|
АД |
|
|||||
| ЧСС |
|
|||||
|
АСТ |
||||||
|
Скорость Плазмотока, мл/мин |
||||||
| Гепарин, ЕД/час | ||||||
| Дополнительно |
Врач: _______________________
ССД: ________________________
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
НАЦИОНАЛЬНЫЕ РЕКОМЕНДАЦИИ
Разработчик:
Ассоциация Нефрологов России
Научное общество нефрологов России
Рабочая группа:
Руководители группы
А.В. Смирнов, директор Научно-исследовательского института нефрологии Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, д.м.н., профессор
В.А. Добронравов, заместитель директора Научно-исследовательского института нефрологии Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, д.м.н., профессор
Члены группы
E.М. Шилов, заведующий кафедрой нефрологии и гемодиализа Института профессионального образования Первого Московского государственного медицинского университета им. И.М. Сеченова, главный внештатный специалист нефролог Министерства Здравоохранения России. д.м.н., профессор
А.Ш. Румянцев профессор кафедры факультетской терапии медицинского факультета Санкт-Петербургского государственного университета, д.м.н.
А.М. Есаян, заведующий кафедрой нефрологии и диализа Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, д.м.н., профессор
И.Г. Каюков, заведующий лабораторией клинической физиологии почек Научно-исследовательского института нефрологии Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, д.м.н., профессор
А.Г. Кучер , профессор кафедры пропедевтики внутренних болезней Первого Санкт-Петербургского государственного медицинского университета им. акад. И.П. Павлова, д.м.н.
А.В. Ватазин, руководитель отдела оперативной нефрологии и хирургической гемокоррекции Московского областного научно-исследовательского института им. М.Ф. Владимирского, д.м.н., профессор
2015 г.
Список сокращений
АВ — атриовентрикулярная (блокада, проводимость)
АД — артериальное давление
АДГ — антидиуретический гормон
АИК — аппарат искусственного кровообращения
АКШ — аортокоронарное шунтирование
АНЦА — антинейтрофильные цитоплазматические аутоантитела (аутоантитела к цитоплазме нейтрофилов)
АТ II — ангиотензин II
АФС — антифосфолипидный синдром
АЦЦ — N-ацетилцистеин
АЧТВ — активированное частичное тромбопластиновое время
БКК — блокаторы кальциевых каналов
БПНС — быстропрогрессирующий нефритический синдром
БРА — блокаторы рецепторов ангиотензина II
БЭН — белково-энергетическая недостаточность
ВПВ — верхняя полая вена
ГБМ — гломерулярная базальная мембрана
ГД — гемодиализ
ГДФ — гемодиафильтрация
ГЛПС — геморрагическая лихорадка с почечным синдромом
ГМК — гладкомышечные клетки
ГН — гломерулонефрит
ГРС — гепаторенальный синдром
ГУС — гемолитико-уремический синдром
ГЭК — гидроксиэтилкрахмалы
ДЗЛА — давление заклинивания легочной артерии
ДЗЛК — давление заклинивания в легочных капиллярах
ДИ — доверительный интервал
ДК — дендритные клетки
ДПП — давление в правом предсердии
ЗПТ — заместительная почечная терапия
иАПФ — ингибиторы ангиотензинпревращающего фермента
ИВЛ — искусственная вентиляция легких
ИРП — ишемическое реперфузионное повреждение
ИТН — ишемический тубулярный некроз
ИФА — иммуноферментный анализ
ИХА — иммунохроматографический анализ
КИ-ОПП — контраст-индуцированное острое повреждение почек
КИУП — контраст-интенсифицированная ультрасонография почек
ККОС — клубочково-канальцевая обратная связь
КОС — кислотно-основное состояние
КРС — кардиоренальный синдром
КТ — компьютерная томография
КФ — клубочковая фильтрация
КФО — комплексное функциональное обследование почек
ЛДГ — лактатдегидрогеназа
ЛПС — липополисахариды
ММ — молекулярная масса
МО — мочевая обструкция
МОД — минутный объем дыхания
МПГН — мембрано-пролиферативный гломерулонефрит
МРТ — магнитно-резонансная томография
МТ — масса тела
ННА — ненаркотические анальгетики
НПВ — нижняя полая вена
НПВП — нестероидные противовоспалительные препараты
НПЗТ — непрерывная почечная заместительная терапия
ОБП — острая болезнь почек
ОГПС — острый гем-пигментный синдром
ОИН — острый интерстициальный нефрит
ОИТН — острый ишемический тубулярный некроз
ОКН — острый кортикальный некроз
ОКРС — острый кардиоренальный синдром
ОМ — объем мочи
ОНС — острый нефритический синдром
ОПН — острая почечная недостаточность
ОПП — острое повреждение почек
ОПСС — общее периферическое сосудистое сопротивление
ОРДС — острый респираторный дистресс-синдром
ОРИТ — отделение реанимации и интенсивной терапии
оРТПХ — острая реакция трансплантат против хозяина
ОСН — острая сердечная недостаточность
ОТИН — острый тубулоинтерстициальный нефрит
ОТИНС — тубулоинтерстициальный нефритический синдром
ОТН — острый тубулярный некроз
ОТТН — острый токсический тубулярный некроз
ОЦК — объем циркулирующей крови
ОЦП — объем циркулирующей плазмы
п/ж — подкожно-жировая (клетчатка)
ПД — перитонеальный диализ
ПДКВ — положительное давление в конце выдоха
ПМЯЛ — полиморфноядерные лейкоциты
ПНГ — пароксизмальная ночная гемоглобулинурия
ПОЛ — перекисное окисление липидов
ПОПП — преренальное острое повреждение почек
ПЦР — полимеразная цепная реакция
РААС — ренин-ангиотензин-альдостероновая система
РАС — ренин-ангиотензиновая система
РДСВ — респираторный дистресс-синдром взрослых
РКИ — рандомизированное клиническое исследование
РКС — рентгеноконтрастные средства
РМА — реакция микроагглютинации
РСК — реакция связывания комплемента
РТ — рост РТПО — реакция трансплантат против опухоли
РТПХ — реакция трансплантат против хозяина
СВ — сердечный выброс
СД — сахарный диабет
СЗП — свежезамороженная плазма
СИАГ — синдром интраабдоминальной гипертензии
СИИ — строгий ионный интервал
СК — система комплемента
СКВ — системная красная волчанка
СКФ — скорость клубочковой фильтрации
СЛОК — синдром лизиса опухолевых клеток
СН — сердечная недостаточность
СНС — симпатическая нервная система
СОС — синдром обструкции синусоидов печени
ССВО — синдром системного воспалительного ответа
ССВР — синдром системной воспалительной реакции
СХАЭ — синдром холестериновой атероэмболии
ТБМ — тубулярная базальная мембрана
ТГCК — трансплантация гемопоэтических стволовых клеток
ТИН — тубулоинтерстициальный нефрит
ТМА — тромботическая микроангиопатия
ТПН — терминальная почечная недостаточность
ТТН — токсический тубулярный некроз
ТТП — тромботическая тромбоцитопеническая пурпура
ТЭЛА — тромбоэмболия легочной артерии
УФ — ультрафильтрация
ФВЛЖ — фракция выброса левого желудочка
ФДЭ — фосфодиэстераза
ФР — фактор риска
ФЭNa — фракционная экскреция натрия
ХБП — хроническая болезнь почек
ХКПС — хантавирусный кардиопульмональный синдром
ХНТВ — хантавирусы
ХНТВИ — хантавирусные инфекции
ХСН — хроническая сердечная недостаточность
ЦВД — центральное венозное давление
цАМФ — циклический аденозинмонофосфат
цГМФ — циклический гуанозинмонофосфат
ЦМВ — цитомегаловирус
ЦП — цирроз печени
ЭК — эпителиальные клетки
ЭКК — экстракорпоральный контур
ЭН — эпидемическая нефропатия
ЭПР — эндоплазматический ретикулум
ЭЦО — эффективный циркулирующий объем
ЮВД — югулярное венозное давление
ЮГА — юкстагломерулярный аппарат
ACT — актированное время свертывания
BNP — натрийуретический пептид B-типа
Ccr — клиренс креатинина
CIN — ингибиторы кальциневрина
CРБ — C-реактивный белок
HGF — фактор роста гепатоцитов
HHV-6 — вирус герпеса шестого типа
IGF — инсулиноподобный фактор роста
IL — интерлейкины
KIM — молекула почечного повреждения
NGAL — нейтрофильный желатиназо-ассоциированный липокалин
PAF — фактора активации тромбоцитов
ROS — реактивные радикалы кислорода
Scr — концентрация креатинина в сыворотке крови
TGF — трансформирующий фактор роста
TLR — Toll-подобные рецепторы
TNF — фактор некроза опухолей
TNFR — рецептор фактора некроза опухоли
VEGF — сосудистый эндотелиальный фактор роста
Методика оценки силы рекомендаций и уровня их предсказательности, использованная при составлении данных клинических рекомендаций*.
По силе рекомендации подразделяются на три категории в убывающем порядке: уровень 1 (эксперты рекомендуют); уровень 2 (эксперты предлагают); «недифференцированный уровень» (табл.1). Сила предсказательности рекомендаций подразделена на 4 уровня (табл. 2).
|
Уровень |
Оценка рекомендаций |
||
|
Со стороны пациентов |
Со стороны врача |
Дальнейшее направление использования |
|
|
Уровень 1 |
Подавляющее большинство пациентов, оказавшихся в подобной ситуации, предпочли бы следовать рекомендуемым путем и лишь небольшая часть из них отвергли бы этот путь |
Подавляющему большинству своих пациентов врач будет рекомендовать следовать именно этим путем |
Рекомендация может быть принята в качестве стандарта действия медицинского персонала в большинстве клинических ситуаций |
|
Уровень 2 |
Большая часть пациентов, оказавшихся в подобной ситуации, высказались бы за то, чтобы следовать рекомендуемым путем, однако значительная часть отвергла бы этот путь |
Для разных пациентов следует подбирать различные варианты рекомендаций, подходящие именно им. Каждому пациенту необходима помощь в выборе и принятии решения, которое будет соответствовать ценностям и предпочтениям данного пациента |
Рекомендации, вероятно, потребуют обсуждения с участием всех заинтересованных сторон до принятия их в качестве клинического стандарта |
|
Уровень 3 |
Данный уровень применяется в тех случаях, когда в основу рекомендации укладывается здравый смысл исследователя-эксперта или тогда, когда обсуждаемая тема не допускает адекватного применения системы доказательств, |
| Уровень | Характеристика уровня предсказательности | Значение/описание |
|---|---|---|
|
А |
Высокий |
Эксперты абсолютно уверены в том, что при выполнении данной рекомендации, наблюдаемый эффект почти полностью совпадет с ожидаемым. |
|
В |
Средний |
Эксперты ожидают, что при выполнении данной рекомендации, наблюдаемый эффект скорее всего будет близок к ожидаемому, однако не исключается возможность того, что он будет существенно отличаться от него. |
|
С |
Низкий |
Предсказываемый эффект может существенно отличаться от реального. |
|
D |
Очень низкий |
Предсказание эффекта крайне ненадежно и очень часто будет отличаться от реального. |
* — в соответствии с клиническими рекомендациями KDIGO.
Введение
Острое повреждение почек (ОПП) – широко распространенное и чрезвычайно опасное состояние, которое, несмотря на совершенствование медицинских технологий , зачастую трудно и несвоевременно диагностируется и является причиной неблагоприятных исходов, в том числе, летального.
ОПП – понятие, вошедшее в медицинский лексикон сравнительно недавно и повсеместно заменившее известный термин – острая почечная недостаточность (ОПН).
Данная замена, обусловлена несколькими обстоятельствами, в том числе, необходимостью унифицировать критерии диагностики и стратификации тяжести острого поражения/дисфункции почек. Например, например, только в англоязычной литературе фигурировало более 30 определений острой почечной недостаточности Такая ситуация не позволяла дать даже минимально объективную оценку результатам исследований по эпидемиологии и изучению исходов этого состояния. В частности, заболеваемость ОПН по данным ряда разработок варьировала от 1 до 31%, а летальность составляла от 19 до 83% [Hoste E.A. и соавт., 2006].
Однако главным основанием для создания понятия ОПП послужило накопление сведений о том, что даже незначительное транзиторное нарастание концентрации креатинина в сыворотке крови (Scr) ассоциируется с резким увеличением летальности. Такое повышение смертности наблюдается как в раннем, так и отдаленном периодах. При этом летальный исход далеко не всегда определяется «почечными» причинами [Chertow G.M. и соавт., 2005]. Все это позволило предположить, что при определенных ситуациях активируется достаточно сложная система патогенетических связей, ведущая не только к повреждениям собственно почечной ткани, но и других органов и систем. Такие представления легли в основу концептуальной модели ОПП, которая при наличии этиологической причины и, возможно, предрасполагающих обстоятельств (факторов риска) предусматривает переход от «нормы» до возможного летального исхода. Этот переход осуществляется через ряд этапов, многие из которых еще являются потенциально обратимыми. Иными словами, модель отражает этапность формирования данного состояния в тесной связи с развитием различных внепочечных осложнений или проявлений ОПП (рис.1). В этом смысле концепция ОПП тесно сближается с представлениями о ХБП [Murugan R., Kellum J.A., 2011].
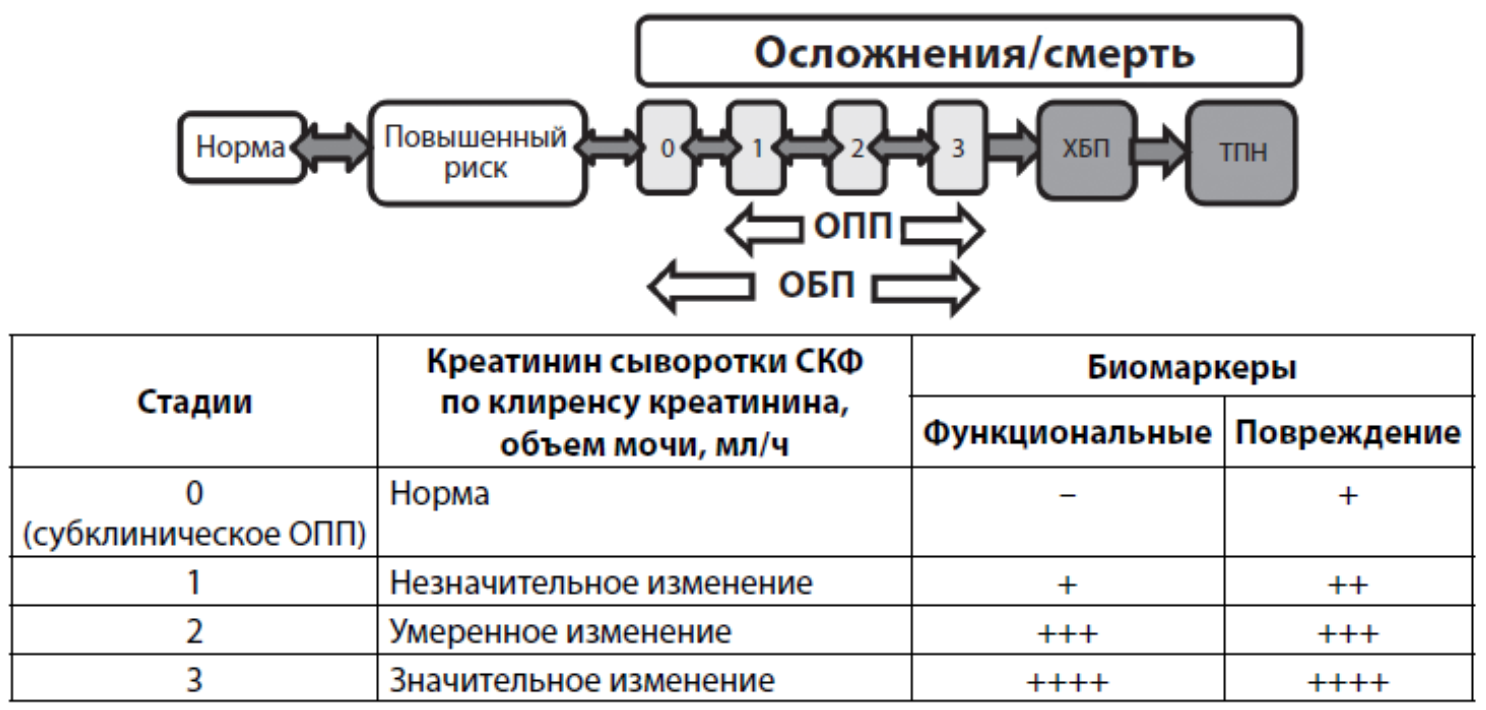
Рисунок 1. Концептуальная модель ОПП
Становление понятия ОПП и внедрение его в медицинскую практику прошло через ряд этапов. Первоначально , группой экспертов Acute Dialysis Quality Initiative (ADQI) была предпринята попытка унифицировать определение и стратификацию тяжести ОПН . Предложения ADQI по данному вопросу (система RIFLE) были представлены в 2002 г. Эта система базировалась на величинах диуреза, Scr и Ccr стратифицировала ОПН по тяжести на пять функциональных классов [Bouman C и соавт., 2002].
Так или иначе, нетерпимость сложившегося положения в отношении определения и стратификации тяжести ОПН требовала какого-то решения. Попытка поиска такого решения была предпринята группами экспертов Acute Dialysis Quality Initiative (ADQI), а позже — Acute Kidney Injury Network (AKIN). Эксперты ADQI справедливо сочли, что диагностика ОПН (в настоящее время ОПП) должна базироваться на простых, доступных любому лечебному учреждению показателях: объем e мочи (диурезe), концентрации креатинина в сыворотке крови (Scr) и, в ряде ситуаций, клиренса креатинина (Ccr). В 2002 г. ADQI были предложены определение ОПП и критерии стратификации его тяжести (система RIFLE). Эта система базировалась на величин ах диуреза, Scr и клиренса креатинина (Ccr) и стратифицировала ОПН по тяжести на пять функциональных классов [Bouman C. и соавт., 2002].
Система критериев RIFLE неплохо зарекомендовала себя на практике, хотя бы в отношении предсказания исходов у пациентов с ОПН [Hoste E.A. и соавт., 2006]. Но оказалось, что эта система не лишена ряда недостатков. Например, много вопросов вызывало наличие в классификации классов R (риск) и E (терминальная почечная недостаточность). Очевидно, что риск развития какого-либо заболевания или патологического состояния — не само это состояние или заболевание. Не менее понятно, что ТПН (класс E) — исход ОПН, а никак не само ОПН. Эти и некоторые другие соображения побудили к поиску модификаций классификационных систем острой патологии почек.
Позже участниками группы ADQI, представителями трех нефрологических ассоциаций (ASN, ISN и NKF) и Европейского Общества Интенсивной Терапии (European Society of Intensive Care Medicine) на встрече в Виченце (Италия) в 2004 г. было предложена концепция «острого повреждения почек» (ОПП – acute kidney injury – AKI). При этом ОПП рассматривалось, как более широкое понятие, чем собственно ОПН [Mehta R.L. и соавт., 2007]. Там же была создано сообщество экспертов различных специальностей Acute Kidney Injury Network (AKIN), которым надлежало проводить дальнейшую разработку проблемы ОПП.
Первые результаты деятельности группы AKIN были опубликованы в 2007 г., они коснулись вопросов уточнения диагностических критериев и стратификации тяжести ОПП (AKIN-критерии). AKIN-критерии предполагали стратификацию тяжести ОПП на три стадии в зависимости от концентрации креатинина в сыворотке крови и объема мочи (диуреза). Величина СКФ (клиренс креатинина) из критериев диагностики и стратификации тяжести ОПП была исключена [Mehta R.L. и соавт., 2007].
Дальнейшее развитие концепции ОПП связано с деятельностью международной группы экспертов Kidney Disease Improving Global Outcomes (KDIGO), которой были несколько модифицированы определение, критерии диагностики, стратификации тяжести ОПП и подготовлены подробные Клинические Рекомендации [KDIGO Clinical Practice Guideline…, 2012]. Несмотря на имеющиеся недостатки, предложения KDIGO в настоящее время стали общепринятыми и в той или иной степени послужили основой для разработки целого ряда национальных Рекомендаций, в том числе, и представленных ниже.
РАЗДЕЛ I. Острое повреждение почек, как важная медицинская и социальная проблема
Рекомендация 1.1
Внедрение концепции ОПП в практическую работу системы национального здравоохранения следует рассматривать, как важный стратегический, междисциплинарный подход к снижению общей смертности и заболеваемости хронической болезнью почек и сердечно-сосудистой патологий, к увеличению продолжительности жизни населения, а также к уменьшению расходов на госпитальное лечение осложнений острого нарушения функции почек и проведение заместительной почечной терапии. (1А)
Комментарий
ОПП является полиэтиологическим состоянием. Оно может вызываться внешними воздействиями, которые накладываются на здоровые или больные почки, или быть связаны с первичным повреждением органа (подробнее см. Рекомендация 4.1., Табл.15).
При этом этиологическая и эпидемиологическая структура ОПП может существенно различаться в зависимости от того формируется оно на догоспитальном этапе (“внебольничное ОПП”) или развивается уже в стационаре (“внутрибольничное ОПП”). Усредненная оценка их частоты в процентном соотношении приведена в Таблице 3.
| ОПП | Внебольничное | Внутрибольничное | ОПП в ОРИТ |
|---|---|---|---|
|
Суммарная частота |
≈ 10%* |
3—7% |
25—30% |
|
Преренальное ОПП и ишемический ОТН |
70% |
39—50%** |
17—48%*** |
|
Токсический ОТН |
5% |
35% |
35,4% |
|
Острый интерстициальный нефрит |
5% |
10% |
— |
|
Гломерулярное ОПП |
3% |
5% |
— |
|
Постренальное ОПП |
17% |
— |
— |
Примечание: * — в развивающихся странах частота внебольничного ОПП более 50%; ** — около 10% из общего числа — сепсис; *** — три главных причины: сепсис, гиповолемия и гипотония, хирургические вмешательства. ОТН — острый тубулярный некроз; ОПП — острое повреждение почек; ОРИТ — отделение реанимации и интенсивной терапии.
Более точные сведения об этиологической структуре внутрибольничного ОПП можно получить из недавно опубликованной работы Zeng X. И соавт. [2014] (Табл.4).
| Вид патологии | Число больных с данной патологией | *Доля пациентов с ОПП, % |
|---|---|---|
|
Сепсис |
1277 |
68,4 |
|
Пневмония |
1566 |
52,5 |
|
Застойная сердечная недостаточность |
2738 |
47,4 |
|
Острый инфаркт миокарда |
1631 |
46,4 |
|
Хроническая болезнь почек |
539 |
45,6 |
|
Лимфопролиферативные заболевания |
758 |
33,6 |
|
Заболевания печени |
647 |
33,1 |
|
Ревматические заболевания |
866 |
21,5 |
|
Солидные злокачественные опухоли |
7735 |
21,0 |
|
Гипертензивные состояния при беременности |
946 |
6,1 |
|
Искусственная вентиляция легких |
2989 |
63,9 |
|
Критические состояния |
3277 |
60,3 |
|
Трансплантация гемопоэтических стволовых клеток |
1519 |
55,9 |
|
Кардиохирургические оперативные вмешательства |
433 |
52,2 |
|
Оперативные вмешательства на сосудах |
1243 |
50,0 |
|
Торакальные хирургические вмешательства |
1418 |
47,3 |
|
Рентгеноконтрастные средства |
2938 |
34,2 |
|
Абдоминальные хирургические вмешательства |
2720 |
27,2 |
|
Акушерские процедуры |
6777 |
1,0 |
Примечание. * — суммарно все стадии ОПП
В любом случае эти данные свидетельствуют о том, что с ОПП может встретиться врач практически любой специальности и подчеркивают мультидисциплинарность даной проблемы.
По суммарным данным заболеваемость ОПП варьирует от 140 до 2880 случаев на миллион населения в год. При этом отмечается нарастание заболеваемости на 400 % с 1988 по 2002 г. [Case J. и соавт., 2013]. По другим данным общая частота новых случаев ОПП за период с 1996 по 2003 год увеличилась с 322,7 до 522,4 новых случаев ОПП на 100 000 населения, а число больных с ОПП, требующих ЗПТ, возросло за тот же период с 19,5 до 29,6 на 100 000 населения [Hsu C.Y. и соавт., 2007].
Интегрированные результаты исследований последних лет свидетельствуют о том, что заболеваемость ОПП в общей популяции достигает 0,25%, что сравнимо с заболеваемостью инфарктом миокарда [Piccinni P. и соавт., 2011].
Распространенность ОПП также достаточно высока. Если принять во внимание только случаи, потребовавшие гемодиализа то по имеющимся оценкам она составляет от 183 до 295 пациентов на млн населения в год (Табл.5).
| Авторы | Страна, регион | Распространенность, пмн/г* |
|---|---|---|
|
Hsu C.Y.и соавт., 2007 |
Северная Калифорния, США |
295 |
|
Ali T. и соавт., 2007 |
Grampian, Шотландия |
183 |
|
Metcalfe W. и соавт., 2002 |
Grampian, Highland, Tayside, Шотландия |
203 |
|
Prescott G.J. и соавт., 2007 |
Шотландия |
286 |
|
Liano F., Pascual J., 1996 |
Испания |
209 |
Примечание. * пациентов на млн населения в год
Исходы ОПП остаются неудовлетворительными. Несмотря на успехи в развитии медицинских технологий летальность при данном состоянии высока. В существенной мере она зависит от этиологии ОПП (Табл. 6).
| Популяция пациентов | Смертность, %, (дефиниция ОПП) | Источники | |
|---|---|---|---|
|
Смешанная |
7,1-72,6 (AKIN-AKIN) |
Mandelbaum T. и соавт., 2011 |
Samimagham H.R. R, и соавт., 2011* |
|
Сепсис |
24,2-62,8 (RIFLE– RIFLE) |
Bagshaw и S.M. соавт., 2008 |
Lerolle N. и соавт., 2006 |
|
Ожоги |
7,6-34,4 (RIFLE– RIFLE) |
Coca S.G. и соавт., 2007 |
Palmieri T. и соавт., 2010 |
|
Травма |
8,2-16,7 (RIFLE– RIFLE) |
Gomes E. и соавт., 2010 * |
Bagshaw S.M. и соавт., 2008 |
|
КИ-ОПП |
18-31 (AKIN- RIFLE) |
Lakhal K. и соавт., 2011* |
Rashid A.H. и соавт., 2009* |
|
Кардиохирургия |
1,3-12,6 (RIFLE-RIFLE) |
Englberger L. и соавт., 2011 |
Machado M.D.N. и соавт., 2011 |
Примечание. * — анализировались пациенты, находящиеся в ОРИТ.
При этом смертность от ОПП превышает суммарную смертность от рака молочной железы, рака простаты, сердечной недостаточности и диабета [Lewington A.J.P. и соавт. , 2013].
Неблагоприятные исходы ОПП не исчерпываются высокой смертностью. ОПП является важной причиной развития ХБП. Данные эпидемиологических, проспективных исследований последних лет свидетельствуют о том, что пациенты, которые изначально имели нормальную функцию почек и перенесли ОПП, после которого функция почек восстановилась до базальных значений, имеют более высокий риск развития ХБП. У 15% из общего числа данных пациентов через 2,5 года формируется стойкая дисфункция почек на уровне 3 ст. ХБП [Jones J. и соавт., 2012]. Примерно у 10% детей, перенесших ОПП, через 1–3 года формируется ХБП [Mammen C. и соавт., 2012 ]. Риск развития ХБП у пациентов, которые имели нормальную функцию почек до возникновения ОПП и в последующем восстановили её до базальных значений в течение короткого периода (90 дней), особенно высок в первые 2-3 года [Bucaloiu I.D. и соавт., 2012; Jones J. и соавт., 2012]. Данные метаанализа свидетельствуют, что после перенесенного ОПП относительный риск формирования ХБП или ТПН соответственно составляет 8,82 (ДИ95% 3,05–25,48) и 3,10 (ДИ95% 1,91–5,03) [Coca S.G. и соавт., 2012].
Этиологическая роль ОПП в развитии ХБП, очевидно, увеличивает и потребность в заместительной почечной терапии (Табл. 7).
| Автор | Период исследования | Число обследованных больных | Доля (%) пациентов, требующих постоянной ЗПТ |
|---|---|---|---|
|
Chertow G.M. и соавт., 1995 |
1991–1993 |
132 |
33% |
|
McCarthy J.T., 1996 |
1977–1979; 1991–1992 |
142 |
21% |
|
Korkeila M., 2000 |
1989–1990 |
3447 |
8% |
|
Morgera S. и соавт., 2002 |
1993–1998 |
979 |
10% |
|
Liaño F. и соавт., 1996 |
1977–1992 |
748 |
2% |
|
Palevsky P.M. и соавт., 2008 |
2003–2007 |
1124 |
24,6% в течение 60 сут |
|
Bellomo R. и соавт., 2009 |
2005–2008 |
1508 |
5,4% в течение 90 сут |
|
Van Berendoncks A.M. и соавт., 2010 |
2001–2004 |
595 |
10,3% в течение 2-х лет |
ОПП и кардиоваскулярные риски. Тесная взаимосвязь между состоянием функции почек и поражениями кардиоваскулярной системы в настоящее время считается аксиомой. При этом снижение СКФ является одной из важнейших детерминант сердечнососудистого риска. В свою очередь, патология кардиоваскулярной системы способствует развитию почечных повреждений (кардиоренальный континуум, острые и хронические кардиоренальные и ренокардиальные синдромы) [Смирнов А.В. и соавт., 2005; Ronco C. и соавт., 2008].
Хорошо известно, что различные острые сердечно-сосудистые проблемы могут стать причинами ОПП (острый кардиоренальный синдром, кардиоренальныий синдром тип 1) [Ronco C. и соавт., 2008 ]. С другой стороны, действующая классификация предполагает выделение острого ренокардиального синдрома (кардиоренальный синдром тип 3). В данном случае эпизод ОПП приводит к развитию острого повреждения/дисфункции сердечно-сосудистой системы [Ronco C. и соавт., 2008; Bagshaw S.M. и соавт., 2013]. Однако, как показали результаты недавнего исследования, выполненного на Тайване, перенесение ОПП, потребовавшего диализа с полным восстановлением функции почек, в отдаленном периоде ассоциируется с большей вероятностью появления коронарной патологии и величиной кардиваскулярной летальности по сравнению с пациентами без ОПП [Wu VC и соавт., 2014]. Эти данные дают основания выделять таких больных в группу повышенного кардиоваскулярного риска.
Сам факт перенесения ОПП определяет не только плохой прогноз, но и связан с существенными дополнительными расходами . Так, уже в 2000 г затраты на одного выжившего с ОПП в течение 6-месячного срока достигли $80000 [Korkeila M. и соавт., 2000]. К 2005 г. общие расходы на госпитальное лечение ОПП достигли 9 млрд. $ [Chertow G.M. и соавт. 2005].
Приведенные выше данные диктуют необходимость, во-первых, организации динамического (диспансерного) наблюдения, во-вторых, осуществления комплекса мероприятий по нефропротекции и, в-третьих, понимания проблемы организаторами здравоохранения при проспективном планировании потребности в ЗПТ.
РАЗДЕЛ II. Определение и классификация острого повреждения почек
Рекомендация 2.1
Под ОПП следует понимать быстрое развитие дисфункции органа в результате непосредственного воздействия ренальных или экстраренальных повреждающих факторов. (NG)
Комментарий
В патогенетическом плане ОПП следует рассматривать как совокупность механизмов, связанных с повреждением различных компартментов почки и приводящих к дисфункции органа в первую очередь в результате нарушения процессов клубочковой фильтрации и экскреции, с последующими нарушениями системного гомеостаза.
Отдельную проблему представляют сроки появления почечной дисфункции после неблагоприятного воздействия или развития острого заболевания (в том числе, заболевания почек). Чисто условно, было принято, что появление острой дисфункции почек должно происходить в срок до семи суток от момента индукции. Однако, в конкретной клинической ситуации данный срок может существенно изменяться. Решение данного вопроса должно приниматься индивидуально в каждом отдельном случае.
Существенно подчеркнуть, что приведенное выше определение ОПП, полностью соответствующее принципам действующих на сегодняшний день международных рекомендаций, является скорее “функциональным”. При этом и определение и классификационные системы KDIGO, RIFLE и AKIN по сути ориентированы на больных с острыми вторичными повреждениями почек, но не охватывает случаи острых повреждений почек на фоне их первичных паренхиматозных заболеваний, что противоречит самой концепции ОПП, которое исходно рассматривалось, как более широкое понятие, чем привычное ОПН. Например, Waikar S.S. и соавт. [2008] отметили, что «снижение СКФ не всегда наблюдается даже в случаях тяжелого паренхиматозного повреждения почек, что, например, может иметь место при волчаночном нефрите». В то же время «редукция СКФ может встречаться в ситуациях без явной [почечной] патологии, в частности, при некоторых вариантах «преренальной азотемии». Отсюда следует то, что замена привычного термина ОПН на ОПП может не иметь существенного смысла, поскольку диагностические критерии AKIN или KDIGO построены сугубо на функциональных параметрах». С этим трудно не согласится. Например, при целом ряде паренхиматозных заболеваний почек (острый пострептококковый гломерулонефрит, острый интерстициальный инефрит) острый процесс может захватить орган, привести к появлению признаков повреждения (например, микроальбуминурии, протеинурии, гематурии), но не сказаться существенно на состоянии функции, особенно если ее оценивать по таким довольно грубым критериям, как диурез или Scr. В дальнейшем этот процесс может более или менее успешно разрешиться. Очевидно, что, в данной ситуации нельзя утверждать, что здесь нет острого повреждения почек. В то же время с действующих позиций оно диагностировано не будет. Мимо этой проблемы не прошли и эксперты KDIGO, обратив внимание на то, что встречаются ситуации, которые не соответствуют критериям ни ХБП, ни ОПП. Поэтому эксперты KDIGO предложили определение “острой болезни почек (ОБП) — острого почечного расстройства” [acute kidney diseases and disorders (AKD)] (Табл. 8). Если принять, что диагноз ОБП, в том числе, может быть обоснован только на наличии маркеров структурного повреждения (без изменений Scr или СКФ), то концепция острой почечной патологии обретает необходимую стройность. При этом ОПП является составной частью ОБП. К случаям неизвестной болезни почек (НБП) следует относить ситуации с нарастанием Scr в течение 7 сут менее, чем в 1,5 раза от базального при неопределенности нозологических признаков почечной патологии.
| Состояние | Функциональные критерии | Маркеры структурного повреждения |
|---|---|---|
|
ОПП |
ОПП или СКФ менее 60 мл/мин <3 месяцев, при снижении СКФ до не менее 35% от базального уровня, или повышение Sсr не менее 50% в течение до 3 мес |
Панель маркеров структурного повреждения не разработана |
|
ОБП |
Наличие ОПП или СКФ менее 60 мл/мин <3 месяцев, при снижении СКФ до не менее 35% от базального уровня, или повышение Sсr не менее 50% в течение до 3 мес |
Персистирование маркеров структурного повреждения до 3 мес |
|
ХБП |
СКФ<60 мл/мин в течение более 3 мес |
Персистирование маркеров структурного повреждения более 3 мес |
|
НБП |
СКФ не менее 60 мл/мин; нарастание Scr в течение 7 последовательных суток менее, чем в 1,5 раза от базального уровня |
Маркеры структурного повреждения отсутствуют |
ОБП пока не является общепринятым понятием и на сегодняшний день не должно фигурировать в диагнозе.
Рекомендация 2.2
В практической деятельности ОПП следует определять в соответствии с рекомендациями KDIGO, как наличие, как минимум, одного из следующих критериев:
-
нарастание Scr ≥ 0,3 мг/дл (≥ 26,5 мкмоль/л) в течение 48 ч,
или
-
нарастание Scr ≥1,5 раза от исходного, которое, как известно или предполагается, произошло в течение 7 суток,
или
-
объем мочи < 0,5 мл/кг/ч в течение 6 ч.
Рекомендация 2.3
В клинической практике ОПП следует стратифицировать по тяжести согласно следующим критериям KDIGO. (NG)
| Стадия | Scr | Объем выделяемой мочи |
|---|---|---|
|
1 |
В 1,5-1,9 раза выше исходного или повышение на ≥0,3 мг/дл (≥26,5 мкмоль/л) |
<0,5 мл/кг/час за 6-12 часов |
|
2 |
в 2,0-2,9 раза выше исходного |
<0,5 мл/кг/час за ≥12 часов |
|
3 |
в 3,0 раза выше исходного или повышение до ≥4,0мг/дл (≥353,6/мкмоль/л) или начало заместительной почечной терапии или у больных < 18 лет, снижение рСКФ до <35 мл/мин на 1,73 м2 |
<0,3 мл/кг/час за ≥24 часа или анурия в течение ≥12 часов |
Комментарий
Как следует из приведенного выше, выявление и стратификация тяжести ОПП базируется на использовании двух диагностических тестах – концентрации креатинина в сыворотке крови и объеме мочи. Такой выбор был обусловлен повсеместной распространенностью и доступностью данных параметров. Однако необходимо иметь в виду, что оба эти теста не идеальны.
Предполагается, что концентрация креатинина в сыворотке крови обратно связана с величиной скорости клубочковой фильтрации и рост Scr должен строго соответствовать снижению СКФ. Тем не менее, давно известно, что креатинин экскретируется не только за счет гломерулярной фильтрациив, но и путем канальцевой секреции. Предсказать вклад секреции в выведение креатинина у конкретного индивидуума особенно страдающего тяжелой патологией почек, невозможно. К роме того концентрация креатина в сыворотке крови подвержена влиянию целого ряда факторов, не имеющих прямого отношения к состоянию функции почек (Табл. 10).
| Снижение концентрации | Повышение концентрации |
|---|---|
|
Низкая мышечная масса |
Высокая мышечная масса |
Примечание. * — блокируют канальцевую секрецию креатинина.
Концентрация креатинина в сыворотке крови является малочувствительным индексом. Отчетливое нарастание уровня сывороточного креатинина происходит тогда, когда глобальная функциональная способность почек уменьшается вдвое (Mårtensson J. и соавт., 2012; Slocum J.L. и соавт., 2012]. Кроме того из самих особенностей кинетики креатинина в организме следует, то что ее рост существенно (на несколько суток) запаздывает вслед за внезапным снижением СКФ. При этом, наиболее медленный рост Scr (во всяком случае в относительном выражении) происходит у пациентов с исходно сниженной функцией почек (исходно низкой СКФ), что может создать проблемы в диагностике “ОПП на ХБП” или дифференциальной диагностике ОПП и ХБП [Смирнов А.В. и соавт., 2009 ; Waikar S.S., Bonventre J.V., 2009].
Среди отмеченных выше принципов стратификации тяжести ОПП необходимо обратить внимание на “базальный (исходный) уровень функции почек”. В подавляющем большинстве случаев у пациентов с подозрением на ОПП исходные уровни ни Scr, ни СКФ не известны. В данной связи составлена таблица, которая позволяет быстро сориентироваться в должных исходных величинах Scr (Табл. 11). В качестве такого заданного уровня СКФ была принято ее значение 75 мл/мин [Bouman C. и соавт., 2002].
| Возраст, годы | Мужчины | Женщины |
|---|---|---|
|
20-24 |
115 |
88 |
|
25-29 |
106 |
88 |
|
30-39 |
106 |
80 |
|
40-54 |
97 |
80 |
|
55-65 |
97 |
71 |
|
>65 |
88 |
71 |
Примечание, В отличие от оригинала приведены значения Scr только для лиц европеоидной расы.
Второй важнейший критерий диагностики и стратификации тяжести ОПП – диурез. При этом следует иметь в виду, что величина объема мочи (диурез) — интегральная, но малоспецифичная характеристика функционального состояния почек, поскольку зависит от целого ряда экстраренальных и ренальных факторов. При этом сами механизмы формирования окончательной величины объема мочи весьма различны [Murugan R., Kellum J.A. 2011]. Однако если у взрослых людей диурез снижается ниже необходимого минимума, у пациента развивается олигурия (выделение за сутки менее 5 мл мочи/кг массы тела) [Bouman C. и соавт., 2002 ]. Появление олигоурии является несомненным признаком тяжелого повреждения почек [Bouman C. и соавт., 2002]. Кроме того, при ОПП изменения объема мочи могут проявляться задолго до того, как отреагируют другие общепринятые маркеры ренальной дисфункции, например, Scr [Bellomo R и соавт., 2004]. Тем не менее, проводя критический анализ системы KDIGO, Эксперты Kidney Disease Outcomes Quality Initiative (KDOQI, США) указали на низкую информативность критериев, основанных на уровне диуреза для диагностики и стратификации тяжести ОПП, по крайней мере, для взрослых [Palevsky P.M. и соавт., 2013].
По-видимому, часть ограничений диагностических возможностей концентрации креатинина в сыворотке крови и объема при ОПП могут быть сняты при использовании, т.н. “биомаркеров” ОПП (см. Рекомендацию 3.1.1).
Очень важным моментом является то, что ОПП является динамическим состоянием, выраженность ее в процессе мониторинга может меняться. Поэтому для правильной стратификации тяжести ОПП во внимание должны приниматься значения критериев, которые приводят к выбору наиболее выраженной стадии повреждения почек у конкретного пациента.
РАЗДЕЛ III. Диагностика и дифференциальная диагностика острого повреждения почек
Рекомендация 3.1
Для максимально ранней диагностики вероятной ОПП у лиц с факторами риска и ассоциированными состояниями необходим мониторинг, как минимум, следующих параметров: массы тела, темпа диуреза, креатинина, мочевины и электролитов сыворотки крови; результаты мониторирования должны быть зарегистрированы в медицинской документации и подвергаться постоянному анализу (NG)
Комментарий
Помимо уже упомянутых ограничений концентрации креатинина в сыворотке крови для диагностики и стратификации тяжести ОПП упоминалось выше (см. комментарий к рекомендациям 2.2 – 2.3). Однако, особенно, в плане мониторинга конкретного пациента с ОПП, заслуживает внимания еще один момент: влияние уровня гидрататции на Scr.
Показано, что у гипергидратированных таких пациентов уровень сывороточного креатинина может существенно занижаться, что, естественно, занижает и оценку тяжести ОПП. Выходом из этой ситуации может быть использование концентраций креатинина в сыворотке крови, корригированных на баланс жидкости:
Корригированный Scr = Scr×фактор коррекции
Фактор коррекции = [масса тела при поступлении, кг×0,6 + Σ(ежедневный кумулятивный баланс жидкости, л)]/масса тела при поступлении, кг×0,6
При этом ежедневный кумулятивный баланс жидкости рассчитывается, как сумма ежедневного баланса жидкости (поступление жидкости в сутки – минус выведение жидкости, без учета неощутимых потерь воды) [Macedo E. и соавт. 2010].
Возможно, также, что проблему невысокой информативности критериев ОПП, основанных на величине объема мочи (см. комментарий к рекомендациям 2.2 – 2.3) можно отчасти разрешить при учете почасового или даже поминутного объема мочи в режиме он-лайн. В настоящее время появились мониторы, включающие в себя блок с системой оптической регистрации скорости потока мочи с расчетом минутного объема в режиме он-лайн (flow-sensing technology) (URINFO™ Flow Sense Medical, Misgav, Israel). При этом динамическая регистрация минутного диуреза позволяет оценить состояние почечного кровотока при гиповолемии на ранних стадиях ее развития еще до того момента, когда в организме активируются процессы нейрогуморальной регуляции. Понятно, что подобная регистрация минутного диуреза в первую очередь касается соматически тяжелых пациентов, находящихся в ОРИТ [Shamir M.Y. и соавт., 2011].
Рекомендация 3.1.1
Для прогнозирования развития ОПП у пациентов с наличием факторов риска, которым планируется проведение медицинской процедуры, потенциально способной спровоцировать развитие данного состояния (например, оперативное вмешательство, рентгеноконтрастное исследование и др.) целесообразно исследование уровней биомаркеров повреждения почек и оценка их динамики до и после выполнения вмешательства. (2C)
Комментарий
Возможно, что применение биомаркеров повреждения почечной ткани в диагностике ОПП (предиктивная диагностика), по примеру использования кардиоспецифических белков в неотложной кардиологии, позволит оценивать формирование патологического процесса в почках на более ранних стадиях его развития, а, следовательно, существенно улучшить результаты терапии. Только в течение последних 10 -15 лет успехи в области молекулярной биологии, транскриптомики, метаболомики и протеомики предоставили медицинской науке возможность анализировать сложные биологические системы. Это предопределило появление исследований, в которых изучается возможность применения различных молекул, содержащихся в биологических средах организма человека, с целью оценки ранних этапов повреждения почечной ткани.
Биомаркер, по определению являющийся не обязательно участником, но обязательно свидетелем патологического процесса [Edelstein C.L., 2011], должен отражать течение патогенетических этапов развития ОПП. Одним из наиболее распространенных подходов к классификации является соотношение биомаркера с преимущественной локализацией повреждения определенного микроструктурного компартмента почки [Bonventre J.V. и соавт. 2010]. Другой подход основан на патофизиологическом принципе, когда определенные биомаркеры соотносятся с характером патологического процесса (Табл. 12) [Tesch G.H., 2010]. Способность маркера отражать различные этапы течения ОПП предопределило их дифференциацию по клинической значимости [Noto A. и соавт., 2013]. Доказательная база в отношении предиктивной роли биомаркеров имеется для достаточно ограниченного числа молекул. К их числу могут быть отнесены маркеры почечной дисфункции, белки с повышенным синтезом при ОПП, низкомолекулярные белки мочи и внутриклеточные ферменты клеток тубулярного эпителия, которые составляют так называемую рабочую классификацию биомаркеров (табл. 3.1) [Geus H. и соавт., 2012].
|
I. Топическая классификация. |
|
|
1. Клубочек |
Альбумин, цистатин С сыворотки, альфа1-микроглобулин, бета2-микроглобулин и др |
|
2. Проксимальный каналец |
NGAL, KIM-1, L-FABP, цистатин-С мочи, IL-18 и др. |
|
3. Дистальный каналец |
GST, NGAL |
|
4. Собирательная трубка |
Калибиндин D28 |
|
5. Петля Генле |
Остеопонтин, NHE-3 |
|
II.Патофизиологическая классификация |
|
|
1. Биомаркеры почечной функции |
креатинин, цистатин С сыворотки и др. |
|
2. Биомаркеры оксидативного стресса |
8(А2а)-изопростан, 4-ОН-2-ноненал и др. |
|
3.Биомаркеры структурного и клеточного повреждения: |
|
|
— Подоцитов |
подокаликсин, нефрин |
|
— Тубулоинтерстиция |
NGAL, KIM-1, L-FABP |
|
— факторы экзосомальной транскрипции |
АТФ3 |
|
4. Маркеры иммунного ответа |
иммуноглобулины, хемокины, компоненты комплемента |
|
5. Маркеры фиброза |
TGF- β1, CTGF, Βig-H3, Collagen type IV |
|
6. Маркеры апоптоза |
аннексин-5 |
|
III.Клиническая классификация |
|
|
1. Маркер в качестве фактора риска развития ОПП |
|
|
2. Маркер, использующийся при скрининге ОПП |
|
|
3.Диагностический маркер, указывающий на патогенетический вариант ОПП |
|
|
4.Биомаркер, стратифицирующий тяжесть процесса. |
|
|
5.Маркер с высокой предиктивной значимостью. |
|
|
6.Маркер, характеризующий ответ на терапию. |
|
|
IV. Рабочая классификация |
|
|
1. Белки, экспрессия которых повышается при ОПП |
NGAL, L-FABP, KIM-1, IL-18 |
|
2. Функциональные маркеры |
цистатин С сыворотки |
|
3. Низкомолекулярные белки мочи |
Цистатин С мочи, альфа1-микроглобулин, бета2-микроглобулин |
|
4. Внутриклеточные энзимы |
NAG, a-GST, p-GST, ГГТП, ЩФ |
Примечание: NGAL – нейтрофильный желатиназо-ассоциированный липокалин, KIM-1 – молекула почечного повреждения, L-FABP – печеночный протеин, связывающий жирный кислоты, GST – глутатион-S-трансфераза, NHE-3 – натрий-водородный обменник 3, TGF-β1 – фактор роста опухолей β1, CTGF – фактор роста соединительной ткани, NAG – N-ацетил-D-глюкозамидаза, ГГТП – гамма-глутамилтранпептидаза, ЩФ – щелочная фосфатаза).
NGAL является наиболее изученным биомаркером ОПП. Была доказана роль данного маркера как чувствительного предиктора развития ОПП после оперативного вмешательства с применением АИК, а также после коронарографии. Менее очевидные результаты (чувствительность 38,1-50%) были получены при обследовании взрослых пациентов, у которых, по всей вероятности, экспрессия NGAL изначально выше вследствие предсуществующего поражения почек. По результатам мета-анализа, проведенного в 2009 году, куда было включено 2538 пациентов из 19 исследований, выполненных в 8 странах, были сделаны выводы о возможности использования уровня NGAL крови и мочи в качестве ранней диагностики ОПП, была доказана высокая чувствительность (95%) и специфичность (95 %), а также возможность с его помощью предсказывать необходимость проведения заместительной почечной терапии и оценивать относительный риск смертности.
Вторым наиболее известным биомаркером ОПП является цистатин С. Цистатин С относится к ингибиторам лизосомальных протеиназ и продуцируется всеми ядерными клетками организма, предохраняя организм от неконтролируемой активации протеолиза собственных белков. Цистатин С поступает из клеток в кровоток равномерно, и его сывороточная концентрация поддерживается на постоянном уровне [Каюков И.Г. и соавт., 2012]. Небольшая молекулярная масса и низкое сродство к другим сывороточным белкам определяют способность данной молекулы свободно фильтроваться в почечных клубочках, поступать в канальцы, где она реабсорбируется за счет мегалин-кубулин-опосредованного эндоцитоза и затем полностью метаболизируется в эпителиоцитах проксимальных канальцев, вследствие чего в норме цистатин С экскретируется с мочой в минимальных количествах. Сывороточная концентрация цистатина С, в отличие от креатинина, не зависит от питания, массы тела, пола, возраста. Отсутствие периода кумуляции при снижении скорости клубочковой фильтрации определило возможность использования сывороточной концентрации цистатина С в качестве маркера ОПП, поскольку она наиболее точно отражает текущие значения СКФ. Повышение мочевой концентрации цистатина С происходит при нарушении реабсорбции в проксимальных канальцах, что определяет клиническое значение оценки его уровня в моче при остром тубулярном некрозе [Conti M. и соавт., 2006].
В мета-анализе, проведенном в 2011 году, были проанализированы результаты 19 исследований, включившие 3336 пациентов. На основании результатов сравнительного анализа был сделан вывод, что увеличение концентрации цистатина С в сыворотке является хорошим предиктором ОПП (чувствительность 86%, специфичность 82 %), тогда как цистатин С мочи обладает умеренной диагностической значимостью [Zhang Z. и соавт., 2011]. В 2012 году результаты данного мета -анализа были дополнены новыми исследованиями, на основании чего авторы заключили, что цистатин-С является скорее хорошим маркером, нежели предиктором ОПП, что вполне соответствует клиническим задачам [Haase M. и соавт., 2012].
Рекомендация 3.2
Диагностика при развитии ОПП должна быть направлена на выявление основного патогенетического варианта ОПП и жизнеугрожающих осложнений дисфункции органа (NG)
Рекомендация 3.2.1.
При наличии критериев ОПП в срочном порядке должна быть выполнена диагностика, направленная на определение основного патогенетического варианта ОПП – преренального, постренального, ренального, что определяет прогноз и тактику ведения больного (NG)
Комментарий
Как уже указывалось выше, в патогенетическом плане ОПП рассматривается, как совокупность механизмов, связанных с повреждением различных компартментов почки и приводящих к дисфункции органа . Этим определяется разнообразие причин, приводящих к снижению клубочковой фильтрации при ОПП. Причины ОПП подразделяются на три основные группы, которые являются основой патогенетической классификации данного состояния (рис. 2):
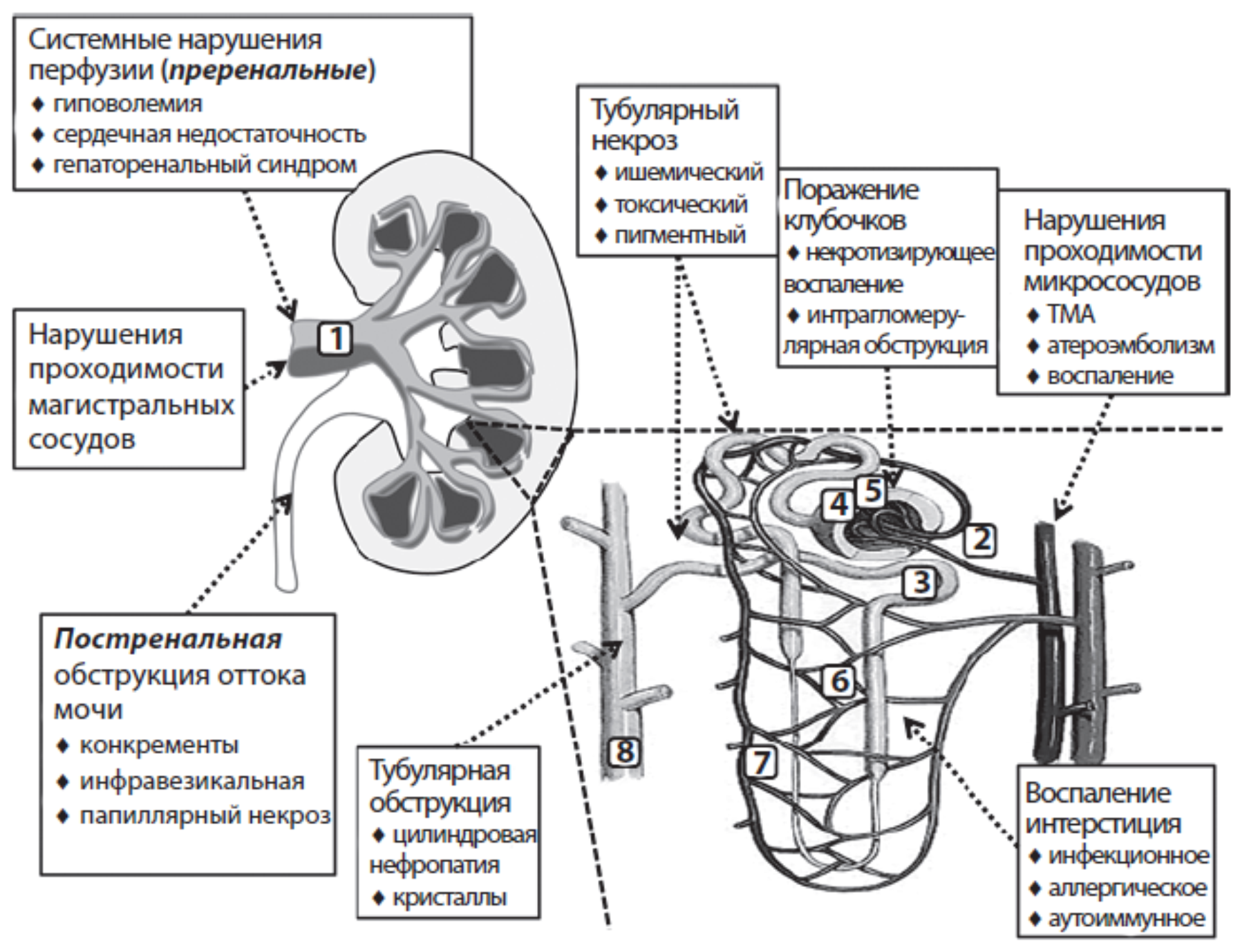
Рисунок 2. Основные группы этиологических факторов развития ОПП. Цифрами отмечены основные факторы регуляции СКФ: 1 — почечный кровоток и перфузионное давление; 2 — баланс тонуса афферентных и эфферентных артериол клубочка; 3 — канальце-клубочковая обратная связь ; 4 — онкотическое давление плазмы; 5 — гидростатическое давление в капсуле Боумена; 6 — распределение внутрипочечного кровотока и интерстициальное гидростатическое давление; 7 — активность ионных каналов и транспорт мочевины; 8 — аквапорины/транспорт воды [Добронравов В.А., 2015].
1) преренальные (связанные с г ипоперфузией почек в результате альтераций системной гемодинамики);
2) ренальные (связанные с прямым повреждением основных компартментов органа — клубочков, сосудов, канальцев и интерстиция);
3) обструктивные (связанные с внутрипочечной и постренальной обструкцией тока мочи).
Механизмы развития ОПП и снижения КФ при повреждении разных компартментов почки — сосудов, клубочка, канальцев и интерстиция могут, в значительной степени, пересекаться. Поэтому непроходимую границу между различными патогенетическими вариантами ОПП зачастую провести невозможно. Например, преренальное ОПП, приведшее к развитию ИТН, практически, переходит в ренальное ОПП.
Основным требованием, предъявляемым к современной диагностике ОПП, является ее ранний характер. Это объясняется тем, что, во -первых, ОПП любой стадии ассоциируется с высоким риском летальности. Так, даже незначительный подъем концентрации креатинина сыворотки крови на 0,3–0,4 мг/дл по сравнению с его базальным уровнем сопровождается увеличением относительного риска смерти на 70 % (Chertow G.M. и соавт., 2005).
Современную клиническую диагностику ОПП, соответствующую ее концептуальной модели (см. Введение), можно представить в виде континуума, то есть непрерывной цепи диагностического поиска, который, начинаясь с анализа факторов риска и заболеваний, ассоциирующихся с ОПП, продолжается на этапе формирования повреждения почечной паренхимы, охватывая при этом идентификацию осложнений, обусловленных дисфункцией почек, и заканчивается диагностикой исходов ОПП [Смирнов А.В., 2015]. Континуум клинической диагностики включает в себя два основных этапа. Первый этап — это предиктивная (predictive) диагностика, заключающаяся в клинической оценке эпидемиологических данных у постели пациента, факторов риска и ассоциированных с ОПП состояний, а также применение с диагностической целью ранних биомаркеров почечного повреждения. Иными словами, предиктивную диагностику по отношению к самому ОПП можно охарактеризовать как доклиническую, которая проводится в «режиме ожидания».
Второй этап континуума клинической диагностики — это презентационная диагностика. Основные ее принципы — неотложность, соответствующая остроте процесса, и последовательность. Презентационная диагностика — это установление факта состоявшегося ОПП и его осложнений, разграничение основных патогенетических вариантов ОПП (преренальное, ренальное и постренальное), проведение внутрисиндромной, межсиндромной и частной дифференциальной диагностики. Предиктивная (предсказательная) диагностика ОПП представляет собой оценку клинического статуса больного, которому может угрожать острая дисфункция почек; она предусматривает раннее выявление лабораторных признаков острого повреждения почечной паренхимы у таких пациентов с помощью биомаркеров. Степень вероятности развития острого патологического процесса в почках оценивается с учетом эпидемиологических данных (распространенность и этиология ОПП) и конкретных факторов риска, имеющихся у больного (см. Рекомендация 4.1., Табл. 15).
В ходе осуществления презентационной диагностики врачу предстоит ответить на целый ряд вопросов, которые могут быть сформулированы следующим образом:
-
Имеется ли у пациента острое повреждение почек?
-
Не является ли ОПП результатом гиповолемии?
-
Не является ли ОПП результатом обструкции мочевыводящих путей?
-
Какова причина ренального ОПП у данного пациента?
-
Не являются ли симптомы (чаще лабораторные), которые можно было бы принять за признаки ОПП (в силу отсутствия данных анамнеза), результатом латентного (скрытого) течения ХБП?
-
Не произошло ли развитие ОПП у пациента, у которого прежде уже имелась ХБП (ОПП на ХБП)?
Перечисленные вопросы носят обязательный характер, и врачу необходимо аргументировано ответить на каждый из них, однако порядок вопросов может быть пересмотрен в зависимости от конкретной клинической ситуации. Незыблемым остается правило неотложной диагностики, в первую очередь пре- и постренального вариантов ОПП.
Можно выделить два варианта клинической презентации ОПП, которые определяют направление и ход дальнейшей диагностики: олиго-/анурический и неолигурический.
Олиго-/анурический вариант клинической презентации ОПП. При этом варианте отправной точкой в диагностическом процессе — ведущий клинический симптом в виде олиго-/анурии.
Неолигурический вариант клинической презентации ОПП. В данном случае отправной точкой в диагностике служит не клинический симптом в виде умеренного ограничения диуреза, оценить который количественно у постели больного не представляется возможным вследствие нечеткости критериев, а лабораторные симптомы в виде азотемии (повышение концентрации в сыворотке крови креатинина, мочевины), дизэлектролитемии (гиперкалиемия).
Общий ход диагностики с учетом вопросов, сформулированных выше и анализом вариантов клинической презентации ОПП представлен в алгоритме (Рис. 3).
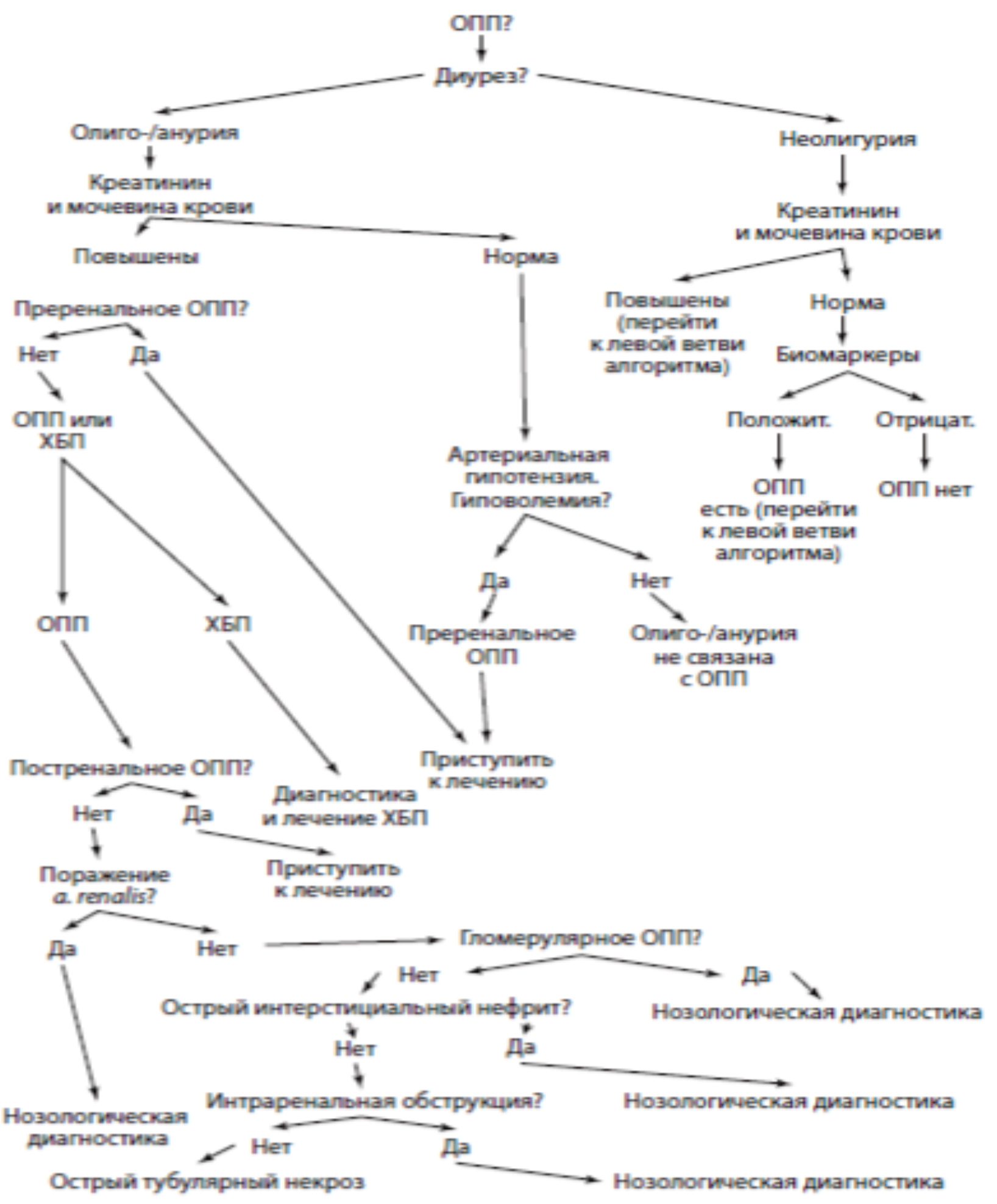
Рисунок 3. Алгоритм общего хода клинической диагностики острого повреждения почек [Смирнов А.В., 2015].
Отдельного комментария заслуживает уже упомянутый вопрос, о том не являются ли симптомы (чаще лабораторные), которые можно было бы принять за признаки ОПП (в силу отсутствия данных анамнеза), результатом латентного (скрытого) течения ХБП? Решение первого вопроса подразумевает проведение дифференциальной диагностики между ХБП и ОПП (межсиндромная дифференциальная диагностика) с привлечением целого ряда как клинических, так и лабораторных и инструментальных критериев (Табл. 13).
Как видно из приведенных в таблице данных, ни один из критериев не имеет абсолютного дифференциально-диагностического значения. Даже исследование биомаркеров может дать ложноположительный результат, особенно в случаях ХБП с высокой протеинурией. Очень важно определить сочетание различных симптомов. Например, достоверность (чувствительность) такого признака ХБП, как уменьшение в размерах почек и/или уменьшение толщины паренхимы (за счет коркового слоя), резко возрастает при одновременном выявлении анемии или низкого темпа прироста креатинина крови и т.д.
| Симптомы | ОПП | ХБП |
|---|---|---|
|
Анамнез |
Медикаменты, нефротоксины, эпизоды гипотонии, рвота, диарея |
Артериальная гипертензия, ИБС, сердечная недостаточность, первичная паталогия почек |
|
Динамика АД |
Норма, эпизоды гипотонии, гипертензия при развернутой стадии ОПП |
Стойкая гипертензия |
|
Указания на изменения в случайных анализах мочи |
Нет |
Есть |
|
Эпизод предшествующий олиго-/анурии |
Может отмечаться |
Нет |
|
Никтурия |
Нет |
Есть |
|
Гипергидратация |
Может отмечаться |
Не свойственна |
|
Кожные покровы: цвет, влажность, эластичность (тругор), расчесы |
Не изменены или отражают тяжесть соматического состояния (гиповолемический шок) |
Желтоватые, сухие, пониженной эластичности, могут быть расчесы |
|
Анемия (Hb, эритроциты) |
Не свойственны в начале |
Характерна |
|
Симптомы полинейропатии |
Не свойственны |
Характерны |
|
Выраженный остеопороз |
Не характерен |
Может отмечаться |
|
Темпы прироста креатина в крови |
> 0,05 ммоль/сут |
< 0,05 ммоль/сут |
|
Эритропоэтин крови |
Норма |
Снижен |
|
Протеинурия > 2 г/сут |
Не характерна |
Может отмечаться |
|
Биомаркеры мочи: |
Повышен |
Может быть повышен |
|
Размеры почек по длиннику по данным УЗИ |
Не изменены или увеличены |
Чаще уменьшены* |
|
Толщина коркового слоя |
Увеличена или нормальная |
Уменьшена |
|
Эхогенность коркового слоя |
Значительно повышена при ОТН |
Незначительно повышена |
|
Индекс резистентности при доплерографии сосудов почек |
> 0,7 при нормальных или увеличенных в размерах почках |
> 0,7 при уменьшенных в размерах почках |
|
Уровень паратгормона в крови |
Нормальный |
Повышен |
Примечание: * — увеличены при диабетической нефропатии, амилоидозе, поликистозе почек.
Рекомендация 3.2.2
Для раннего выявления основных жизнеугрожающих осложнений ОПП (гиперволемия, тяжелая уремическая интоксикация, дизэлектролитемия и метаболический ацидоз) рекомендуется мониторинг волемического статуса, ионограммы, кислотно -основного состояния крови (NG)
Комментарий
См. Рекомендацию Рекомендация 4.1., Табл. 16
Рекомендация 3.3
Дифференциальную диагностику ОПП следует проводить с участием нефролога и начинать с исключения/подтверждения преренального и/ или постренального вариантов; ренальное ОПП является диагнозом исключения. (NG)
Рекомендация 3.3.1.
Следует основывать диагностику преренального ОПП на выявлении клинико-патогенетических факторов гипоперфузии почек (NG)
Комментарий
Наряду с диагностикой одного из трех основных патогенетических вариантов ОПП в каждом конкретном случае врачу следует распознать и ведущий патофизиологический фактор.
Так, при истинной гиповолемии в результате кровотечения и при сепсисе почки будут подвергаться гипоперфузии и ишемическому повреждению, то есть в обоих случаях будет формироваться преренальное ОПП. Однако в первом примере гипоперфузия будет обусловлена уменьшением ОЦК и СВ, тогда как во втором — снижением ЭЦО крови за счет вазодилатации. При кровотечении потребуется восстановление ОЦК и увеличение СВ за счет внутривенной инфузии жидкостей, а при сепсисе помимо этого необходимо будет введение вазоконстрикторов. С другой стороны, гипоперфузия может быть причиной развития не только преренального ОПП, но и ренального, как это можно наблюдать при билатеральном тромбозе почечных артерий.
Наиболее частой причиной гипоперфузии почек в клинике является гиповолемия (истинная или перераспределительная) (Табл.14) Далее следуют причины, обусловливающие снижение ЭЦО. Острое нарушение систолической или диастолической функции миокарда, например, вследствие острого инфаркта миокарда или его станнирующего состояния, сопровождаются падением СВ и почечного кровотока.
| Гиповолемия | |
|---|---|
|
Истинная гиповолемия |
Гиповолемия перераспределенная |
|
Снижение эффективного циркулирующего объема крови |
|
|
Вследствие преимущественного снижения сердечного выброса:
|
Вследствие преимущественного снижения общего переферического сосудистого сопротивления:
|
|
Снижение перфузионного почечного давления |
|
|
Вследствие нарушения венозного оттока |
|
|
Вследствие повышения центрального венозного давления |
|
|
Вследствие обструкции артерий почек |
|
|
Вследствие нарушения физиологических механизмов ауторегуляции внутрипочечного кровотока |
|
|
Вследствие внутрипочечной вазоконстрикции |
|
|
Комбинированные причины гиперфузии почек |
Выявление конкретного варианта (синдрома) гипоперфузии почек должно проводиться на основе сведений, представленных в соответствующих Рекомендациях и Руководствах.
Рекомендация 3.3.2
Для диагностики постренального ОПП в кратчайшие сроки следует выполнить исследования, подтверждающие наличие инфраренальной обструкции с последующим уточнением ее конкретной причины с участием уролога (NG)
Комментарий
Оценка дилатации чашечек и лоханки при выполнении УЗИ почек в B-режиме — самый важный этап в семиологической дифференциальной диагностике симптома олиго-/анурии (особенно анурии) с целью исключения или подтверждения наличия обструктивного ОПП. Необходимо подчеркнуть, что при обструктивном ОПП расширение шеек чашечек и почечной лоханки регистрируется всегда на фоне неизмененной почечной паренхимы (в случае отсутствия предшествующей почечной патологии), тогда как при хронической обструкции, ведущей к развитию гидронефроза, всегда отмечается истончение окружающей паренхимы.
Расширение чашечно-лоханочной системы при УЗИ почек является достаточно чувствительным (95 %) и специфичным (70 %) диагностическим тестом для выявления обструкции мочевыводящих путей. Однако указанные статистические параметры следует всегда соотносить с клиническими данными. Если обструкция мочевыводящих путей развивается постепенно, как это наблюдается в случаях сдавления мочеточников извне (ретроперитонеальный фиброз, опухоли органов малого таза, колоректальный рак с метастазами и др.) и параллельно уменьшению диуреза падает СКФ (а следовательно, скорость образования мочи), то расширения чашечно-лоханочной системы при первичном исследовании пациента может не выявляться.
Такая же ситуация отмечается в тех случаях, когда пациент самостоятельно ограничивает прием жидкости из -за пониженного чувства жажды (внеклеточная гипергидратация и гипоосмоляльность плазмы крови), или при других причинах, ведущих к дегидратации. Дилатация чашечно-лоханочной системы может отсутствовать, если УЗИпочек проводится на ранних сроках развития полной обструкции мочевыводящих путей или когда периферические ткани, окружающие лоханку и мочеточники, вследствие уменьшения их комплаенса препятствуют развитию дилатации.
Во всех перечисленных случаях рекомендуется повторять УЗИ почек через несколько часов после введения пациенту жидкости, а в ряде ситуаций после введения однократной дозы мочегонных. Ложноотрицательные данные при УЗИ почек в отношении обструкции мочевыводящих путей могут быть получены, если лоханка заполнена плотными массами: конкрементами, сгустками крови или гноя. Даже при самом тщательном УЗИ почек данные в отношении обструкции мочевыводящих путей в виде расширения чашечно-лоханочной системы могут быть отрицательными. В ряде случаев в дифференциальной диагностике помогает проведение доплеросонографии, при которой выявляется повышение индекса резистентности интраренальных артерий, что в сочетании даже с минимальным расширением чашечно-лоханочной системы позволяет высказаться в пользу обструктивного генеза ОПП. В затруднительных случаях всегда следует ориентироваться на клинические проявления: наличие остро развившейся анурии (которая редко когда отмечается в других случаях ОПП), отсутствие изменений в осадке мочи, даже при отрицательных данных УЗИ почек, дает основание врачу провести перкутанную нефростомию с одной стороны и, в случае получения диуреза, выполнить подобное оперативное пособие на контрлатеральной почке [Смирнов А.В., 2015]. .
Рекомендация 3.3.3
В случае ренального ОПП необходимо направить нефрологический диагностический поиск на определение конкретного варианта повреждений – канальцев, клубочков, сосудов, интерстиция или их сочетаний, что будет определять тактику ведения и прогноз больного (NG)
Комментарий
Ренальное ОПП связано с первичным повреждением почечной ткани. При этом в патологический процесс могут вовлекаться два основных почечных компартмента – гломерулярный (клубочки) и тубулоинтерстициальный (канальцы и окружающая их соединительная ткань). Основными вариантами ренального ОПП являются:
ОПП при повреждении клубочка (гломерулярное ОПП)
-
ОПП при воспалительном поражении клубочков
-
ОПП при тромботической микроангиопатии
ОПП на фоне интерстициального воспаления (острый интерстициальный нефрит) ОПП при повреждении клубочка (гломерулярное ОПП). ОПП при воспалительном поражении клубочков. Развитие ОПП возможно при любых формах гломерулярного поражения, которые подразделяются на гломерулопатии и гломерулонефриты (ГН). В первом случае, несмотря на наличие клинических признаков, указывающих на поражение клубочков (протеинурию, прогрессирующую дисфункцию), при морфологическом анализе воспалительная реакция в гломерулах не определяется. К типичным примерам гломерулопатий относятся: мембранозная нефропатия, болезнь минимальных изменений, фокально-сегментарный гломерулосклероз. При этих заболеваниях клинически можно наблюдать отдельные случаи развития преренального ОПП, которые главным образом связаны с относительной гиповолемией из-за быстрого перераспределения внеклеточной жидкости при нефротическом синдроме. В отдельных случаях может формироваться типичная картина ИТН. Термин гломерулонефрит обозначает группу заболеваний клубочка, при которых клубочки содержат воспалительные клетки, а именно: тканевые макрофаги, лимфоциты, а также полиморфноядерные лейкоциты (ПМЯЛ). Клинически вариант ОПП, который развивается на фоне острого или активнотекущего первично хронического гломерулярного воспаления часто обозначают как «острый нефритический синдром». Классическим примером развития ОПП (острого нефритического синдрома) является острый постстрептококковый ГН.
ОПП при повреждении клубочка (гломерулярное ОПП). ОПП при тромботической микроангиопатии. ТМА — поражение мелких сосудов (капилляров/артериол) в результате системной или внутрипочечной аггрегации тромбоцитов, без предшествующего воспаления сосудов, протекающее с тромбоцитопенией и механическим повреждением эритроцитов [Salvadori M., Bertoni E., 2013].
Инициальным моментом в развитии любых вариантов ТМА является повреждение эндотелия, вызванное экзо- и эндотоксинами, иммунными комплексами и антителами, а также лекарствами. Образование тромбоцитарных тромбов происходит параллельно с десквамацией эндотелия и может приводить к мультиорганному повреждению.
Тубулярный некроз. Под тубулярным некрозом понимают развитие некробиотических изменений эпителиальных клеток (ЭК) канальцев той или иной степени выраженности. Этот традиционный термин будет использован и далее в этом разделе, хотя следует отметить, что он не вполне точно отражает морфологическую сущность процесса. Во-первых, помимо некроза не менее важным событием является развитие апоптоза ЭК. Во-вторых, если, согласно традиционным представлениям, некробиоз представлялся как пассивное и неконтролируемое событие, то в настоящее время его рассматривают как тонко регулируемый молекулярный процесс (т.н. некроптоз).
Изменение представлений о молекулярной биологии некроза имеет не только теоретическое значение, но также открывает перспективы в лечении этого состояния [Giampietri C. и соавт., 2014].
ОПП на фоне интерстициального воспаления (острый интерстициальный нефрит). Острый интерстициальный нефрит (ОИН) представляет собой иммуноопосредованную реакцию гиперчувствительности на внешние или внутренние антигены. Основными причинами развития ОИН являются инфекции, аллергические реакции на лекарства/ксенобиотики и почечные проявления системных аутоиммунных процессов
С этиологической точки зрения выделяют три архетипа тубулярного некроза: ишемический, токсический и пигментный. Ишемический тубулярный некроз (ИТН) возникает в результате гипоперфузии почек как следствие альтераций системной или локальной (внутрипочечной) гемодинамики и, таким образом, является закономерным следствием ПОПП. ИТН также может развиваться из-за нарушений проходимости сосудистого русла органа.
Токсический тубулярный некроз (ТТН) является следствием прямого повреждения тубулярного эпителия при воздействии экзотоксинов и ксенобиотиков.
Под пигментным тубулярным некрозом понимают два специфических случая повреждения канальцевого эпителия при резком повышении концентрации свободного миоглобина и гемоглобина в циркуляции и в просвете канальцев в результате рабдомиолиза или внутрисосудистого гемолиза
Рекомендация 3.3.4
Если проведенная клиническая диагностика не позволяет уточнить диагноз ренального варианта ОПП, следует рассмотреть возможность выполнения диагностической биопсии и последующего морфологического анализа; уточняющую клиническую и морфологическую диагностику поражений клубочков, интерстиция и сосудов микроциркуляции, являющихся причиной ОПП, следует проводить в специализированном нефрологическом отделении соответствии с действующими рекомендациями. (NG)
Комментарий
Нефробиопсия показана во всех случаях ренального ОПП неясной этиологии, поэтому необходимым условием для ее выполнения является надежное и достоверное исключение пре- и постренальных вариантов острой дисфункции почек на предварительном этапе клинико-лабораторно-инструментального обследования. При ренальном ОПП неясной этиологии 20 % нефрологов предпочитают выполнить биопсию почки на самых ранних этапах наблюдения больного, 26 % специалистов прибегают к ней через неделю от начала острой дисфункции почек, а 40 % врачей придерживаются выжидательной тактики и назначают нефробиопсию через 4 недели от начала ОПП в случаях отсутствия признаков восстановления функции почек [Fuiano G. и соавт., 2000]. В общем массиве всех нефробиопсий, выполненных с диагностической целью, на долю ОПП приходится от 12 до 16 % [Rivera F. и соавт., 2004; Lopez-Gomez J.M. и соавт., 2008].
Пожилой возраст пациентов (> 65 лет) и беременность не являются абсолютными противопоказаниями к проведению биопсии почки, однако в последнем случае к ней прибегают обычно после родоразрешения. В современных условиях, когда частота острого лекарственного интерстициального нефрита в результате полипрагмазии резко возросла, нефробиопсия у пожилых больных зачастую становится единственной процедурой в установлении нозологии ОПП.
Показания к проведению нефробиопсии у пациентов с ренальным ОПП неясной этиогии могут быть суммированы следующим образом:
-
наличие анурии или продолжительной олигурии (более 2–3 недель);
-
клинические данные (анамнез, физикальное и лабораторное исследование), свидетельствующие о системном процессе (СКВ, васкулиты);
-
быстропрогрессирущий нефритический синдром;
-
легочно-почечный синдром;
-
наличие труднокоррегируемой артериальной гипертензии в отсутствии признаков гиперволемии (после коррекции артериального давления);
-
наличие ОПП у тяжелых соматических больных в отсутствие данных за пре- и постренальную дисфункцию почек.
Противопоказания к проведению биопсии почки при ОПП редко когда носят абсолютный характер (например, системные нарушения коагуляции) и чаще являются относительными, к которым можно отнести:
-
наличие единственной функционирующей почки (врожденная или приобретенная патология);
-
анатомические аномалии развития мочевыводящей системы;
-
гидронефроз (с одной или двух сторон);
-
симметрично уменьшенные в размерах почки (< 9 см);
-
наличие локальных инфекций (периренальной, на коже в месте предполагаемой пункции);
-
неконтролируемая гипертензия;
-
множественные кисты обеих почек или подозрение на опухоль почки;
-
некомплаенсный больной.
В случаях крайней необходимости проведения нефробиопсии, но при наличии относительных противопоказаний к ней в ряде случаев прибегают к открытой (операционной) биопсии почек.
РАЗДЕЛ IV. Профилактика и основные подходы к лечению ОПП
Профилактика ОПП
Рекомендация 4.1.
Профилактика ОПП должна быть основана на своевременном выявлении, минимизации или устранении факторов риска и ассоциированных состояний (Таблица 15) (1A); больным с риском развития ОПП показана консультация нефролога (2B).
Комментарий
У каждого больного из группы риска по ОПП (Табл. 15) в истории болезни необходимо ежедневно отмечать показатели водного баланса: объем выпитой и введенной жидкости, суточный диурез, наличие и характер стула, массу тела натощак дважды в день, объем терапии диуретиками. Общим профилактическим мероприятием является восстановление волемического статуса путем введения кристаллоиодов. У пациентов отделений интенсивной терапии/скорой помощи нужно дополнительно контролировать центральное венозное давление в пределах 8-12 мм вод. столба. При негативном водном балансе в первую очередь должна быть повторно рассмотрена необходимость и объем диуретической терапии.
|
Факторы риска |
|
|
Неизменяемые |
Изменяемые |
|
|
|
Ассоциированные состояния |
|
|
Риск развития ОПП определяется комбинацией факторов риска и ассоциированных состояний (Табл. 16)
| Факторы риска | Нет ХБП | ХБП С1-2 ст | ХБП С3-5 ст |
|---|---|---|---|
|
Нет факторов риска и ассоциированных состояний |
низкий риск |
средний риск |
высокий риск |
|
1-2 фактора риска |
средний риск |
средний риск |
очень высокий риск |
|
3 и более факторов риска |
высокий риск |
высокий риск |
очень высокий риск |
|
Ассоциированные состояния |
очень высокий риск |
очень высокий риск |
очень высокий риск |
Рекомендация 4.1.1.
Агонисты допаминергических рецепторов (дозы допамина менее 3 мкг/кг/мин (1А), фенолдопам (2С), предсердный натрийуретический пептид (2С), рекомбинантный человеческий инсулиноподобный фактор роста-1 (1В) не обладают нефропротективными свойствами, поэтому их применение в группах высокого риска не оказывает профилактического эффекта и ограничено непосредственно основными показаниями.
Комментарий
Применение «почечных» доз допамина в РКИ не подтвердило их ренопротективный эффект, описанный в эксперименте на животных. Кроме того, даже низкие дозы допамина способны провоцировать нарушения сердечного ритма, особенно при часто встречающееся при ОПП дизэлектролитемии и метаболическом ацидозе [Friedrich J.O. и соавт, 2005].
Не получено убедительных доказательств успешного профилактического применения при ОПП фенолдопама (селективного агониста постсинаптических допаминергических рецепторов) [Cogliati A.A. и соавт,2007 ], предсердного натрийуретического пептида [Sward K. И соавт. 2004 ], рекомбинантного человеческого инсулиноподобного фактора роста-1 [Hirschberg R. И соавт. 1999].
Рекомендация 4.1.2
У пациентов с наличием факторов риска следует проводить профилактику контраст — индуцированного ОПП путем инфузий изотонических растворов хлорида или бикарбоната натрия (1А), назначения умеренных доз N-ацетил цистеина (2С) и предупреждать развитие анафилактических реакций (2B)
Комментарий
В настоящее время нет сомнений в том, что профилактика КИ-ОПП в группах пациентов с наличием факторов риска может существенно снизить частоту его развития. Оптимальным считается применение инфузий изотонических растворов кристаллоидов (хлорида или бикарбоната натрия) до и после рентгеноконтрастной процедуры. Убедительных доказательств преимуществ одной соли перед другой не имеется [ KDIGO Clinical Practice Guideline…, 2012]. В частности, может быть рекомендована следующая схема инфузионной профилактики: 3 мл/кг массы тела изотонического раствора хлорида натрия за час до процедуры и 1 мл/кг в час в течение 6 ч после процедуры. Для профилактики КИ-ОПП KDIGO считает возможным, также, применение умеренных доз N-ацетил цистеина, хотя в доступной литературе данные по этому вопросу более, чем противоречивы (для справки см. Каюков И.Г., Румянцев А.Ш., 2015). Наиболее распространенным режимом в настоящее время считается применение peros 600 мг × 2 р. за сутки до выполнения и в первые сутки после введения РКС. В/в назначение АЦЦ в умеренных дозах (600 мг) перед исследованием целесообразно при необходимости проведения рентгеноконтрастной процедуры по ургентным показаниям.
Для уменьшения риска развития анафилактоидных реакций следует применять премедикацию (антигистаминные препараты, глюкокортикоиды, адреномиметики и др.). В частности, существует следующая схема:
-
За 12 часов до проведения рентгеноконтрастной процедуры назначить 40 мг преднизона или 32 мг метилпреднизолона реr os
-
За 2 ч до процедуры вновь назначить 40 мг преднизона или 32 мг метилпреднизолона и 300 мг циметидина или 150 мг ранитидина per os
-
Непосредственно перед процедурой ввести внутривенно 50 мг дифенгидрамина (димедрол, бенадрил). В качестве альтернативы может использоваться пероральное назначение дифенгидрамина в той же дозе за 2 ч до исследования
Другой подход заключается в том, что непосредственно перед введением йодсодержащего рентгеновского контраста пациенту в/в болюсом вводятся:
-
Преднизолон 30-60 мг (или эквивалентная доза любого другого препарата глюкокортикоидных гормонов)
-
20-40 мг хлоропирамина (супрастин) — 1,0-2,0 мл
-
Или 2 мг клемастина (тавегил) — 2,0 мл.
-
10 мл 10% р-ра глюконата кальция
Важное место в профилактике КИ-ОПП, также, занимают использование современных низко- или изоосмолярных контрастов (убедительных доказательств преимуществ одних перед другими не существует) и минимизация дозы рентгеноконтрастного агента.
Рекомендация 4.2
При проведении лечебных мероприятий рекомендуется учитывать этиопатогенетический механизм развития ОПП и характер основных осложнений (Таблица 16, Таблица 17). (NG)
Комментарий
Выявление ведущего патогенетического механизма развития ОПП ориентирует врача на необходимость дополнительных консультаций узких специалистов. Так, при подозрении на постренальное ОПП необходима экстренная консультация уролога. При преренальном ОПП тактик у ведения пациента рекомендуется согласовать с кардиологом (острое нарушение сердечного ритма, декомпенсация сердечной недостаточности).
Стадии 1 и 2 ОПП, как правило, позволяют проводить консервативную терапию. Признаки ОПП 3 стадии и/или наличие ренальных осложнений периода олдиго/анурии, а также экстраренальных системных осложнений требуют решения вопроса об экстренном начале ЗПТ.
Рекомендация 4.2.1
Терапия ОПП должна включать нутриционную поддержку, а также мероприятия, направленные на устранение жизнеугрожающих осложнений (Таблица 17, Таблица 18).(NG)
Комментарий
Любой вид терапии является симптоматическим и направлен на устранение или уменьшение выраженности возможных ренальных и экстраренальных осложнений (Табл. 17, Табл. 18)
|
Осложнения периода олиго-/анурии |
Обусловленные нарушениями водно-электролитного баланса:
дизэлектролитемия |
|
Обусловленные нарушениями кислотно-основного состояния
|
|
|
Обусловленные метаболическими нарушениями
|
|
|
Обусловленные азотемией
|
|
|
Осложнения периода полиурии |
|
Примечание: *СИАГ — синдром интраабдоминальной гипертензии.
|
Осложнения основного заболевания, приведшего к развитию ОПП |
Системные осложнения ОПП |
Осложнения, связанные с лечением ОПП |
|
Консервативная терапия:
|
|
|
Заместительная почечная терапия:
|
При проведении ЗПТ рекомендуется коррекции диетотерапии (учет потерь аминокислот и катаболизма белков) и симптоматической терапии (учет диализного клиренса используемых лекарственных препаратов).
Рекомендация 4.2.1.1
При проведении нутритивной поддержки у больных с любой стадией ОПП рекомендуется обеспечивать потребление белка в пределах 0,8 -1,2 г/кг/сут (2D) и калорий (с учетом введения, например, растворов глюкозы, жировых эмульсий) не ниже 20-30 ккал/кг (2С).
Комментарий
Развитие ОПП часто сопровождается формированием белково-энергетической недостаточности, значимо увеличивающей показатели смертности [Fouque D. И соавт 2008]. Однако, оптимальная потребность в белках у больных с ОПП не установлена.
Избыточное поступление белка при ОПП может способствовать усугублению метаболического ацидоза и азотемии и, таким образом привести к необходимости проведения ЗПТ или потребовать увеличения дозы диализа. Таким образом, потребление белка более 2 г/кг/сут и менее 0,8 г/кг/сут нецелесообразно. Рекомендуется назначать 0,8-1,0 г/кг/сут белка пациентам с ОПП без признаков гиперкатаболизма и/или не нуждающимся в ЗПТ; 1,0-1,5 г/кг/сут пациентам с ОПП, получающим ЗПТ. Нормализованная скорость катаболизма белков у пациентов с ОПП, получающих продленную ЗПТ составляет 1,4 -1,8 г/кг/сут. [Fiaccadori E. и соавт. 2013]. Поэтому больным, получающим продленную ЗПТ или при наличии признаков гиперкатаболизма мы рекомендуем увеличить количество белка до 1,7 г/кг/сут (2D).
ОПП сопровождается развитием периферической инсулинорезистентности и активацией глюконеогенеза в печени, главным образом, за счет аминокислот, получаемых при распаде белков [Basi S. и соавт, 2010]. Одновременно с этим могут наблюдаться снижение клиренса экзогенных липидов и гипертригицеридемия за счет угнетения липолиза [Yang RL. И соавт. 2014]
Поступление энергии должно обеспечиваться за счет углеводов из расчета 3-5 (максимум 7) г/кг массы тела, и жиров в количестве 0,8-1,0 г/кг массы тела.
Рекомендация 4.2.1.2
Упациентов с ОПП рекомендуется осуществлять преимущественно энтеральное питание и прибегать к парентеральному лишь по мере необходимости. (2C)
Комментарий
Энтеральное питание при ОПП может быть затруднено из-за явлений пареза кишечника или развития синдрома мальабсорбции вследствие отека слизистой оболочки кишечника [Casaer MP. и соавт., 2008; Scheinkestel CD. и соавт., 2003]. Следует учитывать также влияние лекарственной терапии (седативные, опиаты, катехоламины и др.), дизэлектролитемию, коморбидность. Естественный путь поступления пищи является физиологическим стимулом перистальтики, что снижает вероятность транслокации бактерий и эндотоксинов из просвета кишечника. Благодаря этому снижается возможность развития эрозивных изменений и кровотечений из желудочно-кишечного тракта [Wu PC. Т соавт. 2015]. Начинать мы рекомендуем при помощи техники сипинга, используя жидкие, готовые к употреблению смеси.
Рекомендация 4.2.2
Применение диуретиков при ОПП с олигурией/анурией с целью восстановления диуреза следует считать оправданным только при наличии признаков гиперволемии; в остальных случая от применения диуретиков следует воздержаться.
Рекомендуется внутривенное введение фуросемида в начальной дозе 5 мг/кг/час с постепенным максимально до 20 мг/кг/час. Применение фуросемида в дозах более 400 мг/сут не оправдано (2С).
Комментарий
Применение петлевых диуретиков в ряде случаев может вызывать неблагоприятные эффекты. Так, их использование при постренальном ОПП до восстановления оттока мочи будет способствовать развитию гидронефроза и усугубит течение ОПП. Учитывая механизм действия фуросемида, его введение в условиях гиповолемии усугубит гипоперфузию почек за счет снижения ударного объема левого желудочка, а также значительно увеличит риск тромбоэмболических осложнений. Независимо от патогенетического механизма развития ОПП низкий диуретический эффект фуросемида может быть вызван сочетанием различных механизмов, включающих в себя гипопротеинемию, низкую канальцевую секрецию и слабое действие на Na-K-2Cl- котранспортер в петле Генле. Кроме того, диуретический эффект имеет обратно пропорциональное отношение с тяжестью ОНИ.
При ОПП фуросемид не снижает необходимости в ЗПТ (относительный риск
1,02, 95% С1 0,9-1,16, р = 0,73), а также внутригоспитальную смертность (относительный риск 1,12, 95% С1 0,93-1,34, р = 0,23) при его назначении с про филактической или лечебной целью пациентам с риском или уже возникшей ОПП, соответственно [Ho K.M. и соавт. 2010]. Поэтому в соответствии с рекомендациями KDIGO 2012 его следует использовать только при наличии гиперволемии [Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury, 2012]. Применение маннитола в раннем периода ОПП, преимущественно, ограничено рабдомиолизом.
Рекомендация 4.2.3
Для лечения преренального, контраст-индуцированного ОПП, при рабдомиолизе и для профилактики ОПП в периоперационном периоде рекомендуется внутривенное введение экспандеров, среди которых препаратом выбора является 0,9% раствор хлорида натрия (2В).
Комментарий
Основным механизмом развития преренального ОПП является гиперперфузия почек, обусловленная гиповолемией либо снижением сократительной способности миокарда. Наиболее частым вариантом является именно гиповолемия, для устранения которой рекомендуется начинать лечение с введения кристаллоидов. Минимальная суммарная суточная потребность в жидкости составляет в среднем 30 мл/кг/сут. Для лиц пожилого возраста, страдающих СН III-IV ф кл или имеющих СКФ <60 мл/мин не следует превышать дозу 25 мл/кг/сут. Для пациентов с ожирением объемы рассчитывают на идеальную массу тела. К недостаткам изотонических кристаллоидов следует отнести то, что они дают небольшой прирост ОЦП – примерно 20% от введенного объема даже при нормальной сосудистой проницаемости [Chowdhury A.H. и соавт. 2012; 256 Lobo D.N. и соавт. 2010]. Изотонический раствор хлорида натрия в расчете на 1 л содержит 154 ммоль натрия и 154 ммоль хлора, имеет рН 5,7 и осмолярность 308 мОсм/кг Н 2О. Следовательно, он гипертоничен по отношению к плазме крови и имеет слабокислую реакцию, что следует учитывать, особенно при введении больших его объемов.
При отсутствии эффекта от введения кристаллоидов возможно применение растворов гидроксиэтилкрахмала. При этом доза раствора гидроксиэтилкрахмала не должна превышать 500 мл/сут. [Wiedermann C.J. 2008]. Непосредственными показаниями для введения плазмы является синдром диссеминированного внутрисосудистого свертывания и/или геморрагический шок, для раствора альбумина – концентрация альбумина в сыворотке крови менее 30 г/л [Ertmer C. И соавт. 2009].
Рекомендация 4.2.3.1
Оценку эффективности применения экспандеров при ОПП рекомендуется проводить с учетом изменения клинического состояния больного (стабилизация центральной гемодинамики, уменьшение признаков гиповолемии). При отсутствии эффекта к инфузионной программе присоединяют вазопрессоры (1C).
Комментарий.
Не позднее 60 минут от начала введения экспандеров необходимо оценить динамику состояния больного. Об эффективности проводимого лечения свидетельствуют:
-
снижение времени заполнения капилляров
-
увеличение центрального венозного давления
-
увеличение артериального давления
-
появление (увеличение) диуреза
-
снижение частоты сокращения желудочков (при тахикардии).
При отсутствии эффекта от введения экспандеров (например, при септическом шоке), к инфузионной программе при соединяют вазопрессоры. Длительность их применения не должна превышать 48 часов. При этом больной должен быть подключен к кардиомонитору для своевременного выявления острых нарушений сердечного ритма.
Рекомендация 4.2.4
Лечение ренального ОПП, возникшего в результате поражения клубочков, микрососудов почки и воспаления интерстиция, следует проводить в условиях нефрологического отделения на основе принципов доказательной медицины и в соответствии с существующими клиническими рекомендациями. (NG)
Комментарий
При ренальном ОПП лечение должно включать следующие мероприятия:
-
Устранение основного провоцирующего фактора (лечение основного заболевания, прекращение введения нефротоксичных препаратов).
-
Патогенетическая терапия основного заболевания (восстановление почечного кровообращения, предотвращение тубулярной обструкции, уменьшение отека клеток канальцевого эпителия, блокада иммунных механизмов, защита клеток канальцев, стимулирование репарации почечной ткани).
-
Коррекция осложнений (контроль гидратации, коррекция уремической интоксикации, поддержание электролитного баланса, коррекция нарушений кислотно-основного состояния, профилактика и лечение инфекций).
На начальном этапе для борьбы с гиперволемией рекомендуется использовать петлевые диуретики. Перед их применением необходимо убедиться в том, что ОПП не связано с тромбозом почечных вен или артерий. Введение петлевых диуретиков начинают с тестовой дозы в виде болюса фуросемида в/в 40 или 80 мг. По результатам теста далее применяют инфузию фуросемида соответственно 10 или 20 мг/час под контролем почасового диуреза. Отсутствие эффекта в течение 4 часов является показанием для начала ЗПТ.
Рекомендация 4.2.5
Для раннего выявления основных жизнеугрожающих осложнений ОПП (гиперволемия, тяжелая уремическая интоксикация, дизэлектролитемия и метаболический ацидоз) рекомендуется мониторинг волемического статуса, ионограммы, кислотно -основного состояния крови. При необходимости выполнения этих исследований более 1 раза в сутки рекомендуется решать вопрос о наблюдении больного в условиях отделения интенсивной терапии (NG).
Комментарий
Гиперволемия, тяжелая уремическая интоксикация, дизэлектролитемия (включая как высокий, так и низкий уровень основных электролитов в сыворотке крови) и метаболический ацидоз могут развиваться как при олигурическом, так и при неолигурическом ОПП. С целью ранней диагностики этих состояний рекомендуется мониторинг волемического статуса, ионограммы, кислотно-основного состояния крови. При изменении показателей, требующих их определения более 1 раза в сутки и/или выраженных проявлениях ОПП (гиперазотемия, снижение уровня сознания, перикардит, угроза отека легких) необходимо проводить наблюдение больного в условиях отделения интенсивной терапии.
Рекомендация 4.2.5.1
Симптоматическое лечение дизэлектролитемии и метаболического ацидоза рекомендуется проводить в соответствии с существующими подходами (NG).
Комментарий
Алгоритм терапевтических действий складывается из ряда последовательных мероприятий. В первую очередь рекомендуется установить и по возможности устранить все возможные причины дизэлектролитемии помимо собственно ОПП. Наиболее частым вариантом дизэлектролитемии является гиперкалиемия, основные причины которой приведены ниже и в таблице 19)
Основные причины гиперкалиемии
-
Избыточное алиментарное потребления калия
-
Парентеральное питание
-
Инфузии крови со сроком хранения более 7 суток
-
Повреждение тканей (ожоги, политравма, рабдомиолиз, гемолиз, синдром лизиса опухоли)
-
Гиперкатаболизм белков
-
Инсулинорезистентность
-
Метаболический ацидоз
-
Медикаменты (табл )
| Препарат | Комментарий |
|---|---|
|
Амилорид и триамтерен |
Уменьшает экскрецию калия, |
|
Аминокислоты* |
Лизин, аргинин и ε-аминокапроновая кислота проникают в клетки в обмен на калий |
|
Ингибиторы АПФ и блокаторы рецепторов к ангиотензину |
Снижают экскрецию калия за счет угнетения синтеза альдостерона |
|
Азоловые противогрибковые препараты (флуконазол, итраконазол, кетоконазол и миконазол) |
Подавляют синтез стероидов в надпочечниках, что может приводить к дефициту альдостерона |
|
β-блокаторы |
Снижают активность Na-K-АТФазы; препятствуют действию β-агонистов |
|
Циклоспорин |
Угнетает выработку ренина, приводя к снижению синтеза альдостерона и уменьшению секреции калия в собирательных канальцах почек |
|
Дигоксин |
Снижает активность Na-K-АТФазы |
|
Эплеренон |
Блокирует связывание альдостерона с рецепторами минералокортикостероидов |
|
Этинил эстрадиола/ дроспиренон |
Аналог спиронолактона |
|
Маннитол |
Вызывает повышение осмотического давления крови |
|
Инфузия глюкозы или дефицит инсулина |
Гипертоничность плазмы крови, обусловленная гипергликемией в результате инфузии глюкозы, может способствовать выходу калия из клеток, приводя к гиперкалиемии. Гиперкалиемия может развиваться как при постоянной инфузии, так и при болюсном введении гипертонического раствора глюкозы. |
|
Гепарин и его производные |
Может вызывать гиперкалиемию у больных со сниженной функцией почек; подавляет синтез альдостерона |
|
Растительные препараты, действие которых подобно наперстянке |
Молочай, ландыш, сибирский женьшень, боярышник или лекарства из кожи лягушки (Буфо, Чансу, Сенсо). Перечисленные медикаменты угнетают активность Na-KАТФазы, в результате чего повышается внеклеточное содержание калия |
|
НПВП |
НПВП и селективные ингибиторы ЦОГ угнетают синтез простагландинов, что приводит к снижению кровотока по афферентным артериолам, угнетая синтез альдостерона вторично по отношению к снижению секреции ренина) |
|
Пищевые и растительные добавки |
Некоторые растения содержат большое количество калия (например, люцерна, одуванчик, хвощ, крапива) |
|
Эритромасса |
При хранении более 7 суток происходит лизис эритроцитов |
|
Калиевая соль пенициллина |
Может обусловливать гиперкалиемию у пациентов с нарушением функции почек |
|
Калиевые добавки или заменители соли |
К основным пищевым источникам калия относят бананы, виноград, изюм, дыню и цитрусовые |
|
Спиронолактон |
Подавляет связывание альдостерона с рецепторами почечных канальцев |
|
Сукцинилхолин |
Связывается с никотиновыми ацетилхолиновыми рецепторами, количество которых в поврежденных скелетных мышцах (например, при травме или ожогах) повышено |
|
Такролимус |
Угнетает выработку ренина, приводя к снижению синтеза альдостерона и уменьшению секреции калия в собирательных канальцах почек |
|
Триметоприм и пентамидин |
Угнетает секрецию калия в собирательных канальцах почек |
Основными неблагоприятными эффектами метаболического ацидоза являются:
-
Снижение сократительной способности миокарда
-
Нарушения сердечного ритма
-
Нарушения ритма дыхания
-
Резистентность к сосудосуживающему действию катехоламинов с развитием артериальной гипотензии
Для коррекции метаболического ацидоза можно использовать 3,66 % раствор трометамола или 4 % раствор бикарбоната натрия. Рекомендуется начинать с введения 100 мл 4 % раствора бикарбоната натрия в течение 40–60 мин, затем вновь определить показатели КОС. Как правило, указанной дозы препарата бывает достаточно для поддержания pH выше 7,2. Стремиться к быстрой полной нормализации метаболического ацидоза не следует, так как это может привести к гипернатриемии.
Обычно применяемый при гипернатриемии и метаболическом ацидозе трометамол при олигурической ОПП использовать не следует. Это связано это с тем, что препарат выводится с мочой и его ретенция сопровождается увеличением осмолярности крови и опасна в плане развития отека легких и гиперкалиемии.
Рекомендация 4.2.6
При постренальном ОПП показана консультация уролога для решения вопроса о способе восстановления пассажа мочи (катетеризация мочевого пузыря, наложение эпицистостомы, стентирование мочеточников, наложение нефростомы) как можно быстрее, но не позднее ближайших 12 часов после госпитализации пациента (NG).
Комментарий
Основная задача терапии – как можно быстрее устранить нарушение оттока мочи для того, чтобы избежать необратимой потери функционирующей ткани почек. При нарушении оттока мочи на уровне уретры -мочевого пузыря установка мочевого катетера является необходимой и нередко – достаточной. Как правило, эта процедура выполняется действительно в экстренном порядке. При неэффективности катетеризации мочевого пузыря рассматривают вопрос о наложении эпицистостомы. При нарушении проходимости мочеточников выполняют их стентирование. При неэффективности последнего, необходимо выполнение нефростомии. Следует особо отметить, что при нарушении оттока мочи из обеих почек необходимо выполнять стентирование или нефростомию как справа, так и слева. Подобное вмешательство требует подготовки |операционной, наличия полноценной операционной бригады, что подразумевает проведение определенных организационных мероприятий, обеспечивающих его выполнение круглосуточно 7 дней в неделю, но не позднее 12 часов после поступления больного в стационар.
Нередко у пациентов сразу после выполнения урологического пособия развивается фаза полиурии с увеличением диуреза до 4 -6 и более литров в сутки. Такая ситуация требует тщательного контроля и коррекции волемического статуса. В качестве базового мы рекомендуем введение 0,9% раствора хлорида натрия с дополнением препаратов калия, кальция и магния в соответствии с ионограммой. Объем инфузий мы рекомендуем проводить строго под контролем центрального венозного давления. Полиурическая фаза ОПП требует пребывания больного в отделении интенсивной терапии в связи с необходимостью введения больших объемов жидкости, а также неоднократного биохимического контроля и риска развития сердечно-сосудистых осложнений.
Рекомендация 4.2.7
ЗПТ рекомендуется в качестве основного симптоматического метода лечения с целью ликвидации гиперволемии (рефрактерной к диуретической терапии), при тяжелой уремической интоксикации, угнетении сознания, а также для коррекции дизэлектролитемии и метаболического ацидоза (NG).
Комментарий
При проведении ЗПТ необходимо учитывать риски, связанные с наличием временного сосудистого доступа, инфекцией и антикоагулянтной терапии. Оптимальное время начала ЗПТ не определено. Так как ЗПТ является симптоматическим видом лечения, основным принципом является не раннее или отсроченное , а своевременное начало, до наступления потенциально жизнеугрожаемых осложнений ОПП. [Thakar C.V. и соавт. 2013]. Как правило, необходимость применения ЗПТ возникает (но не ограничивается этим) при ОПП III стадии. Показания для начала ЗПТ можно разделить на абсолютные и относительные (Табл. 20). Абсолютными показаниями для начала ЗПТ являются: концентрация в сыворотке крови мочевины более 36 ммоль/л, калия более 6 ммоль/л, магния более 4 ммоль/л, рН менее 7,15, лактата более 7,0 ммоль/л (на фоне приема метформина).
В ряде случаев нефролог может рекомендовать начинать ЗПТ по относительным показаниям.
| Показатель | Характеристика | Абсолютное/Относительное |
|---|---|---|
|
Метаболические нарушения |
Мочевина > 27 ммоль/л |
Относительное |
|
Мочевина > 35,7 ммоль/л |
Абсолютное |
|
|
Гиперкалиемия > 6 ммоль/л |
Относительное |
|
|
Гиперкалиемия > 6 ммоль/л и ЭКГ-изменения |
Абсолютное |
|
|
Диснатриемия |
Относительное |
|
|
Гипермагнезиемия > 4 ммоль/л с анурией и отсутствием глубоких сухожильных рефлексов |
Абсолютное |
|
|
Ацидоз |
рН>7,15 |
Относительное |
|
рН<7,15 |
Абсолютное |
|
|
Лактатацидоз на фоне приема метформина |
Абсолютное |
|
|
Олигурия/Анурия |
KDIGO I стадия |
Относительное |
|
KDIGO II стадия |
Относительное |
|
|
KDIGO III стадия |
Относительное |
|
|
Гиперволемия |
Чувствительная к диуретикам |
Относительное |
|
Нечувствительная к диуретикам |
Абсолютное |
Рекомендация 4.2.7.1
При ОПП может использоваться любая методика ЗПТ, доступная в данном лечебном учреждении. Интермиттирующий гемодиализ и вено-венозная гемодиафильтрация одинаково эффективны при ОПП. Интермиттирующий гемодиализ является процедурой выбора по медикоэкономическ им причинам. Продленные процедуры гемодиализа рекомендуются при остром церебральном поражении, фултминантной печеночной недостаточности, нестабильности центральной гемодинамики. Перитонеальный диализ рекомендуется использовать у детей, лиц пожилого и старческого возраста, при трудностях создания сосудистого доступа, тяжелой сердечно-сосудистой патологии.
Комментарий
При выборе метода ЗПТ следует учитывать основной механизм развития ОПП. В большинстве случаев при острой дисфункции почек требуется экстренно удалить избыток жидкости и некоторых ионов. Для этой цели достаточно проведения стандартного интермиттирующего ежедневного гемодиализа. В качестве временного доступа рекомендуется катетеризация одной из югулярных вен под контролем УЗИ.
Первую пробную процедуру рекомендуется проводить не долее 1,0-1,5 часов, если состояние больного не требует иного. В дальнейшем длительность процедур интермиттирующего гемодиализа постепенно увеличивают до 4,0-6,0 часов, а величину «дозы диализа» до 1,2. Достижение хотя бы одного из указанных показателей является поводом для перевода больного на три процедуры интермиттирующего гемодиализа в неделю.
Скорость потока диализата рекомендуется не ниже 500 мл/мин, температура диализирующего раствора 36 -37С. Скорость кровотока при до ступе через центральный венозный катетер 250-350 мл/мин. При концентрации мочевины в сыворотке крови более 40 ммоль/л рекомендуется во избежание синдрома рикошета длительность процедуры и скорость кровотока уменьшить таким образом, чтобы получить URR около 40%. Обычно для этого выставляют скорость кровотока, равную трехкратной массе тела больного в килограммах для взрослых пациентов.
Недостаточная эффективность диализа может быть связана с рециркуляцией крови в катетере (чаще всего при бедренном доступе) вследствие низкого тока крови в вене. Нередко процедуру приходится прерывать из-за развития гипотензии. Кроме того, может быть увеличен объем секвестрации мочевины в мышцах за счет действия вазопрессоров, уменьшающих кровоток в коже и мышечной ткани, где накапливается значительный объем мочевины. Сопутствующая инфузионная терапия снижает уровень мочевины за счет разведения крови и также может уменьшать эффективность диализа. При недостаточной эффективности диализа вследствие любых причин рекомендуется проводить два сеанса интермиттирующего диализа в течение суток либо переходить на продленные или гибридные процедуры.
Продленные процедуры гемодиализа позволяют удалять вещества молекулярной массой более 10 кДа, более физиологичны в плане восстановления гомеоста за и волемического статуса, наиболее эффективны при нестабильной гемодинамике. Однако, они сокращают пропускную способность диализной аппаратуры, требуют больших доз антикоагулянтов, постоянного контроля со стороны медперсонала, имеют существенно более высокую стоимость. Рекомендуемая скорость замещения 25-35 мл/кг/час.
Перитонеальный диализ также может использоваться при ОПП, однако РКИ по его применению отсутствуют. К преимуществам этого вида ЗПТ можно отнести простоту, доступность, отсутствие необходимости применения антикоагулянтов. Однако, перитонеальный диализ не лишен недостатков. К ним в первую очередь относят относительно невысокие клиренсы уремических токсинов, трудно регулируемую ультрафильтрацию, зависимость от объема брюшины, риск перитонита. Количество обмениваемой жидкости выбирают индивидуально с учетом состояния внешнего дыхания, объема брюшной полости, а также типа перитонеального катетера. Начинают с введения 1,0-1,5 л раствора, при хорошей переносимости увеличивают объем вливаемого раствора до 2,0 л. Пациентам с большим объемом брюшной полости обменивают за цикл по 2,5-3 л раствора, Обмены производят каждый час. В процессе П. д. в брюшную полость вводят гепарин (500 ЕД на 1 л раствора), чтобы предупредить закупорку катетера сгустками фибрина. Введенный в брюшную полость гепарин не реабсорбируется и практически не увеличивает опасности кровотечения. Пациенты, находящиеся на П. д. и парентеральном питании, нуждаются в дополнительном введении аминокислот и белка.
Рекомендация 4.2.7.2
Интермиттирующий гемодиализ рекомендуется использовать при острых отравлениях барбитуратами, соединениями тяжелых металлов и мышьяка, дихлорэтаном, метиловым спиртом, этиленгликолем, хинином и рядом других токсических веществ, имеющих меньшее практическое значение (Табл. 21, см. ниже) (NG)
Комментарий
Возможность удаления какого-либо вещества через полупроницаемую диализную мембрану зависит от его физикохимических и токсикологических свойств.
Вещество должно:
-
Быть относительно низкомолекулярным (размер молекулы не более 8 нм).
-
Водорастворимым и находиться в плазме в свободном, не связанном с белками состоянии, или эта связь должна быть легко обратима, т.е. при уменьшении концентрации вещества в крови во время диализа она должна непрерывно восполняться за счёт освобождения от связи с белком.
-
Циркулировать в крови не менее 6-8 ч (время, достаточное для подключения аппарата «искусственная почка» и прохождения через диализатор нескольких ОЦК).
-
Иметь прямую зависимость между концентрацией в крови и клиническими проявлениями интоксикации.
Вещества, удаляемые во время гемодиализа при острых отравлениях
Азатиоприн, аллопуринол, амикацин, аминофиллин, ампициллин, анальгетики, атенолол, ацетаминофен, ацетон, бацитрацин, бромиды, ванкомицин. гентамицин, дигоксин, изопропранолол, ингибиторы АПФ, ингибиторы МАО, йодиды, калий, камфора канамицин, карбенициллин, колхицин, литий, маннитол, метанол, метилдопа, метилпреднизолон, мышьяк, неомицин, паральдегид, паракват, пенициллин, пропранолол,салицилаты, свинец, спирты, стрептомицин, стрихнин, сульфонамиды, теофиллин, тетрациклин, тобрамицин, хлоралгидрат, химиотерапевтические средства, хинин, хлориды, хлороквин, фенобарбитал, флуорид, фолиевая кислота, фосфаты, 5-фторурацил, цефамандол, циклосерин, эрготамин, этиленгликоль.
Рекомендация 4.2.7.3
Не рекомендуется при решении вопроса о характере антикоагулянтной терапии использовать шкалы оценки риска кровотечений HAS-BLED, CRUSADE, ATRIA (NG).
Комментарий
Применение любых методик ЗПТ, кроме перитонеального диализа, требует введения антикоагулянтов. Мы не рекомендуем перед назначением антикоагулянтов использовать шкалы оценки риска кровотечений, так как в них уже имеется фактор дисфункции почек с СКФ менее 30 мл/мин/1,73м2. Кроме того, у больных с преренальным ОПП артериальная гипертензия отсутствует. Целесообразно учитывать такие показатели, как возраст старше 65 лет, наличие ЖКТ кровотечений в анамнезе, наличие цирроза печени, злоупотребление алкоголем, прием лекарственных препаратов, способствующих язвообразованию слизистой ЖКТ или снижающих свертывающую способность крови, тромбоцитопения, МНО более 2,0.
Рекомендация 4.2.7.4
У пациентов с низким или средним риском кровотечения, нарушениями коагуляции, не получающих системные антикоагулянты рекомендуется при проведении интермиттирующей ЗПТ использовать нефракционированный или низкомолекулярный гепарин (1С). При продленных процедурах ЗПТ рекомендуется использовать регионарную антикоагуляцию цитратом (при отсутствии противопоказаний для введения цитрата) (2B). При наличии противопоказаний для введения цитрата, мы рекомендуем использовать низкомолекулярный гепарин (2C).
Комментарий
Антикоагулянтгая терапия необходима при ЗПТ для профилактики тромбирования диализатора (потеря крови в тромбированном диализаторе) и/или снижения проницаемости мембраны. Однако, эти положительные эффекты необходимо сопоставлять с риском кровотечений. При использовании нефракционированного гепарина дозу титруют до достижения целевого АЧТВ 60 сек. В качестве низкомолекулярного гепарина мы используем эноксипарин в дозе 1 мг/кг массы тела. При высоком риске развития кровотечения дозу снижаем до 0,5 мг/кг массы тела с последующей инфузией препарата 0,05 мг/кг/ч.
У пациентов с тромбоцитопенией, увеличением протромбинового времени или активированного частичного тромбопластинового времени (АЧТВ), обусловленными основным заболеванием (например, печеночной недостаточностью) или дилюционной коагулопатией, дополнительная антикоагулянтная терапия при ЗПТ не имеет преимуществ. [Bellomo R и соавт. 2009; Palevsky PM и соавт. 2008].
Низкомолекулярный и нефракционированный гепарин одинаково безопасны в отношении риска кровотечения и эффективны в отношении тромбоза экстракорпорального контура [Lim W, Cook DJ, Crowther MA. Safety and efficacy of low molecular weight heparins for hemodialysis in patients with end-stage renal failure: a meta-analysis of randomized trials. J Am Soc Nephrol 2004; 15:3192–3206]. Однако, применение низкомолекулярного гепарина более удобно (одна болюсная инъекция в начале интермиттирующего ГД) и низкого риска развития гепарин-индуцированной тромбоцитопении, а также отдаленных побочных эффектов (дислипидемия, остеопороз, гиперальдостеронизм) [European Best Practice Guidelines for Haemodialysis (Part 1). V. Chronic intermittent haemodialysis and prevention of clotting in the extracorporal system, 2002].
Однако, необходимо помнить о том, что элиминация низкомолекулярных гепаринов осуществляется преимущественно почками. В связи с этим при ОПП возможна кумуляция препарата, что увеличивает риск кровотечения.
Поэтому дозы препаратов при интермиттирующем ГД следует подбирать индивидуально в зависимости от наличия/отсутствия нарушений коагуляции и/или риска кровотечений.
Рекомендация 4.2.7.5
У пациентов с высоким риском кровотечения, не получающим системную антикоагулянтную терапию рекомендуется использовать регионарную цитратную антикоагуляцию (при отсутствии противопоказаний для введения цитрата) (2C). Рекомендуется избегать применения регионарной гепаринизации при проведении продленных процедур ЗПТ у пациентов с высоким риском кровотечения. (2C).
Комментарий
Антикоагулянтное действие цитрата натрия заключается в образовании комплекса с ионизированным кальцием и таким образом, прерывания коагуляционного каскада. Часть цитрата потребляется в экстракорпоральном контуре. Цитрат, попадающий в системную циркуляцию, быстро метаболизируется в печени, мышцах и почках с высвобождением кальция и образованием бикарбоната. Экстракорпоральные потери кальция необходимо компенсировать дополнительно инфузиями.
При проведении процедуры ЗПТ дозу цитрата титруют до достижения уровня ионизированного кальция после диализатора менее 1,2 мг/дл (0,3 ммоль/л).
Рекомендация 4.2.7.6
Рекомендуется прекращать ЗПТ при увеличении диуреза более 0,5/кг/час или при отсутствии риска жизнеугрожающих осложнений ОПП (NG).
Комментарий
У большинства пациентов с ОПП удается восстановить функции почек до уровня, когда ЗПТ не требуется. Рекомендуется завершать проведение процедур ЗПТ при достижении следующих показателей:
-
Диурез более 0,5 мл/кг/час при суточной потребности в петлевых диуретиках не более 200 мг/сут и ЦВД не выше 15 мм вод ст
-
Концентрация калия в сыворотке крови не выше 6,0 ммоль/л
-
Отсутствие тяжелого метаболического ацидоза (SB более 15 ммоль/л без инфузий бикарбоната натрия
-
Концентрация мочевины в сыворотке крови перед началом очередного сеанса гемодиализа менее 20 ммоль/л
Заключение
В настоящих Рекомендациях предпринята попытка суммировать международный и отечественный опыт по поиску адекватного определения, классификации и стратификации тяжести, диагностики, профилактики и подходов к лечению ОПП. К сожалению, приходиться признать, что большинство проблем ОПП в настоящее время не имеют удовлетворительного решения. Тем не менее, выработка единой концепции, стратегии и тактики в отношении ведения пациентов с ОПП может существенно улучшить исходы данного состояния. Есть основания полагать, что, несмотря на все существующие проблемы, данные Рекомендации будут способствовать решению этой чрезвычайно сложной и важной задачи.
Литература
Добронравов ВА. Обзор патофизиологии острого повреждения почек. В: Смирнов А.В., Добронравов В.А., Румянцев А.Ш. Острое повреждение почек. МИА, М., 2015; 30-79
Каюков ИГ, Смирнов АВ, Эмануэль ВЛ. Цистатин С в современной медицине. Нефрология 2012; 16(1): 22–39
Каюков И.Г., Румянцев А.Ш. Контраст-индуцированное ОПП. В: Смирнов А.В., Добронравов В.А., Румянцев А.Ш . Острое повреждение почек. МИА, М., 2015 ; 30-79 Смирнов АВ. Клиника и диагностика острого повреждения почек. В : Смирнов
А.В., Добронравов В.А., Румянцев А.Ш. Острое повреждение почек. МИА, М.,
2015; 393-414
Смирнов АВ, Добронравов ВА, Каюков ИГ. Кардиоренальный континуум: патогенетические основы превентивной нефрологии. Нефрология 2005; 9(3): 7-15
Смирнов АВ, Каюков ИГ, Дегтерева ОА и др. Проблемы диагностики и стратификации тяжести острого повреждения почек. Нефрология 2009; 13(3): 9- 18
Bagshaw SM, Hoste EA, Braam B, Briguori C, Kellum JA, McCullough PA, Ronco C.Cardiorenal syndrome type 3: pathophysiologic and epidemiologic considerations. Contrib Nephrol 2013;182:137-157
Basi S, Pupim LB, Simmons EM, et al. Insulin resistance in critically ill patients with acute renal failure. Am J Physiol Renal Physiol 2005; 289: F259–264
Bellomo R, Ronco C, Kellum JA, Mehta RL, Palevsky P, Acute Dialysis Quality Initiative workgroup. Acute renal failure – definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Crit Care 2004;8:R204–R212
Bellomo R, Cass A, Cole L, et al. Intensity of continuous renal replacement therapy in critically ill patients. N Engl J Med 2009; 361: 1627-1638
Bonventre J.V., Vaidya V.S., Schmouder R. et al. Next-generation biomarkers for detecting kidney toxicity. Nat Biotechnol 2010; 28 (5): 436–440
Bouman C , Kellum JA, Lamiere N, Levin N. Definition of acute renal failure. Acute Dialysis Quality Initiative. 2nd International Consensus Conference, 2002; National Kidney Foundation KD: Clinical practice guidelines for chronic Kidney disease: Evaluation, classification and stratification. Am J Kidney Dis 2002;39 [Suppl 1]: S1- S266
Bucaloiu I.D., Kirchner H.L., Norfolk E.R. et al. Increased risk of death and de novo chronic kidney disease following reversible acute kidney injury, Kidney Int 2012; 81(5): 477–485
Case J, Khan S, Khalid R, Khan A. Epidemiology of acute kidney injury in the intensive care unit. Crit Care Res Pract 2013;2013:479730. doi: 10.1155/2013/479730. Epub 2013 Mar 21
Casaer MP, Mesotten D, Schetz MR. Bench-to-bedside review: metabolism and nutrition. Crit Care. 2008;12(4):222
Chowdhury A.H., Cox E.F., Francis S.T., Lobo D.N. A randomized, controlled, double-blind crossover study on the effects of 2-L infusions of 0.9% saline and plasma-lyte(R) 148 on renal blood flow velocity and renal cortical tissue perfusion in healthy volunteers. Annals of Surgery. 2012; 256 (1): 18-24
Coca S.G., Singanamala S., Parikh C.R. Chronic kidney disease after acute kidney injury: a systematic review and meta—analysis. Kidney Int 2012; 81(5): 442–448
Cogliati A.A., Vellutini R., Nardini A. et al. Fenoldopam infusion for renal protection in high-risk cardiac surgery patients: a randomized clinical study. J Cardiothorac Vasc Anesth. 2007; 21: 847-85
Conti M., Moutereau S., Zater M. et al. Urinary cystatin C as a specifi c marker of tubular dysfunction. Clin Chem Lab Med 2006; 44(3): 288–291
Chertow G.M., Burdick E., Honour M. et al. Acute kidney injury, mortality, length of stay, and costs in hospitalized patients. J Am Soc Nephrol 2005; 16 3365–3370 Edelstein C.L. Biomarkers in Kidney Disease. Elsevier Inc., 2011.
Ertmer C., Rehberg S., Van Aken H. et al. Relevance of non-albumin colloids in intensive care medicine. Best Pract Res Clin Anaesthesiol. 2009; 23: 193–212
European Best Practice Guidelines for Haemodialysis (Part 1). V. Chronic intermittent haemodialysis and prevention of clotting in the extracorporal system. Nephrol Dial Transplant 2002; 17 (Suppl 7): 63-71
Fiaccadori E, Regolisti G, Cabassi A. Specific nutritional problems in acute kidney injury, treated with non-dialysis and dialytic modalities. NDT Plus. 2010;3(1):1-7
Fiaccadori E., Regolisti G., Maggiore U. Specialized nutritional support interventions in critically ill patients on renal replacement therapy. Curr Opin Clin Nutr Metab Care 2013;16(2):217-224
Fouque D, Kalantar-Zadeh K, Kopple J et al. A proposed nomenclature and diagnostic criteria for protein-energy wasting in acute and chronic kidney disease. Kidney Int. 2008;73(4):391-398
Friedrich J.O., Adhikari N., Herridge M.S., Beyene J. Meta-analysis: low-dose dopamine increases urine output but does not prevent renal dysfunction or death. Ann Intern Med. 2005; 142: 510-524
Fuiano G., Mazza G., Comi N. et al. Current indications for renal biopsy: a questionnaire-based survey. Am J Kidney Dis 2000; 35(3): 448–457
Geus H., Betjes M., Bakker J. Biomarkers for the prediction of acute kidney injury: a narrative review on current status and future challenges. Clin Kidney J 2012; 5(2): 102–108
Giampietri C., Starace D., Petrungaro S., Filippini A., Ziparo E. Necroptosis: Molecular signalling and translational Implications. Int J Cell Biol 2014; 2014:490275
Gibney NI, Hoste E, Burdmann EA et al. Timing of initiation and discontinuation of renal replacement therapy in AKI: unanswered key questions. Clin J Am Soc Nephrol. 2008;3(3):876-880
Haase M., Bellomo R., Haase-Fielitz A. Serum cystatin C may diagnose rather than predict acute kidney injury. Am J Kidney Dis 2012; 59(4): 582
Hirschberg R1, Kopple J, Lipsett P et al. Multicenter clinical trial of recombinant human insulin-like growth factor I in patients with acute renal failure. Kidney Int. 1999;55(6):2423- 2432
Ho K.M., Power B.M. Benefits and risks of furosemide in acute kidney injury. Anaesthesia. 2010; 65 (3): 283-293
Hoste EA, Clermont G, Kersten A, Venkataraman R, AngusDC, De Bacquer D, Kellum JA. RIFLE criteria for acute kidney injury are associated with hospital mortality in critically ill patients: a cohort analysis. Crit Care 2006;10(3): R73
Jones J, Holmen J, De Graauw J et al. Association of complete recovery from acute kidney injury with incident CKD stage 3 and all-cause mortality. Am J Kidney Dis 2012; 60(3):402-408
Hsu CY, McCulloch CE, Fan D et al. Community-based incidence of acute renal failure. Kidney Int 2007; 72: 208-212
Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney Inter. Suppl. 2012; Issue 1: 1–126
Korkeila M, Ruokonen E, Takala J. Costs of care, long-term prognosis and quality of life in patients requiring renal replacement therapy during intensive care. Intensive Care Med 2000;26:1824–1831
Lewington AJP, Jorge Cerdá J, Mehta RL. Raising awareness of Acute Kidney Injury: A global perspective of a silent killer. Kidney Int 2013; 84(3): 457–467
Liano F, Pascual J. Epidemiology of acute renal failure: a prospective, multicenter, community-basedstudy. Madrid Acute Renal Failure Study Group. Kidney Int 1996; 50: 811-818
Lobo D.N., Stanga Z., Aloysius M.M. et al. Effect of volume loading with 1 liter intravenous infusions of 0.9% saline, 4% succinylated gelatine (Gelofusine) and 6% hydroxyethyl starch (Voluven) on blood volume and endocrine responses: a randomized, three-way crossover study in healthy volunteers. Critical Care Medicine. 2010; 38 (2): 464-470
Lopez-Gomez J.M., Rivera F. Renal biopsy fi ndings in acute renal failure in the cohort of patients in the Spanish Registry of Glomerulonephritis. Clin J Am Soc Nephrol 2008; 3(3): 674–681
Macedo E, Bouchard J, Soroko S.H. et al. Fluidh accumulation, recognition and staging of acute kidney injury in critically-ill patients. Crit Care. 2010;14(3): R82
Mammen C., Al Abbas A., Skippen P. et al. Long—term risk of CKD in children surviving episodes of acute kidney injury in the intensive care unit: a prospective cohort study. Am J Kidney Dis 2012; 59(4): 523–530
Mårtensson J, Martling CR, Bell M. Novel biomarkers of acute kidney injury and failure: clinical applicability. Br J Anaesth 2012;109(6):843-850
Mehta RL, Kellum JA, Shah SV, Molitoris BA, Ronco C,Warnock DG, Levin A; Acute Kidney Injury Network. Acute Kidney Injury Network: report of an initiative to improve outcomes in acute kidney injury. Crit Care 2007;11(2):R31
Murugan R., Kellum J.A. Acute kidney injury: what’s the prognosis? Nat Rev Nephrol 2011; 7: 209 – 217
Noto A., Cibecchini F., Fanos V. et al. NGAL and metabolomics: the single biomarker to reveal the metabolome alterations in kidney injury. Biomed Res Int 2013; id 612032
Palevsky PM, Zhang JH, O’Connor TZ, et al. Intensity of renal support in critically ill patients with acute kidney injury. N Engl J Med 2008; 359: 7-20
Palevsky PM, Liu KD, Brophy PD, Chawla LS, Parikh CR, Thakar CV, Tolwani AJ, Waikar SS, Weisbord SD. KDOQI US commentary on the 2012 KDIGO clinical practice guideline for acute kidney injury. Am J Kidney Dis 2013;61(5):649-672
Piccinni P, Cruz DN, Gramaticopolo S, Garzotto F, Dal Santo M, Aneloni G, et al; NEFROINT investigators. Prospective multicenter study on epidemiology of acute kidney injury in the ICU: a critical care nephrology Italian collaborative effort (NEFROINT). Minerva Anestesiol 2011;77:1072–1083
Rivera F., Lopez-Gomez J.M., Perez-Garcia R. Clinicopathologic correlations of renal pathology in Spain. Kidney Int 2004; 66(3): 898–904
Ronco C, Haapio M, House AA, Anavekar N, Bellomo RJ. Cardiorenal syndrome. Am Coll Cardiol 2008;52(19):1527-1539
Salvadori M., Bertoni E. Update on hemolytic uremic syndrome: Diagnostic and therapeutic recommendations. World J Nephrol 2013; 2(3): 56–76.
Scheinkestel CD1, Kar L, Marshall K et al. Prospective randomized trial to assess caloric and protein needs of critically Ill, anuric, ventilated patients requiring continuous renal replacement therapy. Nutrition. 2003;19(11-12):909-916
Shamir M.Y., Kaplan L., Marans R.S. et al. Urine fl ow is a novel hemodynamic monitoring tool for the detection of hypovolemiaю Anesth Analg 2011; 112(3): 593– 596
Slocum JL, Heung M, Pennathur S. Marking renal injury: can we move beyond serum creatinine? Transl Res 2012;159(4):277-289
Sward K., Valsson F., Odencrants P. et al. Recombinant human atrial natriuretic peptide in ischemic acute renal failure: a randomized placebocontrolled trial. Crit Care Med. 2004; 32: 1310–1315
Tesch G.H. Review: Serum and urine biomarkers of kidney disease: A pathophysiological perspective. Nephrology (Carlton) 2010; 15(6): 609–616.
Thakar CV, Christianson A, Almenoff P et al. Degree of acute kidney injury before dialysis initiation and hospital mortality in critically ill patients. Int J Nephrol. 2013; 2013: 827459
Wiedermann C.J. Systematic review of randomized clinical trials on the use of hydroxyethyl starch for fluid management in sepsis. BMC Emerg Med. 2008; 8: 1-8
Wu VC, Wu CH, Huang TM et al. Long-Term risk of coronary events after AKI. J Am Soc Nephrol; doi: 10.1681/ASN.2013060610, 6 February 2014
Waikar SS, Liu KD, Chertow GM. Diagnosis, epidemiology and outcomes of acute kidney injury. Clin J Am Soc Nephrol 2008; 3(3):844-861
Waikar SS, Bonventre JV. Creatinine kinetics and the definition of acute kidney injury. J Am Soc Nephrol 2009 20(3):672-679
Wu PC, Wu CJ, Lin CJ et al. Long-term risk of upper gastrointestinal hemorrhage after advanced AKI. Clin J Am Soc Nephrol. 2015;10(3):353-362
Yang RL, Wang XT, Liu DW, Liu SB. Energy and oxygen metabolism disorder during septic acute kidney injury. Kidney Blood Press Res. 2014;39(4):240-251
Zeng X, McMahon GM, Brunelli SM, Bates DW, Waikar SS. Incidence, outcomes, and comparisons across definitions of AKI in hospitalized individuals. Clin J Am Soc Nephrol. 2014;;9(1):12-20
Zhang Z., Lu B., Sheng X. et al. Cystatin C in prediction of acute kidney injury: a systemic review and meta-analysis. Am J Kidney Dis 2011; 58(3): 356–365
Острая почечная недостаточность
Острая почечная недостаточность – это потенциально обратимое, внезапно наступившее выраженное нарушение или прекращение функции почек. Характерно нарушение всех почечных функций (секреторной, выделительной и фильтрационной), выраженные изменения водно-электролитного баланса, быстро нарастающая азотемия. Диагностика осуществляется по данным клинических и биохимических анализов крови и мочи, а также инструментальных исследований мочевыделительной системы. Лечение зависит от стадии ОПН, включает симптоматическую терапию, методы экстракорпоральной гемокоррекции, поддержание оптимального артериального давления и диуреза.
Общие сведения
Острая почечная недостаточность – внезапно развивающееся полиэтиологическое состояние, которое характеризуется серьезными нарушениями функции почек и представляет угрозу для жизни пациента. Патология может провоцироваться заболеваниями мочевыделительной системы, нарушениями со стороны сердечно-сосудистой системы, эндогенными и экзогенными токсическими воздействиями, другими факторами. Распространенность патологии составляет 150-200 случаев на 1 млн. населения. Пожилые люди страдают в 5 раз чаще лиц молодого и среднего возраста. В половине случаев ОПН требуется гемодиализ.
Острая почечная недостаточность
Причины
Преренальная (гемодинамическая) острая почечная недостаточность возникает вследствие острого нарушения гемодинамики, может развиваться при состояниях, которые сопровождаются снижением сердечного выброса (при тромбоэмболии легочной артерии, сердечной недостаточности, аритмии, тампонаде сердца, кардиогенном шоке). Нередко причиной становится уменьшение количества внеклеточной жидкости (при диарее, дегидратации, острой кровопотере, ожогах, асците, вызванном циррозом печени). Может формироваться вследствие выраженной вазодилатации при бактериотоксическом или анафилактическом шоке.
Ренальная (паренхиматозная) ОПН провоцируется токсическим или ишемическим поражением почечной паренхимы, реже — воспалительным процессом в почках. Возникает при воздействии на почечную паренхиму удобрений, ядовитых грибов, солей меди, кадмия, урана и ртути. Развивается при бесконтрольном приеме нефротоксичных медикаментов (противоопухолевые препараты, ряд антибиотиков и сульфаниламидов). Рентгенконстрастные вещества и перечисленные препараты, назначенные в обычной дозировке, могут стать причиной ренальной ОПН у больных с нарушением функции почек.
Кроме того, данная форма ОПН наблюдается при циркуляции в крови большого количества миоглобина и гемоглобина (при выраженной макрогемаглобинурии, переливании несовместимой крови, длительном сдавлении тканей при травме, наркотической и алкогольной коме). Реже развитие ренальной ОПН обусловлено воспалительным заболеванием почек.
Постренальная (обструктивная) ОПН формируется при остро возникшей обструкции мочевыводящих путей. Наблюдается при механическом нарушении пассажа мочи при двухсторонней обтурации мочеточников камнями. Реже возникает при опухолях предстательной железы, мочевого пузыря и мочеточников, туберкулезном поражении, уретритах и периуретритах, дистрофических поражениях забрюшинной клетчатки.
При тяжелых сочетанных травмах и обширных хирургических вмешательствах патология вызывается несколькими факторами (шок, сепсис, переливание крови, лечение нефротоксичными препаратами).
Симптомы ОПН
Выделяют четыре фазы острой почечной недостаточности:начальная, олигоанурическая, диуретическая, выздоровления. На начальной стадии состояние пациента определяется основным заболеванием. Клинически эта фаза обычно не выявляется из-за отсутствия характерных симптомов. Циркуляторный коллапс имеет очень малую продолжительность, поэтому проходит незамеченным. Неспецифичные симптомы ОПН (сонливость, тошнота, отсутствие аппетита, слабость) замаскированы проявлениями основного заболевания, травмы или отравления.
На олигоанурической стадии анурия возникает редко. Количество отделяемой мочи — менее 500 мл в сутки. Характерна выраженная протеинурия, азотемия, гиперфосфатемия, гиперкалиемия, гипернатиемия, метаболический ацидоз. Отмечается понос, тошнота, рвота. При отеке легкого вследствие гипергидратации появляется одышка и влажные хрипы. Больной заторможен, сонлив, может впасть в кому. Нередко развивается перикардит, уремический гастроэнтероколит, осложняющийся кровотечениями. Пациент подвержен инфекции вследствие снижения иммунитета. Возможен панкреатит, стоматит паротит, пневмония, сепсис.
Олигоанурическая фаза ОПН развивается в течение первых трех суток после воздействия, обычно длится 10-14 дней. Позднее развитие олигоанурической фазы считается прогностически неблагоприятным признаком. Период олигурии может укорачиваться до нескольких часов или удлиняться до 6-8 недель. Продолжительная олигурия чаще возникает у пожилых пациентов с сопутствующей сосудистой патологией. При продолжительности фазы более месяца необходимо провести дифференциальную диагностику для исключения прогрессирующего гломерулонефрита, почечного васкулита, окклюзии почечной артерии, диффузного некроза коры почек.
Длительность диуретической фазы составляет около двух недель. Суточный диурез постепенно увеличивается и достигает 2-5 литров. Отмечается постепенное восстановление водно-электролитного баланса. Возможна гипокалиемия вследствие значительных потерь калия с мочой. В фазе восстановления происходит дальнейшая нормализация почечных функций, занимающая от 6 месяцев до 1 года.
Осложнения
Выраженность нарушений, характерных для почечной недостаточности (задержка жидкости, азотемия, нарушение водно-электролитного баланса) зависит от состояния катаболизма и наличия олигурии. При тяжелой олигурии отмечается снижение уровня клубочковой фильтрации, существенно уменьшается выделение электролитов, воды и продуктов азотного обмена, что приводит к более выраженным изменениям состава крови.
При олигурии увеличивается риск развития водной и солевой сверхнагрузки. Гиперкалиемия вызвана недостаточным выведением калия при сохраняющемся уровне его высвобождения из тканей. У больных, не страдающих олигурией, уровень калия составляет 0,3-0,5 ммоль/сут. Более выраженная гиперкалиемия у таких пациентов может говорить об экзогенной (переливание крови, лекарственные препараты, наличие в рационе продуктов, богатых калием) или энодгенной (гемолиз, деструкция тканей) калиевой нагрузке.
Первые симптомы гиперкалиемии появляются, когда уровень калия превышает 6,0-6,5 ммоль/л. Больные жалуются на мышечную слабость. В некоторых случаях развивается вялый тетрапарез. Отмечаются изменения ЭКГ. Снижается амплитуда зубцов P, увеличивается интервал P-R, развивается брадикардия. Значительное повышение концентрации калия может вызвать остановку сердца. На первых двух стадиях ОПН наблюдаются гипокальциемия, гиперфосфатемия, слабо выраженная гипермагниемия.
Следствием выраженной азотемии является угнетение эритропоэза. Развивается нормоцитарная нормохромная анемия. Угнетение иммунитета способствует возникновению инфекционных заболеваний у 30-70% пациентов с острой почечной недостаточностью. Присоединение инфекции утяжеляет течение заболевания и нередко становится причиной смерти больного. Выявляется воспаление в области послеоперационных ран, страдает полость рта, дыхательная система, мочевыводящие пути. Частым осложнением ОПН является сепсис.
Отмечается сонливость, спутанность сознания, дезориентация, заторможенность, чередующаяся с периодами возбуждения. Периферическая нейропатия чаще возникает у пожилых пациентов. При ОПН может развиться застойная сердечная недостаточность, аритмия, перикардит, артериальная гипертензия. Больных беспокоит ощущение дискомфорта в брюшной полости, тошнота, рвота, потеря аппетита. В тяжелых случаях наблюдается уремический гастроэнтероколит, часто осложняющийся кровотечениями.
Диагностика
Основным маркером острой почечной недостаточности является повышение калия и азотистых соединений в крови на фоне значительного уменьшения количества выделяемой организмом мочи вплоть до состояния анурии. Количество суточной мочи и концентрационную способность почек оценивают по результатам пробы Зимницкого. Важное значение имеет мониторинг таких показателей биохимии крови, как мочевина, креатинин и электролиты, что позволяет судить о тяжести ОПН и эффективности проводимых лечебных мероприятий.
Главной задачей в диагностике ОПН является определение ее формы. Для этого проводится УЗИ почек и сонография мочевого пузыря, которые дают возможность выявить или же исключить обструкцию мочевыводящих путей. В некоторых случаях выполняется двусторонняя катетеризация лоханок. Если при этом оба катетера свободно прошли в лоханки, но выделение мочи по ним не наблюдается, можно с уверенностью исключить постренальную форму ОПН. При необходимости оценить почечный кровоток проводят УЗДГ сосудов почек. Подозрение на канальцевый некроз, острый гломерулонефрит или системное заболевание является показанием для биопсии почки.
Лечение ОПН
В начальной фазе терапия направлена, прежде всего, на устранение причины, которая вызвала нарушение функции почек. При шоке необходимо восполнить объем циркулирующей крови и нормализовать артериальное давление. При отравлении нефротоксинами больным промывают желудок и кишечник. Применение в практической урологии таких современных методов лечения как экстракорпоральная гемокоррекция позволяет быстро очистить организм от токсинов, которые стали причиной развития ОПН. С этой целью проводят гемосорбцию и плазмаферез. При наличии обструкции восстанавливают нормальный пассаж мочи. Для этого осуществляют удаление камней из почек и мочеточников, оперативное устранение стриктур мочеточников и удаление опухолей.
В фазе олигурии для стимуляции диуреза больному назначают фуросемид и осмотические диуретики. Для уменьшения вазоконстрикции почечных сосудов вводят допамин. Определяя объем вводимой жидкости, кроме потерь при мочеиспускании, рвоте и опорожнении кишечника, необходимо учитывать потери при потоотделении и дыхании. Пациента переводят на безбелковую диету, ограничивают поступление калия с пищей. Проводится дренирование ран, удаление участков некроза. При выборе дозы антибиотиков следует учитывать тяжесть поражения почек.
Гемодиализ назначается при повышении уровня мочевины до 24 ммоль/л, калия – до 7 ммоль/л. Показанием к гемодиализу являются симптомы уремии, ацидоз и гипергидратация. В настоящее время для предупреждения осложнений, возникающих вследствие нарушений метаболизма, врачи-нефрологи все чаще проводят ранний и профилактический гемодиализ.
Прогноз и профилактика
Летальность в первую очередь зависит от тяжести патологического состояния, ставшего причиной развития ОПН. На исход заболевания влияет возраст больного, степень нарушения функции почек, наличие осложнений. У выживших пациентов почечные функции восстанавливаются полностью в 35-40% случаев, частично – в 10-15% случаев. 1-3% больных необходим постоянный гемодиализ. Профилактика заключается в своевременном лечении заболеваний и предупреждении состояний, которые могут спровоцировать ОПН.
Острая почечная недостаточность — лечение в Москве
Почечная недостаточность — серьезное осложнение различных почечных патологий, выражающееся в нарушении функции почек разной тяжести. Состояние в урологической практике встречается часто. С проблемой можно справиться, но орган не восстанавливается. Последняя стадия почечной недостаточности — хроническая. Это не заболевание, а синдром, то есть совокупность признаков, указывающих на нарушение функциональности почек в следствии тяжелых повреждений органа.
В результате почечной недостаточности страдает весь организм, так как при этой патологии происходит отравление всех органов. Поэтому чем раньше начато лечение, тем больше шансов избежать хронизации процесса и необходимости гемодиализа — тяжелой процедуры аппаратного очищения крови, без которой больной с хроническим процессом уже не может обходиться.
Причины развития почечной недостаточности
От работы почек зависит водный, азотный, электролитный и другие виды обмена веществ в организме. Почечная недостаточность свидетельствует о невыполнении всех функций.
Наиболее частая причина патологии — хронические заболевания, при которых паренхима почек медленно разрушается, замещаясь соединительной тканью. Почечная недостаточность — последняя стадия пиелонефрита, мочекаменной болезни и др. тяжелых почечных заболеваний.
Симптомы почечной недостаточности
Наиболее показательный симптом патологий — суточный объем мочи – суточный диурез, или минутный диурез, используемый при обследовании почек методом клиренса. При нормальной работе почек экскреция с мочой составляет 67-75% от объема жидкости.
Минимальный объем, необходимый для работы органа, — 500 мл., поэтому минимальное количество воды, которое человек должен употреблять в сутки, составляет 800 мл.
При стандартном приеме воды 1-2 литра в сутки диурез у здоровых людей составляет 800-1500 мл в сутки. При почечной недостаточности объем мочи значительно изменяется: потребление воды увеличивается до 3 л, а выделение уменьшается до 500 мл. Абсолютный показатель почечной недостаточности — анурия, при которой практически прекращается выделение мочи в мочевой пузырь до суточного объема 50 мл.
Различают острую и хроническую почечную недостаточность:
- Острая. Характеризуется стремительным развитием синдрома, ярко выраженной симптоматикой, сильными болями. При вовремя начатом лечении большинство изменений обратимы, поэтому можно восстановить функцию почек в течение нескольких недель.
- Хроническая. Процесс затухает, боли притупляются, но обостряются симптомы отравления организма: больного беспокоит тошнота, головокружение, слабость, плохой аппетит и др.
Острая почечная недостаточность
ОПН – это внезапное резкое нарушение функции органа, развивающееся на фоне других заболеваний или травм. Патология связана с подавлением выделительной функции и накоплением продуктов азотистого обмена в крови. Происходит нарушение водного, электролитного, кислотно-щелочного, осмотического балансов. Эти изменения потенциально обратимы.
Чаще острая почечная недостаточность дает о себе знать в течение нескольких часов, но развитие может затягиваться и на несколько дней. Диагноз ОПН ставится, если симптомы сохраняются более суток.
Причины ОПН:
- низкая скорость кровотока;
- трубчатые повреждения;
- нарушение оттока мочи из-за обструкции;
- разрушение клубочка с потерей капилляров и артерий.
Таблица 1. Классификация острой почечной недостаточности по причине возникновения
| Тип ОПН | Характеристика | Количество случаев, % |
| Преренальная | Отмечается снижение почечного кровотока | 70 |
| Ренальная (паренхиматозная) | Повреждение паренхимы почки | 25 |
| Постренальная (обструктивная) | Сужение или полное закрытие мочевыводящих путей | 5 |
По статистике, причины этих событий:
- хирургическое вмешательство или травма — 60% случаев;
- применение нефротоксичных препаратов и острые отравления мышьяком, ртутью, грибным ядом — 40%;
- осложнения беременности 1-2%.
Стадии острой почечной недостаточности
По состоянию пациента выделяют 4 стадии.
Таблица 2. Стадии и характеристики хронической почечной недостаточности
| Стадия | Период, дни | Особенности протекания |
| Начальная | До недели | Период действия этиологического фактора |
| Олигоанурическая или же анурическая | до 21 | Суточный диурез до 500 мл |
| Полиурическая (восстановительная) | до 5-75 | Восстановление диуреза, включающее фазу начального диуреза (кол-во мочи превышает 500 мл/сут) и фазу полиурии (кол-во мочи от 2 л/сут.) |
| Выздоровления | Нормализация азотемии |
Симптомы начального этапа острой почечной недостаточности
Симптомы первичного этапа ОПН зависят от причин и характера основного заболевания и вызваны действием стрессового фактора – отравлением, потерей крови, травмой.
- Симптомы общей интоксикации: головная боль, мышечная слабость, лихорадка.
- Симптомы со стороны ЖКТ — рвота и диарея.
- Симптомы отравления: анемия, желтуха, судороги.
- Симптомы острого заболевания почек – гломерулонефрита: в моче обнаруживается кровь, сильно болит поясница.
Диагностика
Диагностика ОПН на начальном этапе затруднена. Если почечная недостаточность возникает на фоне инфекции или острого отравления, то поражение почки в этом случае закономерно. То же самое можно сказать и об изменении анализов при приеме нефротоксичных лекарств.
Анализ мочи на начальной стадии указывает в первую очередь на факторы, провоцирующие сбой:
- Относительная плотность при почечной недостаточности ниже 1,012;
- В 70% случаев возможны небольшая протеинурия, наличие зернистых или клеточных цилиндров с почечным артериальным нефротоксическим происхождением.
- При травме, опухоли, инфекции, мочекаменной болезни в моче обнаруживается больше эритроцитов;
- Большое количество лейкоцитов свидетельствует об инфекции или аллергическом воспалении мочевыводящих путей;
- При обнаружении кристаллов мочевой кислоты можно предположить уратную нефропатию.
На любой стадии назначается бактериологический анализ мочи.
Общий анализ крови соответствует первичному заболеванию, биохимический на начальной стадии может давать данные о гиперкалиемии или гипокалиемии.
Характеристика олигоанурической стадии ОНП
Эта стадия при недостаточности почек наиболее тяжелая и представляет угрозу для жизни. Симптомы хорошо выражены и характерны, что позволяет быстро поставить диагноз.
На этом этапе в крови быстро накапливаются продукты азотистого обмена – креатинин, мочевина, которые выводятся в здоровом организме с мочой. Снижается всасывание калия, что нарушает водно-солевой баланс. Почка не выполняет функций по поддержанию кислотно-щелочного баланса, в результате чего образуется метаболический ацидоз.
Основные признаки олигоанурической стадии:
- Снижение диуреза. Снижение суточного объема мочи до 500 мл свидетельствует об олигурии, до 50 мл – анурии.
- Интоксикация продуктами обмена. Кожный зуд, тошнота, рвота, тахикардия, учащенное дыхание.
- Выраженное повышение артериального давления. Обычные гипотензивные препараты не помогают.
- Спутанность сознания, потеря сознания.
- Отек органов, полостей, подкожной клетчатки. Масса тела увеличивается из-за накопления жидкости.
Стадия длится от 10 дней до нескольких недель. Длительность периода и методы лечения определяются тяжестью поражения и характером первичного заболевания.
Диагностика
На этом этапе следует дифференцировать анурию от острой задержки мочи. Для этого проводится катетеризация мочевого пузыря. Если через катетер выводится мочи не более 30 мл/час, то у больного ПН. Для уточнения диагноза назначают анализ на креатинин, мочевину и калий в крови:
- При преренальной форме снижается содержание натрия и хлора в моче, доля экскреции натрия — менее 1%. При кальциевом некрозе в случае олигурической картины показатель повышается с 3,5%, при неолигурической – до 2,3%.
- Меняется соотношение мочевины в крови и моче или креатинина в крови и моче. При преренальной форме отношение мочевины к плазменной концентрации составляет 20:1, при почечной – 3:1. Для креатинина соотношение будет аналогичным: 40 в моче и 1 в плазме при преренальной ОПН и 15:1 при почечной.
- Почечной недостаточности характерно низкое содержание хлора в крови – менее 95 ммоль/л.
Данные микроскопии мочи позволяют судить о характере повреждения. Наличие небелковых и эритроцитарных цилиндров свидетельствует о повреждении клубочков. Коричневые эпителиальные цилиндры и свободный эпителий указывают на канальцевый некроз. Гемоглобин выявляется при паранефральной блокаде.
Поскольку вторая стадия АРФ провоцирует тяжелые осложнения, помимо анализа мочи и анализов крови необходимо прибегнуть к инструментальным методам диагностики:
- МРТ, УЗИ почек. Проводятся для выявления обструкции мочевыводящих путей, анализа размера и состояния почек, оценки кровотока.
- Экскреторная урография. Не проводится.
- Рентгеноконтрастная ангиография. Назначается при подозрении на артериальный стеноз.
- Хромоцистоскопия. Назначается при подозрении на обструкцию мочеточника.
- Рентген грудной клетки. Проводится при подозрении на отек легких.
- Изотопное динамическое сканирование почек. Назначают для оценки перфузии почек.
- Биопсия почки. Выполняется, если преренальная ПН исключена, и происхождение заболевания неизвестно.
- ЭКГ. Проводится для выявления аритмии и признаков гиперкалиемии. Назначается всем больным без исключения.
Лечение
Лечение определяется по типу ОПН (преренальному, ренальному, постренальному) и степени поражения почек.
- Первоочередная задача при преренальной форме — восстановление кровоснабжения почек, коррекция обезвоживания и сосудистой недостаточности.
- При ренальной форме в зависимости от этиологии необходимо прекратить прием нефротоксичных препаратов и начать выведение токсинов.
- При системных заболеваниях требуется введение глюкокортикоидов или цитостатиков.
- При пиелонефрите, инфекционных заболеваниях терапия включает противовирусные препараты и антибиотики.
- При гиперкальцемическом кризе внутривенно вводят большие объемы раствора натрия хлорида, фуросемида, препаратов, замедляющих всасывание кальция.
- При обструкции, ее необходимо устранить.
Методы коррекции водно-солевого баланса зависят от диагноза:
- При гиперкалиемии выше 6,5 ммоль/л вводят раствор глюконата кальция, а затем глюкозу. Если гиперкалиемия рефрактерная (прогрессирующая), необходим гемодиализ.
- Для коррекции гиперволемии вводят фурасемид. Доза подбирается индивидуально.
- Корректируют общее потребление ионов калия и натрия: оно не должно превышать суточных потерь. Поэтому при гипонатриемии объем жидкости ограничен, а при гипернатриемии вводят внутривенно раствор Натрия Хлорида;
- Объем жидкости – как потребляемой, так и вводимой внутривенно в целом – должен превышать потери на 400-500 мл.
При неолигурической форме диализ обычно не назначается, за исключением следующих случаев:
- симптоматическая уремия;
- гиперкалиемия;
- тяжелая стадия ацидемии;
- перикардит;
- скопление большого объема жидкости, которую невозможно вывести медикаментозно.
Характеристика полиурической стадии ОНП
Стадия полиурии возможна только при адекватном лечении и характеризуется постепенным восстановлением диуреза. На первой стадии регистрируется суточный объем мочи в 400 мл, на стадии полиурии – более 800 мл.
При этом относительная плотность мочи еще низкая, в осадке много белков и эритроцитов, что свидетельствует о восстановлении клубочковой функции, но указывает на повреждение в трубчатом эпителии. В крови сохраняется высокое содержание креатинина и мочевины.
Постепенно восстанавливается содержание калия, скопившаяся жидкость выводится из организма. Эта стадия опасна тем, что может привести к гипокалиемии, которая не менее опасна, чем гиперкалиемия, и может вызвать обезвоживание.
Полиурическая стадия длится 2-12 дней в зависимости от степени поражения почек и определяется скоростью восстановления трубчатого эпителия.
Лечение при олигурической стадии продолжают и во время восстановления. Дозы лекарств подбираются индивидуально в зависимости от показаний. Лечение проводится на фоне диеты с обязательным ограничением потребления белка, жидкости, соли.
Характеристика стадии выздоровления при острой почечной недостаточности, прогноз
Симптомы выздоровления при ОПН: восстановление нормального диуреза и вывод продуктов азотистого обмена.
Если патология протекает тяжело или заболевание выявлено поздно, соединения азота могут выводиться не полностью, и в этом случае острая почечная недостаточность переходит в хроническую.
Симптомы тяжелой стадии:
- спазмы и мышечные судороги;
- внутренние и подкожные кровоизлияния;
- сердечная дисфункция;
- выделение мокроты с кровью, одышка и кашель, вызванные накоплением жидкости в легочной ткани;
- потеря сознания, кома.
Прогноз излечения
Прогноз выздоровления зависит от тяжести основного заболевания. Согласно статистике, при олигурическом течении смертность больных — 50%, при неолигурическом — 26%. Если ОПН не осложняется другими заболеваниями, то в 90% случаев достигается полное восстановление функции почек в течение 6 недель.
Сайт издательства «Медиа Сфера»
содержит материалы, предназначенные исключительно для работников здравоохранения. Закрывая это сообщение, Вы подтверждаете, что являетесь дипломированным медицинским работником или студентом медицинского образовательного учреждения.
ГБУЗ города Москвы «Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского ДЗМ»
Бердников Г.А.
ГБУЗ города Москвы «Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского ДЗМ»
Васина Н.В.
ГБУ города Москвы «Научно-исследовательский институт организации здравоохранения и медицинского менеджмента ДЗМ»
Острое почечное повреждение 2020: эпидемиология, критерии диагностики, показания, сроки начала и модальность заместительной почечной терапии
Авторы:
Рей С.И., Бердников Г.А., Васина Н.В.
Как цитировать:
Рей С.И., Бердников Г.А., Васина Н.В. Острое почечное повреждение 2020: эпидемиология, критерии диагностики, показания, сроки начала и модальность заместительной почечной терапии. Анестезиология и реаниматология.
2020;(5):63‑69.
Rey SI, Berdnikov GA, Vasina NV. Acute kidney injury in 2020: epidemiology, diagnostic criteria, indications, timing and modality of renal replacement therapy. Russian Journal of Anaesthesiology and Reanimatology. 2020;(5):63‑69. (In Russ.)
https://doi.org/10.17116/anaesthesiology202005163

Читать метаданные
Острое почечное повреждение у пациентов в критическом состоянии резко ухудшает прогноз заболевания, сопровождается неблагоприятными отдаленными исходами и значительной летальностью. В обзоре представлены современные рекомендации по использованию методов заместительной почечной терапии.
Авторы:
Рей С.И.
ГБУЗ города Москвы «Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского ДЗМ»
Бердников Г.А.
ГБУЗ города Москвы «Научно-исследовательский институт скорой помощи им. Н.В. Склифосовского ДЗМ»
Васина Н.В.
ГБУ города Москвы «Научно-исследовательский институт организации здравоохранения и медицинского менеджмента ДЗМ»
Дата поступления:
16.04.2020
Дата принятия в печать:
21.05.2020
Список литературы:
- Coca SG, Singanamala S, Parikh CR. Chronic kidney disease after acute kidney injury: a systematic review and meta-analysis. Kidney International. 2012;81(5):442-448. https://doi.org/10.1038/ki.2011.379
- Harel Z, Wald R, Bargman JM, Mamdani M, Etchells E, Garg AX, Ray JG, Luo J, Li P, Quinn RR, Forster A, Perl J, Bell CM. Nephrologists follow-up improves all-cause mortality of severe acute kidney injury survivors. Kidney International. 2013;83(5):901-908. https://doi.org/10.1038/ki.2012.451
- Brown JR, Rezaee ME, Marshall EJ, Matheny ME. Hospital Mortality in the United States following Acute Kidney Injury. BioMed Research International. 2016;4278579. https://doi.org/10.1155/2016/4278579
- Hoste EA, Bagshaw SM, Bellomo R, Cely CM, Colman R, Cruz DN, Edipidis K, Forni LG, Gomersall CD, Govil D, Honoré PM, Joannes-Boyau O, Joannidis M, Korhonen AM, Lavrentieva A, Mehta RL, Palevsky P, Roessler E, Ronco C, Uchino S, Vazquez JA, Vidal Andrade E, Webb S, Kellum JA. Epidemiology of acute kidney injury in critically ill patients: the multinational AKI-EPI study. Intensive Care Medicine. 2015;41(8):1411-1423. https://doi.org/10.1007/s00134-015-3934-7
- De Corte W, Dhondt A, Vanholder R, De Waele J, Decruyenaere J, Sergoyne V, Vanhalst J, Claus S, Hoste EA. Long-term outcome in ICU patients with acute kidney injury treated with renal replacement therapy: a prospective cohort study. Critical Care. 2016;20(1):256. https://doi.org/10.1186/s13054-016-1409-z
- Gammelager H, Christiansen CF, Johansen MB, Tønnesen E, Jespersen B, Sørensen HT. One-year mortality among Danish intensive care patients with acute kidney injury: a cohort study. Critical Care. 2012;16(4):124. https://doi.org/10.1186/cc11420
- Sawhney S, Marks A, Fluck N, Levin A, Prescott G, Black C. Intermediate and Long-term Outcomes of Survivors of Acute Kidney Injury Episodes: A Large Population-Based Cohort Study. American Journal of Kidney Diseases. 2017;69(1):18-28. https://doi.org/10.1053/j.ajkd.2016.05.018
- Hsu RK, McCulloch CE, Dudley RA, Lo LJ, Hsu CY. Temporal changes in incidence of dialysis-requiring AKI. Journal of the American Society of Nephrology. 2013;24(1):37-42. https://doi.org/10.1681/asn.2012080800
- Kolhe NV, Muirhead AW, Wilkes SR, Fluck RJ, Taal MW. National trends in acute kidney injury requiring dialysis in England between 1998 and 2013. Kidney International. 2015;88(5):1161-1169. https://doi.org/10.1038/ki.2015.234
- Carlson N, Hommel K, Olesen JB, Soja AM, Vilsbøll T, Kamper AL, Torp-Pedersen C, Gislason G. Dialysis-Requiring Acute Kidney Injury in Denmark 2000-2012: Time Trends of Incidence and Prevalence of Risk Factors — A Nationwide Study. PLoS One. 2016;11(2):e0148809. https://doi.org/10.1371/journal.pone.0148809
- Garnier F, Couchoud C, Landais P, Moranne O. Increased in metropolitan France. PLoS One. 2019;14(2):e0211541. https://doi.org/10.1371/journal.pone.0211541
- Vincent JL, Lefrant JY, Kotfis K, Nanchal R, Martin-Loeches I, Wittebole X, Sakka SG, Pickkers P, Moreno R, Sakr Y. Comparison of European ICU patients in 2012 (ICON) versus 2002 (SOAP). Intensive Care Medicine. 2018;44(3):337-344. https://doi.org/10.1007/s00134-017-5043-2
- Проценко Д.Н., Гутова Е.В., Зеникова Н.Ф., Хорина А.Ю., Кондрашова Л.А. Служба анестезиологии и реаниматологии Департамента здравоохранения города Москвы 2017. Медицинский алфавит. 2018; 2(18-355):5-11.
- Рей С.И., Васина Н.В., Марченкова Л.В., Котенко О.Н. Принципы организации заместительной почечной терапии в неотложной медицине Департамента здравоохранения города Москвы. Клиническая нефрология. 2019;11(4):11-16. https://doi.org/10.18565/nephrology.2019.4.11-16
- Cheng Y, Luo R, Wang K, Zhang M, Wang Z, Dong L, Li J, Yao Y, Ge S, Xu G. Kidney disease is associated with in-hospital death of patients with COVID-19. Kidney International. 2020;97(5):829-838. https://doi.org/10.1016/j.kint.2020.03.005
- Ronco C, Reis T, De Rosa S. Coronavirus Epidemic and Extracorporeal Therapies in Intensive Care: si vis pacem para bellum. Blood Purification. 2020;13:1-4. Accessed April 23, 2020. https://doi.org/10.1159/000507039
- Fanelli V, Fiorentino M, Cantaluppi V, Gesualdo L, Stallone G, Ronco C, Castellano G. Acute kidney injury in SARS-CoV-2 infected patients. Critical Care. 2020;24(1):155. https://doi.org/10.1186/s13054-020-02872-z
- Bellomo R, Ronco C, Kellum JA, Mehta RL, Palevsky P. Acute renal failure — definition, outcome measures, animal models, fluid therapy and information technology needs: the Second International Consensus Conference of the Acute Dialysis Quality Initiative (ADQI) Group. Critical Care. 2004;8(4):204-212. https://doi.org/10.1186/cc2872
- Joannidis M, Forni LG, Klein SJ, Honore PM, Kashani K, Ostermann M, Prowle J, Bagshaw SM, Cantaluppi V, Darmon M, Ding X, Fuhrmann V, Hoste E, Husain-Syed F, Lubnow M, Maggiorini M, Meersch M, Murray PT, Ricci Z, Singbartl K, Staudinger T, Welte T, Ronco C, Kellum JA. Lung-kidney interactions in critically ill patients: consensus report of the Acute Disease Quality Initiative (ADQI) 21 Workgroup. Intensive Care Medicine. 2020;46(4):654-672. https://doi.org/10.1007/s00134-019-05869-7
- Kidney Disease: Improving Global Outcomes (KDIGO) Acute Kidney Injury Work Group. KDIGO Clinical Practice Guideline for Acute Kidney Injury. Kidney International Supplements. 2012;2(1 Suppl):138. Accessed April 23, 2020. https://kdigo.org/wp-content/uploads/2016/10/KDIGO-2012-AKI-Guideline-English.pdf
- Chertow GM, Burdick E, Honour M. Bonventre JV, Bates DW. Acute kidney injury, mortality, length of stay, and costs in hospitalized patients. Journal of the American Society of Nephrology. 2005;16(11):3365-3370. https://doi.org/10.1681/asn.2004090740
- Zhang A, Cai Y, Wang PF, Qu JN, Luo ZC, Chen XD, Huang B, Liu Y, Huang WQ, Wu J, Yin YH. Diagnosis and prognosis of neutrophil gelatinase-associated lipocalin for acute kidney injury with sepsis: a systematic review and meta-analysis. Critical Care. 2016;20:41. https://doi.org/10.1186/s13054-016-1212-x
- Kim S, Kim HJ, Ahn HS, Song JY, Um TH, Cho CR, Jung H, Koo HK, Park JH, Lee SS, Park HK. Is plasma neutrophil gelatinase-associated lipocalin a predictive biomarker for acute kidney injury in sepsis patients? A systematic review and meta-analysis. Journal of Critical Care. 2016;33:213-223. https://doi.org/10.1016/j.jcrc.2016.02.014
- Hall PS, Mitchell ED, Smith AF, Cairns DA, Messenger M, Hutchinson M, Wright J, Vinall-Collier K, Corps C, Hamilton P, Meads D, Lewington A. The future for diagnostic tests of acute kidney injury in critical care: evidence synthesis, care pathway analysis and research prioritisation. Health Technology Assessment. 2018;22(32):1-274. https://doi.org/10.3310/hta22320
- Neyra JA, Hu MC, Minhajuddin A, Nelson GE, Ahsan SA, Toto RD, Jessen ME, Moe OW, Fox AA. Kidney Tubular Damage and Functional Biomarkers in Acute Kidney Injury Following Cardiac Surgery. Kidney International Reports. 2019;4(8):1131-1142. https://doi.org/10.1016/j.ekir.2019.05.005
- Lin X, Yuan J, Zhao Y, Zha Y. Urine interleukin-18 in prediction of acute kidney injury: a systemic review and meta-analysis. Journal of Nephrology. 2015;28(1):7-16. https://doi.org/10.1007/s40620-014-0113-9
- Ho J, Tangri N, Komenda P, Kaushal A, Sood M, Brar R, Gill K, Walker S, MacDonald K, Hiebert BM, Arora RC, Rigatto C. Urinary, Plasma, and Serum Biomarkers’ Utility for Predicting Acute Kidney Injury Associated With Cardiac Surgery in Adults: A Meta-analysis. American Journal of Kidney Diseases. 2015;66(6):993-1005. https://doi.org/10.1053/j.ajkd.2015.06.018
- de Geus HR, Betjes MG, Bakker J. Biomarkers for the prediction of acute kidney injury: a narrative review on current status and future challenges. Clinical Kidney Journal. 2012;5(2):102-108. https://doi.org/10.1093/ckj/sfs008
- Ostermann M, Joannidis M, Pani A, Floris M, De Rosa S, Kellum JA, Ronco C; 17th Acute Disease Quality Initiative (ADQI) Consensus Group. Patient Selection and Timing of Continuous Renal Replacement Therapy. Blood Purification. 2016;42(3):224-37. https://doi.org/10.1159/000448506
- Klein SJ, Brandtner AK, Lehner GF, Ulmer H, Bagshaw SM, Wiedermann CJ, Joannidis M. Biomarkers for prediction of renal replacement therapy in acute kidney injury: a systematic review and meta-analysis. Intensive Care Medicine. 2018;44(3):323-336. https://doi.org/10.1007/s00134-018-5126-8
- Pasin L, Boraso S, Tiberio I. Early initiation of renal replacement therapy in critically ill patients: a meta-analysis of randomized clinical trials. BMC Anesthesiology. 2019;19(1):62. https://doi.org/10.1186/s12871-019-0733-7
- Zou H, Hong Q, Xu G. Early versus late initiation of renal replacement therapy impacts mortality in patients with acute kidney injury post cardiac surgery: a meta-analysis. Critical Care. 2017;21(1):150. https://doi.org/10.1186/s13054-017-1707-0
- Clark E, Wald R, Levin A, Bouchard J, Adhikari NK, Hladunewich M, Richardson RM, James MT, Walsh MW, House AA, Moist L, Stollery DE, Burns KE, Friedrich JO, Barton J, Lafrance JP, Pannu N, Bagshaw SM; Canadian Acute Kidney Injury (CANAKI) Investigators. Timing the initiation of renal replacement therapy for acute kidney injury in Canadian intensive care units: a multicentre observational study. Canadian Journal of Anesthesia. 2012;59(9):861-870. https://doi.org/10.1007/s12630-012-9750-4
- Nash DM, Przech S, Wald R, O’Reilly. Systematic review and meta-analysis of renal replacement therapy modalities for acute kidney injury in the intensive care unit. Journal of Critical Care. 2017;9(41):138-144. https://doi.org/10.1016/j.jcrc.2017.05.002
- Zhang L, Yang J, Eastwood GM, Zhu G, Tanaka A, Bellomo R. Extended Daily Dialysis Versus Continuous Renal Replacement Therapy for Acute Kidney Injury: A Meta-analysis. American Journal of Kidney Diseases. 2015; 66(2):322-30. https://doi.org/10.1053/j.ajkd.2015.02.328
- Rabindranath K, Adams J, Macleod AM, Muirhead N. Intermittent versus continuous renal replacement therapy for acute renal failure in adults. The Cochrane Database of Systematic Reviews. 2007;3:CD003773. https://doi.org/10.1002/14651858.cd003773.pub3
- Schneider AG, Bellomo R, Bagshaw SM, Glassford NJ, Lo S, Jun M, Cass A, Gallagher M. Choice of renal replacement therapy modality and dialysis dependence after acute kidney injury: a systematic review and meta-analysis. Intensive Care Medicine. 2013;39(6):987-997. https://doi.org/10.1007/s00134-013-2864-5
- Zhao Y, Chen Y. Effect of renal replacement therapy modalities on renal recovery and mortality for acute kidney injury: A PRISMA-compliant systematic review and meta-analysis. Seminars in Dialysis. 2020;33(2):127-132. https://doi.org/10.1111/sdi.12861
Острое почечное повреждение (ОПП) остается глобальной проблемой неотложной медицины, сопровождается высокой летальностью, особенно в группе пациентов, нуждающихся в заместительной почечной терапии (ЗПТ), нередко приводит к развитию хронической болезни почек (ХБП) и неблагоприятным отдаленным результатам; лечение требует значительных финансовых затрат [1, 2]. Так, в США с 2001 по 2011 г. более чем у 18,8 млн пациентов выявлено ОПП. Количество случаев ОПП увеличилось в эти сроки с 1810 до 11 000 на 1 млн пациентов в год соответственно [3]. И хотя летальность снизилась с 21,9 до 9,1%, количество умерших пациентов в абсолютных цифрах увеличилось вдвое. ОПП является доказанным предиктором развития ХБП, включая терминальную стадию поражения почек. По данным многонационального исследования AKI-EPI [4], в отделениях реанимации и интенсивной терапии (ОРИТ) ОПП развивается в 57,3% случаев, с госпитальной летальностью — 26,9%, с формированием ХБП — 47,7%. У пациентов без ОПП летальность составила 7,2%, ХБП развилась у 14,8% пациентов. По данным бельгийских авторов [5], после выписки из стационара у 13,8% больных с ОПП, которым проводилась заместительная почечная терапия (ОПП_ЗПТ), развилась терминальная стадия ХБП и появилась необходимость в проведении программного гемодиализа (ГД), через 2 года их число увеличилось до 19%, а через 3 года — до 28,1%.
Отдаленные результаты у пациентов, которые перенесли ОПП и выписаны из стационара, остаются крайне неблагоприятными. Так, исследование, проведенное в Дании в 2005—2010 гг., показало, что летальность после выписки из стационара в течение первого года для пациентов без ОПП и с уровнем почечного повреждения R, I и F составила 10,7%, 20,5%, 23,8% и 23,2%, соответственно [6]. В Шотландии при анализе базы данных GLOMMS-II выявлено, что если до поступления в стационар скорость клубочковой фильтрации (СКФ) была менее 60 мл/мин/1,73 м3, пациенты пережили ОПП в ОРИТ, то через 10 лет летальность составила 96%, без перенесенного ОПП — 70%, а при СКФ более 60 мл/мин/1,73 м3 и без ОПП — 30% [7].
ЗПТ является основой лечения тяжелого ОПП. Она претерпела значительные изменения, оказавшись в центре внимания новых технологических и клинических стратегий, и все больше используется в ОРИТ не только у пациентов с ОПП и ХБП, но и в качестве поддерживающей терапии полиорганной дисфункции. По данным крупных эпидемиологических исследований, количество случаев ОПП_ЗПТ на 1 млн человек в год возросло в США с 222 в 2000 г. до 533 в 2009 г. [8], в Великобритании — с 15,9 в 1998 г. до 208,7 в 2013 г., при этом увеличилась летальность с 30,2% в 1998—2003 гг. до 41,1% в 2008—2013 гг. [9]. В Дании выросла потребность в ЗПТ с 143 в 2000 г. до 360 в 2012 г., при этом с 27,4 до 57,6% увеличилась доля пациентов, получающих постоянную заместительную почечную терапию (ПЗПТ) [10]. Во Франции с 2009 по 2014 г. необходимость в ЗПТ выросла с 475 до 512, сохранялась высокая летальность — 47%, применение ПЗПТ увеличилось с 56,9% до 61,8% соответственно [11]. При сравнении результатов двух крупных европейских исследований, проведенных в ОРИТ с интервалом в 10 лет, SOAP — в 2002 г. и ICON — в 2012 г., выявлено, что частота развития ОПП увеличилась с 35,6 до 47,0%, а применение методов ЗПТ — с 9,7 до 12,7%. Летальность в ОРИТ снизилась у пациентов с ОПП с 30,2 до 24,8% [12].
В медицинских организациях Департамента здравоохранения города Москвы (табл. 1) на фоне ежегодного роста числа пациентов реанимационного профиля [13] применение ОПП_ЗПТ в ОРИТ выросло со 128,5 в 2016 г. до 246 в 2018 г. на 1 млн населения [14]. Летальность у пациентов с ОПП_ЗПТ более чем в 3,5 раза превышала среднюю летальность в ОРИТ Москвы и в 2018 г. составила 36,9%.
Таблица 1. Частота проведения методов заместительной почечной терапии в отделениях реанимации и интенсивной терапии Москвы
Table 1. Incidence of renal replacement therapy in the intensive care units in Moscow
|
Показатель |
Годы |
||
|
2016 |
2017 |
2018 |
|
|
Количество пациентов в ОРИТ, n |
323 687 |
348 153 |
362 209 |
|
Пациенты, нуждающиеся в проведении ЗПТ в ОРИТ, n (%) |
4754 (1,47) |
5355 (1,53) |
6539 (1,81) |
|
ЗПТ при ОПП на 1 млн населения Москвы, n |
128,5 |
157,7 |
246,3 |
|
Летальность в ОРИТ, n (%) |
31 325 (9,7) |
32 191 (9,3) |
33 875 (9,4) |
|
Летальность пациентов с ОПП, нуждавшихся в проведении ЗПТ, n (%) |
530 (33,5) |
827 (42,4) |
1138 (36,9) |
Примечание. n — количество пациентов; ОПП — острое почечное повреждение; ОРИТ — отделение реанимации и интенсивной терапии; ЗПТ — заместительная почечная терапия.
ОПП развивается в 5,1—25% случаев у пациентов с новой коронавирусной инфекцией (COVID-19), особенно на фоне тяжелого острого респираторного синдрома SARS-CoV-2 [15—17].
Критерии острого почечного повреждения
В течение последних 20 лет к проблемам ОПП приковано внимание международного медицинского сообщества. Начиная с 2000 г. ежегодно проходят международные согласительные конференции «Инициатива качества заместительной почечной терапии у больных ОПП» (Acute Dialysis Quality Initiative, ADQI) [18], и в 2018 г. состоялась уже 21-я конференция ADQI, посвященная дисфункции легких и почек [19]. В 2012 г. опубликованы рекомендации Международного комитета по улучшению глобальных результатов лечения заболеваний почек (Kidney Disease: Improving Global Outcomes, KDIGO) [20], действующие по настоящее время. Исходя из них, ОПП — это остро возникшее нарушение функции почек, определяемое при наличии как минимум одного из следующих критериев:
— абсолютное повышение концентрации креатинина в крови на 0,3 мг/дл (≥26,4 мкмоль/л) в течение 48 ч;
— относительное повышение сывороточного креатинина в 1,5 раза и более по сравнению с исходным уровнем (если это известно или предполагается, что это произошло в течение предшествующих 7 дней);
— мочеотделение менее 0,5 мл на 1 кг массы тела в час за 6 часов наблюдения.
Классификация ОПП по стадиям базируется на определении уровня креатинина в плазме пациента и критериях мочеотделения (табл. 2).
Таблица 2. Стадии острого почечного повреждения по шкале KDIGO
Table 2. KDIGO grading system of acute renal injury
|
Стадии почечного повреждения |
Креатинин плазмы |
Критерии мочеотделения (темп диуреза) |
|
I |
В 1,5—1,9 раза выше исходного или увеличение на 0,3 мг/дл (≥26 мкмоль/л) |
<0,5 мл на 1 кг массы тела в час 6—12 ч |
|
II |
В 2—2,9 раза выше исходного |
<0,5 мл на 1 кг массы тела в час ≥12 ч |
|
III |
В 3 раза выше исходного, или повышение ≥4,0 мг/дл (353,6 мкмоль/л), или начало ЗПТ, или у пациентов <18 лет снижение сбалансированной СКФ до <35 мл/мин/1,73 м3 |
<0,3 мл на 1 кг массы тела в час ≥24 ч или анурия ≥12 ч |
Примечание. ЗПТ — заместительная почечная терапия; СКФ — скорость клубочковой фильтрации.
Одной из основных проблем ранней диагностики ОПП является отсутствие высокочувствительного и специфичного биомаркера почечного повреждения. Дело в том, что уровень креатинина плазмы (SCr), используемый как суррогатный показатель СКФ, оценивает только изменение функции почек и зависит от возраста, пола, расы, величины мышечной массы, катаболизма, уровня гидратации. Тем не менее даже незначительное повышение SCr сопровождается увеличением летальности. Так, при использовании многофакторного регрессионного анализа выяснено, что увеличение SCr на 0,3 мг/дл (26 мкмоль/л) от нормального значения сопровождалось повышением риска смерти в 4,1 раза, на 2,0 мг/дл (176,8 мкмоль/л) — в 16,4 раза [21]. Несмотря на то что темп диуреза не всегда адекватно отражает функцию почек, олигурия, как правило, отражает снижение СКФ. Если СКФ в норме (около 125 мл/мин, что у взрослого человека с массой тела 70 кг соответствует примерно 107 мл на 1 кг массы тела в час), то уменьшение объема выделяемой мочи менее 0,5 мл на 1 кг массы тела в час должно отражать реабсорбцию более 99,5% гломерулярного фильтрата [20].
Наиболее часто в научной и клинической практике применяются следующие биомаркеры ОПП. Липокалин, ассоциированный с желатиназой нейтрофилов (NGAL), — острофазный белок с молекулярной массой 25 кДа. При развитии ОПП NGAL фильтруется, но не реабсорбируется в проксимальных канальцах и собирательных трубочках, показал высокую чувствительность в моделях ишемического и нефротоксического повреждения. В то же время при сепсисе уровень NGAL не является эффективным маркером ОПП, хотя может потенциально использоваться как критерий начала ЗПТ и предиктор летальности [22]; уровень NGAL в плазме имеет высокую чувствительность — 0,88, но низкую специфичность — 0,22 [23].
Цистатин C — белок с молекулярной массой 13 кДа. Свободно фильтруется через клубочковую мембрану, реабсорбируется в проксимальных почечных канальцах. Концентрация цистатина C, в отличие от SCr, зависит только от СКФ, на нее не оказывают влияния такие факторы, как возраст, пол, мышечная масса пациента [24].
Молекула повреждения почки 1-го типа (KIM-1) — трансмембранный белок из суперсемейства иммуноглобулинов. Не содержится в почках здоровых людей и животных, но активно продуцируется проксимальными канальцами после ишемического или нефротоксического повреждения почек. KIM-1 наиболее эффективна при ранней диагностике ОПП в кардиохирургии [25].
Интерлейкин IL-18. Относится к провоспалительным цитокинам, вырабатывается проксимальным трубчатым эпителием. В ряде исследований IL-18 определен как ранний биомаркер ОПП после искусственного кровообращения, острого легочного повреждения, трансплантации почки, в педиатрической практике [26]. Для тканевого ингибитора металлопротеиназы 2-го типа (TIMP-2) и инсулиноподобного фактора роста, связывающего белок-7 (IGFBP7), чувствительность и специфичность в моче для диагностики ОПП составили 0,83 и 0,72 соответственно. В метаанализе J. Ho и соавт. отметили низкую специфичность этого биомаркера в плазме и моче для диагностики ОПП у кардиохирургических больных, особенно через 24 ч после оперативных вмешательств [27].
Таким образом, несмотря на то что использование биомаркеров является целесообразным для выявления группы риска развития ОПП, прогнозирования тяжести и потребности в ЗПТ, использование их в практическом здравоохранении вызывает ряд проблем. На сегодняшний день не существует единого биомаркера, который доказал бы свою эффективность в клинической практике [28].
Заместительная почечная терапия
Предметом научных дискуссий до сих пор остаются вопросы оптимизации тактики применения ЗПТ у пациентов с ОПП. Это прежде всего использование четких критериев для начала и завершения процедур ЗПТ, применение различных методик, режимов ЗПТ, выбор оптимальных протоколов антикоагуляции. Принимая решение о начале ЗПТ, клиницисту необходимо взвесить пользу и оценить возможные риски методов. Во-первых, необходимо оценить тяжесть ОПП и динамику состояния почечной функции, выявить олигоанурию, наличие осложнений, в первую очередь симптомы перегрузки жидкостью, нарушений электролитного баланса и кислотно-основного состояния, оценить вероятность восстановления почечной функции, особенно у пациентов без олигоанурии. Если есть возможность, следует оценить наличие и стадию ХБП, постренального ОПП, при котором требуется первоочередное выполнение урологических вмешательств.
Во-вторых, принимая решение о начале ЗПТ, необходимо оценить динамику заболевания, приведшего к ОПП, тяжесть органной (внепочечной) дисфункции, наличие дыхательной недостаточности, использование искусственной вентиляции легких, динамику респираторного индекса, выраженность нарушений сердечно-сосудистой системы и коагуляционного статуса, возможность элиминации токсических веществ, коррекции гиперкатаболизма, системного воспаления и тяжелых нарушений терморегуляции. Необходимо четко представлять цели терапии и, исходя из них, формировать программу лечения, выбирая метод и режимы ЗПТ.
В-третьих, нельзя забывать о возможных рисках и осложнениях при проведении ЗПТ, связанных с сосудистым доступом, нарушениями гемодинамики во время процедуры (гипотония, нарушения ритма сердца), катетер-ассоциированной инфекцией, потерей в связи с процедурой аминокислот, микроэлементов, витаминов, лекарственных препаратов, длительной иммобилизацией, особенно при продолжительных манипуляциях.
В-четвертых, ЗПТ можно проводить, только когда есть специальная аппаратура, обученный персонал и расходные материалы. Все это требует нормативной базы, адекватного финансирования и организации обучения как врачебного, так и сестринского персонала. Необходимо также учитывать национальные клинические рекомендации и локальные алгоритмы применения ЗПТ [29].
Критерии начала заместительной почечной терапии
Международным комитетом KDIGO предложены следующие рекомендации по применению ЗПТ [20]: ЗПТ должна быть начата немедленно, как только выявляются опасные для жизни нарушения водного и/или электролитного балансов и кислотно-основного равновесия. Решение о начале ЗПТ должно приниматься не только на основании показателей мочевины и креатинина плазмы крови, но в большей мере на основании оценки динамики лабораторных данных и всестороннего анализа клинической ситуации в целом с учетом тяжести органной дисфункции, основного и сопутствующих заболеваний. Существуют общепринятые показания к началу ЗПТ у больных с ОПП (табл. 3).
Таблица 3. Показания к началу заместительной почечной терапии
Table 3. Indications for renal replacement therapy
|
Абсолютные показания к началу ЗПТ |
|
|
Категория |
Характеристика |
|
Азотемия |
Уровень мочевины в плазме ≥36 ммоль/л |
|
Уремические осложнения |
Энцефалопатия, перикардит, нейро- и миопатия |
|
Гиперкалиемия |
≥6,5 ммоль/л и/или изменения на ЭКГ |
|
Гипермагниемия |
≥4 ммоль/л и/или анурия / отсутствие глубоких сухожильных рефлексов |
|
Ацидоз |
pH ≤7,15 |
|
Олигоанурия |
Диурез <200 мл/12 ч или анурия |
|
Перегрузка объемом |
Резистентные отеки (особенно отек легких и мозга) у больных ОПП |
|
Экзогенные отравления |
Элиминация диализируемого яда |
|
Тяжелое и/или быстро прогрессирующее ОПП |
III стадия ОПП (KDIGO) или критерий RIFLE F |
|
Относительные показания к началу ЗПТ |
|
|
2-я стадия ОПП (KDIGO) или критерии I (по шкале RIFLE) у больных в критическом состоянии с полиорганной дисфункцией |
Примечание. ЗПТ — заместительная почечная терапия; ОПП — острое почечное повреждение; ЭКГ — электрокардиограмма.
Получены данные о возможном применении биомаркеров для прогнозирования начала ЗПТ. Так, средняя площадь под кривой (AUC) составляет для NGAL в плазме и моче 0,75 и 0,72 соответственно, SCr и уровня цистатина С в плазме — 0,76 и 0,77 соответственно, уровней IL-18, цистатина С и TIMP-2 IGFBP7 в моче — 0,67, 0,72 и 0,86 соответственно [30].
Значительное количество исследований посвящено срокам и показателям, на которые необходимо ориентироваться при начале ЗПТ. В исследованиях сравнивается раннее и позднее, или стандартное, начало ЗПТ, но общепринятые критерии для этих понятий отсутствуют. В метаанализе, проведенном L. Pasin и соавт. (2019), раннее начало ЗПТ не сопровождалось разницей в летальности по сравнению с контрольной группой — 43,3% и 40,8% соответственно, но в группе раннего ЗПТ выявлено статистически значимое снижение длительности госпитализации, не отмечено различия в частоте неблагоприятных эффектов [31]. В то же время в метаанализе, оценивающем применение ЗПТ у пациентов после кардиохирургических вмешательств, раннее начало ЗПТ, особенно в течение первых суток после операции, сопровождалось статистически значимым снижением 28-дневной летальности, длительности пребывания в ОРИТ, в стационаре и длительности ЗПТ [32]. По данным канадских авторов, у 54%пациентов с ОПП_ЗПТ диагностирован септический шок, уровень SCr составил 322 мкмоль/л, тяжесть органной дисфункции по шкале SOFA — 13,4 балла, pH — 7,25, К+ — 4,6 ммоль/л, у 64% установлена III стадия ОПП. Медиана времени от момента поступления в ОРИТ и до начала ЗПТ составляла 1 сут. Летальность в ОРИТ составила 45,3%, госпитальная — 51,9% [33]. По данным медицинских организаций города Москвы за 2018 г., у пациентов на I стадии ОПП ЗПТ начинали у 5,0% больных, на 2-й стадии — у 16,6%, на 3-й стадии — у 78,4% [14].
Таким образом, результаты анализа представленных работ позволяют предположить необходимость начинать ЗПТ на III стадии ОПП, а при развитии полиорганной недостаточности — уже на II стадии. Затягивание с принятием решения у больных, находящихся в критическом состоянии, особенно после кардиохирургических вмешательств, может сопровождаться увеличением показателя летальности.
Выбор метода заместительной почечной терапии
В настоящее время для лечения ОПП применяется 4 группы методов ЗПТ: интермиттирующие (ИГД), постоянные (продолжительные), продленные (гибридные) и перитонеальный диализ. Номенклатура методов ЗПТ указана в Приказе Министерства здравоохранения Российской Федерации от 13.10.17 №804н «Об утверждении номенклатуры медицинских услуг».
Метаанализы [34, 35] при сравнении постоянных, продленных и интермиттирующих методов ЗПТ не выявили статистически значимых различий в летальности и сроках восстановления почечной функции. В Кокрейновском метаанализе преимуществами ПЗПТ являются большая гемодинамическая стабильность, снижение потребности в вазопрессорной поддержке, а также плавная коррекция нарушений внутрисосудистого объема, состава крови и тканевых жидкостей, меньшее влияние на величину внутричерепного давления (табл. 4) [36].
Таблица 4. Преимущества и недостатки методов заместительной почечной терапии
Table 4. Advantages and disadvantages of renal replacement therapy methods
|
Интермиттирующие процедуры ЗПТ: гемодиализ, гемодиализ интермиттирующий низкопоточный, гемодиализ интермиттирующий высокопоточный, гемодиафильтрация |
|
Преимущества: 1. Есть время для проведения диагностических и лечебных процедур. 2. Меньше доза антикоагулянтов (снижен риск кровотечения). 3. Быстрое и высокоэффективное удаление низкомолекулярных водорастворимых веществ (коррекция гиперкалиемии). 4. Гибкость применения, возможность приготовления растворов online. 5. Экономичность. 6. Лучше элиминируют низкомолекулярные (диализируемые) токсины. 7. Меньшая иммобилизация пациента. |
|
Недостатки: 1. Нестабильная гемодинамика, особенно при значительной ультрафильтрации. 2. Необходимость периодического контроля водно-электролитного баланса и кислотно-щелочного состояния. 3. Необходимость наличия обученного персонала и системы водоподготовки. 4. Поддержание АИП и системы водоподготовки в рабочем состоянии (промывка и дезинфекция). 5. Потенциально больший риск развития ХБП. 6. Нельзя использовать при внутричерепной гипертензии. 7. Быстрое изменение состава плазмы крови (концентрации мочевины, электролитов, pH) может привести к развитию дизэквилибриум-синдрома и нарушениям ритма сердца. |
|
Методы постоянной (продолжительной) ЗПТ: продолжительный гемодиализ, продолжительная гемофильтрация, продолжительная гемодиафильтрация |
|
Преимущества: 1. Лучшая гемодинамическая переносимость, более высокие шансы восстановления функции почек. 2. Большая мобильность аппаратов, нет необходимости в системе водоподготовки. 3. Постоянный контроль водно-электролитного баланса и кислотно-щелочного состояния (за 24-часовой сеанс). 4. Возможность адекватной нутритивной поддержки. 5. Лучшая коррекция уремии при выраженном гиперкатаболизме. |
|
Недостатки: 1. Выше риск кровотечений или тромбирования гемофильтра. 2. Время простоя может снизить эффективность процедур. 3. Длительная иммобилизация пациента. 4. Высокая стоимость лечения. 5. Менее эффективен в отличие от интермиттирующих процедур при гиперкалиемии. 6. Риск гипотермии. 7. Риск гипофосфатемии. |
|
Продленные (гибридные) методы ЗПТ: гемодиализ интермиттирующий продленный, гемофильтрация крови продленная, гемодиафильтрация продленная |
|
Преимущества: 1. Сходны с преимуществами ПЗПТ, но длительность 8—12 ч. 2. Хорошие возможности для активизации пациентов. 3. Стабильная гемодинамика. 4. Относительно низкая потребность в антикоагуляции. 5. Экономичность (при выполнении на АИП) |
|
Недостатки: 1. Технические навыки (обученный персонал) и инфраструктура. 2. Необходимость наличия системы водоподготовки, проведенных магистралей для подведения очищенной воды к аппаратам (при выполнении на АИП). 3. Риск гипотермии. 4. Риск гипофосфатемии. |
Примечание. ЗПТ — заместительная почечная терапия; ХБП — хроническая болезнь почек; ПЗПТ — постоянная заместительная почечная терапия; АИП — аппарат искусственной почки.
В 2013 г. появился метаанализ, в котором оценивались отдаленные результаты лечения ОПП при сравнении ПЗПТ и ИГД [37]. На основании 23 исследований выявлено, что у больных, получавших ИГД в качестве ЗПТ, чаще развивается терминальная хроническая почечная недостаточность, при которой требуется проведение программного ГД. Но более поздние работы не выявили статистически значимых различий в восстановлении функции почек при использовании различных методов ЗПТ [38].
Таким образом, для принятия решения о выборе метода для начала ЗПТ рекомендуется оценивать клиническое состояние пациента, тяжесть органной дисфункции, доступность метода ЗПТ и опыт его применения в конкретной клинической ситуации. Применение ПЗПТ или продленных процедур рекомендуется гемодинамически нестабильным пациентам с ОПП, пациентам с полиорганной дисфункцией, декомпенсированными нарушениями обмена веществ, при которых требуется постоянный контроль объемов жидкости и метаболизма, пациентам с ОПП и острым повреждением головного мозга или имеющим другие причины для повышения уровня внутричерепного давления или генерализованного отека головного мозга.
В случаях, когда на первый план выходит активизация пациентов и доступен адекватный контроль жидкости и метаболизма, можно использовать ИГД или продленные методы ЗПТ. Необходимо использовать методы ЗПТ, исходя из конкретной клинической ситуации, с возможностью смены метода по мере изменения состояния пациента и динамики почечного повреждения.
На сегодняшний день методом выбора ЗПТ у нестабильных пациентов являются продолжительные или продленные методы ЗПТ. ИГД можно применять у стабильных больных, при необходимости быстрой коррекции гиперкалиемии, у пациентов с терминальной хронической почечной недостаточностью, в том числе находящихся на программном ГД. Так, в Москве в 2018 г. общее количество процедур ЗПТ составило 19 946, из них продленных процедур — 18,1%, продолжительных — 31,9%, интермиттирующих — 49,9% [14]. При проведении 55,8% процедур применяли гемодиафильтрацию как метод ЗПТ на аппаратах искуственной почки и на аппаратах ПЗПТ.
Заключение
Острое почечное повреждение у пациентов, находящихся в критическом состоянии, резко утяжеляет прогноз заболевания, сопровождается значительной летальностью и неблагоприятными отдаленными исходами. В настоящее время остается ряд нерешенных вопросов, касающихся тактики применения заместительной почечной терапии у пациентов с острым почечным повреждением. Это прежде всего использование четких критериев для начала и завершения процедур заместительной почечной терапии, применение различных методов, режимов, выбор оптимальных протоколов антикоагуляции.
Авторы заявляют об отсутствии конфликта интересов.
The authors declare no conflicts of interest.