Оглавление
Ключевые слова
- Острый лимфобластный лейкоз
- Ph+-ОЛЛ
- Транслокация (9;22)
- Транслокация (4;11)
- Транслокация (12;21)
- Метотрексат
- L-аспарагиназа
- Винкристин
- Антрациклины
- 6-меркаптопурин
- Дети
- Подростки
- Индукция
- Консолидация
- Поддерживающая терапия
- Лучевая терапия
- Химиотерапия
Список сокращений
АЛТ – аланинаминотрансфераза
АСТ – аспартатаминотрансфераза
ВОЗ – Всемирная Организация Здравоохранения
Г-КСФ – гранулоцитарный колониестимулирующий фактор
д.м.н. – доктор медицинских наук
КТ – компьютерная томография
ЛДГ — лактатдегидрогеназа
МОБ – минимальная остаточная болезнь
МРТ – магнитно-резонансная томография
ОЛЛ – острый лимфобластный лейкоз
ПХТ – полихимиотерапия
СОЛ – синдром острого лизиса опухоли
ТГСК – трансплантация гемопоэтических стволовых клеток
УЗИ – ультразвуковое исследование
ЦНС – центральная нервная система
ЧМН – черепно-мозговые нервы
ЭКГ – электрокардиография
Эхо-КГ – эхокардиография
Ph+-ОЛЛ – острый лимфобластный лейкоз с наличием Филадельфийской хромосомы – t(9;22)/BCR-ABL
Термины и определения
Полная ремиссия – отсутствие клинических проявлений заболевания при наличии ? 5% бластных клеток в костном мозге при нормальном соотношении других ростков кроветворения и отсутствии экстрамедуллярных проявлений.
Рецидив – это появление морфологически выявляемых бластных клеток после периода, в течение которого идентифицировать опухолевые клетки доступными методами не представлялось возможным.
Костномозговой рецидив – обнаружение в костном мозге 25% и более лимфобластов, без одновременного поражения ЦНС и/или другого экстрамедулярного поражения после констатации ремиссии.
ЦНС-рецидив (нейрорецидив) – появление лимфобластов в ликворе при цитологическом исследовании, а также неврологическая симптоматика, не связанная с другими заболеваниями и повреждениями. При внутричерепном образовании на КТ/МРТ и при отсутствии бластных клеток в ликворе, крови и костном мозге, для диагностики изолированного рецидива ЦНС необходимо получить гистологическое подтверждение или провести однофотонную эмиссионную КТ головного мозга. В костном мозге число бластных клеток должно составлять менее 5%.
Тестикулярный рецидив – изолированный рецидив яичка диагностируется при появлении одно- или двустороннего безболезненного яичка и значительного увеличения его плотности при пальпации при наличии в костном мозге ?5% лимфобластов и отсутствии поражения ЦНС и требует гистологического подтверждения.
Комбинированные рецидивы: сочетание двух и более поражений различной локализации. При комбинированных рецидивах костный мозг считается пораженным при наличии 5% и более лимфобластов.
Рефрактерность – отсутствие полной ремиссии в сроки, определенные протоколом терапии.
Ph-позитивный ОЛЛ– ОЛЛ с наличием транслокации (9;22)(q34;q11) – t(9;22) или BCR-ABL.
Минимальная остаточная болезнь (МОБ; minimal residual disease – MRD) – наличие остаточных лейкемических клеток у пациента в ремиссии, не выявляемых рутинными морфологическими методами.
Бессобытийная выживаемость (event-free survival – EFS) – рассчитывается от даты начала лечения до любого «отрицательного» события или даты последней явки больного. Под «отрицательным» событием понимают рецидив, смерть по любой причине, развитие второй опухоли или рефрактерность.
1. Краткая информация
1.1 Определение
Острый лимфобластный лейкоз (ОЛЛ) – это злокачественное заболевание системы кроветворения, состоящее в появлении опухолевого клона из клеток линий лимфоидной дифференцировки, составляющего не менее 25% от других ядерных клеточных элементов, и в своем естественном течении неизбежно приводящее к фатальному исходу [1-4].
1.2 Этиология и патогенез
Точные причины развития ОЛЛ не установлены. Рассматривается возможная роль различных предрасполагающих факторов (генетических, вирусных, радиация, химическое и физическое воздействие и др.), однако их точное влияние на развитие ОЛЛ на сегодняшний день не установлено.
По современным представлениям в основе патогенеза ОЛЛ лежит мутация стволовой клетки, которая приводит к потере способности к нормальной клеточной дифференцировке и нарушениям в процессах пролиферации и апоптоза. Мутантный клон достаточно быстро вытесняет нормальные гемопоэтические клетки, замещая собой весь гемопоэз. Вытеснение нормальных гемопоэтических клеток и замещение их опухолевыми клетками, неспособными к созреванию, закономерно приводит к уменьшению в периферической крови зрелых клеток с развитием анемии, гранулоцитопении, лимфопении и тромбоцитопении, что проявляется соответствующей клинической картиной. Опухолевые клетки могут покидать костный мозг и инфильтрировать различные органы и ткани (селезенку, печень, лимфоузлы, тимус, центральную нервную систему (ЦНС), кожу и др.) [1-4].
1.3 Эпидемиология
ОЛЛ составляет около 25 % от всех злокачественных опухолей у больных в возрасте до 18 лет и является самым частым онкологическим заболеванием детского возраста. Заболеваемость составляет около 4 на 100 000 детского населения. Пик заболеваемости ОЛЛ у детей приходится на дошкольный возраст (2 – 5 лет при медиане 4,7 года). Несколько чаще болеют мальчики – соотношение 1,6:1 для В-линейного и 4:1 для Т-линейного ОЛЛ [2,3,5]
1.4 Кодирование по МКБ-10
С91.0 – острый лимфобластный лейкоз
1.5 Классификация
Классификация ОЛЛ у детей согласно ВОЗ является общепринятой [4-7]:
- ОЛЛ из В-клеток предшественников
Цитогенетические подгруппы:
- t (9;22)(q34;q11); BCR-ABL, Ph+-ALL
- t (11q23)/MLL реаранжировка
- t (1;19)(q23;p13), E2A/PBX1
- t(12;21)(p12;q22), ETV6/RUNX1
- ОЛЛ из Т-клеток предшественников
2. Диагностика
2.1 Жалобы и анамнез
Клинические симптомы ОЛЛ у детей обусловлены степенью инфильтрации костного мозга лимфобластами и экстрамедуллярным распространением процесса. Пациенты с ОЛЛ могут предъявлять жалобы на слабость, лихорадку, недомогание, боли в костях и/или суставах, кровоточивость со слизистых оболочек (носовые, десневые, желудочно-кишечные и др. кровотечения), геморрагический синдром на коже, бледность. Распространение бластных клеток в лимфатические узлы и паренхиматозные органы приводит к лимфаденопатии, увеличению печени и селезенки, проявляющихся болями в животе, расширению средостения с возможным развитием синдрома сдавления, увеличению яичек у мальчиков. Проявлениями нейролейкемии могут быть симптомы поражения черепно-мозговых нервов, общемозговые, менингеальные симптомы [1-4].
Сбор анамнеза при ОЛЛ подразумевает тщательный расспрос о текущей или проводимой ранее лекарственной терапии, сопутствующих системных заболеваниях и хронической патологии, наличии онкологических заболеваний у родственников. Обязателен сбор эпидемиологического анамнеза семьи: условия проживания, санитарно-гигиенический уровень окружения, наличие хронических инфекционных заболеваний у близких родственников. Очень важно уточнить, откуда поступил больной: из дома или из других лечебных учреждений. Если больной в последнее время лечился в других больницах, обязательно нужно выяснить все детали терапии, в особенности противоинфекционной терапии, а также наличие или отсутствие различных лечебно-диагностических манипуляций, таких как катетеризация, наркоз, интубация, ИВЛ.
2.2 Физикальное обследование
Общий осмотр подразумевает оценку общего физического состояния, роста и массы тела, а также детальную оценку состояния всех органов и систем и неврологического статуса. Особое внимание следует обратить на документирование проявлений основного заболевания (описание всех групп увеличенных лимфоузлов с размерами, размеры печени и селезенки (указываются в сантиметрах ниже края реберной дуги по среднеключичной линии), размеры яичек у мальчиков, наличие/отсутствие лейкемидов на коже) и выявление возможных очагов инфекции. [1-4].
2.3 Лабораторная диагностика
Верификация диагноза проводится с помощью цитологического и цитохимического исследования мазков костного мозга и периферической крови, мультипараметрической проточной цитофлюорометрии клеток костного мозга и цитогенетического и молекулярно-генетического анализа опухолевых лимфобластов [1-4]. Диагностический период не должен занимать более 2-х суток.
- Общий клинический (развернутый) анализ крови с обязательным цитологическим исследованием мазков рекомендуется у всех пациентов с подозрением на ОЛЛ.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: данные общего анализа крови позволяют судить о выраженности тромбоцитопении и анемии, и необходимости проведения заместительной терапии компонентами крови. Общее количество лейкоцитов и наличие бластных клеток в периферической крови необходимо для последующего стадирования, определения группы риска и назначения адекватной терапии [1-5].
- Миелограмма (цитологическое и цитохимическое исследование мазков костного мозга) рекомендуется у всех пациентов с подозрением на ОЛЛ.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Диагноз ОЛЛ ставится на основании обнаружения в пунктате костного мозга более 25% лейкемических клеток, для которых морфологически и цитохимически доказан один из вариантов лимфоидной дифференцировки. При этом в бластных клетках (по данным цитохимического исследования) отсутствует активность миелопероксидазы и неспецифической эстеразы, как ключевых маркёров нелимфоидных клеток-предшественников [1-6].
Костный мозг аспирируется из 3-х – 4-х анатомических точек. Для пункций используются передние и задние гребни крыльев подвздошных костей.
Морфологическая классификация ОЛЛ согласно группе ФАБ (Франко-Америко-Британская кооперативная Группа) на основании размеров, строения ядра, наличия включений и других признаков подразделяет лимфобласты на группы L1, L2 и L3. В настоящее время острый лейкоз со зрелым В-фенотипом (L3) относится к группе неходжкинских лимфом, и его диагностика и лечение должны проводиться согласно соответствующим клиническим рекомендациями [1-6].
Цитохимическое исследование опухолевых клеток является важным для дифференциальной диагностики с другими вариантами лейкемии. Обязательным является проведение двух цитохимических реакций – реакции на миелопероксидазу и реакции на неспецифическую эстеразу [2-4].
- Иммунофенотипирование бластных клеток костного мозга с помощью проточной цитометрии рекомендуется у всех пациентов с подозрением на ОЛЛ.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Мультипараметрическая проточная цитометрия, проводимая, с целью точного определения иммунофенотипа лейкемического клона занимает центральное место в диагностике ОЛЛ, являясь очень важным и обязательным методом для диагностики различных вариантов ОЛЛ, для стратификации на группы риска и для последующего определения минимальной резидуальной болезни (МОБ) [1-6]. Различные иммунофенотипические варианты болезни представлены в таблице 1.
Таблица 1 – Иммунофенотипическая классификация ОЛЛ по EGIL (Европейская группа иммунодиагностики лейкозов), 1995 [8]
|
В-линейный острый лимфобластный лейкоз |
|
|
CD19+ и/или CD79a+ и/или СD22cyt+ Экспрессия не менее двух из трех пан-В-клеточных маркеров Большинство случаев TdT+ и HLA-DR+, зрелый В-ОЛЛ часто TdT- |
|
|
Про-В-ОЛЛ (ВI) |
Нет экспрессии других маркеров |
|
«Common»-ОЛЛ (ВII) |
CD10+ |
|
Пре-В-ОЛЛ (BIII) |
Цитоплазматические IgM+ |
|
Зрелый-В-ОЛЛ (BIV) |
Цитоплазматические цепи каппа+ или лямбда+ |
|
Т-линейный острый лимфобластный лейкоз |
|
|
CD3+ цитоплазматический или мембранный, большинство случаев: TdT+, HLA-DR—, CD34—, но эти маркеры не играют роли в диагностике и классификации. |
|
|
Про-Т-ОЛЛ (TI) |
CD7+ |
|
Пре-Т-ОЛЛ (TII) |
CD2+ и/или CD5+ и/или CD8+ |
|
Кортикальный Т-ОЛЛ (TIII) |
CD1a+ |
|
Зрелый Т-ОЛЛ (TIV) |
CD3mem+, CD1a- |
|
Альфа/бета+ Т-ОЛЛ (а) |
TCR?/?+ |
|
Гамма/дельта+ Т-ОЛЛ (б) |
TCR?/?+ |
- Цитогенетическое и молекулярно-генетическое исследование бластных клеток рекомендуется у всех пациентов с подозрением на ОЛЛ.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Цитогенетическое исследование лейкемических клеток должно включать в себя кариотипирование и исследование методом флуоресцентной in situ гибридизации (FISH) для выявления характерных перестроек. В настоящее время следующие транслокации однозначно имеют клиническое значение – t(9;22)(q34;q11) или BCR-ABL; t(4;11)(q21;q23) и t(12;21)(p13;q22) или TEL/AML1 [3-6, 9-12].
- Исследование спинномозговой жидкости (с определением цитоза, белка, глюкозы и обязательным цитологическим исследованием) рекомендуется у всех пациентов с подозрением на ОЛЛ.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Исследование ликвора обязательно для подтверждения/исключения диагноза поражения ЦНС (нейролейкемии), что необходимо для точного определения группы риска и назначения адекватной терапии.
В результате анализа ликвора возможны следующие варианты:
- CNS1 – пункция не травматичная (<10 эритроцитов/мкл), отсутствие лейкемических клеток
- CNS2 – пункция не травматична, <10 лейкоцитов/мкл, возможно наличие лейкемических клеток
- CNS3 – пункция не травматична, ?10 лейкоцитов/мкл, наличие лейкемических клеток после цитоцентрифугирования
- TLP+ – травматичная пункция с примесью лейкемических клеток
- TLP— – травматичная пункция, отсутствие примеси лейкемических клеток [1-6, 11, 13].
Диагностическая люмбальная пункция должна проводиться только опытным врачом под общей анестезией с целью снижения риска травматичности и механического заноса бластных клеток периферической крови в ЦНС. Точная диагностика инициального поражения ЦНС возможна только путем приготовления цитопрепарата первичного ликвора на цитоцентрифуге. Оседание клеток ликвора на стекло естественным путём требует больше времени, что неизбежно приводит к деформации клеток, появлению артефактов и неправильной интерпретации данных [3, 4].
2.4 Инструментальная диагностика
- Рентгенография грудной клетки в прямой и правой боковой проекции рекомендуется у всех пациентов с подозрением на ОЛЛ.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Диагноз опухолевой массы в переднем средостении ставится по прямому и правому боковому рентгеновским снимкам грудной клетки [1-4]. Прямой и правый боковой рентгеновские снимки грудной клетки должны быть сделаны одновременно и до начала лечения.
- Компьютерная томография органов грудной полости рекомендована пациентам с подозрением на ОЛЛ в случае выявления опухолевой массы в переднем средостении по данным рентгенографии
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: В случае выявления опухолевой массы в переднем средостении при рентгенографии грудной клетки необходимо провести КТ органов грудной полости с оценкой точных размеров опухолевой массы [1-4]. По окончании индукционной терапии КТ проводится повторно для оценки степени уменьшения опухолевой массы в средостении.
- УЗИ брюшной полости и забрюшинного пространства рекомендуется у всех пациентов с ОЛЛ.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Проведение УЗИ необходимо для оценки наличия поражения и размеров инфильтрированных паренхиматозных органов и лимфатических узлов брюшной полости, яичек, органов малого таза [1-4].
- Биопсия яичка не рекомендуется пациентам с подозрением на ОЛЛ.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Диагноз инициального поражения яичек устанавливается на основании клинических данных и УЗИ. Биопсия яичка при подозрении на инициальное поражение не показана. Инициальное поражение яичек не влияет на стратификацию и выбор терапии; односторонняя или двухсторонняя орхиэктомия не предусмотрена [1-4].
- Проведение КТ/МРТ головного мозга рекомендуется пациентам с подозрением на ОЛЛ.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: Проведение КТ/МРТ головного мозга показано (при наличии неврологической симптоматики обязательно) для исключения/подтверждения инициального поражения ЦНС [1-4].
2.5 Иная диагностика
- Осмотр невролога рекомендуется всем пациентам с ОЛЛ.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Осмотр невролога показан всем пациентам с ОЛЛ на этапе инициальной диагностики для выявления/исключения признаков нейролейкемии – поражение ЧМН, очаговая симптоматика [1-4].
- Осмотр офтальмолога рекомендуется всем пациентам с ОЛЛ.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Осмотр офтальмолога с обязательным осмотром глазного дна показан всем пациентам с ОЛЛ на этапе инициальной диагностики для выявления/исключения лейкемической инфильтрации [1-4].
Учитывая необходимость проведения химиотерапии, пациентам с ОЛЛ помимо обязательных исследований, необходимых для установления диагноза, определения степени распространенности процесса и назначения адекватной терапии, на этапе первичной диагностики показано также проведение различных исследований, направленных на определение состояния различных органов и систем (профилактика развития токсических осложнений). Они включают в себя:
- Биохимический анализ крови (мочевина, креатинин, электролиты, общий белок, билирубин, глюкоза, ЛДГ, амилаза, АЛТ, АСТ) рекомендуется всем пациентам с ОЛЛ.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Учитывая необходимость проведения ПХТ, на начальном этапе очень важно определить функциональное состояние различных органов и систем с целью профилактики развития возможных токсических осложнений, т.к. в процессе терапии используются препараты, обладающие гепато-, нефро- и панкреатотоксическим действием. Особенно важно в первые дни терапии контролировать функцию почек (мочевина, креатинин, электролиты), т.к. возможно развитие синдрома острого лизиса опухоли (СОЛ). Степень риска развития СОЛ зависит от инициальной массы опухоли, состояния пациента на момент начала химиотерапии и индивидуальных особенностей метаболизма. Биохимический анализ крови с определением основных ключевых показателей обязательно выполняется до начала терапии; в дальнейшем кратность исследований определяется состоянием пациента и протоколом терапии [2-4, 14].
- Коагулограмма рекомендуется всем пациентам с ОЛЛ
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Определение инициального состояния системы гемостаза необходимо всем пациентам с ОЛЛ, т.к. в процессе лечения используются препараты, обладающие прокоагулянтными свойствами (аспарагиназа, глюкокортикостероиды) [2-4, 14]. В процессе терапии исследование гемостаза проводится регулярно (сроки регламентируются протоколом терапии).
- ЭКГ и Эхо-КГ рекомендуется всем пациентам с ОЛЛ
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Определение инициального состояния сердечно-сосудистой системы необходимо всем пациентам с ОЛЛ, т.к. в процессе лечения используются препараты с выраженным кардиотоксическим действием (антрациклины). В процессе терапии ЭКГ и Эхо-КГ должны повторяться перед каждым введением антрациклинов [2-4, 14].
3. Лечение
3.1 Консервативное лечение
Цели лечения [1-6]:
- Эрадикация лейкемического клона;
- Восстановление нормального кроветворения;
- Достижение длительной бессобытийной выживаемости.
Лечение острого лимфобластного лейкоза осуществляется при помощи комбинаций цитостатических препаратов, вводимых р/о, в/в, в/м и интратекально при строгом соблюдении дозы, длительности и времени введения согласно выбранному терапевтическому протоколу [1-6, 9, 10]. Кроме того, для ряда пациентов в предусмотренных протоколом случаях проводится облучение центральной нервной системы [13, 15, 16]. Терапия должна быть начата как можно раньше, однако для начала терапии необходимо быть полностью уверенным в диагнозе и установить объем поражения [1-4]. Для проведения эффективного лечения необходима адекватная сопроводительная и заместительная терапия [14].
- Лечение пациентов с ОЛЛ рекомендуется проводить только с помощью комбинированной цитостатической терапии по одному из терапевтических протоколов с установленными и хорошо известными конечными результатами.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Лечение должно осуществляется только в соответствии с одним из специально разработанных терапевтических протоколов, подробно регламентирующему дозы и комбинации химиопрепаратов, сроки введения, детали обследования и тактику проведения цитостатической и сопроводительной терапии [1-6, 10, 17, 18]. Дозы, сроки и длительность введения химиопрепаратов должны быть в строгом соответствии с выбранным терапевтическим протоколом. Замена препаратов, пропуски введения, изменение дозы, длительности или очередности введения препаратов не допускаются.
В России проводится лечение по протоколам группы BFM (ALL-BFM-95 или ALL-BFM-2000) или группы Москва-Берлин (ALL-MB-2002 или ALL-MB-2008), имеющим сравнимую эффективность [9, 18-22].
До начала терапии пациенты разделяются на группы риска – подгруппы пациентов с более низким и более высоким риском развития рецидивов заболевания, которое проводится на основании прогностических факторов, определенных при диагностике [1-6, 10-12, 18]. Различные терапевтические протоколы имеют несколько отличающиеся друг от друга критерии, определяющие группы риска, согласно которым пациенты получают различные варианты лечения, однако, в основном, больных разделяют на три группы риска: стандартный, промежуточный и высокий.
Современное лечение ОЛЛ состоит из нескольких основных фаз: индукция ремиссии с помощью 4 и более агентов, вводимых в течение 4-6 недель, мультиагентная консолидация («закрепление») ремиссии и поддерживающая терапия, как правило, антиметаболитами в течение 2-3 лет [1, 4, 6, 19, 21, 23]. Основные элементы и возможные используемые химиопрепараты представлены в таблице 2:
Таблица 2. Фазы терапии ОЛЛ и используемые химиопрепараты.
|
Фаза терапии |
Набор химиопрепаратов |
|
Индукционная терапия |
преднизолон или дексаметазон, винкристин, даунорубицин, аспарагиназа, циклофосфамид, цитарабин, 6-меркаптопурин. |
|
Консолидирующая терапия |
6-меркаптопурин, метотрексат, аспарагиназа |
|
Реиндукционная терапия |
дексаметазон, аспарагиназа, доксорубицин, винкристин, циатрабин |
|
Поддерживающая терапия |
6-меркаптопурин, метотрексат |
Имеются убедительные доказательства увеличения эффективности терапии при использовании как минимум 4-компонентной индукционной терапии (глюкокортикостероид, винкристин, антрациклины и аспарагиназа) [1, 9, 10, 12, 18].
Индукция ремиссии у пациентов с ОЛЛ должна проводиться в стационарных условиях. При лечении больного с ОЛЛ необходимо быть готовыми к развитию тяжелых осложнений, требующих безотлагательной интенсивной терапии.
Оценка эффективности терапии проводится на 8, 15 день и по окончании индукции. На 8 день оценивается количество бластных клеток в периферической крови после циторедуктивной профазы. На 15 день – количество бластных клеток в костном мозге. По окончании индукционной терапии оценивается достижение ремиссии – количество бластных клеток в костном мозге, наличие/сохранение экстрамедуллярных очагов. Ликвор оценивается каждый раз при проведении люмбальной пункции. Пациенты, не достигшие ремиссии после индукционной терапии, переводятся в группу высокого риска [1-6, 11].
Пациенты, достигшие ремиссии после индукционной терапии, далее получают консолидирующую терапию в зависимости от выбранного терапевтического протокола. Терапия консолидации при отсутствии осложнений может проводиться в условиях стационарного одного дня. Если терапевтический протокол предусматривает использование высоких доз метотрексата (протоколы BFM), они должны проводиться в условиях круглосуточного стационара. Консолидирующая терапия, как правило, состоит из нескольких фаз (протоколы МВ: фазы S1, S2, S3; протоколы BFM – фаза II протокола I, протокол М, II протокол). Перед началом каждого этапа обязательно исследование общего анализа крови, биохимического анализа крови. Площадь поверхности тела для расчета доз лекарственных препаратов пересчитывается заново перед началом каждой фазы консолидирующей терапии. Условия начала отдельных этапов консолидации прописываются в каждом терапевтическом протоколе и могут несколько отличаться. Обязательным является сохранение клинико-гематологической ремиссии, отсутствие признаков инфекции и отсутствие цитопении в периферической крови [1-4, 6, 14, 19, 21, 23].
- В лечении пациентов с ОЛЛ рекомендуется обязательное использование компонентов терапии, направленных на профилактику нейролейкемии.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Обязательным компонентом в лечении ОЛЛ является профилактика и лечение нейролейкемии. Основными методами профилактики и лечения нейролейкемии являются интратекальное введение химиопрепаратов (метотрексат, цитарабин, преднизолон) в возрастных дозировках и краниальное облучение в ранние сроки от начала лечения. Краниальное облучение имеет непосредственные и отдаленные побочные эффекты, поэтому в современных протоколах оно используется только для небольшой четко выделенной подгруппы пациентов промежуточного/высокого риска [1, 9,13, 15, 16, 24].
- У пациентов с Ph+-ОЛЛ рекомендуется использование ингибиторов тирозинкиназ в дополнение к стандартной терапии.
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
Комментарии: Особую терапевтическую группу составляют пациенты с Ph+-ОЛЛ (с наличием t(9;22) или BCR/ABL), традиционно отличающиеся плохим прогнозом, связанным с плохим ответом на индукционную терапию и высокой частотой рецидивов. До недавнего времени стандартом терапии для таких пациентов была интенсивная высокодозная химиотерапия с последующим проведением ТГСК при условии достижения ремиссии. Учитывая имеющиеся на сегодняшний день данные проведенных международных исследований, говорящие о высокой эффективности использования у таких пациентов ингибиторов тирозинкиназ на фоне химиотерапии сниженной интенсивности [9, 25, 26], в этой группе больных с 15 дня индукционной терапии и до окончания лечения рекомендуется ежедневный прием иматиниба в дозе 300 мг/м2.
- У пациентов с ОЛЛ обязательно рекомендуется проведение поддерживающей терапии антиметаболитами.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Поддерживающая терапия проводится до достижения общей длительности терапии 2 года. Поддерживающая терапия состоит из ежедневного перорального приема 6-меркаптопурина с еженедельным введением метотрексата (в/м или р/о в зависимости от терапевтического протокола) [1-4, 6, 9, 10, 20, 27]. Обязательным условием адекватного проведения поддерживающей терапии является своевременная коррекция дозировки 6-меркаптопурина и метотрексата в зависимости от количества лейкоцитов. Задачей является такая юстировка доз, прежде всего 6-меркаптопурина, чтобы лейкоциты стабильно держались в пределах от 2 000 до 3 000/мкл, не допуская как развития аплазии, так и увеличения лейкоцитов выше 3 000-3 500/мкл.
Протоколы серии Москва-Берлин предусматривают также проведение реиндукций (дексаметазон + винкристин), каждые 6 недель поддерживающей терапии. На первых трех реиндукциях проводятся интратекальные введения 3-х химиопрепаратов. Больным, которым проводилось краниальное облучение, интратекально вводятся только 2 препарата – метотрексат не вводится [19-21].
- Пациентам с ОЛЛ группы высокого риска рекомендуется проведение интенсивной высокодозной полихимиотерапии.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Пациенты, определенные в группу высокого риска, по завершении индукционной терапии, получают интенсивную высокодозную полихимиотерапию, представляющую собой короткие последовательные курсы интенсивной ПХТ – «блоки». В зависимости от наличия показаний, совместимого донора и достижения ремиссии, пациентам проводится трансплантация гемопоэтических стволовых клеток (ТГСК) в максимально ранние сроки [1-4, 6, 10, 20, 21, 23].
Терапия пациентов группы высокого риска проводится только в условиях круглосуточного стационара. Перед началом каждого блока высокодозной химиотерапии обязательно исследование общего анализа крови, биохимического анализа крови, исследование функции почек (клиренс по эндогенному креатинину), регистрация ЭКГ. Площадь поверхности тела для расчета доз лекарственных препаратов пересчитывается заново перед началом каждого блока. Оценка статуса ремиссии проводится перед началом каждого блока химиотерапии.
Терапия должна начинаться как можно быстрее, что особенно важно для первых трех терапевтических элементов. Временные промежутки между элементами определяются выходом из аплазии, общим состоянием пациента и объективно регистрируемой органной токсичностью. Минимальный промежуток между началом двух последовательных терапевтических элементов составляет 21 день. Редукция доз не предусмотрена. В случае необходимости сроки введения конкретного препарата сдвигаются или он отменяется. Терапевтический элемент не должен прерываться.
Для адекватного выполнения терапевтического протокола необходимо строгое соблюдение принципов сопроводительной терапии, которые подробно описаны в каждом терапевтическом протоколе и зависят от применяемой химиотерапии. Однако, существуют «общие» рекомендации, которые включают в себя следующее [14]:
- Пациентам с ОЛЛ рекомендуется установка центрального венозного катетера.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Наличие центрального венозного катетера, обеспечивающего возможность мониторинга ЦВД, частых заборов крови и высокую скорость введения жидкостей является абсолютно необходимым на начальных этапах терапии и у пациентов группы высокого риска, получающих интенсивную высокодозную химиотерапию.
- Всем пациентам с ОЛЛ в первые дни (недели) терапии рекомендуется проведение терапевтических мероприятий, направленных на профилактику синдрома лизиса опухоли.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Синдром острого лизиса опухоли (СОЛ) – это комплекс метаболических расстройств в результате массивного распада опухолевых клеток и высвобождения в плазму и периферические ткани внутриклеточного содержимого и метаболитов. В основе патофизиологии и клинической картины СОЛ лежат нарушения метаболизма и экскреции калия, кальция, фосфатов и мочевой кислоты. Наиболее часто СОЛ развивается в течение первых 4-х дней после начала ПХТ, однако, описаны случаи и более позднего, до седьмого дня, дебюта синдрома. Степень риска развития СОЛ зависит от инициальной массы опухоли, состояния пациента на момент начала химиотерапии и индивидуальных особенностей метаболизма [14].
К важнейшим мерам профилактики СОЛ относятся адекватная гидратация, защелачивание мочи, предупреждение и коррекция гиперурикемии, а также борьба с электролитными нарушениями. Стандартной нагрузкой является 3000 мл/м2, а у детей весом менее 10 кг – 200 мл/кг жидкости в сутки. Базисный раствор для инфузии состоит из 5% глюкозы и 0,9% NaCl в соотношении 1:1. Инициальная инфузия – без калия. Однако в дальнейшем должна проводиться коррекция электролитов в соответствии с данными биохимических анализов. Главным мероприятием является инициирование и поддержание высокого диуреза – 100-250 мл/м2/час.
Учитывая более низкую растворимость мочевой кислоты в кислой среде, необходимо обеспечить поддержание нейтрального или слабощелочного рН мочи: NaHCO3 60 ммоль на литр инфузии (60 мл 7,5% раствора соды, либо 100-120 мл 4% раствора соды) добавить к постоянной инфузии (или 100-200 ммоль/м2/сутки параллельной инфузией). Регулирование необходимого объёма NaHCO3 соответственно pH мочи.
Всем пациентам в первые дни терапии (5-8 дней) показано назначение аллопуринола в дозе 10 мг/кг в сутки в 2-3 приема (предельно допустимая суточная доза – 500 мг/сутки) [14].
При наличии большой массы лейкемических клеток и/или выраженной органомегалии первая доза глюкокортикостероидов для профилактики СОЛ должна составлять 1/10 – 1/6 от суточной дозы.
- Всем пациентам с ОЛЛ, получающим химиотерапию, рекомендуется универсальная профилактика пневмоцистной пневмонии триметоприм/сульфометоксазолом на протяжении всего периода лечения.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Ко-тримоксазол (Сульфаметоксазол + Триметоприм) 3 раза в неделю в один прием в дозе 5 мг/кг по триметоприму или 20 мг/кг по сульфаметоксазолу per os. (кроме периодов проведения высокодозного метотрексата) [14].
- Всем пациентам с ОЛЛ, в случае появления лихорадки или других признаков инфекции, рекомендуется немедленное начало эмпирической антибактериальной терапии.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Лихорадкой у больного с нейтропенией (нейтрофилы < 500/мкл) считается однократное повышение базальной температуры тела > 38,50С или несколько подъемов (3 – 4 раза в сутки) до 380С. Принимая во внимание высокий риск фатального исхода у больного с инфекцией, лихорадку у такого пациента с нейтропенией, развившую в ходе миелосупрессивной полихимиотерапии, следует расценивать как наличие инфекции, что требует немедленного начала эмпирической антибактериальной терапии и проведения обследования с целью уточнения характера инфекции.
При выборе стартовой комбинации антибиотиков необходимо учитывать результаты повторных бактериологических исследований в данной клинике у других пациентов; длительность текущей нейтропении, предшествующий курс химиотерапии; инфекционный анамнез больного, предшествующие курсы антибиотиков и их эффективность; наличие клинической симптоматики [14].
Эффективность стартовой антибактериальной терапии положено оценивать через 24-36 часов для того, чтобы судить о её достаточности, однако всегда необходим повторный с интервалами 8-12 часов детальный осмотр такого больного с оценкой стабильности гемодинамики и степени интоксикации, появления новых инфекционных очагов.
Антибактериальная терапия продолжается до разрешения нейтропении.
- Одновременное применение итраконазола или вориконазола и винкристина вследствие резкого усиления токсичности последнего не рекомендуется [14].
Уровень убедительности рекомендаций В (уровень достоверности доказательств – 2)
- Использование гранулоцитарного колониестимулирующего фактора (Г-КСФ) рекомендуется только в случаях развития тяжелых инфекций.
Уровень убедительности рекомендаций С (уровень достоверности доказательств – 3)
Комментарии: Имеются данные международных исследований о том, что необоснованное применение G-CSF может увеличивать риск рецидивов [14].
- При снижении гемоглобина ниже 70 г/л рекомендуется трансфузия эритроцитарной массы.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Во всех случаях, исключая пневмонию и дыхательную недостаточность, переливание эритромассы должно производиться при содержании гемоглобина ниже 70 г/л и гематокрите менее 0,3 или при наличии клинических симптомов анемического синдрома (сонливость, тахикардия, одышка). Доза переливаемой эритромассы – 10 мл/кг. При развитии инфекции эритромасса переливается при снижении гемоглобина ниже 100 г/л [14].
- При снижении уровня тромбоцитов ниже 15-20?109/л рекомендуется трансфузия концентрата тромбоцитов.
Уровень убедительности рекомендаций А (уровень достоверности доказательств – 1)
Комментарии: Трансфузия тромбоцитов при отсутствии осложнений программного лечения проводится при снижении уровня тромбоцитов ниже 15 000 – 20 000/мм3. Количество переливаемых тромбоцитов составляет 1 доза на 10 кг веса (4-6 доз на 1,5 м2 площади поверхности тела), при этом в 1 дозе тромбомассы должно содержаться 0,5-0,7?1011 тромбоцитов. При необходимости выполнения инвазивных манипуляций тромбомасса переливается в случае, если тромбоцитов менее 40 000-50 000 тыс/мкл. В настоящее время правилом является использование тромбоцитов, полученных от одного донора путём афереза на специальных приборах сепараторах [14].
3.2 Хирургическое лечение
Не применяется
3.4 Иное лечение
- Проведение лучевой терапии рекомендуется только ограниченной подгруппе пациентов с ОЛЛ.
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: Краниальное облучение имеет непосредственные и отдаленные побочные эффекты, поэтому в современных протоколах оно используется только для небольшой четко выделенной подгруппы пациентов промежуточного/высокого риска (в зависимости от рекомендаций выбранного терапевтического протокола). Краниальное облучение проводится по окончании консолидации, как правило, в дозе 12 Гр [1-4, 9, 13, 15-17, 24, 28].
Большое значение имеет охватывание площадью облучения всего мозгового черепа и обязательно трех верхних сегментов шейного отдела позвоночника. Особое внимание следует обратить на то, чтобы были охвачены ретроорбитальные области, основание черепа, а также глубоко лежащие участки в области средней черепной ямки. Ежедневная доза должна составлять в первый день 1 Гр, в последующие — 1,7 Гр. Облучать следует 5 дней в неделю до достижения соответствующей общей дозы. Общая продолжительность облучения зависит от индивидуально получаемых лучевых доз. Краниальное облучение должно выполняться на линейном ?-ускорителе.
- Проведение трансплантации гемопоэтических стволовых клеток (ТГСК) показано всем больным высокого риска в 1-ой ремиссии.
Уровень убедительности рекомендаций B (уровень достоверности доказательств – 2)
Комментарии: В зависимости от наличия показаний, совместимого донора и достижения ремиссии, пациентам группы высокого риска проводится трансплантация гемопоэтических стволовых клеток (ТГСК) в максимально ранние сроки [1-6, 9, 10, 17, 18, 20].
Проведение ТГСК показано всем больным высокого риска в 1-ой ремиссии и больным с рецидивами ОЛЛ (за исключением пациентов с поздними изолированными экстрамедуллярными рецидивами) при условии обнаружения родственного полностью совместимого (HLA-типирование высокого разрешения) донора. Поэтому всем пациентам HLA-типирование и инициация поиска донора должны проводиться сразу после стратификации пациентов в группу высокого риска.
Показаниями к ТГСК при первичном ОЛЛ у детей считаются: отсутствие ремиссии после индукционной терапии; транслокация (9;22)(q34;q11) или BCR/ABL; транслокация (4;11)(q21;q23) или MLL/AF4 [1-6, 9, 10, 17, 18, 20].
Пациентам, не достигшим ремиссии после проведения индукционной терапии, облигатно показана аллогенная ТГСК любого типа (в зависимости от доступности доноров и от технических возможностей).
4. Реабилитация
Реабилитация детей с ОЛЛ в ремиссии должна носить комплексный характер, охватывая не только медицинские, но и социально-психологические аспекты адаптации не только ребенка, но и его семьи к нормальной жизни. Такая реабилитация требует кроме медицинской помощи обязательного участия социальных работников, педагогов и психологов. Программы реабилитации разрабатываются индивидуально, в зависимости от выявленных осложнений химиотерапевтического лечения, сопутствующей патологии, социальных и психологических проблем.
Поддерживающая терапия проводится по месту жительства под наблюдением врача-педиатра (если есть должность, то врача-гематолога). Врач-педиатр (гематолог) по месту жительства руководствуется рекомендациями, данными специалистами учреждения, проводившего лечение.
5. Профилактика и диспансерное наблюдение
Периодичность лабораторных и инструментальных исследований, осмотров специалистов в период диспансерного наблюдения [29]:
- Общий клинический анализ крови (обязателен подсчет лейкоцитарной формулы) проводится 1 раз в неделю до окончания поддерживающей терапии. После окончания поддерживающей терапии – 1 раз в месяц.
- Биохимический анализ крови, включающий все позиции, определяемые при диагностике, до окончания поддерживающей терапии проводится 1 раз в 3 месяца. После окончания поддерживающей терапии – 1 раз в 6 месяцев.
- Пункции костного мозга и люмбальная пункция проводятся только в случае появления подозрения на развитие рецидива заболевания.
- УЗИ органов брюшной полости, малого таза и забрюшинного пространства до окончания поддерживающей терапии проводятся 1 раз в 3 месяца. После окончания поддерживающей терапии – 1 раз в 6 месяцев.
- Гематолог, проводивший лечение, после начала поддерживающей терапии и передачи пациента педиатру (гематологу) по месту жительства осматривает пациента 1 раз в 3 месяца до окончания поддерживающей терапии, 1 раз в 6 месяцев после окончания поддерживающей терапии и при подозрении на развитие рецидива заболевания.
- При передаче пациента педиатру (гематологу) по месту жительства необходимости в плановом осмотре специалистами смежных специальностей нет. В случае наличия у пациента патологии какой-либо системы органов, возникшей в процессе терапии и потребовавшей вмешательства смежных специалистов, периодичность контрольных осмотров устанавливается индивидуально и определяется самим смежным специалистом.
Пациент снимается с диспансерного учета при условии окончания поддерживающей терапии, наличия полной ремиссии, отсутствия сопутствующих заболеваний и по истечении 5 лет после окончания лечения [29].
6. Дополнительная информация, влияющая на течение и исход заболевания
Вакцинация [29]:
- В период лечения вакцинация не проводится (исключение составляет вакцинация против гепатита В, которую можно проводить на фоне терапии по специальной схеме для иммунокомпрометированных пациентов).
- После окончания поддерживающей терапии при условии наличия полной ремиссии вакцинацию можно проводить в полном объеме, исключив живые вакцины.
Возможность пребывания в организованном коллективе:
- Не желательна на период проведения интенсивной терапии.
- Ограничена эпидемиологической ситуацией и клинико-лабораторным статусом пациента в период проведения поддерживающей терапии.
- Не ограничена после окончания поддерживающей терапии.
Возможность нагрузок и занятий спортом:
- Физические нагрузки не желательны в период проведения интенсивной терапии.
- Ограничены клинико-лабораторным статусом пациента в период проведения поддерживающей терапии.
- После окончания поддерживающей терапии ограничены только развившейся в период лечения патологией опорно-двигательного аппарата или тяжелыми сопутствующими заболеваниями. При их отсутствии не ограничены.
Отношение к рождению детей – Никаких ограничений нет. Риск развития ОЛЛ у потомства минимален.
Критерии оценки качества медицинской помощи
|
№ п/п |
Критерии качества |
Уровень достоверности доказательств |
Уровень убедительности рекомендаций |
|
1. |
Выполнена пункция костного мозга (при установке диагноза) |
А |
1 |
|
2. |
Выполнено цитологическое исследование мазка костного мозга (подсчет формулы костного мозга) и цитохимическое исследование препарата костного мозга (при установке диагноза) |
А |
1 |
|
3. |
Выполнено иммунофенотипирование бластных клеток костного мозга с помощью проточной цитометрии (при установке диагноза) |
А |
1 |
|
4. |
Выполнено цитогенетическое исследование и/или молекулярно-генетическое исследование бластных клеток костного мозга (при установке диагноза) |
А |
1 |
|
5. |
Выполнена спинномозговая пункция (при установке диагноза) |
А |
1 |
|
6. |
Выполнено исследование спинномозговой жидкости (определение цитоза, белка, глюкозы, цитологическое исследование) (при установке диагноза) |
А |
1 |
|
7. |
Выполнена рентгенография органов грудной клетки (при установке диагноза) |
А |
1 |
|
8. |
Выполнены ультразвуковое исследование органов брюшной полости (комплексное) и ультразвуковое исследование забрюшинного пространства (при установке диагноза) |
А |
1 |
|
9. |
Выполнена компьютерная томография головы и/или магнитно-резонансная томография головного мозга (при установке диагноза в случае наличия неврологической симптоматики) |
В |
2 |
|
|
Выполнена повторная пункция костного мозга на 15 день индукционной терапии и не позднее 40 дня от момента начала индукционной терапии |
А |
1 |
|
|
Выполнено цитологическое исследование мазка костного мозга (подсчет формулы костного мозга) на 15 день индукционной терапии и не позднее 40 дня от момента начала индукционной терапии |
А |
1 |
|
|
Выполнена повторная рентгенография органов грудной клетки не позднее 40 дня от момента начала индукционной терапии (при наличии инициального поражения средостения) |
А |
1 |
|
|
Выполнен общий (клинический) анализ крови развернутый с подсчетом лейкоцитарной формулы не реже 1 раза в 7 дней (при поддерживающей терапии) |
А |
1 |
|
|
Выполнена коррекция доз меркаптопурина и метотрексата в зависимости от количества лейкоцитов в общем (клиническом) анализе крови развернутом не реже 1 раза в 7 дней (при поддерживающей терапии) |
А |
1 |
|
|
Выполнен анализ крови биохимический общетерапевтический (аланинаминотрансфераза, аспартатаминотрансфераза, гамма-глутамилтранспептидаза, билирубин, общий белок, альбумин, глюкоза) не реже 1 раза в 3 месяца (при поддерживающей терапии) |
А |
1 |
|
|
Выполнена консультация врачом-гематологом в профильной медицинской организации (при наличии медицинских показаний к трансплантации костного мозга) |
В |
2 |
Список литературы
- Pui C.H., ed. Treatment of acute leukemias. New directions for clinical research. New Jersey, Humana Press Inc.; 2003
- Margolin JF, Poplack DG. Acute lymphoblastic leukemia. In: Principles and Practice of Pediatric Oncology, 3rd ed. (Pizzo PA, Poplack DG, eds.), Philadelphia, Lippincott-Raven Publishers, 1997.
- Мякова Н.В. Острый лимфобластный лейкоз. В книге: Практическое руководство по детским болезням. Под ред. Коколиной В.Ф., Румянцева А.Г., Том IV – Гематология/онкология детского возраста. Под ред. А.Г.Румянцева, Е.В.Самочатовой. М, Медпрактика-М, 2004, стр. 518-537
- Карачунский А.И., Мякова Н.В. Острый лимфобластный лейкоз. В книге: Педиатрия: национальное руководство в 2 т. М, ГЭОТАР-Медиа, 2009, т.1, Глава 59, стр. 944-955
- Hunger SP, Mullighan CG. Acute lymphoblastic leukemia in children. N Engl J Med, 2015; 373(16): 1541-1552
- Cooper SL, Brown PA. Treatment of pediatric acute lymphoblastic leukemia. Pediatr Clin North Am, 2015; 62(1):61-73.
- Vardiman J., Thiele J., Arber D., et al. The 2008 revision of the World Health Organization (WHO) classification of myeloid neoplasms and acute leukemia: rationale and important changes. Blood, 2009; 111: 937-951.
- Bene M., Castoldi G., Knapp W., et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL). Leukemia, 1995; 9(10): 1783-1786.
- Литвинов Д.В., Карелин А.Ф., Романова К.И., Румянцева Ю.В., Карачунский А.И. Лечение острого лимфобластного лейкоза у детей: современные возможности и нерешенные проблемы. Доктор.Ру, 2015, 10(111): 30-37
- Pui C-H. Toward a total cure for acute lymphobalstci leukemia. J Clin Oncol, 2009; 27(31): 5121-5123.
- Vrooman LM., Silverman LB. Childhood acute lymphoblastic leukemia: update on prognostic factors. Curr Opin Pediatr, 2009, 21: 1-8
- Hunger SP, Baruchel A, Biondi A et al. The thirteenth international childhood acute lymphoblastic leukemia workshop report. Pediatr Blood Cancer, 2013; 60(2): 344-348
- Pui C.H. Toward optimal central nervous system-directed treatment in childhood acute lymphoblastic leukemia. J Clin Oncol, 2003; 21: 179–181.
- Сопроводительная терапия и контроль инфекций при гематологических и онкологических заболеваниях. Румянцев А.Г., Масчан А.А., Самочатова Е.В. М, Медпрактика-М, 2009, 448 с.
- Ю.В. Румянцева, Н.И. Пономарева, Л.Г. Фечина и др. Профилактика нейролейкемии у детей с острым лимфобластным лейкозом: стратегия Москва-Берлин. Вопросы гематологии/онкологии и иммунопатологии в педиатрии, 2009; 8 (2): 5-14
- Pui C-H. Central nervous system disease in acute lymphoblastic leukemia: prophylaxis and treatment. Hematology Am Soc Hematol Educ Program, 2006; 142-146
- Pui CH, Evans WE. A 50-year journey to cure childhood acute lymphoblastic leukemia. Semin Hematol. 2013; 50(3): 185-196.
- Румянцев А.Г. Эволюция лечения острого лимфобластного лейкоза у детей. Педиатрия, 2016; 95(4): 11-22
- A.Karachunskiy, R.Herold, A. von Stackelberg, et al. Results of the first randomized multicentre trial on childhood acute lymphoblastic leukaemia in Russia. Leukemia, 2008; 22(6): 1144-1153
- Румянцева Ю.В., Карачунский А.И., Румянцев А.Г. Оптимизация терапии острого лимфобластного лейкоза у детей в России. Педиатрия, 2009; 87(4): 19-28
- Румянцева Ю.В., Карачунский А.И., Алейникова О.В. и др. Эффективность протокола ALL-МВ-2002 у детей с острым лимфобластным лейкозом. Терапевтический архив, 2010; 7: 11-20
- A Karachunskiy, J Roumiantseva, S Lagoiko et al. Efficacy and toxicity of dexamethasone vs methylprednisolone – long-term results in more than 1000 patients from the Russian randomized multicentric trial ALL-MB 2002. Leukemia, 2015; 29(9): 1955-1958
- M?ricke A., Zimmermann M., Reiter A. et al. Long-term results of five consecutive trials in childhood acute lymphoblastic leukemia performed by the ALL-BFM study group from 1981 to 2000. Leukemia, 2010; 24(2): 265-284
- Pui C-H., Campana D., Pei D., et al. Treating childhood acute lymphoblastic leukemia without cranial irradiation. N Engl J Med, 2009; 360(26): 2730-2741
- Schultz KR, Bowman WP, Aledo A, et al. Continuous dosing Imatinib with intensive chemotherapy gives equivalent outcomes to allogeneic BMT for Philadelphia chromosome-positive (Phю) acute lymphoblastic leukemia (ALL) with longer term follow up: Updated Results of Children’s Oncology Group (COG) AALL0031. Pediatr Blood Cancer, 2010; 54: 788.
- Leoni V, Biondi A. Tyrosine kinase inhibitors in BCR-ABL positive acute lymphoblastic leukemia. Haematologica, 2015; 100(3): 295-299
- Richards S., Gray R., Peto R., et al. Duration and intensity of maintenance chemotherapy in acute lymphoblastic leukemia: overview of 42 trials involving 12 000 randomised children Lancet, 1996; 347: 1783-1788
- Hill FG., Richards S., Gibson B. et al. Successful treatment without cranial radiotherapy of children receiving intensified chemotherapy for acute lymphoblastic leukemia: results of the risk-stratified randomized central nervous system treatment trial MRC UKALLXI (ISRC TN 16757172). Br J Haematol, 2004; 124: 33-46
- Баринкова ЕА., Донюш Е.К., Кузнецова Ю.В. и др. Диспансерное наблюдение детей с гематологическими заболеваниями в детской поликлинике. Методические рекомендации. Под ред. Румянцева А.Г., Финогеновой Н.А. ГОУ ВПО РГМУ им. Н.И.Пирогова, 2008
Приложение А1. Состав рабочей группы
- Карачунский А.И. – д.м.н., профессор, директор института онкологии, радиологии и ядерной медицины ФГБУ «Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева» МЗ РФ; профессор кафедры онкологии, гематологии и лучевой терапии п/ф ФГБОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И.Пирогова» МЗ РФ; член правления Национального общества детских гематологов и онкологов (НОДГО)
- Румянцев А.Г. – академик РАН, д.м.н., профессор, Генеральный директор ФГБУ «Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева» МЗ РФ; профессор кафедры онкологии, гематологии и лучевой терапии п/ф ФГБОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И.Пирогова» МЗ РФ; главный внештатный детский специалист гематолог; Президент Национального общества детских гематологов и онкологов (НОДГО), член правления Союза педиатров России.
- Румянцева Ю.В. – д.м.н., зав. отделом исследования лимфопролиферативных заболеваний ФГБУ «Федеральный научно-клинический центр детской гематологии, онкологии и иммунологии имени Дмитрия Рогачева» МЗ РФ; профессор кафедры онкологии, гематологии и лучевой терапии п/ф ФГБОУ ВО «Российский национальный исследовательский медицинский университет имени Н.И.Пирогова» МЗ РФ; член Национального общества детских гематологов и онкологов (НОДГО)
Конфликт интересов: отсутствует.
Приложение А2. Методология разработки клинических рекомендаций
Целевая аудитория данных клинических рекомендаций:
- Врачи-гематологи 14.01.21
- Врачи-онкологи 14.01.12
- Врачи-педиатры 14.01.08
Таблица П1 – Уровни достоверности доказательств
|
Уровень достоверности |
Источник доказательств |
|
I (1) |
Проспективные рандомизированные контролируемые исследования Достаточное количество исследований с достаточной мощностью, с участием большого количества пациентов и получением большого количества данных Крупные мета-анализы Как минимум одно хорошо организованное рандомизированное контролируемое исследование Репрезентативная выборка пациентов |
|
II (2) |
Проспективные с рандомизацией или без исследования с ограниченным количеством данных Несколько исследований с небольшим количеством пациентов Хорошо организованное проспективное исследование когорты Мета-анализы ограничены, но проведены на хорошем уровне Результаты не презентативны в отношении целевой популяции Хорошо организованные исследования «случай-контроль» |
|
III (3) |
Нерандомизированные контролируемые исследования Исследования с недостаточным контролем Рандомизированные клинические исследования с как минимум 1 значительной или как минимум 3 незначительными методологическими ошибками Ретроспективные или наблюдательные исследования Серия клинических наблюдений Противоречивые данные, не позволяющие сформировать окончательную рекомендацию |
|
IV (4) |
Мнение эксперта/данные из отчета экспертной комиссии, экспериментально подтвержденные и теоретически обоснованные |
Таблица П2 – Уровни убедительности рекомендаций
|
Уровень убедительности |
Описание |
Расшифровка |
|
A |
Рекомендация основана на высоком уровне доказательности (как минимум 1 убедительная публикация I уровня доказательности, показывающая значительное превосходство пользы над риском) |
Метод/терапия первой линии; либо в сочетании со стандартной методикой/терапией |
|
B |
Рекомендация основана на среднем уровне доказательности (как минимум 1 убедительная публикация II уровня доказательности, показывающая значительное превосходство пользы над риском) |
Метод/терапия второй линии; либо при отказе, противопоказании, или неэффективности стандартной методики/терапии. Рекомендуется мониторирование побочных явлений |
|
C |
Рекомендация основана на слабом уровне доказательности (но как минимум 1 убедительная публикация III уровня доказательности, показывающая значительное превосходство пользы над риском) или нет убедительных данных ни о пользе, ни о риске) |
Нет возражений против данного метода/терапии или нет возражений против продолжения данного метода/терапии Рекомендовано при отказе, противопоказании, или неэффективности стандартной методики/терапии, при условии отсутствия побочных эффектов |
|
D |
Отсутствие убедительных публикаций I, II или III уровня доказательности, показывающих значительное превосходство пользы над риском, либо убедительные публикации I, II или III уровня доказательности, показывающие значительное превосходство риска над пользой |
Не рекомендовано |
Порядок обновления клинических рекомендаций – пересмотр 1 раз в 3 года.
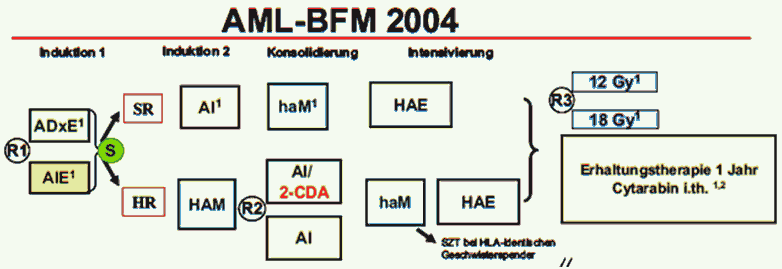
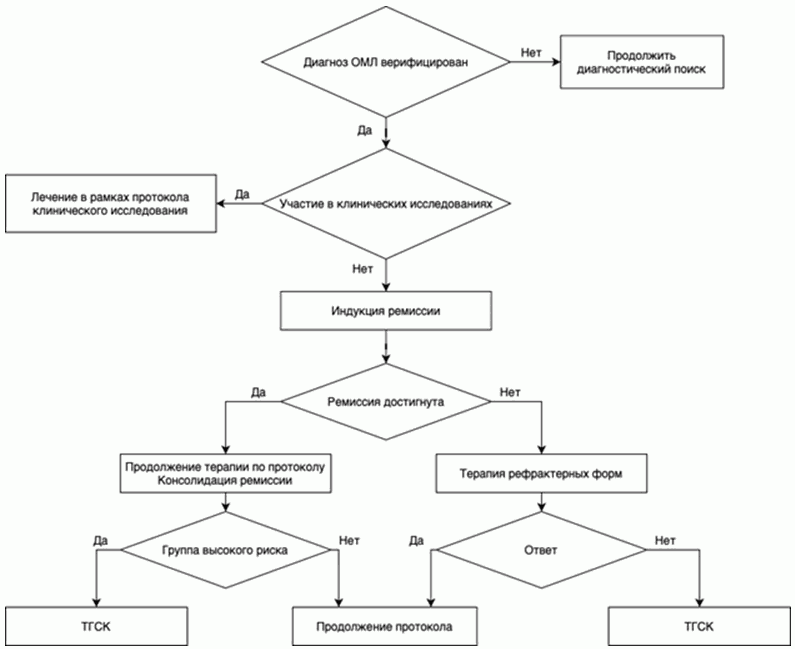
Приложение Б. Алгоритмы ведения пациента
Приложение В. Информация для пациентов
Лейкоз, или лейкемия – заболевание костного мозга, в обиходе иногда называемое «раком крови». При лейкозе нарушено нормальное кроветворение: производится избыточное количество аномальных незрелых клеток крови – предшественников лейкоцитов. Эти бластные клетки, размножаясь и накапливаясь в костном мозге, мешают выработке и функционированию нормальных клеток крови, что и обусловливает основные симптомы заболевания. Кроме того, эти опухолевые клетки могут накапливаться в лимфоузлах, печени, селезенке, центральной нервной системе и других органах, также вызывая появление специфических симптомов.
Острый лимфобластный лейкоз (ОЛЛ) – самый распространенный вид лейкоза у детей и подростков, на его долю приходится 75-80% всех опухолевых заболеваний кроветворной системы у детей (3-4 случая на 100 тысяч детей в год). Чаще всего ОЛЛ возникает в возрасте до 14 лет; пик детской заболеваемости приходится на возраст 2-5 лет. У мальчиков эта болезнь встречается чаще, чем у девочек. Термин «острый» означает быстрое развитие болезни, в противоположность хроническому лейкозу. Термин «лимфобластный» означает, что незрелые клетки, составляющие основу болезни, являются лимфобластами, то есть предшественниками лимфоцитов.
ОЛЛ характеризуется множеством различных признаков и у разных больных может проявляться по-разному. Большинство наблюдаемых симптомов, однако, обусловлено тяжелыми нарушениями кроветворения. Обычно наблюдаются слабость, бледность, снижение аппетита, потеря веса, учащенное сердцебиение (тахикардия) – проявления анемии и опухолевой интоксикации. Недостаток тромбоцитов проявляется мелкими кровоизлияниями на коже и слизистых оболочках, кровотечениями из десен, носовыми и кишечными кровотечениями, кровоподтеками, синяками. Из-за накопления бластных клеток часто увеличиваются лимфоузлы – в частности, шейные, подмышечные, паховые. Нередко увеличиваются также печень и селезенка. Дефицит полноценных лейкоцитов приводит к ослаблению иммунитета, развиваются частые инфекции с высокой температурой.
Распространяясь по организму, лейкемические клетки приводят не только к изменениям в составе крови. Так как лейкозные клетки заполняют костные полости и костный мозг, то появляются боли в костях и суставах, иногда возникают патологические (то есть вызванные заболеванием) переломы костей. Опухолевые клетки могут скапливаться в печени, селезенке и лимфатических узлах; могут наблюдаться боли в животе. В некоторых случаях ОЛЛ вызывает изменения и в других органах: глазах, почках, яичках у мальчиков и яичниках у девочек, причем у мальчиков поражение половых органов наблюдается чаще. Нередко возникает поражение центральной нервной системы – нейролейкемия.
Так как все наблюдаемые симптомы могут быть связаны и с другими заболеваниями и не специфичны для ОЛЛ, перед началом лечения необходима лабораторная диагностика, которая в срочном порядке производится в больничных условиях.
При ОЛЛ возникают изменения в обычном клиническом анализе крови: могут быть понижены уровни эритроцитов и тромбоцитов, появляются бластные клетки, может быть увеличено количество лейкоцитов. Но для окончательной диагностики необходимо получить клетки костного мозга, для этой цели необходима костномозговая пункция.
При морфологическом исследовании диагноз «острый лимфобластный лейкоз» ставится при обнаружении более 25% бластных клеток в костном мозге. Но обязательно производятся более тонкие исследования: цитохимическое (окрашивание клеток, позволяющее более точно установить их природу), цитогенетическое (изучение строения хромосом в лейкемических клетках), иммунофенотипирование (изучение белковых молекул на поверхности клеток). Дело в том, что важно не только диагностировать ОЛЛ, но и определить конкретный вариант ОЛЛ. Это важное условие для планирования терапии.
Как только диагноз лейкоза поставлен, для планирования терапии необходимо выяснить, насколько в процесс вовлечены другие органы, кроме костного мозга. Более точную информацию дают такие методы диагностики как ультразвуковое и рентгеновское исследование, магнитно-резонансная и компьютерная томография и др.
В ходе диагностики ОЛЛ также необходимо исследовать состояние центральной нервной системы. Анализ спинномозговой жидкости (ликвора) позволяет определить, нет ли у больного поражения центральной нервной системы – нейролейкемии. Образец ликвора для анализа получают посредством пункции спинномозгового канала (люмбальная пункция).
Перед лечением (и в процессе) у ребенка проверяют, как работает сердце (ЭКГ и ЭхоКГ) и головной мозг (электроэнцефалограмма). Комплексные лабораторные исследования помогают объективно оценить состояние ребенка и обнаружить нарушения обмена веществ или функций каких-либо органов. Эти изменения обязательно учитываются во время лечения. Для возможно необходимых переливаний крови устанавливают группу крови пациента.
Центральное место в лечении ОЛЛ занимает химиотерапия. У некоторых пациентов дополнительно облучается центральная нервная система и/или проводится трансплантация стволовых клеток. Цель лечения – по возможности полностью уничтожить лейкемические клетки во всем организме. Интенсивность и продолжительность химиотерапии, необходимость лучевой терапии и трансплантации, а также прогноз зависят от типа лейкоза, различных факторов и ответа на терапию.
Химиотерапия – это лечение медикаментами (цитостатики), которые блокируют деление клеток или убивают опухолевые клетки. Для наиболее эффективного лечения применяют различные комбинации препаратов.
Современное лечение ОЛЛ основано на разделении пациентов на группы риска, от которой зависят прогноз заболевания и планируемое лечение. Так, говорят о стандартном риске, высоком риске и т.д. Отнесение к той или иной группе зависит от многих факторов. Соответственно, пациенты, относящиеся к группам более высокого риска (то есть те, у кого изначальный прогноз хуже), получают более интенсивную терапию, а в группах более низкого риска можно использовать менее интенсивную терапию и тем самым избегать излишней токсичности и тяжелых осложнений.
Терапия ОЛЛ, как правило, состоит из трех этапов:
- Индукция ремиссии – это начальный этап интенсивной химиотерапии, цель которого уничтожить за короткое время максимально возможное число лейкозных клеток и достичь ремиссии. Лечение длится приблизительно 6-7 недель. Под ремиссией подразумевается содержание менее 5% бластных клеток в костном мозге и отсутствие их в крови в сочетании с признаками восстановления нормального кроветворения. Индукция позволяет достигнуть ремиссии более чем у 95% детей.
- Консолидация (закрепление) ремиссии направлена на уничтожение остаточных аномальных бластных клеток во избежание рецидива заболевания. Общая продолжительность этого этапа составляет несколько месяцев и сильно зависит от конкретного протокола лечения.
Существует также понятие реиндукции: это периодически повторяемые уже после достижения ремиссии циклы, аналогичные используемым при индукции. Реиндукция позволяет дополнительно снизить число лейкемических клеток и тем самым повысить «надежность» ремиссии.
- Поддерживающая терапия проводится для поддержания ремиссии, то есть для дополнительного снижения риска рецидива после этапов индукции и консолидации. На этом этапе назначаются невысокие дозы химиопрепаратов. Особенность заключается в том, что терапия проводится длительное время и непрерывно – до достижения 2 лет от начала лечения.
На этапах индукции и консолидации введение химиотерапевтических препаратов производится в основном внутривенно и внутримышечно, в условиях больничного стационара или стационара одного дня. Поддерживающая терапия представляет собой этап наименее интенсивного лечения, пребывание в больнице при этом не требуется (за исключением периода реиндукций).
Для лечения и профилактики нейролейкемии на перечисленных этапах химиопрепараты должны вводиться интратекально, то есть в спинномозговой канал посредством люмбальных пункций. Иногда лекарства вводят в желудочки (особые полости) головного мозга через специальный резервуар Оммайя, который устанавливается под кожей головы. У некоторых пациентов используется и облучение головы – краниальное облучение.
В ходе лечения ОЛЛ может применяться трансплантация костного мозга от родственного или неродственного донора. Если по плану лечения предусмотрена трансплантация, то ее проводят после достижения ремиссии. Как правило, трансплантация показана только при высоком риске, поскольку вероятность хорошего ответа на стандартную терапию при ОЛЛ в среднем высока, особенно у детей.
К сожалению, несмотря на все перечисленные меры, иногда возникает рецидив ОЛЛ – костномозговой, экстрамедуллярный (то есть вне костного мозга – например, с поражением центральной нервной системы или яичек) или комбинированный. В этом случае проводится противорецидивная терапия.
Химиотерапия ОЛЛ высокоэффективна, но зачастую тяжело переносится и может быть связана с серьезными побочными эффектами. Так, в процессе лечения подавляется кроветворение и бывают необходимы переливания компонентов донорской крови – тромбоцитов во избежание кровотечений при очень низком уровне собственных тромбоцитов больного, эритроцитов для борьбы с анемией. Переливания донорских лейкоцитов (гранулоцитов) применяются только в редких случаях при тяжелых инфекционных осложнениях.
В числе побочных эффектов химиотерапии можно также назвать тошноту, рвоту, выпадение волос. У каждого из цитостатиков есть свои побочные эффекты. Чаще всего они возникают временно, но иногда сопровождают весь курс лечения.
Серьезная проблема связана с возможностью аллергических реакций на химиопрепараты, вплоть до анафилактического шока – жизнеугрожающего состояния, которое характеризуется отеком, затруднением дыхания, сильным зудом и т.д. Так, сравнительно часто встречается аллергия на аспарагиназу, и может быть необходимо использование аналогов этого препарата.
Поскольку и лейкоз сам по себе, и используемая при его лечении химиотерапия резко снижают сопротивляемость организма различным инфекциям, то больным во время лечения необходимы эффективные антибактериальные и противогрибковые лекарства для профилактики и терапии инфекционных осложнений.
Интенсивное лечение ОЛЛ накладывает серьезные ограничения на образ жизни больного. Необходимо соблюдать определенную диету и строгие гигиенические требования. Во избежание инфекций ограничиваются контакты с внешним миром. При очень низком уровне тромбоцитов нельзя не только допускать травмы, но даже, например, чистить зубы зубной щеткой — чтобы не спровоцировать кровотечение из десен. После достижения ремиссии строгость этих ограничений постепенно снижается. Врачи и медсестры сообщают каждому больному, что ему можно и что нельзя на текущем этапе лечения.
Без лечения ОЛЛ приводит к гибели больного в течение нескольких месяцев или даже недель. Однако использование современных протоколов лечения дает при ОЛЛ очень хороший результат: можно вылечить около 80% больных детей (некоторые источники приводят и более высокие цифры — например, до 85%).
МИНИСТЕРСТВО ЗДРАВООХРАНЕНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
КЛИНИЧЕСКИЕ РЕКОМЕНДАЦИИ
ОСТРЫЕ МИЕЛОИДНЫЕ ЛЕЙКОЗЫ
Кодирование по Международной статистической классификации болезней и проблем, связанных со здоровьем: C92.0, C92.3, C92.5, C92.6, C92.7, C92.8, C92.9, C93.0, C94.0, C94.2
Год утверждения (частота пересмотра): 2020
Возрастная категория: Дети
Год окончания действия: 2022
ID: 586
Разработчик клинической рекомендации
— Национальное общество детских гематологов, онкологов
Одобрено Научно-практическим Советом Минздрава РФ
Список сокращений
алло-ТГСК — трансплантация аллогенных гемопоэтических стволовых клеток
алло-ТКМ — трансплантация аллогенного костного мозга
АЛТ — аланинаминотрансфераза
АСТ — аспартатаминотрансфераза
ауто-ТГСК — трансплантация аутологичных стволовых гемопоэтических клеток
ауто-ТКМ — трансплантация аутологичного костного мозга
БЛРС — бета-лактамазы расширенного спектра
ВДЦ — высокие дозы цитарабина
ВИЧ — вирус иммунодефицита человека
ВОЗ — Всемирная организация здравоохранения
ДНК — дезоксирибонуклеиновая кислота
ЖКТ — желудочно-кишечный тракт
ИА — инвазивный аспергиллез
ИФТ — иммунофенотипическое исследование
КМ — костный мозг
КИ — клинические исследования
КТ — компьютерная томография
ЛДГ — лактатдегидрогеназа
МДС — миелодиспластический синдром
МДЦ — малые дозы цитарабина
МОБ — минимальная остаточная болезнь
МП — меркаптопурин
МПЗ — миелопролиферативное заболевание
МС — миелоидная саркома
ОЛ — острый лейкоз
ОЛЛ — острый лимфобластный лейкоз
ОЛСФ — острый лейкоз смешанного фенотипа
ОМЛ — острый миелоидный лейкоз
ОПЛ — острый промиелоцитарный лейкоз
ПР — полная ремиссия
ПЦР — полимеразная цепная реакция
РКИ — рандомизированное клиническое исследование
РНК — рибонуклеиновая кислота
РТПХ — реакция «трансплантат против хозяина»
ТКМ — трансплантация костного мозга
УДД — уровень достоверности доказательств
УЗИ — ультразвуковое исследование
УУР — уровень убедительности рекомендаций
ХТ — химиотерапия
ЦМВ — цитомегаловирус
ЦНС — центральная нервная система
ЭКГ — электрокардиография
Эхо-КГ — эхо-электрокардиография
FAB классификация — французско-американско-британская классификация
FISH — флюоресцентная in situ гибридизация
NCCN — Национальная общественная противораковая сеть
** — жизненно необходимые и важнейшие лекарственные препараты
# — препарат, применяющийся не в соответствии с показаниями к применению и противопоказаниями, способами применения и дозами, содержащимися в инструкции по применению лекарственного препарата (офф-лейбл)
Термины и определения
Острые миелоидные лейкозы (ОМЛ) — клональные опухолевые заболевания кроветворной ткани, связанные с мутацией в клетке-предшественнице гемопоэза, следствием которой становится блок дифференцировки и бесконтрольная пролиферация незрелых миелоидных клеток [1, 2].
Оценка эффективности терапии:
Полной ремиссией ОМЛ принято называть состояние кроветворной ткани, при котором в пунктате костного мозга обнаруживается 5% и менее бластных клеток при нормальном соотношении всех ростков кроветворения, отсутствуют бластные клетки с палочками Ауэра и экстрамедуллярные очаги, при количестве нейтрофилов в периферической крови 31,0 x 109/л, при количестве тромбоцитов 3100 x 109/л, при отсутствии экстрамедуллярных очагов лейкемического роста. Указанные показатели должны сохраняться в стабильном состоянии в течение 1 месяца и более. Устанавливается при отсутствии данных о статусе МОБ. Оценивается после курса индукции.
Полная ремиссия (ПР) с отсутствием минимальной остаточной болезни (МОБ) (МОБ-ПР) — полная ремиссия с отсутствием в пунктате костного мозга обнаруженного в дебюте ОМЛ генетического маркера (методом ПЦР) или клеток с аберрантным иммунофенотипом (методом проточной цитометрии).
Минимальная остаточная болезнь (МОБ) — это небольшая популяция опухолевых клеток, которая не может быть зафиксирована с помощью светового микроскопа, но обнаруживается более тонкими методами исследования, выявляющими 1 лейкемическую клетку на 104 — 6 исследуемых.
ПР с неполным восстановлением — полная ремиссия при сохраняющейся нейтропении (< 1 x 109/л) или тромбоцитопении (< 100 x 109/л).
Неудачи в лечении:
Резистентная форма — отсутствие полной ремиссии (смотри определение выше) после проведения блока индукции (AME/ADE/AIE).
При бластозе менее 15% и отсутствии однозначных признаков наличия лейкемических бластов (например, палочек Ауэра) необходимо подтверждение рефрактерности с помощью ИФТ или цитогенетических/молекулярных маркеров.
Рецидив — более 10% лейкемических бластов в костном мозге или любое экстрамедуллярное поражение не менее чем через 1 месяц после установления первой полной клинико-гематологической ремиссии. Учитывая возможность ложной диагностики рецидива на основании повышения содержания гематогонов, необходимо соотнесение бластоза, «титра» выявленного молекулярного маркера и иммунофенотипирования.
Молекулярный/иммунологический рецидив — выявление МОБ методом проточной цитометрии и/или ПЦР в последовательном двухкратном исследовании с интервалом не менее 2-х недель, при условии анализа аберрантного иммунофенотипа или выполнения молекулярного исследования до начала терапии.
Нейролейкоз — любое количество бластов в цитопрепарате, необъяснимое контаминацией ликвора периферической кровью; и/или симптомы поражения черепно-мозговых нервов или иная неврологическая симптоматика, связанная с хлоромным ростом. Интракраниальные и интраспинальные эпидуральные «хлоромы» при отсутствии лейкемических клеток в ликворе не считаются нейролейкозом. Градация статуса ЦНС поражения определяется протоколом терапии.
Индукция ремиссии — период начального лечения, целью которого является максимально быстрое и существенное сокращение опухолевой массы и достижение ПР (обычно 1 — 2 курса). Именно в этот период на фоне применения цитостатических средств количество лейкемических клеток в костном мозге уменьшается примерно в 100 раз, т.е. в момент констатации ПР в костном мозге морфологически определяется менее 5% опухолевых клеток.
Консолидация ремиссии — вторым этапом терапии ОМЛ является закрепление достигнутого противоопухолевого эффекта (обычно 2 — 3 курса). В настоящее время в большинстве случаев консолидация является наиболее агрессивным и высокодозным этапом при лечении ОМЛ. Задачей этого периода является по возможности еще большее уменьшение числа остающихся после индукции лейкемических клеток.
Поддерживающее лечение — продолжение цитостатического воздействия в меньших дозах, чем в период индукции/консолидации ремиссии, или иного — таргетного — воздействия на возможно остающийся опухолевый клон.
Профилактика или, при необходимости, лечение нейролейкемии — этот этап распределяется на все периоды программного лечения — индукцию ремиссии, консолидацию и поддерживающее лечение.
Трансплантация костного мозга (ТКМ) — под этим термином объединены трансплантация гемопоэтических стволовых клеток костного мозга периферической крови и пуповинной (плацентарной) крови.
1. Краткая информация по заболеванию или состоянию (группе заболеваний или состояний)
1.1 Определение заболевания или состояния (группы заболеваний или состояний)
Острый миелоидный лейкоз — это клональное опухолевое заболевание кроветворной ткани, связанное с мутацией в клетке-предшественнице гемопоэза, следствием которой становится блок дифференцировки и бесконтрольная пролиферация незрелых миелоидных клеток [1].
1.2 Этиология и патогенез заболевания или состояния (группы заболеваний или состояний)
ОМЛ является следствием повреждения — мутации — в генетическом материале клоногенной кроветворной клетки. В результате этого происходит нарушение контроля за клеточным циклом, изменение процесса транскрипции и продукции ряда ключевых белков. Вследствие бесконтрольной пролиферации в отсутствие дифференцировки происходит накопление патологических клеток. Тот факт, что патогенез острых лейкозов связан с генетическими поломками, довольно часто подтверждается обнаружением различных хромосомных аберраций (транслокаций, делеций, инверсий и т.д.). В большинстве случаев конкретная причина возникновения ОМЛ остается неизвестной. Однако существует несколько предрасполагающих факторов, которые значительно увеличивают риск развития этого заболевания. Четко доказанная взаимосвязь между ионизирующей радиацией при взрыве атомной бомбы, а также химио- и радиотерапией по поводу других опухолей с повышенным риском возникновения острых лейкозов заставила изучить другие возможные лейкемогенные факторы (низкие дозы радиации, химические вещества, курение, электромагнитные волны). Доказано, что между курением и риском развития острого лейкоза существует дозовая зависимость, которая особенно очевидна для лиц старше 60 лет. Ряд исследователей предполагает, что около 20% ОМЛ являются следствием курения. Бензол при длительном воздействие на организм человека дает лейкемогенный эффект, но при небольших концентрациях этого вещества, с которыми чаще всего сталкиваются люди на производстве, не доказана взаимосвязь с повышенным риском возникновения ОМЛ. При изучении постоянного воздействия малых доз радиации пока не получено доказательств в пользу увеличения частоты заболеваемости ОЛ. Впервые взаимосвязь между предшествующей ХТ, лучевым лечением каких-либо других опухолевых заболеваний и увеличенным риском развития ОМЛ была отмечена у пациентов, излеченных от лимфомы Ходжкина. Доказано, что не столько кумулятивная доза, сколько интенсивность дозового воздействия обусловливает повышение частоты заболеваемости ОМЛ. Риск развития вторичного ОМЛ наиболее высок в период от 2 до 9 лет после завершения предшествующей ХТ. В 85% случаев вторичные лейкозы возникают в сроки до 10 лет от окончания лечения [3, 4]. Этиология и специфические факторы, приводящие к развитию вторичных миелоидных опухолей, полностью не изучены. В патогенез вовлечены многие генетические пути и кооперативные мутации. «Вторичные» ОМЛ, ассоциированные с применением алкилирующих агентов, часто дебютируют с миелодиспластического синдрома (МДС) с моносомией или частичной делецией хромосом 5 и 7. Этот тип ОМЛ возникает относительно поздно, в среднем через 5 — 7 лет после лечения первичной опухоли.
Вероятность развития лейкозов увеличивается при следующих генетически обусловленных заболеваниях: врожденная агаммаглобулинемия, синдром Швахмана-Даймонда, атаксия-телеангиоэктазия, синдром Луи-Фраумени, нейрофиброматоз, анемия Даймонда-Блекфана, тяжелая врожденная нейтропения, анемия Фанкони, синдром Дауна, синдром Блума.
1.3 Эпидемиология заболевания или состояния (группы заболеваний или состояний)
Считается, что ОМЛ заболевает в среднем 3 — 5 человек на 100 тыс. населения в год. При этом заболеваемость резко возрастает в возрасте старше 60 лет и составляет 12 — 13 человек на 100 тыс. у людей в возрасте старше 80 лет. Медиана возраста этого заболевания составляет 65 лет. Эпидемиология ОМЛ среди детского населения в Российской Федерации изучена недостаточно. Острый миелоидный лейкоз встречается в 20% от всех острых лейкозов у детей, составляет 6% от всех опухолей у детей. Новые случаи ОМЛ составляют 0,7 — 1,2 / 100 000 в год [1, 5].
1.4 Особенности кодирования заболевания или состояния (группы заболеваний или состояний) по Международной статистической классификации болезней и проблем, связанных со здоровьем
C92.0 Острый миелоидный лейкоз
Исключение: обострение хронического миелоидного лейкоза (C92.1)
C92.3 Миелоидная саркома (хлорома, гранулоцитарная саркома)
C92.5 Острый миеломоноцитарный лейкоз
C92.6 Острый миелоидный лейкоз с 11q23-аномалией
C92.7 Другой миелоидный лейкоз
C92.8 Острая миелоидная лейкемия с мультилинейной дисплазией
C92.9 Миелоидный лейкоз неуточненный
C93.0 Острый моноцитарный лейкоз
C94.0 Острая эритремия и эритролейкоз
C94.2 Острый мегакариобластный лейкоз
1.5 Классификация заболевания или состояния (группы заболеваний или состояний)
Перечень вариантов ОМЛ и других опухолей с миелоидной дифференцировкой (ВОЗ, 2016) [6, 7]:
Классификация ВОЗ (2016) подразделяет все ОМЛ, основываясь на их цитогенетических и молекулярно-генетических особенностях, и именно эти особенности формируют клинико-патологические группы:
ОМЛ с устойчиво выявляемыми генетическими аномалиями
ОМЛ с t(8;21)(q22;q22); RUNX1-RUNX1T1
ОМЛ с inv(16)(p13.1q22) or t(16;16)(p13.1;q22); CBFB-MYH11
ОПЛ с t(15;17)(q22;q12); PML-RARA
ОМЛ с t(9;11)(p22;q23); MLLT3-MLL
ОМЛ с t(6;9)(p23;q34); DEK-NUP214
ОМЛ с inv(3)(q21q26.2) or t(3;3)(q21;q26.2); RPN1-EVI1
ОМЛ (мегакариобластный) с t(1;22)(p13;q13); RBM15-MKL1
ОМЛ с BCR/ABL1 <*>
ОМЛ с генными мутациями <*>:
ОМЛ с мутированным геном NPM1 <*>
ОМЛ с биаллельной мутацией гена CEBPA <*>
ОМЛ с мутированным геном RUNX1 <*>
ОМЛ с изменениями, связанными с миелодисплазией
Миелоидные неоплазии, связанные с предшествующей ХТ
ОМЛ, по-другому не специфицированные (NOS)
Острый миелобластный лейкоз с минимальной дифференцировкой
Острый миелобластный лейкоз без созревания
Острый миелобластный лейкоз с созреванием
Острый миеломонобластный лейкоз
Острый монобластный/моноцитарный лейкоз
Острый эритромиелоз
Острый мегакариобластный лейкоз
Острый лейкоз из базофилов
Острый панмиелоз с миелофиброзом (син.: острый миелофиброз; острый миелосклероз)
Миелоидная саркома (син.: экстрамедуллярная миелоидная опухоль; гранулоцитарная саркома; хлорома)
Миелоидные опухоли, связанные с синдромом Дауна
Транзиторный аномальный миелопоэз (син.: транзиторное МПЗ)
Миелоидный лейкоз, связанный с синдромом Дауна
Опухоль из плазмацитоидных дендритных клеток
Острые лейкозы неопределенной линии дифференцировки
Острый недифференцированный лейкоз
Острый лейкоз смешанного фенотипа с t(9;22)(q34;q11.2); BCR-ABL1
Острый лейкоз смешанного фенотипа с t(v;11q23.3); реарранжировка гена KMT2A (ранее — MLL)
Острый лейкоз смешанного фенотипа, B/миелоидный, NOS
Острый лейкоз смешанного фенотипа, T/миелоидный, NOS
Острый лейкоз смешанного фенотипа NOS <*>
Острые лейкозы неопределенной линии дифференцировки NOS <*>
———————————
<*> новые группы, введенные в классификацию ВОЗ в 2016 г.
Подгруппа «ОМЛ с устойчиво выявляемыми хромосомными аномалиями» объединяет несколько вариантов ОМЛ:
«ОМЛ с t(8;21)(q22;q22); RUNX1-RUNX1T1»
«ОМЛ с inv(16)(p13.1q22) или t(16;16)(p13.1;q22); CBFB-MYH11» (при выявлении указанных хромосомных перестроек, несмотря на число бластных клеток в пунктате костного мозга, всегда устанавливают диагноз острого миелоидного лейкоза).
«ОПЛ с t(15;17)(q22;q12); PML-RARA»; транслокации RARA с другими партнерами выделяются в отдельные формы ОМЛ, например, ОМЛ с t(11;17)(q23;q12); ZBTB16-RARA; ОМЛ с t(11;17)(q13;q12); NUMA1-RARA; ОМЛ с t(5;17)(q35;q12); NPM1-RARA; ОМЛ с STAT5BRARA.
Ранее выделяемая категория «ОМЛ с аномалиями 11q23 (MLL)» была переведена в категорию «ОМЛ с t(9;11)(p22;q23); MLLT3-MLL»; другие транслокации, отличающиеся от тех, что включают MLLT3, должны быть отдельно указаны в диагнозе, например ОМЛ с t(6;11)(q27;q23); MLLT4-MLL; ОМЛ с t(11;19)(q23;p13.3); MLLMLLT1; ОМЛ с t(11;19)(q23;p13.1); MLL-ELL; ОМЛ с t(10;11)(p12;q23); MLLT10-MLL.
Были выделены три новых подгруппы: «ОМЛ с t(6;9)(p23;q34); DEK-NUP214», «ОМЛ с inv(3)(q21q26.2) or t(3;3)(q21;q26.2); RPN1-EVI1» и «ОМЛ (мегакариобластный) с t(1;22)(p13;q13); RBM15-MKL1», редкий вариант ОЛ, наиболее часто диагностируемый у детей.
У пациентов ОМЛ с нормальным кариотипом были выделены две новые категории: «ОМЛ с мутированным геном NPM1 (нуклеофозмин (ядерный фосфопротеин B23, нуматрин))» и «ОМЛ с мутированным геном CEBPA (белок, связывающий энхансер CCAAT альфа (CCAAT/enhancer binding protein (C/EBP) alpha))». Накапливается все больше доказательств в пользу того, что эти мутации определяют нарушения дифференцировки гемопоэтических клеток и относятся к так называемым мутациям 2-го класса.
Мутации в гене fms-связанной тирозинкиназы 3 (fms-related tyrosine kinase, FLT3) обнаруживают при многих вариантах ОМЛ и их относят к мутациям 1-го класса, т.е. к тем, которые определяют преимущество опухолевых клеток в пролиферации и/или выживании. ОМЛ с мутациями FLT3 не выделяются в отдельную категорию, однако необходимо определять эти мутации, так как они имеют прогностическую значимость. Рекомендуется не только определять наличие FLT3-ITD, но и определять так называемое аллельное соотношение, которое характеризует объем опухоли. Аллельное соотношение считается высоким при значениях, равных и более 0,5, и низким — при значениях менее 0,5. Прогностическую значимость имеют высокие значения.
Ранее выделяемая подгруппа «ОМЛ с мультилинейной дисплазией» в классификации ВОЗ (2016) определяется как «ОМЛ с изменениями, связанными с миелодисплазией». ОМЛ могут относиться к категории «ОМЛ с изменениями, связанными с миелодисплазией», если:
1) 3 20% бластных клеток в костном мозге или периферической крови;
2) существует предшествующая история МДС или иного миелопролиферативного заболевания (МПЗ);
3) существуют цитогенетические аномалии, ассоциированные с миелодисплазией:
а — комплексный кариотип (3 хромосомных аномалии и более);
б — несбалансрованные перестройки: -7 или del(7q); -5 или del(5q); i(17q) или t(17p); -13 или del(13q); del(11q); del(12p) or t(12p); del(9q); idic(X)(q13);
в — сбалансированные перестройки (транслокации): t(11;16)(q23;p13.3); t(3;21)(q26.2;q22.1); t(1;3)(p36.3;q21.1); t(2;11)(p21;q23); t(5;12)(q33;p12); t(5;7)(q33;q11.2); t(5;17)(q33;p13); t(5;10)(q33;q21); t(3;5)(q25;q34).
4) мультилинейная дисплазия;
5) отсутствуют «устойчиво выявляемые хромосомные аномалии»;
6) ранее не проводилась ХТ по поводу другого заболевания.
ОМЛ, как другие миелоидные опухоли, возникшие вследствие ранее проводимой ХТ по поводу других заболеваний, в отдельную форму ОМЛ не выделяются.
Прогностические факторы
У детей обусловлены биологическими характеристиками лейкемического клона.
Факторы прогноза, связанные с заболеванием (ОМЛ)
Факторы, связанные с заболеванием и влияющие на результаты терапии, следует анализировать на всех этапах лечения. Это обусловлено тем, что лейкоз-ассоциированные факторы прогноза позволяют оценить объем опухолевой массы, чувствительность бластных клеток к цитостатическим препаратам, скорость элиминации лейкемических клеток и объем МОБ.
Прежде всего, необходимо учитывать такие вполне доступные клинико-гематологические параметры, ассоциированные с неблагоприятным течением ОМЛ, как лейкоцитоз выше 100 x 109/л, недостижение полной ремиссии после первого индукционного курса.
Одним из важнейших факторов прогноза, сопряженных с ОМЛ, является кариотип лейкемических клеток. Исследование кариотипа необходимо проводить в обязательном порядке всем пациентам с подозрением на ОМЛ. Данные цитогенетического исследования позволяют верифицировать ОМЛ в случаях, когда принципиальным является не количество бластных клеток (меньше или больше 20%), а обнаружение характерных хромосомных аберраций. Речь идет, в частности, о так называемом CBF (Core Binding Factor) ОМЛ, который объединяет случаи с транслокацией t(8;21) и инверсией inv(16), независимо от отсутствия или наличия дополнительных хромосомных аберраций.
Помимо этого, на основании изучения кариотипа представляется возможным стратифицировать пациентов ОМЛ на 3 основные группы: благоприятного, промежуточного и неблагоприятного прогноза (см. Приложение Г2). Подразделение пациентов ОМЛ на эти группы целесообразно с точки зрения выбора тактики постремиссионной терапии: применение цитарабина в высоких дозах (ВДЦ), использование трансплантации аллогенных стволовых гемопоэтических клеток (алло-ТГСК). В последнее время ряд российских и американских экспертов пациентам с неблагоприятными аномалиями кариотипа вообще не рекомендуют стандартную химиотерапию вследствие ее низкой эффективности, а предлагают иные низкодозные и таргетные воздействия с первого курса индукции [8].
Следует отметить, что у половины пациентов с ОМЛ определяется нормальный кариотип лейкемических клеток. Это может служить основанием в ряде случаев для проведения FISH-исследования или молекулярно-генетических исследований с целью поиска отдельных химерных генов или поломок кариотипа, ассоциированных с определенным клинико-гематологическим фенотипом ОМЛ и прогнозом: RUNX1-RUNX1T1 (t(8;21)), CBFB-MYH11 (inv16), PML-RARa (t(15;17)), MLLT3-MLL (t(9;11)), DEK-NUP214, моносомии 5, 7, инверсии 3 хромосомы и ряда других.
Вместе с тем, необходимым является и поиск у пациентов с ОМЛ с нормальным кариотипом мутаций отдельных генов с установленным прогностическим потенциалом. Молекулярно-генетическая стратификация пациентов ОМЛ на группы риска представлена в Приложении Г2.
Факторы прогноза, связанные с неадекватной ХТ
В РФ, к сожалению, существует такой фактор неблагоприятного прогноза как неадекватное цитостатическое воздействие в период индукции/консолидации (уменьшение расчетных доз цитостатических препаратов и значительное удлинение интервалов между курсами), или неадекватная предлеченность. Еще в начале 1970-х годов, на первых этапах становления ХТ ОМЛ американскими исследователями было доказано, что эффективность программы «5 + 2» статистически значимо хуже, чем программы «7 + 3». Более 20 лет назад в Российских исследованиях было продемонстрировано, что уменьшение доз антрациклиновых антибиотиков и цитарабина в классической программе «7 + 3» приводит к существенному ухудшению показателей общей и безрецидивной выживаемости [3].
Без молекулярно-генетических исследований, выполненных в дебюте заболевания, современное лечение ОМЛ невозможно.
1.6 Клиническая картина заболевания или состояния (группы заболеваний или состояний)
В основном клинические проявления связаны с замещением нормальной гемопоэтической ткани опухолевыми клетками (анемия, тромбоцитопения, гранулоцитопения), инфильтрацией ими различных органов и продукцией различных цитокинов [9]. Дебют ОМЛ может быть острым со значительным повышением температуры тела, резкой слабостью, интоксикацией, кровоточивостью, тяжелыми инфекциями. Однако нередко диагноз устанавливают случайно при профилактическом осмотре или в случае госпитализации по другой причине.
При объективном обследовании может не наблюдаться никаких симптомов. Но довольно часто выявляется увеличение периферических лимфатических узлов, печени, селезенки (что наиболее характерно для моно- и миеломонобластного лейкоза), гиперплазия десен (при миеломоно- и монобластных вариантах), инфильтрация кожи (при миеломоно- и монобластных вариантах), геморрагический синдром различной степени тяжести — от петехиальных высыпаний до тяжелых кровотечений, боли в костях, артралгии, неврологическая симптоматика (менингеальные знаки — головная боль, ригидность затылочных мышц, симптом Кернига, парез лицевого, глазодвигательного и других нервов, парезы нижних конечностей и т.д.). В анализах крови могут быть неспецифические изменения: трехростковая цитопения, или анемия, или только лейкопения или лейкоцитоз, или тромбоцитопения. Бластные клетки могут не определяться в анализе периферической крови и, наоборот, составлять 90 — 95% всех лейкоцитов. Количество лейкоцитов также варьирует от менее 1,0 до 200 — 300 x 109/л. Примерно в 15% случаев в дебюте заболевания определяется лейкоцитоз более 100 x 109/л.
Дифференциальная диагностика ОМЛ проста, поскольку, если есть его морфологическое подтверждение (бластные клетки в пунктате и/или в периферической крови), диагноз очевиден. Трудности возникают на первых этапах — при анализе мазков периферической крови, когда бластных клеток нет. Увеличение числа лейкоцитов со сдвигом формулы влево при различных инфекционных процессах, а также тромбоцитопения, анемия и геморрагический синдром при тяжелых инфекциях и сепсисе могут вызывать сомнения в диагнозе ОЛ, но в таких случаях никогда не обнаруживаются типичные бластные клетки. Нередко требуется дифференциальная диагностика с инфекционным мононуклеозом и некоторыми другими вирусными инфекциями, тем более что клиническая симптоматика (повышение температуры тела, боли в горле, увеличение лимфатических узлов, печени, селезенки) может напоминать таковую при ОЛ. Дифференциальный диагноз должен проводиться со следующими заболеваниями: другие острые лейкозы: острый лимфобластный лейкоз, острый бифенотипический лейкоз, миелодиспластический синдром, ювенильные миеломоноцитарный лейкоз, лейкемиодные реакции, апластическая анемия; злокачественные новообразования негематологической природы (нейробластома, рабдомиосаркома), особенно при наличии экстрамедуллярных поражений, с бластным кризом хронического миелолейкоза (присутствие филадельфийской хромосомы не всегда помогает, так как этот маркер может обнаруживаться и при впервые диагностированных острых лейкозах).
Особого внимания заслуживают внекостномозговые проявления ОЛ, особенно нейролейкемия, которая может определяться и в момент диагностики ОЛ. Возникновение нейролейкемии обусловлено метастазированием лейкозных клеток в паутинную и мягкую мозговые оболочки головного и спинного мозга. В ряде случаев наблюдается лейкозная инфильтрация периферических нервов с разнообразными двигательными и чувствительными нарушениями, или обнаруживается очаговое поражение вещества головного мозга. Нейролейкемия характеризуется менингеальным и гипертензивным синдромом: отмечается постоянная головная боль, возможна рвота, вялость, выявляется отек дисков зрительных нервов, может быть нистагм, косоглазие, другие признаки поражения черепно-мозговых нервов, выявляется ригидность затылочных мышц, симптом Кернига. При ОМЛ нейролейкемия довольно редка в дебюте болезни, тем не менее встречается при миеломоно- и монобластных вариантах, особенно при тех формах лейкозов, когда обнаруживают поломку 16 хромосомы — inv(16) (у 30% таких пациентов при отсутствии профилактики возникает нейролейкемия). При ОМЛ к экстрамедуллярным относят поражения кожи (лейкемиды — чаще всего это багрово-синюшные уплотнения, узелки в коже), сетчатки, десен, яичек, яичников. Описаны поражения лимфатических узлов, легких, кишечника, сердечной мышцы, мочеточников. При ОМЛ экстрамедуллярные поражения мягких тканей ранее называли «хлоромой». В настоящее время для обозначения поражения мягких тканей и органов используют термин миелоидная или гранулоцитарная саркома.
2. Диагностика заболевания или состояния (группы заболеваний или состояний) медицинские показания и противопоказания к применению методов диагностики
Многие рекомендованные методы диагностики заболевания и связанных с ним состояний имеют ограниченную доказательную базу в соответствии с шкалами оценки уровня достоверности доказательств (УДД) и уровня убедительности рекомендаций (УУР) по причине отсутствия посвященных им клинических исследований. Невзирая на это, они являются необходимыми элементами обследования пациента для установления диагноза и выбора тактики лечения, так как более эффективные и доказанные методы в настоящее время не разработаны.
Критерии установления диагноза/состояния: диагноз ОМЛ устанавливают на основании обнаружения в пунктате костного мозга или в периферической крови не менее 20% бластных клеток, либо независимо от процентного содержания бластных клеток при наличии патогномоничных для ОМЛ хромосомных аномалий: t(8;21) (q22;q22) AML/ETO, t(15;17) (q12;q11 — 12) PML/RAR-, inv(16) или t(16;16) (p12;q23) CBF/MYH11, t(1;22), палочек Ауэра.
Сводная таблица исследований, необходимых для диагностики и верификации диагноза ОМЛ, представлена в Приложении А3.1. На основании клинической картины, а также анализа результатов перечисленных исследований, пациентов стратифицируют на молекулярно-генетические, а также клинические группы прогноза (приложение Г2).
2.1 Жалобы и анамнез
Клинические проявления при ОМЛ обычно связаны с изменениями в гемограмме — цитопенией:
Нейтропения — бактериальные инфекции, проявляющиеся, как правило, лихорадкой;
Анемия — слабость, утомляемость. Общая слабость присутствует у большинства пациентов и может наблюдаться за несколько месяцев до установления диагноза;
Тромбоцитопения — геморрагический синдром в виде петехий, кровоточивости десен, рецидивирующих носовых кровотечений, мено- и метроррагии.
В некоторых случаях могут наблюдаться оссалгии, B-симптомы (лихорадка, снижение массы тела, выраженная потливость).
В ряде случаев у пациентов в течение нескольких месяцев до обращения может наблюдаться немотивированная слабость.
При остром миеломонобластном лейкозе и остром монобластном лейкозе характерна гиперплазия десен и пациенты могут первоначально обращаться к стоматологу.
— Рекомендуется всем пациентам при подозрении и при установленном ОМЛ: тщательный сбор анамнеза заболевания с уточнением терапии, которая проводилась в связи с этим заболеванием или по поводу других заболеваний ранее, семейного анамнеза, а также подробное описание жалоб пациента для верификации диагноза [1, 3, 10].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
2.2 Физикальное обследование
— Рекомендуется всем пациентам при подозрении и при установленном ОМЛ проводить физикальное обследование, включающее измерение роста и массы тела, температуры тела; оценку состояния кожных покровов, костно-суставной системы; выявление признаков геморрагического синдрома; наличие гепатоспленомегалии, лимфаденопатии; наличие признаков дисфункции сердца, легких, печени, органов эндокринной, нервной системы для верификации диагноза [11].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: при физикальном обследовании у части пациентов (в основном, с острым миеломонобластным лейкозом, острым монобластным лейкозом, бластным кризом хронического миелолейкоза) выявляют признаки «пролиферативного» синдрома — спленомегалия, увеличение лимфатических узлов, кожные лейкемиды. Лейкемиды выявляют в 13% случаев и имеют вид узлов с измененным цветом кожи над ними [12]. При миелоидной саркоме выявляют экстрамедуллярные опухолевые образования различной локализации [13]. В остальном проявления малоспецифичны и включают симптомы, связанные с анемией и тромбоцитопенией.
2.3 Лабораторные диагностические исследования
— Рекомендуется всем пациентам при подозрении, диагностике ОМЛ, а также в ходе терапии с частотой от ежедневного до ежемесячного, выполнение общего (клинического) анализа крови с дифференцированным подсчетом лейкоцитов (лейкоцитарной формулы) и исследованием уровня тромбоцитов в крови для определения дальнейшей тактики ведения пациента и верификации диагноза [14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: как правило, в дебюте ОМЛ, выявляется нормохромная, нормоцитарная анемия различной степени тяжести. Количество ретикулоцитов в пределах нормы или снижено. Примерно у 75% пациентов имеется тромбоцитопения. Средний уровень лейкоцитов на этапе установления диагноза около 15 x 109/л. 20% пациентов имеют лейкоцитоз более 100 x 109/л.
Подсчет лейкоцитарной формулы необходимо выполнять не на автоматическом анализаторе. Рекомендовано исследовать как минимум 200 лейкоцитов в мазке периферической крови.
— Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, а также в ходе терапии с частотой от 1 — 3 раз в неделю до ежемесячного, выполнить анализ крови биохимический общетерапевтический (исследование уровня общего белка в крови, исследование уровня альбумина в крови и определение альбумин/глобулинового соотношения в крови, мочевина, креатинин, билирубин, АЛТ, АСТ, ЛДГ, магний, натрий, калий, общий кальций, глюкоза) для диагностики сопутствующей патологии (заболеваний) и определения тактики сопроводительной терапии [14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, а также в ходе терапии с частотой от 1 — 2 раз в неделю до ежемесячного выполнить коагулограмму (ориентировочное исследование системы гемостаза) (АЧТВ, протромбиновое время, протромбиновое время) для диагностики сопутствующей патологии и осложнений, а также определения тактики сопроводительной терапии [3, 14, 15].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, а также в ходе терапии выполнить общий (клинический) анализ мочи с частотой от еженедельного до ежемесячного для диагностики сопутствующей патологии и определения тактики сопроводительной терапии [14, 16].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, а также в ходе терапии с частотой 1 раз в 3 — 6 месяцев определение антител классов M, G (IgM, IgG) к вирусу иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1) в крови, и при необходимости молекулярно-биологическое исследование крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1) для уточнения необходимости одновременного проведения противоопухолевой и антиретровирусной терапии [3, 14, 17].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, а также в ходе терапии с частотой 1 раз в 3 — 6 месяцев определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови, и, при необходимости, молекулярно-биологического исследования крови на вирус гепатита B (Hepatitis B virus) и на вирус гепатита C (Hepatitis C virus) с целью уточнения риска реактивации вирусного гепатита и, в случае необходимости, ее профилактики [3, 14, 18, 19]
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, молекулярно-биологическое исследование крови на на вирус простого герпеса (Herpes simplex virus), на цитомегаловирус (Cytomegalovirus), на вирус Эпштейна-Барра (Epstein — Barr virus) с целью уточнения риска развития герпетической инфекции и, в случае необходимости, ее профилактики [3, 14, 20].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуются всем пациентам при подозрении и при установленном ОМЛ микробиологическое (культуральное) исследование отделяемого из полости рта; исследование микробиоценоза кишечника культуральными методами; микробиологическое (культуральное) исследование крови на стерильность; микробиологическое (культуральное) исследование мочи на бактериальные патогены с целью проведения прецизионной антибиотической терапии в ходе лечения при наличии фебрильной лихорадки и инфекционных осложнений [3, 21, 22].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется всем пациентам при подозрении и при установленном ОМЛ, а также в случае развития рецидива и после выполнения алло-ТГСК, определение основных групп крови по системе AB0 и определение антигена D системы Резус (резус-фактор) для возможности выполнения заместительной гемокомпонентной терапии при наличии показаний до, во время или после терапии [3, 14, 23].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется всем пациентам выполнение цитологического исследования мазка костного мозга (миелограммы) при подозрении на ОЛ, а также пациентам с верифицированным ОМЛ в процессе лечения, после окончания программы индукции, консолидации, в ходе проведения поддерживающей терапии, перед выполнением ТГСК, после завершения всей запланированной программы лечения, а также при выявлении изменений в общем клиническом анализе крови вне связи с проводимым лечением и/или подозрении на рецидив ОМЛ. При констатации рецидива (независимо от процентного содержания бластных клеток в периферической крови) выполнить цитологическое и дополнительно цитохимическое исследование микропрепарата костного мозга (или отпечатков трепанобиоптата костного мозга, при невозможности получения аспирата) с морфологическим и цитохимическим исследованиями бластных клеток для подтверждения рецидива и идентификации клеточной дифференцировки [3, 14, 24, 25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: получение цитологического препарата костного мозга путем пункции является обязательной рутинной диагностической процедурой. Процедура должна проводиться под наркозом!!!!
Мазки костного мозга исследуют с помощью окраски по Маю-Грюнвальду, Паппенгейму или Райту-Гимзе. Выполнение трепанбиопсии не является обязательным, за исключением ситуаций с так называемым «сухим проколом» или очень скудным пунктатом костного мозга. Рекомендовано исследовать как минимум 500 ядросодержащих клеток в мазке костного мозга.
Для установления диагноза ОМЛ в мазке периферической крови или костного мозга необходимо наличие 20% или более бластных клеток. При ОМЛ с t(15;17), t(8;21), inv(16) or t(16;16) и при некоторых случаях острого эритромиелоза доля бластных клеток может быть менее 20%. В соответствии с новой классификацией ВОЗ 2016 года процент бластных клеток подсчитывают вне зависимости от доли красного ростка.
Миелобласты, монобласты и мегакариобласты включают в общее число бластных клеток. В случаях ОМЛ с монобластной, моноцитарной и миеломоноцитарной дифференцировкой промоноциты (но не атипические/зрелые моноциты) также считают эквивалентами бластных клеток. Эритробласты не включают в общее число бластных клеток.
Для верификации диагноза истинного эритробластного лейкоза при подсчете пунктата костного мозга клетки эритроидного ряда должны составлять > 80% от всех клеток костного мозга, при этом проэритробласты должны быть 30%, без учета миелобластов. Проэритробласты, в соответствии с номенклатурой ВОЗ, — это незрелые эритрокариоциты, при этом, в соответствии с терминологией клеток эритропоэза по И.А. Кассирскому и Г.А. Алексееву, — это эритробласты и пронормобласты. При истинном эритробластном лейкозе дисмегакароцитопоэз встречается часто, в то время как дисгранулоцитопоэз — редко [26].
Выполнение цитохимического исследования микропрепарата костного мозга необходимо, даже если определяется высокое содержание бластных клеток в периферической крови. Это связано с тем, что в ряде случаев цитохимические реакции могут давать различные результаты в клетках периферической крови и костного мозга, что может повлечь за собой установление ошибочного диагноза. Диагноз основывают на результатах исследования, полученного на клетках костного мозга. Используют реакции на миелопероксидазу (myeloperoxidase — MPO) или судановый черный, неспецифическую эстеразу (альфа-нафтилацетатэстеразу, подавляемую или нет фторидом натрия) и PAS (Periodic Acid Schiff). Обнаружение миелопероксидазы в 3% и более бластных клеток указывает на миелоидную линию дифференцировки. В то же время ее отсутствие не исключает миелоидную направленность клеток, потому что в ранних миелобластах, а также монобластах, мегакариобластах и эритробластах МРО < 3% или не определяется. Окраска судановым черным аналогична МРО, но является менее специфичной. Неспецифическая эстераза имеет высокую диффузную или гранулярную цитоплазматическую активность (в зависимости от методики проведения реакции) в монобластах и промоноцитах, которая должна подавляться полностью или значительно фторидом натрия. PAS-реакция в миелобластах определяется в диффузном виде, в монобластах и промоноцитах — в диффузно-гранулярном, в эритробластах — в виде гранул или блоков. На основании морфоцитохимического исследования бластных клеток может быть диагностировано около 90% случаев ОМЛ, при отсутствии активности MPO и неспецифической эстеразы необходимо проведение иммунофенотипического исследования методом проточной цитофлюориметрии.
— Рекомендуется всем пациентам при первичной диагностике ОЛ, а также при обследовании по поводу диагностированного рецидива ОМЛ, выполнить иммунофенотипирование гемопоэтических клеток-предшественниц в костном мозге для определения принадлежности бластных клеток к той или иной линии клеточной дифференцировки [3, 6, 14, 27].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: Иммунофенотипирование выполняется всегда на клетках костного мозга, даже если определяется высокое содержание бластных клеток в периферической крови. Определение процента бластных клеток методом проточной цитофлуориметрии при первичной диагностике не является заменой морфологического подсчета, так как результаты этих двух исследований могут не совпадать [27].
Для подтверждения миелоидной направленности опухолевых клеток необходимо оценить экспрессию миелоидных антигенов. MPO — линейно-специфический маркер миелоидной линии, лизосомальный фермент гранулоцитов. К менее специфичным миелоид-ассоциированным антигенам относятся CD11b, CD11c, CD13, CD15, CD16, CD33, CD64, CD65, CD66b, лизоцим и другие. Диагноз ОМЛ может быть установлен и в том случае, если MPO не выявляется, а опухолевые клетки экспрессируют другие, менее специфичные миелоидные маркеры, и исключен лимфобластный вариант ОЛ.
Между морфоцитохимической классификацией ФАБ и иммунофенотипическими признаками нет четкой корреляции. Большинство миелоидных маркеров могут быть как позитивными, так и негативными при разных вариантах ОМЛ по ФАБ, за исключением специфических антигенов CD41а и CD61, которые характерны только для мегакариоцитарной/тромбоцитарной линии. Даже гликофорин A (CD235a), маркер эритроидной линии, может быть негативным при эритробластном лейкозе, если опухолевые клетки происходят из более ранних предшественников. Таким образом, по данным иммунофенотипического (ИФТ) исследования нельзя определять FAB-вариант ОМЛ.
Бластные клетки считаются позитивными по экспрессии мембранного антигена, если он определяется на 20% бластных клеток и более (пороговое значение). Для цитоплазматических маркеров (таких, как цитоплазматический CD3, MPO, лизоцим, ядерная TdT и другие) используют более низкий порог — 10%.
В случае получения невозможности получения аспирата костного мозга, выполняется иммуногистохимическое исследование трепанобиоптата костного мозга.
ИФТ выполняют с помощью мультипараметрической проточной цитофлюориметрии (обычно как минимум 3- или 4-цветной). В случае анализа трепанобиоптата выполняется его ИГХ исследование. Особенно ИФТ исследование необходимо для установления диагноза ОМЛ с минимальной дифференцировкой, острого мегакариоцитарного лейкоза и ОЛ с неопределенной дифференцировкой.
— Рекомендуется всем пациентам при первичной диагностике ОЛ а также при обследовании по поводу диагностированного рецидива ОМЛ, выполнить цитогенетическое исследование (кариотип) аспирата костного мозга с целью выявления аномалии кариотипа и стратификации пациентов по группам риска, а также для определения тактики лечения и выявления маркера для мониторинга динамики опухолевого клона на фоне терапии [3, 6, 14].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: стандартное цитогенетическое исследование является необходимым компонентом диагностических процедур у пациента с подозрением на ОЛ. Хромосомные аномалии выявляются примерно у половины пациентов ОМЛ. Семь транслокаций и инверсий (и их варианты) относятся ВОЗ в категорию «ОМЛ с устойчиво выявляемыми хромосомными аномалиями». Более того, обнаружение некоторых генетических аномалий при наличии 20% и более бластных клеток в костном мозге является достаточным для установления диагноза «ОМЛ с признаками миелодисплазии». Для определения кариотипа достоверным считается исследование как минимум 20 метафаз. Аномалии кариотипа могут устанавливаться и на основании исследования клеток периферической крови. Мониторинг выявленных при первичном исследовании аномалий кариотипа позволяет оценить полноту достигнутого эффекта терапии. Определение тех или иных цитогенетических аномалий уже на момент диагностики ОМЛ может определить терапевтическую тактику для конкретного пациента: например, выявление комплексных изменений кариотипа или моносомного кариотипа свидетельствует о необходимости применения отличного от стандартного цитостатического воздействия и обязательного обсуждения вопроса о возможности предельно раннего включения алло-ТГСК в программу лечения ОМЛ, вплоть до проведения алло-ТГСК в аплазии после первого индукционного курса.
— Рекомендуется всем пациентам при первичной диагностике ОЛ, а также при обследовании по поводу диагностированного рецидива ОМЛ, выполнить молекулярно-генетическое исследование — молекулярно-генетическое исследование мутаций в гене RUNX1-RUNX1T1 методом ПЦР, молекулярно-генетическое исследование мутаций в гене CBFB-MYH11 методом ПЦР и молекулярно-генетическое исследование мутаций в гене FLT3-TKI методом секвенирования в аспирате костного мозга для стратификации пациентов по группам риска и определения тактики лечения, а также с целью выявления маркера для мониторинга динамики опухолевого клона на фоне терапии [3, 14, 25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: тестирование мутаций NPM1, CEBPA и FLT3 является желательным, поскольку современные подходы к лечению ОМЛ предполагают наличие информации об этих мутациях, так как это может влиять на определение терапевтической тактики. ОМЛ с мутациями в генах NPM1 или CEBPA определены ВОЗ как условные категории. Экспрессия генов ERG, MN1, EVI1, BAALC, мутации генов WT1, RUNX1, MLL, KITRAS, TP53, TET2, IDH1 и определение МОБ исследуются в рамках КИ. Молекулярный скрининг на указанные маркеры самостоятельного значения не имеет, но как вспомогательный метод может быть использован при отсутствии результатов стандартного цитогенетического исследования. В современной молекулярной диагностике ОМЛ широко применяется и метод секвенирования нового поколения, созданы так называемые диагностические панели из нескольких десятков генов, вовлеченных в патогенез ОМЛ, которые позволяют четко отнести исследуемый ОМЛ к той или иной категории риска.
— Рекомендуется всем пациентам при первичной диагностике ОЛ, а также при обследовании по поводу диагностированного рецидива ОМЛ, которым не выполнено цитогенетическое исследование (кариотип) аспирата костного мозга (мало материала, не было получено митозов или получено менее 20 митозов) или получен нормальный кариотип, но при этом выявляются яркие клинико-лабораторные симптомы, характерных для определенных вариантов ОМЛ, выполнить молекулярно-цитогенетическое исследование (FISH-метод) для детекции реарранжировок генов в аспирате костного мозга с целью выявления маркера для мониторинга динамики опухолевого клона на фоне терапии [3, 14, 25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: при ОМЛ исследуются RUNX1-RUNX1T1, CBFB-MYH11, PML/RARA, MLL и EVI1 или потеря хромосомы 5q и 7. FISH зачастую необходим для идентификации слияний MLL при транслокациях региона 11q23. Возможно также проведение FISH на морфологических и гистологических препаратах костного мозга.
— Рекомендуется всем пациентам, у которых имеется информация о наличии молекулярного маркера или известен аберрантный иммунофенотип (выявленные на момент диагностики ОМЛ), иммунофенотипирование биологического материала для выявления маркеров минимальной остаточной болезни при гемобластозах (для группы промежуточного прогноза) или молекулярно-генетическое исследование минимальной остаточной болезни при лейкозах при помощи пациент-специфичных праймеров (для группы благоприятного прогноза) для контроля за лечением и определения тактики постиндукционной терапии [3, 14, 28, 29].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: для подтверждения полноты достигнутого ответа на терапию и его сохранение, в соответствии с современными международными рекомендациями, необходимо выполнять в контрольные точки оценку МОБ методом проточной цитофлюорометрии (аберрантный иммунофенотип), а для группы благоприятного прогноза — только молекулярное исследование МОБ методом ПЦР (количественная оценка экспрессии генов RUNX1-RUNX1T1, CBFB-MYH1, NPM1) [29, 30].
По результатам исследований, проводимых Российской группой по терапии острых лейкозов, — при достижении МОБ-негативной ремиссии после 1-го курса терапии у пациентов из группы промежуточного прогноза, при выполнении дальнейшего тщательного мониторинга МОБ, возможно рассмотрение вопроса о продолжении ХТ без выполнения алло-ТГСК. У пациентов из группы благоприятного прогноза динамика химерного транскрипта также определяет целесообразность выполнения пациентам алло-ТГСК [31].
— Рекомендуется всем пациентам выполнить спинномозговую пункцию с общим (клиническим) анализом спинномозговой жидкости с целью диагностики нейролейкемии и нейропрофилактики [3, 14, 25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5).
Комментарии: при ОМЛ в целом вовлечение ЦНС встречается менее чем у 5% пациентов, при ряде вариантов ОМЛ, особенно с моноцитарной дифференцировкой, вероятность вовлечения в процесс оболочек головного мозга выше.
Желательно поддерживать число тромбоцитов в крови перед выполнением спинномозговой пункции 30 x 109/л и выше. Если уровень тромбоцитов не удается повысить до 30 x 109/л и выше, при отсутствии клинических признаков поражения ЦНС, от пункции можно воздержаться до повышения тромбоцитов в гемограмме выше 30 x 109/л.
Если у пациента определяется лейкоцитоз выше 100 x 109/л в крови, то первую спинномозговую пункцию следует отложить до редукции числа лейкоцитов менее 20 x 109/л.
— Рекомендуется всем пациентам выделять первичную ДНК или РНК из клеток костного мозга и сохранять ее в биобанке либо направлять материал на хранение в лаборатории Федеральных Центров для возможности последующего выполнения молекулярных исследований [3, 14, 25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: сохранение первичного биологического материала осуществляется в виде ДНК и/или РНК, выделенных из костномозговых клеток или замороженных клеток. Материал может в последующем понадобиться для проведения молекулярных исследований, позволяющих определить группы риска, а также в рамках клинических исследований (КИ).
2.4 Инструментальные диагностические исследования
— Рекомендуется всем пациентам с ОМЛ до начала специфической терапии, а также в ходе лечения с частотой от 1 раза в неделю до ежемесячного (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения, регистрация, расшифровка, описание и интерпретация электрокардиографических данных для выявления и/или мониторинга нарушений проводимости импульсов в сердечной мышце [3, 14, 32].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется всем пациентам с ОМЛ до начала специфической терапии, а также в ходе лечения с частотой от 1 раз в неделю до ежемесячного (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения, выполнение эхокардиографии для оценки функционального состояния сердечной мышцы, учитывая кардиотоксичность препаратов [3, 14, 32].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется всем пациентам с ОМЛ до начала специфической терапии, а также в ходе лечения с частотой от 1 раза в 2 — 3 недели до 1 раза в 2 — 3 месяца (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения выполнение компьютерной томографии (КТ) головного мозга без контраста для выявления и/или мониторинга изменений в структурах головного мозга. При наличии нейролейкемии выполнение МРТ головного и спинного мозга с внутривенным контрастированием, для оценки вещества головного мозга и оболочек головного и спинного мозга [1, 3, 4, 8, 33 — 35].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется всем пациентам с ОМЛ до начала специфической терапии, а также в ходе лечения с частотой от 1 раза в 2 — 3 недели до 1 раза в 2 — 3 месяца (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения выполнение рентгенографии и/или КТ органов грудной клетки для выявления изменений легочной ткани и органов средостения [3, 14, 33 — 35].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется всем пациентам с ОМЛ на любом этапе ведения с подозрением на наличие экстрамедуллярных очагов выполнение КТ и/или магнитно-резонансной томографии (МРТ) с контрастом соответствующего региона для уточнения распространенности заболевания или диагностики экстрамедуллярного рецидива [3, 33 — 35].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется всем пациентам с ОМЛ до начала специфической терапии, а также в ходе лечения с частотой от 1 раза в 2 — 3 недели до 1 раза в 2 — 3 месяца (с учетом наличия сопутствующей патологии и клинической ситуации), а также при необходимости в любой момент в течение всего периода лечения, для определения объема опухолевой массы и диагностики и мониторинга сопутствующей патологии выполнение ультразвукового исследование (УЗИ) органов брюшной полости с определением размеров печени, селезенки и внутрибрюшных лимфатических узлов, а также оценка состояния органов брюшной полости и выполнение УЗИ органов малого таза у девочек и яичек у мальчиков [3, 33].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
2.5 Иные диагностические исследования
— Рекомендуется пациентам с подозрением на экстрамедуллярные очаги ОМЛ выполнение биопсии вовлеченного органа/ткани в объеме, необходимом для выполнения патолого-анатомического исследования биопсийного материала с применением иммуногистохимических методов и молекулярно-биологических исследований [36].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется всем пациентам, которые потенциально могут рассматриваться как кандидаты на выполнение трансплантации алло-ТГСК, после достижения 1-ой ремиссии ОМЛ, а также их сиблингам молекулярно-генетическое исследование гистосовместимости (HLA-ого разрешения при помощи секвенирования) для подбора неродственного донора костного мозга с целью поиска потенциального донора с консультацией в трансплантационном центре с целью определения целесообразности и возможности выполнения алло-ТГСК [3, 25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется при наличии показаний и определения сопутствующей патологии консультации врача-невролога, врача-офтальмолога, врача-оториноларинголога и других врачей-специалистов, всем девочкам старше 14 лет — консультация врача-акушера-гинеколога [3].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
3. Лечение, включая медикаментозную и немедикаментозную терапии, диетотерапию, обезболивание, медицинские показания и противопоказания к применению методов лечения
Эффективность ХТ ОМЛ зависит от двух ключевых факторов — специфичности цитостатического воздействия и адекватности сопроводительного лечения. Основными принципами лечения ОЛ является максимум эффективности (за счет специфичности и адекватности воздействия) при минимуме токсичности (за счет грамотной сопроводительной терапии).
Лечение ОМЛ у детей основано на интенсивной полихимиотерапии, которая должна быть дополнена трансплантацией гемопоэтических стволовых клеток (ТГСК) от HLA-геноидентичного родственного или альтернативного (неродственного, гаплоидентичного) донора у пациентов группы высокого риска рецидива. Необходимость трансплантации у пациентов группы промежуточного риска продолжает дискутироваться; она показана только при наличии HLA-геноидентичного сиблинга.
Перед началом терапии пациенту желательно обеспечить центральный венозный доступ на продолжительное время постановкой центрального венозного катетера.
3.1 Терапия впервые выявленного ОМЛ
— Рекомендуется всем пациентам с впервые выявленным ОМЛ при наличии возможности участия в клинических исследованиях [37].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: в настоящее время единого стандарта терапии ОМЛ у детей не разработано.
— Рекомендуется всем пациентам с впервые выявленным ОМЛ, которые не могут быть включены в клинические исследования, проведение курса индукции с последующей консолидацией и, для пациентов высокой группы риска, трансплантации аллогенных гемопоэтических стволовых клеток (алло-ТГСК) (см. приложение А3.2) [1, 2, 38 — 40]
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 4)
Комментарии: начало терапии — это курс индукции ремиссии, состоящей из базовых препаратов, эффективных в отношении ОМЛ (цитарабин**, антрациклины и этопозид**). После достижения ремиссии и восстановления гемопоэза следует короткая (не более 3 курсов) консолидирующая терапия, основанная на высоких дозах цитарабина** (2 — 3 г/м2/сутки).
При наличии HLA-совместимого родственного донора все пациенты высокой группы должны быть трансплантированы в первой ремиссии после трех блоков консолидирующей терапии. Пациенты, относящиеся к группе высокого риска, должны получить трансплантацию от HLA-совместимого родственного или неродственного донора, или от альтернативного донора (гаплоидентичного).
Трансплантация проводится только в специализированных центрах, куда информация о пациентах должна направляться заблаговременно. Заявку на проведение ТГСК в трансплантационный центр следует подавать сразу же после констатации у пациента высокого риска или наличия HLA-идентичного родственного донора.
Проведение длительной поддерживающей терапии в настоящее время не рекомендовано [38].
— Всем пациентам, получающим терапию по ОМЛ, рекомендуется выполнение спинномозговой пункции и интратекальная терапия (введение лекарственных препаратов в спинномозговой канал) (см. приложение А3.2) [1, 2, 38 — 40].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: при инициальном лейкоцитозе 100 x 109/л и более люмбальная пункция проводится не в первый день индукции, а только после редукции лейкоцитов до уровня 50 x 109/л — во избежание получения ложного диагноза нейролейкоза из-за контаминации ликвора бластами периферической крови и из-за риска кровотечения в спинномозговой канал вследствие коагулопатии [1].
Интратекальная терапия. Состоит из интратекальных введений цитарабина в возрастной дозировке (см. табл. 2).
Таб. 2. Дозы цитарабина** для интратекального введения в зависимости от возраста [41].
|
Возраст |
Доза, мг |
|
Меньше 1 года |
20 |
|
1 — 2 года |
26 |
|
2 — 3 года |
34 |
|
Старше 3 лет |
40 |
Профилактическая терапия (без инициального поражения ЦНС): интратекальные введения цитарабина**: 5 введений перед началом каждого блока терапии и после окончания последнего блока и восстановления гемопоэза еще 2 введения с интервалом в 1 месяц.
Терапия при инициальном поражении ЦНС: интратекальные введения цитарабина** проводятся 1 раз в неделю до тех пор, пока ликвор не будет санирован, но не менее 3 раз. Затем введения цитарабина** в спинномозговой канал продолжаются по такой же схеме, как в профилактическом лечении, то есть перед началом каждого блока химиотерапии и после окончания последнего блока и восстановления гемопоэза еще 2 введения с интервалом в 1 месяц.
— Пациентам старше 3 лет с ОМЛ с с inv(16) без первичного поражения ЦНС рекомендуется профилактическое краниальное облучение СОД 12 Гр [42].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: профилактическое краниальное облучение проводится как минимум через 4 недели после окончания последнего блока при восстановлении гемопоэза. Два последних введения цитарабина** должны быть проведены во время облучения с интервалом 2 недели.
— Всем пациентам с ОМЛ старше 3 лет с первичным поражением ЦНС, которые не достигли санации ликвора после 3 интратекальных введений цитарабина**, рекомендуется выполнение краниальной лучевой терапии СОД 18 Гр [38, 43 — 46].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: краниальное облучение проводится при помощи гамма-ножа или линейного ускорителя. При этом в поле облучения должен попасть весь нейрокраниум, включая верхнюю часть шейного отдела позвоночника до C2 включительно, ретробульбарное пространство и все основание черепа, особое внимание следует уделить средней мозговой ямке, часто оказывающейся лежащей глубже общего уровня; попадание в область облучения челюстных суставов не должно влиять на конфигурацию поля. Ежедневная разовая доза составляет 1,5 Гр, таким образом в течение недели пациент получает 7,5 Гр. Общая продолжительность облучения составляет от 2 до 3 недель. Спинальное облучение не производится никому. Пациентам, которым планируется ТГСК, облучение и 2 последних интратекальных введения цитарабина** проводятся после трансплантации.
— Всем пациентам с ОМЛ после завершения интенсивной части терапии по протоколу BFM (см. приложение А3.2) рекомендуется рассмотреть вопрос о проведении поддерживающей терапии с учетом возможных пользы и риска для пациента [1, 2, 33, 46, 48].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: этап поддерживающей терапии начинается после восстановления гемопоэза после последнего курса химиотерапии. Меркаптопурин** назначается в стартовой дозе 50 мг/м2 внутрь ежедневно, цитарабин** в дозе 25 мг/м2 2 раза в день подкожно x 4 дня каждого месяца. Длительность поддерживающей терапии — 12 месяцев [38, 47].
Ценность поддерживающей терапии после высокоинтенсивной «блоковой» терапии, согласно данным проведенных исследований, сомнительна. Более того, есть данные о негативном влиянии поддерживающей терапии на общую выживаемость [33, 48].
3.2 Терапия рецидивов и рефрактерных форм ОМЛ
— Всем пациентам с рецидивами и рефрактерным течением ОМЛ рекомендуется проведение интенсивной высокодозной полихимиотерапии с последующим выполнением алло-ТГСК (см. приложение А3.2) [48].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: в том случае, если после курса индукции у пациента достигнута парциальная ремиссия, он должен продолжать лечение по протоколу. Рефрактерным является ОМЛ, при котором после 2 блоков химиотерапии (в данном случае после AIE и HAM) сохраняется бластная инфильтрация в костном мозге более 5% или экстрамедуллярное поражение. В этом случае и при развитии рецидива пациент должен быть переведен на терапию флударабином**, высокими дозами цитарабина** и антрациклином [49].
Для проведения гемотрансфузионной терапии у пациентов после терапии флударабином должны быть использованы облученные препараты крови.
При достижении ремиссии необходимо проведение курса аналогичной терапии без антрациклина и далее — проведение аллогенной трансплантации от HLA-геноидентичного или альтернативного донора. До начала химиотерапии рефрактерного или рецидивного ОМЛ необходимо проведение HLA-типирования пациента, сиблингов и родителей и направить данные в трансплантационный центр.
В качестве таргетной терапии ОМЛ наиболее хорошие результаты показаны при использовании препарата #сорафениб**. Неселективный ингибитор тирозин-киназ #сорафениб** in vitro вызывает угнетение фосфорилирования ITD-Flt-3 рецептора; появилось сообщение об успешном применении #сорафениба** 300 мг/м2 ежедневно в течение 47 дней с последующей поддерживающей терапией #сорафенибом** 170 мг/м2 ежедневно у пациента с экстрамедуллярным рецидивом ОМЛ после алло-ТГСК [50, 51].
Среди исследований, посвященных увеличению эффективности ремиссии путем введения новых препаратов, несомненно важным является опыт исследовательской группы госпиталя St. Jude (США). В протоколах этой группы в индукции применяется #кладрибин (9 мг/м2 в течение 5 дней) с цитарабином** (500 мг/м2 в течение 5 дней), после чего еще 2 курса #DAV (даунорубицин 30 мг/м2 в 1 — 3 дни 72-часовая инфузия, цитарабин 250 мг/м2 в 1 — 5 дни 120-часовая инфузия, этопозид 200 мг/м2 в 4 и 5 дни 48-часовая инфузия), что позволило получить ремиссию у 90 — 100% пациентов, и хотя оценку этого на продолжительные результаты можно будет дать существенно позже, эти данные являются весьма обнадеживающими [52].
3.3 Сопутствующая и сопроводительная терапия
— Всем пациентам, получающим терапию по поводу ОМЛ, рекомендуется проведение сопутствующей и сопроводительной терапии в соответствии с профильными рекомендациями [1, 53 — 56].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии:
1. Рекомендуется изоляция детей в ламинарные боксы или палаты с принудительной вентиляцией под повышенным давлением с установкой переносных HEPA-фильтров.
2. Инфузионная терапия:
a. На первой фазе индукции инфузия проводится без калия хлорида. Декстроза 5% 3000 мл/м2/сутки + натрия хлорид 10% 30 мл/м2 сутки + натрия гидрокарбонат 7,5% 40 — 60 мл/м2/сутки. В это время необходимо внимательно следить за балансом диуреза, при задержке мочи более 200 мл/м2 в течение 6 часов показано введение фуросемида в разовой дозе 0,5 — 1 мг/кг.
b. Инфузионная терапия на второй фазе индукции и всех последующих курсах полихимиотерапии: декстроза 5% 2000 мл/м2/сутки + натрия хлорид 10% 1 мл/кг/сутки + калия хлорид 7,5% — 1 — 2 мл/кг/сутки (или по результатам уровня K+ в сыворотке).
3. Колониестимулирующие факторы. Плановое назначение колониестимулирующих факторов не рекомендуется. Применение должно ограничиваться витальными показаниями, то есть при сепсисе у пациентов, находящихся в состоянии аплазии кроветворения, и неконтролируемой адекватной антимикробной терапией бактериальной и/или грибковой инфекции.
4. Антибактериальная терапия. При возникновении признаков инфекции (очаговые поражения или лихорадка неясной этиологии) назначается эмпирическая антибактериальная терапия, то есть до получения результатов бактериологического исследования. Лихорадкой считается один эпизод аксиллярной температуры 338,0 °C или 3 эпизода субфебрильной лихорадки (37,5 — 38,0 °C) в течение суток или один эпизод температуры 37,5 — 37,9 °C в течение часа и более. При субфебрилитете — жаропонижающие не применять!
5. Профилактика пневмоцистной пневмонии. Хотя пневмоцистная пневмония является редким осложнением терапии ОМЛ, рекомендуется прием #ко-тримоксазола [Сульфаметоксазол + Триметоприм] 3 дня подряд в неделю в дозе 5 мг/кг/с по триметоприму, только пациентам, получившим флударабин** [57].
— Не рекомендуется всем пациентам, учитывая высокую вероятность формирования резистентной микрофлоры, а также высокую частоту инфекций, вызванных энтеробактериями с продукцией бета-лактамаз расширенного спектра (БЛРС), проведение первичной профилактики бактериальных инфекций при ОМЛ антибиотическими препаратами (селективная деконтаминация кишечника) [21, 22].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется пациентам в ходе проведения интенсивной индукционной ХТ выполнение профилактики инвазивных микозов позаконазолом в медицинских организациях, где частота возникновения инвазивного аспергиллеза (ИА) превышает 10% [21, 22, 59].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 4)
— Рекомендуется пациентам, у которых на предшествующих курсах диагностировался ИА, проводить вторичную противогрибковую профилактику с использованием того лекарственного препарата, при назначении которого было достигнуто излечение от ИА [21, 22, 60 — 62].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется в качестве антибиотиков первого этапа при фебрильной нейтропении использовать цефоперазон + сульбактам**, пиперациллин + тазобактам, цефепим**, цефтазидим** [22].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: модификацию антимикробной терапии проводят в соответствии с данными проведенного обследования (КТ, микробиологические исследования и т.д.). Назначение карбапенемов в качестве антибиотиков первого этапа при фебрильной нейтропении обосновано у пациентов с септическим шоком, а также в клиниках, где в этиологии инфекций преобладают энтеробактерии с продукцией БЛРС.
— Рекомендуется при наличии гуморального иммунодефицита и тяжелых инфекционных осложнений (сепсис), в том числе вирусных (цитомегаловирусная) инфекций трансфузии препаратов внутривенного иммуноглобулина человека нормального в дозировках в соответствии с инструкцией к медицинскому применению лекарственного препарата [63].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется всем пациентам младше 18 лет с ОМЛ при снижении уровня тромбоцитов ниже 10 x 109/л либо при более высоких показателях тромбоцитов при наличии геморрагического синдрома или инфекции трансфузия тромбоконцентрата [53, 64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: любое проявление геморрагического синдрома (петехиальные высыпания, особенно на слизистой полости рта, на лице и передней поверхности грудной клетки, любые кровотечения) и/или повышение температуры тела выше 37,5 °C даже в отсутствие явного очага инфекции, требует выполнения трансфузии тромбоконцентратов даже при количестве тромбоцитов в периферической крови более 20 x 109/л. Аналогичные показания для трансфузии тромбоконцентратов при подготовке пациента перед выполнением инвазивных процедур.
Для проведения первой фазы индукции и для выполнения инвазивных манипуляций (люмбальной пункции, катетеризации центральной вены) уровень тромбоцитов должен быть не менее 30 x 109/л. В период аплазии кроветворения после любого курса полихимиотерапии, если нет кровотечений и/или инфекций с фебрильной лихорадкой — тромбоциты должны поддерживаться на уровне не менее 15 x 109/л. При присоединении инфекций с фебрильной лихорадкой и при применении Амфотерицина B тромбоциты должны поддерживаться на уровне не менее 20 x 109/л.
Выраженная кровоточивость со слизистых, кровотечение в ЖКТ, легочное кровотечение, кровоизлияние в мозг — показания к трансфузии тромбоцитов при любых показателях тромбоцитов.
Пациенты, получавшие кладрибин, должны переливаться облученными препаратами крови.
— Рекомендуется всем пациентам младше 18 лет с ОМЛ при снижении гемоглобина ниже 70 г/л и гематокрите менее 0,3 или развитии клинических симптомов анемического синдрома (сонливость, тахикардия, одышка) трансфузия эритроцитарной массы [53, 64].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: пациенты, получавшие кладрибин, должны переливаться облученными препаратами крови.
— Рекомендуется при наличии нарушений плазменного гемостаза (гипо- и гиперкоагуляция) выполнение трансфузии компонентов крови [65].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: показания и объем трансфузионной поддержки определяется показателями коагулограммы и клинической ситуацией.
Пациенты, получавшие кладрибин, должны переливаться облученными препаратами крови.
Трансфузии свежезамороженной плазмы проводятся только при серьезных изменениях в коагулограмме: фибриноген менее 1 г/л, протромбиновый индекс менее 50%, АЧТВ более 55 секунд.
— Рекомендуется при возникновении острого или хронического болевого синдрома уточнение этиологии боли; при выявлении очага воспаления — проведение необходимых мероприятий по лечению очага воспаления согласно соответствующим клиническим рекомендациям (включая, при необходимости, хирургическое лечение); при исключении инфекционно-воспалительной природы болевого синдрома рекомендуется проведение обезболивающей терапии согласно существующим протоколам обезболивания (см. соответствующие клинические рекомендации по хронической боли, клинические рекомендации по анестезиологии), в том числе по показаниям — с применением наркотических и психотропных лекарственных препаратов, с учетом возможных противопоказаний, связанных с цитопенией, иными клиническими ситуациями [66].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
4. Медицинская реабилитация, медицинские показания и противопоказания к применению методов реабилитации
Подход к реабилитации и диспансерное наблюдение пациентов с ОМЛ. Диспансерное наблюдение включает систематические осмотры и целенаправленное лабораторное и инструментальное обследование, направленное на оценку статуса ремиссии основного заболевания и возможных осложнений, связанных с перенесенной полихимиотерапией.
Специальных методов реабилитации при ОМЛ не существует.
— Рекомендуется проведение реабилитации при возникновении осложнений после завершения программы терапии ОМЛ в рамках соответствующих нозологий [67].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
Комментарии: после окончания лечения рекомендуется вести здоровый образ жизни, исключить инсоляцию и физиотерапевтические процедуры.
При проведении полихимиотерапии возможна кардио-, гепато-, нейро-, нефро- и другая токсичность, последствия которой могут проявляться и после ее окончания.
5. Профилактика и диспансерное наблюдение, медицинские показания и противопоказания к применению методов профилактики
Первичная профилактика ОМЛ невозможна в связи с низкой базовой заболеваемостью и неустановленными причинами болезни.
Профилактика рецидива заболевания основана на полном выполнении протокола терапии первой линии и выполнении ТГСК и проведении регулярного динамического наблюдения.
— Рекомендуется в течение поддерживающей терапии выполнение общего (клинического) анализа крови 1 раз в месяц. [1, 3, 4, 8, 25].
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
— Рекомендуется после окончания терапии наблюдение врачом-гематологом и/или врачом-педиатром по месту жительства с выполнением необходимого объема обследований со следующей периодичностью: [1]
1. Пациенты, получившие ТКМ, наблюдаются согласно рекомендациям трансплантационного центра.
2. Пациенты без ТКМ:
3. общий (клинический) анализ крови с подсчетом лейкоцитарной формулы 1 раз в месяц первые 3 мес., затем 1 раз в 6 мес. в течение 5 лет
4. молекулярно-биологическое исследование крови на вирус иммунодефицита человека ВИЧ-1 (Human immunodeficiency virus HIV-1), определение антигена (HbsAg) вируса гепатита B (Hepatitis B virus) в крови, определение антител к вирусу гепатита C (Hepatitis C virus) в крови через 6 месяцев после окончания химиотерапии
5. анализ крови биохимический общетерапевтический с оценкой — альбумина, АЛТ, АСТ, ЛДГ, билирубина (общего и прямого), мочевины и креатинина, ферритина 1 раз в год в течение 5 лет
6. ЭКГ и эхокардиография 1 раз в год в течение 5 лет
7. КТ/МРТ зон экстрамедуллярных очагов через 6 мес. от окончания химиотерапии
Уровень убедительности рекомендаций C (уровень достоверности доказательств — 5)
6. Организация оказания медицинской помощи
Показания для плановой госпитализации:
1. Подозрение/установление диагноза ОЛ
2. Диагностика рецидива ОМЛ
3) Проведение очередного курса ХТ в условиях круглосуточного стационара
4) Проведение запланированной ТГСК
5) Выполнение плановых хирургических вмешательств,
6) Выполнение плановых экстракорпоральных методов очищения крови и заместительной почечной терапии
7) Проведение заместительной гемокомпонентной терапии
Показания для экстренной госпитализации:
Неотложные состояния у пациентов с ОМЛ и при подозрении на ОЛ:
— лейкоцитоз более 100 x 109/л
— фебрильная лихорадка и инфекционные осложнения на фоне нейтропении после курса ХТ
— геморрагический синдром
— тромботические осложнения
— необходимость проведения экстренной заместительной гемокомпонентной терапии
— другие системные нарушения, обусловленные течением основного заболевания или развившиеся вследствие проведенного лечения
Показания к выписке пациента из стационара:
1) Восстановление показателей периферической крови (лейкоциты более 1 x 109/л, гранулоциты более 0,5 x 109/л, тромбоциты более 50 x 109/л, гемоглобин — более 80 г/л) после очередного курса ХТ
2) Нормотермия в течение 3 — 5 суток и отсутствие неконтролируемых инфекционных осложнений в послекурсовом периоде
3) Купирование геморрагических осложнений
4) Купирование тромботических осложнений
5) Купирование системных нарушений, обусловленных течением основного заболевания или развившихся вследствие проведенного лечения.
Заключение о целесообразности перевода больного в профильную медицинскую организацию осуществляется после предварительной консультации по предоставленным медицинским документам и/или предварительного осмотра больного врачами специалистами медицинской организации, в которую планируется перевод.
7. Дополнительная информация (в том числе факторы, влияющие на исход заболевания или состояния)
«Молекулярная» терапия
Прогресс в изучении молекулярного патогенеза ОМЛ привел к разработке новых «молекулярных» препаратов, т.е. молекул, механизм действия которых связан с влиянием на белки, функция которых изменяется в результате мутации или транслокации (таргетное воздействие). Например, генетические изменения приводят к мутациям в генах, активирующих каскады трансдукции сигнала (например, FLT3, KIT, RAS), к слиянию генов или мутациям, приводящим к повышению или угнетению транскрипционной активности (например, PML-RARA, RUNX1-RUNX1T1, CBFB-MYH11, CEBPA) или к нарушению функции генов, вовлеченных в передачу сигнала (например, NPM1, NUP98, NUP). Хотя для некоторых препаратов, действующих на молекулярном уровне, и была продемонстрирована эффективность при ОМЛ, уже на стадии КИ было понятно, что большинство из них необходимо использовать в сочетании со стандартными цитостатическими препаратами. В настоящее время проводится большое число КИ по изучению эффективности при ОМЛ и безопасности препаратов из различных фармацевтических групп.
Критерии оценки качества медицинской помощи
|
N |
Критерии качества |
Уровень достоверности доказательств |
Уровень убедительности рекомендаций |
|
1. |
У пациента с подозрением на ОМЛ или при первичном приеме пациента с ОМЛ выполнен сбор жалоб, анамнеза и оценка объективного статуса |
5 |
C |
|
2. |
У пациента с подозрением на ОМЛ или при первичном приеме пациента с ОМЛ выполнен общий (клинический) анализ крови с дифференцированным подсчетом лейкоцитов (лейкоцитарной формулы) и исследованием уровня тромбоцитов в крови |
5 |
C |
|
3. |
У пациента с подозрением на ОМЛ выполнено цитологического исследования мазка костного мозга (миелограммы) и цитохимическое исследование микропрепарата костного мозга |
5 |
C |
|
4. |
У пациента с подозрением на ОМЛ выполнено цитогенетическое исследование (кариотип) аспирата костного мозга |
5 |
C |
|
5. |
У пациента с подозрением на ОМЛ или при первичном приеме пациента с ОМЛ выполнен анализ крови биохимический общетерапевтический (креатинин, общий белок, общий билирубин, ЛДГ) |
5 |
C |
|
6. |
У пациента с подозрением на ОМЛ выполнен общий (клинический) анализ спинномозговой жидкости |
5 |
C |
|
7. |
У пациента с подозрением на ОМЛ выполнена рентгенография органов грудной клетки и/или КТ органов грудной клетки и/или головного мозга |
5 |
C |
|
8. |
Пациент с впервые диагностированным ОМЛ при наличии возможности включен в клиническое исследование |
5 |
C |
|
9. |
У пациента с впервые диагностированным ОМЛ, который не может быть включен в клиническое исследование, после завершения всех диагностических мероприятий проведена индукционная терапия |
3 |
B |
|
10. |
У пациента с верифицированным ОМЛ, получающего терапию вне рамок клинических исследований и достигшего ПР после индукционного этапа терапии, выполнена программа консолидации ремиссии |
1 |
A |
|
11. |
У пациента с верифицированным ОМЛ, получающего терапию вне рамок клинических исследований и достигшего ПР после индукционного этапа терапии, проведена консультация в трансплантационном центре для решения вопроса о возможности и целесообразности выполнения алло-ТКМ/алло-ТГСК |
1 |
A |
|
12. |
У пациента, получающего терапию по поводу верифицированного ОМЛ вне рамок клинических исследований, после окончания 1 и 2 курсов индукции ремиссии проведено цитологического исследования мазка костного мозга (миелограммы) |
5 |
C |
|
13. |
У пациента, получающего терапию по поводу верифицированного ОМЛ вне рамок клинических исследований, после окончания консолидации ремиссии проведено цитологического исследования мазка костного мозга (миелограммы) |
5 |
C |
|
14. |
У пациента, получающего терапию по поводу верифицированного ОМЛ вне рамок клинических исследований, после завершения всей программы терапии проведено цитологического исследования мазка костного мозга (миелограммы) |
5 |
C |
Список литературы
1. Детская гематология Под ред: А.Г. Румянцева, А.А. Масчана, Е.В. Жуковской. 2015. 656 p.
2. Pui C.-H. Childhood leukemias. 2012. 880 p.
3. Савченко В.Г., Паровичникова Е.Н. Острые лейкозы//Клиническая онкогематология: руководство для врачей. Под ред. Волковой М.А. 2-е изд., перераб. и доп. 2007. P. 409 — 502.
4. Паровичникова Е.Н. et al. Клинический протокол ОМЛ-01.10 по лечению острых миелоидных лейкозов взрослых//Программное лечение заболеваний крови, под ред. Савченко В.Г. М.: Практика, 2012. P. 153 — 207.
5. Shallis R.M. et al. Epidemiology of acute myeloid leukemia: Recent progress and enduring challenges.//Blood Rev. 2019. Vol. 36. P. 70 — 87.
6. Swerdlow S.H. et al. The 2016 revision of the World Health Organization classification of lymphoid neoplasms//Blood. 2016.
7. Arber D.A. et al. The 2016 revision to the World Health Organization classification of myeloid neoplasms and acute leukemia//Blood. 2016.
8. Acute Myeloid Leukemia. National Comprehensive Cancer Network (NCCN) Guidelines. 2-2020. [Electronic resource]. URL: https://www.nccn.org/professionals/physician_gls/pdf/aml.pdf.
9. Kulsoom B. et al. Clinical presentation of acute myeloid leukaemia — A decade-long institutional follow-up.//J. Pak. Med. Assoc. 2017. Vol. 67, N 12. P. 1837 — 1842.
10. Godley L.A. Inherited predisposition to acute myeloid leukemia.//Semin. Hematol. 2014. Vol. 51, N 4. P. 306 — 321.
11. Rubnitz J.E., Gibson B., Smith F.O. Acute Myeloid Leukemia//Hematology/Oncology Clinics of North America. 2010. Vol. 24, N 1. P. 35 — 63.
12. Agis H. et al. A comparative study on demographic, hematological, and cytogenetic findings and prognosis in acute myeloid leukemia with and without leukemia cutis.//Ann. Hematol. 2002. Vol. 81, N 2. P. 90 — 95.
13. Avni B. et al. Clinical implications of acute myeloid leukemia presenting as myeloid sarcoma.//Hematol. Oncol. 2012. Vol. 30, N 1. P. 34 — 40.
14. Creutzig U. et al. Diagnosis and management of acute myeloid leukemia in children and adolescents: Recommendations from an international expert panel//Blood. American Society of Hematology, 2012. Vol. 120, N 16. P. 3167 — 3205.
15. Ku G.H. et al. Venous thromboembolism in patients with acute leukemia: Incidence, risk factors, and effect on survival//Blood. 2009. Vol. 113, N 17. P. 3911 — 3917.
16. Муфтахова Г.М., Аксенова М.Е. Поздние эффекты противоопухолевой терапии со стороны мочеполовой системы (отсроченное влияние противоопухолевой терапии на органы мочеполовой системы)//Российский журнал детской гематологии и онкологии. 2019. Vol. 5, N 4. P. 114 — 119.
17. Fang R.C., Aboulafia D.M. HIV infection and myelodysplastic syndrome/acute myeloid leukemia//HIV-Associated Hematological Malignancies. 2016. P. 133 — 144.
18. Freeman A.J. et al. Estimating progression to cirrhosis in chronic hepatitis C virus infection.//Hepatology. 2001. Vol. 34, N 4 Pt 1. P. 809 — 816.
19. Ribas A. et al. How important is hepatitis C virus (HCV)-infection in persons with acute leukemia?//Leuk. Res. 1997. Vol. 21, N 8. P. 785 — 788.
20. Lam M.T. et al. Herpes simplex infection in acute myelogenous leukemia and other hematologic malignancies: a prospective study.//Cancer. 1981. Vol. 48, N 10. P. 2168 — 2171.
21. Averbuch D. et al. Targeted therapy against multi-resistant bacteria in leukemic and hematopoietic stem cell transplant recipients: Guidelines of the 4th European conference on Infections in Leukemia (ECIL-4, 2011)//Haematologica. 2013. Vol. 98, N 12. P. 1836 — 1847.
22. Averbuch D. et al. European guidelines for empirical antibacterial therapy for febrile neutropenic patients in the era of growing resistance: Summary of the 2011 4th European Conference on Infections in Leukemia//Haematologica. 2013. Vol. 98, N 12. P. 1826 — 1835.
23. Leahy M.F., Mukhtar S.A. From blood transfusion to patient blood management: a new paradigm for patient care and cost assessment of blood transfusion practice.//Intern. Med. J. 2012. Vol. 42, N 3. P. 332 — 338.
24. 
25. 
26. Olsen R.J. et al. Acute leukemia immunohistochemistry: a systematic diagnostic approach.//Arch. Pathol. Lab. Med. 2008. Vol. 132, N 3. P. 462 — 475.
27. Bene M.C. et al. Proposals for the immunological classification of acute leukemias. European Group for the Immunological Characterization of Leukemias (EGIL).//Leukemia. 1995. Vol. 9, N 10. P. 1783 — 1786.
28. Wu D. et al. Efficacy and safety of different doses of cytarabine in consolidation therapy for adult acute myeloid leukemia patients: A network meta-analysis//Sci. Rep. 2017. Vol. 7, N 1. P. 9509.
29. Ravandi F., Walter R.B., Freeman S.D. Evaluating measurable residual disease in acute myeloid leukemia.//Blood Adv. 2018. Vol. 2, N 11. P. 1356 — 1366.
30. Лобанова Т.И., Гальцева И.В., Паровичникова Е.Н. Исследование минимальной остаточной болезни у пациентов с острыми миелоидными лейкозами методом многоцветной проточной цитофлуориметрии (обзор литературы)//Онкогематология. 2018. Vol. 13, N 1. P. 83 — 102.
31. Лобанова Т.И. «Клиренс опухолевого клона у пациентов с разными молекулярно-генетическими вариантами острых миелоидных лейкозов»: диссертация… кандидата медицинских наук: 14.01.21. 2018. 166 p.
32. Herrmann J. et al. Evaluation and management of patients with heart disease and cancer: Cardio-oncology//Mayo Clin. Proc. 2014. Vol. 89, N 9. P. 1287 — 1306.
33. Roberts A.S. et al. Extramedullary haematopoiesis: radiological imaging features//Clinical Radiology. 2016. Vol. 71, N 9. P. 807 — 814.
34. Fritz J. et al. Radiologic spectrum of extramedullary relapse of myelogenous leukemia in adults.//AJR. Am. J. Roentgenol. 2007. Vol. 189, N 1. P. 209 — 218.
35. Arrigan M. et al. Imaging findings in recurrent extramedullary leukaemias//Cancer Imaging. 2013. Vol. 13, N 1. P. 26 — 35.
36. Almond L.M. et al. Myeloid Sarcoma: Presentation, Diagnosis, and Treatment//Clinical Lymphoma, Myeloma and Leukemia. Elsevier Inc., 2017. Vol. 17, N 5. P. 263 — 267.
37. Winestone L.E. et al. Disparities in pediatric acute myeloid leukemia (AML) clinical trial enrollment//Leuk. Lymphoma. Taylor and Francis Ltd, 2019. Vol. 60, N 9. P. 2190 — 2198.
38. Perel Y. et al. Treatment of childhood acute myeloblastic leukemia: Dose intensification improves outcome and maintenance therapy is of no benefit — Multicenter studies of the French LAME (
39. Rasche M. et al. Successes and challenges in the treatment of pediatric acute myeloid leukemia: a retrospective analysis of the AML-BFM trials from 1987 to 2012//Leukemia. Nature Publishing Group, 2018. Vol. 32, N 10. P. 2167 — 2177.
40. Шнейдер М.М. Эффективность риск-адаптированной терапии острого миелоидного лейкоза у детей с использованием режимов интенсивного тайминга и трансплантации гемопоэтических стволовых клеток. Диссертация на соискание ученой степени доктора медицинских наук. 2009. 223 p.
41. 
42. Creutzig U. et al. CNS irradiation in pediatric acute myleoid leukemia: Equal results by 12 or 18 Gy in studies AML-BFM98 and 2004//Pediatr. Blood Cancer. 2011. Vol. 57, N 6. P. 986 — 992.
43. Stevens R.F. et al. Marked improvements in outcome with chemotherapy alone in paediatric acute myeloid leukaemia: Results of the United Kingdom Medical Research Council’s 10th AML trial//Br. J. Haematol. 1998. Vol. 101, N 1. P. 130 — 140.
44. Ravindranath Y. et al. Pediatric Oncology Group (POG) studies of acute myeloid leukemia (AML): A review of four consecutive childhood AML trials conducted between 1981 and 2000//Leukemia. Nature Publishing Group, 2005. Vol. 19, N 12. P. 2101 — 2116.
45. Kardos G. et al. Treatment strategy and results in children treated on three Dutch Childhood Oncology Group acute myeloid leukemia trials//Leukemia. Nature Publishing Group, 2005. Vol. 19, N 12. P. 2063 — 2071.
46. Smith F.O. et al. Long-term results of children with acute myeloid leukemia: A report of three consecutive Phase III trials by the Children’s Cancer Group: CCG 251, CCG 213 and CCG 2891//Leukemia. Nature Publishing Group, 2005. Vol. 19, N 12. P. 2054 — 2062.
47. Perel Y. et al. Maintenance therapy in childhood acute myeloid leukemia//Ann. Hematol. 2004. Vol. Supp. 1. P. S116 — S119.
48. Toyama D. et al. Successful Treatment of Pediatric Refractory/Relapsed AML with KIR-Ligand-Mismatched Cord Blood Transplant after FLAG-IDA Reinduction Therapy with or without the GO Regimen//Case Rep. Hematol. Hindawi Limited, 2020. Vol. 2020.
49. Hashmi K.U. et al. FLAG-IDA in the treatment of refractory/relapsed acute leukaemias: Single centre study//J. Pak. Med. Assoc. 2005. Vol. 55, N 6. P. 234 — 238.
50. Safaian N.N. et al. Sorafenib (
51. Osone S. et al. Sorafenib Therapy for Pediatric Acute Myeloid Leukemia with FMS-like Tyrosine Kinase 3-internal Tandem Duplication Mutations: 2 Case Reports//J. Pediatr. Hematol. Oncol. Lippincott Williams and Wilkins, 2017. Vol. 39, N 4. P. e199 — e202.
52. Crews K.R. et al. Interim comparison of a continuous infusion versus a short daily infusion of cytarabine given in combination with cladribine for pediatric acute myeloid leukemia//J. Clin. Oncol. 2002. Vol. 20, N 20. P. 4217 — 4224.
53. Румянцев А.Г., Масчан А.А., Самочатова Е.В. Сопроводительная терапия и контроль инфекций при гематологических и онкологических заболеваниях. 2009. 448 p.
54. Coiffier B. et al. Guidelines for the management of pediatric and adult tumor lysis syndrome: An evidence-based review//Journal of Clinical Oncology. 2008. Vol. 26, N 16. P. 2767 — 2778.
55. Cairo M.S. et al. Recommendations for the evaluation of risk and prophylaxis of tumour lysis syndrome (TLS) in adults and children with malignant diseases: An expert TLS panel consensus//Br. J. Haematol. 2010. Vol. 149, N 4. P. 578 — 586.
56. Детская онкология. Национальное руководство. Под ред. М.Д. Алиева, В.Г. Полякова, Г.Л. Менткевича, С.А. Маяковой. М.: Издательская группа РОНЦ. Практическая медицина, 2012. 684 p.
57. Maertens J. et al. ECIL guidelines for preventing Pneumocystis jirovecii pneumonia in patients with haematological malignancies and stem cell transplant recipients//J. Antimicrobal Chemother. 2016. Vol. 71, N 9. P. 2397 — 2404.
58. Chen M. et al. Pyridoxine for Prevention of Hand-Foot Syndrome Caused by Chemotherapy: A Systematic Review//PLoS One. Public Library of Science, 2013. Vol. 8, N 8.
59. Korula A. et al. Invasive fungal infection following chemotherapy for acute myeloid leukaemia-Experience from a developing country//Mycoses. Blackwell Publishing Ltd, 2017. Vol. 60, N 10. P. 686 — 691.
60. Fisher B.T. et al. Effect of Caspofungin vs Fluconazole Prophylaxis on Invasive Fungal Disease among Children and Young Adults with Acute Myeloid Leukemia: A Randomized Clinical Trial//JAMA — J. Am. Med. Assoc. American Medical Association, 2019. Vol. 322, N 17. P. 1673 — 1681.
61. Mandhaniya S. et al. Oral voriconazole versus intravenous low dose amphotericin B for primary antifungal prophylaxis in pediatric acute leukemia induction: A prospective, randomized, clinical study//J. Pediatr. Hematol. Oncol. 2011. Vol. 33, N 8. P. e333 — 41.
62. Cornely O.A. et al. Posaconazole vs. fluconazole or itraconazole prophylaxis in patients with neutropenia//N. Engl. J. Med. Massachussetts Medical Society, 2007. Vol. 356, N 4. P. 348 — 359.
63. Ueda M. et al. Immunoglobulin therapy in hematologic neoplasms and after hematopoietic cell transplantation.//Blood Rev. 2018. Vol. 32, N 2. P. 106 — 115.
64. Nellis M.E., Goel R., Karam O. Transfusion Management in Pediatric Oncology Patients//Hematology/Oncology Clinics of North America. W.B. Saunders, 2019. Vol. 33, N 5. P. 903 — 913.
65. Szczepiorkowski Z.M., Dunbar N.M. Transfusion guidelines: when to transfuse.//Hematology/the Education Program of the American Society of Hematology. American Society of Hematology. Education Program. 2013. Vol. 2013. P. 638 — 644.
66. Абузарова Г.Р. et al. Обезболивание взрослых и детей при оказании медицинской помощи. Методические рекомендации. ФГБОУ ВО РНИМУ им. Н.И. Пирогова Минздрава России., 2016. 94 p.
67. Paul K.L. Rehabilitation and exercise considerations in hematologic malignancies.//Am. J. Phys. Med. Rehabil. 2011. Vol. 90, N 5 Suppl 1. P. S88 — 94.
68. Tramsen L. et al. Lack of effectiveness of neutropenic diet and social restrictions as anti-infective measures in children with acute myeloid leukemia: An analysis of the AML-BFM 2004 trial//J. Clin. Oncol. American Society of Clinical Oncology, 2016. Vol. 34, N 23. P. 2776 — 2783.
69. Milligan D.W. et al. Fludarabine and cytosine are less effective than standard ADE chemotherapy in high-risk acute myeloid leukemia, and addition of G-CSF and ATRA are not beneficial: Results of the MRC AML-HR randomized trial//Blood. American Society of Hematology, 2006. Vol. 107, N 12. P. 4614 — 4622.
70. Gibson B.E.S. et al. Results of a randomized trial in children with Acute Myeloid Leukaemia: Medical Research Council AML12 trial//Br. J. Haematol. 2011. Vol. 155, N 3. P. 366 — 376.
71. Creutzig U. et al. Toxicity and effectivity of high-dose Idarubicin during AML induction therapy: Results of a pilot study in children//Klin. Padiatr. 2000. Vol. 212, N 4. P. 163 — 168.
72. Creutzig U. et al. Improved treatment results in high-risk pediatric acute myeloid leukemia patients after intensification with high-dose cytarabine and mitoxantrone: Results of study acute myeloid Leukemia-Berlin-Frankfurt-
73. Acute myeloid leukemia. NCCN evidence blocks. 2020.
74. Uffmann M. et al. Therapy reduction in patients with Down syndrome and myeloid leukemia: the international ML-DS 2006 trial//Blood. American Society of Hematology, 2017. Vol. 129, N 25. P. 3314 — 3321.
75. Cornelissen J.J. et al. The European LeukemiaNet AML Working Party consensus statement on allogeneic HSCT for patients with AML in remission: An integrated-risk adapted approach//Nature Reviews Clinical Oncology. 2012. Vol. 9, N 10. P. 579 — 590.
Приложение А1
СОСТАВ
РАБОЧЕЙ ГРУППЫ ПО РАЗРАБОТКЕ И ПЕРЕСМОТРУ
КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Масчан А.А. — д.м.н., зам. генерального директора ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева, профессор кафедры гематологии, онкологии и лучевой терапии педиатрического факультета РНИМУ им. Н.И. Пирогова, член правления Национального общества детских гематологов и онкологов
Масчан М.А. — д.м.н., зам. генерального директора ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева, профессор кафедры гематологии, онкологии и лучевой терапии профессор кафедры гематологии, онкологии и лучевой терапии РНИМУ им. Н.И. Пирогова РНИМУ им. Н.И. Пирогова, член Национального общества детских гематологов и онкологов
Новичкова Г.А. — д.м.н., генеральный директор ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева, профессор кафедры гематологии, онкологии и лучевой терапии профессор кафедры гематологии, онкологии и лучевой терапии РНИМУ им. Н.И. Пирогова РНИМУ им. Н.И.Пирогова, член правления Национального общества детских гематологов и онкологов
Румянцев А.Г., д.м.н., академик РАН, президент ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева, профессор кафедры гематологии, онкологии и лучевой терапии педиатрического факультета РНИМУ им. Н.И. Пирогова, президент Национального общества детских гематологов и онкологов
Калинина И.И., к.м.н., врач-гематолог ФГБУ НМИЦ ДГОИ им. Дмитрия Рогачева
Конфликт интересов отсутствует
Приложение А2
МЕТОДОЛОГИЯ РАЗРАБОТКИ КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЙ
Целевая аудитория клинических рекомендаций:
1. Врачи-гематологи;
2. Врачи-онкологи;
3. Врачи-педиатры;
4. Врачи — анестезиологи-реаниматологи;
5. Врачи — клинические фармакологи.
Методология сбора доказательств
Методы, использованные для сбора/селекции доказательств:
Поиск публикаций в специализированных периодических печатных изданиях;
Поиск в электронных базах данных.
Базы данных, использованных для сбора/селекции доказательств:
Доказательной базой для рекомендаций являются публикации, вошедшие в Кохрайновскую библиотеку, базы данных PUBMED и MEDLINE. Глубина поиска составляла 30 лет.
Методы, использованные для анализа доказательств:
— Обзоры опубликованных мета-анализов;
— Систематические обзоры с таблицами доказательств.
Методы, использованные для качества и силы доказательств:
— Консенсус экспертов;
— Оценка значимости доказательств в соответствии с рейтинговой схемой доказательств (табл. А2.1 — А2.3).
Таблица А2.1. Шкала оценки уровней достоверности доказательств (УДД) для методов диагностики (диагностических вмешательств)
|
УДД |
Расшифровка |
|
1 |
Систематические обзоры исследований с контролем референсным методом или систематический обзор рандомизированных клинических исследований с применением мета-анализа |
|
2 |
Отдельные исследования с контролем референсным методом или отдельные рандомизированные клинические исследования и систематические обзоры исследований любого дизайна, за исключением рандомизированных клинических исследований, с применением мета-анализа |
|
3 |
Исследования без последовательного контроля референсным методом или исследования с референсным методом, не являющимся независимым от исследуемого метода или нерандомизированные сравнительные исследования, в том числе когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая |
|
5 |
Имеется лишь обоснование механизма действия или мнение экспертов |
Таблица А2.2. Шкала оценки уровней достоверности доказательств (УДД) для методов профилактики, лечения и реабилитации (профилактических, лечебных, реабилитационных вмешательств)
|
УДД |
Расшифровка |
|
1 |
Систематический обзор РКИ с применением мета-анализа |
|
2 |
Отдельные РКИ и систематические обзоры исследований любого дизайна, за исключением РКИ, с применением мета-анализа |
|
3 |
Нерандомизированные сравнительные исследования, в т.ч. когортные исследования |
|
4 |
Несравнительные исследования, описание клинического случая или серии случаев, исследования «случай-контроль» |
|
5 |
Имеется лишь обоснование механизма действия вмешательства (доклинические исследования) или мнение экспертов |
Таблица А2.3. Шкала оценки уровней убедительности рекомендаций (УУР) для методов профилактики, диагностики, лечения и реабилитации (профилактических, диагностических, лечебных, реабилитационных вмешательств)
|
УУР |
Расшифровка |
|
A |
Сильная рекомендация (все рассматриваемые критерии эффективности (исходы) являются важными, все исследования имеют высокое или удовлетворительное методологическое качество, их выводы по интересующим исходам являются согласованными) |
|
B |
Условная рекомендация (не все рассматриваемые критерии эффективности (исходы) являются важными, не все исследования имеют высокое или удовлетворительное методологическое качество и/или их выводы по интересующим исходам не являются согласованными) |
|
C |
Слабая рекомендация (отсутствие доказательств надлежащего качества (все рассматриваемые критерии эффективности (исходы) являются неважными, все исследования имеют низкое методологическое качество и их выводы по интересующим исходам не являются согласованными) |
Порядок обновления клинических рекомендаций.
Актуализация проводится не реже чем один раз в три года с учетом появившейся новой информации о диагностике и тактике ведения пациентов, страдающих ОМЛ. Решение об обновлении принимает Минздрав России на основе предложений, представленных медицинскими профессиональными некоммерческими организациями. Сформированные предложения должны учитывать результаты комплексной оценки лекарственных препаратов, медицинских изделий, а также результаты клинической апробации.
Приложение А3
СПРАВОЧНЫЕ МАТЕРИАЛЫ,
ВКЛЮЧАЯ СООТВЕТСТВИЕ ПОКАЗАНИЙ К ПРИМЕНЕНИЮ
И ПРОТИВОПОКАЗАНИЙ, СПОСОБОВ ПРИМЕНЕНИЯ И ДОЗ ЛЕКАРСТВЕННЫХ
ПРЕПАРАТОВ, ИНСТРУКЦИИ ПО ПРИМЕНЕНИЮ
ЛЕКАРСТВЕННОГО ПРЕПАРАТА
Приложение А3.1
ДИАГНОСТИЧЕСКИЕ ТЕСТЫ И ИССЛЕДОВАНИЯ,
ПРИМЕНЯЕМЫЕ У ПАЦИЕНТОВ ВПЕРВЫЕ ВЫЯВЛЕННЫМ ОМЛ
|
Показатель |
Исследования |
Необходимость проведения исследования |
|
Исследования, необходимые для установления диагноза |
Клинический анализ крови с формулой |
Да |
|
Аспират костного мозга |
Да |
|
|
Трепанобиопсия |
По показаниям |
|
|
Иммунофенотипирование |
Да |
|
|
Цитогенетика |
Да |
|
|
FISH |
По показаниям |
|
|
Скрининг RUNX1-RUNX1T1, CBFB-MYH1, PML/RARA или других генов |
Да |
|
|
Люмбальная пункция |
Да |
|
|
Необходимые исследования до начала лечения |
Анамнез жизни и заболевания |
Да |
|
Статус пациента (по шкалам ECOG/WHO) |
Да |
|
|
Биохимическое исследование, коагулограмма |
Да |
|
|
Тест на беременность |
Да |
|
|
HLA-типирование |
Да |
|
|
Тестирование крови на маркеры вирусов гепатитов B, C; ВИЧ |
Да |
|
|
Рентгенография органов грудной клетки |
Да |
|
|
КТ органов грудной клетки, головного мозга |
Да |
|
|
ЭКГ; ЭХО-КГ |
Да |
|
|
Биобанкинг |
Рекомендательно |
|
|
Мутации генов NPM1, CEBPA, FLT3 |
Рекомендательно |
|
|
Мутации генов WT1, RUNX1, MLL, KIT |
В рамках исследований |
|
|
Исследование прогностических маркеров |
RAS, TP53, TET2, IDH1 |
В рамках исследований |
|
Экспрессия генов ERG, MN1, EVI1, BAALC |
В рамках исследований |
|
|
Определение МОБ |
В рамках исследований |
|
Приложение А3.2
ВАРИАНТЫ КУРСОВ ХИМИОТЕРАПИИ ПРИ ОМЛ
В России традиционно применяются протоколы немецкой группы BFM (
Таблица 1. Результаты терапии по протоколу AML-BFM-98
|
Достижение ремиссии, % |
Вероятность ОВ в течение 4 лет, % |
Вероятность БСВ в течение 4 лет, % |
Вероятность БРВ в течение 4 лет, % |
|
|
Все пациенты |
90 |
67 |
55 |
61 |
|
Стандартный риск |
91 |
78 |
65 |
71 |
|
Высокий риск |
87 |
55 |
40 |
46 |
БСВ — бессобытийная выживаемость, ОВ — общая выживаемость, БРВ — безрецидивная выживаемость.
Исследование AML-BFM-98, которое было призвано сравнить эффективность ранней шестинедельной постремиссионной терапии стандартными дозами цитарабина**, преднизолона**, 6-тиогуанина, циклофосфамида** и доксорубицина** с двумя «блоками» высокодозного цитарабина**, показало, что при одинаковой эффективности частота инфекционных осложнений в группе длительной терапии была выше. В связи с этим группа BFM отказалась от 6-недельной консолидации, использовавшейся в течение 20 лет, в пользу короткой высокодозной терапии [39].
В настоящее время в большинстве клиник РФ применяются модифицированные схемы протокола BFM 2004 года [39].
Описание лечения.
Терапия по модифицированной версии протокола AML-BFM-98/2004 показана детям с первичным ОМЛ, которые не могут быть включены в современные клинические исследования. Пациенты со вторичным и бифенотипическим ОМЛ также могут получать это лечение, однако для них может потребоваться индивидуальная коррекция протокола.
Модифицированная версия протокола AML-BFM-2004 (ветвь высокодозной терапии)
Химиотерапия, согласно «блоковой» ветви протокола, состоит из 5 циклов химиотерапии и поддерживающей терапии 6-тиогуанином ежедневно и стандартными дозами цитозин-арабинозида ежемесячно. (схема 1)
Схема 1. Общий план химиотерапии согласно протоколу AML-BFM-2004 (ветвь высокодозной терапии) [68].
Блоки
Индукция ремиссии AIE:
Начинается независимо от наличия лейкопении и тромбоцитопении!!!
Цитарабин** 100 мг/м2/сутки постоянной инфузией в течение 1-х и 2-х суток, затем
Цитарабин** 100 мг/м2 30-минутной инфузией каждые 12 часов в дни 3 — 8;
Идарубицин** 12 мг/м2 60-минутной инфузией каждые 24 часа в дни 3, 5, 7, перед цитарабином**;
Этопозид** 150 мг/м2 2-часовой инфузией инфузией в дни 6 — 8, за 6 часов до Ara-C;
Цитарабин** интратекально в возрастной дозировке в день 1 и 8.
HAM:
Условие начала блока: гранулоциты > 1000/мкл, лейкоциты > 2000/мкл, тромбоциты > 100 000/мкл
Высокие дозы цитарабина** 3000 мг/м2 3-часовой инфузией каждые 12 часов в дни 1 — 3;
Митоксантрон** 10 мг/м2 60-минутной инфузией в дни 3 и 4;
Цитарабин** интратекально в возрастной дозировке в день 1.
AI:
Условие начала блока: гранулоциты > 1000/мкл, лейкоциты > 2000/мкл, тромбоциты > 100 000/мкл
Цитарабин** 500 мг/м2/сутки непрерывной инфузией в течение 4 дней;
Идарубицин** 7 мг/м2 60-минутной инфузией в дни 3 и 5;
Цитарабин** интратекально в возрастной дозировке в дни 1, 6.
haM:
Условие начала блока: гранулоциты > 1000/мкл, лейкоциты > 2000/мкл, тромбоциты > 100 000/мкл
Цитарабин** 1000 мг/м2 60-минутной инфузией каждые 12 часов в дни 1 — 3;
Митоксантрон** 10 мг/м2/сутки 60-минутной инфузией в дни 3 и 4;
Цитарабин** интратекально в возрастной дозировке в дни 1, 6.
HAE:
Условие начала блока: гранулоциты > 1000/мкл, лейкоциты > 2000/мкл, тромбоциты > 100 000/мкл
Высокие дозы цитарабина** 3 г/м2 3-часовой инфузией каждые 12 часов в дни 1 — 3;
Этопозид** 125 мг/м2 2-часовой инфузией инфузией в дни 2 — 5;
Цитарабин** интратекально в возрастной дозировке в день 1.
Поддерживающая терапия:
В протоколах группы BFM поддерживающая терапия цитарабином** по 40 мг/м2 подкожно 1 раз в сутки по 4 дня каждого месяца применяется после восстановления гемопоэза после последнего курса интенсивной химиотерапии до истечения 18 месяцев от начала лечения.
Однако другими исследовательскими группами после аналогичной интенсивной химиотерапии низкодозная поддерживающая терапия не применяется [38].
Профилактика осложнений, связанных с легочным и церебральным лейкостазом при инициальном гиперлейкоцитозе. Данное осложнение наиболее характерно для пациентов с вариантами M4 и M5 и инициальным лейкоцитозом более 50 x 109/л и с вариантами M1 и M2 с инициальным лейкоцитозом > 100 x 109/л, хотя может развиться и при существенно более низких показателях лейкоцитоза. Популяцию наивысшего риска развития синдрома лейкостаза составляют дети младшего возраста с моноцитарными субвариантами ОМЛ, сопровождаемыми коагулопатией. В этой группе пациентов назначение полных доз цитозин-арабинозида сопряжено с резким возрастанием риска лейкостаза, вследствие этого таким пациентам показано проведение лейкоцитафереза (либо заменного переливания у пациентов до 3-х летнего возраста), и/или медикаментозной циторедукции.
Последняя может включать 6-меркаптопурин 40 мг/м2 в сутки в сочетании с гидроксимочевиной в дозе 1500 мг/м2 в сутки и назначаться до снижения лейкоцитоза ниже 50 x 109/л.
Опыт НМИЦ ДГОИ свидетельствует об эффективности циторедукции сниженными дозами этопозида и даунорубицина (или другого антрациклина) без цитозин-арабинозида. Даунорубицин** (22,5 мг/м2/сутки) и этопозид** (50 мг/м2/сутки) вводятся постоянной инфузией до тех пор, пока уровень лейкоцитов не достигнет 50 x 109/л, но не более 3-х суток. Далее проводится индукция цитарабином** с дозами антрациклина и VP-16, из которых вычтена суммарная доза этих препаратов, полученных на фазе циторедукции. Кроме того, на протяжении циторедуктивной фазы применяется дексаметазон** внутривенно струйно в дозе 10 мг/м2/сутки (разделить на 3 введения). В течение всего курса циторедукции не следует проводить заместительные трансфузии эритроцитов, если уровень гемоглобина не снижается ниже 70 г/л [40].
Варианты курсов индукции и консолидации
|
Программа индукции/консолидации |
Препараты |
|
ADE [69] |
Цитарабин** 100 мг/м2, в/в 2 раза в сутки в 1 — 10-й дни, всего 20 доз в 1 цикл, далее в 1 — 8 дни, всего 16 доз |
|
Даунорубицин** 50 мг/м2, дни 1, 3 и 5 |
|
|
Этопозид 100 мг/м2, дни 1 — 5 |
|
|
AME [70] |
Цитарабин** 100 мг/м2, в/в 2 раза в сутки в 1 — 10-й дни, всего 20 доз |
|
Митоксантрон** 12 мг/м2 в/в, дни 1, 3, 5 |
|
|
Этопозид** 100 мг/м2 в/в, дни 1 — 5 |
|
|
AIE [71] |
Цитарабин** 100 мг/м2 в/в 2 раза в сутки в 1 — 2 дни, всего 4 дозы, 120 мг/м2 в/в 2 раза в сутки в 3 — 8 дни (всего 12 доз) |
|
Идарубицин** 12 мг/м2 в/в, дни 3 — 5 |
|
|
Этопозид** 150 мг/м2 в/в, дни 6 — 8 |
|
|
HAM30 [72] |
Цитарабин** 3000 мг/м2 в/в x 2 раза в сутки 1 — 3 дни |
|
Митоксантрон** 10 мг/м2 в/в 1 раз в день в 4 — 5 й дни |
|
|
HiDAC [73] |
Цитарабин** 3000 мг/м2 3-часовая в/в инфузия x 2 раза в день, дни 1 — 3 |
|
FLAI [73] |
Флударабин** 30 мг/м2 в/в 30-минутная инфузия 1 — 5 дни |
|
Цитарабин** 2000 мг/м2 3-часовая в/в инфузия 1 раз в день через 4 часа после введения флударабина, в/в 1 — 5 дни |
|
|
Идарубицин** 12 мг/м2 в/в 10-минутная инфузия после окончания флударабина** в 1, 3, 5 дни курса |
Протокол AML-BFM DS 2006
У детей с ОМЛ, развившимся на фоне синдрома Дауна, токсичность высоких доз антрациклинов в сочетании с высокими дозами цитарабина** гораздо выше, чем у пациентов без синдрома Дауна; поэтому они должны получать лечение по специальному протоколу (AML-BFM DS 2006) [74].
Схема 2. Общий план химиотерапии согласно протоколу AML-BFM DS 2006.
Блоки
AIE:
Цитарабин** 100 мг/м2/сутки постоянной инфузией в течение 1-х и 2-х суток, затем
Цитарабин** 100 мг/м2 30-минутной инфузией каждые 12 часов в дни 3 — 8;
Идарубицин** 8 мг/м2 60-минутной инфузией каждые 24 часа в дни 3, 5, 7 перед цитарабином**;
Этопозид** 150 мг/м2 2-часовой инфузией инфузией в дни 6 — 8, за 6 часов до цитарабина**;
Цитарабин** интратекально в возрастной дозировке в день 1.
AI:
Условие начала блока: гранулоциты > 1000/мкл, лейкоциты > 2000/мкл, тромбоциты > 100 000/мкл
Цитарабин** 500 мг/м2/сутки непрерывной инфузией в течение 4 дней;
Идарубицин** 5 мг/м2 60-минутной инфузией в дни 3 и 5;
Цитарабин** интратекально в возрастной дозировке в день 0.
haM:
Условие начала блока: гранулоциты > 1000/мкл, лейкоциты > 2000/мкл, тромбоциты > 100 000/мкл
Цитарабин** 1000 мг/м2 60-минутной инфузией каждые 12 часов в дни 1 — 3;
Митоксантрон** 7 мг/м2/сутки 60-минутной инфузией в дни 3 и 4;
Цитарабин** интратекально в возрастной дозировке в день 0.
HA:
Условие начала блока: гранулоциты > 1000/мкл, лейкоциты > 2000/мкл, тромбоциты > 100 000/мкл
Высокие дозы цитарабина** 3 г/м2 3-часовой инфузией каждые 12 часов в дни 1 — 3;
Цитарабин** интратекально в возрастной дозировке в день 0.
Приложение А3.3
ПОКАЗАНИЯ К АЛЛО-ТКМ/АЛЛО-ТГСК В ПЕРВОЙ ПОЛНОЙ РЕМИССИИ ОМЛ
Таблица 3.3.1. Синтетические показания к алло-ТКМ в первой полной ремиссии ОМЛ в зависимости от молекулярно-генетических, клинических характеристик ОМЛ и риска трансплантационной летальности [75]
|
Группа интегрированного риска |
Определение группы риска |
Риск развития рецидива в зависимости от выполнения |
Балльная оценка прогноза летальности, не связанной с рецидивом, которая позволяет считать алло-ТГСК предпочтительным вариантом консолидации |
||||
|
ХТ или ауто-ТГСК, % |
алло-ТГСК, % |
шкала EBMT |
шкала HCT-CI |
риск смерти, не связанный с рецидивом, % |
|||
|
Благоприятный |
— |
t(8;21) и л. |
35 — 40 |
15 — 20 |
|
< 1 |
10 — 15 |
|
— |
inv16; t(16;16) до 35 лет |
||||||
|
— |
мутация CEBPA (2-аллельная) |
||||||
|
— |
мутация NPM без FLT3-ITD мутаций |
||||||
|
— |
ПР после 1-го курса индукции |
||||||
|
— |
Отсутствие МОБ |
||||||
|
Промежуточный |
— |
t(8;21) и л. > 20 x 109/л |
50 — 55 |
20 — 25 |
|
|
< 20 — 25 |
|
— |
Нормальный кариотип (или потеря только X, или только Y хромосомы) с л. |
||||||
|
Плохой |
— |
Недостижение ПР после 1-го курса у пациентов из групп благоприятного и промежуточного риска |
70 — 80 |
30 — 40 |
|
|
< 30 |
|
— |
Нормальный кариотип и л. > 100 x 109/л |
||||||
|
— |
Аномальный кариотип, не отмеченный в группе промежуточного и очень плохого прогноза |
||||||
|
Очень плохой |
Моносомный кариотип |
> 90 |
40 — 50 |
|
|
< 40 |
Приложение Б
АЛГОРИТМЫ ДЕЙСТВИЙ ВРАЧА
Приложение В
ИНФОРМАЦИЯ ДЛЯ ПАЦИЕНТА
Острый миелоидный лейкоз — редкое злокачественное заболевание кроветворной ткани, характеризующееся неконтролируемой пролиферацией, нарушением дифференцировки и накоплением в костном мозге и периферической крови незрелых гемопоэтических клеток.
При развитии ОМЛ поражаются все органы и системы, т.к. заболевание носит генерализованный (распространенный) характер. В клинической картине заболевания преобладают синдромы, связанные с прогрессирующим нарастанием количества злокачественных клеток в костном мозге, а также в печени, селезенке, также возможно поражение ЦНС и других органов и систем. Наиболее частое проявление заболевания:
1. Лихорадка.
Повышение температуры тела выше 38,0 °C может быть первым и единственным проявлением заболевания, в связи с наличием бластных (опухолевых) клеток, выделением их продуктов жизнедеятельности, а также в связи с развитием инфекционного процесса
2. Инфекционный процесс (ангина, стоматит, пневмония и др.) развивается в связи с вытеснением бластными клетками клеток нормального кроветворения — лейкоцитов/нейтрофилов, защищающих в здоровом состоянии организм ребенка от бактериальной и грибковой инфекции
3. Геморрагический синдром (кровотечения, появления синяков) вследствие вытеснения бластными клетками из нормального кроветворения тромбоцитов (клеток, ответственных за остановку кровотечения)
4. Анемический синдром (бледность, вялость, быстрая утомляемость, слабость) также развивается из-за отсутствия эритроцитов (снижение гемоглобина) в костном мозге пациента с ОМЛ
5. Боль в костях и других пораженных органах
6. Увеличение размеров печени и селезенки, появление желтухи
7. Поражение ЦНС может проявляться головной болью, рвотой, судорогами
Для установления диагноза необходимо выполнение большого количества исследований крови, пункции костного мозга и люмбальной пункции, рентгеновских и томографических исследований. Для проведения химиотерапии необходима постановка центрального венозного катетера (ЦВК), во избежание многочисленных уколов в периферические вены.
Все инвазивные процедуры (пункции, постановка ЦВК) выполняются под общей анестезией.
Лечение острого миелоидного лейкоза состоит в основном из двух этапов: интенсивная фаза терапии и проведение трансплантации гемопоэтических стволовых клеток. Во время интенсивной фазы химиотерапия проводится с небольшими интервалами, часто необходимо пребывание пациента в стационаре. Химиотерапия первой линии состоит из трех основных препаратов: цитозар, вепезид, даунорубицин (идарубицин или митроксантрон). Затем проводится несколько курсов высокодозной химиотерапии.
Побочные эффекты химиотерапии:
1. Выпадение волос
2. Тошнота и рвота
3. Снижение/изменение аппетита
4. Лихорадка
5. Развитие инфекционных очагов
6. Целью терапии является излечение болезни, предотвращение рецидивов и осложнений, связанных как с проявлениями болезни, так и с развитием индуцированной (вызванной химиотерапией) аплазии кроветворения. Суммарная длительность терапии составляет около 6 месяцев, без проведения ТГСК. Сокращение длительности терапии может привести к увеличению риска рецидива болезни. При терапии в соответствии с современными программами лечения вероятность выздоровления составляет около 70%.
Приложение Г1 — ГN
ШКАЛЫ ОЦЕНКИ, ВОПРОСНИКИ И ДРУГИЕ ОЦЕНОЧНЫЕ ИНСТРУМЕНТЫ
СОСТОЯНИЯ ПАЦИЕНТА, ПРИВЕДЕННЫЕ В КЛИНИЧЕСКИХ РЕКОМЕНДАЦИЯХ
Приложение Г1
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКАЯ КЛАССИФИКАЦИЯ ОМЛ
Таблица Г1.1. European Leukemia Net (ELN) молекулярно-генетическая классификация ОМЛ (2017 г.) [25].
|
Категории риска |
Молекулярно-генетические характеристики |
|
Благоприятный прогноз |
t(8;21)(q22;q22.1); RUNX1-RUNX1T1 |
|
inv(16)(p13.1q22) or t(16;16)(p13.1;q22); CBFB-MYH11 |
|
|
Мутации NPM1 без FLT3-ITD или с FLT3-ITD и низкой аллельной нагрузкой <*> |
|
|
Биаллельная мутация CEBPA |
|
|
Промежуточный прогноз |
Мутации NPM1 и FLT3-ITD с высокой аллельной нагрузкой <**> |
|
Дикий тип гена NPM1 без FLT3-ITD или с FLT3-ITD с низкой аллельной нагрузкой (при отсутствии цитогенетических критериев неблагоприятного прогноза) |
|
|
t(9;11)(p21.3;q23.3); MLLT3-KMT2Ad |
|
|
Цитогенетические аномалии, которые не относятся к категории благоприятного прогноза или неблагоприятного прогноза |
|
|
Неблагоприятный прогноз |
t(6;9)(p23;q34.1); DEK-NUP214 |
|
t(v;11q23.3); перестройки KMT2A |
|
|
t(9;22)(q34.1;q11.2); BCR-ABL1 |
|
|
inv(3)(q21.3q26.2) или t(3;3)(q21.3;q26.2); GATA2, MECOM(EVI1) |
|
|
-5 or del(5q); -7; -17/abn(17p) |
|
|
Комплексный кариотип |
|
|
Моносомный кариотип |
|
|
Дикий тип гена NPM1 и FLT3-ITD с высокой аллельной нагрузкой** |
|
|
Мутации RUNX1 <***> |
|
|
Мутации ASXL1 <***> |
|
|
Мутации TP53 |
———————————
<*> Низкая аллельная нагрузка (0,5).
<**> Высокая аллельная нагрузка ( 0,5).
<***> Если указанные мутации обнаруживают у пациентов с благоприятными цитогенетическими аномалиями, то их обнаружение не имеет значимости.
Приложение Г2
МОЛЕКУЛЯРНО-ГЕНЕТИЧЕСКИЕ ПРОГНОСТИЧЕСКИЕ ФАКТОРЫ
РИСКА ПРИ ОМЛ
Таблица Г2.1. Молекулярно-генетические и клинические признаки ОМЛ, разделяющие пациентов на благоприятную и неблагоприятную прогностические группы [25]
|
Цитогенетические маркеры |
Молекулярные маркеры |
Клинические факторы |
|
Благоприятные прогностические факторы: |
||
|
t(15;17), (t(8;21)(q22;q22); inv(16)(p13.1q22) или t(16;16)(p13.1;q22) |
Мутированный CEBPA (биаллельная мутация), |
Негативные маркеры МОБ |
|
мутированный NPM1 без FLT3-ITD при нормальном кариотипе |
||
|
Неблагоприятные прогностические факторы: |
||
|
inv(3)(q21q26.2) или |
Увеличена экспрессия Evi1; |
Вторичный ОМЛ |
|
t(3;3)(q21;q26.2); |
MLL-реаранжировки; |
Гиперлейкоцитоз (> 100 х 109/л для любого |
|
t(9;22), |
FLT3-ITD-мутация; |
|
|
t(6;9)(p23;q34); |
DNMT3A-мутация; |
M0-вариант по FAB) |
|
t(v;11)(v;q23); |
С-KIT-мутация (для t(8;21); inv(16)) |
Экспрессия CD34 на бластных клетках |
|
-5 или del(5q); |
BAALC-экспрессия |
Экстрамедуллярные поражения (особенно, кожа) |
|
-7; |
ERG-экспрессия |
|
|
аберрации (17р); |
MN1-экспрессия |
Отсутствие ремиссии после первого курса |
|
комплексный кариотип, моносомный кариотип |
||
|
WT1-полиморфизм |
Персистенция маркеров МОБ |
|
|
BCR-ABL-позитивность |
ФГБУ «Национальный медицинский исследовательский центр гематологии» Минздрава России, Москва, Россия ,
Паровичникова Е.Н.
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
Афанасьев Б.В.
Клиника «Институт детской гематологии и трансплантологии им. Р.М. Горбачевой» Санкт-Петербургского государственного медицинского университета им. И.П. Павлова
Грицаев С.В.
Российский НИИ гематологии и трансфузиологии, Санкт-Петербург;
К/О «Гематология»
Семочкин С.В.
Российский национальный исследовательский медицинский университет им. Н.И. Пирогова, Москва
Бондаренко С.Н.
Институт детской онкологии, гематологии и трансплантологии им. Р.М. Горбачевой, СПбГМУ им. акад. И.П. Павлова
Троицкая В.В.
ФГБУ «Гематологический научный центр» Минздрава России, Москва, Россия
Соколов А.Н.
Гематологический научный центр Минздрава России, Москва
Кузьмина Л.А.
Гематологический научный центр Минздрава России, Москва
Клясова Г.А.
Гематологический научный центр Минздрава России, Москва
Баранова О.Ю.
РОНЦ им. Н.Н. Блохина РАМН, Москва
Лапин В.А.
ОКБ, Ярославль
Константинова Т.С.
ОКБ, Екатеринбург
Самойлова О.С.
ОКБ, Новгород
Капорская Т.С.
ОКБ, Иркутск
Шатохин С.В.
Государственный медицинский университет, Ростов
Клинические рекомендации российских экспертов по лечению больных острыми миелоидными лейкозами в возрасте моложе 60 лет
Авторы:
Савченко В.Г., Паровичникова Е.Н., Афанасьев Б.В., Грицаев С.В., Семочкин С.В., Бондаренко С.Н., Троицкая В.В., Соколов А.Н., Кузьмина Л.А., Клясова Г.А., Баранова О.Ю., Лапин В.А., Константинова Т.С., Самойлова О.С., Капорская Т.С., Шатохин С.В.
Как цитировать:
Савченко В.Г., Паровичникова Е.Н., Афанасьев Б.В., Грицаев С.В., Семочкин С.В., Бондаренко С.Н., Троицкая В.В., Соколов А.Н., Кузьмина Л.А., Клясова Г.А., Баранова О.Ю., Лапин В.А., Константинова Т.С., Самойлова О.С., Капорская Т.С., Шатохин С.В. Клинические рекомендации российских экспертов по лечению больных острыми миелоидными лейкозами в возрасте моложе 60 лет. Терапевтический архив.
2014;86(7):4‑13.
Savchenko VG, Parovichnikova EN, Afanas’ev BV, Gritsaev SV, Semochkin SV, Bondarenko SN, Troitskaya VV, Sokolov AN, Kuz’mina LA, Kliasova GA, Baranova OIu, Lapin VA, Konstantinova TS, Samoĭlova OS, Kaporskaia TS, Shatokhin SV. Russian experts’ clinical guidelines for acute myeloid leukemia treatment in patients less than 60 years of age. Terapevticheskii Arkhiv. 2014;86(7):4‑13. (In Russ.)

Долгосрочные результаты лечения взрослых больных острыми миелоидными лейкозами (ОМЛ) в течение последних 30 лет, несмотря на совершенствование терапии выхаживания и использования ряда новых, в том числе так называемых таргетных препаратов, принципиально не изменились. В среднем 5-летняя общая выживаемость больных моложе 60 лет по данным крупных кооперативных исследовательских групп составляет 35-50%, варьируя от 10 до 90% в зависимости от молекулярно-генетических особенностей лейкемии. Число летальных исходов, связанных с лечением, у этих больных составляет 7-18%. В лечении пожилых больных долгосрочные результаты не претерпели практически никаких изменений в течение 3 последних десятилетий и 5-летняя выживаемость не превышает 10-12%.
Именно ОМЛ является той областью клинической гематологии, в которой продолжаются интенсивные клинические и лабораторные исследования, направленные на любой положительный сдвиг в устоявшихся долгосрочных результатах.
Международные эксперты настоятельно советуют включать пациентов в клинические исследования и сохранять их биологические образцы для возможности дальнейшего исследования и установления корреляции между лабораторными данными и исходом заболевания. Использование принципов доказательной медицины в такой области, как гематология, является необходимым, поскольку, пожалуй, ни в какой другой области медицинских знаний не приходится постоянно сталкиваться с критическими ситуациями и принятием критических решений.
Считается, что ОМЛ заболевают в среднем 3-5 человек на 100 тыс. населения в год. При этом заболеваемость резко увеличивается в возрасте старше 60 лет и составляет 12-13 на 100 тыс. у лиц старше 80 лет. Медиана возраста этого заболевания составляет 65 лет. По опубликованным в США статистическим данным предполагалось, что в 2013 г. при населении 320 млн ОМЛ заболеют около 16 тыс. граждан США, при этом ОМЛ станет причиной смерти 10 тыс. больных [1].
В России объективных эпидемиологических данных, к сожалению, не существует. Сведения, приводимые в отчетах Ракового регистра, представляются заниженными: 2287 больных ОМЛ в год (данные за 2011 г.) [2]. При численности населения 140 млн в Российской Федерации расчетный показатель заболеваемости (исходя из европейских и американских данных) должен составлять около 5 тыс. заболевших.
Кроме того, по результатам регистрационного исследования, выполненного Российской исследовательской группой по изучению острых лейкозов в ряде регионов Российской Федерации, медиана возраста диагностики ОМЛ составляет 53 года, а это более чем на 10 лет меньше, чем в западных странах. Эти показатели свидетельствуют как о недостаточной диагностике ОМЛ у больных старшей возрастной группы, так и меньшей продолжительности жизни населения в нашей стране. И хотя ОМЛ относят к редким («орфанным») заболеваниям, социальная значимость лечения этого самого грозного заболевания системы крови определяет необходимость организации адекватной специализированной помощи, предусматривающей взаимодействие многих медицинских дисциплин, совокупность клинических, лабораторных, инструментальных и научных исследований, преемственность стационарной и амбулаторной помощи. Более того, ОМЛ остается основным показанием к выполнению трансплантации аллогенного костного мозга (алло-ТКМ) как самого эффективного метода лечения лейкемии. С каждым годом в мире увеличивается число пациентов, перенесших трансплантацию, за счет как налаживания кооперации между трансплантационными и гематологическими центрами, увеличения числа центров трансплантации, так и расширения показаний для больных пожилого возраста вследствие появления новых режимов кондиционирования пониженной интенсивности.
В 2010 г. опубликованы Рекомендации европейских экспертов по диагностике и лечению ОМЛ [3]. В течение 10 лет в США разрабатываются и постоянно обновляются рекомендации Национальной общественной противораковой сети (NCCN) [4]. В последние годы достигнут значительный прогресс в понимании молекулярно-генетической и эпигенетической основы развития ОМЛ, что позволило определить новые диагностические и прогностические маркеры заболевания. В классификации ОМЛ Всемирной организации здравоохранения 2008 г. учтены генетические и молекулярные варианты ОМЛ [5]. Изданы Европейские рекомендации по оптимальной интеграции алло-ТКМ в программную терапию ОМЛ [6].
Целью настоящей публикации является представление консолидированного мнения ведущих российских экспертов в области лечения лейкемии по вопросу терапии ОМЛ у больных моложе 60 лет.
Российская исследовательская группа по изучению острых лейкозов с 1992 г. провела 5 национальных рандомизированных клинических исследований у больных ОМЛ в возрасте от 16 до 60 лет, координационным центром которых был ГНЦ Минздрава России и в которых принимали участие гематологические центры из более чем 30 городов России. Результаты этих исследований неоднократно публиковались и обсуждались на ежегодных рабочих совещаниях исследовательской группы [7, 8]. Кроме того, при создании клинических рекомендаций использован опыт многих федеральных и региональных гематологических и трансплантационных центров.
Таким образом, итоги этих исследований и опыт по внедрению программной терапии ОМЛ в регионах Российской Федерации, а также заключения европейских и американских экспертных групп положены в основу настоящих рекомендаций. Все рекомендации, за исключением отдельно отмеченных буквой «С» или «В» (с тем или иным уровнем рекомендуемости), носят уровень доказательности не менее A2.
Лечение больных ОМЛ в возрасте от 18 до 60 лет
1. Индукционная химиотерапия (ХТ)
Индукционная ХТ должна быть начата сразу после того, как все диагностические мероприятия будут завершены, желательно с минимальной задержкой. Данные ретроспективных исследований показали, что именно у больных моложе 60 лет отсрочка в начале лечения неблагоприятно влияет на исходы, особенно, если от установления диагноза до начала терапии прошло более 5 дней.
Тем не менее следует подчеркнуть, что в обычной клинической практике у ряда больных даже молодого возраста тяжелая сопутствующая патология не позволяет выполнить адекватную цитостатическую терапию. Противопоказаниями к немедленному началу адекватной цитостатической терапии служат следующие:
1) тяжелая застойная сердечная недостаточность (фракция выброса менее 50%), нестабильная стенокардия, грубые нарушения ритма и проводимости с нестабильностью гемодинамики, острый инфаркт миокарда (анамнез менее 1 мес);
2) почечная недостаточность (концентрация креатинина в сыворотке крови более 0,2 ммоль/л, или более 200 мг/мкл; за исключением случаев, обусловленных лейкемической инфильтрацией почек);
3) печеночная недостаточность (за исключением случаев, обусловленных лейкемической инфильтрацией органа), острый вирусный гепатит В или С;
4) тяжелая пневмония (дыхательная недостаточность — одышка более 30 дыхательных движений в 1 мин, артериальная гипоксемия менее 80 мм рт.ст.). При этом следует иметь в виду, что если в течение 2-3 дней не удается стабилизировать состояние пациента, курс ХТ должен быть начат, поскольку нередко диагностируется исходное поражение легочной ткани лейкемическими клетками и без специфической терапии шансы на излечение пневмонии чрезвычайно малы;
5) сепсис (при нестабильности гемодинамики); только высокая лихорадка без характерных признаков сепсиса не может служить поводом к отсрочке ХТ;
6) угрожающие жизни кровотечения (желудочно-кишечное, профузное маточное, кровоизлияние в головной мозг);
7) тяжелые психические нарушения (бред, тяжелый депрессивный синдром и другие проявления продуктивной симптоматики);

9) декомпенсированный сахарный диабет;
10) неконтролируемое течение сопутствующего онкологического заболевания.
В случае, если при поступлении в стационар у пациента имелось одно из указанных состояний, но в результате интенсивного симптоматического лечения его удалось купировать или уменьшить, то по истечении 3-7 дней может быть начата цитостатическая ХТ. Если в ходе лечения сопутствующей патологии отмечается увеличение количества лейкоцитов, процентного содержания бластных клеток в периферической крови или исходно количество лейкоцитов составляет 100·109/л и более, целесообразно к терапии осложнений добавить гидроксимочевину в дозе 100 мг/кг/сут и в случае необходимости для профилактики синдрома распада опухоли выполнить плазмаферез.
Если состояние больного вследствие крайне тяжелых осложнений, связанных с заболеванием или вследствие тяжелой сопутствующей патологии не удается стабилизировать в течение максимум 7 дней, возможно рассмотреть вопрос о паллиативном цитостатическом воздействии (например, цитарабин в малых дозах — МДЦ).
Первым курсом индукции, по мнению российских и международных экспертов, должно быть 7-дневное введение цитарабина в дозе 100-200 мг/м2 либо 2 раза в сутки как короткая инфузия либо в виде непрерывной внутривенной инфузии в сочетании с 3-дневным введением антрациклинов: даунорубицина в дозе как минимум 60 мг/м2 (необходимость применения более высоких доз даунорубицина в настоящее время подвергается сомнению) или идарубицина в дозе 12 мг/м2 или митоксантрона 10 мг/м2. Так называемая схема 7+3 в настоящее время является стандартом индукционной терапии. После применения одного курса удается достичь полной ремиссии (ПР) у 55-65%, после двух — у 65-75% больных ОМЛ в возрасте моложе 60 лет. Ни один из исследуемых режимов в настоящее время не продемонстрировал большей эффективности при сопоставимой токсичности.
Рандомизированные исследования по сравнению эффективности даунорубицина в дозе 45-60 мг/м2 с другими антрациклинами, такими как идарубицин или акларубицин, или амсакрин, или митоксантрон, проведены в начале 90-х годов прошлого века. Ни в одном из этих исследований не выявлено преимуществ в долгосрочных результатах альтернативных даунорубицину препаратов в эквивалентных дозах. Исследование американской группы (ECOG) по применению даунорубицина в дозе 90 мг/м2, свидетельствующее в пользу даунорубицина в высоких дозах, с точки зрения российских и ряда европейских экспертов не должно ложиться в основу программ лечения, так как эта дозировка не имеет преимуществ перед дозой даунорубицина 60 мг/м2 (по крайней мере по приводимым в исследовании долгосрочным результатам).
Эквивалентными нужно считать следующие разовые дозы антрациклиновых антибиотиков: даунорубицин — 60 мг/м2, идарубицин — 12 мг/м2, митоксантрон — 10 мг/м2. Амсакрин не зарегистрирован в Российской Федерации. Доксорубицин (адриабластин) не используют в индукции ремиссии ОМЛ.
В индукции цитарабин в высоких дозах — ВДЦ (3 г/м2 2 раза в сутки в 1, 3 и 5-й дни или 2 г/м2 2 раза в сутки в 1-6-й дни) в сочетании с антрациклинами не дает долгосрочных преимуществ, может увеличивать частоту достижения ПР после первого курса, однако обладает более высокой токсичностью и, соответственно, обусловливает большую вероятность ранней летальности. Вне клинических исследований ВДЦ в индукционных курсах использовать не рекомендуется.
Попытки увеличения частоты достижения ПР путем добавления дополнительных цитотоксических препаратов к стандартному режиму ХТ (тиогуанин, этопозид, флударабин, топотекан и др.) или модуляторов механизмов множественной лекарственной резистентности не привели к успеху.
Результаты применения колониестимулирующих факторов роста в качестве препаратов, повышающих чувствительность лейкемических клеток к цитостатическому воздействию (гранулоцитарный колониестимулирующий фактор — Г-КСФ и гранулоцитарно-макрофагальный колониестимулирующий фактор — ГМ-КСФ), так называемого «прайминга», крайне противоречивы: в ряде исследований получено увеличение общей и безрецидивной выживаемости (датско-бельгийская — HOVON, швейцарская — SAKK исследовательские группы). При этом другими исследовательскими группами показано отсутствие влияния на долгосрочные результаты (немецкая группа AMLCG) или даже продемонстрировано снижение общей выживаемости (английская группа MRC). Поэтому применение Г-КСФ в рамках программы индукционной терапии остается исследовательским подходом и пока не может быть рекомендовано в повседневной практике.
Следует обратить внимание на результаты рандомизированного немецкого исследования, в котором 5 исследовательских групп рандомизировали больных в свои собственные очень разнообразные по набору, дозам цитостатическим препаратов протоколы и в одну общую стандартную группу (2 курса 7+3 с даунорубицином в дозе 60 мг/м2 с последующими тремя консолидирующими курсами с цитарабином в дозе 3 г/м2 2 раза в сутки в 1, 3 и 5-й дни). Пятилетняя общая и безрецидивная выживаемость больных не различалась по группам. Главным итогом этого большого исследования стало доказательство абсолютной идентичности различных интенсивных «рискадаптированных» протоколов по сравнению с общей стандартной терапией [9].
Таким образом, индукция ремиссии при любой форме (кроме острого промиелоцитарного лейкоза) ОМЛ должна состоять из 1 или 2 курсов ХТ (в зависимости от того, после какого курса — первого или второго достигается ПР). Если ПР после 2 курсов не достигнута, то констатируется первичная резистентность, и больным проводят терапию по программам лечения рефрактерных форм лейкемии. Необходимо подчеркнуть, что недостижение ПР после первого индукционного курса является достоверным фактором неблагоприятного долгосрочного прогноза ОМЛ, поэтому сразу после первого курса (при условии адекватности доз и длительности цитостатического воздействия) эти больные должны рассматриваться в качестве потенциальных кандидатов для выполнения алло-ТКМ.
Если ПР не получена после первого индукционного курса 7+3, то выбор второго индукционного курса может быть определен в зависимости от клинической ситуации, исходя из 3 вариантов: 1) повторение курса, аналогичного первому; 2) изменение интенсивности химиотерапевтического воздействия — выполнение курса с ВДЦ; 3) проведение курса с МДЦ.
Как уже подчеркивалось, сравнительный анализ 5 различных протоколов со стандартной программой, состоящей из двух курсов 7+3 с последующими тремя курсами консолидации с ВДЦ, показал абсолютную равнозначность используемых подходов. В связи с этим представляется разумным рекомендовать повторение программы 7+3 с даунорубицином 60 мг/м2 (самое главное соблюдать принцип дозирования препаратов на площадь поверхности тела). Исключением из этой рекомендации может быть ОМЛ, при котором после первого курса индукции либо не произошло уменьшения количества бластных клеток в костном мозге более чем на 50%, либо отмечено прогрессирование заболевания (увеличился процент бластных клеток, появились отсутствующие ранее экстрамедуллярные очаги). В этой ситуации вторым индукционным курсом целесообразно признать курс с ВДЦ в сочетании с новыми антрациклиновыми антибиотиками.
При развитии у больного после первого индукционного курса угрожающих жизни осложнений, потребовавших реанимационных мероприятий (септический шок, инфаркт миокарда, миокардит и др.), или активного аспергиллеза, интенсивная индукционная/консолидирующая терапия может быть временно заменена курсами с МДЦ (уровень C3), особенно у больных, которым в дебюте заболевания была определена благоприятная цитогенетическая группа. Может быть выполнено 1-2 курса МДЦ и после купирования всех осложнений целесообразно вернуться к курсу консолидации с ВДЦ и выполнить минимум два курса. МДЦ могут стать основной терапией в течение 3 лет только у больных острым эритромиелозом и мегакариобластным лейкозом (вариант М6 и М7) (уровень C3).
В крупных федеральных и региональных гематологических центрах, в которых осуществляются цитогенетические и молекулярные исследования, больные могут быть распределены в разные группы молекулярно-цитогенетического риска (прогноза) и программы индукционной терапии могут варьировать в зависимости от задач, которые решает центр.
Варианты индукционного лечения, используемые различными исследовательскими группами, представлены в табл. 1.
Следует еще раз подчеркнуть, что добавление к цитарабину и антрациклинам дополнительных цитостатических препаратов не влияет на долгосрочные результаты лечения.
Профилактика нейролейкемии. Изначальное вовлечение центральной нервной системы при ОМЛ встречается менее чем у 5% пациентов. Европейские исследователи полагают, что не существует в настоящее время показаний к интратекальной профилактике нейролейкемии у пациентов без общемозговой симптоматики, хотя такая профилактика может проводиться в особых ситуациях, например при гиперлейкоцитозе. Длительный опыт российских исследователей позволяет нам рекомендовать профилактику нейролейкемии с помощью интратекальных введений при миеломонобластном (М4) и монобластном (М5) варианте ОМЛ, при лейкоцитозе более 30·109/л, при всех формах ОМЛ, при которых диагностируют экстрамедуллярные образования.
Диагностическая люмбальная пункция выполняется всем больным ОМЛ. Если у пациента регистрируется исходная глубокая цитопения (количество лейкоцитов менее 1·109/л и тромбоцитов менее 20·109/л), то первая диагностическая пункция должна осуществляться после обязательной трансфузии концентрата тромбоцитов. Если количество тромбоцитов не удается повысить до 30·109/л и более, от пункции можно воздержаться до восстановления показателей после курса. Если у пациента определяется лейкоцитоз более 100·109/л, то первую люмбальную пункцию следует отложить до редукции количества лейкоцитов менее 10·109/л.
Основной этап профилактики — 5 люмбальных пункций с введением 3 препаратов (метотрексат, цитарабин, дексаметазон) — проводится в период индукции/консолидации (3-4 курса) независимо от проведения курсов с ВДЦ.
2. Постремиссионная терапия
Существует несколько подходов к постремиссионной терапии ОМЛ: традиционная высокодозная ХТ, длительная поддерживающая ХТ, выполнение ауто- или алло-ТКМ.
Курсы консолидации ВДЦ. Исследование, выполненное американской исследовательской группой CALGB, продемонстрировало преимущество 4 курсов с ВДЦ (3 г/м2 каждые 12 ч в 1, 3 и 5-й дни) по сравнению с курсами с цитарабином в меньших дозах (400 мг/м2 на постоянной в/в инфузии в 1-5-й дни) или стандартными дозами (100 мг/м2 на постоянной в/в инфузии в 1-5-й дни). Этот положительный эффект интенсификации дозы цитарабина не распространялся на пациентов с нормальным кариотипом и неблагоприятными цитогенетическими аномалиями. Открытыми остаются вопросы по дозам, схемам введения, количеству циклов и роли сочетания ВДЦ с другими препаратами. Вновь возвращаясь к немецкому рандомизированному исследованию 5 различных протоколов, следует подчеркнуть, что не получено преимуществ ни по одному показателю при использовании цитарабина в разных высоких дозах в сочетании с каким-либо препаратом, с применением эффекта «тайминга» и «прайминга» по сравнению с 3 курсами консолидации ВДЦ.
В связи с этим у больных ОМЛ в возрасте моложе 60 лет оптимальным представляется после 1-2 курсов индукции выполнить 2 (минимум) или 3 курса консолидации ВДЦ (унифицированный протокол лечения ОМЛ). Если по организационным причинам у гематологического центра нет возможности выполнить консолидацию с ВДЦ, в качестве дополнительного варианта может рассматриваться выполнение еще двух курсов 7+3 с любым из антрациклиновых антибиотиков (желательно чередовать антрациклины) в индукционных дозах (уровень C3). Курсы консолидирующей терапии представлены в табл. 1.
Поддерживающая терапия. Обычно международные эксперты указывают, что поддерживающая терапия не назначается пациентам вне клинических испытаний. Тем не менее итоги немецких (AMLCG) и результаты российских (ОМЛ-06.06) исследований свидетельствуют о преимуществах поддерживающей терапии.
Российские эксперты считают, что поддерживающая терапия может быть рекомендована (уровень В2) и должна выполняться в течение как минимум 1 года от начала лечения (4 курса индукция/консолидации и 6 курсов поддерживающей терапии) или в течение 2 лет от начала терапии (4 курса индукция/консолидации и 9-12 курсов поддерживающей терапии). Более продолжительное воздействие не имеет преимуществ. Длительность поддерживающего лечения увеличивается до 3 лет лишь у больных, которым проводят курсы с МДЦ. Особое значение поддерживающая терапия имеет у больных старше 60 лет. Курсы поддерживающей терапии представлены в табл. 1.
Трансплантация аутологичных стволовых гемопоэтических клеток. Трансплантация аутологичных стволовых гемопоэтических клеток/костного мозга (ауто-ТКМ) является альтернативным подходом на этапе постремиссионной терапии у пациентов из группы благоприятного и промежуточного цитогенетического прогноза, тогда как она не может быть рекомендована пациентам из группы высокого риска. Ауто-ТКМ выполняется после завершения индукции/консолидации в отсутствие признаков персистирования минимальной резидуальной болезни (МРБ). Однако следует помнить, что результаты ауто-ТКМ сопоставимы с таковыми при использовании поддерживающей ХТ и ее преимущество не показано.
Ауто-ТКМ не может быть рекомендована больным, у которых исходно не определена группа риска (прогноза) по международным критериям и, соответственно, не выполняется мониторинг МРБ, а также тем, у кого в период индукционного и консолидирующего лечения редуцированы дозы цитостатических препаратов и длительность курсов (неадекватная предлеченность).
Трансплантация аллогенных стволовых гемопоэтических клеток. Трансплантация аллогенных стволовых гемопоэтических клеток/костного мозга (алло-ТКМ) в постремиссионной терапии ассоциирована с самым низким риском развития рецидива. Это обусловлено в основном развитием реакции трансплантат против лейкоза. Однако преимущества алло-ТКМ ограничены летальностью, связанной с самой процедурой трансплантации. Метаанализ клинических исследований продемонстрировал преимущество алло-ТКМ по сравнению с консолидирующими курсами для пациентов из группы промежуточного и высокого риска в первой полной ремиссии (ППР). Значение выполнения алло-ТКМ в ППР также убедительно доказано в рамках популяционного исследования, которое продемонстрировало статистически значимое увеличение выживаемости (55 и 34%) больных ОМЛ в том регионе, где число реализованных алло-ТКМ составило 46% по сравнению с 22% в других областях [10].
Летальность, связанная с трансплантацией, может варьировать от 15 до 50%. Шкалы коморбидности, такие как HCT-CI, являются важным подспорьем соблюдения баланса между увеличением общей выживаемости и смертностью, связанной с трансплантацией. Шкала, изначально созданная для пациентов с хроническим миелолейкозом, включающая возраст, стадию заболевания, время от установления диагноза до трансплантации, тип донора, пол донора и реципиента, имеет высокую прогностическую ценность для смертности, связанной с трансплантацией, общей и безрецидивной выживаемости и у пациентов с ОМЛ. Другие факторы риска включают инфицирование вирусами гепатитов, статус донора и реципиента по цитомегаловирусу (ЦМВ), генетические особенности (SNP, гены рецепторов цитокинов, микросателлиты цитокинов и гены, ассоциированные с врожденным иммунитетом). Таким образом, в каждом конкретном случае необходимо оценивать риск, связанный с течением самого заболевания, и риск последствий трансплантации в каждом случае.
Постремиссионная терапия в соответствии с группой прогноза (риска), определенная по данным цитогенетических и молекулярных исследований. Отнесение больных ОМЛ к той или иной группе прогноза (риска) служит основанием для определения терапевтической тактики, особенно необходимости выполнения алло-ТКМ. К сожалению, как отмечалось ранее, при самых оптимистичных оценках лишь 50% больных ОМЛ в Российской Федерации выполняются цитогенетическое и молекулярное исследования. В связи с этим формируется группа пациентов, у которых невозможно определить группу риска исходя из международных рекомендаций.
На этом основании считаем целесообразным всем больным, которым не выполнены молекулярно-генетические исследования на момент установления диагноза, рекомендовать выполнение алло-ТКМ в период ППР, особенно если есть родственные доноры и естественно с учетом рисков, связанных с трансплантацией.
Параметры отнесения больных к той или иной группе молекулярно-цитогенетического прогноза (риска) представлены в табл. 2.
ОМЛ из группы благоприятного прогноза. Постремиссионная терапия повторяющимися курсами ВДЦ (3 г/м2 каждые 12 ч в 1, 3 и 5-й дни) — минимум 2 курса считается оптимальным вариантом терапии для больных моложе 60 лет из группы благоприятного прогноза, а также у больных ОМЛ с мутированным геном NPM1 без FLT3-ITD или с мутированным геном CEBPA. У этих больных в большинстве исследований не выявлено преимуществ от использования ауто-ТКМ или алло-ТКМ в период ППР.
Тем не менее существуют формы ОМЛ с инверсией 16 и транслокацией t(8;21), отличающиеся значительно худшим прогнозом: например, ОМЛ с t(8;21) и лейкоцитозом выше 20·109/л, ОМЛ у больных в возрасте >35 лет, ОМЛ с t(8;21) и с inv16 и мутациями KIT или персистенцией МРБ, для которых алло-ТКМ является оптимальным вариантом, особенно для пациентов с низким риском, связанным с трансплантацией (например, с риском по шкале European Bone Marrow Transplant — EBMT, равным 0-1, негативным по ЦМВ статусом, без сопутствующих заболеваний). Эти рекомендации относятся и к больным ОМЛ с нормальным кариотипом и благоприятным молекулярным профилем, но с гиперлейкоцитозом >100·109/л.
Таким образом, пациенты с благоприятным прогнозом ОМЛ обычно не являются кандидатами для выполнения трансплантации костного мозга/трансплантации гемопоэтических стволовых клеток (ТКМ) в период ППР, за исключением ранее указанных случаев.
ОМЛ из группы промежуточного прогноза. Для пациентов из группы промежуточного прогноза 1 и 2 повторяющиеся курсы ВДЦ (3-4 цикла; 3 г/м2 каждые 12 ч в 1, 3 и 5-й дни) широко используются многими исследовательскими группами. Однако итоги большинства этих исследований не впечатляют.
Существует все возрастающее число доказательств, что алло-ТКМ служит показанием для пациентов из группы промежуточного прогноза, пациентов с нормальным кариотипом и неблагоприятными молекулярными маркерами в ППР. Преимущество алло-ТКМ особенно очевидно для пациентов с низким или промежуточным риском, связанным с трансплантацией. В частности, хотя доказательства в проспективных рандомизированных исследованиях не получены, для пациентов с FLT3-ITD алло-ТКМ следует рассматривать как обязательный этап лечения.
ОМЛ из группы неблагоприятного прогноза. Эта категория ОМЛ характеризуется значительно меньшей частотой достижения ПР и соответственно большим числом рефрактерных форм ОМЛ. Даже в случае достижения ППР ее продолжительность невелика и никакой вариант консолидирующей ХТ не изменяет крайне плохие долгосрочные результаты лечения. Абсолютно консолидированное мнение международных и российских экспертов состоит в том, что как можно более ранняя алло-ТКМ от совместимого донора, родственного или неродственного, является терапией выбора для пациентов из группы неблагоприятного прогноза в ППР. Исходы алло-ТКМ от полностью совместимого неродственного донора идентичны таковым от родственного донора. Только алло-ТКМ позволяет статистически значимо улучшить долгосрочные результаты (общую и безрецидивную выживаемость).
Именно для этой группы больных крайне важно соблюдать рекомендации по типированию и началу поиска потенциальных доноров до начала первого индукционного курса, в крайнем случае сразу после достижения ППР.
Интегрированные «рискадаптированные» показания к выполнению алло-ТКМ у больных ОМЛ в ППР. Как ранее подчеркивалось, в Российской Федерации большинству пациентов с ОМЛ не выполняются цитогенетические и молекулярные исследования, которые позволяют распределять больных по группам риска. В связи с этим группа российских экспертов полагают, что алло-ТКМ показана всем больным ОМЛ в ППР в возрасте моложе 60 лет, которым не выполнены молекулярно-генетические исследования с учетом риска, связанного с трансплантацией, и сопутствующей патологии. Если цитогенетические и молекулярные исследования выполнены, то показания к выполнению алло-ТКМ в ППР ОМЛ рассматриваются в рамках международных критериев, которые представлены в табл. 3.
Представленная информация может служить подсказкой в принятии решения о выполнении ТКМ у больного ОМЛ в ППР. Например, если у больного, отнесенного к группе благоприятного прогноза, вероятность рецидива на фоне ХТ составляет 35-40%, а при выполнении алло-ТКМ суммированный риск рецидива 15-20% и риск смерти от ТКМ 10-15% составляет те же 35%, то в ППР алло-ТКМ не рекомендуется. Если же риск развития рецидива на фоне ХТ превышает интегрированные риски после алло-ТКМ, то решение принимается в пользу ТКМ.
Интегрированные риски, связанные с трансплантационной летальностью, приведены в табл. 4 [6], а общий алгоритм принятия решений отражен на рисунке.
Заключение
Подводя итоги проведенной группой российских экспертов работы по созданию национальных клинических рекомендаций по лечению ОМЛ, следует отметить, что созданные рекомендации являются руководством к действию и «дорожной картой» для гематологических отделений, занимающихся лечением больных острыми лейкозами. Эксперты понимают, что выполнение ряда лабораторных тестов невозможно во многих региональных центрах, тем не менее рекомендации носят абсолютно реальный, современный характер, хотя и частично адаптированы к российским условиям. Главными в лечении больных ОМЛ остаются соблюдение принципа доза-интенсивность (не уменьшать дозы, не прерывать курсы из-за цитопении, не удлинять интервалы при полном восстановлении показателей) и как можно более раннее решение вопроса о возможности выполнения алло-ТКМ как единственного метода, позволяющего констатировать биологическое излечение от ОМЛ.
Острый лейкоз — заболевание, в основе которого лежит образование клона злокачественных (бластных) клеток, имеющих общую клетку-предшественницу. Бласты инфильтрируют костный мозг, вытесняя постепенно нормальные
гемопоэтические клетки, что приводит к резкому угнетению кроветворения. Для многих типов лейкозов характерна также бластная инфильтрация внутренних органов.
Острый лейкоз подразделяют на лимфобластный (ОЛЛ) и миелобластный (ОМЛ). Считается, что возникновение острого лейкоза могут обусловить следующие факторы:
- неустановленные (чаще всего);
- наследственные:
- синдром Дауна
- синдром Блума
- анемия Фанкони
- атаксия-телеангиэктазия
- синдром Клайнфелтера
- несовершенный остеогенез
- синдром Вискотта — Олдрича
- лейкоз у близнецов
- химические:
- бензол
- алкилирующие агенты (хлорамбуцил, мельфалан)
- радиоактивное облучение
- предрасполагающие гематологические расстройства (миелодисплазия, апластическая анемия)
- вирусы HTLV-I, вызывающие Т-клеточный лейкоз и лимфому у взрослых.
В последние десятилетия достигнуты значительные успехи в лечении острых лейкозов. Пятилетняя выживаемость зависит от типа лейкоза и возраста пациентов:
- ОЛЛ у детей — 65 — 75%;
- ОЛЛ у взрослых — 20 — 35%;
- ОМЛ у пациентов моложе 55 лет — 40 — 60%;
- ОМЛ у пациентов старше 55 лет — 20%.
Классификация
Различия между ОЛЛ и ОМЛ базируются на морфологических, цитохимических и иммунологических особенностях названных типов лейкозов. Точное определение типа лейкоза имеет первостепенное значение для терапии и прогноза.
Как ОЛЛ, так и ОМЛ в свою очередь подразделяются на несколько вариантов согласно FAB- классификации (French-American-British). Так, существуют три варианта ОЛЛ — L1, L2, L3 и семь вариантов ОМЛ:
- М0 — недифференцированный ОМЛ;
- М1 — миелобластный лейкоз без созревания клеток;
- М2 — миелобластный лейкоз с неполным созреванием клеток;
- М3 — промиелоцитарный лейкоз;
- М4 — миеломоноцитарный лейкоз;
- М5 — монобластный лейкоз;
- М6 — эритролейкоз;
- М7 — мегакариобластный лейкоз.
В соответствии с экспрессируемыми антигенами ОЛЛ делится на Т-клеточный и В-клеточный типы, включающие в себя в зависимости от степени зрелости несколько подтипов (пре-Т-клеточный, Т-клеточный, ранний пре-В-клеточный, пре-В-клеточный, В-клеточный). Четкая корреляция между морфологическими и иммунофенотипическими вариантами отсутствует, за исключением того, что морфология L3 характерна для В-клеточного лейкоза.
Что касается ОМЛ, иммунофенотипирование (т.е. определение экспрессируемых антигенов) не всегда помогает различить варианты М0 — М5. С этой целью дополнительно используют специальное цитохимическое окрашивание. Для постановки диагноза эритролейкоза (М6) и мегакариобластного лейкоза (М7) бывает достаточно иммунофенотипирования.
Распространенность
ОЛЛ наиболее часто возникает в возрасте 2 — 10 лет (пик в 3 — 4 года), затем распространенность заболевания снижается, однако после 40 лет отмечается повторный подъем. ОЛЛ составляет около 85% лейкозов, встречающихся у детей. ОМЛ, напротив, наиболее часто встречается у взрослых, причем частота его увеличивается с возрастом.
Клинические проявления
Клинические проявления при лейкозах обусловлены бластной инфильтрацией костного мозга и внутренних органов. Анемия проявляется бледностью, вялостью, одышкой. Нейтропения приводит к различным инфекционным осложнениям. Основные проявления тромбоцитопении — спонтанное образование гематом, кровотечения из носа, матки, мест инъекций, десен. Характерны также боли в костях, лимфаденопатия, гепатоспленомегалия. Возможны затруднение дыхания в связи с наличием медиастинальных масс, увеличение яичек, менингеальные симптомы. При ОМЛ встречается гипертрофия десен.
Обследование пациентов
Общий анализ крови: возможно снижение уровня гемоглобина и числа тромбоцитов; содержание лейкоцитов — от менее 1,0 • 109/л до 200 • 109/л, дифференцировка их нарушена, присутствуют бласты.
Коагулограмма может быть изменена, особенно при промиелоцитарном лейкозе, когда в бластных клетках имеются гранулы, содержащие прокоагулянты.
Биохимический анализ крови при высоком лейкоцитозе может свидетельствовать о почечной недостаточности.
Рентгенограмма органов грудной клетки позволяет выявить медиастинальные массы, которые встречаются у 70% больных с Т-клеточным лейкозом.
Костномозговая пункция: гиперклеточность с преобладанием бластов.
Иммунофенотипирование — определяющий метод в разграничении ОЛЛ и ОМЛ.
Цитогенетические и молекулярные исследования позволяют выявлять хромосомные аномалии, например филадельфийскую хромосому (продукт транслокации части 9-й хромосомы на 22-ю; определяет плохой прогноз при ОЛЛ).
Люмбальная пункция используется для выявления поражения центральной нервной системы (нейролейкоз).
Лечение
Все пациенты с подозреваемым или установленным лейкозом должны быть как можно быстрее направлены для обследования и лечения в специализированные стационары.
Поддерживающая терапия предусматривает трансфузии тромбоцитов, эритроцитов, свежезамороженной плазмы, антибиотикотерапию инфекционных осложнений.
| Факторы | ОЛЛ | ОМЛ |
| Возраст | Менее 1 года или более10 лет | Более 60 лет |
| Пол | Мужской | Мужской или женский |
| Лейкоцитоз | Более 50 • 109/л | Более 50 • 109/л |
| Поражение ЦНС | Бласты в ликворе | Бласты в ликворе |
| Ремиссия | Не достигнута после индукционной терапии | Более 20% бластов в костном мозге после 1-го курса лечения |
| Цитогенетика | Филадельфийская хромосома | Делеции или моносомия по 5 или 7 хромосомам; множественные хромосомные аномалии |
Цель химиотерапии — индукция ремиссии (менее 5% бластов в костном мозге) и последующая элиминация резидуальных бластных клеток посредством консолидирующей терапии. Химиопрепараты нарушают способность злокачественных клеток к делению, а комбинирование двух или трех препаратов повышает эффективность терапии и снижает риск развития резистентности бластов к терапии. Для профилактики и лечения нейролейкоза используются эндолюмбальные введения метотрексата и краниальное облучение.
Трансплантация костного мозга (ТКМ). Аллогенная ТКМ может применяться в случае плохого прогноза при ОЛЛ, при ОМЛ в первую ремиссию, при рецидивах лейкозов. Однако в связи с дефицитом совместимых доноров эта возможность доступна далеко не всем пациентам.
Факторы,обусловливающие плохой прогноз при острых лейкозах, представлены в таблице.
Токсичность терапии
Ранняя токсичность включает тошноту, рвоту, мукозиты, выпадение волос, нейропатии, печеночную и почечную недостаточность, выраженное угнетение кроветворения.
Поздняя токсичность может проявляться поражениями различных органов:
- сердце — аритмии, кардиомиопатии;
- легкие — фиброз;
- эндокринная система — задержка роста, гипотиреоидизм, бесплодие;
- почки — снижение гломерулярной фильтрации;
- психика — эмоциональные и интеллектуальные нарушения;
- вторичные опухоли;
- катаракта.
Все пациенты с острым лейкозом должны наблюдаться не менее 10 лет по завершении лечения. Особого внимания требуют к себе такие проблемы, как задержка роста и эндокринные дисфункции у детей.
Литература:
Liesner RJ, Goldstone AH. The acute leukaemias. BMJ 1997;314:733-6.
Общие сведения
Острый лейкоз – быстро развивающаяся форма рака, при которой патологически измененные лейкоциты накапливаются в крови и в костном мозге. Существует несколько видов острого лейкоза. Так называемый острый лимфобластный лейкоз чаще всего возникает у детей. Другой тип – острый гранулоцитарный лейкоз чаще встречается у взрослых.
При лимфобластном лейкозе патологически измененные лейкоциты образуются в лимфоузлах или костном мозге. Гранулоцитарный лейкоз затрагивает лейкоциты, которые продуцируются в костном мозге.
Причины возникновения острого лейкоза
Причины лейкоза до настоящего времени неизвестны. Считается, что определенные факторы повышают риск развития лейкемии: определенные генетические отклонения, заболевания иммунной системы, воздействие высоких доз радиации и химических веществ, которые подавляют костномозговое кроветворение.
Cимптомы острого лейкоза
- Высокая температура тела;
- Общая слабость и другие гриппоподобные симптомы;
- Увеличение лимфатических узлов, селезенки и печени;
- Боли в костях;
- Тенденция к кровоточивости и образованию синяков;
- Красные или пурпурные пятна на коже, вызванные кровотечением;
- Частые инфекции и прогрессирующая слабость.
Осложнения при остром лейкозе
Острый лейкоз часто возникает внезапно, особенно у детей. Сначала кажется, что это простуда или грипп, но симптомы быстро прогрессируют, состояние ухудшается и появляются патологические изменения со стороны крови.
Острая лейкемия – опасное заболевание. При отсутствии лечения болезнь быстро прогрессирует и приводит к летальному исходу.
Специальных мер профилактики нет.
Что можете сделать Вы
При подозрении на лейкоз следует обратиться к врачу как можно скорее. Лучше всего, чтобы лечение проводил специалист-онколог, имеющий опыт лечения соответствующего типа лейкоза.
Длительность лечения лейкоза обычно составляет 2 года. В течение этого времени необходимо особенно поддерживать свои жизненные силы, поскольку противоопухолевая терапия и лучевая терапия сопровождаются тошнотой.
Чем раньше начато лечение, тем выше вероятность выздоровления.
Что может сделать врач
Во-первых, врач должен определить, связаны ли имеющиеся у пациента симптомы с лейкозом, или они вызваны анемией, или инфекционным заболеванием. Если в крови и костном мозге обнаружены клетки, характерные для лейкемии, дальнейшие исследования проводятся для того, чтобы определить тип лейкоза и наметить программу лечения.
Диагноз острого лейкоза предполагается, когда при проведении нескольких анализов крови выявляется патологически повышенное количество лейкоцитов. Для подтверждения этого диагноза проводят биопсию костного мозга.
Для лечения острого лейкоза проводят химиотерапию, применяя различные комбинации противоопухолевых препаратов. Целью лечения является уничтожение опухолевых клеток.
Доза таких препаратов должна быть тщательно подобрана для того, чтобы опухолевые клетки были уничтожены, а здоровые клетки организма не пострадали. Первая фаза лечения — индукционная терапия. В этот период больной получает наиболее интенсивное лечение в течение 4-6 недель. Этот этап терапии, как правило, вызывает ремиссию заболевания, которая, однако, может оказаться лишь временной, если не продолжать терапию.
Вторая фаза лечения – закрепляющая терапия, целью которой является уничтожение патологических клеток, присутствующих на этот момент в организме. Препараты, которые получает пациент в этой фазе, необходимы для преодоления возможной устойчивости к терапии. Поддерживающая химиотерапия обычно продолжается 2-3 года.
Большинство пациентов остается в стационаре в течение первой фазы лечения, поскольку существует высокий риск инфицирования, а также развития тяжелого кровотечения. Поскольку эти препараты подавляют продукцию лейкоцитов возможно ухудшение самочувствия, могут потребоваться частые переливания крови.
Важной частью лечения может стать трансплантация костного мозга. Это сложная процедура, при которой все продуцируемые клетки крови вначале разрушаются облучением, а затем новые клетки от подходящего донора вводятся в костный мозг со здоровыми клетками. Для предотвращения вторжения опухолевых клеток из костного мозга возможно проведение лучевой терапии.
На сегодняшний день все более количество случаев острого лейкоза успешно поддается терапии, прогноз существенно улучшается, особенно у детей; все большее число пациентов вылечивается. В 90% случаев и более достигается ремиссия, половина пациентов выживает в течение 5 и более лет.