Плегриди — инструкция по применению
Синонимы, аналоги
Статьи
Регистрационный номер:
ЛП-003859
Торговое наименование:
Плегриди
Международное непатентованное наименование:
пэгинтерферон бета-1а
Лекарственная форма:
Раствор для подкожного введения
Состав
1 шприц/шприц-ручка содержит:
действующее вещество:
Для дозировки 63 мкг: пэгинтерферон бета-1а (в пересчете на белок) – 63 мкг
Для дозировки 94 мкг: пэгинтерферон бета-1а (в пересчете на белок) – 94 мкг
Для дозировки 125 мкг: пэгинтерферон бета-1а (в пересчете на белок) – 125 мкг
вспомогательные вещества (для всех дозировок):
L-аргинина гидрохлорид – 15,8 мг, натрия ацетат тригидрат – 0,79 мг, уксусная кислота лед. – 0,25 мг, полисорбат 20 – 0,025 мг, вода для инъекций – до 0,5 мл.
Описание
Прозрачный или слегка опалесцирующий бесцветный или слабо-желтый раствор
Характеристика препарата
Действующим веществом препарата Плегриди является конъюгат интерферона бета-1а, который выделяют генно-инженерным путем из клеток яичников китайского хомячка, и одной линейной молекулы метоксиполиэтиленгликоль-О-2-метилпропиональдегида (мПЭГ) с молекулярной массой 20 кДа, в соотношении, 1 моль белка/1 моль полимера. Средняя молекулярная масса конъюгата составляет примерно 44 кДа, из которых белок составляет около 23 кДа. Не содержит консервантов.
Активность данного препарата не следует сравнивать с активностью других пэгилированных или непэгилированных белков того же терапевтического класса (более подробно см. в разделе «Фармакологические свойства»).
Фармакотерапевтическая группа
Иммуномодулирующее средство
Код ATX:
L03AB13
Фармакологические свойства
Фармакодинамика
Механизм действия
Точный механизм действия пэгинтерферона бета-1а при рассеянном склерозе неизвестен. Плегриди связывается с рецепторами интерферона I типа на поверхности клеток и запускает каскад внутриклеточных реакций, приводящих к регулированию экспрессии генов, зависимых от интерферона. Биологические эффекты, возможно, опосредованные препаратом Плегриди, включают усиление экспрессии противовоспалительных цитокинов (например, интерлейкина-4 (ИЛ-4), ИЛ-10, ИЛ-27), снижение экспрессии провоспалительных цитокинов (например, ИЛ-2, ИЛ-12, интерферона-γ, фактора некроза опухоли α – ФНО-α) и подавление миграции активированных Т-клеток через гематоэнцефалический барьер; однако могут быть задействованы и дополнительные механизмы. Поскольку патофизиология рассеянного склероза выяснена лишь частично, точный механизм действия препарата Плегриди неизвестен.
Фармакодинамические эффекты.
Плегриди представляет собой интерферон бета-1а, коньюгированный по N-концевому аминокислотному остатку альфа-аминогруппы с одной линейной молекулой метоксиполиэтиленгликоля (20 кДа).
Интерфероны – семейство белков естественного происхождения, индуцируемые клетками в ответ на биологические и химические стимулы. Интерфероны опосредуют многочисленные клеточные реакции, классифицируемые как противовирусные, антипролиферативные, иммуномодулирующие. Фармакологические свойства препарата Плегриди согласуются со свойствами интерферона бета-1а и, как считается, опосредуются белковой частью этой молекулы.
Фармакодинамические ответы на введение препарата Плегриди оценивали путем измерения индукции интерферон-зависимых генов, включая гены, кодирующие 2′,5′-олигоаденилатсинтетазу (2′,5′-OAS), белок А резистентности к миксовирусу (MxA), и несколько хемокинов и цитокинов, а также неоптерин (D-эритро-1,2,3-тригидроксипропилптерин), вещество, образующееся под действием интерферон-индуцируемого фермента – ГТФ-циклогидролазы I. Индуцирование генов у здоровых добровольцев было выше в отношении максимальной концентрации и экспозиции (площадь под кривой соотношения эффекта ко времени) на фоне применения Плегриди по сравнению с непэгилированным интерфероном бета-1а (в/м) при введении обоих препаратов в одинаковой дозе, рассчитанной по активности (6 миллионов международных единиц, ММЕ). Этот ответ был более устойчив и дольше наблюдался на фоне применения Плегриди: повышенная концентрация сохранялась до 15 дней по сравнению с 4 днями при применении непэгилированного интерферона бета-1а. Повышенные концентрации неоптерина определяли как у здоровых добровольцев, так и пациентов с рассеянным склерозом, получавших Плегриди; при этом непрерывное и длительное повышение в течение 10 дней наблюдалось при применении Плегриди по сравнению с 5 днями при применении непэгилированного интерферона бета-1а. Концентрация неоптерина снижается до исходных значений через две недели после применения препарата Плегриди.
Клиническая эффективность и безопасность
Эффективность и безопасность препарата Плегриди оценивали в течение 1 года в плацебо-контролируемой фазе двухлетнего рандомизированного двойного слепого исследования у пациентов с ремиттирующим рассеянным склерозом (ADVANCE). 1512 пациентов получали подкожно препарат Плегриди в дозе 125 мкг один раз в 2 недели (n=512) ИЛИ один раз в 4 недели (n=500) ИЛИ плацебо (n=500). Первичной конечной точкой была ежегодная частота рецидивов. План исследования и исходные показатели пациентов в исследовании представлены в таблице 1.
Прямых сравнительных исследований клинической эффективности и безопасности пэгилированного и непэгилированного интерферона бета-1а, а также перевода пациентов с лечения непэгилированным на лечение пэгилированным интерфероном, не проводили.
Таблица 1 План исследования
| Анамнез заболевания | Пациенты с ремиттирующим рассеянным склерозом, имеющие не менее 2 рецидивов за последние 3 года и один рецидив за последний год, сумма баллов по РШОИ ≤5,0 |
| Продолжительность наблюдения | 1 год |
| Исследуемая популяция | 83% нелеченные 47% ≥2 рецидивов за последний год 38% не менее 1 ГД+ очага исходно 92% ≥9 Т2-очагов исходно 16% РШОИ ≥4 17% ранее леченные |
| Исходные показатели | |
| Средний возраст (лет) | 37 |
| Продолжительность заболевания (средняя/медиана, лет) | 3,6/2,0 |
| Среднее число рецидивов за последние 3 года | 2,5 |
| Средняя сумма баллов по РШОИ | 2,5 |
РШОИ: Расширенная Шкала Оценки Инвалидизации (РШОИ)
ГД+: очаги, накапливающие гадолиний
Плегриди, вводимый один раз в 2 недели в течение года, достоверно уменьшил ежегодную частоту рецидивов на 36% в сравнении с плацебо (р=0,0007). Эффект сохранялся при анализе по подгруппам, объединенным на основе демографических показателей и исходных характеристик заболевания. Плегриди также достоверно уменьшил риск рецидивов на 39% (р=0,0003), риск стойкого прогрессирования инвалидизации по оценке через 12 недель лечения на 38% (р=0,0383) и через 24 недели (по данным ретроспективного анализа) на 54% (р=0,0069), число новых или впервые увеличившихся Т2-очагов на 67% (р<0,0001), число ГД+-очагов – на 86% (р<0,0001), число Т1-гипоинтенсивных очагов в сравнении с плацебо – на 53% (р<0,0001). Клиническая эффективность была отмечена уже через 6 месяцев от начала введения препарата Плегриди в дозе 125 мкг один раз в 2 недели, при этом число новых и впервые увеличившихся Т2-очагов снизилось на 61% в сравнении с плацебо. Более выраженное снижение числа рецидивов и конечных точек по данным магнитно-резонансной томографии (МРТ) за год отмечено в группе, получавшей Плегриди в дозе 125 мкг каждые 2 недели, в сравнении с группой, получавшей препарат каждые 4 недели.
Анализ данных, полученных за 2 года исследования, подтвердил сохранение эффективности, отмеченной через 1 год лечения (после завершения плацебо-контролируемой фазы). Ретроспективный анализ данных, полученных за 2 года исследования, показал, что в группе пациентов, получавших Плегриди в дозе 125 мкг каждые 2 недели, в сравнении с группой, получавшей препарат каждые 4 недели, была достоверно меньше частота развития конечных точек, включая ежегодную частоту рецидивов (на 24%, р=0,0209), риск рецидива (на 24%, р=0,0212), риск прогрессирования стойкой инвалидизации через 24 недели от начала терапии (на 36%, р=0,0459), конечных точек по данным МРТ (число новых/впервые увеличившихся Т2-очагов на 60%, ГД+-очагов на 71%, Т1-гипоинтенсивных очагов на 53%, для всех р<0,0001).
Пациентов с предшествующей неэффективной терапией рассеянного склероза в анамнезе в исследование не включали.
Был проведен анализ эффективности в подгруппах пациентов с повышенной активностью заболевания, выделенных по частоте рецидивов и МРТ-критериям.
- В подгруппе пациентов, имевших ≥1 рецидива за последний год и ≥9 Т2-очагов или ≥1 ГД+-очага (n=1401), ежегодная частота рецидивов составила: 0,39 – у получавших плацебо, 0,29 – у получавших Плегриди каждые 4 недели и 0,25 – у получавших Плегриди каждые 2 недели. В данной подгруппе результаты были сопоставимы с общей популяцией, включенной в исследование.
- В подгруппе пациентов, имевших ≥2 рецидивов за последний год и, по крайней мере, один ГД+-очаг (n=273), ежегодная частота рецидивов составила: 0,47 – у получавших плацебо, 0,35 – у получавших препарат Плегриди каждые 4 недели и 0,33 – у получавших Плегриди каждые 2 недели. В данной подгруппе результаты в числовом выражении были сопоставимы с общей популяцией, включенной в исследование, но без статистически значимых различий.
Фармакокинетика
По сравнению с непэгилированным интерфероном бета-1а период полувыведения пэгинтерферона бета-1а из плазмы крови более длительный. Концентрация пэгилированного интерферона бета-1а в плазме крови зависела от дозы в диапазоне доз от 63 до 188 мкг, как отмечено в исследовании с однократным и многократным введением препарата здоровым добровольцам. Параметры фармакокинетики, определяемые у пациентов с рассеянным склерозом, согласовывались с параметрами у здоровых добровольцев.
Всасывание
После подкожного введения пэгинтерферона бета-1а пациентам с рассеянным склерозом максимальная концентрация препарата (Cmax) достигалась через 1-1,5 дня. После многократного введения (каждые 2 недели) дозы 125 мкг Cmax (средняя ± стандартная ошибка) составила 280±79 пг/мл.
Подкожное введение пэгинтерферона бета-1а в однократных дозах 63 (6 ММЕ), 125 (12 ММЕ) и 188 (18 ММЕ) мкг, соответственно, обеспечивало примерно в 4-, 9-, и 13-раз большую экспозицию (площадь под кривой концентрация-время, AUC168 ч) и, примерно, в 2-, 3,5- и 5-раз более высокое значение Cmax по сравнению с внутримышечным введением непэгилированного интерферона бета-1а в дозе 30 (6 ММЕ) мкг.
Распределение
После многократного подкожного введения препарата в дозах 125 мкг каждые 2 недели пациентам с рассеянным склерозом объем распределения пэгинтерферона бета-1а без коррекции на биодоступность (среднее ± стандартная ошибка) составил 481±105 л.
Метаболизм и выведение
Почечный клиренс определен как основной путь выведения препарата Плегриди. Ковалентно связанный с белком (интерфероном бета-1а) фрагмент полиэтиленгликоля (PEG) может изменять in vivo свойства немодифицированного белка, включая снижение почечного клиренса и уменьшение протеолиза, тем самым продлевая период полувыведения из кровотока. Соответственно, у здоровых добровольцев период полувыведения (t1/2) для пэгинтерферона бета-1а примерно в 2 раза больше, чем для непэгилированного интерферона бета-1а. У пациентов с рассеянным склерозом tmax (среднее ± стандартная ошибка) пэгинтерферона бета-1а в равновесном состоянии составил 78±15 часов. Среднее значение клиренса в равновесном состоянии пэгинтерферона бета-1а составило 4,1±0,4 л/час.
Фармакокинетика в особых группах пациентов
Почечная недостаточность
Исследование с однократным введением препарата Плегриди здоровым добровольцам и пациентам с почечной недостаточностью разной степени тяжести показало избирательное увеличение AUC (30-53%) и Cmax (26-42%) у пациентов с легкой (клиренс креатинина, КК, от 50 до ≤80 мл/мин), средней (КК от 30 до <50 мл/мин) и тяжелой (КК <30 мл/мин) почечной недостаточностью, по сравнению с добровольцами с нормальной функцией почек (КК >80 мл/мин). У пациентов с терминальной стадией почечной недостаточности, которым гемодиализ требовался 2-3 раза в неделю, AUC и Cmax были схожими со значениями этих показателей у добровольцев с нормальной функцией почек. Концентрация пэгинтерферона бета-1а снижалась примерно на 24% после каждого сеанса гемодиализа, из чего можно сделать вывод, что гемодиализ способствует частичному выведению пэгинтерферона бета-1а из системного кровотока.
Печеночная недостаточность
Параметры фармакокинетики пэгинтерферона бета-1а у пациентов с печеночной недостаточностью не оценивали.
Пожилые пациенты
Опыт клинического применения препарата у пациентов в возрасте старше 65 лет ограничен. Однако результаты популяционного анализа фармакокинетических данных (у пациентов в возрасте до 65 лет) показывают, что возраст не влияет на клиренс пэгинтерферона бета-1а.
Пол
Популяционный анализ фармакокинетических данных не выявил влияния пола пациентов на параметры фармакокинетики пэгинтерферона бета-1а.
Раса
Популяционный анализ фармакокинетических данных не выявил влияния расы пациентов на параметры фармакокинетики пэгинтерферона бета-1а.
Результаты доклинического изучения безопасности
Еженедельное в течение 5 недель подкожное введение пэгинтерферона бета-1а макакам резус в дозах, в 55 раз превышающих терапевтическую дозу, рассчитанную в мг на кг массы тела (принимая среднюю массу тела как 70 кг), не выявило признаков токсичности у животных.
Пэгинтерферон бета-1a не проявлял мутагенной активности в испытаниях на обратные мутации у бактерий in vitro (тест Эймса), а также кластогенной активности в исследовании лимфоцитов человека in vitro. Исследования канцерогенности пэгинтерферона бета-1а на животных не проводились. Еженедельное подкожное введение пэгинтерферона бета-1а половозрелым самкам макаки резус в дозах, в 70 раз превышающих терапевтическую дозу, рассчитанную в мг на кг массы тела (принимая среднюю массу тела как 70 кг), в течение одного менструального цикла (до 5 недель) привело к нарушению регулярности менструального цикла, ановуляции и снижению концентрации прогестерона в плазме крови. Эти эффекты схожи с эффектами непэгилированного интерферона бета и носят обратимый характер после прекращения применения препарата.
Показания к применению
Лечение ремиттирующего рассеянного склероза у взрослых.
Противопоказания
- Гиперчувствительность к естественному или рекомбинантному интерферону бета или пэгинтерферону или любому вспомогательному веществу данного препарата.
- Начало терапии во время беременности (в связи с отсутствием клинических данных – см. «Применение при беременности и в период грудного вскармливания»).
- Выраженная депрессия и/или суицидальные мысли (см разделы «Особые указания» и «Побочное действие»).
- Детский возраст до 18 лет (в связи с отсутствием клинических данных, см раздел «Способ применения и дозы»).
Применение при беременности и в период грудного вскармливания
Женщины с сохраненным детородным потенциалом
Женщины с сохраненным детородным потенциалом должны использовать надежные методы контрацепции. Если пациентка забеременела или планирует беременность во время применения препарат Плегриди, она должна быть проинформирована о потенциальных рисках; также следует рассмотреть вопрос о прекращении терапии. У женщин с высокой частотой рецидивов до начала лечения риск выраженного рецидива после отмены терапии препаратом Плегриди в связи с беременностью следует оценить в сравнении с повышенным риском спонтанного аборта на фоне лечения.
Беременность
Данные по применению препарата Плегриди у беременных ограничены. Полученные данные указывают на повышение риска спонтанного аборта. Начинать лечение препаратом Плегриди во время беременности противопоказано (см. раздел «Противопоказания»).
Период грудного вскармливания
Не установлено, выделяется ли пэгинтерферон бета-1а с грудным молоком человека. Учитывая возможность развития серьезных нежелательных реакций у новорожденного, необходимо прекратить либо грудное вскармливание, либо лечение препаратом Плегриди.
Фертильность
Данные о влиянии пэгинтерферона бета-1а на фертильность человека отсутствуют. У животных ановуляторные эффекты наблюдались при введении препарата в очень высоких дозах. Данные об изучении влиянии пэгинтерферона бета-1а на фертильность самцов также отсутствуют.
Способ применения и дозы
Применение препарата Плегриди необходимо начинать под наблюдением врача, имеющего опыт в лечении рассеянного склероза.
Эффективность препарата Плегриди была продемонстрирована в сравнении с плацебо. Данные об эффективности препарата Плегриди в сравнении с непэгилированным интерфероном бета, а также у пациентов, переведенных на лечение препаратом Плегриди после лечения непэгилированным интерфероном бета, отсутствуют. Это необходимо учитывать при смене пэгилированного интерферона на непэгилированный, и наоборот (см раздел «Фармакологические свойства»).
Дозирование
Рекомендуемая терапевтическая доза Плегриди составляет 125 мкг, которую вводят подкожно один раз в 2 недели (14 дней).
Начало терапии
Лечение рекомендуется начинать с дозы 63 мкг (доза 1, день 1), затем повышать ее до 94 мкг (доза 2, день 14) и достигать полной дозы 125 мкг (доза 3, день 28). Затем каждые 2 недели (14 дней) рекомендуется вводить полную дозу (125 мкг), см. Таблицу 2.
Упаковка для начала курса лечения содержит первые две дозировки (63 мкг и 94 мкг).
Таблица 2: Схема подбора дозы в начале лечения
| Доза | Время* | Дозировка (мкг) | Маркировка предварительно заполненного шприца/шприц-ручки |
| Доза 1 | День 1 | 63 | Оранжевый |
| Доза 2 | День 14 | 94 | Голубой |
| Доза 3 | День 28 | 125 (полная доза) | Серый |
*Одна инъекция каждые 2 недели (14 дней)
Постепенное увеличение дозы в начале лечения способствует лучшей переносимости гриппоподобных симптомов, сопровождающих начало применения интерферонов. Профилактическое и сопутствующее применение противовоспалительных, обезболивающих и/или жаропонижающих средств может предотвратить или облегчить гриппоподобные симптомы, иногда сопровождающие лечение интерферонами (см раздел «Побочное действие»).
При случайном пропуске дозы препарата Плегриди, ее следует ввести как можно быстрее согласно следующей рекомендации:
- Если осталось 7 дней или более до следующей плановой дозы: немедленно ввести пропущенную дозу. Последующую дозу вводят как запланировано.
- Если осталось менее 7 дней до следующей плановой дозы: новый график плановых инъекций (один раз в 2 недели) следует начать со дня введения пропущенной дозы. Нельзя вводить препарат Плегриди чаще, чем через 7 дней.
Применение у особых групп пациентов
Пожилые пациенты
У пациентов в возрасте старше 65 лет безопасность и эффективность препарата Плегриди изучена недостаточно из-за ограниченного количества пациентов этой возрастной группы, включенных в клинические исследования.
Почечная недостаточность
Согласно данным клинических исследований у пациентов с легкой, средней, тяжелой почечной недостаточностью, а также терминальной стадией почечной недостаточности, коррекции дозы препарата Плегриди не требуется (см. разделы «Особые указания» и «Фармакокинетика»).
Печеночная недостаточность
Плегриди не изучали у пациентов с печеночной недостаточностью (см. раздел «Особые указания»).
Дети
У пациентов младше 18 лет безопасность и эффективность препарата Плегриди не изучали, поэтому данные по применению препарата в данной возрастной группе отсутствуют.
Способ введения
Препарат Плегриди предназначен для подкожного введения.
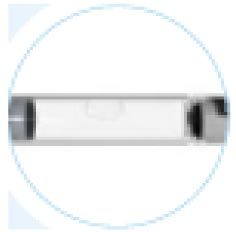
Рекомендуется обучить пациента правильной технике подкожных инъекций с применением предварительно заполненного шприца или шприц-ручки. Пациентам следует рекомендовать менять место инъекций. Препарат обычно вводят под кожу живота, плеча или бедра.
Каждый предварительно заполненный шприц или шприц-ручка снабжены иглой. Предварительно заполненные шприцы и шприц-ручки предназначены только для однократного применения и после применения должны быть утилизированы.
Меры предосторожности перед применением препарата.
Перед инъекцией извлеченный из холодильника препарат Плегриди должен быть согрет в естественных условиях до комнатной температуры (около 30 мин). Запрещено применение внешних согревающих источников, таких как горячая вода.
В рамках указанного срока годности и при отсутствии холодильника, препарат можно хранить при температуре до 25 °С в защищенном от света месте не более 30 дней (см раздел «Срок годности»).
Предварительно заполненные шприцы и шприц-ручки нельзя применять, если содержащаяся в них жидкость окрашена, мутная, содержит видимые частицы или подверглась замораживанию. Жидкость в шприце или шприц-ручке должна быть прозрачная, бесцветная или слабо-желтая.
Инструкция для пациента по применению предварительно заполненного шприца и шприц-ручки
Раздел А: Подготовка к инъекции
Схема дозирования
Предварительно заполненные шприцы и шприц-ручки, содержащие препарат Плегриди, предназначены только для однократного применения, нельзя применять их повторно.
Возьмите нужный предварительно заполненный шприц или шприц-ручку с препаратом Плегриди из упаковки (Таблица 3). Шприц-ручка или предварительно заполненный шприц из упаковки для начала курса лечения содержат препарат Плегриди для первых двух инъекций, предназначенных для постепенного достижения необходимой пациенту дозы.
Таблица 3. Выбор необходимой упаковки препарата Плегриди
| Когда | Выбор дозы | Выбор упаковки |
| День 1 (63 мкг) | Первая инъекция: 63 мкг, выберите оранжевый шприц или шприц-ручку |
Упаковка для начала курса лечения |
| День 14 (94 мкг) | Вторая инъекция: 94 мкг, выберите голубой шприц или шприц-ручку |

|
| День 28 и далее каждые 2 недели (125 мкг) | Инъекция полной дозы: 125 мкг, выберите серый шприц или шприц-ручку |
Упаковка 125 мкг |
Нельзя применять более одного предварительно заполненного шприца или шприц-ручки в течение 14 дней (2 недель).
Устройство шприц-ручки
До применения (рисунок А)

После применения (рисунок Б)

Устройство предварительно заполненного шприца
Подготовка рабочей поверхности
Выберите хорошо освещенную, чистую, ровную поверхность, например, стол, и подготовьте все материалы, которые потребуются для выполнения инъекции или самостоятельного введения препарата.
Подготовка материалов. Для выполнения инъекции потребуются следующие материалы:
- Ватный тампон, смоченный спиртом
- Марлевая салфетка
- Фиксирующая повязка/Лейкопластырь
- Защитный непроницаемый контейнер для утилизации использованных шприцев и шприц-ручек.
Извлечение предварительно заполненного шприца или шприц-ручки из холодильника
Возьмите из холодильника одну упаковку препарата Плегриди с дозой, соответствующей текущему этапу программы лечения пациента, и выберите из упаковки соответствующий предварительно заполненный шприц или шприц-ручку, как показано в Таблице 3 (63 мкг, 94 мкг или 125 мкг).
Если в упаковке остался неиспользованный шприц или шприц-ручка, закройте упаковку и уберите обратно в холодильник до следующей инъекции.
Проверка упаковки и предварительно заполненного шприца или шприц-ручки
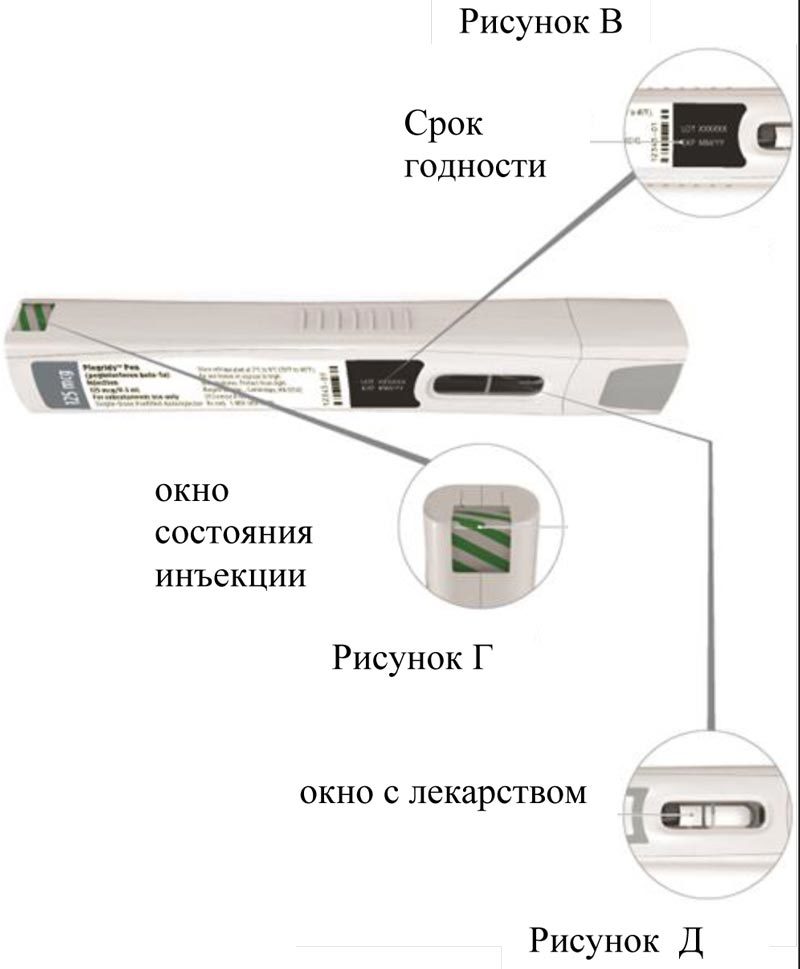
Проверьте срок годности, указанный на предварительно заполненном шприце/шприц-ручке с препаратом Плегриди (рисунок В), пластиковом поддоне для шприцев и первичной упаковке и/или картонной пачке.
Не используйте предварительно заполненный шприц или шприц-ручку после истечения срока годности.
Проверка шприц-ручки
Проверьте состояние шприц-ручки. Убедитесь, что зеленые полосы видны (рисунок Г).
Не используйте шприц-ручку, если в окне состояния инъекции не видны зелёные полосы.
Убедитесь в том, что раствор препарата в окне с лекарством не заморожен, прозрачный и бесцветный или слабо-желтого цвета (рисунок Д).
Не используйте шприц-ручку с препаратом Плегриди, если раствор заморожен, изменил цвет, помутнел или содержит видимые частицы. Допустимо, если в растворе препарата наблюдается пузырек воздуха.
Проверка предварительно заполненного шприца
Убедитесь в том, что раствор препарата прозрачный, бесцветный или слабо-желтого цвета.
Не используйте шприц с препаратом Плегриди, если раствор заморожен, изменил цвет, помутнел или содержит видимые частицы. Допустимо, если в растворе препарата наблюдается пузырек воздуха.
Доведение предварительно заполненного шприца/шприц-ручки до комнатной температуры
Перед выполнением инъекции оставьте предварительно заполненный шприц/шприц-ручку примерно на 30 минут при комнатной температуре.
Не используйте внешние источники тепла, такие как горячая вода, для согревания предварительно заполненного шприца/шприц-ручки.
Проведение инъекции
Предварительно заполненный шприц и шприц-ручка предназначены для подкожного введения препарата Плегриди.
Выполняйте инъекцию препарата Плегриди с помощью предварительно заполненного шприца или шприц-ручки, строго следуя инструкции.
Не следует вводить препарат в ту область тела, где кожа раздражена, покраснела, имеет кровоподтеки, инфицирована или имеет рубцы. Меняйте места инъекций. Не вводите препарат в один и тот же участок тела несколько раз подряд.
Не удаляйте колпачок со шприц-ручки или защитный колпачок с иглы шприца, пока полностью не готовы к выполнению инъекции.
Вымойте руки водой с мылом.
1. Выберите место инъекции
Выберите место для введения препарата и протрите кожу тампоном, смоченным спиртом.
Место инъекции должно подсохнуть перед инъекцией. Плегриди следует вводить под кожу бедра, живота или плеча.
До введения препарата больше не прикасайтесь к планируемому месту инъекции.
Перейдите к разделу Б, если используется шприц-ручка, или к разделу В, если инъекция будет выполняться с помощью предварительно заполненного шприца.
Раздел Б: Выполнение инъекции с помощью шприц-ручки
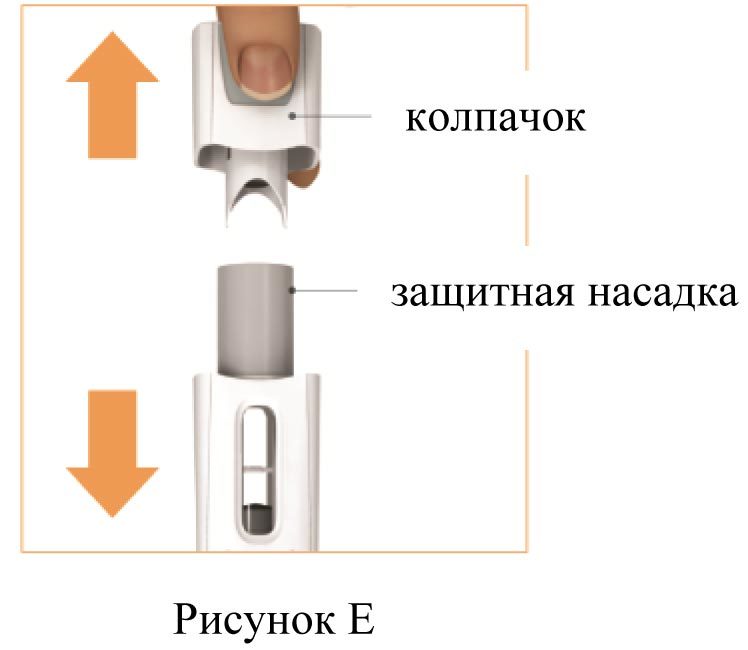
2. Снимите колпачок (рисунок Е)
Потяните за колпачок и снимите его. Не надевайте снятый колпачок обратно.
Игла закрыта защитной насадкой, поэтому не видна.
Не прикасайтесь и не нажимайте на защитную насадку, вы можете уколоться иглой.
Шприц-ручка Плегриди готова к инъекции после снятия колпачка.
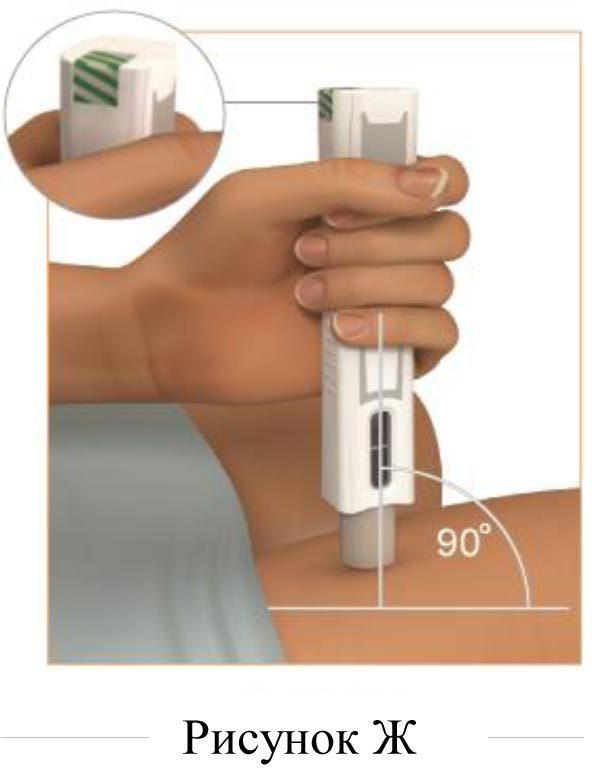
3. Расположение шприц-ручки и ее проверка (рисунок Ж)
Расположите шприц-ручку Плегриди над выбранным местом инъекции. Шприц-ручку следует держать под углом 90 градусов к поверхности инъекции таким образом, чтобы видны были зелёные полосы в окне состояния инъекции.
Не используйте шприц-ручку, пока не увидите зелёные полосы в окне состояния инъекции.
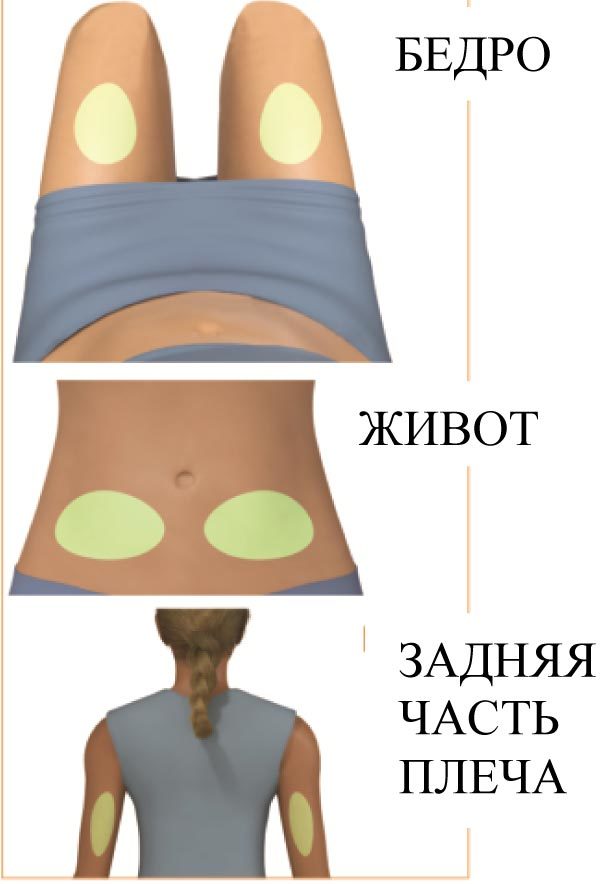
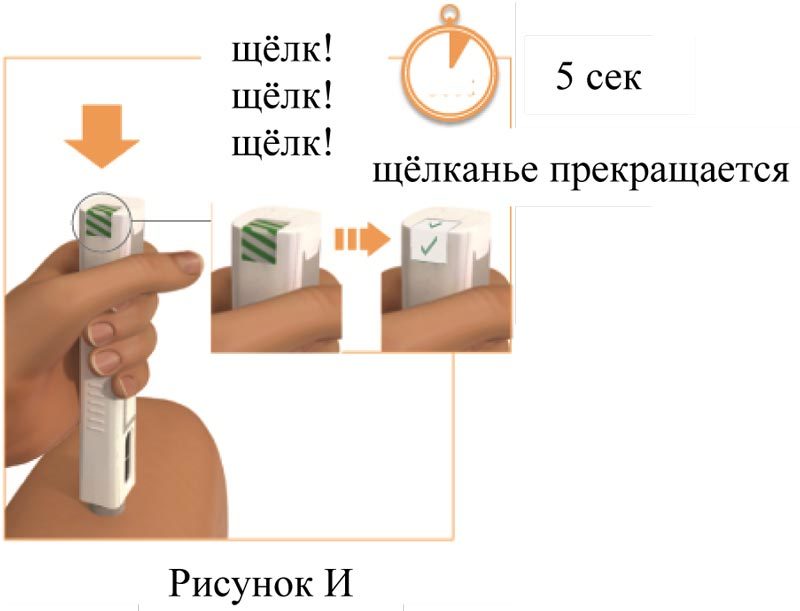
4. Введение препарата (рисунок 3)
Прижимайте шприц-ручку к месту инъекции до тех пор, пока в ней не прекратится щелканье и не появятся зеленые «галочки»
Надавливание способствует введению иглы и автоматическому началу инъекции. Не отнимайте шприц-ручку от места инъекции.
Не делайте никаких движений до тех пор, пока инъекция не завершена.
Продолжайте плотно прижимать шприц-ручку к коже, по-прежнему неподвижно удерживая под углом 90 градусов, до момента завершения инъекции.
Во время выполнения инъекции (рисунок И):
Плегриди шприц-ручка “щёлкнет” несколько раз.
Зелёные полосы будут двигаться в окне состояния инъекции.
Звуки щёлканья шприц-ручки прекратятся, когда инъекция завершится. Это должно занять примерно 5 секунд.
Проверка завершения инъекции. Убедитесь, что в окне состояния инъекции появились зеленые «галочки».
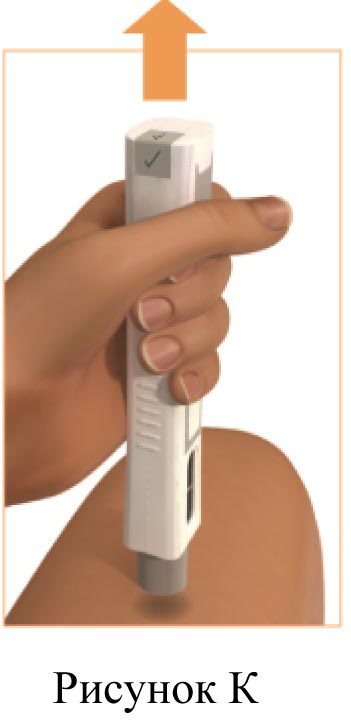
5. Удаление шприц-ручки с места инъекции (рисунок К)
Поднимите Плегриди шприц-ручку вверх от места инъекции.
Защитная насадка полностью закроет иглу.
Перейдите к разделу Г, «После инъекции» для получения инструкции по обработке места инъекции и утилизации Плегриди шприц-ручки.
Раздел В: Выполнение инъекции c помощью предварительно заполненного шприца
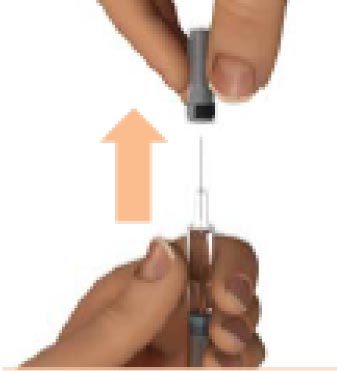
2. Резко снимите защитный колпачок с иглы
Снимите с иглы защитный колпачок и выбросьте его.
Не дотрагивайтесь до иглы.
Не следует вновь надевать защитный колпачок на Плегриди шприц.
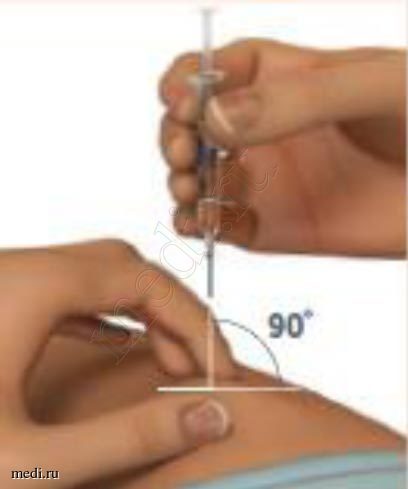
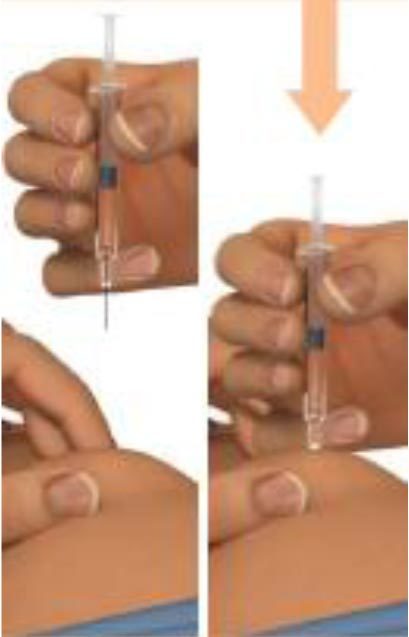
3. Подготовка места инъекции и положение предварительно заполненного шприца
Соберите обработанную кожу в складку с помощью большого и указательного пальцев руки.
Держите шприц с препаратом Плегриди под углом 90 градусов к месту инъекции.
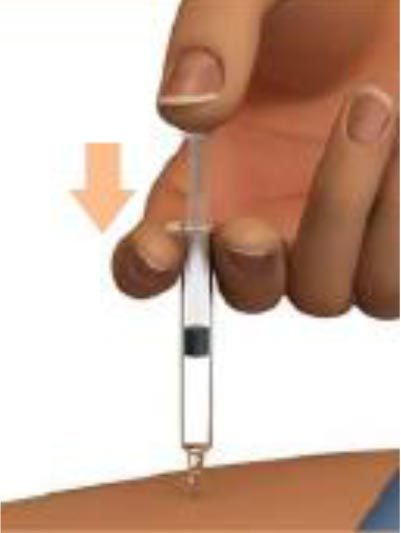
4. Введение препарата
Быстро введите иглу непосредственно в складку кожи до самого основания иглы по типу «бросания дротика».
После введения иглы складку кожи можно отпустить.
Медленно нажимайте на поршень одним мягким движением до полного опорожнения шприца.
Это должно занять около 5 секунд.
Не вынимайте иглу из места инъекции.
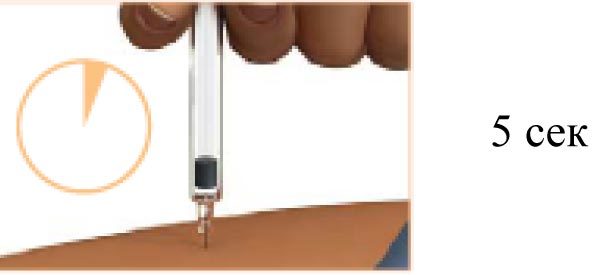
5. Подождите 5 секунд
Введенная игла должна находиться под кожей в течение 5 секунд после завершения введения препарата.
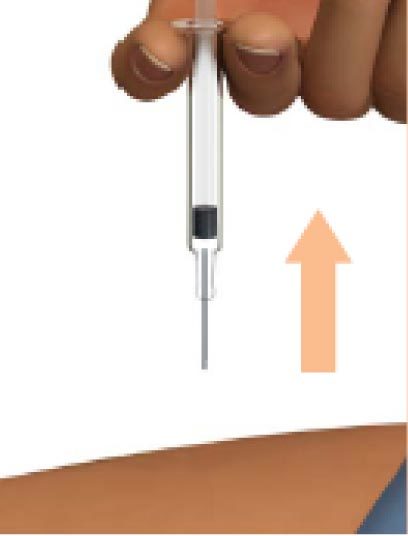
6. Извлеките иглу шприца из места введения
Извлеките иглу, удерживая шприц в вертикальном положении.
Не надевайте вновь защитный колпачок на иглу шприца.
Не используйте повторно шприц.
Перейдите к разделу Г «После инъекции» для получения инструкции по обработке места инъекции и утилизации шприца.
Раздел Г: После инъекции
Обработка места инъекции
Надавливайте на место инъекции в течение нескольких секунд с помощью стерильной марлевой салфетки.
Если появилась кровь, промокните её.
Если потребуется, наклейте пластырь.
Шприц-ручка: проверка полноты введения дозы
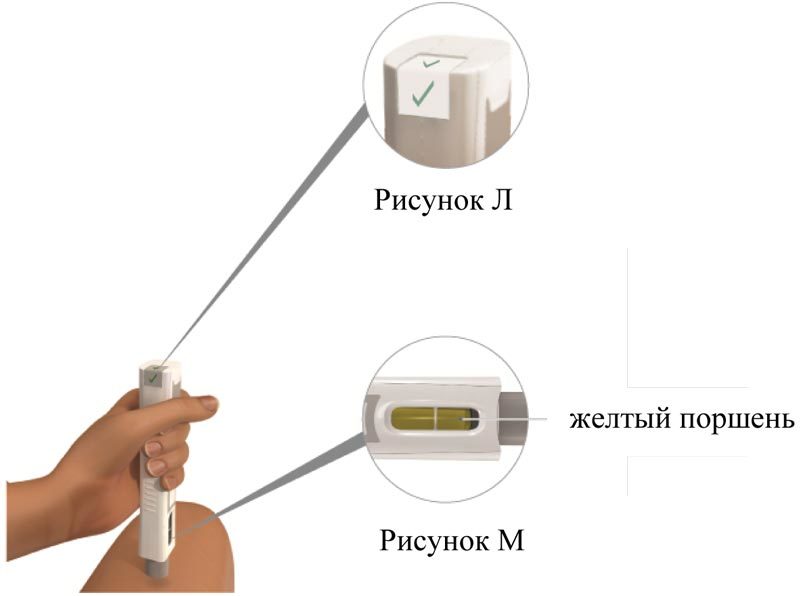
Проверьте: в окне состояния инъекции должны быть видны зеленые «галочки» (рисунок Л).
Проверьте окно с лекарством. Убедитесь, что желтый поршень занял все окно с лекарством (рисунок М).
Желтый поршень, заполнивший все окно, указывает на успешное введение всей дозы препарата.
Не следует повторно использовать шприц-ручку.
Утилизация шприцев и шприц-ручек
Поместите использованный шприц или шприц-ручку от препарата Плегриди в специальный непроницаемый защитный контейнер, например, контейнер для утилизации игл, или контейнер из плотного пластика или металла с завинчивающейся крышкой, например, из-под моющих средств или кофе.
Выясните у медицинского работника или работника аптеки правила утилизации контейнера.
Возможно, существуют локальные требования для утилизации игл и шприцев.
Не выбрасывайте использованные шприцы или шприц-ручки из-под препарата Плегриди с бытовым мусором.
Регистрация даты и места инъекции
Запишите дату и место каждой инъекции и меняйте места инъекции.
Не вводите препарат в один и тот же участок тела несколько раз подряд.
Контроль за состоянием места инъекции
Через 2 часа следует проверить место инъекции на предмет покраснения, припухлости или болезненности.
При появлении кожной реакции, которая не проходит в течение нескольких дней, необходимо обратиться к врачу или медсестре.
Общие предупреждения
Не используйте повторно шприц или шприц-ручку от препарата Плегриди.
Не передавайте шприц или шприц-ручку с препаратом Плегриди другим пациентам.
Храните шприц или шприц-ручку с препаратом Плегриди в недоступном для детей месте.
Побочное действие
Резюме профиля безопасности
Наиболее частыми (чаще, чем при применении плацебо) нежелательными лекарственными реакциями (НЛР) при подкожном применении препарата Плегриди в дозе 125 мкг каждые 2 недели были эритема в месте инъекции, гриппоподобный синдром, лихорадка, головная боль, миалгия, озноб, боль в месте инъекции, астения, зуд в месте инъекции, артралгия. Наиболее частой НЛР, приведшей к отмене терапии препаратом Плегриди в дозе 125 мкг каждые 2 недели, был гриппоподобный синдром (<1%).
В ходе клинических исследований 1468 пациентов получали Плегриди в течение 177 недель (общая экспозиция эквивалентна 1932 пациенто-лет). 1093 пациента получали терапию препаратом Плегриди в течение, как минимум, 1 года, и 415 пациентов, как минимум, в течение 2 лет.
Сопоставимые данные были получены в ходе плацебо-контролируемой фазы рандомизированного исследования ADVANCE, длившейся 1 год, неконтролируемой фазы того же исследования, длившейся еще 1 год, а также продленного исследования по безопасности ATTAIN, продолжавшегося 2 года.
Ниже приведены обобщенные данные о НЛР, чаще выявлявшихся у пациентов, которым подкожно вводили Плегриди в дозе 125 мкг каждые 2 недели (n=512), в сравнении с пациентами, получавшими плацебо (n=500) в течение 48 недель. НЛР представлены в виде предпочтительных терминов MedDRA, распределенных по классу систем и органов MedDRA.
Частота НЛР, приведенных ниже, определялась соответственно следующей классификации: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100), редко (≥1/10,000 до <1/1,000), очень редко (<1/10,000), неизвестно (невозможно оценить согласно имеющимся данным).
Нарушения со стороны крови и лимфатической системы
Нечасто: тромбоцитопения
Редко: тромботическая микроангиопатия, включая тромботическую тромбоцитопеническую пурпуру/гемолитический уремический синдром
Нарушения со стороны иммунной системы
Нечасто: реакция гиперчувствительности
Нарушения со стороны нервной системы
Очень часто: головная боль
Нечасто: судорожные припадки
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Неизвестно: Легочная артериальная гипертензия
Нарушения со стороны желудочно-кишечного тракта
Часто: тошнота, рвота
Нарушения со стороны кожи и подкожных тканей
Часто: зуд
Нечасто: крапивница
Нарушения со стороны скелетно-мышечной и соединительной тканей
Очень часто: миалгия, артралгия
Нарушения со стороны почек и мочевыводящих путей
Редко: нефротический синдром, гломерулосклероз
Общие расстройства и нарушения в месте введения
Очень часто: эритема в месте инъекции, гриппоподобный синдром, лихорадка, озноб, боль в месте инъекции, астения, зуд в месте инъекции
Часто: гипертермия, боль, отек в месте инъекции, ощущение тепла в месте инъекции, гематома в месте инъекции, высыпания в месте инъекции, припухлость в месте инъекции, изменение цвета кожи в месте инъекции, воспаление в месте инъекции Редко: некроз в месте инъекции
Лабораторные и инструментальные данные
Часто: повышение температуры тела, повышение активности аланинаминотрансферазы, повышение активности аспартатаминотрансферазы, повышение активности гамма-глутамилтрансферазы, снижение концентрации гемоглобина, снижение числа лейкоцитов
Нечасто: снижение числа тромбоцитов
Нарушения психики
Часто: депрессия
Описание отдельных НЛР
Гриппоподобные симптомы
Гриппоподобный синдром отмечали у 47% пациентов, получавших Плегриди в дозе 125 мкг каждые 2 недели, и у 13% пациентов, получавших плацебо. Частота гриппоподобных симптомов (например, гриппоподобное состояние, озноб, гиперпирексия, мышечно-скелетная боль, миалгия, боль и лихорадка) была наибольшей в начале терапии, и обычно снижалась в течение первых 6 месяцев. 90% случаев отмеченных гриппоподобных симптомов были легкими или средними по своей тяжести. Не было случаев регистрации гриппоподобного симптома как серьезной НЛР. Менее 1% пациентов, получавших Плегриди во время плацебо-контролируемой фазы исследования ADVANCE, прекратили терапию вследствие гриппоподобных симптомов.
Реакции в месте инъекции
Реакции в месте инъекции (например, эритема, боль, зуд или отек) были зарегистрированы у 66% пациентов, получавших Плегриди в дозе 125 мкг каждые 2 недели, по сравнению с 11% пациентов, получавших плацебо. Эритема в месте инъекции была наиболее частой реакцией. Из отмеченных реакций в месте инъекции 95% были легкими или средними по тяжести. У одного из 1468 пациентов, получавших Плегриди во время клинических исследований, развился некроз в месте инъекции, который разрешился после стандартной терапии.
Изменения активности печеночных трансаминаз
Частота случаев повышения активности ферментов печени была выше у пациентов, получавших Плегриди, по сравнению с частотой в группе плацебо. В большинстве случаев активность ферментов печени превышала верхнюю границу нормы (ВГН) менее, чем в 3 раза. Повышение активности аланинаминотрансферазы и аспартатаминотрансферазы более, чем в 5 раз выше ВГН, отмечены у 1% и <1% пациентов, получавших плацебо, и 2% и <1% пациентов, получавших Плегриди, соответственно. Сочетанное повышение активности ферментов печени и концентрации билирубина в плазме крови наблюдалось у 2 пациентов, у которых ранее, до получения Плегриди в рамках клинических исследований, выявлены отклонения в функциональных пробах печени. Оба случая разрешились после отмены терапии Плегриди.
Гематологические нарушения
Снижение числа лейкоцитов <3,0×109/л отмечены у 7% пациентов, получавших Плегриди, и у 1% пациентов, получавших плацебо. Среднее число лейкоцитов оставалось в пределах нормы у пациентов, получавших лечение препаратом Плегриди. Снижение числа лейкоцитов не сопровождалось повышенным риском развития инфекций или серьёзных инфекций. Частота потенциально клинически значимого снижения числа лимфоцитов (<0,5×109/л) (<1%), числа нейтрофилов (≤1,0×109/л) (<1%) и числа тромбоцитов (≤100×109/л) (≤1%) была схожей у пациентов, получавших Плегриди, и получавших плацебо. Два серьёзных случая были зарегистрированы у пациентов, получавших Плегриди: у одного пациента (<1%) развилась тяжелая тромбоцитопения (число тромбоцитов <10×109/л), у другого пациента (<1%) развилась тяжелая нейтропения (число нейтрофилов <0,5×109/л). У обоих пациентов число клеток крови восстановилось после отмены терапии препаратом Плегриди. Незначительное снижение числа эритроцитов отмечено у пациентов, получавших лечение препаратом Плегриди. Частота потенциально клинически значимых случаев снижения числа эритроцитов (<3,3×1012/л) была схожей у пациентов, получавших Плегриди, по сравнению с пациентами, получавшими плацебо.
Реакции гиперчувствительности
Реакции гиперчувствительности были зарегистрированы у 16% пациентов, получавших Плегриди в дозе 125 мкг каждые 2 недели, и у 14% пациентов, получавших плацебо. Менее чем у 1% больных, получавших Плегриди, развились серьёзные реакции гиперчувствительности (например, ангионевротический отек, крапивница), но они быстро купировались после применения антигистаминных и/или глюкокортикостероидных препаратов.
Депрессия и суицидальные мысли
Общая частота НЛР, проявляющихся депрессией и суицидальными мыслями, составила 8% у пациентов, получавших Плегриди в дозе 125 мкг каждые 2 недели, и у пациентов, получавших плацебо. Частота серьёзных НЛР, связанных с депрессией и суицидальными мыслями, была низкой (<1%) как у пациентов, получавших Плегриди в дозе 125 мкг каждые 2 недели, так и у пациентов, получавших плацебо.
Судорожные припадки
Частота судорожных припадков была низкой и сопоставимой у пациентов, получавших Плегриди (125 мкг каждые 2 недели), и плацебо (<1% в каждой группе).
Легочная артериальная гипертензия
Имеются сообщения о случаях развития легочной артериальной гипертензии (ЛАГ) при применении интерферонов бета. О развитии таких случаев сообщали в различных временных рамках, включая период до нескольких лет после начала лечения интерфероном бета.
Передозировка
Случаев передозировки препарата Плегриди не зафиксировано. Тем не менее, при передозировке рекомендуется проводить соответствующую поддерживающую терапию.
Взаимодействие с другими лекарственными препаратами
Исследования взаимодействий препарата Плегриди и других лекарственных препаратов не проводились. Согласно клиническим данным, пациенты с рассеянным склерозом могут получать сочетанную терапию препаратом Плегриди и глюкокортикостероидами во время рецидивов заболевания. Интерфероны понижали активность ферментов системы цитохрома Р450 печени у человека и животных. Следует с осторожностью применять Плегриди в комбинации с лекарственными препаратами с узким терапевтическим индексом, у которых клиренс существенно зависит от системы цитохрома Р450 печени, например, с некоторыми классами противоэпилептических средств и антидепрессантами.
Особые указания
Поражение печени
На фоне применения препаратов интерферона бета были зарегистрированы случаи повышения активности ферментов печени, гепатита, аутоиммунного гепатита и, редко, тяжелой печеночной недостаточности. При применении препарата Плегриди наблюдались случаи повышения активности ферментов печени. Пациенты должны находиться под наблюдением для своевременного выявления симптомов поражения печени (см раздел «Побочное действие»).
Депрессия
Плегриди следует вводить с осторожностью пациентам, у которых отмечены депрессивные расстройства в анамнезе (см раздел «Противопоказания»).
Депрессия развивается с повышенной частотой у пациентов с рассеянным склерозом и ассоциируется с применением интерферона. Пациентам следует рекомендовать немедленно сообщать о симптомах депрессии и/или суицидальных мыслях своему лечащему врачу. Во время терапии Плегриди следует тщательно контролировать пациентов с депрессией и назначать им соответствующее лечение. Необходимо рассмотреть возможность прекращения применения препарата Плегриди (см. раздел «Побочное действие»).
Реакции гиперчувствительности
Серьёзные реакции гиперчувствительности регистрировали в редких случаях как осложнение терапии интерфероном бета, включая Плегриди. Применение пэгинтерферона бета-1а необходимо прекратить, если развилась серьёзная реакция гиперчувствительности (см. раздел «Побочное действие»).
Реакции в месте инъекции
При подкожном применении интерферона бета были отмечены случаи развития реакций в месте инъекции, включая некроз в месте инъекции.
Для сведения до минимума риска развития реакций в месте инъекции пациентов необходимо проинструктировать о необходимости введения препарата в асептических условиях. Следует периодически проверять выполнение самостоятельного введения препарата пациентом, особенно если регистрировались НЛР в месте инъекций. Если у пациента появилось поражение кожи, которое может сопровождаться припухлостью или оттоком жидкости из области инъекции, то пациенту следует обратиться к врачу.
При применении препарата Плегриди в рамках клинического исследования у одного пациента развился некроз в месте инъекции. Решение о прекращении терапии вследствие появления единственного участка некроза на коже зависит от величины некроза (см. раздел «Побочное действие»).
Снижение числа форменных элементов периферической крови
У пациентов, получавших интерферон бета, отмечено снижение числа всех форменных элементов периферической крови, включая редкие случаи панцитопении и тяжелой тромбоцитопении. Цитопении, включая редкие случаи тяжелой нейтропении и тромбоцитопении, наблюдались у пациентов, получавших лечение препаратом Плегриди. На фоне лечения необходимо контролировать симптомы или признаки снижения числа форменных элементов периферической крови (см. раздел «Побочное действие»).
Нарушение со стороны почек и мочевыводящей системы
Нефротический синдром
При лечении препаратами интерферона бета отмечены случаи развития нефротического синдрома на фоне различных нефропатий, включая склерозирующий, фокально-сегментарный гломерулосклероз (ФСГ), липоидный нефроз (ЛН), мембранозно-пролиферативный гломерулонефрит (МПГН) и мембранозную гломерулопатию (МГП). Эти явления регистрировались на разных этапах лечения и могли возникать через несколько лет после лечения интерфероном бета. Рекомендуется периодическое обследование пациентов с целью выявления ранних признаков или симптомов, например, отеков, протеинурии и нарушения функции почек, особенно у пациентов с повышенным риском поражения почек. Требуется своевременное лечение нефротического синдрома, а также оценка целесообразности прекращения терапии препаратом Плегриди.
Тяжелая почечная недостаточность
Препарат Плегриди применяют с осторожностью у пациентов с тяжелой почечной недостаточностью.
Тромботическая микроангиопатия (TMA)
При применении препаратов интерферона бета зарегистрированы случаи TMA (в том числе, и с летальным исходом), проявлявшиеся в виде тромботической тромбоцитопенической пурпуры (TTП) или гемолитического уремического синдрома (ГУС). Эти явления регистрировались на разных этапах лечения, и могли возникать через несколько недель или лет после начала лечения интерфероном бета. Ранние клинические признаки включают тромбоцитопению, впервые развившуюся артериальную гипертензию, лихорадку, симптомы поражения центральной нервной системы (например, спутанность сознания, парезы) и нарушение функции почек. Лабораторные данные предполагаемой TMA включают снижение числа тромбоцитов, повышение активности лактатдегидрогеназы (ЛДГ) вследствие гемолиза и шистоцитоз (фрагментация эритроцитов) в мазке крови. Поэтому, при выявлении клинических признаков ТМА, рекомендуется провести дополнительные исследования числа тромбоцитов, концентрации ЛДГ, мазков крови и функции почек. Если диагноз ТМА подтвержден, требуется немедленное прекращение терапии препаратом Плегриди и безотлагательное лечение, включающее обменное переливание плазмы.
Изменения лабораторных показателей
Терапия интерферонами сопровождается изменениями лабораторных показателей. Помимо стандартных лабораторных тестов, которые обычно выполняют у пациентов с рассеянным склерозом, перед началом терапии препаратом Плегриди, регулярно после начала терапии и далее периодически (при отсутствии клинических симптомов) рекомендуется выполнять полный клинический анализ крови с подсчетом форменных элементов крови, включая число тромбоцитов, биохимический анализ крови, в том числе функциональные печеночные пробы (например, определение активности аспарагиновой и аланиновой аминотрансферазы). Пациентам с миелосупрессией может потребоваться более интенсивный мониторинг показателей клинического анализа крови с подсчетом числа форменных элементов крови и числа тромбоцитов. Гипотиреоз и гипертиреоз наблюдались при применении препаратов интерферона бета. Оценку функции щитовидной железы рекомендуется проводить по клиническим показаниям, а пациентам с дисфункцией щитовидной железы в анамнезе – регулярно.
Судорожные припадки
Плегриди необходимо применять с осторожностью у пациентов с судорожными припадками в анамнезе, у пациентов, получающих противоэпилептические препараты, особенно если эпилепсия недостаточно контролируется (см. раздел «Побочное действие»).
Заболевания сердца
На фоне применения интерферона бета наблюдались случаи ухудшения заболевания сердца. Частота сердечно-сосудистых явлений была схожей при применении Плегриди (125 мкг каждые 2 недели) и плацебо (7% в каждой группе). В ходе основного клинического исследования ADVANCE не зарегистрировано серьёзных сердечно-сосудистых явлений у пациентов, получавших Плегриди. Тем не менее, необходим постоянный контроль за пациентами с тяжелыми заболеваниями сердца в анамнезе, такими как застойная сердечная недостаточность, заболевание коронарных артерий или аритмия, для своевременного выявления возможного нарастания тяжести симптомов, особенно в начале терапии.
Иммуногенность
При лечении препаратом Плегриди у пациентов могут появиться антитела к препарату. При длительности терапии до 2 лет были отмечены случаи появления персистирующих нейтрализующих антител к интерферону бета-1а в составе пэгинтерферона бета-1а (менее 1%, 5 случаев на 715 пациентов). Нейтрализующие антитела могут снизить эффективность терапии. Формирование антител к интерферону, входящему в состав пэгинтерферона бета-1а, не оказало очевидного влияния на безопасность и эффективность препарата Плегриди, хотя достоверность проведенного анализа ограничена вследствие низкой иммуногенности препарата.
Появление персистирующих антител к пэгилирующему компоненту пэгинтерферона бета-1а было зарегистрировано у 3% пациентов (у 18 из 681). В проведенном клиническом исследовании формирование антител к пэгилирующему компоненту пэгинтерферона бета-1а не оказало очевидного влияния на безопасность или эффективность (в том числе ежегодную частоту рецидивов, появление новых и впервые увеличившихся патологических очагов по данным МРТ, прогрессирование стойкой инвалидизации).
Печеночная недостаточность
Пациентам с тяжелой печеночной недостаточностью Плегриди следует назначать с осторожностью и тщательно контролировать его применение. Необходимо периодически обследовать пациентов на наличие симптомов поражения печени. Кроме того, следует с осторожностью применять интерфероны на фоне сопутствующего лечения другими препаратами, способными вызывать поражение печени (см. разделы «Побочное действие» и «Фармакологические свойства»).
Содержание натрия
Каждый предварительно заполненный шприц с препаратом Плегриди содержит менее 1 ммоль (23 мг) натрия, поэтому препарат может быть расценен как «не содержащий натрия».
Влияние на способность управления автомобилем и работы с механизмами
НЛР со стороны центральной нервной системы (например, тошнота) могут влиять на способность управления автомобилем и выполнение потенциально опасных видов деятельности, требующих повышенной концентрации внимания и быстроты психомоторных реакций (см. раздел «Побочное действие»).
Упаковка
Шприцы
По 0,5 мл (63 мкг, 94 мкг или 125 мкг) препарата в шприцы из прозрачного бесцветного стекла тип I (Евр.Ф.), снабженные иглой из нержавеющей стали, закрытой жестким колпачком из термопластического эластомера и полипропилена, и шток-поршнем с бромбутиловым уплотнителем.
По 1 шприцу (63 мкг, 94 мкг или 125 мкг) в пластиковый поддон, запечатанный бумагой или полимерной пленкой.
Упаковка для начала курса лечения: по 2 пластиковых поддона (63 мкг и 94 мкг) с инструкцией по применению в картонной пачке.
Упаковка для продолжения курса лечения: по 2 или 6 пластиковых поддонов (125 мкг) с инструкцией по применению в картонной пачке.
Шприц-ручки
По 0,5 мл (63 мкг, 94 мкг или 125 мкг) препарата в шприцы из прозрачного бесцветного стекла тип I (Евр.Ф.), помещенные в пластиковые шприц-ручки для одноразового использования.
По 2 шприц-ручки (63 мкг / 94 мкг или 125 мкг / 125 мкг) в пластиковый поддон.
Упаковка для начала курса лечения: по 1 пластиковому поддону (63 мкг / 94 мкг) вместе с инструкцией по применению в картонной пачке.
Упаковка для продолжения курса лечения: по 1 пластиковому поддону (125 мкг /125 мкг) вместе с инструкцией по применению в картонной пачке или по 3 картонных пачки с 1 пластиковым поддоном (125 мкг /125 мкг) и инструкцией по применению в каждой, в картонной коробке.
Различия в дозировках дополнительно обозначены различными цветами: 63 мкг – оранжевый, 94 мкг – голубой, 125 мкг – серый.
Инструкция по применению может быть представлена в двух видах: в сложенном и в виде цветного буклета.
Картонные пачки и/или коробки дополнительно могут иметь контроль первого вскрытия в виде стикера.
Условия хранения
Хранить при температуре от 2 до 8 °С, в защищенном от света месте.
Не замораживать.
Хранить в недоступном для детей месте.
Срок годности
3 года.
В рамках указанного срока годности и при отсутствии холодильника, препарат можно хранить при температуре до 25 °С в защищенном от света месте не более 30 дней.
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска
По рецепту.
Юридическое лицо, на имя которого выдано регистрационное удостоверение:
Биоген Айдек Лимитед, Великобритания
Biogen Idec Limited, UK
Innovation House, 70 Norden Road, Maidenhead, Berkshire SL6 4AY, UK
Производитель
Производитель готовой лекарственной формы и первичный упаковщик:
Веттер Фарма-Фертигунг ГмбХ и Ко. КГ
Шютценштрассе 87 и 99-101, 88212 Равенсбург, Германия
Выпускающий контроль качества:
Биоген (Денмарк) Манюфекчуринг АпС
Биоген Алле 1, 3400 Хиллерод, Дания
Претензии потребителей направлять по адресу:
ООО «Джонсон&Джонсон», Россия,
121614, г. Москва, ул. Крылатская, д. 17, корп. 2
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Обобщенные научные материалы по действующему веществу препарата Плегриди (раствор для подкожного введения)
Дата последней актуализации: 25.10.2018
Содержание
- Действующее вещество
- ATX
- Владелец РУ
- Условия хранения
- Срок годности
- Источники информации
- Фармакологическая группа
- Характеристика
- Фармакология
- Показания к применению
- Противопоказания
- Применение при беременности и кормлении грудью
- Побочные действия
- Взаимодействие
- Передозировка
- Способ применения и дозы
- Меры предосторожности
- Заказ в аптеках Москвы
- Отзывы
Действующее вещество
ATX
Владелец РУ
Биоген Айдек Лимитед
Условия хранения
В защищенном от света месте, при температуре 2–8 °C (не замораживать).
Хранить в недоступном для детей месте.
Срок годности
3 года.
Не применять по истечении срока годности, указанного на упаковке.
Источники информации
Обобщенные материалы www.grls.rosminzdrav.ru, 2016.
Фармакологическая группа
Характеристика
Действующим веществом описываемого средства является конъюгат интерферона бета-1а, который выделяют генно-инженерным путем из клеток яичников китайского хомячка, и одной линейной молекулы метоксиполиэтиленгликоль-О-2-метилпропиональдегида (мПЭГ) с молекулярной массой 20 кДа, в соотношении 1 моль белка/1 моль полимера. Средняя молекулярная масса конъюгата составляет примерно примерно 44 кДа, из которых масса белка составляет около 23 кДа.
Фармакология
Фармакодинамика
Механизм действия
Пэгинтерферон бета-1а — интерферон бета-1а, конъюгированный по N-концевому аминокислотному остатку альфа-аминогруппы с одной линейной молекулой метоксиполиэтиленгликоля (20 кДа).
Точный механизм действия пэгинтерферона бета-1а при рассеянном склерозе неизвестен. Пэгинтерферон бета-1а связывается с рецепторами интерферона I типа на поверхности клеток и запускает каскад внутриклеточных реакций, приводящих к регулированию экспрессии генов, зависимых от интерферона. Биологические эффекты, возможно опосредованные этим средством, включают усиление экспрессии противовоспалительных цитокинов (например ИЛ-4, ИЛ-10, ИЛ-27), снижение экспрессии провоспалительных цитокинов (например ИЛ-2, ИЛ-12, интерферона-?, ФНО-?) и подавление миграции активированных Т-клеток через ГЭБ; однако могут быть задействованы и дополнительные механизмы. Поскольку патофизиология рассеянного склероза выяснена лишь частично, точный механизм действия этого средства неизвестен.
Фармакодинамические эффекты
Фармакологические свойства согласуются со свойствами природного интерферона бета-1а и, как считается, опосредуются белковой частью этой молекулы.
Фармакодинамические ответы оценивали путем измерения индукции интерферонзависимых генов, включая гены, кодирующие 2′,5′-олигоаденилатсинтетазу (2′,5′-OAS), белок А резистентности к миксовирусу (МхА), и несколько хемокинов и цитокинов, а также неоптерин (D-эритро-1,2,3-тригидроксипропилптерин), вещество, образующееся под действием интерферониндуцируемого фермента — гуанозинтрифосфатциклогидролазы 1 (ГТФ-циклогидролаза 1). Индуцирование генов у здоровых добровольцев было выше в отношении Cmax и экспозиции (AUC) по сравнению с непэгилированным интерфероном бета-1а (в/м) при введении в одинаковой дозе, рассчитанной по активности (6 миллионов международных единиц, ММЕ). Этот ответ был более устойчив и дольше наблюдался на фоне применения пэгинтерферона бета-1а: повышенная концентрация сохранялась до 15 дней по сравнению с 4 днями при применении непэгилированного интерферона бета-1а. Повышенные концентрации неоптерина определяли как у здоровых добровольцев, так и пациентов с рассеянным склерозом, получавших пэгинтерферон бета-1а; при этом непрерывное и длительное повышение в течение 10 дней наблюдалось при применении пэгинтерферона бета-1а по сравнению с 5 днями для непэгилированного интерферона бета-1а. Концентрация неоптерина снижается до исходных значений через 2 нед после применения пэгинтерферона бета-1а.
Клиническая эффективность и безопасность
Эффективность и безопасность пэгинтерферона бета-1а оценивали в течение 1 года в плацебо-контролируемой фазе двухлетнего рандомизированного двойного слепого исследования у пациентов с ремиттирующим рассеянным склерозом (ADVANCE). 1512 пациентов получали п/к пэгинтерферон бета-1а в дозе 125 мкг (в пересчете на белок) 1 раз в 2 нед (n=512) или 1 раз в 4 нед (n=500) или плацебо (n=500). Первичной конечной точкой была ежегодная частота рецидивов. План исследования и исходные показатели пациентов в исследовании представлены в таблице 1.
Прямых сравнительных исследований клинической эффективности и безопасности пэгилированного и непэгилированного интерферона бета-1а, а также перевода пациентов с лечения непэгилированным на лечение пэгилированным интерфероном не проводили.
Таблица 1
План исследования
| Анамнез заболевания | Пациенты с ремиттирующим рассеянным склерозом, имеющие не менее 2 рецидивов за последние 3 года и 1 рецидив за последний год, сумма баллов по РШОИ1 ?5 |
| Продолжительность наблюдения | 1 год |
| Исследуемая популяция | 83% — нелеченные
47% — ?2 рецидивов в год 38% — не менее 1 ГД+2 очага исходно 92% — ?9 Т2-очагов3 исходно 16% — РШОИ ?4 17% — ранее леченные |
|
Исходные показатели |
|
| Средний возраст (лет) | 37 |
| Продолжительность заболевания (средняя/медиана, лет) | 3,6/2 |
| Среднее число рецидивов за последние 3 года | 2,5 |
| Средняя сумма баллов по РШОИ | 2,5 |
1РШОИ: Расширенная Шкала Оценки Инвалидизации.
2ГД+: очаги, накапливающие гадолиний
3Т2-очаги: очаги демиелинизации, определяемые в Т2-режиме МРТ-исследования ЦНС как гиперинтенсивные, обнаруживаются в 95% случаев достоверного рассеянного склероза.
Пэгинтерферон бета-1а, вводимый один раз в 2 нед в течение года, достоверно уменьшал ежегодную частоту рецидивов на 36% в сравнении с плацебо (р=0,0007). Эффект сохранялся при анализе по подгруппам, объединенным на основе демографических показателей и исходных характеристик заболевания. Также достоверно уменьшался риск рецидивов на 39% (р=0,0003), риск стойкого прогрессирования инвалидизации по оценке через 12 нед лечения на 38% (р=0,0383) и через 24 нед (по данным ретроспективного анализа) на 54% (р=0,0069), число новых или впервые увеличившихся Т2-очагов на 67% (р<0,0001), число ГД+-очагов — на 86% (р<0,0001), число Т1-гипоинтенсивных очагов в сравнении с плацебо — на 53% (р<0,0001). Клиническая эффективность была отмечена уже через 6 мес от начала введения средства в дозе 125 мкг (в пересчете на белок) 1 раз в 2 нед, при этом число новых и впервые увеличившихся Т2-очагов снизилось на 61% в сравнении с плацебо. Более выраженное снижение числа рецидивов и конечных точек по данным МРТ за год отмечено в группе, получавшей пэгинтерферон бета-1а в дозе 125 мкг (в пересчете на белок) каждые 2 нед, в сравнении с группой, получавшей пэгинтерферон бета-1а каждые 4 нед.
Анализ данных, полученных за 2 года исследования, подтвердил сохранение эффективности, отмеченной через 1 год лечения (после завершения плацебо-контролируемой фазы). Ретроспективный анализ данных, полученных за 2 года исследования, показал, что в группе пациентов, получавших пэгинтерферон бета-1а в дозе 125 мкг (в пересчете на белок) каждые 2 нед, в сравнении с группой, получавшей пэгинтерферон бета-1а каждые 4 нед, была достоверно меньше частота развития конечных точек, включая ежегодную частоту рецидивов (на 24%, р=0,0209), риск рецидива (на 24%, р=0,0212), риск прогрессирования стойкой инвалидизации через 24 нед от начала терапии (на 36%, р=0,0459), конечных точек по данным МРТ (число новых/впервые увеличившихся Т2-очагов на 60%, ГД+-очагов на 71%, Т1-гипоинтенсивных очагов на 53%, для всех р<0,0001).
Пациентов с предшествующей неэффективной терапией рассеянного склероза в анамнезе в исследование не включали.
Был проведен анализ эффективности в подгруппах пациентов с повышенной активностью заболевания, выделенных по частоте рецидивов и МРТ-критериям (данные приведены ниже).
В подгруппе пациентов, имевших ?1 рецидива за последний год и ?9 Т2-очагов или ?1 ГД+-очага (n=1401), ежегодная частота рецидивов составила: 0,39 — у получавших плацебо; 0,29 — у получавших пэгинтерферон бета-1а каждые 4 нед и 0,25 — у получавших пэгинтерферон бета-1а каждые 2 нед. В данной подгруппе результаты были сопоставимы с общей популяцией, включенной в исследование.
В подгруппе пациентов, имевших ?2 рецидивов за последний год и по крайней мере один ГД+-очаг (n=273), ежегодная частота рецидивов составила: 0,47 — у получавших плацебо; 0,35 — у получавших средство каждые 4 нед и 0,33 — у получавших средство каждые 2 нед. В данной подгруппе результаты в числовом выражении были сопоставимы с общей популяцией, включенной в исследование, но без статистически значимых различий.
Фармакокинетика
По сравнению с непэгилированным интерфероном бета-1а Т1/2 пэгинтерферона бета-1а из плазмы крови более длительный. Концентрация пэгилированного интерферона бета-1а в плазме крови зависела от дозы в диапазоне доз от 63 до 188 мкг, как отмечено в исследовании с однократным и многократным введением здоровым добровольцам. Параметры фармакокинетики, определяемые у пациентов с рассеянным склерозом, согласовывались с параметрами у здоровых добровольцев.
Всасывание
После п/к введения пэгинтерферона бета-1а пациентам с рассеянным склерозом Сmax достигалась через 1–1,5 дня. После многократного введения (каждые 2 нед) дозы 125 мкг Сmax (средняя ± стандартная ошибка) составила (280±79) пг/мл.
П/к введение пэгинтерферона бета-1а в однократных дозах 63 (6 ММЕ), 125 (12 ММЕ) и 188 (18 ММЕ) мкг соответственно обеспечивало примерно в 4, 9 и 13 раз бoльшую экспозицию (AUC168) и примерно в 2, 3,5 и 5 раз более высокое значение Сmax по сравнению с в/м введением непэгилированного интерферона бета-1а в дозе 30 мкг (6 ММЕ).
Распределение
После многократного п/к введения средства в дозе 125 мкг (в пересчете на белок) каждые 2 нед пациентам с рассеянным склерозом Vd пэгинтерферона бета-1а без коррекции на биодоступность (среднее ± стандартная ошибка) составил (481±105) л.
Метаболизм и выведение
Почечный клиренс определен как основной путь выведения пэгинтерферона бета-1а. Ковалентно связанный с белком (интерфероном бета-1а) фрагмент полиэтиленгликоля может изменять in vivo свойства немодифицированного белка, включая снижение почечного клиренса и уменьшение протеолиза, тем самым продлевая Т1/2 из кровотока. Соответственно, у здоровых добровольцев Т1/2 для пэгинтерферона бета-1а примерно в 2 раза больше, чем для непэгилированного интерферона бета-1а. У пациентов с рассеянным склерозом Т1/2 (среднее ± стандартная ошибка) пэгинтерферона бета-1а в равновесном состоянии составил (78±15) ч. Среднее значение клиренса в равновесном состоянии пэгинтерферона бета-la составило (4,1±0,4) л/час.
Особые группы пациентов
Почечная недостаточность. Исследование с однократным введением пэгинтерферона бета-1а здоровым добровольцам и пациентам с почечной недостаточностью разной степени тяжести показало избирательное увеличение AUC (30–53%) и Сmax (26–42%) у пациентов с легкой (Cl креатинина от 50 до ?80 мл/мин), средней (Cl креатинина от 30 до <50 мл/мин) и тяжелой (Cl креатинина <30 мл/мин) почечной недостаточностью по сравнению с добровольцами с нормальной функцией почек (Cl креатинина >80 мл/мин). У пациентов с терминальной стадией почечной недостаточности, которым гемодиализ требовался 2–3 раза в неделю, AUC и Сmax были схожими со значениями этих показателей у добровольцев с нормальной функцией почек. Концентрация пэгинтерферона бета-1а снижалась примерно на 24% после каждого сеанса гемодиализа, из чего можно сделать вывод, что гемодиализ способствует частичному выведению пэгинтерферона бета-1а из системного кровотока.
Печеночная недостаточность. Параметры фармакокинетики пэгинтерферона бета-1а у пациентов с печеночной недостаточностью не оценивали.
Пожилые пациенты. Опыт клинического применения пэгинтерферона бета-1а у пациентов в возрасте старше 65 лет ограничен. Однако результаты популяционного анализа фармакокинетических данных (у пациентов в возрасте до 65 лет) показывают, что возраст не влияет на клиренс пэгинтерферона бета-1а.
Пол. Популяционный анализ фармакокинетических данных не выявил влияния пола пациентов на параметры фармакокинетики пэгинтерферона бета-1а.
Раса. Популяционный анализ фармакокинетических данных не выявил влияния расы пациентов на параметры фармакокинетики пэгинтерферона бета-1а.
Результаты доклинического изучения безопасности
Еженедельное в течение 5 нед п/к введение пэгинтерферона бета-1а макакам резус в дозах, в 55 раз превышающих терапевтическую дозу, рассчитанную в мг/кг массы тела (принимая за среднюю массу тела 70 кг), не выявило признаков токсичности у животных.
Пэгинтерферон бета-1а не проявлял мутагенной активности в испытаниях на обратные мутации у бактерий in vitro (тест Эймса), а также кластогенной активности в исследовании лимфоцитов человека in vitro. Исследования канцерогенности пэгинтерферона бета-1а на животных не проводились. Еженедельное п/к введение пэгинтерферона бета-1а половозрелым самкам макаки резус в дозах, в 70 раз превышающих терапевтическую, рассчитанную в мг/кг массы тела (принимая за среднюю массу тела 70 кг), в течение одного менструального цикла (до 5 нед) привело к нарушению регулярности менструального цикла, ановуляции и снижению концентрации прогестерона в плазме крови. Эти эффекты схожи с эффектами непэгилированного интерферона бета и носят обратимый характер после прекращения применения пэгинтерферона бета-1а.
Показания к применению
Ремиттирующий рассеянный склероз у взрослых.
Противопоказания
Гиперчувствительность к естественному или рекомбинантному интерферону бета или пэгинтерферону; начало терапии во время беременности (в связи с отсутствием клинических данных, см. «Применение при беременности и кормлении грудью»); выраженная депрессия и/или суицидальные мысли (см. «Меры предосторожности», «Побочные действия»); детский возраст до 18 лет (в связи с отсутствием клинических данных).
Применение при беременности и кормлении грудью
Женщины с сохраненным детородным потенциалом должны использовать надежные методы контрацепции. Если пациентка забеременела или планирует беременность во время лечения, она должна быть проинформирована о потенциальных рисках; также следует рассмотреть вопрос о прекращении терапии. У женщин с высокой частотой рецидивов до начала лечения риск выраженного рецидива после отмены терапии в связи с беременностью следует оценить в сравнении с повышенным риском спонтанного аборта на фоне лечения.
Данные по применению у беременных ограничены. Полученные данные указывают на повышение риска спонтанного аборта. Начинать лечение во время беременности противопоказано (см. «Противопоказания»).
Не установлено, выделяется ли пэгинтерферон бета-1а с грудным молоком человека. Учитывая возможность развития серьезных нежелательных реакций у новорожденного, необходимо прекратить либо грудное вскармливание, либо лечение.
Данные о влиянии пэгинтерферона бета-1а на фертильность человека отсутствуют. У животных ановуляторные эффекты наблюдались при его введении в очень высоких дозах. Данные об изучении влияния пэгинтерферона бета-1а на фертильность самцов также отсутствуют.
Побочные действия
Наиболее частыми (чаще, чем при применении плацебо) нежелательными реакциями (НР) при п/к применении пэгинтерферон бета-1а в дозе 125 мкг (в пересчете на белок) каждые 2 нед были эритема в месте инъекции, гриппоподобный синдром, лихорадка, головная боль, миалгия, озноб, боль в месте инъекции, астения, зуд в месте инъекции, артралгия. Наиболее частой НР, приведшей к отмене терапии при этой дозировке, был гриппоподобный синдром (<1%).
В ходе клинических исследований 1468 пациентов получали пэгинтерферон бета-1а в течение 177 нед (общая экспозиция эквивалентна 1932 пациенто-годам). 1093 пациента получали терапию в течение как минимум 1 года, и 415 пациентов — как минимум в течение 2 лет.
Сопоставимые данные были получены в ходе плацебо-контролируемой фазы рандомизированного исследования ADVANCE, длившейся 1 год, неконтролируемой фазы того же исследования, длившейся еще 1 год, а также продленного исследования по безопасности ATTAIN, продолжавшегося 2 года.
Ниже приведены обобщенные данные о HP, чаще выявлявшихся у пациентов, которым п/к вводили пэгинтерферон бета-1а в дозе 125 мкг (в пересчете на белок) каждые 2 нед (n=512), в сравнении с пациентами, получавшими плацебо (n=500) в течение 48 нед. НР представлены в виде предпочтительных терминов MedDRA, распределенных по классу систем и органов MedDRA.
Частота НР, приведенных ниже, определялась соответственно следующей классификации: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100); редко (≥1/10000, <1/1000); очень редко (<1/10000); неизвестно (невозможно оценить согласно имеющимся данным).
Со стороны крови и лимфатической системы: нечасто — тромбоцитопения; редко — тромботическая микроангиопатия, включая тромботическую тромбоцитопеническую пурпуру/гемолитический уремический синдром.
Со стороны иммунной системы: нечасто — реакция гиперчувствительности.
Со стороны нервной системы: очень часто — головная боль; нечасто — судорожные припадки.
Со стороны дыхательной системы, органов грудной клетки и средостения: неизвестно — легочная артериальная гипертензия.
Со стороны ЖКТ: часто — тошнота, рвота.
Со стороны кожи и подкожных тканей: часто — зуд; нечасто — крапивница.
Со стороны скелетно-мышечной и соединительной тканей: очень часто — миалгия, артралгия.
Со стороны почек и мочевыводящих путей: редко — нефротический синдром, гломерулосклероз.
Общие расстройства и нарушения в месте введения: очень часто — гриппоподобный синдром, лихорадка, озноб, астения, эритема, боль, зуд в месте инъекции; часто — гипертермия, боль, отек, ощущение тепла, гематома, высыпания, припухлость, изменение цвета кожи, воспаление в месте инъекции; редко — некроз в месте инъекции.
Лабораторные и инструментальные данные: часто — повышение температуры тела, повышение активности АЛТ, АСТ и ГГТ, снижение концентрации Hb, снижение числа лейкоцитов; нечасто — снижение числа тромбоцитов.
Со стороны психики: часто — депрессия.
Описание отдельных HP
Гриппоподобные симптомы. Гриппоподобный синдром отмечали у 47% пациентов, получавших пэгинтерферон бета-1а в дозе 125 мкг (в пересчете на белок) каждые 2 нед, и у 13% пациентов, получавших плацебо. Частота гриппоподобных симптомов (например гриппоподобное состояние, озноб, гиперпирексия, мышечно-скелетная боль, миалгия, боль и лихорадка) была наибольшей в начале терапии и обычно снижалась в течение первых 6 мес. 90% случаев отмеченных гриппоподобных симптомов были легкими или средними по своей тяжести. Не было случаев регистрации гриппоподобного симптома как серьезной HP. Менее 1% пациентов, получавших пэгинтерферон бета-1а во время плацебо-контролируемой фазы исследования ADVANCE, прекратили терапию вследствие гриппоподобных симптомов.
Реакции в месте инъекции. Реакции в месте инъекции (например эритема, боль, зуд или отек) были зарегистрированы у 66% пациентов, получавших пэгинтерферон бета-1а в дозе 125 мкг (в пересчете на белок) каждые 2 нед, по сравнению с 11% пациентов, получавших плацебо. Эритема в месте инъекции была наиболее частой реакцией. Из отмеченных реакций в месте инъекции 95% были легкими или средними по тяжести. У одного из 1468 пациентов, получавших пэгинтерферон бета-1а во время клинических исследований, развился некроз в месте инъекции, который разрешился после стандартной терапии.
Изменения активности печеночных трансаминаз. Частота случаев повышения активности ферментов печени была выше у пациентов, получавших пэгинтерферон бета-1а, по сравнению с частотой в группе плацебо. В большинстве случаев активность ферментов печени превышала ВГН менее чем в 3 раза. Повышение активности АЛТ и АСТ более чем в 5 раз выше ВГН отмечены у 1% и <1% пациентов, получавших плацебо, и 2% и <1% пациентов, получавших пэгинтерферон бета-1а соответственно. Сочетанное повышение активности ферментов печени и концентрации билирубина в плазме крови наблюдалось у 2 пациентов, у которых ранее, до получения пэгинтерферона бета-1а в рамках клинических исследований, выявлены отклонения в функциональных пробах печени. Оба случая разрешились после отмены терапии.
Гематологические нарушения. Снижение числа лейкоцитов <3·109/л отмечены у 7% пациентов, получавших пэгинтерферон бета-1а, и у 1% пациентов, получавших плацебо. Среднее число лейкоцитов оставалось в пределах нормы у пациентов, получавших терапию. Снижение числа лейкоцитов не сопровождалось повышенным риском развития инфекций, в т.ч. серьезных. Частота потенциально клинически значимого снижения числа лимфоцитов (<0,5·109/л) (<1%), числа нейтрофилов (<1·109/л) (<1%) и числа тромбоцитов (<100·109/л) (<1%) была схожей у пациентов, получавших пэгинтерферон бета-1а, и получавших плацебо. Два серьезных случая были зарегистрированы у пациентов, получавших пэгинтерферон бета-1а: у одного пациента (<1%) развилась тяжелая тромбоцитопения (число тромбоцитов <10·109/л), у другого пациента (<1%) развилась тяжелая нейтропения (число нейтрофилов <0,5·109/л). У обоих пациентов число клеток крови восстановилось после отмены терапии. Незначительное снижение числа эритроцитов отмечено у пациентов, получавших лечение. Частота потенциально клинически значимых случаев снижения числа эритроцитов (<3,3·1012/л) была схожей у пациентов, получавших пэгинтерферон бета-1а, по сравнению с пациентами, получавшими плацебо.
Реакции гиперчувствительности. Реакции гиперчувствительности были зарегистрированы у 16% пациентов, получавших пэгинтерферон бета-1а в дозе 125 мкг (в пересчете на белок) каждые 2 нед, и у 14% пациентов, получавших плацебо. Менее чем у 1% больных, получавших пэгинтерферон бета-1а, развились серьезные реакции гиперчувствительности (например ангионевротический отек, крапивница), но они быстро купировались после применения антигистаминных и/или глюкокортикостероидных средств.
Депрессия и суицидальные мысли. Общая частота НР, проявляющихся депрессией и суицидальными мыслями, составила 8% у пациентов, получавших пэгинтерферон бета-1а в дозе 125 мкг (в пересчете на белок) каждые 2 нед, и у пациентов, получавших плацебо. Частота серьезных HP, связанных с депрессией и суицидальными мыслями, была низкой (<1%) как у пациентов, получавших терапию, так и у пациентов, получавших плацебо.
Судорожные припадки. Частота судорожных припадков была низкой и сопоставимой у пациентов, получавших пэгинтерферон бета-1а в дозе 125 мкг (в пересчете на белок) каждые 2 нед и плацебо (<1% в каждой группе).
Легочная артериальная гипертензия. Имеются сообщения о случаях развития легочной артериальной гипертензии при применении интерферонов бета. О развитии таких случаев сообщали в различных временных рамках, включая период до нескольких лет после начала лечения интерфероном бета.
Взаимодействие
Исследования взаимодействий пэгинтерферон бета-1а и других ЛС не проводились. Согласно клиническим данным, пациенты с рассеянным склерозом могут получать сочетанную терапию пэгинтерфероном бета-1а и ГКС во время рецидивов заболевания. Интерфероны понижют активность изоферментов системы цитохрома Р450 печени у человека и животных. Следует с осторожностью назначать пэгинтерферон бета-1а в комбинации с ЛС с узким терапевтическим индексом, у которых клиренс существенно зависит от системы цитохрома Р450 печени, например с некоторыми классами противоэпилептических средств и антидепрессантами.
Передозировка
Случаев передозировки пэгинтерферона бета-1а не зафиксировано. Тем не менее при передозировке рекомендуется проводить соответствующую поддерживающую терапию.
Способ применения и дозы
П/к. Рекомендуемая терапевтическая доза пэгинтерферона бета-1а составляет 125 мкг (в пересчете на белок), которую вводят 1 раз в 2 нед (14 дней).
Меры предосторожности
Поражение печени
На фоне применения препаратов интерферона бета были зарегистрированы случаи повышения активности ферментов печени, гепатита, аутоиммунного гепатита и редко — тяжелой печеночной недостаточности. При применении пэгинтерферона бета-1а наблюдались случаи повышения активности ферментов печени. Пациенты должны находиться под наблюдением для своевременного выявления симптомов поражения печени (см. «Побочные действия»).
Депрессия
Пэгинтерферон бета-1а следует вводить с осторожностью пациентам, у которых отмечены депрессивные расстройства в анамнезе (см. «Противопоказания»).
Депрессия развивается с повышенной частотой у пациентов с рассеянным склерозом и ассоциируется с применением интерферона. Пациентам следует рекомендовать немедленно сообщать о симптомах депрессии и/или суицидальных мыслях своему лечащему врачу. Во время терапии пэгинтерфероном бета-1а следует тщательно контролировать пациентов с депрессией и назначать им соответствующее лечение. Необходимо рассмотреть возможность прекращения терапии (см. «Побочные действия»).
Реакции гиперчувствительности
Серьезные реакции гиперчувствительности регистрировали в редких случаях как осложнение терапии интерфероном бета, включая пэгинтерферон бета-1а. Применение пэгинтерферона бета-1а необходимо прекратить, если развилась серьезная реакция гиперчувствительности (см. «Побочные действия»).
Реакции в месте инъекции
При п/к применении интерферона бета были отмечены случаи развития реакций в месте инъекции, включая некроз в месте инъекции.
Для сведения до минимума риска развития реакций в месте инъекции пациентов необходимо проинструктировать о необходимости введения пэгинтерферона бета-1а в асептических условиях. Следует периодически проверять выполнение самостоятельного введения пэгинтерферона бета-1а пациентом, особенно если регистрировались HP в месте инъекций. Если появилось поражение кожи, которое может сопровождаться припухлостью или оттоком жидкости из области инъекции, то пациенту следует обратиться к врачу.
При применении пэгинтерферона бета-1а в рамках клинического исследования у одного пациента развился некроз в месте инъекции. Решение о прекращении терапии вследствие появления единственного участка некроза на коже зависит от величины некроза (см. «Побочные действия»).
Снижение числа форменных элементов периферической крови
У пациентов, получавших интерферон бета, отмечено снижение числа всех форменных элементов периферической крови, включая редкие случаи панцитопении и тяжелой тромбоцитопении. Цитопении, включая редкие случаи тяжелой нейтропении и тромбоцитопении, наблюдались у пациентов, получавших лечение пэгинтерфероном бета-1а. На фоне лечения необходимо контролировать симптомы или признаки снижения числа форменных элементов периферической крови (см. «Побочные действия»).
Нарушение со стороны почек и мочевыводящей системы
Нефротический синдром. При лечении интерфероном бета отмечены случаи развития нефротического синдрома на фоне различных нефропатий, включая склерозирующий, фокально-сегментарный гломерулосклероз, липоидный нефроз, мембранозно-пролиферативный гломерулонефрит и мембранозную гломерулопатию. Эти явления регистрировались на разных этапах лечения и могли возникать через несколько лет после лечения интерфероном бета. Рекомендуется периодическое обследование пациентов с целью выявления ранних признаков или симптомов, например отеков, протеинурии и нарушения функции почек, особенно у пациентов с повышенным риском поражения почек. Требуется своевременное лечение нефротического синдрома, а также оценка целесообразности прекращения терапии.
Тяжелая почечная недостаточность. Пэгинтерферон бета-1а применяют с осторожностью у пациентов с тяжелой почечной недостаточностью.
Тромботическая микроангиопатия (ТМА)
При применении интерферона бета зарегистрированы случаи ТМА (в т.ч. и с летальным исходом), проявлявшиеся в виде тромботической тромбоцитопенической пурпуры или гемолитического уремического синдрома. Эти явления регистрировались на разных этапах лечения и могли возникать через несколько недель или лет после начала лечения интерфероном бета. Ранние клинические признаки включают тромбоцитопению, впервые развившуюся артериальную гипертензию, лихорадку, симптомы поражения ЦНС (например спутанность сознания, парезы) и нарушение функции почек. Лабораторные данные предполагаемой ТМА включают снижение числа тромбоцитов, повышение активности ЛДГ вследствие гемолиза и шистоцитоз (фрагментация эритроцитов) в мазке крови. Поэтому при выявлении клинических признаков ТМА рекомендуется провести дополнительные исследования числа тромбоцитов, концентрации ЛДГ, мазков крови и функции почек. Если диагноз ТМА подтвержден, требуется немедленное прекращение терапии пэгинтерфероном бета-1а и безотлагательное лечение, включающее обменное переливание плазмы.
Изменения лабораторных показателей
Терапия интерферонами сопровождается изменениями лабораторных показателей. Помимо стандартных лабораторных тестов, которые обычно выполняют у пациентов с рассеянным склерозом, перед началом терапии, регулярно после начала терапии и далее периодически (при отсутствии клинических симптомов) рекомендуется выполнять полный клинический анализ крови с подсчетом форменных элементов крови, включая число тромбоцитов, биохимический анализ крови, в т.ч. функциональные печеночные пробы (например определение активности АСТ и АЛТ). Пациентам с миелосупрессией может потребоваться более интенсивный мониторинг показателей клинического анализа крови с подсчетом числа форменных элементов крови и числа тромбоцитов. Гипотиреоз и гипертиреоз наблюдались при применении интерферона бета. Оценку функции щитовидной железы рекомендуется проводить по клиническим показаниям, а пациентам с дисфункцией щитовидной железы в анамнезе — регулярно.
Судорожные припадки
Пэгинтерферон бета-1а необходимо применять с осторожностью у пациентов с судорожными припадками в анамнезе у пациентов, получающих противоэпилептические ЛС, особенно если эпилепсия недостаточно контролируется (см. «Побочные действия»).
Заболевания сердца
На фоне применения интерферона бета наблюдались случаи ухудшения заболевания сердца. Частота сердечно-сосудистых явлений была схожей при применении пэгинтерферона бета-1а в дозе 125 мкг (в пересчете на белок) каждые 2 нед и плацебо (7% в каждой группе). В ходе основного клинического исследования ADVANCE не зарегистрировано серьезных сердечно-сосудистых явлений у пациентов, получавших пэгинтерферон бета-1а. Тем не менее необходим постоянный контроль за пациентами с тяжелыми заболеваниями сердца в анамнезе, такими как застойная сердечная недостаточность, заболевание коронарных артерий или аритмия, для своевременного выявления возможного нарастания тяжести симптомов, особенно в начале терапии.
Иммуногенность
При лечении пэгинтерфероном бета-1а у пациентов могут появиться к нему антитела. При длительности терапии до 2 лет были отмечены случаи появления персистирующих нейтрализующих антител к интерферону бета-1а в составе пэгинтерферона бета-1а (менее 1%, 5 случаев на 715 пациентов). Нейтрализующие антитела могут снизить эффективность терапии. Формирование антител к интерферону, входящему в состав пэгинтерферона бета-1а, не оказало очевидное влияние на безопасность и эффективность пэгинтерферона бета-1а, хотя достоверность проведенного анализа ограничена вследствие низкой его иммуногенности.
Появление персистирующих антител к пэгилирующему компоненту пэгинтерферона бета-1а было зарегистировано у 3% пациентов (у 18 из 681). В проведенном клиническом исследовании формирование антител к пэгилирующему компоненту пэгинтерферона бета-1а не оказало очевидное влияние на безопасность или эффективность (в т.ч. ежегодную частоту рецидивов, появление новых и впервые увеличившихся патологических очагов по данным МРТ, прогрессирование стойкой инвалидизации).
Печеночная недостаточность
Пациентам с тяжелой печеночной недостаточностью пэгинтерферон бета-1а следует назначать с осторожностью и тщательно контролировать его применение. Необходимо периодически обследовать пациентов на наличие симптомов поражения печени. Кроме того, следует с осторожностью применять интерфероны на фоне сопутствующего лечения другими ЛС, способными вызывать поражение печени (см. «Побочные действия» и «Фармакология»).
Влияние на способность к управлению автомобилем и работе с механизмами. HP со стороны ЦНС (тошнота) могут влиять на способность к управлению автомобилем и выполнение потенциально опасных видов деятельности, требующих повышенной концентрации внимания и быстроты психомоторных реакций (см. «Побочные действия»).
Представленная информация о ценах на препараты не является предложением о продаже или покупке товара.
Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в
соответствии со статьей 55 Федерального закона «Об обращении лекарственных средств» от 12.04.2010 № 61-ФЗ.
Плегриди (Plegridy)
💊 Состав препарата Плегриди
✅ Применение препарата Плегриди
Описание активных компонентов препарата
Плегриди
(Plegridy)
Приведенная научная информация является обобщающей и не может быть использована для принятия
решения о возможности применения конкретного лекарственного препарата.
Дата обновления: 2022.07.01
Владелец регистрационного удостоверения:
Код ATX:
L03AB13
(Пэгинтерферон бета-1a)
Лекарственная форма
| Плегриди |
Р-р д/п/к введения 94 мкг/0.5 мл: шприцы 1 шт. или шприц-ручки 2 шт. рег. №: ЛП-003859 |
Форма выпуска, упаковка и состав
препарата Плегриди
Раствор для п/к введения прозрачный, бесцветный или слабо-желтый.
Вспомогательные вещества: аргинина гидрохлорид L — 15.8 мг, натрия ацетата тригидрат — 0.79 мг, уксусная кислота ледяная — 0.25 мг, полисорбат 20 — 0.025 мг, вода д/и — до 0.5 мл.
0.5 мл — шприцы бесцветного стекла (1) — поддоны пластиковые.
0.5 мл — шприцы бесцветного стекла (2) — шприц-ручки (2) — поддоны пластиковые.
Фармакологическое действие
Представляет собой интерферон бета-1а, конъюгированный по N-концевому аминокислотному остатку альфа-аминогруппы с одной линейной молекулой метоксиполиэтиленгликоля (20 кДа). Фармакологические свойства пэгинтерферона бета-1а согласуются со свойствами интерферона бета-1а и, как считается, опосредуются белковой частью этой молекулы.
Интерфероны — семейство белков естественного происхождения, индуцируемые клетками в ответ на биологические и химические стимулы. Интерфероны опосредуют многочисленные клеточные реакции, классифицируемые как противовирусные, антипролиферативные, иммуномодулирующие.
Точный механизм действия пэгинтерферона бета-1а при рассеянном склерозе неизвестен. Пэгинтерферон бета-1а связывается с рецепторами интерферона I типа на поверхности клеток и запускает каскад внутриклеточных реакций, приводящих к регулированию экспрессии генов, зависимых от интерферона. Биологические эффекты, возможно, опосредованные пэгинтерфероном бета-1а, включают усиление экспрессии противовоспалительных цитокинов (например, интерлейкина-4 (ИЛ-4), ИЛ-10, ИЛ-27), снижение экспрессии провоспалительных цитокинов (например, ИЛ-2, ИЛ-12, интерферона гамма, ФНОα) и подавление миграции активированных Т-клеток через ГЭБ; однако могут быть задействованы и дополнительные механизмы.
Фармакокинетика
Концентрация пэгинтерферона бета-1а в плазме крови зависела от дозы в диапазоне доз от 63 до 188 мкг. Параметры фармакокинетики, определяемые у пациентов с рассеянным склерозом, согласовывались с параметрами у здоровых добровольцев.
После п/к пэгинтерферона бета-1а пациентам с рассеянным склерозом Cmax достигалась через 1-1.5 дня. После многократного введения (каждые 2 недели) дозы 125 мкг Cmax составила 280±79 пг/мл.
После многократного п/к введения в дозах 125 мкг каждые 2 недели пациентам с рассеянным склерозом Vd пэгинтерферона бета-1а без коррекции на биодоступность составил 481±105 л.
Почечный клиренс определен как основной путь выведения пэгинтерферона бета-1а. Ковалентно связанный с белком (интерфероном бета-1а) фрагмент полиэтиленгликоля (PEG) может изменять in vivo свойства немодифицированного белка, включая снижение почечного клиренса и уменьшение протеолиза, тем самым продлевая T1/2 из кровотока.
У пациентов с рассеянным склерозом T1/2 пэгинтерферона бета-1а в равновесном состоянии составил 78±15 ч. Среднее значение клиренса в равновесном состоянии пэгинтерферона бета-1a составило 4.1±0.4 л/ч.
У пациентов, находящихся на гемодиализе, концентрация пэгинтерферона бета-1а снижалась примерно на 24% после каждого сеанса гемодиализа, из чего можно сделать вывод, что гемодиализ способствует частичному выведению пэгинтерферона бета-1а из системного кровотока.
Показания активных веществ препарата
Плегриди
Лечение ремиттирующего рассеянного склероза у взрослых.
Режим дозирования
Способ применения и режим дозирования конкретного препарата зависят от его формы выпуска и других факторов. Оптимальный режим дозирования определяет врач. Следует строго соблюдать соответствие используемой лекарственной формы конкретного препарата показаниям к применению и режиму дозирования.
Лечение пэгинтерфероном бета-1а необходимо начинать под наблюдением врача, имеющего опыт в лечении рассеянного склероза.
Рекомендуемая терапевтическая доза пэгинтерферон бета-1а составляет 125 мкг, которую вводят п/к 1 раз в 2 недели (14 дней).
Лечение рекомендуется начинать с дозы 63 мкг (доза 1, день 1), затем повышать ее до 94 мкг (доза 2, день 14) и достигать полной дозы 125 мкг (доза 3, день 28). Затем каждые 2 недели (14 дней) рекомендуется вводить полную дозу (125 мкг).
Побочное действие
Со стороны системы кроветворения: часто — снижение концентрации гемоглобина, снижение числа лейкоцитов; нечасто — тромбоцитопения; редко — тромботическая микроангиопатия, включая тромботическую тромбоцитопеническую пурпуру/гемолитический уремический синдром.
Со стороны иммунной системы: нечасто — реакции гиперчувствительности.
Со стороны нервной системы: очень часто — головная боль; часто — нарушения психики, депрессия; нечасто — судорожные припадки.
Со стороны дыхательной системы: частота неизвестна — легочная артериальная гипертензия.
Со стороны пищеварительной системы: часто — тошнота, рвота.
Со стороны печени и желчевыводящих путей: часто — повышение активности аланинаминотрансферазы, повышение активности АСТ, повышение активности ГГТ.
Со стороны кожи и подкожных тканей: часто — зуд, нечасто — крапивница.
Со стороны костно-мышечной системы: очень часто — миалгия, артралгия.
Со стороны мочевыводящей системы: редко — нефротический синдром, гломерулосклероз.
Общие реакции: очень часто — эритема в месте инъекции, гриппоподобный синдром, лихорадка, озноб, боль в месте инъекции, астения, зуд в месте инъекции; часто — повышение температуры тела, гипертермия, боль, отек в месте инъекции, ощущение тепла в месте инъекции, гематома в месте инъекции, высыпания в месте инъекции, припухлость в месте инъекции, изменение цвета кожи в месте инъекции, воспаление в месте инъекции; редко — некроз в месте инъекции.
Противопоказания к применению
Повышенная чувствительность к естественному или рекомбинантному интерферону бета или пэгинтерферону; начало терапии во время беременности; выраженная депрессия и/или суицидальные мысли; возраст до 18 лет.
Применение при беременности и кормлении грудью
Женщины с сохраненным детородным потенциалом в период лечения должны использовать надежные методы контрацепции. Если пациентка забеременела или планирует беременность во время применения препарата, содержащего пэгинтерферон бета-1а, она должна быть проинформирована о потенциальных рисках; также следует рассмотреть вопрос о прекращении терапии. У женщин с высокой частотой рецидивов до начала лечения риск выраженного рецидива после отмены терапии пэгинтерфероном бета-1а в связи с беременностью следует оценить в сравнении с повышенным риском спонтанного аборта на фоне лечения.
Данные по применению пэгинтерферона бета-1а ограничены. Считается, что имеется повышенный риск спонтанного аборта. Начинать лечение препаратом, содержащим пэгинтерферон бета-1а, во время беременности противопоказано.
Не установлено, выделяется ли пэгинтерферон бета-1а с грудным молоком человека. Учитывая возможность развития серьезных нежелательных реакций у новорожденного, необходимо прекратить либо грудное вскармливание, либо лечение пэгинтерфероном бета-1а.
Особые указания
С осторожностью применять у пациентов с тяжелой почечной недостаточностью.
В период лечения пациенты должны находиться под наблюдением для своевременного выявления симптомов поражения печени.
Депрессия развивается с повышенной частотой у пациентов с рассеянным склерозом и ассоциируется с применением интерферона. Пациентам следует рекомендовать немедленно сообщать о симптомах депрессии и/или суицидальных мыслях своему лечащему врачу. Во время лечения следует тщательно контролировать пациентов с депрессией и назначать им соответствующее лечение. Необходимо рассмотреть возможность прекращения применения пэгинтерферона бета-1а.
Применение пэгинтерферона бета-1а необходимо прекратить, если развилась серьезная реакция гиперчувствительности.
Цитопении, включая редкие случаи тяжелой нейтропении и тромбоцитопении, наблюдались у пациентов, получавших лечение препаратом Плегриди. На фоне лечения необходимо контролировать симптомы или признаки снижения числа форменных элементов периферической крови.
При лечении препаратами интерферона бета отмечены случаи развития нефротического синдрома на фоне различных нефропатий, включая склерозирующий, фокальносегментарный гломерулосклероз (ФСГ), липоидный нефроз (ЛН), мембранознопролиферативный гломерулонефрит (МПГН) и мембранозную гломерулопатию (МГП). Эти явления регистрировались на разных этапах лечения и могли возникать через несколько лет после лечения интерфероном бета. Рекомендуется периодическое обследование пациентов с целью выявления ранних признаков или симптомов, например, отеков, протеинурии и нарушения функции почек, особенно у пациентов с повышенным риском поражения почек. Требуется своевременное лечение нефротического синдрома, а также оценка целесообразности прекращения терапии пэгинтерфероном бета-1а.
При выявлении клинических признаков тромботической микроангиопатии рекомендуется провести дополнительные исследования числа тромбоцитов, концентрации ЛДГ, мазков крови и функции почек. Если диагноз ТМА подтвержден, требуется немедленное прекращение терапии пэгинтерфероном бета-1а и безотлагательное лечение, включающее обменное переливание плазмы.
Терапия интерферонами сопровождается изменениями лабораторных показателей. Помимо стандартных лабораторных тестов, которые обычно выполняют у пациентов с рассеянным склерозом, перед началом терапии пэгинтерфероном бета-1а, регулярно после начала терапии и далее периодически (при отсутствии клинических симптомов) рекомендуется выполнять полный клинический анализ крови с подсчетом форменных элементов крови, включая число тромбоцитов, биохимический анализ крови, в том числе функциональные печеночные пробы (например, определение активности аспарагиновой и аланиновой аминотрансферазы). Пациентам с миелосупрессией может потребоваться более интенсивный мониторинг показателей клинического анализа крови с подсчетом числа форменных элементов крови и числа тромбоцитов.
Гипотиреоз и гипертиреоз наблюдались при применении препаратов интерферона бета. Оценку функции щитовидной железы рекомендуется проводить по клиническим показаниям, а пациентам с дисфункцией щитовидной железы в анамнезе — регулярно.
Пэгинтерферон бета-1а необходимо применять с осторожностью у пациентов с судорожными припадками в анамнезе, у пациентов, получающих противоэпилептические препараты, особенно если эпилепсия недостаточно контролируется.
В период лечения необходим постоянный контроль за пациентами с тяжелыми заболеваниями сердца в анамнезе, такими как застойная сердечная недостаточность, заболевание коронарных артерий или аритмия, для своевременного выявления возможного нарастания тяжести симптомов, особенно в начале терапии.
При лечении пэгинтерфероном бета-1а у пациентов могут появиться антитела к активному веществу.
При длительности терапии до 2 лет были отмечены случаи появления персистирующих нейтрализующих антител к интерферону бета-1а, которые могут снизить эффективность терапии.
У пациентов с тяжелой печеночной недостаточностью пэгинтерферон бета-1а следует применять с осторожностью и тщательно контролировать состояние пациента. Необходимо периодически проводить обследование на наличие симптомов поражения печени. Кроме того, следует с осторожностью применять интерфероны на фоне сопутствующего лечения другими препаратами, способными вызывать поражение печени.
Влияние на способность к управлению транспортными средствами и механизмами
Побочные реакции со стороны ЦНС (например, тошнота) могут влиять на способность управления автомобилем и выполнение потенциально опасных видов деятельности, требующих повышенной концентрации внимания и быстроты психомоторных реакций.
Лекарственное взаимодействие
Интерфероны понижали активность ферментов системы цитохрома Р450 печени у человека и животных. Следует с осторожностью применять Плегриди в комбинации с лекарственными препаратами с узким терапевтическим индексом, у которых клиренс существенно зависит от системы цитохрома Р450 печени, например, с некоторыми классами противоэпилептических средств и антидепрессантами.
Если вы хотите разместить ссылку на описание этого препарата — используйте данный код
Резюме профиля безопасности
Наиболее частыми (чаще, чем при применении плацебо) нежелательными лекарственными реакциями (НЛР) при подкожном применении препарата Плегриди в дозе 125 мкг каждые 2 недели были эритема в месте инъекции, гриппоподобный синдром, лихорадка, головная боль, миалгия, озноб, боль в месте инъекции, астения, зуд в месте инъекции, артралгия. Наиболее частой НЛР, приведшей к отмене терапии препаратом Плегриди в дозе 125 мкг каждые 2 недели, был гриппоподобный синдром (<1%).
В ходе клинических исследований 1468 пациентов получали Плегриди в течение 177 недель (общая экспозиция эквивалентна 1932 пациенто-лет). 1093 пациента получали терапию препаратом Плегриди в течение, как минимум, 1 года, и 415 пациентов, как минимум, в течение 2 лет.
Сопоставимые данные были получены в ходе плацебо-контролируемой фазы рандомизированного исследования ADVANCE, длившейся 1 год, неконтролируемой фазы того же исследования, длившейся еще 1 год, а также продленного исследования по безопасности ATTAIN, продолжавшегося 2 года.
Ниже приведены обобщенные данные о НЛР, чаще выявлявшихся у пациентов, которым подкожно вводили Плегриди в дозе 125 мкг каждые 2 недели (n=512), в сравнении с пациентами, получавшими плацебо (n=500) в течение 48 недель. НЛР представлены в виде предпочтительных терминов MedDRA, распределенных по классу систем и органов MedDRA.
Частота НЛР, приведенных ниже, определялась соответственно следующей классификации: очень часто (≥1/10); часто (≥1/100, <1/10); нечасто (≥1/1000, <1/100), редко (≥1/10,000 до <1/1,000), очень редко (<1/10,000), неизвестно (невозможно оценить согласно имеющимся данным).
Нарушения со стороны крови и лимфатической системы
Нечасто: тромбоцитопения
Редко: тромботическая микроангиопатия, включая тромботическую тромбоцитопеническую пурпуру/гемолитический уремический синдром
Нарушения со стороны иммунной системы
Нечасто: реакция гиперчувствительности
Нарушения со стороны нервной системы
Очень часто: головная боль
Нечасто: судорожные припадки
Нарушения со стороны дыхательной системы, органов грудной клетки и средостения
Неизвестно: Легочная артериальная гипертензия
Нарушения со стороны желудочно-кишечного тракта
Часто: тошнота, рвота
Нарушения со стороны кожи и подкожных тканей
Часто: зуд
Нечасто: крапивница
Нарушения со стороны скелетно-мышечной и соединительной тканей
Очень часто: миалгия, артралгия
Нарушения со стороны почек и мочевыводящих путей
Редко: нефротический синдром, гломерулосклероз
Общие расстройства и нарушения в месте введения
Очень часто: эритема в месте инъекции, гриппоподобный синдром, лихорадка, озноб, боль в месте инъекции, астения, зуд в месте инъекции
Часто: гипертермия, боль, отек в месте инъекции, ощущение тепла в месте инъекции, гематома в месте инъекции, высыпания в месте инъекции, припухлость в месте инъекции, изменение цвета кожи в месте инъекции, воспаление в месте инъекции Редко: некроз в месте инъекции
Лабораторные и инструментальные данные
Часто: повышение температуры тела, повышение активности аланинаминотрансферазы, повышение активности аспартатаминотрансферазы, повышение активности гамма-глутамилтрансферазы, снижение концентрации гемоглобина, снижение числа лейкоцитов
Нечасто: снижение числа тромбоцитов
Нарушения психики
Часто: депрессия
Описание отдельных НЛР
Гриппоподобные симптомы
Гриппоподобный синдром отмечали у 47% пациентов, получавших Плегриди в дозе 125 мкг каждые 2 недели, и у 13% пациентов, получавших плацебо. Частота гриппоподобных симптомов (например, гриппоподобное состояние, озноб, гиперпирексия, мышечно-скелетная боль, миалгия, боль и лихорадка) была наибольшей в начале терапии, и обычно снижалась в течение первых 6 месяцев. 90% случаев отмеченных гриппоподобных симптомов были легкими или средними по своей тяжести. Не было случаев регистрации гриппоподобного симптома как серьезной НЛР. Менее 1% пациентов, получавших Плегриди во время плацебо-контролируемой фазы исследования ADVANCE, прекратили терапию вследствие гриппоподобных симптомов.
Реакции в месте инъекции
Реакции в месте инъекции (например, эритема, боль, зуд или отек) были зарегистрированы у 66% пациентов, получавших Плегриди в дозе 125 мкг каждые 2 недели, по сравнению с 11% пациентов, получавших плацебо. Эритема в месте инъекции была наиболее частой реакцией. Из отмеченных реакций в месте инъекции 95% были легкими или средними по тяжести. У одного из 1468 пациентов, получавших Плегриди во время клинических исследований, развился некроз в месте инъекции, который разрешился после стандартной терапии.
Изменения активности печеночных трансаминаз
Частота случаев повышения активности ферментов печени была выше у пациентов, получавших Плегриди, по сравнению с частотой в группе плацебо. В большинстве случаев активность ферментов печени превышала верхнюю границу нормы (ВГН) менее, чем в 3 раза. Повышение активности аланинаминотрансферазы и аспартатаминотрансферазы более, чем в 5 раз выше ВГН, отмечены у 1% и <1% пациентов, получавших плацебо, и 2% и <1% пациентов, получавших Плегриди, соответственно. Сочетанное повышение активности ферментов печени и концентрации билирубина в плазме крови наблюдалось у 2 пациентов, у которых ранее, до получения Плегриди в рамках клинических исследований, выявлены отклонения в функциональных пробах печени. Оба случая разрешились после отмены терапии Плегриди.
Гематологические нарушения
Снижение числа лейкоцитов <3,0×109/л отмечены у 7% пациентов, получавших Плегриди, и у 1% пациентов, получавших плацебо. Среднее число лейкоцитов оставалось в пределах нормы у пациентов, получавших лечение препаратом Плегриди. Снижение числа лейкоцитов не сопровождалось повышенным риском развития инфекций или серьёзных инфекций. Частота потенциально клинически значимого снижения числа лимфоцитов (<0,5×109/л) (<1%), числа нейтрофилов (≤1,0×109/л) (<1%) и числа тромбоцитов (≤100×109/л) (≤1%) была схожей у пациентов, получавших Плегриди, и получавших плацебо. Два серьёзных случая были зарегистрированы у пациентов, получавших Плегриди: у одного пациента (<1%) развилась тяжелая тромбоцитопения (число тромбоцитов <10×109/л), у другого пациента (<1%) развилась тяжелая нейтропения (число нейтрофилов <0,5×109/л). У обоих пациентов число клеток крови восстановилось после отмены терапии препаратом Плегриди. Незначительное снижение числа эритроцитов отмечено у пациентов, получавших лечение препаратом Плегриди. Частота потенциально клинически значимых случаев снижения числа эритроцитов (<3,3×1012/л) была схожей у пациентов, получавших Плегриди, по сравнению с пациентами, получавшими плацебо.
Реакции гиперчувствительности
Реакции гиперчувствительности были зарегистрированы у 16% пациентов, получавших Плегриди в дозе 125 мкг каждые 2 недели, и у 14% пациентов, получавших плацебо. Менее чем у 1% больных, получавших Плегриди, развились серьёзные реакции гиперчувствительности (например, ангионевротический отек, крапивница), но они быстро купировались после применения антигистаминных и/или глюкокортикостероидных препаратов.
Депрессия и суицидальные мысли
Общая частота НЛР, проявляющихся депрессией и суицидальными мыслями, составила 8% у пациентов, получавших Плегриди в дозе 125 мкг каждые 2 недели, и у пациентов, получавших плацебо. Частота серьёзных НЛР, связанных с депрессией и суицидальными мыслями, была низкой (<1%) как у пациентов, получавших Плегриди в дозе 125 мкг каждые 2 недели, так и у пациентов, получавших плацебо.
Судорожные припадки
Частота судорожных припадков была низкой и сопоставимой у пациентов, получавших Плегриди (125 мкг каждые 2 недели), и плацебо (<1% в каждой группе).
Легочная артериальная гипертензия
Имеются сообщения о случаях развития легочной артериальной гипертензии (ЛАГ) при применении интерферонов бета. О развитии таких случаев сообщали в различных временных рамках, включая период до нескольких лет после начала лечения интерфероном бета.
Плегриди®
МНН: Пэгинтерферон бета-1а
Производитель: Веттер Фарма-Фертигунг ГмбХ & Ко.КГ
Анатомо-терапевтическо-химическая классификация: Пэгинтерферон бета-1а
Номер регистрации в РК:
№ РК-БП-5№022429
Информация о регистрации в РК:
07.07.2021 — 07.07.2031
- Скачать инструкцию медикамента
Торговое название
Плегриди®
Международное непатентованное название
Пэгинтерферон бета-1а
Лекарственная форма
Раствор для инъекций
Состав
Одна предварительно заполненная шприц-ручка 0,5 мл содержит:
активное вещество – пэгинтерферон бета-1a 63 мкг, 94 мкг и 125 мкг.
вспомогательные вещества: L-Аргинина гидрохлорид, натрия ацетата тригидрат, кислота уксусная ледяная, полисорбат 20, вода для инъекций.
Описание
Прозрачный, бесцветный раствор.
Фармакотерапевтическая группа
Противоопухолевые препараты и иммуномодуляторы. Иммуностимуляторы. Интерфероны. Пэгинтерферон бета-1а.
Код АТХ L03AB13
Фармакологические свойства
Фармакокинетика
Период полураспада пэгинтерферона бета-1а в сыворотке крови более длительный, чем у непегилированого интерферона бета-1а. В исследованиях с использованием одной дозы и в исследованиях с использованием постепенно нарастающих доз у здоровых людей установлено, что концентрация пэгинтерферона бета-1а в сыворотке крови пропорциональна дозе в диапазоне от 63 до 188 мкг.
Всасывание
После подкожного введения пэгинтерферона бета-1а пациентам с рассеянным склерозом максимальная концентрация достигает между 1 и 1,5 днем после принятия дозы. После многократного приема 125 мкг каждые 2 недели зафиксированная максимальная концентрация (среднее значение ± стандартная ошибка) составила 280 ± 79 пг/мл. Подкожный пэгинтерферон бета-1а оказал в 4-, 9-, и 13 раз больше воздействия ((AUC168h) — площадь под кривой 168 ч) и показал примерно в 2-, 3,5- и 5 раз выше максимальной концентрации (Cmax) после однократной дозы в 63 мкг (6 ММЕ), 125 мкг (12 ММЕ) и 188 мкг (18 ММЕ) соответственно по сравнению с внутримышечным введением 30 мкг (6 ММЕ) непегилированного бета-1а.
Распределение
После многократного подкожного введения 125 мкг каждые две недели, объем распределения, без учета поправки на биодоступность (среднее значение ± стандартная ошибка), составил 481 ± 105 л.
Биотрансформация и выведение
Считается, что клиренс с мочой (через почки) является основным путем выведения Плегриди®. Процесс ковалентного конъюгирования части PEG с протеином может изменить in vivo свойства немодифицированного протеина, включая сниженный почечный клиренс и замедленный протеолиз, что может увеличить период полураспада. Соответственно, период полураспада (Т1/2) пэгинтерферона бета-1а у здоровых добровольцев примерно в два раза дольше, чем у непегилированного интерферона бета-1а. У пациентов с рассеянным склерозом период полураспада (среднее значение ± стандартная ошибка) пэгинтерферона бета-1а составил 78 ± 15 ч в равновесном состоянии. Средний клиренс пэгинтерферона бета-1а в равновесном состоянии составил 4,1 ± 0,4 л/ч.
Особые группы населения
Почечная недостаточность
Исследование с использованием одной дозы на здоровых добровольцах и добровольцах с различными стадиями почечной недостаточности (легкая, умеренная и острая почечная недостаточность, а также пациентов с терминальной стадией почечной недостаточности) показало незначительное увеличение площади под кривой (13-62 %) и максимальной концентрации Cmax (42-71 %) у пациентов с легкой (рассчитанная скорость клубочковой фильтрации от 50 до ≤ 80 мл/мин/1,73 м2), умеренной (рассчитанная скорость клубочковой фильтрации от 30 до 50 мл/мин/1,73 м2), и острой (рассчитанная скорость клубочковой фильтрации от < 30 мл/мин/1,73 м2) почечной недостаточностью по сравнению с добровольцами с нормальной функцией почек (рассчитанная скорость клубочковой фильтрации > 80 мл/мин/1,73 м2). У добровольцев с терминальной стадией почечной недостаточности, которым требуется по 2-3 гемодиализа в неделю, были зарегистрированы показатели площади под кривой и максимальной концентрации схожие с теми, что были получены у здоровых добровольцев. Каждый гемодиализ снижал концентрацию пэгинтерферона примерно на 24 %, что показывает, что гемодиализ частично удаляет пэгинтерферон бета-1а из системного кровотока.
Функции печени
Фармакокинетические функции пэгинтерферона бета-1а у пациентов с печеночной недостаточностью не исследовались.
Пациенты пожилого возраста
Клинический опыт на пациентах в возрасте старше 65 лет органичен. Однако результаты популяционного фармакокинетического анализа (на пациентах в возрасте до 65 лет) предполагают, что возраст не влияет на клиренс пэгинтерферона бета-1а.
Пол
В ходе популяционного фармакокинетического анализа влияние пола на фармакокинетические свойства пэгинтерферона бета-1а не было выявлено.
Раса
В ходе популяционного фармакокинетического анализа влияние расы на фармакокинетические свойства пэгинтерферона бета-1а не было выявлено.
Фармакодинамика
Плегриди® представляет собой интерферон бета-1а, конъюгированный единичной линейной молекулой 20000 Da метокси поли (этиленгликоль) -O-2-метилпропиональдегида (20 кДа мПЭГ-О-2-метилпропиональдегид) при степени замещения 1 моль полимера / моль белка. Средняя молекулярная масса составляет примерно 44 кДа, из которых протеиновая часть составляет примерно 23 кДа.
Механизм действия
Точный механизм действия пэгинтерферона бета-1а при рассеянном склерозе (РС) неизвестен. Плегриди® связывается с рецептором интерферона 1 типа на поверхности клетки и вызывает каскад внутриклеточных действий, которые ведут к регуляции экспрессии интерферон-чувствительных генов. Биологический эффект, который может быть достигнут с помощью Плегриди®, включает в себя стимуляцию противовоспалительных цитокинов (например, IL-4, IL-10, IL-27), супрессию провоспалительных цитокинов (например, IL-2, IL-12, IFN-γ, TNF-α) и ингибирование миграции активированных Т-клеток через гематоэнцефалический барьер, однако могут быть задействованы дополнительные механизмы.
Действительно ли механизм действия Плегриди® при рассеянном склерозе происходит тем же путем (путями), что и биологический эффект, описанный выше, неизвестно, так как патофизиология рассеянного склероза изучена только частично.
Фармакодинамические эффекты
Плегриди® является интерфероном бета-1а, конъюгированным с единичной линейной 20 кДа метокси поли(этиленгликоль) молекулой в альфа-аминогруппе N- концевого остатка аминокислоты.
Интерфероны относятся к ряду протеинов природного происхождения, которые вырабатываются клетками в ответ на биологические и химические стимулы, и передают многочисленные клеточные реакции, которые по своей природе классифицируются как антивирусные, антипролиферативные и иммуномодуляторные. Фармакологические свойства Плегриди® соответствуют свойствам интерферона бета-1а и, считается, что передаются протеиновой частью молекулы.
Фармакодинамический ответ был оценен посредством измерения индукции генов, несущих интерферон-чувствительный регуляторный элемент, включая те, которые кодируются как 2′,5′-олигоаденилатсинтетазы (2′,5′-ОАS), миксовирус-резистентный белок A (MxA), и некоторые хемокины и цитокины, а также неоптерин (Д-эритро-1,2,3,-тригидроксипропилпретин), продукт интерферон-индуцируемого энзина, ГТФ циклогидролазы 1. Индукция гена у здоровых людей была выше по уровню пика и воздействию (площадь под кривой эффективности) для Плегриди® по сравнению с непегилированным интерфероном бета-1а (внутримышечно), при условии, что оба препарата вводились в одинаковой по воздействию дозировке (6 ММЕ). У Плегриди® длительность этого ответа была устойчивой и продленной, при этом подъемы были зафиксированы вплоть до 15 дней по сравнению с 4 днями у непегилированного интерферона бета-1а. Повышение концентрации неоптерина было замечено как у здоровых людей, так и у пациентов с рассеянным склерозом, принимавших Плегриди®, с устойчивым и продолжительным подъемом более 10 дней, в то время как у непегилированного интерферона бета-1а подъем продлился 5 дней. Концентрации неоптерина возвращаются к базовым через две недели.
Клиническая эффективность и безопасность
Эффективность и безопасность Плегриди® была оценена в ходе плацебо-контролируемого первого года из двух лет рандомизированного двойного слепого клинического исследования на пациентах с рецидивирующе-ремитирующим рассеянным склерозом (РРРС) (исследование ADVANCE). 1512 пациентов были рандомизированы для получения 125 мкг Плегриди® подкожно каждые 2 (n = 512) или 4 (n = 500) недели или получения плацебо (n = 500).
В качестве первичной конечной точки была взята общегодовая частота рецидивов за один год. Дизайн клинического исследования и персональные данные пациентов представлены ниже в таблице.
Нет данных из исследований клинической эффективности / безопасности, представляющих прямое сравнение пегилированного и непегилированного интерферона бета-1а, как и данных о пациентах, которые бы меняли терапию с пегилированного на непегилированный интерферон или наоборот.
Таблица: Дизайн клинического исследования
|
Дизайн клинического исследования |
|
|
История болезни |
Пациенты с РРРС, у которых за предыдущие три года было как минимум 2 рецидива и 1 рецидив за предыдущий год с баллом по шкале EDSS1 ≤ 5,0 |
|
Последующее врачебное наблюдение |
1 год |
|
Исследуемая популяция |
83 % пациентов не получали предварительного лечения 47 % ≥ 2 рецидивов за предыдущий год 38 % с как минимум 1 очагом поражения, контрастируемым гадолинием (Gd+) на момент начала исследования 92 % ≥ 9 с очагами T2 на момент начала исследования 16 % с баллом по шкале EDSS ≥4 17 % получали ранее лечение |
|
Данные на момент начала исследования |
|
|
Средний возраст (в годах) |
37 |
|
Средняя/медианная длительность заболевания (в годах) |
3.6/2.0 |
|
Среднее количество рецидивов за предшествующие 3 года |
2.5 |
|
Средний балл по шкале EDSS на момент начала исследования |
2.5 |
|
1 Шкала EDSS — Расширенная шкала оценки состояния инвалидности |
Плегриди®, принимаемый каждые 2 недели, значительно снизил общегодовую частоту рецидивов на 36 % по сравнению с плацебо (р = 0,0007) в течение одного года (Таблица 3) с устойчивым снижением общегодовой частоты рецидивов, зафиксированной у подгрупп, определенных по демографическим показателям и данным на момент начала исследования. Плегриди® также значительно снизил риск появления рецидива на 39 % (р = 0,0003), риск устойчивой прогрессии дееспособности на 12-ой неделе на 38 % (р = 0,0383) и на 24-ой неделе (анализ post hoc) на 54 % (р = 0,0069), количество новых или увеличившихся T2 очагов на 67 % (р < 0,0001), количество очагов поражения, контрастируемых гадолинием, на 86 % (p < 0,0001) и количество гипоинтенсивных очагов T1 по сравнению с плацебо на 53 % (p < 0,0001). Терапевтический эффект был замечен уже через 6 мес при приеме Плегриди® по 125 мкг каждые 2 нед, при этом количество новых или увеличившихся T2 очагов уменьшилось на 61 % (p < 0,0001) по сравнению с плацебо.
По конечным точкам рецидивов и МРТ, прием 125 мкг Плегриди® каждые две недели показали номинально больший терапевтический эффект, чем Плегриди®, принимаемый каждые 4 недели, в течение 1 года.
Результаты 2 лет подтвердили, что эффективность сохранилась и после первого года плацебо-контролируемого исследования. Пациенты, получавшие Плегриди® каждые 2 недели, показали статистически значимые снижения по сравнению с пациентами, получавшими Плегриди® каждые четыре недели в течении 2 лет в ходе анализа post hoc для конечных точек, в том числе по общегодовой частоте рецидивов (24 %, p = 0,0209), риску рецидива (24 %, p = 0,0212), риску прогрессии дееспособности на 24-ой неделе (36 %, p = 0.0459) и МРТ (новые / увеличившиеся T2 очаги – 60 %, очаги, контрастируемые гадолинием – 71 % и гипоинтенсивные очаги T1 – 53 %, p < 0,0001 для всех).
Показания к применению
— рецидивирующе-ремитирующий рассеянный склероз
Способ применения и дозы
Препарат применяется по назначению врача.
Лечение следует начинать под надзором врача с опытом лечения рассеянного склероза. Плегриди® доказал свою эффективность по сравнению с плацебо. Прямые данные по сравнению Плегриди® с непегилированным интерфероном бета или данные об эффективности Плегриди® после перехода с непегилированного интерферона бета отсутствуют. Данный факт следует принимать во внимание при смене курса лечения у пациентов между пегилированным и непегилированным интерфероном.
Рекомендуемая дозировка Плегриди® составляет 125 мкг, вводимые подкожно каждые 2 недели.
Начало терапии
Рекомендовано, чтобы лечение пациентов начинали с 63 мкг в 1 дозе, увеличивая дозировку до 94 мкг во 2-ой дозе и переходя на полную дозировку в 125 мкг в 3-ей дозе и затем продолжали принимать полную дозировку (125 мкг) раз в две недели.
Режим титрования в начале лечения
|
Доза |
Время* |
Количество (мкг) |
Маркировка шприц-ручки |
|
Доза 1 |
День 1 |
63 |
Оранжевая |
|
Доза 2 |
Неделя 2 |
94 |
Голубая |
|
Доза 3 |
Неделя 4 (и далее) |
125 (полная дозировка) |
Серая |
*Прием каждые 2 недели
Титрование доз на начальной стадии терапии может уменьшить гриппоподобные симптомы, которые могут возникнуть в начале лечения интерферонами. Профилактическое и сопутствующее применение противовоспалительной, обезболивающей и/или жаропонижающей терапии может предотвратить или уменьшить гриппоподобные симптомы, которые иногда появляются во время терапии интерфероном.
Если очередная доза пропущена, необходимо принять ее как можно быстрее.
— Если осталось 7 и более дней до следующей запланированной дозы: пациенты должны немедленно принять свою пропущенную дозу. Затем лечение можно продолжать со следующей запланированной дозы по плану.
— Если осталось менее 7 дней до следующей запланированной дозы: пациенты должны начать снова 2-недельный план приема препарата начиная с того дня, когда они приняли пропущенную дозу. Пациент не должен принимать две дозы Плегриди® с интервалом менее 7 дней.
Внимание! Перед применением препарата за 30 мин до введения инъекции шприц-ручку с раствором следует извлечь из холодильника для естественного достижения раствором комнатной температуры (15 0С — 25 0С).
Недопустимо применение внешних источников тепла, таких как горячая вода, для согревания Плегриди®.
Препарат Плегриди® не должен использоваться, если на окне состояния предварительно заполненной шприц-ручки не видны зеленые полоски, если жидкость окрашена, замутнена или содержит плавающие частицы.
Побочные действия
Очень часто (≥1/10)
— гриппоподобные симптомы: мышечная боль, лихорадка, озноб, общая слабость, головные боли
— боль, зуд и эритема в месте введения
Часто (≥1/100 до <1/10))
— тошнота, рвота
— местные реакции в месте введения: зуд, гипертермия, боль, отечность, приливы жара, гематома, сыпь, опухоль, изменение цвета, воспаление
— лабораторные показатели: повышение температуры тела, повышение уровня аланинаминотрансферазы, аспартатаминотрансферазы и гамма-глутаминтрансферазы, снижение уровня гемоглобина, снижение количества белых кровяных телец
— депрессия
Нечасто (≥1/1000 до <1/100)
— тромбоцитопения
— реакции гиперчувствительности
— крапивница
— снижение количества тромбоцитов
Редко (≥1/10000 до <1/1 000)
— тромботическая микроангиопатия, включая тромботическую тромбоцитопеническую пурпуру / гемолитико-уремический синдром
— нефротический синдром, гломерулосклероз
— некроз в месте инъекции
Противопоказания
— повышенная чувствительность к естественному или рекомбинантному интерферону бета, пег-интерферону или другим компонентам препарата (в т.ч. в анамнезе)
— текущая тяжелая депрессия и/или суицидальные намерения
— беременность и период лактации
— детский и подростковый возраст до 18 лет
Лекарственные взаимодействия
Специальных исследований взаимодействия препарата Плегриди® (пэгинтерферона бета-1а) с другими лекарственными средствами, в том числе с кортикостероидами или АКТГ, у людей не проводилось. Вместе с тем, опыт клинических испытаний показывает, что больные рассеянным склерозом могут во время обострения заболевания принимать Плегриди® совместно с кортикостероидами или АКТГ.
Известно, что интерфероны обладают способностью снижать активность ферментов, связанных с цитохромом Р-450 печени. Следует проявлять осторожность при назначении Плегриди® вместе с лекарственными препаратами, клиренс которых в значительной степени зависит от системы цитохрома Р-450 печени, например, с противоэпилептическими препаратами и некоторыми классами антидепрессантов.
Особые указания
Применение препарата Плегриди® следует начинать под наблюдением врача, имеющего опыт лечения рассеянного склероза. Перед началом лечения следует информировать больных о возможных побочных эффектах, связанных с применением препарата.
При применении интерферона-бета отмечено возникновение признаков нарушения функции печени, таких как повышение активности ферментов печени в сыворотке крови, развитие гепатитов, в том числе аутоиммунного, острой печеночной недостаточности (редко). Поэтому следует тщательно контролировать функции печени, особенно, если интерферон применяется совместно с другими гепатотоксичными препаратами.
Плегриди®, как и другие интерфероны, следует применять с осторожностью при лечении больных, склонных к депрессивным расстройствам. Известно, что при применении интерферонов возможно возникновение депрессии и суицидальных мыслей, причем в группе лиц, страдающих рассеянным склерозом, частота таких явлений возрастает. Возникновение депрессивных состояний возможно в любое время лечения препаратом Плегриди®. При возникновении любых признаков депрессии или суицидальных мыслей, больному необходимо немедленно обратиться к лечащему врачу. За таким больным необходимо установить тщательное наблюдение в ходе лечения и при необходимости срочно применять соответствующие лечебные меры. В ряде случаев может возникнуть необходимость прекращения применения препарата.
Как редкие осложнения при приеме интерферонов бета, в т.ч и Плегриди®, зарегистрированы серьезные реакции гиперчувствительности. В данном случае необходимо прекратить прием препарата.
При подкожном введении препарата возможно проявление местной реакции и в том числе некроз. Для минимизации риска развития местной кожной реакции следует выполнять требования по асептической технике введения.
При терапии лекарственными препаратами с интерфероном бета на различных временных отрезках в период лечения и с проявлениями через несколько лет после приема интерферона бета были зарегистрированы случаи проявления нефротического синдрома с различными первопричинными нефропатиями, включая фокально-сегментарный гломерулосклероз (ФСГС), липоидный нефроз, мембранозно-пролиферативный гломерулонефрит (МПГН) и мембранозная гломерулопатия. Рекомендуется периодический контроль ранних признаков и симптомов, например, отечности, протеинурии и нарушений функции почек, особенно у пациентов с повышенным риском развития почечной недостаточности. Необходимо своевременное лечение нефротических симптомов, вплоть до прекращения приема Плегриди®.
Необходимо соблюдать осторожность при назначении препарата пациентам с острой почечной недостаточностью.
При приеме препаратов с интерфероном бета были зарегистрированы случаи развития тромботической микроангиопатии, выражающиеся в тромботической тромбоцитопенической пурпуре (ТТП) или гемолитико-уремическом синдроме (ГУС), включая случаи с летальным исходом. Случаи были зафиксированы в разные временные промежутки во время лечения и могут наступить через несколько недель или несколько лет после начала лечения интерфероном бета. Ранние клинические признаки включают в себя тромбоцитопению, впервые выявленную гипертонию и нарушение функций почек. Лабораторные показатели, указывающие на тромботическую микроангиопатию, включают в себя снижение количества тромбоцитов, повышенный уровень лактатдегидрогеназы в сыворотке крови и шизоцитоз (фрагментация эритроцитов) в мазках крови. Поэтому при появлении клинических признаков тромботической микроангиопатии рекомендуется провести анализ уровня тромбоцитов, уровня лактатдегидрогеназы в сыворотке крови, взять мазок крови и проверить функцию почек. При диагностировании тромботической микроангиопатии необходимо провести своевременное лечение плазмаферезом и немедленно прекратить прием Плегриди®.
При применении интерферонов возникают отклонения в лабораторных показателях, поэтому кроме обычных лабораторных анализов, проводимых больным рассеянным склерозом, в ходе лечения рекомендовано проводить подсчет форменных элементов крови (включая тромбоциты), определение лейкоцитарной формулы, и биохимический анализ крови (включая ферменты печени).
Пациентам с миелосупрессией может потребоваться более интенсивный контроль за общим анализом крови с лейкограммой и подсчетом количества тромбоцитов.
Также рекомендуются регулярные исследования функции щитовидной железы у пациентов с предшествующей историей дисфункции щитовидной железы или при наличии клинических показаний.
Необходима осторожность при назначении Плегриди® больным, ранее страдавшим судорожными припадками и у тех, кто принимает соответствующую противосудорожную терапию, особенно, если судороги не купируются данным лечением.
У пациентов, принимавших интерферон бета было зарегистрировано прогрессирование заболеваний сердца. Частота развития сердечно-сосудистых осложнений у группы пациентов, принимавших Плегриди® (125 мкг каждые 2 недели), была схожа с частотой группы, принимавшей плацебо (7 % в обеих группах). Среди пациентов, принимавших Плегриди® в рамках исследования ADVANCE, серьезных сердечно-сосудистых осложнений зарегистрировано не было. Тем не менее, пациентам с выраженными сердечными заболеваниями в анамнезе, такими как хроническая сердечная недостаточность, ишемическая болезнь сердца или аритмия, требуется контроль за состоянием сердечно-сосудистой системы, особенно на начальном этапе приема препарата.
У пациентов могут начать вырабатываться антитела к Плегриди®. Данные по пациентам, принимавшим терапию Плегриди® до 2 лет показывают, что менее 1 % (5/715) пациентов выработали персистентные нейтрализующие антитела к компоненту пэгинтерферона бета-1а – интерферону бета-1а. Нейтрализующие антитела могут снизить клиническую эффективность. Однако развитие антител против интерфероновой части пэгинтерферона бета-1а не оказывает заметного влияния на безопасность и клиническую эффективность, хотя данные для анализа были ограничены связи с низкой частотой развития иммуногенности.
3 % пациентов (18/681) выработали персистентные антитела к ПЭГ составляющей пэгинтерферона бета 1-а. В проведенных клинических исследованиях развитие антител против ПЭГ составляющей пэгинтерферона бета-1а не имело заметного влияния на безопасность или клиническую эффективность (включая общегодовую частоту рецидивов, очаги на МРТ и прогрессию дееспособности).
Беременность и период лактации
Женщины, способные к деторождению должны предпринимать необходимые меры контрацепции. При планировании беременности необходимо учесть потенциальные угрозы и рассмотреть возможность отмены приема препарата. У пациенток, у которых до начала терапии была зафиксирована высокая частота рецидивов, необходимо оценить риск развития тяжелого рецидива после отмены препарата Плегриди® в случае наступления беременности и сравнить его с возможным повышенным риском самопроизвольного аборта.
Информация по применению Плегриди® во время беременности ограничена. Доступные данные указывают на то, что возможен повышенный риск наступления самопроизвольного аборта. Во время беременности противопоказано начинать терапию Плегриди®.
Неизвестно, выделяется ли пэгинтерферон бета-1а в молоко человека. В связи с возможным развитием серьезных нежелательных реакций у детей на грудном вскармливании, необходимо принять решение либо о прерывании грудного вскармливания, либо об отмене Плегриди®.
Нет данных по воздействию пэгинтерферона бета-1а на детородную функцию у людей. У животных наблюдался ановуляторный эффект при очень высоких дозировках. Нет информации о влиянии пэгинтерферона бета-1а на мужскую фертильность.
Особенности влияния лекарственного средства на способность управлять транспортным средством или потенциально опасными механизмами.
Специальные исследования о влиянии на способность управлять транспортным средством или потенциально опасными механизмами не проводились. Нежелательные явления со стороны центральной нервной системы могут влиять на способность управлять автомобилем и работать с механизмами. В период применения Плегриди® следует соблюдать осторожность при занятиях потенциально опасными видами деятельности, требующими повышенного внимания.
Передозировка
При соблюдении рекомендаций передозировка маловероятна.
Симптомы: усиление побочных эффектов.
Лечение: госпитализация для врачебного наблюдения, проведение соответствующей симптоматической терапии.
Форма выпуска и упаковка
По 0.5 мл препарата в шприц-ручке. 2 шприц-ручки дозировки 63 мкг/0.5 мл (шприц-ручка с оранжевой маркировкой, первая доза) и 94 мкг/0.5 мл (шприц-ручка с голубой маркировкой, вторая доза) помещают в пластиковый поддон.
По 1 поддону вместе с инструкцией по медицинскому применению на государственном и русском языках вкладывают в картонную коробку.
По 0.5 мл препарата в шприц-ручке. 2 шприц-ручки дозировки 125 мкг/0.5 мл (шприц-ручка с серой маркировкой) помещают в пластиковый поддон.
По 1 поддону вместе с инструкцией по медицинскому применению на государственном и русском языках вкладывают в картонную коробку.
Условия хранения
Хранить в оригинальной упаковке, в защищенном от света месте при температуре от 2 0С до 8 0С. Не замораживать! Допускается хранение в защищенном от света месте при температуре от 2 0С до 25 0С в течение 30 дней. При неиспользовании в течение 30 дней раствор подлежит уничтожению.
Хранить в недоступном для детей месте.
Срок хранения
3 года
Не применять по истечении срока годности, указанного на упаковке.
Условия отпуска из аптек
По рецепту
Производитель
Веттер Фарма-Фертигунг ГмбХ & Ко. Кг, Равенсбург, Германия
Упаковщик
Биоген Айдек (Дания) Мануфактуринг АпС, Хиллероед, Дания
Владелец регистрационного удостоверения
АО «Ген Илач ве Саглык Урунлери Санаи ве Тиджарет», Турция
Наименование, адрес и контактные данные (телефон, факс, электронная почта) организации на территории Республики Казахстан, ответственной за пострегистрационное наблюдение за безопасностью лекарственного средства
Представительство АО «Ген Илач ве Саглык Урунлери Санаи ве Тиджарет» в Республике Казахстан
г. Алматы 050051, пр. Достык 188, БЦ Кулан, офис 903
тел.: 8 (727) 2599044, 2599043, 2599042
тел./факс: 8 (727) 2599039
e-mail: maral.ordabaeva@genilac.com
12
| 869175061477975706_ru.doc | 124.5 кб |
| 658036301477977417_kz.doc | 151 кб |
Отправить прикрепленные файлы на почту
Национальный центр экспертизы лекарственных средств, изделий медицинского назначения и медицинской техники
|
Необходим предварительный заказ по телефону или на сайте. Дождитесь подтверждения оператора, прежде чем приезжать в аптеку. |
||||||
|