Подагра
Версия: Клинические рекомендации РФ 2013-2017 (Россия)
Категории МКБ:
Подагра (M10)
Разделы медицины:
Ревматология
Общая информация
Краткое описание
Общероссийская общественная организация Ассоциация ревматологов России
Федеральные клинические рекомендации «Подагра»
Клинические рекомендации «Подагра» прошли общественную экспертизу, согласованны и утверждены 17 декабря 2013 г., на заседании Пленума правления АРР, проведенного совместно с профильной комиссией МЗ РФ по специальности «ревматология». (Президент АРР, академик РАН — Е.Л.Насонов)
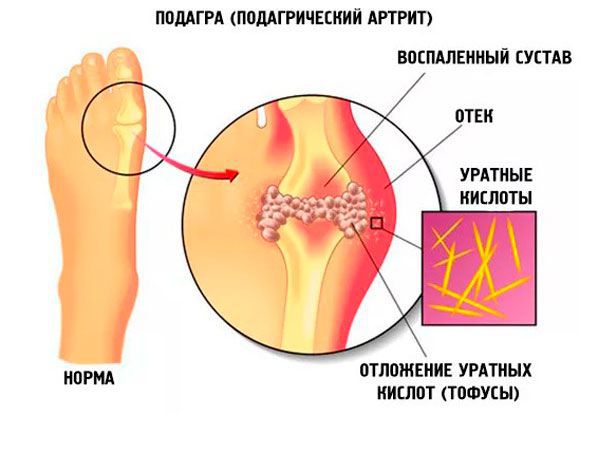
Подагра — системное тофусное заболевание, характеризующееся отложением в различных тканях кристаллов моноурата натрия (МУН) и развивающимся в связи с этим воспалением у лиц с гиперурикемией (ГУ), обусловленной внешнесредовыми и/или генетическими факторами.
Общая характеристика болезни
Основные клинические проявления подагры: рецидивирующие атаки острого артрита, накопление кристаллов уратов в тканях с образованием тофусов, нефролитиаз, подагрическая нефропатия.
В развитии подагры выделяют 3 стадии:
— острый подагрический артрит
— периоды между приступами подагрического артрита (межприступная подагра)
— хроническая тофусная подагра.
Облачная МИС «МедЭлемент»
Облачная МИС «МедЭлемент»

Автоматизация клиники: быстро и недорого!
- Подключено 300 клиник из 4 стран
- 1 место — 800 RUB / 5500 KZT / 27 BYN в месяц
Классификация
Классификационные критерии, принципы диагностики подагры
Для диагностики подагрического артрита в 1975 году Американской Ассоциацией Ревматологов (ААР) были рекомендованы предварительные классификационные критерии, одобренные ВОЗ в 2002 году.
Классификационные критерии острого подагрического артрита
А. Наличие характерных кристаллов мочевой кислоты в суставной жидкости
Б. Наличие тофусов, содержание кристаллов мочевой кислоты, в которых подтверждено химически или поляризационной микроскопией
В. Наличие 6 из 12 ниже перечисленных признаков:
1. Более одной атаки острого артрита в анамнезе
2. Воспаление сустава достигает максимума в 1-й день болезни
3. Моноартрит
4. Гиперемия кожи над пораженным суставом
5. Припухание и боль в первом плюснефаланговом суставе
6. Одностороннее поражение первого плюснефалангового сустава
7. Одностороннее поражение суставов стопы
8. Подозрение на тофусы
9. Гиперурикемия
10. Асимметричный отек суставов
11. Субкортикальные кисты без эрозий (рентгенография)
12. Отрицательные результаты при посеве синовиальной жидкости
Диагностика
Клиническая характеристика основных симптомов подагры.
Демонстрация кристаллов моноурата натрия (МУН) в синовиальной жидкости или в содержимом тофуса позволяет поставить определенный диагноз подагры (уровень доказательности IIb). Специфичность метода поляризационной микроскопии для демонстрации кристаллов крайне высока.
Основным клиническим проявлением, который позволяет заподозрить подагру является острый артрит. Острая атака с быстрым развитием выраженной боли и воспаления, которые достигают максимума в течение 6-12 часов, особенно сопровождающиеся эритемой, высоко подозрительны в отношении микрокристаллического воспаления, хотя не специфичны для подагры (уровень доказательности IIb).
Рутинный поиск кристаллов рекомендуется в любой синовиальной жидкости, полученной из воспаленного сустава у больных с отсутствием определенного диагноза (уровень доказательности IV).
Пунктировать суставы в диагностических целях можно и в межприступный период. Идентификация кристаллов МУН из невоспаленного сустава обеспечивает определенный диагноз в межприступном периоде (уровень доказательности IIb).
Подагра и сепсис могут сосуществовать, поэтому при подозрении на септический артрит окраска по грамму и исследования культуры синовиальной жидкости должны выполняться даже в случае идентификации кристаллов МУН (уровень доказательности IIb). Гораздо чаще септического артрита развиваются нагноения мягких тканей в области вскрывшихся подкожных тофусов.
Несмотря на то, что ГУ является наиболее важным фактором риска подагры, сывороточный уровень МК не является фактором исключения или подтверждения подагры: многие люди с ГУ не развивают подагры, а во время острой атаки сывороточный уровень МК может быть нормальным (уровень доказательности Ib).
Почечная экскреция мочевой кислоты должна определяться у некоторых больных подагрой, имеющих семейную историю подагры с ранним началом, начало подагры ранее 25 лет, с анамнезом МКБ (уровень доказательности IIb).
Рентгенологическое исследование суставов помогает в проведении дифференциального диагноза и может демонстрировать типичные признаки хронической подагры, но бесполезно в ранней диагностике подагры (уровень доказательности IIb). Формирование внутрикостных тофусов часто происходит одновременно с подкожными тофусами, в связи с чем, рентгенологическое исследование используется для определения тяжести тофусного поражения. В действительности, при остром подагрическом артрите, рентгенологические изменения не всегда могут быть полезны для постановки диагноза подагры. Тем не менее, в ряде ситуаций выполнение рентгенограмм вполне оправдано для проведения дифференциального диагноза с травмами и т.д.
Факторы риска подагры и сопутствующие болезни должны выявляться, включая признаки метаболического синдрома (ожирение, гипергликемия, гиперлипидемия, гипертензия) (уровень доказательности Ia или Ib для отдельных факторов).
Лечение
Лечение подагры
Общие рекомендации
1. Оптимальное лечение подагры требует комбинации нефармакологических и фармакологических подходов (уровень доказательности Ib) и должно учитывать:
а) специфические факторы риска (уровень мочевой кислоты, количество предшествующих атак, рентгенография) (уровень доказательности IIb)
б) стадию болезни (асимптоматическая гиперурикемия, острый/интермиттирующий артрит, межприступный период, хроническая тофусная подагра) (уровень доказательности Ib)
в) общие факторы риска (возраст, пол, ожирение, гиперурикемические препараты, сопутствующие, полипрагмазия) (уровень доказательности Ib).
2. Обучение больного правильному образу жизни (уменьшение веса тела при ожирении, диета, уменьшение приема алкоголя, особенно пива) — ключевой аспект лечения. Ограничение в пищевом рационе богатых пуринами продуктов животного происхождения и снижение массы тела способствует снижению сывороточного уровня мочевой кислоты (уровень доказательности IIb), а алкоголь, особенно пиво, является независимым фактором риска для подагры (уровень доказательности III).
3. Гиперлипидемия, гипертензия, гипергликемия, ожирение и курение должны выявляться в каждом случае, т.к. являются важными компонентами при ведении больного с подагрой (уровень доказательности Ib).
Лечение острого приступа подагрического артрита
1. НПВП и колхицин могут быть эффективны в терапии острого приступа артрита (уровень доказательности Ib) и являются первой линией терапии. Данные о сравнительной эффективности НПВП и колхицина отсутствуют и при отсутствии противопоказаний, следует считать рациональным назначение НПВП.
2. Высокие дозы колхицина приводят к побочным эффектам, а низкие дозы (например 0,5 мг 3 раза в день) могут быть достаточны у ряда пациентов (уровень Ib).
3. Удаление синовиальной жидкости (уровень доказательности IV) и введение внутрисуставно длительно действующих глюкокортикоидов (уровень доказательности IIb) может быть эффективным и безопасным лечением острого приступа артрита.
4. При наличии противопоказании и/или неэффективности НПВП, колхицина и глюкокортикоидов для купирования острого приступа возможно применение препаратов, блокирующих интерлейкин-1 (уровень доказательности Ib).
Антигиперурикемическая терапия.
1. Антигиперурикемическая терапия показана больным с персистирующей гиперурикемией и острыми атаками, артропатией, тофусами или рентгенологическими изменениями. Проведение антигиперурикемической терапии показано в указанных случаях при неэффективности нефармакологических методов лечения. Решение о подобной терапии должно быть принято индивидуально, учитывать баланс между пользой и потенциальными рисками и согласовано с больным (уровень доказательности IV).
2. Целью антигиперурикемической терапии является предупреждение образование и растворение имеющихся кристаллов моноурата натрия, это достигается поддержанием уровня МК ниже точки супернасыщения сыворотки уратами (<360 мкмоль/л), так как предотвращение образования и растворении уже имеющихся кристаллов моноурата натрия, возможно при достижении указанного сывороточного уровня мочевой кислоты (уровень доказательности III).
3. Аллопуринол – эффективное средство для долгосрочного медикаментозного лечения у больных с хронической подагрой (уровень доказательности Ib). Назначение аллопуринола – реальная возможность проведения адекватной длительной антигиперурикемической терапии. При этом эффект в отношении снижения сывороточного уровня мочевой кислоты дозозависимый (уровень доказательности IIb).
Препарат должен быть назначен в исходно низкой дозе (100 мг ежедневно) с последующим увеличением (при необходимости) по 100 мг каждые две-четыре недели, что особенно важно у больных с почечной недостаточностью (уровень IV). При наличии почечной недостаточности доза должна быть подвергнута коррекции.
В случае развития побочных эффектов, связанных с применением аллопуринола, возможно назначение других ингибиторов ксантиноксидазы, урикозуриков. Проведение десенсибизизации к аллопуринолу возможно только при умеренных кожных проявлениях аллергической реакции (уровень доказательности IV).
4. Урикозурические агенты (пробенецид, сульфинпиразон) могут применяться как альтернатива аллопуринолу у пациентов с нормальной функцией почек, но относительно противопоказаны больным с уролитиазом. Эффект в отношении снижения сывороточного уровня мочевой кислоты, меньше, чем у аллопуринола (уровень доказательности IIa). Они не должны использоваться в пациентах со сниженной функцией почек (уровень доказательности IIb).
Бензбромарон может применяться у больных с мягкой и умеренной почечной недостаточностью у некоторых больных, но требует контроля в связи с риском гепатотоксичности (уровень доказательности Ib).
5. Профилактика суставных атак в течение первых месяцев антигиперурикемической терапии может достигаться колхицином (0,5-1,0 грамм в день) (уровень доказательности Ib) и/или НПВП (с гастропротекцией при показании) (уровень доказательности IIa). И колхицин и НПВП имеют потенциально серьезные побочные эффекты и их назначение предопределяет необходимость соотнести потенциальные пользу и вред.
При наличии противопоказании и/или неэффективности НПВП и колхицина для профилактики приступов артрита в первые месяцы антигиперурикемической терапии возможно назначение ингибиторов интерлейкина-1 (уровень доказательности Ib).
6. У больных с подагрой прием диуретиков по возможности отменяют (уровень доказательности IV), но это не касается случаев, когда диуретики назначены по жизненным показаниям. В качестве альтернативы могут быть использованы другие гипотенивные препараты.
Лозартан (уровень доказательности IIb) и фенофибрат (уровень доказательности Ib) имеют умеренный урикозурический эффект, что позволяет их применять у больных резистентных или плохо переносящих аллопуринол или урикозоурики, при наличии гипертензии или МС. Клиническое значение такой терапии и ее рентабельность пока неизвестны.
Информация
Источники и литература
-
Федеральные клинические рекомендации по ревматологии 2013 г. с дополнениями от 2016 г.
Информация
Методология
Методы, использованные для сбора/селекции доказательств: поиск в электронных базах данных.
Описание методов, использованных для сбора/селекции доказательств:
доказательной базой для рекомендаций является глубина публикаций вошедших в Кохрановскую библиотеку, базы данных EMBASE и MEDLINE. Глубина поиска составляла 20 лет.
Методы, использованные для оценки качества и глубины доказательств:
· Консенсус экспертов
· Оценка значимости в соответствии с рейтиноговой схемой
Рейтиноговая схема для оценки силы рекомендаций
| Сила | Описание |
| Ia | Мета-анализ рандомизированных контролируемых исследований |
| Ib | Рандомизированное контролируемое исследование |
| IIa | Контролируемое исследование без рандомизации |
| IIb | Квази-экспериментальное исследование |
| III |
Неэкспериментальные описательные исследования, таких как сравнительные, корреляционные и исследования случай-контроль |
| IV | Сообщения или мнения экспертных комитетов или клинический опыт |
Описание метода валидизации рекомендаций
Данные рекомендации в проектной версии были рецензированы независимыми экспертами с целью их адаптации для врачей ревматологов и врачей первичного звена.
Комментарии, полученные от экспертов систематизировались и обсуждались членами рабочей группы, внесенные изменения регистрировались для каждого пункта рекомендаций.
Рабочая группа
Для окончательной редакции и контроля качества предложенных рекомендаций они были повторно проанализированы членами рабочей группы, которые пришли к заключении, что все замечания и комментарии экспертов приняты во внимание, риск систематических ошибок сведен к минимуму.
Прикреплённые файлы
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники. Стандарты лечения
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Мобильное приложение «MedElement»

- Профессиональные медицинские справочники
- Коммуникация с пациентами: онлайн-консультация, отзывы, запись на приём
Скачать приложение для ANDROID / для iOS
Внимание!
Если вы не являетесь медицинским специалистом:
-
Занимаясь самолечением, вы можете нанести непоправимый вред своему здоровью.
-
Информация, размещенная на сайте MedElement и в мобильных приложениях «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта», не может и не должна заменять очную консультацию врача.
Обязательно
обращайтесь в медицинские учреждения при наличии каких-либо заболеваний или беспокоящих вас симптомов.
-
Выбор лекарственных средств и их дозировки, должен быть оговорен со специалистом. Только врач может
назначить
нужное лекарство и его дозировку с учетом заболевания и состояния организма больного.
-
Сайт MedElement и мобильные приложения «MedElement (МедЭлемент)», «Lekar Pro»,
«Dariger Pro», «Заболевания: справочник терапевта» являются исключительно информационно-справочными ресурсами.
Информация, размещенная на данном
сайте, не должна использоваться для самовольного изменения предписаний врача.
-
Редакция MedElement не несет ответственности за какой-либо ущерб здоровью или материальный ущерб, возникший
в
результате использования данного сайта.
Последние 2 десятилетия можно рассматривать как переломные в отношении изучения подагры. Впервые появляются рекомендации по диагностике и лечению заболевания: в 2006 г. – рекомендации Европейской антиревматической лиги (EULAR), затем Великобритании, Американской коллегии ревматологов (ACR), в последние годы – международные рекомендации в рамках программы «3Е-инициатива», несколько национальных рекомендаций в странах Европы (Италии, Португалии), в 2014 г. подвергнуты ревизии рекомендации EULAR 2006 г. и разрабатываются новые классификационные критерии диагностики взамен используемых с 1977 г. критериев C. Wallace et al.
Если исходно формирование подобных рекомендаций было основано преимущественно на обобщении накопленного исторического опыта, то сейчас происходит постепенный пересмотр парадигмы заболевания и положений, лежащих в основе ее диагностики и лечения. Но, несмотря на это, приходится констатировать, что качественного прорыва ни в диагностике, ни в лечении подагры пока не происходит. Так, если сравнивать данные В.А. Насоновой и В.Г. Барсковой, полученные около 20 лет назад, показавшие, что правильный диагноз подагры выставляется на 7–8-й год от дебюта заболевания [1], и результаты подобного анализа последних лет, то существенного улучшения ситуации мы не отметим (анализ 148 случаев первичного обращения в ФГБНУ «НИИР им. В.А. Насоновой» в период с 2009 по 2013 г. демонстрирует, что подагра диагностировалась в среднем спустя 4,6 года с момента первого приступа артрита).
Не лучше дело обстоит с лечением подагры. Недавно американские коллеги проанализировали, насколько оптимальна терапия пациентов с подагрой и как она соотносится с основной целью лечения в соответствии с рекомендациями АСR (снижение сывороточного уровня мочевой кислоты (МК) ниже 6 мг/дл (360 мкмоль/л)) [2]. Оказалось, что только половина из 4,5 млн американцев, больных подагрой, получает уратснижающую терапию, а 2/3 больных она должна быть назначена или усилена (т. е. сывороточный уровень МК у них выше целевого). Наши данные, основанные на длительном наблюдении 160 больных подагрой, мало чем отличаются: 36% пациентов, которым был назначен аллопуринол, от приема препарата воздерживались, титровали дозу препарата до достижения целевого уровня МК всего 23% из тех, кто принимал препарат (сывороточный уровень МК был ниже 360 мкмоль/л лишь у 16% пациентов).
Цель данной работы – не столько анализ предполагаемых достоинств и недостатков тех или иных постулатов отдельных рекомендаций, сколько попытка максимально приблизить, адаптировать имеющиеся современные данные о диагностических и лекарственных возможностях к нашим реалиям.
Обычно диагноз подагры может быть предположен лишь в случае развития у пациента приступа острого артрита. Однако утверждение, что подагра – это прежде всего острое воспаление, сменяющееся межприступным периодом, сейчас подвергается сомнению, т. к. доказано, что воспаление, обусловленное отложением кристаллов моноурата натрия, может выявляться в интактном суставе задолго до развития клинической симптоматики [3]. Но можем ли мы поставить диагноз до развития приступа?
Условно разделим пациентов на 3 группы: с наличием гиперурикемии, но без приступов острого артрита в анамнезе; с предшествующим визиту или текущим приступом острого артрита; с хроническим артритом и наличием подкожных узлов, которые мы можем предположительно принять за тофус. Попытаемся применить к ним те принципы, на которых базируется диагностика подагры.
Объединяющим моментом будет наличие гиперурикемии, без которой говорить о подагре нельзя, притом, что это единственный фактор, непосредственно определяющий возможность развития заболевания. Чем выше уровень МК в крови, тем больше вероятность того, что мы имеем дело с пациентом, у которого либо уже есть подагра, либо высок риск ее возникновения. Однако этот риск не равен нулю даже при сывороточном уровне МК ниже 360 мкмоль/л; чувствительность и специфичность его невысоки; кроме того, показатель этот нестойкий, и однократно полученное нормативное его значение не позволяет диагноз отвергнуть, хотя чем он ниже, тем меньше шансов обнаружить у пациента подагру [4, 5]. Следует также помнить о том, что незадолго до развития и во время приступа артрита уровень МК в сыворотке крови снижается [6].
На этапе 1-го визита у пациентов с предшествующим визиту или текущим приступом острого артрита определяющими будут именно клинические проявления, чаще всего симптомы воспаления.
Вопреки часто ошибочному представлению, кристалл-индуцированное воспаление могут вызывать не только артрит и бурсит, но и тендинит, обусловленный воспалением синовиальной структуры соответственно суставов, суставных сумок и сухожилий. Топографически чаще поражаются периферические структуры, а нижние конечности – чаще верхних. Тем не менее чем «старше» подагра, тем чаще вовлекаются суставы, расположенные «ближе к центру» и даже суставы осевого скелета [7, 8]. Таким образом, вовлечение самых периферийных структур нижних конечностей, таких как 1-й плюснефаланговый сустав, соответствует «классической» подагре, и вероятность их поражения в 2 раза выше, чем любого другого сустава. Суставы предплюсны, голеностопные и коленные суставы при первом приступе артрита поражаются реже, чем 1-й плюснефаланговый, но чаще остальных. У женщин подагра манифестирует артритом 1-го плюснефалангового сустава реже, чем у мужчин (только в половине случаев) [9]. Поражение суставов кистей не является редкостью у пациентов с нелеченной подагрой, при длительном течении заболевания, особенно в пожилом возрасте, причем у женщин суставы кистей поражаются чаще и раньше [9, 10]. Такая локализация в дебюте подагры нередко встречается у пациентов после трансплантации органов [11].
Количество суставов, которые вовлекаются при первых приступах артрита, может варьировать. В большинстве случаев это моноартрит, но чем дальше от первого приступа, тем больше вероятность встретить пациента с олиго- или полиартритом [12]. Клиническим признакам артрита может предшествовать подагрическая «аура», проявляющаяся легкой болью, дискомфортом, неприятными ощущениями при движении [13]. Знание этих продромальных симптомов может способствовать своевременному началу противоспалительной терапии. Общая симптоматика проявляется недомоганием, повышением температуры тела (до субфебрильных, редко – фебрильных значений), не сопровождающимся ознобом. В крови может выявляться небольшой лейкоцитоз с преобладанием нейтрофилов.
Типичные признаки артрита при подагре включают внезапное начало (максимальная интенсивность боли в 1-е сут), быстрое нарастание симптомов воспаления (боль, отечность, гиперемия, ограничение подвижности). Следует помнить, что эти симптомы мало чем отличаются от таковых при болезни депонирования пирофосфата кальция [14]. Отек мягкий тканей и эритема кожи могут быть выражены столь сильно, что иногда симулируют целлюлит или флебит [13].
Длительность приступов в дебюте, как правило, не превышает нескольких дней, но у пациентов с хронической тофусной подагрой один приступ «перетекает» в другой, клинические признаки воспаления полностью не регрессируют. В этом случае у пациентов с хроническим артритом и наличием подкожных узлов постоянное присутствие клинических проявлений заболевания чаще всего является следствием длительного естественного течения подагры и неадекватного лечения. При этом происходит постепенное накопление кристаллов моноурата натрия, что проявляется формированием хронического артрита, нередко полиартикулярного, образованием тофусов, структурным повреждением костных структур, в итоге появляются деформации, ограничение подвижности суставов. Чем выше сывороточный уровень МК, тем быстрее развивается хронический артрит, наблюдается большее количество пораженных суставов. Так, у пациентов, не имевших подагры, которым была проведена пересадка сердца и назначен циклоспорин А, сывороточный уровень МК повысился с 10 до 14 мг/дл, и в течение 4-х лет наблюдения у 22% из них произошло развитие подагры, а у 43% было отмечено полиартикулярное поражение [15].
Стойкое воспаление и формирование тофусов в области суставов кистей и стоп могут имитировать деформацию суставов у пациентов с ревматоидным артритом.
Тофус представляет собой макроскопический конгломерат, состоящий из кристаллов моноурата натрия, они формируются через несколько лет от дебюта подагры, но в некоторых случаях могут быть первым клиническим проявлением заболевания. Места локализации их различны: чаще – подкожно, внутрисуставно, могут формироваться в области сухожилий, суставных сумок, мягких тканей, в почках приводят к развитию уратного нефролитиаза, в костных структурах видны как симптом «пробойника». Пальпаторно определяемые подкожные тофусы чаще локализованы в местах, подверженных давлению или трению, при формировании в области мелких суставов могут симулировать узелковую форму остеоартроза. В области ушных раковин они обнаруживаются в 12% случаев, чаще у мужчин [9]. У пациентов, которые принимают глюкокортикоиды (ГК), формирование подкожных тофусов происходит быстрее [16]. Внутрикостные тофусы по данным рентгенографии (симптом «пробойника») не всегда выявляются даже у пациентов с хроническим артритом [12, 17]. Внутрикостные тофусы также могут быть обнаружены при помощи компьютерной томографии.
Можем ли мы с уверенностью говорить об определенном диагнозе подагры, если клиническая картина полностью соответствует описанной? К сожалению, нет, и вероятность ошибки, как показывает практика, довольно велика. Например, L.B. Kienhorst et al. обследовали 159 пациентов с артритом 1-го плюснефалангового сустава, 98% из которых исходно был поставлен диагноз подагры, подтвердили его только у 77% исследованных пациентов [18].
Как можно в таком случае улучшить диагностику? «Накопление» клинической симптоматики (например, повторение «классических» приступов артрита, появление пальпируемых или видимых тофусов и т. д.) повышает вероятность правильного диагноза. Но если исходить из концепции, что суть подагры – в имеющемся хроническом воспалительном процессе в местах отложения кристаллов моноурата натрия вне зависимости от наличия или отсутствия клинических симптомов, а зачастую и до их появления [19, 20], то проблема именно в том, чтобы обнаружить эти кристаллы в случае подозрения на наличие у пациента подагры (учитывая, что лечение заболевания должно рассматриваться в долгосрочной перспективе, если не в течение всей жизни). Иными словами, нозологический диагноз подагры должен быть ответом на конкретный вопрос: обусловлены ли клинические проявления заболевания именно отложением кристаллов моноурата натрия? Наконец, следует ли искать кристаллы у пациентов с асимптоматической гиперурикемией?
Рассмотрим наиболее применимые методы помимо основанных на клинической картине артрита. Во-первых, это «золотой стандарт» диагностики – поляризационная микроскопия синовиальной жидкости или содержимого тофусов. Очевидно, что в идеале исследование должно проводиться всем без исключения пациентам с предположительным диагнозом подагры, прежде всего в спорных случаях – например, при впервые возникшем остром артрите независимо от локализации, недифференцированном артрите [21]. Чувствительность метода приближается к максимально возможному (100%), однако его специфичность не столь велика, и в каждом 3–5-м случае результат исследования бывает ложноотрицательным. Таким образом, при отсутствии кристаллов в исследуемом биологическом материале диагноз подагры не может быть исключен [22, 23]. Важно, что синовиальная жидкость может быть получена не только из воспаленного, но и из интактного, но ранее поражавшегося сустава [24].
Метод относительно прост, и сложно объяснить, почему подобное исследование не является рутинным даже в крупных медицинских центрах. Можно предположить, что применение поляризационной микроскопии будет тем полезнее, чем раньше она выполнена, но ответ на вопрос, стоит ли использовать ее у пациентов на стадии асимптоматической гиперурикемии, неоднозначен. Необходимы, во-первых, наличие соответствующей аппаратуры – поляризационного микроскопа, во-вторых, навыки выполнения пункции и получения синовиальной жидкости из интактного сустава и соответствующая подготовка для проведения ее анализа. Поэтому вопрос о проведении подобного высокоинвазивного исследования всем без исключения пациентам с гиперурикемией представляется спорным [25].
Есть надежда, что альтернативой может стать намного более доступный, недорогой и безопасный, в отличие от рентгенологических, метод – ультразвуковая диагностика. Так, ультразвуковой феномен «двойного контура» и выявление тофусов (гиперэхогенных узелков, хорошо дифференцируемых от окружающих тканей) считаются высокоспецифичными для подагры. Впечатляют результаты исследования D. Peiteado et al., установивших, что 6-минутное ультразвуковое исследование (УЗИ) 4-х суставов (коленных и 1-х плюснефаланговых) демонстрирует гиперэхогенный пятнистый участок или двойной контур у 28 из 29 (97%) пациентов с кристалл-верифицированным диагнозом подагры [26].
Принципиально важно, что несколько поисковых работ позволили выявить тофусы или феномен двойного контура при проведении УЗИ суставов у 29–42% пациентов (в среднем 36%) с асимптоматической гиперурикемией (сывороточный уровень МК >7 мг/дл) [3]. Более того, по данным G.J. Puig et al., выявивших уратные депозиты (тофусы) при проведении УЗИ у 12 из 23 мужчин с асимптоматической гиперурикемией, в 8 случаях (23%) обнаруживались и ультразвуковые признаки воспаления (васкуляризация) в местах локализации тофусов [27]. Важно, что выявление тофусов коррелировало с длительностью гиперурикемии, которая в среднем составила 5 лет. Можно предположить, что, помимо длительности, значение в частоте выявления депозитов МК или кристаллов в случае асимптоматической гиперурикемии будет тем больше, чем выше ее уровень. Например, 15-летнее наблюдение 2046 здоровых мужчин, у которых в динамике определяли сывороточный уровень МК, показало, что 5-летняя кумулятивная частота развития подагры составила 2,0% при сывороточном уровне МК <8,0 мг/мл (<475 мкмоль/л), 19,8% при уровне от 9,0 до 10,0 мг/дл (от 535 до 595 мкмоль/л) и 30% при уровне >10 мг/дл (595 мкмоль/л) [28]. Безусловно, должна быть изучена и предикторная роль других клинических факторов, их выявление может быть ключевым моментом целевого обследования отдельных групп больных для максимально ранней диагностики подагры – на преклинической стадии.
Таким образом, хотя и неправомочно приравнивать асимптоматическую гиперурикемию к подагре, возможно выделить тех пациентов, у которых она с той или иной долей вероятности разовьется.
Следующие вопросы, которые хотелось бы обсудить: как предположительно должен быть выстроен алгоритм лечения подагры, какими должны быть принципы противовоспалительной и уратснижающей терапии.
Если говорить о подагре как о хронической патологии, связанной с хроническим воспалением, то концепция лечения должна быть изменена. В лечении подагры можно выделить 4 этапа: 1-й – немедикаментозные методы профилактики и лечения, направленные на модификацию факторов риска гиперурикемии (диеты, ожирения, нарушения углеводного и липидного обмена, артериальной гипертензии); 2-й – купирование острого приступа артрита (для этой цели традиционно используются нестероидные противовоспалительные препараты (НПВП), колхицин и ГК; 3-й – уратснижающая терапия, направленная на предотвращение приступов подагрического артрита и формирование тофусов; 4-й – профилактика приступов артрита в первые месяцы уратснижающей терапии [29].
Хотя основные принципы диетотерапии при подагре остаются неизменными на протяжении столетий, некоторые из них пересмотрены. Доказано, что, в отличие от потребления пуриносодержащих продуктов животного происхождения, богатая пуринами растительная пища на сывороточный уровень МК существенно не влияет. Не составляет исключение и табуированный ранее соевый белок, потребление которого может немного повышать сывороточный уровень МК, но это не имеет клинического значения [30]. Практически во всех исследованиях, посвященных диетотерапии, изучается возможность влияния различных рационов питания на риск развития подагры, но не частоту приступов артрита у пациентов, уже имеющих диагноз подагры. Единственное проспективное исследование, проведенное как двойное слепое плацебо-контролируемое, доказало, что от некоторых пищевых продуктов для больных подагрой может быть и реальная польза: обогащенное гликомакропептидом и экстрактом молочного жира G600 обезжиренное молоко снижало риск приступов артрита в сравнении с плацебо [31]. Несколько крупных исследований показали дозозависимый эффект регулярного потребления кофе (при эпизодическом потреблении этого не происходит) вне зависимости от наличия кофеина [32, 33]. Весьма скромное снижение сывороточного уровня МК отмечается при приеме экстракта зеленого чая [34]. Вопреки широко распространенному мнению безопасным в отношении уровня урикемии и риска развития подагры (в отличие от пива и крепких спиртных напитков) является потребление небольшого количества сухого вина, для которого показан ряд метаболически благоприятных эффектов, включая профилактику нарушений углеводного, липидного обмена, снижение АД [35, 36]. Безусловно, значение диеты в лечении подагры велико, однако в подавляющем большинстве случаев этого явно недостаточно для достижения целевого уровня МК без параллельного приема уратснижающих препаратов. Однако возможность и необходимость назначения последних должны быть оценены только после купирования острого артрита, по причине которого пациенты чаще всего и обращаются к врачу.
В идеале максимально упрощенный алгоритм лечения больного можно представить в виде схемы (рис. 1).
Первая линия противовоспалительной терапии – колхицин (алкалоид трополонового ряда, получаемый из растения безвременник осенний (Colchicum autumnale)), НПВП и ГК. Сразу следует оговориться, что возможность назначения колхицина рассмотрена не будет, т. к. в настоящее время препарат в Российской Федерации не зарегистрирован. Таким образом, выбор существенно упрощается: либо НПВП, либо ГК. Возможности НПВП изучены лучше, и именно они составляют конкуренцию колхицину при назначении пациентам с острым приступом артрита. Чем раньше назначены НПВП, тем больше вероятность достижения быстрого анальгетического эффекта. Использовать целесообразно те препараты, которые применяются для лечения острой боли, при этом дозы должны быть максимальными.
Наиболее часто в нашей стране для лечения острого приступа подагры применяется нимесулид (Найз®), противовоспалительный и анальгетический эффект которого стоек и наступает максимально быстро. По данным крупного ретроспективного исследования, в котором анализировался самостоятельный выбор симптоматической терапии пациентами с подагрой, именно нимесулид оказался наиболее часто используемым препаратом [37]. Более 2/3 пациентов отметили, что нимесулид эффективнее в отношении купирования боли в сравнении с другими НПВП, и лишь 2% посчитали, что препарат не оказывает должного анальгетического действия. Этот факт подтверждают результаты другой работы, демонстрирующие преимущества нимесулида, принимаемого в дозе 200 мг/сут, в отношении скорости наступления анальгетического эффекта и купирования других симптомов воспаления в сравнении с диклофенаком натрия (150 мг/сут) [38]. Динамическое наблюдение в рамках открытого контролируемого исследования эффективности и безопасности нимесулида у 56 пациентов с подагрическим артритом, из которых 23 ранее безуспешно получали другие НПВП, 14 не могли купировать артрит на протяжении более чем 3-х мес. и 7 имели полиартикулярное поражение, показало возможность добиться полного купирования симптомов заболевания во всех наблюдаемых случаях [39].
Объясняется это быстрым достижением максимальных концентраций препарата в биологических жидкостях (достаточная для осуществления анальгезии концентрация определяется уже в течение получаса после первого приема и достигает 80% от максимальной), при этом его концентрация в очаге воспаления выше плазменной концентрации [40]. Еще одной особенностью нимесулида, предопределяющей его высокую эффективность, является возможность влиять на механизмы воспаления, не связанные с подавлением активности циклооксигеназы: ингибицию фактора некроза опухоли–α и интерлейкина (ИЛ) -6, ингибирование транслокации протеинкиназы С и фосфодиэстеразы IV типа при фагоцитозе нейтрофилов и моноцитов, в результате которой снижается продукция ex vivo супероксидных анионов, ингибицию урокиназы, блокирование высвобождения гистамина тучными клетками и базофилами, активацию глюкокортикоидных рецепторов [41–44].
Возможно назначение для купирования приступа артрита и ГК – либо в качестве внутрисуставных инъекций, либо внутрь (в этом случае стартовая доза преднизолона составляет 30–35 мг/сут в течение 3–5 дней, далее в течение 1 нед. препарат полностью отменяется). Но прием преднизолона ничуть не эффективнее НПВП, и снижение интенсивности боли по визуальной аналоговой шкале через 90 ч после начала противоспалительной терапии пациентам с острым подагрическим артритом для преднизолона 35 мг/сут и напроксена 1000 мг/сут эквивалентно при сопоставимой частоте развития нежелательных эффектов [45]. При этом тщательный мониторинг пациентов с подагрой, получивших даже однократную инъекцию бетаметазона 7 мг или инфузии метилпреднизолона 500 мг, в рамках слепого рандомизированного исследования зарегистрировал колоссальную частоту нежелательных явлений: например, у 73% пациентов отмечалось клинически значимое повышение АД, требующее медикаментозной коррекции, у 13% – признаки ишемии миокарда по данным ЭКГ [46]. У части больных применение инъекций бетаметазона может приводить к нарушению показателей гликемии как в ближайшие часы, так и при длительном наблюдении [47].
При неэффективности (как правило, у наиболее тяжелого контингента больных, при полиартрите) или наличии противопоказаний к терапии НПВП и ГК, отсутствии текущей инфекции возможно назначение блокаторов ИЛ–1, опыт применения которых есть и в нашей стране (в РФ зарегистрирован блокатор ИЛ-1β канакинумаб) [48].
В подавляющем большинстве случаев купировать симптомы острого артрита удается довольно быстро, и основные сложности и ошибки в лечении возникают на следующем этапе – при подборе уратснижающей терапии. Именно с приемом препаратов, способных нормализовать сывороточный уровень МК, и отождествляется основная цель лечения – достижение целевого уровня МК в крови, при котором развитие кристаллизации МК невозможно, а имеющиеся отложения кристаллов моноурата натрия постепенно рассасываются (для пациентов с наличием тофусов, вне зависимости от их локализации, хроническим артритом, высокой частотой атак целесообразно добиваться достижения сывороточного уровня МК <300 мкмоль/л, тогда тофусы рассасываются быстрее [49]); в остальных случаях достаточно снижения уровня МК до <360 мкмоль/л).
Исходя из концепции, которая предполагает наличие при подагре хронического воспаления (не следует путать его с хроническим артритом – этот термин применяется при наличии стойких клинических признаков воспаления), зачастую предшествующего клиническим проявлениям, должен быть пересмотрен подход к тому, когда и кому назначать такое лечение: сразу или ждать, как обсуждалось ранее, пока не будет более 4-х или 2-х приступов артрита в год.
На диету как на панацею, как было сказано выше, чаще всего уповать не приходится, и при уровне МК >480 мкмоль/л (как предлагается в критериях диагностики подагры 2006 г. с изменениями 2014 г.) следует начинать медикаментозное лечение вне зависимости от частоты приступов острого артрита. Категория пациентов, которым необходимо начинать терапию даже после первого в жизни приступа подагры, включает молодых (до 40 лет) пациентов, пациентов с наличием коморбидных заболеваний (почечная патология, артериальная гипертензия, ишемическая болезнь сердца, сердечная недостаточность) вне зависимости от выраженности гиперурикемии.
Выбор препарата на сегодняшний день не является актуальным: в РФ зарегистрирован только аллопуринол, назначать который следует не ранее чем через 2 нед. после купирования приступа артрита в стартовой дозе не более 100 мг/сут, постепенно поднимая дозу до минимально эффективной (на 100 мг каждые 2–4 нед., максимально – 900 мг/сут), отслеживая возможные нежелательные явления, частота которых увеличивается параллельно увеличению дозы. Особенно осторожно применяют препарат при наличии хронической болезни почек, однако есть данные, что у больных со сниженной функцией почек постепенное увеличение дозы аллопуринола выше лимитированной (в зависимости от значения скорости клубочковой фильтрации) позволяет чаще достигать целевого уровня МК без серьезных неблагоприятных реакций [50, 51]. В ближайшее время в России возможна регистрация фебуксостата, также ингибитора ксантиноксидазы, назначение которого при хронической болезни почек предпочтительнее [52, 53].
Наименее изучена превентивная противовоспалительная терапия, направленная на снижение риска приступа острого артрита в течение первых недель и месяцев после начала приема уратснижающих препаратов. Увеличение частоты приступов артрита при этом происходит независимо от проводимой уратснижающей терапии (аллопуринол, фебуксостат, пробенецид, пеглотиказа) [54] в результате быстрых изменений сывороточного уровня МК [55]. С целью профилактики обострений используют либо колхицин в суточной дозе 0,5–1 мг, либо НПВП в низких дозах, длительность такой терапии составляет 6 мес.
Таким образом, представленный алгоритм лечения предполагает непрерывность терапии, и ошибка на любом из этапов может привести к дальнейшему прогрессированию подагры. Лечение должно быть назначено как можно раньше, ключ к этому – ранняя диагностика заболевания.
Дата публикации 6 декабря 2017Обновлено 26 апреля 2021
Определение болезни. Причины заболевания
Подагра — системное заболевание, которое развивается в связи с воспалительным процессом, возникшим в месте отложения кристаллов моноурата натрия у людей с повышенным уровнем мочевой кислоты в сыворотке крови (более 360 мкмоль/л). Гиперурикемия возникает под воздействием как внешнесредовых, так и генетических факторов.
Роль мочевой кислоты в развитии подагры
Подагра — заболевание, вызванное повышением уровня мочевой кислоты в крови, или гиперурикемией. Чем длительнее и тяжелее протекает гиперурикемия, тем вероятнее развитие подагры. Чаще всего гиперурикемия возникает при нарушенном выведении почками мочевой кислоты.
Эпидемиология
Распространённость подагры среди взрослого населения в европейских странах составляет 0,9–2,5 %, в США достигает 3,9 % [21].
Особенности заболевания у мужчин и женщин
Подагрой страдают преимущественно мужчины, составляя 80-90 % заболевших. Пик заболеваемости у мужчин приходится на возраст 40-50 лет, у женщин — после 50 лет, с наступлением климакса. Подагра у мужчин встречается в 6-7 раз чаще, чем среди женщин; в старческом возрасте — в 3 раза чаще. Однако в последние годы подагра стала более распространена среди женщин [21].
Факторы риска
Причинами подагры могут быть:
- наследственность (предрасположенность к нарушению обмена пуринов);
- избыток в пище пуринов;
- нарушение функции почек, когда теряется их способность выводить мочевую кислоту (хроническая почечная недостаточность, поликистоз почек, гидронефроз, нефропатия в связи со злоупотреблением нестероидными противовоспалительными препаратами, при голодании);
- увеличение распада пуриновых нуклеотидов (цитостатическая терапия, лучевая и химиотерапия, хирургические вмешательства, гемолиз).[1][19]
Особенности современного течения подагры:
- значительный рост заболеваемости;
- увеличение частоты встречаемости у женщин;
- увеличение коморбидных состояний;
- начало заболевания в молодом возрасте.
Распространенность подагры растет, и это можно связать с ростом уровня жизни населения. Бессимптомная гиперурикемия встречается часто, однако далеко не всегда при этом развивается подагра.
При обнаружении схожих симптомов проконсультируйтесь у врача. Не занимайтесь самолечением — это опасно для вашего здоровья!
Симптомы подагры
Боли при подагре. Заболевание сопровождается нестерпимой, быстронарастающей и быстропроходящей за несколько часов или суток суставной болью, кожа над суставом краснеет, сам он увеличивается в объеме.
Из других симптомов — повышенная температура тела, слабость, потливость.
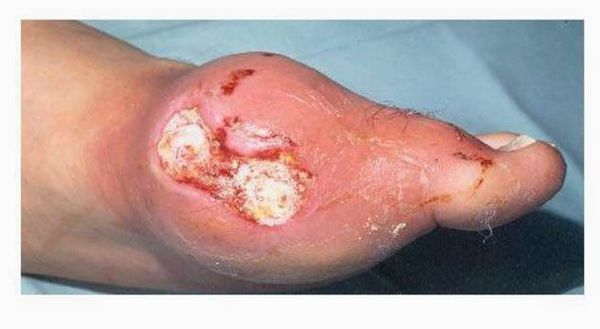
Тофусы. При переходе в хроническую форму заболевания вокруг поражённых суставов образуются тофусы, суставы деформируются. Тофусы — это единичные или множественные узелки белого и жёлтого цвета. Чаще всего возникают на пальцах, кистях, стопах, локтях. Тофусы также могут развиться под кожей на ушах, в почках или других органах.
Локальное повышение температуры. При остром подагрическом артрите локальная температура сустава повышается до 38-40 ºС.
Боли в пояснице, кровь в моче. В почках образуются уратные камни, провоцируя тянущие боли в пояснице и периодическое появление крови в моче, никтурию (больше мочи выделяется ночью).[2][3]
Воспаление околосуставных тканей. При воспалении околосуставных тканей пациент испытывает выраженную боль. Сустав отёчный, кожа над ним приобретает багрово-синюшный оттенок. Местные симптомы сопровождаются общим недомоганием и лихорадкой.
Ограничение подвижности в суставе. При остром подагрическом артрите возникает ограничение подвижности в суставе длительностью 5-14 дней, затем функции полностью восстанавливаются.
Патогенез подагры
Поскольку образование уратов растет и нарушается выведение их почками, образуется избыток мочевой кислоты в крови, и происходит накопление уратов в тканях организма. Когда происходит отложение кристаллов моноурата в полости сустава, возникает воспалительный процесс из-за активации различных провоспалительных цитокинов. Кроме того, эти кристаллы откладываются в почечной ткани, приводя к развитию нефропатии и уратного нефролитиаза.[7]
Классификация и стадии развития подагры
Выделяют пять клинических форм подагры: бессимптомную гиперурикемию, острый подагрический артрит, межприступную подагру, хронический подагрический артрит, хроническую тофусную подагру.
Клинические формы подагры
Бессимптомная гиперурикемия — повышение уровня мочевой кислоты в крови без клинических проявлений подагры.
Острый подагрический артрит. Приступ обычно наступает на утро после застолья, злоупотребления алкоголем, после повышенной физической нагрузки и инфекционных заболеваний. При остром подагрическом артрите возникает резкая, невыносимая боль в большом пальце стопы, температура тела повышается до 39 °C, кожа над поражённым суставом приобретает синюшо-багровый окрас.
Межприступная (интервальная) подагра. Без лечения у 62 % пациентов повторный приступ развивается в течение первого года, в течение двух лет – у 78 %. Продолжительность бессимптомного периода со временем сокращается, приступы становятся всё тяжелее, затрагивая новые суставы.
Хронический подагрический артрит. Дальнейшее отложение кристаллов моноурата натрия приводит к развитию хронического болевого синдрома, значительным деформациям суставам и нарушениям их функций, особенно суставов стоп и кистей.
Хроническая тофусная подагра. Характеризуется появлением тофусов — очаговых скоплений кристаллов мочевой кислоты в тканях в виде узлов. Обычно они располагаются подкожно, но иногда образуются в костях и других органах. Тофусы, как правило, безболезненны, кожа над ними может изъязвляться и инфицироваться.
От первой «атаки» болезни до развития хронической подагры проходит в среднем 11,6 лет, темпы развития заболевания зависят от выраженности гиперурикемии.
Приблизительно 20 % пациентов с хронической подагрой страдают от мочекаменной болезни, которая сопровождается болью в поясничной области, отдающей вниз живота, иногда — в половые органы, а также тошнотой и рвотой [22].
Течение. Симптомы в зависимости от стадии развития подагры
Впервые подагрический приступ настигает пациента без предвестников, как правило, в возрасте от 40 до 50 лет, хотя известны случаи заболевания и в гораздо более молодом возрасте. Острая суставная боль, чаще в плюснефаланговом суставе большого пальца стопы (классический вариант начала), застает человека во второй половине ночи или в ранние утренние часы. Любое движение в суставе или прикосновение вызывает сильнейшую боль.
Нарушение диеты, застолья с алкогольными напитками (алкоголь блокирует почку к выделению мочевой кислоты), хирургические вмешательства, инфекционные заболевания, повышенные нагрузки и травматизация сустава предшествуют возникновению приступа. Пациенты жалуются на покраснение пораженной области, ее припухание, сильную боль, общую слабость и недомогание, повышение температуры тела, потливость, разбитость, подавленность. Также характерными являются острые бурситы (препателлярный или локтевой сумки).[6]
В течение нескольких дней (около недели) приступ самостоятельно проходит. Именно из-за этого подагра часто создаёт видимость доброкачественности: всё проходит (особенно в начале) самостоятельно, и проблема забывается до следующего обострения. На самом деле подагра при таком подходе может привести к разрушению и деформации суставов, хронической болезни почек.
Далее при отсутствии адекватного контроля над заболеванием приступы учащаются, перестают проходить самостоятельно, проходят за больший промежуток времени. Позже человек вообще перестает чувствовать себя здоровым, а находится в состоянии затянувшегося приступа. В результате этого над областью пораженных суставов образуются безболезненные подкожные узелки с крошковидным, творожистым содержимым – тофусы (соли мочевой кислоты беловатого или желтоватого цвета). Излюбленное место расположения тофусов – область суставов кистей и стоп, ахиллово сухожилие, ушные раковины, голеностопные и локтевые суставы. При хронической тофусной подагре происходит разрушение хряща, что грозит деформацией, полным разрушением сустава и его анкилозом (полное заращение и отсутствие движений). Иногда тофусы могут самостоятельно вскрываться, а из них выделяется густое содержимое.[9][17]
Осложнения подагры
Возможные осложнения:
- образование тофусов;
- формирование деформаций и анкилозов суставов;
- нефролитиаз (камни в почках);
- депрессия как следствие постоянного болевого синдрома;
- статистически значимо при подагре гораздо более часто встречаются сопутствующие заболевания (сахарный диабет, атеросклероз, гипертриглицеридемия — метаболический синдром).[10]
Чем опасна подагра
К серьёзным осложнениям подагры относятся повышение артериального давления и ишемическая болезнь сердца. Гиперурикемия связана с повышенным риском смерти от болезней сердечно-сосудистой системы.
Диагностика подагры
Сбор анамнеза
При подозрении на подагру врач выяснит, что предшествовало приступу. К возможным причинам обострения относятся застолье с употреблением мяса и алкогольных напитков, интенсивная физическая нагрузка или голодание, перенесённое простудное заболевание.
Оценка клинической картины течения болезни
При подагре врач осматривает суставы — для подагрического артрита характерно поражение большого пальца стопы. В этом случае доктор обращает внимание на увеличение объёма сустава, изменение цвета кожи, отсутствие движений в суставе из-за выраженных болей, наличие или отсутствие тофусов.
Острый артрит, болевые ощущения при котором нарастают лавинообразно, появляется отек и покраснение пораженного сустава, является веским поводом подумать о подагре.
Диагностические критерии подагры
Диагностические критерии подагры Wallace (предложены ААР в 1975 году, одобрены ВОЗ в 2002 году):
- наличие кристаллов мочевой кислоты в суставной жидкости;
- наличие тофусов, содержание кристаллов мочевой кислоты в которых подтверждено химически или поляризационной микроскопией;
- наличие 6 из 12 следующих признаков:
- типичная картина острой суставной атаки (один и более раз) в анамнезе;
- признаки воспаления наиболее выражены в первые сутки;
- воспаление одного сустава (моноартрит);
- покраснение кожи над пораженным суставом;
- припухание и боль в первом плюснефаланговом суставе;
- поражение первого плюснефалангового сустава с одной стороны;
- поражение суставов стопы с одной стороны;
- тофусы и образования, напоминающие их;
- лабораторные изменения (повышение уровня мочевой кислоты в крови);
- несимметричный отек суставов;
- кисты под кортикальным слоем кости без эрозий на рентгенографии;
- стерильная синовиальная жидкость.[13]
Исследование синовиальной жидкости
При пункции врач получает синовиальную жидкость, в которой под микроскопом обнаруживаются кристаллы моноурата натрия. Они могут обнаруживаться и в тофусе. Диагноз при этом можно установить со стопроцентной вероятностью.
Микроскопическое исследование кристаллов в суставах
Ураты под микроскопом выглядят как иглообразные кристаллы с одним утонченным концом. В отсутствие поляризационного микроскопа диагноз основывается в основном на типичных клинических проявлениях подагры.
Уровень уратов в сыворотке
Около 30 % пациентов во время острой атаки имеют нормальный уровень мочевой кислоты в сыворотке крови. Высокий уровень мочевой кислоты (> 6,8 мг/дл) подтверждает диагноз, но не является специфичным признаком [22].
Визуализация
Рентгенологическое исследование суставов на ранней стадии болезни малоинформативно. Изменения выявляются на поздней стадии. В частности, симптом «пробойника» (субкортикальные кисты) — типичный рентгенологический признак подагры — полезен для диагностики ее тофусных форм. Также при рентгенографии при подагре отсутствует околосуставной остеопороз, редко видим сужение суставной щели, часто выявляется остеолиз.[11]
Диагностика хронического подагрического артрита
При хроническом подагрическом артрите у пациентов значительно поражены суставы, присутствуют подкожные или костные тофусы. Для подтверждения диагноза проводят рентгенологическое и ультразвуковое исследование [22].
Дифференциальная диагностика:
- гнойный артрит;
- болезнь отложения кристаллов пирофосфата кальция дигидрата;
- ревматоидный артрит;
- реактивный артрит;
- псориатический артрит;
- остеоартроз.
Стоит обратить внимание на то, что во время приступа уровень содержания мочевой кислоты в крови может быть нормальным, так как она в этот момент усиленно выводится почками. На ее уровень в крови не следует ориентироваться при постановке диагноза.
Лечение подагры
Можно ли вылечить подагру навсегда
Вылечиться от подагры полностью нельзя, но можно контролировать её развитие и предотвратить обострения.
Нелекарственные методы
- соблюдение диеты;
- ограничение употребления алкоголя;
- уменьшение избыточного веса.
Диета при подагре является довольно строгой, но выполнение диетических рекомендаций является залогом успешного лечения. Продукты, которые богаты пуринами, подлежат исключению или минимизации. Обильное щелочное питье помогает почкам избавиться от избытка мочевой кислоты в крови (почки — единственный орган, выводящий мочевую кислоту).
Начнем с главного источника пуринов — птицы и мяса. Курица — один из самых вредных видов птицы. Курице немного уступают (содержат меньше пуринов) утка и гусь. Индейка замыкает список, обладая самым низким содержанием пуринов среди птицы. Говядина — лидер среди мясных продуктов по содержанию пуринов, далее идут телятина и свинина, баранина.
Что касается рыбы, то самые вредные — лососевые виды, далее шпроты, килька, сардины, треска. Морские обитатели, живущие в раковинах (устрицы), являются самыми богатыми на пурины. Субпродукты также очень вредны (мозги, печень, легкие, почки), так же, как и холодец, мясные бульоны и соусы. Колбасу (любую) стоит полностью исключить из рациона. Не рекомендуются также: грибы и грибные бульоны, бобовые, щавель, яйца, шоколад, дрожжи, рис полированный, инжир, геркулес, капуста цветная, дрожжи. Алкогольные напитки запрещены (особое внимание пиву, вину, шампанскому).
Объем употребляемой за сутки жидкости — 2-2,5 литра. Рекомендовано щелочное питье: щелочная минеральная вода, вода с добавлением лимона, соки.
Теперь о бедных пуринами продуктах — как раз о тех, которые необходимо есть. Ими являются: молоко и молочные, молочнокислые продукты, многие овощи (капуста белокочанная, картофель, огурцы, помидоры, морковь, лук), орехи, фрукты, мучные изделия, крупы, мед, масло сливочное. Отварное мясо и рыбу рекомендуется есть 2-3 раза в неделю. Можно есть сало, так как жир почти не содержит пуринов. Некоторые исследования свидетельствуют, что 1,5 литра кофе в день приравнивается к 100 мг аллопуринола, а таккже известно, что вишня и черешня обладают гипоурикемическим действием.[4][15]
Лекарственные методы
Лечение подагры противоотечными и обезболивающими препаратами поможет уменьшить симптомы заболевания. Анальгетики при подагре неэффективны.
Как лечить подагру в период обострения:
- колхицин и нестероидные противовоспалительные препараты — это первое, чем стоит лечить приступ подагры. Колхицин является растительным препаратом (производное безвременника). При приеме колхицина довольно часто возникают побочные эффекты (рвота, жидкий стул, сильный дискомфорт в животе, синдром мальабсорбции, геморрагический энтероколит, редко возникает миелосупрессия и гиперкоагуляция), поэтому стоит строго придерживаться рекомендуемых дозировок. Нестероидные противовоспалительные препараты (ацеклофенак, нимесулид, диклофенак, эторикоксиб) стоит принимать в максимальных терапевтических дозировках — меньшие могут быть неэффективны. Рекомендуется учитывать риск развития побочных реакций при их назначении у определённого контингента больных. К сожалению, использование НПВП ограничено вызываемыми ими побочными эффектами, которые включают гастро- и нефропатию, поражение печени и ЦНС, особенно у пожилых. При назначении колхицина надо помнить, что лечение будет более успешным, если его назначить в первые сутки и даже часы после развития приступа. Однократная доза не должна превышать 2 мг, а суммарная 4 мг Высокие дозы колхицина приводят к побочным эффектам( диарея, тошнота, рвота).
- глюкокортикоиды внутрисуставно, внутрь или парентерально, когда противопоказан колхицин, нестероидные противовоспалительные препараты или же лечение ими неэффективно. Эти препараты дают выраженный эффект, но должны быть назначены только врачом, злоупотребление глюкокортикоидами имеет необратимые последствия (развитие сахарного диабета, неконтролируемая артериальная гипертензия и т. д.);
- канакинумаб (Иларис) — моноклональные антитела к интерлейкину-1, используются у пациентов с частыми приступами (более трех приступов за последний год), которые не могут принимать колхицин и НПВП.[12][20]
Лечение хроничекого подагрического артрита
Чтобы успешно лечить хроническую подагру, нужно предупредить образование и растворить уже имеющиеся кристаллы моноурата натрия, а для этого необходимо поддерживать уровень мочевой кислоты ниже 360 мкмоль/л.
- аллопуринол — урикодепрессор, доза подбирается индивидуально с врачом. При почечной недостаточности доза подбирается под особым контролем. Аллопуринол подлежит отмене во время приступа;[18]
- фебуксостат (аденурик) — используется при неэффективности аллопуринола, выводится печенью, является альтернативой для лечения пациентов с патологией почек;
- бензбромарон — блокирует обратное всасывание мочевой кислоты в канальцах почек и способствует ее выведению через почки и кишечник;
- пеглотиказа — раствор ферментов, который расщепляет подагрические соли, в РФ не зарегистрирован, применятся только при тяжелом течении подагры;
- колхицин — применяют первое время, для исключения повторных приступов, можно использовать (0,5-1,0 грамм в сутки).[5][16]
Пациенты подлежат диспансерному наблюдению у врача-ревматолога. Врач определяет периодичность контроля анализов, меняет (увеличивает или уменьшает) дозы получаемых препаратов, занимается лечением приступа. Противоподагрические средства принимаются длительное время. Также к лечению сопутствующей патологии могут быть подключены смежные специалисты (кардиолог, эндокринолог, уролог, нефролог). Пациент может быть госпитализирован в ревматологическое отделение при длительном по времени приступе, неэффективном лечении на амбулаторном этапе, а также для подбора постоянной терапии.
Прогноз. Профилактика
Прогноз зависит от своевременности и успешности начатого лечения, приверженности пациента к лечению, соблюдения диетических рекомендаций. По большей части прогноз благоприятный, но он ухудшается при развитии поражения почек, которое может стать даже причиной смерти пациента.
Как предупредить приступы подагры
Строгое соблюдение диеты является основным моментом в профилактике приступов подагры. Необходимо ограничить употребление алкоголя, не принимать некоторые лекарства (мочегонные препараты из группы тиазидов и петлевые мочегонные, неселективные бета-блокаторы, аспирин, никотиновую кислоту, леводопу). Если пациент худеет, то следует опасаться быстрой потери веса. Нужно стараться избегать обезвоживания и тяжелых физических нагрузок, воздействия низких температур. В профилактических целях аллопуринол может быть назначен только пациентам, страдающим онкологическими заболеваниями и получающим химиотерапию.[14]
За дополнение статьи благодарим Ирину Семизарову — ревматолога, научного редактора портала «ПроБолезни».
Подагра является наиболее частой причиной артрита [1], что обусловлено отложением кристаллов моноурата натрия (МУН) в суставах и мягких тканях. Для формирования кристаллов МУН необходима персистирующая гиперурикемия. При повышении сывороточного уровня мочевой кислоты (МК) происходит насыщение тканей МУН, что создает условия для его кристаллизации и, соответственно, манифестации подагры [2]. Порог насыщения МК составляет около 7 мг/дл (420 мкмоль/л), хотя для пациентов с подагрой рекомендуется достигать сывороточный уровень МК менее 6 мг/дл (360 мкмоль/л), поскольку такой уровень МК приводит к более быстрому уменьшению кристаллических отложений МУН [3–6].
Достигнутые в настоящее время успехи в понимании основных механизмов развития хронической гиперурикемии и подагры позволили пересмотреть многие положения, лежащие в основе диагностики и лечения заболевания. Между тем, несмотря на успехи в понимании патофизиологии подагры и доступность эффективных методов лечения, подагра остается плохо контролируемым заболеванием во всех странах [7, 8]. Пожалуй, самой распространенной проблемой является низкая приверженность пациентов к снижению сывороточного уровня МК, что главным образом связано с недостаточным пониманием цели терапии подагры и врачами, и пациентами. Целесообразно объяснить пациентам цель лечения [9–11], которая заключается в растворении имеющихся отложений кристаллов МУН путем снижения сывороточного уровня МК ниже точки насыщения сыворотки уратами и купировании приступов артрита, если таковые возникают. Следует также поддерживать сывороточный уровень МК ниже порога насыщения, чтобы избежать образования новых кристаллов.
Целью настоящей статьи было предоставить практический обзор существующих подходов к управлению заболеванием в четырех аспектах: немедикаментозные методы профилактики и лечения гиперурикемии; купирование острого приступа артрита; уратснижающая терапия, направленная на профилактику приступов артрита и образование тофусов; профилактика приступов артрита при инициации уратснижающей терапии.
Лечение подагры в соответствии с современными рекомендациями направлено на улучшение исходов заболевания. Эффективность лечебно-профилактических вмешательств при подагре зависит от четкого следования предложенной в них концепции лечения [4, 12, 13].
Немедикаментозные методы профилактики
Немедикаментозные методы профилактики, нацеленные на модификацию факторов образа жизни, связанных с риском развития гиперурикемии, предусматривают индивидуальное или групповое профилактическое консультирование по актуальным вопросам диетотерапии, контролю массы тела при ожирении, достижению целевых уровней артериального давления, коррекции нарушений углеводного и липидного обмена.
Ожирение является ведущим фактором риска подагры, особенно у мужчин, соответственно, контроль массы тела оказывает существенное влияние на частоту приступов подагры [14]. Снижение веса за счет ограничения общей калорийности пищи и потребления углеводов благотворно влияет на уровни сывороточного урата у пациентов с подагрой [15, 16].
Следует отметить, что в настоящее время пересмотрены некоторые принципиальные позиции по диетотерапии при подагре. Так, рекомендация по жесткому ограничению в пищевом рационе пуринсодержащих продуктов распространяется только на животные производные (мясо, морепродукты), поскольку именно такая мера способствует снижению сывороточного уровня мочевой кислоты. При этом богатая пуринами растительная пища не оказывает существенного влияния на урикемию [4, 17]. Показано, что потребление обезжиренных молочных продуктов [18, 19], растительных масел и овощей ассоциируется с уменьшением риска гиперурикемии и приступов подагры [4, 12]. Витамин С увеличивает почечную экскрецию мочевой кислоты, поэтому его можно использовать в качестве дополнительной меры при терапии подагры [20, 21]. Безопасным в отношении сывороточного уровня МК и риска развития подагры считается потребление небольшого количества сухого вина [20, 22]. При этом потребление пива, в т. ч. безалкогольного, крепких спиртных напитков, а также подслащенных безалкогольных напитков с высоким содержанием фруктозы должно быть ограничено максимально [20, 23–25].
Несмотря на то, что основная масса клинических исследований затрагивают оценку эффективности диетотерапии в аспекте профилактики риска развития подагры, а не управления частотой приступов артрита у лиц с верифицированным диагнозом, рекомендации по модификации образа жизни должны даваться всем пациентам с подагрой, в т. ч. получающим медикаментозную терапию.
Купирование острого приступа подагрического артрита
В современных рекомендациях в качестве препаратов первой линии противовоспалительной терапии рассматриваются нестероидные противовоспалительные средства (НПВС), колхицин и глюкокортикостероиды (ГК) [4, 12, 13]. Сравнительно недавний систематический обзор показал, что НПВС (в том числе селективные ингибиторы ЦОГ-2), ГК (перорально и внутримышечно), колхицин и ингибитор ИЛ-1β (канакинумаб) являются эффективными методами лечения острых приступов [26]. Целесообразность персонифицированного выбора режима терапии обусловлена и индивидуальными особенностями больного, и гетерогенностью собственно подагрического процесса, протекающего с вовлечением многих органов и систем организма, что существенно модифицирует фармакодинамику препаратов, приводя к кумуляции нежелательных эффектов.
Терапия НПВС занимает лидирующие позиции в лечении как острого приступа, так и хронического подагрического артрита. Считается, чем раньше назначен препарат, тем быстрее может быть достигнут анальгетический эффект. НПВС следует использовать в максимальных суточных дозах, которые могут быть уменьшены по мере ослабления симптоматики. Выбор конкретного НПВС во многом зависит от личных предпочтений. И селективные ингибиторы ЦОГ-2, и традиционные НПВС эффективны при лечении острых приступов подагрического артрита. Недавний систематический обзор, объединяющий результаты шести рандомизированных клинических исследований (851 пациент), продемонстрировал одинаковый эффект эторикоксиба (120 мг в сутки), индометацина и диклофенака при остром артрите, с лучшей у эторикоксиба переносимостью со стороны желудочно-кишечного тракта [27]. Другой селективный ингибитор ЦОГ-2 — целекоксиб также обнаружил сопоставимый с индометацином эффект в отношении умеренной и выраженной боли у пациентов с острым подагрическим артритом [28]. Еще в одном систематическом обзоре был сделан вывод о том, что НПВС и селективные ингибиторы ЦОГ-2 обнаруживают эквивалентные преимущества в плане уменьшения боли, отечности и улучшения общего самочувствия, однако традиционные НПВС отличаются большей частотой отмены из-за нежелательных явлений [29].
Колхицин — алкалоид, получаемый из растения безвременника осеннего (Colchicum autumnae), используется для лечения острой подагры на протяжении многих десятилетий. Клинические исследования и ежедневная рутинная практика демонстрируют высокую частоту побочных эффектов при применении колхицина, которые, вероятно, можно объяснить назначением в прошлые годы более высоких доз препарата, чем рекомендованы в настоящее время. По крайней мере, большое многоцентровое исследование пациентов с подагрой и сохраненной функцией почек убедительно показало сопоставимую эффективность двух режимов терапии острого подагрического артрита: низкодозового (1,8 мг колхицина в сутки: 1,2 мг сразу и 0,6 мг через час) и высокодозового (4,8 мг колхицина в сутки: 1,2 мг сразу и по 0,6 мг каждый час; 6 раз), с существенно меньшей частотой побочных эффектов со стороны желудочно-кишечного тракта в группе с низкой дозой. Причем эффективность низких доз колхицина была эквивалентна высоким в том случае, если колхицин в низких дозах назначался в течение первых 12 часов после начала острого приступа артрита [30]. Клиническая практика показывает, что колхицин оказывается гораздо менее эффективным, если его назначают после 12–24 часов от начала приступа. Соответственно, более позднее назначение может потребовать больших доз препарата, что практически всегда заканчивается развитием нежелательных лекарственных реакций.
Согласно современным национальным рекомендациям для купирования острой атаки артрита целесообразным считается назначение у большинства пациентов низких доз колхицина (1,5 мг в первые сутки (1 мг сразу и через 1 час еще 0,5 мг) и по 1 мг со следующего дня) [13].
Назначение ГК для купирования острого приступа подагры возможно в виде внутрисуставных (после удаления синовиальной жидкости), внутримышечных инъекций или внутрь.
Пероральный прием преднизолона в суточной дозе 30–35 мг/сут демонстрирует высокую эффективность [31, 32] и рекомендуется группами Американского колледжа ревматологов (American College of Rheumatology, ACR) и Европейской антиревматической лиги (European League Against Rheumatism, EULAR) в качестве терапии первой линии при лечении острого приступа подагры [12, 33]. При этом стартовая доза преднизолона 30–35 мг/сут назначается на несколько (3–6) дней с последующей быстрой (в течение 1 недели) полной отменой.
Внутримышечное введение ГК может быть применено в случаях полиартикулярного поражения суставов [34]. Внутрисуставные инъекции стероидов оказываются очень эффективными и рекомендуются как ACR, так и EULAR при моно- или полиартикулярном поражении суставов, несмотря на отсутствие рандомизированных клинических исследований [12, 33].
Однако важно отметить, что, вопреки бытующему мнению, прием преднизолона не эффективнее НПВС. Так, сравнение двух режимов терапии (преднизолон 35 мг/сут и напроксен 1000 мг/сут) у пациентов с острым подагрическим артритом показало отсутствие различий в динамике интенсивности боли при сопоставимой частоте нежелательных эффектов [35]. Кроме того, ГК не безопаснее НПВС, поскольку способны усугубить течение артериальной гипертонии и сахарного диабета [36]. В исследовании [37] частота побочных эффектов даже на однократное внутрисуставное введение ГК (бетаметазон 7 мг) оказалась чрезвычайно высокой: у 73% пациентов обнаружилось клинически значимое повышение уровня систолического артериального давления, у 23% — гликемия натощак, у 13% — ЭКГ-признаки ишемии миокарда.
При наличии абсолютных противопоказаний и/или неэффективности НПВС, колхицина и ГК, а также отсутствии текущей инфекции, с целью купирования острого артрита возможно применение моноклональных антител к ИЛ-1 (канакинумаб) [12].
Уратснижающая терапия
Уратснижающая терапия, основной целью которой является предупреждение образования и растворение имеющихся кристаллов МУН, возможна посредством достижения уровня МК ниже точки супернасыщения сыворотки уратами (< 360 мкмоль/л), при котором процесс кристаллизации МК приостанавливается, а депозиты кристаллов в тканях постепенно растворяются. Для пациентов с тяжелой тофусной подагрой, хроническим артритом и частыми атаками предпочтительно поддержание целевого сывороточного уровня МК ниже 300 мкмоль/л, поскольку это способствует более быстрому рассасыванию тофусов [12, 33].
Нужно заметить, что целесообразность регулярного контроля гиперурикемии на фоне уратснижающей терапии признается далеко не всеми исследователями. По крайней мере, данный подход был опротестован группой ACR, которая рекомендовала врачам назначать терапию подагры с целью управления симптомами, а не уровнем урикемии [38]. Между тем многочисленные клинические и патофизиологические исследования свидетельствуют о том, что снижение уровня МК ниже точки насыщения сыворотки уратами является лучшим и самым надежным способом контроля симптомов подагры в долгосрочной перспективе и что назначение уратснижающей терапии без отслеживания темпов снижения уровня урикемии является частым поводом отказа от лечения подагры для многих пациентов [4, 12, 33].
Поскольку у значительной доли больных хроническое воспаление, обусловленное депозитами моноурата натрия, предшествует клинической манифестации заболевания, то зачастую лечащему врачу довольно сложно принять решение, когда начинать лекарственную уратснижающую терапию: сразу после первого приступа или после повторения двух и более атак острого артрита.
Разумеется, уратснижающая терапия показана всем пациентам со стойкой гиперурикемией и острыми атаками артрита (в том числе в анамнезе), хроническим артритом, наличием тофусов (независимо от их локализации и методов выявления: при осмотре, методами лучевой визуализации). Пациентам с дебютом подагры в возрасте моложе 40 лет, при наличии коморбидной патологии (заболевание почек, артериальная гипертензия, ишемическая болезнь сердца, хроническая сердечная недостаточность) уратснижающая терапия должна быть инициирована сразу после первого приступа подагры, вне зависимости от уровня гиперурикемии. Проведение уратснижающей терапии в других случаях (при неосложненной подагре) показано при неэффективности нефармакологических методов лечения.
Уратснижающими препаратами являются аллопуринол и фебуксостат. Мишенью действия этих препаратов является ключевой фермент пуринового обмена — ксантиноксидаза, которая обеспечивает окисление гипоксантина до ксантина и далее ксантина — до МК. В этой сложной реакции превращения МК из гипоксантина высвобождаются супероксидные анионы и молекулярный кислород, способные вызывать оксидативный стресс и повреждение тканей [39].
Аллопуринол является ингибитором ксантиноксидазы, впервые введенным в клинику в шестидесятые годы. Сегодня он признан препаратом базисной терапии подагры. По своей химической природе аллопуринол — аналог гипоксантина. Механизм действия аллопуринола весьма интересен: в начале реакции он действует в качестве субстрата фермента ксантиноксидазы, а затем — в качестве ее ингибитора. Так, вначале ксантиноксидаза гидроксилирует аллопуринол, превращая его в аналог гипоксантина — аллоксантин (оксипуринол). А далее аллоксантин, прочно связываясь с активным центром ксантиноксидазы, содержащим ион молибдена, меняет ее свойства, в результате чего последующего этапа превращения МК не происходит. Кроме ингибирования трансформации гипоксантина в МК, аллопуринол устраняет выработку продуктов оксидативного стресса [39].
В клинической практике широко используемая доза аллопуринола составляет 300 мг/сут (90–95% пациентов с подагрой) [40], но для контроля гиперурикемии этого довольно часто бывает недостаточно. Так, по данным исследования [41] только 53% пациентов с подагрой достигли сывороточного уровня МК менее 6 мг/дл (360 мкмоль/л) на аллопуриноле 300 мг в день, но когда доза препарата была увеличена до 450–600 мг в сутки, то к целевому уровню МК приблизились все 100% испытуемых. В другом исследовании только 26,0% пациентов, получавших 300 мг аллопуринола в сутки, достигли целевого уровня МК ниже 6 мг/дл (360 мкмоль/л), тогда как 78% пациентов смогли достичь целевых значений только при повышении суточной дозы аллопуринола свыше 600 мг в сутки [42]. Таким образом, стандартная доза аллопуринола 300 мг в сутки зачастую недостаточна для достижения цели и должна титроваться в большую сторону, с учетом целевого уровня МК. Еще один важный момент, который должен учитываться при выборе оптимальной дозы препарата, — это состояние функции почек, поскольку ключевой метаболит аллопуринола — оксипуринол выводится главным образом почками [43]. В свое время, чтобы иметь возможность контролировать токсичность препарата, были предложены правила титрования дозы аллопуринола в зависимости от клиренса креатинина [44], но эта мера довольно часто не позволяла достичь целевых уровней МК [45].
В настоящее время рекомендуется назначать аллопуринол в исходно низкой дозе (50–100 мг в сутки) с последующим увеличением дозы (при необходимости) по 100 мг каждые 2–4 недели, что особенно важно у пациентов с почечной недостаточностью [5, 13]. Такое медленное титрование дозы снижает вероятность острого приступа после старта терапии [3]. Хотя в двух недавних исследованиях было показано, что опасения по поводу вероятности развития острой атаки артрита нередко бывают преувеличенными [46, 47]. По крайней мере, приостанавливать ранее начатую уратоснижающую терапию в случае вспышки острого артрита у большинства больных нет оснований.
Во всяком случае, аллопуринол следует назначать не ранее чем через 2 недели после купирования приступа острого артрита, постепенно титруя дозу до эффективной и отслеживая возможные нежелательные явления, частота которых существенно возрастает параллельно увеличению дозы.
К сожалению, аллопуринол относится к препаратам, на высокие дозы которого возможно развитие серьезных нежелательных явлений в виде прогрессирующей почечной недостаточности, гепатотоксичности, тяжелых аллергических реакций, в т. ч. синдрома Стивена–Джонсона, эпидермального некролиза, DRESS-синдрома [48, 49]. К возможным причинам развития таких тяжелых реакций на аллопуринол относят носительство гена HLA-В 5801, которое с высокой частотой встречается в разных этнических популяциях и максимально распространено в Азии (17%). В России носительство аллеля HLA-В 5801 сопоставимо с таковым в азиатских странах и выше, чем в странах Европы [50].
Впервые за 50 лет в качестве альтернативы аллопуринолу был разработан и внедрен в клиническую практику фебуксостат — сильный селективный непуриновый ингибитор ксантиноксидазы. Мощный уратснижающий эффект препарата связан с селективным подавлением двух изоформ ксантиноксидазы. Известно, что фебуксостат образует прочные высокоаффинные связи с активным молибденовым центром как окисленной, так и восстановленной изоформ ксантиноксидазы. Аллопуринол образует комплексы только с восстановленной изоформой фермента. Поскольку обе изоформы ксантиноксидазы, легко обмениваясь ионами молибдена, могут быстро переходить из одной в другую, это позволяет энзиму ускользать от эффекта аллопуринола. На фоне приема аллопуринола восстановленная форма фермента, под действием спонтанной реоксидации молибденового центра, способна очень быстро реактивироваться. Для фебуксостата характерно длительное и плотное заполнение узких каналов, ведущих к молибденовому центру, обеспечивающее прочность связей и устойчивость энзима к действию каскада окислительных кофакторов. Наконец, фебуксостат, в отличие от аллопуринола, не вступает в иные пуриновые и пиримидиновые реакции, что обеспечивает его селективность и адресное воздействие на синтез МК [51].
Важным преимуществом фебуксостата является смешанный (печеночный и почечный) метаболизм. В отличие от аллопуринола, препарат не требует корректировки дозы у пациентов с легкой или умеренной почечной недостаточностью и общей коморбидностью, которая с высокой частотой отмечается у пациентов с подагрой [52]. Недавние исследования показали, что эффективность и безопасность фебуксостата сохраняется у пациентов с клиренсом креатинина ниже 30 мл/мин [53]. Между тем Европейское агентство лекарственных средств (European Medicines Agency, ЕМА) рекомендует взвешенный подход к титрованию дозы фебуксостата пациентам со сниженной (< 30 мл/мин) скоростью клубочковой фильтрации [54].
В ходе масштабных клинических исследований (APEX, FACT, CONFIRMS, CACTUS, FORTE) фебуксостат доказал более мощный, чем у аллопуринола или плацебо, эффект [55].
В рандомизированном двойном слепом многоцентровом исследовании (с общей численностью больных 760 человек, у 35% из которых имелось легкое или умеренное снижение почечной функции) 52?недельная терапия фебуксостатом в дозах, одобренных для использования в ЕС (80 и 120 мг/день), была значительно более эффективной в отношении снижения сывороточного уровня МК у пациентов с гиперурикемией и подагрой, чем аллопуринол, в дозах, обычно назначаемых в клинической практике (100–300 мг/день). Так, целевого уровня МК (< 360 мкмоль/л) достигли 53% пациентов, принимавших 80 мг фебуксостата, 62% больных, принимавших 120 мг фебуксостата, и 21% принимавших 300 мг аллопуринола (р < 0,001) [56].
Фебуксостат продемонстрировал большую эффективность в снижении урикемии, чем аллопуринол, у пациентов с почечной недостаточностью. Так, в ходе 28?недельного многоцентрового двойного слепого исследования III фазы CONFIRMS с участием 2269 пациентов с подагрой, которые были рандомизированы на 4 группы терапии в зависимости от функции почек: фебуксостат в дозах 40 мг/сут и 80 мг/сут и аллопуринол в дозах 200 мг/сут и 300 мг/сут, было обнаружено, что применение аллопуринола в 300 мг/сут и фебуксостата в дозе 40 мг/сут способствует достижению целевого уровня МК (< 360 мкмоль/л) более чем в 45% случаев. У пациентов, получавших фебуксостат в дозе 80 мг/сут, результат статистически значимо превосходил результаты в двух других группах — 67% (р < 0,001). Подобные результаты были получены при сравнении групп с различной степенью почечной недостаточности: 72% больных, получавших 80 мг/сут фебуксостата, достигли целевых уровней МК, тогда как в группах, принимавших 40 мг/сут фебуксостата или аллопуринол, таких больных было 50% и 42% соответственно [57].
В 28?недельном двойном слепом клиническом исследовании, которое включало 1067 пациентов с подагрой и гиперурикемией более 480 мкмоль/л, пациенты были рандомизированы на группы фебуксостат (80, 120 или 240 мг/сут), аллопуринол (100 или 300 мг/сут) или плацебо. В группах больных, получавших фебуксостат, подбор дозы осуществлялся без учета функции почек. В группах, получавших аллопуринол, учитывался уровень креатинина. Так, больные с уровнем креатинина менее 1,5 мг/дл принимали 300 мг аллопуринола, а больные с уровнем креатинина от 1,6 до 2,0 мг/дл соответственно 100 мг аллопуринола в сутки. Фебуксостат вне зависимости от дозы показал большую эффективность в поддержании уровней сывороточного уровня МК ниже 360 мкмоль/л по сравнению с аллопуринолом или плацебо. Так, доля пациентов, достигших целевых значений МК на дозе фебуксостата 80 мг, 120 мг и 240 мг, составила соответственно 76%, 87% и 94%, тогда как количество больных, достигших целевого уровня МК на аллопуриноле в суточной дозе 300/100 мг и плацебо, составило соответственно 41% и 1% (р < 0,05 для всех групп фебуксостата по сравнению с аллопуринолом и плацебо) [58].
В исследованиях с длительным периодом наблюдения, 3–5?летнее лечение фебуксостатом поддерживало целевой уровень МК (< 360 мкмоль/л) у большинства пациентов. Одно из самых продолжительных исследований FOCUS продемонстрировало не только высокую эффективность фебуксостата в отношении достижения целевых уровней урикемии, но и обнаружило весьма устойчивую связь между снижением уровня МК и ликвидацией приступов артрита. Причем по мере продолжения терапии фебуксостатом преимущества терапии становились более очевидными [59].
В более позднем ретроспективном исследовании, в котором сравнивалась эффективность фебуксостата и аллопуринола, также была отмечена большая эффективность фебуксостата (40 мг/сут или 80 мг/сут) по сравнению с аллопуринолом (300 мг/сут) в снижении сывороточного уровня МК. Причем исследование показало, что на терапии фебуксостатом клинический эффект достигается быстрее [60].
Переносимость фебуксостата во всех клинических исследованиях была хорошей, а частота нежелательных явлений низкой [58, 61, 62]. Сообщаемые побочные эффекты включали нарушения функции печени, диарею и доброкачественные кожные высыпания, о которых сообщалось примерно у 3% пациентов во время испытаний фазы III. Сообщения о развитии серьезных кожных реакций были крайне редкими [63]. Причем кожные реакции на фебуксостат проявлялись чаще у пациентов с ранее предшествующей кожной непереносимостью аллопуринола. При этом было показано, что повышенный риск кожных реакций у таких пациентов возникает не из-за перекрестной реактивности, а из-за повышенной вероятности того, что любой пациент с аллергической реакцией на известный препарат развивает реакцию кожи на другое лекарственное средство [64]. Было отмечено, что фебуксостат — препарат выбора для пациентов с предшествующей сыпью или реакцией гиперчувствительности на аллопуринол [65], хотя не исключено, что в редких случаях реакция гиперчувствительности на фебуксостат также возможна [66].
Причины отмены также были реже у фебуксостата, за исключением приступов подагры, которые чаще встречались на терапию фебуксостатом (вероятно, из-за более глубокого и более быстрого снижения сывороточного уровня МК при назначении относительно более высоких доз (120–240 мг/сут) препарата).
Препарат применяется в Европе и США с 2008 г. В настоящее время он разрешен к применению в РФ. Рекомендованная доза фебуксостата — 80 мг 1 раз в день. При необходимости доза может быть увеличена до 120 мг в сутки. Общая тактика применения фебуксостата не отличается от таковой при назначении аллопуринола. Лечение фебуксостатом не рекомендуется начинать во время острого артрита.
Профилактика приступов острого артрита при инициации уратснижающей терапии
Увеличение частоты приступов артрита в течение первых недель и даже месяцев после старта уратснижающей терапии происходит независимо от препарата (аллопуринол, фебуксостат) в результате быстрых изменений сывороточного уровня мочевой кислоты [4, 12, 13]. Для профилактики приступов артрита рекомендовано в течение первых 6 месяцев от инициации терапии использовать колхицин в дозе 0,5–1,0 мг/сут или НПВС в низких дозах (с обязательной гастропротекцией при наличии показаний).
В случаях почечной недостаточности или при лечении статинами врач и пациент должны иметь настороженность в отношении потенциальной нейро- и миотоксичности на применение колхицина в качестве средства профилактики острых приступов артрита. Следует также избегать сочетанного назначения ингибиторов Р-гликопротеина (циклоспорин A) или ингибиторов CYP3А4 (кларитромицин, эритромицин, кетоконазол, дилтиазем, верапамил и др.) [67].
Таким образом, современные подходы к лечению подагры позволяют управлять заболеванием при достижении целевых уровней МК в сыворотке крови, опираясь на технологии профилактического консультирования и обучения пациентов, а также применения ингибиторов ксантиноксидазы. Фебуксостат является хорошо исследованным уратснижающим средством, которое обеспечивает эффективную альтернативу аллопуринолу в лечении подагры у широкого круга пациентов.
Литература
- Roddy E., Choi H. Epidemiology of gout // Rheum Dis Clin North Am. 2014; 40: 155–175.
- Mandal A. K., Mount D. B. The molecular physiology of uric acid homeostasis // Annu Rev Physiol. 2015; 77: 323–334.
- Zhang W., Doherty M., Bardin T., Pascual E., Barskova V., Conaghan P. et al. EULAR evidence based recommendations for gout. Part II: management. Report of a task force of the EULAR Standing Committee for International Clinical Studies Including Therapeutics (ESCISIT) // Ann Rheum Dis. 2006; 65: 1312–1324.
- Khanna D., Fitzgerald J., Khanna P., Bae S., Singh M., Neogi T. et al. American College of Rheumatology guidelines for management of gout. Part 1: systematic nonpharmacologic and pharmacologic therapeutic approaches to hyperuricemia // Arthritis Care Res. 2012; 64: 1431–1446.
- Sivera F., Andrés M., Carmona L., Kydd A., Moi J., Seth R. et al. Multinational evidence-based recommendations for the diagnosis and management of gout: integrating systematic literature review and expert opinion of a broad panel of rheumatologists in the 3 e initiative // Ann Rheum Dis. 2014; 73: 328–333.
- Pascual E., Andrés M., Vela P. Gout treatment: should we aim for rapid crystal dissolution? // Ann Rheum Dis. 2013; 72: 635–637.
- Roddy E., Zhang W., Doherty M. Concordance of the management of chronic gout in a UK primary-care population with the EULAR gout recommendations // Ann Rheum Dis. 2007; 66: 1311–1315.
- Pascual E., Sivera F. Why is gout so poorly managed? // Ann Rheum Dis. 2007; 66: 1269–1270.
- Riedel A., Nelson M., Joseph-Ridge N., Wallace K., MacDonald P., Becker M. Compliance with allopurinol therapy among managed care enrollees with gout: a retrospective analysis of administrative claims // J Rheumatol. 2004; 31: 1575–1581.
- Harrold L., Andrade S., Briesacher B., Raebel M., Fouayzi H., Yood R. et al. Adherence with urate-lowering therapies for the treatment of gout // Arthritis Res Ther. 2009; 11: R46.
- Rees F., Jenkins W., Doherty M. Patients with gout adhere to curative treatment if informed appropriately: proof-of-concept observational study // Ann Rheum Dis. 2013; 72: 826–830.
- Richette P., Doherty M., Pascual E., Barskova V., Becce F., Castaneda-Sanabria J. EULAR evidence-based recommendations for the management of gout // Ann Rheum Dis. 2017; 76 (1): 29–42.
- Елисеев М. С. Подагра. В кн.: Российские клинические рекомендации. Ревматология / Под ред. Е. Л. Насонова. М.: ГЭОТАР-Медиа, 2017. С. 372–385.
- Choi H. K., Atkinson K., Karlson E. W., Curhan G. Obesity, weight change, hypertension, diuretic use, and risk of gout in men: the health professionals follow-up study // Arch Intern Med. 2005; 165 (7): 742–748.
- Dessein P. H., Shipton E. A., Stanwix A. E., Joffe B. I., Ramokgadi J. Beneficial effects of weight loss associated with moderate calorie/carbohydrate restriction, and increased proportional intake of protein and unsaturated fat on serum urate and lipoprotein levels in gout: a pilot study // Ann Rheum Dis. 2000; 59 (7): 539–543.
- Timmers S., Konings E., Houtkooper R. H. et al. Calorie restriction-like effects of 30 days of resveratrol supplementation on energy metabolism and metabolic profile in obese humans // Cell. Metab. 2011. Vol. 14 (5). Р. 612–622.
- Сhoi H. K., Atkinson K., Karlson E. W., Willett W., Curhan G. Purine-rich foods, dairy and protein intake, and the risk of gout in men // N Engl J Med. 2004; 350 (11): 1093–1103.
- Dalbeth N., Wong S., Gamble G. D., Horne A., Mason B., Pool B. Acute effect of milk on serum urate concentrations: a randomised controlled crossover trial // Ann Rheum Dis. 2010; 69 (9): 1677–1682.
- Dalbeth N., Ames R., Gamble G. D. et al. Effects of skim milk powder enriched with glycomacropeptide and G600 milk fat extract on frequency of gout flares: a proof-of-concept randomized controlled trial // Ann Rheum Dis. 2012; 71 (6): 929–934.
- Kanbara A., Seyama I. Effect of urine pH on uric acid excretion by manipulating food materials // Nucleosides, Nucleotides Nucleic Acids. 2011; 30 (12): 1066–1071.
- Towiwat P., Li Z. G. The association of vitamin C, alcohol, coffee, tea, milk and yogurt with uric acid and gout // Int J Rheum Dis. 2015; 18 (5): 495–501.
- Choi H. K. Atkinson K, Karlson E. W., Willett W., Curhan G. Alcohol intake and risk of incident gout in men: a prospective study // Lancet. 2004; 363 (9417): 1277–1281.
- Choi H. K., Curhan G. Soft drinks, fructose consumption, and the risk of gout in men: prospective cohort study // BMJ. 2008; 336 (7639): 309–312.
- Choi H. K., Willett W., Curhan G. Fructose-rich beverages and risk of gout in women // JAMA. 2010; 304 (20): 2270–2278.
- Kedar E., Simkin P. A. A perspective on diet and gout // Adv Chronic Kidney Dis. 2012; 19 (6): 392–397.
- Khanna P., Gladue H., Singh M., FitzGerald J., Bae S., Prakash S. et al. Treatment of acute gout: a systematic review. Semin Arthritis Rheum. 2014; 44: 31–38.
- Zhang S., Zhang Y., Liu P., Zhang W., Ma J., Wang J. Efficacy and safety of etoricoxib compared with NSAIDs in acute gout: a systematic review and a meta-analysis // Clin Rheumatol June. 2015; Epub ahead of print.
- Schumacher H., Berger M., Li-Yu J., Pérez-Ruiz F., Burgos-Vargas R., Li C. Efficacy and tolerability of celecoxib in the treatment of acute gouty arthritis: a randomized controlled trial // J Rheumatol. 2012; 39: 1859–1866.
- Van Durme C., Wechalekar M., Buchbinder R., Schlesinger N., van der Heijde D., Landewé R. Non-steroidal anti-inflammatory drugs for acute gout // Cochrane Database Syst Rev. 2014; 9: CD010–120.
- Terkeltaub R. A., Furst D. E., Bennett K., Kook K. A., Crockett R. S., Davis M. W. High versus low dosing of oral colchicine for early acute gout flare: Twenty-four-hour outcome of the first multicenter, randomized, double-blind, placebo-controlled, parallel-group, dose-comparison colchicine study // Arthritis Rheum. 2010; 62 (4): 1060–1068.
- Man C. Y., Cheung I. T., Cameron P. A., Rainer T. H. Comparison of oral prednisolone/paracetamol and oral indomethacin/paracetamol combination therapy in the treatment of acute goutlike arthritis: a double-blind, randomized, controlled trial // Ann Emerg Med. 2007; 49 (5): 670–677.
- Rainer T. H., Cheng C. H., Janssens H. J., Man C. Y., Tam L. S., Choi Y. F. Oral prednisolone in the treatment of acute gout: a pragmatic, multicenter, double-blind, randomized trial // Ann Intern Med. 2016; 164 (7): 464–471.
- Khanna D., Khanna P. P., Fitzgerald J. D., Singh M. K., Bae S., Neogi T. American College of Rheumatology guidelines for management of gout. Part 2: therapy and antiinflammatory prophylaxis of acute gouty arthritis // Arthritis Care Res (Hoboken). 2012; 64 (10): 1447–1461.
- Bernal J. A., Quilis N., Andrés M., Sivera F., Pascual E. Gout: optimizing treatment to achieve a disease cure // Ther Adv Chronic Dis. 2016; 7 (2): 135–144.
- Janssens H. J., Janssen M., van de Lisdonk E. H., van Riel P. L., van Weel C. Use of oral prednisolone or naproxen for the treatment of gout arthritis: a double-blind, randomised equivalence trial // Lancet. 2008; 371 (9627): 1854–1860.
- Richette P., Bardin T. Should prednisolone be first-line therapy for acute gout? // Lancet. 2008; 372 (9646): 1301.
- Федорова А. А., Барскова В. Г., Якунина И. А., Насонова В. А. Кратковременное применение глюкокортикоидов у больных затяжным и хроническим подагрическим артритом. Ч. III. Частота развития нежелательных реакций // Научно-практическая ревматология. 2009; № 2. С. 38–42.
- Qaseem A., Harris R. P., Forciea M. A. Management of acute and recurrent gout: a clinical practice guideline from the american college of physicians // Ann Intern Med. 2017; 166 (1): 58–68.
- McLean L., Becker M. A. The pathogenesis of gout. Rheumatology Fourth Edition. Edited by Hochberg M. C., Silman A. J., Smolen J. S. Phyladelphia, 2008. P. 1813–27.
- Annemans L., Spaepen E., Gaskin M., Bonnemaire M., Malier V., Gilbert T. Gout in the UK and Germany: prevalence, comorbidities and management in general practice 2000–2005 // Ann Rheum Dis. 2008; 67 (7): 1021–1030.
- Pérez-Ruiz F., Alonso-Ruiz A., Calabozo M., Herrero-Beites A., García-Erauskin G., Ruiz-Lucea E. Efficacy of allopurinol and benzbromarone for the control of hyperuricaemia. A pathogenic approach to the treatment of primary chronic gout // Ann Rheum Dis. 1998; 57: 545–549.
- Reinders M., van Roon E., Jansen T., Delsing J., Griep E., Hoekstra M. et al. Efficacy and tolerability of urate-lowering drugs in gout: a randomised controlled trial of benzbromarone versus probenecid after failure of allopurinol // Ann Rheum Dis. 2009; 68: 51–56.
- Jennings C., Mackenzie I., Flynn R., Ford I., Nuki G., De Caterina R. et al. Up-titration of allopurinol in patients with gout // Semin Arthritis Rheum. 2014; 44: 25–30.
- Hande K., Noone R., Stone W. Severe allopurinol toxicity. Description and guidelines for prevention in patients with renal insufficiency // Am J Med. 1984; 76: 47–56.
- Dalbeth N., Kumar S., Stamp L., Gow P. Dose adjustment of allopurinol according to creatinine clearance does not provide adequate control of hyperuricemia in patients with gout // J Rheumatol. 2006; 33: 1646–1650.
- Taylor T., Mecchella J., Larson R., Kerin K., Mackenzie T. Initiation of allopurinol at first medical contact for acute attacks of gout: a randomized clinical trial // Am J Med. 2012; 125: 1126–1134.
- Hill E., Sky K., Sit M., Collamer A., Higgs J. Does starting allopurinol prolong acute treated gout? A randomized clinical trial // J Clin Rheumatol. 2015; 21: 120–125.
- Lin M. S., Day Y. S., Pwu R. F. et al. Risk estimates for drugs suspected of being associated with Stevens-Johnson syndrpme and toxic epidermal necrolysis: a case-control study // Inern Med J. 2005; 35 (3): 188–190.
- Yaylact S., Demir M. V., Temis T. et al. Allopourinol-induced DRESS syndrome // Indian J Pharmacol. 2012; 44 (3): 412–414.
- Елисеев М. С. Современные возможности терапии подагры: «вверх по спирали» или «бег на месте» // Ревматология, травматология, ортопедия. 2017; 2: 20–22.
- Zhao L., Takano Y., Horiuchi Y. Effect of febuxostat, a novel non-purine, selective inhibitor of xantin oxidase (NP-SIXO), on enzymes in purine and perimidine methabolism pathway // Arthr Rheum. 2003; 48 (suppl. 9): 531.
- Richette P., Clerson P., Périssin L., Flipo R., Bardin T. Revisiting comorbidities in gout: a cluster analysis // Ann Rheum Dis. 2015; 74: 142–147.
- Juge P. A., Truchetet M. E., Pillebout E., Ottaviani S., Vigneau C., Loustau C. Efficacy and safety of febuxostat in 73 gouty patients with stage 4/5 chronic kidney disease: A retrospective study of 10 centers // Joint Bone Spine. 2016; 364 p.
- EMA® product information. 2015; Available at: http://www.ema.europa.eu.
- Frampton J. E. Febuxostat: a review of its use in the treatment of hyperuricaemia in patients with gout // Drugs. 2015, Mar; 75 (4): 427–438. DOI: 10. 1007/s40265–015–0360–7.
- Becker M. A., Schumacher H. R., Jr, Wortmann R. L., MacDonald P. A., Eustace D., Palo W. A. Febuxostat compared with allopurinol in patients with hyperuricemia and gout // N Engl J Med. 2005; 353 (23): 2450–2461.
- Becker M. A., Schumacher H. R., Espinosa L. et al. The urate-lowering efficacy and safety of febuxostat in treatment of hyperuricemia of gout: the CONFIRMS treal // Arthritis Res. Ther. 2010; 12 (2): ID R63.
- Schumacher H., Becker M., Wortmann R., Macdonald P., Hunt B., Streit J. et al. Effects of febuxostat versus allopurinol and placebo in reducing serum urate in subjects with hyperuricemia and gout: a 28-week, phase III, randomized, double-blind, parallel-group trial // Arthritis Rheum. 2008; 59: 1540–1548.
- Schumacher H., Becker M., Lloyd E. et al. Febuxostat is the treatment of gout: 5-yr findingsof the FOCUS efficacy and safety study // Rheumatology (Oxford). 2009; 48 (2): 188–194.
- Singh J., Akhras K., Shiozawa A. Comparative effectiveness of urate lowering with febuxostat versus allopurinol in gout: analyses from large U. S. managed care cohort // Arthritis Res Ther. 2015; 17: 120–139.
- Huang X., Du H., Gu J., Zhao D., Jiang L., Li X. et al. An allopurinol-controlled, multicenter, randomized, double-blind, parallel between-group, comparative study of febuxostat in Chinese patients with gout and hyperuricemia // Int J Rheum Dis. 2015; 17: 679–686.
- Tausche A., Reuss-Borst M., Koch U. Urate lowering therapy with febuxostat in daily practice-a multicentre, open-label, prospective observational study // Int J Rheumatol. 2014; 27: 1–6.
- Chou H. Y., Chen C. B., Cheng C. Y., Chen Y. A., Ng C. Y., Kuo K. L. Febuxostat-associated drug reaction with eosinophilia and systemic symptoms (DRESS) // J Clin Pharm Ther. 2015; 40 (6): 689–692.
- Bardin T., Chales G., Pascart T., Flipo R. M., Korng Ea H., Roujeau J. C. Risk of cutaneous adverse events with febuxostat treatment in patients with skin reaction to allopurinol. A retrospective, hospital-based study of 101 patients with consecutive allopurinol and febuxostat treatment // Joint Bone Spine. 2016; 83 (3): 314–317.
- Chohan S. Safety and efficacy of febuxostat treatment in subjects with gout and severe allopurinol adverse reactions // J Rheumatol. 2011; 38: 1957–1959.
- Abeles A. Febuxostat hypersensitivity // J Rheumatol. 2012; 39: 659–671.
- Terkeltaub R. A. Novel evidence-based colchicine dose-reduction algorithm to predict and prevent colchicine toxicity in the presence of cytochrome P450 3 A4/Pglycoprotein inhibitors // Arthritis Rheum. 2011; 63: 2226–2237.
М. И. Шупина1, кандидат медицинских наук
Г. И. Нечаева, доктор медицинских наук, профессор
Е. Н. Логинова, кандидат медицинских наук
ФГБОУ ВО ОмГМУ МЗ РФ, Омск
1 Контактная информация: mshupina@mail.ru
Подагра (в переводе с греческого языка – «нога в капкане») – заболевание, возникающее в результате нарушения обмена мочевой кислоты и характеризующееся периодическими атаками острого артрита, чаще всего в области большого пальца стопы. При этой болезни кристаллы мочевой кислоты (моноурат натрия) начинают накапливаться в различных тканях, прежде всего в области суставов, почках и других органах.
Подагра – болезнь достаточно древняя и известна еще со времен Гиппократа, который одним из первых дал подробную характеристику основных симптомов болезни и связал ее развитие с перееданием. В средние века подагра считалась заболеванием королевских особ и аристократии, склонных к обильным застольям.
Сегодня «болезнь аристократии и королей» широко распространена в разных социальных слоях общества, однако всех больных объединяет одно – склонность к чрезмерному употреблению мясных продуктов. По-видимому, это частично объясняет тот факт, что мужчины болеют подагрой в 10 раз чаще, чем женщины. Однако неправильный образ жизни, «перекосы» в питании (в частности увлечение новомодными «белковыми» диетами) делают и современных женщин уязвимыми перед этим заболеванием.
Что такое подагра?
В настоящее время подагра считается системным заболеванием, поскольку помимо суставов поражает практически весь организм.
Нарушение так называемого пуринового обмена приводит к повышению концентрации мочевой кислоты в крови и моче, образованию уратных кристаллов и их отложению в мягких тканях, в том числе в области суставов верхних и нижних конечностей. Со временем отложения кристаллов мочевой кислоты (ураты) формируют узелковые подкожные образования — тофусы, которые хорошо видны невооруженным глазом и позволяют врачу поставить диагноз даже при обычном внешнем осмотре. Однако задолго до образования тофусов болезнь проявляет себя приступообразным, необычно тяжелым воспалением суставов — подагрическим артритом (чаще всего располагающимся в области большого пальца стопы, хотя возможно поражение других суставов, чаще ног).
При подагре поражаются внутренние органы, в частности почки, которые длительное время работают в условиях повышенной нагрузки, связанной с необходимостью выведения мочевой кислоты из крови. Со временем развивается мочекаменная болезнь, усугубляющая негативное действие мочевой кислоты на почечную ткань. Дополнительным повреждающим фактором является частый и как правило бесконтрольный прием обезболивающих средств по поводу болей в суставах. Постепенно функция почек нарушается – формируется почечная недостаточность, которая и определяет окончательный прогноз болезни
Виды подагры
Подагра может быть первичной и вторичной.
Первичная подагра передается по наследству и связана с недостаточной функцией ферментов, участвующих в регуляции уровня мочевой кислоты.
Вторичная подагра развивается на фоне уже имеющегося заболевания, при котором в силу тех или иных причин отмечается повышенное образование мочевой кислоты, например, при заболеваниях крови или хронических болезнях почек. В таких случаях лечение должно быть направлено на лечение болезни, приведшей к развитию вторичной подагры.
Нормальными считаются следующие показатели уровня мочевой кислоты в крови:
- у мужчин моложе 60 лет — 250-450 мкмоль /л; старше 60 лет — 250-480 мкмоль /л;
- у женщин до 60 лет — 240-340 мкмоль /л; в более старшем возрасте – 210-430 мкмоль /л;
- у детей до 12 лет – 120-330 мкмоль /л.
Превышение этих показателей указывает на нарушение обмена мочевой кислоты и повышенный риск развития симптомов, свойственных подагре. В такой ситуации необходимо пройти обследование для уточнения причины такого нарушения, а также своевременного выявления заболеваний, ведущих к повышению уровня мочевой кислоты. Раннее выявление таких фоновых заболеваний в ряде случаев позволяет своевременно начать лечение и избежать опасных для жизни осложнений. При длительном нарушении обмена мочевой кислоты с повышенным выведением ее с мочой неизбежно развивается мочекаменная болезнь и в конечном итоге почечная недостаточность.
Клиническая картина
Классический острый приступ подагры возникает внезапно, как правило, ночью на фоне хорошего общего здоровья. Развитию приступа обычно предшествуют события, предрасполагающие к резкому повышению уровня мочевой кислоты к крови – фуршеты, дни рождения, застолья с обильным употреблением мясных продуктов. Последние, как известно, нередко используются в качестве закуски после приема алкогольных напитков. Сочетание этих факторов крайне неблагоприятно, поскольку алкоголь ухудшает выведение мочевой кислоты с мочой, что быстро приводит к «скачку» мочевой кислоты в крови и созданию необходимых условий для развития подагрического артрита. Еще одним фактором, предрасполагающим к обострению или возникновению приступа суставной подагры, является обезвоживание организма, что нередко случается при обильном потоотделении после посещения бани или сауны. Спровоцировать начало обострения подагры могут также переохлаждение и травма, в том числе незначительная травма, например, ношение тесной обуви. Приступ подагры достаточно однотипен: возникает чрезвычайно интенсивная боль в 1 плюснефланговом суставе (сустав большого пальца), он резко опухает, становится горячим и красным, а затем сине-багрового цвета. Функция сустава нарушается, больной не может даже пошевелить пальцем.
Приступы подагры обычно продолжаются в течение 3-10 дней, затем боли постепенно исчезают, кожа приобретает нормальный цвет, сустав вновь начинает действовать. Следующий приступ подагры может появиться через несколько месяцев или даже лет. Однако со временем «светлые» периоды становятся все короче и короче.
Если подагрический артрит переходит в хроническую форму, то это приводит к деформации суставов и нарушению их функции.

2
Иммунологический анализ крови
3
Диагностика подагры в МедикСити
Причины появления подагры
Повышенный уровень мочевой кислоты в крови возникает в силу действия следующих факторов:
- погрешности в питании, употребление большого количества красного мяса, птицы, морепродуктов;
- злоупотребление алкоголем;
- отягощенная наследственность;
- сахарный диабет, сердечные заболевания, гипертония, высокий уровень холестерина;
- пол (подагра — болезнь преимущественно мужчин);
- регулярный прием мочегонных препаратов;
- повышенная масса тела и др.
Общие симптомы подагры
- развитие тофусов – подкожных узелков желтоватого цвета вокруг суставов и ушных раковин;
- проявления мочекаменной болезни.
Таким образом, основными признаками подагры могут считаться повторные атаки острого артрита, на поздних стадиях — возникновение тофусов.
Диагностика подагры
Для обследования используются следующие методы:
- пункция сустава и исследование синовиальной жидкости на наличие МУН (кристаллов мононатриевых уратов);
- анализ мочи для определения количества мочевой кислоты;
- анализ крови на уровень мочевой кислоты;
- рентгенография суставов (выявление деформации суставов и подкожных тофусов;
- КТ и МРТ (позволяют определить наличие тофусов).
При дифференциальной диагностике необходимо исключить другие заболевания, такие как псевдоподагра, ревматоидный артрит, артроз, инфекционные заболевания, бурсит большого пальца стопы.
Лечение подагры
Существуют различные средства и методы лечения подагры: немедикаментозное, медикаментозное, хирургическое лечение, физиотерапевтические процедуры, специальная диета при подагре.
Медикаментозное лечение подагры
Для лечения острой формы заболевания могут быть использованы следующие препараты при подагре:
- нестероидные противовоспалительные препараты, такие как диклофенак (один из наиболее популярных препаратов в лечении подагры), ибупрофен, напроксен, нимесилуд, мелоксикам и др.;
- колхицин — очень эффективное средство для лечения подагры, которое следует использовать только в случае острого артрита;
- внутрисуставные инъекции кортикостероидов (при поражении одного сустава);
- средства, снижающие уровень мочевой кислоты в крови: аллопуринол, фебуксостат;
- средства, повышающие выведение мочевой кислоты с мочой (урикозурические препараты): бензобромарон, пробенецид и др.
Физиотерапевтические процедуры
В острой фазе подагры пациентам назначают аппликации димексида.
В хронической фазе используют фонофорез с гидрокортизоном, магнитолазеротерапию, различные виды аппликаций (из парафина, лечебной грязи, озокерита), а также разнообразные бальнеологические ванны (йодо-бромные, радоновые, хлоридно-натриевые, сероводородные). Это улучшает кровоснабжение в суставах, способствует рассасыванию кристаллов мочевой кислоты, снижению воспалительного процесса в суставах.
Хирургическое лечение при подагре
Хирургическое лечение подагры рекомендуется при:
- наличии крупных тофусов;
- появлении незаживающих свищей после вскрытия тофусов;
- изъязвлении тканей.
Диета при подагре
Диета при подагре подразумевает ограничение продуктов с высоким содержанием пуринов (мочевой кислоты), таких как:
- красное мясо (говядина, баранина, свинина);
- птица (курятина, индейка и др.)
- субпродукты (печень, почки);
- морепродукты;
- алкоголь;
- бобовые (горох, фасоль);
Рекомендуется включать в свой рацион фруктовые соки, молочные продукты, овощи (морковь, сельдерей, картофель), фрукты (апельсины, вишня, киви) и хлеб.
В ограниченном количестве можно употреблять кофе, некрепкий чай, сливочное масло, грибы, картофельные клецки, мороженое, рыбу, ветчину, вареные яйца.
Самолечение подагры может привести к опасным последствиям! Обратитесь к профессионалам!
-
Гуляев Сергей Викторович
Врач-ревматолог, терапевт, нефролог
Кандидат медицинских наук
Подагра: от этиологии и патогенеза к диагностике и рациональной фармакотерапии
Статьи
Опубликовано в журнале:
СОВРЕМЕННАЯ РЕВМАТОЛОГИЯ №10 7 Л.Э. Атаханова1, В.В. Цурко2, И.М. Булеева3, И.Н. Бойко2, С.П. Железнов4, Т.Б. Иванова5
1ТАШИУВ, 2ММА им. И.М. Сеченова, 3ГКБ № 7,4НИИ физико-химической медицины МЗ РФ, 5МГМСУ
Упоминание о подагре встречается со времен Гиппократа. Первое клиническое описание острого подагрического артрита принадлежит английскому врачу Сиденхаму, а заслуга клинициста Гарро состоит в том, что он отделил хронический подагрический артрит от ревматоидного и тем самым заложил основу их дифференциального диагноза. Несмотря на многовековую историю изучения подагры, пик интереса к этому заболеванию наблюдается в последние 10 лет.
Слово «подагра» означает «нога в капкане», и действительно, приступ острого подагрического артрита считается одним из самых болезненных. Больные так описывают его: ногу «как будто грызет собака». Это хорошо видно и на древних изображениях людей, по-видимому, страдающих подагрой, — в ногу вцепляется огромный краб или какое-то другое чудовище.
В МКБ-10 X подагра отнесена к подклассу микрокристаллических артритов и включает в себя идиопатический (М10.0), свинцовый (М10.1), лекарственный (М10.2) варианты и подагру, обусловленную нарушением функции почек (М10.3).
Многие исследователи считают, что главной причиной, лежащей в основе развития подагры, является повышение уровня мочевой кислоты в сыворотке крови [1].
Патогенез заболевания. В развитии заболевания выделяют 3 основные фазы:
Собственно бессимптомная гиперурикемия выявляется примерно у 2-5% мужчин в США, а также у 17% населения Франции, у 7% Испании, у 19,3% России [2, 3]. Низкий уровень урикемии у женщин репродуктивного возраста объясняется влиянием эстрогенов на канальцевую экскрецию уратов. Только с началом менопаузы уровень мочевой кислоты в сыворотке крови у женщин приближается к таковому у мужчин соответствующего возраста.
Отложение игольчатых кристаллов уратов натрия происходит главным образом в бессосудистых тканях, в первую очередь в хряще и относительно слабо васкуляризованных сухожилиях и связках, дистальных периферических суставах и местах, подвергающихся наибольшему охлаждению (ушная раковина) и трению (область локтевых суставов и седалищные бугры). Кристаллы в случае продолжительной тяжелой болезни могут откладываться и в крупных суставах, а также в паренхиме внутренних органов, например в почках. Описаны случаи отложения кристаллов в костной ткани позвонков с симптомом сдавления спинного мозга и развитием соответствующей неврологической симптоматики [4]. При кислых значениях pH мочи мочевая кислота легко выпадает в осадок, образуя мелкие пластинчатые кристаллы, способные объединяться в мелкие конкременты и камни. Это может приводить к обструкции мочевыводящих путей. Стойкая гиперурикемия практически в 90% случаев обусловлена пониженной почечной экскрецией уратов, особенно у больных, длительно принимающих мочегонные средства, а также у страдающих почечными заболеваниями, приводящими к снижению скорости клубочковой фильтрации (СКФ).
Повышенный синтез пуринов, как правило, вызывает гиперурикемию; иногда он бывает первичной аномалией, а иногда — следствием ускоренного обновления нуклеопротеинов при таких гематологических заболеваниях, как лимфома, лейкозы или гемолитическая анемия, а также при других болезнях, например при псориазе, связанных с ускоренной пролиферацией и гибелью клеток. В некоторых случаях накопление уратов обусловлено дефицитом фермента гипоксантин-гуанин-фосфорибозилтрансферазы (ГГФТ) или повышенной активностью фермента фосфорибозилпирофосфат-синтетазы. Дефицит ГГФТ приводит к образованию камней в почках, нефропатии и выраженной ранней подагре, а его полное отсутствие — к неврологическим аномалиям (хореоатетоз, спастичность, замедление умственного развития и навязчивое стремление к самоповреждениям) — синдром Леша — Нихе. Заметно влияют на уровень мочевой кислоты пурины пищевого происхождения (пиво, мясо, икра, бобовые, кофе, какао, шоколад, крепкий чай). Этиловый спирт вызывает распад нуклеотидов в печени и повышенное образование молочной кислоты, которая, как и другие органические кислоты, блокирует секрецию уратов в почечных канальцах. С этим же связано усугубление гиперурикемии при всех видах ацидоза. Лекарственные средства, в частности никотиновая кислота, тиазидные и петлевые диуретики, этамбутол, низкие дозы салицилатов, также могут приводить к повышению содержания мочевой кислоты [5].
Главным механизмом острого подагрического артрита служит реакция «сторожевой полисистемы» плазмы и полиморфно-ядерных лейкоцитов, в первую очередь нейтрофилов, на полианионные кристаллы уратов, которые запускают альтернативный и классический пути активации комплемента, фактор Хагемана, а через них — всю контактную систему полипептидных медиаторов, включая кинины, свертывание, фибринолиз. Взаимодействие кристаллов уратов, особенно покрытых IgG и IgМ, с полиморфно-ядерными лейкоцитами и другими фагоцитами приводит к высвобождению и активации ряда воспалительных медиаторов, в первую очередь нейтрофильного лейкотриена В4. Нейтрофилы, фагоцитируя острые игольчатые кристаллы, погибают, что способствует высвобождению активных кислородных радикалов, а также особого рода кристаллозависимого хемотаксического фактора и огромного количества лизосомальных гидролаз. Макрофаги, фагоцитируя ураты и клеточные обломки, выделяют цитокины ИЛ-1, 6, 8, кахексин, а также простагландины. Это усиливает воспаление и приводит к выделению синовиоцитами коллагеназ, поддерживающих альтерацию. Самоограничение и обратное развитие симптомов артрита зависят от выработки противовоспалительных механизмов главным образом макрофагального и синовиоцитарного происхождения [6].
R.C. Landis и соавт. [7] предположили, что защиту суставов при гиперурикемии обеспечивают резидентные синовиальные макрофаги путем невоспалительного удаления нерастворимых кристаллов. Однако любые триггерные факторы подагрического приступа: травма, в том числе и длительная микротравма, инфекция или хирургическое вмешательство — способны сдвинуть чашу весов в пользу воспаления, привлекая «свежую волну» моноцитов и нейтрофилов из кровотока в пораженный сустав. Спонтанное прекращение острого приступа может быть связано с окончательной дифференцировкой моноцитов в макрофаги.
Клиническая картина.
В развитии подагры прослеживаются 4 стадии:
По характеру поражения суставов во временном аспекте выделяют:
Клиническим проявлением дебюта заболевания является острый артрит периферических суставов, вызванный отложением в суставах и окружающих тканях, во внутренних органах кристаллов моноурата натрия вследствие перенасыщения жидкостей организма мочевой кислотой.
Классический типичный острый приступ подагры в 50-80% случаев возникает внезапно среди полного здоровья через несколько лет бессимптомной гиперурикемии. Он начинается, как правило, ночью или рано утром и проявляется быстрым резчайшим нарастанием боли в одном пораженном суставе. Для первого приступа подагры у мужчин характерен моноартрит и преимущественное поражение суставов стопы: большого пальца, плюснефаланговых, предплюсневых и др. Менее типично воспаление локтевых, лучезапястных суставов и очень редко поражаются плечевые, грудино-ключичные и тазобедренные суставы. В пожилом возрасте приступы подагры протекают менее остро, нередко наблюдается начало заболевания по типу олиго- или даже полиартрита. У женщин часто отмечаются олиго- или полиартриты, примерно у 1/3 больных с вовлечением суставов кисти. Сустав быстро припухает, кожа над ним краснеет, напряжена, затем становится синевато-багровой, горячей на ощупь, температура тела повышается до 38-39С. Функция пораженных суставов резко нарушается. Как правило, из-за сильной боли пациенты обездвижены. Во время приступа практически всегда отмечаются увеличение СОЭ, повышение уровня сиаловых кислот в крови, фибрина, серомукоида, резко возрастает уровень С-реактивного белка.
Первый приступ подагры обычно длится от 3 до 10 дней, затем боль исчезает, кожа становится обычного цвета, отек проходит и функция сустава, как правило, полностью восстанавливается.
Обострение подагры может быть спровоцировано обильным приемом жирной пищи и алкоголя, переохлаждением, травмой, хирургическими вмешательствами и обострением сопутствующих заболеваний, например локальным воспалением при остеоартрозе. Острый приступ подагры также может возникнуть при воздействии высокой температуры и связанной с этим гиповолемии, например, после посещения бани, сауны, поездки в жаркие страны. У части больных, особенно пожилого возраста, возможны продромальные явления: слабость, повышенная утомляемость, субфебрилитет, головная и суставная или костная боли. Повторные приступы возникают иногда через месяцы, нередко даже через несколько лет. Период без клинических проявлений воспаления суставов называют межприступным. Однако светлые промежутки между острым приступом артрита и следующим приступом укорачиваются, артрит приобретает затяжной характер. Острый приступ артрита может дебютировать и протекать по типу псевдофлегмонозной формы, что проявляется моноартритом любой локализации с резко выраженным воспалением в области сустава и в окружающих тканях; отмечаются выраженные покраснение и отек, высокая температура тела, озноб, лейкоцитоз, увеличение СОЭ, т. е. клиника этой формы сходна с клинической картиной флегмоны или острого инфекционного артрита.
Характерной особенностью подагрического артрита является спонтанное, без лечения полное обратное развитие симптомов за несколько часов или чаще за несколько дней. Подагра практически всегда прогрессирует. Если вовремя не поставлен диагноз и не проводится соответствующее лечение, атаки учащаются и болезнь приобретает затяжное течение.
При межприступной, или «интервальной», подагре наблюдаются периоды относительно удовлетворительного состояния, иногда с незначительными артралгиями. Но каждое обострение заболевания становится все более тяжелым, в процесс вовлекаются все новые суставы, отмечается выраженная картина периартикулярного поражения. На этой стадии, как правило, всегда появляется сопутствующая патология: артериальная гипертензия, атеросклеротическое поражение сосудов, инсулинорезистентность, увеличенный уровень триглицеридов, первые симптомы почечных осложнений гиперурикемии [8, 9].
Хронический подагрический полиартрит развивается у больных после нескольких атак острого подагрического артрита, характеризующегося затяжными приступами и вовлечением в воспаление других суставов, так называемых суставов второй линии поражения, и развитием тофусов. Прогрессируют тугоподвижность и деформация суставов, вплоть до контрактур, развивается атрофия мышц, но анкилозы встречаются крайне редко. Больные с трудом передвигаются, нередко полностью утрачивают трудоспособность. На фоне хронического подагрического артрита продолжаются обострения суставного синдрома. Наиболее тяжелой его разновидностью является подагрический статус, характеризующийся непрерывным обострением артрита, обусловленного массивной инфильтрацией уратами окружающих тканей с формированием хронической воспалительной реакции. Как правило, при длительности заболевания, 5 лет и более и при высоком неконтролируемом уровне гиперурикемии возникают тофусы — подагрические узлы, содержащие ураты, окруженные соединительной тканью. Они чаще всего локализуются на ушных раковинах, локтях, в бурсах локтевых суставов, на стопах, пальцах кистей, разгибательной поверхности предплечий, бедер, голеней, на лбу, в области хрящевой перегородки носа. Часто наблюдаются истончение кожи над тофусом и образование свищей, из которых спонтанно выделяется содержимое в виде пастообразной белой массы.
Классификационные диагностические критерии подагры
S. Wallace и соавт., одобренные ВОЗ (2000 г.)
А. Наличие характерных мононатриевых уратных кристаллов в суставной жидкости.
B. Наличие тофусов, содержащих кристаллические ураты, подтвержденные химически или поляризационной микроскопией.
C. Наличие 6 из 12 клинических, лабораторных и рентгенологических признаков:
1) максимальное воспаление сустава уже в первые сутки;
2) более чем 1 острая атака артрита в анамнезе;
3) моноартикулярный характер артрита;
4) гиперемия кожи над пораженным суставом;
5) воспаление и боль, локализованые в I плюснефаланговом суставе;
6) асимметричное воспаление плюснефалангового сустава;
7) одностороннее поражение тарзальных суставов;

9) гиперурикемия;
10) асимметричное воспаление суставов;
11) обнаружение на рентгенограммах субкортикальных кист без эрозий;
12) отсутствие микроорганизмов в культуре суставной жидкости.
Самым надежным методом диагностики считается обнаружение кристаллов уратов с помощью поляризационной микроскопии. Кристаллы игольчатой формы располагаются вне- или внутриклеточно и обладают отрицательным двойным лучепреломлением (окрашиваются в желтый цвет при расположении параллельно оси красного луча). Внеклеточная локализация кристаллов, как правило, наблюдается в синовиальной жидкости, взятой в межприступный период. При исследовании синовиальной жидкости обнаруживаются признаки воспаления (цитоз 20-100 тыс. лейкоцитов в 1 мм3 с преобладанием нейтрофилов). Концентрация мочевой кислоты в сыворотке крови в период острого артрита снижается и может быть в пределах нормы. Поскольку при бактериальном артрите в синовиальной жидкости также могут обнаруживаться кристаллы уратов, при малейшем подозрении на септический артрит необходимо провести посев синовиальной жидкости на флору. Комбинация из 6 признаков и более подтверждает диагноз. Наиболее достоверны такие признаки, как острый или (реже) подострый артрит, обнаружение кристаллических уратов в синовиальной жидкости и наличие доказанных тофусов. В последнее время верхние границы нормы содержания мочевой кислоты пересматриваются, так как приведенные выше значения были определены ручным методом, а сегодня используются автоматизированные методы. Таким образом, нормальные значения после перерасчета повышаются на 0,4-1,0 мг/дл или 24-60 мкмоль/л и составляют 0,15-0,48 мкмоль/л для мужчин и 0,132-0,42 мкмоль/л для женщин [10]. При клиническом анализе крови определяются повышение СОЭ, умеренный нейтрофильный лейкоцитоз, не исключен реактивный тромбоцитоз.
Клинические рекомендации по противовоспалительному лечению острого и хронического подагрического артрита
Приступая к лечению больного подагрой, нужно представлять, что купирование острого приступа и лечение хронической подагры требуют разных подходов и разных по механизму действия лекарственных препаратов [3, 5, 9].
Общие рекомендации, которые врач дает больному, сводятся к детальной информации о характере клинических проявлений острого подагрического артрита, об опасности неконтролируемой гиперурикемии и ее последствиях, о необходимости устранения факторов риска при первых проявлениях заболевания, которые чаще всего приводят к рецидивам острого артрита и его хронизации. Обязательны отказ от приема алкоголя и снижение массы тела. Диета должна быть малокалорийная и низкоуглеводная с включением полиненасыщенных жирных кислот, что приводит к уменьшению уровня мочевой кислоты. Больного информируют о побочных явлениях лекарственной терапии.
Быстрое и безопасное купирование острого подагрического артрита в дебюте заболевания и предупреждение его рецидивов — главная задача лечения. Большое значение придается также предотвращению хронизации болезни, сопровождающейся образованием тофусов, поражением почек и деструкцией суставов, и профилактике и лечению сопутствующих заболеваний и осложнений лекарственной терапии [11, 12].
Нестероидные противовоспалительные препараты (НПВП) для купирования острого приступа подагрического артрита чаще всего используют в полной терапевтической дозе. Они удобны в применении, достаточно безопасны и эффективны, но у больных с острым подагрическим артритом действуют в среднем только через 12-24 ч. НПВП назначают в высоких дозах, при получении эффекта через несколько суток дозу снижают, вплоть до полной отмены препарата. Можно использовать, например, индометацин: в первые 2 сут по 50 мг внутрь каждые 6 ч, затем в течение 3 сут — по 50 мг каждые 8 ч, а затем еще 2-3 сут по 25 мг каждые 8 ч. Эффективен диклофенак натрия, селективные НПВП (Нимесулид) в дозах 200-400 мг/сут. Препараты длительного действия не используют.
Нимесулид имеет более чем 50-летнюю историю применения. С конца прошлого века в ряде стран он занимает ведущие позиции среди всех НПВП. По химическому составу нимесулид представляет собой 4-нитро-2-феноксиметан-сульфонаниламид, характеризуется нейтральным рН. Препарат назначают в таблетированной и гранулированной форме в дозе 100-200 мг в зависимости от выраженности суставного синдрома. Независимо от приема пищи, он быстро подвергается абсорбции и на 99% связывается с альбумином. Нимесулид также производится в виде свечей. Уже через 30 мин после приема первой дозы препарата в сыворотке крови и синовиальной жидкости достигается 25-80% его максимальной концентрации, что обусловливает аналгезию [13, 14]. Препарат относится к преимущественно селективным ЦОГ-2, что объясняет его низкую гастротоксичность. Выводится в неизмененном виде с мочой и калом. В связи с этим снижение клиренса креатинина до 30-80 мл/мин не требует коррекции дозы. Следует отметить следующие два важных свойства Нимесулида: способность ингибировать ФНО-α, синтез ИЛ-6 и урокиназы, а также воздействовать на глюкокортикоидные рецепторы. В синовиальной жидкости у больных артритом нимесулид ингибирует коллагеназу, разрушающую хрящевую ткань, и тем самым защищает ее [15] .
На базе ГКБ № 7 мы изучали эффективность и безопасность Нимесулида (Найз), представляющего собой НПВП класса сульфонанилидов. Являясь селективным конкурентным ингибитором ЦОГ-2, препарат оказывает противовоспалительное, аналгезирующее и жаропонижающее действие. Не менее важно и то, что он обратимо ингибирует образование простагландина Е2 как в очаге воспаления, так и в восходящих путях ноцицептивной системы, включая пути проведения болевых импульсов спинного мозга. Уменьшение концентрации простагландина Е2 ведет к снижению степени активации простаноидных рецепторов ЕР-типа, что выражается в усилении анальгетического и противовоспалительного эффекта. Найз активно ингибирует высвобождение ФНО-α, обусловливающего каскадное образование цитокинов, в то же время он ингибирует синтез металлопротеиназ, в большей степени эластазы и коллагеназы, и тем самым предотвращает разрушение протеогликанов и коллагена хрящевой ткани.
Мы применяли Найз по 100 мг 2 раза в день в течение 14 дней у 28 больных (средний возраст — 58,2 года) с подагрой (по S. Wallace) и хроническим подагрическим артритом (средняя длительность заболевания — 7,9 года) с поражением от 3 до 7 суставов. 17 больных продолжали применять аллопуринол ( 7 — регулярно, 10 — с перерывами). Основными показаниями для отбора в исследование были длительный артрит нескольких суставов и неэффективность ранее проводившейся терапии НПВП. 10-дневный курс лечения Найзом оказался эффективным — уже к 3-м суткам более чем у половины больных отмечали положительную динамику в отношении боли и воспаления. Боль в покое, оцененная по ВАШ (в см), к 10-му дню снизилась с 6,58 до 4,2 см, тогда как боль при движении — с 7,38 до 2,83 см. Наиболее значимым для оценки суставного синдрома было то, что на фоне приема Найза снизился суставной индекс с 5,1 до 1,2 баллов. К 7-му дню терапии болевой синдром значительно уменьшился более чем у 70% больных.
Колхицин лучше всего действует при раннем назначении, т.е. в первые 12-24 ч; эффект развивается через 6-12 ч. Рекомендации по лечению колхицином сводятся к следующему:
Кортикостероиды применяют при противопоказаниях к колхицину и НПВП. Быстрый эффект дает внутрисуставное введение. Применяют метилпреднизолон и триамцинолон. В крупные суставы (коленный, голеностопный, плечевой) вводят 20-40 мг, в средние (лучезапястный, локтевой) — 10-20 мг, в мелкие суставы кистей и стоп — 5-15 мг препарата. Чтобы ускорить обезболивание, в одном шприце с кортикостероидами вводят 1 мл 1% лидокаина. Кортикостероиды внутрь (преднизолон 40-60 мг/сут) назначают до прекращения приступа, а затем быстро отменяют. Относительная противовоспалительная активность кортикостероидов: кортизон 0,8 г; гидрокортизон 1 г, преднизолон 4 мг, метилпреднизолон 5 мг, дексаметазон 25 мг. Однако следует помнить, что назначение кортикостероидов неизбежно ведет к переходу заболевания в хроническую форму, поэтому показания для их назначения весьма относительны.
Частые (до 4 и более в год) рецидивы приступов острого подагрического артрита, хронические формы подагры и нефролитиаз с высоким уровнем мочевой кислоты — абсолютные показания к проведению терапии, снижающей уровень мочевой кислоты, в частности к назначению ингибиторов гипоксантиноксидазы.
Гипоурикемические средства показаны при частых приступах артрита, поражении почек, значительном повышении концентрации мочевой кислоты в крови и моче. За 5-7 дней до начала гипоурикемической терапии назначают колхицин (0,5 мг внутрь 2 раза в сутки) для профилактики обострения артрита. Если при нормальном уровне мочевой кислоты приступы не возникают в течение 6-8 нед, колхицин отменяют.
Аллопуринол ингибирует ксантиноксидазу, снижая выработку мочевой кислоты. Нельзя начинать терапию аллопуринолом во время острой атаки артрита, необходимо сначала купировать суставной синдром. Если же приступ артрита развился на фоне приема аллопуринола, что возможно в первые полгода лечения или при неадекватном подборе дозы и сохраняющейся гиперурикемии, то отменять его не следует. Для профилактики острых приступов и тяжелых побочных реакций рекомендуется титрование дозы: начинают терапию с дозы 50 мг, далее под контролем уровня мочевой кислоты каждые 2 нед увеличивают дозу на 50 мг до достижения нормоурикемии. Отражением правильного подбора дозы является скорость снижения уровня гиперурикемии — не более 10% от исходных цифр в течение 1-го месяца: «чем медленнее, тем лучше». Для профилактики острого приступа артрита в начале терапии аллопуринолом возможно применение небольших доз НПВП в виде коротких курсов. Поддерживающая доза аллопуринола может составлять не более 100 мг/сут, максимум 200 мг/сут. Для больных с хронической почечной недостаточностью (ХПН) рекомендуется поддерживающая доза 50 мг/сут. Дозу уменьшают и при нарушении функции печени. Необходимо помнить, что при отмене аллопуринола уровень мочевой кислоты нарастает в течение 3-4 дней.
Побочное действие чаще всего (до 5% случаев) характеризовалось аллергическими реакциями — от легкой сыпи до синдрома Стивенса-Джонсона с лихорадкой, эозинофилией, поражением печени и почек. Риск развития побочных эффектов выше при ХПН и приеме диуретиков. В тяжелых случаях применяют кортикостероиды. Аллопуринол усиливает действие непрямых антикоагулянтов, меркаптопурина и азатиоприна, при одновременном применении их дозы снижают на 60-75%.
Урикозурические средства усиливают выведение мочевой кислоты почками. Перед началом лечения определяют СКФ и экскрецию мочевой кислоты. При СКФ <50 мл/мин урикозурические средства неэффективны. При экскреции мочевой кислоты свыше 800 мг/сут они противопоказаны из-за риска образования камней. Для профилактики камнеобразования рекомендуют обильное питье и ощелачивание мочи. При обострении артрита дозу не меняют.
Пробенецид . Начальная доза — 250 мг внутрь 2 раза в сутки, затем дозу повышают на 500 мг/сут каждую неделю, пока не нормализуется уровень мочевой кислоты в крови или пока ее суточная экскреция не превысит 800 мг/сут. Максимальная доза — 3000 мг/сут. В большинстве случаев достаточно 1000-1500 мг/сут в 2-3 приема. Салицилаты и пробенецид ослабляют действие друг друга, поэтому одновременно их не назначают. Пробенецид уменьшает выведение пенициллина, индометацина и производных сульфонилмочевины. Побочное действие минимально.
Сульфинпиразон. Действует аналогично пробенециду, кроме того, он обладает антиагрегантными свойствами. Начальная доза — 50 мг внутрь 2-3 раза в сутки, в дальнейшем ее повышают на 100 мг/сут еженедельно до нормализации уровня мочевой кислоты в крови. Максимальная доза — 800 мг/сут. В большинстве случаев достаточно 300-400 мг/сут в 3-4 приема. Пробенецид и сульфинпиразон противопоказаны при мочекаменной болезни, почечной недостаточности, гастрите, язве желудка, гепатите, лейкопении. В случаях непереносимости антиподагрических препаратов и угрозы развития подагрической нефропатии назначают экстракорпоральный плазмообен, гемосорбцию.
Дополнительный прием жидкости (не менее 2-2,5 л в день) полезен всем больным подагрой, особенно при склонности к камнеобразованию в почках. Для уменьшения камнеобразования показаны диакарб по 250 мг/сут, который увеличивает pH мочи, и особенно цитрат натрия по 6-8 мг/сут дробно, ощелачивающий мочу и способствующий растворению уратных и оксалатных камней. При подагре необходимо дополнительное введение витаминов группы С и В [17].
В межприступный период назначают диатермию, грязевые и парафиновые аппликации. Санаторно-курортное лечение можно проводить на курортах с сероводородными ваннами (Горячий Ключ, Пятигорск, Минеральные Воды, Сочи — Мацеста, Хоста), с радоновыми источниками (Пятигорск, Хмельник). Грязевые аппликации рекомендуют проводить в Анапе, Пятигорске, Саках, Светлогорске, Старой Руссе. Целесообразно использовать минеральные источники в Ессентуках, Горячем Ключе, Железноводске, Нальчике, Старой Руссе, Трускавце, Феодосии на протяжении 3-7 лет.
Прогноз при подагре в большинстве случаев благоприятен, особенно при своевременном распознавании и рациональной терапии. Наиболее прогностически неблагоприятными факторами считаются: раннее развитие заболевания (до 30 лет), стойкая гиперурикемия, превышающая 0,6 ммоль/л, стойкая гиперурикозурия, превышающая 1100 мг/сут, наличие мочекаменной болезни в сочетании с инфекцией мочевыводящих путей, прогрессирующая нефропатия, особенно в сочетании с сахарным диабетом и артериальной гипертензией.
Таким образом, подагра характеризуется непростыми этиопатогенетическими механизмами развития и течения. Заболевание возникает при отложении кристаллов моноурата натрия на фоне гиперурикемии, в последующем развивается острый суставной синдром по типу рецидивирующего с переходом в большинстве случаев в хронический. НПВП в лечении как острого, так и хронического подагрического артрита являются препаратами первой линии. Наши исследования показали, что Найз является эффективным и безопасным препаратом в лечении суставного синдрома при хроническом подагрическом артрите.
ЛИТЕРАТУРА
1. Bird L. Gouty inflammation crystal clear. Nature reviews immunology 2006; 9(6): 627-8.
2. Кабалава Ж.Д., Толкачева В.В., Караулова Ю.Л. Мочевая кислота — маркер и/или новый фактор риска развития сердечно-сосудистых осложнений? РМЖ 2002; 10:431-6.
3. Терапевтический справочник Вашингтонского университета. Под ред. Ч. Кэри, Х. Ли, К. Велтье. М.: Практика 2000; 608-3.
4. St. George E. et al. Spinal cord compression: an unusual neurological complication of gout. Rheumatology (Oxford) 2001; 6:711-2.
5. Дидковский Н.А. и др. Подагра: современный взгляд на этиопатогенез и новые перспективы в лечении. Клин геронтол 2005; 4: 26-9.
6. Зайчик А.Ш., Чурилов Л.П. Основы патохимии. СПб.: ЭЛБИ-СПб, 2001; 120-6.
7. Landis R.C., Yagnik D.R. et al. Safe disposal of inflammatory monosodium urate monohydrate crystals by differentiated macrophages. Arthritis and Rheum 2002; 11: 3026-33.
8. Насонова В.А., Барскова В.Г. Ранние диагностика и лечение подагры — научно обоснованное требование улучшения трудового и жизненного прогноза больных. Научно-практическая ревматол. 2004; 1: 5-7.
9. Насонова В.А., Барскова В.Г. Подагра. В руководстве для врачей: Рациональная фармакотерапия ревматических заболеваний. Под ред. В.А. Насоновой и Е.Л. Насонова. М.: Литтерра, 2007; 188-200.
10. Барскова В.Г., Якунина И.А., Насонова В.А.. Применение нимесила при подагрическом артрите. Тер арх. 2003; 5:60-4.
11. Бунчук Н.В. Фармакотерапия подагры. РМЖ 2000; 9:392-5.
12. Железнов С.П. и др. Подагра: современное представление об этиопатогенезе, диагностические критерии, варианты начала заболевания и лечение (лекция). В сб.: Болевой синдром в гериатрической практике (клиника, диагностика, лечение). Под ред. А.Л. Арьева. СПб. 2004; 49-59.
13. Барскова В.Г., Елисеев М.С., Насонова В.А. Нимесулид: механизмы действия и применение при подагре. Справоч. поликлинического врача 2006; 8: 11-5.
14. Bianchi M. et al. Plasma and synovial fluid concentration of nimesulide and its main metabolite after a single or repeated oral administration in patients with knee osteoarthritis. J Internat Melical Res 2006; 34(4): 348-54.
15. Rainsford K.D. Nimesulide — a multifactorial approach to inflammation and pain: scientific and clinical consensus. Curr Med Res. Opin 2006; 22(6): 1161-70.
16. Барскова В.Г., Якунина И.А. Противовоспалительная терапия острого и хронического подагрического артрита. Consilium Medicum 2005; 2(7):103-6.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)