Министерство
общего и профессионального образования Ростовской области
Государственное
бюджетное профессиональное образовательное учреждение Ростовской области
«ГУКОВСКИЙ
СТРОИТЕЛЬНЫЙ ТЕХНИКУМ»
МЕТОДИЧЕСКОЕ ПОСОБИЕ
по выполнению
экспериментальных работ и занимательных опытов
по учебной дисциплине
«Химия»
для студентов 1 курса
Гуково
2018
Составитель Кранцевич
Е.Ф.
Методическое
пособие по выполнению эксперименльных работ и занимательных опытов учебной
дисциплине «Химия» для студентов 1 курса
Методическое
пособие составлено в соответствии с содержанием программы по
общеобразовательной дисциплине «химия» для специальностей среднего
профессионального образования, реализуемых в ГБПОУ РО «ГСТ» с учетом
требований Федерального государственного образовательного стандарта среднего общего образования в
пределах ППССЗ.
В методическом
пособии предложен ряд экспериментов и опытов по темам дисциплины, в том
числе профессиональной направленности, а также занимательные опыты, выполнение
которых расширяет предметный и общий кругозор, способствует формированию
общих компетенций обучающихся. В перечень опытов внесены те, которые возможны
к выполнению в домашних условиях Пособие содержит инструкцию по проведению
экспериментально-опытных работ. Для каждой работы даны краткие теоретические
основы, что поможет студентам выполнить эти работы самостоятельно. Приведены
правила техники безопасности и оказания первой медицинской помощи при ожогах и
отравлениях химическими веществами.
Предложенный список
литературы, перечень Интернет-ресурсов по соответствующим темам делают
данное пособие потенциально продуктивным.
Данное пособие
может быть использовано обучающимися для самостоятельной работы, в кружковой
работе по дисциплине, а также при подготовке индивидуального учебного проекта
по дисциплине «химия».
Содержание
1.Инструкция
пользования
пособием по организации экспериментально-опытных работ
обучающихся……………………………………………….4
2. Рекомендации
по составлению письменного отчета о выполненной экспериментальной работе…………………………………………………..5
3. Общие правила
техники безопасности……………….………………………5
4. Оказание
первой медицинской помощи…………………………………..6
5. Экспериментальные
работы и опыты:…………………………………….7
Работа
№ 1 Получение
мыла в домашних условиях…………………….7
Работа № 2. Характеристика воды по химическим
показателям…….…8
Работа № 3. Методы очистки воды. Вымораживание……………….…11
Работа № 4. Определение органолептических показателей
воды….….13
Работа № 5. Природные индикаторы…………………………………….15
Работа
№ 6. Изучение свойств крахмала. Исследование крахмала
в различных продуктах питания…………………………….17
Работа №7. Изучение
свойств цемента…………………………………18
Работа №8. Химия чая……………………………………………………20
Работа № 9. Адсорбционная способность активированного угля……22
Работа №10. Выращивание кристаллов……………………………….…24
Работа №11. Опыт «Силикатный сад» ………………………………….25
Работа №12 Коррозия
металлов……………………………….…….….26
Работа № 13. Изучение гипса……………………………..……….……..28
Работа №14. Исследование
химического состава мороженного….…..29
Работа №15. Определения
йода……………………………………….…31
6. Литература.
Интернет-ресурсы………………………………………….…..33
1.
Инструкция пользования пособием
по
организации экспериментально-опытных работ обучающихся
Методическое
пособие по выполнению
экспериментально-исследовательских работ по
дисциплине «Химия» созданы для успешной работы студентов по дисциплине. Данное
пособие позволит студентам ознакомиться с азами занимательного химического
эксперимента, техникой выполнения опытов, способствует
формированию интереса к химии как учебной дисциплине, привлечению к различным
видам внеаудиторной работы, вовлечению студентов в научно-исследовательскую
работу.
Содержание работ, в
основном, соответствует темам дисциплины, ряд опытов имеет профессиональную
направленность, несколько опытов имеют занимательный характер.
Данное
пособие можно использовать в кружковой работе, а также позволит студенту
самостоятельно провести химические опыты в домашних условиях, соблюдая правила
техники безопасности, практическим путем выявить свойства веществ,
соотнести результаты эксперимента и теоретической основы.
Методическое пособие имеет перечень литературы в конце пособия.
Для каждого эксперимента сформулирована цель, перечень оборудования и
реактивов. Для успешного выполнения химических опытов студенту необходимо
изучить теоретические основы по данной теме, информационные источники указаны в
квадратных скобках. Рекомендуется пользоваться основным учебником по
дисциплине: Габриелян
О.С., Остроумов И.Г. Химия: учебник для студентов профессиональных образовательных
организаций, осваивающих профессии и специальности СПО. – М., 2017.
Перед
выполнением экспериментов рекомендуется познакомиться с техническими приемами
проведения опытов по видео, указанными в перечне интернет-ресурсов.
Результаты наблюдений следует систематически записывать. Успешная
оценка письменного отчета о выполнении не менее 5 экспериментов дает
возможность повысить итоговую оценку по дисциплине.
Для удобства пользования в пособии применяется система условных
знаков:
изучи
теоретические основы
соблюдай правила техники безопасности
опыт выполняется в присутствии преподавателя
выводы, результаты
2.Рекомендации
по составлению письменного отчета о выполненной экспериментальной работе
Приступая
к выполнению работы, студент должен:
— внимательно прочитать цель работы,
— ознакомиться
с краткими теоретическими основами опыта,
— четко выполнять опыт в
соответствии с методикой проведения,
— анализировать
полученные результаты по приведенной методике,
— составить письменный
отчет по рекомендуемойтабличной форме.
Таблица 2.1. Результаты наблюдений
|
Ход |
Наблюдение |
Уравнение реакции. Вывод |
В
графе «Ход опыта»
записать кратко последовательность действий, можно выполнить рисунок, схему.
Обязательно указать условия осуществления химических реакций.
В графе «Наблюдения» рисунок или схема
пояснить следующими обозначениями:
— образование
осадка: ↓
Указать цвет
осадка и его характер (мучнистый, творожистый, студенистый);
— выделение
газообразного вещества: ↑
Указать цвет
газа, запах, плотность.
В
графе «Уравнения реакций» записать только молекулярные и сокращенные ионные
уравнения реакций.
Особого внимания требует заполнение графы «Вывод». Вывод должен
соответствовать условию задачи, быть полным и обоснованным.
При описании
опыта применять собственные четкие формулировки, пользоваться структурными
формулами. Записи должны быть лаконичными. Особое внимание следует обратить на
запись наблюдений, отмечать изменение окраски, выпадение и растворение осадка,
появление характерного запаха и т.д., а также на краткость выводов. Вывод
формулируется, исходя из цели работы, и содержит в себе результат анализа.
3. Общие правила
техники безопасности
1.Запрещается пробовать на вкус химические вещества.
2.Щелочи, кислоты и другие ядовитые вещества
необходимо набирать в пипетку только при помощи резиновой груши.
3.При взбалтывании растворов в колбах или пробирках
необходимо закрывать их пробкой.
4.При нагревании жидкостей пробирку следует держать
отверстием в сторону от себя и соседей по работе.
5.Во избежание ожогов от брызг и выбросов не
наклоняться над сосудом, в котором кипит или налита какая-либо жидкость.
6.При переносе сосудов с горячими жидкостями держать
их обеими руками: одной поддерживать дно, другой – верхнюю часть.
7.При работе с горячими и легковоспламеняющимися веществами
(эфиры, спирты, бензин) нельзя нагревать их на открытом огне или сетке.
8.При определении запаха вещества не следует делать
глубокого вздоха, а лишь движением руки направлять к себе воздух.
9.Концентрированную серную кислоту следует приливать в
воду тонкой струей при непрерывном помешивании.
10.Химические стаканы, колбы из обычного стекла нельзя
нагревать на голом огне без асбестовой сети. Категорически запрещается
использовать посуду, имеющую трещины или отбитые края.
11. Использованную химическую посуду и приборы,
содержащие кислоты, щелочи и другие едкие вещества, нужно освобождать от
остатков и тщательно мыть. Прежде чем слить в раковину, их нужно
нейтрализовать.
12. Нельзя оставлять без присмотра работающие
установки, включенные электронагревательные приборы, спиртовки.
13. При обнаружении дефектов в приборах немедленно
сообщите преподавателю, студентам запрещается устранять неисправности.
4.
Оказание
первой медицинской помощи
1.При термических ожогах осторожно обнажить обожженный
участок и закрыть сухой асептической повязкой. Обожженный участок нельзя
как-либо очищать и мочить водой, этиловым спиртом, перекисью или смазывать
мазью.
2.При химических ожогах промыть обожженное место, не
обращая внимания на боль, большим количеством проточной воды (10 – 15 мин), в
случае кислых реагентов – раствором бикарбоната натрия (2%-ным), а в случае
щелочных – разбавленным раствором борной или уксусной кислот.
3.При порезах стеклом:
а) промыть рану можно только в случае попадания в
нее едких или ядовитых веществ, в остальных случаях, даже если в рану попал
песок, ржавчина, промыть ее водой нельзя;
б) нельзя смазывать рану мазями; перед наложением
повязки смазать настойкой йода участок вокруг раны;
в) удалять из раны мелкие осколки стекла может
только врач.
4. При отравлении химическими веществами немедленно
вызвать врача и одновременно приступить к оказанию первой помощи – если яд
попал внутрь – вызвать рвоту, дать противоядие.
5. Экспериментальные
работы и опыты
Работа
№ 1. Получение мыла в домашних условиях
Тема: «Кислородосодержащие органические
соединения»
Цель эксперимента:
Изучить производство мыла в домашних
условиях, изучить химизм получения мыла, уметь применять химические знания на
практике, сделать свое натуральное мыло.
Оборудование и реактивы – мыла без
цвета и с нейтральным запахом (например «Детское»), растительное масло
без запаха, глицерин, эфирные масла, подготовленный отвар лекарственных трав
(чистотела, ромашки, календулы, крапивы, чабреца и т.п.), или можно взять отвар
лепестков роз, отвар апельсиновых или лимонных корок ; посуда, терка, форма для
мыла (если нет специальной, подойдет пластиковый небольшой контейнер
смазанный минеральным маслом).
Техника безопасности:
во избежание ожогов от брызг и выбросов не наклоняться над сосудом, в
котором кипит или налита какая-либо жидкость, при переносе сосудов с горячими
жидкостями держать их обеими руками: одной поддерживать дно, другой – верхнюю
часть.
Теоретическая
часть [3. Стр.281]:
Большинством рецептов для самостоятельного
изготовления мыла сможет воспользоваться даже новичок в данной сфере.
Современные идеи для мыловарения помогают всем желающим создавать пахучие и
безвредные средства по уходу за кожей. Изделия потом можно применять в целях
личной гигиены или, красиво оформив, подарить близким людям просто так или по
случаю праздника.

Мишель Эжен Шеврёль(1786 – 1889) установил состав мыла. В результате анализа
оказалось, что мыло – это натриевая соль высшей жирной карбоновой кислоты.
Причем, жидкое и твердое мыло различаются только катионами: одним из вариантов
твердого мыла является С17Н35СООNa, жидкого – С17Н35СООК.
Получение мыла всегда было
основано на реакции омыления – гидролиза сложных эфиров высших карбоновых
кислот и глицерина (т.е. жиров) со щёлочами, в результате которого образуется
трехатомный спирт глицерин и соли высших карбоновых кислот (мыло). Уравнение
реакции выглядит следующим образом:
Методика проведения
[13]:
1. Натираем
мыло на терке.
2.
Помещаем
в посуду, и постоянно помешивая ,медленно на маленько огне растапливаем на
водяной бане.
3.
Добавляем
полстакана горячего отвара трав и когда смесь полностью растопиться снимаем с
огня.
4.
В
горячую смесь добавляем 3 чайных ложки масла и одну чайную ложку глицерина и
тщательно перемешиваем.
5.
По
желанию добавляем красители или специальные для мыла или природные ( например :
сок свеклы – придаст мылу розоватый цвет, концентрированный настой ромашки –
желтый цвет, порошок карри- ярко-желтый, сок петрушки и укропа – зеленый цвет).
6. Даем смеси
немного остыть.
7. Добавляем
эфирное масло.
8. Разливаем
в форму.
9. После затвердения массы, вынимаем из
формы и сушим несколько дней на бумаге.
Результаты
работы и выводы:
Составьте
отчет о проведенном эксперименте. Принесите мыло или сделайте фотографию.
Таблица 5.1.Форма
отчета
|
Ход |
Наблюдение |
Уравнение реакции. Вывод |
Работа № 2. Характеристика
воды по химическим показателям
Тема: «Вода.
Растворы»
Цель эксперимента:
исследование воды по химическим показателям.
Оборудование и
реактивы: пробирки, цилиндр, колба, мерный цилиндр, дистиллированная
вода, перманганат калия KMnO4,
0,5%-ной серной кислоты) H2SO4 , раствор нитрата серебра AgNO3 , раствор
хлорида бария BaCl2, раствор
аммиака NH3·H2O, , концентрированный
раствор. HNO3.
Техника
безопасности: работа со стеклянной посудой, серной кислотой. Эта работа
проводится под руководством преподавателя с использованием реактивов химической
лаборатории.
Теоретическая
часть [3. Стр.118]: Вода является наиболее
распространённым
растворителем на Земле, во многом определяющим характер земной химии, как
науки. Большая часть химии, при её зарождении как науки, начиналась именно как
химия водных растворов веществ. Природная вода не бывает
совершенно чистой. Наиболее чистой является дождевая вода, но и она содержит
незначительные количества различных примесей, которые захватывает из воздуха.
Количество примесей в пресных водах обычно лежит в пределах от
0,01 до 0,1% (масс.). Морская вода содержит 3,5% (масс.) растворенных веществ,
главную массу которых составляет хлорид натрия (поваренная соль). Вода –
химически активное вещество. Это уникальный растворитель и переносчик всех
веществ, участвующих в жизнедеятельности организма. Она растворяет больше солей
и прочих веществ, чем любая другая жидкость. Именно благодаря воде в организме
происходят сложные химические реакции.
Вещества, которые
чаще всего встречаются в воде.
— Жесткие соли
кальция и магния – это минеральные соединения, которые природная вода
вымывает из почвы и грунта. Они придают воде, так называемую, жесткость, из-за
них возникает накипь, белые разводы на сантехнике и камень на водоразделители в
душе. Регулярное употребление воды с высоким содержанием жестких солей может
вызвать болезни суставов и мочекаменную болезнь. В среднем в водопроводной воде
содержится около 3,0-3,5 мг-кв/л. Бороться с таким загрязнением не сложно,
достаточно подобрать оптимальный фильтр для очистки воды от жестких солей.
— Фтор(F) один
из тех элементов, содержание которых может только радовать человека. Воду
специально фторируют, чтобы увеличить содержание этого элемента в воде, так как
при его недостатке развивается кариес зубов. Рекомендуемое содержание фтора для
человека, живущего в средней полосе должно быть не более 1,2 мг/л.
— Марганец(Mn) редко
встречается без двухвалентного железа. Чаще всего попадает в воду через
отложения в трубах марганцевых бактерий, также через почвенные удобрения. Редко
содержания этого металла превышает 2 мг/л, но допустимая норма для здоровья
человека – не более 0,5 мг/л. В случае отравления марганцем поражается печень и
может развиться заболевание паркинсонизм, симптоматично схожее с болезнью Паркинсона,
так как марганец имеет негативное воздействие на мозг человека.
— Селен(Se).
Несмотря на утверждение, что селен полезен, большое количество селена может
приводить к острому отравлению, сопровождающемуся нарушением работы
желудочно-кишечного тракта, озноба, резкими болями в животе. При регулярном
употреблении воды с повышенным содержанием селена у человека развивается
селеноз, выражающийся в изменении качества ногтевых пластин (ломкость,
истончение), волос (обесцвечивание, облысение), кожи (дерматиты) и зубов
(кариес). Содержание селена в питьевой воде не должно превышать 0,01 мг/л.
— Молибден (Mo).
Редко содержание молибдена превышает 0,01 мг/л, обычно это происходит в местах
нахождения руд, содержащих молибден. В таком случае природные воды могут
содержать его в концентрации до 200 мг/л. Вода насыщенная молибденом обладает
вяжущим вкусом, но при содержании этого элемента в воде не выше нормы,
составляющей 0,07 мг/л, вы не ощутите никакого специфического вкуса. При
употреблении молибденовой воды с концентрацией 10-15 мг/л, может увеличиваться
печени, появляться суставная боль в кистях и стопах, выявляются серьезные
расстройства работы почек и пищеварительной системы.
— Нитраты –
соли азотной кислоты, которые обычно попадают в поверхностные и грунтовые воды,
как загрязнение от сельскохозяйственных удобрений. Если вода заражена нитратами
свыше нормы, могут развиваться заболевания крови, сердечнососудистой системы и
токсичные отравления.
Методика
проведения
Возьмите пробы
воды из различных природных источников. Забор пробы лучше осуществлять на
глубине 50 см в объеме 2 – 3 литров. Сравните качество воды из различных
источников и ее пригодность для бытовых и промышленных нужд, используя
предельно допустимые концентрации, которые найдите в справочной литературе или
Интернете.
1. Определение
органических веществ.
К исследуемым
образцам добавьте по несколько капель 0,5%-ного раствора перманганата калия
(марганцовки) и 0,5%-ной серной кислоты. Нагрейте растворы. Если при нагревании
происходит изменение окраски, то значит, в воде есть органические вещества,
способные окисляться.
2. Определение
хлорид-ионов.
К исследуемым
образцам добавьте несколько капель раствора нитрата серебра. Если растворы
помутнели, значит хлорид-ионы присутствуют.
3. Определение
сульфат-ионов.
Проводится таким
же образом. что и предыдущее исследование, только с добавлением нескольких
капель раствора хлорида бария.
4. Определение
ионов железа (III).
В пробы
исследуемых образцов добавьте 3-4 капли концентрированной азотной кислоты и
кипятите 2-3 минуты с целью окисления ионов железа (II) в ионы
железа (III). После
охлаждения добавьте 3-4 капли раствора роданида аммония. Окрашивание растворов
в красный цвет будет свидетельствовать о наличие ионов железа (III).
5. Определение
ионов меди (II).
К пробам
исследуемых образцов добавьте раствор аммиака, который при взаимодействии с ионами
меди образует сначала осадки основных солей сине-зеленного цвета, которые затем
в избытке реагента образуют растворимые аммиакаты меди интенсивного синего
цвета.
6. Определение
нитритов. К 2 мл исследуемой воды добавьте 2 мл физиологического раствора и 2
мл риванольного раствора. Если появится бледно-розовая окраска, это говорит о
недопустимости уровня содержания нитритов в воде.
Результаты работы
и выводы:
Внесите наблюдения в таблицу
показателей по каждому источнику образца воды и сделайте вывод.
Таблица 5.2.
Характеристика воды по химическим показателям
|
Источник |
Органические вещества |
Cl— |
SO42+ |
Fe3+ |
Cu2+ |
NO2— |
Работа № 3. Методы
очистки воды. Вымораживание
Тема: «Вода.
Растворы»
Цель
работы: изучить один из методов очистки воды путем вымораживания.
Оборудование и реактивы: четыре одинаковые
пластиковые бутылки со срезанным горлышком, вода кипяченная, окрашенная,
минеральная, грязная.
Техника
безопасности: бутылки с замороженной водой берите в перчатках.
Теоретическая часть [3. Стр.120]: Способы
устранения жесткости (очищения) воды:
промышленные:
·
Механические
способы (фильтрация)
·
Хлорирование
·
Обеззараживание
бактерицидными лучами
·
Озонирование
·
Реагентное
умягчение
В домашних условиях (бытовые):
·
Отстаивание
·
Кипячение
·
Использование
фильтров
·
Другие
методы
Самая
мягкая природная вода — дождевая и талая; содержание солей близко к нулю
В домашних
условиях чистую структурированную, полезную для здоровья воду можно получить
методом вымораживания. Лед имеет кристаллическую структуру, состоящую из
молекул воды. Инородным примесям, в том числе растворенным в воде солям, газам
и красителям, при замерзании ни остается места в кристаллической решетке. Они
стекают по структурам кристаллической решетки вместе с загрязненными остатками
воды. Если процесс замерзания остановить при температуре -1 … -60С,
то в кристалликах льда будет только чистая вода. Жидкий остаток – «бульон» из
примесей, солей и растворяя грязи – вреден для здоровья человека. Речь идет не
только о патологических изменениях в кровеносных сосудах и суставах или о
занесении в ткани и клетки чужеродных соединений. Доказано, что некачественная
вода особенно влияет на функции мозга, на ¾ состоящего из воды.
Опыт показал, что воду лучше замораживать
при температуре -1… -6оС, остаток сливать, в нем будут все вредные
примеси. За ночь при данной температуре замерзает примерно 2/3 воды. Вымораживание
можно проводить в морозильной камере, установив регулятор на -4 … -6оС.
Методика проведения
1.Для выполнения
эксперимента приготовьте четыре одинаковые пластиковые бутылки со срезанным
горлышком. Бутылки пронумеруйте.
2. В каждую
бутылку налейте 300 мл воды: в первую – кипяченную охлажденную воду; во вторую
– любую минеральную воду; в третью – ржавую или бытовую грязную воду ; в
четвертую– воду, окрашенную зеленкой или марганцовкой. Бутылки закройте
полиэтиленовыми пакетами.
3.Поставьте
емкости с водой на 6-7 часов в морозильную камеру или на балкон, если
эксперимент проводится в холодное время года.
4.Результаты
наблюдений запишите в виде таблицы.
Таблица 5.3. Вымораживание воды из различных источников
|
Наблюдение |
Вид |
|||
|
кипяченная |
минеральная |
грязная |
окрашенная |
|
|
Время замерзания (ч) |
||||
|
Внешний вид льда |
||||
|
Вид незамерзшей воды в середине |
||||
|
Внешний вид оттаявшего остатка |
Сделайте вывод об
эффективности очистки воды методом вымораживания. Предложите пути использования
талой воды в различных областях народного хозяйства.
Работа № 4.Определение органолептических показателей
воды
Тема: «Вода. Растворы»
Цель эксперимента:
исследование органолептических показателей воды.
Оборудование:
пробирки, цилиндры, колбы: 200 мл, 100 мл, 2 л; мерный цилиндр, дистиллированная
вода, водопроводная вода, вода из природных источников.
Техника
безопасности: осторожно работать со стеклянной посудой.
Теоретическая
часть [3. Стр.118]:
Чистая вода представляет собой бесцветную без вкуса, запаха
прозрачную жидкость. В тонком слое она бесцветна, а в слое толщиной 2м (и
более) приобретает голубоватый оттенок .
Молекулярная масса воды — 18,0160,
химическая формула — Н2О. Максимальная плотность дистиллированной воды — 1 г/см
куб. при температуре 3,982 гр. С и нормальном давлении 1 атм.
Плотность
воды при переходе ее из твердого состояния в жидкое не уменьшается, как почти у
всех других веществ, а возрастает. Как хорошо известно, вода принята за образец
меры – эталон для всех других веществ. Природная вода не бывает совершенно
чистой. Наиболее чистой является дождевая вода, но и она содержит
незначительные количества различных примесей, которые захватывает из воздуха.
Методика
проведения
Возьмите пробы
воды из различных природных источников. Забор пробы лучше осуществлять на
глубине 50 см в объеме 2 – 3 литров. Внимательно изучите внешний вид образца
воды.
1. Определение
цвета.
В цилиндр или
большую пробирку прилейте 10-12 мл исследуемой воды. Под него подложите лист
белой бумаги (в качестве фона). Определите цвет воды, рассматривая воду сверху
при достаточном боковом освещении. Выберите наиболее точное название оттенка:
слабо-желтоватая, светло-желтоватая, желтая, корочневая, красно-коричневая и
др.
2. Определение
характера и интенсивности запаха.
В колбу объемом
200 мл налейте 100 мл исследуемой вод, закройте ее пробкой и сильно взболтайте.
Выньте пробку и определите характер и интенсивность исследуемой пробы с помощью
таблицы.
Таблица 5. 4.Характер
и интенсивность запаха
|
Характер |
Аналог |
|
Неопределенный |
Нет аналога |
|
Травянистый |
Запах сена, |
|
Сероводородный |
Тухлых яиц |
|
Затхлый |
Плесени, |
|
Прелый |
Свежевспаханной |
|
Древесный |
Коры дерева, |
|
Фекальный |
Сточных вод, |
|
Болотный |
Тины, ила, |
|
Ароматный |
Цветов, огурцов, |
Таблица 5.5. Интенсивность
запаха
|
Интенсивность |
Характеристика |
|
Очень сильный |
Интенсивный, сразу ощущается |
|
Отчетливый |
Чувствуется отчетливо |
|
Ощутимо заметный |
Обнаруживается без труда |
|
Слабый |
Ощущается не сразу, но чувствуется, если |
|
Очень слабый или отсутствует совсем |
Может быть зафиксирован только опытным |
3. Определение прозрачности.
Прозрачный мерный
цилиндр установите на газетный лист. Подливайте в цилиндр порциями по 10 мл
дистиллированную воду до тех, пор, пока текст, на который вы смотрите сверху
через толщу воды, не будет расплываться.
Проделайте ту же
процедуру с исследуемой водой. Измерьте линейкой высоту столба жидкости.
Определите степень прозрачности, разделив высоту ее столба на высоту столба
дистиллированной воды и умножив полученный результат на 100 %.
4. Определение
наличие примесей, осадка.
В двухлитровую
колбу наберите исследуемую воду, взболтайте ее, поставьте отстаивать. Через 1-2
часа охарактеризуйте осадок в такой градации: отсутствует, незначительный,
заметный, большой. Если осадок есть, определите его характер (хлопьевидный),
песчаный, илистый и т.д.) и цвет. Наличие масел оцените визуально – об этом
свидетельствуют жирные пятна на поверхности воды.
Результаты
работы и выводы:
Внесите
наблюдения в таблицу показателей по каждому источнику образца воды.
Таблица 5.6. Органолептические
показатели воды из разных источников
|
Источник |
Цвет |
Прозрачность |
Запах |
Наличие |
Работа
№5.
Природные индикаторы
Тема: «Теория электролитической
диссоциации»
Цель эксперимента:
получение природных индикаторов и изучение возможностей их использования.
Оборудование
и реактивы: лепестки цветов, высушенные плоды, питьевая сода, столовый уксус,
лимонная кислота, дистиллированная вода, стакан 100мл, пробирка, водяная баня, воронка.
Техника
безопасности: осторожно работать со стеклянной посудой, во избежание
ожогов от брызг и выбросов не наклоняться над сосудом, в котором кипит или
налита какая-либо жидкость, при переносе сосудов с горячими жидкостями держать
их обеими руками: одной поддерживать дно, другой – верхнюю часть.
Теоретическая
часть [3, стр.89]:
Индикаторы в химии (лат. indicator
указатель) — вещества, изменяющие свой цвет в присутствии тех или иных
химических соединений в исследуемой среде (в растворе, в воздухе, в клетках, в
тканях), а также при изменении pH или окислительно-восстановительного
потенциала среды; широко применяются в биохимических, клинических и
санитарно-гигиенических лабораториях ,в титровании в аналитической химии и биохимии. Кислотно-основные
индикаторы – органические соединения,
способные изменять цвет в растворе при
изменении кислотности (pH). Их
преимуществом является дешевизна, быстрота и наглядность исследования. Однако
из-за субъективности определения цвета и невысокой
точности индикаторы pH не всегда удобны; поэтому для точного измерения pH
используют pH-метры с цифровой индикацией.[11]
Интервалы
перехода цвета индикаторов
На
рисунке 5.2 приведены ориентировочные данные о существовании разных цветных
форм индикаторов в водных растворах.
.
Рисунок
5.2.
Цветные формы
индикаторов в водных растворах
Природные индикаторы –
органические соединения, способные изменять цвет в растворе при изменении
кислотности рН. Индикаторы широко используются в титрировании в аналитической
химии и биохимии. Их преимуществом является дешевизна, быстрота и наглядность
исследования.
Во многих цветах и плодах содержатся
красители, которые изменяют свой цвет в зависимости от кислотности среды. А это
значит , что они могут служить индикаторами.
Летом можно набрать цветов и ягод в саду ,
в лесу (тюльпаны, черника, ежевика, малина, ирисы).
Необходимо высушить собранные лепестки и
плоды и хранить в отдельных коробочках.
Методика
проведения
1.Растворы индикаторов надо готовить прямо
перед опытом, так как они долго не хранятся. Для приготовления растворов
необходимо взять немного высушенных плодов и лепестков ( можно и свежих) и
нагреть на водяной бане.
2. Отвар профильтровать и перелить в
чистую склянку.
3.Отвары испытайте на изменение цвета в
кислой среде ( в растворе лимонной кислоты или уксуса).
4. Эти же отвары испытайте на изменение
цвета в щелочной среде (раствор питьевой соды).
5. Нарезать полосками фильтровальную
бумагу и пропитать полоски фильтровальной бумаги приготовленным отваром.
6. Высушить полоски не допуская попадания
солнечного света.
7. Хранить приготовленные индикаторные
бумажки в темной посуде.
Неплохими индикаторами могут быть и
некоторые соки , например, виноградный, свекольный, сок красной капусты.
Приготовленные индикаторы можно
использовать для определения среды разных бытовых растворов: растворов мыла,
зубной пасты, шампуня; или продуктов питания, например, молока.
Результаты и
выводы
Составьте таблицу изменений цвета отваров
в кислотах (лимонной кислоте) и щелочной среде ( раствор питьевой соды).
Таблица 5.7. Изменение цвета в
отварах
|
Название |
Цвет в |
Цвет в |
Проанализируйте
результаты и сделайте выводы
Работа №6. Изучение свойств
крахмала
Исследование крахмала в
различных продуктах питания
Тема: «Кислородсодержащие
органические вещества»
Цель: Обнаружение
крахмала в различных растениях
Оборудование, реактивы,
материалы: картофель, вода, терка, сито (марля), блюдце,
спиртовка, продукты питания, реактив Люголя.
Техника
безопасности: осторожно с нагревательным прибором.
Теоретическая
часть [3. Стр.291]:
Крахмал
– это белое гранулированное органическое вещество, которое
вырабатывается
всеми зелеными растениями. Фотосинтез — процесс образования органических веществ из углекислого
газа и воды на свету в листьях зеленых растений. Часть глюкозы, образующейся в
зелёных растениях при фотосинтезе, превращается в первичный крахмал:
6CO2 + 5H2O → C6H12O6 (глюкоза)
+ 6O2
nC6H12O6 →
(C6H10O5)n + nH2O
В
сокращенном виде процесс образования крахмала можно записать так:
6nCO2 + 5nH2O → (C6H10O5)n
+ 6nO2
Являет собой
безвкусный порошок, нерастворимый в холодной воде, спирте и большинстве других
растворителей. Эта субстанция принадлежит к группе полисахаридов. Наипростейшая
форма крахмала – линейный полимер амилозы. Разветвленная форма представлена
амилопектином. В реакции с водой образовывает клейстер. Гидролиз крахмала
происходит при наличии кислот и повышения температуры, в результате
образовывается глюкоза. Используя йод, легко проверить завершение реакции
гидролиза (больше не будет появляться синий цвет).
Структурным
звеном крахмала является молекула моносахарида — глюкозы, лишенная 1 молекулы
воды. Таким образом, молекулу крахмала можно представить в виде формулы:
n(С6Н10О5),
где n – некое число остатков молекулы моносахарида.
Так
в наиболее часто используемых для производства растениях крахмала содержится: в
клубнях картофеля – до 25%, в зернах пшеницы – до 64%, кукурузы – до 70%, риса
– до 86%.
Йод
образует с крахмалом соединение сине-фиолетового цвета. Эта реакция является
качественной для обнаружения как йода, так и крахмала .[13]
Аналогом крахмала можно назвать гликоген,
который иногда называется животным крахмалом, так как его структура похожа
на компоненты растительного крахмала. В отличие от крахмала, гликоген
имеет более разветвленную и компактную структуру, не дает синей окраски при
окраске йодом.
Методика
проведения
Опыт
6.1.Получение картофельного крахмала
1.
Картофель очищается от грязи, промывается и измельчается до
состояния опилок.
2.
Залейте всё водой и тщательно отожмите картофель.
3.
Поместите «кашицу» в марлю, и отожмите сок.
4. Вылейте
сок на блюдце, подождите, пока образуется осадок, слейте лишнюю жидкость и
поставьте на подоконник высушиваться (10-12час)
Опыт 6.2.Изучение свойств крахмала опытным путём
1. Рассмотрите
крахмал невооружённым глазом, под лупой, понюхайте, разотрите на руке.
2.
Немного крахмала засыпьте в стакан с холодной водой, размешайте.
3.
Немного крахмала засыпьте в холодную воду и размешайте. Далее этот раствор
нагреете, постоянно взбалтывая. Раствор загустел, после того как он остыл,
определите, что он имеет способность к склеиванию.
4. Нагрейте крахмал в фарфоровой чашечке до изменения окраски
Опыт
6.3.Качественная реакция на обнаружение крахмала
1.
На
кусочек очищенного картофеля и хлеба капаем 1 каплю реактива Люголя или
спиртового раствора йода.
Составьте отчет
о проведенных исследованиях
Таблица 5.8. Результаты наблюдений
|
Ход |
Наблюдение |
Уравнение |
Опыт
6.4. Исследование крахмала в различных продуктах питания
Таблица 5.9. Результаты исследований
|
Наименование |
Наличие |
Заявлено |
Сделайте
вывод.
Работа №7.
Изучение свойств цемента
Тема:
«Силикатная промышленность»
Цель: Изучить
состав цемента, исследовать его химические свойства.
Оборудование
и реактивы: образцы цемента, вода
Техника
безопасности: не допускать попадания сухого цемента в
глаза и дыхательные пути.
Теоретическая
часть [11]:
Для анализа необходимо взять 3 образца:
-портландцемент М400 (характеризуются, в первую очередь,
повышенной морозостойкостью, устойчивостью к химически агрессивным средам
(хлориды, сернокислые соли), применяется при изготовлении различных видов
бетона и строительстве не промышленных объектов);
-портландцемент М350 (интенсивно используется при изготовлении
железобетонных изделий, бордюров, закладке фундамента, лестничных площадок);
-цемент высокопрочный для монтажа ЦЕРЕЗИТ СХ 15 (предназначен для
крепления закладных элементов и металлических конструкций в фундаментах, для
подливки подъездных рельсов, подшипников мостов, фундаментов станков, для
заполнения зазоров между строительными элементами шириной 20-50 мм),
-полноценную и достоверную проверку качества цемента можно
провести только в лаборатории, в условиях образовательного учреждения можно
проверить следующие свойства этих марок на соответствие требованиям:
·
сроки
схватывания;
·
гидрофобность;
Одна из главных проблем, присущих обычному цементу – высокая
гигроскопичность. В связи с этим срок хранения тарированного цемента в
стандартных бумажных мешках не превышает нескольких месяцев. Дальше он начинает
комковаться и терять прочность даже при хранении в сухом помещении.
Гидрофобный цемент – это обычный портландцемент, полученный путем
помола цементного клинкера с введением гидрофобных добавок. В результате цемент
приобретает почти нейтральную активность по отношению к атмосферной влаге. Если
обычный цемент, впитывая влагу из воздуха, вступает с ней в химическую реакцию
(внешний признак которой — комкование), то гидрофобный цемент можно
складировать на срок более года без потери его свойств.
Методика
проведения
Опыт 7.1.Сроки
схватывания
Это начало и конец схватывания цемента. За
начало схватывания принимается начало потери подвижности (пластичности)
цементным тестом, а конец схватывания характеризуется некоторым его
затвердением. Начало схватывания портландцемента должно наступать не ранее 45
минут, а конец — не позднее 12 часов. Для строителей необходимо знать сроки
схватывания цемента, так как применять свежеприготовленные бетоны и растворы
можно только до начала схватывания. При несоблюдении этого условия прочность
растворов и бетонов будет низкой, так как схватившееся цементное тесто утратит
клеящую способность. С повышением температуры окружающей среды сроки
схватывания ускоряются, а с понижением замедляются. На сроки схватывания
оказывает влияние тонкость помола: с повышением тонкости помола сроки схватывания
уменьшаются. Испытания с образцами проводились при комнатной температуре и
в условиях открытого воздуха.
Таблица 5.10. Определение сроков
схватывания цемента
|
Марка |
Температура |
Температура |
||
|
Начало схватывания (ч) |
Конец схватывания (ч) |
Начало схватывания (ч) |
Конец схватывания (ч) |
|
|
портландцемент М400 |
||||
|
портландцемент М350 |
||||
|
цемент высокопрочный ЦЕРЕЗИТ СХ 15 |
Сделайте вывод.
Опыт 7.2.Гидрофобность
1.Пробу цемента массой около 10 г разровняйте на сухой поверхности
ровным и тонким слоем, на которую нанесите несколько капель воды. Гидрофобный
портландцемент в течение 5 мин не должен впитывать воду.
Таблица 5.11. Испытание марок цемента
|
Марка |
Время впитывания воды |
|
портландцемент М400 |
|
|
портландцемент М350 |
|
|
цемент высокопрочный ЦЕРЕЗИТ СХ 15 |
Сделайте вывод.
Работа №8.
Химия чая
Тема: «Методы качественного анализа»
Цель: провести химические опыты, подтверждающие качественный
состав чая.
Оборудование
и реактивы: образцы зеленого и черного чая, цитрамон,
крахмал, раствор йода, концентрированная азотная
кислота HNO3 , раствор аммиака NH3·H2O,
универсальная индикаторная бумага, хлорид железа (Ш) FeCl3, сульфат меди CuSO4, гидроксид натрия NaOH.
Техника безопасности: работа со
стеклянной посудой, азотной кислотой. Эта работа проводится под руководством
преподавателя с использованием реактивов химической лаборатории.
Теоретическая
часть [3.Стр.284; 11]:
Считается, что в среднем в зеленом
чае витамина С в два раза больше, чем в черном. Однако, даже в сухой заварке
доза витамина С более чем велика — 156-233 мг. При заваривании в настой
отдается до 70-90% этой дозы. Под действием кипятка витамин С практически не
разрушается, так как находится в соединении с танинами. При заваривании чая необходимо учитывать,
что танины активно реагируют с железом и кислотами. При заваривании чая в
железной посуде (или с использованием богатой железом воды) получается мутная
бурая («ржавая») заварка. Кислая среда, напротив, осветляет заварку (всем известно
действие на чай лимона). Полифенолы хорошо растворяются только в горячей воде.
Именно поэтому чай мы завариваем кипятком. После того, как заварка остывает,
она зачастую мутнеет — это также свойство полифенолов. Если при охлаждении
заварка не мутнеет — это показатель того, что содержание полифенолов в сырье
явно недостаточно Углеводы в чае содержатся разнообразные – от простых сахаров
до сложных полисахаридов.
Чем выше в чае процент содержания
углеводов, тем ниже его сорт. Поэтому они являются своего рода балластом. К
счастью, большинство из них нерастворимо. Причём нерастворимы как раз ненужные
человеку полисахариды — крахмал, целлюлоза составляющие от 10 до 12% чая. Зато
полезные углеводы – сахароза, глюкоза, фруктоза, мальтоза (их в чае от 1 до 4%
) – растворимы
Методика
проведения
Для исследования было взято два вида чая:
листовые черный и зеленый.
Опыт
№ 8.1.Качественная реакция на кофеин
1.На фарфоровую
пластину поместите 0,1 г чая.
2.Добавляйте 2-3 капли
концентрированной азотной кислоты.
3.Смесь осторожно
выпарите досуха.
В результате окисления
кофеина образуется тетраметилаллоксантин оранжевого цвета. При реакции с
концентрированным раствором аммиака это вещество превращается в пурпурат
аммония.
Данные анализа
сравнивните с эталоном, полученным из таблетки цитрамона, содержащего 43%
кофеина.
Опыт
№ 8.2. Определение витамина С в чае
Это определение проводится с помощью
йодометрического метода.
1.Поместите в
пробирку 2 мл чая и добавьте воду до объёма 10 мл, а затем немного раствора
крахмала.
2.Далее по каплям
добавляйте раствор йода до появления устойчивого синего окрашивания, не
исчезающего 10-15 с.
Техника определения
основана на том, что молекулы аскорбиновой кислоты легко окисляются йодом. Как
только йод окислит всю аскорбиновую кислоту, следующая же капля, окрасит йод в
синий цвет.
Опыт
№ 8.3. Определение кислотно-щелочного баланса
В пробирку с чаем,
опускали индикаторную бумажку для определения рН, а затем сравнивали её с
эталоном.
Опыт
№ 8.4.Определение танина в чае
К 1 мл раствора чая добавьте 1-2 капли хлорида железа (Ш). При наличии
танина в чае наблюдали появление тёмно-фиолетового окрашивания.
Содержание танина в чае определяли визуально-колориметрическим методом.
Опыт № 8.5. Определение
глюкозы
1. В пробирку поместите 2 мл чая
и каплю реактива сульфата меди и гидроксида натрия.
2.Держа пробирку наклонно, осторожно
нагрейте верхнюю часть раствора.
Составьте отчет о проведенных исследованиях.
Таблица
5.12. Форма отчета
|
Ход |
Наблюдение |
Уравнение |
Работа № 9. Адсорбционная способность
активированного угля
Тема:
«Природные источники углеводородов»
Цель
работы: исследовать адсорбционную способность активированного
угля.
— проверить адсорбционную способность активированного угля в
лаборатории и дома;
— выявить влияние природы растворителя на адсорбцию;
—
качественно проследить адсорбционную способность для слабоокрашенных растворов.
Техника
безопасности: работа со стеклянной посудой. Эта работа проводится под
руководством преподавателя с использованием реактивов химической лаборатории
Теоретическая часть [3. Стр.236]
Адсорбцией называется самопроизвольное
изменение концентрации компонента в поверхностном слое по сравнению с его
концентрацией в объеме фазы. Более плотную фазу (определяющую форму
поверхности) принято называть адсорбентом, вещество, молекулы которого могут
адсорбироваться — адсорбтивом, уже адсорбированное вещество — адсорбатом. Процесс,
обратный адсорбции, называют десорбцией. Адсорбция —
всеобщее и повсеместное явление, имеющее место всегда и везде, где есть
поверхность раздела между фазами. Наибольшее практическое значение имеет
адсорбция поверхностно-активных
веществ и адсорбция примесей из газа либо жидкости специальными
высокоэффективными адсорбентами. В качестве адсорбентов могут выступать
разнообразные материалы с высокой удельной поверхностью: пористый углерод (наиболее
распространённая форма — активированный уголь), силикагели, цеолиты, а также
некоторые другие группы природных минералов и
синтетических веществ.
Методика
проведения
Опыт №
9.1. Адсорбция активированным углем различных веществ из растворов.
1.В химический стакан, мерным цилиндром
отмерили по 5 мл 0,01% -х растворов – фуксина, малахитового зеленого, сульфата
меди, йода, дихромата калия.
2.В каждый стакан внесли по 0,25г
растертого активированного угля. После взбалтывания через 5-10 минут смеси фильтруют
через обычные фильтры (9.00 hm).
Опыт № 9.2. Влияние природы вещества на адсорбцию
1.В один химический стакан налили 5 мл.0,01% водного раствора
фуксина, в другой стакан такое же кол-во, спиртового раствора фуксина.
2. В оба стакана внесли по 0,2 г. угольного порошка и взбалтывали
5 мин. 3.Отфильтровали растворы.
Опыт № 9.3. Адсорбция кувшином «Аквафор»
холодной воды из крана
1.В белую чистую миску налить
холодную воду из крана.
2.
Перелить часть воды в кувшин с картриджем, а часть оставить как контрольный
образец.
3.Воду
отфильтровать кувшином «Аквафор» и перелить в чистую белую миску и сравнить
полученный образец из фильтра с начальным образцом из крана.
Опыт 9.4. Адсорбция активированным углем ягодного сиропа
1.В один стакан с сиропом добавить
толченный активированный уголь. Оставить исследуемый раствор на некоторое
время.
2. Во
второй, контрольный, стакан также налить ягодный сироп, но активированного угля
не рмбавили.
Вывод
выполнить самостоятельно
Составьте
отчет о проведенных исследованиях.
Таблица 5.13. Форма отчета
|
Ход |
Наблюдение |
Уравнение реакции. Вывод |
Работа № 10. Выращивание кристаллов
Тема «Растворы»
Цель:
научиться приготавливать насыщенный раствор поваренной соли или других веществ,
выращивать кристаллы различных размеров, закрепить умения и навыки при работе с
веществами и химическим оборудованием. Вырастить кристалл или кристаллы из
насыщенного раствора поваренной соли, медного купороса или алюмокалиевых
квасцов.
Оборудование
и реактивы: стакан и литровая банка для приготовления раствора, деревянная
ложка или палочка для перемешивания, соль для эксперимента – поваренная соль,
медный купорос или квасцы, горячая вода, затравка – кристаллик соли,
подвешенный на нитке, воронка и фильтровальная бумага.
Техника
безопасности: осторожно работать со стеклянной посудой.
Теоретическая
часть [3. Стр.58]
Раство́р —
гомогенная (однородная) смесь,
состоящая из частиц растворённого вещества, растворителя и продуктов их
взаимодействия. «Гомогенный» — значит, что каждый из компонентов
распределен в массе другого в виде своих частиц, то есть атомов, молекул или
ионов. Насыщенный раствор — раствор, в
котором растворённое вещество при данных условиях достигло максимальной концентрации и
больше не растворяется. Осадок данного вещества находится в равновесном состоянии
с веществом в растворе.
Методика проведения
1.Приготовьте насыщенный раствор
соли. Для этого сначала налейте в банку горячей воды до половины её объёма,
затем порциями добавляйте соответствующую соль, постоянно перемешивая.
Добавляйте соли до тех пор, пока она не перестанет растворяться.
2.Отфильтруйте полученный раствор
в стакан через воронку с фильтровальной бумагой или ватой и оставьте раствор
остывать на 2-3 часа. 3.Внесите в остывший раствор затравку – кристаллик соли,
подвешенный на нити, осторожно накройте раствор крышкой и оставьте на
продолжительное время (2-3 дня и более).
Таблица 5.14. Результаты
наблюдений проведенных исследований
|
Ход |
Наблюдение |
Уравнение реакции. Вывод |
Работа
№ 11. Опыт «Силикатный сад»
Тема: «Химические реакции»
Цель:
изучить реакции обмена на примере силиката натрия.
Оборудование
и реактивы: силикат натрия
(или просто силикатный клей), неорганические соли хлорид кальция CaCl2,
магния, никеля(II), меди(II), кобальта(II), железа(II), железа(II), бария,
цинка, хрома(III) и марганца(II)).
Техника безопасности: осторожно работать со стеклянной посудой
Теоретическая часть [3. Стр.109]
Канцелярский клей — это не что
иное, как жидкое стекло или его химическое название «силикат натрия»
Na2SiO3. Можно сказать также — это соль натрия кремниевой кислоты. Рост
водорослей — это результат кристаллизации гидроксидов и силикатов железа, меди,
кальция, никеля, которые образуются в результате обменных реакций.
Это получились
осадки силикатов, например:
CaCl2 + Na2SiO3
→ CaSiO3↓ + 2NaCl
Могут образоваться кремниевая кислота и гидроксид металла (или его основная
соль):
2FeCl3 + 3Na2SiO3 + 6H2O
→ 2Fe(OH)3↓ + 3H2SiO3↓ +6NaCl;
2CuSO4 + Na2SiO3 + 2H2O
→ Cu2(OH)2SO4↓ + H2SiO3↓
+Na2SO4.
Методика
проведения. [12].
Нальём в
пробирку/стакан силикат натрия (или просто силикатный клей) и добавим
неорганическую соль (кальция, магния, никеля(II), меди(II), кобальта(II),
железа(II), железа(II), бария, цинка, хрома(III) и марганца(II)). Через
некоторое время из кристаллов погруженных солей за пузырьками воздуха
вытягиваются тоненькие полые трубочки, стенки которых состоят из образующихся
осадков. Трубочка представляет собой полупроницаемую мембрану (перегородку),
через которую вода проникает внутрь.
Протекает осмос. В результате в некоторых местах трубочка рвется. В
местах разрыва снова образуется осадок. Через 15-20 мин появляются «заросли»,
напоминающие деревья или водоросли.
Таблица
5.15. Результаты
наблюдений проведенных исследований
|
Ход |
Наблюдение |
Уравнение реакции. Вывод |
Работа №12. Коррозия металлов
Тема: «Металлы»
Цель: изучить процессы коррозии металлов, изучить
влияния среды раствора на коррозию железа и гальванических пар.
Оборудование
и реактивы: химические стаканы,
железные гвозди, алюминий дистиллированная вода, раствор соляной кислоты HCl, раствор гидроксида натрия NaOH,
хлорид натрия NaCl.
Техника
безопасности: работа со стеклянной посудой, соляной кислотой щелочью.
Эта работа проводится под руководством
преподавателя с
использованием реактивов химической лаборатории.
Теоретическая
часть [3. Стр.156]
Коррозией металлов называют самопроизвольное
разрушение металлов и сплавов вследствие их взаимодействия с окружающей средой.
В основе этого
взаимодействия лежат химические и электрохимические реакции, а иногда и
механическое воздействие внешней среды. Способность металлов
сопротивляться воздействию среды называется коррозионной
стойкостью или химическим сопротивлением материала. Металл,
подвергающийся коррозии, называют корродирующим металлом, а среда, в которой
протекает коррозионный процесс — коррозионной средой. В результате коррозии изменяются
свойства металла, и часто происходит ухудшение его функциональных
характеристик.
Металл при
коррозии может частично или полностью разрушаться. Химические соединения,
образующиеся в результате взаимодействия металла и коррозионной среды, называют
продуктами коррозии. Продукты коррозии могут оставаться на поверхности металла
в виде оксидных пленок, окалины или ржавчины. В зависимости от степени
сцепления продуктов коррозии с поверхностью металла наблюдаются различные
случаи. Например, ржавчина на поверхности железных сплавов образует рыхлый
слой, процесс коррозии распространяется далеко вглубь металла и может привести
к образованию сквозных язв и свищей. Напротив, при окислении алюминия на
поверхности образуется плотная сплошная пленка оксидов, которая предохраняет
металл от дальнейшего разрушения.
Методика проведения [14,15]
1.В стаканы с водопроводной водой,
раствором щелочи, раствором кислоты и раствором поваренной соли поместите
железные гвозди и оставьте на время. Каждые сутки визуально отмечайте
происходящие изменения. 2.В стаканы
с водопроводной водой, раствором щелочи, раствором кислоты и раствором
поваренной соли поместите металлические пары «железо – медь», «железо –
алюминий» и оставили на время. Каждые сутки визуально отмечайте происходящие
изменения.
3. В мерные цилиндры с растительным
маслом поместите железные гвозди. В первом случае железный гвоздь полностью
погрузите в среду неэлектролита, т.е. не было контакта железа с кислородом
воздуха. Во втором случае железный гвоздь наполовину погрузите.
Результаты наблюдений оформите в таблицы.
Таблица 5.16. Результат
наблюдений (опыт с гвоздями)
|
№ |
Раствор |
Метериал |
наблюдения |
|
Стакан 1 |
Водопроводная вода |
Железо |
|
|
Стакан 2 |
Раствор соляной кислоты |
Железо |
|
|
Стакан 3 |
Раствор гидроксида натрия |
Железо |
|
|
Стакан 4 |
Раствор хлорида натрия |
Железо |
Таблица 5.17.
Результаты наблюдений (опыт с металлами)
|
№ |
Раствор |
Метериал |
наблюдения |
|
Стакан 1 |
Водопроводная вода |
Железо+медь |
|
|
Стакан 2 |
Раствор соляной кислоты |
Железо+медь |
|
|
Стакан 3 |
Раствор гидроксида натрия |
Железо+медь |
|
|
Стакан 4 |
Раствор хлорида натрия |
Железо+медь |
|
|
Стакан 5 |
Водопроводная вода |
Железо+алюминий |
|
|
Стакан 6 |
Раствор соляной кислоты |
Железо+алюминий |
|
|
Стакан 7 |
Раствор гидроксида натрия |
Железо+алюминий |
|
|
Стакан 8 |
Раствор хлорида натрия |
Железо+алюминий |
Таблица 5.18.
Результаты наблюдений (опыт металл в разных средах)
|
Стакан 1 |
железо (без кислорода) |
|
|
Стакан 2 |
железо + воздух |
Вывод сделать самостоятельно.
Работа №13. Изучение
гипса
Тема: «Соли»
Цель: изучить строительный материал гипс как химическое вещество,
изучить его вяжущее свойство.
Оборудование и реактивы: гипс, вода, формы, краски, кисти.
Техника
безопасности: осторожно работать со стеклянной посудой, не
допускать попадания сухого гипса в глаза. При попадании промыть большим
количеством воды. Не допускать попадания гипсовой пыли в дыхательные пути. Гипсы
должны храниться в сухом месте. По возможности, надо работать в тонких защитных
перчатках.
Теоретическая часть [3. Стр.80]
Гипс — минерал, водный сульфат
кальция, CaSO4×2H2O. Название происходит от греч.
«гипсос», что в древности обозначало и собственно гипс или мел. Плотная
снежно-белая, кремовая или розовая тонкозернистая разновидность гипса известна
как алебастр. В строительстве алебастром называют также продукт обжига
природного гипса.
Методика проведения
Измерение
сроков схватывания гипса от количества воды при температуре воздуха 200С
и изучение его химического состава
1.Разное
количество воды смешайте с одной частью гипса. Исследования
проводите при комнатной температуре и с водой комнатной температуры. 2.Результаты испытаний занесены в таблицу
5.19.
3.
Небольшое количество гипса с водой добавить 2-3 мл раствора хлорида бария.
Наблюдения записать в таблицу 5.20.
Создание
фигурки из гипса.
1.Подготовьте форму, в которую буду
заливать материал. Можно купить готовый набор для поделок из гипса, в котором
уже будут пластмассовые формочки.
2. Чтобы фигурку из гипса легче было
доставать, смажьте форму любым растительным маслом.
3.Порошок гипса насыпьте в стеклянную
банку. Добавьте необходимое количество воды – в соответствии с исследованием.
Консистенция должна напоминать сметану.
4.Размешайте массу, чтобы в ней не
осталось комочков.кла3
5.Вылейте гипс в приготовленную форму.
6.
Оставьте массу высыхать в течение 30 минут. Гипсовую
модель можно вынимать из оттиска, когда температура модели понижается.
7.
Если надо разукрасьте.
8.Остатки
гипсового раствора ни в коем случае не выливать в канализацию или раковину!
Застыв в трубе гипс испортит ее. Дождаться пока остаток гипса в емкости, где
замешивали раствор, застынет, обстучать емкость со всех сторон, чтобы гипс
отошел от стенок, и вытряхнуть его в мусорное ведро.
Таблица 5.19 Результаты испытаний
|
Опыт 1 |
Опыт 2 |
Опыт 3 |
|
|
Вода / гипс (части) |
0,5 / 1 |
1 / 1 |
1,5 / 1 |
|
Начало схватывания, |
|||
|
Конец схватывания, |
|||
|
Свойства состава |
Таблица
5.20 Результаты наблюдений
|
Ход |
Наблюдение |
Уравнение реакции. Вывод |
Вывод о свойствах гипса сделайте самостоятельно.
Работа №14. Исследование
химического состава мороженного
Тема: «Кислородсодержащие органические вещества»
Цель:
опытным путем изучить химический состав пищевого продукта -мороженого .
Оборудование и
реактивы: пробирки, молочное мороженое, в плодово-ягодное мороженое, 5-10
% раствора NaOH, дистиллированная вода, 10 % раствор CuSO4
,пищевая сода NaHCO3
,
Техника безопасности: осторожно
работать с щелочью, стеклянной посудой
Теоретическая часть [3. Стр.284, 291,
311]:
Реакция обусловлена наличием в
молекуле белка пептидных группировок –СО–NН– и характерна для всех белков.
При этом появляется ярко-фиолетовое окрашивание, связанное с
взаимодействием пептидных связей белковых молекул со
свежеосажденным Cu(OH)2. Окраска объясняется образованием
комплексных соединений меди. Биуретовая реакция:
Лимонная кислота взаимодействует с гидрокарбонатом натрия с
выделением углекислого газа:
Мороженое на молочной основе содержит дисахариды лактозу и
сахарозу. Образуется ярко-синий раствор комплексного соединения сахарозы и
лактозы с медью(II). Это качественная реакция на многоатомные спирты:

Лактоза, находясь в нециклической (альдегидной) форме реагирует
с Cu(OH)2. При этом образуются различные продукты окисления и
деструкции лактозы. Cu(OH)2в осстанавливается до
оранжевого CuOH, который потом разлагается до Cu2O красного
цвета. В ходе реакции может выделиться и медь. Упрощенно процесс можно
представить следующими уравнением:
2CuOH Сu2O
+ H2O
Методика проведения
Опыт 14.1. .Обнаружение
белков
1.В
пробирку наливают 1 мл растаявшего молочного мороженого и добавляют
5-7 мл дистиллированной воды. Пробирку закрывают пробкой и встряхивают. К 1 мл
полученной смеси добавляют 1 мл 5-10
% раствора NaOH и несколько капель 10 % раствора CuSO4.
2.Содержимое
пробирки встряхивают.
Опыт 14.2.Обнаружение
лимонной кислоты (пищевой добавки Е330) в
плодово-ягодном мороженом
1.В пробирку
налейте 1 мл растаявшего мороженого и добавьте 1 мл насыщенного раствора пищевой
соды.
Опыт 14.3.Обнаружение
углеводов в молочном мороженом
1.В пробирку
налейте 1 мл молочного мороженого и добавьте 5-7 мл дистиллированной воды.
2.Пробирку
закройте пробкой и встряхните несколько раз.
3. Профильтруйте
полученную смесь и к фильтрату добавьте 1 мл 5-10 %
раствора NaOH и 2-3 капли 10 % раствора CuSO4.
4. Содержимое пробирки осторожно встряхните.
5.Полученный раствор нагрейте
1мин.
Опыт 14.4.Обнаружение
сахарозы в плодово-ягодном мороженом
1.В
пробирку наливают 1 мл растаявшего плодово-ягодного мороженого и 1
мл 5-10% раствора NaOH.
2.Затем приливают
2-3 капли 10 % раствора CuSO4. Наблюдают ярко-синее
окрашивание (качественная реакция на многоатомные спирты).
Сделайте вывод о химическом
составе изученных образцов мороженого.
Таблица
5.21. Форма отчета
|
Ход |
Наблюдение |
Уравнение реакции. Вывод |
Работа №15.
Определения йода
Цель: провести
качественный и количественный анализ содержания йода в йодированной соли на
соответствие с заявленными качествами на этикетках;
экспериментальным путем определить наличие
усвояемого йода в йодсодержащих препаратах.
Оборудование
и реактивы: коническая
колба, бюретка,
образцы йодированной соли, крахмал,
дистиллированная вода, 10% раствор KI, 0,005 М Na2S2O3,
Н2SO4
Техника безопасности: осторожно
работать с кислоой, со стеклянной посудой. Эта работа проводится под руководством
преподавателя с использованием реактивов.
Теоретическая часть [3.Стр.124]:
Анализ проводится в соответствии с
методикой определения йода в поваренной соли по ГОСТ Р 51575 – 2000.
Метод основан на
взаимодействии йодата калия с йодидом калия в кислой среде (1), титровании
выделившегося йода тиосульфатом натрия (2).
IО3- + 5I—
+ 6Н+ = 3I2 +
3Н2О
(1)
2Na2S2O3 + I2 = NaI
+ Na2S4O6 (2)
(тиосульфат
(йодид (тетратионат
натрия)
натрия) натрия)
Количество йода в
мг на 1 кг исследуемой соли можно вычислить по формуле:
V
x 0,1057 x 1000
x =
—————— = V x 10,57 (мг/кг),
10
Методика проведения [18]
1. Навеску исследуемой пробы массой 10
г растворить в 100 куб. см дистиллированной воды в конической колбе объемом 250
куб. см. Полученный раствор профильтровать.
2. К полученному раствору добавить
1 куб.см 0,5% Н2SO4 и перемешать, добавить 5 мл
10% раствора KI, перемешать, закрыть колбу пробкой и поместить на 10 мин в
темное место.
3. К исследуемому раствору,
приобретшему темно – желтую окраску, добавить из бюретки при перемешивании
0,005 М Na2S2O3 до перехода окраски в светло
— желтую. Добавить в исследуемый раствор примерно 2 мл индикаторного
раствора крахмала, от чего смесь приобретет темно — синюю окраску, и
титровать тиосульфатом натрия до тех пор, пока темно-синяя окраска не
исчезла. Отметить объем раствора тиосульфата пошедший на титрование.
Результаты анализа
количества йода в пищевой йодированной соли в зависимости от срока хранения
занести в таблицу.
Таблица 5.22.Результаты наблюдений
|
Дата |
Дата исследования |
Срок |
Объем Na2S2O3, |
Результат, |
Норма |
|
40,0 ± |
|||||
|
40,0 ± |
|||||
|
40,0 ± |
6.Литература.
Интернет-ресурсы
1. Алексинский, В.Н. Занимательные опыты по
химии: Книга для учителя [Текст] / В.Н. Алексинский.– М.: Просвещение, 1995.
2. Балаев, И.И. Домашний эксперимент по
химии: Пособие для учителей. Из опыта работы [Текст] / И.И.Балаев,– М.: Просвещение,
1977.
3.Габриелян О.С., Остроумов И.Г. Химия: учебник для студентов
профессиональных образовательных организаций, осваивающих профессии и
специальности СПО. – М., 2017.
4.Габриелян О.С., Остроумов И.Г. Химия для профессий и специальностей
естественно-научного профиля: учебник для студентов профессиональных
образовательных организаций, осваивающих профессии и специальности СПО. – М.,
2017.
5.Габриелян О.С. и др. Химия. Практикум: учеб. пособие для студентов
профессиональных образовательных организаций, осваивающих профессии и
специальности СПО. –М., 2017.
6.Степин Б.Д.Занимательные задания и
эффективные опыты по химии: Книга для учителя [Текст]/ Б.Д.Степин,
Л.Ю.Аликберова.- М.:Дрофа,2002.
7. Шелпакова, Н.А.Мастяева Л.В.,Кузнецова О.К.
Химический эксперимент в школе и дома: пособие для учителей [Текст] /
Н.А.Шелпакова,Л.В.Мастяева, О.К. Кузнецова.- Тюмень: ТГУ,2000.
8 .Штремплер, Г.И. Химия на досуге.
Домашняя химическая лаборатория: Книга для учащихся [Текст] / Г.И. Штремплер. —
М.: Просвещение, 1996.
9. Исаев, Д.С. Об использовании домашнего
эксперимента в 8-11 классах [Текст] / Д. С. Исаев // Химия в школе:
научно-методический журнал. — 2009. — № 2. — С. 56-61.
10. Трухина, М.Д., Кругликова Е.Г. Домашний
эксперимент.\Химия: Приложение к « 1 сентября» 2000 Г. №13.
11. http://ru.wikipedia.org/wik
12.https://www.youtube.com/watch?v=ALaQ9aoR1vw
(силикатный сад).
13.https://www.youtube.com/watch?v=Of9oztl_O5k ( омыление жиров).
14 .https://www.youtube.com/watch?v=brQL5Tf_a5s( коррозия металлов).
15.https://www.youtube.com/watch?v=YAjMzWMf7jo ( коррозия металлов).
16.https://www.youtube.com/watch?v=riICIO_wDpM
(качественная реакция на глюкозу, сахарозу).
17.https://www.youtube.com/watch?v=geyz_MDx4UE
(биуретовая реакция).
18.https://www.youtube.com/watch?v=2Bl6RIX6YnE (
определение йоды).
19.https://www.youtube.com/watch?v=-ztOdsqO2Z8
(выращивание кристаллов).
Станислав Яблоков,
Ярославский государственный университет им. П. Г. Демидова
«Наука и жизнь» №2, 2014
Вот уже два года, как я наблюдаю за микромиром у себя дома, и год, как снимаю его на фотокамеру. За это время собственными глазами увидел, как выглядят клетки крови, чешуйки, опадающие с крыльев бабочек, как бьётся сердце улитки. Конечно, многое можно было бы узнать из учебников, видеолекций и тематических сайтов. Но при этом не было бы ощущения присутствия, близости к тому, что не видно невооружённым глазом. Что это не просто слова из книжки, а личный опыт. Опыт, который сегодня доступен каждому.
Что купить
Театр начинается с вешалки, а микросъёмка с покупки оборудования, и прежде всего — микроскопа. Одна из основных его характеристик — набор доступных увеличений, которые определяются произведением увеличений окуляра и объектива.
Не всякий биологический образец хорош для просмотра при большом увеличении. Связано это с тем, что чем больше увеличение оптической системы, тем меньше глубина резкости. Следовательно, изображение неровных поверхностей препарата частично будет размыто. Поэтому важно иметь набор объективов и окуляров, позволяющий вести наблюдения с увеличением от 10–20 до 900–1000×. Иногда бывает оправданно добиться увеличения 1500× (окуляр 15 и объектив 100×). Большее увеличение бессмысленно, так как более мелкие детали не позволяет видеть волновая природа света.
Следующий немаловажный момент — тип окуляра. «Сколькими глазами» вы хотите рассматривать изображение? Обычно выделяют монокулярную, бинокулярную и тринокулярную его разновидности. В случае монокуляра придётся щуриться, утомляя глаз при длительном наблюдении. В бинокуляр смотрят обоими глазами (не следует путать его со стереомикроскопом, дающим объёмное изображение). Для фото- и видеосъёмки микрообъектов понадобится «третий глаз» — насадка для установки аппаратуры. Многие производители выпускают специальные камеры для своих моделей микроскопов, но можно использовать и обычный фотоаппарат, купив к нему переходник.
Наблюдение при больших увеличениях требует хорошего освещения в силу небольшой апертуры объективов. Световой пучок от осветителя, преобразованный в оптическом устройстве — конденсоре, освещает препарат. В зависимости от характера освещения существует несколько способов наблюдения, самые распространённые из которых — методы светлого и тёмного поля. В первом, самом простом, знакомом многим ещё со школы, препарат освещают равномерно снизу. При этом через оптически прозрачные детали препарата свет распространяется в объектив, а в непрозрачных он поглощается и рассеивается. На белом фоне получается тёмное изображение, отсюда и название метода. С тёмнопольным конденсором всё иначе. Световой пучок, выходящий из него, имеет форму конуса, лучи в объектив не попадают, а рассеиваются на непрозрачном препарате, в том числе и в направлении объектива. В итоге на тёмном фоне виден светлый объект. Такой метод наблюдения хорош для исследования прозрачных малоконтрастных объектов. Поэтому, если вы планируете расширить набор методов наблюдения, стоит выбирать модели микроскопов, в которых предусмотрена установка дополнительного оборудования: конденсора тёмного поля, тёмнопольной диафрагмы, устройств фазового контраста, поляризаторов и т. п.
Оптические системы не идеальны: прохождение света через них сопряжено с искажениями изображения — аберрациями. Поэтому объективы и окуляры стараются изготавливать так, чтобы эти аберрации максимально устранить. Всё это сказывается на их конечной стоимости. Из соображений цены и качества имеет смысл покупать планахроматические объективы для профессиональных исследований. Сильные объективы (с увеличением, например, 100×) имеют числовую апертуру больше 1 при использовании иммерсии, масла с высоким показателем преломления, раствора глицерина (для УФ-области) или просто воды. Поэтому, если кроме «сухих» объективов вы берёте ещё и иммерсионные, стоит заранее позаботиться об иммерсионной жидкости. Её показатель преломления обязательно должен соответствовать конкретному объективу.
Иногда следует обратить внимание на устройство предметного столика и рукояток для управления им. Стоит выбрать и тип осветителя, которым может быть как обычная лампа накаливания, так и светодиод, который ярче и греется меньше. Микроскопы тоже имеют индивидуальные особенности. Каждая дополнительная опция — это добавка в цене, поэтому выбор модели и комплектации остаётся за потребителем.
Сегодня нередко покупают недорогие микроскопы для детей, монокуляры с небольшим набором объективов и скромными параметрами. Они могут послужить хорошей отправной точкой не только для исследования микромира, но и для ознакомления с основными принципами работы микроскопа. После этого ребёнку уже стоит купить более серьёзное устройство.
Как смотреть
Можно купить далеко не дешёвые наборы готовых препаратов, но тогда не таким ярким будет ощущение личного участия в исследовании, да и наскучат они рано или поздно. Поэтому следует позаботиться и об объектах для наблюдения, и о доступных средствах для подготовки препаратов.
Наблюдение в проходящем свете предполагает, что исследуемый объект достаточно тонок. Даже кожура ягоды или фрукта слишком толста, поэтому в микроскопии исследуют срезы. В домашних условиях их делают обычными бритвенными лезвиями. Чтобы не смять кожуру, её помещают между кусочками пробки или заливают парафином. При определённой сноровке можно достигнуть толщины среза в несколько клеточных слоёв, а в идеале следует работать с моноклеточным слоем ткани — несколько слоёв клеток создают нечёткое сумбурное изображение.
Исследуемый препарат помещают на предметное стекло и в случае необходимости закрывают покровным. Купить стёкла можно в магазине медицинской техники. Если препарат плохо прилегает к стеклу, его фиксируют, слегка смачивая водой, иммерсионным маслом или глицерином. Не всякий препарат сразу открывает свою структуру, иногда ему нужно «помочь», подкрасив его форменные элементы: ядра, цитоплазму, органеллы. Неплохими красителями служат йод и «зелёнка». Йод достаточно универсальный краситель, им можно окрашивать широкий спектр биологических препаратов.
При выезде на природу следует запастись баночками для набора воды из ближайшего водоёма и маленькими пакетиками для листьев, высохших остатков насекомых и т. п.
Что смотреть
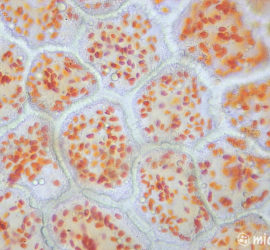
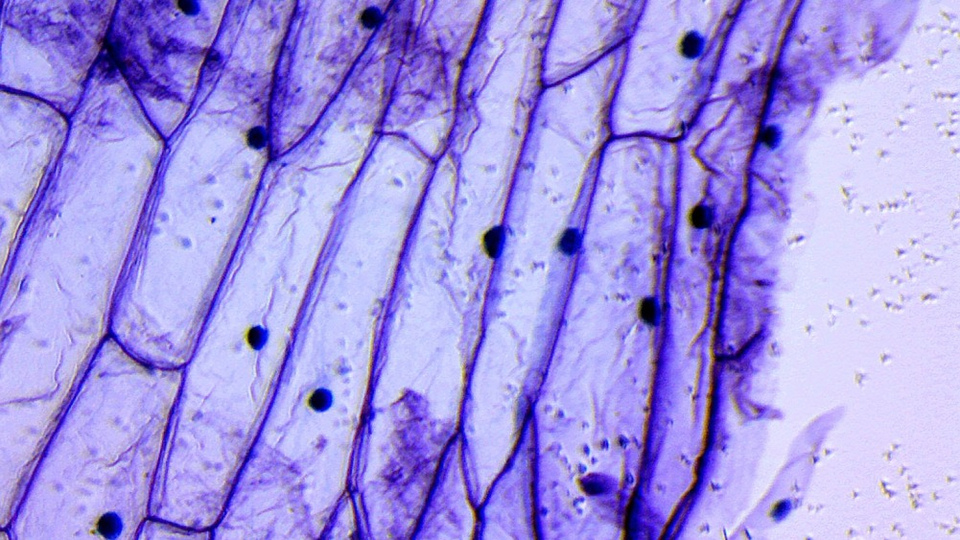
Микроскоп приобретён, инструменты закуплены — пора начинать. И начать следует с самого доступного — например, кожуры репчатого лука. Тонкая сама по себе, подкрашенная йодом, она обнаруживает в своём строении чётко различимые клеточные ядра. Этот опыт, хорошо знакомый со школы, и стоит провести первым. Луковую кожуру нужно залить йодом на 10–15 минут, после чего промыть под струёй воды.
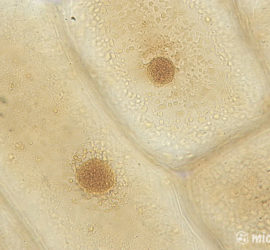
Кроме того, йод можно использовать для окраски картофеля. Срез необходимо сделать как можно более тонким. Буквально 5–10 минут его пребывания в йоде проявят пласты крахмала, который окрасится в синий цвет.
На балконах часто скапливается большое количество трупиков летающих насекомых. Не торопитесь от них избавляться: они могут послужить ценным материалом для исследования. Как видно из фотографий, вы обнаружите, что на крыльях насекомых есть волоски, которые защищают их от намокания. Большое поверхностное натяжение воды не позволяет капле «провалиться» сквозь волоски и коснуться крыла.
Если вы когда-нибудь задевали крыло бабочки или моли, то, наверное, замечали, что с неё слетает какая-то «пыль». На снимках отчётливо видно, что это не пыль, а чешуйки с крыльев. Они имеют разную форму и довольно легко отрываются.
Кроме того, с помощью микроскопа можно изучить строение конечностей насекомых и пауков, рассмотреть, например, хитиновые плёнки на спине таракана. И при должном увеличении убедиться, что такие плёнки состоят из плотно прилегающих (возможно, сросшихся) чешуек.
Не менее интересный объект для наблюдения — кожура ягод и фруктов. Однако либо её клеточное строение может быть неразличимым, либо её толщина не позволит добиться чёткого изображения. Так или иначе, придётся сделать немало попыток, прежде чем получится хороший препарат: перебрать разные сорта винограда, чтобы найти тот, у которого красящие вещества кожуры имели бы интересную форму, или сделать несколько срезов кожицы сливы, добиваясь моноклеточного слоя. В любом случае вознаграждение за проделанную работу будет достойным.
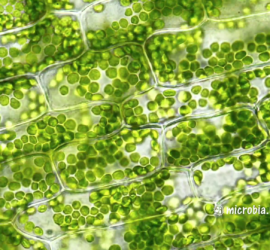
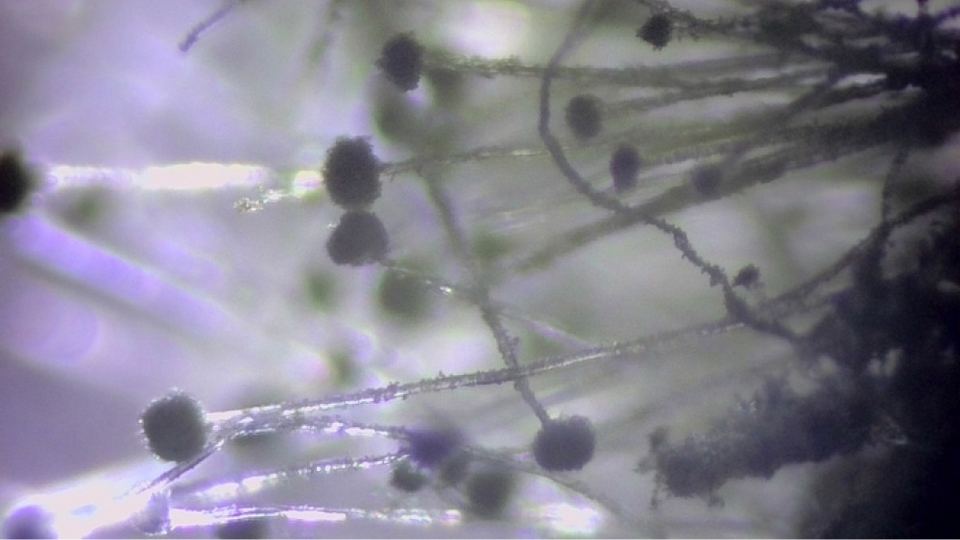
Ещё более доступны для исследования трава, водоросли, листья. Но, несмотря на повсеместную распространённость, выбрать и приготовить из них хороший препарат бывает непросто. Самое интересное в зелени — это, пожалуй, хлоропласты. Поэтому срез должен быть исключительно тонким.
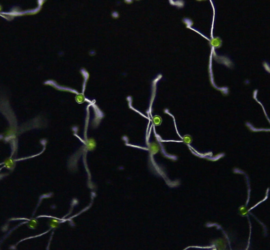
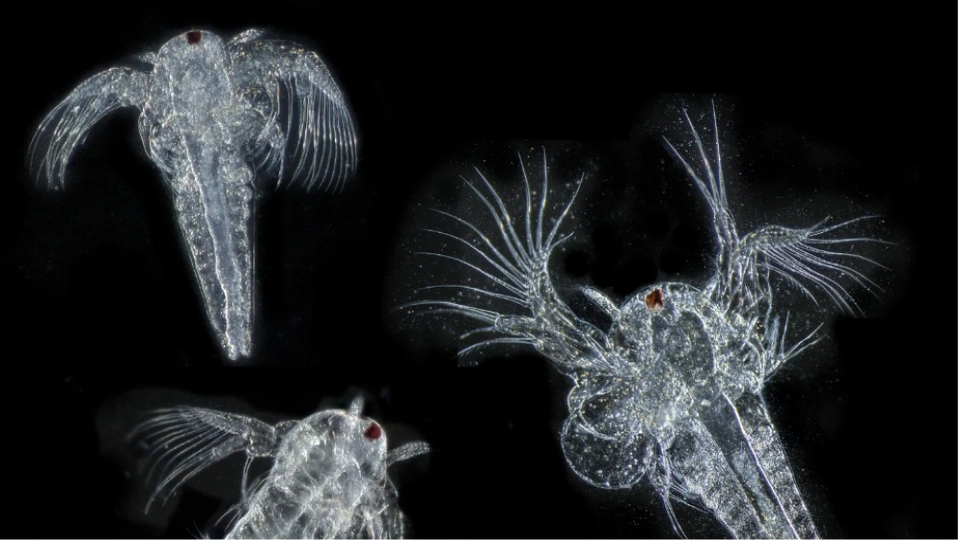
Приемлемой толщиной нередко обладают зелёные водоросли, встречающиеся в любых открытых водоёмах. Там же можно найти плавучие водоросли и микроскопических водных обитателей — мальков улитки, дафний, амёб, циклопов и туфелек. Маленький детёныш улитки, оптически прозрачный, позволяет разглядеть у себя биение сердца.
Сам себе исследователь
После изучения простых и доступных препаратов захочется усложнить технику наблюдения и расширить класс исследуемых объектов. Для этого понадобится и специальная литература, и специализированные средства, свои для каждого типа объектов, но всё-таки обладающие некоторой универсальностью. Например, метод окраски по Граму, когда разные виды бактерий начинают различаться по цвету, можно применить и для других, не бактериальных, клеток. Близок к нему и метод окраски мазков крови по Романовскому. В продаже имеется как уже готовый жидкий краситель, так и порошок, состоящий из его компонентов — азура и эозина. Их можно купить в специализированных магазинах либо заказать в интернете. Если раздобыть краситель не удастся, можно попросить у лаборанта, делающего вам анализ крови в поликлинике, стёклышко с окрашенным её мазком.
Продолжая тему исследования крови, следует упомянуть камеру Горяева — устройство для подсчёта количества клеток крови и оценки их размеров. Методы исследования крови и других жидкостей с помощью камеры Горяева описаны в специальной литературе.
***
В современном мире, где разнообразные технические средства и устройства находятся в шаговой доступности, каждый сам решает, на что ему потратить деньги. Это может быть дорогостоящий ноутбук или телевизор с запредельным размером диагонали. Находятся и те, кто отводит свой взор от экранов и направляет его далеко в космос, приобретая телескоп. Микроскопия может стать интересным хобби, а для кого-то даже и искусством, средством самовыражения. Глядя в окуляр микроскопа, проникают глубоко внутрь той природы, часть которой мы сами.
Фото автора.
«Наука и жизнь» о микросъёмке:
Микроскоп «Аналит» — 1987, №1.
Ошанин С. Л. С микроскопом у пруда. — 1988, №8.
Ошанин С. Л. Невидимая миру жизнь. — 1989, №6.
Милославский В. Ю. Домашняя микрофотография. — 1998, №1.
Мологина Н. Фотоохота: макро и микро. — 2007, №4.
Шелуха лука – удобный и доступный объект для микроскопических наблюдений кристаллических включений в растительных клетках. Ее нужно положить в капельку […]
Циклоз, или цитоплазматический ток, – это движение цитоплазмы внутри клеток, которое характерно для клеток растений, животных, грибов и простейших. Благодаря […]
Хвощи – очень древние растения, появившиеся более 350 млн лет назад и заставшие динозавров. Споры хвоща являются очень интересным объектом […]
Авокадо отличается от всех остальных фруктов не только несладким вкусом, но и высоким содержанием жира. Он достигает 25%, хотя типичное […]
Лейкопласты – это органоиды растительной клетки, отвечающие за синтез и хранение питательных веществ. Лейкопласты, запасающие крахмал, называются амилопластами. Лейкопласты бесцветны, […]
Хромопласты – это органоиды растительных клеток, в которых осуществляются синтез и хранение пигментов, отвечающих за яркую окраску. Например, хромопласты обеспечивают оранжевый […]
Кожица лука является классическим и самым простым растительным препаратом, который можно посмотреть под микроскопом и разглядеть клетки. Причин тому несколько: […]
Статьи
Внеурочная деятельность
Биология
На самоизоляции не хватает активности, хочется разнообразить день чем-то, кроме чтения книг и решения задач? Для вас мы подготовили инструкции к 5 простым биологическим экспериментам, которые вы можете проделать с детьми в домашних условиях. Текущая ситуация показала, что врачи — самая важная профессия. Быть может, пора мотивировать к ее выбору уже с младших классов?
15 апреля 2020
Извлечение ДНК
Звучит сложно и даже немного пугающе, правда? А ведь извлечение ДНК может быть выполнено с помощью обыкновенной кухонной утвари. Опыт можно провести с помощью слюны или имеющихся в наличии овощей и фруктов, например, клубники или бананов.

Необходимые материалы и аппаратура:
-
маленький чистый стакан
-
соль поваренная (1 чайная ложка)
-
образец (слюна)
-
сок ананаса
-
холодный спирт
-
средство для мытья посуды
-
питьевая трубочка
Общие шаги
1. Поместите немного слюны в небольшой стакан или другую маленькую емкость.
2. Добавьте несколько капель средства для мытья посуды.
3 Добавьте полную ложку ананасового сока в стакан, чтобы избавиться от всех клеточных белков.
4. Затем добавьте щепотку поваренной соли.
5. Тщательно перемешайте.
6. Теперь добавьте спирт и дайте ему осесть над смесью. Вы можете делать это с помощью питьевой трубочки, используя ее как пипетку, чтобы не налить слишком много.
7. Через некоторое время вы получите беловатый материал, похожий на слизь. Это ДНК.
Полученный материал вы можете разглядеть в микроскоп, если у вас таковой имеется.
Выращивание бактерий
Микроорганизмы, включая бактерии и дрожжи, являются наиболее распространенными патогенными микроорганизмами, присутствующими повсюду рядом с нами. Приготовление питательных сред для них можно легко провести у себя дома.
Подготовка домашних чашек Петри. Материалы и инструменты
-
Желатин
-
Кубик говяжьего бульона
-
Сахар (2 чайные ложки)
-
1 чашка кипяченой воды
-
Перчатки
-
Чашка
-
Небольшая крышка
Общие шаги
1. Добавьте все ингредиенты в миску.
2. Хорошо перемешайте, пока все не растворится.
3. Теперь перенесите раствор в любую мелкую посуду, накройте ее крышкой, чтобы избежать внешних загрязнений.
4. Поместите посуду с раствором в холодильник на одну ночь.
5. Используйте ватный диск, чтобы взять образец раствора.
6. Нанесите мазок на чашку Петри, закройте ее, и оставьте расти на несколько дней.
7. Белые колонии будут видны под микроскопом.
Изменение цвета цветов
Необходимые материалы
-
цветы (желательно с белыми или светлыми лепестками)
-
чернила
-
стакан
-
вода
Один из самых простых экспериментов, которые вы можете сделать. Поместите цветок в стакан с водой и цветными чернилами. Через некоторое время вы увидите, что лепестки приобретают цветные прожилки того же цвета, что и чернила, которые вы добавили в воду.
Растения имеют систему водопроводящей ткани (называемую ксилемой), которая распределяет воду и некоторые питательные вещества по всем частям растения. Используя подкрашенную воду, мы видим эту систему в действии.
Размягчение скорлупы
Необходимые материалы:
-
яйца
-
уксус
-
банка с крышкой (очень важно, так как это не даст запаху выйти наружу!)
Поместите яйцо (со скорлупой) в банку с уксусом и накройте ее крышкой. Оставьте банку на несколько дней. Яйцо станет мягким как резиновый мячик. Подсветите его фонариком, чтобы рассмотреть внутреннюю структуру.
Дело в том, что яичная скорлупа состоит из карбоната кальция, который взаимодействуя с уксусной кислотой, размягчается.

Приготовление яйца без тепла
Необходимые материалы:
-
яйца
-
миска
-
алкоголь / уксус
Приготовление яйца заключается в денатурировании белков, которые присутствуют в клетке, содержащейся в скорлупе яйца.
Денатурация – процесс, при котором биомолекула (например, ДНК, белок) теряет свою трехмерную структуру.
Денатурация белка обычно достигается тепловым воздействием (кипячение или жарка). Другой способ состоит в добавлении таких соединений, как спирт, которые денатурируют белки через изменения их трехмерной структуры. Налейте в глубокую миску алкоголь (или уксус), положите туда яйцо так, чтобы слой жидкости покрыл его целиком. Закройте миску крышкой, чтобы замедлить испарение.
Яйцо таким способом готовиться будет долго и его вкусовые качества, увы, вас разочаруют. Но что не сделаешь ради науки?
В этой статье мы познакомимся с разновидностью опытов и экспериментов с нашим детским микроскопом. Любознательные детки с интересом познают мир. Детский микроскоп Green Clean с увеличением до 1200х станет прекрасным развивающим и познавательным подарком.
Ниже приводим 5 самых популярных опытов с микроскопом на основании исследования и опроса наших дорогих покупателей.
1. Разведение Артемий
Наблюдать за развитием и этапами роста живого организма очень любопытно. В наш набор для опытов мы включили инкубаторий для артемий. Артемии – один из самых древних видов ракообразных, простых в разведении.
Они предпочитают соленую среду, поэтому обитают в соленых озерах. Интересно, что рачки имеют розовый цвет за счет гемоглобина и каротиноидов в их крови. Поэтому в природе массовое скопление артемий придает воде розовый оттенок. Для того чтобы понаблюдать за жизненным циклом артемий, необходимо пошагово выполнить следующие действия. На каждом этапе можно рассматривать живые организмы под микроскопом.
Инструкция проведения опыта:
- Берем чистую емкость, наливаем 150 мл воды, добавляем 4 г морской или поваренной (не йодированной) соли и перемешиваем до полного растворения. Температура воды должна быть примерно 25 °С. Это будет раствор для жизнедеятельности наших микроорганизмов. Важное замечание: вода должна хорошо отстояться.
- Помещаем яйца артемий в емкость с раствором, накрываем и ставим в хорошо освещенное место. Не забываем постоянно поддерживать температуру раствора около 25 °С.
- Через 2-3 дня из яиц вылупляются личинки, которые называются науплии. Далее берем инкубаторий из набора, наливаем в него соляной раствор из емкости и с помощью пипетки перемещаем науплии в инкубаторий.
- В качестве подкормки для рачков можно использовать сухие дрожжи или корм для рыбок. Одной маленькой щепотки будет достаточно на 1-2 дня. Обязательно следите за качеством раствора, в котором живут артемии: если он стал мутным, нужно приготовить новый следуя пункту под номером 1.
- Рост микроорганизмов происходит в течение 1-2 месяцев. Спустя это время можно будет наблюдать за взрослыми особями.
Итак, вы вырастили потомство артемии! Вы смогли увидеть под окуляром микроскопа, как развиваются рачки: их яйца, процесс вылупления, личинок и, наконец, взрослых особей, которые передвигаются при помощи многочисленных конечностей.
2. Опыт с Кристаллами
Самые настоящие кристаллы вы сможете увидеть, если внимательно и старательно проведёте опыт по нашей инструкции.
- Наливаем в чистую емкость 2-4 ст.л. (30-60 мл) горячей воды, примерно 80-90 °С. Добавляем 1-2 ст.л. соли, можно больше — это опыт не испортит. Помешиваем соль до полного растворения. Для этих целей заранее подготовьте палочку или небольшую ложку.
- Затем возьмите чистое предметное стекло и при помощи пипетки капните на него 1-2 капли соляного раствора. Дождитесь полного высыхания. Чтобы не терять время, промойте емкость и пипетку от соли.
- Подготовьте микроскоп, поместите предметное стекло с высохшей каплей соли под окуляр и закрепите его. Опыт лучше проводить под лампочкой: необходимо направить свет таким образом, чтобы белые кристаллики начали сиять.
- Полюбуйтесь, как переливаются кристаллы соли. Они похожи на кубики, каждый из которых в свою очередь состоит из более мелких кубиков.
- После завершения опыта тщательно промойте стекло под краном и оставьте высыхать. При желании можно сохранить образец на память. Для этого на предметное стекло с кристаллами соли нанесите 1-2 капли резинового клея и накройте сверху покровным стеклом. Прижмите его, чтобы клей равномерно распределился.
Этот опыт можно дополнить и сравнить нерастворенную в воде соль с растворенной. Поместите под окуляр 2-3 крупицы соли и понаблюдайте разницу.
3. Опыт с луком
- Возьмите луковицу, отрежьте небольшой кусочек и проведите по предметному стеклу, словно делаете мазок кисточкой. Либо используйте из набора скальпель и отделите небольшое количество массы, которое будете изучать.
- С помощью пипетки капните сверху каплю воды, накройте покровным стеклом и поместите под микроскоп.
- Регулируйте кратность увеличения и рассматривайте клеточную структуру.
- Можно изготовить образцы из любых овощей или фруктов. К примеру, рассмотреть картофель и кукурузу и наблюдать разницу между картофельным и кукурузным крахмалом. У фруктов лучше видно клеточную мембрану.
- Чтобы изготовить постоянные слайды с образцами для повторного исследования, вместо воды используйте клеящее вещество. Перед тем как накрыть образец покровным стеклом, дайте клею полностью затвердеть.
Клеточную структуру нередко трудно разглядеть под микроскопом, но не расстраивайтесь, можно провести опыт с окрашенными мазками. Для этого необходимо подготовить слабый раствор йода: развести 1 каплю йода в чайной ложке воды.
Следуя описанной выше инструкции, вместо воды добавьте на образец каплю полученного раствора. Пипетку сразу тщательно промойте под краном. Поместите окрашенный образец под микроскоп и рассматривайте мельчайшие детали клетки фрукта или овоща!
4. Опыт с плесенью
В каждой семье так или иначе случается, что плесневеют некоторые продукты. Например, хлеб. При повышенной влажности, теплом воздухе и плохом воздухообмене появляется белая плесень. Испорченный продукт может стать образцом для нашего исследования.
Чтобы специально получить плесень:
- Достаточно небольшой кусочек хлеба поместить в целлофановый пакет и оставить на подоконнике. Результат вскоре проявится.
- С помощью пинцета поместите кусочек плесени на предметное стекло, накройте покровным стеклом.
Вы увидите строение гриба мукора: многочисленные тоненькие ниточки, или гифы. На конце гифов находятся спорангии, в которых образуются споры. Плесень размножается с помощью спор.
5. Изготовление собственного слайда
Вы самостоятельно можете создавать образцы и рассматривать их под микроскопом. Это могут быть листья растений, пыльца, волосы, кристаллы соли или сахара, кожура фрукта или овоща и т.д.
При необходимости можно использовать краситель или слабый раствор йода, например, для того чтобы рассмотреть клеточную структуру фруктов и овощей.
Вот еще несколько идей:
- Взгляните на мякоть авокадо: этот овощ обладает самым высоким содержанием жира. Жировые включения имеют форму мелких капель.
- Или возьмите какой-нибудь яркий овощ, например, красный перец. В его клетках содержатся хлоропласты, отвечающие за красный цвет. Их можно увидеть под микроскопом.
Пример рассмотрения волоса под микроскопом:
С микроскопом от Green Clean ребенок окунется в увлекательный мир биологии. Тренировать усидчивость и внимательность он сможет незаметно, в игровой форме. Собственные научные эксперименты и открытия преумножат тягу к познаниям окружающего мира и займут юного ученого на длительное время. Такой досуг станет прекрасным вариантом для всей семьи.
В каталоге ниже делимся нашими другими бестселлерами! Удачных покупок!