Антимикробные средства относятся клекарственным препаратам, эффективность которых является наиболее очевидной. Внедрение антибиотиков вмедицинскую практику привело кснижению летальности при наиболее тяжелых ишироко распространенных инфекционных болезнях (пневмония, менингит, эндокардит, туберкулез идр.), атакже уменьшению заболеваемости некоторыми социально значимыми болезнями (ревматическая лихорадка).
Первоначальные успехи применения антибиотиков и связанные с этим фактом оптимизм и дальнейшие перспективы разработки новых антимикробных средств позволили ученым и клиницистам в 1950-е и 1960-е гг. высказать мнение о победе медицины над микробами и реальном устранении инфекционных болезней как значительного фактора общественной жизни человечества. Однако вскоре ситуация осложнилась появлением устойчивых к антибиотикам стафилококков и пневмококков, а впоследствии и грамотрицательных бактерий, причем особую остроту проблема приобрела в последние 5–10 лет, когда в лечебных учреждениях стали распространяться микроорганизмы, устойчивые ко многим, а иногда и ко всем антибиотикам. Такая ситуация заставила специалистов высказать опасение о приближении «постантибиотической эры».
Основное ограничение эффективности антимикробных препаратов — это способность микроорганизмов вырабатывать устойчивость (резистентность) к их действию. Этот естественный процесс многократно ускоряется при необоснованном и избыточном применении антимикробных препаратов в качестве средств профилактики в медицине, средств самолечения широкими кругами населения, средств стимуляции роста животных и птиц в сельском хозяйстве. Угроза формирования и распространения антибактериальной резистентности была осознана научным сообществом практически сразу после появления первых антибиотиков, однако в течение многих лет проблема решалась за счет разработки и внедрения новых препаратов, преодолевающих устойчивость.
Ситуация стала меняться к худшему с середины 1990-х гг., когда в силу ряда экономических причин и фундаментальных биологических препятствий процесс разработки и внедрения в практическую медицину новых антимикробных препаратов замедлился, а процесс распространения резистентности ускорился за счет роста потребления этих препаратов, прежде всего за счет их доступности. Осознание угрозы резистентности нашло отражение в принятом ВОЗ в 2001 г. документе «Глобальная стратегия по сдерживанию устойчивости к противомикробным препаратам». В этом документе были предложены конкретные меры по сдерживанию антибактериальной резистентности на государственном уровне, а их реализацию было рекомендовано рассматривать как приоритет в деятельности национальных систем здравоохранения [1].
Однако в глобальном плане эти меры оказались недостаточными. Результаты различных эпидемиологических исследований документируют рост и распространение антибиотикорезистентных микроорганизмов как в стационарах, так и вне их [2–6]. Это объясняется тем, что формирование устойчивости микробов к антибиотикам — процесс многофакторный, причем многие его составляющие взаимосвязаны. Известно, что использование антибиотиков сопровождается селективным давлением на возбудителей заболевания, что ведет к росту их устойчивости к используемым антибиотикам и снижению их эффективности. Другим, гораздо более глобальным по последствиям феноменом, является формирование устойчивости не только у микробов — возбудителей инфекции, но и среди представителей сапрофитной микрофлоры, не являющихся этиологически значимыми. Этот феномен получил название «сопутствующий ущерб» (collateral damage) антибиотикотерапии. Таким образом, распространение антибиотикорезистентных возбудителей инфекций находится в прямой зависимости от количества назначаемых антибиотиков и широты их антимикробного спектра.
В глобальном плане наибольшее количество антимикробных препаратов назначается врачами первичного звена, прежде всего для лечения острых респираторных инфекций. Поэтому определяющими составляющими сдерживания антибиотикорезистентности являются ограничение потребления антибиотиков в амбулаторной практике и рационализация их использования. Комплекс мероприятий по рационализации применения антимикробных препаратов с целью повышения их эффективности и сдерживания антибиотикорезистентности был разработан экспертами Альянса клинических химиотерапевтов и микробиологов и опубликован в 2014 г. в виде рекомендаций по стратегии и тактике применения антимикробных препаратов в лечебных учреждениях первичного звена России [7, 8]. Ключевые положения по рациональному использованию антибиотиков у детей при инфекциях респираторного тракта, изложенные в указанных выше рекомендациях, представлены в настоящей публикации. При этом особое внимание обращается на общие положения, которые обозначены как 10 принципов рационального применения антимикробных средств в амбулаторной практике (табл. 1).

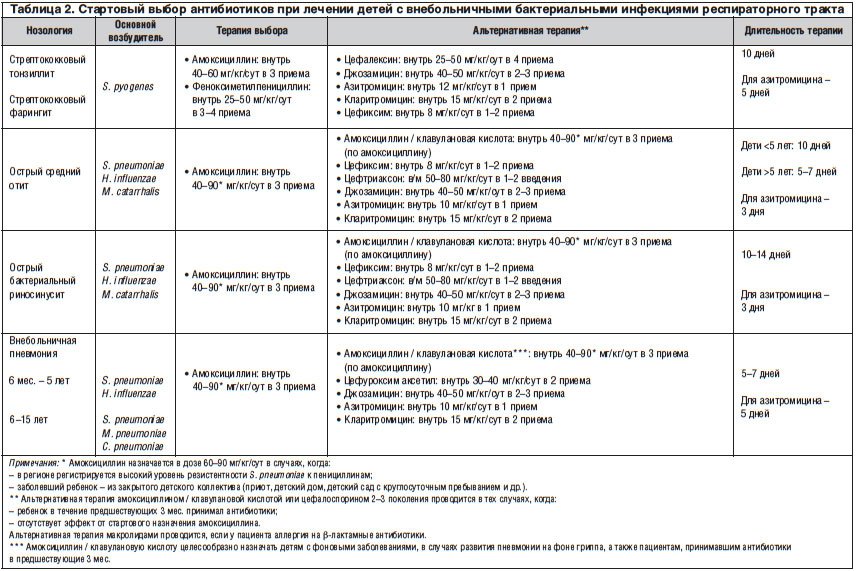
Данные об основных бактериальных возбудителях заболеваний органов дыхания у детей, а также тактика стартовой антибиотикотерапии приведены в таблице 2. Как видно из представленных данных, основным бактериальным возбудителем острого тонзиллофарингита является β-гемолитический стрептококк группы, А (БГСА) [7–10]. Однако провести дифференциальный диагноз между тонзиллофарингитами вирусной и бактериальной этиологии на основании исключительно клинических данных — весьма трудная задача. В связи с этим возрастает роль экспресс-методов верификации. Подтверждение стрептококковой этиологии тонзиллофарингита считается обоснованием незамедлительного назначения антибактериальной терапии. Следует подчеркнуть, что БГСА продолжает сохранять высокую чувствительность к пенициллину и амоксициллину, что позволяет рекомендовать их в качестве препаратов выбора. При использовании пенициллинов в предшествующие месяцы или при рецидивирующем стрептококковом тонзиллофарингите показана альтернативная терапия амоксициллином / клавулановой кислотой или пероральными цефалоспоринами (цефалексин, цефиксим). Макролиды могут быть рекомендованы только при аллергии на β-лактамные антибиотики. Продолжительность антибактериальной терапии не должна быть меньше 10 дней (исключение — азитромицин), что является непременным условием для эрадикации возбудителя и предупреждения осложнений (табл. 2).
Основными бактериальными возбудителями острого среднего отита и синусита являются Streptococcus (S.) pneumoniaе, Haemophilus (Н.) influenzae и реже — Moraxella (М.) catarrhalis. Большинство штаммов указанных возбудителей по-прежнему сохраняют высокую чувствительность к аминопенициллинам (амоксициллин, амоксициллин / клавулановая кислота) и цефалоспоринам третьего поколения (цефтриаксон, цефиксим и др.), что и определяет их выбор в качестве препаратов выбора. Макролиды могут быть использованы только в том случае, если имеются указания на аллергию к β-лактамным антибиотикам (табл. 2). Особо следует отметить, что абсолютными показаниями для назначения антибиотиков при остром среднем отите являются гноетечение из уха и двустороннее поражение у детей в возрасте до 2 лет [7–10].
Среди бактериальных поражений респираторного тракта особое место занимают пневмонии. У детей дошкольного возраста наиболее частым бактериальным возбудителем внебольничных пневмоний является S. pneumoniaе, реже заболевание вызывается H. influenzaе [11–16]. Учитывая этиологические особенности пневмонии, препаратом первого ряда является амоксициллин. В том случае, когда в регионе регистрируется высокий уровень резистентности S. pneumoniae к пенициллинам, дозу амоксициллина необходимо повысить до 60–90 мг/кг/сут. Аналогичную тактику используют и тогда, когда заболевший ребенок находится в коллективе закрытого типа (табл. 2). У детей школьного возраста основным возбудителем внебольничных пневмоний также является S. рneumoniaе. Однако нередко этиологическими факторами пневмонии у детей указанной возрастной группы становятся Mycoplasma (М.) рneumoniae и Chlamydia (С.) рneumoniaе [11–16]. В связи с особенностями этиологии внебольничных пневмоний у детей школьного возраста стартовая антибиотикотерапия может проводиться не только аминопенициллинами или цефалоспоринами, но и макролидами — в случае подозрения на атипичную этиологию пневмонии (табл. 2).
Активное внедрение в педиатрическую практику принципов антибактериальной терапии, изложенных в представленных рекомендациях, позволит не только добиться положительного результата лечения и уменьшения частоты осложнений, но и существенно снизит риск селекции антибиотикоустойчивых штаммов.
Инфекции нижних дыхательных путей (ИНДП) являются одними из наиболее распространенных заболеваний человека и до настоящего времени занимают ведущее место в структуре заболеваемости и смертности от инфекционных болезней. Так, в отношении заболеваемости внебольничной пневмонией (ВП) известно, что ежегодно общее число взрослых больных ВП в пяти европейских странах (Великобритания, Франция, Италия, Германия, Испания) превышает 3 млн человек, в США регистрируется порядка 5–6 млн случаев заболевания, а в РФ расчетные данные говорят о 1,5 млн заболевших в год [1–3]. Хронической обструктивной болезнью легких (ХОБЛ) в странах Евросоюза и Северной Америки страдают от 4% до 10% взрослого населения [4]. При этом в структуре общей смертности среди лиц старше 45 лет ХОБЛ занимает 4-е место, уступая только сердечно-сосудистым, цереброваскулярным заболеваниям и пневмонии, ежегодно становясь причиной смерти более 2,75 млн человек [5]. Кроме всего прочего, эксперты ВОЗ прогнозируют, что к 2020 г. общемировая распространенность ХОБЛ переместится с 12-го места на 5-е, а смертность от этого заболевания к 2030 г. удвоится [6].
Этиология ИНДП
В этиологии ВП преимущественное значение имеют Streptococcus pneumoniae, выявляемый в 30–50% случаев заболевания [7], и «атипичные» микроорганизмы, на долю которых приходится от 8% до 30% — Chlamydophila pneumonae, Mycoplasma pneumoniae и Legionella pneumophila [8]. Haemophilus influenzae, Staphylococcus aureus, Klebsiella pneumoniae и Pseudomonas aeruginosa встречаются реже (3–10%). Гемофильная палочка выявляется чаще всего у больных ВП с сопутствующей хронической бронхолегочной патологией, у курильщиков. Клиническое значение K. pneumoniae, S. аureus и P. aeruginosa возрастает при наличии таких факторов риска, как алкоголизм, проживание в домах престарелых, наличие сопутствующих заболеваний, длительная терапия пероральными кортикостероидами и частые/повторные курсы антибактериальной терапии [9, 10]. P. aeruginosa выделяется, как правило, у больных с бронхоэктатической болезнью, муковисцидозом.
Основными возбудителями инфекционного обострения ХОБЛ являются H. influenzae, S. pneumoniae и Moraxella catarrhalis, удельный вес которых, по данным различных исследователей, составляет 13–46%, 7–26% и 9–20% соответственно [11–13]. Реже из образцов мокроты больных ХОБЛ выделяют Haemophilus parainfluenzae, S. aureus, P. aeruginosa и представителей семейства Enterobacteriaceae [14, 15]. Удельный вес «атипичных» возбудителей — Mycoplasma pneumoniae и Chlamidophila pneumoniae в развитии обострений составляет порядка 5%, однако точная распространенность данных инфекций пока неизвестна. Так, в одних исследованиях маркеры острой хламидийной инфекции выявляются в 5–10% случаев [16], а в других отсутствуют [17]. Порядка 30% обострений ХОБЛ имеют вирусную природу [18, 19]. Чаще всего выявляют риновирусы — 20–25%, реже вирусы гриппа — 3–10% [13, 20]. Кроме всего прочего, доказано, что вирусная инфекция служит неким «проводником» развития обострения в более чем 50% случаев [21].
Антибиотикорезистентность основных возбудителей ИНДП
Существенную проблему представляет растущая во всем мире резистентность S. pneumoniae к пенициллину. Так, по данным многоцентрового исследования Alexander Project, распространенность резистентных штаммов пневмококка варьирует от 0% до 56% [22]. При этом устойчивость S. pneumoniae к пенициллину часто ассоциируется с резистентностью к другим группам антибиотиков (макролиды, тетрациклины). Данные о резистентности клинических штаммов S. pneumoniae в Российской Федерации в 2006–2009 гг. представлены в табл. 1. Они свидетельствуют о том, что уровень устойчивости пневмококков к пенициллину в нашей стране остается стабильным и не превышает 10%, при этом в большинстве случаев выявляются умеренно резистентные штаммы [23]. В то же время к основному антибиотику, применяемому в амбулаторной практике, — амоксициллину частота умеренно резистентных штаммов не превышает 0,4%. Уровень устойчивости H. influenzae к аминопенициллинам в России также остается низким, составляя 4,7% [24].
Современные режимы антибактериальной терапии ВП
Алгоритм эмпирической антибиотикотерапии ВП представлен в табл. 2. Целесообразно выделять группы пациентов с ВП, различающиеся по степени тяжести заболевания, наличию сопутствующей патологии и предшествующему приему антибактериальных препаратов, что в свою очередь позволяет актуализировать круг потенциальных возбудителей заболевания и, соответственно, определить направления антибактериальной терапии. В соответствии с данным подходом выделяют пациентов с ВП нетяжелого течения, не требующих госпитализации и наблюдающихся в амбулаторных условиях, пациентов с ВП, требующих госпитализации, и больных с тяжелым течением ВП [1].
В отношении амбулаторных пациентов с нетяжелой ВП можно также провести разделение на две группы, которые различаются между собой по этиологической структуре и тактике антибактериальной терапии. В первую группу включены пациенты без сопутствующих заболеваний, не принимавших в последние 3 месяца антибактериальные препараты. В качестве средств выбора рекомендуются амоксициллин или «современные» макролидные антибиотики (азитромицин, кларитромицин). Макролидам следует отдавать предпочтение при непереносимости бета-лактамных антибиотиков или при подозрении на атипичную этиологию заболевания (M. pneumoniae, C. pneumoniae). В то же время использование «респираторных» фторхинолонов (левофлоксацин, моксифлоксацин, гемифлоксацин) у пациентов без сопутствующей патологии и/или при отсутствии факторов риска инфицирования лекарственно-устойчивыми пневмококками не приветствуется, так как широкое использование препаратов данной группы может привести к селекции антибиотикорезистентных штаммов микроорганизмов [3].
Во вторую группу включены пациенты, получавшие в последние 3 месяца антибактериальные препараты, и больные сопутствующими заболеваниями (ХОБЛ, сахарный диабет, застойная сердечная недостаточность, заболевания печени, злоупотребление алкоголем, наркомания, дефицит массы тела, курение). Учитывая вероятность участия в этиологии заболевания полирезистентных пневмококков1, грамотрицательных микроорганизмов2 (в том числе обладающих некоторыми механизмами антибиотикорезистентности), а также ко-инфекции, пациентам данной группы рекомендовано проведение комбинированной терапии — «защищенный» аминопенициллин + макролид. Альтернативой может быть применение «респираторных» фторхинолонов (левофлоксацин, моксифлоксацин, гемифлоксацин). Режимы дозирования препаратов представлены в табл. 3.
Рекомендуемый режим приема антибактериальных препаратов при нетяжелой ВП — пероральный. Парентеральное введение антибиотиков при нетяжелой ВП должно применяться лишь в единичных случаях (например, предполагаемая низкая комплаентность больного). В таких случаях применяются цефалоспорины III поколения (желательно, цефтриаксон). Антибактериальная терапия при нетяжелой ВП может быть завершена по достижении стойкой нормализации температуры тела (< 37,5 °С) в течение 3–4 дней. При таком подходе средняя продолжительность терапии составляет 7–10 дней. В случае наличия клинических и/или эпидемиологических данных о микоплазменной или хламидийной этиологии ВП продолжительность терапии составляет 14 дней.
У пациентов с ВП, требующей госпитализации, стартовая терапия предполагает использование парентеральных антибиотиков, при этом предпочтительным является использование ступенчатой терапии. Рекомендованными режимами терапии являются парентеральные бета-лактамы (бензилпенициллин, ампициллин, «ингибиторозащищенные» аминопенициллины, цефалоспорины III поколения) в комбинации с «современными» макролидами (азитромицином либо кларитромицином) для перорального приема. Доказано, что наличие в стартовом режиме терапии препарата, активного в отношении «атипичных» микроорганизмов, улучшает прогноз и сокращает продолжительность пребывания пациентов в стационаре [1, 3]. Кроме того, комбинированная терапия «бета-лактам + макролид» характеризуется более низкой частотой неэффективности терапии по сравнению с монотерапией [25, 26]. Альтернативным режимом лечения является ступенчатая терапия «респираторными» фторхинолонами (левофлоксацин, моксифлоксацин).
Режим терапии в случае тяжелой ВП у госпитализированных в отделение реанимации и интенсивной терапии (ОРИТ) пациентов должен быть направлен против S. pneumoniae, Legionella spp., представителей рода Enterobacteriaceae. В этой связи препаратами выбора для лечения ВП в ОРИТ являются внутривенные цефалоспорины III поколения или «ингибиторозащищенные» пенициллины (амоксициллин/клавуланат) в комбинации с макролидами для внутривенного введения (эритромицин, кларитромицин, спирамицин и азитромицин). Альтернативой является парентеральное использование «респираторных» фторхинолонов (левофлоксацин, моксифлоксацин) в комбинации с цефалоспоринами III поколения (цефотаксим, цефтриаксон). В случае тяжелой ВП, вызванной P. aeruginosa3, препаратами выбора являются цефтазидим, цефепим, цефоперазон/сульбактам, тикарциллин/клавуланат, пиперациллин/тазобактам, карбапенемы (меропенем, имипенем), ципрофлоксацин. Все вышеуказанные препараты можно применять в монотерапии либо в комбинации с аминогликозидами II–III поколения (нетилмицин, амикацин). При подозрении на аспирацию рекомендовано применение амоксициллина/клавуланата, амоксициллина/сульбактама, цефоперазона/сульбактама, тикарциллина/клавуланата, пиперациллина/тазобактама, карбапенемов.
Обострение ХОБЛ
Классическими признаками, характеризующими обострение заболевания, являются критерии, предложенные Anthonisen N. и соавт. [27]: появление или усиление одышки; увеличение объема отделяемой мокроты и усиление гнойности мокроты. Наличие всех трех вышеуказанных критериев описывается как I тип, двух из них — как II тип, одного — как III тип обострения заболевания. Наибольший эффект от применения антибиотиков наблюдается при наличии всех трех признаков [28], а также у лиц с выраженной бронхообструкцией [29]. Напротив, отсутствие гнойной мокроты является надежным предиктором небактериальной этиологии обострения, что делает назначение антибиотиков нецелесообразным [30]. Показаниями к назначению антимикробных препаратов при обострении ХОБЛ являются [31]:
- обострение ХОБЛ I типа;
- обострение ХОБЛ II типа при наличии гнойной мокроты;
- любое обострение ХОБЛ, требующее проведения неинвазивной или искусственной вентиляции легких.
Алгоритм антибактериальной терапии пациентов с инфекционным обострением ХОБЛ представлен в табл. 4. Антибиотиками выбора у пациентов с простым/неосложненным обострением ХОБЛ (нечастые (< 4) обострения заболевания в течение 12 месяцев, возраст до 60 лет, отсутствие серьезной сопутствующей патологии, незначительные или умеренные нарушения бронхиальной проходимости — объем форсированного выдоха за первую секунду (ОФВ1) ≥ 50% от должных значений) являются амоксициллин, «современные» макролиды (азитромицин, кларитромицин) и цефуроксима аксетил.
Напротив, в группе пациентов, переносящих осложненное обострение ХОБЛ (возраст пациента ≥ 60 лет, и/или выраженные нарушения вентиляционной функции легких — ОФВ1 < 50% от должных значений, и/или наличие серьезных сопутствующих заболеваний — сахарный диабет, застойная сердечная недостаточность, заболевания печени и почек с нарушениями их функции и др., и/или ≥ 4 обострения в течение 12 месяцев, и/или госпитализации по поводу обострения в предшествующие 12 месяцев, и/или использование системных глюкокортикостероидов или антибиотиков в предшествующие 3 месяцев), рекомендуется применение «респираторных» фторхинолонов (левофлоксацин, моксифлоксацин, гемифлоксацин) или ингибиторозащищенных пенициллинов. Присутствие же факторов риска синегнойной инфекции (ОФВ1 < 35% от должных значений, хроническое отделение гнойной мокроты, наличие бронхоэктазов, предшествующее выделение P. aeruginosa из мокроты) определяет выбор в пользу левофлоксацина.
Продолжительность антибактериальной терапии составляет, как правило, не менее 7 дней. Путь введения антибиотиков выбирается исходя из степени тяжести обострения. Режимы дозирования препаратов представлены в табл. 3. Для амбулаторных пациентов предпочтительным является пероральный прием антимикробных препаратов, в случае тяжелого обострения возможно назначение парентеральных антибиотиков. В случае клинической неэффективности, рецидива или возникновения очередного обострения ХОБЛ в течение трех месяцев после проведения курса антибактериальной терапии целесообразно назначать препарат, обладающий клинической и микробиологической эффективностью в отношении потенциального возбудителя обострения, но относящийся к другому классу антибиотиков.
Литература
- Чучалин А. Г., Синопальников А. И., Козлов Р. С. и соавт. Внебольничная пневмония у взрослых. Практические рекомендации по диагностике, лечению и профилактике. Москва: 2010. 82 с.
- Woodhed M., Blasi F., Ewig S. et al. Guidelines for the management of adult lower respiratory tract infections // Eur Respir J. 2005; 26: 1138–1180.
- Mandell L. A., Wunderink R. G., Anzueto A. et al. Infectious Diseases Society of America/American Thoracic Society Consensus Guidelines on the Management of Community-Acquired Pneumonia in Adults. Доступно на: http: // www.thoracic.org/sections/publications/statements/pages/mtpi/idsaats-cap.html.
- Roche N., Huchon G. Epidemiology of chronic obstructive pulmonary disease // Rev Prat. 2004; 54 (13): 1408–1413.
- World Health Report 2000. Health systems: improving performance. Annex table 3. 2000 World Health Organization. Geneva, Switzerland.
- Lopez A. D., Murray C. The global burden of disease 1990–2020 // Nat Med. 1998; 4: 1241–1243.
- Jokinen C., Heiskanen L., Juvonen H. et al. Microbial etiology of community-acquired pneumonia in the adult population of 4 municipalities in Eastern Europe // Clin Infect Dis. 2001; 32: 1141–1154.
- Marrie T. J., Peeling R. W., Fine M. J. et al. Ambulatory patients with community-acquired pneumonia: the frequency of atypical agents and clinical course // Am J Med. 1996; 101: 508–515.
- Paganin F., Lilienthal F., Bourdin A. et al. Severe community-acquired pneumonia: assessment of microbial aetiology as mortality factor // Eur Respir J. 2004; 24: 779–785.
- Arancibia F., Bauer T. T., Ewig S. et al. Community-acquired pneumonia due to gram-negative bacteria and Pseudomonas aeruginosa: incidence, risk, and prognosis // Arch Intern Med. 2002; 162: 1849–1858.
- Sethi S. Bacteria in exacerbations of chronic obstructive pulmonary disease // The Proceedings of the American Thoracic Society. 2004; 1: 109–4.
- Murphy T., Parameswaran G. Moraxella catarrhalis, a human respiratory tract pathogen // Clin Infect Dis. 2009; 49 (1): 124–131.
- Sethi S., Murphy T. Infection in the pathogenesis and course of chronic obstructive pulmonary disease // N Engl J Med. 2008; 359: 2355.
- Murphy T., Brauer A., Eschberger K. et al. Pseudomonas aeruginosa in chronic obstructive pulmonary disease // Am J Respir Crit Care Med. 2008; 177 (8): 853–860.
- Donaldson G., Seemungal T., Bhowmik A. et al. The relationship between exacerbation frequency and lung function decline in chronic obstructive pulmonary disease // Thorax. 2002; 57: 847–852.
- Sethi S. Infectious exacerbations of chronic bronchitis: diagnosis and management // J Antimicrob Chemother. 1999; 43 (Suppl. A): 97–105.
- Diederen B., van der Valk P., Kluytmans J. et al. The role of atypical respiratory pathogens in exacerbations of chronic obstructive pulmonary disease // Eur Respir J. 2007; 30: 240–244.
- Sethi S., Murphy T. F. Bacterial Infection in Chronic Obstructive Pulmonary Disease in 2000: a State-of-the-Art Review // Clinical Microbiology Reviews. 2001; 14 (2): 336–363.
- De Serres G., Lampron N., La Forge J. et al. Importance of viral and bacterial infections in chronic obstructive pulmonary disease exacerbations // J Clin Virol. 2009; 46 (2): 129–33.
- Seemungal T., Harper-Owen R., Bhowmik A. et al. Rhinovirus infects the lower respiratory tract during COPD exacerbation // Thorax. 1999; 54 (Suppl 3): Abstract.A70.
- Kherad O., Rutschmann O. Viral Infections as a Cause of Chronic Obstructive Pulmonary Disease (COPD) Exacerbation // Praxis. 2010; 99 (4): 235–240.
- Jacobs M. R., Felmingham D., Appelbaum P. C. et al. The Alexander Project 1998–2000: susceptibility of pathogens isolated from community-acquired respiratory tract infections to commonly used antimicrobial agents // J Antimicrob Chemother. 2003; 52: 229–246.
- Козлов Р. С., Сивая О. В., Кречикова О. И., Иванчик Н. В. с соавт. Динамика резистентности Streptococcus pneumoniae к антибиотикам в России за период 1999–2009 гг. (Результаты многоцентрового проспективного исследования ПеГАС) // Клин. микробиол. антимикроб. химиотер. 2010; 12 (4): 329–341.
- Решедько Г. К., Козлов Р. С. Состояние резистентности к антиинфекционным химиопрепаратам в России. В кн.: Практическое руководство по антиинфекционной химиотерапии. Под ред. Л. С. Страчунского, Ю. Б. Белоусова, С. И. Козлова. М., 2007; с. 32–47.
- Menendez R., Torres A., Zalacain R. et al. Risk factors of treatment failure in community acquired pneumonia: implications for disease outcome // Thorax. 2004. Vol. 59. P. 960–965.
- Arancibia F., Ewig S., Martinez J. et al. Antimicrobial treatment failures in patients with community-acquired pneumonia: causes and prognostic implications // Am. J. Respir. Crit. Care. Med. 2000. Vol. 162. P. 154–60.
- Anthonisen N., Manfreda J., Warren C. et al. Antibiotic therapy in exacerbations of chronic obstructive pulmonary disease // Ann Intern Med. 1987; 106: 196–204.
- Ram F., Rodriguez-Roisin R., Granados-Navarrete A. et al. Antibiotics for exacerbations of chronic obstructive pulmonary disease // Cochrane Database Syst Rev. 2006; (2): CD004403.
- Allegra L., Blasi F., de Bernardi B. et al. Antibiotic treatment and baseline severity of disease in acute exacerbations of chronic bronchitis: a re-evaluation of previously published data of a placebo-controlled randomized study // Pulm Pharmacol Ther. 2001; 14: 149–155.
- Stockley R., O’Brien C., Pye A. et al. Relationship of sputum color to nature and outpatient management of acute exacerbations of COPD // Chest. 2000; 117: 1638–1645.
- Чучалин А. Г., Синопальников А. И., Козлов Р. С., Романовских А. Г., Рачина С. А. Инфекционное обострение ХОБЛ: практические рекомендации по диагностике, лечению и профилактике. Пособие для врачей: 2005. 37 с. Доступно на: http://www.antibiotic.ru/files/pdf/copd-2005-project.pdf.
А. А. Зайцев, кандидат медицинских наук
Т. В. Пучнина
И. Ц. Кулагина
Госпиталь им. Н. Н. Бурденко, Москва
Контактная информация об авторах для переписки: a-zaicev@yandex.ru
1 Факторы риска антибиотикорезистентных S. pneumoniae: возраст > 65 лет, терапия бета-лактамами в течение последних 3 месяцев, хронический алкоголизм, иммунодефицитные заболевания/состояния (включая терапию системными глюкокортикоидами).
2 Факторы риска грамотрицательных энтеробактерий: обитатели домов престарелых, сопутствующие сердечно-сосудистые (например, застойная сердечная недостаточность) и бронхолегочные (например, ХОБЛ) заболевания, проводимая антибактериальная терапия.
3 Факторы риска P. aeruginosa: «cтруктурные» заболевания легких (например, бронхоэктазия), системная терапия глюкокортикоидами (преднизолон > 10 мг/сут), терапия антибиотиками широкого спектра действия свыше 7 дней в течение последнего месяца, истощение.
Воспалительные заболевания в оториноларингологии составляют около 87% [11]. В патогенезе этих заболеваний этиологическую роль играют различные бактерии, но преимущественно: Streptococcus pneumonie, Haemophilis influenzae и Moraxella catarralis [13]. В этой связи включение антибактериальных препаратов в схемы патогенетической терапии оправдано. Однако в настоящее время борьба с инфекцией представляет большие трудности. Обусловлено это в большей мере резистентностью микроорганизмов к антибактериальным препаратам [8].
Развитие приобретенной устойчивости микроорганизмов к антибактериальным препаратам может формироваться различными механизмами:
– изменением проницаемости клеточной стенки бактерий для препарата;
– изменением места действия лекарственного средства в микробной клетке;
– активным выведением антибиотика из микробной клетки;
– продукцией фермента, как b–лактамазы, который гидролизует антибиотик и тем самым инактивирует его.
Поэтому для успешного проведения антибактериальной терапии необходимо выполнение следующих условий:
– антибиотик следует применять только в том случае, если микроорганизм, возбудитель заболевания был чувствителен;
– антибиотик следует использовать в той дозе (разовой, суточной) и вводить таким путем, чтобы обеспечить его непосредственный контакт с возбудителем, причем содержание антибиотика в очаге воспаления должно быть достаточным для подавления роста жизнеспособных организмов;
– антибиотик должен назначаться длительным курсом, в среднетерапевтических дозах с соблюдением кратности приема препарата;
– препарат не должен обладать тяжелыми побочными реакциями.
С учетом изложенного разработаны в настоящее время схемы рациональной антибактериальной терапии воспалительных заболеваний ЛОР–органов [2].
Риносинусит
Доминирующим инфекционным агентом острого риносинусита являются S. pneumoniae, реже встречаются H. influenzae, M.catarralis, S. pyogenus, S. aureus [9]. В подобных случаях препаратом выбора перорально являются ингибиторзащищенный аминопенициллин амоксициллин/клавуланат либо пероральные цефалоспорины II генерации (цефуроксим аксетил), а также макролиды кларитромицин, азитромицин и тетрациклин, доксициклин.
Тяжелое течение риносинусита требует парентерального введения ингибиторзащищенных аминопенициллинов амоксициллина /клавуланата и ампициллина/сульбактама либо цефалоспоринов II (цефуроксима) и III генерации (цефатоксима, цефтриаксона, цефоперазона). При тяжелом течении риносинусита оправдано бактериологическое исследование, и выполнено оно должно быть в более ранние сроки, предшествующие антибактериальной терапии [16].
Хронический риносинусит наиболее вероятными этиопатогенетическими агентами имеет неспорообразующие анаэробные бактерии родов Peptocоccus spp., Peptostreptococcus spp., Vellonella spp., Prevotella spp., Fusobacterium spp., Bacteoides spp., S. Pneumoniae, H. Influenzae, M. Catarralis, S. aureus и грибы родов Candida, Rhizos, Mucor, Aspergillus – как в монокультурах, так и в ассоциациях друг с другом [9]. Препаратом выбора в период ремиссии являются ингибиторзащищенный аминопенициллин амоксициллин/клавуланат, а также фторхинолоны IV генерации моксифлоксацин, гемлоксацин, нитроимидазол, метронидазол, противогрибковый полиен амфотерицин В. В период обострения определяющим фактором является тяжесть течения заболевания: при легком и среднетяжелом течении схемы лечения тождественны таковым при остром риносинусите, при тяжелом течении обострившегося заболевания целесообразно включение фторхинолонов IV генерации. Безусловно показано бактериологическое исследование содержимого околоносовых пазух в такие же сроки с непременным анализом анаэробного роста [10].
Возникающий в условиях реанимации и интенсивной терапии риносинусит у пациентов чаще всего ассоциируется с грамнегативными бактериями: P. aeroginosa. K. Pneumoniae, E. coli, Acinetobacter spp; грампозитивные S. aureus, S. epidermidis и Streptococcus spp. встречаются реже [9]. Лечение таких риносинуситов предполагает парентеральное применение ингибиторзащищенных аминопенициллинов ампициллин/сульбактама, амоксициллин/клавуланата, ингибиторзащищенного карбоксипенициллина тикарциллина/клавуланата, цефалоспоринов III генерации цефотаксима, цефтриаксона, цефоперазона в сочетании с аминогликозидами аминокацином, нетилмицином. Кроме того, показано применение цефалоспорина IV генерации цефепима, карбопенемов имипенема, меропенема, фторхинолонов II генерации ципрофлоксацина, офлоксацина, перлоксацина. Непременно показано бактериологическое исследование содержимого синусов.
Тонзиллофарингит
Поскольку бактериологическое обсеменение одновременно захватывает слизистую оболочку миндалин и глотки, то обоснован термин тонзиллофарингит. При тонзиллите и тонзиллофарингите доминирует S. Piogenes, значительно превосходя по распространенности Streptococcus spp. групп C и G и экзотическую Arcanobacrium haemolyticum, определенную роль в возникновении и развитии тонзиллофарингитов могут играть Mycoplasma pneumoniae [18] и Chlamidophila pneumoniae [22]. Терапия острого тонзиллита опирается на пероральное применение природного пенициллина и аминопенициллина амоксициллина, а также цефалоспорина I генерации цефалодроксила, бензитилпенициллина. Альтернативой непереносимости пациентами лактамов служит применение лечебных схем на основе макролидов эритромицина, азитромицина, спирамицина, кларитромицина, рокситромицина. При непереносимости же и лактамов, и макролидов препаратами выбора становятся линкосамиды линкомицин, клиндамицин. Бактериологически подтвержденное присутствие M. pneumoniae и C. pneumoniae требует применения макролида азитромицина [15].
Рецидивирующий тонзиллит требует применения лечебных схем на основе ингибиторзащищенного амоксициллина/клавуланата, перорального цефалоспорина II генерации цефуроксим аксетила и линкосамидов линкомицина и клиндамицина [10].
Наружный отит
Локализованный наружный отит (фурункул слухового прохода) в большинстве случаев ассоциируется со Staphilococcus spp., среди которых преобладают S. aureus и S. epidermidis [20,24], в том числе их метициллин–резистентные штаммы, требуют системного применения антибактериальных препаратов лишь изредка при появлении симптомов интоксикации. В подобных случаях показано применение резистентных к пенициллиназе пенициллина оксациллина, ингибиторзащищенных аминопенициллинов ампициллина/сульбактама, аминоксициллина/клавуланата либо пероральных цефалоспоринов I генерации цефалексина, цефадроксила в наиболее тяжелых случаях. Оправдано применение парентерального цефалоспорина I генерации цефазолина [21], при рецидивирующем тяжелом течении наружного отита оправдано применение гликопептида ванкомицина и оксазолидинона линезадолида [10] и антибактериальных препаратов резерва грампозитивной кокковой направленности. Возможно местное применение природного антибиотика мупаирацина [1,9].
Диффузный наружный отит чаще ассоциируется с грамнегативной (Escherichia coli, Proteus vulgaris, Pseudomonos aeoginosa), нежели с грампозитивной (S. aureus, Enterococcus faecalis) бактериальной флорой и дрожжеподобными и плесневыми грибами [Schawal, 2002], требует местного лечения антисептиками, мупироцином и противогрибковыми азолами клотримазолоном, аллиламинами нафтифином и тербинафином [5]. В случае генерализации процесса показано пероральное применение ингибиторзащищенных аминопенициллинов ампициллина/сульбактама, амоксициллина/клавуланата и пероральных цефалоспоринов (цефалолексин, цефадроксил, цефаклор, цефуроксил аксетил) [3].
Злокачественный наружный отит, обычно формирующийся на фоне сахарного диабета и ассоциирующийся вообще исключительно с P. aeroginosa, требует применения антисинегнойных антибактериальных препаратов в комбинации с аминогликозидами II (томбрамицин, нетилмицин) и III (амикацин) генераций; уреидопенициллинов азлоциллина, пиперациллина (тазобактама, ингибиторзащищенного карбоксипенициллина тикарцилина/клавуланата, парентеральных цефалоспоринов III (цефтазидим, цефапирозон) и IV (цефепил) генераций, монобактама азтреонама, фторхинолона II генерации ципрофлоксацина [23]. В случаях, не связанных с сахарным диабетом, злокачественный отит ассоциируется с S. aureus и Streptococcus spp. и для его излечения наряду с парентеральными цефалоспоринами III (цефтазидим, цефоперазон) и IV (цефепим) генераций может быть применен карбапенем меропенем [10].
Тактика антибактериальной составляющей лечения остеомиелита височной кости, ассоциирующегося, как правило, с P. aeroginosa, не отличается от таковой при злокачественном наружном отите [10].
Средний отит
Острый средний отит в подавляющем большинстве случаев характеризуется присутствием наиболее часто встречающегося грамположительного C. pneumoniae и реже грамнегативных H. influenzae и M. catarralis. На долю прочих ассоциирующихся с острым средним отитом бактерий приходится не более 10% случаев: грампозитивные S. pyogenes и S. aureus, крайне редко встречаются бактериальные ассоциации [Butter, Willias, 2003]. Все перечисленные виды бактерий за исключением S. pyogenes обладают выраженной способностью к формированию резистентности к тем или иным антибактериальным препаратам. Препаратом выбора является аминопенициллин аминоксициллин, отсутствие эффекта от которого является основанием перехода на ингибиторзащищенный аминопенициллин амоксициллин/клавуланат либо цефалоспорины II (пероральный цефуроксим аксетил) или III (парентеральный цефтриаксон) генераций. Макролиды (кларитромицин, азитромицин) могут быть препаратами выбора при противопоказаниях к применению лактамов общего характера. Проведенная ранее безрезультативная антибактериальная терапия требует применения ингибиторзащищенных аминопенициллинов уже на первом этапе лечения [10].
Гнойная форма хронического среднего отита ассоциируется с присутствием S. aureus либо P. аeruginosa, хотя нередко в его этиопатогенезе принимают участие дрожжеподобные грибы родов Candida и Gedrichum, плесневые грибы родов Aspergillus, Phycomycetes, Rhyzopus, Actinomyces, Peniecillium, Scopulariopsis, Cephlosporium, Mucor, Altenaria [5] и многокомпонентные ассоциации бактерий с почти непременным участием анаэробов.
Стартовая антибактериальная терапия опирается на применение ингибиторзащищенного аминопенициллина амоксициллина/клавуланата. Однако бактериально подтвержденное присутствие P. aeruginosa требует применения антисинегнойных антибактериальных препаратов в комбинации с аминогликозидами II (тобрамицин, нетилмицидин) и III (амикацин) генераций; уреидопенициллинов азлоциллина, пенициллина, пепирациллина и ингибиторзащищенного его аналага пиперациллина (тазобактам, ингибиторзащищенного карбоксипенициллина тикарциллина/клавуланата, парентеральных цефалоспоринов III (цефтазидим, цефоперазон) и IV (цефепим) генераций, монобактама, азтреонама, фторхинолона II генерации ципрофлоксацина; отомикоз требует применения противогрибковых азолов миконазола, флуконазола и полиена амфотерицина В [3].
Как видно из вышеизложенного, современная практическая оториноларингология немыслима без применения целого набора антибактериальных препаратов, включая лактамные антибиотики b–лактамы, аминогликозиды, макролиды, фторхинолоновые линиосалиды, гликопептиды, оксазолидономы, тетрациклины, нитроклидазолы, особняком стоящий мупироцин, противогрибковые полиены и азолы. Перечисленные антибактериальные препараты, изученные к настоящему времени с различной степенью подробности, различаются как механизмом действия, так и эффективностью при клиническом применении.
Суммарный спектр действия современных антибактериальных препаратов потенциально охватывает все значимые для оториноларингологической патологии бактерии. Широкое применение этих препаратов, к сожалению, не всегда оправданное и рациональное, оказывает выраженное давление отбора на микроорганизмы и селекцию резистентных и мультирезистентных к антибактериальным средствам штаммов. Существование таких штаммов вносит серьезные коррективы в планирование схем эмпирической антибактериальной терапии – наиболее рациональной стратегии стартовой этиопатогенетической терапии в оториноларингологии. Планомерная систематическая бактериологическая и эпидемиологическая оценка степени распространенности приобретенной резистентности бактерий к антибактериальным средствам призвана стать научной основой для разработки схем рациональной антибактериальной терапии и мер по предотвращению глобального распространения резистентных и мультирезистентных штаммов бактерий в биосфере.
Вторичное бактериальное воспаление ЛОР–органов у пациентов, находящихся в отделениях интенсивной терапии или в реанимациях, составляет около 25% от всех госпитальных инфекций [12]. Наиболее частыми являются инфекции дыхательных путей (33%).
Сложность лечения таких больных обусловлена тяжестью состояния и полимикробным характером инфекции, высоким уровнем резистентности бактерий к традиционным антибиотикам. Необоснованность бессистемного применения антибиотических средств приводит к распространению устойчивых штаммов микроорганизмов.
В этиологической структуре основных инфекций преобладают прежде всего стафилококки (Staphlococcus aureus 30% коагуляционегативные Staphilococcus spp. – 19%), P. aeruginosa (29%). Также встречаются другие грамотрицательные бактерии, прежде всего – Escherichia coli (13%), Acinetobacter spp. (9%), Klebsiella spp. (8%), Enteribacter spp. (7%), Proteus spp. (6%). Среди грамположительных бактерий большое значение имеют Enterococcus spp. и Streptococcus spp., характеризующиеся устойчивостью ко многим антибактериальным средствам [17].
При ранних риносинусогенных орбитальных и внутричерепных осложнениях, возникающих в первые сутки пребывания пациентов в стационаре, характер флоры зависит от особенностей патологии околоносовых пазух, приведшей к развитию данного гнойного воспаления процесса (в 50% выделены Streptococcus spp., в 40% – Staphilococcus spp., в 10% – бактерии кишечной группы: Enterococcus spp., Proteus spp., Escherichia coli). При бактериологическом исследовании содержимого субпериостального орбитального абсцесса у детей преобладает аэробная флора (Stretococcus spp., Staphilococcus spp., H. Influenzae, M. catarralis и др.), а у больных старше 15 лет практически всегда имеет место смешанная флора, почти всегда обнаруживаются анаэробные бактерии (Bacteriodes spp., Veillonella spp., Peptostrepcoccus spp., Fusobacterium spp. и др.) [7]. Описаны грибковые орбитальные осложнения, встречающиеся преимущественно у пациентов с иммунодефицитным состоянием.
Абсцесс надгортанника
При абсцессе надгортанника основным этиологическим фактором является H. influenzae типа B, а также определенное значение имеют грамотрицательные кокки (гемолитический Streptococcus spp., S. pyogenes, S. pneumoniae, S. aureus) и анаэробные бактерии (Bacteroides spp., Peptostreptococcus spp.) [7].
При гнойно–воспалительных процессах в клеточных пространствах шеи (абсцессы, флегмоны) микробиологическим исследованием выявляются в 45% наблюдений S. aureus, несколько реже S. pyogenes. Среди возбудителей были обнаружены также различные виды анаэробных бактерий.
Подавляющее большинство анаэробов чувствительны к ингиторзащищенным пенициллинам, ингибиторзащищенным цефалоспоринам, метронидазолу. фторхинолонам IV поколения.
При первых признаках инфекции, не дожидаясь результатов бактериологического исследования, следует начинать антибактериальную терапию немедленно [4,6]. Обычно назначают комбинацию двух и более антибактериальных средств, чтобы максимально охватить спектр потенциальных возбудителей. Длительность терапии должна быть достаточной для подавления жизнедеятельности возбудителя, элиминацию которого завершает иммунная система. При адекватном выборе антибиотиков и быстром наступлении эффекта бывает достаточно 7 дней. При тяжелых и осложненных формах лечение проводится более длительно. Показанием к переходу на альтернативные препараты являются невозможность применения средств первого выбора (например, аллергическая реакция), отсутствие клинического эффекта от препарата первого выбора в течение 48–72 часов при нетяжелом и 36–38 часов – при тяжелом течении инфекции, а также развитие серьезных нежелательных лекарственных реакций.
Причинами неэффективности антибактериальной терапии являются наличие высокой резистентности микроорганизмов, развитие суперинфекции (Enterobacter spp., Pseudomonos spp., грибы и др.); позднее начало адекватной антибактериальной терапии, неправильный выбор антибиотика (например, недостаточная биодоступность препарата и, как следствие, плохая пенетрация в респираторную систему либо неактивность антибиотика в отношении причинного патогена), несоблюдение режима дозирования препарата (способ введения, разовая доза, интервал между введениями).
Полимикробная структура нозокомиальной инфекции верхних дыхательных путей определяет и в значительной степени ограниченный выбор эффективных антибактериальных средств. Назначаемые антибиотики должны быть высокоактивными против всех аэробных и анаэробных возбудителей, они должны оказывать быстрый бактерицидный эффект, хорошо проникать в инфицированные ткани, обладать минимальным побочным эффектом [Reed,1998].
В качестве эмпирической терапии ранней госпитальной инфекции верхних дыхательных путей в отделениях интенсивной терапии или реанимации могут быть рекомендованы в режиме монотерапии при высеве S. pneumoniae – цефалоспорины III, P. aeruginosa – фторхинолон III–IV, H. influenzae, S. aureus – тикарциллин–клавуланат; в режиме комбинированной терапии – S. pneumoniae – цефалоспорин II–III + амоксициллин/клавуланат + аминогликозид; P. influenzae – оксациллин + аминогликозид, тикаррцин/клавуланат + аминогликозид, имипенем/ципластин, меропенем.
Оценка клинической эффективности эмпирического лечения производится через 48–72 часа после его начала. К этому времени поступают микробиологические данные, включающие идентификацию возбудителей и определение их чувствительности к антибактериальным препаратам.
С учетом изложенного выше приводим схему антибактериальной терапии инфекций уха, горла и носа в условиях стационара (табл. 1).
Можно заключить, что в настоящее время в арсенале антибактериальных средств против любого известного возбудителя бактериальных инфекций имеются такие антибиотики, как Панклав, рокситромицин лек, лендамицин и др. Но для проведения рациональной терапии необходимо помнить:
– при остром среднем отите ошибкой является назначение антибиотиков, неадекватных по спектру (оксациллин, линкомицин, гентамицин, сульфаниламиды);
– при остром среднем отите не рекомендуется назначать потенциально токсичные антибиотики (ко–тримоксазол, хлорамфеникол, аминогликозиды, тетрациклины);
– при остром синусите не следует назначать линкомицин (не действует на H. influenzae), оксациллин (малоактивен против пневмококка, не действует на H. influenzae), гентамицин (не действует на S. pneumoniae, H. influenzae);
– ко–тримоксазол не может быть рекомендован к широкому применению при синусите из–за высокой резистентности к нему S. pneumonie, H. influenzae и высокого риска развития тяжелых токсико–аллергических реакций (синдромы Стивенса–Джонсона, Лайелла).
Литература
1. Богданович Т.М., Страчунский Л.С. Клин микробиол антимикроб тер 1999; 1:!: 57–65.
2. Жуховицкий В.Г.Бактериологическое обоснование рациональной антибактериальной терапии в оториноларингологии// Вестн. оторинолар.2004:1: 5–15.
3. Каманин Е.И., Стецюк О.У. В кн.: практическое руководство по антиинфекционной химиотерапии. Под редакцией Л.С.Страчунского М.2002;379:211–218.
4. Крюков А.И. Туровский А.Б., Жуховицкий В.Г. Антибактериальная терапия ранних проявлений бактериалдьного воспаления верхних дыхательных путей у пациентов, находяшихся в отделении интенсивной терапии // Вестн. оторинолар. 2005; 1: 49–52.
5. Кунельская В.Я. Микозы в оториноларингологии. М., 1989.
6. Рязанов С.В.Рациональная антимикробная химиотерапия острых заболеваний верхних дыхательных путей. Consilium medicum 2004,6^1:4–7
7. Страчунский Л.С., Каманин Е.И, Тарасов А.А. и др. Клин микробиол антимикроб тер 1999; 1:1:83–88
8. Страчунский Л.С. Белоусов Ю.Б.,Козлов С.Н.Практическое руководство по антиинфекционной химиотерапии М.,2002.:214–218.
9. Страчунский Л.С., Козлов С.Н. Современная антимикробная химиотерапия: Руководство для врачей. М.,2002.
10. Страчунский Л.С.,Богданович Т.М. В кн.: Практическое руководство по антиинфекционной химиотерапии. Под ред. Страчунского Л.С. М.2002;379:32–39.
11. Фанта И.В.Научное обоснование организации специализированной амбулаторно–поликлоинической оториноларингологической помощи взрослдому населению крупного промышленного города в современных условиях: Автореф. дисс… канд. мед. наук. С–ПРетербург,2003.
12. Яковлев С.В., Суворова М.П.Антибиотики и химиотерпия. 1997; 42:10:23–28.
13. Bishai W.R. Otolaring Head Neck Surg 2002, 127:Suppl 6:3–9.
14. Butler C.C.,Williams Curr Infexct Dis Rep 2003:205–212.
15. Desrosiers M. J Otolaringol2002:Suppl 2:2–14.
16. Johnson B.C., Arvi A.Postgrad Med: 2003:11:115–118.
17. FinegoldS.M.,Wexler H.M. Clin Infect Dis 1996:23: Suppl 1^9–14.
18. ManiloffJ.Mycoplasmas molecular biologi and pathogenesis Washington 1992/
19. Reed M.D. Pediat Infect Dis J 1998:17:12: 1195–1199.
20. Roland P.S.,Stroman D.W.Laryngoscope 2002:112:1166–1177/
21. Sander R. Am Fam Physican2001:63:927–942.
22. Stephens R.S.Chlamidia:intractlllarbiology,pathogenesis and immunity. Washington 1999
23. SchapowalA/Ear Nose Throat J 2002:81 Suppl1 21–22.
24. Walsche P., Rowley H.,Timon C. Clin Otolaryngol 2001: 26:218–220.
Антибактериальные препараты для местной терапии ранений различной этиологии
Статьи
Опубликовано в журнале:
« РМЖ. Медицинское обозрение » 2018 №3(I)
Профессор И.П. Левчук, профессор М.В. Костюченко
ФГБОУ ВО РНИМУ им. Н. И. Пирогова Минздрава России, Москва
Резюме
В статье рассматриваются современные проблемы антибактериальной терапии при ранениях различной этиологии, возможности и ограничения применения местных антибактериальных препаратов. Ведущим ограничением в выборе антибактериальных препаратов в настоящее время является широкое распространение полирезистентных микроорганизмов. Это значительно сужает выбор как системных, так и местных препаратов эмпирической антибактериальной терапии ран. В настоящее время в целях профилактики прогрессирования раневой инфекции находят широкое применение местные антибактериальные препараты, позволяющие избежать системных побочных эффектов.
К местным антибактериальным препаратам, наиболее активно применяемым для амбулаторного ведения ран, можно отнести сульфаниламид (Ранавексим), сульфатидин серебра, неомицин с бацитрацином. Местная терапия инфицированных ран должна базироваться на этиологических и анамнестических характеристиках раны, фазе раневого процесса и объеме поражения. Местное применение антибактериальных препаратов (например, сульфаниламида) возможно при небольших по площади поражениях без активного инфекционного процесса в ране (бытовые ссадины, царапины, неглубокие порезы и ожоги).
Ключевые слова: раны, антибактериальная терапия, полирезистентность, местное применение антибиотиков, сульфаниламид.
Для цитирования: Левчук И.П., Костюченко М.В. Антибактериальные препараты для местной терапии ранений различной этиологии //РМЖ. Медицинское обозрение. 2018. № 00. С. 1-6.
Antibacterial drugs for topical therapy of the wounds of various etiologies
Levchuk I.P., Kostyuchenko M.V.
Pirogov Russian National Research Medical University, Moscow
Abstract
The article deals with modern problems of antibiotic therapy of the wounds of various etiologies, possibilities and limitations of the use of topical antibiotics. Currently, the main limitation in the choice of antibacterial drugs is the widespread use of multiresistant microorganisms. This fact significantly reduces the choice of both systemic and topical drugs for empirical antibiotic therapy of wounds. At present, topical antibiotics are often used to prevent the progression of wound infection, which often allows to avoid systemic side effects. Topical antibacterial preparations most actively used for outpatient management of wounds can be attributed to a sulfanilamide (Ranavexim), sulfatides silver, neomycin with bacitracin. Topical therapy of wounds should be based on etiological and anamnestic characteristics of the wound, phase of the wound process and the extent of the lesion. Topical use of antibacterial drugs (e. g. sulfanilamide) is possible with small lesions without an active infectious process in the wound (such as abrasions, scratches, small cuts and burns).
Key words: wounds, antibacterial therapy, multidrug resistance, topical application of antibiotics, sulfonamide.
For citation: Levchuk I.P., Kostyuchenko M.V. Antibacterial drugs for topical therapy of the wounds of various etiologies // RMJ. Medical Review. 2018. № 00. P. 1-6.
Все раны, полученные в нестерильных условиях, являются инфицированными, рост бактериальной флоры в ране провоцирует развитие воспалительного процесса, сопровождающегося повышением местной температуры, гиперемией, болью и нарушением функции части тела, на которой находится рана. Частота развития инфекционных осложнений остается весьма значительной и достигает в целом 45%. Наиболее подвержены развитию инфекционных осложнений раны, загрязненные землей, с нарушением кровоснабжения в области непосредственно самого повреждения или всей части тела, огнестрельные и минно-взрывные раны, укусы животных и человека. В зависимости от вида повреждения и условий окружающей среды в раны могут попадать различные микроорганизмы: резидентные — постоянно живущие и размножающиеся на коже (преимущественно коагулазонегативные кокки, например Staphylococcus epidermidis, S. aureus, и дифтeроиды, например Corinebacterium spp., реже — грамотрицательные бактерии), и транзиторные — в норме отсутствующие и попадающие на кожу после контакта с контаминированными объектами окружающей среды и больными людьми. В зависимости от области тела (голова, конечности, перианальная область и т. д.) спектр резидентной микрофлоры может быть различным. Транзиторная флора также неодинакова по составу, который зависит от характера раны, этиологии, окружающей среды и может быть представлен различными инфекционно-опасными микроорганизмами (Escherichia coli, Klebsiella spp., Pseudomonas spp., Salmonella spp. и другими грамотрицательными бактериями, S. aureus, вирусами и грибами, Candida albicans, ротавирусами и др.). При повреждении кожи транзиторные микроорганизмы способны длительно колонизировать и инфицировать кожу, формируя при этом новую, гораздо более опасную резидентную (но не нормальную) флору. В большинстве случаев инфицирование обусловливается микробными ассоциациями. Так, укусы собак сопровождаются инфекционным осложнением примерно в 20% случаев, кошек — до 30-50%, человека — 70-80% [1-3].
Из-за изменения гистохимических параметров тканей в результате повреждения и разрушения защитной барьерной функции кожи даже непатогенные микроорганизмы могут стать причиной выраженных воспалительных, гнойных процессов. Для выбора оптимальной антибактериальной терапии необходимо учитывать возможный микробный спектр раны (табл. 1).
Таблица 1. Этиология и микробный спектр ран
| Этиология ран | Спектр возбудителей раневых инфекционных осложнений |
| Раны в результате несчастных случаев | Чаще встречаются Enterobacteriaceae spp. и S. aureus, в т. ч. возможны и внебольничные MRSA-штаммы, Staphylococcus spp. [4]. При ранах в области верхних конечностей, особенно кистей рук, преобладают кокковые формы: 90% стафилококк (57% в чистой культуре и 33% — в ассоциации со спороносными палочками); реже обнаруживаются дифтероиды, аэробные спороносные палочки и различные сапрофиты воздушного происхождения; при травме нижних конечностей встречаются кишечная палочка и протей -13,5%, реже — анаэробы [5]. В перианальной области в ране содержатся разнообразные комбинации грамположительных кокков (стафилококки, стрептококки и энтерококки) и энтеробактерий (кишечная палочка, клебсиелла, энтеробактер и др.) в возможной ассоциации с анаэробами (пептострептококки, бактероиды, фузобактерии, клостридии и др.) [6]. При ранении в морской воде — Vibrio spp, Mycobacterium marinun, в пресной воде — Pseudomonas aeruginosa, Aeromonas spp. и Mycobacterium spp. (чаще — M. marinum, Mycobacterium avium), Vibrio spp, Enterobacteriaceae spp. [7, 8]. Повреждения, сопровождающиеся нарушением кровоснабжения и резким снижением оксигенации тканей, наиболее благоприятны для развития C. perfringens, C. novyi, C. septicum, C. hystoliticum, C. bifermentans [6]. |
| Ожоговые раны | Чаще всего рану колонизируют стафилококк, вегетирующий в виде сапрофитной флоры на неповрежденной коже, и стрептококк. На госпитальных этапах — нозокомиальные инфекции (больничная полирезистентная флора), частота MRSA-штаммов -37-50% [9]. Монокультуры микроорганизмов встречаются в 57% случаев, микробные ассоциации — в 43%, они включают: S. aureus и Proteus vulgaris; S. aureus и S. epidermidis; S. aureus и P. aeruginosa; P. vulgaris, E. coli, S. aureus; P. aeruginosa, K. pneumonia, S. aureus (Моррисон В.В., 2015). |
| Укушенные раны | При укусах животных первое место по числу занимают микробные аэробно-анаэробные ассоциации — 50-65%, Pasteurella spр. — 2075% (Pasteurella multocida — 60% и P. canis — 18%), а также Peptostreptococcus spp, S. aureus — 20-40% и Streptococcus mitis, Moraxella spp, Corynebacterium spp. и Neisseria spp. [9-11]. При укусах кошки: P. multocida, S. aureus, MRSA, Cl. tetani; при укусах свиньи: полимикробная флора (грамположительные кокки, грамотрицательные палочки, Pasteurella spp. + анаэробы, Cl. tetani); при укусах крысы: S. moniliformis, Cl. tetani; при укусах змеи: Pseudomonas spp, Enterobacteriaceae spp., Clostridium spp. [1, 4]. При укусах человека спектр возбудителей представлен преимущественно Streptococcus spp. (17-90%), S. aureus (13-50%), Eikenella corrodens (10-29%), Haemophilus influenza (17-26%), Bacteroides spp, Fusobacterium spp. (12-33%), Peptostreptococcus spp. (22%), преобладает смешанная флора [4, 9-10, 12]. Возможны внебольничные MRSA-штаммы, особенно при укусах животных [13]. |
| Раны после разделки мяса или рыбы | Erysipelothrixrhusiopathiae [7]. |
| Раны, полученные в результате боевых действий и других ЧС | Часто грамотрицательные аэробные возбудители: Enterobacteriaceae spp, Pseudomonas spp, а также Staphylococcus spp. При повреждениях полых органов, например при проникающих абдоминальных ранениях: контаминация раны грамотрицательными возбудителями из семейства Enterobacteriaceae и анаэробами [4]. При глубоких ранах, загрязненных землей, с нарушением кровоснабжения и резким снижением оксигенации тканей: C. perfringens, C. novyi, C. septicum, C. hystoliticum, C. bifermentans [6]. |
| Послеоперационные раны | S. aureus — 20% (в т. ч. MRSA-штаммы), коагулазонегативные стафилококки — 14%, энтерококки — 12%, E. coli — 8%, P. aeruginosa — 8%, Enterobacter spp. — 7%, P. mirabilis — 3%, K. pneumoniae — 3%, C. albicans — 3-9,5%, другие грамположительные аэробы — 2%, Bacteroides fragilis — 2% [1, 4]. |
Примечание: MRSA — метициллин-резистентные микроорганизмы, ЧС — чрезвычайные ситуации
Антибактериальная терапия
В настоящее время внебольничные штаммы остаются чувствительными к большому числу антибиотиков, в т. ч. ß-лактамам. До конца 1990-х годов метициллин-резистентные микроорганизмы (MRSA) были исключительно внутрибольничной проблемой с преимущественным распространением в Европе. Однако в настоящее время имеются сведения и о внебольничных резервуарах полирезистентного стафилококка зоонозного происхождения, который составляет в общей массе до 50% и более на юге Европы и 10-25% в Центральной Европе и Великобритании [14]. В России в амбулаторных условиях частота встречаемости MRSA не превышает 3,8%, однако в условиях стационара частота встречаемости этих микроорганизмов, а также устойчивых к цефалоспоринам грамотрицательных E. coli и Klebsiella spp. достигает 60,4-84,9%. При выявлении высокого риска инфицированности MRSA-штаммами необходимо включить анти-MRSA-препарат в схему лечения [6-7].
В целях профилактики прогрессирования раневой инфекции в настоящее время находят широкое применение местные антибактериальные препараты, позволяющие избежать системных побочных эффектов. Системной антибактериальной терапии не требуется при очагах менее 5 см после адекватной хирургической обработки [6].
Таблица 2. Характеристика антибактериальных препаратов для наружного применения





Примечание: ПАБК — парааминобензойная кислота
В случае обширных раневых дефектов, клинических проявлений инфекции, включая системные признаки воспаления (повышение температуры тела >38° С или снижение <36° С; лейкоцитоз >12*109/л или лейкопения <4*109/л; тахикардия >90 уд./мин; одышка >24 дыханий/мин), иммунодефицитного состояния необходимо системное применение антибиотиков [7]. Местные лекарственные формы с антибактериальным компонентом при этом также находят место в протоколах лечения.
Активно применяющиеся в настоящее время антибактериальные препараты, при кажущемся на первый взгляд многообразии, с учетом современной концепции лечения инфицированных ран и требований, предъявляемых к подобным препаратам, имеют существенные ограничения. Спектр действия большей части широко известных препаратов значительно сузился для стационарного применения в связи с полирезистентностью микроорганизмов (табл. 2) и ограничением из-за побочных эффектов при больших раневых поверхностях (табл. 3).
Таблица 3. Показания, побочные эффекты и ограничения для антибактериальных препаратов для наружного применения
| Препарат, форма выпуска | Основные показания к местному применению | Побочные эффекты | Ограничения для наружного применения |
| Сульфаниламид (Стрептоцид, Ранавексим), порошок для наружного применения | Инфицированные раны различной этиологии (в т. ч. язвы, трещины, ссадины), ожоги (I и II степени), гнойно-воспалительные поражения кожи. Преимущества препарата: используется при обширных и глубоких ранах. Может применяться в I фазе раневого процесса на очищенной и обработанной антисептиками раневой поверхности[6] |
Аллергические реакции | При местном применении надо помнить, что препарат лучше действует в чистой ране. Поэтому рекомендуется предварительно обработать рану, промыть перекисью водорода и другими антисептиками, а затем наносить препарат [19] |
| Сульфадиазин серебра, крем, мазь для наружного применения | Инфицированные поверхностные раны и ожоги со слабой экссудацией, трофические язвы, пролежни, длительно не заживающие язвы, ссадины. Может применяться в I фазе раневого процесса | Периферическим и системным кровотоком поглощается около 10% сульфадиазина и 1% серебра | Нанесение на обширные раневые поверхности сопровождается повышением концентрации сульфадиазина в крови до 10-20 мкг/мл. При длительном применении на больших раневых поверхностях возможны системные побочные эффекты, в т. ч. нарушение кроветворения, кожные и аллергические реакции, диспепсические явления, гепатит, гепатоцеллюлярный некроз, нарушение функций ЦНС, токсический нефроз |
| Гентамицин, порошок для наружного применения | Бактериальные инфекции кожи и мягких тканей, вызванные чувствительной микрофлорой: пиодермия. Инфицированные дерматиты, раны (в т. ч. хирургические, вялозаживающие), ожоги (в т. ч. растениями), укусы насекомых, абсцессы кожи и кисты. Вторичное бактериальное инфицирование. Возможно применение при малой площади раневой поверхности |
Аллергические реакции: местные — кожная сыпь, зуд, гиперемия кожи, чувство жжения; генерализованные (редко) — лихорадка, ангионевротический отек, эозинофилия | При всасывании с обширных поверхностей возможно развитие системных эффектов — неврит слухового нерва, миастения, паркинсонизм, ботулизм, почечная недостаточность. Ограничение применения у новорожденных и недоношенных и в пожилом возрасте |
| Фузидовая кислота, крем, мазь для наружного применения | Инфекции кожи и мягких тканей, вызванные чувствительными микроорганизмами, инфицированные раны. Может применяться при выявлении стафилококков, устойчивых к метициллину, пенициллинам, стрептомицину, хлорамфениколу, эритромицину, устойчивых госпитальных штаммов | Местнораздражающее действие (покраснение и зуд кожи), аллергические реакции | Гиперчувствительность, печеночная недостаточность |
| Мупироцин, мазь для наружного применения | Абсорбция после накожной аппликации крайне мала. Применяют при первичных и вторичных инфекциях кожи, в т. ч. инфицированных травмах, ранах и ожогах; профилактике бактериального инфицирования небольших ран, порезов и других «чистых» повреждений кожи при выявлении резистентных микроорганизмов. Может применяться в I и II фазах раневого процесса |
Жжение, зуд в месте аппликации, аллергические реакции | Может адсорбироваться через поврежденную кожу. Ограничения: большая раневая поверхность и изменения функции почек |
Многие местно применяемые антибактериальные препараты имеют достаточно жесткие ограничения для стационарного применения в связи с резистентностью микрофлоры, а также по площади раневой поверхности из-за активного всасывания и токсичности при попадании в системный кровоток [20]. К местным антибактериальным препаратам, наиболее активно применяемым для амбулаторного ведения ран с целью профилактики развития раневой инфекции, можно отнести сульфаниламид, сульфатидин серебра, неомицин с бацитрацином, при риске негоспитальных устойчивых штаммов — мупироцин и фузидовую кислоту. Сульфаниламид не потерял актуальности и характеризуется противомикробным действием по отношению к негоспитальным штаммам грамположительных и грамотрицательных кокков, E. coli, Shigella spp., Vibrio cholerae, Haemophilus influenzae, Clostridium spp., Bacillus anthracis, Corynebacterium diphtheriae, Yersinia pestis, а также Chlamydia spp., Actinomyces spp., Toxoplasma gondii и некоторым другим бактериям при ранах и ожогах, полученных в результате несчастных случаев и в чрезвычайных ситуациях [15-16, 21].
Применяя местные антибактериальные препараты, которые непосредственно контактируют с раной, необходимо учитывать их форму выпуска и состав вспомогательных веществ, соотнося их с фазами раневого процесса.
В первой фазе раневого процесса рекомендуются для местного применения препараты на водорастворимой основе с сульфаниламидом [6]. Сульфаниламид в виде порошка для местного применения (Ранавексим в банке с дозатором) поглощает раневой экссудат, не травмирует ткани раневой поверхности, препятствует развитию микрофлоры в ране и вторичному инфицированию [21, 22]. При использовании лекарственной формы в упаковке с дозатором легко контролируются дозировка лекарственного вещества и равномерность нанесения порошка без контакта с раневой поверхностью, что уменьшает риск побочных эффектов.
При глубоких ранениях в полость раны вносят 5-15 г порошка для наружного применения (Ранавексим), при этом максимальная суточная доза для взрослых составляет 15 г, для детей старше 3-х лет — 300 мг, при местном применении в виде порошка (непосредственном нанесении на раневую поверхность) препарат не обладает раздражающим ткани действием [15, 21, 23].
Во второй фазе раневого процесса следует отдавать преимущество формам, не наносящим ущерба грануляциям.
Учитывая мультирезистентность микроорганизмов, в настоящее время эмпирические схемы антибактериальной терапии претерпевают значительные изменения. Давно известные и широко используемые антибиотики остаются, как правило, препаратами выбора лишь для ведения небольших ран в амбулаторных условиях у пациентов с низким риском инфицирования MRSA и другими устойчивыми штаммами. Раны, требующие хирургического лечения в условиях стационара, автоматически переводят пациентов в группу риска, и выбор препарата меняется. При этом антибактериальный спектр применяемого препарата должен включать возможных возбудителей с учетом этиологических и анамнестических характеристик раны.
Заключение
Таким образом, при назначении антибактериальной терапии ран необходимо учитывать этиологию и обстоятельства, при которых было получено повреждение, возможный спектр возбудителей, лечение амбулаторное или стационарное, риск инфицирования резистентной микрофлорой, особенности хирургического лечения раны и фазу раневого процесса. При этом, несмотря на широкое использование местных форм антибактериальных препаратов, в настоящее время отсутствуют четкие стандартизированные подходы относительно фаз раневого процесса. Только местное применение антибактериальных препаратов (например, сульфаниламида в форме порошка для наружного применения — Ранавексима) возможно при небольших по площади поражениях без активного инфекционного процесса в ране (бытовые ссадины, царапины, неглубокие порезы и ожоги). При глубоких и обширных раневых дефектах после хирургической обработки применяется системная антибактериальная терапия, дополняемая при необходимости местными лекарственными формами.
ЛИТЕРАТУРА
- Блатун Л. А. Местное медикаментозное лечение ран // Хирургия. 2011. № 4. С.51-59 [Blatun L. A. Mestnoe medikamentoznoe lechenie ran // Hirurgija. 2011. № 4. S.51-59 (in Russian)].
- Митрофанов В. Н., Гординская Н. А. Фенотип антибиотикорезистентности возбудителей перипротезной инфекции как основа выбора рационального антимикробного лечения // Медицинский альманах. 2017. № 4 (49). С.72-75 [Mitrofanov V.N., Gordinskaja N. A. Fenotip antibiotikorezistentnosti vozbuditelej periproteznoj infekcii kak osnova vybora racional’nogo antimikrobnogo lechenija // Medicinskij al’manah. 2017. № 4 (49). S.72-75 (in Russian)].
- Привольнев В. В., Забросаев В. С., Даниленков Н. В. Препараты серебра в местном лечении инфицированных ран // Вестник Смоленской государственной медицинской академии. 2015. № 3. С.85-91 [Privol’nev V.V., Zabrosaev V. S., Danilenkov N. V. Preparaty serebra v mestnom lechenii inficirovannyh ran // Vestnik Smolenskoj gosudarstvennoj medicinskoj akademii. 2015. № 3. S.85-91 (in Russian)].
- Гайдуль К. В., Муконин А. А. Раневая инфекция. Этиология, диагностика и ати-бактериальная терапия. АБОЛмед. 2005 [Gajdul’ K.V., Mukonin A. A. Ranevaja infekcija. Jetiologija, diagnostika i atibakterial’naja terapija. ABOLmed. 2005 (in Russian)].
- Мельникова В. М. Химиотерапия раневой инфекции в травматологии и ортопедии. М.: Медицина. 1975 [Mel’nikova V. M. Himioterapija ranevoj infekcii v travmatologii i ortopedii. M.: Medicina. 1975 (in Russian)].
- Хирургические инфекции кожи и мягких тканей: Российские национальные рекомендации. М., 2015. 110 с. [Hirurgicheskie infekcii kozhi i mjagkih tkanej: Rossijskie nacional’nye rekomendacii. M., 2015. 110 s. (in Russian)].
- Голуб А. В., Привольнев В. В. Системная антибактериальная терапия хирургических инфекций кожи и мягких тканей в амбулаторных условиях: что должен знать каждый хирург? // Стационарозамещающие технологии: Амбулаторная хирургия. 2014. № 3-4. URL: cyberleninka.ru/article/n/sistemnaya-antibakterial… [Golub A.V., Privol’nev V. V. Sistemnaja antibakterial’naja terapija hirurgicheskih infekcij kozhi i mjagkih tkanej v ambulatornyh uslovijah: chto dolzhen znat’ kazhdyj hirurg? // Stacionarozameshhajushhie tehnologii: Ambulatornaja hirurgija. 2014. № 3-4. URL: cyberleninka.ru/article/n sistemnaya-antibakterialnaya-terapiya-hirurgicheskih-infektsiy-kozhi-i-myagkih-tkaney-v-ambulatornyh-usloviyah-chto-dolzhen-znat (in Russian)].
- Janda J., Abbott S., Brenden R. Overview of the etiology of wound infections with particular emphasis on community-acquired illness // Eur J Clin Microbiol Infect Dis. 1997. Vol. 16. P.189-201.
- Савельев В. С. и др. Хирургические инфекции кожи и мягких тканей: Российские национальные рекомендации. М., 2009 [Savel’ev V.S. i dr. Hirurgicheskie infekcii kozhi i mjagkih tkanej: Rossijskie nacional’nye rekomendacii. M., 2009 (in Russian)].
- Страчунский Л. С., Беденков А. В. Антибактериальная терапия укушенных ран у детей // Детский доктор. 2000. № 4. С.32-33 [Strachunskij L.S., Bedenkov A. V. Antibakterial’naja terapija ukushennyh ran u detej // Detskij doktor. 2000. № 4. S.32-33 (in Russian)].
- Talan D., Citron D., Abrahamian F. et al. Bacteriologic analysis of infected dog and cat bites // N Engl J Med. 1999. Vol. 340 (2). P.85.
- Talan D. A., Abrahamian F. A., Moran G. J. et al. Clinical presentation and bacteriologic analysis of infected human bites presenting to an Emergency Department // Clin Infect Dis. 2003. Vol. 37. P 1481-1489.
- Cuny C., Friedrich A., Kozytska S. et al. Emergence of methicillinresistant Staphylococcus aureus (MRSA) in different animal species // Int. J. Med. Microbiol. 2010. Vol. 300. P.109-117.
- Демиховская Е. В. MRSA — знаменитый и неизвестный Метициллин- резистентный S.aureus: механизмы резистентности, лабораторная диагностика, клиника и эпидемиология // Болезни и антибиотики. 2012. № 2 (7). URL: http:// www.mif-ua.com/archive/article/34693 [Demihovskaja E.V. MRSA — znamenityj i neizvestnyj Meticillin- rezistentnyj S.aureus: mehanizmy rezistentnosti, laboratornaja diagnostika, klinika i jepidemiologija // Bolezni i antibiotiki. 2012. № 2 (7). URL: http:// www.mif-ua.com/archive/article/34693 (in Russian)].
- Интернет-ресурс: Ранавексим (Ranaveksim) инструкция по применени-ю-https://www.vidal.ru/drugs/ranaveksim [Internet-resurs: Ranaveksim (Ranaveksim) instrukcija po primeneniju-https://www.vidal.ru/drugs/ranaveksim (in Russian)].
- Практическое руководство по антиинфекционной химиотерапии / Под ред. Л. С. Страчунского, Ю. Б. Белоусова, С. Н. Козлова. URL: antibiotic.ru ab/001-07.html [Prakticheskoe rukovodstvo po antiinfekcionnoj himioterapii / Pod red. L. S. Strachunskogo, Ju.B. Belousova, S. N. Kozlova. URL: antibiotic.ru ab/001-07.html (in Russian)].
- Atiyeh S. et al. Effect of silver on burn wound infection control and healing: review of the literature // Burns. 2007. Vol. 33 (2). P.139-148.
- Машковский М. Д. Лекарственные средства. М. 2014 [Mashkovskij M. D. Lekarstvennye sredstva. M. 2014 (in Russian)].
- Фармакология / Под. ред. Ю. Ф. Крылова, В. М. Бобырева. М., 1999. https:// www.rlsnet.ru/books_book_id_4.html [Farmakologija / Pod. red. Ju.F. Krylova, V. M. Bobyreva. M., 1999. rlsnet.ru/books_book_id_4.html (in Russian)].
- Левчук И. П., Костюченко М. В., Назаров А. П. Профилактика раневых инфекций при ограниченных повреждениях кожи // Consilium Medicum. 2017. № 7 (2). С.19-22 [Levchuk I.P., Kostjuchenko M. V., Nazarov A. P. Profilaktika ranevyh infekcij pri ogranichennyh povrezhdenijah kozhi // Consilium Medicum. 2017. № 7 (2). S.19-22 (in Russian)].
- Грабарская Е. А., Данилевская Н. В., Дельцов А. А., Правда А. А. Изучение ранозаживляющей активности новой многокомпонентной мази // Российский ветеринарный журнал. Мелкие домашние и дикие животные. 2015. № 3. С.48-50 [Grabarskaja E.A., Danilevskaja N. V., Del’cov A.A., Pravda A. A. Izuchenie ranozazhivljajushhej aktivnosti novoj mnogokomponentnoj mazi // Rossijskij veterinarnyj zhurnal. Melkie domashnie i dikie zhivotnye. 2015. № 3. S.48-50 (in Russian)].
- Бутко Я. А. Фармакокоррекция раневого процесса // Здравоохранение. 2007. № 15 [Butko Ja.A. Farmakokorrekcija ranevogo processa // Zdravoohranenie. 2007. № 15 (in Russian)].
- Интернет-ресурс: Ранавексим. Инструкция по применению. https://avexima. ru/medicines/ranaveksim/ [Internet-resurs: Ranaveksim. Instrukcija po primeneniju. avexima.ru/medicines/ranaveksim (in Russian)].
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)

