Предварительно заполненный шприц с препаратом Пролиа — инструкция по применению
Синонимы, аналоги
Статьи
Инструкция по применению препарата Пролиа®
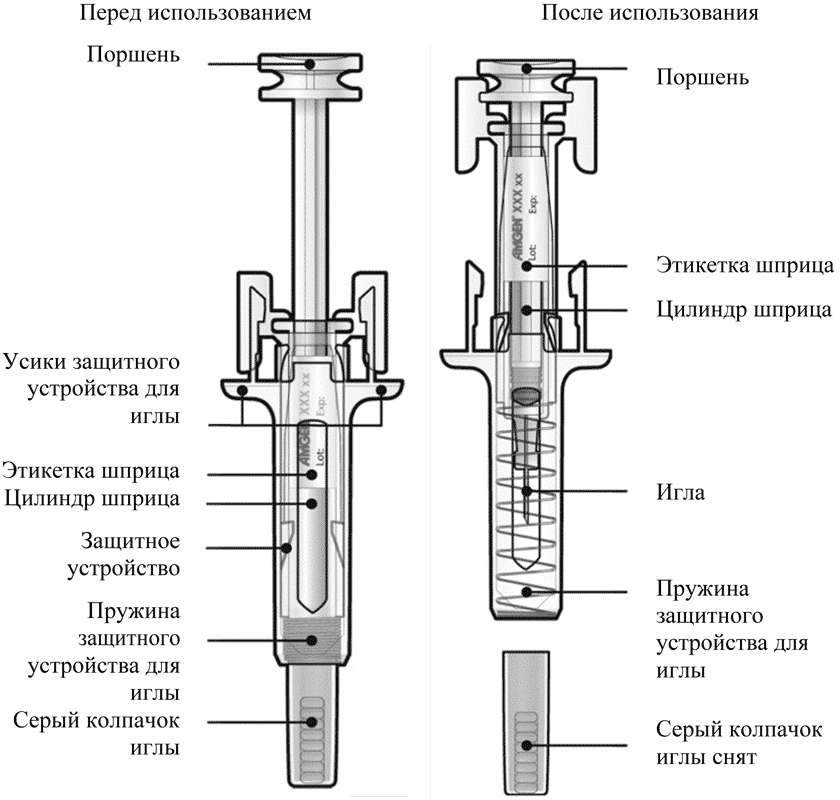
Руководство по частям шприца
Важно
Внимательно прочитайте данную инструкцию перед использованием препарата Пролиа® в предварительно заполненном шприце с защитным устройством для иглы:
- Очень важно, чтобы перед тем, как Вы приступите к самостоятельным инъекциям, ваш лечащий врач или медицинская сестра подробно проинструктировали Вас по технике выполнения инъекции.
- Пролиа® вводится подкожно (подкожная инъекция).
- Сообщите Вашему врачу, если у Вас есть аллергия на латекс (колпачок иглы предварительно заполненного шприца состоит из производного латекса).
- Не снимайте серый колпачок с иглы предварительно заполненного шприца, пока вы не готовы к инъекции.
- Не используйте предварительно заполненный шприц, если он упал на твердую поверхность. Используйте новый предварительно заполненный шприц и сообщите об этом Вашему лечащему врачу или медицинской сестре.
- Не пытайтесь активировать защитное устройство предварительно заполненного шприца перед инъекцией.
- Не пытайтесь снять прозрачное защитное устройство с предварительно заполененного шприца перед инъекцией.
В случае возникновения вопросов, обращайтесь к Вашему лечащему врачу или медицинской сестре.
Шаг 1: Подготовка
- Извлеките контурную ячейковую упаковку с предварительно заполненным шприцем из упаковки и подготовьте все, что необходимо для инъекции.
Для более комфортной инъекции, оставьте предварительно заполненный шприц при комнатной температуре, в течение примерно 30 минут перед инъекцией. Тщательно вымойте руки с мылом.
Расположите предварительно заполненный шприц на чистой, хорошо освещенной поверхности. Также подготовьте смоченные спиртом салфетки, ватные тампоны или бинт и пластырь (не прилагаются к шприцу).- Не пытайтесь подогревать шприц в горячей воде или микроволновой печи.
- Не оставляйте предварительно заполненный шприц под прямыми солнечными лучами.
- Не встряхивайте предварительно заполненный шприц.
- Храните предварительно заполненный шприц в недоступном для детей месте.
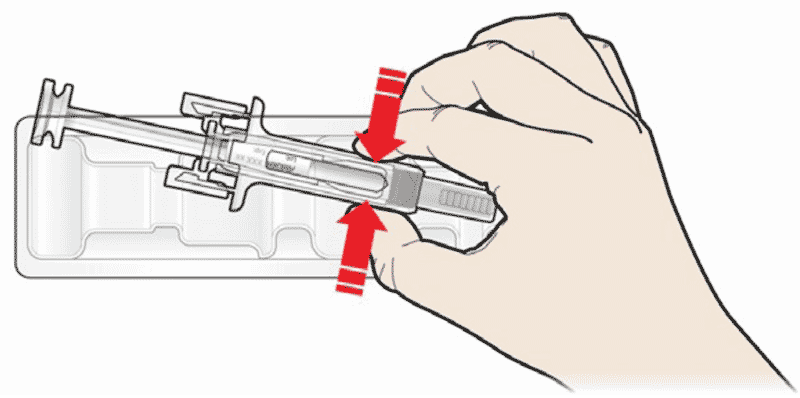
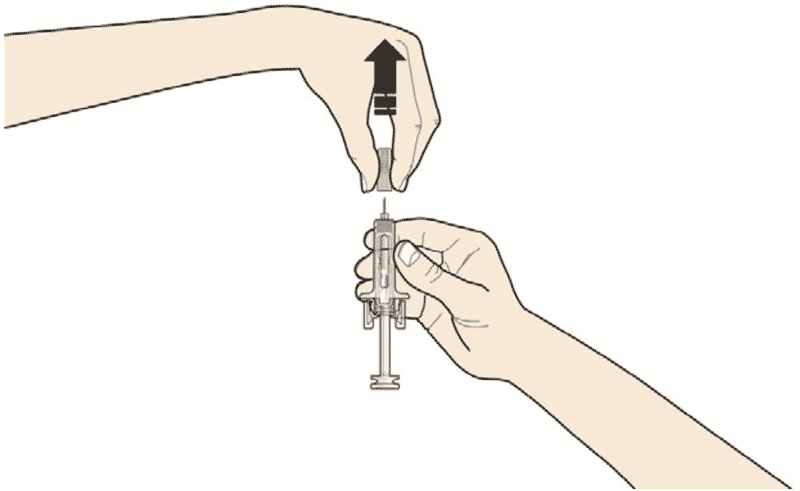
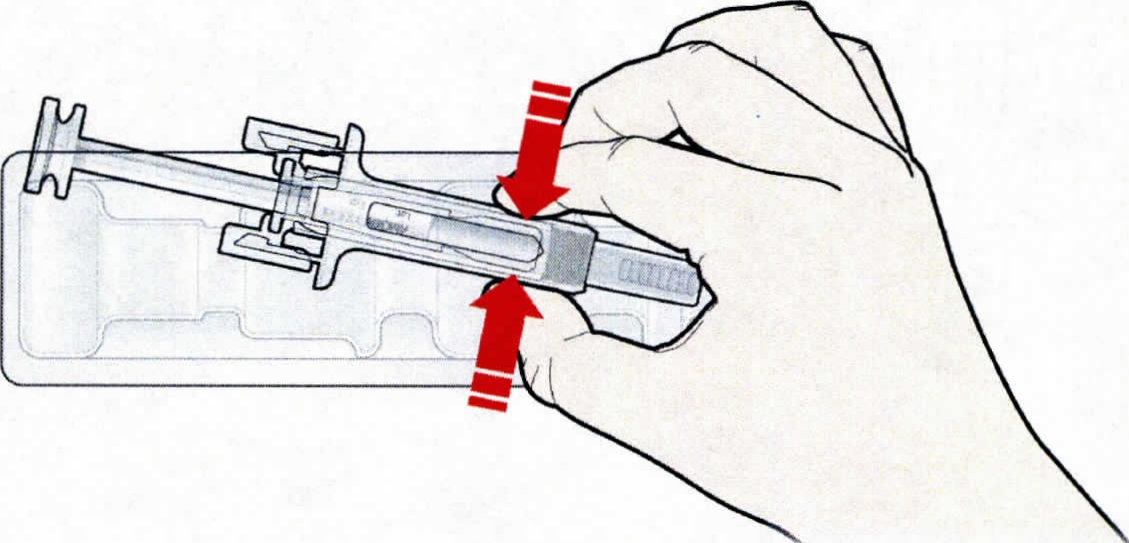
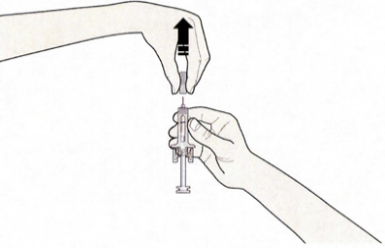
- Откройте контурную ячейковую упаковку, потянув за этикетку. Для извлечения предварительно заполненного шприца из контурной ячейковой упаковки, возьмитесь за защитное устройство.
Возьмите шприц, как показано на рисунке
В целях безопасности:- Не беритесь за плунжер
- Не беритесь за серый колпачок иглы
- Проверьте препарат и предварительно заполненный шприц.
Не используйте предварительно заполненный шприц, если:- Препарат мутный или содержит посторонние частицы. Раствор должен быть прозрачным, бесцветным или светло-желтым.
- Любая из частей повреждена или сломана.
- Серый колпачок иглы отсутствует или неплотно надет.
- Истек последний день указанного на этикетке месяца срока годности.
Сообщите Вашему лечащему врачу или медицинской сестре обо всех перечисленных случаях.
Шаг 2: Подготовка места инъекции
- Тщательно вымойте руки. Подготовьте и обработайте место инъекции.
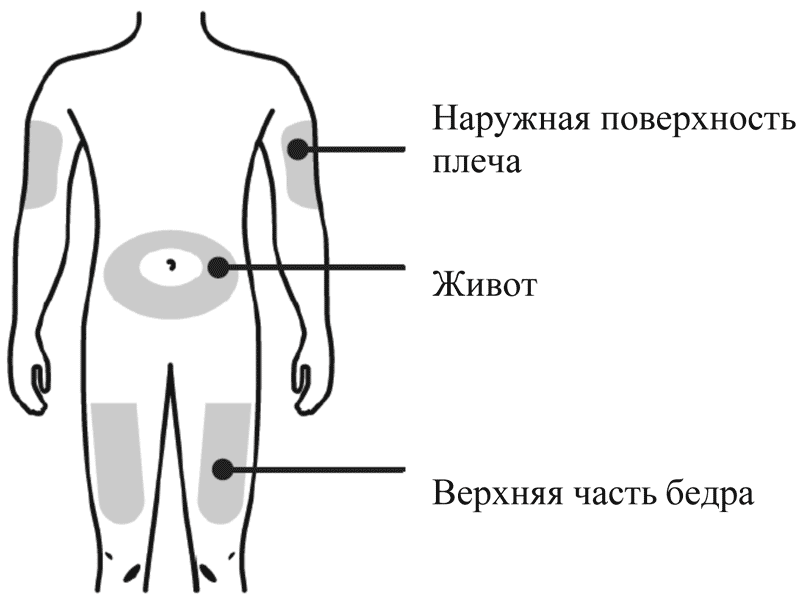
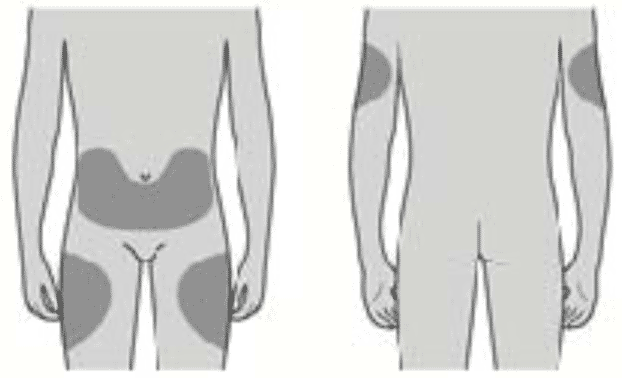
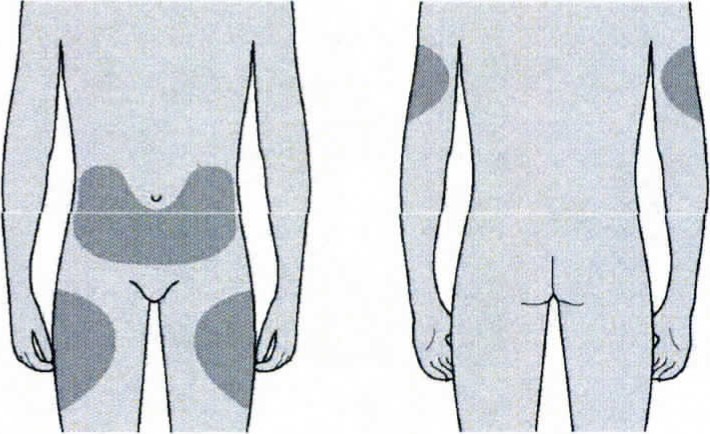
Вы можете использовать:- Верхняя часть бедра
- Верхнюю часть бедра
- Живот, за исключением области вокруг пупка, примерно 5 см
- Наружную поверхность плеча (только если инъекцию Вам делает кто-то другой)
Обработайте место инъекции смоченным в спирте тампоном. Дайте коже высохнуть.
Не дотрагивайтесь до места инъекции перед инъекцией.
Не используйте для инъекций области, где кожа тонкая, с гематомой, покрасневшая или жесткая. Избегайте инъекций в области со шрамами или растяжками. - Осторожно потяните серый колпачок с иглы без скручивания, по направлению от шприца.
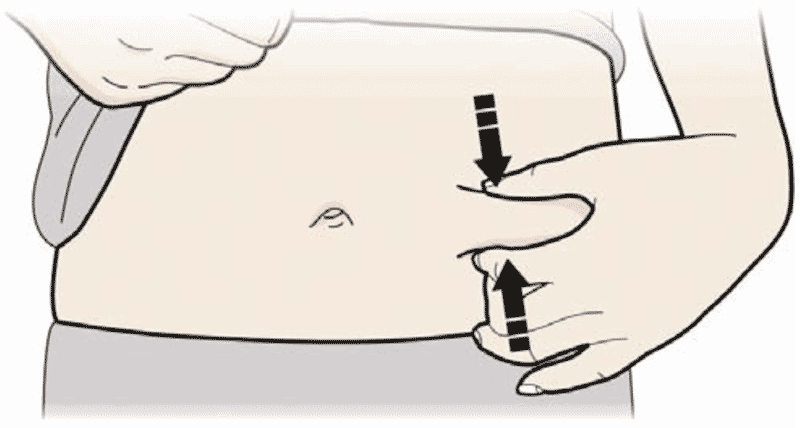
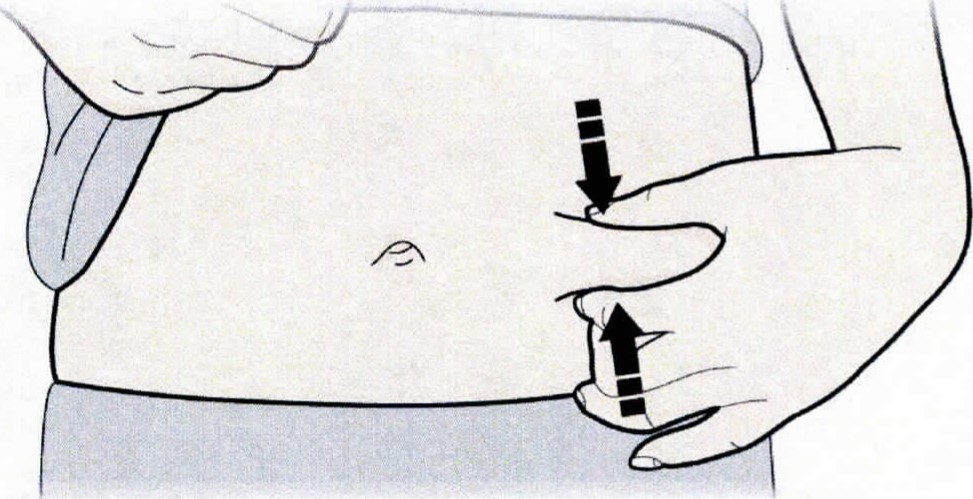
- Зажмите место инъекции для получения упругой поверхности.
Важно удерживать кожу зажатой при проведении инъекции.
Шаг 3: Введение
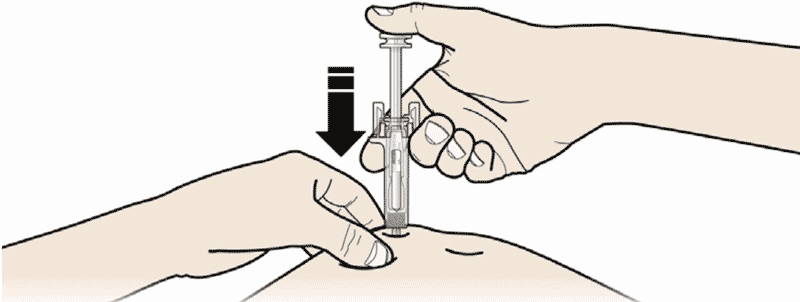
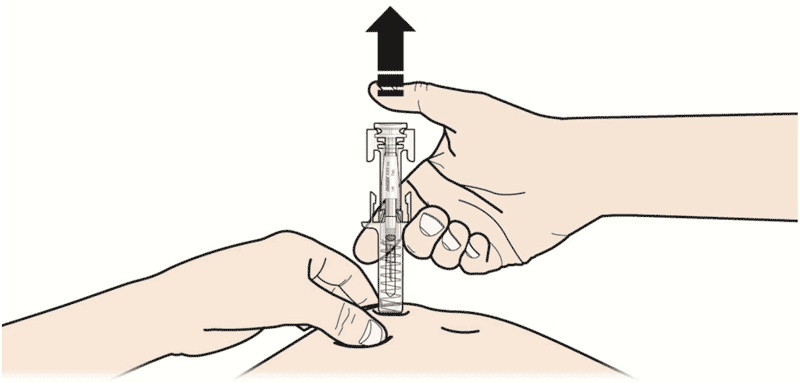
- Зажмите кожу. ВВЕДИТЕ иглу в кожу.
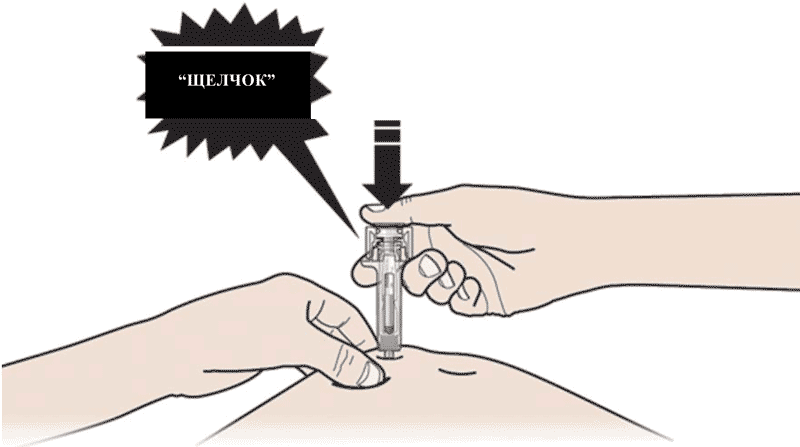
Не дотрагивайтесь до обработанной области инъекции. - Медленно и плавно НАДАВЛИВАЙТЕ на поршень до тех пор, пока Вы не почувствуете или услышите «щелчок». Надавливайте на поршень до щелчка.
Важно надавливать на поршень до щелчка, для введения всей дозы. - ОТПУСТИТЕ большой палец. Затем ИЗВЛЕКИТЕ шприц из кожи.
После того, как вы отпустите поршень, защитное устройство предварительно заполненного шприца покроет иглу.
Не надевайте серый колпачок иглы обратно на предварительно заполненный шприц.
Шаг 4: Окончание
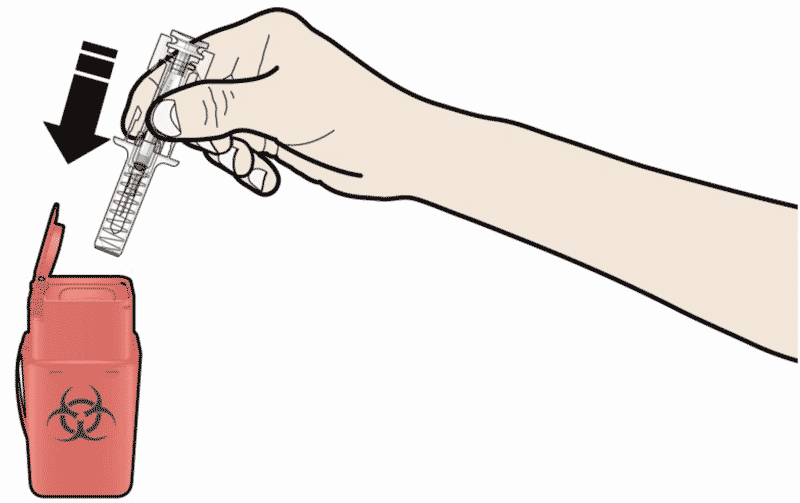
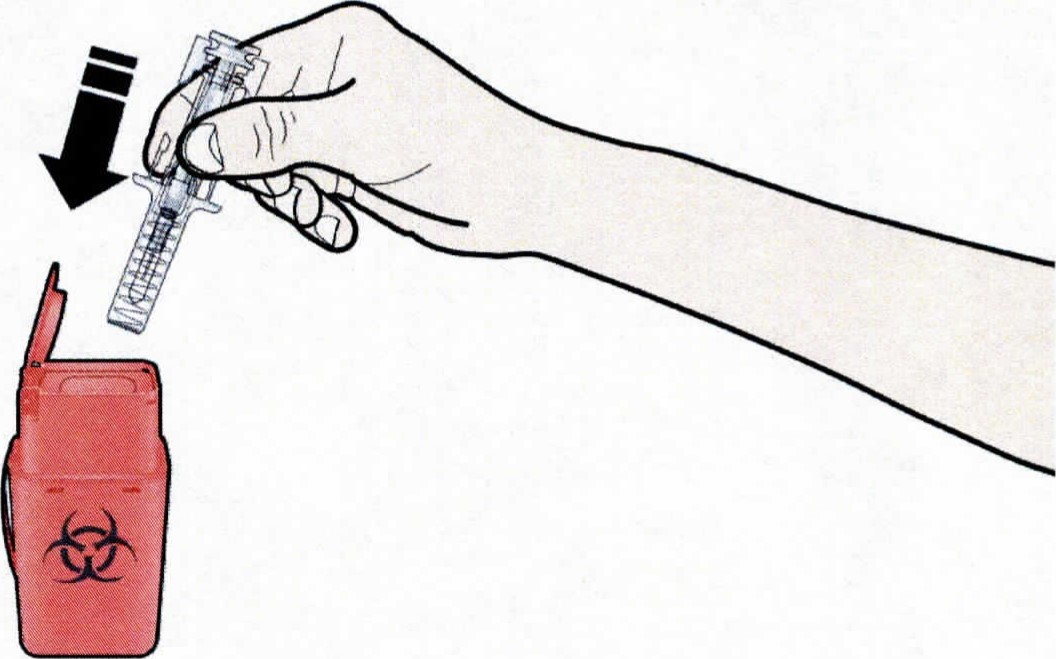
- Выбросите использованный предварительно заполненный шприц и другие сопутствующие материалы в соответствии с местными правилами.
Выбросите использованный предварительно заполненный шприц и серый колпачок иглы. Лекарственные препараты должны быть утилизированы в соответствии с местными требованиями. Спросите у врача или провизора, как уничтожить препарат, если он больше не требуется. Эти меры помогут защитить окружающую среду.
Храните шприцы и сопутствующие материалы в недоступном для детей месте. Не используйте предварительно заполненный шприц повторно. - Осмотрите место инъекции. Если в месте инъекции выступит кровь, прижмите к нему ватный тампон или бинт. Не растирайте место инъекции. При необходимости, заклейте место инъекции пластырем.
Инструкции по введению препарата Пролиа® в предварительно заполненном шприце
В этом разделе приводится информация по правильному проведению инъекции предварительно заполненным шприцем. Очень важно, чтобы перед тем, как Вы приступите к самостоятельным инъекциям, Ваш лечащий врач, медицинская сестра подробно проинструктировали Вас по технике выполнения инъекции. Тщательно вымойте руки перед выполнением инъекции. Если у Вас возникнут вопросы по технике выполнения инъекции, то обратитесь к Вашему лечащему врачу или медицинской сестре.
Перед началом инъекции:
Внимательно прочитайте все инструкции перед использованием ПЗШ.
НЕ используйте ПЗШ, если колпачок был удален.
Как использовать предварительно заполненный шприц?
Ваш врач назначил вам препарат Пролиа® ПЗШ для подкожных инъекций. Вы должны ввести все содержимое шприца (1 мл) однократно и повторить инъекцию через 6 месяцев, как назначено лечащим врачом.
Оборудование:
Для самостоятельной инъекции Вам потребуется:
- новый ПЗШ препарата Пролиа®; и
- смоченные спиртом тампоны или сходные материалы.
Что Вы должны сделать до самостоятельного введения Пролиа® подкожно?
- Достать шприц из холодильника. НЕ берите ПЗШ за поршень или защитный колпачок, это может повредить устройство.
- ПЗШ можно оставить вне холодильника для достижения комнатной температуры. Это позволит сделать инъекцию более комфортной.
НЕ подогревайте ПЗШ каким-либо другим способом (например, в микроволновой печи либо в горячей воде).
НЕ оставляйте шприц под прямыми солнечными лучами. - НЕ встряхивайте ПЗШ.
- НЕ снимайте колпачок с ПЗШ до тех пор, пока Вы не готовы к инъекции.
- Проверить срок годности ПЗШ. Срок годности указан на упаковке как «ГОДЕН ДО: ММ.ГГГГ».
НЕ используйте ПЗШ, если истек последний день указанного на этикетке месяца срока годности. - Проверить внешний вид препарата Пролиа®. Раствор должен быть прозрачным, бесцветным или светло-желтым. Если раствор помутнел или окрашен иначе, препарат использовать нельзя.
- Выбрать комфортное, хорошо освещенное место и чистую поверхность, где можно удобно расположить все необходимые материалы.
- Тщательно вымыть руки.
Как правильно выбрать место для инъекции?
Лучше всего делать инъекции в верхнюю часть бедра и в живот. Если инъекции Вам делает кто-то другой, можно использовать наружную поверхность плеча.
Как правильно сделать инъекцию?
- Продезинфицируйте место инъекции с помощью смоченного в спирте тампона.
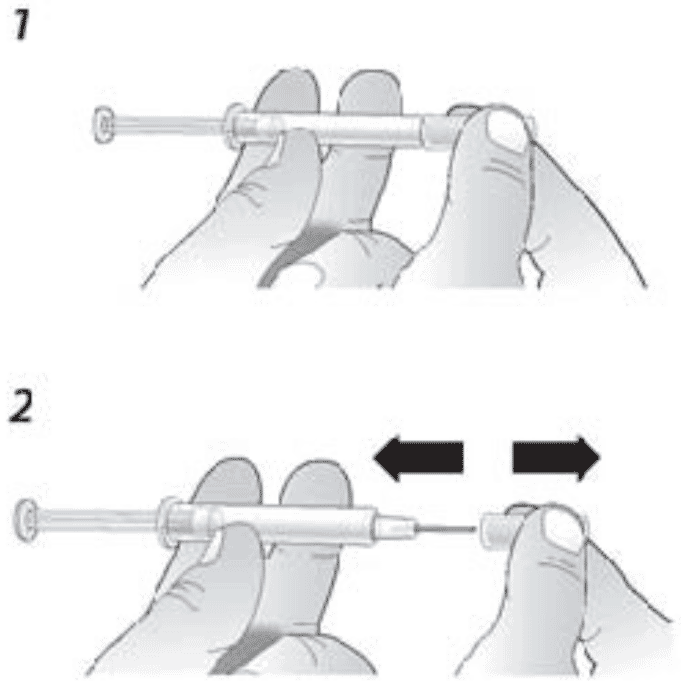
- Во избежание загиба иглы, аккуратно потяните колпачок с иглы сразу без скручивания, как показано на рисунках 1 и 2.
НЕ дотрагивайтесь до иглы и не нажимайте на поршень. - Если внутри ПЗШ видны маленькие пузырьки воздуха, нет необходимости удалять их перед инъекцией. Введение раствора с пузырьками воздуха является безопасным.
- Зажмите кожу (не сдавливая) между большим и указательным пальцами. Введите иглу в кожу полностью, как показывал Вам доктор или медицинская сестра.
- Медленно и плавно надавливайте на поршень, одновременно придерживая кожную складку. Надавливать на поршень следует до тех пор, пока шприц не опустеет.
- Извлеките иглу из кожи, и отпустите кожную складку.
- Если выступит кровь в месте инъекционного прокола, аккуратно стереть ее ватным тампоном или тканью. Не растирайте место инъекции. При необходимости, заклейте место инъекции пластырем.
- Используйте один ПЗШ только для одной инъекции. НЕ используйте оставшийся в шприце препарат.
Помните: При возникновении проблем, обратитесь за помощью или советом к лечащему врачу или медицинской сестре.
Уничтожение использованных шприцев
- НЕ надевайте обратно колпачок на использованный шприц.
- Храните использованный шприц в недоступном для детей месте.
- Использованный шприц должен быть утилизирован в соответствии с местными правилами. Спросите у врача или провизора, как уничтожить препарат, если он больше не требуется. Эти меры помогут защитить окружающую среду.
Купить Предварительно заполненный шприц с препаратом Пролиа в planetazdorovo.ru
*Цена в Москве. Точная цена в Вашем городе будет указана на сайте аптеки.
Комментарии
(видны только специалистам, верифицированным редакцией МЕДИ РУ)
Состав
1 шприц (1 мл) включает 60 мг деносумаба.
Дополнительно: 47 мг сорбитола, 0.1 мг полисорбата 20, 1 мг ледяной уксусной кислоты, до 1 мл воды д/ин, до рН 5.0-5.5 гидроксида натрия.
Форма выпуска
Пролиа выпускается в форме инъекционного раствора для п/к (подкожного) введения, в шприцах по 1мл №1 во вторичной упаковке.
Фармакологическое действие
Ингибирующее (угнетающее) костную резорбцию.
Фармакодинамика и фармакокинетика
Активный ингредиент препарата Пролиа – деносумаб – полностью является моноклональным антителом человека и принадлежит к иммуноглобулиновому подклассу IgG2. Данное вещество характеризуется высокой специфичностью и сродством к рецепторному лиганду κВ (RANKL) – активатору нуклеарного фактора и, связываясь с ним, блокирует активизацию единственного находящегося на поверхности остеокластов, а также их предшественников RANK-рецептора – активатора нуклеарного фактора κВ (RANK). Вследствие этого, взаимодействия RANKL/RANK не происходит, что приводит к подавлению образования, активизации и продолжительности функционирования остеокластов и в свою очередь снижает костную резорбцию (разрушение), а также увеличивает прочность и массу трабекулярного и кортикального слоев кости.
При подкожном (п/к) введении 60 мг деносумаба наблюдалось быстрое снижение плазменных концентраций 1С-телопептида (СТХ), являющегося маркером резорбции костной ткани, примерно на 70% на протяжении 6-ти часов после инъекции и на 85% в течение следующих 3-х суток. Стабильно пониженный уровень СТХ сохранялся на протяжении полугода. При снижении плазменной концентрации деносумаба скорость понижения сывороточного содержания СТХ в некоторой степени уменьшалась, что свидетельствует об обратимости воздействия деносумаба на костное ремоделирование. Такие эффекты отмечались в течение всего терапевтического курса.
В процессе ремоделирования костной ткани в соответствии с физиологической взаимосвязью между ее образованием и резорбцией, после первой инъекции деносумаба в течение первого месяца отмечалось снижение количества маркеров костного образования (например, P1NP и костноспецифической ЩФ). Маркеры костного ремоделирования (образования кости и ее резорбции) обычно приходили к уровню, наблюдаемому до начала терапии, по прошествии не более 9-ти месяцев после введения последней дозы деносумаба. При возобновлении введения деносумаба уровень снижения СТХ соответствовал таковому в начале лечебного курса.
В проведенных исследованиях замены терапии с приема алендроновой кислоты (продолжительность лечения в среднем – 3 года) на введение деносумаба, проходившие с привлечением женщин с малой костной массой в постменопаузе доказали дополнительное уменьшение сывороточного уровня СТХ при применении деносумаба в сравнении с приемом алендроновой кислоты. При этом плазменные концентрации кальция в обеих исследуемых группах были аналогичными.
Также при проведении данных исследований, подавление взаимодействия RANK/RANKL параллельно со связыванием Fc-фрагмента (OPG-Fc) с остеопротегерином приводило к торможению костного роста и замедлению прорезывания зубов. Вследствие этого применение деносумаба у детей может негативно влиять на прорезывание зубов и развитие костей, обладающих открытыми ростовыми зонами.
В связи с тем, что деносумаб является человеческим моноклональным антителом, его применение, как и прочих препаратов белковой природы, теоретически может привести к иммуногенности. Используя иммунологический анализ в сочетании с методом чувствительной электрохемилюминесценции, были произведены обследования более 13000 больных на предмет формирования у них связывающих антител. Менее чем в 1% случаев применение деносумаба на протяжении 5-ти лет приводило к определению антител (включая растущие, транзиторные и существовавшие ранее). Серопозитивные пациенты в дальнейшем прошли обследования с целью выявления нейтрализующих антител. В культуре клеток in vitro методом хемилюминисцентного анализа таких антител обнаружено не было. Также не наблюдалось изменений клинического ответа, фармакокинетического и токсического профиля, зависимых от образования антител.
У женщин с диагностированным постменопаузальным остеопорозом применение Пролиа усиливало минеральную костную плотность, тем самым снижая частоту невертебральных и вертебральных переломов, а также переломов шейки бедра. Профили безопасности и эффективности деносумаба при терапии постменопаузального остеопороза полностью доказаны в ходе исследований, проведенных на протяжении 3-х лет. По результатам данных исследований применение Пролиа по сравнению с введением «плацебо» существенно снижает риск любых переломов, возникающих в постменопаузе у женщин с остеопорозом. В исследовании принимали участие 7808 женщин, у 23,6% из них ранее часто отмечались переломы позвонков. Все три заключительные точки эффективности касательно переломов приходили к статистически значимым показателям, которые оценивали по предварительно разработанному последовательному плану тестирования.
Применение Пролиа на протяжении более 3-х лет показало значимое и стабильное уменьшение риска появления вертебральных переломов. Снижение такого риска наблюдалось в независимости от 10-летней вероятности образования остеопоротических крупных переломов, ранее происходящих частых переломов позвонков, возраста пациентов, невертебральных переломов, минеральной плотности костей, степени костного ремоделирования и предыдущего лечения остеопороза.
У пациенток в постменопаузе в возрасте 75-ти лет и старше применение Пролиа приводило к снижению частоты новых эпизодов вертебральных переломов, а также по данным проведения post hoc анализа сокращало частоту случаев переломов бедренной шейки.
Снижение частоты появления невертебральных переломов также не зависело от 10-летней вероятности образования остеопоротических крупных переломов. Лекарство Пролиа в сравнении с применением «плацебо» существенно повышало минеральную костную плотность, определяемую каждый год проведения 3-х летнего лечения во всех без исключения анатомических областях. Схожее воздействие препарата на минерализацию костей было выявлено в поясничном районе позвоночника и не зависело от расовой принадлежности пациента, его возраста, ИМТ (индекс массы тела), значений минеральной костной плотности и ремоделирования кости. Проведенные гистологические исследования доказали нормальную структуру костей и, в сравнении с «плацебо«, понижение их ремоделирования. Патологических изменений, в том числе остеомаляции, фиброза и нарушений костной структуры отмечено не было.
Безопасность и эффективность препарата Пролиа, назначаемого для терапии снижения костной массы по причине уменьшения содержания андрогенов, также были обоснованы в ходе 3-х летнего исследования с привлечением 1468 больных, страдающих неметастатическим раком простаты. Значимое повышение костной минеральной плотности выявляли в поясничном отделе, бедренной кости ее вертеле и шейке спустя 30 суток после первой инъекции препарата. Увеличение минеральной костной плотности в поясничном отделе возникало в независимости от расовой принадлежности, возраста, ИМТ, географического региона, начальных показателей минеральной костной плотности и костного ремоделирования, а также наличия предшествующих вертебральных переломов и длительности гормондепривационной терапии.
На протяжении 3-х летнего применения Пролиа наблюдалось существенное уменьшение риска образования свежих вертебральных переломов, оцениваемое через 12 и 24 месяца после назначения препарата. Также введение Пролиа уменьшало риск появления свыше одного перелома остеопоротического характера любой локализации.
Безопасность и эффективность Пролиа при терапии потери костной массы, по причине проведения адъювантной терапии с использованием ингибитора ароматазы, определялась в ходе 2-х летнего исследовании с привлечением 252 женщин с диагностированным раком молочной железы (неметастатическим). Применение Пролиа, в сравнении с введением «плацебо«, значительно повышало минеральную костную плотность во всех исследуемых анатомических областях на протяжении 2-х лет. В поясничном отделе наращивание минеральной костной плотности было отмечено спустя 30 суток после введения первой дозы и сохранялось на протяжении всего лечения независимо от возраста пациентки, ИМТ, продолжительности применения ингибитора ароматазы, предыдущей химиотерапии и применения СМРЭ, а также времени, прошедшего от наступления менопаузы.
Фармакокинетика деносумаба при его п/к введении нелинейная и дозозависимая в широком дозировочном диапазоне, характеризующаяся повышением экспозиции препарата в дозировках 60 мг (или 1 мг/кг) и более. При введении 60 мг препарата через 10 суток (с вариабельностью 2-28 дней) его биодоступность была 61%, плазменная Cmax составляла 6 мкг/мл (с вариабельностью 1-17 мкг/мл). По достижению Cmax сывороточная концентрация уменьшалась с T1/2 26 суток (с вариабельностью 6-52 дня) и в дальнейшем на протяжении 3-х месяцев (с вариабельностью 1,5-4,5 месяца). Через 6 месяцев после введения последней дозы Пролиа у 53% пациентов деносумаба в плазме уже не обнаруживалось. При многократном введении 60 мг деносумаба через каждые полгода не отмечалось его кумуляции и изменений фармакокинетики.
Как и обыкновенный иммуноглобулин, деносумаб состоит из углеводов и аминокислот. По результатам проведенных доклинических исследований предполагается, что его метаболические преобразования и дальнейшее выведение будут проходить по пути обычного клиренса и выведения иммуноглобулинов, с распадом на отдельные аминокислоты и короткие пептидные цепи.
Фармакокинетика деносумаба при его применении пациентами в возрасте 28-87 лет не подвергается значимым изменениям. Расовая принадлежность больных также не влияет на фармакокинетику препарата.
Наличие у пациентов патологий почек, по данным исследований с привлечением 55-ти больных с различной степенью тяжести почечной недостаточности, в том числе находящихся на гемодиализе, не приводило к изменениям фармакодинамики и фармакокинетики деносумаба, что говорит об отсутствии необходимости корректировки дозировочного режима.
Влияние печеночных патологий на фармакокинетические параметры деносумаба не изучалось.
Показания к применению
Назначение Пролиа показано для терапии постменопаузального остеопороза, а также потери массы костной ткани у женщин с раком молочной железы, проходящих лечение с применением ингибиторов ароматазы и у мужчин с раком простаты, находящихся на гормондепривационной терапии.
Противопоказания
Применение Пролиа противопоказано при наличествующей гипокальциемии и персональной гиперчувствительности к деносумабу и/или прочим ингредиентам ЛС.
Побочные действия
При проведении контролируемых клинических исследований наблюдали следующие негативные реакции: часто – формирование катаракты у пациентов мужского пола с раком простаты, проходящих андрогендепривационную терапию, болевые ощущения в конечностях; нечасто – развитие экзем (в том числе, включая аллергические, контактные и атопические дерматиты), воспалительные процессы в подкожной клетчатке; редко – челюстной остеонекроз; эпизодически – возникновение гипокальциемии.
Пролиа, инструкция по применению (Способ и дозировка)
Проведение п/к инъекций препаратом Пролиа рекомендуют проводить дважды в год (1 раз в 6 месяцев) в дозе 60 мг. На протяжении всего курса лечения советуют параллельно принимать витамин D и препараты кальция.
К самостоятельному введению Пролиа можно приступить только после предварительной консультации у лечащего врача, в ходе которой он должен подробно объяснить пациенту все нюансы техники проведения инъекций.
С целью снижения риска случайных уколов каждый уже заполненный шприц оснащен защитным предохранителем для иглы, активирующимся автоматически для ее закрытия сразу после выполнения инъекции.
Не следует пытаться разобрать шприц или активизировать защитный предохранитель. Нельзя использовать шприцы с отсутствующим колпачком или активизированным предохранителем иглы.
Для проведения инъекции препаратом Пролиа самостоятельно вам понадобится новый заполненный шприц и спиртовые салфетки.
Непосредственно перед самим введением следует достать из холодильника шприц, при этом, не беря его за защитный колпачок или поршень, так как это может привести к повреждению устройства.
Для комфортного введения необходимо оставить на некоторое время шприц при комнатной температуре, но не под воздействием солнечных лучей (не следует подогревать шприц в горячей воде, микроволновой печи и т.д.). Не нужно встряхивать шприц и удалять защитный колпачок до начала инъекции.
Далее необходимо убедиться в соответствии срока годности препарата Пролиа, указанного на упаковке, и визуально проверить инъекционный раствор на посторонние включения и изменения цвета (допускается введение только прозрачного, бесцветного или светло-желтого раствора). Разрешено введение раствора с небольшими пузырьками воздуха.
Выбрать хорошо освещенное, комфортное место с близко расположенной чистой поверхностью, на которой разместить необходимые для инъекции материалы и тщательно вымыть руки.
Инъекции лучше всего проводить в верхнюю область бедра или живота. В случае проведения процедуры другим лицом может быть использована тыльная поверхность рук. При отечности или покраснении предполагаемой области введения следует выбрать иное место для инъекции.
Продезинфицировать выбранное место спиртовой салфеткой.
Аккуратно снять защитный колпачок, не вращая его, а просто потянув вверх. Следует избегать касания к игле и нажима на поршень.
Взять шприц в удобную руку и, не сдавливая, зажать кожу между указательным и большим пальцами другой руки. Ввести иглу в основание складки кожи под углом 45° на глубину около 15 мм.
Удерживая кожную складку плавно и медленно, надавить на поршень до полного введения раствора. Защитный предохранитель иглы закроется только тогда, когда шприц полностью опустеет.
Не меняя давления на поршень, следует удалить иглу из кожной складки, после чего отпустить поршень и позволить защитному предохранителю целиком закрыть иглу.
В случае несрабатывания предохранителя возможно неполное введение дозы препарата, что потребует дополнительной консультации у врача.
При появлении крови в месте введения нужно аккуратно удалить ее ватной салфеткой. Не следует растирать кожу в районе инъекции. Место прокола можно заклеить пластырем.
Один шприц предназначен для проведения только одной инъекции. Оставшийся препарат повторно применять запрещено.
Использованный шприц закрывать колпачком не следует. Утилизировать все его части нужно в соответствии с рекомендуемыми врачом правилами.
Передозировка
В ходе проведенных клинических исследований введение ежемесячной дозы Пролиа 180 мг на протяжении полугода (в сумме 1080 мг за 6 месяцев) не выявило каких-либо негативных симптомов.
Взаимодействие
Направленных изысканий взаимодействия деносумаба с прочими ЛС не проводилось. Не стоит смешивать препарат с другими растворами.
Условия продажи
Купить Пролиа возможно только по рецепту.
Условия хранения
Длительная сохранность препарата требует температуры 2-8°С. Хранить шприцы следует в упаковке завода-производителя, в холодильнике, не замораживая. После изъятия Пролиа из холодильника срок его хранения при температуре до 25°С ограничен 30-ю сутками.
Срок годности
При условии соблюдения температуры 2-8°С препарат можно использовать на протяжении 3-х лет.
Особые указания
Пожилые пациенты и больные с патологиями почек не требуют корректировки дозировочного режима деносумаба.
Влияние патологий печени на безопасность и эффективность Пролиа не изучалось.
Во время терапии препаратом Пролиа рекомендуют параллельно принимать витамин D и препараты кальция, в особенности пациентам с патологиями почек.
Перед началом лечения корректировка наличествующей гипокальциемии может быть произведена приемом адекватных доз витамина D и препаратов кальция. У пациентов с повышенным риском формирования гипокальциемии следует следить за содержанием кальция.
В некоторых случаях применение Пролиа приводило к развитию кожных инфекций и ее придатков (как правило, наблюдаются воспалительные процессы в подкожной клетчатке), которые иногда могут потребовать госпитализации. В проведенных исследованиях возникновение таких реакций чаще наблюдалось в группе применения деносумаба (0,4%) в сравнении с группой введения «плацебо» (0,1%). В случае возникновения кожных инфекций пациенты должны незамедлительно сообщить об этом своему врачу.
У больных с распространенным раком, которые проходили лечение с ежемесячным введением 120 мг деносумаба, изредка наблюдали развитие остеонекроза челюсти. Также существуют отдельные сообщения о формировании данной патологии при применении схемы терапии деносумабом – 60 мг дважды в 12 месяцев.
При наличии у пациента аллергии на латекс следует избегать касаний к колпачку иглы.
Аналоги
Совпадения по коду АТХ 4-го уровня:
Аналоги Пролиа представлены препаратами: Бивалос, Остеохель С, Остеогенон, Стромос, Остеокеа, Остеолат.
Детям
Безопасность и эффективность Пролиа в педиатрии не изучались, в связи с чем его не назначают в детской возрастной группе.
При беременности и лактации
Каких-либо достоверных данных о применении Пролиа во время беременности не существует, из-за чего его назначение в этот период не рекомендуется.
Возможность проникновения деносумаба в молоко кормящей матери до конца не изучено, однако есть свидетельства его негативного влияния на грудных детей. По этой причине при кормлении грудью применять препарат Пролиа не рекомендуют.
Отзывы
Отзывы о Пролиа относительно эффективности укрепления и наращивания плотности костной ткани при остеопорозе немногочисленные и неоднозначные. Некоторые пациенты, все-таки решившиеся приобрести этот препарат и прошедшие всего одну инъекцию, уже через полгода на очередной денситометрии отмечали положительную динамику своего болезненного состояния, при этом все они строго придерживались предписаний врача на протяжении этого времени и дополнительно принимали витамин D и препараты кальция. Другие больные не ощутили у себя положительных изменений или остались недовольны их значимостью.
Сами врачи, ссылаясь на результаты исследований деносумаба, рекомендуют Пролиа к применению, но предупреждают, что абсолютной гарантии значимого положительного эффекта по отношению ко всем пациентам быть не может. Несмотря на это стоит заметить, что объективно отрицательных отзывов о препарате Пролиа у применявших его пациентов, кроме его стоимости, очень немного.
Цена, где купить
Цена на Пролиа 60 мг/1 мл №1 варьируется в районе 21000-23000 рублей.
Каждый предварительно заполненный шприц содержит:
Активное вещество: 60 мг деносумаба.
Вспомогательные вещества: уксусная кислота ледяная, натрия гидроксид (для доведения уровня рН), сорбитол (Е420), полисорбат 20, вода для инъекций.
Раствор для инъекций.
Прозрачный раствор от бесцветного до светло-желтого цвета, практически свободный от включений.
Средства для лечения заболеваний костей. Прочие средства, влияющие на структуру и минерализацию костей.
Код АТХ: М05ВХ04
Фармакодинамика
Механизм действия
Деносумаб представляет собой человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к лиганду рецептора активатора ядерного фактора каппа В (RANKL) и тем самым препятствует активации рецептора RANK, расположенного на поверхности остеокластов и их предшественников. Предотвращение взаимодействия RANKL/RANK ингибирует образование, активацию и выживаемость остеокластов, приводя к уменьшению костной резорбции в кортикальных и трабекулярных слоях кости.
Фармакодинамические эффекты
Лечение препаратом Пролиа® приводило к быстрому снижению скорости ремоделирования кости, достигая минимальных (снижение на 85%) сывороточных концентраций маркера костной резорбции – 1С-телопептида (СТХ) в течение 3 дней. Уменьшение концентрации СТХ оставалось стабильным в интервале между введениями препарата. В конце каждого интервала дозирования выраженность снижения концентрации СТХ в сыворотке крови частично уменьшалась от максимального снижения ≥ 87% до приблизительно ≥ 45% (диапазон 45-80%), что отражает обратимость влияния Пролиа® на ремоделирование кости при снижении концентрации деносумаба в сыворотке крови. Данные эффекты наблюдались на протяжении всего курса лечения. Маркеры ремоделирования кости, как правило, достигали концентраций периода до начала лечения не позднее, чем через 9 месяцев после введения последней дозы препарата. После возобновления лечения деносумабом степень снижения концентраций СТХ была сходна со степенью снижения концентрации СТХ в начале курса лечения деносумабом.
Иммуногенность
По данным клинических исследований во время применения деносумаба не наблюдалось образования нейтрализующих антител. С помощью метода чувствительного иммуноанализа было показано, что менее чем у 1 % пациентов, получавших деносумаб в течение периода времени до 5 лет, определялись не нейтрализующие связывающие антитела без признаков влияния на фармакокинетический профиль, токсичность или клинический ответ.
Клиническая эффективность и безопасность у женщин в постменопаузе с остеопорозом
Эффективность и безопасность Пролиа®, вводимого каждые 6 месяцев в течение трех лет, исследовались на женщинах с постменопаузальным остеопорозом ( 7808 женщин в возрасте 60-91 год, из которых у 23,6% отмечались часто встречающиеся переломы позвонков) с исходной минеральной плотностью костей (Т-критерий) в поясничном отделе позвоночника или бедре между -2,5 и -4,0 и средней абсолютной 10-летней вероятностью возникновения переломов 18,60% (децили: 7,9-32,4%) для крупных остеопоротических переломов и 7,22% (децили: 1,4-14,9%) для переломов бедра. Женщины с другими заболеваниями или находящиеся на терапии, которая может оказывать влияние на кости, были исключены из исследования. Дополнительно женщины ежедневно получали кальций (не менее 1 000 мг) и витамин D (не менее 400 МЕ).
Влияние на вертебральные переломы
Пролиа® значительно снижает риск появления новых вертебральных переломов через 1, 2 и 3 года после начала терапии (р < 0,0001) (смотрите таблицу 1 ниже).
Таблица 1 Влияние Пролиа® на риск новых вертебральных переломов
| Количественное соотношение женщин с переломами (%) |
Снижение абсолютного риска (%) (95% CI) |
Снижение относительного риска (%) (95% CI) |
||
|
Плацебо n=3906 |
Пролиа® n=3902 | |||
| 0-1 год | 2,2 | 0,9 | 1,4 (0,8, 1,9) | 61 (42, 74)** |
| 0-2 года | 5,0 | 1,4 | 3,5 (2,7, 4,3) | 71 (61 79)** |
| 0-3 года | 7,2 | 2,3 | 4,8 (3,9, 5,8) | 68 (59,74)* |
*р < 0,0001, **р < 0,0001 — исследовательский анализ
Влияние на перелом бедра
Пролиа® показала 40% относительное снижение (0,5% снижение абсолютного риска) риска перелома бедра в течение трех лет (p < 0,05). Частота перелома бедра составила 1,2% в группе плацебо по сравнению с 0,7% в группе приема Пролиа® через 3 года после начала лечения.
Post hoc анализ показал 62% снижение относительного риска перелома бедра (1,4% снижение абсолютного риска, р < 0,01) у женщин > 75 лет, получавших лекарственное средство Пролиа®.
Влияние на все клинические переломы
Лечение препаратом Пролиа® значительно снижало частоту переломов всех типов/групп (смотрите таблицу 2 ниже).
Таблица 2 Влияние Пролиа® на риск клинических переломов после трех лет лечения
|
Количественное соотношение женщин с переломами (%)+ |
Снижение абсолютного риска (%) (95% Cl) |
Снижение относительного риска (%) (95% CI) |
||
| Плацебо n=3906 | Пролиа® n=3902 | |||
|
Любой клинический перелом1 |
10,2 | 7,2 | 2,9 (1,6, 4,2) | 30 (19, 41)*** |
| Клинический вертебральный перелом | 2,6 | 0,8 | 1,8 (1,2, 2,4) | 69 (53, 80)*** |
|
Невертебральный перелом2 |
8,0 | 6,5 | 1,5 (0,3, 2,7) | 20 (5, 33) ** |
| Большой невертебральный перелом3 | 6,4 | 5,2 | 1,2 (0,1, 2,2) | 20 (3, 34)* |
| Большой остеопоротический перелом4 | 8,0 | 5,3 | 2,7 (1,6, 3,9) | 35 (22, 45) *** |
*р ≤ 0,05; **р = 0,0106 (вторичная конечная точка, включенная в корректировку множества),
*** р ≤ 0,0001
*Частота возникновения побочной реакции на основе оценки Каплана-Мейера через 3 года.
1 Включая клинические вертебральные и невертебральные переломы.
2 За исключением переломов позвонков, черепа, нижней челюсти, пясти, фаланг пальцев руг и ног, лицевых переломов.
3 Включая переломы таза, дистального отдела бедра, проксимального отдела большеберцовой кости, ребер, проксимального отдела плечевой кости, костей предплечья и бедра.
4 Включая клинические вертебральные переломы, переломы бедра, костей предплечья, плечевой кости, в соответствии с определением ВОЗ.
У женщин с исходной минеральной плотностью кости шейки бедра ≤ -2,5. Пролиа® снижала риск невертебральных переломов (35% снижение относительного риска, 4,1% снижение абсолютного риска, р < 0,001, исследовательский анализ).
Снижение в частоте новых вертебральных переломов, переломов бедра и невертебральных переломов через 3 года приема препарата Пролиа® наблюдалось независимо от 10-летней вероятности возникновения переломов до начала лечения.
Влияние на минеральную плотность костей
Препарат Пролиа® значительно увеличивал минеральную плотность костей во всех анатомических областях, по сравнению с плацебо, через 1, 2 и 3 года лечения. Увеличение минеральной плотности кости наблюдалось на 9,2% в поясничном отделе позвоночника, на 6,0% в бедре, на 4,8% в шейке бедра, на 7,9% в вертеле бедренной кости, на 3,5% в дистальном отделе лучевой кости и на 4,1% в среднем во всех костях через 3 года после начала лечения (р < 0,0001 для всех значений).
В клинических исследованиях, оценивающих влияние отмены Пролиа®, минеральная плотность костей практически возвращалась к уровню до начала лечения и оставалась выше уровня плацебо в течение 18 месяцев после введения последней дозы. Полученные данные указывают на то, что для поддержания клинического эффекта требуется продолжительное лечение препаратом Пролиа®. Возобновление терапии препаратом Пролиа® приводило к увеличению минеральной плотности костей, схожим с тем, которое наблюдалось при первом введении препарата.
Открытое расширенное клиническое исследование лечения постменопаузального остеопороза
4550 пациентов (2343 получали Пролиа® и 2207 плацебо), которые пропустили не более одной дозы исследуемого препарата в базовом исследовании, описанном выше, и пришедшие на визит к врачу через 36 месяцев после начала исследования, согласились принять участие в семилетнем мультинациональном, мультицентровом, открытом, расширенном несравнительном исследовании долгосрочной безопасности и эффективности препарата Пролиа®. Все женщины в расширенном исследовании получали Пролиа® 60 мг каждые 6 месяцев, а также ежедневно принимали кальций (не менее 1 г) и витамин D (не менее 400 МЕ). В общей сложности 2626 пациентов (58% женщин, включенных в расширенное исследование, т.е. 34% женщин, включенных в базовое исследование) завершили расширенное исследование.
У пациентов, получавших Пролиа® на протяжение 10 лет исходная минеральная плотность костей увеличилась по сравнению с исходным уровнем в расширенном исследовании на 21,7% в поясничном отделе позвоночника, на 9,2% в бедре, на 9,0% в шейке бедра, на 13,0% в вертеле бедра и на 2,8% в дистальном отделе лучевой кости. Среднее значение Т-критерия минеральной плотности костей поясничного отдела позвоночника в конце исследования составляло -1,3 у пациентов, получавших лечение в течение 10 лет.
В качестве конечной точки безопасности оценивалась частота переломов, но эффективность в предотвращении переломов не может быть оценена из-за большого количества прекращения лечения и открытого дизайна исследования. Кумулятивная частота новых вертебральных и невертебральных переломов составила примерно 6,8% и 13,1% соответственно у пациентов, которые получали лечение деносумабом в течение 10 лет (n=1278). У пациентов, которые не завершили исследование по каким-либо причинам, наблюдалась более высокая частота переломов при лечении.
В ходе расширенного исследования было зафиксировано 13 подтвержденных случаев остеонекроза челюсти и 2 случая атипичных переломов шейки бедра.
Клиническая эффективность и безопасность у мужчин с остеопорозом
Эффективность и безопасность применения лекарственного средства Пролиа®, вводимого однократно каждые 6 месяцев, оценивалась в исследовании продолжительностью 1 год, включавшем 242 мужчин в возрасте от 31 до 84 лет. Из исследования были исключены лица с рСКФ (расчетная скорость клубочковой фильтрации) < 30 мл/мин/1,73 м2. Все мужчины дополнительно получали кальций (не менее 1 000 мг) и витамин D (не менее 800 МЕ) ежедневно.
Первичной переменной эффективности являлось процентное изменение минеральной плотности кости в поясничном отделе позвоночника, эффективность в предотвращении переломов не оценивалась. Лекарственное средство Пролиа® значительно увеличило минеральную плотность кости во всех анатомических областях по сравнению с плацебо через 12 месяцев после начала лечения: на 4,8% в поясничном отделе, на 2,0% в бедре, на 2,2% в шейке бедра, на 2,3% в вертеле бедренной кости, на 0,9% в дистальном отделе лучевой кости (р < 0,05 для всех значений). Препарат Пролиа® увеличил минеральную плотность кости в поясничном отделе позвоночника по сравнению с исходным значением у 94,7% мужчин через год лечения. Значительное увеличение минеральной плотности кости в поясничном отделе, бедре, шейке бедра и вертеле бедренной кости наблюдалось через 6 месяцев после начала лечения (р < 0,0001).
Гистология костей у постменопаузальных женщин и мужчин с остеопорозом
Гистология костей оценивалась у 62 женщин с постменопаузальным остеопорозом или с низкой костной массой, которые ранее не проходили лечения по поводу остеопороза либо были переведены с терапии алендронатом с последующим применением препарата Пролиа® в течение 1-3 года. 59 женщин участвовали в исследовании с биопсией костей через 24 месяца (n=41) и/или 84 месяца (n=22) лечения в рамках расширенного клинического исследования у женщин с остеопорозом в постменопаузе. Гистология костей также оценивалась у 17 мужчин с остеопорозом через год лечения Пролиа®. Результаты биопсии костей показали нормальную архитектонику и качество кости без признаков нарушения минерализации, образования волокнистой кости или фиброза костного мозга. Результаты гистоморфометрии в расширенном исследовании у женщин в постменопаузе с остеопорозом показали, что антирезорбтивный эффект Пролиа®, который определялся по частоте активации и уровню формирования костной ткани, сохранялся в течение долгого времени.
Клиническая эффективность и безопасность у пациентов с потерей костной массы, вызванной депривацией андрогенов
Эффективность и безопасность Пролиа®, вводимого каждые 6 месяцев в течение трех лет, исследовались на мужчинах с гистологически подтвержденным неметастатическим раком предстательной железы, получающих андроген-депривационную терапию (1468 пациентов в возрасте 48-97 лет), которые были подвержены повышенному риску переломов (пациенты в возрасте > 70 лет, или пациенты в возрасте < 70 лет с минеральной плотностью костей в поясничном отделе, в бедре или шейке бедра Т-критерий < -1,0 или с наличием остеопоротических переломов в анамнезе). Все пациенты ежедневно получали кальций (не менее 1 000 мг) и витамин D (не менее 400 МЕ).
Препарат Пролиа® значительно увеличивал минеральную плотность костей во всех анатомических областях, по сравнению с плацебо, через 3 года лечения. Увеличение МПК наблюдалось на 7,9% в поясничном отделе позвоночника, на 5,7% в бедре, на 4,9% в шейке бедра, на 6,9% в вертеле бедренной кости, на 6,9% в дистальном отделе лучевой кости и на 4,7% во всем теле (р < 0,0001 для всех значений). В проспективно запланированном исследовательском анализе значительное увеличение минеральной плотности костей в поясничном отделе позвоночника, бедре, шейке бедра и вертеле бедренной кости наблюдалось через 1 месяц после введения начальной дозы.
Пролиа® продемонстрировала значительное снижение относительного риска новых вертебральных переломов: 85% (1,6% снижение абсолютного риска) через год, 69% (2,2% снижение абсолютного риска) через 2 года и 62% (2,4% снижение абсолютного риска) через 3 года (р < 0,01 для всех значений).
Клиническая эффективность и безопасность у пациентов с потерей костной массы, вызванной адъювантной терапией ингибиторами ароматазы
Эффективность и безопасность Пролиа®, вводимого каждые 6 месяцев в течение двух лет, оценивалась у женщин с неметастатическим раком молочной железы (252 пациентки в возрасте 35-84 лет) и исходными значениями минеральной плотности костей Т-критерий между -1,0 и -2,5 для поясничного отдела позвоночника, бедра или шейки бедра. Все женщины ежедневно дополнительно получали не менее 1 000 мг кальция и не менее 400 МЕ витамина D.
Первичной переменной эффективности являлось процентное изменение минеральной плотности костей в поясничном отделе позвоночника. Эффективность в отношении переломов не оценивалась. Препарат Пролиа® значительно увеличивал минеральную плотность костей во всех анатомических областях, по сравнению с плацебо, через 2 года лечения. Увеличение МПК наблюдалось на 7,6% в поясничном отделе позвоночника, на 4,7% в бедре, на 3,6% в шейке бедра, на 5,9 % в вертеле бедренной кости, на 6,1% в дистальном отделе лучевой кости и на 4,2% в среднем в костях (р < 0,0001 для всех значений).
Детская популяция
Европейское агентство по лекарственным средствам отказалось от обязательства представить результаты исследований Пролиа® во всех подгруппах детской популяции при лечении потери костной массы, связанной с аблативной терапией половыми гормонами, а также в подгруппе детского населения в возрасте до 2 лет при лечении остеопороза. Информацию о применении в детской популяции смотрите в разделе «Способ применения и дозы».
Фармакокинетика
Всасывание
После подкожного введения деносумаба в дозе 1,0 мг/кг, что приблизительно соответствует утвержденной дозе 60 мг, экспозиция, определяемая по площади под кривой концентрации (AUC) составила 78% в сравнении с внутривенным введением в той же дозе. При подкожном введении дозы 60 мг максимальная концентрация деносумаба (Сmах) в сыворотке – 6 мкг/мл (диапазон 1-17 мкг/мл) наблюдалась через 10 дней (диапазон 2-28 дней).
Биотрансформация
Деносумаб состоит из аминокислот и углеводов, как естественный иммуноглобулин, поэтому маловероятно, что препарат выводится через механизмы печеночного метаболизма. Ожидается, что метаболизм деносумаба будет происходить по пути клиренса иммуноглобулинов, с распадом на небольшие пептидные цепи и отдельные аминокислоты.
Выведение
После достижения Сmах содержание препарата в сыворотке крови снижалось с периодом полувыведения 26 дней (диапазон 6-52 дня) и далее в течение 3 месяцев (диапазон 1,5 4,5 месяцев). У 53% пациентов деносумаб не обнаруживался в сыворотке крови после 6 месяцев от последнего введения препарата.
Не наблюдалось изменений фармакокинетических параметров деносумаба, а также кумуляции за всё время введения многократных подкожных доз препарата по 60 мг каждые 6 месяцев. На фармакокинетику деносумаба не оказывало влияния формирование связывающих антител к деносумабу. Фармакокинетика была схожа у мужчин и женщин. Возраст (28-87 лет), раса, стадия заболевания (остеопения или остеопороз, рак предстательной или молочной железы) не оказывали значительного влияния на фармакокинетику деносумаба.
На основании показателей AUC и Сmах была выявлена тенденция к снижению экспозиции препарата у пациентов с более высокой массой тела. Однако данная тенденция не является клинически значимой, так как фармакодинамические эффекты, оцениваемые по маркерам ремоделирования кости и повышению минеральной плотности костей, оставались постоянными в различных весовых категориях больных.
Линейность/нелинейность
В ходе исследований по изучению дозозависимости была продемонстрирована нелинейная дозозависимая фармакокинетика деносумаба с уменьшением клиренса препарата при увеличении дозы или концентрации, но приблизительно пропорциональное дозозависимое увеличение экспозиции препарата наблюдается при применении доз 60 мг и выше.
Отдельные группы пациентов
Пациенты с почечной недостаточностью
В исследовании у 55 пациентов с различной степенью почечной дисфункции, включая пациентов, находящихся на диализе, степень почечной недостаточности не оказывала влияния на фармакокинетику деносумаба.
Печеночная недостаточность
Исследований влияния печеночной недостаточности на фармакокинетику деносумаба не проводилось. Как правило, моноклональные антитела не выводятся посредством механизмов печеночного метаболизма. Поэтому ожидается, что печеночная недостаточность не оказывает влияния на фармакокинетику деносумаба.
Применение у детей
Фармакокинетика у детей не изучалась.
• Лечение остеопороза у женщин в постменопаузальном периоде и у мужчин с повышенным риском переломов. У женщин в постменопаузальном периоде Пролиа® значительно снижает риск вертебральных, невертебральных переломов и переломов бедра.
• Лечение потери костной массы, вызванной гормон-депривационной терапией при раке предстательной железы у мужчин с повышенным риском переломов (см. раздел «Фармакодинамика»). У данной категории пациентов Пролиа® значительно снижает риск вертебральных переломов.
Повышенная чувствительность к активной субстанции или к любому из компонентов препарата.
Гипокальциемия (см. раздел «Меры предосторожности»).
Беременность
Нет адекватных данных по применению деносумаба во время беременности. Репродуктивная токсичность была продемонстрирована в исследованиях на макаках, которым во время беременности вводили дозы препарата с AUC, в 119 раз превышающей рекомендуемые для клинического применения у человека.
Пролиа®не рекомендуется для применения у беременных женщин.
Лактация
Не известно, выводится ли деносумаб через грудное молоко. Эксперименты на мышах с выключенным геном RANKL («нокаутные мыши») показали, что отсутствие RANKL (являющегося мишенью деносумаба, см. «Фармакодинамика») может вызвать нарушение созревания молочной железы, что может приводить к ослаблению послеродовой лактации. Решение о прекращении грудного вскармливания или отмене терапии препаратом Пролиа® должно приниматься с учетом пользы грудного вскармливания для новорожденного и пользы лечения для матери.
Фертильность
Данных о воздействии деносумаба на фертильность человека не получено. Исследования на животных указывают на отсутствие прямого или косвенного негативного воздействия на фертильность.
Доза
Рекомендуемая доза препарата Пролиа® – одна подкожная инъекция 60 мг в бедро, живот или плечо каждые 6 месяцев.
В течение курса лечения требуется дополнительно принимать адекватные дозы препаратов кальция и витамина D (см. раздел «Меры предосторожности»).
Не было установлено оптимальной общей продолжительности антирезорбтивного лечения остеопороза (включая деносумаб и бисфосфонаты). Необходимость продолжения лечения следует периодически пересматривать индивидуально для каждого на основе преимуществ и потенциальных рисков деносумаба, особенно после 5 или более лет применения (см. раздел «Меры предосторожности»).
Применение у отдельных групп пациентов
Детская популяция
Препарат Пролиа® не рекомендован к применению в педиатрии (< 18 лет), так как эффективность и безопасность Пролиа® не изучались в этой возрастной группе. В исследованиях на животных ингибирование RANК/RANК лиганда (RANKL) связывали с ингибированием роста костей и нарушением прорезывания зубов.
Пожилые (≥ 65 лет)
Не требуется коррекции режима дозирования препарата у пожилых пациентов.
Почечная недостаточность
Не требуется коррекции режима дозирования препарата у пациентов с почечной недостаточностью (см. рекомендации по мониторингу уровня кальция в разделе «Меры предосторожности»).
Печеночная недостаточность
Эффективность и безопасность деносумаба у пациентов с нарушением функции печени не изучались (см. раздел «Фармакокинетика»).
Способ введения
Для подкожного введения.
Инъекция должна выполняться лицом, предварительно обученным технике выполнения инъекции.
Инструкция по использованию, по введению и уничтожению препарата приведена в конце настоящей инструкции.
Инструкция по использованию
• Следует оценить раствор перед введением на предмет наличия включений или изменения цвета, Раствор нельзя использовать при помутнении или изменении цвета.
• Не встряхивать.
• Чтобы избежать дискомфорта в месте введения, следует дождаться шприца до комнатной температуры (до 25 °С) перед инъекцией и вводите препарат медленно.
• Введите все содержимое предварительно заполненного шприца.
Любые количества неиспользованного препарата или неиспользованные материалы должны быть уничтожены в соответствии с локальными требованиями.
Несовместимость
Так как данные по исследованиям совместимости отсутствуют, не следует смешивать препарат с другими лекарственными средствами.
Резюме профиля безопасности
Наиболее частыми побочными реакциями при лечении препаратом Пролиа® (наблюдаются у более одного из 10 пациентов) являются мышечноскелетная боль и боль в конечности. Были получены сообщения о нечастых случаях целлюлита и редких случаях гипокальциемии, гиперчувствительности, остеонекроза челюсти и атипичных переломов бедра (см. раздел «Меры предосторожности» и раздел «Побочное действие — Описание отдельных нежелательных реакций») у пациентов, получавших препарат Пролиа®
Выявленные побочные реакции
Данные в таблице 3 ниже описывают побочные реакции, о которых сообщалось в фазах II и III клинических исследований у пациентов с остеопорозом, с раком молочной или предстательной железы, находящихся на гормон-депривационной терапии, и/или в спонтанных отчетах.
Частота возникновения побочных реакций определена следующим образом (смотрите таблицу 3 ниже): очень часто (≥ 1 из 10), часто (≥ 1 из 100 и < 1 из 10), нечасто (≥ 1 из 1000 и < 1 из 100), редко (≥ 1 из 10 000 и < 1 из 1 000), очень редко (< 1 из 10 000). В каждой группе систем органов и частоты сообщений нежелательные реакции приводятся в порядке убывания степени серьезности.
Таблица 3 Побочные реакции у пациентов с остеопорозом и раком молочной или предстательной железы, находящихся на гормон-депривационной терапии
|
Класс системы органов по MedDRA |
Частота |
Нежелательная реакция |
| Инфекционные и паразитарные заболевания |
Часто Часто Нечасто Нечасто Нечасто |
Инфекции мочевыводящих путей Инфекции верхних дыхательных путей Дивертикулит1 Целлюлит1 Инфекции уха |
| Со стороны иммунной системы |
Редко Редко |
Гиперчувствительность к лекарственному средству1 Анафилактическая реакция1 |
|
Нарушения со стороны обмена веществ и питания |
Редко |
Гипокальциемия1 |
| Со стороны нервной системы | Часто | Ишиас |
|
Со стороны желудочно-кишечного тракта |
Часто Часто |
Запор Желудочно-кишечный дискомфорт |
|
Со стороны кожи и подкожно-жировой клетчатки |
Часто Часто |
Сыпь Экзема |
|
Со стороны скелетно-мышечной системы и соединительной ткани |
Очень часто Очень часто Редко Редко Частота неизвестна |
Боль в конечностях Мышечноскелетная боль1 Остеонекроз челюсти1 Атипичные переломы бедра1 Остеонекроз наружного слухового прохода2 |
1 См. раздел «Описание отдельных нежелательных реакций»
2 См. раздел «Меры предосторожности»
В объединенном анализе данных, полученных в ходе фаз II и III плацебо-контролируемых исследований, о гриппоподобных реакциях сообщалось с частотой 1,2% для деносумаба и 0,7% для плацебо. Несмотря на то, что данная диспропорция была выявлена в объединенном анализе, она не была выявлена в ходе стратифицированного анализа.
Описание отдельных нежелательных реакций
Гипокальциемия
В двух плацебо-контролируемых клинических исследованиях фазы III у женщин с постменопаузальным остеопорозом примерно у 0,05% (2 из 4050) пациенток после введения Пролиа® наблюдалось снижение уровня кальция в сыворотке (менее 1,88 ммоль/л). О снижении уровня кальция в сыворотке (менее 1,88 ммоль/л) не сообщалось ни в двух плацебо-контролируемых клинических исследованиях фазы III у пациентов, находящихся на гормон-депривационной терапии, ни в плацебоконтролируемом клиническом исследовании фазы III у мужчин с остеопорозом.
При применении в клинической практике сообщалось о редких случаях тяжелой симптоматической гипокальциемии, преимущественно у пациентов с повышенным риском гипокальциемии, получающих препарат Пролиа® большинство случаев наблюдались в первые недели начала терапии. Клинические проявления тяжелых симптомов гипокальциемии включали удлинение интервала QT, тетанию, судороги и изменение психического состояния (см. раздел «Меры предосторожности»). Симптомы гипокальциемии в клинических исследованиях деносумаба включали парестезию или ригидность мышц, судорожные сокращения, спазмы и мышечные судороги.
Кожные инфекции
В плацебо-контролируемых клинических исследованиях фазы III общая частота возникновения кожных инфекций была сравнима в группе плацебо и в группе Пролиа® у женщин с постменопаузальньш остеопорозом (плацебо [1,2%, 50 из 4041], Пролиа® [1,5%, 59 из 4050]), у мужчин с остеопорозом (плацебо [0,8%, из 120], Пролиа® [0%, 0 из 120]), у пациентов с раком молочной или предстательной железы, находящихся на гормон-депривационной терапии (плацебо [1,7%, 14 из 845], Пролиа® [1,4%, 12 из 860]).
О кожных реакциях, потребовавших госпитализации, сообщалось у 0,1% (3 из 41) женщин с постменопаузальным остеопорозом, получавших плацебо по сравнению с 0,4% (16 из 4050) женщин, получавших Пролиа®. В большинстве случаев, сообщения касались целлюлита. Частота кожных реакций, относящихся к серьезным, была сравнима в группе плацебо (0,6%, 5 из 845) и группе Пролиа® (0,6%, 5 из 860) в исследованиях пациентов с раком молочной и предстательной железы.
Остеонекроз челюсти
В клинических исследованиях у пациентов с остеопорозом, а также у пациентов с раком молочной или предстательной железы, получающих гормон-депривационную терапию (общее количество пациентов 23148), поступали редкие сообщения об остеонекрозе челюсти (у 16 пациентов) в ходе лечения препаратом Пролиа® (см. раздел «Меры предосторожности»). 13 из этих случаев остеонекроза челюсти развились у женщин с остеопорозом в постменопаузальном периоде во время III фазы расширенного клинического исследования после применения Пролиа® на протяжении 10 лет. Частота остеонекроза челюсти составила 0,04% через 3 года, 0,06% через 5 лет и 0,44% через 10 лет применения Пролиа®. Риск развития остеонекроза челюсти увеличивается с продолжительностью применения Пролиа
Атипичные переломы бедра
В программе клинических исследований по остеопорозу сообщалось о редких случаях атипичных переломов бедра у пациентов, получавших Пролиа® (см. раздел «Меры предосторожности»).
Дивертикулит
В одном плацебо-контролируемом исследовании фазы III у пациентов с раком простаты, находящихся на андроген-депривационной терапии, была обнаружена диспропорция в проявлении дивертикулита (1,2% для деносумаба, 0% для плацебо). Частота дивертикулита была сравнима между группами лечения в исследовании у женщин в постменопаузальном периоде или мужчин с остеопорозом и у женщин, находящихся на терапии ингибиторами ароматазы по поводу лечения неметастатического рака молочной железы.
Реакции гиперчувствительности к препарату
В ходе пост-маркетинговых исследований применения препарата Пролиа® сообщалось о редких случаях проявления гиперчувствительности, включая сыпь, крапивницу, отек лица, эритему и анафилактические реакции.
Мышечноскелетная боль
В ходе пост-маркетингового наблюдения были получены сообщения о появлении мышечноскелетной боли, включая тяжелые случаи, у пациентов, получающих препарат Пролиа®. В клинических исследованиях мышечноскелетная боль фиксировалась как очень частая побочная реакция в группах плацебо и деносумаба. Прекращение лечения в связи с появлением мышечноскелетной боли было нечастым.
Особые группы пациентов
Почечная недостаточность
В клинических исследованиях было показано, что у пациентов с тяжелой почечной недостаточностью (клиренс креатинина <30мл/мин) или находящихся на диализе существует повышенный риск развития гипокальциемии в отсутствии восполнения кальция. Таким пациентам важно дополнительно принимать препараты кальция и витамин D (см. раздел «Меры предосторожности»).
Информирование о подозреваемых побочных реакциях
Предоставление информации о подозреваемых побочных реакциях, выявленных после регистрации, имеет большое значение, так как позволяет проводить постоянный мониторинг баланса пользы и риска лекарственного средства. Сообщить о любых подозреваемых побочных реакциях специалисты области здравоохранения могут в Республиканское унитарное предприятие «Центр экспертиз и испытаний в здравоохранении», подразделение «Республиканская клинико-фармакологическая лаборатория».
В клинических исследованиях не отмечено случаев передозировки препарата. В клинических исследованиях вводили дозы деносумаба до 180 мг каждые 4 недели (кумулятивная доза до 1080 мг за 6 месяцев). Каких-либо дополнительных побочных реакций зафиксировано не было.
По данным исследования лекарственного взаимодействия препарат Пролиа® не влияет на фармакокинетику мидазолама, который метаболизируется с помощью цитохрома Р450 3А4 (CYP3А4). Это свидетельствует об отсутствии влияния Пролиа® на фармакокинетику лекарственных средств, которые метаболизируются с помощью CYP3А4.
Клинических данных о совместном применении деносумаба и гормон-замещающей терапии (с эстрогенами) нет, однако потенциал фармакодинамического взаимодействия считается низким.
Данные исследования переключения с алендроната на деносумаб позволяют сделать вывод о том, что фармакокинетика и фармакодинамика деносумаба у женщин с постменопаузальным остеопорозом не зависит от предшествующей терапии алендронатом.
Прием кальция и витамина D
Всем пациентам важно принимать адекватные дозы кальция и витамина D.
Меры предосторожности при использовании
Гипокальциемия
Важно выявить пациентов с риском гипокальциемии. Гипокальциемия должна быть скорректирована адекватным приемом препаратов кальция и витамина D перед началом терапии деносумабом. Рекомендуется мониторинг концентрации кальция у пациентов перед каждым дозированием, а у пациентов, предрасположенных к гипокальциемии, в течение двух недель после первой дозы. При появлении у любого пациента симптомов гипокальциемии в ходе лечения препаратом Пролиа® (см. раздел «Побочное действие» для симптомов) необходимо измерить уровень кальция. Пациентам следует сообщить о необходимости информировать врача о симптомах, указывающих на гипокальциемию.
В пост-маркетинговых исследованиях применения препарата сообщалось о случаях развития тяжелой симптоматической гиопкальциемии (см. раздел «Побочное действие»), которые чаще всего наблюдались в течение первых недель после начала терапии, однако могут возникать и позже.
Кожные инфекции
У пациентов, получающих Пролиа®, могут развиться инфекции кожи (преимущественно целлюлит), требующие госпитализации (см. раздел «Побочное действие»). Пациентов следует проинструктировать о незамедлительном обращении за медицинской помощью в случае развития симптомов и признаков целлюлита.
Остеонекроз челюсти
Имеются редкие сообщения о развитии остеонекроза челюсти у пациентов, получавших лекарственное средство Пролиа® для лечения остеопороза (см. раздел «Побочное действие»).
Начало лечения/ новый курс лечения следует отложить у пациентов с имеющимися открытыми повреждениями мягких тканей в ротовой полости. Пациентам, относящимся к группе риска в связи с наличием сопутствующих факторов, следует пройти стоматологическое обследование и сделать все необходимые профилактические стоматологические процедуры перед началом лечения. Таким пациентам требуется индивидуальная оценка пользы-риска начала лечения деносумабом.
Необходимо принимать во внимание следующие факторы при оценке риска развития у пациента остеонекроза челюсти:
• активность лекарственного средства, ингибирующего костную резорбцию (повышение риска для высокоактивных соединений), способ введения (повышение риска при парентеральном введении) и суммарная доза терапии костной резорбции.
• онкологические заболевания, сопутствующие заболевания (например, анемия, коагулопатии, инфекции), курение.
• сопутствующая терапия: кортикостероиды, химиотерапия антиангиогенные ингибиторы, лучевая терапию области головы и шеи.
• плохая гигиена рта, пародонтоз, плохо подобранные зубные протезы, стоматологические заболевания в анамнезе, инвазивные стоматологические процедуры (например, удаление зубов).
В ходе лечения всем пациентам следует соблюдать меры надлежащей гигиены полости рта, проходить регулярное обследование у стоматолога и немедленно сообщать о появлении симптомов в ротовой полости, таких как подвижность зубов, боль, припухлость, незаживающие поражения слизистой или наличие выделений, развившихся в ходе лечения деносумабом. Во время лечения инвазивные стоматологические процедуры следует проводить только после тщательной оценки, при этом их следует избегать в периоды, находящиеся во временной близости с введением препарата Пролиа®.
В случае появления остеонекроза челюсти в ходе терапии препаратом Пролиа® план лечения пациентов должен быть подготовлен совместно лечащим врачом и стоматологом или стоматологом-хирургом, имеющим опыт лечения остеонекроза челюсти. Необходимо рассмотреть возможность временного прекращения лечения до разрешения заболевания и устранения факторов риска в случаях, когда это возможно.
Остеонекроз наружного слухового прохода
Остеонекроз наружного слухового прохода сообщался при применении деносумаба. Возможные факторы риска для развития остеонекроза наружного слухового прохода включают использование стероидов и химиотерапии и/или локальные факторы риска, такие как инфекция или травма. Следует учитывать возможность развития остеонекроза слухового прохода у пациентов, получающих деносумаб, у которых имеются симптомы со стороны органа слуха, включая хронические инфекции уха.
Атипичные переломы бедра
У пациентов, получавших деносумаб, сообщалось о случаях атипичных переломов бедра (см. раздел «Побочное действие»). Атипичные переломы бедра могут возникать при небольших травмах или при их отсутствии в подвертельной или диафизальной области бедра. Эти переломы характеризуются специфическими рентгенологическими признаками. Об атипичных переломах бедра также сообщалось у пациентов с определенными сопутствующими состояниями (например, дефицитом витамина D, ревматоидным артритом, гипофосфатазией) и при применении определенных лекарств (например, бисфосфонатов, глюкокортикоидов, ингибиторов протонной помпы). Такие явления также возникали без антирезорбтивной терапии. Подобные переломы, связанные с приемом бисфосфонатов, часто являются двусторонними; поэтому у пациентов, получающих терапию деносумабом при выявлении перелома бедренной кости необходимо обследовать бедро с противоположной стороны. Следует рассмотреть вопрос о прекращении лечения Пролиа® у пациентов с подозрением на атипичный перелом бедра с учетом индивидуальной оценки пользы и риска. Во время лечения деносумабом пациентов следует предупредить о необходимости уведомления о новых или необычных случаях боли в бедренной кости, бедре или паховой области с такими симптомами необходимо обследовать на наличие неполных переломов.
Продолжительное антирезорбтивное лечение
Продолжительное антирезорбтивное лечение (включая как деносумаб, так и бисфосфонаты) может способствовать увеличению риска неблагоприятных исходов, таких как остеонекроз челюсти и атипичные переломы бедра из-за значительного подавления ремоделирования кости (см. раздел «Способ применения и дозы»).
Параллельное лечение другими деносумаб-содержащими препаратами
Пациенты, находящиеся на лечении препаратом Пролиа®, не должны получать других деносумаб-содержащих лекарственных средств (для предотвращения костных осложнений у взрослых с метастазами солидных опухолей в кости).
Нарушение функции почек
У пациентов с тяжелой почечной недостаточностью (клиренс креатинина < 30 мл/мин) или находящихся на диализе существует повышенный риск развития гипокальциемии. Риск развития гипокальциемии и сопутствующего увеличения уровня паратиреоидного гормона возрастает с увеличением степени нарушения функции почек. Таким пациентам особенно важно принимать адекватные дозы кальция и витамин D, а также проводить регулярный мониторинг уровня кальция.
Сухой натуральный каучук
Колпачок иглы предварительно заполненного шприца содержит сухой натуральный каучук (производное латекса), который может вызвать аллергические реакции.
Меры предосторожности в отношении вспомогательных веществ
Лекарственный препарат содержит сорбитол и не должен использоваться у пациентов с редким наследственным заболеванием непереносимости фруктозы.
Данное лекарственное средство содержит менее 1 ммоль натрия (23 мг) на 60 мг, т.е. практически не содержит натрия.
Пролиа® не оказывает влияния или оказывает крайне незначительное влияние на способность управлять транспортными средствами и механизмами.
3 года.
Не использовать по окончании срока годности.
Хранить при температуре 2-8 °С. Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
Не встряхивать.
После извлечения из холодильника Пролиа® может храниться при температуре не выше 25°С в оригинальной упаковке не более 30 дней. Препарат следует использовать в течение 30 дней.
Хранить в недоступном для детей месте.
Раствор для подкожного введения 60 мг/мл в одноразовом предварительно заполненном шприце (ПЗШ) 1 мл из стекла I гидролитического класса с иглой 27G из нержавеющей стали, эластомерным колпачком и эластомерным плунжером, ламинированным фторполимером (с защитным устройством для иглы или без него).
Маркированный шприц помещают в картонную пачку вместе с инструкцией по применению.
ПЗШ может быть дополнительно помещен в блистер. Каждый блистер помещают в картонную пачку вместе с инструкцией по применению.
По рецепту.
Производитель, ответственный за выпускающий контроль качества
Амджен Европа БВ.
Минервум 7061
NL-4817 ZK Бреда
Нидерланды
Владелец регистрационного удостоверения
Амджен Европа БВ.
Минервум 7061
NL-4817 ZK Бреда
Нидерланды
Официальный представитель в Республике Беларусь
Представительство ООО «AlenMed Promotion» (Латвия) в Республике Беларусь
220020, г. Минск, пр.Победителей, 103 7-й этаж, помещение 4 тел.: +375 17 308-73-84
Факс: +375 17 308-73-88
В этом разделе приводится информация по правильному проведению инъекции предварительно заполненным шприцем. Очень важно, чтобы перед тем, как Вы приступите к самостоятельным инъекциям, Ваш лечащий врач, медицинская сестра подробно проинструктировали Вас по технике выполнения инъекции. Тщательно вымойте руки перед выполнением инъекции. Если у Вас возникнут вопросы по технике выполнения инъекции, то обратитесь к Вашему лечащему врачу или медицинской сестре.
Перед началом инъекции
Внимательно прочитайте все инструкции перед использованием ПЗШ.
НЕ используйте ПЗШ, если колпачок был удален.
Как использовать предварительно заполненный шприц?
Ваш врач назначил вам препарат Пролиа® ПЗШ для подкожных инъекций. Вы должны ввести все содержимое шприца (1 мл) однократно и повторить инъекцию через 6 месяцев, как назначено лечащим врачом.
Оборудование:
Для самостоятельной инъекции Вам потребуется:
• новый ПЗШ препарата Пролиа®.
• смоченные спиртом тампоны или сходные материалы.
Что Вы должны сделать до самостоятельного введения Пролиа® подкожно?
1. Достать шприц из холодильника.
НЕ берите ПЗШ за поршень или защитный колпачок, это может повредить устройство.
2. ПЗШ можно оставить вне холодильника для достижения комнатной температуры. Это позволит сделать инъекцию более комфортной.
НЕ подогревайте ПЗШ каким-либо другим способом (например, в микроволновой печи либо в горячей воде).
НЕ оставляйте шприц под прямыми солнечными лучами.
3. НЕ встряхивайте ПЗШ.
4. НЕ снимайте колпачок с ПЗШ до тех пор, пока Вы не готовы к инъекции.
5. Проверить срок годности ПЗШ. Срок годности указан на упаковке как «ГОДЕН до».
НЕ используйте ПЗШ, если истек последний день указанного на этикетке месяца срока годности.
6. Проверить внешний вид препарата Пролиа®. Раствор должен быть прозрачным, бесцветным или светло-желтым. Если раствор помутнел или окрашен иначе, препарат использовать нельзя.
7. Выбрать комфортное, хорошо освещенное место и чистую поверхность, где можно удобно расположить все необходимые материалы.
8. Тщательно вымыть руки.
Как правильно выбрать место для инъекции?
Лучше всего делать инъекции в верхнюю часть бедра и в живот.
Если инъекции Вам делает кто-то другой, можно использовать наружную поверхность плеча.
Как правильно сделать инъекцию?
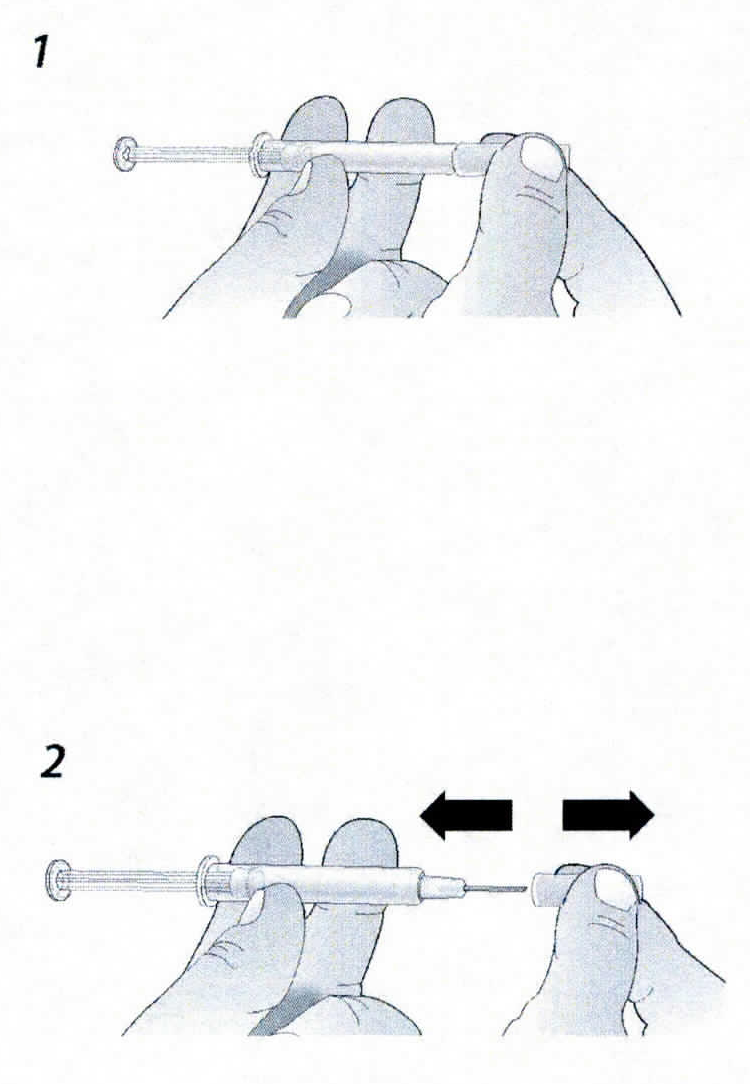
2. Во избежание загиба иглы, аккуратно потяните колпачок с иглы сразу без скручивания, как показано на рисунках 1 и 2.
НЕ дотрагивайтесь до иглы и не нажимайте на поршень.
3. Если внутри ПЗШ видны маленькие пузырьки воздуха, нет необходимости удалять их перед инъекцией. Введение раствора с пузырьками воздуха является безопасным.
4. Зажмите кожу (не сдавливая) между большим и указательным пальцами. Введите иглу в кожу полностью, как показывал Вам доктор или медицинская сестра.
5. Медленно и плавно надавливайте на поршень, одновременно придерживая кожную складку. Надавливать на поршень следует до тех пор, пока шприц не опустеет.
6. Извлеките иглу из кожи, и отпустите кожную складку.
7. Если выступит кровь в месте инъекционного прокола, аккуратно стереть ее ватным тампоном или тканью. Не растирайте место инъекции. При необходимости, заклейте место инъекции пластырем.
8. Используйте один ПЗШ только для одной инъекции. НЕ используйте оставшийся в шприце препарат.
Помните: При возникновении проблем, обратитесь за помощью или советом к лечащему врачу или медицинской сестре.
Уничтожение использованных шприцев
• надевайте обратно колпачок на использованный шприц.
• Храните использованный шприц в недоступном для детей месте.
• Использованный шприц должен быть утилизирован в соответствии с местными правилами. Спросите у врача или провизора, как уничтожить препарат, если он больше не требуется. Эти меры помогут защитить окружающую среду.
| Руководство по частям шприца | |
| Перед использованием | После использования |
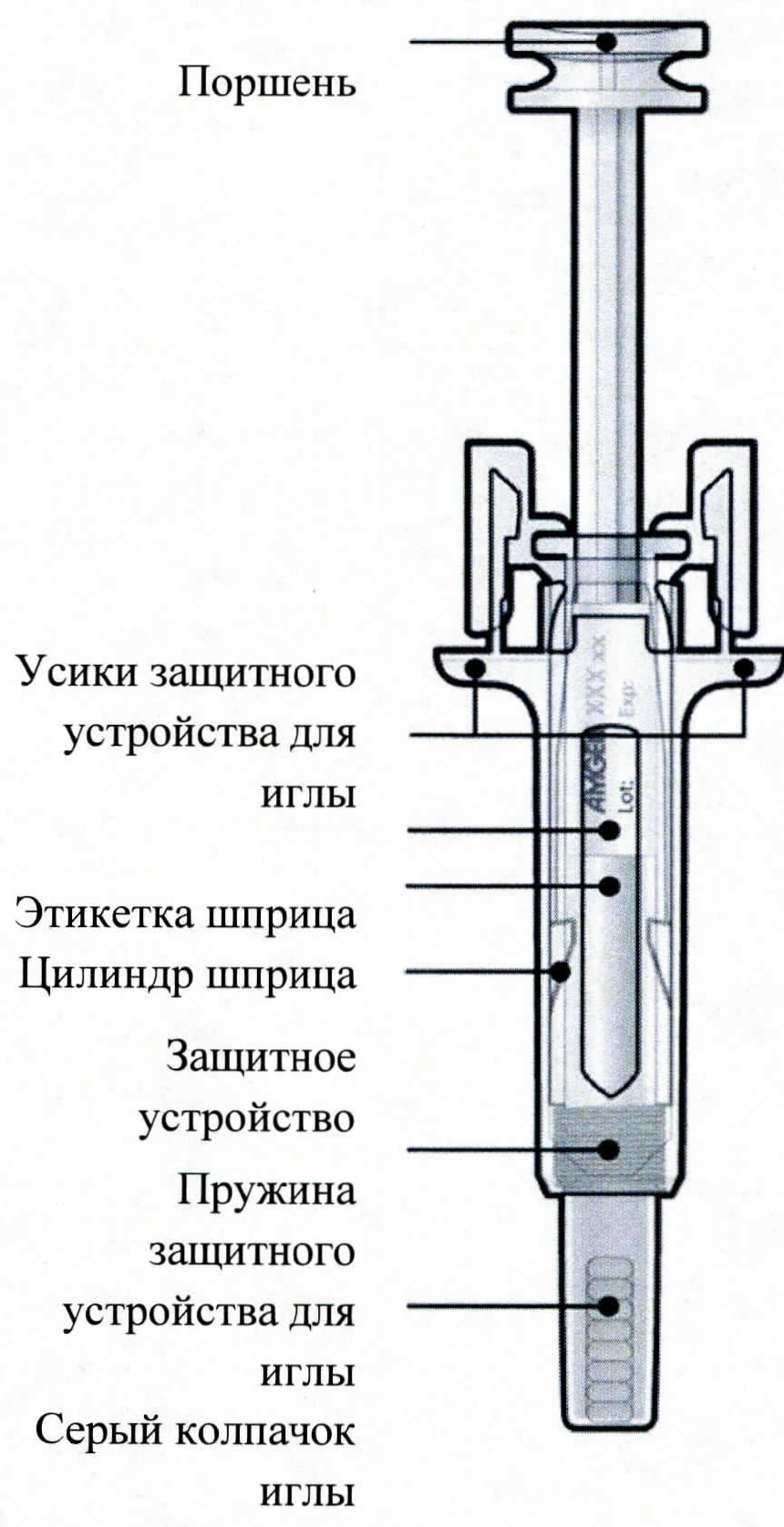 |
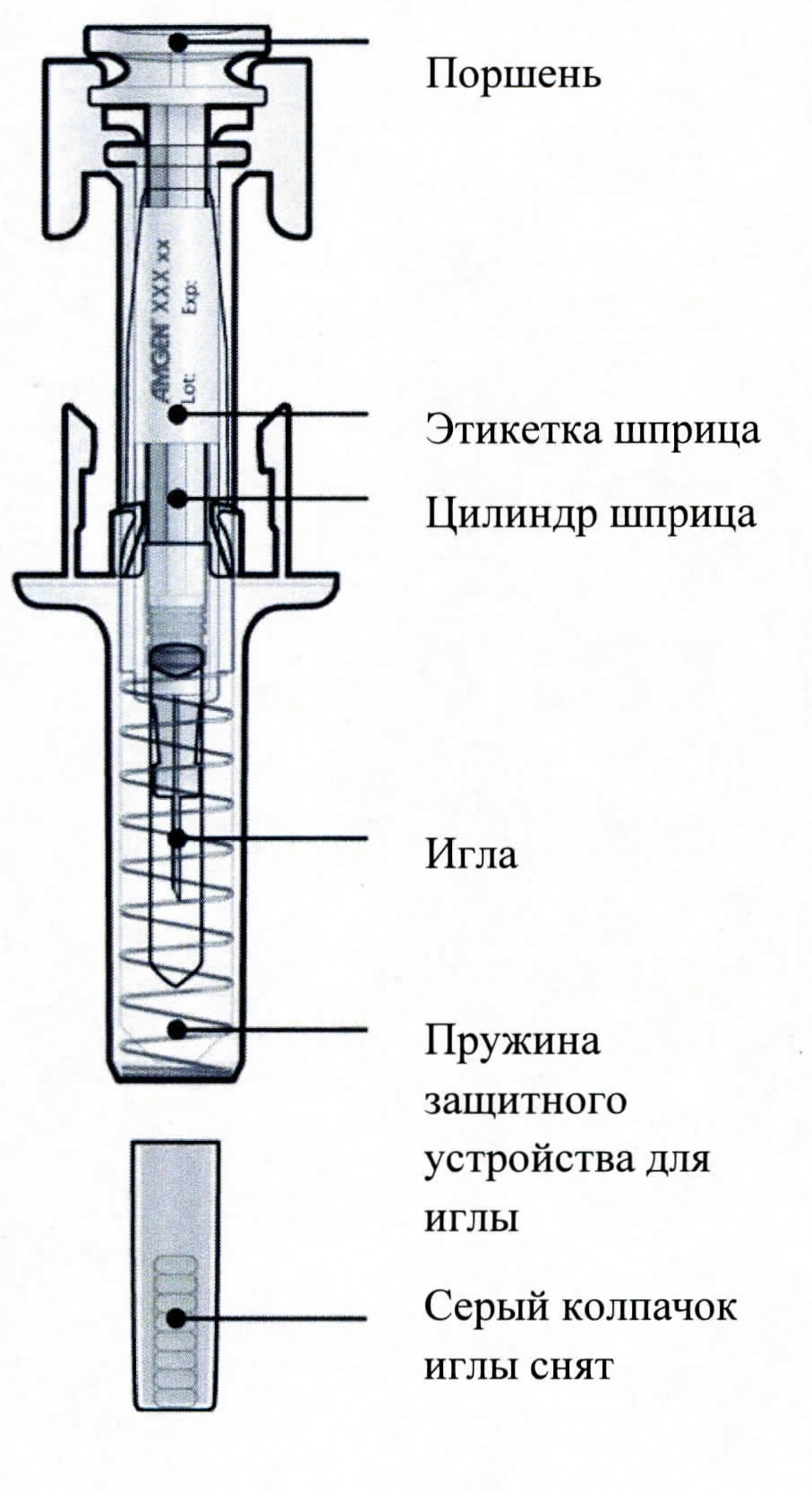 |
|
Важно |
|
| Внимательно прочитайте данную инструкцию перед использованием препарата Пролиа® в предварительно заполненном шприце с защитным устройством для иглы: • Очень важно, чтобы перед тем, как Вы приступите к самостоятельным инъекциям, ваш лечащий врач или медицинская сестра подробно проинструктировали Вас по технике выполнения инъекции. • Пролиа®вводится подкожно (подкожная инъекция). • Сообщите Вашему врачу, если у Вас есть аллергия на латекс (колпачок иглы предварительно заполненного шприца состоит из производного латекса). ✗ Не снимайте серый колпачок с иглы предварительно заполненного шприца, пока вы не готовы к инъекции. ✗ Не используйте предварительно заполненный шприц, если он упал на твердую поверхность. Используйте новый предварительно заполненный шприц и сообщите об этом Вашему лечащему врачу или медицинской сестре. ✗ Не пытайтесь активировать защитное устройство предварительно заполненного шприца перед инъекцией. ✗ Не пытайтесь снять прозрачное защитное устройство с предварительно заполненного шприца перед инъекцией. В случае возникновения вопросов, обращайтесь к Вашему лечащему врачу или медицинской сестре. |
| Шаг 1: Подготовка | |
| А | Извлеките контурную ячейковую упаковку с предварительно заполненным шприцем из упаковки и подготовьте все, что необходимо для инъекции. Также подготовьте смоченные спиртом салфетки, ватные тампоны или бинт и пластырь (не прилагаются к шприцу). |
| Для более комфортной инъекции, оставьте предварительно заполненный шприц при комнатной температуре, в течение примерно 30 минут перед инъекцией. Тщательно вымойте руки с мылом. Расположите предварительно заполненный шприц на чистой, хорошо освещенной поверхности. ✗ Не пытайтесь подогревать шприц в горячей воде или микроволновой печи. ✗ Не оставляйте предварительно заполненный шприц под прямыми солнечными лучами. ✗ Не встряхивайте предварительно заполненный шприц. • Храните предварительно заполненный шприц в недоступном для детей месте. |
| В |
Откройте контурную ячейковую упаковку, потянув за этикетку. Для извлечения предварительно заполненного шприца из контурной ячейковой упаковки, возьмитесь за защитное устройство |
|
|
| С |
Проверьте препарат и предварительно заполните шприц. |
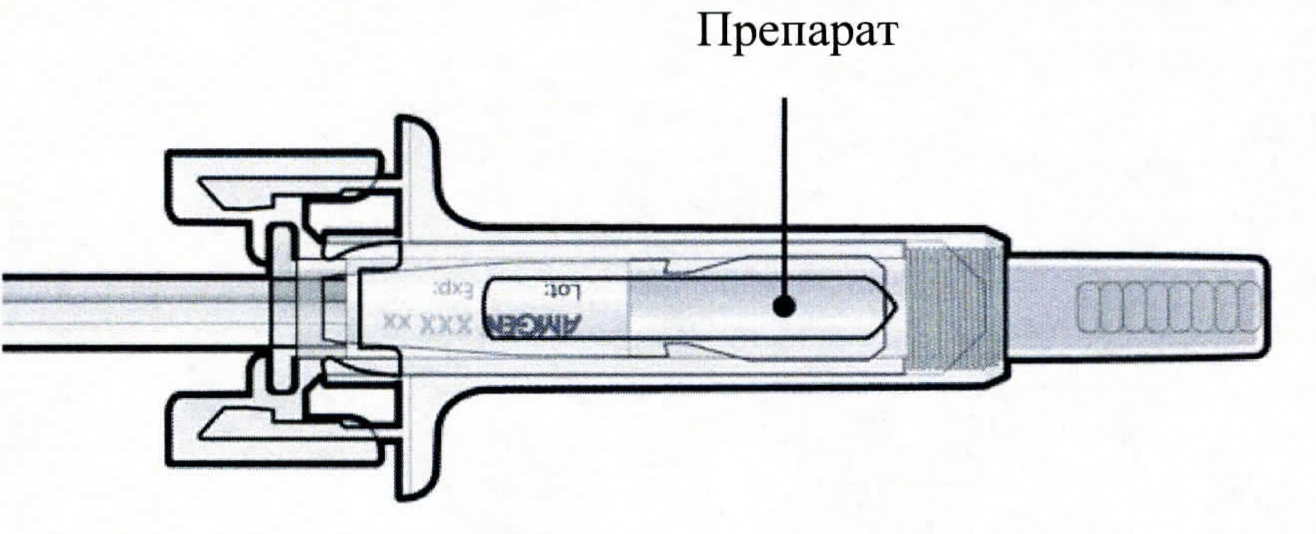
|
|
|
✗ Не используйте предварительно заполненный шприц, если: • Препарат мутный или содержит посторонние частицы. Раствор должен быть прозрачным, бесцветным или светло-желтым. • Любая из частей повреждена или сломана. • Серый колпачок иглы отсутствует или неплотно надет. • Истек последний день указанного на этикетке месяца срока годности. Сообщите Вашему лечащему врачу или медицинской сестре обо всех перечисленных случаях. |
| Шаг 2: Подготовка места инъекции |
|
| А |
Тщательно вымойте руки. Подготовьте и обработайте место инъекции. |
|
|
| В |
Осторожно потяните серый колпачок с иглы без скручивания, по направлению от шприца. |
|
| С | Зажмите место инъекции для получения упругой поверхности |
|
|
|
Шаг 3: Введение |
|
| А | Зажмите кожу. ВВЕДИТЕ иглу в кожу. |
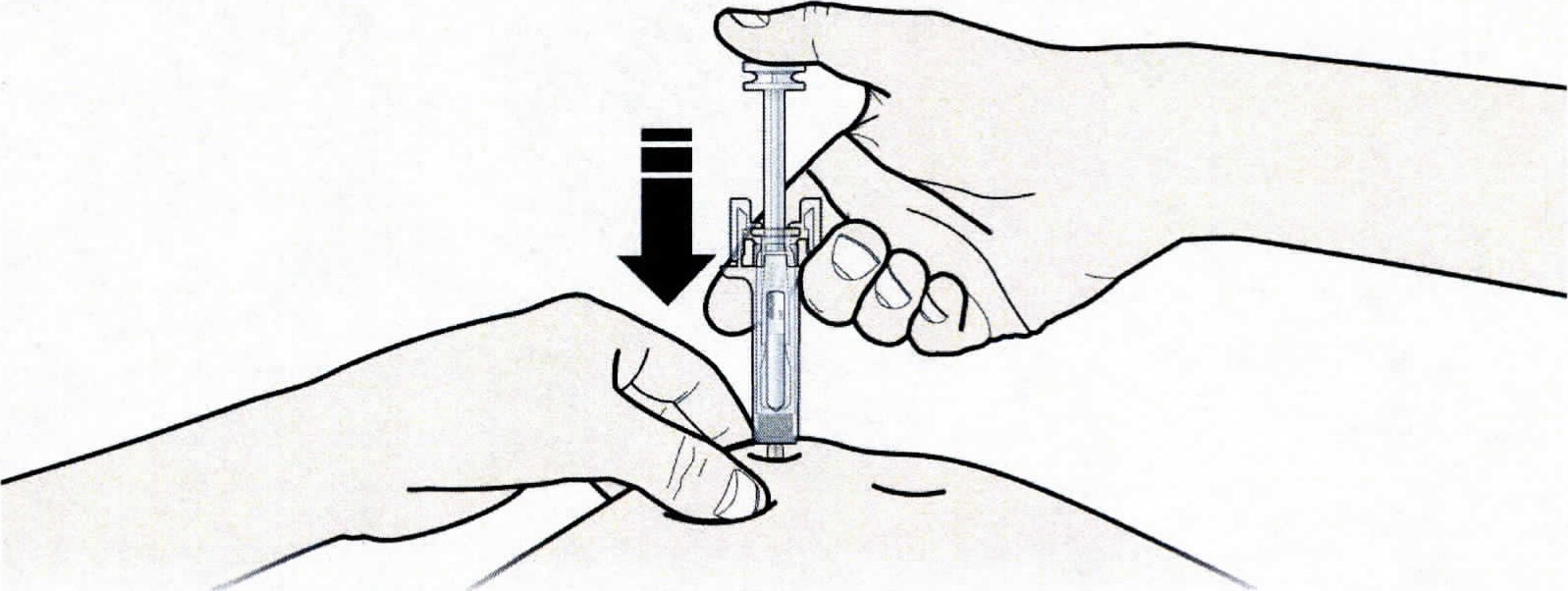 ✗ Не дотрагивайтесь до обработанной области инъекции. |
|
Шаг 4: Окончание |
|
| А |
Выбросите использованный предварительно заполненный шприц и другие сопутствующие материалы в соответствии с местными правилами. |
|
|
|
| В | Осмотрите место инъекции. |
|
Если в месте инъекции выступит кровь, прижмите к нему ватный тампон или бинт. Не растирайте место инъекции. При необходимости, заклейте место инъекции пластырем. |
Состав
Каждый предварительно заполненный шприц содержит:
активное вещество: 60 мг деносумаба в 1 мл раствора (60 мг/мл),
вспомогательные вещества: сорбитол (Е420) 47 мг, уксусная кислота ледяная 1 мг, полисорбат 20 0,1 мг, натрия гидроксид до pH 5,0-5,5, вода для инъекций до 1 мл.
Пролиа представляет собой стерильный продукт и не содержит консервантов.
Лекарственная форма
раствор для подкожного введения
Описание
Прозрачная жидкость, от бесцветного до светло-желтого цвета, практически свободная от видимых включений.
Действие
Препараты для лечения заболеваний костей-другие препараты, влияющие на структуру и минерализацию кости. Антитела моноклональные
Фармакодинамика
Механизм действия
Деносумаб представляет собой полностью человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к лиганду рецептора активатора ядерного фактора каппа В (RANKL) и тем самым препятствует активации единственного рецептора RANKL — активатора ядерного фактора кВ (RANK), расположенного на поверхности остеокластов и их предшественников. Таким образом, предотвращение взаимодействия RANKL/RANK ингибирует образование, активацию и продолжительность существования остеокластов. В результате деносумаб уменьшает костную резорбцию и увеличивает массу и прочность кортикального и трабекулярного слов кости.
Фармакодинамические эффекты
Применение деносумаба в дозе 60 мг приводило к быстрому уменьшению сывороточных концентраций маркера резорбции костной ткани — 1С-телопептида (СТХ) — приблизительно на 70% в течение 6 часов после подкожного введения и приблизительно на 85% в течение последующих 3 дней. Уменьшение концентрации СТХ оставалось стабильным в 6-месячном интервале между введениями. Скорость снижения концентрации СТХ в сыворотке крови частично уменьшалась при снижении концентрации деносумаба в сыворотке крови, что отражает обратимость влияния деносумаба на ремоделирование кости. Данные эффекты наблюдались на протяжении всего курса лечения. Соответственно физиологической взаимосвязи процессов образования и резорбции при ремоделировании костной ткани наблюдалось уменьшение содержания маркеров образования кости (например, костноспецифической щелочной фосфатазы и сывороточного N-концевого пропептида коллагена I типа) с первого месяца после введения первой дозы деносумаба.
Маркеры ремоделирования кости (маркеры образования кости и резорбции кости), как правило, достигали концентраций периода до начала лечения не позднее чем через 9 месяцев после введения последней дозы препарата. После возобновления лечения деносумабом степень снижения концентраций СТХ была сходна со степенью снижения концентрации СТХ в начале курса лечения деносумабом.
Было показано, что перевод с лечения алендроновой кислотой (средняя продолжительность применения — 3 года) на деносумаб приводит к дополнительному снижению концентрации СТХ в сыворотке по сравнению с группой женщин в постменопаузе с низкой костной массой, продолжавших лечение алендроновой кислотой. В то же время изменения содержания кальция в сыворотке были одинаковыми в обеих группах.
В экспериментальных исследованиях ингибирование RANK/RANKL одновременно со связыванием остеопротегерина с Fc-фрагментом (OPG-Fc), приводило к замедлению роста кости и нарушению прорезывания зубов. Поэтому лечение деносумабом может тормозить рост костей с открытыми зонами роста у детей и приводить к нарушениям прорезывания зубов.
Иммуногенность
Деносумаб — человеческое моноклональное антитело, поэтому, как и для других лекарственных средств белковой природы, существует теоретический риск иммуногенности. Более чем 13000 пациентов были обследованы на предмет образования связывающих антител с использованием метода чувствительной электрохемилюминесценции в сочетании с иммунологическим анализом. Менее чем у 1% пациентов, принимавших деносумаб в течение 5 лет, определялись антитела (включая существовавшие ранее транзиторные и растущие). Серопозитивные пациенты были далее обследованы на предмет образования нейтрализующих антител, используя хемилюминисцентный анализ в культуре клетокin vitro, нейтрализующих антител не обнаружено. Не было выявлено изменений фармакокинетического профиля, токсического профиля или клинического ответа, обусловленных образованием антител.
Клиническая эффективность
Лечение остеопороза в постменопаузе
У женщин с постменопаузальным остеопорозом Пролиа увеличивает минеральную плотность кости (МПК), уменьшает частоту переломов шейки бедра, вертебральных и невертебральных переломов. Эффективность и безопасность деносумаба в лечении постменопаузального остеопороза была доказана в исследовании, длительностью 3 года. Результаты исследования показывают, что деносумаб существенно, в сравнении с плацебо, снижает риск возникновения вертебральных и невертебральных переломов, переломов шейки бедра у женщин с остеопорозом в постменопаузе.
В исследование было включено 7808 женщин, из которых у 23,6% отмечались часто встречающиеся переломы позвонков. Все три конечные точки эффективности в отношении переломов достигали статистически значимых значений, оцениваемых по предварительно заданной последовательной схеме тестирования.
Снижение риска возникновения новых вертебральных переломов при применении деносумаба в течение более чем 3 лет оставалось стабильным и значимым. Риск снижался независимо от 10-летней вероятности возникновения крупных остеопоротических переломов. На снижение риска также не влияли наличие часто встречающихся переломов позвонков в анамнезе, невертебральные переломы, возраст пациентов, МПК, уровень ремоделирования кости и предшествующая терапия по поводу остеопороза.
У женщин старше 75 лет в постменопаузе деносумаб уменьшал частоту возникновения новых вертебральных переломов и, по данным post hoc анализа, уменьшал частоту переломов шейки бедра. Уменьшение частоты возникновения невертебральных переломов наблюдалось независимо от 10-летней вероятности возникновения крупных остеопоротических переломов.
Деносумаб существенно, по сравнению с плацебо, увеличивал МПК во всех анатомических областях. МПК определяли через 1 год, 2 и 3 года после начала терапии. Сходное влияние на МПК отмечено в поясничном отделе позвоночника независимо от возраста, расовой принадлежности, индекса массы тела (ИМТ), МПК и ремоделирования кости. Влияние лечения препаратом Пролиа на случаи возникновения новых вертебральных и невертебральных переломов в течение года оценивались в рамках 5-ти летнего расширенного исследования общей продолжительностью 8 лет. При лечении препаратом Пролиа сохраняется низкий риск возникновения новых вертебральных и невертебральных переломов, а также продолжает увеличиваться МПК по сравнению с исходным уровнем в поясничном отделе позвоночника, всей бедренной кости, шейки бедра и вертеле бедренной кости на протяжении 5 лет.
Гистологические исследования лечения препаратом Пролиа продолжительностью 5 лет, подтвердили нормальную архитектонику и, как и ожидалось, снижение костного ремоделирования по сравнению с плацебо. Не отмечено патологических изменений, включая фиброз, остеомаляцию и нарушение архитектоники костной ткани.
Клиническая эффективность при лечении потери костной массы, вызванной гормон-депривационной терапией или терапией ингибиторами ароматазы
Лечение потери костной массы, вызванной депривацией андрогенов
Эффективность и безопасность деносумаба при лечении потери костной массы, ассоциированной со снижением концентрации андрогенов, были доказаны в 3-х летнем исследовании, включавшем 1468 пациентов с неметастатическим раком предстательной железы.
Существенное увеличение МПК определяли в поясничном отделе позвоночника, всей бедренной кости, шейке бедренной кости, вертеле бедренной кости спустя 1 месяц после введения первой дозы. Увеличение МПК в поясничном отделе позвоночника не зависело от возраста, расовой принадлежности, географического региона, ИМТ, начальных значений МПК, ремоделирования кости, продолжительности проведения гормон-депривационной терапии и наличия вертебрального перелома в анамнезе. Деносумаб значительно уменьшал риск возникновения новых вертебральных переломов на протяжении 3 лет применения. Уменьшение риска наблюдалось через 1 год и через 2 года после начала терапии. Деносумаб также снижал риск возникновения более чем одного остеопоротического перелома любой локализации.
Лечение потери костной массы, у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочнойжелезы
Эффективность и безопасность деносумаба в лечении потери костной массы, вызванной адъювантной терапией ингибитором ароматазы, оценивалась в 2-х летнем исследовании, включавшем 252 пациентки с неметастатическим раком молочной железы.
Деносумаб значительно увеличивал МПК во всех анатомических областях, по сравнению с плацебо, в течение 2 лет. Увеличение МПК наблюдалось в поясничном отделе позвоночника спустя месяц после введения первой дозы. Положительное влияние на МПК в люмбальном отделе позвоночника отмечали вне зависимости от возраста, продолжительности терапии ингибитором ароматазы, ИМТ, предшествующей химиотерапии, предшествующего использования селективного модулятора рецепторов эстрогена (СМРЭ) и времени, прошедшего от начала менопаузы.
Лечение остеопороза у мужчин
Эффективность и безопасность Пролиа в лечении остеопороза у мужчин была продемонстрирована в исследовании, продолжительностью 12 месяцев, включавшем 242 пациента со сниженной костной массой, с базовым уровнем Т- показателя МПК между -2,0 и -3,5 в поясничном отделе позвоночника или шейки бедра. Также включались мужчины с Т-показателем МПК между -1,0 и -3,5 для поясничного отдела позвоночника или шейки бедра и переломами в анамнезе. Мужчины с другими заболеваниями (такими как ревматоидный артрит, остеогенез и болезнь Педжета) или лечением, которое может оказывать влияние на кость, были исключены из исследования.
Лечение препаратом Пролиа в течение 1 года значительно увеличивало МПК по сравнению базовыми значениями в поясничном отделе позвоночника и всех отделах скелета (проксимальный отдел бедра, дистальный отдел лучевой кости). Пролиа увеличивала МПК поясничного отдела позвоночника до 4,8%, МПК бедра до 2,0%, МПК вертела бедренной кости до 2,3%, МПК шейки бедренной кости до 2,2%, периферический 1/3 радиус МПК до 0,9%, в сравнении с плацебо.
Увеличение в МПК поясничного отдела позвоночника, бедра и вертела бедренной кости наблюдались через 6 месяцев. Устойчивые эффекты на МПК поясничного отдела позвоночника наблюдались независимо от возраста, расы, массы тела/индекса массы тела (ИМТ), МПК и уровня резорбции кости.
Гистология кости и гистоморфометрия
Качественные гистологические оценки показывали нормальную архитектонику и качество кости, без каких-либо дефектов минерализации костной ткани или фиброза костного мозга у пациентов, получавших Пролиа.
Фармакокинетика
При подкожном введении деносумаб характеризуется нелинейной фармакокинетикой, дозозависимой в широком диапазоне доз, и дозозависимым увеличением экспозиции для дозы в 60 мг (или 1 мг/кг) и выше.
Всасывание
После подкожного введения деносумаба в дозе 60 мг биодоступность составила 61% и максимальная концентрация деносумаба (Сmах) — 6 мкг/мл (диапазон 1-17 мкг/мл), данные параметры наблюдались через 10 дней (диапазон 2-28 дней). После достижения Сmах содержание препарата в сыворотке крови снижалось с периодом полувыведения 26 дней (диапазон 6-52 дня) и далее в течение 3 месяцев (диапазон 1,5-4,5 месяцев). У 53% пациентов деносумаб не обнаруживался в сыворотке крови после 6 месяцев от последнего введения препарата.
Распределение
Не наблюдалось изменений фармакокинетических параметров деносумаба, а также кумуляции за все время введения многократных доз препарата по 60 мг каждые 6 месяцев.
Метаболизм
Деносумаб состоит из аминокислот и углеводов, как обычный иммуноглобулин. На основании данных доклинических исследований, ожидается, что метаболизм деносумаба будет происходить по пути клиренса иммуноглобулинов, результатом которого будет распад на небольшие пептидные цепи и отдельные аминокислоты. В исследовании, 17 женщин с постменопаузальным остеопорозом получали мидазолам (2 мг внутрь) через две недели после однократной инъекции деносумаба (60 мг подкожно), что соответствует времени достижения максимальных фармакодинамических эффектов деносумаба. Деносумаб не влиял на фармакокинетику мидазолама, метаболизирующегося изоферментом CYP3A4 цитохрома Р450. Следовательно, деносумаб не должен изменять фармакоконетику препаратов, метаболизирующихся изоферментом CYP3A4.
Выведение
На основании доклинических данных, выведение деносумаба будет происходить по пути выведения всех иммуноглобулинов, результатом которого будет распад на небольшие пептидные цепи и отдельные аминокислоты.
Отдельные группы пациентов
Пациенты пожилого возраста (возраст 65 лет или старше)
Возраст не оказывает значимого влияния на фармакокинетику деносумаба по данным фармакокинетического анализа в популяции пациентов от 28 лет до 87 лет.
Дети и подростки (до 18 лет)
Фармакокинетика у детей не изучалась.
Расовая принадлежность
Фармакокинетика деносумаба не зависит от расовой принадлежности.
Пациенты с почечной недостаточностью
В исследовании на 55 пациентах с различной степенью почечной недостаточности, включая пациентов, находящихся на диализе, степень почечной недостаточности не оказывала влияния на фармакокинетику и фармакодинамику деносумаба, поэтому не требуется коррекции режима дозирования деносумаба при хронической почечной недостаточности.
Хроническая печеночная недостаточность
Исследований влияния недостаточности функции печени на фармакокинетику деносумаба не проводилось.
Показания к применению
— Лечение постменопаузального остеопороза,
— лечение потери костной массы у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы, и у мужчин с раком предстательной железы, получающим гормон-депривационную терапию,
— лечение сенильного остеопороза у мужчин.
Противопоказания
В клинических исследованиях не отмечено случаев передозировки препарата. В клинических исследованиях вводили дозы деносумаба до 180 мг каждые 4 недели (кумулятивная доза до 1080 мг в 6 месяцев).
Применение при беременности и кормлении грудью
Беременность
Нет каких-либо данных по применению препарата во время беременности. Пролиа не рекомендуется для применения у беременных женщин.
Деносумаб не вызывал снижения фертильности у яванских макак при экспозиции к препарату в 100 раз выше экспозиции у человека (60 мг раз в 6 месяцев).
В исследовании на яванских макаках не отмечено негативного воздействия на организм матери или плод в течение периода, эквивалентного первому триместру экспозиции к деносумабу на дозах, в 99 раз превышающих дозу у человека (60 мг раз в 6 месяцев). В этом исследовании не оценивалось формирование лимфатических узлов плода.
В другом исследовании на яванских макаках, получавших деносумаб в течение беременности, при экспозиции, в 119 раз превышающей таковую у человека (60 мг раз в 6 месяцев), наблюдалось увеличение частоты рождения мертвого плода и постнатальной смертности, аномальный рост костей при сниженной прочности кости, сниженный гемопоэз и нарушение формирования зубов, отсутствие периферических лимфатических узлов, и снижение роста новорожденного. Не отмечено негативного воздействия на организм матери до родов, редко у матери наблюдались нежелательные реакции во время родов. Развитие молочной железы матери было нормальным.
Эксперименты на мышах с выключенным геном показали, что отсутствие RANKL может влиять на созревание молочной железы, что может приводить к ослаблению лактации.
Грудное вскармливание
Неизвестно, выводится ли деносумаб в грудное молоко. Поскольку известно, что потенциально деносумаб может вызывать нежелательные реакции у детей грудного возраста, необходимо или прекратить грудное вскармливание, или отменить препарат.
Применение у детей
Фармакокинетика препарата у детей не оценивалась. Противопоказано: Детский возраст до 18 лет.
Побочные действия
Заключение по профилю безопасности препарата
По результатам четырех плацебо-контролируемых исследований третьей фазы профиль безопасности препарата Пролиа сходен при применении у женщин в постменопаузальном периоде и у пациентов со злокачественными новообразованиями молочных желез или предстательной железы, получавших гормон-депривационную терапию.
При применении препарата Пролиа нечасто сообщалось о развитии целлюлита, редких случаях гипокальциемии, гиперчувствительности и остеонекроза челюсти, и редких случаях развития атипичных переломов бедренной кости (см. раздел Особые указания и описание отдельных нежелательных реакций данного раздела).
Нежелательные реакции, зарегистрированные в исследованиях фаз 2 и 3, включавших пациенток в постменопаузе и получавших гормон-депривационную терапию, а также спонтанные сообщения, полученные в пострегистрационный период, приведены в таблице ниже.
Частота возникновения определена следующим образом: очень часто ( 1/10), часто (1/100,<, 1/10), нечасто (1/1000, <,1/100), редко (1/10000,<,1/1000), очень редко (<, 1/10000), на основании общего коэффициента встречаемости. В каждой группе систем органов и частоты сообщений, нежелательные реакции приводятся по убыванию степени серьезности.
|
Класс системы органов |
Частота |
Нежелательная реакция |
|
Инфекции и инвазии |
Часто |
Инфекции мочевыводящих путей |
|
Часто |
Респираторные инфекции |
|
|
Нечасто |
Дивертикулит1 |
|
|
Нечасто |
Воспаление подкожной клетчатки1 |
|
|
Нечасто |
Инфекции уха |
|
|
Со стороны иммунной системы |
Редко |
Реакции гиперчувствительности1 |
|
Со стороны метаболизма и электролитного обмена |
Редко |
Гипокальциемия1 |
|
Со стороны нервной системы |
Часто |
Ишиалгия |
|
Со стороны органа зрения |
Часто |
Катаракта1 |
|
Со стороны системы пищеварения |
Часто |
Запор |
|
Со стороны кожи и подкожно-жировой клетчатки |
Часто Часто |
Сыпь Экзема |
|
Со стороны костно-мышечной системы и соединительной ткани |
Очень часто |
Боль в конечностях |
|
Редко |
Остеонекроз челюсти1 |
|
|
Редко |
Атипичный перелом бедренной кости1 |
1см. описание отдельных нежелательных реакций.
В обобщенном анализе данных из всех плацебо-контролируемых исследований II и III фазы о развитии гриппоподобного синдрома сообщалось с общим коэффициентом встречаемости 1,2% для деносумаба и 0,7% для плацебо. Этот дисбаланс был установлен в обобщенном анализе данных и не обнаружен при стратифицированном анализе.
Описание отдельных нежелательных реакций
Гипокальциемия
В двух плацебо-контролируемых исследованиях третьей фазы, включавших женщин в постменопаузальном периоде, у приблизительно 0,05% пациентов (2 из 4050) уменьшались концентрации кальции в сыворотке крови (менее 1,88 ммоль/л) после введения препарата. Не сообщалось о снижении концентраций кальция в сыворотке крови (ниже 1,88 ммоль/л) в двух плацебо-контролируемых исследованиях, включавших пациентов, получавших гормон-депривационную терапию.
При применении в рутинной клинической практике сообщалось о редких случаях тяжелой симптоматической гипокальциемии у пациентов с повышенным риском гипокальциемии, получающих препарат Пролиа.
Инфекции кожи
Частота сообщений о развитии инфекций кожи была сравнима для групп препарата Пролиа (1,5%, 59 из 4050) и плацебо 1,2%, 50 из 4041 в контролируемых исследованиях третьей фазы у женщин с постменопаузальным остеопорозом и у пациентов, получающих гормон-депривационную терапию по поводу рака молочной железы или предстательной железы (плацебо 1,7%, 14 из 845 в сравнении с группой препарата Пролиа 1,4%, 12 из 860). Кожные инфекции, потребовавшие госпитализации развивались у 0,1% (3 из 4041) пациенток с постменопаузальным остеопорозом в группе плацебо и у 0,4% (16 из 4050) пациенток группы препарата Пролиа. Это преимущественно были случаи целлюлита. О серьезных случаях инфекций кожи сообщалось со сходной частотой в группах плацебо (0,6%, 5 из 845) и препарата Пролиа (0,6%, 5 из 860) в исследованиях с гормон-депривационной терапией.
Остеонекроз челюсти
В клинических исследованиях остеопороза (пролечено 9768 пациентов более одного года), зарегистрированы редкие сообщения о развитии остеонекроза челюсти в группе препарата Пролиа (см. раздел Особые указания).
Атипичные переломы бедренной кости
В клинических исследованиях остеопороза зарегистрированы редкие случаи атипичных переломов бедренной кости у пациентов в группе, получавшей препарат Пролиа (см. раздел Особые указания).
Катаракта
В одном из плацебо-контролируемых исследований III фазы у пациентов с раком предстательной железы, получавших гормон-деривационную терапию, отмечен дисбаланс сообщений о развитии катаракты (4,7% в группе деносумаба, 1,2% в группе плацебо). Подобного дисбаланса не зарегистрировано в исследованиях, включавших женщин в постменопаузе или у женщин, получавших терапию ингибиторами ароматазы по поводу рака молочной железы.
Дивертикулит
В одном из плацебо-контролируемых исследований III фазы у пациентов с раком предстательной железы, получавших гормон-депривационную терапию, отмечен дисбаланс сообщений о развитии дивертикулита (1,2% в группе деносумаба, 0% в группе плацебо). Частота развития дивертикулита была сравнимой в группах исследований, включавших женщин в постменопаузе или у женщин, получавших терапию ингибиторами ароматазы по поводу рака молочной железы.
Реакции гиперчувствительности
У пациентов, получающих препарат Пролиав пострегистрационном периоде, редко сообщалось о реакциях гиперчувствительности, связанных с вводимым препаратом, включая сыпь, крапивницу, отек лица, эритему и анафилактические реакции.
Костно-мышечная боль
У пациентов, получающих препарат Пролиа, сообщалось о костно-мышечной боли, включая тяжелой степени.
Другие отдельные группы пациентов
В клинических исследованиях, включавших пациентов с тяжелой почечной недостаточностью (клиренс креатинина <,30 мл/мл) или диализных пациентов, отмечался более высокий риск развития гипокальциемии при отсутствии добавок кальция.
Пациентам этой группы важно принимать препараты кальция и витамина D (см. раздел Особые указания).
Взаимодействие
Пролиа (60 мг подкожно) не влияет на фармакокинетику мидазолама, метаболизирующегося изоферментом CYP3A4 цитохрома Р450, что показывает отсутствие влияния на фармакокинетику препаратов, метаболизирующихся по этому пути (см. раздел Фармакокинетика).
Фармацевтическая несовместимость
Препарат не следует смешивать с другими лекарственными средствами.
Способ применения и дозы
Введение
Проведение инъекции препарата требует предварительного обучения — см. рекомендации по введению препарата, приведенные в конце настоящей инструкции.
Доза
Рекомендуемая доза препарата Пролиа — одна подкожная инъекция 60 мг каждые 6 месяцев.
В течение курса лечения рекомендуется дополнительно принимать препараты кальция и витамин D.
Применение у отдельных групп пациентов
Дети
Препарат Пролиа не рекомендован к применению в педиатрии, так как эффективность и безопасность данного препарата не изучались в этой возрастной группе.
Пациенты пожилого возраста
Основываясь на имеющихся данных об эффективности и безопасности препарата в данной возрастной группе, не требуется коррекции режима дозирования препарата см. раздел Фармакокинетика, подраздел Отдельные группы пациентов).
Почечная недостаточность
Основываясь на имеющихся данных об эффективности и безопасности препарата в данной группе пациентов, не требуется коррекции режима дозирования препарата (см. раздел Фармакокинетика, подраздел Отдельные группы пациентов).
У пациентов с тяжелой почечной недостаточностью (клиренс креатинина <,30 мл/мин) или находящихся на диализе существует большой риск развития гипокальциемии. Таким пациентам необходимо дополнительно принимать препараты кальция и витамин D.
Печеночная недостаточность
Эффективность и безопасность не изучались.
Инструкция по использованию
Следует оценить раствор перед введением на предмет наличия включений или изменения цвета. Раствор нельзя использовать при помутнении или изменении цвета.
Не встряхивать.
Чтобы избежать дискомфорта в месте введения, следует согреть раствор до комнатной температуры (до 25 С) перед инъекцией, а затем медленно ввести все содержимое предварительно заполненного шприца. Шприц с остатками препарата выбросить.
Подробные рекомендации по самостоятельному подкожному введению препарата включены в данную инструкцию по медицинскому применению.
Любые количества неиспользованного препарата или неиспользованные материалы должны быть уничтожены в соответствии с местными требованиями.
Передозировка
В клинических исследованиях не отмечено случаев передозировки препарата. В клинических исследованиях вводили дозы деносумаба до 180 мг каждые 4 недели (кумулятивная доза до 1080 мг в 6 месяцев).
Особые указания
Рекомендуется прием препаратов кальция и витамина D во время применения препарата Пролиа.
Гипокальциемия может быть скорректирована приемом препаратов кальция и витамина D в адекватных дозах перед началом терапии деносумабом. Рекомендуется мониторинг концентрации кальция во время терапии у пациентов, предрасположенных к гипокальциемии, особенно в первые недели после начала терапии (см. раздел Побочное действие).
У пациентов, получающих препарат Пролиа, могут развиться инфекции кожи и ее придатков (преимущественно воспаление подкожной клетчатки), в отдельных случаях требующие госпитализации. О таких реакциях чаще сообщалось для группы деносумаба (0,4%), чем группы плацебо (0,1%) (см. раздел Побочное действие). При этом общая частота возникновения кожных инфекций сравнима в группах деносумаба и плацебо. Пациентов следует проинструктировать незамедлительно обратиться за врачебной помощью в случае развития симптомов и признаков воспаления подкожной клетчатки.
У пациентов с распространенным раком, получавших 120 мг деносумаба каждые 4 недели сообщалось о развитии случаев остеонекроза челюсти. Имеются отдельные сообщения о развитии остеонекроза челюсти на дозе 60 мг каждые 6 месяцев (см. раздел Побочное действие).
Недостаточная гигиена полости рта и инвазивные стоматологические процедуры (например, удаление зубов), являлись факторами риска развития ОНЧ у пациентов, получающих препарат Пролиав клинических исследованиях.
Перед началом терапии важно оценить пациентов в отношении факторов риска развития ОНЧ. При выявлении факторов риска перед терапией препаратом Пролиарекомендуется провести обследование полости рта и зубов с проведением соответствующих профилактических стоматологических мероприятий. Во время лечения препаратом Пролиа следует поддерживать адекватную гигиену полости рота.
Во время лечения препаратом Пролиа следует избегать инвазивных стоматологических процедур. При необходимости таких процедур решение по плану лечения каждого пациента должно приниматься совместно с лечащим врачом на основании индивидуальной оценки соотношения польза/риск.
Пациенты с подозрением на развитие ОНЧ, или у которых ОНЧ развился во время лечения препаратом Пролиа, должны находиться под наблюдением стоматолога или челюстно-лицевого хирурга. У пациентов с ОНЧ, развившимся во время применения препарата Пролиа, может быть принято решение о временном прекращении лечения до разрешения состояния на основании индивидуальной оценки соотношения риск/польза.
Атипичные переломы бедренной кости отмечались у пациенток в группе препарата Пролиа. Атипичные переломы бедренной кости — подвертельные или диафизарные переломы проксимальной части бедренной кости — могут появляться при минимальной травме или без травмы и могут быть билатеральными. На снимках эти переломы обычно имеют характерный внешний вид.
Об атипичных переломах бедренной кости также сообщалось у пациентов с сопутствующими заболеваниями и состояниями (например, недостаток витаминов, ревматоидный артрит, гипофосфатазия), и у пациентов, получающих некоторые виды терапии (например, бисфосфонаты, глюкокортикостероиды, ингибиторы протонного насоса). Эти случаи также наблюдались и в отсутствии антирезорбтивной терапии. Следует проинструктировать пациентов, получающих препарат Пролиа, о необходимости сообщать о возникновении новой или необычной боли в бедре, тазобедренном суставе или паху. Пациенты, у которых возникают такие симптомы, должны быть обследованы на наличие трещины бедренной кости и также должно быть исследовано контралатеральное бедро.
Лица с аллергией на латекс не должны касаться резинового колпачка иглы (производное латекса).
Пролиа содержит такое же активное вещество (деносумаб), как и Эксджива. Пациенты, получающие Пролиа, не должны принимать препарат Эксджива.
Инструкции по введению препарата Пролиа в предварительно заполненном шприце с защитным устройством для иглы
Руководство по частям шприца
См. рис. 1.
Важно: Внимательно прочитайте данную инструкцию перед использованием препарата Пролиа в предварительно заполненном шприце с защитным устройством для иглы:
— Очень важно, чтобы перед тем, как Вы приступите к самостоятельным инъекциям, ваш лечащий врач или медицинская сестра подробно проинструктировали Вас по технике выполнения инъекции.
— Пролиа вводится подкожно (подкожная инъекция).
— Сообщите Вашему врачу, если у Вас есть аллергия на латекс (колпачок иглы предварительно заполненного шприца состоит из производного латекса).
— Не снимайте серый колпачок с иглы предварительно заполненного шприца, пока вы не готовы к инъекции.
— Не используйте предварительно заполненный шприц, если он упал на твердую поверхность. Используйте новый предварительно заполненный шприц и сообщите об этом Вашему лечащему врачу или медицинской сестре.
— Не пытайтесь активировать защитное устройство предварительно заполненного шприца перед инъекцией.
— Не пытайтесь снять прозрачное защитное устройство с предварительно заполненного шприца перед инъекцией.
В случае возникновения вопросов, обращайтесь к Вашему лечащему врачу или медицинской сестре.
Шаг 1: Подготовка
А. Извлеките контурную ячейковую упаковку с предварительно заполненным шприцем из упаковки и подготовьте все, что необходимо для инъекции.
Для более комфортной инъекции оставьте предварительно заполненный шприц при комнатной температуре в течение примерно 30 минут перед инъекцией. Тщательно вымойте руки с мылом. Расположите предварительно заполненный шприц на чистой, хорошо освещенной поверхности. Также подготовьте смоченные спиртом салфетки, ватные тампоны или бинт и пластырь (не прилагаются к шприцу).
— Не пытайтесь подогревать шприц в горячей воде или микроволновой печи.
— Не оставляйте предварительно заполненный шприц под прямыми солнечными лучами.
— Не встряхивайте предварительно заполненный шприц.
— Храните предварительно заполненный шприц в недоступном для детей месте.
В. Откройте контурную ячейковую упаковку, потянув за этикетку. Для извлечения предварительно заполненного шприца из контурной ячейковой упаковки, возьмитесь за защитное устройство.
Возьмите шприц, как показано на рисунке 2 (см. рис. 2).
В целях безопасности:
— Не беритесь за плунжер
— Не беритесь за серый колпачок иглы
С. Проверьте препарат и предварительно заполненный шприц.
— Не используйте предварительно заполненный шприц, если:
- препарат мутный или содержит посторонние частицы. Раствор должен быть прозрачным, бесцветным или светло-желтым,
- любая из частей повреждена или сломана,
- серый колпачок иглы отсутствует или неплотно надет,
- истек последний день указанного на этикетке месяца срока годности.
Сообщите Вашему лечащему врачу или медицинской сестре обо всех перечисленных случаях.
Шаг 2: Подготовка места инъекции
А. Тщательно вымойте руки. Подготовьте и обработайте место инъекции.
Вы можете использовать (см. рис. 3):
- Верхнюю часть бедра
- Живот, за исключением области вокруг пупка, примерно 5 см
- Наружную поверхность плеча (только если инъекцию Вам делает кто-то другой).
Обработайте место инъекции смоченным в спирте тампоном. Дайте коже высохнуть.
— Не дотрагивайтесь до места инъекции перед инъекцией.
— Не используйте для инъекций области, где кожа тонкая, с гематомой, покрасневшая или жесткая. Избегайте инъекций в области со шрамами или растяжками.
В. Осторожно потяните серый колпачок с иглы без скручивания, по направлению от шприца.
С. Зажмите место инъекции для получения упругой поверхности.
Важно удерживать кожу зажатой при проведении инъекции (см. рис. 4).
Шаг 3: Введение
А. Зажмите кожу. ВВЕДИТЕ иглу в кожу (см. рис. 5).
— Не дотрагивайтесь до обработанной области инъекции.
В. Медленно и плавно НАДАВЛИВАЙТЕ на поршень до тех пор, пока Вы не почувствуете или услышите щелчок. Надавливайте на поршень до щелчка (см. рис. 6).
Важно надавливать на поршень до щелчка, для введения всей дозы.
С. ОТПУСТИТЕ большой палец. Затем ИЗВЛЕКИТЕ шприц из кожи (см. рис. 7).
После того, как вы отпустите поршень, защитное устройство предварительно заполненного шприца покроет иглу.
— Не надевайте серый колпачок иглы обратно на предварительно заполненный шприц.
Шаг 4: Окончание
А. Выбросите использованный предварительно заполненный шприц и другие сопутствующие материалы в соответствии с местными правилами.
Выбросите использованный предварительно заполненный шприц и серый колпачок иглы. Лекарственные препараты должны быть утилизированы в соответствии с местными требованиями. Спросите у врача или провизора, как уничтожить препарат, если он больше не требуется. Эти меры помогут защитить окружающую среду. Храните шприцы и сопутствующие материалы в недоступном для детей месте.
— Не используйте предварительно заполненный шприц повторно.
В. Осмотрите место инъекции.
— Если в месте инъекции выступит кровь, прижмите к нему ватный тампон или бинт.
Не растирайте место инъекции. При необходимости, заклейте место инъекции пластырем.
Инструкции по введению препарата Пролиа в предварительно заполненном шприце
В этом разделе приводится информация по правильному проведению инъекции предварительно заполненным шприцем.
Очень важно, чтобы перед тем, как Вы приступите к самостоятельным инъекциям, Ваш лечащий врач, медицинская сестра подробно проинструктировали Вас по технике выполнения инъекции.
Тщательно вымойте руки перед выполнением инъекции.
Если у Вас возникнут вопросы по технике выполнения инъекции, то обратитесь к Вашему лечащему врачу или медицинской сестре.
Перед началом инъекции:
Внимательно прочитайте все инструкции перед использованием ПЗШ.
НЕ используйте ПЗШ, если колпачок был удален.
Как использовать предварительно заполненный шприц?
Ваш врач назначил вам препарат Пролиа ПЗШ для подкожных инъекций. Вы должны ввести все содержимое шприца (1 мл) однократно и повторить инъекцию через 6 месяцев, как назначено лечащим врачом.
Оборудование
Для самостоятельной инъекции Вам потребуется:
1. новый ПЗШ препарата Пролиа, и
2. смоченные спиртом тампоны или сходные материалы.
Что Вы должны сделать до самостоятельного введения Пролиа подкожно?
1. Достать шприц из холодильника. НЕ берите ПЗШ за поршень или защитный колпачок, это может повредить устройство.
2. ПЗШ можно оставить вне холодильника для достижения комнатной температуры. Это позволит сделать инъекцию более комфортной.
НЕ подогревайте ПЗШ каким-либо другим способом (например, в микроволновой печи либо в горячей воде).
НЕ оставляйте шприц под прямыми солнечными лучами.
3. НЕ встряхивайте ПЗШ.
4. НЕ снимайте колпачок с ПЗШ до тех пор, пока Вы не готовы к инъекции.
5. Проверить срок годности ПЗШ. Срок годности указан на упаковке как ГОДЕН ДО: ММ.ГГГГ.
НЕ используйте ПЗШ, если истек последний день указанного на этикетке месяца срока годности.
6. Проверить внешний вид препарата Пролиа. Раствор должен быть прозрачным, бесцветным или светло-желтым. Если раствор помутнел или окрашен иначе, препарат использовать нельзя.
7. Выбрать комфортное, хорошо освещенное место и чистую поверхность, где можно удобно расположить все необходимые материалы.
8. Тщательно вымыть руки.
Как правильно выбрать место для инъекции?
Лучше всего делать инъекции в верхнюю часть бедра и в живот.
Если инъекции Вам делает кто-то другой, можно использовать наружную поверхность плеча (см. рис. 8).
Как правильно сделать инъекцию?
1. Продезинфицируйте место инъекции с помощью смоченного в спирте тампона.
2. Во избежание загиба иглы, аккуратно потяните колпачок с иглы сразу без скручивания.
НЕ дотрагивайтесь до иглы и не нажимайте на поршень.
3. Если внутри ПЗШ видны маленькие пузырьки воздуха, нет необходимости удалять их перед инъекцией.
Введение раствора с пузырьками воздуха является безопасным.
4. Зажмите кожу (не сдавливая) между большим и указательным пальцами. Введите иглу в кожу полностью, как показывал Вам доктор или медицинская сестра.
5. Медленно и плавно надавливайте на поршень, одновременно придерживая кожную складку. Надавливать на поршень следует до тех пор, пока шприц не опустеет.
6. Извлеките иглу из кожи, и отпустите кожную складку.
7. Если выступит кровь в месте инъекционного прокола, аккуратно стереть ее ватным тампоном или тканью. Не растирайте место инъекции. При необходимости, заклейте место инъекции пластырем.
8. Используйте один ПЗШ только для одной инъекции. НЕ используйте оставшийся в шприце препарат.
Помните: При возникновении проблем, обратитесь за помощью или советом к лечащему врачу или медицинской сестре.
Уничтожение использованных шприцев
— НЕ надевайте обратно колпачок на использованный шприц.
— Храните использованный шприц в недоступном для детей месте.
— Использованный шприц должен быть утилизирован в соответствии с местными правилами. Спросите у врача или провизора, как уничтожить препарат, если он больше не требуется. Эти меры помогут защитить окружающую среду.
Влияние на способность к вождению автотранспорта и управлению механизмами
Исследований влияния на способность к вождению автотранспортных средств и управлению механизмами не проводилось.
Форма выпуска
Раствор для подкожного введения, 60 мг/мл.
Условия отпуска из аптек
По рецепту
Условия хранения
Хранить при температуре 2-8 С. Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
Не встряхивать.
Хранить в недоступном для детей месте.
После изъятия из холодильника Пролиа может храниться при комнатной температуре не выше 25С, в оригинальной упаковке, не более 30 дней.
Срок годности
3 года. Не использовать по окончании срока годности, указанного на упаковке.
Производитель и организация, принимающие претензии потребителей
Производитель:
AMGEN EUROPE, B.V. Нидерланды
ДОБРОЛЕК, ООО Россия
Представительство: АМДЖЕН ООО Россия
Prolia
Регистрационный номер
Торговое наименование
Пролиа®
Международное непатентованное наименование
Лекарственная форма
раствор для подкожного введения
Состав
Описание
Прозрачная жидкость, от бесцветного до светло-жёлтого цвета, практически свободная от видимых включений.
Фармакотерапевтическая группа
Код АТХ
Фармакологические свойства
Фармакодинамика
Механизм действия
Деносумаб представляет собой человеческое моноклональное антитело (IgG2), обладающее высокой аффинностью и специфичностью к RANKL (лиганд к рецептору RANK), и тем самым, препятствует активации этих рецепторов RANK на поверхности остеокластов и их предшественников. Предотвращение связывания лиганда RANK с рецептором RANK ингибирует созревание, функционирование и выживаемость остеокластов, что уменьшает костную резорбцию в кортикальном и губчатом слое кости.
Фармакодинамические эффекты
Терапия препаратом Пролиа® приводила к быстрому снижению скорости ремоделирования костной ткани, достигая минимальных (снижение на 85 %) показателей концентрации маркера резорбции костной ткани — сывороточных C-телопептидов 1 типа (CTX) в течение 3 дней.
Снижение концентрации СТХ сохранялось в интервале между введениями препарата. В конце каждого интервала дозирования степень снижения концентрации CTX частично нивелировалась приблизительно до ≥ 45 % по сравнению с максимальным снижением концентрации СТХ ≥ 87 % (диапазон — 45-80%), что отражает обратимость эффектов препарата Пролиа® в отношении костного метаболизма при снижении концентрации препарата в сыворотке. Эти эффекты сохранялись на протяжении всего периода терапии.
Концентрации маркеров костной резорбции обычно достигали исходных значений, наблюдавшихся до начала терапии, в течение 9 месяцев после введения последней дозы препарата. После возобновления терапии препаратом степень снижения концентрации CTX была сходна со степенью снижения концентрации СТХ в начале курса лечения деносумабом.
Иммуногенность
В клинических исследованиях не наблюдалось продукции нейтрализующих антител к деносумабу. Используя метод чувствительного иммунологического анализа, было показано, что у <1 % пациентов, получавших деносумаб на протяжении до 5 лет, регистрировались ненейтрализующие связывающие антитела при отсутствии признаков изменения параметров фармакокинетики, токсичности или клинического ответа.
Дети
Европейское агентство по оценке лекарственных средств отказалось от требования предоставить результаты исследований препарата Пролиа® во всех субпопуляциях пациентов детского возраста для лечения потери костной массы, на фоне аблативной терапией половыми гормонами, а также в субпопуляции детей в возрасте младше 2 лет для лечения остеопороза. Информация о применении препарата у детей приведена в разделе «Способ применения и дозы».
Фармакокинетика
Всасывание
После подкожного введения в дозе 1,0 мг/кг, приблизительно соответствующей зарегистрированной дозе 60 мг, значения AUC составили 78 % по сравнению с внутривенным введением препарата в той же дозе.
При подкожном введении препарата в дозе 60 мг максимальная концентрация деносумаба в сыворотке крови (Сmax) составляла 6 мкг/мл (диапазон: 1-17 мкг/мл) и достигалась в течение 10 дней (диапазон: 2-28 дней).
Метаболизм
Деносумаб состоит только из аминокислот и углеводов в виде нативного иммуноглобулина, и элиминация с помощью печёночных метаболических механизмов маловероятна. Поэтому предполагается, что выведение препарата происходит стандартными путями расщепления иммуноглобулинов, результатом которых является распад до малых пептидов и отдельных аминокислот.
Выведение
Поле достижения максимальной концентрации деносумаба в сыворотке крови (Сmax), концентрация препарата снижется с периодом полувыведения 26 дней (размах вариации: 6-52 дня) в течение 3 месяцев (диапазон: 1,5-4,5 месяца). У 53 % пациентов через 6 месяцев после введения последней дозы деносумаба его концентрация в крови не поддавалась количественному определению.
Не наблюдалось кумулирования препарата или изменения параметров фармакокинетики в течение времени при подкожном многократном введении деносумаба в дозе 60 мг в течение 6 месяцев.
Продукция связывающих антител к деносумабу, аналогичная как у мужчин, так и у женщин, не оказывала влияла влияния на параметры фармакокинетики деносумаба.
Возраст (28-87 лет), раса и стадия заболевания (низкая костная масса, остеопороз, рак предстательной железы или рак молочной железы), не оказывают значительного влияния на параметры фармакокинетики деносумаба.
Наблюдалась тенденция к снижению экспозиции препарата (AUC и Сmax) с повышением массы тела. Однако данная тенденция не расценивалась как клинически значимая, поскольку фармакодинамические эффекты (оценка которых осуществлялась по значениям концентраций маркеров метаболизма костной ткани и повышения МПКТ) были аналогичны в широком диапазоне значений массы тела.
Линейность фармакокинетики
В исследованиях применения деносумаб в различных дозах была продемонстрирована нелинейная дозозависимая фармакокинетика, со снижением клиренса препарата при увеличении дозы или концентрации; однако приблизительно дозопропорциональное увеличение экспозиции наблюдалось при применении доз 60 мг и выше.
Отдельные группы пациентов
Дети
Фармакокинетика препарата у детей не оценивалась.
Почечная недостаточность
В исследовании у 55 пациентов с различной степенью тяжести почечной дисфункции, включая пациентов, получавших диализную терапию, было показано, что степень выраженности почечной недостаточности не влияла на параметры фармакокинетики деносумаба.
Печёночная недостаточность
Не проводилось специальных исследований у пациентов с печёночной недостаточностью. Как правило, моноклональные антитела не выводятся при помощи печёночных метаболических механизмов. Предполагается, что печёночная недостаточность не оказывает влияния на параметры фармакокинетики деносумаба.
Показания
— Лечение постменопаузального остеопороза и остеопороза у мужчин при повышенном риске переломов. У женщин в постменопаузе Пролиа® значительно снижает риск вертебральных, невертебральных переломов и переломов бедра.
— Лечение потери костной массы у женщин, получающих терапию ингибиторами ароматазы по поводу рака молочной железы, и у мужчин с раком предстательной железы, получающих гормон-депривационную терапию, при повышенном риске переломов. У мужчин с раком предстательной железы, получающих гормон-депривационную терапию, Пролиа® значительно снижает риск вертебральных переломов.
— Лечение потери костной массы, связанной с длительной терапией системными глюкокортикоидами, у взрослых пациентов при повышенном риске переломов.
Противопоказания
— Гиперчувствительность к любому из компонентов препарата.
— Гипокальциемия (см. раздел «Особые указания»).
— Беременность и период грудного вскармливания.
— Детский возраст до 18 лет.
Применение при беременности и в период грудного вскармливания
Беременность
Данные о применении деносумаба в период беременности ограничены. В исследованиях на животных была продемонстрирована репродуктивная токсичность препарата.
Препарат Пролиа® не следует применять в период беременности и у женщин в репродуктивном периоде, не использующих контрацептивы.
Женщинам рекомендуется избегать наступления беременности в течение периода терапии и минимум 5 месяцев после завершения терапии препаратом.
Любые эффекты препарата Пролиа® вероятно будут более выражены в течение второго и третьего триместров беременности, поскольку моноклональные антитела проникают через плаценту, и степень их проникновения линейно возрастает по мере увеличения срока беременности, а наибольшие значения отмечаются в течение третьего триместра.
Лактация
Неизвестно, проникает ли деносумаб в грудное молоко. В исследованиях на генетически модифицированных мышах с выключенным геном RANKL («нокаутные мыши») было показано, что отсутствие RANKL (мишени деносумаба; см. раздел «Фармакодинамика») в период беременности может оказывать влияние на созревание молочных желёз, приводя к нарушению лактации в послеродовом периоде.
Решение о необходимости прекращения грудного кормления или прекращения терапии препаратом Пролиа® следует принимать с учётом пользы грудного кормления для ребёнка и пользы терапии для матери.
Влияние на фертильность
Данные о влиянии деносумаба на фертильность у человека отсутствуют. Исследования на животных не продемонстрировали прямого или косвенного негативного влияния препарата на фертильность.
Способ применения и дозы
Доза
Рекомендуемая доза препарата Пролиа® составляет 60 мг, которая вводится путём подкожной инъекции 1 раз в 6 месяцев в бедро, живот или плечо.
Во время курса лечения необходимо принимать препараты кальция и витамина D в адекватных дозах (см. раздел «Особые указания»).
Оптимальная длительность терапии остеопороза антирезорбтивными препаратами (деносумаб и бисфосфонаты) не установлена. Необходимость продолжения терапии периодически должна переоцениваться с учётом пользы и потенциальных рисков применения деносумаба у каждого конкретного пациента, и в частности, через 5 лет и более после начала применения препарата (см. раздел «Особые указания»).
Использование в отдельных популяциях пациентов
Дети
Применение препарата Пролиа® у детей (в возрасте < 18 лет) не рекомендуется, поскольку безопасность и эффективность препарата у данной возрастной группы пациентов не установлены. Ингибирование лиганда RANK/RANK (RANKL) в исследованиях на животных ассоциировалось с ингибированием роста костей и отсутствием прорезывания зубов.
Пожилые пациенты (в возрасте ≥ 65 лет)
Коррекции дозы препарата у пожилых пациентов не требуется.
Нарушение функции почек
Не требуется коррекции дозы препарата у пациентов с нарушением функции почек (рекомендации по мониторингу концентрации кальция см. в разделе «Особые указания»). Отсутствуют данные о применении препарата у пациентов с тяжёлым нарушением функции почек (СКФ < 30 мл/мин) и получающих длительную терапию системными глюкокортикоидами.
Нарушение функции печени
Безопасность и эффективность использования деносумаба у пациентов с нарушением функции печени не установлены (см. раздел «Фармакокинетика»).
Способ введения
Подкожно.
Введение препарата должно осуществляться лицом, обученным технике выполнения инъекции.
Особые меры предосторожности при применении и утилизации см. в разделе «Особые указания».
Побочное действие
Заключение по профилю безопасности препарата
К наиболее частым побочным действиям (отмечавшимися более чем у одного из 10 пациентов) относятся скелетно-мышечные боли и боли в конечностях. Сообщалось о нечастых случаях воспаления подкожно-жировой клетчатки и редких случаях гипокальциемии, гиперчувствительности, остеонекроза челюсти и атипичных переломах бедренной кости (см. раздел «Особые указания» и «Описание отдельных нежелательных реакций»).
Табличный перечень нежелательных реакций
Нежелательные реакции, выявленные в клинических исследованиях II и III фазы у пациентов с остеопорозом и раком молочной железы или раком простаты, получавших гормондепривационную терапию, а также спонтанные сообщения, представлены в таблице 3 ниже.
Нежелательные реакции представлены согласно классификации (см. таблицу 3): очень часто (≥ 1/10); часто (≥ 1/100, < 1/10); нечасто (≥ 1/1000, < 1/100); редко (≥ 1/10000, < 1/1000); очень редко (< 1/10000). Нежелательные реакции представлены в пределах каждого класса системы органов по степени убыванию серьёзности.
Таблица 3. Нежелательные реакции, отмечавшиеся у пациентов с остеопорозом и раком молочной железы или раком предстательной железы, получавших гормондепривационную терапию
|
Класс системы органов по классификации MedDRA |
Частота |
Нежелательная реакция |
|
Инфекции и инвазии |
Часто |
Инфекции мочевыводящих путей |
|
Часто |
Инфекции верхних дыхательных путей |
|
|
Нечасто |
Дивертикулит1 |
|
|
Нечасто |
Воспаление подкожно-жировой клетчатки1 |
|
|
Нечасто |
Инфекции уха |
|
|
Нарушения со стороны иммунной системы |
Редко |
Реакции гиперчувствительности1 |
|
Редко |
Анафилактическая реакция1 |
|
|
Нарушения со стороны обмена веществ и питания |
Редко |
Гипокальциемия1 |
|
Нарушения со стороны нервной системы |
Часто |
Ишиас |
|
Нарушения со стороны желудочно-кишечного тракта |
Часто |
Запор |
|
Часто |
Дискомфорт в животе |
|
|
Нарушения со стороны кожи и подкожной клетчатки |
Часто |
Сыпь |
|
Часто |
Экзема |
|
|
Нарушения со стороны костно-мышечной системы и соединительной ткани |
Очень часто |
Боль в конечностях |
|
Очень часто |
Скелетно-мышечная боль 1 |
|
|
Редко |
Остеонекроз челюсти1 |
|
|
Редко |
Атипичный перелом бедренной кости1 |
|
|
Нечасто |
Множественные переломы позвоночника вследствие отмены лечения препаратом Пролиа® 1 |
|
|
Неизвестно |
Остеонекроз наружного слухового прохода 2 |
1 См. раздел «Описание отдельных нежелательных реакций».
2 См. раздел «Особые указания».
В обобщённом анализе данных всех плацебо-контролируемых исследований II и III фазы, сообщалось о развитии гриппоподобного заболевания с частотой 1,2 % в группе с деносумабом и 0,7 % — в группе плацебо. Этот дисбаланс был установлен в обобщённом анализе данных и не был обнаружен при стратифицированном анализе.
Описание отдельных нежелательных реакций
Гипокальциемия
В двух плацебо-контролируемых исследованиях III фазы у женщин c постменопаузальным остеопорозом, приблизительно у 0,05 % пациентов (2 из 4050) снижалась концентрация кальция в сыворотке крови (менее 1,88 ммоль/л) после введения препарата Пролиа®.
Не сообщалось о снижении концентрации кальция в сыворотке крови (ниже 1,88 ммоль/л) в двух плацебо-контролируемых клинических исследованиях III фазы у пациентов, получавших гормон-депривационную терапию, или в плацебо-контролируемом клиническом исследовании III фазы у мужчин с остеопорозом.
В постмаркетинговых исследованиях отмечались редкие случаи тяжёлой симптоматической гипокальциемии, преимущественно у пациентов с повышенным риском гипокальциемии, получавших препарат Пролиа® ; при этом большинство случаев отмечалось в течение первых недель после начала терапии.
Примерами клинических проявлений тяжёлой симптоматической гипокальциемии являются удлинение интервала QT, тетания, судорожные припадки и изменение психического статуса (см. раздел «Особые указания»). Симптомами гипокальциемии в исследованиях деносумаба являлись парестезия или скованность мышц, мышечные подергивания, спазмы или судорожные сокращения мышц.
Инфекции кожи
Частота сообщений развития инфекций кожи в плацебо-контролируемых клинических исследованиях III фазы была идентична у женщин с постменопаузальным остеопорозом (в группе лечения препаратом Пролиа® — 1,5 %; 59 из 4050, в группе плацебо — 1,2 %; 50 из 4041); у мужчин с остеопорозом (в группе плацебо — 0,8 %; 1 из 120; в группе с препаратом — 0 %; 0 из 120); у пациентов с раком молочной железы и раком предстательной железы, получающих гормон-депривационную терапию (в группе плацебо — 1,7 %; 14 из 845; в группе лечения препаратом Пролиа® — 1,4 %; 12 из 860).
Кожные инфекции, требующие госпитализации, были отмечены у 0,1 % (3 из 4041) пациентов с постменопаузальным остеопорозом в группе плацебо и у 0,4 % (16 из 4050) пациентов в группе лечения препаратом Пролиа®. Преимущественно это были случаи воспаления подкожно-жировой клетчатки.
О серьёзных случаях инфекций кожи сообщалось со сходной частотой в группах плацебо (0,6 %; 5 из 845) и группах лечения препаратом Пролиа® (0,6 %; 5 из 860) в исследованиях рака молочной железы и рака предстательной железы.
Остеонекроз челюсти (ОНЧ)
Отмечались редкие случаи ОНЧ: у 16 из включённых 23148 пациентов, принимавших участие в клинических исследованиях применения препарата у пациентов с остеопорозом, раком молочной железы или раком предстательной железы, получавших гормон-депривационную терапию (см. раздел «Особые указания»). 13 из этих случаев ОНЧ отмечались у женщин с постменопаузальным остеопорозом, участвовавших в расширенном клиническом исследовании III фазы и продолжавших терапию препаратом Пролиа® в течение/до 10 лет.
Частота ОНЧ составила 0,04 % — в течение 3 лет; 0,06 % — в течение 5 лет и 0,44 % — в течение 10 лет терапии препаратом Пролиа®. Риск ОНЧ возрастал по мере увеличения длительности терапии препаратом Пролиа®.
Атипичные переломы бедренной кости
В клинических исследованиях остеопороза у пациентов в группе лечения, получавшей препарат Пролиа®, были зарегистрированы редкие случаи атипичных переломов бедренной кости (см. раздел «Особые указания»).
Множественные переломы позвоночника (МПП) вследствие отмены лечения препаратом Пролиа®
В клинических исследованиях остеопороза зарегистрированы случаи МПП вследствие отмены лечения препаратом Пролиа®, в особенности у пациентов с переломами позвоночника в анамнезе.
Дивертикулит
В плацебо-контролируемом клиническом исследовании III фазы у пациентов с раком предстательной железы, получавших гормон-депривационную терапию, отмечен дисбаланс в сообщениях о развитии дивертикулита (1,2 % в группе лечения деносумабом, 0 % в группе плацебо). Частота развития дивертикулита была сравнима в группах исследований, включавших женщин в постменопаузе или мужчин с остеопорозом, а также у женщин, получавших терапию ингибиторами ароматазы по причине неметастатического рака молочной железы.
Реакции гиперчувствительности
В постмаркетинговых исследованиях у пациентов, получающих препарат Пролиа® в пострегистрационном периоде, редко сообщалось о реакциях гиперчувствительности, связанных с препаратом, включая сыпь, крапивницу, отёк лица, эритему и анафилактические реакции.
Скелетно-мышечная боль
Скелетно-мышечные боли, в том числе тяжёлые, отмечались у пациентов, получавших препарат Пролиа®, в постмаркетинговых исследованиях. В клинических исследованиях скелетно-мышечные боли регистрировались очень часто, как в группе лечения деносумабом, так и в группе плацебо. Скелетно-мышечная боль, приводившая к досрочному завершению участия в исследовании, отмечалась нечасто.
Использование в других особых популяциях
Почечная недостаточность
В клинических исследованиях у пациентов с тяжёлой почечной недостаточностью (клиренс креатинина < 30 мл/мин) или пациентов, получавших диализ, отмечался более высокий риск развития гипокальциемии при отсутствии приёма препаратов кальция. Пациентам с тяжёлой почечной недостаточностью или пациентам, получающим диализ, важно принимать препараты кальция и витамина D (см. раздел «Особые указания»).
Передозировка
Не регистрировалось случаев передозировки в клинических исследованиях. В клинических исследованиях деносумаб вводился в дозах до 180 мг, каждые 4 недели (суммарная доза в течение 6 месяцев — до 1080 мг), при этом дополнительных нежелательных реакций не наблюдалось.
Взаимодействие с другими лекарственными средствами
В исследовании лекарственного взаимодействия препарат Пролиа® не оказывал влияния на параметры фармакокинетики мидазолама, который метаболизируется цитохромом P450 3A4 (CYP3A4). Это означает, что препарат Пролиа® не должен оказывать влияние на параметры фармакокинетики лекарственных средств, метаболизирующихся с участием CYP3A4.
Отсутствуют клинические данные о совместном применении деносумаба и гормонзаместительной терапии (эстрогенами), вероятность данного фармакодинамического взаимодействия расценивается как низкая.
У женщин с постменопаузальным остеопорозом предшествующая терапия алендроновой кислотой не оказывала влияния на параметры фармакокинетики и фармакодинамики деносумаба согласно данным переходного исследования (с алендроновой кислоты на деносумаб).
Фармацевтическая несовместимость
В связи с отсутствием результатов исследований по совместимости данный препарат не следует применять с другими лекарственными средствами.
Особые указания
Препараты кальция и витамина D
Всем пациентам рекомендуется приём препаратов кальция и витамина D в адекватных дозах во время терапии препаратом Пролиа®.
Меры предосторожности при использовании
Гипокальциемия
Важно выявить пациентов с риском развития гипокальциемии. Гипокальциемия должна быть скорректирована приёмом препаратов кальция и витамина D в адекватных дозах до начала терапии. Рекомендуется мониторинг концентрации кальция перед введением каждой дозы препарата у пациентов, предрасположенных к развитию гипокальциемии, в течение 2-х недель после введения первой дозы. При развитии симптомов гипокальциемии в течение курса терапии (см. раздел «Побочное действие») необходимо оценить концентрацию кальция в крови. Пациенты должны быть предупреждены о необходимости сообщать при появлении симптомов, указывающих на гипокальциемию.
В постмаркетинговых исследованиях отмечались случаи тяжёлой симптоматической гипокальциемии (см. раздел «Побочное действие»), которые чаще всего регистрировались в течение первых недель после начала терапии, однако их развитие возможно и в более поздние сроки.
Одновременная терапия глюкокортикоидами является дополнительным фактором риска гипокальциемии.
Почечная недостаточность
У пациентов с тяжёлым нарушением функции почек (имеющие клиренс креатинина < 30 мл/мин) или получающих диализ существует повышенный риск развития гипокальциемии. Риск развития гипокальциемии и сопутствующего увеличения уровня паратиреоидного гормона возрастает с увеличением степени тяжести нарушения функции почек. Данным пациентам особенно важно принимать препараты кальция и витамина D в адекватных дозах, а также проводить регулярный мониторинг концентрации кальция в крови (см. выше).
Инфекции кожи
У пациентов, получающих препарат Пролиа®, возможно развитие кожных инфекций (преимущественно, воспаление подкожно-жировой клетчатки), требующих госпитализации (см. раздел «Побочное действие»). Пациентам следует сообщить о необходимости немедлительного обращения за медицинской помощью при появлении признаков или симптомов воспаления подкожно-жировой клетчатки.
Остеонекроз челюсти (ОНЧ)
Были зарегистрированы редкие случаи ОНЧ у пациентов, получавших препарат Пролиа® для лечения остеопороза (см. раздел «Побочное действие»).
Необходимо отложить начало терапии/проведение нового курса терапии у пациентов с незажившими открытыми повреждениями мягких тканей полости рта. Перед началом терапии деносумабом у пациентов с наличием сопутствующих факторов риска необходимо проведение стоматологического обследования и превентивных стоматологических мероприятий, а также индивидуальная оценка соотношения пользы и рисков терапии деносумабом.
При оценке индивидуального риска развития ОНЧ у пациента необходимо учитывать следующие факторы риска:
- активность лекарственного препарата, ингибирующего резорбцию костной ткани (увеличение риска для сильнодействующих препаратов), способ введения (увеличение риска при парентеральном введение) и суммарная доза антирезорбтивной терапии;
- злокачественные опухоли, сопутствующая патология (например, анемия, коагулопатии, инфекции), курение;
- сопутствующая терапия (кортикостероиды, химиотерапия, ингибиторы ангиогенеза, лучевая терапия области головы и шеи);
- недостаточная гигиена полости рта, болезни пародонта, плохо подобранные зубные протезы, наличие стоматологических заболеваний в анамнезе, инвазивные стоматологические процедуры (например, экстракции зубов).
Во время лечения деносумабом всем пациентам следует поддерживать надлежащую гигиену полости рта, проходить регулярные стоматологические осмотры, а также немедленно сообщать о любых нежелательных симптомах со стороны ротовой полости, таких как подвижность зубов, боль, отёк, незаживающие поражения слизистой или наличие выделений.
В процессе терапии инвазивные стоматологические процедуры следует проводить только после тщательной оценки; необходимо избегать выполнения данных процедур непосредственно перед введением и/или сразу после введения препарата Пролиа®.
План лечения пациентов с ОНЧ должен быть разработан совместно с лечащим врачом и стоматологом или челюстно-лицевым хирургом с опытом лечения данной патологии.
Следует рассмотреть вопрос о временном прекращении терапии до разрешения данного состояния и устранения факторов риска во всех случаях, когда это возможно.
Остеонекроз наружного слухового канала
На фоне терапии деносумабом отмечались случаи остеонекроза наружного слухового прохода. Возможными факторами риска данного состояния являются применение стероидов и химиотерапия, и/или местные факторы риска, такие как инфекция или травма.
Возможность развития остеонекроза наружного слухового канала следует рассматривать у пациентов, принимающих деносумаб, у которых имеются симптомы со стороны уха, включая хронические инфекции уха.
Атипичные переломы бедра
Атипичные переломы бедренной кости отмечались у пациентов, принимающих Пролиа® (см. раздел «Побочное действие»). Атипичные переломы бедренной кости могут возникать при небольших травмах или отсутствии травм в подвертельной или диафизарной проксимальной части бедренной кости. На рентгенологических снимках эти переломы обычно имеют характерный внешний вид.
Об атипичных переломах бедренной кости также сообщалось у пациентов с определенными сопутствующими заболеваниями и состояниями (например, недостаток витамина D, ревматоидный артрит, гипофосфатазия), и у пациентов, получающих некоторые виды терапии (например, бисфосфонаты, глюкокортикостероиды, ингибиторы протонной помпы). Эти случаи также наблюдались и в отсутствии антирезорбтивной терапии.
Подобные переломы, связанные с приёмом бисфосфонатов, часто имеют двусторонний характер; поэтому у пациентов, получающих терапию деносумабом, при выявлении перелома бедренной кости, необходимо обследование бедра с противоположной стороны.
Следует рассмотреть вопрос о прекращении лечения препаратом Пролиа® у пациентов с подозрением на атипичный перелом бедра, с учётом индивидуальной оценки соотношения пользы и риска.
Во время лечения Пролиа® пациентов следует предупредить о необходимости информирования о новых или необычных болях в области бедренной кости, тазобедренной кости или паховой области. Пациенты, у которых возникают такие симптомы, должны быть обследованы на наличие неполных переломов бедренной кости.
Множественные переломы позвоночника (МПП) вследствие отмены лечения препаратом Пролиа®, в особенности у пациентов с переломами позвоночника в анамнезе
Пациентов следует проинструктировать не прерывать терапию препаратом Пролиа® без консультации с лечащим врачом. Перед отменой лечения препаратом Пролиа® необходимо провести индивидуальную оценку соотношения польза/риск.
В случае отмены лечения препаратом Пролиа® необходимо рассмотреть перевод на альтернативную антирезорбтивную терапию.
Длительная антирезорбтивная терапия
Длительная антирезорбтивная терапия (как деносумабом, так и бисфосфонатами) может способствовать повышению риска таких осложнений, как остеонекроз челюсти и атипичные переломы бедра, вследствие выраженного подавления процессов ремоделирования кости (см. раздел «Способ применения и дозы»).
Одновременное применение других лекарственных средств, содержащих деносумаб
Пациенты, получающие терапию препаратом Пролиа®, не должны получать одновременно другие содержащие деносумаб лекарственные препараты (для профилактики осложнений со стороны костной ткани у взрослых с солидными опухолями, метастазирующими в кость).
Сухой натуральный каучук
Колпачок иглы предварительно заполненного шприца содержит сухой натуральный каучук (производное латекса), который может вызывать аллергические реакции.
Предупреждения в отношении вспомогательных веществ
Данный препарат содержит 47 мг сорбитола в 1 мл раствора. Следует учитывать аддитивный эффект одновременного применения препаратов, содержащих сорбитол (или фруктозу), а также поступления сорбитола (или фруктозы) с пищей.
Данный препарат содержит менее 1 ммоль натрия (23 мг) в 60 мг, то есть может расцениваться как не содержащий натрия.
Особые меры предосторожности при применении и утилизации
- Перед введением следует оценить раствор на предмет наличия включений или изменения цвета. Раствор нельзя использовать при помутнении, наличии взвешенных частиц или изменении цвета.
- Не встряхивать.
- Чтобы избежать дискомфорт в месте введения, следует довести препарат до комнатной температуры (до 25 °C) перед инъекцией, а затем медленно ввести все содержимое предварительно заполненного шприца.
Любое количество неиспользованного препарата или неиспользованных материалов должно быть утилизировано в соответствии с надлежащими требованиями.
Инструкция по использованию:
Важно
Внимательно прочитайте данную инструкцию перед использованием препарата
Пролиа® в предварительно заполненном шприце с защитным устройством для иглы:
— Очень важно, чтобы перед тем, как Вы приступите к самостоятельным инъекциям, ваш лечащий врач или медицинская сестра подробно проинструктировали Вас по технике выполнения инъекции.
— Пролиа® вводится подкожно (подкожная инъекция).
— Сообщите Вашему врачу, если у Вас есть аллергия на латекс (колпачок иглы предварительно заполненного шприца состоит из производного латекса).
— Не снимайте серый колпачок с иглы предварительно заполненного шприца, пока вы не готовы к инъекции.
— Не используйте предварительно заполненный шприц, если он упал на твердую поверхность. Используйте новый предварительно заполненный шприц и сообщите об этом Вашему лечащему врачу или медицинской сестре.
— Не пытайтесь активировать защитное устройство предварительно заполненного шприца перед инъекцией.
— Не пытайтесь снять прозрачное защитное устройство с предварительно заполоненного шприца перед инъекцией.
В случае возникновения вопросов, обращайтесь к Вашему лечащему врачу или медицинской сестре.
Шаг 1: Подготовка
A. Извлеките контурную ячейковую упаковку с предварительно заполненным шприцем из упаковки и подготовьте все необходимое для инъекции: спиртовые салфетки, ватный тампон или марлевую салфетку, пластырь и контейнер для острых отходов (не включены в упаковку).
Для более комфортной инъекции оставьте предварительно заполненный шприц при комнатной температуре в течение примерно 30 минут перед инъекцией. Тщательно вымойте руки с мылом.
Расположите предварительно заполненный шприц и другие необходимые расходные материалы на чистой, хорошо освещённой поверхности.
— Не пытайтесь подогревать шприц в горячей воде или микроволновой печи.
— Не оставляйте предварительно заполненный шприц под прямыми солнечными лучами.
— Не встряхивайте предварительно заполненный шприц.
— Храните предварительно заполненный шприц в недоступном для детей месте.
B. Откройте контурную ячейковую упаковку, потянув за этикетку. Для извлечения предварительно заполненного шприца из контурной ячейковой упаковки возьмитесь за защитное устройство.
Возьмите шприц, как показано на рисунке.
В целях безопасности:
— Не беритесь за плунжер.
— Не беритесь за серый колпачок иглы.
C. Проверьте препарат и предварительно заполненный шприц.
— Не используйте предварительно заполненный шприц, если:
- Препарат мутный или содержит посторонние частицы. Раствор должен быть прозрачным, бесцветным или светло-жёлтым.
- Любая из частей повреждена или сломана.
- Серый колпачок иглы отсутствует или неплотно надет.
- Истек последний день указанного на этикетке месяца срока годности.
Сообщите Вашему лечащему врачу или медицинской сестре обо всех перечисленных случаях.
Шаг 2: Подготовка места инъекции
A. Тщательно вымойте руки. Подготовьте и обработайте место инъекции.
Вы можете использовать:
- Верхнюю часть бедра.
- Живот, за исключением области вокруг пупка, примерно 5 см.
- Наружную поверхность плеча (только если инъекцию Вам делает кто-то другой).
Обработайте место инъекции смоченным в спирте тампоном. Дайте коже высохнуть.
— Не дотрагивайтесь до места инъекции перед инъекцией.
! Не используйте для инъекций области, где кожа тонкая, с гематомой, покрасневшая или жесткая. Избегайте инъекций в области со шрамами или растяжками.
B. Осторожно потяните серый колпачок с иглы без скручивания, по направлению от корпуса шприца.
C. Зажмите место инъекции для получения упругой поверхности.
Важно удерживать кожу зажатой при проведении инъекции.
Шаг 3: Введение
A. Зажмите кожу. ВВЕДИТЕ иглу в кожу.
— Не дотрагивайтесь до обработанной области инъекции.
B. Медленно и плавно НАДАВЛИВАЙТЕ на поршень до тех пор, пока Вы не почувствуете или услышите «щелчок». Надавливайте на поршень до щелчка.
! Важно надавливать на поршень до щелчка, для введения всей дозы.
C. ОТПУСТИТЕ большой палец. Затем ИЗВЛЕКИТЕ шприц из кожи.
После того, как вы отпустите поршень, защитное устройство предварительно заполненного шприца покроет иглу.
— Не надевайте серый колпачок иглы обратно на предварительно заполненный шприц.
Шаг 4: Окончание
A. Выбросите использованный предварительно заполненный шприц и другие сопутствующие материалы в контейнер для острых отходов.
Лекарственные препараты должны быть утилизированы в соответствии с надлежащими требованиями. Спросите у врача или провизора, как уничтожить препарат, если он больше не требуется. Эти меры помогут защитить окружающую среду.
Храните шприцы и сопутствующие материалы в недоступном для детей месте.
— Не используйте предварительно заполненный шприц повторно.
— Не сдавайте предварительно заполненный шприц на переработку и не выбрасывайте его с бытовым мусором.
B. Осмотрите место инъекции.
Если в месте инъекции выступит кровь, прижмите к нему ватный тампон или бинт. Не растирайте место инъекции. При необходимости, заклейте место инъекции пластырем.
Инструкция по введению препарата Пролиа® в предварительно заполненном шприце
В этом разделе приводится информация по правильному проведению инъекции предварительно заполненным шприцем. Очень важно, чтобы перед тем, как Вы приступите к самостоятельным инъекциям, Ваш лечащий врач, медицинская сестра подробно проинструктировали Вас по технике выполнения инъекции. Тщательно вымойте руки перед выполнением инъекции. Если у Вас возникнут вопросы по технике выполнения инъекции, то обратитесь к Вашему лечащему врачу или медицинской сестре.
Перед началом инъекции:
Внимательно прочитайте все инструкции перед использованием предварительно заполненного шприца.
НЕ используйте ПЗШ, если колпачок был удалён.
Как использовать предварительно заполненный шприц?
Ваш врач назначил вам препарат Пролиа® в предварительно заполненном шприце для подкожных инъекций. Вы должны ввести все содержимое предварительно заполненного шприца Пролиа® (1 мл) однократно и повторить инъекцию через 6 месяцев, как назначено лечащим врачом.
Оборудование:
Для самостоятельной инъекции Вам потребуется:
1. новый предварительно заполненный шприц с препарата Пролиа® ; и
2. спиртовые салфетки или подобные материалы.
Что Вы должны сделать до самостоятельного введения Пролиа® подкожно?
1. Достать шприц из холодильника. НЕ берите предварительно заполненный шприц за поршень или защитный колпачок, это может повредить устройство.
2. Предварительно заполненный шприц можно оставить вне холодильника для достижения комнатной температуры. Это позволит сделать инъекцию более комфортной.
НЕ подогревайте предварительно заполненный шприц каким-либо другим способом (например, в микроволновой печи или в горячей воде).
НЕ оставляйте шприц под прямыми солнечными лучами.
3. НЕ встряхивайте предварительно заполненный шприц.
4. НЕ снимайте колпачок с предварительно заполненного шприца до тех пор, пока Вы не готовы к инъекции.
5. Проверить срок годности предварительно заполненного шприца на упаковке.
НЕ используйте предварительно заполненный шприц, если истек последний день указанного на этикетке месяца срока годности.
6. Проверить внешний вид препарата Пролиа®. Раствор должен быть прозрачным, бесцветным или светло-жёлтым. Если раствор помутнел или окрашен иначе, препарат использовать нельзя.
7. Выбрать комфортное, хорошо освещённое место и чистую поверхность, где можно удобно расположить все необходимые материалы.
8. Тщательно вымыть руки.
Как правильно выбрать место для инъекции?
Лучше всего делать инъекции в верхнюю часть бедра и в живот. Если инъекции Вам делает кто-то другой, можно использовать наружную поверхность плеча.
Как правильно сделать инъекцию?
1. Продезинфицируйте место инъекции с помощью спиртовой салфетки.
2. Во избежание загиба иглы, аккуратно потяните колпачок с иглы сразу без скручивания, как показано на рисунках 1 и 2.
НЕ дотрагивайтесь до иглы и не нажимайте на поршень.
3. Если внутри предварительно заполненного шприца видны маленькие пузырьки воздуха, нет необходимости удалять их перед инъекцией. Введение раствора с пузырьками воздуха является безопасным.
4. Зажмите кожу (не сдавливая) между большим и указательным пальцами. Введите иглу в кожу полностью, как показывал Вам доктор или медицинская сестра.
5. Медленно и плавно надавливайте на поршень, одновременно придерживая кожную складку. Надавливать на поршень следует до тех пор, пока шприц не опустеет.
6. Извлеките иглу из кожи, и отпустите кожную складку.
7. Если выступит кровь в месте инъекционного прокола, аккуратно сотрите её ватным тампоном или салфеткой. Не растирайте место инъекции. При необходимости, заклейте место инъекции пластырем.
8. Используйте один ПЗШ только для одной инъекции. НЕ используйте оставшийся в шприце препарат.
Помните: При возникновении проблем, обратитесь за помощью или советом к лечащему врачу или медицинской сестре.
Уничтожение использованных шприцев
- НЕ надевайте обратно колпачок на использованный шприц.
- Храните использованный шприц в недоступном для детей месте.
- Использованный шприц должен быть утилизирован в соответствии с надлежащими требованиями. Спросите у врача или провизора, как уничтожить препарат, если он больше не требуется. Эти меры помогут защитить окружающую среду.
Влияние на способность управлять транспортными средствами, механизмами
Исследований влияния препарата Пролиа® на способность к управлению автомобилем и работе с механизмами не проводилось.
Форма выпуска
Раствор для подкожного введения, 60 мг/мл.
В одноразовом предварительно заполненном шприце (ПЗШ) 1 мл из стекла I гидролитического класса c иглой 27G из нержавеющей стали, эластомерным колпачком и эластомерным плунжером, ламинированным фторполимером (с защитным устройством для иглы или без него). Маркированный шприц помещают в пачку картонную, вместе с инструкцией по применению.
ПЗШ может быть дополнительно помещен в контурную ячейковую упаковку с термоэтикеткой.
Каждую контурную ячейковую упаковку помещают в пачку картонную вместе с инструкцией по применению и карточкой для пациента с описанием техники инъекции (для ПЗШ с защитным устройством для иглы).
Пачка картонная снабжена отрывной карточкой-напоминанием с двумя напоминающими наклейками.
На каждую пачку наклеивают прозрачные защитные этикетки — контроль первого вскрытия, имеющие продольную цветную полосу.
Пролиа® представляет собой стерильный продукт и не содержит консервантов.
Хранение
Хранить при температуре 2-8 °C. Не замораживать.
Хранить в оригинальной упаковке для защиты от света.
Не встряхивать.
Хранить в недоступном для детей месте!
После изъятия из холодильника Пролиа® может храниться при комнатной температуре не выше 25 °C в оригинальной упаковке не более 30 дней.
Срок годности
3 года.
Не применять по истечении срока годности.
Условия отпуска из аптек
Отпускают по рецепту.