Экстракт зеленого чая, экстракт растений семейства крестоцветных (индол-3-карбинол), лактозы моногидрат — наполнитель, капсула (желатин, вода), крахмал картофельный — наполнитель, целлюлоза микрокристаллическая — наполнитель, минеральный премикс (железа (II) лактат дигидрат, цинка сульфат моногидрат, меди сульфат моногидрат, марганец сульфат моногидрат, йодид калия, селенит натрия);
магния стеарат (антислеживающий агент). Не содержит ГМО
Через аптечную сеть и специализированные магазины, отделы торговой сети для реализации населению в качестве биологически активной добавки к пище — источника эпигаллокатехин-3-галлата, индол-3-карбинола и дополнительного источника железа, меди, йода, цинка, марганца, селена. Места реализации определяются национальным законодательством государств-членов ЕАЭС.
Взрослым по 1 капсуле 2 раза в день во время еды. Продолжительность приема — 1 месяц. При необходимости прием можно повторить.
В суточной дозировке (2 капсулы) содержится % от адекватного уровня потребления: 400** % (200 мг)* индол-3-карбинола, эпигаллокатехин-3-галлата 190** % (190 мг)* и в % от рекомендуемой суточной потребности: железо 67% (9,4 мг), цинк 36% (5,4 мг), медь 60% (0,6 мг), марганец 30% (0,6 мг), йод 54% (0,08 мг), селен 57% (0,04 мг).
*адекватный уровень потребления
**не превышает верхний допустимый уровень потребления
Перед применением рекомендуется проконсультироваться с врачом-эндокринологом.
Промисан® рекомендуется для коррекции метаболических нарушений у пациентов с онкологическими заболеваниями и для профилактики развития рака молочной железы, яичников и эндометрия.
Информация об эффективности БАД, вынесенная в рекомендацию по применению и на этикетку, подтверждена клиническими испытаниями на основании Отчета по исследованию клинической эффективности ГБУЗ «Челябинский областной клинический онкологический диспансер» от 12 марта 2012 г
По данным доклинического и клинического изучения, Промисан® хорошо переносится, не оказывая в терапевтических дозах побочных эффектов.
Индивидуальная непереносимость компонентов, беременность, кормление грудью.
Не является лекарственным средством.
Капсулы, массой содержимого 550 мг.
Капсулы в блистерах 10, 20, 30, 40, 50, 60, 80, 100, 120 капсул в упаковке (10, 20 капсул в блистере).
Капсулы в полимерных банках с крышкой 60, 80, 90, 100, 120 в банке. Допускается упаковка банки в пачку потребительскую.
Хранить в защищенном от попадания прямых солнечных лучей, недоступном для детей месте, при температуре не выше 25°С.
2 года.
Производитель
АО «МираксБиоФарма», 121059, РФ, г. Москва, ул. Брянская, д. 5.
Адрес производства: РФ, 141401, МО, городской округ Химки, г. Химки, ул. Рабочая, д. 2А, стр. 1.
Организация, уполномоченная на принятие претензий от потребителя
ООО «Ацино Рус», РФ, 129110, г. Москва, проспект Олимпийский, дом 16, строение 5, этаж 5, помещение I, тел. +7 (495) 502-92-47.
E-mail: quality_rus@acino.swiss, Medinfo_rus@acino.swiss
Промисан — уникальное негормональное средство для профилактики рака
Промисан — единственное негормональное средство для профилактики рака органов женской репродуктивной системы, которое обладает множественной противоопухолевой активностью, не влияя при этом на здоровые органы и ткани. Промисан создан учеными НИИ молекулярной медицины Московской медицинской академии им. И. М. Сеченова.
Промисан — это таргетный (избирательный) продукт растительного происхождения. Он обладает хорошей переносимостью и высоким уровнем безопасности даже при длительном применении. У Промисана отсутствуют токсические эффекты, к которым обычно приводят химиотерапевтические препараты от рака.
Состав Промисана и принцип его работы
Препарат выпускается в виде капсул по 550 мг. В его состав входят два основных действующих вещества: индол-3-карбинол (I3C) и эпигаллокатехин-3-галлат (EGCG). Давайте разберем подробнее, как они работают в организме человека:
- Индол-3-карбинол. Его природным источником являются некоторые овощные культуры семейства крестоцветных, например, белокочанная и брюссельская капуста, брокколи. Исследование индол-3-карбинола началось еще в 1970-х годах. За прошедшие десятилетия были открыты уникальные свойства этого нутриента, за которые ученые считают его одним из наиболее полезных продуктов для долголетия. Научно доказано воздействие индол-3-карбинола на ключевые механизмы развития опухолей молочной железы, эндометрия, яичников.
- Эпигаллокатехин-3-галлат — это вытяжка из листьев зеленого чая, известного своим положительным влиянием на организм человека. Эпигаллокатехин-3-галлат —природный антиоксидант. Он повышает сопротивляемость и защитные свойства организма, оказывает противовоспалительное действие, но, самое главное, может подавлять образование и рост новых опухолевых клеток.
Также в капсулах содержится минеральный комплекс, улучшающий работу основных компонентов. Активные вещества, входящие в состав препарата, влияют на метаболизм эстрогенов. Они бывают «хорошими» (2-гидроксиэстрон) и «плохими» (16-альфа-гидроксиэстрон).
2-гидроксиэстронов, которые нормализуют клеточный рост, при приеме Промисана становится больше, а «агрессивных» метаболитов 16-альфа-гидроксиэстронов с онкогенным потенциалом, которые могут стать причиной рака молочной железы у женщин, становится меньше. Метаболизм выравнивается, и организм не позволяет навредить сам себе, удерживая опухолевые процессы от возможного рецидива.
Промисан — эффективное средство от рака. Он усиливает действие химиопрепаратов, так как блокирует ряд факторов роста и формирования гормональных метаболитов, которые участвуют в процессе роста опухоли. Промисан можно принимать длительными курсами без негативных последствий, в то время как гормональные препараты при раке вызывают достаточно серьезные побочные эффекты.
Инструкция по применению препарата
Капсулы Промисан назначаются для профилактики рака, предотвращения рецидивов онкологических заболеваний или в составе комплексного лечения. Средство можно принимать совместно с химиотерапией.
В исследованиях пациенток с раком женских репродуктивных органов Промисан доказал свою эффективность в терапевтической дозировке по 2 капсулы 2 раза в день при длительности курса — 6 месяцев.
Точную схему приема назначает специалист-онколог, ориентируясь на состояние организма пациентки и другие условия. Так, например, препараты при раке молочной железы часто комбинируют. Их совместное влияние на заболевание должно быть максимально результативным. Для этого врач подбирает оптимальное сочетание разных средств.
Противопоказания к применению Промисана: индивидуальная непереносимость отдельных компонентов, беременность и кормление грудью, прием лекарств для снижения кислотности желудочного сока.
Опыт применения Промисана
Нельзя сказать, что препараты для профилактики рака сегодня широко представлены на фармацевтическом рынке. Однако к их числу относится Промисан — средство с доказанной эффективностью.
Промисан уже 8 лет активно применяется для профилактики и лечения онкологии. За это время он получил много положительных отзывов от пациентов с распространенными формами рака яичников и молочной железы. В международном издании была опубликована работа заслуженного врача России, академика РАН, доктора медицинских наук, профессора, руководителя института онкогинекологии и маммологии Ашрафяна Льва Андреевича. В ней описано исследование и показаны результаты комплексного лечения с включением Промисана в схему терапии. В этом исследовании женщины, принимавшие таблетки Промисан совместно с проведенной химиотерапией, получили обнадеживающие результаты. Препарат протестирован, прошел многочисленные исследования и призван ускорить выздоровление.
Список научных работ:
- A new promising way of maintenance therapy in advanced ovarian cancer: a comparative clinical study (Kiselev V. I., Ashrafyan L. A., Muyzhnek E. L., Gerfanova E. V., Antonova I. B., Aleshikova O. I., Sarkar F. H.).
- Placebo-controlled trial of indole-3-carbinol in the treatment of CIN (Bell MC, Crowley-Nowick P, Bradlow HL, Sepkovic DW, Schmidt-Grimminger D, Howell P, Mayeaux EJ, Tucker A, Turbat-Herrera EA, Mathis JM).
- Dietary polyphenols may affect DNA methylation (Fang M, Chen D, Yang CS).
- Epigallocatechin Gallate (EGCG) is the most effective cancer chemopreventive polyphenol in green tea (Du GJ, Zhang Z, Wen XD, Yu C, Calway T, Yuan CS, Wang CZ).
- Мультитаргетный подход к терапии рака яичников (Г. Т. Сухих, Л. А. Ашрафян, В. И. Киселев, Е. В. Герфанова, О. И. Алешикова, И. Б. Антонова).
- Современные принципы эффективной терапии рака яичников (Л. А. Ашрафян, В. И. Киселёв, Е. Л. Муйжнек, Е. В. Герфанова, И. Б. Антонова, И. Н. Кузнецов, О. И. Алешикова).
- Результаты комплексного лечения больных с распространенными формами рака яичников с включением в схему терапии препарата Промисан (А. В. Жаров, Г. Р. Кравченко, Л. Ф. Чернова, Т. Н. Губайдуллина).
По материалу сайта проекта «Новая жизнь».

Аналоги Промисан


Товары из категории — БАДы
Инструкция по применению
Цена в интернет-аптеке WER.RU: от 4 153
Фармакологические свойства
Промисан изготавливается производителями в виде биологически активной добавки. На рынке фармацевтики он считается относительно новым медикаментом. Однако, уже успел зарекомендоваться с хорошей стороны. Средство выписывают в комплексе с другими медикаментами для борьбы с раковыми опухолями. Также оно незаменимо в качестве профилактического вещества.
Как показывает практика, продукт воздействует на репродуктивную биосистему женщины. Особенностью материала считается его способность возобновить сенситивность развивающихся раковых клеточных организаций к процедурам химиотерапии. По результатам статистики, в России число онкобольных с каждым годом возрастает. Регистрация пациентов с подобными патологиями происходит часто. Особенно людей, у которых опухоль уже прогрессирует. Такие заболевания трудно поддаются лечению.
В стране еще не налажена система полноценной диагностики патологии на ранних стадиях ее развития. Многое будет зависеть непосредственно от человека. При появлении недомоганий или при негативных реакциях организма рекомендуется обратиться в больницу. Там он пройдет положенное обследование и сможет ознакомиться с окончательным диагнозом. В противном случае опухоль начнет быстро разрастаться. От подобных нарушений в организме страдают пациенты, независимо от пола и возраста. Промисан создан, чтобы ускорить процесс выздоровления. Но его надо употреблять вовремя.
Представительницы слабого пола чаще страдают от онкологии, развивающейся в половых органах, грудных железах. Сегодняшняя медицина не способна противостоять злокачественным новообразованиям на поздних стадиях ее развития. Однако, есть некоторые результаты лечения на первых этапах. Поэтому, чем раньше человек обратиться за помощью к медспециалисту, тем больше у него шансов на выздоровление.
БАД создан группой российских ученых недавно. Главная его задача – возобновлять чувствительность раковых формирований к химической терапии, препятствовать развитию опасных клеточных организаций, предупреждать процесс метастазирования.
Промисан не принадлежит к лекарственным средствам. Его принимают как добавку к еде. Средство содержит натуральные компоненты, поэтому при правильной дозировке не способно наносить организму человека вреда. Препарат активизируется при наличии в системе канцерогенных структур, возобновляет шансы поврежденных тканей чувствовать влияние химических процедур. Согласно результатам исследований, вещество препятствует процессу полиферации тканей на микроуровне. Важную роль играет не токсичность материала. Его разрешается принимать на протяжении длительного периода. При этом БАД не накапливается в биосистемах.
Качества составных продукта характеризуются наличием в его структуре MDR-модуляторов. Они имеют высокую биологическую активность. Изделие не способно наносить вред здоровых клеткам организма, что выделяет средство на фоне других медикаментов. Главные действующие элементы добавки угнетают гиперэкспрессию белкового вещества Pgp, замедляют некоторые негативные процессы, возникающие в раковых образованиях. Важную роль играет то, что препарат Промисан повышает концентрацию химиотерапевтических фармизделий в злокачественных формированиях. Лучше всего он «сотрудничает» с Таксаном, антрациклиновыми антибиотиками, Антрацендионом и другими материалами. Выписывать БАД может только врач после полного медицинского обследования. Заниматься самолечением опасно для здоровья.
Состав и форма выпуска
Средство продается в форме капсул. Дозировка – 550 мг. Главными ингредиентами продукта считаются — настойка зеленого чая, растительных организмов из семейства крестоцветных, вещество минерального премикса. В состав изделия входят и вспомогательные материалы – аэросил, соединение лактозы, микроэлементы – железо, селен, цинк и другие.
Показания к применению
Препарат выписывают женщинам как дополнительный источник полезных компонентов для организма во время терапии раковых опухолей. Пораженные биосистемы получают флавоноиды, индольные продукты. БАД рекомендуют как профилактическое вещество, если у больной обнаружено предраковое состояние. Показано при развитии гиперпластических патологий, развивающихся в репродуктивной биосистеме. Капсулы вправе выписывать только опытный специалист. Немаловажное значение имеет качественное медицинское обследование и диагностирование заболевания. При неправильном дозировании деструкция может усугубиться, или же вызывать дополнительные негативные реакции.
Промисан назначается пациенткам, которые проходят процедуру химиотерапии. При этом их гормональный статус не имеет значения. Возможно использование вещества после оперативных вмешательств, аборта для предупреждения осложнений и развития различных патологий.
Международная классификация болезней (МКБ-10)
N64.4 Мастодиния.
Побочные эффекты
В составе средства Промисан содержатся исключительно натуральные ингредиенты. Это практически снимает проблему интоксикации, что очень важно для пациентов с дисфункциями печеночной и почечной структур. Даже для здоровых людей, которыми считаются добровольцы в проводимых исследованиях, введение некоторой дозы не проходит бесследно.
В случае с этим биоматериалом не исключаются минимальные коллатеральные осложнения, связанные с функционированием пищеварительной биосистемы. Отмечено появление признаков тошноты — если медикамент был принят на пустой желудок. Зафиксированы редкие прецеденты неадекватного ответа иммунной системы в форме аллергенной реакции. Появившиеся симптомы гиперемии кожи, зуда и дерматита самостоятельно исчезали после отмены биодобавки.
Противопоказания
Важным преимуществом медикамента является отсутствие в его составе гормональных материалов. Этот на много повышает профиль безопасности и эффективности. Не допускается использование биопродукта на этапе беременности и кормления новорожденного ребенка грудным молоком. Ограничения также касаются тех пациенток, которые проходят курс лечения с употреблением антацидов, адрено-антагонистов, замедлителей протонной помпы, и лекарственных материалов, понижающих уровень секреции хлористоводородной кислоты в желудке.
Применение при беременности
Специальные исследование касательно влияния Промисана на плод в период беременности не проводились. Неизвестна степень проникновения действующих компонентов через плацентарный барьер. Поэтому использовать вещество во время вынашивания ребенка не следует. Данное предостережение относится и к кормлению материнским молоком.
Способ и особенности применения
Введение капсул с целью профилактики и предупреждения развития раковых клеток инструкция разрешает выполнять по одной капсуле на протяжении суток. Длительность терапевтического курса не должна превышать тридцати дней. Эффективность биопродукта увеличивается, если его начать принимать примерно дней за 10-14 до первой химиотерапии. Это увеличивает восприимчивость раковых клеток к воздействию сильных лекарственных химизделий.
Промисан показан при разных патологиях онкологического характера, возникающих у женщин детородного возраста. Но без предварительной консультации с врачом это средство, несмотря на его натуральный состав, лучше не принимать. Доктор на основании данных анализов и диагностического обследования определит индивидуальный курс терапии. Стандартный профилактический режим употребления включает одноразовую суточную дозу в виде одной капсулы в момент принятия еды. Общая продолжительность лечения не должна превышать 30 суток.
Комбинированная терапия рака с использованием химических медикаментов предусматривает введение 2 капсул 2 раза в день также одновременно с принятием пищи. Курс должен длиться 3-6 месяцев с опережением химиотерапии на 14 дней. Назначение Промисана возможно параллельно с такими химиопрепаратами, как Этопозид, Паклитаксел, Митоксантрон и другие. Использовать биопродукт для монотерапии онкологических патологий у женщин нецелесообразно, так как он не является лекарственным изделием.
Взаимодействие с другими лекарствами
Не допустимы комбинации биодобавки и медикаментов, понижающих уровень секреции соляной кислоты, а также с адренорецепторами, оксидом алюминия и магния, замедлителей протонного насоса.
Передозировка
Прецеденты применения вещества в овердозах не зарегистрированы.
Аналоги
Структурированных аналогов фармпродукта не производится.
Условия продажи
Инструкция по применению позволяет продавать средство без выписки доктора.
Условия хранения
Биоматериал должен храниться при температуре не выше 25° С.
Цены на Промисан в Москве
Заберите заказ в в аптеке
WER (г. Москва)
Цена: от 4 153 руб.
Сертификаты и лицензии
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Жаров А.В.
1, 2
Таратонов А.В.
1, 2
Губайдуллина Т.Н.
1, 2
1 ГБУЗ «Челябинский областной клинический онкологический диспансер»
2 ГБОУ ВПО «ЮУГМУ» Минздрава России
Проведена оценка эффективности комплексного лечения больных распространёнными формами рака яичников с включением в схему терапии препарата Промисан. В исследовании приняли участие 64 пациентки с распространёнными формами рака яичников (III-IV стадии), получающие стандартную схему лечения (НАПХТ + операция + АПХТ) на всём протяжении исследования. Больные из опытной группы (34 пациентки), помимо стандартного лечения, принимали препарат Промисан по 2 капсулы 2 раза в день. По результатам исследования зарегистрировано улучшение непосредственных результатов лечения в группе приема препарата Промисан по сравнению с контрольной группой: более быстрая регрессия опухолевого процесса (73,4% vs 50,9%) и увеличение числа лиц с наименее агрессивными формами течения заболевания (50% vs 29,4%). Период без прогрессирования опухоли у пациенток с рецидивирующим раком яичников был длиннее в опытной группе по сравнению с контрольной (19 и 15,6 месяцев, соответственно). Также отмечалось улучшение результатов трехлетней выживаемости в группе пациенток, получавших Промисан (63,3% vs 47,05%).
промисан
таргетная терапия
рак яичников
1. Ашрафян Л.А., Киселев В.И., Муйжнек Е.Л. Патогенетическая профилактика рака репродуктивных органов. — М. : Молодая гвардия, 2009. — 171 с.
2. Каприн А.Д., Старинский В.В., Петровой Г.В. Злокачественные новообразования в России в 2012 году (заболеваемость и смертность). — М. : ФГБУ «МНИОИ им. П.А. Герцена» Минздрава России, 2014. — 250 с.
3. Киселев В.И., Муйжнек Е.Л. Общие принципы профилактики метастатической болезни и сенсибилизации опухолей. – М. : Димитрейд График Групп, 2007. — 128 с.
4. Киселев В.И., Ляшенко А.А. Индинол – регулятор пролиферативных процессов в органах репродуктивной системы : монография. — М., 2005. — 56 с.
5. Киселев В.И., Ляшенко А.А. Молекулярные механизмы регуляции гиперпластических процессов : монография. — М. : Димитрейд График Групп, 2007. — 280 с.
6. Thigpen J.T., Blessing J.A., Ball H. et al. Phase II trial of paclitaxel in patients with progressive ovarian carcinoma after platinum-based chemotherapy: a Gynecologic Oncology Group study // J. Clin. Oncol. — 1994. — Vol. 12. — P. 1748-1753.
Рак яичников (РЯ) относится к группе социально значимых локализаций злокачественных новообразований и занимает седьмое место в структуре распределения злокачественных опухолей у женщин в Российской Федерации. В 2012 году в России впервые выявлено 12935 человек и умерло 7789 от данного заболевания [2].
До 80% пациенток выявляется в III и IV стадиях заболевания, когда имеются множественные имплантационные метастазы по париетальной и висцеральной брюшине с накоплением асцитической жидкости, канцероматоз плевры с наличием плеврита, поражение забрюшинных, паховых и медиастинальных лимфатических узлов, метастазы в паренхиматозных органах. Это ведёт к тому, что каждая четвёртая пациентка с РЯ умирает, не прожив и года после установления диагноза. Практически все больные с распространёнными формами заболевания после специального лечения и достижения ремиссии в конце концов выходят на рецидив заболевания и погибают. В данной ситуации для практикующего врача важен период времени, свободный от прогрессирования опухолевого процесса, и каждый продлённый месяц жизни пациентки.
После серьёзного прорыва в лечении больных РЯ, связанного с появлением в начале 80-х годов препаратов платины, а затем таксанов, существенных изменений до настоящего времени не произошло.
В последние годы предпринимаются попытки индивидуализации лечения больных РЯ на основании изучения молекулярно-биологических и генетических характеристик опухоли. Большое внимание в настоящее время уделяется разработке новых химио- и биотерапевтических препаратов направленного действия, позволяющих селективно воздействовать только на белки, участвующие в канцерогенезе и определяющие способность опухоли к прогрессии и метастазированию.
Одним из таких биотерапевтических препаратов является Промисан, содержащий два активных соединения — это пищевой индол-3-карбинол (I3C) и флавоноид эпигаллокатехин-3-галлат (EGCG). Он способен блокировать молекулярные механизмы, приводящие к патологической пролиферации, опухолевому неоангиогенезу, снижает инвазивный и метастатической потенциал трансформированных клеток и активирует их апоптоз. Кроме того, препарат способен усиливать действие химиотерапевтических препаратов и восстанавливать чувствительность резистентных опухолей к лекарственным средствам [1].
Препарат Промисан – это таргетный продукт, обладающий хорошей переносимостью и высоким уровнем безопасности при длительном применении. Токсические эффекты, характерные для химиотерапевтических препаратов, у него отсутствуют [3-5].
В настоящем исследовании проведена оценка эффективности комплексного лечения двух групп больных распространёнными формами рака яичников: с включением в схему терапии препарата Промисан и без него.
Цель исследования
Улучшение клинических показателей течения заболевания у больных распростра-нённым раком яичников путём включения в схему комплексного лечения препарата Промисан.
Материалы и методы
Исследование проведено на базе гинекологического отделения Челябинского областного клинического онкологического диспансера за период с 2008 по 2011 год. Выполнялось рандомизированное исследование, в котором пациентки распределялись по группам лечения случайным образом (методом конвертов) и имели одинаковую возможность получить препарат Промисан.
В исследовании участвовали 64 пациентки с распространёнными формами РЯ (III-IV стадии). Основную группу составили 30 больных, которым проведено комплексное лечение по следующему плану. На первом этапе проводилось от 2 до 6 циклов неоадъювантной полихимиотерапии (НАПХТ) с интервалом в 3 недели по схеме СР (цисплатин 100 мг/м2 + циклофосфан 750 мг/м2). На втором — выполнялось хирургическое вмешательство. На третьем этапе проводилась адъювантная полихимиотерапия (АПХТ) от 2 до 6 циклов по той же схеме. На всём протяжении лечения больные принимали препарат Промисан по 2 капсулы 2 раза в день. Контрольную группу составили 34 пациентки, которым проведено комплексное лечение по тому же плану, но без препарата Промисан. Окончательный эффект оценивался после 8 циклов ПХТ и хирургического лечения.
Для уточнения распространенности опухолевого процесса и оценки общего состояния больных до проведения планируемого лечения были выполнены: общие и биохимические анализы крови и мочи, ЭКГ, рентгенологические и ультразвуковые методы исследования, компьютерная томография, морфологическая верификация диагноза (пункция опухоли под УЗИ-контролем, цитологическое исследование пунктата заднего свода, плевральной и асцитической жидкости), исследование опухолевого маркёра СА-125. Во время проведения исследования для мониторинга общего состояния пациенток и динамики опухолевого процесса были использованы все вышеописанные методы диагностики.
Оценка непосредственных результатов лечения основывалась на изучении общего самочувствия больных в каждой группе, переносимости проводимого лечения, уменьшения размеров первичного очага и метастазов, исчезновения плеврита и асцита, снижении показателей опухолевого маркёра СА-125. После проведения хирургического этапа уточнялась распространённость опухолевого процесса и эффективность НАПХТ. При этом оценивался объём остаточной опухоли и лекарственный патоморфоз новообразования.
Отдалённые результаты лечения по группам установлены на основании длительности периода, свободного от прогрессирования опухолевого процесса, и трехлетней выживаемости.
Возраст больных варьировал от 49 до 61 года. Средний возраст пациенток в основной группе составлял 51,4±2,6 года, в группе контроля — 50,8±1,9 года. Сравниваемые группы больных по возрастному критерию репрезентативны.
В исследование были включены пациентки, которым по распространённости опухолевого процесса, по нашему мнению, начинать лечение было целесообразно с НАПХТ, а не с операции. Это больные с большими, ограниченно смещаемыми или несмещаемыми опухолевыми конгломератами, наличием асцита и/или плеврита. Распределение по стадиям согласно классификации TNM в основной группе было следующим: Т3NХМ0 — 28 (93,3%), Т3NХМ1 — 2 (6,7%). В контрольной: Т3NХМ0 — 30 (88,3%), Т3NХМ1 — 4 (11,7%) человек. Различия статистически незначимые (р>0,05). В обеих группах преобладали пациентки с III стадией заболевания. Значение М1 обусловлено положительными цитологическими находками, полученными при пункции плевральной полости при экссудативном плеврите либо обнаруженными при УЗИ, КТ/МРТ паренхиматозных метастазов в печени. Общее состояние больных в группах, несмотря на распространённый опухолевый процесс, было оценено по шкале ECOG-BОЗ в 1-2 балла.
По гистологической структуре опухоли распределение больных в основной группе было следующим: серозная цистаденокарцинома — 24 (80,0%), муцинозная цистаденокарцинома — 4 (13,3%), железисто-солидный рак — 2 (6,6%) случая. В контрольной группе: серозная цистаденокарцинома — 28 (82,3%), муцинозная цистаденокарцинома — 4 (11,7%), железисто-солидный рак — 2 (5,8%) наблюдения. В обеих группах преобладали больные с серозной цистаденокарциномой. В целом по группам различия оказались статистически незначимые (р>0,05).
Анализ по степеням дифференцировки опухоли показал следующее. В основной группе преобладали больные с умеренно дифференцированными вариантами опухоли 14 (46,6%), низкую степень дифференцировки имели 12 (40,0%) человек и высоко дифференцированный вариант оказался у 4 (13,4%) пациенток. В контрольной группе больных с низкой и умеренной степенью дифференцировки оказалось одинаковое количество — по 14 (41,2%) человек. У 6 (17,6%) пациенток опухоль имела высокую дифференцировку. Распределение больных по степеням дифференцировки опухоли показало статистически незначимые различия.
Таким образом, по основным параметрам, характеризовавшим больных и опухолевый процесс, сравниваемые группы были сопоставимы.
Результаты и обсуждение
В результате проведенного лечения, после 8 циклов ПХТ и хирургического вмешательства, у 22 (73,3%) больных основной и у 18 (52,9%) контрольной группы данных о наличии опухоли не было. Это свидетельствует об отчетливой тенденции к лучшему регрессу опухоли у пациенток с включением в схему лечения препарата Промисан. К завершению 3 года без признаков опухолевого процесса в каждой группе оставалось по 2 человека.
Оценка ответа опухоли на лечение выполнялась в соответствии с международными критериями: «Response Evaluation Criteriain Solid Tumors» (RECIST). Критерии RECIST включают в себя следующие понятия.
1. Измеримые очаги – опухолевый очаг размером более 10 мм, выявляемый при КТ или МРТ с шагом 5 мм или менее. Опухолевый очаг размером более 20 мм, измеренный с помощью КТ или МРТ с шагом 10 мм или менее. Опухолевый очаг более 20 мм, выявляемый при рентгенографии легких.
2. Неизмеримые очаги – очаги, не входящие в п. 1, а также следующие очаги: метастазы в кости, лептоменингеальное поражение, асцит, плеврит, перикардит, лимфангоит, поражение полых органов.
Оценка эффекта по RECIST для измеримых очагов.
1. Полный ответ – исчезновение всех измеримых очагов.
2. Частичный ответ – уменьшение суммарных максимальных размеров всех измеримых очагов на 30% и более.
3. Прогрессирование – увеличение суммарных минимальных размеров всех измеримых очагов на 20% и более или появление новых очагов.
4. Стабилизация – увеличение очагов менее, чем при прогрессировании, или уменьшение менее, чем при частичном ответе.
Критерии ответа на лечение для неизмеримых очагов.
1. Полный ответ – исчезновение всех неизмеримых очагов с нормализацией опухолевых маркеров.
2. Частичный ответ/стабилизация – сохранение хотя бы одного неизмеримого очага и/или повышение опухолевых маркеров.
3. Прогрессирование – явное прогрессирование неизмеримых очагов или появление новых очагов.
Общий ответ на лечение оценивался исходя из комбинации оценок измеримых и неизмеримых очагов, результаты представлены на рисунке 1.
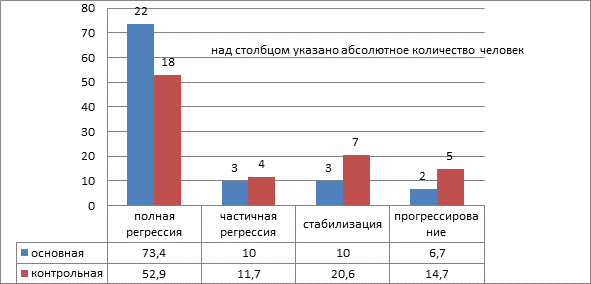
Рис. 1. Общий ответ на лечение больных с распространёнными формами рака яичников
Из представленных данных видно, что в основной группе пациенток есть тенденция к улучшению результатов лечения. У этих больных полная регрессия опухоли наблюдалась на 20,5% наблюдений чаще, чем в контрольной группе. Частичная регрессия и стабилизация опухолевого процесса, наоборот, в контрольной группе была выше на 12,3% случаев. Это объясняется тем, что, во-первых, в основной группе было больше пациенток с полной регрессией опухоли. Во-вторых, в основной группе частота прогрессирования опухолевого процесса на фоне специального лечения была на 8% ниже, чем в контрольной.
Таким образом, у больных, получавших в процессе специального лечения препарат Промисан, чаще наблюдали полную регрессию опухоли и реже прогрессирование опухолевого процесса.
У пациенток с распространёнными формами РЯ в большинстве случаев не удаётся удалить весь объём опухоли и процесс приобретает персистирующее течение. У таких больных трудно достигнуть полного излечения, но можно видеть ремиссию той или иной длительности. В такой ситуации говорить о рецидиве заболевания довольно сложно, т.к. термин «рецидив заболевания» переводится с латинского языка как возврат болезни, но, по сути, несмотря на светлый промежуток, опухоль в организме сохранялась (персистировала). Возобновление прогрессирования опухолевого процесса в каждом случае, как правило, оценивается по данным УЗИ, КТ, МРТ в сочетании с мониторингом уровня опухолевого маркёра СА-125.
Thigpen J.T. et al. (1994) предложили характеристику больных по четырём вариантам течения РЯ (рецидивирующий, резистентный, персистирующий, рефрактерный) [6].
Рецидивирующий РЯ — эта группа включает пациенток, которые достигли полной регрессии опухоли при проведении химиотерапии первой линии с включением производных платины, у которых прогрессирование наступило не ранее чем через 6 месяцев после прекращения лечения.
Резистентный РЯ — полная регрессия опухоли при проведении химиотерапии первой линии, но прогрессирование наступило ранее чем через 6 месяцев после прекращения лечения.
Персистирующий РЯ — у больных достигнута частичная регрессия при проведении химиотерапии первой линии с включением препаратов платины, но сохраняются проявления болезни.
Рефрактерный РЯ — в группу входят больные, у которых не отмечено эффекта от проведения первой линии химиотерапии с включением препаратов платины, а также пациентки, у которых отмечено прогрессирование заболевания на фоне химиотерапии первой линии.
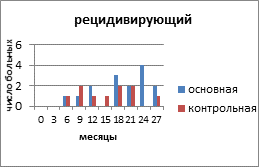
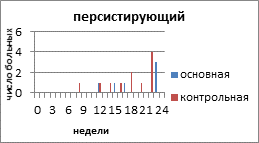
На рисунке 2 представлено распределение больных распространёнными формами РЯ по вариантам течения заболевания с учетом времени, свободного от прогрессирования и числа пациенток.
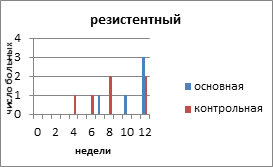
Рис. 2. Распределение больных распространёнными формами рака яичников по вариантам течения заболевания
Клиническими проявлениями прогрессирования заболевания были: местные рецидивы в малом тазу и брюшной полости, метастазы в забрюшинные лимфатические узлы, отдалённые метастазы в печень, легкие. В основной группе у 15 (50%) пациенток зарегистрирован рецидивирующий РЯ, в контрольной — у 10 (29,4%) человек. Рецидив выявлен на основании роста опухолевого маркёра СА-125, а затем был доказан клинически и инструментально. Время, свободное от прогрессирования опухолевого процесса, в контрольной группе с рецидивирующим РЯ составило 19 месяцев, а в контрольной — 15,6 месяца. Статистический анализ показал, что у пациенток с рецидивирующим РЯ, получавших препарат Промисан, видна отчетливая тенденция к увеличению продолжительности безрецидивного периода (Р=0,058).
С резистентным РЯ в основной группе было 5 (16,6%) больных, в контрольной — 6 (17,4%) пациенток. Минимальное время до индикации опухоли в основной группе было 12 недель, максимальное — 23 недели. В контрольной группе соответственно 8 и 22 недели. Время, свободное от прогрессирования, в контрольной группе с резистентным РЯ составило 10,6 недели, а в контрольной — 8,3 недели.
Персистирующий РЯ в основной группе наблюдали у 6 (20%) пациенток, в контрольной — у 11 (32,3%) больных. Время от завершения запланированного лечения с достигнутой стабилизацией опухолевого процесса до начала прогрессирования составило 12 недель в основной и 8 недель в контрольной группе. К концу 3 года умерли все больные с персистирующим РЯ, как в основной, так и в контрольной группе.
Рефрактерный РЯ отмечен у 2 (6,6%) больных основной и 5 (14,7%) пациенток контрольной группы. Все пациентки умерли в течение года от момента установления диагноза и начала специального лечения.
В целом на менее агрессивное течение РЯ (рецидивирующий) в основной группе приходилось 15 (50%) больных, в контрольной – 10 (29,4%) пациенток. На более агрессивное течение (резистентный, персистирующий, рефрактерный) соответственно — 13 (43,3%) и 22 (64,7%) больных. Более благоприятные результаты общего ответа опухоли на лечение больных РЯ и уменьшение агрессивных вариантов течения заболевания в группе с применением препарата Промисан положительно отразилось и на показателях выживаемости и смертности.
Трехлетняя выживаемость пациенток в основной группе составила 63,3±3,7% наблюдений, в контрольной — 47,05±4,2% случаев, при серьёзной тенденции к улучшению показателя в основной группе (р=0,089). Смертность больных в основной группе на первом году жизни составила 3 (10,0%) человека, в контрольной — 5 (14,7%). На втором умерло 8 (26,6%), в основной и 12 (35,3%) пациенток в контрольной группе. На третьем году жизни — 11 (36,6%) в основной и 18 (52,9%) больных в контрольной группе. Различия статистически незначимые (р>0,05), но имеется чёткая тенденция к меньшему числу смертей к третьему году наблюдений в основной группе.
Заключение
Включение в комплексную терапию больных распространёнными формами РЯ препарата Промисан позволило усилить ответ опухоли на проводимое специальное лечение, добиться более благоприятного течения заболевания и тем самым улучшить отдалённые результаты лечения. Резюмируя всё вышесказанное можно констатировать следующее.
1. У больных основной группы отмечены лучшие непосредственные результаты лечения, т.к. полная регрессия опухоли была на 20,5% больше, чем в контрольной группе, а прогрессирование опухолевого процесса на фоне специального лечения на 8% меньше.
2. В основной группе чаще наблюдали менее агрессивное течение РЯ. Так, рецидивирующий РЯ зарегистрирован у 15 (50%) пациенток, в то время как в контрольной — у 10 (29,4%) человек. Кроме того, период, свободный от прогрессирования опухолевого процесса, с рецидивирующим РЯ был длиннее и соответственно составил 19 и 15,6 месяца.
3. Одновременно отмечено и улучшение отдалённых результатов лечения. У пациенток, принимавших препарат Промисан, трёхлетняя выживаемость была 63,3% наблюдений, а у больных, его не принимавших, — 47,05% случаев.
Рецензенты:
Привалов А.В., д.м.н., профессор, заместитель главного врача по инновационным технологиям Челябинского онкологического клинического диспансера, г. Челябинск;
Яйцев С.В., д.м.н., профессор, заведующий кафедрой онкологии ГБОУ ВПО «ЮУГМУ» Минздрава России, г. Челябинск.
Библиографическая ссылка
Жаров А.В., Таратонов А.В., Губайдуллина Т.Н., Жаров А.В., Таратонов А.В., Губайдуллина Т.Н. ОСОБЕННОСТИ ТЕЧЕНИЯ ОПУХОЛЕВОГО ПРОЦЕССА У БОЛЬНЫХ РАСПРОСТРАНЕННЫМИ ФОРМАМИ РАКА ЯИЧНИКОВ В ПРОЦЕССЕ КОМПЛЕКСНОЙ ТЕРАПИИ С ВКЛЮЧЕНИЕМ В СХЕМУ ЛЕЧЕНИЯ ПРЕПАРАТА ПРОМИСАН // Современные проблемы науки и образования. – 2015. – № 1-1.
;
URL: https://science-education.ru/ru/article/view?id=19296 (дата обращения: 21.05.2023).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Состав и форма выпуска Промисан капсулы 120 шт. мираксбиофарма
Капсулы — 1 капс.:
- экстракт зеленого чая (140,0 мг); экстракт растений семейства крестоцветных (индол-3-карбинол) (100,0 мг); лактозы моногидрат — наполнитель (120,0 мг); капсула (желатин, вода) (96 мг); крахмал картофельный — наполнитель (70 мг); микрокристаллическая целлюлоза — наполнитель (67 мг); минеральный премикс (50,0 мг) (цинка сульфат моногидрат; меди сульфат моногидрат; йодид калия; железа (II) лактат дигидрат; марганец сульфат моногидрат; селенит натрия); магния стеарат (антислеживающий агент) (3,0 мг).
Характеристика
Препарат восстанавливает чувствительность опухолей к химиотерапевтическим средствам, блокирует деление клеток опухоли, процесс метастазирования и роста сосудов к злокачественным новообразованиям. Соединения, входящие в состав добавки — эпигаллокатехин-3-галлат и индол-3-карбинол — представляют собой известные биологически активные вещества. Их уникальность связана с тем, что они способны блокировать молекулярные процессы, которые приводят к патологической пролиферации, росту опухолей, активизации трансформированных клеток. Промисан — это безопасное негормональное средство, которое не проявляет токсических эффектов при длительном использовании, а это имеет особенное значение для пациентов, которым применение Промисана рекомендовано одновременно с токсичными химиопрепаратами.
Промисан — это один из новых препаратов на фармацевтическом рынке, который является биологически активной добавкой. Несмотря на его новизну, данный препарат отлично себя зарекомендовал в качестве профилактического и поддерживающего препарата в комплексном лечении онкологических новообразований.
Капсулы, массой содержимого 550 мг.
Способ применения и дозы
Взрослым принимать по 1 капсуле 2 раза вдень во время еды.
Продолжительность приема 1 месяц. При необходимости прием можно повторить. В суточной дозировке (2 капсулы) содержится не менее 180 мг индол-3-карбинола, не менее 190 мг эпигаллокатехин-3-галлата и в % от рекомендуемой суточной потребности: железо 67 % (9,4 мг), медь 60 % (0,6 мг), йод 54 % (0,08 мг), цинк 36 % (5,4 мг), марганец 30 % (0,6 мг), селен 57 % (0,04 мг).
Промисан рекомендуется для коррекции метаболических нарушений у пациентов с онкологическими заболеваниями и для профилактики развития рака молочной железы, яичников и эндометрия.
Фармакодинамика
Промисан рекомендуется для коррекции метаболических нарушений у пациентов с онкологическими заболеваниями и для профилактики развития рака молочной железы, яичников и эндометрия.
Показания к применению Промисан капсулы 120 шт. мираксбиофарма
ПРОМИСАН рекомендуется для профилактической коррекции метаболических нарушений у пациентов с онкологическими заболеваниями и профилактики рака молочных желез яичников и эндометрия.
Противопоказания
Индивидуальная непереносимость компонентов, беременность, кормление грудью. Не рекомендуется лицам, принимающим препараты, снижающие кислотность желудочного сока.
Действие на организм
- действует на молекулярном уровне, сдерживая клеточные механизмы возникновения опухоли;
- восстанавливает противоопухолевую защиту клеток организма;
- блокирует деление опухолевых клеток, вызывая их естественную гибель.
Особые указания
Перед применением необходима консультация врача-эндокринолога. Не является лекарственным средством.
Побочные действия Промисан капсулы 120 шт. мираксбиофарма
По данным доклинического и клинического изучения, Промисан® хорошо переносится, не оказывая в терапевтических дозах побочных эффектов.
А.В. Жаров, Г.Р. Кравченко, Л.Ф. Чернова, Т.Н. Губайдуллина
Челябинский окружной клинический онкологический диспансер.
454087, Россия, г. Челябинск, ул. Блюхера,42, e-mail: roc_chel@mail.ru
Проблема рака яичников является одной из наиболее сложных в современной онкогинекологии. За последние годы смертность от рака яичников остается стабильно высокой и занимает одно из первых мест в структуре смертности от онкологических заболеваний женской репродуктивной системы. Это обусловлено как бессимптомным течением заболевания на ранних стадиях и недостаточной специфичностью методов современной диагностики неопластических процессов яичников, так и отсутствием четко выбранной этиопатогенетической концепции этого вида злокачественных новообразований.
Заболеваемость раком яичников в 2009 году в России составила 16,84 на 100 тысяч женского населения, а смертность — 10,17. Летальность больных в течение первого года жизни –26,4% [12].
На I-II стадии заболевания приходилось 34,4% пациенток, с III-IV стадиями заболевания было выявлено 62,8% больных [10].
Общеизвестно, что одной из главных причин высокой смертности при злокачественных опухолях является их несвоевременное обнаружение. Причина этого заключается в недостаточном распространении в нашей стране скрининговых программ по раннему выявлению рака репродуктивных органов. Одновременно с этим необходимо совершенствовать существующие и разрабатывать новые подходы к адекватной молекулярной противоопухолевой терапии, а также шире внедрять методы первичной и вторичной профилактики [1,2,3].
Совершенствование традиционных методов борьбы с раком (хирургическое вмешательство, лучевая терапия и химиотерапия), а также благодаря революционным открытиям и достижениям в молекулярной биологии, генетике, биохимии, иммунологии и вирусологии, позволило значительно расширить представления о молекулярно-генетической природе рака и глубже понять патогенетические механизмы опухолевого роста [5,13].
К настоящему времени известна довольно обширная (около 40) группа природных соединений, блокирующих развитие гипер- и неопластических процессов в эпителиальных тканях, высокая эффективность которых доказана в экспериментальных и клинических исследованиях. Показано, что такие вещества, являются нетоксичными, а, следовательно, безопасными для здоровых органов и тканей, обладают множественной противоопухолевой активностью, то есть воздействуют на несколько ключевых звеньев процесса канцерогенеза. Особенно успешным оказалось сочетание некоторых из них [6,12].
Два наиболее известных таких соединения – это пищевой индол индол-3-карбинол (I3C) и флавоноид эпигаллокатехин-3-галлат (ЕGCG) являются составляющими препарата промисан. Это инновационая разработка ученых из НИИ молекулярной медицины ММА им. И. М. Сеченова и специалистов отечественных компаний «Миракс-Фарма» и «МираксБиоФарма» (г. Москва). Промисан был выведен на российский рынок в 2007 году.
Уникальность этого препарата обусловлена его способностью блокировать молекулярные механизмы, приводящие к патологической пролиферации, опухолевому неоангиогенезу и повышению инвазивной активности трансформированных клеток.
Промисан – это таргетный (избирательный) продукт растительного происхождения, обладающий хорошей переносимостью и высоким уровнем безопасности при длительном применении. Токсические эффекты, характерные для химиотерапевтических препаратов, у промисана отсутствуют. Препарат выступает своеобразным помощником, усиливающим действие химиопрепаратов, потому что блокирует ряд факторов роста и формирование гормональных метаболитов, которые являются одним из важных моментов, связанных с ростом опухоли.
Промисан – это средство, восстанавливающее чувствительность резистентных опухолей к лекарственным препаратам, блокирует рост опухолей: деление опухолевых клеток, метастазирование, рост сосудов к опухоли [1,7].
В настоящем исследовании проведена оценка эффективности комплексного лечения двух групп больных распространёнными формами рака яичников: с включением промисана и без него.
Цель исследования
Целью нашего исследования явилось улучшение результатов лечения больных распространёнными формами рака яичников путём включения в схему комплексного лечения препарата промисан.
Материалы и методы
Исследование проведено на базе гинекологического отделения Челябинского окружного клинического онкологического диспансера за период с 2007 по 2010 год. Контрольная группа была набрана за период с 2007 по 2009 годы. Основная группа — за период с 2009 по 2010 год включительно, когда стали активно применять для комплексного лечения больных раком яичников препарат промисан.
В исследовании участвовали 53 пациентки с распространёнными формами рака яичников (III-IV стадии). Основную группу составили 23 пациентки, которым проведено комплексное лечение по плану: от 2-х до 6-ти циклов НАПХТ с интервалом 3 недели по схеме СР (цисплатин 100 мг/м2 + циклофосфан 750 мг/м2) с последующим хирургическим этапом лечения и 4-6 циклами АПХТ по той же схеме. На всём протяжении лечения больные принимали промисан по 2 капсулы 2 раза в день. Контрольную группу составили 30 пациенток, которым проведено комплексное лечение по тому же плану, но без промисана.
До проведения планируемого лечения с целью уточнения распространенности опухолевого процесса и оценки общего состояния пациенток в обеих группах были выполнены: общие и биохимические анализы крови и мочи, ЭКГ, рентгенологические и ультразвуковые методы исследования, компьютерная томография, морфологическая верификация диагноза, исследование опухолевого маркёра СА-125.
Во время проведения исследования для мониторинга общего состояния пациенток и динамики опухолевого процесса были использованы все вышеописанные методы диагностики.
После проведения хирургического этапа была уточнена распространённость опухолевого процесса, объём остаточной опухоли. Оценка непосредственных результатов лечения основывалась на изучении общего самочувствия пациенток в каждой группе, переносимости проводимого лечения, уменьшения размеров первичного очага и метастазов, исчезновения плеврита и асцита, снижении показателей опухолевого маркёра СА-125.
Отдалённые результаты лечения по группам установлены на основании длительности безрецидивного периода, одногодичной выживаемости.
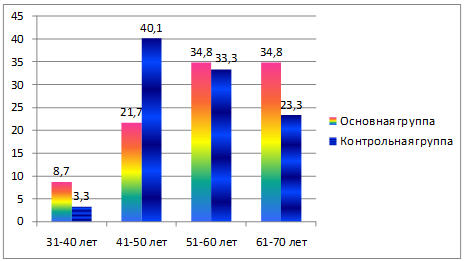
Возраст больных варьировал от 36 до 69 лет. Средний возраст пациенток в основной группе составил 53,1±1,3 года, в группе контроля – 54,3±1,2 года. Сравниваемые группы больных по возрастному критерию репрезентативны. Различия статистически незначимые (р>0,05). Распределение больных по возрасту в процентах представлено на рисунке 1.
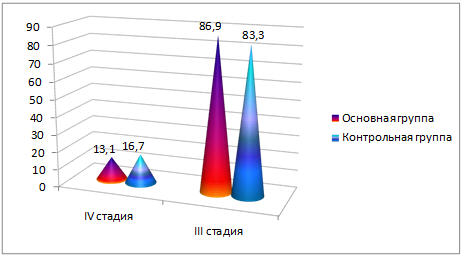
Распределение больных по стадиям согласно классификации TNM в основной группе было следующим: Т3NХМ0 — 20 (86,9%), Т3NХМ1 — 3 (13,1%). В контрольной: Т3NХМ0 — 25 (83,3%), Т3NХМ1 — 5 (16,7%) человек. Различия статистически незначимые (р>0,05). В обеих группах преобладали больные с III стадией заболевания. Значение М1 обусловлено положительными цитологическими находками, полученными при пункции плевральной полости (клетки аденокарциномы) при одно- или двусторонних экссудативных плевритах, либо обнаруженными при УЗИ, КТ/МРТ метастазами в печени. Распределение больных по стадиям в процентах представлено на рисунке 2.
Рис. 1. Распределение больных по возрасту основной и контрольной группах (в процентах).
Рис. 2. Распределение больных по стадиям основной и контрольной группах (в процентах).
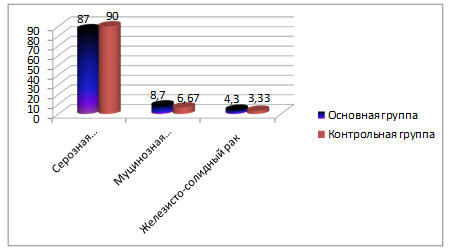
По гистологической структуре опухоли распределение больных в основной группе было следующим: серозная аденокарцинома — 20 (87,0%), муцинозная аденокарцинома — 2 (8,7%), железисто-солидный рак — 1 (4,3%). В контрольной группе: серозная аденокарцинома – 27 (90,0%), муцинозная аденокарцинома — 2 (6,67%), железисто-солидный рак – 1 (3,33%). В обеих группах преобладали больные с серозной аденокарциномой. Различия статистически незначимые (р>0,05). Распределение больных по гистологическому варианту опухоли в процентах представлено на рисунке 3.
Рис. 3. Распределение больных по гистологической структуре опухоли основной и контрольной группах (в процентах).
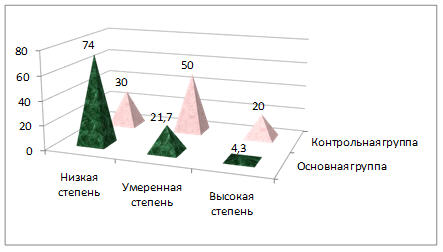
Распределение больных по степеням дифференцировки опухоли в основной и контрольной группах показало статистически значимые различия (р<0,05). В контрольной группе преобладали больные с низкодифференцированными вариантами опухоли 17 (74,0%), умеренную дифференцировку имели 5 (21,5%) человек и высокодифференцированный вариант опухоли оказался у 1 (4,3%) пациентки. В контрольной группе преобладали больные с умеренной степенью дифференцировки опухоли – 15 (50,0%), у 9 (30,0%) человек была низкая степень дифференцировки и 6 (20,0%) имели высокодифференцированную опухоль. Распределение больных по степеням дифференцировки опухоли в основной и контрольной группах представлено на рисунке 4.
Рис. 4. Распределение больных по степени дифференцировки опухоли основной и контрольной группах (в процентах).
Таким образом, в основной группе преобладали больные с низкодифференцированными, наиболее агрессивными опухолями, с плохим прогнозом заболевания.
Результаты и обсуждение
Сравнительный анализ уровней опухолевого маркера СА-125 до хирургического лечения показал следующее. Уровень СА-125 в основной группе до лечения был повышен у 19 из 20 человек, у 3-х пациенток не было данных до начала лечения. В среднем СА-125 составлял 523,3±18,7 Ед/мл (СА-125 минимальное значение – 14,0 Ед/мл, СА-125 максимальное значение – 2335 Ед/мл). После 2-х циклов НАПХТ он снизился в 2 раза и стал составлять — 236,4±14,8 Ед/мл (СА-125 минимальное значение – 0 Ед/мл, СА-125 максимальное значение – 1370 Ед/мл). В группе контроля до начала лечения у 23 пациенток уровень опухолевого маркера СА-125 был повышенным, у 7 больных данные отсутствуют. Среднее значение СА-125 составило 527,5±25,5 Ед/мл (СА-125 минимальное значение – 121,0 Ед/мл, СА-125 максимальное значение – 2550 Ед/мл). После 2-х циклов НАПХТ средний показатель СА-125 составил 415,3±13,7 Ед/мл (СА-125 минимальное значение – 286,0 Ед/мл, СА-125 максимальное значение – 1970 Ед/мл). Различия с основной группой статистически высоко значимые (р<0,01).
В основной группе после 2-х циклов НАПХТ 8 (34,8%) пациенткам было выполнено оперативное лечение в объеме экстирпации матки с придатками и резекции сальника, у одной больной дополненное аппендэктомией и резекцией метастатически измененного участка брыжейки сигмовидной кишки. Объём остаточной опухоли у 6 (26,1%) менее 2 см, у 2 (8,7%) больных более 2 см. В контрольной группе 6 (20,0%) больным после 2-х циклов НАПХТ была произведена операция. Из них трём выполнена экстирпация матки с придатками и резекция сальника, одной из них дополнительно была выполнена аппендэктомия, так как аппендикс входил в опухолевый конгломерат. Двум больным удалось произвести только двустороннюю аднексэктомию и резекцию сальника, и одной пациентке была произведена пробная лапаротомия. Объём остаточной опухоли у 2 (6,7%) пациенток был менее 2 см, у 4 (13,3%) больных более 2 см.
Таким образом, в основной группе после 2-х циклов НАПХТ удалось выйти на хирургическое лечение у каждой третьей пациентки, а в контрольной лишь у каждой пятой. Кроме того, в основной группе 6 (26,1%) больным удалось выполнить оперативное вмешательство с оптимальной циторедукцией (объёмом остаточной опухоли менее 2 см), в сравнении с контрольной группой, где только 2 (6,7%) пациенткам было выполнено оперативное вмешательство с объёмом остаточной опухоли менее 2 см.
Больным, которые не вышли на хирургическое лечение после двух циклов НАПХТ, было продолжено лекарственное лечение до четырёх. После 4-х циклов НАПХТ средний показатель СА-125 у больных основной группы составил 28,3±3,7 Ед/мл (СА-125 минимальное значение – 0 Ед/мл, СА-125 максимальное значение – 41,7±6,3 Ед/мл). В группе контроля средний показатель СА-125 составил 35,7±5,3 Ед/мл (СА-125 минимальное значение – 0 Ед/мл, СА-125 максимальное значение – 57,1±6,9 Ед/мл). Различия по сравниваемым группам статистически незначимые (р>0,05).
После 4-х циклов НАПХТ 14 (60,9%) пациенткам основной группы было выполнено оперативное вмешательство в объёме экстирпации матки с придатками и резекции сальника. Из них 8 (34,5%) больным с оптимальной циторедукцией (объём остаточной опухоли менее 2 см) и у 6 (26,1%) больных объём остаточной опухоли превышал 2 см. В контрольной группе 18 (60,0%) больным произведен хирургический этап лечения. Из них 15 пациенткам произведена экстирпация матки с придатками, резекция сальника, 2 — экстирпация матки с придатками, биопсия сальника, и 1 больной – двусторонняя аднексэктомия, резекция сальника. Оперативное вмешательство с оптимальной циторедукцией было проведено 7 (23,3%) пациенткам, с неоптимальной циторедукцией 11 (36,7%) больным.
В основной группе 1 (4,3%) больной оперативное лечение было выполнено после 6 циклов НАПХТ в объеме экстирпация матки с придатками и резекции сальника. Визуально остаточной опухоли не определялось. СА-125 у данной пациентки перед операцией составлял 16,8 ЕД/мл. В контрольной группе 6 (20,0%) пациенткам после 6 циклов НАПХТ было выполнено оперативное вмешательство в неполном объеме. Трём из них – экстирпация матки с придатками, двум – двусторонняя аднексэктомия, резекция сальника и одной больной – только резекция сальника. Объём остаточной опухоли более 2 см был у всех пациенток.
В целом после проведения 2-6 курсов НАПХТ 15 (65,2±10,1%) больным основной группы удалось провести оперативное лечение с оптимальной циторедукцией и 9 (30,0±7,7%) пациенткам контрольной группы, пробных операций в основной группе не было. Различия статистически высоко значимые (р<0,01).
Необходимо отметить, что токсические реакции при проведении НАПХТ в обеих группах статистически не отличались. Промисан хорошо переносился всеми больными, на фоне его приема отмечено побочное действие в виде изжоги, так как промисан повышает секрецию желудочного сока. Так, в основной группе изжога отмечена у 30% пациенток, в контрольной — у 7% больных.
Продолжительность жизни пациенток, частота возникновения рецидивов заболевания и смертность являются основными показателями эффективности проведенного лечения у онкологических больных.
У больных распространёнными опухолями яичников (III–IV стадии) в подавляющем большинстве случаев не удаётся удалить весь объём опухоли и процесс приобретает хроническое персистирующее течение. У таких больных трудно достигнуть полного излечения. При лечении достигается стойкая ремиссия. Наблюдаемое повышение уровней СА-125 при прогрессировании заболевания свидетельствует о необходимости мониторинга всех больных, находящихся в ремиссии. Более того, даже если при первичном обследовании у нелеченных больных показатели СА-125 не превышали норму, то в процессе ремиссии анализ на содержание маркеров в крови необходим в связи с возможным вторичным повышением маркеров при рецидиве. Последнее еще раз подтверждает потенциальные возможности клеток рака яичников к изменениям, которые проявляются морфологически и на биохимическом уровне [3].
Говорить о рецидиве заболевания при лечении больных с распространёнными формами рака яичников довольно сложно. Термин «рецидив заболевания» переводится с латинского языка как возврат болезни. Однако после хирургического лечения в основной группе только больных с неоптимальной циторедукцией было 34,8% случаев, а в группе контроля эта цифра достигала 70% наблюдений. Следовательно, говорить об излечении, когда имеется остаточная опухоль неправомочно, а значит, термин «рецидив заболевания» в данной ситуации надо воспринимать условно. Прогрессирование опухолевого процесса оценивали по данным УЗИ, КТ, МРТ в сочетании с повышением уровня опухолевого маркёра СА-125.
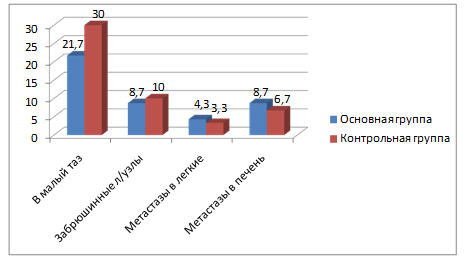
Клиническими проявлениями прогрессирования заболевания были: местные рецидивы в малом тазу, метастазы в забрюшинные лимфатические узлы, отдалённые метастазы в легкие, печень (рисунок 5). В наибольшем проценте случаев это были рецидивы в малом тазу в 21,7% в основной группе и 30,0% — в контрольной. В 8,7% случаев рецидив проявился метастазами в забрюшинные лимфатические узлы у больных основной группы и 10,0% пациенток контрольной группы. Отдалённые метастазы в легкие и печень диагностированы несколько в большем проценте случаев у больных основной группы в сравнении с контрольной: в 8,7% это были метастазы в печень и в 4,3 % метастазы в легкие в основной группе, в 6,7% и 3,3% соответственно в контрольной группе.
Рис. 5. Клинические проявления рецидива в основной и контрольной группах (в процентах).
Отмечено, что у пациенток с местным рецидивом в обеих группах, длительность безрецидивного периода была меньше, чем у пациенток с отдалёнными метастазами. Более длительный безрецидивный период отмечался при метастазировании в забрюшинные лимфатические узлы (9 месяцев и более).
В большинстве индустриальных стран мира рак яичников имеет самые высокие показатели смертности среди всех гинекологических опухолей, что связано с поздней диагностикой заболевания. Летальность больных раком яичников на первом году жизни после установления диагноза составляет 35%. По сводным данным популяционных раковых регистров стран Европы, одногодичная выживаемость больных раком яичников составляет 63% [2].
Так как основная группа пациенток набиралась с 2009 года, мы смогли оценить только одногодичную выживаемость больных в основной и контрольной группах. Одногодичная выживаемость больных с распространенными формами рака яичников в основной и контрольной группах представлена на рисунках 6 и 7.
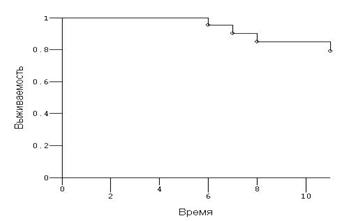
Рис.6. Кривая Каплана-Мейера, оценивающая одногодичную выжи-ваемость больных основной группы – 78,9±2,3%.
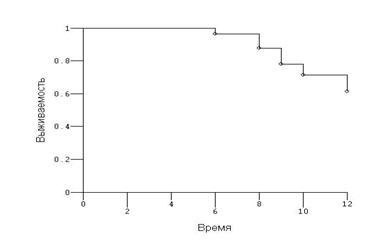
Рис.7. Кривая Каплана-Мейера, оценивающая одногодичную выживаемость больных контрольной группы – 65,2±3,1%.
Одногодичная выживаемость больных распространенными формами рака яичников в основной группе составила 78,9±2,3%, контрольной — 65,2±3,1% (Р=0,408). Таким образом, имеется отчётливая тенденция к увеличению выживаемости у пациенток, которым на протяжении комплексной терапии в схему лечения был включён препарат промисан.
Выводы:
1. Промисан хорошо переносится всеми больными и не увеличивает частоту и тяжесть побочных реакций и осложнений комплексного лечения больных с распространёнными формами рака яичников.
2. После проведения 2-6 курсов НАПХТ 15 (65,2±10,1%) больным основной группы (с промисаном) удалось провести оперативное лечение с оптимальной циторедукцией опухоли и лишь 9 (30,0±7,7%) пациенткам контрольной группы (без промисана), пробных операций в основной группе не было (р<0,01).
3. Клиническими проявлениями прогрессирования заболевания были: в большинстве случаев – это рецидивы в малом тазу в 21,7% случаев у больных основной группы и в 30% у больных контрольной группы; метастазы в забрюшинные лимфатические узлы – в 8,7% в основной группе и 10% в контрольной группе; метастазы в легкие и печень незначительно превалировали у больных основной группы по сравнению с контрольной (4,3%, 8,7% и 3,3%, 6,7% соответственно).
4. Одногодичная выживаемость пациенток, получавших промисан, на 13,7% больше чем у пациенток, которые не получали промисан (78,9% и 65,2% соответственно) Р=0,408.
Литература
- Ашрафян, Л. А. Патогенетичесая профилактика рака репродуктивных органов / Л. А. Ашрафян, В. И. Киселев, Е. Л. Муйжнек // М.: Молодая гвардия, 2009. – 171 с.
- Жорданиа К. И. и др. Клиническая онкогинекология / Под ред. В. П. Козаченко. // Руководство для врачей. – М. Медицина, 2005.
- Максимов С. Я. Практическая онкология / С. Я. Максимов, К. Д. Гусейнов // Т.11, № 3, 2010.
- 5. Киселев В. И., Муйжнек Е. Л. Общие принципы профилактики метастатической болезни и сенсибилизации опухолей / Изд-во «Димитрейд График Групп» // Москва. – 2007.
- 6. Киселев В.И., Ляшенко А. А. Индинол – регулятор пролиферативных процессов в органах репродуктивной системы/ Монография. г. Москва, 2005.
- 7. Киселев В.И., Ляшенко А. А. Молекулярные механизмы регуляции гиперпластических процессов / Монография. Изд-во «Димитрейд График Групп» // Москва. – 2007.
- 8. Опухоли женской репродуктивной системы / В. В. Баринов и др.; под общ. ред. М. И. Давыдова, В. П. Летягина, В. В. Кузнецова. – М.: ООО «Медицинское информационное агентство», 2007. – 376 с.
- 9. Переводчикова, Н.И. Химиотерапия опухолевых заболеваний: краткое руководство / Н.И. Переводчикова. — М., 2004. — 391 с.
- 10.Урманчеева, А.Ф. Вопросы эпидемиологии и диагностики рака яичников/ А.Ф. Урманчеева // Практическая онкогинекология: избранные лекции / под ред. А.Ф. Урманчеевой и др. — СПб., 2008. — С. 320-331.
- 11.Чиссов, В.И. Злокачественные новообразования в России в 2009 году (заболеваемость и смертность) / под ред. В.И. Чиссова и др. — М., 2011. — 259 с.
- 12. Чиссов, В.И. Состояние онкологической помощи населению России в 2009 году / под ред. В.И. Чиссова и др. — М., 2019. — 195 с.
- 13. K?bel M., Kalloger S.E., Boyd N., McKinney S., Mehl E. et al. Ovarian carcinoma subtypes are different diseases: implications for biomarker studies // PLOS Medicine. – 2008. – Vol.5, issue 12. – e232. www.plosmedicine.org
- 14. Gilks C.B., Ionescu D., Kalloger S.E., K?bel M., Irving J. et al. Tumor cell type can reproducibly diagnosed and is of independent prognostic significance in patients with maximally debulked ovarian carcinoma // Human Pathology. – 2008. – Vol.39. – P. 1239-1251.
- 15. Delaying the primary surgical effort for advanced ovarian cancer: a systematic review of neoadjuvant chemotherapy and interval cytoreduction / R.E. Bristow [et al] // Gynecol Oncol. – 2007. – N104. – P. 480 – 490.
- 16. The Role of Cytoreductive/Debulking Surgery in Ovarian Cancer / Mark T. Wakabayashi [et al] // J Natl Compr Canc Netw. – 2008. – Vol. 6, № 8. – P. 803 – 811.
Список сокращений
- ПХТ – полихимиотерапия
- НАПХТ – неоадьювантная полихимиотерапия
- АПХТ – адьювантная полихимиотерапия
- СР – циклофосфан, цисплатин
- УЗИ – ультразвуковое исследование
- КТ – компьютерная томография
- МРТ – магнито-резонанская томография
ГБОУ ВПО Южно-Уральский государственный медицинский университет Минздрава России, Челябинск;
ГБУЗ «Челябинский областной клинический онкологический диспансер»
Жаров А.В.
ГБОУ ВПО Южно-Уральский государственный медицинский университет Минздрава России, Челябинск;
ГБУЗ «Челябинский областной клинический онкологический диспансер»
Губайдуллина Т.Н.
ГБОУ ВПО Южно-Уральский государственный медицинский университет Минздрава России, Челябинск;
ГБУЗ «Челябинский областной клинический онкологический диспансер»
Кравченко Г.Р.
ГБОУ ВПО Южно-Уральский государственный медицинский университет Минздрава России, Челябинск;
ГБУЗ «Челябинский областной клинический онкологический диспансер»
Чернова Л.Ф.
ГБОУ ВПО Южно-Уральский государственный медицинский университет Минздрава России, Челябинск;
ГБУЗ «Челябинский областной клинический онкологический диспансер»
Шимоткина И.Г.
ГБОУ ВПО Южно-Уральский государственный медицинский университет Минздрава России, Челябинск;
ГБУЗ «Челябинский областной клинический онкологический диспансер»
Комплексное лечение больных с распространенными формами рака яичников с включением препарата промисан
Авторы:
Таратонов А.В., Жаров А.В., Губайдуллина Т.Н., Кравченко Г.Р., Чернова Л.Ф., Шимоткина И.Г.
Как цитировать:
Таратонов А.В., Жаров А.В., Губайдуллина Т.Н., Кравченко Г.Р., Чернова Л.Ф., Шимоткина И.Г. Комплексное лечение больных с распространенными формами рака яичников с включением препарата промисан. Онкология. Журнал им. П.А. Герцена.
2013;2(4):20‑24.
Taratonov AV, Zharov AV, Gubaĭdullina TN, Kravchenko GR, Chernova LF, Shimotkina IG. Multimodality treatment incorporating Promisan for disseminated ovarian cancer. P.A. Herzen Journal of Oncology. 2013;2(4):20‑24. (In Russ.)

Рак яичников (РЯ) является одной из наиболее агрессивных опухолей с плохим прогнозом заболевания. В 60—80% случаев выявляют РЯ на III—IV стадии заболевания. За последние годы смертность от РЯ остается стабильно высокой и занимает одно из первых мест в структуре смертности от онкологических заболеваний женского населения. Это обусловлено особенностями анатомического строения и расположением яичников, бессимптомным течением заболевания на ранних стадиях и отсутствием серьезных скрининговых программ по раннему выявлению заболевания.
Заболеваемость РЯ в 2011 г. в России составила 17,9 на 100 000 женского населения, а смертность — 10,82. Летальность больных в течение первого года жизни — 27,6% случаев [1].
Революционные открытия и достижения в молекулярной биологии, генетике, биохимии, иммунологии и вирусологии позволили значительно расширить представления о молекулярно-генетической природе рака и глубже понять патогенетические механизмы опухолевого роста [2]. Новые представления о природе злокачественных опухолей дали толчок для развития нового направления в современной онкологии — таргетной терапии.
Таргетная терапия — это лекарственное лечение направленного действия, т.е. воздействия на опухолевые «мишени» (гены, белки), имеющие важнейшее значение для развития новообразования. Поражение «мишени» приводит к подавлению злокачественного роста и выраженному противоопухолевому эффекту.
Принципом таргетной терапии является лечение больного на основе данных о молекулярных нарушениях, ответственных за опухолевую трансформацию и прогрессирование заболевания. Приобретение клеткой неопластических свойств характеризуется непрерывной и устойчивой стимуляцией сигнальных путей, инициирующих клеточную пролиферацию и ряд других важных биологических эффектов — ангиогенез, инвазию, метастазирование, адгезию [3].
Большинство таргетных препаратов, являясь продуктами химического синтеза, оказывает побочное действие. Они малоэффективны или неэффективны в качестве средств монотерапии. Становится все более очевидно, что таргетная терапия эффективна только тогда, когда «бьет» одновременно по нескольким мишеням (так называемая «мультифокальная таргетная терапия»). Однако следует иметь в виду, что цена подобной повышенной эффективности — всегда повышенная токсичность. Между тем, сегодня существует реальная возможность помочь многим онкологическим больным. Эта возможность основана на использовании фитонутриентов — соединений, содержащихся в природных пищевых продуктах и обладающих выраженными противоопухолевыми и другими полезными свойствами, но, в отличие от традиционных химиотерапевтических препаратов, абсолютно нетоксичных и безвредных для организма [4, 5].
В настоящее время известна обширная группа природных соединений, блокирующих развитие гипер- и неопластических процессов в эпителиальных тканях, высокая эффективность которых доказана в экспериментальных и клинических исследованиях. Показано, что такие вещества являются нетоксичными для здоровых органов и тканей, воздействуя на несколько ключевых звеньев процесса канцерогенеза. Особенно успешным оказалось сочетание некоторых из них [3, 6].
Два наиболее известных таких соединения — это пищевой индол-3-карбинол (I3C) и флавоноид эпигаллокатехин-3-галлат (EGCG), которые входят в состав препарата «Промисан».
Уникальность промисана обусловлена его способностью блокировать молекулярные механизмы, приводящие к патологической пролиферации, опухолевому неоангиогенезу и повышению инвазивной активности трансформированных клеток. Кроме того, он способен усиливать действие химиотерапевтических препаратов [7] и восстанавливать чувствительность резистентных опухолей к лекарственным средствам [2, 8, 9].
Промисан — это таргетный продукт растительного происхождения, обладающий хорошей переносимостью и высоким уровнем безопасности при длительном применении. Токсическое действие, характерное для химиотерапевтических препаратов, у него отсутствует [2, 10].
В настоящем исследовании проведена оценка эффективности комплексного лечения двух групп больных с распространенными формами РЯ: с включением в схему лечения промисана и без него.
Цель исследования — улучшение отдаленных результатов лечения больных с распространенными формами РЯ путем включения в схему комплексного лечения препарата промисан.
Материал и методы
Исследование проведено на базе гинекологического отделения ЧОКОД в период с 2008 по 2011 г. Выполнялось рандомизированное исследование, в котором пациентки распределялись по группам лечения случайным образом (методом конвертов) и имели одинаковую возможность получить препарат промисан.
В исследовании участвовали 64 пациентки с распространенными формами РЯ (III—IV стадия). Основную группу составили 30 пациенток, которым проведено комплексное лечение. На первом этапе проводили от 2 до 6 циклов неоадъювантной полихимиотерапии (НАПХТ) с интервалом в 3 нед по схеме СР (цисплатин 100 мг/м2 + циклофосфан 750 мг/м2). На втором — выполняли хирургическое вмешательство. На третьем этапе проводили адъювантную полихимиотерапию (АПХТ) от 2 до 6 циклов по той же схеме. На протяжении лечения больные принимали промисан по 2 капсулы 2 раза в день. Контрольную группу составили 34 пациентки, которым проведено комплексное лечение по тому же плану, но без промисана. Окончательный эффект оценивали после 8 циклов ПХТ и хирургического лечения.
До проведения планируемого лечения с целью уточнения распространенности опухолевого процесса и оценки общего состояния пациенток в обеих группах провели обследование: общий и биохимический анализы крови и мочи, ЭКГ, рентгенологическое и ультразвуковое исследования, компьютерную томографию, морфологическую верификацию диагноза (пункция опухоли под контролем УЗИ, цитологическое исследование пунктата заднего свода, плевральной и асцитической жидкости), исследование опухолевого маркера СА125.
Во время проведения исследования для мониторинга общего состояния пациенток и динамики опухолевого процесса использовали все указанные методы диагностики.
Оценка непосредственных результатов лечения основывалась на изучении общего самочувствия пациенток в каждой группе, переносимости проводимого лечения, уменьшении размеров первичного очага и метастазов, исчезновении плеврита и асцита, снижении показателей опухолевого маркера СА125. После проведения хирургического этапа уточнялась распространенность опухолевого процесса и эффективность неоадъювантной терапии. При этом оценивали объем остаточной опухоли и лекарственный патоморфоз новообразования.
Отдаленные результаты лечения по группам оценивали на основании длительности безрецидивного периода и 3-летней выживаемости.
Возраст больных варьировал от 49 лет до 61 года. Средний возраст пациенток в основной группе составлял 51,4±2,6 года, в группе контроля — 50,8±1,9 года. Сравниваемые группы больных по возрастному критерию репрезентативны. Различия статистически незначимые (р>0,05).
В исследование были включены больные, которым по распространенности опухолевого процесса, по нашему мнению, начинать лечение целесообразно было с НАПХТ, а не с операции. Это пациентки с большими, ограниченно смещаемыми или несмещаемыми опухолевыми конгломератами, наличием асцита и/или плеврита. Распределение больных по стадии (согласно классификации TNM) в основной группе было следующим: Т3NХМ0 — 28 (93,3%), Т3NХМ1 — 2 (6,7%). В контрольной: Т3NХМ0 — 30 (88,3%), Т3NХМ1 — 4 (11,7%) пациенток. Различия статистически незначимые (р>0,05). В обеих группах преобладали больные РЯ III стадии. Значение М1 обусловлено положительными цитологическими находками, полученными при пункции плевральной полости при экссудативном плеврите либо обнаруженными при УЗИ, КТ/МРТ паренхиматозных метастазов в печени. Общее состояние больных, несмотря на распространенный опухолевый процесс, в обеих группах было оценено по шкале ECOG-BОЗ в 1—2 балла.
По гистологической структуре в основной группе серозная цистаденокарцинома выявлена у 24 (80,0%), муцинозная цистаденокарцинома — у 4 (13,3%), железисто-солидный рак — у 2 (6,6%) пациенток. В контрольной группе серозная цистаденокарцинома выявлена у 28 (82,3%), муцинозная цистаденокарцинома — у 4 (11,7%), железисто-солидный рак — у 2 (5,8%) больных. В обеих группах преобладали больные с серозной цистаденокарциномой. В целом по группам различия оказались статистически незначимые (р>0,05).
В основной группе преобладали больные с умереннодифференцированными вариантами опухоли — 14 (46,6%), низкая степень дифференцировки опухоли определена у 12 (40,0%) и высокодифференцированная — у 4 (13,4%) пациенток. В контрольной группе больных с опухолью низкой и умеренной степени дифференцировки оказалось одинаковое количество — по 14 (41,2%) человек; у 6 (17,6%) пациенток опухоль имела высокую дифференцировку. Распределение больных по степеням дифференцировки опухоли показало статистически незначимые различия (р>0,05)
Таким образом, по основным параметрам, характеризовавших больных и опухолевый процесс, сравниваемые группы были сопоставимы.
Результаты и обсуждение
Сравнительный анализ уровней опухолевого маркера СА125 до начала лечения показал следующее. Уровень СА125 в основной группе до лечения был повышен у 26 из 27 человек, у 3 пациенток не было данных до начала лечения. Средний уровень СА125 составлял 578,3±21,1 Ед/мл (минимальное значение — 24,2 Ед/мл, максимальное — 2452 Ед/мл). В группе контроля до начала лечения у 28 пациенток уровень СА125 был повышенным, у 6 больных данные отсутствовали. Среднее значение СА125 составило 628,1±21,2 Ед/мл (минимальное значение — 231,0 Ед/мл, максимальное — 2750 Ед/мл). Различия уровня опухолевого маркера СА125 в крови до начала лечения в обеих группах незначимы (р>0,05).
После 2 циклов НАПХТ в основной группе уровень СА125 снизился до 241,2±13,2 Ед/мл (минимальное значение — 0 Ед/мл, максимальное — 1469 Ед/мл). В контрольной группе после 2 циклов НАПХТ средний показатель СА125 составил 412,4±14,6 Ед/мл (минимальное значение — 253,2 Ед/мл, максимальное — 2061 Ед/мл). Различия с основной группой статистически значимые (р<0,01).
После проведения 2 циклов НАПХТ у ряда пациенток опухоль существенно уменьшилась в объеме, появилась ее хорошая смещаемость, исчезли асцит и плеврит. Таким больным уже после 2 циклов химиотерапии выполняли оперативное лечение.
В основной группе после 2 циклов НАПХТ оперативное вмешательство выполнено у 12 (40,0%) пациенток. При этом объем остаточной опухоли у 8 (66,6%) больных составил менее 2 см, у 4 (33,3%) — более 2 см. В контрольной группе у 8 (23,5%) больных после 2 циклов НАПХТ была произведена операция. Объем остаточной опухоли у 3 (37,5%) пациенток составил менее 2 см, у 5 (62,5%) — более 2 см.
Таким образом, после 2 циклов НАПХТ чаще удавалось выполнить хирургическое вмешательство в основной, чем в контрольной группе. Кроме того, в основной группе операцию выполняли с более оптимальной циторедукцией.
Больным с недостаточной циторедукцией опухоли хирургический этап не проводили, и лекарственное лечение продолжали до 4 циклов. После 4 циклов НАПХТ средний показатель СА125 у больных основной группы составлял 37,6±2,3 Ед/мл, в контрольной группе — 36,3±6,1 Ед/мл. Различия по сравниваемым группам статистически незначимые (р>0,05).
После 4 циклов НАПХТ 16 (53,3%) пациенткам основной группы было выполнено оперативное вмешательство. Из них у 12 (75,0%) — с оптимальной циторедукцией (объем остаточной опухоли менее 2 см) и у 4 (25,0%) пациенток объем остаточной опухоли превышал 2 см. В контрольной группе после 4 циклов НАПХТ дополнительно прооперировано 20 (58,8%) больных. Оперативное вмешательство с оптимальной циторедукцией было проведено у 8 (40%) пациенток, с неоптимальной циторедукцией — у 12 (60%).
В основной группе 2 (6,6%) больным оперативное лечение было выполнено после 6 циклов НАПХТ. Оптимальная циторедукция опухоли отмечена в одном случае. В контрольной группе у 6 (17,6%) пациенток выполнено оперативное вмешательство после 6 циклов НАПХТ. Объем остаточной опухоли более 2 см отмечен у 3 пациенток.
В целом после проведения 2—6 циклов НАПХТ удалось провести оперативное лечение с оптимальной циторедукцией у 21 (70,0±9,4%) больной основной группы и лишь у 14 (41,2±6,3%) пациенток контрольной группы. Различия статистически значимые (р<0,05).
После оперативного лечения больным в обеих группах проводили от 2 до 6 циклов АПХТ (в зависимости от числа предоперационных циклов химиотерапии), но не более 8 курсов.
Следует отметить, что токсические реакции при проведении НАПХТ и АПХТ в обеих группах статистически не различались. Препарат промисан, дополнительно введенный в схему лечения, хорошо переносили все больные. На фоне его приема отмечено более частое побочное действие в виде изжоги. Изжога в основной группе отмечена у 36,7% пациенток, в контрольной — у 14,7%.
Продолжительность жизни пациенток, частота возникновения рецидивов заболевания и смертность являются основными показателями эффективности проведенного лечения у онкологических больных.
В результате проведенного лечения, после 8 циклов ПХТ у 22 (73,3%) пациенток основной группы и у 18 (52,9%) контрольной группы данных о наличии опухоли не было. Ремиссию оценивали по отсутствию клинических проявлений, результатам УЗИ органов малого таза и брюшной полости, МРТ, показателей СА125. К завершению 3-го года без признаков опухолевого процесса в каждой группе оставалось по 2 человека.
У пациенток с распространенными формами РЯ в большинстве случаев не удается удалить весь объем опухоли и процесс приобретает персистирующее течение. У таких больных трудно достигнуть полного излечения, но можно получить ремиссию той или иной длительности. В такой ситуации говорить о рецидиве заболевания довольно сложно, так как термин «рецидив заболевания» переводится с латинского языка как возврат болезни, но, по сути, несмотря на светлый промежуток, опухоль в организме сохранялась. Возобновление прогрессирования опухолевого процесса в каждом случае, как правило, оценивается по данным УЗИ, КТ, МРТ в сочетании с мониторингом уровня опухолевого маркера СА125.
J. Thigpen и соавт. [11] предложили характеристику больных из четырех вариантов течения РЯ (рецидивирующий, резистентный, персистирующий, рефрактерный).
Рецидивирующий РЯ — у больных полная регрессия опухоли при проведении химиотерапии первой линии с включением производных платины, прогрессирование наступило через 6 мес после прекращения лечения.
Резистентный РЯ — у больных полная регрессия опухоли при проведении химиотерапии первой линии, но прогрессирование наступило ранее 6 мес после прекращения лечения.
Персистирующий РЯ — у больных достигнута частичная регрессия опухоли при проведении химиотерапии первой линии с включением препаратов платины, но проявления болезни сохраняются.
Рефрактерный РЯ — у больных не отмечено эффекта от проведения первой линии химиотерапии с включением препаратов платины, отмечено прогрессирование заболевания на фоне химиотерапии первой линии (рис. 1).
Несмотря на то что к концу 3-го года в каждой группе оставалось по 2 человека без признаков опухолевого процесса, менее агрессивное течение РЯ (рецидивирующий) в основной группе отмечено у 15 (50%) больных, в контрольной — у 10 (29,4%) пациенток. Более агрессивное течение (резистентный, персистирующий, рефрактерный) — у 13 (43,3%) и у 22 (64,7%) больных соответственно.
В большинстве индустриальных стран мира РЯ имеет самые высокие показатели смертности среди всех гинекологических опухолей, что обусловлено поздней диагностикой заболевания. Одногодичная летальность больных РЯ после установления диагноза составляет 26,3%. По сводным данным популяционных раковых регистров стран Европы, 3-летняя выживаемость больных РЯ составляет 58% [12].
В основной группе в первый год умерли 3 (10,0%) пациентки, в контрольной — 5 (14,7%). На втором году — 8 (26,6%) в основной и 12 (35,3%) пациенток в контрольной группе; на третий год — 11 (36,6%) в основной и 18 (52,9%) больных в контрольной группе. Различия статистически незначимые (р>0,05), но имеется отчетливая тенденция к уменьшению летальных исходов к 3-му году наблюдений в основной группе.
Трехлетняя выживаемость больных с распространенными формами РЯ представлена на рис. 2.
Трехлетняя выживаемость больных в основной группе составила 63,9±3,7% (19 больных), в контрольной — 47,05±4,2% (16). Разница в показателях составила 16,8%, хотя достоверных различий не получено (р=0,089). Имеется отчетливая тенденция к повышению выживаемости у пациенток, которым на протяжении комплексной терапии в схему лечения был включен препарат промисан. Большее количество наблюдений, возможно, позволило бы получить достоверные результаты, но для этого требуются комплексные исследования с подключением нескольких лечебных учреждений онкологического профиля.
Заключение
Включение в схему комплексной терапии больных с распространенными формами РЯ препарата промисан позволило улучшить непосредственные и отдаленные результаты лечения.
1. Быстрее наступала нормализация показателей опухолевого маркера СА125.
2. Ускорялась резорбция опухоли, что позволяло большему числу больных и в более короткие сроки проводить оперативное лечение.
3. Отмечена более оптимальная циторедукция после хирургического вмешательства.
4. Увеличилось число больных, у которых после изначально планируемого лечения отмечена полная ремиссия.
5. Уменьшилось число пациенток с неблагоприятным клиническим течением заболевания (резистентный, персистирующий и рефрактерный РЯ).
У больных с распространенными формами РЯ проявилась отчетливая тенденция к снижению смертности и повышению 3-летней выживаемости в группе пациенток, получавших препарат промисан.